Производные [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины и его применение - RU2348636C2
Код документа: RU2348636C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к производному [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины или его фармацевтически приемлемой соли и к иммуносупрессивному средству или индуктору иммунологической толерантности, содержащим указанное производное или его соль. Указанное иммуносупрессивное средство может быть использовано для лечения или профилактики аутоиммунных заболеваний, аллергических заболеваний, заболеваний, связанных с воспалением тканей, реакции отторжения трансплантата и реакции «транслантат против хозяина» при трансплантации органов или костного мозга и других заболеваний. Указанный индуктор иммунологической толерантности может быть использован для приживления трансплантированного органа или костного мозга у пациента, подвергнувшегося операции трансплантации органа или костного мозга. Кроме того, он может быть использован в качестве противоопухолевого лекарственного средства.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
До настоящего времени для лечения или профилактики реакции отторжения трансплантата, аллергических заболеваний и различных аутоиммунных заболеваний использовали иммуносупрессивные средства, такие как стероиды, циклоспорин А, такролимус, микофенолят мофетил, мизорибин или дезоксиспергуалин.
В последние годы стало известно, что при длительном введении в большом количестве стероидного лекарственного средства, используемого в качестве противовоспалительного средства, оно действует на макрофаги и лимфоциты, проявляя иммуносупрессивную активность.
Циклоспорин А и такролимус угнетают продукцию цитокинов, действуя как фактор регуляции лимфоцитов, и проявляют иммуносупрессивную активность.
Циклоспорин А вводят для подавления реакции отторжения, появляющейся после трансплантации почки, печени, костного мозга или сердца, или для лечения болезни Бехчета, псориаза, апластической анемии и нефротического синдрома.
Такроламус применяют как мощное средство угнетения продукции цитокинов и вводят для подавления реакции отторжения, имеющей место после трансплантации почки, печени, костного мозга или сердца, или для лечения атопического дерматита и тяжелой псевдопаралитической миастении.
Микофенолят мофетил и мизорибин проявляют иммуносупрессивную активность в результате действия на лимфоциты в качестве антиметаболита нуклеиновой кислоты.
Микофенолят мофетил применяют для подавления реакции отторжения, имеющей место после трансплантации почки. Мизорибин применяют для подавления реакции отторжения, имеющей место после трансплантации почки, и для лечения нефротического синдрома, люпус-нефрита и хронического ревматоидного артрита.
Дезоксиспергуалин ингибирует выработку антител и действует на лимфоциты, проявляя иммуносупрессивную активность. Его применяют для лечения реакции отторжения после трансплантации почки.
Указанное иммуносупрессивное средство применимо также для лечения аутоиммунных заболеваний, отличных от вышеуказанных заболеваний. Циклоспорин А, например, применим, как было сообщено, для лечения кроме указанных выше заболеваний также таких заболеваний, как атопический дерматит, аутоиммунный гепатит, болезнь Крона, язвенный колит, тяжелая псевдопаралитическая миастения, рассеянный склероз, ревматоидный артрит и инсулинзависимый сахарный диабет.
Между прочим, при указанных выше заболеваниях иммунное явление, которое оказывает вредное воздействие на пациента(ку), возникает через антиген-презентацию, вызывая патологические состояния. В случае аутоиммунного заболевания, например, аутоантиген или чужеродный антиген, похожий на аутоантиген, презентуется иммунокомпетентной клетке дендритной клеткой, которая является одной из антиген-презентующих клеток. Считается, что при этом возникает иммунная реакция на аутоантиген и происходит распад аутотканей.
Кроме того, при ревматизме, который является воспалительным заболеванием, в пораженной области сустава пациента наблюдается накопление дендритных клеток, действующих как антиген-презентующие клетки, и поэтому считается, что указанная антиген-презентация сопровождается развитием и ухудшением болезни.
Когда Т-клетки распознают клетки, экспрессирующие антиген-мишень, такое распознавание проводится через МНС (главный (генный) комплекс гистосовместимости). Поэтому в отношении аутоиммунных заболеваний, а также воспалительного заболевания считается, что презентация антигена связана с активацией Т-клеток в пораженных областях и повреждением ткани. Основываясь на указанных фактах, можно лечить или предупреждать аутоиммунные заболевания, ингибируя презентацию аутоантигена или чужеродного антигена, похожего на аутоантиген.
Кроме того, уже сообщалось, что иммунологическую толерантность создают различия в стадиях созревания дендритных клеток, презентующих антигены. Зрелые дендритные клетки индуцируют эффектор Т-лимфоцитов, обладающих цитотоксичностью и способностью продуцировать цитокины. Наоборот, считается, что незрелые дендритные клетки индуцируют регуляторные, или супрессорные Т-клетки, тем самым играя важную роль в создании и поддержании иммунологической толерантности. Таким образом, считается, что, если подавлять созревание клеток, презентующих антигены (далее называемых как антиген-презентующие клетки), то увеличивается число незрелых дендритных клеток, в результате чего создается иммунологическая толерантность. [Non-Patent Document 1] Ludewig, B. et al., Current Opinion in Immunology, vol. 13, p. 657 (2001); [Non-Patent Document 2] Thomas, R. et al., Journal of Leukocytes Biology, vol. 66, p. 286 (1999); [Non-Patent Document 3] Menekigaku Illustrated (5thedition), Roitt, I. et al., edited translated by Fujio Tada, Nankodo Co., Ltd., (2000), pp. 128-131 и pp. 355-358; [Non-Patent Document 4] Ralph, M. S. et al., Proceedings of the National Academy of Sciences of the United States of America, vol. 99, 351 (2002).
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Как указано выше, презентация антигена, вызывающая патологические состояния, обусловленные антиген-презентующими клетками, сопровождается аутоиммунными заболеваниями, аллергическими заболеваниями, тканевыми воспалительными заболеваниями, реакциями отторжения, возникающими после трансплантации органа или костного мозга, и тому подобным. Поэтому считается, что аномальная или чрезмерная иммунная реакция может быть подавлена ингибированием экспрессии антиген-презентующих молекул или модифицированием указанной презентации антигена антиген-презентующими клетками. Однако в настоящее время такое соединение все еще неизвестно.
Считается, что презентация антигена является функцией, специфичной к иммунной системе, и что вещество, специфически ингибирующее указанное действие, чтобы ингибировать или модифицировать презентацию антигена, не оказывает действия на системы, иные чем иммунная система, то есть не проявляет побочных эффектов известных в настоящее время иммуносупрессивных средств.
Кроме того, считается, что при угнетении созревания дендритных клеток, презентующих антигены, увеличивается количество незрелых дендритных клеток, в результате чего создается иммунологическая толерантность. Однако такое соединение все еще неизвестно.
Целью настоящего изобретения является создание иммуносупрессивного средства или индуктора иммунологической толерантности для подавления вредной иммунной реакции с незначительными побочными эффектами ингибированием или модифицированием презентации антигенов.
В результате интенсивных исследований, направленных на достижение указанной цели, авторы настоящего изобретения нашли, что производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины ингибирует презентацию антигенов, вызываемую антиген-презентующими клетками, и обладает иммуносупрессивной активностью. Авторы нашли также, что поскольку указанное соединение подавляет реакцию на пролиферацию лимфоцитов, то его можно использовать в качестве средства для лечения или профилактики иммунологических заболеваний, что дополняет объем настоящего изобретения.
Кроме того, авторы нашли также, что поскольку указанное соединение подавляет экспрессию антиген-презентующих конъюгированных молекул, связанных с презентацией антигенов, то его можно использовать в качестве индуктора иммунологической толерантности, что дополняет объем настоящего изобретения. Они также нашли, что поскольку указанное соединение обладает цитотоксической активностью по отношению к клеткам клеточной линии лимфомы, его можно использовать в качестве противоопухолевого средства, что дополняет объем настоящего изобретения.
Таким образом, настоящее изобретение относится к следующему:
1) Производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины, представленное следующей общей формулой (1), или его фармацевтически приемлемая соль:
[Формула 1]
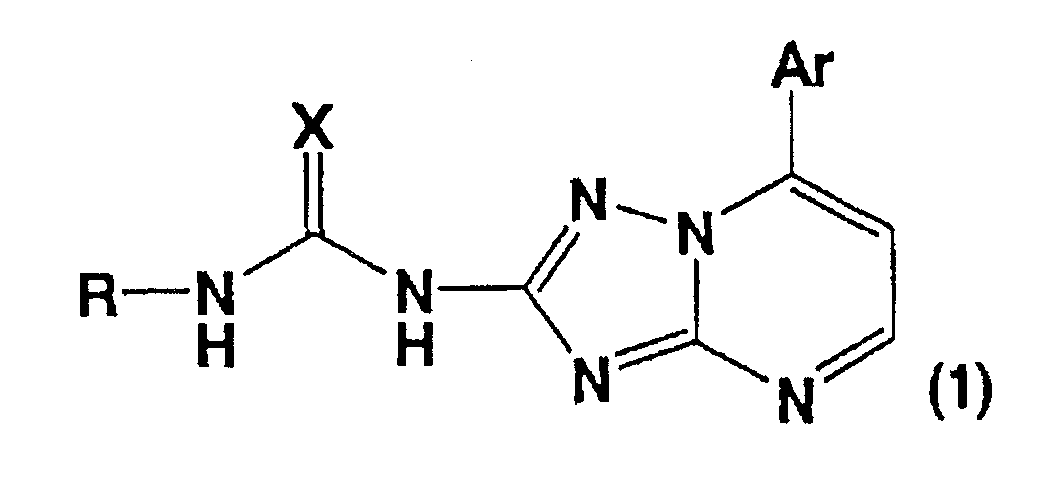
[где Ar представляет собой ароматическую углеводородную группу или ароматическую гетероциклическую группу, содержащую 1-4 гетероатома, которая может содержать заместитель; Х представляет собой O, S, NH, N-CH3 или N-CN; и R представляет собой атом водорода, цианогруппу, неразветвленную, разветвленную или циклическую алкильную группу, которая может содержать заместитель, ароматическую углеводородную группу, которая может содержать заместитель, или 5-7-членную гетероциклическую группу, содержащую 1-4 гетероатома, независимо выбранных из N, O и S, которая может содержать заместитель].
2) Производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по пункту 1) или его фармацевтически приемлемая соль,
где заместитель для Ar в общей формуле (1) представляет собой 1-4 одинаковые или разные группы, выбранные из группы [B] заместителей, состоящей из галогена; гидроксильной группы; оксогруппы; цианогруппы; трифторметильной группы; нитрогруппы; (С1-С6) алкильной группы; алкоксигруппы, представленной формулой О-R1 {где R1 представляет собой (С1-С6) алкильную группу, которая может быть замещена 1-4 одинаковыми или разными группами, выбранными из группы [A] заместителей, состоящей из галогена, гидроксильной группы, оксогруппы, цианогруппы,
трифторметильной группы, трифторметоксигруппы,
(С1-С6) алкоксильной группы,
(С1-С4)алкокси(С1-С4)алкоксильной группы,
2-[2-(С1-С4)алкоксиэтокси]этоксигруппы,
2-{2-[2-(С1-С4)алкоксиэтокси]этокси}этоксигруппы,
(С1-С7) ацильной группы, (С1-С7) ацилоксигруппы,
(С1-С6) алкилсульфанильной группы,
(С1-С6) алкилсульфинильной группы,
(С1-С6) алкилсульфонильной группы, карбоксильной группы,
(С1-С6) алкоксикарбонильной группы, карбамоильной группы,
N-(С1-С6) алкилкарбамоильной группы,
N,N-ди(С1-С6) алкилкарбамоильной группы,
пирролидин-1-илкарбонильной группы,
пиперидин-1-илкарбонильной группы,
морфолин-4-илкарбонильной группы,
4-метилпиперазин-1-илкарбонильной группы, аминогруппы, представленной формулой NR2R3 (где каждый из R2 и R3 независимо представляет собой атом водорода, (С1-С6) алкильную группу, (С1-С7) ацильную группу, (С1-С6) алкоксикарбонильную группу или бензилоксикарбонильную группу), ароматической углеводородной группы и 5-7-членного насыщенного или ненасыщенного гетероциклического кольца, в котором оксогруппа или (С1-С6) алкильная группа может быть замещенной и которое содержит 1-4 гетероатома, независимо выбранных из N, О и S};
аминогруппы, представленной формулой NR2R3 (где R2 и R3 имеют такие же значения, как описанные выше);
5-7-членной насыщенной циклической аминогруппы, которая может быть замещенна (С1-С6) алкильной группой и которая может содержать 1-4 гетероатома, независимо выбранных из N, О и S;
этиленоксигруппы и (С1-С2) алкилендиоксигруппы; и
где неразветвленная, разветвленная или циклическая алкильная группа, которая может содержать заместитель, ароматическая углеводородная группа, которая может содержать заместитель, или 5-7-членная гетероциклическая группа, содержащая 1-4 гетероатома, независимо выбранных из N, O и S, которая может содержать заместитель, будучи группой, представленной символом R, является группой, представленной любой из следующих формул (2)-(6):
[Формула 2]

[где R4 представляет собой атом водорода, (C1-C6) алкильную группу, (C2-C10) алкенильную группу, (C2-C10) алкинильную группу, (C1-C4) алкоксиметильную группу, цианогруппу или трифторметильную группу;
R5 представляет собой атом водорода или метильную группу;
и R6 представляет собой атом водорода, (C1-C10) алкильную группу {где указанная алкильная группа может быть замещенной 1-4 одинаковыми или разными заместителями, выбранными из группы [C] заместителей, состоящей из галогена, гидроксильной группы, оксогруппы, (C1-C6) алкоксильной группы,
(C1-C4) алкокси(C1-C4)алкоксильной группы,
галоген(C1-C3)алкильной группы, (C1-C7) ацильной группы,
(C1-C7) ацилоксигруппы, трифторметильной группы, цианогруппы, (C1-C6) алкилсульфанильной группы, фенилсульфанильной группы, толуол-4-сульфанильной группы,
(C1-C6) алкилсульфинильной группы, фенилсульфинильной группы, толуол-4-сульфинильной группы,
(C1-C6) алкилсульфонильной группы, фенилсульфонильной группы, толуол-4-сульфонильной группы, карбоксильной группы,
(C1-C6) алкоксикарбонильной группы, карбамоильной группы,
N-(C1-C6) алкилкарбамоильной группы,
N,N-ди(C1-C6) алкилкарбамоильной группы,
пирролидин-1-илкарбонильной группы,
пиперидин-1-илкарбонильной группы,
морфолин-4-илкарбонильной группы,
4-метилпиперазин-1-илкарбонильной группы,
аминогруппы, представленной формулой NR13R14 (где каждый из R13 и R14 независимо представляет собой атом водорода,
(C1-C6) алкильную группу, (C1-C7) ацильную группу, ацетоксиизобутирильную группу,
(C1-C6) алкоксикарбонильную группу или бензилоксикарбонильную группу), ароматической углеводородной группы и 5-7-членной насыщенной или ненасыщенной гетероциклической группы, содержащей 1-4 гетероатома, независимо выбранных из N, O и S, которая может быть замещена оксогруппой или (C1-C6) алкильной группой},
(C2-C10) алкенильную группу (где указанная алкенильная группа может содержать 1-4 заместителя, выбранных из описанной выше группы [C] заместителей),
(C2-C10) алкинильную группу (где указанная алкинильная группа может содержать 1-4 заместителя, выбранных из описанной выше группы [C] заместителей) или 5-7-членную гетероциклическую группу, содержащую 1-4 гетероатома, независимо выбранных из N, О и S],
[Формула 3]

[где R7 представляет собой атом водорода, (C1-C6) алкильную группу, (C1-C4) алкоксиметильную группу, цианогруппу или трифторметильную группу;
R8 представляет собой 5-7-членную насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-4 гетероатома, независимо выбранных из N, О и S, которая может быть замещена оксогруппой или (C1-C6) алкильной группой;
p представляет собой целое число от 1 до 3; и
q представляет собой целое число от 0 до 3],
[Формула 4]

[где R9 представляет собой атом водорода, (C1-C6) алкильную группу, (C2-C10) алкенильную группу, (C2-C10) алкинильную группу, (C1-C4) алкоксиметильную группу, цианогруппу или трифторметильную группу; и
R10 представляет собой ароматическую углеводородную группу, которая может содержать 1-4 заместителя, выбранных из группы [D] заместителей, состоящей из галогена, гидроксильной группы,
(C1-C6) алкильной группы, (C1-C6) алкоксильной группы,
(С1-C4)алкокси(C1-C4)алкоксильной группы,
(C1-C4)алкокси(С1-C4)алкокси(C1-C4)алкоксильной группы,
тетрагидрофуран-2-илметоксигруппы,
тетрагидропиран-4-илметоксигруппы,
бензилоксигруппы, метилендиоксигруппы, (C1-C7) ацильной группы, трифторметильной группы, трифторметоксигруппы, цианогруппы, нитрогруппы, (C1-C6) алкилсульфанильной группы,
(С1-C6) алкилсульфинильной группы,
(C1-C6) алкилсульфонильной группы,
(C1-C6) алкилсульфонилоксигруппы,
(C1-C6) алкоксикарбонилоксигруппы, бензилоксикарбонилоксигруппы, (C1-C6) алкоксикарбонилметоксигруппы, карбоксильной группы,
(C1-C6) алкоксикарбонильной группы, карбамоильной группы,
N-(C1-C6) алкилкарбамоильной группы,
N,N-ди(C1-C6) алкилкарбамоильной группы,
пирролидин-1-илкарбонильной группы,
пиперидин-1-илкарбонильной группы,
морфолин-4-илкарбонильной группы,
4-метилпиперазин-1-илкарбонильной группы,
пиридин-2-илметоксигруппы, пиридин-3-илметоксигруппы,
пиридин-4-илметоксигруппы и аминогруппы, представленной формулой NR2R3 (где R2 и R3 имеют такие же значения, как описанные выше)],
[Формула 5]

[где Cy представляет собой фенильную группу, (C3-C10) циклоалкильную группу, 1,2,3,4-тетрагидронафталин-1-ильную группу или 5-7-членную гетероциклическую группу, содержащую 1-4 гетероатома, независимо выбранных из N, О и S, которая может быть замещена 1-4 одинаковыми или разными группами, выбранными из группы [Е] заместителей, состоящей из галогена,
гидроксильной группы, карбоксильной группы,
(C1-C6) алкильной группы, фенильной группы, бензильной группы, (C1-C6) алкоксильной группы, (C1-C7) ацильной группы,
(C1-C7) ацилоксигруппы, трифторметильной группы,
трифторметоксигруппы, цианогруппы,
(C1-C6) алкоксикарбонильной группы, карбамоильной группы,
N-(C1-C6) алкилкарбамоильной группы,
N,N-ди(C1-C6) алкилкарбамоильной группы,
пирролидин-1-илкарбонильной группы,
пиперидин-1-илкарбонильной группы,
морфолин-4-илкарбонильной группы,
4-метилпиперазин-1-илкарбонильной группы и аминогруппы, представленной формулой NR2R3 (где R2 и R3 имеют такие же значения, как описанные выше)], и
[Формула 6]

[где Y представляет собой одинарную связь или α-аминокислотный остаток, боковая цепь которого может быть защищена;
R11 представляет собой боковую цепь аминокислоты, могущую быть защищенной защитной группой; и
R12 представляет собой гидроксильную группу, (C1-C6) алкоксильную группу, бензилоксигруппу, аминогруппу, гидроксиламиногруппу, (C1-C6) алкиламиногруппу, которая может быть замещена 1-2 одинаковыми или разными заместителями, выбранными из описанной выше группы [С] заместителей, ди(C1-C6) алкиламиногруппу, которая может быть замещена 1-2 одинаковыми или разными заместителями, выбранными из описанной выше группы [С] заместителей, циклогексилметиламиногруппу, фениламиногруппу, которая может быть замещена 1-2 одинаковыми или разными заместителями, выбранными из описанной выше группы [С] заместителей, или 5-7-членную насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-4 гетероатома, независимо выбранных из N, О и S, которая может быть замещена 1-4 одинаковыми или разными группами, выбранными из группы [F] заместителей, состоящей из оксогруппы, (C1-C6) алкильной группы, фенильной группы и бензильной группы].
3) Производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины по пункту 2), или его фармацевтически приемлемая соль,
где в описанной выше общей формуле (1) Ar представляет собой фенильную группу, которая может содержать 1-4 одинаковых или разных заместителей, выбранных из группы [G] заместителей, состоящей из фтора, хлора, гидроксильной группы,
метильной группы, цианогруппы, трифторметильной группы,
метоксигруппы, этоксигруппы, изопропоксигруппы,
циклопропоксигруппы, изобутоксигруппы, бензилоксигруппы,
2-метоксиэтоксигруппы, 2-(2-метоксиэтокси)этоксигруппы,
2-[2-(2-метоксиэтокси)этокси]этоксигруппы,
тетрагидрофуран-2-илметоксигруппы,
тетрагидропиран-4-илметоксигруппы,
2-[1,3]диоксан-2-илэтоксигруппы, 2-диметиламиноэтоксигруппы,
3-диметиламинопропильной группы, 2-диэтиламиноэтоксигруппы,
3-диэтиламинопропильной группы,
2-морфолин-4-ил-2-оксоэтоксигруппы,
2-пиперидин-1-илэтоксигруппы, 3-пиперидин-1-илпропоксигруппы,
2-морфолин-4-илэтоксигруппы, 3-морфолин-4-илпропоксигруппы,
2-(1-метилпиперидин-4-ил)этоксигруппы,
3-(1-метилпиперидин-4-ил)пропоксигруппы,
пиридин-2-илметоксигруппы, пиридин-3-илметоксигруппы,
пиридин-4-илметоксигруппы, аминогруппы, диметиламиногруппы, диэтиламиногруппы, ацетиламиногруппы, пирролидин-1-ильной группы, пиперидин-1-ильной группы, 4-метилпиперазин-1-ильной группы, морфолин-4-ильной группы и метилендиоксигруппы,
2,3-дигидробензофуран-5-ильную группу, пиридин-3-ильную группу, пиридин-4-ильную группу, 1-оксипиридин-3-ильную группу,
1-оксипиридин-4-ильную группу, тиофен-2-ильную группу или тиофен-3-ильную группу;
X представляет собой O или S; и
что касается R в формуле (2), то R4 представляет собой атом водорода, метильную группу, этильную группу, изопропильную группу, метоксиметильную группу или трифторметильную группу, R5 представляет собой атом водорода и R6 представляет собой (C1-C6) алкильную группу, которая может содержать 1-2 одинаковых или разных заместителя, выбранных из группы [Н] заместителей, состоящей из фтора, трифторметильной группы, гидроксильной группы, метоксигруппы, этоксигруппы, н-пропоксигруппы, изопропоксигруппы, изобутоксигруппы, трет-бутоксигруппы, 2-метоксиэтоксигруппы, фторметоксигруппы, дифторметоксигруппы, трифторметоксигруппы, 2,2,2-трифторэтоксигруппы, 1,1,2,2-тетрафторэтоксигруппы, ацетильной группы, пропионильной группы, цианогруппы, метансульфонильной группы, этансульфонильной группы, N,N-диметилкарбамоильной группы, пирролидин-1-илкарбонильной группы, пиперидин-1-илкарбонильной группы, морфолин-4-илкарбонильной группы, тетрагидрофуран-2-ильной группы, тетрагидропиран-4-ильной группы и 2-метил[1,3]диоксолан-2-ильной группы,
в формуле (3) R7 представляет собой атом водорода, метильную группу, этильную группу, изопропильную группу, метоксиметильную группу или трифторметильную группу, R8 представляет собой тетрагидрофуран-2-ильную группу, тетрагидропиран-4-ильную группу или 2-метил[1,3]диоксолан-2-ильную группу и сумма p и q равна целому числу 4 или менее, или
в формуле (4) R9 представляет собой атом водорода, метильную группу, этильную группу, изопропильную группу, метоксиметильную группу или трифторметильную группу и R10 представляет собой фенильную группу, содержащую 1-4 заместителя, выбранных из группы, состоящей из гидроксильной группы, метоксигруппы, трифторметоксигруппы, метилендиоксигруппы и метансульфонилоксигруппы.
4) Производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины по любому из пунктов 1)-3) или его фармацевтически приемлемая соль,
где в описанной выше общей формуле (1) Ar представляет собой 3-гидроксифенильную группу, 3-метоксифенильную группу, 4-гидроксифенильную группу, 4-метоксифенильную группу, 3,4-метилендиоксифенильную группу,
3-(пиридин-3-илметокси)фенильную группу,
4-(тетрагидропиран-4-илметокси)фенильную группу или
тиофен-2-ильную группу;
X представляет собой О; и
R представляет собой изопропильную группу,
2-метокси-1-метилэтильную группу,
2-этокси-1-метилэтильную группу,
2-пропокси-1-метилэтильную группу,
3-метокси-1-метилпропильную группу,
3-этокси-1-метилпропильную группу,
4-метокси-1-метилбутильную группу,
1-метил-2-трифторметоксиэтильную группу,
1-метил-2-(2,2,2-трифторэтокси)этильную группу,
1-метил-3-трифторметоксипропильную группу,
4-гидрокси-1,4-диметилпентильную группу,
5-гидрокси-1,5-диметилгексильную группу,
5-метокси-1,5-диметилгексильную группу,
1-метил-3-(тетрагидропиран-4-ил)пропильную группу,
1-метил-2-(тетрагидропиран-4-илокси)этильную группу,
1-метил-2-(тетрагидропиран-4-илметокси)этильную группу,
1-метил-3-(2-метил[1,3]диоксолан-2-ил)пропильную группу,
1-метил-4-оксопентильную группу,
1-(3-гидроксифенил)этильную группу,
1-(3-метоксифенил)этильную группу,
1-(3,4-метилендиоксифенил)этильную группу,
1-(3,4,5-триметоксифенил)этильную группу или
1-(3-метансульфонилоксифенил)этильную группу.
5) Производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины по пункту 4) или его фармацевтически приемлемая соль, где R в описанной выше общей формуле (1) представляет собой изопропильную группу, (S)-2-метокси-1-метилэтильную группу,
(S)-3-метокси-1-метилпропильную группу,
(S)-3-этокси-1-метилпропильную группу,
(S)-4-метокси-1-метилбутильную группу,
(S)-4-гидрокси-1,4-диметилпентильную группу,
(S)-5-гидрокси-1,5-диметилгексильную группу,
(S)-1-(3-метоксифенил)этильную группу,
(S)-1-(3,4-метилендиоксифенил)этильную группу или
(S)-1-(3,4,5-триметоксифенил)этильную группу.
6) 1-изопропил-3-(7-тиофен-2-ил[1,2,4]триазоло[1,5-a]пиримидин-2-ил)мочевина;
(S)-1-(3-этокси-1-метилпропил)-3-[7-(3,4-метилендиоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевина;
(S)-1-(4-метокси-1-метилбутил)-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевина;
(S)-1-(4-гидрокси-1,4-диметилпентил)-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевина;
(S)-1-(5-гидрокси-1,5-диметилгексил)-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевина;
(S)-1-(5-гидрокси-1,5-диметилгексил)-3-{7-[3-(пиридин-3-илметокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевина;
(S)-1-(5-гидрокси-1,5-диметилгексил)-3-[(7-тиофен-2-ил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевина;
(S)-1-[1-(3-метоксифенил)этил]-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевина;
(S)-1-[7-(3,4-метилендиоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-[1-(3-метоксифенил)этил]мочевина;
(S)-1-[7-(3,4-метилендиоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-[1-(3,4,5-триметоксифенил)этил]мочевина;
(S)-1-(7-тиофен-2-ил[1,2,4]триазоло[1,5-a]пиримидин-2-ил)-3-[1-(3,4,5-триметоксифенил)этил]мочевина;
(S)-1-[1-(3,4-метилендиоксифенил)этил]-3-{7-[3-(пиридин-3-илметокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-ил}мочевина или их фармацевтически приемлемая соль.
7) Лекарственное средство, которое содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
8) Ингибитор презентации антигена, который содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
9) иммуносупрессивное средство, которое содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
10) Ингибитор пролиферации лимфоцитов, который содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
11) Ингибитор роста/созревания клеток, который содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
12) Средство для лечения или профилактики реакции отторжения трансплантата или реакции «трансплантат против хозяина», которое содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
13) Индуктор иммунологической толерантности, который содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
14) Средство для лечения или профилактики аутоиммунного заболевания, которое содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
15) Средство для лечения или профилактики ревматоидного артрита, рассеянного склероза, системной красной волчанки, дискоидной красной волчанки, синдрома Шегрена, болезни Крона, язвенного колита, идиопатической тромбоцитемии, апластической анемии, аутоиммунного гепатита, инсулинзависимого сахарного диабета, тяжелой псевдопаралитической миастении, полимиозита, склеродермы, смешанной соединительнотканной болезни, анкилозирующего спондилита или хронического тироидита, которое содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
16) Средство для лечения или профилактики аллергического заболевания, которое содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
17) Средство для лечения или профилактики атопического дерматита, поллиноза, контактной гиперчувствительности, астмы, псориаза или анафилаксии, которое содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
18) Средство для лечения или профилактики воспалительного заболевания, которое содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
19) Средство для лечения или профилактики болезни Бехчета, полиартериита, саркоидоза, гломерулонефрита, нефротического синдрома, резистентного ангиита или синдрома Вегенера, которое содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
20) Противоопухолевое лекарственное средство, которое содержит в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по любому из пунктов 1)-6) или его фармацевтически приемлемую соль.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины по настоящему изобретению представлено показанной выше формулой (1) [где Ar представляет собой ароматическую углеводородную группу или ароматическую гетероциклическую группу, содержащую 1-4 гетероатома, которая может содержать заместитель; Х представляет собой O, S, NH, N-CH3 или N-CN; и R представляет собой атом водорода, цианогруппу, неразветвленную, разветвленную или циклическую алкильную группу, которая может содержать заместитель, ароматическую углеводородную группу, которая может содержать заместитель, или 5-7-членную гетероциклическую группу, содержащую 1-4 гетероатома, независимо выбранных из N, O и S, которая может содержать заместитель].
«Ароматическую углеводородную группу» в настоящем изобретении особо не ограничивают и ароматическое гетероциклическое кольцо, содержащее атом, выбранный из N, O и S, может быть конденсировано. Предпочтительным примером такой ароматической углеводородной группы может быть (С6-С14) ароматическая углеводородная группа. Конкретные примеры могут включать фенильную группу, нафталин-1-ильную группу и нафталин-2-ильную группу. Особенно предпочтительные примеры могут включать фенильную группу и нафталин-1-ильную группу. Наиболее предпочтительным примером является фенильная группа.
«Ароматическую гетероциклическую группу, содержащую 1-4 гетероатома», представленную символом Ar в общей формуле (1) настоящего изобретения, особо не ограничивают. Предпочтительно она представляет собой 5- или 6-членную ароматическую гетероциклическую группу, независимо выбранную из N, O и S. Конкретные примеры могут включать фуран-2-ильную группу, фуран-3-ильную группу, тиофен-2-ильную группу, тиофен-3-ильную группу, оксазол-5-ильную группу, изоксазол-5-ильную группу, тиазол-5-ильную группу, пиридин-2-ильную группу, пиридин-3-ильную группу, пиридин-4-ильную группу, пиримидин-4-ильную группу, пиразин-2-ильную группу и [1,3,5]триазин-2-ильную группу. Особенно предпочтительные примеры могут включать фуран-2-ильную группу, фуран-3-ильную группу, тиофен-2-ильную группу, тиофен-3-ильную группу, пиридин-3-ильную группу, пиридин-4-ильную группу и пиримидин-4-ильную группу. Еще более предпочтительные примеры могут включать тиофен-2-ильную группу, пиридин-3-ильную группу и пиридин-4-ильную группу.
Примеры заместителя, используемого в ароматической углеводородной группе или ароматической гетероциклической группе, содержащей 1-4 гетероатома, которая может иметь заместитель и которая представлена в общей формуле (1) настоящего изобретения символом Ar, могут включать 1-4 одинаковые или разные группы, выбранные из группы [В] заместителей, состоящей из галогена; гидроксильной группы; оксогруппы; цианогруппы; трифторметильной группы; нитрогруппы; (С1-С6) алкильной группы; алкоксигруппы, представленной формулой ОR1 {где R1 представляет собой (С1-С6) алкильную группу, которая может быть замещена 1-4 одинаковыми или разными группами, выбранными из группы [A] заместителей, состоящей из галогена, гидроксильной группы, оксогруппы, цианогруппы, трифторметильной группы, трифторметоксигруппы,
(С1-С6) алкоксильной группы,
(С1-С4)алкокси(С1-С6)алкоксильной группы,
2-[2-(С1-С4)алкоксиэтокси]этоксигруппы,
2-{2-[2-(С1-С4)алкоксиэтокси]этокси}этоксигруппы,
(С1-С7) ацильной группы, (С1-С7) ацилоксигруппы,
(С1-С6) алкилсульфанильной группы,
(С1-С6) алкилсульфинильной группы,
(С1-С6) алкилсульфонильной группы, карбоксильной группы,
(С1-С6) алкоксикарбонильной группы, карбамоильной группы,
N-(С1-С6) алкилкарбамоильной группы,
N,N-ди(С1-С6) алкилкарбамоильной группы,
пирролидин-1-илкарбонильной группы,
пиперидин-1-илкарбонильной группы,
морфолин-4-илкарбонильной группы,
4-метилпиперазин-1-илкарбонильной группы, аминогруппы,
представленной формулой NR2R3 (где каждый из R2 и R3 независимо представляет собой атом водорода, (С1-С6) алкильную группу,
(С1-С7) ацильную группу, (С1-С6) алкоксикарбонильную группу или бензилоксикарбонильную группу), ароматической углеводородной группы и 5-7-членного насыщенного или ненасыщенного гетероциклического кольца, содержащего 1-4 гетероатома, независимо выбранных из N, О и S, в котором оксогруппа или (С1-С6) алкильная группа может быть замещенной};
аминогруппы, представленной формулой NR2R3 (где R2 и R3 имеют такие же значения, как описанные выше); 5-7-членной насыщенной циклической аминогруппы, которая может быть замещена
(С1-С6) алкильной группой и которая может содержать 1-2 гетероатома, независимо выбранных из N, О и S; этиленоксигруппы и (С1-С2) алкилендиоксигруппы.
«Галоген» при использовании в настоящем изобретении означает фтор, хлор, бром или иод. Предпочтительным является фтор или хлор.
«Оксогруппа», используемая в настоящем изобретении, образует карбонильную группу, когда является замещенной углеродным атомом. Будучи замещенной гетероатомом, она образует оксидную форму, такую как N-оксид или сульфоксид.
«(С1-С6) алкильная группа» при использовании в настоящем изобретении означает неразветвленную, разветвленную или циклическую алкильную группу, содержащую 1-6 углеродных атомов, если не указано иное. Примеры такой (С1-С6) алкильной группы могут включать метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, трет-бутильную группу, н-пентильную группу, изопентильную группу, 2-метилбутильную группу, неопентильную группу, 1-этилпропильную группу, н-гексильную группу,
4-метилпентильную группу, 3-метилпентильную группу,
2-метилпентильную группу, 1-метилпентильную группу,
3,3-диметилбутильную группу, 2,2-диметилбутильную группу,
1,1-диметилбутильную группу, 1,2-диметилбутильную группу,
1,3-диметилбутильную группу, 2,3-диметилбутильную группу,
2-этилбутильную группу, циклопропильную группу,
циклопентильную группу и циклогексильную группу.
Предпочтительные примеры могут включать метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу и трет-бутильную группу.
Более предпочтительные примеры могут включать метильную группу, этильную группу и изопропильную группу.
«(С1-С6) алкоксильная группа», используемая в настоящем изобретении, означает группу, образованную присоединением описанной выше (С1-С6) алкильной группы к атому кислорода.
Примеры такой (С1-С6) алкоксильной группы могут включать метоксигруппу, этоксигруппу, н-пропоксигруппу,
изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу,
трет-бутоксигруппу, н-пентилоксигруппу, изопентилоксигруппу, метилбутоксигруппу, неопентилоксигруппу, 1-этилпропоксигруппу, гексилоксигруппу, 4-метилпентилоксигруппу,
3-метилпентилоксигруппу, 2-метилпентилоксигруппу,
1-метилпентилоксигруппу, 3,3-диметилбутоксигруппу,
2,2-диметилбутоксигруппу, 1,1-диметилбутоксигруппу,
1,2-диметилбутоксигруппу, 1,3-диметилбутоксигруппу,
2,3-диметилбутоксигруппу, 2-этилбутоксигруппу,
циклопропоксигруппу, циклопентилоксигруппу и
циклогексилоксигруппу.
Предпочтительные примеры могут включать метоксигруппу, этоксигруппу, н-пропоксигруппу,
изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу и
трет-бутоксигруппу.
Более предпочтительные примеры могут включать метоксигруппу и этоксигруппу.
«(С1-С4)алкокси(С1-С4)алкоксильная группа», используемая в настоящем изобретении, означает неразветвленную или разветвленную алкоксильную группу, содержащую 1-4 углеродных атома, выбранную из описанных выше (С1-С6) алкоксильных групп, которая является замещенной у атомов углерода алкоксильной группы с 1-4 атомами углерода, выбранной из описанных выше (С1-С6) алкоксильных групп.
Примеры указанной (С1-С4)алкокси(С1-С4)алкоксильной группы могут включать метоксиметоксигруппу, этоксиметоксигруппу,
изопропоксиметоксигруппу, трет-бутоксиметоксигруппу,
1-метоксиэтоксигруппу, 2-метоксиэтоксигруппу,
1-этоксиэтоксигруппу, 2-этоксиэтоксигруппу,
2-изопропоксиэтоксигруппу, 2-(трет-бутокси)этоксигруппу,
3-метоксипропоксигруппу, 3-этоксипропоксигруппу,
3-изопропоксипропоксигруппу, 3-(трет-бутокси)пропоксигруппу,
4-метоксибутоксигруппу, 4-этоксибутоксигруппу,
4-изопропоксибутоксигруппу, 4-(трет-бутокси)бутоксигруппу,
1-метокси-1-метилэтоксигруппу, 2-метокси-1,1-диметилэтоксигруппу и 2-метокси-2-метилпропоксигруппу.
Предпочтительные примеры могут включать 2-метоксиэтоксигруппу, 2-(трет-бутокси)этоксигруппу и 2-метокси-2-метилпропоксигруппу.
Более предпочтительной является метоксиэтоксигруппа.
«2-[2-(C1-C4) алкоксиэтокси]этоксигруппа», используемая в настоящем изобретении, означает группу, в которой неразветвленная или разветвленная алкоксильная группа, содержащая 1-4 углеродных атома, является заместителем у концевого атома углерода этоксиэтоксигруппы, описанной в связи с указанной выше (С1-С4)алкокси(С1-С4)алкоксильной группе. Примеры указанной 2-[2-(С1-C4) алкоксиэтокси]этоксигруппы могут включать 2-(2-метоксиэтокси)этоксигруппу, 2-(2-этоксиэтокси)этоксигруппу, 2-(2-изопропоксиэтокси)этоксигруппу и
2-[2-(трет-бутокси)этокси]этоксигруппу.
Предпочтительные примеры могут включать 2-(2-метоксиэтокси)этоксигруппу и 2-[2-(трет-бутокси)этокси]этоксигруппу.
Более предпочтительной является 2-(2-метоксиэтокси)этоксигруппа.
«2-{2-[2-(С1-C4) алкоксиэтокси]этокси}этоксигруппа», используемая в настоящем изобретении, означает группу, в которой неразветвленная или разветвленная алкоксильная группа, содержащая 1-4 углеродных атома, является заместителем у концевого атома углерода этоксиэтоксигруппы, описанной в связи с указанной выше 2-[2-(С1-C4) алкоксиэтокси]этоксигруппой.
Примеры указанной 2-{2-[2-(C1-C4) алкоксиэтокси]этокси}этоксигруппы могут включать 2-[2-(2-метоксиэтокси)этокси]этоксигруппу,
2-[2-(2-этоксиэтокси)этокси]этоксигруппу,
2-[2-(2-изопропоксиэтокси)этокси]этоксигруппу и
2-{2-[2-(трет-бутокси)этокси]этокси}этоксигруппу.
Предпочтительные примеры могут включать 2-[2-(2-метоксиэтокси)этокси]этоксигруппу и 2-{2-[2-(трет-бутокси)этокси]этокси}этоксигруппу.
Более предпочтительной является 2-[2-(2-метоксиэтокси)этокси]этоксигруппа.
Конкретные примеры «(C1-C7) ацильной группы», используемой в настоящем изобретении, могут включать формильную группу, ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу, валерильную группу, изовалерильную группу, пивалоильную группу, гексаноильную группу, циклопропилкарбонильную группу, циклопентилкарбонильную и циклогексилкарбонильную группу. Предпочтительные примеры могут включать ацетильную группу, пропионильную группу и пивалоильную группу. Более предпочтительной является ацетильная группа.
«(C1-C7) ацилоксигруппа», используемая в настоящем изобретении, означает группу, образованную присоединением описанной выше (C1-C7) ацильной группы к атому кислорода. Примеры указанной (C1-C7) ацилоксигруппы могут включать формилоксигруппу, ацетоксигруппу, пропионилоксигруппу, бутирилоксигруппу, изобутирилоксигруппу, валерилоксигруппу, изовалерилоксигруппу, пивалоилоксигруппу, гексаноилоксигруппу, циклопропилкарбонилоксигруппу, циклопентилкарбонилоксигруппу и циклогексилкарбонилоксигруппу. Предпочтительные примеры могут включать ацетоксигруппу, пропионилоксигруппу и пивалоилоксигруппу. Более предпочтительной является ацетоксигруппа.
«(C1-C6) алкилсульфанильная группа», используемая в настоящем изобретении, означает группу, образованную присоединением описанной выше (C1-C6) алкильной группы к атому серы. Примеры указанной (C1-C6) алкилсульфанильной группы могут включать метилсульфанильную группу, этилсульфанильную группу, н-пропилсульфанильную группу, изопропилсульфанильную группу, н-бутилсульфанильную группу, изобутилсульфанильную группу, трет-бутилсульфанильную группу, пентилсульфанильную группу, изопентилсульфанильную группу, 2-метилбутилсульфанильную группу, неопентилсульфанильную группу, 1-этилпропилсульфанильную группу, гексилсульфанильную группу, 4-метилпентилсульфанильную группу, 3-метилпентилсульфанильную группу, 2-метилпентилсульфанильную группу, 1-метилпентилсульфанильную группу,
3,3-диметилбутилсульфанильную группу,
2,2-диметилбутилсульфанильную группу,
1,1-диметилбутилсульфанильную группу,
1,2-диметилбутилсульфанильную группу,
1,3-диметилбутилсульфанильную группу,
2,3-диметилбутилсульфанильную группу,
2-этилбутилсульфанильную группу,
циклопропилсульфанильную группу, циклопентилсульфанильную группу или циклогексилсульфанильную группу.
Предпочтительные примеры могут включать метилсульфанильную группу, этилсульфанильную группу, пропилсульфанильную группу, изопропилсульфанильную группу, бутилсульфанильную группу, изобутилсульфанильную группу и трет-бутилсульфанильную группу. Более предпочтительные примеры могут включать метилсульфанильную группу и этилсульфанильную группу.
«(C1-C6) алкилсульфинильная группа», используемая в настоящем изобретении, означает группу, образованную присоединением описанной выше (C1-C6) алкильной группы к сульфинильной группе (S=О). Примеры указанной (C1-C6) алкилсульфинильной группы могут включать метилсульфинильную группу, этилсульфинильную группу, н-пропилсульфинильную группу, изопропилсульфинильную группу, н-бутилсульфинильную группу, изобутилсульфинильную группу, трет-бутилсульфинильную группу, н-пентилсульфинильную группу, изопентилсульфинильную группу, 2-метилбутилсульфинильную группу, неопентилсульфинильную группу, 1-этилпропилсульфинильную группу, н-гексилсульфинильную группу, 4-метилпентилсульфинильную группу, 3-метилпентилсульфинильную группу, 2-метилпентилсульфинильную группу, 1-метилпентилсульфинильную группу, 3,3-диметилбутилсульфинильную группу, 2,2-диметилбутилсульфинильную группу, 1,1-диметилбутилсульфинильную группу,
1,2-диметилбутилсульфинильную группу,
1,3-диметилбутилсульфинильную группу,
2,3-диметилбутилсульфинильную группу, 2-этилбутилсульфинильную группу, циклопропилсульфинильную группу, циклопентилсульфинильную группу или циклогексилсульфинильную группу.
Предпочтительные примеры могут включать метилсульфинильную группу, этилсульфинильную группу,
н-пропилсульфинильную группу, изопропилсульфинильную группу,
н-бутилсульфинильную группу, изобутилсульфинильную группу и трет-бутилсульфинильную группу.
Более предпочтительные примеры могут включать метилсульфинильную группу и этилсульфинильную группу.
«(C1-C6) алкилсульфонильная группа», используемая в настоящем изобретении, означает группу, образованную присоединением описанной выше (C1-C6) алкильной группы к сульфонильной группе (O=S=O). Примеры указанной (C1-C6) алкилсульфонильной группы могут включать метилсульфонильную группу, этилсульфонильную группу, н-пропилсульфонильную группу, изопропилсульфонильную группу, н-бутилсульфонильную группу, изобутилсульфонильную группу, трет-бутилсульфонильную группу, н-пентилсульфонильную группу, изопентилсульфонильную группу, 2-метилбутилсульфонильную группу, неопентилсульфонильную группу, 1-этилпропилсульфонильную группу, н-гексилсульфонильную группу, 4-метилпентилсульфонильную группу, 3-метилпентилсульфонильную группу, 2-метилпентилсульфонильную группу, 1-метилпентилсульфонильную группу, 3,3-диметилбутилсульфонильную группу, 2,2-диметилбутилсульфонильную группу,
1,1-диметилбутилсульфонильную группу,
1,2-диметилбутилсульфонильную группу,
1,3-диметилбутилсульфонильную группу,
2,3-диметилбутилсульфонильную группу,
2-этилбутилсульфонильную группу,
циклопропилсульфонильную группу, циклопентилсульфонильную группу или циклогексилсульфонильную группу.
Предпочтительные примеры могут включать метилсульфонильную группу, этилсульфонильную группу, н-пропилсульфонильную группу, изопропилсульфонильную группу, н-бутилсульфонильную группу, изобутилсульфонильную группу и трет-бутилсульфонильную группу. Более предпочтительные примеры могут включать метилсульфонильную группу и этилсульфонильную группу.
«(C1-C6) алкоксикарбонильная группа», используемая в настоящем изобретении, означает группу, образованную присоединением описанной выше (C1-C6) алкоксильной группы к карбонильной группе (C=О). Конкретные примеры указанной (C1-C6) алкоксикарбонилььной группы могут включать метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, изопропоксикарбонильную группу, н-бутоксикарбонильную группу, изобутоксикарбонильную группу, трет-бутоксикарбонильную группу, н-пентилоксикарбонильную группу,
изопентилоксикарбонильную группу,
2-метилбутоксикарбонильную группу,
неопентилоксикарбонильную группу,
1-этилпропоксикарбонильную группу,
н-гексилоксикарбонильную группу,
4-метилпентилоксикарбонильную группу,
3-метилпентилоксикарбонильную группу,
2-метилпентилоксикарбонильную группу,
1-метилпентилоксикарбонильную группу,
3,3-диметилбутоксикарбонильную группу,
2,2-диметилбутоксикарбонильную группу,
1,1-диметилбутоксикарбонильную группу,
1,2-диметилбутоксикарбонильную группу,
1,3-диметилбутоксикарбонильную группу,
2,3-диметилбутоксикарбонильную группу,
2-этилбутоксикарбонильную группу,
циклопропоксикарбонильную группу, циклопентилоксикарбонильную группу или циклогексилоксикарбонильную группу.
Предпочтительные примеры могут включать метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, изопропоксикарбонильную группу, н-бутоксикарбонильную группу, изобутоксикарбонильную группу и трет-бутоксикарбонильную группу. Более предпочтительные примеры могут включать этоксикарбонильную группу и трет-бутоксикарбонильную группу.
«N-(C1-C6) алкилкарбамоильная группа», используемая в настоящем изобретении, означает карбамоильную группу, в которой атом азота монозамещен описанной выше (C1-C6) алкильной группой. Примеры указанной N-(C1-C6) алкилкарбамоильной группы могут включать метилкарбамоильную группу, этилкарбамоильную группу, н-пропилкарбамоильную группу, изопропилкарбамоильную группу, н-бутилкарбамоильную группу, изобутилкарбамоильную группу, трет-бутилкарбамоильную группу, н-пентилкарбамоильную группу, изопентилкарбамоильную группу, 2-метилбутилкарбамоильную группу, неопентилкарбамоильную группу, 1-этилпропилкарбамоильную группу, н-гексилкарбамоильную группу, 4-метилпентилкарбамоильную группу, 3-метилпентилкарбамоильную группу, 2-метилпентилкарбамоильную группу, 1-метилпентилкарбамоильную группу,
3,3-диметилбутилкарбамоильную группу,
2,2-диметилбутилкарбамоильную группу,
1,1-диметилбутилкарбамоильную группу,
1,2-диметилбутилкарбамоильную группу,
1,3-диметилбутилкарбамоильную группу,
2,3-диметилбутилкарбамоильную группу,
2-этилбутилкарбамоильную группу,
циклопропилкарбамоильную группу,
циклопентилкарбамоильную группу или
циклогексилкарбамоильную группу.
Предпочтительные примеры могут включать метилкарбамоильную группу, этилкарбамоильную группу,
н-пропилкарбамоильную группу, изопропилкарбамоильную группу,
н-бутилкарбамоильную группу, изобутилкарбамоильную группу и трет-бутилкарбамоильную группу.
Более предпочтительные примеры могут включать метилкарбамоильную группу и этилкарбамоильную группу.
«N,N-ди(C1-C6) алкилкарбамоильная группа», используемая в настоящем изобретении, означает карбамоильную группу, в которой атом азота дизамещен описанной выше (C1-C6) алкильной группой. Примеры указанной N,N-ди(C1-C6) алкилкарбамоильной группы могут включать диметилкарбамоильную группу, диэтилкарбамоильную группу, ди(н-пропил)карбамоильную группу,
диизопропилкарбамоильную группу,
ди(н-бутил)карбамоильную группу, диизобутилкарбамоильную группу, ди(трет-бутил)карбамоильную группу,
ди(н-пентил)карбамоильную группу,
диизопентилкарбамоильную группу,
ди(2-метилбутил)карбамоильную группу,
динеопентилкарбамоильную группу,
ди(1-этилпропил)карбамоильную группу,
ди(н-гексил)карбамоильную группу,
ди(4-метилпентил)карбамоильную группу,
ди(3-метилпентил)карбамоильную группу,
ди(2-метилпентил)карбамоильную группу,
ди(1-метилпентил)карбамоильную группу,
бис(3,3-диметилбутил)карбамоильную группу,
дициклопропилкарбамоильную группу,
дициклопентилкарбамоильную группу или
дициклогексилкарбамоильную группу.
Предпочтительные примеры могут включать диметилкарбамоильную группу, диэтилкарбамоильную группу, ди(н-пропил)карбамоильную группу, диизопропилкарбамоильную группу и ди(н-бутил)карбамоильную группу. Более предпочтительные примеры могут включать диметилкарбамоильную группу и диэтилкарбамоильную группу.
Что касается выражения «5-7-членная насыщенная или ненасыщенная гетероциклическая группа, содержащая 1-4 гетероатома, независимо выбранных из N, O и S» в настоящем изобретении, то примеры указанной насыщенной гетероциклической группы могут включать тетрагидрофуран-2-ильную группу, тетрагидрофуран-3-ильную группу, тетрагидропиран-4-ильную группу, [1,3]диоксолан-2-ильную группу, [1,3]диоксан-2-ильную группу, пирролидин-1-ильную группу, пиперидин-1-ильную группу, пиперидин-4-ильную группу,
азепан-1-ильную группу, морфолин-4-ильную группу,
тиоморфолин-4-ильную группу, оксазолидин-3-ильную группу,
изоксазолидин-2-ильную группу, тиазолидин-3-ильную группу,
имидазолидин-1-ильную группу и пиперазин-1-ильную группу.
Примеры ненасыщенной гетероциклической группы могут включать фуран-2-ильную группу, фуран-3-ильную группу, тиофен-2-ильную группу, тиофен-3-ильную группу, оксазол-5-ильную группу, изоксазол-5-ильную группу, тиазол-5-ильную группу,
пиррол-1-ильную группу, пиридин-2-ильную группу,
пиридин-3-ильную группу, пиридин-4-ильную группу,
пиримидин-4-ильную группу, пиразин-2-ильную группу,
[1,3,5]триазин-2-ильную группу, имидазол-1-ильную группу,
имидазол-2-ильную группу, имидазол-4-ильную группу,
[1,2,4]триазол-1-ильную группу, [1,2,4]триазол-3-ильную группу,
тетразол-1-ильную группу и тетразол-5-ильную группу.
Конкретные примеры указанной выше гетероциклической группы, которая содержит оксогруппу или (C1-C6) алкильную группу в качестве заместителя, могут включать
4-метилтетрагидропиран-4-ильную группу,
2-метил[1,3]диоксолан-2-ильную группу,
2-метил[1,3]диоксан-2-ильную группу,
5,5-диметил[1,3]диоксан-2-ильную группу,
2-оксопирролидин-1-ильную группу,
2,5-диоксопирролидин-1-ильную группу,
2-оксопиперидин-1-ильную группу,
2,6-диоксопиперидин-1-ильную группу,
4-метил-2,6-диоксопиперидин-1-ильную группу,
4-изопропил-2,6-диоксопиперидин-1-ильную группу,
1-метилпиперидин-4-ильную группу,
3,5-диоксоморфолин-4-ильную группу,
4-метилпиперазин-1-ильную группу, 5-метилфуран-2-ильную группу,
2,5-диоксо-2,5-дигидропиррол-1-ильную группу,
2-оксо-2H-пиридин-1-ильную группу или
1-метил-1H-имидазол-2-ильную группу.
Конкретные примеры «5-7-членной насыщенной циклической аминогруппы, которая может содержать 1-4 гетероатома, независимо выбранных из N, O и S», в настоящем изобретении могут включать пирролидин-1-ильную группу, пиперидин-1-ильную группу, пиперидин-4-ильную группу, азепан-1-ильную группу,
морфолин-4-ильную группу, тиоморфолин-4-ильную группу,
оксазолидин-3-ильную группу, изоксазолидин-2-ильную группу,
тиазолидин-3-ильную группу, имидазолидин-1-ильную группу и пиперазин-1-ильную группу.
Предпочтительные примеры могут включать пирролидин-1-ильную группу, пиперидин-1-ильную группу, морфолин-4-ильную группу, оксазолидин-3-ильную группу и пиперазин-1-ильную группу. Более предпочтительные примеры могут включать пирролидин-1-ильную группу, пиперидин-1-ильную группу и морфолин-4-ильную группу.
«Этиленокси группа», используемая в настоящем изобретении, означает заместитель, который образует циклическую структуру вместе с ароматической углеводородной группой или ароматической гетероциклической группой, представленной символом Ar в общей формуле (1), через атомы кислорода и атомы углерода на концах.
«(С1-С2) алкилендиоксигруппа», используемая в настоящем изобретении, означает О-(СН2)1-2-О. Указанная (С1-С2) алкилендиоксигруппа является заместителем, который образует циклическую структуру вместе с ароматической углеводородной группой или ароматической гетероциклической группой, представленной символом Ar в общей формуле (1), через атомы кислорода на обоих концах. Конкретные примеры указанной (С1-С2) алкилендиоксигруппы могут включать метилендиоксигруппу и этилендиоксигруппу.
Предпочтительным примером «неразветвленной, разветвленной или циклической алкильной группы», представленной символом R в соединении, представленном общей формулой (1) настоящего изобретения, может быть (С1-С12) алкильная группа. Кроме групп, указанных в качестве примера в связи с описанной выше (С1-С6) алкильной группой, примеры указанной (С1-С12) алкильной группы могут включать н-гептильную группу, 1-метилгексильную группу, 2-метилгексильную группу, 3-метилгексильную группу, 4-метилгексильную группу, 5-метилгексильную группу, 1-пропилбутильную группу, 1,3-диметилпентильную группу, 1,4-диметилпентильную группу, 4,4-диметилпентильную группу, октильную группу, 1-метилгептильную группу, 2-метилгептильную группу, 3-метилгептильную группу, 4-метилгептильную группу, 5-метилгептильную группу, 6-метилгептильную группу, 1-пропилпентильную группу, 2-этилгексильную группу, 1,3-диметилгексильную группу, 1,4-диметилгексильную группу, 1,5-диметилгексильную группу, 5,5-диметилгексильную группу, н-нонильную группу, 3-метилоктильную группу, 4-метилоктильную группу, 5-метилоктильную группу, 6-метилоктильную группу, 1-пропилгексильную группу, 2-этилгептильную группу, 1,3-диметилгептильную группу, 1,4-диметилгептильную группу, 1,5-диметилгептильную группу, 1,6-диметилгептильную группу, 6,6-диметилгептильную группу, н-децильную группу, 1-метилнонильную группу, 3-метилнонильную группу, 8-метилнонильную группу, 3-этилоктильную группу, 3,7-диметилоктильную группу, 7,7-диметилоктильную группу, циклопропильную группу, циклопентильную группу, циклогексильную группу, циклогексилэтильную группу, 4-метилциклогексильную группу, 2,6-диметилциклогексильную группу, 4,4-диметилциклогексильную группу, циклогептильную группу, адамантан-1-ильную группу или адамантан-2-ильную группу. Кроме групп, которые даны как предпочтительные примеры описанной выше (C1-C6) алкильной группы, предпочтительными являются 1-метилгексильная группа, 1,4-диметилпентильная группа, 1-метилгептильная группа, 1,4-диметилгексильная группа, 1,5-диметилгексильная группа и 1,6-диметилгептильная группа. Кроме групп, которые даны как более предпочтительные примеры описанной выше (C1-C6) алкильной группы, более предпочтительными являются 1,4-диметилпентильная группа и 1,5-диметилгексильная группа.
«Ароматическая углеводородная группа» и «5-7-членная гетероциклическая группа, содержащая 1-4 гетероатома, независимо выбранных из N, O и S», которые представлены символом R в соединении, представленном общей формулой (1) настоящего изобретения, означают то же, что и описанные выше «ароматическая углеводородная группа» и «5-7-членная гетероциклическая группа, содержащая 1-4 гетероатома, независимо выбранных из N, O и S», в настоящем изобретении. Конкретные примеры указанных групп и их предпочтительные примеры тоже такие же, как указанные выше.
Что касается R в общей формуле (1) настоящего изобретения, то примеры неразветвленной, разветвленной или циклической группы, которая может иметь заместитель, ароматической углеводородной группы, которая может иметь заместитель, или 5-7-членной гетероциклической группы, содержащей 1-4 гетероатома, независимо выбранных из N, O и S, которая может иметь заместитель, могут включать группы, представленные любой из описанных выше формул (2)-(6).
В каждой из указанных формул связь, обозначенная символом • (кружок), представляет собой связь с атомом азота.
Предпочтительные примеры «(С1-С6) алкильной группы», представленной символом R4 в формуле (2), могут включать метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, изопентильную группу, 4-метилпентильную группу и 3,3-диметилбутильную группу. Более предпочтительные примеры могут включать метильную группу, этильную группу, пропильную группу, изопентильную группу и 4-метилпентильную группу.
«C2-C10 алкенильная группа», используемая в настоящем изобретении, означает неразветвленную, разветвленную или циклическую группу, содержащую 2-10 углеродных атомов, которая имеет ненасыщенную двойную связь. Примеры указанной C2-C10 алкенильной группы могут включать винильную группу,
аллильную группу, пропен-1-ильную группу, бутен-1-ильную группу, бутен-2-ильную группу, бутен-3-ильную группу,
2-метилпропен-1-ильную группу, пентен-1-ильную группу,
пентен-2-ильную группу, пентен-3-ильную группу,
пентен-4-ильную группу, 3-метилбутен-1-ильную группу,
3-метилбутен-2-ильную группу, гексен-1-ильную группу,
4-метилпентен-1-ильную группу, 3-метилпентен-1-ильную группу, 3,3-диметилбутен-1-ильную группу, гептен-1-ильную группу, гептен-2-ильную группу, 5-метилгексен-1-ильную группу,
4,4-диметилгексен-1-ильную группу, октен-1-ильную группу,
6-метилгептен-1-ильную группу,
5,5-диметилгексен-1-ильную группу, нонен-1-ильную группу,
7-метилоктен-1-ильную группу, 6,6-диметилгептен-1-ильную группу, децен-1-ильную группу, циклопентен-3-ильную группу или циклогексен-1-ильную группу.
Предпочтительные примеры могут включать винильную группу, аллильную группу, пропен-1-ильную группу, бутен-1-ильную группу, пентен-1-ильную группу, 3-метилбутен-1-ильную группу, 4-метилпентен-1-ильную группу и циклопентен-3-ильную группу. Более предпочтительные примеры могут включать винильную группу, пропен-1-ильную группу, бутен-1-ильную группу, 3-метилбутен-1-ильную группу и 4-метилпентен-1-ильную группу.
«C2-C10 алкинильная группа», используемая в настоящем изобретении, означает неразветвленную или разветвленную углеводородную группу, содержащую 2-10 углеродных атомов, которая содержит ненасыщенную тройную связь. Примеры указанной C2-C10 алкинильной группы могут включать этинильную группу, пропин-1-ильную группу, пропин-3-ильную группу,
бутин-1-ильную группу, бутин-3-ильную группу,
бутин-4-ильную группу, 3-метилпропин-3-ильную группу,
1-метилбутин-3-ильную группу, 1-этилбутин-3-ильную группу, пентин-1-ильную группу, пентин-3-ильную группу,
пентин-4-ильную группу, 3-метилбутин-1-ильную группу,
гексин-1-ильную группу, 4-метилпентин-1-ильную группу,
гептин-1-ильную группу, октин-1-ильную группу,
нонин-1-ильную группу и децин-1-ильную группу. Предпочтительные примеры могут включать этинильную группу,
пропин-1-ильную группу, пропин-3-ильную группу,
бутин-1-ильную группу, бутин-3-ильную группу,
пентин-1-ильную группу, пентин-3-ильную группу,
3-метилбутин-1-ильную группу и 4-метилпентин-1-ильную группу. Более предпочтительные примеры могут включать этинильную группу, пропин-1-ильную группу, бутин-1-ильную группу,
3-метилбутин-1-ильную группу и 4-метилпентин-1-ильную группу.
Когда R в общей формуле (1) настоящего изобретения представлен формулой (2), «C1-С4 алкоксиметильная группа», представленная R6, означает алкоксигруппу, содержащую 1-4 углеродных атома, из описанных выше (C1-C6) алкоксильных групп. Примеры указанной C1-С4 алкоксиметильной группы могут включать метоксиметильную группу, этоксиметильную группу, пропоксиметильную группу, изопропоксиметильную группу, бутоксиметильную группу, изобутоксиметильную группу и трет-бутоксиметильную группу. Предпочтительные примеры могут включать метоксиметильную группу, этоксиметильную группу и изопропоксиметильную группу. Более предпочтительные примеры могут включать метоксиметильную группу и этоксиметильную группу.
Когда R в общей формуле (1) настоящего изобретения представлен формулой (2), «(C1-С10) алкильная группа», представленная R6, означает неразветвленную, разветвленную или циклическую алкильную группу, содержащую 1-10 углеродных атомов, из описанных выше (C1-C12) алкильных групп. Более предпочтительные примеры указанной (C1-C10) алкильной группы могут включать метильную группу, этильную группу, пропильную группу, изопентильную группу, 4-метилпентильную группу и циклогексильную группу.
«Галоген(C1-C3)алкильная группа», используемая в настоящем изобретении, означает неразветвленную или разветвленную алкильную группу, содержащую 1-3 атома углерода, которая является замещенной указанными выше 1-7 атомами галогена. Примеры указанной галоген(C1-C3)алкильной группы могут включать фторметильную группу, дифторметильную группу, трифторметильную группу, 2-фторэтильную группу, 2,2-дифторэтильную группу, 2,2,2-трифторэтильную группу, 1,1,2,2-тетрафторэтильную группу, 3-фторпропильную группу, 2,2,3,3-тетрафторпропильную группу, дихлорметильную группу, трихлорметильную группу и 2,2,2-трихлорэтильную группу. Предпочтительные примеры могут включать фторметильную группу, дифторметильную группу, трифторметильную группу, 2,2,2-трифторэтильную группу и 1,1,2,2-тетрафторэтильную группу. Более предпочтительные примеры могут включать трифторметильную группу и 2,2,2-трифторэтильную группу.
Когда R в общей формуле (1) настоящего изобретения представлен формулами (3) или (4), каждый заместитель означает то же самое, что и указанный выше каждый заместитель в настоящем изобретении. Конкретные примеры указанных групп и предпочтительные примеры их тоже такие же, как для указанного выше каждого заместителя в настоящем изобретении.
Когда R в общей формуле (1) настоящего изобретения представлен формулой (5), примеры «(C3-C10) циклоалкильной группы» могут включать циклопропильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу, циклооктильную группу и адамантильную группу. Предпочтительные примеры могут включать циклопропильную группу, циклопентильную группу и циклогексильную группу. Более предпочтительные примеры могут включать циклопентильную группу и циклогексильную группу.
Когда R в общей формуле (1) настоящего изобретения представлен формулой (6), примеры «α-аминокислотного остатка» являются следующими (боковая цепь представлена в скобках): глициновый остаток (атом водорода), аланиновый остаток (метильная группа), норвалиновый остаток (этильная группа), валиновый остаток (изопропильная группа), лейциновый остаток (изобутильная группа), изолейциновый остаток (втор-бутильная группа), фенилаланиновый остаток (бензильная группа), лизиновый остаток (4-аминобутильная группа), сериновый остаток (гидроксиметильная группа), треониновый остаток (1-гидроксиэтильная группа), аспарагиновый (карбамоилметильная группа), глутаминовый остаток (2-карбамоилэтильная группа), остаток аспарагиновой кислоты (карбоксиметильная группа), остаток глутаминовой кислоты (2-карбоксилэтильная группа), метиониновый остаток (2-метилсульфанилэтильная группа) и гистидиновый остаток (имидазол-4-илметильная группа). Предпочтительные примеры могут включать глициновый остаток, аланиновый остаток, норвалиновый остаток, валиновый остаток, сериновый остаток и треониновый остаток. Более предпочтительные примеры могут включать глициновый остаток, аланиновый остаток и сериновый остаток.
Примеры «боковой цепи аминокислоты, которая может быть защищена защитной группой», в настоящем изобретении могут включать боковую цепь серина, защищенную метильной группой (метоксиметильная группа), боковую цепь серина, защищенную трет-бутильной группой (трет-бутоксиметильная группа), боковую цепь серина, защищенную бензильной группой (бензилоксиметильная группа), боковую цепь треонина, защищенную метильной группой (1-метоксиэтильная группа), боковую цепь цистеина, защищенную метильной группой (метилсульфанилметильная группа), боковую цепь цистеина, защищенную трет-бутильной группой (трет-бутилсульфанилметильная группа), боковую цепь тиразина, защищенную метильной группой (4-метоксибензильная группа), боковую цепь аспарагиновой кислоты, защищенную метильной группой (метоксисарбонилметильная группа), боковую цепь аспарагиновой кислоты, защищенную трет-бутильной группой (трет-бутоксикарбонилметильная группа), боковую цепь глутаминовой кислоты, защищенную метильной группой (2-метоксикарбонилэтильная группа), боковую цепь глутаминовой кислоты, защищенную трет-бутильной группой (2-трет-бутоксикарбонилэтильная группа) и боковую цепь лизина, защищенную трет-бутоксикарбонильной группой (4-(трет-бутоксикарбонил)аминобутильная группа).
Предпочтительные примеры боковой цепи аминокислоты, защищенной защитной группой, могут включать боковую цепь глицина, боковую цепь аланина, боковую цепь норвалина, боковую цепь валина, боковую цепь лейцина, боковую цепь изолейцина, боковую цепь серина, защищенную метильной группой, боковую цепь серина, защищенную трет-бутильной группой, боковую цепь треонина, защищенную метильной группой, боковую цепь цистеина, защищенную метильной группой, и боковую цепь метионана. Более предпочтительные примеры могут включать боковую цепь глицина, боковую цепь аланина, боковую цепь норвалина, боковую цепь валина и боковую цепь серина, защищенную метильной группой.
«(C1-C6) алкиламино группа», используемая в настоящем изобретении, означает аминогруппу, монозамещенную описанной выше (C1-C6) алкильной группой. Примеры указанной (C1-C6) алкиламиногруппы могут включать метиламиногруппу, этиламиногруппу, н-пропиламиногруппу, изопропиламиногруппу,
н-бутиламиногруппу, изобутиламиногруппу, трет-бутиламиногруппу, н-пентиламиногруппу, изопентиламиногруппу,
2-метилбутиламиногруппу, неопентиламиногруппу,
1-этилпропиламиногруппу, н-гексиламиногруппу,
4-метилпентиламиногруппу, 3-метилпентиламиногруппу,
2-метилпентиламиногруппу, 1-метилпентиламиногруппу,
3,3-диметилбутиламиногруппу, 2,2-диметилбутиламиногруппу,
1,1-диметилбутиламиногруппу, 1,2-диметилбутиламиногруппу,
1,3-диметилбутиламиногруппу, 2,3-диметилбутиламиногруппу,
2-этилбутиламиногруппу, циклопропиламиногруппу,
циклопентиламиногруппу или циклогексиламиногруппу.
Предпочтительные примеры могут включать метиламиногруппу, этиламиногруппу, н-пропиламиногруппу, изопропиламиногруппу, н-бутиламиногруппу, изобутиламиногруппу и трет-бутиламиногруппу. Более предпочтительные примеры могут включать метиламиногруппу, этиламиногруппу изопропиламиногруппу.
«Ди(C1-C6) алкиламино группа», используемая в настоящем изобретении, означает аминогруппу, дизамещенную описанной выше (C1-C6) алкильной группой. Примеры указанной ди(C1-C6) алкиламиногруппы могут включать диметиламиногруппу,
диэтиламиногруппу, ди(н-пропил)аминогруппу,
диизопропиламиногруппу, ди(н-бутил)аминогруппу,
диизобутиламиногруппу, ди(н-пентил)аминогруппу,
ди(н-гексил)аминогруппу, бис(3,3-диметилбутил)аминогруппу,
дициклопропиламиногруппу, дициклопентиламиногруппу и дициклогексиламиногруппу. Предпочтительные примеры могут включать диметиламиногруппу, диэтиламиногруппу, ди(н-пропил)аминогруппу, диизопропиламиногруппу, ди(н-бутил)аминогруппу и диизобутиламиногруппу. Более предпочтительные примеры могут включать диметиламиногруппу и диэтиламиногруппу.
Примеры группы, не имеющей заместителя, из «5-7-членных насыщенных или ненасыщенных гетероциклических групп, содержащих 1-4 гетероатома, независимо выбранных из N, О и S, которые могут быть замещены 1-4 одинаковыми или разными группами, выбранными из группы [F] заместителей, состоящей из оксогруппы, (C1-C6) алкильной группы, фенильной группы и бензильной группы», представленных символом R12 в формуле (6) в общей формуле (1) настоящего изобретения, могут включать: насыщенные гетероциклические группы, такие как
тетрагидрофуран-2-ильная группа,
тетрагидрофуран-3-ильная группа,
тетрагидропиран-4-ильная группа, пирролидин-1-ильная группа,
пиперидин-1-ильная группа, пиперидин-4-ильная группа,
азепан-1-ильная группа, морфолин-4-ильная группа,
тиоморфолин-4-ильная группа, оксазолидин-3-ильная группа,
изоксазолидин-2-ильная группа, тиазолидин-3-ильная группа,
имидазолидин-1-ильная группа и пиперазин-1-ильная группа; и
ненасыщенные гетероциклические группы, такие как
фуран-2-ильная группа, фуран-3-ильная группа,
тиофен-2-ильная группа, тиофен-3-ильная группа,
оксазол-5-ильная группа, изоксазол-5-ильная группа,
тиазол-5-ильная группа, пиррол-1-ильная группа,
пиридин-2-ильная группа, пиридин-3-ильная группа,
пиридин-4-ильная группа, пиримидин-4-ильная группа,
пиразин-2-ильная группа, [1,3,5]триазин-2-ильная группа,
имидазол-2-ильная группа, имидазол-4-ильная группа,
[1,2,4]триазол-3-ильная группа и тетразол-5-ильная группа.
Примеры указанной выше гетероциклической группы, которая имеет заместитель, могут включать
2-оксотетрагидрофуран-3-ильную группу,
4-метилтетрагидропиран-4-ильную группу,
2-оксопирролидин-1-ильную группу,
2,5-диоксопирролидин-1-ильную группу,
2-оксопиперидин-1-ильную группу,
2,6-диоксопиперидин-1-ильную группу,
4-метил-2,6-диоксопиперидин-1-ильную группу,
4-изопропил-2,6-диоксопиперидин-1-ильную группу,
1-метилпиперидин-4-ильную группу,
3,5-диоксоморфолин-4-ильную группу,
4-метилпиперазин-1-ильную группу, 5-метилфуран-2-ильную группу,
2,5-диоксо-2,5-дигидропиррол-1-ильную группу,
2-оксо-2H-пиридин-1-ильную группу и
1-метил-lH-имидазол-2-ильную группу.
Предпочтительные примеры могут включать тетрагидрофуран-2-ильную группу, тетрагидрофуран-3-ильную группу, тетрагидропиран-4-ильную группу, пиридин-2-ильную группу, пиридин-3-ильную группу, пиридин-4-ильную группу и 2-оксотетрагидрофуран-3-ильную группу. Более предпочтительные примеры могут включать тетрагидропиран-4-ильную группу и пиридин-3-ильную группу.
Примеры X в общей формуле (1) настоящего изобретения могут включать О, S, NH, N-CH3 и N-CN. X представляет собой предпочтительно О или S.
Конкретные примеры Ar в общей формуле (1) настоящего изобретения могут включать фенильную группу,
2-фторфенильную группу, 2-хлорфенильную группу,
2-гидроксифенильную группу, 2-цианофенильную группу,
2-трифторметилфенильную группу,
2-трифторметоксифенильную группу, 2-нитрофенильную группу,
2-метилфенильную группу, 2-этилфенильную группу,
2-метоксифенильную группу, 2-этоксифенильную группу,
2-аминофенильную группу, 2-диметиламинофенильную группу,
3-фторфенильную группу, 3-хлорфенильную группу,
3-гидроксифенильную группу, 3-цианофенильную группу,
3-трифторметилфенильную группу,
3-трифторметоксифенильную группу, 3-нитрофенильную группу,
3-метилфенильную группу, 3-этилфенильную группу,
3-пропилфенильную группу, 3-изопропилфенильную группу,
3-бутилфенильную группу, 3-циклогексилфенильную группу,
3-метоксифенильную группу, 3-этоксифенильную группу,
3-изопропоксифенильную группу, 3-изобутоксифенильную группу,
3-(2-фторэтил)фенильную группу,
3-(2,2-дифторэтил)фенильную группу,
3-(2,2,2-трифторэтил)фенильную группу,
3-(2-хлорэтил)фенильную группу,
3-метоксиметоксифенильную группу,
3-(2-метоксиэтокси)фенильную группу,
3-(2-метоксиэтокси)метоксифенильную группу,
3-[2-(2-метоксиэтокси)этокси]фенильную группу,
3-{2-[2-(2-метоксиэтокси)этокси]этокси}фенильную группу,
3-(2-оксопропокси)фенильную группу,
3-(2-ацетоксиэтокси)фенильную группу,
3-(2-пивалоилоксиэтокси)фенильную группу,
3-(2-метилсульфанилэтокси)фенильную группу,
3-(2-метилсульфенилэтокси)фенильную группу,
3-(2-метилсульфонилэтокси)фенильную группу,
3-(2-этилсульфонилэтокси)фенильную группу,
3-(3-метилсульфонилпропокси)фенильную группу,
3-карбоксиметоксифенильную группу,
3-метоксикарбонилметоксифенильную группу,
3-этоксикарбонилметоксифенильную группу,
3-трет-бутоксикарбонилметоксифенильную группу,
3-(3-метоксикарбонилпропокси)фенильную группу,
3-(3-этоксикарбонилпропокси)фенильную группу,
3-(3-трет-бутоксикарбонилпропокси)фенильную группу,
3-диметилкарбамоилметоксифенильную группу,
3-(2-диметилкарбамоилэтокси)фенильную группу,
3-(3-диметилкарбамоилпропокси)фенильную группу,
3-(2-пирролидин-1-ил-2-оксоэтокси)фенильную группу,
3-(4-пирролидин-1-ил-4-оксобутокси)фенильную группу,
3-(2-пиперидин-1-ил-2-оксоэтокси)фенильную группу,
3-(4-пиперидин-1-ил-4-оксобутокси)фенильную группу,
3-(2-морфолин-4-ил-2-оксоэтокси)фенильную группу,
3-(4-морфолин-4-ил-4-оксобутокси)фенильную группу,
3-[2-(4-метилпиперазин-1-ил)-2-оксоэтокси]фенильную группу,
3-[4-(4-метилпиперазин-1-ил)-4-оксобутокси]фенильную группу,
3-диметиламиноэтоксифенильную группу,
3-диметиламинопропоксифенильную группу,
3-диэтиламиноэтоксифенильную группу,
3-диэтиламинопропоксифенильную группу,
3-(2-ацетиламиноэтокси)фенильную группу,
3-(3-ацетиламинопропокси)фенильную группу,
3-[2-(N-ацетил-N-метиламино)этокси]фенильную группу,
3-[3-(N-ацетил-N-метиламино)пропокси]фенильную группу,
3-(2-трет-бутоксикарбониламиноэтокси)фенильную группу,
3-(3-трет-бутоксикарбониламинопропокси)фенильную группу,
3-(2-бензилоксикарбониламиноэтокси)фенильную группу,
3-(3-бензилоксикарбониламинопропокси)фенильную группу,
3-бензилоксифенильную группу, 3-(2-фенилэтокси)фенильную группу, 3-(3-фенилпропокси)фенильную группу,
3-(тетрагидрофуран-2-илметокси)фенильную группу,
3-(тетрагидропиран-4-илметокси)фенильную группу,
3-[2-(тетрагидропиран-4-ил)этокси]фенильную группу,
3-([1,3]диоксолан-2-илметокси)фенильную группу,
3-(2-метил[1,3]диоксолан-2-илметокси)фенильную группу,
3-[2-([1,3]диоксолан-2-ил)этокси]фенильную группу,
3-[2-(2-метил[1,3]диоксолан-2-ил)этокси]фенильную группу,
3-[2-([1,3]диоксан-2-ил)этокси]фенильную группу,
3-[2-(2-метил[1,3]диоксан-2-ил)этокси]фенильную группу,
3-(2-пирролидин-1-илэтокси)фенильную группу,
3-(3-пирролидин-1-илпропокси)фенильную группу,
3-(2-пиперидин-1-илэтокси)фенильную группу,
3-(3-пиперидин-1-илпропокси)фенильную группу,
3-(2-морфолин-4-илэтокси)фенильную группу,
3-(3-морфолин-4-илпропокси)фенильную группу,
3-[2-(4-метил)пиперазин-1-илэтокси]фенильную группу,
3-[3-(4-метил)пиперазин-1-илпропокси]фенильную группу,
3-пиридин-2-илметоксифенильную группу,
3-пиридин-3-илметоксифенильную группу,
3-пиридин-4-илметоксифенильную группу,
3-(2-пиридин-2-илэтокси)фенильную группу,
3-(2-пиридин-3-илэтокси)фенильную группу,
3-(2-пиридин-4-илэтокси)фенильную группу,
3-(3-пиридин-2-илпропокси)фенильную группу,
3-(3-пиридин-3-илпропокси)фенильную группу,
3-(3-пиридин-4-илпропокси)фенильную группу,
3-пиримидин-2-илметоксифенильную группу,
3-(2-пиримидин-2-илэтокси)фенильную группу,
3-[1,3,5]триазин-2-илметоксифенильную группу,
3-(2-[1,3,5]триазин-2-илэтокси)фенильную группу,
3-[2-(1H-тетразол-5-ил)этокси]фенильную группу,
3-[3-(1H-тетразол-5-ил)пропокси]фенильную группу,
3-аминофенильную группу, 3-диметиламинофенильную группу,
3-диэтиламинофенильную группу, 3-ацетиламинофенильную группу,
3-пропиониламинофенильную группу,
3-пирролидин-1-илфенильную группу,
3-пиперидин-1-илфенильную группу,
3-морфолин-4-илфенильную группу,
3-(4-метилпиперазин-1-ил)фенильную группу,
4-фторфенильную группу, 4-хлорфенильную группу,
4-гидроксифенильную группу, 4-цианофенильную группу,
4-трифторметилфенильную группу,
4-трифторметоксифенильную группу, 4-нитрофенильную группу,
4-метилфенильную группу, 4-этилфенильную группу,
4-пропилфенильную группу, 4-изопропилфенильную группу,
4-бутилфенильную группу, 4-циклогексилфенильную группу,
4-метоксифенильную группу, 4-этоксифенильную группу,
4-изопропоксифенильную группу, 4-изобутоксифенильную группу,
4-(2-фторэтил)фенильную группу,
4-(2,2-дифторэтил)фенильную группу,
4-(2,2,2-трифторэтил)фенильную группу,
4-(2-хлорэтил)фенильную группу,
4-метоксиметоксифенильную группу,
4-(2-метоксиэтокси)фенильную группу,
4-(2-метоксиэтокси)метоксифенильную группу,
4-[2-(2-метоксиэтокси)этокси]фенильную группу,
4-{2-[2-(2-метоксиэтокси)этокси]этокси}фенильную группу,
4-(2-оксопропокси)фенильную группу,
4-(2-ацетоксиэтокси)фенильную группу,
4-(2-пивалоилоксиэтокси)фенильную группу,
4-(2-метилсульфанилэтокси)фенильную группу,
4-(2-метилсульфенилэтокси)фенильную группу,
4-(2-метилсульфонилэтокси)фенильную группу,
4-(2-этилсульфонилэтокси)фенильную группу,
4-(3-метилсульфонилпропокси)фенильную группу,
4-карбоксиметоксифенильную группу,
4-метоксикарбонилметоксифенильную группу,
4-этоксикарбонилметоксифенильную группу,
4-трет-бутоксикарбонилметоксифенильную группу,
4-(3-метоксикарбонилпропокси)фенильную группу,
4-(3-этоксикарбонилпропокси)фенильную группу,
4-(3-трет-бутоксикарбонилпропокси)фенильную группу,
4-диметилкарбамоилметоксифенильную группу,
4-(2-диметилкарбамоилэтокси)фенильную группу,
4-(3-диметилкарбамоилпропокси)фенильную группу,
4-(2-пирролидин-1-ил-2-оксоэтокси)фенильную группу,
4-(4-пирролидин-1-ил-4-оксобутокси)фенильную группу,
4-(2-пиперидин-1-ил-2-оксоэтокси)фенильную группу,
4-(4-пиперидин-1-ил-4-оксобутокси)фенильную группу,
4-(2-морфолин-4-ил-2-оксоэтокси)фенильную группу,
4-(4-морфолин-4-ил-4-оксобутокси)фенильную группу,
4-[2-(4-метилпиперазин-1-ил)-2-оксоэтокси]фенильную группу,
4-[4-(4-метилпиперазин-1-ил)-4-оксобутокси] фенильную группу,
4-диметиламиноэтоксифенильную группу,
4-диметиламинопропоксифенильную группу,
4-диэтиламиноэтоксифенильную группу,
4-диэтиламинопропоксифенильную группу,
4-(2-ацетиламиноэтокси)фенильную группу,
4-(3-ацетиламинопропокси)фенильную группу,
4-[2-(N-ацетил-N-метиламино)этокси]фенильную группу,
4-[3-(N-ацетил-N-метиламино)пропокси]фенильную группу,
4-(2-трет-бутоксикарбониламиноэтокси)фенильную группу,
4-(3-трет-бутоксикарбониламинопропокси)фенильную группу,
4-(2-бензилоксикарбониламиноэтокси)фенильную группу,
4-(3-бензилоксикарбониламинопропокси)фенильную группу,
4-бензилоксифенильную группу, 4-(2-фенилэтокси)фенильную группу, 4-(3-фенилпропокси)фенильную группу,
4-(тетрагидрофуран-2-илметокси)фенильную группу,
4-(тетрагидропиран-4-илметокси)фенильную группу,
4-[2-(тетрагидропиран-4-ил)этокси]фенильную группу,
4-([1,3]диоксолан-2-илметокси)фенильную группу,
4-(2-метил[1,3]диоксолан-2-илметокси)фенильную группу,
4-[2-([1,3]диоксолан-2-ил)этокси]фенильную группу,
4-[2-(2-метил[1,3]диоксолан-2-ил)этокси]фенильную группу,
4-[2-([1,3]диоксан-2-ил)этокси]фенильную группу,
4-[2-(2-метил[1,3]диоксан-2-ил)этокси]фенильную группу,
4-(2-пирролидин-1-илэтокси)фенильную группу,
4-(3-пирролидин-1-илпропокси)фенильную группу,
4-(2-пиперидин-1-илэтокси)фенильную группу,
4-(3-пиперидин-1-илпропокси)фенильную группу,
4-(2-морфолин-4-илэтокси)фенильную группу,
4-(3-морфолин-4-илпропокси)фенильную группу,
4-[2-(4-метил)пиперазин-1-илэтокси]фенильную группу,
4-[3-(4-метил)пиперазин-1-илпропокси]фенильную группу,
4-пиридин-2-илметоксифенильную группу,
4-пиридин-3-илметоксифенильную группу,
4-пиридин-4-илметоксифенильную группу,
4-(2-пиридин-2-илэтокси)фенильную группу,
4-(2-пиридин-3-илэтокси)фенильную группу,
4-(2-пиридин-4-илэтокси)фенильную группу,
4-(3-пиридин-2-илпропокси)фенильную группу,
4-(3-пиридин-3-илпропокси)фенильную группу,
4-(3-пиридин-4-илпропокси)фенильную группу,
4-пиримидин-2-илметоксифенильную группу,
4-(2-пиримидин-2-илэтокси)фенильную группу,
4-[1,3,5]триазин-2-илметоксифенильную группу,
4-(2-[1,3,5]триазин-2-илэтокси)фенильную группу,
4-[2-(1H-тетразол-5-ил)этокси]фенильную группу,
4-[3-(1H-тетразол-5-ил)пропокси]фенильную группу,
4-аминофенильную группу, 4-диметиламинофенильную группу,
4-диэтиламинофенильную группу, 4-ацетиламинофенильную группу,
4-пропиониламинофенильную группу,
4-пирролидин-1-илфенильную группу,
4-пиперидин-1-илфенильную группу,
4-морфолин-4-илфенильную группу,
4-(4-метилпиперазин-1-ил)фенильную группу,
3,4-дигидрофенильную группу, 2,4-диметоксифенильную группу,
3,4-диметоксифенильную группу,
3,4-бис(2-метоксиэтокси)фенильную группу,
3,4,5-триметоксифенильную группу,
2,3-дигидробензофуран-5-ильную группу,
3,4-метилендиоксифенильную группу,
3,4-этилендиоксифенильную группу, нафталин-1-ильную группу,
нафталин-2-ильную группу, фуран-2-ильную группу,
5-метилфуран-2-ильную группу, 5-ацетилфуран-2-ильную группу,
фуран-3-ильную группу, тиофен-2-ильную группу,
5-метилтиофен-2-ильную группу, 5-ацетилтиофен-2-ильную группу, тиофен-3-ильную группу, оксазол-5-ильную группу,
изоксазол-5-ильную группу, тиазол-5-ильную группу,
пиридин-2-ильную группу, 1-оксопиридин-2-ильную группу,
6-хлорпиридин-2-ильную группу, 6-метилпиридин-2-ильную группу, 6-метоксипиридин-2-ильную группу, пиридин-3-ильную группу,
1-оксопиридин-3-ильную группу, 6-хлорпиридин-3-ильную группу, 6-метилпиридин-3-ильную группу, 6-метоксипиридин-3-ильную группу, пиридин-4-ильную группу, 1-оксопиридин-4-ильную группу,
2-хлорпиридин-4-ильную группу, 2-метилпиридин-4-ильную группу, 2-метоксипиридин-4-ильную группу,
2,6-диметоксипиридин-4-ильную группу, пиримидин-4-ильную группу, пиразин-2-ильную группу или [1,3,5]триазин-2-ильную группу.
Предпочтительные примеры указанной Ar могут включать фенильную группу, 3-хлорфенильную группу,
3-гидроксифенильную группу, 3-метоксифенильную группу,
3-(2-метоксиэтокси)фенильную группу,
3-диметиламиноэтоксифенильную группу,
3-диметиламинопропоксифенильную группу,
3-(тетрагидрофуран-2-илметокси)фенильную группу,
3-(тетрагидропиран-4-илметокси)фенильную группу,
3-(2-морфолин-4-илэтокси)фенильную группу,
3-(3-морфолин-4-илпропокси)фенильную группу,
3-пиридин-3-илметоксифенильную группу,
3-пиридин-4-илметоксифенильную группу,
3-(2-пиридин-3-илэтокси)фенильную группу,
3-(2-пиридин-4-илэтокси)фенильную группу,
3-аминофенильную группу, 3-диметиламинофенильную группу,
3-ацетиламинофенильную группу, 3-морфолин-4-илфенильную группу, 4-гидроксифенильную группу, 4-трифторметоксифенильную группу,
4-метоксифенильную группу, 4-этоксифенильную группу,
4-(2-метоксиэтокси)фенильную группу,
4-(2-метоксиэтокси)метоксифенильную группу,
4-[2-(2-метоксиэтокси)этокси]фенильную группу,
4-{2-[2-(2-метоксиэтокси)этокси]этокси}фенильную группу,
4-диметиламиноэтоксифенильную группу,
4-диметиламинопропоксифенильную группу,
4-бензилоксифенильную группу,
4-(тетрагидрофуран-2-илметокси)фенильную группу,
4-(тетрагидропиран-4-илметокси)фенильную группу,
4-(2-морфолин-4-илэтокси)фенильную группу,
4-(3-морфолин-4-илпропокси)фенильную группу,
4-пиридин-3-илметоксифенильную группу,
4-пиридин-4-илметоксифенильную группу,
4-(2-пиридин-3-илэтокси)фенильную группу,
4-(2-пиридин-4-илэтокси)фенильную группу,
4-аминофенильную группу, 4-диметиламинофенильную группу,
4-ацетиламинофенильную группу, 4-морфолин-4-илфенильную группу, 3,4-дигидрофенильную группу, 3,4-диметоксифенильную группу,
3,4-бис(2-метоксиэтокси)фенильную группу,
3,4,5-триметоксифенильную группу,
2,3-дигидробензофуран-5-ильную группу,
3,4-метилендиоксифенильную группу,
3,4-этилендиоксифенильную группу, пиридин-3-ильную группу,
пиридин-4-ильную группу, тиофен-2-ильную группу или
тиофен-3-ильную группу.
Более предпочтительные примеры могут включать 3-хлорфенильную группу, 3-гидроксифенильную группу,
3-метоксифенильную группу,
3-(тетрагидрофуран-2-илметокси)фенильную группу,
3-(2-морфолин-4-илэтокси)фенильную группу,
3-пиридин-3-илметоксифенильную группу,
4-гидроксифенильную группу, 4-метоксифенильную группу,
4-(2-(2-(2-метоксиэтокси)этокси)этокси)фенильную группу,
4-(тетрагидропиран-4-илметокси)фенильную группу,
4-(2-морфолин-4-илэтокси)фенильную группу,
4-аминофенильную группу, 3,4-диметоксифенильную группу,
3,4,5-триметоксифенильную группу,
2,3-дигидробензофуран-5-ильную группу,
3,4-метилендиоксифенильную группу и тиофен-2-ильную группу.
Конкретные примеры R в общей формуле (1) настоящего изобретения могут включать метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, втор-бутильную группу, изобутильную группу, циклопентильную группу, 1,4-диметилпентильную группу, циклогексильную группу, циклогексилметильную группу, 1,5-диметилгексильную группу, адамантан-1-ильную группу, 4-гидроксициклогексильную группу, фенильную группу, 4-гидроксифенильную группу,
3-ацетилфенильную группу, бензильную группу,
1-фенилэтильную группу, 2-фенил-1-метилэтильную группу,
3-фенилпропильную группу, 3-фенил-1-метилпропильную группу,
1-фенилпропильную группу,
1,2,3,4-тетрагидронафталин-1-ильную группу,
3-гидроксибензильную группу, 3-метоксибензильную группу,
3,4-метилендиоксибензильную группу,
3,4,5-триметоксибензильную группу,
1-(3-гидроксифенил)этильную группу,
1-(4-гидроксифенил)этильную группу,
1-(3-метоксифенил)этильную группу,
1-(4-метоксифенил)этильную группу,
1-(3,4-метилендиоксифенил)этильную группу,
1-(3,4,5-триметоксифенил)этильную группу,
1-(3-изопропоксифенил)этильную группу,
1-(3-метансульфонилоксифенил)этильную группу,
3-(диметилкарбамоил)циклогексан-1-ильную группу,
2-метокси-1-метилэтильную группу,
2-этокси-1-метилэтильную группу,
1-метил-2-(2,2,2-трифторэтокси)этильную группу,
2-изопропокси-1-метилэтильную группу,
3-метоксипропильную группу, 3-метокси-1-метилпропильную группу, 3-этокси-1-метилпропильную группу,
1-метил-3-трифторметоксипропильную группу,
4-метоксибутильную группу, 4-метокси-1-метилбутильную группу,
4-этокси-1-метилбутильную группу, 5-метоксипентильную группу,
5-метокси-1-метилпентильную группу,
4-метокси-1,4-диметилпентильную группу,
5-метокси-1,5-диметилгексильную группу,
5-метокси-1-метил-2-пентенильную группу,
1-метил-3-(тетрагидропиран-4-ил)этильную группу,
1-метил-2-(тетрагидропиран-4-илокси)этильную группу,
1-метил-2-(тетрагидропиран-4-илметокси)этильную группу,
1-метил-3-(2-метил[1,3]диоксолан-2-ил)пропильную группу,
1-метил-4-оксопентильную группу,
4-гидрокси-1,4-диметилпентильную группу,
5-гидрокси-1,5-диметилгексильную группу,
3-[N-(трет-бутоксикарбонил)-N-метиламино]-1-метилпропильную группу, 4-[N-ацетил-N-метиламино]-1-метилбутильную группу,
4-[N-(трет-бутоксикарбонил)-N-метиламино]-1-метилбутильную группу, тетрагидрофуран-2-илметильную группу,
2-диметиламиноэтильную группу, 2-диэтиламиноэтильную группу,
3-диметиламинопропильную группу, морфолин-4-ильную группу,
1-этоксикарбонилпиперидин-4-ильную группу,
1-бензилпиперидин-4-ильную группу,
2-морфолин-4-илэтильную группу,
3-морфолин-4-илпропильную группу, пиридин-3-ильную группу,
пиридин-4-ильную группу, пиридин-3-илметильную группу,
пиридин-4-илметильную группу, 2-пиридин-2-илэтильную группу,
2-пиридин-3-илэтильную группу, 2-пиридин-4-илэтильную группу,
3-имидазол-1-илпропильную группу,
1-трет-бутоксикарбонилэтильную группу,
1-трет-бутоксикарбонил-2-метилпропильную группу,
2-трет-бутоксикарбонилэтильную группу,
1-диметиламинокарбонилэтильную группу,
1-диметиламинокарбонил-2-метилпропильную группу,
1-фенилкарбамоилэтильную группу,
1-метил-2-фенилкарбамоилэтильную группу,
2-метил-1-фенилкарбамоилпропильную группу,
1-бензилкарбамоилэтил группу,
1-(N-бензил-N-метилкарбамоил)этильную группу,
1-(тетрагидрофуран-2-илметил)карбамоилэтильную группу,
1-(4-метилпиперазин-1-илкарбонил)этильную группу,
1-морфолин-4-илкарбонилэтильную группу,
1-метил-3-(морфолин-4-илкарбонил)пропильную группу,
1-метил-4-(морфолин-4-илкарбонил)бутильную группу,
1-(2-пиперидин-1-илэтилкарбамоил)этильную группу,
1-(пиридин-3-илметилкарбамоил)этильную группу,
1-(2-пиридин-2-илэтилкарбамоил)этильную группу или
1-[1-(метоксикарбонил)этилкарбамоил]-2-этилпропильную группу.
Предпочтительные примеры указанного R могут включать метильную группу, этильную группу, изопропильную группу,
1,4-диметилпентильную группу, циклогексильную группу,
1,5-диметилгексильную группу, 4-гидроксициклогексильную группу, бензильную группу, 1-фенилэтильную группу,
2-фенил-1-метилэтильную группу, 3-фенил-1-метилпропильную группу, 1-(3-гидроксифенил)этильную группу,
1-(4-гидроксифенил)этильную группу,
1-(3-метоксифенил)этильную группу,
1-(4-метоксифенил)этильную группу,
1-(3,4-метилендиоксифенил)этильную группу,
1-(3,4,5-триметоксифенил)этильную группу,
3-этокси-1-метилпропильную группу,
4-метокси-1-метилбутильную группу,
4-метокси-1,4-диметилпентильную группу,
5-метокси-1,5-диметилгексильную группу,
5-метокси-1-метил-2-пентенильную группу,
4-гидрокси-1,4-диметилпентильную группу,
5-гидрокси-1,5-диметилгексильную группу,
1-трет-бутоксикарбонилэтильную группу,
1-трет-бутоксикарбонил-2-метилпропильную группу,
2-трет-бутоксикарбонилэтильную группу,
1-фенилкарбамоилэтильную группу или
1-метил-2-фенилкарбамоилэтильную группу.
Более предпочтительные примеры могут включать изопропильную группу,
1,4-диметилпентильную группу, 1,5-диметилгексильную группу,
1-фенилэтильную группу, 1-(3-гидроксифенил)этильную группу,
1-(4-гидроксифенил)этильную группу,
1-(3-метоксифенил)этильную группу,
1-(4-метоксифенил)этильную группу,
3-этокси-1-метилпропильную группу,
4-метокси-1-метилбутильную группу,
5-метокси-1-метил-2-пентенильную группу,
4-гидрокси-1,4-диметилпентильную группу и
5-гидрокси-1,5-диметилгексильную группу.
Когда производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины, представленное общей формулой (1) настоящего изобретения, содержит асимметрический атом углерода, настоящее изобретение включает все из таких веществ, как оптически активное вещество, рацемическое вещество и смесь, содержащую указанное оптически активное вещество в любом заданном отношении.
Конкретные примеры производного [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины, представленного общей формулой (1) настоящего изобретения, могут включать соединения, показанные в данных ниже примерах. Предпочтительные соединения могут включать:
1-изопропил-3-[(7-тиофен-2-ил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
1-(3-этокси-1-метилпропил)-3-[7-(3,4-метилендиоксифенил)-[1,2,4]-триазоло[1,5-a]пиримидин-2-ил]мочевину,
1-(4-метокси-1-метилбутил)-3-[7-(4-метоксифенил)-
[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
1-(4-гидрокси-1,4-диметилпентил)-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
1-(5-гидрокси-1,5-диметилгексил)-3-[7-(4-метоксифенил)-
[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
1-(5-гидрокси-1,5-диметилгексил)-3-{7-[3-(пиридин-3-
илметокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-ил}мочевину,
1-(5-гидрокси-1,5-диметилгексил)-3-[(7-тиофен-2-ил)-
[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
1-[1-(3-метоксифенил)этил]-3-[7-(4-метоксифенил)-
[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
1-[7-(3,4-метилендиоксифенил)-[1,2,4]триазоло[1,5-
a]пиримидин-2-ил]-3-[1-(3-метоксифенил)этил]мочевину,
1-[7-(3,4-метилендиоксифенил)-[1,2,4]триазоло[1,5-
a]пиримидин-2-ил]-3-[1-(3,4,5-триметоксифенил)этил]мочевину,
1-(7-тиофен-2-ил[1,2,4]триазоло[1,5-a]пиримидин-2-
ил)-3-[1-(3,4,5-триметоксифенил)этил]мочевину или
1-[1-(3,4-метилендиоксифенил)этил]-3-{7-[3-(пиридин-
3-илметокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину.
Особенно предпочтительные соединения могут включать:
1-изопропил-3-[(7-тиофен-2-ил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
(S)-1-(3-этокси-1-метилпропил)-3-[7-(3,4-метилендиоксифенил)-[1,2,4]-триазоло[1,5-a]пиримидин-2-ил]мочевину,
(S)-1-(4-метокси-1-метилбутил)-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
(S)-1-(4-гидрокси-1,4-диметилпентил)-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
(S)-1-(5-гидрокси-1,5-диметилгексил)-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
(S)-1-(5-гидрокси-1,5-диметилгексил)-3-{7-[3-(пиридин-3-илметокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-ил}мочевину,
(S)-1-(5-гидрокси-1,5-диметилгексил)-3-[(7-тиофен-2-ил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
(S)-1-[1-(3-метоксифенил)этил]-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину,
(S)-1-[7-(3,4-метилендиоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-[1-(3-метоксифенил)этил]мочевину,
(S)-1-[7-(3,4-метилендиоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-[1-(3,4,5-триметоксифенил)этил]мочевину,
(S)-1-(7-тиофен-2-ил[1,2,4]триазоло[1,5-a]пиримидин-2-ил)-3-[1-(3,4,5-триметоксифенил)этил]мочевину или
(S)-1-[1-(3,4-метилендиоксифенил)этил]-3-{7-[3-(пиридин-3-илметокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-ил}мочевину.
Фармацевтически приемлемая соль производного [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины, представленного общей формулой (1) настоящего изобретения, может быть получена с использованием обычных реакций получения солей. Конкретные примеры указанной соли могут включать: соли щелочных металлов (натриевая соль, калиевая соль, литиевая соль и т.д.); соли щелочноземельных металлов (кальциевая соль, магниевая соль и т.д.); неорганические соли, такие как алюминиевая соль, железная соль, цинковая соль и аммониевая соль; соли органических аминов, такие как морфолиновая соль, этилендиаминовая соль, гуанидиновая соль, диэтиламиновая соль, триэтиламиновая соль, дициклогексиламиновая соль, прокаиновая соль, диэтаноламиновая соль, пиперазиновая соль и тетраметиламмониевая соль; соли галогеноводородных кислот (гидрофторид, гидрохлорид, гидробромид, гидроиодид и т.д.); соли неорганических кислот, такие как нитрат, перхлорат, сульфат и фосфат; сульфонаты (метансульфонат, трифторметансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и т.д.); соли органических кислот, такие как ацетат, малат, сукцинат, цитрат, тартрат, оксалат и малеат; и соли аминокислот, такие как орнитинат, глутамат и аспартат.
Предпочтительные примеры могут включать соли галогеноводородных кислот и соли органических кислот.
Кроме того, в объем настоящего изобретения включено также соединение (так называемое пролекарство), которое превращается в производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины, представленное общей формулой (1), или его фармацевтически приемлемую соль после введения в живой организм и его метаболизм или тому подобного в физиологических условиях в указанном живом организме или в физиологических условиях, описанных в "Iyakuhin no kaihatsu, Vol. 7, Bunshi sekkei,", Hirokawa shoten, pp. 163-198 (1990).
Кроме того, когда производное
[1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины, представленное общей формулой (1), или его фармацевтически приемлемая соль является сольватом, таким как гидрат, указанный сольват также включен в объем настоящего изобретения.
Способ получения производного [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины, представленного общей формулой (1) настоящего изобретения, особо не ограничивают. Производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины может быть получено способами, представленными, например, следующими схемами реакций А-С. Символы Ar, Х и R, используемые для указания заместителей в соединениях, представленных следующими формулами в схемах реакций, имеют такие же значения, как и те, что описаны выше.
[Формула 7]
Реакция А
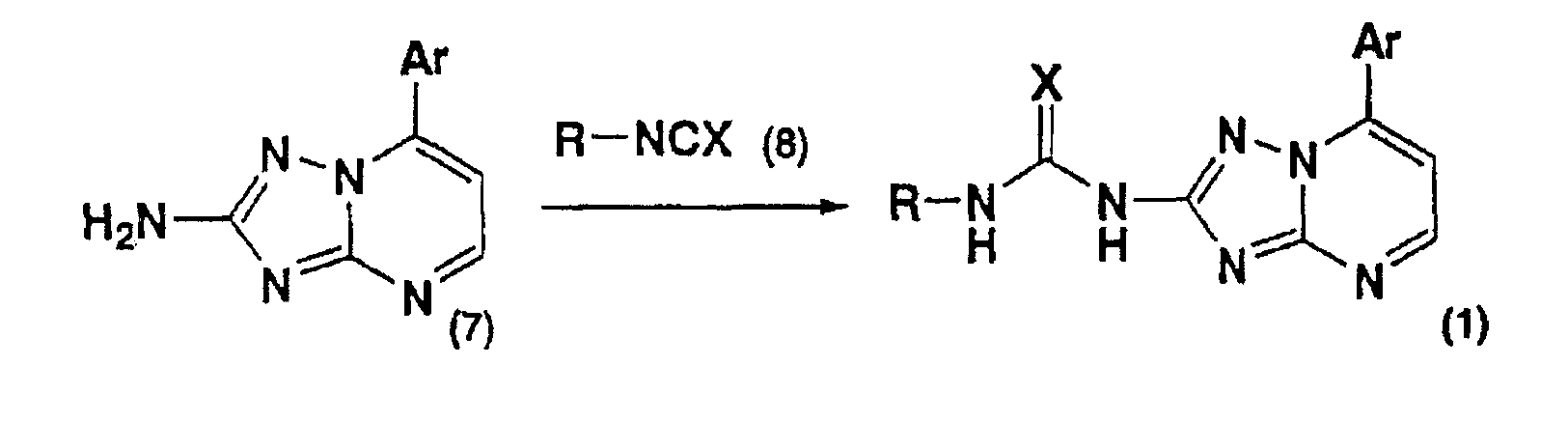
Соединению (8) дают возможность взаимодействовать с производным [1,2,4]триазоло[1,5-a]пиримидин-2-амина (7) и в результате получают производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины (1).
Данную реакцию обычно осуществляют в присутствии или в отсутствие основания. Когда реакцию проводят в присутствии основания, примеры используемого основания могут включать: карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия или карбонат калия; бикарбонаты щелочных металлов, такие как бикарбонат лития, бикарбонат натрия или бикарбонат калия; гидриды щелочных металлов, такие как гидрид лития, гидрид натрия или гидрид калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия или гидроксид калия; алкоксиды щелочных металлов, такие как метоксид лития, метоксид натрия, этоксид натрия или трет-бутоксид калия; алкилметаллы, такие как бутиллитий или хлорид трет-бутилмагния; амиды металлов, такие как диизопропиламид лития (LDA), бис(триметилсилил)амид лития или бис(триметилсилил)амид натрия; и органические амины, такие как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин,
4-(N,N-диметиламино)пиридин, N,N-диметиланилин,
N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нона-5-ен,
1,4-диазабицикло[2.2.2]октан (DABCO) или
1,8-диазабицикло[5.4.0]-7-ундецен (DBU).
Предпочтительные примеры могут включать гидриды щелочных металлов и амиды металлов. Указанное основание используют в молярном эквивалентном отношении от 0,5:1 до 5:1, предпочтительно от 1:1 до 2:1 по отношению к соединению (7). Соединение (8) используют в молярном эквивалентном отношении от 0,5:1 до 5:1, предпочтительно от 1:1 до 2:1 по отношению к соединению (7).
Данную реакцию осуществляют в присутствии или в отсутствие растворителя. Тип используемого в реакции растворителя особо не ограничивают, лишь бы он не оказывал вредного влияния на реакцию. Примеры такого растворителя могут включать: алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ или 1,2-дихлорэтан; простые эфиры, такие как диэтиловымй эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил или пропионитрил; амиды, такие как диметилформамид, диметилацетамид или гексаметилфосфорный триамид; мочевины, такие как N,N-диметилимидазолидинон; и смешанный растворитель, состоящий из указанных выше растворителей. Предпочтительные примеры указанного растворителя могут включать простые эфиры и мочевины. Температура реакции находится в интервале обычно от -80°С до 150°С и предпочтительно от -10°С до 50°С. Время реакции находится в интервале обычно от 10 минут до 48 часов. Примеры соединения (8) могут включать: изоциановые простые эфиры, такие как метилизоцианат, этилизоцианат, изопропилизоцианат, циклогексилизоцианат или фенилизоцианат, и изотиоциановые простые эфиры, такие как метилизотиоцианат или этилизотиоцианат. В качестве соединения (8) может быть использовано коммерчески доступное соединение. Или же соединение (8) может быть получено известными способами или способами, равноценными им.
[Формула 8]
Реакция В

[где Р представляет собой уходящую группу (например, галоген, феноксигруппу, 4-нитрофеноксигруппу, фенилсульфанильную группу, пиридин-2-илсульфанильную группу и т.д.)].
Соединению (9) дают возможность взаимодействовать с производным [1,2,4]триазоло[1,5-a]пиримидин-2-амина (7) и в результате получают производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины (1).
Данную реакцию обычно осуществляют в присутствии или в отсутствие основания. Когда реакцию проводят в присутствии основания, примеры используемого основания являются такими же, как примеры основания, используемого в описанной выше реакции А. Предпочтительные примеры указанного основания тоже такие же, как предпочтительные примеры основания, используемого в описанной выше реакции А. Указанное основание используют в молярном эквивалентном отношении от 0,5:1 до 5:1, предпочтительно от 1:1 до 2:1 по отношению к соединению (7). Соединение (9) используют в молярном эквивалентном отношении от 0,5:1 до 5:1, предпочтительно от 1:1 до 2:1 по отношению к соединению (7). Данную реакцию осуществляют в присутствии или в отсутствие растворителя. Когда реакцию проводят в присутствии растворителя, примеры используемого растворителя являются такими же, как примеры растворителя, используемого в описанной выше реакции А. Предпочтительные примеры указанного растворителя тоже такие же, как предпочтительные примеры растворителя, используемого в описанной выше реакции А. Температура реакции находится в интервале обычно от -80°С до 150°С и предпочтительно от -10°С до 50°С. Время реакции находится в интервале обычно от 10 минут до 48 часов. Примеры соединения (9) могут включать: N-изобутилкарбамоилхлорид, N-бензилкарбамоилхлорид, N-нитрофенил-(1-фенилэтил)карбамат,
N-циано-N'-изопропил-О-фенилизомочевину,
N-циано-N'-(1,5-диметилгексил)-О-фенилизомочевину,
N-циано-N'-(1-фенилэтил)-О-фенилизомочевину,
N-метил-S-фенилизотиомочевину и
N,N'-диметил-S-фенилизотиомочевину.
В качестве соединения (9) может быть использовано коммерчески доступное соединение. Или же соединение (9) может быть получено известными способами или способами, равноценными им.
[Формула 9]
Реакция С
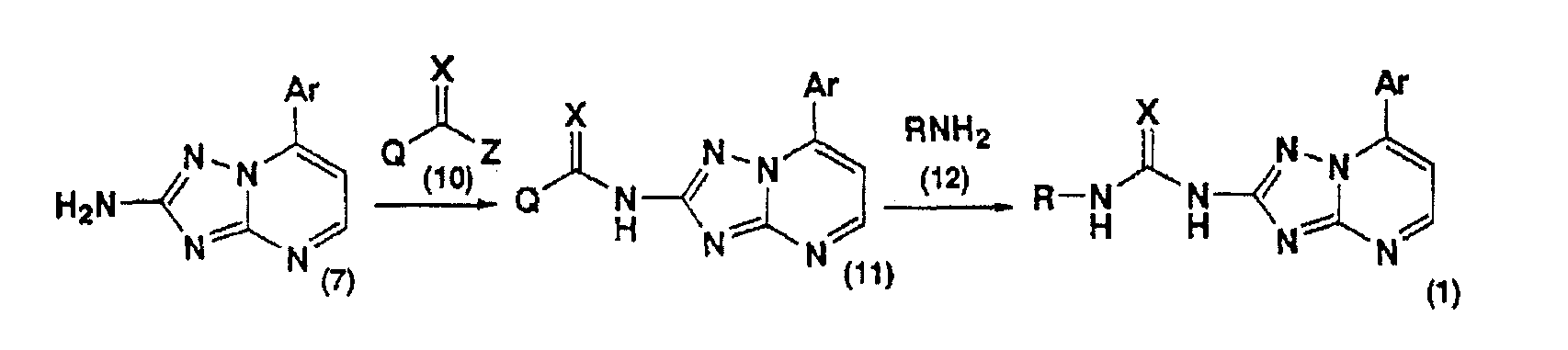
[где Q представляет собой такую же уходящую группу, как Р в описанной выше реакции В, и Z представляет собой галоген].
Соединению (10) дают возможность взаимодействовать с производным [1,2,4]триазоло[1,5-a]пиримидин-2-иламина (7) и в результате получают соединение (11). Затем дают возможность взаимодействовать амину (12) с соединением (11) и в результате получают производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины (1). Реакцию получения соединения (11) обычно осуществляют в присутствии или в отсутствие основания. Когда реакцию проводят в присутствии основания, примеры используемого основания являются такими же, как примеры основания, используемого в описанной выше реакции А. Предпочтительные примеры указанного основания могут включать карбонаты щелочных металлов, бикарбонаты щелочных металлов и органические амины. Указанное основание используют в молярном эквивалентном отношении от 1:1 до избыточного количества (количество растворителя), а предпочтительно от 1:1 до 5:1 по отношению к соединению (7). Соединение (10) используют в молярном эквивалентном отношении от 0,5:1 до 5:1, предпочтительно от 1:1 до 2:1 по отношению к соединению (7). Данную реакцию осуществляют в присутствии или в отсутствие растворителя. Когда реакцию проводят в присутствии растворителя, примеры используемого растворителя являются такими же, как примеры растворителя, используемого в описанной выше реакции А. Предпочтительные примеры указанного растворителя тоже такие же, как предпочтительные примеры растворителя, используемого в описанной выше реакции А. Температура реакции находится в интервале обычно от -50°С до 100°С и предпочтительно от -10°С до комнатной температуры. Время реакции находится в интервале обычно от 10 минут до 24 часов. Полученное соединение (11) может быть непосредственно использовано в качестве растворителя для реакции или может быть использовано в качестве неочищенного продукта для следующей реакции. Или же оно может быть выделено из реакционной смеси обычными методами. Примеры соединения (10) могут включать трихлорметилхлорформиат, фенилхлорформиат, 4-нитрофенилхлорформиат и пентафторфенилхлорформиат. В качестве соединения (10) может быть использовано коммерчески доступное соединение, или же оно может быть также получено известными способами или способами, равноценными им.
Амин (12) используют в реакции в молярном эквивалентном отношении от 0,5:1 до 5:1, предпочтительно от 1:1 до 3:1 по отношению к соединению (11). Данную реакцию осуществляют в присутствии или в отсутствие растворителя. Когда реакцию проводят в присутствии растворителя, примеры используемого растворителя являются такими же, как примеры растворителя, используемого в описанной выше реакции А. Предпочтительные примеры указанного растворителя могут включать простые эфиры, амиды и мочевины. Температура реакции находится в интервале обычно от -50°С до 100°С и предпочтительно от -10°С до комнатной температуры. Время реакции находится в интервале обычно от 10 минут до 24 часов. В качестве соединения (12) может быть использовано коммерчески доступное соединение, или же оно может быть также получено известными способами или способами, равноценными им.
Стереоизомер производного [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины (1) может быть получен стереоспецифически с использованием исходного соединения, имеющего требуемую конфигурацию, или же может быть получен разделением смеси стереоизомеров обычным методом фракционирования или разделения.
Производное [1,2,4]триазоло[1,5-a]пиримидин-2-иламина (7) может быть также получено способом описанной ниже реакции (D).
[Формула 10]
Реакция (D)

(где R' представляет собой (С1-С6) алкильную группу и Ar имеет такие же значения, как описанные ниже).
Соединение (13) и диалкилацеталь диметилформамида (14) конденсируют методом, описанным в Chemische Berichte, 1971, vol. 104, pp. 348-349, например, чтобы получить производное α,β-ненасыщенного кетона (15). Соединение (14) используют в молярном эквивалентном отношении от 0,5:1 до 5:1, предпочтительно от 1:1 до 3:1 по отношению к соединению (13). Данную реакцию осуществляют в присутствии или в отсутствие растворителя. Когда реакцию проводят в присутствии растворителя, примеры используемого растворителя являются такими же, как примеры растворителя, используемого в описанной выше реакции А. Температура реакции находится в интервале обычно от 80°С до 200°С и предпочтительно от 100°С до 150°С. Время реакции находится в интервале обычно от 6 до 24 часов. В качестве соединений (13) и (14) могут быть использованы коммерчески доступные соединения, или же указанные соединения могут быть также получены известными способами или способами, равноценными им.
Затем соединение (15) и 3,5-диамино-1,2,4-триазол конденсируют с получением производного
[1,2,4]триазоло[1,5-a]пиримидин-2-иламина (7). Данную реакцию обычно осуществляют в присутствии кислоты. Примеры указанной кислоты могут включать: минеральные кислоты, такие как хлористоводородная кислота или серная кислота; карбоновые кислоты, такие как уксусная кислота, трифторуксусная кислота или бензойная кислота; сульфоновые кислоты, такие как метансульфоновая кислота, трифторметансульфоновая кислота, п-толуолсульфоновая кислота или камфорсульфоновая кислота; и кислоты Льюиса, такие как трифторид бора, тетрахлорид титана или тетрахлорид олова. Из них предпочтительными являются кислоты Льюиса. Такую кислоту используют в молярном эквивалентном отношении от 0,1:1 до избыточного количества, предпочтительно от 0,2:1 до 2:1 по отношению к соединению (15). 3,5-Диамино-1,2,4-триазол используют в молярном эквивалентном отношении от 0,5:1 до 10:1, предпочтительно от 1:1 до 4:1 по отношению к соединению (15). Данную реакцию осуществляют в присутствии растворителя. Тип такого растворителя особо не ограничивают, лишь бы в присутствии растворителя реакция протекала. Примеры такого растворителя могут включать: алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ или 1,2-дихлорэтан; простые эфиры, такие как диэтиловымй эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил или пропионитрил; амиды, такие как диметилформамид, диметилацетамид или гексаметилфосфорный триамид; мочевины, такие как N,N-диметилимидазолидинон; карбоновые кислоты, такие как уксусная кислота или пропионовая кислота; и смешанный растворитель, состоящий из указанных выше растворителей. Из них предпочтительными являются ароматические углеводороды.
Температура реакции находится в интервале обычно от 50°С до 150°С и предпочтительно от 80°С до 120°С. Время реакции находится в интервале обычно от 10 минут до 6 часов.
Когда заместителем Ar в соединении (1) является (С1-С6) алкоксильная группа, которая может содержать заместитель, указанное соединение может быть получено, например, проведением обычной реакции алкилирования или реакции конденсации, такой как реакция Мицунобу (Mitsunobu), для соединения, в котором заместителем Ar является гидроксильная группа. То есть заместитель преобразуют обычной реакцией органического синтеза с получением производного [1,2,4]триазоло[1,5-a]пиримидин-2-иламина, представленного общей формулой (1).
Когда в каждой из описанных выше реакций заместитель содержит аминогруппу, гидроксильную группу, карбоксильную группу или тому подобное, такую группу защищают известными методами (например, методом, описанным в Greene, T. W. et al., "PROTECTIVE GROUPS IN ORGANIC SYNTHESIS," 2nd edition, WILEY INTERSCIENCE (U.S.A.)). Защищенное соединение может быть использовано в качестве исходного материала, а по окончании реакции защитная группа может быть удалена с получением требуемого соединения. Примеры защитной группы для аминогруппы могут включать формильную группу, ацетильную группу, бензоильную группу, метоксикарбонильную группу, этоксикарбонильную группу, трет-бутоксикарбонильную группу, бензилоксикарбонильную группу и фталоильную группу. Примеры защитной группы для гидроксильной группы могут включать метильную группу, этильную группу, бензильную группу, формильную группу, ацетильную группу, бензоильную группу, трет-бутилдиметилсилильную группу и трет-бутилдифенилсилильную группу. Примеры защитной группы для карбоксильной группы могут включать метильную группу, этильную группу, трет-бутильную группу и бензильную группу. Указанные группы используют в качестве защитных групп, когда это необходимо.
Когда продукт получают в форме свободного соединения, его можно преобразовать в соль обычными методами. Когда продукт получают в форме соли, его можно преобразовывать в свободное соединение обычными методами. Каждый из вышеосанных продуктов может быть выделен и очищен известными методами разделения, такими как дистилляция, вакуумная концентрация, экстракция растворителем, кристаллизация или хроматография.
Настоящее изобретение включает лекарственное средство, содержащее в качестве активного компонента производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины, представленное общей формулой (1), или его фармацевтически приемлемую соль.
Кроме того, производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины, представленное общей формулой (1) настоящего изобретения, или его фармацевтически приемлемая соль обладает ингибирующей активностью по отношению к презентации антигена, как описано ниже в примерах, касающихся испытаний. Настоящее изобретение также включает ингибитор презентации антигена, содержащий в качестве активного компонента описанное выше производное или его фармацевтически приемлемую соль.
Настоящее изобретение также включает иммуносупрессивный агент, содержащий в качестве активного компонента производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины, представленное общей формулой (1), или его фармацевтически приемлемую соль.
Настоящее изобретение включает также ингибитор пролиферации лимфоцитов, ингибитор роста и созревания клеток и индуктор иммунологической толерантности, которые содержат в качестве активного компонента производное [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины, представленное общей формулой (1), или его фармацевтически приемлемую соль.
Кроме того, настоящее изобретение включает также средство для лечения или профилактики реакции отторжения трансплантата или реакции «трансплантат против хозяина», средство для лечения и профилактики аутоиммунного заболевания, средство для лечения и профилактики аллергического заболевания, средство для лечения и профилактики воспалительного заболевания и противоопухолевое средство, которые все содержат в качестве активного компонента описанное выше производное или его фармацевтически приемлемую соль.
Ингибирующее презентацию антигена вещество по настоящему изобретению может быть использовано для лечения и профилактики острого отторжения, реакции трансплантата против хозяина или хронического отторжения, проявляющейся после трансплантации, для индуцирования иммунологической толерантности и тому подобного. В качестве органа для трансплантации могут быть использованы любые виды органов, такие как костный мозг, почка, печень, сердце или поджелудочная железа. Что касается взаимоотношения между донором и реципиентом, то годятся любые типы взаимоотношений, такие как ксеногенная трансплантация, аллогенная трансплантация или трансплантация, влекущая за собой несовместимость крови. Ингибирующее презентацию антигена вещество по настоящему изобретению может быть использовано для иммуносупрессии или увеличения срока жизнеспособности пересаженного органа при лечении рака, лечении аутоиммунных заболеваний, при генной терапии и при трансплантации органов, используемой в регенеративной медицине или тому подобном, такой как трансплантация костного мозга, стволовых клеток периферической крови или стволовых клеток пуповинной крови.
Средство для лечения или профилактики аутоиммунных заболеваний означает, в частности, средство для лечения или профилактики ревматоидного артрита, рассеянного склероза, системной красной волчанки, дискоидной красной волчанки, синдрома Шегрена, болезни Крона, язвенного колита, идиопатической тромбоцитемии, апластической анемии, аутоиммунного гепатита, инсулинзависимого сахарного диабета, тяжелой псевдопаралитической миастении, полимиозита, склеродермы, смешанной соединительнотканной болезни, анкилозирующего спондилита и хронического тироидита.
Средство для лечения или профилактики аллергических заболеваний означает, в частности, средство для лечения или профилактики атопического дерматита, поллиноза, контактной гиперчувствительности, астмы, псориаза и анафилаксии.
Средство для лечения или профилактики воспалительных заболеваний означает, в частности, средство для лечения или профилактики болезни Бехчета, полиартериита, саркоидоза, гломерулонефрита, нефротического синдрома, резистентного ангиита и синдрома Вегенера.
Противоопухолевое лекарственное средство, в частности, означает средство для лечения или профилактики злокачественных опухолей, таких как лимфома, лейкоз, энцефалома, рак легкого, рак поджелудочной железы, рак желудка и рак толстой кишки.
Лекарственное средство по настоящему изобретению изготавливают только из производного [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины или его фармацевтически приемлемой соли или смешиванием указанного производного или его соли с эксципиентом или носителем и затем изготовлением полученного продукта в форме препарата, такого как суспензия, эмульсия, раствор для инъекции, лекарственная форма для ингаляции, таблетка, пилюля, гранула, parvule, порошок, капсула, жидкость для перорального применения, суппозиторий, жидкость для чрескожного применения, адгезивный препарат для чрескожного применения, мазь, жидкость для трансмукозального применения или адгезивный препарат для трансмукозального применения. Полученный описанным образом препарат может быть введен перорально или парентерально. В качестве добавок, таких как эксципиент или носитель, выбирают фармацевтически приемлемые продукты. Тип и состав такой добавки зависит от пути или способа введения. В случае инъекции, например, обычно предпочтительными являются обычные соли и сахара, такие как глюкоза или маннит. В случае перорального средства предпочтительными являются крахмал, лактоза, кристаллическая целлюлоза, стеарат магния и тому подобное. В указанные лекарственные средства при необходимости могут быть введены обычно используемые добавки, такие как вспомогательное вещество, стабилизатор, увлажняющее вещество, эмульгатор или буферный раствор.
Содержание соединения по настоящему изобретению в указанных лекарственных средствах различно и зависит от типа лекарственного средства. Содержание соединения находится в интервале обычно от примерно 1% до примерно 100%, а предпочтительно от примерно 10% до примерно 90% от общей массы лекарственного средства. В случае перорального средства лекарственное вещество вместе с указанными добавками вводят, в частности, в форме таблетки, капсулы, порошка, гранулы, жидкости, сухого сиропа и т.д. Указанные капсулы, таблетки, гранулы или порошки содержат активный компонент в массовом отношении обычно 5%-100% по массе, а предпочтительно 25%-98% по массе.
Лекарственное средство по настоящему изобретению может быть введено любыми способами введения, такими как пероральное введение, инъекция, интраректальное введение, интрапортальное введение, перфузия в органы или локальное введение в органы. Доза лекарственного средства по настоящему изобретению различается в зависимости от способа введения, вида заболевания, патологических состояний, возраста, массы тела пациента и тому подобного. Лекарственное средство по настоящему изобретению может быть введено с дозой обычно от 0,01 мг до 500 мг/кг, предпочтительно от 0,05 мг до 50 мг/кг, в виде разовой дозы или дозы, разделенной на несколько введений в сутки. Лекарственное средство по настоящему изобретению может быть введено за 1 сутки или за ряд последовательных суток. Оно может быть также введено повторно с интервалами в несколько суток или несколько месяцев. При необходимости могут быть также использованы способ введения, доза и схема введения, отличные от описанных выше.
Настоящее изобретение описано более подробно в следующих далее примерах, ссылочных примерах и примерах испытаний. Однако указанные примеры не следует считать ограничивающими объем настоящего изобретения.
Ссылочный пример 1: Синтез 7-тиофен-2-ил[1,2,4]триазоло[1,5-a]пиримидин-2-иламина
Коммерчески доступный 2-ацетилтиофен (8,20 г) и коммерчески доступный диэтилацеталь N,N-диметилформамида (13,6 мл) кипятили с обратным холодильником в ксилоле (13 мл) при 130°С в течение 2 суток. Реакционный раствор концентрировали при пониженном давлении и затем подвергали азеотропной обработке с толуолом. Затем полученный продукт кристаллизовали в смешанном растворителе толуол-гексан с получением 3-диметиламино-1-тиофен-2-илпропенона (11,52 г).
1H-ЯМР (CDCl3): 2,80-3,30 (6H, м), 5,63 (1H, д, J=12,4), 7,08 (1H, дд, J=3,7, 5,0), 7,43 (1H, дд, J=1,1, 5,0), 7,63 (1H, дд, J=1,1, 3,7), 7,79 (1H, д, J=12,4).
Полученный 3-диметиламино-1-тиофен-2-илпропенон (10,78 г) растворяли в толуоле (160 мл). Затем к раствору добавляли 3,5-диамино-1,2,4-триазол (14,15 г) и полученную смесь перемешивали при 100°С. После добавления к смеси 10-камфорсульфоновой кислоты (13,82 г) смесь кипятили с обратным холодильником в течение 1,5 часов. Реакционный раствор охлаждали до комнатной температуры, после чего убирали (декантировали) супернатант. Остаток промывали последовательным опусканием в смесь водный 5% карбонат натрия-10% этанольный раствор, 10% этанольный раствор, этанол и метиленхлорид. Полученный продукт затем сушили при пониженном давлении с получением указанного в заголовке соединения (8,55 г).
Ссылочный пример 2: Синтез 7-(4-бензилоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламина
Указанное в заголовке соединение получали, используя 4'-бензилоксиацетофенон вместо 2-ацетилтиофена, использованного в ссылочном примере 1.
Ссылочный пример 3: Синтез 7-(4-гидроксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламина
Уксусную кислоту (40 мл) и концентрированную хлористоводородную кислоту (40 мл) добавляли к 7-(4-бензилоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламину (соединение, полученное в ссылочном примере 2; 5,70 г) и полученную смесь перемешивали при 80°С в течение 3 часов. Полученный продукт концентрировали при пониженном давлении, после чего остаток промывали опусканием в ацетон (200 мл) и затем в 50% этанольный раствор (100 мл) с получением указанного в заголовке соединения (2,60 г).
Ссылочный пример 4: Синтез 7-[4-(тетрагидропиран-4-илметокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-иламина
7-(4-Гидроксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 3; 295 мг) растворяли в N,N-диметилформамиде (8 мл). Затем к полученному раствору добавляли тетрагидропиран-4-илметил п-толуолсульфонат (460 мг) и карбонат цезия (556 мг) и полученную смесь перемешивали при 90°С в течение ночи. После охлаждения реакционного раствора до комнатной температуры добавляли к нему дистиллированную воду (18 мл). Образовавшийся осадок собирали фильтрованием и затем полученный продукт промывали последовательным опусканием в 20% этанольный раствор, этанол и ацетон с получением указанного в заголовке соединения (310 мг).
Ссылочный пример 5: Синтез 7-(4-нитрофенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламина
Указанное в заголовке соединение получали, используя 4'-нитроацетофенон вместо 2-ацетилтиофена, использованного в ссылочном примере 1.
Ссылочный пример 6: Синтез 7-(4-аминофенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламина
7-(4-Нитрофенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 5; 62,0 мг) суспендировали в уксусной кислоте (0,8 мл). Затем к суспензии добавляли дигидрат хлорида олова(II) (200 мг) и концентрированную хлористоводородную кислоту (0,6 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор нейтрализовали 6 М водным раствором гидроксида натрия и образовавшийся осадок собирали фильтрованием. Полученный продукт промывали последовательным опусканием в дистиллированную воду, этанол и метиленхлорид с получением указанного в заголовке соединения (42,3 мг).
Ссылочный пример 7: Синтез 7-(4-ацетиламинофенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламина
7-(4-Аминофенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 6; 20,1 мг) суспендировали в метаноле (2 мл) и затем к суспензии добавляли уксусный ангидрид (16,9 мкл) с последующим перемешиванием смеси в течение дня и ночи. После этого к реакционному раствору добавляли водный 5% раствор карбоната калия и смесь затем центрифугировали (2000 об/мин, 10 минут). Далее удаляли супернатант, после чего осадок промывали опусканием в этанол и в метиленхлорид с получением указанного в заголовке соединения (19,2 мг).
Ссылочные примеры 8-22
В дальнейшем, используя коммерчески доступные соединения или соединения, полученные известными способами или способами, эквивалентными им, соединения ссылочных примеров 8-19, показанные в таблице 1, получали способом, подобным описанному выше в ссылочном примере 1. Соединение ссылочного примера 20 получали способом, подобным описанному выше в ссылочном примере 3. Соединения ссылочных примеров 21 и 22 получали способом, подобным описанному выше в ссылочном примере 4. Структурные формулы и физико-химические данные соединений ссылочных примеров 1-22 показаны в таблице 1.
Пример 001: Синтез 1-фенил-3-[(7-тиофен-2-ил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевины (Пример способа получения по схеме реакции А)
7-Тиофен-2-ил[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 1; 217 мг) суспендировали в тетрагидрофуране (12 мл). После этого к суспензии добавляли гексаметилдисилановые соли лития (1 М тетрагидрофурановый раствор, 2 мл) и полученную смесь перемешивали при комнатной температуре в течение 5 минут. Затем к реакционному раствору добавляли фенилизоцианат (109 мкл), после чего полученную смесь перемешивали в течение 20 минут. Затем к реакционной смеси добавляли N,N-диметилэтилендиамин (200 мкл) и полученную смесь перемешивали 20 минут. Затем реакционный раствор разбавляли метиленхлоридом (20 мл) и метиленхлоридный раствор промывали 4 М хлористоводородной кислотой (10 мл × 3) и 5% водным раствором карбоната калия (12 мл). Полученный продукт сушили над безводным сульфатом натрия и затем отгоняли при пониженном давлении растворитель. Остаток промывали опусканием в метанол и в метиленхлорид с получением указанного в заголовке соединения (92 мг).
Пример 029: Синтез 1-изопропил-3-[(7-тиофен-2-ил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевины (Пример способа получения по схеме реакции А)
7-Тиофен-2-ил[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 1; 9,73 г) суспендировали в тетрагидрофуране (400 мл). После этого к суспензии добавляли гексаметилдисилановые соли лития (1,73 М тетрагидрофурановый раствор, 51,8 мл) и полученную смесь перемешивали при комнатной температуре в течение 10 минут. Затем к реакционному раствору добавляли изопропилизоцианат (7,04 мл), после чего полученную смесь перемешивали в течение 30 минут. Затем к реакционной смеси добавляли N,N-диметилэтилендиамин (10 мл) и полученную смесь перемешивали 15 минут. Затем реакционный раствор разбавляли метиленхлоридом (500 мл) и разбавленный раствор последовательно промывали 2 М хлористоводородной кислотой (600 мл × 2), 5% водным раствором карбоната калия (600 мл) и насыщенным раствором соли (500 мл). Полученный продукт сушили над безводным сульфатом натрия и затем отгоняли при пониженном давлении растворитель. Остаток очищали колоночной хроматографией на силикагеле (3,6 Φ × 25 см; элюировали метиленхлоридным раствором, содержащим 0%-2% метанол) и полученный продукт кристаллизовали из этилацетата с получением указанного в заголовке соединения (8,40 г).
Пример 040: Синтез 1-[(7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-(тетрагидрофуран-2-илметил)мочевины (Пример способа получения по схеме реакции А)
Ди-трет-бутилдикарбонат (210 мг) растворяли в метиленхлориде (2 мл). Затем к раствору добавляли 4-диметиламинопиридин (117 мг) и тетрагидрофурфуриламин (99,1 мкл) и полученную смесь перемешивали в течение 10 минут с образованием тетрагидрофурфурилового раствора изоцианата.
(7-(4-Метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 8; 145 мг) суспендировали в тетрагидрофуране (4 мл) и затем к суспензии добавляли гексаметилдисилановые соли лития (1,2 М тетрагидрофурановый раствор, 1,0 мл) с последующим перемешиванием смеси. Далее указанный тетрагидрофурфуриловый раствор изоцианата добавляли к реакционному раствору, после чего смесь перемешивали в течение 10 минут. Затем к смеси добавляли N,N-диметилэтилендиамин (120 мкл) и полученную смесь перемешивали еще 10 минут. Далее реакционный раствор разбавляли метиленхлоридом (6 мл). Разбавленный раствор промывали 4 М хлористоводородной кислотой и 5% водным раствором карбоната калия и органический слой концентрировали при пониженном давлении. Остаток очищали гель-фильтрационной колоночной хроматографией (Sephadex LH-20; 2,1 Φ × 110 см; элюировали метанолом) с получением указанного в заголовке соединения (59 мг).
Пример 241: Синтез (S)-N-циано-N'-[1-(4-метоксифенил)этил]-N"-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]гуанидина (Пример способа получения по схеме реакции В)
(S)-(-)-1-(4-Метоксифенил)этиламин (321 мг) растворяли в изопропаноле (6 мл). Затем к раствору добавляли дифенил N-цианокарбонимидат (508 мг) и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Выпавшие в осадок кристаллы собирали фильтрованием, после чего собранные кристаллы промывали изопропиловым эфиром с получением (S)-1-циано-3-[1-(4-метоксифенил)этил]-2-фенилизомочевины (339 мг).
ESI-МС (позитивная мода): m/z 296 (M+H)+
(7-(4-Метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 8; 96,5 мг) суспендировали в тетрагидрофуране (4 мл). Затем к суспензии добавляли гексаметилдисилановые соли лития (1,2 М тетрагидрофуранвый раствор, 0,67 мл) и полученную смесь перемешивали 3 минуты. Далее указанную (S)-1-циано-3-[1-(4-метоксифенил)этил]-2-фенилизомочевину (142 мг) добавляли к реакционному раствору, после чего смесь перемешивали при комнатной температуре в течение 90 минут. Затем реакционный раствор нейтрализовали 10% водным раствором хлорида аммония, полученный раствор концентрировали при пониженном давлении и затем удаляли органический растворитель. После центрифугирования осадка удаляли супернатант. Остаток, растворенный в метаноле, очищали гель-фильтрационной колоночной хроматографией (Sephadex LH-20; 2,1 Φ × 111 см; элюировали метанолом) с получением указанного в заголовке соединения (49,5 мг).
Пример 272: Синтез 1-(5-гидрокси-1,5-диметилгексил)-3-(7-тиофен-2-ил[1,2,4]триазоло[1,5-a]пиримидин-2-ил)мочевины (Пример получения по схеме реакции С)
7-Тиофен-2-ил[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 1; 2,17 г) растворяли в 1,3-диметилимидазолидин-2-оне (DMI, 100 мл). Затем к раствору добавляли 4-нитрофенилхлорформиат (3,02 г) и полученную смесь перемешивали в течение 5 минут при охлаждении на льду. Далее к смеси добавляли пиридин (1,21 мл) и полученную смесь перемешивали 40 минут при охлаждении на льду. Затем добавляли 6-амино-2-метил-2-гептанол (5,81 г) и полученную смесь перемешивали 30 минут при охлаждении на льду. Реакционный раствор разбавляли метиленхлоридом (300 мл) и органический слой последовательно промывали 4 М хлористоводородной кислотой (200 мл × 2), дистиллированной водой и 5% водным раствором карбоната калия (200 мл × 2). После этого органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. К полученному остатку (включающему DMI) добавляли смешанный растворитель, состоящий из этилацетата (40 мл) и гексана (500 мл), после чего смесь перемешивали. Удаляли супернатант, после чего осадок растворяли в этилацетате (250 мл) с последующей промывкой водой. Органический слой сушили над безводным сульфатом натрия и затем отгоняли при пониженном давлении растворитель. Полученный остаток очищали гель-фильтрационной колоночной хроматографией (Sephadex LH-20; 2,1 Φ × 110 см; элюировали метанолом) с получением указанного в заголовке соединения (1,48 г).
Пример 300: Синтез (S)-1-[1-(3-метоксифенил)этил]-3-[7-(3,4-метилендиоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевины (Пример получения по схеме реакции С)
7-(3,4-Метилендиоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 15; 1,277 г) растворяли в DMI (50 мл). После охлаждения полученного раствора на льду к раствору добавляли пиридин (0,61 мл) и 4-нитрофенилхлорформиат (1,511 г) и полученную смесь перемешивали при той же самой температуре в течение 70 минут. Затем к полученной смеси добавляли (S)-1-(3-метоксифенил)этиламин (2,277 г) и смесь перемешивали при той же температуре в течение 1 часа. Далее к смеси добавляли воду и прекращали реакцию. Затем к реакционному раствору добавляли метиленхлорид (200 мл) и полученную смесь последовательно промывали 4 М хлористоводородной кислотой (200 мл × 4), насыщенным водным раствором карбоната калия (200 мл × 4) и водой (300 мл × 2). После этого органический слой концентрировали при пониженном давлении. Полученный остаток растворяли в этилацетате при нагревании (70°С-80°С), после чего удаляли горячим фильтрованием нерастворимые вещества. Далее фильтрат концентрировали и затем концентрат кристаллизовали из этилацетата (90 мл). Полученные кристаллы растворяли в метиленхлориде (150 мл) и затем удаляли фильтрованием нерастворимые вещества. Фильтрат концентрировали и концентрат растворяли в этилацетате (250 мл) при нагревании (70°С-80°С). Далее растворитель концентрировали до примерно одной трети количества и фильтрованием удаляли осадок. Фильтрат концентрировали и остаток перекристаллизовывали из метанола. Полученные кристаллы очищали колоночной хроматографией на силикагеле (элюировали метиленхлоридом, содержащим 1%-2% метанол) с получением указанного в заголовке соединения (0,576 г).
Пример 302: Синтез 1-[7-(3,4-метилендиоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-[1-(3,4,5-триметоксифенил)этил]мочевины (Пример получения по схеме реакции С)
7-(3,4-Метилендиоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 15; 0,510 г) и 4-нитрофенилхлорформиат (0,605 г) растворяли в DMI (20 мл). После охлаждения полученного раствора на льду к раствору добавляли пиридин (0,24 мл) и полученную смесь перемешивали при той же самой температуре в течение 70 минут.
К реакционной смеси добавляли (1-(3,4,5-триметоксифенил)этиламин (1,268 г) и смесь перемешивали при той же температуре в течение 6 часов 40 минут. Далее к реакционному раствору добавляли этилацетат (200 мл) и затем к полученной смеси добавляли по каплям гексан (600 мл). После обработки смеси ультразвуком в течение 10 минут, собирали фильтрованием осадок, который затем опять растворяли в этилацетате (100 мл). Потом к раствору добавляли по каплям гексан (300 мл), удаляли супернатант и затем собирали осадок. Полученный осадок растворяли в метаноле (100 мл) при нагревании (60°С), после чего удаляли фильтрованием нерастворимые вещества. Фильтрат концентрировали и остаток растворяли в метиленхлориде (50 мл). Полученную смесь последовательно промывали 4 М хлористоводородной кислотой (40 мл × 4), насыщенным водным раствором карбоната натрия (40 мл × 4) и водой (40 мл × 2). После сушки полученного продукта органический слой концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюировали метиленхлоридом, содержащим 1%-2% метанол) с получением указанного в заголовке соединения (0,233 г).
Пример 306: Синтез 1-[1-(3,4-метилендиоксифенил)этил]-3-[7-(3-(пиридин-3-илметокси)фенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевины (Пример получения по схеме реакции С)
7-(3-(Пиридин-3-илметокси)фенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 22; 0,536 г) и 4-нитрофенилхлорформиат (0,509 г) растворяли в DMI (13 мл). После охлаждения полученного раствора на льду к раствору добавляли пиридин (0,20 мл) и полученную смесь перемешивали при той же самой температуре в течение 1 часа. Затем к реакционной смеси добавляли (1-(3,4-метилендиоксифенил)этиламин (0,695 г) и полученную смесь перемешивали при той же температуре в течение 3 часов 40 минут. Далее к реакционному раствору добавляли воду (1 мл) и прекращали реакцию. Затем к реакционный раствор добавляли этилацетат (168 мл) и полученную смесь добавляли по каплям к гексану (505 мл). После обработки смеси ультразвуком в течение 10 минут собирали фильтрованием осадок. Полученный продукт суспендировали в смешанном растворителе, состоящем из гексана и этилацетата (3:1; 60 мл). После обработки суспензии ультразвуком в течение 10 минут собирали фильтрованием осадок. Полученный продукт очищали колоночной хроматографией на силикагеле (элюировали метиленхлоридом, содержащим 2% метанол) с получением указанного в заголовке соединения (0,454 г).
Пример 313: Синтез 1-(5-гидрокси-1,5-диметилгексил)-3-{7-[3-(пиридин-3-илметокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевины (Пример получения по схеме реакции С)
4-Нитрофенилхлорформиат (0,786 г) растворяли в DMI (20 мл). Затем к раствору добавляли 7-[3-(пиридин-3-илметокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 22; 0,828 г) и пиридин (421 мкл) с перемешиванием при 10°С. После перемешивания смеси при 10°С в течение 1 часа к ней добавляли DMI раствор (1,5 мл), содержащий 6-амино-2-метил-2-гептанол (1,133 г). Полученную смесь перемешивали при 10°С в течение 2,5 часов и затем перемешивали в течение ночи при постепенном повышении температуры до комнатной температуры. Затем отгоняли при пониженном давлении (63°С, 1 мм рт. столба) растворитель и остаток растворяли в метиленхлориде (500 мл). Полученный раствор промывали 1 М водным раствором гидроксида натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия и отгоняли при пониженном давлении растворитель. Полученный остаток промывали опусканием в смешанный растворитель, состоящий из диэтилового эфира и гексана (1:1; 20 мл × 2). Остаток очищали колоночной хроматографией на силикагеле (элюировали метиленхлоридом, содержащим 3%-7% метанол) с получением указанного в заголовке соединения (1,129 г).
Пример 317: Синтез (±)-1-(4-гидрокси-1,4-диметилпентил)-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевины (Пример получения по схеме реакции С)
Коммерчески доступный гексан-2,5-дион (137 г) растворяли в бензоле (300 мл). После этого к раствору добавляли этиленгликоль (100 мл) и п-толуолсульфоновую кислоту (11,4 г) и полученную смесь дегидратировали кипячением с обратным холодильником в течение 5 часов. Продукт реакции разбавляли этилацетатом и затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия. Отгоняли при пониженном давлении растворитель и остаток подвергали вакуумной дистилляции (80°С-82°С/3 мм рт. столба) с получением 4-(2-метил[1,3]диоксолан-2-ил)бутан-2-она (56,83 г).
1H-ЯМР (CDCl3): 1,32 (3H, с), 1,98 (2H, т, J=1,6), 2,16 (3H, с), 2,52 (2H, т, J=1,6), 3,88-3,98 (4H, перекрываемый).
Полученный 4-(2-метил[1,3]диоксолан-2-ил)бутан-2-он (27,60 г) растворяли в тетрагидрофуране (220 мл) и затем к раствору при комнатной температуре добавляли метилмагнийбромид (3 М тетрагидрофурановый раствор; 85 мл). Полученную смесь перемешивали в течение 40 минут, после чего добавляли к ней насыщенный водный раствор хлорида аммония (300 мл) с последующим экстрагированием этилацетатом (300 мл × 3). Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Отгоняли при пониженном давлении растворитель. Остаток очищали колоночной хроматографией на силикагеле (элюировали смесью этилацетат/гексан (1:1)) с получением 2-метил-4-(2-метил)[1,3]диоксолан-2-ил)бутан-2-ола (21,18 г).
1H-ЯМР (CDCl3): 1,22 (6H, с), 1,34 (3H, с), 1,54-1,82 (4H, перекрываемый), 3,9-4,0 (4H, м)
Полученный 2-метил-4-(2-метил[1,3]диоксолан-2-ил)бутан-2-ол (21,18 г) растворяли в ацетоне (165 мл). Затем к раствору добавляли 1 М хлористоводородную кислоту (6,6 мл) и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор нейтрализовали 1 М водным раствором гидроксида натрия. После этого добавляли к нему насыщенный раствор соли (100 мл) и затем отгоняли при пониженном давлении ацетон. После экстрагирования хлороформом (200 мл × 4) органический слой сушили над безводным сульфатом натрия. Затем удаляли при пониженном давлении растворитель с получением 5-гидрокси-5-метилгексан-2-она (14,23 г).
1H-ЯМР (CDCl3): 1,22 (6H, с), 1,77 (2H, т, J=7,4), 2,19 (3H, с), 2,59 (2H, т, J=7,4)
Полученный 5-гидрокси-5-метилгексан-2-он (14,23 г) растворяли в метиленхлориде (520 мл). После этого к раствору добавляли бензгидриламин (21,00 г) и полученную смесь перемешивали при комнатной температуре в течение ночи. Затем к реакционному раствору добавляли триацетоксиборогидрид натрия (46,30 г) и полученную смесь перемешивали при комнатной температуре в течение 4 часов. После этого к реакционному раствору добавляли дистиллированную воду (173 мл) и полученный раствор доводили до рН 12 добавлением 6 М водного раствора гидроксида натрия. После экстрагирования хлороформом органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Отгоняли при пониженном давлении растворитель и полученный остаток очищали колоночной хроматографией на силикагеле (элюировали смесью 67% этилацетат/гексан) с получением 5-бензгидриламино-2-метилгексан-2-ола (22,80 г).
1H-ЯМР (CDCl3): 1,07 (3H, д, J= 6,3), 1,31 (3H, с), 1,34-1,84 (4H, перекрываемый), 2,58 (1H, м), 3,86-3,96 (4H, перекрываемый), 4,98(1H, с), 7,18-7,44 (10H, перекрываемый)
Полученный 5-бензгидриламино-2-метилгексан-2-ол (5,20 г) растворяли в метаноле (250 мл) и затем к полученному раствору добавляли гидроксид палладия (2,00 г). Смесь перемешивали в автоклаве при давлении водорода 9 кг/см2 в течение 2,5 часов. Реакционный раствор фильтровали, используя фильтровальную среду (целит), и фильтрат затем концентрировали при пониженном давлении. К остатку добавляли дистиллированную воду (50 мл), после чего раствор доводили до рН 2,0 добавлением 1 М хлористоводородной кислоты. После этого раствор промывали диэтиловым эфиром (100 мл × 3). Водный слой доводили до рН 12 добавлением 6 М водного раствора гидроксида натрия с последующим экстрагированием хлороформом (100 мл × 3). Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Отгоняли при пониженном давлении растворитель с получением 5-амино-2-метил-2-гексанола (2,01 г).
1H-ЯМР (CDCl3): 1,12 (3H, д, J=6,4), 1,22 (6H, с), 1,3-1,7 (4H, перекрываемый), 2,90 (1H, м)
7-(4-Метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 8; 579 мг) растворяли в DMI (24 мл). Затем к раствору добавляли 4-нитрофенилхлорформиат (726 мг) и полученную смесь перемешивали при охлаждении на льду. Затем к смеси добавляли пиридин (292 мкл) и полученную смесь перемешивали 45 минут при охлаждении на льду. Далее к реакционному раствору добавляли DMI раствор (2 мл), содержащий 5-амино-2-метил-2-гексанол (1,25 г), и полученную смесь перемешивали в течение 30 минут при охлаждении на льду. Потом к реакционному раствору добавляли диизопропиловый эфир (200 мл) и смесь перемешивали в течение 10 минут с получением осадка в виде сиропа. Удаляли супернатант и осадок растворяли в смешанном растворителе (100 мл), состоящем из 5% метанола и метиленхлорида. Полученный раствор затем промывали 1 М хлористоводородной кислотой (100 мл), 5% водным раствором карбоната калия (100 мл) и дистиллированной водой (100 мл). Органический слой сушили над безводным сульфатом натрия и затем отгоняли при пониженном давлении растворитель. Полученный остаток очищали гель-фильтрационной колоночной хроматографией (Sephadex LH-20; 2,1 Φ × 112 см; элюировали метанолом) и колоночной хроматографией на силикагеле (1,6 Φ × 21 см; элюировали метиленхлоридом, содержащим 0%-4% метанол) с получением указанного в заголовке соединения (368 мг).
Пример 319: Синтез (S)-1-(5-гидрокси-1,5-диметилгексил)-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевины (Пример получения по схеме реакции С)
7-(4-Метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 8; 72,4 мг) растворяли в DMI (3 мл). Затем к раствору добавляли 4-нитрофенилхлорформиат (90,7 мг) и полученную смесь перемешивали при охлаждении на льду. Затем к смеси добавляли пиридин (36,4 мкл) и полученную смесь перемешивали 45 минут при охлаждении на льду. Далее к реакционному раствору добавляли (S)-6-амино-2-метил-2-гептанол (175 мг) при перемешивании с постепенным повышением температуры до комнатной в течение ночи. Затем к реакционному раствору добавляли диизопропиловый эфир (10 мл). Образовавшийся маслянистый осадок отделяли, после чего промывали диизопропиловым эфиром. Остаток растворяли в этилацетате (20 мл) и полученный раствор промывали 5% водным раствором карбоната натрия (15 мл) и дистиллированной водой. Органический слой сушили над безводным сульфатом натрия и затем отгоняли при пониженном давлении растворитель. Полученный остаток очищали гель-фильтрационной колоночной хроматографией (Sephadex LH-20; 2,1 Φ × 110 см; элюировали метанолом) с получением указанного в заголовке соединения (48,2 мг).
Пример 327: Синтез 1-[7-(3,4-метилендиоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-(3-этокси-1-метилпропил)мочевины (Пример получения по схеме реакции С)
7-(3,4-Метилендиоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 15; 766 мг) растворяли в DMI (30 мл). Затем к раствору добавляли 4-нитрофенилхлорформиат (907 мг) и полученную смесь перемешивали при охлаждении на льду. Потом к ней добавляли пиридин (365 мкл) и полученную смесь перемешивали в течение 45 минут при охлаждении на льду. Далее к реакционному раствору добавляли 3-этокси-1-метилпропиламин (1,40 г) и полученную смесь перемешивали в течение 1 часа при охлаждении на льду. Затем реакционный раствор разбавляли метиленхлоридом (160 мл) и полученный раствор промывали 1 М хлористоводородной кислотой (160 мл), дистиллированной водой (160 мл), 5% водным раствором карбоната калия (160 мл) и насыщенным раствором соли (160 мл). Органический слой сушили над безводным сульфатом натрия и отгоняли при пониженном давлении растворитель. Остаток, содержавший DMI, разбавляли этилацетатом (200 мл), после чего промывали дистиллированной водой (200 мл × 4). Полученный продукт сушили над безводным сульфатом натрия и затем отгоняли при пониженном давлении растворитель. Полученный остаток очищали колоночной хроматографией на силикагеле (2,3 Φ × 22 см; элюировали метиленхлоридом, содержащим 1%-2% метанол) и гель-фильтрационной колоночной хроматографией (Sephadex LH-20; 2,1 Φ × 112 см; элюировали метанолом) с получением указанного в заголовке соединения (442 мг).
Пример 333: Синтез 1-(4-метокси-1-метилбутил)-3-[7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевины (Пример получения по схеме реакции С)
4-Нитрофенилхлорформиат (644 мг) растворяли в DMI (26 мл). Затем к раствору добавляли с перемешиванием при охлаждении на льду 7-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 8; 514 мг) и пиридин (347 мкл). Полученную смесь перемешивали в течение 40 минут при охлаждении на льду. Затем к ней добавляли 4-метокси-1-метилпропиламин (500 мг) и полученную смесь перемешивали в течении 1 часа при охлаждении на льду. После этого реакционный раствор перемешивали при комнатной температуре в течение ночи. Далее к реакционному раствору добавляли кусок льда и 3 М водный раствор гидроксида натрия с последующим экстрагированием метиленхлоридом. Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Затем отгоняли при пониженном давлении растворитель. Полученный остаточный раствор дополнительно подвергали вакуумной дистилляции для удаления DMI. Затем остаток от дистилляции растворяли в этилацетате (100 мл) и органический слой промывали 1 М хлористоводородной кислотой (30 мл × 4), после чего сушили над безводным сульфатом натрия. Отгоняли при пониженном давлении растворитель. Полученный остаток очищали колоночной хроматографией на силикагеле (элюировали этилацетатом, содержащим 0%-20% метанол) с получением указанного в заголовке соединения (242 мг).
Пример 222: Синтез (S)-1-[7-(4-бензилоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-[1-(3-метоксифенил)этил]мочевины (Пример получения по схеме реакции С)
7-(4-Бензилоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 2; 6,98 г) растворяли в DMI (100 мл). Затем к раствору добавляли 4-нитрофенилхлорформиат (6,67 г). После этого к нему добавляли пиридин (2,67 мл) при охлаждении на льду. Полученную смесь перемешивали в течение 1 часа при охлаждении на льду. Затем к реакционному раствору добавляли (S)-1-(3-метоксифенил)этиламин (5,00 г) и полученную смесь перемешивали в течение дня и ночи. После этого отгоняли при пониженном давлении растворитель. Остаток разбавляли метиленхлоридом, после чего органический слой промывали 1 М хлористоводородной кислотой и дистиллированной водой. Органический слой сушили над безводным сульфатом натрия. Затем отгоняли при пониженном давлении растворитель. Полученный остаток промывали опусканием в этилацетат с получением указанного в заголовке соединения (6,93 г).
Пример 223: Синтез (S)-1-[7-(4-гидроксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-[1-(3-метоксифенил)этил]мочевины
(S)-1-[7-(4-Бензилоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-[1-(3-метоксифенил)этил]мочевину (соединение, полученное в примере 222; 7,83 г) растворяли в уксусной кислоте (600 мл). После этого к раствору добавляли 10% палладий на углероде (содержание воды 50%; 2,0 г) и полученную смесь перемешивали при 40°С в течение ночи в атмосфере водорода. Реакционный раствор фильтровали через фильтровальную среду (Целит), после чего полученный продукт концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюировали метиленхлоридом, содержащим 4% метанол) с получением указанного в заголовке соединения (5,37 г).
Пример 244: Синтез (S)-1-{7-[4-(2-метоксиэтокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-[1-(3-метоксифенил)этил]мочевины
(S)-1-[7-(4-Гидроксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-[1-(3-метоксифенил)этил]мочевину (соединение, полученное в примере 223; 20,3 мг) суспендировали в 2-бутаноне (2 мл). Затем к суспензии добавляли карбонат калия (69,4 мг) и 2-метоксиэтилбромид (47,2 мкл) и полученную смесь перемешивали при 80°С в течение 5 часов. После этого реакционный раствор разбавляли метиленхлоридом (5 мл) и полученный продукт промывали 1 М хлористоводородной кислотой (5 мл × 3), насыщенным раствором бикарбоната натрия (5 мл × 2) и дистиллированной водой (5 мл × 2). Органический слой концентрировали при пониженном давлении и полученный остаток очищали обращенно-фазовой жидкостной хроматографией (Inertsil PREP-ODS; 20 Φ × 250 мм; элюировали ацетонитрилом, содержащим воду) с получением указанного в заголовке соединения (10,7 мг).
Пример 245: Синтез (S)-1-[7-(4-бензилоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-(1,5-диметилгексил)мочевины (Пример получения по схеме реакции С)
7-(4-Бензилоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-иламин (соединение, полученное в ссылочном примере 2; 8,00 г) и 4-нитрофенилхлорформиат (7,62 г) растворяли в DMI (100 мл). После охлаждения полученной смеси на льду к ней добавляли пиридин (3,1 мл) и полученную смесь перемешивали при той же температуре в течение 40 минут. Далее к реакционному раствору добавляли (S)-(+)-2-амино-6-метилгептан (6,4 мл), после чего температуру полученной смеси повышали до комнатной температуры с последующим перемешиванием в течение ночи. Затем отгоняли при пониженном давлении растворитель. После этого к остатку добавляли метиленхлорид (100 мл) и полученный раствор последовательно промывали 1 М хлористоводородной кислотой (100 мл × 3), 5% водным раствором карбоната калия (100 мл × 5) и насыщенным раствором соли (200 мл). Органический слой концентрировали при пониженном давлении. Остаток растворяли в этилацетате (286 мл), после чего полученный раствор добавляли по каплям к гексану (429 мл). Осадок собирали фильтрованием, после чего полученный продукт очищали колоночной хроматографией на силикагеле (элюировали метиленхлоридом, содержащим 1% метанол) с получением указанного в заголовке соединения (7,39 г).
Пример 255: Синтез (S)-1-(1,5-диметилгексил)-3-[7-(4-гидроксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевины
(S)-1-[7-(4-бензилоксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]-3-(1,5-диметилгексил)мочевину (соединение, полученное в примере 245; 7,1 г) и палладий на углероде (содержание воды 50%; 2,0 г) суспендировали в уксусной кислоте (570 мл) и полученную суспензию перемешивали в атмосфере водорода при комнатной температуре в течение 5 суток. Затем реакционный раствор фильтровали через фильтровальную среду (Целит) и собранный продукт промывали метанолом. Фильтрат и промывной раствор смешивали и полученную смесь концентрировали при пониженном давлении. Полученный остаток растворяли в метиленхлориде (150 мл) и полученный раствор промывали насыщенным раствором соли (100 мл) два раза. Слой насыщенного раствора соли, полученный после второй промывки, экстрагировали метиленхлоридом (70 мл × 3). Органические слои объединяли и полученный слой концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюировали метиленхлоридом, содержащим 1%-2% метанол) с получением указанного в заголовке соединения (4,72 г).
Пример 262: Синтез (S)-1-(1,5-диметилгексил)-3-{7-[4-(2-метоксиэтокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-ил}мочевины
(S)-1-(1,5-диметилгексил)-3-[7-(4-гидроксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину (соединение, полученное в примере 255; 30 мг) и карбонат калия (108 мг) суспендировали в метилэтилкетоне (3 мл). После этого к полученной суспензии добавляли 2-метоксиэтилбромид (327 мг) и полученную смесь перемешивали при 80°С в течение 10 часов. Далее реакционный раствор охлаждали до комнатной температуры и добавляли к нему метиленхлорид (5 мл). Полученную смесь промывали 1 М раствором хлористоводородной кислоты (5 мл × 3), насыщенным водным раствором бикарбоната натрия (5 мл × 2) и дистиллированной водой (5 мл × 2). Органический слой концентрировали при пониженном давлении и полученный остаток очищали обращенно-фазовой жидкостной хроматографией (Inertsil PREP-ODS; 20 Φ × 250 мм; элюировали ацетонитрилом, содержащим воду) с получением указанного в заголовке соединения (14 мг).
Пример 258: Синтез гидрохлорида (S)-1-(1,5-диметилгексил)-3-{7-[4-(2-морфолин-4-илэтокси)фенил]-[1,2,4]триазоло[1,5-a]пиримидин-2-ил}мочевины
(S)-1-(1,5-диметилгексил)-3-[7-(4-гидроксифенил)-[1,2,4]триазоло[1,5-a]пиримидин-2-ил]мочевину (соединение, полученное в примере 255; 20 мг) растворяли в метиленхлориде (1 мл) в атмосфере аргона. Затем к полученному раствору добавляли 2-морфолин-4-илэтанол (21 мг) и трифенилфосфин (41 мг) и полученную смесь перемешивали при комнатной температуре в течение 30 минут. Далее реакционный раствор охлаждали на льду, после чего добавляли к нему диэтилазодикарбоксилат (27 мг) с последующим перемешиванием смеси при той же температуре в течение 30 минут. Реакционный раствор дополнительно перемешивали при комнатной температуре в течение ночи. После этого реакционный раствор концентрировали при пониженном давлении. Затем добавляли к нему этилацетат (3 мл) и 1 М хлористоводородную кислоту (3 мл) и полученную смесь разделяли. После промывки полученного водного слоя этилацетатом (3 мл) к нему добавляли 6 М водный раствор гидроксида натрия для перевода раствора в щелочной. После экстрагирования метиленхлоридом (5 мл) органический слой промывали дистиллированной водой (5 мл × 2), после чего отгоняли при пониженном давлении растворитель. Остаток промывали опусканием в смешанный растворитель (2 мл), состоящий из 50% этилацетата и гексана, с получением указанного в заголовке соединения в форме свободного вещества (18 мг). После этого к полученному соединению добавляли метанол (1 мл) и 1 М хлористоводородную кислоту (0,2 мл), в которых его растворяли, после чего полученный раствор концентрировали при пониженном давлении. Полученный остаток промывали опусканием в ацетон (0,5 мл) с получением указанного в заголовке соединения (17 мг).
Далее, используя производные [1,2,4]триазоло[1,5-a]пиримидин-2-иламина, полученные способами, описанными в ссылочных примерах, или способами, эквивалентными известным способам, и известные амины или производные аминов или амины или производные аминов, полученные способами, эквивалентными известным способам, получали производные [1,2,4]триазоло[1,5-a]пиримидин-2-илмочевины, соответствующие соединениям примеров 001-337, способами, раскрытыми в описанных выше примерах, способами, основанными на обычных реакциях органического синтеза, или иными способами. Структурные формулы и физико-химические данные полученных соединений примеров 001-337 показаны в таблицах 4 и 5.
В таблицах соединения, имеющие символы, такие как "(S)-", "(R)-" или "(S,S)-", в их структурных формулах, означают оптически активные вещества, в которых конфигурация ассиметрического атома углерода представляет собой (S)-форму, (R)-форму или (S,S)-форму.
Таблица 4
Таблица 5

















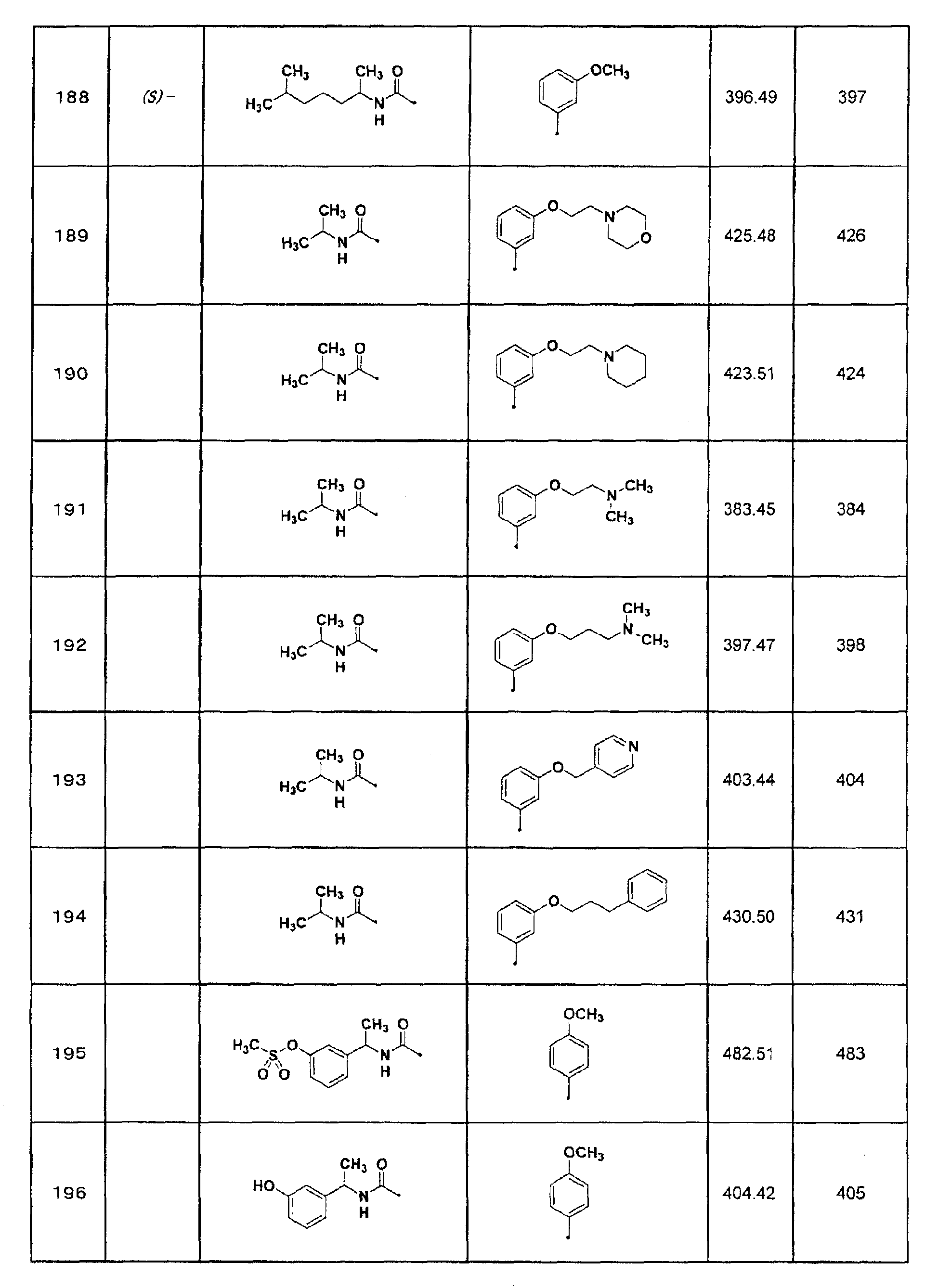








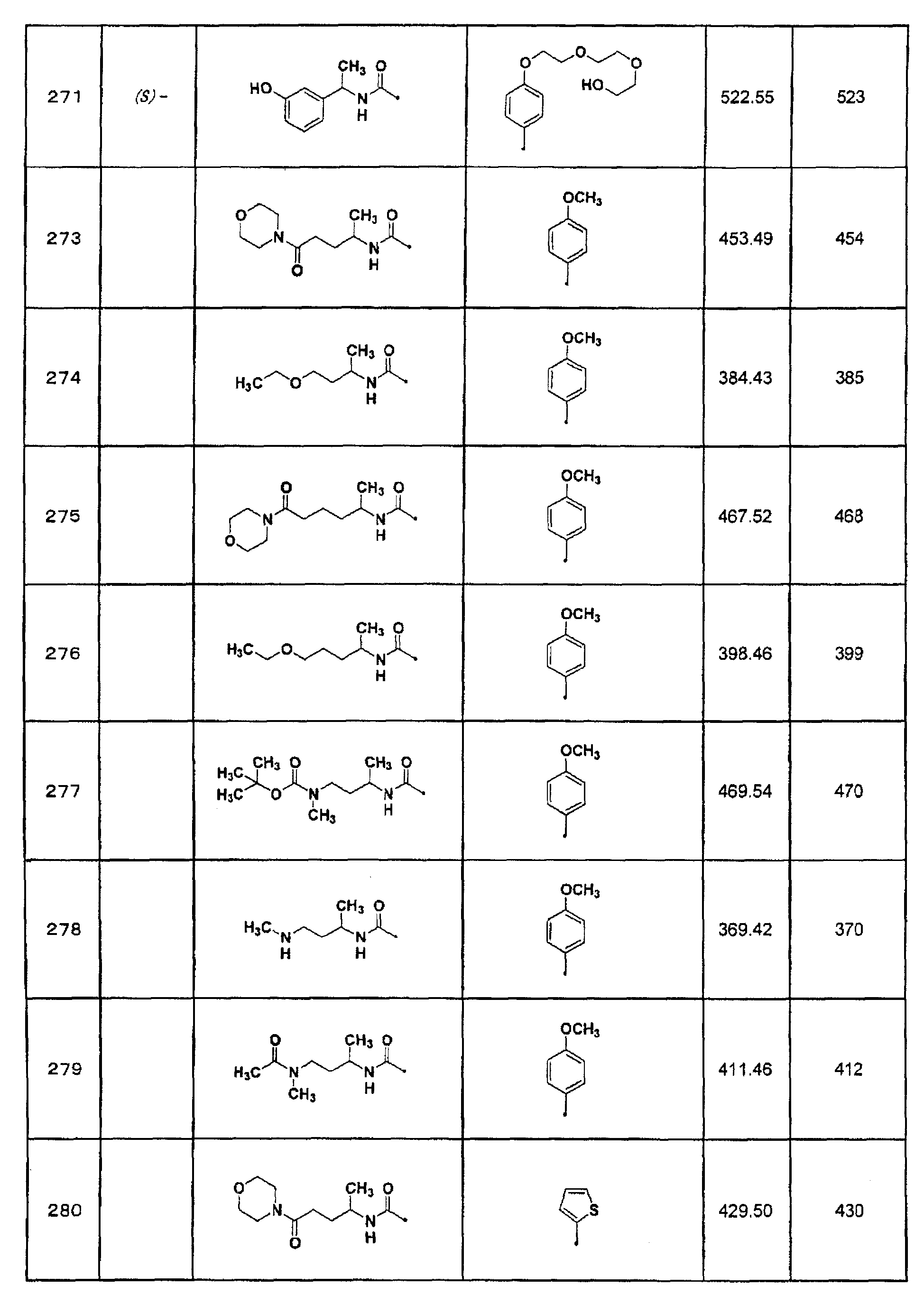



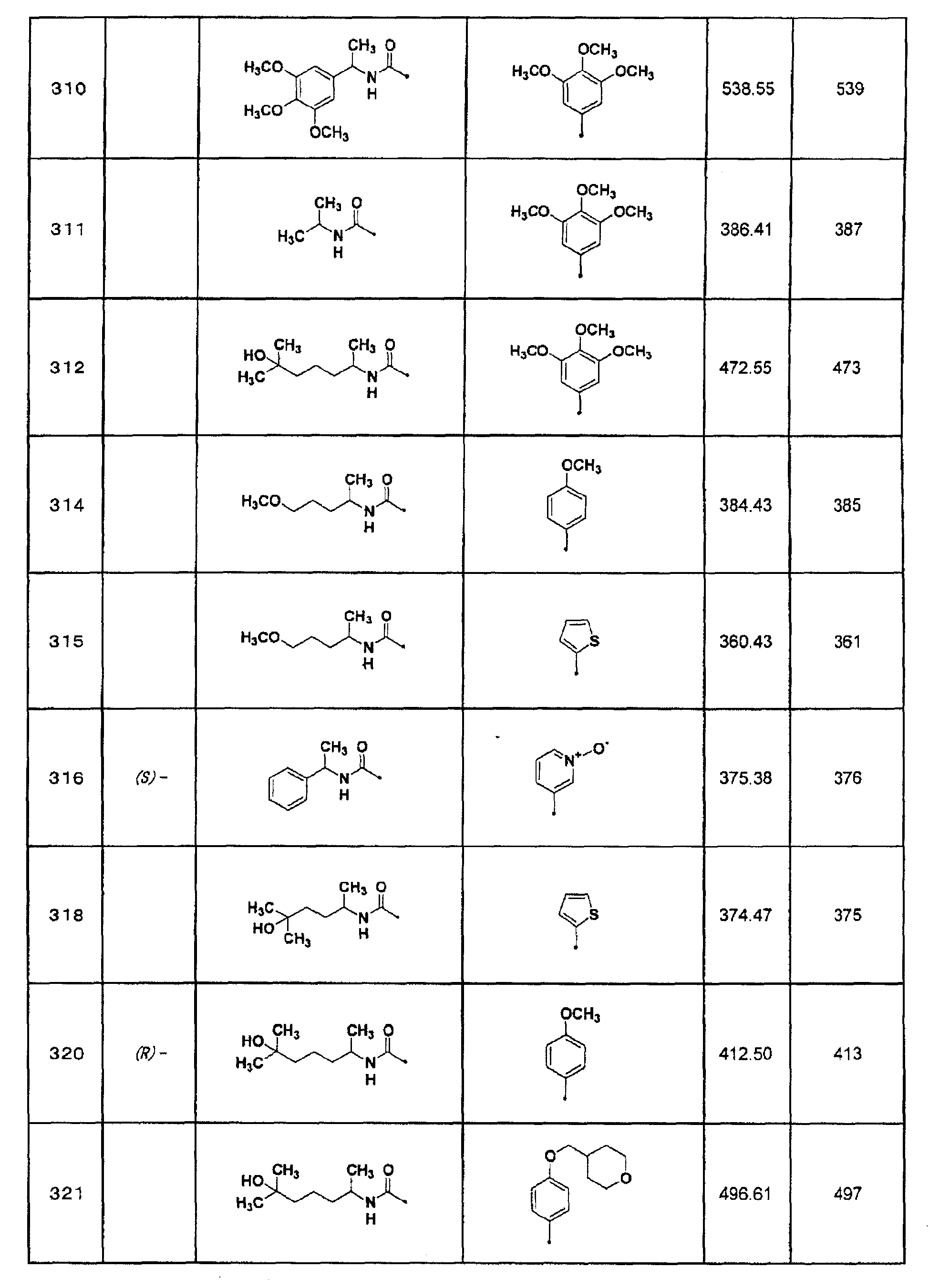

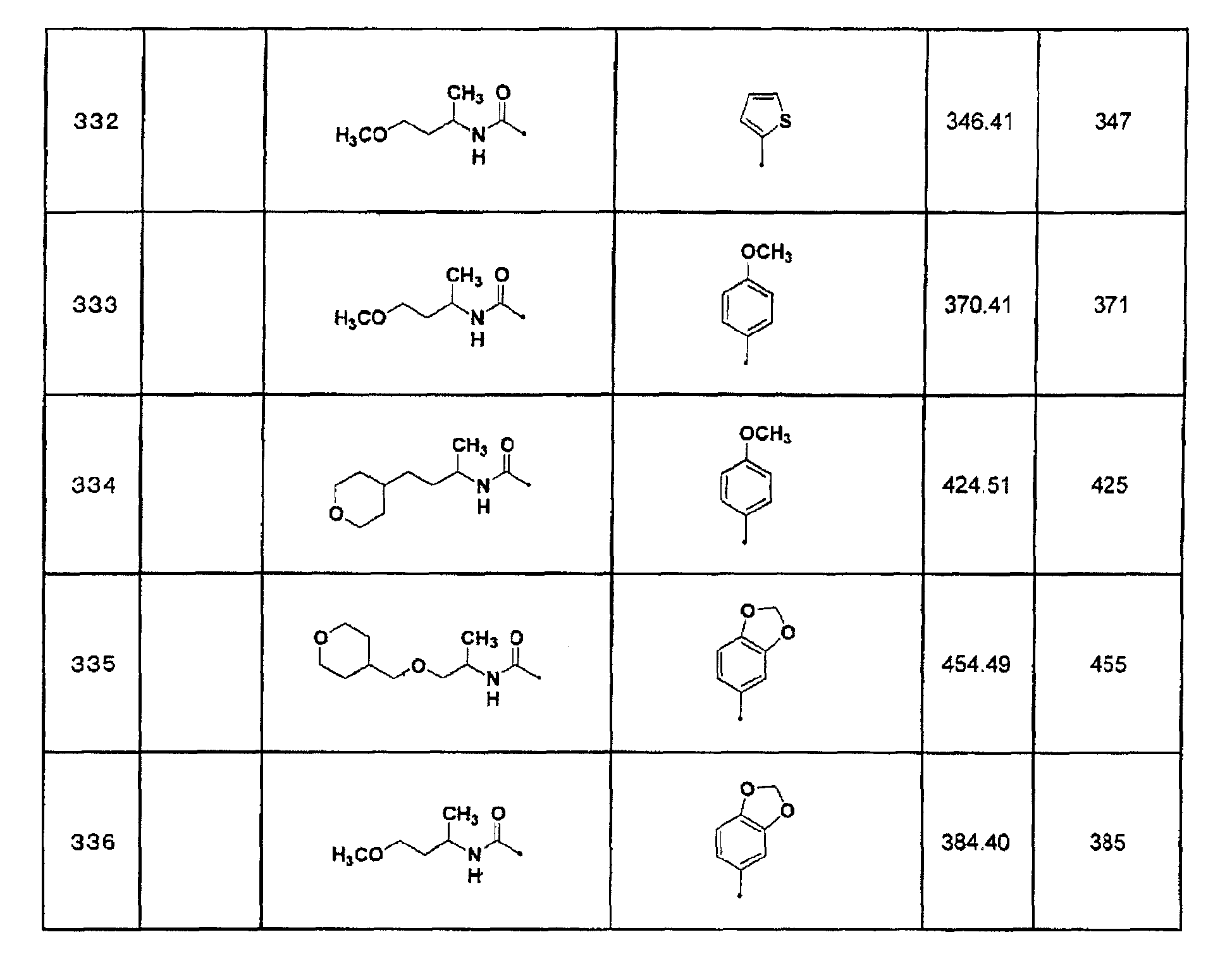
Пример 1 испытания: Действие на экспрессию МНС (ГКГ) класса I из Т1 клеток (клеточная линия 174 × СЕМ. лимфомы человека)
Пользуясь 96-луночным микропланшетом с плоским дном, культивировали Т1 клетки (5,7×103 клеток/200 мкл/лунку) в среде RPMI 1640 (Iwaki Glass), содержащей 10% сыворотку плода коровы (далее обозначаемую сокращенно как FBS; Iruvine Scientific), в инкубаторе, содержавшем 5% диоксид углерода, при 37°С в течение 3 суток в присутствии испытуемого соединения, каждую концентрацию которого получали разведением с общим коэффициентом 10 из 400 мкМ. По окончании культивирования клетки окрашивали мышиным моноклональным антителом против человеческого МНС класса I, меченным фторизотиоцианатом (антитело, полученное из клеток линии W6/32 (ATCC № CRL 1991)). Среднюю интенсивность флюоресценции окрашенных клеток (далее называемую как MFI) измеряли с помощью FACScan (BD) для поточной цитометрии. Полученное значение определяли как уровень экспрессии молекул МНС класса I. Концентрацию испытуемого соединения, необходимую для супрессии 20% уровня экспрессии молекул МНС класса I (значение ЕС20), вычисляли, пользуясь следующей формулой (1). Результаты показаны в таблицах 6 и 7.
Формула (1)
Степень ингибирования экспрессии МНС класса I (%) =

Eexp: MFI культивируемых клеток, содержащих испытуемое соединение, после окрашивания антителом,
Cexp: MFI культивируемых клеток, не содержащих испытуемого соединения, после окрашивания антителом.
Таблица 6

Таблица 7

Данные результаты показывают, что соединение по настоящему изобретению ингибирует экспрессию МНС класса I из Т1 клеток.
Пример 2 испытания: Действие на экспрессию молекул МНС класса I из дендритных клеток, происходящих из периферической крови человека
Из периферической крови человека выделяли моноциты методом центрифугирования по удельной массе. Затем, используя микрогранулы, связывающиеся с мышиным антителом против CD14 человека, и магнитную систему отделения клеток (Miltenyi Biotec), от моноцитов периферической крови отделяли CD14 позитивные клетки. Отделенные CD14 позитивные клетки суспендировали в среде RPMI 1640, содержащей 10% FBS, и затем суспензию вносили в 6-луночный планшет, получив в результате концентрацию 1,0×106 клеток/лунку. Клетки культивировали при 37°С в течение 20 минут в инкубаторе, содержавшем 5% диоксид углерода. По окончании культивирования неадгезивные клетки, которые не обладали липкостью и были суспендированы в растворе, удаляли. После этого к оставшейся суспензии добавляли с концентрацией 2 мл/лунку среду RPMI 1640, содержащую 500 Е/мл колониестимулирующего фактора рекомбинантных гранулоцитов человека (далее называемого как GM-CSF; Anapure Bioscientific), 50 нг/мл рекомбинантного интерлейкина человека и (далее называемого как IL-4; Pepro Tech) и 10% FBS. Полученную смесь затем культивировали при 37°С в инкубаторе, содержавшем 5% диоксид углерода. При культивировании адгезивных CD14 позитивных клеток в присутствии GM-CSF и IL-4 CD14 позитивные клетки дифференцировались в неадгезивные незрелые дендритные клетки. После культивирования клеток в течение 7 суток неадгезивные клетки извлекали, получив незрелые дендритные клетки. Используя 6-луночный планшет, незрелые дендритные клетки (2,5×105 клеток/лунку) культивировали в RPMI 1640, содержащей 100 Е/мл рекомбинантного фактора-α некроза опухоли человека (далее называемого как TNF-α; Pepro Tech), испытуемое соединение и 10% FBS, при 37°С в течение 3 суток в инкубаторе, содержавшем 5% диоксид углерода. Дендритные клетки стали зрелыми в результате присутствия TNF-α, но одновременно имело возможность действовать на клетки испытуемое соединение. Зрелые дендритные клетки затем окрашивали мышиным моноклональным антителом против человеческого МНС класса I, меченным фторизотиоцианатом (антитело, полученное из клеток линии W6/32 (ATCC № CRL 1991)). Методом поточной цитометрии измеряли отношение числа клеток, в которых молекулы МНС класса I имели высокую экспрессию, к общему числу клеток. Вычисляли степень снижения числа клеток, в которых молекулы МНС класса I имели высокую экспрессию, по следующей формуле (2) и получали концентрации испытуемых соединений, необходимые для 50%-ного снижения (значения ЕС50). Результаты показаны в таблице 8.
Формула (2)
Степень снижения числа клеток, в которых молекулы МНС класса I имеют высокую экспрессию (%) =

Eexp: (Число клеток, в которых молекулы МНС класса I имеют высокую экспрессию, в культивируемых клетках, содержащих испытуемое соединение)/(общее число клеток),
Cexp: (Число клеток, в которых молекулы МНС класса I имеют высокую экспрессию, в культивируемых клетках, не содержащих испытуемого соединения)/(общее число клеток).
Результаты показывают, что соединение по настоящему изобретению ингибирует экспрессию молекул МНС класса I из дендритных клеток, полученных из периферической крови человека.
Пример 3 испытания: Действие на способность дендритных клеток человека индуцировать рост аллогенных Т-клеток
Незрелые дендритные клетки культивировали с испытуемым соединением и TNF-α в течение 3 суток по той же методике, которая описана в примере 2 испытания. Полученные дендритные клетки (2,5×103 клеток/50 мкл/лунку) культивировали вместе с аллогенными Т-клетками человека (2,0×105 клеток/150 мкл/лунку) в 96-луночном плоскодонном планшете при 37°С в течение 5 суток в инкубаторе, содержавшем 5% диоксид углерода. Затем, за 16 часов до окончания культивирования, добавляли [3Н]-тимидин (Amersham Pharmacia Biotech) в количестве 1 мкКи/10 мкл/лунку. По окончании культивирования клетки улавливали на стеклянном фильтре с использованием сборщика клеток (Scatron Instrument) и затем высушивали. После этого к ним добавляли сцинтиллятор ACS-II (Amersham Pharmacia Biotech) и с помощью жидкостного сцинтилляционного счетчика измеряли радиоактивность [3Н]-тимидина, введенного в клетки. По следующей формуле (3) вычисляли степень ингибирования синтеза ДНК лимфоцитов. После этого получали концентрацию испытуемого соединения, необходимую для 50%-ного ингибирования (значение IC50). Результаты показаны в таблице 9.
Формула (3)
Степень ингибирования синтеза ДНК лимфоцитов (%) =

Eexp: Количество [3Н]-тимидина, введенного в культивируемые клетки, содержащие испытуемое соединение,
Cexp: Количество [3Н]-тимидина, введенного в культивируемые клетки, не содержащие испытуемого соединения.
Результаты показывают, что соединение по настоящему изобретению ингибирует способность дендритных клеток индуцировать рост лимфоцитов.
Пример 4 испытания: Действие на бляшкообразующие клетки (PFC)
Овечьи эритроциты (Nippon Seibutsu Zairyo Center, Co., Ltd.) вводили внутрибрюшинно каждой из мышей BALB/c (Charles River Japan, Inc.; самки; возраст 8 недель) в количестве 1,0 x 108 клеток. Затем мышам вводили испытуемое соединение два раза в день в течение 4 дней после первого введения (только один раз в первый день) (n = 4). На следующий день после окончания введения испытуемого соединения получали от мыши селезеночные клетки и считали число PFC по овечьим эритроцитам по методу Куннинхама (Cunninham, A. J. et al., Immunology, vol. 14, p. 599 (1968)). Получали число PFC на число селезеночных клеток 1,0 x 106. Степень снижения числа PFC у мыши, которой было введено испытуемое соединение по отношению к числу PFC у контрольной мыши, которой испытуемое соединение не вводили, вычисляли по следующей формуле (4). Результаты показаны в таблице 10.
Формула (4)
Степень снижения числа PFC (%) =

Eexp: Число PFC на 1×106 селезеночных клеток мыши, которой вводили испытуемое соединение,
Cexp: Число PFC на 1×106 селезеночных клеток мыши, которой вводили растворитель.
Число PFC снижалость при введении испытуемого соединения. Число PFC указывает число селезеночных клеток, продуцирующих антитела при взаимодействии с эритроцитами овцы. Таким образом, было показано, что соединение настоящего изобретения ингибируетпродуцирование антител.
Пример 5 испытания: Действие на мышиную реакцию гиперчувствительности замедленного типа (DTH реакция)
1,0×105 овечьих эритроцитов (Nippon Seibutsu Zairyo Center, Co., Ltd.) вводили для сенсибилизации каждой из мышей BALB/c (Charles River Japan, Inc.; самки; возраст 8 недель) способом внутривенной инъекции. Со дня введения овечьих эритроцитов мыше вводили испытуемое соединение. Для контроля мыши того же типа вводили перорально или внутрибрюшинно 0,5% раствор карбоксиметилцеллюлозы (СМС)-Na и обычный физиологический раствор, использованный в качестве растворителя. Спустя пять дней после антигенной сенсибилизации в подошву мыши инъецировали подкожно 1,0×108 овечьих эритроцитов. Через 24 часа измеряли толщину подошвы. Значение, полученное вычитанием среднего значения толщин подошв мышей, которым вместо овечьих эритроцитов был введен обычный физиологический раствор, из значений, полученных описанным выше измерением, определяли как опухание подошвы, произошедшее в результате DTH реакции. Степень ингибирования опухания подошвы, вызванного DTH реакцией, вычисляли по следующей формуле (5). В качестве активности испытуемого соединения в ингибировании DTH реакции получали количество испытуемого соединения, необходимое для 50%-ного ингибирования (значение ED50). Результаты показаны в таблице 11. Следует отметить, что циклоспорин А использовали в качестве положительного контроля.
Формула (5)
Степень ингибирования DTH реакции (степень ингибирования опухания подошвы) (%) =

Eexp: Опухание подошвы мыши, которой было введено испытуемое соединение,
Cexp: Опухание подошвы мыши, которой был введен растворитель.
Было обнаружено, что соединение по настоящему изобретению ингибирует DTH реакцию и что оно обладает эффектом подавления аллергической реакции типа IV.
Пример 6 испытания: Действие на реакцию «трансплантат против хозяина» (GVH)
Действие соединения на GVH реакцию определяли методом измерения массы селезенки по Симонсену и др. (Simonsen et al., Annals of the New York Academy of Sciences, p. 73 (1978)). Селезеночные клетки, полученные от мышей С57BL/6 (Charles River Japan, Inc.; самки; возраст 10 недель) (5,0×106 клеток), переносили в брюшную полость каждой из мышей BDF1 (Charles River Japan, Inc.; возраст 7 дней). Со дня переноса указанных клеток подкожно вводили мышам BDF1 два раза в день в течение 7 последовательных дней испытуемое соединение с каждой разведенной концентрацией или 5% раствор глюкозы, использованный в качестве растворителя. Через восемь дней после переноса указанных клеток измеряли массу селезенки каждой из мышей BDF1. По следующей формуле (6) вычисляли степень снижения массы селезенки. Получали количество испытуемого соединений, необходимое для 50%-ного снижения (значение ED50). Результаты показаны в таблице 12.
Формула (6)
Степень ингибирования GVH реакции (снижение массы селезенки) (%) =

Eexp: Масса селезенки мыши, которой было введено испытуемое соединение,
Cexp: Масса селезенки мыши, которой был введен растворитель.
Соединение по настоящему изобретению обладает эффектом подавления GVH реакции, благодаря чему подавляет реакцию отторжения трансплантата и реакцию «трансплантат против хозяина» после трансплантации.
Пример 7 испытания: Увеличивающее продолжительность жизни действие на болезнь «трансплантат против хозяина» (GVHD)
Данное испытание проводили модифицированным методом Джонатана и др. (Jonathan et al., Blood, p. 93 (1999)). Сначала подвергали рентгеновскому облучению при 6,0 Гр мышей (C57BL/6XB6. C-H2bml) F1 (полученных скрещиванием мышей 6XB6.C-H2bml (Jackson Laboratory) с мышами C57BL/6 (Charles River Japan); самки; возраст 8-12 недель). Затем CDS позитивные T-клетки (1,25×106клеток), полученные из селезеночных клеток мышей C57BL/6 (Charles River Japan; самки; возраст 8 недель), инъецировали внутривенно указанным выше мышам (C57BL/6XB6. C-H2bml) F1. За день до инъекции мышам вводили перорально испытуемое соединение с каждой разведенной концентрацией или 0,5% карбоксиметилцеллюлозу, использованную в качестве растворителя, один раз в день в течение 7-30 последовательных дней. День, в который проводили трансплантацию, был определен как день 0. Основываясь на среднем числе дней выживания каждой группы, вычисляли степень продления таких сроков выживания, используя следующую формулу (7). Таким образом, было проанализировано действие испытуемого соединения на GVHD.
Формула (7)
Степень продления дней выживания мышей, страдающих от GVHD, (%) =

Eexp: Среднее число дней выживания мышей группы с введенным испытуемым соединением,
Cexp: Среднее число дней выживания мышей группы с введенным растворителем.
Результаты показаны в таблице 13. По-видимому, соединение по настоящему изобретению обладает эффектом продления дней выживания мышей, страдающих от GVHD, и эффектом подавления реакции отторжения трансплантата и реакции «трансплантат против хозяина» после трансплантации.
Пример 8 испытания: Действие на мышей SCG/kj модели аутоиммунного заболевания
Мышей SCG/kj модели аутоиммунного заболевания (Kaneshiro et al., Proceedings of National Academy of Sciences, Vol. 90, p.3413 (1993)) использовали для изучения эффекта испытуемого соединения на аутоиммунное заболевание. Мышам SCG/kj (выведены by Nippon Kayaku Co., Ltd.; самки; возраст 8-10 недель) вводили перорально испытуемое соединение или растворитель с дозой 100 мг/кг один раз в день в течение 59 последовательных дней. Затем получали степень выживаемости мышей, выживших 60 дней после введения.
Было найдено, что степень выживаемости после 60 дней составляла 80,0% в группе с введенным испытуемым соединением, тогда как в группе с введенным растворителем она составляла 42,1%. Поскольку соединение по настоящему изобретению проявило очевидный эффект продления жизни мышей SCG/kj (p < 0,05; существенная разница, обнаруженная с помощью Logrank Test), можно сказать, что соединение по настоящему изобретению обладает эффектом подавления развития аутоиммунного заболевания.
Пример 9 испытания: Ингибирующее действие на бластогенез селезеночных клеток мыши
Иссекали селезенку из каждой мыши BALB/c (Charles River Japan; самки; возраст 10 недель) и давали ей возможность пройти через сетку, чтобы получить суспензию одной клетки. Полученную суспензию одной клетки приготавливали в количестве 1,0×106 клеток/мл. После этого 200 мкл суспензии фракционировали в каждую лунку 96-луночного планшета. Затем в качестве бластогенной стимуляции в лунку вносили 5 мкг/мл конканавалина А (Pharmacia) или 25 мкг/мл липополисахарида (DIFCO), продуцированного Escherichia coli, после чего в нее дополнительно вносили раствор, содержащий испытуемое соединение в разной концентрации в количестве 20 мкл/лунку. Полученную смесь культивировали при 37°С в течение 72 часов в инкубаторе, содержавшем 5% диоксид углерода. Затем, через 64 часа после начала культивирования, добавляли 1 мкКи/10 мкл/лунку раствора [3Н]-тимидина. По окончании культивирования (спустя 72 часа) клетки улавливали на фильтре с использованием сборщика клеток и затем высушивали. После этого к ним добавляли сцинтиллятор и с помощью жидкостного сцинтилляционного счетчика измеряли радиоактивность [3Н]-тимидина, введенного в клетки. По указанной выше формуле (3) вычисляли степень ингибирования синтеза ДНК. После этого получали концентрацию испытуемого соединения, необходимую для 50%-ного ингибирования (значение IC50). Результаты показаны в таблице 14.
Было обнаружено, что соединение по настоящему изобретению ингибирует бластогенез лимфоцитов стимуляцией митогеном и обладает действием непосредственного подавления роста лимфоцитов.
Пример 10 испытания: Действие на экспрессию антиген-презентующих молекул и костимуляторных молекул дендритных клеток, происходящих из периферической крови человека
Дендритные клетки, полученные таким же способом, как в примере 2 испытания, суспендировали (2,5×106 клеток/мл) в среде RPMI 1640, содержащей 10% FBS, которая содержала 500 Е/мл GM-CSF, 50 нг/мл IL-4 и 100 Е/мл рекомбинантного фактора некроза опухоли человека. Затем суспензию вносили в 6-луночный планшет в количестве 2,0 мл/лунку, после чего добавляли испытуемое соединение. Смесь культивировали при 37°С в течение 3 дней в инкубаторе, содержавшем 5% диоксид углерода. Затем суспендированные клетки извлекали. После этого клетки окрашивали меченными фторизотиоцианатом мышиными моноклональными антителами, взаимодействующими с МНС класса I (Bechman Coulter), CD1a (Immunotech), CD40 (Pharmingen), CD80 (Pharmingen) и CD83 (Immunotech). Методом поточной цитометрии измеряли среднюю интенсивность флюоресценции и отношение позитивных клеток. Уровень экспрессии вычисляли по формуле «средняя интенсивность флюоресценции × отношение позитивных клеток», после чего получали степень ингибирования уровня экспрессии поверхностных антигенов дендритных клеток по следующей формуле (8). Результаты показаны в таблице 15.
Формула (8)
Степень ингибирования экспрессии поверхностных антигенов дендритных клеток (%) =

Eexp: Уровень экспрессии поверхностных антигенов дендритных клеток, культивированных в присутствии испытуемого соединения,
Cexp: Уровень экспрессии поверхностных антигенов дендритных клеток, культивированных в отсутствие испытуемого соединения.
n.t.: не тестирован
Образцы 1, 2 и 3 означают дендритные клетки, выделенные из периферической крови разных здоровых субъектов. Результаты показывают, что соединение по настоящему изобретению угнетает не только экспрессию молекул CD1a и МНС класса I, которые являются антиген-презентующими молекулами, но и экспрессию CD40, CD80 и CD83, которые являются костимуляторными молекулами, и что оно обладает способностью индуцировать иммунологическую толерантность. Кроме того, CD83 является молекулой-маркером для дифференцировки и созревания дендритных клеток. Исходя из результата, что имеет место ингибирование экспрессии CD83, считают, что соединение по настоящему изобретению угнетает также дифференцировку и созревание дендритных клеток.
Пример 11 испытания: Цитотоксическое действие на Т1 клетки (клеточная линия 174 × СЕМ. лимфомы человека)
Пользуясь 96-луночным микропланшетом с плоским дном, культивировали Т1 клетки (5,7×103 клеток/200 мкл/лунку) в среде RPMI 1640, содержащей 10% FBS, в инкубаторе, содержавшем 5% диоксид углерода, при 37°С в течение 3 суток в присутствии испытуемого соединения, каждую концентрацию которого получали разведением с общим коэффициентом 10 из 400 мкМ. По окончании культивирования клетки, которые были повреждены цитотоксичностью, окрашивали иодидом проподия. Используя FACScan (BD) для поточной цитометрии, получали IC50 из отношения числа окрашенных клеток к общему числу клеток. Полученное значение определяли как цитотоксическую активность. Результаты показаны в таблице 16.
Таким образом, было обнаружено, что соединение по настоящему изобретению оказывает цитотоксическое действие на Т1 клетки и обладает противоопухолевой активностью.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Принимая во внимание описанные выше физико-химические и биологические свойства, считают, что производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины, представленное формулой (1) настоящего изобретения, или его фармацевтически приемлемая соль является новым соединением. Данное соединение проявляет ингибирующую активность по отношению к презентации антигенов и активность в угнетении функции лимфоцитов и применимо в качестве средства для лечения или профилактики аутоиммунного заболевания, реакции отторжения трансплантата, реакции «трансплантат против хозяина», аллергического заболевания или воспалительного заболевания. Кроме того, данное соединение угнетает также экспрессию костимуляторных молекул, связанных с презентацией антигенов, и применимо также в качестве лекарственного средства для индукции иммунологической толерантности. И еще оно применимо также в качестве лекарственного средства для лечения злокачественных опухолей. Производное [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины, представленное формулой (1) настоящего изобретения, или его фармацевтически приемлемая соль проявило(а) высокую активность в in vitro и in vivo испытаниях на иммуносупрессивную активность и поэтому также может быть применено(а) в качестве средства для профилактики и/или лечения отторжения трансплантата и/или реакции «трансплантат против хозяина» при трансплантации органа или костного мозга, аутоиммунного заболевания, аллергического заболевания и/или воспалительного заболевания, в качестве противоопухолевого лекарственного средства и в качестве индуктора иммунологической толерантности для пересаженного органа и/или пересаженного костного мозга.
Реферат
Описываются новые производные [1,2,4]триазоло[1,5-а]пиримидин-2-илмочевины общей формулы (1) или их фармацевтически приемлемые соли:

где Ar означает возможно замещенную фенильную группу, дигидробензофуранильную или тиофенильную группу.
Х означает О.
R означает группу формулы (2)-(6);





где значения радикалов Су и R4-R12 приведены в описании, и лекарственное средство, их содержащее. Соединения обладают иммуносупрессивной или индуцирующей иммунологическую толерантность активностью и могут найти применение в медицине. 2 н. и 12 з.п.ф-лы, 16 табл.
Формула


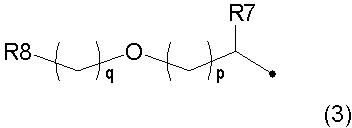













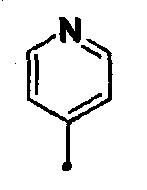


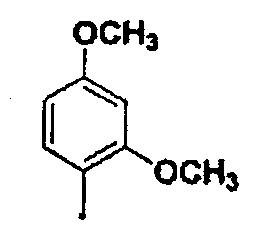


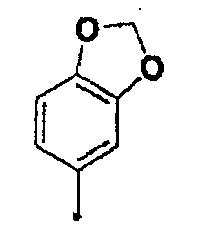



























































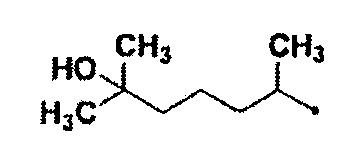













Комментарии