Триазолпиримидиновые производные и фармацевтическая композиция - RU2116308C1
Код документа: RU2116308C1
Чертежи



Описание
Изобретение относится как к новым продуктам к тиазолпиримидиновым производным общей формулы (I), приведенной ниже, и к их таутомерным формам, а также, когда это приемлемо, к их аддуктам, в частности к фармацевтически приемлемым аддуктам.
Предлагаемые соединения обладают очень ценным фармакологическим профилем действия, поскольку они характеризуются антагонистическими свойствами в отношении рецепторов ангиотензина II и антипролиферативными свойствами. Таким образом, они особенно показаны при лечении и профилактике сердечно-сосудистых заболеваний, в частности гипертонии, для лечения сердечной недостаточности и для лечения и профилактики заболеваний артериальной стенки, в особенности атеросклероза.
Кроме того, изобретение относится к способу получения упомянутых продуктов и к их применению в терапии.
Такие триазолпиримидиновые производные и их таутомерные формы отвечают общей формуле (I)

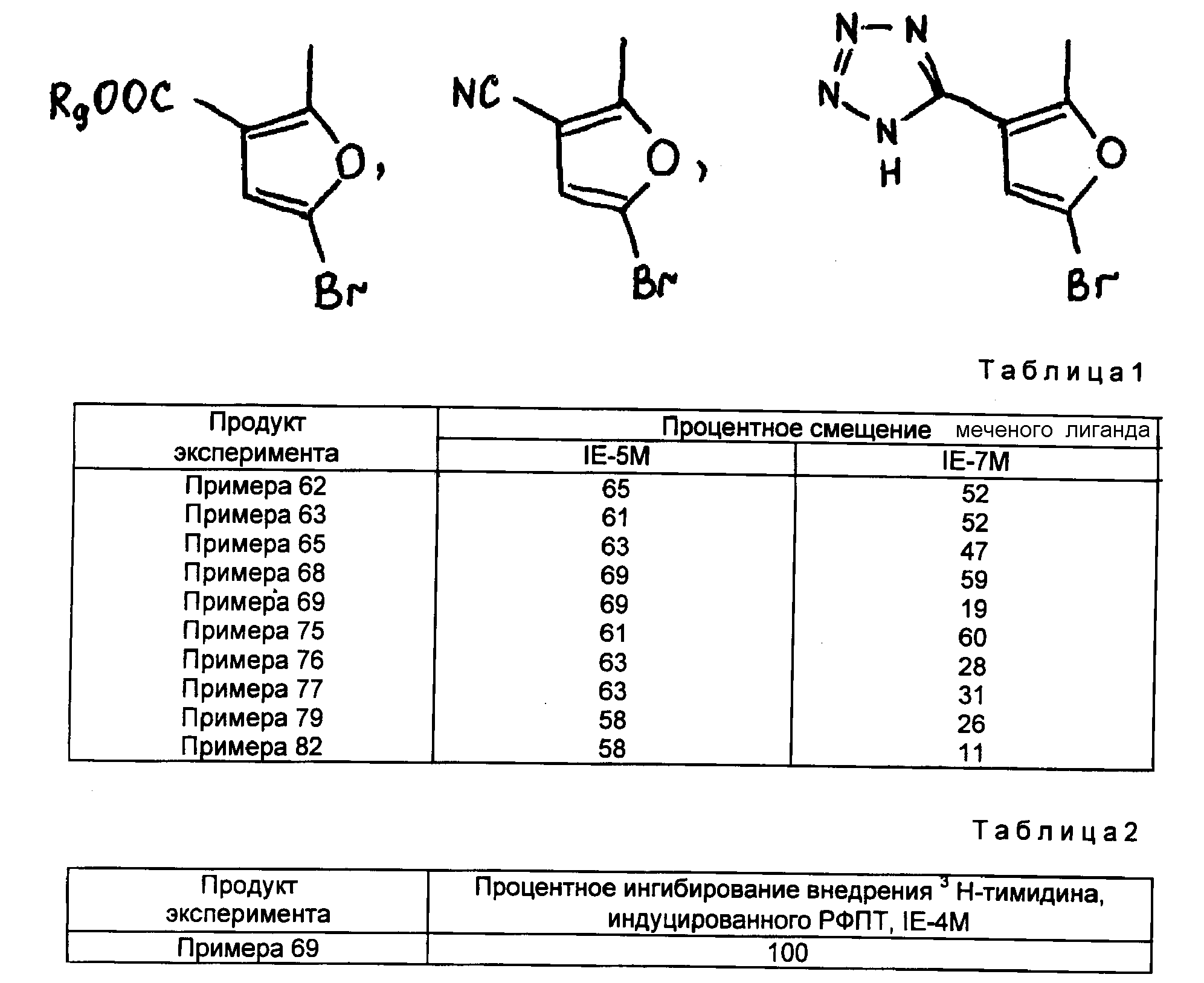
где один из радикалов R1 и R2 обозначает низший алкильный радикал, содержащий от 1 до 6 углеродных атомов; либо радикал формулы - (CH2)pOR, где p - целое число от 1 до 6, а R - низший алкильный радикал, содержащий от 1 до 6 углеродных атомов, или бензильный радикал; или спиртовой остаток формулы - (CH2)pOH, где значения символа p определены выше; а другим радикалом R1 и R2 обозначен водородный атом, атом галогена, низший алкильный радикал, содержащий от 1 до 6 углеродных атомов, или радикал, выбираемый из класса, к которому относятся радикалы N3, OR4, SR4, NR5R6 и NH(CH2)n - NR5R6, где R4 обозначает водородный атом, низший алкильный радикал, содержащий от 1 до 6 углеродных атомов или циклоалкильный радикал C3 - C7, радикал формулы (CH2)m - COOR1, где m - целое число от 1 до 4, а символом R' обозначен водородный атом или низший алкильный радикал, содержащий от 1 до 6 углеродных атомов, или же радикал формулы (CH2)m - O - R', где значения символов m и R' определены выше; каждый из символов R5 и R6, которые могут быть как идентичными, так и различными, обозначен водородный атом; или низший алкильный радикал, содержащий от 1 до 6 углеродных атомов или циклоалкильный радикал C3 - C7, или же совместно с атомом азота, с которым они связаны, радикалы R5 и R6 образуют гетероцикл, выбираемый из класса морфолина, пирролидина и пиперидина, а n - целое число от 1 до 4; каждым из символов X и Y, которые различны, в одном случае обозначен азотный атом, а в другом случае - группа C - R7, где символом R7 обозначен водородный атом; низший алкильный радикал, содержащий от 1 до 6 углеродных атомов или циклоалкильный радикал C3 - C7; радикал формулы (CH2)n'OH, где n' - целое число от 0 до 4; радикал SR', где значения символа R' определены выше; или радикал формулы NR5R6, где каждым из символов R5 и R6, которые могут быть как идентичными, так и различными, обозначен водородный атом, низший алкильный радикал, содержащий от 1 до 6 углеродных атомов, или циклоалкильный радикал C3 - C7; а символом R3 обозначен радикал формулы

где
Z - CH или N или же Z' - атом серы или кислорода;
R11 - водородный атом или атом галогена; а
R12 - тетразоловый радикал, CH, COOH или CONH.
Вышеприведенные производные следует также рассматривать в их таутомерной форме.
В случае, когда R2 - азидная группа, в соответствии с уравнением, которое хорошо известно из литературы (см. Темпл энд Монтгомеры, J. Org. Chem. 30, 826, 1965 г.), такие соединения можно рассматривать в трициклической тетразоло(1,5-с)-1,2,4- триазоло(1,5-а)пиримидиновой форме.
Вышеуказанные производные могут принимать форму аддуктов, в частности фармацевтически приемлемых кислых аддуктов.
Предпочтительные производные настоящего изобретения должны отвечать общей формуле (I), приведенной выше, где одним из символов
R1 и R2 обозначен низший алкильный радикал, содержащий от 1 до 6 углеродных атомов; либо радикал общей формулы - (CH2)pOR, где p - целое число от 1 до 6, а
R - низший алкильный радикал, содержащий от 1 до 6 углеродных атомов, или бензильный радикал; либо спиртовой остаток формулы - (CH2)pOH, где значения символа p определены выше; а
другим из символов R1 и R2 обозначен водородный атом; атом галогена; низший алкильный радикал, содержащий от 1 до 6 углеродных атомов; или радикал, выбираемый из класса, к
которому относятся радикалы N3, OR4, SR4, NR5R6 и NH(CH2)n - NR5R6, где R4 обозначает
водородный атом; или радикал формулы - (CH2)m - O- R', где m - целое число от 1 до 4, а R' - низший алкильный радикал, содержащий от 1 до 6 углеродных атомов; каждым из символов
R5 и R6, которые могут быть как идентичными, так и различными, обозначен водородный атом; или низший алкильный радикал, содержащий от 1 до 6 углеродных атомов; или же совместно с
азотным атомом, с которым они связаны, радикалы R5 и R6 образуют гетероцикл, выбираемый из морфолина, пирролидина и пиперидина; а n - целое число от 1 до 4; каждым из символов X
и Y, которые различны, в одном случае обозначен азотный атом, а в другом случае - группа формулы C - R7, где R7: водородный атом, низшая алкильная группа, содержащая от 1 до 6
углеродных атомов; радикал (CH2)n'OH, где n' - целое число от 0 до 4; радикал SR', где значения символа R' определены выше; или радикал формулы NR5R6, где
каждым из символов R5 и R6, которые могут быть как идентичными, так и различными, обозначен водородный атом или низший алкильный радикал, содержащий от 1 до 6 углеродных атомов;
а символом R3 обозначен один из нижеследующих радикалов


В тексте описания и формуле изобретения термин "низший алкильный радикал" следует понимать как обозначающий линейную или разветвленную углеродистую цепь, содержащую от 1 до 6 углеродных атомов. Примерами низших алкильных радикалов являются метиловый, этиловый, пропиловый, изопропиловый, бутиловый, изобутиловый, трет-бутиловый, пентиловый, изопентиловый, гексиловый или изогексиловый радикалы.
Термин "циклоалкильный радикал C3-C7" следует понимать как обозначающий насыщенный циклический углеводородный радикал, предпочтительнее циклопропильный, циклобутильный, циклогексильный или циклогептильный радикал.
Термин "атом галогена" следует понимать как обозначающий атом хлора, брома, иода или фтора.
В одном из вариантов R1-н-пропильная группа.
В другом варианте R1-N-диэтиламиногруппа.
В еще одном варианте R1-н-бутильная группа.
В одном из вариантов R2-гидроксильная группа.
В другом варианте R2-н-пропильная группа.
В еще одном варианте R2-N-диэтиламиногруппа.
В одном из вариантов R2-2-(1H-тетразол-5-ил)фенильная группа.
В одном из вариантов X-азотный атом.
В одном из вариантов Y-группа CH.
В другом варианте Y-группа C-CH3.
В еще одном варианте Y-группа C-NH2 .
Особенно предпочтительные соединения настоящего изобретения выбирают из продуктов формул, приведенных на схеме 1.
В общем способ получения соединений формулы (I)
включает в себя стадии:
a) получения соединения формулы (альфа)

где значения символов X, Y и R3 определены выше; а каждым из символов A и B в одном случае обозначена гидроксильная группа или низшая алкильная группа, содержащая от 1 до 6 углеродных атомов, а в другом случае - низшая алкильная группа, содержащая от 1 до 6 углеродных атомов, или либо радикал формулы - (CH2)p-OR, где p-целое число от 1 до 6, а R - низший алкильный радикал, содержащий от 1 до 6 углеродных атомов, или бензильный радикал, путем конденсации 3-амино-1,2,4-триазола формулы (II).

где значения символа R7 определены выше, с производным формулы (бета)

где

b) блокировки, если это благоприятно, группы, которую включает в себя радикал R3, в соответствии с методом, который сам по себе известен;
с) нагревания производного, полученного таким образом из производного формулы (бета), когда это последнее представляет собой кетоэфир, в соответствующем реагенте, в частности в POCl3, с конверсией гидроксильной группы, обозначенной символов A и B, в хлорный атом;
d) нагревания этого хлорированного производного в присутствии нуклеофильного соединения, содержащего атом азота, кислорода или серы, при температуре кипения с обратным холодильником в спирте или в автоклаве при температуре 100oC в присутствии или без основания, в частности, такого, как карбонат натрия, с получением производного формулы (альфа), где значения символов A и B идентичны значениям символов соответственно R1 и R2;
e) удаления, если это приемлемо, защитной группы для группы, которую включает в себя радикал R3;
e1) конверсии этой группы в кислотный остаток, например, гидролизом в случае, когда такая группа является нитрильной;
e2) конверсия этой группы в тетразольную группу, например, в случае, когда эта группа является нитрильной, реакцией с триалкилоловоазидом с нагреванием в толуоле или ксилоле, после чего проводят обработку газообразной соляной кислотой в тетрагидрофуране; или
e3) конверсии этой группы в амидную группу, например, в случае, когда эта группа является нитрильной, реакцией с серной кислотой или реакцией с перекисью водорода, или же реакцией с полифосфорной кислотой; и
f) конверсия, если это приемлемо, полученного производного в аддукт, предпочтительнее в фармацевтически приемлемый аддукт.
В соответствии с настоящим изобретение обеспечивается возможность синтеза соединений формулы (I) в соответствии с нижеследующей последовательностью реакций.
Для получения соединений формулы (III)

где
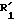
HAUSER C.R.; Swamer F.W.; Adams J.T.: Org. Reaction, vo1, Vi, 1954, 59 - 196.
Henne A.L.;
Tedder J.M.; J. Chem. Soc., 1953, 3628,
Breslon D. S.; Baumgarten E.; Hauser C.R.; J. Am. Chem. Soc., 1944, 66, 1286,
Oikawa Y.; Sugano K.; Yonemitsu O.; J. Org. Chem., 1978, 43 (10),
2087 - 88.
Wierenga W.; Skulnick H.I., J. org. Chem., 1979, 44, 310,
Houghton R.; Lapham D.; Synthesis, 1982, 6, 451 - 2,
Bram G.; Vilkas M.; Bull. Soc. Chim. France,
1964 (5), 945 - 51,
Balyarina M.V.; Zhdanovich E.S.; Preobrazhenskii N.A.; Tr. Vses. Nauchn. Issled. Vitamin. Inst., 1961, 7, 8 - 16,
Renard M.; Maquinay A.; Bull Soc. Chim. Belg.,
1946, 55, 98 - 105,
Bruce F.W.; Coower H.W.; J. Am. Chem. Soc., 1944, 66, 2092 - 94 и
Eby C.J. and Hauser C.R.; J. Am. Chem. Soc., 1957, 79, 723 - 5.
Соединения
формулы (V)

могут быть получены бензилированием соединений формулы (III) соединениями формулы (IV)
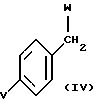
в присутствии такого основания, как карбонат натрия или калия, в ацетоне, алкоголят натрия или калия в спирте или гидрид натрия или лития в таких растворителях, как тетрагидрофуран, диоксан или диметилформамид, например, при температуре от 50 до 100oC, или же в присутствии одного эквивалента хлорида или бромида лития и двух эквивалентов диизопропилэтиламина в тетрагидрофуране при кипячении с обратным холодильником в соответствии с нижеследующей литературной ссылкой: Sung-Eun Yoo; Kyu Yang Yi; Bull. Korean Chem. Soc., 1989, 10 (1), 112.
Эти соединения формулы (V) также могут быть получены конденсацией альдегида формулы (VI)

с соединениями формулы (III) с последующей гидрогенизацией в присутствии катализатора, в частности никеля Ренея, палладия на угле или окиси платины, в среде растворителя, в частности спирта или тетрагидрофурана, под повышенным давлением или обычным давлением, если это позволяют делать присутствующие реагенты.
В более общем виде методы получения соединений формулы (V) можно найти в нижеследующих литературных ссылках:
Durgeshwari P.; Chaudhury N.D.; J. Ind. Chem. Soc., 1962,
39, 735 - 6,
Heinz P.; Kreglewski A.; J. Prakt. Chem., 1963, 21 (3 - 49)б 186 - 197,
Zaugg H. E. ; Dunnigan D.A.; Michaels R.J.; Swett L.R.; J. Org. Chem., 1961, 26, 644 - 51,
Kagan H.B.; Neig Suen Y.; Bull. Soc. Chim. France, 1966 (6), 1819 - 22,
Rathke M.W.; Deitch J.; Tetrahedron Lett., 1971 (31), 2953 - 6,
Borries Kubel; Liebigs Ann. Chem., 1980,
1392 - 1401,
Marqiet J.; Moreno-Manas M.; Chem. Lett., 1981, 2, 173 - 6,
Ioffe t.; Popov E.M.; Vatsuro K.V.; Tulikova E.K.; Kabachnik M.I.; Tetrahedron, 1962, 18, 923 - 940 и
Shepherd T.M.; Chem. Ind. (London), 1970, 17, 567.
В формуле (IV) W - атом галогенида, предпочтительнее хлора или брома.
В той же самой формуле V может обозначать
группу

где
R9 - низший алкильный или бензильный радикал, причем в этом случае соединения формулы (IV) получают реакцией магнийсодержащего соединения n-бромтолуола с соединением формулы

с получением соединения формулы

которое затем гидролизуют, получая соединение формулы

Meyers A. I.: Mihelich E. D.; J. Am. Chem. Soc., 1975, 97, 7383.
Далее полученную кислоту этерифицируют спиртом формулы R9OH, где значения символа R9 определены выше.
После этого такие производные
бромируют или хлорируют, например, N-бромсукцинимидом, N-хлорсукцинимидом или бромом, в таком растворителе, как четырехлористый углерод, дибромбутан или дихлорэтан, получая соединения формулы (IV), у
которых V - группа формулы

Символом V может быть обозначена группа формулы
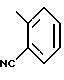
причем в этом случае соединение формулы

полученное по вышеизложенному, подвергают конверсии в первичный амид реакцией хлорангидрида кислоты, полученного с использованием хлористого тионила или оксихлорида фосфора, с водным раствором аммиака, а затем этот амид подвергают конверсии в нитрил реакцией с оксихлоридом фосфора в диметилформамиде или с хлористым тионилом. Подобным же образом соединены формулы

полученное по вышеизложенному, можно подвергать конверсии непосредственно в карбонитрильное производное путем обработки в пиридине в присутствии POCl3. Полученное нитрильное производное формулы
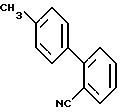
затем подвергают бромированию или хлорированию в тех же самых условиях, что и описанные выше для сложного эфира, в результате чего получают соединение формулы (IV), у которых V - группа формулы
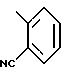
Символом V может быть обозначена группа формулы

причем в этом случае соответствующие соединения формулы (IV) синтезируют следующим образом.
Соединение магния формулы

полученное обычной реакцией Гриньяра, подвергают конверсии в цинкосодержащее производное реакцией с хлористым цинком. Это цинкосодержащее производное конденсируют с 2-хлорникотинонитрилом в присутствии продукта формулы [NiP (фенил)3]2Cl2, в результате чего, получают производное формулы

Это соединение, обработанное трибромидом бора в хлороформе, дает соединения формулы (IV), у которых W - атом брома, а символом V обозначена группа формулы

Символом V может быть обозначена группа формулы

где значения символа R9 определены выше, причем в этом случае соответствующие соединения формулы (IV) могут быть получены из нитрила, полученного по вышеизложенному, формулы

обычным гидролизом нитрильной группы с последующей этерификацией полученной кислоты или прямой конверсией нитрильной группы в сложноэфирную группу по методам, которые известны любому специалисту в данной области техники, а затем проводят обработку трибромида бора в хлороформе, получая соединения формулы (IV), у которых W - атом брома, а V - группа формулы

Символом V может быть обозначена группа

причем в этом случае соответствующие соединения формулы (IV) синтезируют следующим образом.
Соединение формулы

получают с использованием 4-хлор-4'-метилбутирофенона формулы

получение которого проиллюстрировано в описании к бельгийскому патенту 577977, опубликованному 15 мая 1959 г., реферат CA: 54, 4629 с, обработкой оксихлоридом фосфора и диметилформамидом в условиях, которые описаны в нижеследующей литературной ссылке: Volodina M. A.; Tenent'ev A.P.; Kudryashova V.A.; Kabochina L.N.; Khim. Getetosik1. Soedim. 1967, 5 - 8.
Далее это соединение обрабатывают сульфидом натрия в растворителе, в
частности в тетрагидрофуране, кипячением с обратным холодильником, в результате чего получают производное формулы

которое затем подвергают конверсии в две стадии в нитрильное производное дегидратацией оксима, полученного с использованием альдегида и гидроксиламина. Эту дегидратацию можно проводить, например, с использованием уксусного ангидрида, получая нитрильное соединение формулы

которое можно затем ароматизировать обработкой бромом в четыреххлористом углероде с получением соединения формулы

Далее это соединение можно хлорировать или бромировать галоидирующим агентом, в частности N-хлорсукцинимидом или N-бромсукцинимидом, в растворителе, например в четыреххлористом углероде или дихлорметане, в результате чего получают соединения формулы (IV), у которых символом V обозначена группа формулы
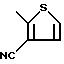
Символом V может быть обозначена группа формулы

где значения символа R9 определены выше, причем в этом случае соответствующие соединения формулы (IV) могут быть получены из нитрила, полученного по вышеизложенному, формулы

путем обычного гидролиза нитрильной группы с последующей этерификацией полученной кислоты или путем прямой конверсии нитрильной группы в сложноэфирную группу по методам, которые известны любому специалисту в данной области техники, после чего проводят хлорирование или бромирование сложного эфира N-хлорсукцинимидом или N-бромсукцинимидом, например, в четыреххлористом углероде или дихлорметане, в результате чего получают соединения формулы (IV), у которых символом W обозначен атом брома или атом хлора, а символом V обозначена группа формулы

Символом V может быть обозначена группа формулы

где значения символа R9 определены выше, причем в этом случае соответствующие соединения формулы (IV) могут быть получены реакцией диазотированного производного n-толуидина с 3-фуроновой кислотой, в результате чего получают соединения формулы

по методу, который описан в нижеследующей литературной ссылке: A. Jurasek et al., Collect. Chem. Commun., 1989, 54, 215.
После этого такое соединение этерифицируют согласно обычным методам, которые известны любому специалисту в данной области техники, в
результате чего получают соединения формулы

где значения символа R9 определены выше, после сего это производное бромируют или хлорируют реакцией с N-бромсукцинимидом или N-хлорсукцинимидом, например, в четыреххлористом углероде или 1,2-дихлорэтане, в результате чего получают производное (IV), у которого W - атом брома или атом хлора, а V - группа формулы

Символом V может быть обозначена группа формулы

причем в этом случае кислоту формулы

полученную по вышеизложенному, подвергают конверсии в хлорангидрид кислоты реакцией с хлористым тионилом, а затем в амид реакцией с аммиаком. Полученный амид подвергают конверсии в нитрил реакцией с оксихлоридом фосфора в диметилформамиде с получением соединений формулы

Далее это производное бромируют или хлорируют реакцией с N-бромсукцинимидом или N-хлорсукцинимидом, например в четыреххлористом углероде или 1,2-дихлорэтане, в результате чего получают соединения формулы (IV), у которых W - атом брома или атом хлора, а V - группа формулы

В формуле (V) значения символов R'1 и R8 определены выше, а значения символа V являются такими, как это определено для формулы (IV).
Однако соединения формулы (V), у которых V - группа формулы

вступают в реакцию с одним эквивалентом азида натрия в растворителе, в частности в диметилформамиде, в присутствии соли аммония, в частности хлористого аммония, или при нагревании в толуоле или ксилоле с триалкилоловоазидом, в результате чего образуются соединения формулы (V), у которых V - группа формулы

В формуле (VI) значения символа V идентичны определенным для формулы (IV), но этот метод конденсации является единственным, который используют в том случае, когда радикал V включает в себя группу, не подвергнутую воздействию при гидрогенизации.
Таким образом, в результате реакции 3-амино-1,2,4-триазола формулы (II)

где значения символа R7 определены выше (эти продукты технически доступны или могут быть получены по методам, описанным в нижеследующих литературных ссылках:
Huffmann and Schaefer, J. of Chem., 963, 28, p. 1812 - 1816 and p. 1816 - 1821,
Allen et al. , J. of Org. Chem., 1959, 24, p. 793 - 796, и Orgnanic Synthesis Collective, volume 3, p. 95),
с соединениями формулы (V), где значения символов

где значения символа R9 определены выше,
получают соединения формулы (VIIa) и/или (VIIb):

и их таутомерные формы, где значения символов

В этом случае, когда радикал V включает в себя тетразоловую группу, реакционная температура не должна превышать 140oC с целью избежать разложения тетразола.
Реакции аминотриазолов или аналогичных
гетероароматических аминов с бета-кетоэфирными и бета-дикетоновыми производными хорошо описаны в литературе, причем получаемые формы продуктов идентифицируют в зависимости от условий проведения
процесса. В качестве примеров можно привести исследования, изложенные в нижеследующих публикациях:
J.A. van Allan et al., J. Org. Chem., p. 779 to p. 801 (1959).
L.A.
Williams. J. Chem. Soc. p. 1829 (1960) и
L.A. Williams, J. Chem. Soc. p. 3046 (1961).
Таким образом, соединения формул VIIa и VIIb должны быть идентифицированы для отдельной обработки.
Тем не менее, заявителем было установлено, что 2-метил-5-этилпиридин в присутствии или без 4-диметиламинопиридина является предпочтительным растворителем для ориентирования реакции почти исключительно в направлении образования производных формулы (VIIb); действительно, использование такого растворителя позволяет достичь температуры 170 - 180oC и величины pH, которые необходимы для такой ориентации.
Если производные формул (VIIa) и (VIIb), у которых R10 - гидроксильная группа, обрабатывают таким реагентом, как пентасульфид фосфора или реактив Лоуэссона, получают производные формул (VIIa) и (VIIb), у которых символом R10 обозначена тиоловая группа.
Так, например, если производные формул (VIIa)
и (VIIb), у которых символом R10 обозначена гидроксильная группа, нагревают в POCl3, образуются производная формул (VIIa) и (VIIb)

у которых значения символов R'1, X, Y и V определены выше.
Гидрогенизация производных формул (VIIIa) и
(VIIIb) в присутствии такого катализатора, как палладий на угле, позволяет заменить атом хлора водородным атомом, а производные формулы (IX)

где значения символов R1, R2, X, Y и V определены выше, получают нагреванием производных формул (VIIIa) и (VIIIb) в присутствии нуклеофильного соединения, содержащего атом азота, кислорода или серы, кипячением с обратным холодильником в спирте в присутствии или без такого основания, как карбонат натрия, или в автоклаве при температуре 100oC.
Производные формул (VIIa) и (VIIb), у которых R'1 группа (CH2)pO-бензил, где значения символа p определены выше, можно гидрогенизовать в присутствии палладия на угле в уксусной кислоте с получением соединений формул (VIIa) и (VIIb), у которых символом

Эти триазолпиримидины формул (VIIa) и (VIIb) могут быть также получены реакцией производных формулы (X)

где значения символов R1, R2 и V определены выше, с кислотами, хлорангидридами кислот или эфирами карбоновых кислот; с изоцианатами или изотиоцианатами; со сложными ортоэфирами; с карбонилдиимидазолом или с мочевиной, ксантогенатом калия, сероуглеродом или аналогичным реагентом путем нагревания без растворителя или в таком растворителе, как N-метилпирролидон или спирт, подобный этанолу или метоксиэтанолу, в присутствии или без такого основания, как триэтиламин, пиридин или 2-метил-5-этилпиридин.
В зависимости от условий проведения процесса, в особенности температуры и величины pH реакционной среды, получают 1,2,4-триазоло(4, 3-а)пиримидиновые производные или 1,2,4-триазоло(1,5-а)пиримидиновые продукты их перегруппировки.
Соединения формулы (X) могут быть получены в соответствии с одним из известных методов
синтеза 2-гидразинопиримидинов (см. "The Pyrimidines; The Chemistry of Heterocyclic Compounds"; Д.Дж. Браун, издательство "Уили интерсайенс", 1970 г.), в особенности, замещением производных формулы
(XI)

где значения символов R1, R2 и V определены выше, с использованием, например, гидразингидрата.
Соединения формулы (XI) получают конденсацией S-метилтиомочевины, например, с производными формулы (V), или согласно одному из методов синтеза 2-тиометилпиримидинов, которые известны из литературы (см. упомянутую работу) "The Pyrimidines").
Соединения формулы (IX), у которых радикал V включает в себя сложноэфирную группу COOR9, можно гидролизовать в кислой или основной среде или гидрогенизовать в случае, когда R9 - бензил, с получением соединений формулы (I), у которых радикал R9 включает в себя кислотный остаток.
Можно проводить реакцию соединений формулы (IX), у которых радикал V включает в себя нитрильную группу, с одним эквивалентом азида натрия в таком растворителе, как диметилформамид, в присутствии аммониевой соли, например хлорида аммония, или нагреванием в толуоле или ксилоле с азидом триалкилолова, например с азидом триметилолова или трибутилолова, с последующей кислотной обработкой, например, газообразной хлористоводородной кислотой в тетрагидрофуране, в результате чего получают соединения общей формулы (I), у которых радикал R9 включает в себя тетразол-5-иловую группу.
Можно проводить конверсию тех же самых соединений, у которых радикал V включает в себя нитрильную группу, реакцией с серной кислотой, реакцией с перекисью водорода или реакцией с полифосфорной кислотой в производные общей формулы (I), у которых радикал R9 включает в себя амидную группу.
Можно также проводить конверсию производных, у которых радикал V включает в себя нитрильную группу или амидную группу, путем основного или кислого гидролиза в производные общей формулы (I), у которых радикал R9 включает в себя кислотный остаток.
Можно получать аддукты некоторых соединений формулы (I), в особенности фармацевтически приемлемые аддукты. Так, в частности, когда молекулы соединений формулы (I) включают в себя кислотные или тетразоловые группы, в этом отношении можно упомянуть соли натрия, калия, кальция, амина, в частности дициклогексиламина или аминокислоты, например лизина. В том же случае, когда они содержат аминогруппы, в этом отношении можно упомянуть соли минеральных или органических кислот, в частности гидрохлориды, метасульфонаты, ацетата, малеаты, сукцинаты, фумараты, сульфаты, лактаты и цитраты.
Новые соединения в соответствии с настоящим изобретением характеризуются замечательными фармакологическими свойствами как антагонисты рецепторов ангиотензина II и антипролиферативы и могут быть использованы в терапии для лечения и профилактики сердечно-сосудистых заболеваний, в частности для лечения гипертонии, сердечной недостаточности и заболевания артериальной стенки, в особенности атеросклероза.
Таким образом, рамками настоящего изобретения охватываются фармацевтические композиции, которые включают в себя в качестве активнодействующей основы лекарства, состоящие из фармацевтически активного количества, по меньшей мере, одного соединения формулы (I), которая определена выше, а также, если это приемлемо, одного из его фармацевтически приемлемых аддуктов.
Такие соединения можно вводить в организм буккальным, ректальным, парентеральным, трансдермальным или глазным путем.
Эти композиции могут быть твердыми или жидкими и могут быть приготовлены в виде фармацевтических препаративных форм, которые обычно используют в медицине человека, например, таких, как простые таблетки и таблетки с покрытиями, желатиновые капсулы, гранулы, суппозитории, препараты для инъекций, трансдермальные системы и глазные лосьоны. Их готовят по обычным методам. В указанных композициях активную основу, состоящую из фармацевтически эффективного количества, по меньшей мере, одного соединения формулы (I), которая определена выше, или одного из его фармацевтически приемлемых аддуктов, можно совмещать с основами для приготовления лекарств, обычно используемыми в составе этих фармацевтических композиций, в частности, с такими, как тальк, аравийская камедь, лактоза, крахмал, стеарат магния, поливидон, производные целлюлозы, масло какао, полусинтетические глицериды, водные и неводные носители, жиры животного и растительного происхождения, гликоли, различные смачивающие агенты, диспергаторы и эмульгаторы, силиконовые гели, некоторые полимеры и сополимеры, консерванты, ароматизирующие и вкусовые добавки и красители.
Рамками настоящего изобретения охватывается также фармацевтическая композиция с антагонистическим действием в отношении рецептеров ангиотензина II и/или антипролиферативным действием, которая обеспечивает возможность особенно успешного лечения или профилактики сердечно-сосудистых заболеваний, в частности гипертонии, сердечной недостаточности и заболеваний артериальной стенки, в особенности, атеросклероза, причем указанная композиция включает в себя фармацевтически эффективное количество, по меньшей мере, одного соединения формулы (I), приведенной выше, или один из его фармацевтически приемлемых аддуктов, который можно вводить в фармацевтически приемлемую основу для приготовления лекарств, носитель или наполнитель.
Дозировку варьируют прежде всего в зависимости от пути введения в организм, заболевания, от которого необходимо лечить, и подвергаемого лечению пациента.
Так, например, для взрослых пациентов со средним весом от 60 до 70 кг она может варьироваться в пределах от 1 до 400 мг активнодействующего вещества, вводимого перорально в виде одной или нескольких ежедневных доз, или от 0,01 до 50 мг активнодействующего вещества, вводимого парентерально в виде одной или нескольких ежедневных доз.
Настоящее изобретение охватывает также способ приготовления фармацевтической композиции, при осуществлении которого предусмотрено введение в фармацевтически приемлемую основу для приготовления лекарств, носитель или наполнитель фармацевтически эффективного количества, по меньшей мере, одного соединения формулы (I), как это определено выше, или одного из его фармацевтически приемлемых аддуктов. Такую фармацевтическую композицию можно приготовить в форме желатиновых капсул или таблеток, каждая из которых включает в себя от 1 до 400 мг активнодействующего вещества, или препаратов для инъекций, каждый из которых включает в себя от 0,01 до 50 мг активнодействующего вещества.
Более того, настоящее изобретение охватывает способ терапевтического лечения млекопитающих, при осуществлении которого предусмотрено введение в организм такого млекопитающего терапевтически эффективного количества, по меньшей мере одного соединения формулы (I), определенной выше, или одного из его фармацевтически приемлемых аддуктов.
При терапевтическом лечении животных ежедневная доза, которую можно использовать, обычно находится в интервале от 1 до 100 мг/кг.
Другие характеристики и достоинства настоящего изобретения более очевидны из нижеследующего подробного описания некоторых примеров приготовления, которыми ни в коем случае не ограничиваются его рамки, поскольку они приведены с иллюстративными целями.
Пример 1. Этил-3-оксогексаноат
Формулы (III):

176 г 2,2-диметил-4,6-диоксо-1,3-диоксана (кислота Мелдрама) растворяют в 550 мл дихлорметана и 188 мл пиридина, смесь охлаждают до температуры 5oC на водяной бане со льдом и по каплям в нее добавляют 133 мл бутилхлорида. После завершения этой операции добавления смесь перемешивают в течение 3 ч при комнатной температуре. Раствор промывают разбавленным раствором соляной кислоты, сушат над сульфатом магния и выпаривают в вакууме с получением маслоподобного продукта. Этот маслоподобный продукт растворяют в 700 мл этанола и смесь кипятят с обратным холодильником в течение 6 ч. Этанол выпаривают в вакууме и полученный остаток перегоняют с получением 145,4 этил-3-оксиогексаноата в форме маслоподобного продукта.
Температура кипения (под остаточным давлением 20 мм рт.ст): 98 - 100oC.
Соединение примера 2 получили согласно процедуре примера 1.
Пример 2. Этил-3-оксигептаноат.
Формула (III):

Температура кипения (под остаточным давлением 20 мм рт.ст.): 115-120oC.
Пример 3. Этил-4-бензилокси-3-оксобутаноат.
Формула (III):

80 г 60%-ного гидрида натрия (NaH) отдельными порциями добавляют в 800 мл безводного тетрагидрофурана. Эту среду охлаждают до температуры 10oC и поддерживают такую температуру. Затем по каплям добавляют 500 мл бензилового спирта. Далее добавляют раствор 65,8 г этил-4-хлорацетоацетата в 200 мл бензилового спирта. Смесь перемешивают при комнатной температуре в течение 20 ч. Осторожным добавлением 120 мл уксусной кислоты ее нейтрализуют, продолжая охлаждать на бане со льдом. После этого всю массу выливают смесь воды со льдом и подвергают экстракционной обработке серным эфиром. Органическую фазу промывают раствором бикарбоната натрия и сушат над сульфатом магния с последующим концентрированием, в результате чего получают оранжевый маслоподобный продукт. Этот продукт очищают двумя последовательными перегонками, получая желтый маслоподобный продукт.
Температура кипения (под остаточным давлением 0,05 мм рт.ст.): 126 - 132oC.
Пример 4. 4'-бромметил-2-цианодифенил.
Формула (IV): W - бром,

a) Получение 2-циано-4'-метилдифенила
563,8 г (4'-метилдифенил-2-ил)карбоновой кислоты, полученной в соответствии с процедурой Мейерса А.И.; Михелича Э.Д.; J.Am.Chem.Soc., 1975, 97(25), 7383, небольшими порциями добавляют в 800 мл хлористого тионила. Эту смесь кипятят с обратным холодильником в течение 2 ч. Хлористый тионил концентрируют в вакууме и остаток выливают в 28%-ный раствор гидрата окиси аммония, предварительно охлажденный на водяной бане со льдом. Эту смесь перемешивают в течение 30 мин и образовавшиеся кристаллы отфильтровывают, промывают водой, а затем серным эфиром и сушат с получением 554,8 г (4'-метилдифенил-2-ил)карбоксамида в форме кристаллов с температурой плавления 128-132oC. Эти кристаллы растворяют в 1300 мл хлористого тионила и смесь кипятят с обратным холодильником в течение 3 ч, а затем концентрируют в вакууме, получая оранжевый маслоподобный продукт. Этот последний растворяют в 2 л хлороформа и промывают водой, а затем органическую фазу сушат и концентрируют с получением 509,8 г маслоподобного продукта, который кристаллизуют из пентана, получая 467,3 г 2-циано-4'-метилдифенила.
Температура плавления: 46 - 48oC.
b) 4'-бромметил-2-цианодифенил.
467,3 г 2-циано-4'-метилдифенила, полученного по вышеизложенному, растворяют в 4, 7 л 1,2-дихлорэтана в присутствии 467,3 г N-бромсукцинимида и 9,3 г перекиси бензоила. Смесь очень осторожно нагревают с целью обеспечить хороший контроль над экзотермическим эффектом. Далее ее кипятят с обратным холодильником в течение 4 ч, охлаждают до температуры 50oC и затем промывают 3 раза горячей водой с последующей сушкой и органическую фазу концентрируют, получая кристаллы кремового цвета.
В результате перекристаллизации из изопропанола получают 451 г белых кристаллов 4'-бромметил-2-цианодифенила.
Температура плавления: 128oC.
Пример 5. Этил-2-[(2'-цианодифенил-4-)-метил]-3-оксагексаноат.
Формула (V): R'1-н-пропил, R8-O-этил,

23 г этил-3-оксогексаноата, полученного согласно изложенному в примере 1, растворяют в 120 мл тетрагидрофурана. Добавляют 30,3 г 4'-бромметил-2-цианодифенила, полученного по вышеизложенному в примере 4, и 4,7 г хлористого лития и смесь перемешивают при комнатной температуре. Затем по каплям вводят 39 мл диизопропилэтиламина, что вызывает слабый экзотермический эффект. Далее смесь перемешивают в течение 3 ч при комнатной температуре, после чего кипятят в течение 10 ч с обратным холодильником. В вакууме выпаривают растворители и остаток растворяют в воде, а затем подвергают экстракционной обработке хлороформом. Органическую фазу декантируют с последующей промывкой разбавленным раствором соляной кислоты, сушат над сульфатом магния и выпаривают в вакууме, получая 38 г оранжевого маслоподобного продукта.
Очистка хроматографической обработкой на силикагеле (элюент - хлороформ) дает 32,3 г этил-2-[(2'-цианодифенил-4-ил)-метил]-3- оксогексаноата.
Соединения примеров с 6 по 10 получают согласно процедуре примера 5 с использованием соответствующего сложного бета-кетоэфира.
Пример 6. Этил-2-[(2'-цианодифенил-4-ил)-метил]-3-оксогептаноат.
Формула (V):


Маслоподобный продукт, который как таковой использовали на следующей стадии.
Пример 7. Этил-2-[(2'-цианодифенил-4-ил)-метил]-3-оксобутаноат.
Формула (V): R'1 - метил, R8-O-этил,

Желтый маслоподобный продукт, очищенный хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% диэтилового эфира).
Пример 8. Этил-2-[(2'-цианодифенил-4-ил)-метил]-3-оксопентаноат.
Формула (V):
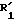

Маслоподобный продукт, очищенный хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% диэтилового эфира).
Пример 9. Этил-2-[(2'-цианодифенил-4-ил)-метил] -4-метокси-3-оксобутаноат.
Формула (V):


Желтый маслоподобный продукт, очищенный хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% диэтилового эфира).
Пример 10. Этил-4-бензилокси-2-[(2'-цианодифенил-4-ил)-метил]-3-оксобутаноат.
Формула (V):
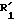

Маслоподобный продукт, очищенный дважды последовательными хроматографическими обработками (элюенты: хлороформ, а затем смесь 80% циклогексана с 20% этилацетата).
Пример 11. Этил-2-[4-(3-циано-2-пиридил)-бензил[-3-оксогексаноат.
Формула (V):


a) Получение 4-бромбензилметилового эфира.
Раствор метилата натрия, полученного из 11,8 г натрия и 350 мл метанола, по каплям вводят в суспензию 117,7 г 4-бромбензилбромида в 350 мл метанола. Эту смесь перемешивают в течение 2 ч при комнатной температуре и оставляют стоять на ночь. Метанол выпаривают, остаток растворяют в диэтиловом эфире и органическую фазу промывают водой, а затем сушат и концентрируют, получая желтый маслоподобный продукт, который очищают перегонкой с получением в виде бесцветной жидкости 102 г бромбензилметилового эфира.
Температура кипения под остаточным давлением 17 мм рт. ст.: 112 - 114oC.
b) Синтез 3-циано-2-(4-метоксиметилфенил)пиридина.
2 г 4-бромбензилметилового эфира, полученного по вышеизложенному, добавляют в суспензию 18 г магния в 50 мл безводного ТГФ. Образование магниевого соединения инициируют несколькими кристаллами иода и, если необходимо, нагреванием на бане с теплой водой. Раствор 121,8 г 4-бромбензилметилового эфира в 200 мл безводного ТГФ вводят по каплям таким образом, чтобы температура не превышала 40oC. Реакцию компонентов проводят в течение 1 ч при комнатной температуре и затем под избыточным давлением азота вводят 800 мл раствора хлористого цинка в диэтиловом эфире. В результате образуется белый осадок. Реакцию компонентов проводят в течение 1 ч 30 мин при комнатной температуре. Добавляют 800 мг катализатора реакции сочетания бис-(трифенилфосфин)-никель(II)хлорида, [NiP(фенил)3]2Cl2 и затем вводят раствор 76,9 г 2-хлорникотинонитрила в 300 мл ТГФ. Смесь перемешивают в течение ночи при комнатной температуре и концентрируют в вакууме. Далее концентрат растворяют в смеси 1 л дихлорметана с 1 л воды 1 л динатриевой соли этилендиаминтетрауксусной кислоты. Эмульсию фильтруют на материале Celite 545. Органическую фазу декантируют, промывают водой, сушат и концентрируют, получая 133,6 г оранжевого маслоподобного продукта, который очищают двумя последовательными хроматографическими обработками (элюент: смесь 95% хлороформа с 5% диэтилового эфира). Таким образом, в форме оранжевого маслоподобного продукта выделяют 69,4 г 3-циано-2-(4-метоксиметилфенил)пиридина, который кристаллизуется.
Температура плавления: 74oC.
c) Получение 3-циано-2-(4-бромметилфенил)пиридина.
Формула (IV): W - бром.

69,4 г 3-циано-2-(4-метоксиметил)пиридина, полученного на предыдущей стадии, растворяют в 700 мл хлороформа, стабилизированного амиленом. Раствор охлаждают до температуры -10oC. Далее по каплям, таким образом, чтобы температура не превышала 5oC, вводят раствор 66 мл трибромида бора в 200 мл хлороформа, стабилизированный амиленом. Смесь оставляют на 1 ч 30 мин на ледяной бане. После этого ее гидролизуют вначале льдом, а затем водой. После фильтрования суспензию растворяют в смеси водой с хлороформом. Далее проводят декантацию и органические фазы объединяют, сушат и затем концентрируют, получая 78.2 г окрашенных в кремовый цвет кристаллов 3-циано-2-(4-бромметилфенил)пиридина.
Температура плавления: 118oC.
d) Получение этил-2-[4-(3-циано-2-пиридил)бензил]- 3-оксогексаноата.
Формула (V):


В соответствии с процедурой примера 5 целевое производное получают в форме оранжевого маслоподобного продукта, который используют как таковой на следующей стадии.
Пример 12. Этил-2-[4-(3-циано-2-тиенил)-бензил]-3- оксогексаноат.
Формула (V):

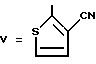
a) Получение 4-хлор-1-(4-метилфенил)бутанона.
Смесь 560 мл 4-хлорбутирилхлорида с 550 мл толуола по каплям добавляют в суспензию 740 г трихлорида алюминия в 2 л дихлорметана, причем температуру при этом поддерживают в интервале от 10 до 15oC. Реакционную смесь перемешивают в течение 30 мин при комнатной температуре и выливают на лед. После декантации органическую фазу отделяют, а водную фазу подвергают экстракционной обработке дихлорметаном. Органические фазы объединяют, промывают водой и затем сушат и концентрируют в вакууме с получением 994,5 г 4-хлор-1-(4-метилфенил)бутанона в форме маслоподобного продукта, который используют на следующей стадии без дополнительной очистки.
b) Получение 3-хлор-2-(2-хлорэтил)-3-(4-метилфенил)-проп- 2-ен-1-ала.
390 мл POC13 по каплям при температуре от 7 до 12oC вводят в раствор 352,5 г 4-хлор-1-(4-метилфенил)бутанона, полученного по вышеизложенному в примере 12 a), в 450 мл ДМФ. Температуру повышают постепенно: в первом случае до 50oC в течение 2 ч, а затем до 75oC в течение 45 мин. Смесь выливают в лед и трижды подвергают экстракционной обработке диэтиловым эфиром, после чего органические фазы объединяют, промывают водой и сушат с последующим выпариванием, в результате чего в форме маслоподобного продукта получают 387,8 г 3-хлор-2-(2-хлорэтил)-3-(4-метилфенил)проп- 2-ен-1-ала, который используют как таковой на последующей стадии.
c) Получение 4,5-дигидро-3-формил-2-(4-метилфенил)-тиофена.
Смесь 200 г 3-хлор-2-(2-хлорэтил)-3-(4-метилфенил)- проп-2-ен-1-ала, полученного в эксперименте примера 12b), с 2,2 л ТГФ, 276,5 г нонагидрата сульфида натрия и 373 мл воды кипятят с обратным холодильником в течение 6 ч. Далее ее концентрируют в вакууме и концентрат растворяют в воде, после чего трижды подвергают экстракционной обработке диэтиловым эфиром. Органические фазы объединяют, промывают водой, сушат и концентрируют, получая 170,3 г маслоподобного продукта, который кристаллизуется.
Температура плавления: ниже 50oC.
d). Получение 4,5-дигидро-3-формил-2-(4-метилфенил)-тиофеноксима.
132,1 г гидроксиламингидрохлорида отдельными порциями добавляют в раствор 323,5 г альдегида, полученного в соответствии с изложенным в примере 12 c), в 800 мл этанола. Затем по каплям добавляют раствор карбоната натрия, приготовленный из 100,5 г карбоната и 700 мл воды. Смесь выдерживают при температуре 40oC в течение 5 мин, после чего реакцию оставляют протекать при комнатной температуре в течение 1 ч. Смесь охлаждают до температуры 15oC и твердый материал отфильтровывают и промывают водой, а затем смесью 50% изопропилового эфира с 50% петролейного эфира, получая 252 г оксима. В результате экстракционной обработки фильтрата дихлорметаном получают 2-ю порцию из 99 г общего количества целевого оксима.
e). Получение 3-циано-4,5-дигидро-2-(4-метилфенил)тиофена.
Раствор 171,8 г оксима, полученный по изложенному в примере 12 d), в 680 мл уксусного ангидрида кипятят с обратным холодильником в течение 3 ч. Затем концентрируют для удаления избытка ангидрида и перегоняют, получая 115,3 г нитрильного производного.
Температура кипения под остаточным давлением 0,05 мм рт.ст.: 140 - 150oC.
f). Получение 3-циано-2-(4-метилфенил)тиофена.
62 мл брома по каплям вводят в раствор, предварительно подогретый до температуры 50oC, 1191,3 г нитрила, полученного в соответствии с изложенным в примере 12 e), в 1,85 л четыреххлористого углерода. Всю массу кипятят с обратным холодильником до прекращения выделения бромистого водорода. Четыреххлористый углерод выпаривают и остаток перегоняют, получая 115,3 г 3-циано-2-(4-метилфенил)тиофена.
Температура кипения под остаточным давлением 0,05 - 0,1 мм рт.ст.: 130 - 150oC.
g) 2-(4-бромметилфенил)-3-цианотиофен.
Формула (IV): W - бром,

182,2 г соединения, полученного по вышеизложенному в примере 12 f), бромируют в соответствии с изложенным в примере 4, получая 133,7 г 2-(4-бромметилфенил)-3-цианотиофена.
Температура плавления: 80 - 84oC.
b) Этил-2-[4-(3-циано-1-тиенил)-бензил]-3-оксогексаноат.
Формула (V):
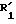

Смесь 50 г 2-(4-бромметилфенил)-3-цианотиофена, полученного по вышеизложенному с 40 г этил-3-оксогексаноата, полученного по изложенному в примере 1, 300 мл ТГФ, 62 мл диизопропилэтиламина и 15,6 г бромистого лития кипятят с обратным холодильником в течение 15 ч. Далее смесь концентрируют в вакууме, добавляют разбавленный раствор соляной кислоты и подвергают экстракционной обработке этилацетатом. Органические фазы объединяют, промывают водой, сушат и выпаривают, получая в форме маслоподобного продукта 62,4 г этил-2-[4-(3-циано-2-тиенил)-бензил] -3-оксогексаноата, который используют без дальнейшей очистки.
Пример 13. Этил-2-[4-(3-циано-2-фурил)бензил]-3-оксогексаноат.
Формула (V):
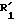

a). Получение 2-( 4-метилфенил)-3- фурановой кислоты.
70,7 г п-толуидина, охлажденного на водяной бане со льдом, обрабатывают 205 мл 36%-ной соляной кислоты. Затем смесь перемешивают при температуре 55 - 60oC в течение 30 мин с последующим повторным охлаждением до температуры 0oC. Далее в смесь вводят раствор 45 г нитрита натрия в 220 мл воды. Смесь перемешивают в течение 1 ч при 0oC. Этот холодный раствор вводят в охлажденную до температуры -5oC смесь 49,3 г 3-фурановой кислоты с 220 мл ацетона, 23,4 г дихлорида меди и 6,3 г воды. Всю массу перемешивают при температуре 0oC в течение 2 ч, а затем при комнатной температуре в течение 48 ч. Далее ее подвергают двукратной экстракционной обработке диэтиловым эфиром и органическую фазу декантируют, сушат и концентрируют с получением маслоподобного продукта, который при обработке водой дает кристаллы. Эти кристаллы отфильтровывают и промывают 50 мл смеси 50% метанола с водой, получая 13,4 г 2-(4-метилфенил)-3-фурановой кислоты.
Температура плавления: 166oC.
b) Получение 2-(4-метилфенил)-фуран-3-карбоксамида.
20 мл тионилхлорида добавляют в раствор 13,4 г фурановой кислоты, полученной по вышеизложенному, в 70 мл толуола. Эту смесь кипятят с обратным холодильником в течение 3 ч и затем отгоняют избыток хлористого тионила и толуола, получая маслоподобный продукт, с использованием которого при температуре 5oC проводят реакцию с раствором 100 мл 1,2-диметоксиэтана, насыщенного аммиаком. Выпавший осадок отфильтровывают и промывают водой, а затем изопропиловым спиртом с получением 7 г белых кристаллов амида.
Температура плавления: 174oC.
c) Получение 3-циано-2-(4-метилфенил)фурана.
Смесь 12,2 г амида, полученного по вышеизложенному, и 65 мл тионилхлорида кипятят с обратным холодильником в течение 3 ч и концентрируют в вакууме. Полученный маслоподобный продукт растворяют в хлороформе и затем добавляют смесь воды со льдом. После декантации водную фазу подвергают экстракционной обработке хлороформом и органические фазы объединяют, сушат и выпаривают с получением маслоподобного продукта. Очистка хроматографической обработкой на силикагеле (элюент: толуол) дает 7,5 г маслоподобного продукта, который кристаллизуется.
Температура плавления: 66oC.
d) 2-(4-бромметилфенил)-3-цианофуран.
Формула (IV): W - бром,

7,5 г соединения, полученного по вышеизложенному в примере 13 c), бромируют согласно изложенному в примере 4, получая после очистки хроматографической обработкой на силикагеле (элюент: смесь 50% пентана с 50% толуола) 4,6 г 5-бром-3-циано-2-(4-метилфенил)-фурана (температура плавления: 88oC), 2,2 г 5-бром-3-циано-2-(4-бромметилфенил)-фурана (температура плавления: 114oC) и 2 г 2-(4-бромметилфенил)-3-цианофурана.
Температура плавления: 108oC.
Проводят дополнительную реакцию бромирования 5-бром-3-циано-2-(4-метилфенил)-фурана в соответствии с вышеизложенным в примере 4, в результате чего получают 5-бром-2-(4-бромметилфенил)-4-цианофурана, который представляет собой соединение примера 13 d)-бис.
e) Этил-2-[4-(3-циано-2-фурил)бензил]-3-оксогексаноат.
Формула (V):


Полученное производное 2-(4-бромметилфенил)-3-цианофуран обрабатывают в соответствии с изложенным в примере 5, получая этил-2-[4-(3-циано-2-фурил)бензил] -3-оксогексаноат в форме маслоподобного продукта, который используют на следующей стадии в сыром состоянии.
Подобным же образом производное 5-бром-2-(4-бромметилфенил)- 3-цианофуран примера 13d)-бис обрабатывают в соответствии с вышеизложенным в примере 5, получая в форме маслоподобного продукта этил-2-[4-(5-бром-3-циано-2-фурил)бензил] оксогексаноат, который представляет собой продукт эксперимента примера 13-бис.
Пример 14. 3-[(2'-цианодифенил-4-ил)-метил]-2, 4-диоксопентан.
Формула (V):


32,8 г 2,4-диоксопентана, 69 г 4'-бромметил-2-цианодифенила, полученного по вышеизложенному в примере 4, 88 мл диизопропиламина и 10,6 г безводного хлорида лития в 300 мл тетрагидрофурана кипятят с обратным холодильником в течение 27 ч. Смесь охлаждают и осадок отфильтровывают. Органическую фазу концентрируют досуха, получая 88,5 г кристаллов. Их растворяют в изопропаноле и смесь фильтруют, выделяя 38,8 г непрореагировавшего 4'-бромметил-2-цианодифенила. Концентрированный маточный раствор дает 26,5 г маслоподобного продукта, который после очистки на силикагеле (элюент: хлороформ) дает дополнительно 5,3 г 4'-бромметил-2-цианодифенила и 12,2 г целевого 3-[(2'-цианодифенил-4-ил)метил] -2, 4-диоксопентана в форме желтого маслоподобного продукта.
Пример 15. 5-[(2'-цианодифенил-4-ил)-метил]-4,6-диоксононан.
Формула (V):


15,6 г 4,6-диоксононана, полученного из метилпропилкетона и этилбутирата в присутствии амида лития (в соответствии с реферативной ссылкой CA 42: 4129f), растворяют в 160 мл безводного ДМФ. В виде порций добавляют 4 г 60%-ного гидрида натрия. После затухания экзотермического эффекта смесь охлаждают до комнатной температуры и по каплям в нее вводят раствор 27,2 г 4'-бромметил-2-цианодифенила, полученного по вышеизложенному в примере 4, в 90 мл ДМФ. Смесь перемешивают в течение 30 мин при комнатной температуре, а затем в течение 2 ч выдерживают при температуре 60oC. Ее концентрируют в вакууме и концентрат растворяют в смеси воды с дихлорметаном и подкисляют разбавленным раствором соляной кислоты. После декантации водную фазу подвергают двукратной экстракционной обработке дихлорметаном. Органическую фазу промывают водой, сушат и затем концентрируют с получением 36,3 г маслоподобного продукта, который очищают двумя последовательными хроматографическими обработками (элюент: соответственно хлороформ, затем смесь 90% циклогексана с 10% этилацетата), получая твердый продукт, который согласно данным ЯМР-спектрограммы, является енольным таутомером с температурой плавления 105oC, и маслоподобный продукт, который соответствует дикетоновой таутомерной форме.
Пример 16. - 2,4-диоксо-3-[(2'-(1H-тетразол-5-ил)-дифенил-4-ил) метил] пентан.
Формула (V):


Смесь 11,8 г 3-[(2'-цианодифенил-4-ил)-метил]-2, 4-диоксопентана, полученного согласно изложенному в примере 14, с 200 мл ксилола 9,3 г азида триметилолова кипятят с обратным холодильником в течение 50 ч. По истечении 24 ч добавляют второй эквивалент азида триметилолова.
Смесь охлаждают и концентрируют с получением вязкого маслоподобного продукта, который после хроматографической обработки на силикагеле (элюент: смесь 90% хлороформа с 10% метанола) дает 9,3 г кристаллов.
В результате дополнительной обработки ацетонитрилом получают 6,2 г аналитически чистого 2,4 диоксо-3-[(2'-(IH-тетразол-5-ил)-дифенил- 4-ил)метил] пентана.
Эмпирическая формула соединения: C19H18N4O2.
Температура плавления: 166oC.
Пример 17. Этил-2-([2'-(1H-тетразол-5-ил)дифенил-4-ил] метил)-3- оксагексаноат.
Формула (V):


Смесь 69, 9 г этил-2-[(2'-цианодифенил-4-ил)-метил]- 3-оксагексаноата, полученного в соответствии с вышеизложенным в примере 5, с 700 мл безводного толуола и 47,5 г азида триметилолова, полученного из азида натрия и хлорида триметилолова, кипятят с обратным холодильником в течение 24 ч. Добавляют дополнительно 47,5 г азида триметилолова и кипячение с обратным холодильником продолжают в течение 16 ч. Смесь концентрируют до 50% объема. Полученный оранжевый раствор очищают двумя последовательными хроматографическими обработками (элюент: смесь 90% хлороформа и 10% метанола, а затем смесь 95% хлороформа с 5% метанола), в результате чего получают 58 г оранжевого маслоподобного продукта, который кристаллизуется.
Температура плавления: 65oC.
Пример 18 (способ A). 6-[(2'-цианодифенил-4-ил)метил]-7-окси-5- пропил-1,2,4-триазоло(1,5-a)пиримидин.
Формула (VIIa):

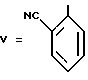
1,7 г 3-амино-1,2,4-триазола, 7 г бета-кетоэфира, полученного по вышеизложенному в примере 5, и 30 мл уксусной кислоты кипятят с обратным холодильником в течение 6 ч. Уксусную кислоту выпаривают. Полученный маслоподобный продукт очищают хроматографической обработкой на силикагеле (элюент: смесь 90% хлороформа с 10% метанола), получая 5,2 г исходного бета-кетоэфира и 1,2 г 6-[(2'- цианодифенил-4-ил)-метил]-7-окси-5-пропил-1,2,4-триазоло-(1,5-a) пиримидина.
Температура плавления: 200 - 205oC.
1H-ЯМР-спектрограмма (200 МГц: DMCO-d6):2,65 (т., 2H, пропиловый CH2), 8,2 (c., 1H, H2).
УФ-спектрограмма (10 мкг/мл, метанол): ламбдаa = 209,1 нм, ламбдаb = 257,7 нм, ламбдаc = 286,8 нм.
Пример 19 (способ B). 6-[(2'-цианодифенил-4-ил)-метил]-5-окси-7- пропил-1,2,4-триазоло(1,5-a)пиримидин.
Формула (VIIb):


7,1 г бета-кетоэфира, полученного по вышеизложенному в примере 5, 1,7 г 3-амино-1,2,4-триазола и 70 мл 1,2,4-трихлорбензола кипятят с обратным холодильником в течение 7 ч. Смесь далее концентрируют в вакууме. После хроматографической обработки на силикагеле (элюент: смесь 95% хлороформа с 5% метанола) полученного густого маслоподобного продукта выделяют 0,8 г изомера, полученного в эксперименте примера 18 (температура плавления: 200oC), и 2,2 г 6-[(2'-цианодифенил-4-ил)-5-окси-7-пропил-1,2,4-триазоло(1,5-a) пиримидина.
Температура плавления: 212oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,98 (т., 2H, пропиловый CH2), 8,1 (с., 1H, H2).
УФ-спектрограмма (10 мкг/мл, метанол): ламбдаa = 207,5 нм, ламбдаb = 258,2 нм.
Пример 20 (способ C). 6-[(2'-цианодифенил-4-ил)-5-окси-7- пропил-1,2,4-триазоло(4,3-а)пиримидина.
Формула (VIIa): R'1 - н-пропил, X - CH, Y - азотный атом,


a) 5-[(2'-цианодифенил-4-ил)метил]-4-окси-6-пропил-2- меркаптопиримидин.
11 г тиомочевины шпателем добавляют в раствор метилата натрия, приготовленный из 4,6 г натрия и 150 мл метанола. Затем в раствор по каплям добавляют 34,9 г бета-кетоэфира, полученного согласно вышеизложенному в примере 5, растворенного в 50 мл метанола. Смесь оставляют стоять на ночь, после чего кипятят с обратным холодильником в течение 7 ч. Далее ее концентрируют в вакууме и концентрат растворяют в 500 мл воды с последующим подкислением концентрированной соляной кислотой до величины pH 1. Смолистый осадок выделяют и растворяют в метаноле, получая 17,3 г белых кристаллов 5[(2'-цианодифенил-4-ил)метил]-4-окси-6-пропил-2-меркаптопиримидина.
Температура плавления: 196o C.
b) 5-[(2'-цианодифенил-4-ил)-метил]-4-окси-2-метилмеркапто-6- пропилпиримидин.
Формула (XI): R1-н-пропил, R2 - OH,

17,3 г соединения, полученного по вышеизложенному, вводят отдельными порциями в смесь 340 мл метанола и 2, 9 г гидроокиси калия. После образования прозрачного раствора его охлаждают и затем по каплям добавляют 3,4 мл метилиодида. Эту смесь оставляют при комнатной температуре для протекания реакции в течение 2 ч. Осадок отфильтровывают с получением 17,2 г 5-[(2'-цианодифенил-4-ил)-метил]-4-окси-2-метилмеркапто-6-пропил- пиримидина.
Температура плавления: 220oC.
c) 5-[(2'-цианодифенил-4-ил)метил-2-гидразино-4-окси-6- пропилпиримидин.
Формула (X): R1-н-пропил, R2-гидроксил,

12,4 г 5-[(2'-цианодифенил-4-ил)-метил]-4-окси-2-метилмеркапто-6- пропилпиримидина, полученного по вышеизложенному, растворяют в 370 мл 2-метоксиэтанола. Вводят 33 мл гидразингидрата и затем смесь кипятят с обратным холодильником в течение 3 ч. Ее концентрируют в вакууме и концентрат растворяют в ацетонитриле с растиранием. Полученный твердый материал отфильтровывают и промывают диэтиловым эфиром и изопропиловым эфиром с получением 9,9 г 5-[(2'-цианодифенил-4- ил)метил]-2-гидразино-4-окси-6-пропилпиримидина.
Температура плавления: 191oC.
d) 6-[(2'-цианодифенил-4-ил)метил] -5-окси-7-пропил-1,2,4- триазоло(4,3-а)пиримидин.
Формула (VIIa):


10 г 5-[(2'-цианодифенил-4-ил)метил]-2-гидразино-4-окси-6- пропилпиримидина, полученного по вышеизложенному, вводят в 100 мл муравьиной кислоты. Смесь кипятят с обратным холодильником в течение 4 ч. Ее концентрируют под пониженным давлением и полученный густой маслоподобный продукт помещают в воду и растирают до кристаллизации. Это соединение очищают хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола). В результате получают 8,3 г 6-[(2'-цианодифенил-4-ил)-метил]-5-окси-7-пропил-1,2, 4- триазол(4,3-а)пиримидина.
Температура плавления: 217oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,6 (т., 2H, пропиловый CH2), 9 (с., 1H, H3).
УФ-спектрограмма (10 мкг/мл, метанол): ламбдаa = 210,2 нм, ламбдаb = 257,5 нм, ламбдаc = 303,4 нм.
Пример 21. 6-[(2'-цианодифенил-4-ил)-метил]-7-окси-5-пропил- 1,2,4-триазоло(4,3-а)пиримидин.
Формула (VIIb):
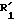

В соответствии с процедурой примера 20, стадия d), одновременно с соединением, указанным выше, получают 1,1 г 6-[(2'-цианодифенил-4- ил)-7-окси-5-пропил-1,2,4-триазоло(4,3-а)пиримидина.
Температура плавления: 204 - 206oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,9 (т., 2H, пропиловый CH2), 9 (с., 1H, H3).
УФ-спектрограмма (10 мкг/мл, метанол): ламбдаa = 211,5 нм, ламбдаb = 260 нм.
Соединение примеров 20 и 21 можно также получать реакцией соединения примера 20 c) с триэтилортоформиатом при кипячении с обратным холодильником в течение 5 ч. В этом случае доля соединения примера 21 оказывается, как установлено, несколько более существенной.
Пример 22 (способ D). 6-[(2'-цианодифенил-4-ил)метил]-7- окси-5-пропил-1,2,4-триазоло(1,5-а)пиримидин.
Формула (VIIa):


500 мг 6-[(2'-цианодифенил-4-ил)-метил]-5-окси-7-пропил-1,2,4- триазоло(4,3-а)пиримидина, полученного по изложенному в примере 20 d), выдерживают на металлической бане при температуре 225oC в течение 2 ч 30 мин. Далее его оставляют охлаждаться и затем переносят в метанол, после чего - в этилацетат, получая 300 мг окрашенных в кремовый цвет кристаллов, идентичных кристаллам соединения примера 18.
Пример 23 (способ E). 6-[(2'-цианодифенил-4-ил)-метил]-5- окси-7-пропил-1,2,4-триазоло(1,5-а)пиримидин.
Формула (VIIb):

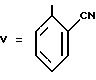
Смесь 24 г 3-амино-1,2,4-триазола с 200 г 5-этил-2-метилпиримидина нагревают до температуры 175oC. По каплям в нее вводят 100 г бета-кетоэфира, полученного по вышеизложенному в примере 5, растворенного в 100 мл 5-этил-2- метилпиридина. Реакционную смесь выдерживают для протекания реакции в течение 6 ч при температуре 175oC. В вакууме отгоняют этилметилпиридин и остаток переводят в смесь воды с хлороформом. После декантации водную фазу подвергают экстракционной обработке хлороформом. Объединенные органические фазы промывают разбавленным раствором соляной кислоты, а затем водой, сушат и концентрируют с получением маслоподобного продукта, который при растирании в метаноле кристаллизуется. В результате перекристаллизации из н-бутанола получают 35,2 г окрашенных в кремовый цвет кристаллов 6-[(2'- цианодифенил-4-ил)метил]-5-окси-7-пропил-1,2,4-триазоло(1,5-а)пиримидина.
Температура плавления: 210oC.
В результате очистки маточных растворов хроматографической обработкой на силикагеле получают вторую порцию в 6,9 г целевого соединения совместно с 13,9 г соединения 6-[(2'-цианодифенил-4- ил)метил]-7-оксо-5-пропил-1,2,4-триазоло(1,5-а)пиримидина), полученного по вышеизложенному в примере 18.
Температура плавления: 196oC.
Добавление 10,5 г 4-диметиламинопиридина в исходную смесь позволяет приблизительно на 10% повысить выход продукта данной реакции.
Пример 24. Полугидрат-6-[(2'-цианодифенил-4-ил)-метил]-7-окси-2-метил-5-пропил- 1,2,4-триазоло(1,5-а)пиримидингидрохлорида.
Формула (VIIa):


Суспензию 10 г соединения примера 20 с) в 100 мл фенилацетата кипятят с обратным холодильником в течение 4 ч. Ее концентрируют под пониженным давлением. Концентрат растворяют в воде и подвергают экстрационной обработке хлороформом, после чего экстракт сушат и выпаривают с получением 9,8 г белых кристаллов, плавящихся при температуре 205oC. Эти кристаллы растворяют в 50 мл ацетонитрила и 40 мл 10%-ного раствора соляной кислоты в диэтиловом эфире, получая 7,5 г 6-[(2'-цианодифенил-4-ил)метил]-7-окси-2-метил-5-пропил-1,2,4-триазоло(1,5-а) пиримидингидрохлорида.
Эмпирическая формула соединения:
C23H21N5O•HCl•(1/2)H2O
Температура плавления:
190oC.
1H-ЯМР-спектрограмма (DMCO-d6); 2,65 (т., 2H, пропиловый CH2).
УФ-спектрограмма (метанол): ламбдаа=213,7 нм, ламбдаб=257,7 нм, ламбдас= 285 нм.
Пример 25. 6-[(2'-цианодифенил-4-ил)метил]-5-окси-7-пропил-3-меркапто-1,2,4-триазоло (4,3-а)пиримидин.
Формула (VIIa):
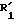

5,3 мл сероуглерода добавляют в суспензию 10 г соединения, полученного по изложенному в примере 20 с), в 300 мл бутанола. Эту смесь кипятят с обратным холодильником в течение 2 ч. Добавляют дополнительно 5,3 мл серо-углерода и кипячение затем продолжают в течение 5 ч. Смесь концентрируют в вакууме. Концентрат растворяют в воде и трижды подвергают экстракционной обработке хлороформом. Растворитель выпаривают с получением 10,8 г аморфных кристаллов, которые очищают хроматографическим путем на силикагеле (элюент: смесь 90% хлороформа с 10% метанола).
Первое соединение в количестве 1,9 г выделяют и идентифицируют как 6-[(2'-цианодифенил-4-ил)метил] -7-окси-5-пропил-3-меркапто-1,2,4- триазол(4, 3-а)пиримидин. Он представляет собой продукт эксперимента примера 25-бис.
Температура плавления: 240oC.
1Н-ЯМР-спектрограмма (DMCO-d6 ): 3,5 (т., 2H, пропиловый CH2).
Второе соединение в количестве 1 г представляет собой целевой продукт, а именно 6-[(2'-цианодифенил-4-ил)метил] -5-окси-7-пропил-3-меркапто- 1,2,4-триазоло(4,3-а)пиримидин.
Температура плавления: 180oC.
1Н-ЯМР-спектрограмма (DMCO-d6): 2,5 (м., пропиловый CH2 + DMCO - d6).
Третий продукт в количестве 6,2 г представляет собой исходное гидразиновое соединение примера 20 с).
Пример 26. 6-[(2'-цианодифенил-4-ил)метил] -3,5-диокси-7-пропил-1,2,4- триазоло(4,3-а)пиримидин.
Формула (VIIa):


4,6 г карбонилдиимидазола добавляют в смесь 10 г соединения, полученного по изложенному в примере 20 с), с 500 мл ТГФ, нагретую до температуры 50oC. Всю массу кипятят с обратным холодильником в течение 7 ч и концентрируют в вакууме. Концентрат растворяют в воде и трижды подвергают экстракционной обработке хлороформом. Выпаривание растворителя дает 12,4 г аморфных кристаллов, которые очищают хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола).
Первое соединение в количестве 3,1 г выделяют и идентифицируют как 6-[(2'-цианодифенил-4-ил)-метил] -3,7-диокси-5-пропил-1,2,4-триазоло(4,3-а) пиримидин. Он представляет собой продукт эксперимента примера 26-бис.
Температура плавления: 228o C.
1Н-ЯМР-спектрограмма (DMCO-d6): 3 (т., 2H, пропиловый CH2).
Второе соединение в количестве 3,8 г представляет собой целевой продукт, а именно 6-[(2'-цианодифенил-4-ил)-метил] -3,5-диокси-7-пропил-1,2,4-триазоло(4,3-а) пиримидин.
Температура плавления: 210oC.
1 Н-ЯМР-спектрограмма (DMCO-d6): 2,4 (т., 2H, пропиловый CH2).
В соответствии с одним из методов, описанных в примерах 19 и 23 (метод B и метод E), проводят реакцию соответствующих аминотриазолов с бета-кетоэфирами, полученными по вышеизложенному в примерах с 5 по 15, в результате чего получают нижеследующие соединения примеров с 27 по 43.
Пример 27. 6-[(2'-цианодифенил-4-ил)метил] -5-окси-2-метил-7-пропил-1,2,4-триазоло (1,5-а)пиримидин.
Формула (VIIb):


Проводят кристаллизацию из метанола. Маточные растворы очищают хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола).
Температура плавления: 218-220oC.
Второе соединение выделяют и идентифицируют как 6-[(2'-цианодифенил-4-ил)метил] -7-окси-2-метил-5-пропил-1,2,4-триазоло (1,5-а)пиримидин. Он представляет собой продукт эксперимента примера 27-бис.
Формула (VIIa):


Температура плавления: 204 - 206oC.
Пример 28. 6-[(2'-цианодифенил-4-ил)метил] -2-этил-5-окси-7-пропил-1,2,4-триазоло (1,5-а)пиримидин.
Формула (VIIb):


Проводят кристаллизацию из метанола. Маточные растворы очищают хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола).
Температура плавления: 216oC.
Второе соединение выделяют и идентифицируют как 6-[(2'-цианодифенил-4-ил)метил] -2-этил-7-окси-5-пропил-1,2, 4-триазоло (1,5-а)пиримидин. Он представляет собой продукт примера 28-бис.
Формула (VIIa):


Температура плавления 186oC.
Пример 29. 6-[(2'-цианодифенил-4-ил)метил]-7-н-бутил-5-окси-1,2,4-триазоло(1,5-а) пиримидин.
Формула (VIIb):


Соединение очищено перекристаллизацией из н-бутанола.
Температура плавления: 210oC.
Пример 30. 2-амино-6-[(2'-цианодифенил-4-ил)метил] -5-окси-7-пропил-1,2,4-триазоло (1,5-а)пиримидин.
Формула (VIIb):


Проводят кристаллизацию из смеси метанола с хлороформом.
Очистка маточных растворов хроматографической обработкой на силикагеле(элюент: смесь 90% хлороформа с 10% метанола).
Температура плавления: 260oC.
Второе соединение выделяют и идентифицируют как 2-амино-6-[(2'-цианодифенил-4-ил)метил] -7-окси-5-пропил-1,2, 4- триазоло(1,5-a)пиримидин. Оно представляет собой продукт эксперимента примера 30-бис.
Формула (VIIa):


Температура плавления: 325 - 330oC.
Пример 31. 6-[(2'-цианодифенил-4-ил)метил] -5-окси-2-метилтио-7- пропил-1,2,4-триазоло(1,5-a)пиримидин.
Формула (VIIb):


Очистка хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола).
Кристаллизация из изопропилацетата.
Температура плавления: 182oC.
Пример 32. 6-[4-(3-циано-2-тиенил)бензил]-5-окси-7-пропил-1,2,4- триазоло(1, 5-a)пиримидин.
Формула (VIIb):


Кристаллизация из смеси хлороформа с водой. Очистка перекристаллизацией из 2-метоксиэтанола.
Температура плавления: 246oC.
Пример 33. 6-[4-(3-циано-2-пиридил)бензил]-5-окси-7-пропил-1,2,4 -триазоло(1,5-a)пиримидин.
Формула (VIIb):


Кристаллизация из метанола. Маточные растворы очищают хроматографической обработкой на силикагеле (элюент: смесь 97,5% дихлорметана с 2,5% метанола). Всю массу очищают перекристаллизацией из метанола.
Температура плавления: 212oC.
Пример 34. 6-[4-(3-циано-2-тиенил)бензил] -5-окси-2-метил-7- пропил-1,2,4-триазоло(1,5-a)пиримидин.
Формула (VIIb):


Кристаллизация из смеси воды с хлороформом. Очистка перекристаллизацией из 2-метоксиэтанола.
Температура плавления: 277oC.
Пример 35. 6-[4-(3-циано-2-фурил)бензил] -5-окси-7-пропил-1,2,4- триазоло(1, 5-a)пиримидин.
Формула (VIIb):


Температура плавления: 256oC.
Пример 36. 7-бутил-6-[(2'-цианодифенил-4-ил)метил] -5-окси-2-метил-1,2,4-триазоло (1,5-a)пиримидин.
Формула (VIIb):


Соединение очищают перекристаллизацией из н-бутанола.
Температура плавления: 230oC.
Пример 37. 6-[(2'-цианодифенил-4-ил)метил]-5-окси-2-оксиметил- 1,2,4-триазоло(1,5-a)пиримидин.
Формула (VIIb):


Очистили хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола).
Температура плавления: 214oC.
Пример 38. 6-[(2'-цианодифенил-4-ил)метил] -5-окси-7-метоксиметил -1,2,4-триазоло(1,5-a)пиримидин.
Формула (VIIb):


Очищают хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола)
Температура плавления: 188oC.
Второе соединение выделяют и идентифицируют как 6-[(2'-цианодифенил-4-ил)метил]-7-окси-5-метоксиметил-1,2,4-триазоло (1,5-a)пиримидин. Он представляет собой продукт эксперимента примера 38-бис.
Формула (VIIa):


Температура плавления: 240oC.
Пример 39. 6-[(2'-цианодифенил-4-ил)метил]-5-окси-7-метил- 1,2,4-триазоло(1,5-a)пиримидин.
Формула (VIIb):

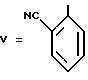
Этот продукт очищают хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола) и кристаллизуют из метанола.
Температура плавления: 212oC.
Второе соединение выделяют и идентифицируют как 6-[(2'-цианодифенил-4-ил)-метил] -7-окси-5-метил-1,2,4-триазоло (1,5-a)пиримидин. Он представляет собой продукт эксперимента примера 39-бис.
Формула (VIIa):


Температура плавления: 252oC.
Пример 40. 6-[(2'-цианодифенил-4-ил)метил] -7-этил-5-окси-1,2, 4- триазоло(1,5-a)пиримидин.
Формула (VIIb):


Выделяют хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола) и очищают перекристаллизацией из н-бутанола.
Температура плавления: 224oC
Второе соединение выделяют и идентифицируют как
6-[(2'-цианодифенил-4-ил)метил] -5-этил-7-окси-1,2,4 -триазоло(1,5-а)пиримидин. Он представляет собой продукт эксперимента примера 40-бис.
Формула (VIIa):

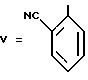
Температура плавления: 234oC.
Пример 41. 6-[(2'-цианодифенил-4-ил)метил]-2-N,N-диэтиламино-5-окси-7-пропил -1,2,4-триазоло-(1,5-а)пиримидин.
Формула (VIIb):



Этот продукт кристаллизуют из метанола.
Температура плавления: 220oC.
Второе соединение выделяют после хроматографической обработки маточных растворов на силикагеле (элюент: смесь 80% хлороформа с 20% изопропиламина) в форме аморфных кристаллов. Его идентифицируют как 6-[(2'-цианодифенил-4-ил)метил]-2-N,N-диэтиламино-7-оксо-5-пропил-1,2,4- триазоло(1,5-а)пиримидин. Он представляет собой соединение примера 41-бис.
Формула: (VIIa):


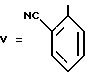
Пример 42. 6-[2'-цианодифенил-4-ил)метил] -5,7-дипропил-1,2, 4-триазоло(1,5-а)пиримидин
Формула (VIIa):


Продукт очищают хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола).
Температура плавления 160oC.
Пример 43. 7-бензилоксиметил-6-(2'-цианодифенил-4-ил)метил] -5-окси-1,2,4- триазоло(1,5-а)пиримидин.
Формула (VIIb):

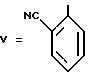
Очищают перекристаллизацией из бутанола с последующей хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола).
Температура плавления: 218oC.
Второе соединение выделяют и идентифицируют как 5-бензилоксиметил-6-[(2'-цианодифенил-4-ил)метил] -7-окси-1,2,4-триазоло (1,5-а)пиримидин. Он представляет собой продукт эксперимента примера 43-бис.
Формула (VIIa):


Температура плавления: 260oC.
Пример 44. 5-хлор-6-[(2'-цианодифенил-4-ил)метил]-7-пропил-1,2,4-триазоло(1,5-а)пиримидин.
Формула (VIIIb):


25,9 г соединения, полученного согласно вышеизложенному в примере 19 или 23, отдельными порциями добавляют в 260 мл POCl3. Смесь кипятят с обратным холодильником в течение 4 ч. Ее концентрируют в вакууме, концентрат растворяют в 200 мл хлороформа, стабилизированного амиленом, и затем добавляют смесь воды со льдом. После декантации водную фазу подвергают экстракционной обработке хлороформом и органические фазы объединяют. После промывки водой и сушки их концентрируют в вакууме с получением густого маслоподобного продукта. Этот продукт кристаллизуют из изопропилацетата, в результате чего получают 21 г 5-хлор-6-[(2'-цианодифенил-4-ил)метил]-7-пропил-1,2,4- триазоло-(1,5-пиримидина).
Температура плавления: 138oC.
С использованием продукта, полученного в ходе эксперимента примера 18, получают производное примера 45.
Пример 45 7-хлор-6-[(2'-цианодифенил-4-ил)метил] -5-пропил-1,2,4-триазоло(1,5-а)пиримидин.
Формула (VIIIa):


Температура плавления: 132oC.
Пример 46. 6-[(2'-цанодифенил-4-ил)метил]-7-меркапто-5-пропил-1,2,4-триазоло (1,5-а)пиримидин.
Формула (IX):


Смесь 5 г хлорированного соединения, полученного по изложенному в примере 45, с 2 г тиомочевины и 150 мл этанола кипятят с обратным холодильником в течение 7 ч и концентрируют в вакууме. Полученный желтый твердый материал растворяют в 60 мл 0,5 н. раствора гидроокиси натрия. Небольшое количество нерастворимого материала отфильтровывают. Фильтрат подкисляют уксусной кислотой. Выпавший в осадок желтый продукт отфильтровывают и очищают хроматографической обработкой на силикагеле (элюент: смесь 90% хлороформа с 10% метанола), получая 3,4 г 6-[(2'-цианодифинил-4-ил)метил]-7-меркапто-5-пропил-1,2,4-триазоло(1,5-а) пиримидина.
Температура плавления: 200 - 205oC.
Пример 47. 6-[(2'-цианодифенил-4-ил)метил)-5-меркапто-7-пропил-1,2,4-триазоло(1,5-а) пиримидин.
Формула (IX):


Смесь 11,1 г продукта, полученного в ходе эксперимента примера 19 или примера 23, с 350 мл толуола и 13,4 г реактива Лауэссона кипятят с обратным холодильником в течение 2 ч. Полученный желтый твердый материал отфильтровывают. Очистка хроматографической обработкой на силикагеле (элюент: смесь 90% дихлорметана с 10% ацетона) дает 10 г 6-[(2'-цианодифенил-4-ил)метил]-5-меркапто-7-пропил-1,2,4-триазоло(1,5-а) пиримидина.
Температура плавления: 226oC.
Пример 48. 6-[(2'-цианодифенил-4-ил)метил] -7-пропил-1,2,4-триазоло-(1,5-а)пиримидин.
Формула (IX):

Раствор 5,4 г соединения, полученного в ходе эксперимента примера 44, в 110 мл 2-метоксиэтанола, содержащего 1,2 г безводного ацетата натрия, гидрогенизуют под атмосферным давлением и при комнатной температуре в присутствии 1,4 г 5%-ного палладия на угле. Через систему продувают азот. Катализатор отфильтровывают и промывают горячим 2-метоксиэтанолом. Фильтруют концентрируют и полученные кристаллы растворяют в диэтиловом эфире, получая 3,7 г сырого продукта. Очистка хроматографической обработкой на силикагеле (элюент: смесь 90% дихлорметана с 10% ацетона) дает 2,5 г белых кристаллов 6-[(2'-цианодифенил-4-ил)метил-7-пропил-1,2,4-триазоло(1,5-а)пиримидина.
Температура плавления: 180oC.
Пример 49. 6-[(2'-цианодифенил-4-ил)метил]-5-метокси-7-пропил-1,2,4-триазоло(1,5-а) пиримидин.
Формула (IX):


Раствор метилата натрия, приготовленного из 0,8 г натрия и 25 мл метанола, добавляют в раствор 11,6 г соединения примера 44 в 120 мл 1,2-диметоксиэтана. Смесь перемешивают при комнатной температуре в течение 3 ч. Нерастворимый материал отфильтровывают и фильтрат концентрируют. Полученные кристаллы переносят в воду, отфильтровывают и промывают вначале водой, а затем изопропиловым спиртом и диэтиловым эфиром, получая 9,5 г 6[(2'-цианодифенил-4-ил)метил]-5-метоксаи-7-пропил-1,2,4-триазоло (1,5-а)пиримидина.
Температура плавления: 166oC.
Пример 50. Эти-{6-[(2'-цианодифенил-4-ил)метил]-7-пропил-1,2,4-триазоло (1,5-а)пиримидин-5-ил}-меркаптоацетат.
Формула (IX):


0,6 г 60%-ного гидрида натрия отдельными порциями добавляют в раствор 1,8 г этилмеркаптоацетата в 50 мл толуола. Смесь выдерживают при температуре 40oC в течение 1/2 ч и затем охлаждают до комнатной температуры. Затем вводят раствор 5 г соединения, полученного по изложенному в примере 44, в 50 мл безводного толуола. Реакцию продолжают проводить при комнатной температуре в течение 3 ч, после чего при температуре 50oC в течение 4 ч. Для завершения этой реакции добавляют второй эквивалент натриевой соли этилмеркаптоацетата, полученного по вышеизложенному. После гидролиза и декантации органическую фазу промывают водой, а затем разбавленным раствором уксусной кислоты, сушат и концентрируют. Полученный маслоподобный продукт очищают хроматографической обработкой на силикагеле (элюент: смесь 90% дихлорметана с 10% ацетона), в результате чего получают 5,4 г этил-{6-[(2'-цианодифенил-4-ил)метил]-7-пропил-1,2,4- триазоло(1,5-a)пиримидин-5-ил}меркаптоацетата.
Температура плавления: 76oC.
Соединение примера 51 получают в соответствии с процедурой примера 50, но с использованием 2-метоксиэтанола вместо этилмеркаптоацетата.
Пример 51. { 6-[(2'-цианодифенил-4-ил)метил] -7-пропил-1,2, 4- триазоло(1,5-a)пиримидин-5-ил}-2-метоксиэтиловый эфир.
Формула (IX):


Продукт кристаллизуют из изопропилового эфира.
Температура плавления: 102oC.
Пример 52. 5-амино-6-[(2'-цианодифенил-4-ил)метил] -7-пропил- 1,2,4-триазоло(1, 5-a)пиримидин.
Формула (IX):


Смесь 10 г производного, полученного в ходе эксперимента примера 44, с 200 мл раствора 1, 2-диметоксиэтана, насыщенного аммиаком, загружают в автоклав. Его содержимое выдерживают при температуре 125oC в течение 24 ч и переводят в смесь хлороформа с водой. После декантации водную фазу подвергают экстракционной обработке. Органические фазы объединяют, сушат и концентрируют с получением 8,1 г 5-амино-6-[(2'-цианодифенил-4-ил)метил]-7-пропил-1,2,4-триазоло (1,5-a)пиримидина.
Температура плавления: 206oC.
Пример 53. 6-[(2'-цианодифенил-4-ил)метил] -7-N, N-диэтиламино-5- пропил-1,2,4-триазоло(1,5-a)пиримидин.
Формула (IX):


Смесь 5 г хлорированного производного примера 45 со 100 мл этанола, 16 мл диэтиламина и 1,5 г карбоната натрия кипятят с обратным холодильником в течение 4 ч. Затем ее концентрируют в вакууме и полученный густой маслоподобный продукт переводят в воду. Трижды проводят экстракционную обработку дихлорэтаном, экстракты сушат и концентрируют. Полученное соединение очищают хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола), получая в форме оранжевого маслоподобного продукта 5 г 6-[(2'-цианодифенил-4-ил)-метил] -7-N, N-диэтиламино-5- пропил-1,2,4-триазоло(1,5-a)пиримидина.
Проведением реакции одного из производных, которые описаны в примерах 44 и 45, с соответствующими аминами согласно одному из двух способов, которые описаны в примерах 52 и 53, получают нижеследующие соединения примеров с 54 по 58.
Пример 54. 6-[(2'-цианодифенил-4-ил)метил] -5-N, N-диэтиламино-7- пропил-1,2,4-триазоло(1,5-a)пиримидин.
Формула (IX):


Продукт кристаллизуют из горячего изопропилового эфира.
Температура плавления: 133oC.
Пример 55. 6-[(2'-цианодифенил-4-ил)метил]-7-пропил-5- (пирролидин-1-ил)-1,2,4-триазоло(1,5-a)пиримидин.
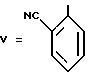
Формула (IX):

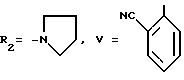
Продукт кристаллизуют из горячего изопропилового эфира.
Температура плавления: 166oC.
Пример 56. 6-[(2'-цианодифенил-4-ил)метил] -7-пропил-5-(морфолин- 4-илэтиламино)-1,2, 4-триазоло(1,5-a)пиримидин.
Формула (IX):


Маслоподобный продукт очищают хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола).
Пример 57. 6-[(2'-цианодифенил-4-ил)метил]-5-(пиперидин-1-ил)-7- пропил-1,2,4-триазоло(1,5-a)пиримидин.
Формула (IX):


Соединение очищают перекристаллизацией из 2-метоксиэтанола.
Температура плавления: 266oC.
Пример 58. 6-[(2'-цианодифенил-4-ил)метил] -5-гидрозино-7-пропил- 1,2,4-триазоло(1,5-a)пиримидин.
Формула (IX):


Продукт кристаллизуют из диэтилового эфира.
Температура плавления: 161oC.
Пример 59. 5-азидо-6-[(2'-цианодифенил-4-ил)метил] -7-пропил- 1,2,4-триазоло(1,5-a)пиримидин.
Формула (IX):


10,3 г соединения, полученного по изложенному в примере 58, смешивают с 2,3 мл концентрированной соляной кислоты и 300 мл уксусной кислоты. Добавляют раствор 1,9 г нитрита натрия в 20 мл воды. Смесь оставляют на ночь при комнатной температуре. Добавляют воды и смесь декантируют и подвергают экстракционной обработке этилацетатом. Органические фазы объединяют, промывают водой, сушат и выпаривают. Очистка двумя последовательными хроматографическими обработками (элюент: смесь 95% дихлорметана с 5% метанола и 90% дихлорметана с 10% метанола) дает 4,3 г 5-азидо-6-[(2'-цианодифенил-4-ил)метил]-7-пропил-1,2,4-триазоло (1,5-a)пиримидина.
Температура плавления: 134oC.
Это же самое соединение можно рассматривать как трициклическое производное, которое соответствует известному равновесию азидов во 2-м положении азотсодержащих колец (см. Темпл и Монтгомери, J. Org. Chem., 30, 826, 1965 г.).
Пример 60. 3-амино-5-оксиметил-1,2,4-триазол.
Формула (II): R7 - группа - CH2OH
Смесь 136 г
аминогуанидинбикарбоната с 80 г гликолевой кислоты ступенчато нагревают до температуры 120oC. При этой температуре реакцию продолжают в течение 5 ч. Смесь переводят в 100 мл этанола и
твердый материал отфильтровывают, получая 45,7 г 3-амино-5-оксиметил-1,2,4-триазола.
Температура плавления: 192 - 194oC.
Пример 61. 3-амино-5-N,
-диэтиламино-1,2,4-триазол
Формула (II):

10,3 мл диэтиламина добавляют в раствор 16,1 г диэтил-N-цианодитиоиминокарбоната в 160 мл ацетонитрила. Смесь перемешивают в течение 1 ч при комнатной температуре и затем кипятят с обратным холодильником до прекращения выделения метилмеркаптана. Раствор охлаждают на ледяной бане и вводят в него 5 мл гидразингидрата. Смесь кипятят с обратным холодильником в течение 4 ч. После отгонки растворителя продукт переводят в ацетонитрил, получая 8,9 г белых кристаллов 3-амино-5-N,N-диэтиламино-1,2,4-триазола.
Температура плавления: 134oC.
Пример 62.
7-окси-5-пропил-6-{[2'-(1H-тетразол-5-ил)-дифенил-4-ил]метил} -1,2,4- триазол(1,5-а)пиримидин
Формула (I): R1 - гидроксил, R2 - н-пропил, X-азотный атом, Y-CH,

Смесь 7,8 г бета-кетоэфира примера 17 с 1,7 г 3-амино-1,2,4-триазола и 70 мл 1,2,4-трихлорбензола выдерживают при температуре 120oC в течение 7 ч. Выпавший осадок очищают хроматографической обработкой на силикагеле (элюент: смесь 80% дихлорметана с 20% метанола). Полученное соединение растворяют в 1 н. растворе гидроокиси натрия, нерастворимый материал отфильтровывают и прозрачный раствор подкисляют пропусканием через него пузырьков сернистого газа, получая 2,4 г белых кристаллов 7-окси-5-пропил-6{[2'-(1H-тетразол-5-ил)-дифенил-4-ил]метил}-1,2,4-триазоло (1,5-а)пиримидина.
Эмпирическая формула соединения: C22H20N6O•0, 5H2O.
Температура плавления: 260 - 265oC (с разложением).
1Р-ЯМР-спектрограмма (DMCO-d6): 2,6 (т., 2H, пропиловый CH2), 8,2 (с., 1H, H2).
УФ-спектрограмма (метанол): ламбдаа = 210 нм, ламбдаb = 250 нм.
Пример 63.
5-окси-7-пропил-6-{[2'-(1H-тетразол-5-ил)дифенил-4-ил]метил} -1,2,4-триазоло (1,5-а)пиримидин
Формула (I): R1 - н-пропил, R2 - гидроксил, X - азотный атом, Y-CH,

Смесь 25 г соединения, полученного по вышеизложенному в примере 19 или 23, с 750 мл ксилола и 34,5 г азида триметилолова кипятят с обратным холодильником в течение 50 ч. Полученный белый осадок отфильтровывают. Он плавится при температуре 290oC с разложением. Это соединение суспендируют в 500 мл ТГФ. В течение 30 мин пропускают пузырьки газообразной соляной кислоты, получая общий раствор, который затем концентрируют в вакууме. Этот концентрат переводят в воду и растирают в ней. Образовавшуюся смолистую массу кристаллизуют из ацетонитрила. Перекристаллизация из изопропанола дает 15,2 г целевого производного.
Температура плавления: 242oC.
Маточные растворы концентрируют, концентрат подщелачивают добавлением 1н. раствора гидроокиси калия и подвергают экстракционной обработке хлороформом с последующей нейтрализацией уксусной кислотой. Выпавший осадок дважды перекристаллизовывают из изопропанола, получая 4,5 г второй порции соединения 5-окси-7-пропил-6-{[2'-(1H-тетразол-5-ил)-дифенил-4-ил]метил}-1,2,4 -триазоло(1, 5-а)пиримидин.
Эмпирическая формула соединения: C22H20N8O.
Температура плавления: 242 - 244oC.
1 H-ЯМР-спектрограмма (DMCO-d6): 2,91 (т., 2H, пропиловый CH2), 8,11 (с., 1H, H2).
В соответствии с той или иной процедурой, которые описаны в примерах 62 и 63, получили нижеследующие соединения примеров с 64 по 95.
Пример 64. 7-окси-2-метил-5-пропил-6-{[2'-(1H-тетразол-5-ил)-дифенил-4-ил]метил}-1,2,4 -триазоло(1,
5-а)пиримидинполусульфат
Формула (I): R1 - гидроксил, R2-н-пропил, X - азотный атом, Y - группа C-CH3,

Эмпирическая формула соединения: C23H22N8O•0,5H2SO4.
Температура плавления: 236 - 238oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,6 (т., 2H, пропиловый CH2).
УФ-спектрограмма (метанол): ламбдаa = 212,1 нм, ламбдаb = 250 нм.
Пример 65. 5-окси-7-пропил-6-{[2'-(1H-тетразол-5-ил)дифенил-4-ил]метил} -1,2,4-триазоло (4,3-а)пиримидин.
Формула (I): R1 - гидроксил, R2 - н-пропил, X-CH, Y - азотный атом,

Эмпирическая формула соединения: C22H20N8O.
Температура плавления: 251oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,55 (т., 2H, пропиловый CH2 ), 9 (с., 1H, H3).
Пример 66. 5-пропил-7-меркапто-6-{[2'-(1H-тетразол-5-ил)дифенил-4-ил] метил}-1,2, 4- триазоло(1,5-а)пиримидин.
Формула (I): R1 - группа SH, R2 - н-пропил, X - азотный атом, Y-CH,

Эмпирическая формула соединения: C22H20N8S.
Температура плавления: 288oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,59 (т., 2H, н-пропиловый CH2), 8,6 (с. , 1H, H2).
Пример 67. 5, 7-диметил-6-{[2'-(1H-тетразол-5-ил)дифенил-4-ил]метил}-1,2,4- триазоло(1,5-а)пиримидин.
Формула (I): R1 - метил, R2 - метил, X - азотный атом, Y-CH,
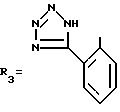
Это соединение получили в соответствии с процедурой примера 62 с использованием 2,4-диоксо-3-{ [2'-(1H-тетразол -5-ил)дифенил-4-ил]метил}пентана, полученного в ходе проведения эксперимента примера 16.
Эмпирическая формула соединения: C21H18N8
Температура плавления: 264oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,48 (с., 3H, CH3), 2,81 (с., 3H, CH3), 8,56 (с., 1H, H2).
Пример 68. 2-этил-7-окси-5-пропил-6-{[2'-(1H-тетразол-5-ил)дифенил-4-ил] метил}-1,2,4- триазоло(1,5-а)пиридин.
Формула (I): R1 - гидроксил, R2 - н-пропил, X - азотный атом, Y - группа C-CH1-CH3,

Эмпирическая формула соединения: C24H24O.
Температура плавления: 246oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,57 (м., 2H, пропиловый CH2 + DMCO-d6).
Пример 69. 7-N, N-диметиламино-5-пропил-6-{ [2'-(1H-тетразол- 5-ил)дифенил-4-ил]метил}-1,2,4-триазоло(1,5-а)пиримидин.
Формула (I): R1 - группа N(CH2-CH3)2, R2-н-пропил, X - азотный атом, Y - CH.
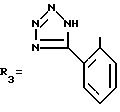
Эмпирическая формула соединения: C25H29N5.
Температура плавления: 192oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,65 (т., 2H, н-пропиловый CH2), 8,5 (с. , 1H, H2).
Пример 70. 5-азидо-7-пропил-6{[2'-(1H-тетразол-5-ил)дифенил- 4-ил]-метил{-1,2,4-триазоло(1,5-а)пиримидин.
Формула (I): R1 - н-пропил, R2 - группа N3, X - азотный
атом, Y - CH,

Эмпирическая формула соединения: C22H19N11,
Температура плавления: 212 - 213oC.
1H-ЯМР-спектрограмма (DMCO-d6): 3,17 (т., 2H, н-пропиловый CH2), 4,06 (с. , 2H, бензиловый CH2), азидо/тетразоловое равновесие - примерно 10%), 4,47 (с. , 2H, бензиловый CH2), 8,56 (с., 1H, H2), азидо/тетразоловое равновесие - примерно 10%), 8,7 (с., 1H, H2).
Пример 71. 3,5-диокси-5-пропил-6-{ [2'(1H-тетразол-5-ил) дифенил-4-ил] метил}-1,2,4-триазоло(4,3-а)пиримидин.
Формула (I): R1 - н-пропил, R2 - гидроксил, X - группа COH, Y - азотный атом,

Эмпирическая формула соединения: C22H20N8O2.
Температура плавления: 252oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,93 (т., н-пропиловый CH2), 3,7 (с., 2H, бензиловый CH2).
Пример 72. 5-окси-2-метил-7-пропил-6{-[2'-(1H-тетразол-5-ил) дифенил-4-ил]метил}-1,2,4-триазоло(4,3-а)пиримидин.
Формула (I): R1 - н-пропил, R2 - гидроксил, X - азотный атом, Y - группа C-CH3.

Эмпирическая формула соединения:C23H22N8O.
Температура плавления: 286oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,85 (т., 2H, н-пропиловый CH2), 3,84 (с., 2H, бензиловый CH2).
Пример 73. 2-этил-5-окси-7-пропил-6-{-2'-(1H-тетразол-5-ил) дифенил-4-ил]метил}-1,2,4-триазоло(4,3-а)пиримидин.
Формула (I): R1 - н-пропил, R2 - гидроксил, X - азотный атом, Y - группа C - CH2CH3.

Эмпирическая формула соединения: C24H24N8O.
Температура плавления: 260oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,86 (т., 2H, н-пропиловый CH2), 3,85 (с., 2H, бензиловый CH2).
Пример 74. 7-бутил-5-окси-6-{ [1H-тетразол-5-ил)дифенил-4-ил] метил}-1,2,4-триазоло(1,5-а)пиримидин.
Формула (I):
R1 - н-бутил, R2 - гидроксил, X - азотный атом, Y - группа CH,

Эмпирическая формула соединения: C23H22N8O.
Температура плавления: 255oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,92 (т., 2H, н-пропиловый CH2), 3,86 (с., 2H, бензиловый CH2), 8,11 (с., 1H, H2).
Пример 75. 2-амино-5-окси-7-пропил-6-{-[2'-(1H-тетразол-5-ил) дифенил-4-ил]метил}-1,2,4-триазоло(1,5-а)-пиримидин.
Формула (I): R1 - н-пропил, R2 - гидроксил, X - азотный
атом, Y - группа CNH2,

Эмпирическая формула соединения: C22H21N9O.
Температура плавления: 282oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,76 (т., 2H, н-пропиловый CH2), 3,8 (с. , 2H, бензиловый CH2).
Пример 76. 5,5-N, N-диметиламино-7-пропил-6-{ [2'-(1H-тетразол- 5-ил)дифенил-4-ил]метил}-1,2,4-триазоло(1,5-а)пиримидин.
Формула
(I): R1 - н-пропил, R2 - группа N(CH2-CH3)2 X - азотный атом, Y - CH,

Эмпирическая формула соединения: C26H29N9.
Температура плавления: 140oC, а затем 205o C.
1H-ЯМР (DMCO-d6): 2,91 (т., 2H, н-пропиловый CH2), 4,07 (с., 2H, бензиловый CH2), 8,32 (с., 1H, H2).
Пример 77. 5-амино-7-пропил-6-{-[2'-(1H-тетразол-5-ил)дифенил- 4-ил]метил}-1,2,4-триазоло(1,5-а)пиримидин.
Формула (I): R1 - н-пропил, R2 - аминогруппа, X - азотный атом, Y - CH.

Эмпирическая формула соединения: C22H21N9.
Температура плавления: 276oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,98 (т., 2H, н-пропиловый CH2), 4,03 (с., 2H, бензиловый CH2), 8,1 (с., 1H, H2).
Пример 78. 5-окси-2-меркаптометил-7-пропил-6-{ [2'-(1H-тетразол-5-ил)дифенил -4-ил]метил}-1,2,4-триазоло(1,5-a)пиримидин.
Формула (I): R1-н-пропил, R2-гидроксил, X-азотный атом, Y-C-SCH3,

Эмпирическая формула соединения: C23H22N8OS
Температура плавления: 260oC.
1 H-ЯМР-спектрограмма (DMCO-d6): 2,85 (т., 2H, н-пропиловый CH2), 3,84 (с., 2H, бензиловый CH2).
Пример 79. 5-окси-7-пропил-6-{4-[3-(1H-тетразол-5-ил)-2-тиенил]бензил}- 1,2,4-триазоло(1,5-а)пиримидин.
Формула (I): R1-н-пропил, R2-гидроксил, X-азотный атом, Y-CH,

Эмпирическая формула соединения: C20H18N8OS.
Температура плавления: 275oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,95 (т., 2H, н-пропиловый CH2), 3,91 (с., 2H, бензиловый CH2), 8, 12 (с., 1H, H2).
Пример 80. 5-окси-7-пропил-6-{4-[3-(1H-тетразол-5-ил)-2-пиридил]бензил} -1,2,4- триазоло(1,5-а)-пиримидин
Формула (I): R1-н-пропил,
R2-гидроксил, X-азотный атом, Y-CH,

Эмпирическая формула соединения: C21 H19N9O
Температура плавления: 244oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,91 (т., 2H, н-пропиловый CH2), 3,89 (с., 2H, бензиловый CH2), 8,11 (с., 1H, H2 с пиридиновым H4).
Пример 81. 5-окси-2-метил-7-пропил-6-{4-[3-(1H-тетразол-5-ил) -2-тиенил] бензил}-1,2, 4-триазоло-(1,5-а)пиримидин.
Формула (I): R1-н-пропил, R2-гидроксил, X-азотный атом, Y-группа C-CH3,
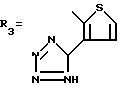
Эмпирическая формула соединения: C21H20N8OS.
Температура плавления: 287oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,9 (т., 2H, н-пропиловый CH2), 3,89 (с. , 2H, бензиловый CH2).
Пример 82. 7-бутил-5-окси-2-метил-6-{[2'-(1H-тетразол-5-ил)дифенил-4-ил] метил}-1,2,4, -триазоло(1,5-а)пиримидин.
Формула (I): R1-н-бутил, R2-гидроксил, X-азотный атом,
Y-группа C-CH3,

Эмпирическая формула соединения: C24H24N8O.
Температура плавления: 275oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,87 (т., 2H, н-бутиловый CH2), 3,84 (с. , 2H, бензиловый CH2).
Пример 83. 5-окси-2-оксиметил-7-пропил-6-{[2'-(1H-тетразол-5-ил) дифенил-4-ил]метил}-1,2,4-тризоло(1,5-а)пиримидин.
Формула (I): R1 -н-пропил. R2-гидроксил, X-азотный атом, Y-группа C-CH2OH,

Эмпирическая формула соединения: C23H22N8O2.
Температура плавления: 274oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,88 (т., 2H, н-пропиловый CH2), 3,86 (с., 2H, бензиловый CH2).
Пример 84. 5-меркапто-7-пропил-6-{[2'-(1H-тетразол-5-ил(дифенил-4-ил] метил}- 1,2,4-триазоло(1,5-а)-пиримидин.
Формула (I): R1-н-пропил, R2-группа SH, X-азотный атом, Y-CH,

Эмпирическая формула соединения: C22H20N8S.
Температура плавления: 278oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,87 (т., 2H, н-пропиловый CH2), 3,37 (с., 2H, бензиловый CH2), 8,29 (с., 1H, H2).
Пример 85. 5-окси-7-метоксиметил-6-{[2'-(1H-тетразол-5-ил)дифенил-4-ил] метил} -1,2,4-триазоло(1,5-а)пиримидин.
Формула (I): R1-группа -CH2-O-CH3,
R2-гидроксил, X-азотный атом, Y-CH,

Эмпирическая формула соединения: C21 H18N8O2.
Температура плавления: 264oC.
1H-ЯМР-спектрограмма (DMCO-d6): 3,91 (т., 2H, бензиловый CH2), 4,79 (с., 2H, O-CH2), 8,12 (с., 1H, H2).
Пример 86. 7-пропил-5-(пирролидин-1-ил)-6-{ [2'-(1H-тетразол-5-ил)дифенил-4-ил] метил}-1,2,4-триазоло(1, 5-а)пиримидин.
Формула (I): R1-н-пропил, R2-группа формулы
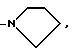
X - азотный атом, Y-CH,

Эмпирическая формула соединения: C26H27N9.
Температура плавления: 280oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,94 (т., 2H, пропиловый CH2), 4,22 (с., 2H, бензиловый CH2) 8,18 (c., 1H, H2).
Пример 87. 5-окси-7-метил-6-{[2'-(1H-тетразол-5-ил) дифенил-4-ил]- метил}-1,2,4-триазоло(1,5-a)пиримидин.
Формула (I): R1 - метил, R2 - гидроксил, X - азотный атом, Y - CH,

Эмпирическая формула соединения: C20H16N8O.
Температура плавления: 248oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,56 (с., 3H, CH3), 3,86 (с., 2H, бензиловый CH2), 8,11 (с., 1H, CH2).
Пример 88. 7-этил-5-окси-6-{[2'-(1H-тетразол-5-ил)дифенил-4-ил]- метил} -1,2,4-триазоло(1,5-a)пиримидин.
Формула (I): R1-группа-CH2-CH3, R2 -гидроксил,
X - азотный атом, Y - CH,

Эмпирическая формула соединения: C21H18N8O.
Температура плавления: 245oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,94 (к., 2H, этиловый CH2), 3,87 (с., 2H, бензиловый CH2), 8,12 (с., 1H, CH2).
Пример 89. 2-N, N-диметиламино-5-окси-6-{ [2'-(1H-тетразол-5-ил) дифенил-4-ил]-метил}-1,2,4-триазоло(1,5-a)пиримидин.
Формула (I): R1 - н-пропил, R2 - гидроксил, X - азотный атом, Y - C-N(CH2-CH3)2,

Эмпирическая формула соединения: C26H29N9O.
Температура плавления: 207oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,79 (т., 2H, н-пропиловый CH2), 3,80 (с., 2H, бензиловый CH2).
Пример 90. 5-(морфолин-4-илэтиламино)-7-пропил-6- {[2'-(1H-тетразол-5-ил)дифенил-4-ил]метил}-1,2,4-триазоло(1,5-a)пиримидин.
Формула (I): R1 - н-пропил, R2 - группа
формулы
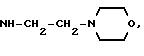
X - азотный атом, Y - CH,

Эмпирическая формула соединения: C28H32N10O.
Температура плавления: 236oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,99 (т., 2H, н-пропиловый CH2), 4,02 (с., 2H, бензиловый CH2), 8,13 (с., 1H, CH2).
Пример 91. 5,7-дипропил-6-{[2'-(1H-тетразол-5-ил)дифенил-4-ил]- метил} -1,2,4-триазоло(1,5-a)пиримидин.
Формула (I): R1 - н-пропил, R2 -н-пропил, X - азотный
атом, Y - CH,

Эмпирическая формула соединения: C25H26N8.
Температура плавления: 226oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,66 (т., 2H, н-пропиловый CH2), 3,15 (т., 2H, н-пропиловый CH2), 4,14 (с., 2H, бензиловый CH2).
Пример 92. 7-пропил-6-{ [2'-(1H-тетразол-5-ил)дифенил-4-ил] - метил}-1,2,4-триазоло(1,5-a)пиримидин.
Формула (I): R1 - н-пропил, R2 - водородный атом, X - азотный атом, Y - CH,

Эмпирическая формула соединения: C22H20N8.
Температура плавления: 238oC.
1H-ЯМР-спектрограмма (DMCO-d6): 3,16 (т., 2H, н-пропиловый CH2), 4,21 (с., 2H, бензиловый CH2), 8,65 (с., 1H), 8,82 (с., 1H).
Пример 93. 7-бензилоксиметил-5-окси-6-{[2'-(1H-тетразол-5-ил)дифенил-4-ил]метил}- 1,2,4-триазоло(1,5-a)пиримидин.
Формула (I): R1 - группа CH2-O-CH2-фенил, R2 - гидроксил, X - азотный атом, Y - CH,
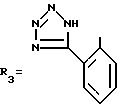
Эмпирическая формула соединения: C27 H22N8O2.
Температура плавления: 270 - 5oC (с разложением).
1H-ЯМР-спектрограмма (DMCO-d6): 3,86 (с., 2H, бензиловый CH2), 4,62 (с., 2H, O-CH2), 4,88 (с., 2H, O-CH2), 8,11 (с., 1H, H2).
Пример 94. 5-(пиперидин-1-ил)-7-пропил-6-{ [2'- (1H-тетразол-5-ил)дифенил-4-ил]метил}-1,2,4-триазоло(1,5-a)пиримидин.
Формула (I): R1 - н-пропил, R2 группа формулы


Эмпирическая формула соединения: C27H29N9.
Температура плавления: 266oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,88 (т., 2H, н-пропиловый CH2), 4,09 (с., 2H, бензиловый CH2), 8,35 (с., 1H, H2).
Пример 95. { 7-пропил-6-[(2'-(1H-тетразол-5-ил)дифенил-4- ил]метил}-1,2, 4-триазоло(1,5-a)пиримидин-5-ил}-2-метоксиэтиловый простой эфир.
Формула (I): R1 - н-пропил, R2 - группа O-CH2-CH2-O-CH3, X
- азотный атом, Y - CH,

Эмпирическая формула соединения: C25H26N8O2.
Температура плавления: 224oC.
1H-ЯМР-спектрограмма (DMCO-d6): 3,14 (т., 2H, н-пропиловый CH2), 4,04 (с., 2H, бензиловый CH2), 8,41 (с., 1H, H2).
Пример 96. 5-хлор-7-пропил-6-{[2'-(1H-тетразол-5-ил)дифенил- 4-ил]метил} -1,2,4-триазоло(1,5-a)пиримидин.
Формула (I): R1 - н-пропил, R2 - хлорный атом, X - азотный атом, Y - CH,

Получено диазотированием продукта эксперимента примера 77 и обработкой диазониевой соли хлоридом одновалентной меди в соответствии с классической реакцией Зандмейера.
Пример 97. 6-[(2'-аминокарбонилдифенил-4-ил)метил] -5-окси-7-пропил-1,2,4-триазоло (4,3-а)пиримидин.
Формула (I): R1 - н-пропил, R2 - гидроксил, X - CH, Y
- азотный атом,
2 г соединения примера 20 d) в 200 мл 1 н. раствора гидроокиси натрия кипятят с обратным холодильником в течение 4 ч. Затем смесь концентрируют в вакууме и концентрат подкисляют добавлением 200 мл 1н. раствора соляной кислоты. Полученные кристаллы очищают перекристаллизацией из 2-метоксиэтанола с получением 1,6 г 6-[(2'-аминокарбонилдифенил-4-ил)метил]-5-окси-7-пропил-1,2,4-триазоло(4,3-а) пиримидина.
Эмпирическая формула соединения: C22H21N5O2
Температура плавления: 258oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,61 (т., 2H, н-пропиловый CH2), 3, 9 (с. , 2H, бензиловый CH2), 9 (с., 1H, H3).
Пример 98. 6-[(2'-карбоксидифенил-4-ил)метил]-5-окси-7-пропил-1,2,4-триазоло(1,5-а) пиримидин.
Формула (I): R1 - н-пропил, R2 - гидроксил, X - азотный атом, Y-CH,

Смесь 9,4 г продукта, полученного в ходе эксперимента примера 97, с 200 мл этиленгликоля и 20 мл концентрированной гидроокиси натрия кипятят с обратным холодильником в течение 10 ч. Этиленгликоль отгоняют, добавляют 200 мл воды и смесь подкисляют добавлением раствора соляной кислоты. Полученные кристаллы очищают перекристаллизацией из 2-метоксиэтанола с получением 5,8 г 6-[(2'-карбоксидифенил-4-ил)метил]-5-окси-7-пропил-1,2,4-триазоло(1,5-а) пиримидина.
Эмпирическая формула соединения: C22H20N4O3.
Температура плавления: 265oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,96 (т., 2H, н-пропиловый CH2), 3,92 (с., 2H, бензиловый CH2), 8,12 (с., 1H, H2).
Соединение примера 99 получили в соответствии с процедурой, изложенной в примере 23.
Пример 99. 6-[4-(5-бром-3-циано-2-фурил)бензил]-5-окси-7-пропил-1,2,4-триазоло(1,5-а) пиримидин.
Формула (VIIb):


Температура плавления: 262oC.
Пример 100. 6-[(2'-цианодифенил-4-ил)метил]-5-окси-7-оксиметил-1,2,4-триазоло(1,5-а) пиримидин.
Формула (VIIb):


Раствор 9 г соединений, полученных в ходе проведения эксперимента примера 43, в 360 мл уксусной кислоты восстанавливают каталитической гидрогенизацией в присутствии 1,8 г 5%-ного палладия на угле. Реакцию проводят под атмосферным давлением и при температуре 50oC. Катализатор отфильтровывают на материале Celite 545 и промывают уксусной кислотой, а фильтрат концентрируют и затем очищают хроматографической обработкой на силикагеле (элюент: смесь 95% хлороформа с 5% метанола), получая 4,5 г исходного материала и 2,2 г 6-[(2'-цианодифенил-4-ил)метил] -5-окси-7-оксиметил-1,2,4-триазоло(1,5-а) пиримидина.
Температура плавления: 262oC.
Это же самое соединение можно также получить проведением реакции с трибромидом бора в хлороформе.
В соответствии с процедурой, изложенной в примере 63, получили нижеследующие производные примеров 101 и 102.
Пример 101 5-окси-7-оксиметил-6-{[2'-(1H-тетразол-5-ил)дифенил-4-ил]-метил}-1,2,-4- триазоло(1,5-а)пиримидин.
Формула (I): R1 - группа CH2 - OH, R2 - гидроксил, X - азотный атом, Y - CH,

Эмпирическая формула соединения: C20 H15N5O2.
Температура плавления: свыше 360oC (с разложением).
1H-ЯМР-спектрограмма (DMCO-d6): 3,93 (с., 2H, бензиловый CH2), 4,82 (с., 2H, CH2-O), 8,06 (с., 1H, H2).
Пример 102. 6-{4-[5-бром-3-(1H-тетразол-5-ил)-2-фурил]бензил}-5-окси-7-пропил-1,2, 4- триазоло(1,5-а)пиримидин.
Формула (I): R1 - н-пропил, R2 - гидроксил, X - азотный атом, Y - CH,

Эмпирическая формула соединения: C20H17BrN8O2.
Температура плавления: свыше 360oC.
1H-ЯМР-спектрограмма (DMCO-d6): 2,93 (т., 2H, н-пропиловый CH2), 3,92 (с., 2H, бензиловый CH2), 6,9 (с., 1H, фурановый протон), 8,03 (с., 1H, H2).
Фармакология.
А - Исследование рецепторов ангиотензина II надпочечников.
I Принцип. Сродство продуктов проведения экспериментов описанных примеров с рецепторами ангиотензина II оценивают с помощью техники смещения специфически связанного радиолиганда к рецепторам ангиотензина II надпочечников крыс.
II Процедура. Аликвоту гомогената надпочечника крысы инкубируют в присутствии взятого в единственной концентрации препарата [125I]-SIAII (Sar1, Tyr4, Ile8 - ангиотензина II), который является антагонистом рецепторов ангиотензина II, и взятых в двух концентрациях (10-5 M, 10-7M) конкурентных агентов в тсение 60 мин при температуре 25oC.
Эту реакцию завершают добавлением буфера с последующим быстрым фильтрованием через фильтры из стеклоткани. Неспецифическую связь определяют в присутствии ангиотензина II.
III Выражение результатов. Для испытываемых концентрации получаемые результаты выражают в процентном смещении специфически связанного радиолиганда к рецепторам ангиотензина II надпочечников.
IV Результаты (см. табл. 1).
B - Измерение ингибирования быстрого разрастания клеток, индуцированного ростовыми факторами (пример: ростовой фактор, полученный из тромбоцитов, или РФПТ) у клеток гладкой мышцы аорты крысы.
I Принцип. Ингибирование быстрого разрастания клеток, индуцированного ростовыми факторами (пример, РФПТ), оценивают измерениями внедрения3H-типидина в клетки гладкой мышцы аорты (КГМВ).
II Процедура. КГВМ культивируют при температуре 37oC в 5%-ном углекислом газе до достижения подслияния и затем помещают на 24 ч в спокойном состоянии в бедную сывороткой среду. В дальнейшем их подвергают предварительной обработке в течение 1 ч испытываемыми молекулами (10-4), после сего стимулируют в течение 22 ч ростовым фактором (пример: РФПТ). В течение последних 4 ч вводят3H-тимидин. Все эти стадии осуществляют при температуре 37oC в присутствии 5% углекислого газа.
Эту реакцию завершают отсасыванием реакционной среды, отделением клеток и последующим фильтрованием лизированных клеток через фильтры из стеклоткани.
III Выражение результатов. Результаты выражают в процентном ингибировании стимулирования внедрения3H-тимидина благодаря действию ростового фактора.
IV Результаты (см. табл. 2).
Токсикология. Продукты эксперимента вышеописанных примеров характеризуются превосходной толерантностью к ним пациентов при пероральном введении в организм.
50%-ная летальная доза этих продуктов для крыс превышает, как это было установлено, 300 мг/кг.
Заключение. Продукты экспериментов, описанных в примерах, обладают хорошим сродством с рецепторами ангиотензина II. В этом отношении их можно с успехом использовать в случаях различных патологических расстройств, в которые вовлечен ангиотензин II, в частности при лечении артериальной гипертонии и сердечной недостаточности, в дозировках от 1 до 400 мг при пероральном введении в организм и от 0,01 до 50 мг при внутреннем введении в виде одной или нескольких ежедневных доз. Более того, некоторые из соединений обладают также антипролиферативным действием и в этом отношении они потенциально полезны при лечении таких пролиферативных заболеваний, как атеросклероз.
Типовые фармацевтические композиции, содержащие соединение по изобретению.
(А) Сухие желатинозные капсулы, содержащие дозу из 20 мг действующего начала.
Ингредиенты, мг: -7-бутил--5-гидрокси-6-[(2'-(1-H-тетразол-5) бифенил-4)метил] -1,2,4-триазоло[1,5-а]пиримидина, 20; магнийстерат 10; лактоза 170, желатинозная капсула размер N 1.
(Б) Таблетки, содержащие дозу из 20 мг действующего начала.
Ингредиенты, мг: -7-бутил-5-гидрокси-6-[(2'-(1-H-тетразол-5)бифенил-4)метил] - 1,2,4-триазоло[1,5-а]пиримидина, 20; микрокристаллическая целлюлоза 430; покрытый желатиной крахмал 47,5; магнийстеарат 2,5.
(В) Препараты для инъекций, содержащие дозу в 5 мг действующего начала. Ингредиенты, мг: -7-бутил-5-гидрокси-6-[(2'-(1-H-тетразол-5) бифенил-4)метил]-1,2,4-триазоло[1,5-а]пиримидина 5; инозит 100; бензиловый спирт 20.
(Г) Свечи, содержащие дозу в 50 мг действующего начала.
Ингредиенты, мг: -7-бутил-5-гидрокси-6-[(2'-(1-H-тетразол-5)бифенил-4)метил]- 1,2,4-триазоло[1,5-а]пиримидина 50; воск для свечей АМЛ 1950.
(Д) Глазные растворы, содержащие 1 мг/мл действующего начала.
Ингредиенты, мг/мл: -7-бутил-5-гидрокси-6-[(2'-(1-H-тетразол-5) бифенил-4)метил] -1,2,4-триазоло[1,5-а] пиримидина 1; двухосновный натрийфосфат 10,4; ордноосновный натрийфосфат 2,4; гидроксипропанолметилцеллюлоза 5; дистиллированная вода: "достаточное количества для" 1 мл, сода 1н: "достаточное количество для" pH 7,4.
Фармацевтические композиции, содержащие прочие соединения по изобретению.
(А) Сухие желатинозные капсулы, содержащие дозу в 20 мг активного начала.
Ингредиенты, мг: -5-гидрокси-7-пропил-6-[(2'-(1-H-тетразол-5) бифенил-4)метил] -1,2,4-триазоло[1,5-а]пиримидина 20; магнийстеарат 10; лактоза 170; желатинозные капсулы размер N 1.
(Б) Прочие сухие желатинозные капсулы, содержащие дозу в 50 мг активного начала, мг: -2-амино-5-гидрокси-7-пропил-6-[(2'-(1-H-тетразол-5)бифенил-4) метил] -1,2,4-триазоло[1,5-а] пиримидина 50; магнийстеарат 10; лактоза 140, желатинозные капсулы размер N 1.
Реферат
Триазолпиримидиновые производные общей
формулы I, приведенной в описании, где один из R1 и R2 - C1-6-алкил, радикал -(CH2)pOR, где p - 1-6, R - C1-6-алкил, водород или
бензил, а другой: водород, галоид, C1-6-алкил, N3, OR4, SR4, NR5-R6 или NH(CH2)n - NR5R6,
где R4 - водород или -(CH2)m, OR, где m - 1-4, R1 - C1-6-алкил; R5 и R6 - одинаковые или различные и означают водород,
С1-6-алкил, или вместе с азотом образуют морфолино, пирролидино и пиперидино; n - 1-4; X и Y различны и означают: N и группу -C-R7, где R7 - H, C1-6-алкил,
радикал (CH2)n'OH, где n' - 0-4, радикал SR', где R' - как указано выше, или NR5R6, где R5 и R6 - одинаковые или различные и означают
водород или C1-6-алкил; R3 - аминокарбонилфенил, карбоксифенил или радикал формулы

где Z - N или CH; Z' - S или O; R5 - водород или, когда Z' - O, галоид, обладающие антагонистическими свойствами в отношении рецепторов ангиотензина II и антипролиферативными свойствами, позволяющими использовать их в фармацевтической композиции. 2 с. и 9 з. п. ф-лы, 2 табл.
Формула

где - один из R1 и R2 - низший C1 - C6-алкил либо радикал общей формулы -(CH)2)pOR, где p - целое число от 1 до 6, а R - низший C1 - C6-алкил, или бензильный радикал, либо спиртовый остаток формулы - (CH)2)pOH, где p имеет указанные значения, а другой из R1 и R2 - водородный атом, атом галогена, низший C1 - C6-алкил, или радикал, выбранный из группы, включающей радикалы N3, OR4, SR4, NR5R6 и NH(CH2)n-NR5R6, где R4 - водородный атом, или радикал формулы (CH2)m-O-R', где m - целое число от 1 до 4, а R' - низший C1 - C6-алкил, каждый из R5 и R6, которые могут быть как идентичными, так и различными, водородный атом, или низший C1 - C6-алкил, или же совместно с азотным атомом, с которым они связаны, R5 и R6 образуют гетероцикл, выбираемый из морфолина, пирролидина и пиперидина, а n - целое число от 1 до 4;
каждый из X и Y, которые различны, - в одном случае азотный атом, а в другом случае - группа формулы C - R7, где R7 - водородный атом, низшая C1 - C6-алкил, радикал (CH2)n' OH, где n' - целое число от 0 до 4, радикал SR', где R' имеет указанные значения, или радикал формулы NR5R6, где каждый из R5 и R6, которые могут быть как идентичными, так и различными, - водородный атом или низший C1 - C6-алкил;
R3 - один из следующих радикалов:




и их таутомерные формы и аддитивные соли, в частности фармацевтически приемлемые аддитивные соли.

9. Производное по п.1 или 2, выбранное из производных формул

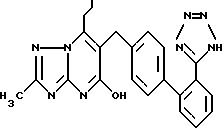



10. Фармацевтическая композиция, проявляющая антагонистическую в отношении рецепторов ангиотензина II активность и антипролиферативную активность, содержащая фармацевтически эффективное количество по меньшей мере одного соединения формулы I, которое определено по любому из пп.1 - 9, или одной из его фармацевтически приемлемой аддитивной соли совместно с носителем или наполнителем.
24.02.92 при: п.1 формулы изобретения, за исключением значения другой из R1 и R2 - низший C1 - C6-алкил, радикал и по пп.2 - 9;
30.04.92 при: другой из R1 и R2 низший C1 - C6-алкил.

Комментарии