Новые мономеры и олигомеры пептидных нуклеиновых кислот - RU2693827C2
Код документа: RU2693827C2
Чертежи






Описание
Настоящее изобретение относится к новым мономерам пептидных нуклеиновых кислот и олигомерам пептидных нуклеиновых кислот, которые содержат диалкиламиновую боковую цепь, замещенную группой(ами) эфира фосфоновой кислоты или группой(ами) фосфоновой кислоты, их получению, а также к вариантам их применения.
Пептидные нуклеиновые кислоты (ПНК) представляют собой синтетические аналоги ДНК/РНК, имеющие N-(2-аминоэтил)глициновую основную структуру - см. общую формулу (ПНК). В общей формуле NB обозначает нуклеотидное основание; n обозначает число звеньев ПНК (n=0-50); и F и G представляют собой заместители.

ПНК получают путем создания пептидных связей между N-ацетил-N-(2-аминоэтил)глициновыми структурными элементами (мономерами ПНК). Каждый из таких индивидуальных N-ацетил-N-(2-аминоэтил)глициновых структурных элементов представляет собой звено ПНК.
Преимущества ПНК заключаются в том, что они являются устойчивыми в физиологических условиях к гидролитическому (ферментативному) расщеплению, а также распознают комплементарные нуклеотидные последовательности (ДНК или РНК) специфическим для последовательности образом и могут связываться с ними с высокой аффинностью. Поэтому ПНК рассматриваются в качестве привлекательных соединений для биотехнологических и/или медицинских применений, например, в качестве диагностических средств, или в антисмысловой терапии.
Для успешного применения в качестве действующего вещества в антисмысловой терапии важным фактором является достаточная биодоступность в живом организме. Антисмысловое действующее вещество должно присутствовать в достаточном для оказания терапевтического действия количестве в сайте-мишени, РНК- или ДНК-мишени. Это означает, что антисмысловое действующее вещество после его введения должно проникать в достаточном количестве сначала (I) в ткань, затем (II) в клетки ткани и, наконец, (III) в клетки клеточного компартмента к РНК- или ДНК-мишени, для того, чтобы оно могло вызвать антисмысловое действие терапевтически значимого уровня.
Однако ПНК имеют недостаток, заключающийся в том, что по сравнению с ДНК они слабо растворимы в воде и лишь с трудом могут проникать через клеточные мембраны. Поэтому применение ПНК в качестве действующего вещества в антисмысловой терапии для живых организмов сильно ограничено, что продемонстрировано, например, у Beth М. и др., Antisense & Nucleic Acid Drug Development, 12, 2002, cc. 65-70 на основе исследований поглощения или биодоступности ПНК в различных органах и тканях. В своих исследованиях Beth М. С соавторами установили, что после внутрибрюшинного ведения крысам 90% ПНК снова выводилось в течение 24 ч в неизмененном виде. Лишь 2,5-4,5% пептидных нуклеиновых кислот абсорбировались почками, а во всех других исследованных органах поглощение фактически составляло даже менее 1%.
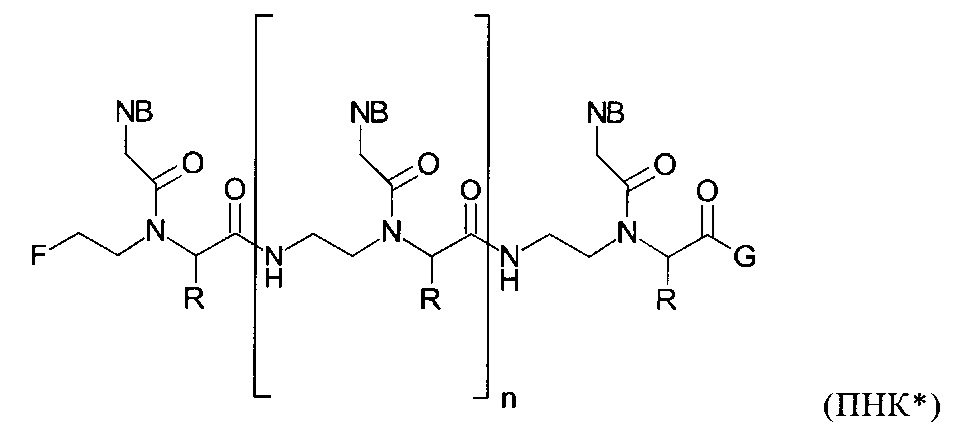
Для улучшения определенных характеристик ПНК, таких как растворимость в воде, способности связываться с комплементарной ДНК или РНК или поглощение клетками, была предложена, среди прочего, модификация РНК путем введения группы R в альфа-положение звена ПНК согласно представленной ниже общей формуле (ПНК*):
Например, в качестве группы R для модификации ПНК были предложены боковые цепи встречающихся в естественных условиях аминокислот (
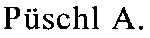
ПНК с модифицированной лизином основной структурой (R=-(CH2)4-NH2) характеризуются улучшенной растворимостью в воде и более высокой температурой плавления гибридов ПНК/ДНК (US 5719262). Однако, недостатком таких модифицированных лизином ПНК является то, что они после поглощения клетками остаются захваченными внутри клеток во внутриклеточных эндосомах (Nielsen P., Quarterly Reviews of Biophysics 38, 4, 2005, сс. 345-350; Koppelhus U. и др., Antisense & Nucleic Acid Drug Development, 12, 2002, cc. 51-63). В результате этого модифицированные таким путем ПНК не являются доступными в достаточной степени внутри клетки для связывания с РНК и поэтому не пригодны для терапевтического применения. Как было установлено R. Corradini и др., Current Topics in Medicinal Chemistry, 11 (12), 2011, cc. 1535-1554, такие модифицированные лизином ПНК, которые описаны, например, в US 5719262, совсем не поглощаются некоторыми клетками, и даже если они поглощаются клеткой, то они часто остаются захваченными в везикулах. В клетках исследованных типов не было выявлено поглощения ядрами клеток (loc. cit., с. 1543).
Для усиления поглощения ПНК клетками были предложены ПНК с модифицированной аргинином основной структурой, так называемые пептидные нуклеиновые кислоты на основе гуанидина (GПНК):
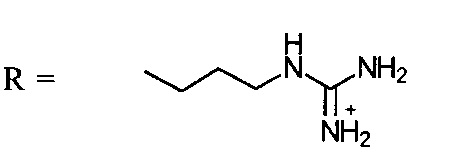
(Zhou Р. и др., J. AM. СНЕМ. SOC. 125, 2003, сс.6878-6879). После поглощения клетками GПНК локализуются внутри клетки в эндоплазматическом ретикулуме (ER) и тем самым могут быть пригодными для связывания с мРНК самой клетки. Однако, в живых организмах после системного введения GПНК поглощаются только почками, печенью и опухолевой тканью (Thomas S. М. и др., ACS Chem. Biol.; 8 (2), 15 февраля 2013 г., сс. 345-352). Такая ограниченная биодоступность препятствует более широкому применению GПНК в качестве терапевтических средств.
В ЕР 1157031, ЕР 2041161 и у Posch W. и др., Mol Med. 18, 2012, сс. 111-122 описаны модифицированные эфиром алкилфосфоновой кислоты ПНК с R=-(CH2)n-P=O(OEt)2, (n=1, 2). Модифицированные таким путем ПНК обладают лучшей способностью проникать в клетки и более высокой растворимостью в воде по сравнению с ПНК, которые не содержат указанную модификацию. Кроме того, было продемонстрировано, что модифицированные таким путем ПНК в случае ВИЧ обладают эффективностью в отношении двух поколений вируса. Кроме того, такие модифицированные группой эфира алкилфосфоновой кислоты ПНК обладают большей биодоступностью по сравнению с GПHК. Однако модифицированные группой эфира алкилфосфоновой кислоты ПНК имеют недостаток, заключающийся в том, что их растворимость в воде зависит от последовательности нуклеотидных оснований. Так, например, в случае последовательности, которая содержит увеличенное количество гуаниновых и цитозиновых оснований, растворимость в воде таких ПНК снижена. Такая зависимая от последовательности растворимость в воде может затруднять терапевтическое применение.
Для широкого применения ПНК в качестве терапевтического средства важна комбинация нескольких различных свойств: высокая и не зависящая от последовательности растворимость в воде; высокая способность к поглощению клеткой; высокие способности к связыванию с ДНК и/или РНК; высокая биодоступность (чем выше биодоступность в различных тканях, тем больше возможностей для терапевтического применения); продолжительные времена полужизни (для достижения связывания ПНК с ДНК и/или РНК также и в клетке живого организма и обеспечения требуемого эффекта модуляции генной экспрессии); высокая способность к связыванию с белками плазмы крови для поддержания биодоступности и удлинения времени полужизни (связанные с белками плазмы крови олигомеры не фильтруются из кровотока в почки и не выделяются с мочой слишком быстро); и выраженный эффект модуляции генной экспрессии, для чего также требуются высокая способность к поглощению клеткой и внутриклеточному распределению, а также высокие способности ПНК к связыванию с ДНК и/или РНК.
Недостаток известных модифицированных ПНК заключается в том, что они обладают лишь некоторыми, но не всеми из таких важных свойств, как (I) высокая и не зависящая от последовательности растворимость в воде, (II) высокая способность к поглощению клеткой и внутриклеточному распределению, (III) высокая биодоступность и продолжительные времена полужизни в максимально возможном количестве терапевтически релевантных типов ткани, (IV) высокая способность к связыванию с белками плазмы крови и/или (V) выраженный эффект модуляции генной экспрессии, которые необходимы для широкой применимости в качестве терапевтического средства.
В основу настоящего изобретения была положена задача создать новые модифицированные мономеры ПНК; и создать новые обладающие улучшенными профилями свойств модифицированные олигомеры ПНК, которые содержат в качестве структурных элементов новые мономеры ПНК. Улучшенный профиль свойств относится к комбинации следующих свойств (I) высокая и не зависящая от последовательности растворимость в воде, (II) высокая способность к поглощению клеткой и внутриклеточному распределению, (III) высокая биодоступность и продолжительные времена полужизни в максимально возможном количестве терапевтически релевантных типов ткани, (IV) высокая способность к связыванию с белками плазмы крови и (V) выраженный эффект модуляции генной экспрессии.
Другая задача изобретения заключалась в том, чтобы разработать новые способы применения указанных выше модифицированных олигомеров ПНК, а также диагностических и терапевтических композиций, содержащих указанные модифицированные олигомеры ПНК.
Этот и другие объекты настоящего изобретения должны стать более понятными после ознакомления с представленными ниже подробным описанием и определениями.
Изобретение относится к:
[1] соединению общей формулы (I):

в которой
К представляет собой активную группу эфира карбоновой кислоты или -О-RM; где RM представляет собой атом Н, метильную, этильную, аллильную, бензильную, трет-бутильную или триметильную группу;
Pr представляет собой атом Н или аминозащитную группу;
# обозначает асимметричный атом С;
Е обозначает атом Н, фенильную группу, гетероцикл, нуклеотидное основание или нуклеотидное основание, замещенное защитной группой для нуклеотидного основания;
R1 обозначает группу, представленную общей формулой (II):
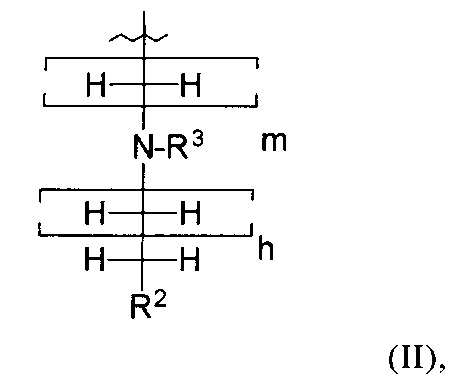
в которой
R2 обозначает группу эфира фосфоновой кислоты или группу фосфоновой кислоты;
R3 обозначает атом Н или аминозащитную группу;
m представляет собой целое число от 1 до 5; и
h представляет собой целое число от 0 до 4;
при условии, что сумма m и h в общей формуле (II) находится в пределах: 2≤х≤5.
В результате связывания группы R1 с каркасом мономерного соединения общей формулы (I) в каркасе образуется асимметричный центр (#) в точке связывания R1 и каркаса. В каждом таком асимметричном центре в каркасе (#) может иметь место либо R-конфигурация, либо S-конфигурация. В данном случае конфигурацию в указанном асимметричном центре (#) определяют согласно правилам последовательности Кана-Ингольда-Прелога при дополнительном условии, что старшинство лигандов всегда определяют следующим образом: атом азота в асимметричном центре всегда имеет старшинство 1. Атом углерода в карбоксильной группе асимметричного центра всегда имеет старшинство 2. Атом углерода в группе R1 асимметричного центра всегда имеет старшинство 3. Атом водорода в асимметричном центре всегда имеет старшинство 4.
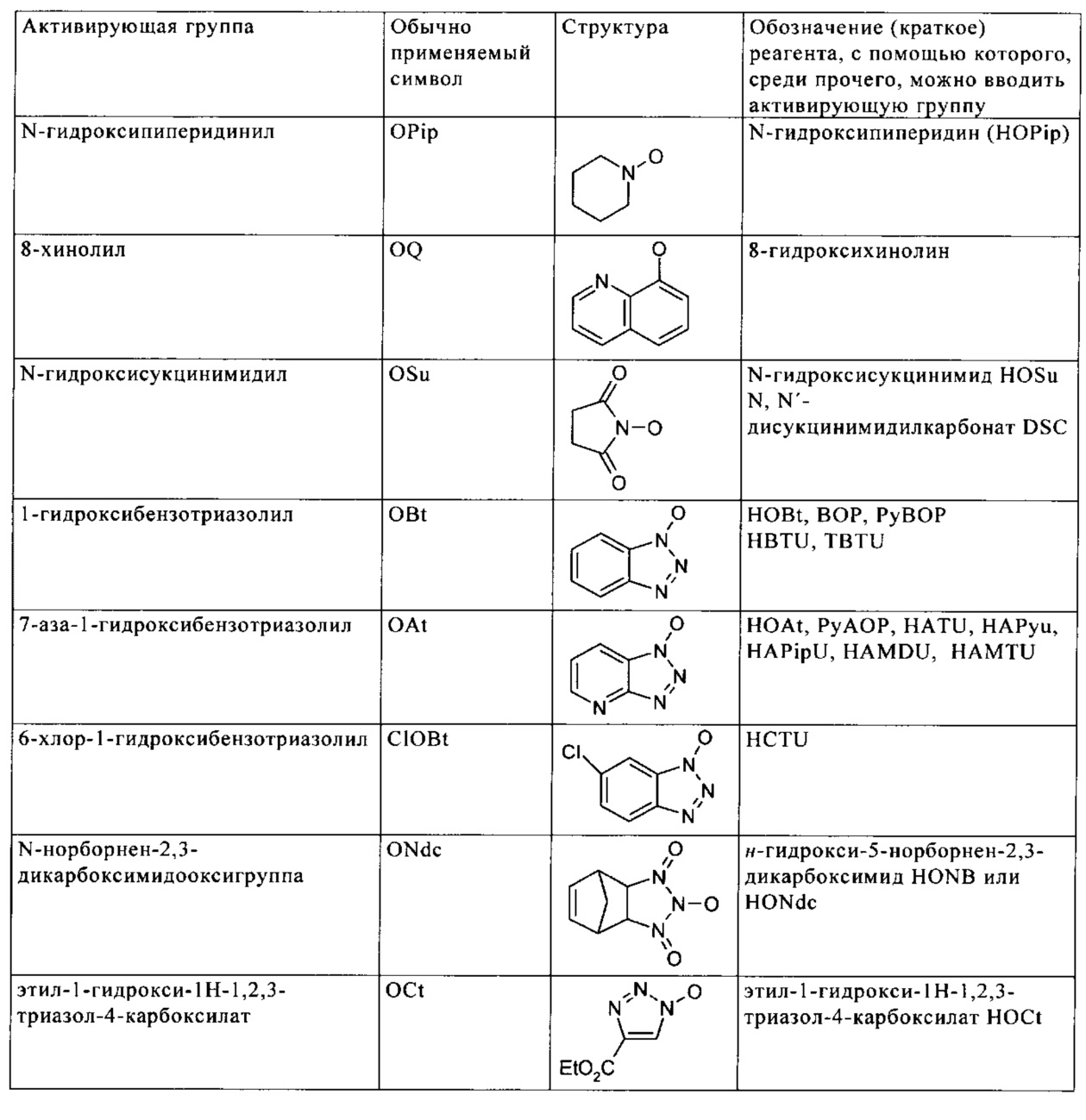
Понятие «активная группа эфира карбоновой кислоты» обозначает производные карбоновой кислоты, известные специалисту в данной области, которые, как правило, применяют в химии пептидов для повышения реакционной связывающей способности функции карбоновой кислоты. Такие активные группы эфира карбоновой кислоты описаны, например, в: О. Marder, F. Albericio, Chimica Oggi, 2002, с. 37; Peptide Chemistry, под ред. N. Sewald, H.-D. Jakubke, изд-во Wiley-VCH Verlag, Weinheim, 2002, глава 4.3 Peptide Bond Formation, c. 197. Примерами активных групп эфира карбоновой кислоты являются галогениды карбоновой кислоты, ацилфосфониевые соли, такие как карбоксилат трис(пирролидино)фосфония (полученный путем взаимодействия с PyBroP), ангидриды, сложные тиофениловые эфиры, сложные цианометиловые эфиры, сложные нитро- и динитрофениловые эфиры, сложные пентафторфениловые эфиры, сложные хлорфениловые эфиры, сложные трихлорфениловые эфиры, сложные пентахлорфениловые эфиры, а также активные сложные эфиры, перечисленные в представленной ниже таблице
Понятие «аминозащитная группа» обозначает известные специалисту в данной области защитные группы, которые применяют в органическом синтезе аминокислот или пептидов, например, защитную трифторацетильную, оксокарбаматную, тиокарбаматную, фторенилметоксикарбонильную (Fmoc) группу, карбобензоксигруппу (Cbz), монометокситритильную (Mmt), фталоильную, трет-бутоксикарбонильную (Boc), бензгидрилоксикарбонильную (Bhoc) или аллилоксикарбонильную группу (Alloc).
Понятие «нуклеотидные основания» обозначает известные специалисту в данной области основания, способные к спариванию с встречающимися в ДНК основаниями или с встречающимися в РНК основаниями. Примеры нуклеотидных оснований включают основания с пуриновой основной структурой, например, аденин, гуанин, гипоксантин, ксантин и 7-метилгуанин; или с пиримидиновой основной структурой, например, цитозин, урацил, тимин, 5-гидроксиметилцитозин, 5-метилцитозин и 5,6-дигидроурацил; а также их аналоги и биоизостеры.
Понятие «защитная группа для нуклеотидного основания» обозначает известные специалисту в данной области защитные группы, которые применяют в органическом синтезе соединений с нуклеотидными основаниями, например, ацетильную, изобутирильную, бензилоксикарбонильную, дифенилметильную, бензгидрилоксикарбонильную, анизоильную, 4-трет-бутилбензоильную, бензильную или дифенилкарбамоильную группу.
Понятие «алкил» относится к насыщенной линейной или разветвленной углеводородной группе, содержащей 1-40 атомов углерода, предпочтительно 1-20 атомов углерода, более предпочтительно 1-12 атомов углерода, и наиболее предпочтительно 1-6 атомов углерода; такой, например, как метальная, этильная, пропильная, изопропильная, н-бутильная, изобутильная, трет-бутильная, н-пентильная, н-гексильная, 2,2-диметилбутильная или н-октильная группа.
Понятия «алкенил» и «алкинил» относятся к по меньшей мере частично ненасыщенным линейным или разветвленным углеводородным группам, содержащим 2-40 атомов углерода, предпочтительно 2-20 атомов углерода, более предпочтительно 2-12 атомов углерода, и наиболее предпочтительно 2-6 атомов углерода, таким, например, как этенильная, аллильная, ацетиленильная, пропаргильная, изопренильная или гекс-2-енильная группа. Алкенильные группы предпочтительно имеют одну или две (наиболее предпочтительно одну) двойные связи или алкенильные группы имеют одну или две (наиболее предпочтительно одну) тройные связи.
Понятие «арил» или «Ar» относится к ароматической группе, которая имеет одно или несколько колец и содержит 6-14 кольцевых атомов углерода, предпочтительно 6-10 (прежде всего 6) кольцевых атомов углерода. Конкретными примерами являются бензол, нафталин или бифенил.
Понятие «аралкил» относится к группам, которые в соответствии с приведенными выше определениями содержат как арильные, так и алкильные, алкенильные, алкинильные и/или циклоалкильные группы, такие, например, как арилалкильная, арилалкенильная, арилалкинильная, арилциклоалкильная, арилциклоалкенильная, алкиларилциклоалкильная и алкиларилциклоалкенильная группы. Конкретными примерами аралкила являются толуол, ксилол, мезитилен, стирол, 1Н-инден, тетралин, дигидронафталин, инданон, фенилциклопентил, циклогексилфенил, флуорен и индан. Аралкильная группа предпочтительно содержит одну или две ароматические кольцевые системы (1 или 2 кольца) с 6-10 атомамии углерода и одну или две алкильные, алкенильные и/или алкинильные группы с 1 или 2-6 атомами углерода, и/или одну циклоалкильную группу с 5 или 6 кольцевыми атомами углерода.
Понятие «циклоалкил» относится к насыщенной или частично ненасыщенной (например, циклоалкенильной) циклической группе, которая имеет одно или несколько колец (предпочтительно 1 или 2) и содержит 3-14 кольцевых атомов углерода, предпочтительно 3-10 (в частности, 3, 4, 5, 6 или 7) кольцевых атомов углерода. Конкретными примерами циклоалкильных групп являются циклопропильная, циклобутильная, циклопентильная, спиро[4,5]деканильная, норборнильная, циклогексильная, циклопентенильная, циклогексадиенильная, декалинильная, бицикло[4.3.0]нонильная, тетралинильная, циклопентилциклогексильная или циклогекс-2-енильная группа.
Понятие «алкилциклоалкил» относится к группам, которые в соответствии с приведенными выше определениями содержат как циклоалкильные, так и алкильные, алкенильные или алкинильные группы, например, алкилциклоалкильные, циклоалкилалкильные, алкилциклоалкенильные, алкенилциклоалкильные и алкинилциклоалкильные группы. Алкилциклоалкильная группа предпочтительно содержит циклоалкильную группу, которая имеет одно или два кольца и 3-14 кольцевых атомов углерода, предпочтительно 3-10, прежде всего, 3, 4, 5, 6 или 7 кольцевых атомов углерода; и одну, две или три, предпочтительно 1 или 2 алькильную(ые), алкенильную(ые) или алкинильную(ые) группу(ы), каждая из которых содержит 1 или 2-6 атомов углерода; при этом предпочтительной является С4-C11алкилциклоалкильная группа, а наиболее предпочтительной является С4-С7алкилциклоалкильная группа. Конкретными примерами алкилциклоалкильных групп являются метилциклопропильная (С4), метилциклобутильная (С5), этилциклопропильная (С5), метилциклопентильная (С6), пропилциклопропильная (С6), этилциклопентильная (С7), метилциклогексильная (С7), этилциклопентенильная (С7) или этилциклогексадиенильная (С8) группа.
Понятия «алкоксигруппа», «алкенилоксигруппа», «алкинилоксигруппа», алкилоксиарильная группа» и «циклоалкоксигруппа» относятся к указанной выше алкильной, алкенильной, алкинильной, алкиларильной или циклоалкильной группе, которая содержит одну или несколько -О-групп. Примерами являются метоксигруппа, этоксигруппа, фуранильная, тетрагидрофуранильная, или 4-метоксибензильная группа.
Понятие «гетероцикл» относится к указанной выше циклоалкильной, арильной или аралкильной группе, в которой один или несколько, предпочтительно 1, 2 или 3 атома углерода замещены атомом кислорода, азота или серы. Примерами являются пиперидильная, пиперазинильная, морфолинильная, уротропинильная, пирролидинильная, тетрагидротиофенильная, тетрагидропиранильная, тетрагидрофурильная или 2-пиразолинильная группа. Понятие «гетероцикл» включает, например, также ароматическую группу, которая имеет одно или несколько колец и содержит 5-14 кольцевых атомов, предпочтительно 5-10, прежде всего 5 или 6 кольцевых атомов, из которых один или несколько, предпочтительно 1, 2, 3 или 4, представляют собой кольцевые атомы кислорода, азота или серы. Примерами являются 4-пиридильная, 2-имидазолильная, 3-фенилпирролильная, тиазолильная, оксазолильная, триазолильная, тетразолильная, изоксазолильная, индазолильная, индолильная, бензимидазолильная, пиридазинильная, хинолинильная, пуринильная, карбазолильная, акридинильная, пиримидильная, 2,3'-бифурильная, 3-пиразолильная и изохинолинильная группы.
Понятие «аминокислота» обозначает карбоновую кислоту, в которой один или несколько атомов водорода на атоме углерода замещены аминогруппой. Аминокислота может представлять собой, например, α-аминокислоту, такую как глицин, лейцин, изолейцин, валин, аланин, фенилаланин, тирозин, триптофан, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, цистеин, метионин, аргинин, лизин, пролин, серии, треонин, гистидин, селеноцистеин, пирролизин, тироксин, DOPA и L-орнитин, 5-гидрокситриптофан, лантионин, β-хлораланин, 2-метилаланин, цитруллин, канаванин, теанин, кукурбитин, β-аминокислоту, такую как β-аланин, или γ-аминокислоту, такую как γ-аминомасляная кислота (GABA).
Под объем изобретения подпадают также:
[2] Соединение, описанное в п. [1], в котором K представляет собой -O-RM и RM имеет указанное в п. [1] значение.
[3] Соединение, описанное в п. [1] или п. [2], в котором Rm представляет собой атом Н, метальную, этильную, аллильную или триметилсилильную группу.
[4] Соединение, описанное в п.п. [1]-[3], в котором Pr представляет собой аминозащитную группу.
[5] Соединение, описанное в п. [4], в котором аминозащитная группа выбрана из оксокарбаматной, тиокарбаматной защитной группы или защитной группы Mmt.
[6] Соединение, описанное в п. [4] или п. [5], в котором аминозащитная группа представляет собой защитную группу Fmoc, Boc, Cbz, Bhoc, Alloc или Mmt.
[7] Соединение, описанное в п.п. [4]-[6], в котором аминозащитная группа представляет собой защитную группу Воc или Fmoc.
[8] Соединение, описанное в п.п. [1]-[7], в котором Е представляет собой аденинильную, цитозинильную, псевдо-изоцитозинильную, гуанинильную, тиминильную, урацильную или фенильную группу, при необходимости замещенную защитной группой для нуклеотидного основания.
[9] Соединение, описанное в п. [8], в котором Е представляет собой группу, выбранную из:


где
X1-Х4 в каждом случае независимо представляют собой атом Н или защитную группу для нуклеотидного основания; и X5 в каждом случае независимо представляет собой атом Н или защитную группу Воc или Bhoc.
[10] Соединение, описанное в п. [9], в котором X1, X2 и X4 в каждом случае независимо представляют собой атом Н, ацетил (Ас), трет-бутилоксикарбонил (Воc), изобутирил (iBu-CO), бензилоксикарбонил (Cbz), (4-метоксифенил)дифенилметил (Mmt), бензгидрилоксикарбонил (Bhoc), анизоил (An) или 4-трет-бутилбензоил (tBuBz);
X5 в каждом случае независимо представляет собой атом Н или защитную группу Воc или Bhoc; и
X3 в каждом случае независимо представляет собой атом Н, бензил (Bn) или дифенилкарбамоил (Dpc).
[11] Соединение, описанное в п.п. [1]-[10], в котором Е представляет собой тиминильную, урацилильную, фенильную, N2-ацетилгуанинильную, N2-изобутирилгуанинильную, N2-бензилоксикарбонилгуанинильную, N2-(4-метоксифенил)дифенилметилгуанинильную, N2-бензгидрилоксикарбонилгуанинильную, N2-дибензгидрилоксикарбонилгуанинильную, N2-трет-бутилоксикарбонилгуанинильную, N2-ди-трет-бутилоксикарбонилгуанинильную, N6-бензилоксикарбониладенинильную, N6-(4-метоксифенил)дифенилметиладенинильную, N6-анизоиладенинильную, N6-бензгидрилоксикарбониладенинильную, N6-дибензгидрилоксикарбониладенинильную, N6-трет-бутилоксикарбониладенинильную, N6-ди-трет-бутилоксикарбониладенинильную, O6-бензгидрилгуанинильную, N2-ацетил-О6-дифенилкарбамоилгуанинильную, N2-изобутирил-O6-дифенилкарбамоилгуанинильную, N2-бензилоксикарбонил-O6-дифенилкарбамоилгуанинильную, N2-(4-Метоксифенил)дифенилметил-O6-дифенилкарбамоилгуанинильную, N2-бензгидрилоксикарбонил-О6-дифенилкарбамоилгуанинильную, N4-бензилоксикарбонилцитозинильную, N4-(4-метоксифенил)дифенилметилцитозинильную, N4-4-трет-бутилбензоилцитозинильную, N4-бензгидрилоксикарбонилцитозинильную, N4-дибензгидрилоксикарбонилцитозинильную, N4-трет-бутилоксикарбонилцитозинильную, N4-ди-трет-бутилоксикарбонилцитозинильную, N2-бензилоксикарбонил-псевдо-изоцитозинильную, N2-(4-метоксифенил)дифенилметил-псевдо-изоцитозинильную, N2-4-трет-бутилбензоил-псевдо-изоцитозинильную, N2-бензгидрилоксикарбонил-псевдо-изоцитозинильную, N2-дибензгидрилоксикарбонил-псевдо-изоцитозинильную, N2-трет-бутилоксикарбонил-псевдо-изоцитозинильную или N2-ди-трет-бутилоксикарбонил-псевдо-изоцитозинильную группу.
[12] Соединение, описанное в п.п. [1]-[11], в котором Е представляет собой тиминильную, урацильную, фенильную, N2-бензилоксикарбонилгуанинильную, N2-бензгидрилоксикарбонилгуанинильную, N2-трет-бутилоксикарбонилгуанинильную, N2-бензилоксикарбонил-O6-дифенилкарбамоилгуанинильную, N2-бензгидрилоксикарбонил-O6-дифенилкарбамоилгуанинильную, N6-бензилоксикарбониладенинильную, N6-бензгидрилоксикарбониладенинильную, N6-трет-бутилоксикарбониладенинильную, N6-ди-трет-бутилоксикарбониладенинильную, N4-бензилоксикарбонилцитозинильную, N4-бензгидрилоксикарбонилцитозинильную, N4-ди-трет-бутилоксикарбонилцитозинильную, N2-бензилоксикарбонил-псевдо-изоцитозинильную, N2-бензгидрилоксикарбонил-псевдо-изоцитозинильную или N2-трет-бутилоксикарбонил-псевдо-изоцитозинильную группу.
[13] Соединение, описанное в п.п. [1]-[12], в котором R2 представляет собой группу эфира фосфоновой кислоты формулы -P(=O)(OV)2 или -P(=O)(OV)(OH); и V каждый независимо представляет собой незамещенную С1-С7алкильную, С3-С7циклоалкильную, С4-С7алкилциклоалкильную, фенильную или бензильную группу.
[14] Соединение, описанное в п. [13], в котором каждый V независимо представляет собой метильную, этильную, циклогексильную или бензильную группу.
[15] Соединение, описанное в п. [14], в котором V в каждом случае представляет собой этильную группу.
[16] Соединение, описанное в п.п. [1]-[15], в котором R3 обозначает атом Н.
[17] Соединение, описанное в п.п. [1]-[15], в котором R3 представляет собой оксокарбаматную, тиокарбаматную защитную группу или защитную группу Mmt.
[18] Соединение, описанное в п. [17], в котором R3 представляет собой защитную группу Cbz, Alloc, Bhoc или Воc.
[19] Соединение, описанное в п.п. [1]-[18], в котором m обозначает 1, 2, 3 или 4.
[20] Соединение, описанное в п.п. [1]-[19], в котором h обозначает 0, 1, 2 или 3.
[21] Соединение, описанное в п.п. [1]-[20], в котором R1 представляет собой группу формулы -CH2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2 или группу формулы -CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2.
[22] Соединение, описанное в п.п. [1]-[15], [19] или [20], в котором R1 представляет собой группу формулы -CH2-CH2-CH2-CH2-NR3-СН2-СН2-P=O(OEt)2 или группу формулы -CH2-CH2-CH2-NR3-CH2-CH2-P=O(OEt)2; и R3 имеет значение, указанное в п. [17] или п. [18].
Предлагаемые в изобретении соединения общей формулы (I), которые описаны, например, выше в п.п. [1]-[22], можно применять для получения новых олигомерных соединений. В соответствии с этим изобретение относится также к:
[23] Соединению, содержащему по меньшей мере одно повторяющееся звено общей формулы (III):

в которой
каждый Y в каждом случае независимо представляет собой группу общей формулы (IV):

каждый Z в каждом случае независимо представляет собой группу общей формулы (V):
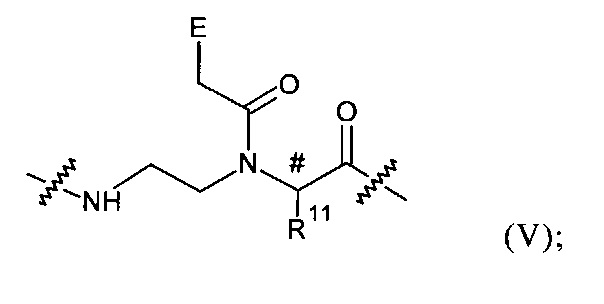
где
каждый Е в каждом случае независимо представляет собой атом Н, фенильную группу, гетероцикл или нуклеотидное основание;
# обозначает асимметричный атом С;
каждый R41 в каждом случае независимо представляет собой атом Н или боковую цепь аминокислоты аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, лизина, метионина, орнитина, фенилаланина, пролина, серина, треонина, триптофана, тирозина или валина;
R11 каждый представляет собой группу -(CH2)m-NH-(CH2)h-CH2-R; в которой R12 в каждом случае представляет собой группу эфира фосфоновой кислоты или группу фосфоновой кислоты; m представляет собой целое число от 1 до 5; и h представляет собой целое число от 0 до 4; при условии, что сумма m и h находтся в пределах: 2≤х≤5;
d в каждом случае представляет собой целое число от 0 до 5;
f в каждом случае представляет собой целое число от 0 до 5;
g в каждом случае представляет собой целое число от 0 до 5;
j в каждом случае о представляет собой целое число от 0 до 5;
n представляет собой целое число от 1 до 10;
при условии, что сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj в общей формуле (III) составляет ≤40 и по меньшей мере одна из переменных f или j обозначает целое число от 1 до 5.
Если повторяющееся звено, например, формулы (III), группа, например, Z или Y, или заместитель или переменная, например, Е, R11 или R41, встречается более одного раза в представленной в настоящем описании формуле, то каждое повторяющееся звено, каждую группу в повторяющемся звене и каждый заместитель или каждую переменную выбирают независимо друг от друга вне зависимости от того, указано это специально или нет. Например, в формуле (III) каждую группу Z и Y и каждую переменную Е, R11 или R41 соответственно выбирают независимо друг от друга. Иными словами, общая формула (III) включает по меньшей мере одно предлагаемое в изобретении мономерное звено Z, указанное выше или, например, определенное в п.п. [1]-[22], и в общей сложности максимум 40 звеньев Z или Z и Y.
Например, в общей формуле (III) каждую группу Y и Z и каждую переменную d, f, g и j выбирают независимо. Соответственно комбинация [Yd-Zf-Yg-Zj]n, в которой d, f, g и j=1; n=10, представляет собой, например, следующую комбинацию звеньев Y и Z: -[Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z-Y-Z]-, в которой суммарное количество всех звеньев Y и Z равна 40. Комбинация [Yd-Zf-Yg-Zj]n, в которой d=3, f=1, g=1 и j=3; n=3, представляет собой, например, следующую комбинацию звеньев Y и Z: -[Y-Y-Y-Z-Y-Z-Z-Z-Y-Y-Y-Z-Y-Z-Z-Z-Y-Y-Y-Z-Y-Z-Z-Z]-, в которой суммарное количество всех звеньев Y и Z равно 24.
Однако переменные d, f, g и j в соответствующих повторяющихся звеньях [Yd-Zf-Yg-Zj] могут отличаться друг от друга. Например, можно комбинировать следующие 4 повторяющихся звена [Yd-Zf-Yg-Zj]: (Y1-Z1-Y1-Z1), (Y1-Z1-Y0-Z0), (Y5-Z1-Y0-Z0), (Y1-Z1-Y1-Z1), т.е. n=4, с получением следующей комбинации групп Y и Z: -[Y-Z-Y-Z-Y-Z-Y-Y-Y-Y-Y-Z-Y-Z-Y-Z]-; суммарное количество всех групп Y и Z равно 16. Аналогичным образом можно комбинировать друг с другом, например, также следующие 3 (т.е. n=3) повторяющихся звена [Yd-Zf-Yg-Zj]: (Y5-Z1-Y1-Z1), (Y1-Z1-Y0-Z0) и (Y1-Z1-Y5-Z0) следующим образом: -[Y-Y-Y-Y-Y-Z-Y-Z-Y-Z-Y-Z-Y-Y-Y-Y-Y]-; суммарное количенство всех групп Y и Z равно 17. При этом каждую группу, содержащуюся в повторяющихся звеньях, или каждый заместитель или каждую переменную, которая встречается более одного раза в повторяющихся звеньях общей формулы (III), в каждом случае выбирают независимо из тех, которые указаны выше, вне зависимости от того, указано это специально или нет.
Кроме того, под объем изобретения подпадает:
[24] Соединение, представленное общей формулой (VI):

в которой
Е, Y, Z, d, f, g, j и n в каждом случае определяют независимо, как это указано в п. [23], при условии, что сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj в общей формуле (VI) составляет ≤40 и по меньшей мере одна переменная f и j представляет собой целое число от 1 до 5;
R31 представляет собой атом Н; боковую цепь аминокислоты аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, лизина, метионина, орнитина, фенилаланина, пролина, серина, треонина, триптофана, тирозина или валина; или группу -(CH2)m-NH-(CH2)h-CH2-R12; в которой R12 представляет собой группу эфира фосфоновой кислоты или группу фосфоновой кислоты; m представляет собой целое число от 1 до 5; и h представляет собой целое число от 0 до 4; при условии, что сумма m и h находится в пределах: 2≤х≤5;
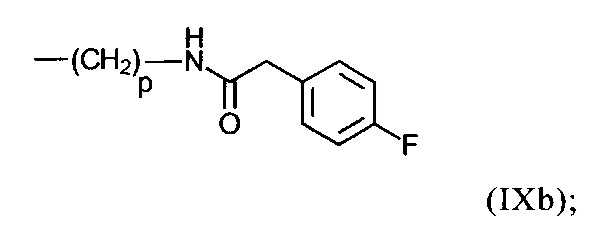
R47 в каждом случае независимо представляет собой атом Н; боковую цепь аминокислоты аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, лизина, метионина, орнитина, фенилаланина, пролина, серина, треонина, триптофана, тирозина или валина; группу формулы (IXb):
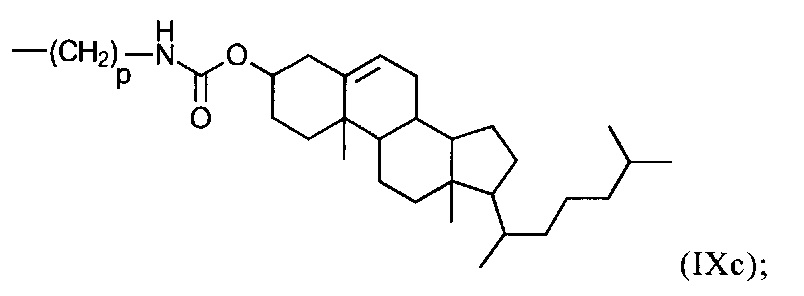
группу формулы (IХс):
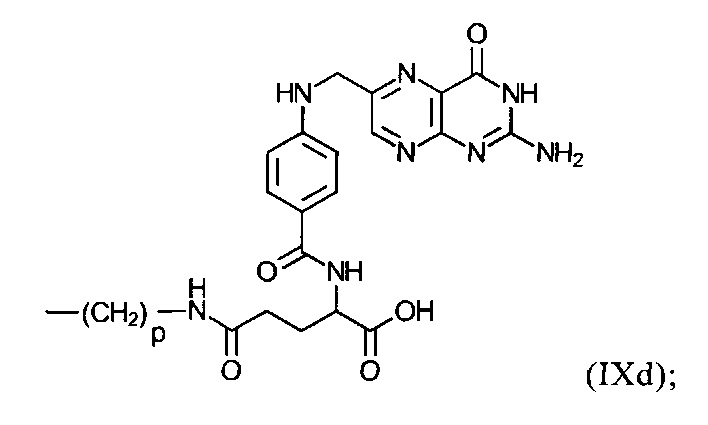
группу формулы (IXd):
или группу формулы (IХе):
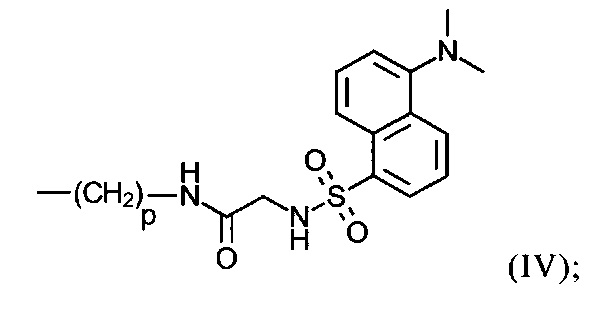
р в формулах (IXb), (IXc), (IXd) и (IXe) представляет собой число 3 или 4;
t представляет собой целое число от 0 до 10;
L представляет собой -NRDRE-NHNRDRE или -ORF; где RD, RE и RF в каждом случае независимо друг от друга представляют собой атом Н; или алкильную, алкенильную, алкинильную, арильную, аралкильную, циклоалкильную илициклоалкенильную группу, в каждом случае содержащую вплоть до 20 атомов С;
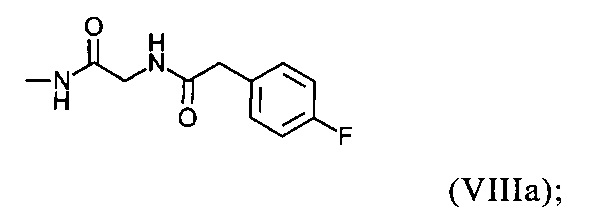
U представляет собой -NRARB; -N⊕RARBRC; -NRA(CO)RB; -NH(CO)NHRB; -NH(CO)ORB; группу формулы (VIIIa):
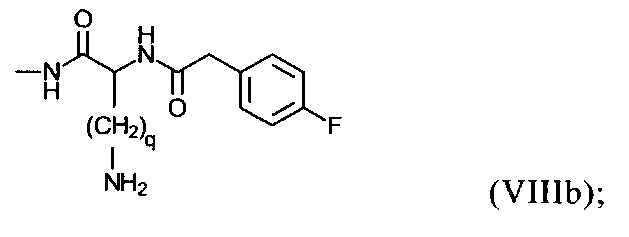
группу формулы (VIIIb):
группу формулы (VIIIc):

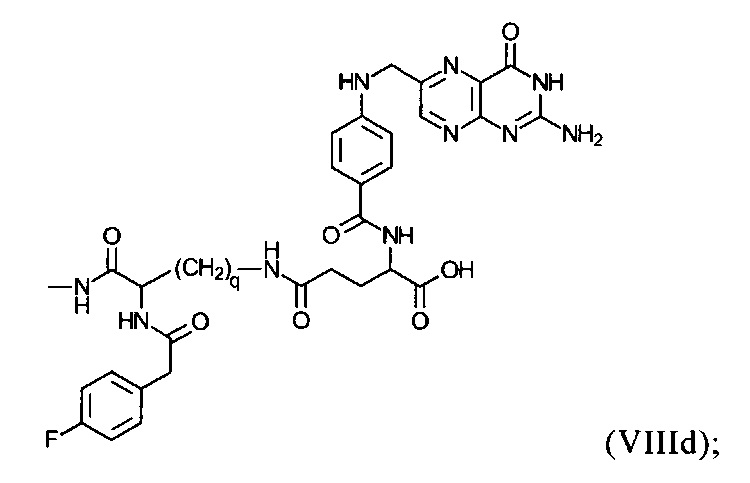
группу формулы (VIIId):
группу формулы (VIIIe):

q в формулах (VIIIb), (VIIIc), (VIIId) и (VIIIe) представляет собой число 3 или 4;
или группу общей формулы (VII):
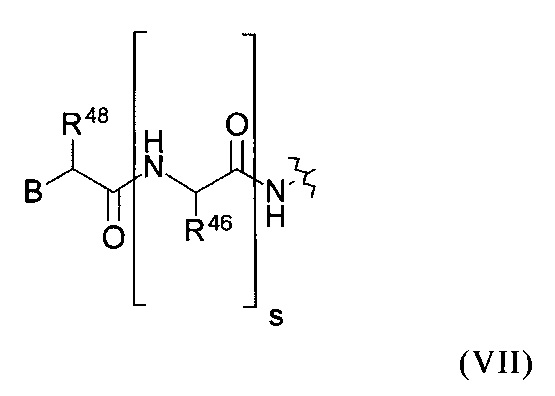
где
В представляет собой атом Н, -NRHRI, -N⊕RHRIRJ, -NRH(CO)R1-NH(CO)NHRI, -NH(CO)ORI, фенильную группу или замещенную фенильную группу, замещенную 1-3 заместителями, выбранными из группы, которая состоит из ОН, F, Cl, Br, I и NO2;
каждый RA, RC, RH и RJ в каждом случае независимо друг от друга представляет собой атом Н, метильную группу или аминозащитную группу;
каждый RB и RI в каждом случае независимо друг от друга представляет собой атом Н; аминозащитную группу; алкильную, алкенильную, алкинильную, арильную, аралкильную, циклоалкильную, алкилциклоалкильную, циклоалкенильную группу, алкилоксигруппу, алкенилоксигруппу, алкинилоксигруппу, алкилоксиарильную группу или циклоалкилоксигруппу, в каждом случае содержащую вплоть до 40 атомов С; где в алкильной, алкенильной, алкинильной, арильной,аралкильной, циклоалкильной, алкилциклоалкильной, циклоалкенильной группе, алкилоксигруппе, алкенилоксигруппе, алкинилоксигруппе, алкилоксиарильной группе или циклоалкилоксигруппе один или несколько атом(ов) водорода в каждом случае независимо друг от друга может(ут) быть замещен(ы) группой эфира фосфоновой кислоты или группой фосфоновой кислоты, F, Cl, Br, I, -ОН, О-СН3, S-CH3, NO2, =O, NH2, -S(O2)NH-, -NHCH3, -N(CH3)2, С1-С6алкильной, C2-С6алкенильной, С2-С6алкинильной, С3-С10циклоалкильной, С6-С10арильной или С7-С12аралкильной группой;
R48 и каждый R46 в каждом случае независимо друг от друга представляют собой атом Н или боковую цепь аминокислоты аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, лизина, метионина, орнитина, фенилаланина, пролина, серина, треонина, триптофана, тирозина или валина, или группу формулы (IXb), (IXc), (IXd) или (IXe); и
s обозначает целое число от 0 до 10.
[25] Соединение, описанное в п. [23] или п. [24], при условии, что сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj в общей формуле (III) или (VI) составляет ≤30.
[26] Соединение, описанное в п.п. [23]-[25], при условии, что сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj в общей формуле (III) или (VI) находится в пределах: 7≤х≤30.
[27] Соединение, описанное в п.п. [23]-[26], при условии, что отношение (сумма повторяющихся звеньев Zf и Zj):(сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj) в общей формуле (III) или (VI) находится в пределах: 0,1≤х≤1,0.
[28] Соединение, описанное в п.п. [23]-[26], при условии, что отношение (сумма повторяющихся звеньев Zf и Zj):(сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj) в общей формуле (III) или (VI) находится в пределах: 0,1≤х≤0,8.
[29] Соединение, описанное в п.п. [23]-[26], при условии, что отношение (сумма повторяющихся звеньев Zf и Zj):(сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj) в общей формуле (III) или (VI) находится в пределах: 0,1≤х≤0,6.
[30] Соединение, описанное в п.п. [23]-[26], при условии, что отношение (сумма повторяющихся звеньев Zf и Zj):(сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj) в общей формуле (III) или (VI) находится в пределах: 0,1≤х≤0,5.
[31] Соединение, описанное в п.п. [23]-[26], при условии, что отношение (сумма повторяющихся звеньев Zf и Zj):(сумма всех повторяющихся звеньев Yj, Zf, Yg и Zj) в общей формуле (III) или (VI) находится в пределах: 0,1≤х≤0,4.
[32] Соединение, описанное в п.п. [23]-[31], в котором каждый Е в каждом случае независимо представляет собой аденинильную, цитозинильную, псевдо-изоцитозинильную, гуанинильную, тиминильную, урацилильную или фенильную группу.
[33] Соединение, описанное в п.п. [23]-[32], в котором каждый R41 в каждом случае независимо представляет собой атом Н или боковую цепь аминокислоты лизина, орнитина, аргинина, гистидина, триптофана, тирозина, треонина или серина.
[34] Соединение, описанное в п.п. [23]-[33], в котором каждый R41 в каждом случае независимо представляет собой атом Н или боковую цепь аминокислоты лизина, орнитина или аргинина.
[35] Соединение, описанное в п.п. [23]-[34], в котором каждый R41 в каждом случае независимо представляет собой атом Н.
[36] Соединение, описанное в п.п. [23]-[34], в котором каждый R12 в каждом случае независимо представляет собой группу эфира фосфоновой кислоты формулы -P(=O)(OV)2 или -P(=O)(OV)(OH); и каждый V в каждом случае независимо представляет собой незамещенную С1-С7алкильную, С3-С7циклоалкильную, С4-С7алкилциклоалкильную, фенильную или бензильную группу.
[37] Соединение, описанное в п. [36], в котором каждый V в каждом случае независимо представляет собой метильную, этильную, циклогексильную или бензильную группу.
[38] Соединение, описанное в п. [36] или п. [37], в котором V в каждом случае представляет собой этильную группу.
[39] Соединение, описанное в п.п. [23]-[38], в котором каждый m в каждом случае независимо обозначает 1, 2, 3 или 4.
[40] Соединение, описанное в п.п. [23]-[39], в котором каждый h в каждом случае независимо обозначает 0, 1, 2 или 3.
[41] Соединение, описанное в п.п. [23]-[40], в котором каждый R11 в каждом случае представляет собой группу формулы -CH2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2 или группу формулы -CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2.
[42] Соединение, описанное в п.п. [23]-[41], в котором каждый d в каждом случае независимо обозначает 0, 1, 2, 3 или 4.
[43] Соединение, описанное в п.п. [23]-[42], в котором каждый f в каждом случае независимо обозначает 0, 1, 2, 3 или 4.
[44] Соединение, описанное в п.п. [23]-[43], в котором каждый g в каждом случае независимо обозначает 0, 1, 2, 3 или 4.
[45] Соединение, описанное в п.п. [23]-[44], в котором каждый j в каждом случае независимо обозначает 0, 1, 2, 3 или 4.
[46] Соединение, описанное в п.п. [23]-[45], в котором n=0, 1, 2, 3, 4, 5, 6, 7 или 8.
[47] Соединение, описанное в п.п. [24]-[46], в котором R31 представляет собой атом Н, боковую цепь аминокислоты лизина, орнитина, аргинина, гистидина, триптофана, тирозина, треонина или серина, группу формулы -СН2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2 или группу формулы -CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2.
[48] Соединение, описанное в п.п. [24]-[47], в котором R31 представляет собой группу формулы -CH2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2 или группу формулы -CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2.
[49] Соединение, описанное в п.п. [24]-[47], в котором R31 представляет собой атом Н или боковую цепь аминокислоты лизина, орнитина или аргинина.
[50] Соединение, описанное в п.п. [24]-[47] или [49], в котором R31 представляет собой атом Н.
[51] Соединение, описанное в п.п. [24]-[50], в котором R47 в каждом случае независимо представляет собой атом Н; боковую цепь аминокислоты лизина, орнитина, аргинина, гистидина, триптофана, тирозина, треонина или серина; или группу формулы (IXb), (IXc), (IXd) или (IXe).
[52] Соединение, описанное в п.п. [24]-[51], в котором R47 в каждом случае независимо представляет собой атом Н или боковую цепь аминокислоты лизина, орнитина или аргинина.
[53] Соединение, описанное в п. [52], в котором R47 в каждом случае представляет собой атом Н.
[54] Соединение, описанное в п. [52], в котором R47 в каждом случае независимо представляет собой боковую цепь аминокислоты лизина, орнитина или аргинина.
[55] Соединение, описанное в п.п. [24]-[54], в котором t=0, 1, 2, 3, 4, 5, 6, 7 или 8.
[56] Соединение, описанное в п.п. [24]-[51], в котором R47 в каждом случае независимо представляет собой атом Н; или группу формулы (IXb), (IXc), (IXd) или (IXe); и t=1, 2, 3 или 4.
[57] Соединение, описанное в п. [56], в котором R47 в каждом случае независимо представляет собой группу формулы (IXb), (IXc), (IXd) или (IXe).
[58] Соединение, описанное в п.п. [24]-[57], в котором L представляет собой -ОН, -NH2, -NHNH2, -O(С1-С10)алкильную, -O(С2-С10)алкенильную, -O(С2-C10)алкинильную, -O(С3-С10)циклоалкильную, -O(С4-С11)алкилциклоалкильную, -O(С6-С10)арильную, -O(С7-С12)аралкильную, -NH-(С1-С10)алкильную, -NH(C2-C10)алкенильную, -NH(C2-C10)циклоалкенильную, -NH(С3-С10)циклоалкильную, -NH(С6-С10)арильную или -NH(C7-С12)аралкильную группу.
[59] Соединение, описанное в п.п. [24]-[58], в котором L представляет собой -ОН, -OEt, -NH2 или -NHNH2.
[60] Соединение, описанное в п.п. [24]-[59], в котором U представляет собой -NRARB; -NRA(CO)RB; -NH(CO)NHRB или -NH(CO)ORB; RA в каждом случае представляет собой атом Н или метильную группу; и RB имеет значение, указанное в п. [24].
[61] Соединение, описанное в п. [60], в котором RB в каждом случае представляет собой атом Н, алкильную, алкенильную, алкинильную, арильную, аралкильную, циклоалкильную, алкилциклоалкильную, циклоалкенильную группу, алкилоксигруппу, алкенилоксигруппу, алкинилоксигруппу, алкилоксиарильную группу или циклоалкилоксигруппу, в каждом случае содержащую вплоть до 30 атомов С; где в алкильной, алкенильной, алкинильной, арильной, аралкильной, циклоалкильной, алкилциклоалкильной, циклоалкенильной группе, алкилоксигруппе, алкенилоксигруппе, алкинилоксигруппе, алкилоксиарильной группе или циклоалкилоксигруппе один или несколько атом(ов) водорода в каждом случае независимо может(ут) быть замещены группой эфира фосфоновой кислоты или группу фосфоновой кислоты, F, Cl, Br, I, -ОН или NO2.
[62] Соединение, описанное в п. [60], в котором RB в каждом случае представляет собой атом Н, алкильную, алкенильную, алкинильную, арильную, аралкильную, циклоалкильную, алкилциклоалкильную, циклоалкенильную группу, алкилоксигруппу, алкенилоксигруппу, алкинилоксигруппу, алкилоксиарильную группу или циклоалкилоксигруппу, в каждом случае содержащую вплоть до 20 атомов С; где в алкильной, алкенильной, алкинильной,арильной,аралкильной, циклоалкильной, алкилциклоалкильной, циклоалкенильной группе, алкилоксигруппе, алкенилоксигруппе, алкинилоксигруппе, алкилоксиарильной группе или циклоалкилоксигруппе один или несколько атом(ов) водорода в каждом случае независимо друг от друга может(ут) быть замещены группой эфира фосфоновой кислоты или группой фосфоновой кислоты, F, Cl, Br, I, -ОН или NO2.
[63] Соединение, описанное в п. [60], в котором RB в каждом случае представляет собой атом Н, алкильную, алкенильную, алкинильную, арильную, аралкильную, циклоалкильную, алкилциклоалкильную, циклоалкенильную группу, алкилоксигруппу, алкенилоксигруппу, алкинилоксигруппу, алкилоксиарильную группу или циклоалкилоксигруппу, в каждом случае содержащую вплоть до 12 атомов С; где в алкильной, алкенильной, алкинильной, арильной,а ралкильной, циклоалкильной, алкилциклоалкильной, циклоалкенильной группе, алкилоксигруппе, алкенилоксигруппе, алкинилоксигруппе, алкилоксиарильной группе или циклоалкилоксигруппе один или несколько атом(ов) водорода в каждом случае независимо друг от друга может(ут) быть замещены группой эфира фосфоновой кислоты или группой фосфоновой кислоты, F, Cl, Br, I, -ОН или NO2.
[64] Соединение, описанное в п.п. [24]-[59], в котором U представляет собой группу общей формулы (VII); В обозначает -NRHRI, -NRH(CO)RI, -NH(CO)NHRI или -NH(CO)ORI; R48 обозначает атом Н; каждый R46 в каждом случае независимо друг от друга представляет собой атом Н или боковую цепь аминокислоты аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, лизина, метионина, орнитина, фенилаланина, пролина, серина, треонина, триптофана, тирозина или валина; и RH и RI имеют значения, указанные в п. [24].
[65] Соединение, описанное в п.п. [24]-[59], в котором U представляет собой группу общей формулы (VII); В обозначает -NRHRI, -NRH(CO)RI, -NH(CO)NHRI или -NH(CO)ORI; R48 представляет собой группу формулы (IXb)-(IXe); каждый R46 в каждом случае независимо друг от друга представляет собой атом Н или боковую цепь аминокислоты аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, лизина, метионина, орнитина, фенилаланина, пролина, серина, треонина, триптофана, тирозина или валина; и RH и RI имеют значения, указанные в п. [24].
[66] Соединение, описанное в п. [64] или п. [65], в котором RH представляет собой атом Н или метильную группу.
[67] Соединение, описанное в п.п. [64]-[66], в котором RI представляет собой атом Н, алкильную, алкенильную, алкинильную, арильную, аралкильную, циклоалкильную, алкилциклоалкильную, циклоалкенильную группу, алкилоксигруппу, алкенилоксигруппу, алкинилоксигруппу, алкилоксиарильную группу или циклоалкилоксигруппу, в каждом случае содержащую вплоть до 30 атомов С; где в алкильной, алкенильной, алкинильной, арильной, аралкильной, циклоалкильной, алкилциклоалкильной, циклоалкенильной группе, алкилоксигруппе, алкенилоксигруппе, алкинилоксигруппе, алкилоксиарильной группе или циклоалкилоксигруппе один или несколько атом(ов) водорода в каждом случае независимо друг от друга может(ут) быть замещены группой эфира фосфоновой кислоты или группой фосфоновой кислоты, F, Cl, Br, I, -ОН или NO2.
[68] Соединение, описанное в п.п. [64]-[66], в котором RI представляет собой атом Н, алкильную, алкенильную, алкинильную, арильную, аралкильную, циклоалкильную, алкилциклоалкильную, циклоалкенильную группу, алкилоксигруппу, алкенилоксигруппу, алкинилоксигруппу, алкилоксиарильную группу или циклоалкилоксигруппу, в каждом случае содержащую вплоть до 20 атомов С; где в алкильной, алкенильной, алкинильной, арильной, аралкильной, циклоалкильной, алкилциклоалкильной, циклоалкенильной группе, алкилоксигруппе, алкенилоксигруппе, алкинилоксигруппе, алкилоксиарильной группе или циклоалкилоксигруппе один или несколько атом(ов) водорода в каждом случае независимо друг от друга может(ут) быть замещены группой эфира фосфоновой кислоты или группой фосфоновой кислоты, F, Cl, Br, I, -ОН или NO2.
[69] Соединение, описанное в п.п. [64]-[66], в котором RI представляет собой атом Н, алкильную, алкенильную, алкинильную, арильную, аралкильную, циклоалкильную, алкилциклоалкильную, циклоалкенильную группу, алкилоксигруппу, алкенилоксигруппу, алкинилоксигруппу, алкилоксиарильную группу или циклоалкилоксигруппу, в каждом случае содержащую вплоть до 12 атомов С; где в алкильной, алкенильной, алкинильной, арильной, аралкильной, циклоалкильной, алкилциклоалкильной, циклоалкенильной группе, алкилоксигруппе, алкенилоксигруппе, алкинилоксигруппе, алкилоксиарильной группе или циклоалкилоксигруппе один или несколько атом(ов) водорода в каждом случае независимо друг от друга может(ут) быть замещены группой эфира фосфоновой кислоты или группой фосфоновой кислоты, F, Cl, Br, I, -ОН или NO2.
[70] Соединение, описанное в п.п. [24]-[59], в котором U представляет собой группу общей формулы (VII); В представляет собой атом Н, фенильную группу или замещенную фенильную группу, которая замещена 1-3 заместителями, выбранными из группы, состоящей из ОН, F, Cl, Br, I и NO2; R48 обозначает атом Н; и каждый R46 в каждом случае независимо друг от друга представляет собой атом Н или боковую цепь аминокислоты аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, лизина, метионина, орнитина, фенилаланина, пролина, серина, треонина, триптофана, тирозина или валина.
[71] Соединение, описанное в п.п. [64]-[70], в котором каждый R46 в каждом случае независимо друг от друга представляет собой атом Н или боковую цепь аминокислоты аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, лизина, метионина, орнитина, фенилаланина, пролина, серина, треонина, триптофана, тирозина или валина.
[72] Соединение, описанное в п.п. [64]-[70], в котором каждый R46 в каждом случае независимо друг от друга представляет собой атом Н или боковую цепь аминокислоты аргинина, гистидина, лизина, метионина, орнитина, серина, треонина, триптофана или тирозина.
[73] Соединение, описанное в п.п. [64]-[72], в котором s=0, 1, 2, 3, 4, 5, 6, 7 или 8.
[74] Соединение, описанное в п.п. [24]-[59], в котором U представляет собой группу общей формулы (VII); В представляет собой атом Н, фенильную группу или замещенную фенильную группу, которая замещена 1-3 заместителями, выбранными из группы, которая состоит из ОН, F, Cl, Br, I и NO2; R48 представляет собой атом Н; каждый R46 в каждом случае независимо друг от друга представляет собой атом Н или группу формулы (IXb)-(IXe); и s=1, 2, 3 или 4.
[75] Соединение, описанное в п. [74], в котором R46 в каждом случае независимо представляет собой группу формулы (IXb), (IXc), (IXd) или (IXe).
[76] Соединение, описанное в п.п. [24]-[59], в котором U представляет собой группу формулы (VIIIa)-(VIIIe).
[77] Соединение, описанное в п.п. [24]-[46], в котором R31 представляет собой атом Н или группу -(CH2)m-NH-(CH2)h-CH2-R12, в которой R12 представляет собой группу эфира фосфоновой кислоты формулы -P(=O)(OV)2 или P(=O)(OV)(OH); V каждый независимо обозначает метальную, этильную, циклогексильную или бензильную группу; m обозначает 1, 2, 3 или 4; и h обозначает 0, 1, 2 или 3; при условии, что сумма m и h находится в пределах: 2≤х≤5;
[78] Соединение, описанное в п. [77], в котором R47 в каждом случае независимо обозначает атом Н или боковую цепь аминокислоты лизина, орнитина или аргинина;
t=0, 1, 2, 3, 4, 5, 6, 7 или 8;
L представляет собой ОН, OEt, NH2 или -NHNH2;
U представляет собой группу общей формулы (VII):
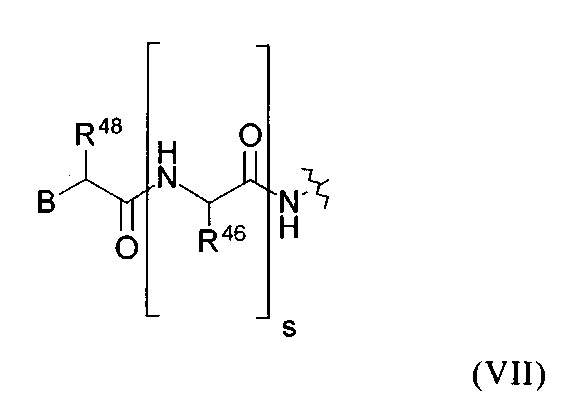
в которой В представляет собой атом Н, фенильную группу или замещенную фенильную групп, которая замещена 1-3 заместителями, выбранными из группы, которая состоит из ОН, F, Cl, Br, I и NO2; R48 обозначает атом Н; и
(I) каждый R46 в каждом случае независимо друг от друга представляет собой атом Н или боковую цепь аминокислоты аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, лизина, метионина, орнитина, фенилаланина, пролина, серина, треонина, триптофана, тирозина или валина; и s обозначает 0, 1, 2, 3, 4, 5, 6, 7 или 8; или
(II) каждый R46 в каждом случае независимо друг от друга представляет собой атом Н или группу формулы (IXb)-(IXe); и s=1, 2, 3 или 4.
[79] Соединение, описанное в п.п. [24], [25] и [27]-[78], при условии, что сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj в общей формуле (VI) находится в пределах: 7≤х≤25.
[80] Соединение, описанное в п.п. [24], [25] и [27]-[78], при условии, что сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj в общей формуле (III) или (VI) находится в пределах: 7≤х≤22.
[81] Соединение, описанное в п.п. [77]-[80], в котором каждый R11 в каждом случае представляет собой группу формулы -CH2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2 или группу формулы -CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2.
[82] Соединение, описанное в п.п. [77]-[81], в котором каждый R31 в каждом случае представляет собой атом Н или группу формулы -СН2-СН2-СН2-CH2-NH-CH2-CH2-P=O(OEt)2 или группу формулы -CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2.
Соединения общей формулы (III) и (VI), описанные выше в п.п. [23]-[76] или [77]-[82], содержат по меньшей мере группу Z. Следовательно, описанные в п.п. [23]-[76] или [77]-[82] соединения общей формулы (III) и (IV), предлагаемые в изобретении, имеют в сайте связывания R11 с основной структурой по меньшей мере 1 асимметричный центр (#). Предпочтительно этот асимметричный центр (#) в сайте связывания R11 с основной структурой имеет R-конфигурацию.
Если в соединениях общей формулы (III) и (VI), которые описаны в п.п. [23]-[76] или [77]-[82], присутствуют два или большее количество указанных асимметричных центров (#), то по меньшей мере 50% асимметричных центров (#), предпочтительно 66%, 70%, 75% или 80%, более предпочтительно 85%, 90% или 95%, и наиболее предпочтительно 100% могут иметь R-конфигурацию.
В альтернативном варианте в соединениях общей формулы (III) и (VI) с двумя или большим количеством асимметричных центров (#), описанные, например, в п.п. [23]-[76] или [77]-[82], по меньшей мере 50%, предпочтительно 66%, 70%, 75% или 80%, более предпочтительно 85%, 90% или 95%, и наиболее предпочтительно 100% указанных асимметричных центров (#) имеют S-конфигурацию.
Под объем изобретения подпадает также фармацевтическая композиция, которая содержит по меньшей мере одно (или большее количество) предлагаемое(ых) в изобретении олигомерное(ых) соединение(й), и необязательно по меньшей мере один носитель при необходимости в комбинации с обычными фармакологически переносимыми вспомогательными веществами и/или наполнителями, и/или по меньшей мере одним адъювантом.
Объектом изобретения является также применение предлагаемого в изобретении олигомерного соединения в качестве медикамента или лекарственного средства. Как правило, предлагаемые в изобретении соединения вводят с помощью известных и пригодных методов либо индивидуально, либо в комбинации с любыми другими терапевтическими средствами. Введение можно осуществлять, например, одним из следующих путей: орально, например, в виде драже, таблеток с покрытием, пилюль, полутвердых форм, мягких или твердых капсул, растворов, эмульсий или суспензий; парентерально, например, в виде инъекционного раствора; ректально в виде суппозиториев; путем ингаляции, например, в виде порошкообразного препарата или спрея, чрескожно или интраназально. Для приготовления таких таблеток, пилюль, полутвердых форм, таблеток с покрытием, драже и твердых желатиновых капсул можно смешивать пригодный для терапевтического применения продукт с фармакологически инертными неорганическими или органическими носителями, например, с лактозой, сахарозой, глюкозой, желатином, солодом, силикагелем, крахмалом или его производными, тальком, стеариновой кислотой или ее солями, сухим обезжиренным молоком и т.п. Для приготовления мягких капсул можно применять, например, такие носители, как растительные масла, жидкий парафин, масла животного происхождения или синтетические масла, воск, жир, полиолы. Для приготовления жидких растворов и сиропов можно применять, например, такие носители, как вода, спирты, водный соляной раствор, водные декстрозы, полиолы, глицерин, растительные масла, жидкий парафин, масла животного происхождения или синтетические масла. Для суппозиториев можно применять, например, такие носители, как растительные масла, жидкий парафин, масла животного происхождения или синтетические масла, воск, жир и полиолы. Для аэрозольных препаратов можно применять сжатые газы, пригодные для рассматриваемой цели, такие, например, как кислород, азот, фторхлоруглеводороды, фторуглеводороды, хлоруглеводороды и диоксид углерода. Фармацевтически пригодные средства могут содержать также добавки для консервации, стабилизации, эмульгаторы, подслащивающие вещества, корригенты, соли для изменения осмотического давления, буферы, добавки для капсулирования и/или антиоксиданты.
Благодаря своей способности связываться с комплементарными нуклеотидными последовательностями, предлагаемое(ую) в изобретении олигомерное соединение или фармацевтическую композицию можно применять для предупреждения и/или лечения многочисленных различных заболеваний.
Примерами таких заболеваний, которые можно предупреждать с помощью предлагаемых в изобретении олигомерных соединений, или которые можно лечить с их применением, являются, например: заболевания, вызываемые вирусами, такими, например, как вирус иммунодефицита человека (ВИЧ), вирус гепатита В и вирус гепатита С, или вирус папилломы человека (HPV); различные виды рака, такие, например, как рак кожи, рак легкого, рак печени, рак предстательной железы, лейкоз или опухоли головного мозга; редко встречающиеся нервномышечные заболевания, такие, например, как мышечная дистрофия типа Дюшенна или спинальная мышечная атрофия; воспалительные заболевания, такие, например, как астма, ревматоидный артрит, или псориаз; аутоиммунные заболевания, такие, например, как болезнь Крона или рассеянный склероз; неврологические заболевания, такие, например, как болезнь Паркинсона; или метаболические состояния, такие, например, как повышенный уровень холестерина или ожирение.
Предлагаемые в изобретении олигомерные соединения, а именно, олигомерные соединения общей формулы (III) или (VI) (которые в настоящем описании обозначают также как N-phos-олигомеры), характеризуются по сравнению с известными из ЕР 2041161 олигомерными соединениями, содержащими группы эфира алкилфосфоновой кислоты (ниже обозначены как: ЕР 2041161-олигомеры), неожиданными и улучшенными свойствами, такими, например, как значительно более высокая биодоступность, а также более продолжительное время полужизни в различных терапевтически релевантных органах. Это было выявлено, например, путем сравнительного исследования распределения в ткани, в котором мышам вводили соответствующие олигомерные соединения и измеряли их уровни в различные моменты времени в 18 терапевтически релевантных органах (см. пример 14 и фиг. 1 и фиг. 2).
Кроме того, было установлено, что предлагаемые в изобретении N-phos-олигомеры по сравнению с ЕР 2041161-олигомерами обладают более высокой способностью к связыванию с белками плазмы крови (см. пример 15); что является преимуществом с точки зрения биодоступности и удлиняет время полужизни.
Кроме того, предлагаемые в изобретении N-phos-олигомеры по сравнению с ЕР 2041161-олигомерами обладают значительно более высокой не зависящей от последовательности растворимостью в воде (см. пример 16).
Помимо этого было установлено, что предлагаемые в изобретении N-phos-олигомеры обладают более высокой способностью к связыванию с ДНК (более высокая температура плавления, см. пример 17).
Предлагаемые в изобретении N-phos-олигомеры характеризуются также неожиданно значительно более сильным воздействием на модуляцию генной экспрессии по сравнению с ЕР 2041161-олигомерами. Более сильное воздействие на модуляцию генной экспрессии проявляется, например, в понижающей регуляции NFkB в клетках HeLa (см. пример 18), а также в модуляции сайта сплайсинга гена TNFR2 в клетках ТНР1 (см. пример 19).
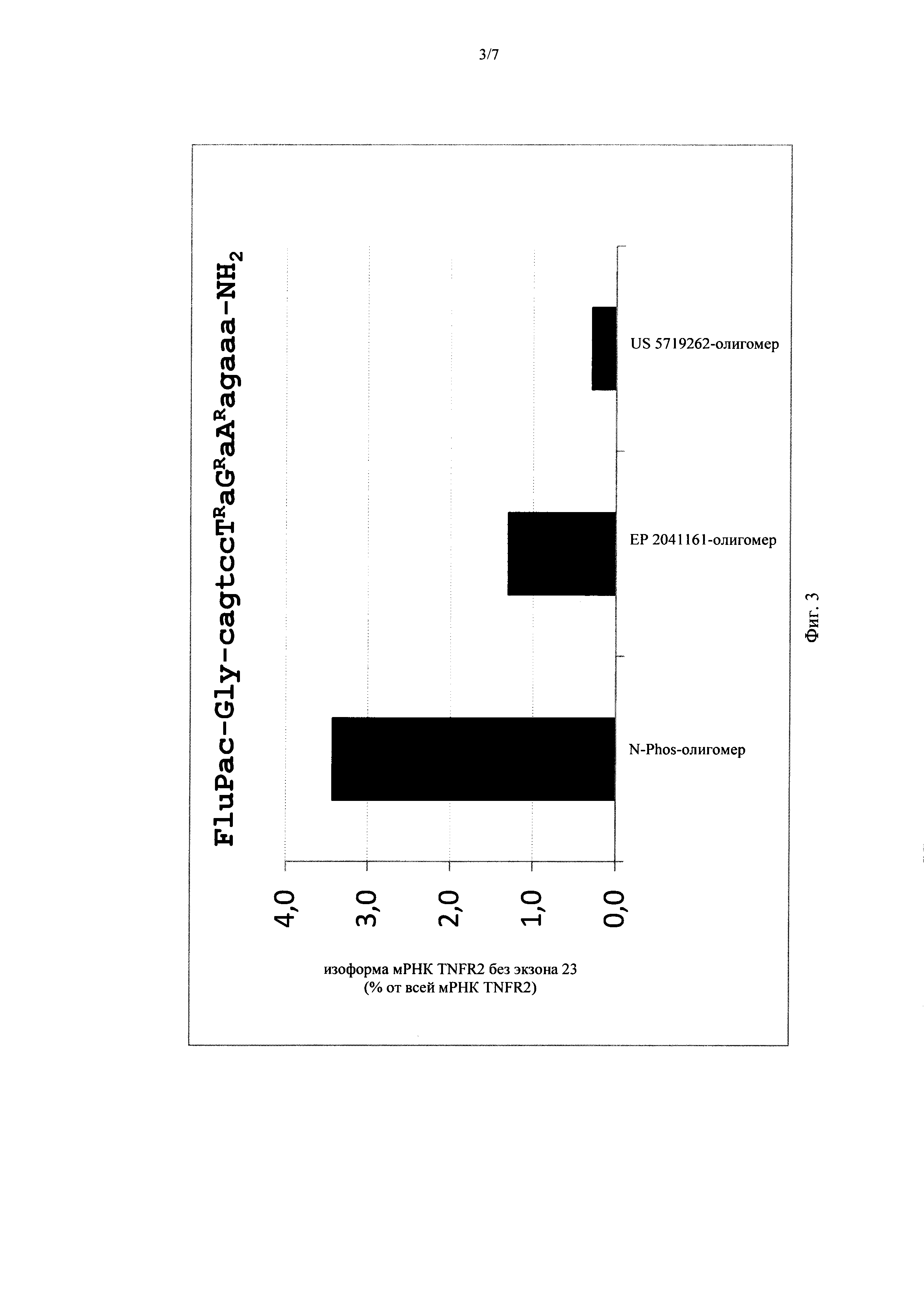
Сравнение эффективности предлагаемого в изобретении N-phos-олигомера с ЕР 2041161 -олигомером и US 5719262-олигомером в отношении модуляции сайта сплайсинга мишени TNFR2 в клетках ТНР1 подтвердило, что предлагаемые в изобретении N-phos-олигомеры оказывают значительно большее действие на модуляцию генной экспрессии. US 5719262-олигомер оказался практически неэффективным, что согласуется с полученными R. Corradini с соавторами (Current Topics in Medicinal Chemistry, 11 (12), 2011, cc. 1535-1554) данными о том, что для US 5719262-олигомеров характерна выраженная тенденция к накоплению в клетках в везикулах и поэтому они не находятся в достаточном для оказания антисмыслового действия количестве в области-мишени, т.е. в мРНК в цитозоле или ядре (см. пример 21 и фиг. 3).
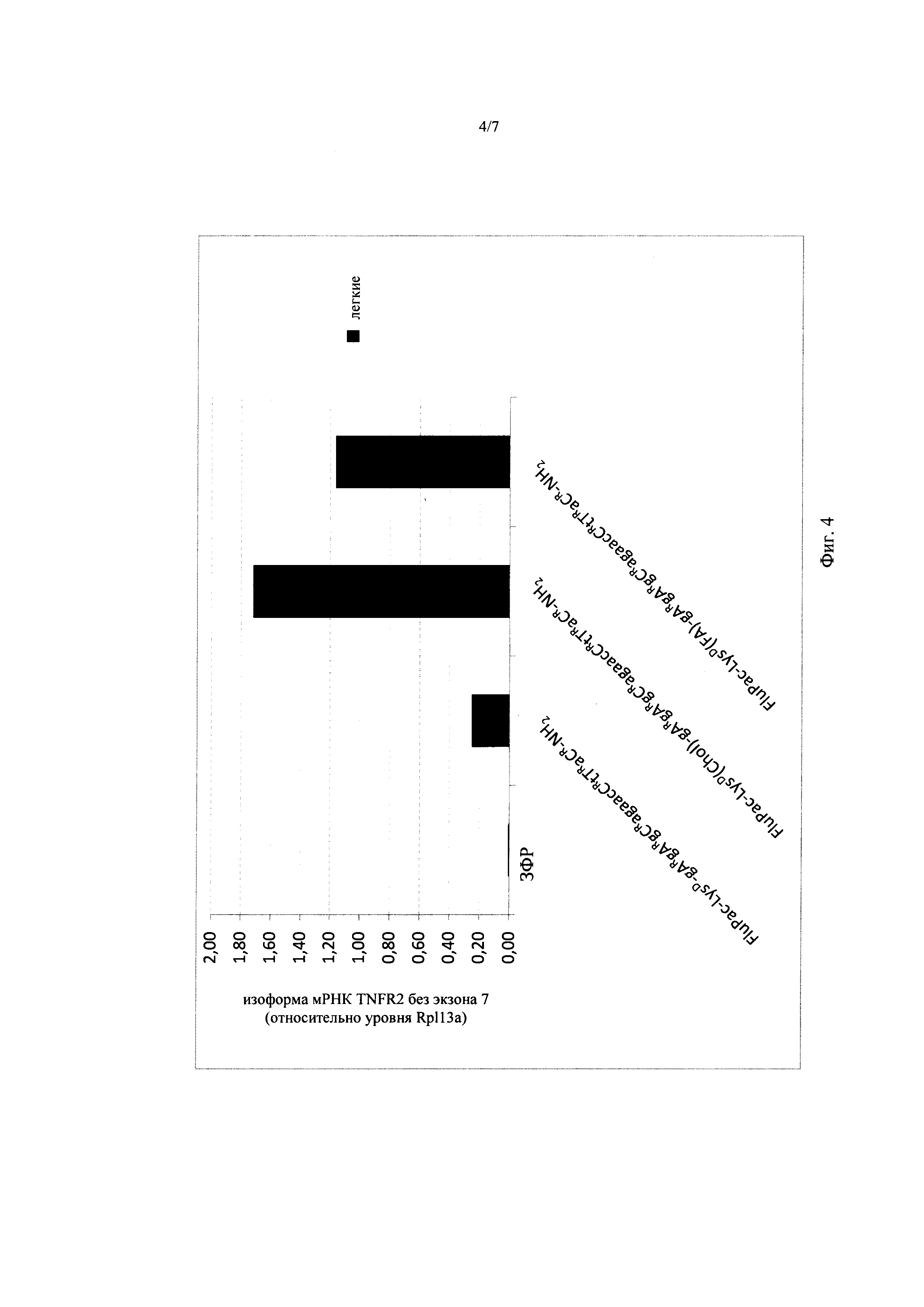
Выраженное воздействие N-phos-олигомеров на модуляцию генной экспрессии также и в живом организме продемонстрировано также на примере модуляции сайта сплайсинга гена TNFR2 в селезенке и в лимфатических узлах мышей (см. пример 20). Для различных предлагаемых в изобретении N-phos-олигомеров оказалось возможным выявить более сильное действие также и в легких (см. пример 22 и фиг. 4, а также пример 23 и фиг. 5), почках (см. пример 23 и фиг. 5, а также пример 24 и фиг. 6), печени (см. пример 23 и фиг. 5) и в мышцах (см. пример 25 и фиг. 7). Например, в почках мыши для предлагаемых в изобретении N-phos-олигомеров продемонстрировано более сильное вплоть до 12,6 раз воздействие на модуляцию сайта сплайсинга гена TNFR2 по сравнению с воздействием ЕР 2041161-олигомеров (см. пример 24 и фиг. 6). В мышцах мышей оказалось возможным выявить более сильное воздействие предлагаемых в изобретении N-phos-олигомеров на модуляцию генной экспрессии гена дистрофина (пропуск экзона 23) (см. пример 25 и фиг. 7).
Мишени NF-каппаВ и TNFR2 играют важную роль в пути трансдукции сигнала TNF-α в иммунных клетках. Важными органами иммунной системы являются селезенка и лимфатические узлы. Таким образом, предлагаемые в изобретении соединения (N-phos-олигомеры) пригодны для терапевтического применения при опосредуемых иммунной системой заболеваниях, таких, например, как воспалительные заболевания, аутоиммунные заболевания или рак.
Предлагаемые в изобретении мономеры общей формулы (I) можно получать с помощью реакций, известных специалисту в данной области. Например, предлагаемый в изобретении мономер общей формулы (I), в котором асимметричный центр (#) имеет R-конфигурацию и R3 представляет собой защитную группу Cbz, можно получать согласно следующей схеме синтеза (более подробное описание представлено в примерах 1-10):
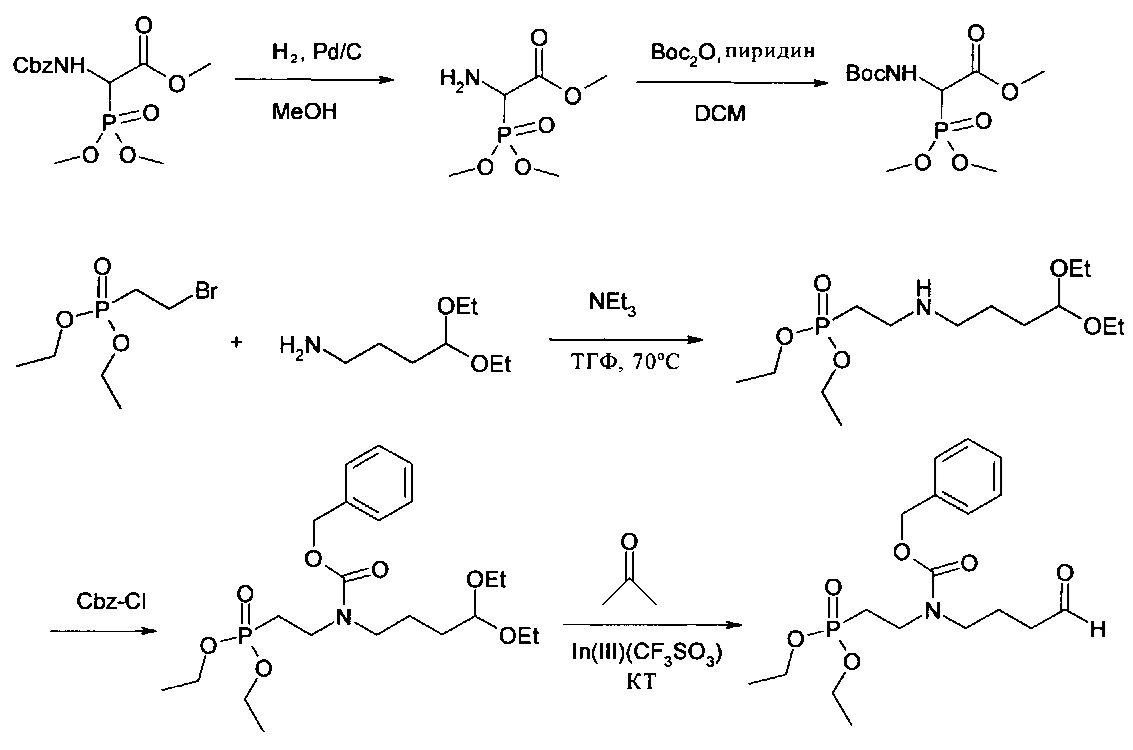
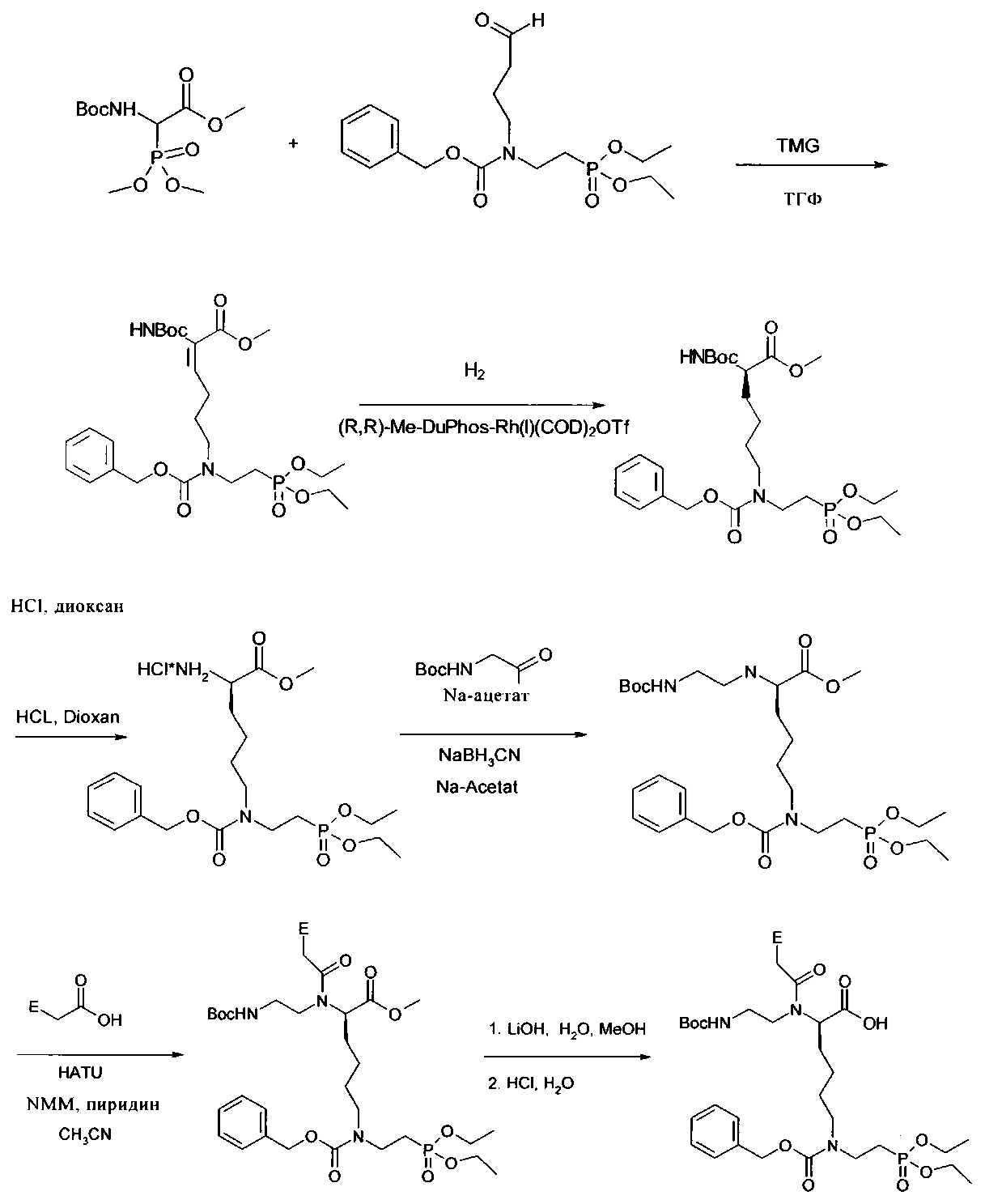
Для получения предлагаемого в изобретении мономера общей формулы (I) (в настоящем описании обозначен также как N-phos-мономер) с S-конфигурацией в асимметричном центре (#) в процессе гидрирования вместо катализатора (R,R)-Me-DuPhos-Rh(I)(OD)2Otf применяют катализатор (S,S)-Me-DuPhos-Rh(I)(COD)2OTf.
Предлагаемые в изобретении олигомерные соединения общей формулы (III) или (VI), можно получать, например, с помощью описанных в литературе методов путем осуществления известным способом реакции с использованием предлагаемых в изобретении мономеров общей формулы (I), или при необходимости других мономеров ПНК или аминокислот (см., например, L. Christensen, R. Fitzpatrick, В. Gildea, K.Н. Petersen, H.F. Hansen, Т. Koch, M. Egholm, О. Buchardt, P.E. Nielsen, J. Coull, R.H. Berg, J. Pept. Sci. 3, 1995, cc. 175-183; T. Koch, H.F. Hansen, P. Andersen, T. Larsen, H.G. Batz, K. Otteson,
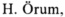
Описание чертежей
На чертежах показано:
на фиг. 1 - биодоступность меченного3Н N-phos-олигомера, предлагаемого в изобретении, а также меченного3Н ЕР 2041161-олигомера в различных тканях в течение 14-дневного периода времени. Как продемонстрировано на чертеже, биодоступность меченного3Н N-phos-олигомера во всех тканях была выше биодоступности меченного3Н ЕР 2041161-олигомера в течение 14-дневного периода времени в 1,7-4,6 раза;
на фиг. 2 - время полужизни меченного3Н N-phos-олигомера, предлагаемого в изобретении, а также меченного3Н ЕР 2041161-олигомера в течение 14-дневного периода времени. На фиг. 2 продемонстрировано, что время полужизни меченного3Н N-phos-олигомера превышает время полужизни меченного3Н ЕР 2041161-олигомера в течение 14-дневного периода времени в большинстве тканей, а в селезенке даже в 2 раза;
на фиг. 3 - сравнение эффективности предлагаемого в изобретении N-phos-олигомера, ЕР 2041161-олигомера и US 5719262-олигомера в отношении модуляции сайта сплайсинга мишени TNFR2 (пропуск экзона 7) в клетках ТНР1. На фиг. 3 продемонстрировано, что N-phos-олигомер оказывает в 2,6 раза более сильное воздействие на модуляцию сайта сплайсинга мишени TNFR2 в клетках ТНР1 по сравнению с ЕР 2041161-олигомером, в то время как модуляция мишени TNFR2 в клетках ТНР1 US 5719262-олигомером практически равна нулю;
на фиг. 4 - воздействие предлагаемых в изобретении N-phos-олигомеров с различными радикалами U на модуляцию сайта сплайсинга мишени TNFR2 (пропуск экзона 7) в легких мышей. На фиг. 4 продемонстрировано, что при применении предлагаемых в изобретении N-phos-олигомеров формулы (VI), содержащих радикал U общей формулы VII и группу формулы IXc (дериватизация холестерином) или IXd (дериватизация фолиевой кислотой) в качестве R46, повышает воздействие на генную экспрессию при модуляции сайта сплайсинга в 560 раз (дериватизация холестерином) или в 378 раз (дериватизация фолиевой кислотой) по сравнению с ЗФР, применяемым в качестве отрицательного контроля;
на фиг. 5 - воздействие предлагаемых в изобретении N-phos-олигомеров N-Phos 23-1, N-Phos 23-2, N-Phos 23-3 и N-Phos 23-4 на модуляцию сайта сплайсинга мишени TNFR2 (пропуск экзона 7) в почках, печени и легких мышей. Предлагаемые в изобретении N-Phos-олигомеры N-Phos 23-1, N-Phos 23-2, N-Phos 23-3 и N-Phos 23-4 различались нуклеотидной последовательностью, радикалом U, а также количеством и положением групп общей формулы (IV) и (V) в общей формуле (VI). На фиг. 5 продемонстрировано, что предлагаемые в изобретении N-Phos-олигомеры N-Phos 23-1, N-Phos 23-2, N-Phos 23-3 и N-Phos 23-4 в различных мышиных тканях (почки, печень и легкие) оказывают очень сильное воздействие на генную экспрессию изоформы мРНК без экзона 7. Например, в почках воздействие N-Phos 23-1 в 1983 раза превышало воздействие ЗФР, применяемого в качестве отрицательного контроля;
на фиг. 6 - сравнение эффективности предлагаемых в изобретении N-Phos-олигомеров и ЕР 2041161-олигомеров в отношении модуляции сайта сплайсинга мишени TNFR2 (пропуск экзона 7) в почках мышей. Протестированные олигомеры отличались друг от друга, во-первых, суммой всех повторяющихся звеньев Yd, Zf, Yg и Zj (15 или 14), и, во-вторых, количеством и положением групп общей формулы (IV) и (V). На фиг. 6 продемонстрировано, что воздействие N-Phos-олигомеров на генную экспрессию изоформы мРНК без экзона 7 при непосредственном сравнении с ЕР 2041161-олигомерами было в 12,6 или 6,7 раз сильнее;
на фиг. 7 - воздействие in vivo предлагаемых в изобретении N-Phos-олигомеров, содержащих 20 структурных элементов (сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj общей формулы (VI) равна 19) на модуляцию сайта сплайсинга мишени дистрофина (пропуск экзона 23) в мышце мышей линии mdx. На фиг. 7 продемонстрировано, что предлагаемый в изобретении N-Phos-олигомер даже по данным кратковременного эксперимента в течение 15 дней с осуществлением только 3 инъекций в мышцу оказывал в 9 раз более сильное воздействие на генную экспрессию изоформы мРНК без экзона 23 по сравнению с обработанной ЗФР контрольной группой.
Примеры
Пример 1: Получение соединения 1
Описание: 66,52 г (200 ммолей) метилового эфира 2-N-Cbz-амино-2-(диметоксифосфорил)уксусной кислоты в 300 мл метанола смешивали с 2,13 г Pd/C 10% (соответствует 1 мол. % Pd) и перемешивали при давлении водорода 2 бара в течение 24 ч при комнатной температуре. Катализатор отфильтровывали через целит и затем из фильтрата выпаривали растворитель. В результате получали продукт в виде масла светло-желтого цвета, которое при выстаивании превращалось в воскоподобное твердое вещество.
Выход: 39 г, 99%.1Н-ЯМР (ДМСО-d6): 4,01 (d, 1Н), 3,66-3,73 (m, 9Н), 2,4-2,5 (s, br, 2Н).31Р-ЯМР (ДМСО-d6): 23,6 част./млн.
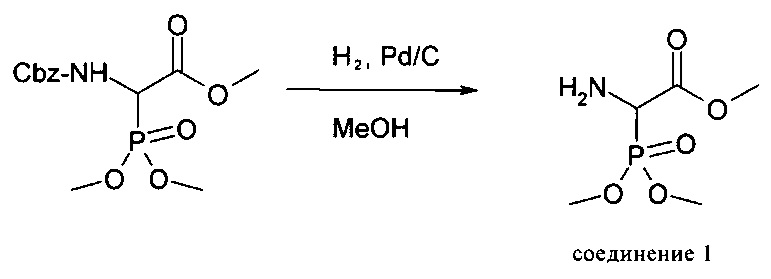
Пример 2: Получение соединения 2
Описание: 39 г (198 ммолей, 1 экв.) соединения 1 растворяли в 1000 мл дихлорметана. Затем добавляли 56,178 г (257 ммолей, 1,3 экв.) Вос2О и 16,1 мл (198 ммолей, 1 экв.) пиридина. Смесь перемешивали в течение 48 ч при комнатной температуре. Растворитель удаляли на роторном испарителе, остаток вносили в уксусный эфир и промывали 5%-ным раствором лимонной кислоты, насыщенным раствором карбоната натрия и насыщенным соляным раствором. Затем сушили с использованием сульфата магния и упаривали. Оставшийся продукт очищали с помощью экспресс-хроматографии (силикагель, гексан / уксусный эфир, 1:5). В результате получали продукт в виде масла желтого цвета.
Выход: 43,5 г (146 ммолей, 74%).1H-ЯМР (CDCl3): 5,35 (d, br, 1H), 4,88 (dd, 1H), 3,80-3,86 (m, 9H), 1,46 (s, 9H).31Р-ЯМР (CDCl3): 20.1 част./млн.
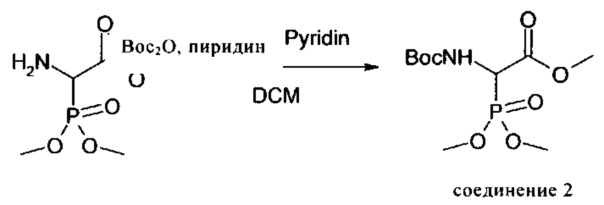
Пример 3: Получение соединения 3
Описание: 50 г (319 ммолей, 1 экв.) диэтилацеталя 4-аминобутиральдегида растворяли при комнатной температуре в 200 мл ТГФ и 51,5 мл (372 ммоля, 1,2 экв.) триэтиламина, затем по каплям добавляли 75,99 г (310 ммолей, 1 экв.) диэтил-2-бромметилфосфоната. Затем раствор нагревали до 70°C и перемешивали при этой температуре в течение 24 ч. Растворитель удаляли на роторном испарителе. Остаток интенсивно перемешивали с простым эфиром и отфильтровывали. Оставшийся при этом твердый продукт еще дважды экстрагировали с помощью простого эфира. Полученные с помощью простого эфира фильтраты объединяли и упаривали. В результате получали продукт в виде масла желтого цвета, которое применяли в следующей реакции без дополнительной очистки.
1Н-ЯМР (ДМСО-d6): 4,45 (t, 1Н); 3,98 (m, 4Н); 3,54 и 3,42 (2m, 2×2Н); 2,5-2,8 (m, 4Н); 1,90 (m, 2Н); 1,25-1,60 (m, 4Н); 1,22 (t, 6Н); 1,10 (2t, 6Н).31Р-ЯМР (ДМСО-d6): 30 част./млн.
Полученный на первой стадии промежуточный продукт растворяли в 400 мл ТГФ, смешивали с 85,94 мл (620 ммолей, 2 экв.) триэтиламина и охлаждали до 0°C. Затем добавляли по каплям 66,11 мл (465 ммолей, 1,5 экв.) бензилхлорформиата, прекращали охлаждение и осуществляли перемешивание в течение ночи при комнатной температуре. Затем реакционную смесь нейтрализовали с помощью 1М соляной кислоты и выпаривали растворитель. Остаток перемешивали с простым эфиром и выдерживали в течение ночи в холодильнике. Осадившийся при этом твердый продукт отделяли и еще дважды тщательно промывали простым эфиром. Эфирные растворы объединяли и упаривали. Остаток очищали с помощью хроматографии на силикагелевой колонке. При этом сначала элюировали все примеси с использованием смеси гексан : уксусный эфир, 2:1, а затем продукт с использованием уксусного эфира.
Выход: 85,752 г (60,2%) бесцветного вязкого масла.1Н-ЯМР (ДМСО-d6): 7,34 (m, 5Н); 5,07 (s, 2Н); 4,44 (m, 1Н); 3,94 (m, 4Н); 3,6-3,2 (m, 8Н); 2,02 (m, 2Н); 1,46 (m, 4Н); 1,19 (m, 6Н); 1,09 (m, 6Н).31Р-ЯМР (ДМСО-d6): 28,93 и 28,57 част./млн.
Пример 4: Получение соединения 4
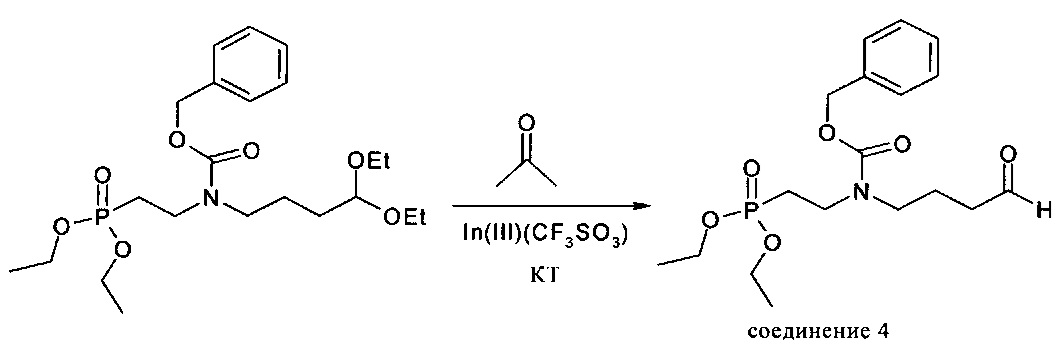
Описание: 80 г соединения 3 в 1000 мл ацетона перемешивали с 0,98 г (1,74 ммоля, 1 мол. %) трифлата индия (III) при комнатной температуре. Мониторинг прохождения реакции осуществляли с помощью ЖХВР (RP18, метанол / вода 80:20). Периодически растворитель выпаривали и заменяли свежим ацетоном. Это осуществляли до тех пор, пока реакция не завершалась более чем на 95%. Затем растворитель выпаривали. Субстанцию, представляющую собой масло желтого цвета, кратковременно сушили в глубоком вакууме и сразу же применяли на следующей стадии.
1Н-ЯМР (ДМСО-d6): 9,62 (d, 1Н); 7,36 (m, 5Н); 5,07 (s, 2Н); 3,94 (m, 4Н); 3,37 и 3,24 (2m, 4Н); 2,41 (m, 2Н), 2,04 (m, 2Н); 1,73 (m, 2Н); 1,22 (t, 6Н).31Р-ЯМР (ДМСО-d6): 29,51, 29,14 част./млн
Пример 5: Получение соединения 5

Описание: В атмосфере аргона охлаждали до -70°C 29,438 г соединения 2 в 350 мл ТГФ, затем по каплям добавляли 12,96 мл (103 ммоля, 1,04 экв.) N,N,N'N'-тетраметилгуанидина. После перемешивания в течение 10 мин при -70°C по каплям добавляли 38,170 г (99,04 ммоля, 1 экв.) соединения 4 в 60 мл ТГФ. Перемешивание продолжали еще в течение 1 ч при -70°C, затем продукту давали медленно нагреться до комнатной температуры и перемешивали в течение ночи.
Растворитель выпаривали. Остаток растворяли примерно в 400 мл уксусного эфира, промывали дважды 5%-ным раствором лимонной кислоты и один раз насыщенным раствором NaCl, сушили с использованием сульфата магния и упаривали. В результате получали продукт в виде масла желтого цвета.
Выход: 53,228 г, 95,6 ммолей, 96,5%.1H-ЯМР (CDCl3): 7,33 (s, 5Н); 6,48 (t, 1Н); 5,13 (s, 2H); 4,08 (m, 4H); 3,81 и 3,76 (2s, все 3Н); 3,49 (m, 2Н); 3,30 (t, 2Н); 2,21 (m, 2Н); 2,04 (m, 2Н); 1,71 (m, 2Н); 1,48 и 1,46 (2s, все 9Н); 1,28 (m, 6Н).31Р-ЯМР (CDCl3): 29,72 и 29.15 част./млн.
Пример 6: Получение соединения 6

Описание: В реакционном сосуде аппарата Парра для гидрирования растворяли в атмосфере аргона 450 мг (0,96 ммоля, 1 мол. %) трифторметансульфоната бис(1,5-циклооктадиенил)родия (I) и 306 мг (0,96 ммоля, 1 мол. %) (-)-1,2-бис-[(2R,5R)-2,5-диметилфосфолано]бензола примерно в 50 мл метанола, затем добавляли 53,228 г (96 ммолей) соединения 5, растворенного в 250 мл метанола. Сосуд устанавливали в аппарат для гидрирования, трижды вакуумировали и заполняли водородом. Наконец, устанавливали давление водорода на уровне 4,5-5 бар и сосуд перемешивали в течение 24 ч.
Выпускали избыток водорода, сосуд вынимали и реакционный раствор фильтровали через целит. Фильтрат упаривали и сушили в вакууме. В результате получали продукт в виде масла светло-коричневого цвета.
Выход: 53,712 г, 96 ммолей, количественый.1H-ЯМР (CDCl3): 7,35 (m, 5Н); 6,48 и 6,35 (2m, все 1Н); 5,13 (s, 2Н); 4,27 (m, 1Н); 4,07 (m, 4Н); 3,73 (s, 3Н); 3,48 (m, 2Н); 3,27 (m, 2Н); 2,25-1,95 (m, 4Н); 1,75-1,55 (m, 4Н); 1,45 (s, 9Н); 1,28 (m, 6Н).31Р-ЯМР (CDCl3): 29,78 и 29.23 част./млн.
Пример 7: Получение соединения 7

Описание: К 53,94 г (96,6 ммоля) соединения 6 в 120 мл ТГФ добавляли по каплям 240 мл 4М раствора HCl в диоксане. Затем осуществляли перемешивание при комнатной температуре. Мониторинг протекания реакции осуществляли с помощью ЖХВР (метанол / вода 70:30). Через 2-3 ч завершалось отщепление Boc. Растворитель выпаривали и остаток промывали простым диэтиловым эфиром и сушили. В результате получали продукт в виде вязкого масла желтого цвета.
Выход: 47,83 г, количественный.1Н-ЯМР (ДМСО-d6): 8,64 (s, br, 2Н); 7,36 (m, 5Н); 5,07 (s, 2Н); 3,97 (m, 5Н); 3,73 (s, 3Н); 3,38 (m, 2Н); 3,22 (m, 2Н); 2,04 (m, 2Н); 1,80 (m, 2Н); 1,48-1,35 (m, 4Н); 1,22 (m, 6Н).31Р-ЯМР (ДМСО-d6): 29,012 и 28,62 част./млн.
Пример 8: Получение соединения 8

Описание: 16,65 г (29,8 ммоля, 1 экв.) соединения 7 в 100 мл метанола охлаждали до 0°C и смешивали с 5,414 г (66 ммолей, 2,2 экв.) ацетата натрия. Затем добавляли по каплям 5,218 г (32,8 ммоля, 1,1 экв.) N-Boc-аминоацетальдегида в 150 мл метанола. Перемешивание продолжали в течение 1 ч при 0°C, затем порциями добавляли 2,074 г (33 ммоля, 1,1 экв.) цианборогидрида натрия. После ослабления образования газа охлаждающую баню удаляли и осуществляли перемешивание в течение ночи при комнатной температуре.
Растворитель удаляли на роторном испарителе, остаток растворяли в уксусном эфире и промывали раствором бикарбоната натрия (полунасыщенным), а также насыщенным раствором хлорида натрия. Органическую фазу сушили с использованием сульфата магния, упаривали и сушили в вакууме. Неочищенный продукт очищали на силикагелевой колонке (дихлорметан/метанол, 5 об. %). В результате получали продукт в виде вязкого масла желтого цвета.
Выход: 15,379 г (25,6 ммоля, 86%).1H-ЯМР (ДМСО-d6): 7,36 (m, 5Н); 6,69 (m, 1H); 5,06 (s, 2Н); 4,02 (m, 4Н); 3,4-3,15 (3m, все 7Н); 2,95 (m, 1Н); 2,38 (m, 1Н); 2,01 (m, 2Н); 1,60-1,30 (m, 6Н); 1,38 (s, 9Н); 1,20 (m, 6Н).31Р-ЯМР (ДМСО-d6): 29,00 и 28.60 част./млн.
Пример 9: Получение соединения 9
Е=Cbz-A, Cbz-C, Cbz-G, Т

Описание: 20,25 ммоля (1,5 экв.) производных уксусной кислоты (N6-Cbz-аденин-9-ил-уксусная кислота, N4-Cbz-цитозин-1-ил-уксусная кислота, N2-Cbz-гуанин-9-ил-уксусная кислота или тимидин-1-ил-уксусная кислота) в 70 мл ацетонитрила, 20 мл пиридина и 4,5 мл (40,5 ммоля, 3 экв.) N-метилморфолина охлаждали до 0°C и смешивали с 7,186 г (18,9 ммоля, 1,4 экв.) HATU. Охлаждение прекращали и осуществляли перемешивание в течение 10 мин при комнатной температуре. Затем смесь медленно добавляли к 8,1 г (13,5 ммоля, 1 экв.) соединения 8, растворенного в 50 мл ацетонитрила. Осуществляли перемешивание в течение 1 ч при комнатной температуре, затем в течение ночи при 40°C.
Смесь снова охлаждали до комнатной температуры и разбавляли с помощью 20 мл воды. После перемешивания в течение 30 мин растворитель выпаривали. Затем остаток еще два раза упаривали с дихлорметаном для возможно большего удаления пиридина. Затем остаток снова растворяли в дихлорметане и выдерживали в течение ночи в холодильнике. Осадившийся при этом твердый продукт отфильтровывали, фильтрат упаривали и очищали с помощью экспресс-хроматографии (силикагель, 2-5% метанола в дихлорметане), в результате чего получали продукт в виде пены светло-желтого цвета.
Соединение 9, Е=Cbz-A:
Выход: 62%.1H-ЯМР (ДМСО-d6): 10,65 (s, 1H); 8,59 (s, 1Н); 8,35 и 8,29 (2s, все 1Н); 1,47-7,24 (m, 10Н); 6,90 и 6,72 (2m, все 1Н); 5,42-5,00 (m, 6Н); 3,92 (m, 5Н); 3,56 и 3,49 (2s, все 3Н); 3,50-2,95 (m, 8Н); 2,12-1,30 (m, 8Н); 1,38 и 1,35 (2s, все 9Н); 1,16 (m, 6Н);31Р-ЯМР (ДМСО-d6): 29,52 и 29,16 част./млн.
Соединение 9, Е=Cbz-C:
Выход: 59%.1H-ЯМР (ДМСО-d6): 10,77 (s, br, 1Н); 7,94 (d, 1H), 7,42-7,33 (m, 10H); 7,01 (d, 1H); 6,91 и 6,80 (2m, все 1H); 5,19 (s, 2H); 5,07 (s, 2H); 4,80-4,6 (m, 2H); 4,36 (m, 1H); 3,94 (m, 4H); 3,7 и 3,59 (2s, все 3Н); 3,5-2,8 (m, 8H); 2,05-1,3 (m, 8H); 1,38 и 1,37 (2s, все 9H); 1,19 (m, 6H).31Р-ЯМР (ДМСО-d6): 29,02 и 28,63 част./млн.
Соединение 9, Е=Cbz-G:
Выход: 77,5%.1H-ЯМР (ДМСО-d6): 11,33 (s, br, 2Н); 7,85 (s, 1H); 7,45-7,30 (m, 10 H); 6,99 и 6,81 (2m, все 1Н); 5,26 (s, 2H); 5,06 (m, 4H); 4,58 и 4,31 (2m, все 1Н); 3,934 (m, 4H); 3,56 (s, 3Н); 3,31-3,19 (m, 8H); 2,21-1,30 (m, 8H); 1,36 и 1,35 (2s, все 9Н); 1,19 (m, 6Н).31Р-ЯМР (ДМСО-d6): 28,98 и 28,59 част./млн.
Соединение 9, Е=Т:
Выход: 78%1Н-ЯМР (ДМСО-d6): 11,26 (s, br, 1Н); 7,35 (m, 6H); 6,90 и 6,79 (2m, все 1H); 5,07 (s, 2H); 4,63-4,49 (m, 2H); 4,31 (m, 1H); 3,94 (m, 4H); 3,70 и 3,58 (2s, все 3Н); 3,46-3,12 (m, 8H); 2,11-1,30 (m, 8H); 1,76 (s, 3H); 1,38 и 1,35 (2s, все 9H); 1,19 (m, 6H).31Р-ЯМР (ДМСО-d6): 29,61 и 29,25 част./млн.
Пример 10: Получение соединения 10: Е=Cbz-A, Cbz-C, Cbz-G, Т
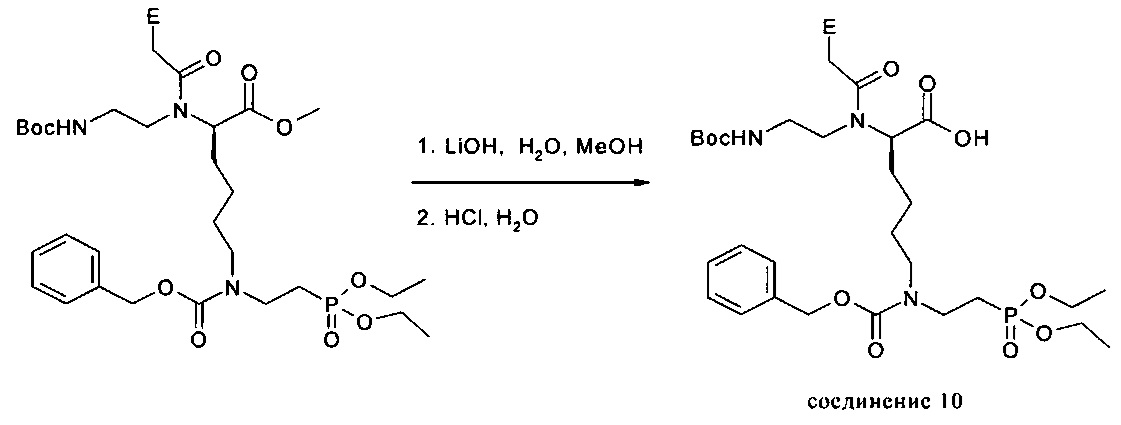
Описание: 2,31 ммоля соединения 9 (Е=Cbz-A, Cbz-C, Cbz-G или Т) охлаждали в 12 мл смеси вода / метанол, 1:1, до 0°, затем по каплям добавляли 12 мл 2н. раствора NaOH. Осуществляли перемешивание в течение 15 мин при 0°C, затем при комнатной температуре до завершения омыления по данным DC-контроля (силикагель, 10% метанола в дихлорметане) (продолжительность: примерно 1 ч). Затем осуществляли разбавление с использованием небольшого количества воды и удаляли путем кратковременного центрифугирования любые присутствующие нерастворившиеся субстанции. Прозрачный раствор разбавляли водой до объема примерно 300 мл и снова охлаждали до 0°C. Значение рН доводили до 2,5 с помощью 1М раствора HCl, в результате чего выпадал осадок в виде твердого вещества белого цвета. Раствор экстрагировали дихлорметаном (примерно 5 раз) до тех пор, пока продукт не переставал переходить в органическую фазу (DC-контроль). Объединенные органические фазы сушили с использованием сульфата магния, упаривали и сушили в вакууме. В результате получали продукт в виде твердого вещества светло-желтого цвета.
Соединение 10, Е=Cbz-A:
Выход: 72%.1Н-ЯМР (ДМСО-d6): 10,68 (s, br, 1Н); 8,59 (s, br, 1H); 8,35 и 8,29 (2s, br, все 1H); 7,49-7,33 (m, 10 H); 6,98 и 6,85 (2m, все 1H); 5,35-5,04 (m 6H); 4,62 и 4,22 (2m, все 1H,); 3,93 (m, 4H,); 3,50-2,85 (m, 8H); 2,20-1,30 (m, 8H); 1,39 и 1,36 (2s, все 9H); 1,17 (m, 6H).31Р-ЯМР (ДМСО-d6): 29,55 и 29,19 част./млн.
Соединение 10, Е=Cbz-C:
Выход: 59%.1H-ЯМР (ДМСО-d6): 7,95 (d, 1Н); 7,42-7,28 (m, 10Н); 7,01 (d, 1H); 6,90 и 6,85 (2m, все 1Н); 5,19 (s, 2Н); 5,07 (s, 2Н); 4,81-4,65 (m, 2Н); 4,33 (m, 1Н); 3,933 (m, 4Н); 3,45-3,15 (m, 8Н); 2,15-1,30 (m, 8Н); 1,38 и 1,35 (2s, все 9Н); 1,20 (m, 6Н).31Р-ЯМР (ДМСО-d6): 29,03 и 28,66 част./млн.
Соединение 10, Е=Cbz-G:
Выход: 62%.1Н-ЯМР (ДМСО-d6): 11,43 (s, br, 1Н); 11,33 (s, br, 1H); 7,85 (s, 1H); 7,44-7,31 (m, 10H); 6,97 и 6,81 (2m, все 1H); 5,24 (s, 2H); 5,10-5,00 (m, 4H); 4,51 и 4,28 (2m, все 1H); 3,91 (m, 4H); 3,52-3,08 (m, 8H); 2,12-1,28 (m, 8H); 1,36 и 1,34 (2s, все 9H); 1,15 (m, 6H).31Р-ЯМР (ДМСО-d6): 29,61 и 29,21 част./млн.
Соединение 10, Е=Cbz-T:
Выход: 72%.1Н-ЯМР (ДМСО-d6): 11,27 (s, br, 1Н); 7,35 (m, 6H); 6,88 (m, 1H); 5,07 (s, 2H); 4,65-4,48 (m, 2H); 4,37 и 4,38 (2m, все 1H); 3,94 (m, 4H); 3,45-3,17 (m, 8H); 2,11-1,30 (m, 8h); 1,75 (s, 3H); 1,38 и 1,36 (2s, все 9H); 1,19 (m, 6H).31Р-ЯМР (ДМСО-d6): 29,64 и 29,26 част./млн.
Пример 11: Получение предлагаемых в изобретении олигомерных соединений общей формулы (III) или (VI)
Путем последовательного связывания соответствующих соединений общей формулы (I) с мономерными звеньями, выбранными из группы, которая состоит из N-ацетил-N-(2-аминоэтил)глициновых структурных элементов, аминокислот, производных аминокислот и группы B-CH(R48)СООН, с помощью твердофазного пептидного синтеза получали предлагаемые в изобретении олигомерные соединения.
Для простоты представления звеньев Z общей формулы (V) в олигомерных соединениях общей формулы (IV) применяли, например, следующие сокращения: TR, CR, GR, AR, PR, TS, CS, GS, AS и PS. При этом T, С, G, А и P (фенил) в каждом случае обозначает нуклеотидное основание соответствующего мономерного звена, а верхние индексы R или S обозначают R- или S-конфигурацию в асимметричном центре (#) звена Z общей формулы (V).
Мономеры, состоящие из N-ацетил-N-(2-аминоэтил)глициновых структурных элементов, сокращенно обозначали аналогично вышеописанным мономерам общей формулы (V) с тем различием, что вместо заглавных букв для нуклеотидного основания и верхних индексов для конфигурации (например, AR) использовали соответствующие строчные буквы. Например, мономер с С в качестве нуклеотидного основания сокращенно обозначали как с.
Пример 12: Олигомерные соединения общей формулы (III) или (VI) с 4-фторфенилацетатным заместителем в качестве группы B-CH(R48)СООН:
Для получения предлагаемых в изобретении соединений с помощью твердофазного пептидного синтеза применяли следующий протокол синтеза:
Стадия 1: Предварительная пропитка 10 мг смолы (смола МВНА, фирма Novabiochem, с низкой загрузкой, составляющей примерно 0,5-06 ммоля/г) в дихлорметане в течение 3 ч.
Стадия 2: Начало цикла синтеза: 4-кратная промывка дихлорметаном.
Стадия 3: Нейтрализация смолы: 3-кратная промывка дихлорметаном/DIPEA (5%).
Стадия 4: 5-кратная промывка дихлорметаном.
Стадия 5: 5-кратная промывка NMP.
Стадия 6: Предварительная активация в течение 1 мин 4 эквивалентов соответствующим образом защищенного соединения (соединение общей формулы (I)/мономер ПНК/аминокислота/производное аминокислоты) 3,8 эквивалентами HATU 9 эквивалентами NMM в смеси NMP / пиридин (2:1).
Стадия 7: Взаимодействие активированного защищенного соединения (соединение общей формулы (I)/мономер ПНК/аминокислота/производное аминокислоты) с твердой фазой (1-е сочетание; продолжительность: 60 мин).
Стадия 8: 4-кратная промывка NMP.
Стадия 9: Повторение стадий 6-8 (2-е сочетание).
Стадия 10: Проверка эффективности сочетания с использованием нингидрина (тест Кайзера; если результат теста Кайзера положительный, то следует повторять стадии 6-8 с использованием соответствующим образом защищенного соединения (соединение общей формулы (I)/мономер ПНК/аминокислота/производное аминокислоты).
Стадия 11: После получения отрицательного результата теста Кайзера: 1-кратное кэпирование в течение 10 мин с использованием раствора Ac2O / NMP / пиридин (1:25:25).
Стадия 12: 5-кратная промывка NMP.
Стадия 13: Замена растворителя на дихлорметан: 5-кратная промывка ДХМ.
Стадия 14: Отщепление Boc путем реакции с ТФК / мета-крезолом (95:5). Продолжительность реакции: 2× каждый раз по 3 мин.
Стадия 15: 5-кратная промывка ДХМ.
Стадия 16: Замена растворителя на NMP. 5-кратная промывка NMP.
Стадия 17: Повторение цикла синтеза (стадии 6-16) до сочетания с последним соответствующим образом защищенным соединением (соединение общей формулы (I)/мономер ПНК/аминокислота/производное аминокислоты). Затем при необходимости повторение цикла синтеза (стадии 6-16) до сочетания с последним соответствующим образом защищенным соединением (соединение общей формулы (I)/мономер ПНК/аминокислота/производное аминокислоты).
Стадия 18: 5-кратная промывка дихлорметаном.
Стадия 19: Отщепление Boc путем реакции с ТФК / мета-крезолом (95:5). Продолжительность реакции: 2×, каждый раз по 3 мин.
Стадия 20: 5-кратная промывка дихлорметаном.
Стадия 21: 5-кратная промывка NMP.
Стадия 22: Предварительная активация в течение 1 мин 6 эквивалентов 4-фторфенилуксусной кислоты с использованием 5,7 эквивалента HATU 13 эквивалентов NMM в смеси NMP / пиридин (2:1).
Стадия 23: Взаимодействие активированной 4-фторфенилуксусной кислоты с твердой фазой (продолжительность: 60 мин).
Стадия 24: 4-кратная промывка NMP.
Стадия 25: Повторение при необходимости стадий 23-24 (2-е сочетание).
Стадия 26: 5-кратная промывка дихлорметаном.
Стадия 27: для сушки: 5-кратная промывка простым диэтиловым эфиром.
Получали соединения общей формулы (III) или (VI), которые связаны на С-конце со смолой.
Отщепление предлагаемого в изобретении соединения общей формулы (III) или (VI) от смолы:
Смолу с предлагаемым в изобретении соединением встряхивали в растворе, содержащем трифторуксусную кислоту, трифторметансульфоновую кислоту, тиоанизол и этандитиол (85/12,5/1,7/0,8, об./об./об./об.) в течение 2 ч. Жидкую фазу отфильтровывали и неочищенный продукт осаждали путем добавления холодного простого эфира. Неочищенный продукт обессоливали с помощью гель-фильтрации. Неочищенный продукт очищали с помощью препаративной ЖХВР на RP-C18-колонке с использованием смеси метанол/вода. В результате получали предлагаемое в изобретении соединение в виде бесцветного твердого вещества с выходом примерно 50%. Массу предлагаемого в изобретении соединения характеризовали с помощью ЖХВР-ESI.
Пример 13: Примеры полученных соединений общей формулы (III) или (VI)
Путем осуществления общей процедуры синтеза, описанной в примере 12, получали олигомерные соединения общей формулы (III) или общей формулы (VI), которые сокращенно обозначали следующим образом:
Например, если получали предлагаемое в изобретении олигомерное соединение, состоящее из мономеров общей формулы (I) с асимметричным центром с R-конфигурацией, а также других мономеров ПНК и аминокислоты L-лизина (сокращение: LysL), и на последней стадии осуществляли кэпирование α-аминофункции лизина ацетилом, и затем отщепляли от смолы олигомерное соединение в виде первичного амида, то его сокращенно обозначали как Ас-LysL-cCRgGRgGRtcgcaGRcTRgGR-NH2.
Например, если получали предлагаемое в изобретении олигомерное соединение, состоящее из мономеров общей формулы (I) с асимметричным центром с S-конфигурацией, а также других мономеров ПНК и аминокислоты глицина (сокращение: Gly), и на последней стадии осуществляли кэпирование α-аминофункции глицина фенилацетатом (сокращение: Рас), и затем отщепляли от смолы олигомерное соединение в виде первичного амида, то его сокращенно обозначали как Pac-Gly-agcccTSaacTSgcacTSTSccaTS-NH2.
Например, если получали предлагаемое в изобретении олигомерное соединение, состоящее из мономеров общей формулы (I) с асимметричным центром с R-конфигурацией, а также других мономеров ПНК и аминокислоты D-лизина (сокращение: LysD), и на последней стадии осуществляли кэпирование α-аминофункции лизина 4-фторфенилацетатом (сокращение: FluPac), и затем отщепляли от смолы олигомерное соединение в виде первичного амида, и после этого еще ε-аминофункцию лизина конъюгировали с флуоресцентным красителем ATTO647, то его сокращенно обозначали как FluPac-LysD (ATTO647)-cCRgGRgGRtcgcaGRcTRgGR-NH2.
Примерами других флуоресцентных красителей являются АТТО, MegaRed, Alexa, BODIPY и TAMRA.
Ниже представлены примеры полученных предлагаемых в изобретении соединений общей формулы (IV):


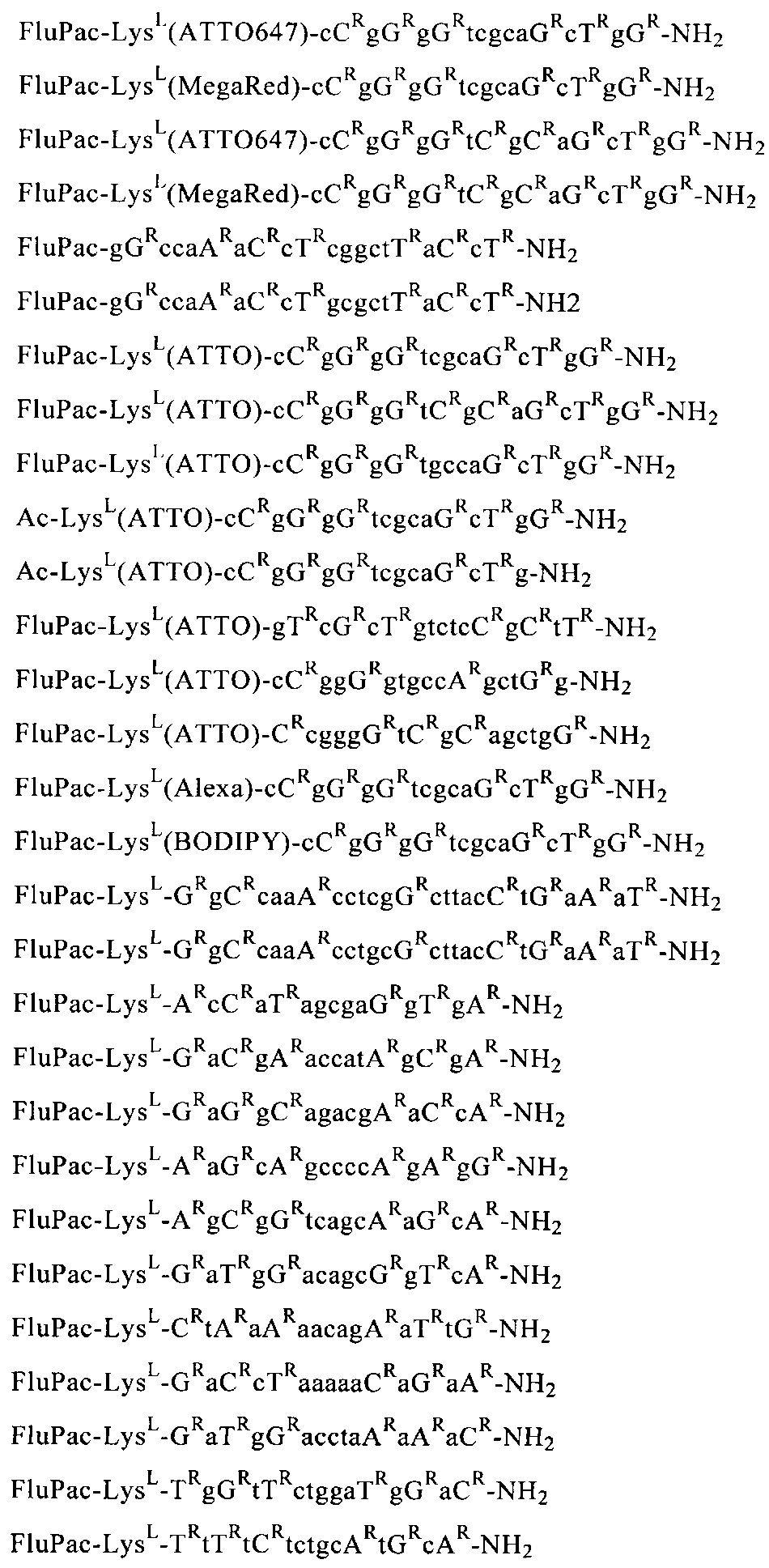


MN обозначает радикал 4-гидрокси-3-нитрофенилацетат
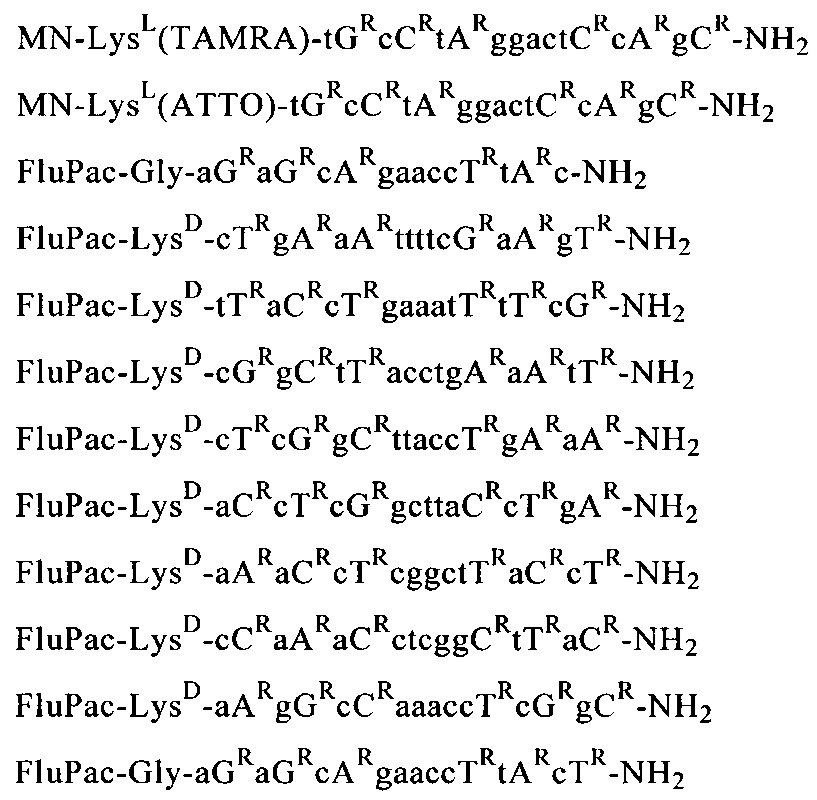


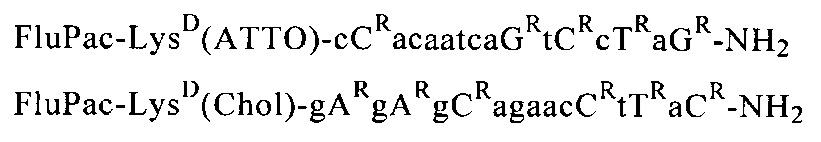
Chol обозначает

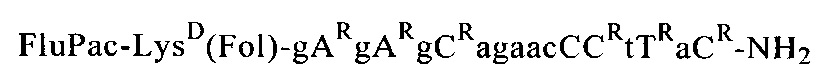
Fol обозначает

Dans обозначает


Пример 14: Улучшенная биодоступность и более продолжительное время полужизни в различных органах/тканях
Меченный3Н N-Phos-олигомер и меченный3Н ЕР 2041161-олигомер растворяли в каждом случае в ЗФР (рН 7,1) и вводили посредством внутривенной болюсной инъекции мышам в концентрации 10 мг/кг. В различные моменты времени (через 20 мин, 1,5, 3, 6, 24 ч, 2 дня, 4 дня, 8 дней и 14 дней) у мышей брали образцы крови, а также изымали 18 различных органов/тканей (почки, печень, селезенку, костный мозг, лимфатические узлы, легкие, толстую кишку, тонкую кишку, поджелудочную железу, мочевой пузырь, сердце, тимус, желудок, мышцу, большой мозг, мозжечок, предстательную железу и кожу) и измеряли концентрацию3Н в соответствующей ткани. Фармакокинетический анализ осуществляли с помощью валидированного профессионального программного обеспечения WinNonlin, версия 4.0.1 (фирма Pharsight Corporation, Маунтин Вью, США). Оценивали в зависимости от времени радиоактивность в соответствующих органах/тканях (среднее значение, полученное для трех животных на одну область, из которой брали образец) без допустимых компартментов для расчета биодоступности (которую выражали в виде площади под кривой) и времени полужизни в органах/тканях.
Было установлено, что биодоступность меченного3Н N-Phos-олигомера на протяжении 14-дневного периода во всех тканях была больше, чем биодоступность меченного3Н ЕР 2041161-олигомера в 1,7-4,6 раза. Результаты представлены на фиг. 1.
Кроме того, было установлено, что время полужизни меченного3Н N-Phos-олигомера на протяжении 14-дневного периода было больше, чем время полужизни меченного3Н ЕР 2041161-олигомера в большинстве тканей, а в селезенке даже превышала ее в 2 раза. Результаты представлены на фиг. 2.
Пример 15: Повышенное связывание с белками плазмы
Связывание с человеческим сывороточным альбумином оценивали на 5 см колонке для ЖХВР фирмы Chromtech (4,0×50 мм, 5 мкм). На этой колонке иммобилизовали человеческий сывороточный альбумин, так что на основе времен удерживания можно определять аффинность связывания с человеческим сывороточным альбумином. В качестве элюента применяли 30% изопроп./ацетат-аммонийный буфер (рН 7).
Константу аффинности рассчитывали согласно инструкциям производителя по следующей формуле:
k'=(tr-tm)/tm,
tr обозначает время удерживания внесенного образца,
tm обозначает время удерживания ацетаминофена
На основе полученного значения рассчитывали связывание Р (в %) с человеческим сывороточным альбумином:
Р=100(k'/(k'+1))
Более высокое значение свидетельствует о более предпочтительном распределении in vivo. В представленной ниже таблице продемонстрировано значительно более сильное по сравнению с ЕР 2041161-олигомером связывание N-Phos-олигомера с сывороточным альбумином.

aN-Phos-олигомер: R1 обозначает -CH2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2
bEP 2041161-олигомер: R1 обозначает -CH2-CH2-CH2-P=O(OEt)2
Пример 16: Повышенная и не зависящая от последовательности растворимость в воде
Отвешивали определенное количество N-Phos-олигомеров и ЕР 2041161-олигомеров и добавляли ЗФР (рН 7,2) в таком количестве, чтобы получить раствор с теоретической концентрацией 100 мкМ. Затем измеряли величины ОП полученных растворов. После этого сравнивали друг с другом величины ОП N-Phos-олигомеров и ЕР 2041161-олигомеров, при этом более высокая величина ОП соответствовала большему количеству растворенных молекул и следовательно более высокой растворимости. В то время как для ЕР 2041161-олигомеров, последовательность которых содержала большее количество гуаниновых и цитозиновых оснований, не удавалось получать 100 мкМ раствор в ЗФР, в котором олигомерные соединения были бы полностью растворены, N-Phos-олигомеры при приготовлении 100 мкМ раствора, напротив, полностью растворялись в ЗФР. В представленной ниже таблице продемонстрировано, что независимо от последовательности растворимость в воде N-Phos-олигомеров оказалась неожиданно значительно выше, чем ЕР 2041161-олигомеров.
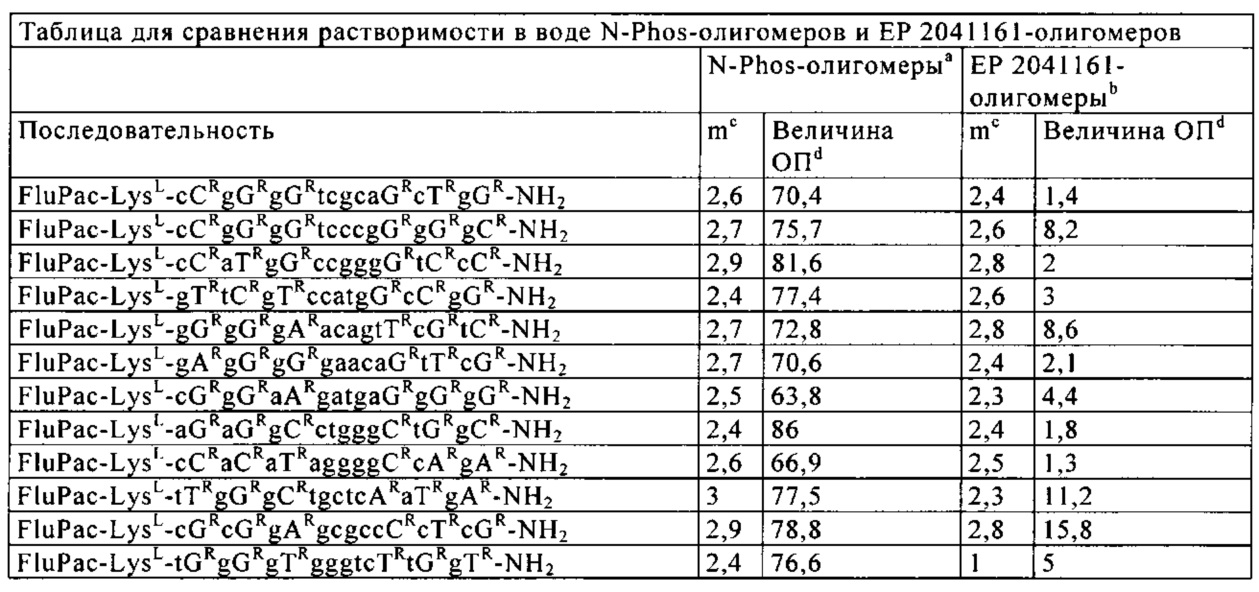
aN-Phos-олигомеры: R1 обозначает -CH2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2
bEP 2041161-олигомеры: R1 обозначает -CH2-CH2-CH2-P=O(OEt)2
cm обозначает навеску [мг]
величина ОПd обозначает измеренную величину ОП после приготовления раствора в ЗФР с теоретической концентрацией 100 мкМ.
Пример 17: Сильное связывание с комплементарной ДНК
N-Phos-олигомер или ЕР 2041161-олигомер и олигомер с комплементарной ДНК-последовательностью растворяли в эквимолярном соотношении в не содержащем магния и кальция физиологическом ЗФР-буфере. Раствор разводили таким образом, чтобы по данным измерений с помощью УФ-спектрофотометра величина ОП была равна 0,8. С помощью нагревательной бани находящиеся в спектрофотометре кюветы постепенно нагревали с шагом 1°C от комнатной температуры до 95°C. После каждого шага увеличения температуры на 1°C определяли величину ОП. Температуру плавления определяли по точке излома полученной кривой.
В представленной ниже таблице продемонстрировано, что N-Phos-олигомер обладал более высокой температурой плавления, чем соответствующий ЕР 2041161-олигомер. Таким образом, N-Phos-олигомер образовывал более стабильную связь с олигомером, имеющим комплементарную ДНК-последовательность.
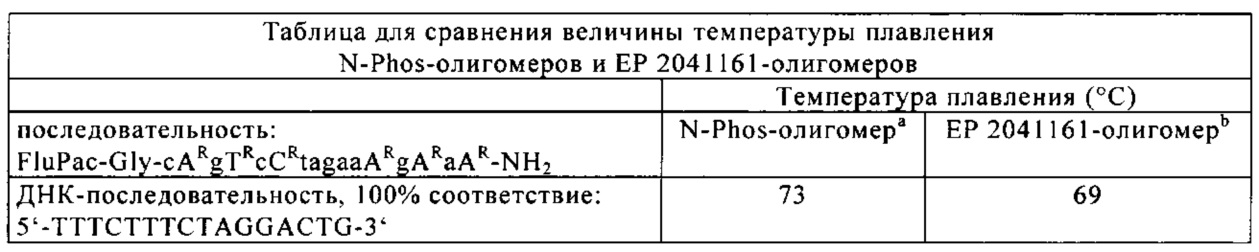
aN-Phos-олигомер: R1 обозначает -CH2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2)
bEP 2041161-олигомер: R1 обозначает -CH2-CH2-CH2-P=O(OEt)2)
Пример 18: Понижающая регуляция NFkB в клетках HeLa
После культивирования клеток HeLa в течение 2 дней (полученных из DSMZ), высеянных в 384-луночные планшеты Greiner μClear 384w с плотностью 800 клеток/лунку, добавляли растворенные в ЗФР N-Phos-олигомеры или ЕР 2041161-олигомеры до получения в каждом случае конечных концентраций 0,5, 2,5 и 10 мкМ в полной среде. В день 5 после посева клеток добавляли свежую полную среду из расчета 20 мкл/лунку. В день 7 осуществляли замену на минимальную среду с 0,1% FCS. В день 8 в среду (0,1% FCS, без антибиотиков) добавляли 10 нг/мл TNFα (фирма Peprotech) для стимуляции клеток, через 30 мин клетки фиксировали (4% PFA) для морфологического анализа и для визуализации наиболее важных субклеточных структур, таких как клеточное ядро и цитоплазма, окрашивали соответствующими красителями и антителами. Обработку изображений осуществляли с помощью автоматизированного микроскопа ImageXPress Micro (фирма MDC). Анализ изображений осуществляли визуально с использованием программного обеспечения (фирма MDC) и затем количественно с помощью программного обеспечения для автоматизированного анализа изображений Definiens XD (фирма Definiens) с применением специфических алгоритмов. Таким путем с применением окрашивания красителем Хёхста определяли количество клеточных ядер, которое служило в качестве показателя уровня клеточной пролиферации и тем самым понижающей регуляции NFkB олигомерными соединениями. В представленной ниже таблице продемонстрировано, что воздействие N-Phos-олигомеров на генную экспрессию вследствие усиления понижающей регуляции NFkB повышалось по сравнению с ЕР 2041161-олигомерами, поскольку количество клеточных ядер было более низким, прежде всего при концентрациях 2,5 мкМ и 10 мкМ.
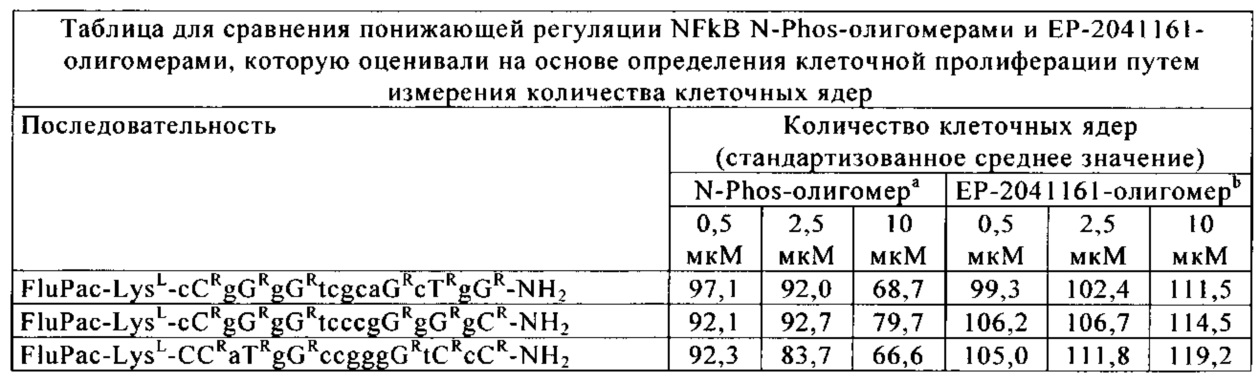
aN-Phos-олигомеры: R1 обозначает -CH2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2
bEP 2041161-олигомеры: R1 обозначает -CH2-CH2-CH2-P=O(OEt)2
Пример 19: Более сильная модуляция сайта сплайсинга мишени TNFR2 (пропуск экзона 7) в клетках ТНР1
Тесты по оценке эффективности олигомерных соединений проводили на культуре клеток ТНР1, полученной из АТСС (АТСС TIB-202®™). ТНР1 представляет собой клеточную линию человеческих моноцитов, полученную из организма пациентов с острым моноцитарным лейкозом. Культуры клеток ТНР1 выращивали (в среде RPMI 1640 с 10% FCS) без добавления антибиотиков. Периодически проводили тесты на микоплазму (с использованием набора Venor GeM фирмы Minerva).
В день 1 клетки ТНР1 с добавлением РМА вносили из расчета 13000 клеток/лунку в обработанные коллагеном типа I 384-луночные планшеты фирмы Greiner (Greiner Kollagen I 384W Platten, №781956) с помощью многоканального диспенсера. На этой стадии клетки обрабатывали полной средой, содержащей 10% сыворотки и пенициллин/стрептомицин. После посева добавляли РМА (фирма Sigma, № Р8139) в концентрации 100 нМ. В день 4 после замены культуральной среды добавляли олигомеры в концентрациях 0,2, 2 и 20 мкМ. В день 6 клетки кондиционировали путем добавления INFg ТНР1 В концентрации 100 ед./мл (фирма Peprotech) и затем IFN-γ в течение 24 ч. В день 7 после замены среды для клеточной культуры добавляли 5 мкг LPS (фирма Sigma) в так называемой минимальной среде (0,1% FCS) и осуществляли стимулирование культуры в течение 24 ч. В день 8 клетки ТНР1 лизировали в буфере для лизиса Stratec S (№7061311700) и лизат помещали на хранение при -80°C. В день 9 с использованием наборов для экстракции РНК RNA Stratec InviTrap (№7061300400) осуществляли экстракцию клеток и помещали на хранение при -80°C для дальнейшего анализа.
ОТ-реакцию проводили с помощью набора для кДНК LifeTech High Capacity (№4368813) с использованием ингибитора РНКазы (№ N8080119). qПЦР проводили в реакционном объеме 11 мкл с применением мастер-смеси для qПЦР Bioline SensiMix Sybr (№ QT605-20) с использованием специфических праймеров для мРНК человеческих изоформ TNFR2, содержащих и не содержащих экзон 7.
qПЦР-реакции проводили с помощью системы ABI PRISM 7900НТ. Полученные в результате ОТ-qПЦР данные проверяли вручную с использованием кривых амплификации для каждой лунки. Относительные количества мРНК гена-мишени стандартизовали относительно количества мРНК референс-гена Rpl13a.
Для каждой протестированной концентрации олигомерных соединений определяли отношение (выраженное в процентах) уровня экспрессии индуцированной изоформы TNFR2 без экзона 7 к уровню экспрессии изоформы TFNR2 с экзоном 7, в каждом случае определенного относительно уровня экспрессии референс-гена Rpl13a. Эквипотентную действующую концентрацию, ЕС50, рассчитывали на основе аппроксимации данных, полученных для индивидуальных концентраций, кривой с помощью статистического метода наилучшей подгонки (квадратичная подгонка) с использованием программы Excel-Add-ins XLfit.5 (IDBS).
В представленной ниже таблице продемонстрировано, что для N-Phos-олигомеров величины ЕС50, характеризующие модуляцию сайта сплайсинга TNFR2, были значительно более низкими по сравнению ЕР 2041161-олигомерами.

aN-Phos-олигомеры: R1 обозначает -CH2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2
bEP 2041161-олигомеры: R1 обозначает -CH2-CH2-CH2-P=O(OEt)2
Пример 20: Модуляция сайта сплайсинга мишени TNFR2 (пропуск экзона 7) у мышей
Мышам в группах обработки, каждая из которых состояла из 5 мышей линии BalB/С (фирма Jackson Labs), вводили в дни 1, 3 и 5 внутривенно либо N-Phos-олигомер из расчета 50 мг/кг, либо ЗФР в таком же объеме. В день 8 осуществляли стимуляцию воспалительной реакции с помощью 15 мг/кг LPS (фенол-LPS Е. coli, серотип ∅127: В8, фирма Sigma, каталожный номер L3129, с уровнем эндотоксина не менее 500000 EU (эндотоксиновых единиц/мг)). Через 3 ч после LPS-стимуляции животных умерщвляли и брали образцы из селезенки и мезентерических лимфатических узлов примерно по 30 мг каждый и сразу замораживали в жидком азоте. Образцы ткани хранили при -80°C в холодильнике до дальнейшей обработки. Для экстракции РНК фрагменты ткани массой немного меньше 30 мг (после удаления избытка ткани с помощью скальпеля) сразу переносили в пробирку, содержащую 300 мкл реагента QIAzol и гранулы из нержавеющей стали (фирма Qiagen, каталожный номер 69989) для лизиса. Экстракцию РНК из образцов ткани осуществляли с использованием набора для ткани Qiagen RNeasy 96 Universal (фирма Qiagen, №74881) согласно протоколу производителя. Полученную РНК помещали на хранение при -80°C до дальнейшей обработки. При проведении qПЦР-анализа для ОТ-реакции использовали набор для обратной транскрипции кДНК High Capacity cDNA Reverse Transkription с ингибитором РНКазы фирмы Invitrogen (каталожный номер 4374966) согласно протоколу производителя. Реакционные смеси для qПЦР приготавливали, применяя мастер-смесь Bioline SensiMix SYBR (№ QT605-20) в реакционном объеме 11 мкл, с использованием идентификации на основе SybrGreen и предварительно валидированных специфических в отношении транскриптов пар праймеров в трех повторностях. ПЦР-реакции в реальном времени проводили с использованием системы ABI PRISM 7900НТ. Данные, полученные в результате OT-qПЦР, проверяли вручную и количество мРНК-мишени стандартизовали относительно количества мРНК референс-гена Rpl13a. Уровень экспрессии мРНК-мишени, изоформы мРНК гена TNFR2 мыши без экзона 7, определяли в виде медианы 5 медиан результатов проведенных в трех повторностях измерений на образцах селезенки или мезентерических лимфатических узлов, стандартизованных в каждом случае относительно уровня гена Rpl13a мыши из тест-группы, состоящей из 5 мышей.

aN-Phos-олигомеры: R1 обозначает -CH2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2
Пример 21: Сравнение эффективности предлагаемого в изобретении N-Phos-олигомера, ЕР 2041161-олигомера и US 5719262-олигомера в отношении модуляции сайта сплайсинга мишени TNFR2 (пропуск экзона 7) в клетках ТНР1
Эксперимент проводили согласно процедуре, описанной в примере 19. Результаты представлены в приведенной ниже таблице и на фиг. 3.
N-Phos-олигомер, предлагаемый в изобретении, обладал по сравнению с ЕР 2041161-олигомером в 2,6 раза более сильным воздействием в отношении модуляции сайта сплайсинга мишени TNFR2 в клетках ТНР1, в то время как модуляция мишени TNFR2 в клетках ТНР1 при использовании US 5719262-олигомера практически отсутствовала.

aN-Phos-олигомер: R1 обозначает -CH2-CH2-CH2-CH2-NH-CH2-CH2-P=O(OEt)2
bEP 2041161-олигомер: R1 обозначает -CH2-CH2-CH2-P=O(OEt)2
cUS 5719262-олигомер: R1 обозначает -CH2-CH2-CH2-CH2-NH2
Пример 22: Воздействие предлагаемых в изобретении N-Phos-олигомеров с различными радикалами U на модуляцию сайта сплайсинга TNFR2-мишени (пропуск экзона 7) в легких мышей
Эксперимент проводили согласно процедуре, описанной в примере 20.
Протестированные N-Phos-олигомеры, предлагаемые в изобретении, формулы (VI) с радикалом U общей формулы VII и группой формулы IXc (производное холестерина) или IXd (производное фолиевой кислоты) в качестве R46 оказывали сильное воздействие на генную экспрессию при модуляции сайта сплайсинга TNFR2-мишени у мышей.
Например, в легких воздействие при использовании производного холестерина было в 560 раз больше, а при использовании производного фолиевой кислоты было в 378 раз больше, чем в случае ЗФР, применяемого в качестве отрицательного контроля. Результаты представлены на фиг. 4.
Пример 23: Воздействие предлагаемых в изобретении N-Phos-олигомеров общей формулы (VI), имеющих различные нуклеотидные последовательности, радикалы U, а также различия в количестве и положении групп общих формул (IV) и (V) на модуляцию сайта сплайсинга TNFR2-мишени (пропус экзона 7) в почках, печени и легких мышей
Эксперимент проводили с использованием предлагаемых в изобретении N-Phos-олигомеров N-Phos 23-1, N-Phos 23-2, N-Phos-23-4 (см. фиг. 5). Эксперимент осуществляли согласно процедуре, описанной в примере 20.
Все протестированные N-Phos-олигомеры, предлагаемые в изобретении, оказывали в различных мышиных тканях (почки, печень и легкие) очень сильные воздействия на генную экспрессию изоформы мРНК без экзона 7. Например, в почках воздействие N-Phos 23-1 было в 1983 раза выше, чем ЗФР, применяемого в качестве отрицательного контроля. Результаты представлены на фиг. 5.
Пример 24: Сравнение эффективности предлагаемых в изобретении N-Phos-олигомеров и ЕР 2041161-олигомеров в отношении модуляции сайта сплайсинга TNFR2-мишени (пропуск экзона 7) в почках мышей
Тестировали 2 варианта N-Phos-олигомеров (вариант 1: сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj общей формулы (VI) равна 15 или 14; вариант 2: количество и положение групп общей формулы (IV) и (V) соответствовали общей формуле (VI)) и соответствующие варианты ЕР 2041161-олигомеров. Протестированные варианты представлены на фиг. 6. Эксперимент проводили согласно процедуре, описанной в примере 20, с тем различием, что в рассматриваемом эксперименте животных умерщвляли уже через 2 ч после стимуляции LPS.
Воздействие N-Phos-олигомеров на генную экспрессию изоформы мРНК без экзона 7 при непосредственном сравнении с ЕР 2041161-олигомерами оказалось в 12,6 или 6,7 раза сильнее. Результаты представлены на фиг. 6.
Пример 25: Воздействие in vivo предлагаемого в изобретении N-Phos-олигомера с 20 структурными элементами на модуляцию сайта сплайсинга гена дистрофина-мишени (пропуск экзона 23) в мышце мышей линии mdx
Эксперимент проводили с использованием предлагаемого в изобретении N-Phos-олигомера с 20 структурными элементами (сумма всех повторяющихся звеньев Yd, Zf, Yg и Zj общей формулы (VI) равна 19). Протестированые соединения представлены на фиг. 7. Этот эксперимент проводили согласно процедуре, описанной в примере 20, с тем различием, что в этом эксперименте использовали мышей линии C57BL/10ScSn-Dmdmdx/J (фирма Jackson Labs), животных не стимулировали LPS и умерщвляли в день 15. Уровень экспрессии мРНК-мишени, изоформы мРНК гена дистрофина мышей без экзона 23, определяли как медиану 5 медиан результатов проведенного в трех повторностях измерения в мышце, стандартизованного относительно уровня Rpl13a.
Предлагаемый в изобретении N-Phos-олигомер с 20 структурными элементами оказывал в мышце в 9 раз более сильное воздействие in vivo на генную экспрессию изоформы мРНК без экзона 23 по сравнению с контрольной группой, обработанной ЗФР. Результат представлен на фиг. 7.
SEQUENCE LISTING
<110> Ugisense AG
<120> Neue Peptid-Nukleinsaeuren-Monomere und -Oligomere
<130> 21474-PCT
<140> PCT/EP2015/000998
<141> 2015-05-15
<150> DE102014007158.8
<151> 2014-05-16
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 16
<212> DNA
<213> Artificial Sequence
<220>
<223> DNA Oligomer for thermal stability (Tm) measurements of PNAs
<220>
<221> misc_feature
<222> (1)..(16)
<223> DNA Oligomer for thermal stability (Tm) measurements of PNAs
<400> 1
tttctttcta ggactg 16
Реферат
Изобретение относится к соединению общей формулы (I):в которой K представляет собой активную группу эфира карбоновой кислоты или -О-R; где Rобозначает атом Н, метальную, этильную, бензильную или трет-бутильную группу; Pr представляет собой атом Н или аминозащитную группу; # обозначает асимметричный атом С; Е представляет собой аденинильную, цитозинильную, псевдо-изоцитозинильную, гуанинильную, тиминильную, урацилильную или фенильную группу, при необходимости замещенную защитной группой для нуклеотидного основания; Rобозначает группу общей формулы (II):в которой Rобозначает группу эфира фосфоновой кислоты или группу фосфоновой кислоты; Rобозначает аминозащитную группу; m обозначает 1, 2, 3 или 4; и h обозначает 0, 1, 2 или 3; при условии что сумма m и h в общей формуле (II) находится в пределах: 2≤х≤5. Также предложены соединение формулы (VI), такое как указано в формуле изобретения, и фармацевтическая композиция. Предложенные соединения формулы (I) представляют новые мономеры для получения олигомеров пептидных нуклеиновых кислот формулы (VI), которые могут применяться в качестве диагностического средства или в антисмысловой терапии. 3 н. и 7 з.п. ф-лы, 7 ил., 8 табл., 24 пр.
Формула
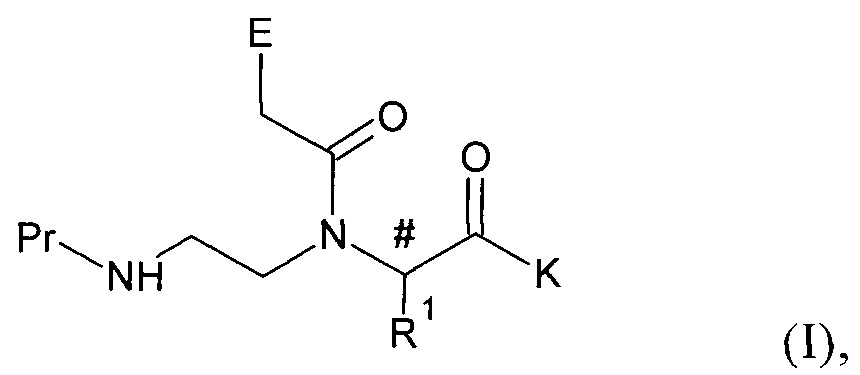
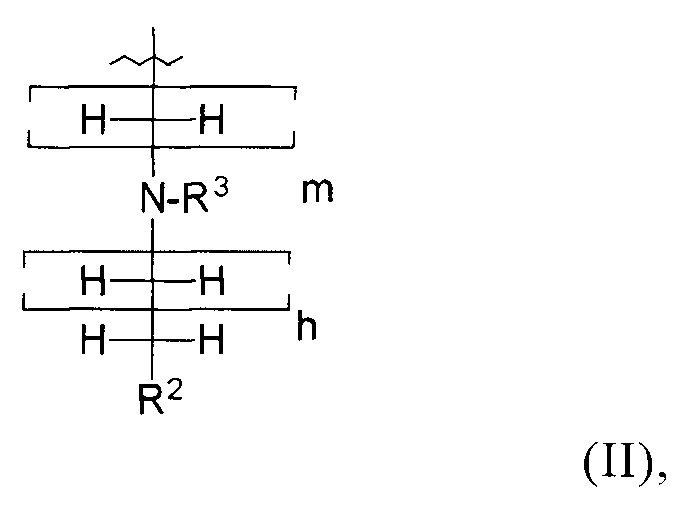
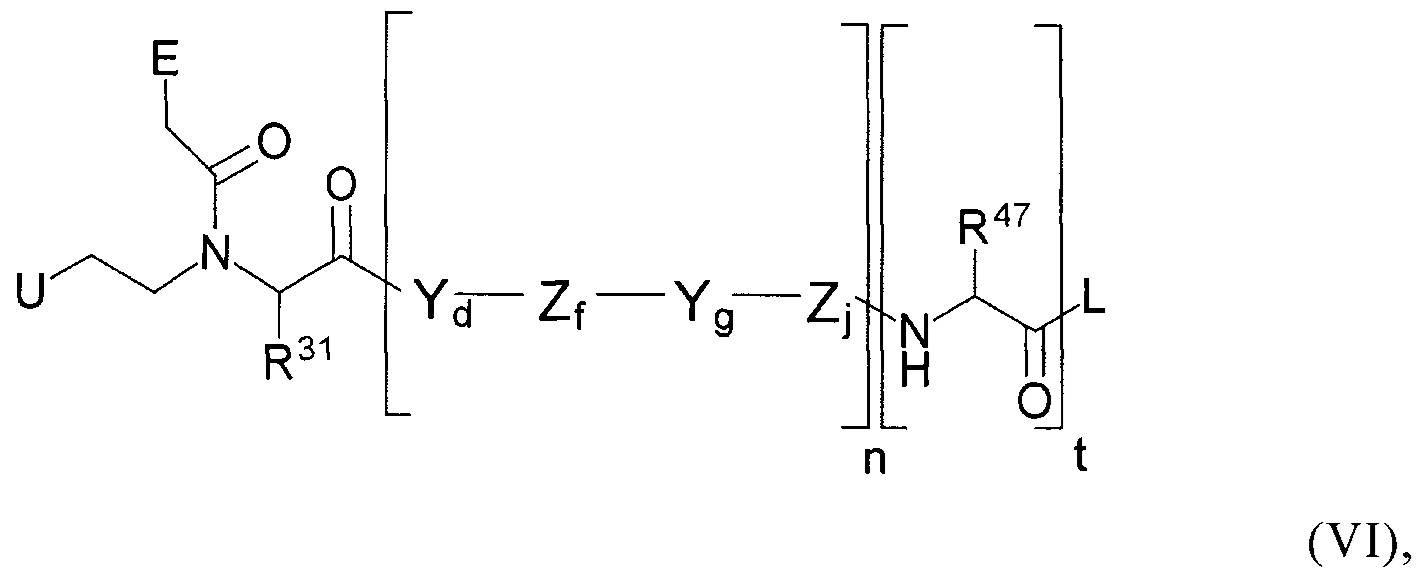
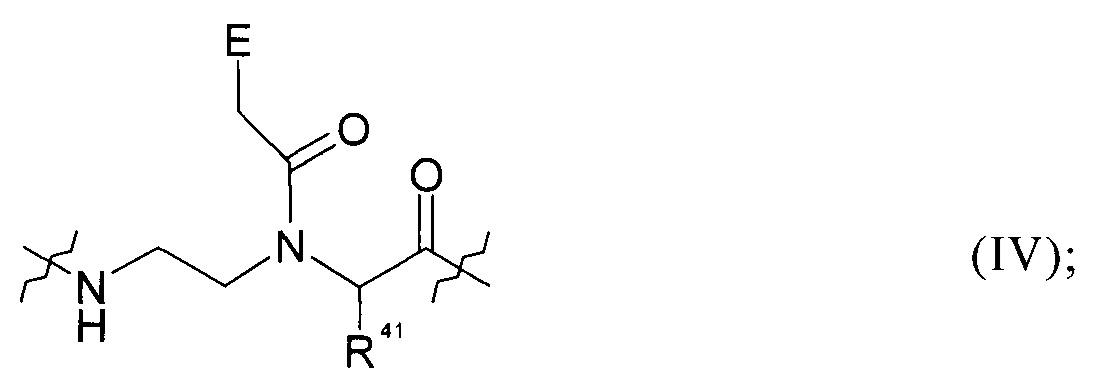
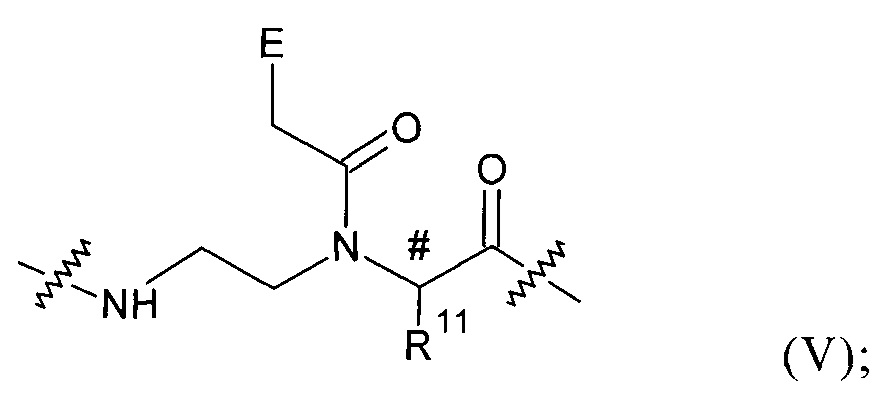
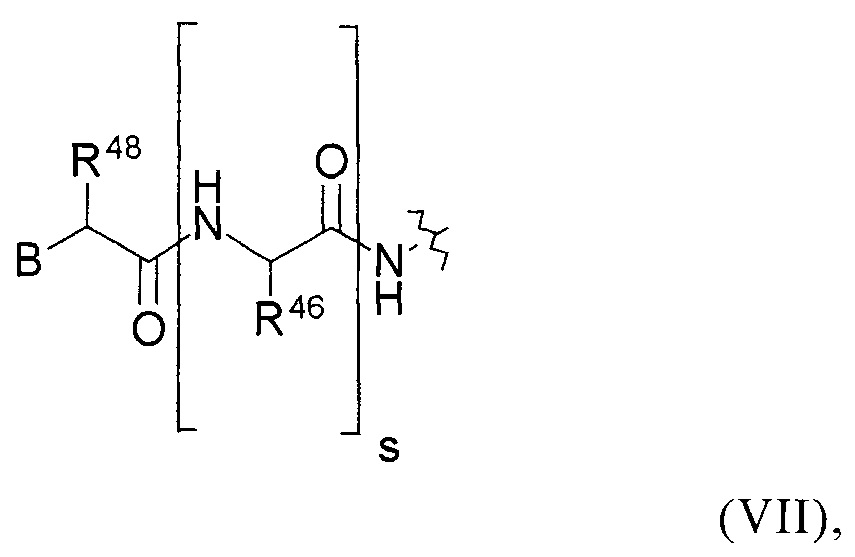


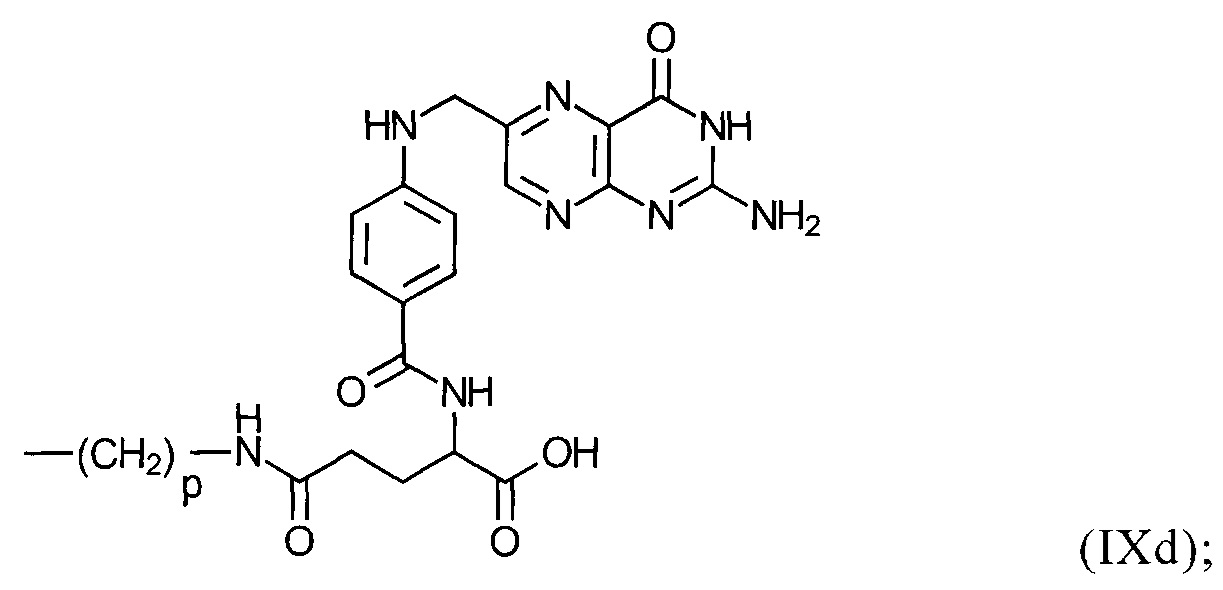

Документы, цитированные в отчёте о поиске
Нуклеиновые кислоты, модифицированные аминокислотами

Комментарии