Нуклеиновые кислоты, модифицированные аминокислотами - RU2154638C2
Код документа: RU2154638C2
Чертежи
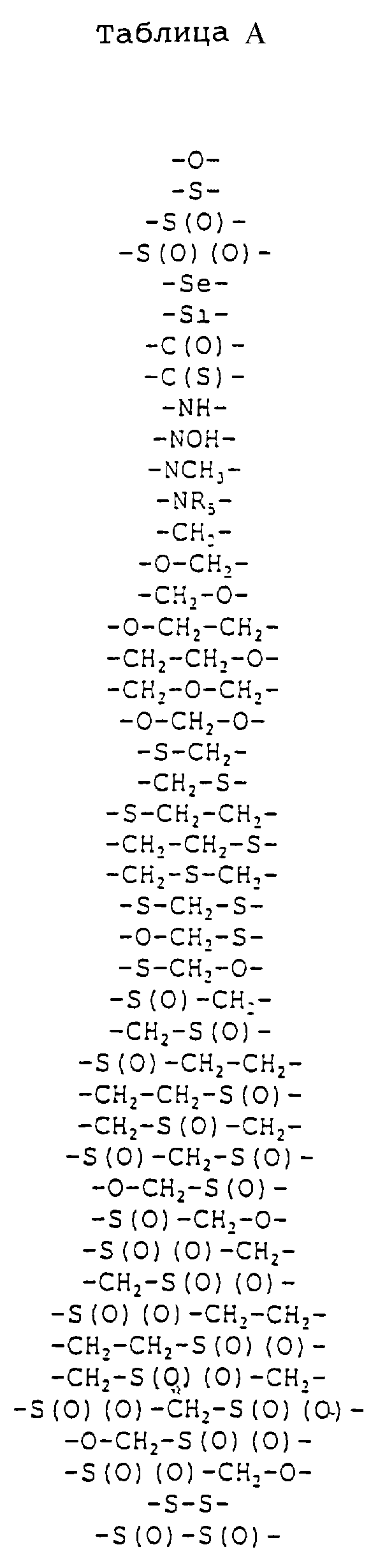
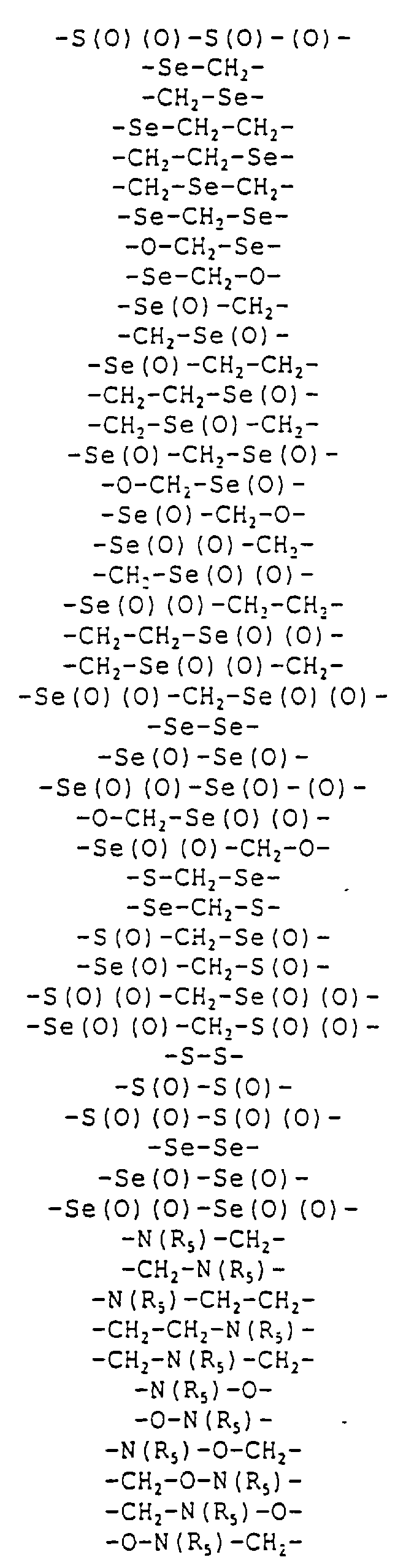
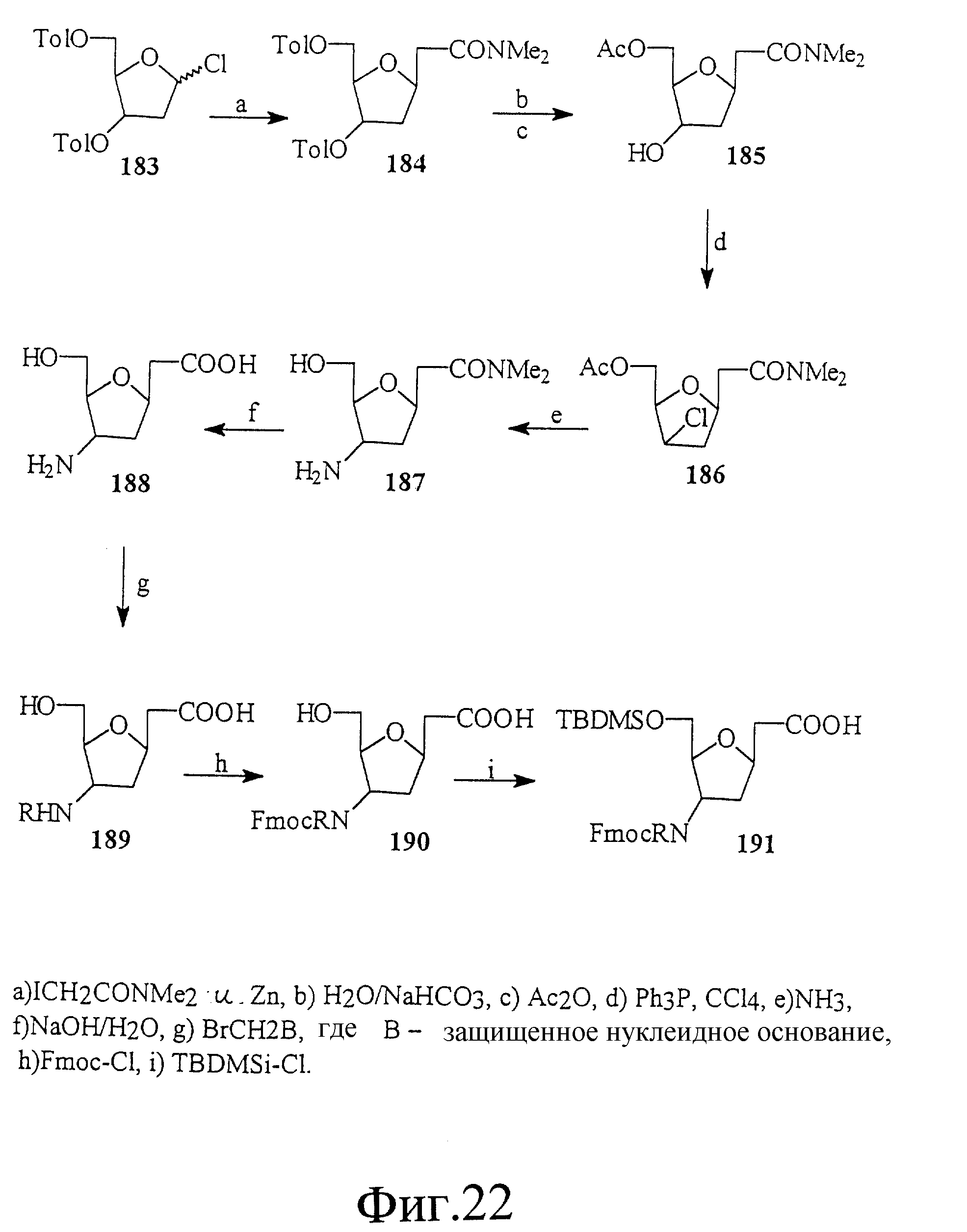
Описание
Область изобретения
Изобретение относится к области аналогов полинуклеотидов, в которых отсутствуют
фуранозные кольца.
Уровень техники
Олигонуклеотиды, которые связываются последовательность-специфическим образом с комплементарными нуклеиновыми кислотами (смысловой цепи) с
помощью водородных связей так, чтобы ингибировалась экспрессия гена, обычно называют антисмысловыми олигонуклеотидами. Эти синтетические олигонуклеотиды связывают мишень (мРНК) и ингибируют таким
образом трансляцию РНК-мессенджера. Такой антисмысловой принцип (Uhlmann, Е. et al., Chem. Reviews, 1990, 90, 543-584; и Stein, С.A. et al., Cancer Res., 1988, 48, 2659-2688) используется в природе
для регуляции экспрессии генов. Этот антисмысловой принцип был использован в лабораторных условиях не только для ингибирования, но также для активации экспрессии генов. Впервые в 1978 Замечник и
Стефенсон предложили применять синтетические олигонуклеотиды в целях терапии (Stephenson, M. L. ; and Zamecnik, P. С., Proc. Natl. Acad. Sci. USA, 1978, 75, 280 and 285). Специфическое ингибирование
антисмысловыми полинуклеотидами основано на специфическом Уотсон-Криковском спаривании оснований между гетероциклическими основаниями антисмыслового олигонуклеотида и вирусной нуклеиновой кислоты.
Процесс связывания олигонуклеотидов с комплементарными нуклеиновыми кислотами называется гибридизацией. В частности, интересен олигомер, имеющий последовательность оснований, комплементарную
последовательности оснований мРНК, кодирующей белок, необходимый для развития болезни. Путем специфической гибридизации с такой мРНК может быть нарушен синтез белка, кодируемого этой мРНК.
Получение немодифицированных олигонуклеотидов, то есть олигонуклеотидов, имеющих структуру ДНК, является центром внимания многих групп ученых в последнее десятилетие. Синтез с помощью
фосфорамидитов согласно Карузерс (McBride, L. J. ; and Caruthers, M.H., Tetrahedron Letts., 1983, 24, 245), первоначально предложенный Летсинджером (Letsinger, R.L.; and Lunsford, W.B. ,
J.Amer.Chen.Soc., 1976, 98, 3655) как фосфиттриэфирный метод, в настоящее время является наиболее эффективным методом получения фосфодиэфирных олигонуклеотидов. Когда в качестве антисмысловых
олигонуклеотидов используют нормальные (то есть немодифицированные) олигонуклеотиды, возникает проблема их нестабильности из-за действия нуклеаз и недостаточного проникновения через мембрану. Для
того
чтобы антисмысловые олигонуклеотиды были способны ингибировать трансляцию, они должны достигнуть внутренности клетки неизмененными. Свойства, полезные для олигонуклеотидов, используемых для
антисмыслового ингибирования, включают в себя:
(1) устойчивость олигонуклеотидов к действию вне- и внутриклеточных ферментов;
(2) способность проходить сквозь клеточную мембрану;
и
(3) способность гибридизоваться с ДНК или РНК мишенью (Agarwal, K.L. et al. , Nucleic Acid Res., 1979, 6, 3009; Agawal, S. et al., Proc Natl Acad Sci. USA. 1988, 85, 7079). Таким образом,
необходимо получить аналоги полинуклеотидов, которые имеют указанные выше свойства, для использования в качестве антисмысловых или для использования в качестве праймеров или гибридизационных
зондов.
Модифицированные полинуклеотиды уже были синтезированы, такие модификации полинуклеотидов включают в себя метилфосфонаты, фосфоротиоаты, различные амидаты и сахарные группировки видов нуклеиновых кислот. Эти замещения в скелете придают в некоторой степени усиленную стабильность, но имеют недостаток, заключающийся в получении хирального фосфора в составе связи, что приводит к образованию 2n диастереомеров, где n - число модифицированных диэфирных связей в олигомере. Наличие таких множественных диастереомеров значительно ослабляет способность модифицированного олигонуклеотида гибридизоваться с последовательностями-мишенями. Некоторые из таких замещений также оставляют способность поддерживать отрицательный заряд, а присутствие заряженных групп снижает способность этих соединений проникать сквозь клеточные мембраны. Существует много других недостатков, связанных с такими модификациями связей, зависящих от конкретной природы связи.
Были синтезированы некоторые аналоги олигонуклеотидов, содержащие модификацию сахара. Модификации сахаров (дезокси)рибозных нуклеиновых кислот, предназначенные для обеспечения того, что понимали под улучшенными структурами, особенно структурами, которые лучше проникают в клетки, включали в себя α-ДНК, гомо-ДНК, морфолино- и тионуклеозиды и пептидные нуклеиновые кислоты (ПНК). Общая схема синтеза для получения таких аналогов должна была включать в себя первичную гидроксильную группу нуклеозида или его нуклеотида, связанную либо с полимерным носителем, либо с последовательность-специфичным 3'-нуклеотидом через атом фосфора в пятивалентной или трехвалентной степени окисления. Методы специфичного связывания представлены фосфитнотриэфирным (фосфорамидитным), фосфодиэфирным и гидрофосфонатным методами. Имеющиеся в продаже мономеры и связанные с полимерными носителями мономеры пригодны для таких методов в силу наличия защищенных оснований (G, A, C, T, U и других гетероциклов) совместно с защищенными атомами фосфора, что позволяет хранить их и предотвращает неспецифические реакции во время процесса связывания.
Виды нуклеиновых кислот, содержащие модифицированные сахара, неионные скелеты или ациклические полиамиды (АПА), имеют, в некоторой степени, одно или несколько из следующих свойств, полезных для модификации гена: усиленная стабильность дуплекса (эффективность гибридизации), повышенная специфичность к мишеням, устойчивость к действию нуклеаз, улучшенное проникновение в клетку и содействие в важных терминирующих событиях нуклеиновых кислот (например активность РНазы H, каталитическое расщепление, остановка гибридизации и другие). Было также предложено использовать карбонатные диэфиры. Однако эти соединения являются высоко нестабильными, и такая карбонатно-диэфирная связь не поддерживает тэтраэдрическую конфигурацию, устанавливаемую фосфором в фосфодиэфире. Аналогично, карбаматные связи, являясь ахиральными, придают тригональную симметрию, и было показано, что поли dT, имеющий такую связь, не гибридизуется строго с dA (Coull, J.М. et al. Tetrahedron Letts., 1987, 28, 745; Stirchak, E.p. et al., J.Org.Chem., 1987, 52, 4202).
В более поздней литературе появляются сведения об ациклических аналогах cахаров (Augustyns, К.A. et al., Nucleic Acids Res., 1991, 19, 2587-2593). Включение этих ациклических нуклеозидов в состав олигонуклеотидов влечет за собой пропуск в Tm в зависимости от числа линкеров, встроенных в эти олигомеры. Обнаружено, что эти олигонуклеотиды являются устойчивыми к действию ферментов и спариваются с основаниями комплементарной последовательности. Учитывая недостатки полинуклеотидов и известных аналогов полинуклеотидов, интерес представляет создание новых аналогов полинуклеотидов для использования в антисмысловом ингибировании и других методиках, применяющих олигомеры.
Такие попытки с модификацией как сахарных, так и скелетных компонентов имеют ряд недостатков при использовании в качестве терапевтических средств и в других методах. Следовательно, требуются более серьезные улучшения этих свойств, прежде чем станет возможным использование в качестве эффективных терапевтических, диагностических и исследовательских средств. Согласно этому, давно имеется необходимость в улучшении олигомерных аналогов олигомеров олигонуклеотидов как фармацевтических соединений.
Согласно настоящему изобретению предлагаются новые олигонуклеотиды и их структурные предшественники, более устойчивые к действию нуклеаз, обладающие повышенной стабильностью в физиологических условиях и которые могут быть нейтрально или положительно заряжены, что могло бы облегчить проникновение в клетку. Далее, новые олигонуклеотиды по изобретению обладают улучшенными гибридизационными свойствами по отношению к гибридизуемым нуклеиновым кислотам-мишеням.
Олигомеры по настоящему изобретению в общем характеризуются тем, что содержат серию встроенных линкеров или мономеров, подходящую для связывания гетероциклических оснований с нуклеиновой кислотой-мишенью последовательность-специфичным образом. Когда описываемые здесь встроенные линкеры находятся в составе олигомеров, они могут обладать большей силой, чем единичная водородная связь, способствуя таким образом образованию при связывании компетентной конформации.
Нуклеомономеры по настоящему изобретению в основном характеризуются как группировки или остатки, заменяющие фуранозное кольцо, которое имеется в природных нуклеотидах, аминокислотными или модифицированными аминоспиртовыми остатками. Примерные мономеры и олигомеры по изобретению показаны в формулах 1-41. Включение этих описанных здесь мономеров в состав олигонуклеотидов позволяет синтезировать соединения с улучшенными свойствами; эти улучшенные свойства включают в себя (1) возросшую липофильность в результате удаления заряда, имеющегося благодаря фосфодиэфирным связям (Dalge, J.М. et al., Nucleic Acids Res., 1991, 19, 1805), и (2) устойчивость к разрушению ферментами, такими как нуклеазы. Олигомеры, содержащие эти мономеры, могут быть совершенно стабильны для гибридизации с последовательностями-мишенями и превосходят немодифицированные нуклеозидные остатки в одном или нескольких применениях.
Краткое содержание
изобретения
Согласно настоящему изобретению предлагаются различные новые аналоги олигонуклеотидов, имеющие одно или несколько свойств, которые обеспечивают
превосходство интересующих нас
соединений над традиционными олигонуклеотидами при использовании в методах, применяющих олигонуклеотиды. Соединения по изобретению являются аналогами олигонуклеотидов,
в которых фуранозное кольцо,
имеющееся в природных нуклеиновых кислотах, заменено на аминокислоту или модифицированный аминоспиртовой остаток. В некоторых реализациях новые соединения по изобретению,
в частности, полезны для
антисмыслового контроля экспрессии генов. Соединения по изобретению также могут быть использованы как зонды для гибридизации с нуклеиновыми кислотами или как праймеры.
В другом аспекте согласно данному изобретению предложены мономерные предшественники аналогов олигонуклеотидов по изобретению. Эти мономерные предшественники могут быть использованы для синтеза интересующих нас аналогов полинуклеотидов.
В другом аспекте согласно данному изобретению предложены препараты интересующих нас аналогов полинуклеотидов, которые созданы для лечения или профилактики болезненных состояний. В еще одном аспекте согласно данному изобретению предложены способы лечения или профилактики заболеваний, в частности вирусных инфекций и нарушений клеточного роста. Интересующие нас способы лечения заболеваний включают в себя стадию, на которой вводят эффективное количество интересующих нас аналогов полинуклеотидов для использования в качестве антисмысловых ингибиторов.
Краткое описание чертежей
На фиг. 1-25 показаны последовательности химических реакций, применяемых для синтеза мономеров и олигонуклеотидов по
изобретению.
Конкретнее:
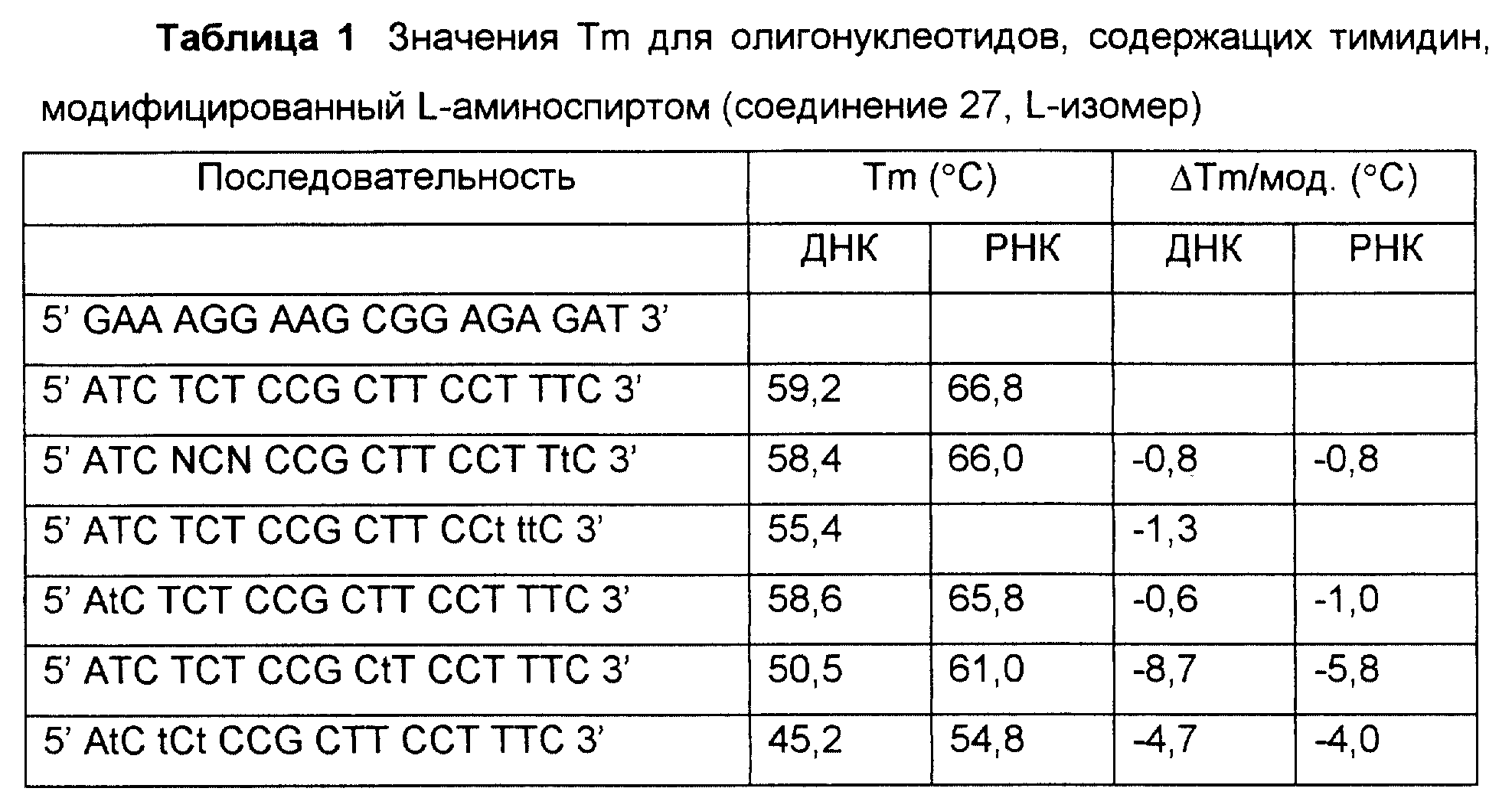
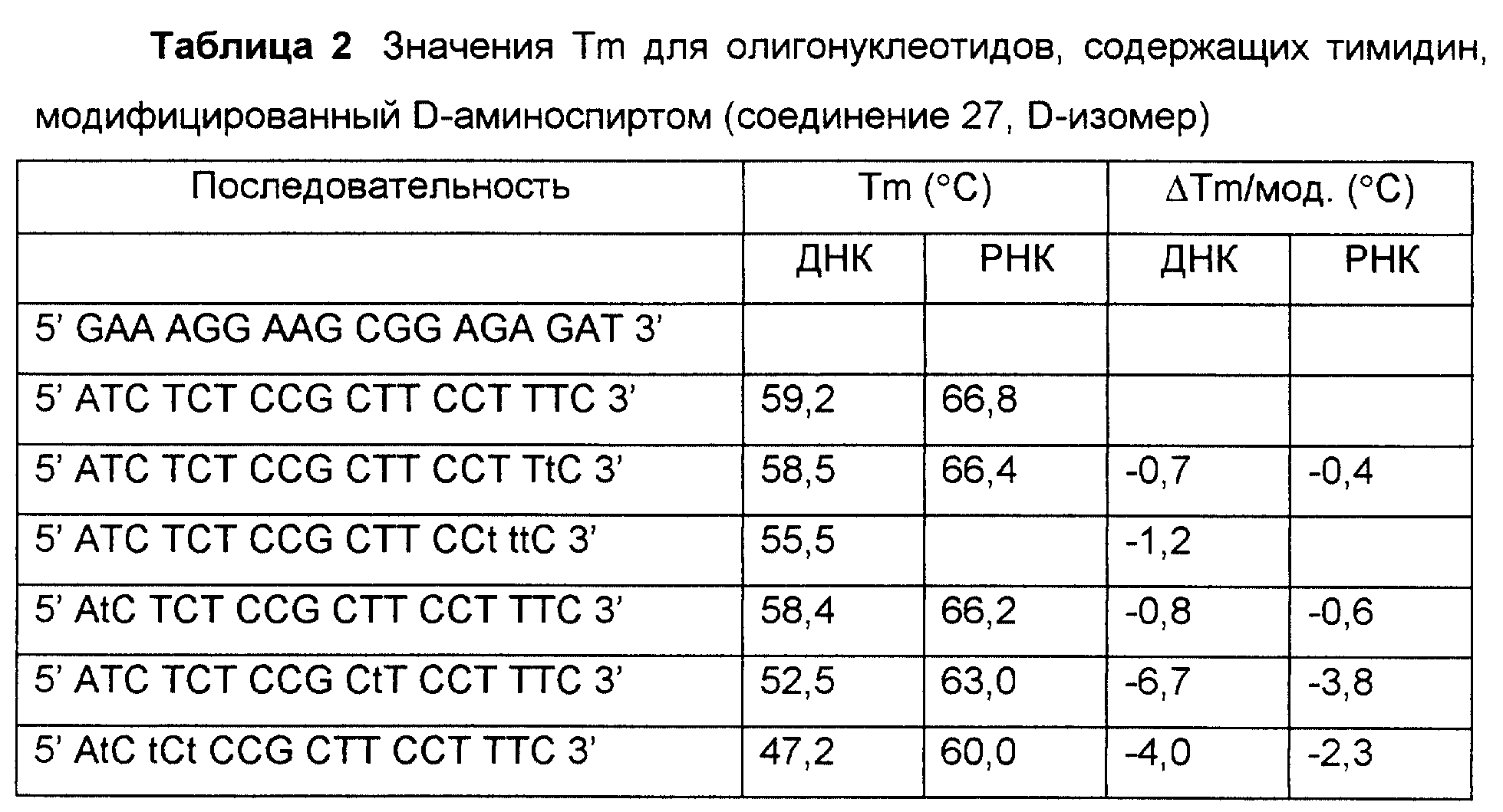
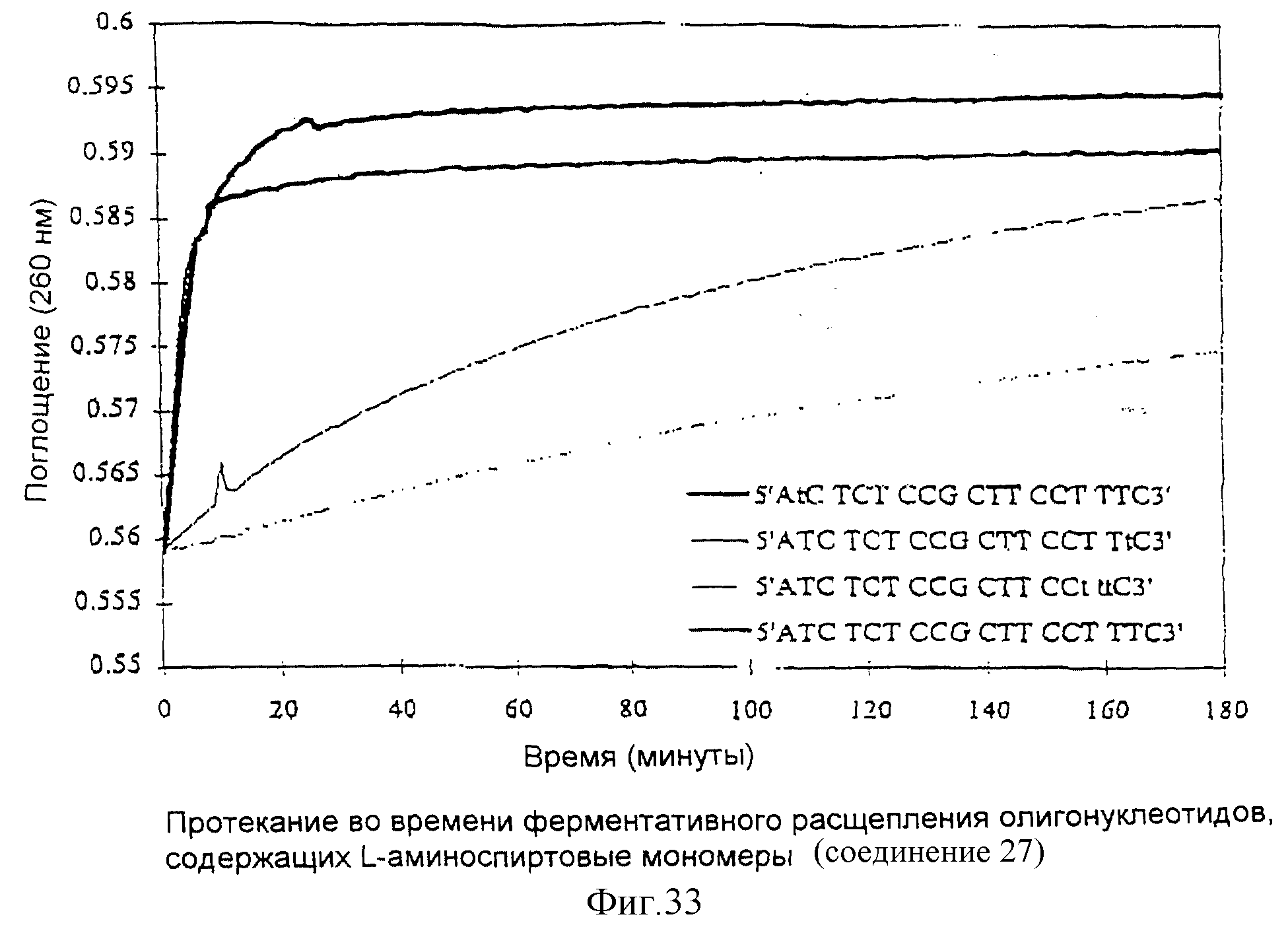
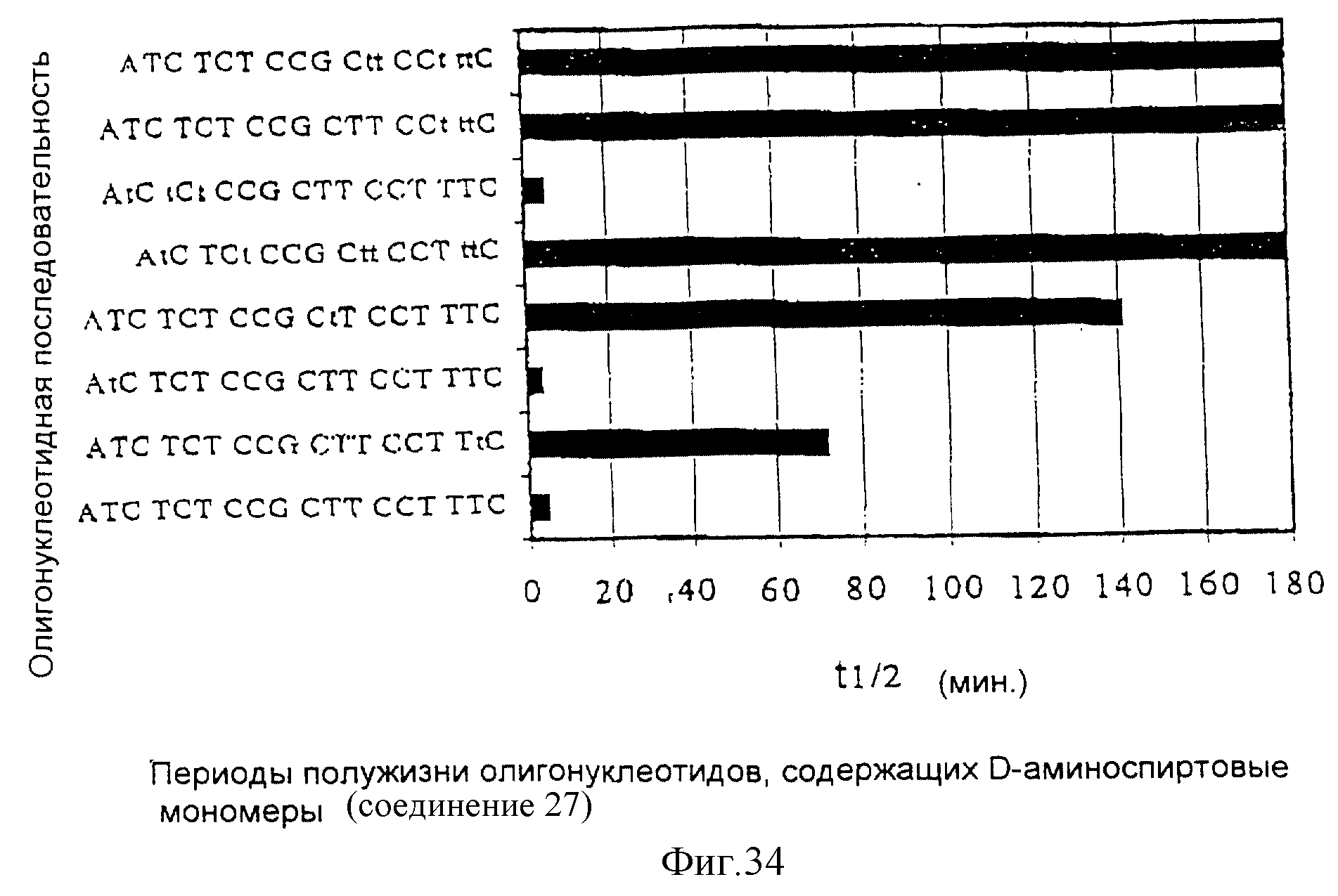
На фиг. 1 показан синтез связанного с L-серинолом тиминового мономерного фосфорамидита с -CH2-CO-связью между тимином и серинолом.
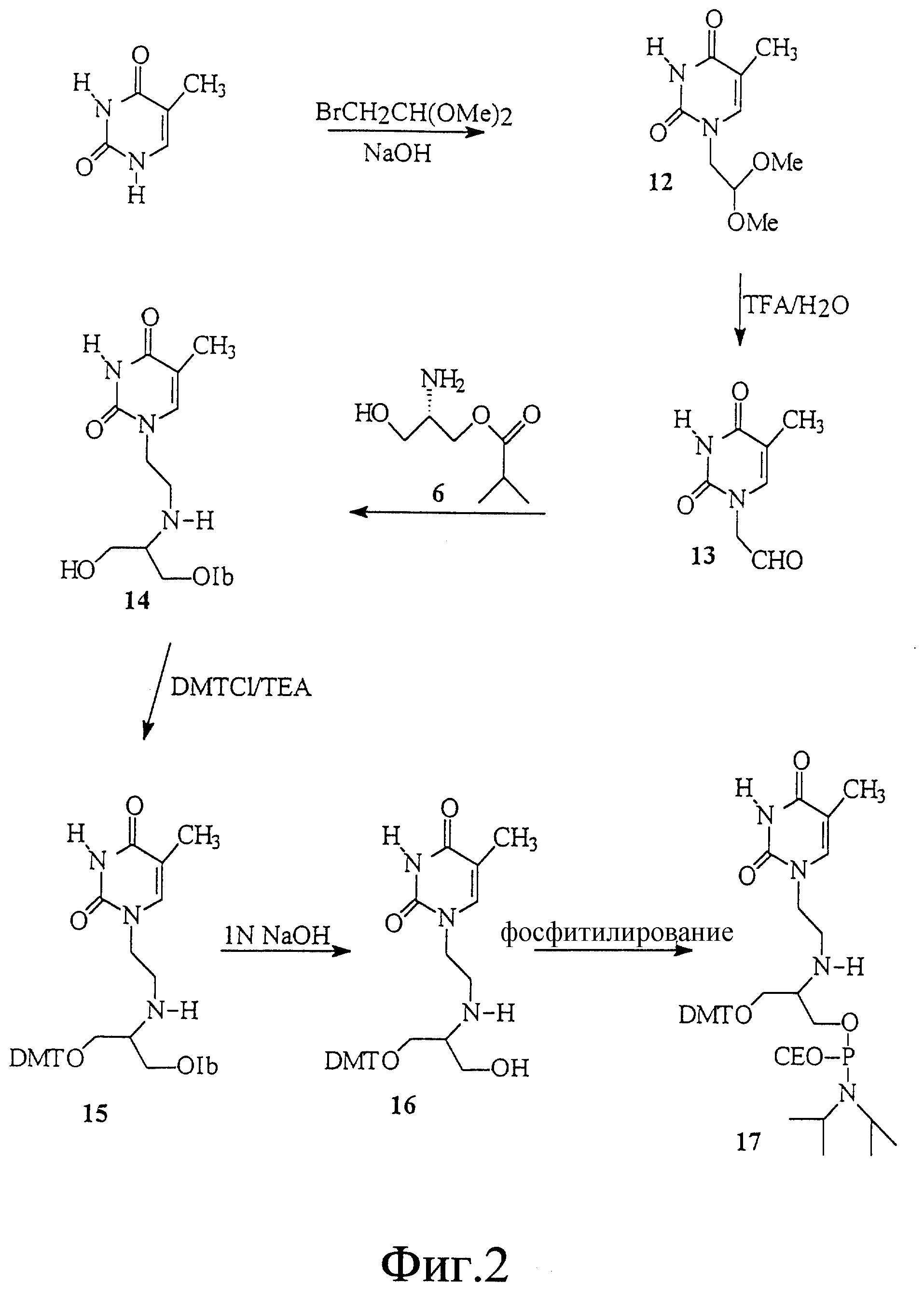
На фиг. 2 показан синтез связанного с L-серинолом тиминового мономерного фосфорамидита с -CH2-CH2-связью между тимином и серинолом.
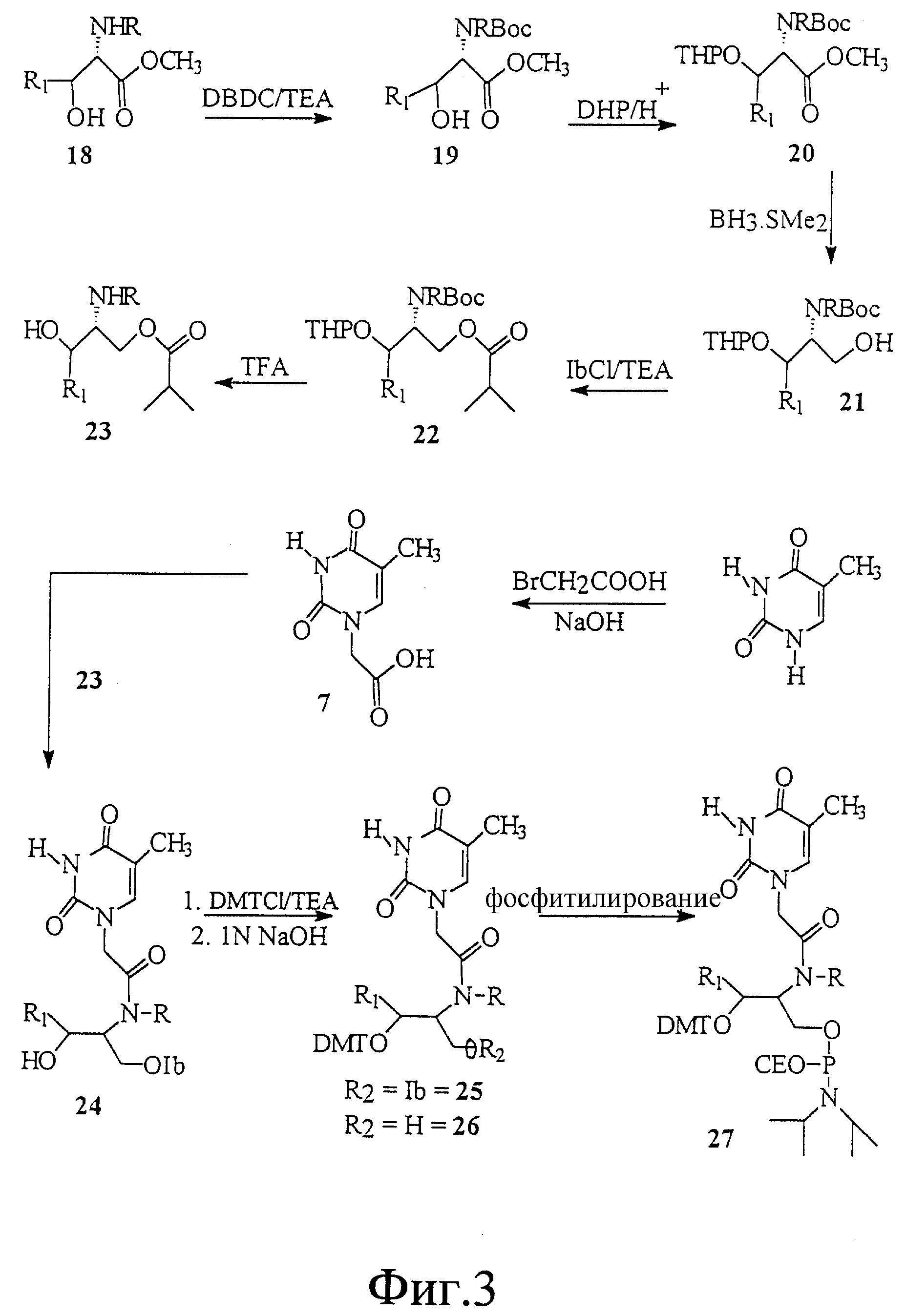
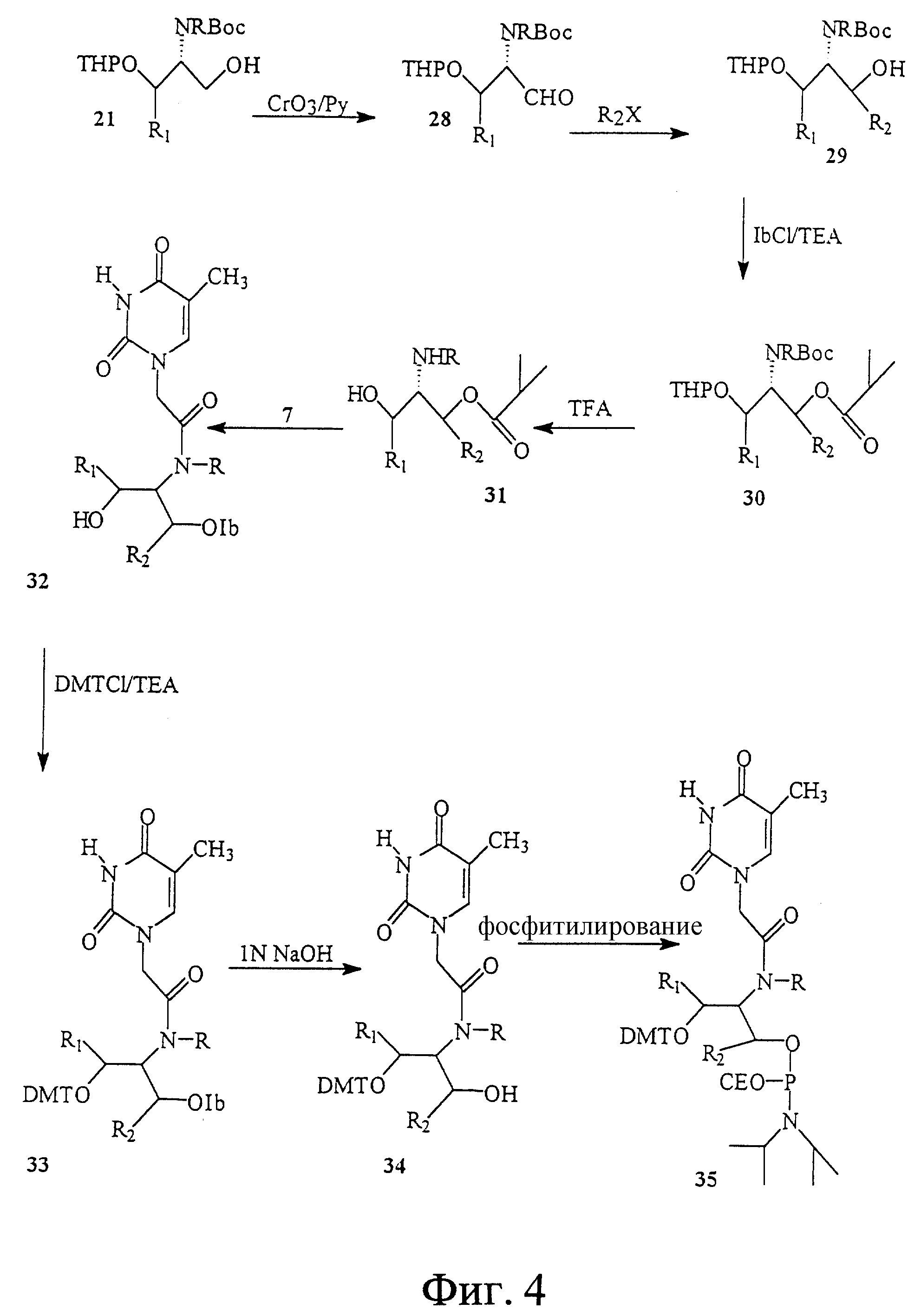
На фиг. 3 и 4 показан синтез связанного с замещенным L-серинолом тиминового мономерного фосфорамидита с -CH2-CO-связью между тимином и серинолом.
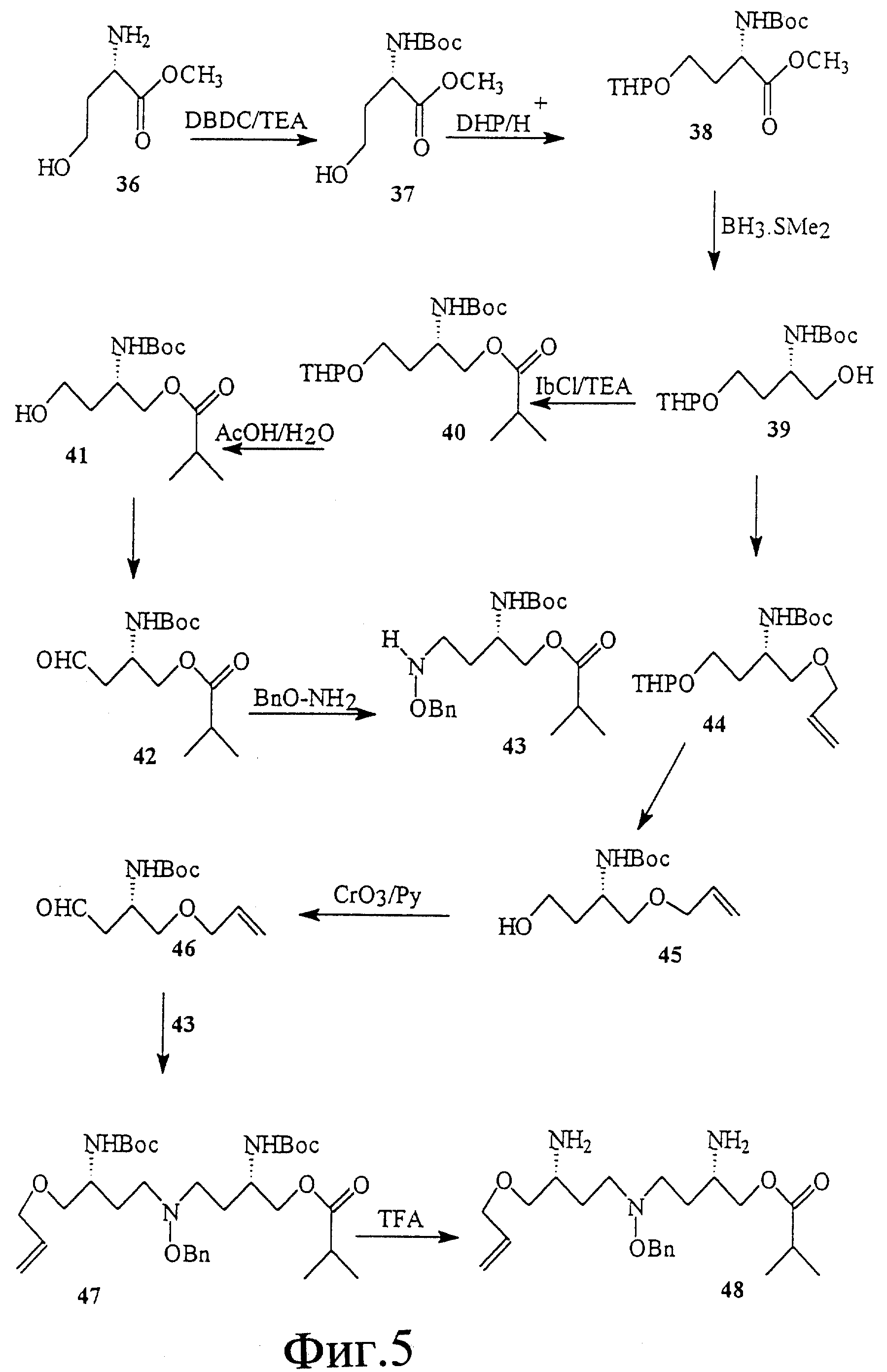
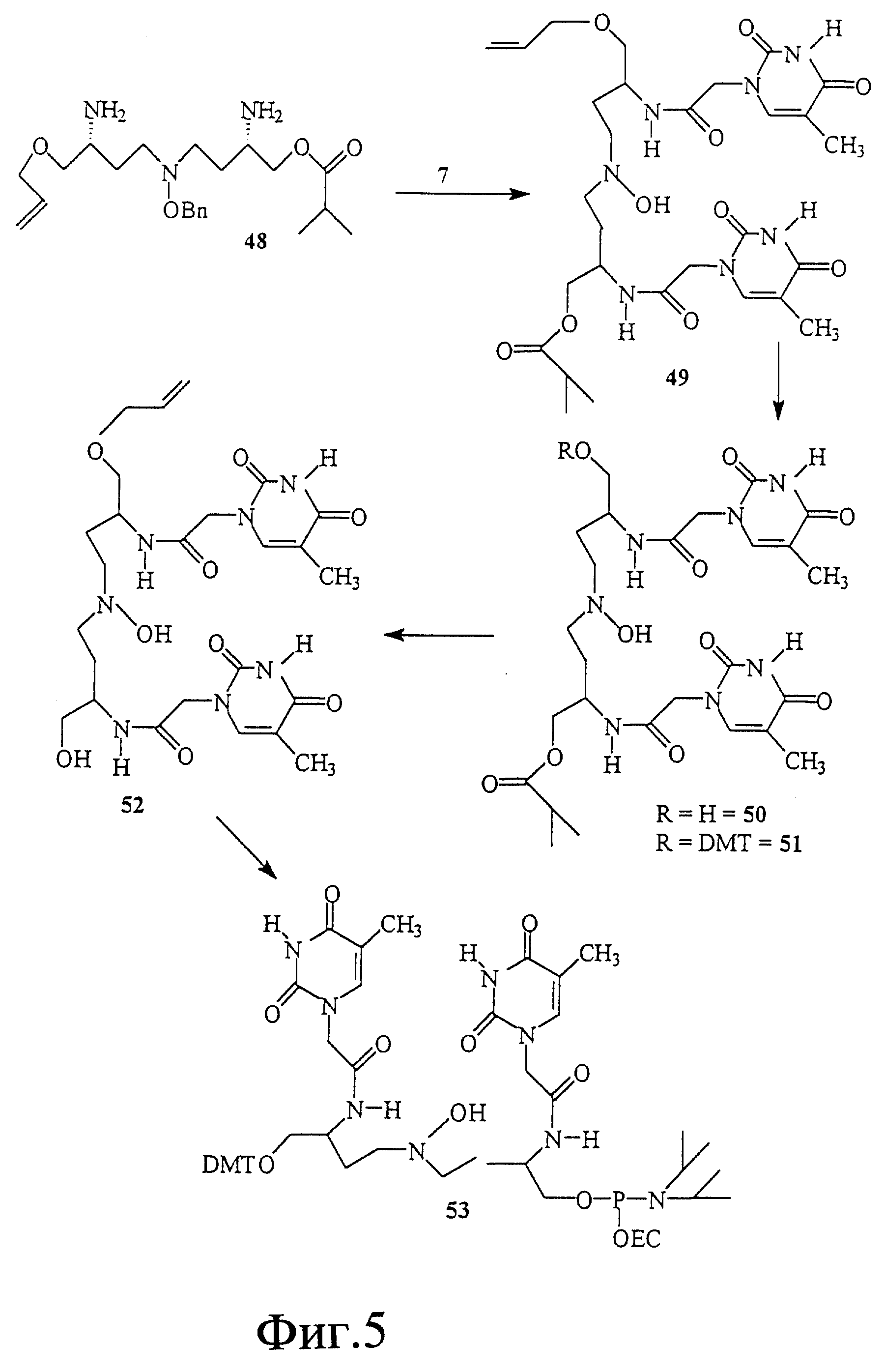
На фиг. 5 показан синтез T-T димера с межнуклеотидной связью из 5 атомов, имеющего гидроксиламин в середине межнуклеотидной связи, с -CH2-CO-связью между тимином и серинолом.
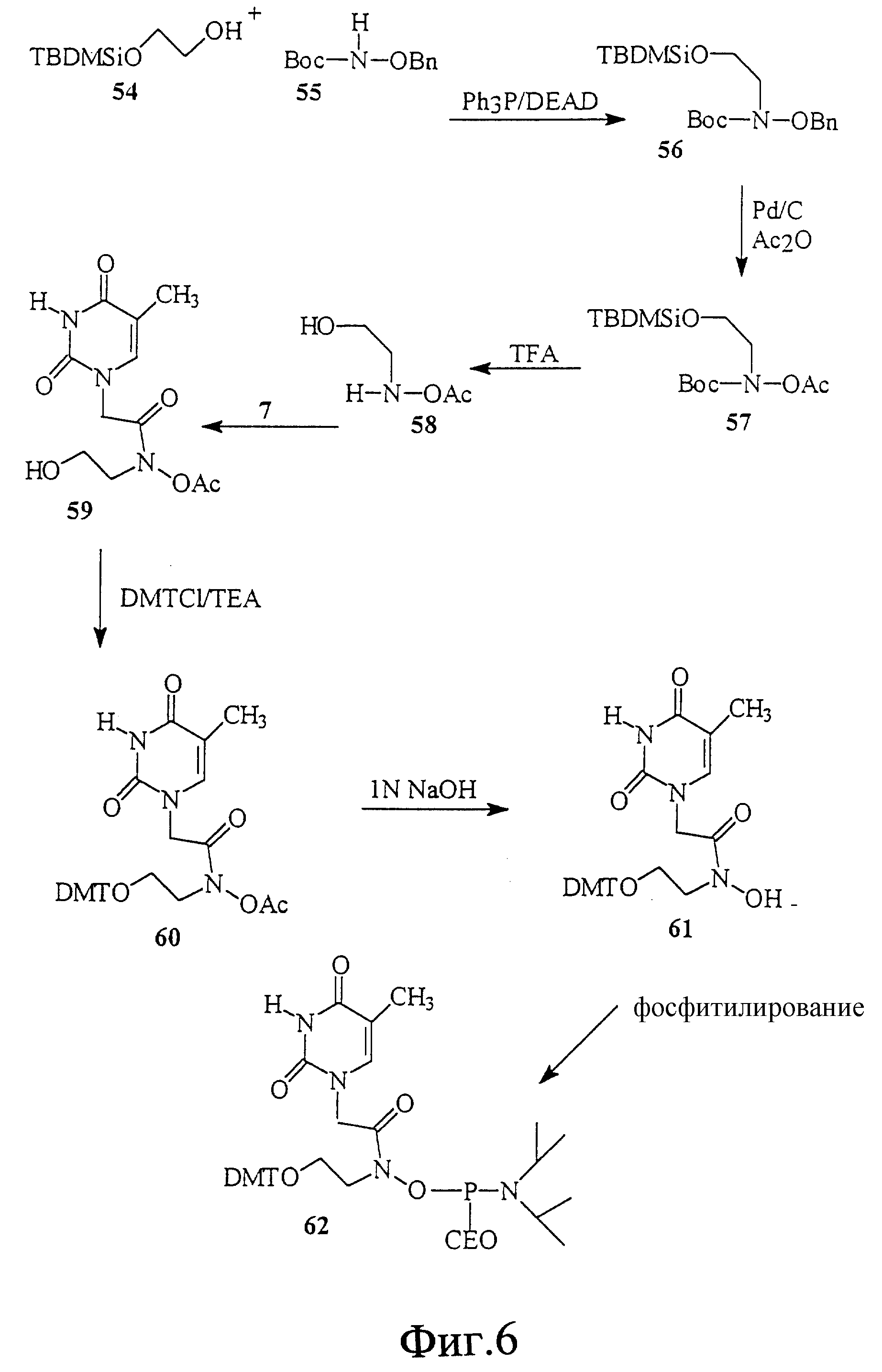
На фиг. 6 показан синтез тиминового мономерного фосфорамидита, в котором тимин присоединен к N-этилгидроксиламину через -CH2-CO-связь.
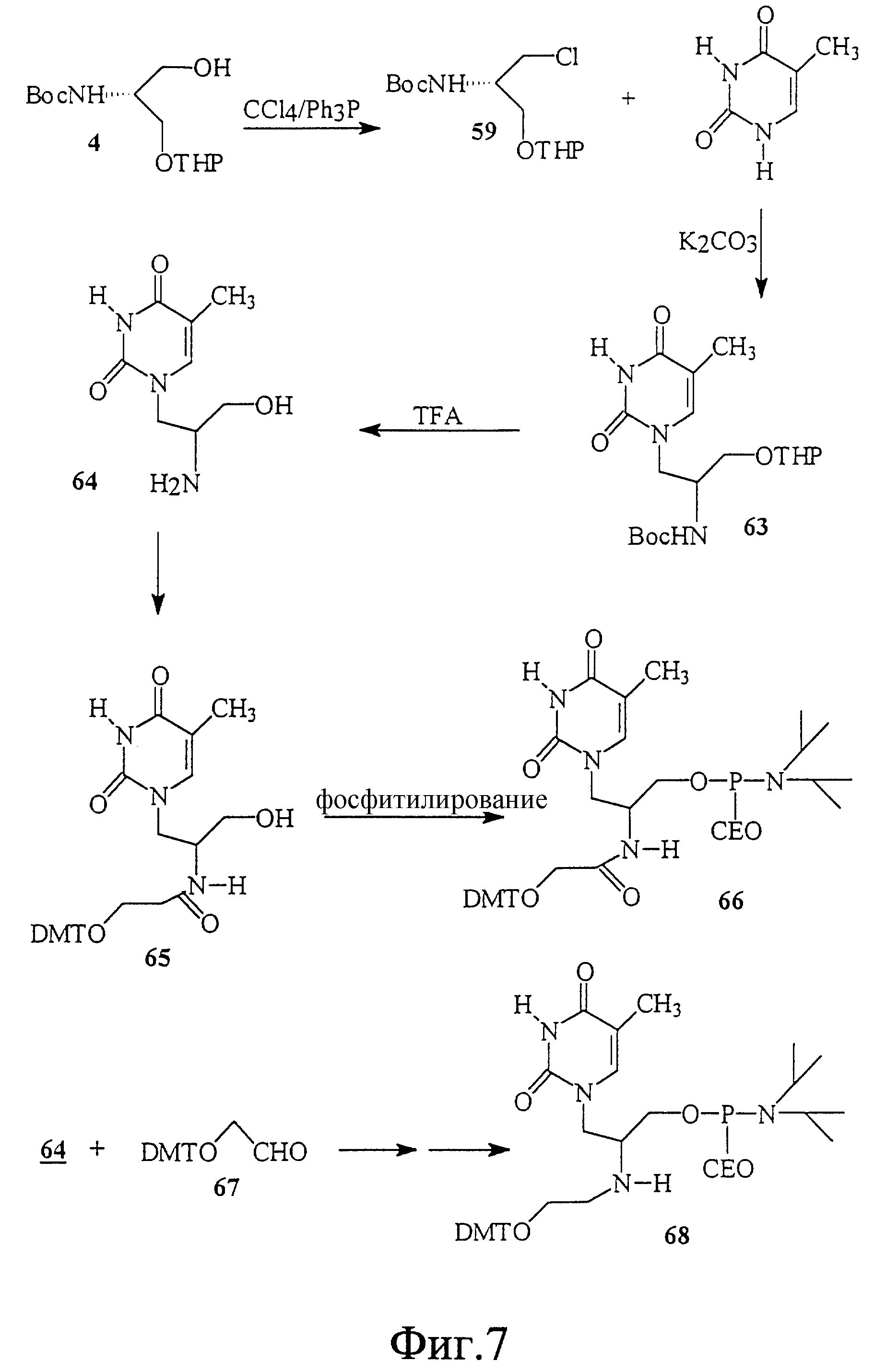
На фиг. 7 показан синтез связанного с L-серинолом тиминового мономерного фосфорамидита, в котором группа NH2 L-серина соединена с 2-гидроксиацетильной группой, и гидрокси-функция блокирована группой DMT. Этот строительный блок использован для 2'-5' соединения. На этом чертеже также показан синтез тиминового мономера, в котором NH2 группа L-серина соединена с 2'-гидроксиэтильной функцией.
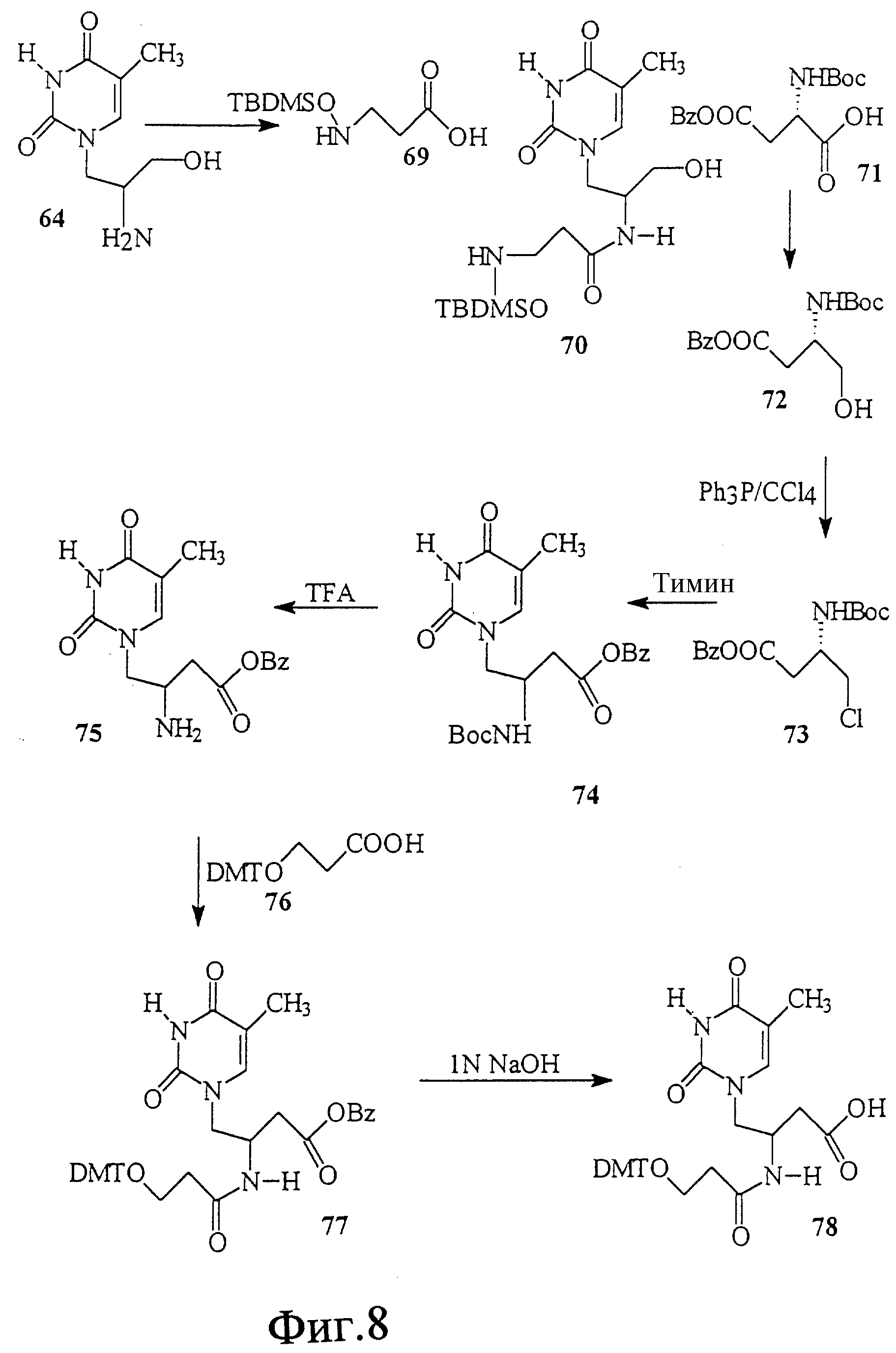
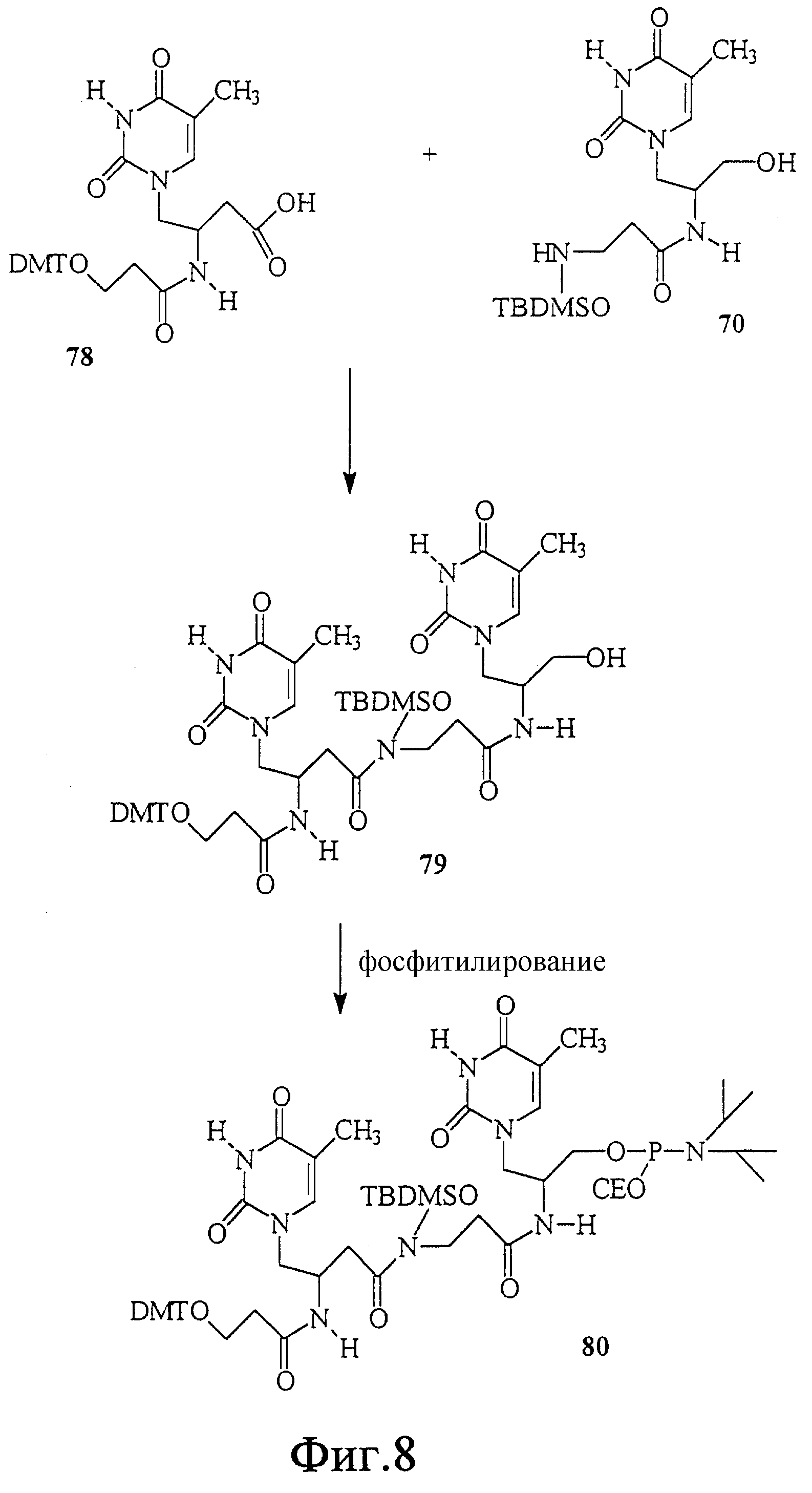
На фиг. 8 показан синтез Т-Т димера, имеющего гидроксаматный скелет с 2'-5' связью. В этом димере один строительный блок состоит из L-аспарагиновой кислоты и тимина, а другой - из L-серина и тимина. Этот димер имеет также две дополнительных амидных связи в скелете.
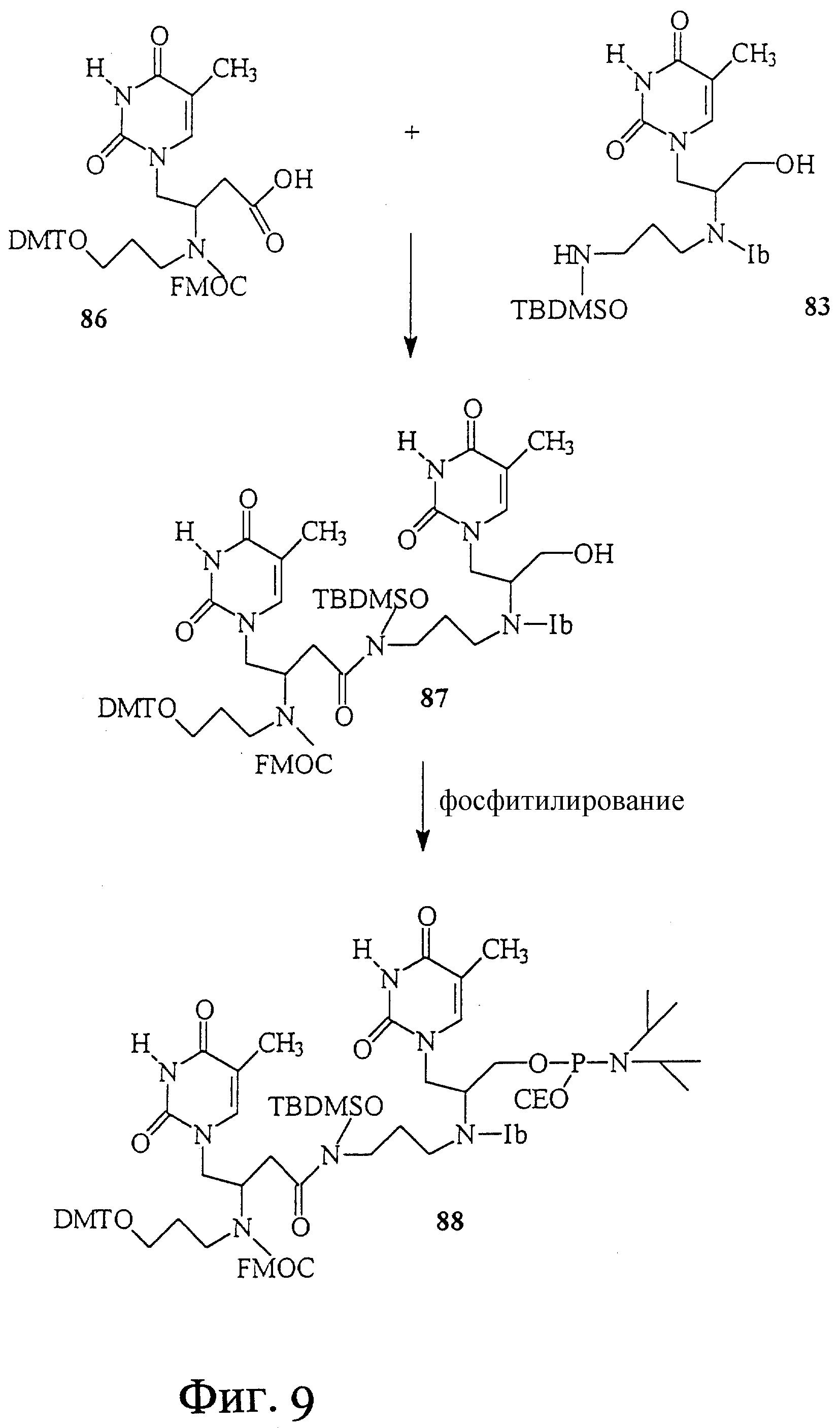
На фиг. 9 показан синтез Т-Т димера, имеющего гидроксаматный скелет с 2'-5' связью. В этом димере один строительный блок состоит из L-аспарагиновой кислоты и тимина, а другой - из L-серина и тимина. В этом димере отсутствует амидная связь в скелете.
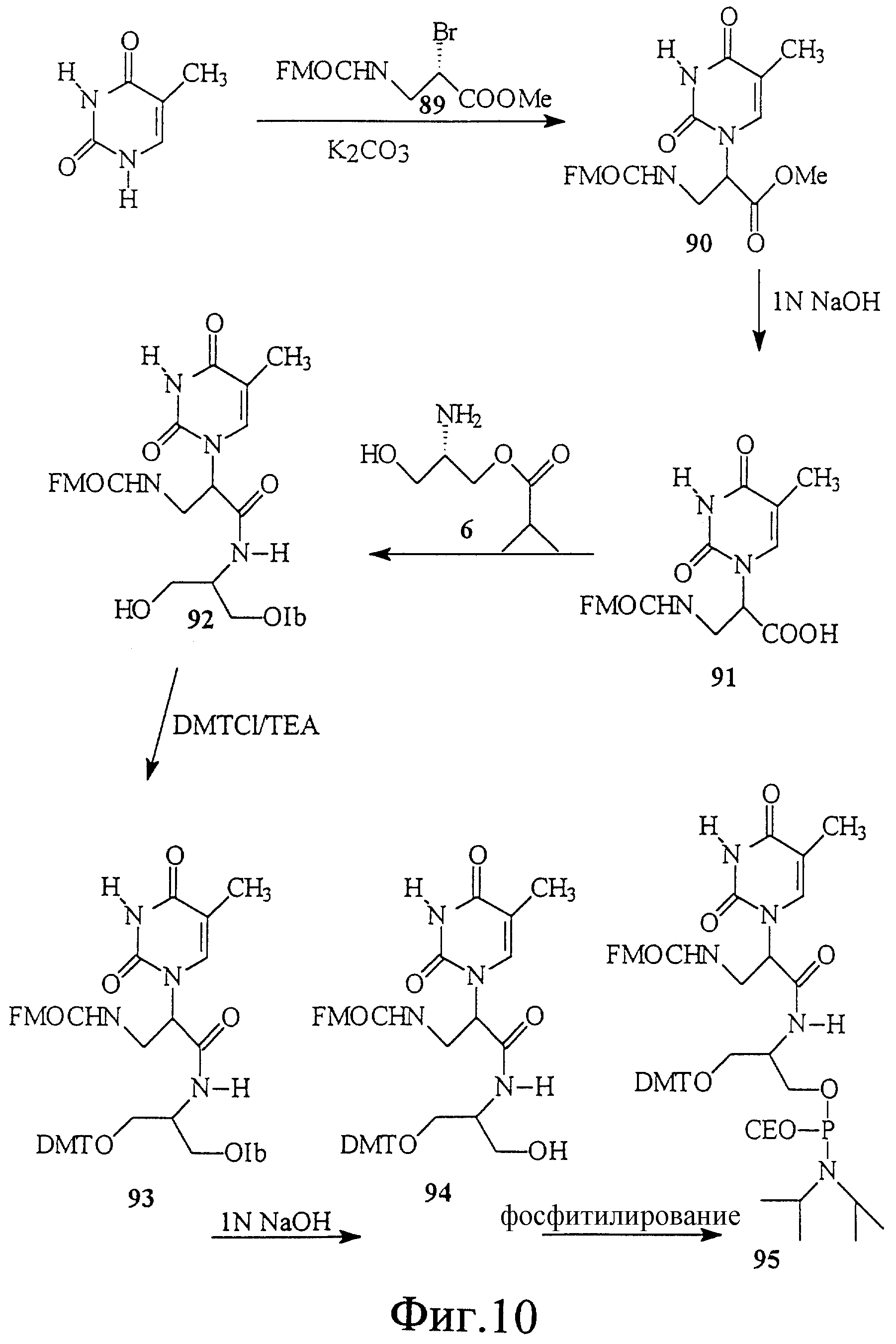
На фиг. 10 показан синтез связанного с L-серинол-β -аланином тиминового мономерного фосфорамидита, в котором β-аланин связывает тимин и серинол.
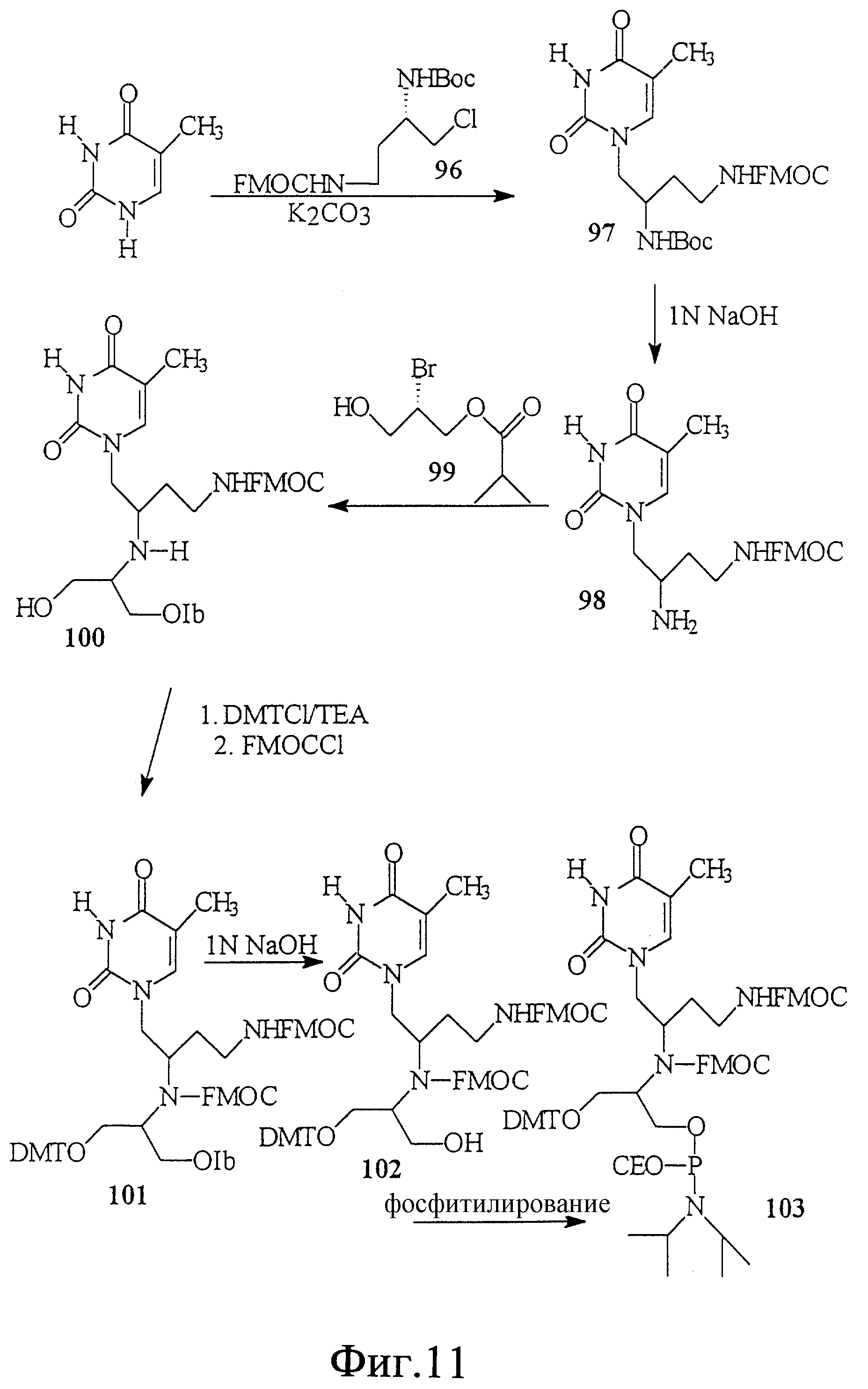
На фиг. 11 показан синтез связанного с L-серинол-алкиламином тиминового мономерного фосфорамидита, в котором алкиламин связывает тимин и серинол.
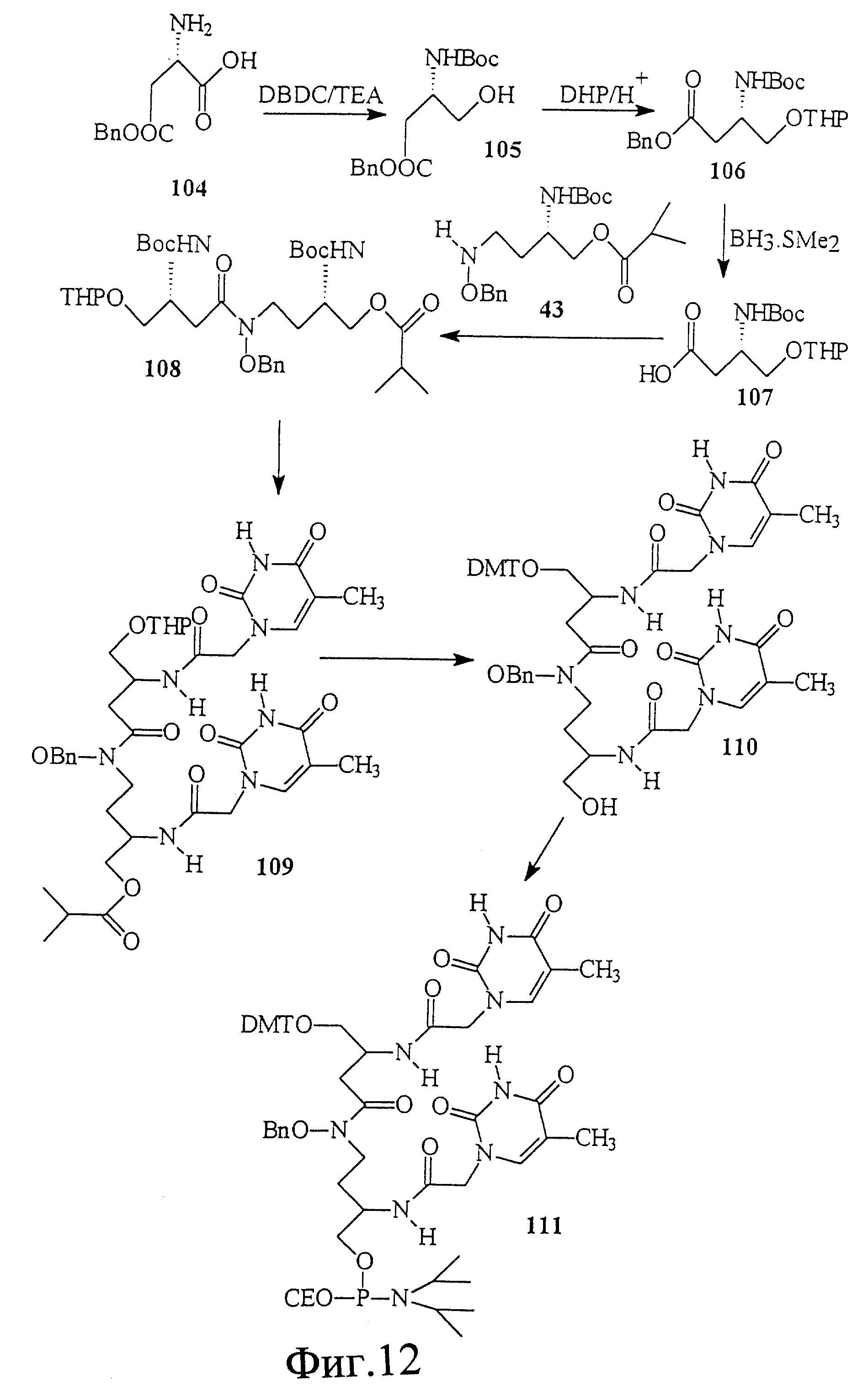
На фиг. 12 показан синтез Т-Т димера, имеющего гидроксаматный скелет с 4'-5' связью. В этом случае димер состоит из двух единиц L-аспарагиновой кислоты и двух тиминовых единиц с ацетиловым линкером между тимином и аспарагиновой кислотой.
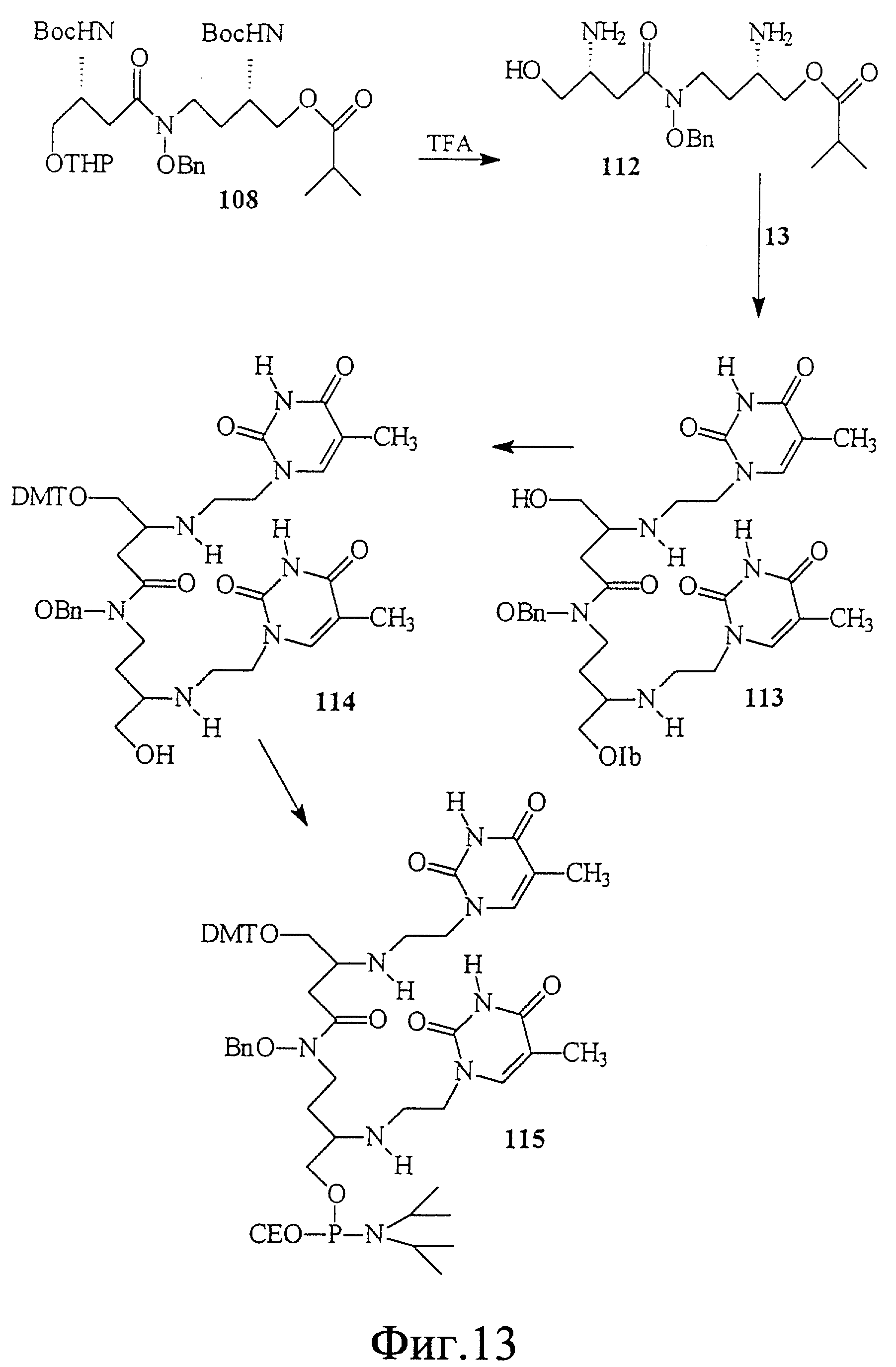
На фиг. 13 показан синтез Т-Т димера, имеющего гидроксаматный скелет с 4'-5' связью. В этом случае димер состоит из двух единиц L-аспарагиновой кислоты и двух тиминовых единиц с этиловым линкером между тимином и аспарагиновой кислотой.
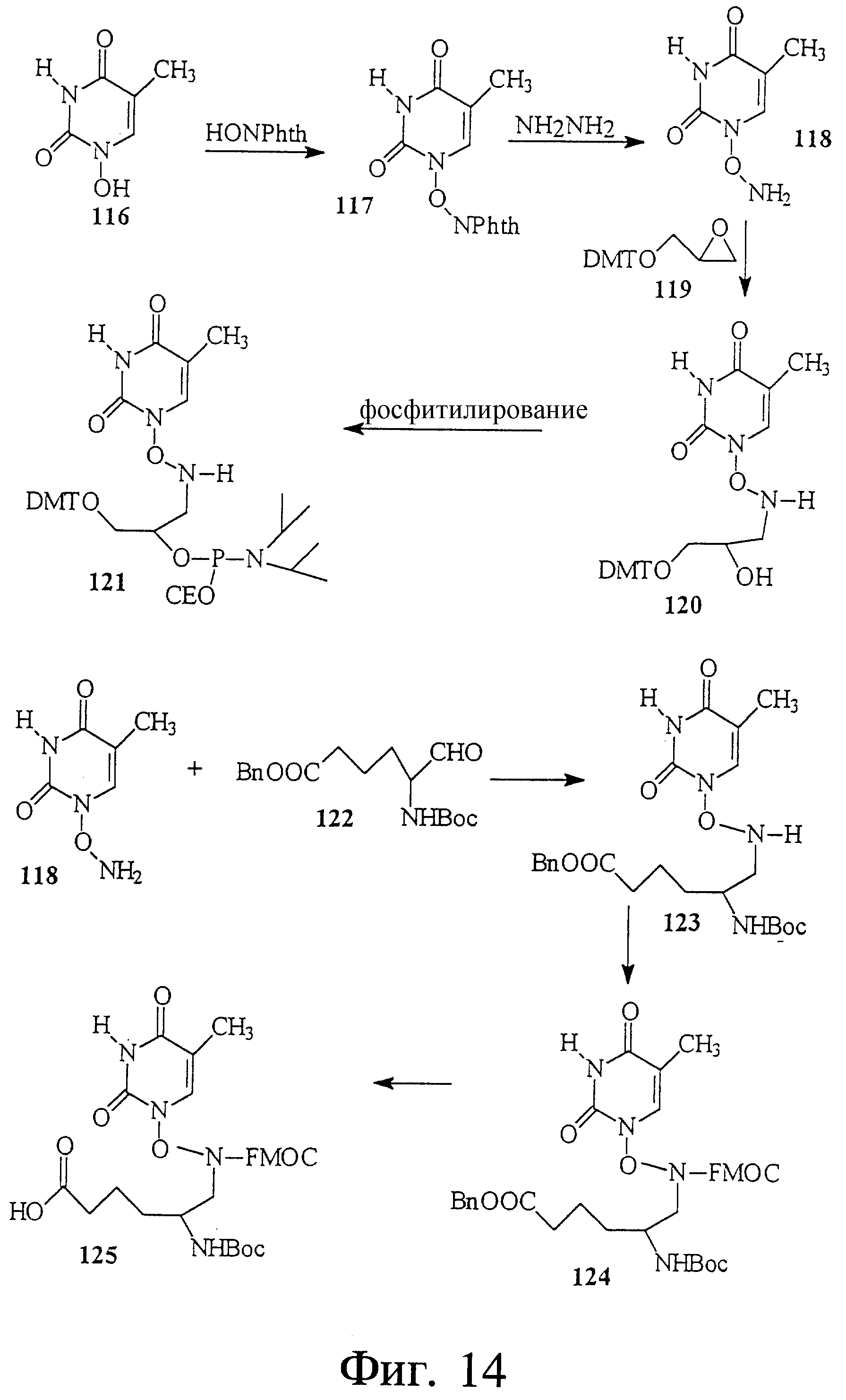
На фиг. 14 показан синтез связанного с N-гидроксаминовой кислотой тиминового строительного блока.
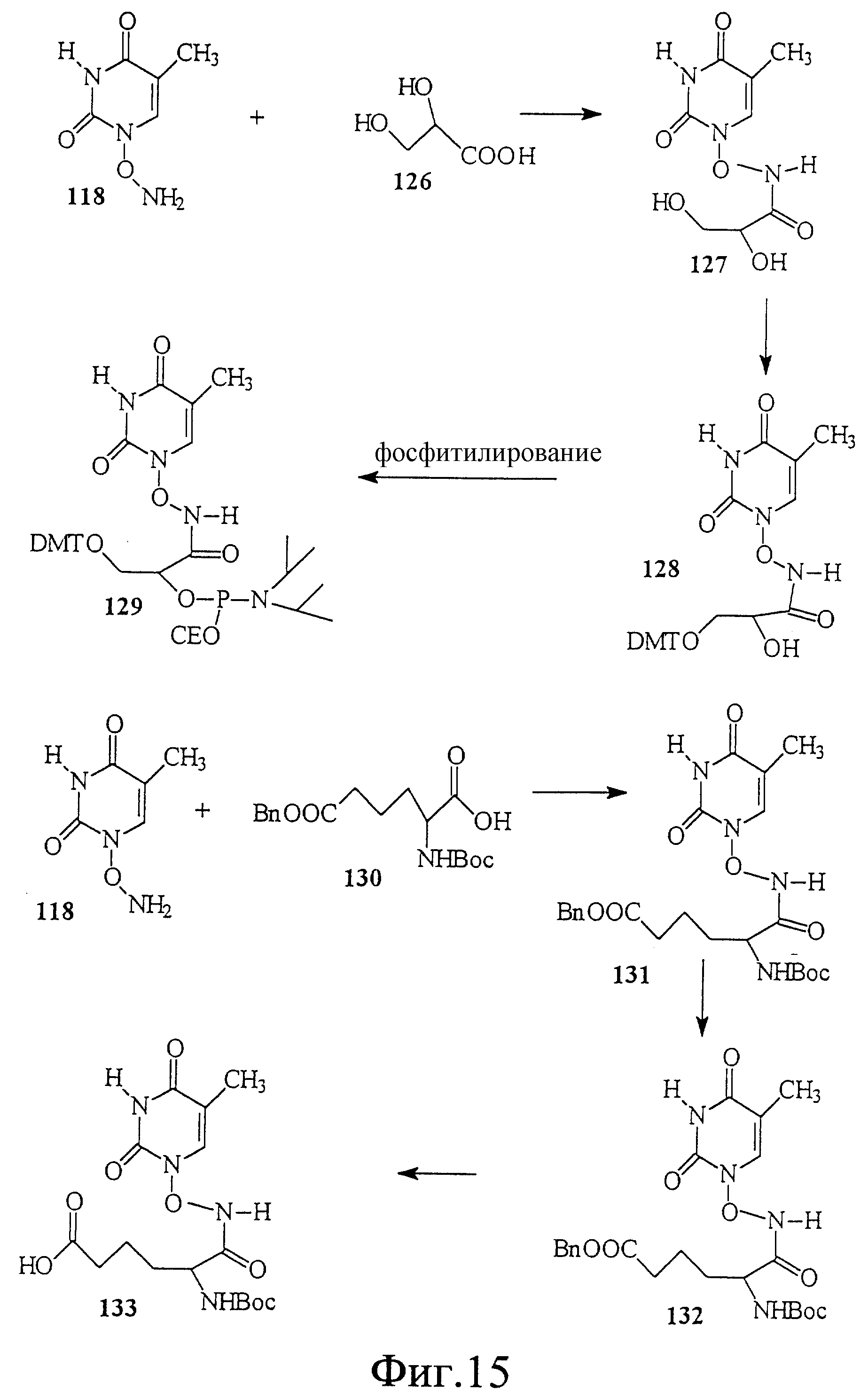
На фиг. 15 показан синтез связанного с L-аспарагиновой кислотой тиминового строительного блока с N-гидроксиламиновым линкером между тимином и аспарагиновой кислотой.
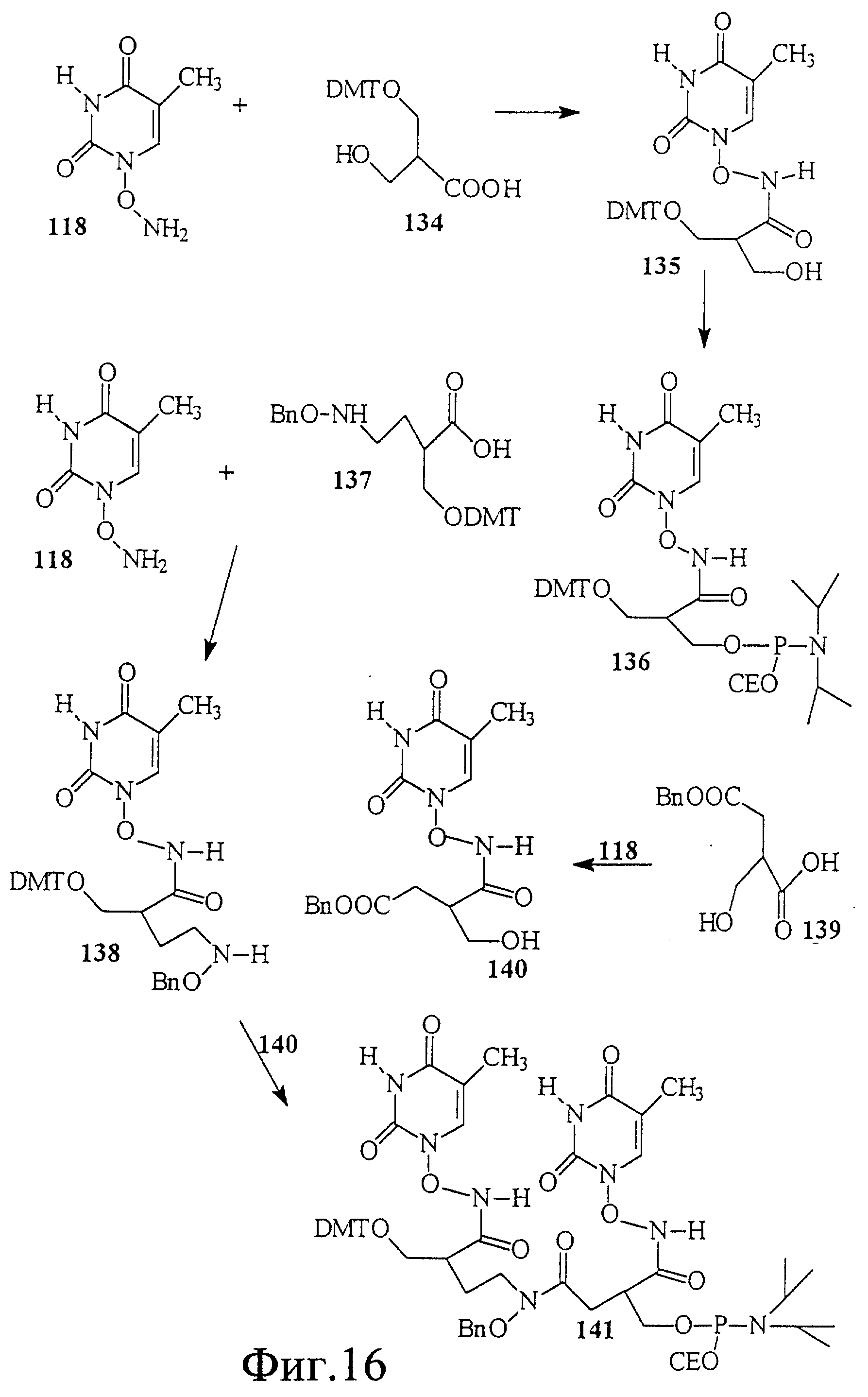
На фиг. 16 показан синтез Т-Т димера, имеющего гидроксаматный скелет с 4'-5' связью. В этом случае группа карбоновой кислоты связана с тиминовым строительным блоком через N-гидроксиламиновый линкер.
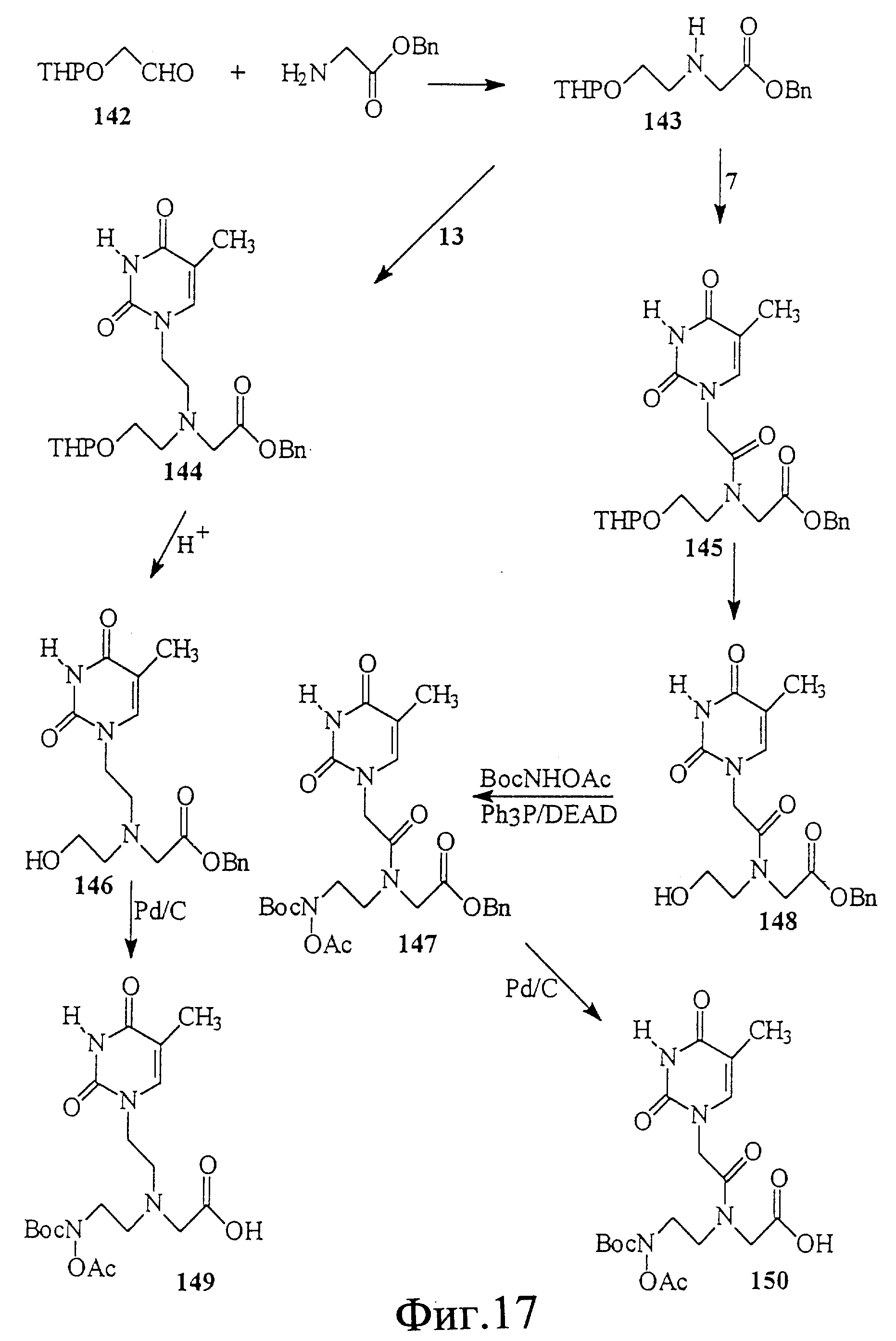
На фиг. 17 показан синтез тимидинуксусной кислоты, замещенной N-гидроксиламинокислотным строительным блоком 150 и его аналогом 149. Эти мономерные строительные блоки полезны для получения нуклеиновой кислоты с гидроксаматными скелетами.
На фиг. 18 показан синтез тимидинуксусной кислоты, замещенной гидроксиламином, содержащим аминокислотные строительные блоки 157 и 158. Эти мономеры полезны для получения нуклеиновой кислоты, имеющей амидный скелет с гидроксиламиновой функциональностью.
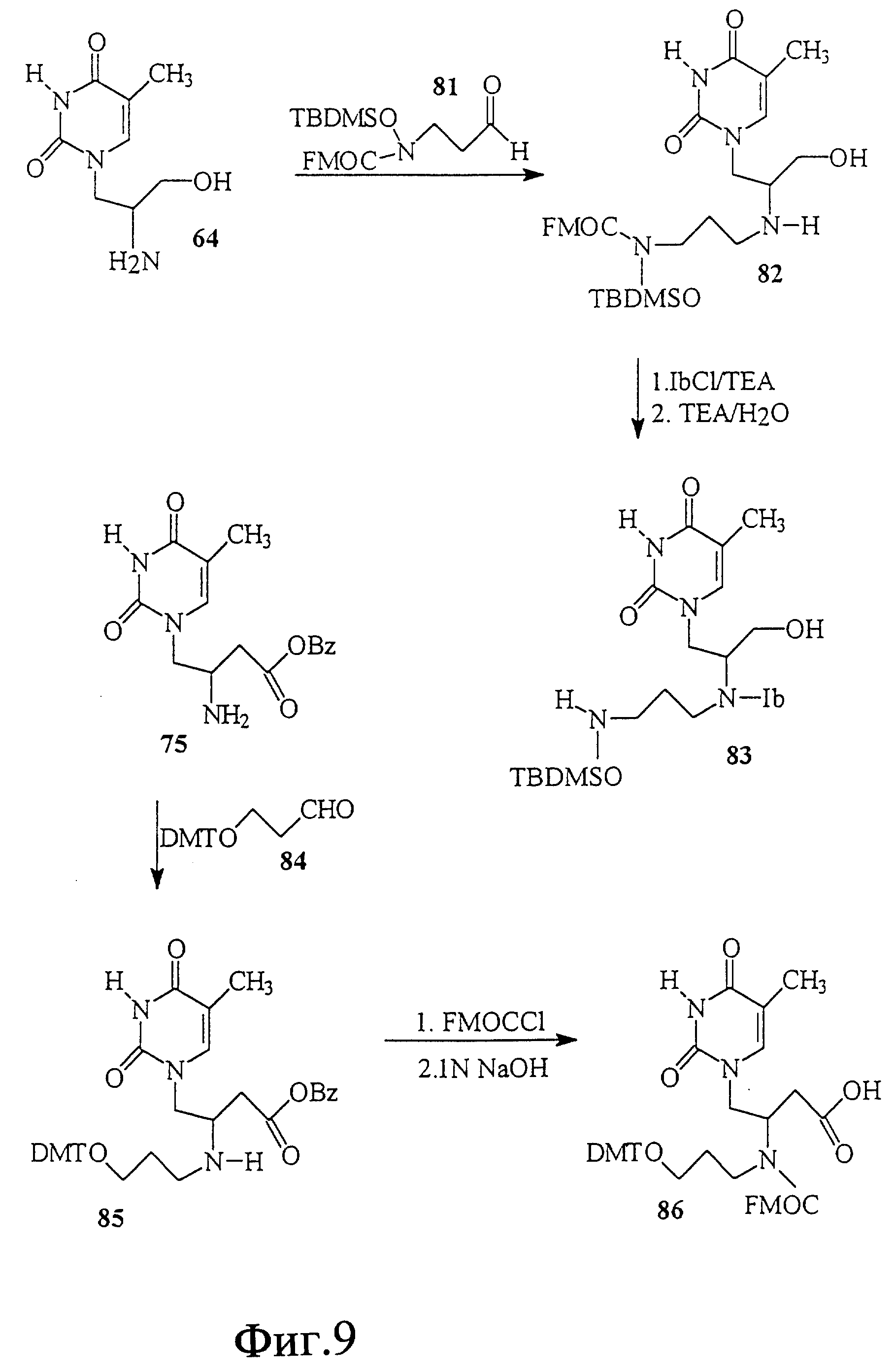
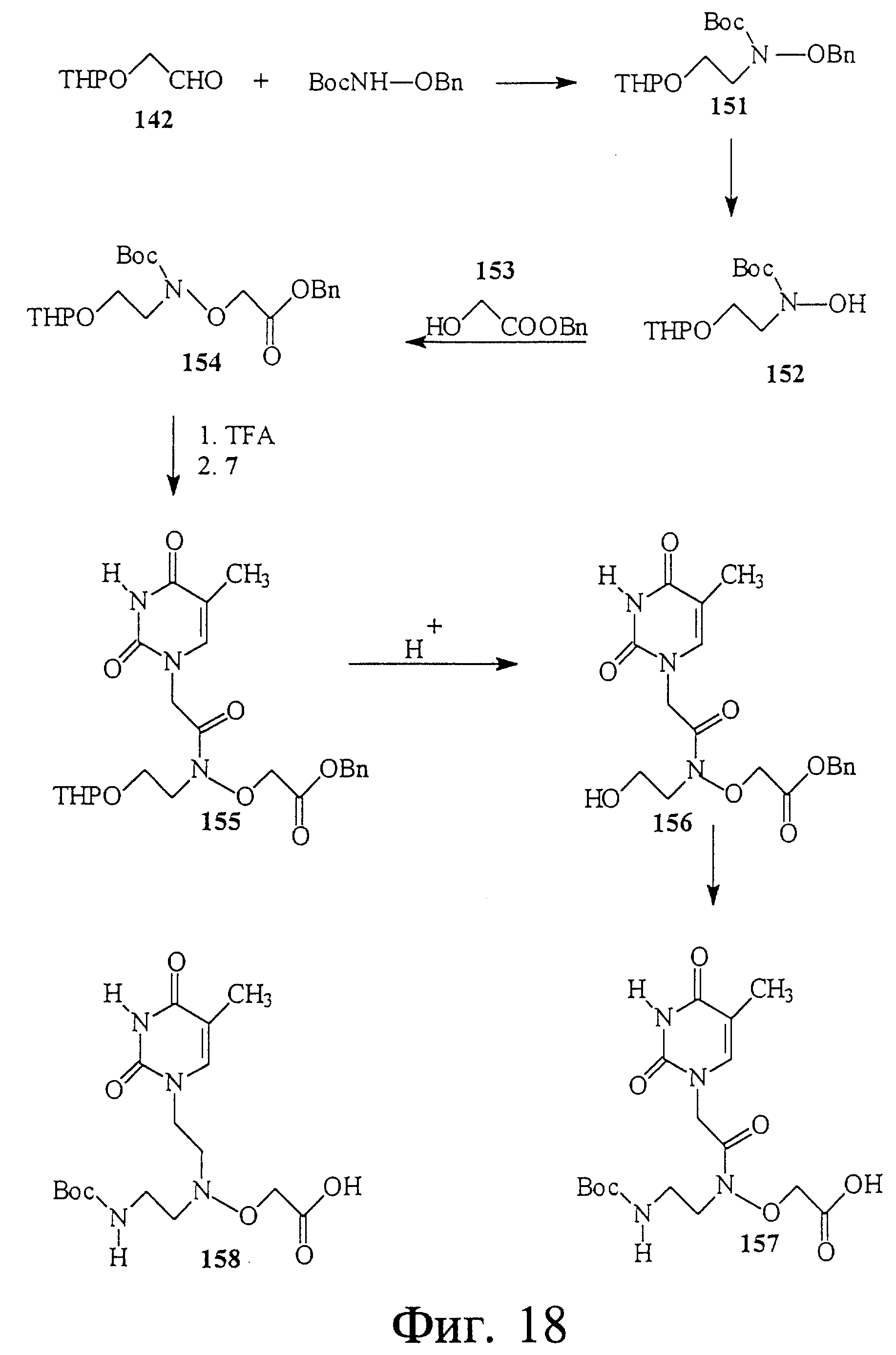
На фиг. 19 показан синтез связанного с L-серинолом тимидинового строительного блока 166, имеющего гидроксиламиновую группировку между тимином и серинолом. Этот строительный блок полезен для получения нуклеиновой кислоты со связями 4'-5'.
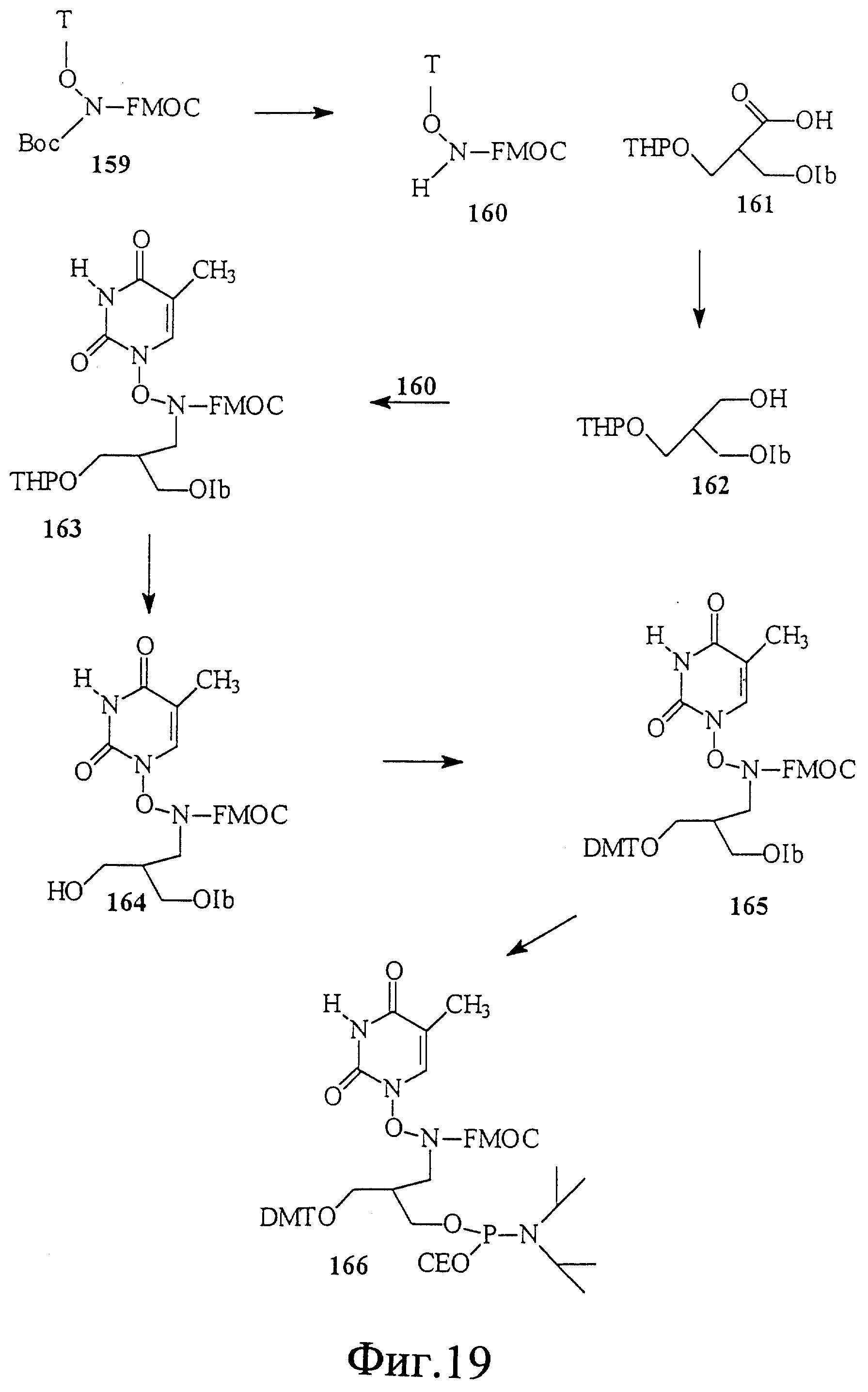
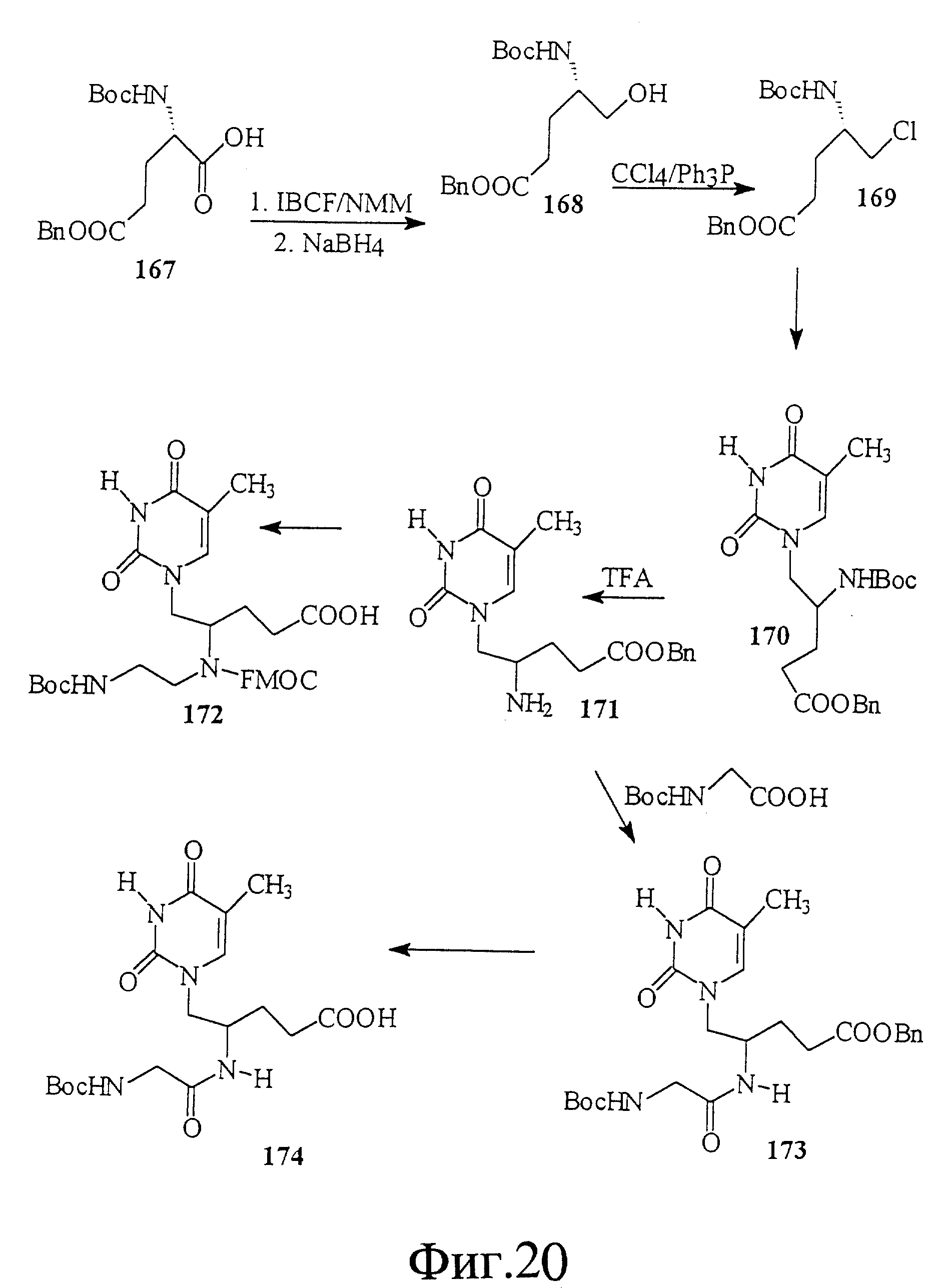
На фиг. 20 показан синтез связанного с глутаминовой кислотой-глицином тимидинового мономера 174. Этот мономерный строительный блок полезен для получения нуклеиновой кислоты с амидными скелетами и связями 2'-5'.
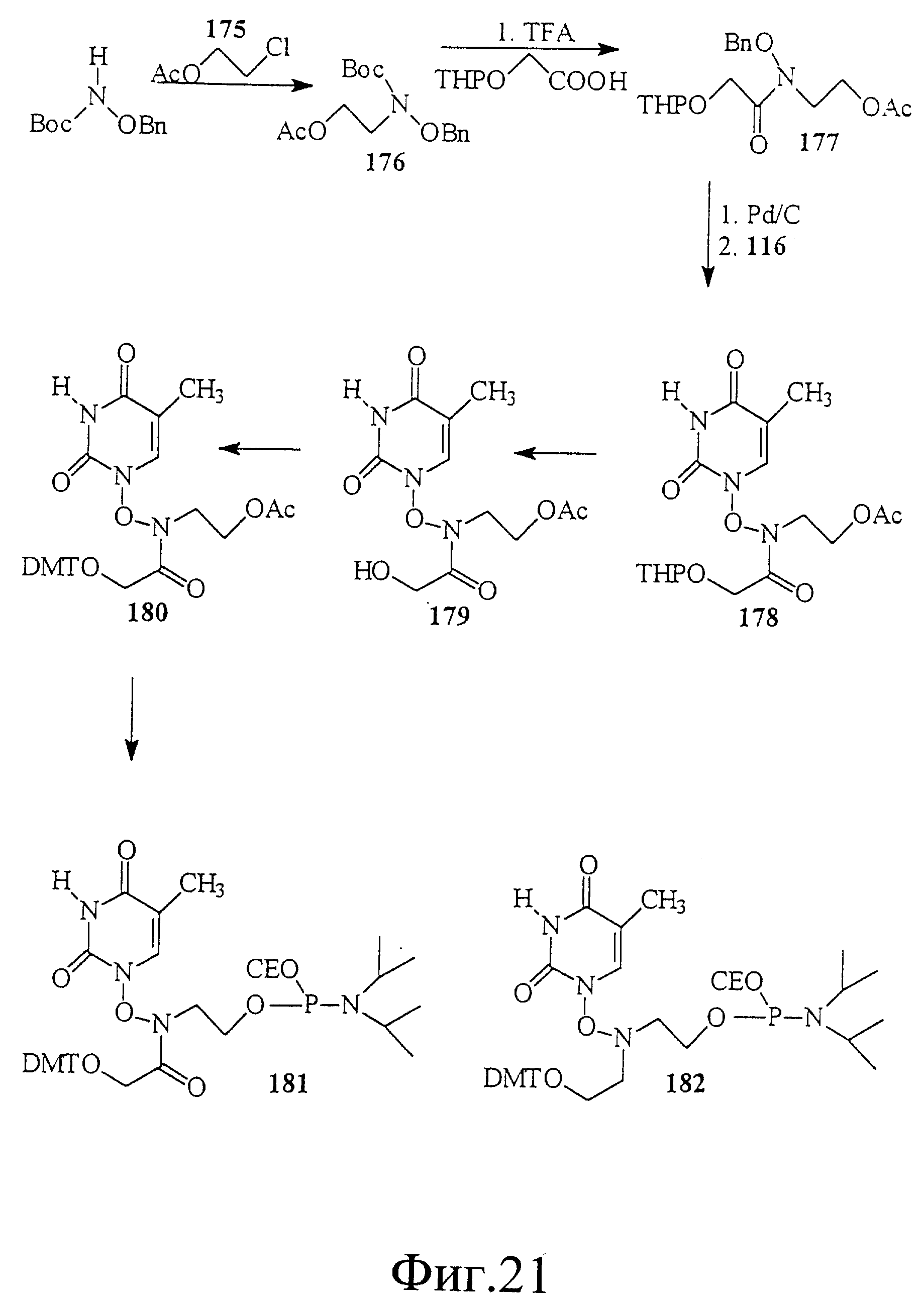
На фиг. 21 показан синтез связанного с глицинол-глицином тимидинового строительного блока 181 и 182, имеющего гидроксиламиновую группировку между тимином и глицинолом. Эти строительные блоки полезны для получения нуклеиновой кислоты со связями 2'-5'.
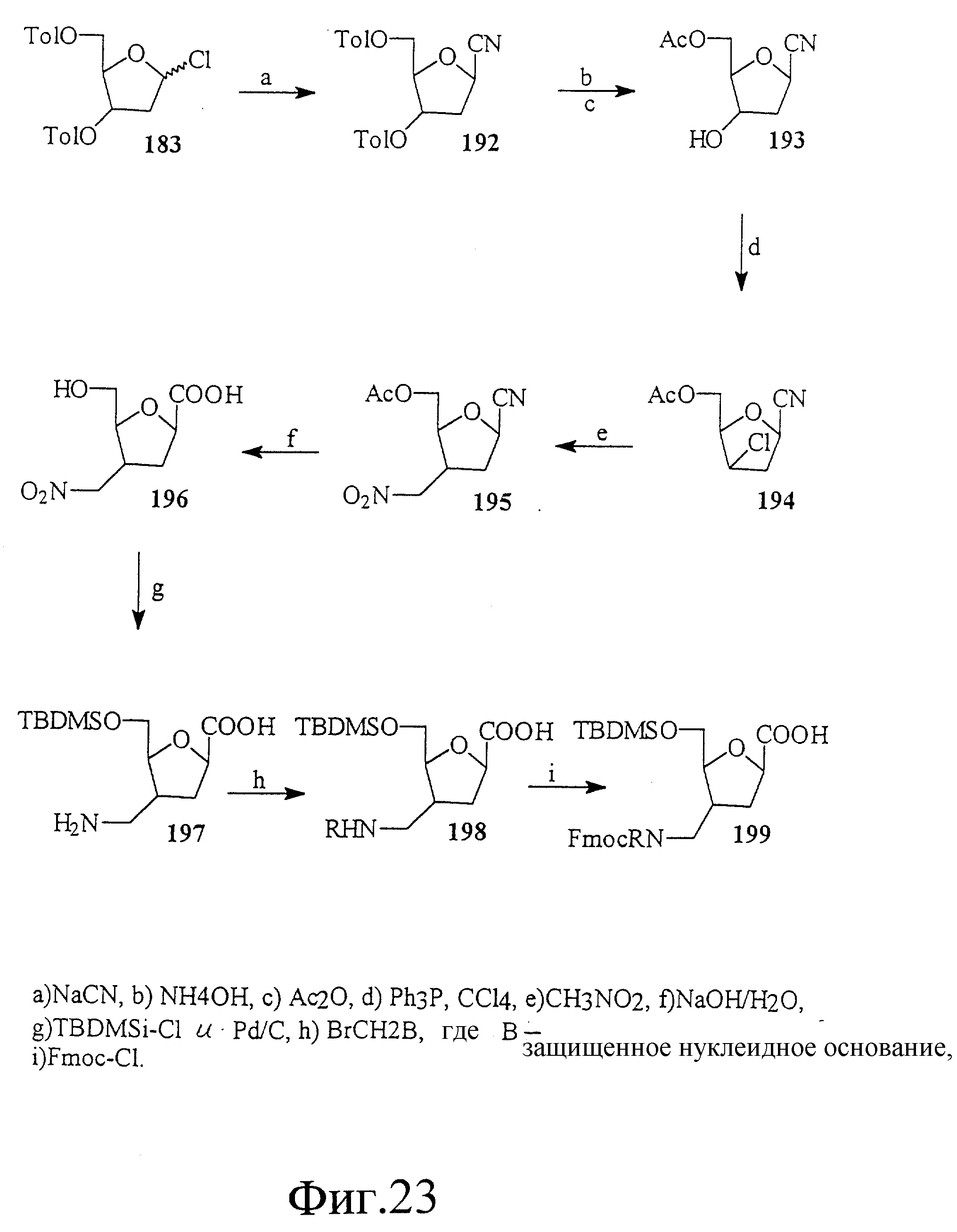
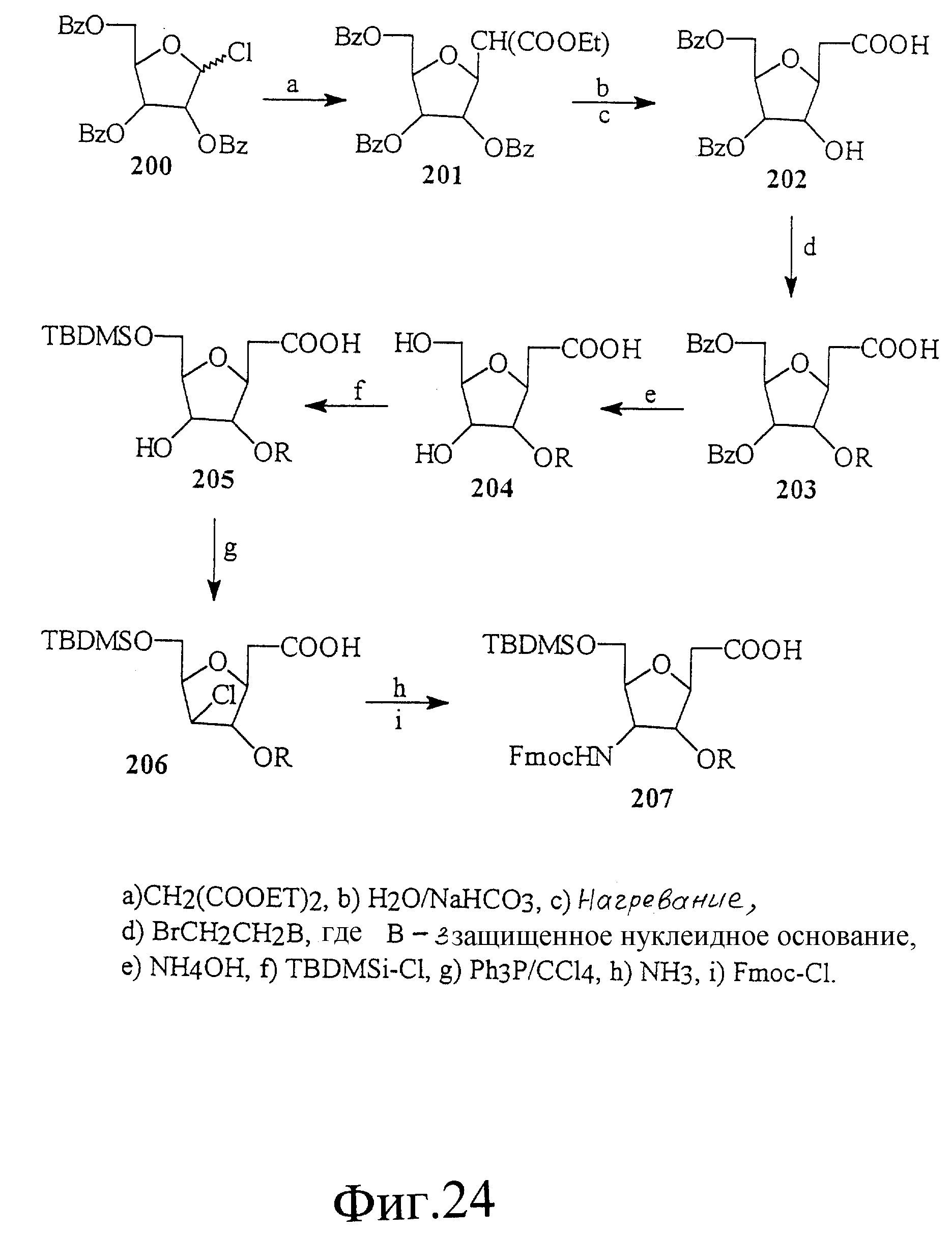
На фиг. 22-24 показан синтез связанных с рибозной аминокислотой тимидиновых строительных блоков 191, 199 и 207. Эти строительные блоки полезны для получения олигонуклеотидов, имеющих рибозоамидный скелет.
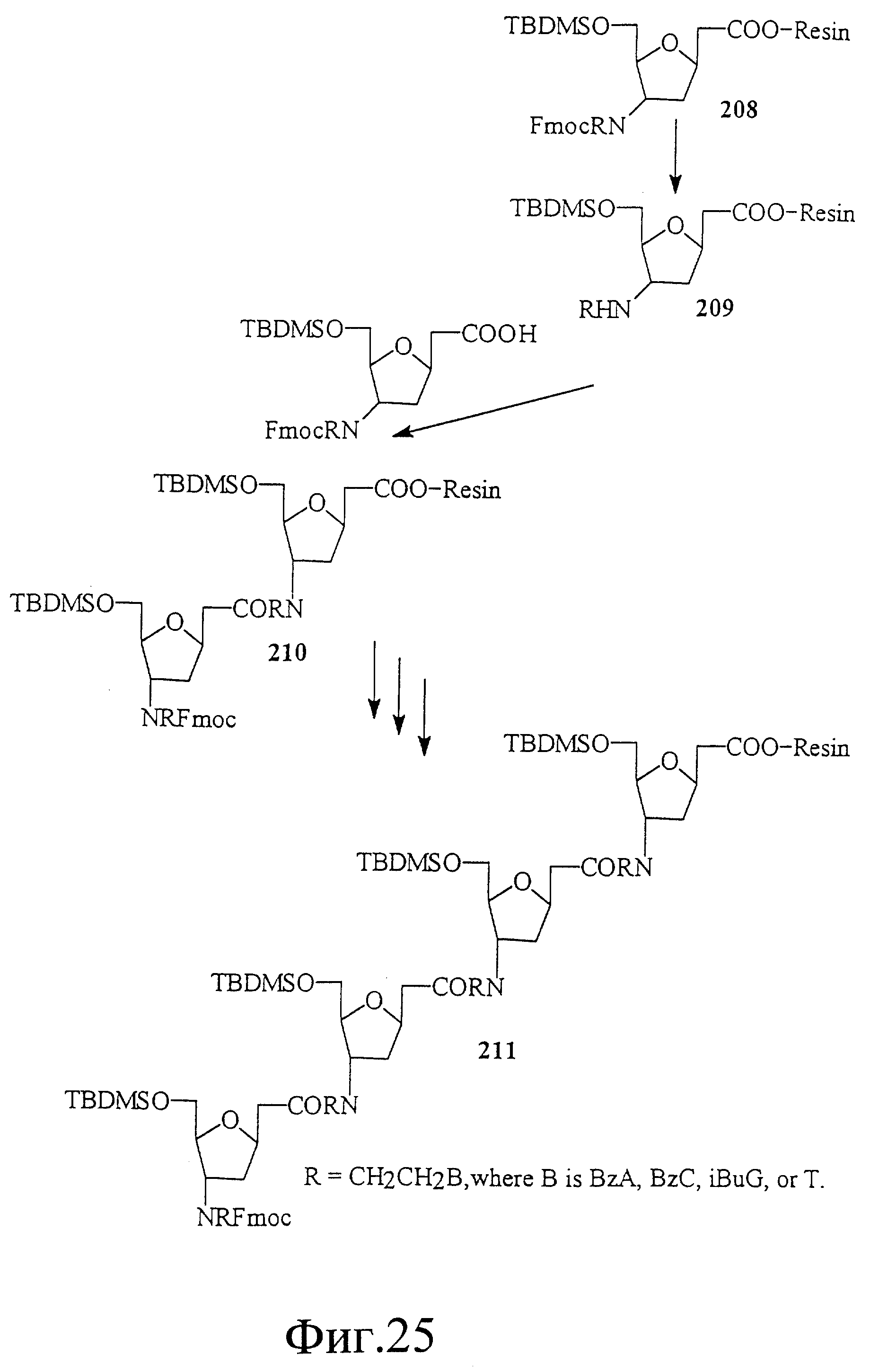
На фиг. 25 показан твердофазный синтез олигонуклеотида 211, имеющего рибозоамидный скелет.
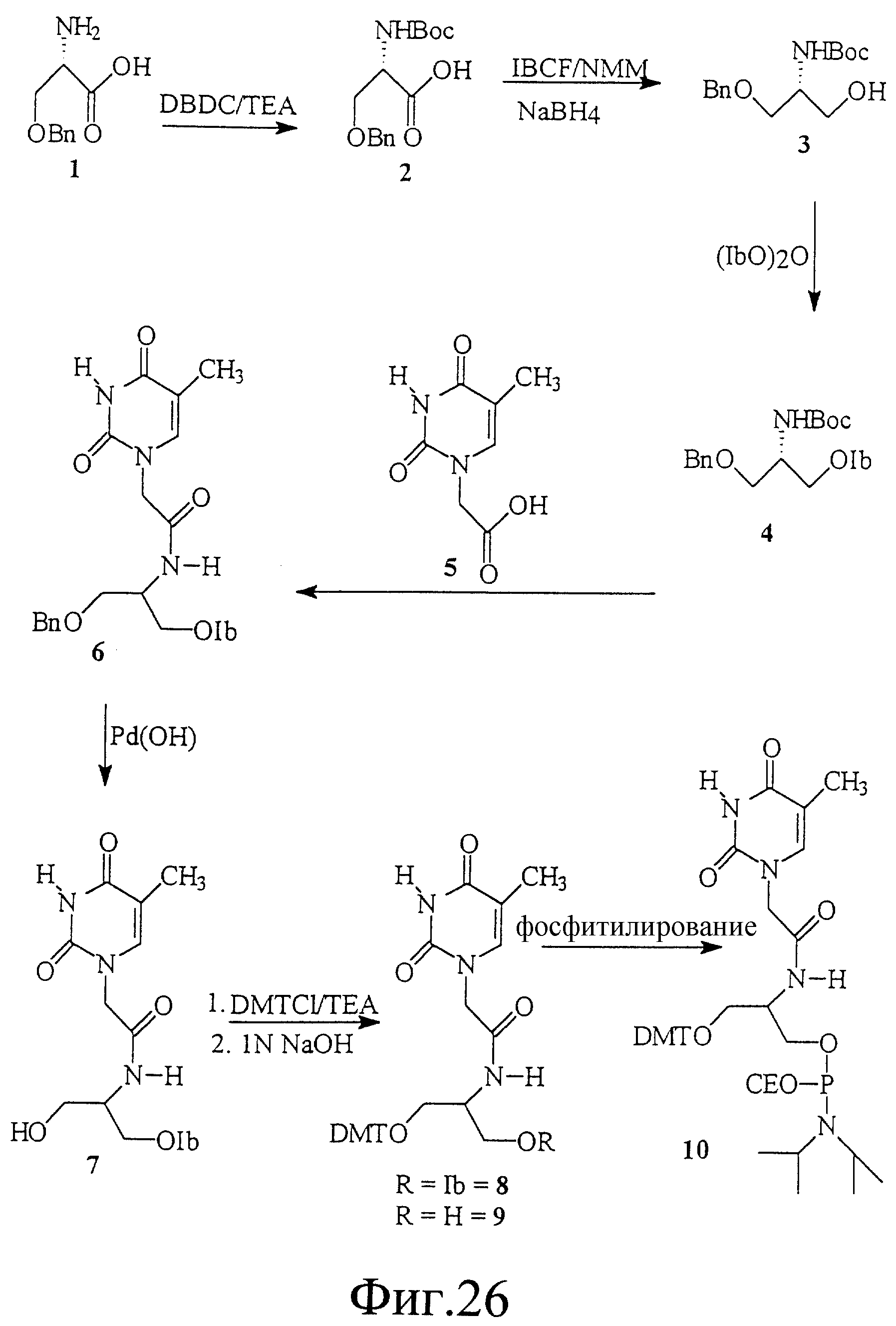
На фиг. 26 показан синтез 1-O-(4,4'-диметокси-тритил) -2- [амино(тиминилацетил)] -L-пропан-3-O-(N, N-диизопропил) -β-цианоэтилфосфорамидита.
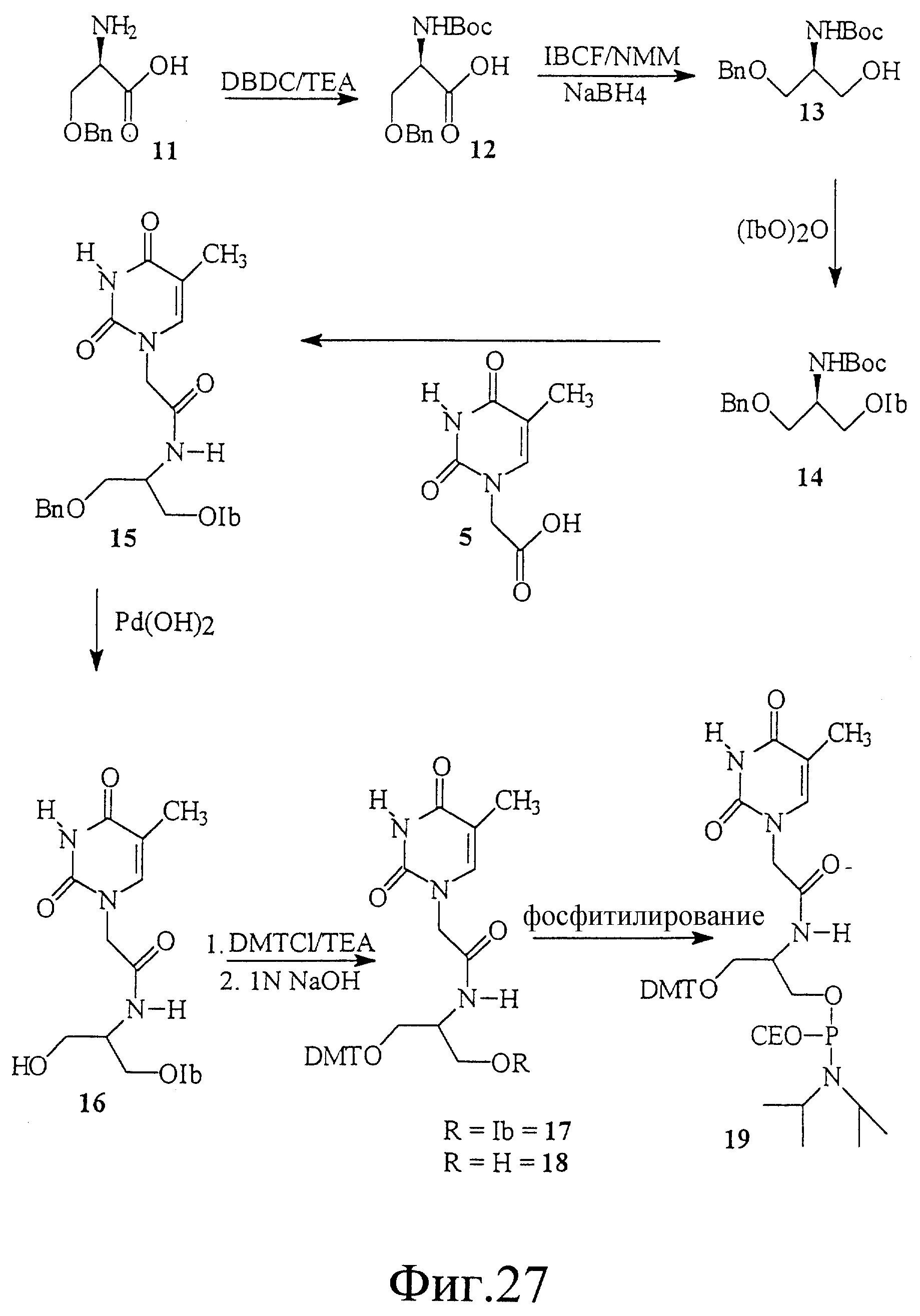
На фиг. 27 показан синтез 1-O-(4, 4'-диметокси-тритил)-2- [амино(тиминилацетил)]-D-пропан-3-O-(H,H-диизопропил) -β -цианоэтилфосфорамидита.
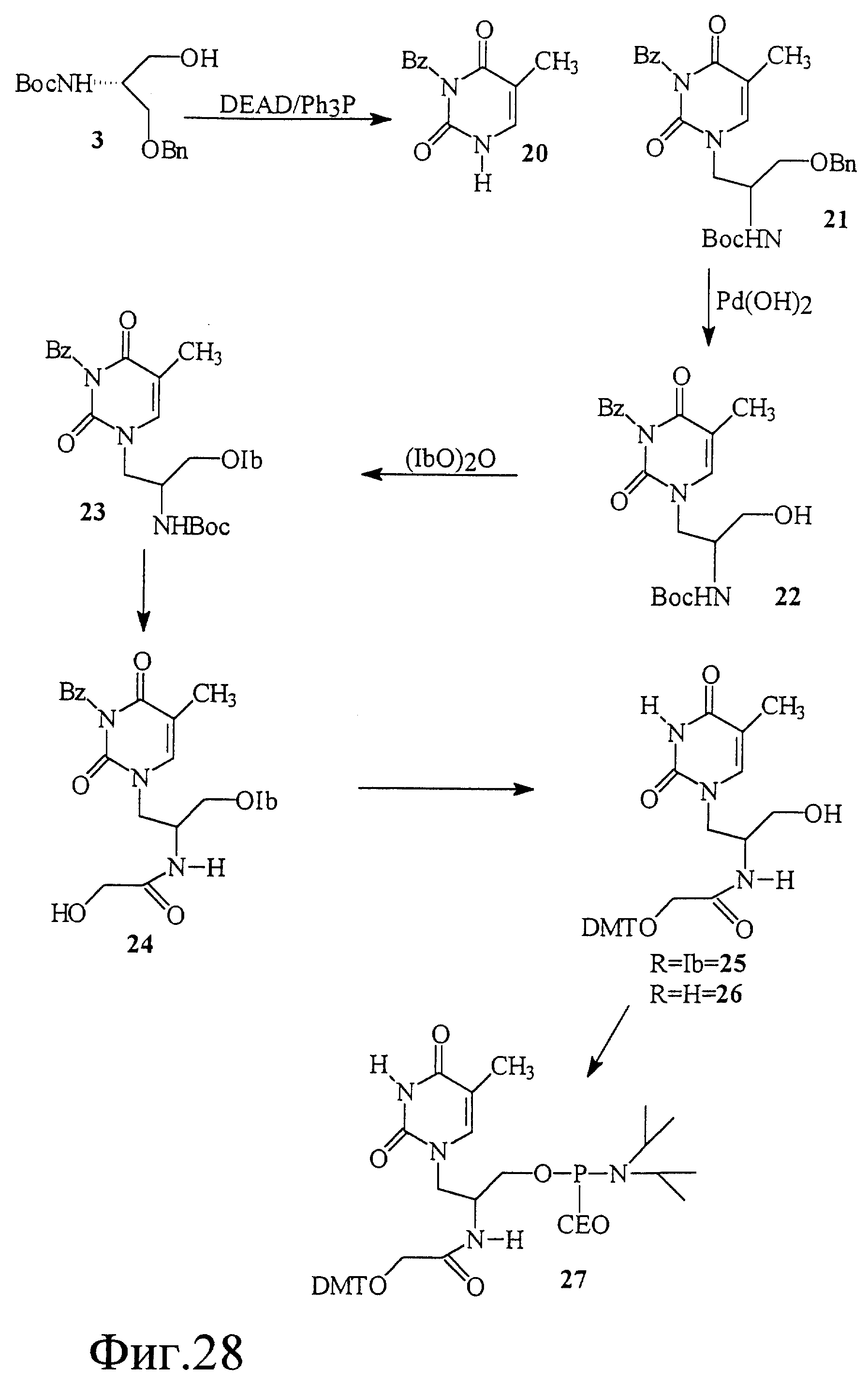
На фиг. 28 показан синтез 2-[(β-(4,4'-диметокси-тритил) -O-ацетил)амино] -3- тиминил-L-пропан-1 -O-(N,N-диизопропил) -β -цианоэтилфосфорамидита.
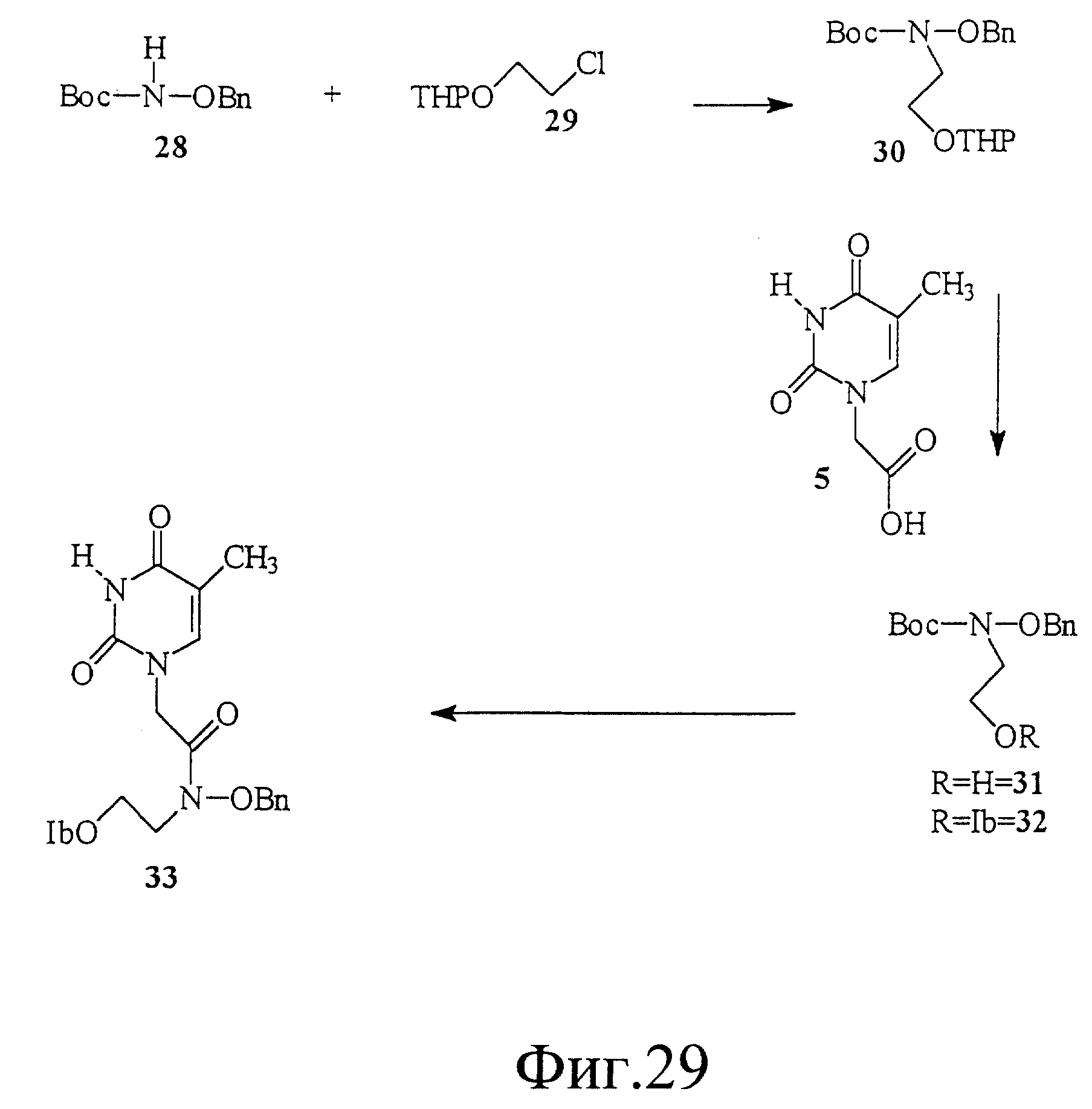
На фиг. 29 показан синтез N-(тиминилацетил)-N-[[(2-изобутирил) окси] этил] -O-бензилгидроксиламина.
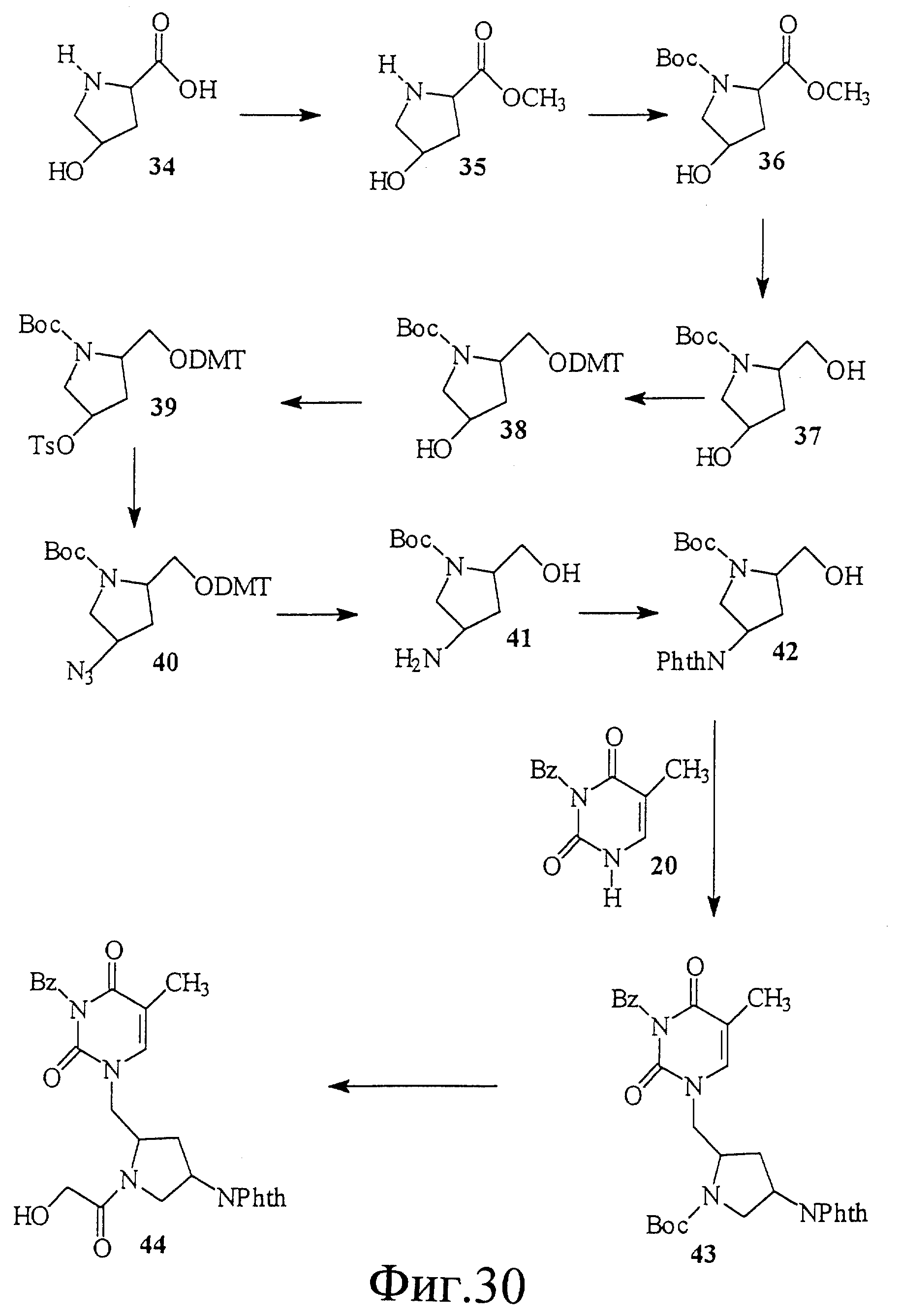
На фиг. 30 показан синтез (2R, 4S)-1-(трет-бутоксикарбонил)-2- [N3-бензоил(тимин-1-ил)]метил-4-фталимидо-пирролидина.
Детальное
описание конкретных воплощений
Определения и аббревиатуры
В настоящем изобретении использованы следующие ниже термины и подразумевается, что они определяют указанное ниже.
Используемый здесь термин "антисмысловая" терапия относится к введению или генерации in situ ДНК или РНК олигомеров или их аналогов, которые специфично связываются с комплементарной последовательностью нуклеиновой кислоты-мишени. Это связывание может происходить путем традиционного комплементарного спаривания оснований либо с помощью другого механизма, например, в случае связывания ДНК-дуплексов, с помощью специфических взаимодействий в большой бороздке двойной спирали. В общем случае термин "антисмысловой" относится к ряду приемов, в основном используемых согласно данному описанию в уровне техники, и включает любую терапию, основывающуюся на специфическом связывании с олигонуклеотидными последовательностями. Эти приемы антисмыслового регулирования генов хорошо известны специалисту в области молекулярной биологии, описания антисмыслового регулирования генов приведены, например, в патенте США 5107065, патенте США 5166195, патенте США 5087617 и Crooke, Annual Review Pharmacology Toxicology 1992 32; 329-376.
Термины "олигомер" или "олигонуклеотид" применяются как взаимозаменимые и включают в себя встречающиеся в природе соединения, такие как РНК или ДНК, а также их синтетические аналоги, включая соединения по изобретению. Если не указано другое термины "олигомер" и "олигонуклеотид" относятся как к ДНК/РНК, так и к их синтетическим аналогам. Термин "олигомер" применяют к соединениям, содержащим два или большее число нуклеомономеров, ковалентно присоединенных друг к другу с помощью фосфодиэфирной связи или других заменяющих связей. Если не указано иное, термин "олигомер" не следует понимать как ограничивающий длину. Таким образом, олигомер может иметь всего лишь два ковалентно увязанных нуклеомономера (димер), либо быть значительно длиннее. Олигомеры могут быть связаны компетентно и, таким образом, образовывать пары с однонитевой или двунитевой последовательностями нуклеиновых кислот. Олигомеры (например димеры - гексамеры) также могут быть использованы в качестве синтонов для более длинных олигомеров, как описано ниже. Олигомеры могут содержать сайты, не являющиеся основаниями, и псевдонуклеозиды.
Олигомеры включают в себя олигонуклеотиды, олигонуклеозиды, полидезоксирибонуклеотиды (содержащие 2'-дезокси-D-рибозу или ее модифицированные формы), то есть ДНК, полирибонуклеотиды (содержащие D-рибозу или ее модифицированные формы), то есть РНК, и любой другой тип полинуклеотидов, являющихся N-гликозидами или C-гликозидами пуриновых или пиримидиновых оснований или модифицированных пуриновых или пиримидиновых оснований.
Подразумевается,
что олигомеры, как здесь используется этот термин, также включают в себя соединения, в которых соседние
нуклеомономеры связаны через гидроксаматные связи. Элементы, обычно присутствующие в олигомерах,
такие как фуранозное кольцо и/или фосфодиэфирная связь, могут быть заменены любым подходящим
функционально эквивалентным элементом. Подразумевается, что термин "олигомер" включает в себя любую
структуру, которая служит каркасом или поддержкой для оснований, причем этот каркас позволяет
осуществлять связывание с нуклеиновыми кислотами-мишенями последовательность-зависимым образом.
Традиционные известные олигомеры могут быть разделены на четыре группы, которые характеризуются как
имеющие
(1) связи в виде фосфодиэфиров или аналогов фосфодиэфиров (фосфоротиоатов,
метил-фосфонатов и т.д.),
(2) заменяющие связи, которые содержат нефосфорные изостеры (рибоацеталь,
формацеталь, карбамат и т.д.),
(3) морфолиновые остатки, карбоциклические остатки
или другие фуранозные сахара, такие как арабиноза или гексоза, вместо рибозы или дезоксирибозы,
(4) нуклеомономеры, связанные через амидные связи, или ациклические нуклеомономеры, связанные
через любую подходящую заменяющую связь.
Термин "нуклеомономер", используемый здесь,
относится к группировке, содержащей
(1) основание, ковалентно связанное с
(2)
второй группировкой.
Нуклеомономеры включают в себя нуклеозиды, нуклеотиды или основания, присоединенные к аминоспирту. Нуклеомономеры могут быть связаны с образованием олигомеров, которые связывают мишени или комплементарные последовательности оснований нуклеиновых кислот последовательность-специфичным образом.
"Вторая группировка", как используется здесь, относится к соединению, соединенному с нуклеомономером, и включает в себя аминокислотную/аминоспиртовую группировку, обычно серинол, аспарагиновую кислоту, глутаминовую кислоту, глицин, и те виды, которые содержат модификации аминокислотной группировки, например в которых один или большее число водородов заменено другой функциональностью (смотри формулы 24-41), или одна карбоновая кислота превращена в функцию спирта, аминов, тиолов, гидроксиламинов и т.п. Нуклеомономеры, как определено здесь, также включают в себя основания, связанные с аминокислотами или аминоспиртами и/или аналогами аминокислот/спиртов, имеющих свободную карбоксильную/гидроксильную группу и/или свободную аминогруппу и/или их защищенные формы.
Термин "нуклеозид", как используется здесь, относится к его аминокислотным и аминоспиртовым производным, как описано ниже, несущим пурин, пиримидин, или их аналоговым формам, как определено ниже, но в которых отсутствует связывающая группировка, такая как аналог фосфодиэфира или модифицированная межнуклеотидная связь. Под "5'" нуклеозидом подразумевают нуклеозид, обеспечивающий возможность связывания линкера по 5' углероду. "5'" конец линкера связывается с 5' нуклеозидом. "3'" конец линкера связывается с 3' положением следующего нуклеозида. Если присутствует модифицированный нуклеозид, который не включает именно 3' и/или 5' углерод, то для специалиста должно быть понятно, что эта "3'" и "5'" терминология для описания полярности нити используется по аналогии с ДНК и РНК.
Термин "нуклеозид", как использовано здесь, относится к основанию, ковалентно присоединенному к аналогу аминоспирта/аминокислоты и содержащему линкер между основанием и аминокислотой/аминоспиртом. Термин нуклеозид естественно включает рибонуклеозиды, дезоксирибонуклеозиды или любой другой нуклеозид, являющийся N-гликозидом или С-гликозидом основания.
Термин "нуклеотид", как использовано здесь, относится к нуклеозидам, имеющим фосфатную группу или аналог фосфата (группы с фосфором в той же степени окисления, как в фосфатной группе, например тиофосфат, амидат).
Термин "основание", как использовано здесь, относится к широкому ряду нуклеозидных оснований, включая пуриновые, пиримидиновые гетероциклы и аналоги гетероциклов и их таутомеры. Пурины включают в себя аденин, гуанин и ксантин, примером аналога пурина является 8-оксо-N6-метиладенин и 7-деазаксантин. Пиримидины включают в себя урацил и цитозин и их аналоги, такие как 5-метилцитозин, 5-(1-пропинилурацил), 5-(1-пропинилцитозин), 5-метилурацил и 4,4-этанцитозин. Когда "основания" включены в подходящую молекулярную рамку считывания, например фосфодиэфирный скелет, они способны принимать участие в спаривании оснований, которое имеет место в двунитевой ДНК или других двунитевых нуклеиновых кислотах со сходными структурами. Основания также способны принимать участие в спаривании оснований в нуклеиновой кислоте с тройной спиралью.
Термин "модификация сахара", как использован здесь, относится к любому остатку аминокислоты или аминоспирта, кроме 2'-дезоксирибозы.
Термин "амино кислота/спирт", как использован здесь, относится к любым природным аминокислотам и спиртам, как "R'", так и "S'" изомерам.
Термин "нуклеозидные связи", как использован здесь, относится к связи, которая существует внутри мономера.
Термин "связь", как использован здесь, относится к группировке, которая используется для соединения основания с аминокислотой/аминоспиртом и их производными.
Термин "межнуклеотидные связи", как использован здесь, относится к фосфодиэфирной группировке (-O-Р(O)(O)O-) или любой другой функционально эквивалентной группировке, которая ковалентно связывает соседние нуклеомономеры.
Термин "заменяющие связи", как использован здесь, относится к любому аналогу нативной группы или любой подходящей группировке, которая ковалентно связывает соседние нуклеомономеры. Заменяющие связи включают в себя аналоги фосфодиэфиров, например, такие как фосфотиоаты и метилфосфонаты, и не содержащие фосфора связи, такие как амиды, гидроксаматы, гидроксиламин. Заменяющие связи включают в себя не содержащие фосфора связи (2',5' связи, 3',5' связи, 4',5' связи) по изобретению.
Термин "перекрестносшивающая группировка", как использован здесь, относится к группе или группировке в олигомере, которая образует ковалентную связь с нуклеиновой кислотой-мишенью. Перекрестносшивающая группировка включает в себя ковалентно сшивающие виды, которые ковалентно связывают олигомер с нуклеиновыми кислотами-мишенями либо спонтанно (например N4, N4 -этаноцитозин) или с помощью фотоактивации (например псорален) и т. п.
Термин "блокирующие группы", как использован здесь, относится к заместителям, кроме H, которые ковалентно связаны с олигомерами или нуклеомономерами либо в качестве защитной группы, сочетающей группы для синтеза, OPO3-2, либо другого традиционного конъюгата, такого как твердая подложка, метка, антитело, моноклональное антитело или его фрагмент и т.п. Не подразумевается, что "блокирующая группа", как использовано здесь, сконструирована только как защитная группа, согласно слэнговой терминологии, но подразумевается, что она также включает, например, сочетающие группы, такие как H-фосфонаты или фосфорамидиты.
Термин "защитная группа", как использован здесь, относится к любой группе, способной защитить О-атом, S-атом или N-атом, к которому она присоединена, от участия в реакции или связывании. Такие защитные группы для N-атомов на основной группировке в нуклеомономере и их введение хорошо известны из уровня техники. Частными примерами подходящих защитных групп являются: диизобутилформамидин, бензоил, силил и т.п. Подходящими защитными группами для O-атомов и S-атомов являются, например, DMT, ММТ, FMOC или сложные эфиры. "Защитные группы", как использовано здесь, включают в себя любую группу, способную предотвращать участие O-атома, S-атома или N-атома, к которому она присоединена, в реакции или связывании. Такие защитные группы для O-, S- или N- атомов в нуклеомономерах описаны и способы их введения традиционно известны из уровня техники. Защитные группы также включают в себя любую группу, способную предотвратить реакцию и связывание на карбоновых кислотах, тиолах и т.п.
Термин "сочетающая группа", как использован здесь, относится к любой группе, способной создавать связь или заменяющую связь между нуклеомономерами, такой как гидрофосфонат и фосфорамидит.
Термин "конъюгат" или "конъюгатная группировка", как использован здесь, относится к любой группе, присоединенной к олигомеру на терминальном конце или внутри самого олигомера. Конъюгаты включают в себя твердые подложки, такие как силикагель, стекло с контролируемыми порами и полистерен; метки, такие как флюоресцентные, хемилюминисцентные, радиоактивные атомы или молекулы, ферментные группы и репортерные группы; транспортные агенты для олигомеров, такие как поликатионы, сывороточные белки и гликопротеины и полимеры и т.п. Другие конъюгатные группировки включают в себя О-холестерин, полиэтиленгликоль (ПЭГ), аминокислоты, интеркаляторы, выводящие полинуклеотиды группировки, перекрестносшивающие функциональности, липиды, гидроксаматы, алкилирующие агенты и т.п.
Термин "синтон", как использован здесь, относится к структурной единице внутри аналога олигонуклеотида по изобретению.
Термин "трансфекция", как использован здесь, относится к любому способу, подходящему для усиленной доставки олигомеров в клетки.
Термин "субъект", как использован здесь, относится к растению или животному, включая млекопитающих, в частности человека.
Термин "производные" и мономерные составляющие их олигомеры включают в себя все, традиционно известные их уровни техники. Например, олигонуклеотиды могут быть ковалентно связаны с различными группировками, такими как интеркаляторы, вещества, взаимодействующие именно с малой бороздкой двойной спирали ДНК и другими произвольно выбранными конъюгатами, такими как метки (радиоактивные, флюоресцентные, ферментные и т.д.). Производные этих добавочных группировок могут быть (но не обязательно) получены через модифицированную скелетную связь как часть самой связи. Например, интеркаляторы, такие как акридин, могут быть связаны через -R-CH2-, присоединенную через любой доступный -ОН или SH, например на концевом 5' положении РНК или ДНК, 2' положении РНК или ОН или SH, созданном в 5 положении пиримидинов, например вместо 5 метила цитозина, производное которого содержит -CH2 CH2CH2OH или -CH2CH2CH2SH в 5 положении. Может быть присоединен широкий ряд заместителей, включая те, которые связываются традиционными связями. Согласно этому, указанные группировки ОН в олигомере формулы (1) могут быть заменены фосфонатными группами, защищенными стандартными защитными группами, или активированы для получения дополнительных связей с другими нуклеотидами, или могут быть связаны со сконъюгированным заместителем. 5'-концевой ОН традиционно является фосфорилированным; 2'-ОН или ОН заместители на 3'-конце также могут быть фосфорилированы. Также могут быть получены производные гидроксилов со стандартными защитными группами.
Термин "аналог фосфодиэфира", как использован здесь, относится как к аналогу традиционной фосфодиэфирной связи, так и к альтернативным связывающим группам. Эти альтернативные связывающие группы включают в себя, но не ограничены воплощениями, в которых O-P(О) заменен на P(O)S, P(O)NR2, P(O)R, P(O)OR', где R является H или алкилом (1-7C) и R' является алкилом (1-7С). Не все аналоги фосфодиэфиров в одном и том же олигомере должны быть идентичными, единственным требованием является то, что по меньшей мере одна из этих связей является модифицированной межнуклеотидной связью, как здесь описано.
"Аналоговые" формы пуринов и пиримидинов - это
формы, известные из уровня техники, многие из которых используются в качестве химиотерапевтических агентов. Примеры
включают в себя (но не исчерпываются этим списком):
4-ацетилцитозин,
8-гидрокси-N5-метиладенин, азиридинилцитозин, псевдоизоцитозин, 5- (карбоксигидроксиметил)урацил, 5-фторурацил,
5-бромурацил, 5- карбоксиметиламинометил-2-тиоурацил,
5- карбоксиметиламинометилурацил, дигидроурацил, инозин, N6- изопентениладенин, 1-метиладенин, 1-метилпсевдоурацил, 1-метилгуанин,
1-метилинозин, 2,2-диметилгуанин, 2-метиладенин,
2-метилгуанин, 3-метилцитозин, 5-метилцитозин, N6-метиладенин, 7-метиладенин, 7-метилгуанин, 5-метиламинометилурацил,
5-метоксиаминометил-2-тиоурацил, бета-D-маннозилгуанозин,
5'-метоксикарбонилметилурацил, 5-метоксиурацил, 2-метилтио-N6-изопентениладенин, метиловый эфир урацил-5-оксиуксусной кислоты,
урацил-5-оксиуксусная кислота, оксибутоксозин, псевдоурацил,
геозин, 2-тиоурацил, 4-тиоурацил, 5-метилурацил, метиловый эфир N-урацил-5-оксиуксусной кислоты, 2-тиоцитозин и 2,6-диаминопурин. Особенно
предпочтительным аналогом является 5-метилцитозин
(используемая здесь аббревиатура: Cme).
Термин "изостеричный", как использован здесь, относится к пространственным и ориентационным свойствам межнуклеозидной связи; фактом является то, что эти свойства являются настолько похожими на свойства нативной фосфодиэфирной связи, что модифицированный олигонуклеотид, содержащий изостерическую связь, будет заменять, замещать, имитировать и/или гибридизоваться с нативным олигонуклеотидом.
Термин "рибозоамид", как использован здесь, относится к межнуклеотидной связи, существующей между двумя нуклеооснованиями. Эта рибозоамидная межнуклеотидная связь содержит комбинацию рибоза/(2'-дезокси) и аминокислотной функциональностей.
В данном описании использованы различные аббревиатуры для функциональных групп и соединений. Эти аббревиатуры понятны специалисту в области органической химии, например "Ph" обозначает фенил, "Me"- метил, "(1-7С)" обозначает, что данная цепь содержит от 1 до 7 углеродов, и т.д.
Описание изобретения
Согласно данному изобретению предложены новые аналоги олигонуклеотидов, содержащие
модифицированные аминокислотные/аминоспиртовые
связи между основаниями и скелетами (фосфодиэфир, фосфоротиоаты и другие, как показано в табл. А), также называемые модифицированными нуклеотидными
связями. Эти модификации или их функциональные
эквиваленты заменяют сахарную группировку, которая лежит между скелетом и основаниями, на производные аминокислоты, например как показано в формуле 24.
Согласно настоящему изобретению также
предложены новые нуклеомономеры и способы их включения в состав олигомеров, содержащих эти нуклеомономеры.
Согласно данному изобретению предложены различные нуклеомономерные соединения, имеющие структуры формул 1-23.
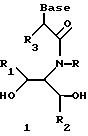
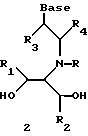
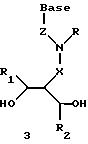
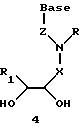
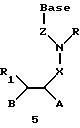
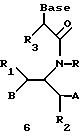
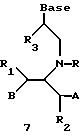
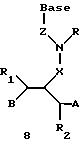
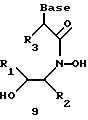
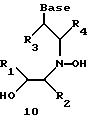
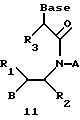
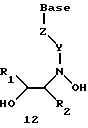
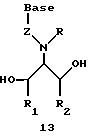
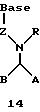
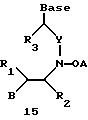
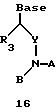
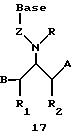
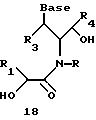
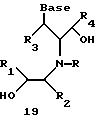
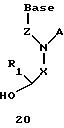
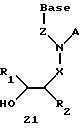
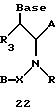
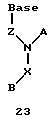
Олигомеры по изобретению являются полимерами, содержащими одно или несколько интересующих нас мономерных соединений, соединенных так, чтобы обеспечить структурный аналог ДНК или РНК. Олигомеры по изобретению содержат два или большее число нуклеомономеров и могут содержать фактически любое число нуклеомономеров, хотя олигомеры, состоящие из 200 или меньшего числа нуклеомономеров, обычно легче синтезировать. Соединения формул 1-23 могут быть присоединены друг к другу через 4'-5' связи, 3'-5' связи и 2'-5' связи, как видно из формул 24-41.
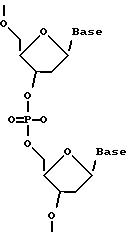
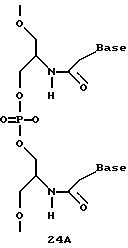
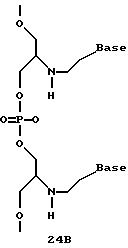
Нуклеотидные связи в соединениях по изобретению получены из аминокислот серина и глицина или их производных. Олигонуклеотиды по изобретению являются стабильными in vivo, устойчивыми к действию эндогенных нуклеаз и способны гибридизоваться с нуклеотидными последовательностями - мишенями. Примеры соединений по изобретению показаны в формулах 24-41, они являются конформационно более ограниченными по сравнению с фосфодиэфирными связями, имеющимися в немодифицированных ДНК и РНК. Это конформационное ограничение может частично содействовать усилению связывающих свойств интересующего нас соединения в отношении комплементарных полинуклеотидных последовательностей-мишеней; однако применение данного изобретения не зависит от этой теории усиления связывающих свойств.
В другом воплощении настоящее изобретение направлено на модифицированные олигонуклеотиды или их производные, в которых фуранозная
группировка природного
олигонуклеотида, например ДНК или РНК, заменена аминокислотной/аминоспиртовой группировкой, другие модификации, содержащие заместитель в аминокислотных позициях, показаны в
формулах 25-41.
Межнуклеотидные связи между соседними нуклеомономерами являются связями между 4' и 5' позициями соседних нуклеомономеров. Другими словами, фосфодиэфирная межнуклеотидная связь или ее
функциональный
эквивалент начинается в 5'-положении одного нуклеомономера и присоединяется к 4'-положению соседнего мономера, как показано в примерах соединений формул 24-33
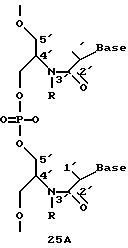
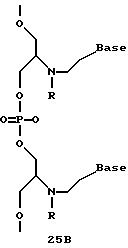
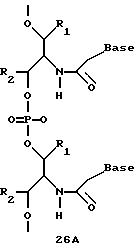
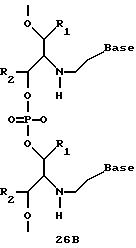
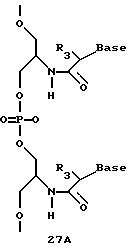
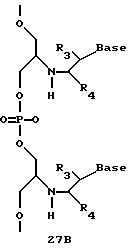
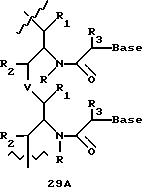
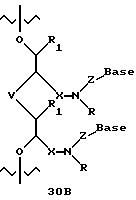
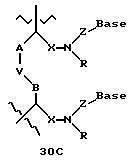
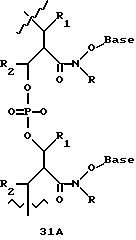
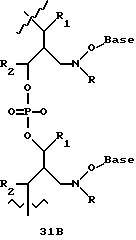
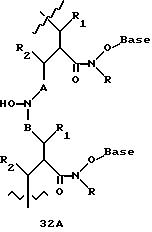
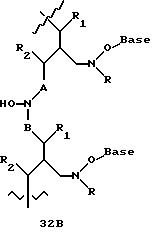
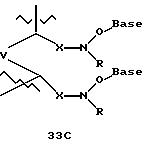
Где каждый "R" независимо представляет собой H, ОН, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, ОН, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждое основание ("base") независимо является нуклеотидным основанием.
Где каждый "R1" независимо представляет собой H, ОН, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, ОН, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "R2" независимо представляет собой H, ОН, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, ОН, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "R3" независимо представляет собой H, ОН, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, ОН, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "R4" независимо представляет собой H, OH, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, OH, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
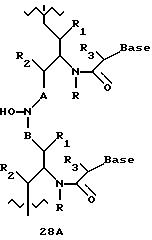
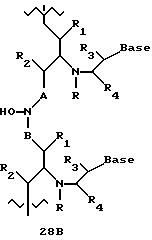
Где каждый "А" независимо представляет собой (CH2)x, CO, CS, S, S(O), S(O)(O), NH, NOH, NCH3, NR5 и Se, где "x" обозначает 1-7 углерод.
Где каждый "B" независимо представляет собой (CH2)x, CO, CS, S, S(O), S(O)(O), NH, NOH, NCH3, NR5 и Se, где "x" обозначает 1-7 углерод.
Где каждый "X" независимо представляет собой (CH2)x, CO, CS, О, S, S(O), S(O)(O), NH, NOH, NCH3 и NR5, где "x" обозначает 1-7 углерод.
Где каждый "Z" независимо представляет собой (CH2)x, CO, CS, S, S(O), S(O)(O), NH, NOH, NCH3 и NR5, где "x" обозначает 1-7 углерод.
R5 является H, OH, OMe, CN, NH, NOH, ONCH3, ONH2, этилом, пропилом, низшим алкилом (1-7С), Me, гетероалкилом (1-7С), арилом (6-7С), -(CH2)x-F, где "x" обозначает 1-7С и "F" независимо обозначает H, OH, SH, OCH3, CN, SCH3, ONH3, ONH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "V" независимо представляет собой аналог фосфодиэфира, фосфоротиоаты, метилфосфонаты, фосфородитиоаты, борофосфонаты, селенфосфонаты, фосфорамидаты, ацетамидаты, оксиформамидо, оксиацетамидо, диизопропилсилил, карбамат, диметиленсульфид, диметилен сульфоксид, диметиленсульфон и/или межнуклеотидную связь длиной от двух до четырех атомов, выбранных из углерода, азота, кислорода, серы и селена. Длина этого олигомера может варьировать от димера до 200-мера или быть еще больше. Предпочтительные модифицированные межнуклеотидные связи, включая структуры "V", показаны в табл. А.
Дополнительно соединения этих формул могут быть сконъюгированы с одной или большим числом конъюгационных группировок. Подходящие конъюгационные группировки включают в себя О-холестерин, полиэтиленгликоль, аминокислоты, интеркаляторы, отщепляемые группировки (например имидазол), перекрестносшивающие функциональности (например псорален), липиды, пептиды, алкилирующие агенты, гидроксамы и флюоресцентные метки. Такая конъюгационная группировка может независимо заменять один или несколько радикалов из R, R1, R2, R3, R4 и R5.
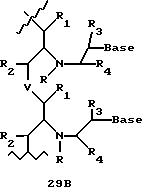
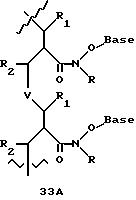
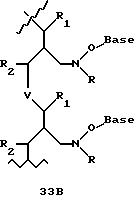
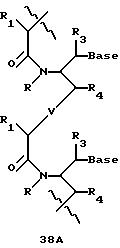
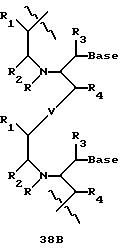
В еще одной реализации согласно изобретению предложены олигомерные структуры, показанные в формулах 34-36, и их производные.
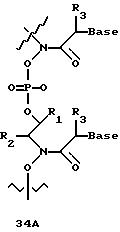
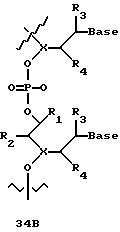
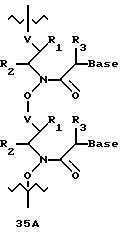
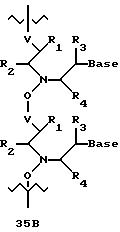
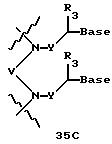
В соединениях формул 34-36 связи между соседними нуклеомономерами являются 3'-5' связями.
Где каждый "R" независимо представляет собой H, ОН, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, ОН, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждое основание ("base") независимо является нуклеотидным основанием.
Где каждый "R1" независимо представляет собой H, ОН, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, ОН, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "R2" независимо представляет собой H, ОН, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, ОН, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "R3" независимо представляет собой H, ОН, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, ОН, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "R4" независимо представляет собой H, ОН, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, ОН, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH2, Ph.
Где каждый "А" независимо представляет собой (CH2)x, CO, CS, S, S(O), S(O)(O), NH, NOH, NCH3, NR5 и Se, где "x" обозначает 1-7 углерод.
Где каждый "B" независимо представляет собой (CH2)x, СО, CS, S, S(O), S(O)(O), NH, NОН, NCH3, NR5 и Se, где "x" обозначает 1-7 углерод.
Где каждый "X" независимо представляет собой (CH2)x, СО, CS, О, S, S(O), S(O)(O), NH, NOH, NCH3 и NR5 где "x" обозначает 1-7 углерод.
Где каждый "Y" независимо представляет собой (CH2)x, СО, CS, O, S, S(O), S(O)(O), NH, NOH, NCH3 и NR5, где "x" обозначает 1-7 углерод.
Где каждый "Z" независимо представляет собой (CH2)x, СО, CS, S, S(O), S(O)(O), NH, NOH, NCH3 и NR5, где "x" обозначает 1-7 углерод.
R5 является H, ОН, ОМе, CN, NH, NOH, ONCH3, ONH2, этилом, пропилом, низшим алкилом (1-7С), Me, гетероалкилом (1-7С), арилом (6-7С), - (CH2)x-F, где "x" обозначает 1-7С и "F" независимо обозначает H, ОН, SH, OCH3, CN, SCH3, ONH2, ONH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "V" независимо представляет собой аналог фосфодиэфира, фосфоротиоаты, метилфосфонаты, фосфородитиоаты, борофосфонаты, селенфосфонаты, фосфорамидаты и/или межнуклеотидную связь длиной от двух до четырех атомов, выбранных из углерода, азота, кислорода, серы и селена. Длина этого олигомера может варьировать от димера до 200-мера или быть еще больше. Предпочтительные модифицированные межнуклеотидные связи, включая структуры "V", показаны в табл. А.
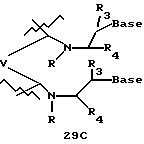
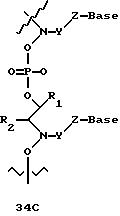
В другом воплощении согласно изобретению предложены олигомеры формул 37-41 или их варианты, причем эти олигомеры
содержат новые межнуклеотидные связи, являющиеся 2', 5' связями. Эти олигонуклеотиды стабильны in vivo и обладают улучшенной устойчивостью к действию эндогенных нуклеаз, и они способны к
гибридизации
с олигонуклеотидными последовательностями-мишенями.
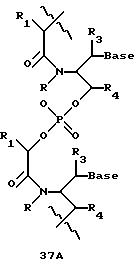
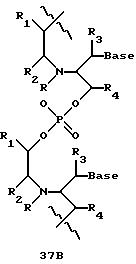
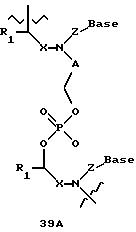
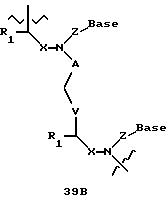
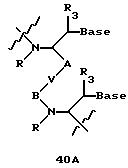
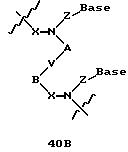
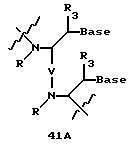
Где каждый "R" независимо представляет собой H, OH, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, OH, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждое основание ("base") независимо является нуклеотидным основанием.
Где каждый "R1" независимо представляет собой H, OH, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, OH, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "R2" независимо представляет собой H, OH, SH, CN, CH3, OCH3, SCH3 , ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, OH, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "R3" независимо представляет собой H, OH, SH, СN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, OH, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "R4" независимо представляет собой H, OH, SH, CN, CH3, OCH3, SCH3, ONH2, ONH(CH3), Ph, -(CH2)x-F, где "x" обозначает 1-7 углерод и "F" обозначает NH2, SH, OH, COOH, OCH3, SCH3, SPh, NOH, NOH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "А" независимо представляет собой (CH2)x, CO, CS, S, S(O), S(O)(O), NH, NOH, NCH3, NR5 и Se, где "x" обозначает 1-7 углерод.
Где каждый "В" независимо представляет собой (CH2)x, CO, CS, S, S(O), S(O)(O), NH, NOH, NCH3, NR5 и Se, где "x" обозначает 1-7 углерод.
Где каждый "X" независимо представляет собой (CH2)x, СО, CS, О, S, S(O), S(O)(O), NH, NOH, NCH3 и NR5, где "x" обозначает 1-7 углерод.
Где каждый "Z" независимо представляет собой (CH2)x, СО, CS, S, S(O), S(O)(O), NH, NOH, NCH3 и NR5, где "x" обозначает 1-7 углерод.
R5 является H, OH, OMe, CN, NH, NOH, ONCH3, ONH2, этилом, пропилом, низшим алкилом (1-7С), Me, гетероалкилом (1-7С), арилом (6-7С), -(CH2)x-F, где "x" обозначает 1-7С и "F" независимо обозначает H, OH, SH, OCH3, CN, SCH3, ONH2, ONH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph.
Где каждый "V" независимо представляет собой аналог фосфодиэфира, фосфоротиоаты, метилфосфонаты, фосфородитиоаты, борофосфонаты, селенфосфонаты, фосфорамидаты и/или межнуклеотидную связь длиной от двух до четырех атомов, выбранных из углерода, азота, кислорода, серы и селена. Длина этого олигомера может варьировать от димера до 200-мера. Предпочтительные модифицированные межнуклеотидные связи, включая структуры "V", показаны в табл. А.
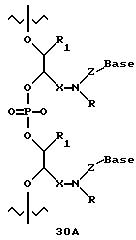
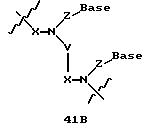
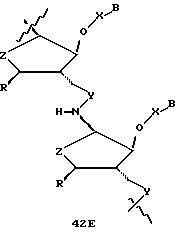
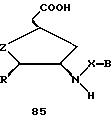
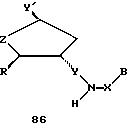
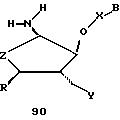
В другом воплощении согласно изобретению предложен олигомер формулы 42 и его мономерные составляющие формул 85-90.
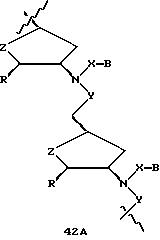
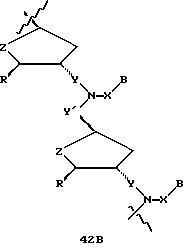
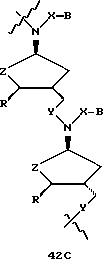
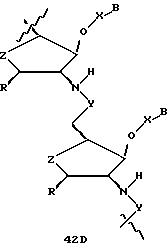
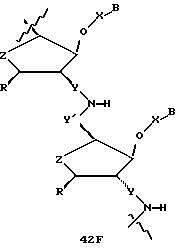
где X выбран из группы, состоящей из (CH2)n, где n=1-3, CO(CH2)n, где n= 0-2, и (CH2)nSO2, где n=1-2,
Y выбран из группы, состоящей из CH2, СО, COOH, CS и SO2,
Y' выбран из группы, состоящей из CH2, СО, COOH, CS и SO2,
Z выбран из группы, состоящей из О, S, NH и CH2,
R выбран из группы, состоящей из CH2OH, CH2NH2, CH2 NHCHO, CONH2 и COOH,
В является нуклеозидным основанием.
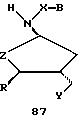
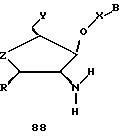
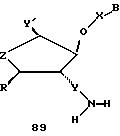
где X выбран из группы, состоящей из (CH2)n, где n=1-3, CO(CH2)n, где n= 0-2, и (CH2)nSO2, где n=1-2,
Y выбран из группы, состоящей из CH2, СО, COOH, CS и SO2,
Y' выбран из группы, состоящей из CH2, СО, COOH, CS и SO2,
Z выбран из группы, состоящей из О, S, NH и CH2,
R выбран из группы, состоящей из CH2OH, CH2NH2, CH2NHCHO, CONH2 и COOH,
B является нуклеозидным основанием.
В других воплощениях согласно настоящему изобретению предложены способы лечения заболеваний, опосредованных наличием некой нуклеотидной последовательности, при которых на субъекта, нуждающегося в лечении, воздействуют таким количеством модифицированных выше олигонуклеотидов, способных специфически связывать такую нуклеотидную последовательность, которое способно инактивировать эту нуклеотидную последовательность.
В олигонуклеотидах по изобретению по меньшей мере одна из фосфодиэфирных групп, входящая в число "V" формул 24-41, заменена описанными здесь модифицированными межнуклеотидными связями. Желательно, чтобы множественные фосфодиэфирные связи в немодифицированных олигонуклеотидах, замененные модифицированной межнуклеотидной связью, могли быть несколько раз использованы в такой структуре, или, если желательно, ряд модифицированных межнуклеотидных связей мог быть использован в одном индивидуальном олигонуклеотиде. В предпочтительном воплощении интересующих нас олигонуклеотидов эти заменяющие связи являются нехиральными и, таким образом, усиливают способность этих нуклеотидов гибридизовать желаемую мишень; однако полезные соединения по изобретению включают в себя и те воплощения, в которых использованы хиральные формы.
Предпочтительные модифицированные межнуклеотидные связи включают в себя структуры "V", показанные в табл. А.
R5 является H, OH, OMe, CN, NH, NOH, ONCH3, ONH2, этилом, пропилом, низшим алкилом (1-7С), Me, гетероалкилом (1-7С), арилом (6-7С), -(CH2)x-F, где "x" обозначает 1-7С и "F" независимо обозначает H, ОН, SH, OCH3, CN, SCH3, ONH2, ONH(CH3), SNH2, S(O)NH2, S(O)(O)NH2, CH3, Ph. Дополнительно одна или большее число конъюгационных группировок может быть присоединена к этой связи, так чтобы получился олигомерный конъюгат. Подходящие конъюгационные группировки включают в себя О-холестерин, полиэтилен гликоль, аминокислоты, интеркаляторы, отщепляемые группировки (например имидазол), перекрестносшивающие функциональности (например псорален), липиды, пептиды, алкилирующие агенты, гидроксаматы и флюоресцентные метки.
Особенно предпочтительные 4'-5' связи включают в себя фосфодиэфиры, фосфоротиоаты, метилфосфонаты, карбоксамид, тиокарбоксамид, гидроксамат, сульфонамид, гидроксиламин и карбамат. Те же модификации предпочтительны и для 2'-5' и 3'-5' связей.
Олигомеры по изобретению не ограничиваются олигомерами с гомогенным типом связей, сюда включены также олигомеры с чередующимися или случайно распределенными связями, включая 2', 5' связи. Так как при синтезе олигомеров по изобретению нуклеомономерные остатки могут быть добавлены по одному, то каждая индивидуальная связь, и/или заменяющая связь и природа каждого индивидуального заместителя "основания" может быть выбрана независимо, так чтобы получались олигонуклеотиды желаемой последовательности.
Олигомеры по изобретению могут содержать любое желаемое количество заменяющих связей. Эти заменяющие связи могут быть идентичными друг другу или различаться из-за реализации, выбранной для "V", включая другие заменяющие связи не по изобретению. Так как эти олигомеры получают последовательно, то могут быть использованы любые образцы типов связи или заменяющей связи, оснований и модификаций сахаров.
В предпочтительном воплощении изобретения заменяющие связи чередуются в регулярном образце. Например, за одной заменяющей связью следуют две фосфодиэфирные связи, за которыми следует одна заменяющая связь по изобретению и т. д. Дополнительные воплощения включают в себя, например, чередующиеся связи, такие как заменяющая связь, за которой следует аналог фосфодиэфира (например тиоат и т.д.), за которым следует заменяющая связь по изобретению, за которой следует аналог фосфодиэфира и т.д., то есть олигомер по изобретению может содержать следующие друг за другом два типа чередующихся заменяющих связей. Олигомеры по изобретению, содержащие более чем один тип связи, могут иметь любое число регулярных образцов, образованных чередованием связей различных типов, находящихся между субъединицами олигомера.
Модификации сахаров могут быть выполнены для одного или большего числа нуклеомономерных остатков в олигомере по изобретению; однако, когда должны быть введены такие модификации, предпочтительны 4'-5', 3'-5' и 2'-5' нуклеотидные связи между аминокислотными остатками. В таком случае для обозначения последовательности оснований аналога олигонуклеотида может быть использована следующая аббревиатура. Например, в стандартной ДНК (или РНК) последовательности обычно обозначены только последовательностью оснований, например ATG CGC TGA. Как правило, просто установлено заранее, представляется ли это РНК или ДНК последовательность. Соответствующая система обозначений используется и здесь, чтобы представить аналоги нуклеотидов с данной последовательностью оснований.
Дополнительные модификации нуклеомономеров
Олигомеры по
изобретению также могут содержать ряд модификаций в дополнение к заменяющим связям по изобретению.
Дополнительные модификации включают в себя олигомеры, где
(1) один или несколько
нуклеомономерных остатков модифицированы в 2', 3', 4' и 5'-положениях,
(2) введены одна или несколько
ковалентных перекрестносшитых группировок,
(3) включены другие заменяющие связи
не по изобретению,
(4) включены другие аналоги оснований, такие как 8-оксо-N5-метиладенин,
и
(5) включены конъюгаты, такие как интеркалирующие агенты или полилизин,
которые соответственно усиливают сродство связывания с последовательностями нуклеиновых кислот-мишеней или усиливают
ассоциацию олигомера с клетками.
Способность олигомеров по изобретению к последовательность-специфичному связыванию полинуклеотидов по отношению к однонитевой или дуплексной мишени совместимо с дальнейшими модификациями олигомеров. Эти дальнейшие модификации также могут придать другие полезные свойства, такие как устойчивость к расщеплению нуклеазами (например в домене олигомера по изобретению, имеющего фосфодиэфирные связи) или усиление их способности проникать сквозь клеточные мембраны и т.п.
Олигомеры по изобретению могут содержать одну или несколько заменяющих связей, таких как сульфидные или сульфоновые связи (Benner, S.A., международная публикация N WO 89/12060), сульфаматные связи (международная публикация N WO 91/15500), карбаматные или другие заменяющие связи в морфолино-связанных олигомерах (Stirchak, Е. Р. et al Nucleic Acids Res, 1989, 17, 6129-6141; Summerton, J., et al, международная публикация N 216 860) и родственные связи.
Таким образом, примеры реализации олигомеров по изобретению
включают в себя олигомеры, имеющие
(1) по меньшей мере одну заменяющую связь и аминокислоту, которая
связана с соседним мономером, и
(2) одну или несколько заменяющих связей не по
изобретению, выбранных из группы, состоящей из фосфоротиоата, метилфосфоната и тиометилфосфоната и/или
(3) одну или несколько фосфодиэфирных связей и/или
(4) аналоги пурина или
пиримидина, которые усиливают сродство связывания комплементарных последовательностей-мишеней.
Другие примеры олигонуклеотидов будут включать
(1) олигомеры, имеющие
заменяющие связи по изобретению на 3'- и/или 5'-концах и фосфоротиоатные связи в других местах олигомера,
(2)
олигомеры, имеющие заменяющие связи по изобретению и стандартные пуриновые или
пиримидиновые основания (например аденин, гуанин, цитозин, тимин или урацил);
(3) олигомеры, имеющие заменяющие
связи по изобретению и одно или несколько оснований, усиливающих сродство
связывания или проникающую способность олигомера (например 5-метилцитозин, 5'(1-пропинил)урацил, 5-(1-пропинил)цитозин.
Включаются также олигомеры, содержащие остатки нуклеомономеров, связанные через
гидроксаматы.
Синтез олигомеров
Олигомеры по изобретению могут быть образованы с
использованием лишь нуклеомономеров по изобретению или в комбинации с традиционными
нуклеомономерами и синтезированы с использованием стандартных методик синтеза олигомеров в твердой фазе (или в фазе
раствора), которые сейчас имеются в продаже. В общем, олигомеры по изобретению
могут быть синтезированы с помощью способа, включающего в себя стадии, на которых: синтезируют нуклеомономер или
олигомерный синтон, имеющий защитную группу и основание и сочетающую группу, способную
сочетаться с нуклеомономером или олигомером; сочетают нуклеомономер или олигомерный синтон с акцепторным
нуклеомономером или акцепторным олигомером; удаляют защитную группу; повторяют по
необходимости этот цикл до тех пор, пока не будет синтезирован желаемый олигомер.
Олигомеры по изобретению могут иметь любую длину, включая олигомеры, содержащие более 40, 50, 100, 200 или 500 нуклеомономеров. В общем, предпочтительные олигомеры содержат 2-30 нуклеомономеров. Длины, равные или большие чем 8-20 нуклеомономеров, могут быть полезны для терапевтического или диагностического применений, если они имеют подходящую последовательность оснований. Короткие олигомеры, содержащие 2, 3, 4 или 5 нуклеомономеров, включены в данное изобретение конкретно и могут быть использованы в качестве синтонов.
Олигомеры, имеющие случайную последовательность и содержащие порядка 6, 7 или 8 нуклеомономеров, могут быть использованы в качестве праймеров, которые используют в протоколах клонирования или амплификации, где используются случайные последовательности праймеров, при условии, что такой олигомер содержит порядка 1 или 2 остатков на 3'-конце, которые могут служить в качестве праймера для полимераз или обратных транскриптаз или, в противном случае, не влияют на полимеразную активность.
Дополнительно к связям, описанным здесь сначала, олигомеры по изобретению могут содержать традиционные фосфодиэфирные связи или могут содержать другие заменяющие связи, такие как фосфорамидатные связи, в дополнение к заменяющим связям по изобретению. Эти заменяющие связи включают в себя, но не ограничиваются воплощениями, в которых группировка формулы -O- P(O)(S)-O ("фосфоротиоат"), -O-P(O)(NR211)-X2, -O-P(O)(R11)-O-, -O-Р(S)(R11)-O- ("тионоалкилфосфонат"), -P(O)(OR9 )-X2, O-C(O)-X2 или -O-C(O)(NR211)-X2-, где R11 является H (или солью) или алкилом (1-12C, включая метил и этил) и R9 является алкилом (1-9С), и связь присоединена к соседним нуклеомономерам через -О- или -S-, связанные с углеродом нуклеомономера, и X2 обозначает О или S. Фосфоротиоатные и фосфодиэфирные связи хорошо известны. Особенно предпочтительные заменяющие связи для применения в олигомерах по изобретению включают в себя фосфодиэфирные, фосфоротиоатные, метилфосфонатные и тиометилфосфонатные заменяющие связи. Фосфоротиоатные и метилфосфонатные заменяющие связи придают дополнительную стабильность олигомеру, который должен быть идентичным, особенно предпочтительные олигомеры по изобретению содержат одну или несколько фосфоротиоатных и метилфосфонатных заменяющих связей.
Олигомеры по изобретению и их сегменты могут быть синтезированы с использованием известных специалисту способов. Способы синтеза, известные из уровня техники и описанные здесь, могут быть применены для синтеза олигомеров, содержащих заменяющие связи по изобретению, а также другие связи или заменяющие связи, известные из уровня техники, с использованием подходящим образом защищенных нуклеомономеров. Способы синтеза олигомеров, имеющих фосфоросодержащие связи, известны (Froehler, В., et al., Nucleic Acids Res., 1986, 14, 5399-5467; Nucleic Acids Res., 1988, 16, 4831-4839; Nucleosides & Nucleotides 1987, 6, 287-291; Froehler, В., Tetrahedron Letts., 1986, 27, 5575-5578; Caruthers, M.H. in Oligodeoxynucleotides Antisense Inhibitions of Gene Expression, 1989, J.S. Cohen, editor, CRC Press, Boca Raton, p. 7-24; Reese, C. B. et al. Tetrahedron Letts., 1985, 26, 2245-2248. Синтез олигомеров, связанных метилфосфонатом, с помощью фосфонамидитной химии также известен (Agrawal, S. et al., Tetrahedron Letts., 1987, 28, 3539-3542; Klem, R. E., et al, международная публикация WO 92/07864).
Олигомеры, содержащие связи по изобретению, также удобно синтезировать путем приготовления димерных или тримерных соединений с помощью химии растворенных фаз с последующим превращением синтона в производное, которое вводят в олигомеры с помощью химии твердых или растворенных фаз. Типичными синтонами являются 5' DMT или ММТ блокированные 3' фосфонатные или фосфорамидатные производные, которые получены стандартными способами (см. Gait, М.J. ed., Oligonucleotide Synthesis; A Practical Approach 1984, IRL Press, Oxford).
Синтоны, включенные в рамки настоящего изобретения, включают в себя димеры, тримеры, тетрамеры, гексамеры и более протяженные олигомеры, полученные с помощью синтеза в твердой или растворенной фазе. Тримеры и более протяженные синтоны могут содержать более одного типа связей. Эти синтоны могут включать в себя любое основание, как описано выше, или 2', 3', 4' или 5'-группы, такие как ОН, DMTO, MMTO, О-аллил, фосфат, фосфонат или амидит, как описано выше.
Рибозоамидные олигонуклеотиды могут быть синтезированы с использованием стандартных условий твердофазного синтеза пептидов (Fmoc химия) (см. фиг. 26).
Блокирующие группы для синтеза соединений по изобретению
1. Сочетающие группы
Подходящими сочетающими группами являются,
например, H-фосфонат,
метилфосфонамидит или фосфорамидит. Фосфорамидиты, которые могут быть использованы, включают в себя β-цианоэтилфосфорамидиты (они предпочтительны). Также могут быть
использованы
метилфосфонамидиты, алкилфосфонамидиты (включая этилфосфонамидиты и пропилфосфонамидиты). Примеры фосфорамидитов показаны на фиг. 1-21.
Подходящие "сочетающие группы" в 2', 3', 4' или 5' положении для синтеза олигомера средствами фосфорамидиттриэфирной химии, называемой здесь "амидитной" химией, включают в себя N,N-диизопропиламино-β-цианоэтоксифосфин, N, N-диизопропиламино-метоксифосфин, N,N-диэтиламино-цианоэтоксифосфин и (N-морфолино)-метоксифосфин (Moore, M.F. et al., J.Org. Chem. , 1985, 50, 2019-2025; Uznanski, A.W., et al., Tetrahedron Letts., 1987, 28, 3401-3404; Bjergarde, К. , et al, Nucl Acids Res., 1991, 19, 5843-5850; Dahl, O. Sulfur Reports, 1991, 11, 167-192). Родственные сочетающие группы, такие как N, N-диизопропиламино-метил-фосфин или N,N-диэтиламино-метил-фосфин, также могут быть использованы для получения метилфосфонатов. Метилфосфонатные олигомеры могут быть удобным образом синтезированы с использованием сочетающих групп, таких как N,N-диизопропиламино-метилфосфорамидит. Синтез нуклеомономерных амидитов по изобретению может быть осуществлен традиционными способами (например Gryaznov, S.M., et al., Nucl Acids Res. , 1992, 20, 1879- 1882; Vinayak, R., et al., Nucl Acids Res., 1992, 20, 1265-1269; Sinha, N. D. , et al., Nucl Acids Res., 1984, 12, 4539-4557; и другие указанные здесь ссылки).
2. Защитные группы
Защитные группы, такие как диизобутилформамидин, бензоил, изобутирил, FMOC, диалкилформамидин, диалкилацетамидин или другие группы, известные из
уровня техники, могут быть использованы для защиты экзоциклического азота цитозинового, аденинового или гуанинового гетероциклов. В альтернативном случае цитидин может быть непосредственно введен в
олигомеры без защитной группы на экзоциклическом азоте с использованием описанных способов (Gryaznov, S. M. et al., J. Amer.Chem.Soc., 1991, 113, 5876-5877; Gryaznov, S. M., et al., Nucl Acids Res.,
1992, 20, 1879-1882; Kung, P.-P. et al. Tetrahedron Letts., 1992, 33, 5869-5872).
Подходящими защитными группами являются DMT (диметокситритил), Bz (бензоил), Bu (изобутирил), феноксиацетил, ММТ (монометокситритил) или FMOC на 5'-конце и/или гидрофосфонат, метилфосфорамидит, метилфосфонамидит, β-цианоэтилфосфорамидит, TBS (трет-бутилдиметилсилил) или TBDPS (трет-бутилдифенилсилил) на 3'-конце.
Предпочтительными защитными группами являются Bz (бензоил), DMT (диметокситритил), ММТ (монометокситритил) или FMOC на 5'-конце или положении и/или TBS, гидрофосфонат, метилфосфорамидит, метилфосфонамидит, β-цианоэтилфосфорамидит на 3'-конце. Однако предполагается, что положения защитных групп можно поменять местами (например фосфорамидит в 5'-положении и DMT в 3'-положении). В общем, могут быть получены производные нуклеомономеров и олигомеров по изобретению с такими "блокирующими группами", как показано в соответствующих формулах, известными из уровня техники способами.
Конъюгаты
Согласно данному изобретению также предложены "конъюгаты" олигомеров по изобретению. "Конъюгаты"
традиционных
олигомеров известны специалисту. Например, олигомеры по изобретению могут быть ковалентно связаны с различными группировками, такими как, например, интеркаляторы и соединения, которые
специфически
взаимодействуют с малой бороздкой двойной спирали ДНК. Другие группировки для конъюгации с интересующими нас олигомерами включают в себя метки (например радиоактивные, флюоресцентные,
ферментные) или
группировки, облегчающие ассоциацию клеток при помощи отщепляемых линкеров и т.п. Подходящие радиоактивные метки включают в себя32P,35S,3H,131I и14С; подходящие флюоресцентные метки включают в себя флюоресценс, резоруфин, родамин, BODIPY (молекулярные зонды) и Texas красный; подходящие ферменты включают в себя щелочную
фосфатазу и
пероксидазу хрена. Другие соединения, которые могут быть использованы в качестве ковалентно связанных группировок, включают в себя биотин, антитела или фрагменты антител,
азиалогликопротеин,
трансферрин и HIV Tat белок, которые также могут быть ковалентно присоединены к олигомерам по изобретению.
Производные этих дополнительных группировок могут быть получены с помощью любой удобной группировки. Например, интеркаляторы, такие как акридин или псорален, могут быть связаны с олигомером по изобретению через любую доступную -ОН или -SH группу, например в концевом 5'-положении олигомера, 2'-положении РНК, или ОН, NH2, COOH или SH, введенную в 5'-положение пиримидинов. Удобны их производные, которые содержат, например, -CH2CH2 CH2OH или - CH2CH2CH2SH в 5'-положении пиримидинов. Конъюгаты, включая полилизин или лизин, могут быть синтезированы как описано и могут далее усилить сродство связывания олигомера с последовательностью нуклеиновых кислот - мишенью (Lemaitre, М. et al., Proc NatI Acad Sci. USA, 1987, 84, 648-652; Lemaitre M. et al., Nucleosides and Nucleotides, 1987, 60, 311- 315).
Может быть присоединен широкий ряд заместителей, включая те, которые связываются через связи и заменяющие связи. Группировки - ОН в олигомерах могут быть заменены фосфатными группами, защищенными стандартными защитными группами, или сочетающими группами для получения дополнительных связей с другими нуклеомономерами, или связаны с конъюгированным заместителем. 5'-концевой ОН может быть фосфорилирован; 2'-ОН или заместитель ОН на 3'-конце также может быть фосфорилирован. Производные гидроксилов также могут быть получены с помощью стандартных защитных групп.
Могут быть получены ковалентные производные олигомеров по изобретению с группировками, которые облегчают ассоциацию клеток, используя отщепляемые линкеры. Подходящие конъюгаты также включают в себя твердые подложки для синтеза олигомеров и для облегчения определения последовательностей нуклеиновых кислот. Твердые подложки включают в себя, но не ограничиваются силикагелем, стеклом с контролируемым размером пор, полистиреном и ферромагнитной стеклянной дробью.
Модификации сахара
Производные могут быть получены
путем замещения сахаров.
Оказываются, что среди предпочтительных производных олигомеров по изобретению 2'-O-аллильная и 3'-аллильные группы усиливают способность проникновения и устойчивость к
расщеплению нуклеазами, но
незаметно, чтобы они уменьшали сродство олигомера к однонитевой или дуплексной мишеням. В частности, в олигонуклеотиды с рибозоамидным скелетом могут быть введены различные
функциональности в 1', 2',
3', 4' и 5'-положения рибозной группировки для улучшения фармакокинетических свойств соответствующих олигонуклеотидов.
Заменяющие связи
Олигомеры
по изобретению могут также
содержать одну или несколько "заменяющих связей" в дополнение к описанным здесь 2'- 5,' 3'-5' и 4'-5' связям, что в общем понятно из уровня техники. Эти "заменяющие связи"
включают в себя фосфоротиоат,
метилфосфонат, тиометилфосфонат, фосфородитиоат, алкилфосфонат, морфолиносульфамиды, борофосфаты (-O-Р(OCH3)(BH3)-O-), силоксан (-O-Si (X4) (X4) -O-; X4 представляет собой 1-6C алкил или фенил) и фосфорамидаты (метоксиэтиламин (-O-P(OCH2CH2OCH3) (О)-О-) и т.п.) и могут быть
синтезированы известными способами
(Sood, A., et al J.Am.Chem. Soc., 1990, 112, 9000-9001; WO 91/08213; WO 09/15065; WO 91/15500; Stirchak, E.P. et al Nucleic Acid Res., 1989, 17, 6129-6141; патент
США 5 034 506; патент США 5 142 047;
Hewitt, J. M. et al., Nucleosides & Nucleotides, 1992, 11, 1661- 1666; Summerton, J. et al., международная публикация N 216 860). Заменяющие связи, которые
могут быть использованы в описанных
здесь олигомерах, включают также сульфонамид (-O-SO2-NH-), сульфид (-CH2-S-CH2-), сульфонат (-O-SO2-CH2-),
карбамат (O-C(O)- NH-, -NH-C(O)-О-),
диметилгидразино (-CH2-NCH3-), сульфамат (-O-S(O) (O)-N-; -N-S(O)(O)-N-), 3'-амин (-NH-CH2-, N-метилгидроксиламин (-CH2
-NCH3-О-) и 2',5' связи
(такие как 2',5' карбамат (2'-N(H)-C(O)-O-5'), 5', 2' карбамат (2'-O- C(O)-N(H)-5'), 5',2' метилкарбамат (2'-O-С(O)-N(CH3)-5') и 5',2' тиоформацеталь
(2'-O-CH2-S-5').
Дополнительные подходящие заменяющие связи включают амидные связи, описанные Бухардом (Buchardt, О., et al.) (международная публикация N WO 92/20702), описанные Куком
(Cook, P.D. et al.)
(международная публикация N WO 92/20822), описанные Де Месмэкером (De Mesmaeker. A., et al.) (международная публикация N WO 92/20823) и описанные в PCT/US 92/04294.
Если не указано иное, то заменяющие связи, такие как формацетальная связь, -O-CH2-O-, присоединены к какому-либо из 4', 3', 2' углеродов нуклеомономера с левой стороны и 5' углероду нуклеомономера с правой стороны. Обозначения 4', 3', 2' или 5' углерод могут быть модифицированы соответственно, когда к соседнему нуклеомономеру присоединена структура иная, чем рибоза, дезоксирибоза или арабиноза. Такие структуры включают ксилозу, гексозу, морфолиновое кольцо, карбоциклическое кольцо (например циклопентан) и т.п.
Известно применение карбаматных, карбонатных, сульфидных, сульфоксидных, сульфоновых, N- метилгидроксиламинных и диметилгидразино связей в синтонах или олигомерах (Vaseur, J.J. et al., J.Amer. Chem. Soc., 1992, 114, 4006-4007; WO 89/12060; Musicki, В. et al., J. Org Chem., 1990, 55, 4231-4233; Reynolds, R. C. et al., J. Org Chem., 1992, 51, 2983-2985; Mertes, M.P., et al. , J. Med. Chem., 1969, 12, 154-157; Mungall, W.S., et al., J. Org Chem., 1977, 42, 703-706; Stirchak, E.P., et al., J. Org Chem., 1987, 52, 4202-4206; Wang, H., et al. Tetrahedron Letts. 1991, 32, 7385-7388; международная публикация N PCT/US 91/03680). Заменяющая связь может быть использована в олигомерах для многих целей, таких как дальнейшее облегчение связывания с комплементарными последовательностями нуклеиновых кислот-мишеней и/или повышение устойчивости олигомеров к действию нуклеаз.
Основания
Подходящими основаниями для использования в качестве нуклеотидных оснований в соединениях по изобретению являются не
только встречающиеся в
природе пуриновые и пиримидиновые основания, но также аналоги этих гетероциклических оснований и их таутомеры. Такие аналоги включают в себя алкилированные пурины или
пиримидины, ацилированные пурины
или пиримидины или другие гетероциклы. Такие "аналогичные пурины" или "аналогичные пиримидины" или аналоги пуринов или пиримидинов являются хорошо известными из
уровня техники, некоторые из них
используются в качестве химиотерапевтических агентов. Их примерный, но не исчерпывающий список включает в себя N4,N4 - этанцитозин,
7-деазаксантозин, 7-деадзагуанозин,
8-оксо-N6 -метиладенин, 4-ацетилцитозин, 5-(карбоксигидроксиметил)урацил, 5-фторурацил, 5-бромурацил, 5-карбоксиметиламинометил-2 - тиоурацил,
5-карбоксиметиламинометилурацил, инозин, N6 -изопентениладенин, 1-метиладенин, 2-метилгуанин, 5-мeтилцитoзин, N6-метиладенин, 7-метилгуанин, 5- метиламинометилурацил, 5-метокси
аминометил-2-тиоурацил, 2-тиоурацил, 4-тиоурацил,
5-(1-пропинил)-4-тиоурацил, 5-(1-пропинил)-2-тиоурацил, 5-(1-пропинил)-2-тиоцитозин, 2-тиоцитозин и 2,6-диаминопурин. В дополнение к этим аналогам
оснований в олигомеры по изобретению могут быть
удобным образом введены аналоги пиримидина, включая 6-азацитозин, 6-азатимидин и 5-трифторметилурацил, описанные Куком (Cook, D.P., et al.) в
международной публикации WO 92/02258.
Известно введение 4-тиоуридина и 2-тиотимидина в олигомеры (Nikiforov, Т.Т. et al. Tetrahedron Letts., 1992, 33, 2379-2382; Clivio, P., et al. Tetrahedron Letts., 1992, 33:65-63; Nikiforov, T.T. et al. Tetrahedron Letts., 1991, 32: 2505-2508; Xu, Y.-Z., et al. Tetrahedron Letts., 1991, 32: 2817-2320; Clivio, P., et al. Tetrahedron Letts., 1992, 33: 69-72; Connolly, В.A. , et al., Nucleic Acids Res., 1989 17: 4957-4974). Предпочтительные основания включают в себя аденин, гуанин, тимин, урацил, цитозин, 5-метилцитозин, 5-(1-пропинил)урацил, 5-(1-пропинил)цитозин, 8-оксо-N6 -метиладенин, 7-деаза-7-метилгуанин, 7-деаза-7-метиладенин и 7-деазаксантозин.
Ковалентно связывающая группировка
В некоторые олигомеры по изобретению включена группировка,
способная осуществлять по меньшей мере одну ковалентную связь между олигомером и дуплексом. Множественные ковалентные связи также
могут быть образованы путем обеспечения множественности таких
перекрестносшивающих группировок. Ковалентная связь предпочтительно создается с остатком основания в нити-мишени, но может быть создана и
с другой частью мишени, включая сахарид или фосфоодиэфир.
Реакционная природа группировки, которая осуществляет перекрестную сшивку, определяет природу мишени в дуплексе. Предпочтительные
перекрестносшивающие группировки включают в себя ацилирующие и
алкилирующие агенты и, в частности, те, которые расположены относительно придающей специфичность части последовательности так, чтобы
могла произойти реакция с мишенью в нити.
Очевидно, что гетероцикл не обязательно является пурином или пиримидином; в самом деле, псевдооснование, к которому присоединена реакционная функция, вовсе не должно быть гетероциклом. Любые средства присоединения реакционной группы удовлетворительны настолько, насколько корректно занимаемое положение.
Полярность
олигомеров
В самом общем виде символ 3'----5'обозначает
направление олигомера, в котором связи последовательно образованы между 5'-гидроксилом аминокислотного остатка нуклеомономера с левой
стороны и 3'- (или 2'- для олигомеров, имеющих 2'-5' связи, или 4'
для олигомеров, имеющих 4'-5' связи) гидроксилом аминокислотного остатка нуклеомономера с правой стороны (то есть область
единообразной полярности), оставляя таким образом 5'-гидроксил самого правого
аминокислотного остатка нуклеомономера свободным для дополнительной конъюгации. Аналогично, 5'----3' обозначает
направление олигомера в противоположной ориентации, когда связи последовательно
образованы между 3'-гидроксилом аминокислотного остатка левого нуклеомономера с 5'-гидроксилом аминокислотного остатка
нуклеомономера с правой стороны, оставляя таким образом 3'-гидроксил самого
правого нуклеомономерного остатка свободным для дополнительной конъюгации. То же самое верно для 5'----4' нити
олигомеров.
Фармацевтически приемлемые соли
Согласно данному
изобретению также предложены различные соли всех описанных здесь соединений, включая фармацевтически приемлемые
соли для воздействия на животных или человека. Фармацевтически приемлемые соли и
образующие их материалы хорошо известны из уровня техники. Фармацевтически приемлемые соли преимущественно
представляют собой соли металла или аммония олигомеров по изобретению и включают в себя соли
щелочных и щелочно-земельных металлов, например соль натрия, калия, магния или кальция; или
преимущественно легко кристаллизуемые аммонийные соли - производные аммония или органических аминов, такие
как моно-, ди- или три-(низший алкил, циклоалкил или гидроксиалкил)-амиды, низшие
алкилендиамины или (низший гидроксиалкил или арилалкил)-алкиламмонийные основания (например метиламин, диэтиламин,
триэтиламин, дициклогексиламин, триэтаноламин, этилендиамин,
трис-(гидроксиметил)-аминометан или гидроксид бензил-триметиламмония. Олигомеры по изобретению могут образовывать соли, полученные в
результате присоединения кислот, предпочтительно терапевтически
приемлемых неорганических или органических кислот, таких как сильные минеральные кислоты, например гидрофильные, в частности
хлороводородная или бромоводородная кислота; серная, фосфорная;
алифатические или ароматические карбоновые или сульфоновые кислоты, например муравьиная, уксусная, пропионовая, янтарная, гликолевая,
молочная, яблочная, винная, глюконовая, лимонная, аскорбиновая,
малеиновая, фумаровая, гидроксималеиновая, пировиноградная, фенилуксусная, бензойная, 4-аминобензойная, антраниловая,
4-гидроксибензойная, салициловая, 4-аминосалициловая, метансульфоновая,
этансульфоновая, гидроксиэтансульфоновая, бензолсульфоновая, сульфанилиновая или циклогексилсульфаминовая кислота и т. п.
Применимость и воздействие
Так как олигомеры по
изобретению обладают значительной связывающей активностью по отношению к одноцепочечным или двухцепочечныым нуклеиновым
кислотам-мишеням с образованием дуплексов, триплексов или других форм
стабильной ассоциации с встречающимися в природе полинуклеотидами или их структурными аналогами, то олигомеры по изобретению могут
быть использованы в большинстве способов, применяющих традиционные
олигомеры. Таким образом, олигомеры по изобретению могут быть использованы в качестве, например, полинуклеотидных гибридизационных
зондов, праймеров для полимеразной цепной реакции и схожих
циклических реакций амплификации, праймеров для секвенирования и т.п. Олигомеры по изобретению могут также быть использованы в диагностике и
терапии болезней. Терапевтические применения олигомеров по
изобретению включают в себя специфическое ингибирование экспрессии генов (или ингибирование трансляции РНК последовательностей, кодируемых
этими генами), которые связаны либо с развитием, либо с
поддержанием патологического состояния, с помощью антисмысловых олигомеров. Олигомеры по изобретению могут быть использованы для осуществления
антисмыслового ингибирования многих генетических
мишеней. Примерами генов или РНК, кодируемых этими генами, которые могут являться мишенями при антисмысловом использовании олигомеров, являются те,
которые кодируют ферменты, гормоны, сывороточные
белки, трансмембранные белки, молекулы адгезии (LFA-1, GPIIa/IIIa, ELAM-1, VACM-1, IСАМ-1, E-селекция и т. п. ), молекулы
рецепторов, включая рецепторы цитокинов, цитокины (IL-1,
IL-2, IL-3, IL-4, IL-6 и т.п.), онкогены, факторы роста и интерлейкины. Гены или РНК-мишени могут быть ассоциированы с любым патологическим
состоянием, например с воспалительными состояниями,
сердечно-сосудистыми заболеваниями, иммунными реакциями, раком, вирусными инфекциями, бактериальными инфекциями, дрожжевыми инфекциями,
паразитическими инфекциями и т.п.
Олигомеры по изобретению подходят для использования как для in vivo, так и для ex vivo терапевтических применений.
Показания для ex vivo применений включают обработку клеток, таких как костный мозг или периферическая кровь, в состояниях, таких как лейкемия (хроническая миелогенная лейкемия, острая лимфоцитная лейкемия) или вирусная инфекция. Гены-мишени или РНК, кодируемые этими генами, которые могут служить мишенями для лечения рака, включают онкогены, такие как ras, k-ras, bcl-2, c-myb, bcr, c-myc, c-abl, или сверхэкспрессированные последовательности, такие как mdm2, онкостатин М, IL-6 (саркома Капоши (Kaposi's)), HER-2, и транслокации, такие как bcr-abl. Вирусные генные последовательности или РНК, кодируемые этими генами, такими как гены полимеразы или обратной транскриптазы вирусов герпеса, таких как CMV, HSV-1, HSV-2, ретровирусов, таких как HTLV-1, HIV-1, HIV-2, или других ДНК или РНК вирусов, таких как HBV, HPV, VZV, вируса гриппа, аденовирусов, флавивирусов, риновируса и т.п. также являются подходящими мишенями. Применение специфически связывающих олигомеров может быть осуществлено совместно с другими терапевтическими воздействиями. Другие терапевтические применения олигомеров по изобретению включают в себя (1) модуляцию воспалительных ответов путем модуляции экспрессии генов, таких как IL-1 рецептор, IL-1, ICAM-1 или E-селекция, играющих роль в опосредовании воспалений, и (2) модуляцию пролиферации клеток в состояниях, таких как закупорка артерий (рестеноз) после ангиоплазии, путем модуляции экспрессии (а) факторов роста или митогенных факторов, таких как немышечный миозин, myc, fox, PCNA, PDGF или FGF или их рецепторов, или (б) факторов пролиферации клеток, таких как c-myb. Другие подходящие факторы пролиферации или факторы сигнальной трансдукции, такие как TGFx IL-6, gINF, протеинкиназа С, тирозинкиназы (такие как p210, p190), могут являться мишенями для лечения псориаза и других состояний. Дополнительно, EGF рецептор, TGFa или MHC аллели могут быть мишенями при аутоиммунных заболеваниях.
Доставка олигомеров по изобретению в клетки может быть усилена любым подходящим методом, включая трансфекцию с помощью фосфата кальция, DMSO, глицериновую или декстрановую трансфекцию, электропорацию или применение катионных, анионных и/или нейтральных липидных композиций или липосом известными способами (международные публикации N WO 90/14074, WO 91/16024, WO 91/17424, патент США 4897355). Олигомеры по изобретению могут быть введены в клетки путем образования комплексов с катионными липидами, такими как DOTMA (который может или не может образовывать липосомы), после чего эти комплексы приводят в контакт с клетками. Подходящие катионные липиды включают в себя N-(2, 3-ди(9-(Z) -октадеценилокси))-проп-1-ил-N,N,N-триметиламмоний (DOTMA) и его соли, 1-O-олеил-2-O-олеил-3 -диметиламинопропил-β -гидроксиэтиламмоний и его соли и 2, 2-бис(олеилокси)-3- (триметиламмонио) пропан и его соли, но не ограничены ими.
Усиленная доставка олигомеров по изобретению также может быть
достигнута путем использования (1)
вирусов, таких как вирус Сендая (Sendai) (Bartzatt, R. , Biotechnol. Appl. Biochem., 1989, 11, 133-135) или аденовирус (Wagner, E. et al. , Proc Nati Acad Sci, USA,
1992, 89, 6099-6013); (2)
полиаминных или поликатионных
конъюгатов с использованием соединений, таких как полилизин, протамин или Na, N12-бис(этил)спермин (Wagner, Е. et al., Proc
Nati Acad Sci. USA, 1991,
88, 4255-4259; Zenke, M. et al., Proc Natl Acad Sci. USA, 1990, 87, 3655-3659; Chank, B. K. et al. , Biochem Biophys Res Commun., 1988, 157, 264-270; патент США 5138045); (3)
комплексов липополиамина
с использованием соединений, таких как липоспермин (Berh, J.-P. et al., Proc Natl Acad Sci. USA, 1989, 86, 6982-6986; Loeffler, J.Р. et al., J.Neurochem., 1990, 54, 1812-1815);
(4) анионных,
нейтральных или pH чувствительных липидов с использованием соединений, включающих анионные фосфолипиды, такие как фосфатидилглицерин, кардиолипин, фосфатидную кислоту или
фосфатидилэтаноламин (Lee,
K. -D. et al., Biochem Biophys ACTA, 1992, 1103, 185-197; Cheddar, G. et al. Arch Biochem Biophys, 1992, 294, 188-192; Yoshimura, Т., et al., Biochem Int. , 1990, 20,
697-706); (5) конъюгатов с
соединениями, такими как трансферрин или биотин или (6) конъюгатов с белками (включая альбумин или антитела), гликопротеинами или полимерами (включая полиэтиленгликоль), что
усиливает
фармакокинетические свойства олигомеров в субъекте. Термин трансфекция используется здесь в отношении любого способа, который подходит для доставки олигомеров в клетки. Любой реагент, такой
как липид,
или любой агент, такой как вирус, который может быть использован в протоколе трансфекции, обозначается здесь как "усиливающий проницаемость агент". Доставка олигомеров в клетки может быть
осуществлена путем котрансфекции с другими нуклеиновыми кислотами, такими как (1) способные к экспрессии фрагменты ДНК, кодирующие белок (белки) или фрагмент белка или (2) способные к трансляции РНК,
кодирующие белок (белки) или фрагмент белка.
Олигомеры по изобретению, таким образом, могут быть включены в состав любого подходящего препарата, который усиливает доставку олигомеров в клетки. Подходящие фармацевтические препараты также включают в себя те препараты, которые обычно используют, когда соединения доставляют в клетки или ткани путем местного применения. Соединения, такие как полиэтиленгликоль, пропиленгликоль, азон, ноноксонил-9, олеиновая кислота, DMSO, полиамины или липополиамины, могут быть использованы в препаратах для местного применения, которые содержат олигомеры.
Олигомеры по изобретению могут быть удобным образом использованы в качестве реагентов для целей исследования или продуцирования, когда желательно ингибирование экспрессии генов. В настоящее время доступно лишь очень небольшое число реагентов, которые способны эффективно и специфично ингибировать экспрессию генов-мишеней в соответствии с каким-либо механизмом. Олигомеры, о способности которых ингибировать экспрессию гена-мишени сообщалось раньше, в большинстве случаев обладают неспецифичным действием; и/или не снижают экспрессию гена-мишени до очень низких уровней (менее чем около 40% от неингибированных уровней).
Таким образом, олигомеры, как описано здесь, составляют реагент, который может быть использован в способах ингибирования экспрессии выбранного белка или белков в субъекте или в клетках, когда эти белки кодируются ДНК последовательностями и эти белки транслируются с последовательностей РНК, включающих в себя стадии, на которых: вводят олигомер по изобретению в клетки; позволяют этому олигомеру образовать триплекс с ДНК или РНК или дуплекс с ДНК или РНК, в результате чего ингибируется экспрессия белка или белков. Способы и соединение по изобретению подходят для модуляции экспрессии генов как в прокариотических, так и в эукариотических клетках, таких как бактерии, грибные паразиты, дрожжи или клетки млекопитающих.
РНаза H "компетентные" или РНаза H "некомпетентные" олигомеры могут быть легко созданы с использованием заменяющих связей по изобретению. РНаза H компетентные олигомеры могут содержать один или большее число РНаза H компетентных доменов, состоящих из соединенных РНаза H компетентных нуклеомономеров. Олигомеры, имеющие модификации, такие как 2'-замещения (2'-O- аллил и т.п.) или некоторые незаряженные связи (метилфосфонат, фосфорамидат и т.п.), являются обычно некомпетентными как субстрат, который узнается и/или на который воздействует РНаза Н. РНаза Н компетентность может облегчить антисмысловую функцию олигомера путем деградирования РНК мишени в дуплексе РНК-олигомер (Dagle, J.М. et al., Nucl Acids Res., 1990, 18, 4751-4757; Walder, J. A. et al., международная публикация N WO 89/05358). Этот фермент отщепляет РНК в РНК-ДНК дуплексах.
Для того чтобы сохранить РНаза H компетентность, олигомер должен иметь РНаза H компетентный домен из трех или большего числа компетентных смежных нуклеомономеров, локализованный в нем (Quartin, R.S., et al., Nucl Acids Res. , 1989, 17, 7253-7262). Конструкция олигомеров, устойчивых к действию нуклеаз, должна содержать модификации терминальной связи, сахара и/или основания для обеспечения устойчивости к нуклеазе. Таким образом, может быть сконструирован олигомер, имеющий модифицированные нуклеомономерные остатки либо на одном, либо на обоих 5'- и/или 3'-концах, имеющий при этом внутренний РНаза компетентный домен. Являющиеся примерами олигомеры, которые сохраняют РНаза H компетентность, должны обычно иметь единообразную полярность и должны содержать от примерно 2 до примерно 12 нуклеомономеров на 5'-конце и на 3'-конце, делающих олигомер устойчивым к деградации нуклеазами, и от около 3 до около 26 нуклеомономеров, которые функционируют в качестве РНаза H компетентного домена между РНаза H некомпетентными 3'- и 5'-концами. Вариации такого олигомера должны включать (1) более короткий РНаза H компетентный домен, содержащий 1 или 2 РНаза H компетентных связи или заменяющих связи; (2) более длинный РНаза H некомпетентный домен, содержащий до 15, 20 или большего числа заменяющих связей или нуклеомономеров; (3) более длинный РНаза H компетентный домен, содержащий до 30, 40 или большего числа связей; (4) олигомеры только с единственным РНаза H некомпетентным доменом на 3'-конце или 5'-конце.
Олигомеры, содержащие всего лишь 8 нуклеомономеров, могут быть использованы для осуществления ингибирования экспрессии белка (белков) - мишени путем образования дуплексных или триплексных структур с последовательностями нуклеиновых кислот - мишенями. Однако линейные олигомеры, используемые для ингибирования экспресии белка-мишени путем образования дуплекса или триплекса, должны предпочтительно иметь от около 10 до около 20 нуклеомономерных остатков.
Олигомеры, содержащие заменяющие связи по изобретению, могут удобным образом быть циркуляризованы известным образом (международная публикация N WO 92/19732; Kool, Е.Т. J. Am. Chem. Soc., 1991, 113, 6265-6266; Prakash, G. et al. , J. Am. Chem. Soc., 1992, 114, 3523-3527). Такие олигомеры подходят для связывания с однонитевыми или двунитевыми нуклеиновыми кислотами-мишенями. Кольцевые олигомеры могут быть разного размера. Такие олигомеры размером около 22-50 нуклеомономеров могут быть приготовлены удобным образом. Кольцевые олигомеры могут иметь от около 3 до около 6 остатков нуклеомономеров в области петли, которая разделяет связывающие домены олигомера, как описано (Prakash, G. ibid). Олигомеры могут быть циркуляризованы ферментативно через концевые фосфаты лигазой или химически - путем образования связи между 5'- и 3'-концевыми сахарами и/или основаниями.
Олигомеры могут быть использованы для модулирования экспрессии гена-мишени путем ингибирования взаимодействия связывающих нуклеиновую кислоту белков, ответственных за модуляцию транскрипции (Maher, L.J., et al. Science, 1989, 245, 725-730) или трансляции. Эти олигомеры, таким образом, пригодны в качестве последовательность-специфичных агентов, конкурирующих со связывающими нуклеиновую кислоту белками (включая рибосомы, РНК-полимеразы, ДНК-полимеразы, факторы инициации трансляции, факторы транскрипции, которые либо увеличивают, либо снижают транскрипцию, факторы транскрипции белков-гормонов и т.п.). Подходящим образом сконструированные олигомеры, таким образом, могут быть использованы для увеличения синтеза белков-мишеней с помощью такого механизма, как связывание с регуляторным сайтом (или вблизи него), который факторы транскрипции используют для репрессии экспрессии, или путем ингибирования экспрессии самого выбранного репрессорного белка.
Олигомеры по изобретению, содержащие дополнительные модификации, которые усиливают сродство связывания, могут быть сконструированы так, чтобы они содержали вторичные или третичные структуры, такие как псевдоузлы или псевдополуузлы (Есker, D.J. et al. Science, 1992, 257, 958- 961). Такие структуры могут иметь более стабильную вторичную или третичную структуру, чем соответствующие немодифицированные олигомеры. Усиленная стабильность таких структур должна опираться на возросшее сродство связывания между областями самокомплементарности в одиночном олигомере или областями комплементарности между двумя или большим числом олигомеров, которые образуют данную структуру.
Такие структуры могут быть использованы для имитации таких структур, как HIV TAR структура, для того, чтобы препятствовать связыванию белком HIV Tat (белок, который связывается с TAR). Сходный подход может быть использован для других факторов транскрипции или трансляции, которые узнают структуры нуклеиновых кислот более высокого порядка, такие как стволы, петли, шпильки, узлы и т.п. В альтернативном случае олигомеры по изобретению могут быть использованы для (1) разрушения или (2) связывания с такими структурами как способ (1) препятствия или (2) усиления связывания белков со структурами нуклеиновых кислот.
Дополнительно к использованию в антисмысловой терапии или терапии триплетной спирали олигомеры по изобретению также могут быть применены как терапевтические или диагностические агенты, которые действуют прямой заменой одной нити в дуплексной нуклеиновой кислоте. Замена нити в естественном дуплексе, таком как хромосомная ДНК или дуплексная вирусная ДНК, РНК или гибрид ДНК/РНК, возможна для олигомеров с высоким сродством связывания, для которых комплементарная им последовательность не настолько велика, чтобы эффективно заменить нить ДНК или РНК в дуплексе. Терапевтическая эффективность олигомеров, которые действуют путем образования D-петли, должна проистекать из связывания с высоким сродством с комплементарной последовательностью, что приводит к модуляции нормальной биологической функции, связанной с нуклеиновой кислотой-мишенью. Типы нуклеиновых кислот-мишеней включают в себя, но не ограничены (1) генными последовательностями, включая экзоны, интроны, сочленения экзон/интрон, области промотор/энхансер и 5' или 3' нетранслируемые области, (2) областями нуклеиновых кислот, которые для функционирования используют вторичные структуры (например HIV TAR ствол-петля элемент или тРНКазы), (3) нуклеиновыми кислотами, которые выполняют структурные или другие функции, такими как теломеры, центромеры или сайты начала (ориджины) репликации (вирусов, бактерий и т. п.), и (4) любыми другими дуплексными областями. Очевидно, что могут быть синезированы олигомеры с дискретными функциональными доменами, в которых одна область олигомера связывает мишень путем образования D-петли, а соседняя область связывает молекулу-мишень путем образования триплексной спирали или связывания с белком в качестве аптамера. В альтернативном случае D-выпетленный олигомер может связываться с каждой нитью в дуплексе путем переключения нити, с которой связывается олигомер (то есть имея одну область олигомера, которая связывает одну нить, и другую область, которая связывает комплементарную нить). Контролирующие элементы, предписывающие тип связывания (триплекс, дуплекс или D-петля) представляют собой последовательность олигомера и свойственное олигомеру сродство. Основные правила узнавания в Уотсон - Криковском дуплексном связывании отличаются от правил контролируемого триплексного связывания Хугстена (Hoogsteen). Из-за этого последовательность оснований олигомера может быть использована для определения типа правил связывания олигомера, который будет использован. D-петлевые структуры образуются в природе путем ферментопосредованных процессов (Harris, L. D. et al., J.Biol Chem., 1987, 262, 9285-9292) или ассоциированы с областями, где происходит репликация ДНК (Jacobs, Н.Т. et al., Nucl Acids Res, 1989, 17, 8949-8966). D-петли, возникающие при связывании олигомеров, могут получаться в результате одно- или двухступенчатого процесса. Прямая замена нити-мишени приведет к возникновению D-петли как единичного события связывания. Однако образование D-петли может также произойти путем образования триплексной спирали, которая облегчает событие замены нити, ведущее к D-петле.
Рибозимы, содержащие заменяющие связи по изобретению, могут быть сконструированы для того, чтобы создать виды с измененными характеристиками. Известны рибозимы, которые расщепляют однонитевую РНК или ДНК (Robertson, D.L. , et al. Nature, 1990, 344, 467-468). Известны терапевтические применения рибозимов (Sarver, N. et al. Science, 1990, 247, 1222-1225; международная публикация N WO 91/04319). На вторичную и третичную структуру, необходимую для функционирования рибозимов, можно воздействовать путем создания соответствующих олигомерных последовательностей. Например, рибозимы, имеющие устойчивые к действию нуклеаз домены связи с мишенями, содержащие заменяющие связи по изобретению, могут иметь более высокое сродство к последовательностям-мишеням, сохраняя специфичность спаривания оснований. Из-за более высокого сродства и/или устойчивости к действию нуклеаззаменяющих связей по изобретению в рибозиме могут быть сконструированы более короткие узнающие домены (преимущество при производстве), что может привести к более рациональному функциональному циклу субстрата (преимущество в действии рибозима).
В терапевтических применениях олигомеры по изобретению могут быть использованы подходящим для лечения различных состояний образом с ингибированием экспрессии соответствующих генов-мишеней. Для такой терапии олигомеры могут быть включены в состав препаратов для различных форм применения, включая системное, местное или локализованное применение. Методики и препараты в основном описаны (Remington's Pharmaceutical Sciences, Merck Publishing Co., Easton, PA, последнее издание). Олигомерный активный ингредиент обычно объединяют с носителем, таким как разбавитель или эксципиент, который может включать в себя наполнители, удешевляющие добавки, связующие вещества, смачивающие агенты, разрыхлители, поверхностно-активные агенты или смазывающие вещества, в зависимости от типа введения и дозовых форм. Типичные дозовые формы включают в себя таблетки, порошки, жидкие препараты, включая суспензии, эмульсии и растворы, гранулы, капсулы и суппозитории, а также жидкие препараты для инъекций, включая препараты липосом.
Для системного введения предпочтительны инъекции, включая внутримышечные, внутривенные, внутрибрюшинные и подкожные. Для инъекций готовят препарат олигомеров по изобретению в жидких растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Ханка (Hank's) или раствор Ринджера (Ringer's). Кроме того, могут быть приготовлены препараты олигомеров по изобретению в твердой форме, которые перерастворяют или суспендируют непосредственно перед использованием. Пригодны также лиофилизированные формы. Дозы, которые могут быть использованы для системного введения, предпочтительно находятся в пределах от 0,001 мг/кг до 50 мг/кг для введения один или два раза в день. Однако могут быть использованы различные схемы введения доз в зависимости от (1) способности индивидуального олигомера ингибировать активность ДНК или РНК мишени, (2) силы и продолжительности патологического болезненного состояния, ассоциированного с данным геном-мишенью, или (3) формакокинетическими свойствами данного олигомера.
Системное введение также может быть осуществлено через слизистую оболочку или через кожу, либо соединение может вводиться перорально. Для введения через слизистую оболочку или через кожу в препаратах используют способствующие проникновению вещества, позволяющие осуществить прохождение через такой барьер. Такие способствующие проникновению вещества в основном известны из уровня техники и включают в себя, например, желчные соли и производные фузидной кислоты для введения через слизистую оболочку. Дополнительно для облегчения проникновения могут быть использованы детергенты. Введение через слизистую оболочку может быть осуществлено с помощью назальных аэрозолей, например, или суппозиториев. Для перорального введения готовят препараты олигомеров в традиционной для перорального введения форме, такой как капсулы, таблетки или тоники.
Для местного введения готовят препараты олигомеров по изобретению в виде мазей, гелей или кремов, что хорошо известно из уровня техники. Препараты олигомеров по изобретению для введения при поражениях глаз, таких как вирусные инфекции, должны основываться на стандартных составах, известных из уровня техники.
Кроме использования в терапии олигомеры по изобретению могут быть использованы в качестве диагностических реагентов для определения наличия или отсутствия последовательностей нуклеиновых кислот-мишеней, с которыми они специфично связываются. Усиленное сродство связывания олигомеров по изобретению дает преимущество при их использовании в качестве праймеров или зондов. Диагностические тесты могут проводиться путем гибридизации с образованием двойной или тройной спирали, которую затем выявляют традиционными методами. Например, олигомеры могут быть помечены радиоактивными, флюоресцентными или хромогенными метками, и будет определяться наличие метки, связанной с твердой подложкой. В альтернативном случае наличие двойной или тройной спирали может быть определено с помощью антител, которые специфично узнают эти формы. Средства для осуществления таких анализов с использованием таких олигомеров в качестве зондов в основном известны.
Применение олигомеров с заменяющими связями по изобретению в качестве диагностических агентов путем образования триплексов является преимущественным, так как тройные спирали образуются в мягких условиях, и анализ может быть проведен без подвергания тестируемого образца жестким условиям. Диагностические анализы, основанные на определении РНК для идентификации последовательностей бактерий, грибов или простейших часто требуют выделения РНК из образцов или организмов, выращенных в лаборатории, что отнимает силы и время, поскольку РНК чрезвычайно чувствительна к убихитозным нуклеазам.
Олигомерные зонды также могут включать дополнительные модификации, такие как модифицированные сахара и/или заменяющие связи, которые придают олигомеру особенную стабильность к действию нуклеаз, и, таким образом, могут быть полезны для анализов, проводимых в присутствии клеточных или тканевых экстрактов, обычно имеющих нуклеазную активность. Олигомеры, содержащие концевые модификации, часто сохраняют свою способность связывать комплементарные последовательности без потери специфичности (Uhlmann et al. Chemical Reviews, 1990, 90, 543-584). Как установлено выше, зонды по изобретению могут также содержать линкеры, которые позволяют специфически связывать альтернативные нити ДНК путем включения в их состав линкера, позволяющего осуществлять такое связывание (Froehler, B. C. et al. Bioche mistry, 1992, 31, 1603-1609; Home et al., J. Am Chem Soc., 1990, 112, 2435-2437).
Введение аналогов оснований по изобретению в зонды, которые также содержат ковалентные перекрестносшивающие агенты, дает возможность увеличить чувствительность и уменьшить фон в анализах для диагностики или определения. Дополнительно применение перекрестносшивающих агентов позволит осуществить новые модификации анализов, такие как (1) применение перекрестной сшивки для усиления распознавания зонда, (2) введение стадии денатурации водой для уменьшения фона и (3) осуществление гибридизации и перекрестной сшивки при или вблизи температуры плавления гибрида для частичного разрушения вторичной структуры мишени и увеличения специфичности зонда. Известны модификации условий гибридизации (Camper et al., Nucleic Acids Res., 1986, 14, 9943).
Олигомеры по изобретению подходят для использования в диагностических анализах, использующих способы, в которых либо олигомер, либо нуклеиновая кислота, которые должны быть определены, ковалентно связаны с твердой подложкой (как описано в патенте США 4775619). Эти олигомеры также подходят для использования в диагностических анализах, которые основываются на технике полимеразной цепной реакции для амплификации последовательностей-мишеней, согласно уровню техники (публикация европейского патента N 0393744). Олигомеры по изобретению, содержащие 3'-конец, который может служить в качестве праймера, совместимы с полимеразами, используемыми в технике полимеразной цепной реакции, такими как Taq или Vent (New England Biolabs) полимеразы. Олигомеры по изобретению, таким образом, могут быть использованы в протоколах ПЦР.
Олигомеры по изобретению полезны в качестве праймеров, которые имеют дискретные последовательности, или в качестве праймеров с произвольной последовательностью. Праймеры с произвольной последовательностью обычно имеют длину около 6, 7 или 8 нуклеомономеров. Такие праймеры могут быть использованы в различных протоколах амплификации нуклеиновых кислот (ПЦР, лигазная цепная реакция и т.д.) или в протоколах клонирования. Заменяющие связи по изобретению обычно не препятствуют способности олигомера работать в качестве праймера. Олигомеры по изобретению, имеющие 2'-модификации в сайтах, не являющихся 3'-концевыми остатками, другие модификации, которые придают олигомеру РНаза H некомпетентность или иную устойчивость к действию нуклеаз, могут быть с успехом использованы в качестве зондов или праймеров для РНК или ДНК последовательностей в клеточных экстрактах или других растворах, содержащих нуклеазы. Таким образом, олигомеры могут быть использованы в протоколах для амплификации нуклеиновых кислот в образце путем смешивания олигомера с образцом, содержащим нуклеиновую кислоту-мишень, с последующей гибридизацией олигомера с нуклеиновой кислотой-мишенью и амплификацией нуклеиновой кислоты-мишени с помощью ПЦР, ЛЦР или других подходящих методов.
Производные олигомеры, полученные с помощью хелатирующих агентов, таких как EDTA, DTPA или аналогов 1,2-диаминциклогексануксусной кислоты, могут быть использованы в различных in vitro диагностических анализах (патенты США 4772548, 4707440 и 4707352). В альтернативном случае могут быть получены производные олигомеров по изобретению с помощью перекрестносшивающих агентов, таких как 5-(3-йодацетамидопроп-1- ил)2'-дезоксиуридин или 5-(3-(4-бромбутирамидо)проп-1-ил)-2'- дезоксиуридин, и использованы в различных методах анализов или наборах (международная публикация WO 90/14353).
Дополнительно к указанным выше применениям способность олигомеров по изобретению ингибировать экспрессию генов может быть проверена в in vitro системе путем измерения уровней экспрессии в клетках-субъектах или в рекомбинантных системах любыми подходящими методами (Graessmann, М. et al., Nucleic Acids Res., 1991, 19, 53-59).
Описанное выше изобретение иллюстрируется данными ниже примерами для лучшего его понимания. Примеры предназначены для иллюстрации изобретения и не должны пониматься как ограничивающие это изобретение.
Примеры
Обзор синтеза нуклеомономерных синтонов и
олигомеров
Олигомеры по изобретению могут быть синтезированы с использованием реакций, известных из уровня техники для синтеза производных олигонуклеотидов (Flandor, J. and Yam, S.Y.,
Tetrahedron Letts., 1990, 31, 597-600; Mattson, R. J. et al., J. Org Chem., 1990, 55, 2552-2554; Chung, С.К. et al., J. Org Chem., 1989, 54, 2767-2769).
Как видно из разнообразия заменяющих связей, конкретно перечисленных в табл. А, заменяющие связи по изобретению могут варьироваться таким образом, чтобы содержать в своей структуре один или несколько атомов азота, серы и/или кислорода. Положения этих атомов в заменяющих связях могут быть различными и находиться на "5'"-конце, "в середине", на "2'" или "3'" и "4'"-конце. В этом разделе приводится ряд чертежей, представляющих реакции синтеза, которые показывают, какими способами можно добиться различного местоположения и комбинаций атомов азота и кислорода в заменяющих связях.
Метод синтеза, показанный на фиг. 1-25, может быть модифицирован известным для специалиста в области олигонуклеотидной химии образом. Например, хотя этап защиты оснований не всегда указан на чертежах, он может быть желателен и осуществлен с использованием реагентов и методик, известных из уровня техники (см., например, Protective Groups in Organic Synthesis, Theodora W. Greene, John Wiley and Sons, 1981). Аналогично, хотя применение защитных групп в некоторых случаях указано, но не всегда необходима блокировка реагентов для синтеза иллюстрирующих изобретение олигомеров.
Пример 1
Первые пять стадий, показанных на фиг. 1, относятся к получению изобутирилзащищенного аминокислотного спирта серинола. Шестая и последующие стадии на фиг.1 направлены на синтез
серинолзамещенного тиминфосфорамидитного строительного блока.
На стадии 1 фиг. 1 аминогруппу аминокислоты серина защищают путем взаимодействия 1 с ди-трет-бутилдикарбонатом с получением соединения 2. Могут быть использованы другие эквивалентные защитные группы. На следующей стадии β-гидроксильную группу соединения 2 блокируют дигидропираном с получением полностью защищенной аминокислоты 3. Аминокислоту 3 затем подвергают взаимодействию с диборан-диметилсульфидным комплексом с получением спирта 4, который под воздействием изобутирилхлорида дает 5. Эта реакция восстановления может также быть осуществлена с использованием изобутилхлорформиата и борогидрида натрия (Ramasamy, R.K. Olsen and Т. Emery, Synthesis 1982, 42). Взаимодействие 5 с трифторуксусной кислотой в течение 30 мин с последующим промыванием NaHCO3 дает 6.
Тиминуксусная кислота 7 была приготовлена как описано в литературе (L. Kosynkina, W.Wang and Т. С. Liang, Tetrahedron Letts, 1994, 35, 5173). Сочетание 7 с 6 в смешанных ангидридных условиях дает 8. Диметокситритилирование соединения 8 с помощью DMTCI дает соединение 9, которое после гидролиза основанием дает 10. Фосфитилирование соединения 10 в стандартных условиях дает связанный с серинолом тиминовый строительный блок 11. Этот синтон затем может быть добавлен к растущему олигомеру методами традиционной химии. Любая химия синтеза ДНК, такая как фософорамидатная или фосфонатная химия, может быть использована для связывания мономеров или димеров аналогичным указанному выше образом.
Пример 2
На реакционной схеме фиг. 2 тимин ацетальдегид 13 получают путем обработки тимина диметилацеталем бромацетальдегида с последующим гидролизом соединения 12
водной TFA.
Альдегид 13 и амин 6 затем сочетают и трансформируют соответствующее промежуточное соединение в фосфорамидитный строительный блок 17 способом, аналогичным стадии, использованной на фиг.
1.
Пример 3
На реакционной схеме фиг. 3 исходным материалом является β-замещенная аминокислота 18. Замещенная аминокислота должна быть трансформирована в
фосфорамидитный
строительный блок 27 с последующими стадиями, использованными на фиг. 1 и 2.
Пример 4
На фиг. 4 исходный аминоспирт 21 окисляют смесью CrO3
/пиридин с получением
альдегида 28. Этот альдегид при взаимодействии с алкилгалогенидом в присутствии основания должен дать соединение 29. Аминоспирт 29 затем может быть трансформирован в
строительный блок 35 способом,
аналогичным стадиям, использованным на фиг. 1 и 2.
Пример 5
На фиг. 5 первые четыре стадии по существу аналогичны первым четырем стадиям,
использованным на фиг. 1, только
вместо серина используют аспарагиновую кислоту. Метиловый эфир аспарагиновой кислоты 36 дает полностью защищенный спирт 40, который после селективного снятия защиты
уксусной кислотой дает 41.
Окисление 41 смесью CrO3/пиридин дает соответствующий альдегид 42. Восстановительное аминирование альдегида 42 о-бензилгидроксиламином в присутствии
триацетоксиборогидрида натрия должно
дать 43 (T. Kolasa and М.J. Miller, J. Org. Chem., 1990, 55, 1711). Спирт 39 затем превращают в альдегид 46, используя по существу те же реакционные условия, как
указанные выше, но с аллильной
защитной группой для гидроксильной функции 39. Сочетание альдегида 46 и гидроксиламина 43 в присутствии триацетоксиборогидрида натрия с последующим снятием защиты
аминозащищающих групп должно привести
к бисамину 48. Бисамин 48 может быть затем превращен в димер 53 с последующими стадиями, использованными на фиг. 1.
Пример 6
На фиг. 6
сочетание спирта 54 с
О-бензилгидроксиламином 55 в условиях реакции Митсунобу (Mitsunobu, Sinthesis, 1981, 1) дает соединение 56. Промежуточное соединение 56 при гидрогенизации с последующим
ацетилированием должно привести
к 57. Под действием TFA в соединении 57 деблокируются "TBDMSI" защитные группы и получается 58. Сочетание 58 с 7 с последующим диметокситритилированием должно дать 60.
Финальный строительный блок 62
получают из 60 основным гидролизом с последующим фосфитилированием.
Пример 7
На фиг. 7 серинол 4 превращают в галогенид 59 и алкилируют с
тимином с получением 63. Защитные
группы в 63 удаляют, сочетают с DMT-защищенной гидроксиуксусной кислотой и фосфитилируют с получением 66.
Пример 8
На фиг. 8 спирт 64
сочетают с N-гидроксиламинопропановой
кислотой 69 с получением 70. Алкилирование тимина галогенидом 73 дает 74, которое после снятия защиты, сочетания с 76 с последующим гидролизом должно привести к
78. Конденсация 78 с 70 с последующим
фосфитилированием должна дать гидроксаматный димер 80.
Пример 9
На фиг. 9 N-гидроксиламинопропановый альдегид 81 используют для
сочетания со спиртом 64. Димер 88 получают из
83 и 86 с последующими стадиями, использованными на фиг. 8.
Пример 10
На фиг. 10 алкилирование (T.Kolasa and М.J. Miller, J.
Org Chem., 1990, 55, 4246) метилового эфира
α-бром-β-аминопропановой кислоты 89 тимином дает 90. Промежуточное соединение 90 при гидролизе гидроксидом натрия дает кислоту 91, которую
сочетают с 6 с получением 92. Соединение 92
затем превращают в фосфорамидитный строительный блок 95, используя стадии, описанные на фиг. 1.
Пример 11
На фиг. 11 тимин
алкилируют алкиламиногалогенидом 96 (получение
аминоалкилгалогенида смотри R. K. Olsen, К. Ramasamy and Т. Emery, J.Org. Chem., 1984, 49, 3527 and Islam et al., J.Med. Chem., 1994, 37, 293-304) с
получением 97. Соединение 97 под действием TFA с
последующим алкилированием даст 100. Строительный блок 103 получают из 100 путем диметокситритилирования, гидролиза и последующего
фосфитилирования.
Пример 12
На фиг. 12
показан альтернативный путь получения димера 111 с гидроксаматным скелетом из N-гидроксиламина 43 и альдегида 107, который в свою
очередь получают из аспарагиновой кислоты.
Пример
13
На фиг. 13 димер 115 получают из промежуточного соединения 108 и 13 с последующими стадиями, описанными на фиг. 2.
Пример 14
На фиг. 14 получают N-гидроксилтимин
(смотри Kim, C.U., et al. Tetrahedron Letts. , 1992, 33, 25-28) и сочетают с N-гидроксифталимидом с получением 117, который под
действием гидразина в этаноле должен дать 118. Обработка 118
DMT-защищенным эпоксидом глицерина 119 дает 120. Промежуточное соединение 120 затем превращают в фосфорамидит 121, используя стандартные
методики. Во втором синтезе соединение 118 сочетают с
аминокислотным альдегидом 122 в условиях восстановительного аминирования с получением 123. Защита вторичной аминофункциональности с помощью
FMOCCI с последующим гидролизом дает 125.
Пример 15
На фиг. 15 1,2-гидроксипропановую кислоту 126 сочетают с N-гидроксиламин тимином 118 с получением
127, который затем
трансформируют в фосфорамидитный синтон 129 в стандартных
условиях. Соединение 118 также сочетают с адипиновой кислотой и трансформируют в нуклеинокислотный строительный блок 133.
Пример 16
На фиг. 16 первый строительный блок 136
синтезируют из 118 и 134 схожим с описанным на фиг. 1 образом. Сочетание 139 со 118 даст 140. Обработка 137 с помощью 118 должна дать 138,
который при конденсации со 140 дает димер 141.
Пример 17
На Фиг. 17 альдегид 142 и бензиловый эфир глицина сочетают с получением 143. Обработка 143 с помощью 7 дает 145,
который под действием уксусной кислоты дает 148.
Митсундовское алкилирование 148 с помощью Boc-NH-O-ацетилгидроксиламина дает 147, который при гидрогенизации дает строительный блок 150. Схожим
образом, сочетание 143 с 13 с такими же, как указано
выше, последующими реакциями дает синтон 149.
Пример 18
На фиг. 18 восстановительное аминирование альдегида 142 и
Boc-NH-O-бензилгидроиламина дает 151. Гидрогенизация 151 с
последующим алкилированием 152 гликолевой кислотой 153 (B.C. Borer and D.C. Balogh, Tetrahederon Letts, 1991, 32, 1039) даст 154. Обработка
154 с помощью TFA удалит Boc защитную группу, что при
сочетании даст 155. Гидроксилзащитные группы на 155 могут быть селективно удалены уксусной кислотой с получением 156. Затем соединение будет
трансформировано в строительный блок 157 с использованием
стандартных реакционных условий. Схожим образом строительный блок 158 будет получен путем сочетания 154 с 13 с последующими стадиями,
используемыми для получения 157.
Пример 19
На фиг. 19 алкилирование тимин-N-гидроксиламина 160 спиртом 162 приведет к 163. Соединение 163 может быть трансформировано в
фосфорамидитный строительный блок 166 с помощью последующих стадий,
использованных на фиг. 1.
Пример 20
На фиг. 20 первое промежуточное соединение 169 синтезируют из
глутаминовой кислоты с использованием стандартных реакционных условий.
Алкилирование тимина с помощью 169 даст 170, которое при обработке с помощью TFA даст 171. Промежуточное соединение 171 можно
сочетать с Boc-глицином с получением 173, который при гидролизе дает
мономерный синтон 174. Схожим образом 172 сочетают со 118 и Boc-аминоуксусным альдегидом с последующим гидролизом бензилового
эфира.
Пример 21
На фиг. 21 промежуточное
соединение 177 получают из Boc-NH-O-бензилгидроксиламина и 175, используя стандартные условия реакции. Гидрогенизирование 177 с
последующим сочетанием с N-гидрокситимином 116 даст 178. Удаление ТНР
защитной группы с последующим диметокситритилированием и фосфитилированием даст синтон строительного блока 181. Схожим образом
182 может быть получен, следуя указанным выше реакциям с использованием
ТНР-гидроксиуксусного альдегида вместо ТНР-гидроксиуксусной кислоты.
Пример 22
На фиг. 22
строительный блок 191 может быть получен с использованием известного исходного
материала 183, следуя условиям реакций, указанным внизу на фиг. 22.
Пример 23
На фиг. 23
синтез строительного блока 199 может быть осуществлен с использованием исходного
материала 183, следуя условиям реакций, указанным внизу на фиг. 23.
Пример 24
На фиг. 24
исходный материал 200 трансформируют в строительный блок 207, следуя условиям реакций,
указанным внизу на фиг. 24.
Пример 25
Соединения, используемые и получаемые в этом
примере, показаны на фиг. 1.
Серин (1): Тимин (37,8 г, 300 ммоль) растворяли в растворе гидроксида калия (64,5 г, 1150 ммоль) в 200 мл воды. Пока раствор нагревался на 40o C-ной водной бане, в течение 1 ч добавляли раствор бромуксусной кислоты (62,5 г, 450 ммоль) в 100 мл воды. Реакционную смесь перемешивали еще 1 ч при такой температуре. Позволяли смеси остыть до комнатной температуры и подводили pH до 5,5 с помощью конц. HCl. Затем раствор охлаждали в холодильнике в течение 2 ч. Любой осадок (непрореагировавший тимин) удаляли фильтрацией. Затем раствор доводили до pH 2 с помощью конц. HCl и помещали в морозильную камеру на 2 ч. Белый осадок собирали фильтрацией и высушивали в вакуумной печи при 40oC в течение 6 ч. Выход составлял 44 г (88%).
Метиловый эфир N-Boc-L-серина (2):
Метиловый эфир L-серина
(15,6 г, 100 ммоль) суспендировали в смеси THF/DMF (100 мл каждого) при комнатной температуре. К этой
перемешиваемой смеси добавляли триэтиламин (11,13 г, 110 ммоль), а затем ди-трет-бутилдикарбонат
(24,0 г, 110 ммоль) и перемешивание продолжали при комнатной температуре в течение 30 мин. Добавляли
воду (20 мл) и раствор перемешивали при комнатной температуре в течение 8 ч. Раствор выпаривали
досуха. Остаток суспендировали в этилацетате (250 мл) и обрабатывали гидросульфатом калия (0,25 N
раствор, 100 мл). Этот продует затем немедленно экстрагировали раствором этилацетата. Органический
экстракт промывали водой (100 мл), рассолом (100 мл) и высушивали над безводным сульфатом натрия.
Выпаривание органического растворителя давало маслянистый остаток в количестве 26 г (90%).
Метиловый эфир N-Boc-L-серина (OTHP) (3):
Соединение 2 (15 г, 68,49 ммоль)
растворяли в сухом CH2Cl2 (100 мл) и обрабатывали 3,4-дигидро-2H-пираном (8,4 г,
100 ммоль) и каталитическим количеством п-толуолсульфоновой кислоты (100 мг) при комнатной
температуре. Реакционную смесь оставляли перемешиваться при комнатной температуре на 12 ч и выпаривали
досуха. Остаток растворяли в этилацетате (200 мл), промывали 5%-ным раствором NaHCO3
(100 мл), водой (50 мл) и рассолом (50 мл). Органический экстракт высушивали над безводным Na2
SO4 и выпаривали досуха. Такой остаток является достаточно чистым для использования
на следующей стадии, и используется как таковой. Выход 15 г (72%).
N-Boc-L-серинол
(OTHP) (4):
Метиловый эфир серина (ОТНР) (10 г, 33 ммоль) растворяли в сухом THF (100 мл)
и охлаждали до 0oC на ледяной бане в атмосфере аргона. К этому охлажденному перемешанному
раствору добавляли борометилсульфидный комплекс (2 М раствор в THF, 100 мл, 200 ммоль) в течение 1
ч при 0oC. После добавления бора реакционную смесь нагревали до комнатной температуры и
выдерживали при 40oC в течение 6 ч. Охлаждали реакционную смесь до 0oC,
нейтрализовали водой и уксусной кислотой до pH 6-7 и экстрагировали эфиром (3 х 100 мл). Эфирный экстракт
промывали водой (2 х 200 мл) и рассолом (100 мл), высушивали над безводным Na2
SO4 и выпаривали досуха с получением сырого продукта в виде масла. Из этого масла при очистке
флэш-хроматографией на силикагеле с использованием гексана->ацетона в качестве элюента
получали 8 г (88%) чистого продукта.
N-Boc-L-серин (OTHP) OIb (5):
К
перемешанному раствору соединения 4 (8 г, 29,09 ммоль) в сухом CH2Cl2 (100 мл) при
0oC добавляли TEA (3,54 г, 35 ммоль), а затем изобутирилхлорид (3,71 г, 35 ммоль) в
течение 30 мин. Затем реакционную смесь перемешивали при комнатной температуре в течение 4 ч и
выпаривали досуха. Остаток растворяли в EtOAc (200 мл), промывали 5%-ным раствором NaHCO3 (50
мл), водой (50 мл) и рассолом (50 мл). Органический экстракт высушивали над безводным Na2SO4 и выпаривали досуха с получением сырого продукта в виде масла. Из этого масла при
очистке флэш-хроматографией на силикагеле с использованием гексана->ацетона в качестве
элюента получали 7,9 г (79%) чистого продукта.
L-серинол (OIb) (6):
Соединение 5
(10 г, 28,98 ммоль) растворяли в CH2Cl2 (100 мл), оставляли
перемешиваться при комнатной температуре с TFA (50 мл) в течение 1 ч и выпаривали досуха. Остаток растворяли в
метаноле (50 мл) и снова выпаривали. Остаток растворяли в CH2Cl2
(200 мл), промывали насыщенным раствором NaHSO3 (2 х 100 мл), водой (100 мл) и рассолом (50 мл).
Органический экстракт высушивали над безводным Na2SO4 и выпаривали
досуха с получением 4,5 г (96%) продукта в виде масла.
N-(тиминилацетил)-L-серинол (OIb)
(8):
Тиминуксусную кислоту (7) (7,3 г, 4 ммоль) и N-метилморфолин (4,4 мл, 40 ммоль)
растворяли в 100 мл DMF. Позволяли раствору охладиться до -20oC в атмосфере аргона. К этому
холодному перемешанному раствору однократно добавляли изобутилхлорформиат (5,2 мл, 40 ммоль).
Через 15 мин добавляли раствор 6 (6,44 г, 40 моль) в 30 мл DMF (охлажденный до той же температуры).
Реакционную смесь перемешивали при -20oC в течение 30 минут, нагревали до комнатной
температуры и продолжали перемешивание в течение 1 часа. Реакционную смесь выпаривали досуха, и
растворяли остаток в CH2Cl2 (200 мл). Органический раствор промывали 5%-ным
раствором NaHCO3 (100 мл), водой (100 мл) и рассолом (50 мл). Органический экстракт
высушивали над безводным Na2SO4 и выпаривали досуха с получением сырого продукта в
виде пены. Из этого сырого продукта при очистке флэш-хроматографией на силикагеле с
использованием CH2Cl2->ацетона в качестве элюента получали 12 г (92%) чистого
продукта.
4,4'-Диметокситритил-N-(тиминилацетил)-L-серинол (OIb) (9):
Соединение 8 (10 г, 30,58 ммоль) подвергали совместному выпариванию с сухим пиридином (3 х 50 мл) и
растворяли в сухом пиридине (100 мл). К этому раствору добавляли TEA (3,54 г, 35 ммоль), а
затем DMTCl (11,83 г, 35 ммоль) при комнатной температуре в атмосфере аргона. Реакционную смесь перемешивали
в течение 12 ч, нейтрализовали метанолом (20 мл) и перемешивали в течение 30 мин. Раствор
выпаривали досуха и растворяли в CH2Cl2 (200 мл). Органический экстракт промывали
5%-ным раствором NaHСО3 (100 мл), водой (100 мл) и рассолом (50 мл). CH2
Cl2-слой высушивали над безводным Na2SO4 и выпаривали досуха с
получением сырого продукта в виде пены. Из этого сырого продукта при очистке флэш-хроматографией на
силикагеле с использованием CH2Cl2->ацетона в качестве элюента
получали 17 г (88%) чистого продукта.
1-O-(4,4'-диметокситритил)-2- [амино(тиминилацетил)]
-L-пропан-1,3-диол (10):
Соединение 9 (10 г, 15,89 ммоль) растворяли в метаноле
(20 мл). К этому раствору добавляли 1 N раствор NaOH (20 мл, 20 ммоль) при 0oC. Реакционную смесь
перемешивали в течение 1 ч, нейтрализовали уксусной кислотой до pH 7. Раствор
экстрагировали EtOAc (2 х 100 мл). Органический экстракт промывали 5%-ным раствором NaHCO3 (100 мл), водой (100
мл) и рассолом (50 мл). EtOAc-слой высушивали над безводным Na2
SO4 и выпаривали досуха с получением сырого продукта в виде пены. Из этого сырого продукта при очистке
флэш-хроматографией на силикагеле с использованием CH2Cl2
->ацетона в качестве элюента получали 8,2 г (92%) чистого продукта.
1'-О-(4,4'-диметокситритил)
-2-[амино(тиминилацетил)] -L-пропан-3'-О- (N,N-диизопропил)-β
-цианоэтилфосфорамидит (11):
Соединение 10 (8,00 г, 14,31 ммоль) подвергали совместному выпариванию с сухим пиридином (3 х
50 мл) и высушивали над твердым NaOH в течение ночи под вакуумом.
Высушенный материал растворяли в сухом CH2Cl2 (100 мл) и охлаждали до 0oC в атмосфере аргона. К этому
охлажденному раствору добавляли N,N-диизопропилэтиламин (5,23 г,
25 ммоль), а затем 2-цианоэтил-N,N-диизопропилхлорфосфорамидит (4,72 г, 20,00 ммоль) в атмосфере аргона. Реакционную смесь перемешивали
при 0oC в течение 1 ч и при комнатной температуре в
течение 1 ч. Реакционную смесь разводили CH2Cl2 (100 мл). CH2Cl2-раствор промывали 5%-ным
раствором NaH-СО3 (100 мл), водой (100 мл) и рассолом
(50 мл). CH2Cl2-слой высушивали над безводным Na2SO4 и выпаривали досуха с получением
сырого продукта в виде пены. Из этого сырого продукта при очистке
флэш-хроматографией на силикагеле с использованием CH2Cl2->ацетона, содержащего 0,1% TEA, в качестве
элюента получали 10 г чистого продукта. Эту пену высушивали над
твердым NaОН в вакууме в течение ночи. Растворяли пену в CH2Cl2 (15 мл) и добавляли по каплям в перемешанный
раствор сухого гексана (2000 мл) в аргоне в течение 1 ч. После
добавления CH2Cl2-раствора образовавшийся осадок перемешивали еще 1 ч и фильтровали, промывали сухим гексаном (200
мл) и высушивали над твердым NaOH в течение ночи. Выход 9,5 г
(87%).
Пример 26 (см. фиг. 26)
N-(трет-бутилоксикарбонил)-O-бензил-L-серин (2):
О-бензил-L-серин (1)
(10 г, 51,28 ммоль) суспендировали в смеси THF/H2O
(8:2, 100 мл) при комнатной температуре. К этой перемешанной смеси добавляли триэтиламин (6,06 г, 60 ммоль), а затем
ди-трет-бутилдикарбонат (13,08 г, 60 ммоль), и перемешивание продолжали при
комнатной температуре в течение ночи. Гомогенный раствор выпаривали досуха и остаток растворяли в этилацетате (300 мл).
Органический экстракт промывали 0,5 N раствором гидросульфата калия (100 мл),
водой (100 мл) и рассолом (50 мл). Этилацетатный экстракт высушивали над безводным сульфатом натрия и выпаривали досуха с
получением 14 г (93%) маслянистого остатка.
N-(трет-бутилоксикарбонил)-O-бензил-L-серинол (3):
N-(трет-бутилоксикарбонил)-O-бензил-L-серин (2) (6,0 г, 20,34 ммоль) растворяли
в сухом THF и охлаждали до -20oC в атмосфере
аргона. К этому холодному перемешанному раствору добавляли TEA (2,32 г, 23 ммоль) и изобутилхлорформиат (3,13 г, 23 ммоль). Перемешивание
продолжали в течение 30 мин при -20oC в атмосфере
аргона. Реакционную смесь немедленно фильтровали под слоем аргона, осадок промывали сухим THF (50 мл). Объединенный фильтрат медленно
добавляли в холодный (0oC) раствор NaBH4 (7,
4 г, 200 ммоль) в смеси THF/вода (80: 20, 200 мл) в течение 10 мин. После этого добавления реакционную смесь перемешивали в течение 2
ч при 0oC и подводили pH до 7 уксусной кислотой.
Раствор выпаривали досуха, фракционировали в смеси этилацетат/вода (300:150 мл) и экстрагировали в этилацетате. Органический экстракт
промывали рассолом (100 мл), высушивали над безводным сульфатом
натрия и выпаривали досуха. Сырой продукт очищали колоночной флэш- хроматографией на силикагеле, используя в качестве элюента CH2Cl2->EtOAc. Фракции, содержащие чистый
продукт, объединяли и высушивали досуха с получением 4,7 г (82%) чистого продукта в виде масла.
1H-ЯМР (CDCl3): δ 1,41 (s, 9H, Boc), 3,60-3,70 (m, 4H), 3, 82 (d, 2H), 4,53 (s, 2H, OCH2Ph), 5,20 (bs, 1H, NH), 7,30-7,40 (m, 5H, Ph).
N-(трет-бутилоксикарбонил)-O-бензил-L-серинол-O-Ib (4):
К высушенному раствору
N-(трет-бутилоксикарбонил) -O-бензил-L-серинола (3) (4,3 г, 14,3 ммоль) в сухом пиридине (50 мл) добавляли TEA
(2,02 г, 20 ммоль) при комнатной температуре. К этому перемешанному раствору добавляли
изомасляный ангидрид (3,16 г, 20 ммоль) и перемешивание продолжали в течение ночи в атмосфере аргона. Реакционную
смесь выпаривали досуха, фракционировали в смеси EtOAc (100 мл) и NaHCO3
(5%-ный раствор, 100 мл) и экстрагировали в EtOAc. Органический экстракт промывали водой (100 мл), рассолом (50 мл)
и высушивали над безводным Na2SO4. Высушенный раствор
выпаривали досуха с получением сырого остатка. Этот остаток очищали флэш-хроматографией на силикагеле с использованием в
качестве элюента гексан->ЕtOАс. Объединяли чистые фракции и выпаривали
с получением 4,5 г (84%) маслянистого продукта.
1H-ЯМР(CDCl3): δ 1,04 (d, 6Н, IbCH3), 1,39 (s, 9H, Boc), 2,46 (m, 1H, IbCH), 3,40 (m, 2H), 3,92 (m, 2H), 4,12 (m, 1H), 4,46 (s, 2H, OCH2Ph), 6,84 (d, 1H, NH), 7,24-7,40 (m, 5H, Ph).
N-(тиминилацетил)-О-бензил-L-серинол-О-Ib (6):
N-(трет-бутилоксикарбонил)-О-бензил-L-серинол-О-Ib (4) (4,3 г, 12,02 ммоль) оставляли перемешиваться при комнатной температуре в трифторуксусной
кислоте (20 мл) и CH2Cl2 (20 мл)
в течение 30 мин. Реакционную смесь выпаривали досуха, растворяли в сухом CH3OH (10 мл) и снова выпаривали досуха. Остаток высушивали
над твердым КОН под вакуумом в течение 12 ч.
Высушенный остаток использовали как таковой для дальнейших реакций без анализа.
Тиминуксусную кислоту 5 (2,76 г, 15 ммоль) растворяли в сухом DMF (75 мл) и охлаждали до -20oC в аргоне. К этому холодному перемешанному раствору добавляли N-метилморфолин (1,72 г, 17 ммоль), а затем изобутил хлорформиат (2,31 г, 17 ммоль). Через 15 мин перемешивания раствор указанной выше соли TFA в сухом DMF (50 мл) нейтрализовали N-метилморфолином (1,72 г, 17 ммоль) и в один прием добавляли в холодный перемешанный раствор тиминуксусной кислоты. Реакционную смесь перемешивали при -20oC в течение 1 ч, нагревали до комнатной температуры и продолжали перемешивание в течение ночи. Раствор выпаривали досуха и растворяли остаток в CH2Cl2 (250 мл) и воде (100 мл) и экстрагировали в CH2Cl2. Органический экстракт промывали 5%-ным раствором NaHCO3 (100 мл), водой (100 мл) и рассолом (50 мл). CH2 Cl2-экстракт высушивали и выпаривали досуха с получением сырого продукта. Из этого сырого продукта при очистке флэш-хроматографией на силикагеле с использованием CH2Cl2->ацетона в качестве элюента получали 4,8 г (94%) чистого продукта. Этот чистый продукт кристаллизировали из смеси CH2Cl2/гексан. Т.пл. 122-124oC.
1H ЯМР (CDCl3): δ 1,04 (d, 6H, IbCH3), 1,72 (s, 3H, CH3), 2,44 (m, 1H, IbCH), 3,42 (m, 2H), 4,06 (m, 2H), 4,18 (m, 1H), 4,30 (s, 2H), 4,46 (s, 2H, OCH3Ph), 7,24-7,40 (m, 6H, С6H и Ph), 8,22 (d, 1H, NH) и 11,22 (s, 1H, NH).
N-(тиминилацетил)-L-серинол-O-Ib (7):
N-(тиминилацетил)-O-бензил-L-серинол-O-Ib (6) (2,08 г, 5 ммоль) растворяли в этаноле (50 мл). К этому раствору при комнатной температуре добавляли
Pd(OH)2 (0,6 г) и циклогексен (5 мл).
Реакционную смесь нагревали при 70oC в течение 12 ч. Катализатор отфильтровывали и промывали метанолом (20 мл). Фильтрат выпаривали досуха с
получением белого твердого вещества. Белое
твердое вещество растворяли в минимальном количестве MeOH и охлаждали до комнатной температуры. Этот продукт кристаллизировали в виде тонкого порошка. Т.пл.
196-198oC. Выход: 1,48 г
(91%).
1H ЯМР (Me2SO-d6): δ 1,04 (d, 6H, IbCH3), 1,72 (s, 3H, CH3), 2,42 (m, 1H, IbCH), 3,40 (m, 2H), 3,94 (m, 2H), 4,06 (m, 1H), 4,28 (s, 2H), 4,90 (t, 1H, OH), 7,20 (8, 1H, C6Н), 8,12 (d, 1H, NH), 11,22 (s, 1H, NH).
4,
4'-диметокситритил-N-(тиминилацетил)-L-серинол-O-Ib (8):
N-(тиминилацетил)-L-серинол-O-Ib (7) (1,48 г, 4,5 ммоль) растворяли в сухом пиридине (50 мл) в аргоне. К этому перемешанному раствору
добавляли TEA (0,51 г, 5 ммоль) и N,N- диметиламинопиридин (0,10
г). Через 10 мин добавили 4,4'- диметокситритилхлорид (1,69 г, 5 ммоль) и продолжали перемешивание при комнатной температуре в аргоне в
течение ночи. Реакционную смесь нейтрализовали с помощью MeOH
(10 мл), перемешивали в течение 10 мин и выпаривали досуха. Остаток растворяли в EtOAc (200 мл), промывали 5%-ным раствором NaHCO3 (100 мл), водой (100 мл) и рассолом (50 мл). Органический
экстракт высушивали над безводным Na2SO4 и выпаривали досуха. Сырой продукт очищали флэш-хроматографией на
силикагеле с использованием CH2Cl2->EtOAc
в качестве элюента. Чистые фракции объединяли и выпаривали с получением 2,5 г (88%) пены.
1H ЯМР (CDCl3): δ 1,04 (d, 6H, IbCH3), 1,72 (s, 3H, CH3), 2,40 (m, 1H, IbCH), 3,38 (m, 2H), 3,72 (s, 6H, 2•OCH3), 4,12 (m, 2H), 4,20 (m, 1H), 4,32 (d, 2H), 6,84 (m, 4H, Ph), 7,20-7,40 (m, 12H, С6H и Ph), 8,30 (d, 1H, NH), 11,28 (s, 1H, NH).
1-O-(4,4'-диметокситритил)-2-[амино(тиминилацетил)] -L-пропан-1,3-диол (9):
4,4' -диметокситритил-N-(тиминилацетил) -L-серинол-O-Ib (8) (3,4 г, 5,
41 ммоль) растворяли в MeOH (30 мл) и охлаждали до 0oC на ледяной бане. К этому холодному перемешанному раствору
добавляли 2 N NaOH (10 мл, 20 ммоль) и продолжали перемешивание в течение
30 мин при 0oC. Подводили pH раствора до 7 уксусной кислотой и выпаривали досуха. Остаток фракционировали в смеси
воды (50 мл) и CH2Cl2 (150 мл) и экстрагировали в
CH2Cl2. Водный слой снова экстрагировали CH2Cl2 (50 мл). Объединенный органический
экстракт промывали рассолом (50 мл), высушивали и выпаривали досуха.
Остаток очищали колоночной флэш-хроматографией на силикагеле с использованием в качестве элюента CH2Cl2
-> ацетон. Выход: 3,0 г (99%).
1H ЯМР (CDCl3): δ 1,72 (s, 3H, CH3), 3,0 (m, 2H), 3,42 (m, 2H), 3,72 (s, 6H, 2•OCH3), 3, 94 (m, 1H), 4,32 (d, 2H), 4,68 (m, 1H, ОН), 6,84 (m, 4H, Ph), 7,20-7,40 (m, 12H, С6H и Ph), 8,06 (d, 1H, NH), 11,28 (bs, 1H, NH).
1-O-(4,4' -диметокситритил)-2-[анино
(тиминилацетил)]-L- пропaн-3-O- (N, N-диизoпpoпил)-β
-циaнoэтилфocфорамидит (10):
1-O-(4,4'-диметокситритил) -2-[амино(тиминилацетил)] -L-пpoпан-1,3-диол (9) (3,1 г, 5,55 ммоль)
высушивали над твердым NaOH под вакуумом в течение ночи и
растворяли в сухом CH2Cl2 (100 мл). Этот раствор охлаждали до 0oC в атмосфере аргона. К холодному
перемешанному раствору добавляли N,N-диизопропилэтиламин (1,29 г, 10
ммоль), а затем 2-цианоэтил-N,N-диизопропил-хлор-фосфорамидит (1,96 г, 8,3 ммоль). Реакционную смесь перемешивали при 0o
C в течение 1 ч и при комнатной температуре в течение 2 ч.
Реакционную смесь разводили CH2Cl2 (100 мл) и промывали органический слой 5%-ным раствором NaHCO3 (100 мл),
водой (100 мл) и рассолом (50 мл). CH2Cl2-экстракт высушивали и выпаривали досуха с получением маслянистого остатка. Этот остаток очищали флэш-хроматографией на силикагеле с
использованием CH2Cl2->EtOAc,
содержащего 0,1% TEA, в качестве элюента. Чистые фракции объединяли и выпаривали с получением пены. Эту пену высушивали на твердом NaOH под
вакуумом в течение ночи. Высушенную пену растворяли в сухом
CH2Cl2 (20 мл) и добавляли по каплям в перемешанный раствор сухого гексана (2000 мл) под аргоном в течение 1 ч. После
добавления образованный осадок перемешивали еще 1 ч и
фильтровали, промывали сухим гексаном (100 мл) и твердое вещество высушивали над твердым NaOH под вакуумом в течение 4 ч. Выход: 3,5 г (83%).
Пример 27 (см. фиг. 27)
N-(трет-бутилоксикарбонил)-O-бензил-D-серин (12):
O-бензил-D-серин (11) (5 г, 25,64 ммоль) суспендировали в смеси THF/H2O (8: 2, 70
мл) при комнатной температуре. К этой
перемешанной смеси добавляли триэтиламин (4,04 г, 40 ммоль), а затем ди-трет-бутилдикарбонат (6,54 г, 30 ммоль) и продолжали перемешивание при комнатной
температуре в течение ночи. Гомогенный раствор
выпаривали досуха и остаток растворяли в этилацетате (150 мл). Органический экстракт промывали 0,5 N раствором гидросульфата калия (100 мл), водой (100
мл) и рассолом (50 мл). Этилацетатный экстракт
высушивали над безводным сульфатом натрия и выпаривали досуха с получением 7,56 г (100%) маслянистого остатка.
N-(трет-бутилоксикарбонил)-О-бензил-D-серинол (13):
N-(трет-бутилоксикарбонил)-O-бензил-D-серин (12) (7,56 г, 25,63 ммоль) растворяли в сухом THF и охлаждали до -20oC в атмосфере
аргона. К этому холодному перемешанному раствору добавляли
TEA (3,03 г, 30 ммоль) и изобутил хлорформиат (4,08 г, 30 ммоль). Перемешивание продолжали в течение 30 мин при -20oC в атмосфере
аргона. Реакционную смесь немедленно фильтровали под слоем
аргона, осадок промывали сухим THF (50 мл). Объединенный фильтрат медленно добавляли в холодный (0oC) раствор NaBH4 (7,
4 г, 200 ммоль) в смеси THF/вода (80: 20, 200 мл) в
течение 10 мин. После этого добавления реакционную смесь перемешивали в течение 2 ч при 0oC и подводили pH до 7 уксусной кислотой.
Раствор выпаривали досуха, фракционировали в смеси
этилацетат/вода (300: 150 мл) и экстрагировали в этилацетат. Органический экстракт промывали рассолом (100 мл), высушивали над безводным сульфатом
натрия и выпаривали досуха. Сырой продукт очищали
колоночной флэш-хроматографией на силикагеле, используя в качестве элюента CH2Cl2->EtOAc. Фракции, содержащие чистый
продукт, объединяли и высушивали досуха с получением
6,68 г (92%) чистого продукта в виде масла.
1H ЯМР (CDCl3): δ 1,41 (s, 9H, Boc), 3,60-3,70 (m, 4H), 3, 82 (d, 2H), 4,53 (s, 2H, OCH2Ph), 5,20 (bs, 1H, NH), 7,30- 7,40 (m, 5H, Ph).
N-(трет-бутилоксикарбонил)-O-бензил-D-серинол-O-Ib (14):
К высушенному раствору
N-(трет-бутилоксикарбонил)-O-бензил-D-серинола (13) (6,
6 г, 23,5 ммоль) в сухом пиридине (50 мл) добавляли TEA (3,03 г, 30 ммоль) при комнатной температуре. К этому перемешанному раствору добавляли
изомасляный ангидрид кислоты (4,74 г, 30 ммоль) и
перемешивание продолжали в течение ночи в атмосфере аргона. Реакционную смесь выпаривали досуха, фракционировали в смеси EtOAc (100 мл) и NaHCO3 (5%-ный раствор, 100 мл) и экстрагировали в
EtOAc. Органический экстракт промывали водой (100 мл), рассолом (50 мл) и высушивали над безводным Na2SO4. Высушенный раствор
выпаривали досуха с получением сырого остатка. Этот
остаток очищали флэш-хроматографией на силикагеле с использованием в качестве элюента гексан->EtOAc. Объединяли чистые фракции и выпаривали с
получением 8,0 г (97%) маслянистого продукта.
1H ЯМР (CDCl3): δ 1,04 (d, 6H, IbCH3), 1,39 (s, 9H, Boc), 2,46 (m, 1H, IbCH), 3,40 (m, 2H), 3,92 (m, 2H), 4,12 (m, 1H), 4,46 (s, 2H, OCH2Ph), 6,84 (d, 1H, NH), 7,24-7,40 (m, 5H, Ph).
N-(тиминилацетил)-О-бензил-D-серинол-О-Ib (15):
N-(трет-бутилоксикарбонил)-O-бензил-D-серинол-O-Ib (14) (5,0 г, 14,25
ммоль) оставляли перемешиваться при комнатной температуре в трифторуксусной кислоте (20 мл) и CH2Cl2 (20 мл)
в течение 30 мин. Реакционную смесь выпаривали досуха, растворяли в
сухом CH3OH (10 мл) и снова выпаривали досуха. Остаток растворяли в CH2Cl2 (150 мл), подводили pH
до 7 с помощью 5%-ного раствора NaHCO3 и экстрагировали в
CH2Cl2. Органический слой промывали водой (50 мл) и рассолом (50 мл). CH2Cl2-экстракт
высушивали и выпаривали досуха. Полученный остаток высушивали над
твердым КОН под вакуумом в течение 12 ч. Высушенный остаток использовали как таковой для дальнейших реакций без анализа.
Тиминуксусную кислоту 5 (2,57 г, 14 ммоль) растворяли в сухом DMF (50 мл) и охлаждали до -20oC в аргоне. К этому холодному перемешанному раствору добавляли N-метилморфолин (1,52 г, 15 ммоль), а затем изобутилхлорформиат (2,04 г, 15 ммоль). Через 15 мин перемешивания раствор указанного выше амина в сухом DMF (50 мл) добавляли в холодный перемешанный раствор тиминуксусной кислоты. Реакционную смесь перемешивали при -20oC в течение 1 ч, нагревали до комнатной температуры и продолжали перемешивание в течение ночи. Раствор выпаривали досуха и растворяли остаток в CH2Cl2 (250 мл) и воде (100 мл) и экстрагировали в CH2Cl2. Органический экстракт промывали 5%-ным раствором NaHCO3 (100 мл), водой (100 мл) и рассолом (50 мл). CH2Cl2-экстракт высушивали и выпаривали досуха с получением сырого продукта. Из этого сырого продукта при очистке флэш-хроматографией на силикагеле с использованием CH2Cl2->ацетона в качестве элюента получают 2,8 г (54%) чистого продукта.
1H ЯМР (CDCl3): δ 1,04 (d, 6H, IbCH3), 1,72 (s, 3H, CH3), 2,44 (m, 1H, IbCH), 3,42 (m, 2H), 4, 06 (m, 2H), 4,18 (m, 1H), 4,30 (s, 2H), 4,46 (s, 2H, OCH2Ph), 7,24-7,40 (m, 6H, C6H и Ph), 8, 22 (d, 1H, NH) и 11,22 (s, 1H, NH).
Указанное в заголовке соединение было также получено путем использования способа для получения L изомера. Использованные реагенты: тиминуксусная кислота (2,2 г, 12 ммоль); изобутилхлорформиат (1,77 г, 13 ммоль); N-метилморфолин (1,52 г, 15 ммоль); соль TFA (3,65 г, 10 ммоль); N-метилморфолин (1,5 г, 15 ммоль) и сухой DMF (100 мл). Выход: 3,5 г (84%).
N-(тиминилацетил)-D-серинол-O-Ib (16):
N-(тиминилацетил)-O-бензил-D-серинол-O-Ib (15) (3,5 г, 8,39 ммоль) растворяли в этаноле (50 мл). К этому раствору при комнатной
температуре добавляли Pd(OH)2 (1,00 г) и циклогексен
(10 мл). Реакционную смесь нагревали при 70oC в течение 12 ч. Катализатор отфильтровывали и промывали метанолом (20 мл).
Фильтрат выпаривали досуха с получением белого твердого вещества.
Выход: 2,7 г (98%).
1H ЯМР (Me2SO-d6): δ 1,04 (d, 6H, IbCH3), 1,72 (s, 3H, CH3), 2,42 (m, 1H, IbCH), 3,40 (m, 2H), 3,94 (m, 2H), 4,06 (m, 1H), 4,28 (s, 2H), 4,90 (t, 1H, OH), 7,20 (s, 1H, С6H), 8,12 (d, 1H, NH), 11,22 (s, 1H, NH).
4,4'-диметокситритил-N-(тиминилацетил)-D-серинол-O-Ib
(17):
N-(тиминилацетил)-D-серинол-O-Ib (16) (2,7 г, 8,26 ммоль) растворяли в сухом пиридине (50 мл) в аргоне. К этому
перемешанному раствору добавляли TEA (1,01 г, 10 ммоль), а затем 4,
4'-диметокситритил хлорид (3,38 г, 10 ммоль) и продолжали перемешивание при комнатной температуре в аргоне в течение ночи.
Реакционную смесь нейтрализовали с помощью MeOH (10 мл), перемешивали в
течение 10 мин и выпаривали досуха. Остаток растворяли в EtOАс (250 мл), промывали 5%-ным раствором NaHCO3 (100 мл),
водой (100 мл) и рассолом (50 мл). Органический экстракт высушивали над
безводным Na2SO4 и выпаривали досуха. Сырой продукт очищали флэш-хроматографией на силикагеле с
использованием CH2Cl2->EtOAc в качестве элюента.
Чистые фракции
объединяли и выпаривали с получением 5,0 г (96%) пены.
1H ЯМР (CDCl3 ): δ 1,04 (d, 6H, IbCH3), 1,72 (s, 3H, CH3), 2, 40 (m, 1H, IbCH), 3,38 (m, 2H), 3,72 (s, 6Н, 2•OCH3), 4,12 (m, 2H), 4,20 (m, 1H), 4,32 (d, 2H), 6,84 (m, 4H, Ph), 7,20-7,40 (m, 12H, С6H и Ph), 8,30 (d, 1H, NH), 11,28 (s, 1H, NH).
1-O-(4,4'-диметокситритил)-2-[амино(тиминилацетил)] -D-пропан-1,3-диол (18):
4,
4'-диметокситритил-N-(тиминилацетил)-D-серинол-O-Ib (17) (5,0 г, 7,95 ммоль)
растворяли в MeOH (30 мл) и охлаждали до 0oC на ледяной бане. К этому холодному перемешанному раствору добавляли
2 N NaOH (10 мл, 20 ммоль) и продолжали перемешивание в течение 30 мин при
0oC. Подводили pH раствора до 7 уксусно й кислотой и выпаривали досуха. Остаток фракционировали в смеси воды (50
мл) и CH2Cl2 (250 мл) и экстрагировали в CH2Cl2. Водный слой снова экстрагировали CH2Cl2 (50 мл). Объединенный органический экстракт
промывали рассолом (50 мл), высушивали и выпаривали досуха. Остаток
очищали колоночной флэш-хроматографией на силикагеле с использованием в качестве элюента CH2Cl2->
ацетон. Выход: 4,0 г (90%).
1H ЯМР (CDCl3): δ 1,72 (s, 3H, CH3), 3,0 (m, 2H), 3,42 (m, 2H), 3,72 (s, 6H, 2•OCH3), 3,94 (m, 1H), 4,32 (d, 2H), 4,68 (m, 1H, OH), 6,84 (m, 4H, Ph), 7,20-7,40 (m, 12H, С6H и Ph), 8,06 (d, 1H, NH), 11,28 (bs, 1H, NH).
1-O-(4,4'-диметокситритил)-2-[амино(тиминилацетил)]
-D-пропан-3-0-(N, N-диизопропил)- β-цианоэтилфосфорамидит
(19):
1-О-(4,4'-диметокситритил)-2-[амино(тиминилацетил)] -D-пропан-1,3-диол (18) (2,79 г, 5,0 ммоль) высушивали над твердым
NaOH под вакуумом в течение ночи и растворяли в сухом CH2Cl2 (100 мл). Этот раствор охлаждали до 0oC в атмосфере аргона. К холодному перемешанному раствору добавляли N,
N-диизопропилэтиламин (1,29 г, 10 ммоль), а затем
2-цианоэтил- N,N-диизопропил-хлорфосфорамидит (1,96 г, 8,3 ммоль). Реакционную смесь перемешивали при 0oC в течение 1 ч и при комнатной
температуре в течение 2 ч. Реакционную смесь
разводили CH2Cl2 (100 мл) и промывали органический слой 5%-ным раствором NaHCO3 (100 мл), водой (100 мл) и рассолом (50
мл). CH2Cl2-экстракт
высушивали и выпаривали досуха с получением маслянистого остатка. Этот остаток очищали флэш-хроматографией на силикагеле с использованием CH2
Cl2->EtOAc, содержащего 0,1%
TEA, в качестве элюента. Чистые фракции объединяли и выпаривали с получением пены. Эту пену высушивали на твердом NaOH под вакуумом в течение ночи.
Высушенную пену растворяли в сухом CH2
Cl2 (20 мл) и добавляли по каплям в перемешанный раствор сухого гексана (2000 мл) под аргоном в течение 1 ч. После добавления образованный
осадок перемешивали еще 1 ч и фильтровали,
промывали сухим гексаном (100 мл) и твердое вещество высушивали на твердом NaOH под вакуумом в течение 4 ч. Выход: 3,3 г (87%).
Пример 28
(фиг. 28)
1-O-бензил-2- [(трет-бутилоксикарбонил) амино] -3-[N3-бензоил(тиминил)-L-пропанол (21):
К перемешанному раствору N3-бензоилтимин (20) (5,75 г, 25
ммоль) в сухом THF
(200 мл) под аргоном добавляли трифенилфосфин (10,48 г, 40 ммоль) и Nα-трет- бутилоксикарбонил-β-бензилокси -L-серинол 3 (5,3 г, 18,86 ммоль) при комнатной
температуре. Через 15 мин
медленно в течение 30 мин добавляли диэтилазодикарбоксилат (6,96 г, 40 ммоль). Реакционную смесь накрывали алюминиевой фольгой и оставляли перемешиваться при комнатной
температуре под аргоном в
течение 24 ч. Растворитель выпаривали досуха и остаток растворяли в EtOAc (300 мл). Органический экстракт промывали 5%-ным раствором NaHCO3 (100 мл), водой (100
мл) и рассолом (100 мл) и
высушивали над безводным Na2SO4. Высушенный EtOAc экстракт выпаривали досуха с получением оранжевого масла. Сырой продукт очищали флэш-хроматографией на
силикагеле с
использованием гексан->EtOAc в качестве элюента. Фракции, содержащие требуемый продукт, объединяли и выпаривали с получением бледно-розового масла. Выход: 8,0 г (86%).
1H ЯМР (CDCl3): δ 1,41 (s, 9H, Boc), 1,72 (s, 3H, CH3), 3,56 (m, 2H), 4,20 (m, 2H), 4,32 (m, 1H), 4,52 (d, 2H, OCH2Ph), 5,20 (d, 1H, NH), 7, 06 (s, 1H, С6Н), 7,20-7,60 (m, 10H, Ph).
2-[(трет-бутилоксикарбонил)амино]-3-[N3 -бензоил (тиминил)-L-пропан-1-ол (22):
1-O-бензил-2-[(трет-бутилоксикарбонил)амино] -3-[N3-бензоил(тиминил)- L-пропанол (21) (4,93 г, 10 ммоль) растворяли в MeOH (100 мл) и обрабатывали Pd/C (10%, 1 г). Реакционную смесь
гидрогенизировали при 50 пси водорода в течение 12 ч. Катализатор отфильтровывали, промывали MeOH (50 мл) и фильтрат выпаривали досуха. Остаток кристаллизовали из ацетон/гексана с получением 3,70 r
(92%) чистого продукта. Т.пл. 156-159oC.
1H ЯМР (CDCl3): δ 1,42 (s, 9H, Boc), 1,94 (s, 3H, CH3), 3,64 (m, 4H), 3,84 (m, 1H), 4,14 (m, 1H), 5,22 (d, 1H, NH), 7,18 (s, 1H, С6Н), 7,48 (t, 2H, Ph), 7,62 (t, 1H, Ph), 7,98 (d, 2H, Ph).
1-O- Изобутирил-2-[(трет-бутилоксикарбонил)амино] -3-[N3
- бензоил(тиминил)-L-пропанол (23):
2-[(трет-бутилоксикарбонил)амино] - 3-[N3-бензоил(тиминил)-L-пропан-1-ол (22) (1,60 г, 3,97 ммоль) растворяли в сухом пиридине (30 мл) и
оставляли перемешиваться при комнатной температуре под аргоном. К этому перемешанному раствору добавляли TEA (0,51 г, 5 ммоль) и изомасляный ангидрид (0,79 г, 5 ммоль). Реакционную смесь перемешивали
при комнатной температуре в течение 12 ч и выпаривали досуха. Остаток растворяли в EtOAc (150 мл) и промывали 5%-ным раствором NaHCO3 (100 мл), водой (100 мл) и рассолом (50 мл).
Органический экстракт высушивали и выпаривали досуха. Остаток очищали колоночной флэш-хроматографией на силикагеле с использованием CH2Cl2->EtOAc в качестве элюента.
Чистые фракции объединяли и выпаривали с получением 1,6 г (85%) пены. Чистый продукт кристаллизовали из ацетона/гексана. Т.пл. 165-167oC.
1H ЯМР (CDCl3 ): δ 1,16 (d, 6H, IbCH3), 1,42 (s, 9H, Boc), 1,94 (s, 3H, CH3), 2,52 (m, 1H), 3,64 (m, 4H), 3,84 (m, 1H), 4,14 (m, 1H), 5,22 (d, 1H, NH), 7,18 (s, 1H, C6H), 7, 48 (t, 2H, Ph), 7,62 (t, 1H, Ph), 7,98 (d, 2H, Ph).
1-O-Изобутирил-2- [(β-гидроксиацетил)амино] -3-[N3-бензоил (тиминил) -L-пропанол (24):
1-O-Изобутирил-2- [(трет-бутилоксикарбонил)амино] -3-[N3- -бензоил(тиминил)-L-пропанол (23) (1,6 г, 3,38 ммоль) оставляли перемешиваться в смеси TFA (5 мл) и CH2Cl2
(10 мл) при комнатной температуре в течение 30 мин и выпаривали досуха. Остаток растворяли в сухом MeOH (10 мл) и выпаривали снова. Полученный остаток высушивали над твердым NaOH под вакуумом в
течение ночи. Высушенный материал использовали как таковой для следующей реакции.
К перемешанному раствору гликолевой кислоты (0,53 г, 7 ммоль) в сухом DMF (50 мл) добавляли 1-гидроксибензотриазол (0,67 г, 5 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)- карбодиимида (EDC) (1,91 г, 10 ммоль). После перемешивания в течение 15 мин добавляли при комнатной температуре TEA (1,01 г, 10 ммолъ) и вышеуказанную соль TFA в DMF (20 мл). Реакционную смесь перемешивали в течение 12 ч и выпаривали досуха. Остаток фракционировали в смеси CH2Cl2 (150 мл) и воды (100 мл) и экстрагировали в CH2Cl2. Органический экстракт промывали рассолом (50 мл), высушивали и выпаривали досуха. Остаток очищали флэш-хроматографией на силикагеле с использованием CH2Cl2 -> ацетона в качестве элюента. Фракции, содержавшие требуемый продукт, объединяли и выпаривали с получением 1,35 г (92%) пены.
1H ЯМР (CDCl3): δ 1,16 (d, 6H, IbCH3), 1,94 (s, 3H, CH3), 2,52 (m, 1H), 3,20 (bs, 1H), 3,80-4,30 (m, 6H), 4,56 (m, 1H), 7,14 (d, 2H, C6H и NH), 7,50 (t, 2H, Ph), 7,64 (t, 1H, Ph), 7,94 (d, 2H, Ph).
1-O-Изобутирил-2-[(β-(4,4' -диметокситритил)-O-ацетил)амино] - 3-[N3-бензоил(тиминил)-L-пропанол (25):
1-O-Иэобутирил-2-[(β-гидроксиацетил) амино]-3-[N3-бензоил (тиминил)-L-пропанол (24) (1,2 г, 2,78 ммоль) растворяли в сухом пиридине (50 мл) и оставляли нагреваться при
комнатной
температуре в атмосфере аргона. К этому перемешанному раствору добавляли TEA (0,35 г, 3,5 ммоль) и 4,4'-диметокситритилхлорид (1,18 г, 3,5 ммоль). Реакционную смесь перемешивали при
комнатной
температуре в течение 12 ч, нейтрализовали с помощью MeOH (10 мл) и выпаривали досуха. Остаток растворяли в EtOAc (150 мл), промывали 5%-ным раствором NaHCO3 (100 мл), водой (100
мл) и
рассолом (50 мл). Органический экстракт высушивали над безводным Na2SO4 и выпаривали досуха. Остаток очищали колоночной флэш-хроматографией на силикагеле с использованием
CH2Cl2->EtOAc в качестве элюента. Чистые фракции объединяли и выпаривали с получением 1,7 г (83%) чистого продукта.
1H ЯМР (CDCl3): δ 1,16 (d, 6H, IbCH3), 1,94 (s, 3H, CH3), 2,52 (m, 1H), 3,74 (s, 6H, 2•OCH3), 3,80-4,30 (m, 6H), 4,56 (m, 1H), 6,82 (d, 4H, Ph), 7,14 (d, 2H, C6H и NH), 7,26-8,00 (m, 14H, Ph).
2-[(β-(4,4'-диметокситритил) -О-ацетил)амино] -3 -тиминил-L-пропанол (26):
1-O-Изобутирил-2-[(β-(4,
4'- диметокситритил)-O-ацетил)амино]
-3-[N3-бензоил(тиминил)-L- пропанол (25) (1,55 г, 2,05 ммоль) растворяли в MeOH (20 мл) и охлаждали до 0oC в ледяной бане. К этому холодному
перемешанному раствору добавляли 2 N
NaOH (5 мл, 10 ммоль) и продолжали перемешивание в течение 30 мин при 0oC. pH раствора подводили до 7 уксусной кислотой и выпаривали досуха. Остаток
фракционировали в смеси вода (50 мл) и
CH2Cl2 (50 мл) и экстрагировали в CH2Cl2 (50 мл). Объединенный органический экстракт промывали рассолом (50 мл),
высушивали и выпаривали досуха. Остаток
очищали флэш-хроматографией на силикагеле с использованием CH2Cl2->ацетона в качестве элюента. Выход: 1,0 г (99%).
1H ЯМР (CDCl3): δ 1,94 (s, 3H, CH3), 3,74 (s, 6H, 2•OCH3), 3,80-4,30 (m, 6H), 4,56 (m, 1H), 6,82 (d, 4H, Ph), 7,14 (d, 2H, C6H и NH), 7,26-8,00 (m, 14H, Ph).
2-[(β-(4,4'-диметокситритил)-O-ацетил)амино]-3- тиминил-L-пропан-1-O-(N, N -диизопропил)-β-цианоэтил-фосфорамидит (27):
2-[(β
-(4,4'-диметокситритил)
-O-ацетил)амино]-3-тиминил L-пропанол (26) (1,00 г, 2,09 ммоль) высушивали над твердым NaOH под вакуумом в течение ночи и растворяли в сухом CH2Cl2 (50
мл). Раствор охлаждали до
0oC в атмосфере аргона. К этому холодному перемешанному раствору добавляли N,N-диизопропилэтиламин (0,54 г, 4,2 ммоль), а затем 2-цианоэтил-N,
N-диизопропилхлорфосфорамидит (0,73 г, 3,1
ммоль). Реакционную смесь перемешивали при 0oC в течение 1 ч и при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли CH2Cl2 (100 мл) и органический
слой промывали 5%-ным раствором NaHCO3 (100 мл), водой (100 мл) и рассолом (50 мл). CH2Cl2-экстракт высушивали и
выпаривали досуха с получением маслянистого остатка.
Остаток очищали флэш-хроматографией на силикагеле с использованием CH2Cl2->EtOAc, содержащего 0,1 TEA, в качестве
элюента. Чистые фракции объединяли и выпаривали с
получением пены. Эту пену высушивали над твердым NaOH под вакуумом в течение ночи. Высушенную пену растворяли в сухом CH2Cl2
(10 мл) и по каплям добавляли в перемешанный раствор
сухого гексана (800 мл) под аргоном в течение 30 мин. После добавления образованный осадок перемешивали еще 30 мин и фильтровали, промывали сухим
гексаном (100 мл) и твердое вещество высушивали над
твердым NaOH под вакуумом в течение 4 ч. Выход: 1,3 г (82%).
Пример 29 (фиг. 29)
Nα-трет-бутилоксикарбонил
-О-бензилгидроксиламин (28):
О-бензил
гидроксиламингидрохлорид (15,9 г, 100 ммоль) суспендировали в смеси THF (150 мл) и воды (50 мл). К этой перемешанной смеси добавляли TEA (15,15 г, 150
ммоль), а затем ди-трет-бутилдикарбонат (23,98 г,
110 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч и выпаривали досуха. Остаток фракционировали в смеси EtOAc (250
мл) и воды (200 мл) и экстрагировали в EtOAc.
EtOAc-экстракт промывали гидросульфатом калия (100 мл) и рассолом (100 мл), высушивали и выпаривали досуха с получением 15 г (91%) прозрачного масла.
1-Хлор-2-(тетрагидропиранил)окси-этан (29):
1-Хлор-этанол (8,06 г, 100 ммоль) растворяли в сухом CH2Cl2 (100 мл) и охлаждали до 0oC на ледяной
бане под
аргоном. К этому перемешанному раствору добавляли дигидропиран (12,6 г, 150 ммоль), а затем пиридин-р-толуол-4-сульфонат (1,25 г, 5 ммоль) и продолжали перемешивание в течение ночи.
Реакционную смесь
выпаривали досуха и растворяли в EtOAc (200 мл). EtOAc-экстракт промывали 5%-ным раствором NaHCO3 (100 мл), водой (100 мл) и рассолом (100 мл). Органический экстракт
высушивали и выпаривали
досуха. Сырой остаток очищали флэш-хроматографией на силикагеле с использованием в качестве элюента гексан->CH2Cl2. Объединяли чистые фракции и
выпарывали с получением 11
г (67%) чистого продукта.
N-трет-бутилоксикарбонил-N-[(тетрагидропиранил)окси] - этил-O-бензилгидроксиламин (30):
К перемешанному раствору
N- трет-бутилоксикарбонил-О-бензилгидроксиламина (28) (5,79 г, 25,96 ммоль) в сухом DMF (50 мл) медленно добавляли NaH (60%, 1,2 г, 30 ммоль) в течение 15 мин в атмосфере аргона при 0oC.
Реакционную смесь оставляли перемешиваться при 0oC в течение 30 мин и при комнатной температуре в течение 1 ч. Добавляли 1-хлор-2- (тетрагидропиранил)окси-этан 29 (4,95 г, 30 ммоль) и
нагревали реакционную смесь при 80oC в течение 12 ч. Реакционную смесь охлаждали и выпаривали досуха. Остаток суспендировали в воде (50 мл), pH раствора подводили до 7 и экстрагировали в
EtOAc (150 мл). EtOAc-экстракт промывали водой и рассолом, высушивали и выпаривали досуха. Остаток очищали флэш-хроматографией на силикагеле с использованием в качестве элюента гексан->CH2Cl2. Требуемые фракции объединяли и выпаривали с получением 6,0 г (66%) маслянистого продукта.
1H ЯМР (CDCl3): δ 1,48 (s, 9H, Boc), 1, 49-1,84 (m, 6H, 3•CH2), 3,48-3,70 (m, 4H, 2•CH2), 3,86 (m, 2H, CH2), 4,60 (t, 1H, CH), 4,84 (s, 2H, CH2Ph) и 7,32-7,42 (m, 5H, Ph).
N-трет-бутилоксикарбонил-N-[(2-гидрокси)этил] -O-бензилгидроксиламин (31):
Перемешанный раствор N-трет-бутилоксикарбонил-N- [(тетрагидропиранил) окси] этил-O-бензилгидроксиламина
(30) (3,51 г, 10 ммоль) в THF:вода:AcOH (1:1:1, 100 мл) нагревали при 70oC в течение 3 ч. Реакционную смесь охлаждали до 0oC и подводили pH до 7 твердым NaHCO3.
Реакционную смесь экстрагировали EtOAc (2 х 75 мл). Объединенные органические экстракты промывами водой (100 мл) и рассолом (100 мл), высушивали и выпаривали досуха. Остаток очищали
флэш-хроматографией на силикагеле с использованием в качестве элюента CH2Cl2->EtOAc. Чистые фракции объединяли и выпаривали с получением 2,5 г (94%) пены.
1H ЯМР (CDCl3): δ 1,48 (s, 9H, Boc), 3,60 (t, 2H, CH2), 3,74 (m, 2H, CH2), 4,84 (s, 2H, CH2Ph) и 7,32-7,42 (m, 5H, Ph).
N-трет-бутилоксикарбонил-N-[[(2-изобутирил)окси] этил] -O- -бензилгидроксиламин (32):
К перемешанному раствору N-трет-бутилоксикарбонил-N-[(2-гидрокси) этил] -O-бензилгидроксиламина (31) (4,
2
г, 16,6 ммоль) в сухом пиридине (50 мл) добавляли TEA (2,02 г, 20 ммоль), а затем изомасляный ангидрид (3,16 г, 20 ммоль) при комнатной температуре в атмосфере аргона. Реакционную смесь
перемешивали
при комнатной температуре в течение 12 ч и выпаривали досуха. Остаток растворяли в EtOAc (200 мл), промывали 5%-ным раствором NaHCO3 (100 мл), водой и рассолом (50 мл).
Органический
экстракт высушивали и выпаривали досуха. Остаток очищали флэш-хроматографией на силикагеле с использованием CH2Cl2 в качестве элюента. Чистые фракции объединяли и
выпаривали с
получением 4,5 г (80%) чистого соединения.
1H ЯМР (CDCl3): δ 1,04 (d, 6H, IbCH3), 1,48 (s, 9H, Boc), 2,44 (m, 1H, IbCH), 3,60 (t, 2H, CH2), 3,74 (m, 2H, CH2), 4,84 (s, 2H, CH2Ph) и 7,32-7,42 (m, 5H, Ph).
N-(тиминилацетил)-N-[[(2- изобутирил)окси] этил]-O-бензил-гидроксиламин
(33):
N-трет-бутилоксикарбонил-N-[[(2-изобутирил)окси] этил] -О- бензилгидроксиламин (32) (5,0 г, 14,84 ммоль) растворяли в CH2Cl2 (10 мл) и оставляли перемешиваться
при комнатной
температуре в трифторуксусной кислоте (12 мл) в течение 30 мин. Реакционную смесь выпаривали досуха, растворяли в сухом метаноле (10 мл). Снова выпаривали досуха и высушивали над
твердым NaOH под
вакуумом в течение ночи. Высушенный материал использовали как таковой для дальнейших реакций без анализа.
Тиминуксусную кислоту 5 (3,13 г, 17 ммоль) растворяли в сухом DMF (75 мл) и охлаждали до -20oC под аргоном. К этому холодному перемешанному раствору добавляли N-метилморфолин (2,02 г, 20 ммоль), а затем изобутилхлорформиат (2,72 г, 20 ммоль). Через 15 мин перемешивания раствор указанной выше соли TFA в сухом DMF (50 мл) нейтрализовали N-метилморфолином (2,02 г, 20 ммоль) и в один прием немедленно добавляли в холодный перемешанный раствор тиминуксусной кислоты. Реакционную смесь перемешивали при -20oC в течение 1 ч, нагревали до комнатной температуры и продолжали перемешивание в течение ночи. Раствор выпаривали досуха и растворяли остаток в CH2Cl2 (250 мл) и воде (100 мл) и экстрагировали в CH2Cl2. Органический экстракт промывали 5%-ным раствором NaHCO3 (100 мл), водой (100 мл) и рассолом (50 мл). CH2Cl2-экстракт высушивали и выпаривали досуха с получением сырого продукта. Этот сырой продукт очищали флэш-хроматографией на силикагеле с использованием CH2Cl2->ацетона в качестве элюента. Собирали необходимые фракции и выпаривали с получением 4,0 г (70%) чистого продукта. Этот чистый продукт кристаллизовали из смеси CH2Cl2/гексан. Т.пл. 185-188oC.
1H ЯМР (Me2SO-d6): δ 1,00 (d, 6H, IbCH3), 1,74 (s, 3H, CH3 ), 2,44 (m, 1H, IbCH), 3,92 (m, 2H), 4,18 (t, 2H), 4,68 (bs, 2H), 4,98 (s, 2H,), 7,34 (s, 1H, C6H), 7,40-7,50 (m, 5H, Ph) и 11,32 (bs, 1H, NH).
Пример 30 (фиг. 30)
(2R,4R)-2-карбометокси-4- гидроксипирролидин (35):
В круглодонную колбу емкостью 250 мл, оборудованную магнитной мешалкой и дефлегматором, помещали сухой метанол
(40 мл) и охлаждали на
ледяной бане в атмосфере аргона. К этому перемешанному раствору добавляли ацетилхлорид (4,32 г, 55 ммоль), а затем цис-4-гидрокси-D-пролин (34) (5,00 г, 38,17 ммоль).
Полученный раствор нагревали при
дефлегмации в течение 7-8 ч и охлаждали до комнатной температуры. Раствор разводили эфиром и собирали образующееся твердое белое вещество отсасыванием, промывали
эфиром и высушивали под вакуумом над
твердым NaOH. Выход: 6,9 г (100%).
1H ЯМР (CDCl3): δ 2,09 (2dd, 1H), 2,34 (m, 1H), 3,49-3,73 (m, 3H), 3,79 (s, 3H, CH3), 4,34 (m, 2H).
(2R, 4R)-1-(трет-бутилоксикарбонил)-2-карбометокси-4- гидроксипирролидин (36):
К перемешанному раствору (2R,
4R)-2-кapбoметокси-4-гидроксипирролидина (35) (6,9 г, 38,12 ммоль) в
THF/вода (8:2, 150 мл) добавляли TEA (10,1 г, 100 ммоль), а затем ди-трет-бутилдикарбонат (10,9 г, 50 ммоль) при комнатной
температуре. Реакционную смесь перемешивали при комнатной температуре в
течение 6 ч и выпаривали досуха. Остаток растворяли в EtOAc (200 мл) и промывали 0,5 N гидросульфатом калия (50 мл), водой (100
мл) и рассолом (50 мл). Органический экстракт высушивали над Na2SO4 и выпаривали досуха с получением 7,8 г (84%) маслянистого продукта. Маслянистый продукт при высушивании давал
бесцветное твердое вещество. Т.пл. 75-77oC.
1H ЯMP (CDCl3): δ 1,45(s, 9H, Boc), 2,09 (2 dd, 1H), 2,34 (m, 1H), 3,49-3,73 (m, 3H), 3,79 (s, 3H, CH3), 4,34 (m, 2H).
(2R,
4R)-1-(трет-бутилоксикарбонил)-2-гидроксиметил-4- гидроксипирролидин (37):
(2R,
4R)-1-(трет-бутилоксикарбонил)-2- карбометокси-4-гидроксипирролидин (36) (7,0 г, 28,6 ммоль) растворяли в сухом
THF (100 мл) и охлаждали на ледяной солевой бане в атмосфере аргона. К этому холодному
раствору добавляли борогидрид лития (1,88 г, 85,8 ммоль) маленькими порциями в течение 15 мин. После добавления
борогидрида лития реакционную смесь оставляли перемешиваться при 0oC в
течение 1 ч, а затем 15 мин при комнатной температуре под аргоном. Раствор охлаждали до 0oC, разводили
водой (50 мл) и подводили pH до 6 с помощью AcOH. Реакционную смесь выпаривали досуха
и растворяли в EtOAc (200 мл), промывали водой (100 мл) и рассолом (100 мл). EtOAc-экстракт высушивали и
выпаривали досуха. Остаток очищали колоночной флэш-хроматографией на силикагеле с
использованием CH2Cl2->EtOAc в качестве элюента. Собирали чистые фракции и выпаривали
досуха с получением 5,00 г (81%) прозрачного масла. Это масло при стоянии
образовывало бесцветное твердое вещество. Т.пл. 95-97oC.
1H ЯMP (CDCl3): δ 1,45 (s, 9H, Boc), 1,90(dd, 1H) 2,34 (m, 1H), 3,40-3,62 (m, 3H), 4, 00 (m, 2H), 4,28 (bs, 1H), 4,44 (m, 1H).
(2R,4R)-1-(трет-бутилоксикарбонил)-2-(4,4'
- диметокситритил)оксиметил-4-гидроксипирролидин (38):
(2R,
4R)-1- (трет-бутилоксикарбонил)-2-гидроксиметил-4-гидроксипирролидин (37) (4,4 г, 20,28 ммоль) растворяли в сухом пиридине (50 мл) и
оставляли перемешиваться в атмосфере аргона. К этому перемешанному
раствору добавляли TEA (2,53 г, 25 ммоль), а затем 4,4'- диметокситритилхлорид (7,45 г, 22 ммоль). Реакционную смесь перемешивали при
комнатной температуре в течение 12 ч и нейтрализовали MeOH (10
мл). Раствор выпаривали досуха и растворяли в EtOAc (200 мл). EtOAc-слой промывали 5%-ным раствором NaHCO3 (100 мл), водой
(100 мл) и рассолом. Органический экстракт высушивали над
безводным Na2SO4 и выпаривали досуха. Сырой продукт очищали флэш-хроматографией на силикагеле с использованием CH2Cl2->EtOAc в качестве элюента.
Требуемые фракции объединяли и выпаривали с получением 8,09 г (100%) оранжевой пены.
1H ЯМР (CDCl3): δ 1,45 (s, 9H, Boc), 1,90 (dd, 1H), 2,34 (m, 1H), 3, 40-3,62 (m, 3H), 3,74 (s, 6H, 2•OCH3), 4,00 (m, 2H), 4,28 (bs, 1H), 4,44 (m, 1H), 6,82 (d, 4H, Ph), 7,26-8,00 (m, 9H, Ph).
(2R, 4R)-1-(трет-бутилоксикарбонил)-2-(4,
4'-диметокситритил) оксиметил)-4-[(п-толуолсульфонил)окси]пирролидин (39):
(2R, 4R)-1-(трет-бутилоксикарбонил)-2-(4,
4'-диметокситритил) оксиметил-4-гидроксипирролидин (38) (8,09 г, 20,27
ммоль) растворяли в сухом пиридин/CH2Cl2 (2: 1, 200 мл) и охлаждали на ледяной бане в атмосфере аргона. К
этому холодному раствору добавляли TEA (3,03 г, 30 ммоль), а затем
п-толуолсульфонилхлорид (5,7 г, 30 ммоль). Оставляли реакционную смесь перемешиваться при 0oC в течение 3 ч и ниже 30oC в течение 8 ч. Реакционную смесь выпаривали досуха,
фракционировали в смеси EtOAc (200 мл) и 5%-ного раствора NaHCO3 (100 мл) и экстрагировали в EtOAc. EtOAc-экстракт промывали
водой (100 мл) и рассолом (100 мл), высушивали и выпаривали
досуха. Сырой продукт очищали флэш-хроматографией на силикагеле с использованием гексан->EtOAc в качестве элюента. Чистые фракции
объединяли и выпаривали с получением 12,2 г (89%) оранжевого
масла.
1H ЯМР (CDCl3): δ 1,45 (s, 9H, Boc), 1,90 (dd, 1H), 2,34 (m, 1H), 2,40 (s, 3H, CH3), 3,40-3,62 (m, 3H), 3,74 (s, 6H, 2•OCH3), 4,00 (m, 2H), 4,28 (bs, 1H), 4,44 (m, 1H), 6,82 (d, 4H, Ph), 7,26-8,00 (m, 13H, Ph).
(2R,
4S)-1-(трет-бутилоксикарбонил)-2-(4,4'-диметокситритил)
оксиметил)-4-азидо-пирролидин (40):
(2R, 4R)-1-(трет-бутилоксикарбонил)-2-(4,4'-диметокситритил)оксиметил) -4-[п-толуолсульфонил)окси]
пирролидин (39) (5,1 г, 7,58 ммоль) растворяли в
диметилформамиде (50 мл) и разбавляли водой (5 мл). К этому перемешанному раствору добавляли азид натрия (0,65 г, 10 ммоль) и нагревали при 80oC в течение 8 ч. Охлаждали и выпаривали
досуха. Остаток фракционировали в смеси CH2Cl2 (200 мл) и вода (100 мл) и экстрагировали в CH2Cl2.
Органический экстракт промывали рассолом (50 мл),
высушивали над Na2SO4 и выпаривали досуха. Сырой продукт очищали флэш-хроматографией на силикагеле с использованием
гексан->EtOAc в качестве элюента. Чистые фракции
объединяли и выпаривали с получением 3,8 г (92%) прозрачного масла.
1H ЯMP (CDCl3): δ 1,45 (s, 9H, Boc), 1,90 (dd, 1H), 2,34 (m, 1H), 3,40-3,62 (m, 3H), 3, 74 (s, 6H, 2•OCH3), 4,00 (m, 2H), 4,28 (bs, 1H), 4,44 (m, 1H), 6,82 (d, 4H, Ph), 7,26-8,00 (m, 9H, Ph).
(2R,
4S)-1-(трет-бутилоксикарбонил)-2-гидроксиметил-4-амино- пирролидин (41):
(2R,4S)-1-(трет-бутилоксикарбонил)-2-(4,4' - диметокситритил)оксиметил)-4-азидо-пирролидин (40) (2,72 т, 5 ммоль) в
метаноле (75 мл) гидрогенизировали в присутствии 10% палладия на угле (0,3 г) при комнатной температуре и давлении 5 атм. Через 12 ч катализатор отфильтровывали, промывали метанолом (20 мл) и удаляли
растворитель под вакуумом. Выход 1,0 г (93%).
1H ЯМР (CDCl3): δ 1,45 (s, 9H, Boc), 1,90 (dd, 1H), 2,34 (m, 1H), 3,40-3,62 (m, 3H), 4,00 (m, 2H), 4,28 (bs, 1H), 4,44 (m, 1H).
(2R, 4S)-1-(трет-бутилоксикарбонил)-2-гидроксиметил-4-фталимидо- пирролидин (42):
(2R, 4S)-1-(трет-бутилоксикарбонил)-2-гидроксиметил-4- амино-пирролидин
(42) (1,00 г, 4,63 ммоль) растворяли в сухом метаноле (20 мл) и обрабатывали N-этоксикарбонилфталимидом (1,09 г, 5 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 6 ч и
выпаривали досуха. Остаток очищали флэш-хроматографией на силикагеле с использованием CH2Cl2->EtOAc в качестве элюента. Чистые фракции объединяли и выпаривали с
получением
1,5 г (94%) чистого соединения в виде пены.
1H ЯМР (CDCl3): δ 1,45 (s, 9H, Boc), 1,90 (dd, 1H), 2,34 (m, 1H), 3,40-3,62 (m, 3H), 4,00 (m, 2H), 4,28 (bs, 1H), 4,44 (m, 1H), 7,3-7,6 (m, 4H, Ph).
(2R, 4S)-1-(трет-бутилоксикарбонил)-2-[N3-бензоил (тимин-1-ил)]метил-4-фталимидо-пирролидин (43):
К
перемешанному раствору
N3-бензоилтимина (20) (1,15 г, 5 ммоль) в сухом THF (70 мл) под аргоном добавляли трифенилфосфин (2,62 г, 10 ммоль) и (2R,
4S)-1-(трет-бутилоксикарбонил)-2-гидроксиметил- 4-фталимидо-пирролидин (1,4 г, 4,05 ммоль) при комнатной температуре. Через 15 мин медленно, в течение 10 мин добавляли диэтилазодикарбоксилат (1,74 г,
10 ммоль). Реакционную смесь накрывали алюминиевой фольгой и оставляли перемешиваться при комнатной температуре под аргоном в течение 24 ч. Растворитель выпаривали досуха и растворяли остаток в EtOAc
(150 мл). Органический экстракт промывали 5%-ным раствором NaHCO3 (100 мл), водой (100 мл) и рассолом (100 мл) и высушивали над безводным Na2SO4. Высушенный
EtOAc-экстракт выпаривали досуха с получением оранжевого масла. Сырой продукт очищали флэш-хроматографией на силикагеле с использованием гексан->EtOAc в качестве элюента. Фракции, содержавшие
требуемый продукт, объединяли и выпаривали с получением бледно-розового масла. Выход 2,0 г (89%).
1H ЯМР (CDCl3): δ 1,41 (s, 9H, Boc), 1,72 (s, 9H, CH3), 1,90 (dd, 1H), 2,34 (m, 1H), 3,40-3,62 (m, 3H), 4,00 (m, 2H), 4,28 (bs, 1H), 4,44 (m, 1H), 7,06 (s, 1H, C2Н), 7,20-7,60 (m, 9H, Ph).
(2R,
4S)-1-(гидроксиацетил)-2-[N3-бензоил(тимин-1 -ил)]метил-4-фталимидо-пирролидин (44):
К перемешанному раствору соединения (43) (1,12 г, 2 ммоль) в метиленхлориде (10 мл) добавляли
TFA (10 мл) при комнатной температуре и продолжали перемешивание в течение 1 часа. Реакционную смесь выпаривали досуха. Остаток подвергали трехкратному совместному выпариванию с сухим метанолом (10
мл) и полученный остаток сушили над твердым NaOH в течение ночи.
Смесь вышеуказанной TFA соли, гликолевой кислоты (0,78 г, 10 ммоль) и HBTU (321 мг, 10 ммоль) оставляли перемешиваться в сухом CH3CN (50 мл) при комнатной температуре в атмосфере аргона. К этому перемешанному раствору добавляли N-метилморфолин (1,01 г, 10 ммоль) и перемешивание продолжали в течение ночи. Реакционную смесь выпаривали досуха. Остаток фракционировали между CH2Cl2 (100 мл) и 5%-ным раствором NaHCO3 (50 мл) и экстрагировали в CH2 Cl2. Органический экстракт промывали водой (50 мл) и рассолом (50 мл), сушили и выпаривали досуха. Остаток очищали посредством флэш-хроматографии на силикагеле, используя в качестве элюента CH2 Cl2 ---> EtOAc. Чистые фракции объединяли и выпаривали с получением пенистого продукта.
Пример 31
Синтез олигонуклеотидов:
Олигонуклеотиды,
содержащие модифицированные аминокислотами нуклеиново-кислотные скелеты, синтезировали на автоматизированном ДНК-синтезаторе (Applied Biosystems model 394) с использованием
стандартной
фосфорамидитной химии. β-Цианоэтилфосфорамидиты, реагенты для синтеза и CPG полистиреновую колонку получили от Applied Biosystems (Foster City, CA). Для фосфоротиоатных
олигонуклеотидов
заменяли стандартную бутыль для окисления на тетраэтилтиурамдисульфид/ацетонитрил, а для ступенчатого введения серы в фосфорные связи использовали стандартную ABI фосфоротиоатную
программу. После
удаления со стеклянной колонки с контролируемым размером пор снимали защитные группы путем обработки олигонуклеотидов концентрированным гидроксидом аммония при 55oC в
течение 8 ч.
Олигонуклеотиды (с DMT) очищали с помощью HPLC (высокоэффективной жидкостной хроматографии) с использованием полуприготовленной C3 колонки с обращенной фазой (ABI) с линейным
градиентом
5%-ного ацетонитрила в 0,1 М ацетате триэтиламмония (буфер А) и ацетонитрила (буфер В). DMT-защитные группы отщепляли путем обработки 80%-ной уксусной кислотой и продукт осаждали этанолом.
Чистоту
продукта контролировали с помощью HPLC с использованием аналитической C18 колонки (Beckman). Модифицированные аминокислотами мономеры нуклеиновых кислот включали в состав ДНК
последовательности на 3'-конце, 5'-конце и в середине со 100%-ной эффективностью сочетания. Гомополимер, содержащий 16 модифицированных аминокислотами тиминов, также был получен без каких-либо
проблем.
Пример 32
Гибридизационный анализ:
Способность модифицированных аминокислотами олигонуклеотидов по изобретению гибридизоваться с комплементарными им РНК и
ДНК последовательностями определяют анализом плавления концов. РНК-комплемент был синтезирован Genset корпорацией (La Jolla, CA) и очищен с помощью электрофореза в полиакриламидном геле в
денатурирующих условиях с мочевиной (PAGE). Антисмысловые последовательности, естественные или содержащие какие-либо функции в конкретных положениях, добавляли либо к РНК, либо к ДНК комплементу в
стехиометрических концентрациях для формирования гибридных дуплексов. Зависимость абсорбционной (260 нм) гиперхромности от температуры при переходе от дуплекса к беспорядочному клубку регистрировали,
используя Varian Cary 1E UV-Visible спектрофотометр. Измерения осуществляли в буфере из 10 мМ Na-фосфата, pH 7,4, 0,1 мМ EDTA и NaCl, имеющем ионную силу либо 0,1 М, либо 1,0 М. Данные анализируют
путем графического представления зависимости 1/Tm от ln[Ct], где Ct - это общая концентрация олигонуклеотидов. По результатам этого анализа определяют термодинамические параметры. Основываясь на
полученной информации относительно стабильности образованного дуплекса или гетеродуплекса, положение модифицированного пиримидина в олигонуклеотидах оценивают по его влиянию на стабильность спирали.
Модификации, которые коренным образом изменяют стабильность гибрида, показывают снижение или повышение свободной энергии (ΔG), и делаются заключения относительно их пригодности в качестве
антисмысловых олигонуклеотидов.
Исследования гибридизации проводились на олигонуклеотидах, содержавших модифицированный аминокислотами нуклеиново-кислотный скелет как на 3'-конце, так и на 5'-конце. Предварительные исследования показали, что модифицированные олигонуклеотиды образуют дуплекс с комплементарными им РНК и ДНК последовательностями так же, как и немодифицированные олигонуклеотиды.
Пример 33
Устойчивость к действию нуклеаз. Естественные, фосфоротиоатные и модифицированные олигонуклеотиды по изобретению исследуют на их устойчивость к
действию сывороточных нуклеаз путем инкубации этих олигонуклеотидов в среде, содержащей различные концентрации фетальной сыворотки теленка или сыворотки взрослого человека. Меченые олигонуклеотиды
инкубируют в течение различных промежутков времени, обрабатывают протеазой К и затем анализируют гель-электрофорезом в 20%-ных полиакриламидных денатурирующих гелях с мочевиной с последующей
авторадиографией или фосфорографией. Авторадиограммы анализируют с помощью лазерной денситометрии. Исходя из положений модификаций и известной длины олигонуклеотида возможно определить действие
конкретной модификации на расщепление нуклеазой. Для цитоплазматических нуклеаз используют HL60 клеточную линию. Постмитохондриальный супернатант готовят путем дифференциального центрифугирования и
меченые олигонуклеотиды инкубируют в этом супернатанте различные промежутки времени. После инкубации олигонуклеотиды исследуют на деградацию, как описано выше для сывороточной нуклеолитической
деградации. Результаты авторадиографии обсчитывают для сравнения немодифицированных, то есть фосфоротиоатных, и модифицированных олигонуклеотидов.
Предварительные исследования модифицированных аминокислотами олигонуклеотидов показали, что они устойчивы к фосфодиэстеразе яда змеи.
Включение по ссылке
Все процитированные патенты, заявки на патенты и
публикации включены в описание путем ссылки.
Эквиваленты
Данное описание рассматривается как достаточное для того, чтобы специалист в данной области смог осуществить данное
изобретение. Изобретение может иметь различные формы выполнения, которые являются очевидными для специалистов в области молекулярной биологии, органической химии, или родственных областей, и они
включены в объем следующих пунктов формулы изобретения.
Методами фосфорамидитной химии, описанными в примере 31 настоящей заявки на изобретение, получили ряд олигонуклеотидов, в
которых по различным положениям включены соединения, представляющие собой:
а) соединение 27, получение которого описано в примере 28, которое является соединением группы II по п.1 (L-и
D-изомер), и
б) соединение 19, получение которого описано в примере 27, которое является соединением группы 1 по п.1.
Синтезированные модифицированные олигонуклеотиды представлены в табл. 1 и 2 (олигонуклеотиды, содержащие соединение 27) и в табл. 3 (олигонуклеотиды, содержащие соединение 19). Гибридизационный анализ проводили, как описано в примере 32 настоящей заявки. Для этого синтезировали комплементарную ДНК (5' GAA AGG AAG CGG AGA GAT 3'), a комплементарную РНК (5' GAA AGG AAG CGG AGA GAU 3') получали из Genset, San Diego. Образцы для измерений Tm содержали 2 мкМ модифицированных олигонуклеотидов и 2,0 мкМ либо комплементарной ДНК, либо комплементарной РНК. Кривые зависимости поглощения от температуры для дуплексов измеряли в диапазоне температур от 20 до 90oC. На основании этих результатов вычисляли значения Tm, представленные в табл. 1, 2 и 3. Устойчивость к действию ферментов исследовали с помощью следующей методики. Олигонуклеотиды (0,75 OD) инкубировали с фосфодиэстеразой из змеиного яда (1,2 единицы) в 1,5 мл буфера (0,1 М Трис.HCl, pH 7,5; 0,1 М NaCl; 14 мМ MgCl2) в кювете спектрофотометра Varian UV при 25oC, и регистрировали возрастание поглощения при 260 нм в течение периода разложения каждые 30 секунд. Из этих кривых поглощения рассчитывали периоды полужизни олигонуклеотидов. Полученные результаты представлены в табл. 1 и 2; Tm - это температура в серединной точке кривой плавления; концентрации были следующими: олигомерные нити, по 2 мкМ каждой; температуры плавления (Tm) определяли путем измерения изменения поглощения при 260 нм (кювета, длина пути 1 мм) как функции температуры в натрий фосфатном буфере. Все значения представляли собой средние из по меньшей мере трех экспериментов. Обозначение "t" относится к модифицированному аминоспиртом тимидину по изобретению (соединение 27). Δ Tm/мод. представляет собой изменение Tm на одну модификацию. Отрицательные значения свидетельствуют о снижении значения Tm на одно включение "t".
Как видно из результатов, представленных в табл. 1, по сравнению с немодифицированной ДНК, замена Т на "t" по 3'-концу олигонуклеотида оказывает очень незначительное действие на стабильность дуплекса. Для одной замены значение Tm снижалось на 0,8oC (строка 3). Эта тенденция сохранялась вплоть до трех включений "t" по 3'-концу (строка 4). Аналогичное поведение при связывании наблюдали и в том случае, когда "t" включали также и 5'-концу (строка 5). С другой стороны, замена на "t" в середине олигонуклеотидной последовательности сильно сказывалась на гибридизационных свойствах, и температура плавления дуплекса снижалась на 8,7oC на одно включение (строка 6). Дуплекс, образованный модифицированным олигонуклеотидом и целевой РНК, характеризовался аналогичным поведением. Для выявления конформационного воздействия аминоспиртовой нуклеиновой кислоты на стабильность дуплекса, авторами был получен соответствующий D-изомер "t" и осуществлено его включение в олигонуклеотидные последовательности, связывающие свойства которых были изучены.
Результаты представлены в табл. 2.
Включение D-изомера "t" в олигонуклеотидные последовательности благоприятно сказывалось на связывании с РНК. Присутствие D-изомера "t" в середине олигопоследовательности (строка 6) значительно снижало температуру плавления (ΔTm = -6,78oC) дуплекса с ДНК, в то время как стабильность дуплекса с РНК уменьшалась менее значительно (ΔTm = -3,8oC). Тем не менее, одиночная замена по 3' или 5'-концу олигонуклеотида не приводит к серьезной дестабилизации гибридизации.
Олигонуклеотиды, содержащие L или D-изомер "t" по 3'-концу, продемонстрировали повышенную во много раз устойчивость к действию экзонуклеаз по сравнению с немодифицированной ДНК. Полученные результаты представлены на фиг. 33 и 34. Как видно из этих чертежей, немодифицированный олигонуклеотид полностью разлагался в течение 20 минут и имел период полужизни 4, 68 минут. Олигонуклеотид, содержавший D-аминоспиртовой нуклеозидный мономер по 3'-концу (табл. 2, последовательность 3, фиг. 34, последовательность 7), имел период полужизни, равный 72 минутам, а олигонуклеотид, содержавший L-аминоспиртовой мономер (табл. 1, последовательность 3, фиг. 33, последовательность 1), имел период полужизни около 60 минут. Замена более чем одним модифицированным аминоспиртом нуклеозидом по 3'-концу делает олигонуклеотиды очень устойчивыми к действию нуклеаз (t1/2 > 180 минут, фиг. 34, последовательность 2 и фиг. 33, последовательность 3).
Реферат
Описываются новые производные аминокислот или аминоспиртов формулы 1 в любой из групп I, II: где N обозначает азот. Группа I: Х обозначает CHR2OH, где R2 обозначает Н, (низший алкил)амин или (низший алкил)имидазол; Y обозначает Base-(CH2)n-, где Base обозначает негалогенизированное вариабельное нуклеозидное основание, где n равно 1-7; А обозначает карбонил; Z обозначает Н или ОR3, где R3 обозначает Н, низший алкил, (низший алкил)амин или (низший алкил)имидазол; W обозначает CHR4OH, где R4 обозначает Н, (низший алкил)амин или (низший алкил)имидазол. Группа II: А обозначает карбонил; Х обозначает Ваsе-(CH2)n-, где Ваsе обозначает негалогенизированное вариабельное нуклеозидное основание, где n равно 1-3; Y обозначает -CH2OH; W обозначает -CH2OH; Z обозначает Н. Соединения по изобретению являются аналогами олигонуклеотидов, в которых фуранозное кольцо встречающейся в природе нуклеиновой кислоты заменено на остаток аминокислоты или модифицированного аминоспирта. В некоторых воплощениях новые соединения по изобретению, в частности, пригодны для антисмыслового контроля экспрессии генов. Соединения по изобретению также могут быть использованы в качестве зондов для гибридизации нуклеиновых кислот или в качестве праймеров. 2 с. и 6 з.п. ф-лы, 4 табл., 34 ил.
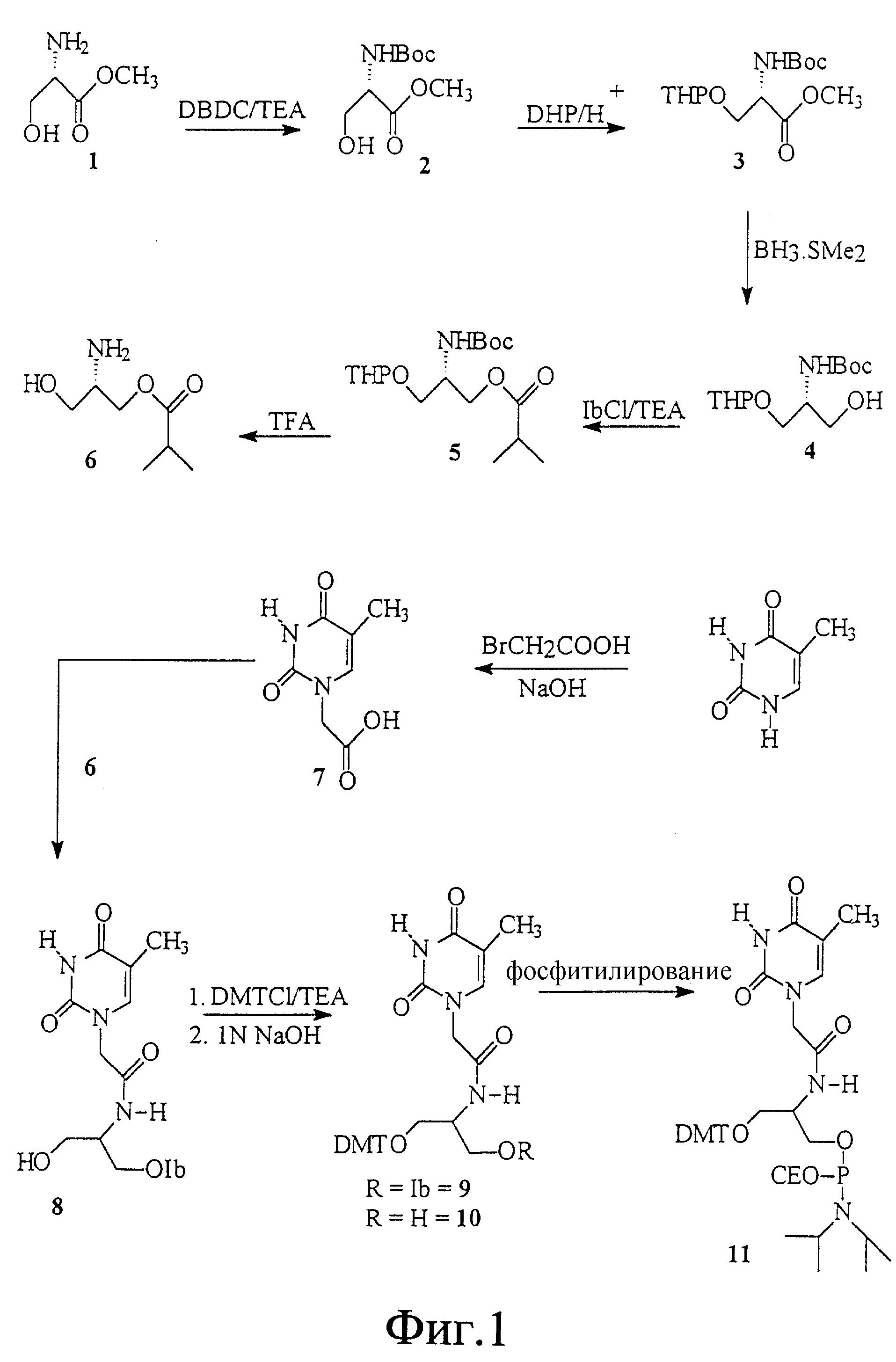
Формула
где N обозначают азот,
Группа I
Х обозначает CHR2OH, где R2 обозначает Н, (низший алкил)амин или (низший алкил)имидазол;
Y обозначает Base-(CH2 )n-, где Base обозначает негалогенизированное вариабельное нуклеозидное основание, где n = 1 - 7;
А обозначает карбонил;
Z обозначает Н или OR3, где R3 обозначает Н, низший алкил, (низший алкил)амин или (низший алкил)имидазол;
W обозначает CHR4OH, где R4 обозначает Н, (низший алкил)амин или (низший алкил)имидазол;
Группа II
А обозначает карбонил;
Х обозначает Base-(CH2)n-, где Base обозначает негалогенизированное вариабельное нуклеозидное основание, где n = 1 - 3;
Y обозначает -СН2ОН;
W обозначает -СН2ОН;
Z обозначает Н.

Комментарии