Способы, устройства и системы для легочной доставки активных средств - RU2728689C2
Код документа: RU2728689C2
Чертежи















Описание
Родственные заявки
В соответствии с настоящей заявкой испрашивается приоритет согласно предварительной заявке на выдачу патента США №62/019225 (номер дела патентного поверенного 59426), поданной 30 июня 2014 г.; 62/035588 (номер дела патентного поверенного 59871), поданной 11 августа 2014 г.; 62/085772 (номер дела патентного поверенного 59424), поданной 1 декабря 2014 г.; 62/086208 (номер дела патентного поверенного 61145), поданной 2 декабря 2014 г., и 62/164710 (номер дела патентного поверенного 60652), поданной 21 мая 2015 г., содержание всех полностью включено в настоящий документ посредством ссылки, как если бы было полностью изложено в настоящем документе.
Область техники
Настоящее изобретение, согласно некоторым его вариантам осуществления, относится к области фармакологии и, более конкретно, но не исключительно, к способам, устройствам и системам контролируемой легочной доставки активных средств.
Уровень техники
Природные вещества, такие как растительные материалы, предлагают множество фармацевтически активных средств, которые могут обеспечить широкий спектр терапевтических и других положительных эффектов; однако, использование многих таких веществ для прямых фармакологических целей было ограничено по техническим и культурным причинам, в первую очередь из-за того, что врачи и фармакологи, которые знают о положительном действии этих веществ, неохотно назначают природное вещество, поскольку содержащиеся в нем активные средства трудно поддаются количественной оценке и, таким образом, ими трудно управлять контролируемо.
Одним из наиболее часто используемых и изученных природных веществ является каннабис, который, как было показано, оказывает благоприятное действие при лечении тошноты и рвоты, рассеянного склероза и другие неврологических состояний, потери аппетита и массы при злокачественной опухоли и СПИД, неврологической боли, бессоннице, тревоге и депрессии, эпилепсии и других судорогах, астмы, синдрома отмены опиоидов, ингибирования роста первичной опухоли, а также является эффективным при жаропонижающем и противовоспалительном, противоглистном, противотошнотном применениях и благодаря окситоцическому действию.
Тем не менее, каннабис как «основное» фармацевтическое средство был предметом споров в течение многих лет из-за трудностей, связанных с его введением в соответствии с типичной медицинской моделью назначения лекарственного средства.
Отсутствие правильных и точных возможностей дозирования является одним из основных препятствий для добавления каннабиса в качестве основного вещества в арсенал лекарственных средств, доступных для, например, устранения боли. Кроме того, отсутствие способа введения каннабиса в фармацевтике затрудняет врачам назначение и контроль лечения, дополнительно размывая грань между медицинским назначением и использованием для развлечения. Таким образом, власти во многих странах воздерживаются от утверждения каннабиса для медицинского применения. Действительно, даже на сегодняшний день, каннабис не рассматривается публикой как безопасное вещество, а в основном рассматривается как незаконное вещество в большинстве стран мира.
Для природных веществ, таких, как каннабис, для использования в качестве «основных» фармацевтических препаратов, эти природные вещества должны предоставляться таким образом, чтобы использование их активных средств могло следовать обычным фармацевтическим стандартам и практикам с точки зрения дозировки и схемы введения.
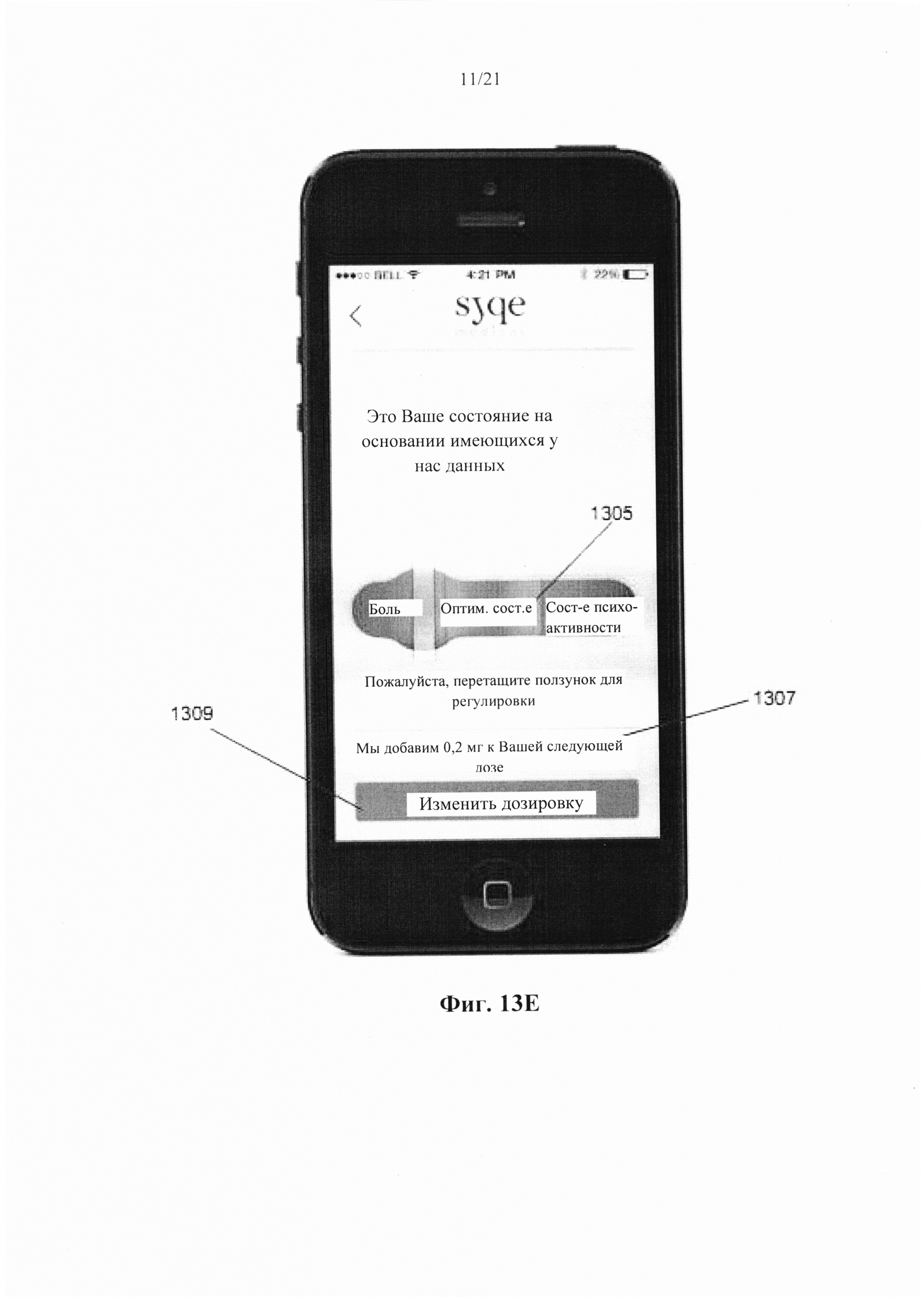
В качестве примера проблем, связанных с использованием каннабиса в качестве природного вещества, может служить недавний опрос о закономерностях и распространенности лекарственного употребления каннабиса, заполненный 953 участниками из 31 страны. Исследование показало, что легочная доставка каннабиса представляет собой наиболее предпочтительный путь введения, используемый 86,6% (62,9% для курения и 23,7% для испарения) участников. Пероральный способ доставки каннабиса в продуктах питания был использован 10,3% участников, в то время как только 2,3% участников использовали либо экстракты каннабиса, поставляемые через слизистую ротовой полости (Sativex®), либо синтетические каннабиноиды (Marinol® и Nabilone®), поставляемые в пероральной форме в виде таблеток. Это может быть частично связано с медленным и беспорядочным поглощением каннабиноидов при пероральном введении, что приводит к отсроченному началу и часто неудовлетворительной величине аналгезии. Рандомизированное, контролируемое, двойное слепое исследование с двойной имитацией введения каннабиса через слизистую ротовой полости выявило фармакокинетический профиль, аналогичный пероральному применению.
Курение продуктов из растения каннабис доказывает быстрый и эффективный способ доставки каннабиноидов. Во время курения продуктов каннабиса, содержание в плазме ТНС быстро увеличивается, в то время как пиковые концентрации, как правило, наблюдаются через 1-3 минуты, приводя в результате к первому появлению эффектов приблизительно через 7 минут. Тем не менее, изменчивость глубины вдоха, продолжительности ингаляции и времени задержки дыхания, а также тот факт, что приблизительно 30% дозы ТНС, как предполагается, будет уничтожено путем пиролиза во время курения, приводят к гетерогенной биодоступности после пути курения, которая колеблется от 2 до 56%. В дополнение к переменной биодоступности, связанные с курением пиролитические побочные продукты, которые могут вызывать различные заболевания, приводят к тому, что курение представляет собой нежелательный способ доставки каннабиноидов.
Шаг вперед был сделан посредством разработки способов испарения каннабиса, направленных на доставку ингаляционных каннабиноидов, избегая при этом опасности курения для органов дыхания. В то время как температура в центре горящей сигареты составляет 750-800°С, выпаривание каннабиса можно проводить при 170-190°С. При таком диапазоне температур активные каннабиноиды, а также пары флавоноидов и терпеноидов, образуются ниже температуры горения (230-235°С), при которой производятся пиролитические токсичные соединения. Было показано, что способ испарения снижает образование моноксида углерода и высоко канцерогенных соединений, таких как полициклические ароматические углеводороды (РАН), бензол и смола.
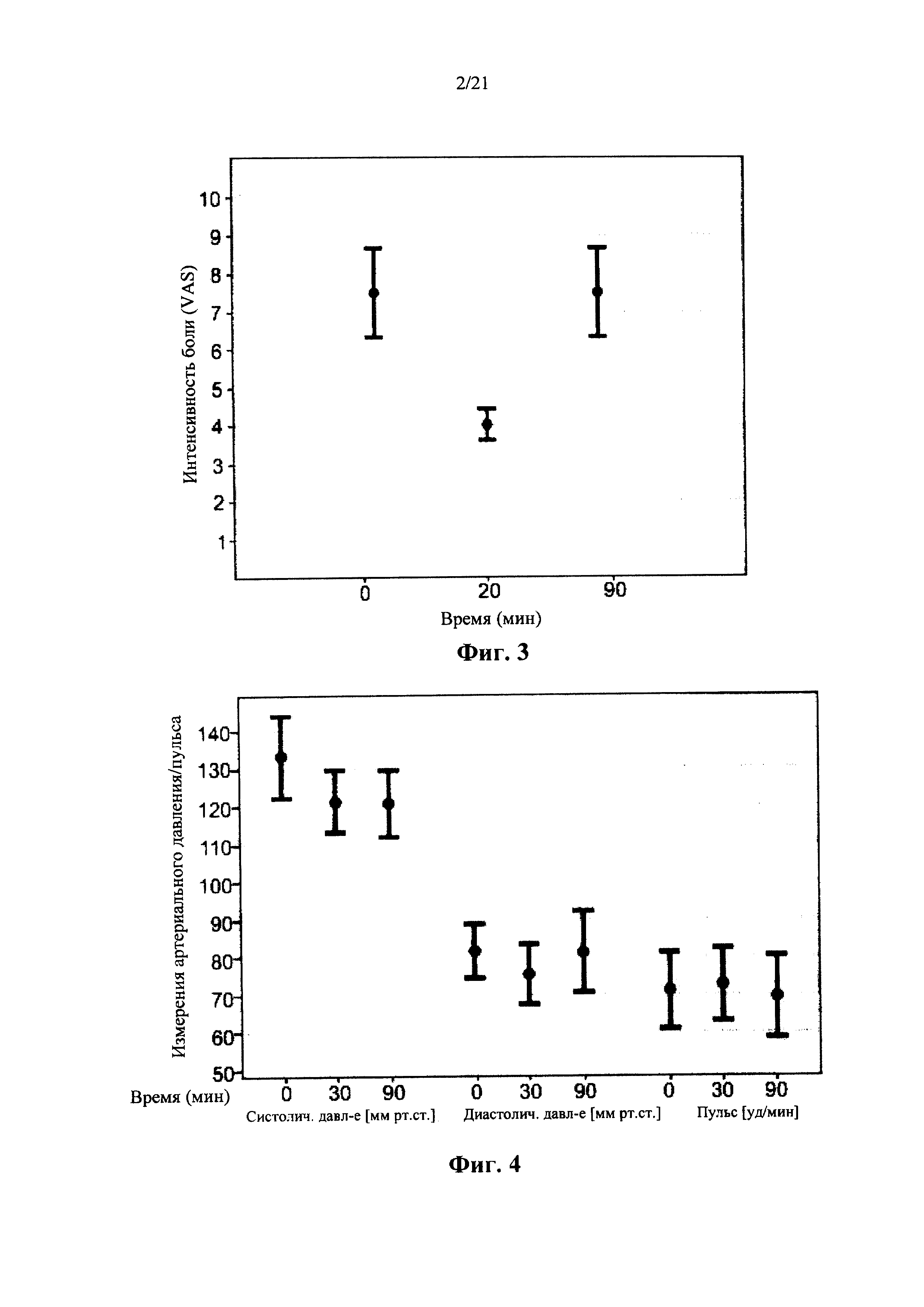
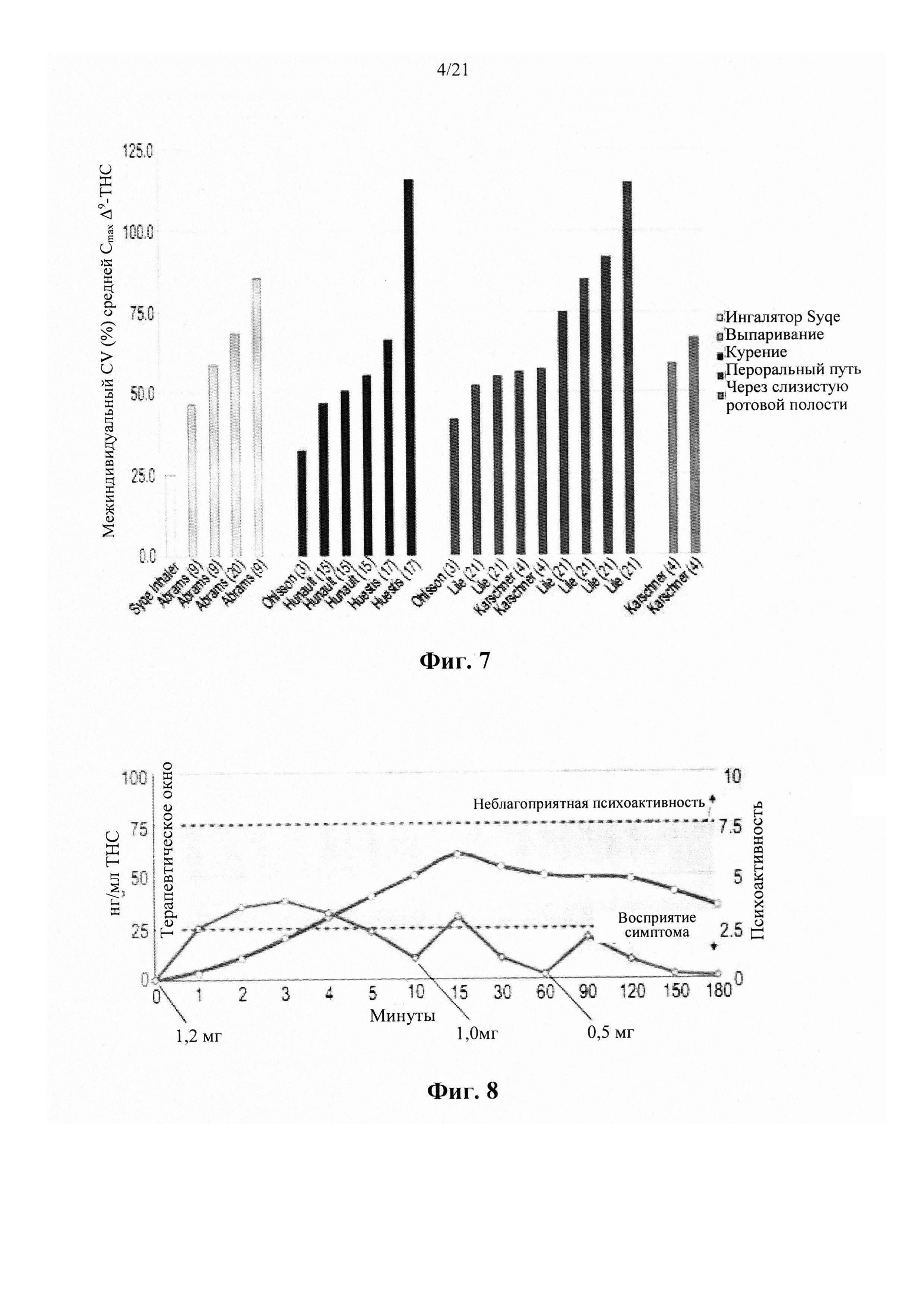
Недавние клинические испытания, которые включали популяцию пациентов, страдающих от хронической невропатической боли различной этиологии, указывали на низкие дозы Δ9-ТНС, как характеризующиеся благоприятным соотношением риска и пользы. Ware с соавт. [в Canadian Medical Association CMAJ. 2010; 182(14):E694-701] сообщил о том, что по сравнению с плацебо, одна ингаляция дыма 25±1 мг каннабиса, содержащего 9,4% Δ9-ТНС (рассчитанная доза 2,35 мг в расчете на общий доступный Δ9-ТНС), получаемая три раза в день в течение 5 дней, была связана со средним повышением Cmax до 45 нг/мл и 11,4%-ным снижением средней суточной интенсивности боли. В другом клиническом испытании, Wilsey с соавт.[в J Pain. 2013; 14(2):136-48] сообщили, что вдыхание парообразных 10,3 мг общих доступных Δ9-ТНС, разделенных на две сессии интервалом в два часа, связано с 31% и 25% снижением интенсивности боли, 3 и 5 ч, соответственно. Увеличение дозы ТНС до 28,2 мг вызывало обезболивающий ответ, который оставался стабильным в эти моменты времени. Во втором клиническом испытании, Wilsey с соавт.[в J Pain. 2008; 9(6):506-21] сообщали, что одинаковые уровни аналгезии были получены при каждой кумулятивной дозе при курении либо 19 мг (промежуточная доза), либо 34 мг общего доступного Δ9-ТНС (высокая доза), разделенного на 3 приема, достигая плато или «эффекта потолка» уменьшения невропатической боли на 45%.
Однако ни один из известных в настоящее время бездымных устройств испарения не может быть использован для введения каннабиса под общими фармацевтическими стандартами и практикой. Доставка в легкие каннабиноидов в паровой фазе варьирует в пределах и между дозами из-за субъективной визуальной оценки величины дозы, введенной пользователем, при неоднократных асинхронных ингаляциях одной и той же вводимой дозы, непоследовательной динамики ингаляции и зависящей от времени конденсации паров на внутренней поверхности устройства. Как следствие, используемые в настоящее время испарители делают правильное фармацевтическое дозирование и контроль медицинского режима нереальным или нецелесообразным.
В дополнение к способности управлять испаренным количеством фармацевтически активных средств из природного растительного вещества с точки зрения точности и последовательности, проблема дозировки и схемы введения, связанная с существующими способами для доставки в легкие таких средств, как правило, решается с помощью проб и ошибок на основе субъективного восприятия пользователя, в то время как измерения фармакокинетических и фармакодинамических параметров остаются вне досягаемости большинства пользователей.
В публикации WO 2012/085919 настоящими заявителями раскрыто ингаляционное устройство для контролируемой экстракции/испарения активных веществ из растительного материала путем применения нагревания, причем растительный материал организован в виде картриджа, и устройство выполнено с возможностью испарять точное количество средства с высокой воспроизводимостью. Ингалятор содержит предварительно загруженные и предварительно взвешенные порции растительного материала, каждый из которых связан со специализированным нагревательным элементом, предназначенным для применения нагревания к растительному материалу, чтобы таким образом испарять одно или несколько активных веществ из растительного материала. На фиг. 1 предшествующего уровня техники представлена фотография примера такого устройства.
Дополнительная информация предшествующего уровня техники включает в себя публикацию заявки на патент США №2005/0268911, в которой раскрыто устройство и способы вовлечения вещества в пределы воздушного потока; и публикацию заявки на патент США №2011/0192399, в которой раскрыт испаритель для испарения вещества, а также публикацию заявки на патент США №20050087189 и 20070240712, и патенты США№6622723, 6830046, 8204729, 8333197 и 8474453.
Сущность изобретения
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен способ легочной доставки субъекту по меньшей мере одного фармакологически активного средства, находящегося в растительном материале, причем указанный способ предусматривает легочной доставки средства субъекту с использованием устройства для ингаляции отмеренной дозы, выполненного с возможностью выпаривания по меньшей мере одного предварительно определенного выпаренного количества средства при контролируемом нагревании растительного материала, причем по меньшей мере одно предварительно определенное выпаренное количество средства выбирают таким образом, чтобы достичь по меньшей мере одного предварительно определенного фармакокинетического (PK) эффекта и/или по меньшей мере одного предварительно определенного фармакодинамического (PD) эффекта, индуцированного средством у субъекта.
Согласно некоторым вариантам осуществления, предварительно определенное выпаренное количество определяют на основе по меньшей мере одного PK эффекта и/или по меньшей мере одного PD эффекта по отношению к популяции.
В соответствии с некоторыми вариантами осуществления способ дополнительно предусматривает корректировку предварительно определенного выпаренного количества для достижения предварительно определенного PK эффекта и/или предварительно определенного PD эффекта на основе данных, указывающих по меньшей мере на один PK эффект и/или по меньшей мере на один PD эффект, индуцируемый средством у субъекта.
В соответствии с некоторыми вариантами осуществления способ дополнительно предусматривает получение данных путем мониторинга по меньшей мере одного PK эффекта и/или по меньшей мере одного PD эффекта, индуцированного средством у субъекта.
В соответствии с некоторыми вариантами осуществления предусмотрена легочная доставка по меньшей мере двух предварительно определенных выпаренных количеств в соответствии с предварительно определенной схемой введения.
В соответствии с некоторыми вариантами осуществления способ предусматривает корректировку схемы введения для достижения предварительно определенного PK эффекта и/или предварительно определенного PD эффекта на основе по меньшей мере одного PK эффекта и/или по меньшей мере одного PD эффекта, индуцированного средством у субъекта.
В соответствии с некоторыми вариантами осуществления способ дополнительно предусматривает получение данных путем мониторинга по меньшей мере одного PK эффекта и/или по меньшей мере одного PD эффекта, индуцированного средством у субъекта.
Согласно некоторым вариантам осуществления мониторинг PK эффекта и/или PD эффекта предусматривает получение данных, указывающих по меньшей мере на один PD эффект у субъекта по меньшей мере от одного датчика, сообщающегося с контроллером, связанным с ингаляционным устройством.
В соответствии с некоторыми вариантами осуществления корректировка предварительно определенного выпаренного количества и/или схемы введения основана на данных, полученных через устройство пользовательского интерфейса.
В соответствии с некоторыми вариантами осуществления корректировка предварительно определенного выпаренного количества и/или схемы введения осуществляется в режиме реального времени.
В соответствии с некоторыми вариантами осуществления мониторинг PK эффекта и/или PD эффекта, индуцированного средством у субъекта, осуществляется в предварительно определенные промежутки времени до, во время и/или после ингаляционной доставки.
Согласно некоторым вариантам осуществления PK эффект предусматривает концентрацию средства в данном объеме биологической жидкости и концентрацию средства в данной массе биологической ткани.
Согласно некоторым вариантам осуществления PD эффект предусматривает желаемый эффект, нежелательный эффект, терапевтический эффект, неблагоприятный эффект и содержание биомаркера.
В соответствии с некоторыми вариантами осуществления предусмотрена корректировка по меньшей мере одного из предварительно определенных PK эффектов и/или предварительно определенных PD эффектов, основанная на данных, полученных через устройство пользовательского интерфейса.
В соответствии с некоторыми вариантами осуществления предварительно определенный PD эффект относится к предварительно определенному PD профилю, который находится в диапазоне от минимального уровня желаемого эффекта до уровня нежелательного эффекта.
В соответствии с некоторыми вариантами осуществления настоящего изобретения предварительно определенный PD профиль находится в диапазоне между минимальным уровнем желаемого эффекта и минимальным уровнем нежелательного эффекта.
В соответствии с некоторыми вариантами осуществления предварительно определенный PD профиль находится в диапазоне между минимальным уровнем желаемого эффекта и уровнем выше, чем минимальный уровень нежелательного эффекта.
В соответствии с некоторыми вариантами осуществления определение по меньшей мере одного желаемого эффекта и/или нежелательного эффекта предусматривает получение инструкций от субъекта.
В соответствии с некоторыми вариантами осуществления биомаркер включает в себя инвазивно распознаваемый биомаркер и неинвазивно распознаваемый биомаркер.
Примеры для неинвазивно распознаваемых биомаркеров включают в себя без ограничения частоту сердечных сокращений, уровень оксигенации (SpO2), артериальное давление, частоту дыхания, температуру тела, объем ингаляции, выражение лица, мышечные подергивания, судороги, спазмы, потливость, координацию рук и глаз, сосудистое расширение глаз, покраснение конъюнктивы и/или склеры, изменение внутриглазного давления, двигательные навыки, атаксию, синусовую тахикардию, тремор, нарушения сердечного ритма, уровень проводимости кожи/импеданс, пароксизм, электромиографию (ЭМГ), электрокардиограмму (ЭКГ), фото-плетизмограмму (PPG), кожно-гальваническую реакцию (GSR), низкую восприимчивость к синему и коричневому цвету, зрительную маскировку, латентное нарушение слуха, латентное нарушение зрения, словесно-цветовой тест Струпа, простую реакцию (задачу конфликта), когнитивное переключение установок, логическое мышление, время принятия решений, скорость обработки информации, перцепционный лабиринт, имитируемое вождение, визуальный поиск, оценку времени, восприятие времени, визуальный поиск, тест на продуктивность внимания, копирование символов, зачеркивание букв, тест на вычеркивание D2, тест Брикенкампа D2, числовой копировальный тест (DDCT), символьно-числовую замену (SDST), тест замены цифровых символов (DSST), тест на внимание, внимание, тест слухового внимания, задачу на внимание Wesnes/Warburton, быструю обработку информации, CRT+отслеживание распределенного внимания, селективное внимание, задачу сосредоточенности внимания, задачу эмоционального внимания, слияние слуховой пульсации, слияние мельканий, критическое слияние мельканий (CFF), постоянное внимание, изучение парных ассоциаций, изучение списка слов, тест 15 слов, вводную выработку условного рефлекса, тест на отсроченное припоминание, тест на отсроченное распознавание слов, тест на отсроченное распознавание картинок, словесное представление, распознавание слов, числовую кратковременную память, числовую память, сканирование памяти, слуховой тест Брауна/Петерсона, зрительный тест Брауна/Петерсона, зрительно-пространственную память, тест фрагментированных картинок, тест Pauli, тест на последовательность блоков, тест на числовую последовательность, тест на числовую последовательность (прямую), тест на числовую последовательность (обратную), словарь WAIS, сходство WAIS, беглость речи, тест беглости речевых ответов, время выполнения операции (тест на отсроченное распознавание слов), время выполнения операции (числовая кратковременная память), время выполнения операции (тест на внимание), время выполнения операции (быстрая обработка информации), время выполнения операции (тест на отсроченное распознавание картинок), время выполнения операции (обработка зрительной информации), время простой реакции CRT, комплекс RTvisual, визуальный выбор RT, VRT, скорость визуальной реакции, ART, слуховую RT, невербальный тест "Лабиринт" на интеллектуальные способности, тест на изображение архимедовой спирали, задание на критическое слежение, тест с построением маршрута, комплекс отслеживания, оценку зрительно-моторной координации с помощью венского прибора, тест на гибкость концентрации внимания, конструирование блоков WAIS, сравнение картинок WAIS, копирование чисел, манипулирование, мелкую моторику, графологический анализ, постукивание, исследование координации горизонтальных движений рук и кистей рук, визуальный тест на дотягивание, двигательный контроль и координацию, двигательное поведение.
В соответствии с некоторыми вариантами осуществления желаемый эффект соответствует симптому, который включает в себя боль, мигрень, депрессию, дефицит когнитивных функций, дефицит внимания, гиперактивность, тревожные расстройства, диарею, тошноту, рвоту, бессонницу, бред, изменения аппетита, сексуальную дисфункцию, спастичность, увеличенное внутриглазное давление, дисфункцию мочевого пузыря, тики, симптомы Туретта, симптомы посттравматического стрессового расстройства (PTSD), симптомы воспалительного заболевания кишечника (IBD), симптомы синдрома раздраженного кишечника (IBS), гипертонию, геморрагические симптомы, септический и кардиогенный шок, наркозависимость и зависимость, симптомы синдрома отмены, тремор и другие двигательные нарушения.
В соответствии с некоторыми вариантами осуществления PD эффект представляет собой психотропный эффект и/или соматический эффект.
В соответствии с некоторыми вариантами осуществления психотропный эффект соответствует симптому, который включает в себя паранойю, беспокойство, приступ паники, эйфорию, псевдо-галлюцинацию, атаксию, седативный эффект, изменение сознательного восприятия, веселость, метапознание и самоанализ, повышенную актуализацию (эпизодическую память), амнезию, изменение чувственности, изменение в сознании ощущения и изменение либидо, головокружение, атаксию, эйфорию, перцептивные изменения, временное искажение, усиление чувственного восприятия, кратковременной памяти и внимания, нарушение реакции, координации произвольных движений, беглости речи, зависимость и депрессию.
В соответствии с некоторыми вариантами осуществления соматический эффект соответствует симптому, который включает в себя тошноту, мышечные судороги, спазмы и мышечную релаксацию, судороги, потливость, атаксию, изменение двигательной активности, сухость во рту и ощущение холодных или горячих рук и ног, увеличение частоты сердечных сокращений, увеличение мозгового кровотока, дилатацию бронхиальных путей, расширение кровеносных сосудов, покраснение глаз и расширение зрачков, сухость во рту, жажду, голод или тягу к определенному виду пищи.
В соответствии с некоторыми вариантами осуществления представленный в настоящем документе способ предусматривает ингаляционную доставку субъекту по меньшей мере первого фармакологически активного средства и второго фармакологически активного средства, по меньшей мере один из которых содержится по меньшей мере в одном растительном материале, причем указанный способ предусматривает независимую доставку средств субъекту с помощью устройства, выполненного с возможностью испарять по меньшей мере первое предварительно определенное выпаренное количество первого средства и по меньшей мере второе предварительно определенное выпаренное количество второго средства, причем нагревание осуществляют таким образом, что первое предварительно определенное выпаренное количество доставляется субъекту последовательно, параллельно и/или по меньшей мере с частичным перекрыванием со вторым предварительно определенным выпаренным количеством.
В соответствии с некоторыми вариантами осуществления растение включает в себя Cannabis sativa, Cannabis indica, Cannabis ruderalis, Acacia spp, Amanita muscaria, Yage, Atropa belladonna, Areca catechu, Brugmansia spp., Brunfelsia latifolia, Desmanthus illinoensis, Banisteriopsis caapi, Trichocereus spp., Theobroma cacao, Capsicum spp., Cestrum spp., Erythroxylum coca, Solenostemon scutellarioides, Arundo donax, Coffea arabica, Datura spp., Desfontainia spp., Diplopterys cabrerana, Ephedra sinica, Claviceps purpurea, Paullinia cupana, Argyreia nervosa, Hyoscyamus niger, Tabernanthe iboga, Lagochilus inebriens, Justicia pectoralis, Sceletium tortuosum, Piper methysticum, Catha edulis, Mitragyna speciosa, Leonotis leonurus, Nymphaea spp., Nelumbo spp., Sophora secundiflora, Mucuna pruriens, Mandragora officinarum, Mimosa tenuiflora, Ipomoea violacea, Psilocybe spp., Panaeolus spp., Myristica fragrans, Turbina corymbosa, Passiflora incarnata, Lophophora williamsii, Phalaris spp., Duboisia hopwoodii, Papaver somniferum, Psychotria viridis, spp., Salvia divinorum, Combretum quadrangulare, Trichocereus pachanoi, Heimia salicifolia, Stipa robusta, Solandra spp., Hypericum perforatum, Peganum harmala, Tabernaemontanaspp, Camellia sinensis, Nicotiana tabacum, Nicotiana rusticum, Virola theidora, Voacanga africana, Lactuca virosa, Artemisia absinthium, Ilex paraguariensis, Anadenanthera spp., Corynanthe yohimbe, Calea zacatechichi, Coffea spp.(Rubiaceae), a Sapindaceae, Camellia spp., Malvaceae spp., Aquifoliaceae spp., Hoodia, spp.Chamomilla recutita, Passiflora incarnate, Camellia sinensis, Mentha piperita, Mentha spicata, Rubus idaeus, Eucalyptus globulus, Lavandula officinalis, Thymus vulgaris, Melissa officinalis, алоэ лекарственное, дудник, анис, аяуаску (Banisteriopsis caapi), барбарис, белокудренник черный, голубой лотос, лопух, ромашку, тмин, кошачий коготь, гвоздику, окопник, кукурузные рыльца, пырей ползучий, дамиан, одуванчик, эфедру, эвкалипт, энотеру, фенхель, пиретрум, снежное дерево, чеснок, имбирь, гинкго, женьшень, золотарник, гидрастис, готу кола, зеленый чай, гуарану, боярышник, хмель, хвощ, иссоп, Кольский орех, кратом, лаванду, мелиссу, солодку, хвост льва (Wild Dagga), корень мака, алтей, таволгу, молочный чертополох, пустырник, страстоцвет, пассифлору, перечную мяту, колючий мак, портулак, лист малины, красный мак, шалфей, пальму сереноа, Sida Cordifolia, синикуичи (Mayan Sun Opener), мяту, аир, могильник (Peganum harmala), чабрец, куркуму, валериану, дикий ямс, полынь, тысячелистник, падуб парагвайский, йохимбе, а также любую часть и любую их комбинацию.
В соответствии с некоторыми вариантами осуществления растение включает в себя Cannabis sativa, Cannabis indica и Cannabis ruderalis.
В соответствии с некоторыми вариантами осуществления фармакологически активное средство включает в себя Δ9-тетрагидроканнабинол (ТНС), каннабидиол (CBD), каннабигеролы (CBG), каннабихромены (СВС), каннабинол (CBN), каннабинодиол (CBDL), каннабициклол (CBL), каннабиэлсоин (СВЕ), каннабидиварин (CBDV), тетрагидроканнабиварин (THCV) и каннабитриол (СВТ).
В соответствии с некоторыми вариантами осуществления фармакологически активное средство включает в себя Δ9-тетрагидроканнабинол (ТНС) и каннабидиол (CBD).
В соответствии с одним аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрена система для легочной доставки субъекту по меньшей мере одного фармацевтически активного средства, содержащегося в растительном материале, которая включает в себя:
устройство для ингаляции отмеренных доз, выполненное с возможностью испарения по меньшей мере одного предварительно определенного выпаренного количества средства при контролируемом нагревании растительного материала; а также
контроллер, связанный с ингаляционным устройством, выполненный с возможностью выбора по меньшей мере одного предварительно определенного выпаренного количества средства таким образом, чтобы достичь по меньшей мере одного предварительно определенного PK эффекта и/или по меньшей мере одного предварительно определенного PD эффекта, индуцированного средством у субъекта.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен способ легочной доставки субъекту по меньшей мере первого фармакологически активного средства и второго фармакологически активного средства, по меньшей мере один из которых содержится по меньшей мере в одном растительном материале, способ предусматривает независимую доставку средств субъекту с использованием устройства для ингаляции отмеренных доз, выполненного с возможностью испарения по меньшей мере первого предварительно определенного выпаренного количества первого средства и по меньшей мере второго предварительно определенного выпаренного количества второго средства при контролируемом нагревании растительного материала, причем нагревание осуществляют таким образом, что первое предварительно определенное выпаренное количество доставляется субъекту последовательно, параллельно и/или по меньшей мере с частичным перекрыванием со вторым предварительно определенным выпаренным количеством, и причем каждый из предварительно определенных выпаренных количеств каждого из средств индуцирует у субъекта независимо по меньшей мере один фармакокинетический (PK) эффект и/или по меньшей мере один фармакодинамический (PD) эффект.
В соответствии с некоторыми вариантами осуществления временной интервал между доставкой первого средства и доставкой второго средства составляет от нуля минут до 30 минут.
В соответствии с некоторыми вариантами осуществления PD эффект включает в себя желаемый эффект, нежелательный эффект, терапевтический эффект, неблагоприятный эффект и содержание биомаркера.
В соответствии с некоторыми вариантами осуществления предварительно определенное выпаренное количество первого средства влияет на уровень PD эффекта, индуцированного вторым средством.
В соответствии с некоторыми вариантами осуществления предварительно определенное выпаренное количество первого средства повышает уровень желаемого эффекта, индуцированного вторым средством.
В соответствии с некоторыми вариантами осуществления предварительно определенное выпаренное количество первого средства снижает уровень нежелательного эффекта, индуцированного вторым средством.
В соответствии с некоторыми вариантами осуществления первое средство и второе средство индуцируют желаемый эффект синергически.
В соответствии с некоторыми вариантами осуществления каждое из предварительно определенных выпаренных количеств каждого из средств выбирают таким образом, чтобы достичь по меньшей мере одного предварительно определенного PK эффекта и/или по меньшей мере одного предварительно определенного PD эффекта, индуцированного независимо каждым из средств у субъекта.
В соответствии с некоторыми вариантами осуществления каждое из предварительно определенных выпаренных количеств каждого из средств определяется на основании по меньшей мере одного PK эффекта и/или по меньшей мере одного PD эффекта, относящегося к популяции.
В соответствии с некоторыми вариантами осуществления способ дополнительно предусматривает корректировку по меньшей мере одного из первого предварительно определенного выпаренного количества и второго предварительно определенного выпаренного количества таким образом, чтобы достичь предварительно определенного PK эффекта и/или предварительно определенного PD эффекта на основании данных, указывающих по меньшей мере на один PK эффект и/или по меньшей мере на один PD эффект, индуцированный средством у субъекта.
В соответствии с некоторыми вариантами осуществления способ дополнительно предусматривает получение данных путем мониторинга по меньшей мере одного PK эффекта и/или по меньшей мере одного PD эффекта, индуцированного по меньшей мере одним из первого средства и второго средства у субъекта.
В соответствии с некоторыми вариантами осуществления способ дополнительно предусматривает легочную доставку по меньшей мере двух предварительно определенных выпаренных количеств по меньшей мере одного из первого средства и второго средства в соответствии с предварительно определенной схемой введения.
В соответствии с некоторыми вариантами осуществления способ дополнительно предусматривает корректировку режима таким образом, чтобы достичь предварительно определенного PK эффекта и/или предварительно определенного PD эффекта на основании по меньшей мере одного PK эффекта и/или по меньшей мере одного PD эффекта, индуцированного по меньшей мере один из первого средства и второго средства у субъекта.
В соответствии с некоторыми вариантами осуществления способ дополнительно предусматривает получение данных путем мониторинга по меньшей мере одного PK эффекта и/или по меньшей мере одного PD эффекта, индуцированного по меньшей мере одним из первого средства и второго средства у субъекта.
В соответствии с некоторыми вариантами осуществления мониторинг PK эффекта и/или PD эффекта осуществляется в предварительно определенные промежутки времени до, во время и/или после легочной доставки.
В соответствии с некоторыми вариантами осуществления мониторинг предусматривает получение данных, указывающих по меньшей мере на один PD эффект у субъекта по меньшей мере от одного датчика, сообщающегося с контроллером, связанным с ингалятором.
В соответствии с некоторыми вариантами осуществления корректировка основана на данных, полученных через устройство пользовательского интерфейса.
В соответствии с некоторыми вариантами осуществления корректировка осуществляется в режиме реального времени.
В соответствии с некоторыми вариантами осуществления контроль PK эффекта и/или PD эффекта, индуцированного по меньшей мере одним из первого средства и второго средства у субъекта, осуществляется в предварительно определенные промежутки времени до, во время и/или после легочной доставки.
В соответствии с некоторыми вариантами осуществления PK эффект включает в себя концентрацию каждого из средств в заданном объеме биологической жидкости и концентрацию каждого из средств в заданной массе ткани организма.
В соответствии с некоторыми вариантами осуществления PD эффект относится к предварительно определенному PD профилю, который варьирует в диапазоне от минимального уровня желаемого эффекта до уровня нежелательного эффекта.
В соответствии с некоторыми вариантами осуществления предварительно определенный PD профиль варьирует в диапазоне от минимального уровня желаемого эффекта до минимального уровня нежелательного эффекта.
В соответствии с некоторыми вариантами осуществления предварительно определенный PD профиль варьирует в диапазоне от минимального уровня желаемого эффекта до уровня выше, чем минимальный уровень нежелательного эффекта.
В соответствии с некоторыми вариантами осуществления определение по меньшей мере одного желаемого эффекта и/или нежелательного эффекта предусматривает получение инструкций от субъекта.
В соответствии с некоторыми вариантами осуществления биомаркер включает в себя инвазивно распознаваемый биомаркер и неинвазивно распознаваемый биомаркер.
В соответствии с некоторыми вариантами осуществления неинвазивно распознаваемый биомаркер включает в себя без ограничения частоту сердечных сокращений, уровень оксигенации (SpO2), артериальное давление, частоту дыхания, температуру тела, объем ингаляции, выражение лица, мышечные подергивания, судороги, спазмы, потливость, координацию рук и глаз, сосудистое расширение глаз, покраснение конъюнктивы и/или склеры, изменение внутриглазного давления, двигательные навыки, атаксию, синусовую тахикардию, тремор, нарушения сердечного ритма, уровень проводимости кожи/импеданс, пароксизм, электромиографию (ЭМГ), электрокардиограмму (ЭКГ), фото-плетизмограмму (PPG), кожно-гальваническую реакцию (GSR), низкую восприимчивость к синему и коричневому цвету, зрительную маскировку, латентное нарушение слуха, латентное нарушение зрения, словесно-цветовой тест Струпа, простую реакцию (задачу конфликта), когнитивное переключение установок, логическое мышление, время принятия решений, скорость обработки информации, перцепционный лабиринт, имитируемое вождение, визуальный поиск, оценку времени, восприятие времени, визуальный поиск, тест на продуктивность внимания, копирование символов, зачеркивание букв, тест на вычеркивание D2, тест Брикенкампа D2, числовой копировальный тест (DDCT), символьно-числовую замену (SDST), тест замены цифровых символов (DSST), тест на внимание, внимание, тест слухового внимания, задачу на внимание Wesnes/Warburton, быструю обработку информации, CRT+ отслеживание распределенного внимания, селективное внимание, задачу сосредоточенности внимания, задачу эмоционального внимания, слияние слуховой пульсации, слияние мельканий, критическое слияние мельканий (CFF), постоянное внимание, изучение парных ассоциаций, изучение списка слов, тест 15 слов, вводную выработку условного рефлекса, тест на отсроченное припоминание, тест на отсроченное распознавание слов, тест на отсроченное распознавание картинок, словесное представление, распознавание слов, числовую кратковременную память, числовую память, сканирование памяти, слуховой тест Брауна/Петерсона, зрительный тест Брауна/Петерсона, зрительно-пространственную память, тест фрагментированных картинок, тест Pauli, тест на последовательность блоков, тест на числовую последовательность, тест на числовую последовательность (прямую), тест на числовую последовательность (обратную), словарь WAIS, сходство WAIS, беглость речи, тест беглости речевых ответов, время выполнения операции (тест на отсроченное распознавание слов), время выполнения операции (числовая кратковременная память), время выполнения операции (тест на внимание), время выполнения операции (быстрая обработка информации), время выполнения операции (тест на отсроченное распознавание картинок), время выполнения операции (обработка зрительной информации), время простой реакции CRT, комплекс RT visual, визуальный выбор RT, VRT, скорость визуальной реакции, ART, слуховую RT, невербальный тест "Лабиринт" на интеллектуальные способности, тест на изображение архимедовой спирали, задание на критическое слежение, тест с построением маршрута, комплекс отслеживания, оценку зрительно-моторной координации с помощью венского прибора, тест на гибкость концентрации внимания, конструирование блоков WAIS, сравнение картинок WAIS, копирование чисел, манипулирование, мелкую моторику, графологический анализ, постукивание, исследование координации горизонтальных движений рук и кистей рук, визуальный тест на дотягивание, двигательный контроль и координацию, двигательное поведение.
В соответствии с некоторыми вариантами осуществления желаемый эффект соответствует симптому, который включает в себя боль, мигрень, депрессию, дефицит когнитивных функций, дефицит внимания, гиперактивность, тревожные расстройства, диарею, тошноту, рвоту, бессонницу, бред, изменения аппетита, сексуальную дисфункцию, спастичность, увеличенное внутриглазное давление, дисфункцию мочевого пузыря, тики, симптомы Туретта, симптомы посттравматического стрессового расстройства (PTSD), симптомы воспалительного заболевания кишечника (IBD), симптомы синдрома раздраженного кишечника (IBS), гипертонию, геморрагические симптомы, септический и кардиогенный шок, наркозависимость и зависимость, симптомы синдрома отмены, тремор и другие двигательные нарушения.
В соответствии с некоторыми вариантами осуществления PD эффект представляет собой психотропный эффект и/или соматический эффект.
В соответствии с некоторыми вариантами осуществления психотропный эффект соответствует симптому, который включает в себя паранойю, беспокойство, приступ паники, эйфорию, псевдо-галлюцинацию, атаксию, седативный эффект, изменение сознательного восприятия, веселость, метапознание и самоанализ, повышенную актуализацию (эпизодическую память), амнезию, изменение чувственности, изменение в сознании ощущения и изменение либидо, головокружение, атаксию, эйфорию, перцептивные изменения, временное искажение, усиление чувственного восприятия, кратковременной памяти и внимания, нарушение реакции, координации произвольных движений, беглости речи, зависимость и депрессию.
В соответствии с некоторыми вариантами осуществления соматический эффект соответствует симптому, который включает в себя тошноту, мышечные судороги, спазмы и мышечную релаксацию, судороги, потливость, атаксию, изменение двигательной активности, сухость во рту и ощущение холодных или горячих рук и ног, увеличение частоты сердечных сокращений, увеличение мозгового кровотока, дилатацию бронхиальных путей, расширение кровеносных сосудов, покраснение глаз и расширение зрачков, сухость во рту, жажду, голод или тягу к определенному виду пищи.
В соответствии с некоторыми вариантами осуществления по меньшей мере одно растение включает в себя Cannabis sativa, Cannabis indica, Cannabis ruderalis, Acacia spp, Amanita muscaria, Yage, Atropa belladonna, Areca catechu, Brugmansia spp., Brunfelsia latifolia, Desmanthus illinoensis, Banisteriopsis caapi, Trichocereus spp., Theobroma cacao, Capsicum spp., Cestrum spp., Erythroxylum coca, Solenostemon scutellarioides, Arundo donax, Coffea arabica, Datura spp., Desfontainia spp., Diplopterys cabrerana, Ephedra sinica, Claviceps purpurea, Paullinia cupana, Argyreia nervosa, Hyoscyamus niger, Tabernanthe iboga, Lagochilus inebriens, Justicia pectoralis, Sceletium tortuosum, Piper methysticum, Catha edulis, Mitragyna speciosa, Leonotis leonurus, Nymphaea spp., Nelumbo spp., Sophora secundifiora, Mucuna pruriens, Mandragora officinarum, Mimosa tenuiflora, Ipomoea violacea, Psilocybe spp., Panaeolus spp., Myristica fragrans, Turbina corymbosa, Passiflora incarnata, Lophophora williamsii, Phalaris spp., Duboisia hopwoodii, Papaver somniferum, Psychotria viridis, spp., Salvia divinorum, Combretum quadrangulare, Trichocereus pachanoi, Heimia salicifolia, Stipa robusta, Solandra spp., Hypericum perforatum, Peganum harmala, Tabernaemontanaspp, Camellia sinensis, Nicotiana tabacum, Nicotiana rusticum, Virola theidora, Voacanga africana, Lactuca virosa, Artemisia absinthium, Ilex paraguariensis, Anadenanthera spp., Corynanthe yohimbe, Calea zacatechichi, Coffea spp.(Rubiaceae), a Sapindaceae, Camellia spp., Malvaceae spp., Aquifoliaceae spp., Hoodia, spp.Chamomilla recutita, Passiflora incarnate, Camellia sinensis, Mentha piperita, Mentha spicata, Rubus idaeus, Eucalyptus globulus, Lavandula officinalis, Thymus vulgaris, Melissa officinalis, алоэ лекарственное, дудник, анис, аяуаску (Banisteriopsis caapi), барбарис, белокудренник черный, голубой лотос, лопух, ромашку, тмин, кошачий коготь, гвоздику, окопник, кукурузные рыльца, пырей ползучий, дамиан, одуванчик, эфедру, эвкалипт, энотеру, фенхель, пиретрум, снежное дерево, чеснок, имбирь, гинкго, женьшень, золотарник, гидрастис, готу кола, зеленый чай, гуарану, боярышник, хмель, хвощ, иссоп, Кольский орех, кратом, лаванду, мелиссу, солодку, хвост льва (Wild Dagga), корень мака, алтей, таволгу, молочный чертополох, пустырник, страстоцвет, пассифлору, перечную мяту, колючий мак, портулак, лист малины, красный мак, шалфей, пальму сереноа, Sida Cordifolia, синикуичи (Mayan Sun Opener), мяту, аир, могильник (Peganum harmala), чабрец, куркуму, валериану, дикий ямс, полынь, тысячелистник, падуб парагвайский, йохимбе, а также любую часть и любую их комбинацию.
В соответствии с некоторыми вариантами осуществления по меньшей мере одно растение включает в себя Cannabis sativa, Cannabis indica и Cannabis ruderalis.
В соответствии с некоторыми вариантами осуществления по меньшей мере одно фармакологически активное средство и второе фармакологически активное средство включает в себя А9-тетрагидроканнабинол (ТНС), каннабидиол (CBD), каннабигеролы (CBG), каннабихромены (СВС), каннабинол (CBN), каннабинодиол (CBDL), каннабициклол (CBL), каннабиэлсоин (СВЕ), каннабидиварин (CBDV), тетрагидроканнабиварин (THCV) и каннабитриол (СВТ).
В соответствии с некоторыми вариантами осуществления по меньшей мере одно фармакологически активное средство и второе фармакологически активное средство включает в себя Δ9-тетрагидроканнабинол (ТНС) и каннабидиол (CBD).
В соответствии с одним аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрена система для легочной доставки субъекту по меньшей мере одного фармацевтически активного средства и второго фармацевтически активного средства, по меньшей мере одно из которых содержится в растительном материале, причем система включает в себя:
устройство для ингаляции отмеренных доз, выполненное с возможностью независимой доставки средств субъекту посредством нагревания по меньшей мере одного растительного материала для испарения по меньшей мере первого предварительно определенного выпаренного количества первого средства и по меньшей мере второго предварительно определенного выпаренного количества второго средства; а также
контроллер, сообщающийся с устройством для ингаляции, выполненный с возможностью влиять на нагревание первого предварительно определенного выпаренного количества последовательно, параллельно и/или по меньшей мере с частичным перекрыванием со вторым предварительно определенным выпаренным количеством.
причем каждое из предварительно определенных выпаренных количеств каждого из средств выбирают таким образом, чтобы индуцировать у субъекта независимо по меньшей мере один PK эффект и/или по меньшей мере один PD эффект.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрена система, которая включает в себя:
устройство для ингаляции отмеренных доз для легочной доставки субъекту по меньшей мере одного предварительно определенного выпаренного количества по меньшей мере одного фармакологически активного средства, содержащегося в растительном материале, посредством контролируемого нагревания растительного материала с тем, чтобы испарить по меньшей мере одно предварительно определенное выпаренное количество средства; а также
контроллер, сообщающийся с устройством для ингаляции, выполненный с возможностью управлять предварительно определенным выпаренным количеством на основании данных, указывающих по меньшей мере на один фармакодинамический эффект, вызванный средством у субъекта.
В соответствии с некоторыми вариантами осуществления данные можно получить с помощью по меньшей мере одного датчика, выполненного с возможностью мониторинга фармакодинамического эффекта, и/или посредством устройства пользовательского интерфейса, выполненного с возможностью ввода данных, получаемых по меньшей мере от одного датчика, для мониторинга фармакодинамического эффекта.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью получения данных рабочих настроек, относящихся к предварительно определенному выпаренному количеству от устройства дистанционного управления.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью приема данных от датчика и/или устройства пользовательского интерфейса.
В соответствии с некоторыми вариантами осуществления контроллер находится в прямой и/или косвенной связи с датчиком и/или устройством интерфейса.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью управления предварительно определенным выпаренным количеством путем регулирования по меньшей мере одного из воздушного потока, температуры нагрева, скорости нагрева, профиля нагрева, длительности нагрева и любой их комбинации.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью управления предварительно определенным выпаренным количеством путем контроля регулирования времени доставки в легкие.
В соответствии с некоторыми вариантами осуществления управление осуществляется в режиме реального времени.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью корректировки предварительно определенного выпаренного количества таким образом, чтобы достичь предварительно определенного фармакокинетического эффекта и/или предварительно определенного фармакодинамического эффекта, основанного на фармакодинамическом эффекте.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью осуществления корректировки предварительно определенного выпаренного количества в режиме реального времени.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью осуществления предварительно определенной схемы введения, которая предусматривает доставку по меньшей мере двух предварительно определенных выпаренных количеств.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью корректировки схемы введения таким образом, чтобы достичь предварительно определенного фармакокинетического эффекта и/или предварительно определенного фармакодинамического эффекта, основанного на фармакодинамическом эффекте.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью корректировки схемы лечения в режиме реального времени.
В соответствии с некоторыми вариантами осуществления система включает в себя по меньшей мере один датчик, выполненный с возможностью мониторинга фармакодинамического эффекта.
В соответствии с некоторыми вариантами осуществления система включает в себя устройство пользовательского интерфейса.
В соответствии с некоторыми вариантами осуществления устройство пользовательского интерфейса включает в себя устройство вывода данных для предоставления информации по меньшей мере одному субъекту, практикующему врачу, блоку памяти и удаленному устройству.
В соответствии с некоторыми вариантами осуществления устройство пользовательского интерфейса включает в себя устройство-смартфон.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью мониторинга по меньшей мере одного из по меньшей мере одного предварительно определенного фармакокинетического эффекта и/или по меньшей мере одного предварительно определенного фармакодинамического эффекта на основании данных, полученных через устройство пользовательского интерфейса.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью осуществления корректировки предварительно определенного выпаренного количества в режиме реального времени.
В соответствии с некоторыми вариантами осуществления датчик включает в себя сенсорный экран, акселерометр, датчик близости, инфракрасный датчик, камеру, магнитометр, датчик местоположения пользователя и ориентации, гироскоп, компас, микрофон, термометр, датчик влажности, датчик частоты пульса, датчик артериального давления, датчик проводимости кожи/импеданса, датчик уровня оксигенации крови (SpO2), датчик объема ингаляции и датчик расхода воздуха.
В соответствии с некоторыми вариантами осуществления система включает в себя по меньшей мере одну единицу дозирования, причем единица дозирования содержит растительный материал.
В соответствии с некоторыми вариантами осуществления система включает в себя множество единиц дозирования, устройство для ингаляции выполняют с возможностью использования по меньшей мере одной из единиц дозирования.
В соответствии с некоторыми вариантами осуществления каждая из единиц дозирования включает в себя растительный материал, характеризующийся другой композицией по меньшей мере одного фармакологически активного средства.
В соответствии с некоторыми вариантами осуществления контроллер выполнен с возможностью управления предварительно определенным выпаренным количеством путем выбора по меньшей мере одной из единиц дозирования в соответствии с композицией по меньшей мере одного фармакологически активного средства.
В соответствии с некоторыми вариантами осуществления ингаляционное устройство, выполненное с контроллером для легочной доставки субъекту по меньшей мере первого фармакологически активного средства и второго фармакологически активного средства, по меньшей мере одно из которых находится по меньшей мере в одном растительном материале, устройство выполнено с возможностью выпаривать по меньшей мере первое предварительно определенное выпаренное количество первого средства и по меньшей мере второе предварительно определенное выпаренное количество второго средства, причем нагревание осуществляют таким образом, что первое предварительно определенное выпаренное количество доставляется субъекту последовательно, одновременно и/или по меньшей мере с частичным перекрыванием со вторым предварительно определенным выпаренным количеством.
В соответствии с некоторыми вариантами осуществления растение включает в себя Cannabis sativa, Cannabis indica, Cannabis ruderalis, Acacia spp, Amanita muscaria, Yage, Atropa belladonna, Areca catechu, Brugmansia spp., Brunfelsia latifolia, Desmanthus illinoensis, Banisteriopsis caapi, Trichocereus spp., Theobroma cacao, Capsicum spp., Cestrum spp., Erythroxylum coca, Solenostemon scutellarioides, Arundo donax, Coffea arabica, Datura spp., Desfontainia spp., Diplopterys cabrerana, Ephedra sinica, Claviceps purpurea, Paullinia cupana, Argyreia nervosa, Hyoscyamus niger, Tabernanthe iboga, Lagochilus inebriens, Justicia pectoralis, Sceletium tortuosum, Piper methysticum, Catha edulis, Mitragyna speciosa, Leonotis leonurus, Nymphaea spp., Nelumbo spp., Sophora secundiflora, Mucuna pruriens, Mandragora officinarum, Mimosa tenuiflora, Ipomoea violacea, Psilocybe spp., Panaeolus spp., Myristica fragrans, Turbina corymbosa, Passiflora incarnata, Lophophora williamsii, Phalaris spp., Duboisia hopwoodii, Papaver somniferum, Psychotria viridis, spp., Salvia divinorum, Combretum quadrangulare, Trichocereus pachanoi, Heimia salicifolia, Stipa robusta, Solandra spp., Hypericum perforatum, Peganum harmala, Tabernaemontanaspp, Camellia sinensis, Nicotiana tabacum, Nicotiana rusticum, Virola theidora, Voacanga africana, Lactuca virosa, Artemisia absinthium, Ilex paraguariensis, Anadenanthera spp., Corynanthe yohimbe, Calea zacatechichi, Coffea spp.(Rubiaceae), a Sapindaceae, Camellia spp., Malvaceae spp., Aquifoliaceae spp., Hoodia, spp.Chamomilla recutita, Passiflora incarnate, Camellia sinensis, Mentha piperita, Mentha spicata, Rubus idaeus, Eucalyptus globulus, Lavandula officinalis, Thymus vulgaris, Melissa officinalis, алоэ лекарственное, дудник, анис, аяуаску (Banisteriopsis caapi), барбарис, белокудренник черный, голубой лотос, лопух, ромашку, тмин, кошачий коготь, гвоздику, окопник, кукурузные рыльца, пырей ползучий, дамиан, одуванчик, эфедру, эвкалипт, энотеру, фенхель, пиретрум, снежное дерево, чеснок, имбирь, гинкго, женьшень, золотарник, гидрастис, готу кола, зеленый чай, гуарану, боярышник, хмель, хвощ, иссоп, Кольский орех, кратом, лаванду, мелиссу, солодку, хвост льва (Wild Dagga), корень мака, алтей, таволгу, молочный чертополох, пустырник, страстоцвет, пассифлору, перечную мяту, колючий мак, портулак, лист малины, красный мак, шалфей, пальму сереноа, Sida Cordifolia, синикуичи (Mayan Sun Opener), мяту, аир, могильник (Peganum harmala), чабрец, куркуму, валериану, дикий ямс, полынь, тысячелистник, падуб парагвайский, йохимбе, а также любую часть и любую их комбинацию.
В соответствии с некоторыми вариантами осуществления растение включает в себя Cannabis sativa, Cannabis indica и Cannabis ruderalis.
В соответствии с некоторыми вариантами осуществления фармакологически активное средство включает в себя Δ9-тетрагидроканнабинол (ТНС), каннабидиол (CBD), каннабигеролы (CBG), каннабихромены (СВС), каннабинол (CBN), каннабинодиол (CBDL), каннабициклол (CBL), каннабиэлсоин (СВЕ), каннабидиварин (CBDV), тетрагидроканнабиварин (THCV) и каннабитриол (СВТ).
В соответствии с некоторыми вариантами осуществления фармакологически активное средство включает в себя Δ9-тетрагидроканнабинол (ТНС) и каннабидиол (CBD).
В соответствии с одним аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрен способ легочной доставки субъекту по меньшей мере одного фармацевтически активного средства, содержащегося в растительном материале, причем способ предусматривает:
легочную доставку средства субъекту из устройства для ингаляции отмеренных доз, выполненного с возможностью испарять по меньшей мере одно предварительно определенное выпаренное количество средства при контролируемом нагревании растительного материала;
мониторинг по меньшей мере одного фармакокинетического эффекта и/или по меньшей мере одного фармакодинамического эффекта, индуцированного средством у субъекта;
корректировку по меньшей мере одного предварительно определенного выпаренного количества таким образом, чтобы достичь по меньшей мере одного предварительно определенного фармакокинетического эффекта и/или по меньшей мере одного предварительно определенного фармакодинамического эффекта, на основании данных, полученных с помощью мониторинга.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен способ записи по меньшей мере одного фармакокинетического эффекта и/или по меньшей мере одного фармакодинамического эффекта, индуцированного легочной доставкой субъекту по меньшей мере одного фармакологически активного средства, содержащегося в растительном материале; причем способ предусматривает:
легочную доставку предварительно определенного парообразного количество средства субъекту из устройства для ингаляции отмеренных доз, выполненного с возможностью выпаривать предварительно определенное выпаренное количество средства при контролируемом нагревании растительного материала;
необязательно, определение по меньшей мере одного фармакокинетического эффекта у субъекта в предварительно определенные промежутки времени до, во время и/или после легочной доставки;
определение по меньшей мере одного фармакодинамического эффекта у субъекта в предварительно определенные промежутки времени до, во время и/или после легочной доставки;
причем фармакодинамический эффект включает в себя желаемый эффект, нежелательный эффект, терапевтический эффект, неблагоприятный эффект и содержание биомаркера.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен способ легочной доставки по меньшей мере одного фармакологически активного средства пациенту (также взаимозаменяемо называемому в настоящем документе как субъект-пользователь), причем указанный способ предусматривает легочную доставку средства пациенту из устройства для ингаляции отмеренных доз, выполненного с возможностью высвобождения по меньшей мере одного предварительно определенного выпаренного количества средства при контролируемом нагревании твердой формы вещества, содержащего средство, причем по меньшей мере одно предварительно определенное выпаренное количество средства выбирают таким образом, чтобы проявлять по меньшей мере один предварительно определенный фармакокинетический профиль и/или по меньшей мере один предварительно определенный фармакодинамический профиль средства у пациента.
В соответствии с некоторыми вариантами осуществления способ дополнительно предусматривает:
определение по меньшей мере одного фармакокинетического параметра и/или по меньшей мере одной фармакокинетической переменной, и/или по меньшей мере одного фармакодинамического параметра, индуцированного у пациента легочной доставкой средства из устройства;
на основании фармакокинетического параметра и/или фармакокинетической переменной, и/или фармакодинамического параметра, определение предварительно определенного выпаренного количества, которое обладает предварительно выбранным фармакокинетическим профилем и/или предварительно выбранным фармакодинамическим профилем средства у пациента, а также
создание устройства с возможностью доставки по меньшей мере одного предварительно определенного выпаренного количества средства.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления каждый из фармакокинетического параметра и/или фармакокинетической переменной, и/или фармакодинамического параметра определяется для отдельного пациента, таким образом, что предварительно определенное выпаренное количество определяется персонально для пациента.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления легочная доставка предусматривает:
определение по меньшей мере одного персонального фармакодинамического и/или по меньшей мере одного персонального фармакокинетического параметра у конкретного пациента, с тем чтобы определить, проявляет ли легочная доставка по меньшей мере одного предварительно определенного выпаренного количества средства предварительно выбранный фармакодинамический и/или предварительно выбранный фармакокинетический профиль у указанного отдельного пациента;
если легочная доставка по меньшей мере одного предварительно определенного выпаренного количества средства не проявляет предварительно выбранный фармакодинамический и/или фармакокинетический профиль у указанного отдельного пациента, определение скорректированного выпаренного количества средства, которое проявляет предварительно выбранный фармакодинамический и/или фармакокинетический профиль у указанного отдельного пациента; а также
повторную настройку устройства для доставки скорректированного выпаренного количества,
вследствие чего при повторной настройке скорректированное выпаренное количество представляет собой предварительно определенное выпаренное количество.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления персональный фармакодинамический параметр выбирают из группы, состоящей из субъективно воспринимаемого терапевтического эффекта, субъективно воспринимаемого неблагоприятного эффекта и (наличия или содержания) биомаркера.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления биомаркер выбирают из группы, состоящей из инвазивно распознаваемого биомаркера и неинвазивно распознаваемого биомаркера.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления неинвазивно распознаваемый биомаркер выбирают из группы, состоящей из следующего: частота сердечных сокращений, уровень оксигенации (SpO2), артериальное давление, частота дыхания, температура тела, объем ингаляции, выражение лица, мышечные подергивания, судороги, спазмы, потливость, координация рук и глаз, сосудистое расширение глаз, покраснение конъюнктивы и/или склеры, изменение внутриглазного давления, двигательные навыки, атаксия, синусовая тахикардия, тремор, нарушения сердечного ритма, уровень проводимости кожи/импеданс, пароксизм, электромиография (ЭМГ), электрокардиограмма (ЭКГ), фото-плетизмограмма (PPG), кожно-гальваническая реакция (GSR), низкая восприимчивость к синему и коричневому цвету, зрительная маскировка, латентное нарушение слуха, латентное нарушение зрения, словесно-цветовой тест Струпа, простая реакция (задача конфликта), когнитивное переключение установок, логическое мышление, время принятия решений, скорость обработки информации, перцепционный лабиринт, имитируемое вождение, визуальный поиск, оценка времени, восприятие времени, визуальный поиск, тест на продуктивность внимания, копирование символов, зачеркивание букв, тест на вычеркивание D2, тест Брикенкампа D2, числовой копировальный тест (DDCT), символьно-числовая замена (SDST), тест замены цифровых символов (DSST), тест на внимание, внимание, тест слухового внимания, задача на внимание Wesnes/Warburton, быстрая обработка информации, CRT+отслеживание распределенного внимания, селективное внимание, задача сосредоточенности внимания, задача эмоционального внимания, слияние слуховой пульсации, слияние мельканий, критическое слияние мельканий (CFF), постоянное внимание, изучение парных ассоциаций, изучение списка слов, тест 15 слов, вводная выработка условного рефлекса, тест на отсроченное припоминание, тест на отсроченное распознавание слов, тест на отсроченное распознавание картинок, словесное представление, распознавание слов, числовая кратковременная память, числовая память, сканирование памяти, слуховой тест Брауна/Петерсона, зрительный тест Брауна/Петерсона, зрительно-пространственная память, тест фрагментированньгх картинок, тест Pauli, тест на последовательность блоков, тест на числовую последовательность, тест на числовую последовательность (прямую), тест на числовую последовательность (обратную), словарь WAIS, сходство WAIS, беглость речи, тест беглости речевых ответов, время выполнения операции (тест на отсроченное распознавание слов), время выполнения операции (числовая кратковременная память), время выполнения операции (тест на внимание), время выполнения операции (быстрая обработка информации), время выполнения операции (тест на отсроченное распознавание картинок), время выполнения операции (обработка зрительной информации), время простой реакции CRT, комплекс RTvisual, визуальный выбор RT, VRT, скорость визуальной реакции, ART, слуховая RT, невербальный тест "Лабиринт" на интеллектуальные способности, тест на изображение архимедовой спирали, задание на критическое слежение, тест с построением маршрута, комплекс отслеживания, оценка зрительно-моторной координации с помощью венского прибора, тест на гибкость концентрации внимания, конструирование блоков WAIS, сравнение картинок WAIS, копирование чисел, манипулирование, мелкая моторика, графологический анализ, постукивание, исследование координации горизонтальных движений рук и кистей рук, визуальный тест на дотягивание, двигательный контроль и координация, двигательное поведение.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления субъективно воспринимаемый терапевтический эффект соответствует симптому, который выбирают из группы, состоящей из следующего: боль, мигрень, депрессия, дефицит когнитивных функций, дефицит внимания, гиперактивность, тревожные расстройства, диарея, тошнота, рвота, бессонница, бред, изменения аппетита, сексуальная дисфункция, спастичность, увеличенное внутриглазное давление, дисфункция мочевого пузыря, тики, симптомы Туретта, симптомы посттравматического стрессового расстройства (PTSD), симптомы воспалительного заболевания кишечника (IBD), симптомы синдрома раздраженного кишечника (IBS), гипертония, геморрагические симптомы, септический и кардиогенный шок, наркозависимость и зависимость, симптомы синдрома отмены, тремор и другие двигательные нарушения.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления субъективно воспринимаемый неблагоприятный эффект представляет собой психотропный неблагоприятный эффект и/или соматический неблагоприятный эффект.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления психотропный неблагоприятный эффект соответствует симптому, выбранному из группы, состоящей из следующего: паранойя, беспокойство, приступ паники, эйфория, псевдо-галлюцинация, атаксия, седативный эффект, изменение сознательного восприятия, веселость, метапознание и самоанализ, повышенная способность к воспоминанию (эпизодическая память), амнезия, изменение чувственности, изменение в сознании ощущения и изменение либидо, головокружение, атаксия, эйфория, перцептивные изменения, временное искажение, усиление чувственного восприятия, кратковременной памяти и внимания, нарушение реакции, координации произвольных движений, беглости речи, зависимость и депрессия.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления соматический эффект соответствует симптому, который выбирают из группы, состоящей из следующего: тошнота, мышечные судороги, спазмы мышечной релаксации, судороги, потливость, атаксия, изменение двигательной активности, сухость во рту и ощущение холодных или горячих рук и ног, увеличение частоты сердечных сокращений, увеличение мозгового кровотока, дилатация бронхиальных путей, расширение кровеносных сосудов, покраснение глаз и расширение зрачков, сухость во рту, жажда, голод или тяга к определенному виду пищи.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления легочная доставка дополнительно предусматривает:
настройку устройства для доставки откорректированного выпаренного количества средства, причем откорректированное выпаренное количество выбирают таким образом, чтобы проявлять вновь выбранный фармакодинамический профиль средства у пациента,
вследствие чего при настройке откорректированное выпаренное количество представляет собой предварительно определенное выпаренное количество, а повторно выбранный фармакодинамический профиль представляет собой предварительно выбранный фармакодинамических профиль.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления устройство выполнено с возможностью доставки предварительно определенного выпаренного количества таким образом, что отклонение фактического выпаренного количества средства от предварительно определенного выпаренного количества средства составляет менее 20% предварительно определенного выпаренного количества.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления отклонение фактического фармакокинетического профиля от предварительно выбранного фармакокинетического профиля составляет менее чем 40% предварительно выбранного фармакокинетического профиля.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления отклонение воспринимаемого фармакокинетического профиля от предварительно определенного фармакокинетического профиля по меньшей мере в один момент времени составляет менее чем 25% предварительно определенного выпаренного количества.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления предварительно выбранный фармакодинамических профиль выбран из группы, состоящей из:
фармакодинамического профиля в пределах уровня ниже минимального уровня терапевтического эффекта,
фармакодинамического профиля, варьирующего в пределах от минимального уровня терапевтического эффекта до максимального уровня терапевтического эффекта, в котором неблагоприятный эффект не проявляется или не воспринимается, и
фармакодинамического профиля в пределах уровня выше минимального уровня неблагоприятного эффекта.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления фармакодинамический профиль варьирует в пределах от минимального уровня терапевтического эффекта до максимального уровня терапевтического эффекта, в котором неблагоприятное воздействие не проявляется или не воспринимается (в пределах терапевтического окна).
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления отклонение воспринимаемого фармакодинамического профиля от предварительно выбранного фармакодинамического профиля по меньшей мере в один момент времени менее чем на 25% ниже предварительно выбранного фармакодинамического профиля.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления фармакокинетическая переменная выбрана из группы, состоящей из массы тела, роста, пола, возраста, индекса массы тела и мышечной массы.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления фармакокинетический параметр выбран из группы, состоящей из максимальной концентрации в плазме (Cmax), времени для достижения максимальной концентрации в плазме (Tmax) и суммарного воздействия с течением времени (AUCo-*»).
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления фармакокинетический параметр и/или фармакодинамический параметр определяют во время мониторинга по меньшей мере одного дополнительного параметра, выбранного из группы, состоящей из:
основного показателя жизнедеятельности, выбранного из группы, состоящей из частоты сердечных сокращений, уровня насыщения кислородом (SpO2), артериального давления, частоты дыхания и температуры тела;
легочной функции, выбранной из группы, состоящей из объема форсированного выдоха (FEV1), максимального полувыдыхаемого потока (MMEF), диффузионной способности легких по монооксиду углерода (DLCO), форсированной жизненной емкости легких (FVC), общей емкости легких (TLC) и остаточного воздуха (RV);
гематологического маркера, выбранного из группы, состоящей из уровня гемоглобина, отношения гематокрита, количества эритроцитов, количества лейкоцитов, лейкоцитарной формулы и количества тромбоцитов;
параметра коагуляции, выбранного из группы, состоящей из протромбинового времени (РТ), протромбинового индекса (PR) и международного коэффициента нормализации (MHO);
маркера почечной функции, выбранного из группы, состоящей из клиренса креатинина (CCR), уровня азота мочевины крови (АМК) и скорости клубочковой фильтрации (СКФ); а также
маркера функции печени, выбранного из группы, состоящей из содержания аспартатаминотрансферазы (ACT), содержания сыворочной глутаматоксалоацетаттрансаминазы (SGOT), содержания щелочной фосфатазы и содержания гамма-глутамилтрансферазы (GGT).
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления описанный в настоящем документе способ представляет собой способ легочной доставки по меньшей мере двух фармакологически активных средств пациенту, причем устройство выполнено с возможностью независимой доставки предварительно определенного выпаренного количества каждого по меньшей мере из двух фармакологически активных средств.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления способ представляет собой способ доставки по меньшей мере двух фармакологически активных средств в предварительно определенный промежуток времени.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления способ представляет собой способ доставки каждого из по меньшей мере двух фармакологически активных средств независимо в предварительно определенном парообразном количестве, причем вещество содержит по меньшей мере два фармакологически активных средства.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления способ представляет собой способ доставки множества предварительно определенных выпаренных количеств фармакологически активного средства, причем множество предварительно определенных выпаренных количеств являются одинаковыми или отличными друг от друга.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления множество предварительно определенных выпаренных количеств доставляют из устройства с предварительно определенными интервалами времени, причем интервалы времени являются одинаковыми или разными.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления устройство поддерживает связь с системой интерфейса пациента.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрено устройство для ингаляции отмеренных доз, выполненное с возможностью легочной доставки предварительно определенного выпаренного количества по меньшей мере одного фармакологически активного средства пациенту при контролируемом нагревании твердой формы вещества, содержащего средство, причем:
предварительно определенное выпаренное количество необходимо для проявления предварительно выбранного фармакокинетического профиля и/или предварительно выбранного фармакодинамического профиля средства у пациента, а также
предварительно определенное выпаренное количество средства определяется путем определения по меньшей мере одного фармакокинетического параметра и/или по меньшей мере одной фармакокинетической переменной, и/или по меньшей мере одного фармакодинамического параметра, индуцированного посредством легочный доставки средства в организме пациента из устройства.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления устройство выполнено с возможностью использования в связи с системой интерфейса пациента.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления устройство способно к высвобождению предварительно определенного выпаренного количества таким образом, что отклонение фактического выпаренного количества средства от предварительно определенного выпаренного количества средства составляет менее 20% предварительно определенного выпаренного количества.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления устройство способно к высвобождению предварительно определенного выпаренного количества таким образом, что отклонение фактического фармакокинетического профиля от предварительно выбранного фармакокинетического профиля составляет менее чем 40% предварительно выбранного фармакокинетического профиля.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления устройство способно к высвобождению предварительно определенного выпаренного количества таким образом, что отклонение воспринимаемого фармакокинетического профиля от предварительно выбранного фармакокинетического профиля по меньшей мере в один момент времени составляет менее чем 25% предварительно выбранного фармакокинетического профиля.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления легочная доставка, средство, предварительно определенное выпаренное количество, предварительно выбранный фармакокинетический профиль и/или предварительно выбранный фармакодинамический профиль средства в организме пациента, по меньшей мере один фармакокинетический параметр и/или по меньшей мере одна фармакокинетическая переменная, и/или по меньшей мере один фармакодинамический параметр, повторно выбранный фармакодинамический профиль, скорректированное выпаренное количество и определение любого из вышеизложенного являются такими, как описано в любом из соответствующих вариантов осуществления.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен электронный блок интерфейса пациента, используемый с устройством для ингаляции отмеренных доз, при этом устройство выполнено с возможностью легочной доставки множества предварительно определенных выпаренных количеств по меньшей мере одного фармакологически активного средства пациенту, причем электронный блок интерфейса пациента содержит:
контроллер;
вход;
модуль связи;
где:
множество предварительно определенных выпаренных количеств поступает из устройства в предварительно определенные временные интервалы, причем количества и/или временные интервалы являются одинаковыми или разными;
множество предварительно определенных выпаренных количеств и предварительно определенные временные интервалы предусматривают дозу, дозирование и/или схему лечения, а вход выполнен с возможностью приема дозы и/или схемы лечения;
вход, выполненный с возможностью взаимодействия с пациентом в режиме реального времени во время легочной доставки средства таким образом, чтобы получить обратную связь от пациента;
контроллер выполнен с возможностью итерационно модифицировать, в соответствии с обратной связью, дозу и/или схему лечения, чтобы таким образом получать скорректированную дозу и/или схему лечения, которая предусматривает скорректированное предварительно определенное выпаренное количество и скорректированные временные интервалы; а также
модуль связи выполнен с возможностью сообщать скорректированную дозу, скорректированное дозирование и/или скорректированную схему лечения устройству MDI.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления дозу и/или схему лечения выбирают таким образом, чтобы проявлять по меньшей мере один предварительно выбранный фармакокинетический профиль и/или по меньшей мере один предварительно выбранный фармакодинамический профиль средства в организме пациента.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления электронный блок интерфейса пациента настраивают на персональном портативном устройстве, карманном устройстве, носимом устройстве, наручном устройстве или встроенном в защитные очки устройстве.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления персональное портативное устройство выбрано из группы, состоящей из смартфона, карманного устройства, носимого устройства, наручного устройства или встроенного в защитные очки устройства.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления электронный блок интерфейса пациента содержит запоминающее устройство в связи с контроллером, выполненное с возможностью хранения дозы и/или схемы лечения и данных пациента об использовании.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления контроллер выполнен с возможностью модификации дозы и/или схемы приема в ответ на данные об использовании.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления схема интерфейса пациента выполнена с возможностью обеспечения набора инструментов для получения по меньшей мере одного персонального фармакодинамического и/или по меньшей мере одного персонального фармакокинетического параметра у пациента.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления персональный фармакодинамический параметр выбран из группы, состоящей из субъективно воспринимаемого терапевтического эффекта, субъективно воспринимаемого неблагоприятного эффекта и биомаркера.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления набор инструментов содержит по меньшей мере одно интерактивное приложение для оказания помощи пациенту в озвучивании уровня по меньшей мере одного из субъективно воспринимаемого терапевтического эффекта и/или уровня субъективно воспринимаемого неблагоприятного эффекта и/или содержания биомаркера.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления интерактивное приложение представляет собой игру, установленную на смартфоне, на котором настроен интерфейс пациента.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрена система, содержащая:
устройство для ингаляции отмеренных доз для легочной доставки по меньшей мере одного предварительно определенного выпаренного количества по меньшей мере одного фармакологически активного средства пациенту, а также
электронный блок интерфейса пациента, сообщающийся с устройством;
причем по меньшей мере одно из электронного блока интерфейса пациента и устройства выполнено с возможностью модифицировать рабочую настройку в соответствии по меньшей мере с одними из прямых и опосредованных входных данных, полученных в режиме реального времени от пациента с использованием устройства, причем рабочая настройка содержит дозу и/или схему лечения для легочной доставки средства пациенту.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления система выполнена с возможностью корректировки рабочей настройки с сохранением дозы и/или схемы лечения в пределах персонифицированного безопасного диапазона, определенного у пациента, при которой предотвращается нанесение вреда пациенту.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления рабочая настройка дополнительно содержит один или несколько протоколов для синхронизации передачи дозы и/или схемы лечения, и/или данных об использовании компонентов системы.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления рабочая настройка определяет график синхронизации для электронного блока интерфейса пациента для напоминания пациенту об использовании устройства.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления система содержит по меньшей мере один датчик для измерения по меньшей мере одного персонального фармакодинамического параметра у пациента.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления интерфейс пациента настроен на персональном устройстве, а датчик представляет собой стандартный компонент смартфона.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления датчик выбран из группы, состоящей из сенсорного экрана, камеры, акселерометра и микрофона.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления датчик представляет собой датчик потока, находящийся в устройстве, причем датчик выполнен с возможностью обнаружения объема ингаляции пациента для оценки по меньшей мере одного персонального фармакодинамического параметра у пациента, основываясь на корреляции объема ингаляции и персонального фармакодинамического параметра.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления персональный фармакодинамический параметр, коррелирующий с объемом ингаляции, представляет собой болевой порог.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления прямые вводные данные содержат умышленную индикацию, обеспечиваемую пациентом с использованием электронного блока интерфейса пациента.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления опосредованные входные данные включают в себя субъективно воспринимаемой терапевтический эффект и/или субъективно воспринимаемый неблагоприятный эффект, получаемый электронным блоком интерфейса пациента от пациента.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления система дополнительно содержит интерфейс врача, связанный с электронным блоком интерфейса пациента и устройством, причем интерфейс врача выполнен с возможностью выбора врачом рабочей настройки.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления система дополнительно содержит сервер базы данных, связанный по меньшей мере с одним из устройства, интерфейса врача и электронного блока интерфейса пациента.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления интерфейс врач выполнен с возможностью связи с сервером базы данных для создания дозы и/или схемы лечения для пациента, и причем рабочая настройка включает в себя дозу и/или схему лечения.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления рабочую настройку модифицируют в соответствии с данными пациента об использовании.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления устройство содержит дозатор вещества, выполненный с возможностью предоставлять средство, и контроллер для приведения в действие дозатора для легочной доставки парообразного средства пациенту.
В соответствии с аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрен способ работы устройства для ингаляции отмеренных доз, выполненный с возможностью легочной доставки по меньшей мере одного фармацевтически активного средства пациенту, причем способ предусматривает:
выбор дозы и/или схемы лечения для легочной доставки средства пациенту с использованием устройства;
получение, в режиме реального времени во время легочной доставки средства, указания на связь по меньшей мере с одним персональным фармакодинамическим эффектом и/или по меньшей мере одним персональным фармакокинетическим эффектом у пациента; автоматически корректируя дозу и/или схему лечения в соответствии с указанием. В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления персональный фармакодинамический параметр выбран из группы, состоящей из субъективно воспринимаемого терапевтического эффекта, субъективно воспринимаемого неблагоприятного эффекта и (присутствия и/или содержания) биомаркера.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления субъективно воспринимаемый терапевтический эффект представляет собой снижение уровня симптома, а субъективно воспринимаемый неблагоприятный эффект представляет собой психотропное действие и/или соматический неблагоприятный эффект.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления дозу и/или схему лечения предварительно выбирают для проявления первоначального накопления средства у пациента и/или для поддержания предварительно выбранного фармакокинетического профиля и/или предварительно выбранного фармакодинамического профиля средства в организме пациента в течение периода времени, который по меньшей мере такой же по длительности, как легочная доставка средства.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления (для способа, устройства, электронного блока или системы), устройство выполнено с возможностью доставки по меньшей мере одного предварительно определенного выпаренного количества средства при контролируемом нагревании твердой формы вещества, содержащего средство.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления (для способа, устройства, электронного блока или системы) вещество представляет собой растительный материал.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления (для способа, устройства, электронного блока или системы) растение выбирают из группы, состоящей из следующего: Cannabis sativa, Cannabis indica, Cannabis ruderalis, Acacia spp, Amanita muscaria, Yage, Atropa belladonna, Areca catechu, Brugmansia spp., Brunfelsia latifolia, Desmanthus illinoensis, Banisteriopsis caapi, Trichocereus spp., Theobroma cacao, Capsicum spp., Cestrum spp., Erythroxylum coca, Solenostemon scutellarioides, Arundo donax, Coffea arabica, Datura spp., Desfontainia spp., Diplopterys cabrerana, Ephedra sinica, Claviceps purpurea, Paullinia cupana, Argyreia nervosa, Hyoscyamus niger, Tabernanthe iboga, Lagochilus inebriens, Justicia pectoralis, Sceletium tortuosum, Piper methysticum, Catha edulis, Mitragyna speciosa, Leonotis leonurus, Nymphaea spp., Nelumbo spp., Sophora secundiflora, Mucuna pruriens, Mandragora officinarum, Mimosa tenuiflora, Ipomoea violacea, Psilocybe spp., Panaeolus spp., Myristica fragrans, Turbina corymbosa, Passiflora incarnata, Lophophora williamsii, Phalaris spp., Duboisia hopwoodii, Papaver somniferum, Psychotria viridis, spp., Salvia divinorum, Combretum quadrangulare, Trichocereus pachanoi, Heimia salicifolia, Stipa robusta, Solandra spp., Hypericum perforatum, Peganum harmala, Tabernaemontanaspp, Camellia sinensis, Nicotiana tabacum, Nicotiana rusticum, Virola theidora, Voacanga africana, Lactuca virosa, Artemisia absinthium, Ilex paraguariensis, Anadenanthera spp., Corynanthe yohimbe, Calea zacatechichi, Coffea spp.(Rubiaceae), a Sapindaceae, Camellia spp., Malvaceae spp., Aquifoliaceae spp., Hoodia, spp.Chamomilla recutita, Passiflora incarnate, Camellia sinensis, Mentha piperita, Mentha spicata, Rubus idaeus, Eucalyptus globulus, Lavandula officinalis, Thymus vulgaris, Melissa officinalis, алоэ лекарственный, дудник, анис, аяуаска (Banisteriopsis caapi), барбарис, белокудренник черный, голубой лотос, лопух, ромашка, тмин, кошачий коготь, гвоздика, окопник, кукурузные рыльца, пырей ползучий, дамиан, одуванчик, эфедра, эвкалипт, энотера, фенхель, пиретрум, снежное дерево, чеснок, имбирь, гинкго, женьшень, золотарник, гидрастис, готу кола, зеленый чай, гуарана, боярышник, хмель, хвощ, иссоп, Кольский орех, кратом, лаванда, мелисса, солодка, хвост льва (Wild Dagga), корень мака, алтей, таволга, молочный чертополох, пустырник, страстоцвет, пассифлора, перечная мята, колючий мак, портулак, лист малины, красный мак, шалфей, пальма сереноа, Sida Cordifolia, синикуичи (Mayan Sun Opener), мята, аир, могильник (Peganum harmala), чабрец, куркума, валериана, дикий ямс, полынь, тысячелистник, падуб парагвайский, йохимбе, а также любая часть и любая их комбинация.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления (для способа, устройства, электронного блока или системы) растение выбирают из группы, состоящей из следующего: Cannabis sativa, Cannabis indica и Cannabis ruderalis.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления (для способа, устройства, электронного блока или системы) фармакологически активное средство выбирают из группы, состоящей из следующего: Δ9-тетрагидроканнабинол (ТНС), каннабидиол (CBD), каннабигеролы (CBG), каннабихромены (СВС), каннабинол (CBN), каннабинодиол (CBDL), каннабициклол (CBL), каннабиэлсоин (СВЕ), каннабидиварин (CBDV), тетрагидроканнабиварин (THCV) и каннабитриол (СВТ).
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления (для способа, устройства, электронного блока или системы) фармакологически активное средство выбирают из группы, состоящей из следующего: Δ9-тетрагидроканнабинол (ТНС) и каннабидиол (CBD).
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления любое из описанного в настоящем документе способа, устройства, электронного блока или системы применяют в лечении заболевания нуждающегося в этом субъекта.
В соответствии с некоторыми из любых описанных в настоящем документе вариантов осуществления (для способа, устройства, электронного блока или системы) заболевание или связанный с ним симптом уменьшается посредством легочной доставки по меньшей мере одного фармацевтически активного средства.
Если не указано иное, все используемые в настоящем документе технические и/или научные термины характеризуются таким же значением, которое обычно понимается обычным специалистом в настоящей области техники, к которой относится настоящее изобретение. Хотя способы и материалы, подобные или эквивалентные описанным в настоящем документе, могут быть использованы в практике или тестировании примеров осуществления настоящего изобретения, некоторые способы и/или материалы описаны ниже. В случае возникновения конфликта, содержание патента, включая определения, будет контролироваться. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для обязательного ограничения.
Краткое описание чертежей
Файл патента или заявки содержит по меньшей мере одно графическое изображение, выполненное в цвете.
Некоторые варианты осуществления настоящего изобретения описаны в настоящем документе только в качестве примера со ссылкой на прилагаемые графические материалы. На конкретном примере подробных графических материалов следует подчеркнуть, что данные показаны в качестве примера и с целью иллюстративного обсуждения вариантов осуществления настоящего изобретения. В связи с этим, описание вместе с графическими материалами делает очевидным для специалистов в настоящей области техники то, как варианты осуществления настоящего изобретения могут быть осуществлены.
Графические материалы представляют собой:
Фиг. 1 (предшествующий уровень техники) представляет собой фотографию устройства для ингаляции отмеренных доз (Syqe Inhaler Ехо™), в соответствии с некоторыми вариантами осуществления настоящего раскрытия.
На фиг. 2 приведены сравнительные графики, показывающие содержание Δ9-ТНС в плазме после однократной дозы ингаляции 15,1±0,1 мг гранулированных высушенных цветов каннабиса, содержащей 3,08±0,02 мг Δ9-ТНС, с использованием устройства для ингаляции отмеренных доз в соответствии с некоторыми вариантами осуществления настоящего раскрытия.
Фиг. 3 представляет собой график, на котором показана визуально-аналоговая шкала (VAS) интенсивности боли после однократной дозы ингаляции 15,1±0,1 мг гранулированных высушенных цветов каннабиса, содержащей 3,08±0,02 мг А9-ТНС.
Фиг. 4 представляет собой график, на котором показаны артериальное давление и частота сердечных сокращений после однократной дозы ингаляции 15,1±0,1 мг гранулированных высушенных цветов каннабиса, содержащей 3,08±0,02 мг Δ9-ТНС.
Фиг. 5 представляет собой график, на котором показана оценка удовлетворенности для ингаляции гранулированных высушенных цветов каннабиса в сравнении с курением цветов каннабиса.
Фиг. 6 представляет собой гистограмму, на которой представлено среднее значение и 95% доверительные пределы содержания в плазме Сщах на мг Δ9-ТНС, вводимого внутривенно, посредством пара и курения (предшествующий уровень техники, смотрите пример 2 ниже), по сравнению с Cmax в плазме Δ9-ТНС, полученного путем ингаляции с использованием устройства в соответствии с некоторыми вариантами осуществления настоящего раскрытия. Цифры в скобках представляют собой родственные ссылки, как указано в примере 2 ниже.
Фиг. 7 представляет собой гистограмму, на которой показана межиндивидуальная изменчивость (коэффициент вариации, CV (%)) Cmax Δ9-ТНС в плазме, полученного при испарении, курении, пероральных способах доставки и при введении через слизистую ротовой полости (предшествующий уровень техники, смотрите пример 2 ниже) в сравнении с Cmax Δ9-ТНС в плазме, полученного путем ингаляции с помощью устройства в соответствии с некоторыми вариантами осуществления настоящего раскрытия. Цифры в скобках представляют собой родственные ссылки, как указано в примере 2 ниже.
Фиг. 8 представляет собой типичный пример легочной доставки трех предварительно определенных выпаренных количеств (рассчитанное дозирование) в течение 3 часов, как определено для пациента X.
Фиг. 9 представляет собой принципиальную схему системы, содержащей устройство для ингаляции, интерфейс врача и/или интерфейс пациента, в соответствии с некоторыми вариантами осуществления настоящего изобретения;
На фиг. 10 показана блок-схема способа назначения персонифицированной схемы лечения пациенту в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Фиг. 11А, 11В, 11С и 11D представляют собой схематическую диаграмму (фиг. 11А) и изображения с экранов (фиг. 11В, 11С и 11D) интерфейса врача для выбора и назначения схемы лечения пациенту в соответствии с некоторыми вариантами осуществления настоящего раскрытия.
На фиг. 12 показана блок-схема способа получения персонального фармакодинамического параметра (PD) от пациента и модификации схемы лечения, соответственно, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Фиг. 13А, 13В, 13С, 13D и 13Е представляют собой изображения с экранов интерфейса пациента (фиг. 13А, 13С, 13Е), а также графические представления ожидаемого фармакодинамического и фармакокинетического профилей пациента до и после получения персонального PD эффекта (фиг. 13В и 13D, соответственно), в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Фиг. 14 представляет собой блок-схему способа получения одного или нескольких биомаркеров с использованием персонального портативного устройства и/или с использованием ингаляционного устройства, и при необходимости модификации дозы и/или схемы лечения соответствующим образом, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Фиг. 15А, 15 В и 15С представляют собой изображения с экранов интерфейса пациента, содержащего различные приложения для получения биомаркеров и/или для оказания помощи пациенту в определении воспринимаемого терапевтического и/или неблагоприятного эффекта, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Фиг. 16 представляет собой схематическую диаграмму устройства для ингаляции отмеренных доз, выполненного с возможностью обеспечить автоматизированную контролируемую легочную доставку одного или нескольких активных средств, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Фиг. 17A-D представляют собой схематические диаграммы конфигурации ингаляционного устройства (фиг. 17А) и картриджа, также называемого взаимозаменяемо в настоящем документе как «единица дозирования» или «картридж дозирования», ингаляционного устройства, необязательно содержащего дискретные дозы (фиг. 17В), а также другие дополнительные функции (фиг. 17C-D), в соответствии с некоторыми вариантами осуществления настоящего раскрытия.
Фиг. 18 представляет собой блок-схему способа лечения отдельного пациента с использованием системы в соответствии с фиг. 9, поддерживая при этом пациента в персонифицированном терапевтическом окне, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Фиг. 19 представляет собой блок-схему процедуры определения и введения персональной дозировки и/или схемы ля лечения неврологической боли у субъекта-человека.
Фиг. 20 представляет собой графическое представление схемы для лечения боли и бессонницы посредством легочной доставки активного средства, где красная линия представляет собой болевой уровень, а зеленая линия представляет собой содержание в крови активного средства, причем активное средство представляет собой обезболивающее, а также седативное средство.
Фиг. 21 представляет собой графическое представление схемы для лечения боли посредством легочной доставки комбинации двух активных средств, ТНС и CBD, где пунктирная линия представляет собой уровень неблагоприятного (психотропного) эффекта, а сплошная линия представляет собой болевой уровень, и где ТНС вдыхают с использованием единицы дозирования 0,5 мг (пустой треугольник), 1,2 мг (серый треугольник) и 2,4 мг (черный треугольник), a CBD вдыхают с использованием единицы дозирования 25 мг (пустой ромб).
Подробное описание настоящего изобретения
Настоящее изобретение, согласно его некоторым вариантам осуществления, относится к области фармакологии и, более конкретно, но не исключительно, к способам, устройствам и системам для контролируемой легочной доставки активных средств.
Перед объяснением по меньшей мере одного из вариантов осуществления настоящего изобретения подробно, следует понимать, что настоящее изобретение не обязательно ограничивается в своем применении деталями, изложенными в приведенном ниже описании или на примере примеров.
Как обсуждалось выше, трудности, связанные с контролируемой доставкой фармацевтически активных веществ из природных веществ, в соответствии с принятыми фармакологическими способами, ограничивают медицинское применение некоторых клинически оцененных природных веществ, таких как активные вещества, содержащиеся в растениях и травах, наиболее яркий пример которых представляет собой каннабис. Отсутствие надежного и точного определения дозы и способностей регулирования представляет собой одно из основных препятствий для добавления природных веществ в качестве полноценных участников в арсенале лекарственных средств, доступных для лечения многих заболеваний. Кроме того, отсутствующий способ для введения активных средств из природных веществ в соответствии со стандартными и принятыми фармацевтическими протоколами и правилами отпугивает практикующих врачей от назначения основанного на нем лечения.
Стандартные фармакологические правила диктуют, что лечение медицинского состояния с помощью фармацевтически активного средства должно быть основано на терапевтически эффективной дозе, которая вводится в соответствии с терапевтически эффективной схемой лечения, прилагая все усилия для поддержания баланса между терапевтическим эффектом и неблагоприятными эффектами.
Как указано дополнительно в настоящем документе выше, устройство для ингаляции отмеренных доз (MDI), способное доставлять активные средства растительного происхождения, такие как каннабиноиды из каннабиса, точно и последовательно, было раскрыто в публикации WO 2012/085919. Фиг. 1 представляет собой типичный пример такого устройства для ингаляции. Во время задумки настоящего раскрытия было предположено, что такое устройство MDI может преодолеть разрыв между использованием природных веществ, содержащих перспективные фармацевтически активные средства, и стандартом все еще строгих фармакологических правил использования любого фармацевтически активного средства в лечении какого-либо медицинского состояния.
Сокращая настоящее изобретение до практики, авторы настоящего изобретения провели фармакокинетическое («PK») и фармакодинамическое («PD») исследование («PK/PD исследование») легочной доставки (ингаляции) каннабиноида из каннабиса субъекту-человеку, которое было проведено в соответствии с общепринятыми фармакологическими протоколами, и которые показали, что надежное и точное устройство MDI может быть использовано для введения по меньшей мере одного каннабиноида из каннабиса. Это исследование также показало, что используемое в нем устройство MDI представляет собой гораздо более эффективное и более производительное в высвобождении точных и воспроизводимых доз парообразного фармацевтически активного средства(средств) из каннабиса, по сравнению с другими известными способами и устройствами, известными в настоящей области техники. Используемые в настоящем документе термины «фармакокинетический/фармакодинамический» и «PK/PD» означают
фармакокинетический и/или фармакодинамический.
Результаты исследования открывают путь к легочной доставке широкого спектра природных растительных материалов в соответствии с широко принятыми фармацевтическими практиками и правилами при использовании этого точного устройства MDI. Такие легочные доставки могут быть использованы при лечении широкого спектра заболеваний, при которых испаряемые средства в указанных природных растительных материалах применимы для лечения медицинского состояния и/или облегчения симптома состояния.
Это PK/PD исследование продемонстрировало возможность предоставления аналитических средств для определения и персонализации терапевтически эффективной дозы и/или схемы для лечения неврологической боли у субъекта-человека. Такая доза и/или схема лечения могут поддерживать лечение в пределах терапевтического окна ТНС у субъекта-человека, а именно доза и/или схема лечения могут позволить себе точный и/или воспроизводимый фармакокинетический профиль, который обеспечивает предварительно выбранный или предварительно определенный фармакодинамический профиль ТНС у нуждающегося в этом субъекта.
Используемые в настоящем документе термины «терапевтическое окно» и «фармацевтическое окно» являются взаимозаменяемыми и относятся к диапазону фармакодинамических эффектов, вызванных диапазоном доз одного или нескольких фармацевтически активных средств, обеспечивая баланс между одним или несколькими желательными (положительными) эффектами и одним или несколькими неблагоприятными (отрицательными) эффектами. В соответствии с некоторыми вариантами осуществления фармацевтическое/терапевтическое окно относится к фармакодинамическому профилю. Окно может иметь отношение к данному моменту времени или может охватывать период времени любой продолжительности, включая в себя, например, минуты, часы, дни или более длинные, более короткие или любой промежуточный период времени. Желательность и нежелательность эффекта может быть определена на основе различных критериев и включать в себя без ограничения медицинскую практику, правила и нормы, культурные и демографические нормы, генетические факторы и личные предпочтения и допуски. Например, желательность и нежелательность эффекта может быть определена, основываясь на цели лечения и основываясь на общепринятых значениях и, возможно, может принимать во внимание другие параметры, такие как предпочтение, способность и активность пациента. Следует отметить, что данный эффект можно рассматривать как желаемый в некоторых случаях, но можно рассматривать как нежелательный в других случаях, и наоборот.
В соответствии с некоторыми вариантами осуществления настоящего изобретения предусмотренные в настоящем документе способы, устройства и системы способны к выпариванию предварительно определенного выпаренного количества активного средства, которое индуцировало один или несколько предварительно определенных фармакодинамических эффектов у данного субъекта или популяции субъектов, причем предварительно определенный фармакодинамический эффект относится к предварительно определенному фармако динамическому профилю, который может находиться в диапазоне между минимальным уровнем желаемого эффекта и любым уровнем нежелательного эффекта.
Согласно некоторым вариантам осуществления это фармацевтическое окно охватывает фармакодинамические эффекты, начиная от самого низкого уровня эффективного лечения медицинского состояния (терапевтический эффект; например, облегчение боли) до самого высокого уровня допустимых нежелательных эффектов (например, описанный в настоящем документе терпимый психотропный эффект). По желанию, терапевтическое окно может коррелировать с выбранным балансом между терапевтическими и нежелательными эффектами. Например, нежелательные эффекты достаточно терпимы или даже сведены к минимуму, в то время как желаемые эффекты достигают по меньшей мере минимального приемлемого уровня или минимального обязательного уровня (например, сохранение жизни или сохранение функции органа или системы пользователя). Необязательно, неблагоприятный эффект может быть ограничен в соответствии с вероятностью серьезного или непоправимого ущерба благополучия субъекта. Тем не менее, может быть получено несколько альтернативных балансов, и можно выбирать между возможными терапевтическими окнами в зависимости от предпочтений пользователя.
В настоящем документе термин «пациент» используется взаимозаменяемо с терминами «субъект», «пользователь» и «нуждающийся в этом человек», чтобы обратиться к объекту, который использует любое из предусмотренных в настоящем документе устройств и систем и является субъектом каких-либо из предусмотренных в настоящем документе способов.
Терапевтическое окно может коррелировать, через фармакокинетический профиль, в диапазоне количеств одного или нескольких фармацевтически активных средств. Например, терапевтическое окно может быть определено как диапазон количеств одного или нескольких фармацевтически активных средств, охватывающее от количества, которое придает желаемый эффект (терапевтический эффект, и в этом случае количество представляет собой терапевтически эффективное количество или терапевтическую дозу), до количества, которое вызывает более приемлемый или допустимый уровень нежелательных эффектов (например, неблагоприятных эффектов). Следовательно, например, фармацевтически активное средство, характеризующееся узким терапевтическим окном, должно вводиться с большой осторожностью и контролем таким образом, чтобы оставаться между терапевтически эффективным количеством и количеством, которое вызывает неблагоприятный эффект.
Терапевтический индекс может быть выражен в терминах терапевтического соотношения (TR), которое представляет собой отношение токсичной дозы (TD) или летальной дозы (LD) к эффективной дозе (ED). Чем выше TR, тем безопаснее лекарство. Например, тетрагидроканнабинол (ТНС) характеризуется терапевтическим индексом 1000 и поэтому считается безопасным активным средством, в то время как дигоксин, сердечный гликозид, характеризуется терапевтическим индексом приблизительно 2:1, что означает, что он представляет собой лекарственное средство, которое требует высокого уровня мониторинга лекарственного средства. Соответственно, на терапевтическое окно влияет, согласно некоторым вариантам осуществления, терапевтический индекс одного или нескольких фармацевтически активных средств и их комбинаций.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предложен способ легочной доставки по меньшей мере одного фармакологически активного средства пациенту, который осуществляется легочной доставкой средства пациенту с использованием устройства для ингаляции отмеренных доз, причем устройство выполнено с возможностью высвобождения по меньшей мере одного предварительно определенного выпаренного количества средства при контролируемом нагревании вещества, которое содержит средство, причем количество устанавливается таким образом, чтобы достичь по меньшей мере одного предварительно определенного эффекта у субъекта, такого как предварительно определенный фармакодинамический эффект.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен способ выпаривания по меньшей мере одного фармакологически активного средства, содержащегося в растительном материале и пригодного для легочной доставки пациенту, который выполняют с использованием устройства для ингаляции отмеренных доз, причем устройство выполнено с возможностью высвобождения по меньшей мере одного предварительно определенного выпаренного количества средства при контролируемом нагревании растительного материала, причем количество устанавливается таким образом, чтобы достичь по меньшей мере одного предварительно определенного фармакокинетического эффекта и/или по меньшей мере одного предварительно определенного фармакодинамического эффекта, индуцированного указанным средством у субъекта после легочной доставки средства пациенту.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрено применение устройства для ингаляции отмеренных доз для выпаривания по меньшей мере одного фармакологически активного средства, содержащегося в растительном материале, подходящее для легочной доставки пациенту, причем устройство выполнено с возможностью высвобождения по меньшей мере одного предварительно определенного выпаренного количества средства при контролируемом нагревании растительного материала, причем количество устанавливается таким образом, чтобы достичь по меньшей мере одного предварительно определенного фармакокинетического эффекта и/или по меньшей мере одного предварительно определенного фармакодинамического эффекта, индуцированного указанным средством у субъекта при легочный доставки средства пациенту.
Следует понимать, что фармацевтически активное средство может быть в твердой или жидкой форме, а также следует отметить, что средство содержится в твердой форме описанного в настоящем документе вещества. В соответствии с некоторыми вариантами осуществления настоящего изобретения фармацевтически активное средство представляет собой испаряемое под воздействием тепла, таким образом, может быть высвобождено из вещества посредством индуцированного нагреванием парообразования.
Согласно некоторым вариантам осуществления вещество, которое содержит по меньшей мере одно подвергаемое выпариванию активное средство, представляет собой, например, растительный материал. Согласно некоторым вариантам осуществления активное средство представляет собой природное средство, а именно средство, в природе находящееся (происходящее) в растении. Альтернативно, вещество представляет собой органический материал, который содержит или состоит из, например, одного или нескольких природных растительных материалов, или синтетический материал, который может содержать по меньшей мере одно подвергаемое выпариванию активное средство. Согласно некоторым вариантам осуществления твердая форма вещества содержит множество подвергаемых выпариванию активных веществ, полученных или извлеченных из природных или органических источников, таких как растения, грибы, бактерии и т.п.
Согласно некоторым вариантам осуществления вещество представляет собой природный растительный материал. Согласно одному варианту осуществления настоящего изобретения растительный материал обрабатывают, не повреждая подвергаемое выпариванию активное вещество в растительном материале. Необязательно, растительный материал сохраняет макроскопическую структуру растения.
Количество вещества, используемого в устройстве MDI, может быть определено на основе содержания содержащегося в нем подвергаемого выпариванию средства и на основе предварительно определенного выпаренного количества, которое должно быть высвобождено из него. Количество вещества, используемого в устройстве MDI, может варьировать в диапазоне от 20 до 500 мг, от 10 до 200 мг, от 9 до 150 мг, от 8 до 100 мг, от 7 до 50 мг, от 5 до 20 мг, от 1 до 10 мг, от 10 до 70 мг, от 10 до 60 мг, от 12 до 50 мг, от 12 до 40 мг, от 15 до 40 мг, от 12 до 30 мг или от 12 до 25 мг.
Термины «фармацевтически активное средство», «биологически активное средство», «активное средство» и «средство» используются в настоящем документе взаимозаменяемо и относятся к соединению, полимеру, конъюгату или комплексу, или любой их комбинации, оказывающей физиологический или психологический эффект при введении субъекту. Как правило, фармацевтически активное средство или биологически активное вещество оказывает желаемый физиологический или психологический эффект при легочной доставки посредством системного пути (например, кровь, лимфа) к органу-мишени. Средство может быть природного происхождения или быть синтетическим. Неограничивающие примеры активных средств включают в себя ЦНС-активные средства, химиотерапевтические средства, седативные или анальгетические средства и психотропное средство. В контексте вариантов осуществления настоящего раскрытия фармацевтически активное средство представляет собой природное средство, обнаруженное в веществе природного происхождения (например, природном растительном веществе, как описано в настоящем документе), или его метаболит. Эти термины также охватывают, если не указано иное, два или более средств.
В соответствии с некоторыми вариантами осуществления настоящего изобретения способ осуществляют с использованием MDI, который способен обеспечить воспроизводимую и точную доставку количества по меньшей мере одного подвергаемого выпариванию средства путем нагревания твердой формы вещества. Такие требования к MDI удовлетворяются для не ограничивающего примера MDI, описанного в заявке на патент США №13/997302 или WO 2012/085919, оба из которых полностью включены в настоящий документ посредством ссылки, как если бы полностью были представлены в настоящем документе.
В соответствии с некоторыми вариантами осуществления настоящего изобретения, устройство MDI представляет собой устройство, описанное в публикации WO 2012/085919, включая в себя любой из описанных в нем вариантов осуществления и любую их комбинацию.
Используемый в настоящем документе термин «выпаренное количество» относится к количеству средства, которое находится в форме пара, в то время как форму пара/количество получают с помощью нагревательных элементов в устройстве MDI. Следует отметить в настоящем документе, что согласно некоторым вариантам осуществления количество парообразного средства в контексте настоящего раскрытия не представляет собой расчетное количество, а скорее представляет собой фактическое количество, выпаренное после указанного нагревания.
Термин «предварительно определенное выпаренное количество» относится к количеству, которое преднамеренно или сознательно высвобождается из устройства MDI, величину которого определяют по собственному желанию или в соответствии с разработкой протокола дозы и/или схемы лечения, как описано в настоящем документе. В контексте некоторых вариантов осуществления термин «доза» представляет собой предварительно определенное выпаренное количество. Отмечено, что предварительно определенное выпаренное количество коррелирует с доступным количеством, присутствующим в устройстве, и что можно предварительно измерить доступное количество, присутствующее в устройстве, или измерить доступное количество, присутствующее в устройстве совместно с событием введения, и, таким образом, предварительно установить, сбросить, откорректировать и/или перенастроить предварительно определенное выпаренное количество, соответственно.
Первоначальное определение дозы и калибровка устройства:
В соответствии с некоторыми вариантами осуществления способ выполняется таким образом, что предварительно определенное выпаренное количество выбирают/регулируют таким образом, чтобы показать предварительно выбранный (также упоминаемый в настоящем документе как предварительно определенный) фармакокинетический профиль и/или предварительно выбранный или предварительно определенный фармакодинамический профиль средства в организме пациента.
Согласно некоторым вариантам осуществления предварительно определенное выпаренное количество выбирают/определяют произвольно, в то время как устройство MDI выполняют с возможность выпаривать и доставлять это количество последовательно и точно в течение любого количества использований и ингаляций, используя любой источник активного средства (вещество; растительный материал, сочетание растительного материала с другим материалом и т.п.). Согласно некоторым вариантам осуществления предварительно определенное выпаренное количество средства может быть определено на основании измерения количества средства на единицу массы вещества, из которого средство подлежит испарению. Такое измерение может быть выполнено с помощью стандартных процедур; таким образом, различные партии и источники вещества могут быть стандартизированы в соответствии с относительным количеством средства на единицу массы вещества.
Следует отметить в настоящем документе, что согласно некоторым вариантам осуществления настоящего изобретения путем проявления предварительно выбранного фармакокинетического и/или фармакодинамического профиля, это означает, что выпаренное количество средства было предварительно определено на основе фармакокинетических/фармакодинамических (PK/PD) исследований, проводимых по меньшей мере у одного субъекта посредством легочной доставки средства с использованием устройства MDI, которое выполнено с возможностью высвобождать точные и адекватные парообразные количества средства при нагревании содержащего его твердого вещества. Также в настоящем документе отмечено, что согласно некоторым вариантам осуществления настоящего изобретения путем проявления предварительно выбранного фармакокинетического профиля, это означает, что по меньшей мере один желаемый фармакокинетический профиль был идентифицирован, и что было показано, что по меньшей мере одно предварительно определенное выпаренное количество средства вызывает желаемый фармакокинетический профиль у субъекта. Также в настоящем документе отмечено, что в соответствии с некоторыми вариантами осуществления настоящего изобретения, путем проявления предварительно выбранного фармакокинетического профиля, это означает, что по меньшей мере один желаемый фармакодинамический профиль был идентифицирован и что было показано, что по меньшей мере одно предварительно определенное выпаренное количество средства вызывает желаемый фармакодинамический профиль у субъекта.
Согласно некоторым вариантам осуществления настоящего изобретения термины «предварительно выбранный» и «предварительно определенный» относятся к или используются взаимозаменяемо с терминами «предназначенный», «желаемый» или «желательно», или с терминами «эффективный», «необходимый» и «терапевтический».
Следует также отметить, что в настоящем документе определение желаемого фармакокинетического профиля и/или желаемого фармакодинамического профиля, как правило, выполняют путем проведения PK/PD исследования для конкретного фармацевтически активного средства у данного субъекта или их группы. Следует также отметить в настоящем документе, что способность проводить стандартные и широко признанные исследования PK/PD у определенного субъекта или их группы для фармацевтически активного средства, которое доставляется посредством ингаляции (легочная доставка) при управляемом и воспроизводимом высвобождении выпаренного количества средства путем нагревания твердого образца вещества, становится возможным, например, посредством устройства MDI, например, как раскрыто в публикации WO 2012/085919, которая может использовать растительный материал в качестве источника активного средства(средств).
Согласно некоторым вариантам осуществления термин «предварительно определенное выпаренное количество» также используется в настоящем документе для описания количества средства, которое определяется на основании фармакокинетических/фармакодинамических (PK/PD) данных, а именно выпарившегося количества, которое было определено путем определения PK/PD эффектов (параметров) для средства у одного или нескольких пациентов.
Согласно некоторым вариантам осуществления настройка устройства MDI для высвобождения предварительно определенного количества, как определено в настоящем документе, означает, согласно некоторым вариантам осуществления, калибровку устройства для проявления предварительно выбранного PK и/или предварительно выбранного PD профиля.
В соответствии с некоторыми из любых вариантов осуществления настоящего изобретения способ осуществляют путем корректировки предварительно определенного выпаренного количества таким образом, чтобы достичь предварительно определенного фармакокинетического эффекта и/или предварительно определенного фармакодинамического эффекта на основе данных, указывающих по меньшей мере на один фармакокинетический эффект и/или по меньшей мере на один фармакодинамический эффект, индуцированный средством у субъекта.
Согласно некоторым вариантам осуществления способ дополнительно предусматривает формирование характеристических данных путем мониторинга по меньшей мере одного фармакокинетического эффекта и/или по меньшей мере одного фармакодинамического эффекта, индуцированного средством у субъекта.
В соответствии с некоторыми из любых вариантов осуществления настоящего изобретения способ осуществляют путем мониторинга и/или определения по меньшей мере одного фармакокинетического эффекта и/или по меньшей мере одной фармакокинетической переменной, и/или по меньшей мере одного фармакодинамического эффекта, поскольку эти термины определены в настоящем описании, которые индуцируются легочной доставкой фармацевтически активного средства пациенту с использованием устройства MDI;
на основе фармакокинетического эффекта и/или фармакокинетической переменной, и/или фармакодинамического эффекта, определяющего предварительно определенное выпаренное количество, которое проявляет предварительно выбранный фармакокинетический профиль и/или предварительно выбранный фармакодинамический профиль средства у пациента, а также корректировки устройства MDI для доставки предварительно определенного выпаренного количества средства.
Используемая в настоящем документе фраза «фармакокинетический профиль» относится к концентрации в организме фармацевтически активного средства или его метаболита (например, активного метаболита), а именно, концентрации средства или его метаболита в физиологической системе организма (всем организме, крови, плазме, лимфе, ткани, органе и т.п.), в который вводилось соединение, как функция времени. Как правило, фармакокинетический (PK) профиль рассматривается с момента времени введения соединения до момента времени, в который соединение больше не обнаруживается в организме, или до любого промежуточного периода времени между введением соединения и временем, в которое он уже не обнаруживается в организме (например, за счет выделения); следовательно, PK профиль описывает концентрацию в организме в конкретной физиологической системе конкретного соединения между введением и исчезновением под влиянием механизмов высвобождения, поглощения, распределения, метаболизма и выведения/секреции соединения. Так как каждый организм и каждый отдельный организм в пределах рода организма по-разному реагирует на введение средства, PK профиль может быть различным, а в некоторых случаях сильно изменяющимся от субъекта к субъекту, и может отличаться в пределах отдельного субъекта на основе текущего физиологического состояния, состояния здоровья, условий окружающей среды и даже от времени суток.
В соответствии с некоторыми вариантами осуществления настоящего раскрытия фармакокинетический профиль достигается путем обеспечения субъекта одним или несколькими из следующего:
Доза - одно количество соединения или средства, которое ему вводится и/или
Схема лечения - множество предварительно определенных доз, которые могут отличаться или быть сходными по количествам, вводимые в различные интервалы времени, которые могут быть разными или схожи с точки зрения продолжительности. Согласно некоторым вариантам осуществления схема лечения также охватывает время периода доставки (например, период введения средства или период лечения).
Альтернативно, схема лечения представляет собой множество предварительно определенного множества предварительно определенных выпаренных количеств, даваемых в предварительно определенные промежутки времени.
Следует отметить, что PK профиль может быть определен в соответствии с изменением PK эффекта (параметра) в зависимости от времени или комбинации PK эффектов в зависимости от функции времени.
PK профиль, как правило, оценивают по концентрации на временной шкале, используя непосредственные и/или опосредованные измеряемые PK эффекты. Например, PK профиль может представлять собой концентрацию в плазме данного фармацевтически активного средства у субъекта, как функцию времени.
Используемый в настоящем документе термин «предварительно выбранный фармакокинетический профиль» относится к PK профилю, который был выбран в качестве желательного. Предварительно выбранный PK профиль может быть выбран, так как было установлено что он, эффективен в достижении желаемого фармакодинамического эффекта у субъекта, как описано в любом из соответствующих вариантов осуществления (например, для поддержания субъекта в пределах терапевтического окна, как описано в настоящем документе).
Термины «фармакокинетический параметр», «фармакокинетический эффект», используемые в настоящем документе взаимозаменяемо, относятся к оценке или количественному определению физиологического эффекта у субъекта, который имеет отношение к присутствию фармацевтически активного средства у субъекта. Эффекты PK представляют собой прямые или опосредованные выражения группы физиологических процессов, которые включают в себя поглощение, распределение, метаболизм и экскрецию (ADME) фармацевтически активного средства у субъекта.
PK эффекты, как правило, включают в себя без ограничения:
Ct, что представляет собой концентрацию средства, как определено, измерено или оценено в определенной физиологической системе (например, в плазме) после его введения (доставки, например, легочной доставки) дозы или схемы лечения субъекту;
Cmax, что представляет собой пиковую концентрацию средства, как определено, измерено или оценено в определенной физиологической системе (как правило, в плазме), после его введения субъекту;
Tmax, что представляет собой время, прошедшее между введением и достижением Cmax;
Площадь под кривой (AUC0→∞; от нуля до бесконечности), которая представляет собой интеграл кривой концентрации в зависимости от времени, как правило, после однократной дозы или в стационарном состоянии;
Cmin, что представляет собой самую низкую концентрацию средства в организме до очередной вводимой дозы;
Tmin, что представляет собой время, прошедшее до обнаружения Cmin или до введения следующей дозы;
Cпоследняя, что представляет собой последнюю наблюдаемую количественную концентрацию;
λz, что представляет собой конечную константу фазы скорости;
Период полувыведения (

Константа скорости элиминации (KE), которая представляет собой скорость, при которой средство удаляется из организма;
Скорость введения (kin), которая представляет собой скорость введения необходимого баланса элиминации;
Клиренс, который представляет собой объем плазмы, очищенный от средства, на единицу времени;
Биодоступность, которая представляет собой системно доступную фракцию средства; а также
Колебание, которое представляет собой пик колебание в пределах одной дозы или один интервал схемы лечения в стационарном состоянии.
В качестве инструмента оценки PK профиля у представителя популяции (субъекта) подобных отдельных субъектов (сходные в биологическом смысле, как и в группе людей), переменные PK, которые, как было обнаружено, коррелируют с PK профилем в подмножестве популяции, могут быть использованы для обобщения (экстраполирования) профиля PK для каждого из индивидуумов, входящих в состав целой популяции.
Используемый в настоящем документе термин «фармакокинетическая переменная» относится к свойству субъекта, которое не обязательно зависит от фармацевтически активного средства или способа доставки фармацевтически активного средства субъекту, а также обеспечения информацией, имеющей отношение к факторам, которые влияют на фармакокинетические и фармакодинамические профили активного средства у субъекта.
Фармакокинетические переменные, как правило, включают в себя без ограничения массу тела, рост, индекс массы тела (ИМТ), индекс талия-бедро, безжировую массу тела (LBM), возраст и пол, расу, сопутствующие заболевания, историю болезни пациента (например, предыдущие воздействия средства или других средств) и сопутствующие лекарственные средства. Следует понимать, что PK переменные зависят от генетической и эпигенетической композиции каждого отдельного субъекта и, следовательно, могут быть использованы для прогнозирования PK/PD профилей у отдельного субъекта с определенной степенью точности. Тем не менее, персонализация/индивидуализация лечения, основанная на введении фармацевтически активного средства, как правило, основана на сборе данных персональных PK/PD эффектов/параметров, которые используются для определения дозы и схемы лечения для отдельного субъекта. В целом, отклонение отдельных параметров от средних параметров, установленных для широкой популяции, заметно мала.
В контексте некоторых вариантов осуществления настоящего изобретения, термин «лечение» относится к любому одному из: одного легочного введения средства в данной дозе; фиксированных и ограниченных серий легочных введений средства, получаемых при одних и тех же или разных дозах в одни и те же или различных дозовые интервалы (схемы лечения); хронического лечения, которое вводят в виде ограниченных серий, но без запланированного прекращения лечения (непрерывное лечение), и/или любой их комбинации. Как правило, серия предварительно определенных доз, вводимых через предварительно определенные промежутки времени, называется в настоящем документе как схема лечения или схема.
В соответствии с некоторыми вариантами осуществления представленного в настоящем документе способа легочная доставка средства предусматривает одну дозу, доставленную как одно предварительно определенное выпаренное количество, высвобожденное устройством MDI в одном сеансе ингаляции, или дозу можно вводить пациенту в виде нескольких сопутствующих ингаляций. Альтернативно, серия доз, каждая вводимая в виде одной или нескольких предварительно определенных выпаренных количеств и вводимых в предварительно определенные промежутки времени, называется в настоящем документе как схема лечения. Схема лечения, следовательно, определяется одной или несколькими дозами, вводимыми в одном или нескольких предварительно определенных выпаренных количествах в предварительно определенные интервалы времени, причем каждое из предварительно определенных выпаренных количеств, доз и интервалов времени может быть одинаковым или различным.
В контексте вариантов осуществления настоящего раскрытия PK профиль данного фармацевтически активного средства представляет собой результат дозы и/или схемы лечения, с помощью которого средство вводят пациенту, или, альтернативно, в соответствии с некоторыми вариантами осуществления PK профиль представляет собой среднее значение для достижения конкретного, предварительно выбранного или иного желаемого фармакодинамического профиля средства у пациента.
Используемый в настоящем документе термин «фармакодинамический профиль» относится к эффекту фармацевтически активного средства у субъекта, как функция от времени. Соответственно, термин «фармакодинамический профиль» относится к сумме всех биологических выражений и реакций организма, как функции от времени, при введении фармацевтически активного средства. Фармакодинамическим профиль, как правило, представляет собой прямой или косвенный результат фармакокинетического эффекта(ов) в любой данный момент времени либо фармакокинетический профиль средства в организме пациента в течение любого заданного периода времени.
Фармакодинамический профиль представляет собой изменение/вариацию прямо и/или косвенно определяемого фармакодинамического эффекта(ов) в зависимости от времени.
Термины «фармакодинамический параметр», «фармакодинамический эффект», используемые в настоящем документе взаимозаменяемо, относятся к группе эффектов, имеющих отношение к субъекту и фармацевтически активному средству, проявляющихся у субъекта при введении средства субъекту. Как правило, фармакодинамические параметры зависят от PK переменных субъекта и PK эффектов субъекта.
Фармакодинамические параметры, как правило, могут быть определены без ограничения посредством терапевтического (желательного) эффекта (например, субъективно воспринимаемого терапевтического эффекта), неблагоприятного (нежелательного) эффекта (например, субъективно воспринимаемого неблагоприятного эффекта), а также с помощью определения содержания биомаркера (который представляет собой показатель терапевтического и/или неблагоприятного эффекта), так как эти термины описаны ниже. Фармакодинамический профиль, который может представлять собой предварительно выбранный (желательный) фармакодинамический профиль, в соответствии с некоторыми вариантами осуществления настоящего изобретения, определяется терапевтическим окном данного средства у данного субъекта, как этот термин определен в настоящем документе.
Фармакодинамический (PD) профиль, как правило, представляет собой зависимую от времени оценку и/или измерение по шкале, идущей от отсутствия ответа, через начало желаемого терапевтического эффекта (ниже порогового значения терапевтического эффекта), через терапевтическое окно, через начало неблагоприятного эффекта (выше порогового значения неблагоприятного эффект) и вплоть до токсического эффекта.
В соответствии с некоторыми вариантами осуществления настоящего изобретения легочная доставка и/или PK/PD исследования (измерение любых фармакокинетических и/или фармакодинамических параметров) необязательно может проводиться во время мониторинга по меньшей мере одного дополнительного физиологического параметра, выбранного из группы, состоящей из:
основного показателя жизнедеятельности, выбранного из группы, состоящей из частоты сердечных сокращений, уровня насыщения кислородом (SpO2), артериального давления, частоты дыхания и температуры тела;
легочной функции, выбранной из группы, состоящей из объема форсированного выдоха (FEV1), максимального полувыдыхаемого потока (MMEF), диффузионной способности легких по монооксиду углерода (DLCO), форсированной жизненной емкости легких (FVC), общей емкости легких (TLC) и остаточного воздуха (RV);
гематологического маркера, выбранного из группы, состоящей из уровня гемоглобина, отношения гематокрита, количества эритроцитов, количества лейкоцитов, лейкоцитарной формулы и количества тромбоцитов;
параметра коагуляции, выбранного из группы, состоящей из протромбинового времени (РТ), протромбинового индекса (PR) и международного коэффициента нормализации (MHO);
маркера почечной функции, выбранного из группы, состоящей из клиренса креатинина (ССг), уровня азота мочевины крови (BUN) и скорости клубочковой фильтрации (GFR); а также
маркера функции печени, выбранного из группы, состоящей из уровня аспартатаминотрансферазы (AST), уровня сыворочной глутаматоксалоацетаттрансаминазы (SGOT), уровня щелочной фосфатазы и уровня гамма-глутамилтрансферазы (GGT).
Результаты такого PK/PD исследования, проведенные у одного или нескольких субъектов, могут быть поэтому использованы для определения начального предварительно определенного выпаренного количества по меньшей мере одного фармакологически активного вещества, которое сразу при введении с помощью устройства MDI, настроенного для его легочной доставки, приводило бы к начальному предварительно выбранному фармакокинетическому профилю и/или начальному предварительно выбранному фармакодинамическому профилю средства у конкретного пациента, и в дальнейшем могло быть использовано для калибровки и предварительной установки аналогичных устройств MDI таким образом, чтобы обеспечить начальное предварительно определенное выпаренное количество для достижения аналогичных последовательных первоначальных результатов.
Эффекты и профили PD также могут быть определены или оценены на основе статистических данных, относящихся к популяции, так как этот термин упоминается в настоящем документе выше в контексте PK эффектов, основанных на аппроксимации того, что когда необязательно рассматриваются один или несколько определенных критериев и переменных, такие как возраст, масса и т.д., наблюдая PD эффект, индуцированный с помощью данного активного средства у одного субъекта, можно сделать вывод об PD эффекте средства на другого субъекта.
Как представлено в настоящем документе, точность и последовательность ингаляционного устройства в испарении и доставке по меньшей мере одного активного средства в качестве предварительно определенного выпаренного количества, позволяет использовать его для проведения PK/PD исследований у одного или нескольких субъектов. Такие исследования основаны на способности точно и последовательно записывать эффекты PK/PD.
Соответственно, предусмотрен способ записи по меньшей мере одного фармакокинетического эффекта и/или по меньшей мере одного фармакодинамического эффекта, индуцированного легочной доставкой субъекту по меньшей мере одного фармакологически активного средства, находящегося в растительном материале; причем способ осуществляется путем:
легочной доставки предварительно определенного выпаренного количества средства субъекту с устройством для ингаляции отмеренных доз, выполненным с возможностью выпаривать предварительно определенные парообразные количества средства при контролируемом нагревании растительного материала;
необязательно, определения по меньшей мере одного фармакокинетического эффекта у субъекта в предварительно определенные промежутки времени до, во время и/или после легочной доставки;
определения по меньшей мере одного фармакодинамического эффекта у субъекта в предварительно определенные промежутки времени до, во время и/или после легочной доставки;
причем фармакодинамический эффект выбирают из группы, состоящей из желаемого эффекта, нежелательного эффекта, терапевтического эффекта, неблагоприятного эффекта и содержания биомаркера.
Персонализация:
Как обсуждалось выше, некоторые PK/PD исследования или некоторые их части основаны на параметрах популяции и на когортах, получающих среднюю или стандартизированную дозу и/или данные схемы лечения, в то время как в действительности PK/PD профиль может отличаться от пациента к пациенту, и даже в пределах отдельного пациента в зависимости от текущего физиологического состояния, психического состояния, состояния здоровья и условий окружающей среды. Таким образом, предварительно определенное выпаренное количество средства (заданная доза и/или схема лечения) может быть признано как не отвечающее требованиям для конкретного индивидуума в любой момент времени и по любой индивидуальной причине. Следовательно, для того, чтобы обеспечить оптимальное лечение для данного индивидуума в любом из способов, предусмотренных в настоящем документе, каждый из фармакокинетических и/или фармакодинамических параметров и/или переменных может быть дополнительно определен для отдельного пациента, таким образом, что предварительно определенное выпаренное количество получают индивидуально для пациента.
Следует отметить, что в соответствии с некоторыми вариантами осуществления настоящего изобретения, в то время как пациент может начать легочную доставку с использованием начального предварительно определенного выпаренного количества, которое не было определено на основании личных/индивидуальных параметров и переменных пациента, способ предусматривает дополнительный шаг, на котором личные параметры и переменные пациента рассматриваются в определении предварительно определенного выпаренного количества. Таким образом, в соответствии с некоторыми из любых вариантов осуществления настоящего изобретения, способ может предусматривать персонализацию предварительно определенного выпаренного количества, которая приводит к получению предварительно выбранного PK/PD профиля. Представленная ниже стадия персонализации может заменить предварительную калибровку устройства MDI или выступать в качестве дополнительной стадии после калибровки устройства MDI.
Соответственно, фармакокинетический эффект(ы) и/или фармакокинетическая переменная(ые), и/или фармакодинамический эффект(ы) независимо друг от друга определяются для отдельного пациента, таким образом, что предварительно определенное выпаренное количество определяется персонально для этого пациента. В настоящем документе отмечено, что персональный фармакокинетический параметр можно получить непосредственно путем проведения PK исследования у пациента путем контроля концентрации средства у пациента (например, с использованием образцов крови и/или других средств) или путем применения расчетов, основанных на персональных PK переменных и других персональных переменных, которые могут оказать влияние на PK/PD профили у этого пациента.
Альтернативно, в соответствии с некоторыми из любых вариантов осуществления настоящего изобретения способ может предусматривать сбор, наблюдение или иной способ мониторинга и определения по меньшей мере одного персонального фармакодинамического эффекта и/или фармакокинетического эффекта у отдельного субъекта с тем, чтобы определить, проявляет ли легочная доставка начального предварительно определенного выпаренного количества средства предварительно выбранный (желательный) фармакодинамический и/или фармакокинетический профиль;
если легочная доставка предварительно определенного выпаренного количества средства не показывает предварительно выбранный/предварительно определенный фармакодинамический и/или фармакокинетический профиль, определение скорректированного выпаренного количества средства, которое проявляет предварительно выбранный фармакодинамический и/или фармакокинетический профиль; а также
корректировку, сброс, повторную калибровку или иную повторную настройку устройства для доставки откорректированного выпаренного количества, в результате чего, после повторной настройки устройства MDI скорректированное выпаренное количество представляет собой в настоящее время предварительно определенное выпаренное количество.
В соответствии с некоторыми вариантами осуществления настоящего изобретения персонализация легочный доставки и/или PK/PD исследование, необязательно, могут быть проведены во время мониторинга по меньшей мере одного дополнительного физиологического параметра, как описано в настоящем документе. По желанию, мониторинг по меньшей мере одного фармакокинетического эффекта и/или по меньшей мере одного фармакодинамического эффекта, индуцированного средством у субъекта, осуществляется в предварительно определенные промежутки времени до, во время и/или после легочной доставки.
В соответствии с некоторыми вариантами осуществления мониторинг фармакокинетического эффекта и/или фармакодинамического эффекта осуществляется путем получения данных, указывающих на эти эффекты у субъекта, по меньшей мере от одного датчика, сообщающегося с контроллером, как эти термины обсуждаются ниже, связанного с ингаляторным устройством, представленным в настоящем документе.
Следует отметить, что персональный фармакодинамический параметр может представлять собой субъективно воспринимаемый терапевтический эффект, субъективно воспринимаемый неблагоприятный эффект и (содержание или присутствие) биомаркера, полученного и/или измеренного у отдельного пациента. В соответствии с некоторыми вариантами осуществления приобретение/определение субъективно воспринимаемого терапевтического эффекта, субъективно воспринимаемого неблагоприятного эффекта и биомаркера может проводиться на добровольной основе пациентом или без согласия с помощью автоматических средств. Способ, в соответствии с его некоторыми вариантами осуществления, затем осуществляют путем определения откорректированного выпаренного количества средства, основанного на персональном фармакодинамическом параметре, и настройки устройства для доставки откорректированного выпаренного количества; в результате откорректированное выпаренное количество представляет собой предварительно определенное выпаренное количество. Другими словами, откорректированное выпаренное количество представляет собой персонализированное предварительно определенное выпаренное количество, которое основано на персональных фармакодинамических параметрах, полученных для конкретного пациента, после введения предварительно определенного выпаренного количества, определенного для популяции в целом и с использованием популяционных PK переменных. Альтернативно, ожидаемый ответ может быть использован в качестве параметра для подтверждения идентичности пользователя. Например, пользователь получает указание выполнить задание в данный момент времени до и/или после введения, а измеренное значение сравнивается с сопоставимым ожидаемым значением, записанным для такого же пользователя, необязательно при аналогичных условиях.
Субъективно воспринимаемый эффект:
А «субъективно воспринимаемый эффект» представляет собой субъективную оценку пациента, относящуюся к эффекту данного средства или лечения в организме пациента. Субъективно воспринимаемый эффект может включать в себя один или несколько из субъективно воспринимаемых терапевтических эффектов или субъективно воспринимаемых неблагоприятных эффектов.
Психотропный эффект необязательно соответствует симптому, который может быть воспринят пациентом. Следует отметить, что в некоторых случаях психотропный эффекта может не точно восприниматься пациентом. Примеры психотропных симптомов включают в себя без ограничения паранойю, тревогу, панику, эйфорию, псевдо-галлюцинации, седативный эффект, изменение сознательного восприятия, веселость, метапознание и самоанализ, повышенную актуализацию (эпизодическую память), амнезию, изменение чувственности, изменение в сознании ощущения и изменение либидо, головокружение, атаксию, эйфорию, перцептивные изменения, временное искажение, усиление чувственного восприятия, кратковременной памяти и внимания, нарушение реакции, координации произвольных движений, беглости речи, зависимость и депрессию.
Соматическая эффект иногда соответствует симптому, который может восприниматься пациентом или быть измеренным таким образом. Примеры соматических симптомов включают в себя без ограничения боль, мигрень, тошноту, судороги, потливость, атаксию, изменение двигательной активности, сухость во рту и ощущение холодных или горячих рук и ног, увеличение частоты сердечных сокращений, увеличение мозгового кровотока (например, симптомы мигрени, «давления в голове»), дилатацию бронхиальных путей (например, кашель и затрудненное дыхание), расширение кровеносных сосудов (например, дрожь, покраснение кожи, румянец), покраснение глаз и расширение зрачков, сухость во рту, жажду, голод или тягу к определенному виду пищи.
Желаемые эффекты - терапевтические эффекты:
«Субъективно воспринимаемый терапевтический эффект» представляет собой субъективную оценку пациента, имеющую отношение к благоприятному (желаемому) эффекту данного средства в организме пациента. Согласно некоторым вариантам осуществления желаемый эффект предусматривает облегчение симптома и/или облегчение причины медицинского состояния. Например, если желаемый терапевтический эффект определяется как облегчение боли, пациент может сообщить об уровне боли с помощью характеризующегося шкалой протокола оценки боли. Характеризующийся шкалой протокол оценки боли измеряет интенсивность боли и/или другие функции пациента. В контексте вариантов осуществления настоящего раскрытия характеризующийся шкалой протокол оценки боли основан на самоотчете (субъективном), наблюдении и/или поведенческих данных, предоставленных пациентом, в то время как физиологические данные подпадают под определение биомаркеров, а именно объективных данных. В общем, все субъективно воспринимаемые (субъективные) оценки пациентом могут быть использованы в качестве обратной связи для самостоятельного подбора и персонификации лечения.
Субъективно воспринимаемый терапевтический эффект может быть связан с или соответствовать, прямо или косвенно, симптому медицинского состояния, которое пациент лечит.В некоторых случаях пациент может воспринимать изменение уровня воспринимаемого симптома, и когда симптом заболевания смягчается (снижение уровня симптома), человек воспринимает это изменение как терапевтический эффект средства, получаемого во время лечения. Следовательно, в соответствии с вариантами осуществления субъективно воспринимаемый терапевтический эффект соответствует снижению уровня симптома, такого как, но без ограничения, боль, мигрень, депрессия, дефицит когнитивной функции, дефицит внимания, гиперактивность, тревожные расстройства, диарея, тошнота, рвота, бессонница, бред, изменение аппетита, половая дисфункция, спастичность, повышение внутриглазного давления, нарушение функции мочевого пузыря, тики, симптомы Туретта, симптомы посттравматического стрессового расстройства (PTSD), симптомы воспалительного заболевания кишечника (IBD), симптомы синдрома раздраженного кишечника (IBS), гипертензия, геморрагические симптомы, септический и кардиогенный шок, наркомания и зависимость, симптомы синдрома отмены, тремор и другие симптомы двигательных расстройств.
Согласно некоторым вариантам осуществления субъективно воспринимаемый терапевтический эффект может включать в себя эффект, который не связан или не соответствует, прямо или косвенно, симптому медицинского состояния, которое пациент лечит, но тем не менее полезен испытывающему такой симптом пациенту. Например, когда симптом включает в себя форму дискомфорта (например, боль или тошноту), пациент может извлечь выгоду из психотропного состояния, в котором дискомфорт может быть менее заметным или более терпимым. Одним из примеров такого желательного эффекта является появление временного умеренного ступора во время боли. Согласно некоторым вариантам осуществления тот же самый эффект может быть терапевтическим или неблагоприятным в зависимости от степени и/или его времени, и/или иных обстоятельств.
Нежелательные эффекты - неблагоприятные эффекты:
«Субъективно воспринимаемый неблагоприятный эффект» связан с возникновением и/или увеличение уровня нежелательного симптома, который не обязательно связан с подвергаемым лечению медицинским состоянием, так как он вызвано, прямо или косвенно, фармакокинетическим параметром фармацевтически активного средства, доставляемого пациенту.
Согласно некоторым вариантам осуществления субъективно воспринимаемый нежелательный эффект может представлять собой психический эффект, психотропный эффект и/или соматический процесс, причем психический и/или психотропный эффект в основном связан с активностью ЦНС, которая охватывает восприятие, сознание, когнитивные и поведенческие эффекты, а соматический эффект связан со всеми другими системами организма и включает в себя без ограничения эффекты желудочно-кишечного тракта, нервно-мышечные, сердечно-сосудистые, судорожные, эндокринные и т.п.
Субъективно воспринимаемый неблагоприятный эффект представляет собой субъективную оценку пациента по отношению к неблагоприятному эффекту данного средства в организме пациента. В общем, все субъективно воспринимаемые (субъективные) оценки неблагоприятного эффекта на пациента могут быть использованы в качестве обратной связи для персонализации лечения и самостоятельного титрования.
Биомаркеры:
В то время как восприятие эффекта представляет собой субъективную оценку эффекта, и, как правило, сложно определить количественно, биомаркер представляет собой более объективную и, как правило, измеримую количественную оценку эффекта. Таким образом, используемый в настоящем документе термин «биомаркер» представляет собой измеримый показатель профиля PD в заданный момент времени и, как правило, состоит из прямого и/или опосредованного соматического, биологического и/или химического проявления терапевтического эффекта и/или неблагоприятного эффекта. Другими словами, биомаркер представляет собой любую объективно измеримую величину, которая может быть использована в качестве индикатора состояния медицинского состояния, эффекта конкретного средства на состояние медицинского состояния или другого физиологического состояния организма. Следует обратить внимание, что некоторые из терапевтических/неблагоприятных эффектов могут быть оценены только качественно, а некоторые из них могут быть оценены опосредованно, например, путем измерения нарушенной реакции посредством применения теста поддержания функции.
В контексте вариантов осуществления настоящего раскрытия биомаркеры разделены на группу инвазивно распознаваемых биомаркеров и группу неинвазивно распознаваемых биомаркеров. В общем, все данные биомаркеров (объективные), собранные у пациента любым способом, измерение наблюдения, измерения датчика и т.п., могут быть использованы в качестве обратной связи для персонализации лечения и самостоятельного подбора дозы. Следует отметить, что некоторые инвазивно распознаваемые биомаркеры могут быть обнаружены и измерены неинвазивно и наоборот.
Примеры для неинвазивно распознаваемых биомаркеров включают в себя без ограничения частоту сердечных сокращений, уровень оксигенации (SpO2), артериальное давление, частоту дыхания, температуру тела, объем ингаляции, выражение лица, мышечные подергивания, судороги, спазмы, потливость, координацию рук и глаз, сосудистое расширение глаз, покраснение конъюнктивы и/или склеры, изменение внутриглазного давления, двигательные навыки, атаксию, синусовую тахикардию, тремор, нарушения сердечного ритма, уровень проводимости кожи/импеданс, пароксизм, электромиографию (ЭМГ), электрокардиограмму (ЭКГ), фото-плетизмограмму (PPG), кожно-гальваническую реакцию (GSR), низкую восприимчивость к синему и коричневому цвету, зрительную маскировку, латентное нарушение слуха, латентное нарушение зрения, словесно-цветовой тест Струпа, простую реакцию (задачу конфликта), когнитивное переключение установок, логическое мышление, время принятия решений, скорость обработки информации, перцепционный лабиринт, имитируемое вождение, визуальный поиск, оценку времени, восприятие времени, визуальный поиск, тест на продуктивность внимания, копирование символов, зачеркивание букв, тест на вычеркивание D2, тест Брикенкампа D2, числовой копировальный тест (DDCT), символьно-числовую замену (SDST), тест замены цифровых символов (DSST), тест на внимание, внимание, тест слухового внимания, задачу на внимание Wesnes/Warburton, быструю обработку информации, CRT+ отслеживание распределенного внимания, селективное внимание, задачу сосредоточенности внимания, задачу эмоционального внимания, слияние слуховой пульсации, слияние мельканий, критическое слияние мельканий (CFF), постоянное внимание, изучение парных ассоциаций, изучение списка слов, тест 15 слов, вводную выработку условного рефлекса, тест на отсроченное припоминание, тест на отсроченное распознавание слов, тест на отсроченное распознавание картинок, словесное представление, распознавание слов, числовую кратковременную память, числовую память, сканирование памяти, слуховой тест Брауна/Петерсона, зрительный тест Брауна/Петерсона, зрительно-пространственную память, тест фрагментированных картинок, тест Pauli, тест на последовательность блоков, тест на числовую последовательность, тест на числовую последовательность (прямую), тест на числовую последовательность (обратную), словарь WAIS, сходство WAIS, беглость речи, тест беглости речевых ответов, время выполнения операции (тест на отсроченное распознавание слов), время выполнения операции (числовая кратковременная память), время выполнения операции (тест на внимание), время выполнения операции (быстрая обработка информации), время выполнения операции (тест на отсроченное распознавание картинок), время выполнения операции (обработка зрительной информации), время простой реакции CRT, комплекс RTvisual, визуальный выбор RT, VRT, скорость визуальной реакции, ART, слуховую RT, невербальный тест "Лабиринт" на интеллектуальные способности, тест на изображение архимедовой спирали, задание на критическое слежение, тест с построением маршрута, комплекс отслеживания, оценку зрительно-моторной координации с помощью венского прибора, тест на гибкость концентрации внимания, конструирование блоков WAIS, сравнение картинок WAIS, копирование чисел, манипулирование, мелкую моторику, графологический анализ, постукивание, исследование координации горизонтальных движений рук и кистей рук, визуальный тест на дотягивание, двигательный контроль и координацию, двигательное поведение и ЭЭГ.
Подробные описания неинвазивно распознаваемых биомаркеров в контексте фармацевтически активных средств, полученных из каннабиса, включают в себя без ограничения, исследование Zuurman L. с соавт.[British Journal of Clinical Pharmacology, 2009, 67(1), pp. 5-21], которое включено в настоящий документ посредством ссылки, как если бы было изложено полностью.
В контексте некоторых вариантов осуществления настоящего изобретения оценка, наблюдение или запись о субъективно воспринимаемом желаемом/терапевтическом эффекте и/или субъективно воспринимаемом нежелательном/неблагоприятном эффекте может быть использована в любой момент, в том числе, когда неинвазивный биомаркер не доступен для пациента или практикующего, в целях проведения мониторинга PD эффектов для определения предварительно определенного выпаренного количества во время первоначальной калибровки и/или для корректировки количества во время самостоятельного подбора дозы или персонализации устройства, используемого в лечении. Альтернативно, пользователь или практикующий может выбрать не использовать неинвазивный биомаркер по какой-либо причине. Необязательно, измерительное устройство инвазивного биомаркера может быть использовано для контроля количества по меньшей мере одного фармакокинетического эффекта и/или по меньшей мере одного фармакодинамического эффекта, индуцированного средством у пациента, особенно если оно уже установлено в или на пациенте, которое может быть доступно и предоставить требуемую информацию. Согласно некоторым вариантам осуществления по меньшей мере два из воспринимаемого эффекта, неинвазивного биомаркера и инвазивного биомаркера используются для измерения и/или оценки тех же самых или различных PD эффектов, индуцированных у пользователя с помощью одного или нескольких фармацевтически активных средств. Следует отметить, что датчики для мониторинга PD эффектов могут быть использованы в качестве части инструкции и/или автоматического процесса обратной связи для определения и/или корректировки предварительно определенного выпаренного количества средства в режиме оффлайн или в режиме реального времени.
Используемый в настоящем документе термин «в режиме реального времени» относится к указанию (протоколированию, обнаружению, измерению, отчетности, описанию, реакции и т.д.) на событие или серии событий, при которых указание происходит по существу в то же время и/или с той же скоростью, что и событие(я). Под термином «по существу в то же самое время и/или с той же скоростью» подразумевается, что одно событие и его соответствующее указание временно разделены временем отклика, которое находится в диапазоне от нуля до 30 минут (0-30 минут), 0-20 минут, 0-10 минут, 0-5 минут, 0-1 минут, 0-45 секунд, 0-30 секунд, 0-20 секунд, 0-10 секунд, 0-5 секунд, 0-1 секунд, 0-750 миллисекунд, 0-500 миллисекунд, 0-250 миллисекунд, 0-100 миллисекунд, 0-50 миллисекунд, 0-10 миллисекунд или 0-1 миллисекунд.
Необязательно, «в режиме реального времени» относится к указанию (протоколированию, обнаружению, измерению, отчетности, описанию, реакции и т.д.) на событие или ряд событий, при которых указание происходит по существу между введением активного средства и рассеиванием по меньшей мере одного фармакодинамического эффекта, индуцированного у субъекта посредством вводимого средства. Согласно некоторым вариантам осуществления «в режиме реального времени» относится к указанию на событие или ряд событий, происходящих между двумя событиями ингаляционной доставки лекарственных средств, запланированных происходить между введением активного средства до рассеивания по меньшей мере одного фармакодинамического эффекта, индуцированного у субъекта посредством вводимого средства. По желанию, событие или ряд событий «в режиме реального времени» предусматривает корректирование срока и/или количества последующего события ингаляционной доставки лекарственного средства в соответствии с данными, указывающими на один или несколько эффектов более раннего события ингаляционной доставки лекарственного средства. Согласно некоторым вариантам осуществления такое рассеивание означает, что эффект достигает такой степени, которая ниже обнаружения для данного датчика и/или для восприятия пользователем, при определенных обстоятельствах.
В контексте вариантов осуществления настоящего изобретения термин «измерение в режиме реального времени» относится к указанию, сделанному с помощью датчика в ответ на событие, которое происходит у субъекта в связи с датчиком. Согласно некоторым вариантам осуществления измерение в режиме реального времени представляет собой непрерывный, спорадический, регулярный или систематический мониторинг, отчетность, протоколирование, анализ, обработку, представление, отображение и передачу фармакодинамического эффекта назначенным датчиком, который находится в связи с субъектом.
В то время как некоторые PD эффекты, по существу, субъективны, такие, как самооценка уровня симптома, определение некоторых PD эффектов было стандартизировано, с тем, чтобы придать объективности или по меньшей мере предоставить сравнительную шкалу, которая может быть обобщена в популяции субъектов, как и в случае шкал боли, где изменение в уровне боли рассматривается как PD эффект.
Протоколы шкал боли представлены в различных формах и доступны для новорожденных, младенцев, детей, подростков, взрослых, пожилых людей и лиц, у которых нарушена коммуникация. Примеры протоколов шкал боли включают в себя без ограничения шкалу Alder Hey для оценки выраженности боли в баллах у детей, поведенческую шкалу боли (BPS), краткий опросник оценки боли (BPI), список невербальных индикаторов боли (CNPI), руководство по оценке боли при критических состояниях (СРОТ), шкалу COMFORT, опросник боли Даллас, описательную рейтинговую шкалу для оценки интенсивности боли (DDS), болевой индекс по альгезиметру (DPI), систему оценки симптомов Edmonton, модифицированную лицевую шкалу боли (FPS-R), шкалу боли «лицо-ноги-активность-плач-комфорт», алгофункциональный индекс Лекена, опросник выраженности боли МагГилла (MPQ), шкалу боли в шее NPAD, числовую 11-балльную шкалу (BS-11), числовую шкалу боли (NRS-11), индекс инвалидизации Освестри (ODI), шкалу паллиативной помощи (PCOS), опросник Роланда-Морриса «Боль в нижней части спины и нарушение жизнедеятельности» (RMDQ), график оценки службы поддержки (STAS), лицевую шкалу оценки боли Вонга-Бейкера, визуальную аналоговую шкалу (VAS), специфическую для каждого заболевания шкалу боли (DSPI), педиатрический опросник боли (PPQ), параметры боли у недоношенных детей (PIPP), шкалу силы ужалений жалящих перепончатокрылых Шмидта, шкалу силы ужалений жалящих перепончатокрылых Старра, опросник самоэффективности при боли (PSEQ), специфическую для пациента функциональную шкалу (PSFS), поведенческую шкалу оценки боли Колорадо (для пациентов под наркозом), AUSCAN: специфический для заболевания, для оценки результатов лечения остеоартрита рук, Womac: специфический для заболевания, для оценки результатов лечения остеоартрита коленного сустава, оценку исходов ревматоидного артрита в клинических исследованиях по инициативе международного общества по изучению артрита (OARSI-OMERACT) и т.п.
Для неограничивающего примера числовая рейтинговая шкала (NRS-11) представляет собой шкалу из 11 пунктов для самоотчетности пациента о боли для взрослых и детей 10 лет и старше, что обеспечивает числовой уровень боли: 0 представляет собой отсутствие боли; 1-3 представляет собой наличие умеренной боли (ноющей, раздражающей, немного мешающей ADL); 4-6 представляет собой наличие умеренной болезненности (значительно мешает повседневной деятельности или ADL); и 7-10 представляет собой наличие сильной боли (отключение, не в состоянии выполнить ADL).
Для другого не ограничивающего примера визуальная аналоговая шкала (VAS) представляет собой психометрическую шкалу отклика, которая может быть использована в опросных листах или интерактивных интерфейсах пациента; это инструмент для измерения субъективных характеристик или отношений, которые не могут быть механически, химически или физически измерены. При ответе на вопрос VAS респонденты указывают свой уровень согласия на заявление, указав позицию вдоль непрерывной линии между двумя конечными точками. Этот непрерывный (или «аналоговый») аспект шкалы отличает его от дискретных шкал, таких как шкала Лайкерта. Существует доказательство, показывающие, что визуальные аналоговые шкалы имеют превосходные метрические характеристики, по сравнению с дискретными шкалами, таким образом, более широкий диапазон статистических способов может быть применен к измерениям. VAS можно сравнить и провести корреляцию с другими линейными шкалами, такими как шкала Лайкерта или шкала Борга, в то время как чувствительность и воспроизводимость результатов в общих чертах очень похожи, хотя VAS в некоторых случаях может быть более практичной и полезной, чем другие шкалы.
Технология, которая позволяет объективно измерить боль и сочетать в себе несколько из вышеуказанных биомаркеров, предусмотрена, например, в публикациях WO 2009/063463 и WO 2010/134068, которые включены в настоящий документ посредством ссылки, как если бы полностью были изложены в нем. Эта технология предназначена для классификации боли и мониторинга у реагирующих, бодрствующих, полубодрствующих субъектов или субъектов под действием успокоительного средства.
Другие неинвазивные технологии определения содержания биомаркеров, таких как автоматические системы распознавания выражения лица для оценки уровня боли [Ashraf, А.В. et al., Image and Vision Computing, 2009, 27(12), p. 1788-1796; Hu, Y. et ah, Conference: IEEE International Conference on Automatic Face and Gesture Recognition -FGR, 2008, p.1-6] и наноразмерные беспроводные измерительные системы EMG [Yamaguchi, Т. et al., Oral Surg Oral Med Oral Pathol Oral Radiol Endod., 2007 104(5), p. e22-7] для оценки боли и других биомаркеров, могут быть интегрированы в способы, представленные в настоящем документе посредством интерфейсов и систем, как представлено ниже.
Инвазивно распознаваемые биомаркеры включают в себя любой индикатор, который требует того, чтобы датчик быть помещен внутрь тела пациента, включая в себя проникновение через кожу, или требует того, чтобы образец был взят из организма пациента для того, чтобы количественно оценить показатель. Например, забор крови из вены пациента с помощью иглы или с помощью укола кожи, для того чтобы измерить концентрацию любого индикатора или фактора (биомаркера), рассматривается как инвазивное измерение, и, таким образом, эти биомаркеры считаются инвазивно распознаваемыми биомаркерами.
Самостоятельный подбор дозы:
В тех случаях, когда пациент испытывает по какой-либо причине неадекватность заданной дозы и/или схемы лечения, независимо от того, было ли получено предварительно определенное выпаренное количество средства (предварительно установленная доза и/или схема лечения) ндивидуально для данного пациента или нет, пациент, возможно, пожелает скорректировать предварительно определенное количество парообразного средства (дозы и/или схемы лечения) в соответствии с текущим физиологическим состоянием, психическим состоянием или по любой другой причине. Этот вариант рассматривается как самостоятельный подбор дозы средства и представляет собой часть ручного процесса обратной связи для определения предварительно определенного выпаренного количества средства.
Следовательно, когда PD профиль требует повторного выбора, легочная доставка активного средства из устройства MDI дополнительно включает в себя стадии, которые позволяют пациенту самостоятельно подбирать дозу предварительно определенного выпаренного количества или практикующему врачу изменять и корректировать предварительно определенное выпаренное количество средства по мере необходимости.
В соответствии с некоторыми из любых вариантов осуществления настоящего раскрытия легочная доставка фармацевтически активного средства дополнительно предусматривает настройку устройства для доставки откорректированного выпаренного количества средства, в то время как скорректированное выпаренное количество выбирают таким образом, чтобы проявлять вновь выбранный фармакодинамический профиль средства у пациента, в результате чего, после настройки, скорректированное выпаренное количество становится предварительно определенным выпаренным количеством, а повторно выбранный фармакодинамический профиль рассматривается как предварительно выбранный фармакодинамический профиль.
Согласно некоторым вариантам осуществления повторная корректировка осуществляется без повторного определения PK и/или PD эффекта у пациента.
Автоматизированная обратная связь:
В соответствии с некоторыми вариантами осуществления корректировка или повторная корректировка предварительно определенного выпаренного количества средства (дозы и его схемы лечения) предусматривает автоматизированный процесс обратной связи на основании данных персональных фармакодинамических параметров.
Данные персональных фармакодинамических параметров необязательно включают в себя по меньшей мере один субъективно воспринимаемый терапевтический эффект и по меньшей мере один субъективно воспринимаемый неблагоприятный эффект; и могут дополнительно включать в себя по меньшей мере одни данные о содержании биомаркера.
Как обсуждалось выше, автоматически полученное содержание биомаркера может представлять собой инвазивно распознаваемый биомаркер и неинвазивно распознаваемый биомаркер. В соответствии с вариантами осуществления настоящего изобретения автоматически полученное содержание биомаркера представляет собой таковое от неинвазивно распознаваемого биомаркера.
Таким образом, согласно некоторым из любых вариантов осуществления настоящего изобретения, способ дополнительно предусматривает:
автоматизированное измерение, получение или иным образом определение по меньшей мере одного персонального фармакодинамического параметра у пациента в виде воспринимаемого терапевтического и/или воспринимаемого неблагоприятного эффекта и/или концентрации по меньшей мере одного биомаркера, коллективно относящегося в настоящем документе к персональным фармакодинамическим данным обратной связи или информации;
автоматизированное повторное определение скорректированного выпаренного количества средства на основе автоматически полученных персональных фармакодинамических данных обратной связи или общей корректировки дозы и схемы лечения в соответствии с полученными персональными фармакодинамическими данными обратной связи;
автоматизированная настройка устройства для доставки откорректированного выпаренного количества, чтобы, таким образом, проявить предварительно выбранный или повторно выбранный PK и/или PD профиль у пациента;
причем для этого конкретного человека, скорректированное выпаренное количество становится предварительно определенным выпаренным количеством фармацевтически активного средства и повторно выбранный PK и/или PD профиль становится предварительно выбранным PK и/или PD профилем.
В настоящем документе отмечается, что автоматизированное определение любого PD эффекта или автоматизированное определение выпаренного количества фармацевтически активного средства, может полностью или частично применяться в любом из вариантов осуществления настоящего изобретения, включая в себя первоначальную калибровку устройства MDI, повторную настройку устройства в процессе персонализации и/или процесс самостоятельного подбора дозы.
Совместное введение:
Следует отметить, что настоящий способ и/или устройство, в соответствии с некоторыми из любых вариантов осуществления настоящего раскрытия, пригоден для легочного доставки более чем одного фармакологически активного средства пациенту, причем устройство выполнено с возможностью доставки независимо предварительно определенного выпаренного количества каждого средства контролируемо, точно и воспроизводимо.
Согласно некоторым вариантам осуществления совместное введение более чем одного активного средства осуществляют таким образом, чтобы достичь желаемого баланса между терапевтическими (желательными, положительными; требуемыми) эффектами и неблагоприятными (ненужными, отрицательными, нежелательными) эффектами. Такой баланс может быть достигнут, например, когда одно активное средство, в то же время характеризующееся некоторыми прямыми терапевтическими эффектами или их отсутствием, обладает способностью снижать неблагоприятный эффект, вызванный другим совместно вводимым активным средством. В другом примере, различные активные средства вызывают сходные и кумулятивные желаемые эффекты и различные некумулятивные нежелательные эффекты; в этом случае такие два средства могут быть введены совместно, чтобы вызвать кумулятивный (например, двойной) желаемый эффект, при этом индуцируя существенно более низкий (например, один) нежелательный эффект, по сравнению с 2-кратной дозой каждого данного соединения индивидуально. Необязательно, второе средство обладает эффектом, который уменьшает и/или изменяет характер неблагоприятного воздействия первого средства. В таких случаях количество первого средства (и самого желаемого эффекта) может быть увеличено, не увеличивая и, при необходимости, одновременно уменьшая, его нежелательные эффекты. Такой подход позволяет использовать более высокую дозу для достижения желаемого эффекта в лечении, сохраняя при этом низкий уровень неблагоприятных эффектов.
Согласно некоторым вариантам осуществления эти два или более средства могут содержаться в том же самом веществе или более чем в одном веществе. Согласно некоторым вариантам осуществления по меньшей мере одно из средств содержится по меньшей мере в одном растительном материале. Следовательно, в соответствии с некоторыми вариантами осуществления устройство и способ, предусмотренные в настоящем документе, выполнены с возможностью доставки каждого из по меньшей мере двух фармакологически активных средств, независимо в предварительно определенном парообразном количестве, в котором вещество при нагревании в устройстве содержит оба или все эти фармакологически активные средства.
Альтернативно, устройство содержит более чем одно вещество, которое содержит фармакологически активные средства.
Согласно некоторым вариантам осуществления предусмотрен способ легочной доставки субъекту по меньшей мере первого фармакологически активного средства и второго фармакологически активного средства, при котором по меньшей мере одно из средств содержится по меньшей мере в одном растительном материале; способ осуществляется путем независимой доставки средств субъекту с использованием устройства для ингаляции отмеренных доз, выполненного с возможность выпарить по меньшей мере первое предварительно определенное выпаренное количество первого средства и по меньшей мере второе предварительно определенное выпаренное количество второго средства при контролируемом нагревании растительного материала, причем нагревание осуществляют таким образом, что первое предварительно определенное выпаренное количество доставляется субъекту последовательно, параллельно и/или по меньшей мере с частичным перекрыванием со вторым предварительно определенным выпаренным количеством, и причем каждое из предварительно определенного выпаренного количества каждого из средств индуцирует у субъекта независимо по меньшей мере один фармакокинетический эффект и/или по меньшей мере один фармакодинамический эффект.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен способ легочной доставки субъекту по меньшей мере первого фармакологически активного средства и второго фармакологически активного средства, по меньшей мере один из которых содержится по меньшей мере в одном растительном материале; причем способ осуществляется путем:
независимой доставки средств субъекту с использованием устройства для ингаляции отмеренных доз, выполненного с возможность выпаривать по меньшей мере первое предварительно определенное выпаренное количество первого средства и по меньшей мере второе предварительно определенное выпаренное количество второго средства при контролируемом нагревании растительного материала,
причем нагревание осуществляют таким образом, что первое предварительно определенное выпаренное количество доставляется субъекту последовательно, параллельно и/или по меньшей мере с частичным перекрыванием со вторым предварительно определенным выпаренным количеством, и причем каждое из предварительно определенного выпаренного количества каждого из средств индуцирует у субъекта независимо по меньшей мере один фармакокинетический эффект и/или по меньшей мере один фармакодинамический эффект.
Легочная доставка более чем одного активного средства субъекту (пациенту), как правило, известна в настоящей области техники как совместное введение. Используемый в настоящем документе термин «совместное введение» относится к сопутствующему введению более чем одного активного средства субъекту, в то время как в контексте представленных в настоящем документе вариантов осуществления термин «сопутствующее» означает, что совместно вводимые активные средства присутствуют в субъекта (PK) или иным образом индуцируют эффект (PD), в аналогичные, идентичные или частично перекрывающиеся периоды времени. Согласно некоторым вариантам осуществления интервал времени между доставкой по меньшей мере одного средства (первого) и доставкой по меньшей мере одного другого средства (второго) находится в диапазоне от нуля минут до 30 минут.
В контексте совместного введения более чем одного активного средства, термины «по существу одновременно» и «в быстрой последовательности» соответствует используемым в настоящем документе терминам «сопутствующий» и «частично перекрывающийся», а именно, это означает, что период времени между ингаляцией первого средства и ингаляцией второго средства представляет собой достаточно короткий, чтобы можно было их рассматривать как единую ингаляцию. При необходимости, ингаляции происходят в течение 5-30 минут. При необходимости, каждая ингаляция в такой «быстрой последовательности» доставляет пользователю разное количество или композицию из одного или нескольких фармацевтически активных средств. При необходимости, две или более ингаляций обеспечивают одну и ту же композицию и количество одного или нескольких фармацевтически активных средств. Согласно некоторым вариантам осуществления ингаляцию второго средства проводят в такое временя, что первое активное средство, подвергнутое ингаляции ранее, все еще индуцирует по меньшей мере один PD эффект у субъекта. Согласно некоторым вариантам осуществления совместное введение более чем одного активного средства путем его доставки в быстрой последовательности означает, что вдыхаемые средства характеризуются по существу одним и тем же эффектом, которым бы они характеризовались при вдыхании в одной ингаляции.
Согласно некоторым вариантам осуществления временной интервал между доставкой первого средства и доставкой второго средства составляет от нуля минут до 30 минут.
В соответствии с некоторыми вариантами осуществления каждое из этих средств может быть доставлено в предварительно определенном парообразном количестве. Следовательно, представленные в настоящем документе устройство и способ способны и разработаны для доставки множества предварительно определенных выпаренных количеств, причем эти парообразные количества могут быть одинаковыми или разными.
В соответствии с некоторыми вариантами осуществления каждое из этих средств может быть доставлено в предварительно определенный интервал времени. Следовательно, представленные в настоящем документе устройство и способ способны и разработаны для доставки множества предварительно определенных выпаренных количеств в предварительно определенные интервалы времени, причем эти интервалы времени могут быть одинаковыми или различными.
Согласно некоторым вариантам осуществления предусмотренные в настоящем документе устройство и способ способны и разработаны для доставки множества предварительно определенных выпаренных количеств каждого из фармакологически активных средств, причем каждое из предварительно определенных выпаренных количеств и предварительно определенных интервалов времени могут быть одинаковыми или отличными друг от друга.
Согласно некоторым вариантам осуществления совместное введение основано на взаимозависимостях между одним или несколькими PD эффектами, индуцированными отдельными средствами, а именно PD эффект одного средства влияет на уровень PD эффекта, индуцированного другим средством. Например, согласно некоторым вариантам осуществления предварительно определенные парообразные количества первого средства влияют на уровень фармакодинамического эффекта, индуцированного вторым средством. Необязательно, предварительно определенное выпаренное количество первого средства повышает уровень желаемого эффекта, индуцированного вторым средством (потенцирование). Необязательно, предварительно определенное выпаренное количество первого средства снижает уровень нежелательного эффекта, индуцированного вторым средством. Необязательно, первое средство и второе средство индуцируют желаемый эффект синергически.
Согласно некоторым вариантам осуществления способ легочной доставки более чем одного представленного выше активного средства дополнительно предусматривает:
корректировку по меньшей мере одного из первого предварительно определенного выпаренного количества и второго предварительно определенного выпаренного количества таким образом, чтобы достичь предварительно определенного фармакокинетического эффекта и/или предварительно определенного фармакодинамического эффекта на основе данных, указывающих по меньшей мере на один фармакокинетический эффект и/или по меньшей мере один фармакодинамический эффект, индуцированный средством у субъекта.
Согласно некоторым вариантам осуществления способ дополнительно предусматривает получение характеристических данных путем мониторинга по меньшей мере одного фармакокинетического эффекта и/или по меньшей мере одного фармакодинамического эффекта, индуцированного у субъекта по меньшей мере одним из первого средства и второго средства.
В качестве не ограничивающего примера совместное введение ТНС и CBD может быть осуществлено с использованием устройства и способов, предусмотренных в настоящем документе. В этом примере, схема лечения боли осуществляется путем ингаляции ТНС в дозах 5 мг предварительно определенных выпаренных количеств, принимаемых шесть раз в день. Они комбинируются с тремя ингаляциями в день 300 мг CBD для лечения воспаления. Два фармакологически активных средства могут быть введены одновременно или последовательно, а именно в 6-9 ингаляционных сеансах.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен способ выпаривания по меньшей мере первого фармакологически активного средства и второго фармакологически активного средства, по меньшей мере один из которых содержится по меньшей мере в одном растительном материале и пригоден для легочной доставки пациенту, которая осуществляется с помощью устройства для ингаляций отмеренных доз, выполненного с возможностью выпарить по меньшей мере первое предварительно определенное выпаренное количество первого средства и по меньшей мере второе предварительно определенное выпаренное количество второго средства при контролируемом нагревании растительного материала, причем при легочной доставке средств субъекту, нагревание осуществляется таким образом, что первое предварительно определенное выпаренное количество доставляется субъекту последовательно, параллельно и/или по меньшей мере с частичным перекрыванием со вторым предварительно определенным выпаренным количеством, и причем при легочной доставке средств субъекту каждое из предварительно определенных выпаренных количеств каждого из средств индуцирует у субъекта независимо по меньшей мере один фармакокинетический эффект и/или по меньшей мере один фармакодинамический эффект.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрено применение устройства для ингаляции отмеренных доз для испарения по меньшей мере первого фармакологически активного средства и второго фармакологически активного средства, по меньшей мере одно из которых содержится по меньшей мере в одном растительном материале и пригодно для легочной доставки пациенту, причем устройство выполнено с возможностью выпарить по меньшей мере первое предварительно определенное выпаренное количество первого средства и по меньшей мере второе предварительно определенное выпаренное количество второго средства при контролируемом нагревании растительного материала и причем при легочной доставке средств субъекту нагревание осуществляют таким образом, что первое предварительно определенное выпаренное количество доставляется субъекту последовательно, параллельно и/или по меньшей мере с частичным перекрыванием со вторым предварительно определенным выпаренным количеством, и причем при легочной доставке средств субъекту каждое из предварительно определенного выпаренного количества каждого из средств индуцирует у субъекта независимо по меньшей мере один фармакокинетический эффект и/или по меньшей мере один фармакодинамический эффект.
Способ лечения
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен способ лечения пациента, страдающего от медицинского состояния, которое поддается лечению посредством легочной доставки испаряемого фармацевтически активного средства. Способ, в соответствии с некоторыми из любых вариантов осуществления настоящего раскрытия, осуществляется посредством легочной доставки средства пациенту из устройства для ингаляции отмеренных доз, выполненного с возможностью высвобождения по меньшей мере одного предварительно определенного выпаренного количества средства при контролируемом нагревании твердой формы вещества, содержащего средство. Согласно некоторым вариантам осуществления предварительно определенное выпаренное количество средства выбирают таким образом, чтобы проявлять по меньшей мере один предварительно выбранный фармакокинетический профиль и/или по меньшей мере один предварительно выбранный фармакодинамический профиль средства у пациента.
Неограничивающие репрезентативные медицинские состояния, поддающиеся лечению посредством легочной доставки испаряемого фармацевтически активного средства, включают в себя нейропатические боли, фантомные боли, ноцицептивные боли, психогенные боли (психалгию или соматоформные боли), астму, хроническую обструктивную болезнь легких (COPD), болезнь Крона, множественный склероз (MS), генерализованную эпилепсию с фебрильными судорогами плюс (GEFS+), спастичность, синдром Драве, судороги, эпилепсию, психические расстройства, тревожные расстройства, посттравматическое стрессовое расстройство (PTSD), бессонницу, бред, повышение внутриглазного давления, нарушение функции мочевого пузыря, тики, симптомы Туретта, изменения аппетита, сексуальную дисфункцию, воспалительные заболевания кишечника (IBD), синдром раздраженного кишечника (IBS), гипертензию, септический и кардиогенный шок, наркоманию и зависимость, тремор и другие двигательные нарушения.
В соответствии с некоторыми из любых вариантов осуществления настоящего раскрытия способ осуществляется путем использования устройства MDI, которое выполнено с возможностью высвобождения предварительно определенного выпаренного количества таким образом, что отклонение фактического выпаренного количества средства от предварительно определенного выпаренного количества средства составляет 20% или менее, 15% или менее, 10% или менее или 5% или менее предварительно определенного выпаренного количества.
В соответствии с некоторыми из любых вариантов осуществления настоящего раскрытия способ осуществляют таким образом, что отклонение фактического фармакокинетического профиля от предварительно выбранного фармакокинетического профиля составляет 40% или менее, чем предварительно выбранный фармакокинетический профиль. Альтернативно, отклонение составляет 35% или менее, 30% или менее, 25% или менее или 20% или менее. Следует отметить, что отклонение может быть в фармакокинетическом профиле или в одном или нескольких составляющих профиль фармакокинетических параметрах, например, Ct или Cmax. Такие отклонения, как ожидается, будут низкими из-за низкой вариабельности между PK эффектами, полученными при использовании правильного, последовательного и точного устройства MDI.
В соответствии с некоторыми из любых вариантов осуществления настоящего раскрытия способ осуществляют таким образом, что отклонение между воспринимаемым PD профилем и предварительно выбранным PD профиля в любой данный момент времени составляет 25% или менее, 20% или менее, 15% или менее, 10% или менее или 5% или менее. Отклонение между воспринимаемым PD профилем и предварительно выбранным PD профилем в любой данный момент времени может быть оценено путем определения PD эффекта, как описано выше. Отклонение, как ожидается, будет низким также из-за низкой вариабельности между описанными выше PK эффектами.
Так как устройство может быть выполнено с возможностью последовательной доставки любого точного количества таким образом, чтобы проявлять предварительно выбранный или предварительно определенный PD эффект у пациента, предусмотренные в настоящем документе устройство и способ могут осуществлять предварительно выбранный или предварительно определенный профиль PD, который можно тонко регулировать таким образом, чтобы быть:
в пределах уровня ниже, чем минимальный уровень желаемого эффекта (например, ниже терапевтического окна, смотрите фиг. 8, область под нижней горизонтальной пунктирной линией);
в пределах от минимального уровня указанного желаемого эффекта до максимального уровня указанного желаемого эффекта, в котором нежелательный эффект терпимый и/или приемлемый, а именно, по существу низкий или не проявляемый или не воспринимаемый (например, в пределах терапевтического окна, смотрите фиг. 8, область между нижним и верхним горизонтальными пунктирными линиями); а также
в пределах уровня выше, чем минимальный уровень нежелательного эффекта (например, выше терапевтического окна, смотрите фиг. 8, область над нижней горизонтальной пунктирной линией).
Согласно некоторым вариантам осуществления минимальный уровень неблагоприятного эффекта коррелирует с максимальным уровнем терапевтического эффекта, при котором неблагоприятный эффект не обнаружен или не воспринимается.
Согласно некоторым вариантам осуществления уровень фармакодинамического профиля, который выше, чем минимальный уровень неблагоприятного эффекта, представляет собой таковой, при котором более высокий уровень неблагоприятного эффекта представляет собой приемлемый уровень неблагоприятного эффекта. Любой из личных, медицинских и юридических факторов может определить приемлемость уровня неблагоприятного эффекта, например, из личных предпочтений, привычек и выносливости, фармацевтических и профессиональных соображений безопасности, а также правового и социального рассмотрения.
Согласно некоторым вариантам осуществления «минимальный уровень терапевтического эффекта» означает минимальный заметный лечебный эффект. Необязательно, такой минимальный уровень представляет собой по меньшей мере достаточный, чтобы оправдать лечение человека заданной дозой и/или схемой лечения с одним или несколькими веществами. Такое обоснование может быть основано, например, на типе и тяжести неблагоприятных эффектов и на том, что лечение может оказывать минимальное влияние на уровень благополучия пациента. Необязательно, минимальный терапевтический эффект означает минимальный эффект, который воспринимается подвергаемым лечению индивидуумом. Необязательно, обоснованием для введения дозы и/или схемы лечения, направленное на достижение PK/PD эффектов ниже терапевтического окна, может служить достижение профилактического лечения или уменьшение последствий острой боли (приступов неконтролируемой боли) и/или предотвращение возникновения толерантности к лечению.
Как обсуждалось выше, в соответствии с некоторыми из любых вариантов осуществления настоящего раскрытия, предварительно выбранный PD профиль соответствует терапевтическому окну средства у пациента, а именно, находится в диапазоне в пределах от минимального уровня терапевтического эффекта до максимального уровня терапевтического эффекта, при котором неблагоприятное воздействие представляет собой приемлемое.
В любом предварительно выбранном PD профиле, способ и устройство обеспечивают высокую точность и воспроизводимость результатов; следовательно, в соответствии с некоторыми из любых вариантов осуществления настоящего раскрытия отклонение воспринимаемого фармакодинамического профиля от предварительно выбранного фармакодинамического профиля в любой данный момент времени составляет 25% или менее, 20% или менее, 10% или меньше или 5% или менее, ниже предварительно выбранного PD профиля, и/или 25% или менее, 20% или менее, 10% или менее или 5% или менее, выше указанного предварительно выбранного PD профиля.
Не ограничивающие примеры медицинского состояния, которое можно лечить легочной доставкой испаряемого фармацевтически активного средства, представляют собой боль, которая поддается лечению с помощью ТНС, испаряемому из каннабиса.
Устройство для ингаляции отмеренных доз (MDI):
В соответствии с другим аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрено устройство для ингаляции отмеренных доз (MDI), выполненное с возможностью легочной доставки предварительно определенного выпаренного количества по меньшей мере одного фармакологически активного средства пациенту, причем:
устройство выполнено с возможностью доставки указанного предварительно определенного выпаренного количества указанного средства при контролируемом нагревании твердой формы вещества, содержащей указанное средство;
предварительно определенное выпаренное количество выбирают таким образом, чтобы оно обеспечивало предварительно выбранный фармакокинетический профиль и/или предварительно выбранный фармакодинамический профиль средства у пациента; а также
предварительно определенное выпаренное количество получают путем измерения по меньшей мере одного фармакокинетического параметра и/или по меньшей мере одного фармакодинамического параметра, индуцированного легочной доставкой средства в организм пациента из устройства MDI (PK/PD исследования).
В соответствии с аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрен способ управления дозированным ингалятором; причем способ осуществляется путем:
нагревания растительного материала с тем, чтобы испарить по меньшей мере одно предварительно определенное выпаренное количество по меньшей мере одного фармакологически активного средства, содержащегося в растительном материале; а также
контроля предварительно определенного выпаренного количества на основе данных, указывающих по меньшей мере на один фармакодинамический эффект, вызванный средством у субъекта.
В соответствии с аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрен способ работы MDI для легочной доставки субъекту по меньшей мере одного фармакологически активного средства, находящегося в растительном материале; причем способ осуществляется путем:
выбора по меньшей мере одного предварительно определенного выпаренного количества средства таким образом, чтобы достичь по меньшей мере одного предварительно определенного фармакокинетического эффекта и/или по меньшей мере одного предварительно определенного фармакодинамического эффекта, индуцированного средством у субъекта; а также
испарения по меньшей мере одного предварительно определенного выпаренного количества средства с использованием устройства для ингаляции отмеренных доз при контролируемом нагревании растительного материала.
Согласно некоторым вариантам осуществления настоящего изобретения устройство MDI дополнительно выполнено с возможностью связи с электронным блоком интерфейса пациента и интеграции в систему, предназначенную для обеспечения сбора и ввода данных PK/PD, хранения записей о пациентах, автоматической или ручной калибровки, корректировки, сброса и повторного определения исходной предварительной настройки устройства пациентом и/или практикующим врачом, как это будет подробно описано в настоящем документе ниже.
Как указывалось выше и продемонстрировано в PK/PD исследовании, представленном в разделе примеров ниже, вариабельность между PK/PD среди когорты исследования была особенно низкой и обеспечивалась использованием точного и последовательного устройства MDI в соответствии с вариантами осуществления настоящего изобретения.
В соответствии с некоторыми из любых вариантов осуществления настоящего раскрытия предусмотренные в настоящем документе способ и устройство также характеризуются высокой правильностью, последовательностью, точностью и воспроизводимостью результатов, которые выражаются минимальным отклонением между фактическим выпаренным количеством средства, вдыхаемым пациентом, и предварительно определенным выпаренным количеством средства.
В соответствии с некоторыми из любых вариантов осуществления настоящего раскрытия устройство MDI для контролируемого испарения по меньшей мере одного активного фармацевтически активного средства по меньшей мере из одного типа вещества путем применения нагревания содержит:
По меньшей мере один картридж (также называемый в настоящем документе как "единица дозирования"), содержащий вещество, которое содержит по меньшей мере одно активное фармацевтически активное средство;
нагревательный элемент, приспособленный для применения нагревания к веществу, чтобы испарить фармацевтически активное средство, а также
механизм, приспособленный для перемещения картриджа относительно контроллера для питания нагревательного элемента.
Согласно одному варианту осуществления устройство дополнительно содержит вещество, организованное в виде множества картриджей, расположенных в кассете, гирлянде или магазине, причем вещество содержит активное фармацевтически активное средство. Необязательно, активное фармацевтически активное средство представляет собой ограниченное фармацевтически активное средство. При необходимости или дополнительно активное фармацевтически активное средство выбирают из группы, содержащей: тетрагидроканнабинол (ТНС), сальвинорин А, бензоилметилэкгонин, диметилтриптамин, псилоцибин. При необходимости или дополнительно, вещество организовано с предварительно определенным количеством активного фармацевтически активного средства на единицу площади каждого картриджа в кассете, гирлянде или магазине. При необходимости или дополнительно, толщина картриджа составляет от приблизительно 0,2 мм до приблизительно 2,0 мм. При необходимости или дополнительно, кассета, гирлянда или магазин содержит от приблизительно 5 граммов до приблизительно 100 граммов вещества. При необходимости или дополнительно, кассета, гирлянда или магазин содержит достаточное количество активного фармацевтически активного средства по меньшей мере для двух воздействий. При необходимости или дополнительно, картридж содержит первый слой материала, соединенный с веществом, причем первый слой содержит отверстия, достаточно большие, чтобы позволить удаление газов, но достаточно маленькие, чтобы содержать остатки разогретого вещества. При необходимости или дополнительно, диаметр отверстий составляет от 25 мкм до 500 мкм. При необходимости или дополнительно, картридж содержит второй слой материала, соединенный с веществом, при этом второй слой выполнен с возможностью передачи тепла к веществу, по существу, без распределения тепла по второму слою. При необходимости или дополнительно, нагревательный элемент и вещество удерживаются между первым и вторым слоями.
Согласно одному варианту осуществления настоящего изобретения устройство дополнительно содержит ингаляционный блок, причем ингаляционный блок содержит мундштук для ингаляции фармацевтически активного средства, сообщающийся по текучей среде с испарительной камерой устройства, причем испарительная камера содержит парообразное активное фармацевтически активное средство.
По желанию, мундштук содержит односторонний клапан для регулирования потока текучей среды в сторону от испарительной камеры. При необходимости или дополнительно, устройство дополнительно содержит датчик, сообщающийся по текучей среде с мундштуком, причем датчик приспособлен для оценки скорости потока воздуха и посылает сигнал на контроллер, адаптированный для испарения фармацевтически активного средства в соответствии со скоростью воздушного потока.
Согласно одному варианту осуществления настоящего изобретения устройство дополнительно содержит контроллер, выполненный с возможностью синхронизировать применение нагревания с движением картриджа и/или с расходом воздуха, осуществляемым путем ингаляции.
Согласно одному варианту осуществления настоящего изобретения устройство дополнительно содержит электронный блок для управления (контроллер) активацией нагревательного элемента.
Согласно одному варианту осуществления настоящего изобретения устройство дополнительно содержит интерфейс связи для связи с одним или несколькими внешними компьютерами и/или системами, и/или интерфейсами пациента/врача.
Согласно одному варианту осуществления настоящего изобретения устройство дополнительно содержит индикатор дозы для обеспечения визуального вывода испарения фармацевтически активного средства.
Согласно одному варианту осуществления настоящего изобретения устройство является портативным и весит не более 300 граммов.
Согласно одному варианту осуществления настоящего изобретения устройство дополнительно содержит запоминающее устройство, приспособленное для хранения по меньшей мере одного из данных о прописи лекарственного средства и данных об использовании, причем запоминающее устройство соединено с контроллером, выполненным с возможностью управления по меньшей мере одним из нагревательного элемента и механизма в соответствии с данными дозы и/или схемы лечения.
Согласно одному варианту осуществления настоящего изобретения устройство дополнительно содержит уникальный идентификатор, адаптированный для отслеживания использования устройства с помощью ассоциированного пациента.
Согласно одному варианту осуществления настоящего изобретения устройство дополнительно содержит датчик, адаптированный для обнаружения физического нарушения устройства.
В соответствии с вариантом осуществления настоящего изобретения предусмотрен способ контролируемого испарения активного фармацевтически активного средства из вещества, организованного как картридж, причем способ предусматривает
применение нагревания к области картриджа, чтобы испарить предварительно определенное количество активного фармацевтически активного средства, и перемещение картриджа относительно источника тепла.
Альтернативно, нагревательный элемент состоит внутри картриджа, и картридж перемещают относительно электрических контактов для питания нагревательного элемента.
Согласно одному варианту осуществления настоящего изобретения способ дополнительно предусматривает корректировку по меньшей мере одного отсчета времени и скорости перемещения для испарения активного фармацевтически активного средства в соответствии с профилем доставки. По желанию, вещество содержит макроскопическую структуру растений.
Согласно одному варианту осуществления настоящего изобретения испарение предусматривает испарение во время легочной доставки.
Согласно одному варианту осуществления настоящего изобретения применение нагревания предусматривает применение нагревания для достижения заданной температуры менее чем за 500 миллисекунд после сигнала запуска.
В соответствии с вариантом осуществления настоящего изобретения предусмотрен способ контролируемого испарения по меньшей мере одного активного фармацевтически активного средства по меньшей мере из одного вида вещества путем применения тепла, причем способ предусматривает:
нагревание нескольких областей вещества, организованных в виде одного или нескольких картриджей с одним пользовательским переключателем для высвобождения по меньшей мере одного активного фармацевтически активного средства.
Необязательно, области содержат различные активные фармацевтически активные средства.
В соответствии с вариантом осуществления настоящего изобретения предусмотрен способ изготовления картриджа вещества, содержащего активное фармацевтически активное средство, причем картридж приспособлен для использования с устройством для автоматического применения локализованного нагревания, чтобы испарить фармацевтически активное средство, причем способ предусматривает:
измельчение вещества без существенного физического повреждения активного фармацевтически активного средства;
просеивание измельченного вещества для выделения мелких частиц;
измерение концентрации мелких частиц активных фармацевтически активных средств, а также
прессование мелких частиц в картридж.
Согласно одному варианту осуществления настоящего изобретения просеивание выполняется множество раз для выделения частиц различных размеров.
Согласно одному варианту осуществления настоящего изобретения размер частиц варьирует в диапазоне от приблизительно 100 мкм до приблизительно 700 мкм.
Согласно одному варианту осуществления настоящего изобретения прессование выполняют на материале с отверстиями размером меньшим, чем размер мелких частиц.
Согласно одному варианту осуществления настоящего изобретения способ дополнительно предусматривает маркировку картриджа с концентрацией активного фармацевтически активного средства.
В соответствии с вариантом осуществления настоящего изобретения предусмотрен картридж для терапевтического доставки лекарственного средства, содержащего вещество, содержащее активное фармацевтически активное средство, указанное вещество организовано с предварительно определенным количеством активного фармацевтически активного средства на единицу площади указанной кассеты (картриджа), и содержащийся в нем нагревательный элемент.
Согласно одному варианту осуществления настоящего изобретения множество картриджей организованы как рулон из кассеты, гирлянды или магазина.
Иллюстративное применение:
В соответствии с некоторыми вариантами осуществления и аспектами настоящего раскрытия каждый и любой способ, устройство, интерфейс, система или подсистема, представленные в настоящем документе, могут быть использованы для лечения медицинских состояний, поддающихся лечению с помощью фармакологически активного средства, испаряемого из твердого вещества. Согласно некоторым вариантам осуществления настоящего раскрытия вещество представляет собой растительный материал.
Некоторые растения, которые могут быть использованы в контексте настоящего раскрытия включают в себя без ограничения Cannabis sativa, Cannabis indica, Cannabis ruderalis, Acacia spp, Amanita muscaria, Yage, Atropa belladonna, Areca catechu, Brugmansia spp., Brunfelsia latifolia, Desmanthus illinoensis, Banisteriopsis caapi, Trichocereus spp., Theobroma cacao, Capsicum spp., Cestrum spp., Erythroxylum coca, Solenostemon scutellarioides, Arundo donax, Coffea arabica, Datura spp., Desfontainia spp., Diplopterys cabrerana, Ephedra sinica, Claviceps purpurea, Paullinia cupana, Argyreia nervosa, Hyoscyamus niger, Tabernanthe iboga, Lagochilus inebriens, Justicia pectoralis, Sceletium tortuosum, Piper methysticum, Catha edulis, Mitragyna speciosa, Leonotis leonurus, Nymphaea spp., Nelumbo spp., Sophora secundiflora, Mucuna pruriens, Mandragora officinarum, Mimosa tenuiflora, Ipomoea violacea, Psilocybe spp., Panaeolus spp., Myristica fragrans, Turbina corymbosa, Passiflora incarnata, Lophophora williamsii, Phalaris spp., Duboisia hopwoodii, Papaver somniferum, Psychotria viridis, spp., Salvia divinorum, Combretum quadrangulare, Trichocereus pachanoi, Heimia salicifolia, Stipa robusta, Solandra spp., Hypericum perforatum, Peganum harmala, Tabernaemontanaspp, Camellia sinensis, Nicotiana tabacum, Nicotiana rusticum, Virola theidora, Voacanga africana, Lactuca virosa, Artemisia absinthium, Ilex paraguariensis, Anadenanthera spp., Corynanthe yohimbe, Calea zacatechichi, Coffea spp.(Rubiaceae), a Sapindaceae, Camellia spp., Malvaceae spp., Aquifoliaceae spp., Hoodia, spp.Chamomilla recutita, Passiflora incarnate, Camellia sinensis, Mentha piperita, Mentha spicata, Rubus idaeus, Eucalyptus globulus, Lavandula officinalis, Thymus vulgaris, Melissa officinalis и любую часть и любую их комбинацию.
Другие растения и растительные материалы, которые могут быть благотворно использованы, чтобы выпарить по меньшей мере одно фармацевтически активное средство в контексте вариантов осуществления настоящего изобретения, включают в себя без ограничения алоэ лекарственное, дудник, анис, аяуаску (Banisteriopsis caapi), барбарис, белокудренник черный, голубой лотос, лопух, ромашку, тмин, кошачий коготь, гвоздику, окопник, кукурузные рыльца, пырей ползучий, дамиан, одуванчик, эфедру, эвкалипт, энотеру, фенхель, пиретрум, снежное дерево, чеснок, имбирь, гинкго, женьшень, золотарник, гидрастис, готу колу, зеленый чай, гуарану, боярышник, хмель, хвощ, иссоп, Кольский орех, кратом, лаванду, мелиссу, солодку, хвост льва (Wild Dagga), корень мака, алтей, таволгу, молочный чертополох, пустырник, страстоцвет, пассифлору, перечную мяту, колючий мак, портулак, лист малины, красный мак, шалфей, пальму сереноа, Sida Cordifolia, синикуичи (Mayan Sun Opener), мята, аир, могильник (Peganum harmala), чабрец, куркуму, валериану, дикий ямс, полынь, тысячелистник, падуб парагвайский, йохимбе, а также любую часть и любую их комбинацию
Согласно некоторым вариантам осуществления активное средство представляет собой терпеноид, алкалоид или каннабиноид. Например, согласно некоторым вариантам осуществления активное средство представляет собой такой дитерпеноид, как, но без ограничения, сальвинорин А из шалфея. Согласно другим вариантам осуществления активное средство представляет собой такой алкалоид, как, но без ограничения, бензоилметилэкгонин из растения коки, или активное средство представляет собой такой триптамин, как псилоцибин из грибов. Согласно альтернативным вариантам осуществления активное вещество представляет собой диметилтриптамин (DMT) из различных растений. Согласно другим вариантам осуществления активное вещество представляет собой никотин из табака. Согласно дополнительным вариантам осуществления активное вещество представляет собой терпеноид, например, лимонен, а-пинен, Р-мирцен, линалоол, (3-кариофиллен, кариофиллен, неролидол или фитол, присутствующий в различных формах растений.
Согласно некоторым вариантам осуществления растительный материал выбирают из группы, состоящей из Cannabis sativa, Cannabis indica и Cannabis ruderalis, a в соответствии с некоторыми вариантами осуществления растение представляет собой Cannabis sativa.
Каннабис представляет собой природный источник для выпаривания каннабиноидов, которые представляют собой класс разнообразных химических соединений, которые действуют на каннабиноидные рецепторы, обнаруженные в клетках человека и других животных. Каннабиноиды, которые включают в себя эндоканнабиноиды (производимые животными), фитоканнабиноиды (обнаруженные в каннабисе и некоторых других растениях) и синтетические каннабиноиды (изготовленные химически), как известно, связываются с естественным белками-рецепторами и подавляют высвобождение нейротрансмиттеров в головном мозге. Основным психоактивным соединением каннабиса является фитоканнабиноид А9-тетрагидроканнабинол (ТНС).
Каннабидиол (CBD) представляет собой другую важную составляющую растения, составляя до 40% в экстрактах растительной смолы. Существует по меньшей мере 85 различных каннабиноидов, выделенных из каннабиса, проявляющих разнообразные эффекты, которые включают в себя каннабигеролы (CBG), каннабихромены (СВС), каннабинол (CBN), каннабинодиол (CBDL), каннабициклол (CBL), каннабиэлсоин (СВЕ), каннабитриол (СВТ), каннабидиварин (CBDV), тетрагидроканнабиварин (THCV) и другие смешанные типы.
Тетрагидроканнабинол (дельта-9-тетрагидроканнабинол, А9-ТНС; ТНС) представляет собой основной психоактивный компонент растения каннабис.А9-ТНС и Д8-ТНС имитируют действие анандамида, нейромедиатора, вырабатываемого естественным образом в организме млекопитающих. Эти два ТНС производят психоактивные эффекты, связанные с каннабисом, путем связывания с каннабиноидными рецепторами СВ1 и СВ2 в головном мозге; сообщалось, что они проявляют приблизительно равное сродство к рецепторам СВ1 и СВ2. ТНС оказывает облегчение умеренной боли (анальгезирующее средство) и является нейропротектором, в то время как исследования также показывают, что ТНС уменьшает нейровоспаление и стимулирует нейрогенез.
Каннабидиол (CBD) не считается психоактивным, и предполагали, что он не влияет на психоактивность ТНС. Однако последние данные свидетельствуют о том, что курильщики каннабиса с более высоким соотношением CBD/THC были менее склонны испытывать шизофреноподобные симптомы. Это подтверждается психологическими тестами, в которых участники испытывают менее интенсивные подобные психотическим эффекты, когда внутривенный ТНС вводили совместно с CBD.
Каннабидиол характеризуется различным сродством к рецепторам СВ1 и СВ2 по сравнению с ТНС (CBD характеризуется более высоким сродством к рецептору СВ2, чем к рецептору СВ1), но выступает в качестве опосредованного антагониста агонистов каннабиноидов. Недавно было установлен антагонист к предположительно новому рецептору каннабиноидов, GPR55, GPCR, экспрессирующийся в дорсальном стриатуме. Также было показано, что каннабидиол действует в качестве агониста рецептора 5-НТ1А, действие, которое участвует в его антидепрессивном, анксиолитическом и нейропротекторном эффектах. Сообщается также, что CBD облегчает судороги, воспаление, беспокойство и тошноту.
CBD, как известно, играет роль в предотвращении потери кратковременной памяти, связанный с ТНС у млекопитающих. CBD был предложен в качестве терапевтического средства при лечении шизофрении. Исследователи обнаружили способность CBD «отключить» активность 1D1, гена, ответственного за метастаз при злокачественной опухоли молочной железы и других видах злокачественных опухолей, включая в себя особенно агрессивный тройной негативный рак молочной железы.
Следовательно, согласно некоторым вариантам осуществления настоящего изобретения фармакологически активное средство представляет собой каннабиноид, выбранный из группы, состоящей из Δ9-тетрагидроканнабинола (ТНС), каннабидиола (CBD), каннабигеролов (CBG), каннабихроменов (СВС), каннабинола (CBN), каннабинодиола (CBDL), каннабициклола (CBL), каннабиэлсоина (СВЕ), каннабидиварина (CBDV), тетрагидроканнабиварина (THCV) и каннабитриола (СВТ), и в соответствии с некоторыми вариантами осуществления фармакологически активное средство выбирают из группы, состоящей из Δ9-тетрагидроканнабинола (ТНС) и каннабидиола (CBD).
Как уже упоминалось выше, легочная доставка каннабиноидов из каннабиса посредством курения представляет собой наиболее распространенный способ введения, используемый большинством пациентов, которым предписан каннабис. Существенно более редко используемый пероральный маршрут и/или оромукозный маршрут доставки каннабиса или его экстрактов частично связан с медленной и беспорядочной абсорбцией каннабиноидов с пероральным введением, что приводит к задержке начала и часто неудовлетворительной величине обезболивания. Тем не менее, хотя курение доказывает быстрый и эффективный способ доставки каннабиноидов, приводя в результате к первому появлению эффектов приблизительно через 7 минут, биологическая доступность тетрагидроканнабинола (ТНС) гетерогенна и варьирует в пределах от 2 до 56%, в основном, из-за изменчивости в глубине ингаляции, продолжительности вдыхания, времени задержки дыхания, а также того факта, что предполагается, что приблизительно 30% дозы ТНС разрушается путем пиролиза во время курения.
Как обсуждалось выше, в целях повышения эффективности, точности и последовательности введения каннабиноидов путем ингаляции, избегая при этом риска связанных с курением заболеваний, вызванных вредными пиролитическими побочными продуктами, некоторые варианты осуществления настоящего изобретения основаны на использовании свободного от горения и бездымного устройства MDI, такого как описано в WO/2012/085919, которое, как было показано, представляет собой наиболее подходящее для введения в легкие каннабиноидов из каннабиса.
Согласно некоторым вариантам осуществления описанный в настоящем документе способ легочной доставки использует ТНС или, более конкретно, А9-ТНС в качестве фармацевтически активного средства. Согласно некоторым вариантам осуществления доза ТНС (предварительно определенное выпаренное количество) составляет приблизительно 0,1-10 мг, которая, как было показано, представляет собой спасительный анальгетик для гетерогенного разнообразия состояний невротических болей. Такая низкая доза ТНС может испаряться точно и последовательно из натурального каннабиса в количестве, которое варьирует в диапазоне от 5 до 50 мг, от 6 до 50 мг, от 7 до 40 мг, от 8 до 40 мг, от 8 до 30 мг, от 9 до 40 мг, от 9 до 35 мг, от 10 до 35 мг, от 11 до 30 мг, от 12 до 30 мг, от 12 до 27 мг или от 12 до 25 мг, в зависимости от общего количества Δ9-ТНС, доступного в каннабисе. Согласно некоторым предпочтительным вариантам осуществления каннабис содержит приблизительно 20% Δ9-ТНС, и используемое в ингаляторе для каждой дозы количество каннабиса варьирует в диапазоне от 15,0 до 25,0 мг.
Согласно некоторым вариантам осуществления одна доза 3,08±0,02 мг общего доступного Δ9-ТНС в образце каннабиса, содержащего приблизительно 20% Δ9-ТНС, доставляемого в одной ингаляции, повышала уровень в плазме Cmax Δ9-ТНС у пациента до 38±10 нг/мл и обеспечивала снижение на 45% интенсивности боли, которая реверсировала в течение 90 минут.
Как показано PK/PD исследованием, представленным в разделе Примеры, который следует ниже, загрузка MDI аликвотами каннабиса, равными приблизительно 15 мг, и нагревание каждой до приблизительно 190°С в течение менее чем приблизительно 3 секунд, приводило приблизительно к 52% от общего объема Δ9-ТНС, доступного для ингаляции в растительном материале. Такой высокий выход Δ9-ТНС представляет собой выдающийся по сравнению с выходом Δ9-ТНС, измеренным в различных типах процедур курения, известных в настоящей области техники. Например, сообщалось, что обеспечиваемое курением содержание Δ9-ТНС в плазме варьировало в широких пределах и составляло только приблизительно 20-37%) от общего объема Δ9-ТНС, доступного для ингаляции в растительном материале, причем оставшаяся часть теряется посредством сгорания (23-30%) и побочного потока дыма (40-50%). Кроме того, даже с применением обычно используемых испарителей и способов испарений, таких как Volcano®, нагревание до 200°С дозы 200 мг сырых цветочных верхушек каннабиса, содержащий 18% ТНС, приводило к доставке ТНС, составляющей всего 22%. Эта разница в эффективности экстракции между различными испарителями, известными в настоящей области техники, и описанным в настоящем документе устройством MDI и способами основана, в частности, на различных уникальных механических атрибутах MDI, что позволяет достигать точности и последовательности, необходимой для калибровки PK/PD.
Среди других выгодных свойств представленных в настоящем документе способов и устройств, которые включают в себя, в соответствии с некоторыми их вариантам осуществления, выпаривание каннабиноидов из каннабиса при температурах 155-218°С, было показано, что содержание полициклических ароматических углеводородов, а также окиси углерода, бензола, толуола и твердых частиц смолы было значительно снижено в газопаровой фазе каннабиса. Этот вывод резко контрастирует с продуктами, производимыми при курении каннабиса. В то время как продукты сгорания не контролировались, вредное потребление из устройства MDI, используемого в соответствии с настоящим изобретением, как ожидается, будет очень небольшим, если таковое вообще имеется, на основании следующих наблюдений: (1) каждая доза состояла из небольшого количества (приблизительно 15 мг) каннабиса с высокой концентрацией ТНС (приблизительно 20%); (2) в отличие от сжигаемого каннабиса, который превращался в пепел, остаточный материал, после выпаривания, характеризуется внешним видом с устойчивым янтарным цветом; (3) пациенты не сообщали об ощущении жжения верхних дыхательных путей; (4) отсутствовало увеличение каннабинола (продукта окисления ТНС) при измерении в остатках; и (5) не обнаруживалось превращение Δ9- в Δ8-ТНС в остатках.
Авторами настоящего изобретения было показано, что PK/PD профиль Δ9-ТНС аналогичен ранее описанному в настоящей области техники с использованием очищенного и таким образом количественно измеренного Δ9-ТНС.Как показано в следующем разделе примеров, способ ингаляции, применяемый авторами настоящего изобретения, характеризуется успешным получением легочной доставки ТНС, который характеризуется быстрым поглощением, с последующим бифазным снижением концентрации в плазме с течением времени: фаза быстрого спада, соответствующая распределению ТНС в тканях и обширному хранению, за которой следует фаза пролонгированного высвобождения из жировой ткани в кровь и элиминацию.
Авторы настоящего изобретения сравнивали максимальную концентрацию в плазме (Cmax) Δ9-ТНС, полученную посредством бездымной ингаляции в соответствии со способом, описанным в настоящем документе, с уровнями Cmax, известными в настоящей области техники для различных маршрутов доставки каннабиса. Как уже обсуждалось в разделе примеров в настоящем документе ниже, описанный в настоящем документе способ ингаляции приводил к наибольшему росту Cmax на мг ТНС, доступного в используемом материале с каннабиноидами - среднее значение 12,3 нг/мл/мг ТНС по сравнению с 6,1-9,0 для испарителя Volcano и 0,6-4,6 для обычного курения сигарет.Кроме того, изменчивость между индивидуумами в пиковые концентрации ТНС, полученные описанным в настоящем документе способом, была значительно ниже по сравнению с индивидуальной изменчивостью, полученной в настоящей области техники: 25,3% против 47-85% для испарителя, 32-115% для курения сигарет, 42-115% для перорального введения и 59-67% для маршрута доставки через слизистую ротовой полости.
Таким образом, согласно некоторым вариантам осуществления высокая разрешающая способность в определении и регулировании количества фармацевтически активного средства обеспечивается описанным в настоящем документе способом легочной доставки. Согласно некоторым вариантам осуществления отдельные предварительно выбранные парообразные количества (дозы), например, ТНС, выпускаются электронными средствами (путем нагревания предварительно взвешенной навески каннабиса), с шагом в количестве 0,1 мг, варьируя в пределах от 0,1 до 6,0 мг, от 0,3 до 1,7 мг, от 0,1 до 2,0 мг, от 0,2 до 1,9 мг, от 0,2 до 1,8 мг, от 0,3 до 1,8 мг, от 0,3 до 1,6 мг, от 0,4 до 1,6 мг, предпочтительно от 0,5 до 2,0 мг, от 0,6 до 2,0 мг или от 0,3 до 0,9 мг, включая в себя любые подгруппы и любые промежуточные значения между ними.
В соответствии с вариантами осуществления предусмотренного в настоящем документе способа прогнозирующие протоколы PK/PD разрабатывают для парообразных каннабиноидов на основании клинических данных, накопленных в индивидуальном порядке для каждого пациента, а также на когорте больных, которые составляют от вводимой дозы и схемы лечения на основании индивидуальных и популяционных параметров, как описано выше. Эти протоколы точно имитируют профиль PK пациента после доставки предварительно определенной дозы или предварительно определенной схемы лечения, и параллельно предсказывают профиль PD, который состоит из облегчения симптомов (терапевтический эффект) и психоактивных уровней (неблагоприятный эффект). После того, как терапевтический уровень, а также неблагоприятный психоактивный уровень коррелирует с PK и параметрами пациента, получают сравнительно узкое терапевтическое окно, в котором устройство MDI может точно поддерживаться у пациента за счет автоматизации конкретных предварительно выбранных выпаренных количеств (доз и/или схемы лечения).
При вводе данных о пациентах протокол вычисляет рекомендованную дозу и схему лечения для этого конкретного пациента, чтобы оставаться в пределах терапевтического окна в течение определенного интервала времени.
Согласно одному варианту осуществления расчетная доза и схема лечения, чтобы остаться в пределах терапевтического окна в течение 3 часов у 35 летнего пациента мужского пола, характеризующегося ИМТ от 22, составляет 1,2 мг при t=0; 1,0 мг при t=10 мин; и 0,5 мг при t=60 мин (смотрите фиг. 8).
В соответствии с этими вариантами осуществления устройство выборочно вводит различные дозы через разные промежутки времени, чтобы не допустить неблагоприятных эффектов, при этом все еще облегчая симптомы.
Система для легочной доставки:
Как уже говорилось выше, предусмотренные в настоящем документе способ и устройство весьма подходят для персонализации, самостоятельного подбора дозы, механизации и автоматизации в противном случае сложного и затруднительного способа введения и лечения различных заболеваний; в то время как любой персонализированный протокол лечения представляет собой проблемы, лечение, основанное на легочной доставки активных средств, выпаренных под воздействием тепла из натуральных веществ, представляет собой задачу, которая не была достигнута до сих пор.
Так как проблема точности, согласованности и воспроизводимости решается с использованием раскрытого в настоящем документе устройства MDI и так как была выполнена необходимость в калибровке и предварительной установке устройства, чтобы оставаться в пределах желаемого терапевтического окна, основанного на широко принятых экспериментальных PK/PD параметрах, как раскрыто в настоящем описании, авторы настоящего изобретения задумали интегрированную систему, которая может управлять устройством с использованием вводных данных, собранных из различных источников, с тем, чтобы обеспечить персонализированное и эффективное лечение для любого данного пациента, а также в режиме реального времени.
В соответствии с аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрена система, которая включает в себя:
устройство для ингаляции отмеренных доз для легочной доставки субъекту по меньшей мере одного предварительно определенного выпаренного количества по меньшей мере одного фармакологически активного средства, находящегося в растительном материале, путем контролируемого нагревания растительного материала с тем, чтобы выпарить предварительно определенное выпаренное количество средства из растения; а также
контроллер, связанный с ингаляционным устройством и выполненный с возможностью управлять предварительно определенным выпаренным количеством.
В соответствии с аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрена система легочной доставки субъекту по меньшей мере одного фармакологически активного средства, находящегося в растительном материале; система включает в себя:
устройство для ингаляции отмеренных доз, выполненное с возможностью выпарить по меньшей мере одно предварительно определенное выпаренное количество средства при контролируемом нагревании растительного материала; а также
контроллер, выполненный с возможностью выбора по меньшей мере одного предварительно определенного выпаренного количества средства таким образом, чтобы достичь по меньшей мере одного предварительно определенного фармакокинетического эффекта и/или по меньшей мере одного предварительно определенного фармакодинамического эффекта, индуцированного средством у субъекта.
В соответствии с аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрена система для легочной доставки субъекту по меньшей мере первого фармакологически активного средства и второго фармакологически активного средства, по меньшей мере одно из которых содержится по меньшей мере в одном растительном материале; система включает в себя:
устройство для ингаляции отмеренных доз, выполненное с возможностью независимой доставки средств субъекту путем нагревания по меньшей мере одного растительного материала, чтобы выпарить по меньшей мере первое предварительно определенное выпаренное количество первого средства и по меньшей мере второе предварительно определенное выпаренное количество второго средства; а также
контроллер, выполненный с возможностью осуществлять нагревание первого предварительно определенного выпаренного количества последовательно, параллельно и/или по меньшей мере с частичным перекрыванием со вторым предварительно определенным выпаренным количеством,
причем каждое из предварительно определенных выпаренных количеств каждого из средств выбирают таким образом, чтобы индуцировать у субъекта независимо по меньшей мере один фармакокинетический эффект и/или по меньшей мере один фармакодинамический эффект.
В соответствии с аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрена система, которая включает в себя:
устройство для ингаляции отмеренных доз для легочной доставки субъекту по меньшей мере одного предварительно определенного выпаренного количества по меньшей мере одного фармакологически активного средства, находящегося в растительном материале, путем контролируемого нагревания растительного материала с тем, чтобы выпарить предварительно определенное выпаренное количество средства из растения; а также
контроллер, связанный с ингаляционным устройством и выполненный с возможностью управления предварительно определенным выпаренным количеством,
причем контроллер выполнен с возможностью получения данных о рабочих настройках, относящихся к предварительно определенному выпаренному количеству, от устройства дистанционного управления. Согласно некоторым вариантам осуществления устройство дистанционного управления выполнено с возможностью приема данных, указывающих по меньшей мере на один фармакодинамический эффект, индуцированный средством у субъекта, и дополнительно выполнено с возможностью определения и передачи данных о рабочих настройках, относящихся к предварительно определенному выпаренному количеству.
В соответствии с аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрена система, которая включает в себя:
устройство для ингаляции отмеренных доз для легочной доставки субъекту по меньшей мере одного предварительно определенного выпаренного количества по меньшей мере одного фармакологически активного средства, находящегося в растительном материале, путем контролируемого нагревания растительного материала с тем, чтобы выпарить предварительно определенное выпаренное количество средства из растения, а также
контроллер, связанный с ингаляторным устройством и выполненный с возможностью управлять предварительно определенным выпаренным количеством на основе данных, указывающих по меньшей мере на один фармакодинамический эффект, вызванный средством у субъекта.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предусмотрена система, которая включает в себя устройство для ингаляции отмеренных доз для легочной доставки по меньшей мере одного предварительно определенного количества по меньшей мере одного фармакологически активного средства субъекту. Система дополнительно включает в себя по меньшей мере один датчик для контроля по меньшей мере одного фармакодинамического эффекта у субъекта, индуцированного средством, например, психоактивного эффекта; и блок обработки, связанный с ингаляционным устройством и с указанным по меньшей мере одним датчиком. Согласно некоторым вариантам осуществления блок обработки выполнен с возможностью определения предварительно определенного количества, основанного на данных, полученных от датчика. Количество, которое определяется и контролируется, может представлять собой однократную дозу или схему лечения.
Характеристические данные можно получить из различных источников, таких, как статистические данные фармакодинамического эффекта, индуцированного средством в популяции, истории болезни пользователя, предпочтений и привычек, рецепта врача и тому подобное. Согласно некоторым вариантам осуществления характеристические данные можно получить с помощью по меньшей мере одного датчика, выполненного с возможностью контроля фармакодинамических эффектов у субъекта и/или через устройство интерфейса пользователя, выполненного с возможностью ввода данных, полученных от таких датчиков. Согласно некоторым вариантам осуществления контроллер выполнен с возможностью принимать характеристические данные, имеющие отношение к фармакодинамическому эффекту от датчика и/или устройства интерфейса пользователя.
Согласно некоторым вариантам осуществления контроллер находится в прямой и/или опосредованной связи с датчиком и/или устройством интерфейса, а именно, контроллер может быть связан с помощью прямой связи с источником характеристических данных (датчиком и/или устройством интерфейса) или быть связан с подобными объектами с помощью устройства дистанционного управления.
Согласно некоторым вариантам осуществления система включает в себя описанное выше ингаляционное устройство, описанный выше контроллер и по меньшей мере один описанный выше датчик и/или пользовательский интерфейс, каждый из которых выполнен независимо, чтобы предоставить контроллеру данные, указывающие по меньшей мере на один PD эффект, индуцированный активным средством у субъекта.
В соответствии с аспектом некоторых вариантов осуществления настоящего раскрытия предусмотрена система, которая включает в себя без ограничения:
устройство для ингаляции отмеренных доз для легочной доставки субъекту по меньшей мере одного предварительно определенного выпаренного количества по меньшей мере одного фармакологически активного средства, содержащегося в растительном материале, путем контролируемого нагревания растительного материала с тем, чтобы выпарить предварительно определенное выпаренное количество средства из растения,
по меньшей мере один датчик для контроля по меньшей мере одного фармакодинамического эффекта у субъекта, индуцированного средством, и/или устройство пользовательского интерфейса для вводимых данных, полученных по меньшей мере от одного датчика, для контроля по меньшей мере одного фармакодинамического эффекта у субъекта, индуцированного средством; а также
контроллер, связанный с ингалятором и по меньшей мере с одним датчиком.
Согласно некоторым вариантам осуществления используемый в системе и описанный в настоящем документе контроллер выполнен с возможностью управления предварительно определенным выпаренным количеством путем регулирования нагревания вещества (например, растительного материала). Контролируемое нагревание растительного материала осуществляется, например, путем регулирования по меньшей мере одного из следующего: температуры нагревания, профиля нагревания (какую часть растительного материала нагревают), скорости нагревания (сколько раз растительный материал подвергается воздействию тепла), длительности нагревания (как долго растительный материал подвергается воздействию тепла в любом данном событии нагревания) и любой их комбинации.
Согласно некоторым вариантам осуществления контроллер выполнен с возможностью управления предварительно определенным выпаренным количеством путем регулирования воздушного потока в ингаляционном устройстве, например, путем управления отверстием протока, клапанами и жалюзи в ингаляционном устройстве.
Согласно некоторым вариантам осуществления контроллер выполнен с возможностью управления предварительно определенным выпаренным количеством путем управления временем одного или нескольких ингаляционных событий. Например, предварительно определенное выпаренное количество поставляется в более чем одном событии ингаляции, и контроллер выполнен с возможностью формирования по меньшей мере одного сигнала тревоги для субъекта использовать ингалятор в указанные моменты времени с указанными временными интервалами и любым другим графиком таким образом, чтобы завершить легочную доставку предварительно определенного выпаренного количества субъекту.
Согласно некоторым вариантам осуществления посредством управления вышеуказанными параметрами нагревания и воздушного потока в ингаляционном устройстве, контроллер используется для корректировки предварительно определенного выпаренного количества таким образом, чтобы достичь предварительно определенного фармакокинетического эффекта и/или предварительно определенного фармакодинамического эффекта, основанного на фармакодинамическом эффекте. Согласно некоторым вариантам осуществления контроллер выполнен с возможностью осуществления корректировки предварительно определенного выпаренного количества в режиме реального времени.
В общем, контроллер используется для выполнения более сложных планов лечения, таких, как схема лечения, доставка более чем одного активного средства, каждое из которых характеризуется разной дозой и/или схемой введения, и/или других связанных с дозой и временем корректировок. Согласно некоторым вариантам осуществления контроллер может быть выполнен с возможностью настройки схемы лечения таким образом, чтобы достичь предварительно определенного фармакокинетического эффекта и/или предварительно определенного фармакодинамического эффекта, основанного на фармакодинамическом эффекте. Согласно некоторым вариантам осуществления контроллер выполнен с возможностью осуществления предварительно определенной схемы лечения, которая предусматривает доставку по меньшей мере двух предварительно определенных выпаренных количеств. Согласно некоторым вариантам осуществления контроллер выполнен с возможностью корректировки в реальном времени различных рабочих настроек ингаляционного устройства и параметров легочной доставки.
Согласно некоторым вариантам осуществления система дополнительно включает в себя или может быть в связи с устройством интерфейса пользователя, который может быть использован для ввода информации и данных в контроллер и/или для отображения, передачи или иного ввода данных и информации от контроллера. Согласно некоторым вариантам осуществления интерфейс пользователя включает в себя устройство вывода для предоставления информации по меньшей мере одному из следующих: субъекту, практикующему врачу, блоку памяти и дистанционному устройству (серверу, дисплею, системе/устройству дистанционного мониторинга и т.п.). Согласно некоторым вариантам осуществления устройство интерфейса пользователя включает в себя устройство-смартфон. Смартфон может включать в себя сенсорный экран, микрофон, динамик, приемник GPS, акселерометр, термометр, детектор света и тому подобное.
Согласно некоторым вариантам осуществления контроллер выполнен с возможностью мониторинга по меньшей мере одного из по меньшей мере одного предварительно определенного фармакокинетического эффекта и/или по меньшей мере одного предварительно определенного фармакодинамического эффекта на основе данных, полученных через устройство интерфейса пользователя. Соответственно, контроллер выполнен с возможностью корректировки предварительно определенного выпаренного количества в режиме реального времени.
Фиг. 9 представляет собой принципиальную схему системы, содержащей устройство MDI (также называемое в настоящем документе «ингаляционным устройством»), интерфейс врача и/или интерфейс пациента, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Согласно некоторым вариантам осуществления устройство MDI 901 выполнено с возможностью связи с интерфейсом врача 903 и/или с интерфейсом пациента 905. Согласно некоторым вариантам осуществления устройство MDI 901 выполнено с возможностью приема входных данных от одного или обоих интерфейсов 903 и/или 905. Дополнительно или альтернативно, устройство MDI 901 выполнено с возможностью посылать выходные данные одному или обоим интерфейсам 903 и/или 907.
Согласно некоторым вариантам осуществления связь между компонентами системы осуществляется с помощью одного или нескольких средств передачи данных, таких как соединение USB, кабельное соединение, беспроводное соединение и/или любой подходящий проводной и/или беспроводной протокол связи.
Согласно некоторым вариантам осуществления связь между компонентами системы осуществляется через один или несколько коммуникационных модулей, таких как модуль связи 907 устройства MDI 901, модуль связи 909 интерфейса врача 903 и/или модуль связи 911 интерфейса пациента 905.
Согласно некоторым вариантам осуществления устройство MDI 901 содержит контроллер 913, выполненный с возможностью, например, активации нагревания вещества, тем самым испаряя активное средство, регулировки профиля нагревания и/или активации нагревания, регулировки механизма подачи кассеты устройства MDI, считывания данных из запоминающего устройства 919 устройства MDI 901, управления потреблением энергии и/или другими функциями. Согласно некоторым вариантам осуществления контроллер 913 осуществляет связь с запоминающим устройством 919. Дополнительно, запоминающее устройство 919 выполнено с возможностью хранения рецептурных данных, персональных данных об использовании, данных о пациенте, персональных PD эффектов, полученных от пациента, модификаций дозы и/или схемы лечения, параметров, полученных от пациента в ответ на изменение в дозе и/или схеме лечения и/или других ценностей или информации. Согласно некоторым вариантам осуществления контроллер 913 активирует легочную доставку активного средства в соответствии с данными о дозе и/или схеме лечения, хранимыми в запоминающем устройстве 919. Согласно некоторым вариантам осуществления запоминающее устройство 919 выполнено с возможностью хранения данных об использовании и/или данных об обратной связи от пациента относительно конкретной дозы и/или схемы лечения и/или по отношению к предварительно выбранному (желательному) PD профилю активного средства в организме пациента.
Согласно некоторым вариантам осуществления интерфейс врача 903, содержащий, например, одно или несколько из контроллера 915, запоминающего устройства 921 и/или модуля связи 909, настроен на персональный компьютер (планшетный компьютер, портативный компьютер, настольный компьютер или другие), мобильное устройство, такое как смартфон, портативное устройство, носимое устройства, наручное устройство или встроенное в защитные очки устройство, монитор клиники или больницы и/или любое другое подходящее устройство. По желанию, врачу предоставляется удаленный доступ к устройству MDI 901. Дополнительно или альтернативно, врач непосредственно активизирует устройство MDI 901. Согласно некоторым вариантам осуществления врач предварительно программирует (предварительно калибрует или устанавливает) устройство MDI 901 с предварительно определенным выпаренным количеством (дозой и/или схемой введения), подходящим для конкретного пациента. Согласно некоторым вариантам осуществления данные посылаются от интерфейса врача 903 к интерфейсу пациента 905, например для инструктирования пациента или для осуществления предварительно настроенных корректировок.
Согласно некоторым вариантам осуществления интерфейс пациента 905, содержащий, например, одно или несколько из следующего: контроллер 917, запоминающее устройство 923 и/или модуль связи 911, настроен на персональный компьютер (планшетный компьютер, портативный компьютер, настольный компьютер или другие), мобильное устройство, такое как смартфон, и/или на само устройство MDI 901.
Согласно некоторым вариантам осуществления интерфейс пациента 905 принимает входные данные 929. Входные данные могут быть получены от одного или нескольких из следующего: пациент, интерфейс врача, сервер базы данных, устройство MDI. Примеры различных типов входных данных могут включать в себя дозу и/или схему лечения, определенную врачом и полученную через интерфейс врача, текущий персональный PD эффект пациента, внесенный пациентом и/или полученный от пациента, статистические данные личного пользования, записанные, например, на сервере базы данных и/или в запоминающем устройстве устройства MDI, указание продолжительности ингаляции и/или объема ингаляции, считанное устройством MDI, и/или другие типы вводных данных.
Согласно некоторым вариантам осуществления интерфейс пациента 905 содержит дисплей 927. Необязательно, дисплей представляет собой интерактивный дисплей, например, сенсорный экран смартфона, портативного устройства, носимого устройства, наручного устройства или встроенного в защитные очки устройства.
В некоторых случаях, некоторые функции, такие как передача данных врачу, получение доступа к базе данных, чтобы получить такую информацию, как инструкции пользователя/пациента, и/или другие функции активируются с помощью интерфейса пациента 905, в то время как другие функции, такие как изменение предварительно определенного выпаренного количества (дозы) и/или схемы лечения (множество доз), просмотр протоколов других пациентов и/или другие функции не разрешены посредством интерфейса пациента 905. При необходимости, врач устанавливает определения доступа интерфейса пациента на отдельного пациента.
Согласно некоторым вариантам осуществления интерфейс пациента 905 и/или устройство MDI 901 выполнены с возможностью уведомлять пациента каждый раз о необходимости легочной доставки (ингаляция).
При необходимости, уведомление осуществляется автоматически на основании запланированной схемы лечения, хранящейся в запоминающем устройстве. Дополнительно или альтернативно, уведомление устанавливается пациентом. Дополнительно или альтернативно, уведомление выдается лечащим врачом.
Согласно некоторым вариантам осуществления один или несколько компонентов системы осуществляет связь с сервером базы данных 925 путем приема вводимых данных из базы данных и/или отправки информации в базу данных. Согласно некоторым вариантам осуществления база данных содержит индивидуальные данные пациента, например, включая в себя историю болезни пациента, данные, передаваемые с помощью устройства MDI 901, входные данные от врача, входные данные от пациента и/или другую информацию. Необязательно, сервер базы данных выполнен с возможностью выполнения вычислений над данными. Согласно некоторым вариантам осуществления сервер базы данных 925 содержит коллективные данные, включающие в себя, например, одно или несколько из следующего: клинические результаты экспериментов, результаты других пациентов, данные исследований и/или другие данные. Необязательно, сервер базы данных 925 осуществляет связь со множеством систем обработки, используемых различными пациентами. Данные различных взаимодействий между пациентами и устройством MDI собирают в центральной базе данных, непрерывно изучая индивидуальные профили использования пациентов и рекомендуя дозу и/или схему лечения, соответственно. Использование коллективной базы данных пользователей может улучшить создание точной предсказательной дозы и/или схемы лечения для существующих и новых пациентов, улучшение общего терапевтического показателя успешности лечения.
Согласно некоторым вариантам осуществления в соответствии с персональными данными обратной связи, полученными от пациента с использованием устройства MDI 901 и/или с помощью интерфейса пациента 905, предварительно определенное выпаренное количество (доза и/или схема лечения) автоматически изменяется с помощью контроллера 917 интерфейса пациента и/или контроллера 913 устройства MDI для компенсации неадекватных настроек или неправильного использования устройства MDI, например, в ситуации, в которой пациент не использует устройство MDI, когда предписано, и/или использование устройства MDI осуществляется в отличное от заданной схемы лечения время. В ответ может быть принято одно или несколько действий, например, отсрочка следующей дозы, увеличение или уменьшение следующей дозы (и/или следующих доз) и/или иное изменение схемы лечения.
Согласно некоторым вариантам осуществления пациент с использованием устройства MDI 901 может пожелать запланировать свои дозу и/или схему лечения таким образом, при котором возможные неблагоприятные эффекты меньше мешают повседневной деятельности пациента. В то время как некоторые неблагоприятные эффекты переносимы в домашних условиях или в определенное время суток и являются приемлемым компромиссом для облегчения симптомов, эти неблагоприятные эффекты могут быть нежелательны, когда пациент занимается такой деятельностью, как вождение, участие в совещании и/или другие виды деятельности. По желанию, используя интерфейс пациента 905 и/или путем прямой активации устройства MDI 901, пациент настраивает дозу и/или схему лечения таким образом, чтобы меньше препятствовать своей планируемой деятельности.
Дополнительно или альтернативно, устройство MDI 901 и/или интерфейс пациента 905 выполняют с возможностью активно навязывать определенную дозу и/или схему лечения, например, на основе входных данных от пациента. Например, пациент вносит свои запланированные ежедневные мероприятия и сроки проведения этих мероприятий, а доза и/или схема лечения автоматически изменяется соответствующим образом. Необязательно, доза и/или схема лечения автоматически изменяется, чтобы гарантировать, что пациент находится в подходящем состоянии для выполнения намечаемой деятельности, например, гарантируя, что во время вождения уровень неблагоприятного эффекта является относительно низким или не воспринимается.
Согласно некоторым вариантам осуществления пациент может добровольно изменить дозу и/или схему лечения, например, с использованием интерфейса пациента 905. При необходимости, степень модификации представляет собой ограниченную, чтобы предотвратить состояние, при котором пациент находится в опасности, например, предотвратить передозировку.
Согласно некоторым вариантам осуществления пациент может просто использовать устройство MDI901, даже если специально не предписано. В таком случае, следующая доза и/или схема лечения могут быть автоматически модифицированы в ответ на использование. По желанию, пациент получает уведомление о модификациях в дозе и/или схеме введения через интерфейс пациента 905. Дополнительно или альтернативно, врач получает уведомление о таких модификациях, например, через интерфейс врача 903.
Фиг. 10 представляет собой блок-схему способа назначения схемы лечения пациенту с использованием устройства MDI для доставки по меньшей мере одного активного средства, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Согласно некоторым вариантам осуществления врач может принять решение лечить пациента путем осуществления легочной доставки одного или нескольких активных средств с помощью устройства MDI (1001).
Согласно некоторым вариантам осуществления данные о пациенте, такие как одно или несколько, например, из следующего: PK переменные (например, возраст, пол, индекс массы тела и т.д.), патофизиологический статус, фармакогенетические и/или фармакогеномические переменные и/или другие параметры, вносимые в систему (1003), например, врачом и/или другим клиническим персоналом. Необязательно, параметры пациента и персональные переменные вносят с помощью интерфейса врача.
Согласно некоторым вариантам осуществления создают предполагаемую дозу и/или схему лечения (1005). Необязательно, дозу и/или схему лечения создают автоматически, например, с помощью программного обеспечения интерфейса врача. Дополнительно или альтернативно, доза и/или схема лечения планируется врачом. Согласно некоторым вариантам осуществления дозу и/или схему лечения создают путем сопоставления внесенных данных пациента с предварительно определенной дозой и/или схемой лечения с использованием данных из базы данных или в соответствии с персональными данными обратной связи, или, например, в соответствии со справочной таблицей.
Согласно некоторым вариантам осуществления производится (1007) моделирование ожидаемого PK/PD профиля пациента для выбранной дозы и/или схемы лечения. Согласно некоторым вариантам осуществления моделируется ожидаемый PK/PD профиль, включая в себя, например, терапевтические эффекты и/или неблагоприятные эффекты. Согласно некоторым вариантам осуществления путем корреляции между фармакодинамическим профилем и/или фармакокинетическим профилем и личными данными пациента выбирается терапевтическое окно. Необязательно, моделирования PK/PD профиля и/или предварительно выбранное терапевтическое окно графически отображаются у врача, например, на дисплее интерфейса врача. При рассмотрении моделирования, врач может принять решение об изменении дозы и/или схемы лечения для более точного соответствия (персонифицированного) пациенту (1009). В некоторых случаях, врач может принять решение об изменении параметров, предложенной дозы и/или схемы лечения, таких как одна или несколько доз, дозирование, схема лечения или общая продолжительность лечения, и/или других параметров лечения.
В некоторых случаях лечение предусматривает введение двух или более веществ, одновременно или последовательно, для получения желаемого терапевтического эффекта у пациента. Система, в соответствии с некоторыми из любых вариантов осуществления настоящего раскрытия, предусматривает использование MDI для доставки более чем одного фармацевтически активного средства (из одного или нескольких веществ) в любом соотношении или в любых предварительно определенных выпаренных количествах, чтобы проявлять предварительно выбранный PD профиль (например, поддержание отдельного пациента в пределах терапевтического окна, рассчитанного для пациента). Согласно некоторым вариантам осуществления различные дозы выборочно вводят в соответствии со схемой введения с тем, чтобы не допустить неблагоприятных эффектов при сохранении облегчения симптомов.
Согласно некоторым вариантам осуществления пациенту назначают выбранную (и, возможно, улучшенную) дозу и/или схему лечения (1011).
Согласно некоторым вариантам осуществления в виде проверки и в течение определенного периода времени, в течение которого пациент подвергается лечению (например, в течение нескольких часов, в течение дня, в течение недели, в течение месяца и/или в течение промежуточных, более длинных или более коротких, периодов), врач получает один или несколько показателей, таких как показатели в отношении общего использования устройства пациентом, показатели в отношении дозы и/или схемы лечения пациента, потребляемого пациентом вещества, одного или нескольких персональный PD эффектов пациента, например, в связи с наличием неблагоприятных эффектов, таких как психотропный уровень, и/или показателей, относящихся к интенсивности симптомов, таких как уровень боли и/или содержание одного или нескольких биомаркеров, и/или другие показатели (1013). При необходимости, один или несколько показателей предоставляются в режиме реального времени. Дополнительно или альтернативно, показатели предусмотрены в конце легочной доставки средства. Дополнительно или альтернативно, показатели предусмотрены по требованию врача. Дополнительно или альтернативно, пациент принимает решение, когда посылать показатели врачу.
Согласно некоторым вариантам осуществления настоящего изобретения показатели передаются врачу с помощью устройства MDI и/или с помощью интерфейса пациента, автоматически и/или в ответ на инструкцию от врача и/или пациента. Необязательно, один или несколько показателей хранятся в базе данных для дальнейшего использования.
Согласно некоторым вариантам осуществления на основе предоставленных показателей, дозу и/или схему лечения корректируют или иным образом модифицируют (1015). По желанию, модификацию выполняют в режиме реального времени. Согласно некоторым вариантам осуществления конкретную дозу и/или схему лечения модифицируют, при необходимости в режиме реального времени. Согласно некоторым вариантам осуществления дозу и/или схему лечения модифицируют с учетом верхнего и нижнего пределов PD эффекта, определенных отдельно для каждого пациента. Верхний предел может позволить дозу и/или схему лечения, выше которой присутствуют существенные неблагоприятные эффекты. Нижний предел может позволить дозу и/или схему лечения, ниже которой симптом, который должен был подвергаться лечению путем доставки активного средства, не достаточно смягчается.
Фиг. 11А, 11В, 11С и 11D представляют собой схематическую диаграмму (фиг. 11А) и изображения с экранов (фиг. 11В, 11С и 11D) интерфейса врача для выбора и назначения дозы и/или схемы лечения пациенту, в соответствии с некоторыми вариантами осуществления по настоящему изобретению.
На фиг. 11А показан общий дисплей 1107 интерфейса врача. Согласно некоторым вариантам осуществления данные пациента вводятся врачом через вход 1109.
Согласно некоторым вариантам осуществления графическое отображение ожидаемого и/или предварительно выбранного фармакокинетического профиля 1111 и/или ожидаемого и/или предварительно выбранного фармакодинамического профиля 1113 представляется врачу. По желанию, показываются один или несколько из профилей, по отдельности или вместе, в отношении временного ряда 1115, в том числе, например, продолжительности (например, почасовой шкале), в течение которой пациент подвергается лечению. Согласно некоторым вариантам осуществления определяется терапевтическое окно 1117, устанавливая верхний предел 1119 и нижний предел 1121.
Согласно некоторым вариантам осуществления дозу и/или схему лечения выбирают таким образом, чтобы получить ожидаемые и/или предварительно выбранные PK/PD профили, вписывающиеся в диапазон терапевтического окна 1117.
Согласно некоторым вариантам осуществления предел определяют как постоянное значение, представленное в виде прямой линии, например, как показано на фиг. ПА. Альтернативно, предел может содержать изменяющийся набор значений и быть представлен в виде кривой линии. Например, нижний предел 1121 представляет собой желательный терапевтический эффект, верхний предел 1119 представляет собой приемлемый неблагоприятный эффект, и более высокий порог Cmax фармакокинетического профиля может быть установлен для начальной части воздействия, например, для ускорения облегчение симптомов, а порог Cmax может уменьшаться по мере продолжения лечения по желанию. Согласно некоторым вариантам осуществления дозу и/или схему лечения выбирают и/или корректируют для достижения первоначального накопления активного средства у пациента, например, в начальной части лечения, а затем, чтобы обеспечить постоянное дозирование для поддержания пациента в стационарном состоянии (поддержание дозирования). В общем, первоначальное накопление средства основано на сравнительно большом количестве средства по сравнению с количествами, приведенными при поддерживающем дозировании.
Согласно некоторым вариантам осуществления, например, при улучшении предварительно определенного выпаренного количества средства (дозы и/или схемы лечения) для отдельного пациента, врач может выполнить одно или несколько из повышения и/или понижения предела 1119 и/или предела 1121, повышения и/или понижения пиков профиля 1113 и/или профиля 1111, расширения и/или укорачивания продолжительности лечения по оси времени и/или другие модификации.
Следует отметить, что графическое представление показано в настоящем документе в качестве примера и что могут быть использованы различные графические представления, такие как гистограммы. Согласно некоторым вариантам осуществления профиль 1111 и/или профиль 1113 может быть представлен в прерывистом виде, например, в виде множества точек.
На фиг. 11В показано моделирование ожидаемого фармакокинетического профиля пациента с использованием предварительно определенного выпаренного количества, доставленного в соответствии с предварительно определенной схемой введения, в соответствии с некоторыми вариантами осуществления. В этом примере для экрана интерфейса врача, врач может заполнить данные пациента 1101 (например, пол, массу, рост, вводимое лекарственное средство, ID пациента и/или другие данные), а также получить экстраполяцию фармакокинетического профиля отдельного пациента, как и показано, например, с помощью графика 1103, имитируя концентрацию активного средства в плазме пациента с течением времени.
Аналогичным образом, на фиг. ПС показана экстраполяция 1105 ожидаемого фармакодинамического профиля отдельного пациента, показывающая уровень неблагоприятного эффекта на пациента с течением времени.
На фиг. 11D показано изображение с экрана интерфейса врача, в соответствии с некоторыми вариантами осуществления настоящего изобретения. Смоделированный фармакокинетический профиль представлен графом 1103 и смоделированный фармакодинамический профиль представлен графом 1105, которые отображаются на оси динамических рядов 1115, в этом примере представляющую собой 8-часовой период. Шкала фармакодинамического параметра пациента визуально разделена на секции, указывающие, например, на состояние «боли» (ниже терапевтического уровня эффекта), указывающие на «оптимальное» состояние (в пределах терапевтического окна), указывающие, например, на «психоактивное» состояние (выше уровня неблагоприятного эффекта), как определено у отдельного пациента, а смоделированные профили PK/PD в виде графов приведены по отношению к этим разделам. В этом моделировании, первая доза предоставляется в 8:00, приводя в результате к изменению, как фармакодинамических, так и фармакокинетических параметров, переходя из раздела «боли» в раздел «оптимальный». Показано, что вторая доза, предоставляемая в 11:00, поддерживает пациента в пределах «оптимального» (терапевтическое окно).
На фиг. 12 показана блок-схема способа получения данных обратной связи от пациента и изменения/корректировки дозы и/или схемы лечения соответствующим образом, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Согласно некоторым вариантам осуществления получают персональный PD эффект пациента (1201).
Согласно некоторым вариантам осуществления настоящего изобретения PD эффект относится к неблагоприятному эффекту, такому как психотропный уровень, терапевтическому эффекту, такому как уровень боли, и/или изменению в любом из этих уровней. PD эффект может включать в себя абсолютное количественное определение уровня и/или относительное количественное определение уровня, оцениваемое, например, по отношению к уровню, измеренному до доставки единицы дозирования и/или до доставки дозирования и/или схемы лечения. PD эффект может быть получен до, во время и/или после доставки единицы дозирования и/или до, во время и/или после доставки дозирования и/или схемы лечения, и/или до, во время и/или после общего периода времени, в течение которого пациенту предоставляется лечение.
Согласно некоторым вариантам осуществления PD эффект предоставляется непосредственно пациентом, например, с помощью интерфейса пациента. Согласно некоторым вариантам осуществления пациент может вручную откорректировать визуальное представление PD эффекта, основанное на персональном определении уровня PD эффекта. В качестве примера, пациент может повысить или понизить столбик на графике, указывающий на уровень боли, например, на сенсорном экране сотового телефона и/или любого другого персонального устройства, на котором настроен интерфейс пациента.
Согласно некоторым вариантам осуществления пациенты, которые не в состоянии сформулировать уровни PD эффекта, могут использовать интерактивный набор инструментов, чтобы помочь им в определении их текущего уровня PD эффекта, например, как описано далее.
Дополнительно или альтернативно, к сознательному, субъективно воспринимаемому PD эффекту, указанному пациентом, персональный PD эффект, такой как биомаркер, получают с помощью интерфейса пациента и/или системы, например, с использованием датчика. Согласно некоторым вариантам осуществления один или несколько стандартных компонентов сотового телефона и/или персонального компьютера, на котором интерфейс пациента выполнен с возможностью действовать как датчик для получения параметра. Некоторые компоненты, которые могут быть использованы в качестве датчиков для получения PD эффектов у пациента, могут включать в себя: сенсорный экран, который может быть использован, например, для оценки ловкости, координации глаз и руки и/или памяти и умственного состояния; гироскоп, акселерометр, датчик близости и/или датчик жестов, например, ИК-датчик может быть использован, например, для оценки моторики; камера и/или источник света может быть использован, например, для обнаружения визуального слежения, саккадической дисперсии, расширения сосудов глаз, расширения и/или пульсации зрачков; RGB-подсветка может использоваться, например, для оценки восприятия окружающей среды; магнитометр и/или GPS могут быть использованы, например, для оценки ориентации; динамик и/или микрофон может быть использован, например, для оценки слуховых и/или голосовых навыков; датчик температуры и/или влажности может быть использован, например, для оценки температуры тела.
Согласно некоторым вариантам осуществления устройство MDI выполнено с возможностью получения персональных данных обратной связи. В качестве примера, устройство МДИ содержит датчик потока и/или датчик давления.
Необязательно, связанный с дыханием показатель пациента получают с использованием датчика потока и/или давления. Согласно некоторым вариантам осуществления датчик адаптирован для обнаружения объема ингаляции. Поскольку может существовать корреляция между объемом ингаляции и PD эффектом, такая как уровень боли, согласно некоторым вариантам осуществления инициируют измерение потока и/или давления для определения PD эффекта у пациента.
После того, как получен один или несколько персональных PD эффектов, доза и/или схема лечения может быть модифицирована соответствующим образом (1203). Согласно некоторым вариантам осуществления дозу и/или режим модифицируют, с одной стороны, чтобы улучшить или иным образом изменить состояние пациента на основании предоставленной индикации, а с другой стороны, для достижения предварительно выбранного фармакодинамического профиля, такого как поддержание пациента в пределах терапевтического окна - между нижним пределом терапевтического эффекта, который обеспечивает облегчение симптомов, и верхним пределом неблагоприятного эффекта, в котором уровень неблагоприятного эффекта все еще терпим. Согласно некоторым вариантам осуществления устройство MDI может быть выполнено таким образом, что, когда оно ниже минимального терапевтического эффекта, входные данные пациента могут увеличивать дозу и/или регулировать схему лечения по частоте и/или количеству. Необязательно, дозу и/или схему лечения модифицируют для получения уровня выше минимального терапевтического эффекта. Дополнительно или альтернативно, дозу и/или схему лечения модифицируют на столько, на сколько позволяет максимальный уровень неблагоприятного эффекта.
Фиг. 13А, 13В, 13С, 13D и 13Е представляют собой изображения с экранов интерфейса пациента (фиг. 13А, фиг. 13С и фиг. 13Е), а также графические изображения ожидаемого фармакодинамического и фармакокинетического профилей пациента до и после получения входных данных персонального PD эффекта от пациента (13В и 131), соответственно), в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Фиг. 13В представляет собой пример для рассчитанной 3-часовой схемы лечения для конкретного пациента (пациент X, 35 лет и характеризуется ИМТ 22). В соответствии с примером для расчетной схемы лечения, чтобы поддерживать пациента X в пределах терапевтического окна в течение 3-х часов, осуществляемого PK профилем, представленным красной кривой на фиг. 13В, пациент X обязан подвергаться легочной доставке активного средства с использованием устройства для ингаляции отмеренных доз MDI в соответствии с некоторыми вариантами осуществления настоящего раскрытия в следующие моменты времени и с использованием следующих доз: 00 минут - 1,2 мг; 10 минут - 1,0 мг; 60 минут - 0,5 мг. Синяя кривая представляет собой пример для расчетного PD профиля в указанных дозах. Как видно, расчетная схема лечения поддерживает пациента X в пределах уровней, а именно ниже уровня неблагоприятного эффекта и выше уровня терапевтического эффекта, а именно в терапевтическом окне 1303 в диапазоне от 2,5 до 7,5 по шкале неблагоприятного психоактивного эффекта.
На фиг. 13С, во время и/или после лечения, пациент X указывает на желание изменить предел неблагоприятного эффекта, например, за счет повышения уровня столбика психоактивности 1301 на экране интерфейса пациента. Поднимая столбик, пациент может указать, что он готов увеличить допустимый уровень неблагоприятного психоактивного эффекта. Терапевтическое окно, как показано на фиг. 13D, затем пересматривают на основе входных данных пациента - например, окно сужается до диапазона от 2,5 до 5 по шкале психоактивности. Текущая вводимая доза и/или схема лечения затем может быть модифицирована соответствующим образом. Например, предварительно определенное выпаренное количество, которое запланировано для легочной доставки, например, через 60 минут после начальной легочной доставки, снижают от 0,5 мг до 0,3 мг, в попытке снизить уровень испытываемого пациентом неблагоприятного эффекта (психоактивного эффекта).
Согласно некоторым вариантам осуществления дозу и/или схему лечения автоматически модифицируют на основе входных данных пациента. Дополнительно или альтернативно, входные данные пациента и/или смоделированные профили передаются, автоматически и/или по желанию пациента, врачу, и врач изменяет схему лечения.
Следует отметить, что чувствительность пациента к терапевтическому и/или неблагоприятному эффекту может меняться в течение дня, например, демонстрируя более высокую болевую чувствительность в вечернее время, снижение когнитивных способностей утром, таким образом, пациент может быть менее восприимчивым к терапевтическому эффект в вечернее время или более восприимчивым к неблагоприятному эффекту утром.
Дополнительно или альтернативно к уровню неблагоприятного эффекта, пациент может указывать на уровень терапевтического эффекта и/или другие условия, и доза и/или схема лечения будет модифицироваться соответствующим образом.
На фиг. 13Е показано приложение интерфейса пациента, включающее регулируемый ползунок 1305, перемещаемый пациентом. Согласно некоторым вариантам осуществления приложение представляет пациенту оценку текущего состояния, рассчитанного на основе одного или нескольких из следующего: предварительно определенной дозы и/или схемы лечения, предыдущих входных данных, полученных от пациента, например, включая в себя биологические маркеры и/или другие прямые и/или опосредованные персональные PD эффекты, лечение и историю эффектов для конкретного пациента, использование записи пациента, медицинского состояния пациента, информации из коллективной базы данных и/или другую информацию.
Во время лечения и/или после лечения пациент может перетащить ползунок, чтобы отразить свой воспринимаемый PD профиль. Например, если пациент испытывает полный терапевтический эффект (например, у пациент больше нет боли), пациент может передвинуть ползунок на «оптимальное» состояние (например, к «психоактивному» состоянию).
Используя материалы, полученные от пациента, интерфейс пациента может автоматически модифицировать следующую дозу и/или схему лечения. Согласно некоторым вариантам осуществления указатель на модификацию 1307 отображается для пациента, например, уведомление пациента о том, что следующая доза увеличена в количестве. По желанию, приложение настроено для запроса подтверждения 1309 от пациента изменить дозу и/или схему лечения.
Согласно некоторым вариантам осуществления вводные данные от пациента и/или модифицированные настройки автоматически передаются на интерфейс врача. В некоторых случаях врач может принять решение изменить вручную заново определенные настройки дозы и/или схемы лечения.
Фиг. 14 представляет собой блок-схему способа измерения одного или нескольких биомаркеров с использованием персонального портативного устройства и/или с использованием устройства MDI, и соответствующей модификации дозы и/или схемы лечения, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Согласно некоторым вариантам осуществления измеряют один или несколько биомаркеров (1401). Согласно некоторым вариантам осуществления биомаркеры указывают на существование и/или степень неблагоприятных эффектов у подвергнутого лечению больного. Необязательно, измерения биомаркеров используются для определения терапевтического окна для отдельного пациента и/или для контроля дозы и/или схемы лечения для поддержания пациента в пределах терапевтического окна.
Неблагоприятные эффекты, такие как когнитивные нарушения и другие психоактивные эффекты, могут отличаться среди пациентов с различными генетическими и биологическими чертами. Таким образом, согласно некоторым вариантам осуществления отдельные биомаркеры, такие как биомаркеры ЦНС, получают от пациента, используя, например, один или несколько датчиков в системе, и/или один или несколько датчиков, установленных в интерфейсе устройства пациента, такие как датчики сотовых телефонов, например, как описано выше.
Неинвазивные способы оценки биомаркеров могут включать в себя одно или несколько из следующего: оценка саккадического движения глаз (например, саккадическое движение), тестирование памяти, адаптивное слежение, оценка пальцевого теппинга, оценка равновесия тела, соответствие визуально-аналоговой шкале и/или другие способы оценки.
Согласно некоторым вариантам осуществления могут быть выполнены различные известные в настоящей области техники неинвазивные тесты биомаркеров, таких как когнитивные задачи, включая в себя, например, время реакции, внимание, зрительно-пространственную ориентацию, воспроизведение названия, воспроизведение повествования, воспроизведение лиц, ассоциации имя-лицо, формирование, беглость речи, присвоение имен объектам, имплицитную память, логическое мышление и/или другие когнитивные задачи.
Согласно некоторым вариантам осуществления измерения биомаркеров сообщаются врачу (1403). Необязательно, измерения PD эффекта сохраняются в памяти устройства MDI и/или памяти интерфейса пациента. Дополнительно или альтернативно, измерения PD эффекта загружаются в базу данных. Необязательно, измерения PD эффекта сравнивают с измерениями PD эффекта, хранящимися в базе данных, включая в себя, например, предыдущие измерения PD эффекта конкретного пациента, измерения PD эффекта других пациентов, измерения PD эффекта из литературы и т.д.
Согласно некоторым вариантам осуществления дозу и/или схему лечения модифицируют в соответствии с измерениями PD эффекта (1405).
Фиг. 15А, 15В и 15С представляют собой изображения с экранов интерфейса пациента, содержащие различные приложения для получения данных PD эффекта и/или для оказания помощи пациенту в определении выпаренного количества средства (дозы и/или схемы лечения), в соответствии с некоторыми вариантами осуществления настоящего изобретения.
В приложении, показанном в настоящем документе в качестве примера, которое может быть установлено на персональном портативном устройстве, таком как сотовый телефон и/или планшетный компьютер, пациент в интерактивном режиме выполняет одну или несколько задач, которые могут быть включены как часть игры или тому подобного, основанных на персональном PD эффекте, который может быть оценен на основании задачи. Согласно некоторым вариантам осуществления уровень неблагоприятного эффекта, такой как психоактивный уровень пациента, автоматически выводится приложением. Дополнительно или альтернативно, приложение помогает пациенту в озвучивании своего воспринимаемого терапевтического и/или неблагоприятного эффекта, которое затем может быть предусмотрено как вход в систему.
Предусмотренные в настоящем документе задачи, например, включают в себя слежение за мишенью пальцем (фиг. 15А), визуальное слежение за мишенью (фиг. 15В), выравнивание мишени (фиг. 15С).
Другие приложения могут включать в себя различные измерения персонального PD эффекта с использованием действий и способов, известных в настоящей области техники, такие как моделируемое вождение, сортировка карт, тестирование арифметических навыков, оценка времени, копирование символов, зрительно-двигательная координация, время реакции, навыки изображения и/или буквенного написания, а также/или другие приложения, например, как описано выше.
Фиг. 16 представляет собой схематическое изображение устройства для ингаляции отмеренных доз MDI, выполненное с возможностью обеспечения автоматизированной контролируемой легочной доставки одного или нескольких активных средств, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Согласно некоторым вариантам осуществления устройство 1601 включает в себя дозатор вещества 1603, например, дозатор для вещества, которое содержит фармацевтически активное средство и позволяет фармацевтически активному средству испаряться из него. Согласно некоторым вариантам осуществления настоящего изобретения дозатор вещества содержит или сообщается с источником по меньшей мере одного вещества, из которого берет свое начало активное средство, и механизмом обработки вещества для получения доставляемого активного средства, например, как описано выше.
Вещество может содержать различные формы, такие как, например, твердую массу, твердые частицы или порошок. По желанию, вещество содержится в картридже, капсуле и/или других контейнерах. Согласно некоторым вариантам осуществления механизм обработки включает в себя одно или несколько из, например, нагревания (например, для испарения), превращения в аэрозоль, вызывая химическую реакцию, например, путем смешивания с другими материалами, высвобождения вещества из контейнера, например, путем разламывания капсулы, создания давления, мобилизации и/или других видов обработки. Альтернативно, активное средство уже находится в готовой к применению форме и не требует какой-либо обработки перед доставкой пользователю посредством нагревания вещества.
Согласно некоторым вариантам осуществления устройство MDI 1601 содержит модуль ввода 1605. Необязательно, модуль ввода 1605 выполнен с возможностью приема данных, относящихся к дозе и/или схеме введения, в соответствии с которыми активное средство будет доставлено пациенту. Дополнительно или альтернативно, модуль ввода 1605 выполнен с возможностью приема одного или нескольких показаний от датчика (не показан на этой фигуре), находящегося в устройстве 1601 и/или сконфигурирован снаружи устройства 1601.
Согласно некоторым вариантам осуществления устройство MDI 1601 содержит контроллер 1607, выполненный с возможностью инициировать и/или модифицировать и/или прекратить легочную доставку фармацевтически активного средства. Согласно некоторым вариантам осуществления контроллер 1607 управляет дозатором вещества 1603, например, активируя нагревание вещества с помощью нагревательного элемента. Согласно некоторым вариантам осуществления контроллер 1607 активизирует доставку предварительно определенного выпаренного количества средства, такого как доза и/или схема лечения, полученные в качестве входных данных. Согласно некоторым вариантам осуществления контроллер 1607 управляет потоком активного средства, например, путем активации одного или нескольких клапанов. Согласно некоторым вариантам осуществления контроллер адаптирован для высвобождения средства на основании текущей скорости потока.
Согласно некоторым вариантам осуществления устройство MDI 1601 содержит выход 1609. По желанию, выход 1609 выполнен в виде мундштука для взаимодействия с пациентом. Альтернативно мундштуку, выход 1609 может быть выполнен в виде маски для дыхания, соски, как приспособления для грудных детей, и/или других структур, пригодных для доставки потока паров пациенту.
Согласно некоторым вариантам осуществления компоненты устройства 1601, такие как дозатор вещества и/или контроллер и/или другие компоненты, содержатся внутри корпуса 1611. По желанию, корпус имеет форму и размеры для использования в качестве портативного устройства.
Согласно некоторым вариантам осуществления устройство MDI 1601 содержит механизм управления потоком.
Необязательно, поток паров контролируется с использованием одного или нескольких клапанов. Согласно некоторым вариантам осуществления поток выбирают и/или модифицируют для отдельного пациента, например, по времени доставки и возможности потока активного средства к пациенту только при вдохе пациента, показанного, например, с помощью датчика, встроенного в устройство MDI. Согласно некоторым вариантам осуществления устройство выполнено с возможностью модификации потока, чтобы позволить пациенту инстинктивно определить, когда следует прекратить ингаляцию, вдыхать глубже и/или иным образом изменить ритм и/или интенсивность дыхания. В качестве примера, устройством подается импульс увеличенного объема потока, чтобы указать пациенту прекратить ингаляцию.
Согласно некоторым вариантам осуществления поток выбирают и/или модифицируют, чтобы уменьшить количество активного средства, которое остается захваченным внутри выходного тракта устройства и не доставляется пациенту. В некоторых случаях количество скопившегося активного средства снижается до известного, предварительно определенного количества путем регулирования потока.
Согласно некоторым вариантам осуществления поток регулируется контроллером 1607. Необязательно, поток регулируется в соответствии с данными, полученными на модуле ввода 1605, данными, полученными с помощью датчика, и/или другими показателями.
Потенциальное преимущество устройства, содержащего механизм управления потоком, который предназначен для конкретного пациента, может включать в себя улучшенную точность доставки пациенту в отношении сроков и/или предварительно определенного выпаренного количества активного средства, поставляемого устройством, улучшая производительность системы/устройства MDI.
Фиг. 17А представляет собой схематическое изображение конфигурации устройства MDI 1701, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
В этой конфигурации, дозатор вещества 1703 содержит картридж вещества 1705, нагревательный элемент 1707 и загрузочное устройство 1709, которое перемещает картридж вещества относительно нагревательного элемента 1707, например, чтобы находиться в контакте или в непосредственной близости от нагревательного элемента.
Согласно некоторым вариантам осуществления нагревательный элемент выполнен с возможностью обеспечения локализованного нагревания, например, за счет кондукции, конвекции и/или излучения. Согласно некоторым вариантам осуществления вещество нагревают достаточно быстро до температуры, подходящей для образования паров испаряемого фармацевтически активного средства, содержащегося в нем. Согласно некоторым вариантам осуществления вещество организовано в виде подвижного элемента, который может быть выборочно и/или локально активирован. По желанию, вещество организовано в компактные формы. По желанию, каждая форма представляет собой предварительно определенное выпаренное количество.
Согласно некоторым вариантам осуществления пары, высвобождаемые из вещества, собирают внутри испарительной камеры 1711, из которого они переносятся пациенту через выходной тракт.
По желанию, клапан 1713 расположен вдоль тракта для управления скоростью потока.
Согласно некоторым вариантам осуществления устройство 1701 содержит мундштук 1715, из которого пары доставляются пациенту в ответ на вдыхание. Альтернативно, мундштук 1715 может быть присоединен к другим элементам, например, к маске и/или носовой канюле, необязательно с дополнительным кислородом, например, для доставки средства лечения ослабленным больным. По желанию, мундштук находится в жидкостном сообщении с клапаном 1713.
Согласно некоторым вариантам осуществления устройство 1701 включает в себя источник питания 1717, например, батарею, закрученную вручную пружину и/или штепсель.
Согласно некоторым вариантам осуществления устройство 1701 включает в себя контроллер 1719, например, как описано в настоящем документе выше, выполненный с возможностью управления одним или несколькими из клапана 1713, источника питания 1717 и/или дозатора вещества 1703 в виде полностью и/или отдельно контролируемых компонентов дозатора вещества. Согласно некоторым вариантам осуществления контроллер 1719 проверяет, чтобы картридж вещества было разрешено использовать.
Согласно некоторым вариантам осуществления контроллер 1719 сообщается с запоминающим устройством 1721, которое может быть прочитано с помощью контроллера и/или на которое может быть произведена запись.
На фиг. 17В показан картридж 1723, содержащий множество дискретных картриджей вещества 1725. Каждый картридж 1725 содержит одно или несколько веществ 1727, предназначенных для парообразования (например, растительный материал), заключенные в нагревательный элемент 1729, который функционирует в качестве корпуса картриджа. Согласно некоторым вариантам осуществления нагревательный элемент 1729 имеет форму подобной клетке сети проводов, которые упаковывают вещество. Согласно некоторым вариантам осуществления, чтобы выпарить активное средство, электрический ток проходит через нагревательный элемент 1729, нагревая вещество, содержащееся в пределах конкретного отдельного картриджа.
Согласно некоторым вариантам осуществления предусмотренная в настоящем документе система включает в себя по меньшей мере одну единицу дозирования, которая включает в себя растительный материал, содержащий активное средство. Согласно некоторым вариантам осуществления система содержит множество единиц дозирования, и контроллер выполнен с возможностью использования по меньшей мере одной из единиц дозирования для испарения активного средства из единицы дозирования.
Согласно некоторым вариантам осуществления система содержит множество единиц дозирования, каждая из которых содержит растительный материал, характеризующийся другой композицией по меньшей мере одного фармакологически активного средства. Согласно некоторым вариантам осуществления подмножество единиц дозирования характеризуется по существу одинаковой композицией активных средств. Согласно некоторым вариантам осуществления множество единиц дозирования содержат одинаковые средства, но в различных соотношениях количеств. В соответствии с некоторыми вариантами осуществления контроллер системы выполнен с возможностью выбирать по меньшей мере одну из единиц дозирования на основе композиции ее активного средства. Например, контроллер может быть использован для выбора единицы дозирования, содержащей растительный материал, который включает в себя одно активное средство, с последующим выбором другой единицы дозирования, чтобы выпарить другое активное средство. Контроллер также может быть использован для осуществления различных температур нагревания различной продолжительности, с тем, чтобы испарить различные средства из одной и той же единицы дозирования на основании их различных температур испарения. Согласно некоторым вариантам осуществления контроллер выполнен с возможностью выбирать последовательность единиц дозирования, имеющих одинаковую или различную композицию для ингаляции одновременно или в быстрой последовательности, обеспечивая тем самым комбинацию средств и/или большее количество, чем может поставляться с единственной единицей дозирования.
Фиг. 17C-D представляют собой схематические виды единицы дозирования 2300 (испарительный картридж дозирования вещества), разобранной и собранной в соответствии с некоторыми вариантами осуществления.
Фиг. 17C-D представляют собой схематичные изображения единицы дозирования (испарительный картридж дозирования вещества, или картридж), в соответствии с некоторыми вариантами осуществления показывающие единицу дозирования 2300, содержащую вещество 2304, содержащее одно или несколько активных средств, а также крепежные детали в отверстии 2303 в рамке 2308, которая образует часть корпуса 2301 (фиг. 17С) и резистивный нагревательный элемент 2306 в термическом контакте и проходящий через две противоположные поверхности вещества 2304 (фиг. 17D). Согласно некоторым вариантам осуществления резистивный нагревательный элемент 2306 проходит только через одну поверхность вещества 2304, в то время как в других вариантах осуществления он простирается более чем на две противоположные поверхности.
Согласно некоторым вариантам осуществления предварительно измеренное или известное количество вещества, содержащее одно или несколько активных средств, собирают над и/или в пределах единицы дозирования 2300. При необходимости, единица дозирования 2300 содержит:
вещество 2304, необязательно образуемое, например, путем уплощения для быстрого испарения;
механическую поддержку вещества 2304 (например, поддержку посредством ограждения в отверстии 2303 в рамке 2308 корпуса 2301, который представляет собой необязательно форму рамки);
средства для облегчения транспортировки единицы дозирования 2300 (например, защелки в виде челюстей 2302) и/или
средство для нагревания (испарения) вещества 2304 (например, резистивный нагревательный элемент 2306, например, в виде сетки).
Необязательно по меньшей мере часть единицы дозирования 2300, содержащая по меньшей мере часть вещества 2304 (или по меньшей мере все нагреваемые части вещества 2304), представляет собой проницаемую для прохождения воздуха, так что воздух может проходить через вещество при нагревании и нести с собой это выпаренное с помощью нагревания средство.
Необязательно, единица дозирования представляет собой одноразовую. Потенциальные преимущества одноразовой единицы дозирования включают в себя: удержание остатка активного средства для удаления; тесную интеграцию поддержки и транспортировки дозировки для надежного дозированного транспорта в пределах дозирующей аппаратуры; и/или сниженную необходимость поддержания и/или мониторинга частей системы дозирования (например, испаряющего нагревательного элемента), которые подвергаются условиям, которые могут привести к снижению производительности с течением времени.
Необязательно, единица дозирования применяется для использования в одной ингаляции. Потенциальные преимущества единицы дозирования однократного применения включают в себя повышение точности и/или надежности в регулировании выпаренного количества биологически активного средства, в соответствии с настройками ингалятора. Например, концентрация и/или распыление активного средства в веществе 2304 можно контролировать в процессе производства в какой-то степени точности. В общем, степень изменения в выходе устройства (например, количестве парообразного и вдыхаемого активного средства) можно поддерживать в пределах допуска менее чем на+/- 15% от предполагаемого выхода. Другие факторы, которые могут оказать влияние на различия в выходе устройства включают в себя условия окружающей среды, привычки использования пользователя и текущее состояние пользователя.
Согласно некоторым вариантам осуществления единица дозирования 2300 содержит корпус 2301, содержащий отверстие или приемную камеру 2303.
Необязательно, корпус 2301 содержит уплощенную и вытянутую полосу, в то время как приемная камера 2303 содержит отверстие, обрамленное полосой (рамка 2308). Во время приготовления единицы дозирования 2300 вещество 2304 вставляется в приемную камеру 2303. По желанию, вещество имеет форму, чтобы соответствовать приемной камере 2303 до или во время введения таким образом, что она соответствует сплющенной форме приемной камеры 2303. Потенциальным преимуществом для вещества 2304 является нахождение в уплощенной форме, так как большая площадь поверхности и/или равномерная толщина потенциально позволяет быстрее и/или более равномерно распределить нагревание и/или поток воздуха при испарении и доставке.
Согласно некоторым вариантам осуществления размеры вещества 2304 составляют, например, приблизительно 6×10 мм по всей площади открытой поверхности, а также приблизительно 1 мм толщиной. Необязательно, толщина вещества 2304 находится в диапазоне от приблизительно 0,1 до 1,0 мм или оно может быть большей, меньшей или промежуточной толщины. Необязательно, площадь поверхности вещества 2304 находится в пределах от приблизительно 20 до 100 мм2; например, 20 мм2, 40 мм2, 50 мм2, 60 мм2, 80 мм2 или оно может характеризоваться другой большей, меньшей или промежуточной площадью поверхности. Вещество 2304 необязательно имеет квадратную форму или по существу квадратную форму (например, приблизительно 8×8×1 мм); необязательно вещество 2304 имеет продолговатую форму с соотношением сторон, например, 1:2, 1:3, 1:4, 1:10 или характеризуется другим большим, меньшим или промежуточным соотношением длин сторон. По желанию, вещество 2304 составляет, например, приблизительно 30×2×0,5 мм по величине. Соответствующее вещество 2304 по массе составляет приблизительно 15 мг согласно некоторым вариантам осуществления. Согласно некоторым вариантам осуществления массу вещества 2304 выбирают в диапазоне от приблизительно 1 до 100 мг или другом диапазоне, характеризующемся теми же, большими, меньшими и/или промежуточными границами.
Потенциальным преимуществом является окружение вещества 2304 корпусом с рамкой 2301 для большей механической стабильностью. Например, вещество 2304 потенциально содержит отдельные частицы вещества, таким образом, что вещество 2304 подвержено осыпанию частиц, особенно при перемещении или сгибании. Ограждение рамкой картриджа 2308 позволяет веществу 2304 перемещаться в системе без применения напряжений непосредственно к нему. Согласно некоторым вариантам осуществления общая длина и ширина картриджа составляет приблизительно 20×10 мм или он может быть другого большего, меньшего или промежуточного размера. В процессе производства корпус с рамкой представляет собой потенциальное преимущество для формирования образца вещества нужного размера для подогнанной закупорки канала, через который с воздушным потоком подхватываются летучие вещества, выделившиеся во время нагревания вещества.
Согласно некоторым вариантам осуществления испарение активного средства предусматривает нагревание с помощью резистивного нагревательного элемента 2306 или резистивного нагревательного элемента другой формы. Резистивная сетка дополнительно содержит материал, который показывает существенное резистивное нагревание; например, нихром (типичное сопротивление составляет приблизительно 1-1,5 мкОм м), FeCrAl (типичное сопротивление составляет приблизительно 1,45 мкОм м), нержавеющая сталь (типичное сопротивление составляет приблизительно 10-100 мкОм⋅м) и/или мельхиор (типичное сопротивление составляет приблизительно 19-50 мкОм⋅м). В соответствии с выбором материала (например, металла) параметры, такие как длина и ширина нагревательного элемента, толщина, размер и/или рисунок отверстий корректируют так, чтобы характеризоваться общим сопротивлением через резистивный нагревательный элемент, который, например, находится в диапазоне приблизительно 0,05-1 Ом, 0,5-2 Ом, 0,1-3 Ом, 2-4 Ом или в другом диапазоне, имеющем такие же, выше, ниже и/или промежуточные границы.
Необязательно, во время сборки, резистивный нагревательный элемент 2306 прикреплен к корпусу 2301 в положении, перекрывающем вещество 2304 на одной или нескольких сторонах. Например, резистивный нагревательный элемент 2306 имеет форму U, которая простирается по обе стороны рамки 2308 с дорсальной поверхности 2309А, складывается на конце корпуса 2311 и простирается назад вдоль вентральной поверхности 2309 В. По желанию, резистивный нагревательный элемент 2306 проходит вокруг камеры 2303 таким образом, что вещество 2304, содержащееся в камере 2303, загорожено нагревательным элементом 2306. Согласно некоторым вариантам осуществления резистивный нагревательный элемент 2306 (например, сетка) содержит множество отдельных панелей, например, панель на каждой стороне картриджа. По желанию, панели электрически соединены один с другим. Потенциальное преимущество двухстороннего окружения сеткой вещества 2304 заключается в увеличении скорости и/или равномерности испарения при приложении тока к нагревательному элементу 2306. Согласно некоторым вариантам осуществления нагревательный элемент встроен полностью или частично внутрь вещества 2304. По желанию, нагревательный элемент встроен частично или полностью в рамку 2308 корпуса 2301; например, корпус 2301 первоначально формуют с нагревательным элементом 2306 на месте и/или нагревательный элемент 2306 вдавливают в место при высокой температуре на другой стадии изготовления.
Согласно некоторым вариантам осуществления резистивный нагревательный элемент 2306 характеризуется соотношением открытой (отверстие) к закрытой (сетчатый материал) площади поверхности, составляющей от приблизительно 1:1 (50%) до 1:3 (33%о). Согласно некоторым вариантам осуществления соотношение находится в пределах приблизительно 10-20%, приблизительно 20-40%), приблизительно 30-50%, приблизительно 40-70%, приблизительно 60-80%, приблизительно 70-90% или характеризуется другим диапазоном соотношений, имеющим такие же, большие, меньшие и/или промежуточные границы. Согласно некоторым вариантам осуществления отверстия сетки находятся в диапазоне приблизительно 10 мкм, приблизительно 25 мкм, 32 мкм, 50 мкм, 75 мкм, 100 мкм, 200 мкм, 300-750 мкм, 700-1200 мкм или другом большем, меньшем или промежуточном диапазоне. По желанию, по меньшей мере два отверстия имеют разные размеры и/или форму. Согласно некоторым вариантам осуществления сетка представляет собой сетку из нержавеющей стали 400/0,03 316, с отверстиями по 0,033 мм, 400 отверстий на квадратный дюйм, причем каждое отверстие составляет приблизительно 0,033 мм (33 мкм), толстая проволока 0,03 мм.
Согласно некоторым вариантам осуществления резистивный нагревательный элемент 2306 содержит резистивную фольгу (например, фольгу, вытянутую в непрерывную ленту или другую форму, поддерживаемую полимером, таким как полиимид и/или силиконовый каучук). Необязательно, поддерживаемая резистивная фольга перфорирована через подложку, чтобы позволить выходить воздуху во время улетучивания дозирования вещества. Согласно некоторым вариантам осуществления к резистивной фольге добавляется запал, например, в качестве дополнительного компонента и/или в качестве области ленты, изготовленной преднамеренно тонкой, так, чтобы обеспечить способ уничтожения нагревательного элемента после использования (путем проведения соответствующего высокого тока через нагревательный элемент в течение достаточного периода времени).
Согласно некоторым вариантам осуществления резистивный нагревательный элемент 2306 прикрепляют к корпусу картриджа 2301, нажав на сетку на корпусе с использованием температуры, достаточно высокой, чтобы расплавить корпус и/или смягчить таким образом, чтобы сетка погрузилась в материал корпуса. Согласно некоторым вариантам осуществления корпус содержит инертный, термостойкий, подходящий материал. Согласно некоторым вариантам осуществления используемый материал корпуса содержит, например, жидкокристаллический полимер (LCP), полиэфирэфиркетон (PEEK), Ultem, тефлон, торлон, Amodel, полифениленсульфид, фортон, Xydear, радел, Udel, полипропилен, Propylux, полисульфон или другой полимерный материал.
Потенциальное преимущество LCP и/или РЕЕК заключается в хорошей устойчивости к температуре выше температуры, необходимой для испарения вещества, поддерживаемого в картридже. Согласно некоторым вариантам осуществления прикрепление сетки и корпуса происходит при температуре приблизительно 280°С (или при другой достаточно высокой температуре, чтобы расплавить и/или смягчить LCP или PEEK). LCP и РЕЕК обеспечивают потенциальное преимущество хорошей термической стабильности при более низких температурах, например, при температуре испарения приблизительно 230°С.
Потенциальное преимущество обеспечения нагревательным элементом, таким как резистивный нагревательный элемент 2306, каждой отдельной единицы дозирования, заключается в обеспечении равномерности производительности между использованиями. Потенциально, часть биологически активного средства, с которым нагревательный элемент вступает в контакт, остается прилипшей к нагревательному элементу после остывания. Это накопление может потенциально влиять на производительность парообразования. Дистанционное нагревание (посредством излучения и/или опосредованной проводимости, например) потенциально создает систему, имеющую относительно высокую тепловую инерцию (требуется больше мощности нагрева) по сравнению с прямым проводящим нагреванием с помощью контактного электрода; проблема загрязнения контактного электрода удаляется путем разработки его для одноразового использования. Пониженное требование к нагреванию потенциально повышает безопасность и/или долголетие устройства. Потенциально, пониженное требование к нагреванию также снижает требования к доставке мощности, позволяя варианты осуществления с повышенной портативностью, большей жизнью заряда и/или пониженной стоимостью (например, для систем с батарейным питанием нагревательных элементов).
Согласно некоторым вариантам осуществления единица дозирования 2300 (картридж) содержит блокирующий элемент для использования при транспортировке картриджа. Запирающий элемент содержит, например, защелку в виде челюсти 2302. Запирание позволяет соединение одним или несколькими подходящими элементами механизма транспорта системы дозирования для закрепления и/или перемещения картриджа. Перемещение и/или закрепление картриджа от нежелательного перемещения может произойти во время цикла службы картриджа, например: когда картридж помещается в очередь картриджей, содержащих множество картриджей, организованных для использования, когда картридж продвигается в очереди, когда картридж выбирают для использования, когда картридж перемещается в положение для использования, когда картридж действительно используется и/или когда картридж отбрасывается или, альтернативно, перемещается в «использованное» положение в очереди картриджей.
Образовавшиеся пары необязательно собираются в испарительной камере и доставляются пациенту.
Потенциальное преимущество индивидуально нагреваемых картриджей может включать в себя более точный контроль над предварительно определенными парообразными количествами активного средства, доставляемых пациенту, например, по сравнению с движущейся лентой картриджей, нагреваемых стационарным нагревательным элементом. Индивидуальная загрузка и нагрев конкретного картриджа в определенный момент времени может повысить точность устройства MDI.
Фиг. 18 представляет собой блок-схему способа лечения отдельного пациента с использованием системы в соответствии с фиг. 9 при сохранении пациента в пределах терапевтического окна, в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Согласно некоторым вариантам осуществления устройство MDI программируют на предварительно определенное выпаренное количество (дозы и/или схемы лечения) (1801). Необязательно, дозу и/или схему лечения устанавливают в ингаляционном устройстве с помощью врача, вручную (например, путем активации кнопки на самом устройстве) и/или с помощью интерфейса врача. Дополнительно или альтернативно, дозу и/или схему лечения устанавливают в устройстве MD1 в соответствии с инструкциями, посланными из интерфейса пациента.
Согласно некоторым вариантам осуществления устройство MDI необязательно выполняют с возможностью выбора по меньшей мере одного предварительно определенного выпаренного количества для ингаляционного сеанса, который может включать в себя множество ингаляций на основе содержимого единицы дозирования, и регулирования по меньшей мере одного из нагревания и воздушного потока в устройстве для управления предварительно определенным выпаренным количеством активного средства, предоставляемого пользователю. Другими словами, на основе свойств вещества, который упакован в единицу дозирования, а именно количестве активного средства(средств), имеющегося в нем для парообразования, устройство может быть выполнено с возможностью выпаривать некоторые или все доступные активные средства в веществе в одну или множество ингаляций, причем регулируемость по выпаренному количеству в каждом вдохе осуществляется благодаря контролю за уровнем нагревания и длительностью, а также выходом и продолжительностью воздушных потоков в устройстве.
Согласно некоторым вариантам осуществления устройство MDI активируется для доставки активного средства пациенту (1803). Согласно некоторым вариантам осуществления прямые и/или опосредованные данные обратной связи от пациента получают в режиме реального времени (1805). Необязательно, данные обратной связи получают в ходе легочной доставки (ингаляционной сессии). Лечение, как правило, может начинаться с легочной доставки и заканчивается через 5-20 минут после этого, например, когда предварительно выбранный фармакодинамический профиль проявится в полной мере для активного средства и/или в более позднее время. Дополнительно или альтернативно, данные обратной связи получают во время серии легочных поставок, например, в течение периода времени, составляющего 1 час, 3 часа, 5 часов, 9 часов, 12 часов или промежуточные, более длинные или более короткие периоды времени. Протокол может включать в себя 5-10 легочных доставок в день, через определенные интервалы времени в диапазоне от 15 до 180 минут между последовательными легочными доставками.
Согласно некоторым вариантам осуществления данные обратной связи, которые получают от пациента, включают в себя персональные PD эффекты, такие как терапевтические эффекты, например, интенсивность симптомов, и/или неблагоприятные эффекты, например, психоактивное состояния пациента.
Согласно некоторым вариантам осуществления интерфейс пациента взаимодействует с пациентом для получения данных обратной связи. Согласно некоторым вариантам осуществления вопросы к пациенту, касающиеся его текущего состояния, отображаются на экране, и пациент отвечает на вопросы. Такой вопрос может быть представлен, например, в форме столбика, указывающего на уровень боли, например, который пациент поднимает и/или понижает. Дополнительно или альтернативно, данные обратной связи получают с помощью одного или нескольких приложений, таких как игры, с которыми пациент взаимодействует. Необязательно, содержание неинвазивных биомаркеров оценивают путем анализа входных данных пациента при взаимодействии с пользовательским интерфейсом. Дополнительно или альтернативно, данные обратной связи от пациента получают путем измерения различных биомаркеров с использованием одного или нескольких датчиков, например, за счет использования компонентов смартфона, карманного устройства, носимого устройства, наручного устройства или встроенного в защитные очки устройства, чтобы действовать в качестве датчиков неинвазивных биомаркеров.
Согласно некоторым вариантам осуществления персональные PD эффекты получают периодически, например, полусуточно, ежедневно, еженедельно, ежемесячно, согласно требованию, например, перед дозой и/или серией доз, до и/или после изменения в дозировке и/или схеме введения или иным образом.
Согласно некоторым вариантам осуществления в ответ на PD эффекты, дозу и/или схему лечения модифицируют (1809). Необязательно, дозу и/или схему лечения модифицируют для достижения желаемого эффекта, например, для снижения уровня боли у пациента, при этом поддерживая пациента в пределах терапевтического окна. Согласно некоторым вариантам осуществления дозу и/или схему лечения итеративно модифицируют посредством интерфейса пациента. Модификации могут происходить множество раз, например, во время, между или после одной или нескольких легочных доставок и/или в течение общего времени периода лечения (дни, недели, месяцы, годы), которому подвергают пациента. Модификация ограничена отсечками безопасности, например, дозами, которые могут подвергнуть пациента риску.
Согласно некоторым вариантам осуществления интерфейс пациента и/или устройство MDI напоминает пациенту выполнять одну или несколько легочных доставок (1811). Такое напоминание может быть предусмотрено в виде визуального сигнала (например, световой индикации), звука, вибрации, уведомления на портативном/карманном устройстве, например смартфоне, карманном устройстве, носимом устройстве, наручном устройстве или встроенном в защитные очки устройстве или их сочетании.
Согласно некоторым вариантам осуществления данные пациента об использовании регистрируются и сохраняются в памяти устройства MDI и/или в памяти интерфейса пациента. При необходимости, доставку активного средства модифицируют, потенциально в режиме реального времени, в соответствии с данными об использовании.
Например, в случае, когда пациент пропустил одну или несколько легочных доставок, доза и/или схема лечения может быть автоматически модифицирована, чтобы установить доставку, например, увеличенного количества активного средства в следующие одну или несколько легочных доставок.
Согласно некоторым вариантам осуществления одно или несколько действий, описанных в 1801-1811, могут повторяться. Предпочтительно, получение персональных PD эффектов и/или данных об использовании от пациента повторно могут предусматривать постоянную корректировку дозы и/или схемы лечения, обеспечивая гибкое, правильное и точное индивидуальное лечение пациента на основе фактического эффекта лечения на отдельном пациенте.
Размеры и значения, раскрытые в настоящем документе, не следует понимать как строго ограниченные точными числовыми значениями. Вместо этого, если не указано иное, каждый такой размер должен обозначать как указанное значение, так и функциональный эквивалентный интервал, окружающий это значение. Например, раскрытый размер «10 мкм» предполагается для обозначения «приблизительно 10 мкм».
Используемые в настоящем документе числовые диапазоны, которым предшествует термин «приблизительно», не следует рассматривать как ограниченные указанным диапазоном. Скорее, числовые диапазоны, которым предшествует термин «приблизительно», следует понимать как включающие диапазон, принятый специалистами в настоящей области техники для любого данного элемента в микрокапсулах или составах согласно настоящему изобретению.
Используемый в настоящем документе термин «приблизительно» означает нахождение в пределах приемлемого диапазона ошибок для конкретного значения, как определено обычным специалистом в настоящей области техники, который будет частично зависеть от того, как измеряется или определяется значение, то есть ограничениями системы измерения. Например, «приблизительно» может означать диапазон до 10%, более предпочтительно до 5% и еще более предпочтительно до 1% заданного значения. Там, где конкретные значения описаны в заявке и в формуле изобретения, если не указано иное, значение термина «приблизительно» находится в пределах приемлемого диапазона ошибок для конкретного значения.
Термины «содержит», «содержащий», «включает в себя», «включающий», «имеющий» и родственные им по значению слова означают «включающий в себя без ограничения».
Термин «состоящий из» означает «включая в себя и ограничиваясь этим».
Термин «состоящий по существу из» означает, что композиция, способ или микрокапсулы могут включать в себя дополнительные ингредиенты, стадии и/или части, но только в том случае, если дополнительные ингредиенты, стадии и/или их части не оказывают значительного влияния на основные и новые характеристики заявляемой композиции, способа или структуры.
Используемая в настоящем документе форма единственного числа включает в себя ссылки на множественное число, если из контекста явно не следует иное. Например, термин «соединение» или «по меньшей мере одно соединение» может включать в себя множество соединений, включая в себя их смеси.
Используемый в настоящем документе термин «способ» относится к подходам средствам, технологиям и процедурам для выполнения данной задачи, включая в себя без ограничения подходы, средства, технологии и процедуры либо известные, либо легко разработанные из известных подходов, средств, технологий и процедур практиками химических, фармакологических, биологических, биохимических и медицинских областей техник.
Следует понимать, что определенные признаки изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления, также могут быть представлены в комбинации в одном варианте осуществления. Наоборот, различные признаки изобретения, которые для краткости описаны в контексте одного варианта осуществления, могут также быть представлены отдельно или в любой подходящей подкомбинации или в качестве пригодных в любом другом описанном варианте осуществления настоящего изобретения. Некоторые функции, описанные в контексте различных вариантов осуществления, не должны рассматриваться как существенные признаки этих вариантов осуществления, если вариант осуществления не находится в нерабочем состоянии без этих элементов.
Различные варианты осуществления и аспекты настоящего изобретения, которые очерчены выше и заявлены в формуле изобретения, находят экспериментальное подтверждение в следующих примерах.
ПРИМЕРЫ
Следующие примеры, вместе с приведенными выше описаниями, иллюстрируют некоторые варианты осуществления настоящего изобретения неограничивающим образом.
Пример 1
Фармакокинетические исследования
Было проведено исследование с целью характеристики межиндивидуальной изменчивости содержания в плазме Δ9-ТНС во время фазы абсорбции при использовании ручного устройства для ингаляции отмеренных доз MDI, выполненного с возможностью легочной доставки предварительно определенных количеств активного средства Δ9-ТНС из твердого вещества (полученного из каннабиса растительного вещества) при его нагревании.
Исследование использовали для дополнительной оценки фармакодинамического эффекта легочной доставки Δ9-ТНС на уменьшение боли от исходного значения с использованием 10 см визуальной аналоговой шкалы (VAS) боли (0 нет никакой боли, а 10 худшая из возможных боль); для мониторинга неблагоприятных эффектов, артериального давления и частоты сердечных сокращений, а также для оценки степени удовлетворенности использования manners MDI по шкале 0-10.
Исследование когорты:
Исследование проводили в научно-исследовательском отделении боли кампуса здравоохранения Рамбам в Хайфе, Израиль. Когорту пациентов включали в исследование после того, как они отвечали следующим критериям:
(a) Возраст от 18 лет и старше.
(b) Испытывание невропатической боли любого типа в течение по меньшей мере 3 месяцев.
(c) Стабильная аналгезирующая схема лечения в течение по меньшей мере 60 дней, которая включала в себя лекарственный каннабис.
(d) Нормальная функция печени (определяемая как содержание аспартатаминотрансферазы менее чем в три раза превышающее нормальное содержание), нормальная функция почек (определяемая как содержание креатинина в сыворотке крови ниже, чем 133 мкмоль/л) и нормальный уровень гематокрита (выше 38%).
(e) Отрицательный тест на беременность (определяется с помощью теста на беременность на человеческий хорионический гонадотропин Р), когда это применимо.
(f) Владение действующей лицензией от Министерства здравоохранения Израиля для получения лекарственного каннабиса.
Критерием исключения было наличие серьезного заболевания сердца или легких, психотическое нарушение в анамнезе, беременность или кормление грудью или присутствие неневропатической боли.
Протокол PK/PD исследования:
PK/PD исследование проводили на основе протокола открытого дизайна с однократной дозой. Оценивали истории болезни всех пациентов, и они сами были физически осмотрены врачом исследования. Прием обычных лекарства продолжался в течение всего процесса. Пациенты должны были воздерживаться от употребления каннабиса в течение 12 часов до начала клинического испытания.
После 3 успешных демонстративных легочных доставок, участники вдыхали одну дозу, выпаренную из 15,1±0,1 мг цветов каннабиса в течение приблизительно 3 секунд.
Образцы крови отбирали немедленно до и через 1, 2, 3, 4, 5, 15, 30, 60, 90 и 120 минут после ингаляции для контроля за содержанием в плазме Δ9-ТНС и его активного метаболита 11-гидрокси Δ9-ТНС (11-ОН-ТНС). Цельную кровь собирали в содержащие ЭДТА пробирки Vacutainer® с фиолетовой верхней частью размером 13×75 мм. Образцы помещали на лед и центрифугировали в течение 30 минут .Аликвоты плазмы отмеряли в полипропиленовые криопробирки Nunc объемом 3,6 мл (Thomas Scientific), хранили при -20°С и анализировали в течение 6 недель. Анализ концентрации в плазме каннабиноидов выполняли в NMS Labs (Willow Grove, Пенсильвания, США) посредством способа многомерной газовой хроматографии/масс-спектрометрии.
Снижение интенсивности боли оценивали в виде терапевтического эффекта, прося участников указать интенсивность их текущей боли на визуальной аналоговой шкале (VAS) длиной 100 мм в диапазоне от 0 (нет боли) до 100 (худшая из возможных боль) в исходном состоянии (до ингаляции) и через 20 и 90 минут после легочной доставки фармацевтически активного средства из каннабиса. Неблагоприятные эффекты, в виде психотропных симптомов, фиксировали через 5, 15, 30, 60 и 120 минут после легочной доставки вместе со спонтанно сообщенными участниками. Неблагоприятные эффекты оценивали в соответствии со стандартными критериями с точки зрения тяжести, частоты, продолжительности и отношения к активному средству исследования. Неблагоприятные эффекты классифицировали с использованием раздела NIH таблицы AIDS для оценки тяжести нежелательных явлений для взрослых. Артериальное давление и частоту пульса также записывали до, во время и после легочной доставки.
Удовлетворенность от опыта легочной доставки паров, по сравнению с текущим способом использования (курение), оценивали с помощью линейки VAS длиной 100 мм, во главе с «вовсе не» на 0 и «очень» на 100 и 120 минут после лечение.
Медикаменты PK/PD исследования:
Используемое сырое вещество представляло собой цветы каннабиса фармацевтического класса (Bedrocan BV, Веендам, Нидерланды), содержащие 19,9% дронабинола (Δ9-ТНС), 0,1% каннабидиола (CBD) и 0,2% каннабинола (CBN). Сырое вещество не содержало пестицидов и тяжелых металлов (менее 0,2 частей на миллион свинца, менее 0,02 частей на миллион ртути и менее чем 0,02 частей на миллион кадмия). Инородные материалы (веточки, насекомых и других вредителей) удаляли из сырого вещества. Подтверждали микробиологическую чистоту (общее аэробное микробное число составляло менее 10 КОЕ/г, общее число дрожжей и плесени составляло менее 10 КОЕ/г и отсутствовали P. aeruginosa, S. aureus и толерантные к желчи грамотрицательные бактерии).
Субстанцию цветов каннабиса осторожно измельчали при сохранении всех соединений в сыром виде, что приводило к физически модифицированному веществу, содержащему 20,4% активного Δ9-ТНС.Измельченный каннабис помещали в предустановленные картриджи, содержащие 15,1±0,1 мг каждый.
Устройство MDI:
Исследуемое устройство MDI представляло собой ручное устройство MDI для ингаляции отмеренных доз на батарейках размером с ладонь (Syqe MDI ™), предназначенное для испарения нескольких доз фармацевтически активного средства(средств), приводя в результате к легочной доставке парообразного активного средства(средств) (смотрите фиг. 1 предшествующего уровня техники и WO/2012/085919). MDI состоял из гирлянды из нескольких картриджей, счетчика картриджей, световой индикации и выключателя питания. Каждый картридж был предварительно загружен предварительно взвешенным веществом массой 15,1±0,1 мг (cannabis flos), полученным, как описано выше, каждый из которых содержащий приблизительно 3,08±0,02 мг Δ9-ТНС на основе анализа вещества. Процесс выпаривания и легочную доставку моментально запускали посредством силы вдыхания пациента, и длился он приблизительно 3 секунды. Переход к следующей легочной доставке осуществлялся путем перемещения индикатора дозы. Каждый картридж нагревался до температуры приблизительно 190°С в течение приблизительно 470 мс и точно поддерживался в течение 2530 мс. Эффективность процесса испарения ТНС составляла 52,7±2,7% (данные не показаны), что указывает на низкую вариабельность между доставляемыми в легкие дозами. Устройство разрешено для ингаляции в пределах от 1 до 30 л/мин, вовлекая управление потоком в режиме реального времени и автоматизированную анатомическим механизмом ликвидацию мертвого пространства, обеспечивая прохождение всех паров в трахею после ингаляции.
Устройство требует минимальной подготовки пользователя. Устройство управляется электронным образом и регистрирует весь процесс легочной доставки, что позволяет хранение и загрузку журналов регистрации данных лечения. Устройство MDI дополнительно разрешено для «однодозовой» разрешающей способности, мгновенного введения и не требует предварительной обработки или какого-либо вмешательства пользователя, кроме ингаляции.
Данные фармакокинетических параметров и статистический анализ: Пик концентрации ТНС (Cmax) и время до достижения Cmax (Tmax) получали непосредственно из экспериментальных данных (анализов крови). Площадь под кривой времени концентрации ТНС в плазме (AUC) определяли с помощью линейного трапециевидного некомпартментного анализа (программное обеспечение WinNonlin Pro версии 2.0; Pharsight, Mountain View, CA, США). AUC экстраполировали до бесконечности (AUC0→бесконечность) путем добавления Споследняя/λZ, где Споследняя и λZ представляют собой последние измеренные концентрации ТНС и наклон в конечной стадии на шкале Ln, соответственно. Для тех участников, которые продемонстрировали остаточное содержание в плазме ТНС в нулевой момент времени (С0>0), AUC0→бесконечность получали из уравнения: AUC0→бесконечность=AUC0→последняя+Споследняя/λZ-C0/λZ, где C0/λZ представляет собой остаточную AUC, привнесшую вклад от предыдущих доз [смотите Rowland М, Tozer TN. "Clinical Pharmacokinetics: Concepts and Applications". 3th ed., Williams and Wilkins, Media, PA, 1995].
В настоящем документе результаты представлены в виде средних значений ±1 стандартное отклонение (±SD). Для каждого из измеренных эффектов (интенсивность боли VAS, систолического и диастолического артериального давления, частоты сердечных сокращений и оценки удовлетворенности) наносили на график среднее значение и 95% доверительный интервал (CI) в различные моменты времени. Различия между значениями интенсивности боли VAS и оценками удовлетворенности до и после ингаляции исследовали посредством двустороннего парного t-критерия Стьюдента. Значения артериального давления и частоты сердечных сокращений сопоставляли в различные моменты времени с помощью одностороннего дисперсионного анализа.
Значения Р<0,05 были приняты в качестве значимых. Все статистические анализы проводили с использованием статистического программного обеспечения Minitab, версия 16.
В исследовании принимали участие восемь пациентов. Данные демографических и исходных характеристик испытуемых представлены в таблице 1.

Участники представляли собой в основном мужчин (62,5%) в возрасте от 25 до 69 лет (средний Возраст ±SD=42±14). Средняя масса и индекс массы тела ±8 В составлял 79±21 кг и 27±6, соответственно. Все участники страдали от невропатической боли: 4 характеризовались комплексным региональным болевым синдромом (CRPS), у 2 наблюдалась пояснично-крестцовая радикулопатия, у 1 - брюшная невропатическая боль и у 1 была боль, связанная с повреждением спинного мозга. Среднее время от постановки диагноза невропатической боли до исследования составляло 48 месяцев (диапазон: 30-147). Все пациенты получали регулярно цветы каннабиса, вдыхаемые посредством курения 2-3 раза в день.
Среднемесячная доза составляла 20-30 г (диапазон доз: от 2-5 граммов до 30-40 граммов в месяц).
В таблице 2 представлены данные фармакокинетики, полученные для Δ9-ТНС после однократной дозы ингаляции 15,1±0,1 мг цветов каннабиса, содержащих 3,08±0,02 мг Δ9-ТНС, вводимой самими 8 взрослыми пациентами, как описано в настоящем документе (смотрите таблицу 1 выше). Межиндивидуальная изменчивость содержания в плазме каннабиноидов после ингаляции однократной дозы представлена на фиг. 2 и в таблице 2 ниже.
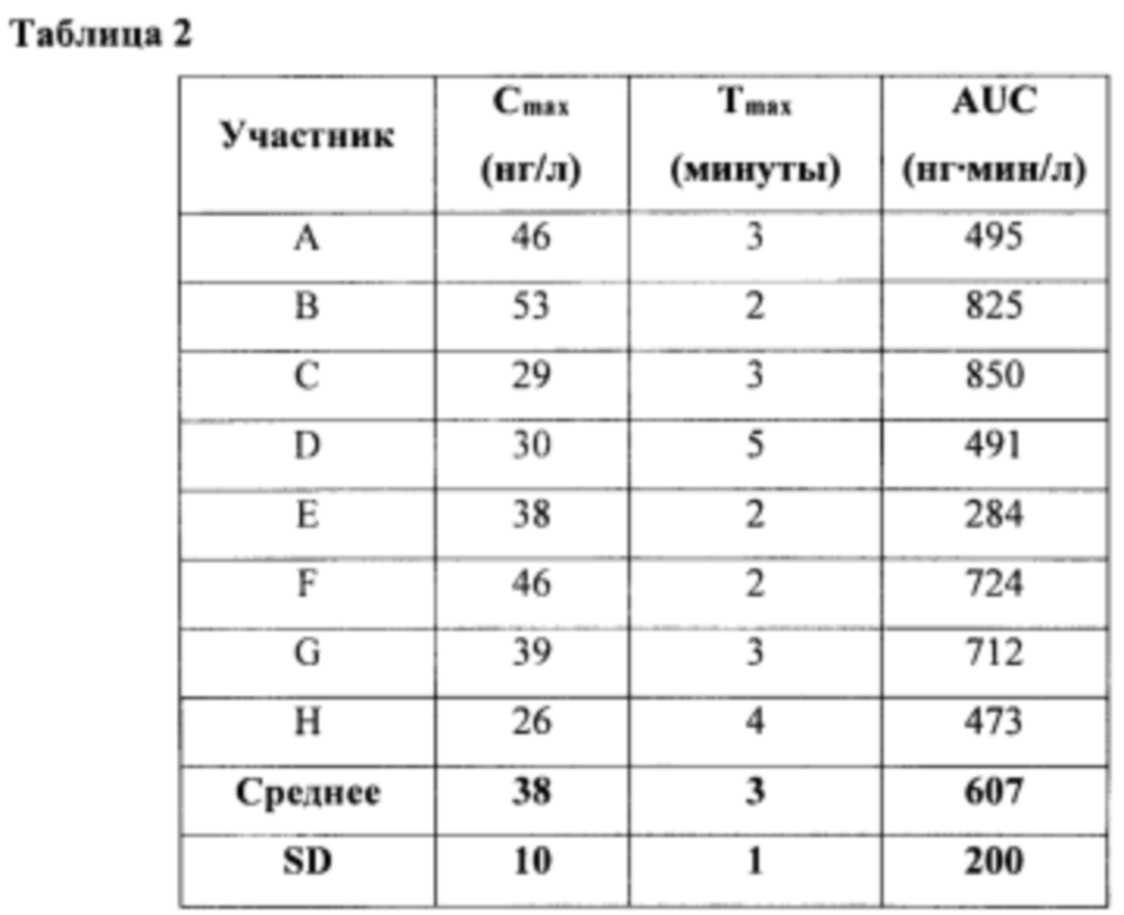
У двоих пациентов наблюдался остаточный плазменный ТНС, выше предела дозировки, на исходном уровне. У остальных шести пациентов ТНС был впервые обнаружен в образце крови, отобранном через 1 минуту после ингаляция. Средняя Cmax ТНС в плазме для всей группы составляла 38±10 нг/мл и происходила через 3±1 мин. Среднее значение THC-AUC0→бесконечность Составляла 607±200 нг⋅мин/мл. Не наблюдались измеримые уровни в плазме активного метаболита (11-ОН-ТНС) в сроки отбора образцов крови (0-120 минут). Средняя исходная интенсивность боли VAS составляла 7,5±1,4. Значительное обезболивание отмечали через 20 минут после ингаляции (разница в 3,4 пункта, 95% CI: [2,1,4,9], Р=0,001). Значения VAS, сообщаемые через 90 минут после дозирования, показали практически идентичные результаты, как в исходном состоянии, как показано на фиг. 3.
Неблагоприятные эффекты были минимальными, обратимыми и хорошо переносимыми. Семь пациентов (87,5%) испытывали головокружение в течение первых 10 минут после ингаляции, но эффект затем быстро отступал. Три пациента полностью восстановились в течение 15 минут, а все остальные - в течение 30 минут после ингаляции.
Как показано на фиг. 4, по сравнению с исходным уровнем, снижение пограничной значимости в среднем уроне систолического артериального давления (АД) было отмечено через 30 минут после ингаляции, которое сохранялось в течение 90 минут (от 133±13 до 122±10 и 121±11 мм рт. ст. через 30 и 90 минут после ингаляции, соответственно; Р=0,068). Никаких существенных различий в среднем диастолическом артериальном давлении и частоте сердцебиения не было измерено в течение периода исследования (для диастолического АД: от 82±9 до 75±10 и 81±12 мм рт.ст. через 0, 30 и 90 мин после ингаляции, соответственно; Р=0,410). Для частоты сердечных сокращений: от 71±12 до 72±11 и 69±13 ударов в минуту через 0, 30 и 90 мин после ингаляции, соответственно; Р=0,873).
Как показано на фиг. 5, все пациенты выбирали легочную доставку с помощью устройства MDI в качестве предпочтительного способа лечения, по сравнению с курением, их текущим режимом использования (балл удовлетворения 9,37±0,52 по сравнению с 5,37±2,61, 95% CI для стандартного отклонения: [1,72, 6,28]; Р=0,004).
Неблагоприятные эффекты, наблюдаемые в исследовании, были минимальными, обратимыми и быстро отступали, в соответствии с клиническими исследованиями с участием низких доз ТНС, высвобождаемых из каннабиса и доставляемых путем ингаляции, как уже упоминалось выше. Ни один из участников не вышел из исследования из-за проблем с переносимостью.
Пример 2
Сравнительные анализы
Данные, полученные в исследованиях, описанных в примере 1, анализировали в сравнении с курением, оромукозальным, пероральным и внутривенным введением Δ9-ТНС и ингаляцией с использованием коммерчески доступного испарителя Volcano®.
Содержание в ПЛаЗМе Cmax на мг введения Δ9-ТНС:
Авторы настоящего изобретения сравнили выходы ТНС, полученные с помощью легочной доставки в соответствии с описанным в настоящем документе способом, с данными, опубликованными в настоящей области техники (предшествующем уровне техники), сравнительные результаты которой графически представлены на фиг. 6.
Таким образом, внутривенное введение Δ9-ТНС, в качестве эталонного способа доставки, дало самое высокое содержание в плазме Cmax на мг введенного Δ9-ТНС - 43.8 (по данным Ohlsson, et al. Clin Pharmacol Ther. 1980; 28(3):409-16; столбец обозначается «Ohlsson (3)» на фиг. 6), и 32,8, 23,8 нг Δ9-ТНС/мл плазмы (по данным D'Souza et al., Neuropsychopharmacology, 2004; 29(8): 1558-72; столбец обозначается «D'Souza (14)» на фиг. 6).
Среди альтернативных способов введения Δ9-ТНС, описанный в настоящем документе легочный способ доставки дал наибольшее увеличение Cmax на мг Δ9-ТНС, доступный в используемом веществе каннабиса - среднее значение 12,3 нг/мл/мг Δ9-ТНС по сравнению с 6,1-9,0 для испарителя Volcano® (столбцы обозначены «Abrams (9)» и «Abrams (20)»; Abrams et al. Clin Pharmacol Ther. 2007; 82(5):572-8; Abrams et al., Clin Pharmacol Ther. 2011; 90(6):844-51, соответственно) и 0,6-4,6 для обычного курения сигарет (столбцы обозначены «Ohlsson (3)», «Hunault (15)», «Hunault (16)» и «Huestis (17)»: Hunault et al. Psychopharmacology (Bed). 2008; 201(2): 171-81; Hunault et al., Toxicol Appl Pharmacol. 2010;246(3):148-53; Huestis et al., Clin Pharmacol Ther. 1992 Jul;52(l):31-41).
Скорость поглощения и распределения ТНС при курении может привести к тому, что Cmax может быть артефактом протокола отбора проб; то есть случайная выборка большого количества отдельных пиков и впадин после каждой затяжки могла произвести искусственные пиковые реакции. Это вынудило исследователей использовать непрерывный аспиратор с регулируемыми скоростями для быстрого последовательного забора крови, чтобы охарактеризовать фазы абсорбции курения марихуаны. Они сообщили о среднем увеличении Cmax до 3,54 или 4,28 нг/мл на мг Δ9-ТНС, наблюдаемом после первой затяжки сигареты с Δ9-ТНС 1,75% или 3,55%, соответственно. Протокол курения состоял из вдыхания длительностью 2 секунды и не более 10 секундного периода удержания и выдоха и периода отдыха продолжительностью 72 секунды.
Результаты, полученные авторами настоящего изобретения, были выше на коэффициент 2,9-3,5 по сравнению с результатами, полученными Huestis с соавт., которые могут быть показательными для одного или нескольких из следующего: на 33% более длительный ингаляционный период, отсутствие бокового потока дыма и минимальное пиролитическое разрушение ТНС во время процесса парообразования в устройстве MDI (фиг. 6).
Индивидуальная изменчивость в Cmax ТНС:
На фиг. 7 представлены данные индивидуальной изменчивости в пиковых концентрациях в плазме Δ9-ТНС, полученных описанным в настоящем документе способом, и сравнительные данные, известные в настоящей области техники (предшествующий уровень техники). Как видно на фиг. 7, индивидуальная вариабельность Cmax устройства MDI в соответствии с вариантами осуществления настоящего изобретения составляла 25,3%.
Некоторые исследования показали значения коэффициента вариации (CV) 47-85% для испарителей (столбцы обозначены «Abrams (9)» и «Abrams (20)» на фиг. 7), 32-115%) для курения сигарет (колонки, обозначенные «Ohlsson (3)», «НипашЧ (15)», и «Huestis (17)»), 42-115% для перорального введения (Ohlsson (3), Karschner (4) и Lile (21); Karschner et al., Clin Chem. 2011; 57(l):66-75; Lile et al., J Clin Pharmacol. 2013; 53(7):680-90) и 59-67%) для маршрута доставки через слизистую ротовой полости (Karschner (4)), как это показано на фиг. 7.
Большинство исследований, представленных на фиг. 7, проводили при контролируемом дозировании и условиях эксперимента. В условиях «реальной жизни» ожидается более высокая индивидуальную изменчивость.
Относительно низкая индивидуальная вариабельность Cmax может быть связана с особенностями исследуемого устройства MDI, которое обеспечивает полную, высокоэффективную доставку парообразного средства(средств) в легкие, независимо от паттерна вдоха конкретного пациента.
Пример 3
Определение терапевтического окна и персонализация PD-профиля
В соответствии с персонализированным способом легочной доставки, описанным в настоящем документе, рассчитывали дозу и схему лечения для поддержания лечения в пределах предварительно определенного терапевтического окна для отдельного пациента, называемого в настоящем документе «пациент X», в течение 3-х часов, с использованием алгоритма, специально разработанного для устройства для ингаляции отмеренных доз, используемого в соответствии с некоторыми вариантами осуществления настоящего раскрытия. Расчеты терапевтического окна были основаны на концентрации ТНС в плазме и организме (PK профиль ТНС), известном в настоящей области техники, в сочетании с PK переменными пациента X (например, индекс массы тела, возраст, пол и т.д.), как это описано выше.
Дозирование (множество предварительно определенных выпаренных количеств) и схему лечения (временные интервалы между дозами) определяли для пациента X с помощью алгоритма, который имитирует фармакокинетический профиль этого пациента на основе приведенных выше и других PK исследований, проведенных в популяции субъектов и популяции PK переменных, необязательно в комбинации с PK эффектами, определенными, как описано выше, для устройства MDI, и параллельно стимулирует фармакодинамический профиль, который, как ожидается, будет проявляться с учетом желаемого уровня терапевтического эффекта и допустимого уровня неблагоприятного эффекта. Полученный предсказанный PD профиль поэтому соизмеряет терапевтическое окно, которое позволило бы пациенту X получить, как терапевтический эффект лечения симптомов (облегчение боли), так и переносимые уровни психотропной активности (связанные с ЦНС неблагоприятные психотропные эффекты).
Алгоритм обеспечивает требуемую дозировку и схему лечения для достижения желаемого PD профиля, основанного на PK эффектах и переменных.
Фиг. 8 представляет собой типичный пример легочной доставки трех предварительно определенных выпаренных количеств (рассчитанное дозирование) в течение периода времени, равного 3 часам, как рассчитано для пациента X. Пациент X представляет собой мужчину 35 лет с ИМТ 22.
В соответствии с предсказанными PK/PD профилями, для того чтобы поддерживать эффект ТНС в пределах терапевтического окна в течение 3 часов, как представлено красной кривой на фиг. 8, пациенту X нужно вдыхать ТНС, испаряющийся из каннабиса с использованием устройства для ингаляции отмеренных доз MDI, используемого в примерах 1 и 2 выше, в соответствии с некоторыми вариантами осуществления настоящего изобретения, в следующие интервалы времени и в предварительно определенных выпаренных количествах (расчетное дозирование и схема лечения): в 00 мин -1,2 мг; через 10 минут -1,0 мг и через 60 минут - 0,5 мг. Синяя кривая представляет собой вычисленный PD профиль в указанной дозировке. Как видно, расчетная схема лечения поддерживает пациента X в пределах допустимых уровней неблагоприятных активностей ЦНС, а именно ниже уровня неблагоприятных эффектов и выше минимального уровня осознания симптомов (а именно, выше минимального терапевтического эффекта).
Устройство MDI и алгоритм, используемые в способе легочной доставки, описанном в настоящем документе, обеспечивают возможность использовать такое устройство MDI для легочной доставки активных средств в предварительно определенных выпаренных количествах (предварительно определенное дозирование и схема лечения), причем устройство MDI калибруют и настраивают на основе PK/PD данных и персональных PK переменных и/или данных, с тем чтобы получить желательный предварительно выбранный PK профиль, который выбирают таким образом, чтобы получить предварительно выбранный (желательный) PD профиль и поддерживать эффекты средства в пределах предварительно определенного терапевтического окна, которое было выбрано для конкретного пациента.
Ниже приведен пример процедуры для определения и введения персональной дозировки и/или схемы лечения для лечения субъекта-человека путем легочной доставки с использованием ингаляционного устройства, в соответствии с некоторыми вариантами осуществления настоящего раскрытия. Процедура показана на блок-схеме 1900, представленной на фиг. 19.
Предоставление данных пациента (смотрите 1901 на фиг. 19) может включать в себя информацию о свойствах пациента, включая в себя, например, одно или несколько из следующего: возраст, пол, масса, ИМТ, ожидаемая активность пациента и т.д., рекомендуемую дозировку и/или схему лечения, и/или синдром или признак, для лечения которого проводят процедуру. По желанию, предоставление данных о пациенте (1901) также включает в себя PK/PD данные от одного или нескольких предыдущих применений ингалятора для того же активного средства(средств) и, возможно, по тем же показаниям. По желанию, предоставление данных о пациенте (1901) включает в себя корреляцию или набор корреляций между дозой и PK профилем и/или PD профилем пациента в течение определенного периода времени, как записано в одной или нескольких предыдущих доставках одного и того же или нескольких фармацевтически активных веществ. По желанию, предоставление данных о пациенте (1901) включает в себя данные, собранные из PK/PD профилей множества пользователей или популяции, к которой принадлежит пользователь.
Необязательно, предоставление данных о пациенте (1901) предусматривает инструкции для лечения и/или предпочтений лечения. Некоторые примеры инструкций для лечения или предпочтений могут включать в себя отсутствие дозы в течение заданного временного окна; позволяя большую сонливость в целом (например, для лежачих больных), или в заданное время (например, первичное воздействие и/или ночное время, и/или при общении с экстремальными симптомами); требование концентрации внимания в заданные сроки (например, когда пациент ожидает потребность в концентрации внимания) и тому подобное. Таким инструкциям может быть дано взвешенное значение; например, пациент может быть менее непреклонен в отношении некоторых инструкций, чем в отношении других, например, пациент может иметь большее предпочтение к сонливости в вечернее время, но может указать о том, что он должен быть сконцентрирован для испытания в 10 часов утра.
Инструкция может иметь относительный эффект в том смысле, что некоторые эффекты могут быть переносимыми в определенной степени только для того, чтобы соответствовать данной инструкции. Например, пациент может дать указание, что он должен быть сконцентрирован для ведения автомобиля, если боль не превышает определенное заданное значение.
Тем не менее, охваченные дополнительным предоставлением данных о пациенте (1901), инструкции лечения могут быть предоставлены в любое время в течение периода лечения; например, перед началом лечения пациент может дать инструкции по лечению и/или предпочтениям лечения. В любое время после этого, пациент может вводить дополнительные указания и/или предпочтения. Например, пациент может в любое время использовать интерфейс пользователя, связанный с устройством, чтобы инструктировать относительно будущей (например, следующей) дозы (или более чем одной дозы). Такое указание может включать в себя то, что доза не будет приниматься в заданном временном окне или должна быть принята до заданного момента времени и т.д. Дополнительно такое указание может включать в себя корректировку приемлемого и/или предпочтительного терапевтического окна пользователя, что представляет собой достаточный терапевтический эффект и/или то, что представляет собой максимальный уровень (допустимый) неблагоприятных эффектов.
Необязательно, предоставление данных о пациенте (1901) обновляется для отражения того, когда доза вдыхалась, количестве дозы и/или как устройство работает в случае ингаляции (например, если ингаляция была успешной или не удалась из-за неисправности устройства и/или ненадлежащего применения). Это может быть принято в качестве индикатора состояния пользователя и/или неисправности устройства и/или количества вдыхаемого активного вещества (фактор эффективности). Такие данные могут быть использованы для корректировки схемы лечения и/или выдачи уведомления пользователю и/или практикующему врачу.
При необходимости, когда схема лечения требует от пользователя введения дозы, пользователю может быть предложено сделать это, визуально и/или с помощью звука, с помощью по меньшей мере одного интерфейса пользователя. В ответ на запрос, пользователь может иметь возможность отложить, выбрав опцию «повторить» и, возможно, установить следующий раз, когда он будет принимать следующую дозу. В ответ на это устройство может скорректировать схему лечения (например, следующий размер дозы и время) и/или предоставить уведомление пользователю, что это будет невозможно или может иметь данный неблагоприятный эффект.
При необходимости, если пользователь пропускает временной интервал, зарезервированный для данной дозы, может иметь место одно или несколько из следующих действий: (а) схема лечения корректируется, чтобы компенсировать задержку; (b) пользователю приходит уведомление (возможно, путем активации сигнала тревоги и/или вибрации); (с) уведомление приходит попечителю и/или практикующему врачу.
Получение первоначальной дозировки и/или схемы лечения (смотрите 1902 на фиг. 19) может быть осуществлено следующим образом:
На основе рекомендуемой дозировки и/или схемы лечения (смотрите подробности ниже) и данных о пациенте (1901) предлагается первоначальная дозировка и/или схема лечения (1902). Первоначальная дозировка и/или схема лечения (1902) может включать в себя рекомендуемые дозировки в соответствии с известными стандартами и/или может быть скорректирована посредством учета данных, связанных с предыдущим лечением(ями) пациента с использованием ингалятора и инструкциями и/или предпочтениями в лечении.
Принимая во внимание рекомендуемую дозировку и/или схему лечения, инструкции относительно лечения могут включать в себя некоторые ограничения, которые представляют собой более жесткие, чем другие. Например, максимальная допустимая доза не может быть превышена вне зависимости от предпочтений пользователя, и устройство может быть выполнено таким образом, чтобы не допускать передозировку. Аналогичным образом, может быть предписана минимальная обязательная доза и ее не следует избегать, вне зависимости от предпочтений пользователя, и устройство может быть выполнено таким образом, чтобы выдавать предупреждение о несоблюдении пользователю и/или попечителю, и/или медицинскому персоналу, в таких случаях. Необязательно, ограничения могут быть наложены предварительно (например, на основе терапевтического индекса одного или нескольких активных веществ и/или в соответствии с планом, построенным или одобренным врачом) и/или периодически или на постоянной основе (например, в результате конкретных событий, возникающих при использовании пользовательского устройства).
Необязательно, создание первоначальной схемы лечения (1902) осуществляется для пациента при первом назначении ингалятора и схемы лечения. В таком случае пациент должен вдыхать первую дозу или первые несколько доз под контролем (например, в течение 2 часов и более). В течение этого периода времени наблюдают симптомы пациента и PD эффекты, записанные и измеренные до первой дозы, а затем время от времени по меньшей мере в течение контролируемого периода. Дополнительно или альтернативно, контролируют одну или несколько ингаляций посредством анализа крови, чтобы извлечь некоторые PK эффекты или полный PK профиль. Это может включать в себя введение нескольких различных доз, чтобы установить персонифицированную начальную дозировку и/или схему лечения. Когда PK эффекты взяты и проанализированы, может быть записана первая корреляция (концентрация в крови с течением времени в зависимости от предварительно определенного выпаренного количества/дозы). Эта корреляция может оставаться неизменной для данного пациента до значительных изменений массы или изменений функций почек и/или печени. Вторая корреляция, такая как PD эффект в зависимости от концентрации в крови с течением времени, может быть использована, поскольку она известна для популяции в целом. На основании этих двух корреляций индивидуальная корреляция начальной дозы/PD с течением времени может быть определена для пациента. По желанию, прямую корреляцию измеряют и используют для данного пациента между PD эффектом в течение долгого времени как функцию отключения предварительно определенного выпаренного количества/дозы.
Получение PKPD обратной связи (смотрите 1903 на фиг. 19) осуществляют для включения по меньшей мере одного из нескольких классов пользовательских показателей/информации, включая в себя пользовательский полуконтролируемый (вольно или невольно) показатель и пользовательский неконтролируемый (непроизвольный) показатель.
Получение PKPD обратной связи (1903) может включать в себя прием управляемого пользователем показателя и/или информации, причем пользователь может обеспечивать ввод данных относительно воспринимаемого и/или ощущаемого эффекта и/или желательного диапазона эффекта. Например, вводя один или несколько ответов на опрос с помощью устройства пользовательского интерфейса и/или практикующим врачом (например, классификацию степени боли и/или степени психоактивного эффекта), пользователь имеет контроль над входными данными, которые он обеспечивает. Ответ может включать в себя классификации по шкале (например, шкале боли от 1 до 10), ответ Да/Нет (например, была ли устранена тошнота или была ли пища съедена без рвоты) и/или временное описание эффекта («когда вы заметили, что боль стала рассеиваться?», «как боль чувствовалась в период времени от вдыхания до опроса?» и т.д.). Опрос может быть периодическим (например, один раз в день или каждые несколько часов, или при ингаляции, или как требование перед ингаляцией) и может быть ограничен лишь частью периода лечения. Например, опрос может охватывать начальные 6, 12 или 24 часа для того, чтобы определить схему лечения, а затем периодически повторяться (например, один раз в день или раз в неделю, или раз в месяц, или по желанию) для того, чтобы подтвердить схему лечения и/или скорректировать ее с учетом прогресса.
Получение PKPD обратной связи (1903) может включать в себя прием полуконтролируемого показателя пользователя, причем пользователь может участвовать в оценке статуса пользователя; в то время как соблюдение инструкций пользователем необходимо для этих показателей, пользователь практически никак не контролирует результат. Например, пользователь может быть проинструктирован о присоединении к его телу датчика, который устанавливает соединение с устройством или позволяет зондирование свойства (например, покраснение глаз). По желанию и в качестве альтернативы, интерфейс пользователя может проверить пользователя, например, с помощью слежения за зрачками и/или инструктирования пользователя выполнять задачу. Примеры задач могут включать в себя без ограничения слежение глазами за меткой на экране; перетаскивание метки на экране через шаблон не касаясь стен; выполнение умственных задач (например, решения математических уравнений или ответ на вопросы); тестирование памяти играми и тестирование концентрации.
Получение PKPD обратной связи (1903) может включать в себя получение пользовательского неконтролируемого показателя, причем ингалятор или устройство, связанное с ингалятором, может ощущать один или несколько свойств пользователя, в качестве показателя состояния пользователя, и использовать его в качестве показателя одного или нескольких эффектов схемы лечения вдыхаемой дозы на пользователя. Например, измерение температуры во рту и/или размера зрачка во время ингаляции без запроса пользователя, каждый из которых может указывать на PD эффект и, таким образом, служить в качестве PD эффекта; контроль тремора или изменения в треморе и измерение частоты сердечных сокращений и/или артериального давления, например, путем взаимодействия с датчиком, носимым пользователем и/или имплантированным в пользователя.
Необязательно и альтернативно, чувствительные свойства воздушного потока в устройстве могут быть использованы в качестве индикатора состояния пользователя, причем такие свойства потока воздуха могут включать в себя одно или несколько из скорости потока и/или скорости повышения скорости потока, и/или степени и/или скорости изменения потока во время события ингаляции. Например, с учетом изменений от одного или нескольких исходных значений, которые могут указывать, например, на улучшение или снижение хорошего самочувствия (например, что проявляется посредством силы и/или боли, которые могут повлиять на ингаляционные свойства/паттерны для пользователя) и/или концентрацию или внимание.
Получение скорректированной схемы лечения (смотрите 1904 на фиг. 19) осуществляется при необходимости для получения скорректированного дозирования и/или схемы лечения. Скорректированное дозирование и/или схема лечения может потребоваться, когда происходит одна или несколько из следующих ситуаций:
1. Один или несколько подвергаемых лечению симптомов не достаточно ослабляются;
2. Один или несколько психоактивных эффектов превышают заданный порог
3. Баланс терапевтического/неблагоприятного эффекта ниже заданного порогового значения и/или
4. Происходит изменение обстоятельств, которые необходимо принимать во внимание (например, появление боли или пропущенная ингаляция).
Следует отметить, что данная активность средства может рассматриваться в качестве желаемого эффекта или нежелательного эффекта, в частности, в различных условиях и для различных субъектов. Например, в случае активного средства, которое представляет собой обезболивающее, седативное и/или галлюциногенное средство, может быть, что обезболивающее свойство представляет собой терапевтический эффект, а галлюциногенное свойство представляет собой неблагоприятный эффектом. Что касается седативного эффекта, в некоторых случаях это может быть желаемым эффектом лечения, в то время как в других случаях это может быть нежелательно.
Необязательно и альтернативно, при создании скорректированной схемы лечения (1904) дозирование и/или схема лечения включает в себя второе активное средство (или более чем два средства), которые вводят совместно с целью снижения нежелательного побочного эффекта лекарственного средства.
Пример схемы для лечения симптомов невропатической боли, иногда эпизодов прорыва боли (ВТН) и бессонницы из-за боли, представлен на фиг. 20.
Фиг. 20 представляет собой графическое представление схемы лечения для лечения боли и бессонницы посредством легочной доставки активного средства, где красная линия представляет собой уровень боли, а зеленая линия представляет собой содержание активного средства в крови, причем активное средство представляет собой болеутоляющее, а также успокаивающее средство и вдыхается с использованием различных доз во время бодрствования.
Как видно на фиг. 20, легочная доставка предварительно определенного выпаренного количества (рассчитанное дозирование) осуществляется в течение дня с бодрствования приблизительно в 6:30 утра до сна после 22:30, причем пациент представляет собой, например, 35-летнего мужчину с ИМТ 22. Пациент страдает от хронической невропатической боли, иногда эпизодов прорыва боли (ВТН) (один раз в день) и бессонницы из-за боли, в частности, характеризуется трудностями при засыпании. В соответствии с вышесказанным, прогнозируют PK/PD профили и предлагают начальный схему лечения, для того чтобы сохранить эффект активного средства (например, ТНС) в пределах терапевтического окна в течение по меньшей мере 12 часов. Схема включает в себя первую дозу, например, 1,2 мг, принимаемую в 7 часов утра в связи с увеличением боли в течение ночи, когда лечение не вводили, а затем 0,5 мг через каждые 1,5 часа.
В этом примере, терапевтический эффект требует минимального значения, которое определяется на основе минимальной дозы, необходимой для восприятия эффективного терапевтического эффекта, и максимальной дозы, которую определяют в соответствии по меньшей мере с одним или несколькими PK/PD эффектами и при необходимости в зависимости от минимального значения. Минимальное значение может изменяться в зависимости от подвергаемых лечению симптомов/заболевания. Максимальное значение может изменяться в зависимости, например, от времени суток и расписания и предпочтений пациента.
На фиг. 20 также показано, что эта схема лечения уменьшала боль (красная линия) от высокого значения до 7 утра до значения, которое поддерживается в пределах допустимого окна до приблизительно 14:30, когда пациент испытывал ВТН сильной боли. В ответ на это, терапевтическое окно корректируют. Высокий порог дозы увеличивается в этом примере, потому что ввиду сильной боли, некоторый избыток психоактивного эффекта становится терпимым и даже желательным. Кроме того, нижняя часть диапазона окна перемещается вверх, так как требуемая доза, необходимая, чтобы облегчить боль, стала выше.
Как далее можно видеть на фиг. 20, эпизод ВТН регулируется путем введения ингаляции в дозе 2,4 мг, что приводит к ожидаемому уменьшению боли при сопутствующем высоком седативном эффекте. После того, как боль возвращается до приемлемого уровня, начальное терапевтическое окно восстанавливается и первоначальная схема лечения возобновляется. Это возвращение к исходной схеме и воссоздании терапевтического окна может быть резким, как показано, или постепенным. Кроме того, верхнее значение и нижнее значение окна может изменяться одновременно или в разное время, как показано.
Как дополнительно можно видеть на фиг. 20, во время, назначенное пациентом (предварительно или в режиме реального времени) как время укладывания спать, дозирование корректируется. Это происходит потому, что PD эффект сонливости изменяется от неблагоприятного эффекта к терапевтическому эффекту. Пациенту вводят дозу 2,4 мг приблизительно за 30 минут до предполагаемого времени сна. Перед пробуждением доза может быть скорректирована постепенно или резко, так что любая ингаляция поздно ночью не будет, вероятно, иметь чрезмерный эффект утром.
Пример 4
Протокол легочной доставки
Ниже приведен пример применения способа, устройства и системы, представленной в настоящем документе, в соответствии с некоторыми вариантами осуществления настоящего раскрытия.
Устройство MDI, например, как описано в настоящем документе на фиг. 16 и/или фиг. 17, загружают множеством предварительно взвешенных картриджей, каждый из которых содержит вещество, которое содержит одно или несколько испаряемых фармацевтически активных средств. MDI предварительно калибруют и устанавливают на высвобождение предварительно определенного выпаренного количества фармацевтически активного средства в соответствии с PK/PD данными, полученными для популяции и/или PK эффектами конкретного пациента, как описано выше.
Система, например, как описано выше на фиг. 9, представляет собой предварительно загруженную персональной информацией, относящейся к пациенту (например, переменные PK) и его или ее медицинским состоянием и анамнезом, данными, относящимися к предварительно определенному выпаренному количеству и временным интервалам для легочной доставки средства (дозирование и схема лечения), данными, относящимися к предварительно выбранному фармакокинетическому профилю и/или предварительно выбранному фармакодинамическому профилю, данными, относящимися к желаемого терапевтическому эффекту и допустимому неблагоприятному эффекту (терапевтическое окно), выбранному или определенному для пациента, данным, относящимся к порогам безопасности для различных условий (токсичность, сон, навыки оповещения и двигательные навыки, когнитивные функции, отдых и т.д.), а также данные, относящиеся к прошлым использованиям системы, если таковые имеются.
Во время первого применения пациент использует систему для запуска набора тестов инициализации для пациента, чтобы определить исходное состояние до воздействия активного средства, с использованием множества неинвазивных объективных (отслеживаемые биомаркеры) и субъективных (сообщаемое восприятие) процедур сбора данных различных персональных PD эффектов. Эти тесты исходного состояния проводятся периодически, а именно ежечасно, полусуточно, ежедневно, еженедельно, ежемесячно, согласно требованию и до введения дозы/схемы лечения и изменений. Следует отметить, что персональные PD эффекты могут быть получены до легочной доставки, а именно до того, как любое средство было доставлено пациенту, и поэтому рассматриваются как исходные значения персональных PD эффектов. Например, если персональный PD эффект представляет собой уровень боли, система регистрирует уровень боли под воздействием нулевого количества средства.
Затем пациент использует устройство MDI, при этом ведется контроль всех или некоторых из биомаркеров, объективных и субъективных, после легочной доставки предварительно определенного выпаренного количества средства или множества предварительно определенных выпаренных количеств средства, доставленного в предварительно определенные промежутки времени (предварительно определенное дозирование/схема лечения).
Согласно некоторым вариантам осуществления мониторинг включает в себя определение персональных PD эффектов. Различные параметры могут быть добровольно предоставлены пациентом через, например, интерфейс пациента, в то время как другие могут быть независимо собраны с помощью системы через датчики и/или интерфейс практикующего врача. Персонально воспринимаемые параметры, такие как воспринимаемый терапевтический эффект (например, уровень боли) и воспринимаемый неблагоприятный эффект (например, психоактивный уровень), встроены в систему, например, посредством взаимодействия пациента с дисплеем интерфейса пациента. Приложение для получения персонально воспринимаемых параметров может, например, визуально представлять собой график для пациента, такие как гистограмма, который пациент может модифицировать на основании его воспринимаемого понятие эффектов.
Другие персональные PD эффекты могут включать в себя наличие и/или содержание биомаркеров.
Согласно некоторым вариантам осуществления наличие и/или содержание биомаркеров определяют с помощью одного или нескольких датчиков. Необязательно, датчики представляют собой обычные компоненты мобильного персонального устройства, такого как смартфон, карманное устройство, носимое устройство, наручное устройство или встроенное в очки устройство, которое используют для сбора показаний, на основании которых могут быть выведены биомаркеры. Альтернативно, биомаркеры обнаруживают и измеряют с помощью внешних элементов, сопряженных с мобильным персональным устройством.
Компоненты, которые могут быть использованы в качестве датчиков для получения параметра от пациента, могут включать в себя: сенсорный экран, который может быть использован, например, для оценки ловкости, координации глаз и рук и/или состояния памяти и познания; гироскоп, акселерометр, датчик близости и/или датчик жестов, например, ИК-датчик может быть использован, например, для оценки моторики; камера и/или источник света могут быть использованы, например, для обнаружения визуального слежения, вариации саккады, сосудистого расширения глаз, расширения и/или пульсации зрачков; RGB-подсветка может использоваться, например, для оценки восприятия внешней среды; магнитометр и/или GPS могут быть использованы, например, для оценки ориентации; динамик и/или микрофон может быть использован, например, для оценки слуховых и/или голосовых навыков; датчик температуры и/или влажности может быть использован, например, для оценки температуры тела.
Дополнительные биомаркеры могут быть определены с помощью добавления одного или нескольких приложений, настроенных, например, на интерфейсе пациента и/или устройстве MDI, которые предназначены для проверки когнитивного, психического, моторного и/или физического состояния пациента.
Способы оценки биомаркеров могут включать в себя одну или несколько оценок саккадического движения глаз (например, саккадического движения), тестирования памяти, адаптивного слежения, оценки пальцевого теппинга, оценки раскачивания тела, соответствия визуальной аналоговой шкале и/или другие способы оценки. Согласно некоторым вариантам осуществления приложения предназначены для тестирования пациента с использованием различных известных в настоящей области техники задач, в том числе, например, тестирование времени реакции, внимания, зрительно-пространственной ориентации, пространственно-временных рассуждений, воспроизведения имени, воспроизведения повествования, воспроизведения лиц, ассоциации имя-лицо, конструкции, беглости речи, присвоения имени объекту, имплицитной памяти, логического мышления, и/или другие когнитивные задачи.
Согласно некоторым вариантам осуществления собранные параметры сохраняются в памяти интерфейса пациента, например, как описано на фиг. 9. Необязательно, собранные параметры передаются на интерфейс врача, например, как описано на фиг. 9. В некоторых случаях параметры передаются в режиме реального времени, во время использования устройства MDI.
Во время использования, если симптомы пациента не смягчаются и/или присутствуют неблагоприятные эффекты выше определенного порогового значения, в соответствии с объективными и/или субъективными измерениями или по любой другой причине, доза и/или схема лечения могут быть модифицированы. Согласно некоторым вариантам осуществления пациент инициирует модуляцию дозы/схемы лечения путем ввода персонально воспринимаемых PD эффектов через интерфейс пациента. Системы могут выполнять серию сбора данных, относящихся к другим PD эффектам, объективным и субъективным, анализировать данные в корреляции с субъективно воспринимаемыми PD эффектами, введенными пациентом, и со значениями прекращения сбора данных по безопасности, и либо предупреждают пациента о сравнительно разрешенной, рекомендуемой и/или предписанной дозе/схеме лечения. Например, система может предупредить пациента/практикующего врача о небезопасной дозе/схеме лечения или о неэффективной дозе/схеме лечения, и/или предупредить пациента/практикующего врача о другой дозе/схеме лечения в соответствии с предписанной дозой/схемой лечения или прошлым опытом, зарегистрированном в базе данных системы, и/или уведомить пациента о распределении любой заданной дозы/схемы лечения на день, активности и положении («слишком рано», «слишком далеко от дома», «в движущемся транспортном средстве» и подобные). Основанная на PD персонализация дозы/схемы лечения контролируется и записывается для дальнейшего использования и может быть переведена во вновь определенное исходное выпаренное количество и схему лечения.
После этого интерфейс пациента автоматически изменяет дозу и/или схему лечения, при этом ограничивая модуляцию посредством порогов безопасности и/или других пороговых значений, таких как первоначально определенные врачом пороговые значения. Дополнительно или альтернативно, врач, после получения персональных PD эффектов, модифицирует дозу и/или схему лечения, например, с использованием интерфейса пациента, и инструкции передаются на интерфейс пациента и/или на устройство MDI. При необходимости, врач повторно выбирает персональный PD профиль для пациента и/или повторно выбирает персональное дозирование/схему лечения, чтобы удовлетворять терапевтическому окну пациента. Дополнительно или альтернативно, пациент и/или врач управляет устройством MDI вручную (например, путем активации кнопок или переключателя на устройстве), чтобы установить желаемое дозирование и/или схему лечения.
Пример 5
Лечение с использованием комбинации активных средств
В соответствии с некоторыми вариантами осуществления настоящего раскрытия лечение комбинацией активных средств может включать в себя активные средства, которые обеспечивают синергетический эффект, активные вещества, которые обеспечивают тот же эффект, но каждый из которых имеет различные преимущества и недостатки, активные вещества, которые потенцируют или ослабляют другие активные средства (например, изменяют эффективное терапевтическое окно или терапевтический индекс друг друга), активные средства, которые обеспечивают противоречивый эффект, такой как, например, ТНС противодействует с CBD, и активные средства, которые имеют противодействующие, но желательные эффекты и должны быть на расстоянии друг от друга.
Потенциальные преимущества осуществляемого комбинированного лечения, в соответствии с некоторыми вариантами осуществления, например, посредством использования описываемого устройства, включают в себя без ограничения, точное дозирование для каждого из множества активных средств и для каждого события ингаляции и точную пропорцию между активными средствами и/или ингаляционными событиями.
Например, согласно некоторым вариантам осуществления способность доставлять сложные схемы лечения, которые включают в себя различные дозы и/или различные временные интервалы введения для каждого средства. Например, устройство может включать в себя хранилище или один или несколько магазинов единиц дозирования, по меньшей мере некоторые из которых содержат различное количество и/или комбинацию одного или нескольких активных средств. Соответственно, может быть выбрана единица дозирования или набор единиц дозирования для обеспечения желаемого результата или комбинации. Дополнительно или альтернативно, комбинация обеспечивается путем регулирования количества активного средства, которое должно быть выпарено из одной или нескольких единиц дозирования, осуществляется посредством температуры и продолжительности нагревания вещества, содержащего средства (например, растительный материал) и/или посредством контроля воздушного потока через вещество.
Другие преимущества предусмотренного в настоящее время комбинированного лечения могут включать в себя увеличенное требование и сниженное количество ошибок пользователя, осуществляемые по меньшей мере путем точного их контроля и корректировки схемы лечения, выполненных в режиме реального времени, чтобы исправить ошибки и/или реагировать на неожиданные события.
Контроль за комбинированным лечением может включать в себя одновременную или по существу одновременную доставку более чем одного активного средства, которая может быть осуществлена, например, с использованием:
I. Единицы дозирования, содержащей более одного активного средства;
II. Множества единиц дозирования, содержащих различные комбинации активных средств, используемых контролируемо в быстрой последовательности, и/или
III. Одновременного применения множества единиц дозирования, содержащих различные активные средства.
Время между событиями ингаляции двух или более различных активных средств или композиций активных средств может быть выбрано на основе их PK и/или PD эффектов и требуемого перекрытия или его отсутствия между активными средствами, необязательно, принимая во внимание эффект, который одно активное средство может оказывать на PK и/или PD эффект другого, когда присутствует у пользователя в тоже самое время. По желанию, обеспечивается уход, чтобы уменьшить число ингаляций для улучшения комфорта пациента и/или соответствия.
Схема, предусматривающая совместное введение, в соответствии с некоторыми вариантами осуществления настоящего раскрытия, предусматривает, например, одно или несколько из следующего:
I. Каждое активное средство характеризуется своей собственной независимой схемой введения;
II. Активные средства доставляются зависимым образом (например, второе активное средство доставляется в течение определенного периода времени после введения первого активного средства);
III. Активные средства получают по требованию, например, немедленная доза вводится по требованию пользователя для лечения прорыва боли или чтобы уменьшить психоактивное действие.
Одновременная доставка двух (или более) активных средств может предусматривать использование:
a. Растения (например, каннабиса), характеризующегося наличием более одного природного активного вещества в нем (примечание: может быть выбран сорт растения для обеспечения требуемого соотношения активных средств);
b. Смешивания более одного растительного материала, характеризующегося наличием различных комбинаций лекарственных средств; например каждый из которых содержит другое активное средство или содержит первое активное средство в избытке по сравнению с другим растительным материалом, который содержит второе активное средство в избытке;
c. Комбинации экстрагированных активных средств или, необязательно, добавление одного или нескольких экстрактов, содержащих одно или несколько активных средств к растительному материалу, также содержащему одно или несколько активных средств.
Может быть доставлена схема, предусматривающая совместное введение, согласно некоторым вариантам осуществления настоящего изобретения, посредством обеспечения различных единиц дозирования, содержащих различные активные вещества, в устройстве и управление их относительным временем парообразования, с тем чтобы обеспечить избирательное выпаривание различных активных средств или композиции активных средств, каждое для различных ингаляционных событий (например, путем выбора единицы дозирования, имеющей требуемый состав и/или путем сопоставления множества единиц дозирования для обеспечения требуемого количества/комбинации активных средств).
Комбинации некоторых активных средств, которые могут быть эффективно доставлены с использованием устройства и способов, предусмотренных в настоящем документе, в соответствии с вариантами осуществления настоящего раскрытия, включают в себя без ограничения, никотин и ТНС, кофеин и ТНС и CBD и ТНС.
Пример комбинированной терапии для ослабления индуцированной ТНС психоактивности включает в себя без ограничения дозу 10-60 мг CBD, вводимую путем ингаляции до, во время или после ингаляции ТНС или при появлении/наблюдении/ощущении индуцированной ТНС психоактивности, используя повторную ингаляцию с интервалами до 1 минуты в течение максимум шести доз (в общей сложности до 360 мг CBD в день) или до ослабления симптомов.
Альтернативное комбинированное лечение для ослабления индуцированной ТНС психоактивности включает в себя без ограничения дозу 10-40 мг лимонена, вводимого путем ингаляции до, во время или после ингаляции ТНС или при появлении/наблюдении/ощущении индуцированной ТНС психоактивности, используя повторную ингаляцию с интервалами до 1 минуты в течение максимум шести доз (в общей сложности до 240 мг лимонена в день) или до ослабления симптомов.
В таблице 3 представлены схемы дозирования, применимые при лечении нарушений и заболеваний, отвечающих на совместное введение ТНС и CBD с использованием устройства и способов, представленных в настоящем документе. Схемы лечения представляют собой профилактическую/событийную, эпизодическую и хроническую (12-часовой период лечения) для лечения пациентов среднего размера.


Ниже приведен пример лечения пациента с болью в спине с использованием комбинации ТНС и CBD. Лечение вводят с использованием устройства в соответствии с настоящим изобретением. Схему лечения выполняют для того, чтобы поддерживать пациента в пределах следующего терапевтического окна:
1. Боль должна поддерживаться на уровне ниже заданного порогового значения по меньшей мере в течение того периода, пока пациент не спит.
2. Психоактивные эффекты должны поддерживаться на уровне ниже заданного порогового значения, что позволит пациенту поддерживать желаемый уровень активности и информированности.
3. Уровень психоактивности может быть увеличен в случае сильной боли и в ночное время, когда предпочтительна сонливость.
Фиг. 21 представляет собой графическое представление схемы лечения для лечения боли посредством легочной доставки комбинации двух активных средств, ТНС и CBD, где пунктирная линия представляет собой уровень неблагоприятного (психотропного) эффекта, а сплошная линия представляет собой уровень боли, и где ТНС вдыхается с использованием единицы дозирования 0,5 мг (пустой треугольник), 1.2 мг (серый треугольник) и 2,4 мг (черный треугольник), a CBD вдыхается с использованием единицы дозирования 25 мг (пустой ромб).
Как видно на фиг. 21, пациент получает единицу дозирования, содержащую 25 мг CBD приблизительно за 20 минут до каждой дозы ТНС, начиная с того времени, когда пациент просыпается утром. Первая единица дозирования содержит 1,2 мг ТНС.Это больше, чем обычная доза, поскольку она необходима для удаления остаточной боли, накопленной в течение ночи. За этим следует использование единицы дозирования, содержащей спаренные дозы 25 мг CBD плюс 0,5 мг ТНС примерно раз в два часа. Как видно на фиг. 21, уровень боли уменьшается и остается постоянным, в то время как психоактивность поддерживается на низком уровне.
Как дополнительно можно видеть на фиг. 21, приблизительно в 2 часа дня, после того, как пациент принимает предшествующую дозу CBD, неожиданно проявляется прорыв боли. Это событие вводят в систему устройства с помощью интерфейса пользователя, и, соответственно, пользователь получает указание (с или без вмешательства врача) ввести себе дозу 2,4 мг ТНС.Эту большую дозу ТНС принимают одновременно с дополнительной дозой 25 мг CBD, с тем чтобы уменьшить или предотвратить предсказанное увеличение психоактивности, и приблизительно через два часа после введения большой дозы ТНС вводят еще одну дозу CBD.
Как далее можно видеть на фиг. 21, как только прорыв боли уменьшился, возобновляется комбинированное дозирование 25 мг CBD плюс 0,5 мг ТНС.Следует отметить, что в первом случае комбинированное дозирование принимается с учетом избытка ТНС, принятым ранее из-за сильной боли.
И, наконец, как можно видеть на фиг. 21, сонливость желательна перед сном, и, следовательно, порог психоактивности смещается, чтобы позволить более высокий уровень неблагоприятного эффекта. Соответственно, последняя доза представляет собой высокую дозу ТНС 1,2 мг, принимаемую отдельно без предшественника CBD.
Пример 6
Вход и выход интерфейса пользователя/врача
Ниже приведено представление категории ввода пользовательского интерфейса в соответствии с некоторыми вариантами осуществления настоящего раскрытия.
Как правило и при необходимости, интерфейс пользователя может обеспечить обратную связь от пользователя, указывающую на одно или несколько из следующего:
1. Идентификация пользователя;
2. Воспринимаемые или измеренные терапевтические или неблагоприятные эффекты, имеющие отношение к лечению/дозированию/схеме лечения;
3. Инструкции/запросы от пользователя относительно времени и/или приемлемых и/или желательных терапевтических или побочных эффектов.
Идентификацию пользователя можно контролировать с помощью ответа пользователя (пароля, входа в схему или другого запроса опознавания) или биометрическими средствами (распознавание лица и/или голоса, отпечатков пальцев, сканирование сетчатки). Использование активности (удерживание/захват устройства, вдыхание, неактивность) можно контролировать с помощью тешючувствительности, электрического заряда и акселерометрии.
Воспринимаемые или измеренные терапевтические или неблагоприятные эффекты могут включать в себя один или несколько видов связанных с лечением эффектов (боль/тошнота/уровень PD) и/или неблагоприятных эффектов (PD), и могут быть представлены в различных классах показаний:
При необходимости, пользователя могут периодически опрашивать (например, один раз в день или каждые несколько часов или при подготовке к ингаляции или как требование перед ингаляцией), и он может быть ограничен лишь частью периода лечения. Например, опрос может охватывать начальные 6,12 или 24 часа для того, чтобы определить схему лечения, а затем периодически повторяться (например, один раз в день или раз в неделю или раз в месяц или по желанию) для того, чтобы подтвердить схему лечения и/или откорректировать ее с учетом прогресса.
При необходимости, пользователь может взаимодействовать с интерфейсом по собственному желанию.
Интерфейс пользователя может быть использован для контролируемой пользователем индикации/информации. Примеры включают в себя добровольный ввод данных или в ответ на запрос с помощью устройства и/или практикующего врача (например, ответ на запрос классифицировать степень боли и/или степень психоактивного эффекта).
Полуконтролируемая пользователем индикация приведена на примере пользователя, участвующего в оценке своего собственного состояния. В таких случаях для этих показаний требуется некоторое согласие пользователя, но пользователь не имеет практически никакого контроля над последствиям, так как они выражаются на выходе и реакции устройства, такие как определение предварительно определенного выпаренного количества.
Примеры включают в себя:
пользователь подвергает сам себя воздействию датчика (например, датчика покраснения глаз или частоты сердечных сокращений);
пользователь выполняет тест, например, игра в игру, или пользователь получает инструкцию выполнить такие задачи, как, например, слежение глазами за меткой на экране, пока контролируют зрачки; перетаскивание метки на экране через шаблон не касаясь стен; выполнение умственных задач, например, решение математических уравнений или ответ на вопросы; игра в игры для исследования памяти и концентрации и т.д.
Неконтролируемая пользователем индикация включает в себя интерфейс пользователя, который связан с регистрацией одного или нескольких пользовательских свойств для предоставления показания о состояния пользователя и использованием этой информации для управления определением предварительно определенного выпаренного количества, дозы и/или схемы лечения, управляя таким образом одним или несколькими терапевтическими/неблагоприятными эффектами у пользователя.
Примеры включают в себя:
Измерение температуры во рту или размера зрачка, что может указывать на высокий PD эффект;
Измерение тремора или изменение тремора;
Измерение частоты сердечных сокращений и/или артериального давления, например, посредством взаимодействия с датчиком, носимым пользователем и/или имплантированным в пользователя;
Измерение свойств воздушного потока в устройстве, индуцированных пользователем. Такие свойства воздушного потока могут включать в себя одно или несколько из скорости потока и/или скорости повышения скорости потока, и/или степени и/или скорости изменения потока во время события ингаляции. Например, рассмотрение изменений от одного или нескольких исходных значений может указывать, например, на улучшение или снижение хорошего самочувствия (например, что проявляется посредством силы и/или боли, которые могут повлиять на свойства/паттерны ингаляции для пользователя).
При необходимости, пользователь может предоставлять инструкции/запросы через интерфейс пользователя к устройству предварительно и/или во время сессии ингаляции.
Примеры включают в себя:
Определение данной схемы лечения/измеренного эффекта для сохранения, чтобы можно было повторить в будущих применениях. Например, одно психоактивное состояние может быть определено пользователем в качестве желаемого состояния «по умолчанию», в то время как другое может быть определено как «достаточно безболезненное», а еще одно, как «хорошо для выполнения конкретных задач (например, вождения)». Такие обозначения могут быть с учетом ограничений, налагаемых устройством на основе, например, входных данных врача или максимальной допустимой дозы в период времени и т.п. По желанию, при последующих ингаляциях пользователю может быть предложено указать, насколько хорошо этот желаемый эффект был воспринят, с тем чтобы улучшить режим дозирования на постоянной основе.
Общие запросы схемы лечения (например, время сна, где сонливость станет желаемым эффектом и больше не представляет собой нежелательный неблагоприятный эффект; время, когда требуется особая внимательность, такое как работа или учеба, или вождение).
При необходимости, запрос дозы или запрос схемы лечения, или режим дозирования, предложенный пользователем, направляется к врачу на утверждение до реализации устройством. При необходимости, запрос посылается только тогда, когда устройство не может выполнить запрос без превышения предварительно введенных ограничений. При необходимости, некоторые ограничения делают жесткими и они не могут быть превышены независимо от одобрения врача (например, летальная доза).
Пользовательский интерфейс может позволять пользователю строить график/планировать свое психоактивное состояние в течение дня вручную (например, на сенсорном экране или изображении, которое захватывается устройством и т.д.), и позволять устройству адаптировать схему лечения соответствующим образом. Пользователь может рисовать уровни психоактивности на основанном на времени графике, представляющем желаемую психоактивность в течение всего дня. При необходимости, пользователь определяет состояние психоактивности и состояние лечения, а именно, пользователь участвует в определении терапевтического окна, и устройство рассчитывает адекватную схему лечения, которая известна или ожидается для достижения желаемого PKPD баланса, до тех пор, пока оно также не входит в любые необязательные предварительно наложенные ограничения.
Незапланированные изменения (например, неожиданная необходимость выполнить задачу, требующую повышенной концентрации внимания, или другое изменение графика или внезапные медицинские требования, такие как прорыв боли).
Отложенное действие устройства или пропуск сеанса. По желанию, устройство накладывает ограничение на количество времени, отведенного на дремоту.
Согласно некоторым вариантам осуществления устройство обеспечивает зависимое от времени и местоположения лечение, которое основано на датчиках, сообщающихся с устройством и личной информацией о лечении пациента. Датчики обеспечивают данные о времени и местоположении (на основе GPS/WiFi и т.п.) и/или данные о местоположении обеспечиваются через интерфейс пользователя и определяются границы, в которых конкретное терапевтическое окно, по сути, таким образом, выбирает зависимую от времени/местоположения дозу и/или схему лечения, а также зависящий от конкретного времени/местоположения набор предупреждений.
Настройку зависящих от конкретного местоположения и/или времени ограничений дозы/схемы лечения/работы устройства осуществляют с помощью, например, основанной на GPS или Wi-Fi, или входных данных информации о географическом местоположении (например, геозонирование). Например, в некоторых областях накладываются разные границы дозы и/или схемы (например, работа по сравнению с домом). Например, степень свободы по умолчанию назначается врачом при предоставлении устройства. Одна или несколько других степеней свободы может быть установлена предварительно или рассчитываться по запросу. Эти степени свободы могут проявляться в качестве границ в лечении (терапевтическое окно). Необязательно, терапевтическое окно может зависеть от местоположения. Например, рабочее место пользователя может быть обозначено как область, которая не позволит пользователю достичь определенного психоактивного состояния, в то время как домашний адрес пользователя и, возможно, время позднего вечера и ночь может рассматриваться в качестве зоны свободной психоактивности (другие типы мест рассматриваются для любого вида предварительных настроек по умолчанию). При необходимости, сигналы, предоставляемые интерфейсом пользователя, являются чувствительными к местоположению таким образом, что, например, звук или объем может быть ограничен на рабочем месте; а также
Интерфейс пользователя оборудован базой данных для хранения, анализа и использования информации о предпочтениях пользователя, датированных мероприятиях и местоположении и т.п.
Выходной интерфейс пользователя может включать в себя автоматизированные текстовые сообщения, предоставляемые, например, посредством электронной почты или текстовых сообщений пользователю, врачу-попечителю или медицинскому центру лечения.
Выходной сигнал может быть доступен в общем или индивидуально для отдельных пользователей.
Ниже приведены некоторые конкретные представляющие интерес примеры:
Выходы и/или предупреждения предоставляются для пациента, попечителя или любого предварительно определенного индивидуума или системы, предназначенной для оказания помощи и/или защиты пользователя в относительно высоком психоактивном состоянии. Могут быть выполнены следующие действия, когда воспринимается неблагоприятный эффект и/или ожидается, и/или по просьбе пользователя, например, уведомления от назначенных получателей (например, родственников или соседей), когда достигнуты некоторые психоактивные уровни.
Установка зависимого от уровня неблагоприятного эффекта (психоактивного) сообщение типа «не беспокоить» на персональном смартфоне пользователя и других устройствах. Например, когда пользователь испытывает определенный уровень неблагоприятного эффекта, звонки от предварительно выбранных абонентов блокируются и/или включается автоответчик с текстовым сообщением, указывающим, что пользователь не доступен, что потенциально снижает беспокойство во время сеанса лечения.
Когда ожидается острый неблагоприятный эффект (например, на основе схемы лечения и/или во время сеанса лечения) может быть дан «предупредительный сигнал». В таком случае, интерфейс может направлять пользователя в безопасную окружающую среду, предлагая возможность обсуждения ситуации с предварительно выбранным получателем, который предположительно имеет еду/напиток, готовый для того, чтобы смягчить неблагоприятный эффект, подготовит дозу антидота к устройству в качестве чрезвычайной меры предосторожности и/или предоставит уведомление попечителю и/или врачу.
Может быть обеспечено визуальное представление в режиме реального времени уровня неблагоприятного эффекта пользователя, например, в виде графика, диаграммы, числа, столбца, линии или любого другого визуального представления. По желанию это представление может быть просмотрено пользователем и/или врачом, и/или попечителем в любое время. Визуальное представление может включать в себя данные, полученные от одного или нескольких ингаляторов, относительно принимаемой дозы и PK/PD алгоритмов, которые имитируют психоактивную PD, историю болезни пользователя, для использования в ингаляторе, и его эффект и сигналы от датчиков.
Интерфейс врача может включать в себя, например, схему лечения, предусмотренную указаниями врача. Эта схема может быть наложена на пользователя или субъекта при согласии пользователя. Необязательно, схема лечения включает в себя степень свободы, которая позволяет пользователю и/или устройству модифицировать схему лечения без вмешательства или одобрения врача. В таких случаях врач может быть уведомлен до и/или после сеанса лечения.
Интерфейс врача может быть также настроен для предоставления набора конкретных предупреждений, когда пользователь достигает определенных уровней неблагоприятных эффектов (например, специфические психоактивные уровни) или когда использование близко к достижению определенных уровней неблагоприятных эффектов, так что врач может отслеживать все доступные параметры, пока пользователь находится в этом состоянии. Необязательно, врач может устанавливать «персонализированное сообщение» для отправки пользователю, как только пользователь достигает/близок к достижению конкретных уровней неблагоприятных эффектов.
Врач может утвердить/отклонить/модифицировать режимы дозирования, выбранные или запрошенные пользователем.
В соответствии с вариантами осуществления настоящего раскрытия интерфейс пользователя/врача для получения входных данных в любой категории может включать в себя любой интерфейс, который позволяет осуществление вышеприведенных примеров (включая в себя контроль пользователя или его отсутствие и визуальные схематические изображения, звук, текст и т.д.). Датчики могут быть интегрированы в ингалятор или иным образом быть связаны с ним. Датчики могут представлять собой специальные датчики или преимущество может быть взято из устройства для другого применения (например, связь с кардиостимулятором для связанных с сердцем свойств).
Датчики окружающей среды могут предоставлять информацию о пользовательской активности в виде показания для PD и/или хорошего самочувствия пользователя. Примеры включают в себя датчики сердечного ритма, датчики темпа/движения/скорости и местоположения GPS.
Пример 7
Схема лечения активным средством
Ниже приведена таблица с подробным дозированием и/или схемой лечения и показаниями к легочной доставке активного средства, ТНС из растения каннабиса, в соответствии с некоторыми вариантами осуществления настоящего раскрытия.
В таблице 4 ниже списков дозирования и/или схемы лечения в соответствии с синдромами (симптомами, событиями, нарушениями и заболеваниями), которые поддаются лечению и/или терапевтическому ответу на ТНС. Доза, индивидуальная или часть схемы, соответствует одному предварительно определенному выпаренному количеству ТНС.
Различные процедуры могут включать в себя профилактическое лечение (предупреждающее лечение/лечение событий), а именно легочную доставку ТНС посредством устройства, представленного в настоящем документе, когда ожидается событие, в зависимости от времени и/или обстоятельства, в которых доза до события может быть предписана; острое или эпизодическое лечение, а именно легочную доставку ТНС с помощью устройства, представленного в настоящем документе, когда происходит эпизод и продолжительность симптома(ов) (период времени до облегчения симптома(ов)); полухроническое или хроническое лечение, а именно легочную доставку ТНС с помощью устройства, представленного в настоящем документе, независимо от восприятия острого симптома или когда событие/симптом(ы) может длиться в течение длительного периода времени.
Лечение представлено в таблице 4 ниже на основе указанных выше групп и для пациентов среднего размера в течение периода лечения длительностью 12 часов.



Пример 8
Растения, содержащие психоактивное средство(а)
Психоактивные средства влияют на центральную нервную систему различными способами, воздействуя на высвобождение нейротрансмиттеров (химические мессенджеры в пределах нервной системы, такие как ацетилхолин, серотонин, дофамин, норадреналин) или имитируя их действия. Психоактивные средства могут быть классифицированы на основе своих эффектов, таких как, без ограничения, седативные средства, стимулирующие средства, стимуляторы и усилители умственной активности и физической активности; снижающие усталость средства, усилители аппетита/супрессанты, галлюциногенные средства, изменяющие восприятие средства, изменяющие настроение средства, супрессанты и стимуляторы.
Ниже приведены некоторые примеры растений, которые могут быть использованы в качестве источника для испаряемого активного средства(средств), согласно вариантам осуществления настоящего раскрытия, за наличие лекарственных, а также психоактивных свойств.
Опийный мак (Papaver somniferum; Papaveraceae) известен своими болеутоляющими, седативными, снотворными и галлюциногенными эффектами у млекопитающих. Активные средства в опиуме включают в себя алкалоиды, при этом в опиуме были идентифицированы более 30 алкалоидов, включая в себя морфин, кодеин, тебаин, папаверин и многие другие. Лекарственное применение опиума и/или активных средств, происходящих из опиума, включает в себя анальгетики, серьезные болеутоляющие (в частности, морфин), лечение бессонницы в сочетании с болью или без нее (опиум), подавление кашля (кодеин) и контроль диареи и болеутоляющее.
Кава (Piper methysticum; Piperaceae) известна своей седативной, супрессорной и гипнотической активностью. Активные средства в кава включают в себя кавалактоны, такие как каваин, янгонин, 10-метоксиянгонин, 11-метоксиянгонин, 11-гидроксиянгонин, десметоксиянгонин, 11-метокси-12-гидроксидегидрокаваин, 7,8-дигидроянгонин, 5-гидроксикаваин, 5,6-дигидроянгонин, 7,8-дигидрокаваин, 5,6,7,8-тетрагидрокаваин, 5,6-дигидрометистицин, метистицин и 7,8-дигидрометистицин. Каваин характеризуется умеренным обезболивающим эффектом, приблизительно вдвое большим, чем аспирин, а также действует как мягкий анестетик и транквилизатор. Различные кавалактоны приводят к различному психоактивному эффекту, и было показано, что они применимы в качестве транквилизаторов и промоторов сна. Было показано, что листья, стебель и кора могут быть использованы в качестве миорелаксантов, чтобы уменьшить тугоподвижность и усталость мышц, и растительные экстракты были использованы в качестве успокаивающих лекарственных средств.
Дурман (Datura stramonium, Jimson weed; Solanaceae; семейство Пасленовых) известен своими афродизиакальными и галлюциногенными эффектами у млекопитающих. Активные средства в дурмане включают в себя тропановые алкалоиды, такие как атропин, гиосциамин, скополамин и многие другие. Применение дурмана (всего растения и его частей) и/или происходящих из дурмана активных средств включает в себя пробуждение полового влечения, стимуляцию и после этого подавление центральной нервной системы и индуцированные галлюцинации.
Пейоте (Lophophora williamsii cactaceae) содержит 30-40 различных сильнодействующих алкалоидов с мескалином, представляющим собой наиболее активный галлюциноген в группе. Пейоте, как правило, используется в качестве сексуального стимулятора и как галлюциноген.
Аяуаска («лиана духов», Banisteriopsis caapi; яге) включает в себя множество алкалоидов, которые вызывают галлюциногенную активность у человека и характеризуются общим структурным сходством с серотонином. Она была использована в качестве антидепрессанта и для индуцирования галлюцинаций.
Другие растения, содержащие активное средство(а) с известными психоактивными свойствами, включают в себя без ограничения:
Семейства покрытосеменных, такие как Пасленовые (паслен), Atropa belladonna (беладонна) (галлюциноген), Datura spp.(дурман) (галлюциноген), Mandragora officinarum (мандрагора) (галлюциноген), Nicotiana spp.(табак) (стимулятор/успокоительное), Мареновые (кофе), Papaver somniferum (опийный мак) (успокоительное), Erythroxylaceae coca (кока) (стимулятор), Convolvulaceae (вьюнок пурпурный), Cactaceae, Lophophora williamsii (пейоте) (галлюциноген), Piperaceae, Piper methysticum (кава) (успокоительное), Malphiginaceae и Banisteriopsis sp.(аяуаска) (галлюциноген).
В таблице 5 приведены некоторые из растений, содержащих активные вещества, которые могут быть использованы в контексте некоторых вариантов осуществления настоящего раскрытия.


Несмотря на то, что настоящее изобретение было описано в связи с конкретными вариантами осуществления, понятно, что многие альтернативы, модификации и вариации будут очевидны специалистам в настоящей области техники. Соответственно, предполагается охватить все такие альтернативы, модификации и вариации, которые попадают в пределы сущности и широкого объема прилагаемой формулы изобретения.
Все публикации, патенты и патентные заявки, упомянутые в настоящем документе, полностью включены посредством ссылки в описание, в той же степени, как если бы конкретно и отдельно было указано, что каждая отдельная публикация, патент или патентная заявка включена в настоящий документ посредством ссылки. Кроме того, цитирование или идентификация любой ссылки в данной заявке не должно быть истолковано как признание того, что такая ссылка доступна в качестве предшествующего уровня техники для настоящего изобретения. В той степени, в которой используются заголовки разделов, они не должны быть истолкованы как обязательное ограничение.
Реферат
Изобретение относится к медицинской технике. Система для контролируемой легочной доставки фармакологически активного средства содержит ингаляционное устройство для легочной доставки субъекту выпаренного количества фармакологически активного средства, содержащегося в растительном материале, за счет контролируемого нагревания указанного растительного материала, с тем чтобы испарить указанное выпаренное количество указанного средства. Одно или оба из интерфейса пользователя и датчика, каждый из которых выполнен с возможностью получения данных, указывают на фармакодинамический эффект, индуцированный указанным средством у субъекта. Датчик выполнен с возможностью мониторинга фармакодинамического эффекта, а интерфейс пользователя выполнен с возможностью анализа входных данных субъекта при взаимодействии субъекта с интерфейсом пользователя для оценки фармакодинамического эффекта на основе анализа взаимодействия. Контроллер связан с ингаляционным устройством и выполнен с возможностью управления выпаренным количеством на основе данных, полученных от одного или обоих из интерфейса пользователя и датчика. Технический результат сводится к обеспечению доставки растительного лекарственного препарата. 21 з.п. ф-лы, 5 табл., 21 ил.
Формула
Документы, цитированные в отчёте о поиске
Устройство для ингаляции и способ ингаляции
Ингаляционное устройство с регулируемой дозой

Комментарии