Новые соединения и пути их применения для обнаружения целевых молекул в образце - RU2768649C2
Код документа: RU2768649C2
Чертежи





Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к профлуорофорам, которые осаждаются в месте реакции с целевой молекулой при фоторедокс-катализе, и их применению для обнаружения указанной целевой молекулы в образце.
Уровень техники
Обнаружение сигнала в сферах применения, касающихся диагностики и гарантии качества (мониторинг и отслеживание, срок хранения, поиск источников, безопасность, фальсификация, соответствие), является возрастающей потребностью. В частности, в области пищевой промышленности существует возрастающая потребность в обнаружении присутствия ингредиентов и бактерий для немедленной проверки подлинности, соответствия и качества пищевых продуктов. Потребительский спрос исходит, в частности, от производителей продуктов питания, предприятий розничной торговли, торговых организаций и государственных органов, которые контролируют целостность цепи поставок. Данная целостность особенно важна для таких конечных потребителей, как люди, которые не могут употреблять в пищу конкретные продукты питания по причинам медицинского (например, виды аллергии, режим питания) или личного характера (например, религия). В настоящее время не существует теста для проверки ингредиентов продукта питания в любой момент времени и при любых условиях, который мог бы легко осуществить неквалифицированный персонал, поэтому организации вынуждены доверять информации, предоставляемой сторонней организацией (т.е. сертификату), или отсылать образцы лабораторной службе. Поскольку животные, растения и микроорганизмы содержат специфическую ДНК, на сегодняшний день можно идентифицировать более 300000 видов по небольшому участку генома, известному как «ДНК-штрихкод», который, таким образом, можно применять для идентификации ингредиентов продукта питания. Хотя стоимость ДНК-секвенирования снижается, неподготовленный персонал не имеет возможности применения таких тестов, поскольку стандартный подход заключается в выделении и секвенировании участка, представляющего собой ДНК-штрихкод длиной 650 п.о. (пар оснований), и сравнении результатов с базой данных известных видов (например, www.ibol.org). Таким образом, данный способ является длительным, подвержен загрязнениям, требует подготовки образцов в лабораторных условиях, применения специализированного оборудования и наличия углубленных знаний для интерпретации результатов анализа.
Обнаружение сигнала в сферах применения, касающихся визуализации и диагностики, часто достигается с помощью различных красителей, например флуоресцентных красителей. Флуорофоры, такие как родамин и азидородамины, не предоставляют информации о пространственном разрешении, поскольку они не осаждаются в месте реакции, а другие флуорофоры просто диффундируют повсюду, рассеивая сигнал и предотвращая распознавание считываемых данных в виде мультиплексных полос/кодов. Следовательно, данные красители не подходят для обеспечения разрешения на субклеточном уровне. Применение другого известного красителя, представляющего собой виологен (например, паракват), часто применяемого в качестве индикатора окислительно-восстановительного состояния, ограничено в сферах применения, касающихся продуктов питания, ввиду его токсичности, а его низкая чувствительность требует высокой концентрации для обеспечения обнаружения невооруженным глазом. Красители на основе хиназолина были разработаны для предоставления информации о сигнале с разрешением на субклеточном уровне, поскольку они осаждаются в месте реакции. Для данной цели были разработаны бесцветные и растворимые профлуорофоры на основе осаждающегося красителя на основе хиназолинона (QPD), конъюгированного с инициаторной азидной группой (N3-QPD), которые при фотокаталитической реакции в присутствии катализатора (например, катализатора на основе рутения, например Ru(bpy)3Cl2) и восстановителя (например, аскорбата натрия, NaAsc и т.д.), которая инициируется светом (например, 455 нм), превращаются в флуоресцирующую молекулу и осаждаются как осаждающийся краситель на основе хиназолинона (QPD). В данной реакции фотовозбуждение катализатора на основе Ru обеспечивает восстановление азида, находящегося вблизи катализатора, что, в свою очередь, приводит к расщеплению линкера между азидом и флуорофором в молекуле профлуорофора, и таким образом обеспечивает демаскирование флуоресцентного красителя (так называемое восстановительное расщепление или демаскирование). Вследствие осаждения красителя при демаскировании в месте протекания реакции возникает флуоресценция, и, таким образом, зарегистрированный сигнал сохраняет информацию о пространственном разрешении (Holtzer et al., 2016, ACS Central Science, 10.1021/acscentsci.6b00054; Sadhu et al., 2015, Chem. Commun., 51: 16664-6). На основании того факта, что переходный металл (например, Ru) действует фотокаталитическим образом, реакцию контролируют во времени, и реагенты можно легко переносить и смешивать без риска преждевременной реакции. Кроме того, поскольку в данной реакции не применяются стадии амплификации с помощью ферментов, применяемые реагенты являются более стабильными, и их можно применять в различных условиях. Данную методику можно применять для визуализации in cellulo белков, меченных катализатором на основе Ru (Sadhu et al., 2015, выше), или при реакциях с использованием матрицы на основе нуклеиновой кислоты для визуализации in vivo целевых microRNA (Holtzer et al., 2016, выше). Однако ограничения в отношении таких флуорофоров, обеспечивающих пространственное обнаружение, все еще нуждаются в снижении для уменьшения времени анализа и обеспечения их включения в одноразовые тесты для обнаружения. Следовательно, существует необходимость в разработке новых флуорофоров, обеспечивающих высокоэффективное обнаружение и являющихся подходящими для переносных и одноразовых систем обнаружения.
Краткое описание изобретения
Настоящее изобретение направлено на новое семейство профлуорофоров (например, предшественник флуорофора или флуороген), которые превращаются в осаждающийся продукт (соответствующий флуорофор) при их фоторедокс-катализе. Настоящее изобретение основано на открытии того, что флуорофоры следующей формулы (I') могут образовываться посредством реакции данного нового семейства профлуорофоров с фоторедокс-катализатором, представляющим собой комплекс переходного металла.
Настоящее изобретение, в частности, направлено на применение превращения таких бесцветных профлуорофоров под действием катализатора в присутствии восстановителя в продукт с высокой флуоресцентной способностью, который осаждается в месте реакции с катализатором, которое, в частности, относится к области диагностики или обнаружения целевого вещества. Профлуорофоры по настоящему изобретению обладают преимуществом, заключающимся в более высоком уровне осаждения, чем таковой у известных осаждающихся красителей, и в способности превращаться в соответствующий флуорофор, характеризующийся большим стоксовым сдвигом (разницей длин волн поглощения и испускания), который позволяет осуществлять измерение с обнаружением испускаемого сигнала при осаждении без необходимости сложного контрольно-измерительного оборудования, поскольку длину волны испускания (сигнал) легко отличить от длины волны возбуждения и других помех, и который является весьма фотостабильным, что позволяет осуществлять надежное измерение без вариаций сигнала и потери разрешения. Настоящее изобретение, в частности, направлено на способы применения таких профлуорофоров при обнаружении целевых малых молекул, природных и синтетических нуклеиновых кислот, белков и других макромолекул в образце, а также на системы и устройства для обнаружения, содержащие их.
Согласно одному аспекту предусмотрен профлуорофор формулы (I).
Согласно другому аспекту предусмотрен способ получения флуорофора формулы (I'), включающий стадию осуществления реакции профлуорофора формулы (I) с фоторедокс-катализатором, представляющим собой комплекс переходного металла, в присутствии восстановителя.
Согласно другому аспекту предусмотрены флуорофоры формулы (I').
Согласно другому аспекту предусмотрен способ обнаружения по меньшей мере одной целевой молекулы (например, малой молекулы, природной и синтетической нуклеиновой кислоты, пептида или белка) в образце, включающий стадию приведения в контакт композиции, содержащей профлуорофор согласно настоящему изобретению или конъюгат на его основе (флуорогенной композиции), с указанным образцом.
Согласно другому аспекту предусмотрен конъюгат на основе профлуорофора формулы (I), где указанный конъюгат представлен формулой (II).
Согласно другому аспекту предусмотрен способ получения профлуорофора формулы (I).
В другом аспекте настоящего изобретения предусмотрен набор для обнаружения по меньшей мере одной целевой молекулы в образце, содержащий профлуорофор формулы (I) или конъюгат на его основе и необязательно по меньшей мере одно средство, выбранное из восстановителя и дополнительного зонда для обнаружения указанной целевой молекулы.
Описание графических материалов
На фигуре 1 представлена иллюстрация способа обнаружения целевой молекулы ДНК (в количестве 10 мкМ) в образце, как дополнительно описано в примере 3. A: схематическое представление основных стадий способа обнаружения, предусматривающих приведение в контакт (e) образца, содержащего целевую молекулу ДНК (c) со смесью каталитического зонда (a), такого как PNA, конъюгированная с фоторедокс-катализатором, представляющим собой комплекс переходного металла, и заякоривающего зонда (b), такого как биотинилированная (Btn) PNA, где оба зонда распознают часть целевой молекулы ДНК, с заякоривающим субстратом в виде индикаторной полоски, содержащим иммобилизированный стрептавидин (d), в присутствии восстановителя (восст.) и профлуорофора по настоящему изобретению (Pro-fl.) в условиях, подходящих для связывания зондов с целевой молекулой ДНК и для заякоривания целевой молекулы на поверхности заякоривающего субстрата (f); инициирование фоторедокс-катализа профлуорофора, находящегося вблизи фоторедокс-катализатора, связанного с поверхностью индикаторной полоски путем воздействия излучением (g), и визуализацию образованной флуоресцентной (Fl.) полосы на заякоривающей поверхности индикаторной полоски; B: изображение поверхности индикаторной полоски с положительной флуоресцентной (слева) и контрольной (справа) полосами.
На фигуре 2 показаны стадии (A) и результаты (B) способа по настоящему изобретению для обнаружения целевого фрагмента ДНК свиньи в образце, как описано в примере 4.
На фигуре 3 показано сравнение одного участка ДНК из 73 п. о., приведенного в направлении 5'→3', выбранного из представляющего собой ДНК-штрихкод участка гена COI от 15 животных, которое позволяет идентифицировать мини-штрихкод ДНК, присутствующий конкретно у свиньи, как описано в примере 2. *: консервативность последовательности. Участки ДНК от свиньи (SEQ ID NO: 5), коровы (SEQ ID NO: 6), лошади (SEQ ID NO: 7), цесарки (SEQ ID NO: 8), индейки (SEQ ID NO: 9), курицы (SEQ ID NO: 10), осла (SEQ ID NO: 11), обезьяны (SEQ ID NO: 12), человека (SEQ ID NO: 13), крысы (SEQ ID NO: 14), мыши (SEQ ID NO: 15), одногорбого верблюда (SEQ ID NO: 16), верблюда (SEQ ID NO: 17), ягненка (SEQ ID NO: 18), козы (SEQ ID NO: 19).
На фигуре 4 проиллюстрирован способ обнаружения целевого фрагмента ДНК свиньи в образце продукта питания, как описано в примере 5. A: предоставляют образец продукта питания, содержащий целевой фрагмент ДНК свиньи; B: образец приводят в контакт с заякоривающим субстратом (s), несущим заякоривающий зонд (Ap) для указанного целевого фрагмента ДНК свиньи, и с зондом для целевого фрагмента ДНК, меченым фоторедокс-катализатором, представляющим собой комплекс переходного металла (Cat.), в условиях, подходящих для связывания меченого зонда с целевой молекулой и для заякоривания целевой молекулы на поверхности заякоривающего субстрата посредством заякоривающего зонда, при этом обеспечивают другой зонд для целевого фрагмента ДНК свиньи, конъюгированный с профлуорофором (Pro-Fl.) по настоящему изобретению; C: при подходящих условиях зонд, несущий профлуорофор (Pro-Fl.), гибридизируется с заякоренной целевой молекулой рядом с участком связывания зонда, меченого фоторедокс-катализатором, в присутствии восстановителя, и происходит фоторедокс-катализ профлуорофора с образованием соответствующего флуорофора (Fl.).
На фигуре 5 схематически представлены стадии способа по настоящему изобретению (A-D) для обнаружения целевого фрагмента ДНК в образце, подвергнутом амплификации ДНК, как описано в примере 6.
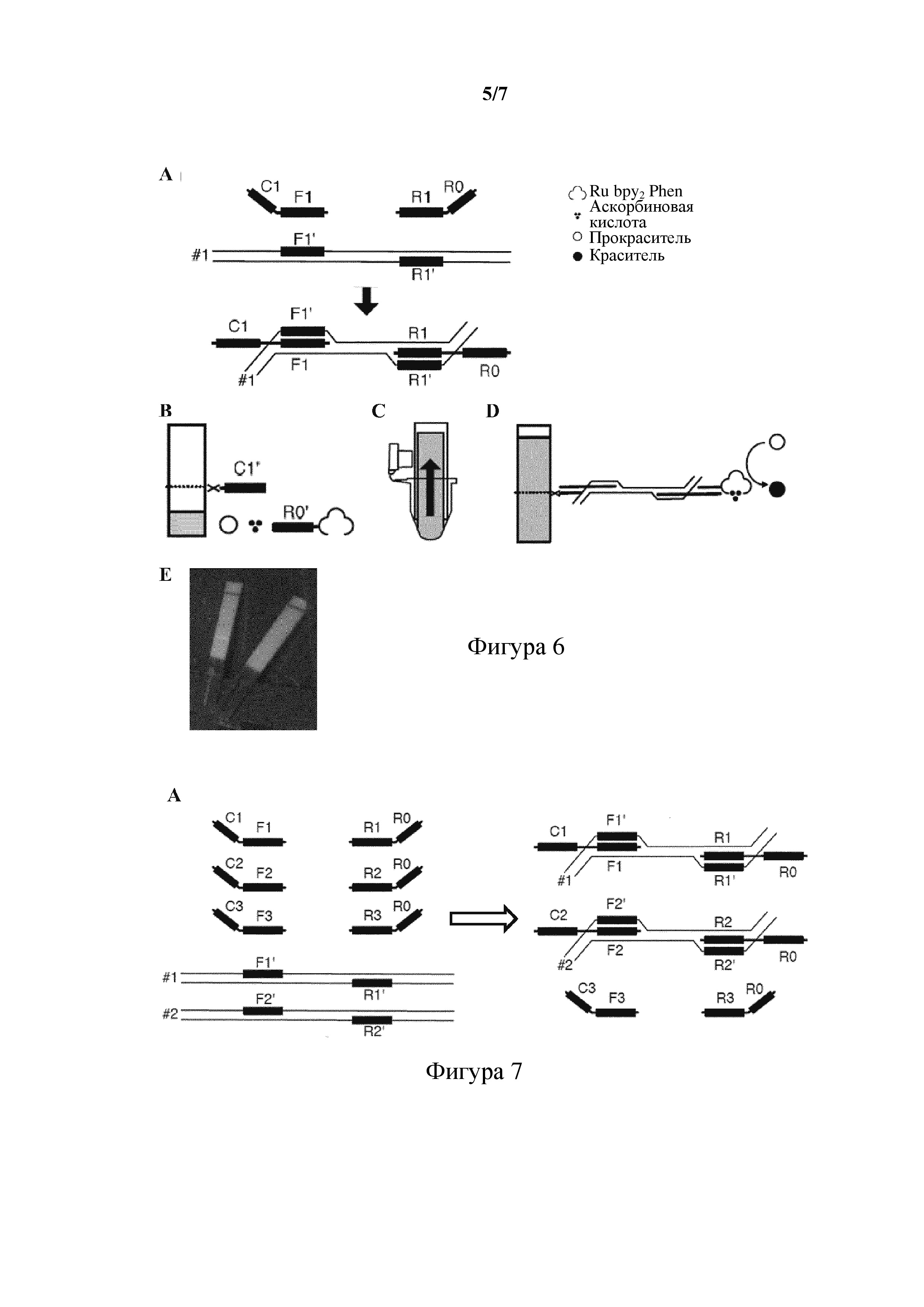
На фигуре 6 схематически представлены стадии (A-D) и результаты (E) анализа для обнаружения фрагмента ДНК в образце посредством встраивания в нить и реакции с использованием ДНК-матрицы, как описано в примере 6.
На фигуре 7 схематически представлены стадии (A-D) анализа для обнаружения нескольких фрагментов ДНК в образце посредством встраивания в нить и реакции с использованием ДНК-матрицы, как описано в примере 6.
На фигуре 8 схематически представлены считанные показания результатов тестирования, как описано в примере 6. A: штрихкод; B: код в виде макроматрицы; C: QR™-код; D: нанесенные с помощью матричного аппликатора пятна (масштаб стрелки - 5 мм).
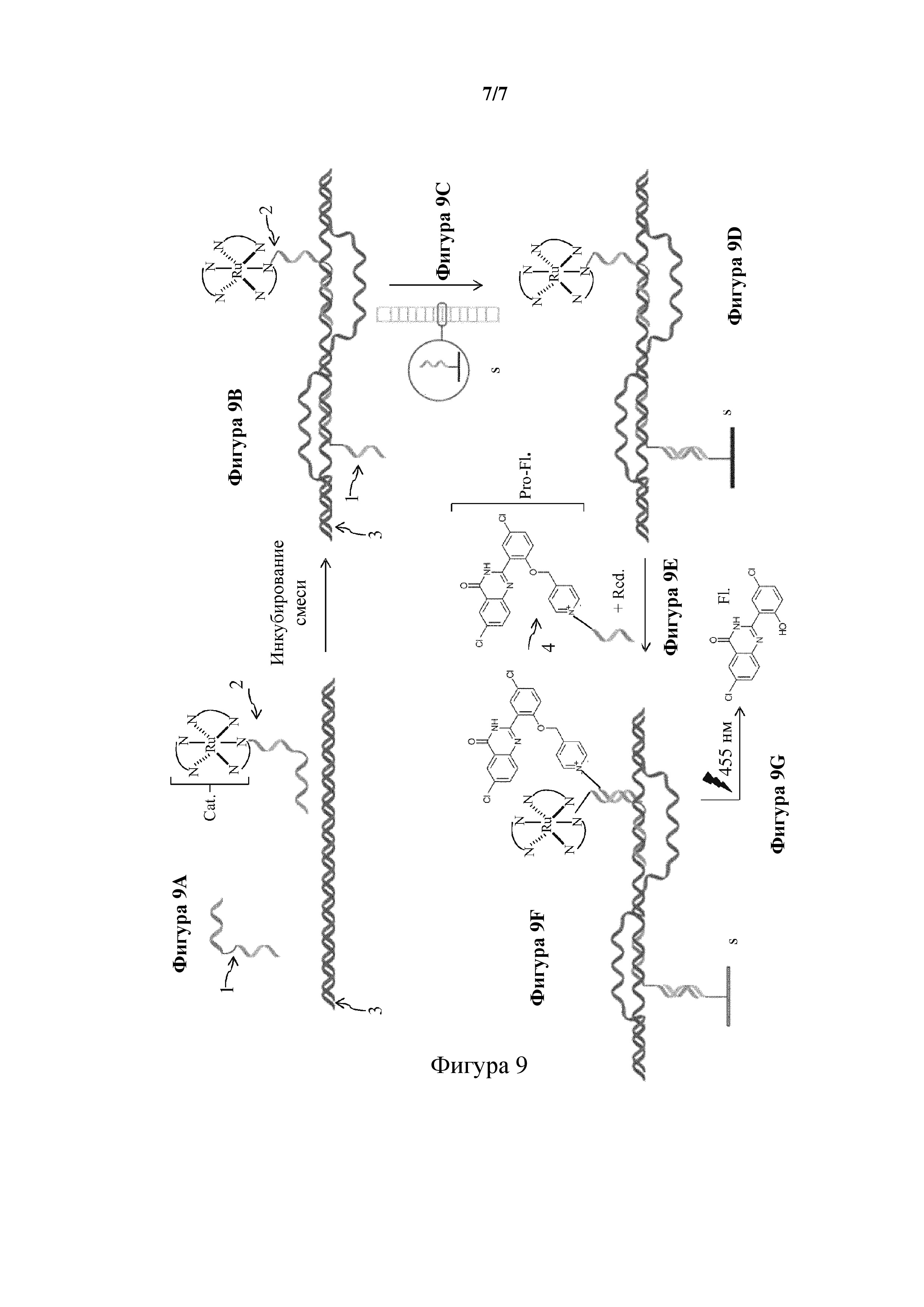
На фигуре 9 показан пример фотореакции с использованием матрицы в способе согласно настоящему изобретению, как описано в примере 7. A: целевую dsDNA (3) приводят в контакт с заякоривающим зондом на основе PNA (1) и каталитическим зондом на основе PNA (2), содержащим конъюгированный фоторедокс-катализатор (Cat.); B: гибридизация зонда и целевой dsDNA; C: гибридизированную целевую dsDNA приводят в контакт с тест-полоской, выступающей в качестве заякоривающего субстрата (s), где заякоривающий субстрат содержит фрагмент, характеризующийся аффинностью в отношении заякоривающего зонда; D: гибридизированная целевая dsDNA иммобилизируется на тест-полоске посредством заякоривающего зонда; E: конъюгат на основе профлуорофора (Pro-Fl.) (4), содержащий профлуорофор (соединение 1), конъюгированный с зондом, имеющим аффинность в отношении части каталитического зонда на основе PNA, приводят в контакт с тест-полоской в присутствии восстановителя (Red.); F: конъюгат на основе профлуорофора связывается с каталитическим зондом на основе PNA в непосредственной близости от каталитического зонда на основе PNA (2); G: тест-полоску подвергают воздействию света (например, LED-лампа, 455 нм) для способствования фотокаталитическому восстановлению Pro-Fl. до флуорофора (Fl.).
Подробное описание изобретения
Термин «флуорогенная композиция» относится к композиции, содержащей профлуорофор согласно настоящему изобретению либо per se, либо в виде конъюгата, и которая способна подвергаться фоторедокс-катализу, когда профлуорофор или конъюгат на его основе находятся вблизи фоторедокс- катализатора и композицию подвергают возбуждающему воздействию при длине волны, достаточной для возбуждения фоторедокс-катализатора, за счет чего образуется соответствующий флуорофор.
Термин «целевая молекула» относится к любой представляющей интерес молекуле, подлежащей тестированию в отношении ее присутствия в образце (например, малой молекуле, природной и синтетической нуклеиновой кислоте, пептиду или белку), такой как, например, целевая ДНК конкретного происхождения (как например целевой фрагмент ДНК млекопитающего конкретного вида (например, свиньи, лошади, грызуна и т.д.) или целевой фрагмент ДНК бактерии (например, ДНК патогенных бактерий, таких как E. coli, Listeria, Salmonella, Campylobacter, Legionella, или их токсинов). Согласно конкретному аспекту целевые молекулы охватывают любую представляющую интерес молекулу, подлежащую тестированию в отношении ее присутствия в любом материале для применения человеком или в ветеринарии, таком как продукт питания (например, мясо или сыр), кормовой продукт, корм для домашних животных, напитки и пригодные для питья составы. Материалы включают сырьевые материалы, промежуточные и готовые продукты, пищевые добавки (например, ферменты, заквасочные культуры, витамины) или фармацевтические или косметические препараты. Примеры нуклеиновых кислот в качестве целевых молекул согласно настоящему изобретению охватывают последовательности ДНК и РНК и праймеры, идентифицирующие конкретный вид (т.е. определение свинины относительно говядины, как в PLoS One., 2017, 12(8):e0181949. doi: 10.1371/journal.pone.0181949), или конкретные сорта (т.е. кофе «Арабика» относительно кофе «Робуста», как в J. Agric. Food Chem. 2006 54(20):7466-70), или общие семейства (т.е. гены устойчивости к антибиотикам микроорганизмов, как в J. Clin. Microbiol., 2003,41(9): 4089-4094).
Термин «зонд» относится к молекуле, специфически распознающей целевую молекулу. Зонд на основе нуклеиновой кислоты относится к зонду, содержащему по меньшей мере одну последовательность нуклеиновой кислоты, которая специфически распознает по меньшей мере один участок целевой молекулы. Согласно конкретному аспекту зонд на основе нуклеиновой кислоты содержит нуклеиновую кислоту длиной от приблизительно 1 до приблизительно 60 нуклеотидов, например от приблизительно 4 до приблизительно 20 нуклеотидов, как например от приблизительно 4 до приблизительно 14 нуклеотидов, в частности от приблизительно 7 до приблизительно 14 нуклеотидов.
Согласно другому конкретному аспекту зонды на основе нуклеиновой кислоты по настоящему изобретению представляют собой PNA или LNA и любую смесь ДНК, РНК, PNA или LNA.
Термины «пептидо-нуклеиновая кислота» или «PNA» относятся к искусственно синтезированному полимеру, представляющему собой аналог нуклеиновой кислоты, схожий с ДНК или РНК, в котором сахарофосфатный остов природной нуклеиновой кислоты был заменен синтетическим пептидным остовом, обычно образованным из N-(2-аминоэтил)-глициновых звеньев, с получением в результате ахирального и незаряженного миметика. Он является химически стабильным и устойчивым к гидролитическому (ферментативному) расщеплению. С целью увеличения аффинности связывания в отношении некоторых целевых молекул зонды можно подвергать стереохимической модификации с приданием хиральности ахиральному зонду для получения свойств связывания у модифицированного таким образом зонда, которые зависят от стереохимической конфигурации. Например, модификации остовов PNA, как например PNA с модифицированной гамма-цепью, недавно были разработаны для применения в диагностических анализах (Manicardi et al., 2014, Artificial DNA: PNA & XNA, 5:3, e1131801; Moccia et al., 2014, Artificial DNA: PNA & XNA, 5:3, e1107176). Согласно конкретному варианту осуществления зонды согласно настоящему изобретению представляют собой зонды на основе PNA, в частности зонды на основе гамма-PNA, такие как зонды на основе γD-PNA, γL-PNA.
Термины «закрытая нуклеиновая кислота» или «LNA» относятся к искусственно синтезированному модифицированному РНК-нуклеотиду. Рибозный фрагмент LNA-нуклеотида модифицируют с помощью дополнительного мостика, соединяющего атом кислорода в положении 2' и атом углерода в положении 4'. Мостик обеспечивает «закрытие» рибозы в 3'-эндоконформации (северной), которая часто встречается у дуплексов A-формы. При необходимости LNA-нуклеотиды можно смешивать с остатками ДНК или РНК в составе олигонуклеотида и гибридизировать с ДНК или РНК согласно правилам спаривания оснований по Уотсону-Крику (Doessing et al., 2011, Molecules 2011, 16, 4511-4526).
В конкретном варианте осуществления зонд предусматривает зонд на основе PNA, выбранный из 14-мерной, 7-мерной или 4-мерной PNA.
Термин «мини-штрихкод ДНК» относится к последовательности ДНК, которая является фрагментом последовательности ДНК-штрихкода (как правило, составляющая приблизительно 650 п.о.). Мини-штрихкод ДНК обычно состоит из 50-250 п.о., предпочтительно 70-130 п.о., и является специфическим для одного вида, при этом характеризуется дивергенцией по отношению к таким же участкам ДНК других видов, с которыми его изначально сравнивали в ходе процесса идентификации. Из-за своей меньшей длины мини-штрихкод ДНК может обеспечивать более эффективную идентификацию одного вида в образцах, в которых ДНК может быть частично разрушенной (например, в переработанном продукте питания). Одна последовательность ДНК-штрихкода может содержать более одного мини-штрихкода ДНК.
Термин «амплификация ДНК» относится к реакции, позволяющей искусственно увеличивать число копий конкретного фрагмента ДНК посредством повторной репликации. Целевая матрица может представлять собой либо ДНК, либо РНК после обратной транскрипции. Примерами амплификации ДНК являются изотермическая амплификация ДНК (LAMP, изотермическая амплификация с формированием петель), специфическая для митохондриальной ДНК свиньи, амплификация, основанная на последовательности нуклеиновой кислоты (NASBA), зависящая от хеликазы амплификация (HDA), рекомбиназная полимеразная амплификация (RPA), амплификация по типу катящегося кольца (RCA), изотермическая амплификация с применением одного праймера (SPIA), способ амплификации Smart версии 2 (SMAP2), амплификация с замещением цепей (SDA), реакция амплификации с внесением однонитевого разрыва и удлинением (NEAR), изотермическая и инициируемая химерным праймером амплификация нуклеиновых кислот (ICAN), полимеразная спиральная реакция (PSR).
Термин «реакция с использованием матрицы на основе нуклеиновой кислоты» относится к реакции, при которой олигонуклеотиды, которые связаны с химическими соединениями (например, конъюгаты реагирующих веществ и зонда), распознают конкретные нуклеиновые кислоты и гибридизируются с ними, за счет чего реагирующие вещества приводятся в непосредственную близость друг к другу (Pianowsky et al., 2007, Chem. Commun., 37: 3820-3822). По сравнению c произвольными межмолекулярными реакциями реакции с использованием матрицы на основе нуклеиновой кислоты протекают с более высокой скоростью, что может являться конкурентным преимуществом для тестов, проводимых при возникновении необходимости, основанных на данном химическом подходе.
Термин «алкоксикарбонил» относится к группе -C(O)OR, где R включает «C1-С6алкил», «арил», «гетероарил», «арил-C1-С6алкил», «гетероарил-C1-С6алкил» или «гетероалкил».
Термин «алкоксикарбонил-C1-С6алкил» относится к C1-С6алкильным группам, содержащим алкоксикарбонильный заместитель, включая 2-(бензилоксикарбонил)этил и т.п.
Если иное не ограничено определением отдельного заместителя, термин «замещенный» относится к группам, замещенным 1-5 заместителями, выбранными из группы, состоящей из «C1-С6алкила», «амино», «аминосульфонила», «аминокарбонила», «сульфонила», «алкокси», «алкоксикарбонила», «галогена», тригалогенметила, циано, гидрокси, меркапто, нитро и т.п.
Соединения согласно настоящему изобретению предусматривают соединение согласно формуле (I) и его геометрические изомеры, в частности хорошо известные изомеры хиназолинового фрагмента.
Как используется в данном документе, набор может содержать «устройство для тестирования» в виде «тест-полоски», которое обеспечивает возможность осуществления способа согласно настоящему изобретению, в частности обнаружения целевых молекул ДНК/РНК согласно настоящему изобретению. Согласно конкретному аспекту устройство для тестирования выполнено из материала, который обеспечивает возможность движения потока раствора и молекул, содержащихся в нем, за счет капиллярного эффекта. Примерами таких материалов являются сложные эфиры целлюлозы (в том числе ацетат нитроцеллюлозы и ацетат целлюлозы), целлюлозная бумага, фильтровальная бумага, санитарно-гигиеническая бумага или пористая полимерная пленка. Примером устройства для тестирования является устройство в виде «полоски, обеспечивающей растекание жидкости в радиальном направлении», которая содержит линию обнаружения, выполненную из иммобилизированного стрептавидина или захватывающих зондов, и расположенный в нижней части карман, содержащий профлуорофор согласно настоящему изобретению и восстановитель. Набор согласно настоящему изобретению может дополнительно содержать устройство для получения образцов.
Термин «устройство для получения образцов» относится к устройству, которое позволяет получать образец для применения в анализе. Примеры устройства для получения образцов включают биопсийный перфоратор для мяса и листьев или тупфер для микроорганизмов.
Термин «устройство для дробления образцов» относится к устройству, которое позволяет измельчать материал образца в совместимом буфере (т.е. 10 мМ Tris, 1 мМ EDTA, pH 8,0). Устройство для дробления образцов обеспечивает переход целевых анализируемых веществ (т.е. ДНК) в раствор путем разрыва клеточной структуры различных образцов. Устройства для дробления образцов можно приобрести у коммерческих поставщиков, например в виде одноразовых пестиков (Eppendorf) или переносных дезинтеграторов клеток (Xpedition, Zymo Research).
Профлуорофоры согласно настоящему изобретению
Согласно одному аспекту предусмотрено соединение формулы (I):
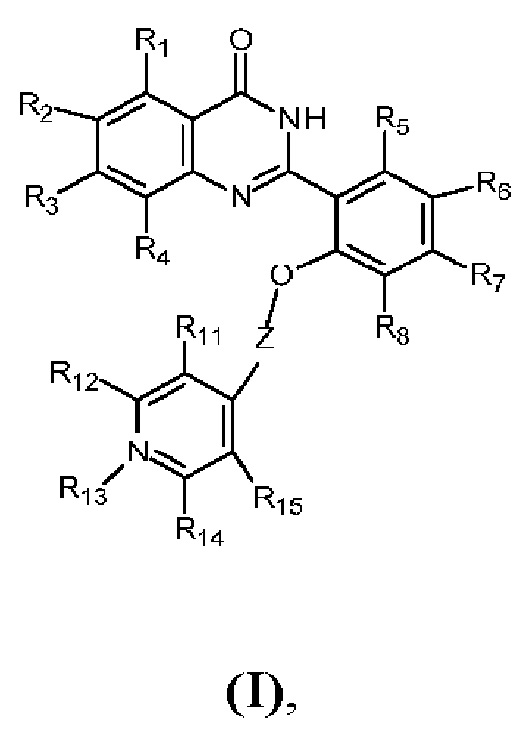
где R1-R8, R11-R12 и R14-R15 независимо выбраны из водорода, гидроксила, галогена, такого как хлор, циано, нитро, необязательно замещенного C1-С10алкила, необязательно замещенного амино-C1-С10алкила, необязательно замещенного C1-С10алкокси, R13 выбран из необязательно замещенного C1-С10алкила, такого как необязательно замещенный этил (например, этил), необязательно замещенный пропил (пропил или N-пропилнитрил) или необязательно замещенный бутил (например, бутил), Z представляет собой - CR16R17, где R16 и R17 независимо выбраны из водорода и необязательно замещенного C1-С6алкила, или его любые таутомер, изомер, конъюгат на его основе или его соли.
Согласно другому аспекту соль профлуорофора по настоящему изобретению с противоионом представляет собой трифторметансульфонат (OTf).
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R1, R3-R5 и R7-R8 представляют собой H.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R11 и R15 представляют собой H.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R11-R12 и R14-R15 представляют собой H.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R12 представляет собой необязательно замещенный C1-С10алкил, такой как метил.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R14 представляет собой необязательно замещенный C1-С10алкил, такой как метил.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R2 представляет собой Cl.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R2 представляет собой H.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R6 представляет собой Cl.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R6 представляет собой H.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R6 представляет собой необязательно замещенный C1-С10алкил.
Согласно дополнительному варианту осуществления аспекта предусмотрен профлуорофор формулы (I), где R6 представляет собой алкоксикарбонил-C1-С10алкил, такой как -CH2C(O)OMe.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R1-R8 представляют собой H.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R13 представляет собой необязательно замещенный бутил.
Согласно дополнительному аспекту предусмотрен профлуорофор формулы (I), где R13 выбран из пропила или N-пропилнитрила.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где R13 представляет собой необязательно замещенный пропил.
Согласно дополнительному аспекту предусмотрен профлуорофор формулы (I), где R16 представляет собой H.
Согласно дополнительному аспекту предусмотрен профлуорофор формулы (I), где R17 представляет собой H.
Согласно дополнительному аспекту предусмотрен профлуорофор формулы (I), где R17 представляет собой необязательно замещенный C1-С6алкил.
Согласно другому дополнительному аспекту предусмотрен профлуорофор формулы (I), где R17 представляет собой этил.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где Z представляет собой метил.
Согласно другому аспекту предусмотрен профлуорофор формулы (I), где Z представляет собой -C(H)(этил)-.
Согласно одному варианту осуществления соединения по настоящему изобретению, являющиеся профлуорофорами, выбраны из следующей группы:



Согласно другому варианту осуществления соединения по настоящему изобретению, являющиеся профлуорофорами, выбраны из следующей группы:



Согласно дополнительному варианту осуществления соединение согласно настоящему изобретению представляет собой 1-пропил-4-((4-хлор-2-(6-хлор-4- оксо-3,4-дигидрохиназолин-2-ил)фенокси)метил)пиридин-1-ий.
Согласно дополнительному варианту осуществления соединение согласно настоящему изобретению представляет собой 3-[4-[[4-хлор-2-(6-хлор-4-оксо-3H-хиназолин-2-ил)фенокси]метил]пиридин-1-ий-1-ил]пропаннитрил.
Согласно дополнительному варианту осуществления соединение согласно настоящему изобретению представляет собой 4-(1-(4-хлор-2-(4-оксо-3,4-дигидрохиназолин-2-ил)фенокси)этил)-1-пропилпиридин-1-ий.
Согласно другому дополнительному варианту осуществления соединение согласно настоящему изобретению представляет собой 4-((4-хлор-2-(4-оксо-3,4-дигидрохиназолин-2-ил)фенокси)метил)-2,6-диметил-1-пропилпиридин-1-ий.
Согласно другому дополнительному варианту осуществления соединение согласно настоящему изобретению представляет собой 4-((2-(4-оксо-3,4-дигидрохиназолин-2-ил)фенокси)метил)-1-пропилпиридин-1-ий.
Согласно конкретному варианту осуществления профлуорофор по настоящему изобретению является бесцветным под излучением видимой части спектра и растворимым в водных растворах при комнатной температуре.
Согласно другому конкретному варианту осуществления профлуорофор по настоящему изобретению превращается в условиях фоторедокс-каталитической реакции при взаимодействии с комплексом переходного металла в присутствии восстановителя во флуоресцентное соединение, нерастворимое в водных растворах (например, осаждается).
Синтез профлуорофоров согласно настоящему изобретению
Согласно одному варианту осуществления соединения по настоящему изобретению, являющиеся профлуорофорами, можно получать с помощью способа синтеза согласно общей схеме 1, приведенной ниже. Альдегид формулы (i) в щелочной среде (например, карбонате калия) растворяют в полярном растворителе (например, DMF). Смесь нагревают (например, 80°C) и по частям добавляют пиридиновое производное формулы (iia) в виде твердого вещества. Полученную смесь перемешивают в течение нескольких часов (например, 6 часов). Затем выпаривают растворитель при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле с получением необходимого промежуточного продукта формулы (iii). Полученное соединение формулы (iii) затем вводят в реакцию с алкилирующим средством (например, бутан-2-илтрифторметансульфонатом или соединением формулы (iv), таким как 1-йодпропан) в полярном апротонном растворителе (например, DMSO) для алкилирования атома азота в пиридине в инертной атмосфере. Раствор перемешивают в течение ночи при комнатной температуре. Неочищенное вещество осаждают (например, в диэтиловом эфире), центрифугируют и промывают с получением необходимого промежуточного соединения формулы (v). Промежуточное соединение формулы (v) затем вводят в реакцию с амидом формулы (vi) в условиях реакции элиминирования (например, в присутствии тозиловой кислоты) в водорастворимом растворителе (например, сухом этаноле), и смесь нагревают с обратным холодильником (например, 3 часа). Затем раствор охлаждают до 0°C и обеспечивают осаждение в окисляющей среде (например, в 2,3-дихлор-5,6-дициано-1,4-бензохиноне (DDQ)), при этом обеспечивают возможность нагревания раствора при комнатной температуре. Через несколько часов (например, 2 часа) соединение формулы (I) в виде твердого вещества извлекают путем последующего центрифугирования и промывают с помощью водорастворимого растворителя (например, холодного этанола).
Схема 1

В качестве альтернативы согласно другому варианту осуществления соединения по настоящему изобретению, являющиеся профлуорофорами, можно получить с помощью способа синтеза согласно общей схеме 1, где промежуточное соединение (iia) заменяют на промежуточное соединение (iib) и вводят его в реакцию с альдегидом формулы (i) с получением промежуточного соединения (iii) согласно схеме 3, приведенной ниже:
Схема 3

где промежуточное соединение (iib) активируют при стандартных условиях реакции Мицунобу (DIAD, PPh3). Промежуточные соединения формул (i), (iia) или (iib) могут быть коммерчески доступными, или их можно получить согласно стандартным способам, известным из уровня техники.
Соединение согласно формуле (I) затем растворяют в полярном апротонном растворителе (например, DMSO), очищают с помощью подходящих способов, таких как центрифугирование и промывание холодным этанолом.
Будет понятно, что если представлены типичные или предпочтительные экспериментальные условия (т.е. значения температуры реакции, время, количество молей реагентов, растворители и т.д.), другие экспериментальные условия можно также использовать, если не указано иное. Оптимальные условия реакции могут изменяться в зависимости от конкретных используемых реагентов или растворителей, но такие условия могут быть определены специалистом в данной области техники, используя обычные процедуры оптимизации.
Профлуорофоры по настоящему изобретению можно применять как таковые в растворе или в виде конъюгатов вместе с малыми молекулами, природными или синтетическими нуклеиновыми кислотами, пептидами или белками. Например, он может быть присоединен посредством его пиридиниевой группы к последовательности нуклеиновой кислоты, такой как последовательность пептидо-нуклеиновой кислоты (PNA), в частности посредством лизинового остатка в ε-положении боковой цепи, или конъюгирован с помощью «клик»-химии посредством азид-алкинового циклоприсоединения путем проведения реакции азид-содержащего профлуорофора по настоящему изобретению с PNA, содержащей алкин, например, как описано в Sadhu et al., 2013, Chem. Eur. J., 19, 8182-8189. Согласно конкретному варианту осуществления конъюгаты на основе профлуорофоров по настоящему изобретению представлены формулой (II):

где Ra представляет собой фрагмент -R13-R13a, Rb представляет собой фрагмент - R12-R12b, Rc представляет собой фрагмент -R11-R11c, Rd представляет собой фрагмент -R15-R15d, Rg представляет собой фрагмент -R14-R14g, где R11-R13 и Z являются такими, как описано в данном документе, R11c, R12b, R13a, R14g и R15d независимо необязательно присутствуют, и по меньшей мере одна из групп R11c, R12b, R13a, R14g и R15d представляет собой линкерную группу,
- имеющую специфическую аффинность в отношении целевой молекулы (например, ДНК, LNA, PNA, последовательности, комплементарной участку целевой молекулы, морфолина, РНК, антител, нанотел и их аналогов или низкомолекулярного лиганда), в частности, вблизи участка, который распознается целевым зондом,
или
- группу, имеющую специфическую аффинность в отношении группы, конъюгирующей фоторедокс-катализатор с зондом, распознающим участок целевой молекулы (например, ДНК, LNA, PNA, морфолина, РНК, антител, нанотел и их аналогов или низкомолекулярного лиганда).
Примеры таких линкерных групп и конъюгатов и их применение согласно настоящему изобретению представлены на фигурах 4 и 9 и в примерах 2 и 7. Согласно конкретному варианту осуществления соединение (2), которое представляет собой азидное производное соединения (1), является особенно применимыми для получения конъюгатов на основе соединения (1) согласно настоящему изобретению посредством клик-химии.
Согласно конкретному варианту осуществления такие линкерные группы, имеющие специфическую аффинность в отношении целевой молекулы или в отношении группы, конъюгирующей фоторедокс-катализатор с зондом, распознающим участок целевой молекулы, могут предусматривать (a) промежуточный фрагмент и (b) стыковочный фрагмент, где стыковочный фрагмент (b) связывается либо с целевой молекулой вблизи участка, который распознается каталитическим зондом, либо с группой, конъюгирующей фоторедокс-катализатор с зондом, распознающим участок целевого зонда, и при этом промежуточный фрагмент (a) представляет собой химический спейсер, обеспечивающий ковалентное связывание стыковочного фрагмента с профлуорофором по настоящему изобретению и имеющий подходящую геометрическую форму для содействия реакциям с использованием матрицы. Согласно конкретному аспекту промежуточный фрагмент может представлять собой простой алкильный линкер (как правило, приблизительно C1-С10алкил) или полиэтиленгликолевую или полиамидную цепь, как правило, из приблизительно 1-10 звеньев (0,3-3 нм).
Согласно конкретному варианту осуществления конъюгаты на основе профлуорофоров по настоящему изобретению представлены формулой (II), где по меньшей мере одна из групп R11c, R12b, R13a, R14g и R15d представляет собой линкерную группу следующей формулы (III):

где n представляет собой целое число от 1 до 10, m представляет собой целое число от 0 до 2, и b представляет собой стыковочный фрагмент, как определено выше.
Согласно дополнительному конкретному варианту осуществления конъюгаты на основе профлуорофоров по настоящему изобретению представляют собой конъюгаты, описанные в разделе «Примеры».
Фотокаталитическое восстановление профлуорофоров по настоящему изобретению
Согласно одному аспекту профлуорофор формулы (I) можно применять в виде флуорогенной композиции (предшественника флуорофора) для фоторедокс-катализа, осуществляемого, когда профлуорофор формулы (I) находится вблизи фоторедокс-катализатора, представляющего собой комплекс переходного металла.
Согласно конкретному аспекту фоторедокс-катализатор может быть выбран из известных переходных металлов, таких как описанные в Prier et al., 2013, Chem. Rev., 113, 5322-5363.
В частности, фоторедокс-катализ (фотокаталитическое восстановление) может быть опосредован комплексом переходного металла (фоторедокс-катализатором) формулы (I''):
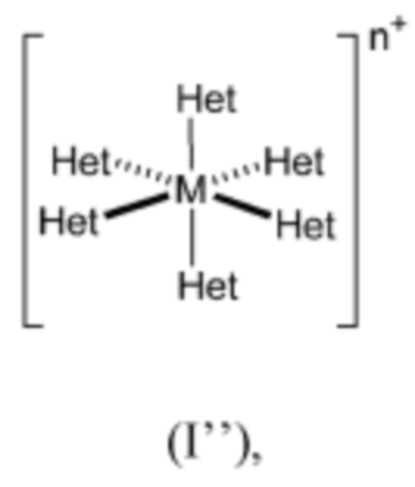
где M представляет собой переходный металл (такой как рутений), n представляет собой целое число от 1 до 6 (такое как 3), Het представляет собой необязательно замещенный гетероцикл, содержащий по меньшей мере один атом азота, и две группы Het могут быть связаны с помощью ковалентной связи (как, например, бипиридин (bpy)) или конденсированы (как, например, фенатролин (Phen)), в присутствии восстановителя, когда профлуорофор формулы (I) находится вблизи указанного фоторедокс-катализатора таким образом, что указанный фоторедокс-катализатор может вовлекаться в процесс одноэлектронного переноса с участием флуорогенной композиции, содержащей указанный профлуорофор формулы (I), при возбуждении светом.
Согласно конкретному аспекту M представляет собой рутений (Ru).
Согласно другому конкретному аспекту Het выбран из необязательно замещенного бипиридина (bpy) (такого как бипиридин или хлорбипиридин) и фенатролина (Phen).
Согласно дополнительному конкретному аспекту фоторедокс-катализатор, применимый для инициирования фоторедокс-катализа флуорогенной композиции, содержащей профлуорофор формулы (I), выбран из хлорида трис(бипиридин)рутения(II) (Ru(bpy)3Cl2), бис(бипиридин)рутений(II)-фенантролина (Ru(bpy)2Phen) или родственных аналогов.
Согласно конкретному аспекту восстановитель может быть выбран из восстановителей, описанных в Sadhu et al., 2015, Chem. Commun., 51, 1664-6).
Согласно дополнительному конкретному аспекту восстановитель может быть выбран из аскорбата натрия (NaAsc), аскорбиновой кислоты (витамина C), фосфинов, как например трис(2-карбоксиэтил)фосфин, третичного амина (этилендиаминтетрауксусной кислоты (EDTA) или триэтаноламина) и никотинамидадениндинуклеотида (NADH).
Согласно другому дополнительному конкретному аспекту восстановитель представляет собой аскорбат натрия (NaAsc).
Из числа осаждающих красителей на основе хиназолинона 6-хлор-2-(5-хлор-2- гидроксифенил)-3H-хиназолин-4-он является одним из наиболее известных, однако известно, что некоторые другие флуорофоры ведут себя подобным образом (Diwu et al., 1999, Conference on Advances in Fluorescence Sensing Technology IV, SPIE, 3602), и было показано, что некоторые дополнительные флуорофоры ведут себя подобным образом, как проиллюстрировано в примере 9. Следовательно, способ по настоящему изобретению является применимым в получении различных QPD, представляющих интерес, в частности, для применения в обнаружении целевых молекул.
Согласно другому аспекту предусмотрен способ получения флуорофора формулы (I'):

где R1-R8 независимо выбраны из водорода, гидроксила, галогена, как например хлор, циано, нитро, необязательно замещенного C1-С10алкила, необязательно замещенного амино-C1-С10алкила, необязательно замещенного C1-С10алкокси, или его любых таутомера, изомера, конъюгата на его основе или его солей, включающий стадию осуществления реакции флуорогенной композиции, содержащей профлуорофор формулы (I), определенный в данном документе, с фоторедокс-катализатором, представляющим собой комплекс переходного металла, в присутствии восстановителя посредством фоторедокс-катализа.
Согласно другому аспекту предусмотрен способ получения флуорофора формулы (I'), где R1, R3-R5 и R7-R8 представляют собой H.
Согласно другому аспекту предусмотрен формулы (I'), где R2 представляет собой Cl.
Согласно другому аспекту предусмотрен формулы (I'), где R2 представляет собой H.
Согласно другому аспекту предусмотрен формулы (I'), где R6 представляет собой Cl.
Согласно другому аспекту предусмотрен формулы (I'), где R6 представляет собой H.
Согласно другому аспекту предусмотрен способ получения флуорофора формулы (I'), где R6 представляет собой необязательно замещенный C1-С10алкил.
Согласно дополнительному варианту осуществления аспекта предусмотрен способ получения флуорофора формулы (I'), где R6 представляет собой алкоксикарбонил-C1-С10алкил, такой как -CH2C(O)OMe.
Согласно другому аспекту предусмотрен способ получения флуорофора формулы (I'), где R1-R8 представляют собой H.
Согласно другому аспекту предусмотрен способ получения флуорофора:

Согласно другому аспекту предусмотрен способ получения флуорофора, выбранного из следующей группы:



Согласно другому аспекту предусмотрен флуорофор, выбранный из следующей группы:


Согласно конкретному аспекту фоторедокс-катализ инициируют излучением при длине волны, достаточной для инициации переноса заряда от металла к лиганду, как правило, от приблизительно 400 до приблизительно 500 нм, в частности от приблизительно 430 до приблизительно 470 нм, в частности от приблизительно 450 (например, для Ru(bpy)3 или Ru(bpy)2Phe) до приблизительно 460 нм.
Согласно конкретному аспекту фоторедокс-катализ инициируют излучением при длине волны приблизительно 450-455 нм.
Согласно конкретному варианту осуществления способ получения флуорофора проводят на твердой подложке, c которой связывается целевая молекула, несущая фоторедокс-катализатор, представляющий собой комплекс переходного металла.
Согласно другому конкретному варианту осуществления флуорофор образуется с помощью способа получения флуорофора согласно настоящему изобретению и осаждается в месте реакции между фоторедокс-катализатором, представляющим собой комплекс переходного металла, и флуорогенной композицией, содержащей профлуорофор формулы (I). Таким образом, катализатор обогащается в заданном физическом местоположении на твердой подложке, на которой присутствует целевая молекула (анализируемое вещество), и образование флуорофора приводит к получению флуоресцирующего осадка, при этом интенсивность сигнала флуоресценции коррелирует с концентрацией целевой ДНК, конъюгированной с катализатором.
Согласно другому аспекту предусмотрен способ обнаружения по меньшей мере одной целевой молекулы (например, малой молекулы, природной и синтетической нуклеиновой кислоты, пептида или белка) в образце, включающий стадию обнаружения флуорофора формулы (I'), образованного согласно способу по настоящему изобретению.
Образование флуорофора формулы (I') можно обнаруживать невооруженным глазом, или его можно визуализировать с помощью излучения при длине волны от приблизительно 300 до приблизительно 400 нм, в частности от приблизительно 330 до приблизительно 380 нм, в частности от приблизительно 360 до приблизительно 370 нм, как например, с помощью невидимого излучения (например, лампы с УФ-излучением при 365 нм).
Способы и пути применения согласно настоящему изобретению
Профлуорофор формулы (I) или конъюгат на его основе согласно настоящему изобретению можно применять в виде флуорогенной композиции (предшественника флуорофора) для фоторедокс-катализа, осуществляемого, когда профлуорофор формулы (I) находится вблизи фоторедокс-катализатора, представляющего собой комплекс переходного металла.
В частности, профлуорофор формулы (I) или конъюгат на его основе согласно настоящему изобретению можно применять в способе обнаружения по меньшей мере одной целевой молекулы (например, малой молекулы, природной и синтетической нуклеиновой кислоты, пептида или белка) в образце, где указанный способ предусматривает:
(i) приведение в контакт образца с (1) заякоривающим субстратом для указанной по меньшей мере одной целевой молекулы и (2) с зондом для указанной по меньшей мере одной целевой молекулы, где указанный зонд мечен фоторедокс-катализатором, представляющим собой комплекс переходного металла, в условиях, подходящих для связывания зонда с указанной по меньшей мере одной целевой молекулой и для заякоривания целевой молекулы на указанном заякоривающем субстрате (например, на его поверхности), если указанная целевая молекула присутствует в образце;
(ii) приведение в контакт композиции, содержащей профлуорофор согласно настоящему изобретению или конъюгат на его основе, с указанным заякоривающим субстратом в присутствии восстановителя при подходящем условии для индуцирования фоторедокс-катализа профлуорофора согласно настоящему изобретению или конъюгата на его основе при расположении профлуорофора вблизи фоторедокс-катализатора, представляющего собой комплекс переходного металла;
(iii) обнаружение образования флуорофора формулы (I') на указанном заякоривающем субстрате, где образование указанного флуорофора свидетельствует о наличии указанной по меньшей мере одной целевой молекулы в указанном образце.
В конкретном варианте осуществления предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где указанный способ дополнительно включает стадию (ia) промывания указанного заякоривающего субстрата перед выполнением стадии (ii) с удалением любой несвязанной с указанным заякоривающим субстратом молекулы.
В конкретном аспекте предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где указанные стадии (i) и (ii) осуществляют параллельно посредством применения конъюгата на основе профлуорофора по настоящему изобретению, в котором указанный профлуорофор конъюгирован с зондом, который специфически распознает (например, посредством спариваний нуклеотидных оснований по Уотсону-Крику) часть последовательности целевой последовательности нуклеиновой кислоты (например, ДНК) («зонд с профлуорофором»), и применения зонда для указанной по меньшей мере одной целевой молекулы, где указанный зонд мечен фоторедокс-катализатором, представляющим собой комплекс переходного металла («каталитический зонд»). В данном варианте конъюгат на основе профлуорофора сам по себе служит в качестве заякоривающего субстрата для целевой нуклеиновой кислоты для осуществления фотокаталитической реакции после того, как каталитический зонд также свяжется с целевой нуклеиновой кислотой.
Следовательно, согласно другому конкретному аспекту настоящего изобретения предусмотрен способ обнаружения по меньшей мере одной целевой молекулы (например, малой молекулы, природной и синтетической нуклеиновой кислоты, пептида или белка) в образце, где указанный способ предусматривает:
(ia) приведение в контакт образца с (1) зондом для указанной по меньшей мере одной целевой молекулы, где указанный зонд мечен профлуорофором согласно настоящему изобретению или конъюгатом на его основе («зонд с профлуорофором»), и (2) с зондом для указанной по меньшей мере одной целевой молекулы, где указанный зонд мечен фоторедокс-катализатором, представляющим собой комплекс переходного металла, в присутствии восстановителя и в условиях, подходящих для связывания зондов с указанной по меньшей мере одной целевой молекулой, если указанная целевая молекула присутствует в образце, при подходящем условии для индуцирования фоторедокс-катализа профлуорофора согласно настоящему изобретению или конъюгата на его основе, когда конъюгат на основе профлуорофора связывается с целевой молекулой вблизи фоторедокс-катализатора, представляющего собой комплекс переходного металла;
(ib) обнаружение образования флуорофора формулы (I'), где образование указанного флуорофора свидетельствует о наличии указанной по меньшей мере одной целевой молекулы в указанном образце.
Данный конкретный вариант преимущественно позволяет применять способ по настоящему изобретению без необходимости физического заякоривания на опорном субстрате в случаях применения, при которых целевая нуклеиновая кислота имеется в большом избытке, и без необходимости стадии промывания. Фактически, ввиду отсутствия целевой нуклеиновой кислоты фоторедокс-катализ будет происходить медленно и произвольным образом между свободными каталитическим зондом и зондом с профлуорофором, и, следовательно, в случае присутствия целевой нуклеиновой кислоты можно будет наблюдать изменение цвета вследствие образования флуорофора.
В конкретном варианте осуществления предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где указанная по меньшей мере одна целевая молекула представляет собой последовательность нуклеиновой кислоты или часть целевой последовательности нуклеиновой кислоты.
В конкретном варианте осуществления предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где указанная по меньшей мере одна целевая молекула представляет собой целевую последовательность ДНК или часть целевой последовательности ДНК.
В конкретном варианте осуществления предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где указанная по меньшей мере одна целевая молекула представляет собой целевую последовательность РНК или часть целевой последовательности РНК.
В конкретном варианте осуществления предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где указанный зонд для указанной по меньшей мере одной целевой молекулы, меченный фоторедокс-катализатором, представляющим собой комплекс переходного металла, представляет собой зонд на основе нуклеиновой кислоты для целевой последовательности нуклеиновой кислоты или части целевой последовательности нуклеиновой кислоты, меченный фоторедокс-катализатором, представляющим собой комплекс переходного металла, например он может представлять собой зонд на основе нуклеиновой кислоты типа застежки-липучки «велкро», который специфически распознает часть последовательности целевой последовательности нуклеиновой кислоты посредством спариваний нуклеотидных оснований по Уотсону-Крику, где указанный зонд мечен фоторедокс-катализатором, представляющим собой комплекс переходного металла. Примерами нуклеиновых кислот типа застежки-липучки «велкро» являются РНК, ДНК, PNA или LNA, описанные в Briones et al. (2012, Anal. Bioanal. Chem., 402(10): 3071-89), или их смеси. Зонд на основе нуклеиновой кислоты для целевой последовательности нуклеиновой кислоты или части целевой последовательности нуклеиновой кислоты, меченный фоторедокс-катализатором, представляющим собой комплекс переходного металла, может представлять собой γD-PNA, γL-PNA.
В конкретном варианте осуществления предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где указанный заякоривающий субстрат представляет собой такой субстрат, как тест-полоска (как например, из сложных эфиров целлюлозы (включая ацетат нитроцеллюлозы и ацетат целлюлозы), целлюлозной бумаги, фильтровальной бумаги, санитарно-гигиенической бумаги или другой пористой полимерной пленки), содержащая средство, которое обеспечивает возможность заякоривания целевой молекулы на поверхности указанного субстрата. Например, заякоривающий субстрат может представлять собой субстрат, содержащий зонд типа застежки-липучки «велкро» для указанной целевой последовательности нуклеиновой кислоты (например, ДНК) или части указанной целевой последовательности ДНК, иммобилизированный на стрептавидин- агарозных гранулах, субстрат, содержащий стрептавидиновую группу, субстрат, содержащий антитела или нанотела к обычным (нуклеиновой кислоте (например, ДНК) маркерам (таким как флуоресцеинизотиоцианат, дигоксигенин, динитрофенил и биотин).
Примеры способа обнаружения по меньшей мере одной целевой молекулы нуклеиновой кислоты (например, ДНК) в образце согласно настоящему изобретению проиллюстрированы на фигурах 1, 2, 4-9.
В конкретном варианте осуществления предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где указанную стадию (i) осуществляют посредством применения по меньшей мере двух различных типов зондов, таких как (a) зонд, который специфически распознает (например, посредством спариваний нуклеотидных оснований по Уотсону-Крику) часть последовательности целевой последовательности нуклеиновой кислоты (например, ДНК) (или последовательности, комплементарной последовательности, ковалентно связанной с фрагментом последовательности, который распознает целевую молекулу) и обеспечивает заякоривание целевой молекулы на субстрате («заякоривающий зонд»), и (b) зонд, который специфически распознает (например, посредством спариваний нуклеотидных оснований по Уотсону-Крику) часть последовательности целевой последовательности нуклеиновой кислоты (например, ДНК) (или последовательности, комплементарной последовательности, ковалентно связанной с фрагментом последовательности, который распознает целевую молекулу), меченный фоторедокс-катализатором, представляющим собой комплекс переходного металла («каталитический зонд»).
В одном варианте осуществления предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где указанную стадию (i) осуществляют посредством применения по меньшей мере двух зондов, которые являются специфическими в отношении одной и той же целевой молекулы ДНК и гибридизируются с ней.
В конкретном варианте осуществления предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где стадия (i) предусматривает стадию амплификации ДНК с применением зондов (праймеров), конъюгированных с заякоривающей группой (заякоривающий зонд) и (праймеров) конъюгированных с фоторедокс-катализатором (каталитический зонд), с получением после амплификации ДНК целевой молекулы ДНК, содержащей молекулу для иммобилизации на заякоривающем субстрате и фоторедокс-катализатор.
В другом конкретном варианте осуществления предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где заякоривающий зонд выбран из биотинилированной последовательности ДНК, которая специфически распознает (например, посредством спариваний нуклеотидных оснований по Уотсону-Крику) часть последовательности целевой последовательности ДНК (или последовательности, комплементарной последовательности, ковалентно связанной с фрагментом последовательности, который распознает целевую молекулу), которая способна заякориваться со стрептавидиновыми группами заякоривающего субстрата в ходе стадии (i), или зонда, который специфически распознает (например, посредством спариваний нуклеотидных оснований по Уотсону-Крику) часть последовательности целевой последовательности ДНК (или последовательности, комплементарной последовательности, ковалентно связанной с фрагментом последовательности, который распознает целевую молекулу), который уже заякорен на заякоривающем субстрате.
В другом конкретном варианте осуществления предусмотрен способ по настоящему изобретению для обнаружения по меньшей мере одной целевой молекулы в образце, где стадию (ii) осуществляют посредством применения флуорогенной композиции, содержащей конъюгат на основе профлуорофора по настоящему изобретению, где указанный конъюгат содержит последовательность нуклеиновой кислоты (например, ДНК), которая специфически распознает участок целевой молекулы вблизи участка, распознаваемого каталитическим зондом, или последовательность нуклеиновой кислоты (например, ДНК), которая специфически распознает в каталитическом зонде линкер, конъюгирующий катализатор с зондом, специфически распознающим участок целевой молекулы.
Молекулы зонда
Согласно одному аспекту настоящее изобретение предусматривает зонд, который распознает конкретную целевую последовательность нуклеиновой кислоты и связывается с ней.
Согласно одному аспекту настоящее изобретение предусматривает конъюгат, содержащий ДНК-зонд, который распознает конкретный участок целевой ДНК, такой как мини-штрихкод ДНК, или нуклеиновую кислоту другого зонда (РНК, ДНК, PNA или LNA), конъюгированного с соединением формулы (I), и связывается с ними.
В некоторых случаях фотокаталитическая реакция может быть дополнительно ускорена с применением нуклеиновой кислоты, имеющей выступающие концы, в качестве матрицы для катализируемого превращения профлуорофора, и анализ можно мультиплексировать путем постановки в соответствие конкретных последовательностей для иммобилизации (штрихкод). С целью предотвращения перекрестного взаимодействия между последовательностью с выступающими концами и последовательностями, связывающими анализируемое вещество, применяют PNA с двумя различными стереохимическими конфигурациями (L-гамма-PNA для последовательности, нацеливающейся на ДНК или РНК, и R-гамма-PNA для реакции с использованием матрицы и иммобилизации). Такая процедура проиллюстрирована в примере 7.
Конкретным преимуществом способа по настоящему изобретению является то, что, в отличие от стандартных методик обнаружения ДНК, для него не требуются лабораторные условия и, таким образом, применение какого-либо оборудования, токсичных реагентов или сложных процедур, таких как биоинформатический анализ. Таким образом, настоящее изобретение представляет собой эффективный с точки зрения затрат анализ, который может осуществлять и интерпретировать любой человек, не имеющий предварительных знаний о тестах для обнаружения ДНК, он является портативным и одноразовым, и его можно осуществлять в течение короткого периода времени (за несколько минут или секунд). Следовательно, настоящее изобретение является особенно применимым для обнаружения целевых молекул, в частности конкретных целевых ДНК в сложной смеси образца, как например в продукте питания (например, для обнаружения ингредиентов-аллергенов), органических жидкостях (например, для диагностики наличия вирусов или бактерий в месте предоставления медицинских услуг), образцах из окружающей среды (например, для тестирования в отношении биозащиты или гигиены) и образцах, которые иным образом сложно идентифицировать (например, образцы от представителей дикой флоры и фауны, находящихся под угрозой исчезновения). Настоящее изобретение также применимо для целей отслеживания, поскольку оно может служить применяемым при возникновении необходимости инструментом для установления подлинности продуктов, в которых встречающиеся в природе или введенные искусственным путем ДНК используют в качестве средств отслеживания или водяных знаков (например, ткани, часы, фильтры для сигарет и т.д.).
Устройство для тестирования
Устройство для тестирования, особенно пригодное для применения в способе по настоящему изобретению, содержит заякоривающий субстрат, который обеспечивает возможность передвижения реагирующих веществ за счет капиллярного эффекта, и который обеспечивает возможность связывания целевых молекул или зондов по настоящему изобретению, например такой, как описанный в US 5798273.
В одном аспекте устройство для тестирования содержит заякоривающий субстрат, предусматривающий материал, выбранный из сложных эфиров целлюлозы (включая ацетат нитроцеллюлозы и ацетат целлюлозы), целлюлозной бумаги, фильтровальной бумаги, санитарно-гигиенической бумаги или пористой полимерной пленки.
В другом аспекте заякоривающий субстрат содержит на своей поверхности захватывающий зонд (например, зонд со стрептавидином или заякоренный зонд), который обеспечивает возможность связывания с целевыми молекулами, или зонды по настоящему изобретению.
Наборы
В другом аспекте настоящего изобретения предусмотрен набор для обнаружения по меньшей мере одной целевой молекулы в образце, при этом указанный набор содержит профлуорофор формулы (I) или конъюгат на его основе и необязательно по меньшей мере одно средство, выбранное из восстановителя и дополнительного зонда для обнаружения указанной целевой молекулы. Согласно конкретному аспекту набор дополнительно содержит устройство для тестирования согласно настоящему изобретению.
Согласно более конкретному аспекту набор согласно настоящему изобретению содержит по меньшей мере один каталитический зонд и один заякоривающий зонд, имеющие специфическую аффинность в отношении целевой молекулы (например, зонды в лиофилизированном виде), восстановитель и профлуорофор согласно настоящему изобретению необязательно вместе с по меньшей мере одним сосудом для проведения реакции амплификации и/или устройством для получения образцов.
Согласно более конкретному аспекту набор согласно настоящему изобретению содержит по меньшей мере один каталитический зонд и один заякоривающий зонд, имеющие специфическую аффинность в отношении целевой молекулы (например, зонды в лиофилизированном виде), восстановитель и профлуорофор согласно настоящему изобретению необязательно вместе с по меньшей мере одной целевой молекулой, положительное обнаружение которой может использоваться в качестве контроля.
Согласно другому дополнительному аспекту предусмотрен набор согласно настоящему изобретению, который содержит по меньшей мере один каталитический зонд и один заякоривающий зонд, имеющие специфическую аффинность в отношении целевой молекулы (например, зонды в лиофилизированном виде), и устройство в виде полоски с линией обнаружения, выполненной из иммобилизированного стрептавидина, и расположенным в нижней части карманом, содержащим смесь профлуорофора согласно настоящему изобретению и восстановитель.
ПРИМЕРЫ
Следующие сокращения относятся соответственно к нижеуказанным определениям:
п. о. (пара оснований), COI (цитохром-c-оксидаза), DDQ (2,3-дихлор-5,6-дициано-1,4-бензохинон), DIAD (диизопропилазодикарбоксилат), DMF (диметилформамид), DMSO (диметилсульфоксид), dsDNA (двухцепочечная ДНК), EtOH (этанол), LED (светоизлучающий диод), LNA (закрытые нуклеиновые кислоты), PBS (фосфатно-солевой буферный раствор), m-CPBA (мета-хлорпероксибензойная кислота), PNA (пептидо-нуклеиновая кислота), TsOH (тозиловая кислота), MS (ESI) (масс-спектрометрия (ионизация электрораспылением)), NaAsc (аскорбат натрия), ЯМР (ядерный магнитный резонанс), QR™-код (код быстрого реагирования), RP-HPLC (обращенно-фазовая высокоэффективная жидкостная хроматография), Ru(bpy)3Cl2 (хлорид трис(бипиридин)рутения(II)), Ru(bpy)2Phen (бис(бипиридин)рутений(II)-фенантролин (Ru(bpy)2Phen).
Пример 1. Синтез профлуорофоров по настоящему изобретению
Профлуорофоры по настоящему изобретению можно синтезировать согласно общей схеме 1. Следующие профлуорофоры синтезировали согласно следующей процедуре согласно схеме 2, где R выбран из H (промежуточные соединения (iva), (va) и соединение (1)) и N3 (промежуточные соединения (ivb), (vb) и соединение (2)).
Стадия 1. Образование промежуточного соединения (iiia)
В 8 мл диметилформамида (DMF) растворяли 5-хлорсалицилальдегид (491 мг, 3,13 ммоль) (промежуточное соединение (ia)) и карбонат калия (K2CO3, 1306 мг, 9,4 ммоль). Смесь нагревали до 80°C и по частям добавляли гидробромид 4-(бромметил)пиридина (промежуточное соединение (iia) (800 мг, 3,13 ммоль) в виде твердого вещества. Полученную смесь перемешивали в течение 6 часов. Затем растворитель выпаривали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле с получением 365 мг необходимого промежуточного продукта (iii) в виде желтого твердого вещества. Выход: 47%.1H ЯМР (ядерный магнитный резонанс) (400 МГц, CDCl3) δ: 10,54 (s, 1H), 8,69 (d, J=6,1 Гц, 2H), 7,86 (d, J=2,8 Гц, 1H), 7,51 (dd, J=8,9, 2,8 Гц, 1H), 7,38 (d, J=6,1 Гц, 2H), 6,96 (d, J=8,9 Гц, 1H), 5,24 (s, 2H).13C ЯМР (101 МГц, CDCl3) δ: 187,82, 158,64, 150,27, 144,64, 135,41, 128,51, 127,29, 126,05, 121,28, 114,38, 68,97. Масс-спектрометрия (ионизация электрораспылением) (MS (ESI)): рассчитанное значение для C13H10ClNO2: 247,04, найденное значение: 248,01 [M+H]+.
Схема 2

Стадия 2a. Образование промежуточного соединения (va)
Промежуточное соединение (iiia) (279 мг, 1,13 ммоль) смешивали с раствором 1-йодпропана (промежуточного соединения (iva)) (3,78 г, 18 ммоль) в 2,2 мл DMSO в инертной атмосфере. Раствор перемешивали в течение ночи при комнатной температуре. Неочищенное вещество осаждали в диэтиловом эфире, центрифугировали и промывали три раза с получением промежуточного продукта (va) в виде коричневого масла. Выход: 90%.1H ЯМР (400 МГц, DMSO-d6) δ: 9,09 (d, J=6,8 Гц, 1H), 8,29 (d, J=6,4 Гц, 1H), 7,83 - 7,70 (m, 1H), 7,35 (dd, J=8,6, 0,7 Гц, 1H), 5,68 (s, 1H), 4,59 (t, J=7,3 Гц, 1H), 1,96 (q, J=7,3 Гц, 1H), 0,90 (t, J=7,4 Гц, 2H).13C ЯМР (101 МГц, DMSO-d6) δ: 189,03, 158,38, 156,33,
2
145,07, 136,07, 128,38, 126,40, 126,22, 125,55, 116,59, 68,33, 62,19, 24,57, 10,70. MS (ESI): рассчитанное значение для C16H17ClNO2+: 290,09, найденное значение: 290,17 [M]+.
Стадия 2b. Образование промежуточного соединения (vb)
Промежуточный продукт (vb) получали из промежуточного соединения (iiia) (365 мг, 1,47 ммоль) и 1-азидо-3-йодпропана (промежуточного соединения (ivb)) (1,58 г, 7 ммоль), как описано для промежуточного соединения (va). Выход: 75%.1H ЯМР (400 МГц, DMSO-d6) δ: 10,48 (s, 0H), 9,11 (d, J=6,7 Гц, 1H), 8,30 (d, J=6,4 Гц, 1H), 7,80 - 7,74 (m, 1H), 7,34 (d, J=8,8 Гц, 0H), 5,69 (s, 1H), 4,69 (t, J=7,2 Гц, 1H), 3,50 (t, J=6,5 Гц, 1H), 2,32 - 2,13 (m, 1H).13C ЯМР (101 МГц, DMSO-d6) δ: 189,01, 158,36, 156,47, 145,31, 136,05, 128,36, 126,40, 126,22, 125,57, 116,61, 68,33, 58,65, 48,07, 30,13. MS (ESI): рассчитанное значение для C16H16ClN4O2+: 331,10, найденное значение: 331,10 [M]+.
Стадия 3a. Образование соединения (1) по настоящему изобретению
Соединение (1) (114,5 мг, 0,27 ммоль), 2-амино-5-хлорбензамид (промежуточное соединение (via) (49 мг, 0,29 ммоль) и TsOH⋅H2O (11 мг, 0,06 ммоль) растворяли в 3 мл сухого этанола (EtOH), и смесь нагревали с обратным холодильником в течение 3 часов. Затем раствор охлаждали до 0°C, и добавляли 2,3-дихлор-5,6- дициано-1,4-бензохинон (DDQ) (80 мг, 0,35 ммоль), и обеспечивали возможность нагревания раствора до комнатной температуры. Через 2 часа твердое вещество извлекали путем последующего центрифугирования и промывания три раза холодным этанолом. Полученный клейкий коричневый осадок очищали с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии (RP-HPLC) с получением соединения (1).1H ЯМР (400 МГц, DMSO-d6) δ: 12,69 (s, 1H), 9,07 (d, J=6,4 Гц, 2H), 8,17 - 8,09 (m, 3H), 7,91 (dd, J=8,7, 2,5 Гц, 1H), 7,80 (d, J=8,7 Гц, 1H), 7,77 (d, J=2,7 Гц, 1H), 7,66 (dd, J=8,9, 2,7 Гц, 1H), 7,27 (d, J=8,9 Гц, 1H), 5,59 (s, 2H), 4,54 (t, J=7,3 Гц, 2H), 1,92 (q, J=7,3 Гц, 2H), 0,87 (t, J=7,3 Гц, 3H).13C ЯМР (101 МГц, CDCl3) δ: 156,75, 154,50, 151,73, 144,99, 135,18, 132,33, 131,69, 130,84, 130,22, 129,74, 125,81, 125,36, 125,28, 125,24, 122,95, 115,59, 68,48, 62,14, 24,53, 10,66. MS (ESI): рассчитанное значение для C23H20Cl2N3O2+: 440,09, найденное значение: 440,28 [M]+.
Стадия 3b. Образование соединения (2) по настоящему изобретению
Соединение (2) получали из соединения (va) (580 мг, 1,32 ммоль) и 2-амино-5-хлорбензамида (270 мг, 1,4 ммоль), как описано для соединения (1).1H ЯМР (500 МГц, DMSO-d6) δ: 12,71 (s, 1H), 9,08 (d, J=6,8 Гц, 2H), 8,17 - 8,09 (m, 3H), 7,92 (dd, J=8,7, 2,5 Гц, 1H), 7,81 (d, J=8,7 Гц, 1H), 7,77 (d, J=2,7 Гц, 1H), 7,67 (dd, J=8,9, 2,7 Гц, 1H), 7,27 (d, J=9,0 Гц, 1H), 5,59 (s, 2H), 4,64 (t, J=7,2 Гц, 2H), 3,47 (t, J=6,5 Гц, 2H), 2,19 (p, J=6,8 Гц, 2H).13C ЯМР (126 МГц, DMSO-d6) δ: 160,43, 157,72, 157,48, 156,41, 154,00, 151,24, 147,57, 144,76, 134,71, 131,82, 131,22, 130,35, 129,76, 125,33, 124,88, 124,81, 124,77, 122,48, 115,08, 67,97, 58,13, 47,57, 29,60. MS (ESI): рассчитанное значение для C23H19Cl2N6O2+: 481,09, найденное значение: 481,31 [M]+.
Соединение (3) получали из (iiia) согласно такой же процедуре с применением на стадии 2 йодбутана вместо йодпропана.
Дополнительные профлуорофоры по настоящему изобретению синтезировали согласно общей схеме 1, где промежуточное соединение (iia) заменяли на промежуточное соединение (iib), которое вводили в реакцию с альдегидом формулы (i) с получением промежуточного соединения (iii) согласно общей схеме 3, как изложено ниже.
Стадия 1. Образование промежуточного соединения (iib1)

К холодному раствору этилмагнийбромида в диэтиловом эфире (конечная концентрация 0,3 M, 12 ммоль) по каплям добавляли 4-пиридинкарбоксальдегид (940 мкл, 10 ммоль). После добавления охлаждающую баню удаляли и раствор перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь гасили водой, и неочищенное вещество абсорбировали на диоксиде кремния.
Посредством очистки на силикагеле получали 850 мг промежуточного продукта (iib1) в виде желтого вязкого масла. Выход: 62%.1H ЯМР (400 МГц, хлороформ-d) δ: 8,56 (d, J=6,1 Гц, 2H), 7,29 (d, J=5,4 Гц, 2H), 4,66 (t, J=6,3 Гц, 1H), 3,50 (s, 1H), 1,79 (qd, J=7,4, 6,2 Гц, 2H), 0,97 (t, J=7,4 Гц, 3H).13C ЯМР (101 МГц, хлороформ-d) δ: 154,00, 149,45, 121,04, 74,03, 31,74, 9,72.
Стадия 2. Образование промежуточного соединения (iiib)

В 20 мл дихлорметана растворяли 5-хлорсалицилальдегид (промежуточное соединение (ia)) (200 мг, 1,27 ммоль), 1-(пиридин-4-ил)пропан-1-ол (промежуточное соединение (iib1), полученное выше) (350 мг, 2,54 ммоль) и PPh3 (732 мг, 2,8 ммоль), и охлаждали до -20°C с помощью бани с ледяной солью. По каплям добавляли раствор DIAD (550 мкл, 2,8 ммоль) в 5 мл дихлорметана. После добавления реакционную смесь нагревали до комнатной температуры, и реакцию продолжали в течение 3 часов. Растворитель выпаривали, и остаток абсорбировали на силикагеле. Посредством очистки с помощью флэш-хроматографии получали 175 мг продукта (iiib) в виде желтого твердого вещества. Выход: 50%.1H ЯМР (400 МГц, хлороформ-d) δ: 10,49 (s, 1H), 8,71 (d, J=6,2 Гц, 2H), 7,80 (d, J=2,8 Гц, 1H), 7,55 (d, J=9 Гц, 1H), 7,42 (d, J=6,2 Гц, 2H), 4,63 (t, J=6,4 Гц, 1H), 1,77 (qd, J=7,4, 6,4 Гц, 2H), 1,03 (t, J=7,4 Гц, 3H).13C ЯМР (400 МГц, хлороформ-d) δ: 188,62, 159,61, 149,97, 145,74, 134,24, 130,51, 126,80, 125,00, 120,58, 114,62, 75,97, 32,51, 9,82.
Стадия 3. Образование промежуточного соединения (vc)

Алкилирование промежуточного соединения (iiib) осуществляли, как показано для промежуточного соединения (va), с получением промежуточного соединения (vc). Выход: 92%.1H ЯМР (400 МГц, DMSO-d6) δ: 10,45 (s, 1H), 9,08 (d, J=6,8 Гц, 2H), 8,03 (d, J=6,4 Гц, 2H), 7,84 (d, J=2,4 Гц, 1H), 7,56 (dd, J=8,8, 2,4 Гц, 1H), 7,21 (d, J=8,7 Гц, 1H), 5,74 (s, 2H), 4,70 (t, J=7,4 Гц, 2H), 4,59 (t, J=6,2 Гц, 1H), 2,03 - 1,98 (m, 2H), 0,96 (t, J=7,4 Гц, 3H), 0,88 (t, J=7,4 Гц, 3H).13C ЯМР (101 МГц, DMSO) δ: 189,25, 158,42, 156,24, 144,86, 136,54, 128,91, 125,57, 124,99, 121,52, 112,90, 75,40, 68,05, 61,79, 31,07, 23,57, 11,03.
Стадия 1. Образование промежуточного соединения (iic)

В 10 мл хлороформа растворяли 2,6-лутидин (2 мл, 17,3 ммоль), и раствор охлаждали до 0°C. К перемешиваемому раствору по частям добавляли mCPBA (3 г, 17,4 ммоль). Раствор выдерживали в течение 1 ч. при 0°C, и медленно нагревали до комнатной температуры, и оставляли перемешиваться в течение дополнительных 9 часов. К раствору добавляли твердый K2CO3 (2,4 г, 70 ммоль), и перемешивали в течение дополнительных 30 минут. Твердое вещество удаляли с помощью фильтрации, фильтрат высушивали над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 1,7 г 2,6-лутидин- N-оксида в виде прозрачного масла. Выход: 80%.1H ЯМР (400 МГц, хлороформ-d) δ: 7,21(d, J=6,3 Гц, 2H), 7,08 (d, J=6,3 Гц, 1H), 2,45 (s, 6H).13C ЯМР (101 МГц, хлороформ-d) δ: 156,21, 150,45, 118,04, 26,35.

В сосуд Шленка помещали 2,6-лутидин-N-оксид (1,5 г, 12,2 ммоль) в атмосфере азота. Сосуд охлаждали до 0°C, и с помощью шприца вводили диметилсульфат (1,15 мл, 12,2 ммоль) в течение 5 минут. Затем реакционную смесь нагревали до 80°C и перемешивали в течение 3 часов. Неочищенную смесь концентрировали до сухого состояния, и остаток перекристаллизовывали из сухого ацетона с получением 2,4 г продукта в виде бесцветных иголок. Выход: 80%.1H ЯМР (400 МГц, хлороформ-d) δ: 8,28 (d, J=7,9 Гц, 1H), 7,79 (d, J=7,6 Гц, 2H), 4,45 (s, 3H), 3,46 (s, 3H), 2,66 (s, 6H).13C ЯМР (101 МГц, хлороформ-d) δ: 153,28, 148,56, 128,41, 69,65, 54,46, 22,64.

Лутидин-N-метоксид (2 г, 8 ммоль) растворяли в 25 мл метанола и нагревали с обратным холодильником. К данной смеси добавляли раствор персульфата аммония (456 мг, 4 ммоль) в 3 мл воды. Нагревание с обратным холодильником продолжали в течение 1 часа. Неочищенное вещество охлаждали до комнатной температуры, и pH регулировали до 7 с применением 10% NaOH. Неочищенное вещество фильтровали и выпаривали до сухого состояния. Конечное соединение очищали на силикагеле с получением 440 мг необходимого промежуточного соединения (iic) в виде белого твердого вещества. Выход: 40%.1H ЯМР (400 МГц, хлороформ-d) δ: 6,88 (s, 2H), 4,58 (s, 2H), 2,41 (s, 6H).13C ЯМР (101 МГц, хлороформ-d) δ: 157,78, 150,71, 117,80, 63,43, 24,27.
Стадия 2. Образование промежуточного соединения (iiic)
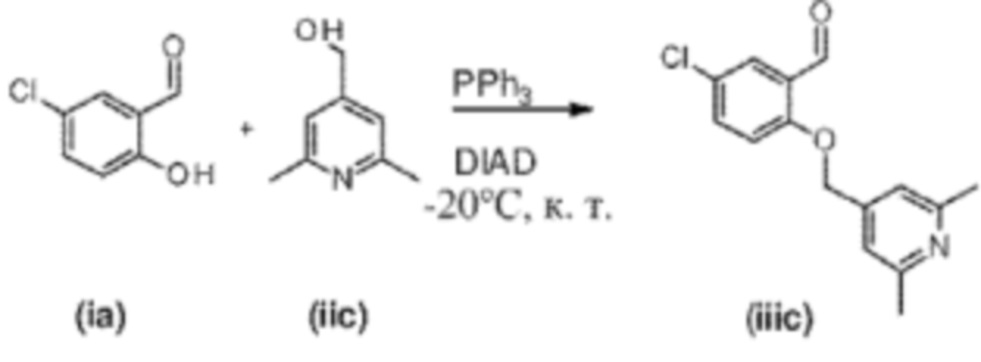
Промежуточное соединение (iiic) получали, как описано выше, начиная с 5-хлорсалицилальдегида формулы (ia) (200 мг, 1,27 ммоль) и (2,6-диметилпиридин-4-ил)метанола (350 мг, 2,54 ммоль), промежуточного соединения (iic), полученного, как описано выше. Желтое твердое вещество, 144 мг. Выход: 40%.1H ЯМР (400 МГц, хлороформ-d) δ: 10,42 (s, 1H), 7,82 (d, J=2,9 Гц, 1H), 7,50 (dd, J=8,9, 2,9 Гц, 1H), 7,02 (d, J=8,9 Гц, 1H), 6,90 (s, 2H), 4,45 (s, 2H), 2,34 (s, 6H).13C ЯМР (101 МГц, хлороформ-d) δ: 188,12, 156,80, 149,71, 145,67, 134,55, 127,83, 127,31, 126,35, 120,67, 118,30, 64,03, 24,83.
Стадия 3. Образование промежуточного соединения (vd)

Алкилирование промежуточного соединения (iiic), полученного выше, осуществляли, как показано для промежуточного соединения (va), с получением промежуточного соединения (vd). Выход: количественный.1H ЯМР (400 МГц, DMSO-d6) δ: 10,40 (s, 1H), 8,10 (s, 2H) 7,93 (d, J=2,7 Гц, 2H), 7,81 (d, J=2,4 Гц, 1H), 7,52 (dd, J=8,8, 2,4 Гц, 1H), 7,24 (d, J=8,7 Гц, 1H), 5,65 (s, 2H), 4,62 (t, J=7,4 Гц, 2H), 2,35 (s, 6H), 2,00 (t, J=7,3 Гц, 2H), 0,98 (t, J=7,4 Гц, 3H).13C ЯМР (101 МГц, DMSO-d6) δ: 189,42, 157,30, 149,51, 146,67, 134,35, 128,06, 127,42, 126,88, 120,15, 119,30, 67,54, 65,24, 26,02, 25,33, 12,11.
Стадия 1. Образование промежуточного соединения (iiid)

Синтез промежуточного соединения (iiid) осуществляли, как для соединения (iiia), начиная с 435 мкл (4,1 ммоль) салицилальдегида ((ib)), 1,5 г пиридинового производного (iic) (6,15 ммоль) и 1,7 г K2CO3 (12,3 ммоль) в 40 мл DMF. Выход: 55%.1H ЯМР (400 МГц, хлороформ-d) δ: 10,61 (s, 1H), 8,68 (d, J=6,0 Гц, 2H), 7,91 (dd, J=7,7, 1,8 Гц, 1H), 7,56 (ddd, J=8,5, 7,3, 1,8 Гц, 1H), 7,40 (d, J=6,1 Гц, 2H), 7,11 (td, J=7,5, 0,9 Гц, 1H), 7,00 (td, J=8,4, 0,8 Гц, 1H), 5,25 (s, 2H).13C ЯМР (101 МГц, CDCl3) δ: 189,22, 160,22, 150,24, 145,13, 135,93, 129,09, 125,24, 121,58, 121,27, 112,71, 68,58.
Стадия 2. Образование промежуточного соединения (ve)
Алкилирование полученного выше промежуточного соединения (iiid) (300 мг) осуществляли, как показано для промежуточного соединения (va), с получением промежуточного соединения (ve) в виде твердого вещества от желтого до коричневого цвета. Выход: 90%.

1H ЯМР (400 МГц, DMSO-d6) δ: 10,57 (s, 1H), 9,11 (d, J=6,8 Гц, 2H), 8,31 (d, J=6,7 Гц, 2H), 7,83 (dd, J=7,7, 1,8 Гц, 1H), 7,73 (ddd, J=8,5, 7,3, 1,9 Гц, 1H), 7,31 (dd, J=8,5, 1,0 Гц, 1H), 7,27 - 7,15 (m, 1H), 5,69 (s, 2H), 4,61 (t, J=7,4 Гц, 2H), 2,03 - 1,91 (m, 2H), 0,92 (t, J=7,4 Гц, 3H).13C ЯМР (101 МГц, DMSO) δ: 190,01, 159,71, 156,72, 145,06, 136,87, 129,31, 125,57, 125,09, 122,22, 114,22, 67,95, 62,19, 24,57, 10,71.
Дополнительные профлуорофоры по настоящему изобретению формулы (I) получали, как соединение (1), из соответствующих промежуточных соединений (vc), (vd), (ve), представляющих собой альдегид, и путем осуществления их реакции с диамином формулы (via), как определено выше, или


Синтез соединения (6) осуществляли из 111 мг альдегида (0,29 ммоль) с получением белого твердого вещества. Выход: 60%.1H ЯМР (400 МГц, DMSO-d6) δ: 9,07 (d, J=6,8 Гц, 2H), 8,21 (d, J=6,4 Гц, 2H), 8,14 (s, 1H), 7,64 (dd, J=7,7, 1,6 Гц, 1H), 7,53 (dd, J=7,5, 1,7 Гц, 1H), 7,36 (ddd, J=8,8, 7,4, 1,7 Гц, 1H), 7,26 (ddd, J=8,2, 7,2, 1,7 Гц, 1H), 7,11 - 7,02 (m, 2H), 6,78 (dd, J=8,2, 1,0 Гц, 1H), 6,70 (ddd, J=8,0, 7,2, 1,1 Гц, 1H), 6,26 (s, 1H), 5,54 (s, 1H), 4,56 (t, J=7,3 Гц, 2H), 2,01 - 1,88 (m, 2H), 0,90 (t, J=7,4 Гц, 3H).13C ЯМР (101 МГц, DMSO-d6): δ 164,24, 157,40, 155,01, 148,55, 146,32, 144,93, 138,00, 133,80, 130,25, 129,79, 128,49, 125,96, 121,81, 117,61, 115,18, 114,91, 112,91, 67,78, 62,16, 24,54, 10,72.
Пример 2. Получение зондов для целевых молекул для применения в способе согласно настоящему изобретению
В способе согласно настоящему изобретению обнаружение целевой молекулы в образце осуществляют посредством обнаружения образования нерастворимого флуорофора после того, как соответствующий профлуорофор оказывается вблизи фоторедокс-катализатора, связавшегося с целевой молекулой в образце, за счет чего обеспечивается возможность обнаружения и количественного определения указанной целевой молекулы.
Зонды
С целью обеспечения связывания фоторедокс-катализатора с целевой молекулой необходимо, чтобы зонды, меченные указанным фоторедокс-катализатором, имели специфическую аффинность в отношении целевой молекулы.
Для того чтобы целевая молекула связалась с заякоривающим субстратом, где может происходить фотореакция, заякоривающий субстрат должен иметь специфическую аффинность в отношении целевой молекулы (например, субстрат, содержащий зонд, имеющий специфическую аффинность в отношении целевой молекулы) или метки, связанной с целевой молекулой (стрептавидиновая группа, которая может реагировать с биотиновой группой, конъюгированной с зондом, имеющим специфическую аффинность в отношении целевой молекулы).
Для обеспечения более высокой эффективности сближения флуорофора с целевой молекулой профлуорофор по настоящему изобретению также можно конъюгировать с фрагментом, имеющим специфическую аффинность в отношении целевой молекулы, и можно применять с последовательностью нуклеиновой кислоты типа застежки-липучки «велкро», как описано в примере 7. В данном случае согласно конкретному варианту осуществления зонд, меченный фоторедокс-катализатором, и зонд, меченный профлуорофором, распознают часть целевых последовательностей, которые расположены в непосредственной близости в последовательности целевой молекулы.
Следовательно, такие фрагменты могут представлять собой, например, зонды на основе нуклеиновых кислот, таких как ДНК, РНК, пептидо-нуклеиновая кислота (PNA), закрытые нуклеиновые кислоты (LNA) или любая смесь ДНК, РНК, PNA, LNA без ограничения четырьмя природными основаниями A, T, C и G, которые специфически распознают по меньшей мере часть последовательности целевой молекулы.
ДНК-зонды могут представлять собой любые известные короткие последовательности, которые имеют специфическую аффинность в отношении целевой молекулы. В области пищевой промышленности, в частности мясной, нахождение зондов на основе короткой ДНК, специфических в отношении одного типа мяса, для обнаружения потенциальных загрязнителей из другого типа мяса, может быть затрудненным. В качестве иллюстративного примера идентификации зондов на основе специфической короткой ДНК в данной области был выбран митохондриальный ген COI (цитохром-c-оксидазы), поскольку его применяют в качестве стандартного ДНК-штрихкода для животных из-за его быстрой эволюции. В то же время митохондрии присутствуют в большом количестве (200-1000 копий/клетка), увеличивая таким образом численность целевой ДНК по сравнению с геномный фоном. Митохондриальную ДНК 15 животных, включая 12 обычно применяемых для производства мяса (курицы, цесарки, осла, лошади, ягненка, одногорбого верблюда, верблюда, коровы, свиньи, индейки, обезьяны и козы) вместе с потенциальными лабораторными загрязнителями (человека, мыши, крысы), загружали из базы данных NCBI (Национального центра биотехнологической информации) и штрихкодовый участок идентифицировали, как описано в Ivanova et al., 2012, Methods Mol. Biol., 858: 153-82). Путем выравнивания последовательностей один участок ДНК свиньи из 74 п.о. с наибольшей степенью дивергенции может быть идентифицирован, как присутствующий конкретно у одного организма (фиг. 2), и на его основе можно разработать ДНК-зонды, специфические в отношении свинины.
Зонды на основе PNA по сравнению с ДНК обладают следующими преимуществами: i) слабое связывание с молекулами РНК или ДНК, которые содержат всего одно ошибочно спаренное основание, с увеличением таким образом селективности; ii) связывание с целевыми молекулами РНК/ДНК независимо от концентрации солей в среде, вследствие чего концентрацию солей в реакционной смеси можно снизить до минимума с увеличением селективности; iii) устойчивость к разрушающим ферментам клетки, что позволяет применять меньшее количество зонда, и, таким образом, сводить к минимуму нецелевые процессы гибридизации. LNA по сравнению с PNA обладают следующими преимуществами: i) синтез химерных молекул LNA-ДНК можно легко осуществлять в лабораторных условиях, поскольку он основан на использовании фосфорамидитной химии, это позволяет увеличивать температуру плавления зонда с одновременным снижением числа нуклеотидов к минимуму, причем минимальное число нуклеотидов является важным для различия однонуклеотидных полиморфизмов; ii) более высокая растворимость в воде по сравнению с PNA.
ДНК-зонды можно синтезировать с низкими затратами, и потенциально наносить посредством печати на подложку, такую как бумага, и применять согласно стандартным методикам растекания жидкости в радиальном направлении, разработанным ранее для анализов, основанных на применении антител (т.е. тест на определение беременности).
Способы присоединения
Присоединение зонда, в частности зондов на основе нуклеиновой кислоты, к фоторедокс-катализатору можно осуществлять с помощью способов, вышеописанных в Sadhu et al., 2013, или как описано ниже.
Кроме того, присоединение зонда, в частности зондов на основе нуклеиновой кислоты, к профлуорофору по настоящему изобретению можно осуществлять с помощью способов, вышеописанных в Sadhu et al., 2013, или как описано ниже.
Например, зонд для применения в способе согласно настоящему изобретению может содержать линкер между двумя последовательностями нуклеиновых кислот, таких как PNA и другая PNA, такой как фрагмент, представляющий собой полиэтиленгликоль (PEG), для улучшения гибкости зонда и его растворимости в воде.
Согласно конкретному аспекту конъюгаты на основе профлуорофора формулы (II) можно получать путем соединения профлуорофора формулы (I) с промежуточным фрагментом (a) и (b) стыковочным фрагментом, определенными в данном документе, посредством стандартных реакций сочетания с получением 4-мерных конъюгатов γD-PNA-профлуорофор формул (IIa) или (IIb), показанных ниже. Автоматизированный синтез осуществляли, как сообщалось ранее в Sadhu et al., 2013, Chemistry-a European Journal, 19, 8182-8189, при этом присоединение профлуорофора (2) на смолу осуществляли посредством [3+2]-циклоприсоединения. Соединение (2) растворяли в 50 мкл NMP с получением 0,1 M раствора. Добавляли 2 мг TBTA в виде твердого вещества. Добавляли 15 мкл 0,4 M раствора CuSO4 в воде, а затем 50 мкл 2 M водного раствора аскорбиновой кислоты. Желтый раствор переносили на смолу, и обеспечивали протекание реакции в течение ночи. Конечные соединения очищали с помощью обращенно-фазовой HPLC. PNA-профлуорофор формулы (IIa) (конъюгат формулы (II), где R13a представляет собой линкерную группу формулы (III), где m равняется 0, и R11c, R12b, R14g и R15d отсутствуют) характеризуется рассчитанным значением MW (C78H91Cl2N32O19+): 1851,69 Да. Найденное с помощью LCMS значение масса/заряд: 1234,58 [2M+H]3+, 926,42 [M+H]2+, 618,08 [M+2H]3+. Найденное с помощью MALDI-TOF значение масса/заряд: 1545,563 [M-QPD]+.
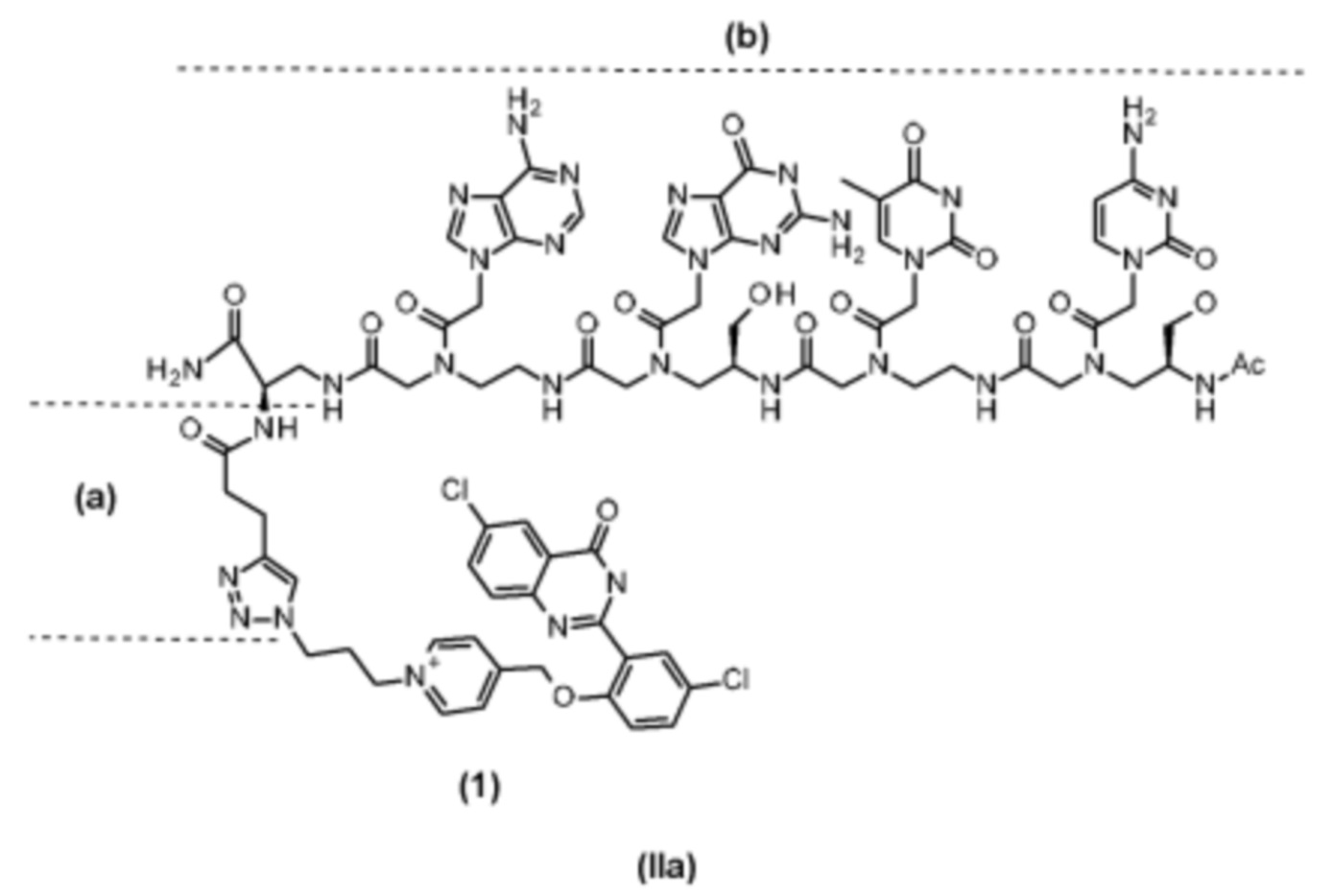
PNA-PEG-профлуорофор формулы (IIb) (конъюгат формулы (II), где R13a представляет собой линкерную группу формулы (III), где m равняется 1, n равняется 2, и R11c, R12b, R14g и R15d отсутствуют) характеризуется рассчитанным значением MW (C84H102Cl2N33O22+): 1996,85 Да. Найденное с помощью LCMS значение масса/заряд: 1330,83 [2M+H]3+, 999,08 [M+H]2+, 666,42 [M+2H]3+. Найденное с помощью MALDI-TOF значение масса/заряд: 1690,226 [M-QPD]+.

Соединения тестировали, и было показано, что они являются функциональными в реакциях с использованием матрицы, таких как описанные в контексте настоящего изобретения.
Пример 3. Анализ для обнаружения целевой ДНК в образце с помощью профлуорофора по настоящему изобретению на тест-полоске
Общий принцип способа обнаружения по настоящему изобретению для обнаружения целевых молекул ДНК в образце с помощью фотохимической реакции тестировали, как изображено на фиг. 1.
Соединение (1) растворяли в чистой воде и разбавляли до 2 мМ. Заякоривающий зонд (биотинилированную PNA, которая распознает целевую молекулу (фиг. 1Aa) и каталитический зонд (Ru-PNA, которая распознает целевую молекулу, конъюгированную с фоторедокс-катализатором, представляющим собой комплекс переходного металла, Ru(bpy)3Cl2 (фиг. 1Ab)) применяли в концентрации 10 нМ. Зонды на основе PNA растворяли в 1x PBS с получением 200 нМ раствора. Аскорбат натрия ((NaAsc, восстановитель) растворяли в воде с получением 30 мМ раствора. Зонды на основе PNA и восстановитель смешивали в равных объемах, по 30 мкл каждого, с получением 90 мкл рабочего раствора.
Стадия (i)
Образец (фиг. 1Ac), содержащий различные концентрации (50 нМ, 100 нМ, 250 нМ, 500 нМ, 1000 нМ в 60 мкл фосфатно-солевого буферного раствора, pH 7,4) целевой молекулы ДНК, содержащей участки, комплементарные каждому из зондов на основе PNA, приводили в контакт со смесью, содержащей зонды на основе PNA и восстановитель, полученной как описано выше, для обеспечения связывания зондов с целевой ДНК таким образом, чтобы в результате гибридизации получить комплекс, в котором целевая молекула ДНК мечена как биотином, так и рутением. Далее образец приводили в контакт с заякоривающим субстратом (фиг. 1Ad) в виде индикаторной полоски, обеспечивающей растекание жидкости в радиальном направлении, которая содержит иммобилизированный стрептавидин, вследствие чего в ходе протекания жидкого раствора по тест-полоске происходил захват образованного комплекса на поверхности индикаторной полоски посредством стрептавидин-биотинового взаимодействия (фиг. 1Af).
Стадия (ii)
Индикаторную полоску приводили в контакт с профлуорофором по настоящему изобретению, присутствующим в растворе образца, и подвергали воздействию излучения в течение 5 минут с применением LED-лампы с длиной волны 455 нм для стимулирования фотохимической реакции с профлуорофором в местоположении, где фоторедокс-катализатор связан с поверхностью индикаторной полоски, приводящей в результате к расщеплению химической связи (фиг. 1Ag), что приводит к образованию соответствующего флуорофора, который осаждается на индикаторной полоске и образует полосу с зеленой флуоресценцией (фиг. 1Ah).
Стадия (iii)
Флуорофор, дающий зеленую флуоресценцию, можно визуализировать на заякоривающей индикаторной полоске при воздействии невидимого излучения (лампа с УФ-излучением при 365 нм), и на основании этого можно получать концентрацию целевой ДНК. Отрицательный контроль проводили в отсутствии зонда на основе PNA, меченого фотокатализатором (фиг. 1B).
Пример 4. Анализ для обнаружения ДНК свиного происхождения
Способ по настоящему изобретению тестировали в отношении его способности обнаруживать целевую последовательность ДНК свиного происхождения в образце с применением ДНК-зондов, специфических в отношении двух фрагментов ДНК свиньи.
Молекулы зонда
Два зонда типа застежки-липучки «велкро», содержащие две различные последовательности нуклеиновой кислоты, которые являются специфическими в отношении конкретного участка ДНК свиньи, идентифицированного в примере 2 (CAGCCCGGAACCCTACTTGGCGATGATCAAATCTATAATG, SEQ ID NO: 3). Зонд 1 (называемый L') применяли в качестве якоря для захвата, иммобилизированного на заякоривающем субстрате в виде стрептавидин-агарозных гранул, и он содержит последовательность нуклеиновой кислоты c SEQ ID NO: 1 (CTTGGGATGAAC), которая гибридизируется с частью целевой последовательности ДНК (частью L). Зонд 2 (называемый R') применяли в качестве каталитического зонда, содержащего нуклеиновую кислоту с SEQ ID NO: 2 (CTACTAGTTTAGAT), которая гибридизируется с частью целевой ДНК (частью R), и которая была конъюгирована с катализатором (Ru(bpy)2Phen), как описано в примере 2.
Титрование стрептавидин-агарозных гранул, нагруженных стехиометрическими (1:1:1) концентрациями (50 нМ, 100 нМ, 250 нМ, 500 нМ, 1000 нМ в 60 мкл фосфатно-солевого буферного раствора, pH 7,4) целевой митохондриальной ДНК свиньи, зонда 1, зонда 2 и аскорбиновой кислоты (восстановитель), проводили в ходе тестирования с помощью способа согласно настоящему изобретению с применением профлуорофора согласно настоящему изобретению (соединения 1).
На первой стадии раствор образца, заякоривающий субстрат (гранулы), содержащий заякоривающий зонд, и каталитический зонд смешивали вместе с обеспечением возможности связывания ДНК-зондов (L' и R') с соответствующими частями L и R целевой ДНК (фиг. 2A), что приводило к заякориванию целевой молекулы на поверхности гранулы посредством иммобилизированных конъюгатов зонд-ДНК, как показано на фиг. 2. Затем гранулы промывали фосфатно-солевым буферным раствором (PBS) и гранулы ресуспендировали в 50 мкл PBS, содержащего 100 мМ профлуорофора по настоящему изобретению и 100 мМ аскорбиновой кислоты (восстановителя). Профлуорофор восстанавливался в присутствии катализатора, конъюгированного с зондом R', в течение 10 минут с обеспечением в результате сигнала флуоресценции в растворе (фиг. 2B). Было обнаружено, что предел обнаружения сигнала флуоресценции невооруженным глазом достигается для образца, содержащего 100 нМ митохондриальной ДНК, что соответствует 0,1 мг свиного мяса.
В заключение необходимо отметить, что анализ на основе способа согласно настоящему изобретению является эффективным инструментом для быстрого обнаружения (в течение приблизительно 10 мин.) присутствия фрагментов ДНК свиньи в образце с помощью сигнала флуоресценции без необходимости применения лабораторного оборудования, токсичных реагентов или сложного биоинформатического анализа.
Пример 5. Увеличенная селективность в отношении обнаружения ДНК свиного происхождения
Зонд должен быть специфическим, селективным и чувствительным в отношении целевой молекулы ДНК, чтобы его можно было применять для обнаружения данной ДНК в образце. В заякоривающих зондах и каталитических зондах, как правило, только 2 или 3 нуклеотида являются специфическими. Следовательно, учитывая эти небольшие различия, ни одна из методик гибридизации, разработанных до настоящего времени, не характеризуется селективностью, что означает, что хотя зонд может быть специфическим в отношении ДНК свиньи, он может также связывать ДНК коровы, приводя в результате к ложноположительному результату применяемого анализа.
Для улучшения селективности анализа, описанного в примере 4, применяли химические зонды на основе PNA, которые разрабатывали таким образом, чтобы они были комплементарными мини-штрихкоду ДНК свиньи, показанному на фигуре 3, за счет спариваний нуклеотидных оснований по Уотсону-Крику. Селективность зонда дополнительно увеличивали путем применения коротких последовательностей (описанных в примере 4), поскольку они более устойчивы к ошибочным спариваниям оснований, чем зонды большей длины. Следовательно, анализ разрабатывали с тремя короткими зондами на основе PNA, полученными, как описано выше, вместо одного длинного зонда, при этом целевую ДНК свиного происхождения можно обнаружить только в том случае, если три зонда на основе PNA гибридизируются с одной и той же молекулой ДНК, как показано на фигуре 4. Первый заякоривающий зонд (CGCGACTTGATCCAG, SEQ ID NO: 6), специфический в отношении ДНК свиньи, применяли для иммобилизации целевой ДНК свиньи на тест-полоске, и получали в результате заякоривающий субстрат, содержащий закрепленную целевую ДНК свиньи, называемую заякоренной целевой ДНК (фиг. 4A). Второй и третий ДНК-зонды применяли для связывания с заякоренной целевой ДНК, где второй зонд (CTTGGGATGAAC, SEQ ID NO: 1) представляет собой «каталитический зонд», содержащий последовательность нуклеиновой кислоты PNA, которая специфически распознает участок заякоренной целевой ДНК свиньи за счет образования пар нуклеотидных оснований, и фоторедокс-катализатор, представляющий собой комплекс переходного металла (Cat.), и третий зонд (CTACTAGTTTAGAT, SEQ ID NO: 2) содержит последовательность нуклеиновой кислоты PNA, которая специфически распознает участок заякоренной целевой ДНК свиньи за счет образования пар нуклеотидных оснований (отличный от участка, распознаваемого вторым зондом), конъюгированную с профлуорофором по настоящему изобретению (Pro-Fl.) (фиг. 4B). После того, как каталитический зонд и зонд, несущий профлуорофор, гибридизируются с заякоренной целевой молекулой ДНК в условиях, подходящих для фотокатализа (восстанавливающая среда и возбуждение светом), из-за небольшого размера целевой молекулы ДНК катализатор и профлуорофор остаются на достаточно близком расстоянии для инициирования фотокатализа профлуорофора и высвобождения флуорофора (Fl.) (фиг. 4C), который можно затем обнаружить невооруженным глазом.
Применение вышеописанных зондов позволяет регистрировать по меньшей мере 1% вес/вес свиного мяса в продукте на основе говядины через 20 минут. Это является пороговым уровнем, который регулирующие органы обычно рассматривают в качестве положительного в отношении загрязнения/неправильной маркировки.
Пример 6. Обнаружение целевой ДНК и мультиплексирование
Дополнительные примеры возможных конструкций, применяемых в способе по настоящему изобретению, приведены ниже. a) Обнаружение целевой ДНК после амплификации ДНК
Возможны случаи, при которых концентрация целевой нуклеиновой кислоты является ниже, чем чувствительность способа. Это может иметь место в отношении безопасности продуктов питания (т.е. для обнаружения нежелательных бактерий, таких как Salmonella, Campylobacter, Lysteria) или в рамках сертификации «Халяль»/«Кошер», при которой следовые количества ДНК свиньи являются нежелательными. Когда способ требует высокой чувствительности, концентрацию целевых нуклеиновых кислот можно увеличить путем специфического синтеза. На первой стадии целевую dsDNA (т.е. свиньи) амплифицируют с помощью праймеров (F1 и R1), специфических в отношении различных участков данной целевой ДНК (F1' и R1'). Один праймер (F1) представляет собой заякоривающий зонд, содержащий ДНК-зонд, специфический в отношении участка F1' целевой ДНК, который конъюгирован с биотином, а второй праймер (R1) представляет собой каталитический зонд, содержащий ДНК-зонд, специфический в отношении участка R1' целевой ДНК, который конъюгирован с фоторедокс-катализатором (Ru(bpy)2Phen). Амплификацию осуществляют с помощью полимеразной цепной реакции (ПЦР) или любой из известных изотермических реакций. Если целевая нуклеиновая кислота основана на РНК (т.е. вирус гепатита A), то предпочтительной может быть полимераза с обратно-транскриптазной активностью. В конце амплификации получают последовательность ДНК, которая содержит биотин на одном конце и катализатор на другом конце (фиг. 5A).
Устройство в виде полоски, обеспечивающей растекание жидкости в радиальном направлении, с линией обнаружения, выполненной из иммобилизированного стрептавидина, и расположенным в нижней части карманом, содержащим смесь профлуорофора (прокрасителя) согласно настоящему изобретению и восстановителя (аскорбиновой кислоты) (фиг. 5B), применяют в качестве заякоривающего субстрата.
Тест-полоску погружают в сосуд, содержащий среду, полученную после амплификации ДНК, которая содержит полученную в результате целевую последовательность ДНК, меченную как биотином, так и катализатором, при этом прокраситель и аскорбиновая кислота двигаются за счет капиллярного эффекта вдоль полоски (фиг. 5C). Затем амплифицированная целевая ДНК захватывается на линии обнаружения (заякоривающем субстрате) посредством стрептавидин-биотинового взаимодействия. После этого катализатор на целевой последовательности ДНК обеспечивает превращение прокрасителя в соответствующий краситель, который осаждается на линии обнаружения (фиг. 5D) и может быть детектирован. Изменение цвета на линии обнаружения свидетельствует о присутствии целевой ДНК в образце.
b) Обнаружение целевой ДНК посредством встраивания в нить
В примере 6a обнаружение целевой ДНК с помощью способа согласно настоящему изобретению зависит от выбора праймеров, применяемых для амплификации целевой ДНК. Данное ограничение можно преодолеть, используя стратегию встраивания в нить. Разрабатывают два зонда, содержащие последовательности нуклеиновой кислоты (например, PNA), комплементарные двум конкретным участкам F1' и R1' целевой dsDNA. Первый зонд имеет последовательность нуклеиновой кислоты F1, комплементарную целевой последовательности ДНК F1' и конъюгированную с последовательностью нуклеиновой кислоты C1, которая комплементарна заякоривающему зонду C1'. Второй зонд имеет последовательность нуклеиновой кислоты R1, комплементарную целевой последовательности ДНК R1' и конъюгированную с последовательностью нуклеиновой кислоты R0, которая комплементарна зонду R0', конъюгированному с катализатором (каталитическому зонду) (фиг. 6A).
Устройство в виде полоски, обеспечивающей растекание жидкости в радиальном направлении, с линией обнаружения, выполненной из заякоривающего зонда C1' (т.е. PNA), комплементарного хвостовой части C1 первого зонда, и расположенным в нижней части карманом, содержащим смесь профлуорофора (прокрасителя) согласно настоящему изобретению, восстановитель (аскорбиновую кислоту) и зонд R0' для обнаружения, комплементарный хвостовой части R0, который конъюгирован с катализатором (фиг. 6B), применяют в качестве заякоривающего субстрата. Зонды F1-C1 и R1-R0 инкубируют в реакционной пробирке с целевой ДНК (№1) в подходящем буфере (т.е. PBS). Зонды встраиваются в нити двухнитевой целевой ДНК с созданием гибридной структуры (фиг. 6A). Тест-полоску погружают в реакционную пробирку, что приводит к иммобилизации комплексов со встроенными в нить ДНК на линии обнаружения и движению зонда R0' для обнаружения, прокрасителя и аскорбиновых кислот вверх по полоске за счет капиллярного эффекта (фиг. 6C). Комплексы ДНК захватываются на линии обнаружения вследствие гибридизации нуклеиновых кислот C1' и C1, и катализатор обеспечивает превращение прокрасителя в соответствующий краситель, который осаждается на линии обнаружения (фиг. 6D). Изменение цвета на линии обнаружения свидетельствует о присутствии целевой ДНК в образце (фиг. 6E).
c) Обнаружение смеси целевых ДНК посредством встраивания в нить
С помощью способа согласно настоящему изобретению также можно обнаруживать смеси целевых ДНК, как проиллюстрировано на фигуре 7.
Разрабатывают несколько зондов, содержащих последовательности нуклеиновой кислоты (например, PNA), комплементарные нескольким целевым последовательностям ДНК. Для каждой целевой dsDNA разрабатывают по два зонда, содержащих последовательности нуклеиновой кислоты, комплементарные двум различным конкретным целевым участкам ДНК. Например, в случае целевой dsDNA №1 зонды комплементарны участкам F1' и R1' соответственно, в случае целевой dsDNA №2 зонды комплементарны участкам F2' и R2', в случае целевой dsDNA №3 зонды комплементарны участкам F3' и R3'. Первый зонд из пары имеет последовательность нуклеиновой кислоты (например, F1, F2, F3), комплементарную целевым последовательностям ДНК (например, F1', F2', F3') и конъюгированную с последовательностью нуклеиновой кислоты (например, C1, C2, C3), комплементарной захватывающему зонду (C1', C2', C3'). Второй зонд из каждой пары имеет последовательность нуклеиновой кислоты (например, R1, R2, R3), комплементарную целевым последовательностям ДНК (например, R1', R2', R3') и конъюгированную с последовательностью нуклеиновой кислоты R0, которая комплементарна зонду R0', конъюгированному с катализатором (фиг. 7A). Устройство, основанное на принципе растекания жидкости в радиальном направлении, содержит линию обнаружения для иммобилизации, выполненную из захватывающего зонда (C1', C2', C3') (т.е. PNA), комплементарного хвостовым нуклеотидам зонда (C1, C2 или C3), и расположенный в нижней части карман, содержащий смесь профлуорофора (прокрасителя) согласно настоящему изобретению, восстановитель (например, аскорбиновую кислоту) и зонд R0' для обнаружения, комплементарный хвостовой части R0, который конъюгирован с катализатором (фиг. 7B). Несколько пар зондов (F1-C1 и R1-R0, F2-C2 и R2-R0, F3-C3 и R3-R0) инкубируют в реакционной пробирке с целевыми ДНК (№1 и №2) в PBS. Зонды встраиваются в нити двухнитевой целевой ДНК с созданием гибридной структуры (фиг. 7A). Тест-полоску (фиг. 7B) погружают в реакционную пробирку, что приводит к иммобилизации комплексов со встроенными в нить ДНК на линии обнаружения и движению зонда R0' для обнаружения, прокрасителя и аскорбиновых кислот вверх по полоске за счет капиллярного эффекта (фиг. 7C). Комплексы ДНК захватываются на линии обнаружения, вследствие гибридизации нуклеиновых кислот C1'/C2' и C1/C2 (фиг. 7C), и катализатор обеспечивает превращение прокрасителя в соответствующий краситель, который осаждается на линии обнаружения (фиг. 7D). Изменение цвета на линии обнаружения свидетельствует о присутствии целевой ДНК в образце (фиг. 7D).
В способе согласно настоящему изобретению, применяемому для обнаружения нескольких целевых ДНК, могут применяться несколько типов считываемых показаний в отношении образования флуорофора. Например, они включают:
1) конфигурацию, представляющую собой штрихкод (фиг. 8A), где захватывающие зонды для соответствующих тестируемых ДНК иммобилизируют на тест-полоске в виде отдельных линий;
2) конфигурацию, представляющую собой код в виде макроматрицы (фиг. 8B), где захватывающие зонды для соответствующих тестируемых ДНК иммобилизируют на тест-полоске в виде отдельных круговых областей;
3) QR™-код (код быстрого реагирования, который является типом матричного штрихкода или двумерного штрихкода) (фиг. 8C), где захватывающие зонды для соответствующих тестируемых ДНК иммобилизируют на тест-полоске в виде матричного штрихкода. Формат QR™-кода представляет интерес, поскольку он позволяет зашифровывать результаты генетического тестирования в безопасном формате, который нельзя расшифровать без ключа и, таким образом, может повышать безопасность и конфиденциальность данных. Он также может предотвращать подделку результатов тестирования;
4) конфигурацию, представляющую собой нанесенные с помощью матричного аппликатора пятна (фиг. 8D), где анализируемые соединения помещают в виде капель (например, 1-144 капель) в зону проведения анализа (например, круговые области диаметром 5 мм, которые совместимы с ограничениями в отношении полосок, обеспечивающих растекание жидкости в радиальном направлении, и поддерживают оптическое разрешение, достаточное для обнаружения невооруженным глазом или с помощью камеры смартфона). Конфигурацию, представляющую собой нанесенные с помощью матричного аппликатора пятна, можно получить с помощью коммерчески доступных приборов, например Scienion.
Пример 7. Обнаружение целевой ДНК в реакции с использованием «матрицы» на основе нуклеиновой кислоты
Ниже приведен пример способа по настоящему изобретению, предусматривающий применение PNA с различными стереохимическими конфигурациями (L, D), что обеспечивает возможность быстрого протекания реакции с использованием матрицы на основе нуклеиновой кислоты, как показано на фиг. 9. Применяли следующие зонды.
Заякоривающий зонд 1, который содержит:
- 14-мерный олигомер γL-PNA, комплементарный целевой ДНК
(двухнитевой ДНК, dsDNA);
- PEG-линкер и
- 7-мерную γD-PNA, комплементарную 7-мерной γD-PNA, иммобилизированной на заякоривающем субстрате, полученный согласно примеру 2.
Каталитический зонд 2, который содержит:
- 14-мерный олигомер γL-PNA, отличный от 14-мерной γL-PNA зонда 1, но комплементарный целевой ДНК;
- PEG-линкер и
- 4-мерную γD-PNA (комплементарную 4-мерной γD-PNA зонда 3), конъюгированную с фоторедокс-катализатором, полученный согласно примеру 2. Конъюгат на основе профлуорофора по настоящему изобретению 3, который содержит
- 4-мерную γD-PNA, комплементарную 4-мерной γD-PNA зонда 2, конъюгированную с профлуорофором согласно настоящему изобретению формулы (I), полученный согласно примеру 2.
Заякоривающий субстрат (тест-полоска), содержащий 7-мерную γD-PNA, комплементарную 7-мерной γD-PNA зонда 1, полученного согласно примеру 2.
14-мерные последовательности γL-PNA зондов 1 и 2 разрабатывали так, чтобы они попарно связывались с уникальной последовательностью dsDNA. Одновременные изменения 14-мерных последовательностей γL-PNA зондов 1 и 2 позволяют различать различные dsDNA. Изменение 7-мерной γD-PNA в зонде 1 и комплементарной 7-мерной γD-PNA на заякоривающем субстрате обеспечивает различное позиционирование комплексов зонд-ДНК на заякоривающем субстрате. 4-мерную γD-PNA зонда 2 сохраняют неизменной, независимо от любого изменения других последовательностей, и она может взаимодействовать только с комплементарной 4-мерной γD-PNA зонда 3. Различные комбинации dsDNA и зондов на основе PNA можно инкубировать вместе, а затем разделять с помощью их специфического взаимодействия с нитью иммобилизированной PNA.
Сначала зонд 1, зонд 2 и целевую dsDNA растворяли в PBS с получением 200 нМ соответствующих растворов соединений. Растворы, содержащие зонды 1, 2 и dsDNA, смешивали с обеспечением гибридизации между целевой dsDNA и зондами на основе PNA 1 и 2 (фиг. 9A), что приводило к мечению целевой ДНК заякоривающим зондом 1 и каталитическим зондом 2 (фиг. 9B). После этого заякоривающий субстрат (фиг. 9C) добавляли к раствору, содержащему конъюгат зонд-ДНК, полученный выше, который захватывался поверхностью заякоривающего субстрата в местоположении (например, полоске), где иммобилизирована 7-мерная γD-PNA, комплементарная 7-мерной γD-PNA зонда 1 (фиг. 9D). Затем заякоривающий субстрат промывали с помощью PBS (500 нМ в PBS) для удаления несвязанных комплексов зонд-ДНК и приводили в контакт с конъюгатом профлуорофора 4 (фиг. 9E) в присутствии восстановителя (10 мМ раствор NaAsc в воде), что приводило к дополнительному конъюгированию конъюгата профлуорофора с целевой ДНК в непосредственной близости с фрагментом, представляющим собой катализатор, каталитического зонда 2 (фиг. 9F). Затем субстрат облучали светом (например, при приблизительно 455 нм с помощью LED-лампы) для стимулирования фотокаталитического восстановления профлуорофора, и обеспечения осаждения полученного флуорофора в месте осуществления реакции (фиг. 9G), и образования флуоресцентной полосы, где комплексы связаны с субстратом посредством заякоривающего зонда 1.
Пример 8. Набор для осуществления анализа согласно способу по настоящему изобретению для обнаружения целевых ДНК/РНК
Наборы для осуществления способа по настоящему изобретению для обнаружения целевой последовательности нуклеиновой кислоты проиллюстрированы ниже. Предусмотрены наборы, например, которые либо позволяют осуществлять анализ для обнаружения целевой последовательности нуклеиновой кислоты, при котором реакцию амплификации проводят перед осуществлением теста (пример 7), либо позволяют осуществлять анализ для обнаружения целевой нуклеиновой кислоты без предварительной реакции амплификации, и, таким образом, будут содержать материал, необходимый для подготовки образца (например, материал для получения лизата) и амплификации (зонды, устройство для тестирования). Например, предусмотрен набор, содержащий:
- в лиофилизированной форме: каталитический зонд (зонд, меченный фоторедокс-катализатором) и заякоривающий зонд (зонд, обеспечивающий возможность заякоривания целевой молекулы на заякоривающем субстрате), при этом оба зонда имеют специфическую аффинность в отношении различных участков целевой молекулы, необязательно со средствами для амплификации, такими как ДНК- полимеразы, необязательно с обратными транскриптазами (в случае, если целевая анализируемая молекула представляет собой РНК), необязательно со вспомогательными ферментами, такими как хеликазы, ферменты, обеспечивающие образование однонитевого разрыва, или белки, связывающие однонитевую ДНК, для стабилизации реакции удлинения ДНК;
- необязательно среду для регидратации;
- необязательно реакционный сосуд для проведения реакции амплификации, предпочтительно позволяющий поддерживать температуру среды для амплификации на уровне температуры, необходимом для осуществления амплификации;
- необязательно устройство для получения образцов, такое как устройство для дробления образцов, предназначенное для нарушения целостности образца и извлечения целевых молекул из указанного образца;
- восстановитель и профлуорофор согласно настоящему изобретению, например помещенные в карман, входящий в состав тест-полоски, которая также содержит заякоривающий субстрат, имеющий аффинность в отношении заякоривающего зонда.
Пример 9. Дополнительные примеры флуорофоров формулы (I')
Чтобы проверить поведение различных флуорофоров формулы (I') в качестве возможных QPD в контексте настоящего изобретения, синтезировали и тестировали следующие соединения.
Флуорофор (9) (формулы (I'), где R1-R8 представляют собой H)
Соединение (9) синтезировали начиная с 70 мг 2-аминобензамида (0,51 ммоль) (vib) и 55 мкл салицилальдегида (viib) (0,51 ммоль) с получением конечного продукта в виде твердого вещества от белого до желтого цвета, как показано ниже.
Выход: 65%.1H ЯМР (400 МГц, DMSO-d6) δ: 13,77 (s, 1H), 12,47 (s, 1H), 8,24 (dd, J=8,1, 1,6 Гц, 1H), 8,17 (dd, J=7,9, 1,5 Гц, 1H), 7,87 (ddd, J=8,5, 7,2, 1,6 Гц, 1H), 7,78 (dd, J=8,3, 1,1 Гц, 1H), 7,56 (ddd, J=8,2, 7,1, 1,2 Гц, 1H), 7,47 (ddd, J=8,6, 7,2, 1,6 Гц, 1H), 7,02 (dd, J=8,3, 1,2 Гц, 1H), 6,98 (ddd, J=8,2, 7,2, 1,2 Гц, 1H).
13C ЯМР (101 МГц, DMSO) δ: 161,84, 160,47, 154,17, 146,62, 135,51, 134,18, 128,18, 127,45, 126,54, 126,50, 121,22, 119,30, 118,34, 114,25.
Флуорофор (10) (формулы (I'), где R1, R3-R5, R7-R8 представляют собой H, R2 представляет собой Cl, и R6 представляет собой -CH2-C(O)-OMe)
Метил-2-(4-гидроксифенил)ацетат (3,31 г, 20 ммоль), параформальдегид (3,3 г, вес 1:1) и хлорид магния (1,85 г, 20 ммоль) суспендировали в 75 мл сухого ацетонитрила. Добавляли триэтиламин (7 мл, 50 ммоль), и реакционную смесь нагревали с обратным холодильником в течение 3 часов. После завершения ацетонитрил частично выпаривали, остаток поглощали диэтиловым эфиром и экстрагировали с помощью 1 M HCl, как показано ниже.

Органический слой высушивали над безводным сульфатом натрия, и растворитель выпаривали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии с получением 2,3 г указанного в заголовке соединения в виде розоватого масла. Выход: 60%.1H ЯМР (400 МГц, хлороформ-d) δ: 10,96 (s, 1H), 9,89 (s, 1H), 7,50 (d, J=2,3 Гц, 1H), 7,46 (dd, J=8,5, 2,3 Гц, 1H), 6,98 (d, J=8,5 Гц, 1H), 3,73 (s, 3H), 3,63 (s, 2H).13C ЯМР (101 МГц, CDCl3) δ 196,38, 171,70, 160,75, 138,03, 134,09, 125,48, 120,47, 117,93, 52,19, 39,79. Затем соединение (9) синтезировали в открытой колбе, в которой в 60 мл метанола растворяли метил-2-(3-формил-4-гидроксифенил)ацетат, полученный как описано выше (616 мг, 3,17 ммоль), 2-амино-5-хлорбензамид (650 мг, 3,8 ммоль) и TsOH⋅H2O (300 мг, 1,58 ммоль), и которую нагревали с обратным холодильником в течение 6 часов, как показано ниже.

По мере протекания реакции осаждалось соединение (9), и желтый осадок выделяли путем центрифугирования и промывали три раза холодным метанолом. Желтое твердое вещество, 490 мг. Выход: 44%.1H ЯМР (400 МГц, DMSO-d6) δ: 13,12 (s, 1H), 12,50 (s, 1H), 8,12 (d, J=2,1 Гц, 1H), 8,09 (d, J=2,4 Гц, 1H), 7,89 (dd, J=8,7, 2,5 Гц, 1H), 7,83 (d, J=8,7 Гц, 1H), 7,37 (dd, J=8,4, 2,1 Гц, 1H), 6,99 (d, J=8,4 Гц, 1H), 3,66 (s, 2H), 3,64 (s, 3H).13C ЯМР (101 МГц, DMSO-d6) δ: 172,15, 160,84, 158,82, 154,14, 145,87, 135,43, 135,34, 131,52, 129,36, 129,04, 125,42, 122,52, 118,23, 114,44, 52,21.
Флуорофор (11) (формулы (I'), где R1, R3-R5, R7-R8 представляют собой H, R2 представляет собой Cl, и R6 представляет собой -CH2-C(O)-OH)
Соединение (11) синтезировали начиная с метил-2-(3-(6-хлор-4-оксо-3,4- дигидрохиназолин-2-ил)-4-гидроксифенил)ацетата (соединения (10), полученного, как описано выше) (70 мг, 4,9 ммоль), который суспендировали в смеси 1:1 диоксана и 10% раствора NaOH в воде (всего 10 мл) и нагревали до 80°C при перемешивании. Нагревание продолжали в течение 6 часов до полного израсходования исходного соединения. Объем растворителя уменьшали путем выпаривания, и остаток очищали с помощью обращенно-фазовой хроматографии с получением желтого раствора. Значение pH раствора доводили до 5 с помощью HCl, и остаток фильтровали и промывали холодной водой, затем холодным ацетоном, как показано ниже.

Белое твердое вещество. Выход: 62%.1H ЯМР (500 МГц, DMSO-d6) δ: 8,17 (d, J=2,4 Гц, 1H), 7,92 (d, J=2,4 Гц, 1H), 7,53 (d, J=2,4 Гц, 1H), 7,52 (d, J=2,4 Гц, 1H), 7,50 (d, J=8,7 Гц, 1H), 7,09 (dd, J=8,3, 2,4 Гц, 1H), 6,59 (d, J=8,3 Гц, 1H), 3,17 (s, 2H).13C ЯМР (126 МГц, DMSO-d6) δ: 189,31, 176,30, 163,44, 161,07, 149,80, 134,18, 132,89, 131,95, 129,28, 128,00, 126,68, 125,25, 123,06, 119,14, 116,99, 45,92.
Была подтверждена способность флуорофоров осаждаться в растворе подобным образом, как и соединение (8). Следовательно, флуорофоры формулы (I') можно применять в качестве QPD в контексте настоящего изобретения.
Пример 10. Обнаружение целевой бактериальной ДНК с помощью способа по настоящему изобретению
Способ по настоящему изобретению можно применять для обнаружения присутствия целевого фрагмента бактериальной ДНК в некоторых материалах для применения человеком или в ветеринарии, таких как продукты питания (например, которые могут присутствовать, например, в мясе или сыре), пригодные для питья составы, фармацевтические или косметические препараты, где тестируемый образец подвергают изотермической амплификации ДНК (LAMP), как описано в примере 6 и на фигуре 5.
Реакционный буфер (например, 50-100 микролитров) для проведения реакции амплификации содержит:
30 мМ NH4B5O8 (пентабората аммония, Sigma),
40 мМ яблочной кислоты (Sigma),
8 мМ Mg2SO4 (Sigma),
0,8 мМ dNTP (Promega),
0,8 M бетаина (5 M раствор для ПЦР, Sigma),
5% трегалозы (Sigma),
0,4 Ед/микролитр полимеразы с активностью в отношении замещения нити (т.е. Bst или GspSSD),
0,0004 Ед/микролитр пирофосфатазы ApePPiase,
0,1% Triton X-100,
1,5 микроМ индивидуально изготовленных праймеров,
pH 8,5 при 25°C.
Обнаружение целевой ДНК проводят с помощью химических реакций с использованием матрицы на основе нуклеиновой кислоты, как описано в данном документе.
Перечень последовательностей
Последовательность нуклеиновой кислоты зонда, специфического в отношении ДНК свиньи SEQ ID NO: 1: CTTGGGATGAAC
Последовательность нуклеиновой кислоты зонда, специфического в отношении ДНК свиньи
SEQ ID NO: 2:
CTACTAGTTTAGAT
Последовательность нуклеиновой кислоты фрагмента ДНК свиньи
SEQ ID NO: 3:
CAGCCCGGAACCCTACTTGGCGATGATCAAATCTATAATG
Последовательность нуклеиновой кислоты зонда, специфического в отношении ДНК свиньи
SEQ ID NO: 4:
CGCGACTTGATCCAG
Участок ДНК свиньи
SEQ ID NO: 5:
GCGCTGAACTAGGTCAGCCCGGAACCCTACTTGGCGATGATCAAATCTATA ATGTAATTGTTACAGCTCATGCC
Участок ДНК коровы
SEQ ID NO: 6:
GCCTGAATTAGGCCAACCCGGAACTCTGCTCGGAGACGACCAAATCTACAACGCAGTTGTAACCGCACACGCA
Участок ДНК лошади
SEQ ID NO: 7:
GTGCTGAATTAGGCCAACCTGGGACCCTACTAGGAGATGATCAGATCTACAATGTCATTGTAACCGCCCATGCA
Участок ДНК цесарки
SEQ ID NO: 8:
GCGCAGAACTAGGACAACCAGGGACCCTTTTAGGGGACGACCAAATTTATAATGTAATCGTCACAGCCCATGCC
Участок ДНК индейки
SEQ ID NO: 9:
GGTGCAGAACTGGGACAACCTGGGACACTCCTAGGAGACGACCAAATCTATAACGTAATCGTCACAGCCCATGC
Участок ДНК курицы
SEQ ID NO: 10:
GCGCAGAACTAGGACAGCCCGGAACTCTCTTAGGAGACGATCAAATTTACAATGTAATCGTCACAGCCCATGCT
Участок ДНК осла
SEQ ID NO: 11:
GTGCTGAATTAGGTCAACCTGGGACCCTGCTGGGAGATGATCAGATCTACAATGTTATTGTAACTGCCCATGCA
Участок ДНК обезьяны
SEQ ID NO: 12:
GAGCTGAACTAGGCCAACCCGGTAGTTTACTAGGTAGTGACCATATCTATAATGTCATTGTGACAGCCCATGCA
Участок ДНК человека
SEQ ID NO: 13:
GAGCCGAGCTGGGCCAGCCAGGCAACCTTCTAGGTAACGACCACATCTACAACGTTATCGTCACAGCCCATGCA
Участок ДНК крысы
SEQ ID NO: 14:
GAGCTGAACTAGGACAGCCAGGCGCACTCCTAGGAGATGACCAAATCTATAATGTCATCGTCACAGCCCATGCA
Участок ДНК мыши
SEQ ID NO: 15:
GAGCAGAATTAGGTCAACCAGGTGCACTTTTAGGAGATGACCAAATTTACAATGTTATCGTAACTGCCCATGCT
Участок ДНК одногорбого верблюда
SEQ ID NO: 16:
GTGCTGAATTGGGGCAGCCTGGGACATTGCTTGGAGATGACCAAATCTATAATGTAGTTGTAACGGCTCATGCT
Участок ДНК верблюда
SEQ ID NO: 17:
GCGCTGAATTGGGACAGCCCGGGACGTTGCTTGGAGACGACCAAATCTATAACGTAGTTGTAACAGCTCATGCT
Участок ДНК ягненка
SEQ ID NO: 18:
GCGCCGAACTAGGCCAACCCGGAACTCTACTCGGAGATGACCAAATCTACAACGTAATTGTAACCGCACATGCA
Участок ДНК козы SEQ ID NO: 19:
GCGCCGAACTAGGTCAACCCGGAACCCTACTTGGAGATGACCAGATCTACAATGTAATTGTAACTGCACACGC
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> УНИВЭРСИТЭ ДЭ ЖЕНЕВ
<120> НОВЫЕ СОЕДИНЕНИЯ И ПУТИ ИХ ПРИМЕНЕНИЯ ДЛЯ ОБНАРУЖЕНИЯ ЦЕЛЕВЫХ МОЛЕКУЛ
В ОБРАЗЦЕ
<130> P2050PC00
<150> EP16193785.9
<151> 2016-10-13
<160> 19
<170> PatentIn версии 3.5
<210> 1
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты 1 зонда, специфического в
отношении ДНК свиньи
<400> 1
cttgggatga ac 12
<210> 2
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты 2 зонда, специфического в
отношении ДНК свиньи
<400> 2
ctactagttt agat 14
<210> 3
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты фрагмента ДНК свиньи
<400> 3
cagcccggaa ccctacttgg cgatgatcaa atctataatg 40
<210> 4
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты 4 зонда, специфического в
отношении ДНК свиньи
<400> 4
cgcgacttga tccag 15
<210> 5
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК свиньи
<400> 5
gcgctgaact aggtcagccc ggaaccctac ttggcgatga tcaaatctat aatgtaattg 60
ttacagctca tgcc 74
<210> 6
<211> 73
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК коровы
<400> 6
gcctgaatta ggccaacccg gaactctgct cggagacgac caaatctaca acgcagttgt 60
aaccgcacac gca 73
<210> 7
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК лошади
<400> 7
gtgctgaatt aggccaacct gggaccctac taggagatga tcagatctac aatgtcattg 60
taaccgccca tgca 74
<210> 8
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК цесарки
<400> 8
gcgcagaact aggacaacca gggacccttt taggggacga ccaaatttat aatgtaatcg 60
tcacagccca tgcc 74
<210> 9
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК индейки
<400> 9
ggtgcagaac tgggacaacc tgggacactc ctaggagacg accaaatcta taacgtaatc 60
gtcacagccc atgc 74
<210> 10
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК курицы
<400> 10
gcgcagaact aggacagccc ggaactctct taggagacga tcaaatttac aatgtaatcg 60
tcacagccca tgct 74
<210> 11
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК осла
<400> 11
gtgctgaatt aggtcaacct gggaccctgc tgggagatga tcagatctac aatgttattg 60
taactgccca tgca 74
<210> 12
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК обезьяны
<400> 12
gagctgaact aggccaaccc ggtagtttac taggtagtga ccatatctat aatgtcattg 60
tgacagccca tgca 74
<210> 13
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК человека
<400> 13
gagccgagct gggccagcca ggcaaccttc taggtaacga ccacatctac aacgttatcg 60
tcacagccca tgca 74
<210> 14
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК крысы
<400> 14
gagctgaact aggacagcca ggcgcactcc taggagatga ccaaatctat aatgtcatcg 60
tcacagccca tgca 74
<210> 15
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК мыши
<400> 15
gagcagaatt aggtcaacca ggtgcacttt taggagatga ccaaatttac aatgttatcg 60
taactgccca tgct 74
<210> 16
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК одногорбого верблюда
<400> 16
gtgctgaatt ggggcagcct gggacattgc ttggagatga ccaaatctat aatgtagttg 60
taacggctca tgct 74
<210> 17
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК верблюда
<400> 17
gcgctgaatt gggacagccc gggacgttgc ttggagacga ccaaatctat aacgtagttg 60
taacagctca tgct 74
<210> 18
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК ягненка
<400> 18
gcgccgaact aggccaaccc ggaactctac tcggagatga ccaaatctac aacgtaattg 60
taaccgcaca tgca 74
<210> 19
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок ДНК козы
<400> 19
gcgccgaact aggtcaaccc ggaaccctac ttggagatga ccagatctac aatgtaattg 60
taactgcaca cgca 74
<---
Реферат
Изобретение относится к профлуорофору формулы (I), где R1 представляет собой Н; R2-R8, R11-R12 и R14 независимо выбраны из водорода, гидроксила, галогена, циано, нитро, необязательно замещенного С1-С10алкила, необязательно замещенного амино-С1-С10алкила, необязательно замещенного С1-С10алкокси, R13 выбран из необязательно замещенного С1-С10алкила, такого как необязательно замещенный этил, необязательно замещенный пропил или необязательно замещенный бутил; R15 представляет собой Н; Z представляет собой -CR16R17, где R16 и R17 независимо выбраны из водорода и необязательно замещенного С1-С6алкила, или его любые таутомер, стереоизомер, соли, где термин «замещенный» относится к группам, замещенным 1-5 заместителями, выбранными из группы, состоящей из «С1-С6алкила», «амино», «аминосульфонила», «аминокарбонила», «сульфонила», «алкокси», «алкоксикарбонила», «галогена», тригалогенметила, циано, гидрокси, меркапто и нитро. Изобретение также относится к конъюгатам на основе профлуорофора формулы (I) и их применению для обнаружения целевой молекулы в образце, в частности целевых молекул нуклеиновой кислоты. Изобретение также относится к новым флуорофорам формулы (I)' и способу их получения. Технический результат – получены новые профлуорофоры, обеспечивающие высокоэффективное обнаружение и являющиеся подходящими для переносных и одноразовых систем обнаружения, которые могут найти свое применение в области диагностики и контроля качества. 6 н. и 19 з.п. ф-лы, 9 ил., 10 пр.


Формула














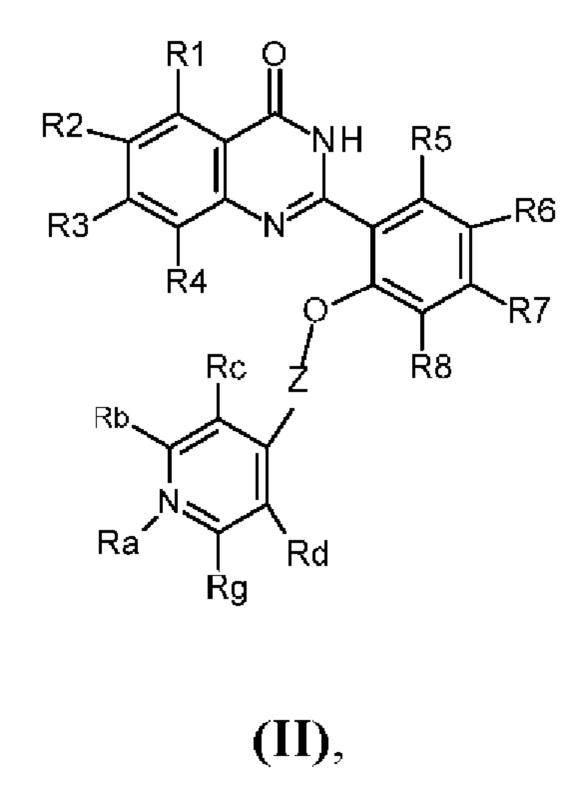






Документы, цитированные в отчёте о поиске
Способы получения производных хиназолинона

Комментарии