Новые карбоксизамещенные циклические производные карбоксамида - RU2199535C2
Код документа: RU2199535C2
Чертежи

Описание
Настоящее изобретение касается новых карбоксизамещенных циклических производных карбоксамида (здесь указаны как соединения или соединения формулы (1)) и их стереоизомеры и фармацевтически пригодные соли, а также их применения в качестве антагонистов рецепторов тахикинина. Такие антагонисты полезны при лечении тахикинин-опосредованных заболеваний и раскрытых здесь симптомов, включая астму, кашель и бронхит.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение касается новых карбоксизамещенных циклических производных
карбоксамида формулы (1):
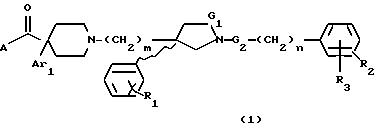
где G1 представляет CH2 или С(О);
G2 представляет CH2 или С(О);
m равно 2 или 3;
n равно 0 или 1;
R1 представляет от 1 до 3 заместителей, каждый из которых независимо выбирают из группы, состоящей из водорода, галогена, CF3, C1-C6 алкила и C1-C6 алкокси;
R2 представляет от 1 до 3 заместителей, каждый из которых независимо выбирают из группы, состоящей из водорода, галогена, циано, СF3, C1-C6 алкила и C1-C6 алкокси;
R3 представляет водород или радикал, выбранный из группы, состоящей из
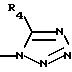
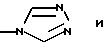
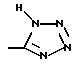
где R4 выбирают из группы, состоящей из водорода, C1-C4 алкила и -СF3;
Ar1 представляет радикал, выбранный из группы, состоящей из
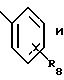
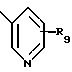
где R8 представляет от 1 до 3 заместителей, каждый из которых независимо выбирают из группы, состоящей из водорода, галогена, СF3, C1-C6 алкила и C1 -C6 алкокси;
R9 представляет от 1 до 2 заместителей, каждый из которых независимо выбирают из группы, состоящей из водорода, галогена, СF3, C1 -C6 алкила и C1-C6 алкокси;
А представляет радикал, выбранный из группы, состоящей из
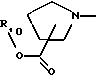
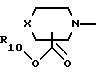
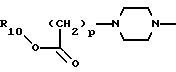
где р равно 1, 2, 3 или 4;
X представляет -О-, -S(О)k- или -CH2-,
в которых k равно 0, 1 или 2;
R10 представляет водород, C1-C6 алкил или радикал, выбранный из группы, состоящей из
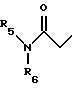
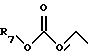
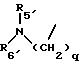
где q равно 2 или 3;
R5 представляет C1-C4 алкил или -(CH2)2OH;
R6 представляет C1-C4 алкил, -(CH2)2OH или -(СН2)2N (СН3)2;
R5' представляет C1-4-алкил; R6' представляет C1 -4-алкил;
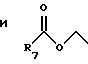
R7 представляет C1-C6 алкил;
при условии, что когда G1 является -С(О)-, то G2 является -СН2-; и когда G2 является -С(О)-, то G1 является -CH2-; и их стереоизомеров и фармацевтически приемлемых солей.
Специалисту ясно, что соединения формулы (1) существуют в виде стереоизомеров. Считают, что любое упоминание в данной заявке одного из соединения формулы (1) подразумевает либо специфические стереоизомеры, либо смесь стереоизомеров. Указано, что соединения снабжены обозначениями (+) и (-) - или обозначениями по Кану-Инг олоду-Прелогу (R)- и (S) - для стереохимии соединений, представленных формулой (1) и их промежуточных соединений. Специально отмечено, что новые карбоксизамещенные циклические производные карбоксамида настоящего изобретения являются асимметричными по 3-положению 3,3-дизамещенного пирролидина и могут существовать в (R)- или (S)-конфигурации или могут представлять собой их смесь. Также специально отмечено, что новые замещенные циклические производные карбоксамида настоящего изобретения могут быть асимметричны по месту присоединения карбоксильного заместителя к циклическому карбоксамиду и что при асимметричности по месту присоединения карбоксильный заместитель может быть в (R)- или (S)-конфигурации или представлять собой их смесь.
Специфические стереоизомеры можно получить путем стереоспецифического синтеза, используя энантиомерно чистые или энантиомерно обогащенные исходные материалы. Специфические стереоизомеры исходных материалов или продуктов можно разделить и выделить известными специалистам способами, такими как хроматография на хирально стационарных фазах, ферментативное растворение или фракционная перекристаллизация солей присоединения, образованных используемыми для этой цели реагентами. Полезные способы разделения и выделения специфических стереоизомеров известны в практике и описаны в Stereochemistry of Organic Compounds, E.L. Eliel и S.H.Wilen, Wiley (1994) и Enantiomers, Racemates and Resolutions, J.Jacques, A. Collet и S.H.Wilen, Wiley (1981).
Как уже ясно специалистам, некоторые соединения формулы (1) могут существовать в виде таутомеров. Считают, что любые упоминания в этой заявке одного из таутомерных соединений формулы (1) подразумевает каждую таутомерную форму и их смеси.
В данной заявке использованы следующие обозначения:
а) термин "галоген" относится к атому фтора,
атому хлора, атому брома или атому иода;
б) термин "C1-С6 алкил" относится к разветвленному или линейному алкильному радикалу, содержащему от 1 до 6 атомов углерода,
такому как метил, этил, н-пропил, изопропил,
н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и др.;
в) термин "C1-C4 алкил" относится к разветвленному или
линейному алкильному радикалу, содержащему от 1
до 4 атомов углерода, такому как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и др.;
г) термин "C1
-C4 алкокси" относится к линейной или
разветвленной алкоксигруппе, содержащей от 1 до 6 атомов углерода, такой как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси,
втор-бутокси, трет-бутокси, пентокси, гексокси и др.;
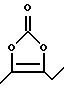
д) обозначение "-С(О)-" или "С(О)" относится к карбонильной группе формулы:
е) обозначение
ж) обозначение
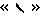
з) обозначение
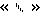
и) использованные в получениях и примерах термины имеют указанные значения: "нг" обозначает нанограммы: "мкг" обозначает микрограммы; "мг" обозначает миллиграммы; "г" обозначает граммы; "кг" обозначает килограммы; "нмоль" обозначает наномоли; "ммоль" обозначает миллимоли; "моль" обозначает моли; "мкл" обозначает микролитры; "мл" обозначает миллилитры; "л" обозначает литры; "Rf " обозначает фактор удерживания; "oС" обозначает градусы Цельсия; "т.к." обозначает температуру кипения; "мм рт.ст." обозначает давление в мм ртутного столба; "т.пл." обозначает температуру плавления; "разл." обозначает разложение; [α] обозначает специфическое вращение D линии натрия при 20oС, полученное в 1 дециметровой кювете; "к" обозначает концентрацию в г/мл; "нМ" обозначает наномолярный; "мкМ" обозначает микромолярный; "мМ" обозначает миллимолярный; "М" обозначает молярный; "кг/см2" обозначает кг на квадратный см; "HPLC" обозначает высокоэффективную жидкостную хроматографию; "HRMS" обозначает масс-спектрометрию высокого разрешения; "ТГФ" обозначает тетрагидрофуран; "рассол" обозначает насыщенный водный раствор хлорида натрия; "П. С. " обозначает потери при сушке; "АИБН" обозначает 2,2' - азобисизобутиронитрил; "μкюри" обозначает микрокюри; "в.б." обозначает внутрибрюшинный; "в.в." обозначает внутривенный; и "распадов/мин" обозначает количество распадов в минуту;
к) под обозначением
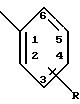
понимают, что радикал присоединен по 1-положению, и заместитель или заместители, представленные как R, могут быть присоединены по любому из 2, 3, 4, 5 или 6 положений;
л) обозначение
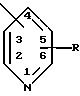
относится к пиридилу или замещенному пиридилу, и понимают, что радикал может быть присоединен по 2-положению, 3-положению или 4-положению, кроме того, понимают, что когда радикал присоединен по 2-положению, заместитель или заместители, представленные как R, могут быть присоединены по любому из 3, 4, 5 или 6 положений, или когда радикал присоединен по 3-положению, заместитель или заместители, представленные как R, могут быть присоединены по любому из 2, 4, 5 или 6 положений, и когда радикал присоединен по 4-положению, заместитель или заместители, представленные как R, могут быть присоединены по любому из 2, 3, 5 или 6 положений;
м) термин "энантиомерный избыток" или "эи" обозначает процент, соответствующий избытку одного энантиомера (Е1) в смеси двух энантиомеров (Е1 плюс Е2), рассчитанный как
{(Е1 - Е2): (Е1 + Е2)} х 100% = эи;
н) термин "их фармацевтически приемлемые соли" обозначает либо соли присоединения кислот, либо основные соли присоединения.
Выражение "фармацевтически приемлемые соли присоединения кислот" предназначено для обозначения любой нетоксической органической или неорганической соли присоединения кислоты основными соединениями, представленными формулой (1). Иллюстративные неорганические кислоты, которые образуют подходящие соли, включают соляную, бромистоводородную, серную и фосфорную кислоты, и кислые соли металлов, такие как моногидрофосфат натрия и гидросульфат калия. Иллюстративные органические кислоты, которые образуют подходящие соли, включают моно-, ди- и трикарбоновые кислоты. Примерами таких кислот являются, например, уксусная, гликолевая, молочная, пировиноградная, малоновая, янтарная, глутаровая, фумаровая, яблочная, винная, лимонная, аскорбиновая, малеиновая, оксималеиновая, бензойная, оксибензойная, фенилуксусная, коричная, салициловая, 2-феноксибензойная, пара-толуолсульфоновая кислота, и сульфоновые кислоты, такие как бензолсульфоновая, метансульфоновая, этансульфоновая и 2-гидроксиэтансульфоновая кислота. Такие соли могут существовать в виде гидратов или по существу безводных форм. В основном, соли присоединения кислот таких соединений растворимы в воде и различных гидрофильных органических растворителях и по сравнению с соответствующими свободными основаниями обычно имеют более высокие температуры плавления.
Выражение "фармацевтически приемлемые основные соли присоединения" предназначено для обозначения любых нетоксических органических или неорганических основных солей присоединения соединений, представленных формулой (1). Иллюстративные основания, которые образуют подходящие соли, включают гидроксиды щелочных или щелочноземельных металлов, такие как гидроксиды натрия, калия, кальция, магния или бария; аммиак и алифатические, алициклические или ароматические органические амины, такие как метиламин, диметиламин, триметиламин и пиколин. Эти соединения могут образовывать моно- или диосновные соли.
Что касается групп особо полезных структурно родственных соединений, то для конечного применения соединения формулы (1) предпочтительны определенные группы и конфигурации.
Ниже приведены предпочтительные варианты соединений формулы (1):
1) предпочтительны соединения, в которых m равно 2;
2) предпочтительны соединения, в
которых n равно 0;
3) предпочтительны соединения, в которых G1 представляет
-CH2-, и G2 представляет -С(О)-;
4) предпочтительны соединения, в
которых m равно 2, п равно 0, G1 представляет -СН2-, и G2 представляет
-С(О)-;
5) предпочтительны соединения, в которых R1 представляет 3,
4-дихлор-группу;
6) предпочтительны соединения, в которых R3 представляет водород, и R2 представляет 3,4,5-триметокси-группу;
7) для соединения, в котором
R3 не является водородом, предпочтительны соединения, в которых R3 представляет радикал,
выбранный из группы
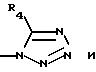
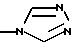
где R4 такой, как определено выше;
8) для соединения, в котором R3 не является водородом, более предпочтительны соединения, в которых R3 представляет радикал
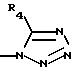
где R4 такой, как определено выше;
9) для соединения, в котором R3 не является водородом, более предпочтительны соединения, в которых R2 представляет 2-метокси, и R3 находится в 5-положении и представляет радикал
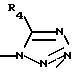
где R4 такой, как определено выше;
10) предпочтительны соединения, в которых А представляет радикал, выбранный из группы
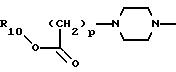
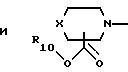
где R10, р и Х такие, как определено выше;
11) более предпочтительны соединения, в которых А представляет радикал
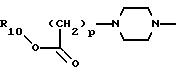
где R10 и р такие, как определено выше;
12) еще более предпочтительны соединения, в которых А представляет радикал
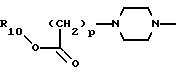
где р равно 1, и R10 представляет водород или C1-C6 алкил;
13) наиболее предпочтительны соединения, в которых А представляет радикал
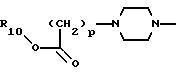
где р равно 1, и R10 представляет водород или этил.
Понятно, что при требовании одного (или более) из предпочтительных вариантов с 1 по 13 формулы (1) или, рассматривая приведенные здесь примеры, можно еще выбрать предпочтительные варианты формулы (1).
Далее приведены примеры соединений, включенных в данное изобретение. Понятно, что примеры охватывают (R)-изомеры и (S)-изомеры соединения по 3-положению 3,3-дизамещенного пирролидина и, где возможно, по месту присоединения карбоксильного заместителя к циклическому карбоксамиду, и их смеси. Считают, что этот список приведен только в качестве примера и никоим образом не ограничивает область данного изобретения.
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3-хлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дифторфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3-фторфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(4-фторфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(4-трифторметилфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-диметилфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-диметоксифенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3-метоксифенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)-пирролидин;
1-(4-хлорбензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3-(2-пропилокси)бензоил-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3-1Н-тетразол-1-ил)бензоил-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(5-трифторметил-1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо) пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(5-метил-1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,
5-бис-(трифторметил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-бензоил-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)-пирролидин;
1-бензоил-3-(3-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)пропил)-3-(3,4-дихлорфенил)-пирролидин;
1-(3,
5-бис(трифторметил)бензил-3-(3-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)пропил)-3-(3,4-дихлорфенил)-5-оксопирролидин;
1-бензоил-3-(2-(4-пирид-4-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил) пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-пирид-4-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-пирид-4-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-4-ил) бензоил)-3-(2-(4-(пирид-4-ил)-4-((4-карбоэтоксиметилпиперидин-1-ил)карбоксамидо) пиперидин-1-ил) этил-3-(3,4-дихлорфенил) пирролидин;
1-бензоил-3-(2-(4-пирид-4-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензил)-3-(2-(4-пирид-4-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-пирид-4-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дифхлорфенил)пирролидин;
1-бензоил-3-(2-(4-пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил) карбоксамидо) пиперидин-1-ил)этил)-3-(3,4-дихлорфенил) пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-4-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-(пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-2-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-(пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-(пирид-2-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо) пиперидин-1-ил)этил)-3-(3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-2-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3-хлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дифторфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3-фторфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(4-фторфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(4-трифторметилфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-диметилфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-диметоксифенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3-метоксифенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(4-хлорбензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3-(2-пропилокси)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(5-трифторметил-1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо) пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(5-(метил-1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,
5-бис-(трифторметил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил) карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-бензоил-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(3-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)пропил)-3-(3,4-дихлорфенил) пирролидин;
1-(3,
5-бис(трифторметил)бензил)-3-(3-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)пропил)-3-(3,4-дихлорфенил)-5-оксопирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-4-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-пирид-4-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-(пирид-4-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-фенилпирролидин;
1-(3,4,
5-триметоксибензил)-3-(2-(4-(пирид-4-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-(пирид-3-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил) пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил) этил) 3-(3,4-дихлорфенил) пирролидин;
1-бензоил-3-(2-(4-(пирид-3-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-2-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-(пирид-2-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(lH-тетразол)-1-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-(пирид-2-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-2-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(4-фторфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-5-ил)
бензоил)-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил) карбоксамидо)
пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,5-триметоксибензоил)-3-(2-(4-(пирид-4-ил)-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-4-ил)-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-2-ил)-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(4-фторфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1H-тетразол-1-ил)бензоил-3-(2-(4-фенил-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(2-(4-фенил-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((3-карбоксипиперидин-1-ил)карбоксамидо) пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-пирид-4-ил)-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил(этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1H-тетразол-5-ил)бензоил)-3-(2-(4-пирид-4-ил)-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-3-ил)-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-2-ил)-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1H-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(4-фторфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил) пирролидин;
1-бензоил-3-(2-(4-фенил-4-((2-карбоксипиперидин-1-ил)карбоксамидо) пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-1-ил)бензоил)-3-(2-(4-фенил-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(2-(4-фенил-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((2-карбоксипиперидин-1-ил) карбоксамидо)пиперидин-1-ил) этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-пирид-4-ил)-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-пирид-3-ил)-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-2-ил)-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(4-фторфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((3-карбоксипирролидин-1-ил)
карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((3-карбоксипирролидин-1-ил)карбоксамидо) пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-4-ил)-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-3-ил)-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-2-ил)-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((3-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-(4-фторфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((4-карбоксипирролидин-1-ил)
карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-дихлорфенил) пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(2-(4-фенил-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((2-карбоксипирролидин-1-ил) карбоксамидо) пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-4-ил)-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-3-ил)-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-4-ил)-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоксиморфолин-4-ил) карбоксамидо) пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил-3-(4-фторфенил) пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((4-карбоксиморфолин-4-ил)карбоксамидо) пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(2-(4-фенил-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-4-ил)-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1H-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-4-ил)-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-2-ил)-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((3-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил-3-(4-фторфенил) пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил) пирролидин;
1-бензоил-3-(2-(4-фенил-4-((2-карбоксиморфолин-4-ил)
карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(2-(4-фенил-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-бензоил-3-(2-(4-фенил-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил) этил)-3-фенилпирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-4-ил)-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-(пирид-4-ил)-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-3-ил)-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1H-триазол-1-ил)бензоил)-3-(2-(4-(пирид-3-ил)-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-2-ил)-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин;
1-(2-метокси-5-(1H-тетразол-3-ил)бензоил)-3-(2-(4-(пирид-2-ил)-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин.
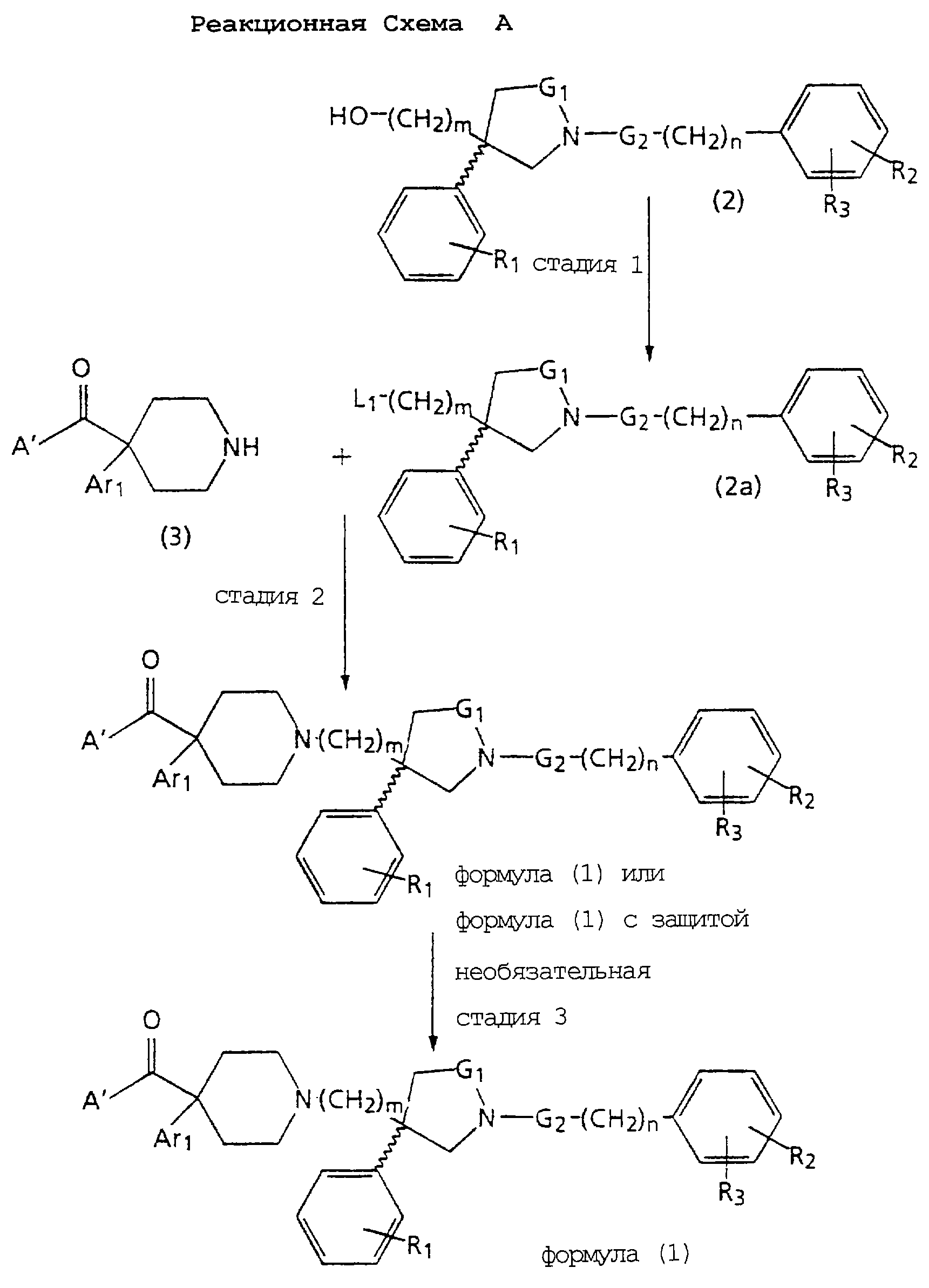
На Реакционной Схеме А показана основная синтетическая процедура для получения таких соединений формулы (1). Реагенты и исходные материалы легко доступны для специалистов. Все вещества в Реакционной Схеме А предварительно идентифицированы, если не указано иначе.
На стадии 1 Реакционной Схемы А гидроксильную группу подходящего 3-(ω-гидроксиалкил)пирролидина формулы 2 превращают в подходящую удаляемую группу L1. Подходящий 3-(ω-гидроксиалкил)пирролидина формулы 2 является веществом, в котором m, n, G1, G2, R1, R2 и R3 такие, как требуется для конечного продукта формулы (1). Подходящий 3-(ω-гидроксиалкил)пирролидина формулы 2 также может иметь стереохимию, как требуется для конечного продукта формулы (1). Подходящие соединения формулы 2 можно получить так, как описано здесь и в Патентах США 5 340 822 и 5 635 510 и в PCT WO 94/26735 и WO 96/06094. Подходящая удаляемая группа L1 является группой, которую можно удалить пиридином формулы 3, получив соединение формулы (1) или защищенное соединение формулы (1). Подходящие удаляемые группы L1 включают (но не ограничены этим) хлор, бром, йод, мезилат, тозилат и подобные, при этом предпочтителен мезилат. Превращение гидроксильных групп в удаляемые группы, такие как хлор, бром, йод, мезилат и тозилат, хорошо известно и высоко оценено на практике.
Например, соединения, в которых L1 представляет бром, образуются при взаимодействии подходящего 3-(ω-гидроксиалкил)пирролидина формулы 2 с 1,0-1,5 молярными эквивалентами четырехбромистого углерода и 1,0-1,75 молярными эквивалентами трифенилфосфина (P.J.Kocienski и др. J.Org.Chem. 42, 353-355 (1977)). Реакцию проводят, объединяя 3-(ω-гидроксиалкил)пирролидин формулы 2 с четырехбромистым углеродом в подходящем растворителе, таком как дихлорметан или хлороформ, и добавляя затем раствор трифенилфосфина в подходящем растворителе, таком как дихлорметан или хлороформ. Обычно проводят реакцию при температуре от -10oС до комнатной. Реакция обычно занимает от 5 минут до 24 часов. Продукт можно выделить и очистить известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
Соединения, в которых L1 представляет бром, образуются также при взаимодействии подходящего 3-(ω-гидроксиалкил)пирролидина формулы 2 с небольшим молярным избытком дибромида трифенилфосфина (R.F.Borch и др. J.Org.Chem. 99, 1612-1619 (1977)). Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир. Реакцию осуществляют в присутствии подходящего основания, такого как пиридин. Обычно проводят реакцию при температуре от 0 до 50oС. Реакция обычно занимает от 5 минут до 24 часов. Продукт можно выделить и очистить известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
Иначе образуются, например, соединения, в которых L1 представляет мезилат, путем взаимодействия подходящего 3-(ω -гидроксиалкил)пирролидина формулы 2 с 1-2 молярными эквивалентами метансульфонилхлорида. Реакцию проводят в подходящем растворителе, таком как дихлорметан, хлороформ, толуол, бензол или пиридин. Реакцию проводят в присутствии подходящего основания, такого как триэтиламин, N, N-диизопропилэтиламин, N-метилморфолин или пиридин. Обычно проводят реакцию при температуре от -20 до 50oС. Реакция обычно занимает от 1 часа до 24 часов. Продукт можно выделить и очистить известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
Соединения формулы 2а, в которых L1 представляет йод, можно получить из соединения формулы 2а, в которых L1 представляет мезилат, хлор или бром, по реакции обмена, такой как реакция Финкельштейна.
Например, соединения формулы 2а, в которых L1 представляет мезилат, хлор или бром, взаимодействуют с 1,0-10,0 молярными эквивалентами йодида, такого как йодид натрия или калия. Реакцию проводят в подходящем растворителе, таком как ацетон или бутанон. Обычно проводят реакцию при температуре от комнатной до температуры кипения растворителя с обратным холодильником. Реакция обычно занимает от 1 часа до 24 часов. Продукт можно выделить и очистить известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На стадии 2 Реакционной Схемы А подходящий 3-(ω-L1-алкил)пирролидин формулы 2 а реагирует с подходящим пиперидиновым соединением формулы 3 или его солью. Подходящее пиперидиновое соединение формулы 3 является веществом, в котором Аr1 такой, как требуется в конечном продукте формулы (1), а А' либо представляет А, как требуется в конечном продукте формулы (1), либо после снятия защиты дает А, как требуется в конечном продукте формулы (1), либо после амидирования дает А, как требуется в конечном продукте формулы (1).
Например, подходящий 3-(ω-L1-алкил)пирролидин формулы 2а реагирует с подходящим пиперидиновым соединением формулы 3 или его солью, давая соединение формулы (1) или соединение формулы (1) с защитой. Реакцию проводят в подходящем по существу безводном растворителе, таком как тетрагидрофуран, пиридин, ацетонитрил, толуол или диметилформамид, используя от 1,0 до 6,0 молярных эквивалентов подходящего основания, такого как триэтиламин, пиридин или N, N-диизопропилэтиламин. Если используют соль подходящего пиперидина формулы 3, то применяют дополнительный молярный избыток подходящего основания. Протеканию реакции можно содействовать, добавляя каталитическое количество (от 0,1 до 0,5 молярных эквивалентов) йодида, такого как йодид натрия или калия. Обычно проводят реакцию при температуре от комнатной до температуры кипения растворителя с обратным холодильником. Реакция обычно занимает от 1 до 72 часов. Продукт можно выделить и очистить известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
По-другому, проводят реакцию в подходящем смешанном растворителе, таком как смеси толуол/вода, смеси этилацетат/вода или смеси тетрагидрофуран/вода, с использованием от 1,0 до 6,0 молярных эквивалентов подходящего основания, такого как гидроксид натрия, гидроксид калия, карбонат натрия, бикарбонат натрия, карбонат калия или бикарбонат калия. Как указано выше, если используют соль подходящего пиперидина формулы 3, то берут дополнительный молярный избыток подходящего основания. Протеканию реакции можно содействовать, добавляя каталитическое количество (от 0,1 до 0,5 молярных эквивалентов) йодида, такого как йодид натрия или калия. Обычно проводят реакцию при температуре от комнатной до температуры кипения смешанного растворителя с обратным холодильником. Реакция обычно занимает от 1 до 150 часов. Продукт можно выделить и очистить известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На необязательной стадии 3 Реакционной Схемы А снимают защиту с защищенного соединения формулы (1), получая соединение формулы (1). Реакция удаления защиты, такая как удаление защиты с карбоксильной группы при использовании подходящих защитных групп, таких как описанные в работе T.Greene Protecting Groups in Organic Synthesis, хорошо известна и оценена на практике.
Кроме того, хорошо известными и оцененными специалистами способами из соединения формулы (1) легко получить фармацевтически приемлемые соли соединения формулы (1).
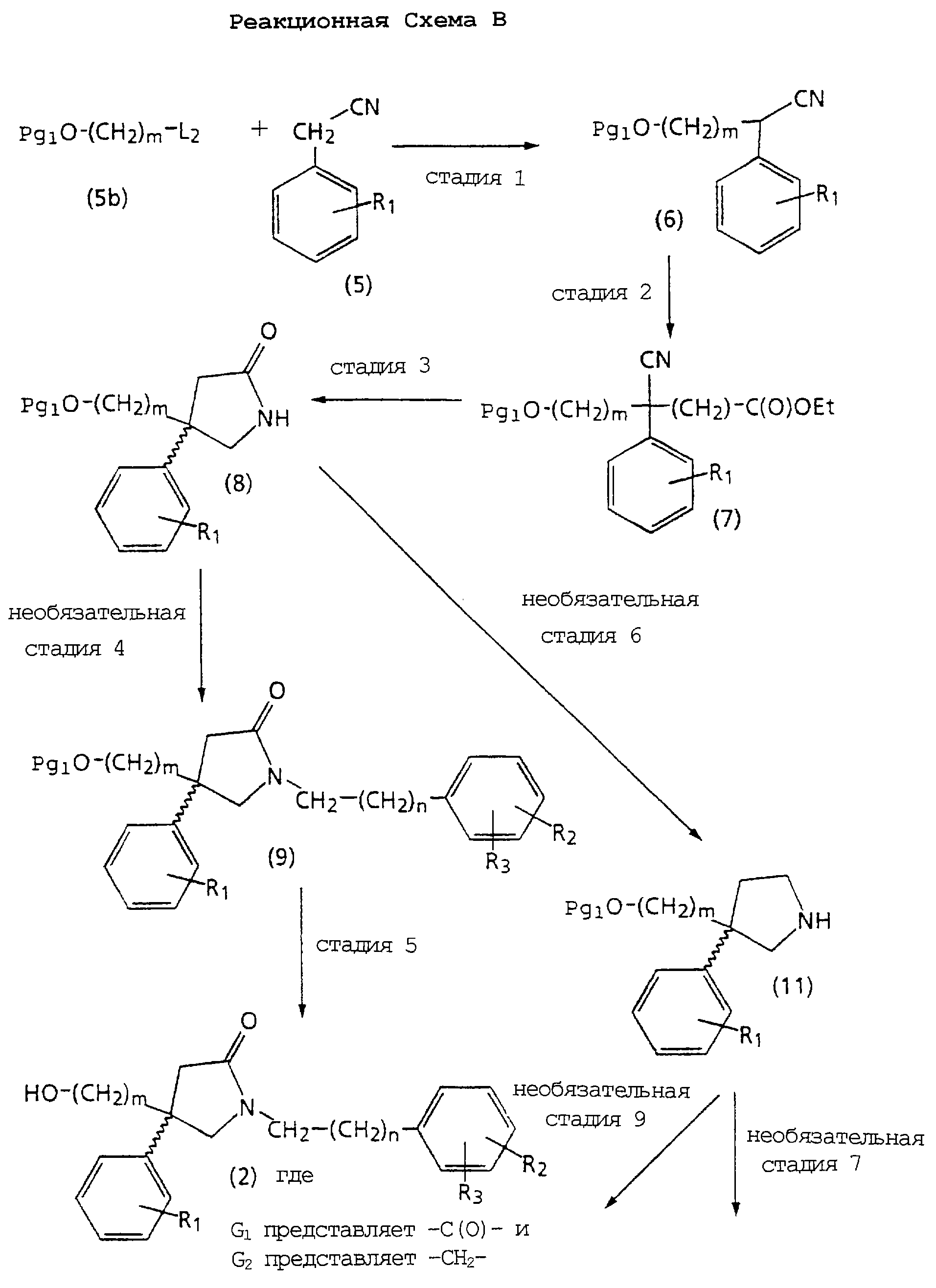
Реакционная Схема В является основной схемой получения спиртов структуры 2, используемых в качестве исходных материалов в Реакционной Схеме А. Реагенты и исходные материалы легко доступны для специалистов. Все вещества в Реакционной Схеме В предварительно идентифицированы, если не указано иначе.
На стадии 1 Реакционной Схемы В подходящий нитрил структуры 5 алкилируют подходящим защищенным спиртом структуры 5b, получая ω-(защищенный гидрокси)алкилнитрил структуры 6.
Подходящий нитрил структуры 5 является веществом, в котором R1 такой, как требуется в конечном продукте формулы (1). Подходящий защищенный спирт структуры 5b является веществом, в котором m такое, как требуется в конечном продукте формулы (1), и удаляемая группа L1 такая, которую можно заместить анионом, производным подходящего нитрила структуры 6. Подходящие удаляемые группы включают (но не ограничены этим) хлор, бром, йод и мезилат, при этом предпочтительны йод и бром. Специалисты хорошо знают и ценят выбор и применение подходящих для защиты гидроксила групп (Pg1), таких как описанные в работе T. Greene Protecting Groups in Organic Synthesis. На стадии 1 Реакционной Схемы В обычно предпочитают применять защитные группы тетрагидропиран-2-ил и трет-бутилдиметилсилил.
Например, подходящий нитрил структуры 5 взаимодействует с 1,0-1,2 молярными эквивалентами подходящего защищенного спирта структуры 5b. Реакцию проводят в присутствии примерно эквимолярного количества подходящего основания, такого как гидрид натрия, натрий бис-(триметилсилил)амид, трет-бутилат калия или литий диизопропиламид, при этом предпочтительны гидрид натрия, натрий бис-(триметилсилил)амид. Реакцию проводят в растворителе, таком как диметилформамид или тетрагидрофуран. Обычно проводят реакцию при температуре от -78 до 0oС. Реакция обычно занимает от 1 до 72 часов. Продукт можно выделить и очистить известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На стадии 2 Реакционной Схемы В ω-(защищенный гидрокси)алкилнитрил структуры 6 алкилируют этилбромацетатом, получая сложноэфирное соединение нитрила структуры 7.
Например, ω-(защищенный гидрокси) алкилнитрил структуры 6 реагирует с примерно молярным эквивалентом этилбромацетата. Реакцию проводят в присутствии примерно молярного эквивалента подходящего основания, такого как натрий бис-(триметилсилил)амид или литий диизопропиламид. Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран. Обычно проводят реакцию при температуре от -78 до 0oС. Реакция обычно занимает от 1 до 72 часов. Продукт можно выделить и очистить известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На стадии 3 Реакционной Схемы В сложноэфирное соединение нитрила структуры 7 восстанавливают и циклизуют, получая 3-(ω -(защищенный гидрокси)алкил)-5-оксопирролидиновое соединение структуры 8. Циклизация может происходить спонтанно после восстановления или ее можно проводить на отдельной стадии после выделения промежуточного амина.
Например, сложноэфирное соединение нитрила структуры 7 взаимодействует с избытком подходящего восстановителя, такого как боргидрид натрия в присутствии гексагидрата хлорида кобальта (II) или водорода в присутствии подходящего катализатора, такого как никель Ренея или оксид платины.
Если используют боргидрид натрия в присутствии гексагидрата хлорида кобальта, реакцию проводят в подходящем растворителе, таком как метанол или этанол. Обычно проводят реакцию при температуре от 0 до 50oС. Реакция обычно занимает от 1 до 72 часов. Как правило, кристаллизация в этих условиях происходит спонтанно. Продукт можно выделить и очистить известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
Если используют никель Ренея, реакцию проводят в подходящем растворителе, содержащем аммиак, таком как этанол/водный гидроксид аммония или метанол/водный гидроксид аммония. Обычно проводят реакцию при температуре от комнатной до 70oС. Реакцию с водородом осуществляют при давлении от 1,055 кг/см2 (15 psi) до 8, 44 кг/см2 (120 psi) в аппарате, предназначенном для проведения реакции под давлением. Как правило, в этих условиях происходит спонтанная циклизация. Продукт можно выделить путем тщательного удаления катализатора фильтрованием и выпаривания. Очистить продукт можно известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
Если используют оксид платины, реакцию проводят в подходящем растворителе, таком как этанол, метанол, хлороформ, смеси этанол/хлороформ или смеси метанол/хлороформ. Обычно проводят реакцию при температуре от комнатной до 50oС. Реакцию с водородом осуществляют при давлении от 1,055 кг/см2 (15 psi) до 8,44 кг/см2 (120 psi) в аппарате, предназначенном для проведения реакции под давлением, таком как аппарат Парра (Parr). Обычно в этих условиях получают промежуточный продукт амин и выделяют его путем тщательного удаления катализатора фильтрованием и выпаривания. Промежуточный амин циклизуют при нагревании в подходящем растворителе, таком как этанол, метанол, толуол или хлорбензол. Обычно проводят реакцию при температуре от 50oС до температуры кипения растворителя с обратным холодильником. Реакция обычно занимает от 8 до 48 часов. Продукт можно очистить посредством экстракции, выпаривания, растирания, хроматографии и перекристаллизации.
На необязательной стадии 4 Реакционной Схемы В 3-(ω-(защищенный гидрокси)алкил)-5-оксопирролидиновое соединение структуры 8 алкилируют подходящим алкилирующим агентом, получая соединение структуры 9. Подходящий алкилирующий агент X1-CH2(CH2)n-Ph1 является веществом, в котором X1 представляет метансульфонил, хлор, бром или йод, n такое, как требуется в конечном продукте формулы (1), и Ph1 представляет фенил или замещенный фенил, имеющий R1 и R3 такие, как требуется в конечном продукте формулы (1).
Например, 3-(ω-(защищенный гидрокси)алкил)-5-оксопирролидиновое соединение структуры 8 взаимодействует с 1-5 молярными эквивалентами подходящего алкилирующего агента. Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран, диметилсульфоксид или диметилформамид. Реакцию проводят в присутствии основания, такого как гидрид натрия, трет-бутилат калия, калий бис (триметилсилил)амид или литий диизопропиламид, при этом предпочтительны гидрид натрия и калий бис(триметилсилил)амид. Обычно проводят реакцию при температуре от 0 до 50oС. Реакция обычно занимает от 1 до 72 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
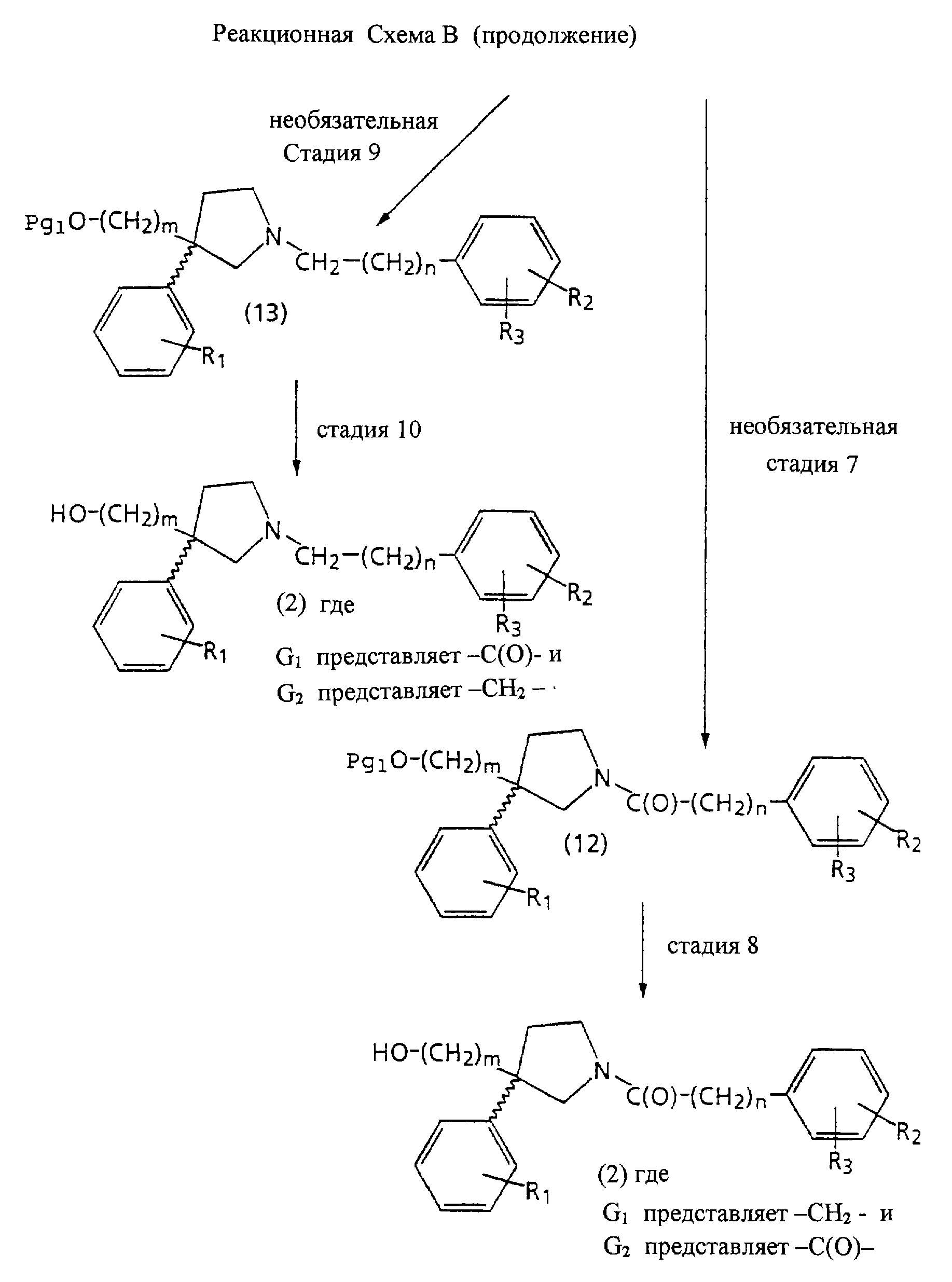
На стадии 5 Реакционной Схемы В снимают защиту с соединения структуры 9, получая спирт структуры 2, в котором G1 представляет -С(О)-, и G2 представляет -СН2-. Реакция удаления защиты, такая как удаление защищающих гидроксил групп с использованием подходящих защитных групп, таких как описанные в работе T. Greene Protecting Groups in Organic Synthesis, хорошо известна и оценена на практике.
Не необязательной стадии 6 Реакционной Схемы В 3-(ω-(защищенный гидрокси)алкил)-5-оксопирролидиновое соединение структуры 8 восстанавливают, получая 3-(ω-(защищенный гидрокси)алкил)пирролидиновое соединение структуры 11.
Например, 3-(3-(ω-(защищенный гидрокси)алкил)-5-оксопирролидиновое соединение 8 взаимодействует с избытком подходящего восстановителя, такого как литийалюминийгидрид, алюминийгидрид или диметилсульфоксидный комплекс бора. Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран. Обычно проводят реакцию при температуре от 0oС до температуры кипения растворителя с обратным холодильником. Реакция обычно занимает от 1 до 72 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как резкое охлаждение комплексов бора или алюминия, экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На необязательной стадии 7 Реакционной Схемы В 3-(ω-(защищенный гидрокси)алкил)пирролидиновое соединение структуры 11 обрабатывают подходящей ароиловой (aroyl) кислотой, ароиловым эфиром, галогенидом ароиловой кислоты, ароиловым ангидридом или ароиловым смешанным ангидридом, Х2-С(О)-(CH2)n-Ph2, получая соединение структуры 12. Подходящая ароиловая кислота, ароиловый эфир, галогенид ароиловой кислоты, ароиловый ангидрид или ароиловый смешанный ангидрид, X2-C(О)-CH2)n-Ph2, является веществом, в котором Х2 представляет гидроксил; активированный эфир, такой как О-гидроксисукцинимид, О-гидроксибензтриазол; активированную удаляемую группу, такую как хлор, бром; или группу, которая образует ангидрид; или смешанный ангидрид, n такое, как требуется в конечном продукте формулы (1), и Ph2 представляет фенил или замещенный фенил, имеющий R1 и R3 такие, как требуется в формуле (1).
Например, 3-(ω -(защищенный гидрокси)алкил)пирролидиновое соединение структуры 11 взаимодействует с 1-1,5 молярными эквивалентами подходящей ароиловой кислоты, ароилового эфира, галогенида ароиловой кислоты, ароилового ангидрида или ароилового смешанного ангидрида. Реакцию проводят в подходящем растворителе, таком как дихлорметан, тетрагидрофуран, ацетонитрил, диметилформамид или пиридин. Реакцию проводят в присутствии основания, такого как триэтиламин, N-метилморфолин, N,N-диизопропилэтиламин или пиридин. Обычно проводят реакцию при температуре от -20 до 50oС. Обычно реакция занимает от 1 до 6 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
По-другому, 3-(ω -(защищенный гидрокси)алкил)пирролидиновое соединение структуры 11 взаимодействует, например, с 1-1,5 молярными эквивалентами подходящей ароиловой кислоты, ароилового эфира, галогенида ароиловой кислоты, ароилового ангидрида или ароилового смешанного ангидрида. Реакцию проводят в подходящем смешанном растворителе, таком как тетрагидрофуран/вода, ацетон/вода или этилацетат/вода. Реакцию проводят в присутствии основания, такого как карбонат натрия, бикарбонат натрия, карбонат калия, бикарбонат калия, гидроксид натрия или гидроксид калия. Реакцию можно проводить в присутствии подходящего катализатора, такого как иодид натрия или иодид калия. Обычно проводят реакцию при температуре от -20 до 50oС. Реакция обычно занимает от 1 до 24 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На стадии 8 Реакционной Схемы В снимают защиту с соединения структуры 12, получая спирт структуры 2, в котором G1 представляет -СН2-, и G2 представляет -С(О)-. Реакция удаления защиты, такая как удаление защищающих гидроксил групп с использованием подходящих защитных групп, таких как описанные в работе T.Greene Protecting Groups in Organic Synthesis, хорошо известна и оценена на практике.
На необязательной стадии 9 Реакционной Схемы В 3-(ω-(защищенный гидрокси)алкил)пирролидиновое соединение структуры 11 алкилируют подходящим алкилгалогенидом Х3-СН2-(СН2)n-Рh3, получая соединение структуры 13. Подходящий алкилгалогенид представляет соединение, в котором Х3 является хлором, бромом или мезилатом, n такое, как требуется в конечном продукте формулы (1), и Рh3 является фенилом или замещенным фенилом, имеющим R2 и R3, как требуется в формуле (1).
Например, 3-(ω-(защищенный гидрокси) алкил) пирролидиновое соединение структуры 11 взаимодействует с 1,0-1,2 молярными эквивалентами подходящего алкилгалогенида. Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран, диметилсульфоксид, ацетонитрил, толуол или диметилформамид. Реакцию обычно проводят в присустствии основания, такого как карбонат натрия, бикарбонат натрия, карбонат калия, триэтиламин, N,N-диизопропилэтиламин или пиридин. Обычно реакцию проводят при температуре от 0oС до температуры кипения растворителя с обратным холодильником. Реакция обычно занимает от 1 до 72 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
По-другому, например, 3-(ω-(защищенный гидрокси)алкил)пирролидиновое соединение структуры 11 взаимодействует с 1-1,2 молярными эквивалентами подходящего алкилгалогенида. Реакцию проводят в подходящем смешанном растворителе, таком как тетрагидрофуран/вода, толуол/вода или этилацетат/вода. Реакцию проводят в присутствии основания, такого как карбонат натрия, бикарбонат натрия, карбонат калия или бикарбонат калия.
Обычно проводят реакцию при температуре от 0oС до температуры кипения растворителя с обратным холодильником. Обычно реакция занимает от 1 до 72 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На стадии 10 Реакционной Схемы В снимают защиту с соединения структуры 13, получая спирт структуры 2, в котором G1 и G2 представляют -СН2-. Реакция удаления защиты, такая как удаление защищающих гидроксил групп с использованием подходящих защитных групп, таких как описанные в работе T.Greene Protecting Groups in Organic Synthesis, хорошо известна и оценена на практике.
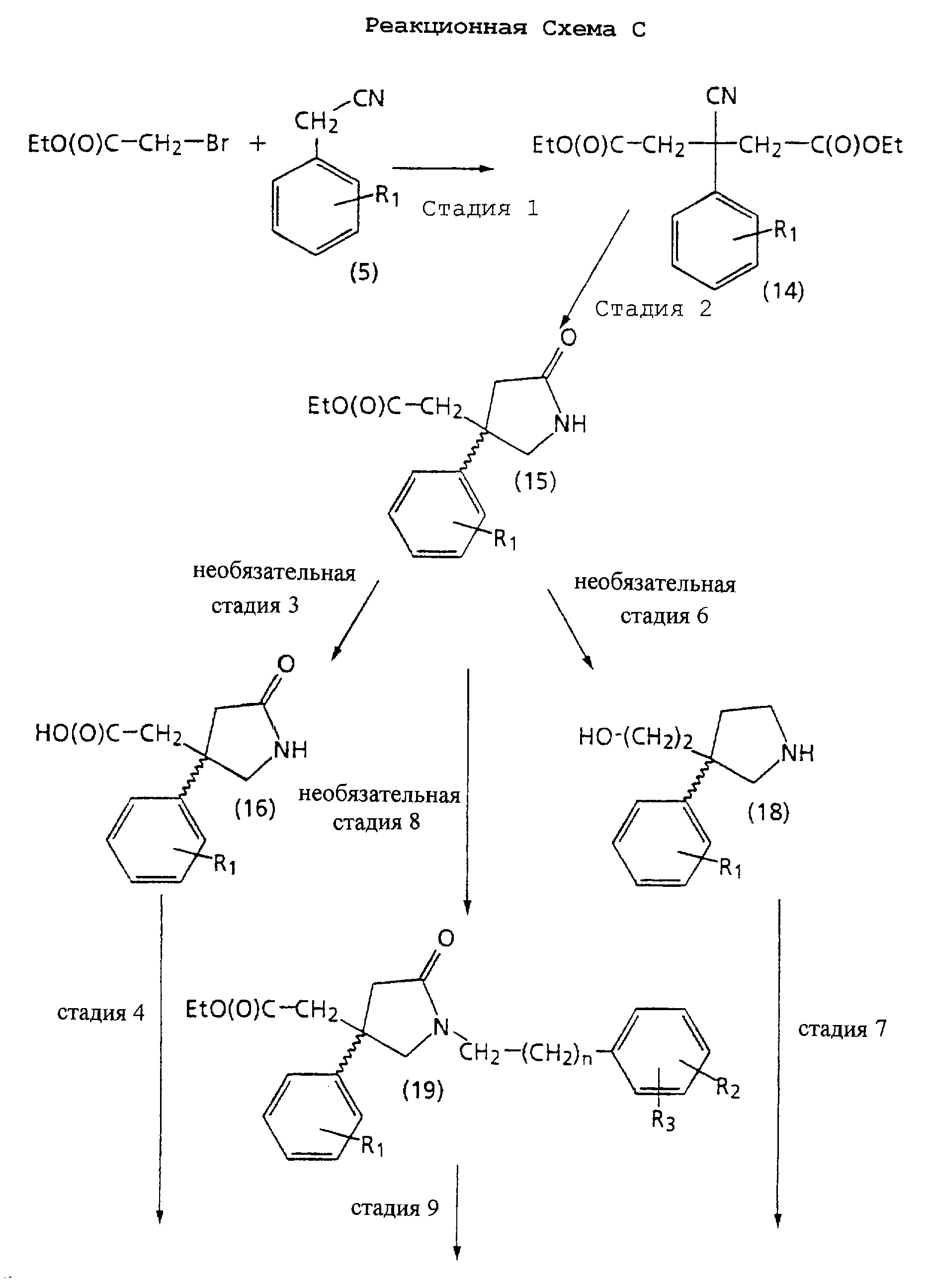
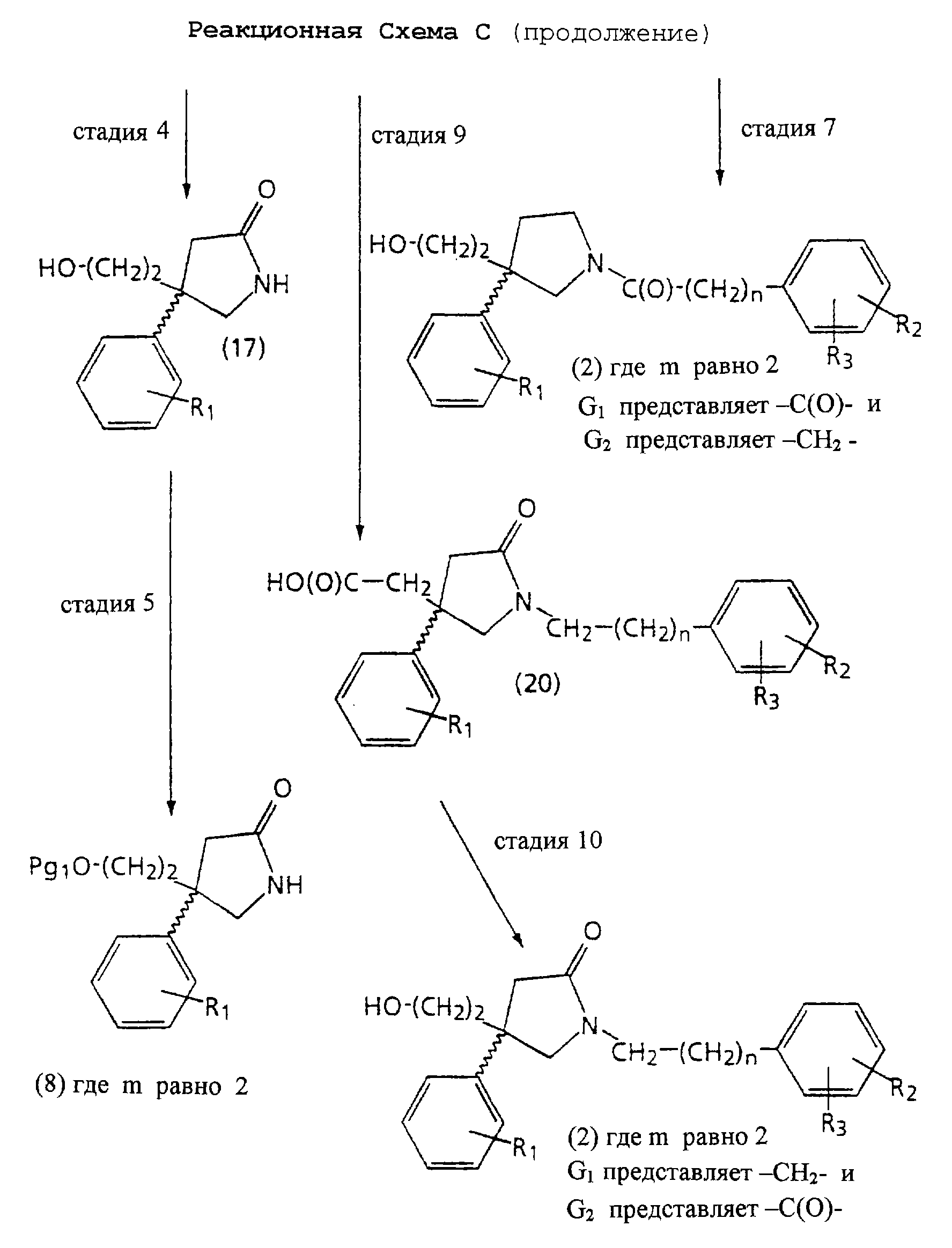
На Реакционной Схеме С показана синтетическая процедура получения спиртов структуры 2, в которых m равно 2, и промежуточных продуктов структуры 8, в которых m равно 2, используемых в Реакционной Схеме В. Для получения спиртов структуры 2, в которых m равно 2, обычно предпочтителен способ Реакционной Схемы С. Реагенты и исходные материалы Реакционной Схемы С легко доступны обычным специалистам, и все вещества, за исключением указанных отдельно, предварительно идентифицируют.
На стадии 1 Реакционной Схемы С подходящий нитрил структуры 5 бис-алкилируют этилбромацетатом, получая бис-эфир нитрила структуры 14. Подходящий нитрил структуры 5 является соединением, определенным на стадии 1 Реакционной Схемы В.
Например, подходящий нитрил структуры 5 взаимодействует с 2,0-3,0 молярными эквивалентами этилбромацетата. Реакцию проводят в присутствии примерно 2,0-3,0 молярных эквивалентов подходящего основания, такого как натрия бис(триметилсилил)-амид или литий диизопропиламид. Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран. Обычно реакцию проводят при температуре от -78 до 0oС. Реакция обычно занимает от 1 до 72 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На стадии 2 Реакционной Схемы С бис-эфир нитрила структуры 14 восстанавливают и циклизуют, получая 5-оксо-3-уксуснокислый эфир пирролидин структуры 15.
Например, нитрил бис-эфирное соединение структуры 14 взаимодействует с подходящим восстановителем, таким как боргидрид натрия в присутствии гексагидрата хлорида кобальта (II) или водород в присутствии подходящего катализатора, такого как никель Ренея или оксид платины, как считают на стадии 3 Реакционной Схемы В.
По-другому, например, нитрил бис-эфирное соединение структуры 14 взаимодействует с бораном или комплексом борана, таким как диметилсульфоксидный комплекс борана. Реакцию проводят в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран. Обычно проводят реакцию при температуре от -20oС до температуры кипения растворителя с обратным холодильником. Обычно реакция занимает от 1 до 72 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как быстрое охлаждение, экстракция, выпаривание, растирание, перегонка, хроматография и перекристаллизация.
На необязательной стадии 3 Реакционной Схемы С 5-оксо-3-уксуснокислый эфир пирролидин структуры 15 гидролизуют, получая 5-оксо-3-уксуснокислый пирролидин структуры 16.
Например, 5-оксо-3-уксуснокислый эфир пирролидин структуры 15 взаимодействует с подходящим гидролизующим агентом, таким как гидроксид натрия, гидроксид калия или гидроксид лития. Реакцию проводят в подходящем растворителе, таком как вода, смеси тетрагидрофуран/вода, метанол, смеси метанол/вода или смеси этанол/вода. Обычно проводят реакцию при температуре от 0oС до температуры кипения растворителя с обратным холодильником. Реакция обычно занимает от 1 до 72 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На стадии 4 Реакционной Схемы С 5-оксо-3-уксуснокислый пирролидин структуры 16 восстанавливают, получая 3-(2-гидроксиэтил)-5-оксопирролидин структуры 17.
Например, 5-оксо-3-уксуснокислый пирролидин структуры 16 взаимодействует с подходящим борановым реагентом, таким как диметилсульфоксидный комплекс борана. Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир. Обычно проводят реакцию при температуре от 0oС до температуры кипения растворителя с обратным холодильником. По завершении реакции ее гасят, осторожно добавляя подходящий водный раствор кислоты, такой как 1М раствор соляной кислоты. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
По-другому, 5-оксо-5-уксуснокислый пирролидин структуры 16 мoжно восстановить через образование промежуточного смешанного ангидрида, который подвергают взаимодействию с подходящим мягким восстановителем, таким как боргидрид натрия.
Например, 5-оксо-3-уксусная кислота пирролидин структуры 16 взаимодействует с 1,2-1,7 эквивалентами подходящего основания, такого как N-метилморфолин, в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир. Реакционную смесь охлаждают до температуры в интервале от (-50oС) до 0oС (предпочтительно от (-25oС) до (-20oС) перед добавлением 1,2-1,7 эквивалентов изобутилхлорформиата. Реакцию оставляют перемешиваться в течение периода от 30 минут до 3 часов для образования смешанного ангидрида. По завершении образования смешанного ангидрида добавляют боргидрид натрия. Продукт мoжно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, хроматография и перекристаллизация.
На стадии 5 Реакционной Схемы С в 3-(2-гидроксиэтил)-5-оксопирролидин структуры 17 вводят защиту, получая 3-(ω-(защищенный гидроксиэтил)-5-оксопирролидин структуры 8, используемый в Реакционной Схеме В. Специалисты хорошо знают и ценят выбор и применение подходящих защитных групп, таких как описанные в работе T.Greene Protecting Groups in Organic Synthesis.
На необязательной стадии 6 Реакционной Схемы С 5-оксо-3-уксуснокислый эфир пирролидин структуры 15 восстанавливают, получая 3-(ω-гидроксиэтил) пирролидин структуры 18, как показано на необязательной стадии 6 Реакционной Схемы В, используя восстановитель, подходящий для восстановления амидной и эфирной групп.
На стадии 7 Реакционной Схемы С 3-(ω-гидроксиэтил) пирролидин структуры 18 взаимодействует с подходящим ароилгалогенидом, ароиловым ангидридом или ароиловым смешанным ангидридом, давая спирт структуры 2. Подходящий ароилгалогенид, ароиловый ангидрид или ароиловый смешанный ангидрид является соединением, описанным на необязательной стадии 7 Реакционной Схемы В.
Например, 3-(ω-гидроксиэтил)пирролидин структуры 18 взаимодействует с 1-1,1 молярными эквивалентами подходящего ароилгалогенида, ароилового ангидрида или ароилового смешанного ангидрида. Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран, дихлорметан, ацетон, этилацетат, толуол или диэтиловый эфир. Реакцию проводят в присутствии основания, такого как N-метилморфолин, карбонат натрия, триэтиламин, N, N-диизопропилэтиламин, карбонат калия или бикарбонат натрия. Обычно проводят реакцию при температуре от -78oС до комнатной температуры. Реакция обычно занимает от 1 до 24 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
По-другому, например, 3-(ω -гидроксиэтил)пирролидин структуры 18 взаимодействует с 1-1,1 молярными эквивалентами подходящего ароилгалогенида, ароилового ангидрида или ароилового смешанного ангидрида в условиях Schotten-Baumann. Реакцию проводят в подходящей смеси растворителей, такой как толуол/вода, ацетон/вода, тетрагидрофуран/вода или этилацетат/вода. Реакцию проводят в присутствии основания, такого как карбонат калия, бикарбонат калия, бикарбонат натрия, карбонат натрия, гидроксид натрия или гидроксид калия. Обычно проводят реакцию при температуре от -20 до 50oС. Реакция обычно занимает от 15 минут до 24 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На необязательной стадии 8 Реакционной Схемы С 5-оксо-3-уксуснокислый эфир пирролидина структуры 15 алкилируют подходящим алкилгалогенидом, получая 1-арилалкил-5-оксо-3-уксуснокислый эфир пирролидин структуры 19. Подходящий алкилгалогенид является соединением, описанным на необязательной стадии 4 Реакционной Схемы В.
Например, 5-оксо-3-уксуснокислый эфир пирролидин структуры 15 взаимодействует с 1,0-1,2 молярными эквивалентами подходящего алкилгалогенида. Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран, диметилсульфоксид, ацетонитрил или диметилформамид. Реакцию проводят в присутствии основания, такого как гидрид натрия, натрий бис(триметилсилил)амид, трет-бутилат калия. Обычно проводят реакцию при температуре от 0 до 50o С. Реакция обычно занимает от 1 до 72 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На стадии 9 Реакционной Схемы С 1-арилалкил-5-оксо-3-уксуснокислый эфир пирролидин структуры 19 гидролизуют, получая 1-арилалкил-5-оксо-3-уксусная кислота пирролидин структуры 20.
Например, 1-арилалкил-5-оксо-3-уксуснокислый эфир пирролидин структуры 19 взаимодействует с подходящим гидролизующим агентом, таким как гидроксид натрия, гидроксид калия или гидроксид лития. Реакцию проводят в подходящем растворителе, таком как вода, смеси тетрагидрофурана/воды, метанол, смеси метанола/воды или смеси этанола/воды. Обычно реакцию проводят при температуре от 0oС до температуры кипения растворителя с обратным холодильником. Реакция обычно занимает от 1 до 72 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На стадии 10 Реакционной Схемы С 1-арилалкил-5-оксо-3-уксусная кислота пирролидин структуры 20 восстанавливают, как показано на стадии 4 Реакционной Схемы С, получая спирт структуры 2, в котором m равно 2, G1 представляет -С(О)-, и G2 представляет -CH2-.
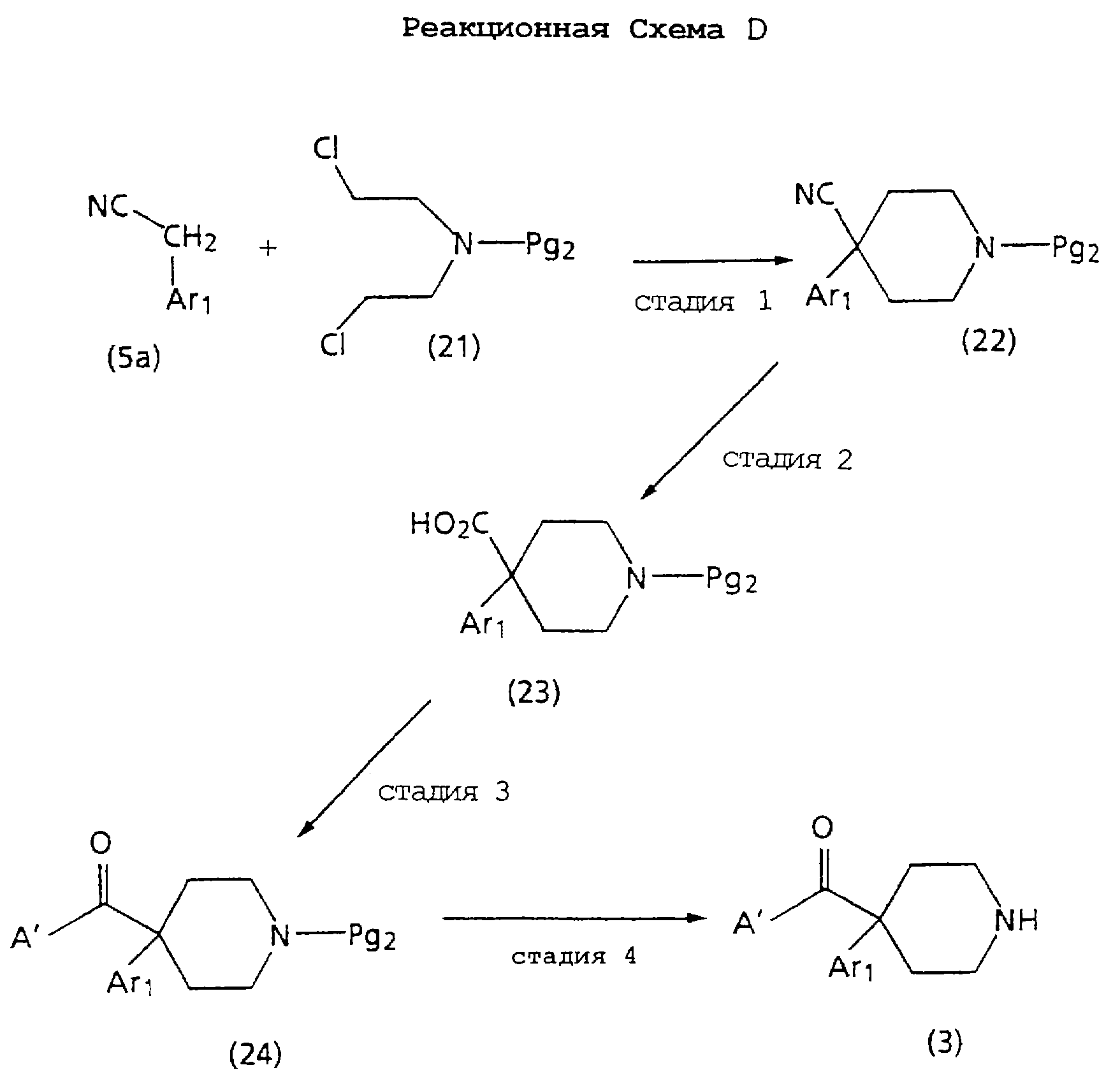
Далее на Реакционной схеме D показана синтетическая процедура для получения пиперидиновых соединений структуры 3 и 3а, используемых в качестве исходных материалов в Реакционных Схемах A.1 и А.2.
На стадии 1 Реакционной схемы D подходящий бис-(2-хлорэтил) амин с защитой формулы 21 алкилируют подходящим арилацетонитрилом формулы 5а, получая 4-арил-4-цианопиперидин с защитой формулы 22. Подходящий бис-(2-хлорэтил)амин с защитой формулы 21 является соединением, в котором защитная группа (Pg2) может быть C1-C4 алкилом, бензилом, замещенным бензилом, пара-толуолсульфонилом, бензол-сульфонилом или карбаматом, таким как трет-бутоксикарбонил или этоксикарбонил. Подходящий арилацетонитрил формулы 5а является соединением, в котором Ar1, такой, как требуется в конечном продукте формулы (1). Апкилирование такого типа хорошо известно и оценено на практике, некоторые примеры такого типа реакций найдены среди прочих в работах T.Caronack и Р.С.Reeves, J.Heterocyclic Chem. 23, 73-75 (1986) и C.V.Bercz и R.D.Ice, J.Pharmaceutical Sci., 21, 1316-1317 (1972).
Например, подходящий бис-(2-хлорэтил)амин с защитой формулы 21 взаимодействует с подходящим арилацетонитрилом формулы 5а. Реакцию проводят в присутствии основания, такого как амид натрия, гидрид натрия, натрий гексаметилдисилазид, трет-бутилат калия и литий диизопропиламид. Реакцию проводят в растворителе, таком как диметилсульфоксид и тетрагидрофуран. Можно проводить реакцию в присутствии 0,01-0,5 молярных эквивалентов подходящего катализатора, такого как йодид натрия или йодид калия. Обычно проводят реакцию при температуре от 0 до 80oС. Реакция обычно занимает от 1 до 72 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
По-другому, например, подходящий бис-(2-хлорэтил) амин с защитой формулы 21 взаимодействует с подходящим арилацетонитрилом формулы 5а в условиях фазового переноса. Реакцию можно проводить в воде или растворителе, состоящем из органической и водной фаз. Реакцию проводят в присутствии гидроксида, такого как гидроксид натрия или гидроксид калия. Реакцию проводят в присутствии подходящего катализатора, включающего соли четвертичного аммония и фосфония, такие как тетрабутиламмоний бромид, тетрабутиламмоний гидросульфат, гексадецилтрибутилфосфоний бромид, бензилтриметиламмоний хлорид и подобные. Реакцию интенсивно перемешивают и проводят обычно при температуре от 0 до 100oС. Реакция обычно занимает от 1 до 24 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
На стадии 2 Реакционной Схемы D 4-арил-4-цианопиперидин формулы 22 гидролизуют до 4-арил-4-пиперидин-4-карбоновой кислоты формулы 23. Гидролиз нитрилов до кислот можно проводить в кислых или щелочных условиях, что хорошо знают и понимают специалисты. Специалисты хорошо знают и понимают выбор и применение условий гидролиза, подходящих для определенной защитной группы (Рg2).
Специалистам понятно, что удаление защищающей амин группы Pg2 может потребоваться до или после стадии 2. Например, если Рg2 представляет бензил, то защитную группу можно удалить, способствовуя гидролизу нитрила, и затем снова ввести после гидролиза. Если защита снята, то повторное введение защитной группы Рg2 (будь то бензильная или другая защитная группа) после гидролиза дает 4-арилпиперидин-4-карбоновую кислоту формулы 23. Иначе, защитную группу, использованную на стадиях 1 и 2 Реакционной Схемы D, можно удалить и заменить другой группой для облегчения снятия защиты соединения 24 на стадии 4 Реакционной Схемы D. Введение защитных групп для амина хорошо известно и оценено на практике и показано в работе T.Greene Protecting Groups in Organic Synthesis, Wiley-Interscience (1981).
На стадии 3 Реакционной Схемы D эфир 4-арилпиперидин-4-карбоновой кислоты формулы 23 подвергают реакции амидиро-вания подходящим карбокси-замещенным циклическим амином, получая 4-арил-4-карбоксамидо-пиперидин с защитой формулы 24. Подходящий карбокси-замещенный циклический амин является соединением, которое дает группу А', которая является группой А, как требуется в конечном продукте формулы (1), или дает группу А (как требуется в конечном продукте формулы (1)) после снятия защиты или функционализации (functionalization).
Иллюстративные примеры таких подходящих карбокси-замещенных циклических аминов включают 4-карбоэтоксипиперидин, 3-карбоэтоксипиперидин, 2-карбоэтоксипиперидин, 4-карбометоксипиперидин, 3-карбометоксипиперидин, 2-карбометоксипиперидин, 4-карбо-н-пропилоксипиперидин, 4-карбо-трет-бутилоксипиперидин, 3-карбоэтоксипирролидин, 2-карбоэтоксипирролидин, 3-карбометоксипирролидин, 2-карбометоксипирролидин, 4-карбометоксиметилпиперазин, 2-карбоэтоксиморфолин, 3-карбоэтоксиморфолин, 4-карбоэтоксиметилпиперазин, 4-карбо-н-пропилоксиметилпиперазин, 4-карбоизопропилоксиметилпиперазин, 4-карбо-н-бутилоксиметилпиперазин, 4-карбо-трет-бутилоксиметилпиперазин, 4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо) пиперидин, 4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил) карбоксамидо)пиперидин, 4-фенил-4-((4-карбо(этоксикарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин, 4-фенил-4-((4-карбо(трет-бутилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин, 4-фенил-4-((4-карбо(метилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо) пиперидин, 4-фенил-4-((4-карбо (пропилкарбонилоксиметокси) метилпиперазин-1-ил)карбоксамидо)пиперидин, 4-карбо-(5-метил-2-оксо-1,3-диоксол-4-илметокси)метилпиперазин, 4-карбо-(карбо-(2-(триметилсилил)этокси)метилокси)метилпиперазин и подобные. Специалистам понятно, что далее с карбоксильной функции подходящего карбокси-замещенного циклического амина можно снять защиту или функционализировать (functionalized) после снятия защиты для получения А, как требуется в конечном соединении формулы (1). Такое снятие защиты или функционализация включает амидирование, гидролиз сложных эфиров, образование сложных эфиров и переэтерификацию.
Реакция амидирования может протекать через кислоту формулы 23, или сначала кислотную функцию соединения 23 можно превратить в активированный промежуточный продукт, такой как ангидрид; смешанный ангидрид замещенной фосфорной кислоты, такой как диалкилфосфорная кислота, дифенилфосфорная кислота, галогенфосфорная кислота; алифатической карбоновой кислоты, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, изомасляная кислота, пивалиновая кислота, 2-этилмасляная кислота, трихлоруксусная кислота, трифторуксусная кислота и подобные; активированный сложный эфир, такой как эфир фенола, эфир пара-нитрофенола, эфир 2,4-динитрофенола, эфир пентафторфенола, эфир N-гидроксисукцинимида, эфир N-гидроксифталимида, эфир 1-гидроксибензтриазола и подобные; активированный амид, такой как имидазол, диметилпиразол, триазол или тетразол; или промежуточный продукт образуется в присутствии связывающего агента, такого как дициклогексилкарбодиимид или 1-(3-диметиламинопропил)-3-этилкарбодиимид. Активированные промежуточные продукты можно получить и сразу использовать или получить и выделить перед добавлением подходящего карбокси-замещенного циклического амина. По-другому, активированные промежуточные продукты можно получить, выделить и очистить перед добавлением подходящего карбокси-замещенного циклического амина. Специалисты хорошо знают и понимают использование и получение активированных промежуточных продуктов.
Например, кислота формулы 23 взаимодействует с небольшим молярным избытком подходящего карбокси-замещенного циклического амина или соли подходящего карбокси-замещенного циклического амина и 1-гидроксибензотриазол гидрата в присутствии небольшого молярного избытка связывающего агента, такого как дициклогексилкарбодиимид или 1-(3-диметиламинопропил)-3-этилкарбодиимид. Реакцию проводят в присутствии подходящего основания, такого как N,N-диизопропилэтиламин, N-метилморфолин или триэтиламин, а если используют соль подходящего карбоксизамещенного циклического амина, то дополнительно добавляют примерно молярное количество подходящего основания. Реакцию проводят в подходящем растворителе, таком как дихлорметан, хлороформ или диметилформамид. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, хроматография и перекристаллизация.
По-другому, например, кислота формулы 23 взаимодействует с 1,2-1,7 эквивалентами подходящего основания, такого как N-метилморфолин, в подходящем растворителе, таком как тетрагидрофуран. Как сказано выше, если используют соль подходящего карбокси-замещенного циклического амина, то дополнительно добавляют примерно молярное количество подходящего основания. Реакционную смесь охлаждают до температуры от -50 до 0oС (предпочтительно от -25oС до -20o С) перед добавлением 1,2-1,7 эквивалентов изобутилхлорформиата. Реакцию оставляют перемешиваться в течение времени от 30 минут до 3 часов для образования активированного промежуточного продукта смешанного ангидрида. Поддерживая температуру между -50 и 0oС, добавляют подходящий карбокси-замещенный циклический амин. По завершении добавления амина реакционную смесь можно нагреть до комнатной температуры. Реакция обычно занимает от 2 до 48 часов. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, хроматография и перекристаллизация.
На стадии 4 Реакционной Схемы D удаляют защиту с защищенного 4-арил-4-карбоксамидо-пиперидина формулы 24, получая пиперидин формулы 3. Удаление защищающей амин группы хорошо известно, оценено на практике и описано в работе T. Greene Protecting Groups in Organic Synthesis, Wiley-Interscience (1981).
Кроме того, специалистам понятно, что 4-арилпиперидин-4-карбоновую кислоту формулы 23 можно получить из 4-арил-4-цианопиридина формулы 22 дальнейшим гидролизом амида 4-арилпиперидин-4-карбоновой кислоты, полученного посредством гидролиза 4-арил-4-цианопиперидина формулы 22.
Например, подходящий 4-арил-4-цианопиперидин формулы 22 взаимодействует с основным пероксидом водорода, давая 4-арил-4-карбокислотный амид-пиперидин или 4-арил-4-карбокислотный амид-пиперидин N-оксид. Применение основного пероксида водорода для гидролиза нитрилов до карбоксамидов хорошо известно и оценено на практике. Reagents for Organic Synthesis, Fieser и Fieser, John Wiley & Sons, Inc. (1967). Подходящими основаниями для этой реакции являются гидроксиды щелочных металлов, такие как гидроксиды натрия и калия. Реакцию проводят в подходящем растворителе, таком как вода, этанол, метанол, смеси вода/этанол или смеси вода/метанол. Реакцию проводят при температуре от 0oС до температуры кипения подходящего растворителя с обратным холодильником. Обычно реакция занимает примерно от 4 часов до 4 дней. Продукт можно выделить и очистить хорошо известными в практике способами, такими как экстракция, выпаривание, растирание, хроматография и перекристаллизация.
Если получают 4-арил-4-карбокислотный амид-пиперидин, с него удаляют защиту, получая амид 4-арилпиперидин-4-карбоновой кислоты. Если получают 4-арил-4-карбокислотный амидпиперидин N-оксид, его восстанавливают и удаляют защиту, получая амид 4-арилпиперидин-4-карбоновой кислоты. Понятно, что снятие защиты с амина и восстановление оксида амина можно проводить одновременно или последовательно. Восстановление оксидов аминов также хорошо известно специалистам. После восстановления N-оксида удаляют защищающую амин группу Pg2.
Удаление защищающей амин группы, такой как бензил и замещенный бензил, хорошо известно, оценено на практике и описано в работе T.Greene Protecting Groups in Organic Synthesis, Wiley-Interscience (1981). Продукт можно выделить и очистить хорошо известными в практике способами, такими как фильтрация, экстракция, выпаривание, растирание, хроматография и перекристаллизация.
Проверено на практике, что амид 4-арилпиперидин-4-карбоновой кислоты можно далее гидролизовать в кислых или основных условиях, получая 4-арилпиперидин-4-карбоновую кислоту формулы 23.
Следующие далее примеры и получения представляют типичный синтез соединений формулы (1). Следует понимать, что эти примеры являются лишь иллюстративными и никоим образом не призваны ограничивать область данного изобретения.
ПОЛУЧЕНИЕ 1
соль 4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо) пиперидина и соляной кислоты.
Объединяют 4-фенилпиперидин-4-карбоновую кислоту-паратолуолсульфоновую кислоту (97,5 г, 0,258 моль), N,N-диизопропилэтиламин (55 мл, 0,316 моль) и диметилформамид (900 мл). Добавляют по капле раствор ди-трет-бутилдикарбоната (65,0 г, 0,30 моль) в диметилформамиде. Через 20 часов разбавляют реакционную смесь диэтиловым эфиром и трижды экстрагируют водой, а затем рассолом. Сушат органический слой над MgSO4, фильтруют, промывают МgSО4, дихлорметаном. Упаривают в вакууме, получая 1-трет-бутоксикарбонил-4-фенилпиперидин-4-карбоновую кислоту.
Объединяют 1-трет-бутоксикарбонил-4-фенилпиперидин-4-карбоновую кислоту (18,7 г, 97,5 ммоль), N,N-диизопропилэтиламин (34,0 мл, 0,195 моль) в дихлорметане (400 мл). Добавляют гидрат 1-гидроксибензотриазола (13, 2 г, 97,7 ммоль) и этилизонипекотат (4-карбоэтоксипиперидин) (14,0 г, 88,8 ммоль). Добавляют гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида. Через 18 часов разбавляют реакционную смесь дихлорметаном и дважды экстрагируют водой. Сушат органический слой над MgS04, фильтруют и упаривают в вакууме, получая 1-трет-бутоксикарбонил-4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин.
Объединяют 1-трет-бутоксикарбонил-4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин (25,0 г, 56,6 ммоль) и дихлорметан (200 мл). Добавляют раствор соляной кислоты в диоксане (50 мл, 4М, 200 ммоль). Через 3 часа добавляют диэтиловый эфир (400 мл) и фильтруют, получая после сушки указанное в заголовке соединение.
Способом Получения 1 синтезируют также:
а) соль 4-фенил-4-((3-карбоэтоксипиперидин-1-ил) карбоксамидо)пиперидина и соляной кислоты,
используя
этил-нипекотат (3-карбоэтоксипиперидин);
б) соль 4-фенил-4-((2-карбометоксипирролидин-1-ил) карбоксамидо)пиперидина и соляной кислоты, используя гидрохлорид DL-пролинметилового
эфира
(гидрохлорид 2-карбометоксипирролидина);
в) соль 4-фенил-4-((2-карбоэтоксипиперидин-1-ил)карбоксамидо )пиперидина и соляной кислоты, используя этилпипеколинат (2-карбоэтоксипиперидин);
г) соль 4-фенил-4-((2-карбоэтоксиморфолин-4-ил)карбоксамидо) пиперидина и соляной кислоты, используя (2-карбоэтоксиморфолин).
Пример 1
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-диметоксифенил)пирролидин
1. 1. Синтез диэтилового эфира 3-циано-3-(3,4-диметоксифенил)пентандиоевой кислоты
Объединяют 3,4-диметоксифенилацетонитрил (20 г, 113 ммоль) и безводный тетрагидрофуран (100 мл). Охлаждают на бане с сухим льдом/ацетоном. Добавляют по капле раствор натрий бис-(триметилсилил)амида (226 мл, 1М в тетрагидрофуране, 226 ммоль). Когда добавление закончено, нагревают реакционную смесь до 10oС и оставляют перемешиваться на 15 минут. Охлаждают на бане с сухим льдом/ацетоном, добавляют по капле этилбромацетат (37,7 г, 226 ммоль). Когда добавление этилбромацетата закончено, нагревают реакционную смесь до комнатной температуры. Через 18 часов распределяют реакционную смесь между диэтиловым эфиром и водой. Экстрагируют органический слой водой и насыщенным водным раствором хлорида аммония. Органический слой отделяют, сушат над MgSO4, фильтруют и концентрируют в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя смесью 33% этилацетатат-гексан. Удаляют оставшийся растворитель в вакууме при 82oС, получая указанное в заголовке соединение: Rf=0,37 (силикагель, 33% этилацетат-гексан).
Элементный анализ
Рассчитано для С18Н23NО6: С 61,88; Н 6,64; N 4,01.
Найдено: С 61,79; Н 6,62; N 3, 91.
1.2 Синтез этилового эфира (3-(3,4-диметоксифенил)-5-оксопирролидин-3-ил)уксусной кислоты
Объединяют диэтиловый эфир 3-циано-3-(3,4-диметоксифенил)пентандиоевой кислоты (1,
3 г, 3,
24 ммоль) и гексагидрат хлорида кобальта (II) (1,54 г, 6,48 ммоль) в метаноле (50 мл). Поддерживая температуру при 20oС или ниже при помощи бани со льдом, добавляют порциями
боргидрид
натрия (2,17 г, 57 ммоль). Когда добавление закончено, оставляют реакционную смесь стоять при комнатной температуре на 18 часов. Упаривают реакционную смесь в вакууме, получая остаток.
Разделяют
остаток между дихлорметаном и 1М раствором соляной кислоты. Несколько раз экстрагируют водный слой дихлорметаном, сушат над MgSO4, фильтруют и концентрируют в вакууме, получая
остаток.
Хроматографируют остаток на силикагеле, элюируя смесью этилацетат/метанол=20/1. Удаляют оставшийся растворитель в вакууме при 82oС, получая указанное в заголовке соединение: Rf=0,
74 (силикагель, этилацетат/метанол=5/1); т.пл. 116-118oС.
Элементный анализ
Рассчитано для C16H21NO5: С 62,53; Н 6,89;
N 4,56.
Найдено: С 62,52; Н 6,85; N 4,50.
1.3. 3-(3,4-диметоксифенил)-3-(2-гидроксиэтил)пирролидина
Объединяют литийалюминийгидрид (0,99 г, 26,0 ммоль) и
безводный
тетрагидрофуран (20 мл). Медленно добавляют этиловый эфир (3-(3,4-диметоксифенил)-5-оксопирролидин-3-ил)уксусной кислоты (2,0 г, 6,5 ммоль) в виде раствора в безводном тетрагидрофуране (40
мл). Когда
добавление закончено, нагревают смесь до кипения с обратным холодильником. Через 18 часов охлаждают на бане со льдом. Добавляют по капле воду (1 мл) с такой скоростью, чтобы температура
реакционной
смеси не поднималась выше 20oС. Охлаждают до 10oС, добавляют 15% раствор гидроксида натрия (1,0 мл). Добавляют воду (3 мл). Через 15 минут фильтруют реакционную
смесь и
концентрируют фильтрат в вакууме, получая указанное в заголовке соединение: Rf=0,68 (силикагель, этилацетат/метанол=5/1).
Готовят аналитический образец следующим образом: объединяют 3-(3,4-диметоксифенил)-3-(2-гидроксиэтил)пирролидин (0,51 г, 2,02 ммоль) и щавелевую кислоту (0,18 г, 2.00 ммоль) в тетрагидрофуране (70 мл). Через 18 часов фильтруют и сушат. Растирают с диэтиловым эфиром (100 мл), фильтруют и сушат в вакууме при 82oС, получая указанное в заголовке соединение в виде его соли - оксалата: т.пл. 140-142oС.
Элементный анализ
Рассчитано для C14H21NO3•C2H2O4: С 56,30; Н 6,79; N 4,10.
Найдено: С 56, 15; Н 6,76; N 4,13.
1.4.1 Синтез 1-(3,4,5-триметоксибензоил)-3-(3,4-диметоксифенил)-3-(2-гидроксиэтил)пирролидина
Объединяют 3-(3,4-диметоксифенил)-3-(2-гидроксиэтил)
пирролидин (2,27 г,
9,03 ммоль) и N-метилморфолин (2,48 мл, 22,6 ммоль) в безводном дихлорметане (100 мл). Охлаждают реакционную смесь до 5oС на бане со льдом. Медленно добавляют 3,4,
5-триметоксибензоилхлорид
(2,2 г, 9,5 ммоль) в виде раствора в дихлорметане (30 мл). Нагревают смесь до комнатной температуры. Через 18 часов экстрагируют реакционную смесь насыщенным раствором
карбоната калия. Сушат
органический слой над Na2SO4, фильтруют и концентрируют в вакууме, получая остаток. Остаток хроматографируют на силикагеле, элюируя смесью 95% дихлорметан
- метанол, получая
остаток. Объединяют остаток с дихлорметаном (100 мл) и экстрагируют трижды 1М раствором соляной кислоты и насыщенным раствором карбоната калия. Сушат органический слой над Na2SO4,
фильтруют и концентрируют в вакууме, получая остаток. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/ /метанол=20/1 и получая масло: Rf=0,14
(силикагель,
этилацетат/метанол= 20/1). Сушат в вакууме при 110oС, получая указанное в заголовке соединение в виде стекла: т.пл. 60-62oС.
Элементный анализ
Рассчитано для С24Н31НO7: С 64,70; Н 7,01; N 3,14.
Найдено: С 64,40; Н 7,21; N 2,85.
1.4.2 Синтез 1-(3,4,
5-триметоксибензоил)-3-(3,
4-диметоксифенил) -3-(2-гидроксиэтил)пирролидина
Объединяют 3-(3,4-диметоксифенил)-3-(2-гидроксиэтил) пирролидин (5,34 г, 21,2 ммоль) и карбонат натрия (1,24 г, 11,
7 ммоль) в смеси
этилацетатат/вода=4/1 (120 мл). Охлаждают реакционную смесь до -5oС на бане с солью и льдом. Медленно добавляют 3,4,5-триметоксибензоилхлорид (5.14 г, 22,3 ммоль) в виде
раствора в
этилацетате (60 мл) с такой скоростью, чтобы температура реакционной смеси не поднималась выше 0oС. Поддерживают температуру реакции около 0oС. Через 18 часов
отделяют
органический слой. Органический слой экстрагируют дважды 1М водным раствором соляной кислоты, насыщенным раствором карбоната калия, водой и насыщенным раствором хлорида натрия. Сушат
органический слой
над Na2SO4, фильтруют и концентрируют в вакууме, получая остаток. Объединяют водные слои и нейтрализуют насыщенным раствором бикарбоната натрия. Экстрагируют
нейтрализованные
водные слои дихлорметаном. Сушат органический слой над Na2SO4, фильтруют и концентрируют в вакууме, получая другой остаток. Остатки объединяют и
хроматографируют на силикагеле,
элюируя смесью дихлорметан/метанол=10/1 и получая остаток. Объединяют остаток с дихлорметаном (100 мл) и экстрагируют трижды 1М раствором соляной кислоты и насыщенным
раствором карбоната калия. Сушат
органический слой над Nа2SO4, фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение: Rf=0,23 (силикагель,
этилацетат/метанол=10/1).
1.5 Синтез 1-(3,4,5-триметоксибензоил)-3-(3,4-диметоксифенил)-3-(2-метансульфонилоксиэтил)пирролидина
Объединяют 1-(3,4,5-триметоксибензоил)-3-(3,
4-диметоксифенил)-3-(2-гидроксиэтил)пирролидин (0,43 г, 0,97 ммоль), триэтиламин (3,3 мл, 2,4 ммоль) и безводный дихлорметан (30 мл). Охлаждают реакционную смесь до -5oС на бане с солью и
льдом. Медленно добавляют метансульфонил хлорид (0,082 мл, 1,06 ммоль) с такой скоростью, чтобы температура реакционной смеси не поднималась выше 2oС. Нагревают смесь до комнатной
температуры. Через 18 часов гасят реакцию, добавляя лед. Органический слой отделяют и экстрагируют трижды 1М раствором соляной кислоты и дважды насыщенным раствором бикарбоната натрия. Сушат
органический слой над Na2SO4, фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение: Rf=0,48 (силикагель, этилацетат/метанол=20/1).
1.6 Синтез 1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-диметоксифенил)пирролидина
Объединяют 1-(3,4,
5-триметоксибензоил)-3-(3,4-диметоксифенил) -3-(2-метансульфонилоксиэтил)пирролидин (0,86 г, 1,64 ммоль), соль 4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидина и соляной кислоты (0,57
г,
1,97 ммоль), йодид натрия (0,25 г, 1,64 ммоль) и N,N-диизопропилэтиламид (0,84 г, 6,6 моль) в ацетонитриле (12 мл). Нагревают до температуры кипения с обратным холодильником. Через 10 часов
реакционную смесь охлаждают и разбавляют этилацетатом. Экстрагируют трижды насыщенным водным раствором хлорида аммония, дважды насыщенным водным раствором бикарбоната натрия и затем рассолом. Сушат
органический слой над Na2SO4, фильтруют и упаривают в вакууме, получая указанное в заголовке соединение.
1.7. Синтез 1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-диметоксифенил)пирролидина
Объединяют 1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-диметоксифенил)пирролидин (0,3 г, 0,4 ммоль) и гидроксид лития (60 мг, 2,4 ммоль) в смеси
тетрагидрофуран/вода (6 мл/6 мл). Через 3 часа реакционную смесь концентрируют в вакууме, удаляя большую часть тетрагидрофурана, и разбавляют водой. Доводят рН примерно до 7, применяя 1М водный
раствор соляной кислоты. Экстрагируют трижды дихлорметаном, регулируют рН таким образом, чтобы поддерживать рН 7 в водном слое. Сушат органический слой над МgSO4, фильтруют и упаривают в
вакууме, получая указанное в заголовке соединение.
Пример 2
1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин
2.1.1 Синтез диэтилового эфира 3-циано-3-(3, 4-дихлорфенил)пентандиоевой кислоты
Получают способом Примера 1.1, используя 3,4-дихлорфенилацетонитрил (30,0 г, 0,161 моль). Очистку выполняют способом перекристаллизации из диэтилового эфира, получая указанное в заголовке соединение: Rf=0,28 (силикагель, 20% этилацетат-гексан), т.пл. 68-69oС.
Элементный анализ
Рассчитано для C16H17Cl2NO4: С 53,65; Н 4,78; N 3,91.
Найдено: С 53,69; Н 4,79; N 3,93.
2.1.2. Синтез диэтилового эфира 3-циано-3-(3,
4-дихлорфенил)пентадиоевой кислоты
Охлаждают раствор натрий бис(триметилсилил)амида (480 фунтов=217,72 кг, 1М в ТГФ) примерно до -10oС и перемешивают. Добавляют раствор 3,
4-дихлорфенилацетонитрила в метил-трет-бутиловом эфире (34,5% по весу, 125 фунтов= 56,7 кг раствора) с такой скоростью, чтобы температура реакционной смеси не поднималась выше примерно 10o
С. Объединят этилбромацетат (94 фунта=42,64 кг) и метил-трет-бутиловый эфир (примерно 125 фунтов=56,7 кг) и охлаждают примерно до -18oС, а затем добавляют раствор, полученный выше, за
60-90
минут. По завершении реакции, что определяют хроматографически, добавляют воду (18 галлонов= 68,136 л). Добавляют 12М водный раствор соляной кислоты по рН примерно 4. Если рН падает ниже 3,
применяют
20% водный раствор гидроксида натрия, повышая рН примерно до 4. Разделяют слои и экстрагируют органический слой рассолом. Упаривают в вакууме при температуре около 40oС, получая
остаток.
Объединяют остаток и изопропанол (примерно 45 фунтов=20,4 кг) и упаривают в вакууме при температуре около 40oС, получая остаток. Добавляют изопропанол (190 фунтов=86,18 кг),
нагревают
примерно до 35oС и затем охлаждают примерно до -10oС, получая твердое вещество. Это твердое вещество собирают фильтрованием, промывают холодным изопропанолом и
центрифугируют,
получая указанное в заголовке соединение в виде влажного осадка, содержащего изопропанол.
2.1.1. Синтез этилового эфира (3-(3,
4-дихлорфенил)-5-оксопирролидин-3-ил)уксусной кислоты
Получают способом Примера 1.2, используя диэтиловый эфир 3-циано-3-(3,4-дихлорфенил)пентадиоевой кислоты (10 г, 28 ммоль). Очистку
проводят способом хроматографии на силикагеле, элюируя
последовательно смесью 3% метанол/дихлорметан и затем 6% метанол/дихлорметан, получая указанное в заголовке соединение.
2.2.2
Синтез этилового эфира (3-(3,
4-дихлорфенил)-5-оксопирролидин-3-ил)уксусной кислоты
Объединяют диэтиловый эфир 3-циано-3-(3,4-дихлорфенил) пентадиоевой кислоты (32 г, 89 ммоль) и этанол (150
мл) в склянке Парра (Parr).
Добавляют никель Ренея (100 г) и водный концентрированный раствор аммиака (40 мл). Проводят гидрирование при 3,515 кг/см2 (50 psi) в течение 24 часов. Фильтруют
через слои целита и
промывают твердое вещество этанолом. Упаривают фильтрат в вакууме, получая остаток. Остаток хроматографируют на силикагеле, элюируя 6% метанол/ дихлорметан и получая указанное в
заголовке соединение:
Rf=0,34 (силикагель, 6% метанол/дихлорметан), т.пл. 87-90oС.
Элементный анализ
Рассчитано для C14H15Cl2NO3:
С 53,18; Н 4,78; N 4,43.
Найдено: С 53,34; Н 4,71; N 4,51.
2.2.3. Синтез этилового эфира (3-(3,4-дихлорфенил)-5-оксопирролидин-3-ил)уксусной
кислоты
Объединяют никель Ренея (24 фунта=10,89 кг) и водный концентрированный раствор аммиака (19 фунтов=8,62 кг). В реактор для проведения процессов под давлением добавляют раствор
диэтилового эфира
3-циано-3-(3,4-дихлорфенил)пентадиоевой кислоты (15 фунтов=6,80 кг) и этанол (117 фунтов=53,07 кг). Проводят гидрирование при 14,06 кг/см2 (200 psi) и температуре 35oС. Через 20
часов реактор охлаждают, открывают, продувают азотом и фильтруют реакционную смесь. Промывают твердое вещество этанолом. Фильтрат упаривают в вакууме, получая остаток. Остаток
кристаллизуют, растворяя
его в этилацетате и растирая раствор с гептаном, получают твердое вещество. Собирают твердое вещество, получая указанное в заголовке соединение.
Элементный
анализ
Рассчитано
для C14H15Cl2NO3: С 53,18; Н 4,78; N 4,43.
Найдено: С 53,18; Н 4,72; N 4,46.
2.2.4. Синтез
этилового эфира (3-(3,
4-дихлорфенил)-5-оксопирролидин-3-ил)уксусной кислоты
Объединяют диэтиловый эфир 3-циано-3-(3,4-дихлорфенил) пентадиоевой кислоты (6,7 кг, влажный осадок, содержащий
изопропанол, примерно 3%
П.С.) и 3С этанол (52 кг) в реакторе для работы под давлением. Добавляют никель Ренея в воде (17,5 кг, примерно 11 кг активного катализатора) и водный концентрированный
раствор аммиака (8,7 кг).
Проводят гидрирование при 14,06 кг/см2 (200 psi) и 35oС. По завершении реакции реактор охлаждают, открывают и продувают азотом. Фильтруют через
мешочный фильтр, промывают
этанолом и затем фильтруют через фильтр плотностью 0,2 микрона и промывают твердое вещество этанолом. Фильтрат упаривают в вакууме, получая указанное в заголовке
соединение.
2.2.5.
Синтез этилового эфира (3-(3,4-дихлорфенил)-5-оксопирролидин-3-ил)уксусной кислоты
Объединяют никель Ренея (промытый дважды водой и дважды этанолом, 3,6
кг), диэтиловый эфир 3-циано-3-(3,
4-дихлорфенил)пентадиоевой кислоты (1260 г, 3,51 моль), этанол (9 л) и водный концентрированный раствор аммиака (1,6 л) в автоклаве на 18,9 л (5 галлонов).
Гидрирование проводят при 3,867 кг/см3 (55 psi). Через 20 часов реактор открывают, продувают азотом и фильтруют реакционную смесь. Твердое вещество промывают этанолом (примерно 1 л).
Упаривают фильтрат в вакууме, получая остаток.
Объединяют остаток и этилацетат (10 л) и экстрагируют дважды водой (1 л) и затем рассолом. Сушат органический слой над МgSO4, фильтруют и
концентрируют в вакууме, получая остаток. Остаток
кристаллизуют из этилацетата (примерно 1,8 л) и гептана (примерно 7,2 л), получая твердое вещество. Собирают это твердое вещество, получая указанное
в заголовке соединение: т.пл. 98-99o
С.
2.3. Синтез 3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина
Охлаждают раствор литийалюминийгидрида (450 мл, 1М в
тетрагидрофуране (45 ммоль) до -10oС на бане
лед/ацетон. Добавляют по капле раствор серной кислоты (12 мл, 99,999%, 225,3 ммоль) в тетрагидрофуране (35 мл). (Серную кислоту осторожно
добавляют к тетрагидрофурану и также осторожно добавляют
раствор серная кислота/тетрагидрофуран к раствору литийалюминийгидрида). Когда добавление завершено, перемешивают реакционную смесь 1 час.
Нагревают до комнатной температуры и перемешивают 2 часа.
Добавляют по капле раствор этилового эфира (3-(3,4-дихлорфенил)-5-оксопирролидин-3-ил)уксусной кислоты (23,2 г, 73,4 ммоль) в
тетрагидрофуране (70 мл). Нагревают до 45-50oС в течение 36
часов. Охлаждают на бане со льдом. Добавляют по капле раствор тетрагидрофуран/вода (1/1, 70 мл). Фильтруют и промывают остаток
на фильтре тетрагидрофураном и дихлорметаном, фильтрат сохраняют.
Объединяют остаток с фильтра со смесью тетрагидрофуран/вода/15% раствор гидроксида натрия (1 л, 70 мл/20 мл) и энергично перемешивают
в течение 2 часов. Фильтруют и объединяют этот фильтрат с
фильтратом, полученным выше. Концентрируют объединенные фильтраты в вакууме, получая остаток. Остаток растворяют в дихлорметане и сушат над
MgSO4, фильтруют и концентрируют в вакууме,
получая другой остаток. Перекристаллизовывают остаток из диэтилового эфира, получая указанное в заголовке соединение: Rf=0,27
(силикагель, дихлорметан/метанол/гидроксид аммония=9:1:0,2);
т.пл. 91-94oС.
Элементный анализ
Рассчитано для C12H15Cl2NO: С 55,40;
Н 5,81; N 5,38.
Найдено: С 55,64; Н 5,88; N 5,20.
2.4. Синтез 1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина
Объединяют 3-(3,
4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин (288 мг, 1,1
ммоль) и N-метилморфолин (0,25 мл, 2,27 ммоль) в дихлорметане (10 мл). Охлаждают до -78oС на бане сухой лед/ацетон. Добавляют
раствор 3,4,5-триметоксибензоилхлорида (250 мг, 1,1 ммоль) в
дихлорметане (3 мл). Нагревают смесь до 0oС. Через 1 час экстрагируют реакционную смесь 1М раствором соляной кислоты и 5%
раствором бикарбоната натрия. Сушат органический слой над МgSO4, фильтруют и концентрируют в вакууме, получая остаток. Остаток хроматографируют на силикагеле, элюируя последовательно
смесью 50% этилацетат/гексан и 6% метанол/дихлорметан, получая указанное
в заголовке соединение: Rf=0,38 (силикагель, 6% метанол/дихлорметан).
2.5.1. Синтез 1-(3,4,
5-триметоксибензоил)-3-(3,
4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидина
Получают способом Примера 1.5, используя для получения указанного в заголовке соединения 1-(3,4,
5-триметоксибензоил)-3-(3,
4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин.
2.5.2. Синтез 1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидина
Объединяют 1-(3,4,
5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин (200 мг, 0,44 ммоль) и N,N-диизопропилэтиламин (0,17 мл, 0,97 ммоль) в дихлорметане (25 мл). Охлаждают на бане
сухой лед/ацетон.
Добавляют по капле метансульфонилхлорид (0,066 г, 0,57 ммоль). Через 2 часа экстрагируют реакционную смесь 1М раствором соляной кислоты и 5% раствором бикарбоната натрия. Сушат
органический слой над
МgSO4, фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение: Rf=0,42 (силикагель, 6% метанол/дихлорметан), т.пл. 64,0-66,0oС.
2.5.3. Синтез 1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидина
Объединяют 1-(3,4,5-триметоксибензоил)-3-(3,
4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин
(200 мг, 0,44 ммоль) и N-метилморфолин (0,97 ммоль) в толуоле (10 мл). Добавляют по капле метансульфонилхлорид (0,066 г, 0,57 ммоль). Через 12 часов
разбавляют толуолом (20 мл) и экстрагируют 1М
раствором соляной кислоты и 5% раствором бикарбоната натрия. Сушат органический слой над MgSO4, фильтруют и концентрируют в вакууме, получая
указанное в заголовке соединение.
2.6. Синтез 1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидина
Получают способом Примера 1.6,
используя для получения указанного в заголовке соединения 1-(3,4,5-триметоксибензоил)-3-(3,
4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидин и соль
4-фенил-4-((3-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидина и соляной кислоты.
2.7. Синтез 1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,4-дихлорфенил)пирролидина
Получают способом Примера 1.7, используя для получения
указанного в заголовке соединения 1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((3-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин.
Пример
3
1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин;
3.1.1 Синтез диэтилового эфира 3-циано-3-фенилпентандиоевой кислоты
Получают способом Примера 1.1, используя фенилацетонитрил (5,85 г, 50,0 ммоль). Очистку выполняют способом хроматографии на силикагеле, элюируя 20% этилацетатом в гексане и получая указанное в заголовке соединение: Rf=0,23 (силикагель, 20% этилацетат/гексан).
3.1.2 Синтез диэтилового эфира 3-циано-3-фенилпентандиоевой кислоты
Объединяют фенилацетонитрил (5,85 г, 50,0 ммоль) и тетрагидрофуран (140 мл).
Охлаждают
реакционную смесь примерно до 5oС. Добавляют по капле раствор натрий бис(триметилсилил)амида (800 мл, 1М в тетрагидрофуране, 800 ммоль). По завершении добавления нагревают
реакционную смесь
до комнатной температуры и оставляют перемешиваться на 1 час. Полученный раствор переносят через трубку в охлажденный (-8oС) раствор этилбромацетата (84,5 мл, 762 ммоль)
в тетрагидрофуране
(500 мл) с такой скоростью, чтобы температура реакционной смеси не поднималась выше примерно 20oС. Оставляют перемешиваться при комнатной температуре. Через 18 часов
разбавляют реакционную
смесь диэтиловым эфиром (1,5 л) и экстрагируют насыщенным водным раствором хлорида аммония, затем водой и насыщенным водным раствором хлорида натрия. Сушат органический слой
над MgSО4,
фильтруют и концентрируют в вакууме, получая остаток. Остаток перегоняют способом "bulb-to-bulb distillation", получая указанное в заголовке соединение: т.кип. 140-150oС при 0,2 мм
рт.ст.
3.1.3 Синтез диэтилового эфира 3-циано-3-фенилпентандиоевой кислоты
Объединяют фенилацетонитрил (175,5 г, 1,5 моль) и тетрагидрофуран (1,95 л).
Охлаждают реакционную
смесь примерно до 0oС. Добавляют по капле примерно за 15 минут раствор натрий бис(триметилсилил)амида (3,2 л, 1М в тетрагидрофуране, 3,2 моль). По завершении
добавления нагревают
реакционную смесь до комнатной температуры и оставляют перемешиваться на 1 час. Полученный выше раствор переносят примерно за 45 минут в охлажденный (примерно -20oС)
раствор этилбромацетата
(510 г, 3,05 моль) в тетрагидрофуране (1,95 л). Нагревают до комнатной температуры и оставляют перемешиваться. Через 18 часов разбавляют реакционную смесь диэтиловым эфиром (3
л) и водой (1,5 л).
Экстрагируют дважды насыщенным водным раствором хлорида аммoния (2,25 л) и затем рассолом. Сушат органический слой над MgSO4, фильтруют и концентрируют в вакууме,
получая остаток. Остаток
перегоняют способом "bulb-to-bulb distillation", получая указанное в заголовке соединение: т. кип. 180-190oС при 30 мм рт.ст.
Элементный анализ
Рассчитано для
C16H19NO4: С 66,43; Н 6,62; N 4,84.
Найдено: С 66,34; Н 6,57; N 4,82.
3.2.1. Синтез этилового эфира
(3-фенил-5-оксопирролидин-3-ил)уксусной кислоты
Получают способом Примера 2.2.2, используя для получения указанного в заголовке соединения диэтиловый эфир 3-циано-3-фенилпентадиоевой
кислоты:
Rf=0,60 (силикагель, 6% метанол/дихлорметан).
3.2.2 Синтез этилового эфира (3-фенил-5-оксопирролидин-3-ил)уксусной кислоты
Объединяют диэтиловый эфир
3-циано-3-фенилпентадиоевой кислоты (93 г, 321 ммоль) и этанол (400 мл) в автоклаве на 7,5 л (2 галлона). Добавляют никель Ренея (280 г). Нагревают до 50oС и закачивают водород при 14,6
кг/см2 (200 p. s. i). Через 15 мин реактор открывают и добавляют водный концентрированный раствор аммиака (120 мл). Закачивают реактор водородом при 14,6 кг/см2 (200 p.s.i).
Спустя 7 часов реактор открывают и выдерживают в течение 18 часов. Фильтруют реакционную смесь через слой целита и промывают твердое вещество этанолом. Фильтрат упаривают в вакууме, получая остаток.
Объединяют остаток и смесь диэтиловый эфир/гексан 1/5 (500 мл) и охлаждают до (-20oС). Спустя 18 часов, смесь декантируют и добавляют смесь диэтиловый эфир/гексан 1/5 (500 мл) и охлаждают
до (-20oС), получая твердое вещество.
Собирают полученное твердое вещество фильтрацией и растирают со смесью диэтиловый эфир/гексан 1/5 (500 мл). Фильтруют и растворяют в диэтиловом эфире (300 мл) и добавляют гексан (700 мл), получая твердое вещество. Собирают полученное твердое вещество и сушат, получая названное в заголовке соединение.
Элементный
анализ
Рассчитано для С14Н17NО3: С 68,00; Н 6,93; N 5,66.
Найдено: С 67,63; Н 6,99; N 5,81.
3.2.3. Синтез этилового эфира
(3-фенил-5-оксопирролидин-3-ил)уксусной кислоты
Объединяют диэтиловый эфир 3-циано-3-фенилпентадиоевой кислоты (396,6 г, 1,37 ммоль), этанол (4 л) и концентрированный водный аммиак (530 мл)
в
автоклаве на 7,5 л (2 галлона).
Добавляют никель Ренея (410 г). Нагревают до 24oС и заканчивают водород при 14,96 кг/см2 (205 p.s.i); через 26 часов реактор открывают и продувают азотом. Реакционную смесь фильтруют через слой целита и промывают полученное твердое вещество этанолом (1,5 л).
Упаривают фильтрат в вакууме, получая указанное в заглавии соединение.
3.2.4. Синтез этилового эфира (3-фенил-5-оксопирролидин-3-ил)уксусной кислоты.
Объединяют диэтиловый эфир 3-циано-3-фенилпентандиоевой кислоты (243 г, 0,84 моль) и этанол (2,5 л), концентрированный водный раствор аммиака (325 мл) и никель Ренея (250 г, предварительно трижды промытый водой) в автоклаве на 7,57 л (2 галлона). Закачивают водород до 14,06 кг/см2 (200 psi). Нагревают до 50oС. Через 24 часа открывают реактор и продувают азотом. Фильтруют реакционную смесь через слой целита и промывают твердое вещество этанолом (1 л). Упаривают фильтрат в вакууме, получая указанное в заголовке соединение.
3.3.1. Синтез 3-фенил-3-(2-гидроксиэтил)пирролидина
Получают способом
Примера 1.3, используя этиловый эфир (пирролидин-3-ил)уксусной кислоты (8,7 г, 35 ммоль) для получения после перекристаллизации из смеси дихлорметан/диэтиловый эфир указанного в заголовке соединения:
т. пл. 115,0-117,0oС; Rf=0,03 (силикагель, 6% метанол/дихлорметан).
Элементный анализ
Рассчитано для C12H17NO: С 75,36; Н 8,96; N
7,32.
Найдено: С 75,78; Н 8,96; N 7,45.
3.3.2 Синтез 3-фенил-3-(2-гидроксиэтил)пирролидина
Объединяют этиловый эфир (3-фенил-5-оксопирролидин-3-ил)уксусной
кислоты (301 г, 1,25 моль) и тетрагидрофуран (3,5 л). Охлаждают примерно до 5oС. Медленно по капле добавляют за 45 минут раствор литийалюминийгидрида в тетрагидрофуране (3,9 л, 1М, 3,9
моль). Когда добавление завершено, нагревают до 60oС. Через 18 часов охлаждают на бане со льдом. Добавляют по капле смесь вода/тетрагидрофуран=1/1 (1,95 л) с такой скоростью, чтобы
температура реакционной смеси не повышалась выше 20oС. Разбавляют реакционную смесь тетрагидрофураном (2,25 л) и перемешивают. Через 1,5 часа реакционную смесь фильтруют. Твердое вещество
суспендируют в диэтиловом эфире (3 л) и фильтруют. Фильтраты объединяют и концентрируют в вакууме, получая остаток. Остаток объединяют с дихлорметаном (4 л) и экстрагируют трижды водой (1 л). Сушат
органический слой над MgSO4, фильтруют и концентрируют в вакууме, получая твердое вещество. Это твердое вещество растирают с диэтиловым эфиром (0,3 л), собирают фильтрованием, промывают
диэтиловым эфиром и сушат, получая указанное в заголовке соединение: Rf= 0,12 (силикагель, дихлорметан/метанол/концентрированный водный аммиак=9:1:0,1).
3.3.3 Синтез
3-фенил-3-(2-гидроксиэтил)пирролидина
Объединяют этиловый эфир (3-фенил-5-оксопирролидин-3-ил)уксусной кислоты (171 г, 0,69 моль) и тетрагидрофуран (2 л). Охлаждают примерно до 5o
С. Медленно по капле добавляют за 15 минут раствор литийалюминийгидрида в тетрагидрофуране (2,24 л, 1М, 2,24 моль). Когда добавление завершено, нагревают до 60oС. Через 18 часов охлаждают
на бане со льдом. Медленно гасят реакционную смесь, добавляя насыщенный водный раствор тартрата натрия-калия (208 мл). По завершении гашения добавляют Na2SО4 (100 г) и целит
(150
г) и перемешивают. Через 3 часа реакционную смесь разбавляют тетрагидрофураном (2 л) и фильтруют. Твердое вещество суспендируют в диэтиловом эфире (2 л) и фильтруют. Фильтраты объединяют и
концентрируют в вакууме, получая указанное в заголовке соединение: т. пл. 106-110oС; Rf= 0,12 (силикагель, дихлорметан/метанол/концентрированный водный аммиак=9:1:0,1).
3.4.1. Синтез 1-(3,4,5-триметоксибензоил)-3-фенил-3-(2-гидроксиэтил)пирролидина
Получают способом Примера 1.4.1, используя 3-фенил-3-(2-гидроксиэтил)пирролидин для получения
указанного в заголовке соединения: Rf=0,38 (силикагель, 6% метанол/дихлорметан).
3.4.2. Синтез 1-(3,4,5-триметоксибензоил)-3-фенил-3-(2-гидроксиэтил)пирролидина
Получают способом Примера 1.4.2, используя 3-фенил-3-(2-гидроксиэтил)пирролидин для получения указанного в заголовке соединения: Rf=0,05 (силикагель, этилацетат).
3.5
Синтез 1-(3,4,5-триметоксибензоил)-3-фенил-3-(2-метансульфонилоксиэтил)пирролидина
Объединяют 1-(3,4,5-триметоксибензоил)-3-фенил-3-(2-гидроксиэтил) пирролидин (0,5 г, 1,3 ммoль), N,
N-диизопропилэтиламин (0,5 мл, 2,9 ммоль) и безводньй дихлорметан (10 мл). Охлаждают на бане со льдом. Добавляют метансульфонилхлорид (201 мг, 1,36 ммоль). Через 2 часа разбавляют реакционную смесь
дихлорметаном и экстрагируют насыщенным раствором бикарбоната натрия. Сушат органический слой над MgSO4, фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение:
Rf=0,26 (силикагель, этилацетат).
3.6. Синтез 1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидина
Получают способом Примера 1.6, используя для получения указанного в
заголовке соединения 1-(3,4,5-триметоксибензоил)-3-фенил-3-(2-метансульфонилоксиэтил)пирролидин и соль
4-фенил-4-((2-карбоэтоксипиперидин-1-ил)карбоксамидо) пиперидина и соляной кислоты.
3.7 Синтез 1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксипиперидин-1-ил) карбоксамидо)
пиперидин-1-ил) этил)-3-фенилпирролидина
Получают способом Примера 1.7, используя
для получения указанного в заголовке соединения 1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин.
Пример
4
1-(3,4,
5-Триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
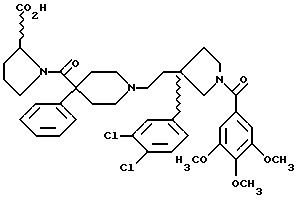
4.1 Синтез 1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((2-карбометоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3, 4-дихлорфенил)пирролидина
Получают способом Примера 1.6, используя для получения указанного в заголовке соединения 1-(3,4,5-триметоксибензоил)-3-(3, 4-дихлорфенил)-3-(2-метансульфонилоксиэтил) пирролидин и соль 4-фенил-4-((2-карбометоксипирролидин-1-ил)карбоксамидо)пиперидина и соляной кислоты.
4.2. Синтез 1-(3,4,
5-Триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина
Получают способом Примера 1.7, используя для получения
указанного в заголовке соединения 1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбометоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин.
Получение 2
4-(Пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин
Объединяют N-бензил-N-бис-(2-хлорэтил)амин гидрохлорид (72,0 г, 269 ммоль),
пирид-3-илацетонитрил (31,8 г, 269 ммоль) и гексадецилтрибутилфосфонийбромид (6 г) в водном растворе гидроксида натрия (50% по весу, 400 мл). Нагревают на паровой бане и интенсивно перемешивают.
Через
1,5 часа охлаждают реакционную смесь до комнатной температуры. Трижды экстрагируют реакционную смесь дихлорметаном. Объединяют органические слои и дважды экстрагируют водным 10% раствором
соляной
кислоты. Объединяют водные слои и доводят рН до основного водным раствором гидроксида натрия (50% по весу). Водный слой после подщелачивания экстрагируют трижды диэтиловым эфиром. Сушат
объединенные
эфирные слои над MgSO4 и фильтруют, получая фильтрат. Продувают фильтрат газообразным хлористым водородом, получая твердое вещество. Собирают твердое вещество фильтрованием и
сушат в
вакууме при 65oС, получая 1-бензил-4-(пиридил-3-ил)-4-цианопиперидин гидрохлорид.
Объединяют 1-бензил-4-(пирид-3-ил)-4-цианопиперидин гидрохлорид (10,0 г, 28 ммоль), гидроксид натрия (7,6 г, 190 ммоль) и воду (2 мл) в этиленгликоле (120 мл). Нагревают до кипения с обратным холодильником. Через 15 часов упаривают в вакууме, получая остаток. Объединяют остаток с метанолом (20 мл) и этанолом (20 мл) и перемешивают, получая твердое вещество. Удаляют твердое вещество фильтрованием. Добавляют к фильтрату этанол (50 мл) и перемешивают в течение 1 часа, получая второе твердое вещество. Удаляют второе твердое вещество фильтрованием и подкисляют фильтрат водным 12М раствором соляной кислоты. Упаривают подкисленный фильтрат, получая остаток. Объединяют остаток с дихлорметаном. Экстрагируют водой. Доводят рН водного слоя до 7, используя бикарбонат натрия. Упаривают водный слой в вакууме, получая остаток, объединяют остаток с этанолом и снова упаривают в вакууме, получая остаток. Объединяют остаток с метанолом и нагревают примерно до 50oС, получая суспензию. Суспензию фильтруют, добавляют к фильтрату ацетон (30 мл), получая твердое вещество. Собирают твердое вещество фильтрованием, промывают ацетоном и сушат, получая 1-бензил-4-(пирид-3-ил)пиперидин-4-карбоновую кислоту.
Объединяют 1-бензил-4-(пирид-3-ил)пиперидин-4-карбоновую кислоту (5,1 г), 4-карбоэтоксиметилпиперазин (5,8 г), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (5,0 г) и 1-гидроксибензотриазол гидрат (3,6 г) в диметилформамиде (130 мл). Через 60 часов разбавляют реакционную смесь этилацетатом (1 л). Экстрагируют разбавленную реакционную смесь насыщенным водным раствором бикарбоната натрия. Сушат органический слой над MgSO4, фильтруют и упаривают в вакууме, получая остаток. Растирают остаток с диэтиловым эфиром, фильтруют и сушат, получая 1-бензил-4-(пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил) карбоксамидо)пиперидин. Rf=0,52 (силикагель, дихлорметан/метанол/концентрированный водный аммиак=90/10/1).
Объединяют 1-бензил-4-(пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин (1,9 г) и этанол (200 мл). Добавляют 5% палладий на углероде (1,2 г). Гидрируют в аппарате для работы под давлением при 4,57 кг/см2 (65 psi). Через 17 часов фильтруют через целит, удаляя катализатор, и упаривают фильтрат в вакууме, получая остаток. Остаток хроматографируют на силикагеле, элюируя последовательно смесью дихлорметан/метанол=98/2, дихлорметан/метанол= 96/4, дихлорметан/метанол/концентрированный водный аммиак= 94/6/0,6 и дихлорметан/метанол/концентрированный водный аммиак=94/8/0,6, получая указанное в заголовке соединение.
Пример 5
(R)-1-(3,4,
5-Триметоксибензоил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
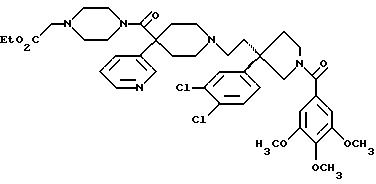
5.1.1 Разделение соли (S)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты и соли (R)-3-(3, 4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты
Объединяют 3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин (1,0 г, 38,5 ммоль) и бутанон. Добавляют раствор (R,R)-ди-пара-анизоилвинной кислоты (1,6 г, 38,0 ммоль) в бутаноне (80 мл). Нагревают до температуры кипения с обратным холодильником. Через 15 минут охлаждают до комнатной температуры и затем охлаждают дальше на бане соль со льдом. Отфильтровывают образовавшееся твердое вещество и промывают бутаноном. Перекристаллизовывают это твердое вещество из смеси вода/метанол, получая соль (S)-(-)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин (R, R)-ди-пара-анизоилвинной кислоты: т. пл. 201-204oС (разложение). [α]0D2 = -18,9° (с=0,60, диметилсульфоксид). Исследование рентгеновской дифракции отдельного кристалла подтверждает (S)-конфигурацию. Анализ способом высокоэффективной жидкостной хроматографии (ВЭЖХ) аналитического образца свободного амина, полученного экстракцией с использованием колонки CHIRAL-РАК AD 25 см х 0,46 см при элюировании смесью пентан/метанол/триэтиламин= 80/10/0,1 и скорости потока 1,0 мл/мин, показывает 96% энантиомерный избыток (96% эи), время удерживания (S)-изомера 11,2 минуты, время удерживания (R )-изомера 14,5 минуты.
5.1.2 Разделение соли (S)-3-(3,
4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты и соли (R)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты
Объединяют (R,R)-ди-пара-анизоилвинную кислоту (0,8 г, 19 ммоль) и водный 12М раствор соляной кислоты (0,16 мл, 19 ммоль) в смеси вода/метанол (10 мл/10 мл). Нагревают до температуры кипения с
обратным холодильником. Добавляют по капле раствор 3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина (1,0 г, 38,5 ммоль) в метаноле (10 мл). Через 15 минут медленно охлаждают реакционную смесь до
комнатной температуры. Отфильтровывают образовавшееся твердое вещество и промывают водой, получая соль (S)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты:
т.пл. 201-204oС (разложение). Анализ ВЭЖХ, описанный в Примере 5.1.1, показывает 97% энантиомерный избыток (97% эи).
5.1.3 Синтез и разделение соли (S)-3-(3,
4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты
Объединяют этиловый эфир (3-(3,4-дихлорфенил)-5-оксопирролидин-3-ил)уксусной кислоты (18,14 кг=40 фунтов) и
тетрагидрофуран (117,93 кг=260 фунтов). Продувают сосуд азотом. Добавляют раствор диметилсульфоксидного комплекса борана (17,24 кг=38 фунтов, 2М раствор в тетрагидрофуране). Нагревают до температуры
дефлегмации. Через 60 часов перегоняют до тех пор, пока внутренняя температура не поднимется примерно до 70oС, и тогда медленно гасят реакцию метанолом (294,83 кг=650 фунтов). Добавляют
воду (294,83 кг= 650 фунтов). Добавляют метансульфоновую кислоту (7,26 кг=16 фунтов). Нагревают до температуры дефлегмации и удаляют дистиллят с целью удаления основного количества оставшегося
тетрагидрофурана. Объединяют метанол (примерно 68,14 л=18 галлонов) и (R,R)-ди-пара-анизоилвинную кислоту (14,52 кг=32 фунта). Нагревают до температуры дефлегмации и переносят в сосуд, содержащий
указанный выше остаток. Добавляют затравочные кристаллы и медленно охлаждают до 10oС, получая твердое вещество. Собирают твердое вещество и объединяют с метанолом (548,88 л=145 галлонов) и
водой (548,88 л=145 галлонов). Нагревают до температуры дефлегмации. Через 1 час медленно охлаждают до 10oС, получая твердое вещество. Собирают это твердое вещество и после сушки получают
указанное в заголовке соединение.
5.1.4 Разделение с целью получения (S)-1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина
Объединяют 1-(3,4,
5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин (4,5 г, 9,9,9 ммоль) и смесь дихлорметан/пиридин (70 мл, 6/1). Добавляют уксусный ангидрид (1,04 мл, 11,0 ммоль) и
4-диметиламинопиридин (50 мг, 0,41 ммоль). Через 2 часа концентрируют реакционную смесь в вакууме, получая остаток. Растворяют этот остаток в этилацетате и экстрагируют 1М раствором соляной кислоты
(2
х 200 мл), насыщенным раствором бикарбоната натрия и насыщенным раствором хлорида натрия. Сушат органический слой над MgSO4, фильтруют и концентрируют в вакууме, получая остаток.
Остаток
хроматографируют на силикагеле, элюируя этилацетатом и получая 1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-ацетоксиэтил)пирролидин: Rf=0,38 (силикагель, этилацетат).
Элементный анализ:
Рассчитано для C24H27Cl2NO6: С 58,07; Н 5,48; N 2,82.
Найдено: С 57,67; Н 5,46; N 2,84.
Объединяют 1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-ацетоксиэтил)пирролидин (6,6 г, 13,3 ммоль) и дихлорметан (100 мл). Добавляют силикагель (32 г). Концентрируют суспензию в вакууме, получая остаток. Суспендируют остаток в фосфатном буфере (800 мл, 0,1 М, рН 7,5, буфер готовят из 11,5 г Н2РО4 (85%), разбавленной до 1 л деионизированной водой, и доводя рН до 7,5 гранулами твердого гидроксида калия, получая суспензию. Обрабатывают пасту посредством Lipase (13 г, ЕС 3.1.1.3, Типа VII, от Candida cylindracea). Контролируют реакцию ВЭЖХ на колонке CHIRALPAK AD 25 x 0,46 см, элюируя смесью пентан/этанол/метанол (80/15/5) при скорости потока 1,0 мл/мин. Аликвоту для анализа получают следующим образом: центрифугируют раствор 10 минут при 14000 см-1, удаляют супернатант и концентрируют в токе азота, получая остаток, растворяют его в дихлорметане (примерно 1 мл) и вводят в колонку для анализа. Если энантиомерный избыток удовлетворителен (>95% эи) для (+)-ацетата, реакционную смесь фильтруют. Промывают твердое вещество дихлорметаном (8 х 500 мл). Экстрагируют фильтрат дихлорметаном (8 х 500 мл). Хроматографируют твердые вещества на силикагеле, элюируя смесью 6% метанол/дихлорметан. Концентрируют объединенные смывы и экстракты в вакууме, получая остаток. Растворяют этот остаток в дихлорметане, сушат над MgSO4, фильтруют и концентрируют в вакууме, получая остаток. Хроматографируют этот остаток на силикагеле, элюируя этилацетатом и получая (+)-1-(3,4,5-триметоксибензоил)-3-(3, 4-дихлорфенил)-3-(2-ацетоксиэтил) пирролидин: Rf= 0,38 (силикагель, этилацетат).
Элементный анализ:
Рассчитано для C24H27Cl2
NO6•0,5H2O: С 57,14; Н 5,59; N 2,78.
Найдено: С 57,37; Н 5,45; N 2,87.
[α]2D0 = +36,4° (с=0,894, хлороформ).
Объединяют (+)-1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-ацетоксиэтил)пирролидин (670 мг, 1,35 ммоль) и водный раствор гидроксида лития (4,2 мл 1М) в метаноле (15 мл). Через 3,5 часа концентрируют в вакууме, получая остаток. Растворяют остаток в дихлорметане и экстрагируют 1М раствором соляной кислоты и насыщенным раствором бикарбоната натрия. Сушат органический слой над MgSO4, фильтруют и концентрируют в вакууме, получая остаток. Этот остаток сушат при высоком вакууме в течение 18 часов, получая (S)-1-(3,4, 5-триметоксибензоил)-3-(3, 4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин: Rf=0,11 (силикагель, этилацетат).
5.2.1 Синтез (S)-(+)-1-(3,4,5-триметоксибензоил)-3-(3,
4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина
Объединяют соль (S)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R, R)-ди-пара-анизоилвинной кислоты (0,14 г, 0,21 ммоль), этилацетат (15
мл), ацетонитрил (6 мл), воду (6 мл) и бикарбонат натрия (0,09 г, 1,03 ммоль). Охлаждают до 0oС на бане соль со льдом. Добавляют 3,4,5-триметоксибензоилхлорид (0,048 г, 0,21 ммоль). Через
30 минут при комнатной температуре разделяют реакционную смесь между этилацетатом и рассолом. Экстрагируют органический слой 1М раствором соляной кислоты, затем насыщенным водным раствором
бикарбоната
натрия. Сушат органический слой над МgSO4, фильтруют и упаривают в вакууме, получая указанное в заголовке соединение: Rf=0,11 (силикагель, этилацетат). [α
]2
D0 = +61,7° (с=1,01, метанол).
5.2.2 Синтез (S)-(+)-1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина
Объединяют соль
(S)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R, R)-ди-пара-анизоилвинной кислоты (6,0 г, 8,84 ммоль), ацетон (40 мл), воду (40 мл), гидроксид натрия (0,335 г, 8,87 ммоль)
и бикарбонат
натрия (3,73 г, 8,87 ммоль). Охлаждают примерно до 0oС. Добавляют примерно за 15 минут раствор 3,4,5-триметоксибензоилхлорида (2,2 г, 9,7 ммоль) в ацетоне (12 мл). Через 3
часа распределяют
реакционную смесь между этилацетатом и рассолом. Экстрагируют органический слой 1М раствором гидроксида натрия, насыщенным раствором бикарбоната натрия, 1М раствором соляной кислоты
и затем рассолом.
Сушат органический слой над MgSO4, фильтруют и упаривают в вакууме, получая указанное в заголовке соединение:
Rf=0,11 (силикагель, этилацетат).
5.3.
Синтез (S)-1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидина
Получают способом Примера 2.5.2., используя (S)-(+)-1-(3,4,
5-триметоксибензоил)-3-(3,
4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин (1,351 ммоль) и метансульфонилхлорид (0,14 мл, 1,81 ммоль) для получения указанного в заголовке соединения: Rf=0,11
(силикагель, этилацетат).
5.4.1. Синтез (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидина
Объединяют (S)-1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил) пирролидин (2 г),
4-(пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин (5,9 г) и N,
N-диизопропилэтиламин (1,53 г) в ацетонитриле (40 мл). Нагревают до температуры кипения с обратным
холодильником. Через 12 часов упаривают реакционную смесь в вакууме, получая остаток. Остаток
хроматографируют на силикагеле, элюируя последовательно этилацетатом, смесью дихлорметан/метанол= 98/2,
дихлорметан/метанол= 96,5/3,5, дихлорметан/метанол=95/5 и затем дихлорметан/метанол= 94/6,
получая указанное в заголовке соединение: Rf=0,11 (силикагель, дихлорметан/метанол= 9/1).
5.4.2. Синтез (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют
3,4,5-триметоксибензойную кислоту (3,
5 кг, 16,5 моль), 1,2-диметоксиэтан (14,2 кг) и диметилформамид (4 г). Охлаждают на бане со льдом. Добавляют оксалилхлорид (2,99 кг, 23,5 ммоль) в течение
примерно 50 минут, не давая температуре
реакции повышаться выше примерно 19oС. Через 20 часов концентрируют в вакууме при 25oС, удаляя примерно 3,7 кг дистиллята и получая
раствор 3,4,5-триметоксибензоилхлорида.
Объединяют соль (S)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R, R)-ди-пара-анизоилвинной кислоты (9,05 кг, 13,3 моль), карбонат калия (6,42 кг) в ацетоне (27,2 кг). Охлаждают примерно до 5oС и добавляют воду (31,42 л = 8,3 гал.). Охлаждают примерно до 3oС и медленно добавляют раствор 3,4, 5-триметоксибензоилхлорида (14,0 кг, 26,9% в 1,2-диметоксиэтане, 16,3 моль) примерно за 25 минут. По завершении реакции нагревают реакционную смесь до 25oС. Разбавляют реакционную смесь толуолом (36,35 кг). Разделяют слои и экстрагируют органический слой водой (7,57 л = 2 гал.), 3М водным раствором соляной кислоты и затем рассолом. Концентрируют органический слой в вакууме до тех пор, пока не останется примерно (18,93 л = 5 гал.). Добавляют толуол (18, 2 кг) и снова концентрируют в вакууме до тех пор, пока не останется примерно (18,93 л = 5 гал.). Добавляют толуол (36,15 кг) и охлаждают примерно до -3oС. Добавляют N-метилморфолин (6,85 кг, 67,7 моль) и затем метансульфонилхлорид (3,40 кг, 29,7 моль). По завершении реакции добавляют воду (18,17 л =4,8 галлона) и нагревают примерно до 25oС. Разделяют слои и экстрагируют органический слой 3М водным раствором соляной кислоты (18,1 кг). Разделяют слои, получая раствор (S)-1-(3,4, 5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидина.
Объединяют полученный выше раствор (S)-1-(3,4,5-триметоксибензоил)-3-(3, 4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидина, карбонат калия (4,07 кг, 29,5 моль), 4-(пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо) пиперидин (12,0 моль) и воду (12,49 л = 3,3 гал.). Нагревают примерно до 70oС. Когда реакция завершена, разбавляют реакционную смесь метилэтилкетоном (18,1 кг) и через 15 минут перемешивания разделяют слои. Экстрагируют органический слой водой (12,87 л = 3,4 гал.) и затем концентрируют в вакууме, получая указанное в заголовке соединение.
5.5. Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидина и соляной кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,
4-дихлорфенил)пирролидин (1,1 г) и дихлорметан (50 мл). Продувают газообразным
хлористым водородом (около 1,6 г) примерно за 10 минут. Упаривают в вакууме, получают остаток, дважды добавляют этанол
(50 мл) и упаривают в вакууме, получая после сушки указанное в заголовке
соединение.
Пример 6
(R)-1-(3,4,
5-Триметоксибензоил)-3-(2-(4-пирид-3-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
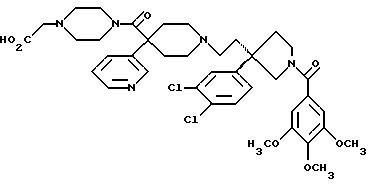
6.1. Синтез соли (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3, 4-дихлорфенил)пирролидина и соляной кислоты
Объединяют (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-(пирид-3-ил)-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3, 4-дихлорфенил)пирролидин (0,3 г, 0,4 ммоль) и гидроксид лития (59 мг, 2,34 ммоль) в смеси тетрагирофуран/вода (6 мл/6 мл). Охлаждают на бане со льдом. Через 2 часа упаривают в вакууме для удаления тетрагидрофурана, охлаждают на бане со льдом и подкисляют водную реакционную смесь (рН примерно 5), используя водный 1М раствор соляной кислоты. Доводят рН водной реакционной смеси примерно до 7, используя бикарбонат натрия, и экстрагируют дихлорметаном. Сушат органический слой над MgSO4 и фильтруют. Продувают фильтрат газообразным хлористым водородом и затем упаривают в вакууме, получая после сушки указанное в заголовке соединение: Rf=0,11 (силикагель, дихлорметан/метанол/концентрированный водный раствор аммиака=80/20/1).
Получение 3
Соль
4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидина и соляной
кислоты
Объединяют 1-трет-бутоксикарбонил-4-фенилпиперидин-4-карбоновую кислоту (27,0 г, 88,5 ммоль), N,
N-диизопропилэтиламин (34 мл, 0,195 моль), 4-карбоэтоксиметилпиперазин (5,8 г) и
1-гидроксибензотриазол гидрат (13,2 г, 98 ммоль) в дихлорметане (400 мл). Добавляют
1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (18,7 г, 87,5 ммоль). Через 20 часов разбавляют реакционную
смесь дихлорметаном и дважды экстрагируют водой. Сушат органический слой над MgSО4, фильтруют и упаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя
последовательно смесью 20% этилацетат/гексан, этилацетатом, смесью дихлорметан/метанол=94/6 и
затем дихлорметан/метанол=90/10, получая
1-трет-бутоксикарбонил-4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил) карбоксамидо)пиперидин.
Объединяют 1-трет-бутоксикарбонил-4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин (37,5 г, 78 ммоль) и дихлорметан (300 мл). Добавляют раствор соляной кислоты в диоксане (70 мл, 4М, 280 ммоль). Через 5 часов добавляют диэтиловый эфир и продолжают перемешивание, получая твердое вещество. Собирают твердое вещество, промывают диэтиловым эфиром и сушат, получая указанное в заголовке соединение.
Пример 7
1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-диметилфенил)пирролидин
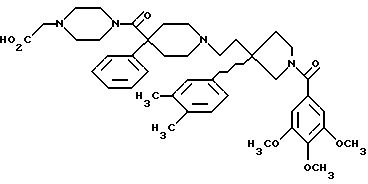
7.1.1. Синтез диэтилового эфира 3-циано-3-(3,4-диметилфенил)пентадиоевой кислоты
Объединяют 3, 4-диметилфенилацетонитрил (50,0 ммоль) и тетрагидрофуран (140 мл). Охлаждают примерно до 5oС. Добавляют по капле раствор натрий бис-(триметилсилил)амида (800 мл, 1М в тетрагидрофуране, 800 ммоль). Когда добавление закончено, нагревают реакционную смесь до комнатной температуры и оставляют перемешиваться на 1 час. Переносят полученный выше раствор через трубку в охлажденный (-8oС) раствор этилбромацетата (84,5 мл, 762 ммоль) в тетрагидрофуране (500 мл) с такой скоростью, чтобы температура реакционной смеси не повышалась выше 20oС. Оставляют перемешиваться при комнатной температуре. Через 18 часов разбавляют диэтиловым эфиром (1,5 л) и экстрагируют насыщенным водным раствором хлорида аммония, затем водой и насыщенным водным раствором хлорида натрия. Органический слой сушат над MgSO4, фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение.
7.1.2. Синтез диэтилового эфира 3-циано-3-(3,
4-диметилфенил)пентадиоевой кислоты
Охлаждают раствор натрий бис(триметилсилил)амида (723 мл, 1М в тетрагидрофуране, 723 ммоль) до 0oС на бане со льдом. Добавляют раствор 3,
4-диметилфенилацетонитрила (50,0 ммоль) в тетрагидрофуране (130 мл) примерно за 1,5 часа. Когда добавление закончено, нагревают реакционную смесь до комнатной температуры и оставляют перемешиваться.
Через 2 часа переносят полученный выше раствор через трубку в охлажденный (-50oС) раствор этилбромацетата (126 г, 757 ммоль) в тетрагидрофуране (250 мл). По завершении переноса дают
реакционной смеси нагреться до комнатной температуры. Через 18 часов разбавляют диэтиловым эфиром (1,5 л) и экстрагируют водой, 1М раствором соляной кислоты, насыщенным водным раствором бикарбоната
натрия и затем рассолом. Сушат органический слой над МgSO4, фильтруют и концентрируют в вакууме, получая остаток. Перекристаллизовывают остаток из диэтилового эфира, получая указанное в
заголовке соединение в виде твердого вещества.
7.2.1 Синтез этилового эфира (3-(3,4-диметилфенил)-5-оксопирролидин-3-ил)уксусной кислоты
Получают способом примера 2.2.2,
используя для получения указанного в заголовке соединения диэтиловый эфир 3-циано-3-(3,4-диметилфенил)пентадиоевой кислоты.
7.2.2 Синтез этилового эфира (3-(3,
4-диметилфенил)-5-оксопирролидин-3-ил)уксусной кислоты
Объединяют диэтиловый эфир 3-циано-3-(3,4-диметилфенил) пентадиоевой кислоты (56 г, 177 ммоль) и этанол (500 мл) в склянке Парра
(Parr).
Добавляют никель Ренея (50 г) и водный концентрированный раствор аммиака (85 мл). Проводят гидрирование при 50oС и 70,3 кг/см2 (100 psi) в течение 48 часов. Фильтруют
через слои
целита и промывают твердое вещество этанолом. Фильтрат упаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя смесью 6% метанол/дихлорметан и получая
указанное в
заголовке соединение.
7.3 Синтез 3-(3,4-диметилфенил)-3-(2-гидроксиэтил)пирролидина
Получают способом Примера 2.3, используя этиловый эфир (3-(3,
4-диметилфенил)-5-оксопирролидин-3-ил)уксусной кислоты для получения после перекристаллизации из смеси дихлорметан/диэтиловый эфир указанного в заголовке соединения: Rf= 0,35 (силикагель,
дихлорметан/метанол/уксусная кислота= 85/10/5).
7.4 Синтез 1-(3,4,5-триметоксибензоил)-3-(3,4-диметилфенил)-3-(2-гидроксиэтил)пирролидина
Объединяют 3-(3,
4-диметилфенил)-3-(2-гидроксиэтил)пирролидин (20 ммоль) и бикарбонат натрия (8,4 г) в смеси ацетон (50 мл)/вода (50 мл). Добавляют раствор 3,4,5-триметоксибензоилхлорида (4,6 г, 19,9 ммоль) в ацетоне
(50 мл). Через 3 часа трижды экстрагируют реакционную смесь этилацетатом. Сушат органический слой над MgSО4, фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение:
Rf=0,25 (силикагель, 6% метанол/дихлорметан).
7.5. Синтез 1-(3,4,5-триметоксибензоил)-3-(3,4-диметилфенил)-3-(2-метансульфонилоксиэтил)пирролидина
Получают
способом Примера 2.5.2, используя 1-(3,4,5-триметоксибензоил)-3-(3,4-диметилфенил)-3-(2-гидроксиэтил) пирролидин для получения указанного в заголовке соединения: Rf=0,11 (силикагель,
этилацетат).
7.6 Синтез 1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-диметилфенил)пирролидина
Получают способом Примера 1.6, используя 1-(3,4,5-триметоксибензоил)-3-(3,4-диметилфенил)-3-(2-метансульфонилоксиэтил)пирролидин и 4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин
для получения указанного в заголовке соединения.
7.7. Синтез 1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо) пиперидин-1-ил)этил)-3-(3,
4-диметилфенил)пирролидина
Получают способом Примера 1.7, используя 1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,
4-диметилфенил)пирролидин для получения указанного в заголовке соединения.
Получение 4
Соль 4-фенил-4-(94-карбоэтоксиметилпиперазин-1-ил)карбоксамидо) пиперидина и соляной
кислоты
Объединяют
1-трет-бутоксикарбонил-4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин (26,0 г, 56,7 ммоль) и дихлорметан (40 мл). Добавляют газообразный йодистый
водород (2,8 г). Через 3 часа упаривают в вакууме, получая после сушки указанное в заголовке соединение.
По-другому, объединяют 1-трет-бутоксикарбонил-4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин (10,0 г, 21,8 ммоль) и этанол (700 мл). Добавляют водный раствор йодистоводородной кислоты (57%, 6,1 мл, 45, 75 ммоль). Через 2 часа нагревают до кипения с обратным холодильником. Через 19 часов охлаждают до комнатной температуры и разбавляют реакционную смесь диэтиловым эфиром (300 мл), получая твердое вещество. Охлаждают на бане со льдом. Через 1 час собирают твердое вещество фильтрованием, промывают диэтиловым эфиром и сушат, получая указанное в заголовке соединение.
Элементный
анализ:
Рассчитано для С20Н29Н3О3•2Hl: С 39,04; Н 5,08; N 6,83.
Найдено: С 39,14; Н 5,38; N 6,88.
Пример
8
(R)-1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
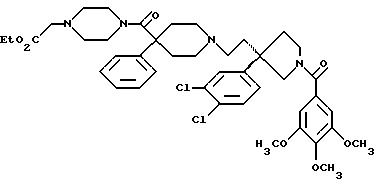
8.1.1 Синтез (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин) этил)-3-(3, 4-дихлорфенил)пирролидина
Объединяют (S)-1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидин (2 г), соль 4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидина и йодистоводородной кислоты (3,1 г, 5 ммоль) и N,N-диизопропилэтиламин (3 мл) в ацетонитриле (25 мл). Нагревают до кипения с обратным холодильником. Через 28 часов охлаждают реакционную смесь и разбавляют этилацетатом (200 мл). Фильтруют разбавленную реакционную смесь и экстрагируют фильтрат дважды насыщенным водным раствором бикарбоната натрия и затем рассолом. Сушат органический слой над MgSО4, фильтруют и упаривают в вакууме, получая остаток. Объединяют остаток и смесь диэтиловый эфир/этилацетат (300 мл/70 мл). Нагревают до кипения с обратным холодильником и фильтруют, получая фильтрат. Объединяют фильтрат и щавелевую кислоту (1 г), получая твердое вещество. Собирают твердое вещество фильтрованием. Объединяют твердое вещество и смесь дихлорметан/насыщенный водный раствор бикарбоната натрия (500 мл/500 мл) и перемешивают. Отделяют органический слой над MgSО4, фильтруют и упаривают в вакууме, получая указанное в заголовке соединение. Rf=0,39 (силикагель, 6% метанол/дихлорметан).
8.1.2. Синтез (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют (S)-1-(3,4,5-триметоксибензоил)-3-(3,
4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидин (43,4 г, 81,5 ммоль), соль 4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидина и соляной кислоты (32 г, 70 ммоль) и карбонат
калия (35 г, 253 ммоль) в тетрагидрофуране (225 мл) и воде (75 мл). Нагревают до кипения с обратным холодильником. Через 108 часов охлаждают реакционную смесь и отделяют органический слой. Дважды
экстрагируют водный слой дихлорметаном. Объединяют органические слои и сушат над MgSО4, фильтруют и упаривают в вакууме, получая остаток. Этот остаток хроматографируют на силикагеле,
элюируя последовательно этилацетатом, смесью 1% метанол/дихлорметан, 2% метанол/дихлорметан, 3% метанол/дихлорметан, 4% метанол/дихлорметан, 5% метанол/дихлорметан и затем 6% метанол/дихлорметан,
получая указанное в заголовке соединение.
HBMS
Рассчитано для С42Н53Сl2N4О7: 795,329131.
Найдено 795, 329832.
8.2.1 Синтез соли (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и щавелевой кислоты.
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (1,0 г, 1,26 ммоль) и толуол (10 мл). Добавляют щавелевую кислоту (0,25 г, 2,8 ммоль). Добавляют этилацетат (5 мл), получая твердое вещество. Через 30 минут собирают твердое вещество фильтрованием, промывают толуолом и сушат, получая указанное в заголовке соединение.
8.2.2. Синтез соли (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин) этил)-3-(3,4-дихлорфенил)пирролидина и щавелевой кислоты.
Объединяют (R) -1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (1,0 г, 1,26 ммоль) и толуол (10 мл). Добавляют щавелевую кислоту (0, 125 г, 1,4 ммоль). Добавляют этилацетат (3 мл), получая твердое вещество. Через 30 минут собирают твердое вещество фильтрованием, промывают толуолом и сушат, получая указанное в заголовке соединение.
8.2.3 Синтез соли (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и щавелевой кислоты.
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (1,0 г, 1, 26 ммоль) и бутанон (20 мл). Добавляют раствор щавелевой кислоты (0,125 г, 1,4 ммоль) в бутаноне (5 мл), получая твердое вещество. Через 5 минут собирают твердое вещество фильтрованием и сушат, получая указанное в заголовке соединение.
8.3.1. Синтез соли (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,
4-дихлорфенил)пирролидина и соляной кислоты
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,
4-дихлорфенил)пирролидин (45,6 г, 57,3 ммоль) и дихлорметан (600 мл) и фильтруют. Через 1 час упаривают в вакууме, получая остаток. Растирают этот остаток с диэтиловым эфиром, фильтруют и сушат,
получая указанное в заголовке соединение.
8.3.2. Синтез соли (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,
4-дихлорфенил)пирролидина и соляной кислоты
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,
4-дихлорфенил)пирролидин (1,19 г, 1,46 ммоль) и дихлорметан (15 мл). Охлаждают на бане со льдом. Продувают раствор газообразным хлористым водородом. Через 1 час упаривают в вакууме, получая указанное
в заголовке соединение.
8.4. Синтез соли (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,
4-дихлорфенил)пирролидина
и малеиновой кислоты
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,
4-дихлорфенил)пирролидин (0,88 г, 1,1
ммоль) и этанол (5 мл). Нагревают до кипения с обратным холодильником. Добавляют раствор малеиновой кислоты (0,28 г, 2,4 ммоль) в этаноле (5 мл). Через 5 минут
дают реакционной смеси охладиться и
добавляют диэтиловый эфир, получая твердое вещество. Собирают твердое вещество фильтрованием и сушат, получая указанное в заголовке соединение.
8.5.1. Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и фумаровой кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин) этил)-3-(3,4-дихлорфенил)пирролидин (1,0 г, 1,26 ммоль) и этилацетат (5 мл).
Нагревают до кипения с
обратным холодильником. Добавляют раствор фумаровой кислоты (0,32 г, 2,76 ммоль) в смеси этилацетат/этанол (5 мл/5 мл). Через 5 минут дают реакционной смеси охладиться и
упаривают в вакууме, получая
остаток. Растирают этот остаток с диэтиловым эфиром, получая указанное в заголовке соединение.
8.5.2. Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо) пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и фумаровой кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (1,0 г, 1,26 ммоль) и этанол (20 мл). Нагревают до кипения с
обратным
холодильником. Добавляют фумаровую кислоту (0,302 г). Через 15 минут дают реакционной смеси охладиться и упаривают в вакууме, получая остаток. Растирают этот остаток с диэтиловым эфиром,
получая
твердое вещество. Собирают твердое вещество фильтрованием и сушат, получая указанное в заголовке соединение.
Элементный анализ:
Рассчитано для C48H58
Cl2N4О13•1,27 H2O: С 58,07; Н 6,15; N 5,64.
Найдено: С 57,95; Н 6,13; N 5,46.
8.6.1. Синтез соли (R)-1-(3,
4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо) пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и лимонной кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (2,0 г, 2,6 ммоль) и этилацетат (10 мл). Нагревают примерно до
50oС. Добавляют раствор лимонной кислоты (0,5 г, 2,6 ммоль) в этаноле (5 мл). Через 30 минут дают реакционной смеси охладиться и добавляют диэтиловый эфир, получая твердое вещество.
Упаривают в
вакууме, получая указанное в заголовке соединение.
8.6.2. Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и лимонной кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (0,5 г, 0,65 ммоль) и этилацетат (4 мл). Нагревают примерно до
50oС. Добавляют раствор лимонной кислоты (0,25 г, 1,3 ммоль) в этаноле (2 мл). Через 30 минут дают реакционной смеси охладиться и добавляют диэтиловый эфир, получая твердое вещество.
Упаривают в
вакууме, получая указанное в заголовке соединение.
8.6.3. Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и лимонной кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (1,0 г) и этанол 30 мл). Добавляют раствор лимонной кислоты (0,5 г)
в
этаноле (5 мл). Через 1 час упаривают в вакууме, получая указанное в заголовке соединение.
8.7 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и метансульфоновой кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (2,0 г, 2,6 ммоль) и этанол (10 мл). Нагревают примерно до 45oС. Добавляют раствор метансульфоновой кислоты (1,0 г, 10,4 ммоль) в диэтиловом эфире (2 мл). Через 30 минут добавляют диэтиловый эфир, получая твердое вещество. Упаривают в вакууме и добавляют
диэтиловый эфир. Четыре раза декантируют растворитель и добавляют диэтиловый эфир. Собирают твердое вещество фильтрованием и сушат, получая указанное в заголовке соединение.
8.8
Синтез соли (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и 2-гидроксиэтансульфоновой кислоты
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (1,0 г, 1,26 ммоль) и этанол (10 мл).
Добавляют
водный раствор 2-гидроксиэтансульфоновой кислоты (14 мл, 0.18М, 2,52 ммоль). Нагревают до кипения с обратным холодильником. Через 15 минут охлаждают и упаривают в вакууме, получая остаток.
Растирают
остаток с диэтиловым эфиром, получая твердое вещество. Собирают твердое вещество фильтрованием и сушат, получая указанное в заголовке соединение.
8.9 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и бромистоводородной кислоты
Объединяют этанол (1 мл) и
диэтиловый эфир (10 мл). Охлаждают на бане со льдом. Добавляют ацетилбромид (0,2 мл). Через 5 минут добавляют полученный выше раствор к раствору (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина (2 г) в этилацетате (20 мл). Добавляют диэтиловый эфир (40 мл),
получая твердое вещество. Через 1,5 часа фильтруют, промывают диэтиловым эфиром и сушат, получая указанное в заголовке соединение.
8.10 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и винной кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-((3,4-дихлорфенил)пирролидин (1,0 г, 1,26 ммоль) и (1)-винную кислоту (0,6 г) в ацетоне (25 мл).
Нагревают примерно по 50oС. Через 1 час охлаждают до комнатной температуры. Через 72 часа концентрируют в вакууме и добавляют диэтиловый эфир (40 мл), получая твердое вещество. Собирают
твердое вещество фильтрованием, промывают диэтиловым эфиром и сушат, получая указанное в заголовке соединение.
8.11 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и этансульфоновой кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (0,88 г) и этанол (20 мл). Добавляют этансульфоновую кислоту (0,24
г). Через 30 минут концентрируют реакционную смесь в вакууме, получая остаток. Объединяют этот остаток с диэтиловым эфиром и упаривают, получая указанное в заголовке соединение.
8.12
Синтез соли (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо) пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и (1R)-(-)-10-камфорсульфоновой кислоты
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (1,0 г, 1,26 ммоль) и
(1R)-(-)-10-камфорсульфоновую кислоту (0,6 г) в ацетоне (25 мл). Нагревают примерно до 50oС. Через 1 час охлаждают до комнатной температуры. Через 72 часа концентрируют в вакууме и
добавляют диэтиловый эфир (40 мл), получая твердое вещество. Собирают твердое вещество фильтрованием, промывают диэтиловым эфиром и сушат, получая указанное в заголовке соединение.
Пример 9
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
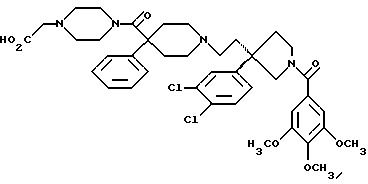
9.1 Синтез (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3, 4-дихлорфенил)пирролидина
При охлаждении на бане со льдом объединяют соль (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3, 4-дихлорфенил)пирролидин соляной кислоты (1,0 г, 1,2 ммоль) и гидроксид лития (0,3 г, 12,6 ммоль) в смеси тетрагидрофуран/вода (20 мл/20 мл). Через 5 часов упаривают реакционную смесь в вакууме, удаляя большую часть тетрагидрофурана. Доводят рН до 6, используя 1М водный раствор соляной кислоты. Экстрагируют нейтрализованную водную реакционную смесь дихлорметаном. Сушат органический слой над MgSО4, фильтруют и упаривают в вакууме, получая указанное в заголовке соединение.
9.2 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (2,25 г, 2,94 ммоль) и насыщенный раствор соляной кислоты в
дихлорметане
(200 мл). Через 2 часа упаривают реакционную смесь в вакууме, получая указанное в заголовке соединение. HRMS рассчитано для C40H49Cl2N4О7: 767,
297831. Найдено 767,298515.
Получение 5
2-Метокси-5-(1Н-тетразол-1-ил)бензоилхлорид
Объединяют 2-гидрокси-5-нитробензойную кислоту (21,5 г, 117 ммоль),
карбонат
калия (162,3 г, 1,174 моль) и метилиодид (136,8 г, 96,4 ммоль) в ацетоне (500 мл). Нагревают до кипения с обратным холодильником. Через 18 часов охлаждают реакционную смесь до комнатной
температуры и
добавляют метилиодид (136,8 г, 96,4 ммоль). Снова нагревают до кипения с обратным холодильником. Через 56 часов охлаждают реакционную смесь до комнатной температуры и фильтруют,
промывают ацетоном и
упаривают фильтрат в вакууме, получая остаток. Перекристаллизовывают остаток из этанола, получая второй остаток. Объединяют второй остаток и хлороформ (примерно 100 мл),
фильтруют и упаривают фильтрат
в вакууме, получая 2-метокси-5-нитробензоат. Rf=0,38 (силикагель, этилацетат/гексан=1/1).
Объединяют метил 2-метокси-5-нитробензоат (13,3 г, 63 ммоль) и метанол. Добавляют 5% палладий-на-углероде (0,66 г). Гидрируют в установке для работы под давлением при 3,515 кг/см2 (50 psi). Через 17 часов фильтруют через целит, удаляя катализатор, и упаривают фильтрат в вакууме, получая остаток. Объединяют этот остаток и дихлорметан и экстрагируют водой. Сушат органический слой над Na2SО4, фильтруют и упаривают в вакууме, получая метил 2-метокси-5-аминобензоат. Rf=0,18 (силикагель, этилацетат/гексан=1/1).
Рассчитано для С9Н11NО3: С 59,66; Н 6,12; N 7,73.
Найдено: С 59,44; Н 6,04; N 7,62.
Объединяют метил 2-метокси-5-аминобензоат (3,94 г, 21,7 ммоль) и триэтилортоформиат (12,8 г, 86,7 ммоль) в ледяной уксусной кислоте (20 мл). Через 20 часов концентрируют реакционную смесь в вакууме, удаляя этанол. Добавляют ледяную уксусную кислоту (20 мл) и азид натрия (5,64 г, 86,7 ммоль). Нагревают по 70oС. Через 1 час добавляют ледяную уксусную кислоту (10 мл) и продолжают нагревание до 70oС. Еще через час охлаждают реакционную смесь до комнатной температуры, разбавляют водой (500 мл). Собирают твердое вещество фильтрованием, промывают водой и сушат, получая метил 2-метокси-5-(1Н-тетразол-1-ил)бензоат.
Объединяют метил 2-метокси-5-(1Н-тетразол-1-ил)бензоат (2, 86 г, 12,2 ммоль) и 1М водный раствор гидроксида натрия (13,43 мл, 13,43 ммоль) в смеси метанол/вода (100 мл, 5:1 об./об.). Нагревают до кипения с обратным холодильником. Через 4 часа концентрируют в вакууме, удаляя большую часть метанола, добавляют воду (50 мл) и доводят рН примерно до 4, используя 1М водный раствор соляной кислоты. Упаривают в вакууме, получая твердое вещество, суспендируют это твердое вещество с водой, фильтруют и сушат, получая 2-метокси-5-(1H-тетразол-1-ил)бензойную кислоту.
По-другому, объединяют метил 2-метокси-5-(lH-тетразол-1-ил)бензоат (13,3 г, 56,8 ммоль) и метанол (150 мл). Добавляют 1М водный раствор гидроксида натрия (62,5 мл, 62,5 ммоль). Нагревают до кипения с обратным холодильником. Через 30 минут добавляют метанол (50 мл) и воду (50 мл) и продолжают нагревать при кипении с обратным холодильником. Через 1 час концентрируют в вакууме, удаляя большую часть растворителя. Доводят рН примерно до 1-2, используя 1М водный раствор соляной кислоты, получая твердое вещество. Собирают твердое вещество фильтрованием, промывают водой и сушат, получая 2-метокси-5-(1Н-тетразол-1-ил)бензойную кислоту.
Объединяют 2-метокси-5-(1Н-тетразол-1-ил)бензойную кислоту (1,2 г, 5.5 ммоль) и дихлорметан (40 мл). Добавляют по капле оксалилхлорид (0,72 мл, 8,25 ммоль), а затем диметилформамид (3 капли). Через 4 часа упаривают в вакууме и сушат, получая указанное в заголовке соединение.
Пример 10
(R)-1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин
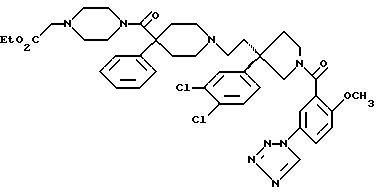
10.1. Синтез (S)-1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(3, 4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина
Объединяют соль (S)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин и (R, R)-ди-пара-анизоилвинной кислоты (1,21 г, 5,5 ммоль) и бикарбонат натрия (2,6 г, 31 ммоль) в смеси ацетон/вода (20 мл/20 мл). Охлаждают реакционную смесь на бане со льдом. Добавляют 2-метокси-5-(1Н-тетразол-1-ил)бензоилхлорид (1,48 г, 6,2 ммоль). Через 30 минут нагревают до комнатной температуры. Через 6 часов фильтруют реакционную смесь и экстрагируют фильтрат этилацетатом. Экстрагируют органический слой насыщенным водным раствором бикарбоната натрия и затем рассолом. Сушат органический слой над MgSO4, фильтруют и упаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно этилацетатом, смесью 3% метанол/этилацетат и затем 6% метанол/этилацетат, получая указанное в заголовке соединение. Rf=0,38 (силикагель, 6% метанол/дихлорметан).
10.2.
(S)-1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(3,
4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидина
Получают способом Примера 2.5.2, используя
(S)-1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(3,
4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин (0,6 г, 1,3 ммоль) и метансульфонилхлорид (0,12 мл, 1,55 ммоль) для получения указанного в заголовке
соединения: Rf=0,20 (силикагель,
этилацетат).
10.3 (R)-1-(2-метокси-5-(1Н-тетразол-1-ил)
бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют (S)-1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(3,
4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидин (1,0 г, 1,62 ммоль), соль
4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидина и соляной кислоты (0,81 г, 1,3 ммоль) и N,
N-диизопропилэтиламин (1 мл, 5,8 ммоль) в ацетонитриле (25 мл). Нагревают до кипения с
обратным холодильником. Через 15 часов охлаждают и упаривают в вакууме, получая остаток. Распределяют остаток
между водой и этилацетатом. Отделяют органический слой и экстрагируют насыщенным водным
раствором бикарбоната натрия, а затем рассолом. Сушат органический слой над MgSО4, фильтруют и
упаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя
последовательно этилацетатом, смесью 3% метанол/этилацетат и затем 6% метанол/этилацетат, получая указанное в
заголовке соединение. Rf=0,11 (силикагель, 6% метанол/дихлорметан).
10.4. Синтез соли
(R)-1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и соляной
кислоты
Объединяют
(R)-1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (0,74 г, 0,91
ммоль) и дихлорметан (25 мл).
Охлаждают на бане со льдом. Добавляют при перемешивании газообразный хлористый водород. Через 1 час упаривают в вакууме, получая остаток. Добавляют дихлорметан,
упаривают в вакууме и сушат, получая
указанное в заголовке соединение.
Пример 11
Соль
(R)-1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)
этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
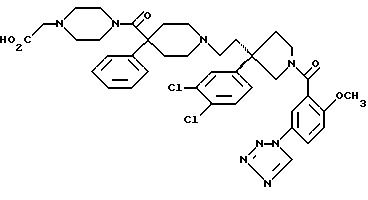
11.1. Синтез соли (R)-1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
Объединяют соль (R)-1-(2-метокси-5-(1Н-тетразол-1-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты (0,3 г, 0,34 ммоль) и гидроксид лития (50 мг, 2,1 ммоль) в смеси тетрагидрофуран/вода (10 мл/10 мл). Через 2 часа упаривают в вакууме, удаляя основную часть тетрагидрофурана. Доводят рН до 6, используя 1М водный раствор соляной кислоты. Упаривают водную реакционную смесь в вакууме, получая остаток. Объединяют этот остаток и этанол и снова упаривают в вакууме, получая остаток, добавляют воду, перемешивают и декантируют, получая остаток. Объединяют этот остаток и 1М раствор соляной кислоты и упаривают в вакууме, затем добавляют этанол и упаривают в вакууме, получая после сушки указанное в заголовке соединение. Элементный анализ
Рассчитано для С39Н44Сl2Н8О5•2НСl•3,71H2O: С 51,17; Н 5,88; N 12,24.
Найдено: С 51,35; Н 5,80; N 12,02.
Пример 12
(S)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
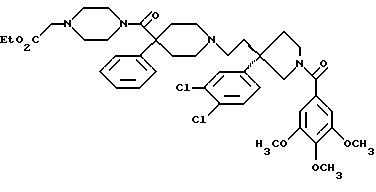
12.1 Разделение соли (R)-(+)-3-(3, 4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (S,S)-ди-пара-анизоилвинной кислоты (0,14 г, 0,21 ммоль)
Объединяют (S,S)-ди-пара-анизоилвинную кислоту (14,77 г, 35 ммоль), воду (200 мл) и метанол (200 мл). Нагревают до кипения с обратным холодильником. Добавляют по капле раствор 3-(3, 4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина (18,36 г, 70 ммоль) в метаноле (135 мл). Через 1,5 часа добавляют воду (135 мл) и медленно охлаждают реакционную смесь до комнатной температуры, получая твердое вещество. Отфильтровывают образовавшееся твердое вещество и промывают водой, получая указанное в заголовке соединение: т.пл. 201-202oС (разложение). Анализ ВЭЖХ, описанный в Примере 5.1.1, показывает 99,9% энантиомерный избыток (99,9% эи). [α]2D0=+17,9o (с=1,00, диметилсульфоксид).
12.2. Синтез (R)-1-(3,4,
5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина
Получают способом Примера 5.2.2, используя соль (R)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R,
R)-ди-пара-анизоилвинной кислоты для получения указанного в заголовке соединения: Rf=0,29 (силикагель, 6% метанол/дихлорметан).
12.3. Синтез (R)-1-(3,4,
5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидина
Получают способом Примера 2.5.2, используя (S)-1-(3,4,5-триметоксибензоил)-3-(3,
4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин для получения указанного в заголовке соединения: Rf=0,33 (силикагель, этилацетат) и Rf=0,44 (силикагель, 6% метанол/дихлорметан).
12.4. Синтез (S)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил) пирролидин (5 г, 9,4 ммоль), соль 4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил) карбоксамидо)пиперидина и соляной кислоты (5,0 г,
8,1 ммоль) и N,N-диизопропилэтиламин (4,6 г, 35,5 ммоль) в ацетонитриле (100 мл). Нагревают до кипения с обратным холодильником. Через 19 часов охлаждают реакционную смесь и упаривают в вакууме,
получая первый остаток. Объединяют первый остаток и дихлорметан и экстрагируют насыщенным водным раствором бикарбоната натрия и затем рассолом. Сушат органический слой над МgSО4, фильтруют
и упаривают в вакууме, получая второй остаток. Хроматографируют второй остаток, элюируя последовательно смесью 1% метанол/дихлорметан, 1,5% метанол/дихлорметан, 1,5% метанол/дихлорметан и затем 2%
метанол/дихлорметан, получая указанное в заголовке соединение.
12.5. Синтез соли (S)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)
пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
Получают способом Примера 8.4, используя (S)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил-3-(3,4-дихлорфенил) пирролидин для получения указанного в заголовке соединения.
Пример 13
(S)-1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
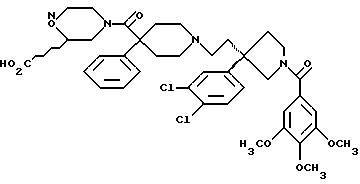
13.1 Синтез (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3, 4-дихлорфенил)пирролидин
Получают способом Примера 9.1, используя соль (S)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3, 4-дихлорфенил)пирролидина и соляной кислоты для получения указанного в заголовке соединения.
13.2 Синтез соли (S)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
Получают способом Примера 9.2, используя
(S)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин для получения указанного в заголовке соединения.
Получение 6
Соль 4-Фенил-4-(((S)-2-карбометоксипирролидин-1-ил)карбоксамидо) пиперидина и иодистоводородной кислоты
Объединяют
1-трет-бутоксикарбонил-4-фенилпиперидин-4-карбоновую кислоту (0,64 г, 3,34 ммоль) и N,N-диизопропилэтиламин (0,58 мл, 6,8 ммоль) в дихлорметане (20 мл). Добавляют (S)-2-карбометоксипирролидин
гидрохлорид (гидрохлорид L-пролинметилового эфира, 0,61 г, 3,67 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (0,70 г, 3.67 ммоль) и 1-гидроксибензотриазол гидрат (0,25 г, 3.67
ммоль). Через 18 часов разбавляют реакционную смесь дихлорметаном и дважды экстрагируют водой. Сушат органический слой над MgSО4, фильтруют и упаривают в вакууме, получая
1-трет-бутоксикарбонил-4-фенил-4-(((S)-2-карбометоксипирролидин-1-ил) карбоксамидо) пиперидин.
Объединяют 1-трет-бутоксикарбонил-4-фенил-4-(((S)-2-карбометоксипирролидин-1-ил)карбоксамидо)пиперидин (0,45 г) и дихлорметан (40 мл). Добавляют газообразный хлористый водород (примерно 1 г). Через 3 часа упаривают в вакууме, получая после сушки указанное в заголовке соединение.
Пример 14
(R)-1-(3,4,
5-Триметоксибензоил)-3-(2-(4-фенил-4-(((S)-2-карбометоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
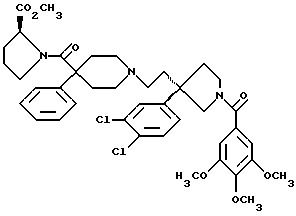
14.1 Синтез (R)-l-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-(((S)-2-карбометоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3, 4-дихлорфенил)пирролидина
Получают способом Примера 8.1.1, используя соль (S)-1-(3,4, 4-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидин и соль 4-фенил-4-(((S)-2-карбометоксипирролидин-1-ил)карбоксамидо)пиперидина и йодистоводородной кислоты для получения после хроматографии остатка на силикагеле с элюированием смесью 10% метанол/этилацетат указанного в заголовке соединения.
HRMS (FAB+).
Рассчитано для C40H48Cl2N3О7: 752,286932.
Найдено 752,286459.
Пример 15
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-(((S)-2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин
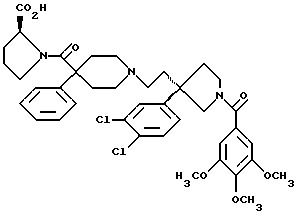
15.1 Синтез (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-(((S)-2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-(((S)-2-карбометоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин (2,0 г), 1М водный раствор гидроксида натрия (100 мл, 100 ммоль) и метанол (60 мл). Через 2 часа подкисляют реакционную смесь примерно до рН 4, используя 1М водный раствор соляной кислоты, и экстрагируют несколько раз дихлорметаном. Объединяют органические слои, сушат над MgSO4, фильтруют и упаривают в вакууме, получая указанное в заголовке соединение.
HRMS (FAB+).
Рассчитано для С39Н46 Сl2N3O7: 738,271282.
Найдено 738,270696.
15.2. Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-(((S)-2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
Получают способом Примера 5.5,
используя (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-(((S)-2-карбоксипирролидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин для получения указанного в заголовке
соединения.
Пример 16
1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин
16.1.1 Разделение соли (+)-3-фенил-3-(2-гидроксиэтил) пирролидина и (R, R)-ди-пара-анизоилвинной кислоты и соли (-)-3-фенил-3-(2-гидроксиэтил)пирролидина и соляной кислоты
Объединяют (R, R)-ди-пара-анизоилвинной кислоты (1,10 г, 2,62 ммоль) в смеси вода/метанол (13,6 мл/13,6 мл). Добавляют 12М раствор соляной кислоты (0,217 мл, 2,63 ммоль). Добавляют горячий раствор 3-фенил-3-(2-гидроксиэтил) пирролидина (1,0 г, 5.23 ммоль) в метаноле (13,6 мл). Нагревают до температуры кипения с обратным холодильником. Через 30 минут медленно охлаждают до комнатной температуры, получая твердое вещество. Собирают твердое вещество фильтрованием и перекристаллизовывают дважды из смеси метанол/вода, один раз из смеси метанол/2-бутанон и один раз из этанола, получая соль (-)-3-фенил-3-(2-гидроксиэтил) пирролидина и (R,R)-ди-пара-анизоилвинной кислоты. После превращения образца в 3,4, 5-триметоксибензамид, используя карбонат натрия и 3,4,5-триметоксибензоилхлорид в смеси ацетон/вода, анализ ВЭЖХ на колонке CHIRALPAK AD (10 мкм х 4,6 см х 250 см) с элюированием смесью пентанол/этанол/метанол/триэтиламин=80/15/5/0,1 при скорости потока 1,5 мл/мин, показывает энантиомерный избыток 98% (98% эи), время удерживания 22,30 минуты для 3,4,5-триметоксибензамида, полученного из (-) изомера соли (R,R)-ди-пара-анизоилвинной кислоты.
16.1.2 Разделение соли (+)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R, R)-ди-пара-анизоилвинной кислоты и соли
(-)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты
Добавляют горячий раствор 3-фенил-3-(2-гидроксиэтил) пирролидина (5,0 г, 20,2 ммоль) в этаноле (100 мл) к
кипящему с обратным холодильником раствору (R, R)-ди-пара-анизоилвинной кислоты (16,46 г, 20,2 ммоль), содержащему небольшое количество ацетона в этаноле (200 мл). По завершении добавления медленно
охлаждают до комнатной температуры, получая твердое вещество. Собирают твердое вещество фильтрованием и трижды перекристаллизовывают из этанола, получая соль (-)-3-фенил-3-(2-гидроксиэтил)пирролидина
и (R,R)-ди-пара-анизоилвинной кислоты: т.пл. 176-179oС.
Элементный анализ:
Рассчитано для C12H17NO.C20H18O10
: С 63,05; Н 5,79; N 2,30.
Найдено: С 62,72; Н 5,80; N 2,33.
После превращения образца в 3,4,5-триметоксибензамид, используя карбонат натрия и 3,4, 5-триметоксибензоилхлорид в смеси ацетон/вода, анализ ВЭЖХ на колонке CHIRALPAK AD (10 мкМ х 4,6 см х 250 см) с элюированием смесью пентан/этанол/метанол/триэтиламин= 80/15/5/0,1 при скорости потока 1, 5 мл/мин показывает энантиомерный избыток 99,9% (99,9% эи), время удерживания 22,30 минуты для 3,4,5-триметоксибензамида, полученного из (-)-изомера соли (R, R)-ди-пара-анизоилвинной кислоты.
После стояния вышеуказанные маточники дают твердое вещество. Это твердое вещество собирают фильтрованием и перекристаллизовывают дважды из этанола, получая соль (+)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты: t.пл. 175,0-176,0oС.
Элементный анализ:
Рассчитано для C12H17
NO.C20H18O10.0,8 С3Н6О: С 62,98; Н 6,11; N 2,13.
Найдено: С 62,86; Н 5,94; N 2,33.
После превращения образца в 3,4,5-триметоксибензамид, используя карбонат натрия и 3,4,5-триметоксибензоилхлорид в смеси ацетон/вода, анализ ВЭЖХ на колонке CHIRALRAK AD (10 мкМ х 4,6 см х 250 см) с элюированием смесью пентан/этанол/метанол/триэтиламин= 80/15/5/0,1 при скорости потока 1,5 мл/мин, показывает энантиомерный избыток 99,9% (99,9% эи), время удерживания 10,26 минуты для 3,4,5-триметоксибензамида, полученного из (-)-изомера соли (R, R)-ди-пара-анизоилвинной кислоты.
16.1.3 Разделение соли (+)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R, R)-ди-пара-анизоилвинной кислоты и соли
(-)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты
Объединяют 3-фенил-3-(2-гидроксиэтил)пирролидин (99,2 г, 659 ммоль) и этанол (2,5 л). Нагревают до температуры
кипения с обратным холодильником. Добавляют кипящий с обратным холодильником раствор (R,R)-ди-пара-анизоилвинной кислоты (212 г, 507 ммоль) в этаноле (5,07 л). По завершении добавления медленно
охлаждают до комнатной температуры при перемешивании, получая масло. Это масло растворяют в этаноле при кипячении с обратным холодильником (595 мл) и добавляют кипящий с обратным холодильником
раствор
(R,R)-ди-пара-анизоилвинной кислоты (49,2 г) в этаноле (1,1 л). Охлаждают до комнатной температуры при перемешивании, получая твердое вещество. Собирают твердое вещество фильтрованием и
перекристаллизовывают из этанола (3,2 л), получая второе твердое вещество. Собирают указанное второе твердое вещество фильтрованием и перекристаллизовывают из этанола (2,6 л), вносят затравочные
кристаллы соли (-)-3-фенил-3-(2-гидроксиэтил) пирролидина и (R,R)-ди-пара-анизоилвинной кислоты, получая соль (-)-3-фенил-3-(2-гидроксиэтил)пирролидин (R,R)-ди-пара-анизоилвинной кислоты (121 г).
16.1.4 Разделение соли (+)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R, R)-ди-пара-анизоилвинной кислоты и соли (-)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной
кислоты
Объединяют 3-фенил-3-(2-гидроксиэтил)пирролидин (101 г, 530 ммоль) и этанол (1,92 л). Нагревают до температуры кипения с обратным холодильником. Добавляют кипящий с обратным
холодильником раствор (R,R)-ди-пара-анизоилвинной кислоты (107 г, 410 ммоль) в этаноле (3,9 л). Продолжают кипячение с обратным холодильником. Через 10 минут медленно охлаждают до комнатной
температуры, вносят затравочные кристаллы. Через 18 часов собирают образовавшееся твердое вещество фильтрованием, промывают этанолом (200 мл), дважды перекристалли-зовывают из этанола, получая соль
(-)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R, R)-ди-пара-анизоилвинной кислоты: т.пл 179-180oС.
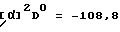
16.1.5. Синтез соли (+)-3-фенил-3-(2-гидроксиэтил)пирролидина и соляной кислоты
Объединяют соль (-)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R,
R)-ди-пара-анизоилвинной кислоты (30,9 г, 50,7 ммоль) и бикарбонат натрия (11,6 г, 53,2 ммоль) в смеси тетрагидрофуран/вода=5/1 (200 мл). Охлаждают на бане со льдом и добавляют
ди-трет-бутилдикарбонат
(8,52 г, 101 ммоль). Через 18 часов упаривают в вакууме, удаляя большую часть тетрагидрофурана. Разбавляют этилацетатом и экстрагируют водой, насыщенным водным раствором
хлорида аммония, насыщенным
водным раствором бикарбоната натрия и затем рассола. Сушат органический слой над MgSO4, фильтруют и упаривают в вакууме, получая остаток. Хроматографируют
остаток на силикагеле, элюируя
смесью 50% этилацетат/гексан, получая 1-трет-бутоксикарбонил-3-фенил-3-(2-гидроксиэтил)пирролидин, полученный из соли (-)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R,
R)-ди-пара-анизоилвинной кислоты:
Rf=0,25 (силикагель, 50% этилацетат/гексан).
Объединяют 1-трет-бутоксикарбонил-3-фенил-3-(2-гидроксиэтил)пирролидин (13,0 г, 44,6 ммоль) и раствор соляной кислоты в диоксане (22,3 мл, 4М, 89,2 ммоль). Нагревают до 50oС. Через 1 час охлаждают и добавляют диэтиловый эфир, получая твердое вещество. Собирают твердое вещество фильтрованием, получая после сушки указанное в заголовке соединение: т.пл. 161-163oС. [α]2D0 = +11,8 (c=0,563, метанол).
Элементный анализ:
Рассчитано для C12H17NO•HCl: С 63,29; Н 7,97; N 6,15.
Найдено: С 63,21; Н 7,86; N 6,05.
16.2.1 Синтез 1-(3,4,
5-триметоксибензоил)-3-фенил-3-(2-гидроксиэтил)пирролидина
Объединяют соль (-)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты (3,95 г, 6,48 ммоль) и ацетон (20
мл), воду (6 мл) и карбонат калия (2,70 г, 19,5 ммоль). Охлаждают до 0oС на бане со льдом. Через 30 минут добавляют по капле раствор 3,4,5-триметоксибензоилхлорида (1,71 г, 7,4 ммоль) в
ацетоне (20 мл). Нагревают до комнатной температуры. Через 18 часов распределяют реакционную смесь между этилацетатом и насыщенным водным раствором бикарбоната натрия. Отделяют органический слой и
экстрагируют рассолом. Сушат органический слой над Na2SО4, фильтруют и упаривают в вакууме, получая указанное в заголовке соединение: Rf= 0,23 (силикагель,
этилацетат). Анализ способом ВЭЖХ на колонке CHIRALPAK AD (10 мкМ х 4,6 см х 250 см) с элюированием смесью пентан/этанол/метанол/триэтиламин= 80/15/5/0,1 при скорости потока 1,5 мл/мин, показывает
энантиомерный избыток 99,9% (99,9% эи), время удерживания 22,30 минуты.
16.2.2 Синтез 1-(3,4,5-триметоксибензоил)-3-фенил-3-(2-гидроксиэтил)пирролидина
Объединяют соль
(-)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты (56,0 г, 92,1 ммоль), карбонат натрия (19,5 г, 184 ммоль) в этилацетате (2 л) и воде (2 л). Охлаждают примерно до 0oС на бане со льдом. Через 30 минут медленно по капле добавляют 3,4,5-триметоксибензоилхлорид (21,2 г, 92,1 ммоль). По завершении добавления нагревают реакционную смесь до комнатной
температуры.
Через 1 час разбавляют реакционную смесь этилацетатом и экстрагируют водой, 1М водным раствором соляной кислоты и затем рассолом. Сушат органический слой над Na2SО4,
фильтруют и
упаривают в вакууме, получая указанное в заголовке соединение.
16.3 Синтез 1-(3,4,5-триметоксибензоил)-3-фенил-3-(2-метансульфонилоксиэтил)пирролидина
Получают
способом
Примера 2.5.2, используя 1-(3,4,5-триметоксибензоил)-3-фенил-3-(2-гидроксиэтил)пирролидин (полученный из соли (-)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты)
(2,21 г,
5,51 ммоль) и метансульфонилхлорид (0,7 мл, 9,0 ммоль) для получения указанного в заголовке соединения: Rf=0,47 (силикагель, этилацетат).
16.4 Синтез 1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидина
Получают способом Примера 8.1.1, используя 1-(3,4,
5-триметоксибензоил)-3-фенил-3-(2-метансульфонилоксиэтил)пирролидин (полученный из соли (-)-3-фенил-3-(2-гидроксиэтил) пирролидина и (R, R)-ди-пара-анизоилвинной кислоты) и соль
4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидина и иодистоводородной кислоты для получения указанного в заголовке соединения.
Пример 17
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидин
17.1 Синтез 1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-фенилпирролидина
Получают способом Примера 9.1, используя 1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-фенилпирролидин (полученный из соли (-)-3-фенил-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты) для получения указанного в заголовке соединения.
Получение 7
2-Метокси-5-(4Н-триазол-4-ил)бензоилхлорид
Согласно способу J.Chem.Soc. (С), 1664 (1967) объединяют метил 2-метокси-5-аминобензоат (2,0 г, 11 ммоль), N,N-диметилформамидазин (1,56 г, 11
ммоль), паратолуолсульфоновую кислоту (190 мг) в толуоле (25 мл). Оснащают реакционный сосуд входным отверстием для газа, через которое верхнее пространство сосуда заполняют аргоном, и пропускают
поток через разбавленный водный раствор соляной кислоты. Нагревают до кипения с обратным холодильником. Через 20 часов концентрируют реакционную смесь в вакууме, получая остаток. Распределяют остаток
между дихлорметаном и насыщенным водным раствором бикарбоната натрия. Дважды экстрагируют водный слой дихлорметаном. Объединяют органические слои, сушат над МgSO4, фильтруют и упаривают в
вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно смесью 70% этилацетат/дихлорметан и затем 55% метанол/дихлорметан, получая остаток. Перекристаллизовывают
остаток из смеси этилацетат/гексан, получая метил 2-метокси-5-(4Н-триазол-4-ил)бензоат: т.пл. 191-195,5oС.
По-другому, согласно способу J.Med.Chem., 21, 1100 (1978) объединяют метил 2-метокси-5-аминобензоат (1,8 г, 10 ммоль), диформилгидразин (0,972, 11 ммоль) и пентоксид фосфора (1,84 г, 13 ммоль). Нагревают до 160oС. Через 1,5 часа охлаждают реакционную смесь и добавляют насыщенный водный раствор бикарбоната натрия. Трижды экстрагируют дихлорметаном. Сушат объединенные органические слои над MgSО4, фильтруют и упаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно смесью 40% этилацетат/дихлорметан и затем 5% метанол/дихлорметан, получая метил 2-метокси-5-(4Н-триазол-4-ил)бензоат: т.пл. 179-182oС.
Объединяют 2-метокси-5-(4Н-тетразол-4-ил)бензоат (56 ммоль), метанол (200 мл) и воду (50 мл). Добавляют 1М водный раствор гидроксида натрия (62,5 мл, 62,5 ммоль). Нагревают до кипения с обратным холодильником. Через 8 часов концентрируют в вакууме, удаляя большую часть растворителя. Доводят рН примерно до 1-2, используя 1М раствор соляной кислоты, экстрагируют насыщенным дихлорметаном. Сушат органический слой над МgSО4, фильтруют и упаривают в вакууме, получая 2-метокси-5-(4Н-триазол-4-ил)бензойную кислоту.
Объединяют 2-метокси-5-(4Н-триазол-4-ил)бензойную кислоту (5,5 ммоль) и дихлорметан (40 мл). Добавляют по капле оксалилхлорид (0,72 мл, 8,25 ммоль), а затем диметилформамид (3 капли). Через 4 часа упаривают в вакууме и сушат, получая указанное в заголовке соединение.
Пример 18
(R)-1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
18.1 Синтез (S)-1-(2-метокси-5-(тетразол-1-ил)бензоил)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина
Получают способом Примера 10.1, используя для получения указанного в заголовке соединения соль (S)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R, R)-ди-пара-анизоилвинной кислоты и 2-метокси-5-(4Н-триазол-4-ил)бензоилхлорид.
18.2. Синтез (S)-1-(2-метокси-5-(4Н-тетразол-4-ил)бензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидина
Получают
способом Примера 2.5.2, используя для получения указанного в заголовке соединения (S)-1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-дихлорфенил)-3-(2-гидроксиэтил)-пирролидин и метансульфонилхлорид.
18.3 Синтез (R)-1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина
Получают
способом Примера 10.3, используя для получения указанного в заголовке соединения (S)-1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидин и соль
4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидина и йодистоводородной кислоты.
Пример 19
(R)-1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
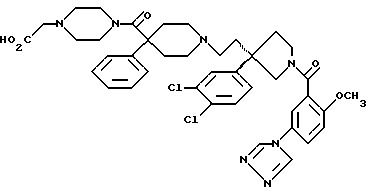
19.1 Синтез (R)-1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин) этил)-3-(3,4-дихлорфенил)пирролидина
Получают способом Примера 9.1, используя для получения указанного в заголовке соединения (R)-1-(2-метокси-5-(4Н-триазол-4-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин.
Получение 8
2-Метокси-5-(1Н-тетразол-5-ил)бензоилхлорид
Объединяют метил 2-метокси-5-формилбензоат (5,0 г, 25,9 ммоль), гидроксиламин гидрохлорид (8,55 г, 133 ммоль) и ацетат натрия (10,25 г, 125 ммоль)
в смеси этанол/вода (200 мл, 1/1). Нагревают до 50oС. Через 1 час выливают реакционную смесь на лед, получая твердое вещество. Собирают твердое вещество фильтрованием, получая метил
2-метокси-5-формилбензоат оксим: Rf=0,76 (силикагель, дихлорметан/метанол=9/1).
Объединяют метил 2-метокси-5-формилбензоат оксим (3,5 г, 16,7 ммоль) в дихлорметане (75 мл) и охлаждают на бане со льдом. Добавляют по капле тионилхлорид (2,0 мл, 27,2 ммоль). Через 20 минут разбавляют реакционную смесь дихлорметаном и экстрагируют насыщенным водным раствором бикарбоната натрия, а затем рассолом. Сушат органический слой над MgSО4, фильтруют и упаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя смесью этилацетат/гексан=1/1 и получая метил 2-метокси-5-циано-бензоат.
Объединяют метил 2-метокси-5-цианобензоат (0,67 ммоль), азид натрия (0,13 г, 2,04 ммоль) и триэтиламмоний гидрохлорид (0,14 г, 1,03 ммоль) в N-метилпирролидоне (6 мл). Нагревают до 150oС. Через 4 часа охлаждают до комнатной температуры и распределяют реакционную смесь между водой и этилацетатом. Разделяют слои и трижды экстрагируют водный слой этилацетатом. Доводят рН водного слоя примерно до 1, используя 1М водный раствор соляной кислоты. Водный слой снова трижды экстрагируют этилацетатом и дважды дихлорметаном. Водный слой насыщают хлоридом натрия и снова четыре раза экстрагируют дихлорметаном. Объединяют органические слои, сушат над MgSO4, фильтруют и упаривают в вакууме, получая метил 2-метокси-5-(1Н-тетразол-5-ил)бензоат.
Объединяют метил 2-метокси-5-(1H-тетразол-5-ил)бензоат (1 ммоль) и гидроксид лития (1,1 ммоль) в смеси тетрагидрофуран/вода=1/1 (5 мл). Через 24 часа разбавляют реакционную смесь 0,5 М водным раствором соляной кислоты и дихлорметаном. Разделяют слои и водный слой трижды экстрагируют дихлорметаном. Объединяют органические слои, сушат над MgSO4, фильтруют и упаривают вакууме, получая 2-метокси-5-(1Н-тетразол-5-ил)бензойную кислоту.
Объединяют 2-метокси-5-(1Н-тетразол-5-ил)бензойную кислоту (5 ммоль) и дихлорметан (40 мл). Добавляют по капле оксалилхлорид (0,72 мл, 8,25 ммоль), а затем диметилформамид (3 капли). Через 4 часа упаривают в вакууме и сушат, получая указанное в заголовке соединение.
Пример 20
(R)-1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(2-(4-фенил-4-((карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
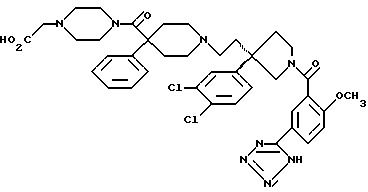
20.1. Синтез (S)-1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(3, 4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина
Получают способом Примера 10.1, используя для получения указанного в заголовке соединения соль (S)-3-(3, 4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина и (R, R)-ди-пара-анизоилвинной кислоты и 2-метокси-5-(1Н-тетразол-5-ил)бензоилхлорид.
20.2. Синтез
(S)-1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидина
Получают способом Примера 2.5.2, используя для получения указанного в заголовке
соединения (S)-1-(2-метокси-5-(1H-тетразол-5-ил)бензоил-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидин и метансульфонилхлорид.
20.3. Синтез
(R)-1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина
Получают способом Примера 10.3,
используя для получения указанного в заголовке соединения (S)-1-1-(2-метокси-5-(1Н-триазол-5-ил)бензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидин (1,0 г, 1,62 ммоль) и соль
4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо) пиперидина и иодистоводородной кислоты.
20.4. Синтез
(R)-1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина
Получают способом Примера 9.1,
используя для получения указанного в заголовке соединения (R)-1-(2-метокси-5-(1Н-тетразол-5-ил)бензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,
4-дихлорфенил)
пирролидин.
Пример 21
(R)-1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин
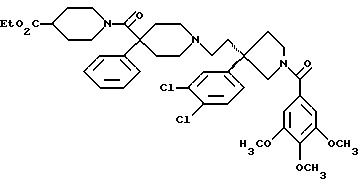
21.1. Синтез (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина
Получают способом Примера 8.1.1, используя (S)-1-(3,4, 5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидин и соль 4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидина и соляной кислоты для получения после хроматографии на силикагеле при элюировании смесью 3% метанол/дихлорметан указанного в заголовке соединения: Rf=0,40 (силикагель, 6% метанол/дихлорметан).
21.2. Синтез
соли
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин (3,1 г) и дихлорметан (100 мл). Добавляют постоянный поток
газообразного хлористого водорода в течение примерно 10 минут. Упаривают в вакууме до твердого вещества. Собирают твердое вещество и сушат, получая указанное в заголовке соединение.
Элементный анализ
Рассчитано для С42Н51Сl2N3О7• HCl•1,1 H2О: С 59,94; Н 6,53; N 5,02.
Найдено: С 59,92; Н 6,40; N 4,86.
Пример 22
(R)-1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин
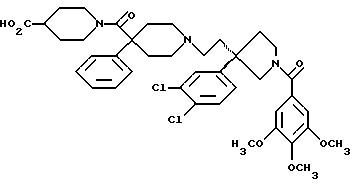
22.1. Синтез (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)карбоксамидо)пиперидин)-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
Объединяют соль (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипиперидин-1-ил)карбоксамидо)пиперидин)-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты (0,65 г, 0,8 ммоль), тетрагидрофуран (15 мл) и воду (150 мл). Добавляют гидроксид лития (0,11 г, 4,8 ммоль). Через 2 часа доводят рН примерно до 6, используя 1М водный раствор соляной кислоты, и упаривают в вакууме для удаления большей части тетрагидрофурана. Разбавляют упаренную реакционную смесь рассолом и дважды экстрагируют дихлорметаном. Объединенные органические слои сушат над MgSO4, фильтруют и упаривают в вакууме, получая остаток. Объединяют остаток и дихлорметан (100 мл). Добавляют газообразный хлористый водород (примерно 1,3 г), получая твердое вещество. Собирают твердое вещество и сушат, получая указанное в заголовке соединение.
Пример 23
1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин
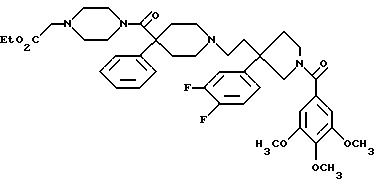
23.1. Синтез диэтилового эфира 3-циано-3-(3,4-дифторфенил) пентандиоевой кислоты
Получают способом Примера 3.1.2, используя для получения указанного в заголовке соединения 3,4-дифторфенилацетонитрил.
23.2.1 Синтез этилового эфира
(3-(3,4-дифторфенил)-5-оксопирролидин-3-ил)уксусной кислоты
Получают способом Примера 2.2.2, используя для получения указанного в заголовке соединения диэтиловый эфир 3-циано-3-(3,
4-дифторфенил)пентадиоевой кислоты.
23.2.2 Синтез этилового эфира (3-(3,4-дифторфенил)-5-оксопирролидин-3-ил)уксусной кислоты
Объединяют диэтиловый эфир 3-циано-3-(3,
4-дифторфенил) пентадиоевой кислоты (106 г, 326 ммоль), этанол (3 л), концентрированный водный аммиак (160 мл) и никель Ренея (100 г). Гидрирование проводят в автоклаве при температуре около 50oС и 14,06 кг/см2 (200 psi). Через 22 часа фильтруют через целит и промывают твердое вещество этанолом. Упаривают фильтрат в вакууме, получая остаток. Остаток растирают со смесью
этилацетат/гексан, получая указанное в заголовке соединение.
23.3 Синтез 3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина
Получают способом Примера 2,3, используя этиловый
эфир (3-(3,4-дифторфенил)-5-оксопирролидин-3-ил)уксусной кислоты для получения указанного в заголовке соединения: Rf=0,26 (силикагель, дихлорметан/метанол/уксусная кислота=85/10/5).
23.4.1 Разделение соли (+)-3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты и соли (-)-3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина и соляной
кислоты
Объединяют (R, R)-ди-пара-анизоилвинную кислоту (0,93 г, 0,2 ммоль) и водный 12М раствор соляной кислоты (0,19 мл, 2,28 ммоль) в смеси вода/метанол (10 мл/10 мл). Нагревают до
кипения
с обратным холодильником. Добавляют по капле раствор 3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина (1,0 г, 4,4 ммоль) в метаноле (10 мл). Через 15 минут медленно охлаждают до комнатной
температуры. Отфильтровывают образовавшееся твердое вещество и промывают водой, получая соль (-)-3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина и (R, R)-ди-пара-анизоилвинной кислоты. [α
]2D0 = -25,1 (с= 1,02, диметилсульфоксид). Анализ аналитического образца, полученного экстракцией свободного амина, ВЭЖХ на колонке CHIRALPAK AD (25 см х 0,46 см) с элюированием
смесью пентан/метанол/триэтиламин=80/10/0,1 при скорости потока 1,0 мл/мин, показывает энантиомерный избыток 97,8% (97,8% эи), время удерживания 19,0 минут для 3,4,5-триметоксибензамида, полученного
из (-)-изомера соли (R, R)-ди-пара-анизоилвинной кислоты; время удерживания 12,5 минут для 3,4,5-триметоксибензамида, полученного из (+)-изомера соли (R,R)-ди-пара-анизоилвинной кислоты.
23.4.2 Разделение соли (+)-3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты и соли (-)-3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина и соляной
кислоты
Объединяют (R, R)-ди-пара-анизоилвинной кислоты (6,6 г, 15,8 ммоль) и смесь вода/метанол (70 мл/70 мл). Нагревают до кипения с обратным холодильником. Добавляют водный 12М раствор
соляной кислоты (1,31 мл, 15,7 ммоль). Добавляют по капле раствор 3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина (7,15 г, 31,5 ммоль) в метаноле (70 мл). Через 15 минут дают смеси немного
охладиться и добавляют затравочные кристаллы соли (-)-3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина и (R, R)-ди-пара-анизоилвинной кислоты, а затем медленно охлаждают до комнатной температуры.
Отфильтровывают образовавшееся твердое вещество. Сохраняют фильтрат, который обогащен медленнее элюируемым изомером. Объединяют твердое вещество с горячим этанолом (800 мл), фильтруют, уменьшат объем
раствора примерно до 600 мл и медленно охлаждают до комнатной температуры, получая твердое вещество. Собирают твердое вещество фильтрованием и сушат в вакууме при 82oС, получая соль
(-)-3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты. Анализ аналитического образца производного 3,4,5-триметоксибензамида ВЭЖХ на колонке CHIRALPAK AD (25 см х
0,46 см) с элюированием смесью пентан/этанол/метанол/триэтиламин=80/15/5/0,1 при скорости потока 1,0 мл/мин, показывает энантиомерный избыток более 99% (>99% эи).
23.5 Синтез
(S)-1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-гидроксиэтил)пирролидина
Получают способом Примера 5.2.2, используя для получения указанного в заголовке соединения соль (-)-3-(3,
4-дифторфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты.
23.6 Синтез 1-(3,4,5-триметоксибензоил)-3-(3,
4-дифторфенил)-3-(2-метансульфонилоксиэтил)пирролидина
Получают способом Примера 2.5.2, используя для получения указанного в заголовке соединения 1-(3,4,5-триметоксибензоил)-3-(3,
4-дифторфенил)-3-(2-гидроксиэтил)пирролидин (полученный из соли (-)-3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты).
23.7 Синтез-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дифторфенил)пирролидина
Объединяют 1-(3,4,5-триметоксибензоил)-3-(3,
4-дифторфенил)-3-(2-метансульфонилоксиэтил) пирролидин (полученный из соли (-)-3-(3,4-дифторфенил)-3-(2-гидроксиэтил)пирролидина и (R,R)-ди-пара-анизоилвинной кислоты) (0,4 г, 1,0 ммоль), карбонат
калия (0,33 г, 2,4 ммоль) и соль 4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидина и соляной кислоты (0,4 г, 0,8 ммоль) в смеси тетрагидрофуран/вода (6 мл/2 мл). Нагревают до
кипения с обратным холодильником. Через 64 часа упаривают в вакууме, получая остаток. Объединяют остаток и дихлорметан и экстрагируют насыщенным водным раствором бикарбоната натрия. Сушат
органический
слой над MgSO4, фильтруют и упаривают в вакууме, получая остаток. Этот остаток хроматографируют на силикагеле, элюируя последовательно этилацетатом, смесью 1%
метанол/дихлорметан, 2%
метанол/дихлорметан, 3% метанол/дихлорметан, 4% метанол/дихлорметан и затем 5% метанол/дихлорметан, получая указанное в заголовке соединение.
23.8 Синтез соли
1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил) карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дифторфенил)пирролидина и соляной кислоты
Объединяют 1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дифторфенил)пирролидин (0,38 г, 0,45 ммоль) и дихлорметан. Продувают газообразный
хлористый водород примерно в течение 5 минут. Выпаривают в вакууме, получая после сушки указанное в заголовке соединение.
Пример 24
1-(3,4,
5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дифторфенил)пирролидин
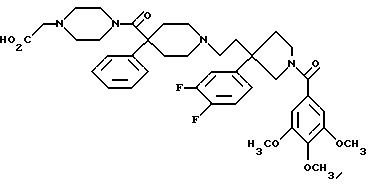
24.1. Синтез-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дифторфенил)пирролидина
Получают способом Примера 9.1, используя для получения указанного в заголовке соединения 1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиметилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дифторфенил) пирролидин.
Пример 25
(R)-1-(3,4,
5-Триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоэтоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
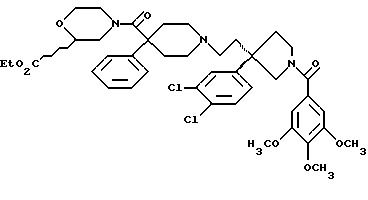
25.1 Синтез (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоэтоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют (S)-1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил) пирролидин (2 г), соль 4-фенил-4-((2-карбоэтоксиморфолин-4-ил)карбоксамидо)пиперидина и соляной кислоты (5 ммоль) и N,N-диизопропилэтиламин (3 мл) в ацетонитриле (25 мл). Нагревают до кипения с обратным холодильником. Через 10 часов выпаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно этилацетатом и затем смесью дихлорметан/метанол=95/5, получая указанное в заголовке соединение. Rf= 0,50 (силикагель, дихлорметан/метанол=9/1) и Rf=0,20 (силикагель, этилацетат/метанол=9/1).
25.2 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидина и фумаровой кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоэтоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин (0,8 г, 1,06 ммоль) и фумаровую кислоту (184 мг, 1,6 ммоль) в этаноле
(10 мл). Через 10 минут выпаривают в вакууме, получая остаток. Остаток растирают с диэтиловым эфиром,
получая твердое вещество. Собирают твердое вещество, промывают диэтиловым эфиром и сушат, получая
указанное в заголовке соединение: т.пл. 125-128oС.
Пример 26
(R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
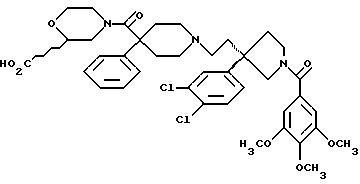
26.1 Синтез (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксиморфолин-4-ил) карбоксамидо) пиперидин-1-ил) этил)-3-(3, 4-дихлорфенил)пирролидина
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксиморфолин-4-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин (0,77 г, 1,02 ммоль) и гидрат гидроксида лития (128 мг, 3,06 ммоль) в смеси тетрагидрофуран/метанол/вода (2/2/1, 15 мл). Через 1 час упаривают в вакууме, получая остаток, объединяют остаток и воду, подкисляют водным 1М раствором соляной кислоты и экстрагируют пять раз дихлорметаном. Объединяют органические слои, сушат над Na2SО4, фильтруют и упаривают в вакууме, получая остаток. Этот остаток хроматографируют на силикагеле, элюируя последовательно смесью 1% метанол/дихлорметан и затем 5% метанол/дихлорметан, получая указанное в заголовке соединение. Rf=0,30 (силикагель, 25% метанол/дихлорметан).
Получение 9
Соль 4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо) пиперидина и йодистоводородной кислоты
Объединяют 1-трет-бутил
1-пиперазинкарбоксилат (10,47 г, 36,2 ммоль), этилакрилат (8 мл) в этаноле (30 мл). Нагревают при кипении с обратным холодильником. Через 5,5 часов охлаждают реакционную смесь и упаривают в вакууме,
получая остаток. Объединяют этот остаток и диэтиловый эфир (200 мл) и экстрагируют 1М водным раствором соляной кислоты. Доводят рН водного слоя до основного, используя бикарбонат натрия, и затем
экстрагируют этилацетатом. Сушат органический слой над MgSО4, фильтруют и упаривают в вакууме, получая трет-бутил 4-карбоэтоксиэтил-1-пиперазинкарбоксилат.
Объединяют трет-бутил 4-карбоэтоксиэтил-1-пиперазин-карбоксилат (14,3 г, 50 ммоль) и дихлорметан (250 мл). Перемешивают, охлаждают примерно до 0oС и продувают газообразным хлористым водородом. Через 43 часа концентрируют реакционную смесь в вакууме, дважды добавляют диэтиловый эфир (200 мл) и упаривают в вакууме, получая твердое вещество. Это твердое вещество растирают с диэтиловым эфиром и собирают фильтрованием, получая соль 4-карбоэтоксиэтил-1-пиперазина и соляной кислоты.
Объединяют соль 4-карбоэтоксиэтил-1-пиперазина и соляной кислоты (6,8 г, 26,2 ммоль), 1-трет-бутоксикарбонил-4-фенилпиперидин-4-карбоновую кислоту (8,0 г, 26,2 ммоль), N,N-диизопропилэтиламин (14 мл) и 1-гидроксибензотриазол гидрат (3,9 г) в дихлорметане (250 мл). Добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (5,53 г). Через 17 часов разбавляют реакционную смесь дихлорметаном (300 мл) и экстрагируют насыщенным водным раствором бикарбоната натрия, водой и затем 1М водным раствором соляной кислоты. Сушат органический слой над МgSО4, фильтруют и упаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно гексаном, смесью 20% этилацетат/гексан, 30% этилацетат/гексан, 50% этилацетат/гексан, 60% этилацетат/гексан, 50% этилацетат/гексан, содержащем 2,0 мл триэтиламина, и затем этилацетатом, получая 1-третбутоксикарбонил-4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин.
Объединяют 1-трет-бутоксикарбонил-4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин (7,3 г, 15,3 ммоль) и дихлорметан (250 мл). Перемешивают, охлаждают примерно до 0oС и продувают газообразным хлористым водородом. Через 2 часа нагревают до комнатной температуры и снова продувают газообразным хлористым водородом. Через 3 часа концентрируют реакционную смесь в вакууме, трижды добавляют диэтиловый эфир (50 мл) и упаривают в вакууме, получая твердое вещество. Объединяют это твердое вещество, дихлорметан (100 мл) и водный раствор бикарбоната натрия. Разделяют слои, насыщают водный слой хлоридом натрия и дважды экстрагируют дихлорметаном. Объединяют органические слои, сушат над MgSО4, фильтруют и упаривают в вакууме, получая 4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин.
Объединяют 4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин (6,0 г) и этанол (60 мл). Добавляют водный раствор йодистоводородной кислоты (7,9 г, 57%). Через 30 минут добавляют диэтиловый эфир (200 мл), получая твердое вещество. Фильтруют, промывают твердое вещество диэтиловым эфиром и сушат, получая указанное в заголовке соединение.
Пример 27
(R)-1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дифторфенил)пирролидин
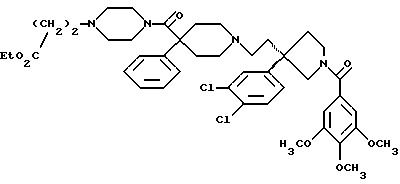
27.1 Синтез (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дифторфенил)пирролидина
Объединяют (S)-1-(3,4,5-триметоксибензоил)-3-(3, 4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидин (3,72 г), соль 4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо)пиперидина и йодистоводородной кислоты (4,0 г, 6,36 ммоль) и триэтиламин (2,7 мл) в ацетонитриле (40 мл). Нагревают до кипения с обратным холодильником. Через 6 часов охлаждают реакционную смесь, концентрируют в вакууме и разбавляют дихлорметаном (200 мл). Экстрагируют насыщенным водным раствором бикарбоната натрия и затем водой. Сушат органический слой над MgSО4, фильтруют и упаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно этилацетатом, смесью 2% метанол/этилацетат, 3% метанол/этилацетат, 4% метанол/этилацетат, 5% метанол/этилацетат, получая указанное в заголовке соединение.
27.2
Синтез соли (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтосиэтилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и фумаровой кислоты
Объединяют
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (0,7 г, 0,86 ммоль) и этанол (15 мл). Нагревают до кипения
с обратным холодильником. Добавляют фумаровую кислоту (206 мг) и продолжают нагревать при кипении с обратным холодильником. Через 30 минут охлаждают, концентрируют в вакууме и растирают с диэтиловым
эфиром (50 мл). Фильтруют и сушат, получая указанное в заголовке соединение.
27.3 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (0,5 г) и этилацетат (6 мл). Добавляют раствор соляной кислоты в
диэтиловом эфире (1,3 мл, 1М), получая твердое вещество. Через 30 минут фильтруют и сушат, получая указанное в заголовке соединение.
Пример 28
(R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
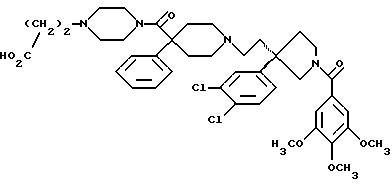
28.1 Синтез (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((2-карбоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (0,81 г, 1,0 ммоль) в тетрагидрофуране (20 мл) и воде (20 мл). Охлаждают на бане со льдом, добавляют гидроксид лития (0,15 г). Через 3 часа добавляют воду (100 мл) и 1М водный раствор соляной кислоты (1,5 мл). Экстрагируют этилацетатом (100 мл). Разделяют слои, доводят рН водного слоя примерно до 5, используя 1М водный раствор соляной кислоты, и экстрагируют трижды дихлорметаном. Объединяют органические слои, сушат над MgSO4 и упаривают в вакууме, получая указанное в заголовке соединение.
28.2 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксиэтилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (0,57 г) и дихлорметан (20 мл). Добавляют раствор соляной кислоты в
диэтиловом эфире (1,7 мл, 1М). Через 2 часа упаривают реакционную смесь в вакууме, дважды добавляют диэтиловый эфир и упаривают в вакууме, получая остаток. Этот остаток растирают с диэтиловым эфиром,
получая твердое вещество. Собирают твердое вещество фильтрованием и сушат, получая указанное в заголовке соединение.
Получение 10
Соль
4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил)карбоксамидо) пиперидина и иодистоводородной кислоты
Объединяют 1-трет-бутил 1-пиперазинкарбоксилат (10,7 г, 57,5 ммоль), этил 4-хлорбутират (10,
4 мл) и карбонат калия (8 г) в диметилформамиде (60 мл). Нагревают при кипении с обратным холодильником. Через 4,5 часа охлаждают реакционную смесь, разбавляют водным раствором бикарбоната натрия и
экстрагируют дважды диэтиловым эфиром (200 мл). Объединяют органические слои и экстрагируют 1М водным раствором соляной кислоты. Доводят рН водного слоя до основного, используя бикарбонат натрия, и
затем экстрагируют диэтиловым эфиром. Сушат объединенный органический слой над МgSО4, фильтруют и упаривают в вакууме, получая остаток. Этот остаток хроматографируют на силикагеле, элюируя
последовательно смесью 10% этилацетат/гексан, 20% этилацетат/гексан, 25% этилацетат/гексан, получая трет-бутил 4-карбоэтоксипропил-1-пиперазинкарбоксилат. Rf=0,5 (силикагель,
этилацетат).
Объединяют трет-бутил 4-карбоэтоксипропил-1-пиперазинкарбоксилат (7,0 г, 23,3 ммоль) и дихлорметан (100 мл). Перемешивают, охлаждают примерно до 0oС и продувают газообразным хлористым водородом. Через 2 часа концентрируют реакционную смесь в вакууме, дважды добавляют диэтиловый эфир (50 мл) и упаривают в вакууме, получая твердое вещество. Это твердое вещество растирают с диэтиловым эфиром и собирают фильтрованием, получая соль 4-карбоэтоксипропил-1-пиперазина и соляной кислоты.
Объединяют соль 4-карбоэтоксипропил-1-пиперазина и соляной кислоты (5,6 г, 20,5 ммоль), 1-трет-бутоксикарбонил-4-фенилпиперидин-4-карбоновую кислоту (8,13 г, 26,6 ммоль), N,N-диизопропилэтиламин (7,9 г) и 1-гидроксибензотриазол гидрат (3,3 г, 24,6 ммоль) в дихлорметане (250 мл). Добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (4,72 г, 24,6 ммоль). Через 24 часа разбавляют реакционную смесь дихлорметаном (100 мл) и экстрагируют насыщенным водным раствором бикарбоната натрия и затем 1М водным раствором соляной кислоты. Сушат органический слой над MgSО4, фильтруют и упаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно гексаном, смесью 20% этилацетат/гексан, 40% этилацетат/гексан, 60% этилацетат/гексан, 80% этилацетат/гексан, этилацетатом и затем смесью 6% метанол/этилацетат, получая 1-трет-бутоксикарбонил-4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил)карбоксамидо)пиперидин.
Объединяют 1-трет-бутоксикарбонил-4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил)карбоксамидо)пиперидин (6,7 г, 12,5 ммоль) и этанол (90 мл). Добавляют водный раствор йодистоводородной кислоты (6,2 г, 57%). Нагревают при кипении с обратным холодильником. Через 15 часов охлаждают до комнатной температуры и добавляют диэтиловый эфир (300 мл), получая твердое вещество. Фильтруют, промывают твердое вещество диэтиловым эфиром и сушат, получая соль 4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил)карбоксамидо)пиперидина и йодистоводородной кислоты.
Пример 29
(R)-1-(3,4,
5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
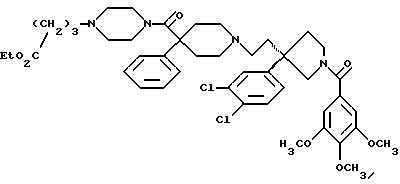
29.1 Синтез (R)-1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил)карбоксамидо)пиперидин) этил)-3-(3, 4-дихлорфенил)пирролидина
Получают способом Примера 28.1, используя (S)-1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-метансульфонилоксиэтил)пирролидин (4,0 г) и соль 4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил)карбоксамидо)пиперидина и йодистоводородной кислоты. Очистку проводят хроматографией на силикагеле, элюируя последовательно этилацетатом, смесью 2% метанол/дихлорметан, 3% метанол/дихлорметан и затем 4% метанол/дихлорметан, получая указанное в заголовке соединение: Rf=0,31 (силикагель, 6% метанол/дихлорметан).
29.2.
Синтез соли (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и фумаровой кислоты
Объединяют
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил)карбоксамидо)пиперидин) этил)-3-(3,4-дихлорфенил) пирролидин (0,7 г, 0,86 ммоль) и этанол (15 мл). Нагревают до
кипения с обратным холодильником. Добавляют фумаровую кислоту (202 мг) и продолжают нагревать при кипении с обратным холодильником. Через 30 минут охлаждают, концентрируют в вакууме и растирают с
диэтиловым эфиром (50 мл). Фильтруют и сушат, получая указанное в заголовке соединение.
29.3 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
Объединяют (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (0,5 г) и этилацетат (8 мл). Добавляют раствор соляной кислоты в
диэтиловом эфире (1,4 мл, 1М), получая твердое вещество. Через 30 минут фильтруют и сушат, получая указанное в заголовке соединение.
Пример 30
(R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипропилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
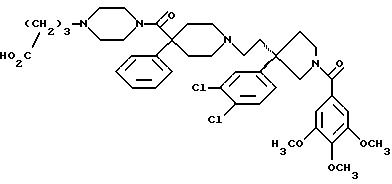
30.1 Синтез (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипропилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3, 4-дихлорфенил)пирролидина
Получают способом Примера 28.1, используя (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоэтоксипропилпиперазин-1-ил) карбоксамидо)пиперидин) этил)-3-(3, 4-дихлорфенил)пирролидин для получения указанного в заголовке соединения.
30.2 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипропилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и соляной кислоты
Получают способом Примера 28.2, используя
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипропилпиперазин-1-ил) карбоксамидо) пиперидин) этил)-3-(3, 4-дихлорфенил) пирролидин (0,63 г) для получения указанного в заголовке
соединения.
Получение 11
Соль 4-фенил-4-((4-карбо(этоксикарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидина и соляной кислоты
Объединяют
4-карбоэтоксиметилпиперазин (100 г, 580 ммоль) и дихлорметан (750 мл). Охлаждают на бане лед с метанолом. Добавляют раствор ди-трет-бутил дикарбоната (131 г, 600 ммоль) в дихлорметане (250 мл). Через
18 часов упаривают в вакууме, получая остаток. Делят остаток на три части и хроматографируют на силикагеле, элюируя смесью этилацетат/дихлорметан=1/1, получая продукт как первое элюируемое вещество.
Упаривают фракции, содержащие продукт, и перекристаллизовывают из смеси этилацетат/гексан, получая 1-трет-бутоксикарбонил-4-карбоэтоксиметилпиперазин в виде твердого вещества, т.пл. 67-69o
С.
ИК спектр (КВr) nmах 2980, 1748, 1679, 1461, 1423, 1366, 1296, 1251, 1214, 1188, 1170, 1131, 1035 см-1;1ЯМР (СDС13) м.д. 4,19 (кв, 2H, J=7,1 Гц),
3,49 (т, 4Н, J=4,7 Гц), 3,23 (с, 2H), 2,53 (т, 4Н, J=4,9 Гц), 1,46 (с, 9Н), 1,28 (т, 3Н, J=7,1 Гц);13С ЯМР (СDС13) м.д. 170,06, 154,64, 79,68, 60,68, 59,39, 52,65, 28,39, 14,20;
MS (СI/NН3) m/z 273 (М+1)+.
Объединяют 1-трет-бутоксикарбонил-4-карбоэтоксиметилпиперазин (20,8 г, 76,5 ммоль) и гидроксид лития (6,71 г, 160 ммоль) в
тетрагидрофуране (100 мл) и воде (100 мл). Через 60 минут концентрируют в вакууме, получая твердое вещество. Объединяют это твердое вещество и воду, экстрагируют диэтиловым эфиром. Объединяют водный
слой и 1М водный раствор гидросульфата калия (160 мл). Трижды экстрагируют хлороформом. Упаривают водный слой, получая твердое вещество. Растирают это твердое вещество несколько раз с теплым
этилацетатом и изопропанолом и фильтруют. Каждый раз после растирания реакционную смесь упаривают, получая твердые вещества. Объединяют полученные при выпаривании твердые вещества, растворяют в
хлороформе и упаривают для удаления растворителя. Сушат в вакууме при 50oС, получая 1-трет-бутоксикарбонил-4-карбоксиметилпиперазин в виде твердого вещества, т.пл. 195-197oС. ИК
спектр (KBr) nmax 3007, 2934, 1691, 1631, 1479, 1453, 1427, 1415, 1393, 1366, 1301, 1283, 1232, 1209, 1177, 1139, 1084 см-1;1ЯМР (CDCl3) м.д. 3,71 (широкий с, 4Н), 3,
56 (широкий с, 2Н), 3,12 (широкий с, 4Н), 1,46 (с, 9Н);
13С ЯМР (CDCl3) м. д. 169,10, 154,13, 80,70, 58,49, 52,38, 28,25; MS (CI/NH3) m/z 245 (М+1)+
.
Объединяют хлорметилхлорформиат (19 мл) и дихлорметан (300 мл) и охлаждают на бане со льдом. Добавляют по капле примерно за 1 час раствор этанола (11,7 мл) и триэтиламина (30,7 мл) в дихлорметане (100 мл). Через 3,5 часа фильтруют и концентрируют фильтрат, получая остаток. Остаток распределяют между диэтиловым эфиром и водой. Отделяют органический слой и сушат над MgSО4, фильтруют и упаривают в вакууме, получая этилхлорметилкарбонат.
Объединяют 1-трет-бутоксикарбонил-4-карбоксиметилпиперазин (10 г, 40,9 ммоль), йодид натрия (6,15 г), карбонат цезия (13,3 г), этилхлорметилкарбонат (9,6 г) в диметилформамиде (250 мл). Нагревают до 65oС. Через 3 часа охлаждают до комнатной температуры и продолжают перемешивание. Через 18 часов концентрируют в вакууме, получая остаток. Остаток хроматографируют на силикагеле, элюируя последовательно смесью 5% этилацетат/гексан, 10% этилацетат/гексан, 15% этилацетат/гексан и затем 20% этилацетат/гексан, получая 1-третбутоксикарбонил-4-карбо(этоксикарбонилоксиметокси)метилпиперазин.
Объединяют 1-трет-бутоксикарбонил-4-карбо(этоксикарбонилоксиметокси)метилпиперазин (9,5 г) и дихлорметан (500 мл). Охлаждают на бане со льдом и продувают газообразным хлористым водородом. Через 1 час концентрируют в вакууме, получая остаток. Объединяют остаток и диэтиловый эфир и упаривают, получая остаток, который сушат в вакууме при 56oС, получая указанное в заголовке соединение.
Получение 12
(R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-карбоксипиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
Объединяют амид (+)-1-(2-(3-(3,4-дихлорфенил)-1-(3,4,
5-триметоксибензоил)пирролидин-3-ил)этил)-4-фенилпиперидин-4-карбоновой кислоты, полученный способом Патента США 5635510 от 3 июня 1997 (200 г, 300 ммоль), диоксан (400 мл), концентрированный водный
раствор соляной кислоты (400 мл) и воду (400 мл). Нагревают до кипения с обратным холодильником. Через 26 часов охлаждают до комнатной температуры и концентрируют реакционную смесь в вакууме при
60oС до объема примерно 700 мл. Добавляют воду (400 мл) и экстрагируют смесью этилацетат/гексан= 9/1. Разделяют слои и водный слой дважды экстрагируют смесью этилацетат/гексан=1/1. При
помощи гидроксида натрия доводят рН водного слоя примерно до 7, получая твердое вещество. Фильтруют и сушат, получая (S)-3-(2-(4-фенил-4-карбоксипиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин.
Объединяют (S)-3-(2-(4-фенил-4-карбоксипиперидин-1-ил) этил)-3-(3,4-дихлорфенил)пирролидин (50 г, 112 ммоль) и бикарбонат натрия (30 г) в тетрагидрофуране (1300 мл) и воде (300 мл). Добавляют частями примерно за 45 минут раствор 3,4,5-триметоксибензоилхлорида (26 г, 112 ммоль) в тетрагидрофуране (130 мл). Через 2 часа разбавляют водой (1000 мл). Доводят рН примерно до 4, используя концентрированный водный раствор соляной кислоты, и получают твердое вещество. Собирают твердое вещество фильтрованием и промывают водой. Растирают это твердое вещество с метанолом (1300 мл) и водой (1300 мл). Фильтруют, промывают водой и сушат в вакууме, получая указанное в заголовке соединение.
По-другому, получают указанное в заголовке соединение способом, аналогичным описанному в Примере 5.4.1, используя (S)-1-(3,4,5-триметоксибензоил)-3-(3,4-дихлорфенил)-3-(2-матансульфонилоксиэтил)пирролидин и 4-фенилпиперидин-4-карбоновую кислоту.
Пример 31
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(этоксикарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
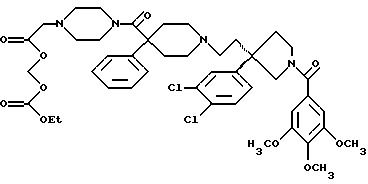
31.1 Синтез (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(этоксикарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-карбоксипиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин (10 г, 15,52 ммоль) и соль 4-фенил-4-((карбо(этоксикарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидина и соляной кислоты (6 г, 18,8 ммоль) и N,N-диизопропилэтиламин (13 мл) в дихлорметане (400 мл). Добавляют 1-гидроксибензотриазол гидрат (2,1 г, 15,5 ммоль) в дихлорметане и 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (3 г, 15,5 ммоль). Через 18 часов экстрагируют реакционную смесь водой. Сушат органический слой над МgSО4, фильтруют и концентрируют в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно смесью 0,3% метанол/дихлорметан, 0,6% метанол/дихлорметан, 1,0% метанол/дихлорметан, 1,5% метанол/дихлорметан и затем 2,5% метанол/дихлорметан, получая остаток. Этот остаток повторно хроматографируют на силикагеле, элюируя последовательно смесью 1,0% метанол/дихлорметан, 2,0% метанол/дихлорметан и затем 3,0% метанол/дихлорметан, получая указанное в заголовке соединение.
31.2 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(этоксикарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и фумаровой кислоты
Объединяют
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(этоксикарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (0,51 г, 0,59 ммоль) и фумаровую
кислоту (0,14 г, 1,17 ммоль) в 2-бутаноне (40 мл). Нагревают до кипения с обратным холодильником. Через 20 минут охлаждают до комнатной температуры. Концентрируют в вакууме, получая остаток.
Растирают
остаток с диэтиловым эфиром, получая твердое вещество. Собирают твердое вещество фильтрованием, промывают диэтиловым эфиром и сушат, получая указанное в заголовке соединение.
Получение 13
Соль 4-фенил-4-((4-карбо(трет-бутилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидина и соляной кислоты
Объединяют
1-трет-бутоксикарбонил-4-карбоксиметилпиперазин (1,22 г, 5 ммоль) и карбонат цезия (1,63 г, 5 ммоль) в безводном диметилформамиде (20 мл). Через 1,5 часа добавляют хлорметилпивалат (828 мг, 5,5
ммоль)
и йодид натрия (750 мг, 5 ммоль). Нагревают до 60oС. Через 3 часа дают реакционной смеси охладиться до комнатной температуры. Через 18 часов упаривают в вакууме, получая остаток.
Остаток
распределяют между этилацетатом и водой. Разделяют слои и дважды экстрагируют водный слой этилацетатом. Объединяют органические слои и экстрагируют несколько раз водой, а затем рассолом.
Сушат над
MgSO4 и концентрируют в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя смесью 75% этилацетат/гексан, получая
1-трет-бутоксикарбонил-4-карбо(трет-бутилкарбонилоксиметокси)метилпиперазин: ИК (КВr) nmах 2977, 1756, 1698, 1458, 1421, 1279, 1247, 1173, 1107, 1019, 1009, 986 см-1;1H ЯМР
(СDС13) м.д. 5,79 (с, 2Н), 3,48 (т, 4Н, J=4,7 Гц), 3,23 (с, 2Н), 2,53 (т, 4Н, J=5,0 Гц), 1,46 (с, 9Н), 1,21 (с, 9Н);13С ЯМР (СDС13) м. д. 177,07, 168,84, 154,61, 79,
75, 79,45, 77,20, 58,92, 52,49, 38,76, 28,41, 26,84; MS (CI/CH4 m/z 359 (М+1)+.
Элементный анализ:
Рассчитано для С17Н30N2О6: С 56,96; Н 8,44; N 7,82.
Найдено: С 56,93; Н 8,43; N 7,77.
Объединяют 1-трет-бутоксикарбонил-4-карбо(трет-бутилкарбонилоксиметокси)метилпиперазин (960 мг, 2,7 ммоль) в безводном диоксане. Охлаждают на бане со льдом. Добавляют раствор соляной кислоты в диоксане (6 мл, 4М). Через 3 часа убирают охлаждающую баню и дают реакционной смеси нагреться до комнатной температуры. Упаривают в вакууме, получая твердое вещество: т.пл. 156-159oС; ИК (КВr) nmах 2981, 2937, 2923, 2719, 1763, 1459, 1417, 1396, 1209, 1156, 1123, 1006 см-1;1H ЯМР (ДМСО-D6) м.д. 9,53 (широкий с, 2Н), 5,77 (с, 2Н), 3,99 (широкий с, 2Н), 3,26 (широкий с, 4Н), 3,19 (широкий с, 4Н), 1,15 (с, 9Н);13С ЯМР (ДМСО-D6) м.д. 176,10, 166,31, 79,78, 55,14, 51,21, 48,26, 26,48; (CI/NН3) m/z 259 (М+1)+.
Элементный анализ:
Рассчитано для C12H22N2О4•2HCl: С 43,51; Н 7,30; N 8,46.
Найдено: С 43,90; Н 7,55; N 7, 94.
Пример 32
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-((4-карбо(трет-бутилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил-3-(3,
4-дихлорфенил)пирролидин
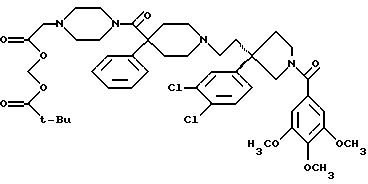
32.1 Синтез (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-((4-карбо-(трет-бутилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-карбоксипиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин (11,7 г, 18,24 ммоль) и соль 4-фенил-4-((карбо(трет-бутилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)-пиперидина и соляной кислоты (6 г, 18,1 ммоль) и N,N-диизопропилэтиламин (9,5), HATU (О-7-азабензотриазол-1-ил)-N,N, N', N'-тетраметилуроний гексафторфосфат) (7 г, 18,4 ммоль) и безводный диметилформамид (100 мл). Через 48 часов распределяют реакционную смесь между этилацетатом (500 мл) и 0,1М водным раствором соляной кислоты. Разделяют слои и экстрагируют водный слой этилацетатом. Объединяют органические слои и экстрагируют водой и затем рассолом. Сушат органический слой над MgSО4, фильтруют и упаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно смесью 1% метанол/дихлорметан, 2% метанол/дихлорметан и затем 3% метанол/дихлорметан, получая указанное в заголовке соединение.
32.2 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-((4-карбо(трет-бутилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил-3-(3,4-дихлорфенил)пирролидина и фумаровой кислоты
Раствор (R)-1-(3,
4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(трет-бутилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина (830 мг) в бутаноне (5 мл) нагревают
примерно до температуры кипения с обратным холодильником. Объединяют с раствором фумаровой кислоты (221 мг, 1,90 ммоль) в 2-бутаноне (30 мл), нагретым почти до кипения с обратным холодильником. Через
30 минут охлаждают до комнатной температуры и упаривают в вакууме, получая остаток. Растирают остаток с диэтиловым эфиром и перемешивают. Примерно через 1 час, позволив твердому веществу осадиться,
осторожно декантируют растворитель и добавляют еще диэтиловый эфир. Несколько раз декантируют и добавляют диэтиловый эфир. Фильтруют и сушат, получая указанное в заголовке соединение: т.пл.
135-140oС.
Получение 14
Соль 4-фенил-4-((4-карбо(N,N-диэтилкарбоксамидометокси)метилпиперазин-1-ил)карбоксамидо)пиперидина и соляной кислоты
Объединяют
1-трет-бутоксикарбонил-4-карбоксиметилпиперазин (1,0 г, 4,1 ммоль) и карбонат цезия (1,33 г) в диметилформамиде (20 мл). Через 2,5 часа добавляют 2-хлop-N,N-диэтилацетамид (0,67 г) и иодид натрия (0,
6
г). Нагревают до 65oС. Через 3 часа дают реакционной смеси охладиться до комнатной температуры. Через 18 часов распределяют остаток между диэтиловым эфиром и насыщенным водным раствором
бикарбоната натрия. Экстрагируют водный слой диэтиловым эфиром. Объединяют органические слои и экстрагируют несколько раз водой, а затем рассолом. Сушат над MgSО4, фильтруют и
концентрируют
в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно смесью 1% метанол/дихлорметан, 2% метанол/дихлорметан и затем 3% метанол/дихлорметан, получая
1-трет-бутоксикарбонил-4-карбо(N,N-диэтилкарбоксамидометокси)метилпиперазин.
Объединяют 1-трет-бутоксикарбонил-4-карбо(N, N-диэтилкарбоксамидометокси)метилпиперазин (0,3 г) и дихлорметан (10 мл). Охлаждают на бане со льдом. Продувают газообразным хлористым водородом. Через 2 часа упаривают в вакууме, добавляют дихлорметан и сушат в вакууме, получая указанное в заголовке соединение.
Пример 33
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо (N, N-диэтилкарбоксамидометокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин
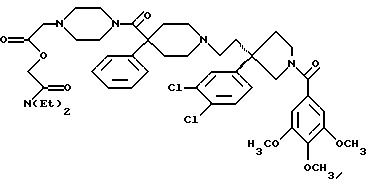
3.3.1 Синтез (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо (N,N-диэтилкарбоксамидометокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина.
Объединяют (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбоксипиперидин-1-ил)этил-3-(3,4-дихлорфенил) пирролидин (1,9 г, 1,5 ммоль) и соль 4-фенил-4-((карбо(N, N-диэтилкарбоксамидометокси)метилпиперазин-1-ил)карбоксамидо) пиперидина и соляной кислоты (0,49 г, 1,49 ммоль), N,N-диизопропилэтиламин (0,58 г), 1-гидроксибензотриазол гидрат (0,28 г, 2,1 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (0,4 г, 2,1 ммоль) в диметилформамиде (20 мл). Через 18 часов объединяют реакционную смесь с насыщенным водным раствором бикарбоната натрия (200 мл) и экстрагируют трижды этилацетатом. Объединяют органические слои и упаривают в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно смесью 1% метанол/дихлорметан, 2% метанол/дихлорметан, 3% метанол/дихлорметан, 4% метанол/дихлорметан и затем 5% метанол/дихлорметан, получая указанное в заголовке соединение.
33.2 Синтез соли
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(N,N-диэтилкарбоксамидометокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил) пирролидина и фумаровой кислоты
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(N, N-диэтилкарбоксамидометокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил) пирролидин (0,47 г) и
фумаровую
кислоту (0,125 г) в 2-бутаноне (10 мл). Нагревают примерно до 45oС. Через 15 минут концентрируют реакционную смесь в вакууме, получая остаток. Растирают остаток с диэтиловым
эфиром, получая
твердое соединение. Собирают твердое соединение фильтрованием, промывают диэтиловым эфиром и сушат в вакууме, получая указанное в заголовке соединение:
Элементный анализ:
Рассчитано
для C50H60Cl2N5O13: С 57,34; Н 6,15; N 6,19.
Найдено: С 57,71; Н 6,36; N 6,09.
Получение
15
Соль
4-фенил-4-((4-карбо(метилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидина и соляной кислоты
Объединяют 1-трет-бутоксикарбонил-4-карбоксиметилпиперазин (2,44
г) и карбонат цезия
(3,3 г) в диметилформамиде (60 мл). Через 1 час добавляют бромметилацетат (2 г) и йодид натрия (1,5 г). Нагревают до 65oС. Через 3 часа дают реакционной смеси
охладиться до комнатной
температуры. Через 18 часов фильтруют и разбавляют фильтрат диэтиловым эфиром для образования осадка. Фильтруют, удаляя осадок, и промывают диэтиловым эфиром, упаривают
фильтрат в вакууме, получая
остаток. Хроматографируют остаток на силикагеле, элюируя последовательно смесью 5% этилацетат/гексан, 10% этилацетат/гексан, 15% этилацетат/гексан, 20% этилацетат/гексан и
затем 25% этилацетат/гексан,
получая 1-трет-бутоксикарбонил-4-карбо(метилкарбонилоксиметокси)метилпиперазин.
Объединяют 1-трет-бутоксикарбонил-4-карбо(метилкарбонилоксиметокси) метилпиперазин (2,5 г) и дихлорметан (50 мл). Охлаждают на бане со льдом. Продувают газообразным хлористым водородом. Через 2 часа упаривают в вакууме, несколько раз добавляют диэтиловый эфир и упаривают. Добавляют диэтиловый эфир, фильтруют и сушат в вакууме, получая указанное в заголовке соединение.
Пример 34
(R)-1-(3,4,
5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо
(метилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
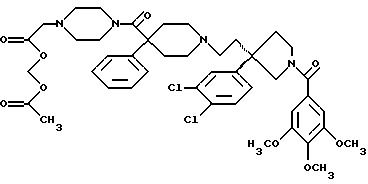
34.1. Синтез (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(метилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин
Получают способом Примера 31.1, используя (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-карбоксипиперидин-1-ил)-этил)-3-(3,4-дихлорфенил)пирролидин (3,5 г) и соль 4-фенил-4-((4-карбо(метилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидина и соляной кислоты (1,4 г) для получения после хроматографии на силикагеле с элюированием последовательно смесью 1% метанол/дихлорметан, 2% метанол/дихлорметан и 3% метанол/дихлорметан указанного в заголовке соединения.
34.2. Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(метилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и фумаровой кислоты
Получают способом
Примера 33.2, используя (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(метилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин (0,97 г) и
фумаровую кислоту (0,27 г) для получения указанного в заголовке соединения.
Получение 16
Соль
4-фенил-4-((4-карбо(пропилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидина и соляной кислоты
Получают способом Получения 15, используя хлорметилбутират для получения после
хроматографии на силикагеле с элюированием смесью 75% этилацетат/гексан 1-трет-бутоксикарбонил-4-карбо(пропилкарбонилоксиметокси)метилпиперазина: ИК (чистый) nmах 2973, 1763, 1696, 1457, 1422, 1366,
1291, 1276, 1262, 1247, 1173, 1127, 1101, 1008, 988 см-1;1H ЯМР (СDС13) м.д. 5,79 (с, 2Н), 3,48 (т, 4Н, J=4,9 Гц), 3,29 (с, 2Н), 2,54 (т, 4Н, J=5,0 Гц), 2,35 т, 4Н,
J=7,3 Гц), 1,71-1,61 (м, 2Н), 1,49 (с, 9Н), 0,96 (т, 3Н, J=7,3 Гц).
Объединяют 1-трет-бутоксикарбонил-4-карбо(пропилкарбонилоксиметокси)метилпиперазин (1,15 г, 3,30 ммоль) и безводный диоксан (20 мл). Охлаждают на бане со льдом. Добавляют раствор соляной кислоты в диоксане (7 мл, 4М). Через 18 часов концентрируют в вакууме, получая указанное в заголовке соединение: т.пл. 137-140oС.
Пример 35
(R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(пропилкарбонилоксиметокси)метилпиперазин-1-ил)карбокcамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидин
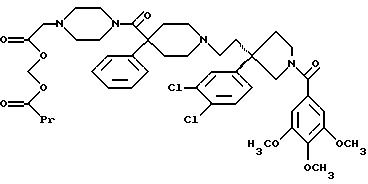
35.1. Синтез (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(пропилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидин
Получают способом Примера 32.1, используя (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-карбоксипиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин (1,3 г) и соль 4-фенил-4-((4-карбо(пропилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидина и соляной кислоты (635 мг) для получения после хроматографии на силикагеле с элюированием последовательно смесью 1% метанол/дихлорметан, 2% метанол/дихлорметан и 3% метанол/дихлорметан указанного в заголовке соединения.
35.2. Синтез (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(пропилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин)этил)-3-(3,4-дихлорфенил)пирролидина и фумаровой кислоты
Получают способом
Примера 3.2, используя (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(пропилкарбонилоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин) этил)-3-(3,4-дихлорфенил)пирролидин и фумаровую
кислоту для получения указанного в заголовке соединения: ИК (чистый) nmах 1761, 1632, 1583, 1459, 1418, 1237, 1128, 1102, 1005, 845 см-1; MS (CI/NH3) m/z 906 (М+1)+
.
Получение 17
(R)-1-(3,4,5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо (карбоксиметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1- ил)этил)-3-{ 3,
4-дихлорфенил)пирролидин
Объединяют 2-(триметилсилил)этанол (7,3 мл) и триэтиламин (25 мл) в дихлорметане (80 мл). Охлаждают на бане со льдом. Добавляют по капле хлорацетилхлорид (6,9 г). По
завершении добавления нагревают реакционную смесь до комнатной температуры. Через 5 часов добавляют хлорацетилхлорид (2,8 г). Через 2 часа фильтруют реакционную смесь и экстрагируют насыщенным водным
раствором бикарбоната натрия и затем водой. Сушат органический слой над MgSО4, фильтруют и упаривают в вакууме, получая остаток. Остаток перегоняют, получая
2-(триметилсилил)этилхлорацетат:
Т.кип. 150oС при 28 мм рт.ст.
Объединяют 1-трет-бутоксикарбонил-4-карбоксиметилпиперазин (1,25 г, 5,1 ммоль) и карбонат цезия (1,66 г, 5,1 ммоль) в безводном диметилформамиде (15 мл). Добавляют раствор 2-(триметилсилил)этилхлорацетата (1,1 г, 5,6 ммоль) в диметилформамиде (5 мл) и йодид натрия (0,77 г). Нагревают до 70oС. Через 1,5 часа охлаждают до комнатной температуры. Через 18 часов разбавляют реакционную смесь водой и экстрагируют трижды диэтиловым эфиром. Объединяют органические слои, сушат над MgSО4 и концентрируют в вакууме, получая остаток. Хроматографируют остаток на силикагеле, элюируя последовательно смесью 0,5% метанол/дихлорметан, 1% метанол/дихлорметан и затем 2% метанол/дихлорметан, получая 1-трет-бутоксикарбонил-4-карбо(карбо(2-(триметилсилил)этокси)-метокси)метилпиперазин.
Объединяют 1-трет-бутоксикарбонил-4-карбо(карбо(2-(триметилсилил)этокси)метокси)метилпиперазин (2, 1 г) и дихлорметан (20 мл). Охлаждают на бане со льдом. Продувают газообразным хлористым водородом. Через 2,5 часа упаривают в вакууме, получая остаток. Объединяют остаток и дихлорметан и упаривают в вакууме, получая остаток. Растирают остаток с диэтиловым эфиром, фильтруют и сушат, получая соль 4-карбо (карбо(2-(триметилсилил)этокси)метокси)метилпиперазина и соляной кислоты.
Объединяют соль 4-карбо(карбо(2-(триметилсилил) этокси)метокси)метилпиперазина и соляной кислоты (0,92 г, 2, 45 ммоль), (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-карбоксипиперидин-1-ил)этил)-3-(3, 4-дихлорфенил)пирролидин (5,1 г, 7,9 ммоль) и N,N-диизопропилэтиламин (5 мл) в дихлорметане (100 мл). После перемешивания в течение 10 минут добавляют 1-гидроксибензотриазол гидрат (1,1 г) и 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (1,53 г). Через 18 часов хроматографируют реакционную смесь на силикагеле, элюируя последовательно смесью 0,5% метанол/дихлорметан, 1% метанолом/дихлорметан и затем 1,5% метанол/дихлорметан, получая (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((карбо(карбо(2-(триметилсилил)этокси)метокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин: Rf= 0,38 (силикагель, 6% метанол/дихлорметан).
Объединяют (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((карбо(карбо(2-(триметилсилил)этокси)метокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин (3,78 г, 4,15 ммоль) и тетрагидрофуран (50 мл). Добавляют раствор тетрабутиламмонийфторида в тетрагидрофуране (6,6 мл, 1М, 6,6 ммоль). Через 1 час добавляют раствор тетрабутиламмонийфторида в тетрагидрофуране (3,0 мл, 1М). Через 4,5 часа упаривают реакционную смесь в вакууме, получая остаток. Делят остаток между дихлорметаном и водой. Разделяют слои, сушат органический слой над MgSO4, фильтруют и упаривают в вакууме, получая указанное в заголовке соединение.
Пример 36
(R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((карбо(N,
N-ди-(2-гидроксиэтил)карбоксамидометокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
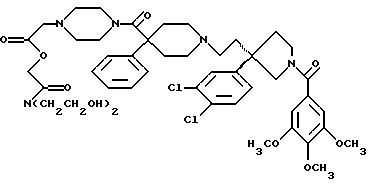
36.1. Синтез (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(N, N-ди-(2-гидроксиэтил)карбоксамидометокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(карбоксиметокси)метилпиперазин-1-ил)карбоксамидо) пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин (2,1 г, 2,54 ммоль), диэтаноламин (0,27 г, 2,54 ммоль), 1-гидроксибензотриазол гидрат (0,3 г, 2,8 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (0,54 г, 2,8 ммоль) и N,N-диизопропилэтиламин (0,75 мл) в дихлорметане (30 мл). Через 18 часов хроматографируют реакционную смесь на силикагеле, элюируя последовательно смесью 2% метанол/дихлорметан, 3% метанол/дихлорметан, 4% метанол/дихлорметан, 5% метанол/дихлорметан, 6% метанол/дихлорметан, 6% метанол/дихлорметан, содержащем 2 мл/л концентрированного гидроксида аммония, 6% метанол/дихлорметан, содержащем 4 мл/л концентрированного гидроксида аммония, 6% метанол/дихлорметан, содержащем 6 мл/л концентрированного гидроксида аммония, получая остаток. Повторно хроматографируют остаток на силикагеле, элюируя последовательно смесью 2% метанол/дихлорметан, 4% метанол/дихлорметан, 6% метанол/дихлорметан и затем 6% метанол/дихлорметан, содержащем 6 мл/л концентрированного гидроксида аммония, получая остаток. Повторно хроматографируют остаток на силикагеле, элюируя смесью дихлорметан/метанол/концентрированный гидроксид аммония=95/5/0,5, получая указанное в заголовке соединение.
36.2 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(N, N-ди-(2-гидроксиэтил)карбоксамидометокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина и фумаровой кислоты
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(ди-(2-гидроксиэтил)карбоксамидометокси) метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
(0,75 г) и фумаровую кислоту (0,190 г) в 2-бутаноне (40 мл). Нагревают до кипения с обратным холодильником. Через 20 минут охлаждают реакционную смесь и концентрируют в вакууме, получая остаток.
Растирают остаток с диэтиловым эфиром, фильтруют и сушат, получая указанное в заголовке соединение.
Пример 37
(R)-1-(3,4,
5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(N-метил-N-(2-диметиламиноэтил)карбоксамидометокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
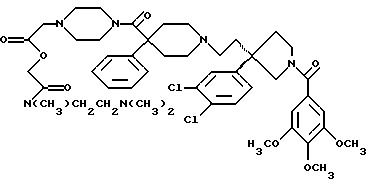
37.1 Синтез (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(N-метил-N-(2-диметиламиноэтил)карбоксамидометокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(карбоксиметокси)метилпиперазин-1-ил)карбоксамидо) пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин (2,2 г, 2,7 ммоль), N,N, N'-триметилэтилендиамин (0,3 г, 2,9 ммоль) и N,N-диизопропилэтиламин (0,8 мл) в дихлорметане (30 мл). Через 10 минут добавляют 1-гидроксибензотриазол гидрат (0,39 г, 2,9 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (0,56 г, 2,9 ммоль). Через 18 часов хроматографируют реакционную смесь на силикагеле, элюируя последовательно смесью 2% метанол/дихлорметан, 3% метанол/дихлорметан, 4% метанол/дихлорметан, 5% метанол/ дихлорметан, 6% метанол/дихлорметан, содержащем 5 мл/л концентрированного гидроксида аммония, получая остаток. Объединяют остаток и дихлорметан (200 мл), экстрагируют рассолом, сушат органический слой над MgSО4, фильтруют и упаривают в вакууме, получая указанное в заголовке соединение: Rf=0,5 (силикагель, дихлорметан/метанол/концентрированный гидроксид аммония = 90/10/0).
37.2 Синтез соли (R)-1-(3,4,
5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(N-метил-N-(2-диметиламиноэтил)карбоксамидометокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-дихлорфенил)пирролидина и фумаровой
кислоты
Получают способом Примера 36.2, используя (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(N-метил-N-(2-диметиламиноэтил)карбоксамидометокси)метилпиперазин-1-ил)
карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин для получения указанного в заголовке соединения.
Получение 18
Соль 4-карбо-(5-метил-2-оксо-1,
3-диоксол-4-илметокси)метилпиперазина и соляной кислоты
Объединяют 4-диметил-1,3-диоксол-2-он (3,42 г, 30 ммоль), N-бромсукцинимид (5,34 г, 30 ммоль) и АИБН (2,2'-азобисизобутиронитрил) (500
мг, 3 ммоль) в безводном четыреххлористом углероде (100 мл). Нагревают при кипении с обратным холодильником. Через 2 часа охлаждают и фильтруют. Концентрируют фильтрат, получая 4-бромметил-5-метил-1,
3-диоксол-2-он (6,5 г, сырой) в виде масла, которое можно применять на следующей стадии без дополнительной очистки.
Объединяют 1-трет-бутоксикарбонил-4-карбоксиметилпиперазин (980 мг, 4,01 ммоль), сырой 4-бромметил-5-метил-1,3-диоксол-2-он (1,21 г, примерно 70% чистоты, 4,4 ммоль) и карбонат цезия (1,30 г, 3,99 ммоль) в диметилформамиде (16 мл). Нагревают примерно до 60o С. Через 4 часа реакционную смесь охлаждают, разбавляют водой и трижды экстрагируют этилацетатом. Объединяют органические слои, экстрагируют водой и концентрируют в вакууме, получая остаток. Остаток хроматографируют на силикагеле, элюируя этилацетатом и получая 1-трет-бутоксикарбонил-4-карбо-(5-метил-2-оксо-1,3-диоксол-4-илметокси)метилпиперазин: ИК (KBr) nmax 2976, 1825, 1750, 1693, 1423, 1247, 1231, 1169, 1130, 1012 см-1;1H ЯМР (CDCl3) м.д. 4,87 (с, 2Н), 3,47 (т, 4Н, J=5,0 Гц), 3,28 (с, 2Н), 2,53 (т, 4Н, J=5,0 Гц), 2,18 (с, 3Н), 1,71 (широкий, 1Н, Н2О), 1,45 (с, 9Н); MS (CI, CH4) m/z 357 (M+1)+.
Элементный анализ:
Рассчитано для C16H24N2О7
: С 53,93;
Н 6,79; N 7,86.
Найдено: С 54,11; Н 6,71; N 7,52.
Объединяют 1-трет-бутоксикарбонил-4-карбо-(5-метил-2-оксо-1,3-диоксол-4-илметокси)метилпиперазин (832 мг, 2,3 ммоль) и безводный диоксан (20 мл). Охлаждают на бане со льдом. Добавляют раствор соляной кислоты в диоксане (6 мл, 4М НСl). Через 1 час нагревают до комнатной температуры. Через 18 часов упаривают в вакууме примерно при 50oС, получая указанное в заголовке соединение, т.пл. 79-82oС.
Элементный анализ:
Рассчитано для С11Н16N2
О5•2НСl: С 40,14; Н 5,51; N 8,51.
Найдено: С 39,89; Н 5,88; N 7,35.
Пример 38
(R)-1-(3,4,
5-Триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(5-метил-2-оксо-1,3-диоксол-4-илметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидин
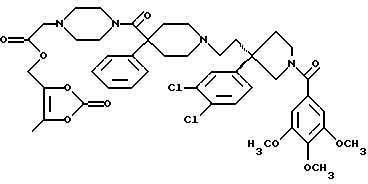
38.1 Синтез (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(5-метил-2-оксо-1, 3-диоксол-4-илметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,4-дихлорфенил)пирролидина
Объединяют (R)-1-(3,4, 5-триметоксибензоил)-3-(2-(4-фенил-4-карбоксипиперидин-1-ил)этил)-3-(3,4-дихлорфенил) пирролидин (1,28 г, 2,00 ммоль), HATU ((О-7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат) (760 мг, 2 ммоль), соль 4-карбо(5-метил-2-оксо-1,3-диоксол-4-илметокси)метилпиперазина и соляной кислоты (658 мг, 2 ммоль) и N,N-диизопропилэтиламин (2,0 мл) в безводном диметилформамиде (10 мл). Через 72 часа упаривают в вакууме при 60oС, удаляя большую часть растворителя. Распределяют выпаренную реакционную смесь между этилацетатом и насыщенным водным раствором бикарбоната натрия. Разделяют слои и экстрагируют водный слой другой частью этилацетата. Объединяют органические слои и экстрагируют водой, а затем рассолом. Концентрируют в вакууме, получая остаток. Остаток хроматографируют на силикагеле, элюируя последовательно смесью 3,75% метанол/дихлорметан, 5% метанол/дихлорметан и затем 7,5% метанол/дихлорметан, получая указанное в заголовке соединение.
38.2 Синтез соли (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(5-метил-2-оксо-1,З-диоксол-4-илметокси) метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил)этил)-3-(3,
4-дихлорфенил)пирролидина и фумаровой кислоты
Получают способом Примера 36.2, используя (R)-1-(3,4,5-триметоксибензоил)-3-(2-(4-фенил-4-((4-карбо(5-метил-2-оксо-1,
3-диоксол-4-илметокси)метилпиперазин-1-ил)карбоксамидо)пиперидин-1-ил) этил)-3-(3,4-дихлорфенил)пирролидин (955 мг, 1,085 ммоль) и фумаровую кислоту (252 мг, 2,17 ммоль) для получения указанного в
заголовке соединения. ИК (КВr) nmах 3438, 2939, 1821, 1711, 1633, 1601, 1582, 1458, 1420, 1236, 1177, 1152, 1127 см-1;1H ЯМР (ДМСО-D6) м.д. 4,87 (с, 2Н), 3,47 (т, 4Н,
J=5,0 Гц), 3,28 (с, 2Н), 2,53 (т, 4Н, J=5,0 Гц), 2,18 (с, 3Н), 1,71 (широкий, 1Н, Н2О), 1,45 (с, 9Н); MS (CI, СН4) m/z 883, 881, 879 (М+1)+.
Элементный анализ:
Рассчитано для C45H52Cl2N4О10•1,75 С4Н4О4•0,6(С2Н5)2О•Н2О:
С 57,04; Н 5,90; N 4,89.
Найдено: С 57,09; Н 5,81; N 4,52.
Тахикинины представляют собой класс нейропептидов, которые участвуют в обычной С-терминальной последовательности Phe-Xaa-Gly-Leu-Met-NH2. Тахикинины широко распространены в периферической и центральной нервных системах, где они связывают, по крайней мере, три типа рецепторов. Рецепторы NK1, NK2 и NК3 определяют по способности предпочтительного связывания вещества Р, нейрокина A (NKA) и нейрокина В (NKB), соответственно.
Использование антагонистов тахикинина показано в качестве терапии разнообразных тахикинин-опосредованных заболеваний и состояний, включая цистит; бронхостеноз; аллергические реакции; боли; периферическую невропатию; невралгию после опоясывающего лишая; побочные иммунологические реакции; респираторные заболевания, такие как астма, бронхит, кашель, ринит, аллергии и подобное; глазные болезни, такие как конъюнктивит и весенний конъюнктивит; кожные заболевания, такие как контактный дерматит, атопический дерматит и крапивница; воспалительные заболевания, такие как ревматоидный артрит, остеоартрит и подобные; желудочно-кишечные симптомы, такие как болезнь Крона, рвота и неспецифический язвенный колит; состояния, обусловленные расширением кровеносных сосудов, такие как стенокардия и мигрень; состояния и заболевания центральной нервной системы, такие как страх, депрессия, психоз, шизофрения, слабоумие.
Понятно, что тахикинин-опосредованные заболевания и состояния - это те заболевания и состояния, которые включают тахикинины, целиком или частично, в их клиническом проявлении (проявлениях). Кроме того, включение тахикининов не обязательно является причиной конкретной тахикинин-опосредованной болезни и состояния. Антагонисты тахикинина полезны при регулировании или обеспечении терапевтического облегчения таких тахикинин-опосредованных заболеваний и состояний.
Настоящее изобретение обеспечивает новые и полезные антагонисты тахикинина формулы (1) и их стереоизомеры и фармацевтически приемлемые соли. В частности, настоящее изобретение обеспечивает соединения формулы (1), которые являются антагонистами рецепторов NK1 и NK2.
Еще один вариант настоящего изобретения обеспечивает способ лечения тахикинин-опосредованных заболеваний и состояний у нуждающегося в этом пациента, отличающийся тем, что включает введение указанному пациенту терапевтически эффективного количества соединения формулы (1). Различные заболевания и состояния, подлежащие лечению данным способом, хорошо известны и понятны специалистам. Признано также, что специалист может влиять на сопутствующие заболевания и состояния при лечении пациента, страдающего в настоящее время от данных заболеваний или состояний, или при профилактическом лечении пациента терапевтически эффективным количеством соединений формулы (1).
Использованный здесь термин "пациент" обозначает теплокровное животное, такое как млекопитающее, которое страдает от конкретного тахикинин-опосредованного заболевания или состояния. Понятно, что область, охваченная данным термином, включает морских свинок, собак, кошек, крыс, мышей, лошадей, крупный рогатый скот, овец и людей. Пациент нуждается в лечении тахикинин-опосредованных заболеваний и состояний, если он страдает от одного (или более) из описанных здесь заболеваний или состояний.
Идентификация тех пациентов, которые нуждаются в лечении тахикинин-опосредованного заболевания или состояния, успешно выполняется в пределах возможностей и знаний специалиста. Практикующий врач может легко провести идентификацию, используя клинические тесты, физические исследования и фамильную историю болезни пациентов, нуждающихся в таком лечении.
Использованный здесь термин "терапевтически эффективное количество" соединения формулы (1) обозначает количество, которое эффективно при регулировании тахикинин-опосредованных заболеваний и состояний. Термин "регулирование" предназначен для обозначения всех процессов, в которых возможно замедление, прерывание, задержка или прекращение развития описанных здесь заболеваний или состояний, но необязательно указывает полное исключение всей болезни и симптомов, и предназначен включить профилактическое лечение тахикинин-опосредованных заболеваний или состояний.
Терапевтически эффективное количество можно легко определить, привлекая диагноста как специалиста, используя общеизвестные приемы и следя за результатами, полученными в аналогичных обстоятельствах. При определении терапевтически эффективного количества, дозы диагност рассматривает ряд факторов, включая (но не ограничиваясь этим) вид млекопитающего; его размер, возраст и общее состояние здоровья; имеющееся конкретное заболевание; степень поражения или тяжести заболевания; реакцию индивидуального пациента; конкретное принимаемое соединение; способ приема; характеристику биологической пригодности принимаемого препарата; выбранную схему приема лекарственного средства; использование сопутствующего лекарственного средства и другие относящиеся к делу обстоятельства.
Полагают, что терапевтически эффективное количество соединения формулы (1) варьируется примерно от 0,1 до 100 мг/кг/день. Специалист способен определить предпочтительные количества.
При эффективном лечении пациента, страдающего от описанных выше тахикинин-опосредованных заболеваний и состояний, соединение формулы (1) можно вводить в любом виде или любым способом, который делает это соединение биологически приемлемым в эффективном количестве, включая оральный прием, ингаляцию, парентеральный и локальный способы введения. Например, соединения формулы (1) можно вводить орально в виде ингаляции аэрозоля или сухого порошка, подкожно, внутримышечно, внутривенно, внутриносовым способом, ректально, трансдермально, локально и подобными способами. Для лечения респираторных заболеваний и состояний, например, астмы, бронхита и кашля предпочтительно оральное введение или ингаляция. Специалист по приготовлению лекарственных препаратов легко может выбрать подходящую форму и способ приема в зависимости от конкретных характеристик выбранного соединения и подлежащего лечению заболевания или состояния, стадии заболевания и других относящихся к делу обстоятельств (Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co. (1990).
Соединения настоящего изобретения можно вводить сами по себе или в виде фармацевтических композиций с фармацевтически пригодными носителями или наполнителями, долю и природу которых определяют по растворимости и химическим свойствам выбранного соединения, способа приема и стандартной фармацевтической практики. Соединения настоящего изобретения, при их собственной эффективности, можно готовить и вводить в виде их фармацевтически приемлемых солей, таких как соли присоединения кислот или соли присоединения оснований, в целях стабильности, удобства кристаллизации, повышения растворимости и подобного.
В другом варианте настоящее изобретение обеспечивает фармацевтические композиции, включающие терапевтически эффективное количество соединения формулы (1) в смеси (или другой ассоциации) с одним (или большим количеством) фармацевтическим носителем или наполнителем.
Фармацевтические композиции получают хорошо известным в фармацевтической практике способом. Носитель или наполнитель может быть полутвердым или жидким материалом, который может служить в качестве наполнителя или среды для активного ингредиента. Подходящие носители или наполнители хорошо известны в практике. Фармацевтическую композицию можно применять для орального приема, ингаляции, парентерального введения или локального использования и можно вводить пациенту в виде таблеток, капсул, аэрозолей, ингаляционных препаратов, суппозиториев, растворов, суспензий и подобного.
Соединения настоящего изобретения можно вводить орально, например, с инертным растворителем или годным в пищу носителем. Их можно заключать в желатиновые капсулы или прессовать в таблетки. Для целей орального терапевтического приема соединения формулы (1) можно включать с наполнителями и использовать в форме таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток, жевательных резинок и подобного. Эти препараты должны содержать, по крайней мере, 4% соединения формулы (1) - активного ингредиента, но количество можно варьировать в зависимости от конкретной формы, и в общепринятом случае оно может составлять от 4 до примерно 70 мас.% стандартной дозы. Количество присутствующего в композиции активного ингредиента таково, что получают подходящую для приема стандартную дозированную форму.
Таблетки, пилюли, капсулы, пастилки и др. могут также содержать один или более из следующих адъювантов: связующие, такие как микрокристаллическая целлюлоза, трагакант или желатин; наполнители, такие как крахмал или лактоза; дезинтеграторы, такие как альгиновая кислота, Primogel, кукурузный крахмал и подобное; лубриканты, такие как стеарат магния или Sterotex; агенты для придания скольжения (glidants - глиданты), такие как коллоидный диоксид кремния; и можно также добавлять подслащающие агенты, такие как сахароза или сахарин, или ароматизаторы, такие как мята перечная, метилсалицилат или апельсиновый ароматизатор. Когда стандартная дозированная форма является капсулой, то в дополнение к материалам указанных выше типов она может содержать жидкий носитель, такой как полиэтиленгликоль или жирное масло. Другие стандартные дозированные формы могут содержать другие разные материалы, которые модифицируют физическую форму дозированной единицы, например, оболочки. Таким образом, таблетки или пилюли можно покрыть сахаром, шеллаком или другими агентами для энтеросолюбильных оболочек. Сиропы в дополнение к соединениям данного изобретения могут содержать сахарозу в качестве подслащающего агента и определенные консерванты, красители и цветные агенты, ароматизаторы. Используемые в приготовлении этих разных композиций материалы должны быть фармацевтически чистыми и нетоксическими в используемых количествах.
Для парентерального терапевтического введения соединения настоящего изобретения можно включить в раствор или суспензию. Эти препараты должны содержать, по крайней мере, 0,1% соединения данного изобретения, но их количество можно менять от 0,1 до примерно 50 мас.%. Количество присутствующего в таких композициях активного ингредиента таково, что дает подходящую дозировку. Специалист в состоянии определить предпочтительные композиции и препараты.
Растворы или суспензии могут также включать один или более из следующих адъювантов: стерильные разбавители, такие как вода для инъекции, физиологический раствор, определенные масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты; и агенты для регулирования токсичности, такие как хлорид натрия или декстроза. Препараты для парентерального введения можно заключать в ампулы, имеющиеся в распоряжении шприцы и пузырьки на несколько доз, сделанные из стекла или пластика.
Соединения настоящего изобретения можно также вводить посредством ингаляции аэрозоля или сухого порошка. Подачу можно осуществлять при помощи сжиженного или сжатого газа, или используя подходящий насос, который распыляет соединения настоящего изобретения или их препараты. Препараты для введения посредством ингаляции соединения формулы (1) можно подавать в виде однофазной, двухфазной или трехфазной системы. Для введения соединения формулы (1) в виде аэрозоля допустимо разнообразие систем. Препараты - сухие порошки получают либо путем гранулирования или размалывания соединения формулы (1) до подходящего размера частиц, либо путем смешивания гранулированного или размолотого соединения формулы (1) с подходящим материалом носителя, таким как лактоза и подобные. Устройство подачи посредством ингаляции включает необходимый контейнер, активаторы, клапаны, субконтейнеры и подобное. Специалист может определить предпочтительные аэрозольные и сухие порошковые препараты для введения путем ингаляции.
Соединения настоящего изобретения можно также применять локально, при этом подходящий носитель может включать основу в виде раствора, мази или геля. Основа, например, может включать одно или более из следующих веществ: петролатум, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, эмульгаторы и стабилизаторы. Препараты для локального применения могут иметь концентрацию соединения формулы (1) или его фармацевтически пригодной соли примерно от 0,1 до 10% (масс/объем).
Антагонисты рецепторов тахикинина настоящего изобретения можно оценить при помощи процедур, которые описаны ниже.
Пример А
Антагонизм предполагаемых антагонистов связыванию йодированного тахикинина с NK1 и NK2
рецепторами
Специалист может определить сродство рецептору NK1 и рецептору NK2 in vitro следующим образом. Сродство рецептору NK1
антагонистов тахикинина
оценивают на легких морских свинок (Keystone Biologicals, Cleveland, ОН), а сродство рецептору NK2 оценивают на клетках HSKR-1 (которые являются фибробластами 3Т3,
экспрессирующими
человеческий еюнальный рецептор NK2). Ткани или клетки гомогенизируют с Polytron в 15 объемах 50 мМ буфера Трис-НСl (рН 7,4, 4oС) и центрифугируют. Гранулы
суспендируют повторно
в буфере Трис-НСl и центрифугируют; дважды промывают гранулы повторным суспендированием. Конечные гранулы снова суспендируют при концентрации 40 мг/мл для тканей и 20 мг/мл для
клеток в инкубационном
буфере и оставляют до использования при комнатной температуре, по крайней мере, на 15 минут. Связывание рецепторов инициируют, добавляя 250 мкл мембранного препарата (два
параллельных эксперимента) к
0,1 нМ следующих радиолигандов:125I-Bolton Hunter Lys-3 меченное вещество Р и125иодгистидил-1-нейрокинин А; в конечном объеме 500 мкл буфера,
содержащего 50 мМ Трис-НСl (рН 7,4
при комнатной температуре), 0,1% бычьего сывороточного альбумина, 2 мМ хлорида марганца, 40 мкг/мл бацитрацина (bacitracin), по 4 мкг/мл лейпептина (lеupeptin) и
химостатина (chymostatin), 10 мкМ
тиорфана (thiorphan) и разные дозы предполагаемых антагонистов тахикинина. Инкубацию проводят при комнатной температуре в течение 90 минут (исследование рецептора
NK1) или 2 часов
(исследование рецептора NK2); связывание прекращают, добавляя 50 мМ буфера Трис-НСl (рН 7,4, 4oС) и фильтруя в вакууме через фильтры GF/B,
предварительно пропитанные 0,1%
полиэтиленимином (исследование рецептора NK1) или 0,5% бычьим сывороточным альбумином (исследование рецептора NK2). При помощи гамма-счетчика
проводят количественное определение
фильтра, связывающего радиоактивность. Неспецифическое связывание определяют как связывание в присутствии 1 мкМ вещества Р или нейрокинина А. Специфическое
связывание рассчитывают, вычитая
неспецифическое связывание из общего связывания. Конкуренцию йодированного SP (вещества Р) или связывание NKA (нейрокинина А) исследуемыми соединениями или
стандартами выражают как процент от этого
максимального связывания. Значения IC50 (концентрация, необходимая для ингибирования 50% связывания рецепторов) получают для каждого из
исследуемых соединений путем нелинейной регрессии с
использованием программы подгонки итерационной кривой (GraphPAD Inplot, San Diego, CA).
Пример В
Антагонизм
предполагаемых антагонистов тахикинин-индуцированному обороту
фосфатидилинозитола (PI) in vitro
Специалист может также определить силу антагонизма рецептору NK1 и рецептору NK2 in vitro следующим образом. Тахикинин-опосредованное
накопление фосфатидилинозитола (PI, инозитолфосфат) определяют в клетках UC11 или SKLKB82# 3 в присутствии и в отсутствие антагонистов
рецепторов NK1 или NK2, соответственно.
Ткани инкубируют в буфере Krebs-Henseleit при 37oС c наполнением газом: 95% кислорода - 5% диоксида углерода. Затем ткани
инкубируют в свежем буфере, содержащем 100 микрокюри мио[2-3H(N)]инозитола при 37oС в течение 60 минут при спокойном выделении газа. После двух раз промывания при комнатной
температуре в 5 мл буфера, содержащего 10 мМ хлорида лития, ткани
инкубируют в течение 30 минут при комнатной температуре с заменой буфера через 15 минут. Буфер удаляют и добавляют буфер
Krebs-Henseleit (содержащий 40 мкг/мл бацитрацина (bacitracin), по 4 мкг/мл
лейпептина (leupeptin) и химостатина (chymostatin), 0,1% бычьего сывороточного альбумина, 10 мкМ тиорфана (thiorphan) и 10
мкМ хлорида лития), включающий исследуемые соединения. Для начала реакции
через 15 минут добавляют SP к клеткам UC11 или NKA к клеткам SKLKB82#3 при разных концентрациях. После инкубации в течение 60
минут при комнатной температуре реакцию прекращают, добавляя к каждой
пробирке 930 мкл смеси хлороформ:метанол (1:2 по объему), а затем 310 мкл хлороформа и 310 мкл дважды дистиллированной воды.
Образцы перемешивают, центрифугируют, удаляют 0,9 мл водной (верхней) фазы
и добавляют до 2 мл дважды дистиллированную воду. Смесь перемешивают и загружают в ионообменную колонку 50% Bio-Rad AG 1-Х8
(формиатная форма, 100-200 меш) (Bio-Rad Laboratories, Hercules, CA).
Колонки промывают по порядку: 1) 10 мл дважды дистиллированной воды, 2) смесью 5 мл 5 мМ динатрий тетраборат/60 мМ формиат натрия
и 3) смесью 5 мл 1М формиат аммония/0,1М муравьиная кислота. Третий
смыв собирают и 1 мл подсчитывают в 7 мл сцинтилляционной жидкости. Удаляют аликвоту 50 мкл органической (нижней) фазы, сушат в
сцинтилляционной пробирке и подсчитывают в 7 мл сцинтилляционной
жидкости.
Рассчитывают соотношение DPM в аликвоте водной фазы (общее количество инозитол фосфатов) к DPM в 50 мкл органической фазы (общее количество включенного [3 Н]-инозитола) для каждого образца. Данные выражают как процент агонист-индуцированного накопления [3H]-инозитол фосфатов сверх основных уровней. Сравнивают соотношение в присутствии исследуемого соединения и/или стандартов относительно соотношений для контрольных образцов (то есть, без стимулирующего агониста).
Строят графики зависимости реакции от дозы и при помощи компьютерной программы определяют способность исследуемых соединений ингибировать тахикинин-индуцированный оборот фосфатидилинозитола. Данные выражают как процент стимулирования общего накопления инозитол фосфата сверх основных уровней и нормируют относительно максимальной реакции, вызванной тахикинином. Используя кривые откликов на дозы, проводят анализ (Schild analysis) для получения величины, показывающей силу конкурирующего антагониста, и обозначают как рА2, что является отрицательным логарифмом молярной концентрации агониста, который снижает эффект дозы агониста до половины величины, ожидаемой при данной дозе агониста. Если наклон линий, полученных посредством анализа (Schild analysis), несущественно отличается от (1), соединение действует как конкурентный антагонист.
Пример С
Оценка антагонизма NK1 in vivo
Специалист может
также определить in vivo, что соединения настоящего изобретения являются
антагонистами рецептора NK1, оценивая способность соединения ингибировать индуцированную веществом Р транссудацию
белка плазмы в трахее морской свинки. Индуцированное веществом Р
просачивание белка через посткапиллярные венулы исследуют, измеряя накопление красителя Evans Blue dye в трахее морской свинки.
Животным проводят анестезию пентобарбиталом, потом делают инъекцию
красителя Evans Blue dye (20 мг/кг, внутривенно, приготовлен в 0,9% растворе хлорида натрия). Через минуту после введения красителя
вводят антагонист (внутривенно), а затем вещество Р (1,0 нмоль/кг,
внутривенно), и через 5 минут избыток красителя удаляют из циркуляции посредством транскардиальной перфузии 50 мл 0,9% раствора
хлорида натрия. Трахею и первичные бронхи (primary bronchi) удаляют,
промокают досуха и взвешивают.
Количественное определение красителя производят спектрофотометрически (620 нм) после экстракции тканей в формамиде в течение 24 часов при 50o С. Значения вычитают из основы (только краситель без агониста). ED50 (доза соединения, которая ингибирует на 50% индуцированную веществом Р транссудацию белка плазмы) рассчитывают посредством линейного регрессионного анализа.
Пример D
Оценка антагонизма NK2 in vivo
Специалист может определить in vivo, что соединения настоящего
изобретения являются антагонистами рецептора NK2, оценивая способность соединения ингибировать бронхостеноз, вызванный
избирательным антагонистом рецептора NK2[β-Ala8]NKA 4-10 у морских свинок. Животным проводят анестезию уретаном и затем канюлирование через шейную вену, сонную артерию и
трахею. Канюлю из сонной артерии соединяют с датчиком давления
(Statham pressure transducer) для измерения кровяного давления, а расположенный в шейной вене катетер используют для введения
исследуемых соединений. Трахейную канюлю вставляют в Т-соединительное
устройство. Одно плечо Т-соединения присоединяют к респираторному насосу, тогда как другое плечо присоединяют к другому датчику
давления. Респираторный насос регулируют таким образом, чтобы он делал
64 хода в минуту и объем подаваемого воздуха был таким, чтобы давление вдувания составляло 10 см вод.ст. Животное оставляют
акклиматизироваться на 15 минут, пока не получат стабильное дыхание и
кровяное давление. Предполагаемые антагонисты тахикинина или наполнитель вводят внутривенно и трубку промывают водой. Затем
строят кривые зависимости реакции на дозу избирательного антагониста
рецептора NK2[β-Ala8]NKA 4-10 при дозах 1-30 нмоль/кг, внутривенно. Из зависящего от дозы увеличения
легочного давления вдувания, которое происходит в ответ на агонист,
делают вывод о бронхостенозе. Антагонизм исследуемых соединений определяют из сдвига вправо на графике "доза агониста-отклик" и
подавления максимального давления вдувания, производимого в ответ на
[β-Ala8]NKA 4-10.
Пример Е
Оценка антагонизма NK1 и NK2 in
vivo
Специалист может определить in vivo, что соединения
настоящего изобретения являются антагонистами рецептора NK2, оценивая способность этих соединений ингибировать
капсаицин-индуцированные (capsaicin-induced) респираторные эффекты, которые,
как известно, освобождают SP и NKA из чувствительных нервов дыхательных путей. Антагонизм капсаицин-индуцированных
респираторных эффектов у находящихся в сознании морских свинок осуществляют следующим
образом. Эксперименты in vivo проводят, используя самцов морских свинок Dunkin Hartley (250-350 г). Одновременно
следят за изменениями у находящихся в сознании дышащих 4 животных, применяя
модифицированный способ плетизмографии всего тела, устройство для которого состоит из четырех небольших плексиглазовых
коробочек, каждая из которых соединена с коробкой сравнения через
дифференциальный датчик давления Validyne DP 45-16. 4 Коробки оборудованы трубопроводом, подающим воздух (также используется для
подачи аэрозоля), и выводящим воздухопроводом. Линии подачи и вывода
имеют одинаковую длину и узкое отверстие из общей камеры подачи и в общую камеру для исходящего воздуха. Эту систему используют
для обеспечения условий, когда флуктуации подаваемого воздуха и
атмосферное давление остаются в фазе и удаляются из полезного сигнала при помощи дифференциальных датчиков давления. Аналоговые сигналы
давления преобразуют в цифровую форму посредством
преобразователя (Data Translation DT2821 A to D board). Данные собирают со скоростью 100 образцов/секунда/животное. Каждый цикл изменения давления
анализируют, используя следующие параметры: наклон
подъема и падения, определенный между минимумом и максимумом давления, отношение наклона подъема к наклону спада и величину изменения между
начальным давлением и пиковым давлением цикла. Используя эти
величины (и наблюдая за животными), характеризуют циклы давления как нормальное дыхание, усиленное выдыхание (видно по поднятию брюшины),
важные респираторные случаи (SREs; обычно кашель, реже чиханье
или затрудненное дыханье, которые характеризуются временными предельно большими увеличениями давления, которые отличимы от шума) и
движение/шум при помощи компьютера РСАТ 286, управляющего
операционной системой System V UNIX. Одышку определяют как существенное длительное повышение давления в плетизмографе, что связано с
наблюдаемым у животных сдвигом к одышке.
На протяжении типичного эксперимента, в котором исследуют чувствительность дыхательных путей к различным вызывающим бронхостеноз агентам, в течение 19 минут подают аэрозоли (0,33 мл/мин), используя ультразвуковой распылитель DeVil-biss Ultraneb 99, и в течение этого времени следят за животными. Перед распылением наблюдают 1 минуту спокойного дыхания для получения базовой линии. В предварительных экспериментах оценивают различные концентрации каспаицина и выбирают концентрацию 0,001%, при которой максимально увеличено количество животных, демонстрирующих одышку, но уменьшена до минимума тяжесть реакции. Предполагаемые антагонисты тахикинина вводят внутривенно за 20 минут до начала подачи аэрозоля или орально за 1 час до подачи аэрозоля.
Связывание рецепторов тахикинина (величины IC50) для типичных соединений настоящего изобретения показано в табл. 1. Величины в табл. 1 определены способом примера А настоящего изобретения и представляют средние значения нескольких экспериментов, за исключением отмеченных. Некоторые представленные соединения демонстрируют высокое сродство к обоим рецепторам NK1 и NK2.
Далее приводятся данные касающиеся физико-химических свойств соединений настоящей заявки (табл. 2).
Температура плавления соединения примера 26: 182-185oС.
Далее приведены данные ЯМР для соединений следующих примеров:
Пример 4: Спектр1H ЯМР (300 МГц, ДМСО-D6): δ 12,5 шир.с (протон карбоновой кислоты), 11,2-10,0 ряд
шир.с (протон пиперидиния), 7,67-7,23 ряд м (8Н; ароматические протоны), 6,83 и 6,79 с (2Н; триметоксифенил), 4,36-1,39 ряд м
(25Н; алифатический метин и метилен), 3,81 с (6Н; ароматический метокси),
3,71 и 3,69 с (3Н; ароматический метокси).
Пример 6: Спектр1H ЯМР (300 МГц, ДМСО-D6): δ 11,6-11,25 ряд шир. с (протон пиперидиния), 8,64-8,44 ряд м (2Н; Н-α и Н-ε пиридина), 7,82-7,22 ряд м (5Н; Н-γ и Н-δ пиридина и дихлорфенил), 6,85 и 6,79 с (2Н; триметоксифенил), 4,05-2,00 ряд м (28Н; алифатический метилен), 3,82 с (6Н; ароматический метокси), 3,71 и 3,68 с (3Н; ароматический метокси).
Пример 8: Спектр1H ЯМР (300 МГц, СDСl3), различимы два конформера (примерно 1: 1, отнесенные к пирролидиновым амидным ротамерам); δ 7,44-7,15 ряд м (7Н; ароматические ротоны), 7,11 и 6,98 дд (J=8,5 2 Гц; Н-6 дихлорфенила), 6,71 и 6,70 с (2Н; триметоксифенил), 4,12 кв (2H, J=7 Гц; метиленовая группа этилового эфира), 4,03-1,70 ряд м (26Н; алифатический метилен), 3,87-3,84 ряд с (9Н; ароматический метокси), 3,04 с (2H; выделенная группа метилена), 1,22 т (3Н, J= 7 Гц; метильная группа этилового эфира).
Пример 9: Спектр1H ЯМР (300 МГц, СDСl3): δ 7,43 и 7,38 шир.д (J=8,5 Гц; Н-5 дихлорфенила), 7,31 и 7,15 шир. с (Н-2 дихлорфенила), 7,25-6,92 ряд м (6Н; протоны фенила и Н-6 дихлорфенила), 6,71 и 6,69 шир. с (2H; триметоксифенил), 4,15-1,80 ряд м (28Н; алифатический метилен), 3,88-3,84 ряд с (9Н; ароматический метокси).
Пример 10: Спектр1H ЯМР (300 МГц, СDСl3): δ 12,1-11,6 ряд шир.с (протон пиперидиния), 9,9-9,6 ряд шир.с (протон тетразола), 8,05-7,10 ряд м (11Н; ароматические протоны), 4,30-2,10 ряд м (28Н; алифатический метилен), 4,20 и 4,18 кв (2H, J=7 Гц; метиленовая группа этилового эфира), 3, 97 и 3,93 с (3Н; ароматический метокси), 1,26 и 1,24 т (3Н, J=7 Гц; метильная группа этилового эфира).
Пример 14: Спектр1H ЯМР (300 МГц, СDСl3), различимы два конформера (прим. 1: 1, отнесенные к пирролидинамидным ротамерам); δ 7, 43 и 7,38 д (J= 8,5 Гц; Н-5 дихлорфенила), 7,38-7,19 ряд м (6Н; ароматические протоны), 7,12 и 6,99 дд (J= 8,5, 2 Гц; Н-6 дихлорфенила), 6,71 с (2Н; триметоксифенил), 4,51-4,41 м (пролин Н-α), 4,02-3,36 ряд м (16Н; ароматический метокси, карбометокси и алифатический метилен), 3,04-1,42 ряд м (20Н; алифатический метилен).
Пример 15: Спектр1H ЯМР (300 МГц, CDCl3): δ 7,50-6,95 ряд м (8Н; ароматические протоны), 6,74-6,70 ряд шир. с (2Н; триметоксифенил), 4,50-1,30 ряд м (25Н; алифатический метин и метилен), 3,89-3,83 ряд с (9Н; ароматический метокси).
Пример 21: Спектр1H ЯМР (300 МГц, СDCl3), различимы множественные конформеры (отнесенные к пирролидинамидным ротамерам и пиперидиниевым конформерам); δ 12,37 шир.с (протон триалкиламмония), 7,50-7,04 ряд м (8Н; ароматические протоны), 6,84 и 6,71 с (прим. в отношении 60:40, всего 2Н; триметоксифенил), 4,45-0,85 ряд м (27Н; алифатический метин и метилен), 4,06 кв. (2Н, J=7 Гц; метиленовая группа этилового эфира), 3,90 с (6Н; ароматический метокси), 3,84 с (3Н; ароматический метокси), 1,19 т (3Н, J= 7 Гц; метильная группа этилового эфира).
Пример 23: Спектр19F ЯМР (300 МГц, CDCl3), различимы два конформера (прим. 70: 30, отнесенные к пирролидинамидным ротамерам или пиперидиниевым конформерам); δ -135,6 и -135,9 м (прим. в отношении 30:70), -138,7 и -139,0 м (прим. в отношении 30:70).
Пример 31: Спектр1H ЯМР (300 МГц, ДМСО-D6):
Пример 35: Спектр1H ЯМР (300 МГц, ДМСО-D6):
Что касается токсикологических данных, для соединения Примера номер 8.3.1, LD50=800 мг/i.р., определено в соответствии с ПРОТОКОЛОМ ИСПЫТАНИЯ НА ОСТРУЮ ТОКСИЧНОСТЬ после внутрибрюшинной инъекции у мышей.
МЕТОДИКА: Самцам мышей (группы по 4 особи) вводили увеличивающиеся дозы испытываемого соединения путем внутрибрюшинной инъекции. Использовали 3 стандартные дозы: 10, 30 и 100 мг/кг. Общее поведение животных наблюдали в течение 0,5 ч сразу после инъекции и отмечали изменения в поведении. Если наблюдали расхождение общеповеденческих и автономных эффектов, делались записи, например, стимуляция или подавление спонтанного поведения; атаксия; потеря установочного рефлекса; тремор; конвульсии и частота дыхания. Общее время наблюдений составило 7 дней, случаи смертности регистрировали.
АНАЛИЗ РЕЗУЛЬТАТОВ: Результаты представлены как приблизительное значение LD50. Подтверждающие данные указывают для каждой дозы количество смертей, имевших место в течение 7 дней периода наблюдения, и количество испытываемых животных.
Например
Приблизительное значение LD50 = 30 мг/кг:
Доза - Количество смертей
10 - 0/4
30 - 2/4
100 - 4/4
Пример 36:
Фармацевтические композиции на основе соединений данного изобретения получали следующим образом:
Таблетки: Соединение по
примеру 37 добавляли к тщательно перемешанной смеси крахмала, талька и
окиси магния. Полученную смесь таблетируют с получением таблеток следующего состава:
Соединение 37 - 50 мг
Крахмал - 40 мг
Тальк - 10 мг
Окись магния - 10 мг
Капсулы: Соединение по примеру 37 добавляли к тщательно перемешанной смеси крахмала, талька и карбоксиметилцеллюлозы.
Полученной смесью заполняют капсулы с получением капсул следующего
состава:
Соединение 37 - 100 мг
Крахмал - 120 мг
Тальк - 40 мг
Карбоксиметилцеллюлоза - 40
мгк
Реферат
Изобретение
относится
к новым карбоксизамещенным циклическим производным карбоксамида формулы 1
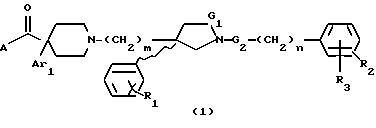
где G1 - CH2; G2 - С(О); m = 2 или 3, n равно 0 или 1; R1 представляет 1-3 заместителя, независимо выбранные из Н, Г, C1-С6алкокси; R2 представляет 1-3 заместителя, независимо выбранные из Н, C1-C6 алкокси; R3 означает Н или
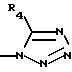
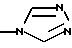
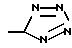
R4 - H; Ar1 означает
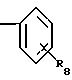
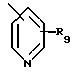
R8 означает 1-3 заместителя, независимо выбранные из Н, Г; R9 означает Н;
А означает
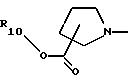
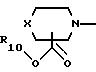
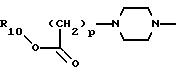
где р = 1, 2, 3 или 4; Х означает -О-, -СН2-; R10-H, C1-С6 алкил или
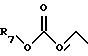
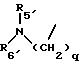
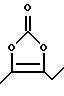
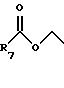
где q = 2 или 3; R5 - C1-C4 алкил, (СН2)2ОН; R6 - C1-C4 алкил, -(СН2)2ОН, (СН2)2N(СН3)2; R5', R6' - C1-C4 алкил; R7 - C1-С6 алкил, и его стереоизомеры и фармацевтически приемлемые соли. Описан способ их получения. Соединения 1 проявляют ангонистическую активность в отношении рецепторов NK1 и NK2, что позволяет использовать их в фармацевтической композиции для лечения астмы, кашля, бронхита. 4 с. и 65 з.п. ф-лы, 2 табл.
Формула
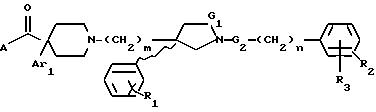
где G1 представляет СН2;
G2 представляет С(О);
m = 2 или 3;
n = 0 или 1;
R1 представляет 1-3 заместителя, каждого из которых независимо выбирают из группы, состоящей из водорода, галогена и С1-С6 алкокси;
R2 представляет 1-3 заместителя, каждого из которых независимо выбирают из группы, состоящей из водорода и С1-С6 алкокси;
R3 представляет водород или радикал, выбранный из группы, состоящей из
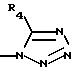
где R4 означает водород,
Аr1 представляет радикал, выбранный из группы, состоящей из
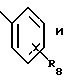
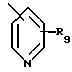
где R8 представляет 1-3 заместителя, каждого из которых независимо выбирают из группы, состоящей из водорода, галогена;
R9 означает водород;
А представляет радикал, выбранный из группы, состоящей из
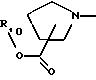
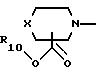
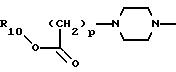
где р = 1, 2, 3 или 4;
Х представляет -О-, или -СН2-,
R10 представляет водород, С1-С6 алкил или радикал, выбранный из группы, состоящей из
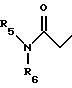
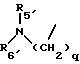
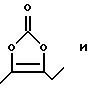
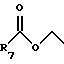
где q = 2 или 3;
R5 представляет С1-С4 алкил или -(СН2)2ОН;
R6 представляет С1-С4 алкил, -(СН2)2 ОН или -(СН2)2N(СН3)2;
R'5 представляет С1-С4 алкил;
R'6 представляет С1-С4 алкил;
R7 представляет С1-С6 алкил;
и его стереоизомеры и фармацевтически приемлемые соли.
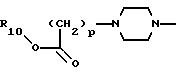
где р = 1;
R10 выбирают из группы, состоящей из водорода и С1-С6 алкила.
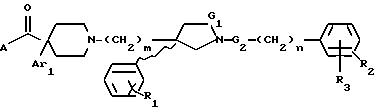
где G1 представляет СН2;
G2 представляет С(О);
m = 2 или 3;
n = 0 или 1;
R1 представляет 1-3 заместителя, каждого из которых независимо выбирают из группы, состоящей из водорода галогена и С1-С6 алкокси;
R2 представляет 1-3 заместителя, каждого из которых независимо выбирают из группы, состоящей из водорода, и С1-С6 алкокси;
R3 представляет водород или радикал, выбранный из группы, состоящей из
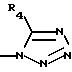
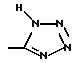
где R4 означает водород,
Аr1 представляет радикал, выбранный из группы, состоящей из
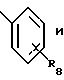
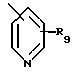
где R8 представляет 1-3 заместителя, каждого из которых независимо выбирают из группы, состоящей из водорода, галогена;
R9 означает водород;
А представляет радикал, выбранный из группы, состоящей из
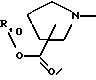
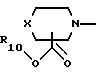
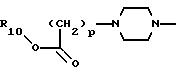
где р = 1, 2, 3 или 4;
Х представляет -О-, или -СН2-,
R10 представляет водород, С1-С6 алкил или радикал, выбранный из группы, состоящей из
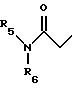
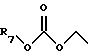
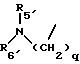
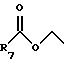
где q = 2 или 3;
R5 представляет С1-С4 алкил или -(СН2)2ОН;
R6 представляет С1-С4 алкил, -(СН2)2 ОН или -(СН2)2N(СН3)2;
R'5 представляет С1-С4 алкил;
R'6 представляет С1-С4 алкил;
R7 представляет С1-С6 алкил;
и его стереоизомеров и фармацевтически приемлемых солей, отличающийся тем, что включает взаимодействие соединения формулы
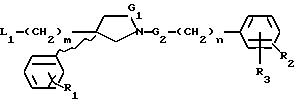
где m, n, G1, G2, R1, R2 и R3 такие, как описано выше;
L1 представляет удаляемые группы, выбранные из группы, состоящей из хлора, брома, йода, мезилата и тозилата,
с соединением формулы
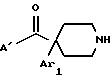
где Аr1 такой, как описано выше;
А' представляет А, как требуется для конечного продукта формулы (1) и необязательное образование фармацевтически пригодной соли.
17.11.1997 - по п.1 в части R10 водород или C1-С6 алкил и по пп.34-59;
19.12.1996 - по п.1 кроме R10 водород или C1-С6 алкил и пп.2-33, 60-69.

Комментарии