Новые пиперазинамидные производные - RU2454412C2
Код документа: RU2454412C2
Описание
Настоящее изобретение относится к новым пиперазинамидным производным формулы (I):
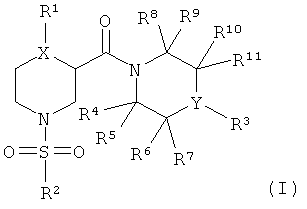
где
X представляет собой N или СН;
Y представляет собой N или СН;
R1 представляет собой низший алкил, низший алкоксинизший алкил, галоген-низший алкил, низший алкенил, циклоалкил, циклоалкил-низший алкил, арил, арилнизший алкил, гетероциклил, гетероциклил-низший алкил, гетероарил или гетероарилнизший алкил, где циклоалкил, арил, гетероциклил или гетероарил необязательно может быть замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшей алкоксигруппы, фторнизшего алкила и фторнизшей алкоксигруппы;
R2 представляет собой низший алкил, фторнизший алкил, низший алкоксинизший алкил, циклоалкил, циклоалкил-низший алкил, арил, арилнизший алкил, гетероциклил, гетероциклил-низший алкил, гетероарил или гетероарилнизший алкил, где циклоалкил, арил, гетероциклил или гетероарил необязательно может быть замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшей алкоксигруппы, фторнизшего алкила, фторнизшей алкоксигруппы, низшего алкоксикарбонила и фенила;
R3 представляет собой арил или гетероарил, где арил или гетероарил необязательно может быть замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, CN, низшего алкила, фторнизшего алкила, низшего алкокси и фторнизшей алкоксигруппы;
R4, R5, R6, R7, R8, R9, R10 и R11 независимо друг от друга представляют собой водород или низший алкил, или
R4 и R5 связаны вместе, или R6 и R7 связаны вместе, или R8 и R9 связаны вместе, или R10 и R11 связаны вместе с образованием кольца вместе с атомом углерода, к которому они присоединены, и -R4-R5-, -R6-R7-, -R8-R9- и/или -R10-R11- представляет собой -(СН2)2-6-;
и их фармацевтически приемлемым солям.
Также настоящее изобретение относится к способу получения описанных соединений, фармацевтическим препаратам, которые содержат такие соединения, а также к применению этих соединений для изготовления фармацевтических препаратов.
Х-рецепторы печени (LXR) являются членами суперсемейства рецепторов ядерного гормона. LXR активируются эндогенными оксистеролами и глюкозой и регулируют транскрипцию генов, контролирующих множественные метаболические пути передачи сигнала. Описаны два подтипа, LXRальфа и LXRбета (статьи Willy, P.J. и др., Genes Dev., 1995, 9, с.1033-45; Song, С. и др., Proc Natl Acad Sci USA, 1994, 91, сс.10809-13). LXRбета экспрессируется повсеместно, тогда как LXRальфа предпочтительно экспрессируется в тканях, метаболизирующих холестерин, таких как печень, жировая ткань, кишечник и макрофаги. LXR модулируют различные физиологические отклики, включая регулирование абсорбции холестерина, расщепление холестерина (синтез желчной кислоты) и транспорт холестерина из периферийных тканей липопротеинами плазмы в печень. LXR, как оказалось, также регулируют гены, участвующие в метаболизме глюкозы, метаболизме холестерина в головном мозге, клеточной дифференциации и апоптозе, воспалении и инфекционных заболеваниях (статья Geyeregger, R. и др., Cell. Mol. Life. Sci., 2006, 63, с.524-539).
Около половины всех пациентов с заболеванием коронарной артерии имеют низкие концентрации в плазме холестерина липопротеина высокой плотности (ЛВП-С). Атерозащитная функция ЛВП впервые была установлена почти 25 лет назад и стимулировала исследование генетических и окружающих факторов, которые влияют на уровни ЛВП-С (статья Miller NE., Lipids, 1978, 13, с.914-9). Защитная функция ЛВП вытекает из его участия в процессе, называемом обратный транспорт холестерина (статья Forrester, J.S. и Shah, Р.К., Am. J. Cardiol., 2006, 98, с.1542-49). ЛВП опосредует выведение холестерина из клеток периферийных тканей, включая макрофагиальные пенистые клетки в атеросклеротических бляшках стенок артерий. ЛВП доставляет их холестерин в печень и органы, метаболизирующие стерин, для превращения в желчную кислоту и расщепления в экскременты. Исследования показали, что уровни ЛВП-С прогнозируют риск заболевания коронарной артерии независимо от уровней холестерина липопротеина низкой плотности (ЛНП-С) (статья Gordon, Т. и др., Am J Med., 1977, 62, с.707-14).
В настоящее время предполагаемое возрастное количество американцев возрастом 20 и старше с ЛВП-С менее 35 мг/дл составляет 16% (мужчины) и 5,7% (женщины). Существенное снижение ЛВП-С в настоящее время достигается лечением ниацином в различных препаратах. Однако значительные нежелательные побочные эффекты ограничивают терапевтический потенциал этого подхода.
Установлено, что 90% из 14 миллионов пациентов с диагнозом сахарного диабета 2 типа в США имеют повышенный вес или ожирение, и большая часть пациентов с сахарным диабетом 2 типа имеют нарушенные концентрации липопротеинов. Исследования показали, что значение общего холестерина >240 мг/дл составляет 37% у мужчин с диабетом и 44% у женщин. Значения ЛНП-С >160 мг/дл составляют 31% и 44%, и для ЛВП-С <35 мг/дл составляют 28% и 11% у мужчин с диабетом и у женщин соответственно. Диабет является заболеванием, при котором способность пациента контролировать уровни глюкозы в крови снижается из-за частичного ухудшения отклика на действие инсулина. Сахарный диабет II типа (T2D) также называется инсулиннезависимым сахарным диабетом (NIDDM), и как показано, составляет 80-90% от общего количества больных диабетом в развитых странах. При T2D панкреатические островки Лангерганса продолжают вырабатывать инсулин. Однако целевые органы для действия инсулина, главным образом мышцы, печень и жировая ткань, проявляют сильную резистентность к стимулированию инсулином. Организм продолжает компенсировать выработку нефизиологически высоких уровней инсулина, которые в конце концов снижаются на поздних стадиях заболевания вследствие истощения и нарушения способности поджелудочной железы вырабатывать инсулин. Так, T2D представляет собой сердечнососудистый-метаболический синдром, связанный с многочисленными сочетанными заболеваниями, включая резистентность к инсулину, дислипидемию, гипертензию, эндотелиальную дисфункцию и воспалительный атеросклероз.
Первая линия лечения дислипидемии и диабета в настоящее время обычно включает низкожировую диету и диету с низким содержанием глюкозы, физические упражнения и снижение веса. Однако результаты могут снижаться, и с развитием заболевания становится необходимым лечение различных метаболических нарушений с помощью липид-модулирующих агентов, таких как статины и фибраты для дислипидемии, и гипогликемические лекарственные препараты, например, сульфонилмочевины, метформин или вещества, повышающие чувствительность к инсулину класса тиазолидиндионов (TZD) PPARγ-агонистов, для резистентности к инсулину. Последние исследования подтверждают то, что модуляторы LXR являются соединениями с повышенным терапевтическим потенциалом, и как таковые, модуляторы LXR улучшают липидный профиль в плазме и повышают уровни ЛВП-С (статьи Lund, E.G. и др., Arterioscler. Thromb. Vasc. Biol., 2003, 23, с.1169-77; Mitro, N. и др., Nature, 2007, 445, с.219-23). LXR, как известно, контролируют отток холестерина из макрофагиальных пенистых клеток атеросклеротических бляшек, и агонисты LXR, как показано, являются атерозащитными агентами (статья Joseph, S.B. и Tontonoz, P., Curr. Opin. Pharmacol., 2003, 3, с.192-7). Так, модуляторы LXR могли бы быть эффективными лекарственными препаратами для лечения атеросклеротического заболевания, которое является причиной сердечнососудистой заболеваемости и смертности от инсульта и заболевания сердца. Последние исследования также показывают, что существует независимое LXR-опосредованное действие на активизацию инсулина в дополнение к атерозащитному действию (статья Cao, G. и др., J Biol Chem., 2003, 278, с.1131-6). Так, модуляторы LXR также могут показывать отличную терапевтическую эффективность на повышение ЛВП и атерозащиту, с дополнительными эффектами при диабете по сравнению с используемыми в настоящее время лекарственными средствами.
Было обнаружено, что новые соединения настоящего изобретения связываются и селективно активируют LXR альфа и LXR бета или соактивируют LXR альфа и LXR бета. Следовательно, снижается абсорбция холестерина, повышается содержание ЛВП холестерина и снижается воспалительный атеросклероз. Поскольку многочисленные аспекты совместно дислипидемии и гомеостаза холестерина связаны с модуляторами LXR, новые соединения настоящего изобретения имеют повышенный терапевтический потенциал по сравнению с соединениями, известными из предшествующего уровня техники. Следовательно, они могут использоваться для лечения и профилактики заболеваний, которые модулируются агонистами LXR альфа и/или LXR бета. Такие заболевания включают повышенные уровни липидов и холестерина, особенно низкого ЛВП-холестерина, высокого ЛНП-холестерина, атеросклеротические заболевания, диабет, особенно инсулиннезависимый сахарный диабет, метаболический синдром, дислипидемию, болезнь Альцгеймера, сепсис и воспалительные заболевания, такие как колит, панкреатит, холестаз/фиброз печени, псориаз и другие воспалительные заболевания кожи, и заболевания, которые имеют воспалительный компонент, такие как болезнь Альцгеймера или ослабленная/поддающаяся усовершенствованию когнитивная функция. Более того, новые соединения настоящего изобретения могут использоваться для лечения инфекционных заболеваний, таких как ВИЧ, рак, и профилактики возрастных и наследственных (например, болезнь Старгардта) форм дегенерации желтого пятна.
Другие соединения, которые связываются и активируют LXR альфа и LXR бета, описаны ранее (например, международная заявка на патент WO 03/099769). Однако все еще существует потребность в новых соединениях с улучшенными свойствами. Настоящее изобретение относится к новым соединениям формулы (I), которые связываются с LXR альфа и/или LXR бета. Соединения настоящего изобретения неожиданно показали улучшенные фармакологические свойства по сравнению с соединениями, известными из предшествующего уровня техники, в отношении, например, метаболической стабильности, селективности, биодоступности и активности.
Если не указано иное, следующие определения приведены для иллюстрации и определения значения и объема различных терминов, использующихся для описания настоящего изобретения.
В настоящем описании термин "низший" используется для обозначения группы, содержащей от одного до семи, предпочтительно от одного до четырех атомов углерода.
Термин "галоген" обозначает фтор, хлор, бром и йод, причем фтор, хлор и бром являются предпочтительными.
Термин "алкил", отдельно или в комбинации с другими группами, обозначает разветвленный или линейный моновалентный насыщенный алифатический углеводородный радикал, содержащий от одного до двадцати атомов углерода, предпочтительно от одного до шестнадцати атомов углерода, более предпочтительно от одного до десяти атомов углерода. Низшие алкильные группы как определено ниже также являются предпочтительными алкильными группами.
Термин "низший алкил", отдельно или в комбинации с другими группами, обозначает разветвленный или линейный моновалентный алкильный радикал, содержащий от одного до семи атомов углерода, предпочтительно от одного до четырех атомов углерода. Этот термин представлен такими радикалами, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и им подобные.
Низшие алкильные группы могут быть замещены, например, 1-5, предпочтительно 1-3 атомами галогена. Такие группы обозначаются как "галоген-низший алкил". Примерами галоген-низших алкильных групп являются, например, хлорэтильные или йодпропильные группы.
Термин "фторнизший алкил" обозначает низшие алкильные группы, которые являются моно- или полизамещенными фтором. Примерами фторнизших алкильных групп являются, например, CFH2, CF2H, CF3, CF3CH2, CF3(СН2)2, (CF3)2СН и CF2H-CF2.
Термин "алкенил", отдельно или в комбинации с другими группами, обозначает линейный или разветвленный углеводородный остаток, содержащий олефиновую связь и вплоть до 20, предпочтительно вплоть до 16 атомов углерода. Термин "низший алкенил" обозначает линейный или разветвленный углеводородный остаток, содержащий олефиновую связь и вплоть до 7, предпочтительно вплоть до 4 атомов углерода, такой как, например, 2-пропенил.
Термин "амино", отдельно или в комбинации, обозначает первичную, вторичную или третичную аминогруппу, соединенную через атом азота с вторичной аминогруппой, содержащей алкильный или циклоалкильный заместитель, и с третичной аминогруппой, содержащей два одинаковых или различных алкильных или циклоалкильных заместителя или два заместителя азота, вместе образующих кольцо, такой как, например, -NH2, метиламиногруппа, этиламиногруппа, диметиламиногруппа, диэтиламиногруппа, метилэтиламиногруппа, пирролидин-1-ил или пиперидиногруппа и т.д.
Термин "циклоалкил" обозначает моновалентный карбоциклический радикал, содержащий от 3 до 10 атомов углерода, предпочтительно от 3 до 6 атомов углерода, такой как циклопропил, циклобутил, циклопентил или циклогексил.
Термин "алкокси" обозначает группу R'-O-, где R' представляет собой алкил. Термин "низший алкокси" обозначает группу R'-O-, где R' представляет собой низший алкил.
Термин "фторнизший алкокси" обозначает группу R''-O-, где R'' представляет собой фторнизший алкил. Примерами фторнизших алкоксигрупп являются, например, CFH2-O, CF2H-O, CF3-О, CF3CH2-О, CF3(СН2)2-O, (CF3)2СН-O и CF2H-CF2-O.
Термин "алкилен" обозначает линейную или разветвленную дивалентную насыщенную алифатическую углеводородную группу, содержащую от 1 до 20 атомов углерода, предпочтительно от 1 до 16 атомов углерода, более предпочтительно вплоть до 10 атомов углерода. Низшие алкиленовые группы, описанные далее, также являются предпочтительными алкиленовыми группами. Термин "низший алкилен" обозначает линейную или разветвленную дивалентную насыщенную алифатическую углеводородную группу, содержащую от 1 до 7, предпочтительно от 1 до 6 или от 3 до 6 атомов углерода. Линейные алкиленовые или низшие алкиленовые группы являются предпочтительными.
Термин "арил", отдельно или в комбинации, относится к фенильной или нафтильной группе, предпочтительно фенильной группе, которая необязательно может быть замещена 1-5, предпочтительно 1-3 заместителями, независимо выбранными из группы, состоящей из низшего алкила, низшей алкоксигруппы, галогена, гидроксигруппы, CN, CF3, аминогруппы, аминокарбонила, карбокси, NO2, диоксо-низшего алкилена (образуя, например, бензодиоксильную группу), низшего алкилсульфонила, аминосульфонила, низшего алкилкарбонила, низшего алкилкарбонилокси, низшего алкилкарбонил-NH, низшего алкоксикарбонила, фторнизшего алкила, фторнизшей алкоксигруппы, низший алкоксинизшего алкила, циклоалкила и фенилокси. Если не указано иное, предпочтительными заместителями являются галоген, низший алкил, фторнизший алкил, CN и низший алкоксикарбонил. Кроме того, арильные группы предпочтительно могут быть замещены как определено далее в описании и формуле изобретения.
Термин "гетероциклил", отдельно или в комбинации, обозначает насыщенный или частично ненасыщенный 4-10-членный моно- или бициклический гетероцикл, который содержит один или несколько гетероатомов, предпочтительно от одного до трех, выбранных из азота, кислорода и серы. Примерами таких гетероциклильных групп являются пиперидинил, пиперазинил, пирролидинил, имидазолидинил, пиразолидинил, пиранил, морфолинил и оксетанил. Предпочтительными являются пиперидинил и пиранил. Гетероциклильная группа необязательно может иметь заместитель, как описано выше в отношении термина "арил". Кроме того, гетероциклильные группы предпочтительно могут быть замещены как описано ниже в описании и в формуле изобретения.
Термин "гетероарил" обозначает ароматическое 5-6-членное моноциклическое кольцо или 9-10-членное бициклическое кольцо, которое может включать 1, 2 или 3 атома, выбранных из азота, кислорода и/или серы, такое как фурил, пиридинил, пиридазинил, пиримидинил, пиразинил, тиофенил, изоксазолил, оксазолил, оксадиазолил, имидазолил, пирролил, пиразолил, триазолил, тетразолил, тиазолил, изотиазолил, 1,2,3-тиадиазолил, бензоимидазолил, индолил, индазолил, бензоизотиазолил, бензоксазолил, бензоизоксазолил, 3-тиено[3,2-с]пиридин-4-ил и хинолинил. Предпочтительными гетероарильными группами являются изоксазолил, хинолинил, тиофенил, пиридинил и пиразинил. Гетероарильная группа необязательно может содержать заместитель, как описано выше в отношении термина "арил". Кроме того, гетероарильные группы предпочтительно могут быть замещены как описано ниже в описании и в формуле изобретения.
Соединения формулы (I) могут образовывать фармацевтически приемлемые кислотные аддитивные соли. Примерами таких фармацевтически приемлемых солей являются соли соединений формулы (I) с физиологически совместимыми минеральными кислотами, такими как хлористоводородная кислота, серная кислота, сернистая кислота или фосфорная кислота; или с органическими кислотами, такими как метансульфоновая кислота, п-толуолсульфоновая кислота, уксусная кислота, молочная кислота, трифторуксусная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, янтарная кислота или салициловая кислота.
Более конкретно, настоящее изобретение относится к соединениям формулы (I):

где
X представляет собой N или CH;
Y представляет собой N или CH;
R1 представляет собой низший алкил, низший алкоксинизший алкил, галоген-низший алкил, низший алкенил, циклоалкил, циклоалкил-низший алкил, арил, арилнизший алкил, гетероциклил, гетероциклил-низший алкил, гетероарил или гетероарилнизший алкил, где циклоалкил, арил, гетероциклил или гетероарил необязательно могут быть замещены 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшей алкоксигруппы, фторнизшего алкила и фторнизшей алкоксигруппы;
R2 представляет собой низший алкил, фторнизший алкил, низший алкоксинизший алкил, циклоалкил, циклоалкил-низший алкил, арил, арилнизший алкил, гетероциклил, гетероциклил-низший алкил, гетероарил или гетероарилнизший алкил, где циклоалкил, арил, гетероциклил или гетероарил необязательно могут быть замещены 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшей алкоксигруппы, фторнизшего алкила, фторнизшей алкоксигруппы, низшего алкоксикарбонила и фенила;
R3 представляет собой арил или гетероарил, где арил или гетероарил необязательно могут быть замещены 1-5 заместителями, независимо выбранными из группы, состоящей из галогена, CN, низшего алкила, фторнизшего алкила, низшего алкокси и фторнизшей алкоксигруппы;
R4, R5, R6, R7, R8, R9, R10 и R11 независимо друг от друга представляют собой водород или низший алкил, или
R4 и R5 связаны вместе, или R6 и R7 связаны вместе, или R8 и R9 связаны вместе, или R10 и R11 связаны вместе с образованием кольца вместе с атомом углерода, к которому они присоединены, и -R4-R5-, -R6-R7-, -R8-R9- и/или -R10-R11- представляет собой -(СН2)2-6-;
и их фармацевтически приемлемым солям.
Соединения формулы (I) являются особенно предпочтительными и их физиологически приемлемые соли являются особенно предпочтительными, причем соединения формулы (I) являются особенно предпочтительными.
Соединения формулы (I) содержат один или несколько асимметричных атомов С, и следовательно, могут существовать в виде энантиомерной смеси, смеси стереоизомеров или в виде оптически чистых соединений.
Предпочтительными соединениями настоящего изобретения являются соединения, в которых Х представляет собой N. Другими предпочтительными соединениями являются соединения, в которых Х представляет собой СН. Кроме того, предпочтительны соединения, в которых Y представляет собой N.
Другими предпочтительными соединениями настоящего изобретения являются соединения, в которых R1 представляет собой низший алкил, арил или арилнизший алкил, где арил необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена и низшего алкила. Более предпочтительно, R1 представляет собой низший алкил или фенил, где фенил необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена и низшего алкила. Еще более предпочтительно, R1 представляет собой н-бутил, фенил, 4-фтор-2-метилфенил, 2-метилфенил, 4-фторфенил, 2-фтор-4-метилфенил или 2,4-дифторфенил.
Другой предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы (I) как описано выше, где R2 представляет собой низший алкил, арил или гетероарил, выбранный из группы, состоящей из изоксазолила, хинолинила, тиофенила и пиридинила, где арил или гетероарил необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшей алкоксигруппы, фторнизшего алкила, низшего алкоксикарбонила и фенила. Предпочтительно, R2 представляет собой низший алкил, фенил или гетероарил, выбранный из группы, состоящей из хинолинила и пиридинила, где фенил или гетероарил необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкокси и фторнизшего алкила. Более предпочтительно, R2 представляет собой метил, изопропил, 3-метоксифенил, 3-хлорфенил, 2-трифторметилфенил, хинолин-8-ил или пиридин-3-ил.
Кроме того, предпочтительно, когда R3 представляет собой арил или гетероарил, выбранный из группы, состоящей из пиридинила и пиразинила, где арил или гетероарил необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила и фторнизшего алкила. Более предпочтительно, R3 представляет собой фенил или пиразинил, где фенил или пиразинил необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена и низшего алкила. Еще более предпочтительно, R3 представляет собой 2,5-диметилфенил, 2-метил-5-хлорфенил, 2,5-дихлорфенил или 3,6-диметилпиразин-2-ил.
Кроме того, предпочтительно, когда по крайней мере 4 из R4, R5, R6, R7, R8, R9, R10 и R11 представляют собой водород. Также предпочтительно, что не более двух из -R4-R5-, -R6-R7-, -R8-R9- и -R10-R11- связаны вместе образованием кольца. Особенно предпочтительными соединениями в соответствии с настоящим изобретением являются соединения, в которых R4, R5, R6, R7, R8, R9, R10 и R11 представляют собой водород.
В частности, предпочтительными соединениями являются соединения формулы (I), описанные в примерах в качестве индивидуальных соединений, а также их фармацевтически приемлемые соли.
Предпочтительными соединениями формулы (I) являются соединения, выбранные из группы, состоящей из следующих соединений:
[4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(3-метоксибензолсульфонил)пиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон,
(-)-[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-(4-о-толилпиперазин-1-ил)метанон,
[4-(2,5-дихлорфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бензил-4-(3-метоксибензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
(-)-[1-бензил-4-(3-метоксибензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бензил-4-(3,5-диметилизоксазол-4-сульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-пропилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бутил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-пентилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-изобутилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-фенэтилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(4-хлорбензолсульфонил)-1-пентилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бутил-4-(4-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(4-хлорбензолсульфонил)-1-фенилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон,
[4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-дихлорфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон,
[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]-[4-(3-трифторметилпиридин-2-ил)пиперазин-1-ил]метанон,
[4-(2,5-дихлорфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон,
[4-(2,5-дихлорфенил)пиперазин-1-ил]-[4-(пропан-2-сульфонил)-1-о-толилпиперазин-2-ил]метанон,
[4-(бифенил-4-сульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон,
метиловый эфир 3-{3-[4-(2,5-дихлорфенил)пиперазин-1-карбонил]-4-о-толилпиперазин-1-сульфонил}тиофен-2-карбоновой кислоты,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон,
[1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон,
[4-(3-хлорфенил)пиперидин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(пропан-2-сульфонил)пиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон,
цис-[4-(2,5-диметилфенил)пиперазин-1-ил]-[-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[(3S,4S)-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-ил]метанон,
[транс-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[транс-1-(3,5-диметилизоксазол-4-сульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[(3S,4S)-1-(3-метоксибензолсульфонил)-4-о-толилпиперидин-3-ил]метанон,
[(3S,4S)-1-(3-хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-о-толилпиперидин-3-ил)метанон,
[(3S,4S)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-фенилпиперидин-3-ил)метанон,
[(3R,4R)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[(3S,4R)-1-(3-метоксибензолсульфонил)-4-о-толилпиперидин-3-ил]метанон,
[(3S,4S)-1-(3-хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-(4-фторфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[(3S,4R)-1-(3-хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[(3S,4R)-1-(2-хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-(4-фторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[(3S,4S)- или (3R,4R)-1-(3-хлорбензолсульфонил)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[(3S,4S)- или (3R,4R)-1-(2-хлорбензолсульфонил)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
(3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
(3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
(3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон,
[(3S,4R)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-фенил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-фенил-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[(3S,4R)-1-(3-хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-о-толил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-1-(пиридин-3-сульфонил)-4-о-толилпиперидин-3-ил]метанон,
[(3S,4R)- или (3R,4S)-1-(3-хлорбензолсульфонил)-4-(2,4-дифторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
(3S,4R)- или (3R,4S)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2,4-дифторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[(3S,4S)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-фенилпиперидин-3-ил)метанон,
[(3S,4S)-1-(3-хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-о-толил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-1-(пиридин-3-сульфонил)-4-о-толилпиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-о-толилпиперидин-3-ил)метанон,
[(3S,4S)- или (3R,4R)-1-(3-хлорбензолсульфонил)-4-(4-фтор-2-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-метансульфонилпиперидин-3-ил]метанон,
[(3S,4S)- или (3R,4R)-1-(3-хлорбензолсульфонил)-4-(2,4-дифторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-метансульфонилпиперидин-3-ил]метанон и
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон,
и их фармацевтически приемлемые соли.
Особенно предпочтительными соединениями формулы (I) являются соединения, выбранные из группы, состоящей из следующих соединений:
[4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(3-метоксибензолсульфонил)пиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бутил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон,
[4-(2,5-дихлорфенил)пиперазин-1-ил]-[4-(пропан-2-сульфонил)-1-о-толилпиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[(3S,4R)-1-(3-метоксибензолсульфонил)-4-о-толилпиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-(4-фторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
(3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[(3S,4R)-1-(3-хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
(3S,4R)- или (3R,4S)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2,4-дифторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон и
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-метансульфонилпиперидин-3-ил]метанон
и их фармацевтически приемлемые соли.
Следует понимать, что из соединений общей формулы (I) в настоящем изобретении могут быть получены производные по функциональным группам с получением производных, которые способны превращаться обратно исходное соединение in vivo.
Настоящее изобретение далее относится к способу получения соединений формулы (I) как описано выше, который включает:
а) реакцию соединения формулы (II):

с соединением формулы (III):
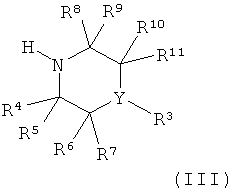
или
б) реакцию соединения формулы (IV):
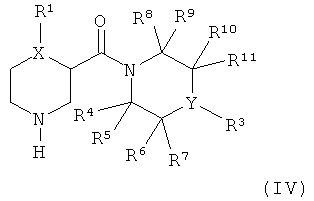
с соединением R2SO2Cl,
где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, X и Y являются такими, как определено выше.
Приведенные выше реакции могут осуществляться в условиях, хорошо известных специалисту в данной области техники, например, как описано далее на схемах 2, 3 и 4.
Настоящее изобретение также относится к соединениям формулы (I) как описано выше, полученным описанным выше способом.
Соединения формулы (I) могут быть получены способами, известными из предшествующего уровня техники, или как описано далее на схемах 1-4, или аналогично описанным ниже способам. Все исходные материалы являются либо коммерчески доступными, описанными в предшествующем уровне техники, либо могут быть получены способами, известными из предшествующего уровня техники, или способами, аналогичными описанным далее. Если не указано иное, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, Х и Y являются такими, как определено выше.
Специалисту в данной области техники ясно, что для получения энантиомерно чистых продуктов должны использоваться энантиомерно чистые исходные материалы. Дополнительно, соединения формулы (I) могут быть разделены на энантиомерно чистые соединения хроматографией на хиральной колонке ВЭЖХ, хроматографией с хиральным элюентом или кристаллизацией с помощью диастереомерных солей.

Получение исходных материалов для производных пиперазина формулы (I), в которых Х=N, приведено на схеме 1. Синтез начинают с хлорацетилхлорида 2 и бензиламина 3, который превращают в N-бензил-2-хлорацетамид 4 в присутствии оснований, таких как триэтиламин, N,N-диизопропилэтиламин или N-этилморфолин, в растворителях, таких как диэтиловый эфир или тетрагидрофуран, при комнатной температуре (стадия а). Соединение 4 может быть превращено в амин 5 с помощью избытка соответствующего амина или аминопроизводного NH2R1 в подходящем растворителе, таком как DMA или ДМФА, при температуре от КТ до 100°С в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин (стадия б). Восстановление соединения 5 комплексом борана с тетрагидрофураном приводит к получению амина 6, который превращают в производные пиперазина 8 и 9 обработкой сложными эфирами 2,3-дибромпропионовой кислоты 7 в присутствии оснований, таких как триэтиламин или N,N-диизопропилэтиламин, в толуоле при кипении (стадии в, г).
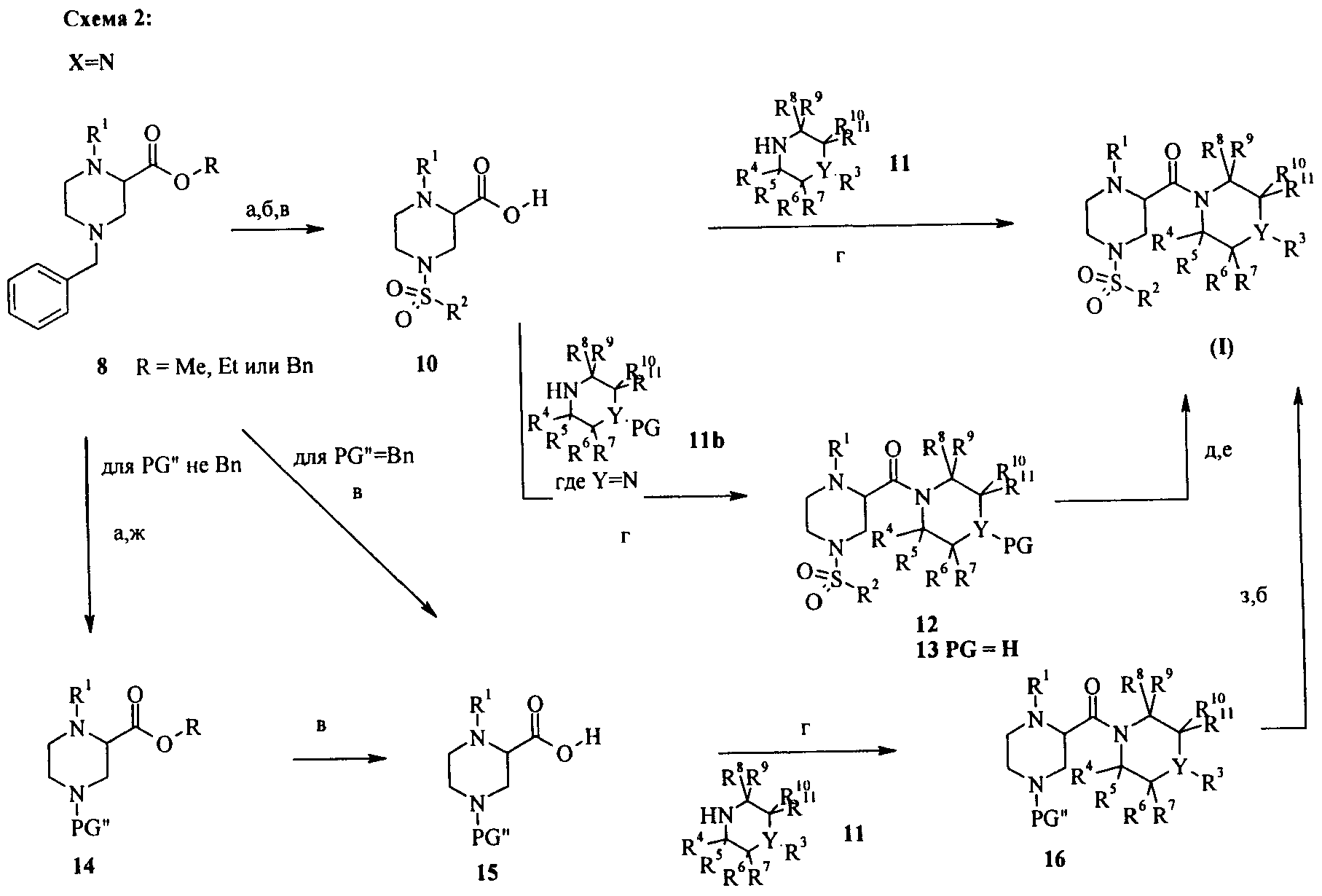
На схеме 2 описан синтез соединений общей формулы (I), в которых Х=N, из промежуточного соединения 8. Соединение 8 может быть превращено в кислоту 10 в 3 стадии: Отщепление бензильного остатка гидрированием в растворителях, таких как метанол, этанол, этилацетат, с помощью Pd/C (стадия а), сульфонилирование незащищенного пиперазина сульфонилхлоридами в растворителях, таких как дихлорметан, ТГФ, ДМФА или диоксан, с основаниями, такими как N-этилдиизопропиламин или триэтиламин, необязательно в присутствии ДМАП, при температуре от 0°С до комнатной температуры (стадия б), затем омыление сложного эфира обработкой гидроксидом натрия или гидроксидом лития в растворителе, таком как вода, метанол, этанол, тетрагидрофуран или их смеси, при температуре от 0°С до 60°С.
Конденсация соединений 10 и 11 с соединениями формулы (I) может осуществляться с помощью хорошо известных методик образования амида, используя конденсирующие реагенты, такие как гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDCI), гексафторфосфат 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU), тетрафторборат O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N,N-тетраметилурония (TPTU), гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) или гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР), в присутствии основания, такого как этилдиизопропиламин, триэтиламин, N-метилморфолин, необязательно в присутствии 4-диметиламинопиридина или 1-гидроксибензотриазола (HOBt) в растворителях, таких как дихлорметан, диметилформамид, диметилацетамид или диоксан, при температуре от 0°С до комнатной температуры (стадия г). Альтернативно, может использоваться двухстадийная методика: обработка кислоты 10 оксалилхлоридом в CH2Cl2 в присутствии ДМФА или тионилхлоридом в толуоле, с последующей реакцией с амином 11. Альтернативно, кислота 10 может быть конденсирована с амином 11b (для Y=N) с получением защищенного соединения 12. Отщепление защитной группы (PG) может осуществляться в кислых условиях, таких как ТФУК в CH2Cl2 или HCl, в диоксане для ВОС-групп (стадия д). Соединение 13 может быть превращено в соединения формулы (I) обработкой галогенгетероароматическими веществами в присутствии оснований, таких как N,N-диизопропиламин или триэтиламин, в растворителях, таких как ДМФА или ацетонитрил, для гетероароматических групп R3. Для соединений с R3 = арил может использоваться реакция аминирования Бушвальда-Хартвига (например, арил-LG (LG = Br, Cl, I, трифлат), Pd(OAc)2, 2-(дициклогексилфосфино)бифенил, NaOтретBu в толуоле или трис(дибензилиденацетон)дипалладий, 2,8,9-триизобутил-2,5,8,9-тетрааза-1-фосфабицикло[3,3,3]ундекан, трет-бутилат натрия в толуоле).
В альтернативном способе производное пиперазина 8 превращают в защищенное соединение 14 отщеплением бензильного остатка гидрированием в растворителях, таких как метанол, этанол, этилацетат, с помощью Pd/C (стадия а), с последующей N-BOC-защитой с помощью ди-трет-бутилдикарбоната в растворителях, таких как диэтиловый эфир, ТГФ или CH2Cl2, необязательно в присутствии ДМАП, при комнатной температуре (стадия г). Альтернативно, может использоваться одностадийная методика. Гидрирование в метаноле или этаноле с помощью Pd/C в качестве катализатора в присутствии ди-трет-бутилдикарбоната и амина, такого как триэтиламин или диизопропилэтиламин, приводит к получению непосредственно соединения 14. Омыление сложного эфира 14 или 8 обработкой гидроксидом натрия или гидроксидом лития в растворителе, таком как вода, метанол, этанол, тетрагидрофуран или их смеси, при температуре от 0°С до 60°С приводит к получению кислоты 15 (стадия в). Конденсация соединения 15 и 11 в амиды 16 может осуществляться, как описано для соединения 10, известными методиками образования амида, используя конденсирующие реагенты, такие как гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDCI), гексафторфосфат 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU), тетрафторборат O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N,N-тетраметилурония (TPTU), гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) или гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР), в присутствии основания, такого как этилдиизопропиламин, триэтиламин, N-метилморфолин, необязательно в присутствии 4-диметиламинопиридина или 1-гидроксибензотриазола (HOBt) в растворителях, таких как дихлорметан, диметилформамид, диметилацетамид или диоксан, при температуре от 0°С до комнатной температуры (стадия г). Альтернативно, может использоваться двухстадийная методика: обработка кислоты 10 оксалилхлоридом в CH2Cl2 в присутствии ДМФА или тионилхлоридом в толуоле, с последующей реакцией с амином 11. Соединения 16 могут быть превращены в соединения формулы (I) в две стадии: отщепление защитной группы в кислых условиях, таких как ТФУК в CH2Cl2 или HCl в диоксане для ВОС-групп или гидрированием в растворителях, таких как метанол, этанол, этилацетат, с помощью Pd/C для бензильных групп (стадия з), с последующим сульфонилированием незащищенного пиперазина с сульфонилхлоридами в растворителях, таких как дихлорметан, ТГФ, ДМФА или диоксан, с основаниями, такими как N-этилдиизопропиламин или триэтиламин, необязательно в присутствии ДМАП, при температуре от 0°С до комнатной температуры (стадия б).
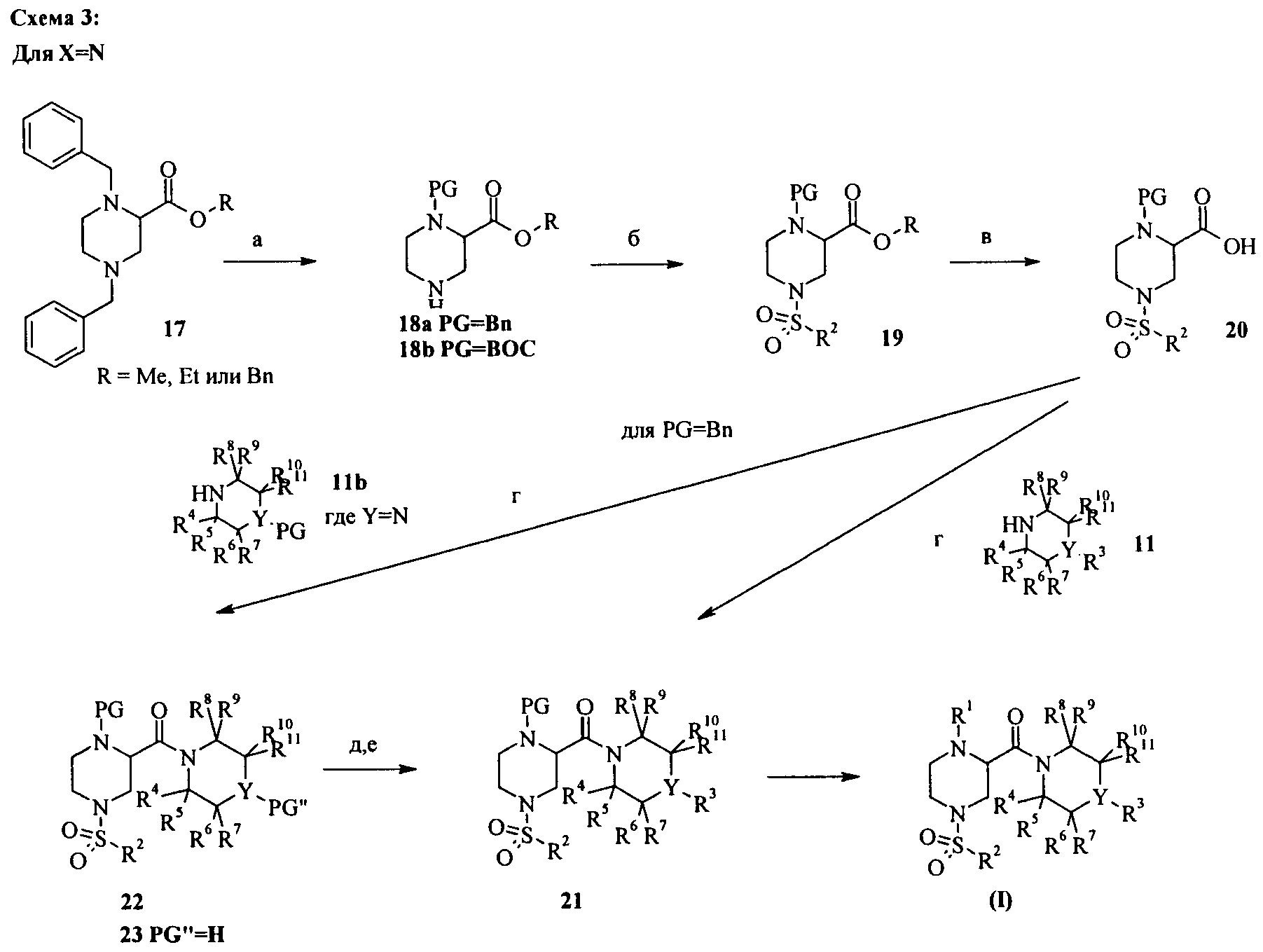
На схеме 3 описан другой способ синтеза соединений формулы (I). Монодебензилирование соединения 17 в соединение 18а осуществляют в соответствии со способом, описанным в статье S.Gubert*, С.Braojos, A.Sacristán, J.A.Ortiz, Synthesis, 1991, с.318 (стадия а: 1) 1-хлорэтилхлорформиат, дихлорэтан, кипение; 2) МеОН, кипение). Сульфонилирование незащищенного пиперазина 18а или 18b сульфонилхлоридами в растворителях, таких как дихлорметан, ТГФ, ДМФА или диоксан, с основаниями, такими как N-этилдиизопропиламин или триэтиламин, необязательно в присутствии ДМАП, при температуре от 0°С до комнатной температуры (стадия б), с последующим омылением сложного эфира обработкой гидроксидом натрия или гидроксидом лития, в растворителе, таком как вода, метанол, этанол, тетрагидрофуран или их смеси, при температуре от 0°С до 60°С приводит к получению кислоты 20 (стадия в). Получение амида 21 или 22 может осуществляться конденсацией кислоты 20 с соединением 11 или 11b, соответственно, как описано для соединения 10, используя конденсирующие реагенты, такие как гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDCI), гексафторфосфат 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU), тетрафторборат O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N,N-тетраметилурония (TPTU), гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) или гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР), в присутствии основания, такого как этилдиизопропиламин, триэтиламин, N-метилморфолин, необязательно в присутствии 4-диметиламинопиридина или 1-гидроксибензотриазола (HOBt) в растворителях, таких как дихлорметан, диметилформамид, диметилацетамид или диоксан, при температуре от 0°С до комнатной температуры (стадия г). Отщепление защитной группы (PG) может осуществляться в кислых условиях, таких как ТФУК в CH2Cl2 или HCl, в диоксане для ВОС-групп (стадия д). Соединение 23 может быть превращено в соединение 21 (стадия е) обработкой галогенгетероароматическими соединениями в присутствии оснований, таких как N,N-диизопропиламин или триэтиламин, в растворителях, таких как ДМФА или ацетонитрил для гетероароматических групп R3. Для соединения с R3 = арил может использоваться реакция аминирования Бушвальда-Хартвига (например, Pd(OAc)2, 2-(дициклогексилфосфино)бифенил, NaOтретBu в толуоле или трис(дибензилиденацетон)дипалладий, 2,8,9-триизобутил-2,5,8,9-тетрааза-1-фосфабицикло[3,3,3]ундекан, трет-бутилат натрия в толуоле). Отщепление бензильного остатка гидрированием в растворителях, таких как метанол, этанол, этилацетат, с помощью Pd/C (стадия з), с последующим алкилированием с помощью R1-LG' (LG' = уходящая группа, такая как Cl, Br, I, мезилат, тозилат или трифлат), в присутствии основания, такого как карбонат калия или карбонат цезия, в растворителе, таком как ацетон, ДМФА или DMA, приводит к получению соединений (I). Для соединений с R1 = арил может использоваться реакция аминирования Бушвальда-Хартвига (например, арил-LG (LG = Br, Cl, I, трифлат), Pd(OAc)2, 2-(дициклогексилфосфино)бифенил, NaOтретBu в толуоле или трис(дибензилиденацетон)дипалладий, 2,8,9-триизобутил-2,5,8,9-тетрааза-1-фосфабицикло[3,3,3]ундекан, трет-бутилат натрия в толуоле).
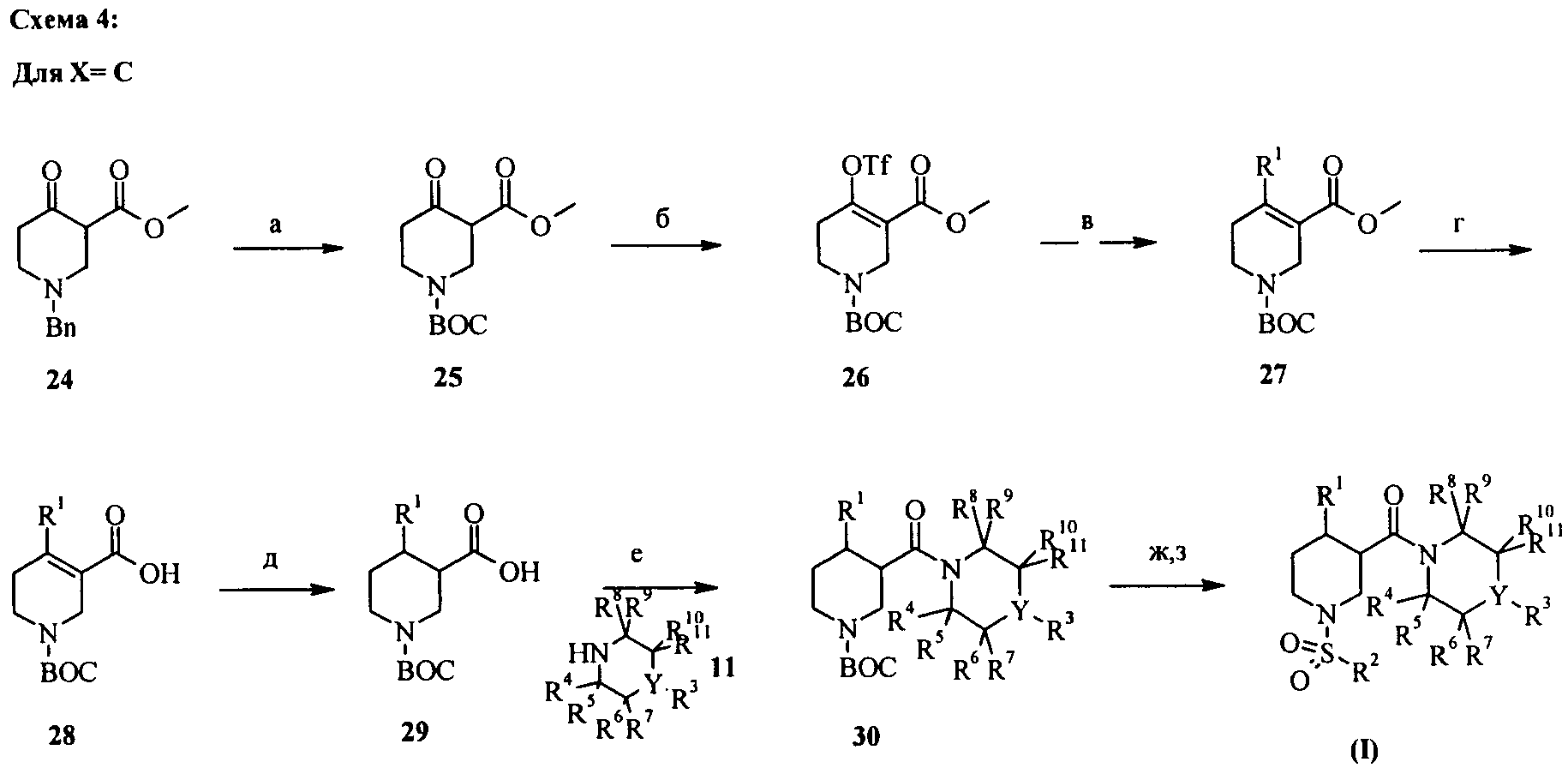
На схеме 4 описано получение соединений формулы (I) с Х=С. Исходя из коммерчески доступного соединения 24, отщепление бензильного остатка гидрированием в метаноле или этаноле с помощью Pd/C в качестве катализатора в присутствии ди-трет-бутилдикарбоната и амина, такого как триэтиламин или диизопропилэтиламин, приводит к получению соединения 25 (стадия а). Енолтрифлат 26 может быть получен из соединения 25 обработкой N-фенилтрифторметансульфонимидом в присутствии оснований, таких как NaH, КН или NaN(TMS)2, в растворителях, таких как диэтиловый эфир, ТГФ или ДМФА (стадия б). Палладийкатализирумая перекрестная конденсация енолтрифлата 26 с цинкорганическими галогенидами R1ZnBr или R1ZnCl в ТГФ, ДМФА или их смесях при 65°С в присутствии
бис(дибензилиденацетон)палладия(0) [Pd(dba)2] и
бис(дифенилфосфино)ферроцена (dppf) приводит к получению соединения 27.
Альтернативно, могут использоваться R1 борные кислоты в присутствии LiCl, оснований, таких как Na2CO3, К2СО3, и катализаторов, таких как
трис(дибензилиденацетон)дипалладий(0) или
тетракис(трифенилфосфин)палладий(0) в 1,2-диметоксиэтане, 1,2-диэтоксиэтане толуоле, или ТГФ, или R1 станнаны в присутствии
трис(дибензилиденацетон)дипалладия(0) или
тетракис(трифенилфосфин)палладия(0) в растворителях, таких как ТГФ,
диэтиловый эфир или толуол (стадия в). Омыление сложного эфира 27 обработкой гидроксидом натрия или гидроксидом лития в растворителе, таком как вода, метанол, этанол, тетрагидрофуран или их смеси, при температуре от 0°С до 60°С приводит к получению кислоты 28 (стадия г). Гидрирование кислоты 28 с помощью Pd/C в качестве катализатора в растворителях, таких как метанол, этанол, этилацетат или ТГФ, приводит к получению целевого промежуточного соединения 29 (стадия д), которое может быть разделено на цис- и транс-продукты. Дальнейшее разделение на энантиомеры может осуществляться хиральной ВЭЖХ или кристаллизацией диастереомерных солей, полученных из кислот 29 с хиральными основаниями. Энантиомерно обогащенные или чистые цис-пиперидины (R1 = арил, гетероарил) могут быть получены энантиоселективным гидрированием с помощью рутениевого катализатора, такого как [Ru(ОАс)2((R)-2-фурил)-MeOBIPHEP)], с добавкой, например, триэтиламина и растворителя, такого как метанол, в течение около 42 ч при температуре 20-80°С при 40 бар водорода. Соответствующие транспиперидины могут быть получены из цис-соединений селективной эпимеризацией хирального центра α в карбоксильную группу, используя трехстадийную методику: образование сложного эфира в условиях Мицунобу с помощью спирта, трифенилфосфина и диэтилазодикарбоксилата (DEAD) или диизопропилазодикарбоксилата (DIAD) в ТГФ, эпимеризация алкоголята натрия в толуоле при кипении, с последующим омылением сложного эфира в основных условиях обработкой гидроксидом натрия или гидроксидом лития в растворителе, таком как вода, метанол, этанол, тетрагидрофуран или их смеси.
Получение амида 30 может осуществляться конденсацией кислоты 29 с соединением 11 как описано для соединения 10 используя конденсирующие реагенты, такие как гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDCI), гексафторфосфат 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU), тетрафторборат O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N,N-тетраметилурония (TPTU), гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) или гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР), в присутствии основания, такого как этилдиизопропиламин, триэтиламин, N-метилморфолин, необязательно в присутствии 4-диметиламинопиридина или 1-гидроксибензотриазола (HOBt) в растворителях, таких как дихлорметан, диметилформамид, диметилацетамид или диоксан, при температуре от 0°С до комнатной температуры (стадия е).
Отщепление защитной группы (PG) может осуществляться в кислых условиях, таких как ТФУК в CH2Cl2 или HCl в диоксане для ВОС-групп (стадия г). Сульфонилирование незащищенного пиперидина сульфонилхлоридами в растворителях, таких как дихлорметан, ТГФ, ДМФА или диоксан, с основаниями, такими как N-этилдиизопропиламин или триэтиламин, необязательно в присутствии ДМАП при температуре от 0°С до комнатной температуры, приводит к получению соединений формулы (I) (стадия з).
Превращение соединения формулы (I) в фармацевтически приемлемую соль может осуществляться обработкой такого соединения неорганической кислотой, например, галогенводородной кислотой, такой как, например, хлористоводородная кислота или бромистоводородная кислота, или другими неорганическими кислотами, такими как серная кислота, азотная кислота, фосфорная кислота и т.д., или органической кислотой, такой как, например, уксусная кислота, лимонная кислота, малеиновая кислота, фумаровая кислота, винная кислота, метансульфоновая кислота или n-толуолсульфоновая кислота. Одним из способов получения таких солей является, например, добавление 1/n эквивалента кислоты, где n = количество кислотных групп кислоты, к раствору соединения в подходящем растворителе (например, этанол, смесь этанол-вода, смесь тетрагидрофуран-вода) и удаление растворителя упариванием или лиофилизацией.
Несмотря на то, что их получение не описано в примерах, соединения формулы (I), а также все промежуточные продукты могут быть получены в соответствии с аналогичными способами или в соответствии со способами, приведенными далее. Исходные материалы являются коммерчески доступными или известными из предшествующего уровня техники.
Как описано выше, было обнаружено, что новые соединения настоящего изобретения связываются и селективно активируют LXR альфа и LXR бета или соактивируют LXR альфа и LXR бета. Следовательно, снижается абсорбция холестерина, повышается уровень ЛВП холестерина и снижается воспалительный атеросклероз. Следовательно, они могут использоваться для лечения и профилактики заболеваний, которые модулируются агонистами LXR альфа и/или LXR бета. Такие заболевания включают повышенные уровни липидов и холестерина, особенно низкого ЛВП-холестерина, высокого ЛНП-холестерина, атеросклеротические заболевания, диабет, особенно инсулиннезависимый сахарный диабет, метаболический синдром, дислипидемию, сепсис и воспалительные заболевания, такие как колит, панкреатит, холестаз/фиброз печени, псориаз и другие воспалительные заболевания кожи, и заболевания, которые имеют воспалительный компонент, такие как болезнь Альцгеймера или ослабленная/поддающаяся усовершенствованию когнитивная функция. Более того, новые соединения настоящего изобретения могут использоваться для лечения инфекционных заболеваний, таких как ВИЧ, а также рак, и профилактики возрастных и наследственных (например, болезнь Старгардта) форм дегенерации желтого пятна.
Следовательно, настоящее изобретение также относится к фармацевтическим композициям, включающим соединение как описано выше и фармацевтически приемлемый носитель и/или адъювант.
Также настоящее изобретение включает соединения как описано выше для применения в качестве терапевтически активных веществ, особенно в качестве терапевтически активных веществ для лечения и/или профилактики заболеваний, которые модулируются агонистами LXR альфа и/или LXR бета, особенно в качестве терапевтически активных веществ для лечения и/или профилактики повышенных уровней липидов, повышенных уровней холестерина, низкого ЛВП-холестерина, высокого ЛНП-холестерина, атеросклеротических заболеваний, диабета, инсулиннезависимого сахарного диабета, метаболического синдрома, дислипидемии, сепсиса, воспалительных заболеваний, инфекционных заболеваний, кожных заболеваний, колита, панкреатита, холестаза печени, фиброза печени, псориаза, болезни Альцгеймера, ослабленной/поддающейся усовершенствованию когнитивной функции, ВИЧ, рака, возрастных форм дегенерации желтого пятна, наследственных форм дегенерации желтого пятна и/или болезни Старгардта.
В другом предпочтительном варианте осуществления, настоящее изобретение относится к способу терапевтического и/или профилактического лечения заболеваний, которые модулируются агонистами LXR альфа и/или LXR бета, особенно терапевтического и/или профилактического лечения повышенных уровней липидов, повышенных уровней холестерина, низкого ЛВП-холестерина, высокого ЛНП-холестерина, атеросклеротических заболеваний, диабета, инсулиннезависимого сахарного диабета, метаболического синдрома, дислипидемии, сепсиса, воспалительных заболеваний, инфекционных заболеваний, кожных заболеваний, колита, панкреатита, холестаза печени, фиброза печени, псориаза, болезни Альцгеймера, ослабленной/поддающейся усовершенствованию когнитивной функции, ВИЧ, рака, возрастных форм дегенерации желтого пятна, наследственных форм дегенерации желтого пятна и/или болезни Старгардта, который включает введение соединения как определено выше человеку или животному.
Настоящее изобретение также включает применение соединений как определено выше для терапевтического и/или профилактического лечения заболеваний, которые модулируются агонистами LXR альфа и/или LXR бета, особенно для терапевтического и/или профилактического лечения повышенных уровней липидов, повышенных уровней холестерина, низкого ЛВП-холестерина, высокого ЛНП-холестерина, атеросклеротических заболеваний, диабета, инсулиннезависимого сахарного диабета, метаболического синдрома, дислипидемии, сепсиса, воспалительных заболеваний, инфекционных заболеваний, кожных заболеваний, колита, панкреатита, холестаза печени, фиброза печени, псориаза, болезни Альцгеймера, ослабленной/поддающейся усовершенствованию когнитивной функции, ВИЧ, рака, возрастных форм дегенерации желтого пятна, наследственных форм дегенерации желтого пятна и/или болезни Старгардта.
Настоящее изобретение также относится к применению соединений как определено выше для изготовления лекарственных средств для терапевтического и/или профилактического лечения заболеваний, которые модулируются агонистами LXR альфа и/или LXR бета, особенно для терапевтического и/или профилактического лечения повышенных уровней липидов, повышенных уровней холестерина, низкого ЛВП-холестерина, высокого ЛНП-холестерина, атеросклеротических заболеваний, диабета, инсулиннезависимого сахарного диабета, метаболического синдрома, дислипидемии, сепсиса, воспалительных заболеваний, инфекционных заболеваний, кожных заболеваний, колита, панкреатита, холестаза печени, фиброза печени, псориаза, болезни Альцгеймера, ослабленной/поддающейся усовершенствованию когнитивной функции, ВИЧ, рака, возрастных форм дегенерации желтого пятна, наследственных форм дегенерации желтого пятна и/или болезни Старгардта. Такие лекарственные средства включают соединение как определено выше.
Профилактика и/или лечение повышенных уровней липидов, повышенных уровней холестерина, атеросклеротических заболеваний, дислипидемии или диабета является предпочтительным показанием, особенно профилактика и/или лечение повышенных уровней липидов, повышенных уровней холестерина, атеросклеротических заболеваний или дислипидемии, особенно профилактика и/или лечение атеросклеротических заболеваний или дислипидемии. Диабеты, особенно инсулиннезависимый сахарный диабет, является другим предпочтительным заболеванием.
Приведенные далее тесты осуществляют для определения активности соединений настоящего изобретения. Информация из уровня техники о проводимых аналих описана в статье: Nichols JS и др., "Development of a scintillation proximity assay for peroxisome proliferator-activated receptor gamma ligand binding domain", Anal Biochem., 1998, 257, с.112-119.
Векторы экспрессии млекопитающего конструировали для экспрессии полноцепочечных LXR альфа и LXR бета человека. Векторы бактериальной экспрессии конструировали для получения меченых вариантов доменов, связывающих лиганд (LBD) LXR альфа (аминокислоты 164 до 447) и LXR бета человека (аминокислоты 155 до 460). Для этого части последовательностей, кодирующих LBD, амплифицировали из полноцепочечных клонов с помощью PCR, и затем субклонировали в плазмидные векторы. Конечные клоны верифицировали с помощью анализа последовательности ДНК (статьи Willy и др., Genes Dev., 1995, 9, с.1033-45; Song и др., Proc Natl Acad Sci USA, 1994, 91, с.10809-13).
Индукцию, экспрессию и очистку белков LBD осуществляли в клетках штамма Е.coli BL21 (pLysS) стандартными методиками (книга Current Protocols in Molecular Biology, Wiley Press, под ред. Ausubel и др.).
Анализ на связывание с радиолигандом
Связывание рецептора LXR альфа и LXR бета осуществляли в буфере, содержащем 50 мМ HEPES, рН 7,4, 10 мМ NaCl, 5 мМ MgCl2. Для каждой из 96-луночных реакций, 500 нг белков LXRα-LBD или 700 нг LXRβ-LBD связывали с 80 мкг или 40 мкг SPA гранул соответственно, в конечном объеме 50 мкл при встряхивании. Полученную взвесь инкубировали в течение 1 ч при КТ и центрифугировали в течение 2 мин при 1300×g. Супернатант, содержащий несвязанный белок, удаляли, и полусухой остаток, содержащий покрытые рецептором гранулы, повторно суспендировали в 50 мкл буфера. Добавляли радиолиганд (например, 100,000 dpm (N-(2,2,2-трифторэтил)-N-[4-(2,2,2-трифтор-1-гидрокси-1-трифторметилэтил)фенил]бензолсульфонамида)), и реакционную смесь инкубировали при КТ в течение 1 ч в присутствии тестируемых соединений, и затем осуществляли сцинтилляционную проксимальную обработку. Все анализы на связывание осуществляли в 96-луночных планшетах, и количество связанного лиганда измеряли на Packard TopCount, используя OptiPlates (Packard). Кривые зависимости от дозы измеряли в диапазоне концентраций от 10-10 М до 10-4 М.
Анализы с транскрипционным репортерным геном люциферазы
Клетки почек молодых хомячков (ВНК21 АТСС CCL10) выращивали в среде DMEM, содержащей 10% FBS при 37°С в атмосфере 95% O2:5% CO2. Клетки высаживали в 6-луночные планшеты с плотностью 105 клеток/лунка и затем порционно трансфецировали либо с плазмидами экспрессии полноцепочечной LXRα или полноцепочечной LXRβ плюс репортерная плазмида, экспрессирующая люциферазу под контролем элементов отклика LXR. Трансфекцию осуществляли с реагентом Fugene 6 (Roche Molecular Biochemicals) в соответствии с предлагаемым протоколом. Через шесть часов после трансфекции клетки собирали трипсинизацией и высаживали в 96-луночные планшеты с плотностью 104 клеток/лунка. Через 24 часа связывания клеток среду удаляли и замещали 100 мкл среды, не содержащей фенола красного, содержащей тестируемые вещества или контрольные лиганды (конечная концентрация ДМСО: 0,1%). После инкубирования клеток в течение 24 часов с веществами выгружали 50 мкл супернатанта, и затем добавляли 50 мкл реагента люциферазы постоянного свечения (Roche Molecular Biochemicals) для лизиса клеток и инициирования реакции с люциферазой. Люминесценцию, измеренную как активность люциферазы, определяли на Packard TopCount. Транскрипционную активацию в присутствии тестируемого вещества выражали как кратность изменения люминесценции по сравнению с люминесценцией клеток, инкубированных в отсутствии вещества. Значения ЕС50 рассчитывали, используя программу XLfit (ID Business Solutions Ltd. UK).
Соединения формулы (I) обладают активностью по крайней мере в одном из описанных выше анализов (ЕС50 или IC50) от 1 нМ до 100 мкМ, предпочтительно от 1 нМ до 10 мкМ, более предпочтительно от 1 нМ до 1 мкМ.
Например, следующие соединения показывают следующие значения IC50 в анализе на связывание:
Эти результаты получали с помощью описанного выше теста.
Соединения формулы I и/или их фармацевтически приемлемые соли могут использоваться в качестве лекарственных средств, например, в форме фармацевтических препаратов для энтерального, парентерального или местного введения. Они могут вводиться, например, перорально, например, в форме таблеток, покрытых оболочкой таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например, в форме суппозиториев, парентерально, например, в форме инъекционных растворов или суспензий или инфузионных растворов, или местно, например, в форме мазей, кремов или масел. Пероральное введение является предпочтительным.
Изготовление фармацевтических препаратов может осуществляться способом, который является известным любому специалисту в данной области техники путем введения описанных соединений формулы I и/или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически ценными веществами, в форму для галенового введения вместе с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими материалами носителя, и, при необходимости, с обычными фармацевтическими адъювантами.
Подходящими материалами носителя являются не только неорганические материалы носителя, но также органические материалы носителя. Так, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли могут использоваться в качестве материалов носителя для таблеток, покрытых оболочкой таблеток, драже и твердых желатиновых капсул. Подходящими материалами носителя для мягких желатиновых капсул являются, например, растительные масла, воски, жиры и полужидкие и жидкие полиолы (в зависимости от природы активного ингредиента носители, однако, могут не требоваться для мягких желатиновых капсул). Подходящими материалами носителя для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар и им подобные. Подходящими материалами носителя для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Подходящими материалами носителя для суппозиториев являются, например, природные или отвержденные масла, воски, жиры и полужидкие или жидкие полиолы. Подходящими материалами носителя для местных препаратов являются глицериды, полусинтетические и синтетические глицериды, гидрированные масла, жидкие воски, жидкие парафины, жидкие жирные спирты, стеролы, полиэтиленгликоли и производные целлюлозы.
Обычные стабилизаторы, консерванты, увлажняющие и эмульгирующие агенты, улучшающие консистенцию агенты, улучшающие запах агенты, соли для регулирования осмотического давления, буферные вещества, солюбилизаторы, красители и маскирующие агенты и антиоксиданты используются в качестве фармацевтических адъювантов.
Дозировка соединений формулы I может изменяться в широких пределах в зависимости от контролируемого заболевания, возраста и индивидуального состояния пациента и способа введения, и, конечно, будет определяться в соответствии с индивидуальными требованиями в каждом конкретном случае. Для взрослых пациентов используется суточная дозировка от около 1 до 2000 мг, особенно от около 1 до 500 мг. В зависимости от степени тяжести заболевания и точного фармакокинетического профиля соединение может вводиться одной или несколькими дозированными единицами в сутки, например, 1-3 дозированными единицами.
Фармацевтические композиции обычно содержат около 1-500 мг, предпочтительно 1-200 мг соединения формулы I.
Следующие примеры служат для более подробной иллюстрации настоящего изобретения. Однако они никоим образом не предназначены для ограничения его объема.
Примеры
Сокращения
ВОС = трет-бутилоксикарбонил, DEAD = диэтилазодикарбоксилат, ДМФА = диметилформамид, HBTU = гексафторфосфат 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, ТВМЕ = трет-бутилметиловый эфир, ТГФ = тетрагидрофуран, ТФУК = трифторуксусная кислота.
Лиганды:
1) Лиганды известны из предшествующего уровня техники и/или могут быть получены в соответствии с примерами или способами, описанными в документах ЕР 0398132, WO 92/16535, EP 0104375 или ЕР 0580331.
2) статья Benincori, Т.; Brenna, E.; Sannicolo, F.; Trimarco, L.; Antognazza, P.; Cesarotti, E.; Demartin, F.; Pilati, T. J. Org. Chem., 1996, 61, с.6244.
Пример 1
[4-(2,5-Диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(3-метоксибензолсульфонил)пиперазин-2-ил]метанон
Стадия 1: 1-трет-Бутиловый эфир 4-(4-фтор-2-метилфенил)пиперазин-1,3-дикарбоновой кислоты (CAS Reg. No.: [499780-10-8]) (100 мг) в ДМФА (2,5 мл) обрабатывали 1-(2,5-диметилфенил)пиперазином (62 мг), гексафторфосфатом 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU) (123 мг) и триэтиламином (124 мкл) при комнатной температуре в течение 5 ч. Добавляли воду, фазы разделяли и неорганическую фазу экстрагировали трет-бутилметиловым эфиром (ТВМЕ). Объединенные органические фазы промывали водой и насыщенным раствором хлорида натрия, сушили (Na2SO4), отфильтровывали и упаривали. Очистка хроматографией (SiO2, н-гептан/этилацетат 2:1) приводила к получению трет-бутилового эфира 3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-(4-фтор-2-метилфенил)пиперазин-1-карбоновой кислоты в виде белого твердого вещества (143 мг), MS: 511,5 ([М+Н]+).
Стадия 2: К раствору трет-бутилового эфира 3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-(4-фтор-2-метилфенил)пиперазин-1-карбоновой кислоты (133 мг) в этаноле (5 мл) добавляли насыщенный раствор хлорида водорода в этаноле (1 мл). Смесь перемешивали при комнатной температуре в течение 2 ч и концентрировали с получением гидрохлорида [4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)пиперазин-2-ил]метанона в виде сырого белого твердого вещества, MS: 411,5 ([М+Н]+).
Стадия 3: К раствору гидрохлорида [4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)пиперазин-2-ил]метанона (42 мг) в ДМФА (1 мл) добавляли 3-метоксибензолсульфонилхлорид (21,4 мг) и триэтиламин (40 мкл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, разбавляли этилацетатом и промывали насыщенным водным раствором NaHCO3. Объединенные органические фазы промывали водой и насыщенным раствором хлорида натрия, сушили (Na2SO4), отфильтровывали и упаривали. Сырой продукт очищали колоночной хроматографией (SiO2, н-гептан/этилацетат 2:1) с получением [4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(3-метоксибензолсульфонил)пиперазин-2-ил]метанона (42 мг) в виде белого твердого вещества, MS: 581,3 ([М+Н]+).
Пример 2
[4-(3-Хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Стадия 1: К раствору бензиламина (60,3 мл) и триэтиламина (96,3 мл) в ТГФ (800 мл) добавляли хлорацетилхлорид (45,8 мл) при 0°С. Реакционную смесь оставляли нагреваться до температуры в течение ночи. Добавляли дополнительное количество хлорацетилхлорида (4,6 мл) и перемешивание продолжали до исчезновения исходного материала. Реакционную смесь отфильтровывали, промывали этилацетатом и концентрировали. Сырой продукт перекристаллизовывали из дихлорметана с получением N-бензил-2-хлорацетамида (71,6 г) в виде беловатого твердого вещества.
Стадия 2: К раствору N-бензил-2-хлорацетамида (20 г) в ДМФА (200 мл) добавляли 4-фтор-2-метиланилин (13,3 мл) и N,N-диизопропилэтиламин (22,2 мл). Реакционную смесь нагревали при 100°С в течение ночи, охлаждали до комнатной температуры и смесь разбавляли этилацетатом и промывали водой. Объединенные неорганические фазы экстрагировали этилацетатом и объединенные органические фазы сушили (Na2SO4), отфильтровывали и упаривали. Сырой продукт очищали хроматографией (SiO2, н-гептан/этилацетат 1:2) с получением N-бензил-2-(4-фтор-2-метилфениламино)ацетамида (20 г) в виде серого твердого вещества, MS: 273,0 ([М+Н]+).
Стадия 3: К раствору N-бензил-2-(4-фтор-2-метилфениламино)ацетамида (17 г) в ТГФ (500 мл) добавляли раствор комплекса борана с тетрагидрофураном (499,4 мл, 1М в ТГФ). Раствор кипятили с обратным холодильником в течение 4 ч, концентрировали и растворяли в смеси 2М HCl и TBME. Неорганическую фазу экстрагировали ТВМЕ, органические фазы промывали 2М HCl. Значение рН объединенных неорганических фаз доводили до рН 11 добавлением концентрировалинного раствора NaOH и раствор экстрагировали ТВМЕ. Объединенные органические фазы сушили (Na2SO4), отфильтровывали и упаривали с получением N-бензил-N'-(4-фтор-2-метилфенил)этан-1,2-диамина (15,1 г) в виде сырого продукта, MS: 259,3 ([М+Н]+).
Стадия 4: К N-бензил-N'-(4-фтор-2-метилфенил)этан-1,2-диамину (15,1 г) в толуоле (150 мл) добавляли N,N-диизопропилэтиламин (33,8 мл) и этиловый эфир 2,3-дибромпропионовой кислоты (25,61 мл) в толуоле (350 мл). Реакционную смесь нагревали при 135°С в течение 18 ч, охлаждали до комнатной температуры и осажденное твердое вещество удаляли фильтрацией. Раствор концентрировали и сырой материал растворяли в ТВМЕ и промывали 2М водным раствором Na2CO3 и насыщенным раствором хлорида натрия, сушили (Na2SO4), отфильтровывали и упаривали. Хроматография (SiO2, н-гептан/этилацетат 97:3) с получением этилового эфира 4-бензил-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты (5,5 г) в виде желтого масла, MS: 357,3 ([М+Н]+) и этилового эфира 1-бензил-4-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты (3,3 г) в виде желтого масла, MS: 357,1 ([М+Н]+).
Стадия 5: Этиловый эфир 4-бензил-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты (1 г) в этилацетате (10 мл) гидрировали в присутствии 10% Pd/C (149 мг) и уксусной кислоты (1 мл). После удаления катализатора и упаривания растворителя остаток растворяли в ДМФА (8 мл) и обрабатывали 3-хлорбензолсульфонилхлоридом (280 мкл) и триэтиламином (1,96 мл) при комнатной температуре до исчезновения исходного материала по данным ТСХ. Смесь разбавляли этилацетатом и промывали водным раствором NaHCO3, сушили (Na2SO4), отфильтровывали и упаривали. Очистка хроматографией (SiO2, н-гептан/этилацетат 2:1) приводила к получению этилового эфира 4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты в виде белого твердого вещества (750 мг), MS: 441,3 ([М+Н, 1Cl]+).
Стадия 6: К раствору этилового эфира 4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты (730 мг) в тетрагидрофуране (20 мл) добавляли 1 М водный раствор LiOH (16,6 мл) и метанол до получения прозрачного раствора. Смесь перемешивали при кипении с обратным холодильником в течение 1 ч, добавляли 1М KHSO4 (20 мл) и неорганическую фазу экстрагировали этилацетатом. Объединенные органические фазы сушили (Na2SO4), отфильтровывали и упаривали с получением 4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты в виде светло-желтого твердого вещества, MS: 411,0 ([М-Н, 1Cl]-).
Стадия 7: Аналогично примеру 1, стадия 1, из 4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты, 1-(2,5-диметилфенил)пиперазина, HBTU и триэтиламина в ДМФА получали [4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белого твердого вещества, MS: 584,7 ([М+Н, 1Cl]+).
Пример 3
[4-(3-Хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Аналогично примеру 1, стадия 1, из 4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты и 1-(5-хлор-орто-толил)пиперазина получали [4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белого твердого вещества, MS: 604,8 ([М+Н, 1Cl]+).
Пример 4
[4-(3-Хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон
Аналогично примеру 1, стадия 1, из 4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты и дигидрохлорида 1-(2,5-дихлорфенил)пиперазина получали [4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон в виде белого твердого вещества, MS: 624,5 ([М+Н, 1Cl]+).
Пример 5
(-)-[4-(3-Хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон
[4-(3-Хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон (пример 4) разделяли на энантиомеры хиральной ВЭЖХ на Chiralpak AD, используя смесь н-гептан/30% этанол в качестве подвижной фазы, с получением (+)-[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанона в виде беловатого твердого вещества, MS: 624,5 ([M+H, 1Cl]+) и (-)-[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанона в виде беловатого твердого вещества, MS: 624,5 ([M+H, 1Cl]+).
Пример 6
[4-(3-Хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-(4-о-толилпиперазин-1-ил)метанон
Аналогично примеру 1, стадия 1, из 4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты и 1-(2-метилфенил)пиперазина получали [4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-(4-о-толилпиперазин-1-ил)метанон в виде светло-желтой пены, MS: 571,2 ([M+H, 1Cl]+).
Пример 7
[4-(2,5-Дихлорфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон
Стадии 1-4: Аналогично примеру 2, стадии 1-4, из бензиламина, хлорацетилхлорида, анилина и этилового эфира 2,3-дибромпропионовой кислоты получали этиловый эфир 4-бензил-1-фенилпиперазин-2-карбоновой кислоты в виде светло-желтого масла, MS: 325,5 ([M+H]+).
Стадия 5: Аналогично примеру 2, стадия 5, из этилового эфира 4-бензил-1-фенилпиперазин-2-карбоновой кислоты и 3-метоксибензолсульфонилхлорида получали этиловый эфир 4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-карбоновой кислоты в виде светло-желтого масла, MS: 405,3 ([М+Н]+).
Стадия 6: Аналогично примеру 2, стадия 6, из этилового эфира 4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-карбоновой кислоты получали 4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-карбоновую кислоту в виде беловатого твердого вещества, MS: 375,5 ([М+Н]+).
Стадия 7: Аналогично примеру 1, стадия 1, из 4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-карбоновой кислоты и дигидрохлорида 1-(2,5-дихлорфенил)пиперазина получали [4-(2,5-дихлорфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон в виде белого твердого вещества, MS: 589,0 ([M+H, 1Cl]+).
Пример 8
[4-(2,5-Диметилфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон
Аналогично примеру 1, стадия 1, из 4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-карбоновой кислоты и 1-(2,5-диметилфенил)пиперазина получали [4-(2,5-диметилфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон в виде белого твердого вещества, MS: 548,8 ([М+Н]+).
Пример 9
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон
Аналогично примеру 1, стадия 1, из 4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-карбоновой кислоты и 1-(5-хлор-2-метилфенил)пиперазина получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон в виде белого твердого вещества, MS: 568,8 ([М+Н, 1Cl]+).
Пример 10
[4-(3-Хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон
Стадии 1-4: Аналогично примеру 2, стадии 1-4, из бензиламина, хлорацетилхлорида, о-толуидина и этилового эфира 2,3-дибромпропионовой кислоты получали этиловый эфир 4-бензил-1-о-толилпиперазин-2-карбоновой кислоты в виде оранжевого масла, MS: 339,4 ([М+Н]+).
Стадия 5: Аналогично примеру 2, стадия 5, из этилового эфира 4-бензил-1-о-толилпиперазин-2-карбоновой кислоты и 3-хлорбензолсульфонилхлорида получали этиловый эфир 4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-карбоновой кислоты в виде белого твердого вещества, MS: 422,9 ([М+Н, 1Cl]+).
Стадия 6: Аналогично примеру 2, стадия 6, из этилового эфира 4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-карбоновой кислоты получали 4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-карбоновую кислоту в виде светло-желтого твердого вещества, MS: 393,3 ([М-Н, 1Cl]-).
Стадия 7: Аналогично примеру 1, стадия 1, из 4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-карбоновой кислоты и дигидрохлорида 1-(2,5-дихлорфенил)пиперазина получали [4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон в виде белого твердого вещества, MS: 606,6 ([М+Н, 1Cl]+).
Пример 11
[4-(3-Хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Аналогично примеру 1, стадия 1, из 4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-карбоновой кислоты и 1-(5-хлор-орто-толил)пиперазина получали [4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде светло-желтого твердого вещества, MS: 586,8 ([М+Н, 1Cl]+).
Пример 12
[4-(3-Хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Аналогично примеру 1, стадия 1, из 4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-карбоновой кислоты и 1-(2,5-диметилфенил)пиперазина получали [4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде светло-желтого твердого вещества, MS: 567,3 ([М+Н, 1Cl]+).
Пример 13
[1-Бензил-4-(3-метоксибензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Стадия 1: В атмосфере аргона при 0°С, к раствору этил 1,4-дибензилпиперазин-2-карбоксилата (10 г) в дихлорэтане (40 мл) по каплям добавляли раствор 1-хлорэтилхлорформиата (4,73 мл) в дихлорэтане (14 мл) в течение 10 мин. Реакционную смесь перемешивали в течение 15 минут при 0°С и затем кипятили с обратным холодильником в течение ночи. Растворитель упаривали и сырой материал растворяли в этаноле и кипятили с обратным холодильником в течение ночи. Растворитель упаривали и остаток растворяли в воде и экстрагировали диэтиловым эфиром (×2) и CH2Cl2 (×2). К водной фазе затем добавляли насыщенный раствор NaHCO3 и неорганическую фазу экстрагировали CH2Cl2 (×2). Органические слои затем объединяли, промывали насыщенным раствором хлорида натрия, сушили (Na2SO4), отфильтровывали и концентрировали с получением этилового эфира 1-бензилпиперазин-2-карбоновой кислоты в виде сырого продукта, MS: 248,9 ([М+Н]+).
Стадия 2: Раствор этилового эфира 1-бензилпиперазин-2-карбоновой кислоты (300 мг) в ДМФА (13 мл) обрабатывали триэтиламином (0,5 мл) и 3-метоксибензолсульфонилхлоридом (274,6 мг) при КТ в течение 2 часов. Добавляли воду и неорганический слой экстрагировали этилацетатом (×3). Объединенные органические слои сушили (Na2SO4), отфильтровывали и упаривали с получением этилового эфира 1-бензил-4-(3-метоксибензолсульфонил)пиперазин-2-карбоновой кислоты в виде бесцветного масла (417 мг), MS: 419,3 ([М+Н]+).
Стадия 3: Аналогично примеру 2, стадия 6, из этилового эфира 1-бензил-4-(3-метоксибензолсульфонил)пиперазин-2-карбоновой кислоты получали 1-бензил-4-(3-метоксибензолсульфонил)пиперазин-2-карбоновую кислоту, которую использовали в следующей реакции без дополнительной очистки. MS: 389,5 ([М-Н]-).
Стадия 4: Аналогично примеру 1, стадия 1, из 1-бензил-4-(3-метоксибензолсульфонил)пиперазин-2-карбоновой кислоты и 1-(2,5-диметилфенил)пиперазина получали [1-бензил-4-(3-метоксибензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 563,5 ([М+Н]+).
Пример 14
(-)-[1-Бензил-4-(3-метоксибензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
1-Бензил-4-(3-метоксибензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон разделяли на энантиомеры хиральной ВЭЖХ на Chiralpak AD, используя смесь н-гептан/25% изопропанол в качестве подвижной фазы с получением (+)-[1-бензил-4-(3-метоксибензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона в виде бесцветного масла, MS: 563,3 ([М+Н]+ и (-)-[1-бензил-4-(3-метоксибензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона в виде бесцветного масла, MS: 563,3 ([М+Н]+).
Пример 15
[1-Бензил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 1, стадия 1, из 1,4-дибензилпиперазин-2-карбоновой кислоты (CAS Reg. No.: [215597-67-4]) и 1-(2,5-диметилфенил)пиперазина получали (1,4-дибензилпиперазин-2-ил)-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 483,3 ([М+Н]+).
Стадия 2: Аналогично примеру 13, стадии 1-2, из (1,4-дибензилпиперазин-2-ил)-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона и 3-хлорбензолсульфонилхлорида получали [1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 567,3 ([М+Н, 1Cl]+).
Пример 16
[1-Бензил-4-(3,5-диметилизоксазол-4-сульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Аналогично примеру 13, стадии 1-2, из (1,4-дибензилпиперазин-2-ил)-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона и 3,5-диметилизоксазол-4-сульфонилхлорида получали [1-бензил-4-(3,5-диметилизоксазол-4-сульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 552,3 ([М+Н]+).
Пример 17
[4-(3-Хлорбензолсульфонил)-1-пропилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Стадия 1: К раствору метилового эфира N-1-Boc-2-пиперазинкарбоновой кислоты (CAS Reg. No: [129799-15-1]) (1 г) в ДМФА (5 мл) добавляли 3-хлорбензолсульфонилхлорид (0,95 г) и триэтиламин (1,71 мл). Реакционную смесь перемешивали при КТ в течение ночи. Добавляли воду и смесь экстрагировали этилацетатом (×2). Объединенные органические слои промывали водой (×2) и насыщенным раствором хлорида натрия, сушили (Na2SO4), отфильтровывали и упаривали. Очистка хроматографией (SiO2, н-гептан/этилацетат 3:1) приводила к получению 1-трет-бутилового эфира 2-метилового эфира 4-(3-хлорбензолсульфонил)пиперазин-1,2-дикарбоновой кислоты в виде белой пены (1,66 г), MS: 436,3 ([M+NH4, 1Cl]+).
Стадия 2: Аналогично примеру 2, стадия 6 (комнатная температура), из 1-трет-бутилового эфира 2-метилового эфира 4-(3-хлорбензолсульфонил)пиперазин-1,2-дикарбоновой кислоты получали 1-трет-бутиловый эфир 4-(3-хлорбензолсульфонил)пиперазин-1,2-дикарбоновой кислоты в виде белой пены, MS: 403,2 ([М-Н, 1Cl]-).
Стадия 3: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира 4-(3-хлорбензолсульфонил)пиперазин-1,2-дикарбоновой кислоты и 1-(2,5-диметилфенил)пиперазина получали трет-бутиловый эфир 4-(3-хлорбензолсульфонил)-2-[4-(2,5-диметилфенил)пиперазин-1-карбонил]пиперазин-1-карбоновой кислоты в виде белой пены, MS: 577,4 ([М+Н, 1Cl]+).
Стадия 4: К раствору трет-бутилового эфира 4-(3-хлорбензолсульфонил)-2-[4-(2,5-диметилфенил)пиперазин-1-карбонил]пиперазин-1-карбоновой кислоты (2,18 г) в этаноле (21,8 мл) добавляли насыщенный раствор HCl в этаноле (21,8 мл) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение ночи, раствор концентрировали и остаток растворяли в смеси раствора NaHCO3 и этилацетата. Неорганическую фазу экстрагировали этилацетатом (×3), и объединенные органические слои промывали насыщенным раствором хлорида натрия, сушили (Na2SO4), отфильтровывали и упаривали с получением [4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона в виде сырого продукта (1,79 г), MS: 477,0 ([М+Н, 1Cl]+).
Стадия 5: К раствору [4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона (100 мг) в ацетоне (4 мл) добавляли карбонат цезия (82 мг), затем 1-бромпропан (21 мкл). Реакционную смесь перемешивали при кипении с обратным холодильником в течение ночи. Добавляли воду и реакционную смесь экстрагировали этилацетатом (×2). Объединенные органические слои промывали насыщенным раствором хлорида натрия, сушили (Na2SO4), отфильтровывали и упаривали. Очистка хроматографией (SiO2, н-гептан/этилацетат 3:1) приводила к получению [4-(3-хлорбензолсульфонил)-1-пропилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона в виде белой пены (75 мг), MS: 519,3 ([М+Н, 1Cl]+).
Пример 18
[1-Бутил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Аналогично примеру 17, стадия 5, из [4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона и 1-бромбутана получали [1-бутил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 533,4 ([М+Н, 1Cl]+).
Пример 19
[4-(3-Хлорбензолсульфонил)-1-пентилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Аналогично примеру 17, стадия 5, из [4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона и 1-бромпентана получали [4-(3-хлорбензолсульфонил)-1-пентилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 547,3 ([М+Н, 1Cl]+).
Пример 20
[4-(3-Хлорбензолсульфонил)-1-изобутилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Аналогично примеру 17, стадия 5, из [4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона и 1-бром-2-метилпропана получали [4-(3-хлорбензолсульфонил)-1-изобутилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 533,2 ([М+Н, 1Cl]+).
Пример 21
[4-(3-Хлорбензолсульфонил)-1-фенэтилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Аналогично примеру 17, стадия 5, из [4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона и (2-бромэтил)бензола получали [4-(3-хлорбензолсульфонил)-1-фенэтилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде бесцветного масла, MS: 581,3 ([М+Н, 1Cl]+).
Пример 22
[4-(4-Хлорбензолсульфонил)-1-пентилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Стадии 1-3: Аналогично примеру 17, стадии 1-3, из метилового эфира N-1-Вос-2-пиперазинкарбоновой кислоты (CAS Reg. No: [129799-15-1]), 4-хлорбензолсульфонилхлорида и 1-(2,5-диметилфенил)пиперазина получали трет-бутиловый эфир 4-(4-хлорбензолсульфонил)-2-[4-(2,5-диметилфенил)пиперазин-1-карбонил]пиперазин-1-карбоновой кислоты в виде светло-желтой пены, MS: 577,4 ([М+Н, 1Cl]+).
Стадия 4: К раствору трет-бутилового эфира 4-(4-хлорбензолсульфонил)-2-[4-(2,5-диметилфенил)пиперазин-1-карбонил]пиперазин-1-карбоновой кислоты (1,64 г) в этаноле (16,4 мл) добавляли насыщенный раствор HCl в этаноле (16,4 мл) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и концентрировали с получением гидрохлорида [4-(4-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона, MS: 477,0 ([М+Н, 1Cl]+).
Стадия 5: К раствору гидрохлорида [4-(4-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона (100 мг) в ацетоне (4 мл) добавляли карбонат цезия (254 мг), затем 1-бромпентан (27 мкл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли дополнительное количество карбоната цезия (127 мг) и 1-бромпентана (14 мкл) и перемешивание продолжали при кипении с обратным холодильником в течение ночи. Добавляли воду и реакционную смесь экстрагировали этилацетатом (×2). Объединенные органические слои промывали насыщенным раствором хлорида натрия, сушили (Na2SO4), отфильтровывали и упаривали. Очистка хроматографией (SiO2, н-гептан/этилацетат 3:1) приводила к получению [4-(4-хлорбензолсульфонил)-1-пентилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона в виде белой пены, MS: 547,3 ([М+Н, 1Cl]+).
Пример 23
[1-Бутил-4-(4-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Аналогично примеру 20, стадия 5, из гидрохлорида [4-(4-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона и 1-бромбутана получали [1-бутил-4-(4-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 533,3 ([М+Н, 1Cl]+).
Пример 24
[4-(4-Хлорбензолсульфонил)-1-фенилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
В атмосфере аргона в высушенную в печи колбу загружали трис(дибензилиденацетон)дипалладий (9,6 мг), трет-бутилат натрия (40 мг) и 2-(ди-трет-бутилфосфино)бифенил (6,3 мг). Затем добавляли [4-(4-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон (100 мг), заранее полученный из гидрохлорида [4-(4-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона экстракцией в основных условиях, в толуоле (5 мл), затем раствор бромбензола (55 мкл) в толуоле (3 мл). Реакционную смесь перемешивали при 80°С в течение ночи. Смесь охлаждали до комнатной температуры, добавляли водный раствор NaHCO3, фазы разделяли и неорганический слой экстрагировали этилацетатом (×3). Объединенные органические слои сушили (Na2SO4), отфильтровывали и упаривали. Очистка хроматографией (SiO2, н-гептан/этилацетат 3:1; ISOLUTE Flash NH2, н-гептан/этилацетат) и обработка н-гептаном приводили к получению [4-(4-хлорбензолсульфонил)-1-фенилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанона в виде белого твердого вещества, MS: 553,3 ([М+Н, 1Cl]+).
Пример 25
[4-(2-Хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 2, стадия 5, из этилового эфира 4-бензил-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты и 2-хлорбензолсульфонилхлорида получали этиловый эфир 4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты в виде желтого масла, MS: 441,1 ([М+Н, 1Cl]+).
Стадия 2: Аналогично примеру 2, стадия 6, из этилового эфира 4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты получали 4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновую кислоту в виде белого твердого вещества, MS: 410,9 ([М-Н, 1Cl]-).
Стадия 3: Аналогично примеру 1, стадия 1, из 4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты и дигидрохлорида 1-(2,5-дихлорфенил)пиперазина получали [4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон в виде белого твердого вещества, MS: 626,8 ([М+Н, 1Cl]+).
Пример 26
[4-(2-Хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Аналогично примеру 1, стадия 1, из 4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты (пример 25, стадия 2) и 1-(5-хлор-орто-толил)пиперазина получали [4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белого твердого вещества, MS: 604,8 ([М+Н, 1Cl]+).
Пример 27
[4-(2-Хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Аналогично примеру 1, стадия 1, из 4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты (пример 25, стадия 2) и 1-(2,5-диметилфенил)пиперазина получали [4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белого твердого вещества, MS: 584,8 ([М+Н, 1Cl]+).
Пример 28
[4-(2,5-Дихлорфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон
Стадия 1: Аналогично примеру 2, стадия 5, из этилового эфира 4-бензил-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты и 1-нафталинсульфонилхлорида получали этиловый эфир 1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-карбоновой кислоты в виде белого твердого вещества, MS: 457,3 ([М+Н]+).
Стадия 2: Аналогично примеру 2, стадия 6, из этилового эфира 1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-карбоновой кислоты получали 1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-карбоновую кислоту в виде белого твердого вещества, MS: 427,0 ([М-Н]-).
Стадия 3: Аналогично примеру 1, стадия 1, из 1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-карбоновой кислоты и дигидрохлорида 1-(2,5-дихлорфенил)пиперазина получали [4-(2,5-дихлорфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон в виде белого твердого вещества, MS: 641,2 ([М+Н, 1Cl]+).
Пример 29
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон
Аналогично примеру 1, стадия 1, из 1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-карбоновой кислоты и 1-(5-хлор-орто-толил)пиперазина получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон в виде белого твердого вещества, MS: 621,0 ([М+Н, 1Cl]+).
Пример 30
[4-(2,5-Диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон
Аналогично примеру 1, стадия 1, из 1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-карбоновой кислоты и 1-(2,5-диметилфенил)пиперазина получали [4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон в виде белого твердого вещества, MS: 601,0 ([М+Н]+).
Пример 31
[1-(4-Фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]-[4-(3-трифторметилпиридин-2-ил)пиперазин-1-ил]метанон
Аналогично примеру 1, стадия 1, из 1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-карбоновой кислоты и 1-(3-трифторметилпиридин-2-ил)пиперазина (CAS Reg. No.: [87394-63-6]) получали [1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]-[4-(3-трифторметилпиридин-2-ил)пиперазин-1-ил]метанон в виде белого твердого вещества, MS: 642,3 ([М+Н]+).
Пример 32
[4-(2,5-Дихлорфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон
Стадия 1: Аналогично примеру 2, стадия 5, из этилового эфира 4-бензил-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты и 8-хинолинсульфонилхлорида получали этиловый эфир 1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-карбоновой кислоты в виде белого твердого вещества, MS: 458,3 ([M+H]+).
Стадия 2: Аналогично примеру 2, стадия 6, из этилового эфира 1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-карбоновой кислоты получали 1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-карбоновую кислоту в виде белого твердого вещества, MS: 428,4 ([М-Н]-).
Стадия 3: Аналогично примеру 1, стадия 1, из 1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-карбоновой кислоты и дигидрохлорида 1-(2,5-дихлорфенил)пиперазина получали [4-(2,5-дихлорфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон в виде белого твердого вещества, MS: 642,0 ([M+H, 1Cl]+).
Пример 33
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон
Аналогично примеру 1, стадия 1, из 1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-карбоновой кислоты и 1-(5-хлор-орто-толил)пиперазина получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон в виде белого твердого вещества, MS: 621,8 ([М+Н, 1Cl]+).
Пример 34
[4-(2,5-Диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон
Аналогично примеру 1, стадия 1, из 1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-карбоновой кислоты и 1-(2,5-диметилфенил)пиперазина получали [4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон в виде белого твердого вещества, MS: 602,0 ([М+Н]+).
Пример 35
[4-(2,5-Дихлорфенил)пиперазин-1-ил]-[4-(пропан-2-сульфонил)-1-о-толилпиперазин-2-ил]метанон
Стадия 1: Аналогично примеру 2, стадия 6, из этилового эфира 4-бензил-1-о-толилпиперазин-2-карбоновой кислоты (пример 10, стадии 1-4) получали 4-бензил-1-о-толилпиперазин-2-карбоновую кислоту в виде белого твердого вещества, MS: 309,3 ([М-Н]-).
Стадия 2: Аналогично примеру 1, стадия 1, из 4-бензил-1-о-толилпиперазин-2-карбоновой кислоты и дигидрохлорида 1-(2,5-дихлорфенил)пиперазина получали (4-бензил-1-о-толилпиперазин-2-ил)-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон в виде белого твердого вещества, MS: 522,8 ([М+Н, 1Cl]+).
Стадия 3: Аналогично примеру 2, стадия 5, из (4-бензил-1-о-толилпиперазин-2-ил)-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанона и изо-пропилсульфонилхлорида получали [4-(2,5-дихлорфенил)пиперазин-1-ил]-[4-(пропан-2-сульфонил)-1-о-толилпиперазин-2-ил]метанон в виде белой пены, MS: 539,3 ([М+Н, 1Cl]+).
Пример 36
[4-(Бифенил-4-сульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон
Аналогично примеру 35, стадия 3, из (4-бензил-1-о-толилпиперазин-2-ил)-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанона и 4-бифенилсульфонилхлорида получали [4-(бифенил-4-сульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 649,3 ([М+Н, 1Cl]+).
Пример 37
Метиловый эфир 3-{3-[4-(2,5-дихлорфенил)пиперазин-1-карбонил]-4-о-толилпиперазин-1-сульфонил}тиофен-2-карбоновой кислоты
Аналогично примеру 35, стадия 3, из 4-бензил-1-о-толилпиперазин-2-ил)-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанона и 2-(метоксикарбонил)тиофен-3-сульфонилхлорида получали метиловый эфир 3-{3-[4-(2,5-дихлорфенил)пиперазин-1-карбонил]-4-о-толилпиперазин-1-сульфонил}тиофен-2-карбоновой кислоты в виде белой пены, MS: 637,0 ([М+Н]+).
Пример 38
[4-(3-Хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон
Стадия 1: Аналогично примеру 1, стадия 1, из 4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты (пример 2, стадия 5) и N-Boc-пиперазина получали трет-бутиловый эфир 4-[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбонил]пиперазин-1-карбоновой кислоты в виде белого твердого вещества, MS: 580,8 ([М+Н, 1Cl]+).
Стадия 2: Аналогично примеру 17, стадия 4, из трет-бутилового эфира 4-[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-карбонил]пиперазин-1-карбоновой кислоты получали [4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]пиперазин-1-илметанон в виде белого твердого вещества, MS: 481,0 ([М+Н, 1Cl]+).
Стадия 3: [4-(3-Хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]пиперазин-1-илметанон (60 мг), 3-хлор-2,5-диметилпиразин (18,1 мкл) и триэтиламин (20,8 мкл) в ацетонитриле (1 мл) нагревали при 170°С в микроволновой печи. Добавляли воду и реакционную смесь экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили (Na2SO4), отфильтровывали и упаривали. Очистка хроматографией (SiO2, н-гептан/этилацетат 1:2) приводила к получению [4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанона в виде желтого масла, MS: 587,3 ([М+Н, 1Cl]+).
Пример 39
[1-Бензил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон
Стадия 1: Аналогично примеру 13, стадия 2, из этилового эфира 1-бензилпиперазин-2-карбоновой кислоты и 3-хлорбензолсульфонилхлорида получали этиловый эфир 1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-карбоновой кислоты в виде желтого масла, MS: 423,1 ([М+Н, 1Cl]+).
Стадия 2: Аналогично примеру 2, стадия 6, из этилового эфира 1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-карбоновой кислоты получали 1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-карбоновую кислоту в виде беловатого твердого вещества, MS: 593,0 ([М-Н, 1Cl]-).
Стадия 3: Аналогично примеру 1, стадия 1, из 1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-карбоновой кислоты и 1-Вос-пиперазина получали трет-бутиловый эфир 4-[1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-карбонил]пиперазин-1-карбоновой кислоты в виде белой пены, MS: 562,8 ([М+Н, 1Cl]+).
Стадия 4: Аналогично примеру 38, стадия 2, из трет-бутилового эфира 4-[1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-карбонил]пиперазин-1-карбоновой кислоты получали [1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]пиперазин-1-илметанон в виде белой пены, MS: 463 ([М+Н, 1Cl]+).
Стадия 5: Аналогично примеру 38, стадия 3, из [1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]пиперазин-1-илметанона и 3-хлор-2,5-диметилпиразина получали [1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон в виде желтого масла, MS: 569,3 ([М+Н, 1Cl]+).
Пример 40
[4-(3-Хлорфенил)пиперидин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(пропан-2-сульфонил)пиперазин-2-ил]метанон
Стадия 1: Аналогично примеру 2, стадия 5, из этилового эфира 4-бензил-1-(4-фтор-2-метилфенил)пиперазин-2-карбоновой кислоты и изо-пропилсульфонилхлорида получали эфир 1-(4-фтор-2-метилфенил)-4-(пропан-2-сульфонил)пиперазин-2-карбоновой кислоты в виде бесцветного масла, MS: 373,1 ([М+Н, 1Cl]+).
Стадия 2: Аналогично примеру 2, стадия 6, из эфира 1-(4-фтор-2-метилфенил)-4-(пропан-2-сульфонил)пиперазин-2-карбоновой кислоты получали 1-(4-фтор-2-метилфенил)-4-(пропан-2-сульфонил)пиперазин-2-карбоновую кислоту в виде желтого твердого вещества, MS: 343,1 ([М-Н, 1Cl]-).
Стадия 3: Аналогично примеру 1, стадия 1, из 1-(4-фтор-2-метилфенил)-4-(пропан-2-сульфонил)пиперазин-2-карбоновой кислоты и 4-(3-хлорфенил)пиперидина получали [4-(3-хлорфенил)пиперидин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(пропан-2-сульфонил)пиперазин-2-ил]метанон в виде белого твердого вещества, MS: 522,2 ([М+Н, 1Cl]+).
Пример 41
[4-(3-Хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон
Аналогично примеру 1, стадия 1, из 4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-карбоновой кислоты и 3',6'-диметил-3,4,5,6-тетрагидро-2H-[1,2']бипиразинила (CAS Reg. No.: [59215-42-8]) получали [4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон в виде белого твердого вещества, MS: 569,3 ([М+Н, 1Cl]+).
Пример 42
цис-[4-(2,5-Диметилфенил)пиперазин-1-ил]-[-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-ил]метанон
Стадия 1: Гидрохлорид цис-4-фенилнипекотиновой кислоты (CAS Reg. No. [858430-42-9]) (195 мг) (три раза суспендированный в толуоле и упаренный при пониженном давлении для удаления воды) суспендировали в гексаметилдисилазане (4 мл) и кипятили с обратным холодильником в течение 3 ч. Раствор упаривали при пониженном давлении и растворяли в ТГФ (4 мл). Добавляли 3-метоксибензолсульфонилхлорид (0,13 мл) и раствор перемешивали в течение 16 ч при комнатной температуре. Добавляли H2O и через 1 ч растворители упаривали. Остаток разделяли между водой и этилацетатом (3×), органические фазы промывали насыщенным раствором хлорида натрия, сушили (Na2SO4), отфильтровывали и упаривали. Очистка хроматографией (SiO2, н-гептан/этилацетат 1:1) приводила к получению цис-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-карбоновой кислоты в виде белого твердого вещества, MS: 374,3 (М-Н])-.
Стадия 2: Аналогично примеру 1, стадия 1, из цис-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-карбоновой кислоты и 1-(2,5-диметилфенил)пиперазина получали цис-[4-(2,5-диметилфенил)пиперазин-1-ил]-[-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-ил]метанон в виде белого твердого вещества (tпл 192°С), MS: 548,4 ([M+H])+.
Пример 43
[4-(2,5-Диметилфенил)пиперазин-1-ил]-[(3S,4S)-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-ил]метанон
Цис-[4-(2,5-диметилфенил)пиперазин-1-ил]-[-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-ил]метанон разделяли на энантиомеры хиральной ВЭЖХ на Chiralpak AD, используя смесь н-гептан/25% изопропанол в качестве подвижной фазы, с получением [4-(2,5-диметилфенил)пиперазин-1-ил]-[(3S,4S)-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-ил]метанона в виде белой пены, MS: 548,3 ([M+H])+ и [4-(2,5-диметилфенил)пиперазин-1-ил]-[(3R,4R)-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-ил]метанона в виде белой пены, MS: 548,3 ([M+H])+.
Пример 44
[транс-1-(3-Хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 1, стадия 1, из транс-N-Boc-4-фенилнипекотиновой кислоты (CAS Reg. No.: [170838-49-0]) и 1-(2,5-диметилфенил)пиперазина получали трет-бутиловый эфир транс-3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-фенилпиперидин-1-карбоновой кислоты в виде белой пены, MS: 478,2 ([М+Н])+.
Стадия 2: Аналогично примеру 22, стадия 4, из трет-бутилового эфира транс-3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-фенилпиперидин-1-карбоновой кислоты получали гидрохлорид транс-[4-(2,5-диметилфенил)пиперазин-1-ил]-(-4-фенилпиперидин-3-ил)метанона в виде белой пены, MS: 378,4 ([М+Н])+.
Стадия 3: Аналогично примеру 1, стадия 3, из гидрохлорида транс-[4-(2,5-диметилфенил)пиперазин-1-ил]-(-4-фенилпиперидин-3-ил)метанона и 3-хлорбензолсульфонилхлорида получали [транс-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 552,1 ([М+Н, 1Cl])+.
Пример 45
[транс-1-(3,5-Диметилизоксазол-4-сульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Аналогично примеру 1, стадия 3, из гидрохлорида транс-[4-(2,5-диметилфенил)пиперазин-1-ил]-(-4-фенилпиперидин-3-ил)метанона и 3,5-диметилизоксазол-4-сульфонилхлорида (CAS Reg. No.: [80466-79-1]) получали [транс-1-(3,5-диметилизоксазол-4-сульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 537,4 ([М+Н])+.
Пример 46
[4-(2,5-Диметилфенил)пиперазин-1-ил]-[(3S,4S)-1-(3-метоксибензолсульфонил)-4-о-толилпиперидин-3-ил]метанон
Стадия 1: К раствору хлорида 2-метилфенилцинка ([84109-17-1], заранее полученного из хлорида о-толилмагния (44,07 мл) и хлорида цинка (8,81 г) в ТГФ (200 мл)) добавляли смесь 1-трет-бутилового эфира 3-метилового эфира 4-трифторметансульфонилокси-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты (CAS Reg. No. [161491-25-4]) (11,4 г) в ТГФ (90 мл), затем тетракис(трифенилфосфин)палладий(0) (1,02 г). Реакционную смесь перемешивали при комнатной температуре в течение ночи и затем гасили льдом. Смесь разбавляли трет-бутилметиловым эфиром и промывали 2 М водным раствором карбоната натрия. Водные фазы экстрагировали трет-бутилметиловым эфиром. Объединенные органические слои промывали насыщенным раствором хлорида натрия, сушили (Na2SO4), отфильтровывали и упаривали. Очистка хроматографией (SiO2, н-гептан/этилацетат 5:1) приводила к получению 1-трет-бутилового эфира 3-метилового эфира 4-о-толил-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты в виде светло-желтого масла, MS: 332,0 ([M+H])+.
Стадия 2: Аналогично примеру 2, стадия 6, из 1-трет-бутилового эфира 3-метилового эфира 4-о-толил-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты получали 1-трет-бутиловый эфир 4-о-толил-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты в виде белого твердого вещества, MS: 316,2 ([М-Н])-.
Стадия 3: В защитную камеру с перчатками в автоклаве загружали 1-трет-бутиловый эфир 4-о-толил-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты (2,5 г), [Ru(OAc)2((R)-(2-фурил)-MeOBIPHEP)] (24 мг), триэтиламин (1,1 мл) и метанол (25 мл). Асимметричное гидрирование осуществляли в течение 60 ч при 80°С при 40 бар водорода. После охлаждения до комнатной температуры давление из автоклава спускали, метанольный раствор разбавляли трет-бутилметиловым эфиром (320 мл) и экстрагировали 1 М водным раствором гидроксида натрия (2×, 320 мл). Водный слой выливали в лед, подкисляли охлажденным льдом 2 М водным раствором хлористоводородной кислоты до значения рН 1 и экстрагировали этилацетатом (3×). Объединенные органические слои сушили (Na2SO4), отфильтровывали и концентрировали в вакууме и обрабатывали n-гептаном с получением 1-трет-бутилового эфира (3S,4S)-4-о-толилпиперидин-1,3-дикарбоновой кислоты в виде белого твердого вещества, MS: 318,2.
Стадия 4: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4S)-4-o-толилпиперидин-1,3-дикарбоновой кислоты и 1-(2,5-диметилфенил)пиперазина получали трет-бутиловый эфир (3S,4S)-3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-о-толилпиперидин-1-карбоновой кислоты в виде белой пены, MS: 492,3 ([М+Н])+.
Стадия 5: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4S)-3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-o-толилпиперидин-1-карбоновой кислоты получали гидрохлорид [4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-4-о-толилпиперидин-3-ил)метанона в виде бесцветного масла, MS: 392,4 ([М+Н])+.
Стадия 6: Аналогично примеру 1, стадия 3, из гидрохлорида [4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-4-о-толилпиперидин-3-ил)метанона и 3-метоксибензолсульфонилхлорида получали [4-(2,5-диметилфенил)пиперазин-1-ил]-[(3S,4S)-1-(3-метоксибензолсульфонил)-4-о-толилпиперидин-3-ил]метанон в виде белой пены, MS: 562,5 ([М+Н])+.
Пример 47
[(3S,4S)-1-(3-Хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Аналогично примеру 1, стадия 3, из гидрохлорида [4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-4-о-толилпиперидин-3-ил)метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4S)-1-(3-хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 566,4 ([М+Н, 1Cl])+.
Пример 48
[4-(2,5-Диметилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-о-толилпиперидин-3-ил)метанон
Аналогично примеру 1, стадия 3, из гидрохлорида [4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-4-о-толилпиперидин-3-ил)метанона и метансульфонилхлорида получали [4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-о-толилпиперидин-3-ил)метанон в виде белой пены, MS: 470,1 ([M+Н])+.
Пример 49
[(3S,4S)-1-(3-Хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4S)-4-фенилпиперидин-1,3-дикарбоновой кислоты (CAS Reg. No.: [197900-77-9]) и 1-(2,5-диметилфенил)пиперазина получали трет-бутиловый эфир (3S,4S)-3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-фенилпиперидин-1-карбоновой кислоты в виде белой пены, MS: 478,28 ([М+Н])+.
Стадия 2: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4S)-3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-фенилпиперидин-1-карбоновой кислоты получали гидрохлорид [4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-4-фенилпиперидин-3-ил)метанона в виде сырого продукта, MS: 392,4 ([М+Н])+.
Стадия 3: Аналогично примеру 1, стадия 3, из гидрохлорида [4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-4-фенилпиперидин-3-ил)метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4S)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 552,2 ([М+Н, 1Cl])+.
Пример 50
[4-(2,5-Диметилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-фенилпиперидин-3-ил)метанон
Аналогично примеру 1, стадия 3, из гидрохлорида [4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-4-фенилпиперидин-3-ил)метанона и метансульфонилхлорида получали [4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-фенилпиперидин-3-ил)метанон в виде белой пены, MS: 456,3 ([М+Н])+.
Пример 51
[(3R,4R)-1-(3-Хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3R,4R)-4-фенилпиперидин-1,3-дикарбоновой кислоты (CAS Reg. No.: [197900-84-8]) и 1-(2,5-диметилфенил)пиперазина получали трет-бутиловый эфир (3R,4R)-3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-фенилпиперидин-1-карбоновой кислоты в виде белой пены, MS: 478,27 ([M+H])+.
Стадия 2: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3R,4R)-3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-фенилпиперидин-1-карбоновой кислоты получали гидрохлорид [4-(2,5-диметилфенил)пиперазин-1-ил]-((3R,4R)-4-фенилпиперидин-3-ил)метанона, который непосредственно использовали на следующей реакции, MS: 378,4 ([М+Н, 1Cl])+.
Стадия 3: Аналогично примеру 1, стадия 3, из гидрохлорида [4-(2,5-диметилфенил)пиперазин-1-ил]-((3R,4R)-4-фенилпиперидин-3-ил)метанона и 3-хлорбензолсульфонилхлорида получали [(3R,4R)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 552,2 ([М+Н, 1Cl])+.
Пример 52
[4-(2,5-Диметилфенил)пиперазин-1-ил]-[(3S,4R)-1-(3-метоксибензолсульфонил)-4-о-толилпиперидин-3-ил]метанон
Стадия 1: Аналогично примеру 46, стадия 3, из 1-трет-бутилового эфира 4-о-толил-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты, используя Ru(OAc)2((S)-BITIANP в качестве катализатора для энантиоселективного гидрирования получали 1-трет-бутиловый эфир (3R,4R)-4-о-толилпиперидин-1,3-дикарбоновой кислоты в виде белого твердого вещества, MS: 318,4 ([М-Н])-.
Стадия 2: К раствору трифенилфосфина (2,66 г) в ТГФ (30 мл) добавляли диэтилазодикарбоксилат (1,58 мл) при 0°С. Через 30 минут последовательно добавляли метанол (1,58 мл) и раствор 1-трет-бутилового эфира (3R,4R)-4-о-толилпиперидин-1,3-дикарбоновой кислоты в ТГФ (30 мл) при 0-5°С. Реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Реакцию гасили насыщенным водным раствором NH4Cl, добавляли трет-бутилметиловый эфир и фазы разделяли. Неорганическую фазу экстрагировали трет-бутилметиловым эфиром (3×100 мл). Объединенные органические слои сушили (Na2SO4), отфильтровывали и упаривали. Очистка хроматографией (SiO2, от CH2Cl2 до CH2Cl2/МеОН 95:5) приводила к получению 1-трет-бутилового эфира 3-метилового эфира (3R,4R)-4-о-толилпиперидин-1,3-дикарбоновой кислоты в виде бесцветного смолистого вещества, MS: 334,1 ([М+Н])+.
Стадия 3: Смесь 1-трет-бутилового эфира 3-метилового эфира (3R,4R)-4-о-толилпиперидин-1,3-дикарбоновой кислоты (200 мг) и метоксида натрия (65 мг) в безводном толуоле (6 мл) кипятили с обратным холодильником в течение ночи. После охлаждения до комнатной температуры реакционную смесь гасили водой и концентрировали в вакууме. Остаток растворяли в смеси 1,4-диоксана (3 мл) и 2 М водного раствора гидроксида натрия (3 мл). После перемешивания при КТ в течение 5 ч смесь разбавляли водой и промывали двумя порциями трет-бутилметилового эфира. Водный слой охлаждали до 0°С, подкисляли до значения рН 1-2 с помощью охлажденного льдом 1 М водного раствора KHSO4 и экстрагировали этилацетатом. Объединенные органические слои сушили (Na2SO4), отфильтровывали и упаривали с получением 1-трет-бутилового эфира (3S,4R)-4-о-толилпиперидин-1,3-дикарбоновой кислоты в виде белого твердого вещества, MS: 318,4 ([М-Н])-.
Стадия 4: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4R)-4-о-толилпиперидин-1,3-дикарбоновой кислоты и 1-(2,5-диметилфенил)пиперазина получали трет-бутиловый эфир (3S,4R)-3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-о-толилпиперидин-1-карбоновой кислоты в виде белого твердого вещества, MS: 492,1 ([М+Н])+.
Стадия 5: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4R)-3-[4-(2,5-диметилфенил)пиперазин-1-карбонил]-4-о-толилпиперидин-1-карбоновой кислоты получали гидрохлорид [4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4R)-4-о-толилпиперидин-3-ил)метанона в виде белого твердого вещества, MS: 392,3 ([М+Н])+.
Стадия 6: Аналогично примеру 1, стадия 3, из гидрохлорида [4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4R)-4-о-толилпиперидин-3-ил)метанона и 3-метоксибензолсульфонилхлорида получали [4-(2,5-диметилфенил)пиперазин-1-ил]-[(3S,4R)-1-(3-метоксибензолсульфонил)-4-о-толилпиперидин-3-ил]метанон в виде белого твердого вещества, MS: 562,3 ([М+Н]+.
Пример 53
[(3S,4S)-1-(3-Хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 46, стадии 1-2, из 1-трет-бутилового эфира 3-метилового эфира 4-трифторметансульфонилокси-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты (CAS Reg. No. [161491-25-4]) и бромида 4-фторфенилцинка получали 1-трет-бутиловый эфир 4-(4-фторфенил)-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты в виде белой пены, MS: 320,5 ([М-Н])-.
Стадия 2: Аналогично примеру 46, стадия 3, из 1-трет-бутилового эфира 4-(4-фторфенил)-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты, используя [Ru(OAc)2((R)-MeOBIPHEP)] в качестве катализатора для энантиоселективного гидрирования, получали 1-трет-бутиловый эфир (-)-(3S,4S)-4-(4-фторфенил)пиперидин-1,3-дикарбоновой кислоты в виде беловатого твердого вещества, MS: 322,5 ([М+Н])+.
Стадия 3: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (-)-(3S,4S)-4-(4-фторфенил)пиперидин-1,3-дикарбоновой кислоты и 1-(5-хлор-2-метилфенил)пиперазина получали трет-бутиловый эфир (3S,4S)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(4-фторфенил)пиперидин-1-карбоновой кислоты в виде белой пены, MS: 516,3 ([М+Н, 1Cl])+.
Стадия 4: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4S)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(4-фторфенил)пиперидин-1-карбоновой кислоты получали гидрохлорид [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-(4-фторфенил)пиперидин-3-ил]метанона в виде белой пены, MS: 416,4 ([М+Н, 1Cl])+.
Стадия 5: Аналогично примеру 1, стадия 3, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-(4-фторфенил)пиперидин-3-ил]метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4S)-1-(3-хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 590,3 ([М+Н, 1Cl])+.
Пример 54
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-(4-фторфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон
Аналогично примеру 1, стадия 3, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-(4-фторфенил)пиперидин-3-ил]метанона и 2-(трифторметил)бензолсульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-(4-фторфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 624,2 ([М+Н, 1Cl])+.
Пример 55
[(3S,4R)-1-(3-Хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 46, стадия 3, из 1-трет-бутилового эфира 4-(4-фторфенил)-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты, используя [Ru(OAc)2((S)-(3,5-Xyl,4-MeO-MeOBIPHEP))] в качестве катализатора для энантиоселективного гидрирования получали 1-трет-бутиловый эфир (3R,4R)-4-(4-фторфенил)пиперидин-1,3-дикарбоновой кислоты в виде белой пены, MS: 322,5 ([М-Н])-.
Стадия 2: Аналогично примеру 52, стадии 2-3, из 1-трет-бутилового эфира (3R,4R)-4-(4-фторфенил)пиперидин-1,3-дикарбоновой кислоты получали 1-трет-бутиловый эфир (3S,4R)-4-(4-фторфенил)пиперидин-1,3-дикарбоновой кислоты в виде белой пены, MS: 322,5 ([М-Н])-.
Стадия 3: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4R)-4-(4-фторфенил)пиперидин-1,3-дикарбоновой кислоты и 1-(5-хлор-2-метилфенил)пиперазина получали трет-бутиловый эфир (3S,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(4-фторфенил)пиперидин-1-карбоновой кислоты в виде светло-желтой пены, MS: 516,3 ([М+Н, 1Cl])+.
Стадия 4: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(4-фторфенил)пиперидин-1-карбоновой кислоты получали гидрохлорид [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-(4-фторфенил)пиперидин-3-ил]метанона в виде белой пены, MS: 416,4 ([М+Н, 1Cl])+.
Стадия 5: Аналогично примеру 1, стадия 3, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-(4-фторфенил)пиперидин-3-ил]метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4R)-1-(3-хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 590,3 ([М+Н, 1Cl])+.
Пример 56
[(3S,4R)-1-(2-Хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Аналогично примеру 1, стадия 3, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-(4-фторфенил)пиперидин-3-ил]метанона и 2-хлорбензолсульфонилхлорида получали [(3S,4R)-1-(2-хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 590,3 ([М+Н, 1Cl])+.
Пример 57
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-(4-фторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон
Аналогично примеру 1, стадия 3, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-(4-фторфенил)пиперидин-3-ил]метанона и пиридин-3-сульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-(4-фторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 557,1 ([М+Н, 1Cl])+.
Пример 58
[(3S,4S)- или (3R,4R)-1-(3-Хлорбензолсульфонил)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 46, стадия 1, из 1-трет-бутилового эфира 3-метилового эфира 4-трифторметансульфонилокси-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты (CAS Reg. No. [161491-25-4]) и бромида 2-фтор-4-метилфенилцинка (CAS Reg. No. [737797-14-7]) получали 1-трет-бутиловый эфир 3-метиловый эфир 4-(2-фтор-4-метилфенил)-5,6-дигидро-2Н-пиридин-1,3-дикарбоновой кислоты в виде светло-желтого масла, MS: 350,4 ([М+Н])+.
Стадия 2: Аналогично примеру 46, стадия 2, из 1-трет-бутилового эфира 3-метилового эфира 4-(2-фтор-4-метилфенил)-5,6-дигидро-2Н-пиридин-1,3-дикарбоновой кислоты получали 1-трет-бутиловый эфир 4-(2-фтор-4-метилфенил)-5,6-дигидро-2Н-пиридин-1,3-дикарбоновой кислоты в виде белого твердого вещества, MS: 334,2 (М-Н])-.
Стадия 3: Аналогично примеру 46, стадия 3, из 1-трет-бутилового эфира 4-(2-фтор-4-метилфенил)-5,6-дигидро 2Н-пиридин-1,3-дикарбоновой кислоты, используя [Ru(ОАс)2((R)-(2-фурил)-MeOBIPHEP)] в качестве катализатора для энантиоселективного гидрирования получали 1-трет-бутиловый эфир (3S,4S)- или (3R,4R)-4-(2-фтор-4-метилфенил)пиперидин-1,3-дикарбоновой кислоты в виде белой пены, MS: 336,2 (М-Н])-; [α]D=-62,82 (с=0,962 г/100 мл, CHCl3).
Стадия 4: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4S)- или (3R,4R)-4-(2-фтор-4-метилфенил)пиперидин-1,3-дикарбоновой кислоты и 1-(5-хлор-2-метилфенил)пиперазина получали трет-бутиловый эфир (3S,4S)- или (3R,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(2-фтор-4-метилфенил)пиперидин-1-карбоновой кислоты в виде белой пены, MS: 530,3 ([М+Н, 1Cl])+.
Стадия 5: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4S)- или (3R,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(2-фтор-4-метилфенил)пиперидин-1-карбоновой кислоты получали гидрохлорид (3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)пиперидин-3-ил]метанона в виде сырого продукта, MS: 430,4 ([М+Н, 1Cl])+.
Стадия 6: Аналогично примеру 1, стадия 3, из гидрохлорида (3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)пиперидин-3-ил]метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4S)- или (3R,4R)-1-(3-хлорбензолсульфонил)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 604,1 ([М+Н, 1Cl])+; [α]D=+14,03 (с=0,442 г/100 мл, CHCl3).
Пример 59
[(3S,4S)- или (3R,4R)-1-(2-Хлорбензолсульфонил)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Аналогично примеру 1, стадия 3, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]метанона и 2-хлорбензолсульфонилхлорида получали [(3S,4S)- или (3R,4R)-1-(2-хлорбензолсульфонил)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 604,1 ([М+Н, 1Cl])+; [α]D=-8,8 (c=0,659 г/100 мл, CHCl3).
Пример 60
(3S,4S)- или (3R,4R)-[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон
Аналогично примеру 1, стадия 3, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]метанона и 2-(трифторметил)бензолсульфонилхлорида получали (3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 638,3 ([М+Н, 1Cl])+; [α]D=-13,63 (с=0,477 г/100 мл, CHCl3).
Пример 61
(3S,4S)- или (3R,4R)-[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон
Аналогично примеру 1, стадия 3, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]метанона и гидрохлорида пиридин-3-сульфонилхлорида получали (3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 571,3 ([М+Н, 1Cl])+; [α]D=+0,67 (с=0,446 г/100 мл, CHCl3).
Пример 62
(3S,4S)- или (3R,4R)-[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон
Аналогично примеру 1, стадия 3, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]метанона и 2-пропансульфонилхлорида получали (3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 536,4 ([М+Н, 1Cl])+; [α]D=-16,22 (с=0,746 г/100 мл, CHCl3).
Пример 63
[(3S,4R)-1-(3-Хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 52, стадии 2-3, из 1-трет-бутилового эфира (3R,4R)-4-фенилпиперидин-1,3-дикарбоновой кислоты (CAS Reg. No.: [197900-84-8]) получали 1-трет-бутиловый эфир (3S,4S)-4-фенилпиперидин-1,3-дикарбоновой кислоты в виде беловатого твердого вещества, MS: 304,3 (М-Н])-.
Стадия 2: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4S)-4-фенилпиперидин-1,3-дикарбоновой кислоты и 1-(5-хлор-2-метилфенил)пиперазина получали трет-бутиловый эфир (3S,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-фенилпиперидин-1-карбоновой кислоты (Cas Reg. No. [652971-20-5]) в виде белой пены, MS: 500,5 ([М+Н, 1Cl])+.
Стадия 3: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-фенилпиперидин-1-карбоновой кислоты и 1-(5-хлор-2-метилфенил)пиперазина получали гидрохлорид [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4R)-4-фенилпиперидин-3-ил)метанона в виде белой пены, MS: 400,5 ([М+Н, 1Cl])+.
Стадия 4: Аналогично примеру 1, стадия 3, используя изоPr2NEt в качестве основания и CH2Cl2 в качестве растворителя, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4R)-4-фенилпиперидин-3-ил)метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4R)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 572,15 ([М+Н, 1Cl])+.
Пример 64
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-фенил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4R)-4-фенилпиперидин-3-ил)метанона и 2-(трифторметил)бензолсульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-фенил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 606,2 ([М+Н, 1Cl])+.
Пример 65
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-фенил-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4R)-4-фенилпиперидин-3-ил)метанона и гидрохлорида пиридин-3-сульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-фенил-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 539,3 ([М+Н, 1Cl])+.
Пример 66
[(3S,4R)-1-(3-Хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 46, стадия 1, из 1-трет-бутилового эфира 4-о-толил-5,6-дигидро-2Н-пиридин-1,3-дикарбоновой кислоты, используя [Ru(OAc)2((S)-(BITIANP))] в качестве катализатора для энантиоселективного гидрирования получали 1-трет-бутиловый эфир (3R,4R)-4-о-толилпиперидин-1,3-дикарбоновой кислоты в виде белой пены, MS: 318,2 ([М-Н])-.
Стадия 2: Аналогично примеру 52, стадии 2-3, из 1-трет-бутилового эфира (3R,4R)-4-о-толилпиперидин-1,3-дикарбоновой кислоты получали 1-трет-бутиловый эфир (3S,4R)-4-о-толилпиперидин-1,3-дикарбоновой кислоты в виде белого твердого вещества, MS: 318,4 ([М-Н])-.
Стадия 3: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4R)-4-о-толилпиперидин-1,3-дикарбоновой кислоты и 1-(5-хлор-2-метилфенил)пиперазина получали трет-бутиловый эфир (3S,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-о-толилпиперидин-1-карбоновойкислоты в виде белой пены, MS: 512,5 ([М+Н])+.
Стадия 4: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-o-толилпиперидин-1-карбоновой кислоты получали гидрохлорид [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4R)-4-o-толилпиперидин-3-ил)метанона в виде сырого продукта, MS: 512,5 ([М+Н, 1Cl])+.
Стадия 5: Аналогично примеру 63, стадия 4, из гидрохлорида 4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4R)-4-o-толилпиперидин-3-ил)метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4R)-1-(3-хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 586,1 ([М+Н, 1Cl])+.
Пример 67
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-о-толил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида 4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4R)-4-о-толилпиперидин-3-ил)метанона и 2-(трифторметил)бензолсульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-о-толил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 620,3 ([М+Н, 1Cl])+.
Пример 68
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-1-(пиридин-3-сульфонил)-4-о-толилпиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида 4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4R)-4-о-толилпиперидин-3-ил)метанона и гидрохлорида пиридин-3-сульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-1-(пиридин-3-сульфонил)-4-о-толилпиперидин-3-ил]метанон в виде белой пены, MS: 553,2 ([М+Н, 1Cl])+.
Пример 69
[(3S,4R)- или (3R,4S)-1-(3-Хлорбензолсульфонил)-4-(2,4-дифторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 46, стадия 1, из 1-трет-бутилового эфира 3-метилового эфира 4-трифторметансульфонилокси-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты (CAS Reg. No. [161491-25-4]) и бромида 2,4-дифторфенилцинка получали 1-трет-бутиловый эфир 4-(2,4-дифторфенил)-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты в виде светло-желтого масла, MS: 354,2 (М+Н)+.
Стадия 2: Аналогично примеру 46, стадия 2, из 1-трет-бутилового эфира 3-метилового эфира 4-(2,4-дифторфенил)-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты получали 1-трет-бутиловый эфир 4-(2,4-дифторфенил)-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты в виде белого твердого вещества, 338,1 (М-Н)-.
Стадия 3: Аналогично примеру 46, стадия 3, из 1-трет-бутилового эфира 4-(2,4-дифторфенил)-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты, используя [Ru(OAc)2((S)-(BITIANP))] в качестве катализатора для энантиоселективного гидрирования получали 1-трет-бутиловый эфир (3R,4R)- или (3S,4S)-4-(2,4-дифторфенил)пиперидин-1,3-дикарбоновой кислоты в виде белого твердого вещества, MS: 340,1 ([М-Н])-; [α]D=+61,90 (с=0,806 г/100 мл, CHCl3).
Стадия 4: Аналогично примеру 52, стадии 2-3, из 1-трет-бутилового эфира (3R,4R)- или (3S,4S)-4-(2,4-дифторфенил)пиперидин-1,3-дикарбоновой кислоты получали 1-трет-бутиловый эфир (3S,4R)- или (3R,4S)-4-(2,4-дифторфенил)пиперидин-1,3-дикарбоновой кислоты в виде беловатой пены, MS: 340,4 ([М-Н])-; [α]D=-8,11 (с=0,271 г/100 мл, CHCl3).
Стадия 5: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4R)- или (3R,4S)-4-(2,4-дифторфенил)пиперидин-1,3-дикарбоновой кислоты и 1-(5-хлор-2-метилфенил)пиперазина получали трет-бутиловый эфир (3S,4R)- или (3R,4S)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(2,4-дифторфенил)пиперидин-1-карбоновой кислоты в виде белой пены, MS: 534,2 ([М+Н, 1Cl])+.
Стадия 6: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4R)- или (3R,4S)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(2,4-дифторфенил)пиперидин-1-карбоновой кислоты получали гидрохлорид (3S,4R)- или (3R,4S)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2,4-дифторфенил)пиперидин-3-ил]метанона в виде сырого продукта, MS: 434,3 ([М+Н, 1Cl])+.
Стадия 7: Аналогично примеру 63, стадия 4, из гидрохлорида (3S,4R)- или (3R,4S)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[-4-(2,4-дифторфенил)пиперидин-3-ил]метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4R)- или (3R,4S)-1-(3-хлорбензолсульфонил)-4-(2,4-дифторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 607,1 ([М+Н, 1Cl])+; [α]D=-66,8 (с=0,434 г/100 мл, CHCl3).
Пример 70
(3S,4R)- или (3R,4S)-[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[4-(2,4-дифторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида (3S,4R)- или (3R,4S)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2,4-дифторфенил)пиперидин-3-ил]метанона и гидрохлорида пиридин-3-сульфонилхлорида получали (3S,4R)- или (3R,4S)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-(2,4-дифторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 575,4 ([М+Н, 1Cl])+; [α]D=-66,76 (с=0,454 г/100 мл, CHCl3).
Пример 71
[(3S,4S)-1-(3-Хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4S)-4-фенилпиперидин-1,3-дикарбоновой кислоты (CAS Reg. No.: [197900-77-9]) и 1-(5-хлор-2-метилфенил)пиперазина получали трет-бутиловый эфир (3S,4S)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-фенилпиперидин-1-карбоновой кислоты в виде белой пены, MS: 498,5 ([М+Н, 1Cl])+.
Стадия 2: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4S)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-фенилпиперидин-1-карбоновой кислоты получали гидрохлорид [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-4-фенилпиперидин-3-ил)метанона в виде сырого продукта, MS: 398,4 ([М+Н, 1Cl])+.
Стадия 3: Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-4-фенилпиперидин-3-ил)метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4S)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 572,2 ([М+Н, 1Cl])+.
Пример 72
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-4-фенилпиперидин-3-ил)метанона и 2-(трифторметил)бензолсульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 606,0 ([М+Н, 1Cl])+.
Пример 73
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-4-фенилпиперидин-3-ил)метанона и гидрохлорида пиридин-3-сульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 539,2 ([М+Н, 1Cl])+.
Пример 74
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-4-фенилпиперидин-3-ил)метанона и 2-пропансульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 504,1 ([М+Н, 1Cl])+.
Пример 75
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-фенилпиперидин-3-ил)метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-4-фенилпиперидин-3-ил)метанона и метансульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-фенилпиперидин-3-ил)метанон в виде белой пены, MS: 476,1 ([М+Н, 1Cl])+.
Пример 76
[(3S,4S)-1-(3-Хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4S)-4-о-толилпиперидин-1,3-дикарбоновой кислоты (пример 46, стадия 3) и 1-(5-хлор-2-метилфенил)пиперазина получали трет-бутиловый эфир (3S,4S)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-о-толилпиперидин-1-карбоновой кислоты в виде белой пены, MS: 512,3 ([М+Н, 1Cl])+.
Стадия 2: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4S)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-о-толилпиперидин-1-карбоновой кислоты получали гидрохлорид [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-4-о-толилпиперидин-3-ил)метанона в качестве сырого продукта, MS: 412,5 ([М+Н, 1Cl])+.
Стадия 3: Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-4-о-толилпиперидин-3-ил)метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4S)-1-(3-хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 586,2 ([М+Н, 1Cl])+.
Пример 77
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-о-толил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-4-о-толилпиперидин-3-ил)метанона и 2-(трифторметил)бензолсульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-о-толил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 620,5 ([М+Н, 1Cl])+.
Пример 78
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-1-(пиридин-3-сульфонил)-4-о-толилпиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-4-о-толилпиперидин-3-ил)метанона и гидрохлорида пиридин-3-сульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-1-(пиридин-3-сульфонил)-4-о-толилпиперидин-3-ил]метанон в виде белой пены, MS: 553,2 ([М+Н, 1Cl])+.
Пример 79
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-о-толилпиперидин-3-ил)метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-4-о-толилпиперидин-3-ил)метанона и метансульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-о-толилпиперидин-3-ил)метанон в виде белой пены, MS: 490,2 ([М+Н, 1Cl])+.
Пример 80
[(3S,4S)- или (3R,4R)-1-(3-Хлорбензолсульфонил)-4-(4-фтор-2-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 46, стадии 1-2, из 1-трет-бутилового эфира 3-метилового эфира 4-трифторметансульфонилокси-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты (CAS Reg. No. [161491-25-4]) и бромида 4-фтор-6-метилфенилцинка (заранее полученного из 4-фтор-6-метилфенилмагнийбромида и хлорида цинка) получали 1-трет-бутиловый эфир 4-(4-фтор-2-метилфенил)-5,6-дигидро-2Н-пиридин-1,3-дикарбоновой кислоты в виде белого твердого вещества, MS: 334,3 (М-Н])-.
Стадия 2: Аналогично примеру 46, стадия 3, из 1-трет-бутилового эфира 4-(4-фтор-2-метилфенил)-5,6-дигидро-2Н-пиридин-1,3-дикарбоновой кислоты, используя [Ru(ОАс)2((R)-(2-фурил)-MeOBIPHEP)] в качестве катализатора для энантиоселективного гидрирования получали 1-трет-бутиловый эфир (3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)пиперидин-1,3-дикарбоновой кислоты в виде белой пены, MS: 336,2 (М-Н])-; [α]D=-52,53 (с=0,643 г/100 мл, CHCl3).
Стадия 3: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)пиперидин-1,3-дикарбоновой кислоты и 1-(5-хлор-2-метилфенил)пиперазина получали трет-бутиловый эфир (3S,4S)- или (3R,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(4-фтор-2-метилфенил)пиперидин-1-карбоновой кислоты в виде белой пены, MS: 530,2 ([М+Н, 1Cl])+.
Стадия 4: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4S)- или (3R,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(4-фтор-2-метилфенил)пиперидин-1-карбоновой кислоты получали гидрохлорид [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)пиперидин-3-ил]метанона в качестве сырого продукта, MS: 430,4 ([М+Н, 1Cl])+.
Стадия 5: Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)пиперидин-3-ил]метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4S)- или (3R,4R)-1-(3-хлорбензолсульфонил)-4-(4-фтор-2-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 604,0 ([М+Н, 1Cl])+; [α]D=-32,13 (с=0,426 г/100 мл, CHCl3).
Пример 81
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)пиперидин-3-ил]метанона и 2-(трифторметил)бензолсульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 638,2 ([М+Н, 1Cl])+; [α]D=-60,75 (с=0,423 г/100 мл, CHCl3).
Пример 82
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)пиперидин-3-ил]метанона и гидрохлорида пиридин-3-сульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 571,2 ([М+Н, 1Cl])+; [α]D=-49,92 (с=0,535 г/100 мл, CHCl3).
Пример 83
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-метансульфонилпиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)пиперидин-3-ил]метанона и метансульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-метансульфонилпиперидин-3-ил]метанон в виде белой пены, MS: 508,3 ([М+Н, 1Cl])+; [α]D=-77,86 (с=0,434 г/100 мл, CHCl3).
Пример 84
[(3S,4S)- или (3R,4R)-1-(3-Хлорбензолсульфонил)-4-(2,4-дифторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон
Стадия 1: Аналогично примеру 46, стадия 1, из 1-трет-бутилового эфира 3-метилового эфира 4-трифторметансульфонилокси-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты (CAS Reg. No. [161491-25-4]) и бромида 2,4-дифторфенилцинка получали 1-трет-бутиловый эфир 3-метиловый эфир 4-(2,4-дифторфенил)-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты в виде светло-желтого масла, MS: 354,2 ([М+Н])+.
Стадия 2: Аналогично примеру 46, стадия 2, из 1-трет-бутилового эфира 3-метилового эфира 4-(2,4-дифторфенил)-5,6-дигидро-2H-пиридин-1,3-дикарбоновой кислоты получали 1-трет-бутиловый эфир 4-(2,4-дифторфенил)-5,6-дигидро-2Н-пиридин-1,3-дикарбоновой кислоты в виде белого твердого вещества, MS: 338,0 (М-Н])-.
Стадия 3: Аналогично примеру 46, стадия 3, из 1-трет-бутилового эфира 4-(2,4-дифторфенил)-5,6-дигидро-2Н-пиридин-1,3-дикарбоновой кислоты, используя [Ru(OAc)2((S)-(BITIANP))] в качестве катализатора для энантиоселективного гидрирования получали 1-трет-бутиловый эфир (3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)пиперидин-1,3-дикарбоновой кислоты в виде белого твердого вещества, MS: 340,1 (М-Н])-; [α]D=-61,33 (с=0,473 г/100 мл, CHCl3).
Стадия 4: Аналогично примеру 1, стадия 1, из 1-трет-бутилового эфира (3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)пиперидин-1,3-дикарбоновой кислоты и 1-(5-хлор-2-метилфенил)пиперазина получали трет-бутиловый эфир (3S,4S)- или (3R,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(2,4-дифторфенил)пиперидин-1-карбоновой кислоты в виде белой пены, MS: 534,2 ([М+Н, 1Cl])+.
Стадия 5: Аналогично примеру 22, стадия 4, из трет-бутилового эфира (3S,4S)- или (3R,4R)-3-[4-(5-хлор-2-метилфенил)пиперазин-1-карбонил]-4-(2,4-дифторфенил)пиперидин-1-карбоновой кислоты получали гидрохлорид [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)пиперидин-3-ил]метанона в виде сырого продукта, MS: 434,5 ([М+Н, 1Cl])+.
Стадия 6: Аналогично примеру 63, стадия 4, из гидрохлорида 4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)пиперидин-3-ил]метанона и 3-хлорбензолсульфонилхлорида получали [(3S,4S)- или (3R,4R)-1-(3-хлорбензолсульфонил)-4-(2,4-дифторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон в виде белой пены, MS: 608,0 ([М+Н, 1Cl])+; [α]D=+10,71 (с=0,392 г/100 мл, CHCl3).
Пример 85
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида 4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)пиперидин-3-ил]метанона и 2-(трифторметил)бензолсульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 642,3 ([М+Н, 1Cl])+; [α]D=-22,86 (с=0,442 г/100 мл, CHCl3).
Пример 86
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида 4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)пиперидин-3-ил]метанона и гидрохлорида пиридин-3-сульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 575,3 ([М+Н, 1Cl])+; [α]D=-5,09 (с=0,746 г/100 мл, CHCl3).
Пример 87
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-метансульфонилпиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида 4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)пиперидин-3-ил]метанона и метансульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-метансульфонилпиперидин-3-ил]метанон в виде белой пены, MS: 512,1 ([М+Н, 1Cl])+; [α]D=-44,38 (с=0,388 г/100 мл, CHCl3).
Пример 88
[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон
Аналогично примеру 63, стадия 4, из гидрохлорида 4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)пиперидин-3-ил]метанона и 2-пропансульфонилхлорида получали [4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон в виде белой пены, MS: 540,3 ([М+Н, 1Cl])+; [α]D=-36,27 (с=0,623 г/100 мл, CHCl3).
Пример А
Покрытые пленкой таблетки, содержащие следующее ингредиенты, могут быть получены обычным образом:
Ингредиенты
Ядро:
Пленочное покрытие:
Активный ингредиент просеивали и смешивали с микрокристаллической целлюлозой и смесь гранулировали с раствором поливинилпирролидона в воде. Гранулят затем смешивали с натрийгликолированным крахмалом и стеаратом магния и прессовали с получением ядер по 120 или 350 мг соответственно. Ядра покрывали водн. раствором/суспензией указанного выше пленочного покрытия.
Пример Б
Капсулы, содержащие следующее ингредиенты, могут быть получены обычным образом:
Компоненты просеивали и смешивали и наполняли в капсулы размера 2.
Пример В
Инъекционные растворы могут иметь следующий состав:
Активный ингредиент растворяли в смеси полиэтиленгликоля 400 и воды для инъекций (часть). Значение рН доводили до 5,0 добавлением уксусной кислоты. Объем доводили до 1,0 мл добавлением оставшегося количества воды. Раствор отфильтровывали, наполняли в сосуды, используя подходящее оборудование, и стерилизовали.
Пример Г
Мягкие желатиновые капсулы, содержащие следующее ингредиенты, могут быть получены обычным образом:
Содержание капсулы
Желатиновая капсула
Активный ингредиент растворяли в теплом расплаве других ингредиентов и смесь наполняли в мягкие желатиновые капсулы подходящего размера. Заполненные мягкие желатиновые капсулы обрабатывали в соответствии с обычными методиками.
Пример Д
Саше, содержащие следующее ингредиенты, могут быть получены обычным образом:
Активный ингредиент смешивали с лактозой, микрокристаллической целлюлозой и натрийкарбоксиметилцеллюлозой и гранулировали со смесью поливинилпирролидона в воде. Гранулят смешивали со стеаратом магния и отдушками и наполняли в саше.
Реферат
Изобретение относится к новым пиперазинамидным производным формулы (I), где Х представляет собой N или СН; Y представляет собой N или СН; R1 представляет собой низший алкил, фенил, фенил-низший алкил, где фенил необязательно может быть замещен 1-2 заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила; R2 представляет собой низший алкил, фенил, нафтил или гетероарил, выбранный из диметилизоксазолила, хинолинила, тиофенила или пиридинила, где фенил или гетероарил необязательно могут быть замещены 1 заместителем, независимо выбранным из группы, состоящей из галогена, низшей алкоксигруппы, фтор-низшего алкила, низшего алкокси-карбонила и фенила; R3 представляет собой фенил, пиридинил или пиразинил, где фенил, пиридинил или пиразинил замещены 1-2 заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила и фтор-низшего алкила; R4, R5, R6, R7, R8, R9, R10 и R11 независимо друг от друга представляют собой водород, а также к их физиологически приемлемым солям. Эти соединения связываются с LXR альфа и LXR бета и могут использоваться в качестве лекарственных средств, предназначенных для терапевтического и/или профилактического лечения повышенных уровней липидов, повышенных уровней холестерина, низкого ЛВП-холестерина, высокого ЛНП-холестерина, атеросклеротических заболеваний, диабета, инсулиннезависимого сахарного диабета, метаболического синдрома, дислипидемии, сепсиса, воспалительных заболеваний, инфекционных заболеваний, кожных заболеваний, колита, панкреатита, холестаза печени, фиброза печени, псориаза, болезни Альцгеймера и др. 2 н. и 13 з.п. ф-лы, 88 пр.
Формула

где X представляет собой N или СН;
Y представляет собой N или СН;
R1 представляет собой низший алкил, фенил, фенил-низший алкил, где фенил необязательно может быть замещен 1-2 заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила;
R2 представляет собой низший алкил, фенил, нафтил или гетероарил, выбранный из диметилизоксазолила, хинолинила, тиофенила или пиридинила, где фенил или гетероарил необязательно могут быть замещены 1 заместителем, независимо выбранным из группы, состоящей из галогена, низшей алкоксигруппы, фтор-низшего алкила, низшего алкокси-карбонила и фенила;
R3 представляет собой фенил, пиридинил или пиразинил, где фенил, пиридинил или пиразинил замещены 1-2 заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила и фтор-низшего алкила;
R4, R5, R6, R7, R8, R9, R10 и R11 независимо друг от друга представляют собой водород,
и их фармацевтически приемлемые соли.
[4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(3-метоксибензолсульфонил)пиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон,
(-)-[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-(4-о-толилпиперазин-1-ил)метанон,
[4-(2,5-дихлорфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бензил-4-(3-метоксибензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
(-)-[1-бензил-4-(3-метоксибензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бензил-4-(3,5-диметилизоксазол-4-сульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-пропилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бутил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-пентилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-изобутилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-фенэтилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(4-хлорбензолсульфонил)-1-пентилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бутил-4-(4-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(4-хлорбензолсульфонил)-1-фенилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон,
[4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(2-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-дихлорфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]метанон,
[1-(4-фтор-2-метилфенил)-4-(нафталин-1-сульфонил)пиперазин-2-ил]-[4-(3-трифторметилпиридин-2-ил)пиперазин-1-ил]метанон,
[4-(2,5-дихлорфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон,
[4-(2,5-дихлорфенил)пиперазин-1-ил]-[4-(пропан-2-сульфонил)-1-о-толилпиперазин-2-ил]метанон,
[4-(бифенил-4-сульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1-ил]метанон,
метиловый эфир 3-{3-[4-(2,5-дихлорфенил)пиперазин-1-карбонил]-4-о-толилпиперазин-1-сульфонил}тиофен-2-карбоновой кислоты,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон,
[1-бензил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон,
[4-(3-хлорфенил)пиперидин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(пропан-2-сульфонил)пиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон,
цис-[4-(2,5-диметилфенил)пиперазин-1-ил]-[-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[(3S,4S)-1-(3-метоксибензолсульфонил)-4-фенилпиперидин-3-ил]метанон,
[транс-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[транс-1-(3,5-диметилизоксазол-4-сульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[(3S,4S)-1-(3-метоксибензолсульфонил)-4-о-толилпиперидин-3-ил]метанон,
[(3S,4S)-1-(3-хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-о-толилпиперидин-3-ил)метанон,
[(3S,4S)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-фенилпиперидин-3-ил)метанон,
[(3R,4R)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[(3S,4R)-1-(3-метоксибензолсульфонил)-4-о-толилпиперидин-3-ил]метанон,
[(3S,4S)-1-(3-хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-(4-фторфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[(3S,4R)-1-(3-хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[(3S,4R)-1-(2-хлорбензолсульфонил)-4-(4-фторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-(4-фторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[(3S,4S)- или (3R,4R)-1-(3-хлорбензолсульфонил)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[(3S,4S)- или (3R,4R)-1-(2-хлорбензолсульфонил)-4-(2-фтор-4-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
(3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
(3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
(3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон,
[(3S,4R)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-фенил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-фенил-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[(3S,4R)-1-(3-хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-о-толил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-1-(пиридин-3-сульфонил)-4-о-толилпиперидин-3-ил]метанон,
[(3S,4R)- или (3R,4S)-1-(3-хлорбензолсульфонил)-4-(2,4-дифторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
(3S,4R)- или (3R,4S)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2,4-дифторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[(3S,4S)-1-(3-хлорбензолсульфонил)-4-фенилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-фенил-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-фенилпиперидин-3-ил)метанон,
[(3S,4S)-1-(3-хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-4-о-толил-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)-1-(пиридин-3-сульфонил)-4-о-толилпиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-((3S,4S)-1-метансульфонил-4-о-толилпиперидин-3-ил)метанон,
[(3S,4S)- или (3R,4R)-1-(3-хлорбензолсульфонил)-4-(4-фтор-2-метилфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(4-фтор-2-метилфенил)-1-метансульфонилпиперидин-3-ил]метанон,
[(3S,4S)- или (3R,4R)-1-(3-хлорбензолсульфонил)-4-(2,4-дифторфенил)пиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S - или (3R,4R)-4-(2,4-дифторфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-метансульфонилпиперидин-3-ил]метанон и
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-(пропан-2-сульфонил)пиперидин-3-ил]метанон, и
их фармацевтически приемлемые соли.
[4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(3-метоксибензолсульфонил)пиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-[4-(2,5-дихлорфенил)пиперазин-1'-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[4-(3-метоксибензолсульфонил)-1-фенилпиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[1-бутил-4-(3-хлорбензолсульфонил)пиперазин-2-ил]-[4-(2,5-диметилфенил)пиперазин-1-ил]метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[1-(4-фтор-2-метилфенил)-4-(хинолин-8-сульфонил)пиперазин-2-ил]метанон,
[4-(2,5-дихлорфенил)пиперазин-1-ил]-[4-(пропан-2-сульфонил)-1-о-толилпиперазин-2-ил]метанон,
[4-(3-хлорбензолсульфонил)-1-(4-фтор-2-метилфенил)пиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон,
[4-(3-хлорбензолсульфонил)-1-о-толилпиперазин-2-ил]-(3',6'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)метанон,
[4-(2,5-диметилфенил)пиперазин-1-ил]-[(3S,4R)-1-(3-метоксибензолсульфонил)-4-о-толилпиперидин-3-ил]метанон,
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4R)-4-(4-фторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон,
(3S,4S)- или (3R,4R)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2-фтор-4-метилфенил)-1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]метанон,
[(3S,4R)-1-(3-хлорбензолсульфонил)-4-о-толилпиперидин-3-ил]-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]метанон,
(3S,4R)- или (3R,4S)-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[4-(2,4-дифторфенил)-1-(пиридин-3-сульфонил)пиперидин-3-ил]метанон и
[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-[(3S,4S)- или (3R,4R)-4-(2,4-дифторфенил)-1-метансульфонилпиперидин-3-ил]метанон,
и их фармацевтически приемлемые соли.

Комментарии