Фактор коагуляции viii с уменьшенной иммуногенностью - RU2631801C2
Код документа: RU2631801C2
Чертежи







Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к молекулам фактора коагуляции VIII со сниженной или отсутствующей иммуногенностью и к их применению в лечении нарушений коагуляции, и в частности в лечении гемофилии типа А.
Предшествующий уровень техники
Фактор VIH является фактором коагуляции, действующим в качестве кофактора при генерации тромбина, существенного компонента коагуляции. При отсутствии или недостаточности функционального фактора VIII индивидуумы страдают от нарушений свертываемости крови, вместе обозначаемых как гемофилия А. Имеются два типа гемофилии А, в зависимости от происхождения, либо врожденная (спонтанная гемофилия), либо приобретенная (приобретенная или аутоиммунная гемофилия). Спонтанная гемофилия А является заболеванием, поражающим мужчин, из-за расположения гена фактора VIII в Х-хромосоме. Женщины являются носителями, но не страдают нарушениями свертываемости крови благодаря присутствию двух Х-хромосом. Спонтанную гемофилию дополнительно разделяют на три подгруппы у пациентов, определяемые в соответствии с уровнем циркулирующего фактора VIII: тяжелую гемофилию (менее 1% фактора VIII), среднюю гемофилию (от 1 до 5% фактора VIII) и умеренную (концентрация фактора VIII от 5 до 10%).
Пациентам, страдающим гемофилией, требуется заместительная терапия фактором VIII. Это постоянная терапия для пациентов с тяжелой гемофилией А из-за повышенного риска спонтанного, иногда угрожающего жизни кровотечения, или периодическая терапия у пациентов со средней или умеренной гемофилией, которым требуется фактор VIII в случае травмы или хирургического вмешательства, и имеется острая потребность в повышенных концентрациях фактора VIII.
Общепризнано, что главным осложнением у пациентов, страдающих гемофилией А, является возникновение антител к терапевтическому агенту (фактору VIII), используемому для восстановления функциональной коагуляции. В настоящее время имеется 2 типа фактора VIII, используемого для заместительной терапии, выделенный из плазмы и рекомбинантный. Выделенный из плазмы фактор VIII получают из пулов плазмы крови человека, и он содержит дополнительные белки и, в частности, физиологический шаперон фактора VIII, фактор Виллебранда. Рекомбинантный фактор VIII получают посредством генной инженерии и продукции клетками животного или человеческого происхождения. Рекомбинантный фактор VIII является чистым и не содержит фактора Виллебранда. Продолжаются жаркие споры о том, есть ли существенная разница в риске развития иммунного ответа против фактора VIII при использовании полученной из плазмы или рекомбинантной молекулы фактора VIII. Независимо от ситуации, в среднем у 25% пациентов, получающих фактор VIII в качестве терапевтического агента, возникают антитела, ингибирующие активность заместительного агента. Такие антитела называют ингибиторами фактора VIII.
Не имеется средств лечения ингибиторов фактора VIII. На эмпирических основаниях было показано, что применение очень высоких доз фактора VIII на ежедневной основе в некоторых случаях может приводить к исчезновению ингибиторов. Это лечение, называемое индукцией иммунной толерантности, не обеспечивает надежного успеха. Отсутствие суррогатных маркеров, способных прогнозировать развитие иммунной толерантности, фактически ограничивает его применение в попытке устранения формирования ингибиторов фактора VIII. Кроме того, чрезмерно высокая стоимость, связанная с индукцией толерантности, такова, что лишь немногие пациенты могут проводить индукцию толерантности.
Ингибиторы фактора VIII являются высокоаффинными специфичными антителами, что подразумевает участие Т-лимфоцитов в их образовании. Следствием этого является то, что иммунный ответ полностью связан с иммунной памятью, оставляя популяции В-клеток памяти, которые при стимуляции трансформируются в плазматические клетки, продуцирующие антитела, и Т-клетки памяти, поддерживающие способность к развитию дальнейшего ответа антител на каждое последующее воздействие фактора VIII. У пациентов, у которых присутствуют ингибиторы фактора VIII, нельзя применять фактор VIII, не только потому, что ингибиторы нейтрализуют функцию фактора VIII и, вероятно, повышают скорость клиренса фактора VIII, но также потому, что дальнейшее применение фактора VIII повышает концентрации таких ингибиторов.
В патентной заявке WO 2009/101206 описан способ, позволяющий устранить продукцию ингибиторов путем воздействия на уровне приобретенного иммунитета, а именно на уровне взаимодействия между Т- и В-клетками, специфичными к фактору VIII. В этой заявке описано, как можно устранить риск продукции новых ингибиторов, а также как можно устранить существующие ингибиторы. Однако мы неожиданно установили, что фактор VIII является очень мощным активатором врожденного иммунитета, что считается необходимым условием для появления приобретенного иммунитета и ингибиторов. С учетом того, что фактор VIII нужно применять на регулярной основе (например, 2 или 3 раза в неделю у больных тяжелой гемофилией А), и таким образом, существует риск стимуляции новой продукции ингибиторов фактора VIII, имеется актуальная потребность в определении способов получения терапевтических молекул фактора VIII, утративших способность к активации врожденного иммунитета.
Заявка на патент РСТ/ЕР2011/070911 описывает способы, с помощью которых белки, способные активировать NKT-клетки, можно трансформировать так, чтобы они теряли эту способность. Так, NKT-клетки являются частью системы врожденного иммунитета, которую обычно определяют как не способную к запоминанию. Однако, как описано в заявке РСТ/ЕР2011/070911, NKT-клетки могут распознавать и активироваться путем презентации гидрофобных пептидов молекулой CD1d. Поскольку пептид получен из антигена, для которого NKT-клетки являются специфичными, это представляет активацию антиген-специфической системы врожденного иммунитета. Вышеупомянутая РСТ заявка описывает способы, при которых белки, демонстрирующие свойство к активации антиген-специфических NKT-клеток, можно модифицировать путем аминокислотной замены или делеции, таким образом, устраняя способность к связыванию с CD1d.
Настоящее изобретение описывает молекулы фактора VIII, полученные путем методики, описанной в заявке РСТ/ЕР2011/070911, утратившие их способность к активации системы врожденного иммунитета, и соответственно, демонстрирующие отсутствие или значительно сниженную способность к активации приобретенного иммунного ответа с продукцией ингибиторов. Далее изобретение описывает применение таких молекул фактора VIII для лечения пациентов, нуждающихся в заместительной терапии, и, в частности пациентов с тяжелой гемофилией А. Настоящее изобретение также раскрывает способы, в которых можно применять генную терапию с применением молекул фактора VIII из настоящего изобретения.
Изложение сущности изобретения
Настоящее изобретение относится к получению молекул фактора VIII со сниженной иммуногенностью.
Настоящее изобретение также относится к применению указанных молекул фактора VIII для лечения пациентов, нуждающихся в указанном лечении.
В заявке РСТ/ЕР2011/070911 описаны способы получения пептидов или полипептидов со сниженной способностью к активации NKT-клеток. Таким образом, мы неожиданно обнаружили, что существенная доля пептидов или полипептидов несет аминокислотные последовательности, позволяющие им связываться и презентироваться CD1d детерминантами для активации естественных киллерных Т-клеток (NKT-клеток). Активация таких клеток приводит к высвобождению цитокинов и, в некоторых случаях, к приобретению или к повышению цитолитических свойств.
Настоящее изобретение относится в одном аспекте к применению по меньшей мере одного изолированного полипептида, используемого в качестве аллофактора, который модифицирован для удаления по меньшей мере одного гидрофобного аминокислотного остатка, вовлеченного в формирование эпитопа, распознаваемого NKT-клетками, для получения медикамента для профилактики у субъекта иммунного ответа к указанному аллофактору.
В частности, настоящее изобретение относится к фактору VIII, и к применению фактора VIII в качестве медикамента. Фактор VIII является кофактором системы коагуляции, который участвует в активации тромбина путем облегчения формирования теназы, сериновой эстеразы, которая собирает фактор VIII, фактор XI и фактор X. Фактор X обладает ферментативной активностью, конвертирующей тромбин. При отсутствии фактора VIII скорость формирования теназы резко снижается, приводя к возникновению риска спонтанного кровотечения у пациентов, которое часто является угрожающим жизни и требует быстрых терапевтических мер. Когда концентрация фактора VIII умеренно снижается (от 5 до 10%), кровотечение у пациентов обычно происходит только при травме или хирургическом вмешательстве.
У пациентов, страдающих тяжелой гемофилией А (менее 1% фактора VIII), отмечаются частые спонтанные кровотечения, и требуется профилактическое лечение с постоянным применением или болюсным введением 2 или 3 раза в неделю. Кроме того, у пациентов, у которых наблюдается повышенный катаболизм фактора VIII, как при септическом шоке, остром фибринолизе, множественных травмах или кровоизлиянии в мозг, также необходимо применение фактора VIII.
Определения
Термин «пептид», применяемый в настоящей заявке, относится к молекуле, содержащей аминокислотную последовательность от 2 до 200 аминокислот, соединенных пептидными связями, которая может в конкретном варианте осуществления содержать неаминокислотные структуры (например, такие, как связывающее органическое соединение). Пептиды в соответствии с настоящим изобретением могут содержать любые из обычных 20 аминокислот или их модифицированных вариантов, или могут содержать аминокислоты неприродного происхождения, встроенные путем химического пептидного синтеза или путем химической или ферментативной модификации. Термин «полипептид», используемый в настоящей заявке, относится, как правило, к более длинным пептидам или белкам.
Термин «эпитоп», используемый в настоящей заявке, относится к одной или нескольким частям (которые могут определять конформационный эпитоп) белка, которые специфически распознаются и связываются антителом или его частью (Fab', Fab2', и т.д.) или рецептором, презентируемым на клеточной поверхности В- или Т-лимфоцитов, и которые способны, при указанном связывании, индуцировать иммунный ответ.
Термин «антиген», используемый в настоящей заявке, означает структуру макромолекулы, содержащую один или несколько гаптенов, и/или содержащую один или несколько Т-клеточных эпитопов. Как правило, указанная макромолекула является белком или пептидом (с полисахаридами или без них), или изготовлена из белковой композиции и содержит один или несколько эпитопов; указанная макромолекула в настоящей заявке может альтернативно обозначаться как «антигенный белок» или «антигенный пептид».
Термин «эпитоп Т-клеток» или «Т-клеточный эпитоп» в контексте настоящего изобретения означает доминантный, суб-доминантный или минорный Т-клеточный эпитоп, т.е. часть антигенного белка, которая специфически распознается и связывается рецептором на клеточной поверхности Т-лимфоцита. Является ли эпитоп доминантным, суб-доминантным или минорным, зависит от иммунной реакции, проявляемой против эпитопа. Доминантность зависит от частоты, при которой такие эпитопы распознаются Т-клетками и способны активировать их, среди всех возможных Т-клеточных эпитопов белка. В частности, Т-клеточный эпитоп является эпитопом, связывающимся молекулами главного комплекса гистосовместимости (МНС) I класса или II класса.
Термин «эпитоп NKT-клеток» относится к части антигенного белка, которая специфически распознается и связывается рецептором на клеточной поверхности Т-лимфоцита. В частности, эпитоп NKT-клетки является эпитопом, связываемым CD1d молекулами.
Термин «CD4+ клетки-эффекторы» относится к CD4-позитивной подгруппе Т-клеток, чья функция состоит в обеспечении помощи другим клеткам, например, таким как В-клетки. Эти клетки-эффекторы обычно обозначаются как Th-клетки (для Т-хелперных клеток), с различными подгруппами, такими как Th0, Th1, Th2 и Th17 клетки.
Термин «NKT-клетки» относится к клеткам системы врожденного иммунитета, характеризующимися тем, что они распознают эпитопы, представленные CD1d молекулой. В контексте настоящего изобретения NKT-клетки могут принадлежать либо к подгруппе 1 типа (инвариантной) (iNKT), либо к любой другой подгруппе, которая может быть активирована путем презентации пептидных эпитопов CD1d. Термин «NKT-клетки» также включает NKT-клетки, принадлежащие к CD4 или CD8 линии. NKT-клетки часто несут такие рецепторы, как NK1.1 и NKG2D.
Термин «молекула CD1d» означает не относящуюся к МНС молекулу, состоящую из 3 альфа-цепей и антипараллельного набора бета-цепей, расположенных в глубокой гидрофобной борозде, открытой на обеих сторонах и способной к презентации липидов, гликолипидов или гидрофобных пептидов NKT-клеткам.
Термин «иммунные нарушения» или «иммунные заболевания» относится к заболеваниям, в которых реакция иммунной системы ответственна или поддерживает нарушение функции или нефизиологическое состояние организма. Иммунные нарушения в контексте настоящего изобретения означают патологию, индуцированную инфекционными агентами, и нарушения противоопухолевого иммунитета.
Термин «аллофактор» или «аллоантиген» относится к белку, пептиду или фактору (т.е. любой молекуле), проявляющей полиморфизм при сравнении двух индивидуумов одного и того же вида, и в целом, любой белок, пептид или фактор, индуцирующий (аллореактивный) иммунный ответ у субъекта, получающего аллофактор. Следовательно, аллофакторы также включают генетически модифицированные белки, используемые для питания.
Подробное описание изобретения
Настоящее изобретение обеспечивает молекулы фактора VIII для профилактики у субъекта иммунного ответа на молекулы указанного фактора VIII.
Фактор VIII имеет зрелую последовательность, состоящую из 2332 аминокислот с доменной структурой А1-а1-А2-а2-В-а3-А3-С1-С2, в которой A1, А2, В, A3, C1 и С2 представляют домены, и a1, а2 и а3 представляют кислотные участки, связывающие указанные домены. При протеолитическом процессинге, который происходит после секреции, фактор VIII присутствует в плазме в главной форме, состоящей из вариабельной длины А1-а1-А2-а2-В (длины, обусловленной длиной В домена), нековалентно связанной с легкими цепями, состоящими из А3-С1-С2.
Фактор VIII ускоряет активацию фактора X посредством фактора IX на подходящей фосфолипидной поверхности, таким образом, амплифицируя процесс коагуляции. Активная форма фактора VIII построена из гетеротримера, состоящего из A1-a1, А2-а2 и А3-С1-С2.
В частности, изобретение обеспечивает способы предотвращения экспансии и функциональной активности NKT-клеток. Такие клетки обычно классифицируются на различные подгруппы, а именно тип 1 для NKT-клеток, несущих инвариантную TCR альфа-цепь (Vальфа14 у мыши, Vальфа24 у людей), или тип 2 NKT-клеток, которые присутствуют с различным спектром альфа-цепи, и считается специфичными для сульфатидов. Однако недавние доказательства позволили предположить, что имеются альтернативные подгруппы NKT-клеток, которые не относятся к категории 1 типа или 2 типа. Целью настоящего изобретения является включение этих необычных NKT-клеток, которые могут нести либо CD4, либо CD8 корецептор. При презентации антигена, связанного с CD1d, NKT-клетки быстро активируются и секретируют ряд цитокинов, считающихся детерминантами для влияния на другие клетки как системы врожденного иммунитета, так и системы приобретенного иммунитета. В некоторых случаях указанные активированные NKT-клетки приобретают или повышают цитотоксические свойства.
В контексте настоящего изобретения мы сделали неожиданное наблюдение, что пептиды могут быть презентированы CD1d молекулой. Характеристикой CD1d молекулы является то, что она состоит из двух антипараллельных альфа-цепей, образующих щель на вершине платформы, состоящей из двух антипараллельных бета-цепей. Щель является узкой и глубокой, и принимает только гидрофобные остатки, классически считающиеся только липидами. Щель может принимать последовательность из 7 аминокислот, характеризующуюся как гидрофобный остаток в положениях (Ρ) 1 и 7, и алифатический остаток в Р4. Р1 является облигатным гидрофобным остатком, таким как F, W, H или Y. Однако Р7 является допустимым, и может содержать альтернативные остатки, с тем условием, что они являются неполярными. Остатки в Р4 предпочтительно являются алифатическими, но это необязательно. Таким образом, общей последовательностью для CD1d мотива связывания является [FWTHY]-X2X3-[ILMV]-X5X6-[FWTHY]. Однако специалисту в данной области техники необходимо понять, что мотив является симметричным, и что Р7 может рассматриваться как P1, а Р1 может рассматриваться как Р7. Общая последовательность мотива связывания CD1d обеспечивается в настоящей заявке в виде общего указания, без какого-либо ограничения.
Настоящее изобретение относится к получению молекул фактора VIII и к его способам, где указанные молекулы содержат мотив(ы) связывания CD1d, который придает им способность к активации NKT-клеток, и который модифицирован путем удаления и/или замены гидрофобных остатков в Р1 и/или Р7 не-гидрофобным остатком, с тем условием, что F в положении 309 не замещен S, а H в положении 317 не замещен А; и/или добавления не-гидрофобного остатка в положении Р1 и/или Р7, факультативно, с заменой или делецией алифатических остатков в Р4, или любой их комбинации, что приводит к потере или значительному снижению способности пептидов или полипептидов к связыванию с CD1d, и таким образом, приводит к потере или значительному снижению способности указанных пептидов или полипептидов к активации NKT-клеток.
Таким образом, настоящее изобретение относится к молекуле фактора VIII с доменной структурой А1-а1-А2-а2-В-а3-А3-С1-С2, в которой A1, А2, В, A3, C1 и С2 представляют домены, a a1, а2 и а3 представляют кислотные участки, связывающие указанные домены указанной молекулы фактора VIII, обладающей сниженной способностью к активации NKT клеток, где указанные молекулы фактора VIII получают путем:
a) идентификации по меньшей мере одного эпитопа NKT-клеток, где указанный эпитоп содержит гидрофобные аминокислотные остатки в положении Р1 и/или Р7;
b) модификации указанного эпитопа(ов) путем элиминации по меньшей мере одного гидрофобного аминокислотного остатка в положении Р1 и/или Р7, замены по меньшей мере одного гидрофобного аминокислотного остатка в положении Р1 и/или Р7 негидрофобным остатком, или добавления не-гидрофобного остатка в положении Р1 и/или Р7.
Настоящее изобретение также относится к способам получения молекулы фактора VIII со сниженной способностью к активации NKT-клеток, включающим этапы:
a) идентификации по меньшей мере одного эпитопа NKT-клетки, где указанный эпитоп содержит гидрофобные аминокислотные остатки в положении Р1 и/или Р7;
b) модификации указанного эпитопа(ов) путем элиминации по меньшей мере одного гидрофобного аминокислотного остатка в положении Р1 и/или Р7, замены по меньшей мере одного гидрофобного аминокислотного остатка в положении Р1 и/или Р7 негидрофобным остатком, или добавления не-гидрофобного остатка в положении Р1 и/или Р7.
В более конкретном варианте осуществления F, W, Τ, Η или Y в положениях Р1 и/или Р7 замещены не-гидрофобным аминокислотным остатком, или, факультативно, I, L, M или V в положении Р4 замещены не-алифатическим остатком, или любой их комбинацией.
В еще одном частном варианте осуществления гидрофобные остатки, расположенные в положениях Р1 и/или Р7, или факультативно, алифатические остатки, расположенные в Р4, или любая их комбинация, замещены по меньшей мере одной неприродной аминокислотой, отличающейся от неприродных F, W, Τ, H, Y, или неароматическим органическим соединением.
В другом частном варианте осуществления добавлена по меньшей мере одна аминокислота в CD1d мотив связывания, в любом участке в P1-Р7 последовательности, разрушающая мотив, предотвращая его способность к связыванию с CD1d, и таким образом, его способность к активации NKT-клеток.
В предпочтительном варианте осуществления неприродные аминокислоты являются D-аминокислотами.
Настоящее изобретение также относится к молекулам фактора VIII, содержащим мотив(ы) связывания CD1d, придающий им способность к активации NKT клеток, и которые модифицированы путем элиминации по меньшей мере одного гидрофобного аминокислотного остатка в положении Р1 и/или Р7, замены по меньшей мере одного гидрофобного аминокислотного остатка в положении Р1 и/или Р7 не-гидрофобным остатком, или добавления не-гидрофобного остатка в положении Р1 и/или Р7, и дополнительно, путем делеции алифатических остатков в Р4, или любой их комбинации, что приводит к потере или значительному уменьшению способности пептидов или полипептидов к связыванию с CD1d, и таким образом, к потере или значительному снижению способности указанных пептидов к активации NKT клеток.
При применении у субъекта такие молекулы фактора VIII не загружаются на CD1d, и таким образом, предотвращается активация NKT-клеток.
В другом аспекте настоящее изобретение также охватывает применение молекул фактора VIII, включающих по меньшей мере одну замену или делецию F, W, Τ, H или Y в положениях Р1 или Р7, для предотвращения у субъекта иммунного ответа против фактора VIII.
В еще одном аспекте изобретение охватывает применение молекул фактора VIII, включающих по меньшей мере одну замену или делецию F, W, Τ, H или Y в положениях Р1 или Р7, для предотвращения у субъекта активации NKT-клеток против фактора VIII.
В еще одном аспекте изобретение также охватывает применение молекул фактора VIII, включающих по меньшей мере одну замену или делецию F, W, Τ, H или Y в положениях Р1 или Р7, в производстве медикамента для предотвращения у субъекта иммунного ответа против фактора VIII.
Число мотивов связывания CD1d, присутствующих в пептиде или полипептиде, очень ограничено. Примеры таких пептидов или полипептидов приведены ниже для фактора VIII. Как правило, в полипептиде присутствует от одного до пяти из этих мотивов.
Дополнительным преимуществом настоящего изобретения является то, что CD1d молекула представляет очень ограниченную степень полиморфизма. Таким образом, для специалиста в данной области техники очевидно, что одни и те же аминокислотные замены, добавления или делеции в соответствии с настоящим изобретением обеспечивают пептиды или полипептиды, пригодные для всех или основного большинства субъектов. Это резко отличается от пептидных или полипептидных мотивов связывания с молекулами II класса МНС, где можно описать большое число пептидов, содержащих подходящие последовательности. Это обусловлено минимальными ограничениями, налагаемыми на связываемые пептиды II класса МНС, и большим полиморфизмом молекул II класса.
Молекулы фактора VIII, которые являются объектом настоящего изобретения, идентифицируются следующим образом:
(1) факультативно, аминокислотную последовательность фактора VIII оценивают по присутствию по меньшей мере одного CD1d мотива, содержащего гидрофобный остаток в Р1 и Р7, и алифатический остаток в Р4. Общую последовательность, такую как [FWTHY]-Х2Х3-[ILMV]-Х5Х6-[FWTHΥ], можно применять для использования алгоритмов, хорошо известных в данной области техники, как указано в http://expasv.org/tools/scanprosite/. Эту общую последовательность можно рассматривать в качестве инструмента, позволяющего установить, какая последовательностей) в указанном пептиде или полипептиде содержит указанный мотив, который может вызывать активацию NKT-клеток указанным пептидом или полипептидом;
(2) способность пептида или полипептида к связыванию CD1d тестируют in vitro с применением клеточной линией, экспрессирующей CD1d молекулу. Примеры таких клеточных линий известны в данной области техники и применяются для получения примеров из настоящей заявки (например, клетки JAWS2 и U937). В предпочтительном варианте осуществления клеточная линия не презентирует молекулы II класса МНС, и трансдуцирована для гиперэкспрессии CD1d с применением вирусного вектора, содержащего последовательность ДНК из CD1d, или любыми другими средствами, известными в данной области техники, для введения гена в клетку. Способы клеточной трансдукции известны в данной области техники. Клеточную линию загружают в культуру с пептидом или полипептидом, или с синтетическим пептидом, охватывающим соответствующую последовательность. Такие синтетические пептиды легко получить путем синтеза, с применением, например, FMOC-твердофазного синтеза, хорошо известного в данной области техники. Эффективную презентацию пептида, полипептида или соответствующего синтетического пептида CD1d молекулой затем оценивают путем измерения активации NKT-клеток. Такие клетки можно получить из периферической крови, например, путем магнитной сортировки и поддержки в культуре, в присутствии таких цитокинов, как ИЛ-2, ИЛ-15 или ИЛ-7. Эти способы описаны в данной области техники (см., например, Godfrey et al, Nature reviews Immunology 2010, 11: 197-206). Активацию NKT клеток оценивают с применением таких способов, как оценка продукции цитокинов.
Альтернативно, пептиды, фактически презентируемые антиген-презентирующими клетками в CD1d молекулах, можно элюировать и разделить различными хроматографическими способами. Полное описание такой методологии можно найти в Scott et al, Immunity, 12: 711-720, 2000. Указанные пептиды затем секвенируют, чтобы установить, какие аминокислотные остатки расположены в Р1 и Р7.
Альтернативно, указанные синтетические пептиды можно загрузить на димеры, тетрамеры или полимеры CD1d молекулы для детекции NKT-клеток, специфичных для такого пептида. Одним возможным способом является применение тетрамеров с флуоресцентной меткой, и детекция с применением системы сортировки клеток, активированной флюоресценцией (FACS);
(3) аминокислотные последовательности, идентифицированные как способные к активации NKT-клеток, и факультативно, идентифицированные посредством алгоритмов, затем модифицируют путем замены или делеции. В предпочтительном варианте осуществления F, W, Τ, H или Y в положениях Р1 и/или Р7 заменяют по меньшей мере одной аминокислотой, отличающейся от F, W, Τ, H, Y. Природные аминокислоты могут быть модифицированы путем посттранскрипционных модификаций, или заменены такими химическими группами, как метальные группы. В другом предпочтительном варианте осуществления F, W, Τ, H или Y в положениях Р1 и/или Р7 замещены любой подходящей альтернативной неприродной аминокислотой. Примерами неприродных аминокислотных остатков являются D-аминокислоты. В другом предпочтительном варианте осуществления F, W, Τ, H или Y в положениях Р1 и/или Р7 замещены по меньшей мере одной аминокислотой, отличающейся от F, W, Τ, H, Y. В другом предпочтительном варианте осуществления F, W, Τ, H или Y в положении Р1 замещены по меньшей мере одной аминокислотой, отличающейся от F, W, Τ, H, Y, любой подходящей альтернативной неприродной аминокислотой, или неароматическим органическим соединением. Такую замену аминокислоты осуществляют с применением способов, хорошо известных в данной области техники. В другом предпочтительном варианте осуществления F, W, Τ, H или Y в положении Р1 удаляют. В другом варианте осуществления F, W, Τ, H или Y в положениях Р1 и Р7 удаляют. Способы получения таких делеций хорошо известны в данной области техники. В еще одном частном варианте осуществления по меньшей мере одну аминокислоту добавляют в CD1d мотив связывания, в любом участке в последовательности от Ρ1 до Р7;
(4) факультативно, может быть предпочтительно заменить гидрофобные аминокислотные остатки рядом с первым (Р1) и/или последним (Р7) положением на негидрофобные остатки. Указанные гидрофобные остатки могут быть расположены внутри фланкирующих участков эпитопа или внутри самой последовательности эпитопа в положениях (Р2) или (Р6). Положения Р-2 и Р-1, Р2 и/или Р6, Р8 и Р9, расположенные на аминоконцевой части или карбоксиконцевой части эпитопа, соответственно, предпочтительно заняты не-гидрофобными остатками, в частности, аминокислотами, отличающимися от F, W, Т, Н или Y, что дополнительно снижает аффинность эпитопа к CD1d, и таким образом, способность эпитопа к активации NKT-клеток;
(5) NKT-клетки затем тестируют на их реактивность с пептидами, модифицированными, как описано в (3). Альтернативно, белок полной длины, из которого получают пептид, можно получить модификацией последовательности, как описано в (3). Различные способы можно применять для определения того, действительно ли NKT-клетки утратили или снизили свою способность к реакции с модифицированным пептидом или белком. Эти способы известны в данной области техники. Пролиферацию NKT-клеток можно оценить путем включения радиоактивного тимидина или путем оценки концентрации цитокинов, продуцируемых в культуральную среду. Альтернативно, NKT-клетки можно оценить посредством ELISPOT с применением множества антител, направленных к цитокинам или молекулам, связанным с цитолитическими свойствами клеток, таким как гранзим В. Альтернативно, для NKT-клеток можно оценить ранние события сигналинга, такие как фосфорилирование Fyn или поверхностных маркеров активации.
В частности, анализ последовательности А1 домена фактора VIII выявил два участка, содержащих мотивы, позволяющие фактору VIII связываться с CD1d молекулой, в соответствии со способами, описанными выше. Эти 2 участка охватывают аминокислотные остатки 190-209 и 309-323, и предпочтительно, 309-316, с последовательностью:
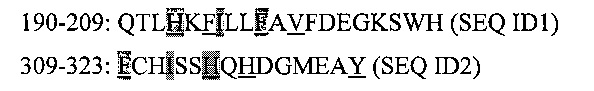
Гидрофобные аминокислотные остатки подчеркнуты, и каждая из 2 последовательностей содержит 2 мотива связывания CD1d, а именно:
H193-F199
F195-V201 (Р7 является допустимым, и может содержать валин)
F309-H315
H317-Y323
В соответствии с настоящим изобретением, предусмотрены медикаменты для лечения заболеваний, где необходимо применение фактора VIII, таких как врожденный или приобретенный дефицит фактора VIII, и заболеваний, при которых благоприятно применение фактора VIII, таких как нарушения свертывания, связанные с острым расходом фактора VIII, как наблюдается при септическом шоке, множественных травмах и остром фибринолизе, или при неконтролируемом кровотечении, связанном с кровоизлиянием в мозг.
Медикамент из настоящего изобретения. как правило, но не обязательно, является (фармацевтической) рецептурой, содержащей в качестве активного ингредиента по меньшей мере одну из молекул фактора VIII из настоящего изобретения, или вектор для генной терапии, способный к экспрессии указанных молекул фактора VIII. Помимо активного ингредиента(ов), такая рецептура будет содержать по меньшей мере один из (фармацевтически пригодных) разбавителей.
Как правило, применение молекул фактор VIII из настоящего изобретения предотвращает активацию системы врожденного иммунитета, в частности, активацию NKT-клеток, в частности, продукцию цитокинов, связанную с активацией NKT-клеток.
Идентификация эпитопа NKT-клетки в контексте настоящего изобретения известна специалистам в данной области техники. Например, пептидные последовательности, выделенные из молекулы фактора VIII, тестируют, например, с помощью методик клеточной биологии NKT, чтобы определить, действительно ли пептидные последовательности способны вызывать ответ NKT-клеток. Те пептидные последовательности, которые, как было установлено, вызывают ответ NKT-клеток, определяют как обладающие стимулирующей активностью в отношении NKT-клеток. Стимулирующую активность в отношении NKT-клеток человека можно дополнительно тестировать путем культивирования NKT-клеток, полученных от индивидуума, сенсибилизированного к фактору VIII, и определения того, происходит ли пролиферация NKT-клеток в ответ на определяемый пептид/эпитоп, например, по поглощению клетками меченого тритием тимидина. Показатели стимуляции NKT-клеток пептидами/эпитопами можно рассчитать в виде максимума имп./мин в ответ на пептид/эпитоп, деленного на контрольный показатель имп./мин. Индекс стимуляции NKT-клеток (S.I.), равный и превышающий более чем в два раза фоновый уровень, считается «положительным». Положительные результаты применяют для расчета среднего индекса стимуляции для каждого пептида/эпитопа для группы тестированных пептидов/эпитопов. Иммуногенный пептид, имеющий индекс стимуляции NKT-клеток, больший или равный 2, считается пригодным в качестве кандидата для замены или делеции гидрофобных аминокислотных остатков, как описано в настоящем изобретении.
Пептид или полипептид из настоящего изобретения считается обладающим сниженной способностью к активации NKT клеток, если индекс S.I. меньше двойного значения фонового уровня, или если уровни цитокинов, продуцируемых при стимуляции, составляют менее 50% от продуцируемых при стимуляции натуральным пептидом или полипептидной последовательностью, или если уровни цитолитических агентов, таких как гранзим В, снижаются по меньшей мере в два раза, по сравнению со стимуляцией пептидами или полипептидами с натуральной последовательностью.
Растворимые молекулы CD1d получают и делают тетрамерными путем синтеза и/или химического соединения. Молекулу CD1d очищают путем аффинной хроматографии. Растворимые молекулы CD1d инкубируют с референсным пептидом, меченым биотином, полученным в соответствии с его сильной аффинностью связывания с указанной молекулой CD1d. Пептиды, оцениваемые на связывание с CD1d, затем инкубируют при различных концентрациях, и рассчитывают их способность к замене референсного пептида из участка связывания CD1d, путем добавления нейтравидина. Способы можно найти, например, в Texier et al., ((2000) J. Immunology 164, 3177-3184), для пептидов, представленных детерминантами II класса МНС, но способы можно легко применить к CD1d-рестриктированным эпитопам NKT клеток.
Если две или более аминокислотные последовательности, которые разделяют область перекрывания в нативном пептиде или полипептидной последовательности будут признаны, как обладающие стимулирующей активностью в отношении NKT-клеток человека, по результатам определения с помощью методик Т-клеточной биологии можно проводить мутацию или делению аминокислотных остатков для остатков, относящихся к одной или обеим из этих последовательностей.
Способ применения молекул фактора VIII из настоящего изобретения может варьировать в соответствии с изобретением. Примерами является внутривенное или подкожное применение фактора VIII, но настоящее изобретение также охватывает альтернативные пути введения, такие как интраназальный, пероральный, сублингвальный, чрескожный или внутримышечный.
Молекулы фактора VIII могут быть получены с применением способов, известных в данной области техники для получения рекомбинантных белков с применением таких систем экспрессии, как бактериальные клетки, дрожжевые клетки, клетки насекомых, растительные клетки или клетки млекопитающих.
Молекулы фактора VIII из настоящего изобретения могут быть получены путем рекомбинантной экспрессии, например, в бактериальных клетках (например, Escherichia coli), дрожжевых клетках (например, видов Pichia, видов Hansenula, видов Saccharomyces или Schizosaccharomyces), клетках насекомых (например, из Spodoptera frugiperda или Trichoplusia ni), клетках растений или млекопитающих (например, СНО, COS клетках). Такая конструкция требует подходящих векторов экспрессии (включая дополнительную информацию, такую как промотерные и терминирующие последовательности), включая при этом стандартные методики рекомбинантной ДНК. Рекомбинантные молекулы фактора VIII из настоящего изобретения можно получить из большего белка-предшественника, например, путем ферментативного расщепления участков расщепления ферментов, вставленных рядом с N- и/или С-концами пептида, с последующей подходящей очисткой.
Настоящее изобретение также относится к последовательностям нуклеиновых кислот, кодирующим молекулы фактора из настоящего изобретения, и способам их применения, например, для рекомбинантной экспрессии или генной терапии. В частности, указанные последовательности нуклеиновых кислот способны к экспрессии молекул фактора N- из настоящего изобретения.
При генной терапии рекомбинантные молекулы нуклеиновых кислот, кодирующие молекулы фактора VIII из настоящего изобретения, можно применять в качестве чистой ДНК, или в липосомах или других липидных системах для доставки к клеткам-мишеням. Другие способы прямого переноса плазмидной ДНК в клетки хорошо известны в данной области техники для применения в генной терапии у человека, и включают таргетинг ДНК к рецепторам на клетках путем комплексообразования плазмидной ДНК с белками. В самой простой форме, перенос генов можно проводить путем простого введения минимальных количеств ДНК в ядро клетки, посредством микроинъекции. Когда рекомбинантные гены вводят в клетку, они могут распознаваться обычными клеточными механизмами для транскрипции и трансляции, и экспрессируется продукт гена. Были испробованы другие способы для введения ДНК в большое число клеток. Эти способы включают: трансфекцию, где ДНК осаждают фосфатом кальция и вводят в клетки путем пиноцитоза; электропорацию, где клетки подвергают воздействию импульсов большого напряжения для индукции отверстий в мембране; липофекцию/слияние липосом, где ДНК пакуют в липосомные пузырьки, которые объединяют с клеткой-мишенью; и бомбардировку частицами с применением ДНК, связанной с малыми частицами. Другим способом введения ДНК в клетки является связывание ДНК с химически модифицированным белками. Аденовирусные белки способны к дестабилизации эндосом и повышению ввода ДНК в клетки. Смешивание аденовируса с растворами, содержащими комплексы ДНК, или связывание ДНК с полилизином, ковалентно присоединенным к аденовирусу с применением агентов для поперечной сшивки белка, существенно улучшает поглощение и экспрессию рекомбинантного гена. Аденоассоциированные вирусные векторы можно также применять для доставки гена. Как применяется в настоящей заявке, «перенос гена» означает процесс ведения чужеродной молекулы нуклеиновой кислоты в клетку, обычно применяемый для обеспечения экспрессии конкретного продукта, кодируемого геном. Указанный продукт может включать белок, полипептид, антисмысловую ДНК или РНК, или ферментативно активную РНК. Перенос генов можно проводить в культивируемых клетках или путем прямого введения млекопитающим. В другом варианте осуществления обеспечивается вектор, включающий последовательность молекулы нуклеиновой кислоты, кодирующей молекулу фактора VIII в соответствии с настоящим изобретением. В частных вариантах осуществления генерируют такой вектор, чтобы последовательность молекулы нуклеиновой кислоты экспрессировалась только в специфической ткани. Способы достижения тканеспецифической экспрессии гена хорошо известны в данной области техники, например, путем помещения последовательности, кодирующей молекулу фактора VIII из настоящего изобретения, под контроль промотора, который направляет экспрессию указанной молекулы специфически в одной или нескольких тканей или органов. Векторы экспрессии, полученные из таких вирусов, как ретровирусы, вирус коровьей оспы, аденовирус, адено-ассоциированный вирус, вирусы герпеса, РНК вирусы или вирус бычьей папилломы, можно применять для доставки нуклеотидных последовательностей (например, кДНК), кодирующих пептиды, их гомологи или производные, в соответствии с настоящим изобретением в целевых тканях или популяции клеток. Способы, хорошо известные специалистам в данной области техники, можно применять для конструирования рекомбинантных вирусных векторов, содержащих указанные кодирующие последовательности. Альтернативно, сконструированные клетки, содержащие молекулу нуклеиновой кислоты, кодирующую пептид или полипептид в соответствии с настоящим изобретением, можно применять в генной терапии.
Фактор VIII из настоящего изобретения можно модифицировать посредством способов, известных в данной области техники.
Молекулы фактора VIII могут охватывать полную аминокислотную последовательность фактора VIII или только ее части. Одним примером являются молекулы фактора VIII с удаленным В доменом. Домен В является несущественным для функции фактора VIII, и таким образом, может быть удален без влияния на функцию фактора VIII. Домены а2 и а3 обычно связаны аминокислотной последовательностью, которая может быть искусственной, или может представлять последовательности из самого домена В. Молекулы фактора VIII могут быть модифицированы путем добавления и/или замены аминокислот, так чтобы повысить стабильность фактора VIII, например, путем снижения скорости увлечения домена А2, или путем повышения устойчивости фактора VIII к протеолитическим ферментам. Молекулы фактора VIII можно стабилизировать путем связывания с Fc-гамма частью антител, например, для повышения его оборота через FcRn рецептор. Фактор VIII можно стабилизировать путем снижения его деградации с применением полиэтиленгликольных остатков (производных ПЭГ) или альтернативной химической замены. Все эти модификации находятся в пределах объема настоящего изобретения.
В предшествующем уровне техники (Swaroop et al., The Journal of Biological Chemistry, vol. 272, pp 24121-24124, 1997; Cerullo et al., Molecular Therapy, vol. 15, pp. 2080-2087, 2007) было установлено, что мутация F309 (SEQ ID) повышает скорость продукции молекул фактора VIII клетками, трансфицированными конструкцией фактора VIII. Cerullo et al. отмечали незначительное снижение продукции ингибирующих антител у фактор-VIII-KO мышей, леченных F309, что противоречило сведениям, известным для специалистов в данной области техники, о применении такого мутанта для снижения иммуногенности фактора VIII. Далее, в указанном предшествующем уровне техники не упоминалось, что F309 может быть частью мотива связывания CD1d.
Медикамент из настоящего изобретения обычно, но не обязательно, является (фармацевтической) рецептурой, содержащей в качестве активного ингредиента по меньшей мере одну молекулу фактора VIII из настоящего изобретения, вектор для генной терапии, способный к экспрессии указанной молекулы фактора VIII. Помимо активного ингредиента(ов), такая рецептура может содержать по меньшей мере один из (фармацевтически пригодных) разбавителей. Как правило, фармацевтическим пригодные соединения можно найти, например, в Фармакопейном справочнике (например, Фармакопее США, Европейской или Международной Фармакопее). Медикамент или фармацевтическая композиция из настоящего изобретения обычно содержит (профилактически или терапевтически) эффективное количество активного ингредиента(ов), где эффективность обеспечена относительно состояния или заболевания, подлежащего профилактике или лечению.
Медикамент или фармацевтическую композицию из настоящего изобретения можно, в предпочтительном варианте осуществления, применять у нуждающегося субъекта как часть профилактического или терапевтического режима, включающего множество применений указанного медикамента или композиции. Указанное множество применений обычно осуществляют последовательно, и интервал времени между двумя применениями может варьировать и регулироваться в зависимости от природы активного ингредиента и природы состояния, подлежащего профилактике или лечению. Количество активного ингредиента, назначаемого нуждающемуся субъекту при отдельном применении, также может варьировать, и зависит от таких факторов, как физический статус субъекта (например, масса тела и возраст), и статус состояния, подлежащего профилактике или лечению, и опыт лечащего врача, медицинского работника или медсестры.
Термин «разбавители» относится, например, к физиологическим солевым растворам. Термин «фармацевтически пригодный носитель» означает любой материал или субстанцию, с которой объединен активный ингредиент для облегчения его применения или распространения в участке лечения, например, путем растворения, диспергирования или диффузии указанной композиции, и/или для облегчения его хранения, транспортировки или обработки, без нарушения эффективности. Они включают любые подходящие растворители, дисперсионные среды, оболочки, антибактериальные и противогрибковые агенты (например, фенол, сорбиновую кислоту, хлоробутанол), изотонические агенты (такие как сахара или хлорид натрия) и тому подобное. Дополнительные ингредиенты могут быть включены для контроля продолжительности действия активного ингредиента в композиции. Фармацевтически пригодный носитель может быть твердым веществом, или жидкостью, или газом, сжатым до получения жидкости; т.е. композиции из настоящего изобретения можно применять в качестве концентратов, эмульсий, растворов, гранул, присыпок, спреев, аэрозолей, суспензий, мазей, кремов, таблеток, пилюль или порошков. Подходящие фармацевтические носители для применения в указанных фармацевтических композициях и их получение хорошо известны специалистам в данной области техники, и не имеется конкретного ограничения к их выбору в настоящем изобретении. Они могут также включать добавки, такие как увлажняющие агенты, диспергирующие агенты, клейкие вещества, адгезивные средства, эмульгирующие агенты, растворители, оболочки, антибактериальные и противогрибковые агенты (например, фенол, сорбиновую кислоту, хлоробутанол), изотонические агенты (такие как сахара или хлорид натрия) и тому подобные, с тем условием, чтобы они были пригодными для фармацевтической практики, т.е. носители и добавки, не вызывающие долговременных нарушений у млекопитающих. Фармацевтические композиции из настоящего изобретения могут быть приготовлены любым известным способом, например, путем однородного смешивания, нанесения и/или измельчения активных ингредиентов, в одноэтапной или многоэтапной процедуре, с выбранным материалом носителя, и где это необходимо, с добавлением других добавок, таких как поверхностно-активные агенты. Их можно также приготовить путем микронизации, например, для получения в виде микросфер, обычно имеющих диаметр примерно от 1 до 10 мкм, а именно для получения микрокапсул для контролируемого или отсроченного высвобождения активных ингредиентов.
Рецептуры могут быть предпочтительно представлены в виде лекарственной формы, и могут быть приготовлены путем любого из способов, хорошо известных в области фармацевтики.
Следующие примеры приведены для иллюстрации изобретения. Однако настоящее изобретение не ограничивается такими примерами.
Пример 1
Связывание пептида из SEQ ID1 с тетрамерами CD1d
Пептид из SEQ ID1 получали путем химического синтеза. Этот пептид применяли для загрузки тетрамеров CD1d (ProImmune) путем инкубации в течение ночи.
NKT-клетки готовили из селезенки интактной мыши путем истощения всех CD4(-) с помощью магнитных бусин.
CD4+ клетки инкубировали с CD1d тетрамерами, загруженными пептидом из SEQ ID1 (Р28 WT на Фигуре 1), что соответствовало аминокислотной последовательности 190-209.
На Фигуре 1 показано, что было выявлено ±1% CD4+ Т-клеток. Далее, пептид из SEQ ID1 разделяли на 2 части и получали синтетические пептиды, охватывающие последовательность (SEQ ID3, Р28 А на Фигуре 1) и 200-210 (SEQ ID4, Р28 В на Фигуре 1).
Последовательность пептида из SEQ ID3:
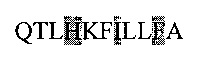
Последовательность пептида из SEQ ID4: AVFDEGKSWHS (соответствует аминокислотной последовательности 200-210).
Фигура показывает, что основной мотив связывания CD1d расположен в SEQ ID3, и ограничен, хотя значительный процент NKT-клеток выявляли с помощью пептида из SEQ ID4.
Таким образом, было сделано заключение, что основной мотив связывания CD1d расположен в пептиде из SEQ ID3.
Пример 2
Активация NKT-клеток путем иммунизации с JAWS2 клетками, загруженными пептидом из SEQ ID1
JAWS2 клетки экспрессируют CD1d, но не детерминанты II класса МНС. Эти клетки использовали, чтобы показать, что презентация пептида из SEQ ID1 может осуществляться через CD1d.
JAWS2 клетки инкубировали в течение 2 часов при 37°С с пептидом из SEQ ID1 (10 мкг/мл), и тщательно промывали дважды. Затем клетки обрабатывали митомицином, чтобы блокировать деление клеток, и отмывали 4 раза для удаления митомицина. Суспензию клеток, содержащую 2×106 клеток в физиологическом растворе с сывороткой, вводили интраперитонеально каждой особи из групп из трех интактных фактор-VIII-KO мышей. В качестве контроля 3 интактным фактор-VIII-KO мышам вводили такое же количество JAWS2 клеток, которые не инкубировали с пептидом из SEQ ID1.
Спустя пять суток после интраперитонеального введения мышей умерщвляли и выделяли селезенку, как указано выше, с применением магнитных бусин для элиминации всех CD4(-) клеток.
CD4+ клетки инкубировали с тетрамерами, загруженными пептидом из SEQ ID1.
Фигура 2 показывает, что значительная часть NKT-клеток (8%), присутствующих в природном репертуаре, являются специфичными для пептида из SEQ ID1, и что эта доля удваивается (16%), когда пептид из SEQ ID1 презентируется JAWS2 клетками.
Специфичность детекции NKT-клеток показана по отсутствию детекции NKT с незагруженными тетрамерами, а также когда тетрамеры загружены пептидом, не связанным с пептидом из SEQ ID1.
Таким образом, можно сделать вывод, что презентация пептида из SEQ ID1 происходит посредством CD1d презентации, и что эта презентация достаточна для связывания и активации NKT-клеток.
Пример 3
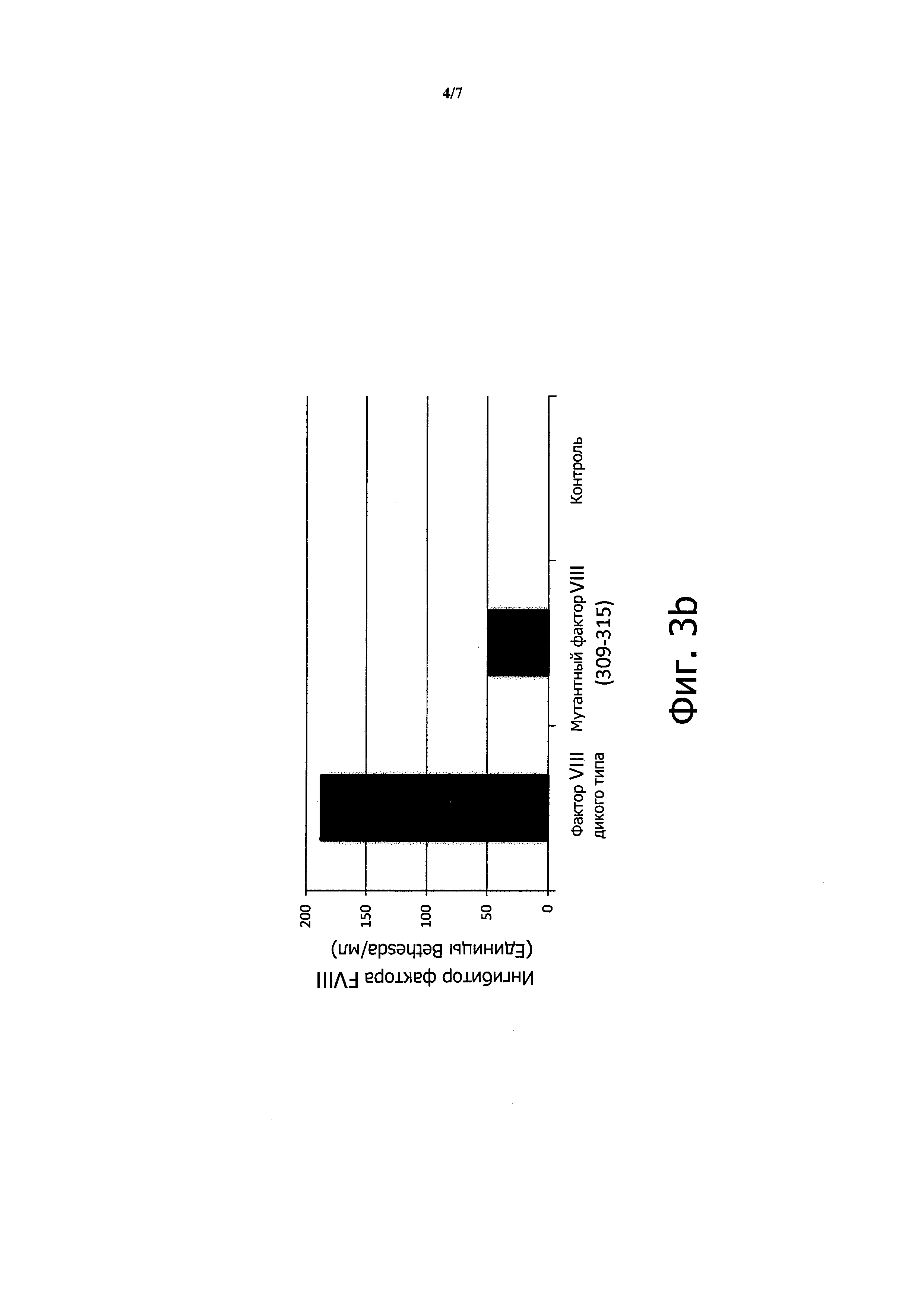
Применение мутантного фактора VIII снижает образование антител к фактору VIII
Чтобы определить, действительно ли мутация, направленная на устранение мотива связывания CD1d в факторе VIII, может снижать концентрацию антител к фактору VIII, дикий или мутантный фактор VIII клонировали в плазмиду pGC5AM-EN. Мутации в положениях F309 и Н315, каждый раз в аланине, вводили в последовательность фактора VIII с применением ПЦР и методики сращивания генов перекрывающимися расширениями (SOE-PCR).
Плазмиды, содержащие нативную или мутантную последовательность, проверяли путем секвенирования и готовили с помощью Maxiprep.
Плазмиды (100 мкг в 2 мл) вводили непосредственно интактным фактор-VIII-KO C57BL/6 мышам (3 мыши на группу) с применением способа гидродинамического давления (инъекции, сделанной менее чем за 7 секунд), известного в данной области техники для введения плазмид непосредственно в печень. Контрольным мышам проводили инъекцию тем же самым способом, но с применением чистых плазмид (n=3).
Всего делали 3 инъекции с интервалом 10 суток.
Спустя 10 суток после последней инъекции измеряли концентрации антител к фактору VIII и концентрацию антител, ингибирующих функцию фактора VIII, с помощью ИФА и хромогенного анализа, соответственно.
На Фигуре 3а показано 3,6-кратное снижение антител, наблюдаемое у мышей при инъекции мутантного фактора VIII F309A-H315A. На Фигуре 3b показано 3,8-кратное снижение антител, ингибирующих функцию фактора VIII.
Эти данные показывают, что удаление единственного мотива связывания CD1d в молекуле фактора VIII является достаточным для существенного снижения концентрации специфических антител, включая ингибирование функции фактора VIII.
Пример 4
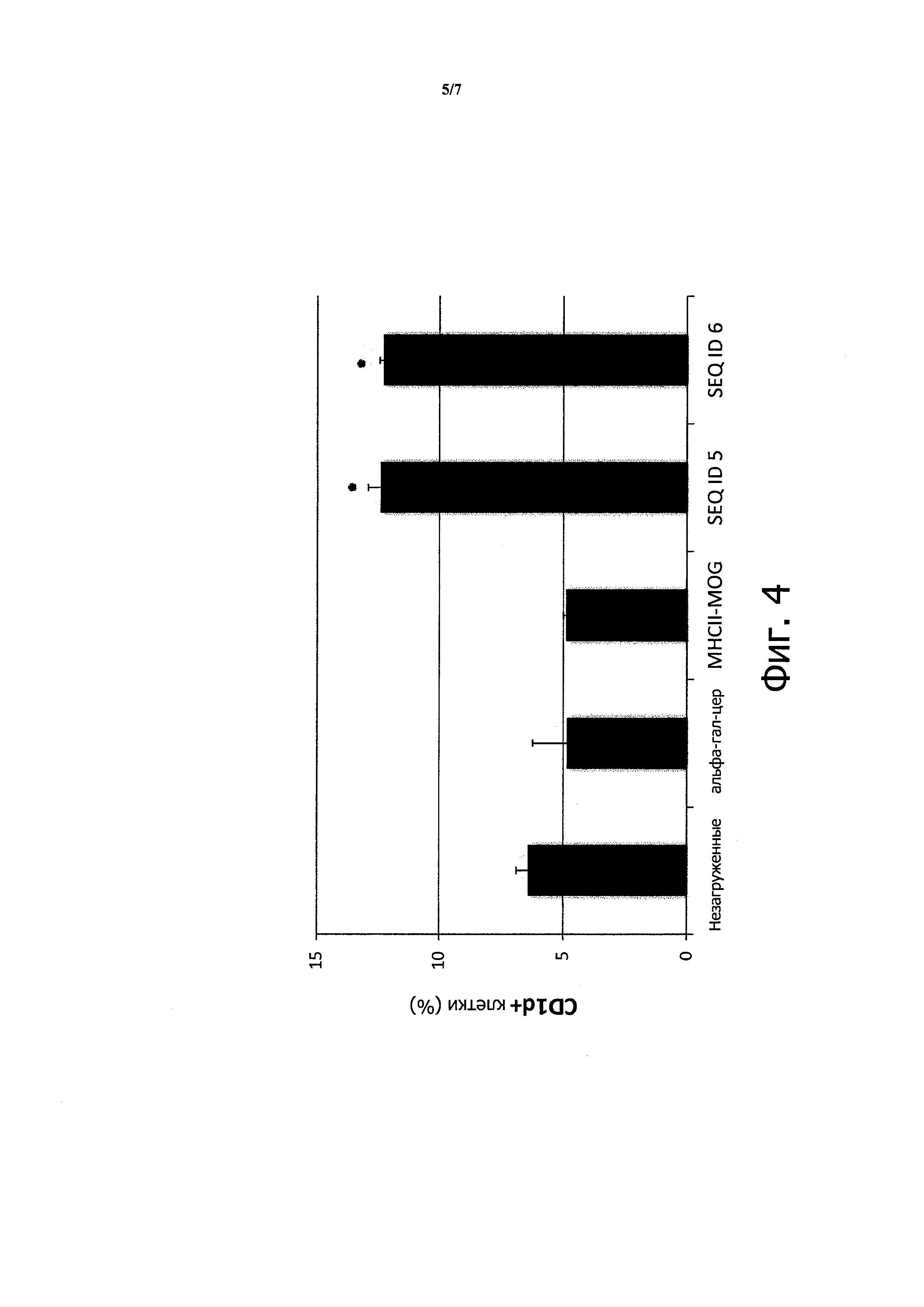
Повышение экспрессии CD1d в человеческих антиген-презентируюших клетках при инкубации с пептидом, содержащим мотив связывания CD1d
Чтобы определить, действительно ли человеческие антиген-презентирующие клетки обладают способностью к обработке и презентации пептидного эпитопа в контексте молекулы CD1d, использовали линию макрофагов человека U937. Такие клетки не экспрессируют комплексы II класса МНС, и применяются для оценки презентации CD1d.
Процент покоящихся U937 клеток, экспрессирующих CD1d, является низким по результатам детекции специфическими анти-CD1d антителами. Полагали, что если U937 клетки инкубировать с пептидом, имеющим мотив последовательности, позволяющий связываться с CD1d, их можно будет выявить по повышению экспрессии CD1d на поверхности клеток. Как наблюдалось для пептидов, охватывающих эпитопы II класса МНС, связывание пептида стабилизирует конформацию молекулы (II класса, или CD1d в данном случае), позволяя прикреплять комплекс на клеточной поверхности и снижая его внутриклеточный рециклинг.
U937 клетки (7×105 клеток) инкубировали в течение 24 часов при 37°С с 5 мкг пептида, охватывающего мотивы связывания CD1d, или контролями. Затем клетки отмывали и инкубировали с антителами, специфичными к CD1d, несущими флуоресцентную метку, и оценивали число положительных клеток с применением FACS системы.
На Фигуре 4 показано, что процент клеток, экспрессирующих CD1d, возрастает от 6% в контрольных экспериментах до 13%, когда применяли пептиды, содержащие последовательности, связывающие CD1d. Данные, показанные на гистограмме, являются средними значениями по результатам трех измерений, а звездочкой отмечены результаты, достоверно превышающие контрольные значения (р<0,05).
Контроли включают (слева направо) незагруженные U937; клетки, инкубированные с альфа-гал-церамидом и обычным эпитопом, рестриктированным II классом (MHCII-MOG). Эксперимент включает последовательности фактора VIII человека (ID SEQ5) или мыши (ID SEQ 6), соответствующие аминокислотам 188-204 последовательности фактора VIII.
Таким образом, было сделано заключение, что человеческие антиген-презентирующие клетки стабилизируют комплексы пептидов и CD1d на их поверхности при инкубации с указанными пептидами.
Пример 5
Мононуклеарные клетки периферической крови человека (МКПК) содержат NKT-клетки, специфичные для пептидных эпитопов связывания CD1d
Чтобы установить, действительно ли человеческие МКПК содержат клетки, реагирующие с CD1d-связывающим пептидным эпитопом, инвариантные NKT (iNKT) клетки готовили из лейкоцитарной пленки с применением магнитных бусин, покрытых антителами, специфичными к Vaльфa24-Jaльфa18 цепи Т-клеточного рецептора (так называемой инвариантной цепи).
Указанные человеческие iNKT клетки (105/образец) затем инкубировали с U937 клетками, обработанными митомицином С (отношение 1:1), загруженными 5 мкг либо пептида, охватывающего аминокислотные остатки 188-204 человеческого фактора VIII (ID SEQ 5), либо контрольного пептида (MHCII-MOG). Инкубацию проводили в течение 2 недель при 37°С в среде RPMI, содержащей 10% эмбриональной телячьей сыворотки и 50 Ед/мл человеческого рекомбинантного ИЛ-2.
Культуральные пластины оценивали визуально на присутствие скоплений клеток. Отмечались скопления клеток U937, загруженных пептидом из ID SEQ 5 до той же степени, что и альфа-гал-церамидом, но не контрольным пептидом (MHCII-MOG). На Фигуре 5 показано среднее значение по подсчету в трех полях наблюдения под микроскопом (минимум 10 клеток/скопление).
Таким образом, можно сделать вывод, что клетки периферической крови человека содержат клетки, определенные как NKT-клетки с инвариантной цепью, реагирующие с пептидом, представленным CD1d.
Пример 6
Фланкирующие остатки, расположенные вне щели связывания CD1d, важны для эффективной презентации на клеточной поверхности
Эксперимент, показанный в Примере 1, указывает, что пептид из SEQ ID 3, соответствующий аминокислотам 190-200 человеческого фактора VIII, связывается с CD1d тетрамерами и обеспечивает детекцию NKT-клеток, указывая, что эта последовательность содержит минимальный мотив связывания для CD1d.
Чтобы определить, действительно ли этот мотив является достаточным для эффективной презентации клетками, эксперимент, приведенный в примере 4, повторяли с пептидом из SEQ ID 3.
На фигуре 6 показано, что пептид из SEQ ГО 3 не повышает экспрессию CD1d на поверхности клеток U937, в отличие от пептидов из SEQ ID 5, показанных на Фигуре 4.
Таким образом, можно заключить, что эффективная загрузка in vivo пептида, содержащего мотив связывания CD1d, требует присутствия фланкирующих остатков, расположенных вне CD1d щели.
Пример 7
NKT-клетки, специфичные для CD1d-связываюшего эпитопа фактора VIII, принадлежат как к CD4+, так и к CD8+ популяциям
Для определения клеточной популяции, к которой относятся NKT-клетки, проводили эксперимент, как описано в Примере 2. Таким образом, JAWS2 клетки загружали пептидом из SEQ ID 3, фактором VIII с удаленным доменом, альфа-гал-церамидом, или оставляли незагруженными перед интраперитонеальной инъекцией (ИП) фактор-VIII-KO мышам (2×106 клеток на мышь). Спустя пять суток после интраперитонеальной инъекции мышей умерщвляли, и готовили спленоциты. Проводили реакцию клеточных суспензий с CD1d тетрамерами, незагруженными или загруженными пептидом из SEQ ID3 или альфа-гал-церамидом.
Для FACCS анализа клетки, связывающие CD1d тетрамеры, метили DX5- и CD160-специфичными антителами и анти-CD4 или анти-CD8 антителами. В таблице приведены результаты.

Эти эксперименты показали, что:
- природный репертуар NKT-клеток содержит значительное число клеток, реагирующих с пептидом из SEQ ID3, как CD4+, так и CD8+ линий (строка 3);
- эта популяция клеток может быть дополнительно увеличена путем иммунизации пептидом из SEQ ID3, как в CD4+, так и в CD8+ линиях (строка 6);
- иммунизация фактором VIII является еще более эффективной для увеличения этих клеточных популяций (строка 9);
- иммунизация альфа-гал-церамидом слегка повышает число CD4+ Т-клеток, специфичных для пептида из SEQ ID3, но не число CD8+ Т-клеток;
- взятые вместе, эти результаты показывают, что иммунизация фактором VIII вызывает размножение клеток, принадлежащих к NKT линии, как CD4+, так и CD8+ фенотипа.
Последовательности
ID1 QTLHKFILLFAVFDEGKSWH (человеческая 190-209)
ID2 FCHISSHQHDGMEAY (человеческая 309-323)
ID3 QTLHKFILLFA (человеческая 190-200)
ID4 AVFDEGKSWHS (человеческая 200-210)
ID5 KTQTLHKFILLFAVFDE (человеческая 188-204)
ID6 RTQMLYQFVLLFAVFDE (мышиная 188-204)
Реферат
Настоящее изобретение относится к области биотехнологии и может быть использовано для получения модифицированных молекул фактора VIII со сниженной иммуногенностью. Способ включает: (a) идентификацию по меньшей мере одного эпитопа NKT-клеток, где мотивом указанного эпитопа NKT клетки является [FWTHY]-XX-[ILMV]-XX-[FWTHY], где по меньшей мере один эпитоп NKT клетки находится в SEQ ID NO: 1 и (b) модификацию указанного эпитопа(ов) путем замены по меньшей мере одного гидрофобного аминокислотного остатка в положении Р1 и Р7 на одну аминокислоту, отличную от F, W, Т, Н, Y. Изобретение позволяет получить активную молекулу фактора VIII, которая обладает сниженной способностью к активации NKT клеток за счет сниженного связывания с молекулой CD1d. 3 н. и 3 з.п. ф-лы, 6 ил., 1 табл., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Сайт-направленная модификация fviii

Комментарии