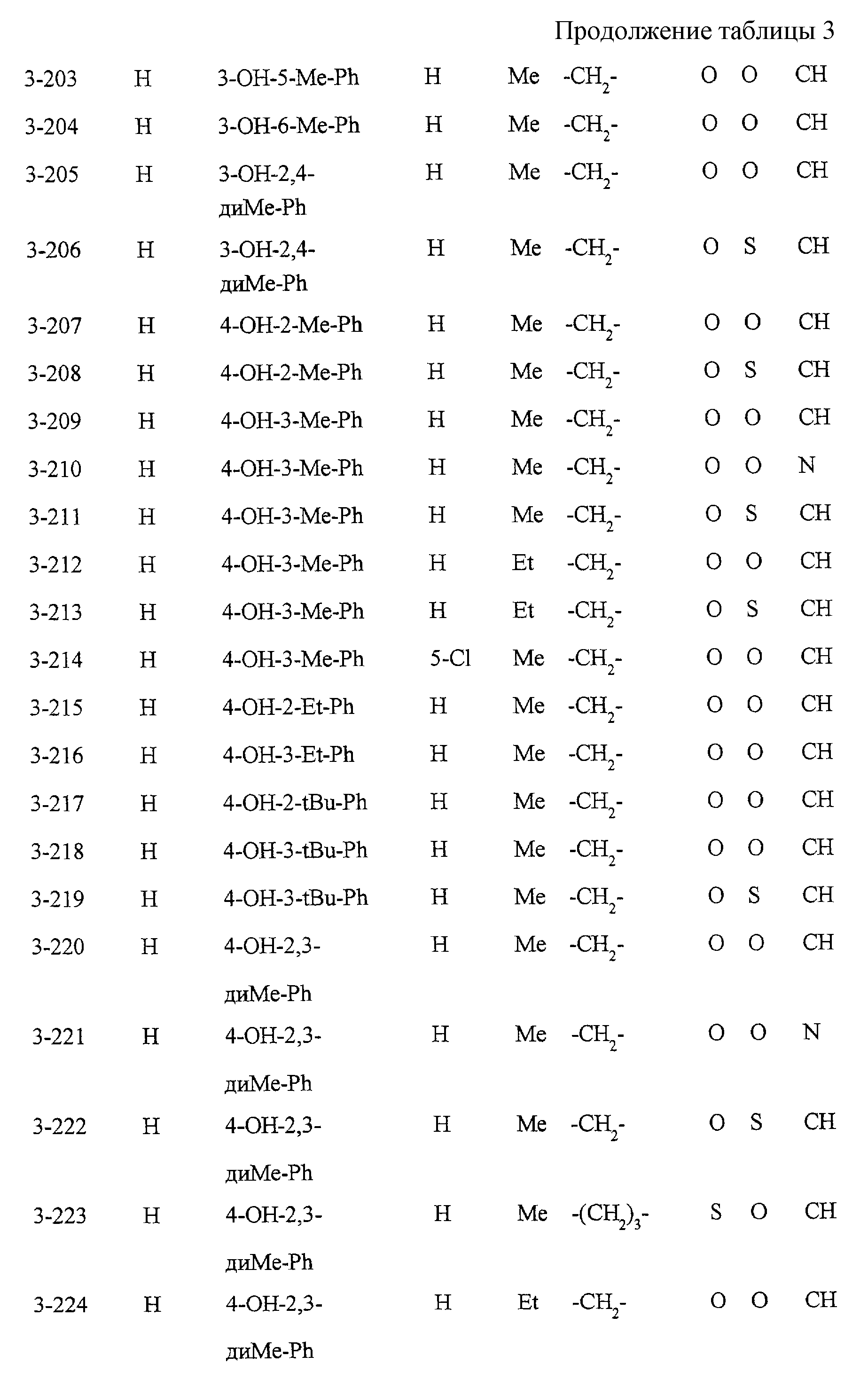
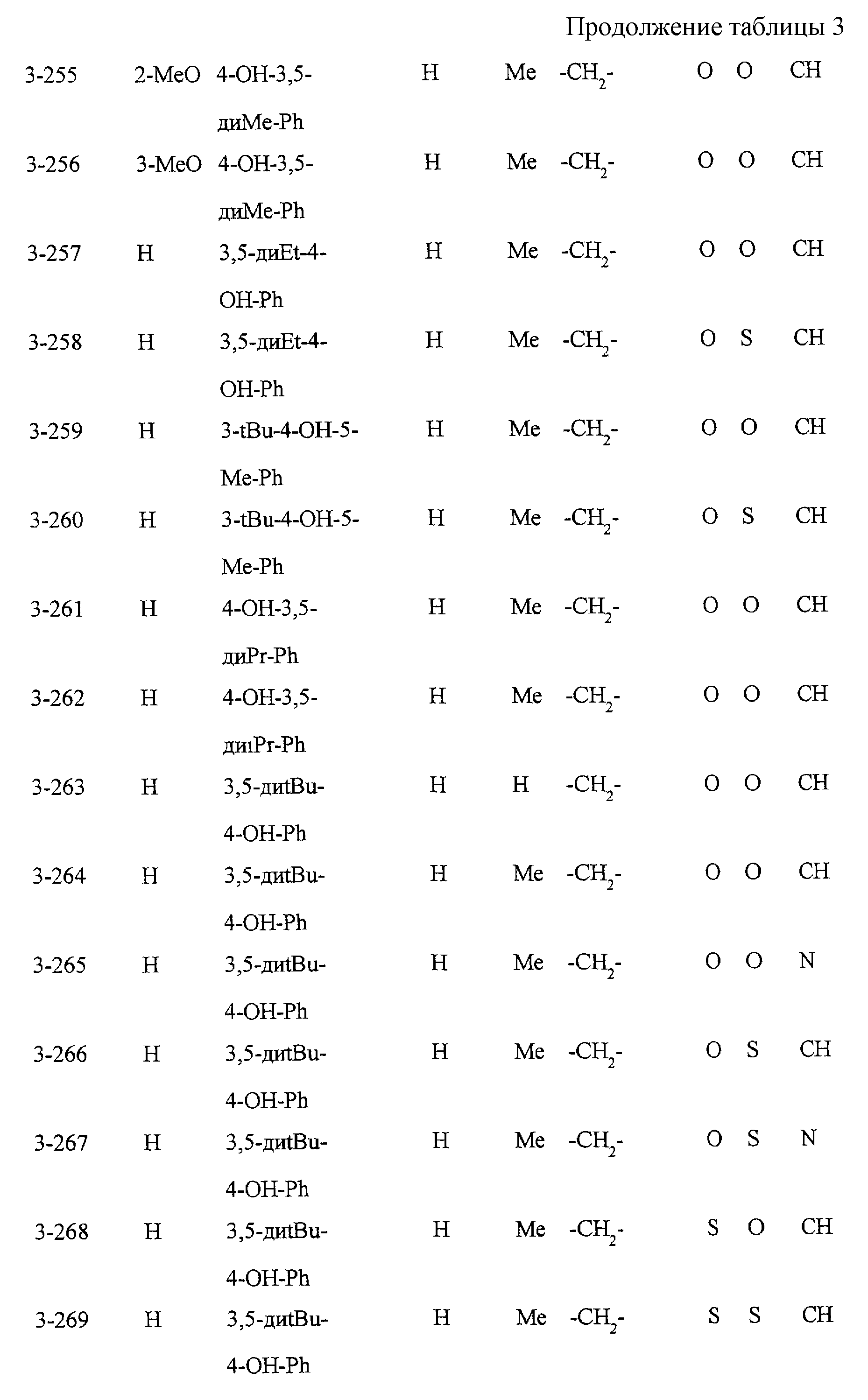
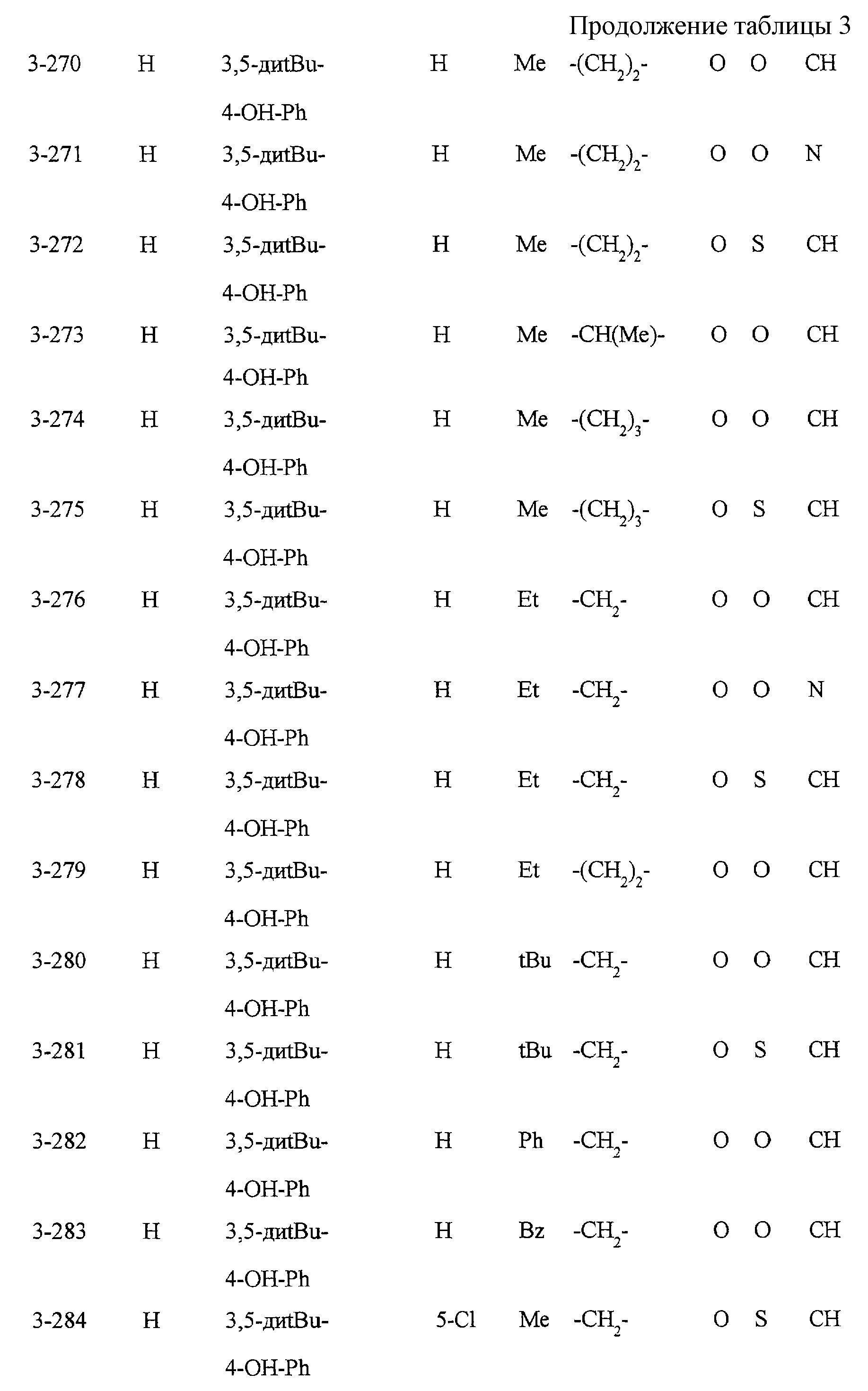
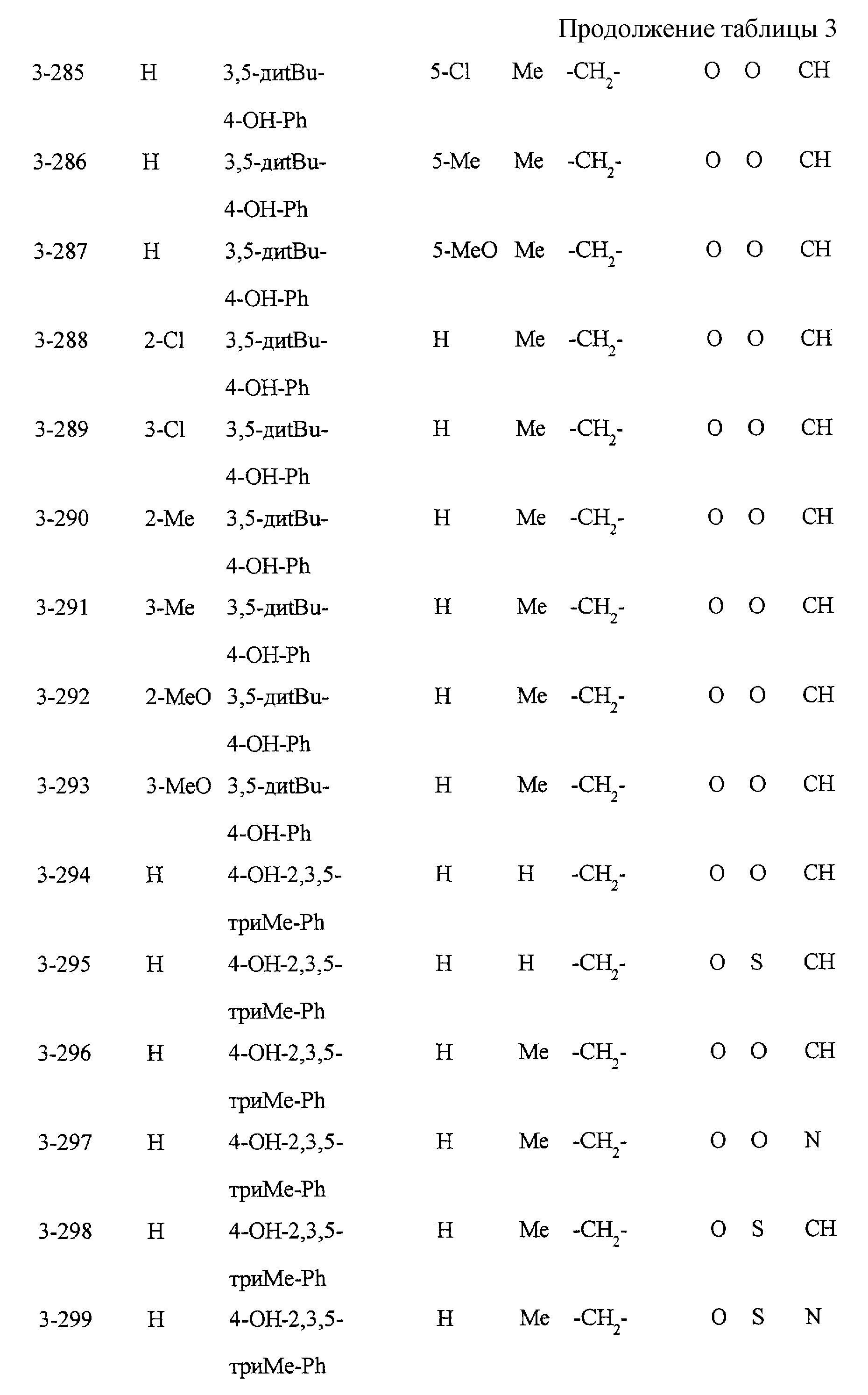
Замещенное конденсированное гетероциклическое соединение, способ фармакологического воздействия, способ ингибирования 5-липоксигеназы, ингибирования продукции липидных пероксидов или снижения уровня сахара в крови - RU2196141C2
Код документа: RU2196141C2
Чертежи






































































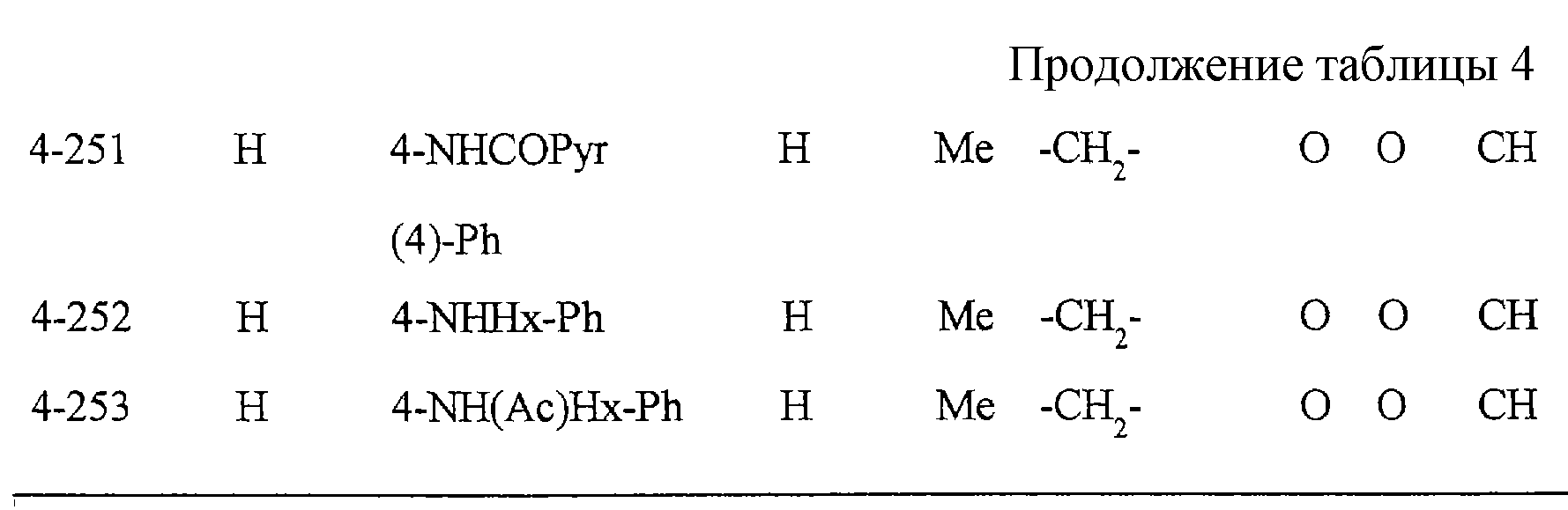









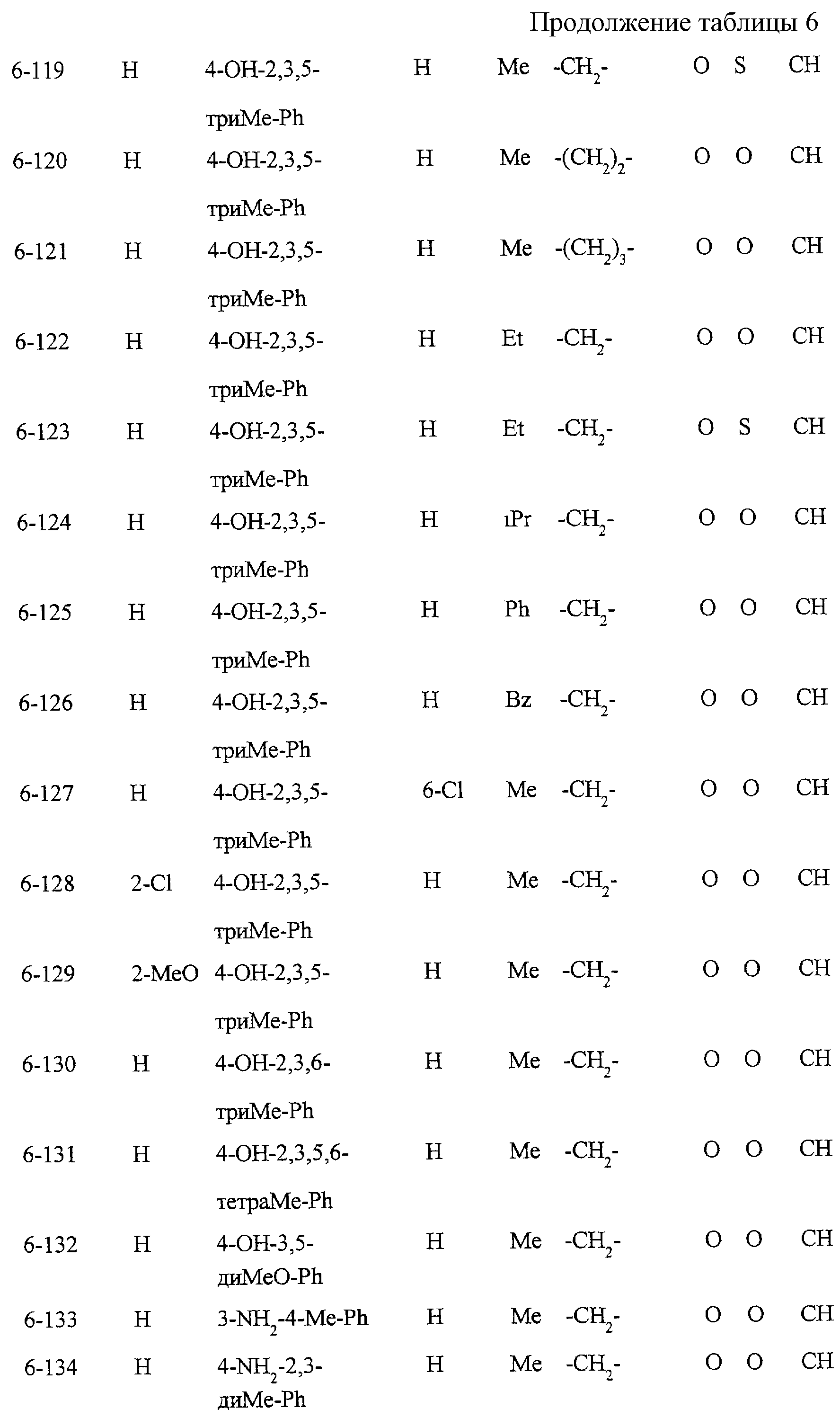
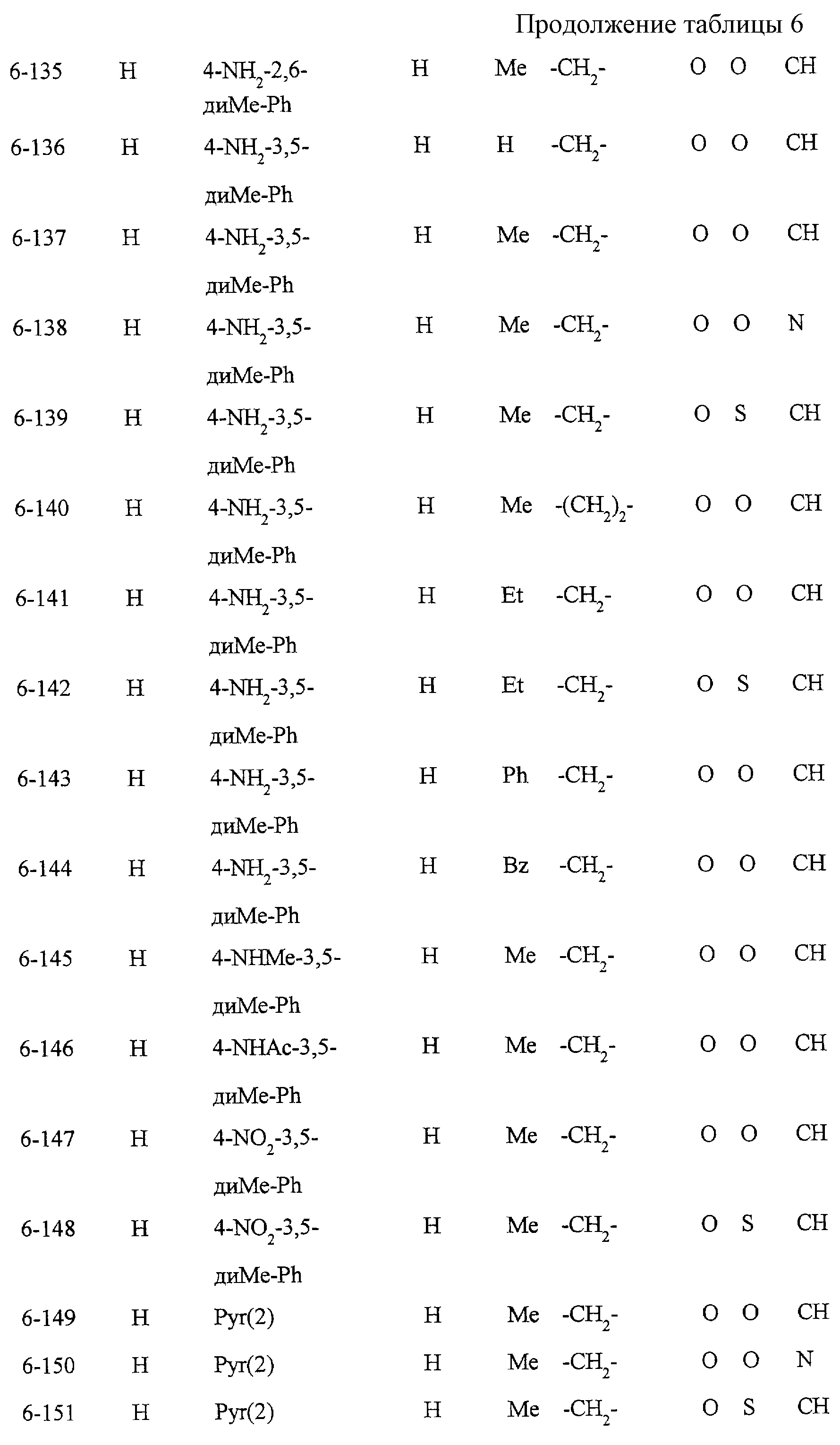
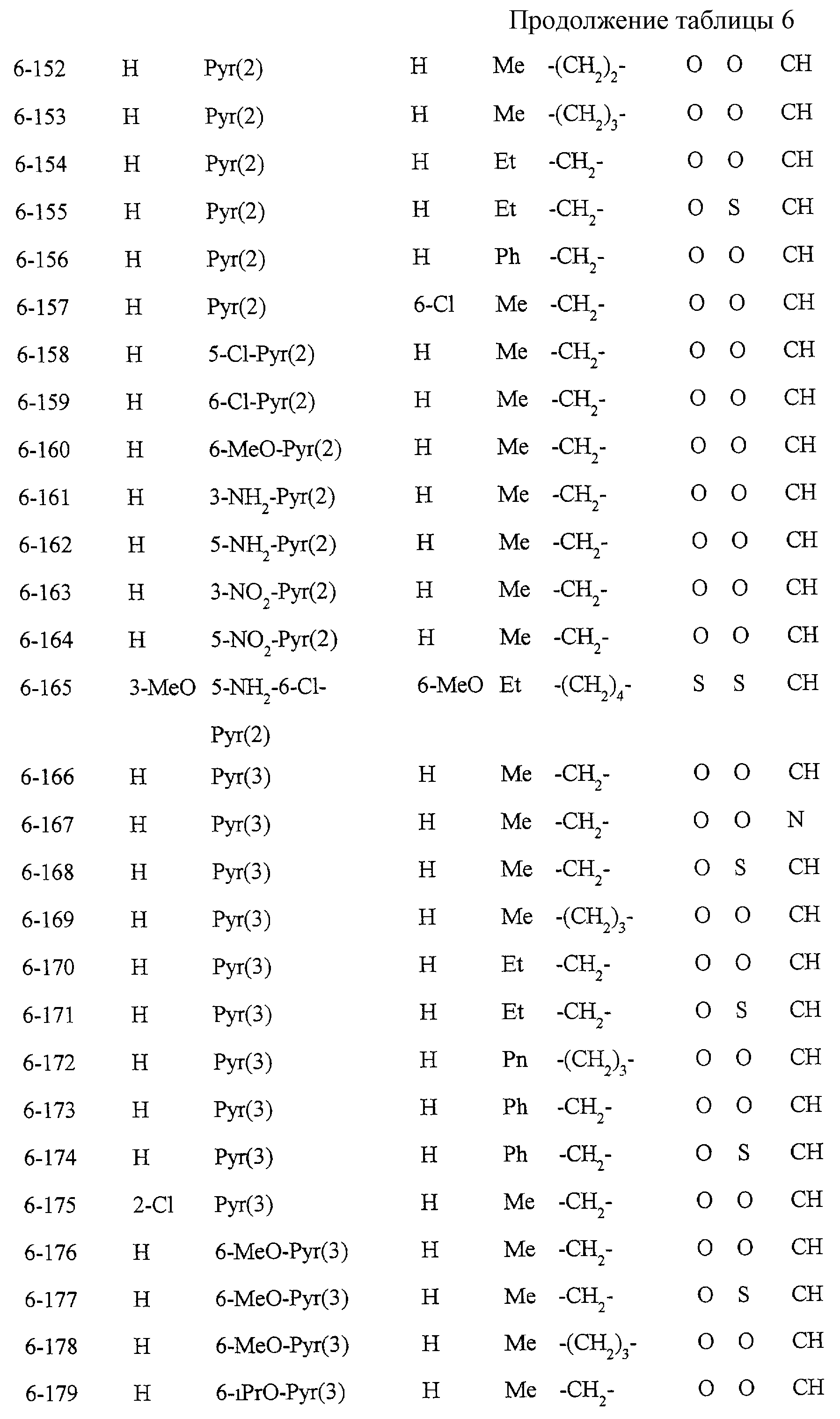
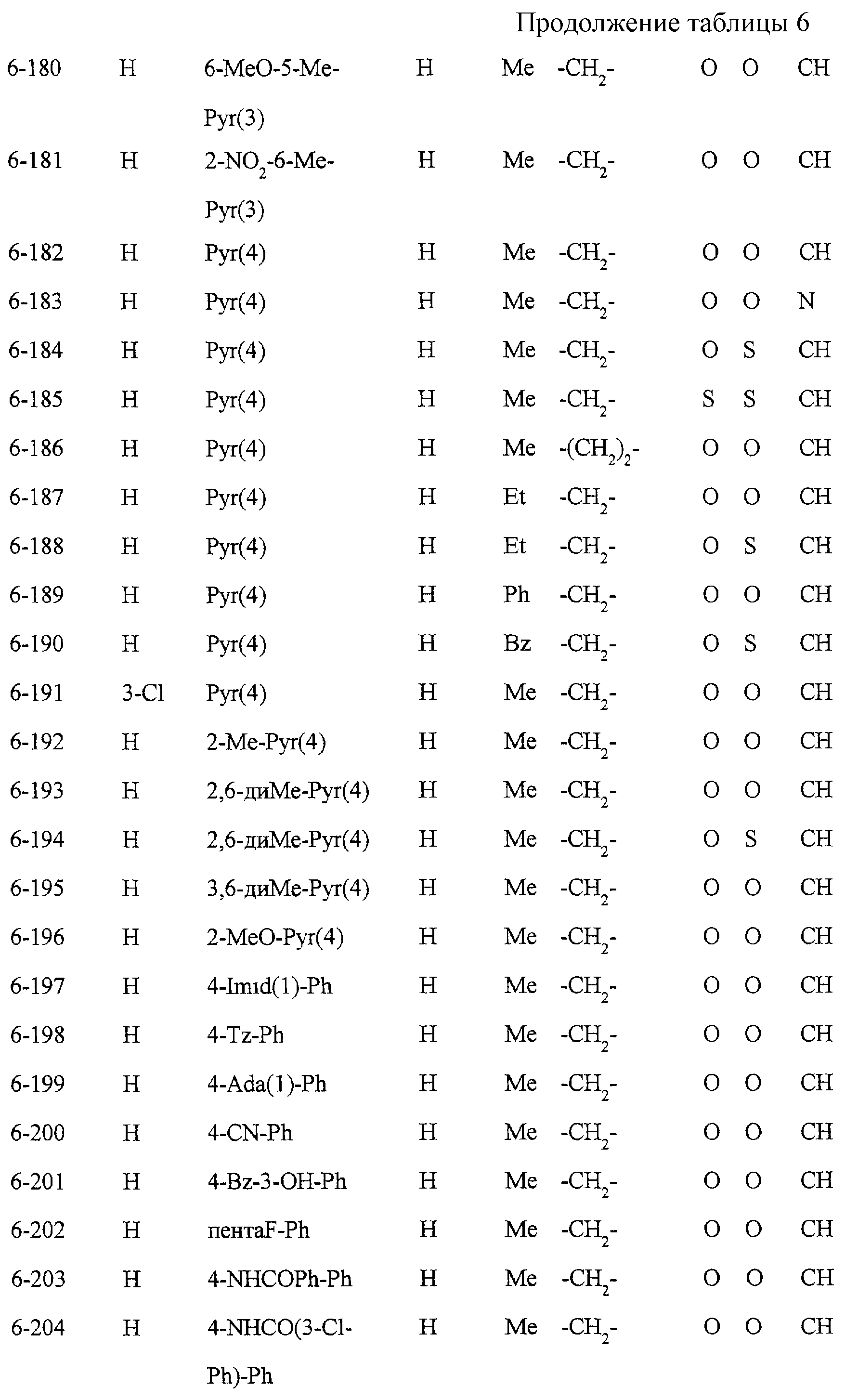



























Описание
Изобретение относится к замещенному конденсированному гетероциклическому соединению или его фармацевтически приемлемой соли, обладающим превосходным повышающим инсулиновую резистентность действием, противовоспалительным действием, иммунно-модулирующим действием, альдегидроредуктаза-ингибирующим действием, 5-липоксигеназа-ингибирующим действием, действием, ингибирующим продуцирование липидного пероксида, активирующим действием в отношении пероксисомного пролиферирующего активированного рецептора (который далее будет сокращаться как "PPAR"), антиостеопорозным действием, антагонизмом к лейкотриенам, действием, промотирующим образование жировых клеток, действием, ингибирующим пролиферацию раковых клеток и кальциевым антагонизмом; к фармацевтической композиции, содержащей в качестве эффективного ингредиента вышеуказанное замещенное конденсированное гетероциклическое соединение или его фармакологически приемлемую соль; к применению вышеуказанного замещенного конденсированного гетероциклического соединения или его фармакологически приемлемой соли для получения фармацевтической композиции; к способу профилактики или лечения диабета или подобных заболеваний, который включает введение эффективного количества вышеуказанного замещенного конденсированного гетероциклического соединения или его фармакологически приемлемой соли теплокровному животному; или к фармацевтической композиции, получаемой с использованием, в сочетании, вышеуказанного замещенного конденсированного гетероциклического соединения или его фармакологически приемлемой соли и, по крайней мере, одного соединения, выбранного из ингибиторов α-глюкозидазы, ингибиторов альдегидроредуктазы, препаратов бигуанида, статиновых основных соединений, ингибиторов синтеза сквалена, фибратных основных соединений, промоторов катаболизма LDL и ингибиторов ангиотензин-конвертирующего фермента.
[Предпосылки создания изобретения]
Сообщалось, что тиазолидиновые соединения, оксазолидиновые соединения и
тому подобные могут использоваться в качестве профилактических агентов и/или лекарственных средств при различных заболеваниях, таких как диабет и гиперлипидемия (повышенное содержание жира в
крови).
Например, ряд тиазолидиновых соединений, обладающих гипогликемическим действием, описан в Chem. Pharm. Bull., 30, 3580-3600 (1982), Prog. Clin. Biol. Res., 265, 177-192 (1988), Diabetes, 37(11), 1549-1558 (1988), Arzneim. - Forsch., 40(1), 37-42 (1990), ЕР0441605А и тому подобное.
Действие тиазолидиновых соединений в отношении гиперлипидемии описано в Diabetes, 40(12), 1669-1674 (1991), Am. J. Physiol., 267 (1 Pt 1), Е95-Е101 (1994), Diabetes, 43(10), 1203-1210 (1994) и тому подобное.
Действие тиазолидиновых соединений в отношении недостаточности толерантности к глюкозе и инсулиновой резистентности описано в Arzneim-Forsch., 40 (2 Pt 1), 156-162 (1990), Metabolism, 40(10), 1025-1230 (1991), Diabetes, 43(2), 204-211 91994) и тому подобное.
Недавно в N. Engl. J. Med., 331(18), 1226-1227 (1994) сообщалось, что обычный человек, обладающий инсулиновой резистентностью, заболевает диабетом без недостаточности толерантности к глюкозе, а также, что лекарственное средство для повышения инсулиновой резистентности может использоваться в качестве профилактического агента на начальной стадии диабета у такого нормального человека.
Действие тиазолидиновых соединений на гипертензию описано в Metabolism, 42(1), 75-80 (1993), Am. J. Physiol., 265 (4 Pt 2), R726-R732 (1933), Diabetes, 43(2), 204-211 (1994) и тому подобное.
Действие тиазолидиновых соединений на заболевания коронарной артерии описано в Am. J. Physiol., 265 (4 Pt 2), R726-R732 (1933), Hypertension, 24(2), 170-175 (1994) и тому подобное.
Действие тиазолидиновых соединений на артериосклероз описано в Am. J. Physiol., 265 (4 Pt 2), R726-R732 (1933) и тому подобное.
Действие тиазолидиновых соединений на кахексию (резкое истощение) описано в Endocrinology, 135(5), 2279-2282 (1994), Endocrinology, 136(4), 1474-1481 (1995) и тому подобное.
Из тиазолидиновых соединений, обладающих гипогликемическим действием, соединения, содержащие гетероциклическую группу, описаны в W092/07839A, W092/07850A и ЕР00745600А.
Кроме того, производные оксазолидин-2,4-диона, обладающие гипогликемическим действием, описаны в W092/02520A и тому подобное.
В W092/03425A описано, что соединения, содержащие 3, 5-диоксооксадиазолидин-2-илметилфенильную или N-гидроксиуреидо-группу, обладают гипогликемическим действием.
В ЕР00676398А 5-{4-[5-(3, 5-ди-трет-бутил-4-гидроксифенилтио)-3-метил-3Н-имидазо[4,5-b] пиридин-2-илметокси] бензил} тиазолидин-2,4-дион описан только в качестве одного из иллюстративных соединений.
[Описание
изобретения]
В результате многолетнего исследования по синтезу ряда замещенных конденсированных гетероциклических соединений и их фармакологической активности авторы настоящего изобретения
установили, что замещенное конденсированное гетероциклическое соединение, имеющее новую структуру, обладает превосходным действием, повышающим инсулиновую резистентность, противовоспалительным
действием, иммунно-модулирующим действием, альдегидроредуктаза-ингибирующим действием, 5-липоксигеназа-ингибирующим действием, действием, ингибирующим продуцирование липидного пероксида, активирующим
действием в отношении PPAR, антиостеопорозным действием, антагонизмом к лейкотриенам, действием, промотирующим образование жировых клеток, действием, ингибирующим пролиферацию раковых клеток, и
кальциевым антагонизмом; имеет пониженные побочные действия; и, кроме того, обладает высокой растворимостью в жирах.
Другим объектом настоящего изобретения является профилактическое средство и/или лекарственное средство, которые содержат в качестве эффективного ингредиента ранее описанное замещенное конденсированное гетероциклическое соединение или его фармакологически приемлемую соль, при заболеваниях, облегчаемых вышеописанными типами действия, таких как диабет, гиперлипидемия, ожирение, нарушение толерантности к глюкозе, гипертензия, ожирение печени, диабетические осложнения (например, ретинопатия, нефропатия, невроз, катаракты и заболевания коронарной артерии и тому подобные), артериосклероз, диабет беременных, синдром поликистоза яичников, сердечно-сосудистые заболевания (например, ишемическая болезнь сердца и тому подобные), повреждения клеток (например, повреждение головного мозга, вызванное инсультом, и тому подобные), индуцированные атеросклерозом или ишемической болезнью сердца, подагра, воспалительные заболевания (например, эпифизарный остеомиелит, боль, жар, ревматоидный артрит, воспалительный энтерит, угри, солнечные ожоги, псориаз, экзема, аллергия, астма, гастроинтестинальная язва, истощение, аутоиммунные заболевания, панкреатит и тому подобные), рак, остеопороз и катаракты.
Другим объектом настоящего изобретения является фармацевтическая композиция (в частности, подходящим является профилактическое средство и/или лекарственное средство при диабете или диабетических осложнениях), получаемая с использованием, в сочетании, описанного выше замещенного конденсированного гетероциклического соединения или его фармакологически приемлемой соли и, по крайней мере, одного соединения, выбранного из ингибиторов α -глюкозидазы, ингибиторов альдегидроредуктазы, препаратов бигуанида, статиновых основных соединений, ингибиторов синтеза сквалена, фибратных основных соединений, промоторов катаболизма LDL и ингибиторов ангиотензин-конвертирующего фермента.
В настоящем изобретении замещенное конденсированное гетероциклическое соединение
представленно следующей формулой (I):
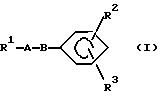
где R1 представляет группу следующей формулы:
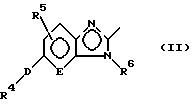
или группу следующей формулы:
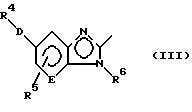
[в которых R4 представляет фенильную группу, которая замещена 1-5 заместителями, выбранными из заместителей α, или пиридильную группу, которая может быть замещена 1-4 заместителями, выбранными из заместителей α,
R5 представляет атом водорода или заместитель, выбранный из заместителей α,
R6 представляет атом водорода, C1-6 алкильную группу, С6-10 арильную группу, которая может быть замещена 1-3 заместителями, выбранными из заместителей β, или C7-16 аралкильную группу, которая может быть замещена 1-3 заместителями, выбранными из заместителей β,
D представляет атом кислорода или серы и
Е представляет СН группу или атом азота],
R2 представляет атом водорода или заместитель, выбранный из заместителей α,
R3 представляет группу со следующими формулами:
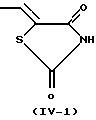
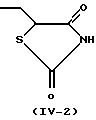

или

А представляет C1-6 алкиленовую группу и
В представляет атом кислорода или серы,
при условии, что
5-{ 4-[5-(3,5-ди-трет-бутил-4-гидроксифенилтио)- 3-метил-3Н-имидазо[4,5-b]пиридин-2-илметокси]бензил}тиазолидин-2, 4-дион исключается].
<3аместители α>
Атом галогена, гидроксильная группа, C1-6 алкильная группа, галоген (C1-6 алкильная) группа,
C1-6 алкоксигруппа, C1-6 алкилтиогруппа, аминогруппа, которая
может быть замещена заместителями, выбранными из заместителей γ, группы С3-10 циклоалкил, С6-10 арил, C7-16 аралкил, C6-10 арилокси, C7-16
аралкилокси и С6-10 арилтио, каждая из которых может быть замещена 1-3 заместителями, выбранными из
заместителей β,C1-7 алифатическая ацилоксигруппа, 4-7-членная
насыщенная азотсодержащая гетероциклическая группа, 5- или 6-членная ароматическая азотсодержащая гетероциклическая
группа, нитрогруппа и цианогруппа.
<Заместители β
>
Атом галогена, гидроксильная группа, C1-6 алкильная группа, галоген (C1-6
алкильная) группа, C1-6 алкоксигруппа, аминогруппа, которая может быть
замещена заместителями, выбранными из заместителей γ, С6-10 арильная группа и нитрогруппа.
<Заместители γ>
C1-10 алкильная
группа и С6-10 арильная и C7-16 аралкильная группы, каждая из которых может иметь заместитель,
и ацильная группа, которая может иметь заместители (указанная ацильная группа
представляет С1-7 алифатическую ацильную группу или С7-11 ароматическую ацильную, C8-12
ароматическую алифатическую ацильную, С4-11 циклоалкилкарбонильную
или 5- или 6-членную ароматическую азотсодержащую гетероциклическую карбонильную группу, каждая из которых может иметь
заместители).
В вышеуказанном описании примеры "атома галогена" в определении заместителей α и β включают атомы фтора, хлора, брома и иода, среди которых атомы фтора и хлора являются предпочтительными.
В вышеуказанном описании "C1-6 алкильная группа" в определении R6 и заместителей α, β и γ представляет линейную или разветвленную C1-6 алкильную группу. Примеры включают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную, изопентильную, 2-метилбутильную, неопентильную, 1-этилпропильную, гексильную, 4-метилпентильную, 3-метилпентильную, 2-метилпентильную, 1-метилпентильную, 3,3-диметилбутильную, 2,2-диметилбутильную, 1, 1-диметилбутильную, 1,2-диметилбутильную, 1,3-диметилбутильную, 2,3-димет илбутильную и 2-этилбутильную группы. При ссылке на R6 предпочтительной является C1-4 алкильная группа, в которой более предпочтительна C1-2 алкильная группа, и особенно предпочтительна метильная группа. При ссылке на заместители α, предпочтительными являются метильная и трет-бутильная группы, тогда как при ссылке на заместители β метильная, этильная и трет-бутильная группы являются предпочтительными.
В вышеуказанном описании "галоген(C1-6 алкильная) группа" в определении заместителей α и β представляет проиллюстрированную выше C1-6 алкильную группу, имеющую связанные с нею от одного до трех проиллюстрированных выше атомов галогена. Примеры включают трифторметильную, трихлорметильную, трибромметильную, дифторметильную, дихлорметильную, дибромметильную, фторметильную, 2,2, 2-трихлорэтильную, 2,2,2-трифторэтильную, 2-бромэтильную, 2-хлорэтильную, 2-фторэтильную, 2-иодэтильную, 3-хлорпропильную, 4-фторбутильную, 6-иодгексильную и 2,2-дибромэтильную группы, среди которых предпочтительна галоген(C1-2 алкильная) группа и особенно предпочтительна трифторметильная группа.
В вышеуказанном описании "C1-6 алкоксигруппа" в определении заместителей α и β представляет описанную ранее C1-6 алкильную группу, связанную с атомом кислорода. Примеры включают группы метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентокси, изопентокси, 2-метилбутокси, неопентокси, 1-этилпропокси, гексилокси, 4-метилпентокси, 3-метилпентокси, 2-метилпентокси, 3,3-диметилбутокси, 2, 2-диметилбутокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2, 3-диметилбутокси и 2-этилбутокси, среди которых C1-2 алкоксигруппа является предпочтительной, и особенно предпочтительна метоксигруппа.
В вышеуказанном описании "C1-6 алкилтиогруппа" в определении заместителей α и β представляет проиллюстрированную выше C1-6 алкильную группу, связанную с атомом серы. Примеры включают группы метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, пентилтио, изопентилтио, 2-метилбутилтио, неопентилтио, 1-этилпропилтио, гексилтио, 4-метилпентилтио, 3-метилпентилтио, 2-метилпентилтио, 1-метилпентилтио, 3,3-диметилбутилтио, 2, 2-диметилбутилтио, 1,1-диметилбутилтио, 1, 2-диметилбутилтио, 1,3-диметилбутилтио, 2,3-диметилбутилтио и 2-этилбутилтио, среди которых C1-2 алкилтиогруппа является предпочтительной, и особенно предпочтительна метилтиогруппа.
В вышеуказанном описании "аминогруппа, которая может быть замещена заместителем, выбранным из заместителей γ", в определении каждого из заместителей α и β означает аминогруппу, которая может быть замещена 1 или 2 заместителями, которые являются одинаковыми или различными и выбраны из заместителей γ, включающих C1-10 алкильные группы, С6-10 арильные и C7-16 аралкильные группы, каждая из которых может иметь заместители (указанные заместители означают 1-3 группы, выбранные из группы, состоящей из атомов галогена и гидроксильной, C1-6 алкильной, галоген (C1-6 алкильной), C1-6 алкокси и C1-6 алкилтио групп), и ацильные группы, которые могут иметь заместители (каждая из которых означает C1-7 алифатическую ацильную группу или С7-11 ароматическую ацильную, С8-12 ароматическую-алифатическую ацильную, С4-11 циклоалкилкарбонильную или 5- или 6-членную ароматическую азотсодержащую гетероциклическую карбонильную группу, которая может быть замещена 1-3 заместителями, выбранными из группы, состоящей из атомов галогена и гидроксильной, C1-6 алкильной, галоген (C1-6 алкильной), C1-6 алкокси и C1-6 алкилтио групп).
В вышеуказанном описании "C1-10 алкильная группа" в описании заместителей γ означает линейную или разветвленную алкильную группу, имеющую от 1 до 10 атомов углерода, и примеры включают проиллюстрированные выше C1-6 алкильные группы, гептильную, 1-метилгексильную, 2-метилгексильную, 3-метилгексильную, 4-метилгексильную, 5-метилгексильную, 1-пропилбутильную, 4,4-диметилпентильную, октильную, 1-метилгептильную, 2-метилгептильную, 3-метилгептильную, 4-метилгептильную, 5-метилгептильную, 6-метилгептильную, 1-пропилпентильную, 2-этилгексильную, 5,5-диметилгексильную, нонильную, 3-метилоксильную, 4-метилоктильную, 5-метилоктильную, 6-метилоктильную, 1-пропилгексильную, 2-этилгептильную, 6,6-диметилгептильную, децильную, 1-метилнонильную, 3-метилнонильную, 8-метилнонильную, 3-этилоктильную, 3,7-диметилоктильную и 7,7-диметилоктильную группы, среди которых предпочтительны C1-8 алкильные группы, и метильная, бутильная, изобутильная, пентильная, гексильная, гептильная и октильная группы являются особенно предпочтительными.
В вышеуказанном описании С6-10 арильная часть "С6-10 арильной группы, которая может иметь заместитель", в определении заместителей γ означает С6-10 ароматическую углеводородную группу, и примеры включают фенильную, инденильную и нафтильную группы, среди которых предпочтительны фенильные группы.
В вышеуказанном описании C7-16 аралкильная часть "C7-16 аралкильной группы, которая может иметь заместитель", в определении заместителей γ означает описанную выше С6-10 арильную группу, связанную с ранее описанной C1-6 алкильной группой, и примеры включают бензильную, нафтилметильную, инденилметильную, дифенилметильную, 1-фенетильную, 2-фенетильную, 1-нафтилэтильную, 2-нафтилэтильную, 1-фенилпропильную, 2-фенилпропильную, 3-фенилпропильную, 1-нафтилпропильную, 2-нафтилпропильную, 3-нафтилпропильную, 1-фенилбутильную, 2-фенилбутильную, 3-фенилбутильную, 4-фенилбутильную, 1-нафтилбутильную, 2-нафтилбутильную, 3-нафтилбутильную, 4-нафтилбутильную, 5-фенилпентильную, 5-нафтилпентильную, 6-фенилгексильную и 6-нафтилгексильную группы, среди которых предпочтительны бензильные группы.
В вышеуказанном описании "C1-7 алифатическая ацильная группа" в определении заместителей γ означает атом водорода или насыщенную или ненасыщенную углеводородную группу с C1-6 цепью, связанную с карбонильной группой, и примеры включают формильную, ацетильную, пропионильную, бутирильную, изобутирильную, валерильную, изовалерильную, пивалоильную, гексаноильную, акрилоильную, метакрилоильную и кротоноильную группы, среди которых предпочтительны ацетильная, пропионильная и пивалоильная группы, и особенно предпочтительны ацетильные группы.
В вышеуказанном описании С7-11 ароматическая ацильная часть "С7-11 ароматической ацильной группы, которая, может иметь заместители", в определении заместителей γ означает С6-10 арильную группу, связанную с карбонильной группой, и примеры включают бензоильную, 1-инданкарбонильную, 2-инданкарбонильную и 1- и 2-нафтоильные группы, среди которых предпочтительны бензоильная и нафтоильная группы.
В вышеуказанном описании С8-12 ароматическая-алифатическая ацильная часть "C8-12 ароматической-алифатической ацильной группы, которая может иметь заместители", в определении заместителей γ означает фенильную группу, связанную с С2-6 алифатической ацильной группой, и примеры включают фенилацетильную, 3-фенилпропионильную, 4-фенилбутирильную, 5-фенилпентаноильную и 6-фенилпентаноильную группы, среди которых фенилацетильная группа является предпочтительной.
В вышеуказанном описании С4-11 циклоалкилкарбонильная часть "C4-11 циклоалкилкарбонильной группы, которая может иметь заместители", в определении заместителей γ означает С3-10 циклоалкильную группу (которая означает 3-10-членную насыщенную циклическую углеводородную группу, которая может быть конденсированной, и примеры включают циклопропильную, циклобутильную, циклопентильную, циклогексильную, циклогептильную, норборнильную и адамантильную группы, среди которых предпочтительны С3-6 циклоалкильные группы), связанную с карбонильной группой, и примеры включают циклопропаноильную, циклобутирильную, циклопентаноильную, циклогексаноильную, циклогептилкарбонильную, норборнилкарбонильную и адамантилкарбонильную группы, среди которых предпочтительны С4-7 циклоалкилкарбонильные группы, и особенно предпочтительны циклопентаноильная и циклогексаноильная группы.
В вышеуказанном описании "5- или 6-членная ароматическая азотсодержащая гетероциклическая карбонильная часть в 5- или 6-членной ароматической азотсодержащей гетероциклической карбонильной группе, которая может иметь заместители", в определении заместителей γ означает 5- или 6-членный ароматический гетероцикл, который содержит, по крайней мере, один атом азота и в то же время может содержать дополнительные гетероатомы, выбранные из группы гетероатомов, состоящей из атома азота, атома кислорода и атома серы (примеры таких гетероциклов включают пирролильную, имидазолильную, пиразолильную, триазолильную, тетразолильную, пиридильную, пиразинильную, пиримидинильную, пиридазинильную, тиазолильную, оксазолильную, оксадиазолильную и тиадиазолильную группы), связанный с карбонильной группой, и примеры включают пирролилкарбонильную, имидазолилкарбонильную, пиразолилкарбонильную, триазолилкарбонильную, тетразолилкарбонильную, никотиноильную, изоникотиноильную, пиразинилкарбонильную, пиримидинилкарбонильную, пиридазинилкарбонильную, тиазолилкарбонильную, оксазолилкарбонильную, оксадиазолилкарбонильную и тиадиазолилкарбонильную группы, среди которых предпочтительны пиридилкарбонильные группы, и особенно предпочтительны никотиноильная и изоникотиноильная группы.
Примеры "аминогруппы, которая может быть замещена заместителями, выбранными из заместителей γ", в определении таких заместителей α или β включают амино, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, втор-бутиламино, трет-бутиламино, пентиламино, гексиламино, диметиламино, диэтиламино, N-этил-N-метиламино, дипропиламино, дибутиламино, дипентиламино, дигексиламино, фениламино, 2-, 3- или 4-фторфениламино, 2-, 3- или 4-хлорфениламино, 2-, 3- или 4-бромфениламино, 2,3-дифторфениламино, 2,4-дифторфениламино, 2,4-дихлорфениламино, 1- или 2-индениламино, 1- или 2-нафтиламино, дифениламине, бензиламино, 2-, 3- или 4-фторбензиламино, 2-, 3- или 4-хлорбензиламино, 2-, 3- или 4-бромбензиламино, 2,3-дифторбензиламино, 2, 4-дифторбензиламино, 2,4-дихлорбензиламино, 1- или 2-нафтилметиламино, 1-инденилметиламино, 1- или 2-фенетиламино, 1-, 2- или 3-фенилпропиламино, 4-фенилбутиламино, 1-фенилбутиламино, 5-фенилпентиламино, 6-фенилгексиламино, дибензиламино, формиламино, ацетиламино, пропиониламино, бутириламино, изобутириламино, валериламино, изовалериламино, пивалоиламино, гексаноиламино, акрилоиламино, метакрилоиламино, кротоноиламино, бензоиламино, 1-инданкарбониламино, 1- или 2-нафтоиламино, 2-, 3- или 4-фторбензоиламино, 2-, 3- или 4-хлорбензоиламино, 2-, 3- или 4-бромбензоиламино, 2,3-дифторбензоиламино, 2,4-дифторбензоиламино, 2,4-дихлорбензоиламино, 2,6-диизопропилбензоиламино, 4-трифторметилбензоиламино, 4-гидрокси-3,5-диметилбензоиламино, 4-гидрокси-3, 5-ди-трет-бутилбензоиламино, 1-инданкарбониламино, 1- или 2-нафтоиламино, фенилацетиламино, 3-фенилпропиониламино, 4-фенилбутириламино, 5-фенилпентаноиламино, 6-фенилгексаноиламино, 2-, 3- или 4-фторфенилацетиламино, 2-, 3- или 4-хлорфенилацетиламино, 2-, 3- или 4-бромфенилацетиламино, 2,3-дифторфенилацетиламино, 2,4-дифторфенилацетиламино, 2,4-дихлорфенилацетиламино, циклопропиониламино, циклобутириламино, циклопентаноиламино, циклогексаноиламино, пирролилкарбониламино, имидазолилкарбониламино, пиразолилкарбониламино, триазолилкарбониламино, тетразолилкарбониламино, никотиноиламино, изоникотиноиламино, пиразинилкарбониламино, пиримидинилкарбониламино, пиридазинилкарбониламино, тиазолилкарбониламино, оксазолилкарбониламино, оксадиазолилкарбониламино, тиадиазолилкарбониламино, N, N-диацетиламино, N-формил-N-гексиламино, N-ацетил-N-метиламино, N-ацетил-N-этиламино, N-ацетил-N-пропиламино, N-ацетил-N-бутиламино, N-ацетил-N-пентиламино, N-ацетил-N-гексиламино, N-бензоил-N-метиламино, N-бензоил-N-этиламино, N-бензоил-N-пропиламино, N-бeнзол-N-бутиламино, N-бензоил-N-пентиламино, N-бензоил-N-гексиламино, N-бензоил-N-фениламино, N-бензил-N-бензоиламино, N-4-трифторметилбензил-N-2,4-дифторбензоиламино, N-2,4-дифторбензил-N-никотиноиламино, N-3-xлopбензоил-N-мeтиламино, N-3-хлорбензоил-N-гексиламино, N-3-xлopбензил-N-ацетиламино, N-2, 4-дифторбензоил-N-гексиламино, N-2,4-дифторбензоил-N-фениламино, N-2,4-дифторбензоил-N-фениламино, N-4-трифторметилбензоил-N-бутиламино, N-3, 5-ди-трет-бутил-4-гидpoкcибeнзoил-N-гeкcилaминo, N-гексил-N-1-нафтоиламино, N-гексил-N-2-нафтоиламино, N-гексил-N-фенилацетиламино, N-изобутил-N-циклопентаноиламино, N-бутил-N-никотиноиламино, N-гексил-N-никотиноиламино и N-изоникотиноил-N-гексиламино группы, среди которых предпочтительны аминогруппы, замещенные одним или двумя заместителями (указанные заместители могут быть одинаковыми или различными, и каждый независимо представляет группу, выбранную из класса, состоящего и C1-10 алкильных групп и С6-10 арильных и C7-16 аралкильных групп, каждая из которых может иметь заместители) и ациламиногруппы, которые могут быть замещены заместителем, выбранным из заместителей γ (ациламиногруппа означает аминогруппу, замещенную описанной ранее ацильной группой); более предпочтительны аминогруппы, моно- или ди-C1-10 алкиламиногруппы и ациламиногруппы, каждая из которых может быть замещена C1-10 алкильной группой или C7-16 аралкильной группой, которая может иметь заместитель; еще более предпочтительны амино, моно- или ди-C1-10 алкиламиногруппы или С7-11 ароматический ациламино, С4-11 циклоалкилкарбониламино и 5- или 6-членные ароматические азотсодержащие гетероциклические карбониламиногруппы, каждая из которых может иметь заместитель; и особенно предпочтительными являются амино, диметиламино, гексиламино, ацетиламино, бензоиламино, 3-хлорбензоиламино, 2,4-дифторбензоиламино, 4-гидрокси-3,5-ди-трет-бутилбензоиламино, нафтоиламино, циклопентаноиламино, циклогексаноиламино, никотиноиламино, изоникотиноиламино, N-ацетил-N-гексиламино и адамантилкарбониламино группы.
С3-10 циклоалкильная часть "С3-10 циклоалкильной группы, которая может быть замещена 1-3 заместителями, выбранными из заместителей β", имеет такое же значение, как описано ранее. Предпочтительные примеры включают С3-10 циклоалкильные группы, каждая из которых может быть замещена одним заместителем, выбранным из заместителей β, среди которых С3-10 циклоалкильные группы, каждая из которых может быть замещена одним заместителем, выбранным из группы, включающей атомы галогена и C1-6 алкильные и галоген (C1-6 алкильные) группы; более предпочтительны группы адамантила, которые могут быть замещены одним атомом фтора, атомом хлора, гидроксильной группой, метильной группой, этильной группой, трет-бутильной группой, трифторметильной группой, метоксигруппой, аминогруппой, метиламиногруппой или диметиламиногруппой; и особенно предпочтительна группа адамантила.
В вышеуказанном описании С6-10 арильная часть "С6-10 арильной группы" для "С6-10 арильной группы, которая может быть замещена 1-3 заместителями, выбранными из заместителей β", в определениях R6 и заместителей α и таковая "С6-10 арильная группа" в определении заместителей β имеет такое же значение, как описано ранее. В качестве R6 предпочтительны фенильные группы, которые могут быть замещены 1-3 заместителями, выбранными из группы, состоящей из атомов галогена и гидроксила, C1-6 алкильной и галоген (C1-6алкильной) групп, и особенно предпочтительны фенильные группы, каждая из которых может быть замещена одним заместителем, выбранным из группы, состоящей из атомов фтора и хлора, гидроксила, метильной, этильной и трифторметильной групп. При ссылке на заместители α предпочтительными являются С6-10 арильные группы, каждая из которых может быть замещена одним заместителем, выбранным из заместителей β; более предпочтительны C6-10 арильные группы, каждая из которых может быть замещена одной аминогруппой, может быть замещена атомом галогена, гидроксильной группой, C1-6 алкильной группой, галоген (C1-6 алкильной) группой, C1-6 алкоксигруппой или заместителем, выбранным из заместителей γ; еще более предпочтительны фенильные группы, которые могут быть замещены одним атомом фтора, атомом хлора, гидроксильной группой, метильной группой, этильной группой, трет-бутильной группой, трифторметильной группой, метоксигруппой, аминогруппой, метиламиногруппой или диметиламиногруппой; и особенно предпочтительны фенильная или 4-гидроксифенильная группа. При ссылке на заместители β, предпочтительной является фенильная группа.
В вышеуказанном описании C7-16 аралкильная часть "C7-16 аралкильной группы, которая может быть замещена 1-3 заместителями, выбранными из заместителей β", в определении R6 или заместителей α имеет такое же значение, как описано ранее. При ссылке на R6 предпочтительны бензильные группы, которые могут быть замещены 1-3 заместителями, выбранными из группы, состоящей из атомов галогена и гидроксильной, C1-6 алкильной и галоген(C1-6 алкильной) групп, и особенно предпочтительны бензильные группы, которые могут быть замещены заместителем, выбранным из группы, включающей атомы фтора и атомы хлора, и гидроксильную, метильную, этильную и трифторметильную группы. Со ссылкой на заместитель α предпочтительными являются C7-16 аралкильные группы, каждая из которых может быть замещена одним заместителем, выбранным из заместителей β; более предпочтительны бензильные группы, которые могут быть замещены аминогруппой, которые могут быть замещены заместителем, выбранным из атома галогена, гидроксильной группы, C1-6 алкильной группы, галоген (C1-6 алкильной) группы, C1-6 алкоксигруппы и заместителей γ; еще более предпочтительными являются бензильные группы, которые могут быть замещены одним атомом фтора, атомом хлора, гидроксильной группой, метильной группой, этильной группой, трет-бутильной группой, трифторметильной группой, метоксигруппой, аминогруппой, метиламиногруппой или диметиламиногруппой; и особенно предпочтительны бензильные группы.
В вышеуказанном описании С6-10 арилокси часть "С6-10 арилокси группы, которая может быть замещена 1-3 заместителями, выбранными из заместителей β", означает описанную ранее С6-10 арильную группу, связанную с атомом кислорода, и примеры включают фенокси, 1-инденилокси, 2-инденилокси, 3-инденилокси, 1-нафтилокси и 2-нафтилокси группы, среди которых феноксигруппы являются предпочтительными.
В вышеуказанном описании C7-16 аралкилокси часть "С7-16 аралкилокси группы, которая может быть замещена 1-3 заместителями, выбранными из заместителей β", в определении заместителей α означает ранее описанную C7-16 аралкильную группу, связанную с атомом кислорода, и примеры включают бензилокси, нафтилметокси, инденилметокси, дифенилметокси, 1-фенетилокси, 2-фенетилокси, 1-нафтилэтокси, 2-нафтилэтокси, 1-фенилпропокси, 2-фенилпропокси, 3-фенилпропокси, 1-нафтилпропокси, 2-нафтилпропокси, 3-нафтилпропокси, 1-фенилбутокси, 2-фенилбутокси, 3-фенилбутокси, 4-фенилбутокси, 1-нафтилбутокси, 2-нафтилбутокси, 3-нафтилбутокси, 4-нафтилбутокси, 5-фенилпентилокси, 5-нафтилпентилокси, 6-фенилгексилокси и 6-нафтилгексилокси группы, среди которых предпочтительными являются бензилоксигруппы.
В вышеуказанном описании С6-10 арилтио часть "C6-10 арилтиогруппы, которая может быть замещена 1-3 заместителями, выбранными из заместителей β", означает описанную ранее С6-10 арильную группу, связанную с атомом серы, и примеры включают фенилтио, 1-инденилтио, 2-инденилтио, 3-инденилтио, 1-нафтилтио и 2-нафтилтиогруппы, среди которых предпочтительны фенилтиогруппы.
В вышеуказанном описании "C1-7 алифатическая ацилоксигруппа" в определении заместителей α представляет собой проиллюстрированную выше C1-7 алифатическую ацильную группу, связанную с атомом кислорода. Примеры включают формилокси, ацетокси, пропионилокси, бутирилокси, изобутирилокси, валерилокси, изовалерилокси, пивалоилокси, гексаноилокси, акрилоилокси, метакрилоилокси и кротоноилокси группы, среди которых предпочтительными являются ацетоксигруппы.
В вышеуказанном описании "4-7-членная насыщенная азотсодержащая гетероциклическая группа" в определении заместителей α означает 4-7-членную насыщенную азотсодержащую гетероциклическую группу, которая содержит, по крайней мере, один атом азота, и в то же самое время может дополнительно содержать гетероатомы, выбранные из группы гетероатомов, состоящей из атомов азота, кислорода и серы. Примеры включают группы азетидинила, пирролидинила, имидазолидинила, тиазолидинила, пиразолидинила, пиперидинила, морфолинила, тиоморфолинила, пиперазинила и гомопиперазинила, среди которых предпочтительны группы пирролидинила, пиперидинила и морфолинила группы, и особенно предпочтительны группы пирролидин-1-ила, пиперидин-1-ила и морфолин-4-ила.
В вышеуказанном описании "5- или 6-членная ароматическая азотсодержащая гетероциклическая группа" в определении заместителей α имеет такое же значение, как определено выше, и предпочтительными являются имидазолильная, тетразолильная и пиридинильная группы, среди которых группы пиридин-2-ила и пиридин-3-ила особенно предпочтительны.
В вышеуказанном описании "фенильная группа, замещенная 1-5 заместителями, выбранными из заместителей α" в определении R4 представляет фенильную группу, замещенную 1-5 заместителями, выбранными из группы, которая включает атомы галогена; гидроксильные группы; C1-6 алкильные группы, галоген(C1-6 алкильные) группы; C1-6 алкоксигруппы; C1-6 алкилтиогруппы; аминогруппы, каждая из которых может быть замещена заместителем, выбранным из заместителей γ; С3-10 циклоалкильные, С6-10 арильные, C7-16 аралкильные, C6-10 арилокси, C7-16 аралкилокси и C6-10 арилтио группы, каждая из которых может быть замещена 1-3 заместителями, выбранными из заместителей β; C1-7 алифатические ацилоксигруппы; 4-7-членные насыщенные азотсодержащие гетероциклические группы; 5- или 6-членные ароматические азотсодержащие гетероциклические группы; нитрогруппы и цианогруппы. Примеры включают 2-, 3- или 4-фторфенил, 2-, 3- или 4-хлорфенил, 2-, 3- или 4-бромфенил, 2-, 3- или 4-иодфенил, 2,4-дифторфенил, 3,5-дифторфенил, пентафторфенил, 3, 5-дихлорфенил, 2-, 3- или 4-гидроксифенил, 3,5-дигидроксифенил, 2-, 3- или 4-метилфенил, 2-, 3- или 4-этилфенил, 2-, 3- или 4-пропилфенил, 2-, 3- или 4-изопропилфенил, 2-, 3- или 4-бутилфенил, 2-, 3- или 4-втор-бутилфенил, 2-, 3- или 4-трет-бутилфенил, 2-, 3- или 4-трифторметилфенил, 2-, 3- или 4-метоксифенил, 2-, 3- или 4-этоксифенил, 2-, 3- или 4-пропоксифенил, 2-, 3- или 4-изопропоксифенил, 2-, 3- или 4-бутоксифенил, 2-, 3- или 4-втор-бутоксифенил, 2-, 3- или 4-трет-бутоксифенил, 2-, 3- или 4-метилтиофенил, 2-, 3- или 4-этилтиофенил, 2-, 3- или 4-изопропилтиофенил, 2-, 3- или 4-аминофенил, 3,5-диаминофенил, 2-, 3- или 4- метиламинофенил, 2-, 3- или 4-диметиламинофенил, 2-, 3- или 4-(N-этил-N-метиламино)фенил, 2-, 3- или 4-диэтиламинофенил, 2-, 3- или 4-(н-пентиламино)фенил, 2-, 3- или 4- (н-гексиламино)фенил, 2-, 3-или 4-фенилминофенил, 2-, 3- или 4-бензиламинофенил, 2-, 3-или 4-формиламинофенил, 2-, 3- или 4-ацетиламинофенил, 2-, 3-или 4-пропиониламинофенил, 2-, 3- или 4-бензоиламинофенил, 2-, 3- или 4-(2-, 3- или 4-фторбензоиламино)фенил, 2-, 3- или 4-(2-, 3- или 4-хлорбензоиламино)фенил, 2-, 3- или 4-(2,4-дифторбензоиламино)фенил, 2-, 3- или 4-(4-гидрокси-3, 5-диметилбензоиламино)фенил, 2-, 3- или 4-(4-гидрокси-3,5-ди-трет-бутилбензоиламино)фенил, 2-, 3- или 4-(1- или 2-нафтоиламино)фенил, 2-, 3- или 4-фенилацетиламинофенил, 2-, 3- или 4-(2-, 3- или 4-фторфенилацетиламино)фенил, 2-, 3- или 4-(2-, 3- или 4-хлорфенилацетиламино)фенил, 2-, 3- или 4-(3-фенилпропиониламино)фенил, 2-, 3- или 4-циклопентаноиламинофенил, 2-, 3- или 4-циклогексаноиламинофенил, 2-, 3- или 4-никотиноиламинофенил, 2-, 3- или 4-изоникотиноиламинофенил, 2-, 3- или 4-(N-ацетил-N-метиламино)фенил, 2-, 3- или 4-(N-ацетил-N-пентиламино)фенил, 2-, 3- или 4- (N-ацетил-N-гексиламино)фенил, 2-, 3- или 4-(N-бензоил-N-гексиламино)фенил, 2-, 3- или 4-(N-3-хлорбензоил-N-метиламино)фенил, 2-, 3- или 4-(N-3-хлорбензоил-N-гексиламино)фенил, 2-, 3- или 4-(N-2, 4-дифторбензоил-N-гексиламино)фенил, 2-, 3- или 4-[N-(1- или 2-нафтоил)-N-гексиламино] фенил, 2-, 3- или 4-(N-гексил-N-фенилацетиламино)фенил, 2-, 3- или 4-(N-изобутил-N-циклогептаноил)амино)фенил, 2-, 3- или 4-(N-бутил-N-никотиноиламино)фенил, 2-, 3- или 4-циклопентилфенилил, 2-, 3- или 4-циклогексилфенилил, 2-, 3- или 4-(1-адамантил)фенил, 2-, 3- или 4-бифенилил, 2-, 3- или 4-(2'-, 3'- или 4'-гидрокси)бифенилил, 2-, 3- или 4-(4-гидрокси-3,5-диметилфенил)фенил, 2-, 3- или 4-(4-гидрокси-3,5-диизопропилфенил)фенил, 2-, 3- или 4-(3,5-ди-трет-бутил-4-гидроксифенил)фенил, 2-, 3- или 4-бензилфенил, 2-, 3- или 4-(4-гидроксибензил)фенил, 2-, 3- или 4-(4-гидрокси-3, 5-диметилбензил)фенил, 2-, 3- или 4-(3,5-ди-трет-бутил-4-гидроксибензил)фенил, 2-, 3- или 4-феноксифенил, 2-, 3- или 4-(4-гидроксифенокси)фенил, 2-, 3- или 4-(4-гидрокси-3,5-диметилфенокси)фенил, 2-, 3- или 4-(3,5-ди-трет-бутил-4-гидроксифенокси)фенил, 2-, 3- или 4-бензилоксифенил, 2-, 3-или 4-(4-гидроксибензилокси)фенил, 2-, 3- или 4-(4-гидрокси-3,5-диметилбензилокси)фенил, 2-, 3- или 4-(3, 5-ди-трет-бутил-4-гидроксибензилокси)фенил, 2-, 3- или 4-фенилтиофенил, 2-, 3- или 4-(4-гидроксифенилтио)фенил, 2-, 3- или 4-(3,5-диметил-4-гидроксифенилтио)фенил, 2-, 3- или 4-(3, 5-ди-трет-бутил-4-гидроксифенилтио)фенил, 2-, 3- или 4-формилоксифенил, 2-, 3- или 4-ацетоксифенил, 2-, 3- или 4-пропионилоксифенил, 2-, 3- или 4-(1-азетидинил)фенил, 2-, 3- или 4-(1-, 2- или 3-пирролидинил)фенил, 2-, 3- или 4-(1-, 2-, 3- или 4-пиперидинил)фенил, 2-, 3- или 4-(2-, 3- или 4-морфолинил)фенил, 2-, 3- или 4-(2-, 3- или 4-тиоморфолинил)фенил, 2-, 3- или 4-(1- или 2-пиперазинил)фенил, 2-, 3- или 4-(1-, 2- или 4-имидазолил)фенил, 2-, 3- или 4-(тетразол-5-ил)фенил, 2-, 3-или 4-(2-, 3- или 4-пиридил)фенил, 2-, 3- или 4-нитрофенил, 2-, 3- или 4-цианофенил, 2- или 3-хлор-4-гидроксифенил, 4-хлор-3,5-дигидроксифенил, 3,5-дихлор-4-гидроксифенил, 2-фтор-4-гидрокси-3, 5-диметилфенил, 3-фтор-5-гидрокси-2,6-диметилфенил, 4-фтор-3-гидрокси-2,5-диметилфенил, 2-хлор-4-гидрокси-3,5-диметилфенил, 3-хлор-5-гидрокси-2,6-диметилфенил, 4-хлор-3-гидрокси-2,5-диметилфенил, 2- или 3-амино-4-хлорфенил, 2,3-дихлор-4-аминофенил, 2- или 3-хлор-4-метиламинофенил, 2-гидрокси-3- или 4-метилфенил, 2-гидрокси-3,4-диметилфенил, 3-гидрокси-4- или 5-метилфенил, 3-гидрокси-2, 4-диметилфенил, 4-гидрокси-2- или 3-метилфенил, 2- или 3-этил-4-гидроксифенил, 4-гидрокси-2- или 3-пропилфенил, 4-гидрокси-2- или 3-изопропилфенил, 2- или 3-трет-бутил-4-гидроксифенил, 4-гидрокси-2, 3-диметилфенил, 4-гидрокси-2,5-диметилфенил, 4-гидрокси-3,5-диметилфенил, 3, 5-диэтил-4-гидроксифенил, 3-трет-бутил-4-гидрокси-5-метилфенил, 4-гидрокси-3,5-дипропилфенил, 4-гидрокси-3, 5-диизопропилфенил, 2,5-ди-трет-бутил-4-гидроксифенил, 3,5-ди-трет-бутил-4-гидроксифенил, 4-гидрокси-2,3,5-триметилфенил, 4-гидрокси-2,3,6-триметилфенил, 4-гидрокси-2,3,5,6-тетраметилфенил, 4-гидрокси-3,5-диметоксифенил, 2- или 3-гидрокси-4-диметиламинофенил, 4-бензил-(2- или 3-гидрокси)фенил, 3-, 5- или 6-бензил-2-гидроксифенил, 3-гидрокси-4-нитрофенил, 3-амино-4-метилфенил, 4-амино-2, 3-диметилфенил, 4-амино-2,6-диметилфенил, 4-амино-3,5-диметилфенил, 4-амино-3, 5-диэтилфенил, 4-амино-3,5-дипропилфенил, 4-амино-3,5-диизопропилфенил, 4-амино-3,5-ди-трет-бутилфенил, 4-метиламино-3, 5-диметилфенил, 4-(N-этил-N-метиламино)-3,5-диметилфенил, 4-ацетиламино-3, 5-диметилфенил, 4-ацетиламино-3,5-ди-трет-бутилфенил, 4-бензоиламино-3,5-диметилфенил, 4-ацетокси-3,5-диметилфенил, 4-ацетокси-2,3,5-триметилфенил и 3,5-диметил-4-нитрофенил группы.
В
вышеуказанном описании "пиридильная группа, которая может быть замещена 1-4 заместителями, выбранными из
заместителей α" в определении R4 представляет собой пиридильную группу,
которая может быть замещена 1-4
заместителями, выбранными из группы, включающей атомы галогена;
гидроксильные группы; C1-6 алкильные группы, галоген (C1-6 алкильные)
группы; C1-6 алкоксигруппы; C1-6 алкилтиогруппы; аминогруппы, каждая из которых может
быть замещена заместителем, выбранным из заместителей γ; С3-10
циклоалкильные, С6-10 арильные, C7-16 аралкильные, С6-10 арилокси, C7-16
аралкилокси и С6-10 арилтио группы, каждая из которых может быть
замещена 1-3 заместителями, выбранными из заместителей β; C1-7 алифатические ацилоксигруппы; 4-7-членные
насыщенные азотсодержащие гетероциклические группы; 5- или 6-членные
ароматические азотсодержащие гетероциклические группы; нитрогруппы и цианогруппы.
Примеры включают группы 2-, 3- и 4-пиридил, 3-, 4-, 5- и 6-фтор-2-пиридил, 2-, 4-, 5- или 6-фтор-3-пиридил, 2- или 3-фтор-4-пиридил, 3-, 4-, 5- или 6-хлор-2-пиридил, 2-, 4-, 5- или 6-хлор-3-пиридил, 2- или 3-хлор-4-пиридил, 3-, 4-, 5- или 6-бром-2-пиридил, 2-, 4-, 5- или 6-бром-3-пиридил, 2- или 3-бром- 4-пиридил, 3-, 4-, 5- или 6-иод-2-пиридил, 2-, 4-, 5- или 6-иод-3-пиридил, 2- или 3-иод-4-пиридил, 3-, 4-, 5- и 6-гидрокси-2-пиридил, 2-, 4-, 5- или 6-гидрокси-3-пиридил, 2- или 3-гидрокси-4-пиридил, 3-, 4-, 5- и 6-метил-2-пиридил, 2-, 4-, 5- или 6-метил-3-пиридил, 2- или 3-метил-4-пиридил, 3, 5-диметил-4-пиридил, 3-, 4-, 5- и 6-этил-2-пиридил, 2-, 4-, 5- или 6-этил-3-пиридил, 2- или 3-этил-4-пиридил, 3,5-диэтил-4-пиридил, 3-, 4-, 5- и 6-пропил-2-пиридил, 2-, 4-, 5- или 6-пропил-3-пиридил, 2- или 3-пропил-4-пиридил, 3,5-дипропил-4-пиридил, 3-, 4-, 5- и 6-изопропил-2-пиридил, 2-, 4-, 5- или 6-изопропил-3-пиридил, 2- или 3-изопропил-4-пиридил, 3,5-диизопропил-4-пиридил, 3-, 4-, 5- и 6-трет-бутил-2-пиридил, 2-, 4-, 5- или 6-трет-бутил-3-пиридил, 2- или 3-трет-бутил-4-пиридил, 3,5-ди-трет-бутил-4-пиридил, 3-, 4-, 5- и 6-трифторметил-2-пиридил, 2-, 4-, 5- или 6-трифторметил-3-пиридил, 2- или 3-трифторметил-4-пиридил, 3-, 4-, 5- и 6-метокси-2-пиридил, 2-, 4-, 5- или 6-метокси-3-пиридил, 2- или 3-метокси-4-пиридил, 3-, 4-, 5- и 6-этокси-2-пиридил, 2-, 4-, 5- или 6-этокси-3-пиридил, 2- или 3-этокси-4-пиридил, 3-, 4-, 5- и 6-пропокси-2-пиридил, 2-, 4-, 5- или 6-пропокси-3-пиридил, 2- или 3-пропокси-4-пиридил, 3-, 4-, 5- и 6-изопропокси-2-пиридил, 2-, 4-, 5- или 6-изопропокси-3-пиридил, 2- или 3-изопропокси-4-пиридил, 3-, 4-, 5- и 6-трет-бутокси-2-пиридил, 2-, 4-, 5- или 6-трет-бутокси-3-пиридил, 2- или 3-трет-бутокси-4-пиридил, 4-метилтио-2-пиридил, 6-изопропилтио-3-пиридил, 6-трет-бутилтио-2-пиридил, 3-, 4-, 5- и 6-амино-2-пиридил, 2-, 4-, 5- или 6-амино-3-пиридил, 2- или 3-амино-4-пиридил, 3-, 4-, 5- и 6-метиламино-2-пиридил, 2-, 4-, 5- или 6-метиламино-3-пиридил, 2- или 3-метиламино-4-пиридил, 5-фениламино-2-пиридил, 5-бензиламино-2-пиридил, 5-ацетиламино-2-пиридил, 5-бензоиламино-2-пиридил, 5-фенилацетиламино-2-пиридил, 6-фенил-2-пиридил, 6-(4-гидроксифенил)-2-пиридил, 6-(4-гидрокси-3, 5-диметилфенил)-2-пиридил, 6-(3,5-ди- трет-бутил-4-гидроксифенил)-2-пиридил, 6-бензил-2-пиридил, 6-(4-гидроксибензил)-2-пиридил, 6-(4-гидрокси-3,5-диметилбензил)-2-пиридил, 6-(3, 5-ди-трет-бутил-4-гидроксибензил)-2-пиридил, 6-фенокси-2-пиридил, 6-(4-гидроксифенокси) -2-пиридил, 6-(4-гипрокси-3,5-диметилфенокси)-2-пиридил, 6-(3, 5-ди-трет-бутил-4-гидроксифенокси)-2-пиридил, 6-бензилокси-2-пиридил, 6-(4-гидроксибензилокси)-2-пиридил, 6-(4-гидрокси-3,5-диметилбензилокси)-2-пиридил, 6-(3, 5-ди-трет-бутил-4-гидроксибензилокси)-2-пиридил, 6-фенилтио-2-пиридил, 6-(4-гидроксифенилтио)-2-пиридил, 6-(4-гидрокси-3,5-диметилфенилтио)-2-пиридил, 6-(3, 5-ди-трет-бутил-4-гидроксифенилтио)-2-пиридил, 3-, 4-, 5- и 6-формилокси-2-пиридил, 2-, 4-, 5- или 6-формилокси-3-пиридил, 2- или 3-формилокси-4-пиридил, 3-, 4-, 5- и 6-ацетокси-2-пиридил, 2-, 4-, 5- или 6-ацетокси-3-пиридил, 2- или 3-ацетокси-4-пиридил, 6-(1-пирролидинил)-2-пиридил, 6-(1-пиперидинил)-2-пиридил, 6-(4-морфолинил)-2-пиридил, 3-, 4-, 5- и 6-нитро-2-пиридил, 2-, 4-, 5- или 6-нитро-3-пиридил, 2- или 3-нитро-4-пиридил, 5-амино-6-фтор-2-пиридил, 5-амино-6-хлор-2-пиридил, 6-хлор-3-нитро-2-пиридил, 6-метокси-5-метил-3-пиридил, 6-метил-2-нитро-3-пиридил, 6-хлор-3-нитро-2-пиридил, 6-метокси-3-нитро-2-пиридил, 6-изопропокси-3-нитро-2-пиридил, 6-трет-бутокси-3-нитро-2-пиридил и 6-(4-гидрокси-3,5-диметилфенокси)-5-нитро-2-пиридил.
В качестве такой "пиридильной группы, которая может быть замещена 1-4 заместителями, выбранными из заместителей α", предпочтительными являются пиридильные группы, которые могут быть замещены следующими заместителями (указанные заместители представляют атомы галогена, гидроксильные группы, C1-6 алкильные группы, галоген (C1-6 алкильные) группы, C1-6 алкоксигруппы, C1-6 алкилтиогруппы, аминогруппы, которые могут быть замещены заместителями, выбранными из заместителей γ,и нитрогруппы); более предпочтительными являются пиридильные группы, которые могут быть замещены следующими заместителями (указанные заместители представляют атомы фтора, атомы хлора, гидроксильные группы, метильные группы, этильные группы, трет-бутильные группы, трифторметильные группы, метоксигруппы, аминогруппы, метиламиногруппы, диметиламиногруппы и нитрогруппы); и особенно предпочтительными являются пиридильные группы.
В вышеуказанном описании "C1-6 алкиленовая группа" в определении А представляет собой линейную или разветвленную C1-6 алкиленовую группу. Примеры включают метилен, метилметилен, этилен, пропилен, триметилен, метилэтилен, этилэтилен, тетраметилен, 1-метилтриметилен, 2-метилтриметилен, 3-метилтриметилен, 1,1-диметилэтилен, пентаметилен, 1-метилтетраметилен, 2-метилтетраметилен, 3-метилтетраметилен, 4-метилтетраметилен, пропилэтилен, 1,1-диметилтриметилен, 2,2-диметилтриметилен, 3, 3-диметилтриметилен, гексаметилен, 1-метилпентаметилен, 2-метилпентаметилен, 3-метилпентаметилен, 4-метилпентаметилен, 5-метилпентаметилен, 1,1-диметилтетраметилен, 2,2-диметилтетраметилен, 3, 3-диметилтетраметилен, 4,4-диметилтетраметилен, бутилэтилен и изобутилэтилен, среди которых C1-4 алкиленовые группы являются предпочтительными, более предпочтительны C1-2 алкиленовые группы и наиболее предпочтительны метиленовые группы.
Соединение (I) по настоящему изобретению может быть превращено в соль обычными способами. Примеры таких солей включают соли щелочных металлов, такие как натриевые соли, калиевые соли и литиевые соли; соли щелочноземельных металлов, такие как кальциевые соли и магниевые соли; соли металлов, такие как соли алюминия, соли железа, соли цинка, соли меди, соли никеля и соли кобальта; неорганические соли, такие как соли аммония и соли органичеких аминов, такие как соли трет-октиламина, соли дибензиламина, соли морфолина, соли глюкозамина, соли сложных алкиловых эфиров фенилглицина, соли этилендиамина, соли N-метилглюкамина, гуанидиновые соли, соли диэтиламина, соли триэтиламина, соли дициклогексиламина, соли N,N'-дибензилэтилендиамина, соли хлорпрокаина, соли прокаина, соли диэтаноламина, соли N-бензил-N-фенетиламина, соли пиперазина, соли тетраметиламмония и соли трис(гидроксиметил)аминметана; гидрогалогенированные соли, такие как соли фторводородной кислоты, гидрохлориды, гидробромиды и гидроиодиды; неорганические соли, такие как нитраты, перхлораты, сульфаты и фосфаты, соли низших алкансульфонатов, такие как метансульфонаты, трифторметансульфонаты и этансульфонаты; арилсульфонатные соли, такие как бензолсульфонаты и п-толуолсульфонаты; соли органических кислот, такие как ацетаты, малаты, фумараты, сукцинаты, цитраты, тартраты, оксалаты и малеаты; и соли аминокислот, такие как орнитинаты, глутаматы и аспартаты, среди которых гидрогалогенированные соли и соли органических кислот являются предпочтительными.
Когда соединение (I) по настоящему изобретению оставляют на воздухе или перекристаллизовывают, оно может поглощать воду или содержать абсорбированную воду, связанную с его поверхностью, и иногда переходить в гидрат. Все такие сольваты полностью включены в объем настоящего изобретения.
Кроме того, соединение (I) по настоящему изобретению может поглощать некоторые растворители и образовывать их сольваты. Такие сольваты также обхватываются настоящим изобретением.
Кроме того, соединения, которые превращаются при физиологических условиях в соответствующее соединение (I) или его фармакологически приемлемую соль, то есть, так называемые пролекарственные средства, также включены в объем настоящего изобретения.
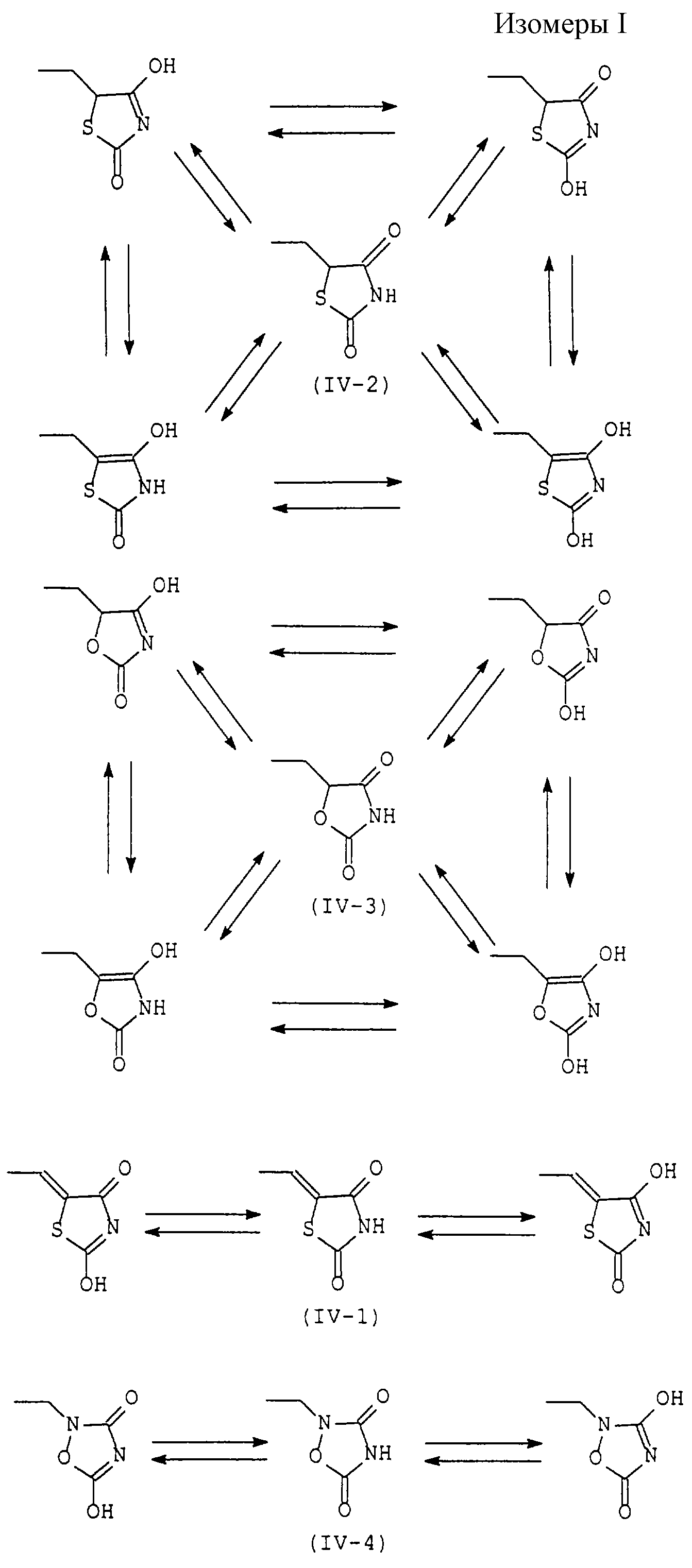
Помимо того, соединение (I) по настоящему изобретению имеет различные изомеры.
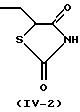
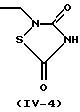
Более конкретно, когда R3 представляет 2,4-диоксотиазолидин-5-илметильную группу (IV-2) или 2,4-диоксооксазолидин-5-илметильную группу (IV-3), ее тиазолидиновое или оксазолидиновое кольцо имеет асимметрический атом углерода в 5-положении, так что существуют стереоизомеры в R-форме и S-форме. Каждый из стереоизомеров и смесь, состоящая из стереоизомеров в любом соотношении, также охватываются настоящим изобретением. В случае такого стереоизомера соединение (I) может быть синтезировано из оптически разделенных исходных материалов или синтезированное соединение (I) может быть оптически разделено, при необходимости, обычными способами оптического разделения или способами отделения.
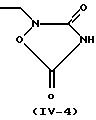
Когда в соединении (I) по настоящему изобретению R3 представляет 2, 4-диоксотиазолидин-5-илметильную группу (IV-2), 2,4-диоксооксазолидин-5-илметильную группу (IV-3) или 3,5-диоксооксадиазолидин-2-илметильную группу (IV-4), предполагается, что оно существует в виде различных таутомеров, и каждый из них или их смесь при любом соотношении охватываются настоящим изобретением. Такими изомерами являются, например, проиллюстрированные в конце описания (см. Изомеры I).
Примеры лекарственных средств, которые могут образовывать фармацевтическую композицию, при использовании в сочетании с соединением (I) настоящего изобретения или его фармакологически приемлемой солью включают ингибиторы α-глюкозидазы, ингибиторы альдегидроредуктазы, препараты бигуанида, статиновые основные соединения, ингибиторы синтеза сквалена, фибратные основные соединения, промоторы катаболизма LDL и ингибиторы ангиотензин-конвертирующего фермента.
В вышеуказанном описании ингибитор α-глюкозидазы представляет собой лекарственное средство, обладающее ингибирующим действием в отношении пищеварительного фермента, такого как амилаза, мальтаза, α-декстриназа или сукраза (сахарозо-α-глюкозидаза), замедляя таким образом ферментативный гидролиз крахмала или сахарозы. Их примеры включают акарбозу, N-(1,3-дигидрокси-2-пропил)вариоламин (обычное название: воглибоза) и миглитол.
В вышеуказанном описании ингибитор альдередуктазы представляет собой лекарственное средство, ингибирующее фермент, лимитирующий скорость первой стадии полиолового пути метаболизма, ингибируя таким образом диабетические осложнения. Примеры включают толрестат, эпалрестат, 2,7-дифторспиро(9Н-фтор-9,4'-имидазолидин)-2', 5'-дион (обычное название: имирестат), 3-[(4-бром-2-фторфенил)метил] -7-хлор-3, 4-дигидро-2,4-диоксо-1(2Н)-хинозолинуксусная кислота (обычное название: зенарестат), 6-фтор-2,3-дигидро-2',5' -диоксоспиро[4Н-1-бензопиран-4,4'-имидазолидин] -2-карбоксамид (SNK-860), зополрестат, сорбинил и 1-[(3-бром-2-бензофуранил)сульфонил]-2,4-имидазолидиндион (М-16209).
В вышеуказанном описании препарат бигуанида представляет собой лекарственное средство, обладающее действием, стимулирующим анаэробный гликолиз, усиливающим действие инсулина в периферическом кровотоке, ингибирующим абсорбцию глюкозы в кишечнике, ингибирующим печеночный глюконеогенез и ингибирующим оксиление жирных кислот, и примеры включают фенформин, метформин и буформин.
В вышеуказанном описании статиновое основное соединение представляет собой лекарственное средство, которое ингибирует гидроксиметилглутарил СоА (HMG-CoA) редуктазу, понижая в результате этого уровень холестерина в крови, и его примеры включают правастатин и его натриевую соль, симвастатин, ловастатин, аторвастатин и флувастатин.
В вышеуказанном описании ингибитор синтеза сквалена представляет собой лекарственное средство для ингибирования синтеза сквалена, понижающее за счет этого уровень холестерина в крови, и примеры включают монокалий (S)-α-[бис(2,2-диметил-1-оксопропил)метокси] -фосфинил-3-феноксибензолбутансульфонат (BMS-188494).
В вышеуказанном описании фибратное основное соединение представляет собой лекарственное средство для ингибирования синтеза и секреции триглицеридов в печени и активации липопротеинлипазы, понижающее в результате этого уровень триглицеридов в крови. Примеры включают безафибрат, беклобрат, бинифибрат, ципрофибрат, клинофибрат, клофибрат, клофибриновую кислоту, этофибрат, фенофибрат, гемфиброзил, никофибрат, пирифибрат, ронифибрат, симфибрат и теофибрат.
В вышеуказанном описании промотор катаболизма LDL представляет собой лекарственное средство для увеличения LDL (липопротеин низкой плотности) рецепторов, понижающее таким образом уровень холестерина в крови, и примеры включают соединения, описанные в заявке на патент Японии Kokai Hei 7-316144, или их соли, более конкретно, N-[2-[4-бис(4-фторфенил)метил-1-пиперазинил] этил]-7,7-дифенил-2,4,6-гептатриеновый амид.
В вышеуказанном описании статиновые основные соединения, ингибиторы синтеза сквалена, фибратные основные соединения и промоторы LDL катаболизма могут быть заменены другими химически эффективными препаратами для снижения холестерина в крови или уровня триглицеридов. Примеры таких лекарственных средств включают препараты на основе производных никотиновой кислоты, такие как никомол и ницеритрол; антиоксиданты, такие как пробукол; и препараты ионообменных смол, такие как холестирамин.
В вышеуказанном описании ингибитор ангиотензин-конвертирующего фермента представляет собой лекарственное средство для ингибирования ангиотензин-конвертирующего фермента, понижающее за счет этого давление крови и в то же время частичного понижения уровня сахара в крови пациента, страдающего от диабета. Примеры включают каптоприл, эналаприл, алацеприл, делаприл, рамиприл, лизиноприл, имидаприл, беназеприл, церонаприл, цилазаприл, эналаприлат, фозиноприл, мовелтиприл, периндоприл, хинаприл, спираприл, темокаприл и трандолаприл.
При ссылке на
соединение (I) по настоящему изобретению предпочтительные примеры включают
(1) соединения, где R1 представляет группу формулы (II),
(2) соединения, где R2 и
R5 являются одинаковыми или различными и представляют атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, галоген (C1-6 алкильную) группу,
C1-6 алкоксигруппу, C1-6 алкилтиогруппу или аминогруппу, которая может быть замещена заместителями, выбранными из заместителей γ,
(3) соединения, где R2 и
R5 являются одинаковыми или различными, и каждый представляет атом водорода, атом фтора, атом хлора, гидроксильную группу, метильную группу, этильную группу, трифторметильную
группу,
метоксигруппу, метилтиогруппу или аминогруппу,
(4) соединения, где R2 и R5, каждый, представляют атом водорода,
(5) соединения, где R3
представляет
любую одну из групп формул (IV-1)-(IV-3),
(6) соединения, где R3 представляет группу формулы (IV-2)-(IV-3),
(7) соединения, где R3 представляет
группу формулы
(IV-2),
(8) соединения, где R4 представляет пиридильную группу, которая может быть замещена одним из описанных ниже заместителей (заместитель представляет атом
галогена,
гидроксильную группу, C1-6 алкильную группу, галоген (C1-6 алкильную) группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, аминогруппу, которая может
быть
замещена заместителями, выбранными из заместителей γ,или нитрогруппу),
(9) соединения, где R4 представляет пиридильную группу, которая может быть замещена одним из
описанных
ниже заместителей (заместитель представляет атом фтора, атом хлора, гидроксильную группу, метильную группу, этильную группу, трет-бутильную группу, трифторметильную группу, метоксигруппу,
метилтиогруппу, аминогруппу, метиламиногруппу, диметиламиногруппу или нитрогруппу),
(10) соединения, имеющие в качестве R4 пиридильную группу,
(11) соединения, где R4 представляет фенильную группу, замещенную по крайней мере одним заместителем, выбранным из следующих заместителей (заместители включают С3-10 циклоалкильную, С6-10
арильную и C7-16 аралкильную группы, каждая из которых может быть замещена 1-3 заместителями, выбранными из заместителей β, 4-7-членные насыщенные азотсодержащие гетероциклические
группы или 5- или 6-членные ароматические азотсодержащие гетероциклические группы),
(12) соединения, где R4 представляет фенильную группу, замещенную одним из описанных ниже
заместителей (заместители представляют С3-10 циклоалкильную, С6-10 арильную и C7-16 аралкильную группу, которые могут быть замещены одним заместителем, выбранным из
заместителей β, 4-7-членную насыщенную азотсодержащую гетероциклическую группу или 5- или 6-членную ароматическую азотсодержащую гетероциклическую группу),
(13) соединения, где R4 представляет фенильную группу, замещенную одним из описанных ниже заместителей (заместители представляют С3-10 циклоалкильную, С6-10 арильную и C7-16
аралкильную группу, которые могут быть замещены атомом галогена, гидроксильной группой, C1-6 алкильной группой, галоген (C1-6 алкильной) группой, C1-6 алкоксигруппой
или аминогруппой, которая может быть замещена заместителями, выбранными из заместителей γ, 4-7-членную насыщенную азотсодержащую гетероциклическую группу или 5- или 6-членную ароматическую
азотсодержащую гетероциклическую группу),
(14) соединения, где R4 представляет фенильную группу, замещенную одним из описанных ниже заместителей (заместители представляют
фенильную
или бензильную группу, которая может быть замещена атомом галогена, гидроксильной группой, C1-6 алкильной группой, галоген (C1-6 алкильной) группой, C1-6
алкоксигруппой или аминогруппой, которая может быть замещена заместителями, выбранными из заместителей γ, адамантильную группу, пирролидинильную группу, морфолинильную группу, пиперидинильную
группу, имидазолильную группу, тетразолильную группу или пиридинильную группу),
(15) соединения, где R4 представляет фенильную группу, замещенную одним из описанных ниже
заместителей (заместитель представляет фенильную или бензильную группу, которая может быть замещена атомом фтора, атомом хлора, гидроксильной группой, метильной группой, этильной группой,
трет-бутильной группой, трифторметильной группой, метоксигруппой, аминогруппой, метиламиногруппой или диметиламиногруппой, адамантильную группу, пирролидинильную группу, морфолинильную группу,
пиперидинильную группу, имидазолильную группу, тетразолильную группу или пиридинильную группу),
(16) соединения, где R4 представляет 4-бифенилильную, 4-бензилфенильную,
4'-гидроксибифенилильную, (пирролидин-1-ил)фенильную, (морфолин-4-ил)фенильную, (пиперидин-1-ил)фенильную, (пиридин-2-ил)фенильную, (пиридин-3-ил)фенильную или 4-(1-адамантил)фенильную группу,
(17) соединения, где R4 представляет фенильную группу, замещенную одной ациламиногруппой, в которой амино фрагмент может быть замещен дополнительным заместителем, выбранным из
заместителей
γ, и указанная фенильная группа может быть дополнительно замещена 1-3 заместителями, выбранными из следующих заместителей (заместители включают атомы галогена и гидроксильную,
C1-6
алкильную, галоген (C1-6 алкильную), C1-6 алкокси и C1-6 алкилтиогруппы),
(18) соединения, где R4 представляет фенильную группу,
замещенную одной
ациламиногруппой, в которой амино фрагмент может быть замещен заместителем, выбранным из заместителей γ, и указанная фенильная группа может быть дополнительно замещена 1-3
заместителями,
выбранными из следующих заместителей (заместители состоят из атомов галогена и C1-6 алкильных групп),
(19) соединения, где R4 представляет фенильную
группу, замещенную
одной ациламиногруппой, в которой амино фрагмент может быть дополнительно замещен C1-10 алкильной группой или С7-12 аралкильной группой, которая может иметь
заместители, и
указанная фенильная группа может быть дополнительно замещена 1-3 C1-6 алкильными группами),
(20) соединения, где R4 представляет фенильную группу,
замещенную одним из
описанных ниже заместителей (заместитель представляет С7-11 ароматическую ациламино, С4-11 циклоалкилкарбониламино или 5- или 6-членную ароматическую
азотсодержащую
гетероциклическую карбониламиногруппу, которая может иметь заместители),
(21) соединения, где R4 представляет фенильную группу, замещенную бензоиламино,
3-хлорбензоиламино, 2,
4-дифторбензоиламино, 4-гидрокси-3,5-ди-трет-бутилбензоиламино, нафтоиламино, циклопентаноиламино, циклогексаноиламино, никотиноиламино, изоникотиноиламино,
N-ацетил-N-гексиламино или
адамантилкарбониламино группой,
(22) соединения, где R4 представляет фенильную группу, замещенную одной амино, амино, замещенной 1 или 2 заместителями
(заместители являются
одинаковыми или различными и каждый представляет группу, выбранную из C1-10 алкила, и С6-10 и C7-16 аралкила, каждый из которых может иметь
заместители), нитро или
циано группой, и указанная фенильная группа может быть дополнительно замещена 1-3 заместителями, выбранными из следующих заместителей (заместители включают атомы галогена и
гидроксильную, C1-6 алкильную, галоген (C1-6 алкильную), C1-6 алкокси и C1-6 алкилтиогруппы),
(23) соединения, где R4 представляет
фенильную группу, которая
замещена одной амино, моно- или ди(C1-10) алкил) амино или цианогруппой и, в то же самое время, может быть замещена 1 или 2 C1-6 алкильными группами,
(24) соединения,
где R4 представляет 4-аминофенильную, 4-амино-3,5-диметилфенильную, 4-амино-3,5-ди-трет-бутилфенильную, 3-или 4-диметиламинофенильную или 4-цианофенильную группу,
(25) соединения,
где R4 представляет фенильную группу, которая замещена одной С6-10 арилокси, C7-16 аралкилокси или С6-10 арилтио группой,
которая может быть замещена 1-3
заместителями, выбранными из заместителей β, и указанная фенильная группа может быть дополнительно замещена 1-3 заместителями, выбранными из следующих
заместителей (заместители состоят из
атомов галогена и гидроксильной, C1-6 алкильной, галоген (C1-6 алкильной), C1-6 алкокси и C1-6 алкилтио групп),
(26) соединения, где R4
представляет фенильную группу, которая замещена C6-10 арилокси, который может быть замещен 1-3 заместителями, выбранными из заместителей β,
и указанная фенильная группа может быть
дополнительно замещена 1-2 C1-6 алкильными группами,
(27) соединения, где R4 представляет фенильную группу, замещенную C6-10 арилоксигруппой, которая может
быть замещена одним заместителем, выбранными из заместителей β,
(28) соединения, где R4 представляет 4-феноксифенильную группу,
(29) соединения, где R4
представляет фенильную группу, замещенную 1-5 заместителями, выбранными из следующих заместителей (заместители включают атомы галогена и гидроксильную, C1-6 алкильные, галоген (C1-6 алкильные), C1-6 алкокси, C1-6 алкилтио и C1-7 алифатические ацилоксигруппы),
(30) соединения, где R4
представляет фенильную группу,
замещенную одним атомом галогена, гидроксильной группой, C1-6 алкильной группой, галоген (C1-6 алкильной) группой, C1-6 алкоксигруппой,
C1-6 алкилтиогруппой
или C1-7 алифатической ацилоксигруппой, и указанная фенильная группа может быть дополнительно замещена 1-4 заместителями, выбранными из следующих
заместителей (заместители включают атомы
галогена и C1-6 алкильные или галоген (C1-6 алкильные) группы),
(31) соединения, где R4 представляет фенильную
группу, замещенную одной C1-6
алкильной группой, галоген (C1-6 алкильной) группой, C1-6 алкоксигруппой или C1-6 алкилтиогруппой или 1-5 атомами галогена,
(32) соединения, где R4
представляет фенильную группу, замещенную одной галоген (С1-2 алкильной), C1-2 алкокси или C1-2 алкилтио группой или 1-5
атомами фтора или атомами хлора,
(33)
соединения, где R4 представляет 4-трифторметилфенильную, 4-метилтиофенильную, 4-метоксифенильную или пентафторфенильную группу,
(34)
соединения, где R4 представляет
фенильную группу, которая замещена одной гидроксильной или C1-7 алифатической ацилоксигруппой, и указанная фенильная группа может быть
дополнительно замещена 1-3 заместителями, выбранными
из следующих заместителей (заместители включают атомы галогена и C1-6 алкильные группы),
(35) соединения, где R4
представляет фенильную группу, которая замещена одной
гидроксильной группой, и указанная фенильная группа может быть дополнительно замещена 1-3 заместителями, выбранными из следующих заместителей
(заместители включают атомы галогена и C1-6
алкильные группы),
(36) соединения, где R4 представляет фенильную группу, которая замещена одной гидроксильной группой, и
указанная фенильная группа может быть дополнительно
замещена 1-3 заместителями, выбранными из следующих заместителей (заместители включают атомы фтора и хлора и метильную и трет-бутильную группы),
(37) соединения, где R4
представляет 4-гидроксифенильную, 4-гидрокси-3,5-диметилфенильную, 4-гидрокси-3,5-ди-трет-бутилфенильную, 4-гидрокси-2,3,5-триметилфенильную или
2-хлор-4-гидрокси-3,5-диметилфенильную группу,
(38) соединения, где R6 представляет атом водорода, C1-6 алкильную группу или фенильную или бензильную группу, которая
может быть замещена 1-3 заместителями, выбранными из
следующих заместителей (заместители включают атомы галогена и гидроксильную, C1-6 алкильную и галоген (C1-6 алкильную)
группы),
(39) соединения, где R6
представляет атом водорода, C1-4 алкильную группу или фенильную или бензильную группу, которая может быть замещена одним из описанных
ниже заместителей (заместители представляют атом фтора,
атом хлора, гидроксильную группу, метильную группу или этильную группу),
(40) соединения, где R6 представляет атом водорода
или C1-4 алкильную группу,
(41)
соединения, где R6 представляет C1-2 алкильную группу,
(42) соединения, где R6 представляет метильную
группу,
(43) соединения, где А представляет
C1-4 алкиленовую группу,
(44) соединения, где А представляет C1-2 алкиленовую группу,
(45) соединения, где
А представляет метиленовую группу,
(46)
соединения, где В представляет атом кислорода,
(47) соединения, где D представляет атом кислорода,
(48) соединения, где D
представляет атом серы,
(49) соединения, где Е
представляет СН-группу, и
(50) соединения, где Е представляет атом азота.
Любое сочетание от двух до девяти групп, выбранных из (1), (2)-(4), (5)-(7), (8)-(37), (38)-(42), (43)-(45), (46), (47)-(48) и (49)-(50) также является предпочтительным.
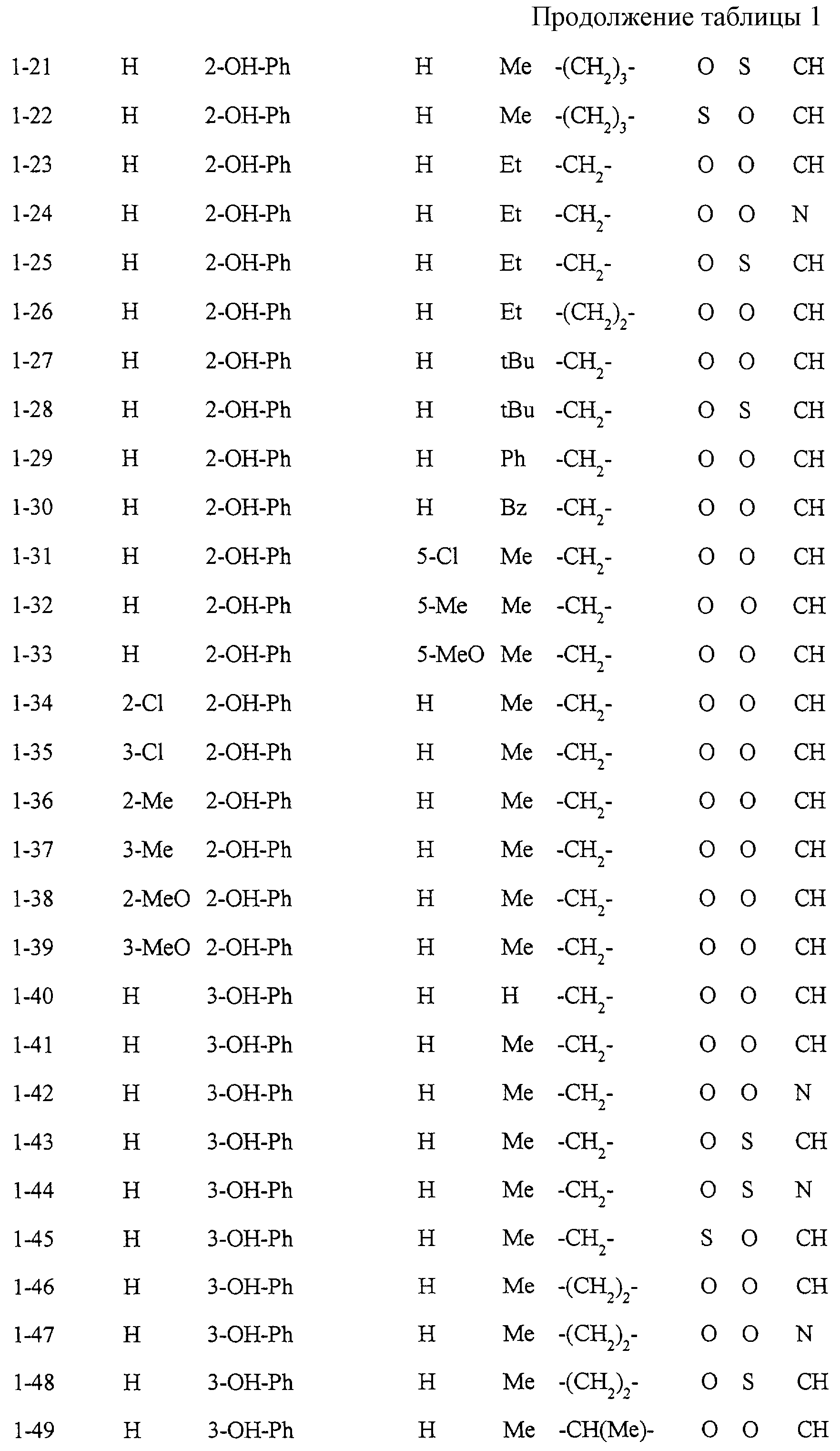
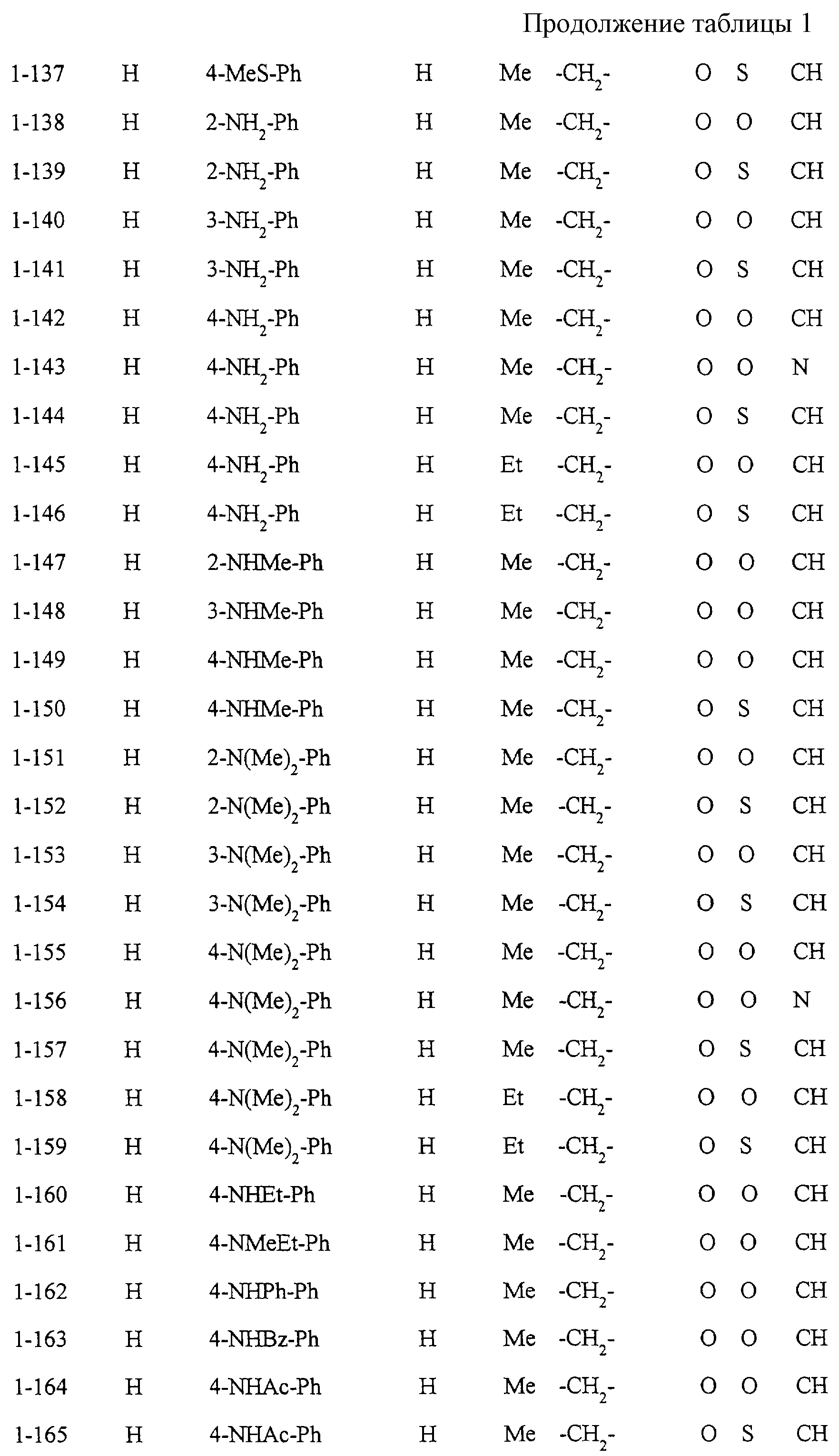
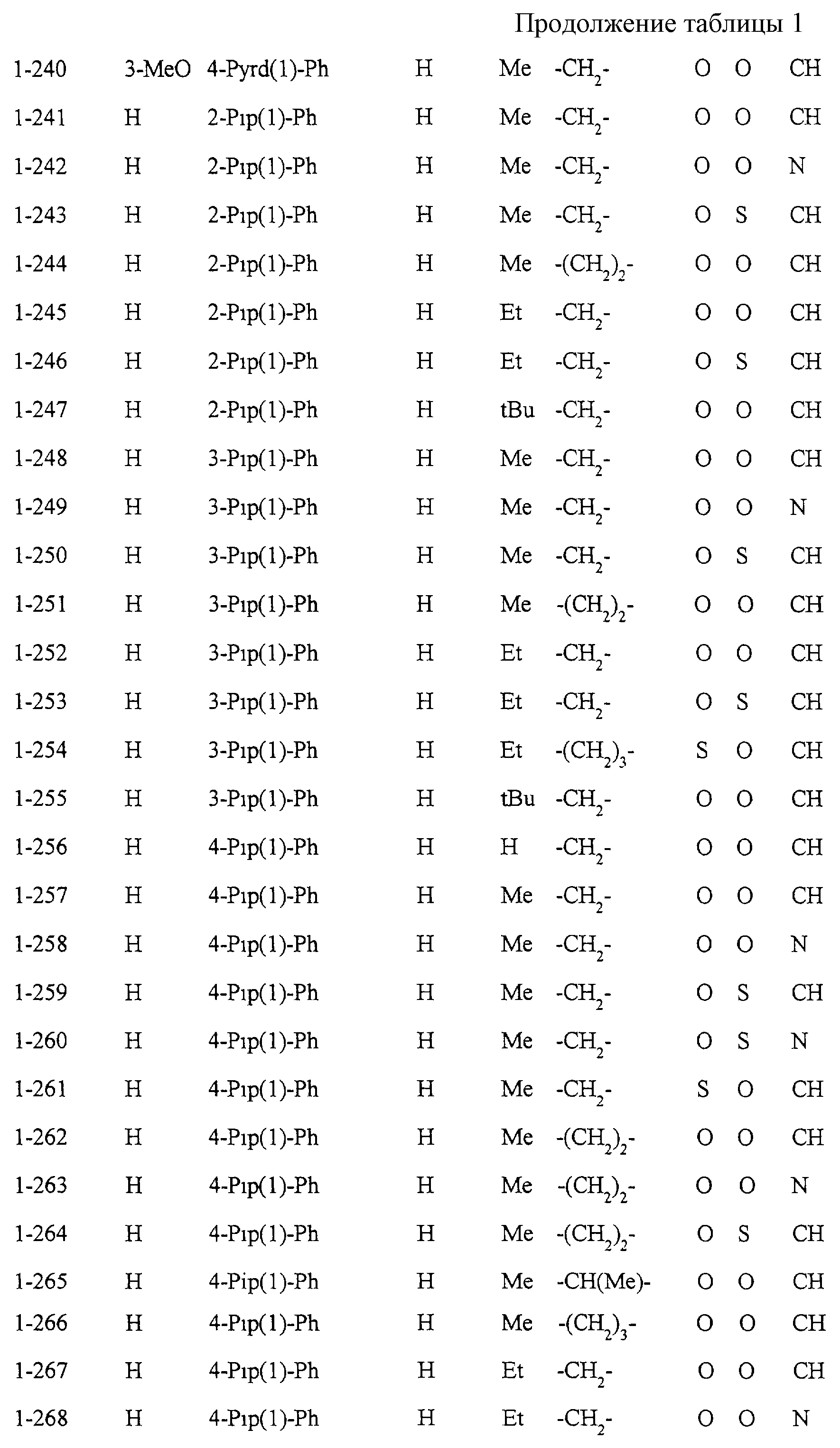
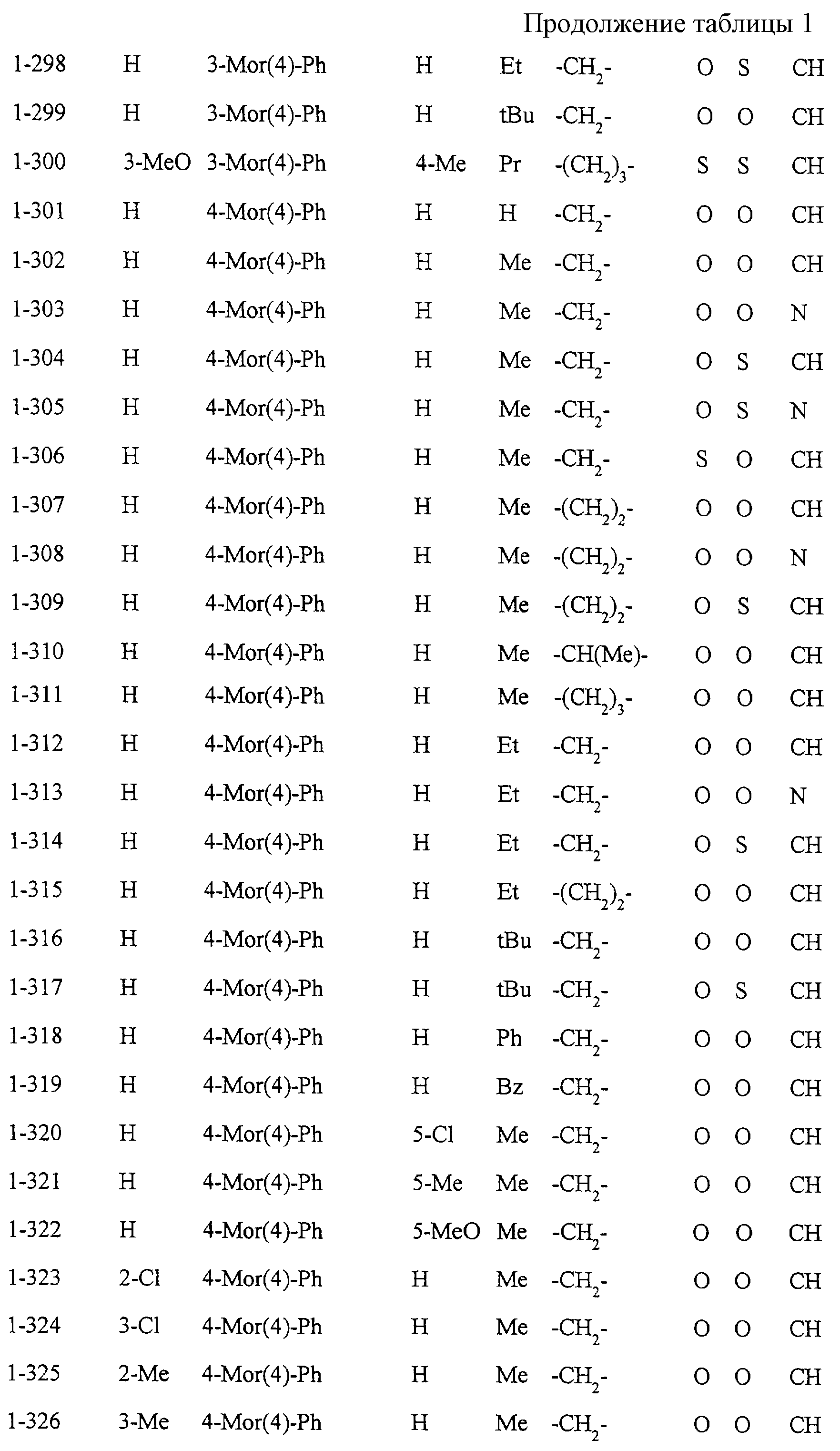
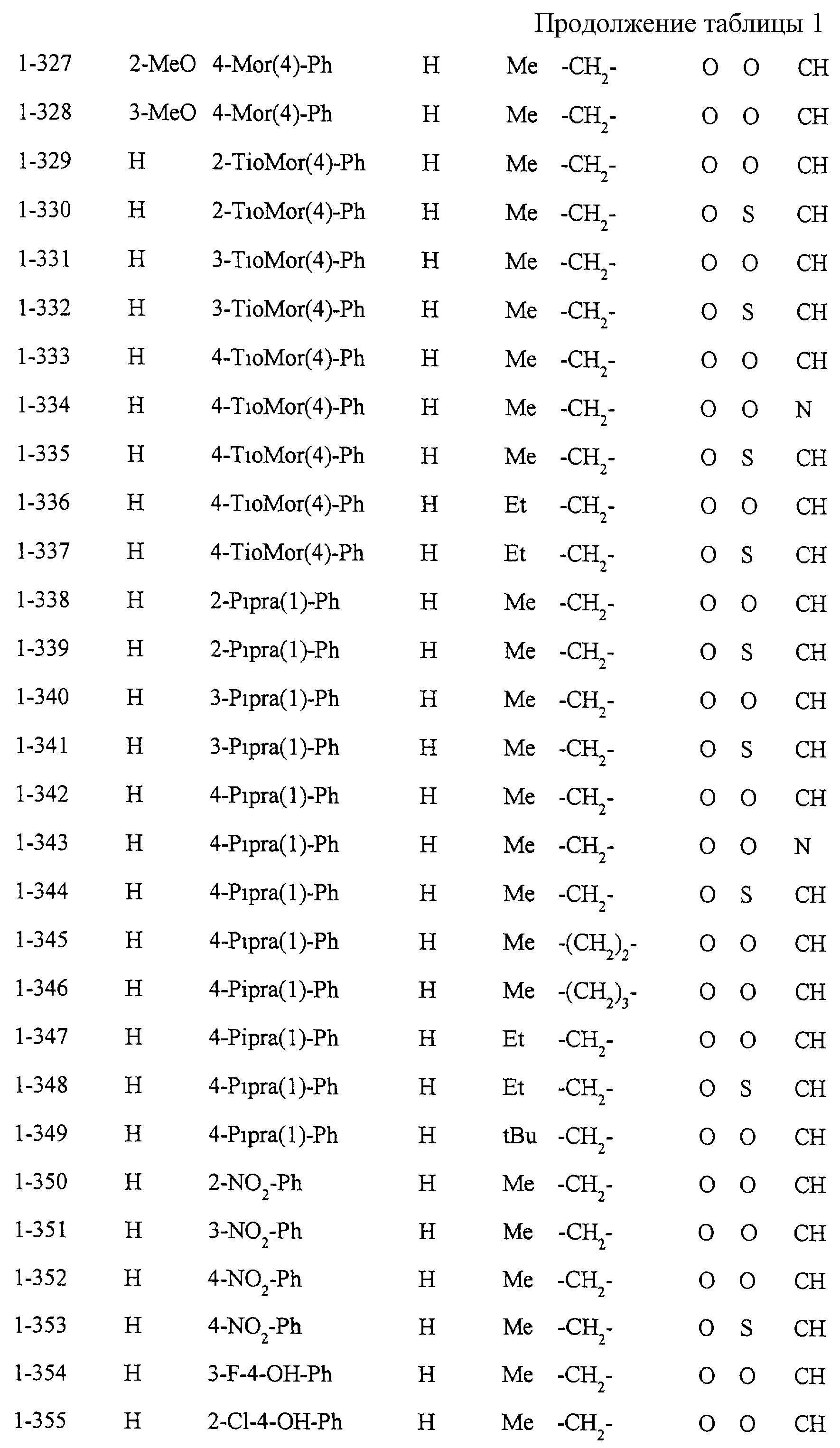
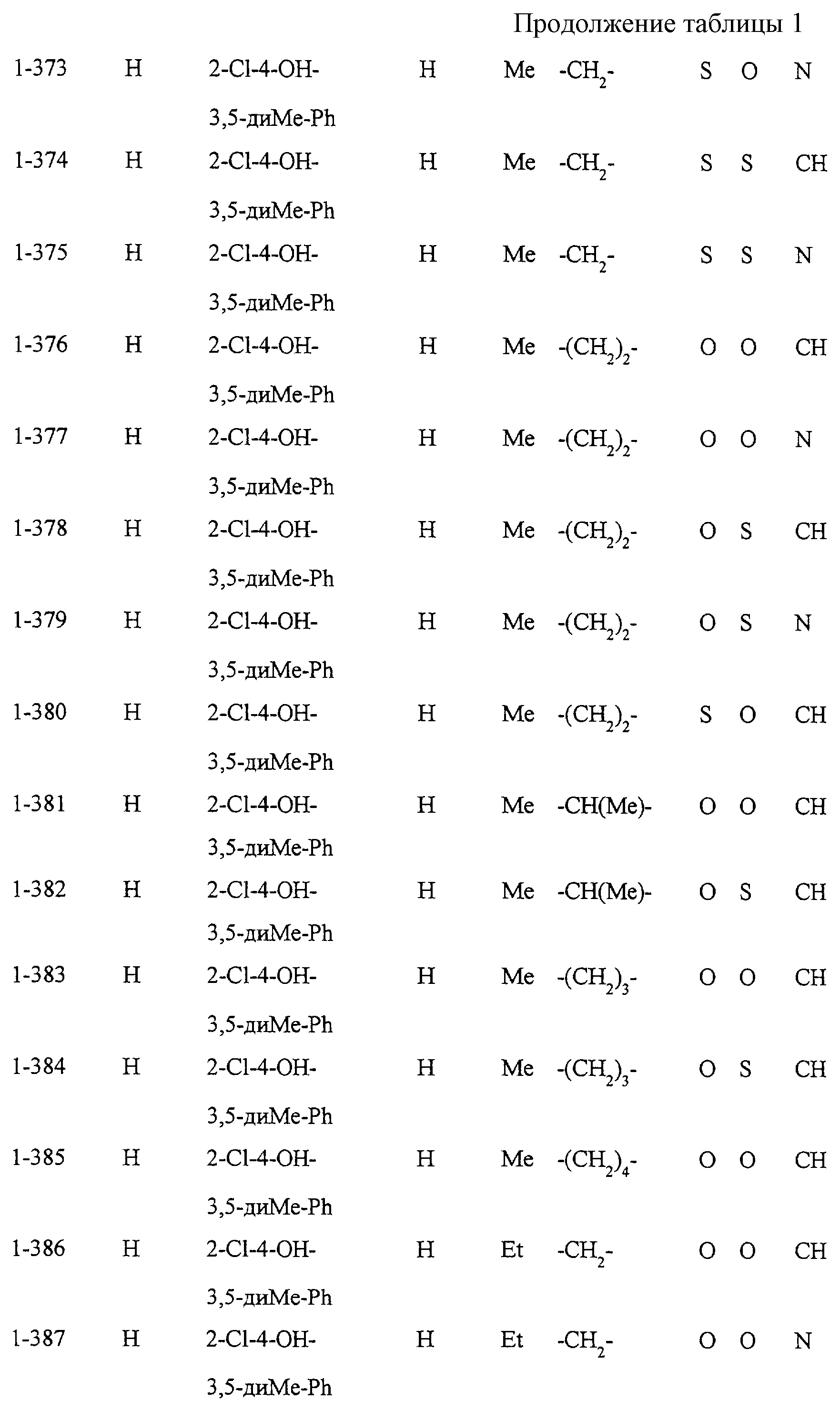
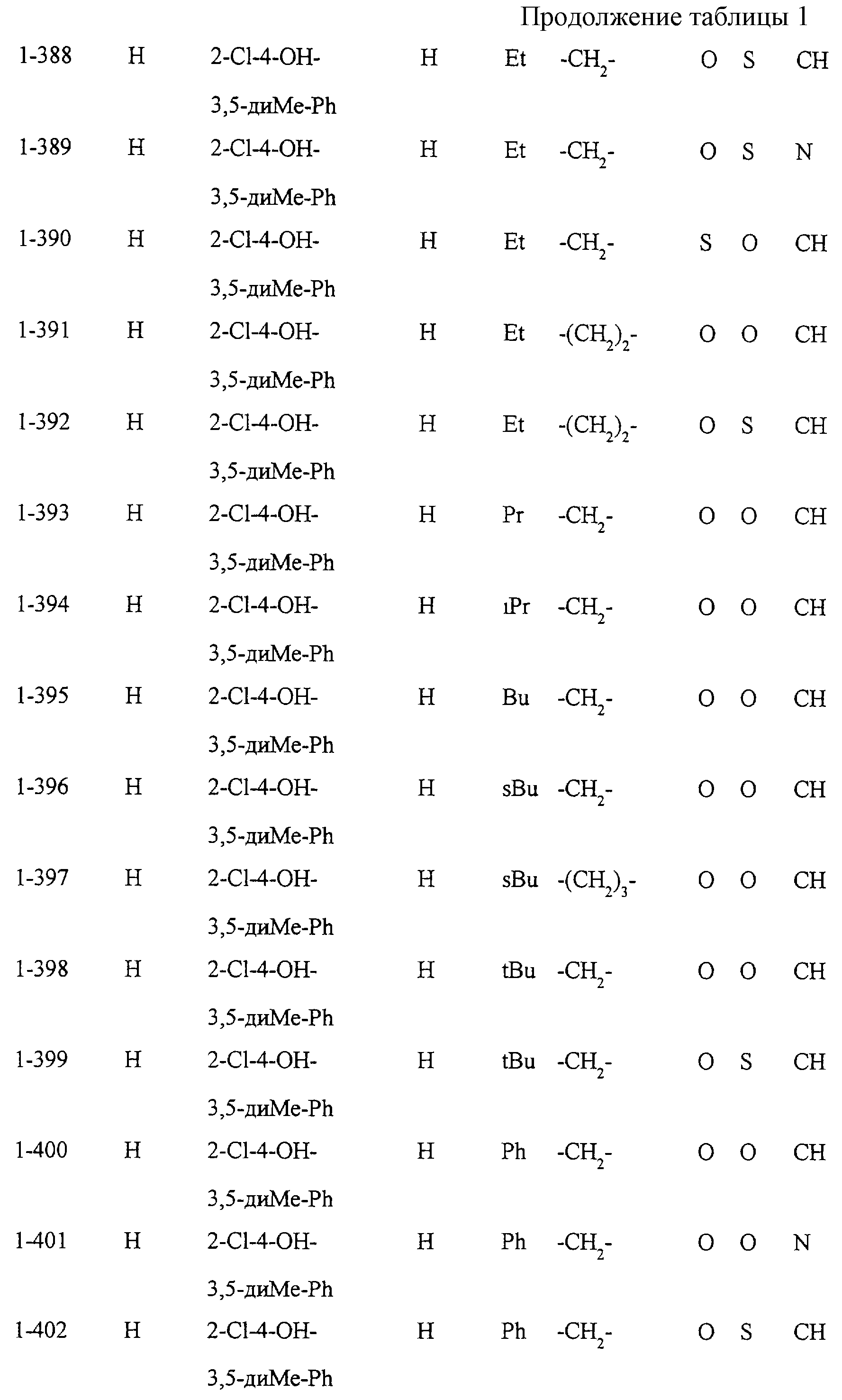
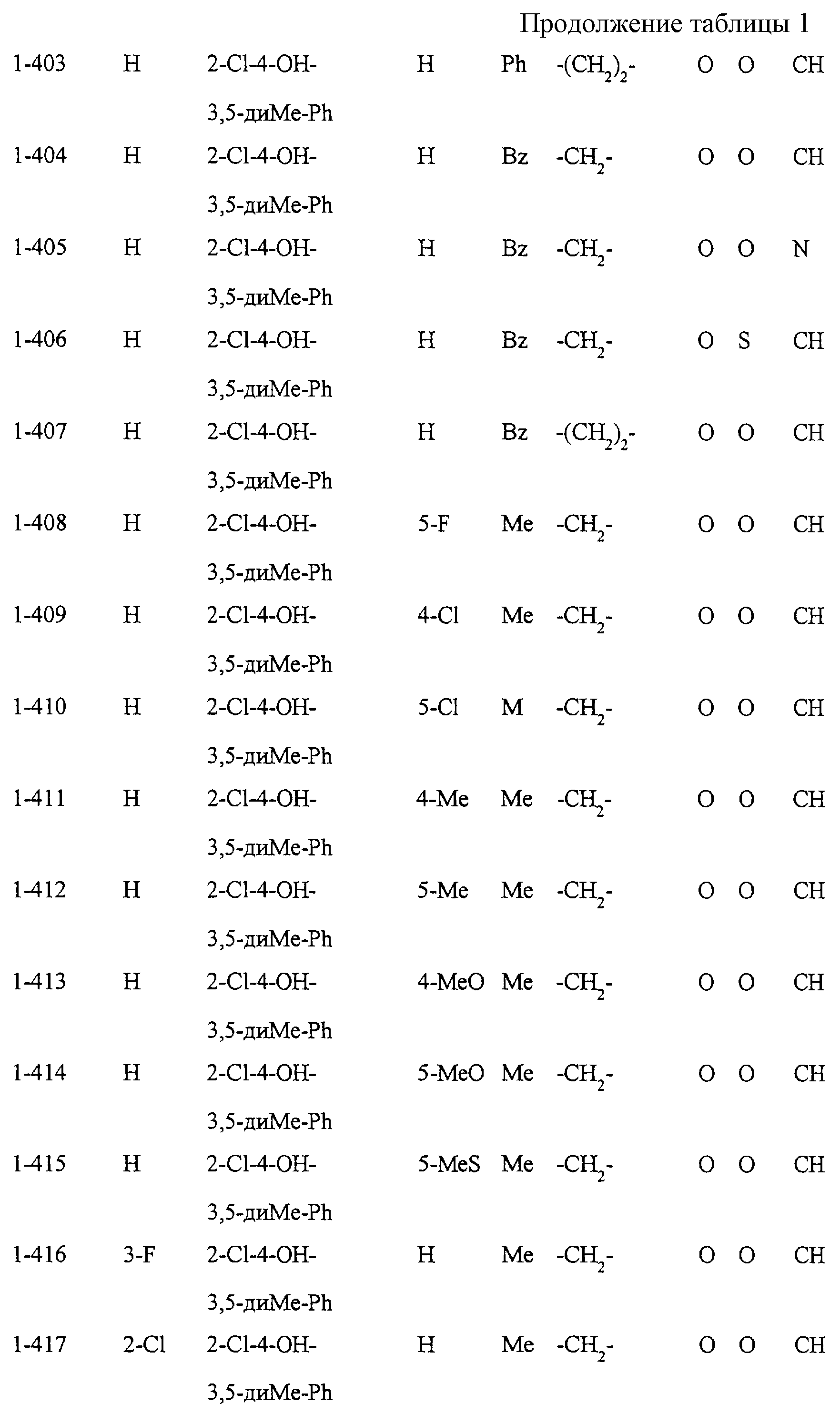
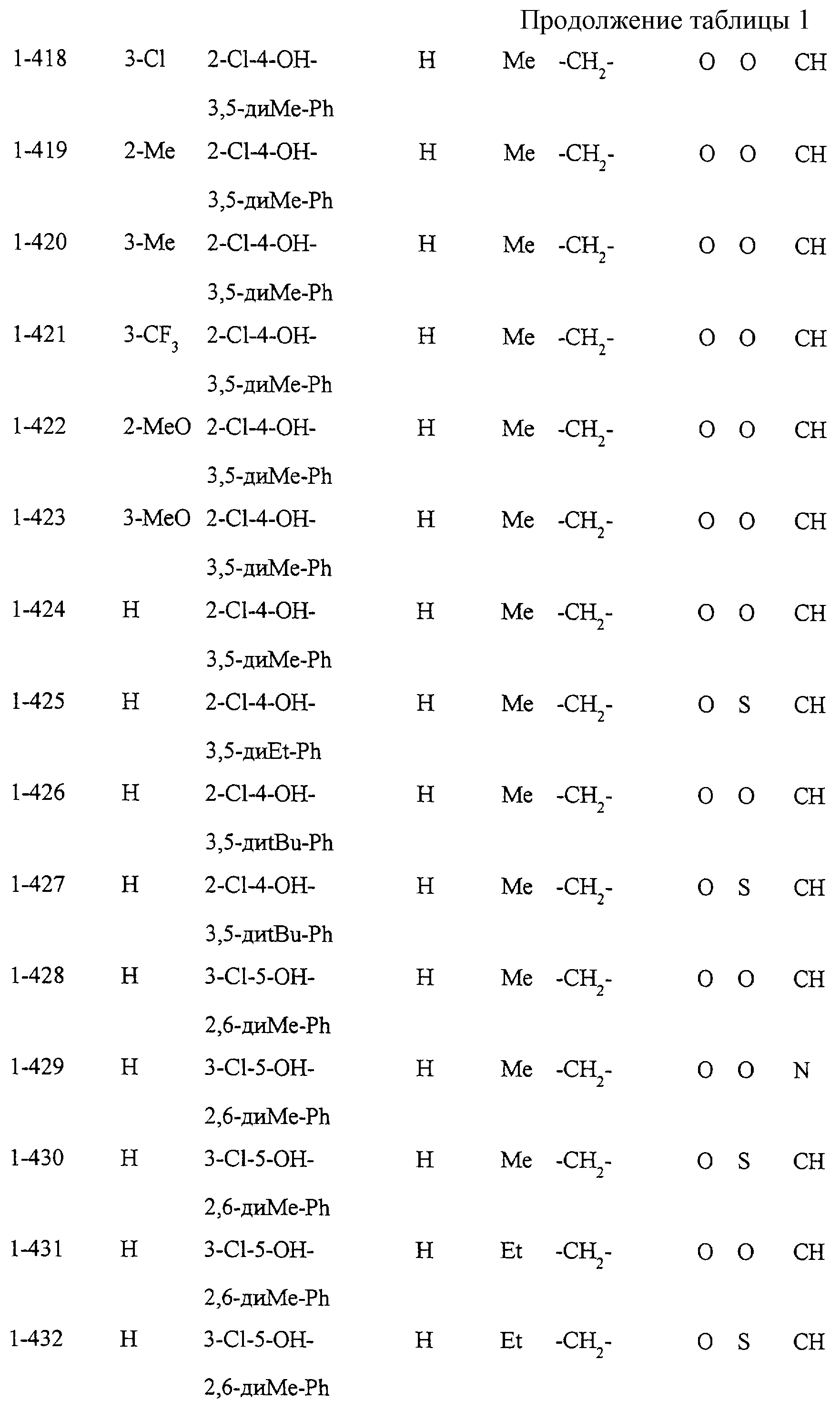
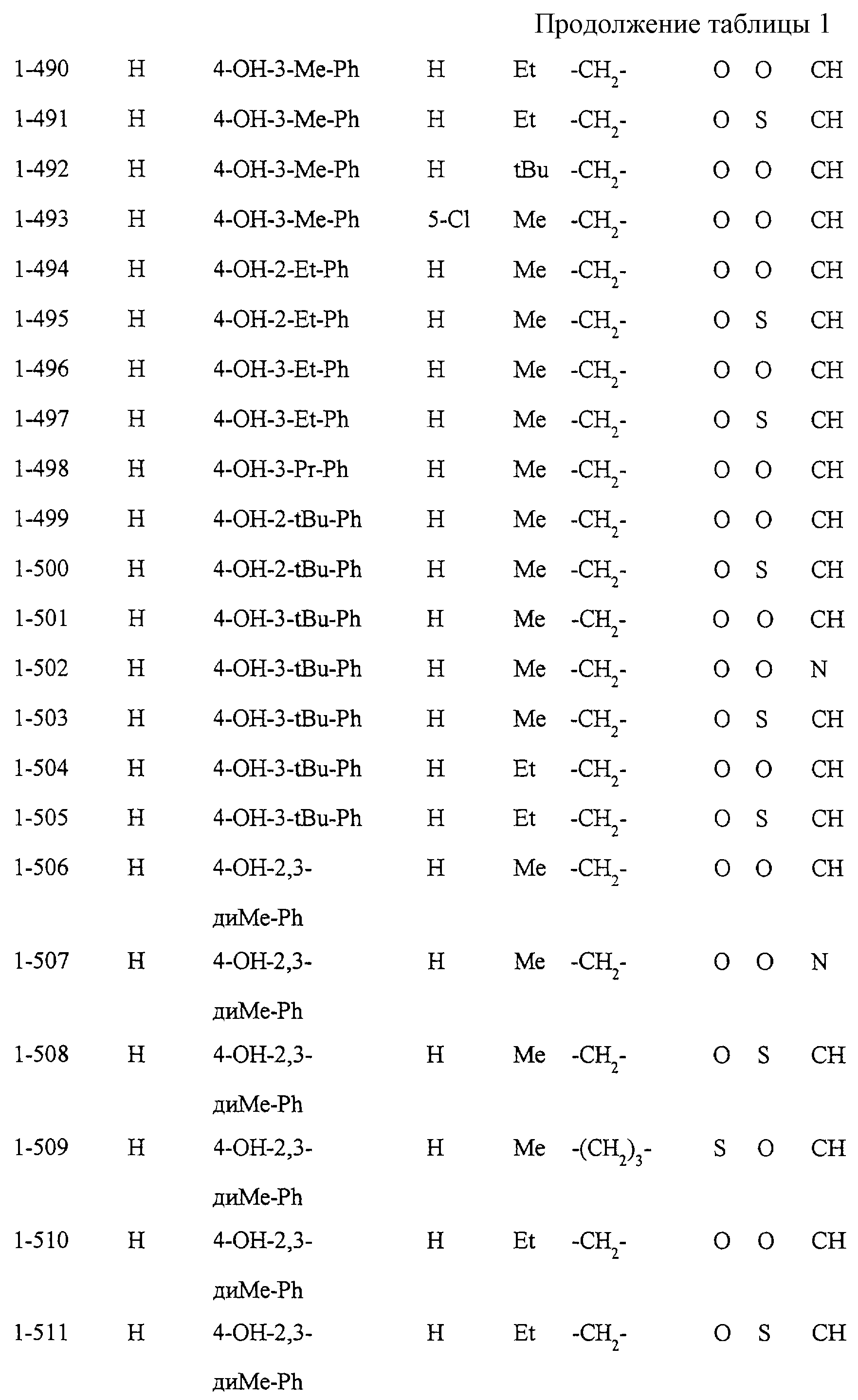
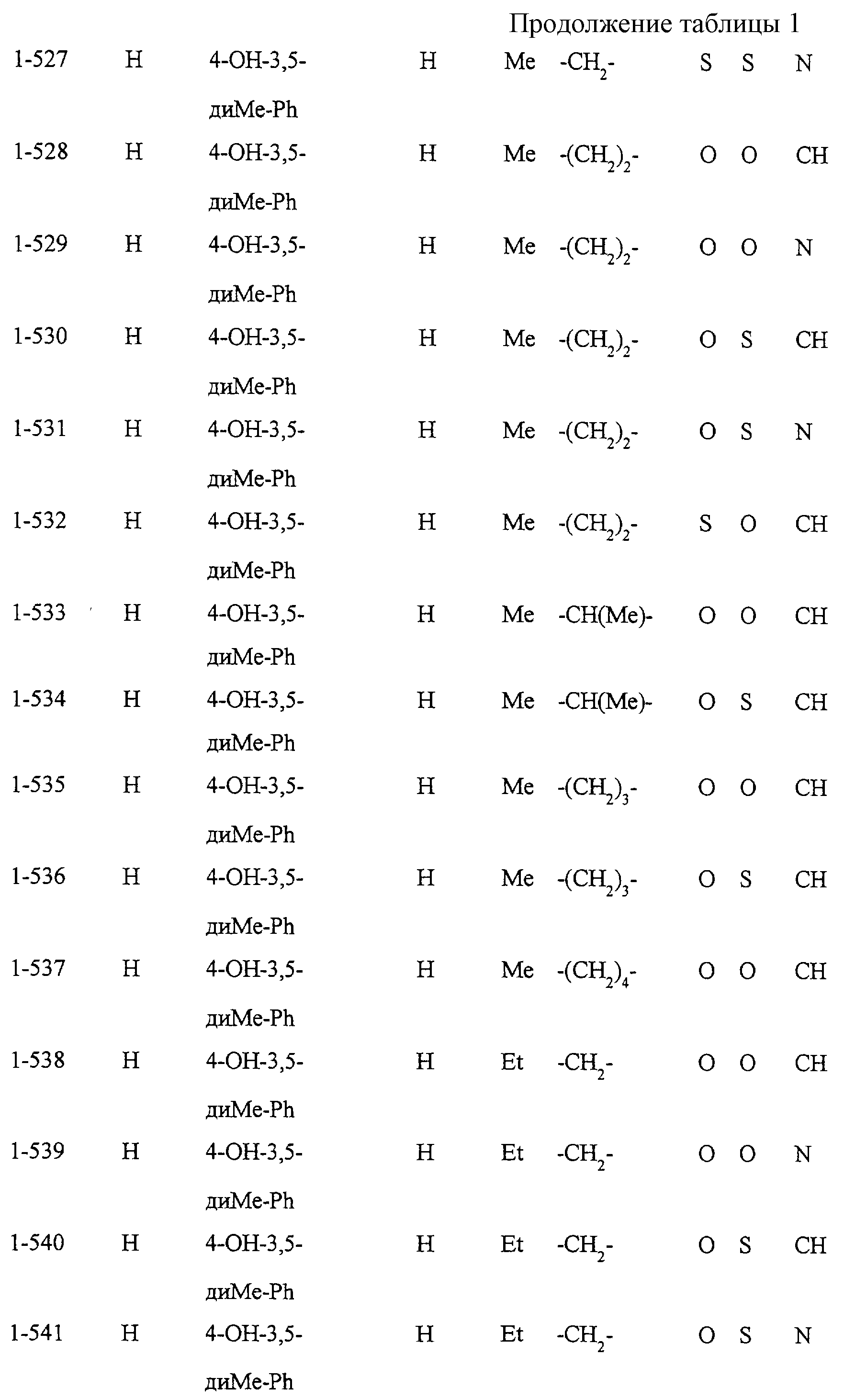
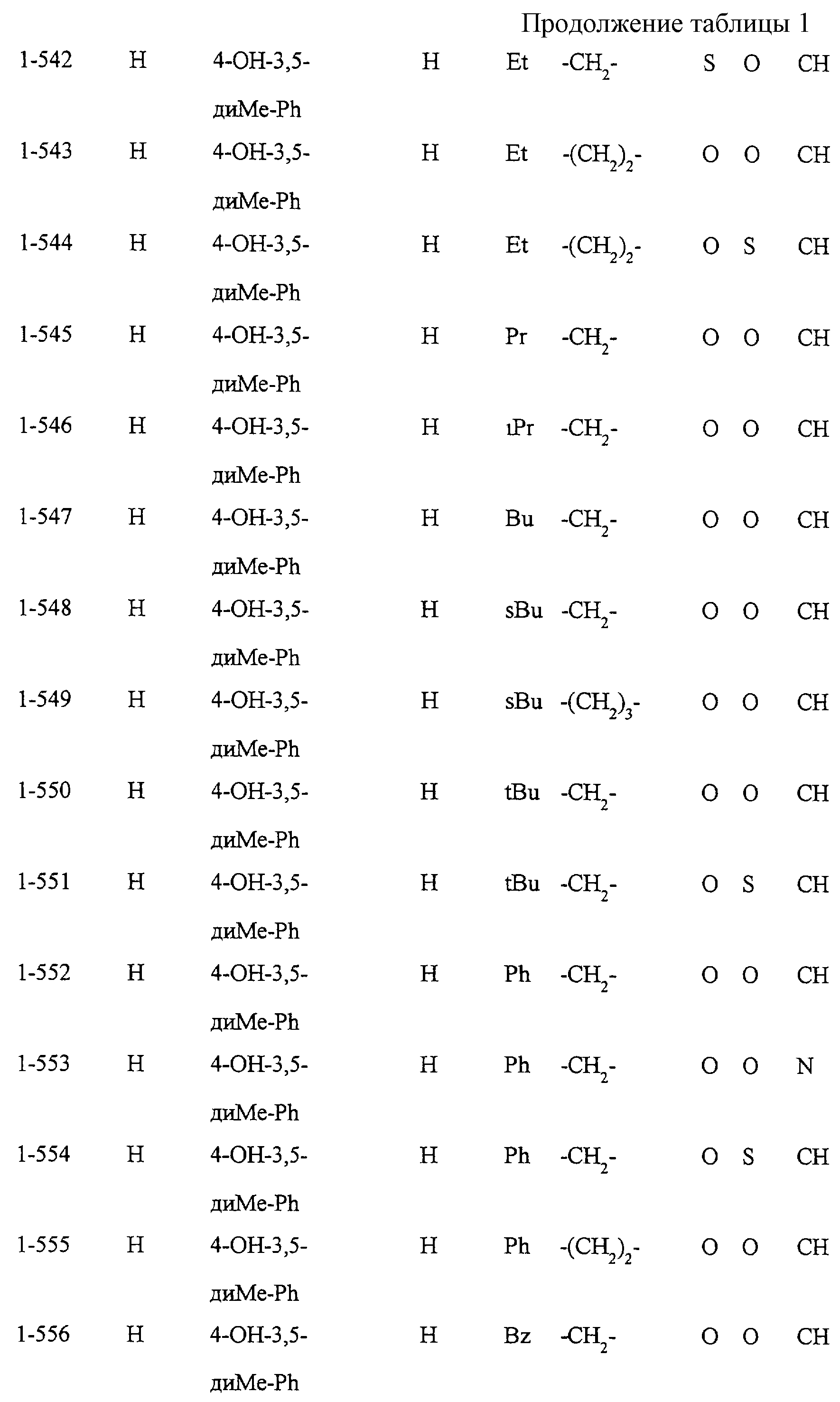
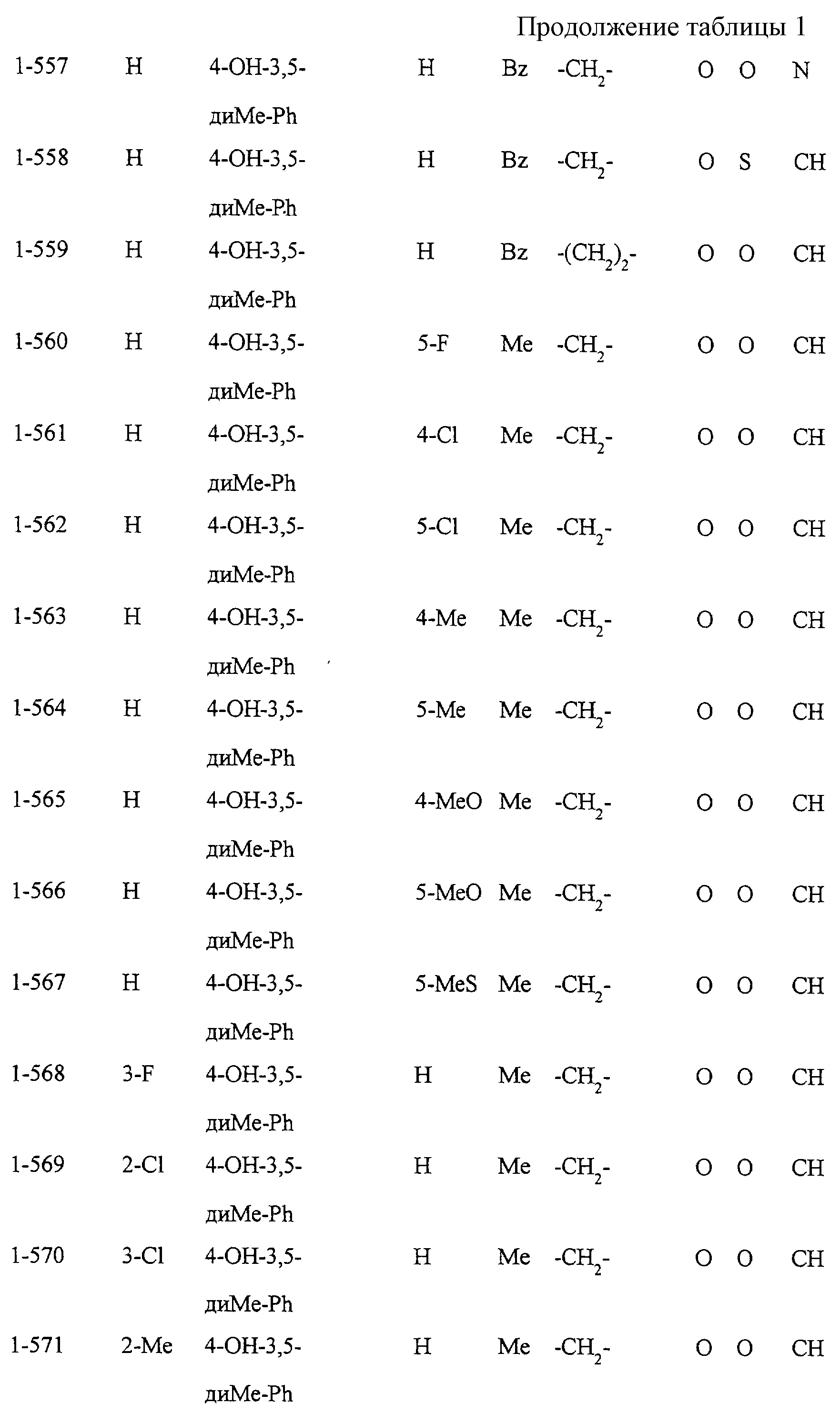
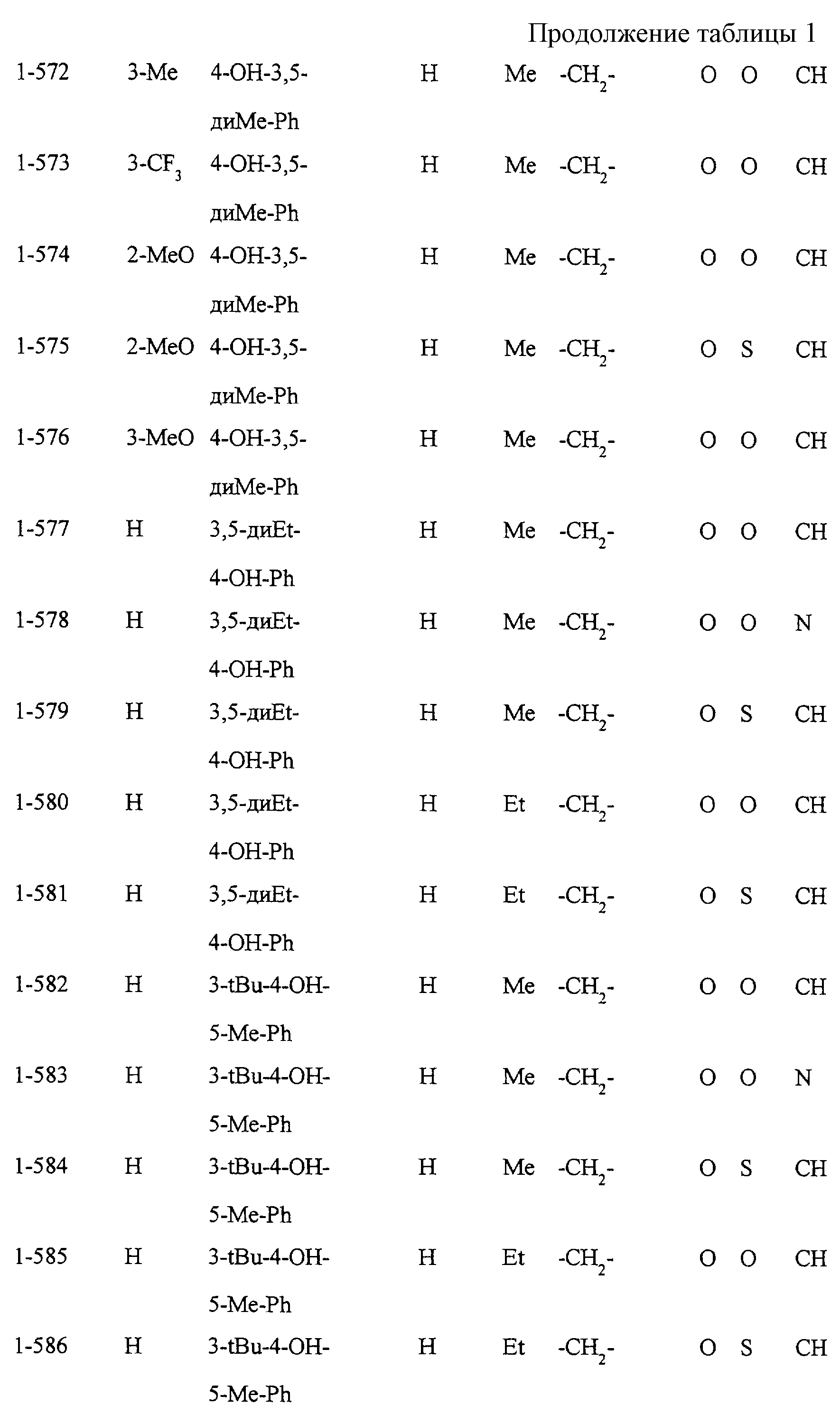
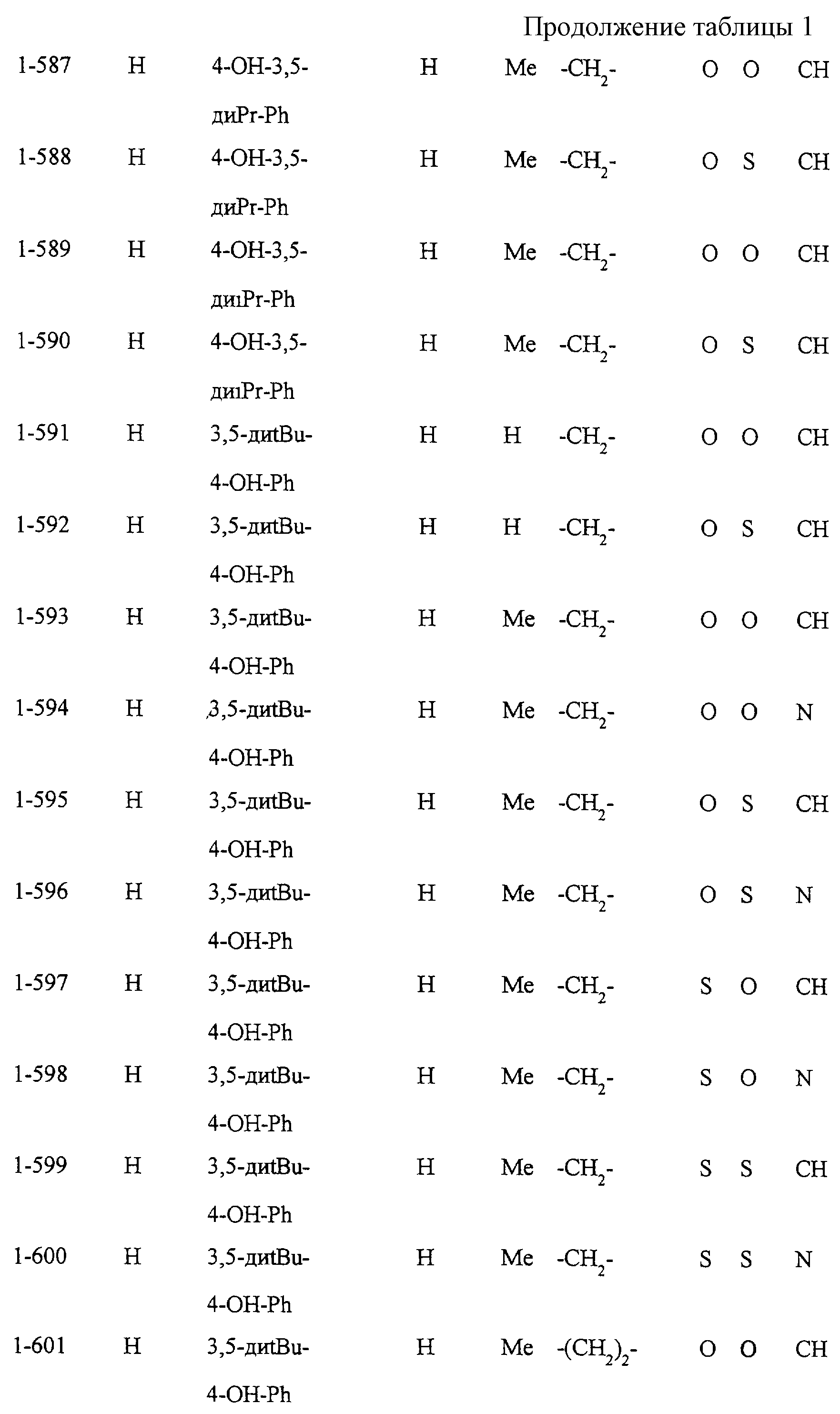
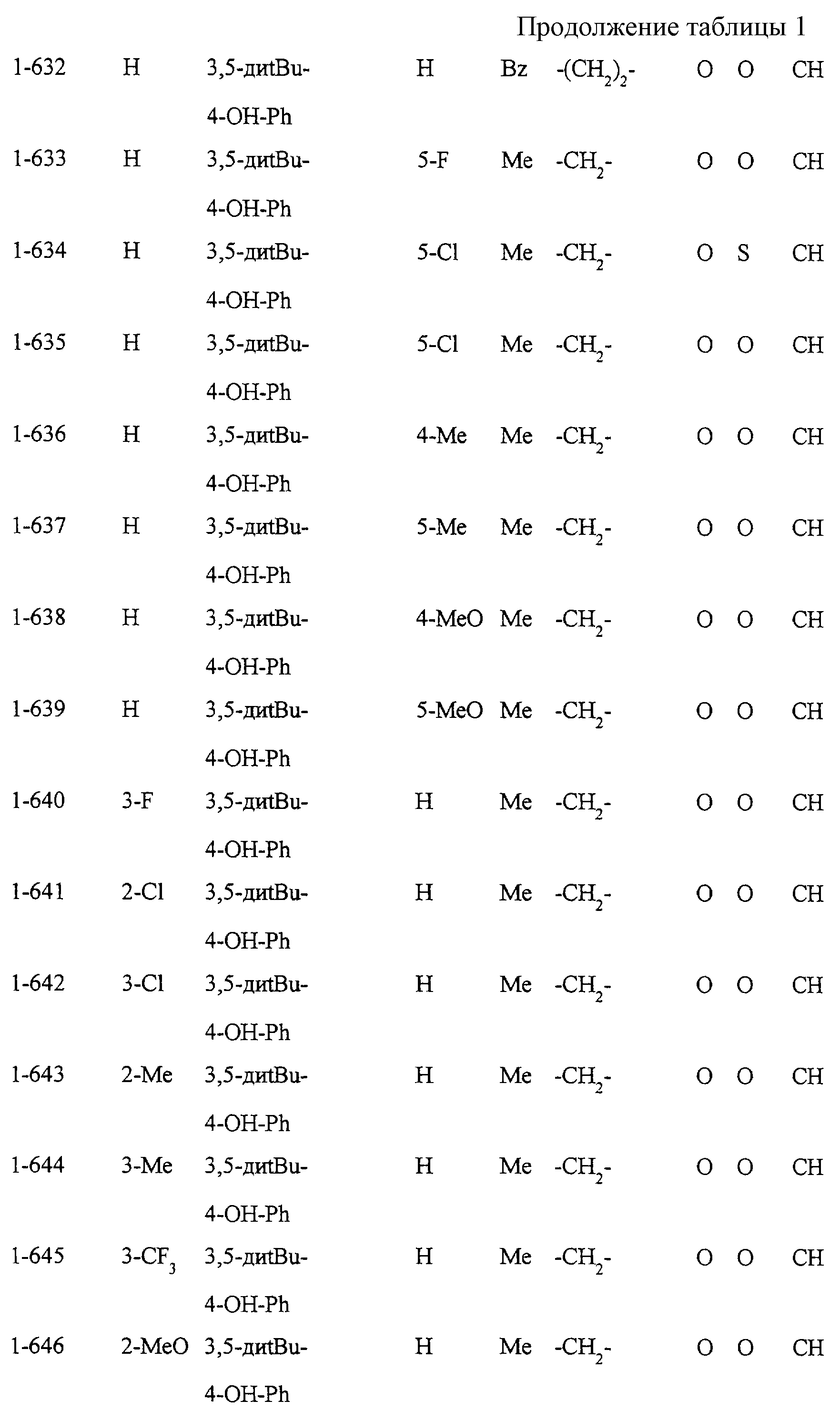
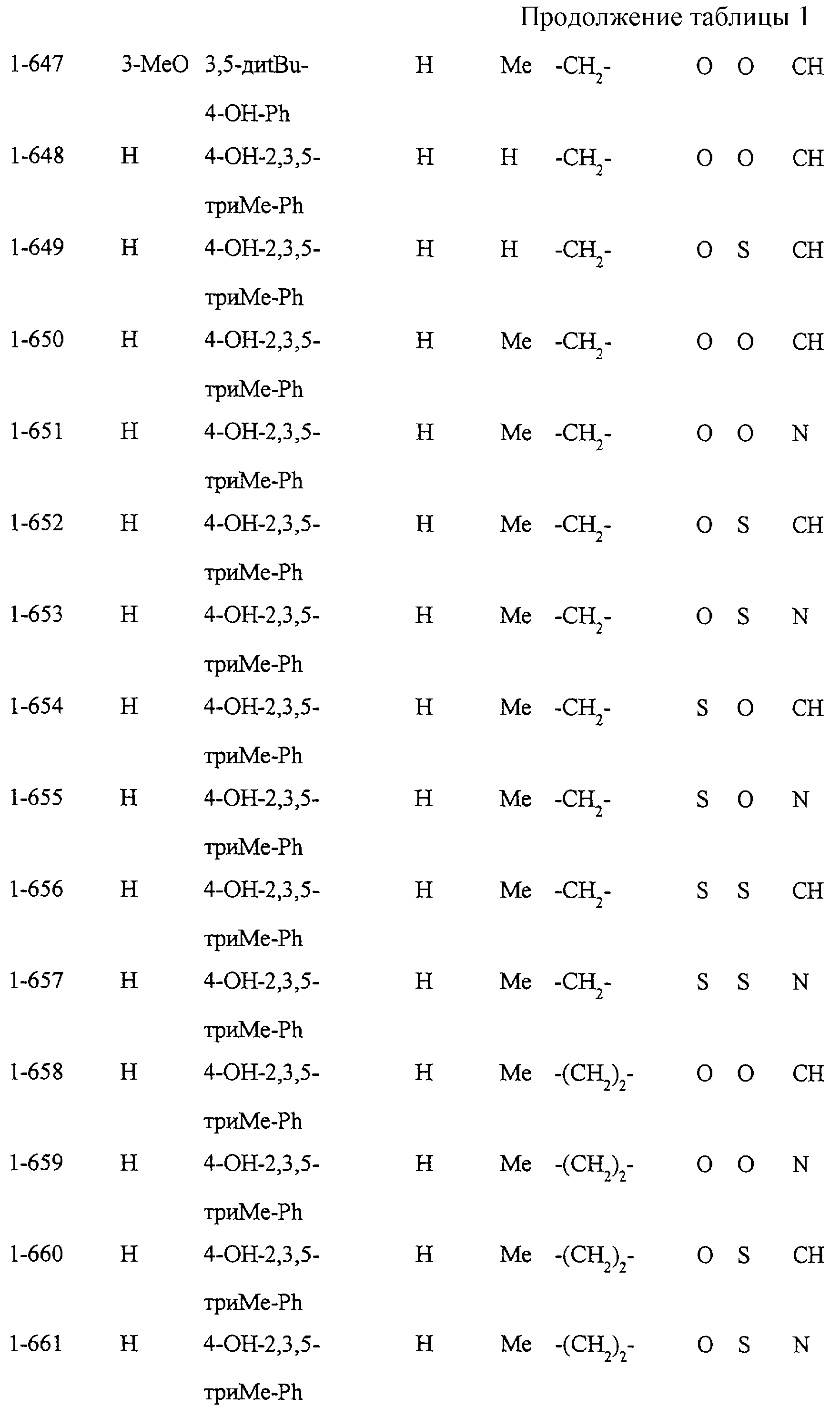
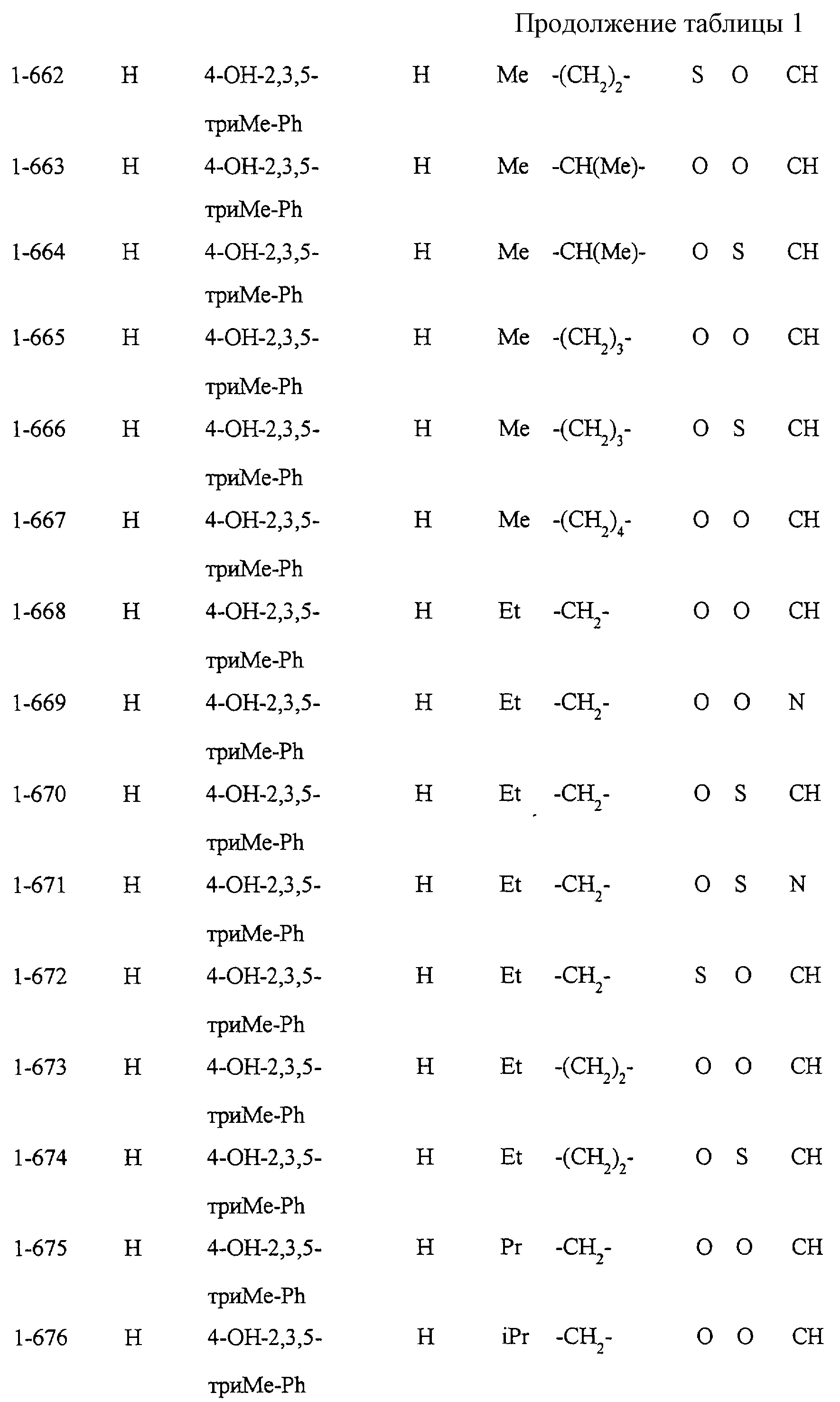
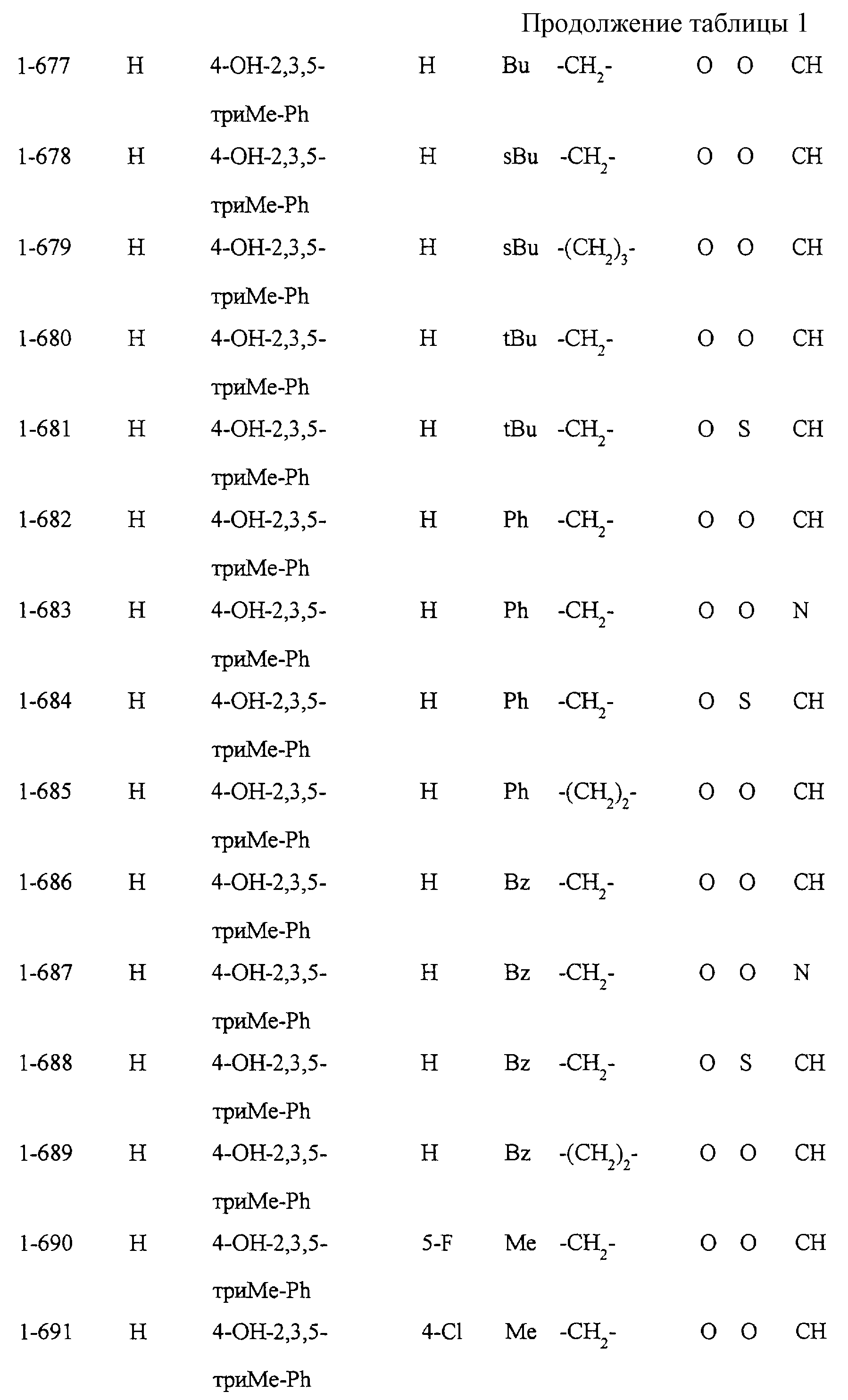
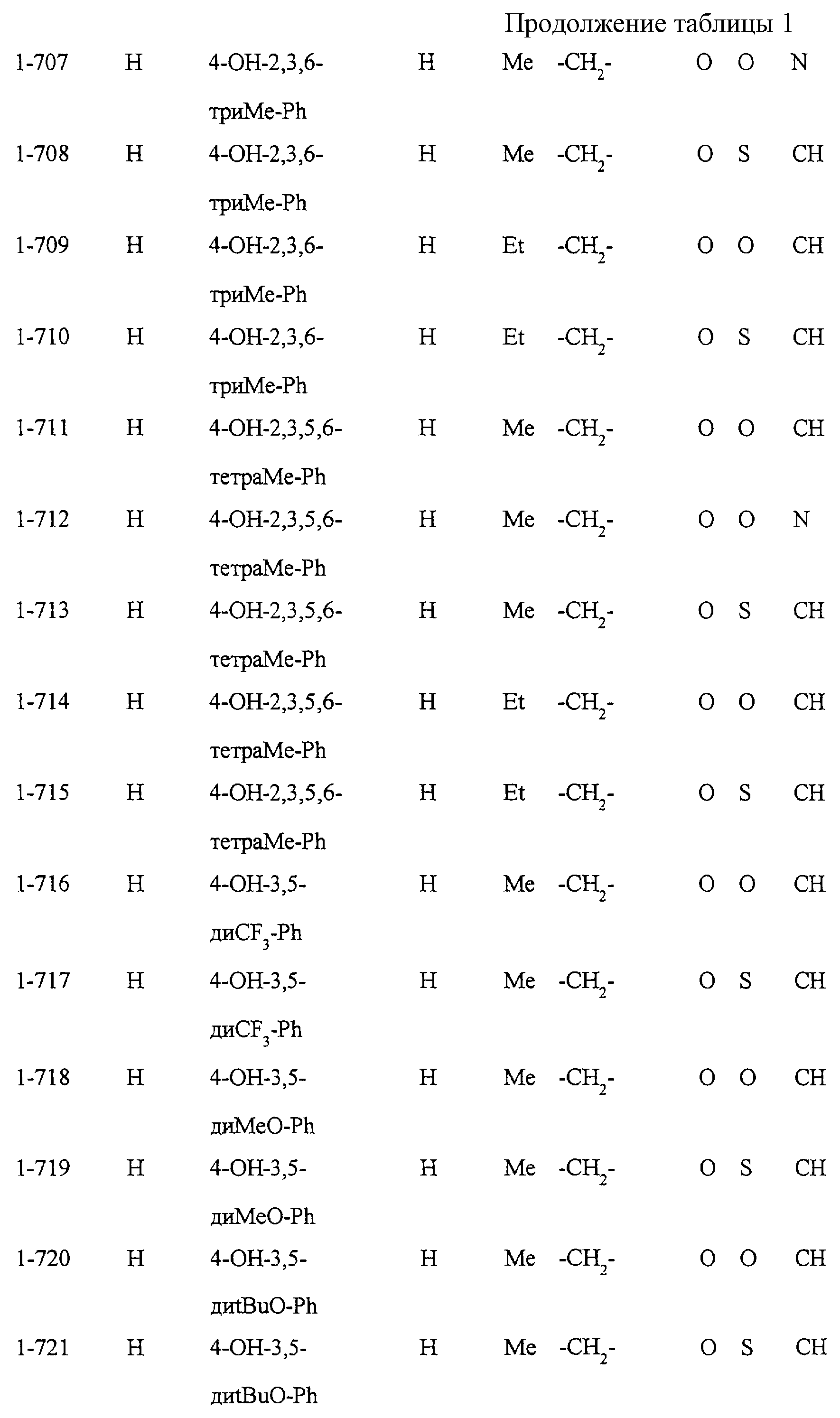
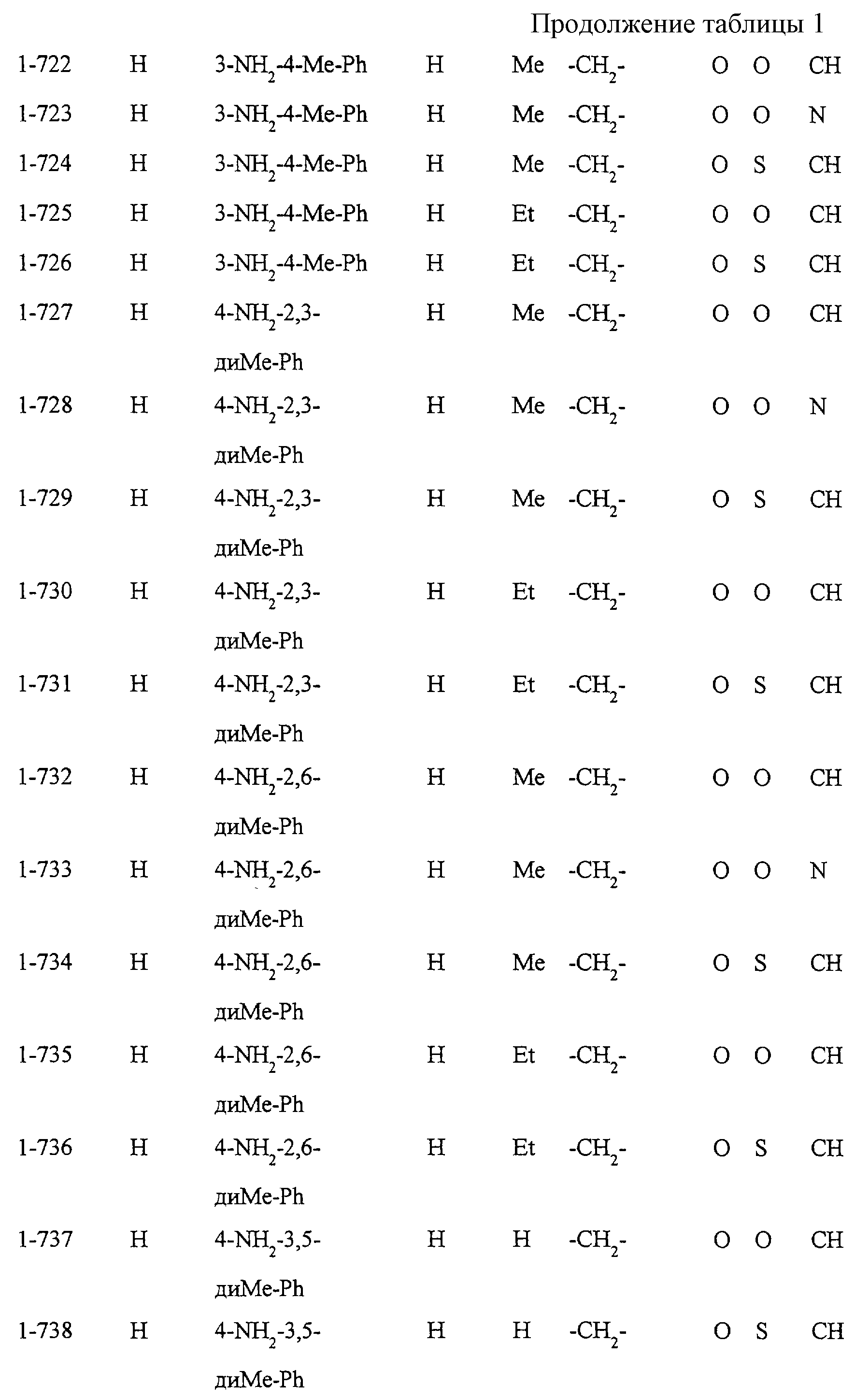
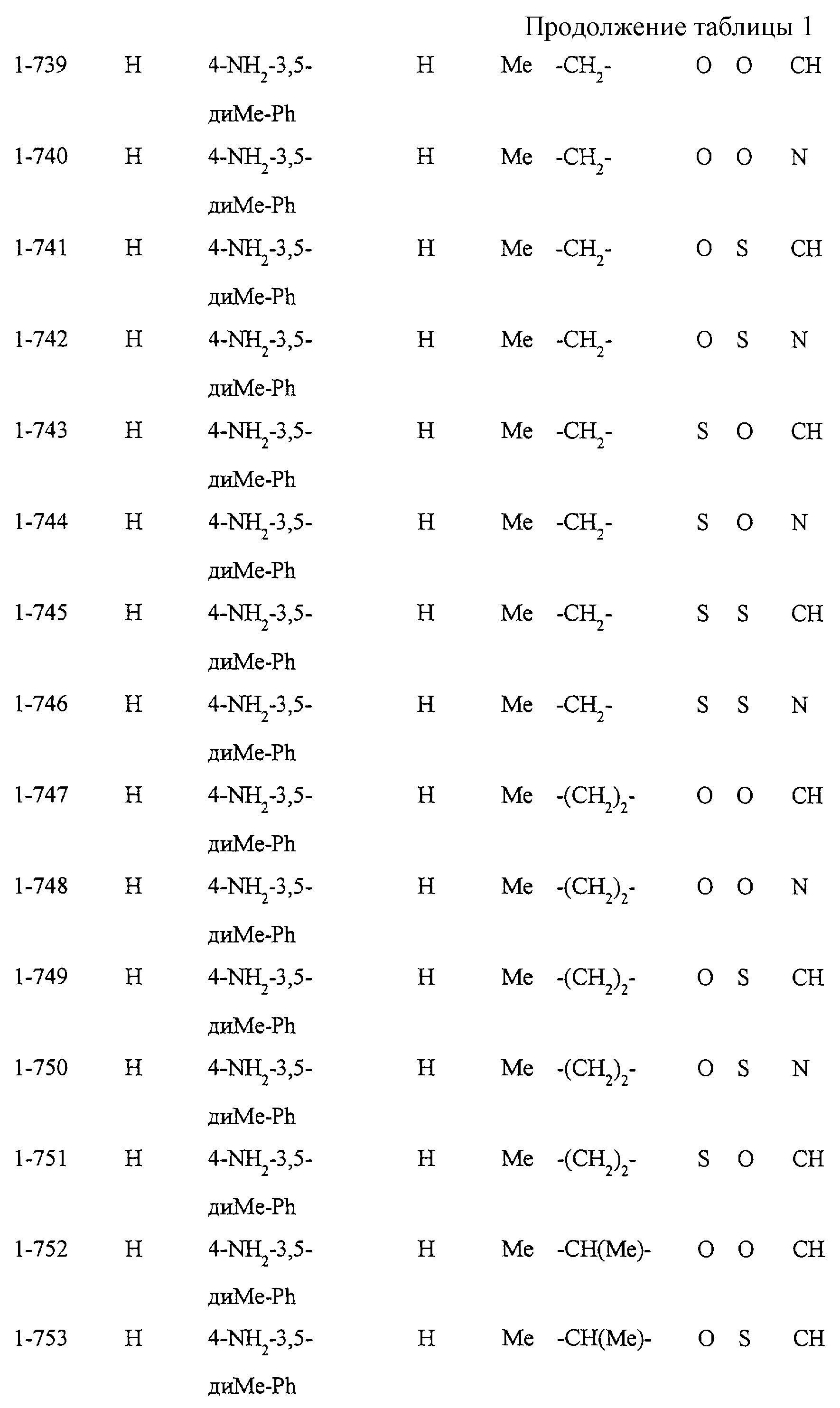
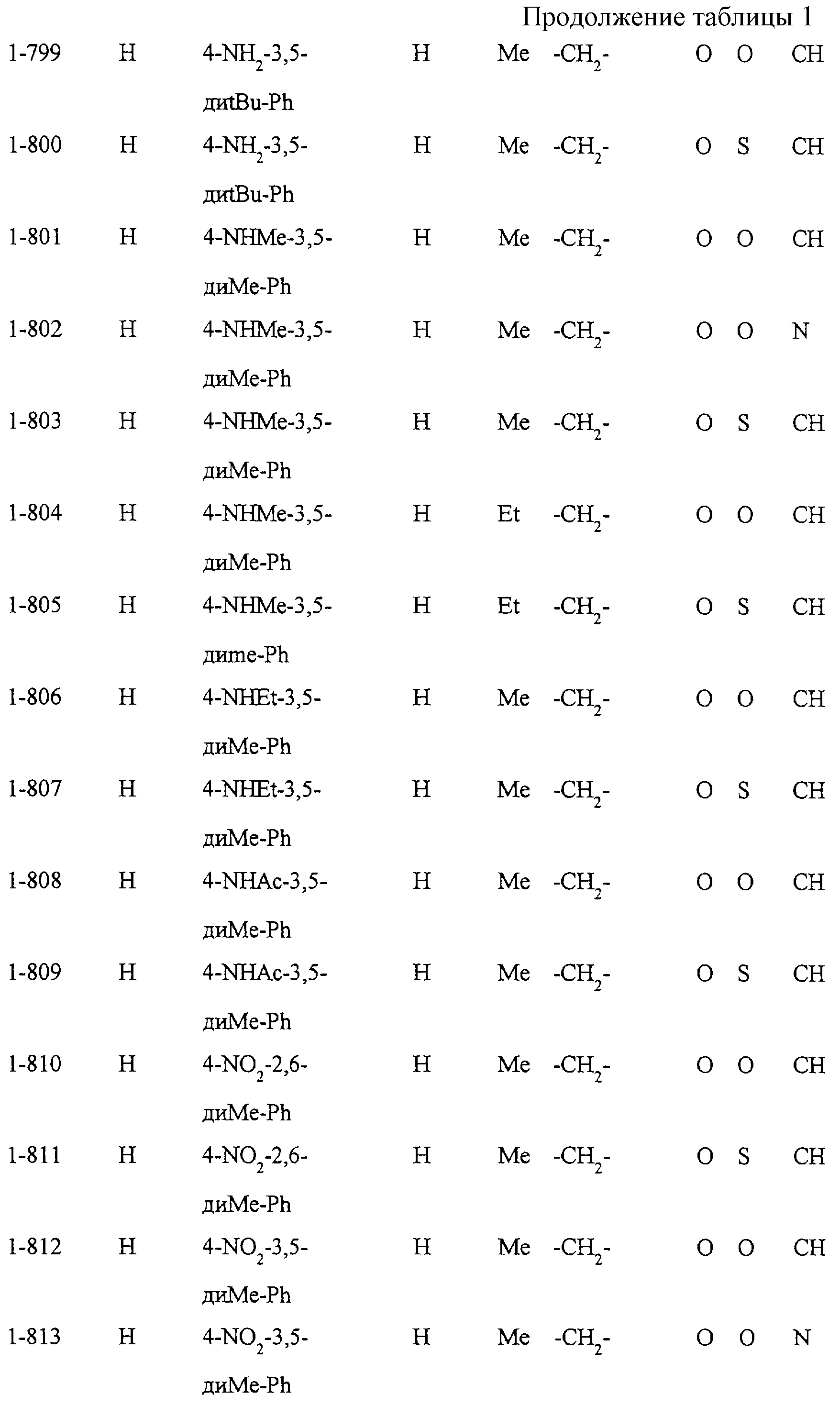
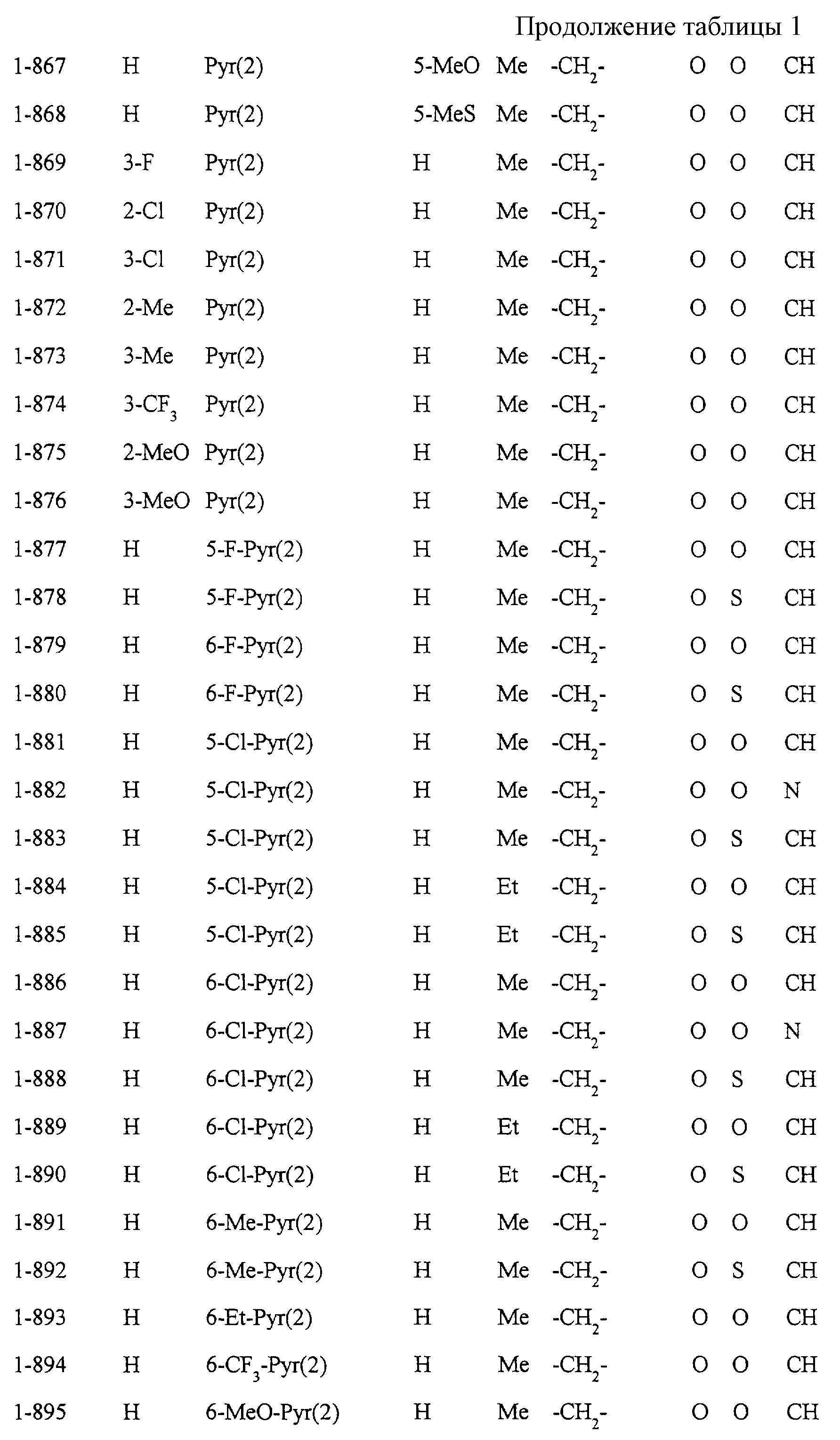
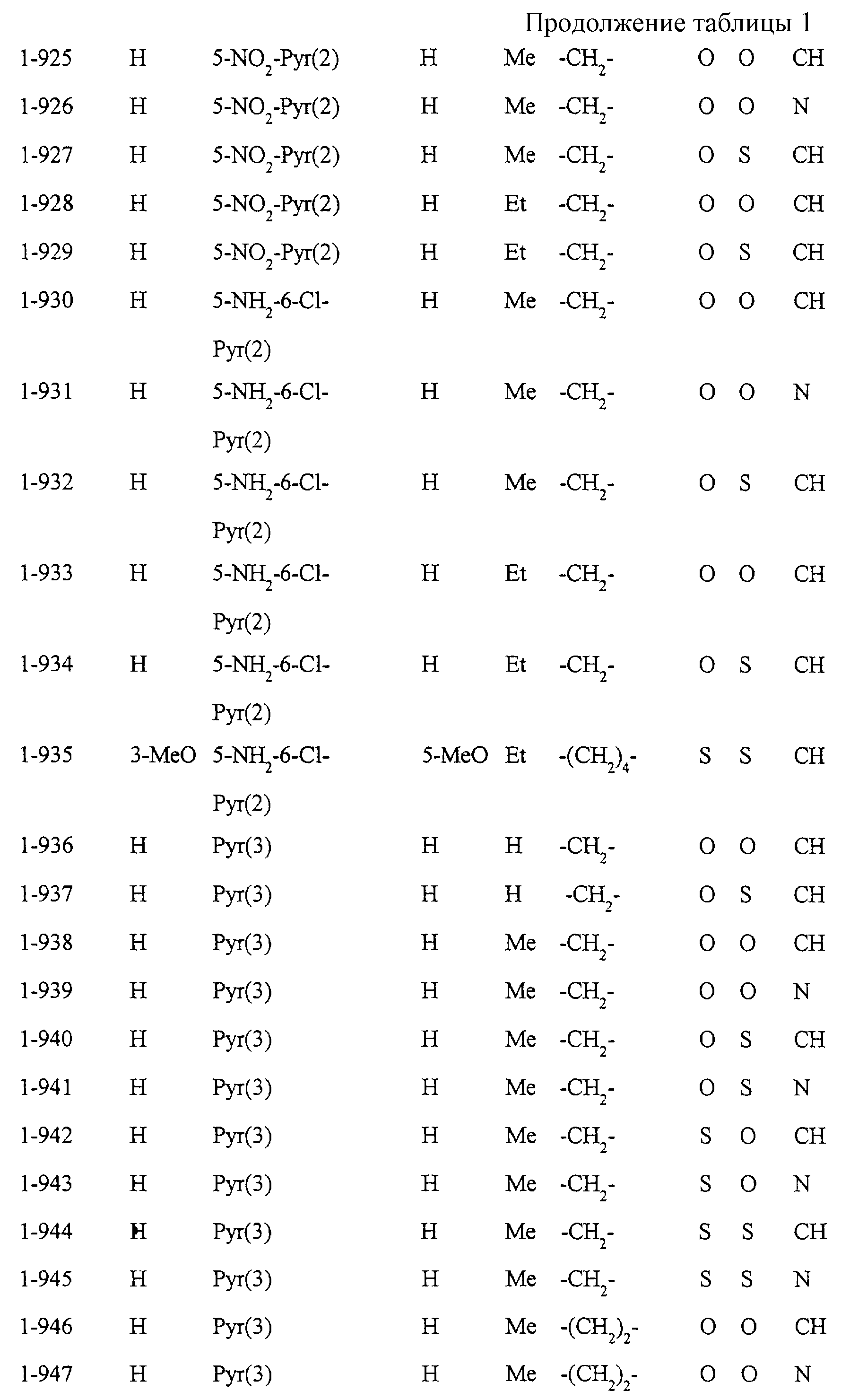
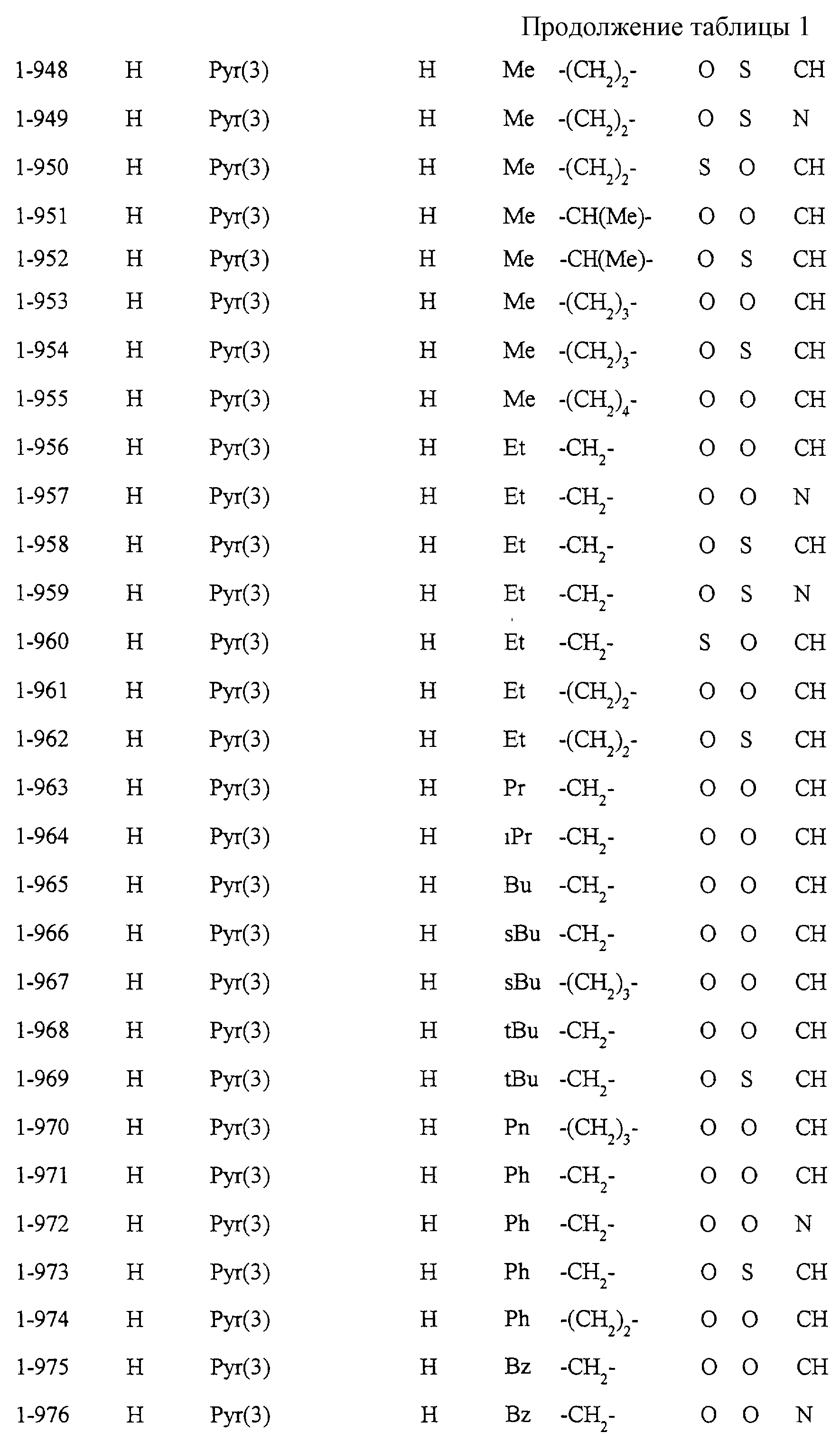
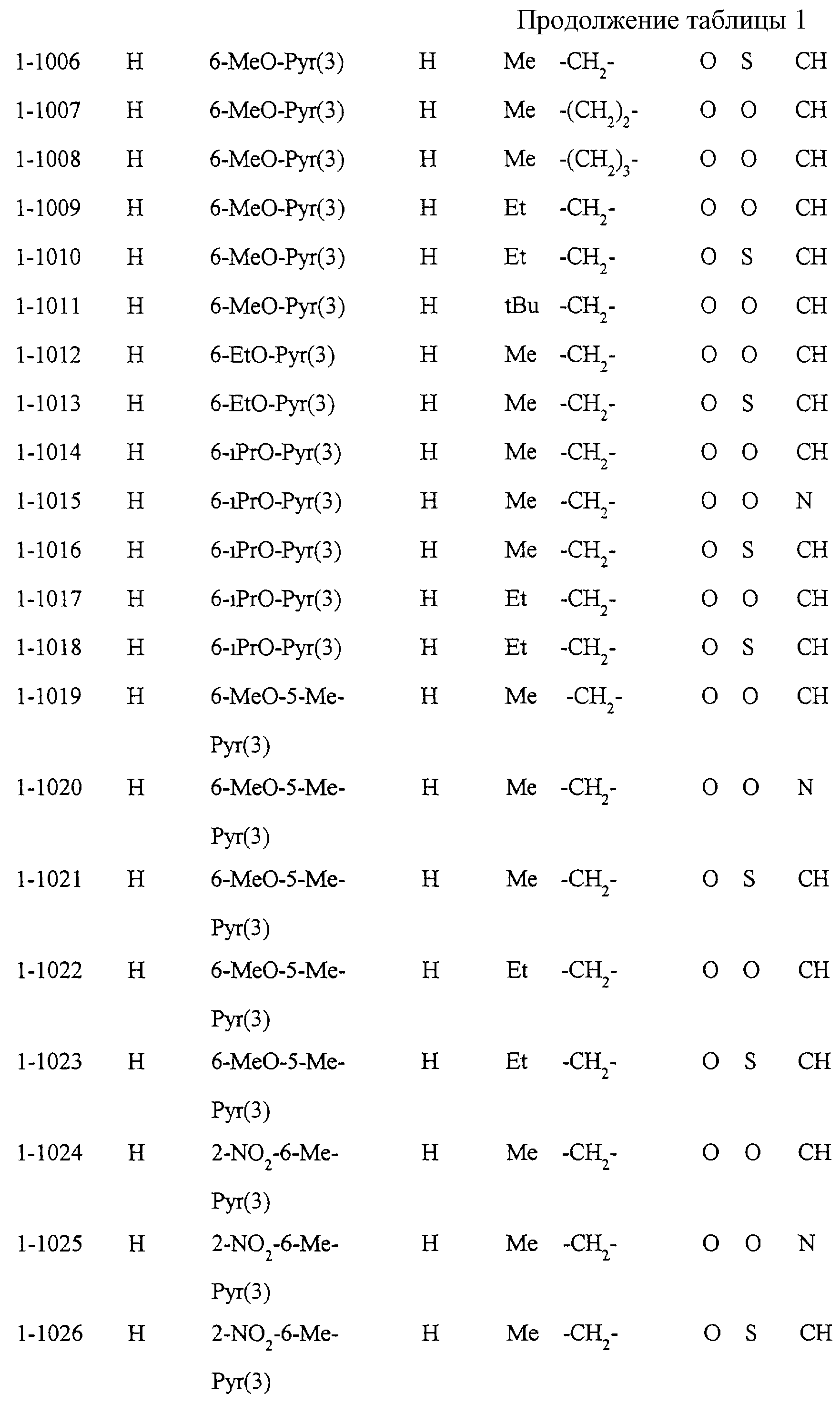
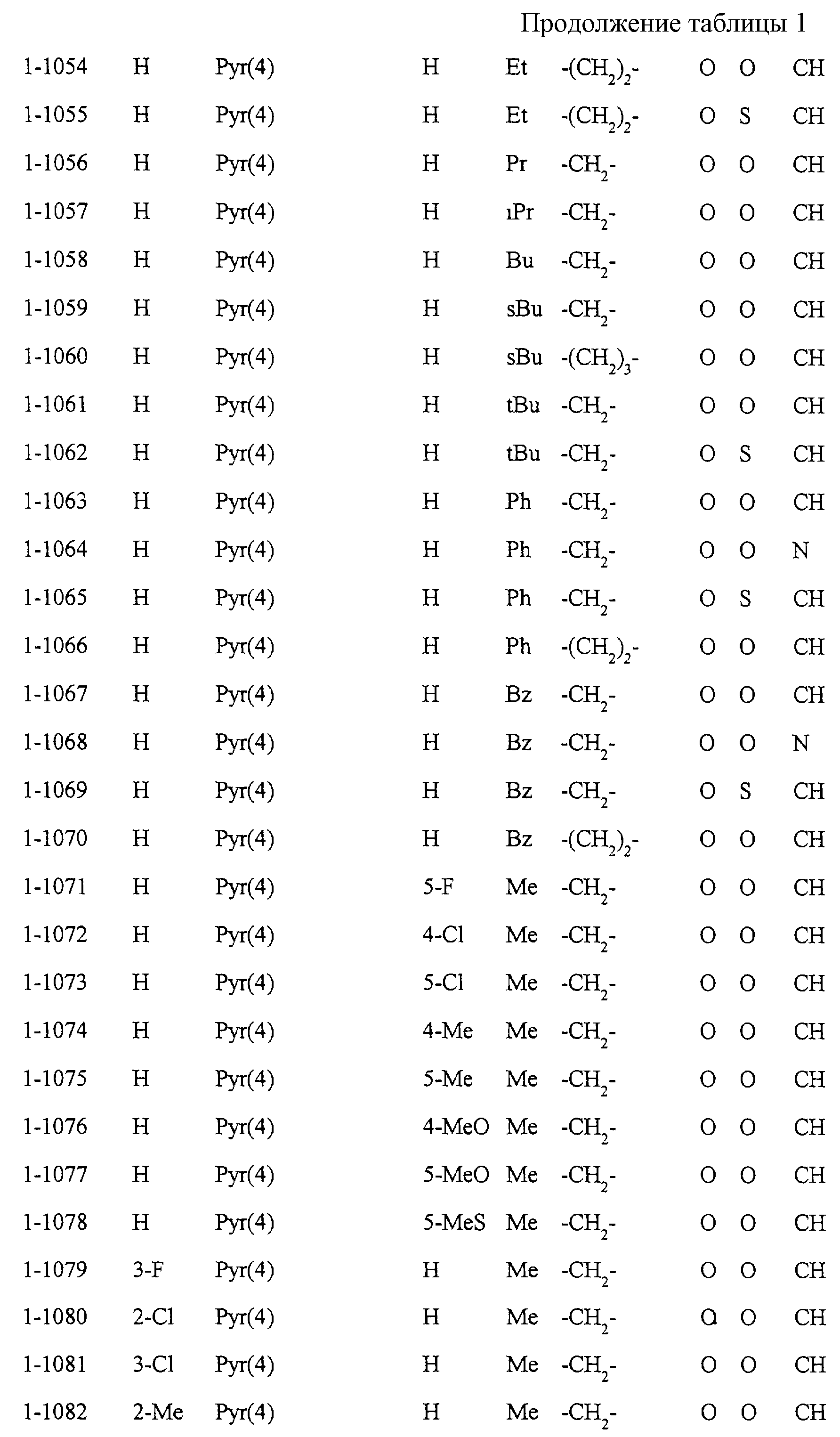
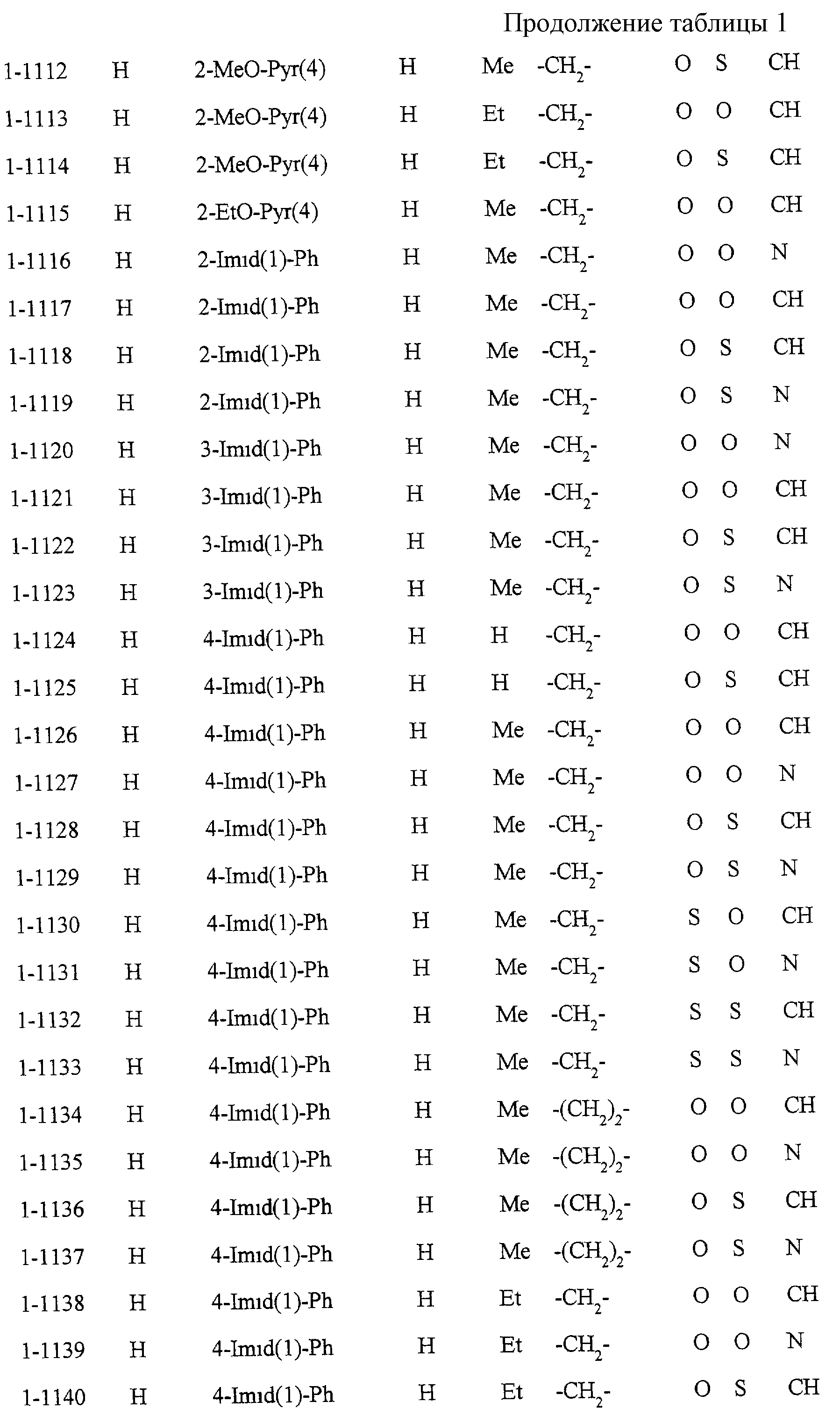
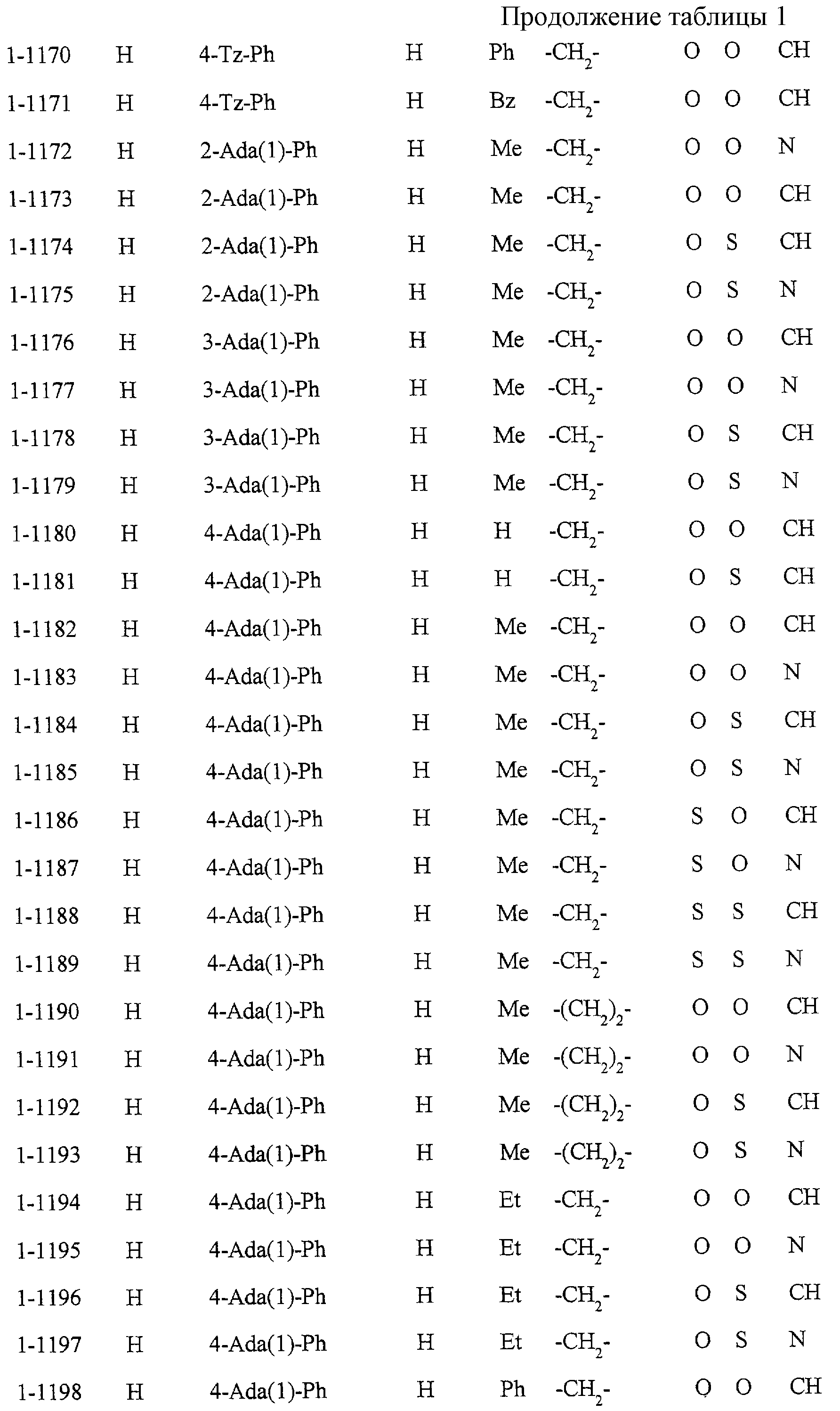
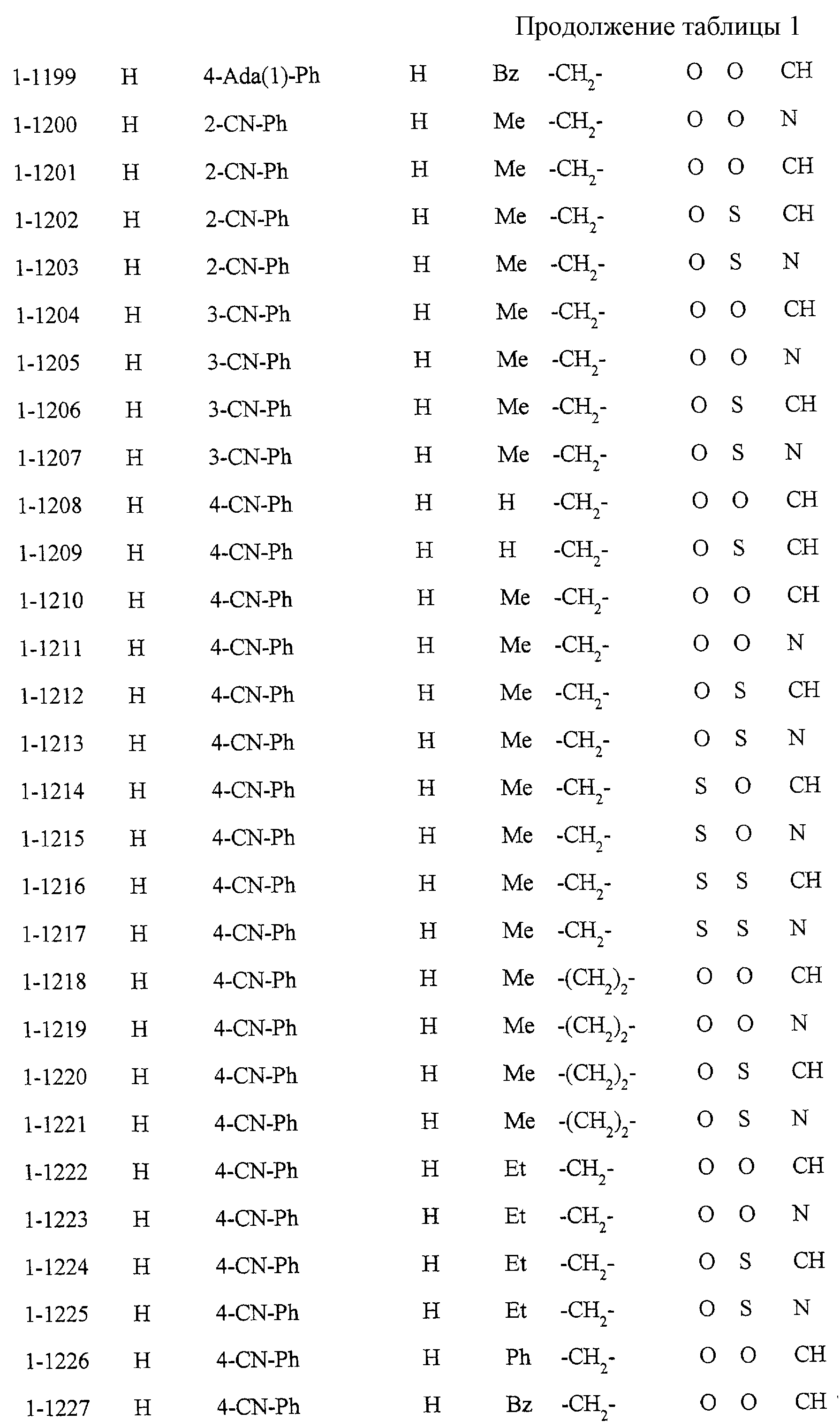
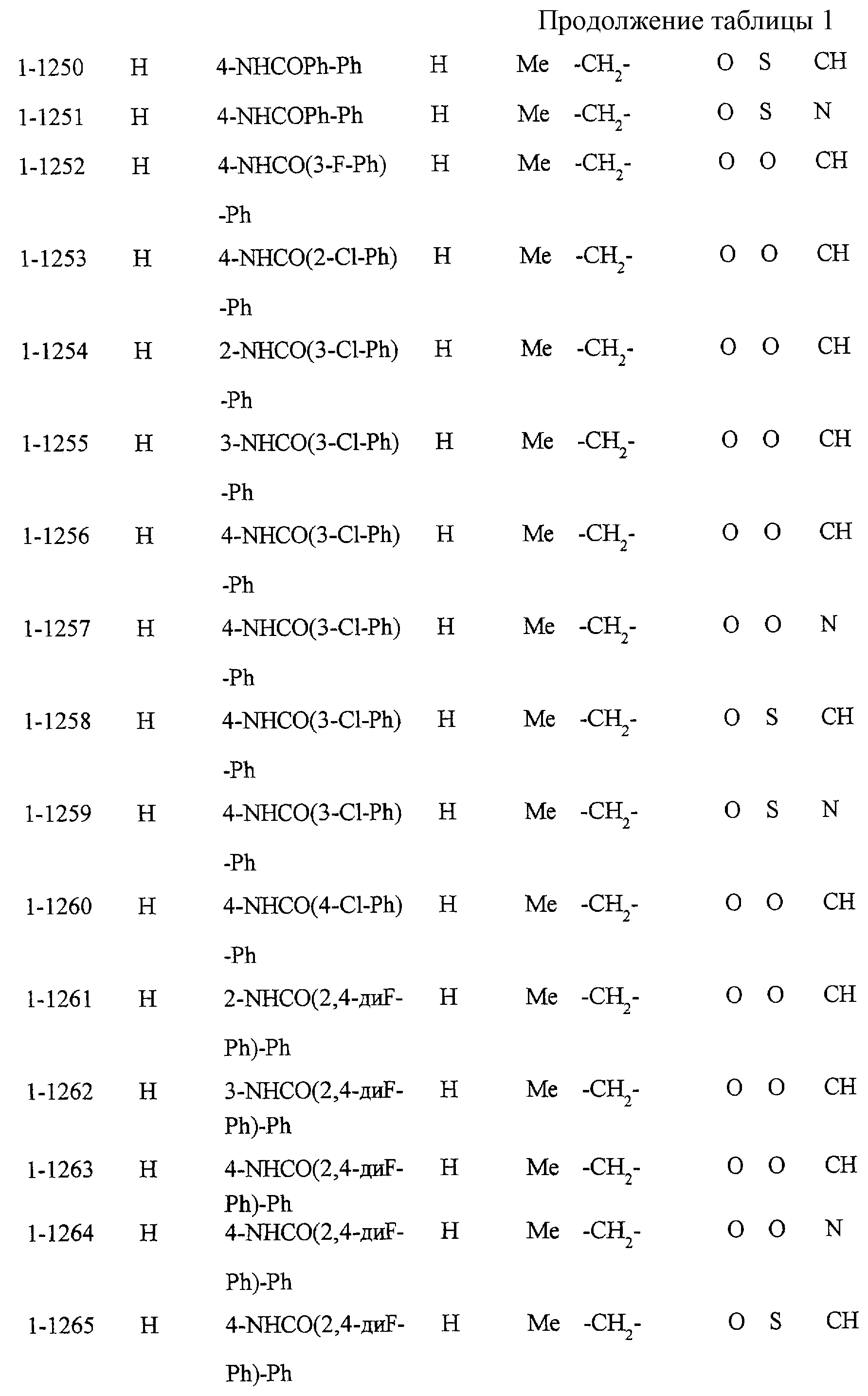
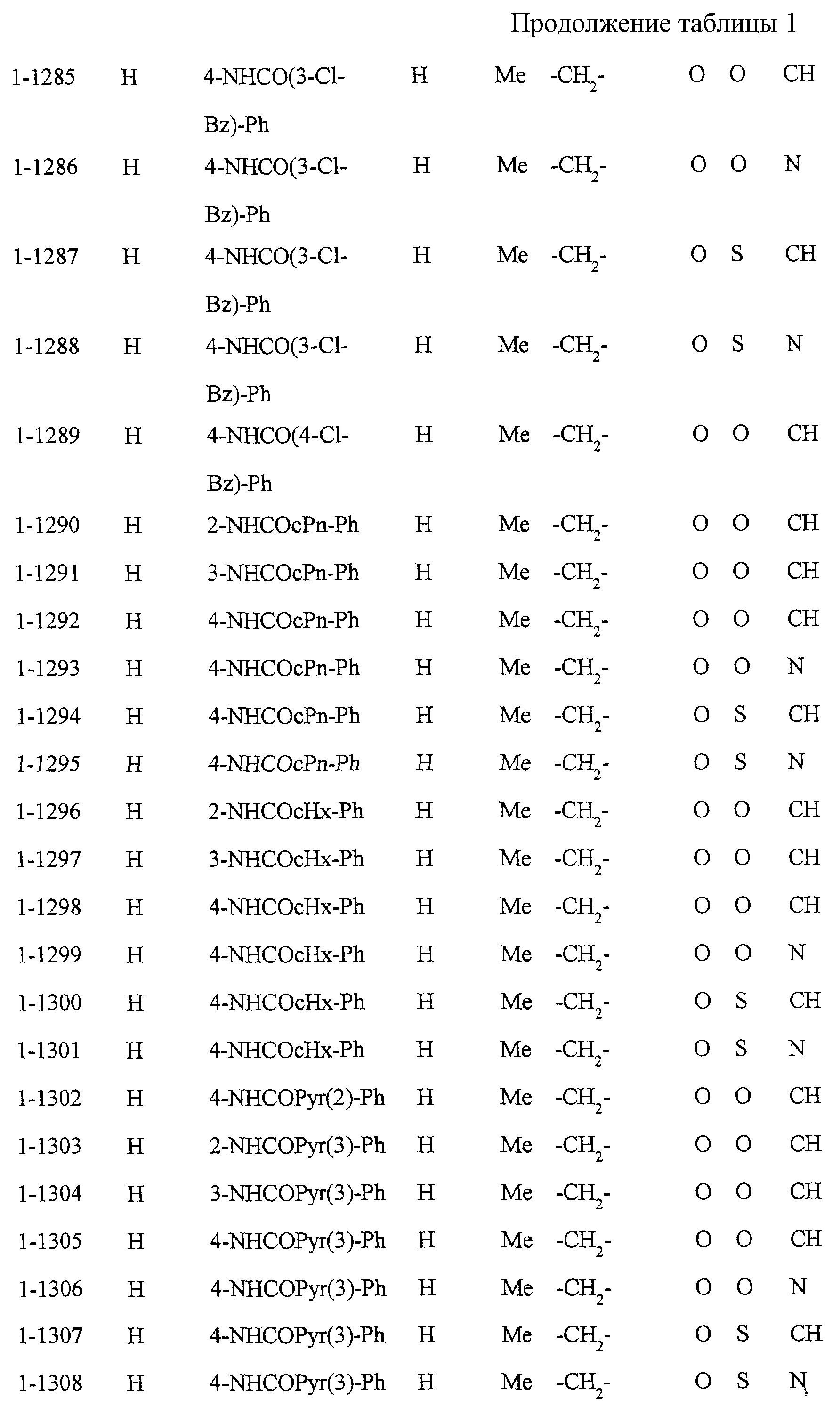
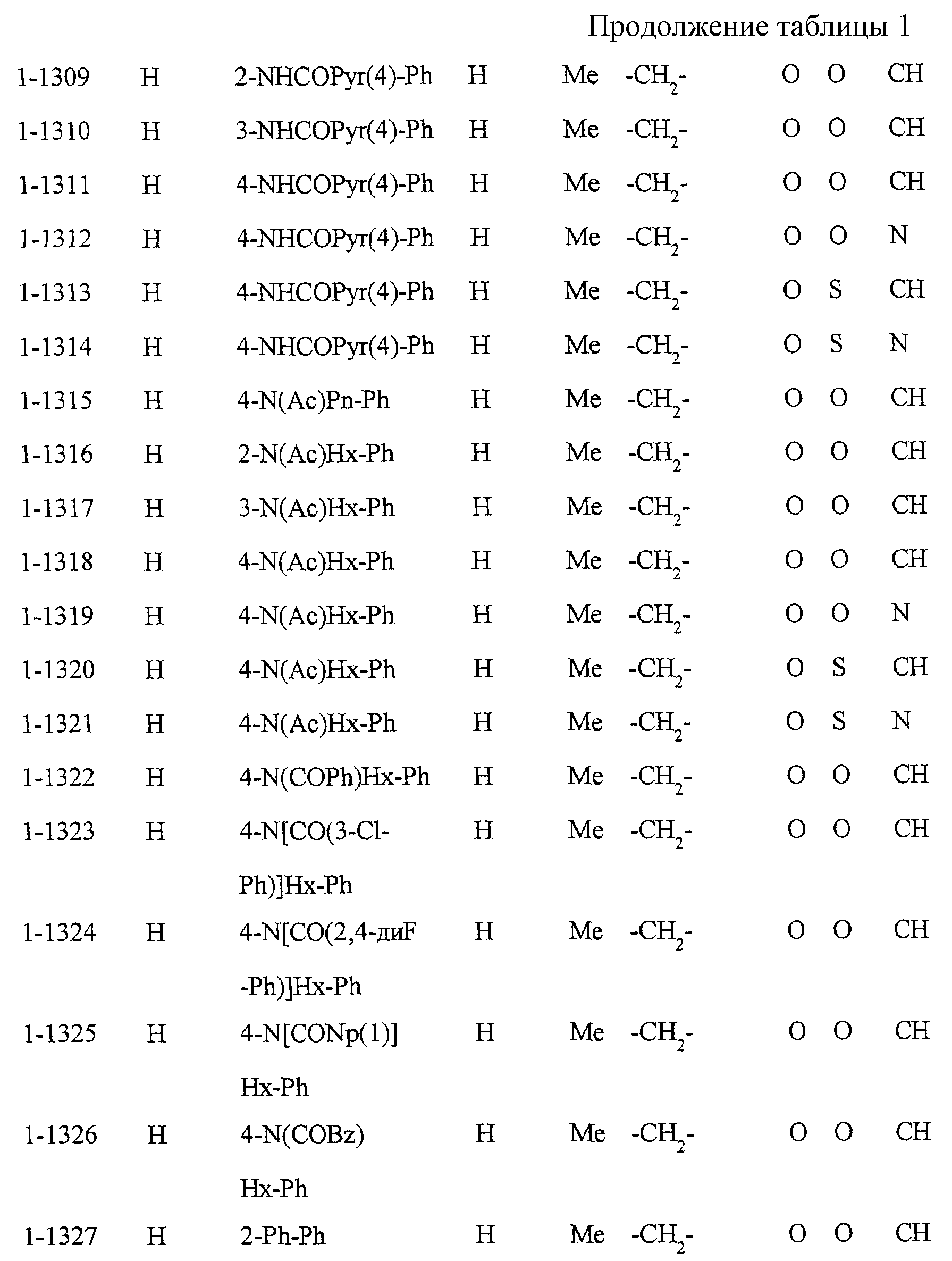
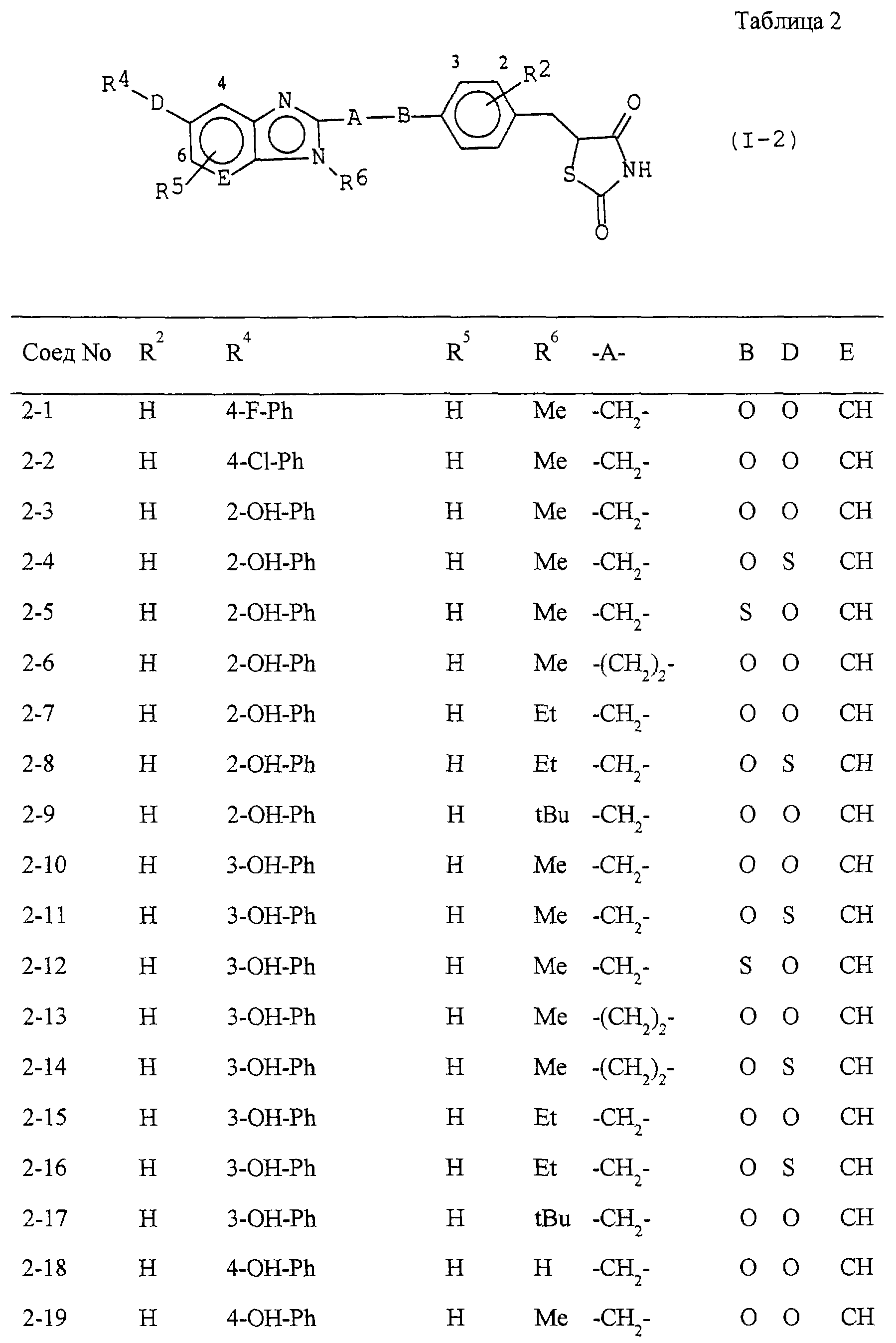
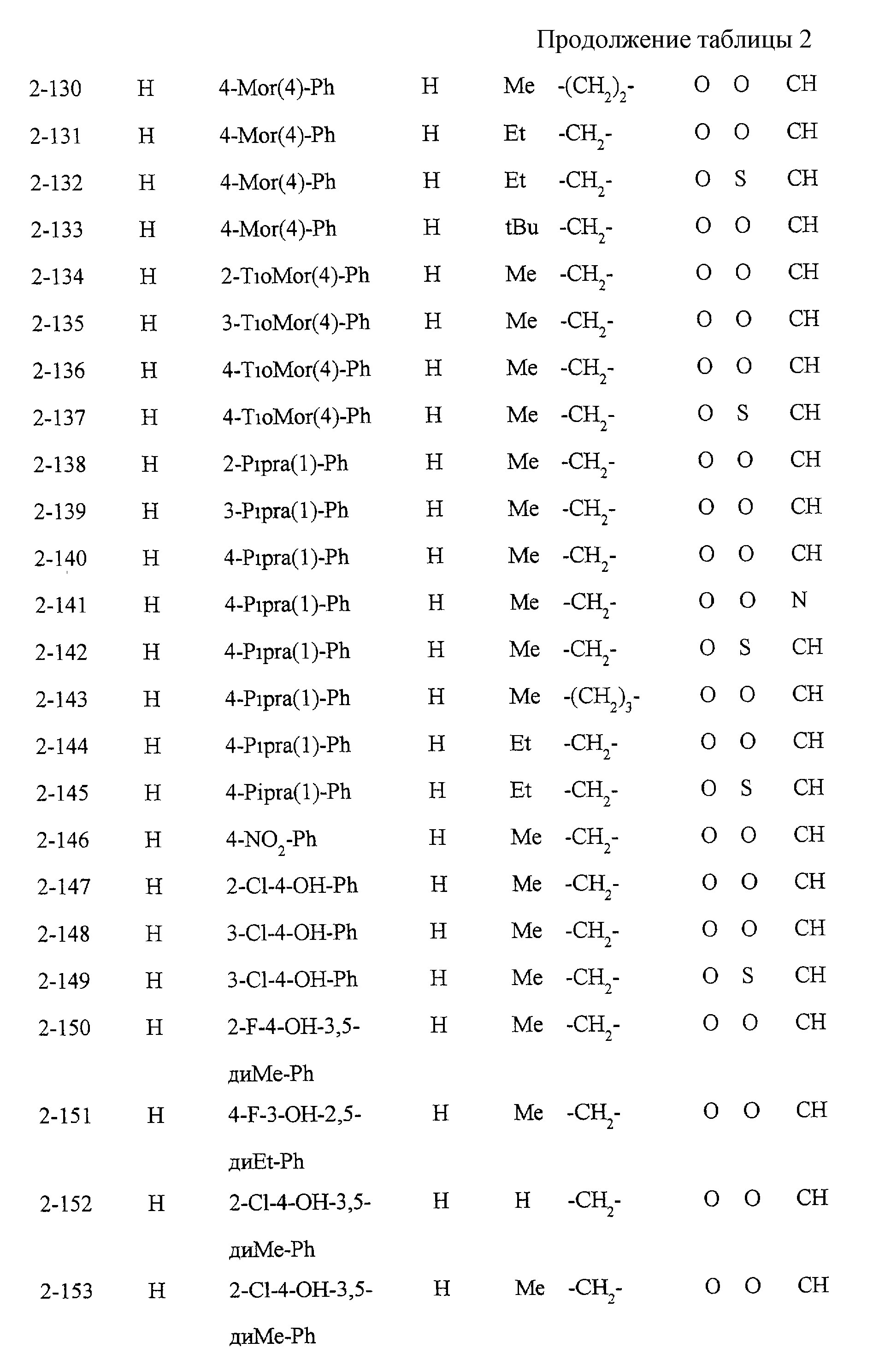
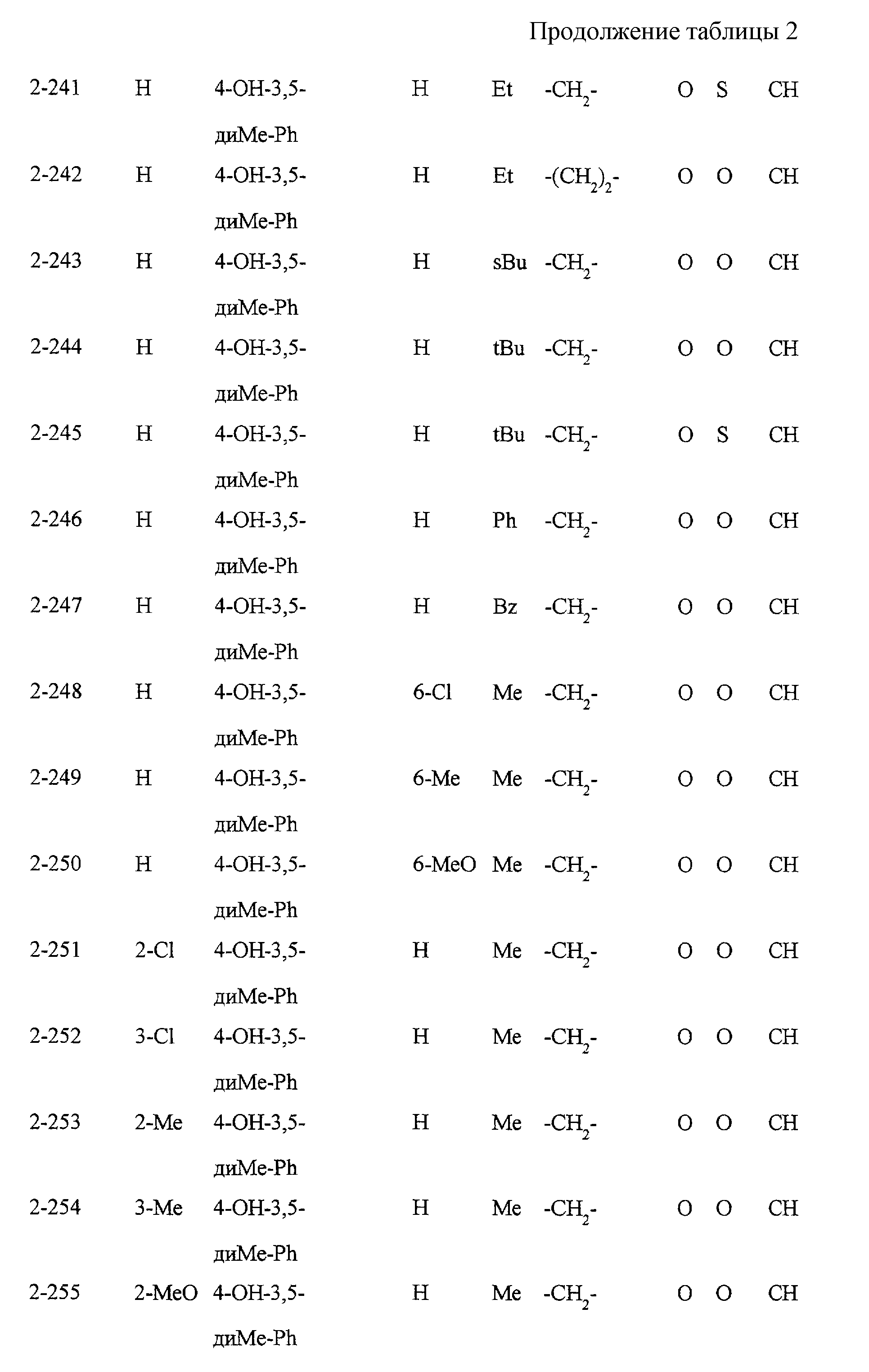
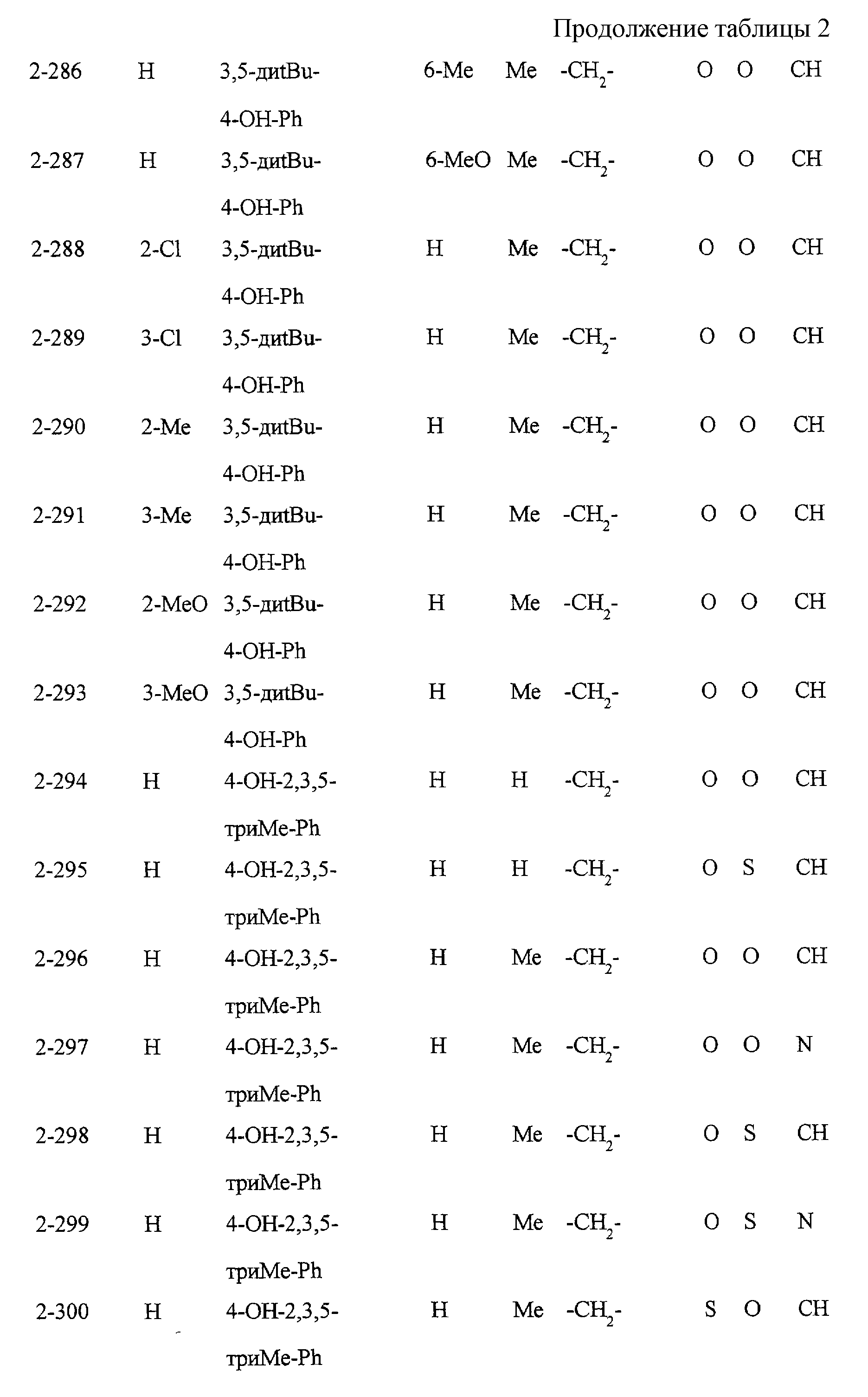
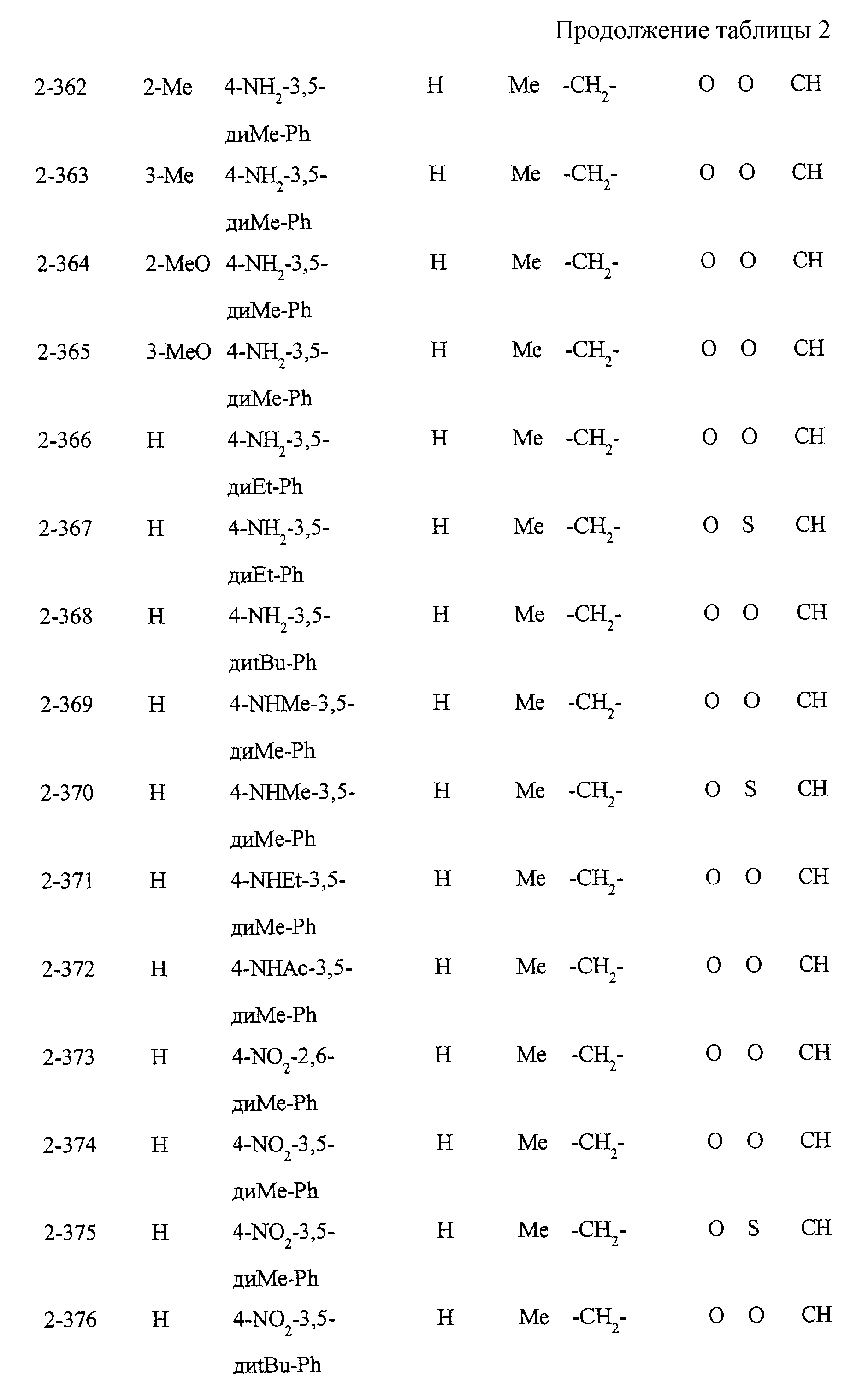
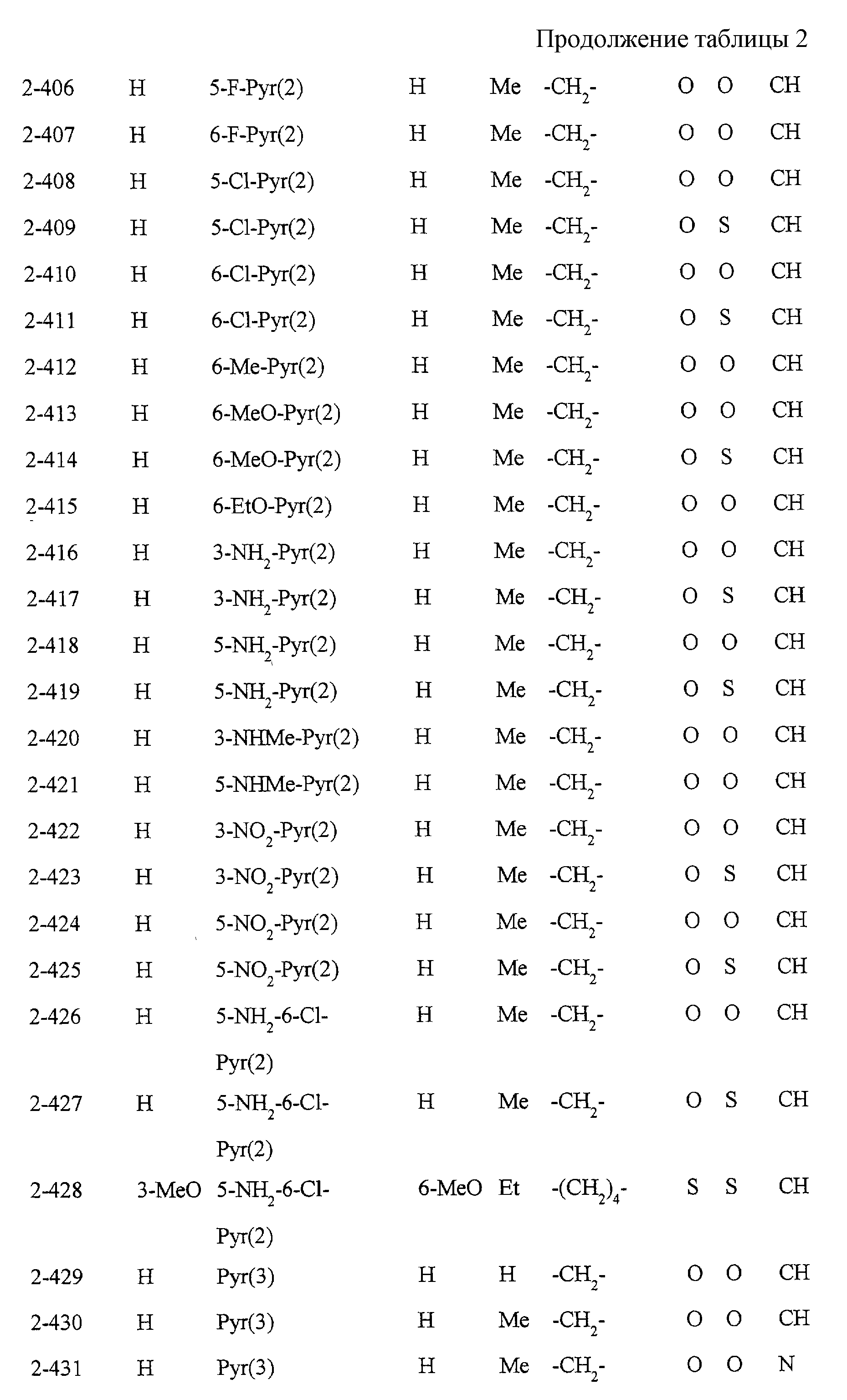
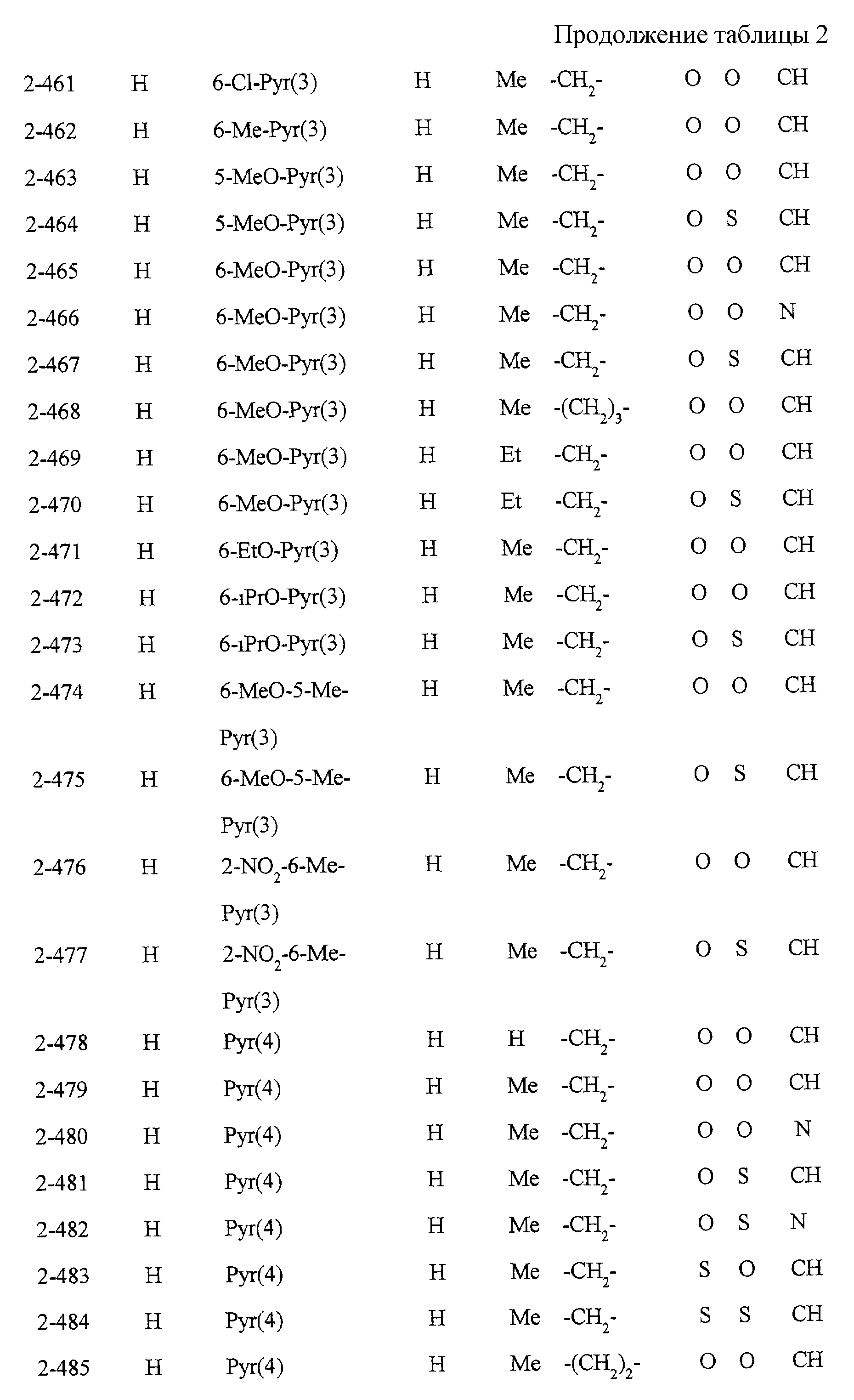
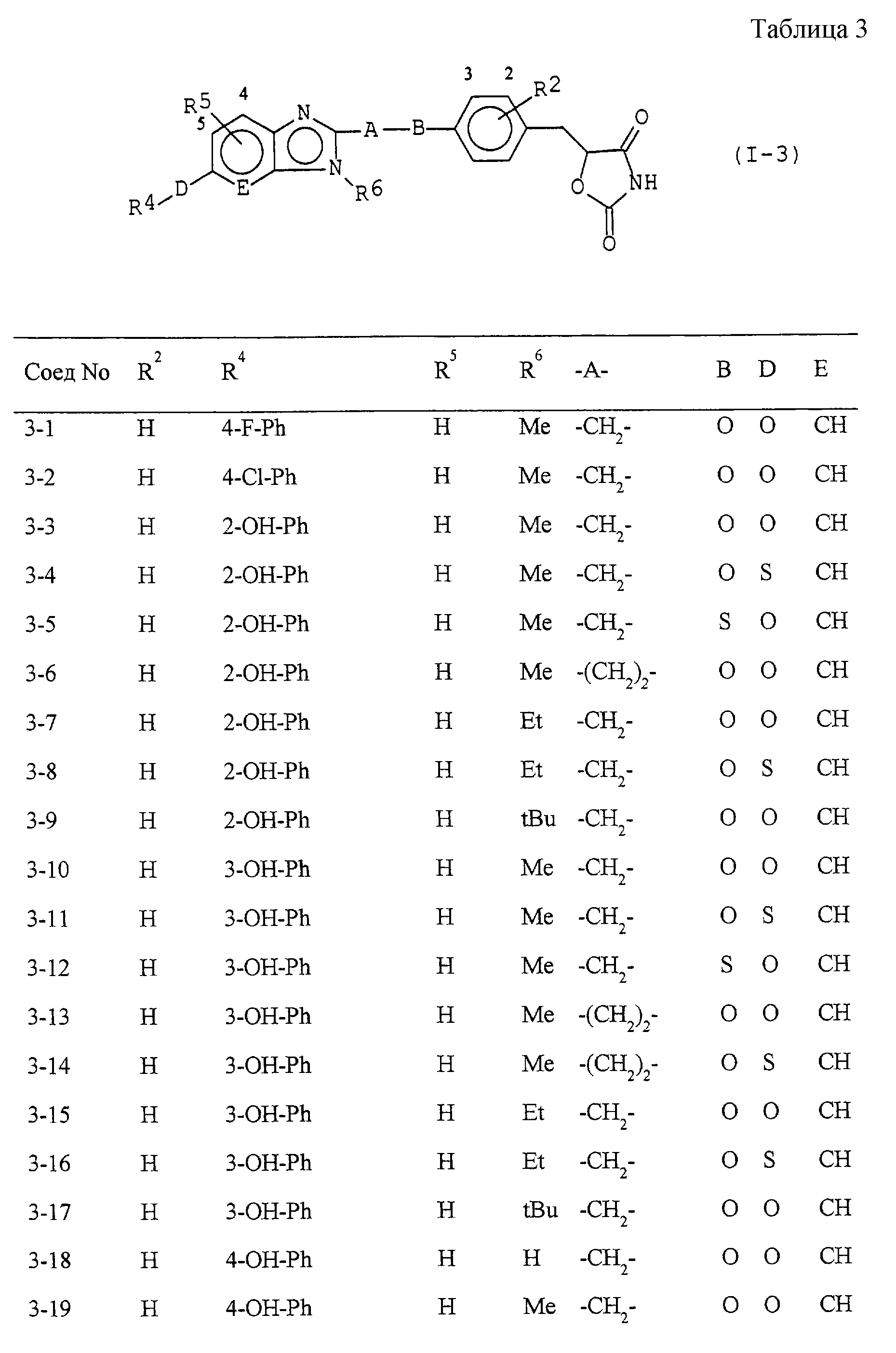
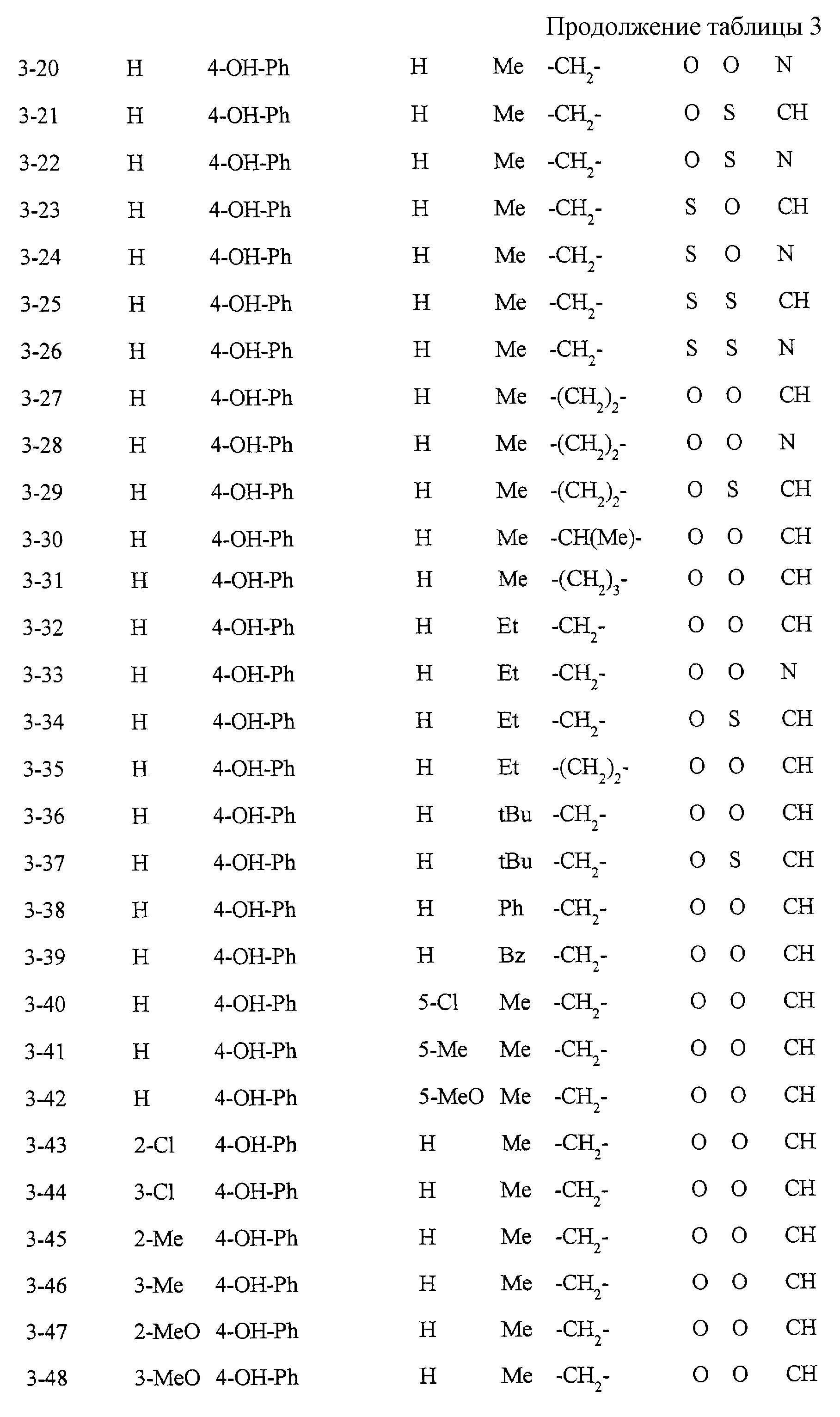
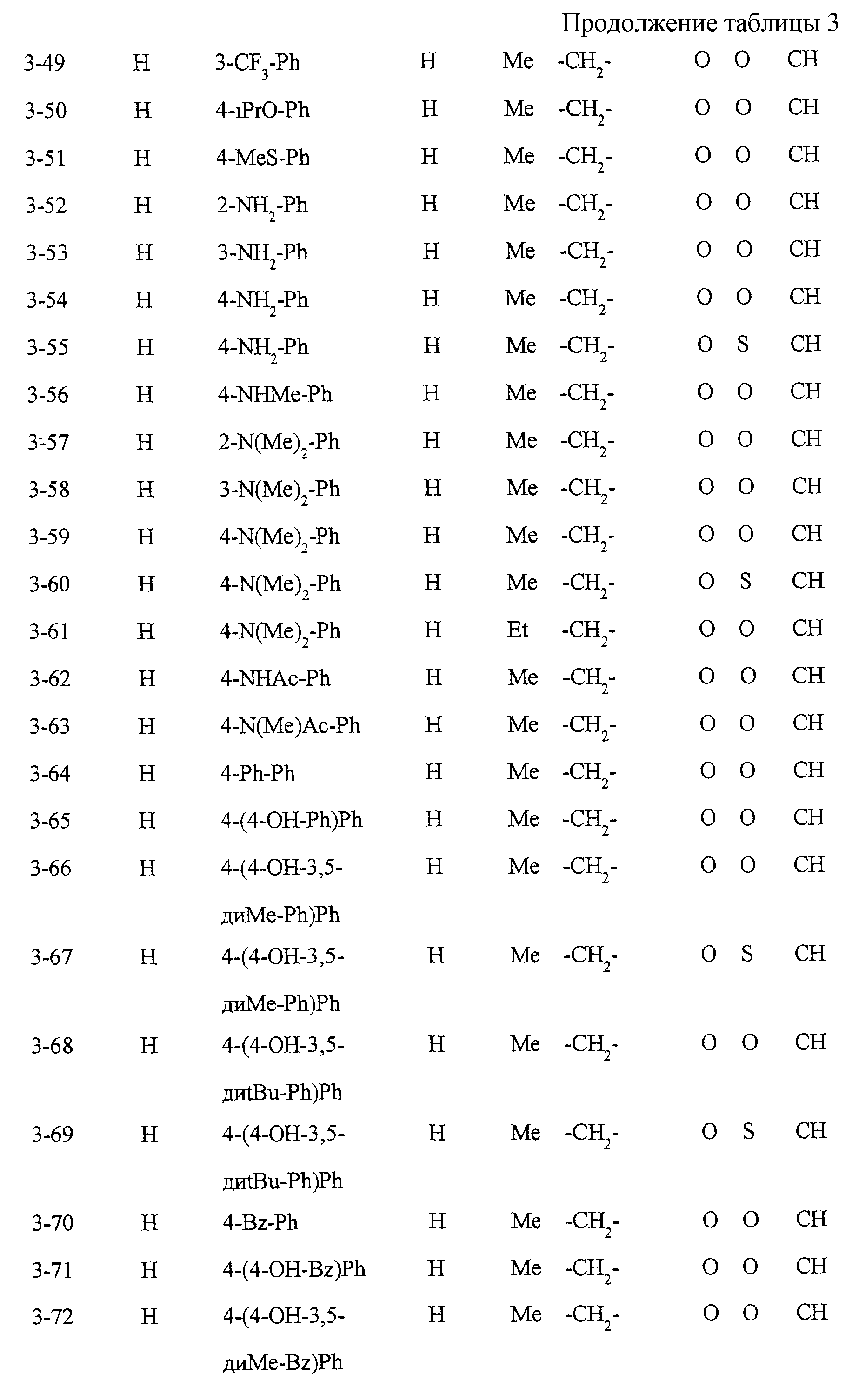
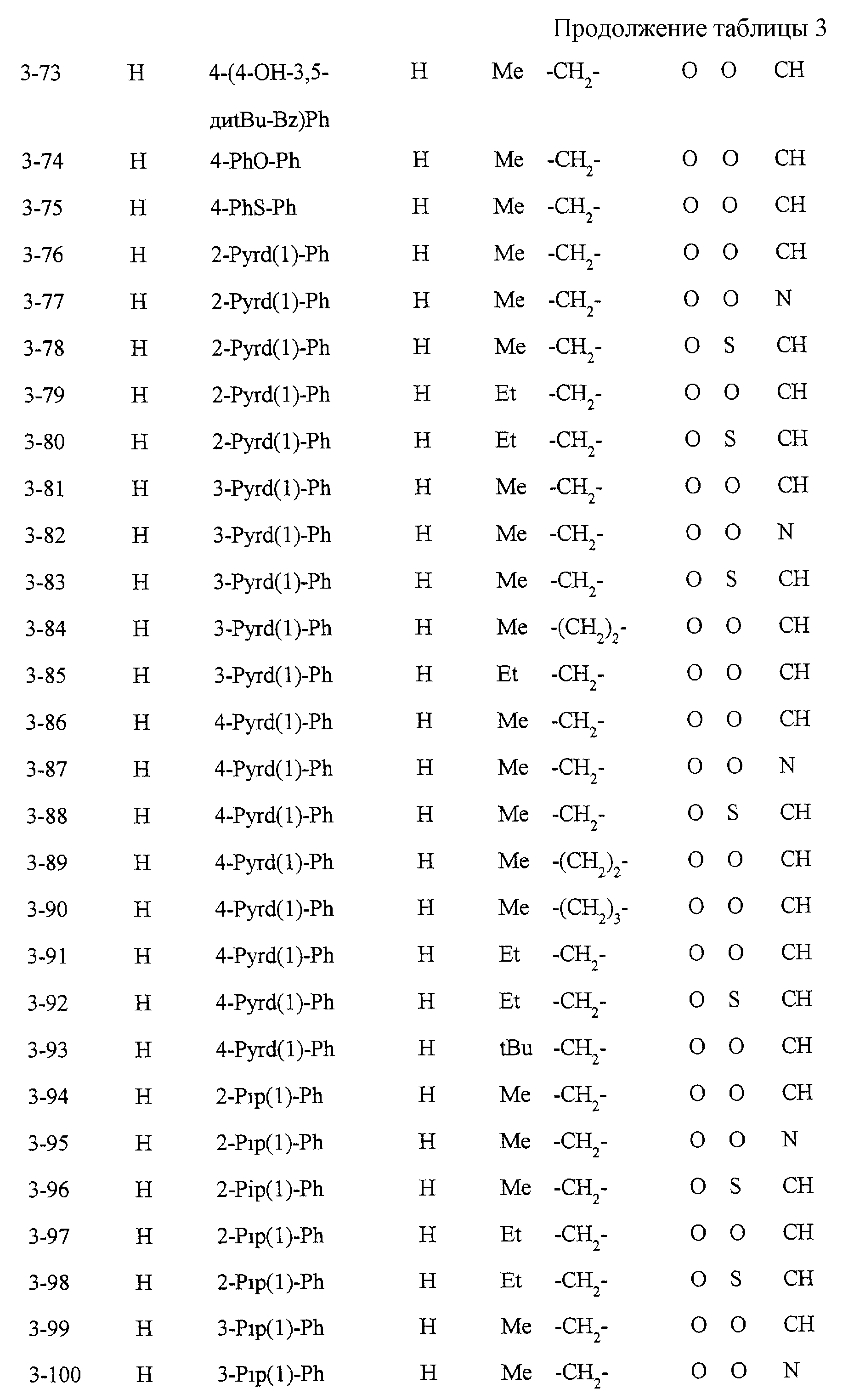
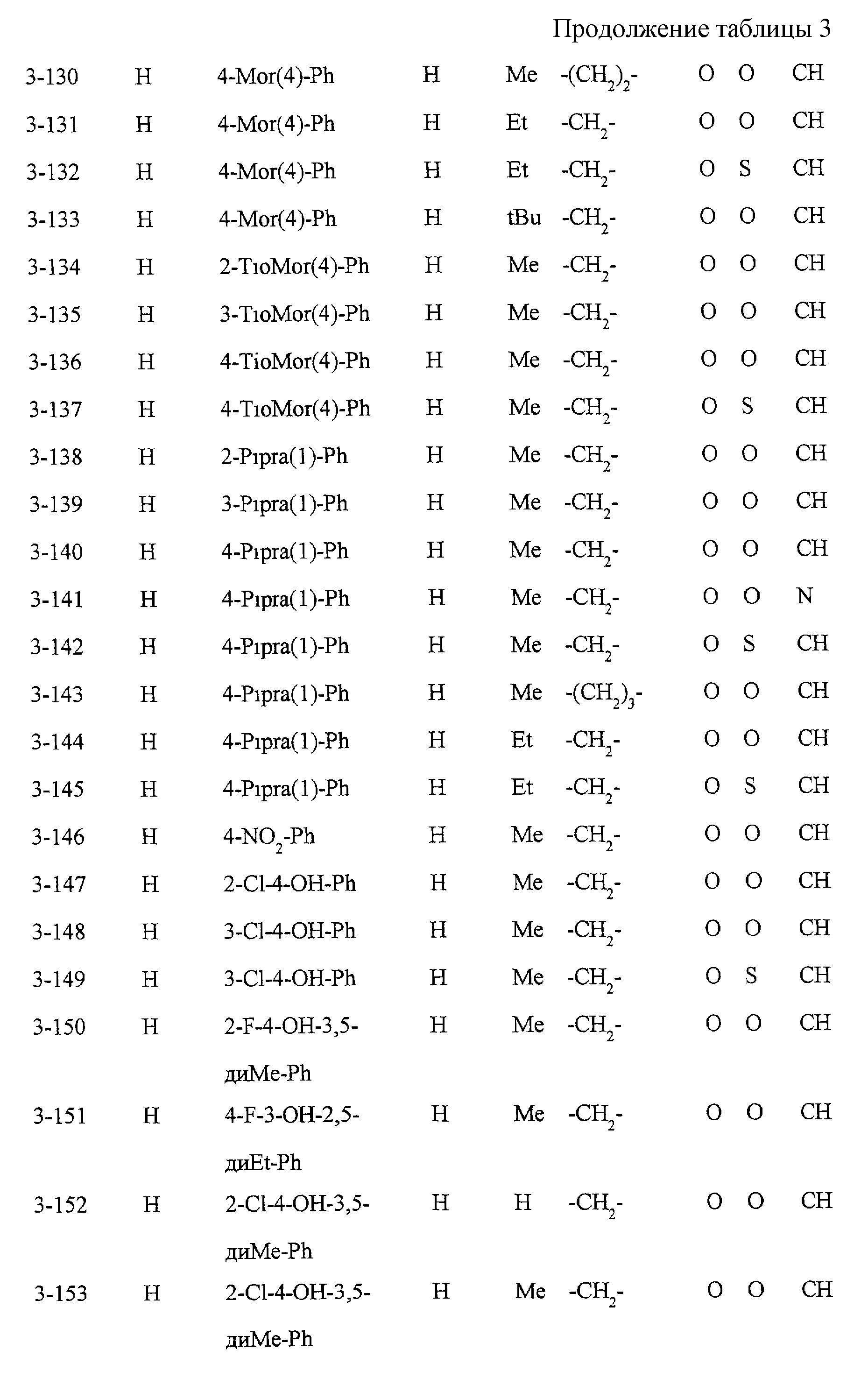
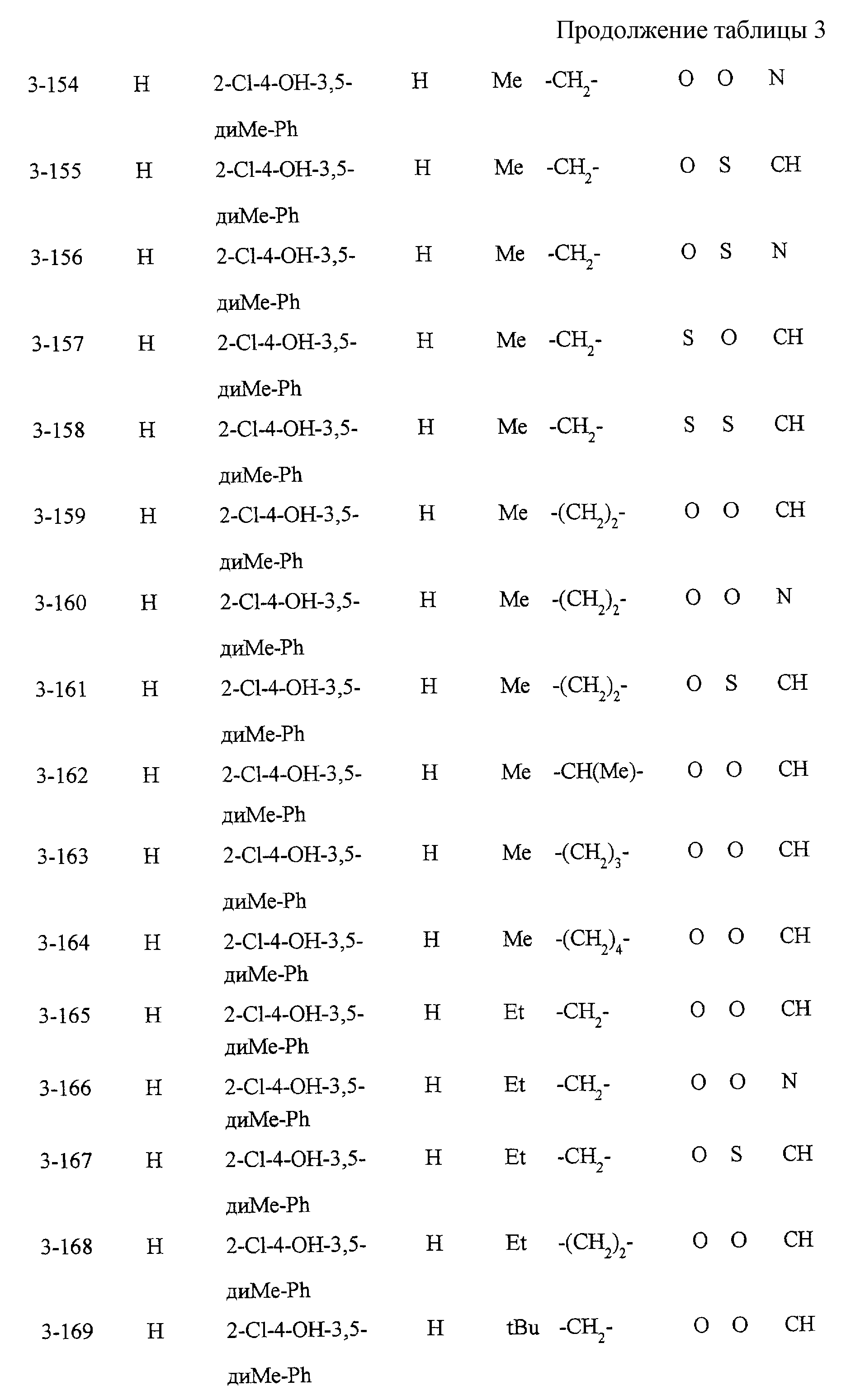
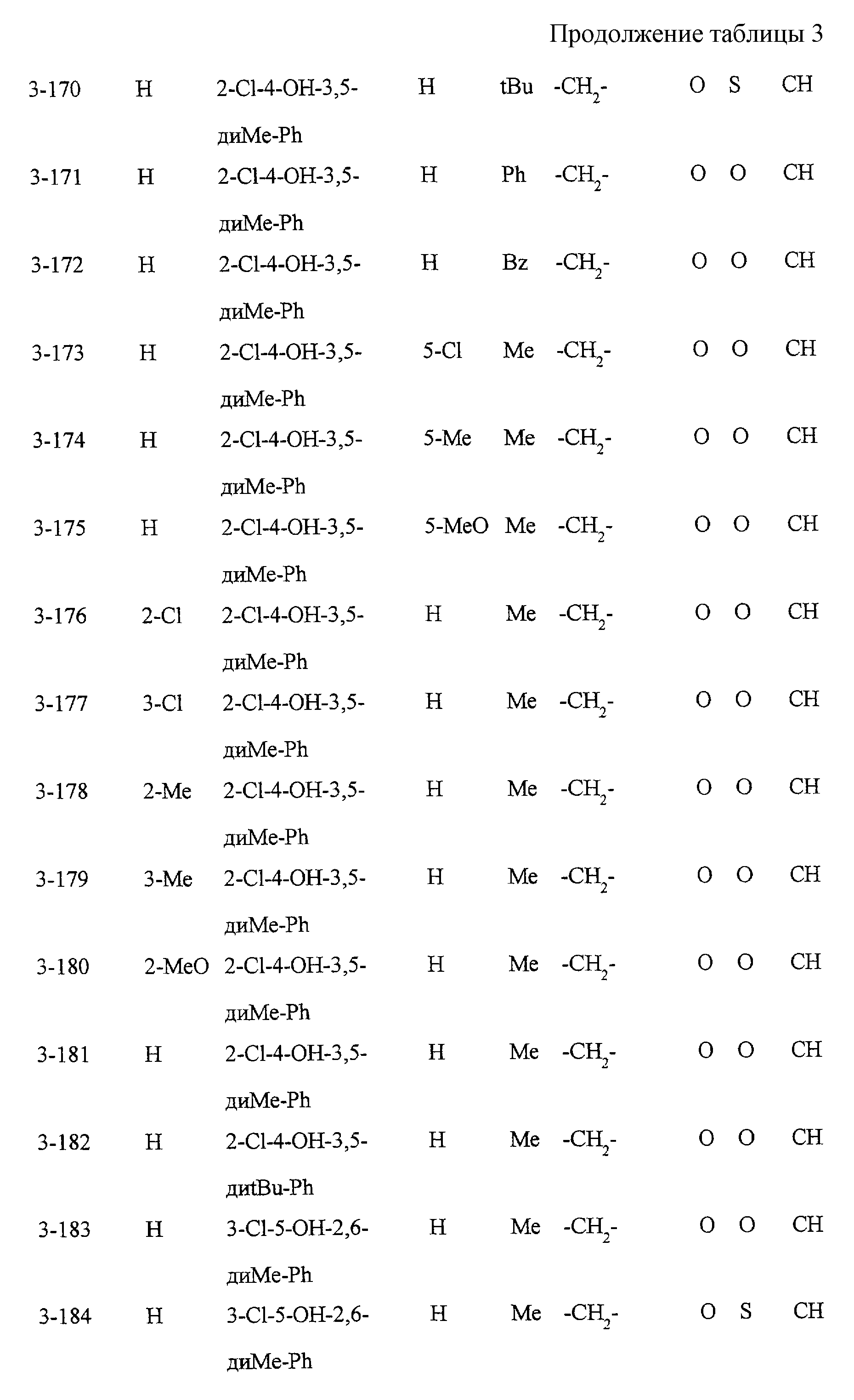
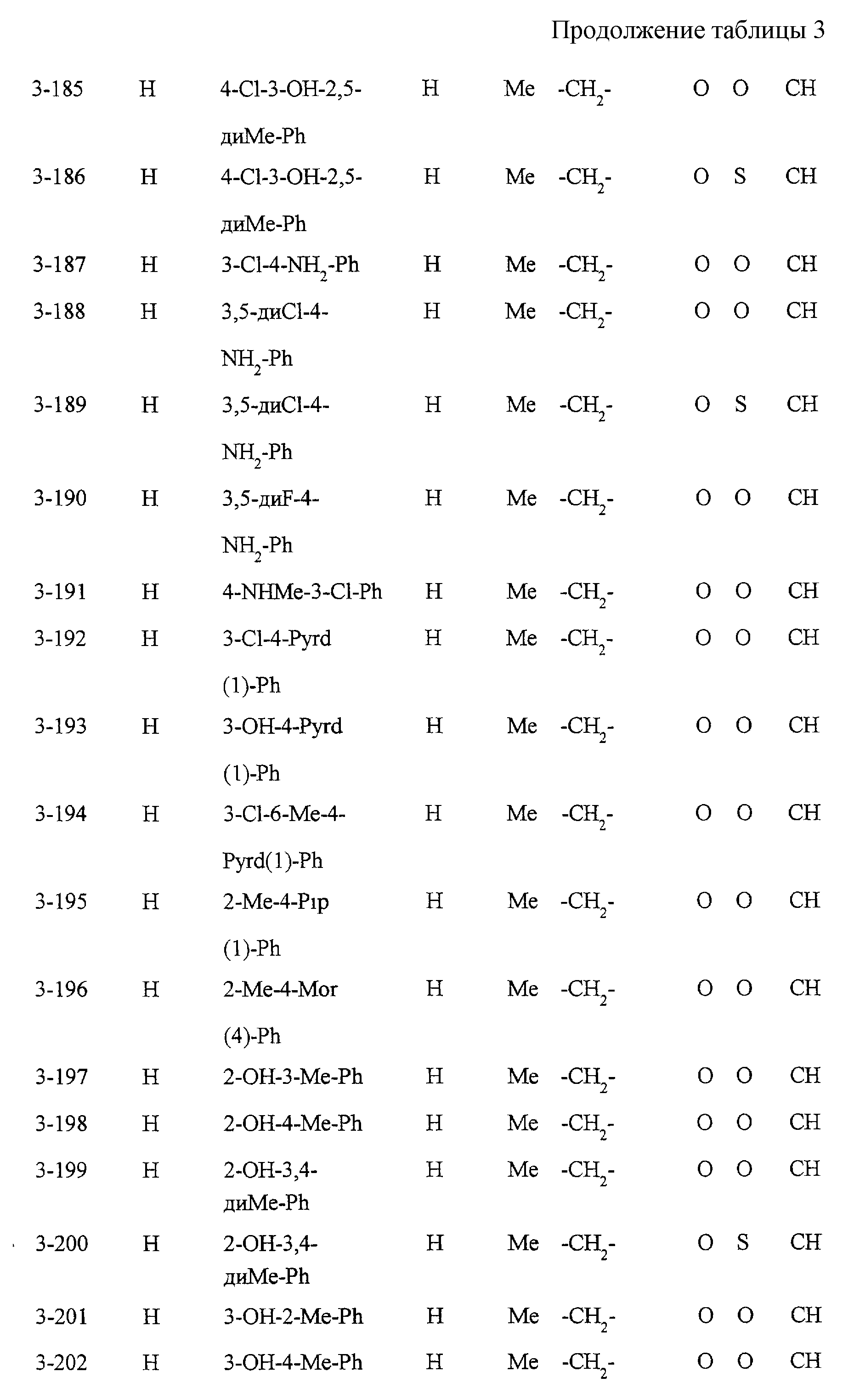
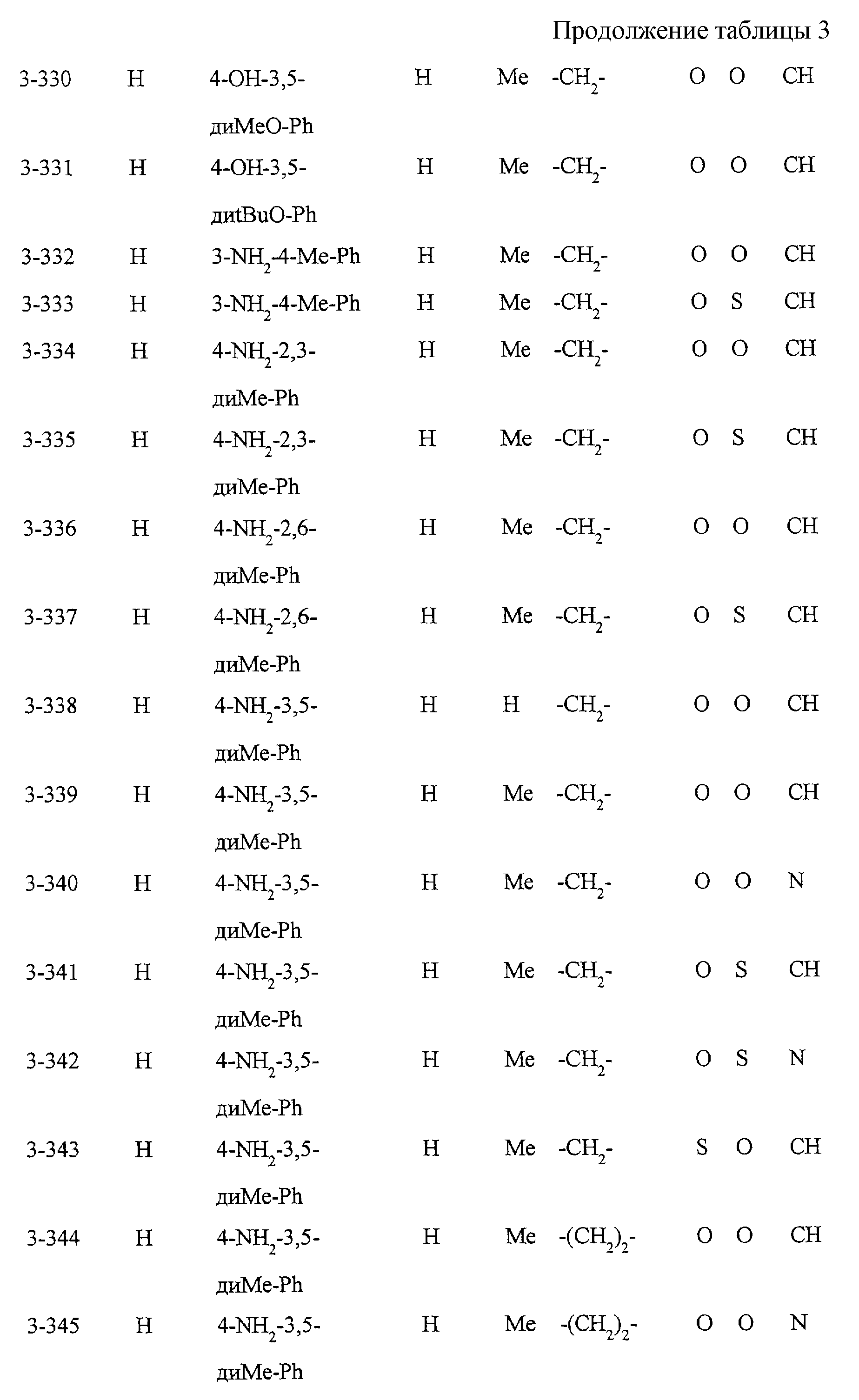
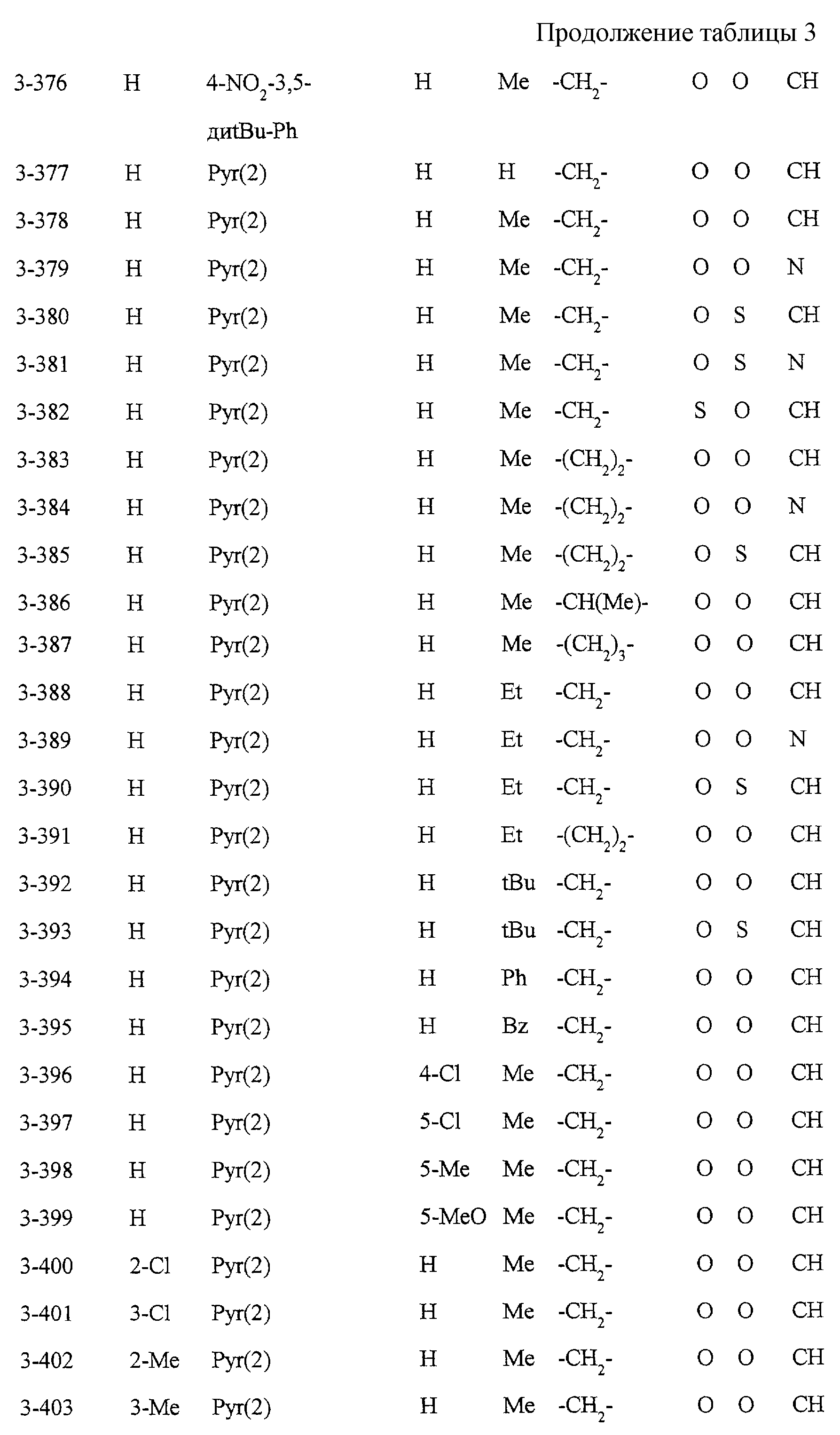
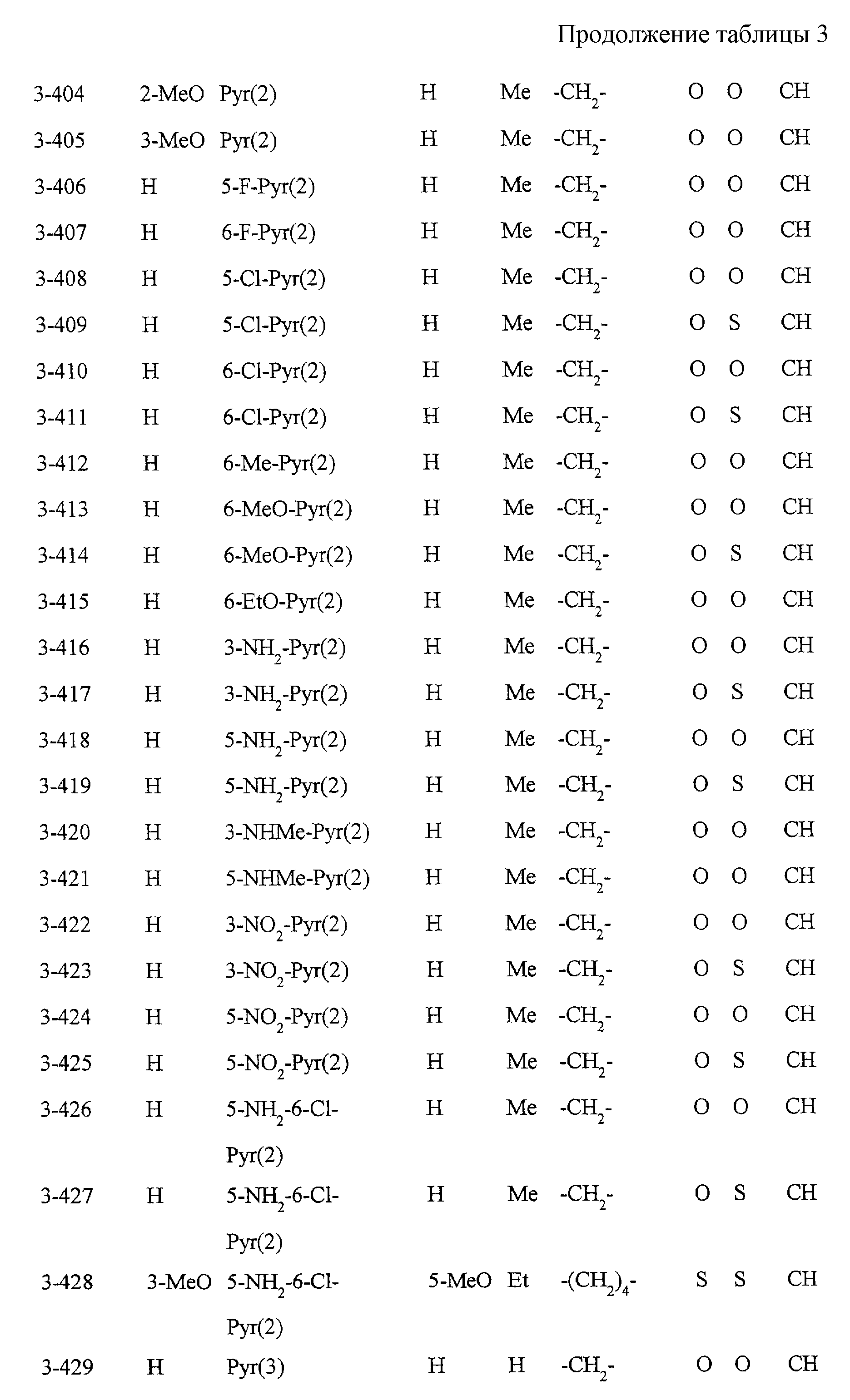
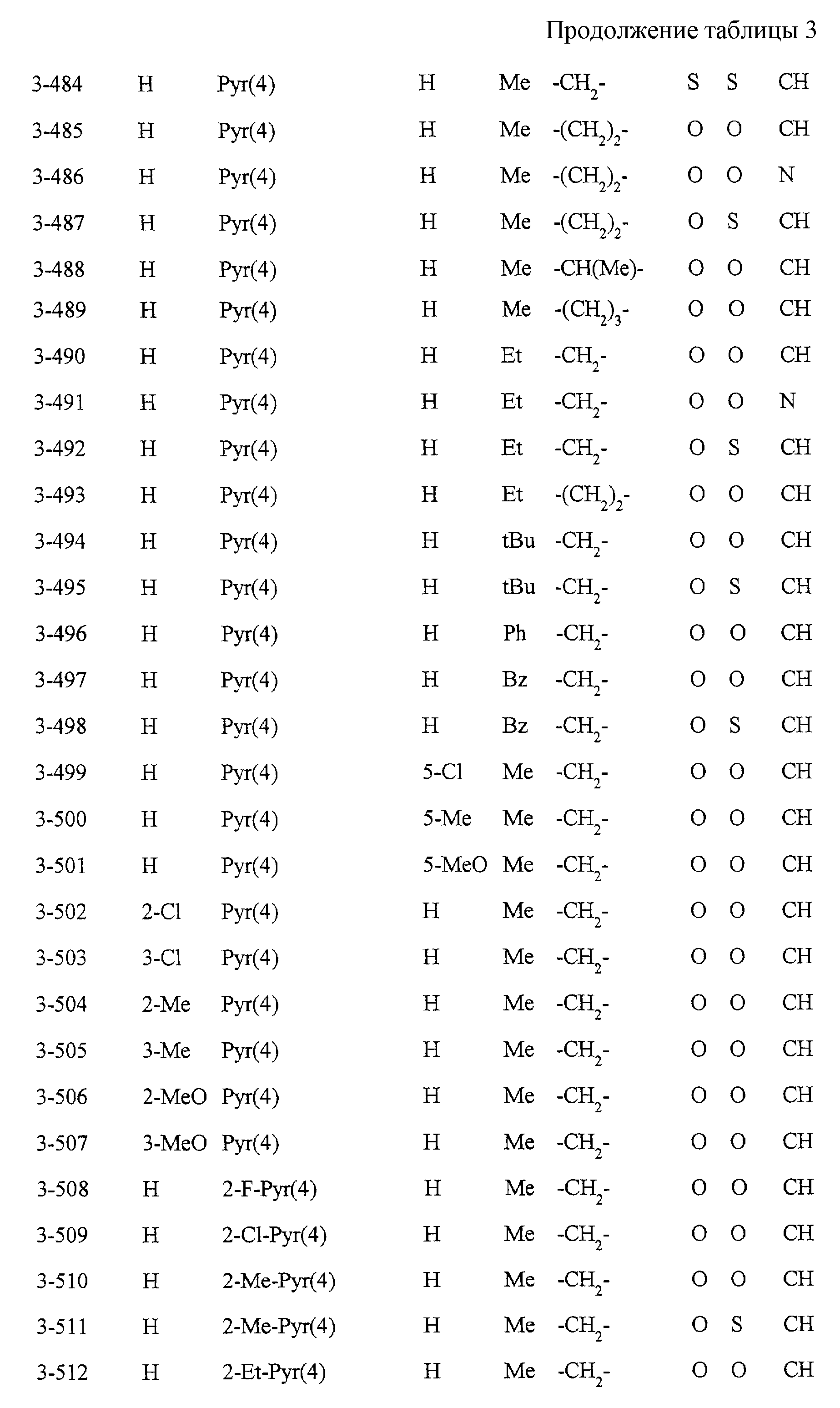
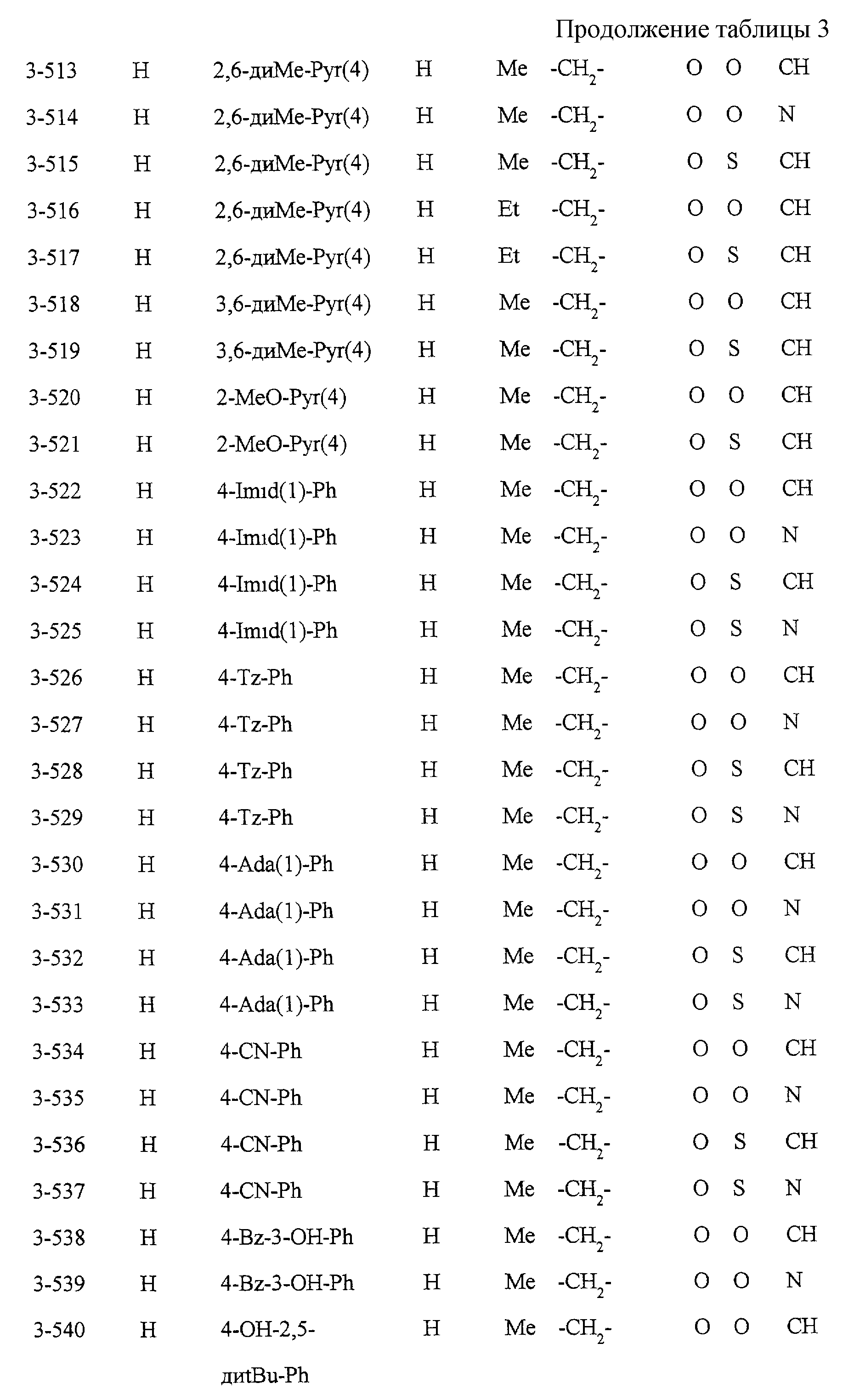
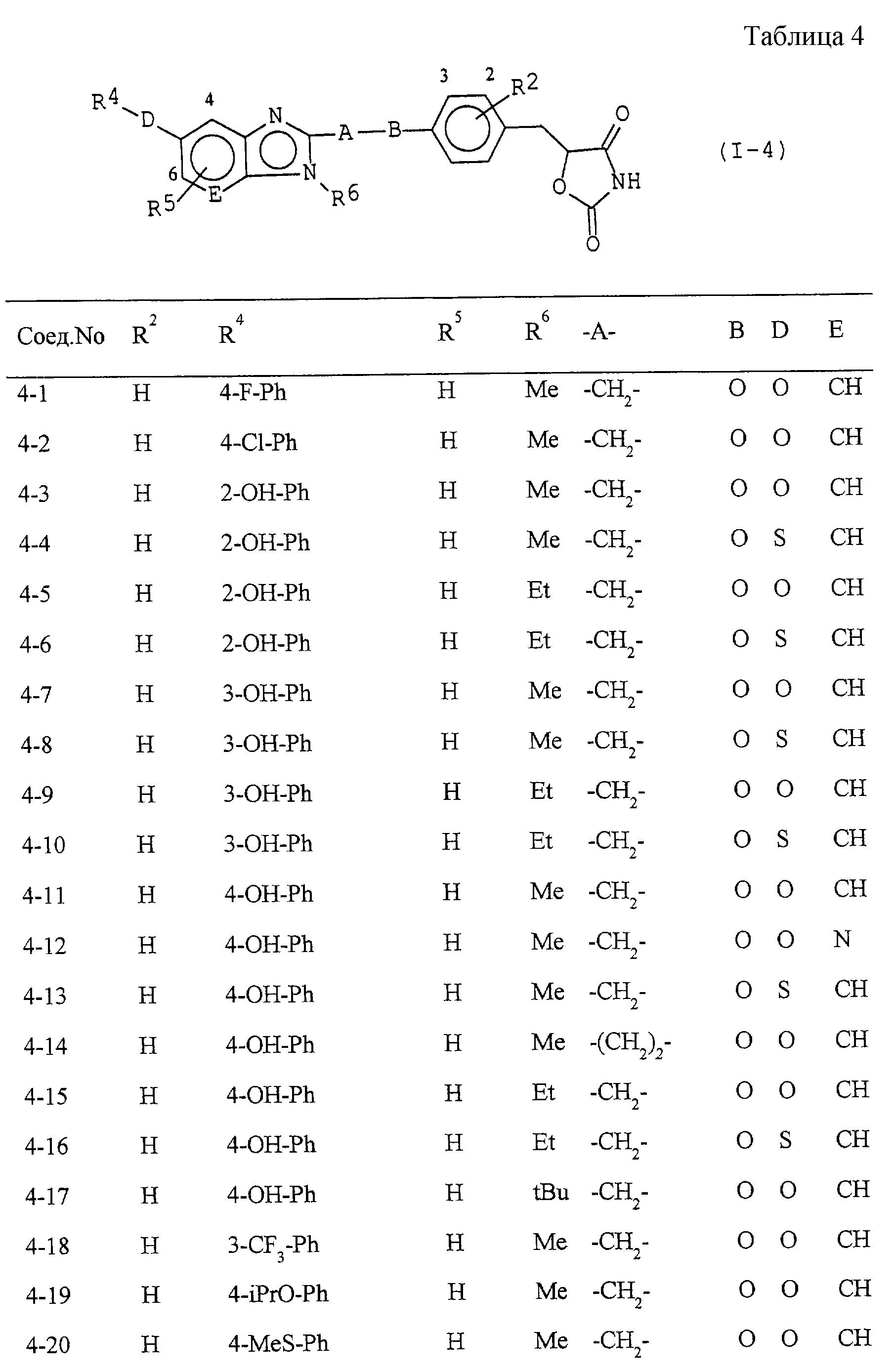
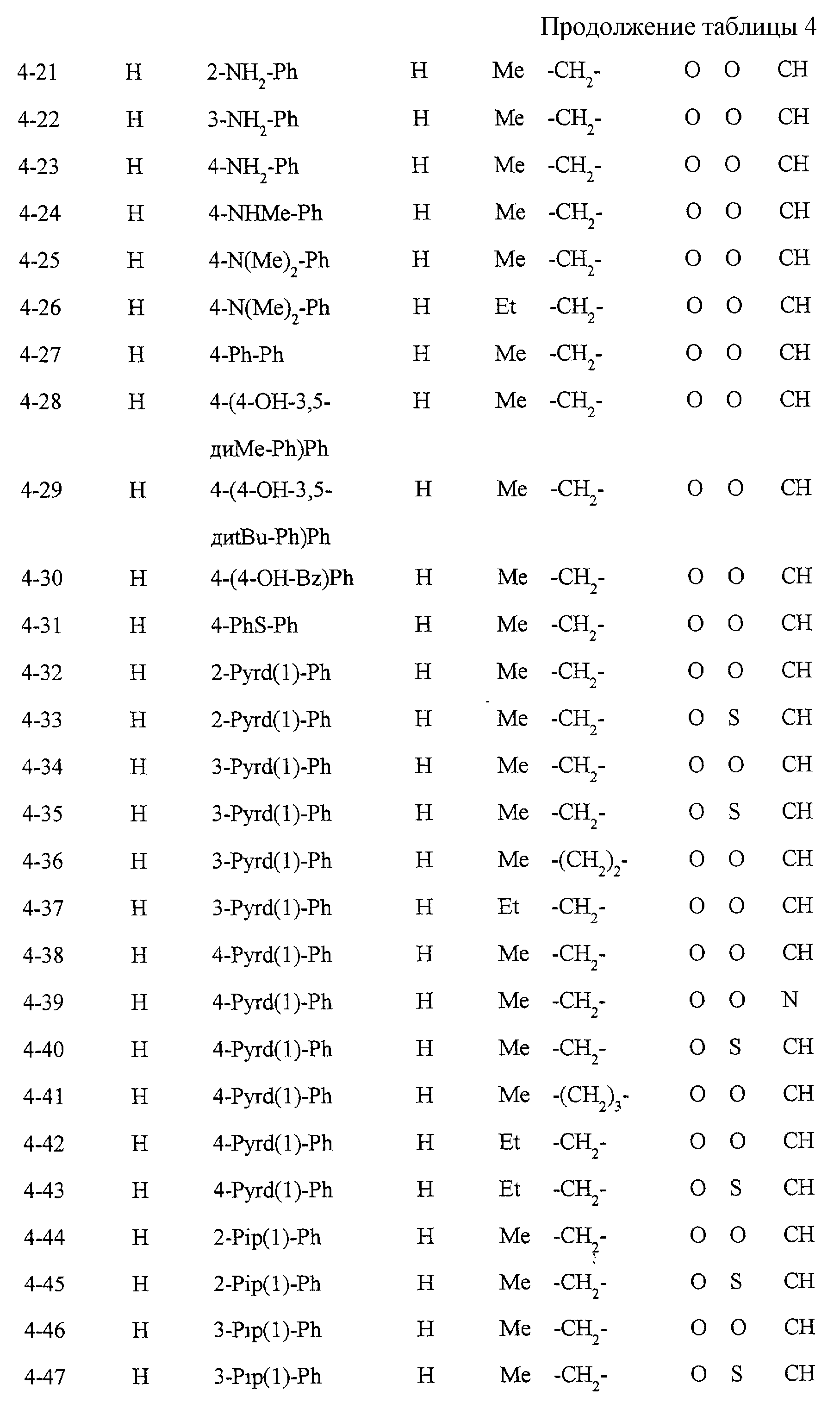
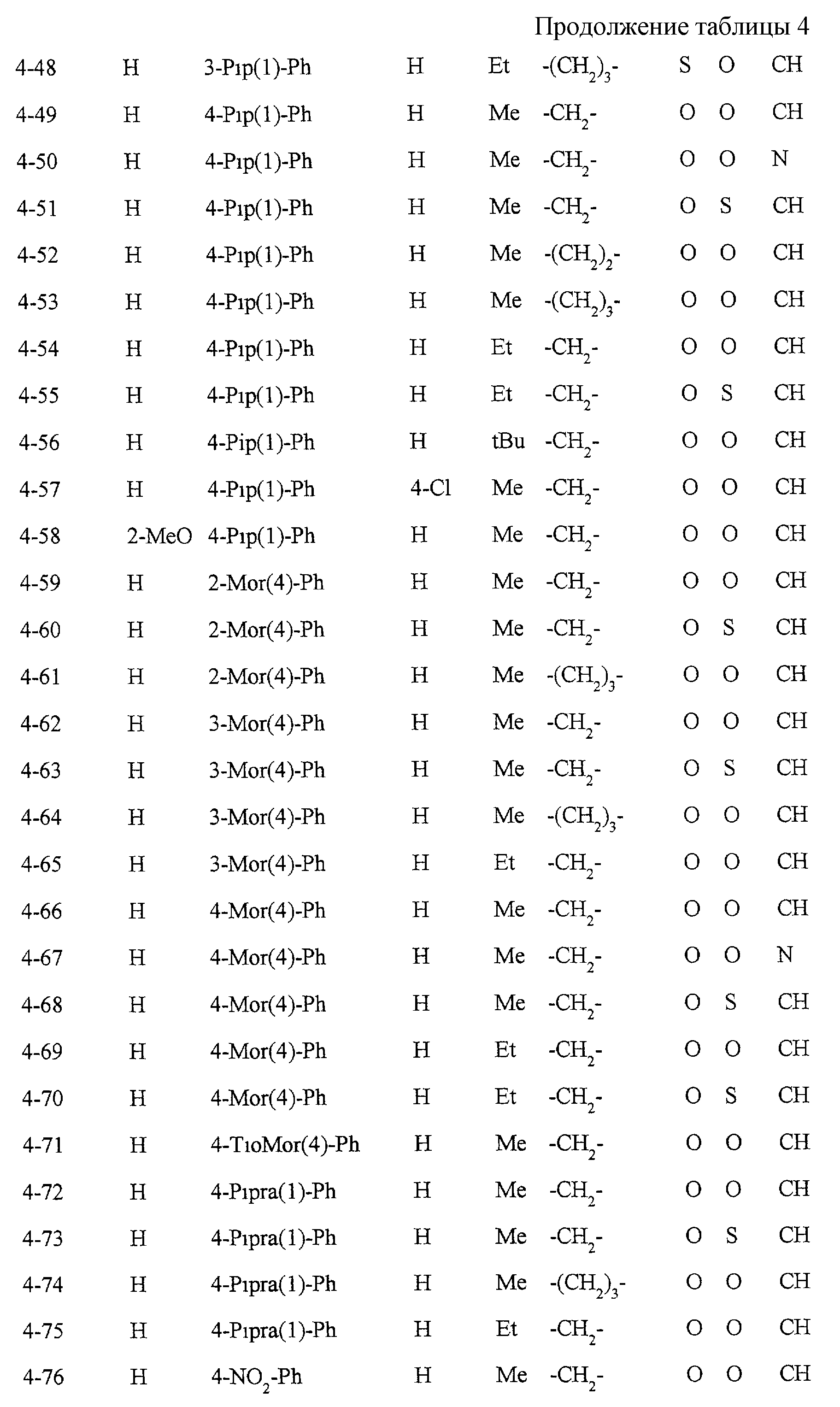
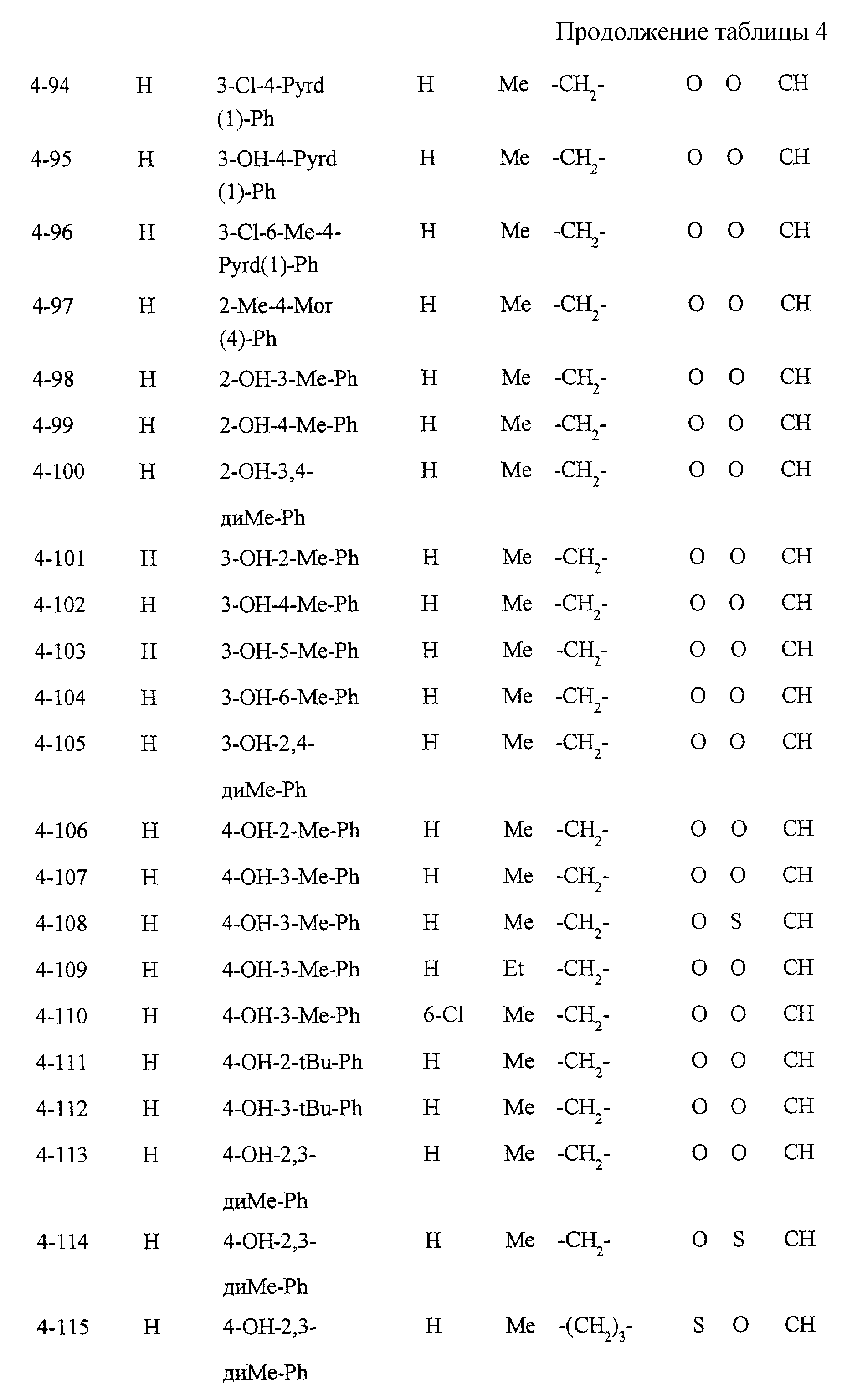
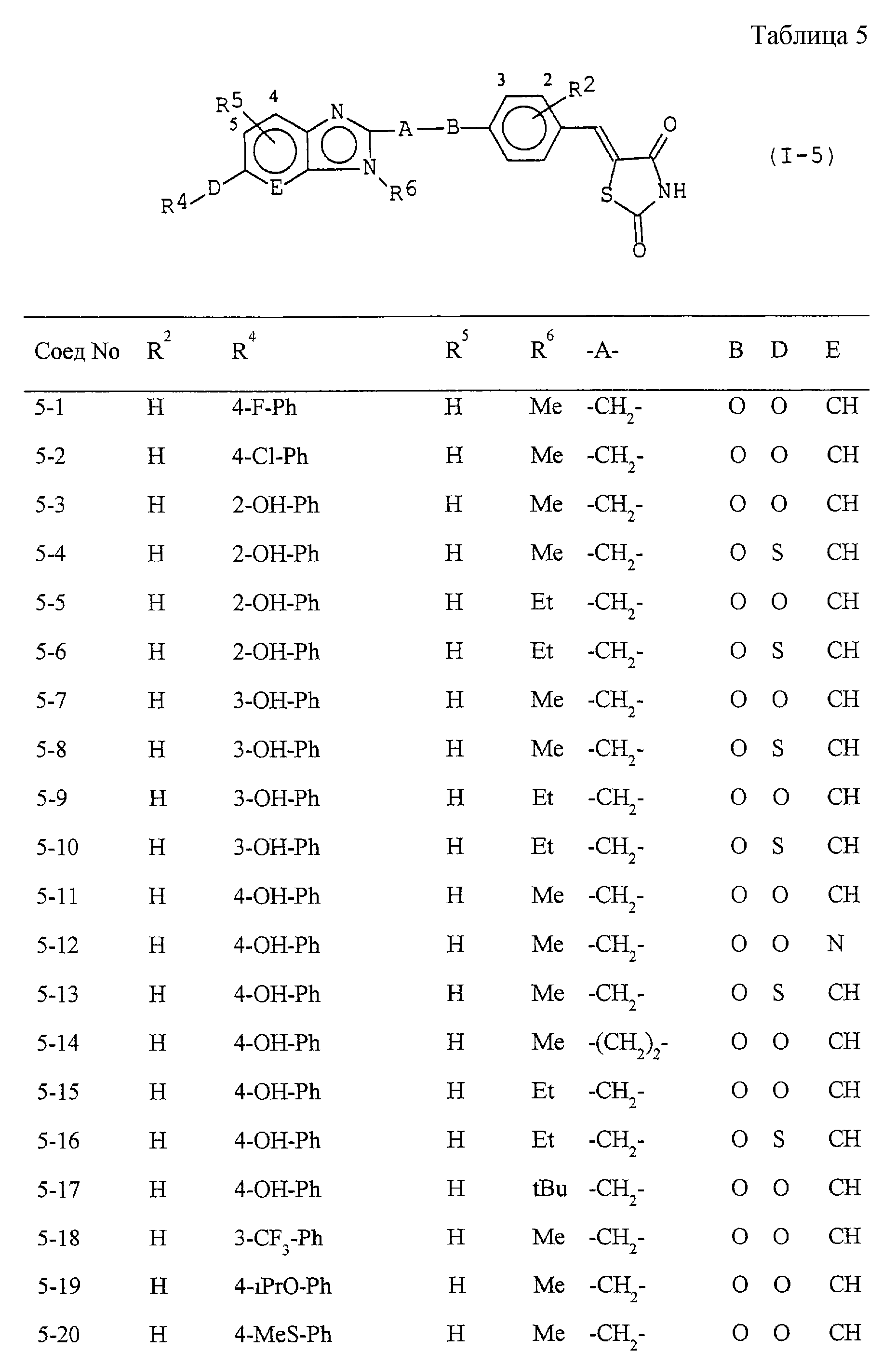
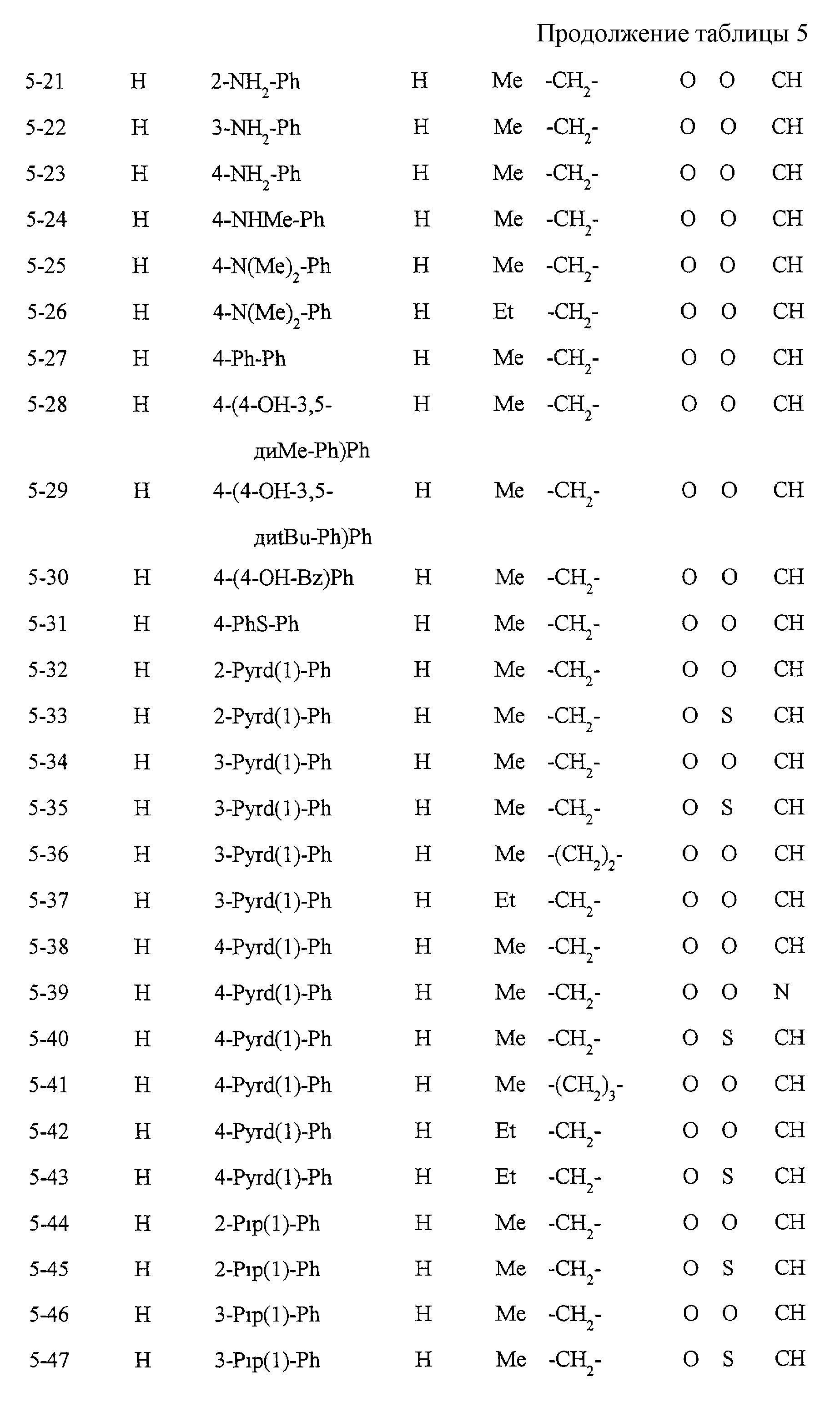
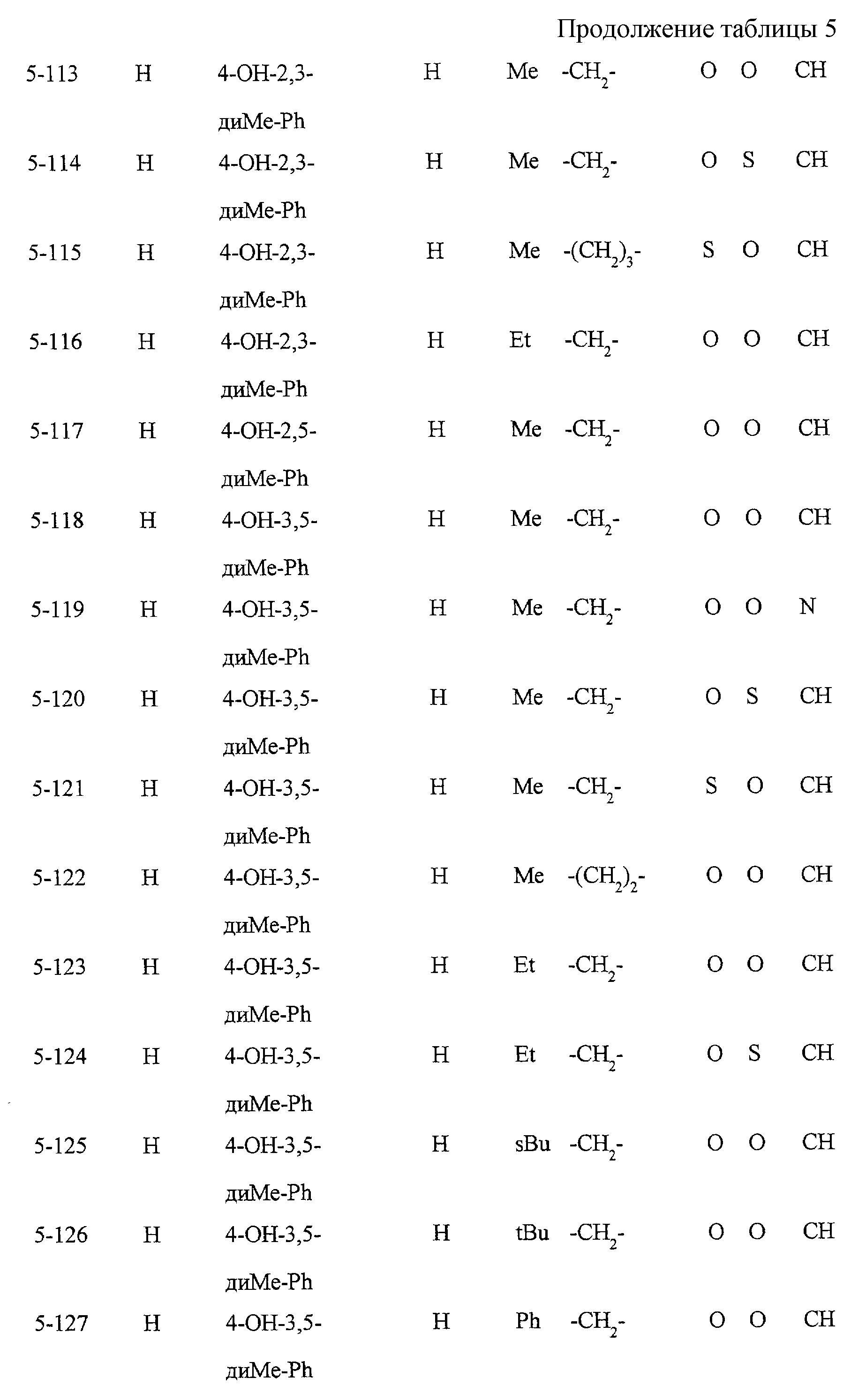
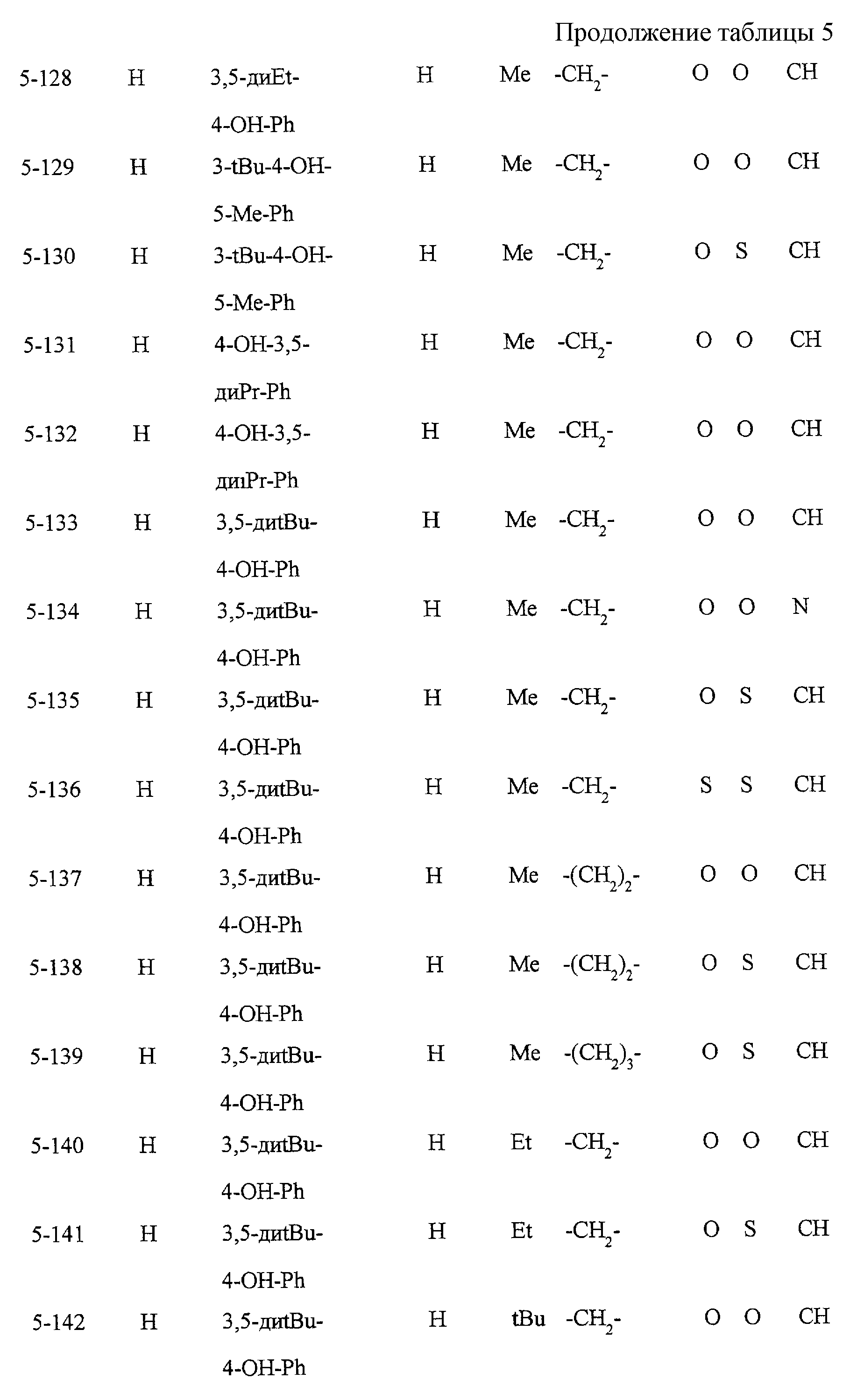
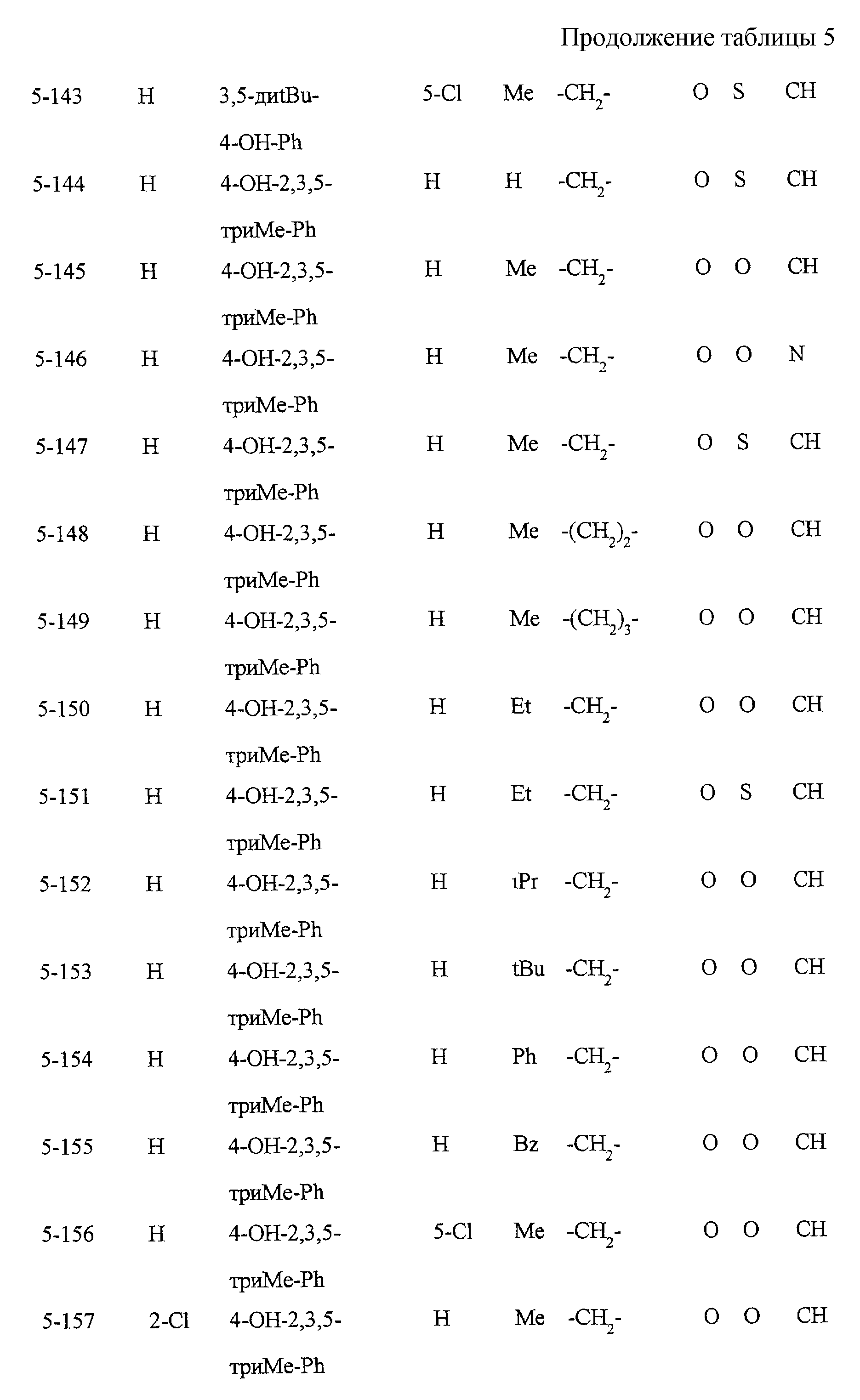
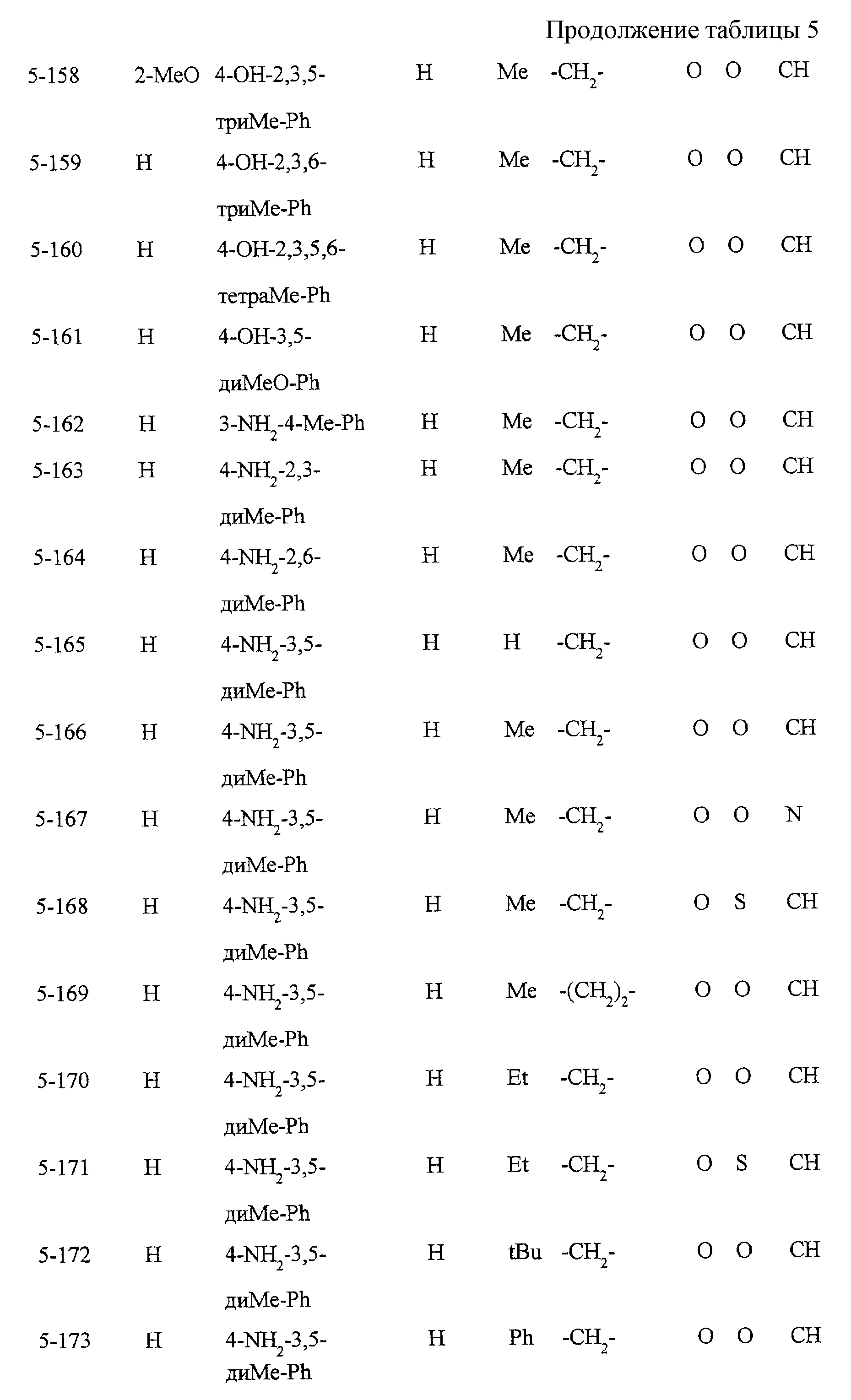
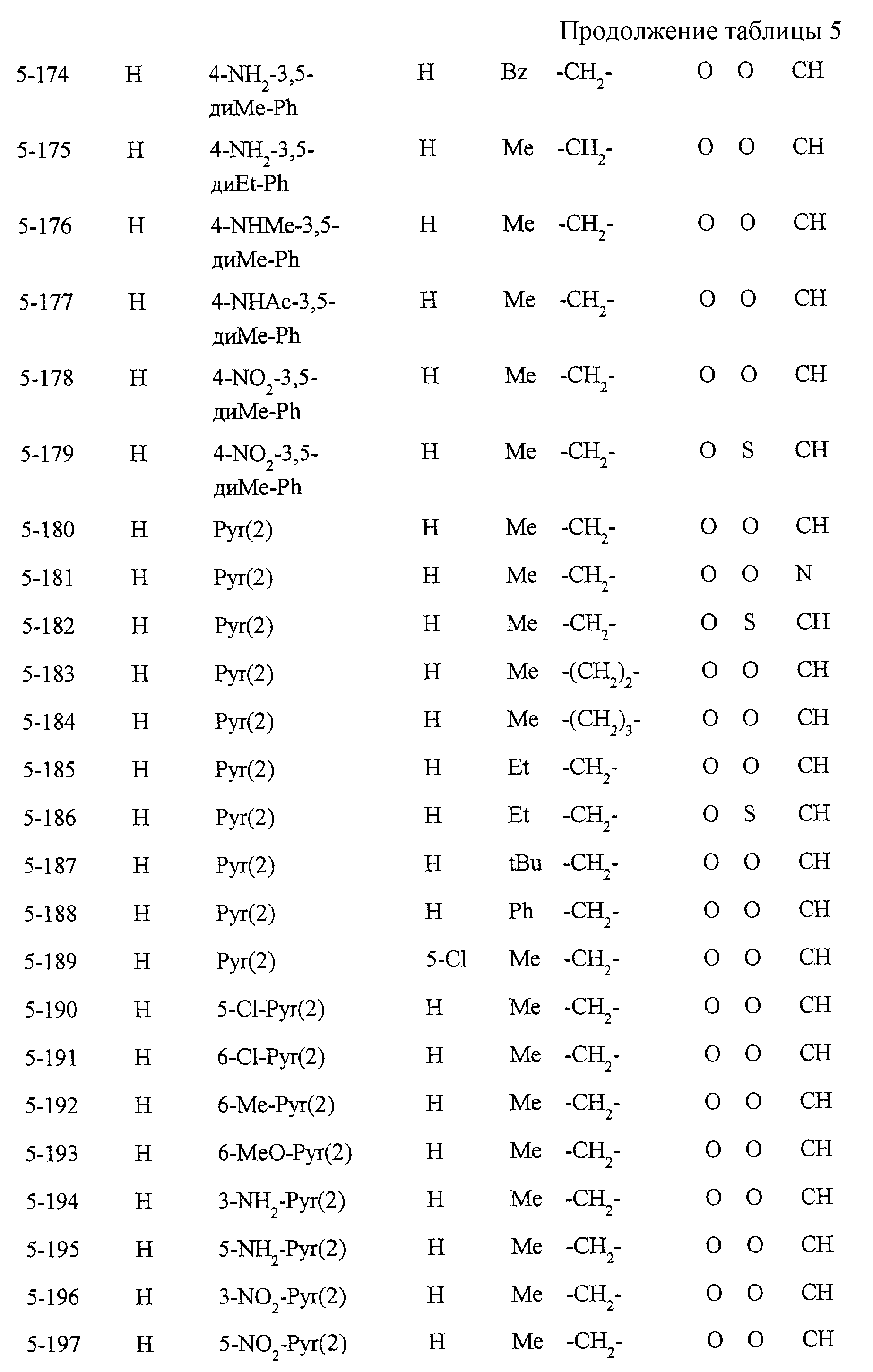
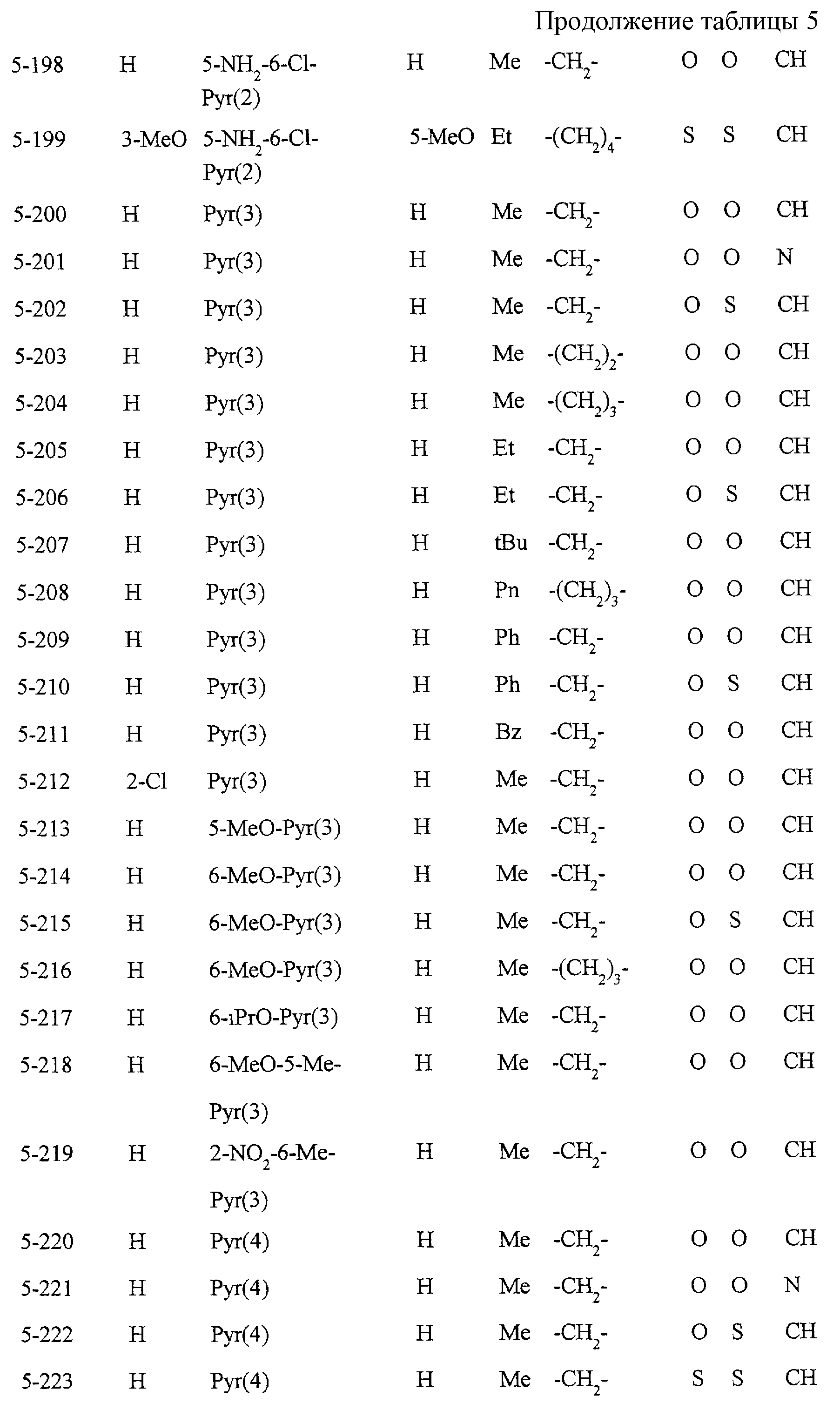
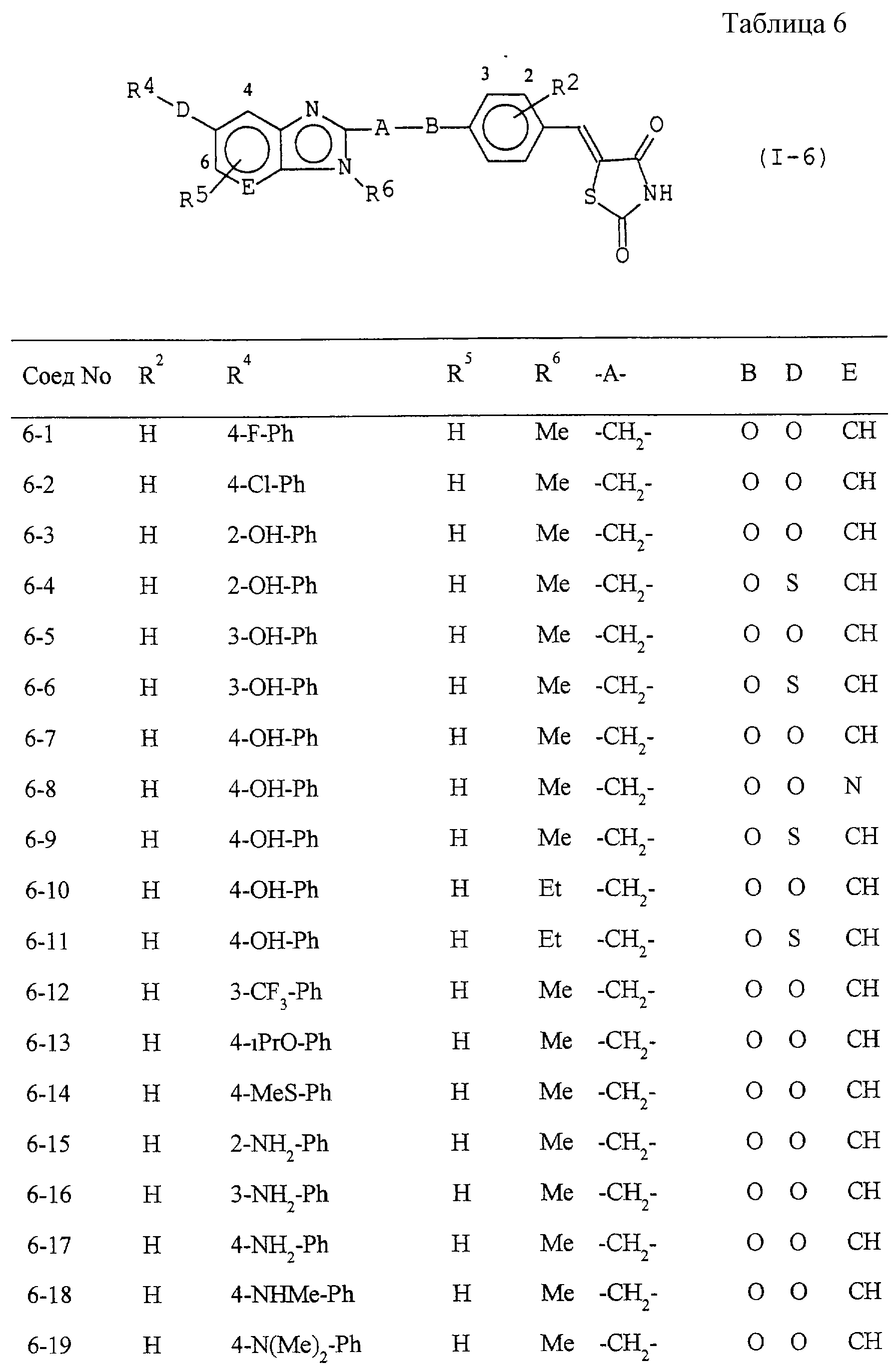
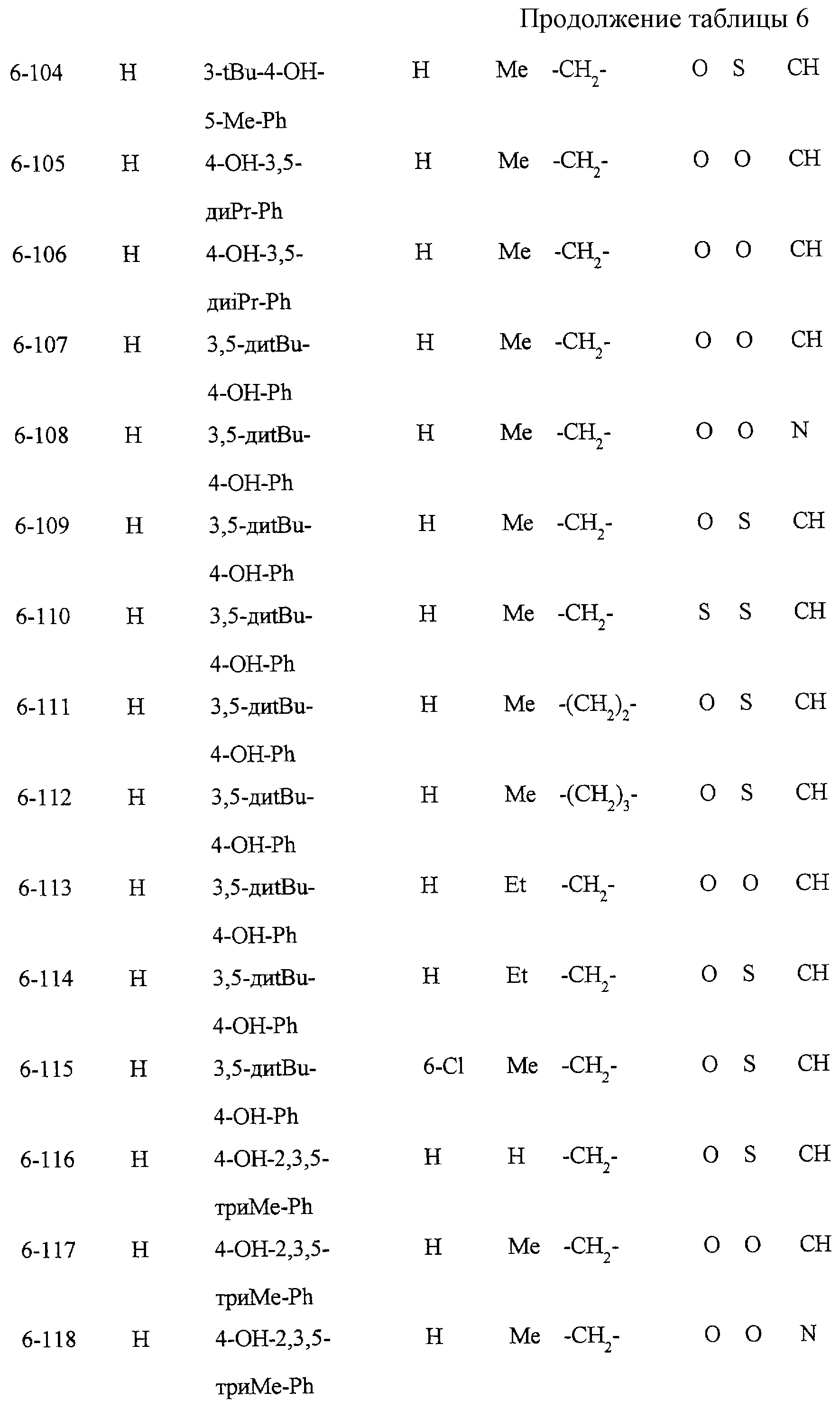
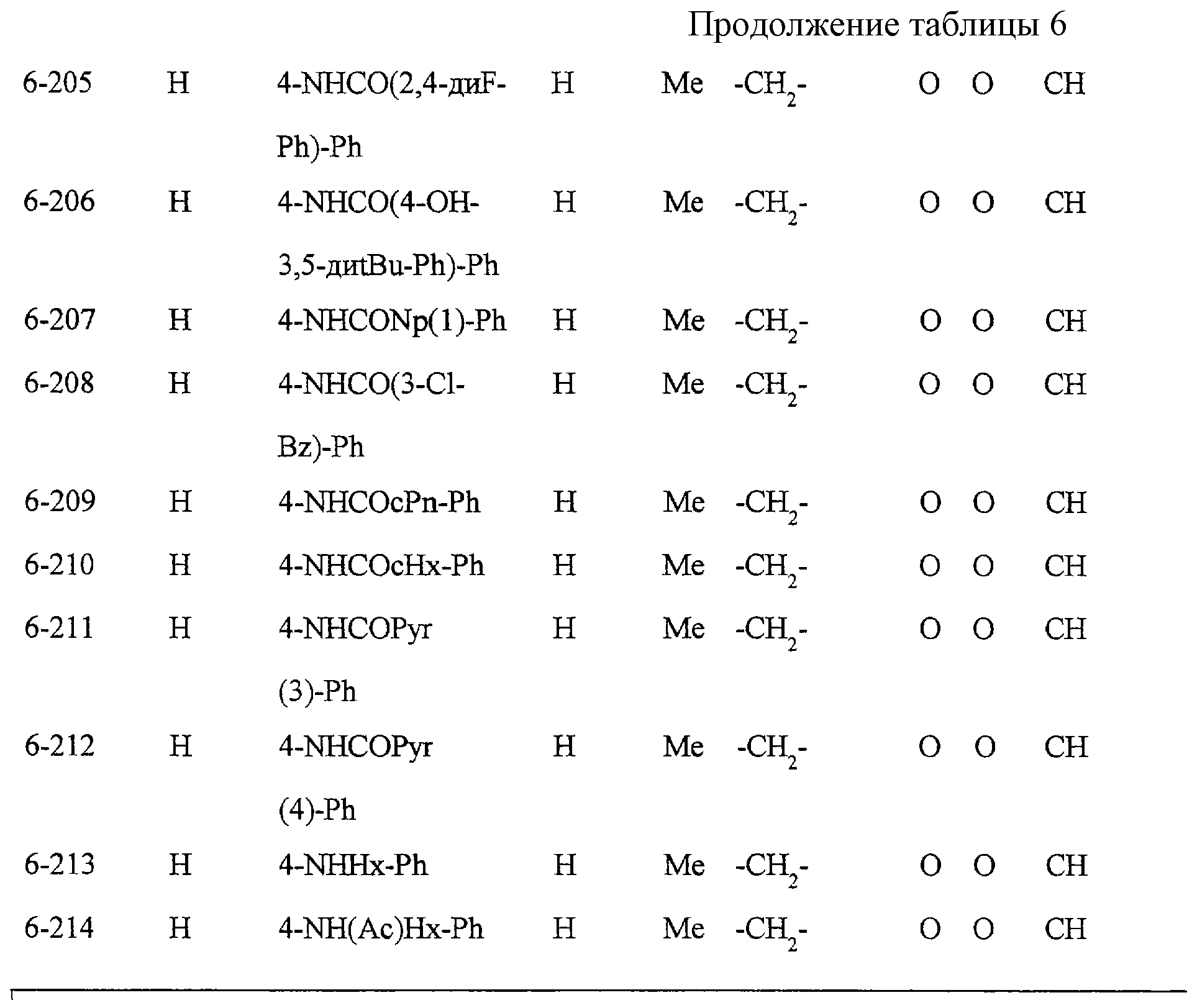
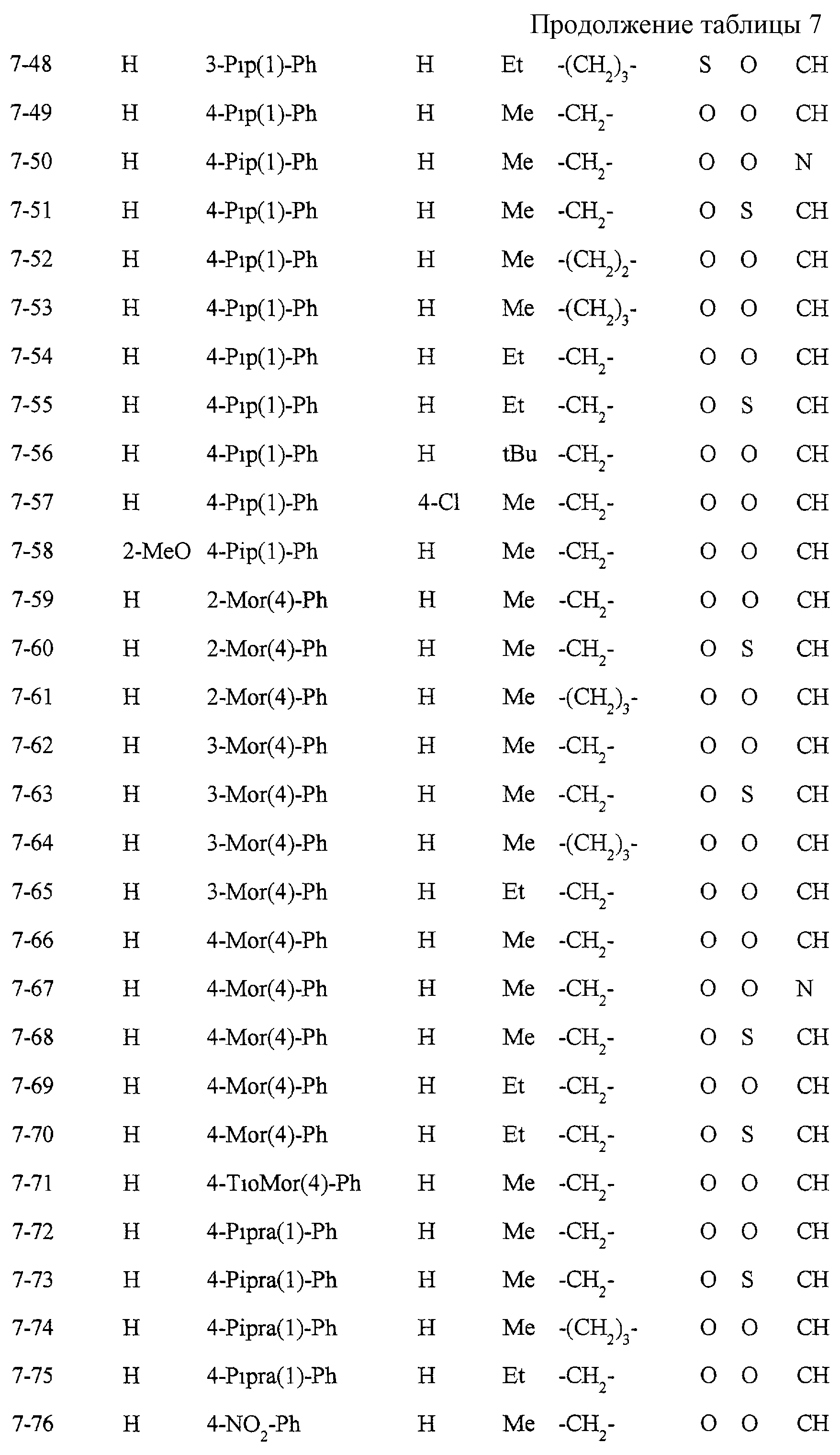
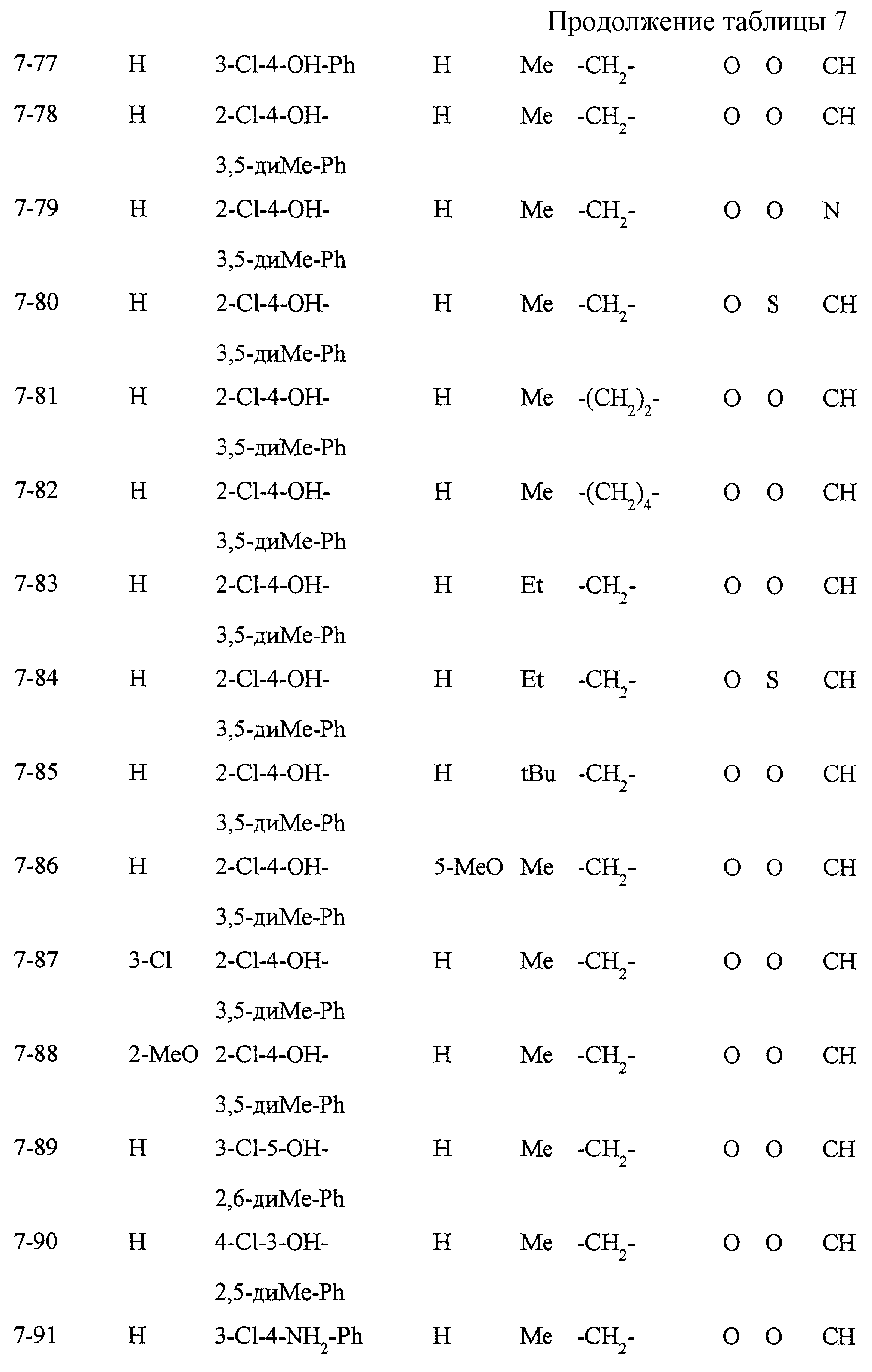
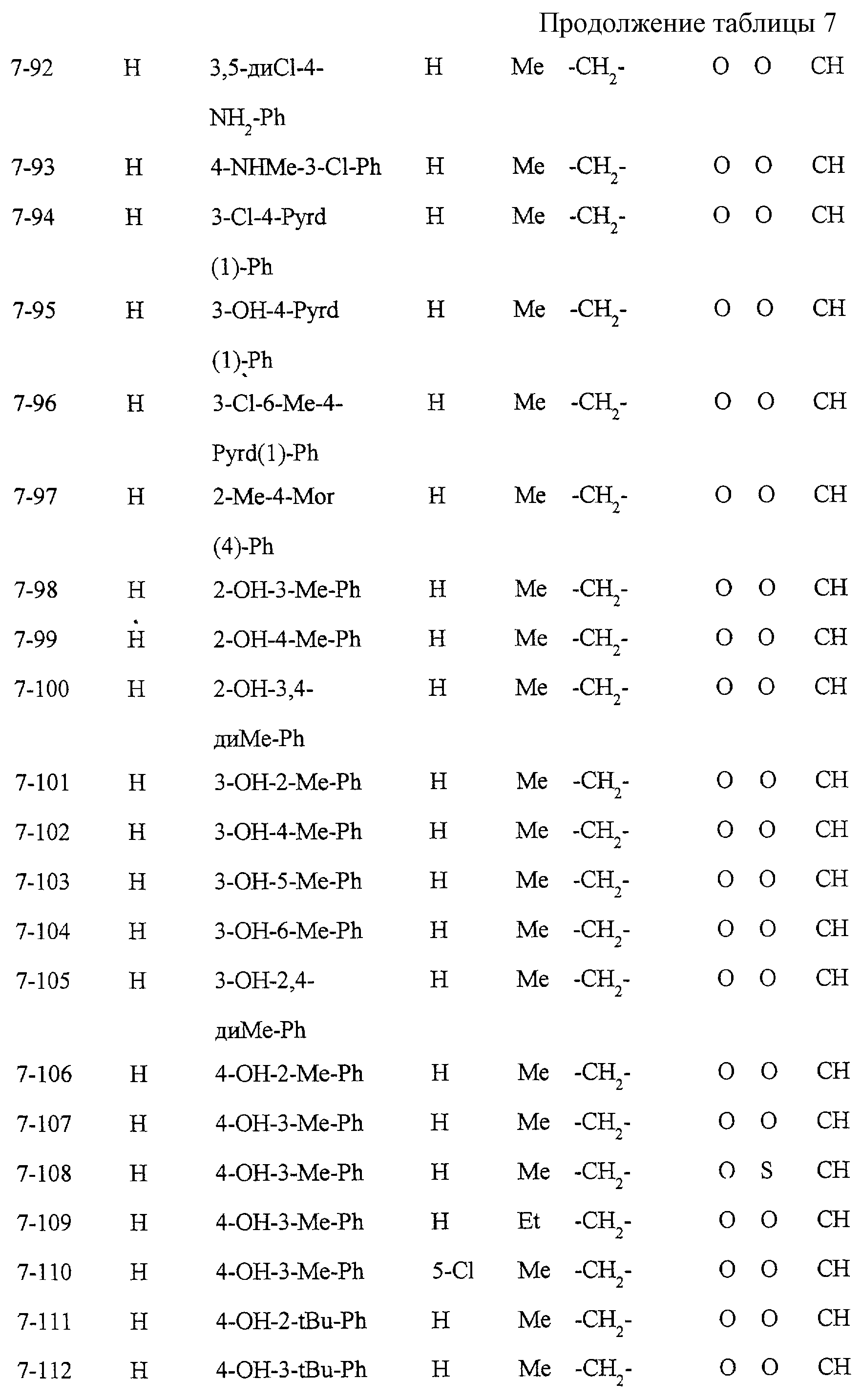
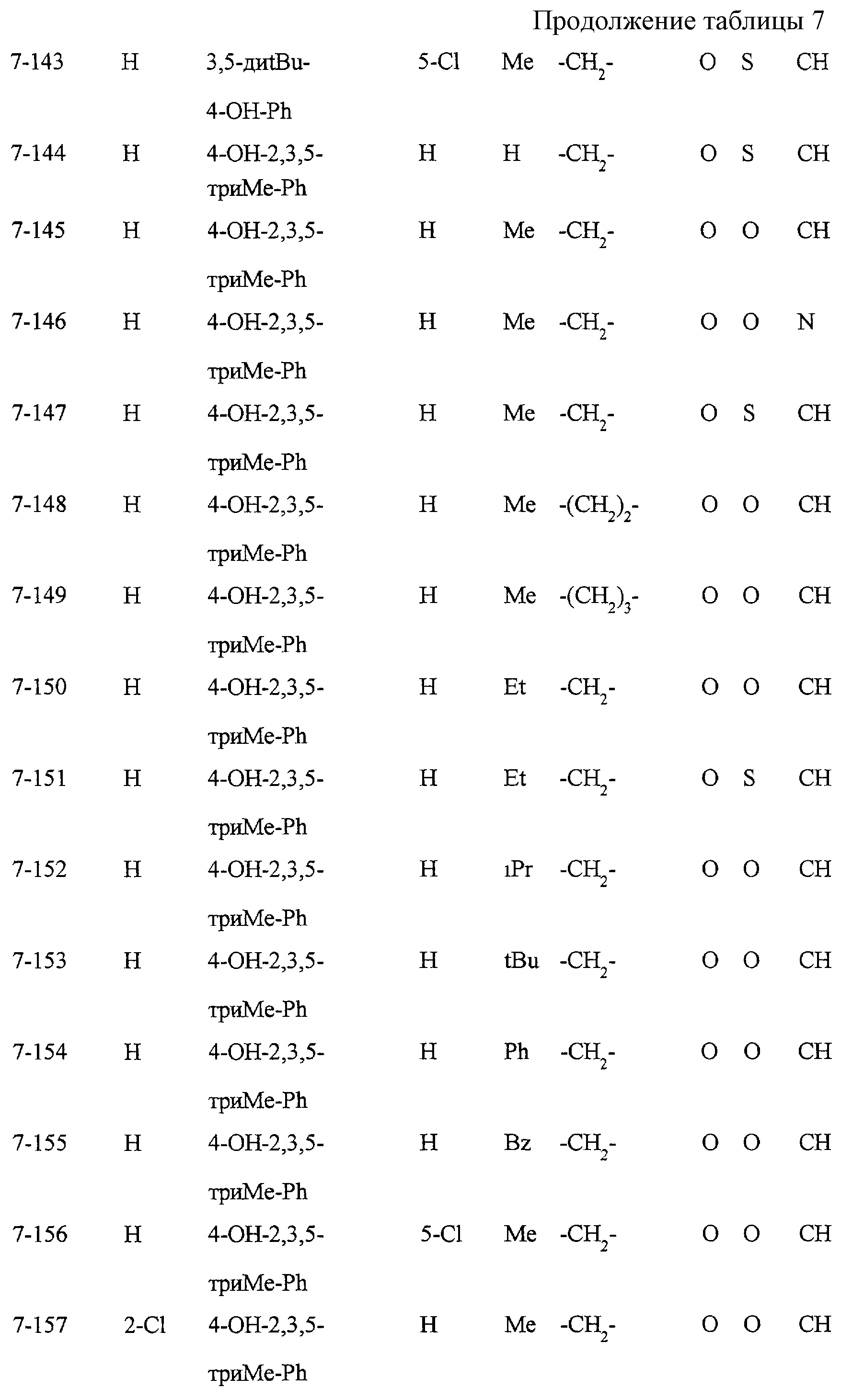
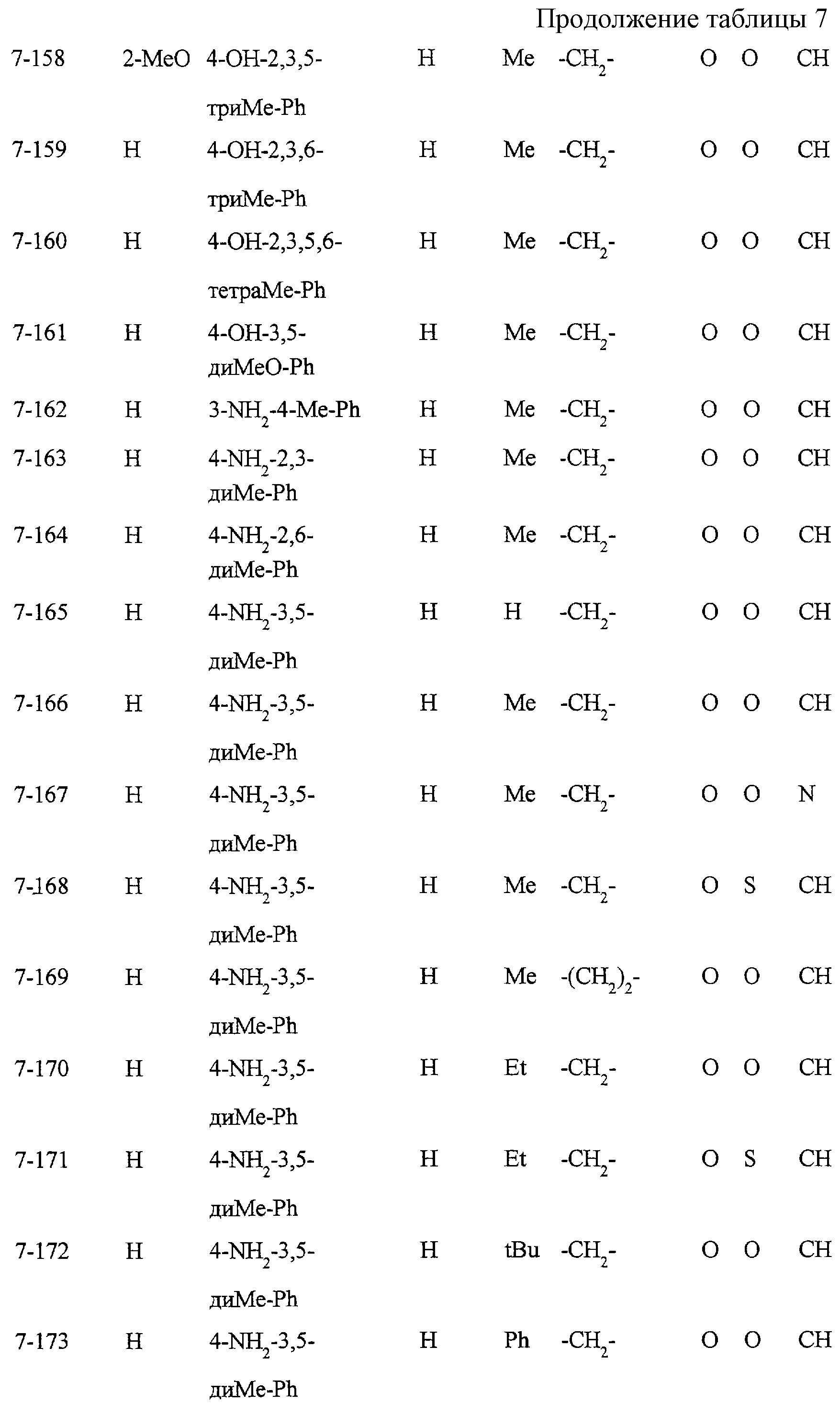
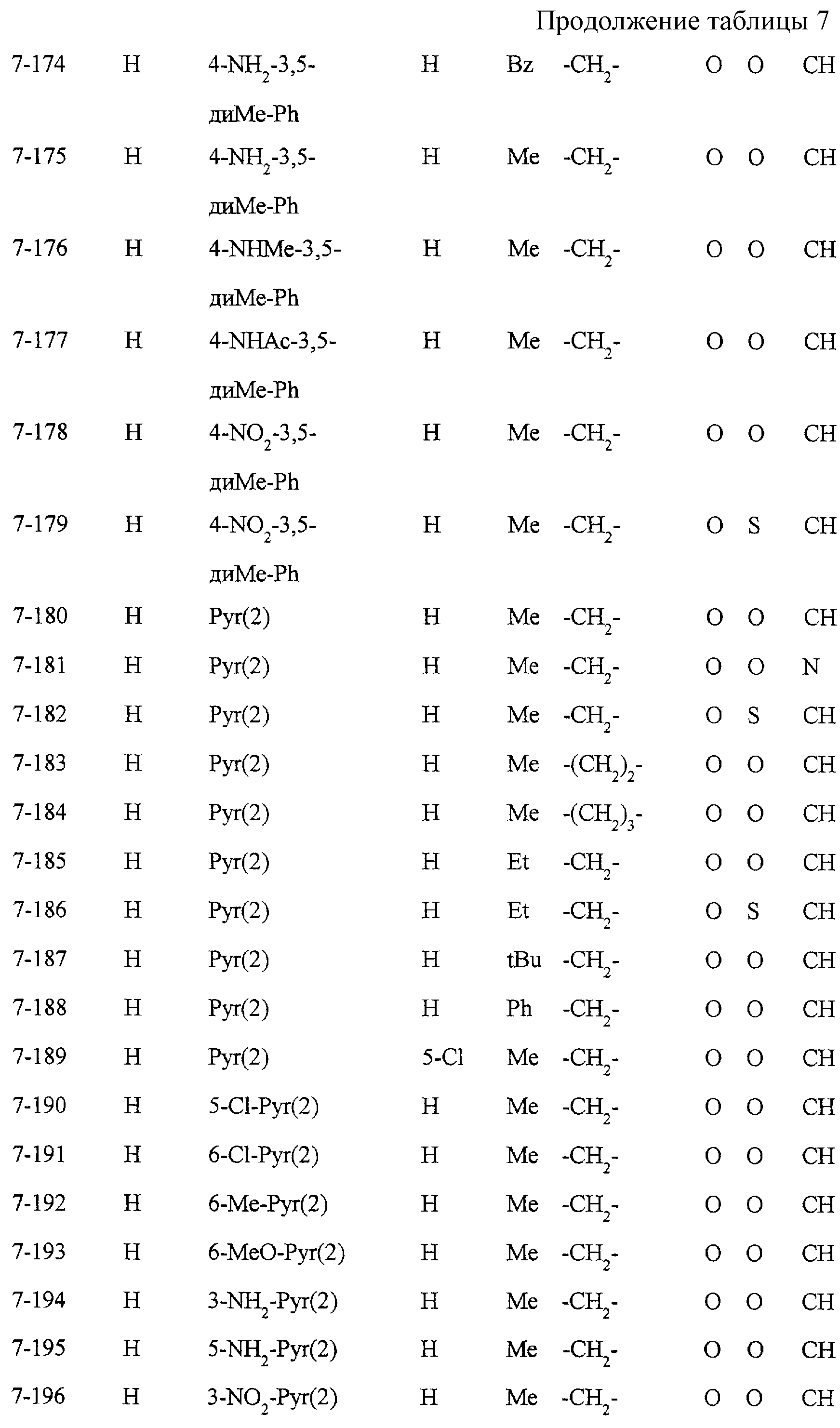
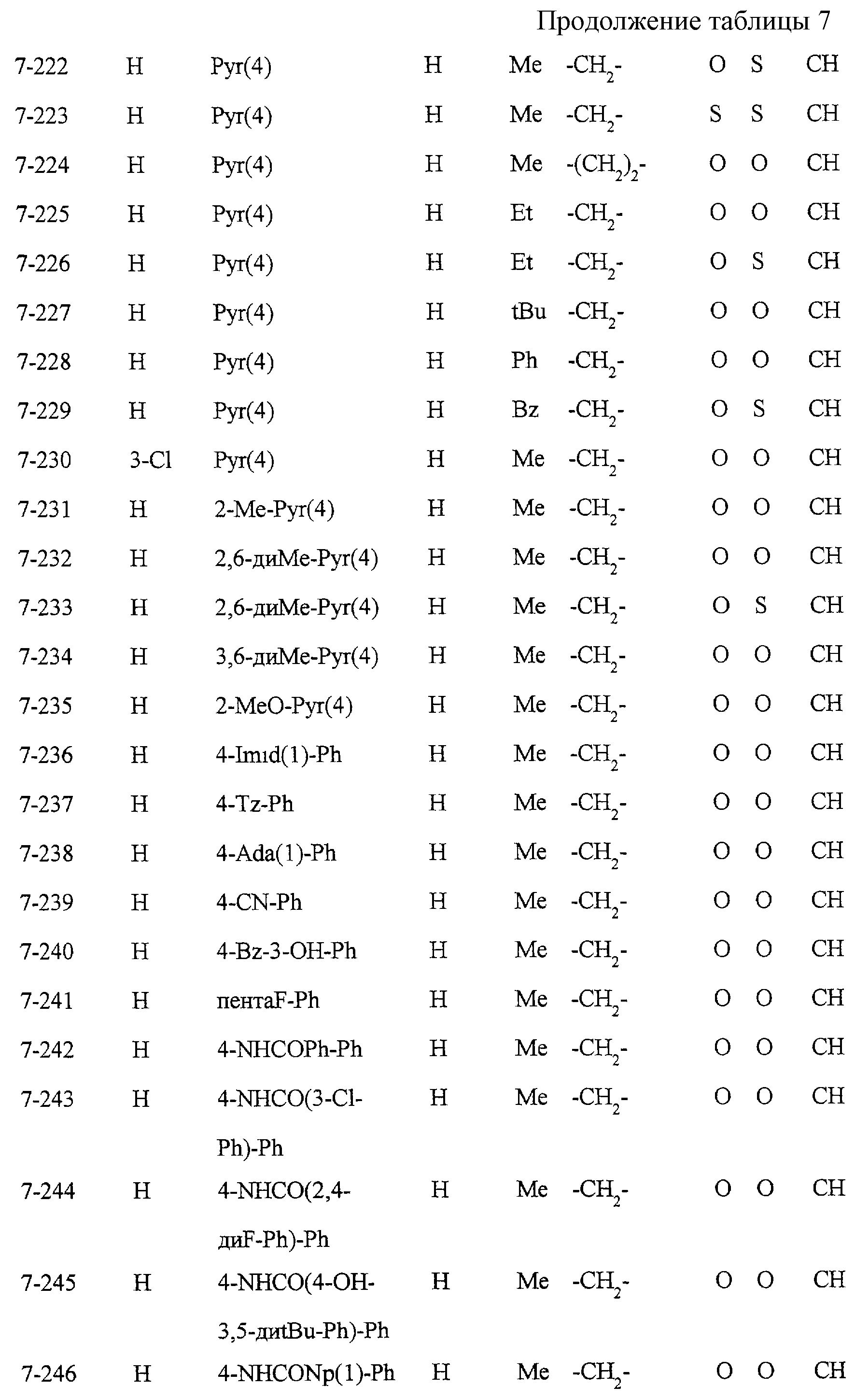
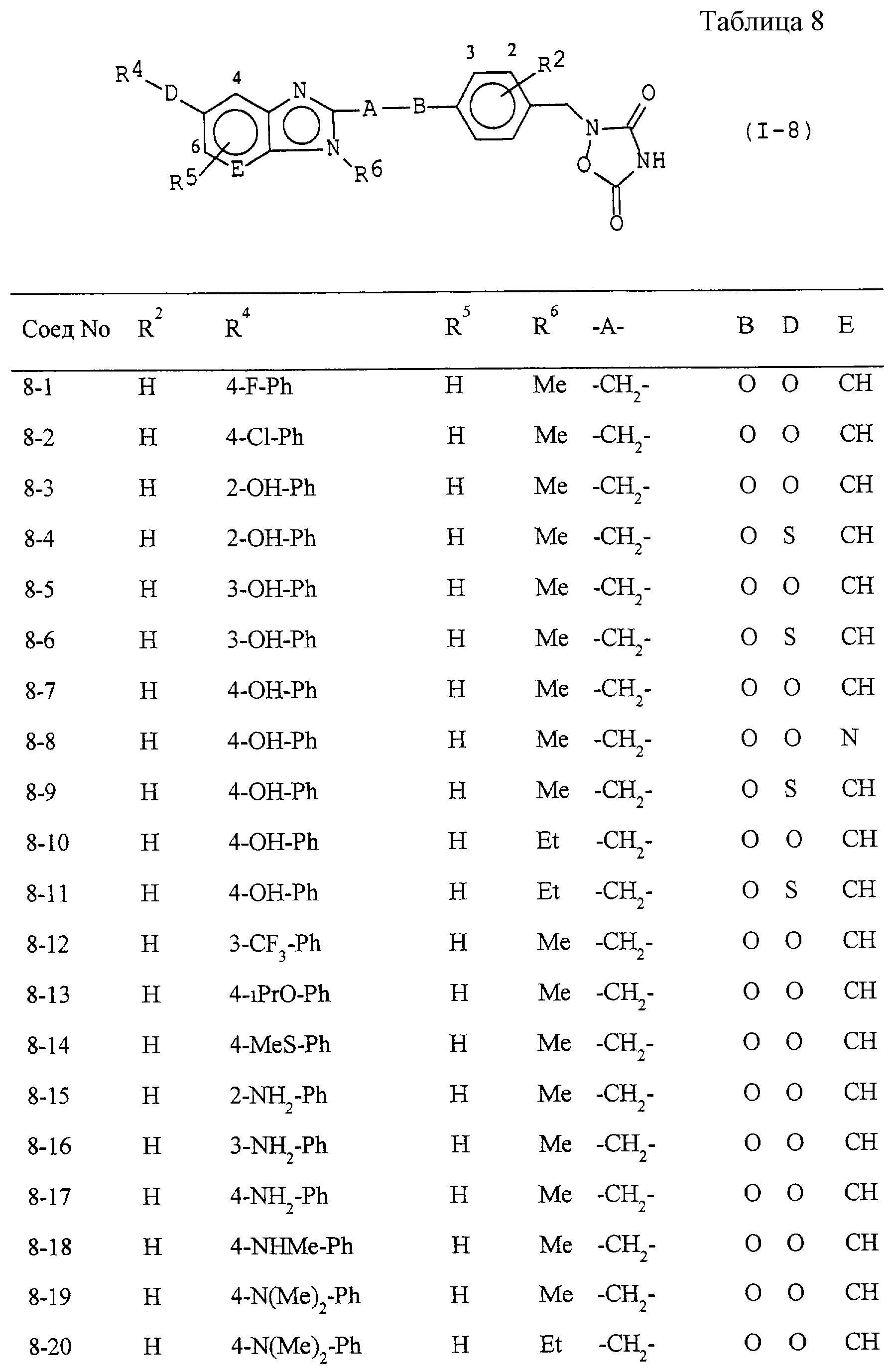
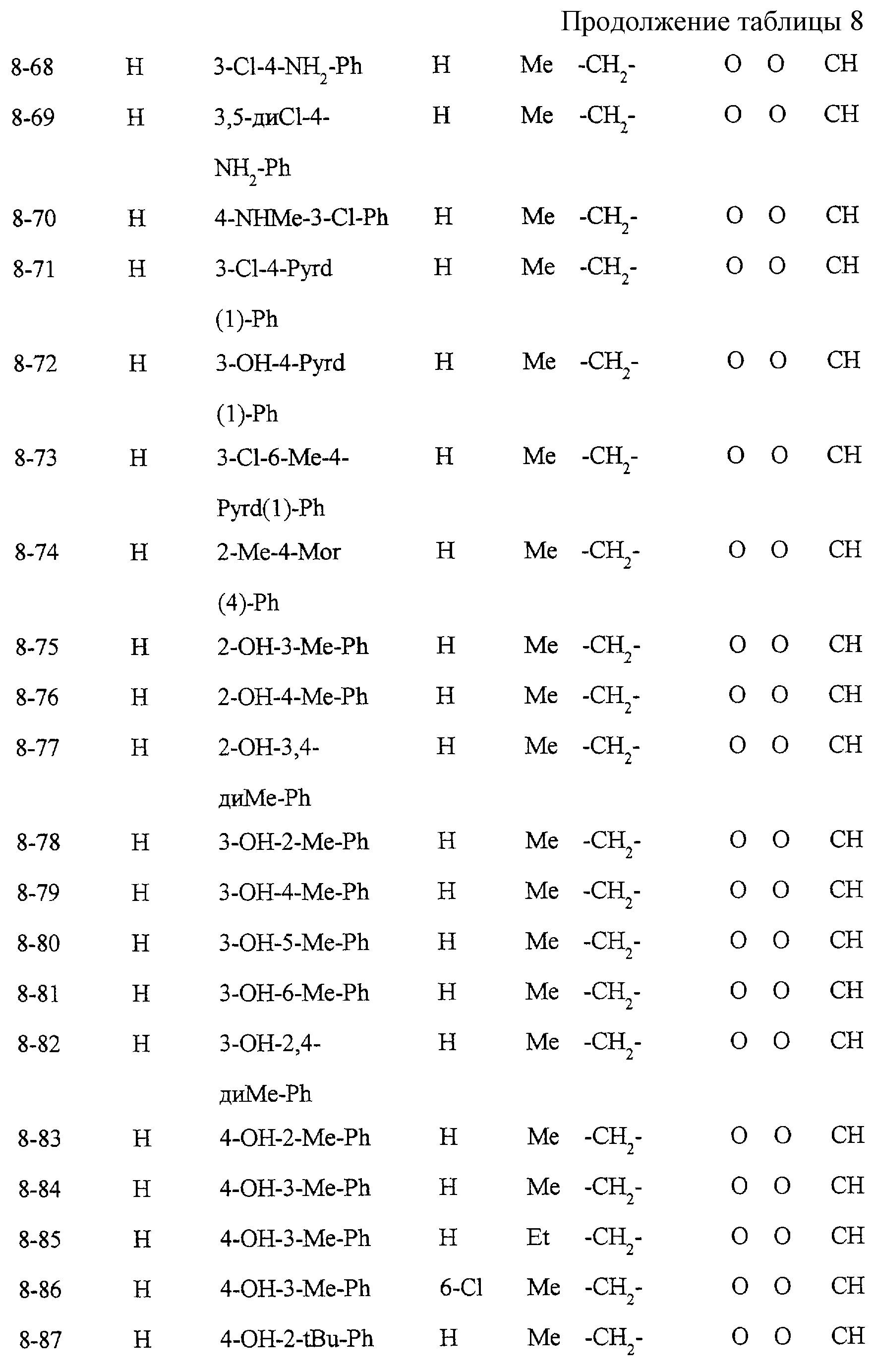
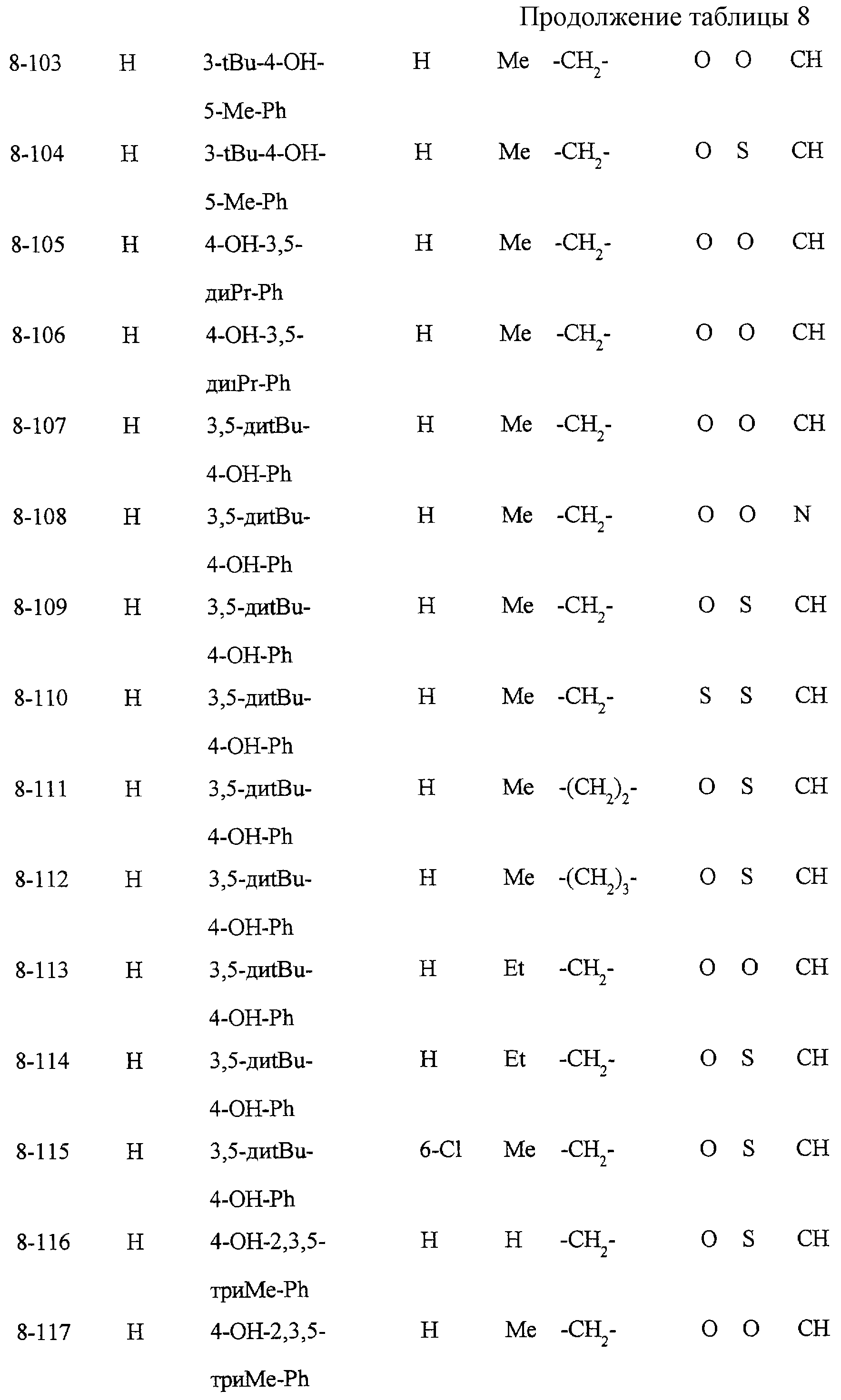
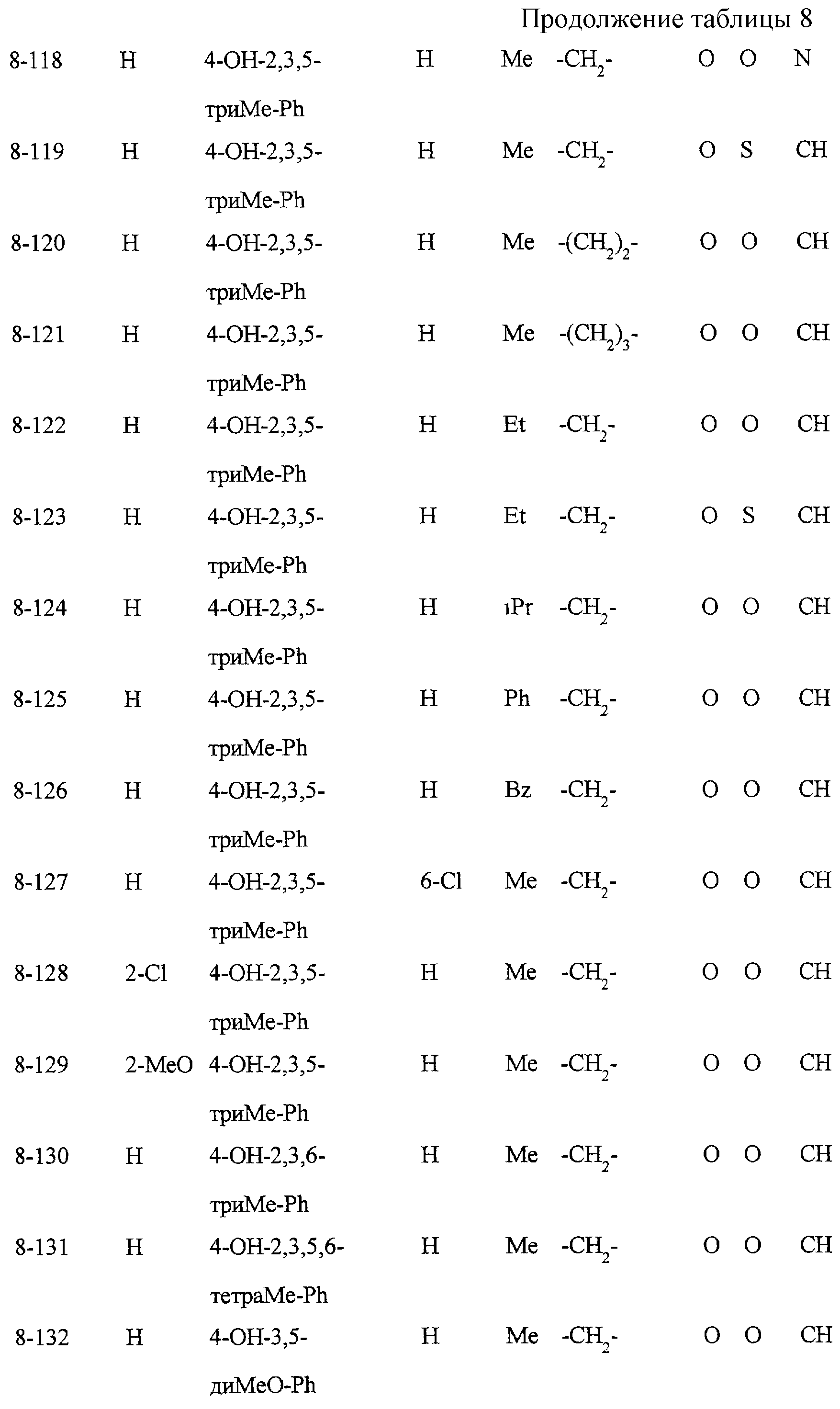
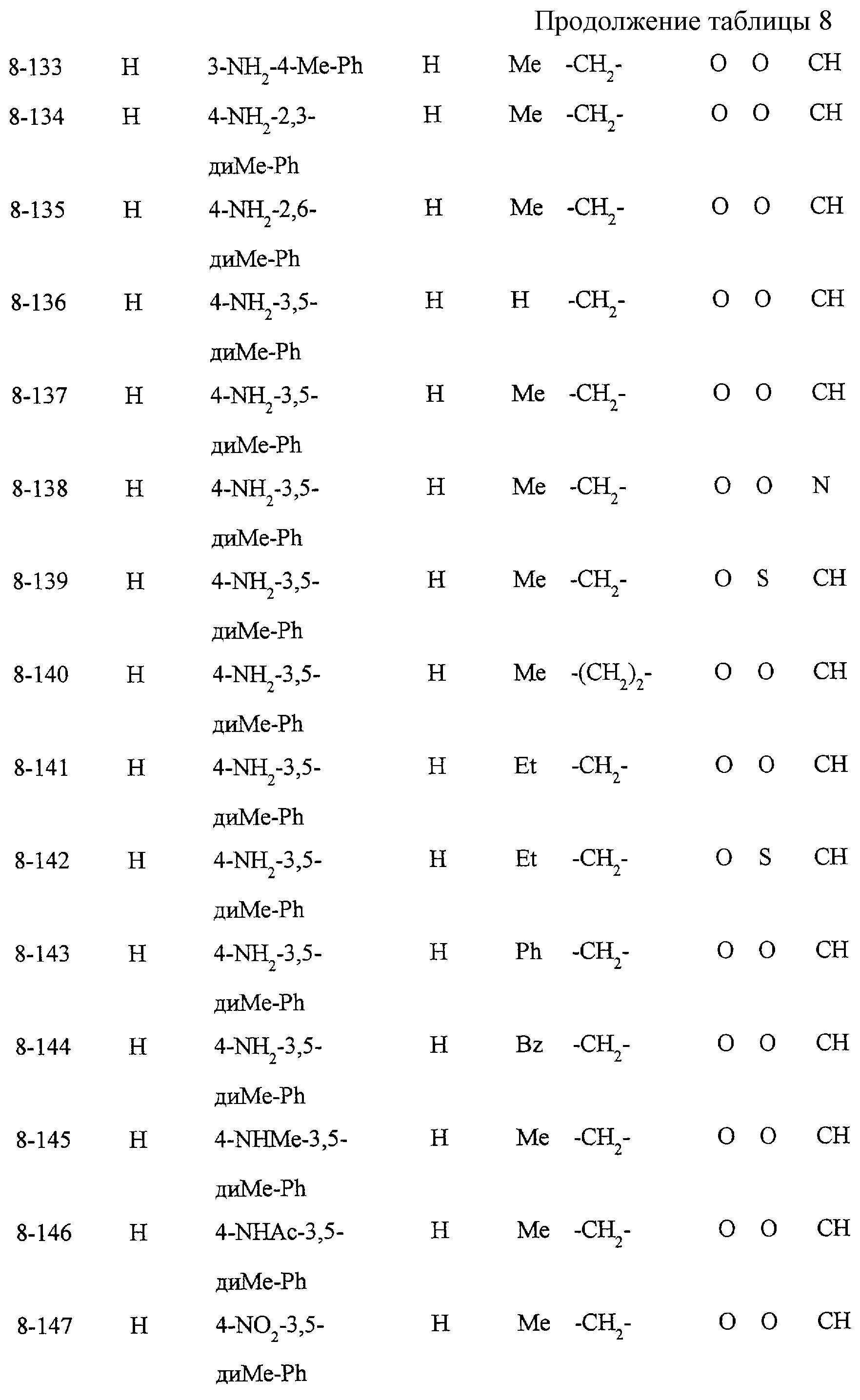
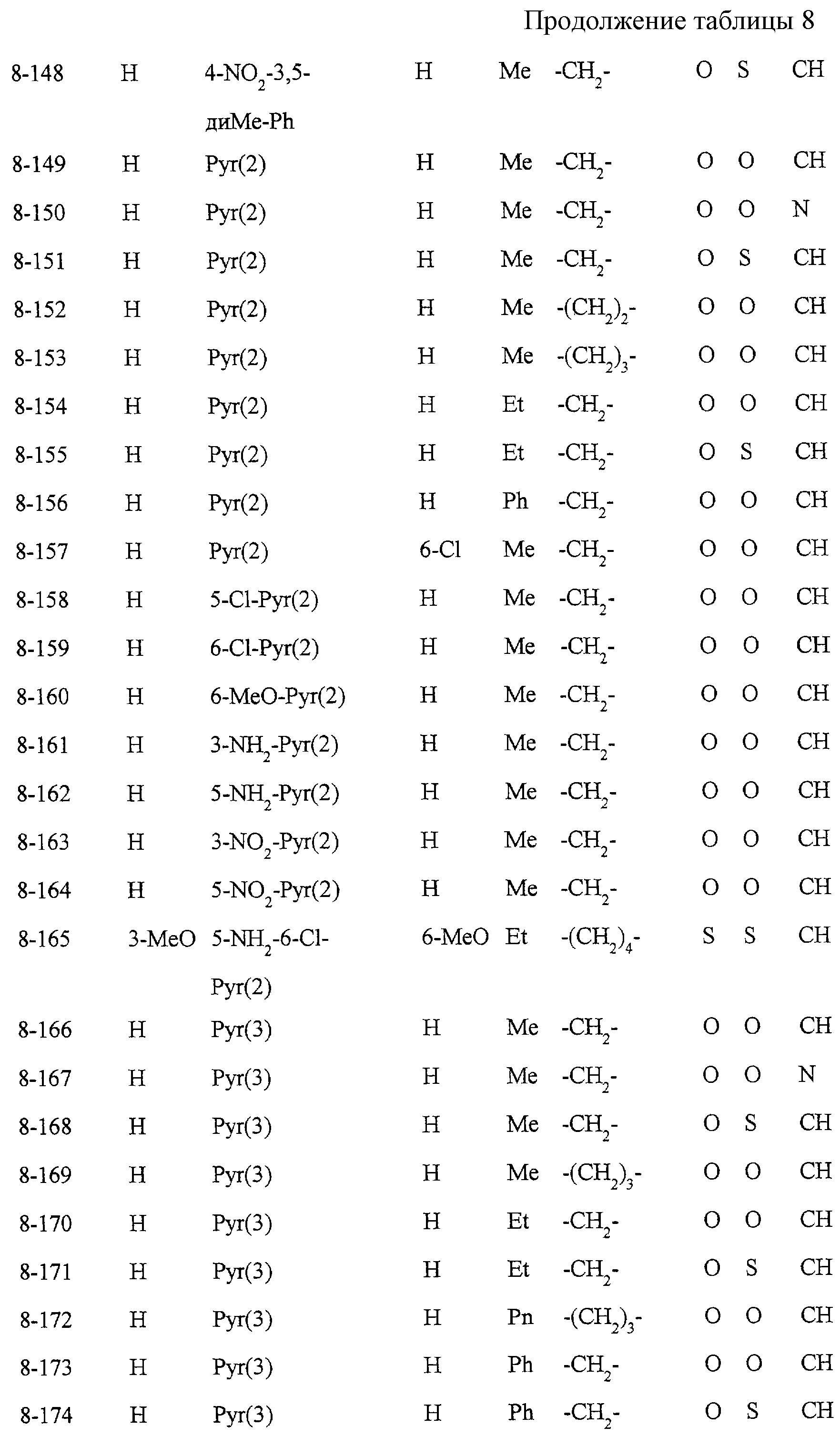
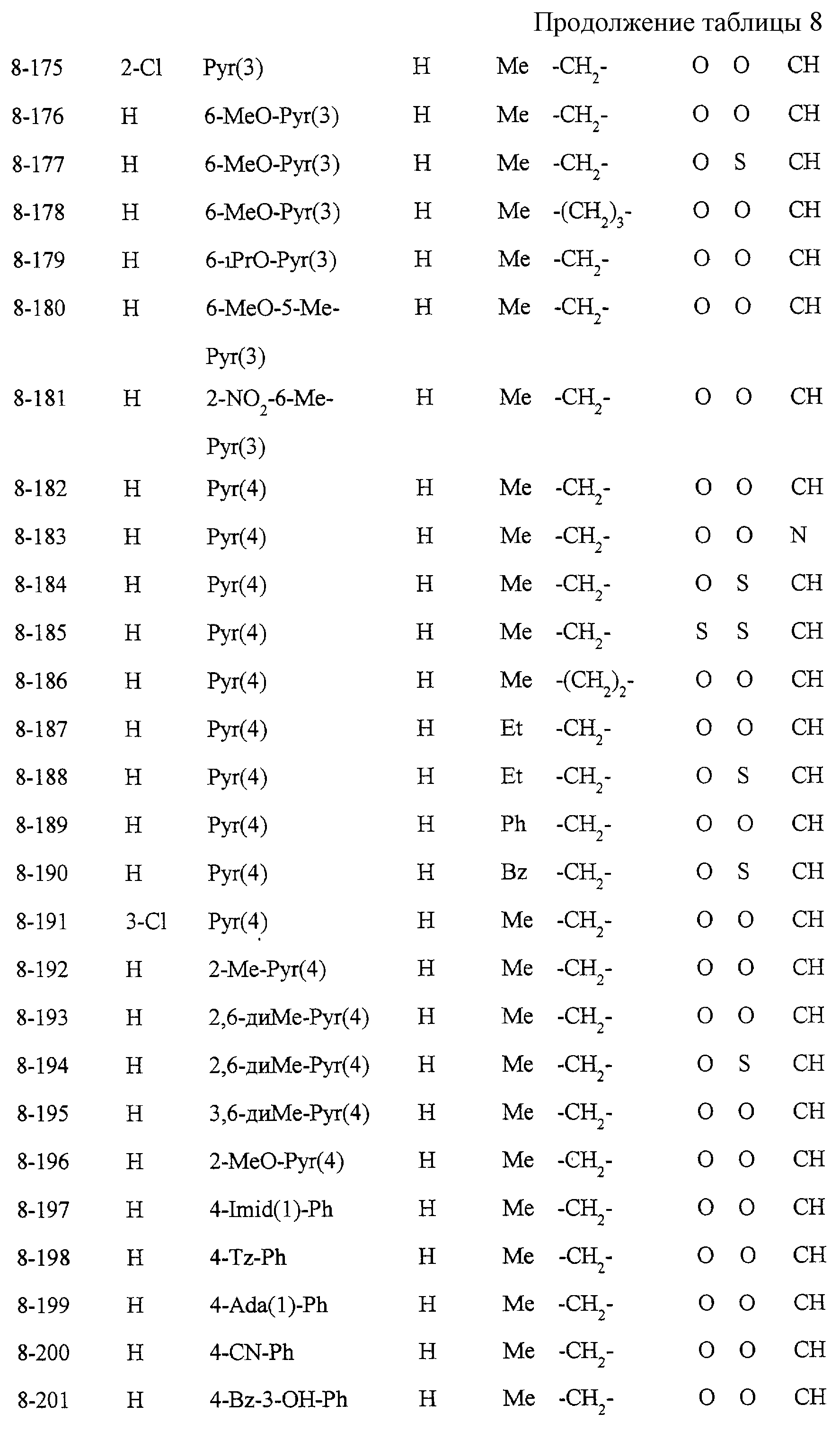
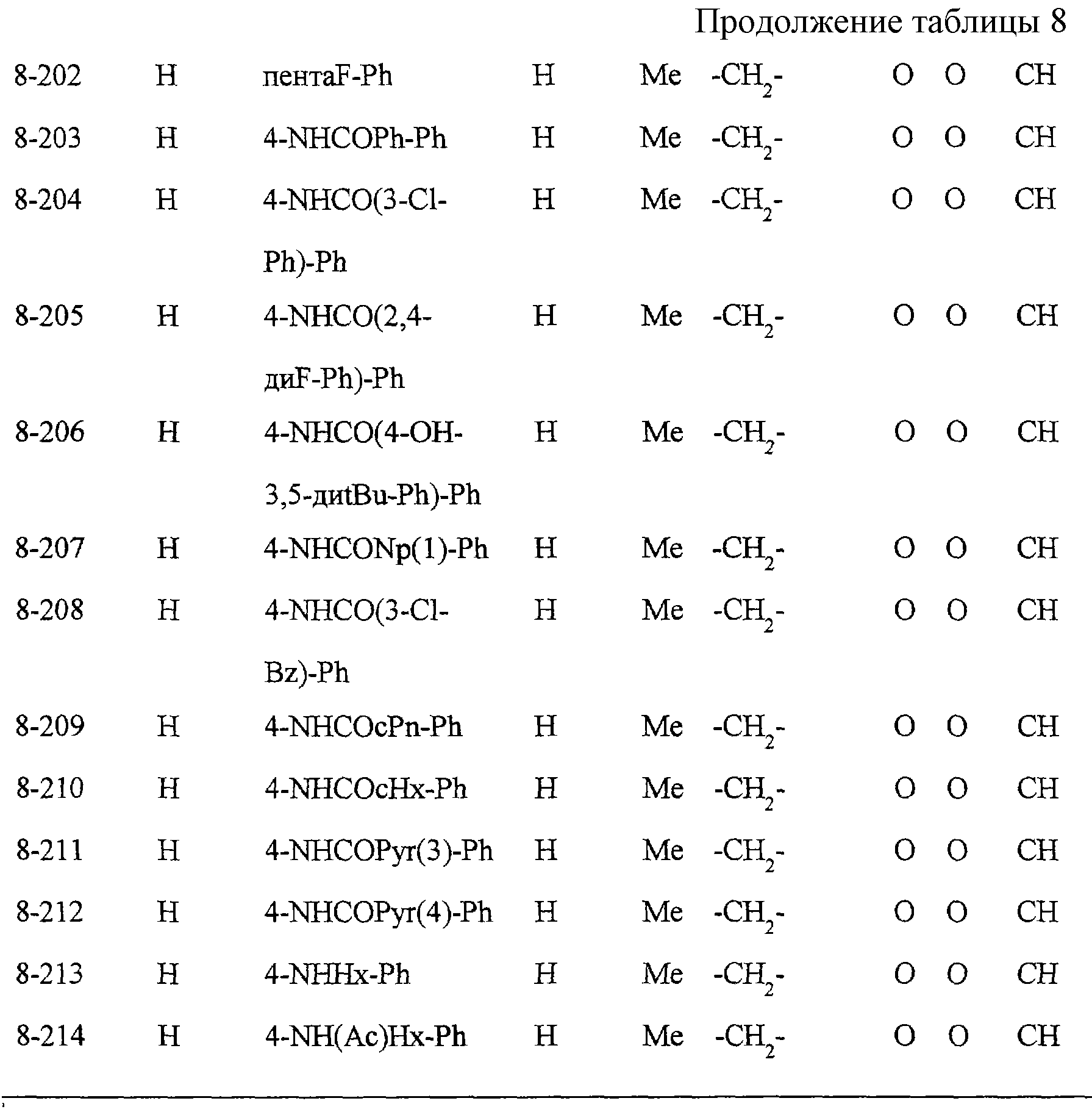
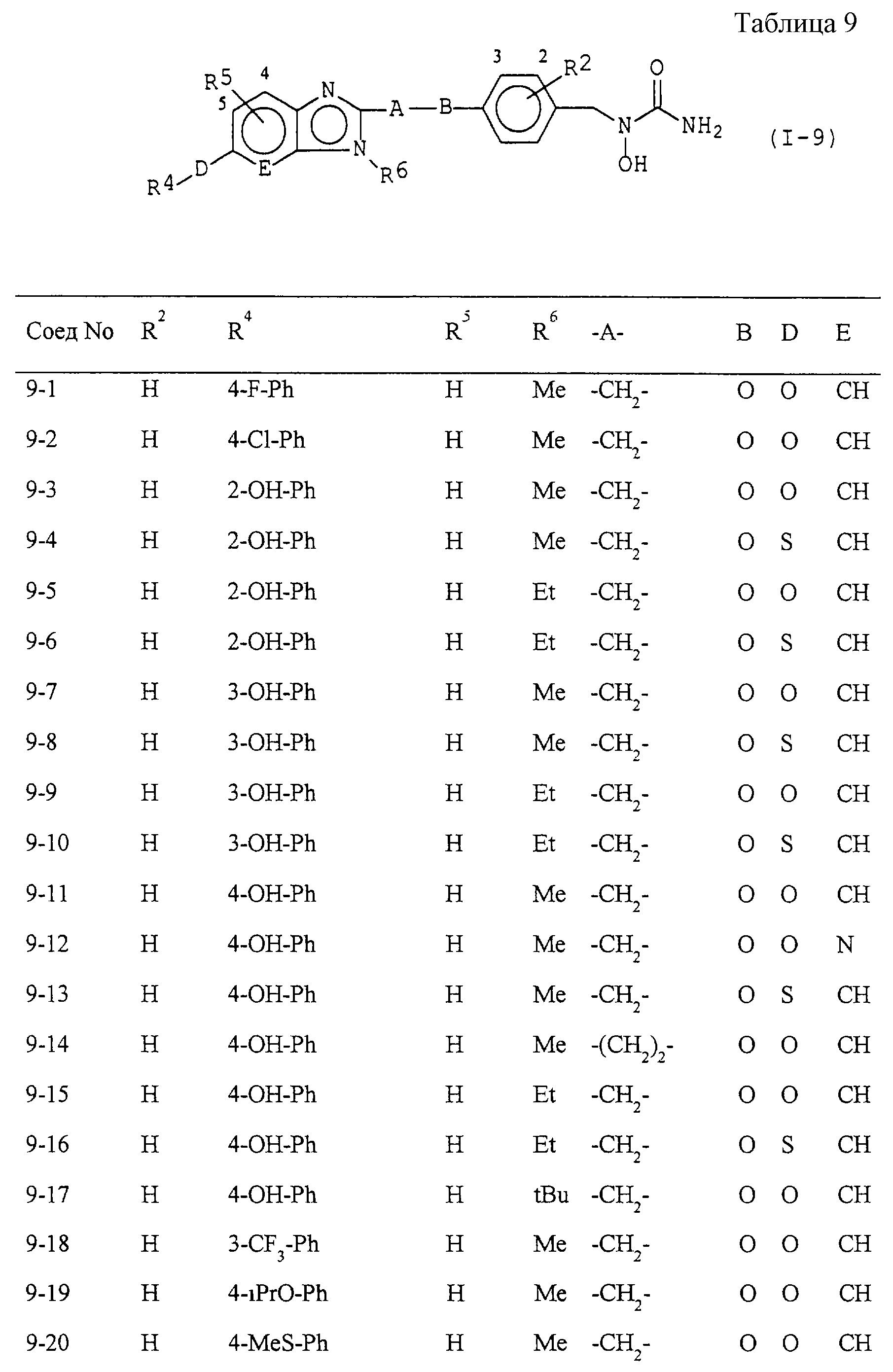
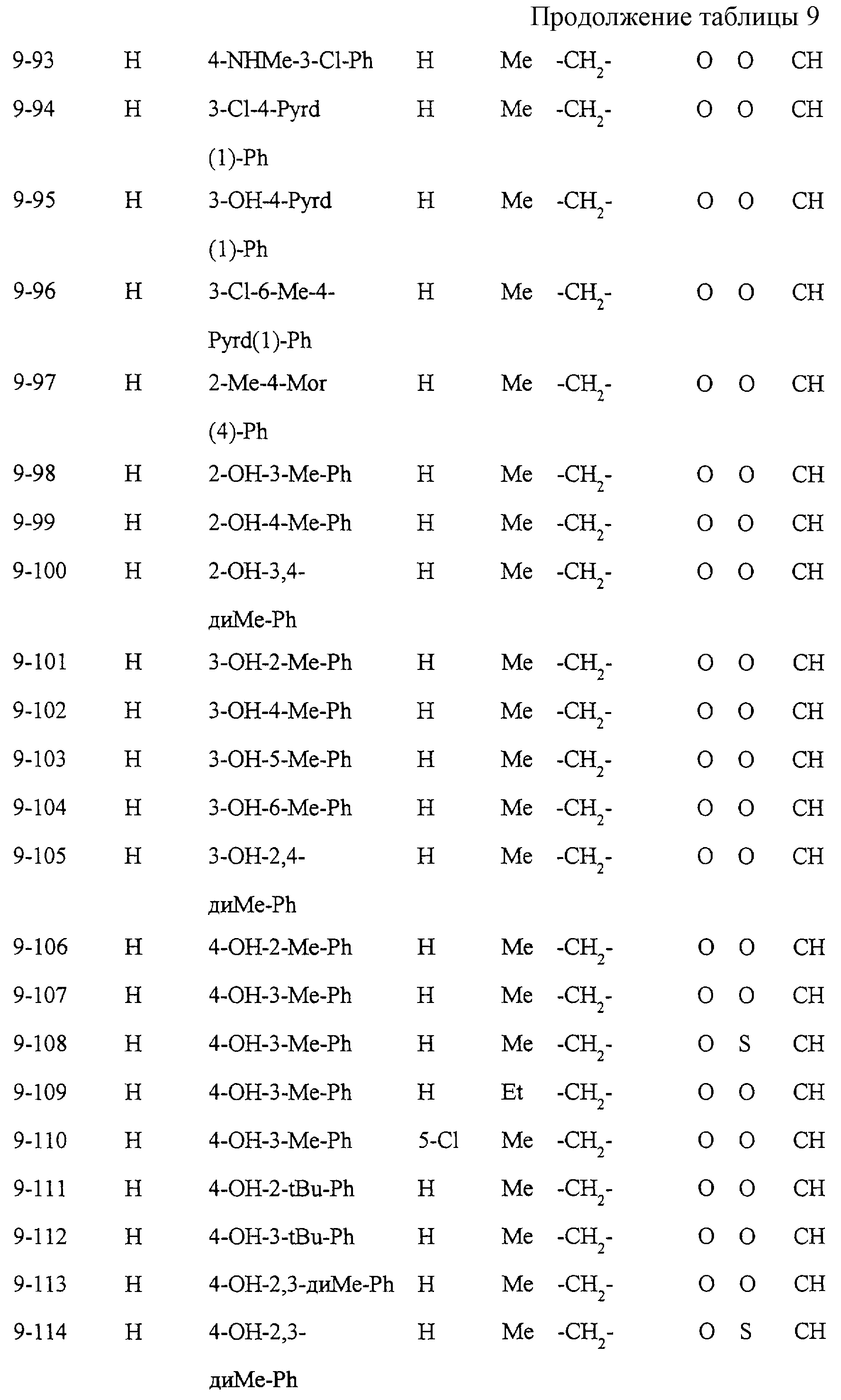
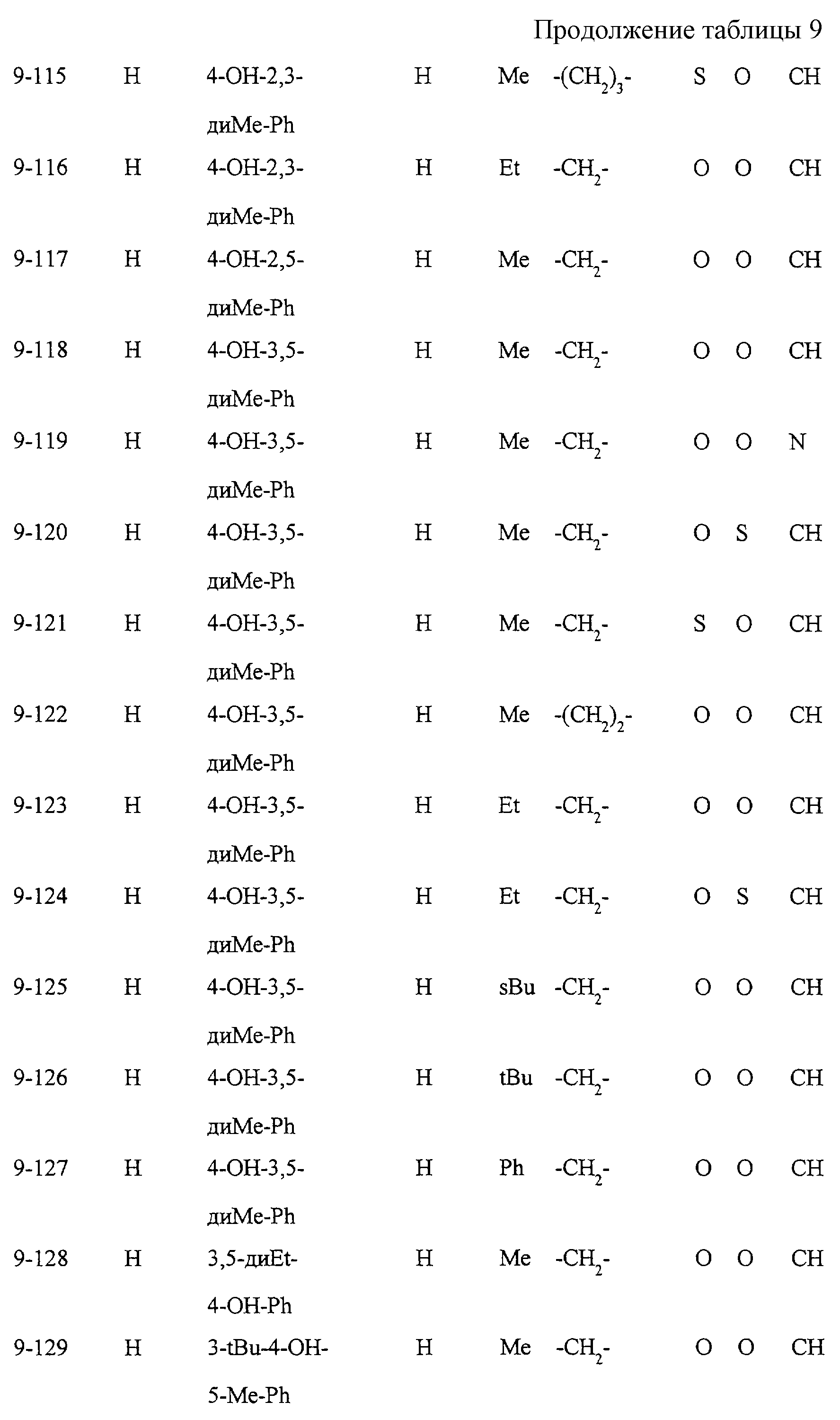
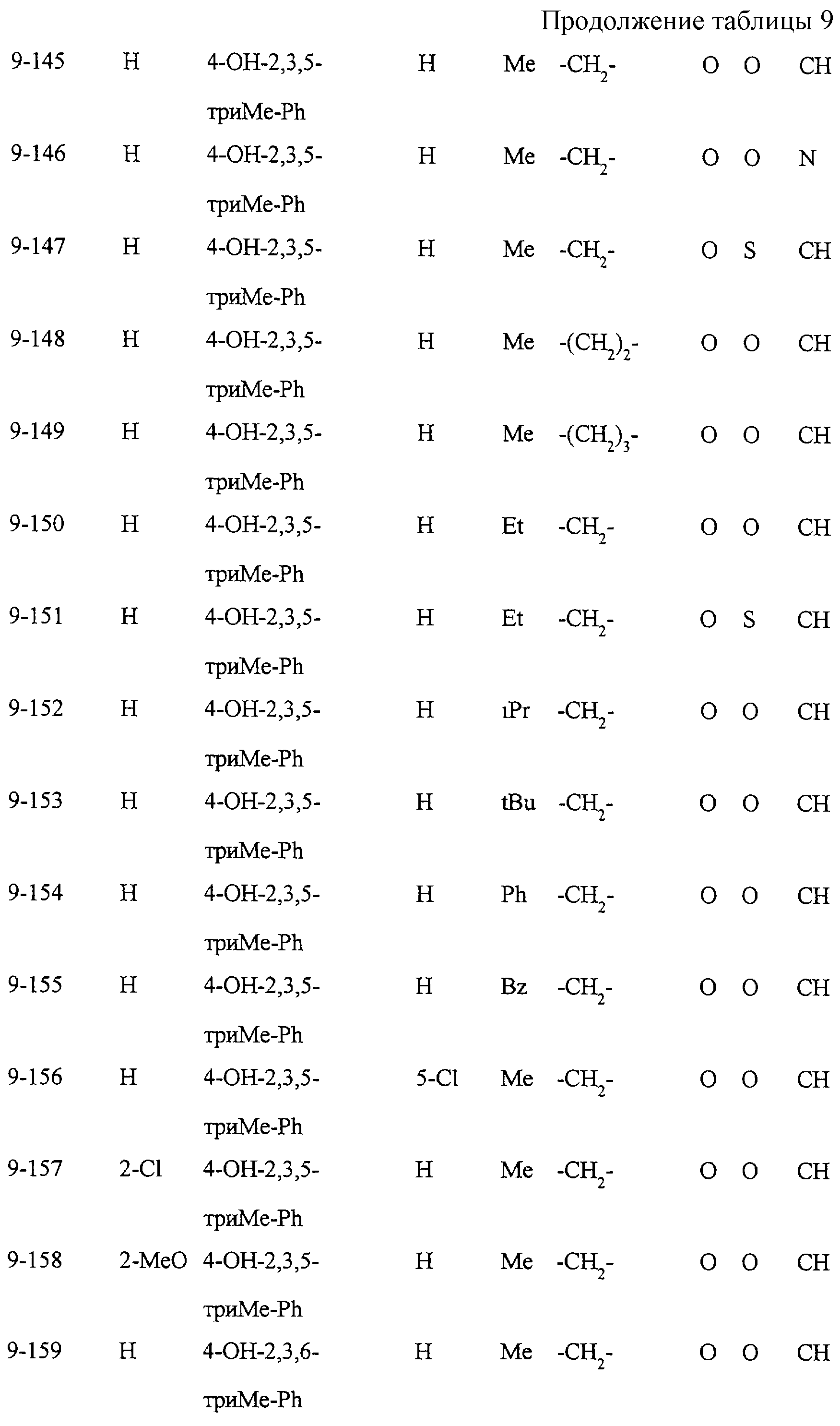
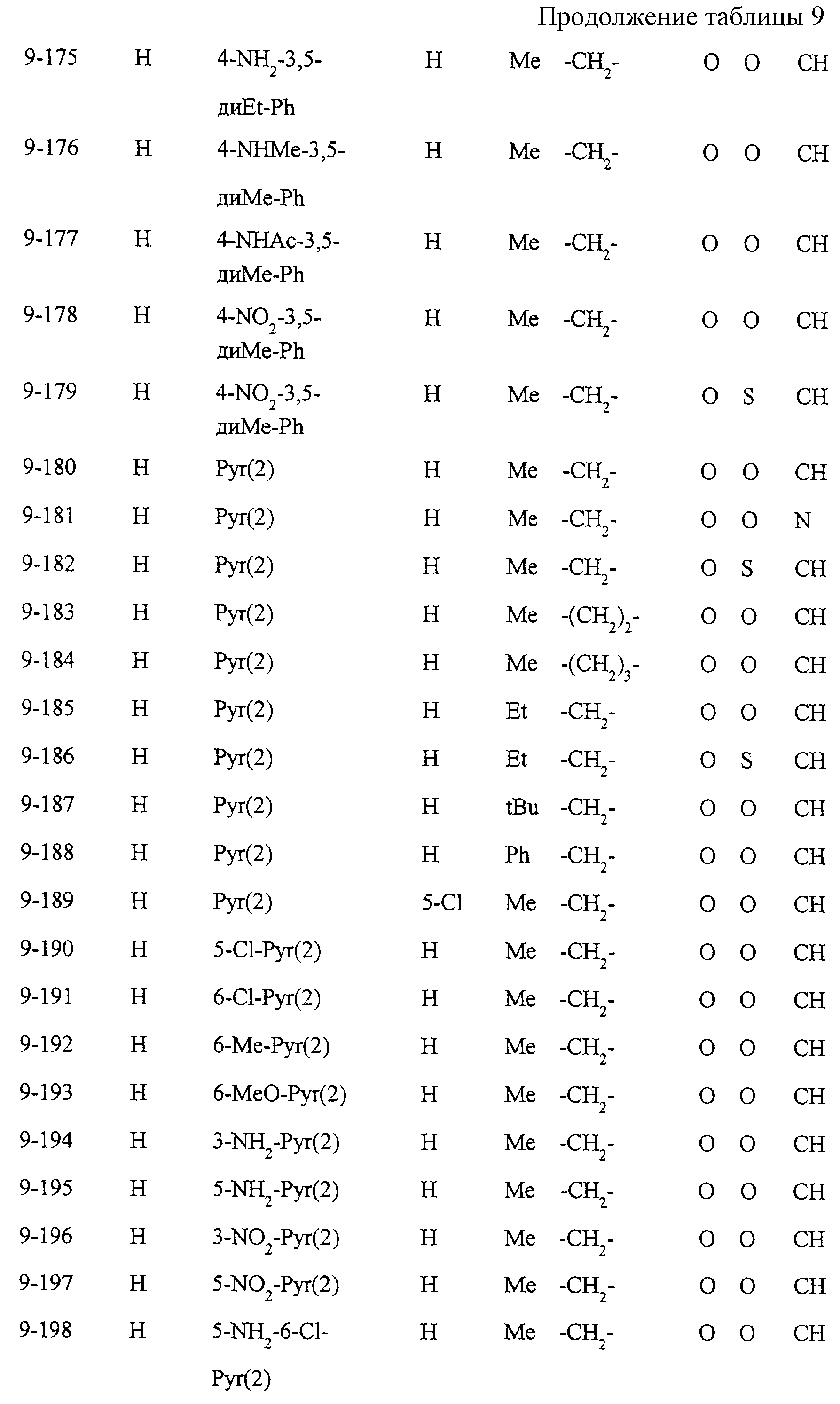
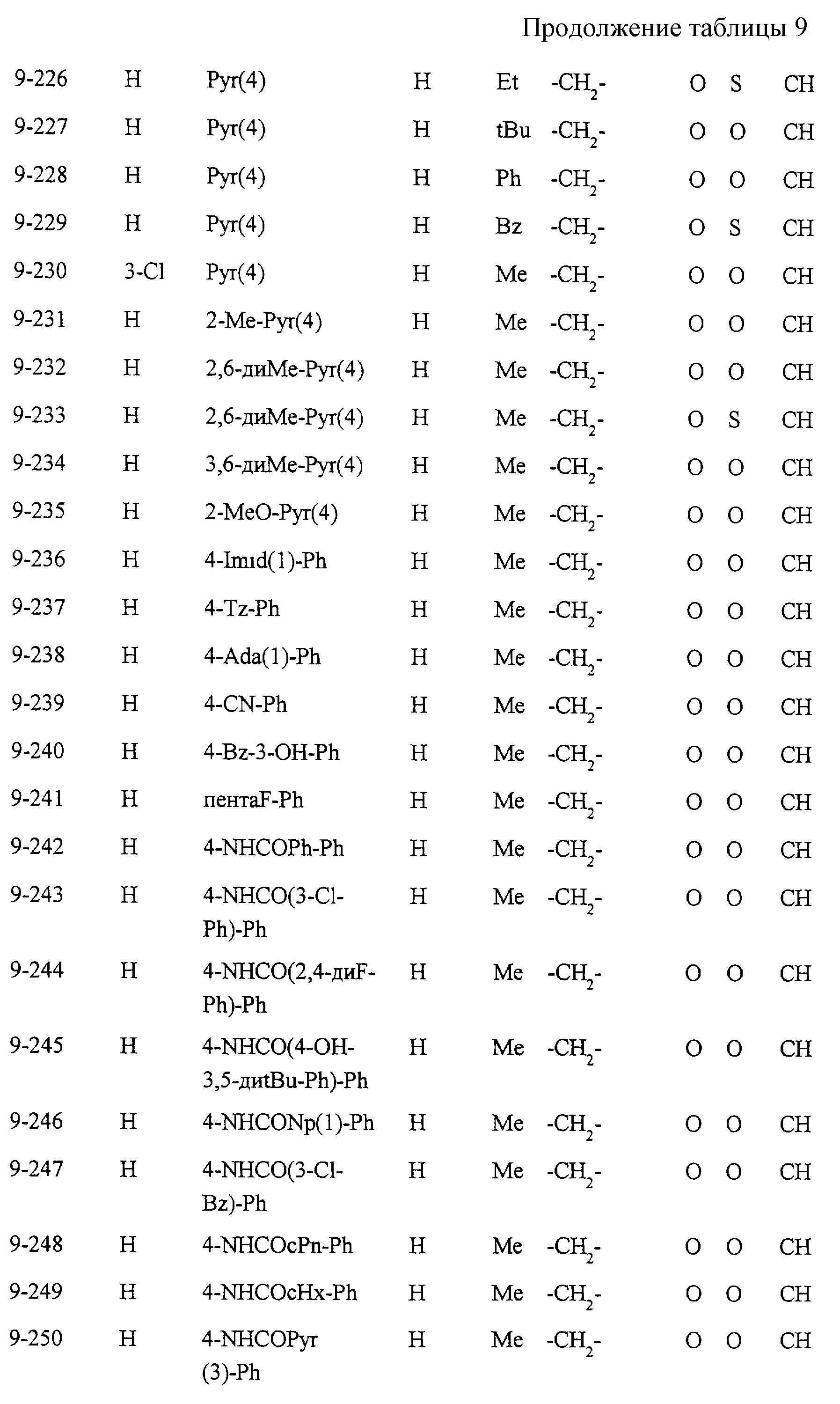
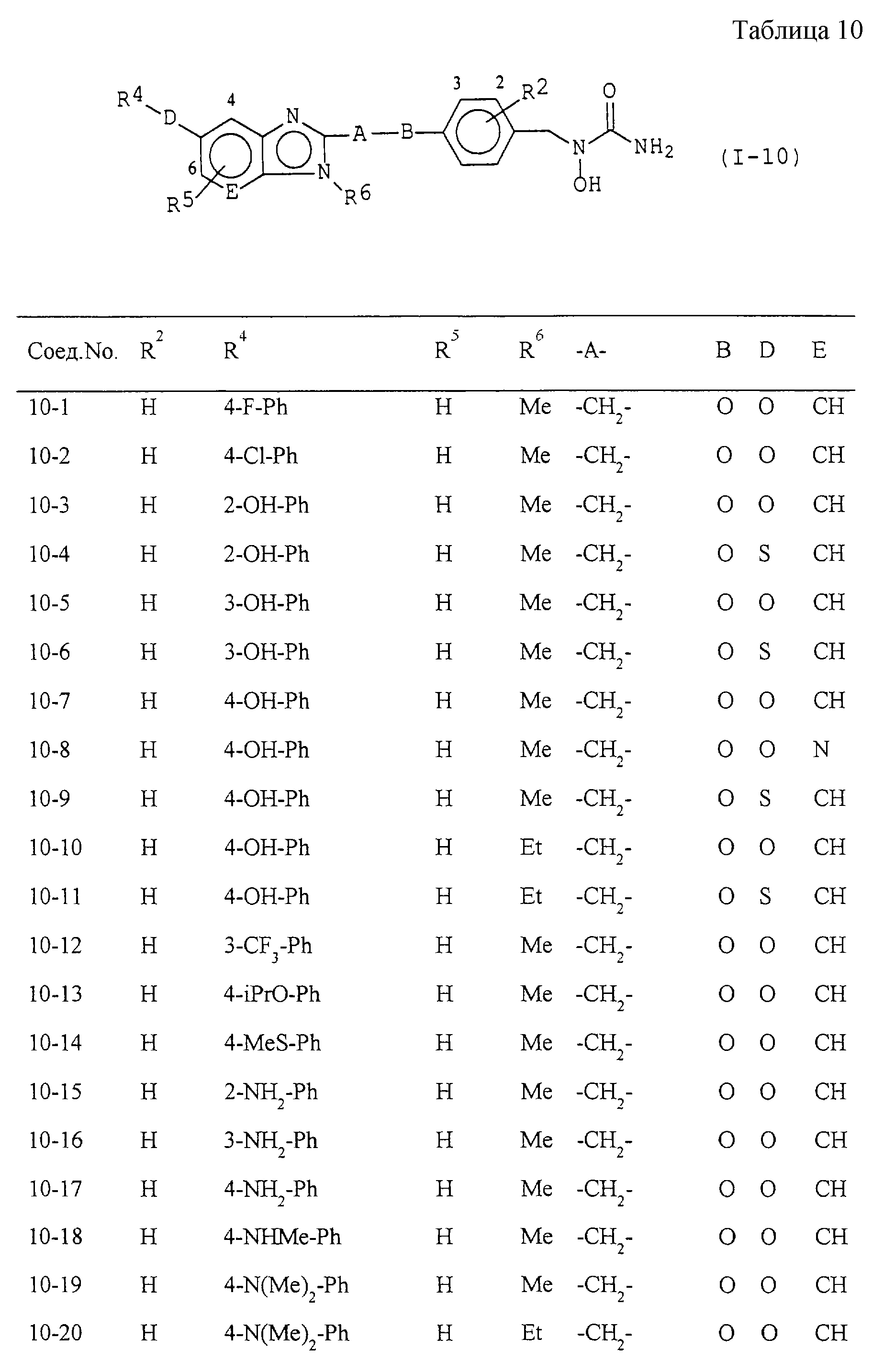
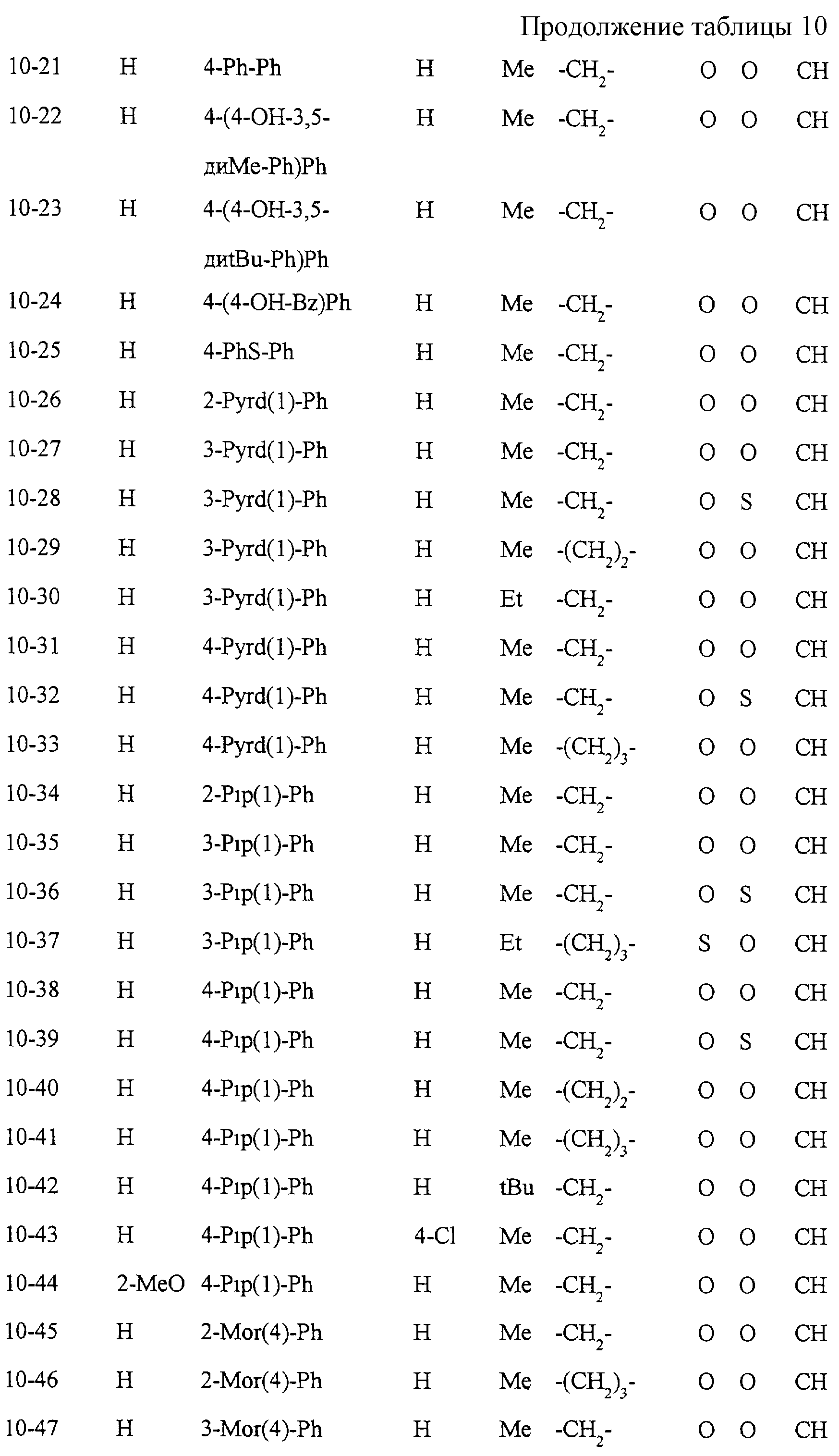
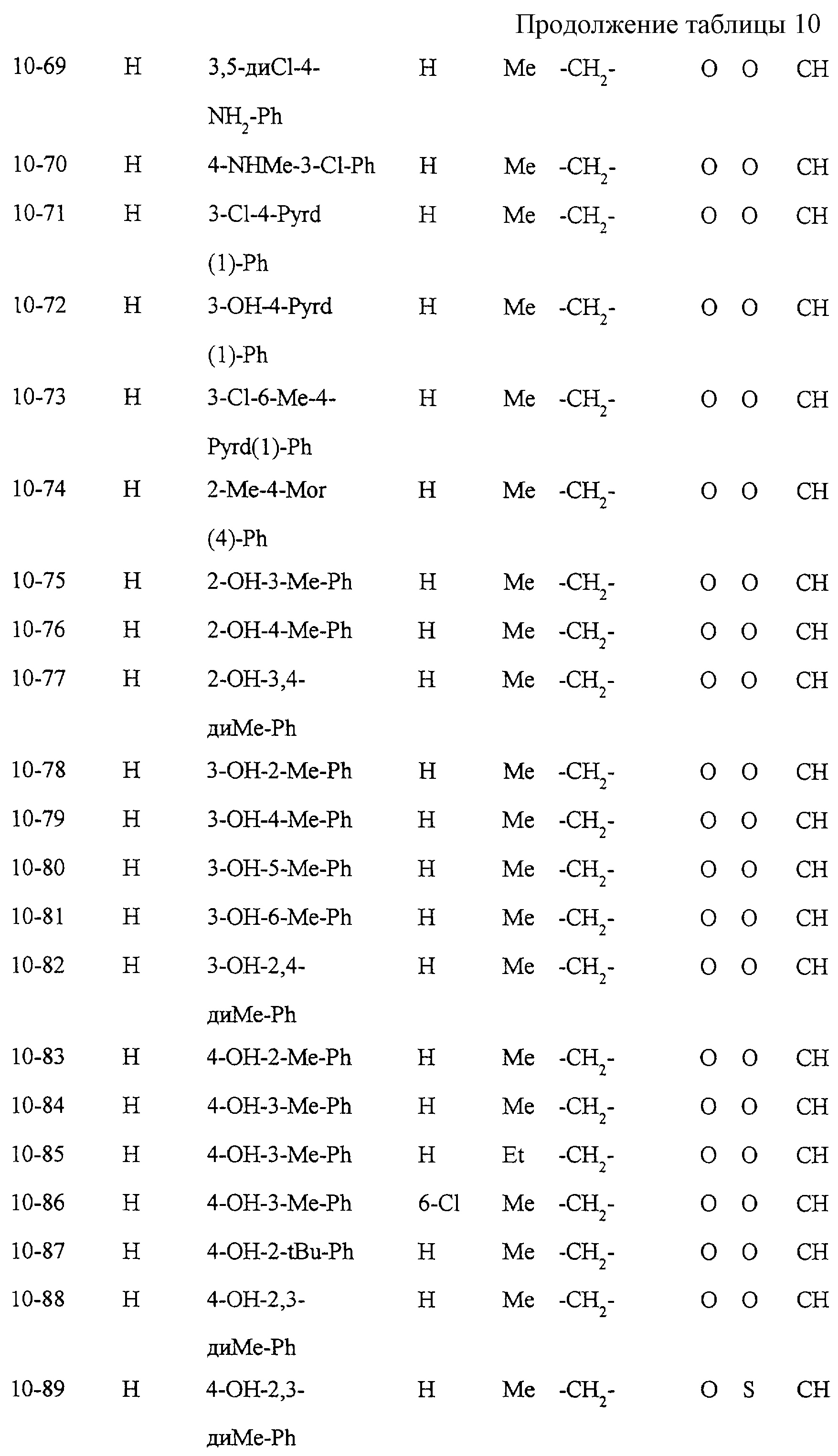
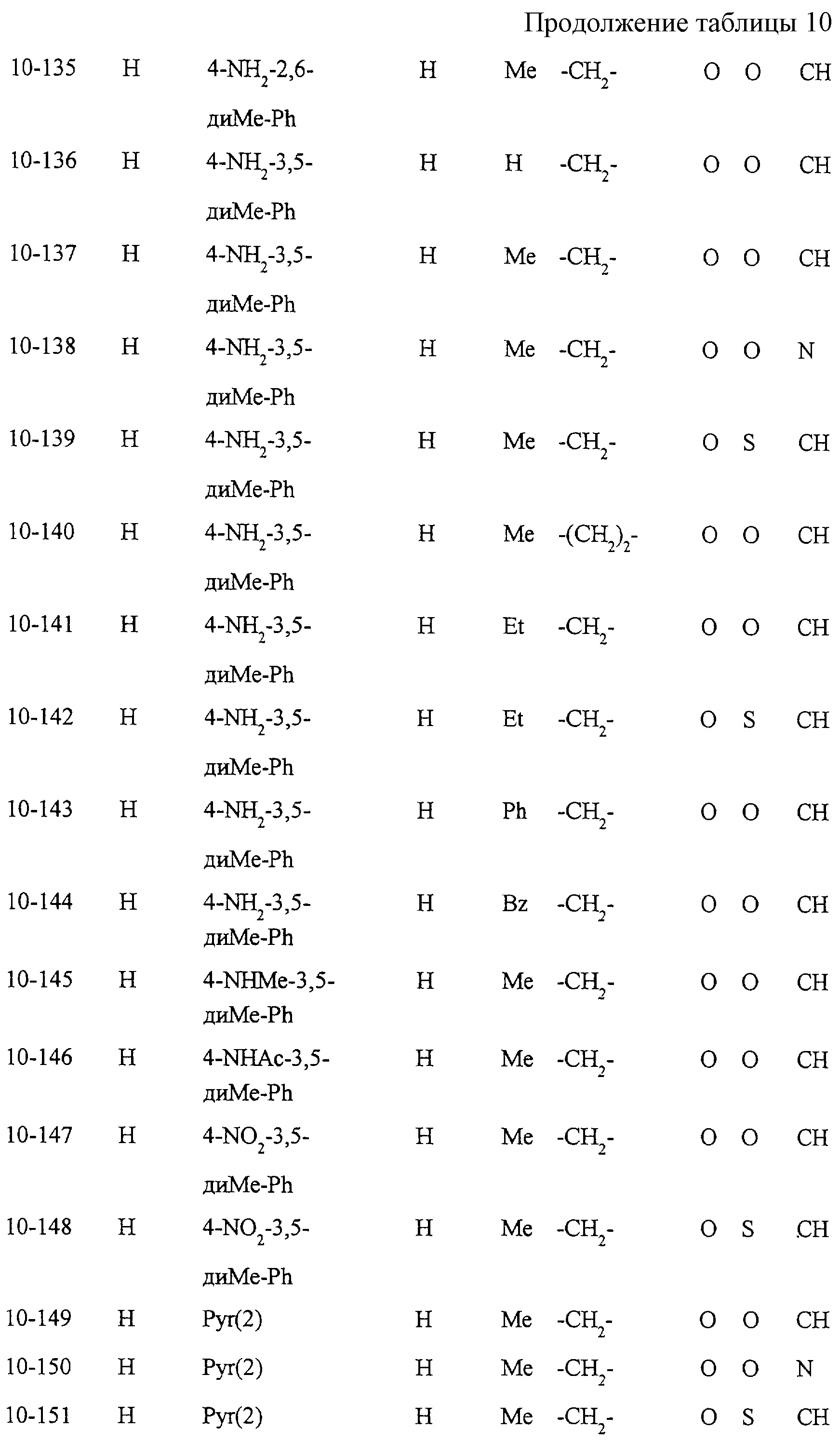
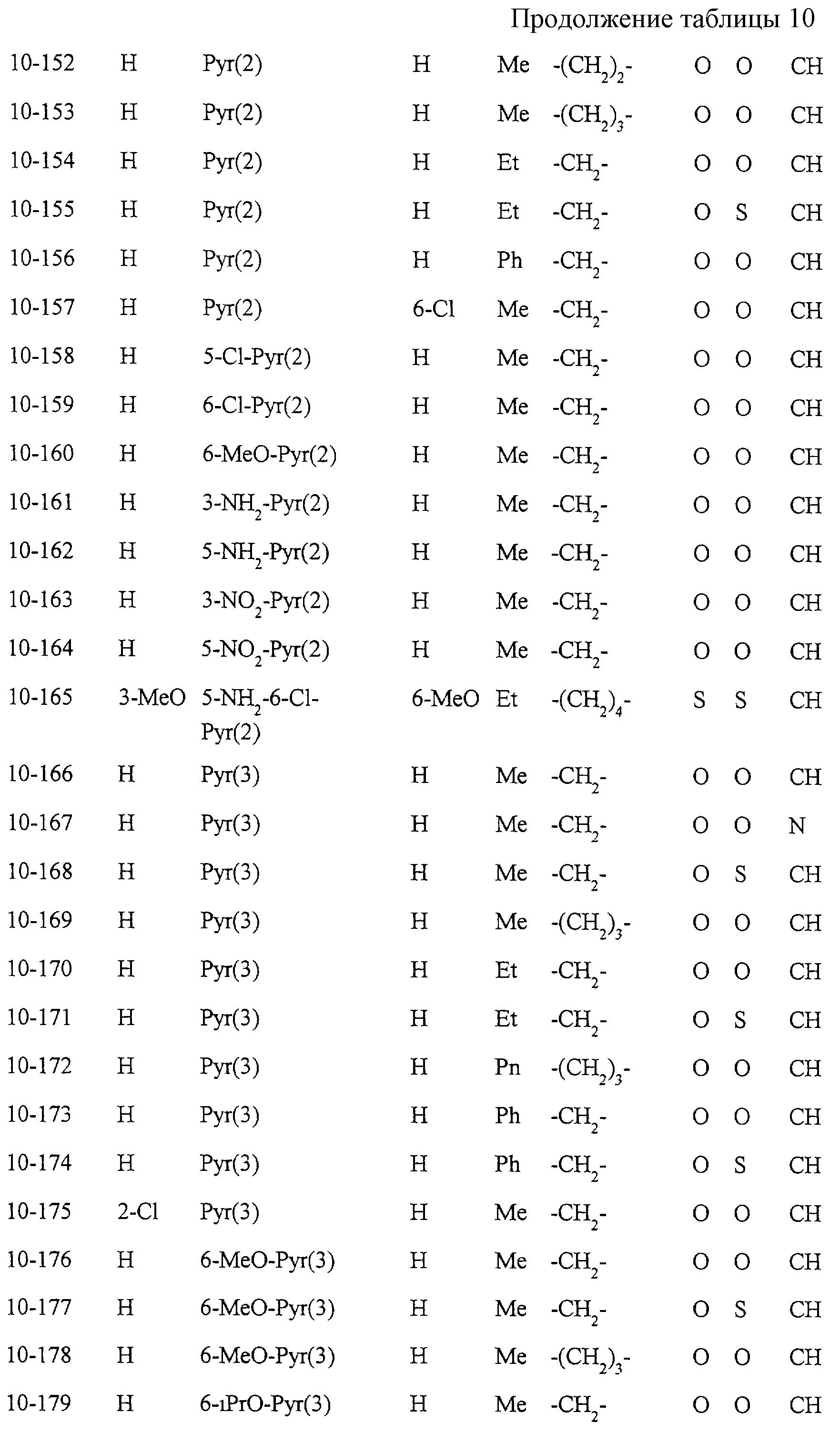
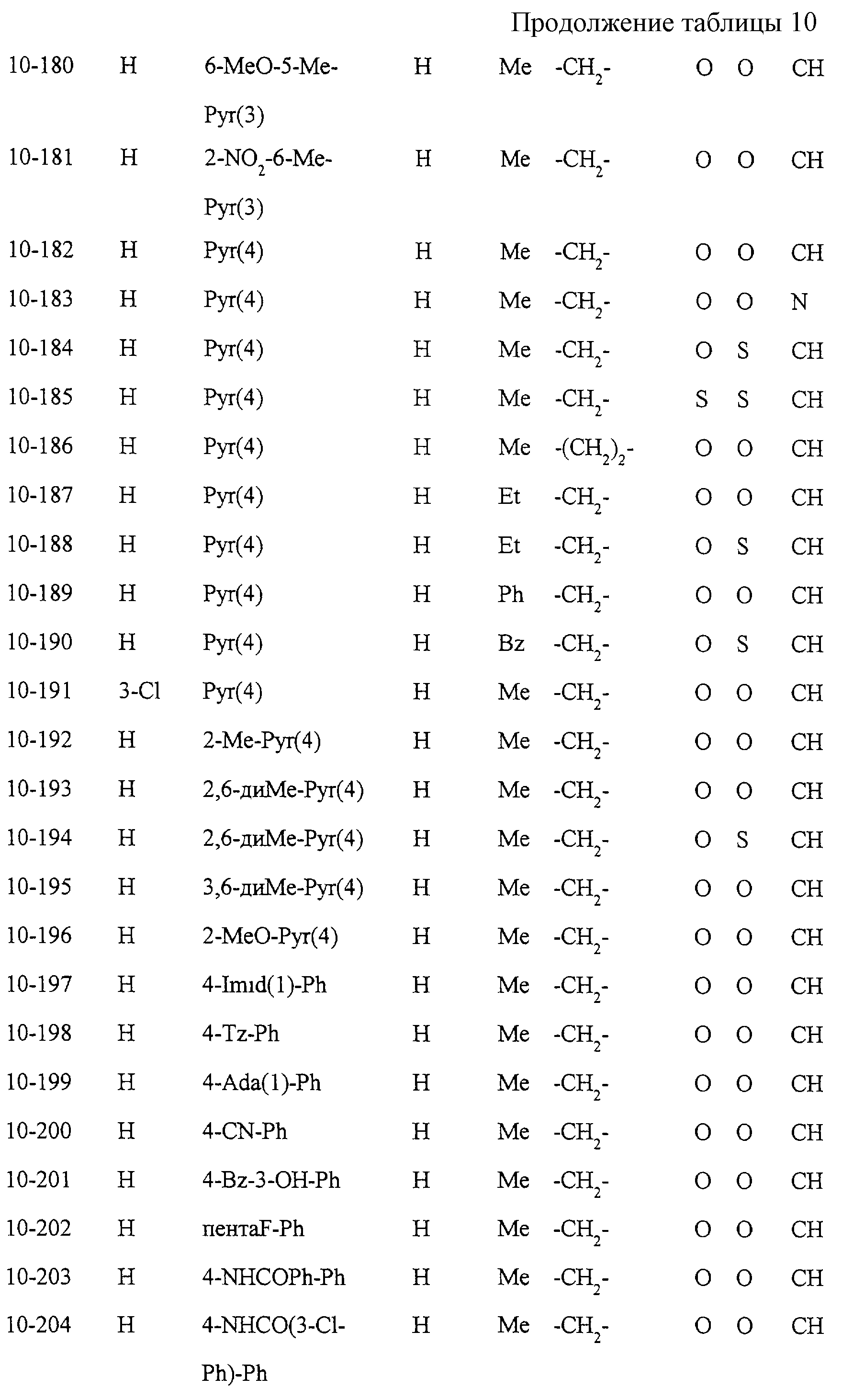
Некоторые соединения по настоящему изобретению
представлены в таблицах 1-10. Следует иметь в виду, что настоящее
изобретение ими не ограничено. Каждое из соединений в таблицах 1-10 имеет структурную формулу (1-1) - (1-10) и приведенные в таблицах
сокращения являются следующими:
Ас: ацетильная группа
Ada(1): 1-адамантильная группа
Вu: бутильная группа
sBu: втор-бутильная группа
tBu: трет-бутильная
группа
Bz: бензильная группа
Et: этильная
группа
Нх: гексильная группа
сНх: циклогексильная группа
Imid(l): 1-имидазолильная группа
Me: метильная
группа
Моr(4): 4-морфолинильная группа
Np(1): 1-нафтильная группа
Np(2): 2-нафтильная группа
Рh: фенильная группа
Pip(l): 1-пиперидильная группа
Pipra(l): 1-пиперазинильная группа
Рn: пентильная
группа
сРn: циклопентильная группа
Рr: пропильная группа
iPr: изопропильная группа
Руr(2): 2-пиридильная
группа
Руr(3): 3-пиридильная группа
Руr(4): 4-пиридильная группа
Pyrd(l): 1-пирролидинильная группа
TioMor(4): 4-тиоморфолинильная группа
Tz: группа
тетразол-5-ил
Соединения по настоящему изобретению,
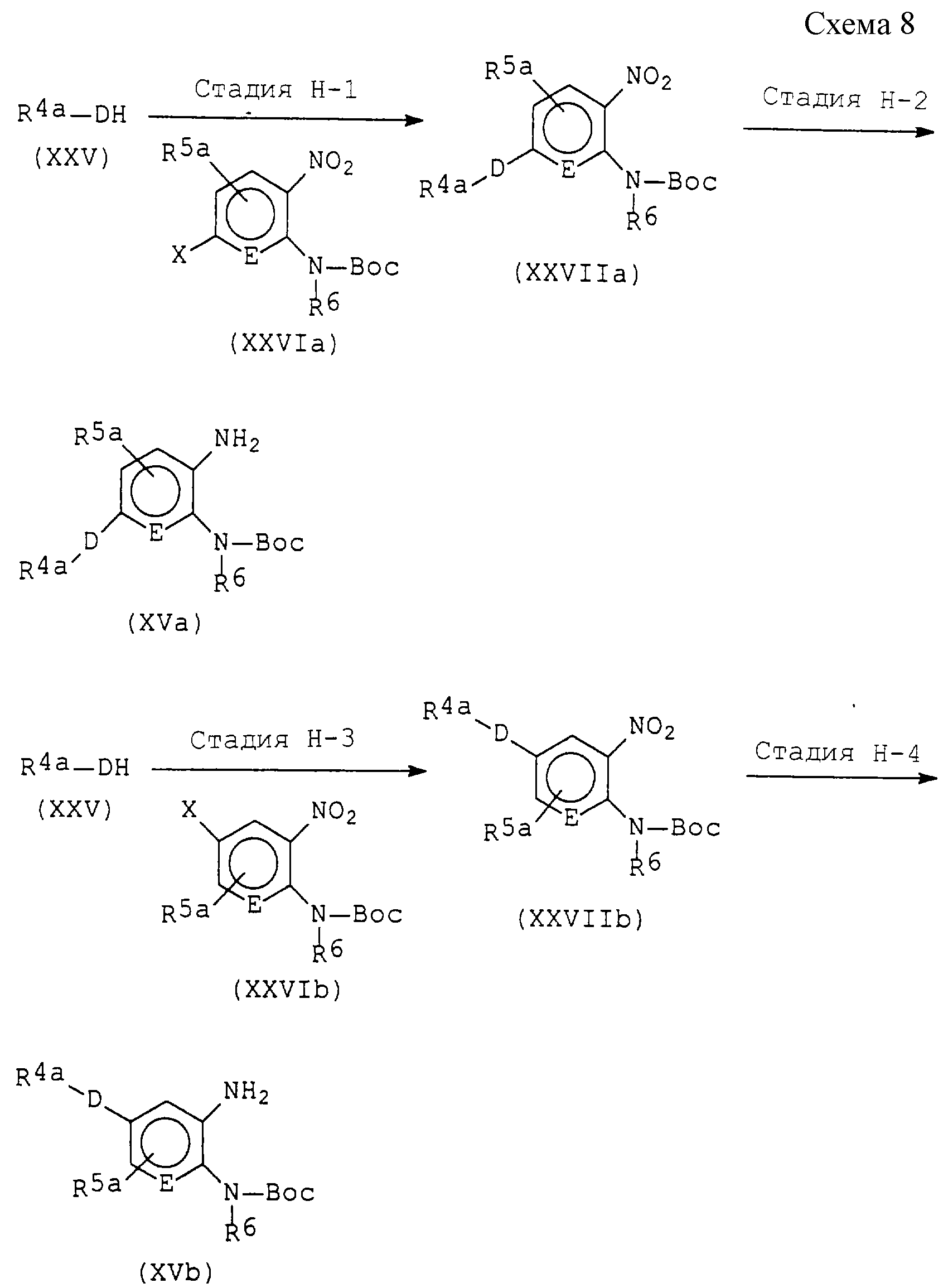
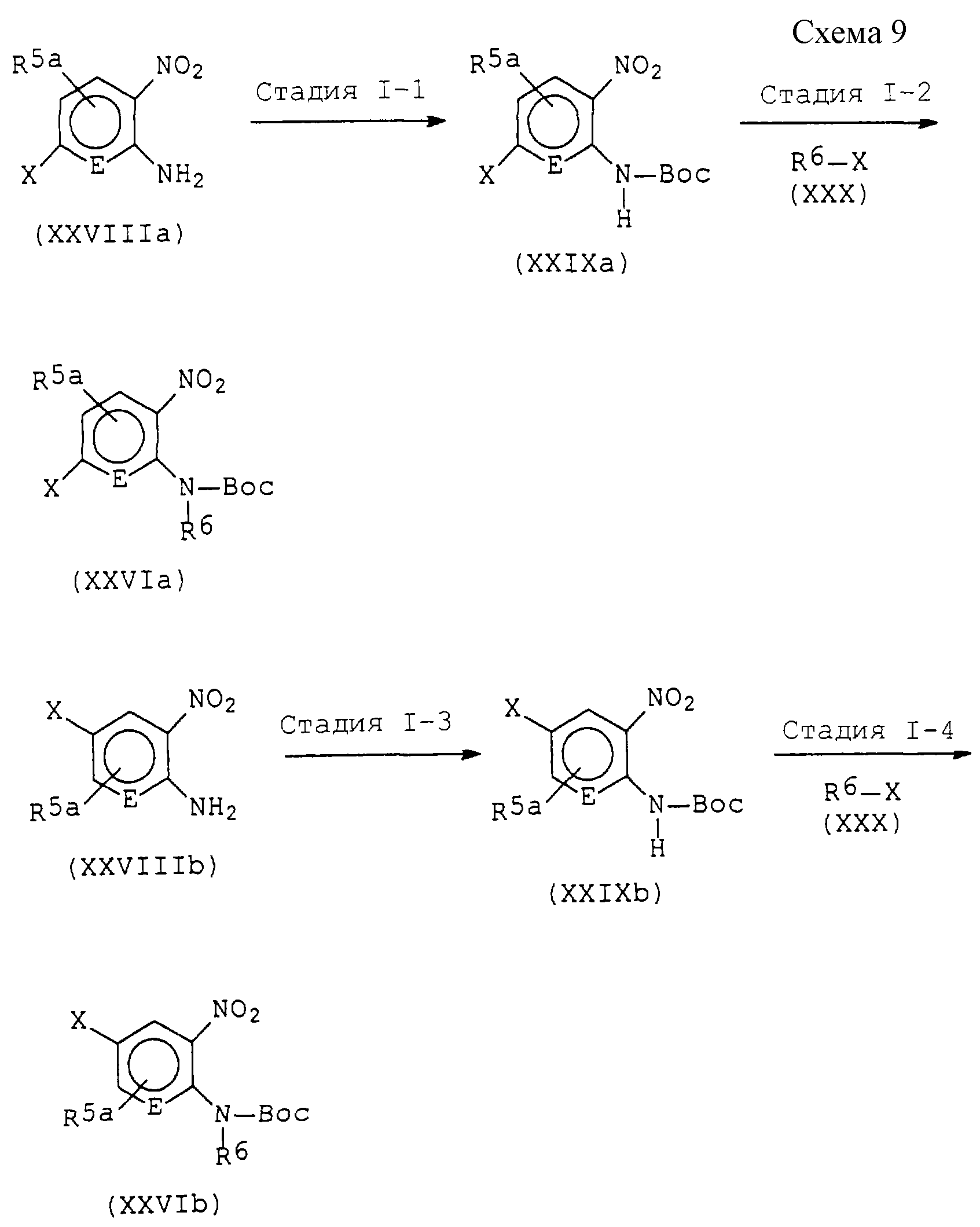
представленные формулой (I), легко могут быть получены в соответствии с любым одним из следующих способов.
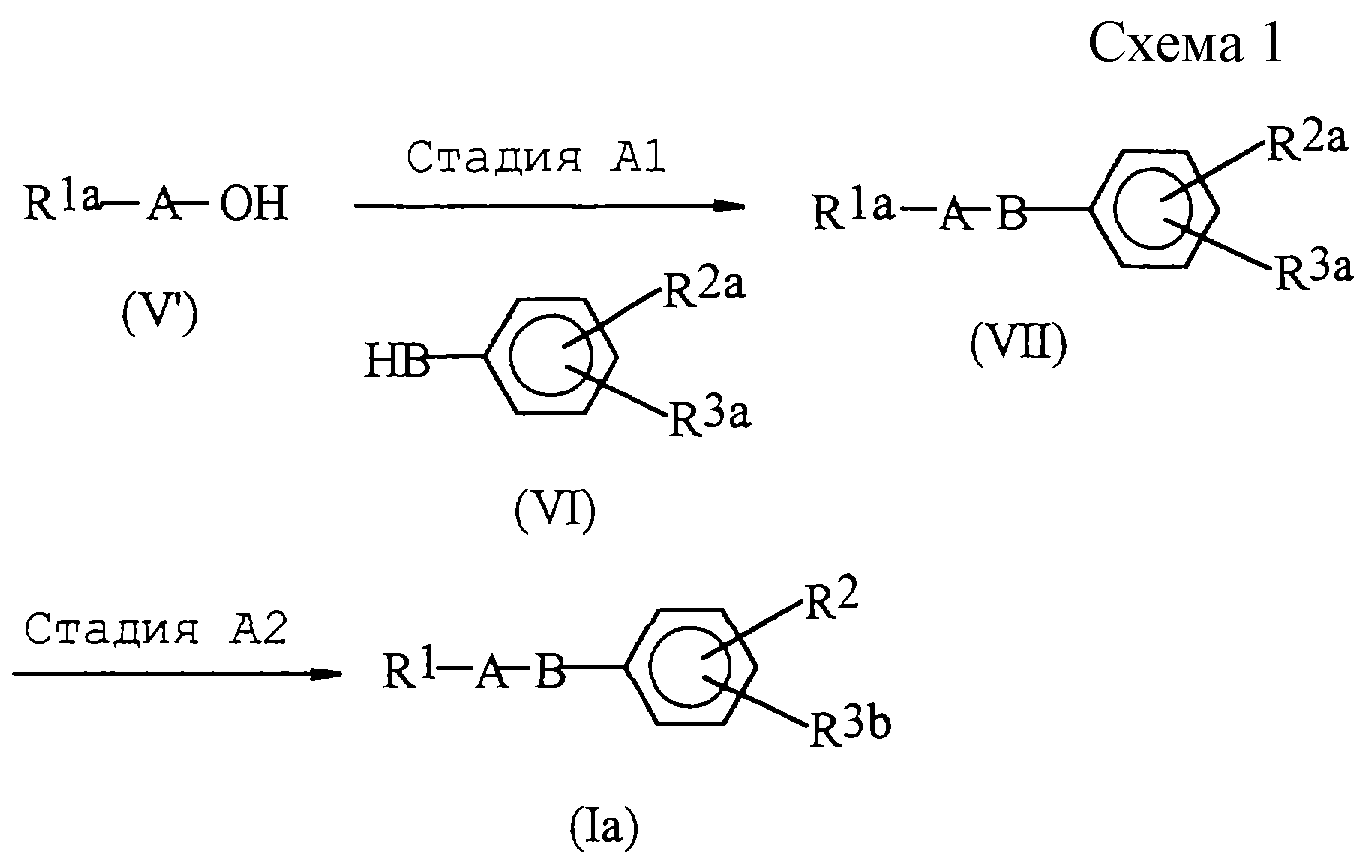
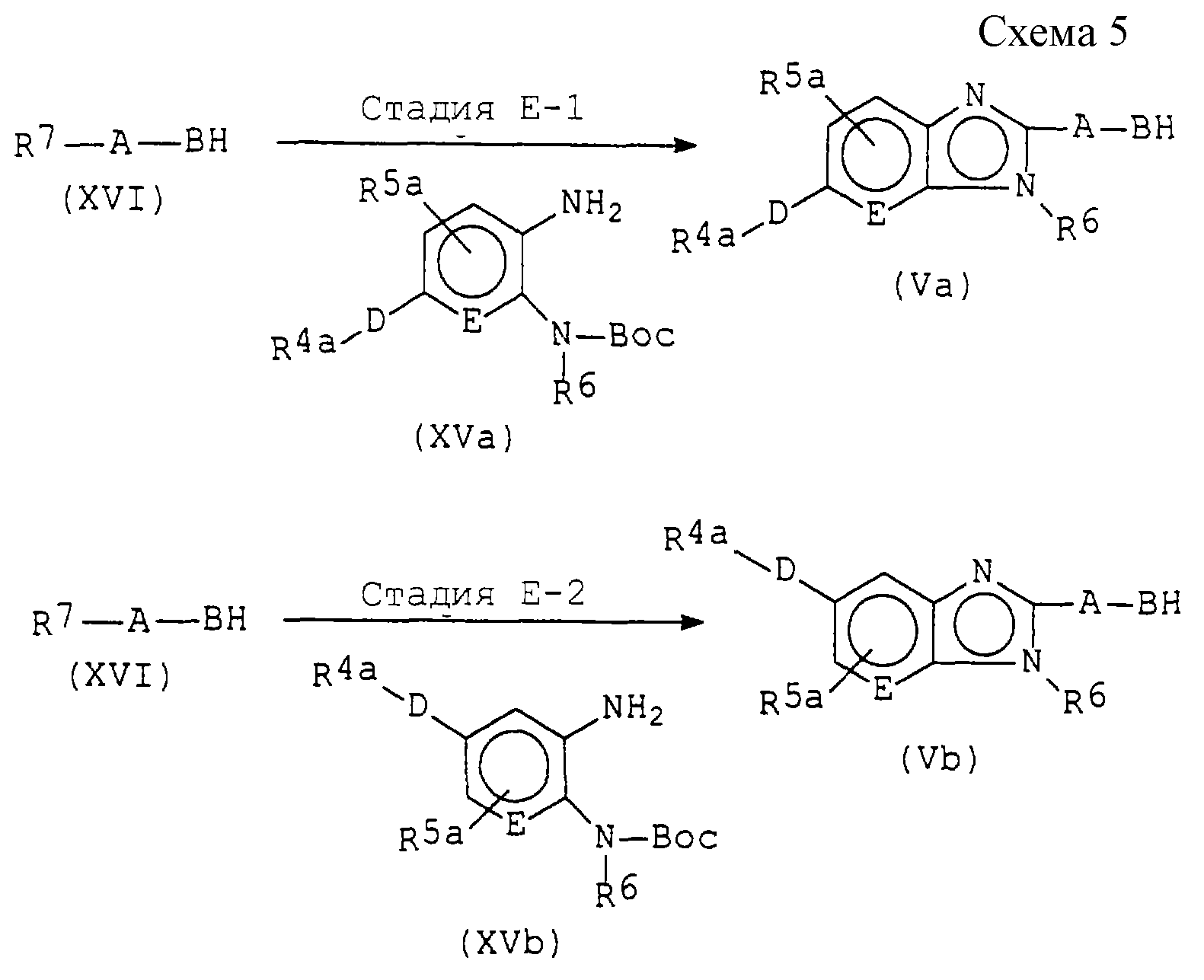
Способ А (схема 1, приведенная в конце описания).
На
реакционной схеме 1 R1, R2, А и В имеют такие же значения, как описано выше; R1a представляет группу, аналогичную
тем, которые определены в качестве группы R1, за исключением того, что любая амино- и/или гидроксильная группа, включенные в R1, представляет амино- и/или гидроксильную группу,
которые могут быть защищены амино- и/или
гидроксилзащитной группой; R2a представляет группу, аналогичную тем, которые определены в качестве группы R2, за исключением того, что
любая амино- и/или гидроксильная группа,
включенные в R2, представляет амино и/или гидроксильную группу, которые могут быть защищены амино- и/или гидроксилзащитной группой; R3a
представляет следующую группу:




(где R8 представляет трифенилметильную группу); и R3b представляет следующие группы:


В описании выше не имеется особенного ограничения в отношении "защитной группы" для "аминогруппы, которая может быть защищена аминозащитной группой" в R1a и R2a, при условии, что это аминозащитная группа, используемая в области синтетической органической химии. Примеры включают "алифатические ацильные группы", например, проиллюстрированные ранее C1-7 алифатические ацильные группы, галоген (С2-7 алкил)карбонильные группы, такие как хлорацетильная, дихлорацетильная, трихлорацетильная и трифторацетильная группы, и С2-7 алкилкарбонильные группы, замещенные C1-6 алкоксигруппами, такие как метоксиацетильные группы; "ароматические ацильные группы", например, проиллюстрированные ранее С7-11 ароматические ацильные группы, галоген(С7-11 ароматические ацильные) группы, такие как 2-бромбензоильная и 4-хлорбензоильная группы, С7-11 ароматические ацильные группы, замещенные C1-6 алкильными группами, такие как 2,4,6-триметилбензоил и 4-толуоил, С7-11 ароматические ацильные группы, замещенные C1-6 алкоксигруппами, такие как 4-анизоил, С7-11 ароматические ацильные группы, замещенные нитрогруппами, такие как 4-нитробензоильные группы и 2-нитробензоильные группы, С7-11 ароматические ацильные группы, замещенные С2-7 алкоксикарбонильными группами, такие как 2-(метоксикарбонил) бензоильные группы, и С7-11 ароматические ацильные группы, замещенные С6-10 арильными группами, такие как 4-фенилбензоильные группы; "алкоксикарбонильные группы", например, проиллюстрированные ранее C2-7 алкоксикарбонильные группы и С2-7 алкоксикарбонильные группы, замещенные галогеном или три(С1-6 алкил)силильными группами, такие как 2,2, 2-трихлорэтоксикарбонильная и 2-триметилсилилэтоксикарбонильная группы; "алкенилоксикарбонильные группы", такие как винилоксикарбонильные группы и аллилоксикарбонильные группы; "аралкилоксикарбонильные группы, имеющие арильное кольцо, которое может быть замещено 1 или 2 C1-6 алкокси или нитрогруппами", такие как бензилоксикарбонильная, 4-метоксибензилоксикарбонильная, 3,4-диметоксибензилоксикарбонильная, 2-нитробензилоксикарбонильная и 4-нитробензилоксикарбонильная группы; "силильные группы", например, тpи(C1-6 алкил)силильные группы, такие как триметилсилильная, триэтилсилильная, изопропилдиметилсилильная, трет-бутилдиметилсилильная, метилдиизопропилсилильная, метилди-трет-бутилсилильная и триизопропилсилильная группы и силильные группы, замещенные тремя заместителями, выбранными из арильных и C1-6 алкильных групп, такие как дифенилметилсильная, дифенилбутилсилильная, дифенилизопропилсилильная и фенилдиизопропилсилильная группы; "аралкильные группы", например, C1-6 алкильные группы, замещенные 1-3 арильными группами, такие как бензильная, фенетильная, 3-фенилпропильная, α-нафтилметильная, β-нафтилметильная, дифенилметильная, трифенилметильная, α-нафтилдифенилметильная и 9-антрилметильная группы, и C1-6 алкильные группы, замещенные 1-3 арильными группами, имеющими арильное кольцо, замещенное C1-6 алкильной, C1-6 алкокси или нитрогруппами, атомами галогена или цианогруппами, такие как 4-метилбензильная, 2,4,6-триметилбензильная, 3,4,5-триметилбензильная, 4-метоксибензильная, 4-метоксифенилдифенилметильная, 2-нитробензильная, 4-нитробензильная, 4-хлорбензильная, 4-бромбензильная, 4-цианобензильная, 4-цианобензилдифенилметильная, бис(2-нитрофенил)метильная и пиперонильная группы; и "замещенные метиленовые группы, каждая из которых образует основание Шиффа", такие как N, N-диметиламинометиленовая, бензилиденовая, 4-метоксибензилиденовая, 4-нитробензилиденовая, салицилиденовая, 5-хлорсалицилиденовая, дифенилметиленовая и (5-хлор-2-гидроксифенил)фенилметиленовая группы, среди которых C1-7 алифатические ацильные группы, С7-11 ароматические ацильные группы и С2-7 алкоксикарбонильные группы являются предпочтительными, и более предпочтительны С2-7 алкоксикарбонильные группы и наиболее предпочтительна трет-бутоксикарбонильная группа.
В описании выше не
имеется особенного ограничения в отношении
"защитной группы" для "гидроксильной группы, которая может быть защищена гидроксилзащитной группой" в R1a и R2a, при условии, что это
гидроксилзащитная группа, используемая в
области синтетической органической химии. Примеры включают "алифатические ацильные группы", например, проиллюстрированные ранее C1-7 алифатические
ацильные группы, С2-7
алкилкарбонильные группы, замещенные карбоксигруппами, такие как сукциноильная, глутароильная и адипоильная группы, галоген(С2-7 алкил)карбонильные группы,
такие как хлорацетильная,
дихлорацетильная, трихлорацетильная и трифторацетильная группы, и С2-7 алкилкарбонильные группы, замещенные C1-6 алкоксигруппами, такие как
метоксиацетильные группы;
"ароматические ацильные группы", например, проиллюстрированные ранее С7-11 ацильные группы, галоген(С7-11 ароматические ацильные) группы, такие как
2-бромбензоильная и
4-хлорбензоильная группы, С7-11 ароматические ацильные группы, замещенные C1-6 алкильными группами, такие как 2,4,6-триметилбензоильная и 4-толуоильная
группы, С7-11
ароматические ацильные группы, замещенные C1-6 алкоксигруппами, такие как 4-анизоильные группы, С7-11 ароматические ацильные группы, замещенные
карбоксигруппами, такие как
2-карбоксибензоильная, 3-карбоксибензоильная и 4-карбоксибензоильная группы, С7-11 ароматические ацильные группы, замещенные нитрогруппами, такие как
4-нитробензоильная и 2-нитробензоильная
группы, С7-11 ароматические ацильные группы, замещенные С2-7 алкоксикарбонильными группами, такие как 2-(метоксикарбонил)- бензоильные
группы, и С7-11 ароматические
ацильные группы, замещенные С6-10 арильными группами, такие как 4-фенилбензоильные группы; "тетрагидропиранильные или тетрагидротиопиранильные
группы", такие как группы тетрагидропиран-2-ил,
3-бромтетрагидропиран-2-ил, 4-метокситетрагидропиран-4-ил, тетрагидротиопиран-2-ил и 4-метокситетрагидротиопиран-4-ил; "тетрагидрофуранильные и
тетрагидротиофуранильные группы", такие как группы
тетрагидрофуран-2-ил и тетрагидротиофуран-2-ил; "силильные группы", например, три(С1-6 алкил)силильные группы, такие как
триметилсилильная, триэтилсилильная, изопропилдиметилсилильная,
трет-бутилдиметилсилильная, метилдиизопропилсилильная, метилди-трет-бутилсилильная и триизопропилсилильная группы и силильные группы,
замещенные тремя заместителями, выбранными из арильных и C1-6 алкильных групп, такие как дифенилметилсильная, дифенилбутилсилильная, дифенилизопропилсилильная и фенилдиизопропилсилильная
группы; "алкоксиметильные группы", например, (C1-6
алкокси)метильные группы, такие как метоксиметильная, 1,1-диметил-1-метоксиметильная, этоксиметильная, пропоксиметильная,
изопропоксиметильная, бутоксиметильная и трет-бутоксиметильная группы, (C1-6 алкокси)метильные группы, замещенныые C1-6 алкоксигруппами, такие как 2-метоксиэтоксиметильные
группы и галоген(C1-6 алкокси)метильные группы, такие как 2,2,
2-трихлорэтоксиметильная и бис(2-хлорэтокси)метильная группы; "замещенные этильные группы", например, (C1-6
алкокси)этильные группы, такие как 1- этоксиэтильная и 1-(изопропокси)этильная
группы, и галогенированные этильные группы, такие как 2,2,2-трихлорэтильные группы; "аралкильные группы", например,
C1-6 алкильные группы, замещенные 1-3 арильными группами, такие как
бензильная, α-нафтилметильная, β-нафтилметильная, дифенилметильная, трифенилметильная, α
-нафтилдифенилметильная и 9-антрилметильная группы, и C1-6 алкильные группы,
замещенные 1-3 арильными группами, имеющими арильное кольцо, замещенное C1-6 алкильными или C1-6 алкоксигруппами, атомами галогена или цианогруппами, такие как 4-метилбензильная,
2,4,6-триметилбензильная, 3,4,5-триметилбензильная, 4-метоксибензильная, 4-метоксифенилдифенилметильная,
2-нитробензильная, 4-нитробензильная, 4-хлорбензильная, 4-бромбензильная, 4-цианобензильная,
4-цианобензилдифени-лметильная и пиперонильная группы; "алкоксикарбонильные группы", такие как
проиллюстрированные выше С2-7 алкоксикарбонильные группы и С2-7 алкоксикарбонильные
группы, замещенные атомами галогена или тpи(C1-6 алкил)силильными группами, такие
как 2,2,2-трихлорэтоксикарбонильная и 2-триметилсилилэтоксикарбонильная группы; "алкенилоксикарбонильные
группы", такие как винилоксикарбонильная и аллилоксикарбонильная группы;
"аралкилоксикарбонильные группы", имеющие арильное кольцо, которое может быть замещено 1 или 2 C1-6 алкокси или
нитрогруппами, такие как бензилоксикарбонильная,
4-метоксибензилоксикарбонильная, 3,4-диметоксибензилоксикарбонильная, 2-нитробензилоксикарбонильная и 4-нитробензилоксикарбонильная группы;
среди которых C1-7 алифатические
ацильные группы, С7-11 ароматические ацильные группы, С2-7 алкоксикарбонильные и (C1-6 алкокси)метильные группы являются
предпочтительными, и более предпочтительны
С7-11 ароматические ацильные и (C1-6 алкокси)метильные группы, и наиболее предпочтительны бензоильная и метоксиметильная группы.
Способ А представляет собой способ получения соединения (1а), которое является соединением (I), в котором R3 выбрано из группы, представленной формулами (IV-1)-(IV-4).
Стадия А1 представляет собой стадию получения соединения формулы (VII) взаимодействием соединения формулы (V) с соединением формулы (VI) в инертном растворителе в присутствии фосфина (предпочтительно, трибутилфосфина или трифенилфосфина) и соединения азодикарбоновой кислоты (предпочтительно, диэтилазодикарбоксилата или 1,1'-(азодикарбонил)дипиперидина).
Не имеется особенных ограничений в отношении природы инертного растворителя для использования в вышеуказанной реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1, 2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; и смеси вышеуказанных растворителей, среди которых алифатические углеводороды, ароматические углеводороды, галогенированные углеводороды, простые эфиры и смеси этих растворителей являются предпочтительными (более предпочтительны ароматические углеводороды и простые эфиры и особенно предпочтительны толуол и тетрагидрофуран).
Температура реакции зависит от природы исходных материалов и растворителя и тому подобного, однако она обычно колеблется от -20 до 150oС (предпочтительно от 0 до 60oС).
Время реакции зависит от природы исходных материалов и растворителя, температуры реакции и тому подобного, однако оно обычно колеблется от 30 минут до 5 суток (предпочтительно от 5 часов до 72 часов).
По завершении реакции полученное соединение (VII) по настоящему изобретению извлекают из реакционной смеси
известным способом. Например,
оно может быть получено путем удаления нерастворимого вещества из реакционной смеси фильтрованием; добавления к фильтрату органического растворителя, который не
смешивается с водой, такого как
этилацетат, отделения органического слоя, содержащего целевое соединение, и промывания водой или тому подобным; сушки над безводным сульфатом магния, безводным
сульфатом натрия, безводным
бикарбонатом натрия или тому подобным; и затем отгонки растворителя. Полученный таким образом продукт при необходимости может быть выделен и очищен с использованием
любого подходящего
сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Стадия А2 представляет собой стадию получения соединения формулы (1а) путем взаимодействия соединения (VII) с кислотой в присутствии или в отсутствии (предпочтительно, в присутствии) инертного растворителя, и тем самым удаления трифенилметильной группы R8, и затем удаления, при необходимости, амино- и/или гидроксилзащитной группы в R1а и R2а.
Не имеется особенных ограничений в отношении природы кислоты, используемой на первой из упомянутых стадий реакции, при условии, что ее используют в обычных реакциях в качестве кислотного катализатора. Примеры включают неорганические кислоты, такие как хлорводородная кислота, бромводородная кислота, серная кислота, перхлорная кислота и фосфорная кислота; кислоты Бренстеда, например, органические кислоты, такие как уксусная кислота, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, трифторуксусная кислота и трифторметансульфоновая кислота; кислоты Льюиса, такие как хлорид цинка, тетрахлорид олова, трихлорид бора, трифторид бора и трибромид бора; кислотные ионообменные смолы, среди которых неорганические и органические кислоты (особенно хлорводородная кислота, уксусная кислота и трифторуксусная кислота) являются предпочтительными.
Не имеется особенных ограничений в отношении природы инертного растворителя для использования на первой из упомянутых стадий реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; сложные эфиры, такие как метилацетат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; воду; и смеси вышеуказанных растворителей, среди которых простые эфиры, спирты и вода (особенно диоксан, тетрагидрофуран, этанол и вода) являются предпочтительными.
Температура реакции зависит от природы исходного вещества, кислоты и растворителя и тому подобного, однако она обычно колеблется от -20oС до температуры кипения (предпочтительно от 0 до 100oС).
Время реакции зависит от природы исходного материала, кислоты и растворителя, температуры реакции и тому подобного, однако оно обычно колеблется от 15 минут до 48 часов (предпочтительно от 30 минут до 20 часов).
На данной стадии целевое соединение (1а) также может быть получено с помощью каталитического восстановления соединения (VII) в инертном растворителе при атмосферном давлении или под давлением (предпочтительно под давлением), и тем самым удаления трифенилметильной группы R8, и затем удаления, при необходимости, защитных групп аминогруппы и/или гидроксильной группы в R1а и R2а.
Не имеется особенных ограничений в отношении природы катализатора для использования в вышеуказанном каталитическом восстановлении, при условии, что он используется в обычных реакциях каталитического восстановления. Примеры включают палладий-на-угле, никель Ренея, родий-алюминий оксид, трифенилфосфин-родий оксид, палладий-барий сульфат, палладиевую чернь, оксид платины и платиновую чернь, среди которых палладий-на-угле является предпочтительным.
Не имеется особенных ограничений в отношении природы инертного растворителя для использования при вышеуказанном каталитическом восстановлении, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н- пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; воду; органические кислоты, такие как уксусная кислота и трифторуксусная кислота; и смеси вышеуказанных растворителей, среди которых простые эфиры, спирты и органические кислоты (особенно спирты) являются предпочтительными.
Температура реакции зависит от природы исходного материала, катализатора и используемого растворителя и тому подобного, однако она обычно колеблется от 0oС до 100oС (предпочтительно от 10oС до 50oС).
Время реакции зависит от природы исходного вещества, катализатора и используемого растворителя, температуры реакции и тому подобного, однако оно обычно колеблется от 30 минут до 48 часов (предпочтительно от 1 часа до 24 часов).
Удаление защитной группы аминогруппы или гидроксильной группы зависит от ее природы, однако его обычно проводят, как описано далее в соответствии со способом, известным в области синтетической органической химии, например, Т. W.Green (Protective Groups in Organic Synthesis), John Wiley & Sons или J.F. W.McOmis (Protective Groups in Organic Chemistry), Plenum Press.
Когда аминозащитная группа представляет силильную группу, она может быть удалена обработкой соединением, образующим фтор-анион, таким как фторид тетрабутиламмония, фторводородная кислота, фторводородная кислота-пиридин или фторид калия.
Не имеется особенных ограничений в отношении природы растворителя для использования в вышеуказанной реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Предпочтительные примеры включают простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля.
Хотя на температуру реакции и время реакции и не накладывается особенного ограничения, взаимодействие обычно осуществляют при температуре от 0 до 50oС в течение 10-18 часов.
Когда аминозащитная группа представляет алифатическую ацильную группу, ароматическую ацильную группу, алкоксикарбонильную группу или замещенную метиленовую группу, образующую основание Шиффа, она может быть удалена обработкой кислотой или основанием в присутствии водного растворителя.
Не имеется особенного ограничения в отношении природы кислоты, используемой в вышеуказанной реакции, при условии, что она обычно используется в качестве кислоты и не оказывает неблагоприятного воздействия на реакцию. Примеры включают неорганические кислоты, такие как бромводородная кислота, хлорводородная кислота, серная кислота, перхлорная кислота, фосфорная кислота и азотная кислота, среди которых хлорводородная кислота является предпочтительной.
Никакого особенного ограничения не накладывается на природу основания для использования в вышеуказанной реакции, при условии что оно не оказывает неблагоприятного воздействия на другую часть соединения. Предпочтительные примеры включают карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; алкоксиды щелочных металлов, такие как метоксид лития, метоксид натрия, этоксид натрия и трет-бутоксид калия; и аммиак, такой как водный аммиак и концентрированный аммиак в метаноле.
Не имеется особенных ограничений в отношении природы растворителя для использования в вышеуказанной реакции, при условии, что он может использоваться при обычном гидролизе. Примеры включают спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; воду; и смеси воды и проиллюстрированных выше органических растворителей, среди которых простые эфиры (особенно диоксан) являются предпочтительными.
Не имеется особенного ограничения в отношении температуры реакции и времени реакции, и они зависят от природы исходного вещества, растворителя и используемых кислоты или основания. Взаимодействие обычно осуществляют при температуре от 0 до 150oС в течение 1-10 часов для подавления побочных реакций.
Когда аминозащитная группа представляет аралкил- или аралкилоксикарбонильную группу, ее предпочтительно удаляют путем контактирования с восстанавливающим агентом (предпочтительно каталитическое восстановление в присутствии катализатора при комнатной температуре) в инертном растворителе или с использованием окисляющего агента.
Не имеется особенных ограничений в отношении природы растворителя для использования при удалении путем каталитического восстановления, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как толуол, бензол и ксилол; сложные эфиры, такие как метилацетат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; органические кислоты, такие как уксусная кислота; воду и смешанные растворители из воды и указанных выше растворителей, среди которых спирты, простые эфиры, органические кислоты и вода (особенно спирты и органические кислоты) являются предпочтительными.
Не имеется особенного ограничения в отношении природы используемого катализатора, при условии, что он используется для каталитического восстановления. Примеры включают палладий-на-угле, никель Ренея, оксид платины, платиновую чернь, родий-алюминий оксид, трифенилфосфин-родий оксид, палладий-барий сульфат.
Хотя никакого особенного ограничения не накладывается на давление, реакцию обычно осуществляют при давлении от 1 до 10 атм.
Хотя температура реакции и время реакции зависят от природы исходного материала, катализатора и растворителя и тому подобного, реакцию обычно осуществляют при температуре от 0 до 100oС в течение от 5 минут до 24 часов.
Не имеется особенного ограничения в отношении природы растворителя, используемого для удаления путем окисления, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Предпочтительно используются органические растворители, содержащие воду.
Примеры таких органических растворителей включают галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; нитрилы, такие как ацетонитрил; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; сульфоксиды, такие как диметилсульфоксид; и сульфолан, среди которых галогенированные углеводороды, простые эфиры и сульфоксиды (особенно галогенированные углеводороды и сульфоксиды) являются предпочтительными.
Не имеется особенного ограничения в отношении используемого окисляющего агента, при условии, что он обычно используется при окислениях. Предпочтительные примеры включают персульфат калия, персульфат натрия, церийаммонийнитрат (ЦАН) и 2,3-дихлор-5, 6-дициано-п-бензохинон (ДДХ). Хотя температура реакции и время реакции зависят от природы исходного материала, катализатора и растворителя и тому подобного, реакцию обычно осуществляют при температуре от 0 до 150oС в течение от 10 минут до 24 часов.
Когда аминозащитная группа представляет алкенилоксикарбонильную группу, она обычно может быть удалена обработкой основанием при условиях, аналогичных используемым в том случае, когда аминозащитная группа представляет собой описанные выше алифатическую ацильную группу, ароматическую ацильную группу, алкоксикарбонильную группу или замещенную метиленовую группу, образующую основание Шиффа.
Между прочим, когда защитная группа представляет аллилоксикарбонильную группу, она обычно может быть удалена при меньших побочных реакциях при использовании, в частности, палладия и трифенилфосфина или тетракарбонила никеля.
Когда в качестве гидроксилзащитной группы используется силильная группа, она обычно может быть удалена обработкой соединением, образующим фтор-анион, таким как фторид тетрабутиламмония, фторводородная кислота, фторводородная кислота-пиридин или фторид калия; или обработкой неорганической кислотой, такой как хлорводородная кислота, бромводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота, или органической кислотой, такой как уксусная кислота, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота.
Между прочим, если удаление силильной группы осуществляют с использованием фторид иона, бывает, что реакция ускоряется при добавлении органической кислоты, такой как муравьиная кислота, уксусная кислота или пропионовая кислота.
Не имеется особенных ограничений в отношении природы инертного растворителя для использования в вышеуказанной реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Предпочтительные примеры включают простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; органические кислоты, такие как уксусная кислота; воду и смеси вышеуказанных растворителей.
Хотя температура реакции и время реакции зависят от природы исходного материала, катализатора и растворителя и тому подобного, реакцию обычно осуществляют при температуре от 0 до 100oС (предпочтительно от 10 до 50oС) в течение от 1 часа до 24 часов.
Когда гидроксилзащитная группа представляет аралкил- или аралкилоксикарбонильную группу, обычно является предпочтительным удалять защитную группу путем контактирования с восстанавливающим агентом (предпочтительно каталитическое восстановление при комнатной температуре в присутствии катализатора) или с использованием окисляющего агента, в инертном растворителе.
Не имеется особенного ограничения в отношении природы растворителя для использования в вышеуказанной реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как толуол, бензол и ксилол; сложные эфиры, такие как этилацетат и пропилацетат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; жирные кислоты, такие как муравьиная кислота и уксусная кислота; воду; и смеси вышеуказанных растворителей, среди которых спирты (особенно метанол) являются предпочтительными.
Не имеется особенного ограничения в отношении природы используемого катализатора, при условии, что он обычно используется для каталитического восстановления. Примеры включают палладий-на-угле, палладиевую чернь, никель Ренея, оксид платины, платиновую чернь, родий-алюминий оксид, трифенилфосфин-родий хлорид и палладий-барий сульфат, среди которых палладий-на-угле является предпочтительным.
Хотя особенного ограничения не накладывается на давление, реакцию обычно осуществляют под давлением от 1 до 10 атм.
Хотя температура реакции и время реакции зависят от природы исходных материалов, катализатора и растворителя и тому подобного, реакцию обычно осуществляют при температуре от 0 до 100oС (предпочтительно от 20 до 70oС) в течение от 5 минут до 48 часов (предпочтительно от 1 до 24 часов).
Не имеется особенного ограничения в отношении природы растворителя, используемого для удаления путем окисления, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Предпочтительными в качестве растворителя являются органические растворители, содержащие воду.
Конкретные примеры такого органического растворителя включают кетоны, такие как ацетон; галогенированные углеводороды, такие как хлористый метилен, хлороформ и четыреххлористый углерод; нитрилы, такие как ацетонитрил; простые эфиры, такие как диэтиловый эфир, тетрагирофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и гексаметилфосфортриамид; и сульфоксиды, такие как диметилсульфоксид.
Не имеется особенного ограничения в отношении используемого окисляющего агента, при условии, что он обычно используется при окислениях. Предпочтительные примеры включают персульфат калия, персульфат натрия, церийаммонийнитрат (ЦАН) и 2,3-дихлор-5, 6-дициано-п-бензохинон (ДДХ).
Хотя температура реакции и время реакции зависят от природы исходных материалов, катализатора и растворителя и тому подобного, реакцию обычно осуществляют при температуре от 0 до 150oС в течение от 10 минут до 24 часов.
Защитная группа также может быть удалена обработкой щелочным металлом, таким как металлический литий или металлический натрий в жидком аммиаке или спирте, таком как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или метилцеллозольв, при -78 - 0oС.
Защитная группа также может быть удалена с использованием алкилсилилгалогенида, такого как хлорид алюминия-иодид натрия или триметилсилилиодид в растворителе.
Не имеется особенного ограничения в отношении природы используемого растворителя, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Предпочтительные примеры включают галогенированные углеводороды, такие как хлористый метилен, хлороформ и четыреххлористый углерод; нитрилы, такие как ацетонитрил; смеси вышеуказанных растворителей.
Хотя температура реакции и время реакции зависят от природы исходных материалов и растворителя и тому подобного, реакцию обычно осуществляют при температуре от 0 до 50oС в течение от 5 минут до 72 часов.
Между прочим, когда реакционный субстрат имеет атом серы, предпочтительно используют хлорид алюминия-иодид натрия.
Когда гидроксилзащитная группа представляет алифатическую ацильную, ароматическую ацильную или алкоксикарбонильную группу, она может быть удалена обработкой основанием в растворителе.
Не имеется особенного ограничения в отношении основания для использования в вышеуказанной реакции при условии, что оно не оказывает неблагоприятного воздействия на остаток соединения. Предпочтительные примеры включают карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; бикарбонаты щелочных металлов, такие как бикарбонат лития, бикарбонат натрия и бикарбонат калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; алкоксиды металлов, такие как метоксид лития, метоксид натрия, этоксид натрия и трет-бутоксид калия; и аммиак, такой как водный аммиак и концентрированный аммиак в метаноле, среди которых гидроксиды щелочных металлов, алкоксиды металлов и аммиак (особенно гидроксиды щелочных металлов и алкоксиды металлов) являются предпочтительными.
Не имеется особенных ограничений в отношении природы растворителя для использования в вышеуказанной реакции, при условии, что он может использоваться при обычном гидролизе. Примеры включают простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; воду; смеси воды и проиллюстрированных выше органических растворителей.
Не имеется особенного ограничения в отношении температуры реакции и времени реакции, они зависят от природы исходных материалов, основания и растворителя и тому подобного. Реакцию обычно осуществляют при температуре от -20 до 150oС в течение от 1 до 10 часов для подавления побочных реакций.
Когда гидроксилзащитная группа проставляет алкоксиметильную, тетрагидропиранильную, тетрагидротиопиранильную, тетрагирофуранильную, тетрагидротиофуранильную или замещенную этильную группу, то ее обычно удаляют обработкой кислотой в растворителе.
Не имеется особенного ограничения в отношении кислоты для использования в вышеуказанной реакции, при условии, что ее обычно применяют в качестве кислоты Бренстеда или кислоты Льюиса. Предпочтительные примеры включают кислоты Бренстеда, например, хлористый водород, неорганические кислоты, такие как хлорводородная кислота, серная кислота и азотная кислота, и органические кислоты, такие как уксусная кислота, трифторуксусная кислота, метансульфоновая кислота и п-толуолсульфоновая кислота, и кислоты Льюиса, такие как трифторид Бора. Также может использоваться сильнокислотная катионообменная смола, такая как Dowex 50W.
Не имеется особенного ограничения в отношении природы растворителя для использования в вышеуказанной реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлористый метилен, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексан; вода и смешанные растворители из проиллюстрированных выше растворителей, среди которых простые эфиры (особенно тетрагидрофуран) и спирты (особенно метанол) являются предпочтительными.
Хотя температура реакции и время реакции зависят от исходных материалов, кислоты и растворителя и тому подобного, реакцию обычно осуществляют при температуре от -10 до 200oС (предпочтительно от 0 до 150oС) в течение от 5 минут до 48 часов (предпочтительно от 30 минут до 10 часов).
Когда защитная группа гидроксила представляет собой алкенилоксикарбонильную группу, она может быть удалена обработкой основанием при условиях, аналогичных тем, которые используются, когда защитная группа гидроксила представляет вышеописанные алифатический ацил, ароматический ацил или алкоксикарбонильную группу.
Между прочим, когда защитная группа представляет собой аллилоксикарбонильную группу, она может быть удалена более легко при меньшем количестве побочных реакций с использованием, в частности, палладия и трифенилфосфина или гексафторфосфата бис(метилдифенилфосфин)(1,5-циклооктадиен)иридия(I).
Посредством вышеописанной реакции, где приводят во взаимодействие соединение (VII) и кислоту или при каталитическом восстановлении соединения (VII), случается, что аминозащитная группа и/или гидроксилзащитная группа удаляются одновременно.
Аминозащитная группа и/или гидроксилзащитная группа могут быть удалены последовательно в желательном порядке.
По завершении реакции полученное соединение (1а) по настоящему изобретению извлекают из реакционной смеси известным способом. Например, оно может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием; добавления к фильтрату органического растворителя, который не смешивается с водой, такого как этилацетат; отделения органического слоя, содержащего целевое соединение, и промывания водой или тому подобным; сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным; и затем отгонки растворителя. Полученный продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Способ В (схема 2, приведенная в конце
описания)
На реакционной схеме 2 R1, R1a, R2, R2a, А и В имеют те же значения, как описано выше, Х
представляет вышеописанный атом галогена, и Y
представляет атом кислорода или серы.
Способ В представляет способ получения соединения (Ib), которое является соединением (I), в котором R3 представляет формулу (IV-2) или (IV-3), или соединения (1с), которое является соединением (I), в котором R3 представляет формулу (IV-1).
Стадия В1 представляет собой стадию получения соединения формулы (IX) путем взаимодействия соединения (V) с основанием в присутствии или в отсутствии (предпочтительно в присутствии) инертного растворителя и затем взаимодействия полученного соединения с соединением формулы (VIII).
Примеры основания для использования в вышеуказанной реакции включают карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; бикарбонаты щелочных металлов, такие как бикарбонат лития, бикарбонат натрия и бикарбонат калия; гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; алкоксиды щелочных металлов, такие как метоксид лития, метоксид натрия, этоксид натрия и трет-бутоксид калия; и органические амины, такие как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, N,N-диметиланилин, N, N-диэтиланилин, 1, 5-диазабицикло[4.3.0]нона- 5-ен, 1,4-диазабицикло[2.2.2]октан (DABCO), 1,8-диазабицикло[5.4.0]-7-ундецен (ДБУ), среди которых гидриды щелочных металлов (особенно гидрид натрия) являются предпочтительными.
Не имеется особенных ограничений в отношении природы инертного растворителя для использования в вышеуказанной реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; амиды, такие как диметилформамид, диметилацетамид и гексаметилфосфортриамид; смеси вышеуказанных растворителей, из которых амиды (особенно диметилформамид) являются предпочтительными.
Температура реакции соединения (V) с основанием зависит от природы исходных материалов, основания и растворителя и тому подобного, однако она обычно колеблется от -50 до 200oС (предпочтительно от 0 до 120o С).
Время реакции соединения (V) с основанием зависит от природы исходных материалов, основания и растворителя, температуры реакции и тому подобного, однако оно обычно колеблется от 15 минут до 24 часов (предпочтительно от 1 часа до 10 часов).
Температура реакции соединения (V) с соединением (VIII) обычно колеблется от -20 до 200oС (предпочтительно от 0 до 150oС).
Время реакции соединения (V) с соединением (VIII) обычно колеблется от 30 минут до 48 часов (предпочтительно от 1 часа до 24 часов).
По завершении реакции полученное соединение (IX) по настоящей реакции может быть извлечено из реакционной смеси известным способом. Например, оно может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества фильтрованием; добавления к фильтрату органического растворителя, который не смешивается с водой, такого как этилацетат, и отделения органического слоя, содержащего целевое соединение; промывания водой или тому подобным; сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным и затем отгонки растворителя. Полученный таким образом продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Стадия В2 представляет собой стадию получения соединения формулы (XI), и ее осуществляют взаимодействием соединения (IX) с соединением формулы (X) в инертном растворителе в присутствии или в отсутствии (предпочтительно в присутствии) катализатора, такого как ацетат натрия, ацетат пиперидиния или бензоат пиперидиния.
Не имеется особенных ограничений в отношении природы инертного растворителя для использования в вышеуказанной реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; сложные эфиры, такие как метилацетат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; смеси вышеуказанных растворителей, среди которых амиды (особенно диметилформамид) являются предпочтительными.
Температура реакции зависит от природы исходных материалов, основания и растворителя и тому подобного, однако она обычно колеблется от 0 до 200oС (предпочтительно от 10oС до 150o С).
Время реакции зависит от природы исходных материалов, катализатора, растворителя, температуры реакции и тому подобного, однако оно обычно колеблется от 1 часа до 50 часов (предпочтительно от 2 часов до 24 часов).
По завершении реакции полученное соединение (XI) по настоящей реакции извлекают из реакционной смеси известным способом. Например, оно может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, такого как этилацетат; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным и затем отгонки растворителя. Полученный таким образом продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Стадия В3 представляет собой стадию получения соединения формулы (Ib) путем каталитического восстановления соединения (XI) в инертном растворителе и затем удаления, при необходимости, аминозащитной группы и/или гидроксилзащитной группы в R1a и R2a. Каталитическое восстановление и удаление, при желании, амино- и/или гидроксилзащитной группы осуществляют способами, аналогичными описанным для стадии А2 способа А.
Альтернативно, данная стадия может быть осуществлена посредством взаимодействия соединения (XI) с гидридом металла и затем удаления, при необходимости, амино- и/или гидроксилзащитной группы в R1a и R2a. Взаимодействие между соединением (XI) и гидридом металла можно проводить способом, аналогичным описанному в WO 93/1309А.
Стадия В4 представляет собой стадию получения соединения формулы (1с) путем удаления амино- и/или гидроксилзащитной группы в R1a и R2a соединения (XIa), которое представляет собой соединение (XI), имеющее в качестве Y атом серы. Данную стадию осуществляют способом, аналогичным описанному на стадии А2 способа А для удаления амино- и/или гидроксилзащитной группы.
Способ С (схема 3,
приведенная в конце описания)
На реакционной схеме 3 R1, R1a, R2, R2a, А и В имеют значения такие же, как описано выше.
Способ С представляет способ получения соединения (Id), которое является соединением (I), в котором R3 представляет формулу (IV-4), или соединения (1е), которое является соединением (I), в котором R3 представляет формулу (IV-5).
Стадия С1 является стадией получения соединения формулы (XII) путем взаимодействия соединения (IX) с гидроксиламином (гидрохлорид) в инертном растворителе, а затем контактированием реакционной смеси с восстанавливающим агентом.
Не имеется особенных ограничений в отношении природы инертного растворителя для использования при взаимодействии соединения (IX) с гидроксиламином (гидрохлорид), при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1, 2-дихлорэтан и четыреххлористый углерод; сложные эфиры, такие как метилацетат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; воду; смеси вышеуказанных растворителей, из которых смешанные растворители со спиртом (особенно, метанолом и этанолом) являются предпочтительными.
Температура взаимодействия соединения (IX) с гидроксиламином (гидрохлорид), зависит от природы исходных материалов, катализатора, растворителя и тому подобного, однако она обычно колеблется от -20 до 200oС (предпочтительно от 10 до 120oС).
Время взаимодействия соединения (IX) с гидроксиламином (гидрохлорид), зависит от природы исходных материалов, катализаторов, растворителя, температуры реакции и тому подобного, однако оно обычно колеблется от 1 часа до 50 часов (предпочтительно от 2 часов до 24 часов).
Примеры восстанавливающих агентов для использования на последней стадии реакции включают боргидриды щелочных металлов, такие как боргидрид натрия, боргидрид лития и цианоборгидрид натрия, и гидриды алюминия, такие как диизобутилалюминийгидрид, литийалюминийгидрид и литийтриэтоксиалюминийгидрид, среди которых боргидриды щелочных металлов (особенно, боргидрид натрия) являются предпочтительными.
Не имеется особенных ограничений в отношении растворителя для использования при контактировании с восстанавливающим агентом на последней стадии реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Предпочтительно используют растворители, аналогичные тем, которые применяют при взаимодействии соединения (IX) с гидроксиламином (гидрохлорид).
Температура взаимодействия при контактировании с восстанавливающим агентом на последней стадии реакции зависит от природы исходных материалов, восстанавливающего агента, растворителя и тому подобного, однако она обычно колеблется от -50 до 200oС (предпочтительно от 0 до 120oС).
Время взаимодействия при контактировании с восстанавливающим агентом на последней стадии реакции зависит от природы исходных материалов, восстанавливающего агента, растворителя, температуры реакции и тому подобного, однако оно обычно колеблется от 15 минут до 24 часов (предпочтительно от 1 часа до 12 часов).
По завершении реакции полученное в настоящей реакции соединение (XII) извлекают из реакционной смеси известным способом. Например, оно может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, такого как этилацетат; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным; и затем отгонки растворителя. Полученный продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Стадия С2 является стадией получения соединения формулы (XIII) путем взаимодействия соединения (XII) с триметилсилилизоцианатом в инертном растворителе.
Не имеется особенных ограничений в отношении природы растворителя для использования в вышеуказанной реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; смеси вышеуказанных растворителей, из которых ароматические углеводороды, простые эфиры и амиды (особенно диэтиловый эфир, тетрагидрофуран и диметилформамид) являются предпочтительными.
Температура реакции зависит от природы исходных материалов, растворителя и тому подобного, однако она обычно колеблется от -50 до 200oС (предпочтительно от 0 до 120oС).
Время реакции зависит от природы исходных материалов, растворителя, температуры реакции и тому подобного, однако оно обычно колеблется от 15 минут до 48 часов (предпочтительно от 1 часа до 24 часов).
По завершении реакции полученное в настоящей реакции соединение (XIII) извлекают из реакционной смеси известным способом. Например, оно может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, такого как этилацетат; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным; и затем отгонки растворителя. Полученный продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Стадия С3 является стадией получения соединения формулы (Id) путем взаимодействия соединения (XIII) с карбонилирующим агентом в инертном растворителе и затем удаления при необходимости амино- и/или гидроксилзащитных групп в R1a и R2a.
Не имеется особенных ограничений в отношении природы карбонилирующего агента для использования в вышеуказанной реакции, при условии, что он обычно применяется при карбонилировании. Примеры включают фосген, дифосген, трифосген и 1,1'-карбонилдиимидазол.
Не имеется особенных ограничений в отношении природы растворителя для использования в вышеуказанной реакции соединения (XIII) с карбонилирующим агентом, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; сложные эфиры, такие как метилацетат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; смеси вышеуказанных растворителей, из которых ароматические углеводороды, галогенированные углеводороды, простые эфиры и амиды (особенно тетрагидрофуран, диоксан и диметилформамид) являются предпочтительными.
Температура реакции соединения (XIII) с карбонилирующим агентом зависит от природы исходных материалов, растворителя и тому подобного, однако она обычно колеблется от -50 до 200o С (предпочтительно от 0 до 120oС).
Время реакции соединения (XIII) с карбонилирующим агентом зависит от природы исходных материалов, растворителя, температуры реакции и
тому подобного, однако оно
обычно
колеблется от 15 минут до 50 часов (предпочтительно от 1 часа до 24 часов).
Удаление амино- и/или гидроксилзащитной группы в R1a и R2a осуществляют, при необходимости, способами, аналогичными описанным для стадии А2 при удалении амино- и/или гидроксилзащитной группы.
По завершении реакции полученное по настоящей реакции соединение (1d) извлекают из реакционной смеси известным способом. Например, оно может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, как, например, этилацетат, к остатку; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным и затем отгонки растворителя. Полученный таким образом продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Стадия С4 представляет собой стадию получения соединения формулы (1е) путем удаления амино- и/или гидроксилзащитной группы в R1 и R2 в соединении (XIII) в инертном растворителе. Данную стадию осуществляют способом, аналогичным описанному на стадии А2 способа А для удаления амино- и/или гидроксилзащитных групп.
Стадия С5 представляет собой другую стадию получения соединения формулы (1d) посредством взаимодействия соединения (XII) с N-(хлоркарбонил)изоцианатом в присутствии или в отсутствие (предпочтительно в присутствии) инертного растворителя и затем удаления амино- и/или гидроксилзащитной группы в R1a и R2a, при желании.
Не имеется особенных ограничений в отношении природы растворителя для использования при реакции соединения (XII) с N-(хлоркарбонил)изоцианатом, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; сложные эфиры, такие как метилацетат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; смеси вышеуказанных растворителей, среди которых ароматические углеводороды, галогенированные углеводороды, простые эфиры и амиды (особенно тетрагидрофуран, диоксан и диметилформамид) являются предпочтительными.
Температура реакции зависит от природы исходных материалов, растворителя и тому подобного, однако она обычно колеблется от -50 до 200oС (предпочтительно от -20 до 50oС).
Время реакции зависит от природы исходных материалов, растворителя, температуры реакции и тому подобного, однако оно обычно колеблется от 15 минут до 50 часов (предпочтительно от 1 часа до 24 часов).
Удаление амино- и/или гидроксилзащитной группы в R1a и R2a осуществляют способом, аналогичным описанному на стадии А2 способа А для удаления амино- и/или гидроксилзащитной группы.
По завершении реакции полученное по настоящей реакции соединение (1d) извлекают из реакционной смеси известным способом. Например, оно может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, как, например, этилацетата к остатку; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным и затем отгонки растворителя. Полученный таким образом продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Способ D (схема 4, приведенная в конце описания).
На реакционной схеме 4 R2, R2a, R4, R5, R6, А, В, D, Е и Y имеют такие же значения, как описано выше; R4a представляет группу, аналогичную группам в определении группы R4, за исключением того, что амино- и/или гидроксильная группа, включеные в определение R4, означают амино- и/или гидроксильную группу, которые могут быть защищены амино- и/или гидроксилзащитной группой; R5a представляет группу, аналогичную приведенным в определении группы R5, за исключением того, что амино- и/или гидроксильная группа, включеные в определение R5, означают амино- и/или гидроксильную группу, которые могут быть защищены амино- и/или гидроксилзащитной группой; R7 представляет формил, карбокси или С2-7 алкоксикарбонильную группу, и Вос означает трет-бутоксикарбонильную группу.
Способ D представляет способ получения соединения (Ifa), которое является соединением (I), в котором R1 представляет группу формулы (II), и R3 представляет группу формулы (IV-2) или (IV-3), или соединения (Ifb), которое является соединением (I), в котором R1 представляет группу формулы (III), и R3 представляет формулу (IV-2) или (IV-3).
Стадия D1 представляет собой стадию получения соединения формулы (Ifa), и ее осуществляют путем взаимодействия соединения формулы (XIV) с соединением формулы (XVa) и затем удаления амино- и/или гидроксилзащитной группы в R2a, R4a и R5a, при необходимости.
Когда R7 в соединении (XIV) представляет формильную группу, соединение (XIV) взаимодействует с соединением (XVa) в инертном растворителе и затем трет-бутоксикарбонильную группу, которая является аминозащитной группой, удаляют из реакционной смеси с использованием кислоты для осуществления замыкания кольца с последующей реакцией с окисляющим агентом.
Альтернативно, данная стадия может быть осуществлена путем взаимодействия соединения (XIV) с соединением (XVa), выделения и очистки промежуточного продукта, полученного удалением трет-бутоксикарбонильной группы, которая является аминозащитной группой, с использованием кислоты из реакционной смеси для осуществления замыкания кольца, и затем приведением окисляющего агента во взаимодействие с полученным промежуточным продуктом.
Не имеется особенных ограничений в отношении природы растворителя для использования при реакции соединения (XIV) с соединением (XVa), при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; кислоты, такие как уксусная кислота и пропионовая кислота; сульфоксиды, такие как диметилсульфоксид; сульфолан; смеси вышеуказанных растворителей, среди которых простые эфиры (особенно тетрагидрофуран) являются предпочтительными.
Температура реакции соединения (XIV) с соединением (XVa) зависит от природы исходных материалов, растворителя и тому подобного, однако она обычно колеблется от 0 до 200oС (предпочтительно от 10 до 120oС).
Время реакции соединения (XIV) с соединением (XVa) зависит от природы исходных материалов, основания, растворителя, температуры реакции и тому подобного, однако оно обычно колеблется от одного часа до 50 часов (предпочтительно от 5 часов до 24 часов).
Удаление трет-бутоксикарбонильной группы, представляющей собой аминозащитную группу, с использованием кислоты осуществляют способом, аналогичным описанному на стадии А2 для удаления алкоксикарбонильной группы, которая является аминозащитной группой.
Не имеется особенного ограничения в отношении природы окисляющего агента для использования в вышеуказанной реакции, при условии, что он обычно используется в реакциях окисления. Примеры включают неорганические металлические окисляющие агенты, например оксиды марганца, такие как перманганат калия и диоксид марганца; оксиды рутения, такие как тетраоксид рутения; соединения селена, такие как диоксид селена; соединения железа, такие как хлорид железа(III); соединения осмия, такие как тетраоксид осмия, дигидрат осмат калия (K2OsO4• 2H2O); соединения серебра, такие как оксид серебра; соединения ртути, такие как ацетат ртути; соединения оксида свинца, такие как оксид свинца и тетраацетат свинца; соединения хромовой кислоты, такие как хромат калия, комплекс хромовая кислота - серная кислота и комплекс хромовая кислота - пиридин; соединения церия, такие как церийаммоний нитрат (CAN); неорганические окисляющие агенты, например, такие как молекулы галогена, такие как молекулы хлора, молекулы брома и молекулы иода; соединения периодной кислоты, такие как периодат натрия; озон; пероксид водорода; соединения азотистой кислоты, такие как азотистая кислота; соединения хлористой кислоты, такие как хлорит калия и хлорит натрия; соединения персерной кислоты, такие как персульфат калия и персульфат натрия; органические окисляющие агенты, например, реагенты, используемые для ДМСО окисления (комплексы между диметилсульфоксидом и дициклогексилкарбодиимидом, оксалилхлоридом, уксусным ангидридом или пентаоксидом фосфора или комплекс между пиридином и серным ангидридом); сочетание пероксида, такого как трет-бутилгидропероксид и ванадиевым или молибденовым комплексом; стабильные катионы, такие как трифенилметил катионы; сочетание сукцинимида, такого как N-бромсукцинимид и щелочи; оксираны, такие как диметилдиоксиран; соединения хлорноватистой кислоты, такие как трет-бутил-гипохлорит; соединения азодикарбоновой кислоты, такие как азодикарбоксилатный сложный эфир; перкислоты, такие как м-хлорпербензойная кислота и перфталевая кислота; дисульфиды, такие как диметилдисульфид, дифенилдисульфид и дипиридилдисульфид и трифенилфосфин; сложные эфиры азотистой кислоты, такие как метилнитрит; тетрагалогенированные углероды, такие как тетрабромид метана, и хиноновые соединения, такие как 2,3-дихлор-5,6-дициано-п-бензохинон (ДДХ), среди которых молекулы галогена (особенно молекулы иода) являются предпочтительными.
Не имеется особенного ограничения в отношении природы растворителя для использования при контактировании с окисляющим агентом, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Предпочтительно применяют растворители, используемые при взаимодействии соединения (XIV) с соединением (XVa).
Температура реакции и время реакции при контактировании с окисляющим агентом аналогичны условиям, используемым при взаимодействии соединения (XIV) с соединением (XVa).
Когда R7 в соединении (XIV) представляет карбоксильную группу, соединение формулы (XIV) или его реакционноспособное производное (галогенангидрид кислоты, активный сложный эфир или смешанный ангидрид кислоты) взаимодействуют с соединением формулы (XVa) или его кислотно-аддитивной солью (например, солью минеральной кислоты, такой как гидрохлорид, нитрат или сульфат), а затем трет-бутоксикрабонильную группу, которая является аминозащитной группой, удаляют с использованием кислоты с последующим замыканием кольца.
Альтернативно, на данной стадии возможно выделить и очистить амидное соединение, которое является промежуточным продуктом, удалить в полученном амидном соединении трет-бутоксикарбонильную группу, представляющую собой аминозащитную группу, с использованием способа, аналогичного описанному для стадии выше, и затем осуществить замыкание кольца.
Галогенангидридный способ осуществляют взаимодействием соединения (XIV) с галогенирующим агентом (например, тионил хлоридом, тионилбромидом, оксалилхлоридом, оксалилдихлоридом, оксихлоридом фосфора, трихлоридом фосфора или пентахлоридом фосфора) для получения галогенангидрида кислоты и затем взаимодействием полученного галогенангидрида кислоты с соединением (XVa) или его кислотно-аддитивной солью в инертном растворителе в присутствии или в отсутствие (предпочтительно в присутствии) основания.
Примеры основания для использования в вышеуказанной реакции включают карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; бикарбонаты щелочных металлов, такие как бикарбонат лития, бикарбонат натрия и бикарбонат калия; гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; алкоксиды щелочных металлов, такие как метоксид лития, метоксид натрия, этоксид натрия и трет-бутоксид калия; органические амины, такие как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4- (N, N-диметиламино) пиридин, N,N-диметиланилин, N,N-диэтиланилин, 1, 5-диазабицикло[4.3.0]нона-5-ен, 1,4-диазабицикло[2.2.2]октан (DABCO), 1,8-диазабицикло[5.4.0]-7-ундецен (ДБУ), среди которых органические амины (особенно триэтиламин) являются предпочтительными.
Не имеется особенных ограничений в отношении природы растворителя для использования в вышеуказанной реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; гидрированные углеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; сульфоксиды, такие как диметилсульфоксид и сульфолан, среди которых галогенированные углеводороды, простые эфиры и амиды являются предпочтительными (дихлорметан, хлороформ, тетрагидрофуран и диметилформамид являются особенно предпочтительными).
Температура реакции зависит от природы исходных материалов, реагентов и тому подобного, однако обычно она колеблется от -20 до 150oС для каждой из реакций галогенирующего агента с соединением (XIV) и реакции галогенангидрида кислоты с соединением (XVa) или его кислотно-аддитивной солью. Предпочтительно, реакцию галогенирующего агента с соединением (XIV) осуществляют при температуре от -10 до 100oС, тогда как реакцию галогенангидрида кислоты с соединением (XVa) или его кислотно-аддитивной солью осуществляют при температуре от -20 до 100oС.
Время реакции зависит от природы исходных материалов, реагентов и температуры реакции и тому подобного, однако время реакции колеблется от 30 минут до 80 часов (предпочтительно от 1 часа до 48 часов) для каждой из реакций галогенирующего агента с соединением (XIV) и галогенангидрида кислоты с соединением (XVa) или его кислотно-аддитивной солью.
Способ активного сложного эфира осуществляют посредством взаимодействия соединения (XIV) с активным этерифицирующим агентом в инертном растворителе для получения его активного сложного эфира и затем взаимодействия сложного эфира с соединением (XVa) или его кислотно-аддитивной солью в инертном растворителе в присутствии или в отсутствие (предпочтительно в присутствии) основания.
Примеры активных этерифицирующих агантов для использования в вышеуказанной реакции включают N-гидроксисоединения, такие как N-гидроксисукцинимид, 1-гидроксибензотриазол и N-гидрокси-5-норборнен-2,3-дикарбоксиимид; дисульфидные соединения, такие как дипиридилдисульфид; карбодиимиды, такие как дициклогексилкарбодиимид, карбонилдиимидазол и трифенилфосфин.
Не имеется особенного ограничения в отношении природы растворителя для использования в вышеуказанной реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; сульфоксиды, такие как диметилсульфоксид и сульфолан, среди которых простые эфиры и амиды (особенно диоксан, тетрагидрофуран и диметилформамид) являются предпочтительными.
Основания для использования в вышеуказанной реакции аналогичны тем, которые используются в описанном ранее галогенангидридном способе.
Температура реакции зависит от природы исходного материала и реагентов, и тому подобного, однако обычно реакцию образования активного сложного эфира осуществляют при температуре от -70 до 150oС (предпочтительно от -10 до 100oС), тогда как последующее взаимодействие между активным сложным эфиром и соединением (XVa) или его кислотно-аддитивной солью осуществляют при температуре от -20 до 100oС (предпочтительно от 0 до 50oС).
Время реакции зависит от природы исходного материала, реагентов, температуры реакции и тому подобного, однако обычно оно колеблется от 30 минут до 80 часов (предпочтительно от 1 часа до 48 часов) для каждой из реакций получения активного сложного эфира и реакции активного сложного эфира с соединением (XVa) или его кислотно-аддитивной солью.
Способ на основе смешанного ангидрида кислоты осуществляют посредством взаимодействия соединения (XIV) и агента, образующего смешанный ангидрид кислоты, в инертном растворителе в присутствии или в отсутствие (предпочтительно в присутствии) основания для получения соответствующего смешанного ангидрида кислоты и затем взаимодействия полученного смешанного ангидрида кислоты с соединением (XIVa) или его кислотно-аддитивной солью в инертном растворителе.
Примеры основания для использования в вышеуказанной реакции включают карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; бикарбонаты щелочных металлов, такие как бикарбонат лития, бикарбонат натрия и бикарбонат калия; гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; алкоксиды щелочных металлов, такие как метоксид лития, метоксид натрия, этоксид натрия и трет-бутоксид калия; органические амины, такие как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N, N-диметиламино)пиридин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нона-5-ен, 1/4-диазабицикло[2.2.2]октан (DABCO), 1,8-диазабицикло[5.4.0]-7-ундецен (ДБУ), среди которых органические амины (особенно триэтиламин) являются предпочтительными.
Примеры агентов, образующих смешанный ангидрид кислоты, для использования в вышеуказанной реакции включают C1-4 алкилгалогенкарбонаты, такие как этилхлоркарбонат и изобутилхлоркарбонат; (C1-5 алканоил)галогениды, такие как пивалоилхлорид; и ди(С1-4алкил) или ди(С6-14 арил)цианофосфаты, такие как диэтилцианофосфонаты и дифенилцианофосфонаты, среди которых ди(С1-4 алкил) или ди(С6-14 арил) цианофосфаты (особенно диэтилцианофосфонат) являются предпочтительными.
Не имеется особенного ограничения в отношении природы растворителя для использования при получении смешанного ангидрида кислоты, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; сульфоксиды, такие как диметилсульфоксид и сульфолан, среди которых простые эфиры и амиды (особенно тетрагидрофуран и диметилформамид) являются предпочтительными.
Температура реакции получения смешанного ангидрида кислоты зависит от природы исходных материалов, реагентов и тому подобного, однако она обычно колеблется от -50 до 100oС (предпочтительно от 0 до 60oС).
Время реакции получения смешанного ангидрида кислоты зависит от природы исходных материалов, реагентов, температуры реакции и тому подобного, однако оно обычно колеблется от 30 минут до 72 часов (предпочтительно от 1 часа до 24 часов).
Смешанный ангидрид кислоты взаимодействует с соединением (XVa) или его кислотно-аддитивной солью в инертном растворителе в присутствии или в отсутствие (предпочтительно в присутствии) основания, и основание и инертный растворитель для использования в данной реакции аналогичны тем, которые применяются при реакции получения вышеуказанного смешанного ангидрида кислоты.
Температура реакции смешанного ангидрида кислоты с соединением (XVa) или его кислотно-аддитивной солью зависит от природы исходных материалов, реагентов и тому подобного, однако она обычно колеблется от -30 до 100oС (предпочтительно от 0 до 80oС).
Время реакции смешанного ангидрида кислоты с соединением (XVa) или его кислотно-аддитивной солью зависит от природы исходных материалов, реагентов, температуры реакции и тому подобного, однако оно обычно колеблется от 5 минут до 24 часов (предпочтительно от 30 минут до 16 часов).
Когда в данной реакции используют ди(С1-4 алкил)цианофосфорную кислоту или ди(С6-14 арил)цианофосфорную кислоту, соединение (XIV) может взаимодействовать с соединением (XVa) непосредственно в присутствии основания.
Удаление трет-бутоксикарбонильной группы, представляющей собой аминозащитную группу, с использованием кислоты осуществляют способом, аналогичным описанному на стадии А2 способа А для удаления защитной группы из алкоксикарбонилзащищенной аминогруппы с использованием кислоты.
Замыкание кольца, следующее за удалением трет-бутоксикарбонильной группы, которая представляет аминозащитную группу, с использованием кислоты может быть осуществлено способом, аналогичным описанному на стадии А2 способа А для удаления защитной группы из алкоксикарбоксизащищенной аминогруппы при использовании кислоты.
Когда соединение (XIV) содержит С2-7 алкоксикарбонильную группу в качестве R7, соединение (XIV) взаимодействует с соединением (XVa) в присутствии или в отсутствие (предпочтительно в отсутствие) инертного растворителя и в присутствии или в отсутствие основания, трет-бутоксикарбонильную группу, которая является аминозащитной группой, удаляют с использованием кислоты с последующим замыканием кольца.
Альтернативно, на данной стадии возможно выделить и очистить амидное соединение, являющееся промежуточным продуктом, удалить трет-бутоксикарбонильную группу, которая представляет собой аминозащитную группу, из полученного амидного соединения способом, аналогичным описанному в вышеуказанной реакции, и затем осуществить замыкание кольца.
Примеры основания для использования в вышеуказанной реакции соединения (XIV) с соединением (XVa) включают карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; бикарбонаты щелочных металлов, такие как бикарбонат лития, бикарбонат натрия и бикарбонат калия; гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; алкоксиды щелочных металлов, такие как метоксид лития, метоксид натрия, этоксид натрия и трет-бутоксид калия; органические амины, такие как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N, N-диметиламино)пиридин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0] нона-5-ен, 1,4-диазабицикло[2.2.2] октан (DABCO), 1, 8-диазабицикло[5.4.0]-7-ундецен (ДБУ), среди которых органические амины (особенно триэтиламин) являются предпочтительными.
Не имеется особенных ограничений в отношении природы растворителя для использования при взаимодействии соединения (XIV) с соединением (XVa), при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; смеси вышеуказанных растворителей, из которых простые эфиры и амиды (особенно тетрагидрофуран, диоксан и диметилформамид) являются предпочтительными.
Температура реакции зависит от природы исходных материалов, основания, растворителя и тому подобного, однако она обычно колеблется от 0 до 200oС (предпочтительно от 50 до 150oС).
Время реакции зависит от природы исходных материалов, основания, растворителя, температуры реакции и тому подобного, однако оно обычно колеблется от 1 часа до 50 часов (предпочтительно от 5 часов до 24 часов).
Замыкание кольца после удаления трет-бутоксикарбонильной группы, которая является аминозащитной группой, с использованием кислоты может быть осуществлено способом, аналогичным описанному для стадии А2 в способе А для удаления защитной группы из алкоксикарбоксизащищенной аминогруппы при использовании кислоты.
Удаление, если необходимо, амино- и/или гидроксилзащитных групп в R2a, R4a и R5a осуществляют способом, аналогичным описанному для стадии А2 способа А для удаления амино- и/или гидроксилзащитных групп.
По завершении реакции полученное в настоящей реакции соединение (Ifа) извлекают из реакционной смеси известным способом. Например, оно может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, как, например, этилацетата к остатку; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным; и затем отгонки растворителя. Полученное соединение при необходимости может быть выделено и очищено с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Стадия D2 является стадией получения соединения формулы (Ifb) и ее осуществляют способом, аналогичным описанному для стадии D1 способа D, более конкретно, взаимодействием соединения формулы (XIV) с соединением формулы (XVb) и затем удалением, при необходимости, амино- и/или гидроксилзащитных групп в R2a, R4a и R5a. Данную стадию осуществляют аналогично тому, как описано для стадии D1.
Если R4 в соединениях (Ia), (Ib), (Ic), (Id), (Ie), (Ifa) и (Ifb), полученных описанными выше способом А, способом В, способом С и способом D, представляет собой фенильную или пиридильную группу, замещенную аминогруппой, то при необходимости можно осуществить алкилирование, арилирование, аралкилирование или ацилирование аминогруппы. Такая реакция известна или может быть осуществлена известным способом или, кроме того, аналогичным способом [The Chemistry of Amino Group, chapter 6, 1968, John Wiley & Sons, The Chemistry of the Amino group, chapter 2, 1970, John Wiley & Sons и т.д.].
Исходные вещества (V), (VI), (VIII), (X), (XIV), (XVa) и (XVb) известны, или их легко получают известными способами, или, кроме того, аналогичными способами.
Исходные вещества (V), (XIV), (XVa) и (XVb) также могут быть получены, например, следующими способами.
Способ Е (схема 5, приведенная в конце описания).
На реакционной схеме 5 R4a, R5a, R6, R7, A, B, D, Е и Воc имеют такие же значения, как описано выше.
Способ Е представляет собой способ получения соединений (Va) и (Vb).
Стадия Е1 представляет собой стадию получения соединения (Va) взаимодействием соединения формулы (XVI) с соединением (XVa) и затем удалением трет-бутоксикарбонильной группы, которая является аминозащитной группой, с использованием кислоты с последующим замыканием кольца. Эту стадию осуществляют способом, аналогичным описанному для стадии D1 способа D, где соединение (XIV) взаимодействует с соединением (XVa), и трет-бутоксикарбонильную группу, которая является аминозащитной группой, удаляют с использованием кислоты с последующим замыканием кольца.
В частности, когда в соединении (XVa) E представляет атом азота, замыкание кольца предпочтительно осуществляют с использованием соединения (XVI) в большом избытке в отсутствие растворителя.
Стадия Е2 представляет собой стадию получения соединения (Vb) путем взаимодействия соединения формулы (XVI) с соединением (XVb) и затем удаления трет-бутоксикарбонильной группы, которая является аминозащитной группой, с использованием кислоты. Данную стадию осуществляют способом, аналогичным описанному для стадии D1 способа D, где соединение (XIV), имеющее в качестве R7 карбонильную группу, взаимодействует с соединением (XVa), а затем трет-бутоксикарбонильную группу, которая является аминозащитной группой, удаляют с использованием кислоты.
Замыкание кольца также проводят способом, аналогичным описанному на стадии D1 способа D. Однако когда в соединении (XVa) E представляет атом азота, замыкание кольца предпочтительно осуществляют с использованием большого избытка соединения (XVI) в отсутствие растворителя.
По завершении реакции полученное в настоящей реакции соединение (Va) или (Vb) извлекают из реакционной смеси известным способом. Например, оно может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, такого как этилацетат; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным и затем отгонки растворителя. Полученный продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Способ F (схема 6, приведенная в конце описания).
На реакционной схеме 6 R2a, R7, R8, А, В, Х и Y имеют такие же значения, как описано выше, и R7a представляет группу, аналогичную определенным для R7 за исключением того, что формильная или карбоксильная группа, включенные в определение R7, означают формильную или карбоксильную группу, которая может быть защищена защитной группой.
В вышеуказанном описании не имеется особенного ограничения в отношении "защитной группы" для "формильной группы, которая может быть защищена защитной группой", при условии, что она является формилзащитной группой, используемой в области синтетической органической химии. Примеры включают метильную группу, замещенную проиллюстрированными выше C1-6 алкоксигруппами, такую как диметоксиметил, диэтоксиметил, дипропоксиметил и дибутоксиметил, и группы 1, 3-диоксан-2-ил, 1,3-диоксолан-2-ил, 1,3-дитиан-2-ил и 1,3-дитиолан-2-ил, среди которых группы диметоксиметил, диэтоксиметил, 1,3-диоксолан-2-ил и 1,3-дитиан-2-ил являются предпочтительными.
В вышеуказанном описании не имеется особенного ограничения в отношении "защитной группы" для "карбоксильной группы, которая может быть защищена защитной группой", при условии, что она является карбоксилзащитной группой, используемой в области синтетической органической химии. Примеры включают C1-6 алкильные группы, такие как метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил; и C1-6 алкильные групппы, замещенные 1-3 С6-10 арильными группами, которые могут быть замещены C1-6 алкильной группой, C1-6 алкоксигруппой, нитрогруппой, атомом галогена или цианогруппой, такие как бензильная, фенетильная, 3-фенилпропильная, 1-нафтилметильная, дифенилметильная, трифенилметильная, 4-метилбензильная, 4-метоксибензильная, 4-нитробензильная, 4-фторбензильная и 4-цианобензильная группы, среди которых предпочтительны C1-6 алкильные группы и бензильная группа.
Способ F представляет собой способ получения соединения (XIV).
Стадия F1 является стадией получения соединения (XIV) взаимодействием соединения формулы (XVII) с соединением формулы (XVIII) в инертном растворителе в присутствии основания и затем удалением защитной группы, если формильная или карбоксильная группа R7a является защищенной формильной или карбоксильной группой.
Основание, используемое при взаимодействии соединения формулы (XVII) с соединением формулы (XVIII), аналогично основанию, используемому в описанной выше стадии В1 способа В и предпочтительно представляет собой гидрид щелочного металла (особенно гидрид натрия).
Растворитель, используемый при взаимодействии соединения формулы (XVII) с соединением формулы (XVIII), аналогичен используемому в описанной выше стадии В1 способа В и предпочтительно представляет собой амид или смешанный растворитель из амида и другого растворителя (особенно диметилформамид).
Температура реакции при взаимодействии соединения формулы (XVII) с соединением формулы (XVIII) зависит от природы исходных материалов, основания, растворителя и тому подобного, однако обычно она колеблется от -50 до 200oС (предпочтительно от 0 до 120oС).
Время реакции при взаимодействии соединения формулы (XVII) с соединением формулы (XVIII) зависит от природы исходных материалов, основания, растворителя, температуры реакции и тому подобного, однако обычно оно колеблется от 30 минут до 24 часов (предпочтительно от 1 часа до 10 часов).
Удаление, при желании, защитной группы формильной группы или карбоксильной группы зависит от ее природы, однако обычно его проводят с использованием способов, известных в области синтетической органической химии, например, Т.W.Green (Protective Groups in Organic Synthesis), John Wiley & Sons или J.F.W.McOmie: (Protective Groups in Organic Chemistry), Plenum Press.
Соединение (XIV), где R7 представляет карбоксильную группу, или соединение (XVIII), где R7a представляет карбоксильную группу, легко может быть получено известным способом из соединения, где R7 или R7a представляет формильную или защищенную формильную группу.
По завершении реакции полученное в настоящей реакции соединение (XIV) извлекают из реакционной смеси известным способом. Например, оно может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, такого как этилацетат; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным и затем отгонки растворителя. Полученный продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Способ G (схема 7, приведенная в конце описания).
На реакционной схеме 7 R2a, R7, R7a, А, В, X и Y имеют такие же значения, как описано выше, и R9 представляет карбоксилзащитную группу (которая имеет такие же значения, как описано выше).
Способ G также представляет собой способ получения соединения (XIV) и отличается от способа F.
Стадия G1 является стадией получения соединения формулы (XXI) взаимодействием соединения формулы (XIX) с соединением формулы (XX) в инертном растворителе в присутствии основания. Эту стадию осуществляют способом, аналогичным для стадии F1 способа F.
Стадия G2 представляет стадию получения соединения формулы (XXII) восстановлением соединения (XXI). Данное взаимодействие осуществляют путем каталитического восстановления или цинк-уксуснокислым способом, олово-спиртовым способом или олово-солянокислым способом, которые обычно используются при восстановлении нитрогруппы.
Стадия G3 является стадией получения соединения формулы (XXIII) и ее проводят, подвергая соединение (XXII) арилированию по Мейервейну с использованием способа, аналогичного описанному в заявке на патент Японии Kokai Sho 55-22657 (USP4258193) или S.Oae et al., "Bull. Chem.Soc.Jpn., 53, 1065 (1980)".
Стадия G4 является стадией получения соединения (XIV) взаимодействием соединения (XXIII) с соединением формулы (XXIV)с последующим гидролизом реакционной смеси и, при желании, удалением формил- или карбоксилзащитной группы, как определено в случае группы R7a.
Взаимодействие соединения (XXIII) с соединением (XXIV) и последующий гидролиз осуществляют способом, аналогичным описанному в заявке на патент Японии Kokai Sho 55-22657 (USP4258193).
Удаление формил- или карбоксилзащитной группы, определенной для группы R7a, осуществляют способом, аналогичным описанному для удаления формил- или карбоксилзащитной группы в способе F.
По завершении реакции полученное в настоящей реакции соединение (XIV) извлекают из реакционной смеси известным способом. Например, оно может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, такого как этилацетат; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным и затем отгонки растворителя. Полученный продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Способ Н (схема 8, приведенная в конце описания).
На реакционной схеме 8 R4a, R5a, R6, D, E, Х и Воc имеют такие же значения, как описано выше.
Способ Н представляет собой способ получения соединений (XVa) и (XVb).
Стадия HI является стадией получения соединения формулы (XXVIIa) взаимодействием соединения формулы (XXV) с соединением формулы (XXVIa) в присутствии основания. Данную стадию осуществляют способом, аналогичным описанному на стадии F1 способа F.
Стадия Н2 является стадией получения соединения (XVa) восстановлением соединения (XXVIIa). Данную стадию осуществляют способом, аналогичным описанному на стадии G2 способа G.
Стадия Н3 является стадией получения соединения (XXVI1b) взаимодействием соединения формулы (XXV) с соединением формулы (XXVIb) в инертном растворителе в присутствии основания. Данную стадию осуществляют способом, аналогичным описанному на стадии F1 способа F.
Стадия Н4 является стадией получения соединения (XVb) восстановлением соединения (XXVIIb). Данную стадию осуществляют способом, аналогичным описанному на стадии G2.
По завершении реакции полученные в настоящей реакции соединения (XVa) и (XVb) извлекают из реакционной смеси известным способом. Например, каждое из них может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, как, например, этилацетата к остатку; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным и затем отгонки растворителя. Полученный продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Способ I (схема 9, приведенная в конце описания)
На реакционной схеме 9
R5a, R6, Е, Х и Воc
имеют такие же значения, как описано выше.
Способ I представляет собой способ получения соединений (XXVIa) и (XXVIb).
Стадия I1 является стадией получения соединения формулы (XXIX) посредством защиты аминогруппы в соединении формулы (XXVIIIa) трет-бутоксикарбонильной группой с использованием способа, аналогичного обычному способу, известному в области синтетической органической химии, например, Т.W. Green (Protective Groups in Organic Synthesis), John Wiley & Sons или J.F.W. McOmie (Protective Groups in Organic Chemistry), Plenum Press.
Стадия I2 является стадией получения соединения (XXVIa) взаимодействием соединения формулы (XXIXa) с соединением формулы (XXX) в инертном растворителе в присутствии основания.
Основание, используемое в вышеуказанной реакции, аналогично основанию, используемому в описанной выше стадии В1 способа В, и гидриды щелочного металла (особенно гидрид натрия) являются предпочтительными.
Растворитель, используемый в вышеуказанной реакции, аналогичен используемому в описанной выше стадии В1 способа В, и простые эфиры и амиды (особенно тетрагидрофуран, диоксан и диметилформамид) являются предпочтительными.
Температура реакции зависит от природы исходных материалов, основания, растворителя и тому подобного, однако обычно она колеблется от -50 до 200oС (предпочтительно от 0 до 120oС).
Время реакции зависит от природы исходных материалов, основания, растворителя, температуры реакции и тому подобного, однако обычно оно колеблется от 30 минут до 24 часов (предпочтительно от 1 часа до 10 часов).
Стадия I3 является стадией получения соединения формулы (XXIXb) посредством защиты аминогруппы в соединении формулы (XXVIIIb) трет-бутоксикарбонильной группой. Данную стадию осуществляют способом, аналогичным описанному для стадии I1.
Стадия I4 является стадией получения соединения (XXVIb) взаимодействием соединения формулы (XXIXb) с соединением формулы (XXX) в инертном растворителе в присутствии основания. Данную стадию осуществляют способом, аналогичным описанному для вышеуказанной стадии I2 способа I.
По завершении реакции полученные в настоящей реакции соединения (XXVIa) или (XXVIb) извлекают из реакционной смеси известным способом. Например, каждое из них может быть получено путем нейтрализации, при необходимости, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, такого как этилацетат; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным и затем отгонки растворителя. Полученный продукт при необходимости может быть выделен и очищен с использованием любого подходящего сочетания обычных методов, например, перекристаллизации, переосаждения и хроматографии.
Способ J (схема 10, приведенная в конце описания).
На реакционной схеме 10 R5a, R6, D, E и Воc имеют такие же значения, как
описано выше, R10 представляет атом водорода или
трифенилметильную группу и группу следующей формулы:

представляет фенильную группу, которая может быть замещена 1-4 заместителями, выбранными из заместителей α, или пиридильную группу, которая может быть замещена 1-3 заместителями, выбранными из заместителей α.
Способ J представляет собой способ получения соединения (XVd) или (XVf), имеющих в качестве R4a фенильную или пиридильную группу, замещенную тетразолильной группой, которая может быть защищена, и отличается от способа Н.
Стадия J1 является стадией получения соединения (XVd) путем взаимодействия соединения (XVc), которое представляет собой соединение (XVa), имеющее в качестве R4 цианозамещенную фенильную или пиридильную группу, с азидным соединением в инертном растворителе и затем, при желании, защиты тетразолильной группы полученного соединения.
Не имеется особенного ограничения в отношении природы инертного растворителя для использования в вышеуказанной реакции, при условии, что он не оказывает неблагоприятного воздействия на настоящую реакцию. Примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; нитрилы, такие как ацетонитрил; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; сульфоксиды, такие как диметилсульфоксид, среди которых ароматические углеводороды (особенно толуол) являются предпочтительными.
Примеры соединения азида для использования в вышеуказанной реакции включают производные диарилфосфорилазида, такие как дифенилфосфорилазид; триалкилсилилазиды, такие как триметилсилилазид и триэтилсилилазид; азидные соли щелочных металлов, такие как азид натрия и азид калия; азиды триалкилолова, такие как азид три-н-бутилолова, среди которых азиды триалкилолова (особенно азид три-н-бутилолова) являются предпочтительными.
В вышеуказанной реакции азидные соединения могут использоваться или сами по себе, или в сочетании, например, с триалкилсилилтрифлатом, таким как триметилсилилтрифлат или триэтилсилилтрифлат, или с кислотой Льюиса, такой как эфират трехфтористого бора, хлорид алюминия и хлорид цинка.
Хотя температура реакции зависит от природы исходного материала, используемого азида и растворителя, и тому подобного, однако обычно она колеблется от -10 до 200oС (предпочтительно от 50 до 150oС).
Время реакции зависит от природы исходного материала, используемого азида и растворителя, температуры реакции и тому подобного, однако обычно оно колеблется от 15 минут до 48 часов (предпочтительно от 30 минут до 30 часов).
Реакцию для защиты тетразолильной группы осуществляют, при необходимости, путем взаимодействия соединения, полученного в вышеуказанной реакции с галогенированным трифенилметаном в инертном растворителе в присутствии основания.
Основание, используемое в вышеуказанной реакции, аналогично используемому на стадии В1 способа В, и органические амины (особенно триэтиламин) являются предпочтительными.
Растворитель, используемый в вышеуказанной реакции, аналогичен используемому при взаимодействии соединения (XVc) с азидным соединением, и смесь простого эфира и амида (особенно смесь тетрагидрофурана и диметилформамида) является предпочтительной.
Температура реакции зависит от природы исходного материала, основания, растворителя и тому подобного, однако обычно она колеблется от -10 до 150oС (предпочтительно от 0 до 60oС).
Время реакции зависит от природы исходного материала, основания и растворителя, температуры реакции и тому подобного, однако обычно оно колеблется от 15 минут до 48 часов (предпочтительно от 30 минут до 30 часов).
Стадия J2 является стадией получения соединения формулы (XVf) путем взаимодействия соединения (XVe), которое представляет собой соединение (XVb), имеющее в качестве R4a цианозамещенную фенильную или пиридильную группу, с азидным соединением и, при необходимости, защиты тетразолильной группы полученного соединения. Данную стадию осуществляют способом, аналогичным описанному для стадии J1 способа J.
По завершении реакции полученные в настоящей реакции соединения (XVd) или (XVf) извлекают из реакционной смеси известным способом. Например, они могут быть получены путем нейтрализации, при желании, реакционной смеси; удаления нерастворимого вещества из реакционной смеси фильтрованием и добавления к фильтрату органического растворителя, который не смешивается с водой, такого как этилацетат; отделения органического слоя, содержащего целевое соединение, промывания водой или тому подобным и сушки над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или тому подобным и затем отгонки растворителя. Полученный продукт при необходимости может быть выделен и очищен с использованием, в сочетании, способов, обычно применяемых для выделения и очистки органических соединений, таких как перекристаллизации, переосаждение и хроматографии с использованием подходящего элюента.
Исходные вещества (XVI), (XVII), (XVIII), (XIX), (XX), (XXIV), (XXV), (XXVIIIa), (XXVIIIb) и (XXX) известны или легко могут быть получены известным способом или аналогичным ему методом [например, заявка на патент Японии kokai Hei 9-188669 (ЕР543662А) и тому подобные].
Соединение формулы (I) или его фармакологически приемлемая соль по настоящему изобретению обладают превосходным повышающим инсулиновую резистентность действием, воздействием, снижающим уровень сахара в крови, противовоспалительным действием, иммунно-модулирующим действием, альдегидроредуктазаингибирующим действием, 5-липоксигеназаингибирующим действием, действием, ингибирующим продуцирование липидного пероксида, активирующим PPAR действием, антиостеопорозным действием, антагонизмом к лейкотриенам, действием, промотирующим образование жировых клеток, действием, ингибирующим пролиферацию раковых клеток и кальциевым антагонизмом, и, следовательно может использоваться в качестве профилактического и/или лекарственного средства при диабете, гиперлипидемии, ожирении, нарушении толерантности к глюкозе, гипертензии, ожирении печени, диабетических осложнениях (например, ретинопатии, нефропатии, неврозе, катарактах и коронарных заболеваниях и тому подобных), артериосклерозе, диабете беременных, синдроме поликистоза яичников, сердечнососудистых заболеваниях (например, ишемической болезни сердца и тому подобном), повреждениях клеток (например, при повреждении головного мозга, вызванном инсультом, и тому подобном), индуцированных атеросклерозом или ишемической болезнью сердца, подагре, воспалительных заболеваниях (таких как эпифиэарный остеомиелит, боль, жар, ревматоидный артрит воспалительный энтерит, угри, солнечные ожоги, псориаз, экзема, аллергия, астма, гастроинтестинальная язва, истощение, аутоиммунные заболевания, панкреатит и тому подобные), раке, остеопорозе и катарактах.
Кроме того, соединение формулы (I) или его фармакологически приемлемая соль по настоящему изобретению могут использоваться в качестве фармацевтической композиции (особенно в качестве профилактического и/или лекарственного средства при диабете или диабетических осложнениях), полученной путем использования его в сочетании с по крайней мере одним из ингибиторов α-глюкозидазы, ингибиторов альдегидроредуктазы, препаратов бигуанида, статиновых основных соединений, ингибиторов синтеза сквалена, фибратных основных соединений, промоторов катаболизма LDL и ингибиторов ангиотензин-конвертирующего фермента.
[Промышленная применимость]
Когда соединение формулы (I) или его фармакологически приемлемую соль в соотвествии с настоящим изобретением
используют в качестве вышеуказанного лекарственного
или профилактического средства, оно может вводиться само по себе или, при необходимости, после смешивания с фармакологически приемлемым эксципиентом,
разбавителем или тому подобным, перорально в виде
таблеток, капсул, гранул, порошков или сиропов или парентерально в виде инъекций или суппозиториев.
Вышеуказанные фармацевтические препаративные формы могут быть получены известным способом с использованием добавок. Примеры добавок включают эксципиент (например, органические эксципиенты, например, производные сахара, такие как лактоза, сахароза, декстроза, маннит и сорбит; производные крахмала, такие как кукурузный крахмал, картофельный крахмал, α-крахмал и декстрин; производные целлюлозы, такие как кристаллическая целлюлоза, гуммиарабик, декстран и паллулан; неорганические эксципиенты, например, силикатные производные, такие как мягкий кремневый ангидрид, синтетический силикат алюминия, силикат кальция и метасиликат магния-алюминия; фосфатные производные, такие как гидрофосфат кальция; карбонатные производные, такие как карбонат кальция; сульфаты, такие как сульфат кальция), смазывающее вещество (например, стеариновая кислота, металлические соли стеариновой кислоты, такие как стеарат кальция и стеарат магния; тальк; коллоидный диоксид кремния; воск, такой как пчелиный воск или спермацет; борная кислота; адипиновая кислота; сульфаты, такие как сульфат натрия; гликоль; фумаровая кислота; бензонат натрия, DL лейцин; натриевые соли жирных кислот; лаурилсульфаты, такие как лаурилсульфат натрия или лаурилсульфат магния; кремниевые кислоты, такие как кремниевый ангидрид или кремниевый гидрат, и проиллюстрированные выше производные крахмала), связующее вещество (например, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидин. Макроголь и подобные им соединения, описанные выше для эксципиентов), дезинтегратор (например, производные целлюлозы, такие как гидроксипропилцеллюлоза с низкой степенью замещения, карбоксиметилцеллюлоза, карбоксиметилцеллюлоза кальция и внутренне сшитая карбоксиметилцеллюлоза натрия, и химически модифицированная крахмал-целлюлоза, такая как карбоксиметилкрахмал, карбоксиметилкрахмал натрия и сшитый поливинилпирролидон), стабилизатор (например, параоксибензоат, такой как метилпарабен и пропилпарабен; спирт, такой как хлорбутанол, бензиловый спирт или фенилэтиловый спирт; хлорид бензалькония; фенол и производные фенола, такие как крезол; тримерозаль; дегидроуксусная кислота и сорбиновая кислота), корригент (например, обычно применяемый подсластитель, подкислитель или ароматизатор) и разбавитель.
Доза соединения по изобретению будет меняться в зависимости от состояния и возраста пациента, способа введения и тому подобного. Перорально его вводят в количестве 0,001 мг/кг веса тела (предпочтительно 0,01 мг/кг веса) в единичной дозе в качестве нижнего предела и 500 мг/кг веса тела (предпочтительно 50 мг/кг веса) в единичной дозе в качестве верхнего предела, тогда как внутривенно его вводят в количестве 0,005 мг/кг веса (предпочтительно 0,05 мг/кг веса) в единичной дозе в качестве нижнего предела и 50 мг/кг веса (предпочтительно 5 мг/кг веса) в единичной дозе в качестве верхнего предела. Желательно проводить введение однократно или несколько раз в день в зависимости от состояния пациента.
[Лучшие способы осуществления изобретения]
Далее настоящее изобретение будет описано более конкретно на примерах, ссылочных примерах и
примерах фармакологических тестов. Однако
следует понимать, что настоящее изобретение не ограничено данными примерами или посредством данных примеров.
Пример 1
5-{4-[5-(4-Гидрокси-2,3,
5-триметилфенокси)-3-метил-3Н-имидазо[4,5-b]пиридин-2-илметокси]бензил}тиазолидин-2,4-дион и его гидрохлорид (Иллюстративное соединение 1-651)
(1-1) 5-{
4-[5-(4-Ацетокси-2,3,
5-триметилфенокси)-3-метил-3Н-имидазо[4,5-b]пиридин-2-илметокси]бензил}-3-трифенилметилтиазолидин-2,4-дион
К смеси 16,4 г 5-(4-ацетокси-2,3,
5-триметилфенокси)-2-гидроксиметил-3-метил-3Н-имидазо[4,5-b] пиридина, 32,5 г 5-(4-гидроксибензил)-3-трифенилметил-тиазолидин-2,4-диона, 17,5 г азодикарбонилдипиперидина и 400 мл толуола добавляли по
каплям при комнатной температуре раствор 17,2 мл трибутилфосфина в 50 мл толуола с последующим облучением ультразвуком в течение одного часа и перемешиванием при комнатной температуре в течение 3
часов. Реакционную смесь оставляли на ночь при комнатной температуре. Нерастворимое вещество отфильтровывали из реакционной смеси и фильтрат концентрировали упариванием. Остаток очищали
хроматографией
на колонке с силикагелем (элюирующий растворитель: н-гексан/этилацетат = 2/1-->1/1) и кристаллизовали из смеси растворителей 2/1 н-гексан/этилацетат. Полученные кристаллы
собирали собирали
фильтрованием, получая 31,7 г целевого соединения.
Температура плавления: 190-191oС.
(1-2а) 5-{ 4-[5-(4-Гидрокси-2,3,
5-триметилфенокси)-3-метил-3Н-имидазо[4,5-b]пиридин-2-илметокси]бензил}тиазолидин-2,4-дион
Смесь 27,0 г 5-{4-[5-(4-ацетокси-2,3,5-триметилфенокси)-3-метил-3Н-имидазо[4,5-b]
пиридин-2-илметокси] бензил}-3-трифенилметилтиазолидин-2,4-диона, 150 мл 6 н. соляной кислоты и 200 мл уксусной кислоты перемешивали при 80oС в течение 5 часов и затем выливали в ледяную
воду. К полученной смеси для нейтрализации добавляли карбонат натрия. К смеси добавляли этилацетат и нерастворимое вещество отфильтровывали. Остаток промывали этанолом, получая 10,2 г указанного в
заголовке соединения. Кроме того, из фильтрата отделяли органический слой и водный слой экстрагировали этилацетатом. Органический слой и экстракт объединяли с последующей промывкой насыщенным солевым
раствором и сушили над безводным сульфатом натрия.Затем растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюирующий растворитель:
н-гексан/этилацетат = 1/1-->1/2-->этилацетат) с последующей кристаллизацией из этанола. Кристаллы собирали фильтрованием, получая при этом 6,90 г указанного в заголовке соединения.
Температура плавления: 215-217oС.
(1-2b) Гидрохлорид 5-{4-[5-(4-гидрокси-2,3,5-триметилфенокси)-3-метил-3Н-имидазо[4,
5-b]пиридин-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь 10,2 г 5-{4-[5-(4-гидрокси-2,3,5-триметилфенокси)-3-метил-3Н-имидазо[4,5-b] пиридин-2-илметокси] бензил} тиазолидин-2,4-диона, 100
мл
этилацетата и 100 мл смеси 4 н. хлорводородная кислота/этилацетат перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь оставляли на ночь при комнатной температуре. Из
реакционной смеси отфильтровывали кристаллы, получая при этом 10,7 г указанного в заголовке соединения.
Температура плавления: 148-150oС.
Пример 2
5-{ 4-[6-(4-Гидрокси-2,3,5-триметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион и его гидрохлорид (Иллюстративное соединение 1-650)
(2-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4-метоксиметокси-2,3,5-триметилфенокси )фенил}-N-метилкарбамат
К смеси 18,7 г трет-бутил N-[2-амино-5-(4-метоксиметокси- 2,3,
5-триметилфенокси)фенил} -N-метилкарбамата, 12,6 г 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты, 4,55 г триэтиламина и 300 мл безводного тетрагидрофурана добавляли 7,34 г
диэтилцианофосфоната. Полученную смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь концентрировали упариванием. К концентрату добавляли воду. После экстракции
этилацетатом экстракт сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюирующий растворитель:
н-гексан/этилацетат = 1/1), получая при этом 23,1 г целевого соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 2/3): значение Rf=0, 41.
(2-2а) 5-{ 4-[6-(4-Гидрокси-2,3,5-триметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион
0,49 г трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4-метоксиметокси-2,3,5-триметилфенокси)фенил} -N-метилкарбамата растворяли в 10 мл 4 н. раствора хлорводородная кислота/диоксан. Полученный
раствор
оставляли при комнатной температуре на 2-е суток. К реакционной смеси добавляли воду и водный раствор бикарбоната натрия, затем экстрагировали этилацетатом. Экстракт сушили над безводным
сульфатом
натрия. Затем растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем с использованием этилацетата в качестве элюирующего растворителя,
получая при этом
0,27 г указанного в заголовке соединения.
Температура размягчения: 137-147oС.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 1/2): значение Rf=0,21.
(2-2b) Гидрохлорид 5-{ 4- [6-(4-гидрокси-2,3,5-триметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил} тиазолидин-2,
4-диона
18,0 г сырого продукта 5-{4- [6-(4-гидрокси-2,3,5-триметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона выделяли и очищали хроматографией на колонке с
силикагелем с
использованием этилацетата в качестве элюирующего растворителя, с последующим суспендированием в растворе 4 н. хлорводородная кислота/этилацетат. Полученную суспензию перемешивали в
течение ночи при
комнатной температуре. Из реакционной смеси отфильтровывали кристаллы и промывали этилацетатом, получая таким образом 14,7 г указанного в заголовке соединения.
Температура плавления: 160-165oС.
Пример 3
5-{4-[6-(4-Гидроксифенокси)-1-метил-1Н-бензимидазол-2-ил-метокси]бензил} тиазолидин-2,4-дион (Иллюстративное соединение
1-70)
(3-1)
трет-Бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-гидроксифенокси)фенил}-N-метилкарбамат
При использовании 0,79 г трет-бутил
N-[2-амино-5-(4-гидроксифенокси)фенил}
-N-метилкарбамата, 0,84 г 4-(2,4- диоксотиазолидин-5-илметил)феноксиуксусной кислоты, 0,49 г диэтилцианофосфоната, 0,30 г триэтиламина и 60 мл безводного
тетрагирофурана проводили взаимодействие и
очистку способом, аналогичным описанному в примере (2-1), получая таким образом 1,49 г целевого соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 1/2): значение Rf=0,35.
(3-2) 5-{ 4-[6-(4-Гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил}тиазолидин-2,
4-дион
Используя 1,49 г трет-бутил
N-{ 2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4-гидроксифенокси) фенил}-N-метилкарбамата и 10 мл 4 н. раствора хлорводородная
кислота/диоксан, взаимодействие и очистку проводили
способом, аналогичным описанному в примере (2-2а), получая таким образом 0,26 г целевого соединения.
Температура плавления: 126-131oС.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 1/3): значение Rf=0,13.
Пример 4
5-{
4-[6-(4-Гидрокси-3,
5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион и его гидрохлорид (Иллюстративное соединение 1-520)
(4-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4-метоксиметокси-3,5-диметилфенокси )фенил}-N-метилкарбамат
Используя 0,96 г трет-бутил N-[2-амино-5-(4-метоксиметокси-3,
5-диметилфенокси)фенил} -N-метилкарбамата, 0,84 г 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты, 0,49 г диэтилцианофосфоната, 0,30 г триэтиламина и 60 мл безводного тетрагидрофурана,
проводили взаимодействие и очистку способом, аналогичным описанному в примере (2-1), получая таким образом 1,44 г целевого соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 1/1): значение Rf=0,27.
(4-2а) 5-{ 4-[6-(4-Гидрокси-3,5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,
4-дион
Используя 1,44 г трет-бутил N-{ 2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4-метокси-метокси-3,5-диметилфенокси)фенил} -N-метилкарбамата и 10 мл 4 н. раствора
хлорводородная кислота/диоксан, осуществляли взаимодействие и очистку способом, аналогичным описанному в примере (2-2а), получая таким образом 0,62 г указанного в заголовке соединения.
Температура плавления: 147-157oС.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 1/2): значение Rf=0,21.
(4-2b)
Гидрохлорид 5-{ 4-[6-(4-гидрокси-3,5-диметилфенокси) -1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Используя 3,11 г 5-{4-[6-(4-гидрокси-3,
5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона и 50 мл 4 н. раствора хлорводородная кислота/этилацетат, взаимодействие и очистку осуществляли способом,
аналогичным
описанному в примере (2-2b), получая таким образом 3,18 г указанного в заголовке соединения.
Температура плавления: 206-209oС.
Пример 5
5-{
4-[6-(2-Хлор-4-гидрокси-3,5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион и его гидрохлорид (Иллюстративное соединение 1-368)
(5a) 5-{
4-[6-(2-Хлор-4-гидрокси-3,5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион
Смесь 9,19 г трет-бутил N-[5-(2-хлор-4-метоксиметокси-3,
5-диметилфенокси)-2-нитрофенил]-N-метилкарбамата, 2,5 г 10%-ного палладия на угле и 400 мл метанола интенсивно перемешивали при комнатной температуре в течение 90 минут в атмосфере водорода. Затем
катализатор отфильтровывали и растворитель из фильтрата отгоняли при пониженном давлении. Остаток растворяли в 250 мл безводного тетрагидрофурана. К полученному раствору добавляли 15,8 г 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты, 9,18 г диэтилцианофосфоната и 5,69 г триэтиламина. Полученную смесь перемешивали при комнатной температуре в течение 64 часов. Реакционную смесь
концентрировали упариванием. К концентрату добавляли воду с последующей экстракцией этилацетатом. Экстракт сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении.
Остаток очищали хроматографией на колонке с силикагелем (элюирующий растворитель: н-гексан/этилацетат=1/1) и затем растворяли в 200 мл 2 н. раствора хлорводородная кислота/диоксан. Полученный раствор
оставляли при комнатной температуре на 19 часов. Реакционную смесь концентрировали упариванием. Концентрат нейтрализовали водным раствором бикарбоната натрия с последующей экстракцией смешанным
растворителем из этилацетата и тетрагидрофурана. Экстракционный раствор сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на колонке
с силикагелем (элюирующий растворитель: н-гексан/этилацетат=1/2) и препаративной высокоэффективной жидкостной хроматографией с обращеной фазой (проявляющий растворитель: ацетонитрил/вода=7/3),
получая
таким образом 2,56 г указанного в заголовке соединения.
Температура плавления: 240-243oС.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 1/2): значение Rf=0,21.
(5b) Гидрохлорид 5-{ 4-[6-(2-хлор-4-гидрокси-3,5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,
4-диона
Используя 2,54 г 5-{4-[6-(2-хлор-4-гидрокси-3,5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона и 50 мл 4 н. раствора хлорводородная
кислота/этилацетат, взаимодействие и очистку осуществляли способом, аналогичным описанному в примере (2-2b), получая таким образом 2,67 г указанного в заголовке соединения.
Температура плавления: 174-176oС.
Пример 6
5-{ 4-[6-(Пиридин-2-илокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион (Иллюстративное соединение
1-821)
(6-1) трет-Бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(пиридин-2-илокси)фенил}-N-метилкарбамат
Смесь 0,34 г трет-бутил
N-[2-нитро-5-(пиридин-2-илокси)фенил]-N-метилкарбамата, 50 мг 10% палладия на угле и 10 мл метанола интенсивно перемешивали при комнатной температуре в течение 90 минут в атмосфере водорода. Затем из
реакционной смеси отфильтровывали катализатор и растворитель отгоняли при пониженном давлении. Остаток растворяли в 10 мл безводного тетрагидрофурана. К полученному раствору добавляли 0,34 г 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты, 0,20 г диэтилцианофосфоната и 0,12 г триэтиламина и полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь
концентрировали упариванием. К концентрату добавляли воду с последующей экстракцией этилацетатом. Экстракт сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении.
Остаток
очищали хроматографией на колонке с силикагелем (элюирующий растворитель: н-гексан/этилацетат=1/2), получая таким образом 0,37 г целевого соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 1/2): значение Rf=0,36.
(6-2) 5-{ 4-[6-(Пиридин-2-илокси)-1-метил-1H-бензимидазол-2-илметокси]
бензил}тиазолидин-2,
4-дион
Используя 0,37 г трет-бутил N-{ 2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(пиридин-2-илокси)фенил}-N-метилкарбамата и 20 мл 4 н. раствора
хлорводородная
кислота/диоксан, осуществляли взаимодействие и очистку способом, аналогичным описанному в примере (2-2а), получая таким образом 0,20 г указанного в заголовке соединения.
Температура плавления: 200-210oС.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: этилацетат): значение Rf=0,28.
Пример
7
1/2 Гидрохлорид
и гидрохлорид 5-{4-[6-(3,5-ди-трет-бутил-4-гидроксифенилтио)-1-метил-1H-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (Иллюстративное соединение 1-595)
(7-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(3,5-ди-трет-бутил-4-гидроксифенилтио)фенил} -N-метилкарбамат
Смесь 359 мг трет-бутил N-[2-нитро-5-(3,
5-ди-трет-бутил-4-гидроксифенилтио)фенил]-N-метилкарбамата, 360 мг 10% палладия на угле и 50 мл метанола интенсивно перемешивали при комнатной температуре в течение 9 часов в атмосфере водорода.
Затем
из реакционной смеси отфильтровывали катализатор и растворитель отгоняли при пониженном давлении. Остаток растворяли в 20 мл безводного тетрагидрофурана. К полученному раствору добавляли 248 мг
4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты, 144 мг диэтилцианофосфоната и 89 мг триэтиламина. Полученную смесь оставляли при комнатной температуре на 15 часов. Реакционную смесь
концентрировали упариванием. К концентрату добавляли воду с последующей экстракцией этилацетатом. Экстракт сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении.
Остаток
очищали хроматографией на колонке с силикагелем (элюирующий растворитель: н-гексан/этилацетат= 3/2), получая таким образом 275 мг целевого соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 1/1): значение Rf=0,44.
(7-2а) 1/2 Гидрохлорид 5-{4-[6-(3,
5-ди-трет-бутил-4-гидроксифенилтио)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
259 мг трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(3,
5-ди-трет-бутил-4-гидрокси-фенилтио)фенил}-N-метилкарбамата растворяли в 10 мл 4 н. раствора хлорводородная кислота/диоксан. Полученный раствор оставляли при комнатной температуре на 18 часов.
Реакционную смесь упаривали досуха при пониженном давлении. После добавления эфира нерастворимое вещество собирали фильтрованием и промывали эфиром. Полученное твердое вещество очищали тонкослойной
хроматографией с обращенной фазой (проявляющий растворитель: ацетонитрил/вода=5/1), получая таким образом 115 мг указанного в заголовке соединения.
Температура плавления: 120-123oС.
(7-2b) Гидрохлорид 5-{4-[6-(3,5-ди-трет-бутил-4- гидроксифенилтио)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Используя 2,29 г 5-{4-[6-(3,
5-ди-трет-бутил-4-гидроксифенилтио)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона и 4 н. раствор хлорводородная кислота/этилацетат, осуществляли взаимодействие и очистку способом,
аналогичным описанному в примере (2-2b), получая таким образом 1,25 г указанного в заголовке соединения.
Температура плавления: 144-146oС.
Пример 8
5-{ 4-[6-(4-Амино-3,5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион и его дигидрохлорид (Иллюстративное соединение 1-739)
(8-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4-трет-бутоксикарбониламино-3,5-диметилфенокси)фенил}-N-метилкарбамат
Используя 1,56 г трет-бутил
N-[2-амино-5-(4-трет-бутоксикарбониламино-3,5-диметилфенокси)фенил} -N-метилкарбамата, 1,05 г 4-(2,4-диоксотиазолидин-5-илме-тил)феноксиуксусной кислоты, 0,61 г диэтилцианофосфоната, 0,38 г
триэтиламина и 30 мл безводного тетрагидрофурана, проводили взаимодействие и очистку способом, аналогичным описанному в примере (2-1), получая таким образом 1,89 г целевого соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 3/2): значение Rf=0,19.
(8-2а) 5-{4-[6-(4-Амино-3,
5-диметилфенокси)-1-метил-1Н-
бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион
Используя 1,88 г трет-бутил N-{ 2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]
-5-(4-трет-бутоксикарбониламино-3,
5-диметилфенокси)фенил} -N-метилкарбамата и 20 мл 4 н. раствора хлорводородная кислота/диоксан, осуществляли взаимодействие и очистку способом, аналогичным
описанному в примере (2-2а), получая таким
образом 0,26 г указанного в заголовке соединения.
Температура плавления: 209-211oС.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат=1/2): значение Rf=0,29.
(8-2b) Дигидрохлорид 5-{4-[6-(4-амино-3,
5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Используя 0,25 г 5-{4-[6-(4-амино-3,5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил}
тиазолидин-2,4-диона и 50 мл 4 н. раствора хлорводородная кислота/этилацетат, осуществляли
взаимодействие и очистку способом, аналогичным описанному в примере (2-2b), получая таким образом 0,25 г
указанного в заголовке соединения.
Температура плавления: 165-175o С.
Пример 9
Гидрохлорид 5-{ 4-[6-(4-ацетиламино-3,
5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона (Иллюстративное соединение 1-808)
Смесь 155 мг дигидрохлорида 5-{4-[6-(4-амино-3,
5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона, 36 мг уксусного ангидрида, 107 мг пиридина, 7,3 мг 4-(N,
N-диметиламино) пиридина и 5 мл безводного
тетрагидрофурана нагревали при кипении с обратным холодильником в течение 2 часов. Реакционную смесь концентрировали упариванием. К концентрату добавляли
воду с последующей экстракцией этилацетатом.
Экстракт сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. К остатку добавляли 10 мл 4 н. раствора хлорводородная
кислота/этилацетат с последующим перемешиванием
при комнатной температуре в течение 21 часа. Нерастворимый продукт отфильтровывали, затем промывали эфиром, получая таким образом 97 мг указанного в
заголовке соединения.
Температура размягчения: 160-165oС.
Пример 10
5-{ 4-(1-Метил-6-[2-(морфолин-4-ил)фенокси]
-1H-бензимидазол-2-илметокси)бензил}тиазолидин-2,4-дион и его дигидрохлорид
(Иллюстративное соединение 1-284)
(10-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-[2-(морфолин-4-ил)фенокси]фенил}-N-метилкарбамат
Используя 1,18 г
трет-бутил N-(2-aмино-5-[2-(морфолин-4-ил)фенокси]фенил}-N-метилкарбамата,
0,92 г 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты, 0,53 г диэтилцианофосфоната, 0,33 г триэтиламина и 30 мл
безводного тетрагирофурана, проводили взаимодействие и очистку способом,
аналогичным примеру (2-1), получая таким образом 1,47 г целевого соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 1/1): значение Rf=0,30.
(10-2а) 5-{
4-(1-Метил-6-[2-(морфолин-4-ил)фенокси]-1Н-бензимидазол-2-илметокси)бензил}тиазолидин-2,4-дион
Используя 1,45 г трет-бутил N-{ 2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]
-5-[2-(морфолин-4-ил)фенокси]фенил}-N-метилкарбамата и 20 мл 4 н. раствора хлорводородная кислота/диоксан, осуществляли взаимодействие и очистку
способом, аналогичным примеру (2-2а), получая таким
образом 0,94 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат=1/2): значение Rf=0,33.
(10-2b) Дигидрохлорид 5-{4-(1-метил-6-[2-(морфолин-4-ил)фенокси]-1Н-бензимидазол-2-илметокси)бензил}тиазолидин-2,4-диона
В смеси
30 мл концентрированной соляной кислоты и 30 мл 1,4-диоксана
растворяли 0,64 г 5-{4-(1-метил-6-[2-(морфолин-4-ил) фенокси]-1Н-бензимидазол-2-илметокси)бензил} тиазолидин-2,4-диона. Полученный раствор
перемешивали при комнатной температуре в течение 90 минут.
Реакционную смесь упаривали досуха с последующим добавлением эфира. Нерастворимый продукт отфильтровывали и промывали эфиром, получая таким
образом 0,71 г указанного в заголовке соединения.
Температура размягчения: 120-130oС.
Пример 11
Дигидрохлорид 5-{
4-(1-метил-6-[3-(морфолин-4-ил)фенокси]-1Н-бензимидазол-2-илметокси)бензил}
тиазолидин-2,4-диона (Иллюстративное соединение 1-292)
(11-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-[3-(морфолин-4-ил)фенокси]фенил }-N-метилкарбамат
Используя 1,18 г трет-бутил N-{2-aмино-5-[3-(морфолин-4-ил)фенокси]фенил}-N-метилкарбамата,
0,92 г 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты, 0,53 г диэтилцианофосфоната, 0,33 г
триэтиламина и 30 мл безводного тетрагирофурана, проводили взаимодействие и очистку способом,
аналогичным примеру (2-1), получая таким образом 1,48 г целевого соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 1/1): значение Rf=0,26.
(11-2) Дигидрохлорид
5-{4-(1-метил-6-[3-(морфолин-4-ил)фенокси]-1Н-бензимидазол-2-илметокси)бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]
-5-[3-(морфолин-4-ил)фенокси]фенил}-N-метилкарбамата и 20 мл 4 н. раствора хлорводородная кислота/диоксан перемешивали при комнатной температуре в
течение 3 часов. Реакционную смесь упаривали досуха
при пониженном давлении с последующим добавлением эфира. Нерастворимый продукт отфильтровывали и промывали эфиром, получая таким образом 1,27 г
указанного в заголовке соединения.
Температура размягчения: 150-160oС.
Пример 12
Дигидрохлорид 5-{ 4-(1-метил-6-[2-(пиперидин-4-ил)фенокси]
-1Н-бензимидазол-2-илметокси)бензил} тиазолидин-2,4-диона
(Иллюстративное соединение 1-241)
(12-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-[2-(пиперидин-1-ил)фенокси]фенил}-N-метилкарбамат
Взаимодействие
осуществляли способом, аналогичным описанному в примере (2-1) с
использованием трет-бутил N-{2-амино-5-[2-(пиперидин-1-ил)фенокси] фенил}-N-метилкарбамата (1,19 г), 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,93 г), диэтилцианофосфоната (0,54 г),
триэтиламина (0,33 г) и безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая целевой
продукт (1,80 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/1: Rf=0,39.
(12-2) Дигидрохлорид
5-{4-(1-метил-6-[2-(пиперидин-1-ил)фенокси]-1Н-бензимидазол-2-илметокси)бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-[2-(пиперидин-1-ил)фенокси]фенил}-N-метилкарбамата (1,80 г) и 4 н. раствора хлористый водород/диоксан (20 мл)
перемешивали при температуре
окружающей среды в течение 19 часов. Растворитель из реакционной смеси упаривали досуха. К остатку добавляли этилацетат и нерастворимый продукт собирали фильтрованием и
подвергали высокоэффективной
жидкостной хроматографии с обращенной фазой с использованием в качестве элюента смеси ацетонитрил/вода = 1/1 и затем обрабатывали 4 н. раствором хлористый
водород/этилацетат, получая указанное в
заголовке соединение (0,47 г).
Т.пл.: 151-154oС.
Пример 13
5-{4-[1-Метил-6-(пиридин-2-илтио)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,
4-дион и его дигидрохлорид (Иллюстративное соединение 1-823)
(13-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(пиридин-2-илтио)фенил}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с использованием
трет-бутил N-[2-амино-5-(пиридин-2-илтио)фенил]-N-метилкарбамата (0,78 г), 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (1,06 г), диэтилцианофосфоната (0,61 г), триэтиламина (0,38 г) и
безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая целевой
продукт (0,68 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/2: Rf=0,51.
(13-2) 5-{
4-[1-Метил-6-(пиридин-2-илтио)-1H-бензимидазол-2-илметокси] бензил}тиазолидин-2,4-дион
Способом, аналогичным описанному в
примере (2-2а), проводили реакцию с использованием трет-бутил
N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(пиридин-2-илтио)фенил}-N-метилкарбамата (0,63 г) и 4 н. раствора хлористый
водород/диоксан (20 мл) и реакционную смесь очищали, получая
указанное в заголовке соединение (0,20 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием этилацетата: Rf=0,26.
(13-2b) Дигидрохлорид
5-{4-[1-метил-6-(пиридин-2-илтио)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Способом, аналогичным описанному в
примере (2-2b), проводили реакцию с использованием 5-{
4-[1-метил-6-(пиридин-2-илтио) -1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (0,20 г) и 4 н. раствора хлористый водород/этилацетат
(50 мл) и реакционную смесь очищали, получая указанное
в заголовке соединение (0,21 г).
Т.пл.: 139-147oС.
Пример 14
5-{
4-(1-Метил-6-[2-(пирролидин-1-ил)фенокси]
-1H-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион (Иллюстративное соединение 1-199)
(14-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]
-5-[2-(пиррролидин-1-ил)фенокси] фенил }-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с
использованием трет-бутил
N-[2-амино-5-[2-(пиррролидин-1-ил)фенокси] фенил} -N-метилкарбамата (0,77 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,90 г), диэтилцианофосфоната (0,52
г), триэтиламина (0,32 г)
и безводного тетрагирофурана (30 мл), и реакционную смесь очищали, получая целевой продукт (1,26 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/1: Rf=0,40.
(14-2) 5-{4-(1-Метил-6-[2-(пирролидин-1-ил)фенокси]-1H-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион
Взаимодействие осуществляли
способом, аналогичным описанному в примере (2-2а), с использованием трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-[2-(пиррролидин-1-ил)фенокси]фенил}-N-метилкарбамата (1,25
г) и 4 н. раствора хлористый водород/диоксан (25 мл) и реакционную смесь очищали, получая
указанное в заголовке соединение (0,94 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/2: Rf=0,27.
Пример
15
Гидрохлорид 5-{
4-[6-(2-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона (Иллюстративное соединение 1-11)
(15-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(2-гидроксифенокси)фенил}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с использованием
трет-бутил N-[2-амино-5-(2-гидроксифенокси)фенил}-N-метилкарбамата (0,99 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,93 г), диэтилцианофосфоната (0,54 г), триэтиламина (0,33 г) и
безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая целевой продукт (1,18 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 2/3: Rf=0,47.
(15-2) Гидрохлорид 5-{ 4-[6-(2-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Способом, аналогичным
описанному в примере (2-2а), проводили реакцию с использованием трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(2-гидроксифенокси)фенил} -N-мeтилкарбамата (1/16 г) и 4 н.
раствора хлористый водород/диоксан (20 мл), и реакционную смесь очищали, а затем способом, аналогичным описанному в примере (2-2b), продукт подвергали взаимодействию с 4 н. раствором хлористый
водород/этилацетат (20 мл) и очищали, получая указанное в заголовке соединение (0,79 г).
Т.пл.: 155-165oС.
Пример 16
Гидрохлорид 5-{
4-(6-[4-(1-адамантил)фенокси]-1-метил-1Н-бензимидазол-2-илметокси)бензил}тиазолидин-2,4-диона (Иллюстративное соединение 1-1182)
(16-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-[4-(1-адамантил)фенокси]фенил}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с
использованием трет-бутил N-{2-амино-5-[4-(1-адамантил)фенокси] фенил}-N-метилкарбамата (1, 34 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,93 г), диэтилцианофосфоната (0,54 г),
триэтиламина (0,33 г) и безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая целевой продукт (1,83 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/1: Rf=0,29.
(16-2) Гидрохлорид 5-{ 4-(6-[4-(1-адамантил)фенокси]-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-[4-(1-адамантил)фенокси] фенил} -N-метилкарбамата (1,82 г) и 4 н. хлористого водорода/диоксана (20 мл) перемешивали при
температуре окружающей среды в течение 29 часов. Растворитель из реакционной смеси упаривали досуха и к остатку добавляли эфир, нерастворимый продукт отфильтровывали и промывали эфиром, получая
указанное в заголовке соединение (1,35 г).
Т.пл.: 160-165oС.
Пример 17
5-{ 4-[6-(3-Диметиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси]
бензил}тиазолидин-2,4-дион (Иллюстративное соединение 1-153)
(17-1) трет-Бутил N-{ 5-(3-диметиламинофенокси)-2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]фенил}-N-метил-карбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с использованием трет-бутил
N-[2-амино-5-(3-диметиламинофенокси)фенил] -N-метилкарбамата (1,00 г), 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (1,57 г), диэтилцианофосфоната (0,91 г), триэтиламина (0,57 г) и
безводного тетрагирофурана (40 мл), и реакционную смесь очищали, получая целевой
продукт (1,69 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/1: Rf=0,26.
(17-2) 5-{
4-[6-(3-Диметиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион
Взаимодействие осуществляли
способом, аналогичным описанному в примере (2-2а), с использованием
трет-бутил N-{ 5-(3-диметиламинофенокси)-2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] фенил} -N-метилкарбамата (1,68 г)
и 4 н. раствора хлористый водород/диоксан (30 мл) и реакционную
смесь очищали, получая указанное в заголовке соединение (0,57 г). Т.пл.: 180-186oС.
Пример 18
Дигидрохлорид 5-{
4-[1-Метил-6-(пиридин-3-илокси)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона (Иллюстративное соединение 1-938)
(18-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(пиридин-3-илокси)фенил}-N-метил-карбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с использованием
трет-бутил N-[2-амино-5-(пиридин-3-илокси)фенил]-N-метилкарбамата (0,63 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,62 г), диэтилцианофосфоната (0,36 г), триэтиламина (0,22 г) и
безводного тетрагирофурана (15 мл), и реакционную смесь очищали, получая целевой продукт (0,88 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси
н-гексан/этилацетат = 1/2: Rf=0,38
(18-2) Дигидрохлорид 5-{ 4-[1-Метил-6-(пиридин-3-илокси)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(пиридин-3-илокси)фенил}-N-метилкарбамата (0,87 г) и 4 н. раствора хлористый водород/диоксан (15 мл) перемешивали при температуре окружающей среды в
течение 4,5 часов и оставляли на 9 суток при температуре окружающей среды. Нерастворимый продукт собирали фильтрованием и промывали этилацетатом, получая указанное в заголовке соединение (0,77 г).
Т.пл.: 146-156oС.
Пример 19
Дигидрохлорид 5-{ 4-(6-[4-(имидазол-1-ил)фенокси]-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона
(Иллюстративное соединение 1-1126)
(19-1) трет-Бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-[4-(имидазол-1-ил)фенокси]фенил}-N-метилкарбамат
Взаимодействие
осуществляли способом, аналогичным описанному в примере (2-1), с использованием трет-бутил N-{2-амино-5-[4-(имидазол-1-ил)фенокси] фенил}-N-метилкарбамата (1,14 г), 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,93 г), диэтилцианофосфоната (0,54 г), триэтиламина (0,33 г) и безводного тетрагирофурана (30 мл), и реакционную смесь очищали, получая целевой
продукт (1,75 г).
Тонкослойная хроматография на пластинке с силикагелем с
использованием смеси этилацетат/метанол = 10/1: Rf=0,51
(19-2) Дигидрохлорид
5-{4-(6-[4-(имидазол-1-ил)фенокси]-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]
-5-[4-(имидазол-1-ил)фенокси]фенил}-N-метилкарбамата (1,75 г) и 4 н. раствора хлористый водород/диоксан (20 мл) перемешивали при температуре окружающей среды в течение 19 часов. Растворитель из
реакционной смеси упаривали досуха. К остатку добавляли этилацетат и нерастворимый продукт собирали фильтрованием. Продукт очищали высокоэффективной жидкостной хроматографией с обращенной фазой с
использованием в качестве элюента смесь ацетонитрил/вода = 7/13 и обрабатывали 4 н. раствором хлористый водород/ацетат, получая указанное в заголовке соединение (0,20 г).
Т.пл.: 183-186oС.
Пример 20
Гидрохлорид 5-{ 4-[1-метил-6-(2-фенилфенокси)-1H-бензими-дазол-2-илметокси]бензил}тиазолидин-2,4-диона (Иллюстративное соединение 1-1327)
(20-1) трет-Бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(2-фенилфенокси)фенил}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в
примере (2-1), с использованием трет-бутил N-[2-амино-5-(2-фенилфенокси)фенил]-N-метилкарбамата (1,60 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (1,26 г), диэтилцианофосфоната (0,
73
г), триэтиламина (0,45 г) и безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая целевой продукт (2,33 г).
Тонкослойная хроматография на пластинке с
силикагелем с
использованием смеси н-гексан/этилацетат = 3/2: Rf=0,25
(20-2) Гидрохлорид 5-{4-[1-метил-6-(2-фенилфенокси)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил
N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(2-фенилфенокси)фенил}-N-метилкарбамата (2,33 г) и 4 н. раствора хлористый водород/диоксан (20 мл) перемешивали при
температуре окружающей
среды в течение 20 часов. Растворитель из реакционной смеси упаривали досуха. К остатку добавляли этилацетат и нерастворимый продукт собирали фильтрованием и промывали
этилацетатом, получая указанное
в заголовке соединение (1,87 г).
Т.пл.: 142-152oС.
Пример 21
Гидрохлорид 5-{ 4-[6-(4-гидрокси-2,
3-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (Иллюстративное соединение 1-506)
(21-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4-гидрокси-2,3-диметилфенокси)фенил}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с
использованием трет-бутил N-[2-амино-5-(4-гидрокси-2,3-диметилфенокси)фенил] -N-метилкарбамата (1,60 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (1,38 г), диэтилцианофосфоната (0,80
г), триэтиламина (0,50 г) и безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая целевой продукт (2,35 г).
Тонкослойная хроматография на пластинке с силикагелем с
использованием смеси н-гексан/этилацетат = 1/2: Rf=0,54
(21-2) Гидрохлорид 5-{4-[6-(4-гидрокси-2,3-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4-гидрокси-2,3-диметилфенокси)фенил}-N-метилкарбамата (2,35 г) и 4 н. раствора хлористый водород/диоксан (20 мл)
перемешивали при температуре окружающей среды в течение 44 часов. Растворитель из реакционной смеси упаривали досуха. К остатку добавляли этилацетат и нерастворимый продукт собирали фильтрованием и
промывали этилацетатом, получая указанное в заголовке соединение (1,82 г).
Т.пл.: 168-170oС.
Пример 22
Гидрохлорид 5-{
4-[1-метил-6-(4-феноксифенокси)-1H-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
(Иллюстративное соединение 1-193)
(22-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-феноксифенокси)фенил}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с использованием
трет-бутил N-[2-амино-5-(4-феноксифенокси)фенил]-N-метилкарбамата (1,66 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (1,26 г), диэтилцианофосфоната (0,73 г), триэтиламина (0,45 г) и
безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая целевой продукт (1,99 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси
н-гексан/этилацетат = 1/2: Rf=0,62
(22-2) Гидрохлорид 5-{4-[1-метил-6-(4-феноксифенокси)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-феноксифенокси)фенил}-N-метилкарбамата (1,99 г) и 4 н. раствора хлористый водород/диоксан (20 мл) перемешивали при температуре окружающей среды в
течение 22 часов. Растворитель из реакционной смеси упаривали досуха. К остатку добавляли этилацетат и нерастворимый продукт собирали фильтрованием и промывали этилацетатом, получая указанное в
заголовке соединение (1,57 г).
Т.пл.: 190-200oС.
Пример 23
5-{4-[6-(4-Гидроксифенилтио)-1-метил-1Н-бензимидазол-2-илметокси]бензил} тиазолидин-2,
4-дион и его гидрохлорид (Иллюстративное соединение 1-72)
(23-2а) 5-{ 4-[6-(4-Гидроксифенилтио)-1-метил-1Н-бензими-дазол-2-илметокси]бензил}тиазолидин-2,4-дион
Способом, аналогичным
описанному в примере (2-1), проводили реакцию с использованием трет-бутил N-[2-амино-5-(4-гидроксифенилтио)фенил]-N-метилкарбамата (2,36 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты
(2,87 г), диэтилцианофосфоната (1,67 г), триэтиламина (1,03 г) и безводного тетрагирофурана (60 мл), и реакционную смесь очищали. Затем, способом, аналогичным описанному в примере (2-2а),
осуществляли
взаимодействие с использованием вышеуказанного продукта и 4 н. раствора хлористый водород/диоксан (20 мл) и реакционную смесь очищали, получая целевой продукт (0,72 г).
Тонкослойная
хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/2: Rf=0,19
(23-2b) Гидрохлорид
5-{4-[6-(4-Гидроксифенилтио)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Способом, аналогичным описанному в примере (2-2b) осуществляли взаимодействие с использованием
5-{4-[6-(4-гидроксифенилтио)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (0,72 г) и 4 н. раствора хлористый водород/этилацетат (40 мл) и реакционную смесь очищали, получая
указанное в заголовке соединение (0,63 г).
Т.пл.: 204-207oС.
Пример 24
Гидрохлорид 5-{
4-[1-метил-6-(3-фенилфенокси)-1H-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона (Иллюстративное соединение 1-168)
(24-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(3-фенилфенокси)фенил}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с использованием
трет-бутил N-[2-амино-5-(3-фенилфенокси)фенил]-N-метилкарбамата (1/60 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (1,26 г), диэтилцианофосфоната (0,73 г), триэтиламина (0,45 г) и
безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая целевой продукт (2,57 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси
н-гексан/этилацетат = 1/1: Rf=0,32
(24-2) Гидрохлорид 5-{4-[1-метил-6-(3-фенилфенокси)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(3-фенилфенокси)фенил}-N-метилкарбамата (2,57 г) и 4 н. раствора хлористый водород/диоксан (30 мл) перемешивали при комнатной температуре в течение
63 часов. Растворитель из реакционной смеси упаривали досуха, к остатку добавляли этилацетат, и нерастворимый продукт выделяли фильтрованием и промывали этилацетатом, получая указанное в заголовке
соединение (2,01 г).
Т.пл.: 150-160oС
Пример 25
Гидрохлорид 5-{ 4-[6-(3-трет-бутил-4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил}
тиазолидин-2,4-диона (Иллюстративное соединение 1-501)
(25-1) трет-Бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(3-трет-бутил-4-гидроксифенокси)фенил
}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с использованием трет-бутил N-[2-амино-5-(3-трет-бутил-4-гидроксифенокси)фенил]
-N-метилкарбамата (1,11 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,89 г), диэтилцианофосфоната (0,52 г), триэтиламина (0,32 г) и безводного тетрагирофурана (20 мл), и
реакционную
смесь очищали, получая целевой продукт (1,75 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/1: Rf=0,26
(25-2)
Гидрохлорид 5-{4-[6-(3-трет-бутил-4-гидроксифенок-си)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]
-5-(3-трет-бутил-4-гидроксифенокси)фенил}-N-метилкарбамата (1,75 г) и 4 н. раствора хлористый водород/диоксан (20 мл) перемешивали при комнатной
температуре в течение 14 часов. Растворитель из
реакционной смеси упаривали досуха, к остатку добавляли этилацетат и нерастворимый продукт выделяли фильтрованием и промывали этилацетатом, получая
указанное в заголовке соединение (1,11 г).
Т.пл.: 160-170oС.
Пример 26
Гидрохлорид 5-{
4-[6-(2-трет-бутил-4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона
(Иллюстративное соединение 1-499)
(26-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(2-трет-бутил-4-гидроксифенокси)фенил}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с
использованием трет-бутил N-[2-амино-5- (2-трет-бутил-4-гидроксифенокси)фенил] -N-метилкарбамата (0,95 г), 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,76 г), диэтилцианофосфоната (0,
44 г), триэтиламина (0,27 г) и безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая целевой
продукт (1,24 г).
Тонкослойная хроматография на пластинке с
силикагелем с использованием смеси н-гексан/этилацетат = 1/1: Rf=0,19
(26-2) Гидрохлорид 5-{
4-[6-(2-трет-бутил-4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,
4-диона
Смесь трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]
-5-(2-трет-бутил-4-гидроксифенокси)фенил}-N-метилкарбамата (1,24 г) и 4 н. раствора хлористый
водород/диоксан (20 мл) перемешивали при комнатной температуре в течение 14 часов. Растворитель из
реакционной смеси упаривали досуха, к остатку добавляли этилацетат, и нерастворимый продукт выделяли
фильтрованием и промывали этилацетатом, получая указанное в заголовке соединение (0,75 г).
Т.пл.: 167-172oС.
Пример 27
Гидрохлорид 5-{
4-[1-метил-6-(4-фенилфенокси)-1H-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона (Иллюстративное
соединение 1-169)
(27-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-фенилфенокси)фенил}-N-метилкарбамат
Взаимодействие осуществляли способом,
аналогичным описанному в примере (2-1), с использованием
трет-бутил N-[2-амино-5-(4-фенилфенокси)фенил]-N-метилкарбамата (1,60 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (1,26 г),
диэтилцианофосфоната (0,73 г), триэтиламина (0,45 г) и
безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая целевой продукт (2,39 г).
Тонкослойная хроматография на
пластинке с силикагелем с использованием смеси
н-гексан/этилацетат = 1/1: Rf=0,32
(27-2) Гидрохлорид 5-{4-[1-метил-6-(4-фенилфенокси)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,
4-диона
Смесь трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-фенилфенокси)фенил}-N-метилкарбамата (2,39 г) и 4 н. раствора хлористый водород/диоксан (20 мл)
перемешивали при комнатной температуре в течение
21 часа. Растворитель из реакционной смеси упаривали досуха, к остатку добавляли этилацетат, и нерастворимый продукт выделяли фильтрованием и промывали
этилацетатом, получая указанное в заголовке
соединение (1,90 г).
Т.пл.: 170-180oС.
Пример 28
Гидрохлорид 5-{ 4-[6-(4-гидрокси-2,
5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]
бензил} тиазолидин-2,4-диона (Иллюстративное соединение 1-513)
(28-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4-гидрокси-2,5-диметилфенокси)фенил
}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с
использованием трет-бутил N-[2-амино-5-(4-гидрокси-2,5-диметилфенокси)фенил]
-N-метилкарбамата (0,54 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,51 г), диэтилцианофосфоната (0,29
г), триэтиламина (0,18 г) и безводного тетрагирофурана (10 мл), и
реакционную смесь очищали, получая целевой продукт (0,71 г).
Тонкослойная хроматография на пластинке с силикагелем с
использованием смеси н-гексан/этилацетат = 1/2: Rf=0,68
(28-2) Гидрохлорид 5-{4-[6-(4-гидрокси-2,5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{ 2-[4-(2,4-диоксотиазолидин-5-илметил)
феноксиацетиламино] -5- (4-гидрокси-2,5-диметилфенокси) фенил}-N-метилкарбамата (0,71 г) и 4 н. раствора хлористый водород/диоксан (10 мл)
перемешивали при комнатной температуре в течение 17 часов.
Растворитель из реакционной смеси упаривали досуха. К остатку добавляли этилацетат, и нерастворимый продукт выделяли фильтрованием и
подвергали высокоэффективной жидкостной хроматографии с обращенной
фазой с использованием смеси ацетонитрил/вода=9/11 в качестве элюента, а затем обрабатывали 4 н. раствором хлористый
водород/этилацетат, получая указанное в заголовке соединение (0,41 г).
Т.пл.: 170-171oС.
Пример 29
Гидрохлорид 5-{ 4-[6-(3,
5-ди-трет-бутил-4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,
4-диона (Иллюстративное соединение 1-593)
(29-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(3,5-ди-трет-бутил-4-гидроксифенокси)фенил} -N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1),
с использованием трет-бутил N-[2-амино-5-(3,5-ди-трет-бутил-4-гидроксифенокси)фенил] -N-метил-карбамата (0,55 г),
4-(2,4-диоксотиазолидин-5-илметил)фен-оксиуксусной кислоты (0,42 г),
диэтилцианофосфоната (0,24 г), триэтиламина (0,15 г) и безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая
целевой продукт (0,72 г).
Тонкослойная хроматография на
пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/2: Rf=0,68
(29-2) Гидрохлорид 5-{4-[6-(3,
5-ди-трет-бутил-4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазоли-дин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(3,
5-ди-трет-бутил-4-гидрокси-фенокси)фенил }-N-метилкарбамата (0,72 г) и 4 н. раствора хлористый водород/диоксан (20 мл) перемешивали при комнатной температуре в течение 17 часов. Растворитель из
реакционной смеси упаривали досуха. К остатку добавляли этилацетат и нерастворимый продукт выделяли фильтрованием и промывали этилацетатом, получая указанное в заголовке соединение (0,41 г).
Т.пл.: 173-178oС.
Пример 30
Гидрохлорид 5-{ 4-[6-(4'-гидроксибифенил-4-илокси)-1-метил-1H-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона
(Иллюстративное соединение 1-171)
(30-1) трет-Бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4'-гидроксибифенил-4-илокси)фенил }-N-метилкарбамат
Смесь
трет-бутил N-[2-амино-5-(4'-гидроксибифенил-1-илокси)фенил]-N-метилкарбамата (0,61 г), 4-(2, 4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,51 г), диэтилцианофосфоната (0,29 г), триэтиламина
(0,18 г) и безводного тетрагирофурана (10 мл) перемешивали при температуре окружающей среды в течение 2 дней. Реакционную смесь концентрировали, и остаток распределяли между этилацетатом и водой.
Этилацетатный слой сушили над безводным сульфатом натрия. Этилацетат отгоняли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем с использованием в качестве элюента
смеси н-гексан/этилацетат=1/1, получая целевой продукт.
(30-2) Гидрохлорид 5-{ 4-[6-(4'-гидроксибифенил-4-илокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетил-амино] -5-(4'-гидроксибифенил-4-илокси)фенил} -N-метилкарбамата (2,39 г) в 4 н. растворе хлористый водород/диоксан (20 мл)
оставляли при комнатной температуре на 4 дня. Растворитель из реакционной смеси упаривали досуха. К остатку добавляли этилацетат, и нерастворимый продукт выделяли фильтрованием и промывали
этилацетатом, получая указанное в заголовке соединение (0,23 г).
Т.пл.: 160-163oС.
Пример 31
Гидрохлорид 5-{
4-[6-(4-гидрокси-2-метилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (Иллюстративное соединение 1-481) и гидрохлорид
5-{4-[6-(4-гидрокси-3-метилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (Иллюстративное соединение 1-486)
(31-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-гидрокси-2-метилфенокси)фенил}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с
использованием трет-бутил N-[2-амино-5-(4-гидрокси-2-метилфенокси)фенил] -N-метилкарбамата и N-[2-амино-5-(4-гидрокси-3-метилфенокси)фенил] -N-метилкарбамата (1,88 г), 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (1,69 г), диэтилцианофосфоната (0,98 г), триэтиламина (0,61 г) и безводного тетрагирофурана (20 мл), и реакционную смесь очищали, получая целевой
продукт (1,57 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/2: Rf=0,53
(31-2а) Гидрохлорид
5-{4-[6-(4-гидрокси-2-метилфенокси)- 1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона и
(31-2b) Гидрохлорид 5-{
4-[6-(4-гидрокси-3-метилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-гидрокси-2-метилфенокси)фенил}-N-метилкарбамата и трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетил-амино]-5-(4-гидрокси-3-метилфенокси)фенил} -N-метилкарбамата (1,57 г) и 4 н. раствора хлористый водород/диоксан (20 мл) перемешивали при комнатной
температуре в течение 66 часов. Растворитель из реакционной смеси упаривали досуха. К остатку добавляли этилацетат и нерастворимый продукт (1,24 г) выделяли фильтрованием и очищали высокоэффективной
жидкостной хроматографией с обратимой фазой с использованием смеси ацетонитрил/вода, содержащей уксусную кислоту (0,2%) и триэтиламин (0,2%),=2/3, а затем обрабатывали 4 н. раствором хлористый
водород/этилацетат, получая гидрохлорид 5-{4-[6-(4-гидрокси-2-метилфенокси)-1-метил-1Н-бензимидазол-2-илметок-си] бензил} тиазолидин-2,4-диона (50 мг; т.пл. 165-168oС) и гидрохлорид
5-{4-[6-(4-гидрокси-3-метилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (183 мг; т.пл. 165-168oС).
Пример 32
5-[4-{ 6-[4-(3,
5-Ди-трет-бутил-4-гидроксибензоиламино)фенокси]-1-метил-1Н-бензимидазол-2-илметокси} бензил] тиазолидин- 2,4-диона (Иллюстративное соединение 1-1269)
К раствору гидрохлорида
5-{4-[6-(4-аминофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил}тиазолидин-2,4-диона (400 мг), циклопентанкарбоновой кислоты (204 мг) и триэтиламина (304 мг) в диметилформамиде (8 мл) добавляли
гидрохлорид 1-этил-3-(3'-диметиламинопропил)карбодиимида (287 мг). Смесь перемешивали при температуре окружающей среды в течение 1 часа и оставляли на 2 ночи. Реакционную смесь концентрировали, и
остаток распределяли между этилацетатом и водой. Этилацетатный слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и этилацетат выпаривали. Остаток
очищали хроматографией на колонке с силикагелем с использованием смеси н-гексан/этилацетат = 1/2 - 1/3 в качестве элюента, получая остаток. Остаток перекристаллизовывали из смеси н-гексан/этилацетат
=
1/3, получая целевое соединение (176 мг).
Т.пл.: 159,8-162,0oС.
Пример 33
Гидрохлорид 5-{
4-[6-(4-бензил-3-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (Иллюстративное соединение 1-1230)
(33-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-бензил-3-гидроксифенокси)фенил}-N-метилкарбамат и трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-гидрокси-3-метилфенокси)фенил}-N-метилкарбамат
Взаимодействие осуществляли способом, аналогичным описанному в примере (2-1), с
использованием трет-бутил N-[2-амино-5-(4-бензил-3-гидроксифенокси)фенил] -N-метилкарбамата (1,8 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (1,16 г), диэтилцианофосфоната (0,99 г),
триэтиламина (0,76 г) и безводного тетрагирофурана (30 мл), и реакционную смесь очищали, получая целевой продукт (1,5 г).
Тонкослойная хроматография на пластинке с силикагелем с
использованием смеси н-гексан/этилацетат = 1/1: Rf=0,32
(33-2) Гидрохлорид 5-{ 4-[6-(4-бензил-3-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь
трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-бензил-3-гидроксифенокси)фенил}-N-метилкарбамата (1,4 г) в 4 н. растворе хлористый водород/диоксан (20 мл)
перемешивали при
температуре окружающей среды в течение 3 дней. При добавлении этилацетата и н-гексана образовыался нерастворимый продукт, который выделяли фильтрованием, получая указанное в
заголовке соединение (1,5
г).
Т.пл.: 205-219oС.
Пример 34
5-{ 4-[1-Метил-6-(4-метилтиофенокси)-1Н-бензимидазол-2-илметокси]бензил} тиазолидин-2,
4-дион и его гидрохлорид
(Иллюстративное соединение 1-136)
(34-1) трет-Бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-метилтиофенокси)фенил}-N-метилкарбамат
Взаимодействие
осуществляли способом, аналогичным описанному в примере (2-1), с использованием трет-бутил N-[2-амино-5-(4-метилтиофенокси)фенил]-N-метилкарбамата (1,93 г), 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (3,01 г), диэтилцианофосфоната (1,75 г), триэтиламина (1,08 г) и безводного тетрагирофурана (80 мл), и реакционную смесь очищали, получая целевой
продукт (2,96 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 7/3: Rf=0,11
(34-2а)
5-{4-[1-Метил-6-(4-метилтиофенокси)-1H-бензимидазол-2-илметокси] бензил}тиазолидин-2,4-дион
Аналогично описанному в примере (2-2а) осуществляли взаимодействие с использованием трет-бутил
N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4-метилтиофенокси)фенил} -N-метилкарбамата (2,95 г) и 4 н. раствора хлористый водород/диоксан (60 мл), и реакционную смесь очищали,
получая указанное в заголовке соединение (2,15 г).
Т.пл.: 199-200oС.
(34-2b) Гидрохлорид 5-{
4-[1-метил-6-(4-метилтиофенокси)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Реакцию проводили способом, аналогичным описанному в примере (2-2b), с использованием 5-{
4-[1-метил-6-(4-метилтиофенокси) -1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (1,15 г) и 4 н. раствора хлористый водород/этилацетат (20 мл), и реакционную смесь очищали, получая
указанное в заголовке соединение (1,06 г).
Т.пл.: 137-147oС.
Пример 35
5-{ 4-[1-Метил-6-(4-метоксифенокси)-1Н-бензимидазол-2-ил-метокси]бензил}
тиазолидин-2,4-дион и его гидрохлорид (Иллюстративное соединение 1-132)
(35-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-метоксифенокси)фенил}-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в примере (2-1), с использованием трет-бутил
N-[2-амино-5-(4-метоксифенокси)фенил]-N-метилкарбамата (2,0 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (2,0 г), диэтилцианофосфоната (1,3 г), триэтиламина (0,81 г) и безводного
тетрагирофурана (50 мл), и реакционную смесь очищали, получая целевой продукт (3,3 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси
н-гексан/этилацетат
= 1/1: Rf=0,61
(35-2а) 5-{4-[1-Метил-6-(4-метоксифенокси)-1H-бензимидазол-2-илметокси] бензил}тиазолидин-2,4-дион
Раствор трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-метоксифенокси)фенил}-N-метилкарбамата (3,28 г) в трифторуксусной кислоте (50 мл) перемешивали при 65oС в течение 8 часов и оставляли
на 1 ночь при температуре окружающей среды. Реакционную смесь концентрировали, и к остатку добавляли воду и нейтрализовали водным раствором бикарбоната натрия. Смесь экстрагировали этилацетатом.
Этилацетатный слой промывали насыщенным водным
раствором хлорида натрия и сушили над безводным сульфатом натрия, а затем упаривали. При добавлении смеси эфир/этилацетат =1/1 к остатку
образовывались кристаллы, и их выделяли фильтрованием, получая указанное в заголовке соединение (1,91 г).
Т.пл: 122-126oС.
(35-2b) Гидрохлорид 5-{
4-[1-метил-6-(4-метоксифенокси)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Реакцию проводили способом, аналогичным описанному в примере (2-2b), с использованием 5-{
4-[1-метил-6-(4-метоксифенокси)-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона (1,8 г) и 4 н. раствора хлористый водород/этилацетат (50 мл), и реакционную смесь очищали, получая указанное в
заголовке соединение (1,85 г).
Т.пл: 148-151oС.
Пример 36
5-{
4-[1-Метил-6-(4-трифторметилфенокси)-1H-бензимидазол-2-илметокси]бензил}тиазолидин-2,
4-дион и его гидрохлорид (Иллюстративное соединение 1-131)
(36-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илме-тил)феноксиацетиламино]-5-(4-трифторметилфенокси)фенил}-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в примере (2-1), с использованием
трет-бутил N-[2-амино-5-(4-трифторметилфенокси)фенил]-N-метилкарбамата (0,68 г), 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,73 г), диэтилцианофосфоната (0,49 г), триэтиламина (0,3
г) и безводного тетрагирофурана (50 мл), и реакционную смесь очищали, получая целевой
продукт (0,97 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси
н-гексан/этилацетат = 2/1: Rf=0,23
(36-2а) 5-{
4-[1-Метил-6-(4-трифторметилфенокси)-1H-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион
Раствор трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]
-5-(4-трифторметилфенокси)фенил} -N-метилкарбамата (0,95 г) в трифторуксусной кислоте (20 мл) перемешивали при 60oС в течение 3 часов и
оставляли на ночь при температуре окружающей среды.
Реакционную смесь концентрировали, и к остатку добавляли воду и нейтрализовали водным раствором бикарбоната натрия (5%). Смесь экстрагировали
этилацетатом. Этилацетатный слой промывали насыщенным
водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем упаривали. Остаток очищали хроматографией на колонке с силикагелем
с использованием в качестве элюента
н-гексан/этилацетат =1/2, получая указанное в заголовке соединение (0,60 г).
Тонкослойная хроматография на пластинке с силикагелем с
использованием смеси н-гексан/этилацетат = 1/1:
Rf=0,29
(36-2b) Гидрохлорид 5-{4-[1-метил-6-(4-трифторметилфенокси) -1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Реакцию
проводили способом, аналогичным описанному в
примере (2-2b), с использованием 5-{ 4-[1-метил-6-(4-трифторметилфенокси)-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (0,58 г) и 4 н.
раствора хлористый водород/этилацетат (20 мл), и
реакционную смесь очищали, получая указанное в заголовке соединение (0,55 г).
Т.пл: 145-147oС.
Пример
37
Гидрохлорид 5-{
4-[6-(4-бензилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона (Иллюстративное соединение 1-184)
(37-1) трет-Бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(4-бензилфенокси)фенил}-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в примере (2-1), с использованием трет-бутил
N-[2-амино-5-(4-бензилфенокси)фенил]-N-метилкарбамата (0,61 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,51 г), диэтилцианофосфоната (0,29 г), триэтиламина (0,18 г) и безводного
тетрагирофурана (10 мл), и реакционную смесь очищали, получая целевой продукт (0,91 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси
н-гексан/этилацетат = 1/1: Rf=0,26
(37-2) Гидрохлорид 5-{4-[6-(4-бензилфенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(4-бензилфенокси)фенил}-N-метилкарбамата (0,91 г) в 4 н. растворе хлористый водород/диоксан (10 мл) оставляли при температуре окружающей среды на 3
дня. Растворитель из реакционной смеси упаривали досуха. К остатку добавляли этилацетат, и нерастворимый продукт выделяли фильтрованием и промывали этилацетатом, получая указанное в заголовке
соединение (0,69 г).
Т.пл: 170-180oС.
Пример 38
Гидрохлорид 5-{ 4-[6-(3-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,
4-диона (Иллюстративное соединение 1-41)
(38-1) трет-Бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-(3-гидроксифенокси)фенил}-N-метилкарбамат
Реакцию проводили
способом, аналогичным описанному в примере (2-1), с использованием трет-бутил N-[2-амино-5-(3-гидроксифенокси)фенил]-N-метилкарбамата (0,95 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной
кислоты (0,89 г), диэтилцианофосфоната (0,52 г), триэтиламина (0,32 г) и безводного тетрагирофурана (30 мл), и реакционную смесь очищали, получая целевой продукт (1,18 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/1: Rf=0,28
(38-2) Гидрохлорид 5-{
4-[6-(3-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]
-5-(3-гидроксифенокси)фенил} -N-метилкарбамата (1,18 г) в 4 н. растворе хлористый водород/диоксан (20 мл) оставляли при температуре окружающей среды на 18 часов. Растворитель из реакционной смеси
упаривали досуха. К остатку добавляли этилацетат, и смесь облучали ультразвуковыми волнами. Нерастворимый продукт выделяли фильтрованием и промывали этилацетатом, получая указанное в заголовке
соединение (0,86 г).
Т.пл: 192-195oС.
Пример 39
Гидрохлорид 5-[4-{ 6-[4-(тетразол-5-ил)фенокси] -1-метил-1Н-бензимидазол-2-илметокси} бензил]
тиазолидин-2,4-диона (Иллюстративное соединение 1-1154)
(39-1) трет-Бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино]-5-[4-(тетразол-5-ил)фенокси]фенил}-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в примере (2-1), с использованием трет-бутил N-{2-амино-5-[4-(тетразол-5-ил)фенокси]фенил]-N-метилкарбамата (0,69 г), 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,37 г), диэтилцианофосфоната (0,21 г), триэтиламина (0,13 г) и безводного тетрагирофурана (30 мл), и реакционную смесь очищали, получая целевой
продукт (0,76 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/1: Rf=0,49
(39-2) Гидрохлорид 5-[4-{
6-[4-(тетразол-5-ил)фенокси]-1-метил-1Н-бензимидазол-2-илметокси}бензил]тиазолидин-2,4-диона
Смесь трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил) феноксиацетиламино]
-5-[4-(тетразол-5-ил)фенокси]фенил}-N-метилкарбамата (0,76 г) в 4 н. растворе хлористый водород/диоксан (20 мл) перемешивали при температуре окружающей среды в течение 24 часов. Растворитель из
реакционной смеси упаривали. К остатку добавляли этилацетат и нерастворимый продукт выделяли фильтрованием и промывали этилацетатом, получая указанное в заголовке соединение (0,44 г).
Т.пл: 232-235oС.
Пример 40
Гидрохлорид 5-{ 4-[6-(4-цианофенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона (Иллюстративное соединение
1-1210)
Смесь 5-{ 4-[6-(4-цианофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} -3-трифенилметилтиазолидин-2,4-диона (0,69 г) и водного раствора уксусной кислоты (80%, 25 мл)
перемешивали при 70oС в течение 3 часов. Реакционную смесь концентрировали и к остатку добавляли водный раствор бикарбоната натрия (10%, 250 мл). Смесь перемешивали при температуре
окружающей среды в течение нескольких часов. Нерастворимый продукт выделяли фильтрованием и сушили на воздухе, получая 5-{4-[6-(4-цианофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил}
тиазолидин-2,4-дион. Смесь полученного продукта и 4 н. раствора хлористый водород/диоксан перемешивали при температуре окружающей среды в течение 2 часов. Нерастворимый продукт выделяли фильтрованием
и промывали этилацетатом, получая указанное в заголовке соединение (0,41 г).
Т.пл: 215-218oС.
Пример 41
Гидрохлорид
5-[4-(6-пентафторфенокси-1-метил-1Н-бензимидазол-2-илметокси)бензил]тиазолидин-2,4-диона (Иллюстративное соединение 1-1235)
(41-а)
5-[4-(6-Пентафторфенокси-1-метил-1H-бензимидазол-2-илметокси)бензил]тиазолидин-2,4-дион
Смесь 2-гидроксиметил-1-метил-6-пентафторфенокси-1Н-бензимидазола (1,17 г),
5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона (1,86 г), азодикарбонилдипиперидина (1,01 г), три-н-бутилфосфина (0,81 г) и толуола (50 мл) перемешивали при температуре окружающей среды в
течение 16 часов. Реакционную смесь подвергали хроматографии на колонке с силикагелем. Собирали фракцию, элюированную смесью н-гексан/этилацетат = 3/2, и растворитель упаривали, получая
5-[4-(6-пентафторфенокси-1-метил-1Н-бензимидазол-2-илметокси)бензил]-3-три-фенилметилтиазолидин- 2,4-дион. Смесь этого продукта и водной уксусной кислоты (80%, 100 мл) перемешивали при 70o
С
в течение 1 часа. Реакционную смесь концентрировали и затем нейтрализовали водным раствором бикарбоната натрия (10%). Нерастворимый продукт выделяли фильтрованием и промывали водой, получая
кристаллы.
Кристаллы очищали хроматографией на колонке с силикагелем, используя в качестве элюента смеси н-гексан/этилацетат = 1/1, получая указанное в заголовке соединение (1,29 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/1: Rf=0,42
(41-1b) Гидрохлорид
5-[4-(6-пентафторфенокси-1-метил-1Н-бензимидазол-2-илметокси)бензил]тиазолидин-2,4-диона
Реакцию проводили способом, аналогичным описанному в примере (2-2b), с использованием
5-[4-(6-пентафторфенокси-1- метил-1Н-бензимидазол-2-илметокси)бензил] тиазолидин-2,4-диона (1,29 г) и 4 н. раствора хлористый водород/этилацетат (30 мл) и реакционную смесь очищали, получая указанное
в заголовке соединение (1,13 г).
Т.пл: 169-172oС.
Пример 42
5-{ 4-[6-(2,5-Ди-трет-бутил-4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси]
бензил} тиазолидин-2,4-дион и его гидрохлорид (Иллюстративное соединение 1-1234)
(42-1) трет-Бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(2,
5-ди-трет-бутил-4-гидроксифенокси)фенил} -N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в примере (2-1), с использованием трет-бутил N-[2-амино-5-(2,
5-ди-трет-бутил-4-гидроксифенокси)фенил] -N-метилкарбамата (0,71 г), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (0,68 г), диэтилцианофосфоната (0,39 г), триэтиламина (0,24 г) и
безводного тетрагирофурана (30 мл), и реакционную смесь очищали, получая целевой продукт (1,13 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси
н-гексан/этилацетат = 1/1: Rf=0,41
(42-2а) 5-{ 4-[6-(2,5-Ди-трет-бутил-4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион
Реакцию проводили способом,
аналогичным описанному в примере (2-2а), с использованием трет-бутил N-{2-[4-(2,4-диоксотиазолидин-5-илметил)феноксиацетиламино] -5-(2,5-ди-трет-бутил-4-гидроксифенокси)фенил} -N-метилкарбамата (1,12
г) и 4 н. раствора хлористый водород/диоксан (25 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (0,73 г).
Тонкослойная хроматография на пластинке с
силикагелем с использованием смеси н-гексан/этилацетат = 1/1: Rf=0,19
(42-2b) Гидрохлорид 5-{ 4-[6-(2,
5-ди-трет-бутил-4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Реакцию проводили способом, аналогичным описанному в примере (2-2b), с использованием 5-{
4-[6-(2,5-ди-трет-бутил-4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2, 4-диона (0,73 г) и 4 н. раствора хлористый водород/этилацетат (20 мл), и реакционную смесь
очищали,
получая указанное в заголовке соединение (0,31 г).
Т.пл: 182-195oС.
Пример 43
5-{ 4-[6-(3,
5-Ди-трет-бутил-4-гидроксифенилтио)-1-метил-1Н-бензимидазол-2-илметокси] бензилиден} тиазолидин-2,4-дион (Иллюстративное соединение 5-135)
Смесь 4-[6-(3,
5-ди-трет-бутил-4-гидроксифенилтио)-1-метил-1Н-бензимидазол-2-илметокси] бензальдегида (502 мг), тиазолидин-2,4-диона (234 мг), пиперидина (170 мг) и этанола (60 мл) нагревали при кипении с обратным
холодильником в течение 19 часов. Реакционную смесь упаривали досуха, и к остатку добавляли воду, и нерастворимый продукт выделяли фильтрованием, промывали водой и диизопропиловым эфиром, получая
указанное в заголовке соединение (517 мг).
Т.пл: 247-249oС.
Пример 44
5-{ 4-[6-(4-н-Гексиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси]
бензил}тиазолидин-2,4-дион (Иллюстративное соединение 1-1242)
Смесь трет-бутил N-[2-амино-5-(4-трет-бутоксикарбонил-н-гексиламинофенокси)фенил] -N-метилкарбамата (4,10 г), 4-(2,
4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (2,81 г), диэтилцианофосфоната (1,63 г), триэтиламина (1,01 г) и безводного тетрагирофурана (100 мл) перемешивали при температуре окружающей среды
в течение 28 часов. Реакционную смесь концентрировали, и остаток распределяли между этилацетатом и водой. Этилацетатный слой сушили над безводным сульфатом натрия и концентрировали. Смесь остатка и 4
н. раствора хлористый водород/диоксан (50 мл) перемешивали при температуре окружающей среды в течение 66 часов. К реакционной смеси добавляли воду, и смесь нейтрализвоали бикарбонатом натрия и
экстрагировали этилацетатом. Этилацетат сушили над безводным сульфатом натрия и упаривали. Остаток очищали хроматографией на колонке с силикагелем с использованием смеси н-гексан/этилацетат = 2/3 в
качестве элюента, получая указанное в заголовке соединение (2,89 г).
Т.пл: 177-179oС.
Пример 45
Гидрохлорид 5- {
4- (6-[4-(N-ацетил-N-н-гексиламино)фенокси]-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2, 4-диона (Иллюстративное соединение 1-1318)
Смесь 5-{
4-[6-(4-н-гексиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (502 мг), уксусного ангидрида (112 мг), пиридина (356 мг), 4-(диметиламино)пиридина (37 мг) и
безводного
тетрагидрофурана оставляли при температуре окружающей среды в течение 14 часов. Реакционную смесь концентрировали и распределяли между этилацетатом и водой, этилацетатный слой сушили над
безводным
сульфатом натрия и концентрировали. Остаток очищали хроматографией на колонке с силикагелем с использованием в качестве элюента смеси н-гексан/этилацетат = 1/3 и затем обрабатывали 4 н.
раствором
хлористый водород/этилацетат (20 мл), получая указанное в заголовке соединение (410 мг).
Пример 46
Дигидрохлорид 5-{
4-[6-(4-аминофенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона (Иллюстративное соединение 1-142)
(46-1) трет-Бутил N-{5-(4-аминофенокси)-2-[4-(2,
4-диоксотиазолидин-5-илметил)феноксиацетиламино]фенил}-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в примере (2-1), с использованием трет-бутил
N-[2-амино-5-(4-трет-бутоксикарбониламинофенокси)фенил] -N-метилкарбамата (500 мг), 4-(2,4-диоксотиазолидин-5-илметил)феноксиуксусной кислоты (366 мг), диэтилцианофосфоната (212 мг), триэтиламина
(132
мг) и безводного тетрагирофурана (10 мл), и реакционную смесь очищали, получая целевой продукт (395 мг).
Тонкослойная хроматография на пластинке с силикагелем с использованием
смеси
н-гексан/этилацетат = 2/3 Rf=0,51
(46-2) Дигидрохлорид 5-{4-[6-(4-аминофенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-диона
Смесь раствора трет-бутил
N-{5-(4-аминофенокси-2-[4-(2, 4-диоксотиазолидин-5-илметил)феноксиацетиламино]фенил}-N-метилкарбамата (27,08 г) в 1,4-диоксане (50 мл) и 4 н. раствора хлористый водород/диоксан (150 мл) перемешивали
при температуре окружающей среды в течение 2 дней. Нерастворимый продукт выделяли фильтрованием и промывали этилацетатом, получая указанное в заголовке соединение (14,43 г).
Т.пл: 195oС (разложение).
Пример 47
5-{ 4-[6-(4-Ацетиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион (Иллюстративное соединение 1-164)
Смесь дигидрохлорида 5-{4-[6-(4-аминофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (400 мг), ацетилхлорида (71 мг), триэтиламина (263 мг) и безводного N,
N-диметилформамида (8 мл) перемешивали при температуре окружающей среды в течение 1 часа. Реакционную смесь концентрировали и распределяли между этилацетатом и водой. Этилацетатный слой промывали
насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали. Остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента
н-гексан/этилацетат=1/4 --> этилацетат --> этилацетат/метанол = 1/10, получая указанное в заголовке соединение (320 мг).
Т.пл: 92,2-95,0oС.
Пример 48
5-{ 4-[6-(4-Бензоиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион (Иллюстративное соединение 1-1248)
Реакцию проводили способом, аналогичным
описанному в примере 47, с использованием дигидрохлорида 5-{4-[6-(4-аминофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (400 мг), бензоилхлорида (126 мг), триэтиламина
(263
мг) и безводного N,N-диметилформамида (8 мл), и реакционную смесь очищали, получая указанное в заголовке соединение (247 мг).
Т.пл: 200,2-204,4oС.
Пример
49
5-[4-{ 6-[4-(3-Хлорбензоиламино)фенокси] -1-метил-1Н-бензимидазол-2-илметокси}бензил]тиазолидин-2,4-дион (Иллюстративное соединение 1-1256)
Реакцию проводили способом,
аналогичным
описанному в примере 47, с использованием дигидрохлорида 5-{ 4-[6-(4-аминофенокси) -1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (400 мг), 3-хлорбензоилхлорида (123
мг),
триэтиламина (263 мг) и безводного N,N-диметилформамида (8 мл), и реакционную смесь очищали, получая указанное в заголовке соединение (232 мг).
Т.пл: 237,8-238,8o С.
Пример 50
5-{ 4-[6-(4-Изоникотиноиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион (Иллюстративное соединение 1-1311)
Реакцию
проводили
способом, аналогичным описанному в примере 47, с использованием дигидрохлорида 5-{4-[6-(4-аминофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-диона (400 мг),
изоникотиноилхлорида
(142 мг), триэтиламина (232 мг) и безводного N,N-диметилформамида (8 мл), и реакционную смесь очищали, получая указанное в заголовке соединение (306 мг).
Т.пл: 222oС (разложение).
Пример 51
5-{ 4-[6-(4-Никотиноиламинофенокси)-1-метил-1H-бензимидазол-2-илметокси] бензил}тиазолидин-2,4-дион (Иллюстративное соединение
1-1305)
Реакцию проводили способом, аналогичным описанному в примере 47, с использованием дигидрохлорида 5-{ 4-[6-(4-аминофенокси) -1-метил-1Н-бензимидазол-2-илметокси] бензил }тиазслидин-2,
4-диона (400 мг),
никотиноилхлорида (195 мг), триэтиламина (354 мг) и безводного N,N-диметилформамида (8 мл), и реакционную смесь очищали, получая указанное в заголовке соединение (297 мг).
Т.пл: 213, 0-214,7oС.
Пример 52
5-[4-{ 6-[4-(2,4-Дифторбензоиламино)фенокси]-1-метил-1Н-бензимидазол-2-илметокси}бензил]тиазолидин-2,4-дион
(Иллюстративное соединение
1-1236)
Реакцию проводили способом, аналогичным описанному в примере 47, с использованием дигидрохлорида
5-{4-[6-(4-аминофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,
4-диона (400 мг), 2, 4-дифторбензоилхлорида (141 мг), триэтиламина (232 мг) и безводного N,N-диметилформамида (8 мл),
и реакционную смесь очищали, получая указанное в заголовке соединение (251 мг).
Т.пл: 171,5-174,2oС.
Пример 53
5-[4-{6-[4-(2-нафтоиламино)фенокси]-1-метил-1Н-бензимидазол-2-илметокси} бензил]тиазолидин-2,4-дион (Иллюстративное
соединение 1-1277)
Реакцию проводили способом, аналогичным описанному в
примере 47, с использованием дигидрохлорида 5-{4-[6-(4-аминофенокси)-1-метил-1Н-бензимидазол-2-илметокси]
бензил}тиазолидин-2,4-диона (400 мг), 2-нафтоилхлорида (153 мг), триэтиламина (232 мг) и
безводного N,N-диметилформамида (8 мл) и реакционную смесь очищали, получая указанное з заголовке соединение
(337 мг).
Т.пл: 220,7-222,7oС.
Пример 54
5-{ 4-[6-(4-Циклогексаноиламинофенокси)-1-метил-1H-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион
(Иллюстративное соединение 1-1298)
К раствору циклогексанкарбоновой кислоты (90
мг) и триэтиламина (232 мг) в безводном N, N-диметилформамиде (8 мл) при температуре окружающей среды добавляли
по каплям этилхлорформиат (87 мг). Смесь перемешивали при той же температуре в течение
1,5 часов. К реакционной смеси добавляли небольшими порциями дигидрохлорид
5-{4-[6-(4-аминофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил}тиазолидин-2,4-диона (400 мг). Смесь перемешивали при
50oС в течение 1,5 часов. Реакционную смесь концентрировали и
распределяли между этилацетатом и водой. Этилацетатный слой сушили над безводным сульфатом натрия и концентрировали. При
добавлении к остатку этилацетата образовывался нерастворимый продукт, который
выделяли фильтрованием и промывали этилацетатом, получая указанное в заголовке соединение (262 мг).
Т.пл: 181,7-183,7oС.
Пример 55
5-{
4-[6-(4-Циклопентаноиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси]бензил}тиазолидин-2,4-дион (Иллюстративное соединение
1-1292)
К раствору циклопентанкарбоновой кислоты (90 мг) и
триэтиламина (232 мг) в безводном N, N-диметилформамиде (8 мл) при температуре окружающей среды добавляли этилхлорформиат (87 мг).
Смесь перемешивали при той же температуре в течение 1,5 часов. К
реакционной смеси добавляли небольшими порциями дигидрохлорид 5-{4-[6-(4-аминофенокси)-1-метил-1H-бензимидазол-2-илметокси]бензил}
тиазолидин-2,4-диона (400 мг). Смесь перемешивали при температуре
окружающей среды в течение 5 часов и оставляли на ночь при той же температуре. После концентрирования смеси к реакционной смеси
добавляли воду, и нерастворимый продукт выделяли фильтрованием, и
промывали водой и этилацетатом, получая указанное в заголовке соединение (236 мг).
Т.пл: 227,3-228,4o С.
Ссылочный пример 1
4-Метоксиметокси-2,3,
5-триметилфенол
50 г гидрида натрия (55% по весу) промывали н-гексаном, затем добавляли 2000 мл безводного
тетрагидрофурана. К полученной смеси добавляли по каплям 500 мл раствора 240 г 2,3,
6-триметил-4-пивалоилоксифенола в безводном тетрагидрофуране в течение 90 минут при охлаждении льдом; затем смесь
перемешивали при комнатной температуре в течение двух часов. К реакционной смеси при
охлаждении льдом в течение 30 минут добавляли по каплям 86 мл хлорметилметилового простого эфира, и смесь
перемешивали при комнатной температуре в течение одного часа. Из реакционной смеси при
пониженном давлении отгоняли примерно 50% по объему тетрагидрофурана. Остаток выливали в ледяную воду с
последующей экстракцией этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили
над безводным ацетатом натрия. Растворитель отгоняли при пониженном давлении, получая таким образом 294
г желтого масла. К желтому маслу добавляли 1000 мл метанола с последующим прибавлением по каплям
при охлаждении льдом 500 мл раствора 116 г гидроксида калия в метаноле. Полученную смесь перемешивали
при комнатной температуре в течение одного часа. Растворитель отгоняли при пониженном давлении.
Остаток выливали в ледяную воду и нейтрализовали 6 н. водным раствором хлорводородной кислоты с
последующей экстракцией этилацетатом. Экстракт промывали насыщенным солевым раствором и затем сушили над
безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток очищали
хроматографией на колонке с силикагелем (элюирующий растворитель: н-гексан/этилацетат = 5/1-->3/1), в
результате чего было получено 193 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 3/1): значение Rf=0, 47.
Ссылочный пример 2
6-(4-Метоксиметокси-2,3,
5-триметилфенокси)-2-метиламино-3-нитропиридин
К суспензии 50 г гидрида натрия (55% по весу, промытый н-гексаном) в
1000 мл N,N-диметилформамида добавляли по каплям при охлаждении льдом 300
мл раствора 193 г 4-метоксиметокси-2,3,5-триметилфенола в безводном N,N-диметилформамиде; затем смесь перемешивали при
комнатной температуре в течение 2 часов. К реакционной смеси добавляли по каплям
в течение одного часа при охлаждении льдом 800 мл раствора 197 г 6-хлор-2-метиламино-3-нитропиридина в безводном N,
N-диметилформамиде с последующим перемешиванием при комнатной температуре в течение
2 часов. Растворитель отгоняли при пониженном давлении. Остаток выливали в ледяную воду. К полученной смеси
добавляли этилацетат и воду. Нерастворимый продукт собирали фильтрованием и промывали водой
и этанолом, получая таким образом 141 г указанного в заголовке соединения. Отдельно органический слой
отделяли от фильтрата, и водный слой экстрагировали этилацетатом. Органический слой и экстракт
объединяли, затем промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия.
Растворитель отгоняли при пониженном давлении и остаток промывали этанолом, в результате чего было
получено 126 г указанного в заголовке соединения.
Температура плавления: 102-103oС.
Ссылочный пример 3
2-Гидроксиметил-5-(4-гидрокси-2,3,
5-триметилфенокси)-3-метил-3Н-имидазо[4,5-b]пиридин
Смесь 288 г 6-(4-метоксиметокси-2,3,
5-триметилфенокси)-2-метиламино-3-нитропиридина, 14 г 10%-ного палладия на угле и 1500 мл метанола
перемешивали при комнатной температуре в течение 2 часов в атмосфере водорода. К реакционной смеси
добавляли 14 г 10%-ного палладия на угле, 500 мл метанола и 500 мл тетрагидрофурана, и полученную
смесь перемешивали при 50oС в течение 8 часов в атмосфере водорода. Из реакционной смеси
отфильтровывали палладий на угле и фильтрат концентрировали упариванием. К остатку добавляли 500 г
гликолевой кислоты и смесь перемешивали при 150oС в течение 6 часов. К реакционной смеси
добавляли 1000 мл 4 н. водного раствора соляной кислоты, и смесь перемешивали при 120oС
в течение одного часа. Реакционную смесь оставляли на ночь при комнатной температуре. Реакционную
смесь выливали в ледяную воду с последующей нейтрализацией водным раствором гидроксида натрия и
водным раствором карбоната натрия. Полученное твердое вещество отделяли фильтрованием и очищали
хроматографией на колонке с силикагелем с использованием тетрагидрофурана в качестве элюирующего
растворителя. Полученное из элюата твердое вещество промывали этанолом, в результате чего получали 45,5
г указанного в заголовке соединения.
Температура плавления: 181-182o С.
Ссылочный пример 4
2-Ацетоксиметил-5-(4-ацетокси-2,3,
5-триметилфенокси)-3-метил-3Н-имидазо[4,5-b]пиридин
К 400 мл раствора 38,0 г 2-гидроксиметил-5-(4-гидрокси-2,
3,5-триметилфенокси)-3-метил-3Н-имидазо[4,5-b] пиридина в пиридине добавляли по
каплям при охлаждении льдом 69 мл уксусного ангидрида. После перемешивания при комнатной температуре в течение 3 часов
реакционную смесь оставляли на ночь при комнатной температуре. Растворитель
отгоняли при пониженном давлении. К остатку добавляли воду с последующей экстракцией этилацетатом. Экстракт промывали
насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель
отгоняли при пониженном давлении. Остаток отделяли и очищали хроматографией на колонке с силикагелем (элюирующий
растворитель н-гексан/этилацетат= 1/2), в результате чего получили 39,5 г указанного в
заголовке соединения.
Температура плавления: 128-129oС.
Ссылочный
пример 5
5-(4-Ацетокси-2,3,
5-триметилфенокси)-2-гидроксиметил-3-метил-3Н-имидазо[4,5-b]пиридин
К 500 мл раствора 26,0 г 2-ацетоксиметил-5-(4-ацетокси-2,3,
5-триметилфенокси)-3-метил-3Н-имидазо[4,5-b] пиридина в метаноле
добавляли по каплям при -18oС 1,2 мл раствора (28%) метоксида натрия в метаноле с последующим перемешиванием при той же
температуре в течение одного часа. К реакционной смеси добавляли воду
с последующей экстракцией этилацетатом. Экстракт промывали насыщенным солевым раствором и затем сушили над безводным сульфатом
натрия. Растворитель отгоняли при пониженном давлении. Остаток
кристаллизовали из этанола. Кристаллы собирали фильтрованием, в результате чего получали 20,5 г указанного в заголовке соединения.
Температура плавления: 179-180oС.
Ссылочный пример 6
трет-Бутил N-[5-(4-метоксиметокси-2,3,5-триметилфенокси) -2-нитрофенил] -N-метилкарбамат
В
300 мл N,N-диметилформамида суспендировали 6,11 г гидрида
натрия (55% по весу) с последующим добавлением 27,5 г 4-метоксиметокси-2,3,5-триметилфенола. Полученную смесь перемешивали при комнатной
температуре в течение одного часа. К реакционной смеси
небольшими порциями добавляли 40,1 г трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата и смесь перемешивали при 120oС в течение 2
часов. Реакционную смесь концентрировали упариванием. К
концентрату добавляли воду с последующей экстракцией этилацетатом. Экстракт сушили над безводным сульфатом натрия. Растворитель отгоняли при
пониженном давлении. Остаток очищали хроматографией на
колонке с силикагелем (элюирующий растворитель: н-гексан/этилацетат = 5/1), в результате чего получали 57,0 г указанного в заголовке
соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 4/1): значение Rf=0,55.
Ссылочный пример 7
трет-Бутил
N-[2-амино-5-(4-метоксиметокси-2,3,5-триметилфенокси)фенил]
-N-метилкарбамат
Смесь 57,0 г трет-бутил N-[5-(4-метоксиметокси-2,3,5-триметилфенокси)-2-нитрофенил] -N-метилкарбамата, 3 г
10%-ного палладия на угле и 500 мл метанола интенсивно перемешивали
при комнатной температуре в течение 8 часов в атмосфере водорода. Из реакционной смеси отфильтровывали палладий на угле, и фильтрат
концентрировали упариванием. Остаток очищали хроматографией на
колонке с силикагелем (элюирующий растворитель: н-гексан/этилацетат = 3/1), в результате чего получали 52,5 г указанного в заголовке
соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 3/1): значение Rf=0,31.
Ссылочный пример 8
2-Хлор-3,
5-диметилбензол-1,4-диол
Смесь 12,08 г 3,
5-диметил-4-нитрозофенола, 11,45 г оксида меди (I), 100 мл 1,4-диоксана, 10 мл ацетона и 100 мл 6 н. соляной кислоты нагревали при кипении с обратным
холодильником в течение 2 часов. Реакционную смесь
выливали в ледяную воду с последующей экстракцией эфиром. Экстракт сушили над безводным сульфатом натрия и затем растворитель отгоняли при
пониженном давлении. Остаток растворяли в 150 мл
дихлорметана. К полученному раствору добавляли при охлаждении льдом 3,61 г боргидрида натрия с последующим добавлением по каплям 50 мл метанола при
внутренней температуре, не превышающей 10o
С. Реакционную смесь перемешивали при комнатной температуре в течение 90 минут. Реакционную смесь концентрировали упариванием. Концентрат выливали
в ледяную воду. Полученную смесь подкисляли 3 н.
соляной кислотой. Выпавший в осадок продукт собирали фильтрованием, промывали последовательно водой и н-гексаном, в результате чего получали 5,93 г
указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 4/1): значение Rf=0,35.
Ссылочный пример
9
3-Хлор-2,6-диметил-4-пивалоилоксифенол
К смеси 5,91 г 2-хлор-3,5-диметилбензол-1,4-диола, 8,13 г пиридина и 30 мл дихлорметана добавляли по каплям при охлаждении льдом 10 мл
раствора дихлорметана, содержащего 4,54 г пивалоилхлорида,
с последующим перемешиванием при той же температуре в течение одного часа и при комнатной температуре в течение 90 минут. Реакционную смесь
концентрировали упариванием. К концентрату добавляли воду, и
смесь экстрагировали этилацетатом. Экстракт сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Остаток
очищали хроматографией на колонке с силикагелем (элюирующий
растворитель: н-гексан/этилацетат = 10/1), в результате чего получали 8,02 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 4/1): значение Rf=0,53.
Ссылочный пример 10
2-Хлор-4-метоксиметокси-3,
5-диметилфенол
К 20 мл суспензии безводного тетрагидрофурана, содержащей
1,78 г гидрида натрия (55% по весу), добавляли по каплям 30 мл раствора 8,02 г 3-хлор-2,
6-диметил-4-пивалоилоксифенола в безводном тетрагидрофуране с последующим перемешиванием при комнатной
температуре в течение 30 минут. К реакционной смеси добавляли 3,28 г хлорметилметилового
простого эфира, и смесь перемешивали при комнатной температуре в течение 13 часов. Затем реакционную смесь
концентрировали упариванием. К концентрату добавляли воду с последующей экстракцией
этилацетатом. Экстракт сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. 9,30
г остатка растворяли в 30 мл метанола. К полученному раствору добавляли по каплям
30 мл раствора 3,51 г гидроксида калия в метаноле с последующим перемешиванием при комнатной температуре в течение 30
минут. Реакционную смесь концентрировали упариванием. Концентрат нейтрализовали 3
н. соляной кислотой и бикарбонатом натрия с последующей экстракцией этилацетатом. Экстракт сушили над безводным
сульфатом натрия, и растворитель отгоняли при пониженном давлении. Остаток отделяли и
очищали хроматографией на колонке с силикагелем (элюирующий растворитель: н-гексан/этилацетат = 10/1), в
результате чего получали 5,65 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 10/1): значение Rf=0, 29.
Ссылочный пример 11
2,6-Диметил-4-пивалоилоксифенол
С использованием 6,90 г 2,6-диметилбензол-1,4-диола, 6,63 г пивалоилхлорида, 11,85 г пиридина и 60 мл
дихлорметана проводили взаимодействие и очистку способом, аналогичным описанному в
ссылочном примере 9, в результате чего получали 6,77 г указанного в заголовке соединения.
Температура плавления: 92-94oС.
Ссылочный пример 12
4-Метоксиметокси-3,5-диметилфенол
К 50 мл суспензии безводного тетрагидрофурана, содержащей 1,72 г
гидрида натрия (55% по весу), добавляли небольшими порциями 6,75 г 2,
6-диметил-4-пивалоилоксифенола с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционной смеси
добавляли 3,18 г хлорметилметилового простого эфира, и полученную смесь
перемешивали при той же температуре в течение 3 часов. Затем к реакционной смеси добавляли воду с последующей экстракцией
этилацетатом. Экстракт сушили над безводным сульфатом натрия, и растворитель
отгоняли при пониженном давлении, в результате чего получали 8,17 г 4-метоксиметокси-3,6-диметилпивалоата в виде сырого
продукта.
Тонкослойная хроматография на силикагеле (проявляющий раствор: н-гексан/этилацетат = 10/1): значение Rf=0,39.
8,09 г сырого 4-метоксиметокси-3, 6-диметилпивалоата растворяли в 30 мл метанола. К полученному раствору добавляли по каплям 30 мл раствора 3,40 г гидроксида калия в метаноле с последующим перемешиванием при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали упариванием. К остатку добавляли воду. Смесь нейтрализовали 3 н. соляной кислотой и бикарбонатом натрия с последующей экстракцией этилацетатом. Экстракт сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Остаток отделяли и очищали хроматографией на колонке с силикагелем (элюирующий растворитель: н-гексан/этилацетат = 4/1), в результате чего получали 5,58 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 10/1): значение Rf=0,10.
Ссылочный пример 13
трет-Бутил N-[5-(4-бензилоксифенокси)-2-нитрофенил]-N-метилкарбамат
С использованием 1,60 г
4-бензилоксифенола, 2,29 г трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата, 0,35 г гидрида
натрия (55% по весу) и 20 мл безводного N, N-диметилформамида взаимодействие и очистку осуществляли
способом, аналогичным описанному в ссылочном примере 6, в результате чего получали 3,33 г
указанного в заголовке соединения.
Температура плавления: 108-110oС.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 5/1): значение Rf=0,36.
Ссылочный пример 14
трет-Бутил
N-[5-(4-метоксиметокси-3,5-диметилфенокси)-2-нитрофенил]-N-метилкарбамат
С
использованием 1,46 г 4-метоксиметокси-3,5-диметилфенола, 2,29 г трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата,
0,35 г гидрида натрия (55% по весу) и 30 мл безводного N,N-диметилформамида
взаимодействие и очистку осуществляли способом, аналогичным описанному в ссылочном примере 6, получая таким образом 3,14 г
указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 5/1): значение Rf=0,29.
Ссылочный пример
15
трет-Бутил N-[5-(2-хлор-4-метоксиметокси-3,
5-диметилфенокси)-2-нитрофенил]-N-метилкарбамат
С использованием 5,65 г 2-хлор-4-метоксиметокси-3,5-диметилфенола, 8,88 г трет-бутил
N-(5-хлор-2-нитрофенил)-N-метилкарбамата, 1,35 г гидрида
натрия (55% по весу) и 100 мл безводного N,N-диметилформамида взаимодействие и очистку осуществляли способом, аналогичным описанному в
ссылочном примере 6, в результате чего получали 9,19 г
указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 4/1): значение Rf=0,47.
Ссылочный пример
16
трет-Бутил N-[5-(пиридин-2-илокси)-2-нитрофенил]-N-метилкарбамат
С использованием 0,76 г 2-гидроксипиридина, 2,29 г
трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата, 0,35 г
гидрида натрия (55% по весу) и 10 мл безводного N, N-диметилформамида взаимодействие и очистку осуществляли способом, аналогичным описанному
в ссылочном примере 6, в результате чего получали 0,36 г
указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 4/1): значение Rf=0,32.
Ссылочный пример
17
трет-Бутил N-[5-(3,5-ди-трет-бутил-4-гидроксифенилтио)-2-нитрофенил] -N-метилкарбамат
С использованием 476 мг 3,
5-ди-трет-бутил-4-гидроксибензолтиола, 573 мг
трет-бутил
N-(5-хлор-2-нитрофенил)-N-метилкарбамата, 175 мг гидрида натрия (55% по весу) и 10 мл безводного N,N-диметилформамида взаимодействие и
очистку осуществляли способом, аналогичным описанному в
ссылочном примере 6, в результате чего получали 371 мг указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 4/1): значение Rf=0,59.
Ссылочный пример 18
трет-Бутил N-[5-(4-амино-3,5-диметилфенокси)-2-нитрофенил]
-N-метилкарбамат
С использованием 1,10 г 4-амино-3,
5-диметилфенола, 2,29 г трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата, 0,35 г гидрида натрия (55% по весу) и 30 мл безводного N,
N-диметилформамида взаимодействие и очистку осуществляли способом,
аналогичным описанному в ссылочном примере 6, в результате чего получали 2,27 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 3/1): значение Rf=0,24.
Ссылочный пример 19
трет-Бутил
N-[5-[4-(трет-бутоксикарбониламино-3,
5-диметилфенокси)-2-нитрофенил]-N-метилкарбамат
Смесь 2,27 г трет-бутил N-[5-(4-амино-3,5-диметилфенокси)-2-нитрофенил] -N-метилкарбамата, 1,28 г
ди-трет-бутилдикарбоната, 0,59 г
триэтиламина и 20 мл безводного тетрагидрофурана нагревали при кипении с обратным холодильником в течение 6 часов. Затем реакционную смесь концентрировали упариванием.
К концентрату добавляли воду с
последующей экстракцией этилацетатом. Экстракт сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Остаток очищади хроматографией на
колонке с силикагелем
(элюирующий растворитель: н-гексан/этилацетат = 10/1), в результате чего получали 1,74 г указанного в заголовке соединения.
Температура плавления: 154-156oС.
Ссылочный пример 20
трет-Бутил N-[2-амино-5-(4-гидроксифенокси)фенил]-N-метилкарбамат
С использованием 3,32 г трет-бутил
N-[5-(4-бензилоксифенокси)-2-нитрофенил]-N-метилкарбамата, 0,39 г 10%-ного палладия на угле, 100 мл метанола и 100 мл 1,4-диоксана взаимодействие и очистку осуществляли способом, аналогичным
описанному в ссылочном примере 7, в результате чего получали 2,40 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 1/2): значение Rf=0,59.
Ссылочный пример 21
трет-Бутил N-[2-амино-5-(4-метоксиметокси-3,5-диметилфенокси)фенил]-N-метилкарбамат
С
использованием 3,12 г трет-бутил N-[5-(4-метоксиметокси-3,5-диметилфенокси)-2-нитрофенил] -N-метилкарбамата, 0,33 г 10%-ного палладия на угле и 30 мл метанола взаимодействие и очистку осуществляли
способом, аналогичным описанному в ссылочном примере 7, в результате чего получали 2,72 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 3/1): значение Rf=0,14.
Ссылочный пример 22
трет-Бутил N-[2-амино-5-(4-трет-бутоксикарбониламино-3,
5-диметилфенокси)фенил]-N-метилкарбамат
Смесь 1,71 г N-[5-(4-трет-бутоксикарбониламино-3,5-диметилфенокси)-2-нитрофенил] -N-метилкарбамата, 0,2 г 10%-ного палладия на угле и 100 мл метанола
перемешивали
интенсивно при комнатной температуре в течение 11 часов в атмосфере водорода. Катализатор отфильтровывали из реакционной смеси и фильтрат концентрировали упариванием, в
результате чего получали 1,56 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 3/1): значение Rf=0, 14.
Ссылочный пример 23
трет-Бутил N-{5-[2-(морфолин-4-ил)фенокси]-2-нитрофенил]-N-метилкарбамат
С использованием 0,72 г 2-(4-морфолино)фенола, 1,15 г трет-бутил
N-(5-хлор-2-нитрофенил)-N-метилкарбамата, 0,17 г гидрида натрия (55% по весу) и 10 мл безводного N,N-диметилформамида взаимодействие и очистку осуществляли способом, аналогичным описанному в
ссылочном
примере 6, в результате чего получали 1,44 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 4/1): значение Rf=0,34.
Ссылочный пример 24
трет-Бутил N-{5-[3-(морфолин-4-ил)фенокси]-2-нитрофенил]-N-метилкарбамат
С использованием 2,16 г 3-(4-морфолино)фенола,
3,37 г
трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата и 15 мл безводного N,N-диметилформамида взаимодействие и очистку осуществляли способом, аналогичным описанному в ссылочном примере 6, в
результате
чего получали 5,0 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: бензол/этилацетат = 10/1): значение Rf=0,34.
Ссылочный пример 25
трет-Бутил N-{2-амино-5-[2-(морфолин-4-ил)фенокси]фенил}-N-метилкарбамат
С использованием 1,44 г трет-бутил
N-{5-[2-(морфолин-4-ил)фенокси]-2-нитрофенил}-N-метилкарбамата, 0,20 г 10%-ного палладия на угле и 50 мл метанола взаимодействие и очистку осуществляли способом, аналогичным описанному в ссылочном
примере 7, в результате чего получали 1,20 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: н-гексан/этилацетат = 2/1): значение Rf=0,25.
Ссылочный пример 26
трет-Бутил N-{2-амино-5-[3-(морфолин-4-ил)фенокси]фенил}-N-метилкарбамат
С использованием 5,0 г трет-бутил
N-{5-[3-(морфолин-4-ил)фенокси]-2-нитрофенил} -N-метилкарбамата, 0,5 г 10%-ного палладия на угле и смешанного растворителя из 30 мл метанола и 70 мл толуола, взаимодействие и очистку осуществляли
способом, аналогичным описанному в ссылочном примере 7, в результате чего получали 4,5 г указанного в заголовке соединения.
Тонкослойная хроматография на силикагеле (проявляющий растворитель: бензол/этилацетат = 4/1): значение Rf=0,23.
Ссылочный пример 27
трет-Бутил N-[2-амино-5-(2-пиперидинофенокси)фенил]-N-метилкарбамат
К раствору
2-пиперидинофенола (3,4 г) в N,N-диметилформамиде (35 мл) на ледяной бане в атмосфере азота добавляли гидрид натрия (55 вес.%, 1,04 г). Смесь перемешивали при температуре окружающей среды в течение
15
минут. К реакционной смеси небольшими порциями добавляли трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамат (5,25 г). Смесь перемешивали при 60oС в течение 2 часов. По окончании этого
промежутка времени растворитель упаривали и к остатку добавляли воду. Смесь нейтрализовали концентрированной соляной кислотой и экстрагировали этилацетатом. Этилацетатный слой сушили над сульфатом
натрия и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем с использованием смеси ц-гексан/изопропиловый эфир = 5/1 в качестве элюента, получая
трет-бутил N-[2-нитро-5-(2-пиперидинофенокси)фенил]-N-метилкарбамат, значение Rf для которого при тонкослойной хроматографии на пластинке с силикагелем с использованием в качестве элюента смеси
ц-гексан/изопропиловый эфир =5/1 составляло 0,27. Смесь раствора данного продукта в смеси толуол/метанол=7/3 (100 мл) и палладия на угле (10%, 0,63 г) интенсивно перемешивали при комнатной
температуре
в атмосфере водорода в течение 14,5 часов. Катализатор удаляли фильтрованием и фильтрат концентрировали. Остаток промывали охлажденным метанолом и н-гексаном, получая указанное в
заголовке соединение
(4,2 г).
Т.пл.: 108-110oС.
Ссылочный пример 28
трет-Бутил N-метил-N-[2-нитро-5-(пиридин-2-илтио)фенил]карбамат
Способом, аналогичным
описанному в ссылочном примере 6, проводили реакцию с использованием 2-меркаптопиридина (0,89 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (2,29 г), гидрида натрия
(55 вес.%, 0.11 г) и
безводного N,N-диметилформамида (40 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (1,13 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 5/1: Rf=0,20.
Ссылочный пример 29
трет-Бутил N-[2-амино-5-(2-пирролидинофенокси)фенил]-N-метилкарбамат
Взаимодействие
осуществляли способом, аналогичным описанному в ссылочном примере 27, с использованием 2-пирролидинофенола (1,88 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (3,34 г),
гидрида натрия (55
вес.%, 0,52 г) и безводного N,N-диметилформамида (22 мл) и реакционную смесь очищали, получая трет-бутил N-[2-нитро-5-(2-пирролидинофенокси)фенил]-N-метилкарбамат, значение Rf для
которого при
тонкослойной хроматографии на пластинке с силикагелем с использованием в качестве элюента смесь ц-гексан/этилацетат = 10/1 составляло 0,25. Способом, аналогичным описанному в ссылочном
примере 27,
проводили реакцию с использованием данного продукта, палладия на угле (10%, 0,45 г) и смеси толуол/метанол =7/3 (50 мл) и реакционную смесь очищали, получая указанное в заголовке
соединение (3,0
г).
Т.пл.: 136-138oС.
Ссылочный пример 30
трет-Бутил N-[5-(2-бензилоксифенокси)-2-нитрофенил]-N-метилкарбамат
Способом,
аналогичным
описанному в ссылочном примере 6, проводили реакцию с использованием 2-бензилоксифенола (2,00 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (2,87 г), гидрида натрия (55 вес.%, 0,
44 г) и
безводного N,N-диметилформамида (20 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (4,16 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 3/1: Rf=0,62.
Ссылочный пример 31
трет-Бутил N-{5-[4-(1-адамантил)фенокси]-2-нитрофенил}-N-метилкарбамат
Способом,
аналогичным описанному в ссылочном примере 6, проводили реакцию с использованием 4-(1-адамантил)фенола (2,28 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (2,87 г), гидрида натрия (55 вес.%,
0,44 г) и безводного N,N-диметилформамида (40 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (4,30 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 3/1: Rf=0,76.
Ссылочный пример 32
трет-Бутил N-[5-(3-диметиламинофенокси)-2-нитрофенил]-N-метилкарбамат
Способом,
аналогичным описанному в ссылочном примере 6, проводили реакцию с использованием 3-диметиламинофенола (0,82 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (1,72 г), гидрида натрия
(55 вес.%,
0,26 г) и безводного N,N-диметилформамида (50 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (2,17 г)
Тонкослойная хроматография на пластинке с
силикагелем с
использованием смеси н-гексан/этилацетат = 9/1: Rf=0,21.
Ссылочный пример 33
трет-Бутил N-[2-амино-5-(пиридин-3-илокси)фенил]-N-метилкарбамат
Способом,
аналогичным
описанному в ссылочном примере 27, проводили взаимодействие с использованием 3-гидроксипиридина (3,1 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (9,3 г), гидрида натрия (55
вес.%, 1,4 г) и
безводного N,N-диметилформамида (25 мл) и реакционную смесь очищали, получая трет-бутил N-[2-нитро-5-(2-пиридин-3-илокси)фенил] -N-метилкарбамат (9,2 г). Способом, аналогичным
описанному в ссылочном
примере 27, осуществляли взаимодействие с использованием данного продукта, палладия на угле (10%, 1,0 г) и смеси толуол/метанол =7/3 (100 мл) и реакционную смесь очищали,
получая указанное в заголовке
соединение (7,5 г).
Т.пл.: 101-102oС.
Ссылочный пример 34
трет-Бутил
N-{5-[4-(имидазол-1-ил)фенокси]-2-нитрофенил}-N-метилкарбамат
Способом, аналогичным описанному в ссылочном примере 6, проводили реакцию с использованием 4-(имидазол-1-ил)фенола (4,1 г),
трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (7,85 г), гидрида натрия
(55 вес.%, 1,25 г) и безводного N,N-диметилформамида (45 мл) и реакционную смесь очищали, получая указанное в заголовке
соединение (8,8 г).
Т.пл.: 182-184oС.
Ссылочный пример 35
трет-Бутил N-метил-N-[2-нитро-5-(2-фенилфенокси)фенил]карбамат
Способом,
аналогичным описанному в ссылочном примере 6, проводили реакцию с
использованием 2-фенилфенола (3,5 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (5,6 г), гидрида натрия (55 вес.%, 1,08 г)
и безводного N,N-диметилформамида (35 мл) и реакционную смесь
очищали, получая указанное в заголовке соединение (8,3 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси толуол/этилацетат = 10/1: Rf=0,56.
Ссылочный пример 36
трет-Бутил N-[5-(4-гидрокси-2,3-диметилфенокси)-2-нитрофенил] -N-метилкарбамат
Способом,
аналогичным описанному в ссылочном примере 6, проводили
реакцию с использованием 2,3-диметилгидрохинона (1,38 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (2,87 г), гидрида натрия (55
вес.%, 0,87 г) и безводного N,N-диметилформамида (20 мл) и
реакционную смесь очищали, получая указанное в заголовке соединение (1,92 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 3/1: Rf=0,35.
Ссылочный пример 37
трет-Бутил N-метил-N-[2-нитро-5-(4-феноксифенокси)фенил] карбамат
Способом, аналогичным описанному в ссылочном примере 6, проводили
реакцию с использованием 4-феноксифенола (4,0 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (5,8 г), гидрида натрия (55
вес.%, 1,1 г) и безводного N, N-диметилформамида (35 мл) и реакционную
смесь очищали, получая указанное в заголовке соединение (8,6 г).
Тонкослойная хроматография на пластинке с
силикагелем с использованием смеси толуол/изопропиловый эфир = 20/1:
Rf=0,41.
Ссылочный пример 38
трет-Бутил
N-[5-(4-гидроксифенилтио)-2-нитрофенил]-N-метилкарбамат
Способом, аналогичным описанному в ссылочном примере 6, проводили
реакцию с использованием 4-гидрокситиофенола (1,26 г), трет-бутил
N-(5-хлор-2-нитрофенил)-N-метилкарбамата (2,87 г), гидрида натрия (55 вес.%, 0,87 г) и безводного N,N-диметилформамида (20 мл) и
реакционную смесь очищали, получая указанное в заголовке соединение (2,
86 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 3/1: Rf=0,27.
Ссылочный пример 39
трет-Бутил
N-метил-N-[2-нитро-5-(3-фенилфенокси)фенил] карбамат
Способом, аналогичным описанному в ссылочном примере 6, проводили
реакцию с использованием 3-фенилфенола (4,0 г), трет-бутил
N-(5-хлор-2-нитрофенил)-N-метилкарбамата (6,5 г), гидрида натрия (55 вес.%, 1,13 г) и безводного N,N-диметилформамида (35 мл) и реакционную
смесь очищали, получая указанное в заголовке соединение (8,
7 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 10/1: Rf=0,22.
Ссылочный пример 40
трет-Бутил
N-[5-(3-трет-бутил-4-гидроксифенокси)-2-нитрофенил] -N-метилкарбамат и трет-бутил
N-[5-(2-трет-бутил-4-гид-роксифенокси)-2-нитрофенил]-N-метилкарбамат
Способом, аналогичным описанному в
ссылочном примере 6, проводили реакцию с использованием трет-бутилгидрохинона (1,66 г),
трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (2,87 г), гидрида натрия (55 вес.%, 0,87 г) и безводного N,
N-диметилформамида (20 мл) и реакционную смесь очищали хроматографически на колонке с
силикагелем с использованием смеси н-гексан/этилацетат = 4/1, получая трет-бутил
N-[5-(3-трет-бутил-4-гидроксифенокси)-2-нитрофенил] -N-метилкарбамат (1,35 г), значение Rf которого составляло 0,45 при
тонкослойной хроматографии на пластинке с силикагелем с использованием смеси
н-гексан/этилацетат = 3/1 и трет-бутил N-[5-(2-трет-бутил-4-гидроксифенокси)-2-нитрофенил] -N-метилкарбамат (1,11 г),
значение Rf которого составляло 0,35 при тонкослойной хроматографии на пластинке
с силикагелем с использованием смеси н-гексан/этилацетат = 3/1.
Ссылочный пример 41
трет-Бутил N-метил-N-[2-нитро-5-(4-фенилфенокси)фенил] карбамат
Способом,
аналогичным описанному в ссылочном примере 6, проводили реакцию с использованием 4-фенилфенола (4,0 г), трет-бутил
N-(5-хлор-2-нитрофенил)-N-метилкарбамата (6,5 г), гидрида натрия (55 вес.%, 1,13 г)
и безводного N,N-диметилформамида (35 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (5,5
г).
Т.пл.: 166-167oС.
Ссылочный
пример 42
трет-Бутил N-[5-(3,5-ди-трет-бутил-4-гидроксифенокси)-2-нитрофенил]-N-метилкарбамат
Способом,
аналогичным описанному в ссылочном примере 6, проводили реакцию с
использованием 2,6-ди-трет-бутилгидрохинона (4,44 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (8,60 г), гидрида натрия (55
вес.%, 2,18 г) и безводного N,N-диметилформамида (50 мл) и
реакционную смесь очищали, получая указанное в заголовке соединение (0,60 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 10/1: Rf=0,22.
Ссылочный пример 43
трет-Бутил N-[5-(4-гидрокси-2,5-диметилфенокси)-2-нитрофенил] -N-метилкарбамат
Способом, аналогичным описанному в ссылочном примере 6,
проводили реакцию с использованием 2,5-диметилгидрохинона (1,38 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (2,87 г), гидрида
натрия (55 вес.%, 0,87 г) и безводного N,N-диметилформамида
(20 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (1,72 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси толуол/этилацетат = 5/1: Rf=0,58.
Ссылочный пример 44
трет-Бутил N-[2-амино-5-(4-гидрокси-2-метилфенокси)фенил]
-N-метилкарбамат и трет-бутил
N-[2-амино-5-(4-гидрокси-3-метилфенокси)фенил]-N-метилкарбамат
К суспензии гидрида натрия (55 вес.%, 0,87 г) в N,N-диметилформамиде (20 мл) добавляли
метилгидрохинон (1,24 г). Смесь
перемешивали при температуре окружающей среды в течение 15 минут. К этой смеси добавляли небольшими порциями трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамат (2,87 г)
и перемешивали при 120oС в течение 2 часов. Реакционную смесь концентрировали и остаток распределяли между этилацетатом и водой. Этилацетатный слой сушили над сульфатом натрия и
концентрировали при пониженном
давлении. Остаток очищали хроматографией на колонке с силикагелем с использованием смеси н-гексан/этилацетат = 3/1 в качестве элюента, получая смесь (2,20 г) трет-бутил
N-[5-(4-гидрокси-2-метилфенокси)-2-нитрофенил]-N-метилкарбамата и трет-бутил N-[5-(4-гидрокси-3-метилфенокси)-2-нитрофенил] -N-метилкарбамата. Смесь раствора вышеуказанного продукта и палладия на
угле
(10%, 0,21 г) интенсивно перемешивали при температуре окружающей среды в атмосфере водорода в течение 2 часов. По окончании данного времени катализатор удаляли фильтрованием и фильтрат
концентрировали,
получая указанное в заголовке соединение (1,88 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 2/1: Rf=0, 16.
Ссылочный пример 45
трет-Бутил N-[5-(4'-бензилоксибифенил-4-илокси)-2-нитрофенил] -N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в
ссылочном примере 6, с
использованием 4'-бензилоксибифенил-4-ола (11,07 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (11,5 г), гидрида натрия (55 вес.%, 2,2 г) и смеси безводный N,
N-диметилформамид/безводный
тетрагид-рофуран/безводный толуол= 1/1/1 (360 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (14,75 г).
Т.пл.: 123-125oС.
Ссылочный пример 46
трет-Бутил N-[5-(4-цианофенокси)-2-нитрофенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере
6, с использованием
4-цианофенола (5,1 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (11,5 г), гидрида натрия (55 вес.%, 1,19 г) и смеси безводный N, N-диметилформамид/безводный
тетрагидрофуран = 5/3 (80 мл) и
реакционную смесь очищали, получая указанное в заголовке соединение (8,45 г).
Т.пл.: 141-143oС.
Ссылочный пример 47
N-Метил-N-[2-нитро-5-(пентафторфенокси)фенил]амин
К суспензии гидрида натрия (55 вес.%, 1,66 г) в безводном N,N-диметилформамиде (50 мл) добавляли пентафторфенол (6,38 г). Смесь
перемешивали
при температуре окружающей среды в течение нескольких минут. К этой смеси добавляли небольшими порциями) трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамат (10 г) и смесь перемешивали
при 150oС в течение 15 часов. Реакционную смесь концентрировали и остаток распределяли между этилацетатом и водой. Экстракт сушили над безводным сульфатом натрия и концентрировали при
пониженном
давлении. Остаток очищали хроматографией на колонке с силикагелем с использованием смеси н-гексан/толуол =4/1 в качестве элюента, получая указанное в заголовке соединение (2,2 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/толуол = 2/1: Rf=0,14.
Ссылочный пример 48
трет-Бутил
N-[2-амино-5-(пиридин-2-илтио)фенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-метил-N-[2-нитро-5-(пиридин-2-илтио)фенил] карбамата (1,08 г), палладия на угле (10%, 1,00 г) и метанола (20 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (0,78 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 3/2: Rf=0,33.
Ссылочный пример 49
трет-Бутил
N-[2-амино-5-(2-гидроксифенокси)фенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-[5-(2-бензилоксифенокси)-2-нитрофенил]-N-метилкарбамата (4,14 г), палладия на угле (10%, 0,41 г) и метанола (60 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (2,89
г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 2/1: Rf=0,26.
Ссылочный пример 50
трет-Бутил
N-{5-[4-(1-адамантил)фенокси]-2-аминофенил}-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-{5-[4-(1-адамантил)фенокси]-2-нитрофенил} -N-метилкарбамата (4,28 г), палладия на угле (10%, 0,42 г) и метанола (60 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (4,00
г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 2/1: Rf=0,49.
Ссылочный пример 51
трет-Бутил
N-[2-амино-5-(3-диметиламинофенокси)фенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-[5-(3-диметиламинофенокси)-2-нитрофенил]-N-метилкарбамата (2,14 г), палладия на угле (10%, 2,14 г) и метанола (40 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (1,63
г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 2/1: Rf=0,41.
Ссылочный пример 52
трет-Бутил
N-{2-амино-5-[4-(имидазол-1-ил)фенокси]фенил}-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-{5-[4-(имидазол-1-ил)фенокси]-2-нитрофенил} -N-метилкарбамата (8,8 г), палладия на угле (10%, 0,8 г) и N,N-диметилформамида (160 мл) и реакционную смесь очищали, получая указанное в заголовке
соединение (5,7 г).
Т.пл.: 115-116oС.
Ссылочный пример 53
трет-Бутил N-[2-амино-5-(2-фенилфенокси)фенил]-N-метилкарбамат
Реакцию
проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил N-метил-N-[2-нитро-5-(2-фенилфенокси)фенил] карбамата (8,3 г), палладия на угле (10%, 0,66 г) и смеси
толуол/метанол=7/3 (100 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (6,9 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси бензол/этилацетат = 4/1: Rf=0,30.
Ссылочный пример 54
трет-Бутил N-[2-амино-5-(4-гидрокси-2,3-диметилфенокси) фенил]-N-метилкарбамат
Реакцию проводили
способом,
аналогичным описанному в ссылочном примере 7, с использованием трет-бутил N-[5-(4-гидрокси-2,3-диметилфенокси)-2-нитрофенил] -N-метилкарбамата (1,90 г), палладия на угле (10%, 0,20 г) и
метанола (20
мл) и реакционную смесь очищали, получая указанное в заголовке соединение (1,61 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 2/1: Rf=0,13.
Ссылочный пример 55
трет-Бутил N-[2-амино-5-(4-феноксифенокси)фенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным
описанному в ссылочном
примере 7, с использованием трет-бутил N-[2-нитро-5-(4-феноксифенокси)фенил]-N-метилкарбамата (8,6 г), палладия на угле (10%, 0,6 г) и смеси толуол/метанол = 16/3 (190 мл) и
реакционную смесь очищали,
получая указанное в заголовке соединение (7,2 г).
Т.пл.: 105-106oС.
Ссылочный пример 56
трет-Бутил
N-[2-амино-5-(4-гидроксифенилтио)фенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-[5-(4-гидроксифенилтио)-2-нитрофенил]-N-метилкарбамата (2,84 г), палладия на угле (10%, 1,52 г) и метанола (50 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (2,37 г).
Т.пл.: 62-67oС.
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/2: Rf=0,59.
Ссылочный
пример 57
трет-Бутил N-[2-амино-5-(3-фенилфенокси)фенил]-N-метил-карбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-[2-нитро-5-(3-фенилфенокси)фенил]-N-метилкарбамата (8,70 г), палладия на угле (10%, 0,69 г) и смеси толуол/метанол= 7/3 (100 мл) и реакционную смесь очищали, получая указанное в заголовке
соединение
(6,06 г).
Т.пл.: 114-115oС.
Ссылочный пример 58
трет-Бутил N-[2-амино-5-(3-трет-бутил-4-гидроксифенокси)фенил]-N-метилкарбамат
Реакцию
проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил N-[5-(3-трет-бутил-4-гидроксифенокси)-2-нитрофенил] -N-метилкарбамата (1,29 г), палладия на угле
(10%, 0,
16 г) и метанола (40 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (1,11 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 2/1: Rf=0,18.
Ссылочный пример 59
трет-Бутил N-[2-амино-5-(2-трет-бутил-4-гидроксифенокси)фенил] -N-метилкарбамат
Реакцию
проводили способом,
аналогичным описанному в ссылочном примере 7, с использованием трет-бутил N-[5-(2-трет-бутил-4-гидроксифенокси)-2-нитрофенил] -N-метилкарбамата (1,09 г), палладия на угле (10%, 0,
15 г) и метанола (20
мл) и реакционную смесь очищали, получая указанное в заголовке соединение (0,95 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 2/1: Rf=0,18.
Ссылочный пример 60
трет-Бутил N-[2-амино-5-(4-фенилфенокси)фенил]-N-метил-карбамат
Реакцию проводили способом, аналогичным
описанному в ссылочном
примере 7, с использованием трет-бутил N-[2-нитро-5-( 4-фенилфенокси)фенил]-N-метилкарбамата (5,32 г), палладия на угле (10%, 0,68 г) и смеси толуол/этилацетат= 1/1 (140 мл) и
реакционную смесь
очищали, получая указанное в заголовке соединение (4,82 г).
Т.пл.: 122-123oС.
Ссылочный пример 61
трет-Бутил
N- [2-амино-5- (4-гидрокси-2,
5-диметилфенокси) фенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил N-[5-(4-гидрокси-2,
5-диметилфенокси)-2-нитрофенил] -N-метилкарбамата (1,73 г), палладия на угле (10%, 0,17 г) и метанола (50 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (1,44 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 2/1: Rf=0,17.
Ссылочный пример 62
трет-Бутил
N-[2-амино-5-(4'-гидроксибифенил-4-илокси)фенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-[5-(4'-бензилоксибифенил-4-илокси)-2-нитрофенил] -N-метилкарбамата (14,75 г), палладия на угле (10%, 0,86 г) и смеси толуол/этилацетат = 1/1 (140 мл) и реакционную смесь очищали, получая указанное
в
заголовке соединение (10,2 г).
Т.пл.: 89-91oС.
Ссылочный пример 63
трет-Бутил N-[2-амино-5-(4-гидрокси-3,
5-ди-трет-бутилфенокси)фенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил N-[5-(4-гидрокси-3,
5-ди-трет-бутилфенокси)-2-нитрофенил] -N-метилкарбамата (0,58 г), палладия на угле (10%, 0,12 г) и метанола (20 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (0,55 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 3/1: Rf=0,29.
Сссылочный пример 64
[2-Амино-5-(4-цианофенокси)фенил]метиламин
Раствор трет-бутил N-[5-(4-цианофенокси)-2-нитрофенил]-N-метилкарбамата (3,29 г) и дигидрата дихлорида олова (10,06) в смеси
трет-бутанол/этилацетат
= 1/9 (100 мл) перемешивали при 60oС в течение 1 часа. Затем к смеси добавляли боргидрид натрия (0,17 г) и затем смесь перемешивали при той же температуре в течение
2,5 часов. Реакционную
смесь концентрировали и к остатку добавляли воду. Данную смесь нейтрализовали бикарбонатом натрия и к нейтрализованному раствору добавляли этилацетат. Смесь фильтровали через
целит для удаления
нерастворимого вещества. Этилацетатный слой отделяли и сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с
силикагелем с
использованием в качестве элюента смеси н-гексан/этилацетат=3/2, получая указанное в заголовке соединение (1,49 г).
Т.пл.: 80-82oС.
Ссылочный пример 65
трет-Бутил N-[5-(4-бензоил-3-гидроксифенокси)-2-нитрофенил] -N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 6, с
использованием 2,
4-дигидроксибензофенона (4,5 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (6,0 г), гидрида натрия (55 вес.%, 1,75 г) и безводного N,N-диметилформамида (130 мл) и
реакционную смесь очищали,
получая указанное в заголовке соединение (2,2 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 5/1: Rf=0,36.
Ссылочный пример 66
трет-Бутил N-[2-амино-5-(4-бензил-3-гидроксифенокси)фенил] -N-метилкарбамат
Смесь раствора
N-[5-(4-бензоил-3-гидроксифенокси)-2-нитрофенил]-N-метилкарбамата (2,1
г) в смеси метанол/тетрагидрофуран =5,3 (80 мл) и палладия на угле (20%, 0,5 г) перемешивали при температуре окружающей среды в
атмосфере водорода в течение 4 часов. Реакционную смесь фильтровали для
удаления катализатора и фильтрат концентрировали, получая указанное в заголовке соединение (1,8 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 2/1: Rf=0,26.
Ссылочный пример 67
трет-Бутил
N-метил-N-[5-(4-метилтиофенокси)-2-нитрофенил]карбамат
Реакцию проводили способом, аналогичным
описанному в ссылочном примере 6, с использованием 4-метилтиофенола (0,98 г), трет-бутил
N-(5-хлор-2-нитрофенил)-N-метилкарбамата (2,00 г), гидрида натрия (55 вес.%, 0,31 г) и безводного N,
N-диметилформамида (60 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (2,
56 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 9/1: Rf=0,17.
Ссылочный пример 68
трет-Бутил
N-метил-N-[5-(4-метоксифенокси)-2-нитрофенил] карбамат
Реакцию проводили способом, аналогичным
описанному в ссылочном примере 6, с использованием 4-метоксифенола (5,0 г), трет-бутил
N-(5-хлор-2-нитрофенил)-N-метилкарбамата (10/9 г), гидрида натрия (55 вес.%, 2,2 г) и безводного N,
N-диметилформамида (120 мл) и реакционную смесь очищали, получая указанное в заголовке соединение
(12,2 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 8/1: Rf=0,32.
Ссылочный пример 69
трет-Бутил
N-метил-N-[2-нитро-5-(4-трифторметилфенокси) фенил]карбамат
Реакцию проводили способом,
аналогичным описанному в ссылочном примере 6, с использованием 4-трифторметилфенола (3,0 г),
трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (4,3 г), гидрида натрия (55 вес.%, 1,1 г) и безводного
N,N-диметилформамида (70 мл) и реакционную смесь очищали, получая указанное в заголовке
соединение (1,26 г).
Т.пл.: 92-93oС.
Ссылочный пример 70
трет-Бутил N-метил-N-[5-(4-бензилфенокси)-2-нитрофенил] карбамат
Реакцию
проводили способом, аналогичным описанному в ссылочном примере 6, с использованием 4-бензилфенола (7 г), трет-бутил
N-(5-хлор-2-нитрофенил)-N-метилкарбамата (9,15 г), гидрида натрия (55 вес.%, 1,74
г) и безводного N,N-диметилформамида (70 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (12,
2 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси толуол/диизопропиловый эфир = 20/1:Rf=0,40.
Ссылочный пример 71
трет-Бутил
N-метил-N-[5-(3-бензилоксифенокси)-2-нитрофенил]карбамат
Реакцию
проводили способом, аналогичным описанному в ссылочном примере 6, с использованием 3-бензилоксифенола (5 г), трет-бутил
N-(5-хлор-2-нитрофенил)-N-метилкарбамата (6 г), гидрида натрия (55 вес.%, 1,1
г) и безводного N,N-диметилформамида (40 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (7,8
г).
Тонкослойная хроматография на пластинке с силикагелем с
использованием смеси н-гексан/этилацетат = 5/1: Rf=0,32
Ссылочный пример 72
трет-Бутил
N-[2-амино-5-(4-метилтиофенокси)фенил]-N-метилкарбамат
Реакцию проводили способом,
аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-метил-N-[5-(4-метилтиофенокси)-2-нитрофенил] карбамата (2,53 г), палладия на угле (10%, 2,5 г) и метанола (55 мл) и
реакционную смесь очищали, получая указанное в заголовке соединение (1,94 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 4/1: Rf=0,15.
Ссылочный пример 73
трет-Бутил
N-[2-амино-5-(4-метоксифенокси)фенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере
7, с использованием трет-бутил
N-[5-(4-метоксифенокси)-2-нитрофенил]-N-метилкарбамата (7,2 г), палладия на угле (10%, 0,5 г) и метанола (100 мл) и реакционную смесь очищали, получая указанное в
заголовке соединение (6,23 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 5/1: Rf=0,18.
Ссылочный пример 74
трет-Бутил
N-[2-амино-5-(4-трифторметилфенокси)фенил]-N-метилкарбамат
К раствору трет-бутил N-мeтил-N-[5-(4-трифторметилфенокси)-2-нитрофенил] карбамата в смеси вода/диоксан =1/5 (60
мл) добавляли
бикарбонат натрия (4,2 г) и дитионит натрия (3,5 г). Смесь нагревали при кипении с обратным холодильником в течение 1 часа. По окончании этого времени реакционную смесь распределяли
между этилацетатом
и водой. Этилацетатный слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Остаток
очищали хроматографией
на колонке с силикагелем с использованием в качестве элюента смеси н-гексана/этилацетата =3/1 -2/1, получая указанное в зааголовке соединение (0,7 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 4/1: Rf=0,27.
Ссылочный пример 75
трет-Бутил
N-[2-амино-5-(4-бензилфенокси)фенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-[5-(4-бензилфенокси)-2-нитрофенил]-N-метилкарбамата (12,2 г), палладия на угле (10%, 0,91 г) и
смеси толуол/этилацетат = 1/1 (140 мл) и реакционную смесь очищали, получая указанное в заголовке
соединение (10,1 г).
Т.пл.: 114-115oС.
Ссылочный пример
76
трет-Бутил N-[2-амино-5-(3-гидроксифенокси)фенил]-N-метилкарбамат
Реакцию
проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-[5-(3-гидроксифенокси)-2-нитрофенил]-N-метилкарбамата (7,8 г), палладия на угле (10%, 0,9 г) и смеси
толуол/этилацетат =1/1 (140 мл) и реакционную смесь очищали, получая указанное в заголовке
соединение (6 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси н-гексан/этилацетат = 1/1: Rf=0,50.
Ссылочный пример 77
трет-Бутил N-метил-N-[2-нитро-5-(4-тетразол-5-илфенокси) фенил]карбамат
Смесь трет-бутил
N-[5-(4-цианофенокси)-2-нитрофенил]-N- метилкарбамата (2,95 г), азидотрибутилолова (7,97 г) и
безводного толуола (30 мл) нагревали при кипении с обратным холодильником в течение 23 часов. Реакционную
смесь концентрировали и затем распределяли между этилацетатом и водой. Этилацетатный слой
сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали жидкостной
хроматографией с обращенной фазой с использованием смеси вода/ацетонитрил =1/1 в качестве
элюента, получая указанное в заголовке соединение (3,20 г).
Т.пл.: 81-84oС.
Ссылочный пример 78
трет-Бутил N-метил-N-{
2-нитро-5-[4-(2-трифенилметилтетразол-5-ил)фенокси]фенил}карбамат
Смесь трет-бутил
N-метил-N-[2-нитро-5-(4-тетразол-5-илфенокси)фенил]карбамата (3,22 г), трифенилметилхлорида (2,18 г),
триэтиламина (0,79 г), безводного тетрагидрофурана (30 мл) и безводного N,N-диметилформамида
перемешивали при температуре окружающей среды в течение 24 часов. Реакционную смесь концентрировали и
распределяли между этилацетатом и водой. Этилацетатный слой сушили над безводным сульфатом натрия
и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с
силикагелем с использованием в качестве элюента смеси н-гексан/этилацетат =5/1, получая указанное в
заголовке соединение (3,15 г).
Т.пл.: 161-163oС.
Ссылочный пример 79
трет-Бутил N-метил-N-{
2-амино-5-[4-(2-трифенилметилтетразол-5-ил)фенокси]фенил}карбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7,
с использованием трет-бутил
N-метил-N-{2-нитро-5-[4-(2-трифенилметилтетразол-5-ил)фенокси] фенил}карбамата (0,98 г), палладия на угле (10%, 0,13 г) и этилацетата (100 мл) и реакционную смесь очищали,
получая указанное в
заголовке соединение (0,70 г).
Т.пл.: 192-193oС.
Ссылочный пример 80
2-Гидроксиметил-1-метил-6-пентафторфенокси-1Н-бензимидазол
Смесь
N-метил-N-[2-нитро-5-(пентафторфенокси)фенил] амина (2,10 г), палладия на угле (10%, 0,23 г) метанола (300 мл) перемешивали в
атмосфере водорода при температуре окружающей среды в течение 4 часов.
Катализатор удаляли фильтрованием и фильтрат концентрировали. Остаток очищали хроматографией на колонке с силикагелем с
использованием в качестве элюента смеси н-гексан/этилацетат=3/1, получая
N-[2-амино-5-(пентафторфенокси)фенил]-N-метиламин (1,48 г), Rf которого составляло 0,26 при тонкослойной хроматографии на
пластинке с силикагелем с использованием смеси н-гексан/этилацетат=4/1. Смесь
данного продукта, гликолевой кислоты (0,76 г), 4 н. соляной кислоты (25 мл) и диоксана (25 мл) нагревали при кипении с
обратным холодильником в течение 16 часов. Реакционную смесь концентрировали и к
остатку добавляли воду. Смесь нейтрализовали бикарбонатом натрия и экстрагировали этилацетатом. Этилацетатный слой
сушили над безводным сульфатом натрия и концентрировали. Остаток очищали
хроматографией на колонке с силикагелем с использованием в качестве элюента смеси этилацетат/метанол =20/1. Продукт
кристаллизовали из н-гексана при облучении ультразвуком. Кристаллы собирали
фильтрованием и промывали н-гексаном, получая указанное в заголовке соединение (1,17 г).
Т.пл.: 121-128oС.
Ссылочный пример 81
4-Цианофенокси-2-гидроксиметил-1-метил-1Н-бензимидазол
Смесь N-[2-амино-5-(4-цианофенокси)фенил]-N-метиламина (1,08 г), гликолевой
кислоты (0,68 г), 4 н. соляной кислоты (20 мл) и 1,
4-диоксана (20 мл) нагревали при кипении с обратным холодильником в течение 9 часов. Реакционную смесь концентрировали и к остатку добавляли воду.
Смесь нейтрализовали бикарбонатом натрия и
экстрагировали этилацетатом. Этилацетатный слой сушили над безводным сульфатом натрия и затем концентрировали. Остаток очищали хроматографией на колонке с
силикагелем, используя в качестве элюента
смесь этилацетат/метанол=20/1, получая указанное в заголовке соединение (0,86 г).
Т.пл.: 183-185oС.
Ссылочный
пример 82
5-{
4-[6-(4-Цианофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил}-3-трифенилметилтиазолидин-2,4-дион
Смесь 4-цианофенокси-2-гидроксиметил-1-метил-1Н- бензимидазола
(279 мг),
5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона (558 мг), азодикарбонилпиперидина (378 мг), три-н-бутилфосфина (303 мг) и толуола (20 мл) перемешивали при температуре окружающей
среды в
течение 15 часов. Реакционную смесь очищали хроматографией на колонке с силикагелем с использованием в качестве элюента н-гексан/этилацетат=1/1, получая указанное в заголовке соединение (706
мг).
Т.пл.: 135-138oС.
Ссылочный пример 83
4-Бензилокси-2,5-ди-трет-бутилфенилацетат
К раствору 2,5-ди-трет-бутил-4-гидроксифенилацетата
(5,3 г)
в ацетоне (40 мл) добавляли бензилбромид (5,17 г) и карбонат калия (4,15 г). Смесь перемешивали при температуре окружающей среды в течение 48 часов. Реакционную смесь распределяли между
этилацетатом
и водой. Этилацетатный слой сушили над безводным сульфтом натрия и концентрировали. Остаток очищали хроматографией на колонке с силикагелем с использованием в качестве элюента смеси
ц-гексан/диизопропиловый эфир=1/1, получая указанное в заголовке соединение (4,9 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси ц-гексан/диизопропиловый эфир = 10/1:Rf=0,35.
Ссылочный пример 84
4-Бензилокси-2,5-ди-трет-бутилфенол
К раствору гидроксида калия (1,51 г) в метаноле (12 мл)
добавляли 4-бензилокси-2,5-ди-трет-бутилфенилацетат (4,9 г). Смесь оставляли на ночь при температуре окружающей среды. Реакционную смесь нейтрализовали разбавленной соляной кислотой и затем
экстрагировали этилацетатом. Этилацетатный раствор сушили над безводным сульфатом натрия и упаривали досуха, получая указанное в заголовке соединение (4,3 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси ц-гексан/диизопропиловый эфир = 10/1:Rf=0,44.
Ссылочный пример 85
трет-Бутил N-[5-(4-бензилокси-2,
5-ди-трет-бутилфенокси)-2-нитрофенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 6, с использованием 4-бензилокси-2,5-ди-трет-бутилфенола (4,3 г),
трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (3,51 г), гидрида натрия (55 вес.%, 0,72 г) и безводного N,N-диметилформамида (15 мл) и реакционную смесь очищали, получая указанное в заголовке
соединение (7,1 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием. смеси ц-гексан/диизопропиловый эфир = 10/1:Rf=0,20.
Ссылочный пример
86
трет-Бутил N-[2-амино-5-(2,5-ди-трет-бутил-4-гидроксифенокси)фенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием
трет-бутил
N-[5-(4-бензилокси-2,5-ди-трет-бутилфенокси)-2-нитрофенил]-N-метил-
карбамата (7,1 г), палладия на угле (10%, 0,7 г) и смеси толуол/метанол/этилацетат = 16/16/25 (57 мл) и
реакционную смесь
очищали, получая указанное в заголовке соединение (3,56 г).
Т.пл.: 208-210oС.
Ссылочный пример 87
6-(3,
5-Ди-трет-бутил-4-гидрокси)фенилтио-2-гидроксиметил-1-метил-1Н-бензимидазол
К раствору [2-амино-5-(3,5-ди-трет-бутил-4-гидроксифенилтио)фенил] метиламина (11,68 г), который получали
гидрированием и обработкой кислотой трет-бутил N-[5-(3,5-ди-трет-бутил-4-гидроксифенокси)-2-нитрофенил]-N-метилкарбамата, в 4 н. соляной кислоте (300 мл) добавляли гликолевую кислоту (7,43 г). Смесь
нагревали при кипении с обратным холодильником в течение 6 часов. Реакционную смесь выливали в смесь льда и воды и нейтрализовали бикарбонатом натрия и экстрагировали этилацетатом. Этилацетатный
раствор сушили над безводным сульфатом натрия и концентрировали. Остаток очищали хроматографией на колонке с силикагелем с использованием в качестве элюента смеси этилацетат/метанол =20/1, получая
указанное в заголовке соединение (8,66 г).
Т.пл.: 195-198oС.
Ссылочный пример 88
4-[6-(3,
5-Ди-трет-бутил-4-гидроксифенилтио)-1-метил-1Н-бензимидазол-2-илметокси]бензальдегид
Смесь 6-(3,5-ди-трет-бутил-4-гидрокси)фенилтио-2-гидроксиметил-1-метил-1Н-бензимидазола (5,33 г),
4-гидроксибензальдегида (2,22 г), 1,1'-(азодикарбонил) дипиперидина (4,59 г), три-н-бутилфосфина (3,68 г) и безводного толуола перемешивали при температуре окружающей среды в течение 64 часов.
Реакционную смесь концентрировали. Остаток очищали хроматографией на колонке с силикагелем с использованием в качестве элюента смеси н-гексан/этилацетат = 1/1, давая указанное в заголовке соединение
(3,74 г).
Т.пл.: 219-221oС.
Ссылочный пример 89
трет-Бутил N-[5-(4-трет-бутоксикарбониламинофенокси)-2-нитрофенил]-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 6, с использованием трет-бутил (4-гидроксифенил)карбамата (15,6 г), трет-бутил N-(5-хлор-2-нитрофенил)-N-метилкарбамата (21 г),
гидрида натрия (55 вес. %, 3,22 г) и безводного N,N-диметилформамида (130 мл) и реакционную смесь очищали, получая указанное в заголовке соединение (27,7 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси толуол/диизопропиловый эфир = 10/1:Rf=0,33.
Ссылочный пример 90
трет-Бутил
N-[2-амино-5-(4-трет-бутоксикарбониламинофенокси)фенил] -N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-[5-(4-трет-бутоксикарбониламинофенокси)-2-нитрофенил] -N-метилкарбамата (27,7 г), палладия на угле (10%, 1,07 г) и смеси тетрагидрофуран/этилацетат = 9/8 (170 мл) и реакционную смесь очищали,
получая указанное в заголовке соединение (26,2 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси ц-гексан/тетрагидрофуран = 2/1: Rf=0,37.
Ссылочный пример 91
трет-Бутил N-{5-[4-(трет-бутоксикарбонил-н-гексиламино) фенокси)-2-нитрофенил]-N-метилкарбамат
К суспензии гидрида натрия (55 вес.%, 1,26 г) в
безводном N,N-диметилформамиде (100 мл) добавляли N-[5-(4-трет-бутоксикарбониламинофенокси)-2-нитрофенил] -N-метилкарбамат (12,1 г). Смесь перемешивали при температуре окружающей среды в течение
нескольких минут. К смеси добавляли броммистый гексил (6,5 г) при охлаждении льдом и смесь перемешивали при той же температуре в течение 30 минут, а затем при комнатной температуре в течение 1,0
часа.
Реакционную смесь концентрировали и остаток распределяли между этилацетатом и водой. Этилацетатный слой сушили над безводным сульфатом натрия и концентрировали. Остаток очищали хроматографией
на
колонке с силикагелем с использованием в качестве элюента смеси толуол/диизопропиловый эфир = 100/7, получая указанное в заголовке соединение (13,8 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси толуол/диизопропиловый эфир = 100/7:Rf=0,32.
Ссылочный пример 92
трет-Бутил
N-{2-амино-5-[4-(трет-бутоксикарбонил-н- гексиламино)фенокси] фенил}-N-метилкарбамат
Реакцию проводили способом, аналогичным описанному в ссылочном примере 7, с использованием трет-бутил
N-{5-[4-(трет-бутоксикарбонил-н-гексиламино)фенокси] -2-нитрофенил}-N-метилкарбамата (13,8 г), палладия на угле (10%, 1,0 г) и смеси толуол/этилацетат = 1/1 (140 мл) и реакционную смесь очищали,
получая указанное в заголовке соединение (13,1 г).
Тонкослойная хроматография на пластинке с силикагелем с использованием смеси толуол/этилацетат = 3/1:Rf=0,44
Фармакологическое испытание, пример 1
Действие против липидных пероксидов
Ингибирующее действие соединения изобретения против продуцирования липидного пероксида проводили с
использованием микросомы печени крысы.
К 400 мкл смеси 1:2 буфера [0,1М водный раствор трис(гидроксиметил)аминометана, доведенный до рН 7,4 соляной кислотой} и 0,15 М водного
раствора
хлорида калия добавляли 5 мкл раствора с предварительно определенной концентрацией испытуемого соединения в диметилсульфоксиде и 100 мкл печеночной микросомы от крыс Wister (возраст 10
недель) с
последующим перемешиванием при 37oС в течение 5 минут. Для инициирования реакции указанной смеси добавляли 10 мкл 1:1 смешанного раствора из 0,5 мМ водного раствора 7-гидрата
сульфата
железа (II) и 50 мМ водного раствора цистеина и полученную смесь перемешивали при 37oС в течение 30 минут. К реакционной смеси для окончания реакции добавляли 1 мл 10%-ного
водного раствора
трихлоруксусной кислоты. Реакционную смесь центрифугировали при 3000 об/мин при 5oС в течение 10 минут и супернатант отделяли. К 1,0 мл супернатанта добавляли 1,0 мл
50%-ного водного
раствора уксусной кислоты, содержащей 0,67% тиобарбитуровой кислоты и смесь кипятили при 100oС в течение 15 минут. Затем реакционную смесь оставляли при комнатной
температуре на 15 минут и
измеряли поглощение на длине волны 535 нм. Из поглощения контроля, измеренного без испытуемого соединения, и поглощения в присутствии испытуемых соединений с предварительно
определенной концентрацией
определяли степень ингибирования (%) и определяли концентрацию 50% ингибирования испытуемого соединения против липидного пероксида. Результаты следующие:
Соединение примера - IC50
(мкг/мл)
1-2а - 0,97
2-2а - 0,54
4-2а - 0,83
5b - 1,3
7-2а - 0,65
8-2b - 3,2
Из приведенных выше
результатов было установлено, что
соединения по настоящему изобретению обладают превосходным действием против липидных пероксидов.
Фармакологическое испытание, пример 2
Ингибирующее действие в отношении
5-липоксигеназы
В 5 мкл раствора испытуемого соединения в диметилсульфоксиде добавляли 750 мкл 1/15М фосфатного буфера (рН 7,4), который получали
растворением упаковки порошка фосфатного
буфера (Yatron) в 10 мл воды, 40 мкл 30 мМ водного раствора хлорида кальция, 50 мкл 20 мМ водного GSH (глютантион, восстановленная форма) раствора, 50 мкл 40
мМ водного раствора АТФ
(аденозин-5-трифосфат) и 100 мкл полиморфоядерного лейкоцитного феремента морской свинки с последующим перемешиванием при 25oС в течение 5 минут. Для инициирования
реакции к указанной смеси
добавляли 5 мкл арахидоновой кислоты (10 мг/мл этанола) и смесь перемешивали при 25oС в течение 5 минут. Для прекращения реакции к реакционной смеси добавляли 50
мкл 2 н. соляной кислоты.
Затем к реакционной смеси добавляли 2,0 мл этилацетата, содержащего вещество внутреннего стандарта (вещество внутреннего стандарта: 2 мкг/мл изоамилпарабена). Полученную
смесь экстрагировали в течение
1 минуты с помощью смесителя с последующим отделением в центрифуге при 3000 об/мин в течение 5 минут. Этилацетатный слой отделяли, упаривали досуха при пониженном
давлении и затем растворяли в 200 мкл
ацетонитрила. С помощью высокоэффективной жидкостной хроматографии определяли количество 5-НЕТЕ. Из определения 5-НЕТЕ для контроля без испытуемого соединения и
для испытуемых соединений находили
степень ингибирования (%) и определяли концентрацию 50% ингибирования испытуемых соединений против 5-липоксигеназы. Результаты следующие:
Пример . - IC50 (мкг/мл)
1-2а - 0,
59
2-2а - 0,10
4-2а - 0,20
5b - 0,53
Из вышеуказанных результатов было установлено, что соединения согласно настоящему
изобретению обладают превосходным
5-липоксигеназаингибирующим действием.
Фармакологическое испытание, пример 3
Гипогликемическое действие
Образец крови отбирали из
хвостовой вены каждой из мышей КК
(возраст 4-5 месяцев), болеющих диабетом, и измеряли уровень сахара в крови. Затем мышей классифицировали на группы (4 мыши в группе) таким образом, чтобы у мышей
был примерно равный уровень сахара в
крови. На протяжении трех дней мышам давали порошкообразную еду (F-1, произведенную Funabashi Farm), отрегулированную так, чтобы она содержала 0,01% испытуемого
соединения. Группа мышей, которым
вводили испытуемое соединение, упоминается как "группа с введением лекарственного средства", тогда как та, где мыши получали порошковую еду, не содержащую
испытуемого соединения, называется
"контроль". Через три дня отбирали образцы крови из хвостовой вены каждой мыши и измеряли концентрацию глюкозы в плазме, полученной отделением на центрифуге, с
использованием анализатора глюкозы
("Glucoroder" A&T Inc.).
Степень снижения сахара в крови рассчитывали из следующего уравнения:
Степень снижения сахара в крови (%)
= (средний уровень сахара в крови
для контроля - средний уровень сахара в крови для группы с введением лекарственного средства) •100/ уровень сахара в крови контроля
Пример No.
- Степень снижения сахара в крови (%)
1-2b - 48,1
2-2b - 49,2
3-2 - 60,1
4-2а - 67,5
6-2 - 62,6
7-2а - 71,7
13-2b - 68,1
19-2
- 66,8
34-2b - 71,2
40
- 66,4
51 - 63,6
Из вышеуказанных результатов было установлено, что соединения по настоящему изобретению обладают превосходным
гипогликемическим действием. Т Тц
Реферат
Изобретение относится к новым гетероциклическим соединениям формулы (I), где R1 представляет группу формулы (II), R представляет 2, 4-диоксотиазолидин-5-илметильную группу и др., А представляет C1-6 алкиленовую группу, В представляет атом кислорода, R4 представляет замещенный фенил или пиридил, который может иметь заместитель, R6 представляет атом водорода или C1-6 алкильную группу, D представляет атом кислорода или серы, Е представляет СН группу или атом азота, или их фармакологически приемлемым солям. Изобретение также относится к способу фармакологического воздействия, способу ингибирования 5-липоксигеназы, ингибирования продукции липидных пероксидов или снижения уровня сахара в крови. Изобретение может быть использовано в медицине в качестве терапевтического средства. 3 с. и 54 з.п.ф-лы, 10 табл.
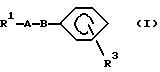
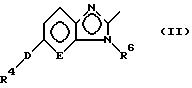
Формула
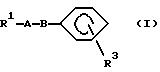
где R1 представляет собой группу формулы (II)
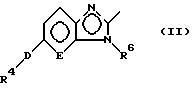
в которой R4 представляет собой фенильную группу, которая замещена 1-5 заместителями, выбранными из определенных ниже заместителейα, или пиридильную группу, которая может быть замещена 1-4 заместителями, выбранными из определенных ниже заместителей α;
R6 представляет собой атом водорода или C1-6 алкильную группу;
D представляет собой атом кислорода или серы;
Е представляет собой СН группу или атом азота;
R3 представляет собой группу, выбранную из следующих формул (IV-1) и (IV-2) или их таутомеров в случае (IV-2):


А представляет собой C1-6 алкиленовую группу;
В представляет собой атом кислорода;
при условии, что 5-{ 4-[5-(3,5-ди-трет-бутил-4-гидроксифенилтио)-3-метил-3Н-имидазо[4,5-b] пиридин-2-илметокси] бензил} тиазолидин-2,4-дион исключен, и что, когда R4 представляет собой замещенную фенильную группу и D представляет атом серы, тогда Е представляет собой атом азота,
или его фармакологически приемлемая соль, пролекарство или сольват,
где заместители α - атом галогена, гидроксильная группа, C1-6 алкильная группа, галоген (C1-6 алкильная) группа, C1-6 алкоксигруппа, C1-6 алкилтиогруппа, аминогруппа, которая может быть замещена заместителями, выбранными из определенных ниже заместителей γ, группы С3-10 циклоалкил, C6-10 арил, C7-16 аралкил и C6-10 арилокси, каждая из которых может быть замещена 1-3 заместителями, выбранными из определенных ниже заместителей β, C1-7 алифатическая ацилоксигруппа, 4 - 7-членная насыщенная азотсодержащая гетероциклическая группа, 5- или 6-членная ароматическая азотсодержащая гетероциклическая группа и цианогруппа;
заместители β - атом галогена, гидроксильная группа и C1-6 алкоксигруппа;
заместители γ - C1-10 алкильная группа, C6-10 арильная группы, каждая из которых может иметь 1-3 заместителя, выбранных из атомов галогена и гидроксильной, C1-6 алкильной, галоген (C1-6 алкильной) и C1-6 алкоксигрупп, и ацильная группа (указанная ацильная группа представляет собой C1-7 алифатическую ацильную группу или С7-11 ароматическую ацильную, С4-11 циклоалкилкарбонильную или 5- или 6-членную ароматическую азотсодержащую гетероциклическую карбонильную группу, каждая из которых может иметь 1-3 заместителя, выбранных из атомов галогена и гидроксильной и C1-6 алкильной групп).
5-{ 4-[6-(4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[1-метил-6-(4-трифторметилфенокси)-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[1-метил-6-(4-метоксифенокси)-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[1-метил-6-(4-метилтиофенокси)-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2, 4-дион,
5-{ 4-[6-(4-аминофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(3-диметиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-ацетиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2, 4-дион,
5-{ 4-[1-метил-6-(4-фенилфенокси)-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4'-гидроксибифенил-4-илокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-бензилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-(6-[2-(пирролидин-1-ил)фенокси] -1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2, 4-дион,
5-{ 4-(6-[2-(пиперидин-1-ил)фенокси] -1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-(6-[2-(морфолин-4-ил)фенокси] -1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-(1-метил-6-[3-(морфолин-4-ил)фенокси] -1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(2-хлор-4-гидрокси-3,5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-гидрокси-2-метилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-гидрокси-3-метилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-гидрокси-2, 5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-гидрокси-3, 5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(3,5-ди-трет-бутил-4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2, 4-дион,
5-{ 4-[6-(3, 5-ди-трет-бутил-4-гидроксифенилтио)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-гидрокси-2,3, 5-триметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[5-(4-гидрокси-2,3,5-триметилфенокси)-3-метил-3Н-имидазо[4,5-b] пиридин-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-амино-3, 5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-ацетиламино-3, 5-диметилфенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2, 4-дион,
5-{ 4-[6-(пиридин-2-илокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[1-метил-6-(пиридин-2-илтио)-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[1-метил-6-(пиридин-3-илокси)-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-(6-[4-(имидазол-1-ил)фенокси] -1-метил-1Н-бензимидазол-2-илметокси)бензил} тиазолидин-2,4-дион,
5-{ 4-(6-[4-(1-адамантил)фенокси] -1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-цианофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(2, 5-ди-трет-бутил-4-гидроксифенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-[4-(6-пентафторфенокси-1-метил-1Н-бензимидазол-2-илметокси)бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-бензоиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-[4-{ 6-[4-(2,4-дифторбензоиламино)фенокси] -1-метил-1Н-бензимидазол-2-илметокси} бензил] тиазолидин-2,4-дион,
5-{ 4-[6-(4-циклопентанкарбониламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион,
5-{ 4-[6-(4-никотиноиламинофенокси)-1-метил-1Н-бензимидазол-2-илметокси] бензил} тиазолидин-2,4-дион, и
5-{ 4-[6-(3,5-ди-трет-бутил-4-гидроксидифенилтио)-1-метил-1Н-бензимидазол-2-илметокси] бензилиден} тиазолидин-2,4-дион.
Документы, цитированные в отчёте о поиске
Производные тиозолидиндиона или их фармацевтически приемлемые соли, фармацевтическая композиция на их основе и способ лечения или профилактики заболеваний

Комментарии