Полисахарид из штамма bifidobacterium infantis и его применение для лечения или предупреждения воспалительных расстройств. - RU2511044C2
Код документа: RU2511044C2
Чертежи




Описание
Область изобретения
Настоящее изобретение относится к экзополисахариду и к его применению в лечении и предупреждении воспалительных расстройств.
Предшествующий уровень техники
Желудочно-кишечный тракт обеспечивает защитную границу раздела между внутренней средой и постоянной угрозой от антигенов, происходящих из пищи и от микроорганизмов внешней среды (Sanderson et al., 1993). По оценкам, сложная экосистема кишечной микрофлоры взрослых людей содержит 500 разных бактериальных видов. Некоторые из этих видов считаются потенциально вредными из-за продуцирования токсинов, инвазии через слизистую оболочку или активации карциногенов и воспалительных реакций (Salminen, 1998). Однако были идентифицированы бактериальные штаммы с укрепляющими здоровье активностями.
Пробиотики представляют собой полезные бактерии, которые существуют в микрофлоре здорового кишечника и были определены как группа живых микроорганизмов, которые благотворно действуют на животное-хозяина путем улучшения баланса его кишечной микрофлоры. Они состоят из "дружественных бактерий", которые культивируют в лабораторных условиях и затем используют для восстановления баланса микрофлоры, которая стала несбалансированной, например, из-за стресса, болезни или в результате применения антибиотиков. Важно, как это было показано, что прием внутрь пробиотических бактерий, возможно, может стабилизировать иммунологический барьер в слизистой оболочке кишечника путем уменьшения образования локальных провоспалительных цитокинов (Isolauri, 1993; Majamaa, 1997). Показано, что изменение свойств местной микрофлоры посредством пробиотической терапии реверсирует некоторые иммунологические нарушения, характерные для болезни Крона (Malin, 1996), пищевой аллергии (Majamaa, 1997) и атопической экземы (Isolauri, 2000).
Одним из преобладающих бактериальных видов, присутствующих в кишечной микрофлоре, является Bifidobacterium. В кишечнике Bifidobacterium ферментирует сахара с получением молочной кислоты. Геномные коды многих белков Bifidobacterium longum специализированы в отношении катаболизма олигосахаридов, что дает возможность бактерии использовать так называемые «неусваиваемые» растительные полимеры или гликопротеины и гликоконъюгаты хозяина. Считается, что способность Bifidobacterium конкурировать с другими желудочно-кишечными бактериями и составлять большой процент бактериальной флоры желудочно-кишечного отдела может быть частично обусловлена большим разнообразием молекул, которые они способны использовать для получения энергии.
В то время как B.infantis, B.breve и S.longum являются крупнейшей бактериальной группой в кишечнике младенцев, Bifidobacteria считаются только 3-й или 4-й по размеру группой бактерий у взрослых (и составляют только 3-6% фекальной флоры взрослого). Количество этих бактерий в организме человека с возрастом обычно уменьшается. У младенцев, которых вскармливают грудью, Bifidobacteria составляют примерно 90% их кишечных бактерий; однако это количество ниже у младенцев, вскармливаемых искусственно. Когда питание вскармливаемых грудью младенцев меняют на коровье молоко и твердую пищу, Bifidobacteria объединяются с возрастающим количеством других бактерий, обнаруженных в организме человека, таких как Bacteroides и Streptococci lactobacilli.
Было показано, что бифидобактерии играют роль в модулировании иммунной системы. Считают, что B.breve высвобождают метаболиты, оказывающие анти-ТNF-эффект, способные проникнуть через кишечный барьер. Сообщалось, что воспаление слизистой оболочки у мышей с отсутствием интерлейкина-10 (IL-10) уменьшается при кормлении испытуемых животных препаратом молочнокислых бактерий (Madsen, К et al., 1997; O'Mahony et al., 2001; McCarthy et al., 2004). В W0 00/41168 раскрыт штамм Bifidobacterium infantis, выделенный из резецированного и промытого желудочно-кишечного тракта человека, который является в значительной степени иммуномодулирующим при пероральном употреблении людьми.
Научное исследование указывает на возрастающую заболеваемость болезнями, которые могут быть вызваны неполной или нарушенной микрофлорой (естественной микробной резидентной популяции пищеварительной системы), такими как инфекции желудочно-кишечного тракта (GIT), запор, синдром раздраженного кишечника (IBS), воспалительное заболевание кишечника (IBD), болезнь Крона и язвенный колит, пищевые аллергии, диареи, вызванные антибиотиками, сердечно-сосудистое заболевание и некоторые виды рака, такие как колоректальный рак. Данные указывают, что после лечения одним штаммом Bifidobacterium infantis тяжесть симптома IBS снижается (Whorwell et al., 2006). Эффективность связана с модулированием системных иммунных ответов, что указывает на то, что механизм действия, частично, является иммуно-опосредованным (O'Mahony et al., 2005). В настоящем изобретении описано соединение, выделенное из Bifidobacterium infantis, которое имитирует иммуномодулирующую активность Bifidobacterium infantis in vitro.
Краткое изложение сущности изобретения
В настоящем изобретении предложен полисахарид, продуцируемый Bifidobacterium infantis, который демонстрирует иммуномодулирующие свойства. Полисахарид может быть секретируемым (экзополисахарид) или несекретируемым.
Согласно одному аспекту изобретения предложен выделенный полисахарид, содержащий структуру: [-β(1,3)-D-GalpNAc-β(1,4)-D-Glcp-]n.
Полисахарид может быть выделен из бактериального штамма Bifidobacterium. Штамм может представлять собой такой штамм, как NCIMB 41003. Согласно другому аспекту изобретения предложено применение полисахарида по изобретению в качестве лекарственного средства.
Согласно другому аспекту изобретения предложено применение полисахарида по изобретению в получении лекарственного средства для лечения или предупреждения нежелательной воспалительной активности.
Согласно еще одному аспекту изобретения предложено применение полисахарида по изобретению в получении лекарственного средства для лечения или предупреждения нежелательной желудочно-кишечной воспалительной активности.
В одном воплощении желудочно-кишечная воспалительная активность представляет собой болезнь Крона, язвенный колит, синдром раздраженного кишечника, паучит, постинфекционный колит, диарею, ассоциированную с Clostridium difficile, диарею, ассоциированную с ротавирусом, или постинфекционную диарею.
Согласно еще одному аспекту изобретения предложено применение полисахарида по изобретению в получении лекарственного средства для лечения или предупреждения ревматоидного артрита.
Согласно еще одному аспекту изобретения предложено применение полисахарида по изобретению в получении лекарственного средства для лечения или предупреждения аутоиммунных расстройств.
Согласно еще одному аспекту изобретения предложена фармацевтическая композиция, содержащая полисахарид по изобретению и фармацевтически приемлемый носитель.
В дополнительном воплощении изобретения также предложен продукт питания, содержащий выделенный полисахарид. Например, продукт питания может представлять собой один или более, выбранный из группы, включающей йогурты, каши, напитки и тому подобное.
Подробное описание изобретения
Ниже различные предпочтительные признаки и воплощения настоящего изобретения описаны посредством неограничивающего примера.
При осуществлении на практике настоящего изобретения используются, если не указано иное, обычные технологические способы химии, микробиологии и иммунологии, которые находятся в рамках квалификации специалиста в данной области техники. Такие способы изложены в литературе.
Авторами изобретения был идентифицирован Bifidobacterium, секретирующий экзополисахарид, который имеет иммуномодулирующие свойства.
Экзополисахарид
Настоящее изобретение относится к экзополисахариду, биосинтезированному с помощью Bifidobacterium infantis. Полисахариды синтезируются широким рядом микроорганизмов и обычно представляют собой повторяющиеся единицы сахара, которые остаются или связанными с клеточной поверхностью, или секретируются, или и то и другое. Они играют роль в обеих клеточных стрессовых реакциях или могут вносить вклад в вирулентность патогена. В последнее время была продемонстрирована иммуномодулирующая роль полисахарида Bacteroides fragilis (Mazmanian et al., 2005).
Лечение
Следует принимать во внимание, что все ссылки в данном описании изобретения на лечение включают куративное, паллиативное и профилактическое лечение. Лечение млекопитающих особенно предпочтительно. Как лечение человека, так и ветеринарное лечение входят в объем настоящего изобретения.
Воспаление
Воспаление представляет собой местную реакцию на клеточное повреждение, которое характеризуется капиллярным расширением, инфильтрацией лейкоцитов, покраснением, жаром, болью, опуханием и часто потерей функции. Контроль за воспалительным ответом осуществляется на ряде уровней (обзор смотри в Henderson B. и Wilson M. 1998.) Контролирующие факторы включают цитокины, гормоны (например, гидрокортизон), простагландины, реакционно-способные промежуточные соединения и лейкотриены.
Цитокины являются низкомолекулярными биологически активными белками, которые вовлечены в образование и контроль иммунологических и воспалительных ответов, а также регулируют развитие, восстановление тканей и гематопоэз. Они обеспечивают сообщение между самими лейкоцитами, а также с другими типами клеток. Большинство цитокинов являются плейотропными и демонстрируют многообразные биологически перекрывающиеся активности.
Цитокиновые каскады и сети контролируют воспалительный ответ, а не действие конкретного цитокина на конкретный тип клеток (Arai Kl, et al., 1990). Ослабление воспалительного ответа приводит к более низким концентрациям соответствующих активирующих сигналов и других воспалительных медиаторов, что приводит к приостановке воспалительного ответа. Фактор некроза опухоли альфа (TNFα) представляет собой основной провоспалительный цитокин, так как он инициирует каскад цитокинов и биологических эффектов, приводящих к воспалительному состоянию. Таким образом, агенты, которые ингибируют TNFα, например инфликсимаб, в настоящее время используются для лечения воспалительных заболеваний.
Считается, что провоспалительные цитокины играют большую роль в патогенезе многих воспалительных заболеваний, включая воспалительное заболевание кишечника (IBD). Современные терапии для лечения IBD направлены на снижение уровней этих провоспалительных цитокинов. Экзополисахарид по настоящему изобретению может иметь потенциальное применение в лечении воспалительных расстройств. Это может быть достигнуто, например, путем увеличения концентрации невоспалительных цитокинов, таких как IL-10, но не ограничиваясь им, и/или снижения концентрации воспалительных цитокинов.
Воспалительное заболевание кишечника
Воспалительное заболевание кишечника (IBD) характеризуется хроническим рецидивирующим воспалением кишечника. IBD подразделяется на фенотипы болезни Крона и язвенного колита. Болезнь Крона может охватывать любую часть желудочно-кишечного тракта, но наиболее часто терминальный отдел подвздошной кишки и толстую кишку. Приблизительно в 10% случаев, ограниченных прямой кишкой и толстой кишкой, определительная классификация болезни Крона или язвенного колита не может быть осуществлена, и они называются «недетерминированным колитом». Оба заболевания включают внекишечное воспаление кожи, глаз или суставов.
Болезнь Крона и язвенный колит обычно классифицируются как аутоиммунные заболевания, так как оба расстройства отмечены аномальным ответом иммунной системы организма, приводящим к хроническому воспалению в выстилке кишечника. Распространенность воспалительного заболевания кишечника увеличена у субъектов с другими аутоиммунными заболеваниями, в частности с анкилозирующим спондилитом, псориазом, склерозирующим холангитом и рассеянным склерозом.
Болезнь Крона
Болезнь Крона представляет собой хроническое расстройство, которое вызывает воспаление пищеварительного или желудочно-кишечного отдела, при котором иммунная система атакует кишечник.
Хотя болезнь Крона чаще всего затрагивает конец подвздошной кишки и начало толстой кишки, она может охватывать любую часть желудочно-кишечного тракта. Воспаление кишечника является трансмуральным и прерывистым; оно может включать гранулему или быть ассоциированным с кишечным или перианальным свищем. Полагают, что ген CARD 15 и аллель гена АВСВ1 связаны с предрасположенностью к болезни Крона.
Язвенный колит
Язвенный колит является заболеванием, которое вызывает воспаление и язвы в выстилке толстой кишки. Он представляет собой неспецифическое хроническое воспалительное заболевание, поражающее кишечник. Язвы образуются и кровоточат в тех местах, где воспаление разрушило клеточную выстилку. В отличие от болезни Крона, воспаление является непрерывным и ограничивается слоями слизистой прямой и ободочной кишки; фистулы и гранулемы не наблюдаются.
Как генетические, так и факторы окружающей среды представляются важными в его этиологии. Fuss et al. изучали T-клетки собственной пластинки пациентов с язвенным колитом и обнаружили, что они продуцировали значительно большие количества IL13 и IL5, чем контроль или клетки с болезнью Крона, и мало γ-интерферона. Был сделан вывод о том, что язвенный колит связан с атипичным Th2-ответом, опосредованным неклассическими клетками NKT (неспецифические киллерные T-клетки), которые продуцируют IL13 и обладают цитотоксическим потенциалом в отношении эпителиальных клеток.
Паучит
Хроническое и/или острое воспаление подвздошного резервуара, так называемый "паучит", является часто наблюдаемым долговременным осложнением анастамоза илеоанального кармана. У пациентов с язвенным колитом распространение паучита варьируется от менее 10% до более 40%. Определение "паучит" включает клинические симптомы, макроскопические воспалительные очаги повреждения при эндоскопии и гистологическое свидетельство интенсивного острого воспаления резервуара слизистой оболочки.
Диарея, ассоциированная с Clostridium difficile
Clostridium difficile представляет собой анаэробную, грамположительную спорогенную бациллу, впервые выделенную в 1935 из фекальной флоры здоровых новорожденных. Только в 1978 установлена ее взаимосвязь с псевдомембранным колитом (РМС), индуцированным антибиотиками. Почти все антибиотики были связаны с диареей C.difficile и колитом, включая ванкомицин и метронидазол (которые используют для их лечения) и противораковую химиотерапию. Частота взаимосвязи относится к частоте использования, способу введения и влияния этого антибиотика на микрофлору толстого кишечника.
Синдром раздраженного кишечника
Синдром раздраженного кишечника (IBS) является хроническим расстройством, которое затрагивает нормальные функции толстого кишечника (толстой кишки). Он характеризуется группой симптомов - спастической абдоминальной болью, вздутием, запором и диареей.
IBS является причиной большой части неудобств и недомоганий, но он не причиняет постоянный вред кишечнику и не приводит к кишечному кровотечению или к любому серьезному заболеванию, такому как рак. Признаки и симптомы IBS широко варьируются от одного пациента к другому и часто возникают при многих других заболеваниях.
Другие активные ингредиенты
Следует понимать, что экзополисахарид по настоящему изобретению может быть введен профилактически или в качестве способа лечения либо сам по себе, либо с другими пробиотическими и/или пребиотическими веществами. Кроме того, бактерии можно применять в виде части профилактической или лечебной схемы, используя другие активные вещества, например используемые для лечения воспаления или других расстройств, особенно расстройств желудочно-кишечного тракта. Такие комбинации можно вводить в одном препарате или в виде отдельных препаратов, вводимых одновременно или в разное время и с использованием одинаковых или разных путей введения.
Фармацевтические композиции
Фармацевтическая композиция представляет собой композицию, которая содержит терапевтически эффективное количество фармацевтически активного агента или состоит из него. Она предпочтительно содержит фармацевтически приемлемый носитель, разбавитель или эксципиенты (включая их комбинации). Приемлемые носители или разбавители для терапевтического использования хорошо известны в фармацевтической области и описаны, например, в Remington's Pharmaceutical Sciences. Выбор фармацевтического носителя, эксципиента или разбавителя может быть осуществлен с учетом предполагаемого пути введения и общепринятой фармацевтической практики. Фармацевтические композиции могут содержать в качестве носителя, эксципиента или разбавителя, или в дополнение к ним, любое(ые) подходящее(ие) связывающее(ие) вещество(а), смазывающее(ие) вещество(а), суспендирующий(ие) агент(ы), покрывающее(ие) вещество(а), солюбилизатор(ы).
Примеры фармацевтически приемлемых носителей включают, например, воду, солевые растворы, спирт, силикон, воски, вазелин, растительные масла, полиэтиленгликоли, пропиленгликоль, липосомы, сахара, желатин, лактозу, амилозу, стеарат магния, тальк, поверхностно-активные вещества, кремниевые кислоты, вязкий парафин, парфюмерное масло, моноглицериды и диглицериды жирных кислот, петролейноэфирные (petroethral) сложные эфиры жирных кислот, гидроксиметилцеллюлозу, поливинилпирролидон и тому подобное.
В случае необходимости фармацевтические композиции можно вводить с помощью любого одного или более способов: ингаляции, в форме суппозитория или пессария, локально в форме лосьона, раствора, крема, мази или присыпки, посредством использования кожного пластыря, перорально в форме таблеток, содержащих эксципиенты, такие как крахмал или лактоза, или в капсулах или овулях, либо отдельно, либо в смеси с эксципиентами, или в форме эликсиров, растворов или суспензий, содержащих ароматизаторы или красители, или их можно инъецировать парентерально, например интракавернозно, внутривенно, внутримышечно или подкожно. Для парентерального введения композиции можно наилучшим образом использовать в форме стерильного водного раствора, который может содержать другие вещества, например достаточное количество солей или моносахаридов, чтобы получить раствор изотоничный крови. Для буккального или сублингвального введения композиции можно вводить в форме таблеток или пастилок, которые можно приготовить в виде препарата общепринятым способом.
Могут предъявляться разные требования к композиции/препарату в зависимости от разных систем доставки. Например, фармацевтическая композиция по настоящему изобретению может быть приготовлена в виде препарата для доставки с использованием минипомпы, или мукозальным путем, например в виде назального спрея, или аэрозоля для ингаляции, или принимаемого внутрь раствора, или парентерально, когда композицию готовят в виде инъецируемой формы для доставки, например, внутривенным, внутримышечным или подкожным путем. Альтернативно, композиция может быть предназначена для доставки с помощью как одного, так и другого путей.
Дополнительные предпочтительные признаки и воплощения настоящего изобретения будут далее описаны посредством неограничивающего примера и со ссылкой на прилагаемые фигуры.
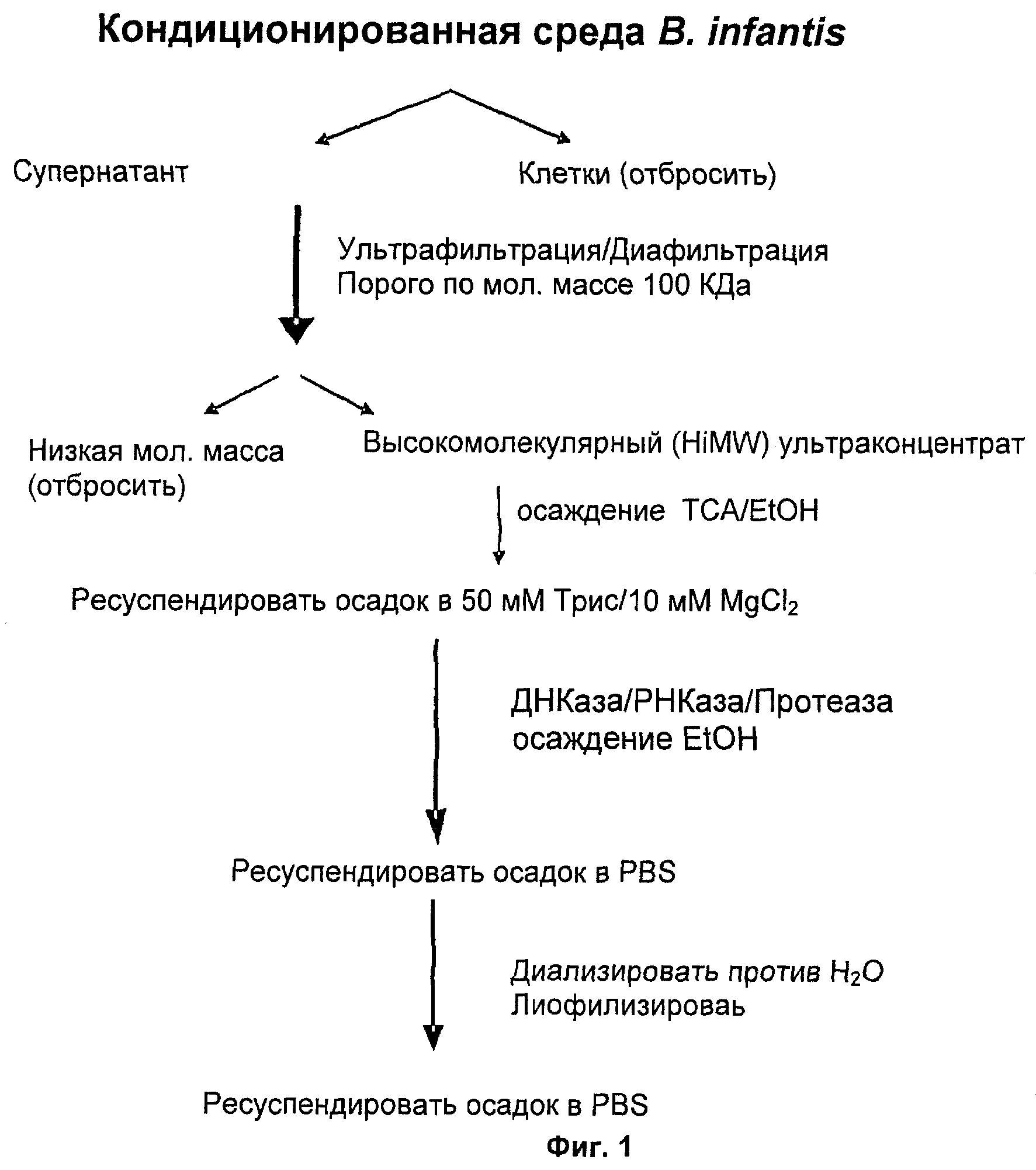
На Фиг.1 показана схема очистки экзополисахарида (PS1) из кондиционированной среды, продуцируемой Bifidobacterium 35624 (NCIMB 41003).
На Фиг.2 показана структура экзополисахарида (PS1), продуцируемого Bifidobacterium 35624 (NCIMB 41003).
На Фиг.3 показано, что очищенный экзополисахарид (PS1) из Bifidobacterium 35624 [NCIMB 41003] проявляет иммуномодулирующую активность при совместном инкубировании in vitro с мононуклеарными клетками периферической крови человека.
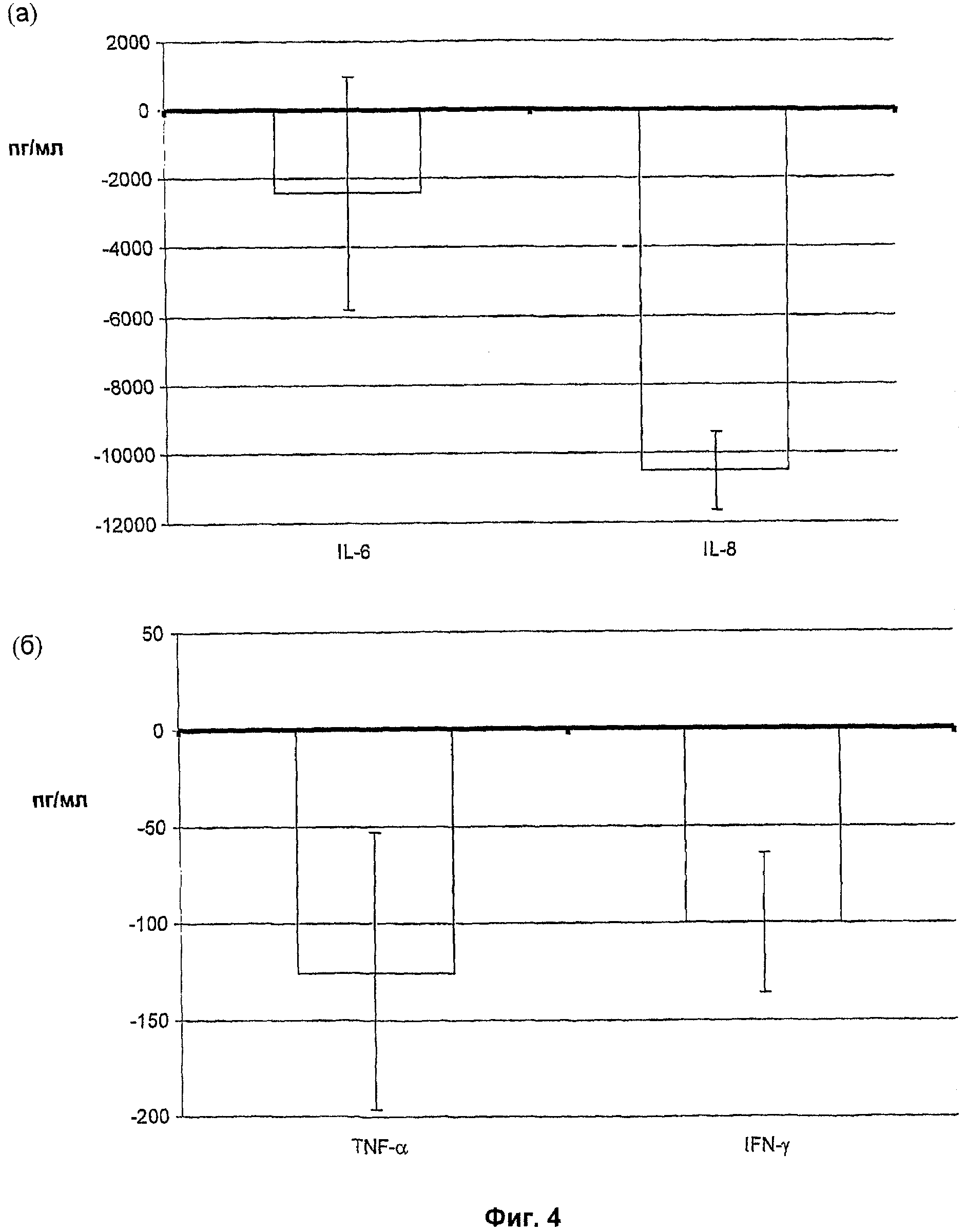
На Фиг.4 показано, что PS1 ограничивает высвобождение провоспалительных цитокинов в ответ на стимуляцию Toll-подобного рецептора 4 (TLR-4) in vitro.
На Фиг.5 показано, что PS1 ограничивает высвобождение провоспалительных цитокинов в ответ на стимуляцию Toll-подобного рецептора 4 (TLR-4) in vivo.
На Фиг.6 показано, что PS1 ограничивает высвобождение провоспалительных цитокинов в ответ на повторную стимуляцию Toll-подобного рецептора 4 (TLR-4) in vitro.
Штамм Bifidobacterium 35624 (NCIMB 41003) описан в WO 00/42168, полное содержание которой включено в данное описание изобретения посредством ссылки. Штамм был депонирован в NCIMB (Национальной коллекции промышленных и морских бактерий) 13 января 1999 года.
Пример 1 - Очистка и определение структуры экзополисахарида (PS1) из кондиционированной среды, продуцируемой Bifidobacterium 35624.
Очистка. 100 мл стерильной среды MRS (СМ359 MRS Broth, Oxoid Ltd., Basingstoke, Hampshire, England) с добавлением 0,05% (масс./об.) цистеина, помещали в стерильную 250 мл колбу Эрленмейера, инокулированную Bifidobacterium 35624. Инокулированную среду инкубировали в анаэробных условиях (10-01 Pack-Anaero, Mitsubishi Gas Chemical Company-America, New York, NY) при 37°C без встряхивания. Образец неинокулированной среды MRS использовали в качестве контрольной среды и обрабатывали идентично инокулированному образцу в методиках, изложенных ниже.
После 48 ч роста культура Bifidobacterium 35624 достигала стационарной фазы и показывала OD оптическую плотность при 600 нм примерно 3 (2-3×109 колониеобразующих единиц/мл). Культуры переносили в поликарбонатные центрифужные пробирки и центрифугировали при 40000xg в течение 30 мин (ротор JA-20, центрифуга Beckman J2-21, Beckman Coulter, Inc., Fullerton, CA), что приводило к получению прозрачного супернатанта и плотного клеточного осадка. Супернатант (кондиционированную среду) осторожно удаляли и использовали в очистке экзополисахарида (EPS). Клеточный осадок отбрасывали.
Схема очистки EPS от кондиционированной среды, продуцируемой Bifidobacterium 35624, показана на Фиг.1. Если не указано иное, все стадии проводили на льду или при 4°C. 80 мл культурального супернатанта загружали в ультрафильтрационное устройство, с порогом по молекулярной массе (MW) 100000 Да (концентратор VC1042 Vivacell 100 мл, Vivascience, Ганновер, Германия). Образцы концентрировали центрифугированием при 2000xg в центрифуге для клиник. После достижения объема примерно 0,5 мл ультраконцентрат (высокомолекулярная фракция HiMW) один раз подвергали диафильтрации, используя фосфатно-солевой буферный раствор (PBS), и снова концентрировали до примерно 0,5 мл. Ультраконцентрат переносили в стандартную 15 мл центрифужную пробирку. Ультрафильтрационное устройство промывали с помощью 4 мл PBS и эту промывную жидкость объединяли с ультраконцентратом с получением HiMW фракции ультраконцентрата.
Раствор 100% трихлоруксусной кислоты (ТСА) добавляли к фракции ультраконцентрата HiMW до конечной концентрации 20% (об./об.) ТСА. Образцы инкубировали в течение 2 ч на льду и затем центрифугировали при 8000xg в течение 20 мин (ротор JA-20). Супернатант, содержащий EPS, переносили в 30 мл пробирку из корекса. Осадок, содержащий белки, отбрасывали. Супернатант, содержащий EPS, обрабатывали 3 объемами ледяного 95%-ного этанола и инкубировали в течение ночи при -20°C. Затем пробирки центрифугировали при 8000xg в течение 20 мин (ротор JA-20). Супернатант отбрасывали. Осадок, содержащий EPS, ресуспендировали в 5 мл PBS и затем снова осаждали 3 объемами этанола, как указано выше. Осадок сушили на воздухе на льду в течение 60 мин и затем ресуспендировали в 9 мл 10 мМ MgCl2, 50 мМ Трис-HCl (pH 7,4).
Для удаления нуклеиновых кислот каждую из дезоксирибонуклеазы I (LS006331, Worthington Biochemical Corporation, Lakewood, NJ) и рибонуклеазы A (R5250, Sigma-Aldrich Corporation, St.Louis, MO) добавляли до конечных концентраций 0,1 мг/мл и инкубировали в течение 2 ч при 37°C. Остаточные белки удаляли путем добавления протеиназы K (Р2308, Sigma-Aldrich) до конечной концентрации 0,02 мг/мл и затем инкубации смеси в течение 2 ч при 37°C. Протеиназу K инактивировали посредством инкубации в течение 15 мин при 70°C, с последующим добавлением фенилметилсульфонилфторида (Р7626, Sigma-Aldrich) до конечной концентрации 0,2 мМ в течение 15 мин при комнатной температуре. Очищенный EPS осаждали из раствора путем добавления 3 объемов этанола, как указано выше. Осадок ресуспендировали в 9 мл фосфатно-солевого буферного раствора. Ресуспендированный образец загружали в диализную трубку SnakeSkin (68035, Pierce 10 Biotechnology, Rockford, IL), имеющую порог по молекулярной массе 3500 и затем диализовали против 7 литров воды (2 цикла) в течение 48 ч при 4°C.
Небольшую аликвоту диализированного образца отбирали для определения количества присутствующего полисахарида, используя стандартный фенол/сернокислотный способ Dubois et al. (Anal. Chem. 28, 350-356 (1956)). После того как определили концентрацию EPS, отбирали соответствующие аликвоты, замораживали на сухом льду и лиофилизировали досуха. Лиофилизированное вещество хранили при -80°C.
ЯМР анализы. Анализ с помощью протонного ядерно-магнитного резонанса (1H-NMR) выполняли на спектрометре Varian Inova 600 МГц (Varian Medical Systems, Palo Alto, CA). Лиофилизированные образцы растворяли в D20 и после обеспечения экстенсивного обмена дейтерия получали спектр при 25°C. Химические сдвиги относили к внутреннему TSP. Данные1H-1Н корреляционной спектроскопии (COSY), общей корреляционной спектроскопии (TOCSY), спектроскопии ядерного эффекта Оверхаузера (NOESY) и протон-углеродной гетероядерной одноквантовой корреляционной спектроскопии (HSQC) собирали в фазо-чувствительных режимах, используя квадратуру Стетса-Наберкорна-Рубина (States-Haberkorn-Rubin). Все последовательности импульсов поставлялись поставщиком спектрометра и использовались без модификации. Предварительное насыщение малой мощности применяли к остаточному импульсу HDO. Обычно совокупности данных собирали с 512 умноженных 2048 точек комплексных данных и 16-32 сканирований/инкремент. Импульсная программа TOCSY содержала 60-мс MLEV-17 смешанную последовательность, и время смешивания в NOESY составляло 150 мс.
Анализы углеводов. Анализы гликозильных композиций выполняли посредством комбинированной газовой хроматографии/масс-спектрометрии (GC/MS) пер-O-триметилсилиловых (TMS) производных моносахаридных метилгликозидов, полученных из очищенного EPS Bifidobacterium 35624 с помощью кислого метанолиза (York et al., (1986); 5 Merkle, R.K. и Poppe, I. 1994). Для анализа гликозильной связи образец EPS перметилировали, деполимеризовали, восстанавливали и ацетилировали. Образующиеся частично метилированные альдитолацетаты (PMAAs) анализировали с помощью GC-MS, как описано ранее (York et al., (1986); Merkle и Poppe (1994)).
Определение структуры EPS.
Очищенный EPS анализировали, используя1H-NMR. Спектры показали, что данное вещество состоит исключительно из углевода; не указывали на присутствие нуклеиновой кислоты, белка, липида или незначительных органических примесей. В анализе с помощью двухмерного ЯМР, с использованием экспериментов, известных в данной области техники и описанных выше, установили, что большая часть присутствующего углевода содержала линейный полисахарид, который состоит из дисахаридных повторов. В комбинации с данными анализов состава и связей структура данного полисахарида (названного PS1) представляет собой [-β(1,3)-присоединенный-D-N-ацетил-галактозамин-пиранозил-β(1,4)-присоединенный-D-глюкозо-пиранозил-]n, где n указывает, что данная дисахаридная единица повторяется n раз, что дает полисахарид с молекулярной массой более 100000 Да. Структуру PS1 можно сокращенно обозначить как [-β(1,3)-D-GalpNAc-β(1,4)-D-Glcp-]n, и она показана на Фиг.2. Заметим, что PS1 не был обнаружен в образце среды контроля.
Пример 2 - Экзополисахарид (PS1) B.infantis 35624 обладает иммуномодулирующей активностью при совместном инкубировании с клетками иммунной системы человека in vitro.
Фракции EPS анализировали, используя анализ индукции цитокинов РВМС (мононуклеарных клеток периферической крови). В этом анализе РВМС выделяют из крови с помощью разделения в градиенте плотности и инкубируют в течение 72 часов при 37°C (в присутствие пенициллина и стрептомицина) с контрольной средой или с увеличивающимися концентрациями очищенного PS1 из В. infantis 35624. Супернатант анализировали в отношении уровней IL-1β, IL-6, IL-8, IL-10, IL-12, TNF-α и IFN-y, используя наборы для среднемасштабного исследования (MSD), и анализировали, используя планшетное считывающее устройство для MSD.
На Фиг.3 показаны результаты данного анализа. PS1 стимулировал секрецию всех тестируемых цитокинов при стимулировании РВМС 1-5 мкг/мл PS1. Активность стимулирования цитокинов была снижена до фоновых уровней для многих цитокинов при использовании 10 мкг/мл PS1.
В дополнение к испытанию покоящихся РВМС, для активации РВМС в присутствии или в отсутствие PS1 стимулирования использовали TLR-4-лигандный липополисахарид (LPS). Так как было установлено, что 5 мкг/мл PS1 представляет собой оптимальную дозу в предварительных экспериментах, эту дозу использовали в следующих анализах. Эти результаты иллюстрированы на Фиг.4 в виде среднего значения для цитокинов для клеток, стимулированных LPS+PS1, за вычетом значения для цитокинов для клеток, стимулированных только LPS. При совместном инкубировании с PS1, РВМС, стимулированные LPS, секретируют существенно меньше IL-6 и значительно меньше IL-8, TNF-α и IFN-y.
Пример 3 - Экзополисахарид (PS1) из B.infantis 35624 обладает противовоспалительной активностью при инъекции в мышиной модели сепсиса.
PS1 инъецировали и.п. (интраперитонеально) здоровым мышам и за этими мышами наблюдали в течение 24 часов. Не было замечено явных признаков недомогания, что дало возможность предположить, что данный полисахарид хорошо переносился животными, и PS1 не вызывал сепсис или провоспалительный ответ. После 24-часового периода наблюдения животным инъецировали интраперитонеально липополисахарид (LPS), чтобы индуцировать сепсис-подобный ответ. Всех животных выбраковывали через 2 часа и секрецию цитокинов в спленоцитах измеряли in vitro. Спленоциты, выделенные из мышей, обработанных PS1+LPS, высвобождали значительно меньшее количество TNF-α по сравнению с мышами, которые получали только LPS (Фиг.5). Кроме того, спленоциты из этих животных повторно стимулировали LPS in vitro, и снова наблюдался притупленный ответ провоспалительных цитокинов в спленоцитах, полученных от животных, ранее подверженных воздействию PS1 (Фиг.6).
Взятые вместе, эти данные показывают, что EPS1, полученный из Bifidobacterium infantis 35624, обладает иммуномодулирующей активностью и защищает от воспалительных реакций, опосредованных LPS или TLR-4.
Хотя вышеприведенный эксперимент описывает секретируемый экзополисахарид (PS1), предполагается, что несекретируемая форма экзополисахарида, например ассоциированная/связанная с клеткой или с мембраной, или капсульная форма экзополисахарида, будет вести себя аналогично секретируемому EPS. Эксперимент, описанный в данном описании изобретения, был предназначен для исследования секретируемого EPS, но специалисту в данной области техники очевидно, что часть секретируемого EPS может быть связана с клеткой (например, ассоциированного с клеткой или капсульного) в процессе изготовления EPS и перед транспортом или высвобождением EPS из клетки.
Изобретение не ограничено воплощениями, описанными в данном описании изобретения выше, которые могут варьироваться в деталях.
Ссылки
Arai Kl, et al., Annu Rev Biochem 59: 783-836, 1990.
Fuss et al., "Nonclassical CD Id-restricted NK T cells that produce IL-13 characterize an atypical Th2 response in ulcerative colitis." Inflamm Bowel Dis. 2005 Jan; ll(l):74-5.
Henderson B., and Wilson M. ln "Bacteria-Cytokine interactions in health and disease".
Isolauri et al., Clin Exp Allergy 30:1605-10, 2000.
Isolauri et al. Pediatr Res. 33:548-53, 1993.
Madsen et al., Gastroenterology 112:A1030, 1997.
Majamaa et al., J Allergy Clin Immunol 99:179-86, 1997.
Malin et al., Br J Rheumatol 35:689-94, 1996.
McCarthy et al., Gut 53:694-700, 2004.
Mazmanian et al., Cell 122:107-118, 2005.
Merkle and Poppe Methods Enzymol. 230:1-15, 1994.
O'Mahony et al., Aliment Pharmacol Ther 15:1219-25, 2001.
O'Mahony et al., Gastroenterology 128:541-51, 2005 Portland Press, 79-130, 1998.
Remington's Pharmaceutical Sciences, Mack Publishing Co. 1985 (Editor: A.R. Gennaro).
Salminen, Int J Food Microbiol 20:93-106, 1998.
Sanderson et al., Gastroenterology 104:622-39, 1993.
Whorwell et al., Am J Gastroenterol 101:1581-90, 2006.
York et al., Methods Enzymol. 118:3-40, 1986.
Реферат
Группа изобретений относится к области битехнологии и медицины. Предложен полисахарид, выделенный из штаммаNCIMB 41003 и имеющий структуру [-β(1,3)-D-GalNAc-β(1,4)-D-Glc-],где данная дисахаридная единица повторяется n раз, что дает полисахарид с молекулярной массой более 100000 Да. Полисахарид проявляет иммуномодулирующую активность и применяется в изготовлении лекарственных средств для лечения или предупреждения нежелательной воспалительной активности, нежелательной желудочно-кишечной воспалительной активности, ревматоидного артрита и аутоиммунных расстройств. Также предложены фармацевтическая композиция для лечения и предупреждения воспалительных расстройств и пищевой продукт, которые содержат выделенный полисахарид. 7 н. и 2 з.п. ф-лы, 6 ил., 3 пр.
Формула

где n указывает, что данная дисахаридная единица повторяется n раз, что дает полисахарид с молекулярной массой более 100 000 Да.
Документы, цитированные в отчёте о поиске
Экзополимер

Комментарии