Способ получения мономера, содержащего сульфогруппу - RU2751162C1
Код документа: RU2751162C1
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения мономера, содержащего сульфогруппу. Более конкретно, настоящее изобретение относится к способу получения с высоким выходом мономера, содержащего сульфогруппу, который можно использовать в качестве сырья для различных полимерных электролитов на основе фтора, таких, как мембраны для топливных элементов, каталитические связующее полимеры для топливных элементов и мембраны для хлорщелочного электролиза.
Уровень техники
Перфторполимеры, представленные следующей общей формулой (6), типично использовались в качестве основных компонентов мембран для топливных элементов, мембран для хлорщелочного электролиза и т.п.
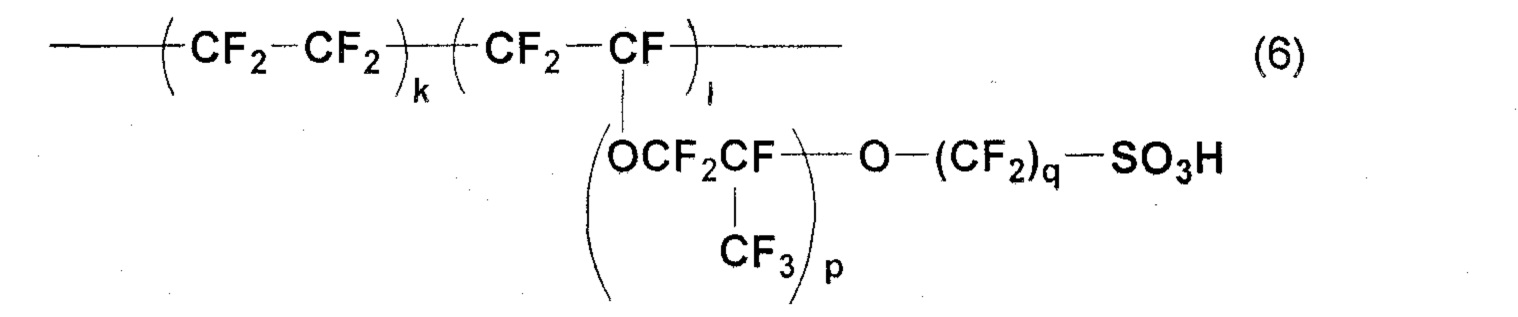
(здесь p означает целое число от 0 до 6, и q означает целое число от 1 до 6).
Хорошо известно, что полимеры общей формулы (6) можно получить путем омыления и кислотной обработки сополимера фторсодержащего мономера следующей общей формулы (7) и тетрафторэтилена (TFE):
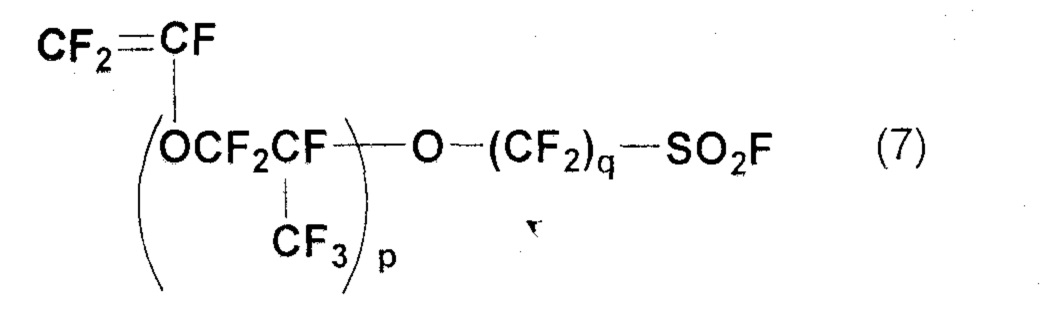
(где p и q определены в общей формуле (6)).
Из фторсодержащих мономеров, представимых общей формулой (7), широко использовались полимеры, полученные из мономеров, в которых p равно 1, и q составляет 2-4. Хорошо известно, что мономеры, у которых p равно 1, а q составляет 2-4, можно получить следующим путем:
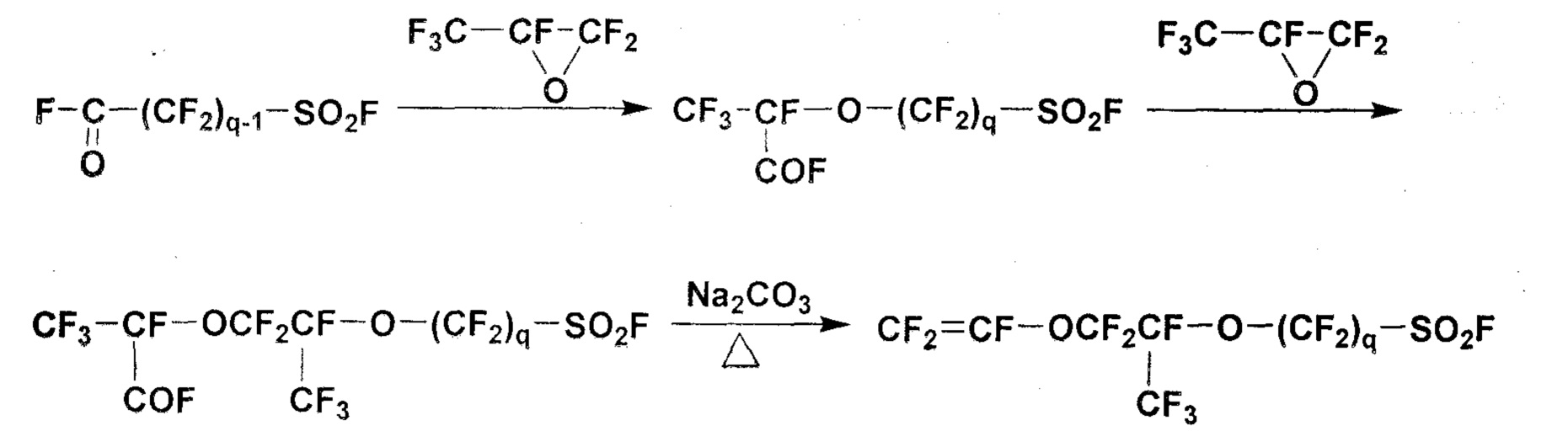
Между тем, хорошо известно, что полимеры, у которых p равно 0 в общей формуле (6), имеют более короткое расстояние между основной цепью и сульфогруппами, чем полимеры, у которых p равно 1 или больше, и, таким образом, имеют более высокую температуру стеклования и более высокую прочность, чем полимеры с p больше или равным 1.
Недостатком фторсодержащих мономеров, представимых общей формулой (7) с p равным 0, являющихся исходным материалом для полимеров с p равным 0, является сложность их синтеза. Более конкретно, хорошо известно, что когда CF3CF(COF)O(CF2)qSO2F подвергают декарбоксилированию и введению винильной группы таким же способом, что и для фторсодержащих мономеров, представимые общей формулой (7), в которой p равно 1, доминирующей становится реакция циклизации, и выход фторсодержащего мономера вышеуказанной общей формулы (7), имеющего короткоцепочечную структуру, в которой p равно 0, становится чрезвычайно низким. Например, когда q равно 2, протекает только циклизация, что затрудняет получение фторсодержащего мономера (смотри, например, документ NPL 1).

В качестве другого способа синтеза фторсодержащего мономера общей формулы (7), в которой p равно 0, описан способ синтеза с использованием фторэпоксида, содержащего атом хлора (смотри, например, документ PTL 1). Однако это способ далек от практического применения, так как он требует особого фторэпоксида, содержащего атом хлора, который труднодоступен и синтез которого является трудоемким.
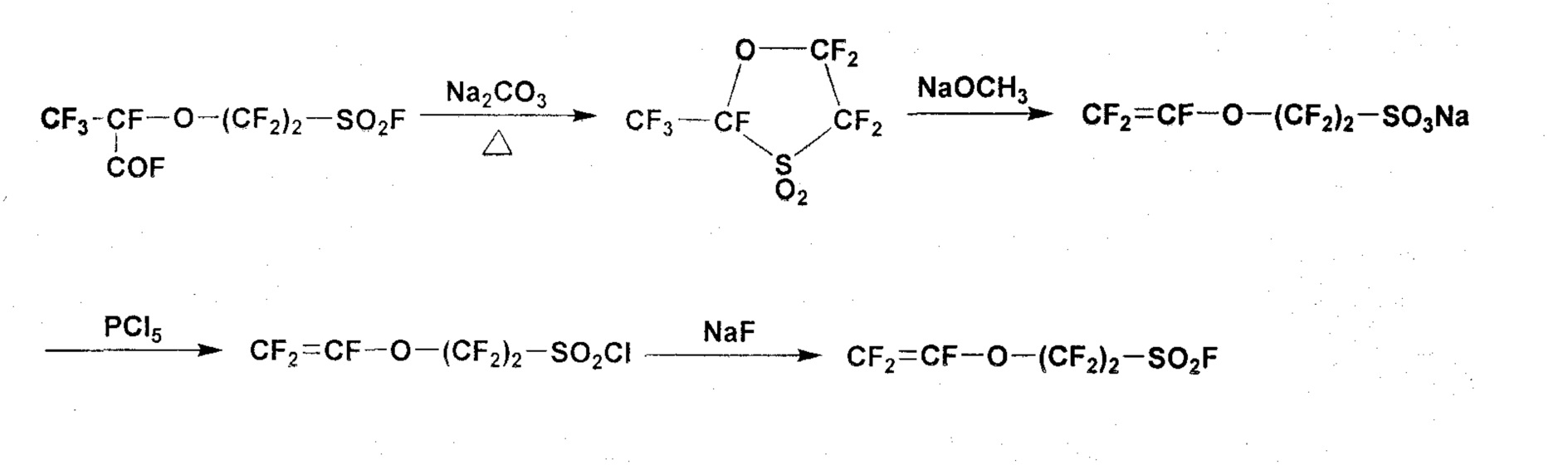
В качестве способа синтеза фторсодержащего мономера, представимого общей формулой (7), в которой p=0, документ PTL 2 описывает получение мономера, содержащего сульфогруппу (CF2=CFO(CF2)2SO3Na). В этом способе 5-звенное циклическое соединение получают путем декарбоксилирования соединения CF3CF(COF)O(CF2)2SO2F с использованием нагрева с карбонатом натрия, и затем 5-звенное циклическое соединение приводят в реакцию с метоксидом натрия (NaOCH3), так что полученный мономер, содержащий сульфогруппу, доступен для сополимеризации с TFE. Далее, описан также способ получения фторсодержащего мономера общей формулы (7), в которой p=0 и q=2 (CF2=CFO(CF2)2SO2F) путем реакции указанного мономера, содержащего сульфогруппу, с пятиокисью фосфора с получением CF2=CFO(CF2)2SO2Cl, который затем приводят в реакцию с фторидом натрия.
Список цитирования
Патентная литература
PTL 1: JP S57-28024 A
PTL 2: US 3560568 A
PTL 3: WO 98/43952 A
Непатентная литература
NPL 1: The 155th Committee on Fluorine Chemistry, Japan Society for the Promotion of Science, "Introduction to Fluorine Chemistry 2010: The Frontiers of Basics and Applications," April 2010, pp. 353-355.
NPL 2: Gronwald, Oliver, et al. "Synthesis of difluoroethyl perfluorosulfonate monomer and its application." Journal of Fluorine Chemistry 129 (2008) 535-540.
Сущность изобретения
Техническая проблема
Однако в реальном процессе, когда 5-звенное циклическое соединение, которое получено декарбоксилированием соединения CF3CF(COF)O(CF2)2SO2F путем нагрева с карбонатом натрия, подвергают реакции с метоксидом натрия, получается сложная реакционная смесь, в которой количество получаемого целевого мономера, содержащего сульфогруппу (CF2=CFO(CF2)2SO3Na), мало, но в больших количествах образуются соединения, предположительно имеющие структуры CH3OCF2CFH- или CF3CFH-. Хотя точная причина, почему соединения, предположительно имеющие структуры CH3OCF2CFH- или CF3CFH-, получают в большем количестве, не ясна, предполагается, что метоксид (CH3O-) имеет тенденцию присоединяться к винильной группе (CF2=CF-), образующейся во время реакции.
В качестве способа получения содержащего сульфогруппу мономера CF2=CFO(CF2)2SO3Na, не включающего образования 5-звенных циклических соединений, описан способ, согласно которому CF3CF(COF)O(CF2)2SO2F приводят в реакцию с метанолом для получения сложного метилового эфира, который нейтрализуют спиртовым раствором гидроксида натрия, чтобы получить порошкообразный CF3CF(CO2Na)O(CF2)2SO3Na, который затем декарбоксилируют путем нагрева с получением CF2=CFO(CF2)2SO3Na. Однако CF3CF(CO2Na)O(CF2)2SO3Na необходимо полностью высушить до декарбоксилирования путем нагрева, полностью удаляя спирт и воду, что усложняет проведение реакции (смотри, например, документ PTL 3).
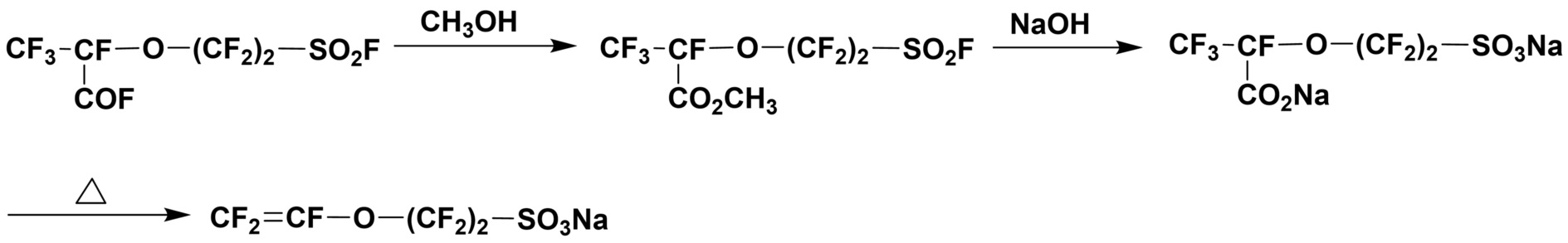
Учитывая вышеизложенное, для получения фторсодержащего мономера общей формулы (7), в которой p=0, существует потребность в способе, позволяющем с хорошим выходом и экономически выгодным образом получать мономер, содержащий сульфогруппу, служащий в качестве промежуточного продукта синтеза такого фторсодержащего мономера.
Настоящее изобретение направлено на разработку способа, позволяющего получать мономер, содержащий сульфогруппу, с хорошим выходом.
Решение проблемы, задачи
Авторы изобретения провели обширные исследования для решения вышеупомянутых проблем, что привело их к разработке способа, позволяющего с высоким выходом получать целевой мономер, содержащий сульфогруппу, путем объединения и перемешивания циклического соединения и силанольного соединения, тем самым осуществляя настоящее изобретение.
Более конкретно, настоящее изобретение заключается в следующем:
[1]. Способ получения мономера, содержащего сульфогруппу, включающий стадию объединения и перемешивания следующих веществ:
- циклического соединения, представленного следующей общей формулой (1)

где X означает F или CF3, и n означает целое число от 1 до 6, причем когда n больше или равно 2, все CFX могут быть одинаковыми или разными; и
- силанольного соединения, представленного следующей общей формулой (2)
R1R2R3Si(OM) (2),
где M означает щелочной металл или щелочноземельный металл; и каждый из R1 до R3 независимо означают необязательно замещенную углеводородную группу с числом атомов углерода от 1 до 10, или OM, где M означает щелочной или щелочноземельный металл,
причем мономер, содержащий сульфогруппу, представлен следующей общей формулой (3)
CF2=CFO(CFX)nSO3Y (3),
где (3) n и X такие же, как n и X в общей формуле (1); и Y означает атом водорода, M или R1R2R3Si, где M и R1 - R3 такие же, как M и R1 - R3 в общей формуле (2)).
[2] Способ получения мономера, содержащего сульфогруппу, согласно пункту [1], причем способ включает стадию, содержащую:
(i) выделение силоксана, представленнго следующей общей формулой (4) и/или кремниевого соединения, содержащего атом фтора, представимого следующей общей формулой (5),
R1R2R3SiOSiR1R2R3 (4),
где R1 - R3 такие же, как R1 - R3 в формуле (2);
R1R2R3SiF (5),
где R1 - R3 такие же, как R1 - R3 в формуле (2),
из реакционной смеси, включающей содержащий сульфогруппу мономер общей формулы (3), полученный на предыдущей стадии; и силоксан общей формулы (4) и/или соединение кремния, содержащее атом фтора, представленного общей формулой (5);
(ii) превращение силоксана общей формулы (4) и/или соединения кремния, содержащего атом фтора, общей формулы (5), выделенных на стадии (i), в силанольное соединение, представленное общей формулой (2); и
(iii) объединение и перемешивание циклического соединения общей формулы (1) и силанольного соединения общей формулы (2), полученного на стадии (ii).
[3]. Способ получения мономера, содержащего сульфогруппу, согласно пунктам [1] или [2], причем силанольное соединение является соединением, в котором M в общей формуле (2) представляет собой щелочной металл.
[4] Способ получения мономера, содержащего сульфогруппу, согласно любому из пунктов [1]-[3], причем силанольное соединение является соединением, выбранным из группы, состоящей из триметилсиланолята лития, триэтилсиланолята лития, триизопропилсиланолята лития, (трет-бутил)диметилсиланолята лития, трифенилсиландиолята лития, диметилсиландиолята дилития, диэтилсиландиолята дилития, дифенилсиландиолята дилития, триметилсиланолята натрия, триэтилсиланолята натрия, триизопропилсиланолята натрия, (трет-бутил)диметилсиланолята натрия, трифенилсиландиолята натрия, диметилсиландиолята динатрия, диэтилсиландиолята динатрия и дифенилсиландиолята динатрия.
Полезные эффекты изобретения
Благодаря настоящему изобретению можно с хорошим выходом получать мономер, содержащий сульфогруппу.
Подробное описание
Далее более подробно описывается вариант осуществления настоящего изобретения (далее называемый просто "настоящим вариантом осуществления").
Настоящее изобретение относится к способу получения мономера, содержащего сульфогруппу, включающему стадию объединения и перемешивания следующих веществ:
- циклического соединения, представленного следующей общей формулой (1)

где X означает F или CF3, и n означает целое число от 1 до 6, причем когда n больше или равен 2, все CFX могут быть одинаковыми или разными; и
- силанольного соединения, представленного следующей общей формулой (2)
R1R2R3Si(OM) (2),
где M означает щелочной металл или щелочноземельный металл; и каждый из R1 до R3 независимо означает необязательно замещенную углеводородную группу с числом атомов углерода от 1 до 10, или OM, где M означает щелочной или щелочноземельный металл,
причем мономер, содержащий сульфогруппу, представим следующей общей формулой (3)
CF2=CFO(CFX)nSO3Y (3)
где n и X такие же, как n и X в общей формуле (1); и Y означает атом водорода, M или R1R2R3Si, где M и R1 - R3 такие же, как M и R1 - R3 в общей формуле (2).
Как используется здесь, циклическое соединение, представленное вышеуказанной общей формулой (1), силанольное соединение, представленное вышеуказанной общей формулой (2), и мономер, содержащий сульфогруппу, представленный вышеуказанной общей формулой (3), обозначаются также как "соединение (1)", "соединение (2)" и "соединение (3)", соответственно.
Циклическое соединение (соединение (1))
В соединении (1) X означает F или CF3, и n является целым числом от 1 до 6, причем когда n больше или равно 2, все CFX могут быть одинаковыми или разными. С точки зрения доступности и легкости синтеза соединения (1), X предпочтительно означает F или CF3, и n предпочтительно составляет от 2 до 4.
Соединение (1) можно синтезировать, например, путем термического разложения карбоксилата щелочного металла, полученного из CF3CF(COF)O(CFX)nSO2F (где X означает F или CF3, и n означает целое число от 1 до 6) (смотри, например, документ PTL 2).
Силанольное соединение (соединение (2))
В соединении (2) M означает щелочной металл или щелочноземельный металл. С точки зрения доступности и легкости синтеза соединения (2), M предпочтительно представляет собой щелочной металл. Предпочтительным щелочным металлом является литий, натрий или калий, особенно предпочтительны литий и натрий благодаря их способности вступать в реакцию с соединением (1). Когда молекула соединения (2) содержит более одного M, все M могут быть одинаковыми или разными, но предпочтительно все M одинаковы.
В соединении (2) группы R1 - R3 независимо представляют собой углеводородную группу, возможно замещенную, содержащую от 1 до 10 атомов углерода, или OM (где M означает щелочной металл или щелочноземельный металл). Все R1 - R3 могут быть одинаковыми или разными.
Примеры "необязательно замещенной углеводородной группы, " в описании R1 - R3 включают алифатические углеводородные группы, ароматические углеводородные группы, такие, как фенильная группа, и фтор-замещенные углеводородные группы, такие как трифторметильная группа, в которой все атомы водорода в углеводородной группе замещены, например, атомами фтора.
Отметим, что при необходимости углеводородная группа может содержать функциональную группу. Примеры таких функциональных групп включают атомы галогена, такие как атом фтора, атом хлора и атом брома, нитрильную группу (-CN), группу простого эфира (-O-), карбонатную группу (-OCO2-), сложноэфирную группу (-CO2-), карбонильную группу (-CO-), сульфидную группу (-S-), сульфоксидную группу (-SO-), сульфонильную группу (-SO2-) и уретановую группу (-NHCO2-).
Число атомов углерода в каждой углеводородной группе в R1 -R3 составляет от 1 до 10, более предпочтительно от 1 до 8 с учетом доступности соединения (2), и особенно предпочтительно от 1 до 6 с точки зрения химической активности по отношению к соединению (1).
Примеры R1 - R3 включают алифатические углеводородные группы, такие как метильная группа, этильная группа, винильная группа, аллильная группа, 1-метилвинильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, и фторметильная группа, и ароматические углеводородные группы, такие как бензильная группа, фенильная группа, замещенная нитрилом фенильная группа и фторсодержащая фенильная группа. Из них более предпочтительными являются метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, бензильная группа и фенильная группа, особенно предпочтительны метильная группа, этильная группа, изопропильная группа, трет-бутильная группа и фенильная группа.
Примеры соединения (2) включают триметилсиланолят лития, триэтилсиланолят лития, триизопропилсиланолят лития, (трет-бутил)диметилсиланолят лития, трифенилсиландиолят лития, диметилсиландиолят дилития, диэтилсиландиолят дилития, дифенилсиландиолят дилития, триметилсиланолят натрия, триэтилсиланолят натрия, триизопропилсиланолят натрия, (трет-бутил)диметилсиланолят натрия, трифенилсиландиолят натрия, диметилсиландиолят динатрия, диэтилсиландиолят динатрия и дифенилсиландиолят динатрия.
Соединение (2) может быть серийно выпускаемым продуктом или может быть синтезирован из доступного соединения, такого, например, как галогенированный силан, силанол и силоксан.
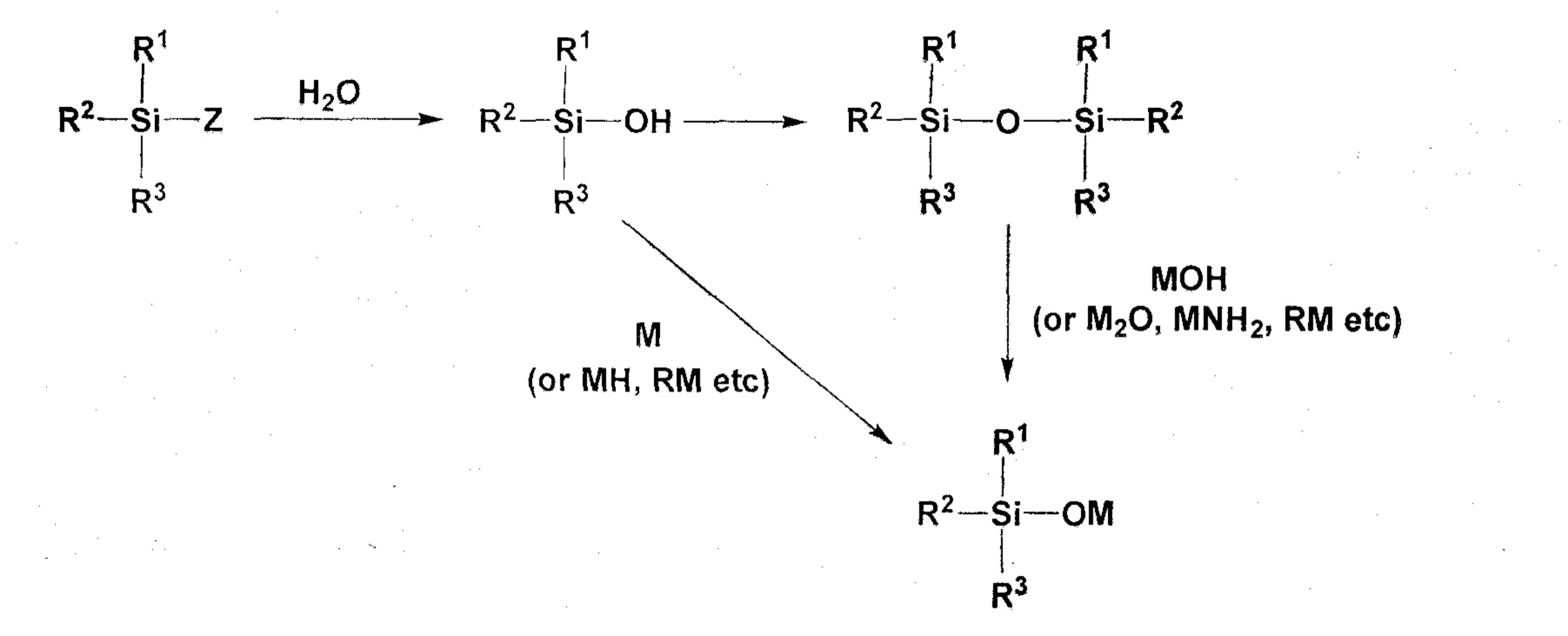
Способ синтеза соединения (2) заключается в следующем. Галогенированный силан (R1R2R3SiZ) (где R1 - R3 определены для соединения (2), Z означает атом фтора, атом хлора, атом брома или атом йода, причем когда Z означает атом фтора, это соответствует соединению (5)) гидролизуют для превращения, например, в силанол (R1R2R3SiOH) (где R1 - R3 определены для соединения (2)) или в силоксан (R1R2R3SiOSiR1R2R3) (где R1 - R3 определены для соединения (2)). Затем силанол приводят в реакцию с M, MH, RM или подобным (M определен в соединении (2), и R означает алкильную или арильную группу с числом атомов углерода от 1 до 10), или силоксан приводят в реакцию с MOH, M2O, MNH2, RM или подобным (M определен в соединении (2), и R означает алкильную или арильную группу с числом атомов углерода от 1 до 10), чтобы тем самым синтезировать соединение (2).
Примеры M, используемого для реакции с силанолом, включают Li, Na и K. Примеры MH включают LiH, NaH и KH. Примеры RM включают n-C4H9Li, sec-C4H9Li, tert-C4H9Li, CH3Li, C6H5Li, n-C4H9Na и n-C4H9K. Из них предпочтительными являются MH и RM с учетом химической активности по отношению к силанолу и контролируемости реакции на промышленном масштабе, более предпочтительны NaH, KH, n-C4H9Li и CH3Li.
Используемое количество вышеупомянутых M, MH или RM предпочтительно составляет от 0,95 моль до 2 моль на 1 моль гидроксильных групп в силаноле. Реакционная температура предпочтительно составляет от -100°C до 200°C, и продолжительность реакции предпочтительно составляет от 0,01 часа до 100 часов.
Примеры MOH, используемого для реакции с силоксаном, включают LiOH, NaOH и KOH. Примеры M2O включают Li2O, Na2O и K2O. Примеры MNH2 включают LiNH2, NaNH2 и KNH2. Примеры RM включают n-C4H9Li, sec-C4H9Li, tert-C4H9Li, CH3Li, C6H5Li, n-C4H9Na и n-C4H9K. Из них, с учетом химической активности по отношению к силоксану и контролируемости реакции на промышленном масштабе, предпочтительными являются MOH и RM, более предпочтительны NaOH, KOH, n-C4H9Li и CH3Li.
Используемое количество вышеупомянутых MOH, M2O, MNH2 и RM предпочтительно составляет от 0,95 моль до 4 моль на 1 моль силоксановых связей (Si-O-Si) в силоксане. Реакционная температура предпочтительно составляет от -100°C до 200°C, и продолжительность реакции предпочтительно составляет от 0,01 часа до 100 часов. Когда используется MOH, в реакционной системе может образовываться вода. Чтобы удалить образующуюся воду, в реакционную систему можно добавить, например, LiH, NaH, KH, MgO, CaO, CaCl2, MgSO4, Na2SO4, молекулярные сита или активный оксид алюминия в качестве дегидратирующего агента. Количество используемого LiH, NaH, KH, MgO, CaO, CaCl2, MgSO4 или Na2SO4 предпочтительно составляет от 0,95 моль до 4 моль на 1 моль силоксановых связей (Si-O-Si) в силоксане. Количество используемых молекулярных сит или активного оксида алюминия предпочтительно составляет от 1 г до 180 г на 1 моль силоксановых связей (Si-O-Si) в силоксане.
Примечание к формуле: or - и, etc - и т.д.
Получение мономера, содержащего сульфогруппу (соединение (3))
Соединение (3) можно получить путем объединения и перемешивания соединения (1) и соединения (2).
Точная причина, по которой соединение (3) получают с хорошим выходом путем объединения и перемешивания соединения (1) и соединения (2), не выяснена. Как указано ниже, предполагается, что соединение (2) раскрывает цикл соединения (1) с образованием силилового эфира сульфокислоты (CF2=CFO(CFX)nSO3SiR1R2R3), связь O-Si которого затем расщепляется соединением (2) и/или фторидом металла (MF) с получением соединения (3).
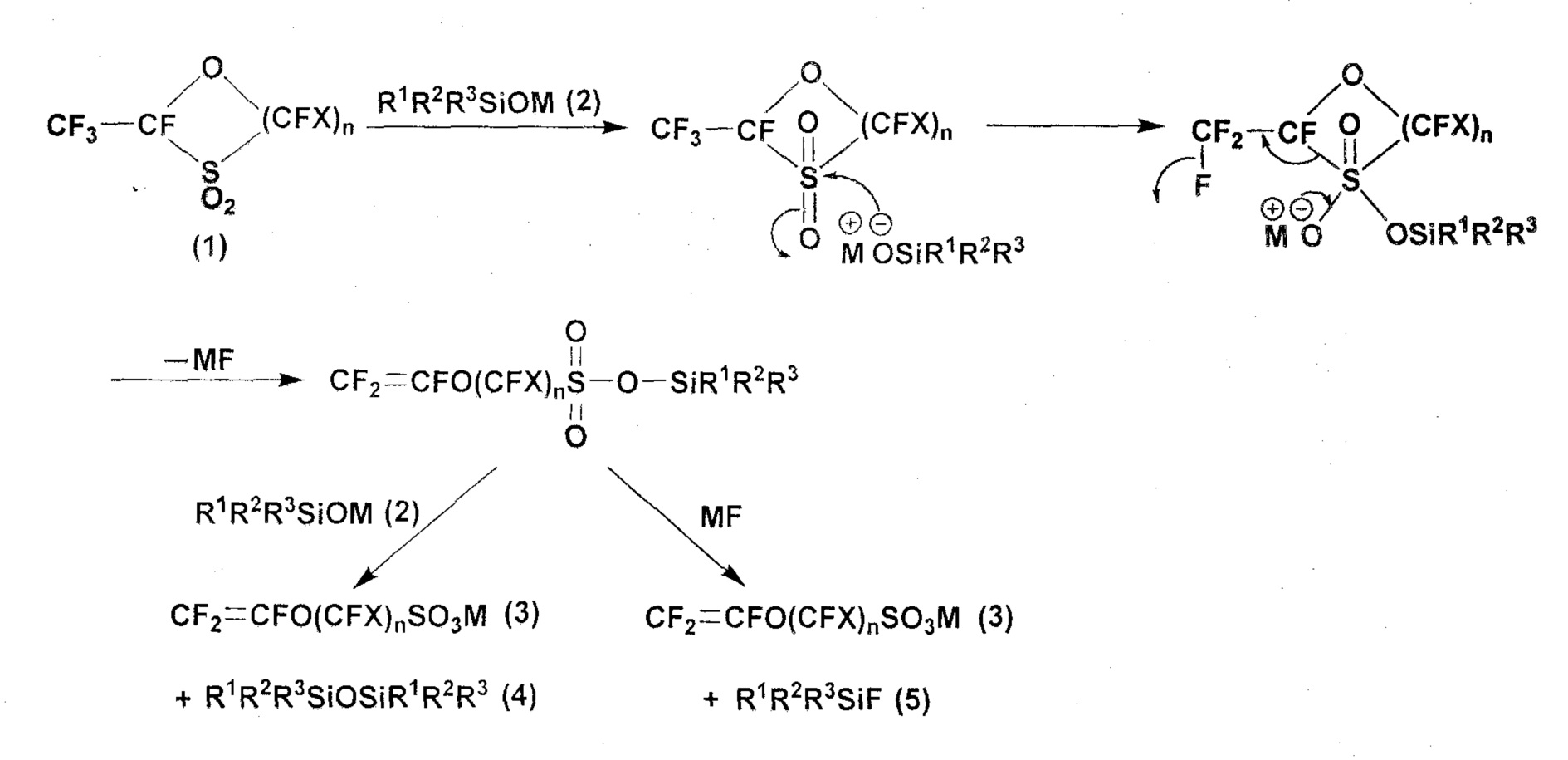
Как описано выше, когда 5-звенное циклическое соединение приводят в реакцию, например, с метоксидом натрия (NaOCH3) вместо соединения (2), образуется сложная реакционная смесь, в которой количество полученного целевого мономера, содержащего сульфогруппу (CF2=CFO(CF2)2SO3Na), мало, но соединения, предположительно имеющие структуры CH3OCF2CFH- или CF3CFH-, образуются в большем количестве. Альтернативно, когда 5-звенное циклическое соединение вместо соединения (2) реагирует с трет-бутоксидом калия (KOtC4H9), который, как известно, является объемным основанием, образуется сложная реакционная смесь, в которой количество полученного целевого мономера, содержащего сульфогруппу (CF2=CFO(CF2)2SO3K), мало, но соединения, предположительно имеющие структуры tC4H9OCF2CFH- или CF3CFH-, образуются в большем количестве
Исходя из этих фактов, в качестве причины, по которой соединение (1) и соединение (2) дают соединение (3) с хорошим выходом, предполагается, что соединение (2) представляет собой соединение кремния и имеет объемную структуру, поэтому его сложно присоединить к месту винильной группы в образованном соединении (3).
В способе получения согласно настоящему варианту осуществления на стадии соединения и перемешивания предпочтительно используется растворитель.
Можно использовать широкий спектр апротонных полярных растворителей, если они инертны во время реакции, и примеры апротонных полярных растворителей включают растворители, содержащие группы простого эфира, такие как тетрагидрофуран, 1,2-диметоксиэтан, 1,2-диэтоксиэтан, 1,4-диоксан, циклопентилметиловый эфир, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, диметиловый эфир триэтиленгликоля, диметиловый эфир тетраэтиленгликоля и 4-метилтетрагидропиран; растворители, содержащие нитрильные группы, такие как ацетонитрил; и растворители, содержащие сульфонильную группу, такие как сульфолан. Из них для получения соединения (3) с хорошим выходом предпочтительно использовать растворитель, содержащий группу простого эфира, такой как тетрагидрофуран, 1,2-диметоксиэтан, 1,2-диэтоксиэтан и 4-метилтетрагидропиран.
В способе получения согласно настоящему варианту осуществления соединение (2) предпочтительно используется в количестве, соответствующем или больше молярного эквивалента соединения (1), более предпочтительно в количестве, в 1-4 раза превышающем молярный эквивалент соединения (1), и наиболее предпочтительно в количестве, в 1-3 раза превышающем молярный эквивалент соединения (1).
Температура на стадии соединения и перемешивания предпочтительно составляет от -80°C до 100°C, более предпочтительно от -50°C до 80°C.
Продолжительность стадии соединения и перемешивания предпочтительно составляет от 0,01 до 50 часов, более предпочтительно от 0,1 до 10 часов.
В способе получения согласно настоящему варианту осуществления вместе с целевым соединением (3) в качестве побочного продукта может образовываться протонный аддукт, представленный следующей общей формулой (8) (ниже называемый "соединением (8)"):
CF3CFHO(CFX)nSO3Y (8),
где n и X идентичны n и X в вышеуказанной общей формуле (1), Y означает атом водорода, M или R1R2R3Si, где M и R1 - R3 такие же, как M и R1 - R3 в общей формуле (2) выше. Известно, что соединение (8) легко превращается в соединение (3) в результате добавления объемного основания, такого, как гексаметилдисилазид лития, к соединению (8), как описано в документе NPL 2.
Кроме вышеописанного соединение (8), способ получения по настоящему варианту осуществления дает силоксан, представленный следующей общей формулой (4) (далее называемый "соединением (4)")
R1R2R3SiOSiR1R2R3(4),
где R1 - R3 такие же, как R1 - R3 в формуле (2) выше), и/или
соединение кремня, содержащее атом фтора, представленное следующей общей формулой (5) (ниже называемое "соединением (5)")
R1R2R3SiF (5),
где R1 - R3 такие же, как R1 - R3 в формуле (2) выше)
в качестве побочных продуктов, вместе с целевым соединением (3).
Далее, реакция может также давать фторид металла (MF) (M определено в общей формуле (2) выше), который может присутствовать в реакционной системе. Хотя точная причина, по которой соединение (4), соединение (5) и фторид металла (MF) образуются в качестве побочных продуктов, не выяснена, предполагается, что побочные продукты образуются по механизму, описанному выше.
Авторы провели также обширные исследования способа получения по настоящему варианту осуществления, который включает (i) выделение соединения (4) и/или соединения (5) из реакционной смеси, содержащей целевое соединение (3) и соединение (4) и/или соединение (5) в качестве побочных продуктов, которые получаются в результате соединения и перемешивания соединения (1) и соединения (2); с последующим (ii) превращением выделенного соединения (4) и/или соединения (5) в соединение (2); и (iii) соединение и перемешивание соединения (1) и соединения (2), полученного на стадии (ii), чтобы тем самым получить соединение (3). Заявители считают этот способ промышленно выгодным, что будет описано ниже.
Для выделения соответствующих компонентов из реакционной смеси, содержащей целевое соединение (3) и соединение (4) и/или соединение (5) в качестве побочных продуктов, можно использовать самые разные методы выделения. Типичные методы включают выделение дистилляцией и выделение экстракцией с помощью органического растворителя или воды. Когда фторид металла (MF) осаждается или суспендируется в суспензии, фторид металла можно удалить фильтрацией перед выделением и очисткой.
Например, при выделении путем дистилляции соединение (3) можно выделить, отгоняя используемый растворитель и соединение (4) и/или соединение (5) из раствора или суспензии после реакции. Дистиллят, содержащий растворитель, и соединение (4) и/или соединение (5), которые были отогнаны, подвергают дополнительной дистилляции или экстракции, чтобы разделить растворитель и соединение (4) и/или соединение (5).
При выделении экстракцией с помощью, например, органического растворителя или воды используемый растворитель отгоняют из раствора или суспензии после реакции. Затем к остатку добавляют воду, чтобы тем самым вызвать растворение соединения (3) в воде, чтобы соединение (3) можно было выделить фильтрацией или подобным.
Соединение (4) и/или соединение (5), полученные в результате вышеописанного выделения, можно легко превратить в соединение (2), которое затем соединяют и перемешивают с соединением (1) для получения соединения (3), как описано выше в связи с синтезом силанольного соединения (соединение (2)).
Как описано выше, настоящее изобретение обеспечивает эффективное получение мономера, содержащего сульфогруппу, который служит исходным материалом для различных полимерных электролитов на основе фтора, обладающих высокой термостойкостью, таких, как мембраны для топливных элементов, каталитические связующее полимеры для топливных элементов и мембраны для хлорщелочного электролиза.
Примеры
Хотя настоящее описание описывается далее более подробно на примерах и сравнительных примерах, понятно, что настоящее изобретение не ограничивается этими примерами.
В примерах и сравнительных примерах использованы следующие аналитические методы:
- спектроскопия ядерного магнитного резонанса (ЯМР): анализ молекулярной структуры с помощью1H-ЯМР и19F-ЯМР
- аналитический прибор: ЯМР-спектрометр, тип JNM-ECZ400S (производство JEOL Ltd.)
- растворители: дейтерохлороформ и оксид дейтерия
- эталон сравнения: CFCl3 (0 ppm)
Пример 1
В 3-литровую круглодонную колбу, снабженную механической мешалкой, капельной воронкой и обратным холодильником, загружали карбонат натрия (328,6 г, 3,10 моль), который сушили при 180°C в течение 6 часов, и тетраглим (1000 мл). Когда температура внутри реактора поддерживалась на уровне 30°C или ниже, по каплям в течение более 3 часов добавляли CF3CF(COF)OCF2CF2SO2F (934,2 г, 2,70 моль). После завершения капельного добавления реакционную смесь дополнительно перемешивали при 40°C в течение 1 часа, получая натриевую соль карбоновой кислоты (CF3CF(CO2Na)OCF2CF2SO2F). Полученную реакционную смесь грели при 160°C при нормальном давлении, чтобы инициировать декарбоксилирование. Летучий компонент отгоняли и собирали в сосуд, охлаждаемый на льду. Эта бесцветная жидкость была идентифицирована посредством19F-ЯМР как циклическое соединение (741,9 г, 2,65 моль; выход: 98%).
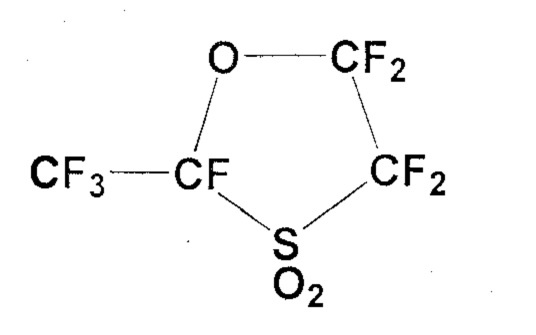
19F-ЯМР: δ(ppm) -124.7 (1F), -120.6 (1F), -115.4 (1F), -90.1 (1F), -80.5 (3F), -78.0 (1F)
В четырехгорлую колбу на 500 мл в атмосфере азота загружали циклическое соединение (20,39 г, 73 ммоль), полученное на предыдущей стадии, и охлаждали до 0°C. Затем в эту колбу по каплям в течение 1 часа добавляли раствор триметилсиланолята натрия (доступен от Sigma Aldrich Co., LLC; 16,03 г, 143 ммоль), растворенного в 4-метилтетрагидропиране (120,85 г), после чего дополнительно перемешивали 2 часа при комнатной температуре. Из полученной реакционной смеси отбирали образец, анализ которого методом19F-ЯМР показал исчезновение циклического соединения и получение 93 моль% CF2=CFOCF2CF2SO3Na и 7 моль% CF3CFHOCF2CF2SO3Na. Образование триметилсилилфторид (точка кипения: 16°C) было подтверждено по19F-ЯМР при -158.5 ppm, а образование гексаметилдисилоксана (точка кипения: 100°C) было подтверждено по1H-ЯМР при 0.8 ppm. Полученную реакционную смесь нагревали при пониженном давлении (190 гПа), жидкость (125,22 г) отгоняли, а твердый остаток (28,7 г) оставляли. Отогнанная жидкость была идентифицирована с помощью1H-ЯМР (внутренний стандарт: бензотрифторид) как смесь 4-метилтетрагидропирана (91,0 вес.%) и гексаметилдисилоксана (9,0 вес.%). Кроме того, по данным19F-ЯМР (внутренний стандарт: трифторэтанол) было установлено, что твердый остаток содержал 70,0 вес.% (выход: 92%) CF2=CFOCF2CF2SO3Na и 6,4 вес.% (выход: 8%) CF3CFHOCF2CF2SO3Na.
CF2=CFOCF2CF2SO3Na
19F-ЯМР: δ(ppm) -136.3 (1F), -123.3 (1F), -118.8 (2F), -115.4 (1F), -85.4 (2F)
CF3CFHOCF2CF2SO3Na
19F-ЯМР: δ(ppm) -147.3 (1F), -118.8 (2F), -85.8 (1F), -85.0 (3F), -84.3 (1F)
Пример 2
В четырехгорлую колбу на 50 мл в атмосфере азота загружали гексаметилдисилоксан (1 г, 6 ммоль), который был получен очисткой путем дистилляции из жидкого дистиллята (смесь 4-метилтетрагидропирана и гексаметилдисилоксана), полученного как описано в примере 1, гидроксид натрия (0,49 г, 12 ммоль), NaH (содержание: 62%) (0,70 г, 18 ммоль) и 1,2-диметоксиэтан (4 г). Систему грели при 85°C в течение 10 часов и затем охлаждали до комнатной температуры. Нерастворимые компоненты отфильтровывали, получая раствор триметилсиланолята натрия в 1,2-диметоксиэтане.
В четырехгорлую колбу на 50 мл в атмосфере азота загружали циклическое соединение (1,71 г, 6 ммоль), полученное как описано в примере 1. Когда система была охлаждена до 0°C, по каплям добавляли раствор триметилсиланолята натрия в 1,2-диметоксиэтане, полученный выше, после чего дополнительно перемешивали при комнатной температуре в течение 1 часа. Из полученной реакционной смеси отбирали образец, анализ которого методом19F-ЯМР показал исчезновение циклического соединения и получение 87 моль% CF2=CFOCF2CF2SO3Na и 13 моль% CF3CFHOCF2CF2SO3Na. Кроме того, было подтверждено образование триметилсилилдфторида при -158.5 ppm.
Пример 3
В двухгорлую колбу на 50 мл в атмосфере азота загружали NaH (содержание: 62%) (0,308 г, 8,0 ммоль) и 1,2-диметоксиэтан (3 г) и охлаждали до 0°C. В эту колбу по каплям добавляли раствор трифенилсиланола (доступен от Tokyo Chemical Industry Co., Ltd.; 1,972 г, 7,1 ммоль), растворенного в 1,2-диметоксиэтане (3 г), с последующим дополнительным перемешиванием при 0°C в течение 30 минут, получая в результате раствор трифенилсиланолята натрия в 1,2-диметоксиэтане.
В двухгорлую колбу объемом 50 мл в атмосфере азота загружали циклическое соединение (1,00 г, 3,6 ммоль), полученное, как описано в примере 1, и охлаждали до 0°C. В колбу по каплям добавляли раствор трифенилсиланолата натрия в 1,2-диметоксиэтане, полученный, как описано выше, с последующим дополнительным перемешиванием при 0°C в течение 1 часа. Из полученной реакционной смеси отбирали образец, анализ которого методом19F-ЯМР показал исчезновение циклического соединения и получение 95 моль% CF2=CFOCF2CF2SO3Na и 5 моль% CF3CFHOCF2CF2SO3Na. Кроме того, при -170,1 ppm было подтверждено образование трифенилсилилфторида.
Пример 4
В трехгорлую колбу объемом 200 мл в атмосфере азота загружали 1М раствор триметилсиланолата натрия в тетрагидрофуране (доступный от Sigma Aldrich Co., LLC; 44 мл, 44 ммоль) и когда система охлаждалась на льду, по каплям добавляли циклическое соединение (5,60 г, 20 ммоль), полученное, как описано в примере 1, с последующим перемешиванием при комнатной температуре в течение 2 часов. Отгонка жидкости из полученной реакционной смеси при пониженном давлении дала желтое твердое вещество (9,64 г). Методом19F-ЯМР (внутренний стандарт: гексафторбензол) было установлено, что полученное желтое твердое вещество содержит 57 вес.% (выход 93%) CF2=CFOCF2CF2SO3Na и 4,7 вес.% (выход: 7%) CF3CFHOCF2CF2SO3Na.
Пример 5
Повторяли ту же процедуру, что и в примере 3, за исключением того, что вместо трифенилсиланола, использовавшегося в примере 3, использовали триэтилсиланол (доступный от Tokyo Chemical Industry Co., Ltd.). Из полученной реакционной смеси отбирали образец, анализ которого методом19F-ЯМР показал исчезновение циклического соединения и получение 83 моль% CF2=CFOCF2CF2SO3Na и 17 моль% CF3CFHOCF2CF2SO3Na. Кроме того, было подтверждено образование триэтилсилилфторида при -176.1 ppm.
Пример 6
В трехгорлую колбу объемом 100 мл в атмосфере азота загружали триметилсиланолат лития (доступный от Sigma Aldrich Co., LLC; 2,11 г, 22 ммоль) и 1,2-диметоксиэтан (30 мл), которые перемешивали. Затем, когда система охлаждалась на льду, по каплям добавляли циклическое соединение (5,60 г, 20 ммоль), полученное, как описано в примере 1, с последующим дополнительным перемешиванием при комнатной температуре в течение 2 часов. Из полученной реакционной смеси отбирали образец, анализ которого методом19F-ЯМР показал исчезновение циклического соединения и получение 90 моль% CF2=CFOCF2CF2SO3Li и 10 моль% CF3CFHOCF2CF2SO3Li. Кроме того, было подтверждено образование триметилсилилфторида при -158.5 ppm. Отгонка жидкости из полученной реакционной смеси при пониженном давлении дала желтое твердое вещество (7,60 г). Методом19F-ЯМР (внутренний стандарт: гексафторбензол) было установлено, что это желтое твердое вещество содержит 67 вес.% (выход: 90%) CF2=CFOCF2CF2SO3Li и 8 вес.% (выход: 10%) CF3CFHOCF2CF2SO3Li.
Пример 7
В трехгорлую колбу объемом 100 мл в атмосфере азота загружали триэтилсиланол (доступный от Tokyo Chemical Industry Co., Ltd.; 0,66 г, 5 ммоль) и тетрагидрофуран (12 мл), охлажденный до 0°C. Затем по каплям добавляли раствор 1,6 М н-бутиллития в гексане (3,1 мл) с последующим дополнительным перемешиванием при 0°C в течение 30 минут, получая в результате раствор триэтилсиланолата лития в тетрагидрофуране. В эту колбу по каплям добавляли циклическое соединение (1,40 г, 5 ммоль), полученное, как описано в примере 1, с последующим перемешиванием при 0°C в течение 30 минут и дальнейшим перемешиванием при комнатной температуре в течение 2 часов. Из полученной реакционной смеси отбирали образец, анализ которого методом19F-ЯМР показал исчезновение циклического соединения и образование 82 моль% CF2=CFOCF2CF2SO3Li и 18 моль% CF3CFHOCF2CF2SO3Li. Кроме того, было подтверждено образование триэтилсилилфторида при -176.8 ppm.
Пример 8
Осуществляли ту же процедуру, что и в примере 7, с тем отличием, что вместо триэтилсиланола, использованного в примере 7, использовали трифенилсиланол (доступный от Tokyo Chemical Industry Co., Ltd.). Из полученной реакционной смеси отбирали образец, анализ которого методом19F-ЯМР показал исчезновение циклического соединения и получение 80 моль% CF2=CFOCF2CF2SO3Li и 20 моль% CF3CFHOCF2CF2SO3Li. Кроме того, было подтверждено образование трифенилсилилфторида при -170,9 ppm.
Сравнительный пример 1
В трехгорлую колбу на 50 мл в атмосфере азота загружали метоксид натрия (NaOCH3) (0,19 г, 3,52 ммоль) и диэтиловый эфир (7 мл) с последующим перемешиванием. Затем, когда система охлаждалась на льду, по каплям добавляли циклическое соединение (1,19 г, 4,25 ммоль), полученное, как описано в примере 1, с последующим дополнительным перемешиванием при комнатной температуре в течение 24 часов. Анализ методом19F-ЯМР показал, что циклическое соединение (37 моль%) осталось, и в полученной реакционной смеси содержалось целевое соединение CF2=CFOCF2CF2SO3Na (13 моль%) и соединения (50 моль%), предположительно имеющие структуры CH3OCF2CFH- или CF3CFH-.
Сравнительный пример 2
В трехгорлую колбу на 50 мл в атмосфере азота загружали трет-бутоксид калия (KOtC4H9) (1,12 г, 10 ммоль) и 1,2-диметоксиэтан (10 мл) с последующим перемешиванием. Затем, когда система охлаждалась на льду, по каплям добавляли циклическое соединение (2,80 г, 10 ммоль), полученное, как описано в примере 1, с последующим дополнительным перемешиванием при комнатной температуре в течение 24 часов. Анализ методом19F-ЯМР показал, что циклическое соединение (33 моль%) осталось, и в полученной реакционной смеси содержалось целевое соединение CF2=CFOCF2CF2SO3K (15 моль%) и соединения (52 моль%), предположительно имеющие структуры tC4H9OCF2CFH- или CF3CFH-.
Промышленная применимость
Согласно настоящему изобретению, можно с высоким выходом получать мономер, содержащий сульфогруппу, который является сырьем для обладающих высокой термостойкостью полимерных электролитов на основе фтора, подходящих для таких приложений, как мембраны для топливных элементов, каталитические связующие полимеры для топливных элементов и мембраны для хлорщелочного электролиза.
Реферат
Изобретение относится к способам получения мономеров, содержащих сульфогруппу. Предложен способ получения мономера, содержащего сульфогруппу, формулы CF2=CFO(CFX)nSO3Y, включающий стадию объединения и перемешивания циклического соединения общей формулы (1) и силанольного соединения общей формулы R1R2R3Si(OM), где X представляет собой F или CF3, и n означает целое число от 1 до 6, причем, когда n больше или равно 2, все CFX могут быть одинаковыми или разными; M представляет щелочной металл или щелочноземельный металл; и каждый из R1до R3независимо представляет собой необязательно замещенную углеводородную группу с числом атомов углерода от 1 до 10, или OM, где M представляет собой щелочной или щелочноземельный металл. Технический результат – предложенный способ позволяет с высоким выходом получать мономер, содержащий сульфогруппу, который можно использовать в качестве сырья для полимерных электролитов на основе фтора, таких как мембраны для топливных элементов, каталитические связующие полимеры для топливных элементов и мембраны для хлорщелочного электролиза. 3 з.п. ф-лы, 8 пр.
Формула

Документы, цитированные в отчёте о поиске
Перфторалкансульфонат калия и способ его получения

Комментарии