Высокоамилозная пшеница - RU2619636C2
Код документа: RU2619636C2
Чертежи










































































Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В данном описании представлены способы получения гексаплоидных растений пшеницы, имеющих высокоамилозный крахмал, и применение таких растений, и в частности их зерна или крахмала, в ряде продуктов питания и непродовольственных товаров.
УРОВЕНЬ ТЕХНИКИ
Детальные библиографические данные публикаций, упомянутых автором в настоящем описании, собраны в конце описания.
Ссылка на любой прототип в данном описании не является и не должна приниматься как утверждение или любая форма предположения того, что данный прототип является частью общедоступных сведений в любой стране.
За последнее десятилетие было много изучено о молекулярных, генетических и клеточных процессах, лежащих в основе жизненных циклов растений и растениеводства. Одним из наиболее важных растительных продуктов является зерно пшеницы. Зерно пшеницы является основным продуктом питания во многих странах и поставляет по меньшей мере 20% килоджоулей из продуктов питания для всего населения мира. Крахмал является основным компонентом зерна пшеницы, и его применяют в широком спектре продуктов питания и непродовольственных товаров. Характеристики крахмала меняются, и они играют ключевую роль в определении пригодности пшеничного крахмала для конкретного конечного применения. Несмотря на огромное мировое потребление и несмотря на повышенную осведомленность о важности влияния функциональности крахмала на качество конечного продукта, исследования по генетической изменчивости пшеницы и ее конкретного воздействия на характеристики крахмала отстают по сравнению с исследованиями для других промышленно важных растительных культур.
Пшеница обыкновенная (Triticum aestivum) является гексаплоидом, имеющим три пары гомологичных хромосом, определяющих геномы А, В и D. Эндосперм зерна содержит 2 гаплоидных набора от материнской клетки и один от отцовской клетки. Зародыш зерна пшеницы содержит один гаплоидный набор от каждой материнской и отцовской клеток. Гексаплоидия считалась значительным препятствием в исследованиях и разработке полезных вариантов пшеницы. На самом деле, известно очень мало о том, как взаимодействуют гомологичные гены пшеницы, как регулируется их экспрессия и как различные белки, продуцируемые гомологичными генами, работают отдельно или совместно.
Зерновой крахмал состоит из двух полимеров глюкозы, амилозы и амилопектина. Соотношение амилозы к амилопектину считается основным фактором, определяющим (I) пользу для здоровья у пшеницы и пшеничного крахмала и (II) конечное качество продуктов, содержащих пшеничный крахмал.
Амилоза представляет собой в основном линейный полимер α-1,4-связанных звеньев глюкозы, в то время как амилопектин сильно разветвлен при помощи α-1,6-связей гликозидных звеньев, соединяющих линейные цепи.
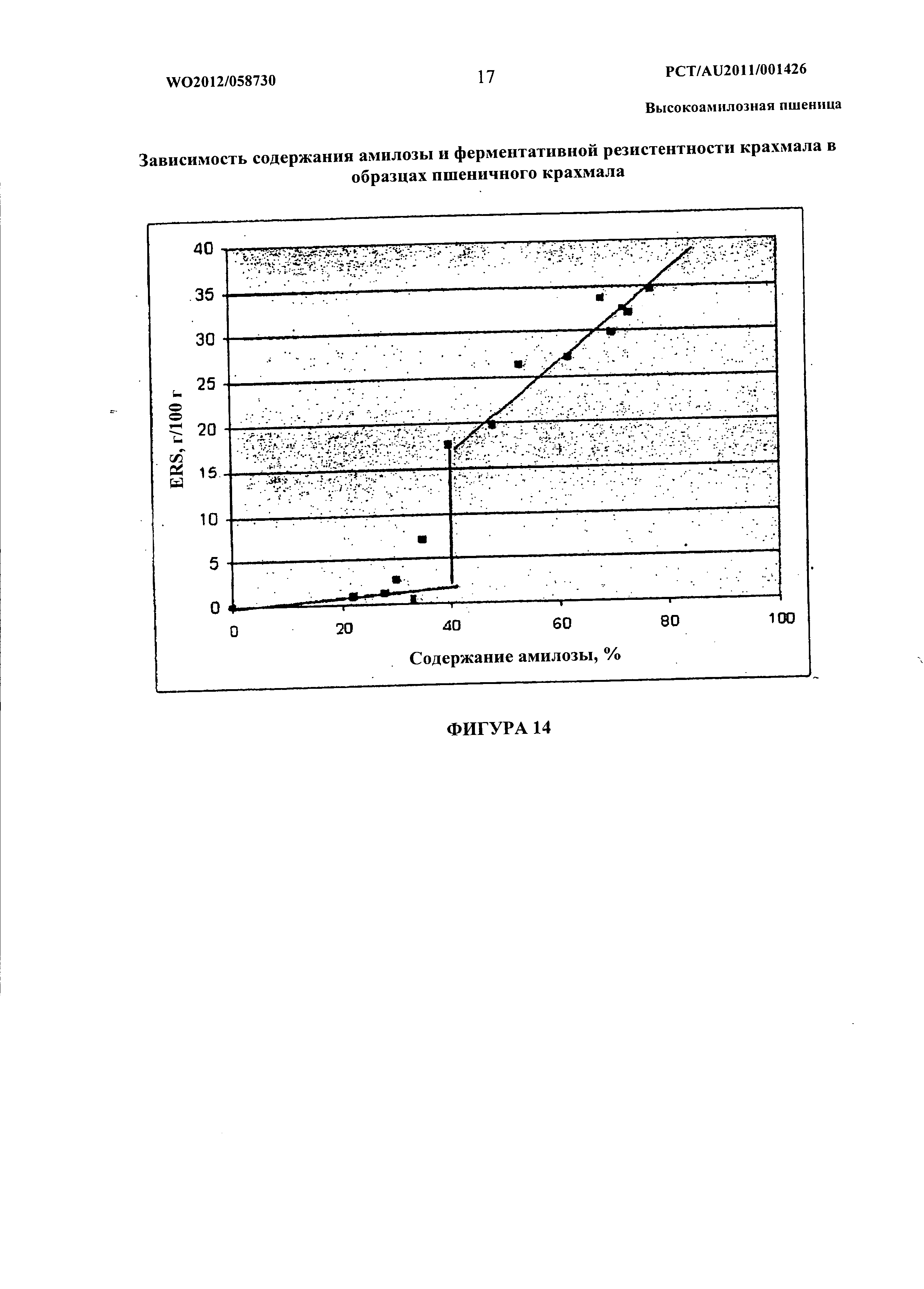
Высокоамилозные крахмалы представляют особый интерес в отношении их пользы для здоровья. Продукты питания, имеющие высокое содержание амилозы, были определены inter alia как естественным образом имеющие более высокое содержание резистентного крахмала, формы пищевого волокна. RS является крахмалом или продуктами расщепления крахмала, которые не расщепляются или всасываются в тонком кишечнике. Резистентный крахмал все чаще рассматривают как играющий важную роль в улучшении здоровья кишечника и в защите от заболеваний, таких как колоректальный рак, диабет II типа, ожирение, болезнь сердца и остеопороз. Были разработаны высокоамилозные крахмалы у определенных зерновых культур, таких как маис и ячмень, для применения в пищевых продуктах в качестве средства улучшения здоровья кишечника. Благоприятные эффекты резистентного крахмала являются результатом обеспечения питательного вещества в толстой кишке, в которой микрофлора кишечника получает источник энергии, который сбраживается с образованием inter alia короткоцепочечных жирных кислот. Эти короткоцепочечные жирные кислоты обеспечивают питательные вещества для колоноцитов, повышают поглощение определенных питательных веществ в толстой кишке и способствуют физиологической активности толстой кишки. Как правило, если резистентные крахмалы или другое пищевое волокно не поступают в толстую кишку, она становится метаболически относительно неактивной. Таким образом, высокоамилозные продукты обладают потенциалом к стимуляции повышенного потребления волокна. Некоторые из потенциальных полезных для здоровья эффектов потребления высокоамилозного зерна пшеницы или его продуктов, например, крахмала, включают его роль в регулировании уровней сахара, инсулина и липидов, улучшении здоровья кишечника, производстве пищи более низкой калорийности, что способствует насыщению, улучшении перистальтики кишечника, водного объема фекалий, стимуляции роста пробиотических бактерий и повышении экскреции желчных кислот с фекалиями.
Большинство обработанных крахмалистых пищевых продуктов содержат очень мало RS. Хлеб, полученный с применением муки из пшеницы дикого типа и традиционного способа составления и выпечки, содержал <1% RS. Для сравнения хлеб, испеченный с применением того же способа и условий хранения, но содержащий модифицированную высокоамилозную пшеницу, имел уровни RS до 10 раз выше (см. международную публикацию WO 2006/069422). Бобовые, которые являются одним из немногих богатых источников RS в рационе человека, содержат уровни RS, которые обычно составляют <5%. Поэтому потребление высокоамилозного пшеничного хлеба в количествах, обычно потребляемых взрослыми (например, 200 г/день), легко обеспечивало бы по меньшей мере 5-12 г RS. Таким образом, включение высокоамилозной пшеницы в пищевые продукты обладает потенциалом к внесению значительного вклада в диетическое потребление RS в развитых странах, где среднее суточное потребление RS по оценкам составляет только приблизительно 5 г.
Крахмал широко применяется в пищевой, бумажной и химической промышленностях. Физическая структура крахмала может иметь важное влияние на питательные свойства и пригодность крахмала к обработке для пищевой, непищевой или промышленной продукции. Некоторые характеристики можно принимать в качестве показателя структуры крахмала, включая распределение длины амилопектиновой цепи, степень и тип кристаллического состояния и такие свойства, как температура клейстеризации, вязкость и объем набухания. Изменения в длине амилопектиновой цепи может быть показателем измененного кристаллического состояния, клейстеризации или ретроградации амилопектина.
В то время как химически или иначе модифицированные крахмалы можно применять в пищевых продуктах, которые обеспечивают функциональные возможности, обычно не предоставляемые немодифицированными источниками, такая обработка имеет тенденцию либо изменять другие ценные компоненты, либо приводить к пониманию того, что она нежелательна вследствие процессов, вовлеченных в модификации. Поэтому предпочтительно предоставить источники составляющих компонентов, которые можно применять в немодифицированной форме пищевых продуктов.
Изначально крахмал синтезируется в растениях в хлоропластах фотосинтезирующих тканей, таких как листья, в форме временного крахмала. Он мобилизируется в течение последующих периодов темноты для поставкой углерода для передачи к органам-акцепторам и энергетического обмена, или для хранения в таких органах, как семена или клубни. Синтез и долговременное хранение крахмала осуществляется в амилопластах запасающих органов, таких как эндосперм, где крахмал осаждается в виде полукристаллических гранул до 100 мкм в диаметре. Гранулы содержат как амилозу, так и амилопектин, первую обычно в виде аморфного вещества в нативной грануле крахмала, а второй полукристаллический, посредством укладки линейных гликозидных цепей. Гранулы также содержат некоторые белки, участвующие в биосинтезе крахмала.
Синтазы крахмала в эндосперме приводятся в исполнение в четыре основных стадии. АДФ-глюкоза-пирофосфорилаза (ADGP) катализирует синтез АДФ-глюкозы из глюкозо-1-фосфата и АТФ. Затем синтазы крахмала содействуют переносу АДФ-глюкозы к концу α-1,4-связанного звена глюкозы. β-третьих, крахмал-ветвящие ферменты (SBE) формируют новые α-1,6-связи в α-полиглюканах. Крахмал-деветвящие ферменты (SDBE) затем удаляют некоторые связи ветвей с помощью механизма, который не был полностью изучен.
Хотя ясно, что по меньшей мере эти четыре операции необходимы для нормального синтеза крахмальных гранул у высших растений, в эндосперме высших растений встречаются несколько изоформ ферментов, участвующих на одной из четырех операций. Были предложены специфические роли для некоторых изоферментов на основе мутационного анализа или посредством модификации уровней экспрессии генов с применением трансгенных подходов (Abel и соавт., 1996; Jobling и соавт., 1999; Schwall и соавт., 2000). Однако точные вклады каждой изоформы в каждой операции в биосинтезе крахмала до сих пор не известны, и оказывается, эти вклады заметно отличаются между видами.
В эндосперме хлебных злаков присутствуют две изоформы АДФ-глюкозопирофосфорилазы (ADGP), одна форма - внутри амилопласта, и одна форма - в цитоплазме. Каждая форма состоит из двух типов субъединиц. Мутанты shrunken (sh2) и brittle (bt2) маиса проявляют повреждения большой и малой субъединиц, соответственно.
Некоторые усилия были сосредоточены на ферментах-синтазах крахмала для исследования стратегий модуляции соотношения амилоза/амилопектин в пшенице (см. Sestili и соавт. 2010).
В эндосперме хлебных злаков обнаружены четыре класса крахмалсинтазы (SS), изоформа, исключительно локализованная внутри гранулы крахмала (гранулоассоциированная крахмалсинтаза (GBSS)), две формы, которые распределены между гранулой и растворимой фракцией (SSI, SSII) и четвертая форма, которая полностью локализована в растворимой фракции (SSIII). Показано, что GBSS необходима для синтеза амилозы, и показано, что мутации в SSII и SSIII изменяют структуру амилопектина.
Мутантные растения пшеницы, у которых полностью отсутствует белок SGP-1 (SSIIa), были получены при скрещивания линий, у которых отсутствуют специфические геномные формы А, В и D белка SGP-1 (SSII) (Yamamori и соавт., 2000). Оценка SSII-нуль семян, показала, что данная мутация приводила к изменению структуры амилопектина, давала деформированные гранулы крахмала и повышенное относительное содержание амилозы до приблизительно 30-37% у крахмала, что примерно на 8% превышает уровень у дикого типа (Yamamori и соавт., 2000). Амилозу измеряют с помощью колориметрического анализа, амперометрического титрования (оба эти анализа основаны на связывании с йодом) и способом на основе использования конканавалина А. Крахмал, полученный из SSII-нуль мутанта, обнаруживал пониженную температуру-клейстеризации по сравнению с крахмалом, полученным от эквивалентного немутантного растения. Содержание крахмала было снижено с 60% у дикого типа до менее 50% у SSII-нуль зерна.
У маиса мутация dull1 обуславливает сниженное содержание крахмала и повышенные уровни амилозы в эндосперме, где степень изменения зависела от генетического окружения, а также повышенную степень ветвления в остаточном амилопектине. Ген, соответствующий мутации, идентифицировали и выделили с применением стратегии транспозонного мечения транспозоном-мутатором (Mu), и было показано, что он кодирует фермент, называемый крахмалсинтазой II (SSII). У зерновых этот фермент в настоящее время известен как член семейства SSIII. Мутантный эндосперм имел пониженные уровни активности SBEIIa, ассоциированной с мутацией dull1. Неизвестно, относятся ли эти данные к другим зерновым культурам.
Ранее были идентифицированы линии ячменя, имеющие повышенное относительное содержание амилозы в крахмале зерна. К таким относится High Amylose Glacier (AC38), которая имеет относительное содержание амилозы приблизительно 45% и химически индуцированные мутации в гене SSIIa ячменя, которые повысили содержание амилозы в крахмале зерна приблизительно до 65-70% (WO 02/37955 A1; Morell и соавт., 2003). Крахмал демонстрировал пониженные температуры клейстеризации.
У растений известны два основных класса SBE: SBEI и SBEII. У зерновых SBEII можно дополнительно разделить на два типа: SBEIIa и SBEIIb. О дополнительных формах SBE также сообщалось у некоторых зерновых, предполагаемо 149 кДа SBEI в пшенице и 50/51 кДа SBE в ячмене.
Выравнивание последовательностей показывает высокую степень сходства последовательностей как на нуклеотидном, так и на аминокислотном уровнях и делает возможной группировку на классы SBEI, SBEIIa и SBEIIb. SBEIIa и SBEIIb обычно имеют приблизительно 80% идентичности нуклеотидных последовательностей друг к другу, особенно в центральных областях генов.
Было показано, что у маиса и у риса фенотипы с высоким содержанием амилозы обусловлены повреждениями гена SBEIIb, известного так же как ген-удлинитель амилозы (ае) (Воyеr&Preiss, 1981, Mizuno и соавт., 1993; Nishi и соавт., 2001). В этих мутантах по гену SBEIIb гранулы крахмала в эндосперме демонстрировали аномальную морфологию, содержание амилозы было значительно повышено, частота ветвления остаточного амилопектина была ниже, а также была снижено доля коротких цепей ( SBEIIa, SBEIIb и SBEI также могут отличаться своими профилями экспрессии, как временными, так и пространственными, в эндосперме и в других тканях. SBEI экспрессируется с середины развития эндосперма и далее у пшеницы и маиса (Morell и соавт., 1997). SBEIIa и SBEIIb, наоборот, экспрессируются с самого раннего этапа развития эндосперма. У маиса SBEIIb является преобладающей формой в эндосперме, тогда как SBEIIa присутствует на высоких уровнях экспрессии в листе (Gao и соавт., 1997). У риса SBEIIa и SBEIIb встречаются в эндосперме примерно в равных количествах. Тем не менее, существуют различия в сроках и тканях экспрессии SBEIIa экспрессируется на более ранней стадии развития семени и обнаруживается через 3 дня после цветения, а также экспрессируется в листьях, в то время как SBEIIb не обнаруживается через 3 дня после цветения и наиболее распространен в развивающихся семенах на 7-10 день после цветения и не экспрессировался в листьях. В эндосперме пшеницы SBEI (Morell и соавт., 1997) встречается исключительно в растворимой фракции, тогда как SBEIIa и SBEIIb встречаются как в растворимой, так и в фракциях, связанных с гранулами крахмала (Rahman и соавт., 1995). С некоторого времени известны сорта маиса с очень высоким содержанием амилозы. Маис с низким содержанием амилопектина крахмала, который содержит очень высокий уровень амилозы (>90%), была получен значительным снижением активности SBEI вместе с почти полным подавлением активности SBEII (Sidebottom и соавт., 1998). В картофеле даун-регуляция основного SBE в клубнях (SBE В, эквивалентный SBEI) с помощью антисмысловых способов дала в результате некоторые новые характеристики крахмала, но не изменило содержание амилозы (Safford и соавт., 1998). Антисмысловое ингибирование менее обильной формы SBE (SBE А, аналогичного SBEII в зерновых) привело к умеренному повышению содержания амилозы до 38% (Jobling и соавт., 1999). Однако даун-регуляция комбинации как SBEII, так и SBEI приводила к гораздо большим увеличениям относительного содержания амилозы, до 60-89%, чем даун-регуляция только одного SBEII (Schwall и соавт., 2000). Международная публикация WO 2005/001098 и международная публикация № WO 2006/069422 описывают inter alia трансгенную гексаплоидную пшеницу, содержащую экзогенные конструкции дуплексной РНК, которые уменьшают экспрессию SBEIIa и/или SBEIIb в эндосперме. Зерно из трансгенных линий либо вообще не имело белка SBEIIa и/или SBEIIb, либо имело сниженные уровни белка. Потеря белка SBEIIa в эндосперме была связана с повышенным относительным уровнем амилозы более чем на 50%. Потеря уровней белка SBEIIb, как оказалось, существенно не изменяла относительное содержание амилозы в крахмале зерна. Было предложено, но не установлено, что тройной нуль-мутант SBEIIa и/или SBEIIb, в котором по сути отсутствовала экспрессия белков SBEIIa и SBEIIb, в результате дал бы дальнейшим повышениям уровня амилозы. Однако не было известно или предсказуемо из известного уровня техники, сколько мутантных аллелей SBEIIa и/или SBEIIb было бы необходимо для обеспечения высоких уровней амилозы по меньшей мере 50% в качестве относительного содержания от общего содержания крахмала. Кроме того, было неизвестно, будет ли зерно с тройными нулевыми генотипами жизнеспособным или будут ли растения пшеницы фертильными. В данной области существует необходимость улучшенных высокоамилозных растений пшеницы и способов их получения. СУЩНОСТЬ ИЗОБРЕТЕНИЯ В данном описании, если контекст не требует иного, слово ʺсодержатьʺ или его вариации, такие как ʺсодержитʺ или ʺсодержащийʺ, следует понимать как подразумевающие включение установленного элемента, или единого целого, или группы элементов или единых целых, но не исключение любого другого элемента, или целого, или группы элементов или целых. Применяемые в настоящем документе формы единственного числа включают объекты во множественном числе, если контекст явно не указывает на иное. Таким образом, например, ссылка на ʺмутацияʺ включает единичную мутацию, а также две или более мутаций; ссылка на ʺрастениеʺ включает в себя одно растение, а также два или более растений; и так далее. Каждый вариант осуществления в данном описании изобретения следует применять mutatis mutandis к каждому другому варианту осуществления, если конкретно не указано иное. Гены и другой генетический материал (например, мРНК, конструкции и т.д.) представлены курсивом, а их белковые продукты экспрессии представлены в форме некурсива. Так, например, SBEIIa является продуктом экспрессии SBEIIa. На нуклеотидные и аминокислотные последовательности ссылаются при помощи номера идентификатора последовательности (SEQ ID NO:). SEQ ID NO: численно соответствуют идентификаторам последовательности <400> 1 (SEQ ID NO:1), <400> 2 (SEQ ID NO:2) и т.д. Перечень последовательностей приведен после формулы изобретения. Если не определено иначе, все технические и научные термины, применяемые в данном документе, имеют то же самое значение, которое обычно понятно рядовым специалистам в данной области, к которой относится настоящее изобретение. Хотя любые способы и материалы, подобные или эквивалентные описанным в данном документе, можно применять на практике или тестировании настоящего изобретения, описаны предпочтительные способы и материалы. Настоящее изобретение предлагает ряд растений пшеницы, имеющих модифицированные характеристики крахмала. В одном варианте осуществления настоящее изобретение предлагает зерно пшеницы (Triticum aestivum), содержащее эндосперм и низкие количество или активность общего белка SBEIIa или белка SBEII, который составляет от 2% до 30% от количества или активности общего белка SBEII или белка SBEIIa в зерне пшеницы дикого типа, и где зерно имеет содержание амилозы по меньшей мере 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) в виде доли от общего крахмала в зерне. В одном варианте осуществления настоящее изобретение предлагает зерно пшеницы, содержащее зародыш и крахмал, где зародыш содержит два идентичных аллеля гена SBEIIa-A, два идентичных аллеля гена SBEIIa-B и два идентичных аллеля гена SBEIIa-D, причем каждый из генов SBEIIa является источником некоторого количества белка (вес/вес) или белка, обладающего SBEIIa-активностью, которая ниже, чем у соответствующего гена дикого типа, и по меньшей мере один из указанных генов содержит точечную мутацию, где крахмал содержит амилозу так, чтобы такое зерно имело содержание амилозы по меньшей мере 50% (вес/вес) в виде доли экстрагируемого из зерна крахмала. В одном варианте осуществления настоящее изобретение предлагает зерно пшеницы, содержащее зародыш, крахмал и один, два или три белка SBEIIa, причем указанный зародыш содержит два идентичных аллеля гена SBEIIa-A, два идентичных аллеля гена SBEIIa-B и два идентичных аллеля гена SBEIIa-D, где крахмал имеет содержание амилозы по меньшей мере 50% (вес/вес) в виде доли экстрагируемого из зерна крахмала, и где по меньшей мере один из белков SBEIIa продуцируется в развивающемся эндосперме пшеницы и обладает крахмал-ветвящей ферментативной активностью. В некоторых вариантах осуществления количество и активность белка SBEIIa снижены. Так, например, зерно по настоящему изобретению может содержать пониженное количество белка SBEIIa (вес/вес), который обладает пониженной SBEIIa-активностью. В различных вариантах осуществления уровень или активность общего белка SBEII или SBEIIa в зерне составляет менее 2%, или от 2% до 15%, или от 3% до 10%, или от 2% до 20%, от или 2% до 25% уровня или активности общего белка SBEII или SBEIIa в зерне дикого типа. В некоторых вариантах осуществления количество или активность белка SBEIIa в зерне составляет менее 2% количества или активности белка SBEIIa в зерне пшеницы дикого типа. В другом аспекте зерно происходит от гексаплоидной пшеницы. В одном варианте осуществления зерно происходит от гексаплоидной пшеницы и содержит зародыш, где зародыш содержит мутацию потери функции в каждой из от 5 до 12 аллелей эндогенных генов SBEII, выбранных из группы, состоящей из SBEIIa-A, SBEIIa-B, SBEIIa-D, SBEIIb-A, SBEIIb-B и SBEIIb-D. В одном случае каждый из указанных от 5 до 12 аллелей, в том числе 4, 5 или 6 аллелей SBEIIa, содержат мутацию потери функции. В другом случае, когда число аллелей SBEIIa, содержащих мутацию потери функции, - только 4, то число аллелей SBEIIb, содержащих мутацию потери функции, - 6. В другом варианте осуществления, когда число аллелей SBEIIa, содержащих мутацию потери функции, - 6, то, по меньшей мере, две аллели SBEIIb включают мутацию частичной потери функции. В следующем варианте осуществления зародыш гексаплоидной пшеницы не имеет нуль-аллелей генов SBEIIb или только 1, или только 2, или только 3, или только 4, или только 5, или 6 нуль-аллелей генов SBEIIb. В следующем варианте осуществления зародыш гексаплоидной пшеницы имеет только 2, только 3, только 4 или только 5 нуль-аллелей генов SBEIIa. В некоторых вариантах осуществления зародыш гексаплоидной пшеницы имеет 6 нуль-аллелей генов SBEIIa. В некоторых вариантах осуществления зерно или зародыш имеет только 1 нуль-ген SBEIIa. В некоторых вариантах осуществления зерно или зародыш имеет только 2 нуль-гена SBEIIa. В следующем варианте осуществления зародыш гексаплоидной пшеницы не имеет нуль-аллелей генов SBEIIb или только 1, только 2, только 3, только 4, только 5 или 6 нуль-аллелей генов SBEIIb. В еще одном варианте осуществления нуль-аллели генов SBEIIa или SBEIIb находятся в геноме А, геноме В, геноме D, геномах А и В, геномах А и D, геномах В и D или всех трех из геномов А, В и D. В еще одном варианте осуществления зародыш гексаплоидной пшеницы содержит 0, 1, 2, 3, 4, 5 или 6 аллелей частичной потери функции генов SBEIIa. В некоторых случаях аллель частичной потери функции гена SBEIIa находится в геноме А, геноме В, геноме D, геномах А и В, геномах А и D, геномах В и D или всех трех из геномов А, В и D. Кроме того, в некоторых вариантах осуществления зародыш гексаплоидной пшеницы содержит 0, 1, 2, 3, 4, 5 или 6 аллелей частичной потери функции генов SBEIIb. В некоторых случаях аллель частичной потери функции гена SBEIIb находится в геноме А, геноме В, геноме D, геномах А и В, геномах А и D, геномах В и D или всех трех из геномов А, В и D. В других вариантах осуществления аллели частичной потери функции генов SBEIIa и SBEIIb находятся в геноме А, геноме В, геноме D, геномах А и В, геномах А и D, геномах В и D или всех трех из геномов А, В и D. В другом варианте осуществления зародыш гексаплоидной пшеницы включает пять аллелей SBEIIa, каждый из которых содержит нуль-мутацию или мутацию частичной потери функции, и 1 аллель SBEIIa, который является аллелью дикого типа. В другом варианте осуществления зерно происходит тетраплоидной пшеницы. В другом варианте осуществления настоящее изобретение предлагает зерно пшеницы из тетраплоидной пшеницы, где зерно содержит эндосперм и низкий уровень или активность общего белка SBEII или белка SBEIIa, которые составляют от 2% до 30% уровня или активности общего белка SBEII или белка SBEIIa в зерне пшеницы дикого типа, и где зерно имеет содержание амилозы по меньшей мере 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) в виде доли от общего крахмала в зерне. В некоторых вариантах осуществления, где зародыш содержит мутацию потери функции в каждой из 5-8 аллелей эндогенных генов SBEII, выбранных из группы, состоящей из SBEIIa-A, SBEIIa-B, SBEIIb-A и SBEIIb-B, при этом указанные 5-8 аллелей включают 2, 3 или 4 аллели SBEIIa, каждая из которых содержит мутацию потери функции, и где если число аллелей SBEIIa, содержащих мутацию потери функции, -только 2, то число аллелей SBEIIb, содержащих мутацию потери функции, - 4, а если число аллелей SBEIIa, содержащих мутацию потери функции, - 4, то по меньшей мере одна, предпочтительно по меньшей мере две таких аллели содержат мутацию частичной потери функции. В некоторых вариантах осуществления зародыш имеет только 2 или только 3 нуль-аллели генов SBEIIa. В одном конкретном варианте осуществления зародыш тетраплоидной пшеницы не имеет нуль-аллелей генов SBEIIb или только 1, только 2, только 3 или 4 нуль-аллели генов SBEIIb. В некоторых вариантах осуществления один белок SBEIIb кодируется геномом А, геномом В или геномом D, или два белка SBEIIb кодируются геномами А и В, геномами А и D или геномами В и D. В некоторых вариантах осуществления нуль-мутацию независимо выбирают из группы, включающей делеционную мутацию, инсерционную мутацию, мутацию сайта сплайсинга, мутацию преждевременной терминации трансляции и мутацию со сдвигом рамки. В некоторых вариантах осуществления нуль-аллели генов SBEIIa или SBEIIb находятся в геноме А, геноме В или как в геноме А, так и в геноме В. В других вариантах осуществления зародыш тетраплоидной пшеницы содержит 0, 1, 2, 3 или 4, 5 или 6 аллелей частичной потери функции генов SBEIIa. В других вариантах осуществления зародыш содержит 0, 1, 2, 3 или 4 аллели частичной потери функции генов SBEIIb. В еще одном варианте осуществления аллели частичной потери функции генов SBEIIa или SBEIIb находятся в геноме А, геноме В или как в геноме А, так и в геноме В. В некоторых вариантах осуществления зародыш является гомозиготным по мутантным аллелям каждого из 2 или 3 генов SBEIIa и/или каждого из 2 или 3 генов SBEIIb. В других вариантах осуществления зародыш является гомозиготным по каждому из 2 или 3 генов SBEIIa и/или каждому из 2 или 3 генов SBEIIb. Предпочтительно, в различных вариантах осуществления настоящего изобретения зерно включает как нуль-аллели, так и аллели частичной потери функции SBEIIa и/или SBEIIb, где каждый нуль-аллель находится в геноме, отличном от того, в котором находится каждый аллель частичной потери функции. В некоторых вариантах осуществления, связанных с нуль-аллелью, каждую нуль-мутацию независимо выбирают из группы, состоящей из делеционной мутации, инсерционной мутации, мутации сайта сплайсинга, мутации преждевременной терминации трансляции и мутации со сдвигом рамки. В варианте осуществления одна или несколько нуль-мутаций являются мутациями замен неконсервативных аминокислот, или нуль-мутация имеет сочетание двух или более замен неконсервативных аминокислот. В этом контексте замены неконсервативных аминокислот определены в данном документе. Зерно может содержать мутации в каждом из двух генов SBEIIa, каждая из которых является нуль-мутацией, и мутацию аминокислотной замены в третьем гене SBEIIa, где каждая из нуль-мутаций предпочтительно является мутацией преждевременной терминации трансляции, или одной делеционной мутацией, или одной мутацией преждевременной терминации трансляции и одной делеционной мутацией, и мутация аминокислотной замены является либо заменой консервативной аминокислоты, либо, предпочтительно, заменой неконсервативной аминокислоты. В некоторых широких вариантах осуществления зерно настоящего изобретения включает одну или несколько нуль-мутаций или мутации частичной потери функции, которые являются мутациями аминокислотной замены, которые независимо представляют собой замены неконсервативных или консервативных аминокислот. В некоторых вариантах осуществления зерно настоящего изобретения содержит одну точечную мутацию, которая представляет собой мутацию аминокислотной замены. В некоторых вариантах осуществления настоящего изобретения один из генов SBEIIa-A, SBEIIa-B или SBEIIa-D содержит точечную мутацию таким образом, что у белка, кодируемого указанным геном, отсутствует крахмал-ветвящая ферментативная активность. В некоторых вариантах осуществления зерно настоящего изобретения имеет нуль-аллели, которые являются делеционными мутациями в геномах В и D, которые удаляют, по меньшей мере, часть генов SBEIIa-B и SBEIIa-D, соответственно, и где ген SBEIIa-A содержит точечную мутацию; или имеет нуль-аллели, которые являются делеционными мутациями в геномах А и В, которые удаляют по меньшей мере часть генов SBEIIa-A и SBEIIa-B, соответственно, и где ген SBEIIa-B содержит точечную мутацию; или имеет нуль-аллели, которые являются делеционными мутациями в геномах В и D, которые удаляют по меньшей мере часть генов SBEIIa-B и SBEIIa-D, соответственно, и где ген SBEIIa-D содержит точечную мутацию. В некоторых вариантах осуществления настоящего изобретения зародыш включает 6 аллелей SBEIIb, среди которых по меньшей мере один имеет мутацию потери функции. В некоторых вариантах осуществления настоящего изобретения зародыш не имеет нуль-аллелей генов SBEIIb, или только 2, только 4 или 6 нуль-аллелей генов SBEIIb. В некоторых вариантах осуществления зерно содержит нуль-мутацию, которая является делеционной мутацией в геноме А, В или D, которая удаляет по меньшей мере часть гена SBEIIa, и по меньшей мере часть гена SBEIIb, предпочтительно, которая удаляет весь ген SBEIIa и/или ген SBEIIb. В некоторых вариантах осуществления зерно содержит нуль-мутацию, которая является делеционной мутацией в геноме В, которая удаляет по меньшей мере часть гена SBEIIa-B и по меньшей мере часть гена SBEIIb-B, предпочтительно, которая удаляет весь ген SBEIIa-B и/или ген SBEIIb-B; или содержит нуль-мутацию, которая является делеционной мутацией в геноме D, которая удаляет по меньшей мере часть гена SBEIIa-D и по меньшей мере часть гена SBEIIb-D, предпочтительно которая удаляет весь ген SBEIIa-D и/или ген SBEIIb-D; или содержит нуль-мутацию, которая является делеционной мутацией в геноме В, которая удаляет по меньшей мере часть гена SBEIIa-A и по меньшей мере часть гена SBEIIb-A, предпочтительно которая удаляет весь ген SBEIIa-A и/или ген SBEIIb-A. В иллюстративных примерах предложено зерно, где каждая аллель, содержащая мутацию частичной потери функции, экспрессирует фермент SBEIIa или SBEIIb, который по количеству и/или активности соответствуют от 2% до 60% или от 10% до 50% количества или активности соответствующей аллели дикого типа. В некоторых вариантах осуществления зерно содержит по меньшей мере один белок SBEIIa, который обладает крахмал-ветвящей ферментативной активностью при экспрессии в развивающемся эндосперме, при этом белок присутствует в количестве или обладает крахмал-ветвящей ферментативной активностью от 2% до 60%, или от 10% до 50%, или от 2% до 30%, или от 2% до 15%, или от 3% до 10%, или от 2% до 20%, или от 2% до 25% количества или активности соответствующего белка в зерне пшеницы дикого типа. В некоторых вариантах осуществления настоящего изобретения количество или активность общего белка SBEII в зерне составляет менее 60%, предпочтительно менее 2% от количества или активности общего белка SBEII в зерне пшеницы дикого типа. В некоторых вариантах осуществления настоящего изобретения в зерне отсутствует активность белка SBEIIa. В частности, в некоторых вариантах осуществления зерно является нетрансгенным, т.е. не содержит никаких трансгенов или, в более конкретном варианте осуществления, не содержит экзогенной нуклеиновой кислоты, которая кодирует РНК, которая снижает экспрессию гена SBEIIa, т.е. если оно содержит трансген, этот трансген кодирует РНК, но не РНК, которая снижает экспрессию гена SBEIIa. Такие РНК включают РНК, которые кодируют белки, которые придают, например, стойкость к гербицидам, стойкость к болезням, повышают коэффициент использования питательных веществ или стойкость к засухе или другим стрессам. В некоторых вариантах осуществления зерно имеет только один белок SBEIIa при определении с помощью вестерн-блот анализа, и где белок кодируется одним из генов SBEIIa-A, SBEIIa-B и SBEIIa-D и имеет сниженную крахмал-ветвящую ферментативную активность при продуцировании в развивающемся эндосперме, по сравнению с белком SBEIIa, кодируемым соответствующим геном дикого типа. В некоторых вариантах осуществления белок SBEIIa имеет измененную подвижность относительно соответствующего белка SBEIIa дикого типа при определении с помощью аффинного гель-электрофореза на гелях, содержащем крахмал. В некоторых вариантах осуществления у зерна отсутствует обнаруживаемый белок SBEIIa при определении с помощью вестерн-блот анализа. В некоторых вариантах осуществления зародыш содержит только один или только два белка SBEIIb, которые обладают крахмал-ветвящей ферментативной активностью при продуцировании в развивающемся эндосперме, или только один или только два белка SBEIIb, обнаруживаемых с помощью вестерн-блот анализа. В связи с мутациями потери функции, в некоторых вариантах осуществления по меньшей мере одна, несколько или все мутации потери функции являются i) введенными мутациями, ii) индуцированы у родительского растения пшеницы или семени путем мутагенеза при помощи мутагена, такого как химическое вещество, биологический агент или облучение, или iii) введены для того, чтобы модифицировать геном растения. В другом иллюстративном варианте осуществления зерно содержит экзогенную нуклеиновую кислоту, которая кодирует РНК, которая снижает экспрессию гена SBEIIa, гена SBEIIb или обоих генов. Определенное в данном документе зерно представлено в некоторых конкретных вариантах осуществления, где зерно имеет энергию прорастания от приблизительно 70% до приблизительно 90%, или от приблизительно 90% до приблизительно 100% по отношению к энергии прорастания контрольного зерна или зерна дикого типа в стандартных условиях. Стандартные условия предпочтительно являются такими, которые определены в данном документе. В одном конкретном варианте осуществления активность SBEII или активность SBEIIa определяют путем анализа ферментативной активности в зерне, в то время как оно развивается в растении пшеницы, или путем анализа количества белка SBEII, например, белка SBEIIa, в собранном зерне с помощью иммунологических или других способов. В другом аспекте настоящее изобретение предлагает зерно, где крахмал зерна составляет по меньшей мере 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) амилозы в качестве доли от общего крахмала и характеризуется одним или несколькими из следующего: (i) содержание от 2% до 30% количества SBEII или SBEIIa по сравнению с гранулами крахмала или крахмалом пшеницы дикого типа; (ii) содержание по меньшей мере 2% резистентного крахмала; (iii) имеет низкий относительный гликемический индекс (GI); (iv) содержание низких относительных уровней амилопектина; (v) деформированные гранулы крахмала; (vi) уменьшенное двойное лучепреломление гранул; (vii) уменьшенный объем набухания; (viii) модифицированное распределение длины цепи и/или частоту разветвления; (ix) увеличение конечной температуры клейстеризации и более высокая пиковая температура; (х) пониженная вязкость (пиковая вязкость, температура образования клейстера и т.д.); (xi) увеличенная молекулярная масса амилопектина и/или (xii) модифицированная % кристалличность или % крахмала типа А или типа В, относительно гранул крахмала или крахмала пшеницы дикого типа. В некоторых вариантах осуществления зерно содержится в растении пшеницы. В других вариантах зерно является развивающимся зерном или зрелым, собранным зерном. Предпочтительно, количество зерна характеризуется весом по меньшей мере 1 кг или весом по меньшей мере 1 тонна. Для удобства, зерно обрабатывают так, чтобы оно больше не было способно прорастать, как, например, крупно перемолотое, дробленое, пропаренное, плющеное, толченое, измельченное или молотое зерно. В другом аспекте настоящее изобретение предлагает растение пшеницы, которое способно продуцировать зерно, определенное в данном документе, в том числе зерно, содержащее эндосперм и имеющее низкий уровень или активность общего белка SBEII или белка SBEIIa, что составляет от 2% до 30% от уровня или активности общего белка SBEII или белка SBEIIa в зерне пшеницы дикого типа, и где зерно имеет содержание амилозы по меньшей мере 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) в виде доли от общего крахмала в зерне. В одном конкретном случае растение пшеницы характеризуется как мужской, так и женской фертильностью. В одном варианте растением пшеницы является пшеница обыкновенная, например Triticum aestivum ssp. Aestivum, или твердая пшеница. В других вариантах осуществления растение пшеницы характеризуется одним или несколькими признаками зерна, описанными в данном документе, предпочтительно, включая количества и типы мутаций SBEIIa и SBEIIb, описанных в данном документе. Представлены все комбинации таких признаков. В другом варианте осуществления настоящее изобретение предлагает муку грубого помола, или муку, или другой пищевой ингредиент, такой как очищенный крахмал, полученный из зерна, определенного в данном документе, в том числе зерно, содержащее эндосперм и имеющее низкий уровень или активность общего белка SBEII или белка SBEIIa, что составляет от 2% до 30% от уровня или активности общего белка SBEII или белка SBEIIa в зерне пшеницы дикого типа, и где зерно имеет содержание амилозы по меньшей мере 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) в виде доли от общего крахмала в зерне. Муку грубого помола, муку или другой пищевой ингредиент можно очистить с помощью фракционирования, отбеливания, термической обработки для стабилизации ингредиентов, обработать ферментами или смешать с другими пищевыми ингредиентами, такими как мука грубого помола или мука из пшеницы дикого типа. Мукой предпочтительно является белая мука, имеющая характеристики, которые известны в области выпечки. В предпочтительном варианте мука грубого помола, мука или другой продукт упакован и готов к продаже в качестве пищевого ингредиента, упаковка которого может иметь инструкции рецептов для его применения. Настоящее изобретение дополнительно предусматривает гранулы крахмала пшеницы или пшеничный крахмал, произведенный из данного зерна. В некоторых вариантах осуществления гранулы крахмала или пшеничный крахмал содержит по меньшей мере 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) амилозы в качестве доли от общего крахмала, и характеризуется одним или несколькими из признаков: (i) содержание от 2% до 30% количества SBEII или SBEIIa по сравнению с гранулами крахмала или крахмалом пшеницы дикого типа; (ii) содержание по меньшей мере 2% резистентного крахмала; (iii) наличие низкого относительного гликемический индекс (GI); (iv) содержание низких относительных уровней амилопектина; (v) деформированные гранулы крахмала; (vi) уменьшенное двойное лучепреломление гранул; (vii) уменьшенный объем набухания; (viii) модифицированное распределение длины цепи и/или частота разветвления; (ix) увеличение конечной температуры клейстеризации и более высокая пиковая температура; (х) пониженная вязкость (пиковая вязкость, температура образования клейстера и т.д.); (xi) увеличенная молекулярная масса амилопектина и/или (xii) модифицированная % кристалличность или % крахмала типа А или типа В, относительно гранул крахмала или крахмала пшеницы дикого типа. Настоящее изобретение дополнительно предлагает пищевой ингредиент, который включает зерно, муку грубого помола, муку, гранулы крахмала или крахмал, определенные в данном документе, для применения в производстве пищевых продуктов, для потребления животными, не имеющими отношения к человеку, или предпочтительно, людьми. В некоторых вариантах осуществления пищевой ингредиент содержит зерно, где зерно является крупно перемолотым, дробленым, пропаренным, плющеным, толченым, измельченным или молотым или их любой комбинацией. Настоящее изобретение также предлагает пищевые или питьевые продукты, которые содержат пищевой ингредиент или ингредиент напитка в количестве по меньшей мере 10% по сухому весу, где пищевой ингредиент представляет собой или содержит зерно, муку грубого помола, муку, гранулы крахмала или крахмал, определенные в данном документе. Предпочтительно, пищевой или питьевой продукт упакован и готов к продаже. В другом варианте осуществления настоящее изобретение предлагает композицию или сочетание, содержащее зерно, муку грубого помола, муку, гранулы крахмала или крахмал, определенные в данном документе, на уровне по меньшей мере 10% по весу, и зерно пшеницы, имеющее уровень амилозы ниже, чем приблизительно 50% (вес/вес), или муку, муку грубого помола, гранулы крахмала или крахмал, полученные из них. Предпочтительно, зерно пшеницы, имеющее уровень амилозы ниже 50% (вес/вес), является зерном пшеницы дикого типа. Предлагаются способы получения, или идентификации, или отбора, или выращивания растения пшеницы, которое дает зерно с содержанием амилозы по меньшей мере 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) в виде доли общего крахмала в зерне. Растение пшеницы можно идентифицировать или отобрать из популяции множества растений-кандидатов, например, мутагенизированной популяции или популяции растений, полученных в результате процесса скрещивания или процесса обратного скрещивания/селекции. В некоторых вариантах осуществления способ включает: (i) скрещивание двух родительских растений пшеницы, каждое из которых содержит мутацию потери функции в каждом из одного, двух или трех генов SBEIIa или SBEIIb, выбранных из группы, состоящей из SBEIIa-A, SBEIIa-B, SBEIIa-D, SBEIIb-A, SBEIIb-B и SBEIIb-D, или мутагенез родительского растения, содержащего указанные мутации потери функции, и (ii) скрининг растений или зерна, полученного в результате скрещивания или мутагенеза, или растений-потомков или зерна, полученного из них, путем анализа ДНК, РНК, белка, гранул крахмала или крахмала из растений или зерна, и (iii) отбор фертильного растения, которое демонстрирует уровень или активность SBEII или SBEIIa в своем зерне, составляющий от 2% до 30% уровня или активности соответствующего белка в зерне дикого типа. Как альтернатива, способ включает приведенные выше стадии (ii) и (iii), при этом стадия (i) является необязательной, например, при отборе или идентификации растения из популяции множества растений-кандидатов. В некоторых вариантах осуществления способа стадия (ii) включает скрининг растений-потомков или зерна первого, второго и/или последующего поколения на мутацию потери функции в 5-12 аллелях 6 эндогенных генов, кодирующих белок SBEII, в том числе 4, 5 или 6 аллелей SBEIIa, и где если число мутантных аллелей SBEIIa равно 4, то число мутантных аллелей SBEIIb равно 6, и где если число мутантных аллелей SBEIIa равно 6, то по меньшей мере два таких мутанта имеют частичные мутации. В некоторых вариантах осуществления зерно выбранного фертильного растения пшеницы характеризуют одним или несколькими признаками, определенными в данном документе. Кроме того, настоящее изобретение предлагает способы получения гексаплоидного или тетраплоидного растения пшеницы, которое дает зерно с содержанием амилозы по меньшей мере 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) в виде доли общего крахмала в зерне. В некоторых вариантах осуществления способ включает (1) введение в клетку пшеницы экзогенной нуклеиновой кислоты, которая кодирует РНК, которая снижает экспрессию одного или нескольких генов, кодирующих общий содержание белка SBEII или белка SBEIIa, (ii) регенерацию трансгенного растения пшеницы, содержащего экзогенную нуклеиновую кислоту клетки из стадии (i), и (iii) скрининг и отбор потомства первого, второго или последующего поколения трансгенного растения пшеницы, которое дает зерно, имеющее от 2% до 30% уровня или активности общего белка SBEII или белка SBEIIa в растении дикого типа. Предпочтительно, молекула РНК является двухцепочечной молекулой РНК или молекулой предшественника микроРНК, которая, предпочтительно, экспрессируется из химерной ДНК, содержащей область ДНК, который при транскрипции продуцирует молекулу РНК, функционально связанную с гетерологичным промотором, например, промотором, специфическим для эндосперма. Химерную ДНК можно ввести в клетку пшеницы, которая содержит одну или несколько мутаций SBEIIa или SBEIIb, так чтобы общая активность SBEII у трансгенных растений уменьшалась путем сочетания мутации(й) и ингибирующей(их) молекул(ы) РНК. В некоторых вариантах осуществления зерно, имеющее от 2% до 30% уровня или активности общего белка SBEII или белка SBEIIa в растениях дикого типа, показывает, что по меньшей мере 3 гена SBEIIa или 2 гена SBEIIa и 3 гена SBEIIb растений содержат мутацию потери функции и, следовательно, зерно растения содержит более 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) амилозы в виде доли от общего крахмала в зерне. В некоторых вариантах осуществления наличие по меньшей мере низкого уровня белка SBEIIa свидетельствует о том, что растение является фертильным. В другом варианте осуществления настоящее изобретение предлагает способ скрининга растения или зерна пшеницы, причем способ включает скрининг растения или зерна на наличие мутаций в гене SBEIIa или генах SBEIIa или SBEIIb в каждом из геномов А, В и D гексаплоидной пшеницы или геномов А и В тетраплоидной пшеницы с применением одного или нескольких праймеров, выбранных из группы, состоящей из SEQ ID NO:36-149. В другом варианте осуществления настоящее изобретение предлагает способ скрининга растения или зерна пшеницы, причем способ включает (i) определение уровня или активности SBEIIa и/или SBEIIb по сравнению с уровнем или активностью у растения или зерна дикого типа или контрольного растения или зерна и отбор растения или зерна, имеющего от 2% до 30% уровня или активности общего белка SBEII или SBEIIa в растении дикого типа. В еще одном варианте осуществления настоящее изобретение предлагает способ производства пищевого продукта или напитка, включающий (i) получение зерна настоящего изобретения, (ii) обработку зерна для производства пищевого ингредиента или ингредиента напитка и (iii) добавление пищевого ингредиента или ингредиента напитка из (ii) к другому пищевому ингредиенту или ингредиенту напитка с получением таким образом пищевого продукта или напитка. В другом аспекте настоящее изобретение предлагает способ улучшения одного или нескольких параметров метаболического здоровья, здоровья кишечника или здоровья сердечно-сосудистой системы у субъекта или предупреждения или уменьшения тяжести или частоты метаболического заболевания, такого как диабет, заболевание кишечника или сердечно-сосудистое заболевание, включающий введение субъекту зерна, пищевых продуктов или напитков, определенных в данном документе. Настоящее изобретение также предусматривает применение зерна или полученных из него продуктов для применения в терапии или профилактики метаболического заболевания, заболевания кишечника или сердечно-сосудистого заболевания. Соответственно, подобные аспекты настоящего изобретения предлагают субъекту зерно, продукт питания или напиток для применения внутрь для улучшения одного или нескольких параметров метаболического здоровья, здоровья кишечника или здоровья сердечно-сосудистой системы у субъекта или предупреждения или уменьшения тяжести или частоты метаболических заболеваний, таких как диабет, заболевание кишечника или сердечно-сосудистое заболевание. Соответственно, подобные аспекты настоящего изобретения предлагают для применения субъекту зерно, продукт питания или напиток для улучшения одного или нескольких параметров метаболического здоровья, здоровья кишечника или здоровья сердечно-сосудистой системы у субъекта или предупреждения или уменьшения тяжести или частоты метаболического заболевания, такого как диабет, заболевание кишечника или сердечно-сосудистое заболевание. Соответственно, в некоторых вариантах осуществления настоящее изобретение предлагает пищевой продукт или напиток, определенные в данном документе, для применения в улучшении одного или нескольких параметров метаболического здоровья, здоровья кишечника или здоровья сердечно-сосудистой системы или предупреждения или уменьшения тяжести или частоты метаболического заболевания, заболевания кишечника или сердечно-сосудистого заболевания у субъекта. В другом варианте осуществления настоящее изобретение предлагает способ получения зерна, включающий стадии i) получения растения пшеницы, способного давать зерно, определенное в данном документе, содержащее эндосперм и низкий уровень или активность общего белка SBEII или белка SBEIIa, что составляет от 2% до 30% уровня или активности общего белка SBEII или SBEIIa у растения пшеницы дикого типа, и где зерно имеет содержание амилозы по меньшей мере 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) в виде доли общего крахмала в зерне, и ii) сбора зерна пшеницы от растения и iii) необязательно, обработки зерна. В другом варианте осуществления настоящее изобретение предлагает способ получения крахмала, включающий стадии i) получения зерна пшеницы, определенного в данном документе, содержащего эндосперм и низкий уровень или активность общего белка SBEII или белка SBEIIa, что составляет от 2% до 30% уровня или активности общего белка SBEII или SBEIIa у растения пшеницы дикого типа, и где зерно имеет содержание амилозы по меньшей мере 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) в виде доли общего крахмала в зерне и ii) экстракцию крахмала из зерна с получением таким образом крахмала. Настоящее изобретение также предлагает способ торговли зерном пшеницы, включающий получение зерна пшеницы настоящего изобретения и торговлю полученным зерном пшеницы с получением денежного дохода. В некоторых вариантах осуществления получение зерна пшеницы включает культивирование и сбор зерна пшеницы. В некоторых вариантах осуществления получение зерна пшеницы включает сбор зерна пшеницы. В некоторых вариантах осуществления получение зерна пшеницы дополнительно включает хранение зерна пшеницы. В некоторых вариантах осуществления получение зерна пшеницы дополнительно включает транспортировку зерна пшеницы в другое место. Приведенное выше краткое описание не рассматривается и не должно рассматриваться каким-либо образом в качестве исчерпывающего перечня всех вариантов осуществления настоящего изобретения. КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ Фиг.1 представляет собой изображение, показывающее выравнивание выравнивания белка SBEIIa (AAK26821.1 происходит из генома D, CAR95900.1 происходит из генома В, и САА72154 происходит из генома А). Точки в выравнивании указывают на присутствие идентичной аминокислоты, как в главной последовательности. Фиг.2 представляет собой изображение, показывающее выравнивание аминокислотных последовательностей SBEIIb, кодируемых экзонами от 1 до 3 из геномов А, В и D пшеницы. Штрихи указывают на присутствие аминокислот в белке, но последовательность неизвестна, точки в выравнивании указывают на присутствие идентичной аминокислоты, как в главной последовательности. Фиг.3 представляет собой выравнивание аминокислотных последовательностей SBEIIb. Фиг.4 представляет собой графическое изображение, показывающее график рассеяния для содержания амилозы у трансгенных мутантных линий (см. пример 5). Фиг.5 представляет собой графическое представление данных, показывающих модель амилозы, полученную по характеристикам трансгенных линий SBEII. Фиг.6 представляет собой графическое представление данных, показывающих модель амилозы, полученную по характеристикам трансгенной линии SBEII. Фиг.7 представляет собой изображение, показывающее выравнивание последовательностей ДНК областей экзонов от 12 до 14 гомологичных генов SBEIIa, полученных из пшеницы сорта Chara. Нуклеотидная последовательность фрагмента генома В Chara показана полностью, в то время как соответствующие нуклеотиды для гомологичных фрагментов геномов А и D показаны только там, где есть полиморфизмы. Точки указывают на то, что соответствующие нуклеотиды идентичны фрагменту генома В Chara. Штрихи указывают, что соответствующий нуклеотид отсутствует в последовательности. Фиг.8 представляет собой изображение, показывающее выравнивание последовательностей ДНК области интрона 3 генов SBEIIa, полученных из пшеницы сортов Sunco и Tasman. Нуклеотидная последовательность фрагмента генома D Tasman показана полностью, в то время как соответствующие нуклеотиды для гомологичных фрагментов показаны только там, где есть полиморфизмы. Точки указывают на то, что соответствующие нуклеотиды идентичны фрагменту генома D Tasman. Штрихи указывают, что соответствующий нуклеотид отсутствует в последовательности. Фиг.9 представляет собой изображение, показывающее выравнивание последовательностей ДНК области экзона 3 генов SBEIIa, полученных из пшеницы сорта Chinese Spring. Нуклеотидная последовательность фрагмента генома D Chinese Spring показана полностью, в то время как соответствующие нуклеотиды для гомологичных фрагментов геномов А и В показаны только там, где есть полиморфизмы. Точки указывают на то, что соответствующие нуклеотиды идентичны фрагменту генома D Chinese Spring. Фиг.10 представляет собой изображение, показывающее последовательность ДНК области экзона 1 гена SBEIIa из гексаплоидной пшеницы сорта Chinese Spring. Фиг.11 представляет собой изображение, показывающее ПЦР-амплификацию области, охватывающей экзоны 12-14 генов SBEIIa от нулисомных-тетрасомных линий CS. Линия, обозначенная BDD, является нулем для генома A, ADD является нулем для генома В, и ААВ является нулем для генома D. Фиг.12 представляет собой фотографическое изображение вестерн-блот анализа, показывающего экспрессию белка SBEIIa в развивающихся эндоспермах от линии S28. Белковые экстракты из эндосперма анализировали с помощью вестерн-блот анализа, описанного в Примере 1, применяя SBEIIa-специфические антитела. Последняя дорожка с правой стороны показывает бэнды, происходящие от эндосперма дикого типа (сорт NB1). Указаны положения белков SBEIIa, кодируемых геномами А, bhd. Фиг.13 представляет собой график отношения подвижности взаимодействующего SBEIIa в отсутствии (m0) и присутствии (m) предельного β-декстрина в ПААГ 1-D Native к концентрации предельного β-декстрина (S). Константу диссоциации (Kd) получают из уравнения m0/m=1+[S]/Kd. На фиг.14 показана взаимосвязь содержания амилозы и фермент-резистентного крахмала в объединенных образцах крахмала пшеницы, полученных из трансгенных линий пшеницы, описанных в Примере 2. Фиг.15 представляет собой изображение точечного графика показателей по прогнозам NIRS и биохимических показателей для очевидного содержания амилозы в единичных семенах пшеницы. Фиг.16 представляет собой графическое изображение, показывающее распределение очевидного содержания амилозы в популяциях WM и WMC, определенное с помощью NIRS. Фиг.17(а) и (b) представляют собой графическое изображение данных, показывающих влияние добавления возрастающих количеств линий пшеницы на водопоглощение (а) и время перемешивания миксографа (б). Фиг.18(а) и (b) представляют собой графическое изображение данных, иллюстрирующих влияние добавления возрастающих количеств высокоамилозной пшеничной муки на резистентный крахмал (а) и прогнозируемый GI (b) (HI%) буханок хлеба малого размера. КРАТКОЕ ОПИСАНИЕ ТАБЛИЦ В таблице 1 приведены гены крахмал-ветвящего фермента, характеризуемого из злаковых. В таблице 2 приведена подклассификация аминокислот. В таблице 3 приведены иллюстративные аминокислотные замены. В таблице 4 представлены геном-специфические праймеры для гена SBEIIa пшеницы. В таблице 5 представлены нуклеотидные последовательности геном-специфических праймеров для SBEIIa. В таблице 6 представлены праймеры, сконструированные для амплификации частей гена SBEIIa, в частности, из генома А пшеницы. В таблице 7 представлены праймеры, сконструированные для амплификации частей гена SBEIIa, в частности, из генома В пшеницы. В таблице 8 представлены праймеры, сконструированные для амплификации частей гена SBEIIa, в частности, из генома D пшеницы. В таблице 9 представлены геном-специфические праймеры для гена SBEIIb пшеницы. В таблице 10 представлены нуклеотидные последовательности геном-специфических праймеров для SBEIIb. В таблице 11 представлена экспрессия общего SBEII, и SBEIIa, и SBEIIb и содержание амилозы линий с RNAi пшеницы, как описано в Примере 4. В таблице 12 представлен перечень микросателлитных маркеров, испытанных на мутантах, как описано в Примере 5. В таблице 13 представлены мутанты, идентифицированные из популяции с HIB, и данные микросателлитного картирования, как описано в примере 5. В таблице 14 представлено описание двойных нуль-мутантов SBEII, определенных как описано в Примере 5. В таблице 15 представлено описание скрещиваний, выполненных между двойными и единичными нуль-мутантами, как описано в Примере 5. В таблице 16 представлены табличные данные содержания амилозы в крахмале зерна тройных нуль-мутантов, как описано в Примере 5. В таблице 17 представлены результаты наблюдений фертильности растений-потомков F2. В таблице 18 представлен аллельный состав SBEII и данные о доле амилозы для идентифицированных двойных нулей. В таблице 19 представлена подробная информация о дальнейших скрещиваниях между двойными и единичными нуль-мутантами. В таблице 20 представлена наблюдаемая частота генотипов нормально прорастающего зерна от гибрида A2B2D2. Числа в скобках указывают на ожидаемую частоту на основе менделевского расщепления. В таблице 21 представлены дальнейшие скрещивания между двойными и единичными нуль-мутантами. В таблице 22 представлены предполагаемые двойные и тройные нуль-мутанты в генах SBEIIa, идентифицированные в начальном скрининге с помощью доминантных маркеров. В таблице 23 представлена характеристика крахмала для крахмала зерна от трансгенных линий пшеницы. В таблице 24 представлено распределение молекулярной массы фракций крахмала из трансгенных линий пшеницы. В таблице 25 представлены параметры RVA крахмала трансгенной пшеницы hp5'-SBEIIa. В таблице 26 представлены параметры DSC пика клейстеризации крахмала трансгенной пшеницы hp5'-SBEIIa по сравнению с контрольным образцом NB1. В таблице 27 представлено содержание RS в продуктах с плющеным и хлопьевым зерном. В таблице 28 представлено содержание резистентного крахмала в пищевых продуктах на различном уровне включения у высокоамилозной пшеницы (HAW). В таблице 29 представлены геном-специфичные праймеры, упоминаемые в примере 18. ПОДРОБНОЕ ОПИСАНИЕ Настоящее изобретение частично основано на наблюдениях, сделанных в описанных в данном документе экспериментах, о том, что растения пшеницы, у которых полностью отсутствует активность SBEIIa во всем растении, нельзя получить при скрещиваниях, разработанных для их получения, и действительно, был сделан вывод, что полное отсутствие SBEIIa является летальным для развития семени и/или фертильности. Это было неожиданно, так как предыдущие исследования показали, что в пшенице можно легко получить единичные нуль-мутанты в SBEIIa, и они были бы фертильными. Кроме того, было отмечено, что минимальный уровень активности SBEIIa, который должен быть сохранен у растения пшеницы, чтобы оно давало нормальные, жизнеспособные семена, составляет приблизительно 2% от уровня дикого типа. Было также отмечено, что мутантные растения и зерно, содержащие по меньшей мере одну точечную мутацию в гене SBEIIa, имеют преимущество над растениями и зерном, которые имели делеции в каждом из генов SBEIIa, для объединения мутантных генов SBEIIa, в частности, для получения фенотипически нормальных фертильных мужских и женских растений и зерна, которое прорастало при энергии, аналогичной таковой для зерна дикого типа. Одним возможным объяснением этого наблюдения было то, что делеции способствуют удалению важных генетических элементов, прилегающих к генам SBEIIa. Было также отмечено, что для получения содержания амилозы по меньшей мере 50% (вес/вес) в крахмале зерна, на уровне которого количество резистентного крахмала и связанная с ним польза для здоровья существенно возрастали, общая активность SBEII и, в частности, активность SBEIIa в зерне необходимо было сократить до уровня, ниже 30% от уровня дикого типа. Кроме того, было установлено, что в гексаплоидной пшенице снижение уровня и/или активности белка SBEII каждого из трех гомологичных генов SBEIIa или по меньшей мере двух гомологичных генов SBEIIa и двух или трех гомологичных генов SBEIIb приводит к существенному нелинейному увеличению доли амилозы в крахмале эндосперма пшеницы по сравнению с растениями, имеющими нуль-мутацию в двух гомологичных генах SBEIIa. Эта нелинейная зависимость между содержанием амилозы и уровнями SBEII в зерне гексаплоидной пшеницы проиллюстрирована графически на фигурах 5 и 6. При изучении мутаций частичной и полной потери функции в комбинациях аллелей SBEIIa и/или SBEIIb геномов А, В и D была установлена роль нескольких генов SBEII в модуляции характеристик крахмала. В частности, был исследован и определен ряд мутантных аллелей и комбинаций мутантных аллелей, необходимых для получения фертильных растений пшеницы, имеющих очень высокие уровни амилозы. Синтез крахмала в эндосперме высших растений, включая пшеницу, осуществляется рядом ферментов, которые катализируют четыре ключевые стадии. В первой стадии АДФ-глюкозопирофосфорилаза (ЕС 2.7.7.27) активирует мономерный предшественник крахмала путем синтеза АДФ-глюкозы из G-1-P и АТФ. Во второй стадии активированный глюкозильный донор, АДФ-глюкоза, переносится на невосстанавливающий конец уже существующей α-1,4-связи с помощью крахмалсинтаз (ЕС 2.4.1.24). На третьей стадии крахмал-ветвящие ферменты вводят точки ветвления путем расщепления области α-(1-4)-связанного глюкана с последующим переносом отщепленной цепи на акцепторную цепь, образуя новую α-(1-4)-связь. Крахмал-ветвящими ферментами являются только те ферменты, которые могут вводить α-(1-6)-связи в α-полиглюканы и, следовательно, играют важную роль в образовании амилопектина. На четвертой стадии крахмал-деветвящие ферменты (ЕС 2.4.4.18) удаляют некоторые из указанных связей в точке ветвления. Крахмал является главным запасающим углеводом в растениях, например, зерновых, включая пшеницу. Крахмал синтезируется в амилопластах и образуется и хранится в гранулах в развивающихся запасающих органах, например, зерне; он упоминается в данном документе как ʺзапасной крахмалʺ или ʺкрахмал зернаʺ. В зерновых культурах подавляющее большинство запасного крахмала откладывается в эндосперме. Термин ʺкрахмалʺ определяется в данном документе как полисахарид, состоящий из глюкопиранозы звеньев, полимеризованных путем объединения как α-(1-4)-, так и α-(1-6)-связей. Полидисперсные молекулы крахмала по классификации принадлежат к двум составляющим фракциям, известным как амилоза и амилопектин, на основе их степени полимеризации (DP) и соотношения α-(1-4)- и α-(1-6)-связей. Крахмал зерна у зерновых растений дикого типа, в том числе пшеницы, содержит приблизительно 20%-30% амилозы и приблизительно 70%-80% амилопектина. Термин ʺамилозаʺ определяется в данном документе как, в основном, линейные молекулы, состоящие из α-(1,4)-связанных глюкозидных (глюкопиранозных) звеньев, иногда называемых ʺистинная амилозаʺ, и амилозоподобного длинноцепочечного крахмала, иногда называемого ʺпромежуточным материаломʺ или ʺамилозоподобным амилопектиномʺ, который является йод-связывающим материалом в йодометрическом анализе наряду с истинной амилозой (Takeda и соавт., 1993b; Fergason, 1994). Как правило, линейные молекулы в истинной амилозе характеризуются DP от 500 до 5000 и содержат менее 1% α-(1,6)-связей. Недавние исследования показали, что в амилозе может встречаться приблизительно 0,1% α-(1,6)-гликозидных сайтов ветвления, поэтому ее описывают как ʺв основном линейнуюʺ. В противоположность этому, амилопектин является гораздо более крупной молекулой с DP, варьирующей от 5000 до 50000, и содержит 4-5% α-(1,6)-связей. Следовательно, молекулы амилопектина сильнее разветвлены. Амилоза имеет спиральную конформацию с молекулярной массой от приблизительно 104 до приблизительно 106 Дальтон, а амилопектин имеет молекулярную массу от приблизительно 107 до приблизительно 108 Дальтон. Эти два типа крахмала можно легко отличить или разделить с помощью способов, хорошо известных в данной области. Доля амилозы в крахмале, как определено в настоящем документе, выражена на основе весового соотношения (вес/вес), т.е. вес амилозы в процентах от веса общего крахмала, получаемого из зерна, по отношению к крахмалу до какого-либо фракционирования на фракции амилозы и амилопектина. Термины ʺдоля амилозы в крахмалеʺ и ʺсодержание амилозыʺ при использовании в данном документе в контексте зерна, муки или другого продукта настоящего изобретения являются по сути взаимозаменяемыми. Содержание амилозы можно определить с помощью любого из способов, известных в данной области, в том числе эксклюзивной высокоэффективной жидкостной хроматографии (ВЭЖХ), например, в 90% (вес/объем) ДМСО, способами с применением конканавалина A (Int Megazyme, Ireland) или, предпочтительно, йодометрическим способом, например, как описано в примере 1. Способ ВЭЖХ может включать, или не включать, деветвление крахмала (Batey и Curtin, 1996). Будет понятно, что такие способы, как способ ВЭЖХ по Batey и Curtin, 1996, с помощью которых анализируют только истинную амилозу, могут недооценить содержание амилозы, согласно определению в данном документе. Такие способы, как ВЭЖХ или гель-проникающая хроматографии, зависят от фракционирования крахмала на фракции амилозы и амилопектина, в то время как йодометрические способы зависят от дифференциального йодосвязывания и поэтому не нуждаются в фракционировании. Исходя из веса зерна и содержания амилозы, количество отложенной амилозы на зерно можно рассчитать и сравнить для тестируемых и контрольных линий. Изначально крахмал синтезируется и накапливается в листьях и других зеленых тканях растения в качестве продукта фотосинтеза. Этот крахмал упоминается в данном документе как ʺтранзиторный крахмалʺ и т.п., поскольку, в отличие от крахмала семени или клубня, он накапливается в пластидах фотосинтетических тканей в течение дня и снижается по меньшей мере в течение ночи. Ночью транзиторный крахмал гидролизуется до Сахаров, которые транспортируются, в основном в виде сахарозы, от донорных тканей к акцепторным тканям для использования в росте растения в качестве источника энергии для метаболизма или для хранения в тканях в качестве запасного крахмала. Применяемый в данном документе термин ʺкрахмалсинтазаʺ означает фермент, который переносит АДФ-глюкозу на невосстанавливающий конец уже существующих α-1,4-связей. В эндосперме зерновых встречаются четыре класса крахмалсинтазы, изоформа, которая локализуется исключительно в грануле крахмала, гранулоассоциированная крахмалсинтаза (GBSS), две формы, которые распределяются между гранулой и растворимой фракцией (SSI, Li et at, 1999a; SSII, Li и соавт., 1999b), и четвертая форма, которая целиком локализуется в растворимой фракции SSIII (Сао и соавт., 2000; Li и соавт, 1999b; Li и соавт, 2000). Было показано, что GBSS играет важную роль в синтезе амилозы (Shure и соавт., 1983), и было показано, что мутации в SSII и SSIII приводят к изменению структуры амилопектина (Gao и соавт., 1998; Craig и соавт, 1998). Мутанты в зерновых культурах, у которых отсутствует GBSS, также не имеют истинную амилозу и поэтому накапливают только амилопектин; они обычно называются мутантами по гену ʺwaxyʺ. Мутации, определяющие роль активности SSI, не были описаны. Синтез амилопектина является более сложным, чем синтез амилозы, требующий комбинации крахмалсинтаз, кроме GBSS, нескольких крахмал-ветвящих ферментов и деветвящего фермента. Применяемый в данном документе термин ʺдеветвящий ферментʺ означает фермент, который удаляет некоторые из ветвлений амилопектина, образованные крахмал-ветвящими ферментами, у высших растений присутствуют деветвящие ферменты двух типов, и их определяют по их специфичностям к субстрату, а именно деветвящие ферменты типа изоамилазы и деветвящие ферменты типа пуллуланазы (Myers и соавт., 2000). Мутации Sugary-1 у маиса и риса ассоциированы с дефицитом обоих деветвящих ферментов (James и соавт., 1995; Kubo и соавт, 1999), однако являющаяся причинной мутация находится на карте в том же положении, что и ген деветвящего фермента изоамилазного типа. Примеры генов, кодирующих крахмал-ветвящие ферменты зерновых, включая пшеницу, приведены в таблице 1. Применяемый в данном документе термин ʺкрахмал-ветвящий ферментʺ означает фермент, который вводит α-1,6-гликозидные связи между цепями глюкозных остатков (ЕС 2.4.1.18). Три формы крахмал-ветвящего фермента экспрессируются в зерновых культурах, таких как рис, маис, ячмень и пшеница, а именно крахмал-ветвящий фермент I (SBEI), крахмал-ветвящий фермент IIa (SBEIIa) и крахмал-ветвящий фермент IIb (SBEIIb) (Hedman и Воyеr, 1982; Boyer и Preiss, 1978; Mizuno и соавт., 1992, Sun и соавт., 1997). Геномные последовательности и кДНК-последовательности для генов, кодирующих эти ферменты, были охарактеризованы для риса, ячменя и пшеницы (таблица 1). Выравнивание этих последовательностей выявляет высокую степень сходства последовательностей как на нуклеотидном, так и на аминокислотном уровнях, а также и различия последовательностей и дает возможность сгруппировать эти по классам SBEI, SBEIIa и SBEIIb. SBEIIa и SBEIIb от любого вида обычно обладают примерно 80% идентичности друг с другом, в частности, в центральных областях генов. SBEIIa и SBEIIb могут также отличаться по их паттернам экспрессии, но это различается у различных видов. У маиса SBEIIb больше всего экспрессируется в эндосперме, в то время как SBEIIa присутствует во всех тканях растения. У ячменя как SBEIIa, так и SBEIIb присутствует в приблизительно равных количествах в эндосперме, а в эндосперме пшеницы SBEIIa экспрессируется в 4 раза больше, чем SBEIIb. Таким образом, виды злаков показывают значительные различия в экспрессии SBEIIa и SBEIIb, и выводы, сделанные для одного вида, нельзя легко применить для других видов. У пшеницы белки SBEIIa и SBEIIb отличаются по размеру (см. ниже), и это является удобным способом их различия. Также можно применить специфические антитела для их различия. Было показано, что у маиса фенотипы с высоким содержанием амилозы обусловлены повреждениями гена SBEIIb, известного так же как ген-удлинитель амилозы (ае) (Boyer и Preiss, 1981, Mizuno и соавт., 1993; Nishi и соавт., 2001). У этих мутантов SBEIIb гранулы крахмала в эндосперме демонстрировали аномальную морфологию, содержание амилозы было значительно повышенным, частота ветвления остаточного амилопектина была снижена, и доля коротких цепей ( В развивающемся эндосперме пшеницы SBEI (Morell и соавт., 1997) находится исключительно в растворимой фракции (строма амилопласта), в то время SBEIIa и SBEIIb находятся в эндосперме в растворимой и ассоциированной с гранулой крахмала фракций (Rahman и соавт., 1995). У пшеницы видимые случаи дупликации генов увеличили число генов SBEI в каждом геноме (Rahman и соавт., 1999). Устранение более 97% активности SBEI путем объединения мутаций в наиболее высоко экспрессирующихся формах генов SBEI из геномов А, В и D не оказывало заметного влияния на структуру или функциональность крахмала (Regina и соавт., 1999). С другой стороны, снижение экспрессии SBEIIa с помощью конструкции для генного сайленсинга у пшеницы привело к высоким уровням амилозы (>70%), в то время как соответствующая конструкция, которая уменьшала экспрессию SBEIIb, но не SBEIIa, оказывала минимальный эффект (Regina и соавт., 1999). Крахмал-ветвящую ферментативную (SBE) активность можно измерить с помощью ферментативного анализа, например, анализа стимуляции фосфорилазы (Boyer и Preiss, 1978). Этот анализ измеряет стимуляцию посредством SBE включения глюкоза-1-фосфата в полимер, нерастворимый в метаноле (α-D-глюкан), с помощью фосфорилазы А. Активность SBE можно измерить с помощью анализа с окрашиванием йодом, который измеряет снижение абсорбционной способности глюкан-полийодинного комплекса в результате ветвления полимеров глюкана. Активность SBE можно также проанализировать с помощью анализа связей в точке ветвления, который измеряет формирование восстанавливающих концов из восстановленной амилозы в качестве субстрата после расщепления изоамилозы (Takeda и соавт., 1993а). Предпочтительно, активность измеряют в отсутствие активности SBEI. Изоформы SBE демонстрируют различные специфичности к субстрату, например SBEI проявляет более высокую активность в ветвлении амилозы, в то время как SBEIIa и SBEIIb демонстрируют более высокие скорости ветвления с амилопектиновым субстратом. Изоформы можно также различить на основе длины переносимой цепи глюкана. Белок SBE можно также измерить с применением специфических антител, например, описанных в данном документе. Активность SBEII можно измерить в развивающемся эндосперме в ходе развития зерна. Альтернативно, уровни SBEII измеряют в зрелом зерне, где по-прежнему присутствует белок, и их можно проанализировать с помощью иммунологических способов. В некоторых вариантах осуществления уровень или активность SBEII или SBEIIa можно оценить путем оценки уровней транскриптов, например, с помощью нозерн-блот анализа или ОТ-ПЦР. В предпочтительном способе количество белка SBEIIa в зерне или развивающемся эндосперме измеряют путем разделения белков в экстрактах зерна/эндосперма на гелях с помощью электрофореза, а затем переноса белков на мембрану с помощью вестерн-блот анализа, с последующим количественным обнаружением белка на мембране с применением специфических антител (ʺвестерн-блот анализʺ). Это проиллюстрировано в примере 11. Как показано в данном документе, развивающийся эндосперм гексаплоидной пшеницы экспрессирует SBEIIa и SBEIIb из каждого из геномов А, В и D. Тетраплоидная пшеница экспрессирует SBEIIa и SBEIIb из каждого из геномов А и В. Применяемый в данном документе термин ʺSBEIIa, экспрессированный из генома Аʺ или ʺSBEIIa-Aʺ означает крахмал-ветвящий фермент, аминокислотная последовательность которого изложена в SEQ ID NO:1, или который по меньшей мере на 99% идентичен аминокислотной последовательности, изложенной в SEQ ID NO:I, или содержащий такую последовательность. Аминокислотная последовательность SEQ ID NO:I (Genbank рег. № CAA72154) соответствует SBEIIa, экспрессированному из генома А пшеницы, который применяют в данном документе в качестве эталонной последовательности SBEIIa-А дикого типа. Длина белка SEQ ID NO:1 составляет 823 аминокислоты. Активные варианты этого фермента существуют у пшеницы, например, в культиваре Cheyenne, см. рег. № AF286319, который на 99,88% (822/823) идентичен SEQ ID NO. 1. Такие варианты включены в представленный ʺSBEIIa-Aʺ, они по сути обладают крахмал-ветвящей ферментативной активностью дикого типа, как для SEQ ID NO:1. Применяемый в данном документе термин ʺSBEIIa, экспрессированный из генома Вʺ или ʺSBEIIa-Bʺ означает крахмал-ветвящий фермент, аминокислотная последовательность которого изложена в SEQ ID NO:2, или который по меньшей мере на 99% идентичен аминокислотной последовательности, изложенной в SEQ ID NO:2, или содержащий такую последовательность. Аминокислотная последовательность SEQ ID NO:2 (Genbank рег. № CAR95900) соответствует SBEIIa, экспрессированному из генома В пшеницы сорта Chinese Spring, который применяют в данном документе в качестве эталонной последовательности SBEIIa-B дикого типа. Длина белка SEQ ID NO:2 составляет 823 аминокислоты. Активные варианты этого фермента могут существовать в пшенице и включены в представленный SBEIIa-B, при условии, что они по сути обладают крахмал-ветвящей ферментативной активностью дикого типа, как для SEQ ID NO:2. SEQ ID NO:2 на 98,42% (811/824) идентична SEQ ID NO:1. Выравнивание аминокислотных последовательностей на фигуре 1 показывает аминокислотные различия, которые можно использовать для того, чтобы отличить белки или классифицировать варианты на SBEIIa-A или SBEIIa-B. Применяемый в данном документе термин ʺSBEIIa, экспрессированный из генома Dʺ или ʺSBEIIa-Dʺ означает крахмал-ветвящий фермент, аминокислотная последовательность которого изложена в SEQ ID NO:3, или который по меньшей мере на 99% идентичен аминокислотной последовательности, изложенной в SEQ ID NO:3, или содержащий такую последовательность. Аминокислотная последовательность SEQ ID NO:3 (Genbank рег. № AAK26821) соответствует SBEIIa, экспрессированному из генома D в A. tauschii, вероятному предшественнику из генома D гексаплоидной пшеницы, который применяют в данном документе в качестве эталонной последовательности SBEIIa-D дикого типа. Длина белка SEQ ID NO:2 составляет 819 аминокислот. Активные варианты этого фермента могут существовать у пшеницы и включены в SBEIIa-D при условии, что они по сути обладают крахмал-ветвящей ферментативной активностью дикого типа, как для SEQ ID NO:3. SEQ ID NO:3 на 97,57% (803/823) идентична SEQ ID NO:1 и на 97,81% (805/823) идентична SEQ ID NO:2. Выравнивание аминокислотных последовательностей на фигуре 1 показывает аминокислотные различия, которые можно использовать для того, чтобы отличить белки или классифицировать варианты на SBEIIa-A, SBEIIa-B или SBEIIa-D. При сравнении аминокислотных последовательностей, чтобы определить процент идентичности в данном контексте, например, посредством Blastn, следует сравнивать полноразмерные последовательности и считать гэпы в последовательности в качестве аминокислотных различий. Применяемый в данном документе термин ʺбелок SBEIIaʺ включает варианты белка, которые имеют уменьшенную крахмал-ветвящую ферментативную активность или не обладают крахмал-ветвящей ферментной активностью, а также белки, по сути обладающие ферментативной активностью дикого типа. Также понятно, что белки SBEIIa могут присутствовать в зерне, в частности в зерне, находящемся в состоянии покоя, обычно собранном в промышленных масштабах, но в неактивном состоянии из-за физиологических условий в зерне. Такие белки включены в ʺбелки SBEIIaʺ, применяемые в данном документе. Белки SBEIIa могут быть ферментативно активными только во время части развития зерна, в частности, во время развития эндосперма, когда обычно откладывается запасной крахмал, но в неактивном состоянии в иных случаях. Такой белок SBEIIa можно легко идентифицировать и измерить количественно с помощью иммунологических способов, например, вестерн-блот анализа. Применяемый в данном документе термин ʺбелок SBEIIbʺ имеет аналогичное значение. Применяемый в данном документе термин ʺSBEIIb, экспрессированный из генома Аʺ или ʺSBEIIb-Aʺ означает крахмал-ветвящий фермент, содержащий аминокислотную последовательность, которая изложена в SEQ ID NO:4, или которая по меньшей мере на 98% идентична аминокислотной последовательности, изложенной в SEQ ID NO:4, или содержащая такую последовательность. Аминокислотная последовательность SEQ ID NO:4 соответствует амино-концевой последовательности SBEIIb, экспрессированной из генома А пшеницы, которую применяют в данном документе в качестве эталонной последовательности для SBEIIb-A дикого типа. Применяемый в данном документе термин ʺSBEIIb, экспрессированный из генома Вʺ или ʺSBEIIb-Bʺ означает крахмал-ветвящий фермент, аминокислотная последовательность которого изложена в SEQ ID NO:5, или которая по меньшей мере на 98% идентична аминокислотной последовательности, изложенной в SEQ ID NO:5, или содержащая такую последовательность. Аминокислотная последовательность SEQ ID NO:5, которую применяют в данном документе в качестве эталонной последовательности для SBEIIb-B дикого типа, представляет собой частичную аминокислотную последовательность, кодируемую экзонами 2-3 гена SBEIIb-B у пшеницы. Вариантная последовательность SBEIIb-B представляет собой аминокислотную последовательность, кодируемую нуклеотидной последовательностью под рег. № K335378, выделенной из сорта Chinese Spring. Применяемый в данном документе термин ʺSBEIIb, экспрессированный из генома Dʺ или ʺSBEIIb-Dʺ означает крахмал-ветвящий фермент, аминокислотная последовательность которого изложена в SEQ ID NO:6, или которая по меньшей мере на 98% идентична аминокислотной последовательности, изложенной в SEQ ID NO:6, или содержащая такую последовательность. Аминокислотная последовательность SEQ ID NO:6 (Genbank рег. № AAW80631) соответствует SBEIIb, экспрессированному из генома D A.tauschii, вероятного предшественника из генома D гексаплоидной пшеницы, и ее применяют в данном документе в качестве эталонной последовательности SBEIIa-D дикого типа. Активные варианты этого фермента существуют у пшеницы и включены в SBEIIb-D при условии, что они по сути обладают крахмал-ветвящей ферментативной активностью дикого типа, как для SEQ ID NO:6. Например, в SEQ ID NO:4 из публикации патентной заявки США №20050074891, начиная с первого метионина, показана аминокислотная последовательность белка SBEIIb-D, которая на 99,5% идентична SEQ ID NO:6 в данной заявке. Выравнивание аминокислотных последовательностей на фигуре 2 показывает аминокислотные различия, которые можно использовать для того, чтобы отличить белки SBEIIb или классифицировать варианты на SBEIIa-A, SBEIIa-B или SBEIIa-D. Таким образом, термин ʺдикий типʺ, применяемый в данном документе при упоминании SBEIIa-A, означает крахмал-ветвящий фермент, аминокислотная последовательность которого изложена в SEQ ID NO:1; термин ʺдикий типʺ, применяемый в данном документе при упоминании SBEIIa-B, означает крахмал-ветвящий фермент, аминокислотная последовательность которого изложена в SEQ ID NO:2; термин ʺдикий типʺ, применяемый в данном документе при упоминании SBEIIa-D, означает крахмал-ветвящий фермент, аминокислотная последовательность которого изложена в SEQ ID NO:3; термин ʺдикий типʺ, применяемый в данном документе при упоминании SBEIIb-A, означает крахмал-ветвящий фермент, аминокислотная последовательность которого изложена в SEQ ID NO:4; термин ʺдикий типʺ, применяемый в данном документе при упоминании SBEIIb-B, означает крахмал-ветвящий фермент, аминокислотная последовательность которого изложена в SEQ ID NO:5; и термин ʺдикий типʺ, применяемый в данном документе при упоминании SBEIIb-D, означает крахмал-ветвящий фермент, аминокислотная последовательность которого изложена в SEQ ID NO:6. Применяемые в данном документе термины ʺген SBEIIa пшеницыʺ и ʺген SBEIIb пшеницыʺ относятся к генам, которые кодируют функциональные ферменты SBEIIa или SBEIIb, соответственно, у пшеницы, включая гомологичные гены, присутствующие в других сортах пшеницы, а также мутантные формы генов, которые кодируют ферменты с пониженной активностью или необнаруживаемой активностью. Они включают, но без ограничения, гены SBEII пшеницы, которые были клонированы, включая геномные последовательности и кДНК-последовательности, перечисленные в таблице 1. Гены, применяемые в данном документе, охватывают мутантные формы, которые вообще не кодируют какие-либо белки, и в этом случае мутантные формы представляют собой нуль-аллели генов. Термин ʺэндогенный ген SBEIIʺ относится к гену SBEII, который находится в своем нативном местоположении в геноме пшеницы, в том числе дикого типа и мутантных форм. Наоборот, термины ʺвыделенный ген SBEIIʺ и ʺэкзогенный ген SBEIIʺ относятся к гену SBEII, который не находится в своем нативном местоположении, например был клонирован, синтезирован, включен в вектор или в форме трансгена в клетку, предпочтительно, в виде трансгена в трансгенных растениях пшеницы. Геном SBEII в данном контексте может быть любой ген из конкретных форм, описываемых далее. Применяемый в данном документе термин ʺген SBEIIa в геноме А пшеницыʺ или ʺген SBEIIa-A' означает любой полинуклеотид, который кодирует SBEIIa-A, как определено в данном документе, или который получают из полинуклеотида, кодирующего SBEIIa-A, включая естественные полинуклеотиды, варианты последовательности или синтетические полинуклеотиды, в том числе ʺген(ы) SBEIIa-A дикого типаʺ, которые кодируют SBEIIa-A с активностью по сути дикого типа, и ʺмутантный(е) ген(ы) SBEIIa-Aʺ, которые не кодируют SBEIIa с активностью по сути дикого типа, но которые различимо происходят из гена SBEIIa-A дикого типа. Сравнение нуклеотидной последовательности мутантной формы гена SBEII с набором генов дикого типа SBEII применяют для определения того, какой из генов SBEII происходит от какого и, таким образом, чтобы классифицировать его. Например, мутантный ген SBEII считается мутантным геном SBEIIa-A, если его нуклеотидная последовательность является более близкородственной, т.е. имеющей более высокую степень идентичности последовательности, к гену SBEIIa-A дикого типа, чем любому другому гену SBEII. Мутантный ген SBEIIa-A кодирует SBE с пониженной крахмал-ветвящей ферментативной активностью (частичный мутант), или белок с недостаточной активностью SBE, или не кодирует белок вообще (нуль-мутантный ген). Иллюстративная нуклеотидная последовательность кДНК, соответствующей гену SBEIIa-A, приведена в Genbank под рег. № Y11282. Последовательности частей генов SBEIIa-A также приведены в данном документе, как указано на фиг.7, 8, 9 и 10 и SEQ ID NO:13, 14 и 15. Применяемые в данном документе термины ʺSBEIIa, экспрессированный из генома Вʺ или ʺSBEIIa-Bʺ, ʺSBEIIa, экспрессированный из генома Dʺ или ʺSBEIIa-Dʺ, ʺSBEIIb, экспрессированный из генома Аʺ или ʺSBEIIb-Aʺ, ʺSBEIIb, экспрессированный из генома Вʺ или ʺSBEIIb-Bʺ и ʺSBEIIb, экспрессированный из генома Dʺ или ʺSBEIIb-Dʺ имеют соответствующие значения, как для SBEIIa-A в предыдущем абзаце. Иллюстративные частичные белковые последовательности SBEIIb-A, SBEIIb-B и SBEIIb-D приведены на фигуре 2. Иллюстративные аминокислотные последовательности SBEIIb-A изложены в SEQ ID NO:1 и SEQ ID NO:4 (амино-концевая последовательность, кодируемая экзоном 1-3). Иллюстративные аминокислотные последовательности SBEIIb-B изложены в SEQ ID NO:2 и SEQ ID NO:5. Иллюстративные аминокислотные последовательности SBEIIb-D изложены в SEQ ID NO:3, и SEQ ID NO:6, и SEQ ID NO:9. Гены SBEII, которые определены выше, включают любые регуляторные последовательности, которые лежат 5'- или 3'- от транскрибируемой области, включая промоторную область, которые регулируют экспрессию соответствующей транскрибируемой области, и интроны внутри транскрибируемых областей. Понятно, что есть естественная вариация в последовательностях генов SBEIIa и SBEIIb из разных сортов пшеницы. Гомологичные гены являются легко узнаваемыми специалистом в данной области на основе идентичности последовательностей. Считается, что степень идентичности последовательностей гомологичных генов SBEIIa или белков, составляет по меньшей мере 90%, аналогично для генов SBEIIb или белков. Гены SBEIIa пшеницы приблизительно на 80% идентичны по последовательности генам SBEIIb пшеницы. Кодируемые белки также приблизительно на 80% идентичны по последовательности. Аллель является вариантом гена в одном генетическом локусе. Диплоидный организм имеет два набора хромосом. Каждая хромосома имеет одну копию каждого гена (один аллель). Если оба аллеля одинаковы, организм является гомозиготным в отношении этого гена, а если аллели разные, организм является гетерозиготным в отношении этого гена. Взаимодействие между аллелями в локусе, как правило, описывают как доминантное или рецессивное. Мутация потери функции является мутацией аллеля, которая не приводит вообще или приводит к пониженному определяемому уровню или активности фермента SBEII, SBEIIa или SBEIIb в зерне. Мутация может означать, например, что РНК не транскрибируется или транскрибируется меньше РНК с гена, содержащего мутации, или что продуцируемый белок не обладает вообще или обладает пониженной активностью. Аллели, которые не кодируют или не способны привести к производству какого-либо активного фермента, являются нуль-аллелями. Мутация потери функции, которая включает в себя мутацию частичной потери функции аллеля, означает мутацию аллеля, приводящую к сниженному уровню или активности фермента SBEII, SBEIIa или SBEIIb в зерне. Мутация аллеля может означать, например, что транслируется меньше белка, обладающего активностью дикого типа или пониженной активностью, или что за уровнем транскрипции дикого типа или пониженным уровнем транскрипции следует трансляция фермента с пониженной ферментативной активностью. ʺПониженноеʺ количество или уровень белка означает сниженный по отношению к количеству или уровню, продуцируемому соответствующим аллелем дикого типа. ʺПониженнаяʺ активность означает сниженную по отношению к соответствующему ферменту дикого типа SBEII, SBEIIa или SBEIIb. Различные аллели в зародыше могут иметь одинаковую или различную мутацию, и различные аллели можно комбинировать с помощью известных в данной области способов. В некоторых вариантах осуществления количество белка SBEIIa или белка SBEIIb понижено из-за снижения транскрипции или трансляции гена SBEIIa или гена SBEIIb, соответственно. В некоторых вариантах осуществления количество по весу белка SBEIIa или белка SBEIIb понижено даже несмотря на наличие ряда белковых молекул SBEIIa или белковых молекул SBEIIb дикого типа в зерне, потому что некоторые из продуцируемых белков короче, чем белок SBEIIa или белок SBEIIb дикого типа, например мутантный белок SBEIIa или белок SBEIIb урезан из-за преждевременного сигнала прекращения трансляции. Иллюстративные гены биосинтеза крахмала, которые были клонированы из хлебных злаков, представлены в таблице 1. Применяемое в данном документе выражение ʺдва идентичных аллеля гена SBEIIa-Aʺ означает, что два аллеля гена SBEIIa-A являются идентичными друг другу; выражение ʺдва идентичных аллеля гена SBEIIa-Bʺ означает, что два аллеля гена SBEIIa-B являются идентичными друг другу; выражение ʺдва идентичных аллеля гена SBEIIa-Dʺ означает, что два аллеля гена SBEIIa-D являются идентичными друг другу; выражение ʺдва идентичных аллеля гена SBEIIb-Aʺ означает, что два аллеля гена SBEIIb-A являются идентичными друг другу; выражение ʺдва идентичных аллеля гена SBEIIb-Bʺ означает, что два аллеля гена SBEIIb-B являются идентичными друг другу; и выражение ʺдва идентичных аллеля гена SBEIIb-Dʺ означает, что два аллеля гена SBEIIb-D являются идентичными друг другу. Растения пшеницы настоящего изобретения можно получить и идентифицировать после мутагенеза. Можно получить растение пшеницы, которое не является трансгенным, что желательно на некоторых рынках, или которое не содержит какую-либо экзогенную молекулу нуклеиновой кислоты, которая снижает экспрессию гена SBEIIa. Мутантные растения пшеницы, имеющие мутацию в одном гене SBEII, которую можно скомбинировать путем скрещивания и селекции с другими мутациями SBEII с получением растений пшеницы настоящего изобретения, могут быть либо синтетическими, например, путем проведения сайт-направленного мутагенеза нуклеиновой кислоты, либо индуцированными мутагенной обработкой, либо естественно возникающими, т.е. выделенными из естественного источника. Как правило, клетку, ткань, семя или растение растения-предшественника можно подвергнуть мутагенезу с получением одной или нескольких мутаций, например, нуклеотидных замен, делеций, присоединений и/или модификации кодона. Предпочтительные растения пшеницы и зерно настоящего изобретения содержат по меньшей мере одну введенную мутацию SBEII, более предпочтительно две или более введенных мутаций SBEII, и могут не содержать каких-либо мутаций из естественного источника, т.е. все мутантные аллели SBEIIa и SBEIIb у растения были получены синтетическими способами или путем мутагенной обработки. Мутагенез можно осуществить с помощью химических или радиоактивных средств, например, обработки семени EMS или азидом натрия (Zwar и Chandler, 1995), или гамма-облучением, что хорошо известно в данной области. Химический мутагенез способствует образованию нуклеотидных замен, а не делеций. Облучение пучком тяжелых ионов (HIB) известно как эффективный способ для мутационной селекции для получения новых культиваров растений, см., например, Hayashi и соавт., 2007 и Kazama и соавт, 2008. Облучение пучком ионов характеризуется двумя физическими показателями, дозой (Гр) и LET (линейной передачи энергии, кэВ/мкм) в отношении биологических эффектов, которые определяют количество повреждений ДНК и размер делеции ДНК, и их можно скорректировать в соответствии с требуемой степенью мутагенеза. HIB создает набор мутантов, многие из которых содержат делеции, которые можно подвергнуть скринингу на наличие мутаций в конкретных генах SBEII, как показано в примерах. Мутантов, которых определяют, можно подвергнуть обратному скрещиванию с немутантными растениями пшеницы в качестве рекуррентных родителей с целью удаления и, следовательно, уменьшения влияния несвязанных мутаций в мутагенизированном геноме, см. пример 9. Биологические агенты, пригодные в получении сайт-специфических мутантов, включают ферменты, которые имеют двухцепочечные разрывы в ДНК, которые стимулируют эндогенные механизмы репарации. К ним относятся эндонуклеазы, нуклеазы белкового домена ʺцинковые пальцыʺ, транспозазы и сайт-специфические рекомбиназы. Нуклеазы белкового домена ʺцинковые пальцыʺ (ZFN), например, облегчают сайт-специфическое расщепление внутри генома, позволяя эндогенным репарационным механизмам или другим соединяющим концы репарационным механизмам вводить делеции или инсерции для репарации гэпа. Технология нуклеаз белкового домена ʺцинковые пальцыʺ рассмотрена в Le Provost и соавт., 2009. См. также Durai и соавт, 2005 и Liu и соавт., 2010. Выделение мутантов можно осуществить путем скрининга мутантных растений или семян. Например, мутантную популяцию пшеницы можно подвергнуть скринингу непосредственно по генотипу SBEIIa и/или SBEIIb или косвенным путем скрининга по фенотипу, который является следствием мутаций в генах SBEII. Скрининг непосредственно по генотипу предпочтительно включает анализ на наличие мутаций в генах SBEII, что можно наблюдать в анализах ПЦР по отсутствию специфических маркеров SBEIIa или SBEIIb, что ожидаемо при удалении некоторых генов, или гетеродуплексные анализы в Tilling. Скрининг по фенотипу может включать скрининг по потере или снижению количества одного или нескольких белков SBEIIa или SBEIIb с помощью ELISA или аффинной хроматографии, или увеличенному содержанию амилозы в крахмале зерна. У гексаплоидной пшеницы скрининг предпочтительно осуществляют в генотипе, в котором уже не хватает одной или двух SBEII-активностей, например, у растения пшеницы, уже мутантному в генах SBEIIa или SBEIIb в двух из трех геномов, так чтобы провести поиск мутанта, у которого дополнительно отсутствует функциональная активность. У тетраплоидной пшеницы скрининг предпочтительно осуществляют в генотипе, в котором уже не хватает одной SBEII-активности, в геноме либо А, либо В, и определение мутанта которого ниже у SBEII из второго генома. Аффинную хроматографию можно провести, как показано в примере 11. Большие популяции мутагенных семян (тысячи или десятки тысяч семян) можно подвергать скринингу на высокоамилозные фенотипы, применяя спектроскопию в ближней инфракрасной области (NIR), как показано в примере 10. Применяя NIR, можно получить субпопуляцию, обогащенную кандидатами с высоким содержанием амилозы. С помощью этих способов можно легко осуществить высокопроизводительный скрининг, который позволяет выделять мутантов с частотой примерно один на несколько сотен семян. Растения и семена настоящего изобретения можно получить с применением способа, известного как TILLING (направленные индуцированные локальные повреждения геномов), с помощью которого можно получить одну или несколько мутаций у растений пшеницы или зерна. На первой стадии в популяции растений индуцируют введенные мутации, например, новые замены единичных пар оснований, с помощью обработки семян или пыльцы химическим или радиоактивным мутагеном, а затем совершенствуя растения до поколения, где мутации стабильно наследуются, обычно поколения М2, у которого можно идентифицировать гомозиготы. Экстрагируют ДНК и хранят семена от всех членов популяции для создания ресурса, к которому можно периодически обращаться с течением времени. Для анализа TILLING разрабатывают ПЦР-праймеры для того, чтобы специфически амплифицировать единичную интересующую ген-мишень. Далее, меченные красителем праймеры можно применять для амплификации продуктов ПЦР из объединенных в пул ДНК нескольких особей. Эти продукты ПЦР денатурируют и повторно отжигают, чтобы позволить образование пар несоответствующих оснований. Несоответствия, или гетеродуплексы, представляют собой как естественно возникающие однонуклеотидные полиморфизмы (SNP) (т.е. несколько растений популяции способны нести одинаковый полиморфизм), так и индуцированные SNP (т.е. лишь редкие особи растений способны проявлять мутацию). После образования гетеродуплексов применение эндонуклеазы, например, Сеl I, которая распознает и расщепляет несоответствующие ДНК, является ключевым для обнаружения новых SNP внутри популяции TILLING. С помощью этого подхода можно подвергнуть скринингу многие тысячи растений для того, чтобы определить любую особь с изменением одного основания, а также небольшими инсерциями или делениями (1-30 пар оснований) в любом гене или конкретной области генома. Исследуемые геномные фрагменты могут варьировать в размере где-то от 0,3 до 1,6 т.н. При 8-кратном объединении и амплификации 1,4 т.н. фрагментов с 96 дорожками а анализ эта комбинация позволяет проводить скрининг до миллиона пар оснований геномной ДНК за один анализ, что делает TILLING высокопроизводительным способом. TILLING подробнее описан в Slade и Knauf, 2005, и Henikoff и соавт, 2004. В дополнение к возможности эффективного обнаружения мутаций, высокопроизводительный способ TILLING идеально подходит для обнаружения естественных полиморфизмов. Следовательно, детальное исследование неизвестной гомологичной ДНК путем получения гетеродуплекса с известной последовательностью показывает число и расположение полиморфных сайтов. Выявляют как нуклеотидные изменения, так и малые инсерции и делеции, включая полиморфизма по меньшей мере с некоторым количеством повторов. Это назвали Ecotilling (Comai и соавт., 2004). Можно подвергнуть скринингу пластины, содержащие упорядоченную экотипическую ДНК, а не пулы ДНК от мутантных растений. Поскольку обнаружение происходит на гелях с разрешением почти в пару оснований, а фоновые картины одинаковы для всех дорожки, можно совместить бэнды, которые имеют одинаковые размеры, таким образом, выявляя и генотипируя мутации за одну стадию. Таким образом, секвенирование мутантного гена является простым и эффективным. Выявленные мутации затем можно вводить в желаемый генетический фон путем скрещивания мутанта с растением с необходимым генетическим фоном и выполнения подходящего количества возвратных скрещиваний, чтобы устранить первоначальный нежелательный родительский фон. В контексте данной заявки ʺиндуцированная мутацияʺ или ʺвведенная мутацияʺ является искусственной генетической модификацией, которая может быть результатом химического, радиационного или биологического мутагенеза, например, инсерцией транспозона или Т-ДНК. Предпочтительными мутациями являются нуль-мутации, например, нонсенс-мутации, мутации со сдвигом рамки, делеции, инсерционные мутации или сайт-сплайсинговые варианты, которые полностью инактивируют ген. Другими предпочтительными мутациями являются частичные мутации, которые сохраняют некоторую активность SBEII, но меньше уровней фермента дикого типа. Нуклеотидные инсерционные производные включают 5'- и 3'-концевые гибриды, а также инсерции одного или множества нуклеотидов внутрь последовательности. Вариантами инсерционных нуклеотидных последовательностей являются такие, в которых один или несколько нуклеотидов вводят в сайт нуклеотидной последовательности, либо в заданный сайт, как это возможно с нуклеазами белкового домена ʺцинковые пальцыʺ (ZFN) или другими способами гомологичной рекомбинации, либо с помощью случайной инсерции с соответствующим скринингом полученного продукта. Делеционные варианты характеризуются удалением одного или нескольких нуклеотидов в данной последовательности. Предпочтительно, мутантный ген имеет только одну инсерцию или делецию последовательности нуклеотидов по сравнению с геном дикого типа. Удаление может быть достаточно широким с тем, чтобы захватить один или более экзонов или интронов, как экзонов, так и интронов, интрон-экзонную границу, часть промотора, сайта инициации трансляции или даже весь ген. Делеции могут распространяться достаточно далеко с тем, чтобы включить по меньшей мере частично или полностью, как гены SBEIIa, так и гены SBEIIb в геноме А, В или D, что основано на тесной генетической связи этих двух генов. Инсерции или делеции внутри экзонов кодирующего белок участка гена, которые вставляют или удаляют число нуклеотидов, которое не кратно трем, тем самым вызывая изменение рамки считывания в процессе трансляции, почти всегда устраняют активность мутантного гена, содержащего такую инсерцию или делецию. Вариантами с заменяющими нуклеотидами являются варианты, в которых по меньшей мере один нуклеотид в данной последовательности был удален, и на его место введен другой нуклеотид. Предпочтительное количество нуклеотидов, подвергаемых заменам в мутантном гене относительной гена дикого типа, составляет максимум десять нуклеотидов, более предпочтительно, максимум 9, 8, 7, 6, 5, 4, 3 или 2, или, наиболее предпочтительно, только один нуклеотид. Замены могут быть ʺмолчащимиʺ, то есть такая замена не изменяет аминокислоту, определяемую кодоном. Нуклеотидные замены могут снижать эффективность трансляции и тем самым снижать уровень экспрессии SBEII, например, путем снижения стабильности мРНК, или вблизи границы соединения экзона и интрона, изменять эффективность сплайсинга. Ожидается, что молчащие замены, которые не изменяют эффективность трансляции гена SBEIIa или SBEIIb, не изменяют активность генов и поэтому рассматриваются в данном документе в качестве не-мутантных, то есть такие гены являются активными вариантами и не охвачены термином ʺмутантные аллелиʺ. С другой стороны, нуклеотидная(ые) замена(ы) может изменить кодируемую аминокислотную последовательность и, таким образом, изменить активность кодируемого фермента, в частности, в случае замены консервативных аминокислот на другую аминокислоту, которая существенно отличается, т.е. в случае неконсервативной замены. Типичными консервативными заменами являются замены, сделанные в соответствии с таблицей 3. Применяемый в данном документе термин ʺмутацияʺ не включает в себя молчащие нуклеотидные замены, которые не влияют на активность гена и, следовательно, включает в себя только изменения в последовательности генов, которые влияют на активность гена. Термин ʺполиморфизмʺ относится к любому изменению нуклеотидной последовательности, в том числе такие молчащие нуклеотидные замены. Способы скрининга могут, в первую очередь, включать скрининг на полиморфизмы, а затем на мутации внутри группы полиморфных вариантов. Как понятно из уровня техники, разновидности гексаплоидной пшеницы, например, пшеница обыкновенная, включают три генома, которые обычно обозначаются геномы А, В и D, в то время как разновидности тетраплоидной пшеницы, например, пшеница твердая, включают два генома, обычно обозначаемые геномы А и В. Каждый геном содержит 7 пар хромосом, которые можно наблюдать с помощью цитологических способов во время мейоза и, таким образом, определить, что хорошо известно в данной области. Применяемые в данном документе ʺрастение(я)ʺ и ʺрастение(я) пшеницыʺ в качестве имени существительного обычно относятся к целым растениям, но когда ʺрастительныйʺ или ʺпшеничныйʺ применяют в качестве имени прилагательного, термины относятся к любому веществу, которое присутствует в, получено из, происходит от или связано с растением или растением пшеницы, таким как, например, растительные органы (например, листья, стебли, корни, цветки), единичные клетки (например, пыльца), семена, растительные клетки, включая, например, клетки культуры тканей, продукты, полученные из растения, например, ʺпшеничная мукаʺ, ʺзерна пшеницыʺ, ʺпшеничный крахмалʺ, ʺпшеничные гранулы крахмалаʺ и тому подобное. Проростки и пророщенные семена, из которых появились корни и побеги, также включают в значение термина ʺрастениеʺ. Применяемый в данном документе термин ʺчасти растенияʺ относится к одной или нескольким растительным тканям или органам, которые получают из целого растения, предпочтительно, растения пшеницы. Части растения включают вегетативные структуры (например, листья, стебли), корни, цветочные органы/структуры, семя (в том числе зародыш, эндосперм и семенная оболочка), ткань растения (например, сосудистая ткань, покровная ткань и тому подобное), клетки и их потомство. Применяемый в данном документе термин ʺрастительная клеткаʺ относится к клетке, полученной из растения или в растении, предпочтительно растении пшеницы, и включает протопласты или другие клетки, полученные из растений, гаметопродуцирующие клетки и клетки, которые регенерируют в целые растения. Растительные клетки могут быть клетками в культуре. Под ʺрастительной тканьюʺ подразумевают дифференцированную ткань растения или полученную из растения (ʺэксплантʺ), или недифференцированную ткань, полученную из незрелых или зрелых зародышей, семян, корней, побегов, плодов, пыльцы и различных форм скоплений растительных клеток в культуре, например, каллус. Растительные ткани в семенах или из семян, например семян пшеницы, представляют семенную оболочку, эндосперм, щиток зародыша, алейроновый слой и зародыш. Применяемый в данном документе термин ʺзерновые культурыʺ означает растения или зерно семейств однодольных Роасеае или Graminae, которые культивируют для получения съедобных компонентов их семян, и включает пшеницу, ячмень, маис, овес, рожь, рис, сорго, тритикале, просо, гречиху. Предпочтительно, зерновым растением или зерном является растение или зерно пшеницы или ячменя, более предпочтительно, растение или зерно пшеницы. В дополнительном предпочтительном варианте осуществления зерновое растение не является рисом, или маисом, или обоими из них. Применяемый в данном документе термин ʺпшеницаʺ относится к любым видам рода Triticum, в том числе их предшественникам, а также их потомству, полученному путем скрещивания с другими видами. Пшеница включает ʺгексаплоидную пшеницуʺ с организацией генома AABBDD, состоящего из 42 хромосом, или ʺтетраплоидную пшеницуʺ с организацией генома ААВВ из 28 хромосом. Гексаплоидная пшеница включает Т.aestivum, Т.spelta, Т.macha, Т.compactum, Т.sphaerococcum, Т.vavilovii и их межвидовые гибриды. Тетраплоидная пшеница включает T.durum (также называемую пшеницей твердой или Triticum turgidum ssp. durum), T.dicoccoides, Т.dicoccum, T.polonicum и их межвидовые скрещивания. Кроме того, термин ʺпшеницаʺ включает возможные предшественники гексаплоидной или тетраплоидной Triticum sp., такие как Т.uartu, Т.monococcum или Т.boeoticum для генома A, Aegilops speltoides для генома В и Т.tauschii (также известную как Aegilops squarrosa или Aegilops tauschii) для генома D. Культивар пшеницы для применения в настоящем изобретении может принадлежать, но без ограничений, к любым из вышеперечисленных видов. Также к ним принадлежат растения, которые получают с помощью обычных способов с применением Triticum sp. в качестве родителя в половом скрещивании с видами, отличными от Triticum, такими как рожь Secale cereale, в том числе, но без ограничений, тритикале. Предпочтительно, растение пшеницы подходит для промышленного производства зерна, например, промышленные сорта гексаплоидной пшеницы или пшеницы твердой, имеющие подходящие агрономические характеристики, известные специалистам в данной области. Более предпочтительно, пшеницей является Triticum aestivum ssp. aestivum или Triticum turgidum ssp. durum и, наиболее предпочтительно, пшеницей является Triticum aestivum ssp. aestivum, также упоминаемая в данном документе как ʺпшеница обыкновеннаяʺ. Применяемый в данном документе термин ʺячменьʺ относится к любому из видов рода Hordeum, в том числе их предшественникам, а также их потомству, полученному путем скрещивания с другими видами. Предпочтительно, чтобы растение принадлежало к видам Hordeum, которые выращивают промышленно, как, например, линия, культивар или сорт Hordeum vulgare, или было подходящим для промышленного производства зерна. Растения пшеницы настоящего изобретения могут иметь множество применений, кроме применений для продукта питания или корма для животных, например, применения в исследовании или селекции. В культурах для разведения семян, например, пшенице, растения можно подвергнуть инбредному скрещиванию с получением растения, которое является гомозиготным по желаемым генам или гаплоидным тканям, например, развивающиеся зародышевые клетки можно индуцировать к удвоению хромосомного набора с получением гомозиготного растения. Инбредное растение пшеницы настоящего изобретения, таким образом, производит семя, содержащее комбинацию мутантных аллелей SBEII, которые могут быть гомозиготными. Эти семена можно выращивать для получения растений, которые будут иметь избранный фенотип, например, высокое содержание амилозы в его крахмале. Растения пшеницы настоящего изобретения можно скрещивать с растениями, содержащими более желаемый генетический фон, и, следовательно, настоящее изобретение включает перенос признака низкого SBEII на другой генетический фон. После первого скрещивания можно осуществить соответствующее количество обратных скрещиваний для удаления менее желаемого фона. SBEII-аллель-специфические ПЦР-маркеры, например, описанные в данном документе, можно применять для скрининга или идентификации растений-потомков или зерна-потомка с желаемой комбинации аллелей, тем самым отслеживания присутствие аллелей в селекционной программе. Желаемый генетический фон может включать подходящую комбинацию генов, дающих промышленный выход и другие характеристики, например, сельскохозяйственный показатель или устойчивость к абиотическому стрессу. Генетический фон может также включать другие гены биосинтеза или модификации измененного крахмала, например, гены из других линий пшеницы. Генетический фон может включать один или несколько трансгенов, например, ген, который придает устойчивость к гербициду, такому как глифосат. Желаемый генетический фон растения пшеницы будет включать факторы агрономического выхода и других характеристик. Такие характеристики могут включать, независимо от того, необходимо ли получить озимые или яровые типы, сельскохозяйственный показатель, устойчивость к болезням и устойчивость к абиотическому стрессу. Для применения в Австралии может оказаться желательным скрещивание растения пшеницы с признаком измененного крахмала по настоящему изобретению, с такими культиварами пшеницы как Baxter, Kennedy, Janz, Frame, Rosella, Cadoux, Diamondbird или другими традиционно выращиваемыми сортами. Для других сельскохозяйственных регионов подойдут другие сорта. Предпочтительно, чтобы растение пшеницы по настоящему изобретению давало урожай зерна не менее 80% по отношению к урожаю соответствующей разновидности дикого типа, более предпочтительно, не менее 90%, а еще более предпочтительно, не менее 95%, по сравнению с разновидностью дикого типа, имеющей приблизительно такой же генетический фон и выращенной в таких же условиях. Наиболее предпочтительно, чтобы урожай зерна растения пшеницы по настоящему изобретению был по меньшей мере таким же, как урожай растений пшеницы дикого типа, имеющих приблизительно такой же генетический фон и выращенных в таких же условиях. Урожай можно легко измерить в испытаниях, проводимых в регулируемых полевых условиях, или в испытаниях, проводимых в моделируемых полевых условиях, в теплице, предпочтительно, в поле. Отбор с помощью маркера является признанным способом отбора гетерозиготных растений, полученных при обратном скрещивании с рекуррентным родителем в классической селекционной программе. Популяция растений в каждом поколении обратного скрещивания будет гетерозиготной по интересующему гену(ам), обычно присутствующему в соотношении 1:1 в популяции обратного скрещивания, и молекулярный маркер можно применять для того, чтобы различить две аллели гена. Посредством извлечения ДНК, например, из молодых побегов и тестирования при помощи специфического маркера интрогрессированного желаемого признака, осуществляют ранний отбор растений для дальнейшего обратного скрещивания, в то время как энергию и ресурсы концентрируют на меньшем количестве растений. Такие процедуры, как скрещивание растений пшеницы, самоопыление растений пшеницы или отбор с помощью маркера, являются стандартными методиками и хорошо известны в данной области. Перенос аллелей от тетраплоидной пшеницы, например, пшеницы твердой, в гексаплоидную или другие формы гибридизации являются более трудным, но также известен в данной области. Для того, чтобы определить желаемую фенотипическую характеристику, растения пшеницы, которые содержат комбинацию мутантных аллелей SBEIIa и SBEIIb или другие желаемые гены, как правило, сравнивают с контрольными растениями. При оценке фенотипической характеристики, связанной с ферментативной активностью, например содержанием амилозы в крахмале зерна, подлежащие тестированию растения и контрольные растения выращивают в вегетационной камере, теплице, камере с открытым верхом и/или полевых условиях. Идентификация конкретного фенотипического признака и сравнение с контрольными образцами основано на обычном статистическом анализе и подсчете. Статистические различия между линиями растений можно оценить путем сравнения ферментативной активности между линиями растений в пределах каждого типа ткани, экспрессирующей фермент. Экспрессию и активность сравнивают с параметрами роста, развития и урожая, которые включают морфологию части растения, цвет, количество, размер, габариты, сухую и влажную массу, созревание, соотношения надземной и подземной биомассы, а также сроки, темпы и продолжительность различных стадий роста во время старения, в том числе вегетативного роста, плодоношения, цветения, а также содержание растворимых углеводов, в том числе уровни сахарозы, глюкозы, фруктозы и крахмала, а также уровень эндогенного крахмала. Предпочтительно, растения пшеницы настоящего изобретения отличаются от растений дикого типа по одному или нескольким из этих параметров менее чем на 50%, более предпочтительно менее чем на 40%, менее чем на 30%, менее чем на 20%, менее чем на 15%, менее чем на 10%, менее чем на 5%, менее чем на 2% или менее чем на 1% при выращивании в таких же условиях. Применяемый в данном документе термин ʺсцепленныйʺ относится к маркерному локусу и второму локусу, которые расположены достаточно близко на хромосоме, так что они будут наследоваться вместе в более чем 50% мейоза, например, не случайным образом. Это определение включает ситуацию, когда маркерный локус и второй локус формируют часть одного и того же гена. Кроме того, это определение включает ситуацию, когда маркерный локус содержит полиморфизм, ответственный за интересуемый признак (другими словами, маркерный локус непосредственно ʺсцепленʺ в фенотипе). Применяемый в данном документе термин ʺгенетически сцепленныйʺ является более узким и применяется только в отношении того случая, когда маркерный локус и второй локус находятся достаточно близко на хромосоме, так что они будут наследоваться вместе в более чем 50% мейоза. Таким образом, процент рекомбинации, наблюдаемый между локусам за поколение (сантиморганы (сМ)), будет составлять менее 50. В конкретных вариантах осуществления настоящего изобретения генетически сцепленные локусы могут быть на расстоянии 45, 35, 25, 15, 10, 5, 4, 3, 2 или 1 или менее сМ друг от друга на хромосоме. Предпочтительно, маркеры находятся менее 5 сМ или 2 сМ друг от друга и, наиболее предпочтительно, приблизительно 0 сМ друг от друга. Как описано в примере 5 в данном документе, гены SBEIIa и SBEIIb генетически сцеплены на длинном плече хромосомы 2 каждого из геномов пшеницы, находясь приблизительно на 0,5 сМ друг от друга, что соответствует примерно 100-200 т.н. в физическом расстоянии. Как используют в данном документе, термин ʺдругие генетические маркерыʺ может представлять собой любые молекулы, которые сцеплены по желаемому признаку в растениях пшеницы настоящего изобретения. Такие маркеры хорошо известны специалистам в данной области и включают молекулярные маркеры, сцепленные с генами, определяющими такие признаки, как устойчивость к заболеваниям, урожайность, морфология растения, качество зерна, другие признаки состояния покоя, например, цвет зерна, содержание гибберелловой кислоты в семенах, высота растений, цвет муки и т.п. Примерами таких генов являются гены резистентности к стеблевой ржавчине Sr2 или Sr38, гены резистентности к желтой ржавчине злаков YrlO или Yrl7, гены резистентности к нематодам, например Cre1 и Cre3, аллели в глютениновых локусах, которые определяют прочность теста, например, аллели Ax, Bx, Dx, Ay, By и Dy, гены Rht, которые определяют полукарликовый характер роста и, следовательно, устойчивость к полеганию (Eagles и соавт., 2001; Langridge и соавт., 2001; Sharp и соавт., 2001). Растения пшеницы, части растения пшеницы и продукты из них по настоящему изобретению являются, предпочтительно, нетрансгенными по генам, которые ингибируют экспрессию SBEIIa, т.е. они не содержат трансген, кодирующий молекулу РНК, которая уменьшает экспрессию эндогенных генов SBEIIa, хотя в данном варианте осуществления они могут содержать другие трансгены, например, гены устойчивости к гербицидам. Более предпочтительно, растения пшеницы, части растения пшеницы и продукты из них являются нетрансгенными, т.е. они не содержат никакого трансгена, что является предпочтительным на некоторых рынках. Подобные продукты также описаны в данном документе как ʺнетрансформированныеʺ продукты. Такие нетрансгенные растения и зерно содержат множественные мутантные аллели SBEII, как описано в данном документе, например, как таковые, которые получают после мутагенеза. Как используют в данном документе термины ʺтрансгенное растениеʺ и ʺтрансгенное растение пшеницыʺ относятся к растению, которое содержит генный конструкт (ʺтрансгенʺ), не обнаруженный в растении дикого типа одного и того же вида, разновидности или сорта. То есть трансгенные растения (трансформированные растения) содержат генетический материал, который они не содержали до трансформирования. ʺТрансгенʺ, упоминаемый в данном документе, имеет стандартное значение в области биотехнологии и относится к генетической последовательности, которую получили или изменили с помощью технологии рекомбинантных ДНК или РНК и которую ввели в клетку растения. Трансген может включать генетические последовательности, полученные или происходящие из растительной клетки или другой растительной клетки, или нерастительного источника, или синтетической последовательности. Как правило, трансген вводят в растение с помощью манипуляций, применяемых для человека, например, трансформации, но специалист в данной области может применять любой очевидный способ. Генетический материал, как правило, стабильно интегрируют в геном растения. Введенный генетический материал может содержать последовательности, которые встречаются в природе у тех же видов, но в переставленном порядке или в виде различного расположения элементов, например антисмысловой последовательности. Растения, содержащие такие последовательности, в данном документе включены в ʺтрансгенные растенияʺ. Трансгенные растения, как определено в данном документе, включают все потомство начально трансформированного и регенерированного растения (растение ТО), которое генетически модифицировали с помощью рекомбинантных техник, и у которого потомство содержит трансген. Такое потомство можно получить путем самоопыления первичного трансгенного растения или путем скрещивания таких растений с другим растением того же вида. В одном варианте осуществления трансгенные растения являются гомозиготными в отношении каждого гена и по каждому гену, который вводили (трансген), таким образом их потомство не разделяют по желаемому фенотипу. Части трансгенных растений включают все части и клетки указанных растений, которые содержат трансген, например, семена, ткани культуры, каллус и протопласты. ʺНетрансгенное растениеʺ, предпочтительно, нетрансгенное растение пшеницы, является таким, которое не было генетически модифицировано путем введения генетического материала с помощью техник рекомбинантных ДНК. Как используют в данном документе, термин ʺсоответствующее нетрансгенное растениеʺ относится к растению, которое является аналогичным или подобным в большинстве характеристик, предпочтительно изогенным или почти изогенным по отношению к трансгенному растению, но без интересующего трансгена. Предпочтительно, соответствующее нетрансгенное растение того же сорта или разновидности, как и предшественник интересующего трансгенного растения, или линии дочернего растения, у которой отсутствует конструкт, часто называют ʺсегрегантомʺ, или растение того же сорта или разновидности, трансформированного конструкцией ʺпустого векторʺ, и может быть нетрансгенным растением. Как используют в данном документе, термин ʺдикий типʺ относится к клетке, ткани или растению, которое не было модифицировано, согласно настоящему изобретению. Клетки, ткани или растения дикого типа, известные в данной области, могут быть использованы в качестве контрольных образцов для сравнения уровня экспрессии экзогенной нуклеиновой кислоты или степени и характера модификации признака с клетками, тканями или растениями, модифицированными, как описано в данном документе. Как используют в данном документе, термин ʺзерно пшеницы дикого типаʺ означает соответствующее немутагенизированное, нетрансгенное зерно пшеницы. Как используют в данном документе, определенные зерна пшеницы дикого типа включают, но без ограничений, Sunstate и Cadoux. Можно применять любой из способов, для определения наличия трансгена в трансформированном растении. Так, например, полимеразную цепную реакцию (ПЦР) можно применять для амплификации последовательностей, которые являются уникальными для трансформированного растения, с обнаружением амплифицированных продуктов при помощи гель-электрофореза или других способов. ДНК можно экстрагировать из растений с помощью традиционных способов и ПЦР, проводимой с применением праймеров, которые будут отличать трансформированные и нетрансформированные растения. Альтернативным способом для подтверждения положительного трансформанта является гибридизация с использованием Саузерн-блоттинга хорошо известная в данной области техники. Трансформируемые растения пшеницы также можно идентифицировать, т.е. отличить от нетрансформированных или растений пшеницы дикого типа по их фенотипу, например, по наличию селектируемого гена-маркера, либо с помощью иммунологического анализа, который обнаруживает или определяет количественно экспрессию фермента, кодируемого трансгеном, или любому другому фенотипу с помощью трансгена. Растения пшеницы настоящего изобретения можно выращивать и собирать их зерно, главным образом, для применения в качестве продукта питания для употребления человеком или в качестве корма для животных, или для ферментации, или для промышленного производства сырья, например, производства этанола, среди прочих применений. В качестве альтернативы, растения пшеницы можно использовать непосредственно в качестве корма. Растение настоящего изобретения, предпочтительно, полезно в производстве пищевых продуктов и, в частности, для промышленного производства пищевых продуктов. Такое производство продуктов питания может включать изготовление муки, теста, семолины или других продуктов из зерна, которые могут быть ингредиентом в промышленном производстве продуктов питания. Как используют в данном документе, термин ʺзерноʺ в целом относится к зрелому, собранному зерну растения, но также может относиться к зерну после набухания или прорастания, в соответствии с контекстом. Зрелое зерно злаков, таких как пшеница, обычно имеет содержание влаги менее чем около 18-20%. Как используют в данном документе, термин ʺсемяʺ включает собранные семена, но также включает семена, которые развиваются в растении после цветения, и зрелые семена, находящиеся в растении до урожая. Как используют в данном документе, ʺпрорастаниеʺ относится к появлению кончика корня из семенной оболочки после набухания. ʺЭнергия прорастанияʺ относится к проценту семян в популяции, которые проросли за период времени, например, 7 или 10 дней после набухания. Энергию прорастания можно рассчитать, применяя методики известные в данной области техники. Например, популяцию семян можно оценивать ежедневно за несколько дней, чтобы определить прорастание в течение длительного времени. В отношении зерна настоящего изобретения, как используют в данном документе, термин ʺэнергия прорастания, которая в сущности такая жеʺ означает, что энергия прорастания зерна составляет по меньшей мере 90%, что соответствует зерну дикого типа. Крахмал легко выделяют из зерна пшеницы, применяя стандартные способы, например, способ Schulman и KaмMiovirta, 1991. В промышленном масштабе можно применять мокрый или сухой помол. Размер гранулы крахмала играет важную роль в промышленной обработке крахмала, где происходит разделение более крупных гранул А от более мелких гранул В. Пшеница дикого типа, выращенная в промышленных масштабах, имеет содержание крахмала в зерне, которое как правило находится в пределах 55-65%, в зависимости от выращенного сорта. Для сравнения, семена или зерно настоящего изобретения имеет содержание крахмала по меньшей мере 90% по отношению к содержанию в зерне дикого типа, и предпочтительно по меньшей мере 93%, по меньшей мере 95% или по меньшей мере 98% по сравнению с содержанием крахмала в зерне дикого типа, если растения выращивают в тех же условиях. В других вариантах осуществления содержание крахмала в зерне составляет по меньшей мере приблизительно 25%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 45%, или по меньшей мере от приблизительно 55% до приблизительно 65% в виде процента от веса зерна (вес/вес). Другие желаемые характеристики включают способность к измельчению зерна, в частности твердость зерна. Другим аспектом, который может сделать растение пшеницы высоко ценным, является степень экстракции крахмала из зерна, причем более высокий уровень экстракции является более полезным. Форма зерна является еще одним признаком, который может оказывать влияние на промышленную применимость растения, таким образом, форма зерна может оказывать влияние на легкость или другое качество, с которой зерно можно измельчить. В другом аспекте настоящее изобретение предлагает гранулы крахмала или крахмал, полученные из зерна растения, как описано выше, имеющие повышенное содержание амилозы и пониженное содержание амилопектина. Очищенный крахмал можно получить из зерна с помощью процесса измельчения, например, процесса влажного измельчения, который включает в себя отделение крахмала от белка, масла и волокна. Исходным сырьем процесса измельчения является смесь или композиция гранул крахмала, поэтому настоящее изобретение включает такие гранулы. Гранулы крахмала пшеницы ассоциированы с гранулами белки крахмала, в том числе GBSS, SBEIIa и SBEIIb среди других белков, и, следовательно, присутствие данных белков отличает крахмальные гранулы пшеницы от крахмальных гранул других злаков. Крахмал из гранул крахмала можно очистить при помощи удаления белков после разрушения и диспергирования белков гранул крахмала при помощи тепловой и/или химической обработки. Гранулы крахмала зерна пшеницы настоящего изобретения при исследовании под световым микроскопом, как правило, деформированы по форме и морфологии поверхности, как проиллюстрировано в данном документе, особенно в зерне пшеницы, имеющем содержание амилозы по меньшей мере 50% в виде процента от общего содержания крахмала зерна. В варианте осуществления по меньшей мере 50%, предпочтительно, по меньшей мере 60% или по меньшей мере 70% гранул крахмала, полученных из зерна, демонстрируют деформированную форму или морфологию поверхности. Гранулы крахмала также демонстрируют потерю двойного лучепреломления при исследовании в поляризованном свете. Крахмал зерна, крахмал гранул крахмала и очищенный крахмал настоящего изобретения можно дополнительно охарактеризовать одним или несколькими из следующих свойств: (i) по меньшей мере 50% (вес/вес), или по меньшей мере 60% (вес/вес), или по меньшей мере 67% (вес/вес) амилозы в виде доли от общего содержания крахмала; (ii) модифицированный объем набухания; (iii) модифицированное распределение длины цепи и/или частота ветвления; (iv) модифицированная температура клейстеризации; (v) модифицированная вязкость (максимальная вязкость, температура образования клейстера и т.д.); (vi) модифицированная молекулярная масса амилопектина и/или амилозы; (vii) модифицированная % кристалличность; (viii) содержащий по меньшей мере 2% резистентного крахмала и/или; (ix) имеет низкий относительный гликемический индекс (GI). Крахмал также можно охарактеризовать по его объему набухания в избытке нагретой воды по сравнению с крахмалом из дикого типа. Объем набухания обычно измеряют путем смешивания крахмала или муки с избытком воды и нагреванием до повышенных температур, как правило, более 90°С. Образец затем собирают при помощью центрифугирования и объем набухания выражают в виде массы осажденного материала, деленной на сухой вес образца. Низкая характеристика набухания полезна, когда желательно увеличить содержание крахмала для приготовления пищи, в частности приготовления гидратированной пищи. Одним из способов измерений измененной структуры амилопектина является распределение длин цепи или степень полимеризации крахмала. Распределения длин цепи можно определить при помощи электрофореза углеводов с применением флуорофора (FACE) после деветвления изоамилазой. Амилопектин крахмала настоящего изобретения может иметь распределение длины цепи в интервале от 5 до 60, что превышает значения, полученные для распределения крахмала растений дикого типа при деветвлении. Крахмал с более длинной цепью также будет иметь соответствующее уменьшение частоты ветвления. Таким образом, в крахмале также может быть распределение больших длин цепей амилопектина при все еще присутствующем амилопектине. Амилопектин зерна может отличаться тем, что содержит уменьшенное долю фракции с длиной цепи при степени полимеризации 4-12 по отношению к амилопектину зерна дикого типа, как измеряли после деветвления изоамилазой амилопектина. В другом аспекте настоящего изобретения крахмал пшеницы может иметь измененную температуру клейстеризации, которую можно легко измерить с помощью дифференциальной сканирующей калориметрии (DSC). Клейстеризация представляет собой стимулируемое теплом разрушение (распад) молекулярного порядка внутри гранулы крахмала в избытке воды с сопутствующими и необратимыми изменениями свойств, таких как гранулярное набухание, плавление кристаллита, потеря двойного лучепреломления, увеличение вязкости и растворимости крахмала. Температура клейстеризации может быть увеличена или уменьшена по сравнению с крахмалом растений дикого типа, в зависимости от длины цепи остаточного амилопектина. Высокоамилозный крахмал, полученный из мутантов по удлинителю амилозы (ае) маиса, показал более высокую температуру клейстеризации, чем крахмал нормального маиса (Fuwa и соавт., 1999; Krueger и соавт., 1987). С другой стороны, крахмал, полученный из мутантов sex6 ячменя, у которых отсутствует активность крахмалсинтазы IIа, имеет более низкие температуры клейстеризации, а энтальпия для пика клейстеризации является более низкой по сравнению с таковой у контрольных растений (Morell и соавт., 2003). Температура клейстеризации, в частности, температура начала первого пика или температура на вершине первого пика, может быть повышена по меньшей мере на 3°С, предпочтительно по меньшей мере на 5°С или более предпочтительно по меньшей мере на 7°С, как измеряли при помощи DSC в сравнении с крахмалом, экстрагированным из аналогичного, но неизмененного зерна. Крахмал может содержать повышенный уровень резистентного крахмала с измененной структурой, на которую указывают конкретные физические свойства, включая одну или несколько групп, состоящих из физической недоступности для пищеварительных ферментов, причиной которой может быть измененная морфология гранул крахмала, наличия выявляемого липида, связывающего крахмал, измененной кристалличности и измененного распределения длины цепи амилопектина. Высокое содержание амилозы также способствует повышению уровня резистентного крахмала. Структура крахмала пшеницы настоящего изобретения может также отличаться тем, что степень кристалличности уменьшена по сравнению с обычным крахмалом, полученным из пшеницы. Также считают, что уменьшенная кристалличность крахмала связана с повышением органолептических свойств и способствует более однородному вкусовому ощущению Таким образом, крахмал может дополнительно проявлять пониженную степень кристалличности в результате пониженного уровня активности одного или нескольких ферментов синтеза амилопектина. Кристалличность, как правило, исследуют методом рентгеноструктурного анализа. В некоторых вариантах осуществления данный крахмал обеспечивает модифицированные ферментативные свойства, как, например, повышенная резистентность крахмала, в том числе от 1% до 20%, от 2% до 18%, от 3% до 18% или от 5% до 15% резистентного крахмала и пониженный гликемический индекс (GI). Настоящее изобретение также предоставляет муку, муку крупного помола или другие продукты, полученные из зерна. Они могут быть необработанными или обработанными, например, путем фракционирования или отбеливания. Настоящее изобретение также предоставляет крахмал из зерна представленных в качестве примера растений пшеницы, содержащий повышенные количества пищевого волокна, предпочтительно в сочетании с повышенным уровнем резистентного крахмала. Это повышение также по меньшей мере частично является результатом высокого относительного уровня амилозы. Применяемый в данном документе термин ʺпищевое волокноʺ включает углевод и продукты расщепления углевода, которые не всасываются в тонком кишечнике здоровых людей, а попадают в толстый кишечник. Они включают резистентный крахмал и другие растворимые и нерастворимые углеводные полимеры. При этом предполагается, что часть углеводов являются сбраживаемыми, по меньшей мере частично, в толстом кишечнике присутствующей в нем микрофлорой. Крахмал по настоящему изобретению содержит относительно высокие уровни пищевого волокна, более конкретно, амилозы. Содержание пищевого волокна в зерне по настоящему изобретению по меньшей мере частично является результатом повышенного содержания амилозы в крахмале зерна, а также или в сочетании с повышенным содержанием резистентного крахмала в виде процента от общего крахмала. Применяемый в данном документе термин ʺрезистентный крахмалʺ определяется как совокупность крахмала и продуктов расщепления крахмала, не всасываемых в тонком кишечнике здоровых людей, а попадающих в толстый кишечник. В зависимости от контекста они определяются в виде процента от общего крахмала зерна или процента от общего содержания крахмала в пище. Таким образом, резистентный крахмал не включает продукты, которые расщепляются и всасываются в тонком кишечнике. Резистентные крахмалы включают физически недоступный крахмал (форма RS1), гранулы резистентного нативного крахмала (RS2), крахмалы, подвергнутые ретроградации (RS3) и химически модифицированные крахмалы (RS4). Измененная структура крахмала и, в частности, высокие уровни амилозы в крахмале по настоящему изобретению приводят к повышению уровня резистентного крахмала, употребляемого в пищу. Этот крахмал может быть в форме RS 1, которая в некоторой степени является недоступной для расщепления. Связь крахмал-липид, оцениваемая по кристалличности V-комплекса, вероятно, также вносит вклад в уровень резистентного крахмала. В то время как настоящее изобретение может быть особенно полезным при лечении или профилактике заболеваний у людей, следует понимать, что настоящее изобретение также является применимым к отличающимся от человека субъектам, в том числе без ограничения сельскохозяйственным животным, например, коровам, овцам, свиньям и т.п., домашним животным, например, собакам или кошкам, лабораторным животным, например, кроликам или грызунам, таким как мыши, крысы, хомяки, или животным, которых можно использовать для спортивных целей, таким как лошади. В частности, способ может быть применимым к нежвачным млекопитающим или таким животным, как млекопитающие с однокамерным желудком. Настоящее изобретение также может быть применимым к другим сельскохозяйственным животным, например, домашней птице, в том числе, например, курам, гусям, уткам, индейкам или перепелам, или рыбе. Способ лечения субъекта, в частности людей, может включать стадию введения измененного зерна пшеницы, муки, крахмала или пищевого продукта или напитка, определенных в данном документе, субъекту, в одной или нескольких дозах, в количестве и в течение периода времени, в результате чего улучшается уровень одного или нескольких показателей здоровья кишечника или метаболических показателей. Показатель может меняться в зависимости от потребления неизмененного пшеничного крахмала или пшеницы, или продукта из них в течение периода времени нескольких часов, как в случае с некоторыми из показателей, такими как значение рН, повышение уровней SCFA, колебание уровня глюкозы после приема пищи, или это может занять несколько дней, например, в случае увеличения фекальной массы или улучшения перистальтике кишечника, или, возможно, больше времени, порядка недель или месяцев, например, в случае, когда измеряют усиление пролиферации нормальных колоноцитов при помощи бутирата. Может быть желательным введение измененного крахмала или пшеницы, или пшеничного продукта на протяжении всей жизни. Однако есть хорошие перспективы в отношении комплаентности индивида, который подвергается лечению, учитывая относительную легкость, с которой можно вводить измененный крахмал. Дозы можно варьировать в зависимости от состояния, подлежащего лечению или предупреждению, но для людей предусматривается по меньшей мере 1 г зерна или крахмала пшеницы по настоящему изобретению в день, более предпочтительно, по меньшей мере 2 г в день, предпочтительно, по меньшей мере 10 или по меньшей мере 20 г в день. Для введения более чем приблизительно 100 грамм в день могут требоваться значительные объемы доставки и при этом снижается комплаентность. Наиболее предпочтительно, доза для человека составляет от 5 до 60 г зерна или крахмала пшеницы в день, или для взрослых - от 5 до 100 г в день. Гликемический индекс (GI) имеет отношение к скорости расщепления продуктов питания, содержащих крахмал, и является сравнением влияния тестируемого продукта питания с влиянием белого хлеба или глюкозы на колебания концентрации глюкозы в крови. Гликемический индекс является мерой возможного влияния изучаемого продукта питания на концентрацию глюкозы в сыворотке крови после приема пищи и потребности в инсулине для обеспечения гомеостаза глюкозы в крови. Одной важной характеристикой, обеспечиваемой продуктами питания по настоящему изобретению, является сниженное значение гликемического индекса. Уровень глюкозы в сыворотке крови у людей-добровольцев понизился через 30 мин после приема высокоамилозных продуктов из пшеницы по сравнению с пшеницей с низким содержанием амилозы (Goddard и соавт., 1984). Кроме того, эти продукты питания могут иметь низкий уровень конечного расщепления, а следовательно, быть относительно низкокалорийными. Низкокалорийный продукт может быть на основе включения муки, полученной из молотого зерна пшеницы. Такие продукты питания могут давать ощущение сытости, улучшают здоровье кишечника, снижают концентрацию глюкозы и липидов в сыворотке крови после приема пищи, а также обеспечивать низкокалорийные пищевые продукты. Показатели улучшения здоровья кишечника могут без ограничения включать i) пониженное значение рН содержимого кишечника, ii) увеличенную общую концентрацию SCFA или общее количество SCFA содержимого кишечника, iii) увеличенную концентрацию или количество одной или нескольких SCFA содержимого кишечника, iv) увеличенную фекальную массу, v) увеличение общего объема воды в кишечнике или фекалиях без диареи, vi) увеличенную перистальтику кишечника, vii) увеличение количества или активности одного или нескольких видов пробиотических бактерий, viii) увеличение экскреции желчных кислот с фекалиями, ix) уменьшенный уровень гнилостных продуктов в моче, х) уменьшенный уровень гнилостных продуктов в фекалиях, xi) увеличенную пролиферацию нормальных колоноцитов, xii) уменьшенное воспаление в кишечнике индивида с воспаленным кишечником, xiii) уменьшенные уровни любого из мочевины, креатинина и фосфата в фекалиях или в толстом кишечнике у пациентов с уремией, а также xiv) любое сочетание вышеупомянутого. Показатели улучшенного метаболического здоровья могут без ограничения включать i) стабилизацию колебания глюкозы после приема пищи, ii) улучшенную (пониженную) гликемическую реакцию, iii) сниженную концентрацию инсулина в плазме до приема пищи, iv) улучшенный липидный профиль крови, v) понижение LDL холестерина в плазме, vi) уменьшенные уровни любого из мочевины, креатинина и фосфата в плазме у пациентов с уремией, vii) улучшение дисгликемической реакции или viii) любое сочетание вышеупомянутого. Понятно, что одним из преимуществ настоящего изобретения является то, что оно предоставляет продукты, такие как хлеб, которые имеют особую питательную ценность, и, кроме того, это осуществляется без необходимости модифицировать крахмал или другие составляющие зерна пшеницы после сбора урожая. Однако может быть желательно осуществить модификацию крахмала или другой составляющей зерна, и при этом настоящее изобретение охватывает такую модифицированную составляющую. Способы модификации хорошо известны и включают экстракцию крахмала или другой составляющей с помощью обычных способов и модификацию крахмалов для увеличения уровня резистентной формы. Крахмал можно модифицировать путем обработки теплом и/или влагой, физически (например, размолом на шаровой мельнице), ферментативно (с применением, например, α- или β-амилазы, пуллуланазы или т.п.), химическим гидролизом (влажным или сухим с применением жидких или газообразных реагентов), окислением, образованием поперечных связей с бифункциональными реагентами (например, триметафосфатом натрия, оксихлоридом фосфора) или карбоксиметилированием. Крахмал пшеницы по настоящему изобретению будет являться подходящим субстратом для ферментации для получения этанола (биотоплива) или содержащих этанол напитков, и при этом зерно пшеницы или крахмал пшеницы применяется для получения других продуктов ферментации, например, продуктов питания, биологически активных добавок (нерастворимого или растворимого волокна), ферментов и промышленных материалов. Способы ферментации с применением крахмала растительного происхождения хорошо известны специалистам в данной области техники, причем разработаны способы для получения различных продуктов ферментации (смотри, например, Vogel и соавт., 1996 и приведенные в нем ссылки). В одном варианте осуществления углеводы крахмала можно экстрагировать путем дробления частей растения пшеницы по настоящему изобретению, например, зерна, либо путем диффузии из тканей растения в воду или другой подходящий растворитель. Ткани пшеницы или крахмал по настоящему изобретению можно применять непосредственно в качестве субстрата для ферментации или биоконверсии в периодическом, непрерывном или процессе с иммобилизованными клетками. Термины ʺполипептидʺ и ʺбелокʺ, как правило, применяются в данном документе взаимозаменяемо. Применяемые в данном документе термины ʺбелкиʺ и ʺполипептидыʺ также включают варианты, мутанты, модификации и/или производные полипептидов по настоящему изобретению, как описано в данном документе. Применяемый в данном документе термин ʺсущественно очищенный полипептидʺ имеет отношение к полипептиду, который отделили от липидов, нуклеиновых кислот, других пептидов и других молекул, с которыми он связан в естественном состоянии. Предпочтительно, по меньшей мере 60% существенно очищенного полипептида является свободным, более предпочтительно, по меньшей мере 75% является свободным и, более предпочтительно, по меньшей мере 90% является свободным от других компонентов, с которыми он связан в естественных условиях. Под ʺрекомбинантным полипептидомʺ подразумевается полипептид, полученный с применением рекомбинантных методик, т.е. посредством экспрессии рекомбинантного полинуклеотида в клетке, предпочтительно в растительной клетке и более предпочтительно в клетке пшеницы. В одном варианте осуществления полипептид обладает крахмал-ветвящей ферментативной активностью, в частности активностью SBEII, и по меньшей мере на 90% идентичен SBEII, описанному в данном документе. Применяемый в данном документе термин ʺбиологически активныйʺ фрагмент представляет собой часть полипептида по настоящему изобретению, которая поддерживает определенную активность полипептида полной длины. В особенно предпочтительном варианте осуществления биологически активный фрагмент обладает крахмал-ветвящей ферментативной активностью. Биологически активные фрагменты могут быть любого размера, при условии, что они поддерживают определенную активность, но предпочтительно имеют длину по меньшей мере 700 или 800 аминокислотных остатков. % идентичности полипептида по отношению к другому полипептиду можно определить с помощью анализа GAP (Needleman и Wunsch, 1970) (программа GCG) со штрафом за открытие гэпа =5 и штрафом за продолжение гэпа =0,3. Искомая последовательность составляет в длину по меньшей мере 50 аминокислот, а при помощи анализа GAP осуществляется выравнивание двух последовательностей на протяжении участка, содержащего по меньшей мере 50 аминокислот. Более предпочтительно, искомая последовательность составляет в длину по меньшей мере 100 аминокислот, а при помощи анализа GAP осуществляется выравнивание двух последовательностей на протяжении участка, содержащего по меньшей мере 100 аминокислот. Еще более предпочтительно, искомая последовательность составляет в длину по меньшей мере 250 аминокислот, а при помощи анализа GAP осуществляется выравнивание двух последовательностей на протяжении участка, содержащего по меньшей мере 250 аминокислот. Наиболее предпочтительно, осуществляется выравнивание аминокислотных последовательностей полной длины двух полипептидов SBEII. Что касается определенного полипептида, следует понимать, что более высокие значения % идентичности, чем те, которые приведены выше, будут охватывать предпочтительные варианты осуществления. Таким образом, если применимо, с учетом минимальных значений % идентичности, предпочтительно, когда полипептид содержит аминокислотную последовательность, которая по меньшей мере на 75%, более предпочтительно, по меньшей мере на 80%, более предпочтительно, по меньшей мере на 85%, более предпочтительно, по меньшей мере на 90%, более предпочтительно, по меньшей мере на 91%, более предпочтительно, по меньшей мере на 92%, более предпочтительно, по меньшей мере на 93%, более предпочтительно, по меньшей мере на 94%, более предпочтительно, по меньшей мере на 95%, более предпочтительно, по меньшей мере на 96%, более предпочтительно, по меньшей мере на 97%, более предпочтительно, по меньшей мере на 98%, более предпочтительно, по меньшей мере на 99%, более предпочтительно, по меньшей мере на 99,1%, более предпочтительно, по меньшей мере на 99,2%, более предпочтительно, по меньшей мере на 99,3%, более предпочтительно, по меньшей мере на 99,4%, более предпочтительно, по меньшей мере на 99,5%, более предпочтительно, по меньшей мере на 99,6%, более предпочтительно, по меньшей мере на 99,7%, более предпочтительно, по меньшей мере на 99,8% и, еще более предпочтительно, по меньшей мере на 99,9% идентична соответствующей предложенной SEQ ID NO. Аминокислотные последовательности мутантов полипептидов по настоящему изобретению можно получить с помощью введения соответствующих нуклеотидных замен в нуклеиновую кислоту по настоящему изобретению или путем мутагенеза in vivo, например, путем обработки химическими веществами или излучением. Такие мутанты включают, например, делеции, вставки или замены остатков в пределах аминокислотной последовательности. Полинуклеотиды по настоящему изобретению можно подвергать методикам перестановки в ДНК, как описано в Harayama, 1998, или другим способам in vitro для получения измененных полинуклеотидов, которые кодируют варианты полипептидов. В таких методиках перестановки в ДНК могут использоваться генетические последовательности, родственные последовательностям по настоящему изобретению, например, гены SBE из других видов растений, помимо пшеницы. Продукты, полученные из мутированных/измененных ДНК, можно легко подвергнуть скринингу с применением методик, описанных в данном документе, для определения того, обладают ли они, например, активностью SBE. Делеции в аминокислотной последовательности обычно находятся в диапазоне от приблизительно 1 до 15 остатков, более предпочтительно, от приблизительно 1 до 10 остатков и обычно от приблизительно 1 до 5 смежных остатков. У мутантов с заменой удален по меньшей мере один аминокислотный остаток в полипептидной молекуле, а вместо него вставлен другой остаток. Сайты, представляющие наибольший интерес для мутагенеза посредством замены, включают сайты, определенные как активный(ые) сайт(ы). Другими представляющими интерес сайтами являются те, в которых определенные остатки, полученные из различных штаммов или видов, являются идентичными, т.е. консервативные аминокислоты. Эти положения могут быть важными для биологической активности. Предпочтительно, осуществляют замену этих аминокислот, в особенности тех, которые находятся в пределах непрерывной последовательности по меньшей мере из трех других одинаково консервативных аминокислот, относительно консервативным образом для того, чтобы сохранить функцию, например, активность SBEII. Такие консервативные замены приведены в таблице 1 под заголовком ʺиллюстративные заменыʺ. ʺНеконсервативные аминокислотные заменыʺ определены в данном документе как замены помимо тех, которые перечислены в таблице 3 (иллюстративные консервативные замены). Ожидается, что неконсервативные замены в SBE11 снижают активность фермента, и многие будут соответствовать SBEII, кодируемому ʺмутантным геном SBEII с частичной потерей функцииʺ. В объем настоящего изобретения также включены полипептиды по настоящему изобретению, которые дифференциально модифицированы во время или после синтеза, например, путем фосфорилирования, как было показано для SBEI, SBEIIa и SBEIIb в амилопластах пшеницы (Tetlow и соавт., 2004). Такие модификации могут служить для регуляции активности фермента, например, путем регуляции образования белковых комплексов в амилопластах во время синтеза крахмала (Tetlow и соавт., 2004), или для увеличения стабильности и/или биологической активности полипептида по настоящему изобретению, или для того, чтобы выступать в качестве лиганда для связывания другой молекулы. В некоторых вариантах осуществления настоящее изобретение включает модификацию активности гена, в частности активности гена SBEII, комбинации мутантных генов, а также конструирование и использование химерных генов. Применяемый в данном документе термин ʺгенʺ включает любую дезоксирибонуклеотидную последовательность, которая включает участок, кодирующий белок, или которая транскрибируется, но не транслируется в клетке, вместе со связанными некодирующими и регуляторными участками. Такие связанные участки, как правило, расположены рядом с кодирующим участком на обоих 5'- и 3'-концах на протяжении расстояния приблизительно 2 т.п.о. с каждой стороны. В связи с этим, ген включает управляющие сигнальные последовательности, такие как промоторы, энхансеры, сигнальные последовательности терминации транскрипции и/или полиаденилирования, которые в естественных условиях связаны с данным геном, или гетерологичные управляющие сигналы, в случае которых ген называется ʺхимерным геномʺ. Последовательности, которые расположены в направлении 5' от кодирующего белок участка и которые присутствуют в мРНК, называются 5'-нетранслируемыми последовательностями. Последовательности, которые расположены в направлении 3' от или дальше по ходу транскрипции от кодирующего белок участка и которые присутствуют в мРНК, называются 3'-нетранслируемыми последовательностями. Термин ʺгенʺ включает как форму кДНК, так и геномную форму гена. Термин ʺгенʺ включает как синтетические, так и гибридные молекулы, кодирующие белки по настоящему изобретению, описанные в данном документе. Гены обычно присутствуют в геноме пшеницы в виде двухцепочечной ДНК. Химерный ген можно ввести в соответствующий вектор для поддержания во внехромосомном состоянии в клетке или для интеграции в геном хозяина. Гены или генотипы обозначены в данном документе курсивом (например, SBEIId), в то время как белки, ферменты или фенотипы не обозначены курсивом (SBEIIa). Геномная форма или клон гена, содержащего кодирующий участок, может прерываться некодирующими последовательностями, называющимися ʺнитронамиʺ или ʺпромежуточными участкамиʺ, или ʺпромежуточными последовательностямиʺ. Применяемый в данном документе термин ʺинтронʺ относится к сегменту гена, который транскрибируется как часть первичного РНК-транскрипта, но не присутствует в зрелой молекуле мРНК. Интроны удаляются или ʺвырезаютсяʺ из ядерного или первичного транскрипта; поэтому интроны отсутствуют в матричной РНК (мРНК). Интроны могут содержать регуляторные элементы, например энхансеры. Применяемый в данном документе термин ʺэкзоныʺ относится к участкам ДНК, соответствующим последовательностям РНК, которые присутствуют в зрелой мРНК или в зрелой молекуле РНК в случаях, когда молекула РНК является нетранслируемой. В ходе трансляции мРНК функционирует для определения последовательности или порядка аминокислот в образующемся полипептиде. Настоящее изобретение имеет отношение к различным полинуклеотидам. Применяемые в данном документе термины ʺполинуклеотидʺ, ʺнуклеиновая кислотаʺ или ʺмолекула нуклеиновой кислотыʺ означают полимер нуклеотидов, который может представлять собой ДНК или РНК, или их комбинацию, например, гетеродуплекс ДНК и РНК, и включает, например, мРНК, кРНК, кДНК, тРНК, siRNA, shRNA, hpRNA и одно- или двухцепочечную ДНК. Это может быть ДНК или РНК клеточного, геномного или синтетического происхождения, например, полученная в автоматизированном синтезаторе, и она может быть объединенной с углеводом, липидами, белком или другими материалами, меченой флуоресцентными или другими группами или прикрепленной к твердому носителю для выполнения конкретной функции, определенной в данном документе. Предпочтительно, полинуклеотид представляет собой только ДНК или только РНК, как это имеет место в клетке, и некоторые основания могут быть метилированы или модифицированы иным образом, как это имеет место в клетке пшеницы. Полимер может быть одноцепочечным, по сути двухцепочечным или частично двухцепочечным. Примером частично двухцепочечной молекулы РНК является шпилечная РНК (hpRNA), короткая шпилечная РНК (shRNA) или самокомплементарная РНК, которая включает двухцепочечный стержень, образованный спариванием оснований между нуклеотидной последовательностью и ее комплементом, а также петлевую последовательность, которая ковалентно присоединяется к нуклеотидной последовательности и ее комплементу. Применяемый в данном документе термин спаривание оснований относится к стандартному спариванию оснований между нуклеотидами, в том числе к парам оснований G:U в молекуле РНК. ʺКомплементарныйʺ означает два полинуклеотида, которые способны к спариванию оснований вдоль части их длины или вдоль полной длины одного или обоих. Под ʺвыделеннымʺ подразумевается материал, который является существенно или по сути свободным от компонентов, которые обычно дополняют его в естественном состоянии. Применяемые в данном документе термины ʺвыделенный полинуклеотидʺ или ʺвыделенная молекула нуклеиновой кислотыʺ означают полинуклеотид, который по меньшей мере частично отделен от, предпочтительно, существенно или по сути свободен от полинуклеотидной последовательности того же типа, с которой он связан или соединен в естественном состоянии. Например, ʺвыделенный полинуклеотидʺ включает полинуклеотид, который очистили или отделили от последовательностей, фланкирующих его во встречающемся в природе состоянии, например, фрагмент ДНК, который удалили из последовательностей, которые обычно примыкают к фрагменту. Предпочтительно, выделенный полинуклеотид также по меньшей мере на 90% свободен от других компонентов, таких как белки, углеводы, липиды и т.д. Применяемый в данном документе термин ʺрекомбинантный полинуклеотидʺ относится к полинуклеотиду, полученному in vitro посредством манипуляции с нуклеиновой кислотой, в форме, обычно не встречающейся в природе. Например, рекомбинантный полинуклеотид может быть в форме вектора экспрессии. Как правило, такие векторы экспрессии включают регулирующую транскрипцию и трансляцию нуклеиновую кислоту, функционально связанную с нуклеотидной последовательностью, транскрибируемой в клетке. Настоящее изобретение имеет отношение к применению олигонуклеотидов, которые могут быть применены в качестве ʺзондовʺ или ʺпраймеровʺ. Применяемый в данном документе термин ʺолигонуклеотидыʺ относится к полинуклеотидам длиной до 50 нуклеотидов. Они могут представлять собой РНК, ДНК или комбинациями, или производными того и другого. Олигонуклеотиды, как правило, являются относительно короткими одноцепочечными молекулами длиной от 10 до 30 нуклеотидов, обычно 15-25 нуклеотидов, как правило, состоящими из 10-30 или 15-25 нуклеотидов, которые идентичны или комплементарны части гена SBEIIa или SBEIIb или кДНК, соответствующей гену SBEIIa или SBEIIb. При применении в качестве зонда или праймера в реакции амплификации минимальным размером такого олигонуклеотида является размер, необходимый для образования стабильного гибрида между олигонуклеотидом и комплементарной последовательностью на целевой молекуле нуклеиновой кислоты. Предпочтительно, олигонуклеотиды составляют в длину по меньшей мере 15 нуклеотидов, более предпочтительно, по меньшей мере 18 нуклеотидов, более предпочтительно, по меньшей мере 19 нуклеотидов, более предпочтительно, по меньшей мере 20 нуклеотидов, еще более предпочтительно, по меньшей мере 25 нуклеотидов. Полинуклеотиды, применяемые в качестве зонда, как правило, конъюгированы с детектируемой меткой, например, радиоактивным изотопом, ферментом, биотином, флуоресцентной молекулой или хемилюминесцентной молекулой. Олигонуклеотиды и зонды по настоящему изобретению являются пригодными для способов обнаружения аллели SBEIIa, SBEIIb или другого гена, ассоциированного с представляющим интерес признаком, например, модифицированным крахмалом. В таких способах используется гибридизация нуклеиновых кислот, и во многих случаях они включают удлинение олигонуклеотидного праймера с помощью подходящей полимеразы, например, при применении в ПЦР для обнаружения или идентификации аллелей дикого типа или мутантных аллелей. Предпочтительные олигонуклеотиды и зонды гибридизируют с последовательностью гена SBEIIa или SBEIIb пшеницы, в том числе любой из последовательностей, раскрытых в данном документе, например, SEQ ID NO:36-149. Предпочтительными парами олигонуклеотидов являются те, которые охватывают один или несколько интронов, или часть интрона и, следовательно, могут применяться для амплификации последовательности интрона в реакции ПЦР. Многочисленные примеры приведены в Примерах в данном документе. Термины ʺвариант полинуклеотидаʺ и ʺвариантʺ и т.п. имеют отношение к полинуклеотидам, демонстрирующим значительную идентичность последовательности эталонной полинуклеотидной последовательности, и которые способны функционировать аналогичным образом или с такой же активностью, что и эталонная последовательность. Эти термины также охватывают полинуклеотиды, которые отличаются от эталонного полинуклеотида добавлением, делецией или заменой по меньшей мере одного нуклеотида, или которые имеют одну или несколько мутаций по сравнению со встречающимися в природе молекулами. Соответственно, термины ʺвариант полинуклеотидаʺ и ʺвариантʺ включают полинуклеотиды, в которых один или несколько нуклеотидов были добавлены или удалены, или заменены на различные нуклеотиды. В связи с этим, в данной области техники хорошо понятно, что определенные изменения, включающие мутации, добавления, делении и замены, можно осуществить применительно к эталонному полинуклеотиду, при этом измененный полинуклеотид сохраняет биологическую функцию или активность эталонного полинуклеотида. Соответственно, эти термины охватывают полинуклеотиды, которые кодируют полипептиды, проявляющие ферментативную или другую регуляторную активность, или полинуклеотиды, способные выступать в качестве селективных зондов или других средств для гибридизации. Термины ʺвариант полинуклеотидаʺ и ʺвариантʺ также включают встречающиеся в природе аллельные варианты. Мутанты могут быть как встречающимися в природе (то есть выделенными из природного источника), так и синтетическими (например, с помощью осуществления сайт-направленного мутагенеза нуклеиновой кислоты). Предпочтительно, вариант полинуклеотида по настоящему изобретению, который кодирует полипептид с ферментативной активностью, составляет в длину более 400, более предпочтительно, более 500, более предпочтительно, более 600, более предпочтительно, более 700, более предпочтительно, более 800, более предпочтительно, более 900 и, даже более предпочтительно, более 1000 нуклеотидов, вплоть до полной длины гена. Вариант олигонуклеотида по настоящему изобретению включает молекулы различных размеров, которые способны к гибридизации, например, с геномом пшеницы в положении, близком к положению конкретной молекулы олигонуклеотида, определенного в данном документе. Например, варианты могут включать дополнительные нуклеотиды (например, 1, 2, 3, 4 или более), или меньше нуклеотидов, при условии, что они все еще гибридизируются с целевым участком. Кроме того, несколько нуклеотидов можно заменить без влияния на способность олигонуклеотида к гибридизации с целевым участком. Кроме того, можно легко разработать варианты, которые гибридизируются близко (например, без ограничения в пределах 50 нуклеотидов) к участку генома растения, где гибридизируются конкретные олигонуклеотиды, определенные в данном документе. Под ʺсоответствуетʺ или ʺсоответствующийʺ, в контексте полинуклеотидов или полипептидов, подразумевается полинуклеотид, (а) имеющий нуклеотидную последовательность, которая по существу идентична или комплементарна всей или части эталонной полинуклеотидной последовательности или (б) кодирующий аминокислотную последовательность, идентичную аминокислотной последовательности в пептиде или белке. Эта фраза также включает в своем объеме пептид или полипептид, имеющий аминокислотную последовательность, которая по существу идентична последовательности аминокислот в эталонном пептиде или белке. Термины, применяемые для описания сходства последовательностей двух или более полинуклеотидов или полипептидов, включают ʺэталонную последовательностьʺ, ʺокно сравненияʺ, ʺидентичность последовательностейʺ, ʺпроцент идентичности последовательностейʺ, ʺзначительная идентичностьʺ и ʺидентичныйʺ, и при этом определяются в отношении определенного минимального числа нуклеотидов или аминокислотных остатков, или, предпочтительно, относительно всей длины. Применяемые в данном документе термины ʺидентичность последовательностейʺ и ʺидентичностьʺ являются взаимозаменяемыми при обозначении степени, в которой последовательности идентичны в зависимости от конкретного нуклеотида или в зависимости от конкретной аминокислоты в окне сравнения. Таким образом, ʺпроцент идентичности последовательностейʺ рассчитывается путем сравнения двух оптимально выровненных последовательностей в окне сравнения, при этом определяется число положений, в которых в обеих последовательностях встречается идентичное основание нуклеиновой кислоты (например, А, Т, С, G, U) или идентичный аминокислотный остаток (например, Ala, Pro, Ser, Thr, Gly, Val, Leu, He, Phe, Tyr, Trp, Lys, Arg, His, Asp, Glu, Asn, Gin, Cys и Met), для получения количества совпадающих положений, затем число совпадающих положений делится на общее число положений в окне сравнения (т.е. размер окна), а результат умножается на 100 для получения процента идентичности последовательностей. % идентичности полинуклеотида можно определить с помощью анализа GAP (Needleman и Wunsch, 1970) (программа GCG) со штрафом за открытие гэпа =5 и штрафом за продолжение гэпа =0,3. Если не указано иное, искомая последовательность составляет в длину по меньшей мере 45 нуклеотидов, а при помощи анализа GAP осуществляется выравнивание двух последовательностей на протяжении участка, содержащего по меньшей мере 45 нуклеотидов. Предпочтительно, искомая последовательность составляет в длину по меньшей мере 150 нуклеотидов, а при помощи анализа GAP осуществляется выравнивание двух последовательностей на протяжении участка, содержащего по меньшей мере 150 нуклеотидов. Более предпочтительно, искомая последовательность составляет в длину по меньшей мере 300 нуклеотидов, а при помощи анализа GAP осуществляется выравнивание двух последовательностей на протяжении участка, содержащего по меньшей мере 300 нуклеотидов или по меньшей мере 400, 500 или 600 нуклеотидов в каждом случае. Также можно сослаться на семейство программ BLAST, как раскрыто, например, Altschul и соавт, 1997. Детальное обсуждение анализа последовательности можно найти в разделе 19.3 Ausubel и соавт., 1994-1998, глава 15. Нуклеотидные или аминокислотные последовательности обозначают как ʺпо сути сходныеʺ, когда такие последовательности имеют идентичность последовательностей по меньшей мере приблизительно 95%, в частности, по меньшей мере приблизительно 98%, более конкретно, по меньшей мере приблизительно 98,5%, достаточно конкретно, приблизительно 99%, в особенности, приблизительно 99,5%, в большей степени в особенности, приблизительно 100%, или действительно в особенности, являются идентичными. Ясно, что если последовательности РНК описываются как по сути сходные или имеющие определенную степень идентичности последовательностей с последовательностями ДНК, то тимин (Т) в последовательности ДНК рассматривается как соответствующий урацилу (U) в последовательности РНК. В отношении определенных полинуклеотидов следует понимать, что более высокие значения % идентичности, чем те, которые приведены выше, будут охватывать предпочтительные варианты осуществления. Таким образом, если применимо, с учетом минимальных значений % идентичности, предпочтительно, когда полинуклеотид содержит полинуклеотидную последовательность, которая по меньшей мере на 75%, более предпочтительно, по меньшей мере на 80%, более предпочтительно, по меньшей мере на 85%, более предпочтительно, по меньшей мере на 90%, более предпочтительно, по меньшей мере на 91%, более предпочтительно, по меньшей мере на 92%, более предпочтительно, по меньшей мере на 93%, более предпочтительно, по меньшей мере на 94%, более предпочтительно, по меньшей мере на 95%, более предпочтительно, по меньшей мере на 96%, более предпочтительно, по меньшей мере на 97%, более предпочтительно, по меньшей мере на 98%, более предпочтительно, по меньшей мере на 99%, более предпочтительно, по меньшей мере на 99,1%, более предпочтительно, по меньшей мере на 99,2%, более предпочтительно, по меньшей мере на 99,3%, более предпочтительно, по меньшей мере на 99,4%, более предпочтительно, по меньшей мере на 99,5%, более предпочтительно, по меньшей мере на 99,6%, более предпочтительно, по меньшей мере на 99,7%, более предпочтительно, по меньшей мере на 99,8% и, еще более предпочтительно, по меньшей мере на 99,9% идентична соответствующей предложенной SEQ ID NO. В некоторых вариантах осуществления настоящее изобретение имеет отношение к жесткости условий гибридизации для того, чтобы определить степень комплементарности двух полинуклеотидов. Применяемый в данном документе термин ʺжесткостьʺ относится к условиям температуры и ионной силы, и наличию или отсутствию определенных органических растворителей в ходе гибридизации. Чем выше жесткость, тем выше будет степень комплементарности между целевой нуклеотидной последовательностью и меченой полинуклеотидной последовательностью. Термин ʺжесткие условияʺ относится к температуре и ионным условиям, при которых будут гибридизироваться только нуклеотидные последовательности, имеющие высокую частоту комплементарных оснований. При помощи применяемого в данном документе выражения ʺгибридизируется при низкой жесткости, средней жесткости, высокой жесткости или очень высокой жесткости условийʺ описываются условия гибридизации и промывки. Инструкции для осуществления реакций гибридизации можно найти в руководстве Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1-6.3.6, включенном в данный документ посредством ссылки. Конкретными условиями гибридизации, указанными в данном документе, является следующие: 1) условия гибридизации низкой жесткости в 6 Х хлориде натрия/цитрате натрия (SSC) при приблизительно 45°С, с последующими двумя промывками в 0,2 Х SSC, 0,1% SDS при 50-55°С; 2) условия гибридизации средней жесткости в 6 Х SSC при приблизительно 45°С, с последующей одной или несколькими промывками в 0,2 Х SSC, 0,1% SDS при 60°С; 3) условия гибридизации высокой жесткости в 6 Х SSC при приблизительно 45°С, с последующей одной или несколькими промывками в 0,2 Х SSC, 0,1% SDS при 65°С; и 4) условия гибридизации очень высокой жесткости представляют собой 0,5М фосфат натрия, 7% SDS при 65°С, с последующей одной или несколькими промывками в 0,2 Х SSC, 1% SDS при 65°С. Применяемый в данном документе термин ʺхимерный генʺ или ʺгенетическая конструкцияʺ относится к любому гену, который не является нативным геном в своем нативном положении, т.е. применительно к нему осуществлялись искусственные манипуляции, включая химерный ген или генетическую конструкцию, которую интегрировали в геном пшеницы. Как правило, химерный ген или генетическая конструкция содержит регуляторные и транскрибируемые или кодирующие белок последовательности, которые в природе не встречаются вместе. Соответственно, химерный ген или генетическая конструкция может включать регуляторные последовательности и кодирующие последовательности, которые происходят из различных источников, или регуляторные последовательности и кодирующие последовательности, которые происходят из одного и того же источника, но расположены другим образом, чем те, которые встречаются в природе. Применяемый в данном документе термин ʺэндогенныйʺ имеет отношение к веществу, которое, как правило, образуется в немодифицированном растений на той же стадии развития, что и в исследуемом растении, предпочтительно в растении пшеницы, например, крахмал, или SBEIIa, или SBEIIb. ʺЭндогенный генʺ имеет отношение к нативному гену в его природном положении в геноме организма, предпочтительно, к гену SBEIIa или SBEIIb в растении пшеницы. Применяемый в данном документе термин ʺрекомбинантная молекула нуклеиновой кислотыʺ имеет отношение к молекуле нуклеиновой кислоты, которую сконструировали или модифицировали с помощью технологии рекомбинантных ДНК. Термины ʺчужеродный полинуклеотидʺ или ʺэкзогенный полинуклеотидʺ, или ʺгетерологичный полинуклеотидʺ и т.п. имеют отношение к любой нуклеиновой кислоте, которая вводится в геном клетки, предпочтительно геном пшеницы, с помощью экспериментальных манипуляций, но которая не встречается в клетке в естественных условиях. Они включают модифицированные формы последовательностей генов, находящихся в этой клетке, при условии, что введенный ген содержит некоторую модификацию, например, введенную мутацию, или присутствие селективного маркерного гена в отношении гена, встречающегося в естественных условиях. Чужеродные или экзогенные гены могут являться генами, встречающимися в природе, которые вставлены в неродственный организм, нативными генами, введенными в новое положение в нативном хозяине, или химерными генами или генетическими конструкциями. ʺТрансгеномʺ является ген, который ввели в геном путем процедуры трансформации. Термин ʺгенетически модифицированныйʺ включает введение генов в клетки, мутирование генов в клетках и изменение или модулирование регуляции гена в клетке или организмах, по отношению к которым осуществлялись эти действия, или их потомстве. Настоящее изобретение имеет отношение к элементам, которые функционально соединены или связаны. Термины ʺфункционально соединенныйʺ или ʺфункционально связанныйʺ и т.п. имеют отношение к связи полинуклеотидных элементов в функциональном отношении. Как правило, функционально соединенные последовательности нуклеиновых кислот являются непрерывно связанными между собой и при необходимости соединения двух кодирующих белок участков являются смежными и в пределах рамки считывания. Кодирующая последовательность ʺфункционально соединена сʺ другой кодирующей последовательностью в случае, если РНК-полимераза будет осуществлять транскрипцию двух кодирующих последовательностей в одну РНК, которая при трансляции затем транслируется в один полипептид, имеющий аминокислоты, происходящие из обеих кодирующих последовательностей. Кодирующие последовательности не обязательно должны быть смежными друг с другом, при условии, что в конечном итоге осуществляется процессинг экспрессирующихся последовательностей для образования необходимого белка. Применяемый в данном документе термин ʺцис-действующая последовательностьʺ, ʺцис-действующий элементʺ или ʺцис-регуляторный участокʺ или ʺрегуляторный участокʺ или аналогичный термин будет означать любую последовательность нуклеотидов, которая регулирует экспрессию генетической последовательности. Это может быть встречающаяся в природе цис-действующая последовательность в ее естественном состоянии, например, регулирующая ген пшеницы SBEIIa или SBEIIb, или последовательность в генетической конструкции, которая при соответствующем расположении относительно экспрессируемой генетической последовательности регулирует ее экспрессию. Такой цис-регуляторный участок может быть способен к активации, сайленсингу, усилению, репрессии или другому изменению уровня экспрессии и/или специфичности экспрессии последовательности гена в отношении типа клеток, и/или специфичности в отношении стадии развития на транскрипционном или пост-транскрипционном уровне. В предпочтительных вариантах осуществления настоящего изобретения цис-действующая последовательность представляет собой активирующую последовательность, которая усиливает или стимулирует экспрессию экспрессируемой генетической последовательности, например, промотор. Показано, что присутствие интрона в 5'-лидерной последовательности (UTR) генов усиливает экспрессию генов у однодольных растений, таких как пшеница (Tanaka и соавт., 1990). Другим типом цис-действующей последовательности является участок прикрепления к матриксу (MAR), который может оказывать влияние на экспрессию гена посредством заякоривания активных доменов хроматина на ядерном матриксе. ʺФункционально соединениеʺ промоторного или энхансерного элемента с транскрибируемым полинуклеотиду означает размещение транскрибируемого полинуклеотида (например, кодирующего белок полинуклеотида или другого транскрипта) под регуляторным контролем промотора, который затем регулирует транскрипцию этого полинуклеотида. При конструировании комбинаций гетерологичного промотора/структурного гена, как правило, предпочтительно расположить промотор или его вариант на таком расстоянии от сайта инициации транскрипции транскрибируемого полинуклеотида, которое является приблизительно таким же, что и расстояние между указанным промотором и геном, который он контролирует в своем нативном окружении; т.е. геном, из которого происходит промотор. Как известно в данной области техники, некоторая вариация этого расстояния может быть осуществлена без потери функции. В настоящем изобретении векторы применяются для получения, манипуляции с или переноса химерных генов или генетических конструкций. Под термином ʺвекторʺ подразумевается молекула нуклеиновой кислоты, предпочтительно молекула ДНК, происходящая, например, из плазмиды, бактериофага или вируса растений, в которую можно вставить последовательность нуклеиновой кислоты. Предпочтительно, вектор содержит один или несколько уникальных сайтов рестрикции и может быть способным к автономной репликации в определенной клетке-хозяине, в том числе целевых клетках или тканях, или клетках-предшественниках, или ткани из них, или интегрируемым в геном определенного хозяина таким образом, что клонированная последовательность является воспроизводимой. Таким образом, вектор может быть автономно реплицирующимся вектором, т.е. вектором, существующим в виде внехромосомного объекта, репликация которого не зависит от репликации хромосом, например, линейная или замкнутая кольцевая плазмида, внехромосомный элемент, минихромосома или синтетическая хромосома. Вектор может содержать любые средства для обеспечения саморепликации. В качестве альтернативы, вектор может быть таким, который при введении в клетку интегрируется в геном клетки-реципиента и реплицируется вместе с хромосомой(ами), в которую он был интегрирован. Векторная система может включать один вектор или плазмиду, два или более векторов или плазмид, которые вместе содержат общую ДНК, подлежащую введению в геном клетки-хозяина, или транспозон. Выбор вектора, как правило, зависит от совместимости вектора с клеткой, в которую должен быть введен вектор. Вектор также может включать селективный маркер, такой как ген устойчивости к антибиотику, который можно применять для отбора подходящих трансформантов, или последовательности, которые усиливают трансформацию прокариотических или эукариотических клеток (в особенности клеток пшеницы), например, последовательности T-DNA или P-DNA. Примеры таких генов устойчивости и последовательностей хорошо известны специалистам в данной области техники. Под ʺмаркерным геномʺ подразумевается ген, который наделяет клетки, экспрессирующие маркерный ген, особым фенотипом, что позволяет отличить такие трансформированные клетки от клеток, которые не содержат маркер. ʺСелективный маркерный генʺ обеспечивает признак, в отношении которого можно осуществлятьʺотборʺ на основе устойчивости к селективному агенту (например, гербициду, антибиотику, излучению, нагреванию или другой обработке, повреждающей нетрансформированные клетки) или на основе преимущества роста в присутствии метаболизируемого субстрата. Подвергаемый скринингу маркерный ген (или ген-репортер) обеспечивает признак, который можно определить с помощью наблюдения или тестирования, т.е. ʺскринингаʺ (например, β-глюкуронидазной, люциферазной, GFP или другой ферментативной активности, не присутствующей в нетрансформированной клетке). Маркерный ген и нуклеотидная последовательность, представляющие интерес, не обязательно связаны между собой. Примерами бактериальных селективных маркеров являются маркеры, которые обеспечивают устойчивость к антибиотикам, например, устойчивость к ампициллину, канамицину, эритромицину, хлорамфениколу или тетрациклину. Иллюстративные селективные маркеры для отбора трансформантов растений без ограничения включают ген hyg, обеспечивающий устойчивость к гигромицину В, ген неомицин-фосфотрансферазы (npt), обеспечивающий устойчивость к канамицину, паромомицину, G418 и т.п., например, описанные в Potrykus и соавт, 1985; ген глутатион-S-трансферазы из печени крысы, обеспечивающий устойчивость к гербицидам, являющимся производными глутатиона, например, описанный в ЕР-А-256223; ген глутамин-синтетазы, при сверхэкспрессии обеспечивающий устойчивость к ингибиторам глутамин-синтетазы, таким как фосфинотрицин, например, описанный в WO 87/05327, ген ацетилтрансферазы из Streptomyces vindochromogenes, обеспечивающий устойчивость к селективному агенту фосфинотрицину, например, описанный в ЕР-А-275957, ген, кодирующий 5-енолшикимат-3-фосфатсинтазу (EPSPS), обеспечивающий устойчивость к N-фосфонометилглицину, например, описанный в Hinchee и соавт, 1988, ген bar, обеспечивающий устойчивость к биалафосу, например, описанный в WO 91/02071; ген нитрилазы, например, ген bxn из Klebsiella ozaenae, который обеспечивает устойчивость к бромоксинилу (Stalker и соавт., 1988); ген дигидрофолатредуктазы (DHFR), обеспечивающий устойчивость к метотрексату (Thillet и coaew., 1988); мутантный ген ацетолактатсинтазы (ALS), обеспечивающий устойчивость к имидазолинону, сульфонилмочевине или другим ALS-ингибирующим химикатам (ЕР-А-154204); мутантный ген антранилатсинтазы, обеспечивающий устойчивость к 5-метилтриптофану; или ген далапондегалогеназы, обеспечивающий устойчивость к гербициду. Предпочтительные скринируемые маркеры без ограничения включают ген uidA, кодирующий фермент β-глюкуронидазу (GUS), для которого известны различные хромогенные субстраты, ген β-галактозидазы, кодирующий фермент, для которого известны различные хромогенные субстраты, ген аэкворина (Prasher и соавт., 1985), который можно применять для кальций-чувствительного биолюминесцентного обнаружения; ген зеленого флуоресцентного белка (GFP, Niedz и соавт., 1995) или один из его вариантов; ген люциферазы (luc) (Ow и соавт., 1986), который обеспечивает биолюминесцентное обнаружение, и другие, известные в данной области техники. В некоторых вариантах осуществления уровень эндогенной крахмал-ветвящей активности или другой ферментативной активности модулируется путем снижения уровня экспрессии генов, кодирующих белки, вовлеченные в эти активности в растении пшеницы, или повышения уровня экспрессии нуклеотидной последовательности, которая кодирует этот фермент в растении пшеницы. Повышения экспрессии можно достичь на уровне транскрипции с помощью промоторов различной силы или индуцируемых промоторов, которые способны регулировать уровень транскриптов, экспрессируемых кодирующей последовательностью. Можно вводить гетерологичные последовательности, кодирующие транскрипционные факторы, которые модулируют или усиливают экспрессию генов, продукты которых отрицательно регулируют ветвление крахмала. Уровень экспрессии этого гена можно модулировать путем изменения числа копий конструкции в клетке, содержащей кодирующую последовательность и транскрипционный управляющий элемент, который функционально соединен с ней и который является функциональным в клетке. В качестве альтернативы, можно выбрать множество трансформантов и подвергнуть их скринингу для выявления таковых с подходящим уровнем и/или специфичностью экспрессии трансгена в результате влияний эндогенных последовательностей в непосредственной близости от сайта интеграции трансгена. Подходящим уровнем и паттерном экспрессии трансгена является тот, который приводит в результате к существенному увеличению синтеза крахмала или содержания амилозы в растении пшеницы. Это можно определить с помощью несложного тестирования трансформантов. Снижения экспрессии гена можно достичь путем введения и транскрипции ʺхимерного гена, обеспечивающего сайленсинг геновʺ, введенного в растение пшеницы. Химерный ген, обеспечивающий сайленсинг генов, предпочтительно целенаправленно вводится в геном пшеницы, предпочтительно ядерный геном пшеницы. Применяемый в данном документе термин ʺэффект сайленсинга геновʺ имеет отношение к снижению экспрессии целевой нуклеиновой кислоты в клетке пшеницы, предпочтительно клетке эндосперма, что можно достичь путем введения сайленсирующей РНК. В предпочтительном варианте осуществления вводится химерный ген, обеспечивающий сайленсинг генов, который кодирует молекулу РНК, снижающую экспрессию одного или нескольких эндогенных генов, предпочтительно генов SBEIIa и/или SBEIIb. Целевые гены в пшенице также включают гены, перечисленные в таблице 51. Такое снижение может быть результатом снижения транскрипции, в том числе путем ремоделирования хроматина посредством метилирования, или пост-транскрипционной модификации молекул РНК, в том числе посредством деградации РНК, или и того, и другого. Сайленсинг генов не обязательно должен быть интерпретирован как отмена экспрессии целевой нуклеиновой кислоты или гена. Достаточно того, что уровень экспрессии целевой нуклеиновой кислоты в присутствии сайленсирующей РНК ниже, чем при ее отсутствии. Уровень экспрессии целевого гена можно снизить по меньшей мере на приблизительно 40% или по меньшей мере на приблизительно 45%, или по меньшей мере на приблизительно 50%, или по меньшей мере на приблизительно 55%, или по меньшей мере на приблизительно 60%, или по меньшей мере на приблизительно 65%, или по меньшей мере на приблизительно 70%, или по меньшей мере на приблизительно 75%, или по меньшей мере на приблизительно 80%, или по меньшей мере на приблизительно 85%, или по меньшей мере на приблизительно 90%, или по меньшей мере на приблизительно 95%, или фактически довести до необнаружимого уровня. Методики с применением антисмысловых последовательностей можно применять для снижения экспрессии генов в клетках пшеницы. Под термином ʺантисмысловая РНКʺ следует понимать молекулу РНК, комплементарную по меньшей мере части конкретной молекулы мРНК и способную снижать экспрессию гена, кодирующего мРНК, предпочтительно гена SBEIIa и/или SBEIIb. Такое снижение обычно происходит зависимым от последовательности образом, и как считается, происходит путем препятствования пост-транскрипционному событию, например транспорту мРНК из ядра в цитоплазму, стабильности мРНК или путем ингибирования трансляции. Использование методик с применением антисмысловых последовательностей хорошо известно в данной области техники (смотри, например, Hartmann и Endres, 1999). Способы с применением антисмысловых последовательностей в настоящее время являются хорошо известными методиками для манипуляции с экспрессией генов в растениях. Антисмысловые молекулы обычно включают последовательности, которые соответствуют части транскрибируемого участка целевого гена или последовательностей, которые осуществляют управление экспрессией гена или событием сплайсинга. Например, антисмысловая последовательность может соответствовать целевому кодирующему белок участку генов согласно настоящему изобретению или 5'-нетранслируемому участку (UTR), или 3'-UTR, или их комбинации, предпочтительно только последовательностям экзонов целевого гена. Ввиду, как правило, большего расхождения между родственными генами UTR, нацеливание на эти участки обеспечивает более высокую специфичность ингибирования гена. Длина антисмысловой последовательности должна составлять по меньшей мере 19 смежных нуклеотидов, предпочтительно, по меньшей мере 50, более предпочтительно, по меньшей мере 100, 200, 500 или 1000 нуклеотидов, до максимума полной длины ингибируемого гена. Можно применять последовательность полной длины, комплементарную транскрипту всего гена. Наиболее предпочтительно, длина составляет 100-2000 нуклеотидов. Степень идентичности антисмысловой последовательности целевому транскрипту должна составлять по меньшей мере 90% и, более предпочтительно, 95-100%. Разумеется, молекула антисмысловой РНК может содержать неродственные последовательности, которые могут служить для стабилизации молекулы. Генетические конструкции для экспрессии антисмысловой РНК можно легко получить путем присоединения промоторной последовательности к участку целевого гена в ʺантисмысловойʺ ориентации, которая, как применяется в данном документе, имеет отношение к обратной ориентации относительно ориентации транскрипции и трансляции (если это имеет место) последовательности в целевом гене в клетке растения. Предпочтительно, антисмысловая РНК экспрессируется преимущественно в эндосперме растения пшеницы с помощью эндосперм-специфического промотора. Термин ʺрибозимʺ имеет отношение к молекуле РНК, которая специфически распознает определенную РНК-субстрат и катализирует ее расщепление. Как правило, рибозим содержит антисмысловую последовательность для специфического распознавания целевой нуклеиновой кислоты и ферментативный участок, называемый в данном документе ʺкаталитическим доменомʺ. Типы рибозимов, которые являются в особенности применимыми в настоящем изобретении, представлены рибозимом типа hammerhead (Haseloff и Gerlach, 1988; Pemman и соавт., 1992) и рибозимом в виде шпильки (Shippy и соавт., 1999). Применяемый в данном документе термин ʺискусственно введенная молекула dsRNAʺ имеет отношение к введению молекулы двухцепочечной РНК (dsRNA), которая, предпочтительно, синтезируется в клетке пшеницы путем транскрипции химерного гена, кодирующего такую молекулу dsRNA. РНК-интерференция (RNAi) является в особенности применимой для специфического снижения экспрессии гена или ингибирования продуцирования конкретного белка, причем также и у пшеницы (Regina и соавт., 2006). Эта технология основана на присутствии молекул dsRNA, которые содержат последовательность, по существу идентичную мРНК гена, представляющего интерес, или ее части, и ее комплемент, тем самым образуя dsRNA. Для удобства, молекула dsRNA может быть получена из одного промотора в клетке-хозяине, причем смысловая и антисмысловая последовательности транскрибируются для получения шпилечной РНК, в которой смысловая и антисмысловая последовательности гибридизуются с образованием участка dsRNA с родственной (с геном SBE1I) или неродственной последовательностью, причем образуется петлевая структура, так что шпилечная РНК содержит структуру типа ʺстебель-петляʺ. Разработка и получение подходящих молекул dsRNA для применения по настоящему изобретению находится в пределах возможностей специалиста в данной области техники, особенно с учетом Waterhouse и соавт., 1998; Smith и соавт., 2000; WO 99/32619; WO 99/53050; WO 99/49029 и WO 01/34815. ДНК, кодирующая dsRNA, обычно содержит как смысловые, так и антисмысловые последовательности, расположенные в виде инвертированного повтора. В предпочтительном варианте осуществления смысловая и антисмысловая последовательности отделены друг от друга спейсерным участком, который содержит интрон, который вырезается при транскрипции в РНК. Как было показано, такое расположение приводит в результате к более высокой эффективности сплайсинга генов (Smith и соавт., 2000). Двухцепочечный участок может содержать одну или две молекулы РНК, транскрибируемые либо с одного, либо с двух участков ДНК. Можно классифицировать dsRNA как длинную hpRNA, имеющую длинные смысловые и антисмысловые участки, которые могут быть в значительной степени комплементарными, но не должны быть полностью комплементарными (как правило, больше приблизительно 200 п.о., в диапазоне 200-1000 п.о.). Также hpRNA могут быть достаточно небольшими, причем с размером двухцепочечной части в диапазоне от приблизительно 30 до приблизительно 42 п.о., но не намного длиннее, чем 94 п.о. (смотри WO 04/073390). Считается, что наличие участка двухцепочечной РНК вызывает реакцию эндогенной системы растения, которая разрушает как двухцепочечную РНК, так и гомологичные РНК-транскрипты целевого гена растения, значительно снижая или устраняя активность целевого гена. Длина каждой из смысловой и антисмысловой последовательностей, которые гибридизуются, должна составлять по меньшей мере 19 смежных нуклеотидов, предпочтительно, по меньшей мере 30 или 50 нуклеотидов и, более предпочтительно, по меньшей мере 100, 200, 500 или 1000 нуклеотидов. Можно применять последовательность полной длины, соответствующую транскрипту всего гена. Наиболее предпочтительно, длины составляют 100-2000 нуклеотидов. Степень идентичности смысловой и антисмысловой последовательностей целевому транскрипту должна быть по меньшей мере 85%, предпочтительно, по меньшей мере 90% и, более предпочтительно, 95-100%. Чем длиннее последовательность, тем менее строгими являются требования к общей идентичности последовательности. Разумеется, молекула РНК может содержать неродственные последовательности, которые могут служить для стабилизации молекулы. Промотором, применяемым для экспрессии dsRNA-образующей конструкции, может являться промотор любого типа, который экспрессируется в клетках, которые экспрессируют целевой ген. Если целевым геном является SBEIIa или SBEIIb, или другой ген, избирательно экспрессируемый в эндосперме, промотор из эндосперма является предпочтительным для того, чтобы не воздействовать на экспрессию целевого(ых) гена(ов) в других тканях. Примеры молекул dsRNA, которые можно применять для снижения экспрессии гена(ов) SBEII, приведены в Примере 4. Другой сайленсирующей РНК может быть ʺнеполиаденилированная РНКʺ, содержащая по меньшей мере 20 последовательных нуклеотидов, которая имеет по меньшей мере 95% идентичности последовательности по отношению к комплементу нуклеотидной последовательности РНК-транскрипта целевого гена, например, описанная в WO 01/12824 или US 6423885. Еще одним типом сайленсирующей РНК является молекула РНК, описанная в WO 03/076619 (включается в данный документ посредством ссылки), содержащая по меньшей мере 20 последовательных нуклеотидов, которая имеет по меньшей мере 95% идентичности последовательности по отношению к последовательности целевой нуклеиновой кислоты или ее комплемента, а также содержит в значительной степени двухцепочечный участок, описанный в WO 03/076619. Применяемый в данном документе термин ʺсайленсирующие РНКʺ имеет отношение к молекулам РНК, имеющим от 21 до 24 смежных нуклеотидов, которые комплементарны участку мРНК, транскрибируемой из целевого гена, предпочтительно SBEIIa или SBEIIb. Предпочтительно, последовательность 21-24 нуклеотидов является полностью комплементарной последовательности 21-24 смежных нуклеотидов мРНК, т.е. идентична комплементу, состоящему из 21-24 нуклеотидов, участка мРНК. Тем не менее, также можно применять последовательности miRNA, которые имеют до пяти несовпадений в участке мРНК (Palatnik и соавт., 2003), а спаривание оснований может включать одну или две пары оснований G-U. Если не все из 21-24 нуклеотидов сайленсирующей РНК способны к спариванию оснований с мРНК, предпочтительно присутствие только одного или двух несовпадений между 21-24 нуклеотидами сайленсирующей РНК и участком мРНК. По отношению к miRNA, предпочтительно, если любые несовпадения, вплоть до максимум пяти, находятся около 3'-конца miRNA. В предпочтительном варианте осуществления между последовательностями сайленсирующих РНК и их целевыми мРНК не присутствует более одного или двух несовпадений. Сайленсирующие РНК происходят из более длинных молекул РНК, кодируемых химерными ДНК по настоящему изобретению. Более длинные молекулы РНК, также упоминаемые в данном документе как ʺпредшественники РНКʺ, являются исходными продуктами, которые образуются путем транскрипции химерных ДНК в клетках пшеницы и имеют частично двухцепочечный характер, образованный посредством внутримолекулярного спаривания оснований между комплементарными участками. Процессинг предшественников РНК до сайленсирующих РНК осуществляется специализированным классом РНКаз, обычно называемых ʺдайсер(ы)ʺ, как правило, длиной 21-24 нуклеотидов. Применяемые в данном документе Сайленсирующие РНК включают малые интерферирующие РНК (siRNA) и микроРНК (miRNA), которые различаются по их биосинтезу. Происходят siRNA из полностью или частично двухцепочечных РНК, имеющих по меньшей мере 21 смежную пару оснований, в том числе возможны пары оснований G-U, причем без несовпадений или неспаренных нуклеотидов, выступающих из двухцепочечного участка. Эти двухцепочечные РНК образуются либо из одного самокомплементарного транскрипта, который образуется путем наслаивания на себя самого и образования структуры типа ʺстебель-петляʺ, называемой в данном документе ʺшпилечной РНКʺ, или из двух отдельных РНК, которые по меньшей мере частично комплементарны и которые гибридизуются с образованием участка двухцепочечной РНК. Образуются miRNA путем процессинга более длинных одноцепочечных транскриптов, которые включают комплементарные участки, которые не являются полностью комплементарными и тем самым образуют структуру с несовершенным спариванием оснований так, что в пределах частично двухцепочечной структуры имеются несовпадения или неспаренные нуклеотиды. Структура со спаренными основаниями также может включать пары оснований G-U. Процессинг предшественников РНК с образованием miRNA приводит к преимущественному накоплению одной отдельной малой РНК, имеющей определенную последовательность, а именно miRNA. Она происходит из одной цепи предшественника РНК, как правило, ʺантисмысловойʺ цепи предшественника РНК, тогда как при помощи процессинга длинного комплементарного предшественника РНК для получения siRNA образуется группа siRNA, последовательности которых не являются одинаковыми, но соответствуют многим частям и происходят из обеих цепей предшественника. Впервые miRNA были обнаружены в виде небольшой регуляторной РНК, управляющей геном lin-4 у С.elegans (Lee и соавт., 1993). С тех пор сообщалось о большом количестве других встречающихся в природе miRNA, участвующих в регуляции функционирования генов у животных и растений. РНК-предшественники miRNA по настоящему изобретению, также называемые в данном документе ʺискусственными предшественниками miRNAʺ, обычно получаются из предшественников miRNA, встречающихся в природе, путем изменения нуклеотидной последовательности части miRNA встречающегося в природе предшественника так, что она является комплементарной, предпочтительно, полностью комплементарной участку 21-24 нуклеотидов целевой мРНК, и изменения нуклеотидной последовательности комплементарного участка предшественника miRNA, который образует спаренные основания с последовательностью miRNA с сохранением спаривания оснований. Остальная часть РНК-предшественника miRNA может быть неизмененной и, следовательно, иметь такую же последовательность, что и предшественник miRNA, встречающийся в природе, или ее последовательность также можно изменить с помощью замен нуклеотидов, вставок нуклеотидов или, предпочтительно, делеций нуклеотидов или их любой комбинации. Считается, что остальная часть РНК-предшественников miRNA участвует в распознавании структуры ферментом дайсером, называемого Dicer-подобный 1 (DCL1), и, следовательно, предпочтительно, если вносятся какие-либо изменения, то в остальную часть структуры вносится мало изменений. Например, спаренные нуклеотиды можно заменить на другие спаренные нуклеотиды без существенных изменений общей структуры. Встречающийся в природе предшественник miRNA, из которого получается искусственный предшественник miRNA по настоящему изобретению, может быть из пшеницы, другого растения, например, другого злакового растения, или из источников, не являющихся растительными. Примерами таких РНК-предшественников являются предшественник mi395 из риса, предшественник mi159b из Arabidopsis или предшественник mi172. Искусственные miRNA были продемонстрированы в растениях, например, Alvarez и соавт, 2006; Parizotto u соавт, 2004; Schwab и соавт, 2006. Другим молекулярно-биологическим подходом, который можно применять, является косупрессия. Механизм косупрессии не совсем ясен, но, считается, что в него вовлекается пост-транскрипционный сайленсинг гена (PTGS), и с этой точки зрения он является очень сходным со многими примерами супрессии при помощи антисмысловых последовательностей. Этот механизм включает введение дополнительной копии гена или его фрагмента в растение в ʺсмысловой ориентацииʺ по отношению к промотору для его экспрессии, которая, как применяется в данном документе, имеет отношение к той же ориентации, что и транскрипция и трансляция (если они имеют место) последовательности по отношению к последовательности целевого гена. Размер смыслового фрагмента, его соответствие участкам целевого гена и степень его гомологии целевому гену являются такими же, как и у антисмысловых последовательностей, описанных выше. В некоторых случаях дополнительная копия последовательности гена препятствует экспрессии целевого гена растения. Применительно к способам реализации подходов косупрессии следует упомянуть описание международной заявки на патент WO 97/20936 и описание европейского патента 0465572. Молекулы антисмысловой, косупрессионной или двухцепочечной РНК также могут содержать в значительной степени двухцепочечный участок РНК, предпочтительно содержащий сигнальную последовательность ядерной локализации, как описано в WO 03/076619. Любую из этих технологий для снижения экспрессии гена можно применять для скоординированного снижения активности нескольких генов. Например, одну молекулу РНК может быть нацелить на семейство родственных генов путем нацеливания на участок генов, который является общим. Кроме того, может осуществляться нацеливание на неродственные гены путем включения нескольких участков в одну молекулу РНК, при этом каждый участок нацеливается на другой ген. Это можно легко осуществить путем слияния нескольких участков под контролем одного промотора. Специалистам в данной области техники хорошо известен ряд методик, пригодных для введения молекул нуклеиновых кислот в клетку пшеницы. Применяемый в данном документе термин ʺтрансформацияʺ означает изменение генотипа клетки, например, бактерии или растения, в частности, растения пшеницы, путем введения чужеродной или экзогенной нуклеиновой кислоты. Под ʺтрансформантомʺ подразумевается организм, измененный таким образом. Введение ДНК в растение пшеницы путем скрещивания родительских растений или путем мутагенеза per se не относится к трансформации. Применяемый в данном документе термин ʺтрансгенныйʺ относится к генетически модифицированному растению, у которого эндогенный геном дополнен или модифицирован с помощью случайной или сайт-направленной интеграции, или стабильного поддержания в реплицируемой неинтегрированной форме введенного чужеродного или экзогенного гена или последовательности. Под ʺтрансгеномʺ подразумевается чужеродный или экзогенный ген или последовательность, которая вводится в растение. Молекула нуклеиновой кислоты может реплицироваться как внехромосомный элемент или, предпочтительно, целенаправленно интегрироваться в геном растения. Под ʺгеномомʺ подразумевается общий наследственный генетический комплемент в клетке, растении или части растения, который включает хромосомную ДНК, пластидную ДНК, митохондриальную ДНК и внехромосомные молекулы ДНК. В одном варианте осуществления трансген интегрируется в ядерный геном пшеницы, который у гексаплоидной пшеницы включает субгеномы А, В и D, называемые в данном документе ʺгеномомʺ А, В и D. Наиболее часто применяемые способы для получения фертильных трансгенных растений пшеницы включают две стадии: доставка ДНК в регенерируемые клетки пшеницы и регенерация растения посредством культуры тканей in vitro. Для доставки ДНК обычно применяются два способа: перенос Т-ДНК с применением Agrobacterium tumefaciens или родственных бактерий и непосредственное введение ДНК посредством бомбардировки частицами, хотя применяются и другие способы для интеграции последовательностей ДНК в пшеницу или другие злаки. Для специалиста очевидно, что конкретный выбор системы трансформации для введения конструкции нуклеиновой кислоты в клетки растения не является необходимым или не является ограничением настоящего изобретения, при условии, что достигается приемлемый уровень переноса нуклеиновых кислот. Для пшеницы такие методики являются хорошо известными в данной области техники. Трансформированные растения пшеницы можно получить путем введения конструкции нуклеиновой кислоты согласно настоящему изобретению в клетку-реципиент и выращивания нового растения, содержащего и экспрессирующего полинуклеотид по настоящему изобретению. Процесс выращивания нового растения из трансформированной клетки, которая находится в культуре клеток, в данном документе называется ʺрегенерациейʺ. Регенерируемые клетки пшеницы включают клетки зрелых зародышей, меристематической ткани, например, мезофильные клетки основания листа, или, предпочтительно, клетки из щитков незрелых зародышей, полученные через 12-20 дней после цветения, или каллус, полученный из любого из вышеперечисленных. Наиболее часто применяемым путем для получения регенерированных растений пшеницы является соматический эмбриогенез с применением таких сред, как MS-агар, дополненный ауксином, например 2,4-D, и низким уровнем цитокинина (смотри Sparks and Jones. 2004). Agrobacterium-опосредованную трансформацию пшеницы можно осуществлять с помощью способов Cheng и соавт., 1997; Weir и соавт., 2001; Kanna and Daggard, 2003 или Wu и соавт., 2003. Можно применять любой штамм Agrobacterium с достаточной вирулентностью, предпочтительно, штаммы, имеющие функционирующие дополнительные гены вирулентности, например, LBA4404, AGL0 или AGL1 (Lazo и соавт., 1991), или разновидности С58. Также можно применять бактерии, родственные Agrobacterium. ДНК, которая переносится (Т-ДНК) из Agrobacterium в клетки-реципиенты пшеницы, содержится в генетической конструкции (химерная плазмида), которая содержит один или два пограничных по отношению к участку Т-ДНК участка плазмиды Ti дикого типа, фланкирующих нуклеиновую кислоту, которая переносится. Генетическая конструкция может содержать две или более Т-ДНК, например, если одна Т-ДНК содержит ген, представляющий интерес, а вторая Т-ДНК содержит селективный маркерный ген, при условии независимой вставки двух Т-ДНК и возможной сегрегации селективного маркерного гена от представляющего интерес трансгена. Можно применять любую разновидность пшеницы, которая является регенерируемой; сообщалось о успехах с применением сортов Bob White, Fielder, Veery-5, Cadenza и Florida. События трансформации в одном из этих более легко регенерируемых сортов можно перенести в любые другие культивары пшеницы, включая элитные сорта, путем стандартного возвратного скрещивания. В качестве альтернативного способа с применением Agrobacterium применяется способ инокуляции in vivo с последующей регенерацией и отбором трансформированных растений с применением культуры тканей, эффективность которого была доказана, смотри WO 00/63398. Другие способы, связанные с применением Agrobacterium, включают совместное культивирование Agrobacterium с культивируемыми выделенными протопластами; трансформацию семян, верхушек или меристем с помощью Agrobacterium или инокуляцию in planta, например, способ ʺfloral-dipʺ для Arabidopsis, описанный Bechtold и соавт., 1993. Этот последний подход основан на вакуумной инфильтрации суспензии клеток Agrobacterium. В качестве альтернативы, химерные конструкции можно вводить с применением плазмид Agrobacterium, индуцирующих корни (R1), в качестве векторов. Еще одним способом, обычно применяемым для введения конструкции нуклеиновой кислоты в клетку растения, является высокоскоростное баллистическое проникновение с помощью малых частиц (также известен как бомбардировка частицами или бомбардировка микрочастицами), причем нуклеиновая кислота, подлежащая введению, содержится либо в матриксе мелких гранул или частиц, либо на их поверхности, как описано, например, Klein и соавт, 1987. Этот способ был адаптирован для пшеницы (Vasil, 1990). Бомбардировку микрочастицами можно применять для того, чтобы вызвать повреждение, с последующим совместным культивированием с Agrobacterium (EP-A-486233). Генетическую конструкцию также можно ввести в растительные клетки с помощью электропорации, как, например, описано Fromm и соавт., 1985 и Shimamoto и соавт., 1989. В качестве альтернативы, конструкцию нуклеиновой кислоты можно ввести в клетку пшеницы, например, клетку пыльцы, путем приведения клетки в контакт с нуклеиновой кислотой с применением механических или химических средств. Предпочтительные селективные маркерные гены для применения при трансформации пшеницы включают ген bar или ген pat Streptomyces hygroscopicus в сочетании с отбором с применением гербицида глюфосината аммония, ген hpt в сочетании с антибиотиком гигромицином или ген nptll с канамицином или G418. В качестве альтернативы, можно применять положительные селективные маркеры, например, ген mаnА, кодирующий фосфоманнозоизомеразу (PMI) с сахаром манноза-6-фосфатом в качестве единственного источника С. Далее настоящее изобретение описывается с помощью следующих неограничивающих примеров. ПРИМЕР 1: СПОСОБЫ И МАТЕРИАЛЫ Определение и анализ углеводов. В небольших масштабах крахмал выделяли как из развивающегося, так и из зрелого зерна пшеницы с применением способа Regina и соавт. (2006). В больших масштабах осуществляли экстракцию крахмала согласно способу Regina и соавт. (2004). Определяли содержание крахмала с применением набора для анализа общего крахмала, поставляемого компанией Megazyme (Брей, графство Уиклоу, Ирландия), и рассчитывали на основе веса в виде процента от веса зрелого неразмолотого зерна. Содержание крахмала затем сравнивали с контрольными растениями. Вычитание веса крахмала из общего веса зерна с получением общего содержимого зерна без крахмала использовали для определения того, было ли снижение общего веса обусловлено снижением содержания крахмала. Содержание амилозы в образцах крахмала определяли колориметрическим (йодометрическим) способом по Morrison и Laignelet (1983) с небольшими модификациями, как указано далее. Точно взвешивали приблизительно 2 мг крахмала (с точностью до 0,1 мг) в пробирку с завинчивающейся крышкой, оснащенной резиновым уплотнителем. Для удаления липидов 1 мл 85% (объем/объем) метанола смешивали с крахмалом и пробирку нагревали на водяной бане при 65°С в течение 1 часа с периодическим перемешиванием на вортексе. После центрифугирования при 13000g в течение 5 мин супернатант аккуратно удаляли, а этапы экстракции повторяли. Крахмал затем высушивали при 665°С в течение 1 часа и растворяли в растворе мочевины-диметилсульфоксида (UDMSO; 9 объемов диметилсульфоксида к 1 объему 6М мочевины) с использованием 1 мл UDMSO на 2 мг крахмала (взвешенного как указано выше). Эту смесь немедленно тщательно перемешивали на вортексе и инкубировали на водяной бане при 95°С в течение 1 часа с кратковременным перемешиванием на вортексе для полного растворения крахмала. Аликвоту раствора крахмала-UDMSO (50 мкл) обрабатывали 20 мкл реактива I2-KI, который содержал 2 мг йода и 20 мг йодида калия на мл воды. Смесь доводили водой до 1 мл. Измеряли поглощение смеси при 620 нм с помощью переноса 200 мкл на микропланшет и считывания поглощения при помощи микропланшет-ридера Emax Precision Microplate Reader (Molecular Devices, США). Стандартные образцы, содержащие от 0 до 100% амилозы и от 100 до 0% амилопектина, получали из картофельной амилозы и кукурузного (или картофельного) амилопектина (Sigma) и обрабатывали как тестовых образцов. Содержание амилозы (процент амилозы) определяли исходя из значений поглощения с применением уравнения регрессии, выведенного исходя из поглощений стандартных образцов. Анализ соотношения амилозы/амилопектина в крахмалах, не являющихся деветвящимися, также можно осуществлять согласно Case и соавт, (1998) или способом HPLC с применением 90% DMSO для отделения деветвящихся крахмалов, как описано Batey and Curtin, (1996). Статистический анализ данных по амилозе осуществляли с использованием 8-ой версии Genstat for Windows (VSN International Ltd, Хартфордшир, Великобритания). Распределение длин цепей в крахмале анализировали посредством электрофореза углеводов в присутствии флуорофора (FACE) с применением устройства для капиллярного электрофореза в соответствии с Morell и соавт, (1998) после деветвления образцов крахмала. Профили температуры клейстеризации образцов крахмала измеряли в дифференциальном сканирующем колориметре Pyris I (Perkin Elmer, Норуолк, Коннектикут, США). Вязкость растворов крахмала измеряли на Rapid-Visco-Analyser (RVA, Newport Scientific Pty Ltd, Уорривуд, Сидней), например, с использованием условий, описанных Batey и соавт. (1997). Измеряемые параметры включали пиковую вязкость (максимальную вязкость горячего клейстера), силу сцепления, конечную вязкость и температуру образования клейстера. Объем набухания муки или крахмала определяли в соответствии со способом Konik-Rose и соавт. (2001). Поглощение воды измеряли посредством взвешивания образца до и после перемешивания образца муки или крахмала в воде при определенных температурах и последующего сбора клейстеризованного материала. Морфологию гранул крахмала анализировали с помощью микроскопии. Суспензии очищенных гранул крахмала в воде исследовали как при нормальном, так и при поляризованном свете с применением биологического микроскопа Leica-DMR для определения морфологии гранул крахмала. Осуществляли сканирующую электронную микроскопию с применением прибора Joel JSM 35C. Очищенные крахмалы покрывали золотом способом напыления и сканировали при 15 кВ при комнатной температуре. Уровни β-глюкана определяли с применением набора, предоставляемого компанией Megazyme (Брей, графство Уиклоу, Ирландия). Анализ экспрессии белков в эндосперме. Специфическую экспрессию белков SBEI, SBEIIa и SBEIIb в эндосперме, в частности, уровень экспрессии или накопление этих белков, анализировали с применением методик вестерн-блоттинга. Отсекали эндосперм от всех материнских тканей, а приблизительно по 0,2 мг образцов гомогенизировали в 600 мкл 50 мМ калий-фосфатного буферного раствора (42 мМ K2HPO4 и 8 мМ KH2PO4), рН 7,5, содержащего 5 мМ EDTA, 20% глицерина, 5 мМ DTT и 1 мМ Pefabloc. Измельченные образцы центрифугировали в течение 10 мин при 13000g, отбирали аликвоты супернатанта и замораживали при -80°С до применения. Для оценки общего белка получили стандартные кривые при помощи BSA с использованием 0, 20, 40, 60, 80 и 100 мкл аликвот стандарта 0,25 мг/мл BSA. Образцы (3 мкл) доводили до 100 мкл дистиллированной водой и добавляли 1 мл реактива Coomassie Plus Protein к каждому. Поглощение считывали через 5 мин при 595 нм с использованием образца с нулевым содержанием BSA из стандартной кривой в качестве контроля, и определяли уровни белков в этих образцах. Осуществляли электрофорез образцов, содержащих 20 мкг общего белка, из каждого эндосперма в 8% неденатурирующем полиакриламидном геле, содержащем 0,34М Tris-HCl (pH 8,8), акриламид (8,0%), персульфат аммония (0,06%) и TEMED (0,1%). После электрофореза белки переносили на нитроцеллюлозную мембрану согласно Morell и соавт, 1997 и проводили иммунную реакцию со специфическими антителами к SBEIIa, SBEIIb или SBEI. Иммунную сыворотку против белка пшеницы SBEIIa (anti-wBEIIa) получили с применением синтетического пептида, имеющего аминокислотную последовательность N-концевой последовательности зрелого SBEIIa пшеницы AASPGKVLVPDGESDDL (SEQ ID NO:16) (Rahman и соавт, 2001). Иммунную сыворотку против SBEIIb пшеницы (anti-wBEIIb) получили аналогичным образом с применением N-концевого синтетического пептида AGGPSGEVMI (SEQ ID NO:17) (Regina и соавт, (2005). Как предполагалось, этот пептид представлял N-концевую последовательность зрелого пептида SBEIIb и, более того, был идентичным N-концу белка SBEIIb ячменя (Sun и соавт, 1998). Поликлональное антитело против SBEI пшеницы синтезировали аналогичным образом с применением N-концевого синтетического пептида VSAPRDYTMATAEDGV (SEQ ID NO:18) (Morell и соавт., 1997). Такие иммунные сыворотки получили из кроликов, иммунизированных синтетическими пептидами согласно стандартным способам. Анализ ферментов применительно к SBE. Анализы активности ферментов по отношению к ветвящим ферментам для определения активности всех трех изоформ, SBEI, SBEIIa и SBEIIb, были основаны на способе Nishi и соавт, 2001 с небольшими модификациями. После электрофореза гель дважды промывали 50 мМ HEPES, pH 7,0, содержащего 10% глицерола и инкубировали при комнатной температуре в реакционной смеси, состоящей из 50 мМ HEPES, pH 7,4, 50 мМ глюкозо-1-фосфата, 2,5 мМ AMP, 10% глицерола, 50 ед. фосфорилазы, 1 мМ DTT и 0,08% мальтотриозы, в течение 16 часов. Полосы визуализировали с применением раствора 0,2% (вес/объем) I2 и 2% KI. Специфические активности изоформ SBEI, SBEIIa и SBEIIb разделяли в этих условиях электрофореза. Осуществляли подтверждение путем иммуноблоттинга с применением антител к SBEI, SBEIIa и SBEIIb. Осуществляли денситометрический анализ иммуноблотов с использованием пакета программного обеспечения TotalLab (Nonlinear Dynamics Ltd, Ньюкасл, Великобритания), при помощи которого измеряют интенсивность каждой полосы для определения уровня ферментативной активности каждой изоформы. Крахмал-ветвящую ферментативную активность (SBE) можно измерить посредством анализа ферментов, например, анализа стимуляции фосфорилазы (Воyеr и Preiss, 1978). Этот анализ измеряет стимуляцию посредством SBE вклочения глюкозо-1-фосфата в полимер, нерастворимый в метаноле (α-D-глюкан), с помощью фосфорилазы А. Активность специфических изоформ SBE можно измерить посредством анализа с последующей очисткой индивидуальных изоформ, как в описано в Regina и соавт., 2004. Экстракты общего растворимого белка анализировали в 3 мл β-циклодекстриновой (β-CD) колонке для аффинной хроматографии, предварительно уравновешенной буфером для экстракции, описанным выше. Колонку подготавливали соединением β-CD с эпоксиактивированной сефарозой 6В (Amersham Biosciences, Уппсала, Швеция) согласно инструкциям разработчиков. Связанные белки (содержащие SBE) элюировали с применением 1% β-CD в фосфатном буферном растворе и затем диализировали против буфера А (20 мМ фосфатный буферный раствор, рН 8,0, 1 мМ EDTA и 1 мМ DTT). Диализированные образцы подвергали анионообменной хроматографии с применением 1 мл колонки MonoQ (Amersham Pharmacia), предварительно уравновешенной буфером А. После элюирования несвязанных белков применяли 30 мин линейный градиент посредством введения буфера В (500 мМ фосфатного буферного раствора, рН 8,0, 1 мМ EDTA, 1 мМ DTT) в буфер А для элюирования связанных белков. Активность SBE также можно измерить посредством анализа с помощью йодного красителя, посредством которого измеряют снижение поглощательной способности глюкан-полийодного комплекса, образующегося в результате ветвления глюкановых полимеров. Активность SBE также можно анализировать посредством анализа связывания ветвей, посредством которого измеряют образование восстанавливающих концов из восстановленной амилозы в качестве субстрата после расщепления изоамилазой (Takeda и соавт., 1993а). Предпочтительно, активность измеряют в отсутствие активности SBEI. Изоформы SBE демонстрируют различные субстратные специфичности, например, SBEI проявляет более высокую активность ветвления амилозы, в то время как SBEIIa и SBEIIb демонстрируют более высокие показатели ветвления в присутствии амилопектинового субстрата. Изоформы также могут различаться на основе длины глюкановой цепи, которую они переносят. Белок SBE также можно измерить с использованием специфических антител, таких как те, которые описаны в данном документе. Предпочтительно, активность SBEII измеряют во время развития зерна в развивающемся эндосперме. Уровни белка SBEII предпочтительно измеряют в зрелом зерне, в котором белок все еще присутствует, посредством иммунологических способов, таких как вестерн-блот анализ. Анализ ДНК растений пшеницы. ПЦР-анализ трансформированных растений пшеницы или растений, которые необходимо протестировать на наличие трансгенов, осуществляли по отношению к геномной ДНК, экстрагированной из 1-2 см2 свежего листового материала с использованием способа минипреп, описанного Stacey и Isaac, (1994). В ПЦР-анализах для определения присутствия конструкций шпилечной РНК используют праймеры, а именно SBEIIa-For: 5'-CCCGCTGCTTTCGCTCATTTTG-3' (SEQ ID NO:19) и SBEIIa-Rev: 5'-GACTACCGGAGCTCCCACCTTC-3' (SEQ ID NO:20) сконструированные для амплификации фрагмента (462 п.о.) гена SBEIIa. Условия реакции были следующими: ʺгорячий стартʺ (94°С, 3 мин) с последующими 30 циклами из денатурации (95°С, 30 с), отжига (55°С, 30 с), элонгации (73°С, 2 мин), за которыми следует 1 цикл при 73°С (5 мин). Продукты реакции анализировали посредством электрофореза в агарозном или полиакриламидном геле. Анализ посредством саузерн-блот гибридизации осуществляли по отношению к ДНК из экстракции в больших масштабах (9 мл) из лиофилизированной основной паренхимы (Stacey и Isaac, 1994). Образцы ДНК доводили до 0,2 мг/мл и расщепляли рестрикционными ферментами, такими как HindIII, EcoRl и Kpnl. Расщепление рестрикционными ферментами, электрофорез в геле и вакуумный блоттинг осуществляют, как описано Stacey и Isaac, (1994). Образцы, меченые диоксигенином, включающие участок интрона 3 конструкций ds-SBEII, получают с помощью ПЦР согласно способу по McCreery и Helentjaris, (1994). Саузерн-блот гибридизацию образцов и обнаружение посредством хемилюминесценции осуществляют согласно способу по McCreery и Helentjaris, (1994). Трансформация пшеницы посредством Agrobactaerium. Генетические конструкции для трансформации пшеницы вводили путем электропорации в нейтрализованный штамм Agrobacterium tumefaciens LBA4404, несущий vir-плазмиду pAL4404 и pSBl, с последующим отбором на средах при помощи спектиномицина. Трансформированные штаммы Agrobacterium инкубировали на затвердевающей среде YEP при 27°С в течение 2 дней. Затем бактерии собирали и ресуспендировали в TSIM1 (среды MS со 100 мг/л миоинозитола, 10 г/л глюкозы, 50 мг/л буфера MES, рН 5,5), содержащей 400 мМ ацетосирингона, до оптической плотности 2,4 при 650 нм для инокуляции пшеницы. Растения пшеницы (сорт NB1, сорт яровой пшеницы, полученный от Nickerson Seeds Ltd, Ротвелл, Линкольншир) выращивали в теплице при температуре 22°С днем и 15°С ночью с дополнительным светом в течение 16 часов в день. Побеги, включающие побег со стеблем длиной 50 см, срезали приблизительно через 14 дней после цветения (зародыши приблизительно 1 мм в длину). Все листья затем удаляли с побегов, оставляя кроющий лист, который очищали для удаления загрязняющих грибковых спор. Затем аккуратно удаляли колосковые чешуи каждого вторичного колоска и нижние цветковые чешуи из первых двух цветков для открывания незрелого семени. В общем, только эти два семени в каждом вторичном колоске были непокрытыми. Эта процедуру осуществляли вдоль всей длины соцветия. Колоски затем опрыскивали 70% IMS в качестве кратковременной поверхностной стерилизации. Осуществляли инокуляцию суспензий Agrobacterium (1 мкл) с применением 10 мкл шприца Гамильтона в незрелое семя приблизительно в месте расположения поверхности соприкосновения щитка и эндосперма так, что все открытые семена были инокулированы. Затем эти побеги помещали в воду, накрывали прозрачным пластиковым контейнером для предотвращения дегидратации семян и помещали в освещенный инкубатор на 3 дня при 23°С, 16 часов в день при PAR 45 мкЕ⋅м-2⋅с-1. После трех дней совместного культивирования извлекали инокулированные незрелые семена и стерилизовали поверхность 70% этанолом (30 с), затем 20% отбеливателем (Domestos, 20 мин), с последующим тщательным отмыванием в стерильной дистиллированной воде. Незрелые зародыши выделяли в асептических условиях и помещали в среду W3 (MS, дополненная 20 г/л сахарозы и 2 мг/л 2,4-D и отвержденная с помощью 6 г/л агарозы, тип I, Sigma) с добавлением 150 мг/л тиментина (среда W3T) и с верхним щитком (20 зародышей на планшет). Культуры размещали при 25°С на свету (16 часов в день, PAR 80 мкЕ⋅м-2⋅с-1). Развитие главной оси зародыша оценивали приблизительно через 5 дней после выделения и удаляли главную ось в случае необходимости улучшения образования каллуса. Зародыши поддерживали в W3T в течение 4 недель, причем переносили в свежую среду через 2 недели после изоляции, и оценивали эмбриогенный потенциал. После роста в течение 4 недель каллус, полученный из инокулированных зародышей, был сходным с контрольным каллусом, полученным из неинокулированных зародышей, помещенных в среду W3T. Оказалось, что присутствие бактерий не приводило к значительному снижению эмбриогенного потенциала каллуса, полученного из инокулированных зародышей. Эмбриогенные каллусы переносили в среду W3 с 2 мг/л азулама или генетицина при 25 мг/л и 150 мг/л тиментина (среда W32AT). Каллусы поддерживали в этой среде в течение последующих 2 недель, а затем каждый каллус разделяли на фрагменты размером 2 мм и снова помещали в W32AT. Контрольные зародыши, полученные в результате инокуляций LBA4404 без бинарных векторных конструкций, не образовывали трансформированный каллус на селективной среде. После дальнейшего культивирования в течение двух недель всю ткань оценивали в отношении развития эмбриогенного каллуса, при этом любой каллус, демонстрирующий признаки продолжающегося развития после 4 недель на селективной среде, переносили в среду для регенерации (RMT - MS с 40 г/л мальтозы и 150 мг/л тиментина, рН 5,8, отвержденная с помощью 6 г/л агарозы, тип I, Sigma). Регенерацию побегов осуществляли в течение 4 недель в этой среде, а затем их переносили в MS30 с 150 мг/л тиментина для удлинения и укоренения побегов. Молодые растения затем переносили в почвенную смесь и поддерживали в условиях искусственного тумана в течение двух недель, и в конечном итоге переносили в теплицу. В этом способе также можно применять альтернативные штаммы Agrobactermm, такие как штамм AGL1, или селективные маркеры, такие как гены, кодирующие устойчивость к гигромицину. ПРИМЕР 2: ИНГИБИРОВАНИЕ ГЕНОВ SBEIIA В ПШЕНИЦЕ С ПРИМЕНЕНИЕМ ЧЕТЫРЕХ КОНСТРУКЦИЙ ШПИЛЕЧНОЙ РНК Сконструировали четыре конструкции шпилечной РНК (dsRNA) для снижения экспрессии генов пшеницы i) SBEIIa или ii) SBEIIa, SBEIIb и SBEI. В каждой конструкции ДНК, кодирующая шпилечную РНК, была связана с промоторной последовательностью глютенина с высоким молекулярным весом (HMWG), полученной из гена пшеницы Dx5, для обеспечения эндосперм-специфической экспрессии шпилечной РНК и последовательностью терминации транскрипции из гена нопалин-синтазы из Agrobacterium (nos3'). Этот промотор обеспечивал эндосперм-специфическую экспрессию синтетических генов, кодирующих шпилечные РНК. hp5'-SBEIIa. Конструирование и применение первой из конструкций, обозначенной как hp5'-SBEIIa, описано в Regina и соавт. (2006). Конструкция hp5'-SBEIIa содержала 1536 п.о. нуклеотидной последовательности, амплифицированной с помощью ПЦР из гена SBEIIa пшеницы (номер доступа в GenBank AF338431). Она включала последовательность 468 п.о., которая содержит целые экзоны 1 и 2 и часть экзона 3 (нуклеотиды в положениях 1058-1336, 1664-1761 и 2038-2219 (включая нуклеотиды в положениях 1-578 кДНК Aegilops tanschii, кодирующей SBEIIa, номер доступа в GenBank AF338431.1), с сайтами рестрикции для EcoRI и Kpnl на обоих концах (фрагмент 1), последовательность 512 п.о., содержащая часть экзонов 3 и 4 и целый интрон 3 SBEIIa (нуклеотиды в положениях 2220-2731), с сайтами для Kpnl и Sacl на обоих концах (фрагмент 2) и фрагмент с 528 п.о., содержащий полные экзоны 1, 2 и 3 SBEIIa (нуклеотиды в положениях 1058-1336, 1664-1761 и 2038-2279 в AF3 38431, что включает нуклеотиды в положениях 1-638 кДНК SBEIIa Aegilops tauschii, номер доступа в GenBank AF338431.1), с сайтами для BamRl и Sacl на каждом конце (фрагмент 3). Фрагменты 1, 2 и 3 затем лигировали таким образом, что последовательность фрагмента 3 лигировали с фрагментом 2 в антисмысловой ориентации относительно фрагмента 1. Конструкции шпилечной РНК вначале получали в векторе pDV03000, который содержит промоторную последовательность HMWG и терминатор nos3'. hpc-SBEIIa. Конструкция SBEIIa, обозначенная как hpc-SBEIIa, содержала фрагмент ДНК из 293 п.о., соответствующий нуклеотидам 1255-1547 кДНК SBEIIa (№ доступа в GenBank AF338432.1), которая соответствует части экзона 12, экзонам 13 и 14 и части экзона 15 гена SBEIIa. Этот участок SBEIIa выбрали потому, что он имеет только приблизительно 81% идентичности нуклеотидной последовательности соответствующего участка кДНК SBEIIb, таким образом, повышается вероятность специфичности сайленсинга SBEIIa, но не SBEIIb. hp3'-SBEIIa. Конструкция SBEIIa, обозначенная как hp3'-SBEIIa, содержала фрагмент ДНК из 130 п.о., соответствующий нуклеотидам 2305-2434 кДНК SBEIIa, которая соответствует части экзона 21, экзону 22 и части 3'-нетранслируемого участка (3' UTR) гена SBEIIa. hp-combo. Конструкция шпилечной РНК, обозначенная как hp-combo, включала участки гена SBEI пшеницы в дополнение к частям гена SBEIIa и содержала i) последовательность 417 п.о., соответствующую нуклеотидам 1756-2172 из кДНК SBEIIa, которая соответствует части экзона 16, экзонам 17-19 и части экзона 20, и ii) последовательность 357 п.о., соответствующую нуклеотидам 267-623 кДНК SBEI (номер доступа в GenBank AF076679), которая соответствует части экзона 3, экзону 4 и части экзона 5 гена SBEI. Фрагмент гена SBEIIa обладал приблизительно 86% идентичности соответствующему участку гена SBEIIb, включающему несколько участков из 23 последовательных нуклеотидов со 100% идентичностью соответствующим им участкам SBEIIb, и поэтому комбинационную конструкцию конструировали с расчетом на то, что она будет снижать экспрессию генов, кодирующих SBEIIb, так же, как и генов, кодирующих SBEIIa и SBEI у пшеницы. Осуществляли вставку двух копий каждого из описанных выше фрагментов, одну в смысловой, а другую в антисмысловой ориентации, в подходящий вектор так, что интрон гена тубулина риса находился между двумя копиями. Осуществляли вставку этого синтетического гена в бинарный вектор и применяли для трансформации пшеницы. Эти конструкции применяли для трансформации пшеницы так, как описано в Примере 1. Количества независимых трансгенных линий пшеницы, которые при анализе с помощью ПЦР оказались положительными по соответствующим конструкциям, были следующими: hp5'-SBEIIa, 27; hpc-SBEIIa, 10; hp3'-SBEIIa, 10 и hp-combo, 63. Анализ трансгенных растений: анализ ДНК. ПЦР-анализ осуществляли для выявления одного или нескольких трансгенов в регенерированных растениях с использованием геномной ДНК, экстрагированной из 1-2 см2 свежего листового материала с применением способа минипреп, описанного Stacey и Isaac, (1994). Реакции ПЦР осуществляли в отношении растений, трансформированных трансгеном hp5'-SBEIIa, например, с применением праймеров SBEIIa-For: 5'-CCCGCTGCTTTCGCTCATTTTG-3' (SEQIDNO:19) и SBEIIa-Rev. 5'-GACTACCGGAGCTCCCACCTTC-3' (SEQ ID NO:20). Эти реакции ПЦР разработаны для амплификации фрагмента с приблизительно 462 п.о. гена SBEIIa. Условия реакции были следующими: ʺгорячий стартʺ (94°С, 3 мин) с последующими 30 циклами из денатурации (95°С, 30 с), отжига (55°С, 30 с) и элонгации (73°С, 2 мин), за которыми следует 1 цикл при 73°С (5 мин). Морфология гранул крахмала. Морфологию гранул крахмала из зрелого Т1 семени, полученного из Т0 трансформированных растений пшеницы, оценивали при помощи световой микроскопии. Анализировали десять отдельных зерен из каждого из 25 Т0 растений с hp5'-SBEIIa. Каждый эндосперм аккуратно разрушали для высвобождения гранул крахмала, которые диспергировали в воде, и наблюдали с помощью светового микроскопа. Из проанализированных 25 линий 12 имели зерна с деформированными гранулами, хотя визуальное наблюдение показало различные уровни деформации в различных семенах. Девять семян из каждого растения, трансформированного трансгенами hpc-SBEIIa, hp3'-SBEIIa и hp-combo, аналогичным образом анализировали в отношении морфологических изменений в гранулах крахмала. В этом случае половины семян анализировали таким образом, что оставшаяся половина семени могла быть выращена в Т1 растение, таким образом, сохраняют каждую линию. Пятьдесят пять из 63 линий с hp-combo имели семена с измененной морфологией гранул, причем с варьирующими уровнями деформации. Все десять линий с hp5'-SBEIIa имели семена с измененной морфологией гранул крахмала, в этом случае также с варьирующими уровнями деформации. Ни в одной из линий SBEIIa 3' не наблюдали существенных изменений морфологии гранул крахмала. Деформированные гранулы крахмала являются показателем повышенных уровней амилозы в крахмале эндосперма, как правило, выше 50% амилозы или выше 70% амилозы для сильно деформированных гранул крахмала. Это означало, что применительно к каждой конструкции для эффективного сайленсинга наблюдался диапазон фенотипических вариаций. Анализ экспрессии белков в развивающемся эндосперме посредством вестерн-блоттинга. От четырех до семи Т2 развивающихся эндоспермов из Т1 трансгенных линий анализировали в отношении уровня белков SBEIIa и SBEIIb посредством вестерн-блоттинга с применением антител к SBEIIa и SBEIIb, соответственно. В случае линий с hp-combo экспрессию SBEI также анализировали с применением антител к SBEI. Общие уровни белков SBEII (SBEIIa и SBEIIb) из выбранных трансгенных линий рассчитывали в виде процента от уровня в диком типе (сорт NB1), и они показаны в таблице 11. Также определяли уровни амилозы в зрелом зерне из трансгенных линий, которые рассчитывали в виде процента от всего крахмала в зерне (таблица 11), с применением йодометрического способа, как описано в Примере 1. Это представлено графически на фигуре 5. Диапазон уровней экспрессии SBEIIa и SBEIIb получали применительно к зерну трансгенных растений из независимых линий. Такой диапазон обычно ожидается применительно к трансгенным линиям, полученным с любой конструкцией, по причине вариации сайтов интеграции трансгена при различных трансгенных событиях, причем обычно именуется ʺэффектом положенияʺ. Диапазон уровней экспрессии, наблюдаемый в этих экспериментах, был расширенным по причине того, что как наблюдалось, четыре конструкции не являются одинаково эффективными при снижении экспрессии генов SBEIIa и SBEIIb. В частности, степень снижения экспрессии SBEIIb, обусловленного конструкцией hp-combo, в некоторых трансформированных линиях не коррелировала со степенью снижения экспрессии SBEIIa, например, у линий 679.5.3 и 672.2.3. Однако все конструкции обеспечивали снижение экспрессии соответствующих генов в большинстве трансформированных линий. Когда построили график зависимости процента амилозы от общего уровня белка SBEII и исходя из точек данных сгенерировали максимально соответствующую им кривую (смотри фигуру 5), было обнаружено, что снижение общего SBEII на по меньшей мере 75% по сравнению с диким типом привело к 50% (вес/вес) или большему содержанию амилозы в крахмале эндосперма. Снижение общей активности SBEII на по меньшей мере 40% по сравнению с диким типом привело к содержанию амилозы по меньшей мере 40% (вес/вес). Когда построили график зависимости процента амилозы от оставшегося уровня белка SBEIIa, то получили очень похожую кривую (смотри фигуру 6), что приводит к заключению, что уровень SBEIIa в эндосперме пшеницы был первичным определяющим фактором в отношении уровня амилозы в крахмале, и что уровни SBEIIb и SBEI были вторичными определяющими факторами. Модель амилозы в дальнейшем разработали на основе трех наборов вводных параметров (фигура 6): (1) теоретические данные, основанные на относительных уровнях экспрессии SBEIIa и SBEIIb и данных по амилозе из трансгенных организмов; (2) данные по амилозе для организмов с одним и двумя нуль-аллелями и теоретические данные, основанные на относительных уровнях экспрессии SBEIIa и SBEIIb; (3) измеренные данные по амилозе и измеренные уровни SBEIIa и SBEIIb у трансгенных организмов с ʺдополнительными конструкциямиʺ. На фигуре 6 кривая степени экспрессии приведена в соответствие с этими данными. При помощи этих трех наборов данных, вместе взятых, создавали модель, которая хорошо согласовывалась с типами вводных параметров, усиливая модель в качестве инструмента для прогнозирования. Эта модель позволила предсказать важность создания нескольких мутаций в генах SBEII для получения высокого содержания амилозы в пшенице мягкой или тетраплоидной пшенице. ПРИМЕР 3: КЛОНИРОВАНИЕ И СРАВНЕНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ГЕНОВ SBEII ПШЕНИЦЫ Выделение генов SBEII из геномной библиотеки Aegilops tauschii и их характеристика с помощью ПЦР описаны в WO 99/14314 и WO 200162934-А. Последовательности ДНК из участка интрона 5 гена SBEIIa геномов А, В и D описаны в WO 200162934-A. Дальнейшие исследования привели к получению последовательностей из других участков генов SBEIIa пшеницы из различных генотипов пшеницы и дальнейшей характеристике гомеологичных генов, например, как приведено ниже. Амплифицировали участок экзонов 12-14 SBEIIa, полученный из гексаплоидного сорта Chara с применением праймеров AR2aE12F07 (5'-CATTCGTCAAATAATACCCTTGACGG-3' (SEQ ID NO:21)) и AR2aE14R07 (5'-CTTCACCAATGGATACAGCATCAG-3' (SEQ ID NO:22)). Это давало ПЦР-продукт приблизительно 656 п.о., которые предположительно были смесью амплифицированных фрагментов каждого из трех гомеологичных генов. Этот продукт секвенировали после клонирования в вектор ТОРО. Получали три полиморфные последовательности, которые охватывают участок экзонов 12-14 (фигура 7). На основе ПЦР-анализа линии Chinese Spring со сконструированной хромосомой с применением расщепленных амплифицированных полиморфных маркеров (CAP) последовательность FI-1 была отнесена к геному D, последовательность FI-13 была отнесена к геному В, а последовательность FI-15 была отнесена к геному А, как детально описано в Примере 4. Амплифицировали участок интрона 3 SBEIIa из двух гексаплоидных сортов пшеницы Sunco и Tasman с применением пары праймеров AR2akpnIF (5'-GGTACCGGCAAATATACGAG ATTGACCCG-3' (SEQ ID NO:23)) и AR2aSacIR (5'-GAGCTCCCACCTTCATGTT GGTCAATAGC-3' (SEQ ID NO:24)). Три полиморфных последовательности получали как из Sunco, так и из Tasman (фигура 8). Посредством сравнения с последовательностью SBEIIa из генома D (№ доступа в GenBank AF338431.1), последовательности Tasman 0257 и Sunco 0242 были отнесены к геному D. Последовательности Tasman 0272 и Sunco 0241 были отнесены к геному В на основе картирования полиморфных маркеров, основанных на полиморфизме по одному нуклеотиду в сегрегирующей популяции. Последовательности Tasman 0264 и Sunco 0243 оказались отличающимися от последовательностей из генома В и D, и было сделано заключение, что они должны быть из генома А. Применительно к этому участку SBEIIa также наблюдали генотип-специфические полиморфизмы между Sunco и Tasman в каждом из трех геномов. Амплифицировали участок экзона 3 SBEIIa из Chinese Spring (CS) с применением праймеров AR2aexon3F (5'-GATACCTGAAGATATCGAGGAGC-3' (SEQ ID NO:25)) и AR2aexon3R (5'-CGGTAGTCAAGATGGCTCCG-3' (SEQ ID NO:26)). Получали три полиморфные последовательности (фигура 9). При помощи сравнения с геном SBEIIa пшеницы (№ доступа в GenBank AF338431.1) обнаружили, что экзон 3а последовательности CS был из генома D. Обнаружили, что экзон 3b последовательности CS был из генома В на основе 100% идентичности последовательности с № доступа в GenBank FM865435, которая, как описано, происходит из хромосомы 2 В пшеницы мягкой. В отношении экзона 3d третьей последовательности CS показана 99% идентичность последовательности с № доступа в GenBank Y11282.1, которая, в свою очередь, имела высокую степень идентичности (99%) описанной частичной кодирующей последовательности из генома A Chinese Spring (№ доступа в GenBank EU670724). Это привело к предположению, что экзон 3d последовательности CS был из генома А. Амплифицировали участок экзона 1 SBEIIa из CS с применением праймеров AR2aexonlF (5'-CACACGTTGCTCCCCCTTCTC-3' (SEQ ID NO:29)) и AR2aexonlR (5-GAGAGGAGTCCTTCTTCCTGAGG-3 (SEQ ID NO:28)). Получали последовательности (фигура 10). Выравнивание с SBEII с № доступа в GenBank привело к отнесению экзона 1а последовательности CS к геному В (100% гомология по отношению к FM865435), а экзона 1b к геному А CS (99% гомология по отношению к Y11282.1), а экзона 1c к геному D CS (100% гомология по отношению KAF338431.1). Последовательности генов SBEIIa также получали из диплоидных предков или видов, родственных пшенице мягкой, а именно Triticum urartu, которая, как считается, является предком генома А пшеницы мягкой, Aegilops speltoides (также известный как Triticum speltoides), который считается предком генома В, и Aegilops tauschii, который, как считается, является близкородственным предку генома D. Фрагменты генов получали из этих видов следующим образом: десять праймеров сконструировали на основе нуклеотидной последовательности гена SBEIIa из генома D (№ доступа AF338432) или ее комплемента и охватывающие всю эту последовательность. Эти наборы праймеров применяли для амплификации фрагментов генов SBEIIa из диплоидных видов с помощью ПЦР. С применением 10 праймеров использовали 16 комбинаций в ПЦР с ДНК из диплоидных видов Т.urartu (геном АА), A.speltoides (ВВ), A.tauschii (DD) и тетраплоидного вида Т.durum (геном ААВВ). В результате этих амплификации выбрали всего 35 фрагментов, которые имели достаточное качество для секвенирования для того, чтобы определить их нуклеотидные последовательности. Последовательности будут сравнивать и обрабатывать с применением Contig Express, и будут определять объединенные последовательности предковых генов SBEIIa из диплоидных видов. Будут определять полиморфизмы, такие как SNP или вставки/делении, которые можно применять для того, чтобы различить гены из геномов А, В и D, и сконструировать специфические праймеры с применением амплификатора для определения мутантов. Нуклеотидная последовательность участка экзона 11-22 гена SBEIIa из Т. urartu показана в SEQ ID NO:13, экзонов 3-8 в SEQ ID NO:15, а экзонов 1-3 в SEQ ID NO:14. Нуклеотидная последовательность всего гена SBEIIa A.tauschii представлена в WO 2005001098 (включена в данный документ посредством ссылки). Картирование SBEIIa и SBEIIb по генетическому сцеплению SBEIIa и SBEIIb у пшеницы. Оба гена SBEIIa и SBEIIb были расположены на длинном плече 2 хромосомы пшеницы (Regina и соавт., 2005; Rahman и соавт., 2001) и на основании этих сообщений считалось, что они связаны между собой, хотя не было известно точно, насколько близкой была связь. Генетическое картирование генов SBEIIa и SBEIIb осуществляли с использованием расщепляющейся популяции, полученной из четырехлинейного скрещивания, вовлекающего родительские сорта Baxter, Yitpi, Chara и Westonia. Анализ популяции на рекомбинантов между генами выявил только одного рекомбинанта из приблизительно 900 потомства. Исходя из этих данных, было подсчитано, что генетическое расстояние между SBEIIa и SBEIIb было всего лишь 0,5 сМ, что являлось очень тесной связью между двумя генами. Для того, чтобы определить физическое расстояние между двумя генами, скринировали ВАС библиотеку Aegilops tauschii, построенную Moullet и соавт. (1999), для выявления SBEII содержащих клонов. Гибридизационные зонды, меченные32Р изготавливали из 5' и 3' областей каждого из SBEIIa и SBEIIb генов и использовали для скрининга библиотеки ВАС. Когда провели скрининг смесью четырех зондов, определили девять клонов с положительными сигналами гибридизации. Девять клонов затем скринировали отдельно с каждым из зондов и отобрали три клона. Один из них (ВАС2) полностью секвенировали и, как показано, он содержал ген SBEIIb полной длины. Из других клонов, ВАС1 как показано путем частичного прямого секвенирования, содержит ген SBEIIa и ВАС3, как оказалась, содержит части как SBEIIa, так и SBEIIb генов, как показано с помощью ПЦР. Это указывает, насколько близко два гена физически связаны. ВАС1 и ВАС3 будут полностью секвенированы. Это физические данные подтвердили близкую генетическую связь. Таким образом, было предположено, что делеционные мутации, создаваемые средствами, такими как радиация, которые повлияли на один из генов, вероятно, будут распространяться в или по обоим генам, т.е. являться нулевыми для обоих генов. Более того, это предоставляет нам возможность того, что такие делеционные мутанты могут быть жизнеспособными и иметь приспособленность дикого типа. По крайней мере, наблюдаемая тесная связь подняла вопрос о возможности получения мутантов с относительно небольшими делениями, которые не распространялись на другие связанные гены, необходимые для жизнеспособности или приспособленности. Такие мутанты разыскиваются так, как описано ниже в Примерах 5-7. ПРИМЕР 4: РАЗДЕЛЕНИЕ SBEIIA И SBEIIB ГОМОЛОГИЧНЫХ ГЕНОВ ПШЕНИЦЫ На основе форм полиморфизма последовательностей, полученных в Примере 2, разработали и подготовили анализы ПЦР для того, чтобы разделить гомологичные гены SBEIIa у пшеницы обыкновенной. Пару гнездовых праймеров, AR2aI13genomeF2 (5'-GTACAATTTTACCTGATGAGATC ATGG-3' (SEQ ID NO:9)) и AR2aI13genomeR2 (5'-CTTCAGGAATGGATACAGCATCAG-3' 10 (SEQ ID NO:30)) сконструировали для того, чтобы амплифицировать 207bp продукт из области между экзонами 12-14 SBEIIa пшеницы. При обработке двумя рестрикционными ферментами, Ssp1 и Mse1, амплифицируемый продукт с использованием этих праймеров от Chinese Spring (CS) производил четыре четких цепи размерами 207 п.н., 147 п.н., 99 п.н. и 108 п.н. Использование этого ПЦР-маркерного анализа на сконструированные линии CS хромосомы выявило, что 207 п.н. продукт произошел от генома А, 147 п.н. продукт произошел от генома В и 99 п.н. и 108 п.н. продукты произошли от генома D (Фигура 11). На основании последовательностей SBEIIa от диплоидных предков пшеницы, а именно Triticum urartu для генома A, Aegilops speltoides для генома В и Aegilops taiischii для генома D, разработали пары праймеров, которые могли бы специфически амплифицировать фрагменты из разных областей генов SBEIIa из разных геномов и различать их (Таблицы 4-8). В Таблицах 6-8 перечислены некоторые из форм нуклеотидного полиморфизма (столбец под именем SNP) и размеры амплифицированных фрагментов, полученных при использовании указанных пар праймеров. Эти же комбинации праймеров могут использовать для различения гомологичных генов SBEIIa А и В геномов из твердых сортов пшеницы. Разработка некоторых наборов ПЦР-праймеров, различающих гомологичные SBEIIb гены из А, В и D геномов пшеницы обыкновенной и определение SBEIIb в каждом из этих геномов у гексаплоидной пшеницы, описаны в WO 200162934-A. На основании SBEIIb последовательностей от диплоидных предков пшеницы, а именно Triticum urartu для генома A, Aegilops speltoides для генома В и Aegilops tauschii для генома D, разработали пары праймеров, которые могли бы специфически амплифицировать каждый из трех геномов из разных областей SBEIIb (Таблицы 9-10). Эти же комбинации праймеров могут использовать для различения гомологичных генов SBEIIa А и В геномов из твердых сортов пшеницы. ПРИМЕР 5: ПОЛУЧЕНИЕ И ОПРЕДЕЛЕНИЕ SBEII МУТАНТОВ Мутагенез пшеницы с помощью бомбардировки тяжелыми ионами. Мутагентизированную популяцию пшеницы получили в сорте пшеницы Chara, обычно используемом коммерческом сорте, с помощью бомбардировки тяжелыми ионами (HIB) семян пшеницы. Использовали два источника тяжелых ионов, а именно углерод и неон, для мутагенеза, который проводили в Riken Nishina Centre, Вако, Сайтама, Япония. Мутагенизированные семена высевали в теплице для того, чтобы получить M1 растения. Их самоопыляли для получения поколения М2. Образцы ДНК, выделенные из каждого из приблизительно 15000 М2 растений, индивидуально скринировали на мутации в каждом из SBEIIa и SBEIIb генов с использованием геномспецифических ПЦР-праймеров для SBEIIa (ARIIaF2/ARIIaR2) и SBEIIb (ARA19F/ARA23R) (диагностические ПЦР). Каждая из реакций ПЦР на образцы ДНК дикого типа произвела три отдельных продукта амплификации, что соответствовало амплифицируемым областям SBEIIa или SBEIIb генов на А, В и D геномах, тогда как отсутствие одного из фрагментов в реакциях ПЦР от мутировавших М2 образцов указывает на отсутствие соответствующей области в одном из геномов, т.е. присутствие мутантного аллеля, в котором по крайней мере часть гена была удалена. Такие мутантные аллели почти наверняка будут нулевыми аллелями. Скрининг линий М2 с использованием геномспецифических пар праймеров определил в общей сложности 34 мутантов, которые были мутантны по SBEIIa и/или SBEIIb генам. Мутантов в SBEIIa, затем скринировали на присутствие генов SBEIIb, и наоборот. Определенных мутантов, таким образом, классифицировали на три группы: ʺТип 1ʺ, где как SBEIIa, так и SBEIIb гены были мутантными т.е. с отсутствием обоих генов дикого типа в одном геноме, ʺТип 2ʺ, где только ген SBEIIa была мутантным, в то время как ген SBEIIb был дикого типа, и ʺТип 3ʺ, где только ген SBEIIb были мутантным, а ген SBEIIa был дикого типа в определенном геноме. Поскольку гены SBEIIa в А, В и D геномах были выделены с помощью диагностических реакций ПЦР, так же, как и гены SBEIIb, мутантные аллели могут быть отнесены к одному из геномов, соответственно которому продукт амплификации отсутствовал. Используемое в данном документе обозначение ʺА1ʺ относится к генотипу, где как SBEIIa, так и SBEIIb гены в геноме А были мутантными, ʺА2ʺ относится к генотипу, где ген SBEIIa был мутантным и ген SBEIIb в геноме А был дикого типа, и ʺA3ʺ относится к генотипу, где ген SBEIIa был дикого типа и ген SBEIIb в геноме А был мутантным. Обозначения ʺB1ʺ, ʺB2ʺ, ʺВ3ʺ, ʺD1ʺ, ʺ D2 ʺиʺ D3 ʺимеют аналогичные значения для В и D геномов. Были определены мутанты каждого из этих девяти возможных типов среди коллекции из 34 мутантов. Степень делеции хромосом в каждом из 34 мутантов определяли с помощью микросателлитного картирования. Микросателлитные маркеры, ранее картированные на длинном плече хромосом 2А, 2В и 2D (Таблица 12) тестировали на этих мутантов для того, чтобы определить наличие или отсутствие каждого маркера в каждом мутанте. Был сделан вывод, что мутантные растения, в которых все или большинство специфических микросателлитных маркеров хромосомы сохранялись, на основании производства соответствующего продукта амплификации в реакциях являются относительно небольшими делеционными мутантами. Такие мутанты были предпочтительными, учитывая, что было менее вероятно, что другие, важные гены пострадали от мутаций. Определенные мутанты и результаты микросателлитного картирования приведены в Таблице 13. Скрещивание мутантов. Мутантные растения, которые были гомозиготными по меньшим делениям, судя по микросателлитного маркерному анализу, отбирали для скрещивания для того, чтобы создать потомственные растения и зерно, которое имело мутантные SBEII аллели во множественных геномах. Потомственные растения F1 из скрещиваний самоопыляли и семена F2 получали и анализировали на их генотип SBEII. Скрининг 12 таких F2 популяций привел к определению 11 разных комбинаций мутантных аллелей (ʺдвойные нулевыеʺ) (Таблица 14). Двойную нулевую комбинацию генотипа B1D1 не получили в двенадцатом скрещивании, несмотря на скрининг более 1200 потомков F2 того конкретного скрещивания. Одним из возможных объяснений этого может быть наличие критического гена в окрестностях локуса SBEII в геномах В и D, но не в геноме А, и, следовательно, комбинация B1 и D1 двойных нулевых мутаций может приводить семя в состояние нежизнеспособности. Теоретически возможны двадцать семь комбинаций двойных нулевых мутантов, и больше популяций F2 будут скринированы для того, чтобы определить другие комбинации. ПРИМЕР 6: СОДЕРЖАНИЕ АМИЛОЗЫ В ОДИНОЧНЫХ ИЛИ ДВОЙНЫХ НУЛЕВЫХ SBEII МУТАНТАХ ПШЕНИЦЫ Процентное содержание амилозы в зерновом крахмале зерна одиночных и двойных нулевых растений, описанных в Примере 5, определяли с использованием йодометрического способа, который описан в Примере 1. Диаграмма рассеивания, отображающая содержание амилозы (ось Y) против номера мутантной линии (ось X) показана на Фигуре 4. Содержание амилозы в мутантных зернах колебалось от 27,3 до 38,7%. Содержание амилозы в образцах Chara дикого типа (немутировавшего) колебалось от 27,4% до 29,5%. В двадцати шести линиях зарегистрировано содержание амилозы выше 34%. Было отмечено, что из этих 26 линий 20 были двойными нулями, из которых некоторые были репликатами от того же скрещивания комбинаций или Типа 1 или Типа 2. Другими словами, существовала тенденция к значительному увеличению содержания амилозы в двойных нулевых комбинациях Типа 1 и Типа 2 по сравнению с содержанием амилозы в одиночных нулевых зернах. Важно и неожиданно до этого исследования, ни одно из зерен двойных нуль-мутантов не имело крахмала с более чем 40% амилозы. Они включали А1 В1, A1D1 и B1D1 генотипы, каждый из которых содержал четыре SBEIIa и четыре SBEIIb нуль-аллеля и сохранял два аллеля SBEIIa дикого типа и два аллеля SBEIIb дикого типа. Это наблюдение согласовалось, однако, с прогнозом, сделанным, исходя из данных в Примере 2. Поэтому был сделан вывод, что для того, чтобы получить зерно пшеницы с более чем 40% амилозы путем комбинирования мутаций, зерну необходимо иметь более четырех мутантных аллелей SBEIIa, или, альтернативно, если присутствовали только четыре мутантных аллеля SBEIIa, более четырех мутантных аллелей SBEIIb в сочетании с четырьмя аллелями SBEIIa, при этом предпочтительно все шесть SBEIIb генов являются мутантными. Также предполагалось, исходя из данных, что гены SBEIIa в каждом из геномов А, В и D экспрессировались при похожих уровнях относительно друг друга, т.е. экспрессия SBEIIa у пшеницы обыкновенной не была преимущественно из одного генома. Было интересно отметить, что генотипы ʺA3ʺ и ʺA3D3ʺ имели низкие содержания амилозы, согласующиеся с данными из Примера 2, подтверждая, что SBEIIb играл меньшую роль при определении содержания амилозы в зерне пшеницы относительно SBEIIa. ПРИМЕР 7: СКРЕЩИВАНИЯ В ПОПЫТКАХ СОЗДАНИЯ МУТАНТОВ С ТРЕМЯ НУЛЬ-АЛЛЕЛЯМИ Для того чтобы создать мутантные линии с более чем четырьмя мутантными аллелями SBEIIa, скрещивали некоторые из линий с одним нуль-аллелем или с двумя нуль-аллелями и потомков в F2 этих скрещиваний анализировали с использованием диагностических анализов ПЦР. Анализы исследовали на наличие трех SBEIIa и трех SBEIIb генов, и они использовались в попытке определить растения, которые имели нуль-мутации в SBEIIa и/или SBEIIb генах в каждом из геномов А, В и D (тройные нулевые линии по SBEIIa и/или SBEIIb). Скрещивания, которые проводили в первом эксперименте, и генотипы родительских линий, и возможные потомки в F2 с тремя нуль-аллелями перечислены в Таблице 15. Морфологию крахмальных гранул анализировали с помощью микроскопии выбранных нормального вида и сморщенных/щуплых F2 семян от этих скрещиваний. Были отобраны шесть сморщенных/щуплых семян, 5 от 08/dd гибрида и 1 от 08/bb гибрида, каждое из которых получили от скрещиваний родительского растения с одним нуль-аллелем D2 и родительского растения с двумя нуль-аллелями А1В2. Каждое из шести семян демонстрировало сильную деформацию гранул крахмала, демонстрируя ненормальные, искаженные формы для большинства гранул в семенах, что было похоже на гранулы, наблюдаемые в трансгенных семенах с повышенными уровнями амилозы (Пример 2). Проверка ряда сморщенных/щуплых семян и выбранных странно выглядящих семян из других скрещиваний не выявила измененной морфологии гранул крахмала, указывая, что фенотип, наблюдаемый в семенах 08/dd и 08/bb, был генотип-специфическим, а не обусловленным проблемами развития во время развития семени. Крахмал, выделенный из 6 семян, имеющих деформированные гранулы крахмала, объединяли и тестировали на содержание амилозы с использованием йодометрического способа, описанного в Примере 1. Было измерено, что содержание амилозы в объединенных образцах составляет 67% (Таблица 16). Уровни амилозы в семенах дикого типа (контроль) сортов Cadoux и Chara составляли примерно 35%. Генотипический анализ семян с измененной морфологией крахмальных гранул. Семена от 08/dd и 08/bb гибридов с измененной морфологией гранулы высевали и полученные в результате растения выращивали в теплице. ДНК, выделенную из растений, анализировали с использованием геном-специфических праймеров для SBEIIa и SBEIIb, описанных в Примере 3. Результаты анализов ПЦР показали, что каждое из этих семян было гомозиготным мутантом с двумя нуль-аллелями с генотипом А1 В2, B2D2 или A1D2, тогда как третий ген (дикого типа) присутствовал как в гомозиготном, так и в гетерозиготном состоянии. ДНК из этих растений в дополнительно тестировали с использованием количественной ПЦР (ПЦР в реальном времени, Rotorgene 6000) с использованием геном-специфических отдельных пар праймеров для того, чтобы провести анализ наличия или отсутствия и гомозиготности или гетерозиготности 3 SBEIIa генов в растениях. Парами праймеров, используемых для SBEIIa, были Snp6for/Arev5 (SEQ ID NO:51/SEQ ID NO:61) (геном А, продукт амплификации 205 п.н.), BSnp4/Arev5 (SEQ ID NO:55/SEQ ID NO:61) (геном В, продукт амплификации 494 п.н.) и DSnp7for/Drevl (SEQ ID NO:58/SEQ ID NO:62) (геном D, продукт амплификации 278 п.н.). Для того чтобы нормализовать реакции амплификации SBEIIa, в контрольных амплификациях использовали пару праймеров (SJ156/SJ242), которая амплифицировала 190 п.н. продукт гена CslF6, который является геном биосинтеза клеточной стенки, который, как ожидается, экспрессируется в равной степени у всех растений и расположен в хромосоме 7 пшеницы. ДНК растения дикого типа из подвергнутой мутагенезу популяции, обозначенной 2 В2, и из дикого типа сорта Chinese Spring (CS) использовали в качестве контрольных эталонов. Относительные значения концентрации, полученные в реакциях с SBEIIa праймерами, нормализовали со значением для Cslf6 праймеров для каждого эталонного препарата ДНК. Значения для возможных растений с тремя нуль-аллелями и CS рассчитывали относительно линии 2 В2. Из этих трех пар праймеров праймеры генома D давали четкую отдельную полосу для одного растения, обозначенного как S14, что позволило количественное определение. Не были получены полосы для генов SBEIIa в геномах А и В S14, указывая на то, что он был гомозиготным по мутантным аллелям в этих геномах. Количественное определение показало, что S14 имел аллель D комплементарный приблизительно на 30-50% по сравнению с 2В2, тогда как CS давал значение приблизительно 95% 2В2 для гена SBEIIa генома D. Это показало, что S14, который давал семена с уровнями содержания амилозы приблизительно 67%, был гомозиготным по SBEIIa нуль-мутациям в двух из геномов (А и В) и гетерозиготным в третьем геноме (D) дополнительно к тому, что он является гомозиготным по нуль-мутации SBEIIb в геноме А. То есть S14 имел А1 (гомозиготный), В2 (гомозиготный), D2/+(гетерозиготный) генотип. Подобным образом, количественная ПЦР показала, что растение, обозначенное как S24, имело В2 (гомозиготный), D2 (гомозиготный) и А1 (гетерозиготный) генотип. Анализ ПЦР показал, что остальные 5 растений имели следующие генотипы: 08dd9-B4 было гомозиготным по А1 В2 генотипу, т.е. гомозиготным мутантом по SBEIIa и SBEIIb в геноме А, гомозиготным мутантом по SBEIIa и диким типом SBEIIb в геноме В и гомозиготным диким типом по обоим генам в геноме D, в то время как 08bbll-D9 был гомозиготным по генотипу B2D2 и S28 и S22 были гомозиготными по генотипу A1D2. Анализ семян F3. Семена линий S28, S22, S14 и S24 высевали в теплице, полученные в результате растения самоопыляли, и семена (поколение F3) получали из каждого растения. Наблюдали, что фертильность растений пострадала в том, что количество семян на одно растение и процентное содержание колосьев, которые были фертильными, значительно снизилось по сравнению с диким типом, нуль-мутантами с одним нуль-аллелем и другими нуль-мутантами с двумя нуль-аллелями, выращенными в то же время и при тех же условиях, но не была утеряна (Таблица 17). Морфологию крахмальных гранул определяли с помощью световой микроскопии на 100-200 семенах от каждой из линий S28, S14 и S22. Из линии S22 определили 102 семени F3 с деформированными гранулами крахмала из числа 200 проверенных семян. Данные выявили отклонение соотношения расщепления от ожидаемого 1:2:1 (гомозиготный мутант: гетерозигота: дикий тип) с более высоким числом нормальных фенотипов, чем ожидалось. Для того чтобы увидеть, можно ли определить гомозиготное растение с высокоамилозным фенотипом, 102 семени с деформированными гранулами помещали в условия, подходящие для прорастания. Шестьдесят одно из 102 семян проросло. ДНК из этих 61 растений анализировали с помощью SBEIIa геном-специфичной ПЦР и оказалось, что все 61 растения являются таковыми с двумя нуль-аллелями генотипа A1D2, при этом не было определено гомозиготных растений с тремя нуль-аллелями. Ген SBEIIa дикого типа в геноме В, как было показано, является гетерозиготным, т.е. как дикий тип, так и мутантные аллели присутствовали в геноме В. 41 семя, которое имело деформированные гранулы крахмала, но не прорастало, анализировали на его генотип SBEIIa. Было отмечено, что многие из них имели три нуль-аллеля, т.е. показывали отсутствие продукта амплификации по генам SBEIIa и, следовательно, имели шесть нуль-аллелей по SBEIIa. Это подтвердило, что семена с тремя нуль-аллелями можно получить, но эти семена имели дефекты, которые влияли на прорастание. Зародыши из некоторых из этих семян вырезали и культивировали с использованием среды для культуры тканей в таких условиях, чтобы способствовать прорастанию зародышей. Некоторые зародыши прорастали успешно, в результате давая зеленые проростки. Однако когда эти проростки переносили в почву, они росли плохо и не давали фертильных растений пшеницы. Исходя из этих данных был сделан вывод, что гомозиготные семена с тремя нуль-мутациями на основе HIВ-производных делеционных мутаций, и проростки, полученные из этих семян и имеющие шесть нуль-аллелей SBEIIa и с полностью отсутствующим SBEIIa, были получаемы из этих скрещиваний, но это отрицательно сказалось на прорастании и росте, что указывает на существенную роль некоторых SBEIIa в этих процессах. В отличие от этого, двойные нулевые мутанты по SBEIIa, которые были гетерозиготными по третьему нуль-аллелю и, следовательно, имевшие пять нуль-аллелей SBEIIa, получали, они росли нормально и были фертильными, хотя и с пониженной фертильностью. Анализ экспрессии белков в линии S28. Экспрессию белка SBEIIa в развивающихся эндоспермах, полученных из одного целого колоса от растения S28, анализировали с помощью вестерн-блоттинга с использованием специфического антитела к SBEIIa. Все 15 эндоспермов в колосе демонстрировали структуру с отсутствием изоформ SBEIIa как А, так и D геномов (AD с двумя нуль-аллелями) только с одной присутствующей линией SBEIIa, экспрессированной из генома В. Из 15 эндоспермов 7 имели значительно более низкий уровень экспрессии SBEIIa генома В, чем другие, и чем таковой контрольной линии, NB1. На основании интенсивности полос экспрессию SBEIIa количественно определяли в каждом эндосперме. Остальные гранулы крахмала из эндоспермов очищали с использованием 90% Percoll. После ресуспендирования в 200 мкл воды гранулы исследовали под микроскопом. Было отмечено, что все эндоспермы, имеющие уровень экспрессии SBEIIa, который составлял менее приблизительно 36% от дикого типа, имели гранулы крахмала с искаженной морфологией, типичным высокоамилозным фенотипом. Диапазон уровней экспрессии белка SBEIIa наблюдали в развивающихся зернах от одного колоса растения S24 вплоть до менее 5% от дикого типа. Эндоспермы с более низкими уровнями SBEIIa также показывали измененную морфологию крахмальных гранул; фенотипы таким образом полностью коррелировали в этом эксперименте. Уровни экспрессии SBEIIb во всех этих эндоспермах также анализировали с использованием специфического к SBEIIb антитела. Результаты ясно показали, что существовало сопутствующее уменьшение экспрессии SBEIIb, соответствующее уменьшению в экспрессии SBEIIa. Обсуждение. Анализ семян от растений с А1 В2 мутантным генотипом (обобщенный в Таблице 18), имеющем четыре мутантных SBEIIa аллеля, показал, что содержание амилозы было повышено только незначительно для этого генотипа, что давало уровень амилозы менее 40%. В сравнении, данные от S14, S22, S24 и S28 семян продемонстрировали, что добавление пятого SBEIIa мутантного аллеля повышало уровень амилозы примерно до 67%. Соответственно, увеличение в числе от четырех SBEIIa нулевых аллелей до минимум пяти мутантных SBEIIa аллелей было критическим для повышения уровня амилозы до более чем 50% (весовых процентов), даже более 60% (весовых процентов). Этот вывод совпал с предположениями, сделанными из данных в Примере 2. Наблюдаемая связь аллельного состава с содержанием амилозы показала, что общее число мутантных аллелей SBEIIa в растении было важным в определении содержания амилозы (Таблица 18). Был также сделан вывод, что число мутантных аллелей SBEIIb также играло роль, хотя менее важную, чем число мутантных аллелей SBEIIa. Был также сделан вывод, что гомозиготные семена с тремя нуль-мутациями и проростки, имеющие шесть нуль-аллелей SBEIIa, и с полным отсутствием SBEIIa можно получить из мутантов с одним нуль-аллелем, содержащих HIB-производные делеции, но это отрицательно сказалось на их прорастании и росте, что указывает на существенную роль некоторых SBEIIa в этих процессах. Напротив, мутанты с двумя нуль-аллелями SBEIIa, которые были гетерозиготными по третьему нуль-аллелю и, таким образом, имели пять нуль-аллелей SBEIIa, получали, они росли нормально и были фертильными. ПРИМЕР 8: ДАЛЬНЕЙШИЕ ПОПЫТКИ ПОЛУЧЕНИЯ МУТАНТОВ С ТРЕМЯ НУЛЬ-АЛЛЕЛЯМИ С ПОЛНЫМ ОТСУТСТВИЕМ SBEIIA ИЛИ SBEIIB Наблюдаемая неспособность к получению мутанта с тремя нуль-аллелями с полным отсутствием SBEIIa в приведенном выше Примере, могла зависеть от конкретных мутантных растений, используемых в качестве родительских особей при скрещивании. Чтобы проверить это был проведен второй набор скрещиваний с использованием дополнительных родительских мутантов, также полученных от HIB-мутагенеза, обобщенный в Таблице 19. Семена F2 от 38 скрещиваний собирали и выделяли ДНК. По меньшей мере 96 образцов ДНК, полученных в результате 25 скрещиваний, 12 из которых - от скрещиваний, направленных на получение A1B2D2 генотипа (мутанта с тремя нуль-аллелями), но с использованием родительских линий, отличных от описанных в Примере 7, подвергали скринингу с помощью ПНР, для того, чтобы определить тенденцию расщепления. Жизнеспособных тройных нулей не определили ни в каком из этих скрещиваний. Выделение двойных нулей также варьировало в зависимости от скрещивания, но в большинстве случаев были получены ожидаемые генотипы. Семена F2 от шести A1B2D2 гибридов также подвергали скринингу с помощью микроскопии с тем, чтобы определить семена с высокоамилозным фенотипом. Такие семена определяли с умеренной частотой. Скрининг семян гибридов A2B2D2, 08/mm-l. Из скрещиваний, перечисленных в Таблице 19, 12, были скрещивания между родителем с генотипом А2 и родителем с генотипом B2D2, т.е. оба родителя были дикого типа по всем трем генам SBEIIb, с целью получения мутантов с тремя нуль-аллелями SBEIIa, имеющих A2B2D2 генотип. Препараты ДНК из приблизительно 672 семян F2, полученных от скрещивания 08/mm-l подвергали скринингу с помощью ПЦР. Соотношения расщепления были искажены относительно ожидаемых менделевских соотношений со значительно меньшим количеством определенных двойных нулей, чем ожидалось (Таблица 20). Тем не менее, определяли все возможные комбинации двойных нуль-мутаций в жизнеспособном семени. Никаких генотипов A2B2D2 с тремя нуль-аллелями не определяли среди 672 семян, хотя по менделевскому расщеплению можно было бы ожидать около 10. Параллельно семена F2 от гибрида 08/mm-l подвергали скринингу с помощью микроскопии с тем, чтобы определить любые семена с высокоамилозным фенотипом/фенотипом с деформированными гранулами крахмала (НА). Из 576 семян F2, которые проверили, не определили семян с фенотипом НА. Эта популяция семян должна была включать низкую частоту семян, имеющих 5 мутантных аллелей SBEIIa, являющихся гомозиготными мутантными в двух геномах и гетерозиготными мутантными/дикого типа в третьем геноме по SBEIIa. Наблюдаемое отсутствие семян с фенотипом НА в скрещивании A2B2D2 показало, что 5 мутантных аллелей SBEIIa при отсутствии любых мутантных аллелей SBEIIb, как оказывается, не достаточно для того, чтобы обеспечить высокоамилозный (>50% амилозы) фенотип. То есть снижение уровней SBEIIb относительно дикого типа дополнительно к значительно пониженному уровню SBEIIa в контексте 5 мутантных аллелей SBEIIa и одного аллеля дикого типа SBEIIa или эквивалентного уровня активности SBEIIa в эндосперме, имеющем мутацию частичной потери функции в одном или нескольких генах SBEIIa, было необходимо для того, чтобы обеспечить более 50% амилозы. Скрининг F2 семян из одиннадцати дополнительных скрещиваний между мутантными по одному аллелю SBEIIa родительскими особями (дикого типа по SBEIIb) и мутантными по двум аллелям SBEIIa родителями в двух других геномах также не определил какого-либо жизнеспособного семени с тремя нуль-мутациями генотипа A2B2D2. Скрещивания с участием мутаций Типа 3 Скрещивания с участием мутаций Типа 3 проводили с целью нахождения гомозиготных мутантов, имеющих два, четыре или шесть мутантных аллелей SBEIIb в сочетании с четырьмя мутантными аллелями SBEIIa и определения фенотипа полученных в результате растений и их зерна. В Таблице 21 обобщены результаты скрининга скрещиваний с участием мутаций Типа 3. Тройные нули определяли из гибридов A3B3D3 и A3B2D2, оба из которых показывали морфологию крахмальных зерен дикого типа. ПРИМЕР 9: ДАЛЬНЕЙШИЙ СКРИНИНГ В ОТНОШЕНИИ ВЫСОКОАМИЛОЗНЫХ МУТАНТОВ В дальнейших попытках создания мутантов с тремя нуль-аллелями SBEIIa из определенных одиночных мутантов была принята измененная стратегия. В этой стратегии добавили стадию из нескольких первоначальных возвратных скрещиваний одиночных мутантов после их определения с целью удалить несвязанные и неродственные мутации из растений М2, имеющих одиночные SBEIIa мутации. Его включили для снижения влияния мутировавшего фона в связи с высоким уровнем используемой мутагенной обработки, которая будет давать дополнительные мутации в растениях, независимые от желаемых SBEIIa мутаций, которые могут оказывать вредные воздействия при сочетании мутаций. Эти первоначальные возвратные скрещивания проводили, скрещивая мутантов М2 с растениями или озимой пшеницы сорта Apache, или яровой пшеницы сорта Chara. Первоначально, выполнили 13 скрещиваний для объединения мутаций во всех трех геномах и провели молекулярный анализ на ДНК из 21400 половин семян F2, причем вторую половину каждого семени оставляли для того, чтобы сохранить линию. В предварительном скрининге для выявления мутации использовали доминантные SSR маркеры, которые были геномспецифическими для SBEIIa или SBEIIb. Исходя из этого, определили 21 семя в качестве предполагаемых нуль-мутантов с тремя нуль-аллелями и 793 семени в качестве предполагаемых мутантов с двумя нуль-аллелями (Таблица 22) по отсутствию геномспецифических продуктов амплификации. Анализы генотипов семян пшеницы с помощью Q-PCR TaqMan. Первый раунд скрининга с использованием доминантных маркеров, как описано выше, не может дать различия между семенами, которые были гетерозиготными или гомозиготными дикого типа по любому одному гену SBEIIa. Поэтому был разработан TaqMan ПЦР анализ для того, чтобы отличить гетерозиготы и гомозиготы по гену SBEIIa в третьем геноме и подтвердить генотипы от первоначального скрининга. Поскольку анализ TaqMan выполняли на половинах семян и поскольку эндосперм пшеницы является триплоидным (3n) по каждому геному, два типа профилей были возможными для гетерозиготного эндосперма по аллелю SBEIIa дикого типа в третьем геноме - либо 2n, где аллель дикого типа был предоставлен материнской родительской особью, либо In, где аллель дикого типа был предоставлен отцовской родительской особью через пыльцу. В анализах с помощью Q-PCR TaqMan использовали систему для ПЦР в реальном времени Applied Biosystems 7900HT Fast Real Time PCR System (ABI, Фостер, Калифорния) для того, чтобы определить число копий гена SBEIIa в третьем геноме предполагаемых мутантных семян пшеницы с двойными аллелями. В анализах использовали геномную ДНК, выделенную из половин семян с помощью способов с использованием магнитных бусин (Nucleomag, каталожный №744400.24). ДНК загружали в 384-луночные планшеты и проводили двойные Q-PCR реакции в двух повторностях для каждого планшета. Реакции ПЦР разработали для того, чтобы амплифицировать 65 п.н. фрагмент экзона генов SBEIIa с использованием праймеров SBE2a QPCRABDF4 (прямой праймер): 5-ACGATGCACTCTTTGGTGGAT-3' (SEQ ID NO:31) и SBE2a QPCRABDR4 (обратный праймер): 5'-ACTTACGGTTGTGAAGTAGTCGACAT (SEQ ID NO:32). Зондом, используемым для доставки флюоресцентного сигнала в ходе Q-PCR реакций, был SBE2a QPCRABDS4 (TaqMan® зонд MGB, FAM) 5'-CAGCAGGCTTGATCAT-3' (SEQ ID NO:33). Последовательность из эндогенного гена, GamyB, использовали в качестве внутреннего контроля для того, чтобы нормализовать значение сигнала каждого образца с использованием праймеров GamyB IF (прямой праймер): 5'-GATCCGAATAGCTGGCTCAAGTAT-3' (SEQ ID NO:34) и GamyB2R (обратный праймер): 5'-GGAGACTGCAGGTAGGGATCAAC-3' (SEQ ID NO:35). Условия реакции были следующими: ʺгорячий стартʺ (95°С, 10 мин), за которым следовали 40 циклов денатурации (95°С, 15 с), отжиг (58°С, 60 с). Продукты реакции анализировали с использованием программного обеспечения Relative Quantification manager, интегрированного в систему 7900HT Fast Real Time PCR System. С использованием этого TaqMan анализа было подтверждено, что все из 21 предполагаемых тройных нуль-мутантов имеют два нуль-аллеля, а не три нуль-аллеля. Неправильное определение при первоначальном скрининге, как считается, было обусловлено ложноотрицательными результатами, возможно, вызванными плохим качеством матричной ДНК. Когда 14 из семян исследовали в отношении морфологии гранул крахмала с помощью световой микроскопии, было отмечено, что все 14 имели фенотип гранул дикого типа, что согласовалось с тем, что семена являются нуль-мутантами с двумя нуль-аллелями, а не нуль-мутантами с тремя аллелями. В анализах также определили несколько предполагаемых семян с двумя мутантными аллелями, которые были 2n гетерозиготными в третьем геноме, от скрещиваний М76, М77, М82, М83 и М86. Тем не менее, эти результаты нуждаются в подтверждении, так как было трудно отличить 2n гетерозиготный генотип от 3n гомозиготного генотипа даже в присутствии фона SBEIIa с двумя нуль-аллелями. Это будет подтверждено в следующем поколении потомства. Анализы также показали, что не было получено мутантов с двумя нуль-аллелями SBEIIa, которые были гетерозиготными мутантными/дикого типа по SBEIIa в третьем геноме от скрещиваний М79, М81, М74, М75, М78 и М80. Скрещивания М84 и М85 дали наибольшее число четко определенных гомозиготных нулевых мутантов SBEIIa с двумя нуль-аллелями, которые были хорошими кандидатами на то, чтобы являться 1n гетерозиготами (мутантным/дикого типа SBEIIa) в третьем геноме. Некоторые 2n гетерозиготы были также определены, но нуждаются в подтверждении. В этих скрещиваниях число нуль-мутантов SBEIIa с одним и двумя нуль-аллелями было более низким, чем частота, которая ожидалась от менделевского расщепления. Это искажение расщепления изучалось дополнительно. Там где ожидаемая частота гомозиготных одиночных мутантов должна была составлять 25%, в некоторых скрещиваниях частота была значительно ниже, находясь в диапазоне от 1% до 25%. Число двойных гомозиготных мутантов в потомстве скрещиваний для получения нуль-мутантов с тремя нуль-аллелями теоретически должно быть около 6% (1/4*1/4) на комбинацию (6% АВ, 6% AD и 6% АВ). Фактическое количество определенных двойных мутантов было значительно ниже и колебалось от 0 до 5,2%. Это позволило предположить, что некоторые комбинации мутаций были вредными для растения, например, для развития семени, приводя к более низкому выделению комбинаций мутаций, чем ожидалось. Два скрещивания, М74 и М75, дали самые низкие частоты по сравнению с ожидаемыми. Было отмечено, что родительские особи, используемые в этих скрещиваниях, не подвергались обратному скрещиванию с Apache или Chara до проведения скрещиваний, позволяя предположить, что дополнительные, неродственные мутации у родительских особей, связанные с мутагенной обработкой, возможно, играли роль в искажении соотношения расщепления. Даже для скрещиваний М76 и М86, которые давали большее количество одиночных мутантов, частота нуль-мутантов с двумя нуль-аллелями была низкой, в частности, для некоторых комбинаций. Например, для скрещивания М76 частоты растений с одним нуль-аллелем в геноме D и геноме А были 23% и 17%, соответственно, в то время, как частота нуль-мутантов с двумя нуль-аллелями как в А, так и D геномах была только 0,8%. Это позволило предположить, что некоторые комбинации мутаций SBEIIa были менее благоприятными для растения, чем другие, и, следовательно, подвергались негативному отбору. Доля мутантов, содержащих пять мутантных аллелей SBEIIa (растения с двумя нуль-аллелями, которые были гетерозиготными мутантами в третьем геноме), была также очень низкой. Ожидаемая частота была бы 9% (1/4*1/4*1/2*3), тогда как самое высокое наблюдаемое процентное соотношение было 1,1% в скрещиваниях М84 и М85. Корреляция между частотами одинарных и двойных гомозиготных мутантов в скрещиваниях М74 и М75 была довольно хорошей по мутациям SBEIIa в геномах А и D (0,789 и 0,558, соответственно), и в то же время значительно более низкой (0,386) для генома В. Возможным объяснением было бы то, что одна из родительских особей (19,832 (D1)/20,257(A2) [08/bl2]), используемых в М74 и М75 скрещиваниях, была изначально гетерозиготой, а не двойным гомозиготным мутантом. В этих условиях вероятность получения тройного нуль-мутанта (6 нуль-мутантных аллелей SBEIIa) была очень низкой и гораздо меньшей, чем ожидаемая частота 1/64. Тем не менее, ожидается, что самоопыление двойных мутантов, которые были также гетерозиготными в третьем геноме, в частности от скрещиваний М84 и М85, подтвердит, являются ли тройные нулевые мутанты выделяемыми из этих родительских мутантов. Потомство самоопыленных растений будут анализировать для того, чтобы определить тройное мутантное семя. ПРИМЕР 10: СКРИНИНГ В ОТНОШЕНИИ МУТАНТНЫХ СЕМЯН ПШЕНИЦЫ С ПОМОЩЬЮ NIR Быстрый, недеструктивный и высокопроизводительный способ разработали для скрининга отдельных семян в отношении фенотипа, который был связан с высоким содержанием амилозы. Способы скрининга, основанные на ПЦР, описанные в Примерах 4-6, хотя и были успешными при выявлении мутантов в популяции из 15000 семян, требовали получения необходимой ДНК из каждой половины семени после разрезания каждого семени вручную и, следовательно, были времязатратными и трудоемкими. Было установлено, что спектроскопия в ближней инфракрасной области (NIRS) можно использовать, чтобы различать высокоамилозный фенотип и фенотип, содержащий нормальное количество амилозы. Спектроскопия в ближней инфракрасной области (NIRS) является недеструктивной технологией, которая использовалась для того, чтобы определить некоторые свойства семян пшеницы (McClure, 2003). NIRS анализ отдельных семян пшеницы в отношении фенотипа, производящего восковой крахмал (низкое содержание амилозы), разработали на твердой пшенице Delwiche и соавт. (2006). Dowell и соавт. (2009) разработали автоматизированную систему сортировки с помощью NIRS для того, чтобы разделять восковую, частично восковую и нормальную твердую и гексаплоидную пшеницу. Насколько известно, этот способ не использовался ранее для того, чтобы различать семена с высоким содержанием амилозы у гексаплоидной пшеницы. Разработка и валидация эталонного биохимического способа в уменьшенном масштабе для измерения наблюдаемого содержания амилозы в материале дробленых семян. С целью калибровки NIRS измерений в соответствии с наблюдаемым содержанием амилозы в отдельных семенах нужно было создать математическую модель для того, чтобы соотнести спектральные данные от NIRS и наблюдаемое содержание амилозы, измеренное биохимическим способом на том же образце, в случае отдельных семян. В стандартных иодометрических способах, например способе, описанном в Примере 1, обычно используют несколько семян, которые объединяют перед солюбилизацией крахмала, что дает крахмал в объеме (объединенный), который обычно обезжиривают перед колориметрическим измерением содержания амилозы на основании связывания йода. Чтобы быть пригодным для использования в целях калибровки NIRS, этот способ был модифицирован, упрощен и уменьшен в масштабе с тем, чтобы позволить измерение наблюдаемого содержания амилозы в отдельных семенах, чтобы тем самым принять в расчет изменения содержания амилозы между семенами. В данном контексте используют термин ʺнаблюдаемое содержание амилозыʺ, потому что в модифицированном способе крахмал не очищали от молотого зерна, липиды, взаимодействующие с амилозой в крахмале, не удаляли и результаты выражали в виде процента от веса свежего семени, а не в виде процента выделенного крахмала из семян. По этим причинам значения, полученные для ʺнаблюдаемого содержания амилозыʺ, были намного ниже, чем значения, полученные с использованием стандартного способа, описанного в Примере 1. В качестве первой стадии этот способ был разрабатывали, оценивая линейность между колориметрической реакцией и содержанием амилозы с использованием молотого зерна пшеницы без очистки крахмала. Материалом с высоким содержанием амилозы, использовавшимся для этого, было зерно пшеницы, трансформированное конструктом hp5'-SBEIIa и имеющее уменьшенный SBEIIa (WM, линия 85.2 с, см. Пример 2), и пшеница с нормальным уровнем амилозы, которая была пшеницей дикого типа (WMC), выращенные в одно и то же время и при тех же условиях. Молотое WM зерно содержало около 80% амилозы, как определено с помощью стандартного способа Примера 1, в то время как молотое WMC зерно имело содержание амилозы примерно 25%. Образцы с различными соотношениями WM к WMC готовили из молотого зерна, но не подвергали дальнейшей очистке. Образцы примерно в 17 мг использовали для анализа. Смеси WM и WMC точно взвешивали в 1,5 мл микроцентрифужных пробирках. Для того чтобы солюбилизировать крахмал в образцах, 1 мл DMSO добавляли на 17 мг образца и затем смеси нагревали в 95°С водяной бане в течение 90 мин с периодическим перемешиванием на вортекс-мешалке. 10 мкл аликвоты из каждой смеси добавляли к 1,98 мл воды и обрабатывали 10 мкл 0,3% I2+3% KI в 0,01H растворе NaOH. Поглощение каждой смеси измеряли при 605 нм и значения поглощения пересчитывали в процент амилозы с использованием стандартной кривой. Стандартную кривую строили с использованием кукурузного амилопектина (Sigma каталожный №А7780) и картофельной амилозы (Sigma, A0512) в соотношениях от 0% до 100% амилозы и обрабатывали таким же образом, как образцы молотой пшеницы. Результаты показали линейную зависимость между уровнем включения WM и наблюдаемым содержанием амилозы, показывая, что упрощенный йодометрической способ можно использовать для калибровки NIRS и что очистка крахмала не требовалось для этой цели. Исследование биохимического эталонного способа измерения наблюдаемого содержания амилозы в половинах семян. Для этого исследования использовались семена от WM и WMC (контрольных) линий, полученные от полевых пробных экспериментов, проведенных в Аризоне и Вашингтоне. В общей сложности 47 половин семян с удаленными зародышами отдельно помещали в 1,5 мл микроцентрифужные пробирки и точно взвешивали перед добавлением 0,6 мл DMSO в каждую. Пробирки инкубировали на водяной бане при 95°С в течение 20 мин, после чего образцы давили в пробирках с помощью стеклянной палочки. Объем каждой смеси доводили до ровно 1 мл DMSO на 17 мг образца, после чего пробирки инкубировали при 95°С на водяной бане в течение еще 70 мин с периодическим перемешиванием на вортекс-мешалке. Наблюдаемую амилозу измеряли с помощью взятия аликвот по 10 мкл каждой смеси и их обработки 10 мкл 0,3% I2+3% KI в 0,011-1 растворе NaOH и разбавляли Н2O до 2 мл, как и ранее. Поглощение каждого образца измеряли при 605 нм и значения поглощения пересчитывали в процент ʺнаблюдаемой амилозыʺ с использованием стандартной кривой, как описано выше. При использовании этого способа наблюдаемое содержание амилозы WM семян находилось в диапазоне от 20% до 41% (в среднем 27%), в то время как наблюдаемое содержание амилозы в WMC семенах находилось в диапазоне от 7,5% до 17% (в среднем 11,4%). Причины, по которым эти показатели были существенно ниже, чем содержание амилозы, определенное по способу из Примера 1, описаны выше. Этот упрощенный способ следовательно позволил отличить семена с высоким содержанием амилозы от таковых с диким типом содержания амилозы. Калибровка NIRS. Изображения, полученные с помощью NIRS отдельных семян, для WM и WMC семян получали с использованием NIRS спектрометра с многоцелевым анализатором (МРА) (Bruker Optics, F-77420 Champs Sur Mames, Франция). Каждое семя помещали на дно стеклянной пробирки, обернутой алюминиевой фольгой и сканировали дважды. Спектры записывали с использованием спектрометра с многоцелевым анализатором Bruker МРА (Bruker Optics) (Bruker Optics), оснащенного волоконным зондом. Спектры записывали с использованием 32 эталонных изображений и 16 изображений образцов в диапазоне 4000-12500 см-1 при разрешении 16 см-1, что дало в результате 1100 точек данных. Используемым волоконно-оптическим зондом был IN 261 зонд для твердых веществ. Для того чтобы определить корреляцию между наблюдаемыми уровнями амилозы и показаниями NIRS, анализировали 226 отдельных WM или WMC с наблюдаемыми содержаниями амилозы в диапазоне от 6 до 44%. Во-первых, получили дублированные NIRS спектры для каждого семени, после чего наблюдаемое содержание амилозы измеряли биохимически для каждого семени в соответствии со способом, описанным выше. Спектральные выбросы (6 образцов) определяли как спектры, которые были ненормальными по сравнению со спектрами полного набора данных и исключали, а оставшиеся спектры анализировали с предварительной обработкой в виде интервальной нормализации данных. Программное обеспечение для вычисления методом дробных наименьших квадратов с полной (одной) перекрестной проверкой использовали для создания модели. Спектральным окном, используемым для разработки модели, было 9827-7150 см-1 и 6271-4481 см-1. Число PLS факторов, использованных для разработки калибровки, было равно 14. Точность калибровочной модели выражали с помощью стандартной ошибки перекрестной проверки (SECV) и коэффициента детерминации (R2). Эффективность калибровки показывали с помощью RPD, что является отношением стандартной ошибки предположения (RMSECV), к стандартному отклонению эталонного набора данных. Положительную корреляцию (R2=0,702) получали между биохимическими данными и спектральными данными от NIRS (Фигура 15). Был сделан вывод, что модель была достаточно надежной, чтобы отличить семена пшеницы с высоким содержанием амилозы от семян пшеницы с нормальным содержанием амилозы, но еще не достаточно точной, чтобы точно измерить содержание амилозы в одном семени. Следовательно, способ был пригоден для скрининга очень большой популяции семян с тем, чтобы обогатить ее зернами с фенотипом с высоким содержанием амилозы. Это была подтверждено следующим образом. Валидация NIRS. Для того чтобы валидировать способ NIRS при определении отличий высокоамилозного зерна и контрольного зерна, более 60 WM семян и 34 WMC семени сканировали дважды с помощью NIRS и рассчитывали прогнозируемые наблюдаемые содержания амилозы. Когда наблюдаемые значения амилозы, определенные таким образом, нанесли на график, чтобы получить профиль распределения для популяций WM и WMC, было видно, что две группы в основном разделялись с небольшим перекрытием (Фигура 16). Согласно этим результатам, семена с прогнозируемым амилозным фенотипом, определенным с помощью NIRS, равным или выше 30% могут считаться хорошими кандидатами на то, чтобы быть высокоамилозными семенами. Скрининг семян F2 от скрещиваний пшеницы с помощью NIRS. Скрининг с помощью NIRS проводили для того, чтобы выявить мутантные семена, имеющие высокое содержание амилозы. В скрининге использовали 2700 семян F2 от двух разных скрещиваний: М80 и М85, которые были, соответственно: 21,142 (В2) / Тип 1-20257 (А1) [08/h-111] // Тип 1-19,832 (D1) / CHARA и 5,706 (D2) / 21,668 (B2) // 20,257 (A1) / CHARA. Следовательно, скрининг был направлен на определение семян с генотипом A1B2D1 или A1B2D2, соответственно. Записывали два NIRS-спектра на семя, как описано выше. Семена, которые давали прогнозируемое значение наблюдаемой амилозы выше 34% в по меньшей мере одном из двух дублированных скринингов, отбирали в первую очередь для дальнейшего анализа. Из 2700 семян 27 семян отобрали и затем оценивали с помощью световой микроскопии для того, чтобы определить морфологию крахмальных гранул крахмала. Каждое семя тщательно скоблили, чтобы сохранить зародыш, но при этом получить достаточно материала эндосперма, подлежащего обследованию. Наблюдали, что четыре семени из 27 имели искаженную морфологию гранул крахмала. Эти четыре семени, как оказалось, имели наиболее высокое прогнозируемое наблюдаемое содержание амилозы из скрининга с помощью NIRS и были единственными, где оба предположительных наблюдаемых значения амилозы были выше 30%. Другие 23 семени показали нормальную (дикого типа) морфологию гранул. Молекулярные данные по семенам, отобранным путем скрининга с помощью MRS. ПЦР-анализ проводили на четырех семенах для того, чтобы определить генотип по SBEIIa для каждого из них. В начальных анализах использовали доминантные ПЦР маркеры, которые показывали наличие или отсутствие каждого гена SBEIIa в трех геномах. Было показано, что три из семян являются двойными нуль-мутантами, в то время как четвертое было предполагаемым тройным нуль-мутантом. Однако при дополнительном исследовании с кодоминантным ПЦР маркером (смотри ниже) было показано, что все четыре семени являются двойными нуль-мутантами по SBEIIa (т.е. с отсутствием SBEIIa в двух геномах) и гетерозиготными по мутантному гену SBEIIa в третьем геноме. Таким образом, эти семена содержали 5 мутантных аллелей SBEIIa и по меньшей мере два мутантных аллеля SBEIIb. Когда зародыш от каждого семени помещали в условия для прорастания, ни один из них не пророс успешно, возможно, потому, что они были слишком повреждены или комбинация мутаций была слишком вредной. Для того чтобы попытаться определить больше кандидатов, дальнейший скрининг с помощью NIRS выполняли на большем количестве семян потомства F2 от скрещиваний М80 и М85 с менее строгим отбором семян-кандидатов. Критерий отбора для второго скрининга был таким, что одно из прогнозируемых значений наблюдаемой амилозы должно быть выше 30%, а второе - по меньшей мере 23%. Новый набор из 22 семян отобрали для оценки гранул крахмала с помощью световой микроскопии. Из них 22 кандидатов, 1 семя, BD85; 9F08 (P279-F08-834), показало искаженный фенотип крахмальных гранул. Этого мутанта в дальнейшем анализировали с помощью ПЦР, и было показано, что он являлся двойным нуль-мутантом по SBEIIa в геномах А и В и гетерозиготным по мутантному гену SBEIIa в геноме D. Он был успешно пророщено для размножения. ПРИМЕР 11: ВЫЯВЛЕНИЕ АЛЛЕЛЕЙ КРАХМАЛ-ВЕТВЯЩЕГО ФЕРМЕНТА С ИЗМЕНЕННЫМ СРОДСТВОМ СВЯЗЫВАНИЯ КРАХМАЛА Популяции мутагенизированных зерен пшеницы, полученных путем обработки химическими мутагенами азидом натрия или EMS, подвергали скринингу для определения мутантов, которые имели точечные мутации в генах SBEIIa и, следовательно, потенциально пониженную, но не утерянную, активность SBEIIa-A, -В или -D или активность SBEIIb-A, -В или -D (частичные мутанты) относительно пшеницы дикого типа. Скрининг в отношении мутантов был основан на измерении количества белков SBEIIa или SBEIIb с использованием вестерн-блоттинга с антителами, специфическими для SBEIIa или SBEIIb (смотри Пример 2), или с помощью методик, основанных на сродстве, следующим образом. Также ожидалось, что этот скрининг обнаружит мутантов с точечными мутациями, при которых полностью отсутствовала активность SBEIIa-A, -В, или -D, а также мутантов с частичной активностью. Нативный гель-электрофорез белковых экстрактов из зерна, включающих крахмал-ветвящие ферменты через полиакриламидную матрицу, содержащую гликоген, амилопектин, амилозу или β-предельный декстрин (аффинный гель-электрофорез), обеспечивает способ определения аллелей SBEIIa или SBEIIb, которые кодируют SBEIIa или SBEIIb с измененной способностью к связыванию крахмала. Учитывая, что активный центр крахмал-ветвящих ферментов содержит участок связывания крахмала, полипептиды SBEII с измененной эффективностью связывания, вероятно, имеют изменения в каталитической скорости и/или сродстве. В частности, ожидалось, что полипептиды с пониженной эффективностью связывания имеют пониженную активность SBEII. Использовали следующие способы, основанные на Morell и соавт. (1997); и Kosar-Hashemi и соавт, (2006) с некоторыми изменениями. Получение белков. Растворимые белки экстрагировали путем гомогенизации выделенных эндоспермов из развивающихся семян (примерно 15 дней после цветения) в 50 мМ фосфатном буфере, рН 7,5, содержащем 5 мМ EDTA, 5 мМ DTT, 0,4% коктейль ингибиторов протеаз и 20% глицерин. После центрифугирования при 14000 g в течение 10 мин супернатант использовали для гель-электрофореза. Концентрацию белка в экстрактах оценивали с использованием реактива для анализа Coomassie Plus Protein Assay Reagent. Аффинный электрофорез. В методике двумерного (2D) аффинного электрофореза для разделения изоформ белка SBEIIa, аликвоты (40 мкг или 100 мкг) белковых экстрактов загружали в первое измерение геля, неденатурирующий полиакриламидный гель, вылитый в устройство Hoefer SE600 с вертикальным 16 см слоем геля. Разрешающим компонентом геля второго измерения был 6% неденатурирующий гель (14×16 см или 16×16 см, толщина 1,5 мм), содержащий 10% глицерин с соответствующим количеством полисахаридной мишени (амилопектин, β-предельный декстрин или гликоген), иммобилизованной в структуре геля. Концентрирующий гель (без полисахарида) выливали до 1 см от верха стеклянных пластин, используя гребень для того, чтобы образовать лунки. Гели прогоняли в течение ночи при 4°С при постоянном напряжении (100 В для гликогена и β-предельного декстрина и 135V для амилопектин-содержащих гелей). В качестве альтернативы, использовали одномерную систему для разделения белков SBEIIa, в которой белковые экстракты (20 мкг) загружали на неденатурирующий полиакриламидный гель. Разрешающим компонентом геля был 6% неденатурирующий гель, содержащий 10% глицерола с 0,15% β-оредельного декстрина, иммобилизованного в пределах структуры геля, в то время как концентрирующий гель не содержал полисахаридов. Гели прогоняли при 4°С при постоянном токе 20 мА на гель и максимальным напряжении 200 В. SBEIIb белки также могут разделять на Bis-Tris 4-12% градиентном геле (Invitrogen). Гель прогоняют при 4°С при постоянном токе 20 мА на гель и максимальным напряжением 200 В. Иммунологическое выявление. Для иммунохимического выявления SBEII белков после электрофореза, белки переносили из гелей на нитроцеллюлозные мембраны, используя аппарат для полусухого электроблоттинга ТЕ 70 PWR semi-dry transfer unit (Amersham Biosciences). Гибридизационный буфер содержал 39 мМ глицина, 48 мМ Tris, 0,0375% SDS и 20% метанола. Перенос проводили в течение 1-1,5 ч при постоянном токе 0,8 мА/см2. Мембрану блокировали 5% обезжиренным молоком перед вестерн-блоттингом с использованием первичных поликлональных антител кролика, специфичных для SBEIIa пшеницы. Формы миграции изоформ SBEII, кодируемых гомоаллелями из А, В и D геномов пшеницы показали различия между разными сортами пшеницы, будучи проанализированными способом одномерного аффинного гель-электрофореза. Для некоторых сортов было возможно четкое разделение А, В и D гомоформ, позволяя простое измерение полиморфизма в мутагенизированных популяциях от тех сортов. Например, аффинный гель-электрофорез белковых экстрактов из эндоспермов сортов пшеницы дикого типа Sunstate и NB1 показал четкое разделение SBEIIa-A, -В и -D изоформ. Аллели фермента ветвления с пониженным сродством к крахмалу мигрировали на большее расстояние через полисахарид-содержащий полиакриламидный гель, чем соответствующие нативные гомоаллели. Линии, содержащие аллели с пониженной экспрессией или отсутствием экспрессии определенного гомоаллеля, определяли с помощью наличия/отсутствия полосы в гомозиготном состоянии и через денситометрию для того, чтобы измерить интенсивность полос у гетерозиготных линий. Для того, чтобы подтвердить этот способ, было подтверждено, что в SBEIIa- и SBEIIb-мутантных растениях, которые были определены с помощью генотипического анализа (Пример 6), отсутствуют специфические SBEIIa или SBEIIb белки, с помощью аффинного гель-электрофореза, в соответствии с их генотипами. Эти эксперименты подтвердили этот способ анализа белков для выявления мутантов, имеющих снижение количества или активности SBEII изоформы. Скрининг популяции из 2100 мутагенизированных линий пшеницы сорта Sunstate, обработанных азидом натрия, как описано в Zwar and Chandler (1995), с использованием аффинного гель-электрофореза с β-оредельным декстрином привел к определению 18 мутантов, которые имели или измененную мобильность в аффинных гелях одного из белков SBEIIa (мутанты по сродству) или нуль-мутантов по одному из генов SBEIIa, основываясь на отсутствии детектируемого белка, кодируемого этим геном. Константу диссоциации (Kd), взаимодействий крахмал-фермент для каждой из изоформ SBEIIa в одном из мутантов по сродству рассчитали путем измерения изменения в подвижности фермента в зависимости от концентрации β-оредельного декстрина в 1-D аффинном геле, как описано в Kosar- Hashemi и соавт., 2006. Этот мутант по сродству имел белки SBEIIa со следующими значениями Kd: 0,53 г/л, 0,52 г/л и 1,69 г/л для SBEIIa-A, -B SBEIIa и SBEIIa-D изоформ соответственно (Фигура 13). Высшее наблюдаемое значение Kd для D изоформы, по сравнению с таковым А и В изоформ указывало на более низкое, пониженное сродство этой изоформы к связыванию с крахмалом, указывая, что эта линия была мутантом по сродству по SBEIIa-D гену. Ожидалось, что изоформа D-генома (SBEIIa-D) этой линии, имеет более низкую ферментативную активность, но не полную потерю активности, по сравнению с другими двумя изоформами. Это ожидание подтверждено анализами SBEII-активности в присутствии нулевых аллелей SBEIIa-A и SBEIIa-B. Одиночных SBEIIa мутантов, определенных из мутагенизированной азидом натрия популяции Sunstate затем скрещивали с ранее определенными двойными нулевыми HIB-мутантами для выделения тройных мутантов, которые не обладают SBEIIa активностью двух геномов с полной или частичной потерей активности третьего генома. Проводили четыре скрещивания для того, чтобы выделить A1B2D2, два скрещивания, каждое, чтобы выделить A2B2D2 и A2B2D1, и одно скрещивание для того, чтобы выделить генотипы A1B2D1. Исследование морфологии гранул крахмала семян F2 от одного из A1B2D2 скрещиваний с помощью микроскопии определило семена с сильно искаженными гранулами крахмала, аналогично тому, что находится в высокоамилозных формах крахмала (по меньшей мере 70% амилозы). Генотип и амилозный фенотип этих семян подтвержден с помощью анализирования SBEIIa аллелей в семенах и потомстве и путем экстракции и анализирования крахмала из зерна потомства. Также проводили восемь скрещиваний между одиночными мутантами по сродству для того, чтобы получить двойных мутантов по сродству по SBEIIa. Это включало скрещивания, созданные с целью выделения А2 В2, A2D2 и B2D2 двойных мутантов по сродству. F2 потомков анализируют с помощью способов, описанных выше для того, чтобы определить двойных гомозиготных мутантных по сродству. ПРИМЕР 12: СВОЙСТВА ГРАНУЛ КРАХМАЛА И КРАХМАЛА ИЗ ВЫСОКОАМИЛОЗНОГО ЗЕРНА ПШЕНИЦЫ Изменения в морфологии гранул крахмала и двулучепреломлении. Свойства крахмала и гранулы крахмала исследовали на трансгенной высокоамилозной пшенице, описанной в Примере 2. Сканирующую электронную микроскопию использовали для того, чтобы определить общие изменения в размере и структуре гранулы крахмала. По сравнению с нетрансформированным контролем, гранулы крахмала из эндоспермов, имеющих сниженную экспрессию SBEIIa, демонстрировали значительные морфологические изменения. Они были весьма неправильными по формы и многие из А гранул (диаметром >10 мкм), как оказалось, являются серповидными. В противоположность этому, как А, так и В (диаметром <10 мкм) гранулы крахмала из эндоспермов, имеющие пониженную экспрессию SBEIIb и неизмененную экспрессию SBEIIa имели гладкую поверхность, были сферической или эллипсоидной формы и неотличимыми от гранул крахмала пшеницы дикого типа. При рассмотрении в поляризованном свете, гранулы крахмала дикого типа как правило показывают сильный характер двулучепреломления. Тем не менее, двулучепреломление было значительно пониженным для гранул, содержащих высокоамилозный крахмал. Менее 10% гранул крахмала от линий, имеющих пониженную экспрессию SBEIIa и 70%-80% содержания амилозы, были двулучепреломляющими при визуализации в поляризованном свете. Для линий, не имеющих существенной экспрессии SBEIIb, но с диким типом экспрессии SBEIIa, изменений в двулучепреломлении не наблюдалось по сравнению с нетрансформированными контролями. Как в линиях дикого типа, так и SBEIIb-супрессированных, приблизительно 94% крахмальных гранул демонстрировали полное двулучепреломление. Данные приведены в Таблице 23. Потеря двулучепреломления, следовательно, тесно коррелирует с высоким содержанием амилозы. Содержание амилозы в трансгенном зерне пшеницы. Содержание амилозы в трансгенном зерне пшеницы анализировали с помощью двух независимых способов, а именно йодометрического способа и способа эксклюзионной хроматографии (SEC). Иодометрическое определения содержания амилозы основывалось на измерении изменения цвета, индуцируемого, когда йод связывается с линейными областями 1,4-глюкана, по отношению к стандартной кривой, полученной с использованием известных концентраций очищенной картофельной амилозы и амилопектина, как описано в Примере 1. Способ эксклюзионной хроматографии основывался на разделении, с помощью колоночной хроматографии, амилозы и амилопектина, которые не утратили ветвей, с последующим измерением концентрации крахмала во фракциях, элюированных из колонки. Анализировали три генотипа зерна. Во-первых, растения, трансформированные с помощью hp-SBEIIa-конструкта и имеющие очень низкие уровни экспрессии SBEIIa, во-вторых, растения, содержащие hp-SBEIIb конструкт и не имеющие обнаруживаемой экспрессии SBEIIb, но дикого типа по SBEIIa, и, в-третьих, нетрансформированный контроль дикого типа (NB1). Зерно из растений с отсутствующей экспрессией SBEIIb (008) имело содержание амилозы 27,3%, определенное йодометрическим способом и 32% по способу SEC. Это не было существенно отличающимся от содержания амилозы в зерне из нетрансформированной контрольной линии NB1 (31,8% иодометрический, 25,5% SEC). Тем не менее, в зерне, имеющем пониженную экспрессию SBEIIa (линия 087) содержание амилозы, было существенно повышенным (88,5% иодометрический, 74,4% SEC). Считается, что разница в этих двух фигурах для линии 087, является наличием некоторого ʺпромежуточного материалаʺ, который связывает йод подобно амилозе и измерялся иодометрическим анализом, как амилоза, но отделялся в колоночной хроматографии как больший амилопектин. Распределение длин цепей крахмала с помощью FACE. Распределение длин цепи изоамилазного утратившего разветвления крахмала определяли электрофорезом углеводов с помощью флуорофора (FACE). Эта техника обеспечивает высокое разрешение анализа распределения длин цепей в диапазоне DP от 1 до 50. Из графика молярной разности, в котором нормализированное распределение длин цепи нетрансформированного контроля вычитали из нормализированного распределения трансгенных линий, было видно, что существовало заметное снижение доли длин цепи 6-12 DP и соответствующее увеличением в длинах цепи больше, чем DP 12 в крахмале из зерен, имеющих пониженную экспрессию SBEIIa. Статистически значимого изменения в распределении длин цепи крахмала из HP-SBEIIb-линий не наблюдалось по сравнению с диким типом. Молекулярная масса амилопектина и амилозы. Распределение молекулярной массы крахмала определяли с помощью эксклюзионной ВЭЖХ (SE-HPLC). ВЭЖХ система состояла из насоса GBC (LC 1150, GBC Instruments, Вик, Австралия), оснащенных автодозатором (GBC, LC1610) и испарительным детектором светорассеяния (ELSD) (ALLtech, Deerfield, США). Использовали Ultrahydrogel™ 1000 колонку, Ultrahydrogel™ 250 колонку и предохранительную колонку (7,8×300 мм, Уотерс, Япония), и выдерживали при 35°С во время проведения ВЭЖХ. Аммоний-ацетатный буфера (0,05 М, рН 5,2) использовали в качестве подвижной фазы при скорости потока 0,8 мл мин-1. Молекулярная масса амилопектина в крахмале зерна с пониженным SBEIIa, как оказалось, значительно ниже, чем таковая амилопектина в формах крахмала NB1 (дикий тип, нетрансгенный) и зерна с пониженным SBEIIb (пиковое значение 7166 кДа по сравнению с 45523, 43646 кДа). В противоположность этому, молекулярная масса амилозы из зерна с пониженным SBEIIb существенно не отличалась по сравнению с таковой зерна дикого типа от нетрансформированного сора NB1. Данные находятся в Таблице 24. Общее содержание крахмала в эндосперме пшеницы с пониженной экспрессией SBEIIa. Анализ общего содержания крахмала в зерне, как процентного значения от веса зерна, выявил небольшое снижение содержания крахмала эндосперма в линии hp-SBEIIa (43,4%), по сравнению с 52% в контроле и 50,3% в линии hp-SBEIIb (Таблица 23). Это показало, что было некоторое снижение общего синтеза крахмала, когда снизилась экспрессия SBEIIa с помощью ингибиторного конструкта. Набухаемость крахмала (SSP). Набухаемость крахмала желатинизированного крахмала определяли, следуя маломасштабному тесту из Konik-Rose и соавт. (2001), в котором измерялось поглощение воды во время клейстеризации крахмала. Оценочное значение SSP было значительно более низким для крахмала из линии со сниженным SBEIIa, с цифрой 3,51, по сравнению с крахмалом из контроля (9,31) и зерна со сниженным SBEIIb (10,74) (Таблица 23). Свойства склеивания крахмала. Параметры вязкости крахмального клейстера определяли с использованием быстрого анализатора вязкости Rapid Visco Analyzer (RVA), главным образом так, как описано в Regina и соавт. (2004). Температурный профиль для RVA включал следующие этапы, на которых: выдерживают при температуре 60°С в течение 2 мин, нагревают до 95°С в течение 6 мин, выдерживают при 95°С в течение 4 мин, охлаждают до 50°С в течение 4 мин, и выдерживают при 5,0°С в течение 4 мин. Результаты (Таблица 25) показали, что пиковая и конечная вязкости были значительно более низкими в крахмале из зерна с пониженным SBEIIa, по сравнению с контрольным пшеничным крахмалом. Свойства клейстеризации крахмала. Свойства клейстеризации крахмала изучали с использованием дифференциальной сканирующей калориметрии (ДСК, DSC), как описано в Regina и соавт. (2004). DSC проводили на дифференциальном сканирующем калориметре Perkin Elmer Pyris 1. Крахмал и воду заранее перемешивали в соотношении 1:2 и примерно 50 мг отвешивали в кювету DSC, которую запечатывали и оставляли для того, чтобы уравновеситься в течение ночи. Скорость нагрева 10°С в минуту использовали для того, чтобы нагреть тестируемые и контрольные образцы от 30 до 130°С. Данные анализировали с использованием программного обеспечения, предоставленного с инструментом. Результаты (Таблица 26) четко показали задержанную температуру окончания клейстеризации (72,6°С) для крахмала из зерна с пониженным SBEIIa по сравнению с контролем (66,6°С). Пиковая температура клейстеризации была также более высокой в крахмале со сниженным SBEIIa (63,51°С), по сравнению с крахмалом контроля (61,16°С). ПРИМЕР 13: АНАЛИЗ ВЫСОКОАМИЛОЗНОЙ ПШЕНИЧНОЙ МУКИ ВО ВРЕМЯ ОБРАБОТКИ Исследования обработки давлением в сотрудничестве с CSIRO питания и диетологии, Верриби. Структурную характеристику форм высокоамилозного крахмала пшеницы в сравнении с нативным крахмалом проводили с использованием малоуглового рентгеновского рассеяния (SAXS). Исследование было разработано, при этом исследование включает a) характеристику сырой пшеничной муки и b) анализ процесса клейстеризации в режиме реального времени при варке под давлением образцов муки или крахмала при температурах выше 100°С и с) структурные изменения при охлаждении в течение 0-10 суток, и ретроградации. В исследовании использовали образцы пшеничной муки с различным содержанием амилозы, в диапазоне от примерно 25% (дикий тип) до примерно 75%, увеличиваясь с шагом примерно в 10%. Три набора образцов муки включили в эксперименты. Во-первых, из чистых линий без объединения с высокоамилозной пшеницей от линий с пониженным SBEIIa, линии пшеницы со средним уровнем амилозы АС45.1, которую трансформировали с помощью комбинированного hp конструкта, содержащей около 50% амилозы (Пример 2) и из контрольной пшеницы (NB1). Во-вторых, из объединенного материала пшеницы из трансформированных линий, как описано в Примере 2, при этом объединяя образцы с шагом в 10% увеличивая содержание амилозы. β-третьих, сравнение муки из разных видов, включая пшеницу (высокоамилозную, дикого типа, и пшеницу с отсутствием SSIIa), ячмень (дикого типа, высокоамилозный за счет пониженных SBEIIa и SBEIIb, и высокоамилозный за счет пониженного SSII) и высокоамилозную кукурузу. Результаты анализа резистентного крахмала в объединенном пшеничном материале с диапазоном содержания амилозы показали линейное увеличение в резистентном крахмале от содержания амилозы >40%. ПРИМЕР 14: ПРОИЗВОДСТВО ВИДОВ ХЛЕБА И ДРУГИХ ПИЩЕВЫХ ПРОДУКТОВ Одним из наиболее эффективных способов поставки в рацион зерна, такого как высокоамилозная пшеница, является хлеб. Для того, чтобы показать, что высокоамилозную пшеницу можно легко включать в виды хлеба, и изучить факторы, которые сделали возможным сохранение хлебопекарного качества, получили образцы муки, проанализировали и использовали в выпечке. Использовали следующие способы. Способы. Зерна пшеницы кондиционировали до содержания влаги 16,5% в течение ночи и перемалывали с помощью либо лабораторной мельницы Buhler в BRI Ltd, Австралия, либо с использованием мельницы Quadromat Junior с последующим просеиванием до получения конечного размера частиц 150 мкм. Содержание белков и влаги в образцах определяли с помощью отражения инфракрасного излучения (БИКС) в соответствии со способом 39-11 ААСС (1999) или по способу Дюма и воздушной печи в соответствии со способом 44-15 А ААСС (AACC5 1999). Замешивание с помощью микромешалки с Z-образными месильными органами. Оптимальные значения водопоглощения видов пшеничной муки определяли с помощью микромешалки с Z-образными месильными органами с использованием 4 г тестируемой муки на смесь (Gras и соавт. (2001); 30 Bekes и соавт. (2002). Постоянную угловую скорость со скоростями вращения вала для быстрой и медленной лопастей 96 и 64 оборотов в минуту, соответственно, использовали при всех смешиваниях. Смешивание проводили в трех повторностях, каждая в течение 20 минут. Перед добавлением воды к муке, автоматически записывали исходный уровень (30 сек) путем смешивания только твердых компонентов. Добавление воды проводили в одну стадию с использованием автоматического водяного насоса. Следующие параметры определяли по результатам экспериментов индивидуального смешивания путем взятия средних: WA% - водопоглощение определяли при консистенции теста в 500 единиц Брабендера (BU); время тестообразования (DDT): время до пикового сопротивления (сек). Миксограммы. Для того, чтобы определить оптимальные параметры замешивания теста с мукой из модифицированной пшеницы, образцы с переменным водопоглощением, соответствующим водопоглощению, определенному с помощью микромешалки с Z-образными месильными органами, замешивали в 10-г миксографе-прототипе CSIRO, поддерживая общую массу теста постоянной. Для каждого из образцов муки записывали следующие параметры: МТ - время перемешивания (сек); PR - пиковое сопротивление миксографа (произвольные единицы, AU); BWPR - производительность при пиковом сопротивлении (произвольные единицы, AU); RBD - спад сопротивления (%); BWBD - спад производительности (%); TMBW - время до достижения максимальной производительности (с), и MBW - максимальная производительность (произвольные единицы, AU). Тестирование микрорастяжения. Параметры растяжимости теста измеряли следующим образом: виды теста смешивали до пикового тестообразования в 10-г миксографе-прототипе. Тесты на растяжение со скоростью 1 см/с проводили на анализаторе текстуры ТА.ХТ2i с помощью установки Киффера с измененной геометрией для измерения растяжимости клейковины теста (Mann и соавт., 2003). Образцы теста для тестирования растяжения (≈1,0 г/тест) формовали при помощи формовочного устройства Киффера и оставляли при 30°С и 90% RH на 45 мин перед тестированием растяжения. R_Max и Ext_Rmax определяли из данных с помощью программного обеспечения Exceed Expert (Smewing, The measurement of dough and gluten extensibility using the SMS/Kieffer rig and the TA.TX2 texture analyzer handbook, SMS Ltd: Surrey, UK, 1995; Mann (2002)). Иллюстративный рецепт, в котором за 100% берут 14 г муки, был следующим: мука 100%, соль 2%, сухие дрожжи 1,5%, растительное масло 2%, и добавка, улучшающая качество (аскорбиновая кислота 100 частей на миллион, грибная амилоза 15 частей на миллион, ксиланаза 40 частей на миллион, соевый порошок 0,3%, полученный от Goodman Fielder Pty Ltd, Австралия) 1,5%. Уровень добавления воды был основан на значениях водопоглощения в микромешалке с Z-образными месильными органами, которые корректировали по общему рецепту. Муку (14 г) и другие ингредиенты замешивали до пикового времени развития теста в 35-г миксографе. Формование и укладку теста проводили за две поэтапные стадии проверки при 40°С при 85% RH. Выпечку проводили в печи Rotel в течение 15 минут при 190°С. Объем буханки (определенный способом сдвига семян канолы) и весовые измерения делали после охлаждения на решетке в течение двух часов. Чистые потери измеряли, взвешивая буханки в течение периода времени. Муку или муку грубого помола можно смешивать с мукой или мукой грубого помола из разновидностей немодифицированной пшеницы или других зерновых, таких как ячмень, для обеспечения желаемых качеств теста и выпечки хлеба или питательных качеств. К примеру, мука из культиваров Chara или Glenlea имела высокую плотность теста, в то время как из культивара Janz имела среднюю плотность теста. В частности, уровни субъединиц глютенина с высокой и низкой молекулярной массой в муке положительно коррелируют с плотностью теста и дополнительно зависели от природы присутствующих аллелей. Муку из трансгенных линий пшеницы с редуцированным SBEIIa использовали при уровнях добавления 100%, 60% и 30%, например, добавляли либо всю муку, происходящую из разных линий пшеницы, либо 60%, либо 30% добавляли в контрольную муку. Проценты даны от общего количества муки в составе хлеба. Использовали четыре трансгенные линии пшеницы, а именно: 072 (сниженная SBEIIa), 212 (линия пшеницы, выведенная от гибридной, сниженная SBEIIa и тройной нуль SBEI), Н7 (линия пшеницы, выведенная из скрещивания сниженной SBE На и тройной нулевой SSIIa) и 008 (редуцированная SBEIIb) тестировали вместе с нетрансформированной контрольной пшеницей (NB1). Все виды пшеницы перемалывали в дробилке Brabender Quadramat Junior. Абсорбцию воды всех смесей определяли на мешалке с Z-образными месильными органами, а время оптимального перемешивания определяли на 10 г мисксографе, как описано выше. Эти условия использовали при приготовлении 10 г тестовых печеных буханок. Свойства смесей. Помимо контрольных линий (Baking Control, NB1 и 008) все остальные линии пшеницы имели значительно повышенные уровни абсорбции воды (Фигура 17(а)). Линии 212 и 072 дали возрастающие значения абсорбции воды с возрастающими дообавочными уровнями, вплоть до 95% абсорбции воды при 100% добавлении муки 212. Повышенные уровни инкорпорации муки из этих линий также привели к возрастанию оптимального времени размешивания в миксографе (Фигура 17(b)). Что касается данных по абсорбции воды, неконтрольные линии продемонстрировали сильное снижение специфического объема буханки (объем буханки/вес буханки) с возрастающими уровнями добавления. Данный эффект был особенно силен для линии 212. Эти исследования показали, что виды хлеба с коммерческим потенциалом, включая приемлемую структуру крошек, текстуру и внешность, можно получить с использованием высокоамилозной пшеничной муки, смешанной с контрольными образцами муки. Кроме того, высокоамилозная пшеница используется в сочетании с предпочитаемыми характеристиками генетического фона (т.е. предпочитаемыми глютеинами высокой и низкой молекулярной массы), добавлением улучшителей, таких как глютеин, аскорбат или эмульсификаторы, или использованием различных способов приготовления хлеба (т.е. опарный способ (sponge and dough bread-making), хлебная закваска (sour dough), смешанное зерно (mixed grain), или грубого помола (wholemeal)) для предоставления диапазона продуктов с определенной практичностью и питательной эффективностью для улучшения кишечного и метаболического здоровья. Другие пищевые продукты: Желтую щелочную лапшу (YAN) (100% муки, 32% воды, 1% Na2CO3) приготовляли в мешалке Hobart с использованием стандартного способа изготовления лапши (BRI Research Noodle Manufacturing Method (AFL 029). Листы лапши формировали в роликах из нержавеющей стали в машине Otake для производства лапши. После периода покоя (30 мин) листы лапши уменьшали и разрезали на тяжи. Размеры лапши составили 1,5×1,5 мм. Лапшу быстрого приготовления (100% муки, 32% воды, 1% NaCl и 0,2% Na2CO3) приготовляли в мешалке Hobart с использованием стандартного способа изготовления лапши (BRI Research Noodle Manufacturing method (AFL 028). Листы лапши формировали в роликах из нержавеющей стали в машине Otake для производства лапши. После периода покоя (5 мин) листы лапши уменьшали и разрезали на тяжи. Размеры лапши составили 1,0×1,5×25 mm. Тяжи лапши пропаривали в течение 3,5 минут и затем прожаривали на масле при температуре 150°С в течение 45 секунд. Хлеб Sponge and Dough (S&D). Приготовление BRI Research sponge and dough включало двухступенчатый процесс. На первой ступени делали кислое тесто путем смешивания части всей муки с водой, дрожжами и дрожжевой пищей. Кислое тесто оставляли для ферментации в течение 4 часов. На следующей ступени кислое тесто объединяли с остатком муки, водой и другими ингредиентами для изготовления теста. Стадию кислого теста делали с 200 г муки и 4-часовой ферментацией. Тесто приготовляли путем смешивания оставшихся 100 г муки и других ингредиентов с ферментированным кислым тестом. Паста-Спагетти. Этот способ использовали для производства пасты как описано у Sissons и соавт. (2007). Тестовые образцы муки из высокоамилозной пшеницы (с пониженным SBEIIa) и контрольной пшеницы (NB1) смешивали с манной крупой в разных процентных соотноошениях (тестовые образцы: 0, 20, 40, 60, 80, 100%) для получения смесей муки для приготовления пасты в небольшом масштабе. Эти образцы корректировали до влажности 30%. Желаемое количество воды добавляли в образцы и смешивали сразу перед переносом на 50 г месилку фаринографа для дальнейшего смешения в течение 2 мин. Получившееся тесто, которое было похоже на частицы размером с кофейное зерно, переносили в отсек из нержавеющей стали и оставляли под давлением 7000 kPa в течение 9 мин при 50°С. Затем эту пасту выдавливали при постоянном усилии и разрезали на куски длиной приблизительно 48 см. Для каждого образца делали две партии пасты. Эту пасту высушивали с использованием Thermoline Temperature and Humidity Cabinet (TEC 2604) (Thermoline Scientific Equipment, Смитфилд, Австралия). Цикл высушивания состоял из выдерживания при температуре 25°С с последующим возрастанием до 65°С в течение 45 минут, затем из периода примерно 13 часов при 50°С с последующим охлаждением до 25°С. Влажность контролировали в течение цикла. Высушенную пасту разрезали на тяжи длиной 7 см для последующих тестов. ПРИМЕР 15: ИЗМЕРЕНИЯ IN VITRO ГЛИКЕМИЧЕСКОГО ИНДЕКСА (GI) И РЕЗИСТЕНТНОГО КРАХМАЛА (RS) ОБРАЗЦОВ ПИЩЕВЫХ ПРОДУКТОВ Гликемический индекс (GI) образцов пищевых продуктов, включая хлеб, осуществили, как описано в данном документе, in vitro следующим образом: образцы пищевых продуктов гомогенизировали при помощи бытового кухонного комбайна. Количество образца, составляющее приблизительно 50 мг углеводов, навешивали в 120 мл пластиковый контейнер для образцов и добавляли 100 мкл карбонатного буфера без α-амилазы. Приблизительно через 15-20 секунд после добавления карбонатного буфера добавляли 5 мл раствора пепсина (65 мг пепсина (Sigma), растворенного в 65 мл 0,02М HCl, рН 2,0, приготовлен в день использования), и смесь инкубировали при 37°С в течение 30 минут в водяной бане с возвратно-поступательным движением при 70 оборотах в минуту. После инкубирования пробы нейтрализовали добавлением 5 мл NaOH (0,02M) и 25 мл 0,2М ацетатного буфера, рН 6. Затем добавляли 5 мл ферментной смеси, содержащей 2 мг/мл панкреатина (α-амилаза, Sigma) и 28U/мл амилоглюкозидазы из Aspergillus niger (AMG, Sigma), растворенной в буфере ацетата натрия (натрий-ацетатный буфер, 0,2М, рН 6,0, содержащий 0,20М хлорида кальция и 0,49 мМ хлорида магния), и смесь инкубировали в течение 2-5 минут.1 мл раствора переносили из каждой колбы в 1,5 мл пробирку и центрифугировали при 3000 оборотов в минуту в течение 10 минут. Супернатант переносили в новую пробирку и хранили в морозильной камере. Остаток каждого образца закрывали алюминиевой фольгой и контейнеры инкубировали при 37°С в течение 5 часов на водяной бане. Еще 1 мл раствора затем собирали из каждой колбы, центрифугировали и супернатант переносили как выполняли ранее. Также их сохраняли в морозильной камере до определения поглощающих способностей. Все образцы оттаивали до комнатной температуре и центрифугировали при 3000 оборотов в минуту в течение 10 минут. При необходимости разводили образцы (разведения 1 в 10, как правило, достаточно), 10 мкл супернатанта переносили из каждого образца в 96-луночные титрационные микропланшеты в двух или трех повторах. Стандартную кривую для каждого титрационные микропланшета получали с использованием глюкозы (0 мг, 0,0625 мг, 0,125 мг, 0,25 мг, 0,5 мг и 1,0 мг). 200 мкл глюкозного реагента Триндера (Microgenetics Diagnostics Pty Ltd, Лидкомб, Новый Южный Уэльс) добавляли в каждую лунку и планшеты инкубировали при комнатной температуре в течение приблизительно 20 минут. Поглощающую способность каждого образца измеряли при 505 нм с использованием планшет-ридера и количество глюкозы определяли согласно стандартной кривой. Уровень резистентного крахмала (RS) в образцах пищевых продуктов, включая хлеб, изготовленный как описано в данном документе, измеряли in vitro следующим образом. Данный способ описывает подготовку образцов и расщепление крахмала в пищевых продуктах in vitro, как при нормальном поедании. Этот способ имеет две части: во-первых, крахмал в пище гидролизировали при искусственно созданных физиологических условиях, во-вторых, побочные продукты удаляли путем промывки и остаточный крахмал определяли после гомогенизации и сушки образца. Крахмал, количественно определенный в конце обработки расщеплением, представляет содержание резистентного крахмала в пище. В день 1, образцы пищи были обработаны таким образом, чтобы имитировать употребление, например, путем гомогенизации бытовым кухонном комбайном до консистенции которая могла быть достигнута путем жевания. После гомогенизации, количество пищи, соответствующий до 500 мг углеводов, навешивали в 125 мл колбу Эрленмейера. Карбонатный буфер готовили растворением 121 мг NaHCO3 и 157 мг KCl приблизительно в 90 мл очищенной воды, добавляя 159 мкл 1М раствора CaCl2*6Н2О и 41 мкл 0,49М MgCl2⋅H2O, pH доводили при помощи 0,32М HCl 7-7,1 и доводили объем до 100 мл. Данный буфер хранили при 4°С до пяти дней. Готовили раствор искусственной слюны, содержащей 250 единиц α-амилазы (Sigma A-3176 Type VI-B из поджелудочной железы свиньи) на мл карбонатного буфера. Количество раствора искусственной слюны, примерно равное весу пищи, добавляли в колбу. Приблизительно через 15-20 сек после добавления слюны, в каждую колбу добавляли 5 мл раствора пепсина в HCl (1 мг/мл пепсина (Sigma) в 0,02М HCl, pH 2,0, приготовленный в день использования). Смешивание с амилазой, а затем с пепсином имитировало пережевывание человеком пищи перед проглатыванием. Смесь инкубировали при 37°С в течение 30 мин с встряхиванием при 85 оборотах в минуту. Затем смесь нейтрализовали 5 мл 0,02М раствора NaOH. 25 мл ацетатного буфера (0,2М, pH 6) и 5 мл ферментной смеси панкреатина, содержащей 2 мг/мл панкреатина (Sigma, поджелудочная железа свиньи при активности 4×USP) и 28U амилоглюкозидазы (AMG, Sigma) из Aspergillus niger в ацетатном буфере, pH 6, были добавлены в колбу. Каждую колбу закрывали алюминиевой фольгой и инкубировали при 37°С в течение 16 часов в водяной бане с возвратно-поступательным движением, установленной на 85 оборотов в минуту. В день 2, содержимое каждой колбы переносили количественно в 50 мл полипропиленовую пробирку и центрифугировали при 2000×g в течение 10 мин при комнатной температуре. Удаляли супернатанты и каждый осадок три раза промывали 20 мл воды, осторожно взбалтывая пробирку при каждом промывании, чтобы разбить осадок с последующим центрифугированием. 50 мкл воды последней промывки водой тестировали глюкозным реагентом Триндера на отсутствие свободной глюкозы. Каждый осадок ресуспендировали в приблизительно 6 мл очищенной воды и гомогенизировали три раза в течение 10 секунд с помощью Ultra Turrax TP18/10 с устройством для диспергирования S25N-8G. Содержимое количественно переносили в мерную колбу вместимостью 25 мл и доводили до объема. Содержимое тщательно перемешивали и возвращали в полипропиленовую пробирку. 5 мл образца каждой суспензии переносили в 25 мл культуральную пробирку и немедленно поверхностно замораживали в жидком азоте и лиофилизировали. В день 3, общий крахмал в каждом образце измеряли с использованием реагентов, поставляемых в наборе Megazyme Total Starch Procedure. Подготовили стандарты крахмала (стандартный кукурузный крахмал, Sigma S-5 5296) и холостые пробы. Образцы, контроли и холостые пробы смачивали 0,4 мл 80% этанола, для ускорения дисперсии с последующим перемешиванием. Немедленно добавляли 2 мл ДМСО и растворы смешивали на вортексе. Пробирки помещали в кипящую водяную баню в течение 5 мин и добавляли сразу же 3 мл термостабильной α-амилазы (100 U/мл) в буфере MOPS (pH 7, содержащий 5 мМ CaCl2 и 0,02% азида натрия). Растворы инкубировали в кипящей водяной бане дополнительно в течение 12 мин, с перемешиванием вортексом через каждые 3 мин. Пробирки помещали в 50°С водяную баню и добавляли 4 мл натрий-ацетатного буфера (200 мМ, pH 4,5, содержащий 0,02% азида натрия) и 0,1 мл амилоглюкозидазы при 300 U/мл. Смеси инкубировали при 50°С в течение 30 мин при осторожном перемешивании с 10-минутными интервалами. Объемы доводили до 25 мл в мерной колбе и хорошо перемешивали. Аликвоты центрифугировали при 2000g в течение 10 мин. Количество глюкозы в 50 мкл супернатанта определяли с помощью 1,0 мл Глюкозного реагентом Триндера и измерения оптической плотности при 505 нм после инкубации пробирки при комнатной температуре в темноте в течение не менее 18 мин и не более 45 мин. Буханки хлеба, испеченные из муки из четырех трансгенных линий пшеницы, а именно 20 072 (редуцированная по (с пониженным) SBEIIa), 212 (линия пшеницы, полученная от скрещивания, редуцированной SBEIIa Х(и) SBEI тройной нулевой пшеницы), Н7 (линия пшеницы, полученная от скрещивания, редуцированной SBEIIa×SSIIa тройной нулевой пшеницы) и 008 (редуцированная SBEIIb) тестировали вместе с нетрансформированной контрольной пшеницей (NB1) для уровня RS и GI ГИ после регистрации(после включения) 100%, 60% и 30% муки, а остальные 40% или 70% муки составляло зерно дикого типа. Повышенное включение 212, 072, 25 и Н7 муки привело к значительному росту RS (Фигура 18(а) и сокращению предсказанного (ожидаемого) GI ГИ (Фигура 18 (b)). Амплитуда изменений, была наибольшей при использовании муки из линии 212. Например, хлеб изготовленный со 100% добавлением этой высокоамилозной(с высокой амилозой, с высоким содержанием амилозы) муки имел содержание RS около 10%, что представляет собой увеличение на 150% выше для 30% уровня включения и в 9 раз больше по сравнению с контролями NB1. Увеличение степени включения муки из 008 линий не оказывали эффекта на RS и GI ГИ полученных хлебов и результаты были сопоставимы с таковыми для из выпечки контрольной муки. ПРИМЕР 16: ПЕРЕРАБОТКА ВЫСОКОАМИЛОЗНОЙ ПШЕНИЦЫ И РЕЗУЛЬТИРУЮЩИЕ УРОВНИ RS Исследование в небольшом масштабе проводили для определения содержания резистентного крахмала (RS) в обработанных зернах пшеницы с высоким содержанием амилозы, которые раскатывали или в виде хлопьев. Техника включает кондиционирование зерна до уровня влажности 25% в течение одного часа, сопровождающееся пропариванием зерна. После пропаривания, зерна превращали в хлопья с использованием ролика малого размера. Хлопья прокаливали в печи при 120°С в течение 35 мин. Две ширины ролика и три времени пропаривания использовали на примерно 200 г образцов из высокоамилозной пшеницы с пониженным SBEIIa (HAW, линия 85.2 с) и контрольной пшеницы дикого типа (сорт Hartog). Тестировали ролики шириной 0,05 мм и 0,15 мм. Тестировали пропаривание в течение 60', 45' и 35'. Это исследование показало четкое и существенное увеличение количества RS в обработанной высокоамилозной пшенице по сравнению с контролем (Таблица 27 Фигура 18). Также обнаружилось некоторое влияние условий обработки на уровень RS. Например, с высокоамилозным зерном, увеличенное время пропаривания привело к небольшому снижению уровня RS, скорее всего в связи с ростом клейстеризации крахмала во время пропаривания (варки) (Таблица 27). Чем шире зазор между роликами тем более высок уровень RS, за исключением самого долгого времени пропаривания. Это возможно связано с увеличением повреждения гранул крахмала сдвигом, когда зерна закатывали в узкие зазоры, незначительно снижая уровни RS. Узкие пробелы между роликами также приводили к росту уровней RS в контролях Hartog, хотя и значительно ниже общего уровня RS. В отличие от результатов для высокоамилозного (зерна), повышение времени пропаривания привело к более высоким уровням RS, возможно за счет увеличения клейстеризации крахмала при длительном пропаривании, что способствует большей ретроградации крахмала в процессе последующей обработки и охлаждения. Консолидированные данные по RS из различных продуктов. RS данных, полученных из различных продуктов, таких как лапша, губки и тесто для хлеба и спагетти, полученных, как описано в примере 10, представлены в Таблице 28. Не все уровни включения тестировали для всех продуктов, но уровни включения 20%, 40% и 60% использовали в большинстве проанализированных продуктов. Результаты показали линейную зависимость между содержанием RS и уровнем включения высокоамилозной муки. ПРИМЕР 17: ИЗОЛЯЦИЯ РАСТЕНИЙ, ОБЛАДАЮЩИХ ТОЧЕЧНЫМИ МУТАЦИЯМИ В SBEIIA Популяцию мутантных линий растений разработали после EMS мутагенеза семян пшеницы сорта Арх или Apache, используя стандартные условия обработки EMS. Около 5000 Apache и 900 Arche отдельных M1 растений, вырастили из мутагенизированных семян, самоопылили и семена с каждого растения и последующих поколений потомства поддерживали как потенциально мутантные линии, каждая из которых происходит из отдельного растения M1. Линии обследовали на наличие мутаций в трех гомологичных генах SBEIIa с помощью секвенирования следующего поколения Solexa (Illumina). Чтобы сделать это, готовили 7 объединений (пулов) ДНК, каждый путем объединения ДНК от 130 M1 семей от популяции Arche и 96 от популяции Apache. ПНР проводили с ДНК, объединенными в три или четыре области на гомологичном гене, ориентированных на экзонные регионы, включая сайты сплайсинга генов. Геном-специфичные праймеры приведены в Таблице 29. 10 ампликонов (продукты амплификации) из того же объединения (пула) ДНК объединяли после нормализации продуктов ПЦР и секвенирование осуществляли с одним потоком клеток на ДНК пул. Данные секвенирования анализировали, чтобы выбрать из всех полиморфизмов те, которые наиболее вероятно образовались из-за мутаций, а не из-за ошибок секвенирования, на основе частоты наблюдаемого полиморфизма. 64 предполагаемых мутантов из популяции Arche и 48 из популяции Apache наблюдали с первого сиквенс-анализа, охватывающего экзонные регионы и сайты сплайсинга. SNP анализы разработали для каждого полиморфизма, основываясь на технологии Kaspar и генотипирование проводили на 130 семей в каждом пуле, который был положительным для конкретного полиморфизма. Таким образом, идентифицировали 30 индивидуальных мутантных линий, каждая из которых содержала мутантный ген и подтвердили мутантные последовательности SBEIIa. С помощью этого способа, определили 31 мутантную линию из популяции Apache и 9 из популяции Арх каждая из которых имеет мутацию SBEIIa и М2 зерна каждой сохранили. От каждой мутантной линии, в зависимости от доступности, около 10 М2 семян разрезали надвое, половину без эмбриона использовали для выделения ДНК и анализа, а другую половину с эмбрионом сохраняли для посева. В общей сложности подтвердили 5 мутантов на половинах семян популяции Arche и на 28 популяции Apache. Соответствующие семена посеяли, чтобы произвести потомство растений, чтобы подтвердить, что мутации наследуются по Менделю, путем повторения анализа на М2 материале листьев растения, обеспечивая гораздо лучшее качество ДНК. Эти анализы подтвердили 19 мутантов, 4 от популяции Arche и 15 от популяции Apache и позволили их ранжирование в зависимости от их ДНК и выведения последовательностей белков, кодируемых мутантами. Полученные мутанты включают те, которые имеют мутировавшие гены SBEIIa со стоп-кодонами в кодирующей белок области генов SBEIIa на В или D геномах, что приводит к преждевременной терминации трансляции белков SBEIIa и линии с мутациями сайта сплайсинга в SBEIIa-В или D генах. Такие мутации должны были быть нулевыми. Точечные мутации в SBEIIa-A,-B SBEIIa и SBEIIa-D генах, такие как мутации, приводящие к замещению аминокислоты, также получили, и их влияние на структуру кодируемых белков предположено с использованием BLOSUM 62 и Рат250 матриц. Растения из наиболее перспективных 8 мутантных линий скрещивали с двойными нулевыми мутантами SBEIIa соответствующего генотипа в том числе A1D2, A2D2, А1В2, B2D2 генотипов с целью получения тройных мутантных растений и семян в поколении F2. Отобрали плодородные 20 растений производящих семена, содержащие по крайней мере 50% амилозы в крахмале. Мутантные растения также скрестили с твердой пшеницей (сорт Soldur) чтобы ввести мутации в тетраплоидную пшеницу.










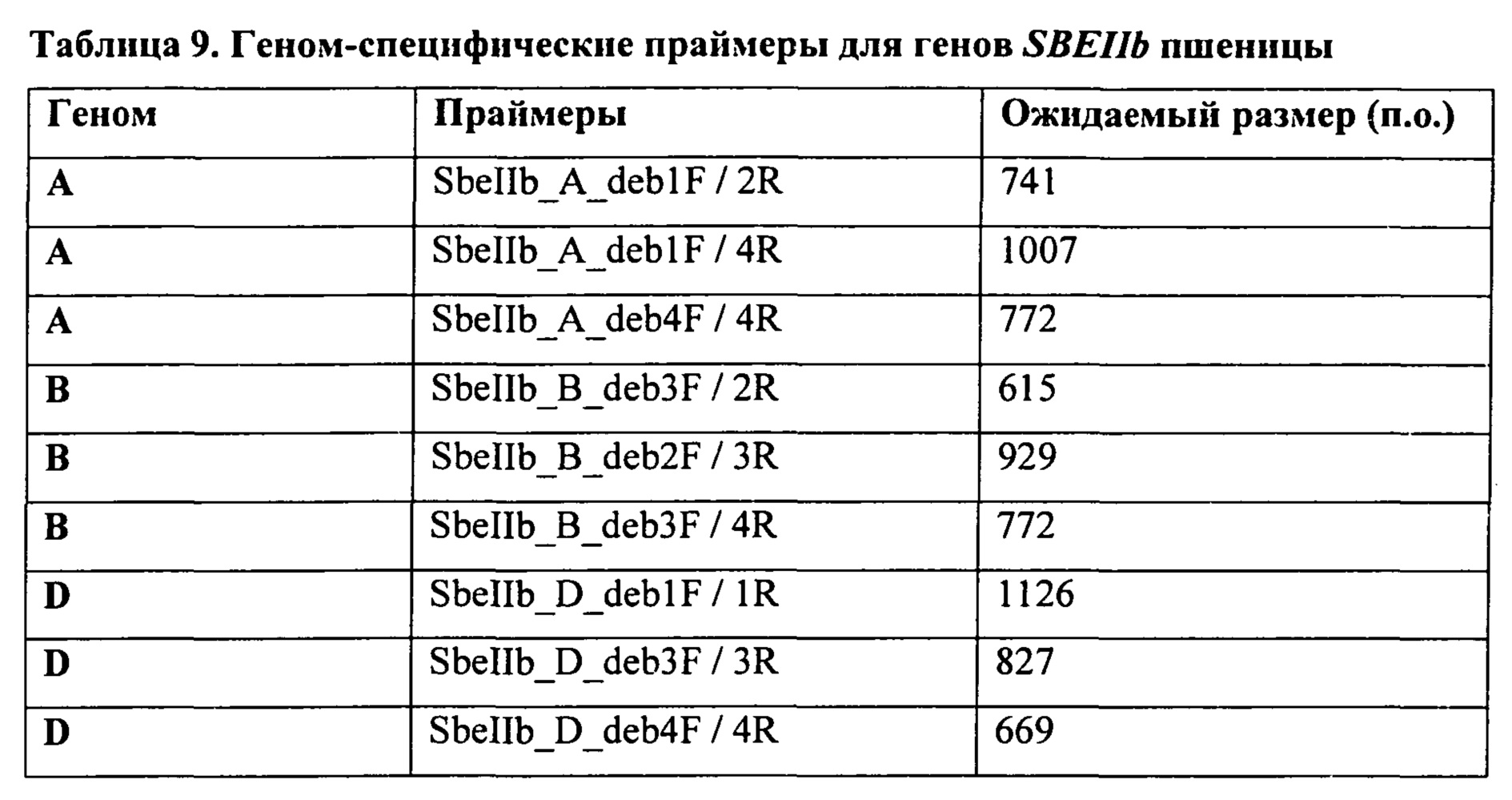













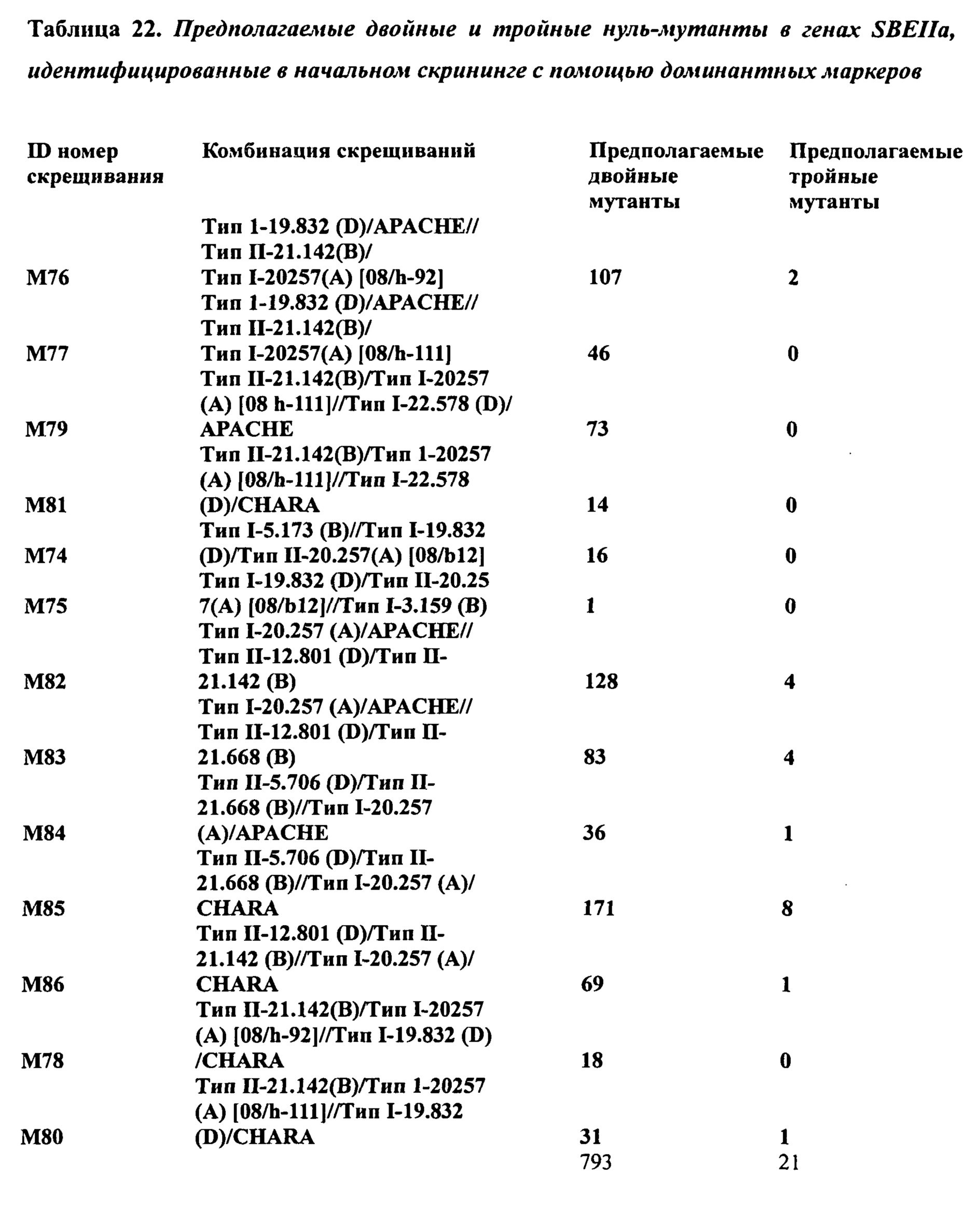







Реферат
Изобретение относится к области биохимии, в частности к зерну пшеницы Triticum aestivum, имеющему повышенное содержание амилозы по сравнению с зерном пшеницы дикого типа, к растению пшеницы Triticum aestivum, которое продуцирует зерно, которое имеет пониженный уровень или активность общего белка SBEII, а также к способу получения указанного зерна. Также раскрыты мука, содержащая крахмал, который имеет содержание амилозы от 50% до 88,5% (вес/вес) и имеет пониженный уровень или активность общего белка SBEII, пищевой ингредиент и пищевой продукт, ее содержащие, а также способ получения указанного пищевого продукта. Изобретение также относится к способу скрининга растения пшеницы или зерна пшеницы для отбора зерна или растения, продуцирующего зерно, которое имеет содержание амилозы от 50% до 88,5% (вес/вес) в виде доли общего крахмала в зерне. Изобретение позволяет эффективно получать зерно пшеницы, имеющее повышенное содержание амилозы по сравнению с зерном пшеницы дикого типа. 10 н. и 13 з.п. ф-лы, 18 ил., 29 табл., 17 пр.
Формула
Документы, цитированные в отчёте о поиске
Пшеница с модифицированной активностью ветвящего фермента, а также полученные из нее крахмал и крахмалсодержащие продукты

Комментарии