Пшеница с модифицированной активностью ветвящего фермента, а также полученные из нее крахмал и крахмалсодержащие продукты - RU2377303C2
Код документа: RU2377303C2
Чертежи


























Описание
2420-135359RU/092
ПШЕНИЦА С МОДИФИЦИРОВАННОЙ АКТИВНОСТЬЮ ВЕТВЯЩЕГО ФЕРМЕНТА,
А ТАКЖЕ ПОЛУЧЕННЫЕ ИЗ НЕЕ КРАХМАЛ И КРАХМАЛСОДЕРЖАЩИЕ ПРОДУКТЫ
ОПИСАНИЕ
Область, к которой относится изобретение
Настоящее изобретение относится к растению пшеницы, зерно которой содержит крахмал с высоким содержанием амилозы. Настоящее изобретение также относится к пшенице со сниженной активностью крахмал-ветвящего фермента IIа (SBEIIa) в эндосперме и к способам получения таких растений. Кроме того, настоящее изобретение относится к зерну, а также к крахмалу и к пищевым и непищевым продуктам, полученным из этого зерна.
Предшествующий уровень техники
Содержание крахмала в зерне составляет приблизительно 45-65% от всей массы зрелого зерна. Крахмал состоит из молекул двух типов, амилозы и амилопектина. Амилоза представляет собой, в основном, линейную молекулу, состоящую из глюкозидных цепей, соединенных α-1,4-связью, а амилопектин представляет собой в высокой степени разветвленную молекулу, имеющую линейные цепи, соединенные α-1,6-глюкозидными связями.
Синтез крахмала в эндосперме высших растений осуществляется рядом ферментов, которые катализируют четыре ключевые стадии. В первой стадии АDP-глюкозопирофосфорилаза активирует мономерный предшественник крахмала путем синтеза ADP-глюкозы из G-1-Р и АТР. Во второй стадии активированный глюкозильный донор, ADP-глюкоза, переносится крахмал-синтазами на невосстанавливающий конец уже существующей α1-4-связи. На третьей стадии, крахмал-ветвящие ферменты вводят точки ветвления путем расщепления области α-1,4-связанного глюкана с последующим переносом отщепленной цепи на акцепторную цепь с образованием новой α-1,6-связи. Крахмал-ветвящими ферментами являются лишь те ферменты, которые могут вводить α-1,6-связи в α-полиглюканы, а поэтому они играют важную роль в образовании амилопектина. И, наконец, крахмал-деветвящие ферменты удаляют некоторые из указанных связей в точке ветвления, хотя механизм такого удаления пока еще неясен (Myers et al., 2000).
Хотя очевидно, что для нормального синтеза крахмальных гранул в высших растениях необходимы, по крайней мере, эти четыре активности, однако, в эндосперме высших растений было обнаружено множество изоформ каждой из указанных четырех активностей, и исходя из анализа мутаций (Wang et al., 1998, Buleon et al., 1998) или из анализа, проводимого путем модификации уровней экспрессии гена с использованием трансгенной технологии (Abel et al., 1996, Jobling et al., 1999, Scwall et al., 2000), было высказано предположение, что каждая отдельная изоформа играет определенную роль в этом синтезе. Однако конкретная роль каждой изоформы в активности каждого фермента, участвующего в биосинтезе крахмала, пока неизвестна, а также неизвестно, имеют ли эти роли заметные отличия для разных видов. В эндосперме зерновых присутствуют две изоформы ADP-глюкозопирофосфорилазы, одна из которых находится в амилопласте, а другая в цитоплазме (Denyer et al., 1996, Thorbjornsen et al., 1996). Каждая форма состоит из субъединиц двух типов. Мутанты, приводящие к морщинистости, (sh2), и хрупкости, (bt2), зерна кукурузы, имеют повреждения в большой и малой субъединицах соответственно (Giroux & Hannah, 1994). В эндосперме зерна были обнаружены крахмал-синтазы четырех классов: изоформа, которая локализуются исключительно в крахмальной грануле, а именно гранулоассоциированная крахмал-синтаза (GBSS); две формы, которые распределяются между крахмальной гранулой и растворимой фракцией (SSI, Li et al., 1999a, SSII, Li et al., 1999b), и четвертая форма, которая целиком локализуется в растворимой фракции SSIII (Cao et al., 2000, Li et al., 1999b, Li et al., 2000). Было показано, что GBSS играет главную роль в синтезе амилозы (Shure et al., 1983), и было показано, что мутации в SSII и SSIII приводят к изменению структуры амилопектина (Gao et al., 1998, Craig et al., 1998). При этом не были описаны какие-либо мутации, которые играли бы определяющую роль в SSIII-активности.
В эндосперме зерновых экспрессируются три формы ветвящего фермента, а именно ветвящий фермент I (SBEI), ветвящий фермент IIа (SBEIIa) и ветвящий фермент IIb (SBEIIb) (Hedman & Boyer, 1982, Boyer & Preiss, 1978, Mizuno et al., 1992, Sun et al., 1997). Геномные последовательности и кДНК-последовательности были охарактеризованы для риса (Nakamura & Yamanouchi, 1992), кукурузы (Baba et al., 1991, Fisher et al., 1993; Gao et al., 1997) и пшеницы (Repellin et al., 1997; Nair et al., 1997; Rahman et al., 1997). Сравнение этих последовательностей путем выравнивания показало высокую степень их сходства как на нуклеотидном, так и на аминокислотном уровне, и позволило сгруппировать эти ферменты в классы SBEI, SBEIIa и SBEIIb. Последовательности SBEIIa и SBEIIb обнаруживают примерно 80%-ную идентичность друг с другом, а в частности, в центральных областях генов. SBEIIa и SBEIIb могут также отличаться по типу их экспрессии. В общих чертах, SBEIIb специфически экспрессируется в эндосперме, тогда как SBEIIa присутствует во всех тканях растения.
В эндосперме пшеницы SBEI (Morell et al., 1997) обнаруживается исключительно в растворимой фракции, тогда как SBEIIa и SBEIIb обнаруживаются как в растворимой фракции, так и во фракции, ассоциированной с крахмальными гранулами (Rahman et al., 1995). Было показано, что в кукурузе и в рисе продуцирование фенотипов с высоким содержанием амилозы обусловлено повреждением гена SBEIIb, известного так же как ген-удлинитель амилозы (ае), (Boyer & Preiss, 1981, Mizuno et al., 1993; Nishi et al., 2001). В этих мутантах по гену SBEIIb крахмальные гранулы в эндосперме обнаруживают аномальную морфологию со значительно повышенными содержанием амилозы, при этом уровень ветвления остаточного амилопектина был ниже, а также было снижено количество коротких цепей (
В кукурузе мутация dull1 приводит к снижению содержания крахмала и к увеличению уровней амилозы в эндосперме, где степень изменения зависит от генетического фона, а также к повышению уровня ветвления в остаточном амилопектине (Shannon & Garwood, 1984). Ген, соответствующий мутации, был идентифицирован и выделен с применением стратегии транспозонного мечения транспозоном-мутатором (Мu), и было показано, что он кодирует фермент, называемый крахмал-синтазой II (SSII) (Gao et al., 1998). У зерновых этот фермент в настоящее время известен как член семейства SSIII (Li et al., 2003). Мутантный эндосперм имел пониженные уровни SBEIIa-активности, ассоциированной с dull1-мутацией. В других зерновых культурах о какой-либо аналогичной мутации не сообщалось. Неизвестно, относятся ли эти данные к другим зерновым культурам, например к пшенице.
В WO 94/09114 было высказано предположение об возможности использования смысловых и антисмысловых генов для изменения природных соотношений крахмал-синтазы (SS) и SBE в кукурузе. Однако там не было представлено каких-либо данных, подтверждающих предложенные молекулярные стратегии, и не было высказано предположения о специфическом снижении активности SBEIIa.
В картофеле регуляция по типу обратной связи лишь одного гена SBEI оказывает минимальное влияние на структуру крахмала (Flipse et al., 1996), хотя в другой работе были идентифицированы некоторые качественные изменения (Safford et al., 1998). Однако в картофеле ингибирование комбинации генов SBEII и SBEI приводило к гораздо большему увеличению относительного содержания амилозы, чем ингибирование лишь одного SBEII (Schwall et al., 2000).
В высших растениях присутствуют деветвящие ферменты двух типов, определенных по их специфичности к субстрату, а именно деветвящие ферменты типа изоамилазы и деветвящие ферменты типа пуллуланазы (Myers et al., 2000). Мутации Sugary-1 в кукурузе и рисе ассоциированы с дефицитом обоих деветвящих ферментов (James et al., 1995, Kubo et al., 1999), однако являющаяся причинной мутация была картирована в том же положении, что и ген деветвящего фермента изоамилазного типа. Репрезентативные гены биосинтеза крахмала, которые были клонированы из зерновых культур, перечислены в таблице 1.
Крахмал широко используется в пищевой, бумажной и химической промышленности. Физическая структура крахмала может оказывать значительное влияние на питательные и технологические свойства крахмала, используемого для производства пищевых или непищевых продуктов или промышленных изделий. Некоторые характеристики могут быть использованы как показатели структуры крахмала, включая распределение длин амилопектиновой цепи, степень и тип кристалличности и такие свойства, как температура желатинизации, вязкость и объем набухания. Изменения длины амилопектиновой цепи может служить показателем изменения кристалличности, желатинизации или деградации амилопектина.
Состав крахмала, а в частности формы, называемой резистентным крахмалом, которая может быть ассоциирована с высоким содержанием амилозы, имеет важное значение для нормальной работы кишечника, а в частности толстого кишечника. В соответствии с этим, высокоамилозные крахмалы были продуцированы в некоторых зерновых, таких как кукуруза, в целях их применения в пищевых продуктах, которые могут употребляться как средства стимуляции нормальной работы кишечника. Благоприятные эффекты резистентного крахмала обусловлены его поступлением в качестве питательного вещества в толстый кишечник, где кишечная микрофлора обеспечивается энергетическим источником, который позволяет ферментацию с образованием inter alia короткоцепочечных жирных кислот. Эти короткоцепочечные жирные кислоты обеспечивают питательными веществами колоноциты, усиливают усвоение некоторых питательных веществ толстым кишечником и стимулируют физиологическую активность толстой кишки. В общих чертах, если резистентные крахмалы или другие пищевые волокна не поступают в толстую кишку, то она становится относительно метаболически неактивной.
Хотя химически или как-либо иначе модифицированные крахмалы могут быть использованы для приготовления пищевых продуктов, обеспечивающих функциональные свойства, которые не могут нормально обеспечиваться немодифицированными источниками, однако такая обработка имеет тенденцию либо к изменению ценных качеств других компонентов, либо к сообщению нежелательного вкуса из-за процессов, участвующих в модификации. Поэтому в пищевых продуктах предпочтительно использовать источники компонентов, которые могут быть использованы в немодифицированных формах.
Каждый год, во всем мире, пшеницы выращивается больше, чем какой-либо другой зерновой культуры. Известные изменения структуры крахмала пшеницы, по сравнению с изменениями, наблюдаемыми в кукурузе или рисе, имеют ограничения, отчасти из-за эффективности трансформации пшеницы, которая происходит с запаздыванием по сравнению с другими зерновыми, а также из-за гексаплоидной природы хлебопекарной пшеницы. Присутствие трех геномов в Triticum aestivum дает тормозящий эффект благодаря маскировке мутаций в отдельных геномах в отличие от более легко идентифицируемых мутаций у диплоидных видов. Мутации в SBEIIb, соответствующие фенотипам удлинения амилозной цепи у кукурузы и риса, не были охарактеризованы у пшеницы. У пшеницы фенотип, сообщаемый мутациями SBEIIa и SBEIIb, пока неизвестен. Известными мутантами являются мутанты по гену waxy (GBSS, Zhao & Sharp, 1998) и мутант, у которого полностью отсутствует белок SGP-1 (Yamamori et al., 2000), продуцируемый при скрещивании линий, у которых отсутствуют специфические геномные формы А, В и D белка SGР-1 (SSII), как было определено путем электрофореза белков. Оценка семян, не содержащих SSII, показала, что данная мутация приводит к изменению амилопектиновой структуры, к деформации крахмальных гранул и к повышению относительного содержания амилозы в крахмале приблизительно на 30-37%, что примерно на 8% превышает уровни дикого типа (Yamamori et al., 2000). Уровень амилозы измеряют с помощью калориметрического анализа, амперометрического титрования (оба эти анализа основаны на связывании с йодом) и методом с использованием конканавалина А. Крахмал, полученный от мутанта, не содержащего SSII, обнаруживал пониженную температуру желатинизации по сравнению с крахмалом, полученным от эквивалентного немутантного растения. Содержание крахмала было снижено на 60% по сравнению с растением дикого типа и ниже на менее 50% по сравнению с растениями, зерно которых не содержало SSII.
В WO 99/14314 описано выделение гена SBEIIa из Aegilops tauschii, диплоидного растения, родственного пшенице, но не сообщалось о продуцировании пшеницы с модифицированнм крахмалом.
В WO 00/15810 описано клонирование кДНК гена SBEIIb пшеницы. В результате такого клонирования на было получено растений пшеницы с измененными уровнями амилозы и не сообщалось, что полученная пшеница имела крахмал, содержащий, по крайней мере, 50% амилозы.
В WO 01/62934 также описан ген SBEIIb пшеницы и было предложено вводить ингибиторы активности ветвящего фермента в растение пшеницы, но не сообщалось, что полученная пшеница имела крахмал, содержащий, по крайней мере, 50% амилозы.
В WO 01/32886 охарактеризована кДНК, кодирующая форму SBEI в эндосперме пшеницы. Было обнаружено, что кодируемый полипептид преимущественно ассоциирован с крахмальными гранулами А-типа. При этом активность SBEI не подавлялась и не было обнаружено изменения морфологии крахмальных гранул или повышения уровня амилозы в пшенице.
Отсюда следует, что в настоящее время отсутствуют какие-либо данные о получении пшеницы, содержащей крахмал с уровнем амилозы примерно более чем 50%. Хотя известны высокоамилозные сорта кукурузы и ячменя, однако продукты, полученные из этих зерновых культур, имеют определенные недостатки по сравнению с высокоамилозными продуктами из пшеницы, которая является предпочтительной зерновой культурой, например, для выпекания хлеба и изготовления макаронных изделий (пасты) или лапши.
Хотя высокоамилозные крахмалы таких типов являются ценными продуктами, однако, пшеничный крахмал с повышенным содержанием амилозы является предпочтительным, а особенно, если он ассоциируется с более легким синтезом и другими характеристиками, такими как, например, меньшая потребность в модификации после сбора урожая. Такие продукты крахмала также являются относительно устойчивыми к разложению и более полезны для здоровья.
Общее описание
Для каждого специалиста очевидно, что в описанное здесь изобретение могут быть внесены изменения и модификации, конкретно не описанные в настоящей заявке. Следует отметить, что описанное здесь изобретение включает все указанные варианты и модификации. Настоящее изобретение также включает все стадии, признаки, композиции и соединения, взятые отдельно или вместе и относящиеся к настоящему описанию или указанные в настоящем описании, а также любые и все комбинации любой из двух или более из указанных стадий или признаков.
Используемый в настоящем описании термин “включают” и его варианты “содержит” или “содержащий”, если в контексте не указано иначе, означает включение установленного целого элемента или стадии, либо группы элементов или стадий, но не исключает присутствие любого другого элемента или стадии, либо группы элементов или стадий. Объем настоящего изобретения не ограничен конкретными описанными вариантами, которые приводятся лишь в иллюстративных целях. Очевидно, что в объем описанного здесь настоящего изобретения входят функционально эквивалентные продукты, композиции и способы.
Подробная библиография публикаций, представленная заявителями в настоящем описании, приводится в конце описания. Упомянутые здесь работы во всей своей полноте вводятся в настоящее описание в качестве ссылки. Предшествующие работы, включая любой один или несколько предшествующих документов, не должны восприниматься как подтверждение или предположение, то есть указанный известный уровень техники представляет собой лишь общедоступные сведения, известные в Австралии, или составляют часть таких общедоступных сведений, известных в Австралии.
Используемый здесь термин “происходит от” указывает на то, что данный конкретный элемент или группа таких элементов происходит от конкретных видов, однако, это не означает, что они должны быть обязательно получены непосредственно от данного конкретного источника.
Обозначение упомянутых здесь нуклеотидных остатков соответствует обозначениям, рекомендованным Комиссией по биохимической номенклатуре IUPAC-IUB, где А означает аденин, С означает цитозин, G означает гуанин, Т означает тимидин.
Описание сущности изобретения
В своем первом аспекте, настоящее изобретение относится к зерну, полученному из растения пшеницы, где содержание амилозы в крахмале данного зерна составляет, по крайней мере, 50%. Это растение пшеницы может иметь пониженный уровень экспрессии гена SBEIIa и активности фермента SBEIIa или того и другого, а предпочтительно, пониженный уровень экспрессии и гена SBEIIa, и гена SBEIIb, и пониженный уровень активности этих ферментов или то и другое. Указанное зерно может включать генетическую модификацию, которая представляет собой либо мутацию гена SBEIIa, которая ингибирует экспрессию гена SBEIIa, активность фермента или то и другое, либо встроенную нуклеиновую кислоту, которая ингибирует экспрессию гена SBEIIa, активность фермента или то и другое. Кроме того, указанное зерно может содержать аналогичную генетическую модификацию в SBEI. Такое зерно, кроме того, может иметь измененный уровень белка и/или активности фермента, выбранного из группы, состоящей из ADP-глюкозопирофосфорилазы, GBSS, SSI, SSII, SSIII, деветвящего фермента типа изоамилазы и деветвящего фермента типа пуллуланазы. Такое зерно может содержать трансген, и этот трансген может кодировать антисмысловую, ко-суппрессорную, рибозимную или дуплексную молекулу РНК. Наличие такого трансгена, предпочтительно, приводит к снижению уровня экспрессии мРНК, кодирующей SBEIIa. Указанное зерно может содержать мутацию в гене SBEIIa, а в одном из вариантов оно может содержать молчащую мутацию (нуль-мутацию) гена SBEIIa, по крайней мере, в одном геноме, и может содержать молчащую мутацию гена в двух или трех геномах. Содержание амилозы в крахмале указанного зерна может составлять, по крайней мере, 40%, 50%, 55%, 60%, 70% или 80%. В другом варианте, по крайней мере, 50% крахмальных гранул в зерне являются недвоякопреломляющими при их наблюдении в поляризованном свете. Указанное зерно может быть неморщинистым, и его средняя масса может составлять, по крайней мере, 36 мг или 40 мг. В альтернативном варианте, содержание крахмала в чистом виде составляет, по крайней мере, 25% (мас./мас.) или, по крайней мере, 35% (мас./мас.), тогда как в зерне дикого типа содержание крахмала может составлять, по крайней мере, 90%. Это зерно может представлять собой целое, шелушенное, помолотое, битое, плющенное, обрушенное, дробленое или опаленное зерно.
В другом варианте своего первого аспекта, настоящее изобретение относится к зерну, полученному из пшеницы, где указанное зерно содержит крахмал и его генетическую модификацию, которая приводит к снижению уровня экспрессии гена SBEIIa, активности фермента SBEIIa в эндосперме или того и другого, по сравнению с зерном дикого типа, и которая содержит мутацию гена SBEIIa или встроенную нуклеиновую кислоту, кодирующую ингибитор экспрессии гена SBEIIa, где содержание амилозы в крахмале указанного зерна составляет, по крайней мере, 30%.
Во втором своем аспекте, настоящее изобретение относится к продукту помола, полученному из зерна первого аспекта изобретения, включая, но не ограничиваясь ими, муку, муку из цельного зерна, крупку или крахмал, полученные из зерна настоящего изобретения, или пищевые продукты, включающие указанную муку, муку из цельного зерна, крупку или крахмал, либо раскатанные, плющенные или прессованные зерновые продукты. Таким продуктом может быть мука, мука из цельного зерна, крупка или крахмал, полученные из зерна первого аспекта настоящего изобретения, смешанного с мукой, мукой из цельного зерна, крупкой или крахмалом, полученными из другого источника.
В своем третьем аспекте, настоящее изобретение относится к крахмальным гранулам или к крахмалу, полученному из зерна пшеницы первого аспекта изобретения. В конкретном варианте третьего аспекта изобретения, растения пшеницы, кроме того, имеют пониженный уровень активности фермента SBEIIa в эндосперме.
В четвертом своем аспекте, настоящее изобретение относится к композиции, содержащей крахмал третьего аспекта настоящего изобретения и пищевые ингредиенты или воду. Этот аспект включает пищевые продукты и непищевые композиции и смесь крахмала с другими видами крахмала или крахмалсодержащими продуктами.
В своем пятом аспекте, настоящее изобретение относится к композиции, содержащей крахмальные гранулы четвертого аспекта изобретения, описанного выше, и другой пищевой ингредиент или воду.
В своем шестом аспекте, настоящее изобретение относится к растению пшеницы, которое может быть использовано для получения зерна или крахмальных гранул или крахмала в соответствии с предыдущими аспектами. Такое растение пшеницы может быть трансгенным или нетрансгенным, либо оно может продуцировать трансгенное или нетрансгенное зерно.
В своем седьмом аспекте, настоящее изобретение относится к способу выращивания растения пшеницы, продуцирующего зерно, где указанный способ включает стадии: i) введения генетической модификации в родительское растение пшеницы или в его зерно, и ii) идентификации потомства растения или семян родительского растения пшеницы или его семян, которые имеют пониженный уровень экспрессии гена SBEIIa, активности фермента SBEIIa в эндосперме или того и другого по сравнению с растениями или семенами дикого типа, где указанное зерно содержит крахмал, и где содержание амилозы в указанном крахмале зерна составляет, по крайней мере, 50%.
Во втором варианте своего седьмого аспекта, настоящее изобретение относится к способу выращивания растения пшеницы, продуцирующего зерно, где указанный способ включает стадии: i) введения генетической модификации в родительское растение пшеницы или в его зерно, где указанная генетическая модификация содержит мутацию гена SBEIIa или встроенную нуклеиновую кислоту, кодирующую ингибитор экспрессии гена SBEIIa, и ii) идентификации потомства растения или семян родительского растения пшеницы или его семян, которые имеют пониженный уровень экспрессии гена SBEIIa, активности фермента SBEIIa в эндосперме или того и другого по сравнению с растениями или семенами дикого типа, где указанное зерно содержит крахмал, содержание амилозы в котором составляет, по крайней мере, 30%. Указанная стадия введения генетической модификации может включать введение экзогенной нуклеиновой кислоты, экспрессирующей ингибитор экспрессии гена SBEIIa, или мутагенез родительского растения пшеницы.
В третьем варианте своего седьмого аспекта, настоящее изобретение относится к способу выращивания растения пшеницы, продуцирующей зерно, где указанный способ включает стадии: i) введения генетического варианта в родительское растение пшеницы или в его зерно, где указанная генетическая модификация содержит мутацию гена SBEIIa, и ii) идентификации потомства растения или семян родительского растения пшеницы или семян, которые имеют пониженный уровень экспрессии гена SBEIIa, активности фермента SBEIIa в эндосперме или того и другого по сравнению с зерном дикого типа, iii) введения генетической модификации в родительское растение пшеницы или зерно, где указанная генетическая модификация содержит мутацию гена SBEIIb, и iv) идентификации потомства растения или зерна родительского растения или зерна пшеницы, имеющих пониженный уровень экспрессии гена SBEIIb, активности фермента SBEIIa в эндосперме или того и другого по сравнению с зерном дикого типа; v) скрещивания растения, имеющего пониженный уровень экспрессии гена SBEIIa, активности фермента SBEIIa в эндосперме или того и другого с растением, имеющим пониженный уровень экспрессии гена SBEIIb, активности фермента SBEIIb в эндосперме, или того и другого; и идентификацию растения пшеницы, имеющего пониженный уровень экспрессии генов, активности ферментов SBEIIa и SBEIIb, а также и того и другого.
В четвертом варианте своего седьмого аспекта, настоящее изобретение относится к способу культивирования растения пшеницы, имеющего относительное содержание амилозы в крахмале зерна, по крайней мере, 50%, а предпочтительно, имеющего пониженную активность фермента SBEIIa в эндосперме, где указанный способ предусматривает: а) идентификацию растения или зерна пшеницы, имеющего пониженную активность фермента SBEIIa, экспрессируемого из генома пшеницы А, В или D; и b) скрещивание указанного растения пшеницы или растения пшеницы, выращенного из зерна стадии (а), со вторым растением пшеницы, имеющим пониженную активность фермента SBEIIa; или с) скрещивание растения, имеющего пониженную активность фермента SBEIIa, с растением пшеницы, имеющим пониженную активность фермента SBEIIb; и идентификацию растения пшеницы, имеющего пониженную активность ферментов SBEIIa и SBEIIb. Предпочтительным растением седьмого аспекта является Triticumaestivum ssp. aestivum.
В своем восьмом аспекте, настоящее изобретение относится к способу получения модифицированного крахмала, предусматривающего модификацию растения способом, определенным выше, и экстракцию крахмала, имеющего измененные свойства.
В своем девятом аспекте, настоящее изобретение относится к способу идентификации растения пшеницы или его зерна по мутации в гене SBEIIa или в гене SBEIIb, где указанный способ включает стадии скрининга популяции растений пшеницы или его зерна с использованием молекулярного маркера, присоединенного к гену SBEIIb, или к гену SBEIIa пшеницы, соответственно, и к способу идентификации растения или зерна на присутствие или отсутствие указанного присоединенного молекулярного маркера.
Во втором варианте своего девятого аспекта, настоящее изобретение относится к способу идентификации растения пшеницы или его зерна на мутацию в гене SBEIIa или в гене SBEIIb, где указанный способ включает стадии скрининга популяции растений пшеницы или его зерна с использованием антитела, которое является специфическим к белку SBEIIb, или к белку SBEIIa пшеницы, соответственно, и к способу идентификации растения или зерна на наличие или отсутствие связывания с антителом.
В своем десятом аспекте, настоящее изобретение относится к зерну, полученному от растения пшеницы и содержащему мутацию, где ген SBEIIa отсутствует в длинном плече хромосомы 2А, или где ген SBEIIa, присутствующий на длинном плече хромосомы 2А, содержит мутацию, приводящую к снижению уровня белка SBEIIa, активности фермента SBEIIa или того и другого, в эндосперме указанного зерна по сравнению с зерном дикого типа. Такая мутация может быть нуль-мутацией гена SBEIIa, либо она может представлять собой делецию, по крайней мере, части гена SBEIIa. Указанное зерно может, кроме того, содержать мутацию, где ген SBEIIb отсутствует в длинном плече хромосомы 2А, или где ген SBEIIb, присутствующий на длинном плече хромосомы 2А, содержит мутацию, приводящую к снижению уровня белка SBEIIb, активности фермента SBEIIb или того и другого в эндосперме указанного зерна по сравнению с зерном дикого типа. Делеция может прекращать экспрессию генов SBEIIa и SBEIIb на длинном плече хромосомы 2А.
Указанным растением может быть растение твердой пшеницы сорта дурум (durum), которое может дополнительно содержать генетическую модификацию, приводящую к снижению активности крахмал-ветвящего фермента, кодируемого геном SBEIIa на длинном плече хромосомы 2В по сравнению с зерном дикого типа. Другой генетической модификацией может быть делеция гена SBEIIa на длинном плече хромосомы 2В или мутация гена SBEIIa на длинном плече хромосомы 2В, приводящее к снижению активности фермента SBEIIa в эндосперме указанного зерна по сравнению с зерном дикого типа.
Растением может быть Triticumaestivum ssp. aestivum,, которое, вероятно, дополнительно содержит генетическую модификацию, приводящую к снижению активности крахмал-ветвящего фермента, кодируемого геном SBEIIa на длинном плече(ах) хромосомы 2В, хромосомы 2D или обеих хромосомах, по сравнению с зерном дикого типа. Другой генетической модификацией может быть делеция гена SBEIIa, по крайней мере, в одной из указанных хромосом, или мутация гена SBEIIa, по крайней мере, в одной из указанных хромосом, которые приводят к снижению активности фермента SBEIIa в эндосперме указанного зерна по сравнению с зерном дикого типа.
Данное растение может иметь встроенную нуклеиновую кислоту, кодирующую ингибитор экспрессии гена SBEIIa, его активности или того и другого. Уровень активности фермента SBEIIa может быть снижен, по крайней мере, на 40% по сравнению с уровнем ферментов в зерне дикого типа. Содержание амилозы в крахмале такого зерна может составлять, по крайней мере, 30% или, по крайней мере, 50%. Указанное зерно может быть неморщинистым, и его средняя масса может составлять, по крайней мере, примерно 36 мг. По крайней мере, 50% крахмальных гранул в указанном зерне могут быть недвоякопреломляющими при их наблюдении в поляризованном свете. В одном из вариантов изобретения, содержание крахмала в очищенных зернах составляет, по крайней мере, 25% (мас./мас.) или, по крайней мере, 90% от содержания крахмала в зерне дикого типа.
Амилопектин, присутствующий в зерне по любому варианту настоящего изобретения, может содержать пониженный уровень фракции dp (D-пиранозы) с длинной цепи 4-12 звеньев, по сравнению с амилопектином зерна дикого типа, как было измерено после деветвления амилопектина изоамилазой.
Кроме того, указанное зерно может содержать пониженный уровень белка SBEI, активности фермента SBEI или того и другого, а также может содержать измененные уровни фермента по сравнению с зерном дикого типа, где указанный фермент выбран из группы, состоящей из ADP-глюкозопирофосфорилазы, GBSS, SSI, SSII, SSIII, деветвящего фермента типа изоамилазы и деветвящего фермента типа пуллуланазы и любой их комбинации.
Варианты десятого аспекта настоящего изобретения охватывают зерно; крахмальные гранулы, экстрагированные из зерна; а также продукты, продуцированные из этого зерна или его крахмала, такие как, например, мука, мука из цельного зерна или крупка.
Краткое описание графического материала
Фиг.1. Последовательность гена крахмал-ветвящего фермента IIа (wSBE II-D1)[SEQ ID NO:1] от A.tauschii, соответствующего гену SBEIIa генома D гексаплоидной пшеницы (T.aestivum).
Фиг.2. Неполная последовательность гена SBEIIb (геномная последовательность wbe2b)[SEQ ID NO:2] от T.aestivum.
Фиг.3. Схематические конструкции дуплексных РНК. А. Генные элементы располагаются в следующем порядке: промотор, последовательность гена SBEIIa или SBEIIb (экзоны 1, 2 и 3) в смысловой ориентации, интрон (интрон 3), последовательность гена SBEIIa или SBEIIb (экзоны 1, 2, 3 и 4) в антисмысловой ориентации, и последовательность терминатора транскрипции/полиаденилирования. В. Транскрипт генов ds-SBEIIa и ds-SBEIIb образует “шпилечную” РНК-структуру с двухцепочечной областью, образованной путем гибридизации между смысловой и антисмысловой последовательностями. Интронная последовательность, ограниченная нуклеотидами GТ и АG, вырезана.
Фиг.4. Крахмальные гранулы, наблюдаемые под оптическим микроскопом и происходящие от (А) семян пшеницы с крахмальными гранулами дикого типа, происходящими от ds-SBEIIa-трансгенной линии 83.1b, (В) семян пшеницы с деформированными крахмальными гранулами дикого типа, происходящими от ds-SBEIIa-трансгенной линии 50.1b.
Фиг.5. Двоякопреломление крахмальных гранул, происходящих от семян пшеницы, показанных на фиг.4, и визуализированных в поляризованном свете.
Фиг.6. Сравнение неполных кДНК-последовательностей SBEIIa пшеницы. sbe 9 соответствует части AF338432.1. Показаны нижеследующие неполные последовательности: Y1182 [SEQ ID NO:3], sr997 [SEQ ID NO:4], sr995 [SEQ ID NO:5], sbe9 [SEQ ID NO:6].
Фиг.7. Сравнение неполных последовательностей SBEIIa пшеницы для первых 63 аминокислот с использованием программы PILEUP. Указана предположительная локализация генома в генах, соответствующих клонам.
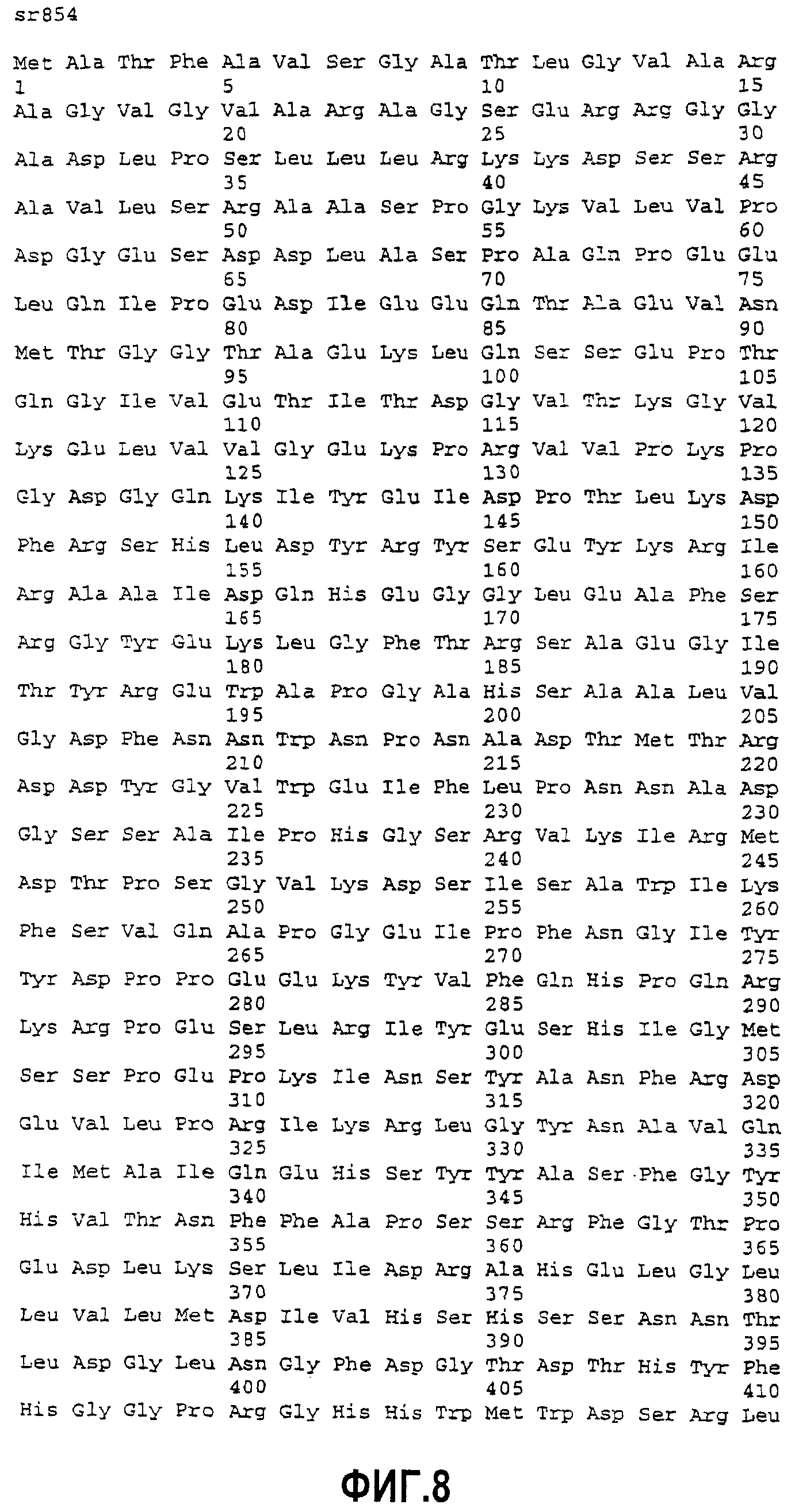
Фиг.8. Сравнение выведенных аминокислотных последовательностей полипептида D-генома (sr854)[SEQ ID NO:7] с продуктами генома А или В (у11282)[SEQ ID NO:8]. Перенесенная последовательность (положения 1-54) показана курсивом.
Фиг.9. ПЦР-амплификация области интрона 3 гена SBEIIb для различных линий пшеницы (дорожки 1-11) с использованием праймеров ARA19F и ARA23R после гидролиза ферментом Rsa1. Полосы, соответствующие геномам А, В и D, показаны стрелками. На дорожке 3 (Aus17340) и на дорожке 5 (Aus10103) отсутствует специфический маркер генома D, а на дорожке 8 (Aus12509) и дорожке 9 (Aus12565) отсутствует маркер генома В.
Фиг.10. Саузерн-гибридизация HindIII-гидролизованной ДНК линий пшеницы с использованием зонда от области интрона 3 гена SBEIIb. Дорожки соответствуют: 1) Aus12565, 2) Aus12509, 3) Aus10103, 4) CSDT2DL-4, 5) Aus12530 (пшеница дурум), 6) CSDT2BL-9, 7) Aus6323, 8) CSDT2DS, 9) Aus17340, 10) Aus12745, 11) CSDT2DL-4, 12) Aegilops tauschii.
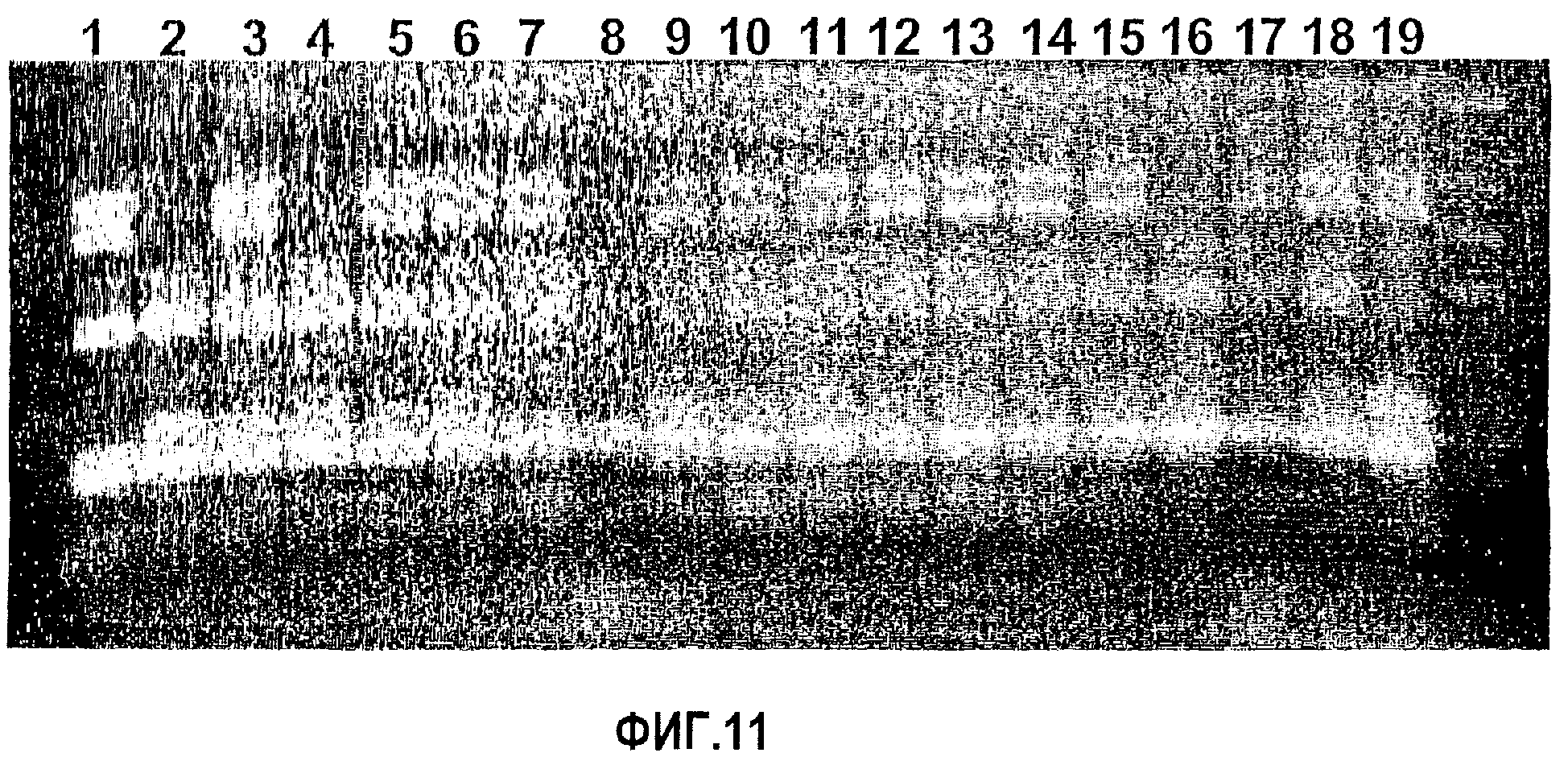
Фиг.11. Скрининг популяции F2 кроссов Aus17340a X Aus12509 путем ПЦР-амплификации области интрона 3 гена SBEIIb с использованием праймеров AR2b19cF AR2b23cR с последующим расщеплением RsaI. На дорожке 8 отсутствуют маркеры геномов В и D, а поэтому линия ВD54 представляет собой линию BD, в которой отсутствуют два генома В и D.
Фиг.12. Саузерн-гибридизация HindIII- (дорожки 1-4) и EcoR1- (дорожки 5-8)-гидролизованных клонов ВАС с использованием зонда от области интрона 3 гена SBEIIb. Дорожки соответствуют: 1) ВАС4, 2) ВАС5, 3) ВАС9, 4) ВАС12, 5) ВАС4, 6) ВАС5, 7) ВАС9, 8) ВАС12.
Фиг.13. А) FISH с использованием зонда wSBEII-DА1 и зонда с повторяющейся ДНК-последовательностью (рSc 119.2) для хромосом A. tauschii (главная фотография и нижняя вставка) и для хромосом пшеницы (верхняя вставка). В) FISH зонда SBEIIb для хромосом пшеницы.
Фиг.14. SDS-ПААГ-анализ связанных с зернами белков в пшенице дикого типа сорта Китайская яровая (Chinese Spring) (СS) и в линиях пшеницы, не содержащих SGP-1, проводимый при нескольких указанных стадиях развития семян (10, 15, 25 дней после цветения, М=зрелый). Измеряли интенсивность полосы белка, визуализированной в окрашенном серебром геле. Интенсивность полосы GВSS в зрелых семенах СS нормализовали путем деления на 100, и количество других ферментов, продуцируемых в указанной стадии развития, выражали как процент GВSS в зрелой пшенице СS. а) GВSS, b) SSI, с) SBEII. Черные столбцы соответствуют отсутствию SGP-1. Представлен пример электрофоретограммы геля для связанных с зернами белков CS и линии, не содержащей SGP-1.
Фиг.15. Относительные количества SBEIIa и SBEIIb в растворимой фракции. Иммуноблоты SDS-ПААГ сканировали и измеряли интенсивность полосы белка путем визуализации. Количества белков оценивали исходя из SBEIIa- и SBEIIb-гибридных белков, используемых на гелях в качестве стандарта.
Фиг.16. А. Анионообменная хроматография активности ветвящего фермента в эндосперме пшеницы (сорт Rosella). Растворимые белки в эндосперме фракционировали с использованием сульфата аммония и хроматографировали на колонке с Сефакрилом S-200, а затем наносили на анионообменную колонку Resource Q. В) Анализ проводили путем иммунодетекции белка SBEI в эндосперме пшеницы, разделенного с помощью электрофореза в неденатурирующем ПААГ, с использованием анти-WBE1 антитела. Полосы белка SBEI, помеченные как А и В, представляют собой продукты, происходящие от геномов А и В, соответственно, а Di и Dii представляют собой продукты, происходящие от генома D. Дорожки соответствуют экстрактам из: 1, CS; дорожка 2, N7BT7A; дорожка 3, N7AT7B; дорожка 4, N7DT7A. C) Анализ очищенных фракций, представляющих активные пики на анионообменной хроматограмме, проводили путем иммунодетекции с использованием анти-WBE1 антитела. Дорожка 1, неочищенный растворимый экстракт эндосперма; дорожка 2, фракции, представляющие пик 1; дорожка 3, фракция, представляющая пик 2.
Фиг.17. Скрининг двойного гаплоидного потомства от кроссов VC3.1.11 x CS7AL-15 на сегрегацию изоформ SBEI проводили путем иммунодетекции с использованием анти-WBEI антитела. Дорожки 1-14 соответствуют линиям двойного гаплоидного потомства. На дорожке 6 представлена линия тройного нуль-мутанта по SBEI, обозначенная А113, а на дорожке 7 представлена линия, нормальная по изоформам SBEI и обозначенная D28.
Фиг.18. ПЦР-амплификация ДНК от индуцированных гамма-излучением мутантных семян (дорожки 1-6) кроссов Veery 3 x Gabo 1BL.1RS с использованием праймеров AR2b19cF/AR2b23cR. На дорожке 2 представлены мутантные семена MLT2B8, а на дорожке 7 представлен сорт Китайская яровая (Chinese Spring).
Фиг.19. ПЦР-амплификация ДНК от линий пшеницы с использованием специфических к геному А праймеров для гена SBEIIa пшеницы, ARIIaAF/ARIIaAR. Дорожки 1-5 соответствуют, по порядку: CS, MLT2B8, MLT2D1, Dt2AS и BD219 (растение, которое представляет собой нуль-мутант по обоим генам SBEIIa и SBEIIb в обоих геномах В и D).
Фиг.20. Хроматограмма на 2В-геле с сефарозой СL для крахмала линий пшеницы а) Асс144008 и b) Асс 144087, проанализированных с использованием набора для анализа крахмала (Sigma).
Фиг.21. Сравнение профиля длины цепи крахмалов от трансгенных линий пшеницы с нетрансформированным контролем, NВ1 (пшеница). Процент общей массы отдельных олигосахаридов крахмалов от нетрансформированного контроля вычитали из соответствующих значений для крахмалов от трансгенных линий. Образцы: 085 (♦), 025 (▲), 008 (О).
Подробное описание изобретения
Модификация SBEIIa в пшенице
Настоящее изобретение основано на обнаружении того факта, что SBEIIa-активность в эндосперме пшеницы приводит к продуцированию модифицированного крахмала, а в частности, относительно высоких уровней амилозы в зерне пшеницы. Этот неожиданный результат контрастирует с результатами, полученными для кукурузы и риса, где мутация в SBEIIa не приводила к изменению профиля амилопектина/амилозы (Blauth et al., 2001, Nakamura, 2002). В другом своем варианте, настоящее изобретение включает модификацию одной или нескольких дополнительных активностей фермента, участвующего в биосинтезе крахмала, таких как снижение SBEIIb-, а также SBEIIa-активности. Мутация генов, кодирующих эти две активности, была создана благодаря неожиданному обнаружению того факта, что в пшенице, в отличие от кукурузы и риса, SBEIIa и SBEIIb непосредственно сцеплены друг с другом. Авторами было также неожиданно обнаружено, что зерно растения пшеницы, которое имеет пониженные уровни активности SBEIIa и SBEIIb, не является морщинистым.
Способ получения растения пшеницы
В одном из своих аспектов, настоящее изобретение относится к способу получения растения пшеницы, содержащего в своем зерне модифицированный крахмал, а в частности, повышенный уровень амилозы в крахмале, по крайней мере, на 30%. Обычно в гексаплоидной пшенице и в пшенице дурум содержание амилозы в крахмале составляет от примерно 18 до примерно 30%, а в некоторых мутантах (дефицитных по SGP-1) до примерно 35%. В одном из вариантов изобретения, способ настоящего изобретения включает стадию введения генетической модификации в родительское растение пшеницы или в его семена в целях продуцирования растений пшеницы, в зерне которых крахмал будет содержать, по крайней мере, 30% амилозы. В настоящем изобретении, содержание амилозы в крахмале определяют по массе (мас./мас.), то есть массу амилозы выражают в процентах массы крахмала по массе зерна. В других вариантах изобретения, содержание амилозы в крахмале составляет, по крайней мере, 40%, по крайней мере, 50%, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70% или по крайней мере, 75% (каждый - масс/масс). В других вариантах изобретения, указанный способ позволяет достичь содержания амилозы, по крайней мере, 80% или, по крайней мере, 90% (мас./мас.).
В другом варианте изобретения, указанный способ включает изменение, предпочтительно, снижение уровня белка, а именно крахмал-ветвящего фермента IIа (SBEIIa) или ферментативной активности, или того и другого в эндосперме пшеницы. То есть, генетическая модификация, которую вводят в растение пшеницы, приводит, прямо или опосредованно, к изменению уровня SBEIIa, а следовательно, и к модификациям крахмала, описанным в настоящей заявке. В другом варианте изобретения, который не исключает предыдущий вариант, указанный способ предусматривает изменение, а предпочтительно, снижение уровня экспрессии гена SBEIIa в эндосперме пшеницы, либо он предусматривает введение мутации гена SBEIIa в пшеницу, которое приводит к снижению SBEIIa-активности в эндосперме. Снижение уровня экспрессии гена SBEIIa или других генов может быть достигнуто путем встраивания нуклеиновой кислоты, например трансгена, который кодирует ингибирующую молекулу. Примерами ингибирующих молекул являются антисмысловые, ко-супрессорные, рибозимы или дуплексные РНК-молекулы.
Используемые здесь термины “изменение”, “увеличение”, “повышенный”, “снижение”, “пониженный”, “ингибируемый” или т.п. рассматриваются как семантически близкие понятия по сравнению с понятиями “дикого типа” или “немодифицированный”. Термин “уровень белка” означает количество конкретного белка, например SBEIIa, которое может быть измерено любым методом, известным специалистам, таким как, например, Вестерн-блот-анализ или другие иммунологические методы. Термин “уровень ферментативной активности” означает количество конкретного фермента, измеренное в ферментативном анализе. При этом следует отметить, что может быть изменен уровень активности фермента в мутанте, но не уровень экспрессии (количество) в самом белке. И, наоборот, количество белка может быть изменено, а его активность может оставаться на том же самом уровне, если продуцируется более или менее активный белок. Количество и активность могут также уменьшаться, если, например, ген, кодирующий фермент, является инактивированным. В некоторых вариантах изобретения, снижение уровня белка или активности составляет, по крайней мере, 40% или, по крайней мере, 60% или, по крайней мере, 75%, по крайней мере, 90% или, по крайней мере, 95% по сравнению с уровнем белка или активности в эндосперме немодифицированной пшеницы. Снижение уровня белка, ферментативной активности или экспрессии гена может происходить на любой стадии развития зерна, а в частности, на стадии налива зерна, когда крахмал синтезируется в развивающемся эндосперме, либо на всех стадиях развития зерна вплоть до его спелости.
Используемый здесь термин “крахмал” определяется как полисахарид, состоящий, в основном, из α-глюкопиранозных звеньев. Крахмал является главным запасающим углеводом пшеницы, синтезируется в амилопластах и образуется и накапливается в крахмальных гранулах. Он включает амилозу, главным образом, линейный α-1,4-D-глюкопиранозный полимер и амилопектин, который имеет короткие цепи из α-D-глюкопиранозных звеньев, связанных, главным образом, α-1,4-D-связями с α-1,6-присоединенными ветвями. Крахмал пшеницы растений дикого типа содержит примерно 20-30% амилозы и примерно 70-80% амилопектина. Другим существенным различием между двумя этими молекулами является из молекулярная масса. Амилоза имеет спиральную конформацию с молекулярной массой 104-106, а амилопектин имеет молекулярную массу 107-108 Дальтон. Недавно проведенные исследования показали, что в амилозе может присутствовать примерно 0,1% α-1,6-гликозидных точек ветвления, а поэтому ее определяют как, в основном, “линейную молекулу”. Термин “амилоза” определяется здесь как, в основном, линейная молекула, состоящая из α-1,4-связанных глюкозидных (глюкопиранозных) звеньев и амилозоподобного длинноцепочечного амилопектина (иногда называемого “промежуточным материалом” или “амилозоподобным амилопектином”, Takeda et al., 1993b; Fergason, 1994). Содержание амилозы может быть определено любыми методами, известными специалистам, включая эксклюзионную ВЭЖХ, проводимую, например, методами с использованием 90% (мас./об.) ДМСО и конканавалина А (Megazyme Int., Ireland), или, предпочтительно, йодометрическими методами, например, как описано в примере 1. ВЭЖХ-метод может включать (Batey & Curtin, 1996), а может и не включать, деветвление крахмала. Исходя из массы зерна и содержания амилозы, можно быть вычислить и сравнить количества амилозы, аккумулированные в зерне трансгенных и контрольных линий.
В другом варианте изобретения, указанный способ включает стадию определения количества активности SBEIIa в эндосперме пшеницы любым известным методом. В некоторых вариантах изобретения, уровень белка измеряют, например, методами иммунодетекции, такими как Вестерн-блот-анализ или ELISA-анализ, либо измеряют уровень его мРНК в соответствии с хорошо известными методами, такими как Нозерн-блот-гибридизационный анализ или полимеразная цепная реакция с участием обратной транскриптазы (ОТ-ПЦР). В другом варианте изобретения, указанный способ включает стадию отбора или скрининга растения пшеницы или его зерна, имеющего измененный уровень белка SBEIIa или ферментативной активности в эндосперме. Стадия отбора может быть осуществлена исходя из пониженного уровня SBEIIa-активности или уровня белка, либо она может быть осуществлена исходя из фенотипа зерна растения пшеницы, такого как повышенное содержание амилозы или пониженное содержание амилопектина, или исходя из визуальной оценки фенотипа, например, по морщинистому зерну или по измененным свойствам крахмальных гранул.
Следует отметить, что настоящее изобретение включает способ идентификации растения пшеницы с измененными свойствами крахмала в зерне любыми методами, описанными в настоящей заявке, либо прямого или опосредованного определения свойств, например, путем детекции наличия генетической модификации в растении или в его зерне. Такими растением может быть растение, относящееся к популяции растений пшеницы, например к селекционной пшенице.
SBE-активность может быть измерена прямым методом путем ферментативного анализа, например путем анализа на стимуляцию (Boyer & Preiss, 1978). В этом анализе измеряют SBE-стимуляцию введения не растворимого в метаноле глюкозо-1-фосфата в полимер (α-D-глюкан) под действием фосфорилазы а. SBE-активность может быть определена с помощью анализа на окрашивание йодом, в котором измеряют снижение оптической плотности комплекса “глюкан-полийод” в результате ветвления глюкановых полимеров. SBE-активность может быть также оценена с помощью анализа на связи в точках ветвления, в котором оценивают генерирование редуцирующих концов из восстановленной амилозы в качестве субстрата после расщепления изоамилазой (Takeda et al., 1993a). Предпочтительно, указанную активность измеряют в отсутствии SBEI- или SBEIIb-активности. Изоформы SBE обнаруживают различные специфичности к субстрату, например, SBEI обладает более высокой активностью ветвления амилозы, тогда как SBEIIa и SBEIIb способствуют ускорению ветвления при взаимодействии с амилопектиновым субстратом. Эти изоформы могут быть также идентифицированы исходя из длины переносимой глюкановой цепи. Белок SBE может быть также оценен с использованием специфических антител, таких как антитела, описанные в настоящей заявке. SBEII-активность может быть также измерена в процессе развития зерна в развивающемся эндосперме, или альтернативно, в зрелом зерне, где белок еще присутствует в эквивалентом, но немодифицированном зерне и может быть проанализирован иммунологическими методами.
В другом своем аспекте, настоящее изобретение относится к способу изменения, а предпочтительно, снижения активности множества ферментов биосинтеза крахмала в эндосперме пшеницы, где одним из таких ферментов является SBEIIa, таким образом, чтобы содержание амилозы в крахмале зерна составляло, по крайней мере, 50%. В некоторых вариантах изобретения, уровни белков SBEIIa и SBEIIb или ферментативных активностей являются пониженными, либо уровни всех трех ферментов SBEIIa, SBEIIb и SBEI являются пониженными. Другими ферментами биосинтеза крахмала, которые могут быть модифицированы в комбинации с SBEIIa, являются SSI, SSII, SSIII. Крахмал-деветвящие ферменты могут быть также модифицированы, например, в отношении активности изоамилазы или пуллуланазы. Настоящее изобретение также относится к любой комбинации вышеуказанных ферментов при условии, что SBEIIa является модифицированным. В другом варианте изобретения, активность одного или нескольких ферментов биосинтеза крахмала в тканях растения, не относящихся к эндосперму, изменена; так, например, в листьях, активность SBEI или SBEII может быть увеличена для компенсации некоторой потери активности, вызванной влиянием трансгена, кодирующего SBEIIa-ингибирующую молекулу, участвующую, главным образом, в экспрессии в эндосперме. Таким изменением может быть увеличение или снижение количества или изменение, например, времени экспрессии. Альтернативно, синтез крахмала может быть также усилен посредством сверхэкспрессии одного или нескольких ферментов биосинтеза крахмала в комбинации со снижением уровня SBEIIa. Гены, кодирующие такие ферменты, могут происходить от источника любого типа, например от бактериальных или других источников, не относящихся к пшенице, и они могут быть модифицированы в целях изменения каталитических свойств, например изменения зависимости действия ферментов от температуры (например, см., WO 94/09144).
Фенотип с высоким содержанием амилозы может быть достигнут путем частичного или полного ингибирования экспрессии гена SBEIIa или генов SBEIIa и SBEIIb. Степень ингибирования такого гена или генов будет до некоторой степени определять свойства крахмала, образующегося в зерне пшеницы. Природа и степень модификации SBEIIa- и/или SBEIIb-активности может быть выявлена любыми методами гель-электрофореза, осуществляемыми для анализа белков, экстрагируемых из модифицированного эндосперма пшеницы. Такой модификацией может быть снижение SBEIIa- и/или SBEIIb-активности, полная элиминация ферментативной активности или изменение распределения SBEIIb или других ферментов в эндосперме. Для проведения этих анализов крахмал может быть экстрагирован из эндосперма пшеницы, и присутствующие в нем белки могут быть проанализированы, например, как описано у Rahman et al., 1995. Такие хорошо известные методы как электрофорез в SDS-ПААГ и иммуноблоттинг проводят на растворимой и на гранулярной фракции крахмала, и полученные результаты используют для идентификации растений или зерна, которые несут модификацию ферментов SBEIIa и/или SBEIIb.
Растения пшеницы
В другом своем аспекте, настоящее изобретение относится к растению пшеницы, способному продуцировать зерно, в котором содержание амилозы в крахмале составляет, по крайней мере, 30%. В других вариантах изобретения, содержание амилозы в крахмале составляет, по крайней мере, 40%, по крайней мере, 50%, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70% или по крайней мере, 80%. В другом варианте изобретения, растение пшеницы, зерно которого содержит любые уровни амилозы в крахмале, имеет генетическую модификацию, приводящую к снижению уровня экспрессии гена SBEIIa, активности фермента SBEIIa в эндосперме или того и другого по сравнению с зерном дикого типа. В предпочтительном варианте изобретения, генетическая модификация включает мутацию гена SBEIIa или введенную нуклеиновую кислоту, кодирующую ингибитор экспрессии гена SBEIIa. Такой ингибитор может содержать антисмысловую, ко-супрессорную, рибозимную или дуплексную РНК-молекулу или аналогичную молекулу, ингибирующую экспрессию и/или активность SBEIIa.
Используемым здесь растением пшеницы является любое растение рода Triticum, которое представляют собой коммерчески ценные сорта, включая, например, Triticum aestivum L.ssp. aestivum (пшеница обыкновенная или хлебопекарная пшеница), другие подвиды Triticum aestivum, Triticum turgidum L. ssp. durum (пшеница дурум, также известная как янтарный дурум или пшеница твердая), Triticum monococcum L.ssp. monococcum (однозернянка культурная или полба), Triticum timopheevi ssp. timopheevi, Triticum turgigum L. ssp. dicoccon (полба-эммер) и другие подвиды Triticum turgidum (Feldman). Такая пшеница может быть гексаплоидной пшеницей, имеющей геном типа ААВВDD, или тетраплоидная пшеница, имеющая геном типа ААВВ. Поскольку генетическая модификация в пшенице настоящего изобретения может передаваться некоторым родственным видам, включая рожь и ячмень путем гибридизации, то настоящее изобретение также охватывает выведенные таким образом гибридные виды, включая сорт “тритикале”, который представляет собой гибрид пшеницы и ржи. В конкретном варианте изобретения, таким растением пшеницы является вид Triticum aestivum, а предпочтительно, подвиды aestivum. Альтернативно, поскольку мутации или трансгены могут быть легко перенесены из Triticum aestivum в пшеницу дурум, то предпочтительной пшеницей является Triticum turgidum L. ssp. durum.
Настоящее изобретение также относится к растениям пшеницы с пониженным уровнем белка SBEIIa, ферментативной активности в эндосперме или того и другого, где указанное растение пшеницы способно продуцировать зерно, крахмал которого имеет повышенное содержание амилозы по сравнению с крахмалом, экстрагированным из растения дикого типа. Снижение уровня SBEIIa может происходить, по крайней мере, в течение части процесса развития зерна или в течение всего процесса развития растения до достижения его зрелости. В другом варианте изобретения, уровень SBEIIa в эндосперме снижен, по крайней мере, на 50%, по крайней мере, на 75%, по крайней мере, на 90% или, по крайней мере, на 95% по сравнению с уровнем в растении дикого типа. Термин “дикий тип” употребляется в своем обычном значении, известном специалистам-генетикам, и включает сорта или генотипы пшеницы, которые не являются модифицированными, как описано в настоящей заявке.
Настоящее изобретение также относится к потомству растений и к зерну, которое сохраняет нужные генотипические и/или фенотипические свойства родительских растений пшеницы. Настоящее изобретение также относится к любому материалу для выращивания растений пшеницы, который может быть использован в целях культивирования растений с нужными свойствами, такому как культивируемые ткани или клетки.
Настоящее изобретение также относится к растениям пшеницы, которые, помимо пониженной SBEIIa-активности, содержат измененные, а предпочтительно, пониженные уровни ферментов SBEIIb или других ферментов биосинтеза крахмала. Растения с пониженной SBEIIa- и SBEIIb-активностью могут быть продуцированы путем скрещивания растения, имеющего пониженный уровень SBEIIa, с растением, имеющим пониженный уровень SBEIIb, или путем введения трансгена, кодирующего молекулы, ингибирующую экспрессию обоих генов SBEIIa и SBEIIb. Из-за тесного сцепления генов SBEIIa и SBEIIb в пшенице, как было выявлено в настоящем изобретении, растения со сниженной активностью обоих ферментов, могут быть также продуцированы путем идентификации сортов, не содержащих изоформ SBEIIa и SBEIIb, кодируемых одним из геномов пшеницы, и путем скрещивания таких сортов для продуцирования растения, содержащего пониженный уровень изоформ, кодируемых, по крайней мере, двумя геномами.
Настоящее изобретение также относится к генетическому(им) изменению(ям) или мутациям в других генетических фенотипах или в других видах, которые могут быть гибридизованы с растением пшеницы, описанным выше. Измененные (мутантные) растения могут быть скрещены с растениями, имеющими более желательный генетический фон. После первоначального скрещивания может быть получено подходящее число “бэккроссов” для удаления менее желательного фона. Желательный генетический фон может включать подходящую комбинацию генов, обеспечивающих урожайность при промышленном производстве и другие характеристики, такие как агрономическая эффективность или устойчивость к абиотическому стрессу. Генетический фон может также включать другие изменения биосинтеза крахмала или модификации генов, например генов от других линий пшеницы, имеющих морщинистый эндосперм, каузальный ген которого неизвестен.
Такие растения могут быть трансгенными или нетрансгенными.
Настоящее изобретение также относится к растениям пшеницы, содержащим мутацию, где ген SBEIIa отсутствует в длинном плече хромосомы 2А (2АL), или где ген SBEIIa, присутствующий на длинном плече хромосомы 2А, несет мутацию, приводящую к снижению уровня активности фермента SBEIIa в эндосперме указанного зерна по сравнению с зерном дикого типа. Несмотря на широкий скрининг библиотеки из 2400 сортов пшеницы, авторами не было обнаружено таких растений в природе, что позволяет предположить, что в природе может происходить отбор на сохранение функционального гена SBEIIa на хромосоме 2АL. Однако указанные растения могут быть продуцированы и идентифицированы после мутагенеза. Такими растениями являются нетрансгенные растения, которые в некоторых случаях являются предпочтительными для продажи. Указанными растениями могут быть хлебопекарная пшеница, пшеница дурум или другие сорта пшеницы. В предпочтительном варианте изобретения, растение пшеницы содержит на хромосоме 2АL делецию, по крайней мере, части гена SBEIIa, которая может распространяться, по крайней мере, на часть гена SBEIIb. Как очевидно для каждого специалиста, гексаплоидная пшеница, такая как хлебопекарная пшеница, имеет три генома, которые обычно обозначаются геномами А, В и D, а тетраплоидная пшеница, такая как пшеница дурум содержит два генома, обычно обозначаемые геномами А и В. Каждый геном содержит 7 пар хромосом, которые могут наблюдаться цитологическими методами в процессе мейоза. Хромосомы обычно обозначают в соответствии с их размером, от самого большого размера до самого маленького, а поэтому хромосома 2 представляет собой вторую по величине, после самой крупной, хромосому в каждом геноме. Каждая хромосома имеет центромер, который на хромосоме 2 расположен асимметрично, а поэтому два плеча хромосомы 2 называются “короткими” и “длинными”. Используемый здесь термин “длинное плечо хромосомы 2А” имеет свое обычное значение, то есть определяется как область хромосомы, расположенная между центромером и концом длинного плеча. Термины “длинное плечо хромосомы 2В” и “длинное плечо хромосомы 2D” имеют то же самое значение, за исключением того, что они относятся к хромосоме 2 геномов пшеницы В или D соответственно.
Авторами было обнаружено, что гены SBEIIa и SBEIIb тесно сцеплены на хромосоме 2 пшеницы. В конкретном варианте изобретения, растение пшеницы содержит множество (>50%) 2АL, где плечо этой хромосомы содержит мутацию, по крайней мере, гена SBEIIa. То есть, в основном, присутствует хромосома 2АL, содержащая мутацию, по крайней мере, гена SBEIIa в геноме А. Присутствие 2АL может быть определено цитологическими методами, такими как, например, методы гибридизации in situ (см. пример 9), или методами с использованием 2АL-специфических молекулярных маркеров. В предпочтительном варианте изобретения, растение пшеницы является гомозиготным по указанной мутации. Указанная мутация может быть молчащей мутацией (нуль-мутацией). Такой мутацией может быть делеция.
В конкретном варианте осуществления изобретения, делеционный аллель происходит от растений MLT2B8 или MLT2D1. Поскольку в этих растениях мутантные аллели SBEIIa находятся на хромосоме 2АL, то эти аллели могут быть введены в растения сортов хлебопекарной пшеницы или пшеницы дурум путем скрещивания, а поэтому такие растения, а также зерно и полученные из него крахмальные продукты также входят в объем настоящего изобретения. Эти аллели могут быть объединены с другими генами или аллелями, ответственными за биосинтез крахмала, или с другими аллелями, обладающими ценными генетическими признаками.
Очевидно, что настоящее изобретение также относится к способам продуцирования или идентификации таких растений пшеницы или зерна, продуцируемого такими растениями.
Зерно
Настоящее изобретение также относится к зерну пшеницы, содержащему модифицированный крахмал по сравнению с крахмалом, экстрагированным из зерна пшеницы дикого типа. Используемый здесь термин “зерно” означает, в основном, зрелое зерно. Этот термин включает зерно, собранное при промышленном возделывании. В одном из вариантов изобретения, модифицированный крахмал продуцируется, по крайней мере, частично в результате снижения SBEIIa-активности в процессе развития эндосперма зерна пшеницы. В другом варианте изобретения, который не исключает предыдущий вариант, указанное зерно имеет повышенное содержание амилозы (процент от общего содержания крахмала). Это количество может быть определено как пониженное содержание амилопектина в крахмале по сравнению с его содержанием в зерне растения дикого типа. Крахмал пшеницы дикого типа содержит приблизительно 20-30% амилозы и 70-80% амилопектина. Зерно настоящего изобретения содержит крахмал, предпочтительно, имеющий, по крайней мере, 50% (мас./мас.) амилозы. В другом варианте изобретения, SBEIIa- и SBEIIb-активности также снижаются в процессе развития эндосперма. В другом варианте изобретения также снижается активность SBEI. В других вариантах изобретения, содержание амилозы в крахмале зерна, измеренное методами, хорошо известными специалистам, составляет, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70%, по крайней мере, 75%, по крайней мере, 80% или, по крайней мере, 90% (каждое значение дано по массе). Увеличение уровней амилозы может наблюдаться при аномальной морфологии крахмальных гранул или при отсутствии двоякопреломления указанных гранул, наблюдаемого под оптическим микроскопом или другими известными методами. В конкретном варианте изобретения, содержание амилозы измеряют йодометрическим методом, которым может быть, например, спектрофотометрический метод, такой как, например, метод, описанный Morrison & Laignelet (1983), или высокоэффективная жидкостная хроматография (ВЭЖХ, например, Batey & Curtin, 1996).
В других вариантах изобретения, зерно пшеницы содержит крахмал, который имеет измененные физические свойства, такие, как, например, повышенная или пониженная температура желатинизации, измененные свойства набухания в процессе или после желатинизации, измененная вязкость, измененное распределение длин цепи в амилопектине, или любые их комбинации. Повышенная или пониженная температура желатинизации может быть характерной для первого пика желатинизации, для второго пика желатинизации или для обоих пиков. Одно или несколько свойств крахмала, таких как, например, энтальпия желатинизации, могут оставаться неизмененными. Температура первого пика (максимум) желатинизации, измеренная с помощью дифференциальной сканирующей калориметрии, может быть повышена, по крайней мере, на 3°С или на 5°С, а предпочтительно, по крайней мере, на 7°С или на 8°С, а более предпочтительно, по крайней мере, на 10°С по сравнению с температурой первого пика для соответствующего крахмала зерна дикого типа. В конкретном варианте изобретения, температура повышается с 3 до 12°С.
Зерно может быть морщинистым или неморщинистым, а предпочтительно, оно является неморщинистым. Используемый здесь термин “неморщинистый”, относится к большому количеству зерна, предпочтительно, по крайней мере 90% индивидуальных зерен которого проявляет “выполненный” или полностью налитый фенотип. Этот фенотип обычно ассоциируется с нормальным уровнем или близким к нормальному уровню накопления крахмала. В противоположность этому, используемый здесь термин “морщинистый” фенотип означает фенотип зерна, где большинство зерен, предпочтительно, по крайней мере, 90% зерен имеет фенотип с пониженной аккумуляцией крахмала. Слегка морщинистое зерно означает снижение содержания крахмала в среднем, по крайней мере, на 30%; умеренно морщинистое зерно означает снижение содержания крахмала в среднем, по крайней мере, на 50%; а сильно морщинистое зерно означает снижение содержания крахмала, в среднем, по крайней мере, на 70% по сравнению с зерном дикого типа. Морщинистость может быть также определена по относительному содержанию крахмала как процент по массе зрелого зерна. Содержание крахмала в немодифицированном зерне пшеницы, выращенной в полевых условиях, составляет примерно 65%, а содержание крахмала в морщинистом зерне снижено до менее чем 50%.
В других вариантах изобретения, зерно имеет среднюю массу, по крайней мере, 36 или 40 мг. Среднюю массу зерна определяют путем измерения массы известного числа зерен пшеницы, составляющих репрезентативный образец партии зерна, и деления общей массы на число зерен. При этом следует отметить, что характеристики этого зерна, такие как содержание крахмала, средняя масса и неморщинистый фенотип, которые близки характеристикам зерна дикого типа, являются желательными для промышленного производства зерна.
Настоящее изобретение также относится к муке, мучным продуктам, к тесту и к другим продуктам, изготавливаемым из указанного зерна или с использованием такого зерна. Это зерно может быть необработанным или обработанным, например, путем фракционирования или отбеливания. Настоящее изобретение также относится к зернам пшеницы, используемым для изготовления пищевых продуктов, получаемых из растений пшеницы настоящего изобретения. Кроме того, настоящее изобретение включает зерно, обработанное другими способами, в результате чего данное зерно может быть помолотым, дробленым, плющенным, обрушенным, измельченным или битым, или опаленным (полента) зерном, например зерно кус-кус.
Крахмал
В другом своем аспекте, настоящее изобретение относится к крахмалу, полученному из зерна описанных здесь растений пшеницы, где указанный крахмал имеет повышенное содержание амилозы и пониженное содержание амилопектина. В предпочтительном варианте изобретения, такой крахмал получают из зерна растения пшеницы, имеющего пониженный уровень белка SBEIIa, пониженную активность фермента SBEIIa в эндосперме или того и другого по сравнению с пшеницей дикого типа. В другом варианте изобретения, уровни обеих SBEIIa- и SBEIIb-активностей являются пониженными, либо активности всех трех ферментов SBEIIa, SBEIIb и SBEI являются пониженными по сравнению с активностью пшеницы дикого типа.
В другом своем аспекте, настоящее изобретение относится к крахмалу, полученному из зерна описанных здесь растений пшеницы, в котором содержание амилозы составляет, по крайней мере, 50%, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70%, по крайней мере, 75%, по крайней мере, 80% или, по крайней мере, 90%. Этот крахмал является, по крайней мере, частично очищенным, то есть он отделен, по крайней мере, от одного из других компонентов зерна. Очищенный крахмал может быть получен из зерна путем помола, например мокрого помола, который предусматривает отделение крахмала от белка, масла и волокон. Первичным продуктом помола является смесь или композиция крахмальных гранул, а поэтому такие гранулы, содержащие описанный здесь модифицированный крахмал, также входят в объем настоящего изобретения.
Указанный крахмал может иметь повышенную или пониженную температуру желатинизации, а предпочтительно, повышенную температуру желатинизации. В конкретных вариантах изобретения, по крайней мере, одна из температур, соответствующая началу первого пика, или максимуму первого пика, увеличивается, по крайней мере, на 3°С, по крайней мере, на 5°С, по крайней мере, на 7°С или, по крайней мере, на 10°С, как было измерено с помощью DSC, по сравнению с температурой желатинизации крахмала, экстрагированного из зерна пшеницы дикого типа. В конкретном варианте настоящего изобретения, повышение температуры составляет от 3 до 12°С. В конкретном случае температура желатинизации может быть снижена в начале первого пика и увеличена в верхней точке пика. В другом варианте изобретения, который не исключает предыдущий вариант, указанный крахмал может иметь измененную температуру желатинизации для первого пика, но иметь, в основном, прежнюю температуру для второго пика, что соответствует диссоциации амилозы-липида, как было определено с помощью DSC. В другом варианте изобретения, крахмал обладает пониженной энтальпией в процессе желатинизации, например обнаруживает снижение температуры желатинизации, по крайней мере, на 25% или, по крайней мере, на 40% по сравнению с соответствующим значением температуры для крахмала пшеницы дикого типа.
В другом варианте изобретения, указанный крахмал содержит повышенный уровень резистентного крахмала, при этом его модифицированная структура характеризуется конкретными физическими свойствами. Такие свойства могут включать физическую недоступность для гидролизующих ферментов, что может быть обусловлено измененной морфологией крахмальных гранул; присутствие ценного ассоциированного с крахмалом липида; измененную кристалличность, измененное распределение длин цепи амилопектина или любую комбинацию этих свойств. Высокое содержание амилозы также способствует увеличению уровня резистентного крахмала.
Настоящее изобретение также относится к крахмалу, полученному из зерна описанного здесь растения пшеницы, содержащего повышенное количество пищевого волокна, предпочтительно, в сочетании с повышенным уровнем резистентного крахмала. Такое увеличение также, по крайней мере, частично, обусловлено относительно высоким уровнем амилозы.
Отсюда очевидно, что настоящее изобретение относится к способам продуцирования пшеничного крахмала, описанного в настоящей заявке. В одном из вариантов изобретения, указанный способ включает стадии получения описанного здесь пшеничного зерна и экстракции крахмала из такого зерна. Пшеничное зерно может быть получено путем культивирования описанных здесь растений пшеницы и сбора такого зерна, либо оно может быть получено от поставщиков или импортеров такого зерна.
Способы снижения активности гена
Экспрессия и/или активность SBEIIa, SBEIIb или других генов биосинтеза или модификации крахмала может быть изменена путем введения одной или нескольких генетических модификаций в растение пшеницы. Используемый здесь термин “генетическая модификация” означает любое наследуемое изменение в геноме растения пшеницы, которое в данном окружении влияет на экспрессию или активность представляющего интерес гена. Генетическими модификациями являются мутации, такие как точковые мутации, инсерции, замены, инверсии, дупликации, транслокации, а предпочтительно, делеции, и встраивание одного или нескольких трансгенов в геном.
Используемые здесь термины “молекула нуклеиновой кислоты” и “последовательность нуклеиновой кислоты” означают полимер, состоящий из нуклеотидов, который может быть одноцепочечным или двухцепочечным. Этот полимер может включать ДНК, такую как, например, геномная ДНК или кДНК, РНК, мРНК или любые их комбинации. Для введения в клетки пшеницы молекула нуклеиновой кислоты может быть химически модифицирована для улучшения доставки или увеличения стабильности, либо она может быть представлена в защищенном виде как часть вектора, такого как вирусный вектор. Молекула нуклеиновой кислоты может быть получена методами клонирования, либо она может быть синтезирована хорошо известными методами. Молекула нуклеиновой кислоты может содержать кодирующую цепь, или некодирующую цепь (антисмысловую цепь), или их комбинацию, такую, которая, например, присутствует в конструкциях инвертированных повторов. Что касается последовательностей нуклеиновой кислоты, которые “соответствуют” гену, то термин “соответствует” означает степень сходства нуклеотидных последовательностей, то есть это означает, что данная нуклеотидная последовательность имеет нуклеотидную последовательность, которая является идентичной сравниваемой последовательности гена или его указанной части, либо она имеет нуклеотидную последовательность, которая является абсолютно комплементарной с точки зрения нормального спаривания оснований согласно модели Уотсона-Крика, либо она представляет собой РНК-эквивалент такой последовательности, например мРНК, либо она представляет собой кДНК, происходящую от мРНК гена.
Описанные здесь нуклеотидные последовательности представляют собой одноцепочечную последовательность нуклеотидов в направлении 5' → 3', которые обозначены стандартными однобуквенными аббревиатурами. Термин “комплементарный” описывает сходство между двумя одноцепочечными молекулами нуклеиновой кислоты или последовательностями, которые гибридизуются путем спаривания оснований. Так, например, 5'-GАСТ-3'-пары соответствуют их комплементу 5'-АGТС-3'. Термины “гомология” или “гомологичный” означают сходство или идентичность между двумя или более нуклеотидными последовательностями или между двумя или более полипептидными последовательностями в соответствии с контекстом. Термин “процент идентичности”, относящийся к нуклеотидным последовательностям, означает процент нуклеотидных соответствий между двумя нуклеотидными последовательностями, выровненными с использованием стандартизированного алгоритма, такого как, например, алгоритм CLUSTAL V или программ Blastn или BLAST2, которые могут быть взяты из Национального Центра Биотехнологической Информации, и из Интернета на сайте http://www.ncbi.nlm.nih.gov/BLAST/, предпочтительно, с использованием параметров по умолчанию. Аналогичным образом, термин “процент идентичности” может относиться к полипептидным последовательностям.
Термин “ген”, включая ген SBEIIa и SBEIIb или другой ген биосинтеза крахмала, или ген, кодирующий антисмысловые молекулы, ко-супрессорные молекулы, рибозим, молекулы дуплексной РНК или т.п., используется здесь в самом широком смысле этого слова и означает классический геномный ген, имеющий транскрибируемые области, ассоциированные с регуляторными областями, такими как промоторы, и терминаторами транскрипции, и последовательности полиаденилирования. Транскрибируемые области включают транскрибируемые, но не транслируемые последовательности (нетранслируемые последовательности, UTR) и могут включать, но необязательно, белок-кодирующую область или интроны, которые подвергаются сплайсингу с образованием зрелой ДНК, или любую их комбинацию. Термин “ген” включает формы, полученные из кДНК, соответствующие экзонам, и гены РНК, присутствующие в РНК-геномах. Термин “ген” также используется для описания синтезированных или гибридных молекул, кодирующих весь или часть функционального продукта.
“Ген”, присутствующий в клетке, а предпочтительно, в клетке пшеницы, направляет “экспрессию” “биологически активной молекулы” или “генного продукта”, которым может быть РНК или полипептид. Таким процессом обычно является транскрипция с продуцированием РНК и трансляция с продуцированием белка. Указанный продукт может быть затем модифицирован в клетке. РНК может быть модифицирована, например, путем полиаденилирования, сплайсинга, “кэппинга”, “нарезания” на фрагменты из 21-23 нуклеотидов, или экспорта из ядра или путем ковалентного или нековалентного взаимодействия с белками. Белки могут быть модифицированы, например, путем фосфорилирования, гликозилирования или липидирования. Все указанные процессы охватываются термином “экспрессия гена” или других используемых здесь терминов.
Используемые здесь термины “ген пшеницы SBEIIa” и “ген пшеницы SBEIIb” и родственные термины означают гены, которые были идентифицированы в пшенице, как гены, кодирующие ферменты SBEIIa или SBEIIb, соответственно, и гомологичные гены, присутствующие в других сортах пшеницы. Эти термины включают, но не ограничиваются ими, генные последовательности, перечисленные в таблице 1. При этом следует отметить, что в последовательностях генов SBEIIa и SBEIIb имеются природные модификации, отличающиеся у различных сортов пшеницы. Гомологичные гены могут быть легко идентифицированы средним специалистом. Степень идентичности последовательностей между гомологичными генами или белками SBEIIa составляет, по крайней мере, 90%, то же самое относится и к генам или белкам SBEIIb.
Гены, используемые в настоящем изобретении, могут быть получены из природных генов SBEIIa и SBEIIb или от других генов биосинтеза крахмала стандартными методами рекомбинантных ДНК. Используемый здесь термин “рекомбинантная молекула нуклеиновой кислоты” или т.п. означает последовательность, которая не встречается в природе или которая имеет последовательность, созданную путем искусственного комбинирования двух или нескольких других отдельных сегментов последовательности. Эта искусственная комбинация может быть образована путем химического синтеза или, в основном, путем искусственной модификации отдельных сегментов нуклеиновых кислот, например, методами генной инженерии, хорошо известными специалистам. Термин “рекомбинантный” включает нуклеиновые кислоты, которые модифицированы только путем добавления, замены или делеции части нуклеиновой кислоты. В большинстве случаев рекомбинантная нуклеиновая кислота может включать последовательность нуклеиновой кислоты, функционально присоединенную к промоторной последовательности. Такая рекомбинантная нуклеиновая кислота может быть частью вектора, используемого, например, для трансформации клетки.
В общих чертах, ген может быть подвергнут мутагенезу с продуцированием одной или множества нуклеотидных замен, делеций и/или добавлений, такому как, например, модификация кодона. Нуклеотидными инсерционными производными таких генов являются 5'- и 3'-концевые гибриды, а также инсерции одного или множества нуклеотидов внутрь последовательности. Вариантами инсерционной нуклеотидной последовательности являются варианты, в которых один или несколько нуклеотидов встроены в предварительно определенный сайт нуклеотидной последовательности, хотя при соответствующем скрининге полученного продукта может быть также обнаружена и случайная инсерция. Делеционные варианты характеризуются отсутствием одного или нескольких нуклеотидов в данной последовательности. Вариантами нуклеотидов с заменами являются варианты, в которых, по крайней мере, один нуклеотид в данной последовательности был удален, и на его место введен другой нуклеотид. Такая замена может быть “молчащей”, то есть такая замена не приводит к замене аминокислоты, определяемой данным кодоном. Альтернативно, консервативные замены осуществляют в целях замены одной аминокислоты на другую аминокислоту с аналогичной функцией. Типичными заменами являются замены, осуществляемые следующим образом.
Подходящие остатки для консервативных аминокислотных замен:
Трансгены
Экспрессия и/или активность генов SBEIIa и SBEIIb или других генов, ответственных за биосинтез или модификацию крахмала, может быть изменена путем введения одного или нескольких трансгенов в растения пшеницы. Используемый здесь термин “трансген” имеет общепринятое значение в области биотехнологии и включает генную последовательность, которая была продуцирована или модифицирована методами рекомбинантных ДНК или РНК и которая была введена в представляющие интерес организм или клетку, а предпочтительно, в клетку пшеницы. Такой трансген может включать генетические последовательности, происходящие от организма или клетки, например антисмысловую последовательность. Обычно трансген включает экзогенную нуклеиновую кислоту, которая не происходит от указанного организма или от указанной клетки. Термин “трансгенный” относится к организму или к клетке, содержащим трансген. Термин “нетрансгенный” означает отсутствие любого трансгена в геноме. Трансген, предпочтительно, интегрируют в геном организма или клетки для обеспечения стабильного наследования.
Каждому среднему специалисту известно, что для экспрессии гена или комплементарной ему последовательности в клетке требуется, чтобы указанный ген был функционально присоединен к промоторной последовательности. Для достижения этих целей промотор может быть выбран в зависимости от необходимого уровня экспрессии, и/или от ткани, органа и вида, в котором должна происходить экспрессия, а в частности таким промотором являются эндосперм-специфические промоторы.
Введение молекулы нуклеиновой кислоты под контроль промоторной регуляторной последовательности подразумевает, что указанная молекула должна находиться в таком положении, чтобы ее экспрессия регулировалась промоторной последовательностью. Промотор обычно, но необязательно, расположен выше или со стороны 5'-конца от молекул нуклеиновой кислоты, которую он регулирует. Кроме того, регуляторные элементы, содержащие промотор, обычно расположены в пределах 2 т.п.н. от сайта инициации транскрипции гена. В конструкции комбинаций гетерологичного промотора/структурного гена, в основном, предпочтительно, чтобы промотор находился на определенном расстоянии от сайта инициации транскрипции гена, которое является примерно таким же, как и расстояние между указанным промотором и геном, который им регулируется в природе (то есть геном, от которого происходит данный промотор). Как известно специалистам, могут быть допущены некоторые изменения в этом расстоянии, если при этом не изменяется промоторная функция. Аналогичным образом, предпочтительная локализация элемента регуляторной последовательности по отношению к гетерологичному гену, помещенному под его контроль, определяется локализацией этого элемента в природе (то есть гена, от которого он происходит). И в этом случае, как известно специалистам, это расстояние может до некоторой степени варьироваться.
Примерами промоторов, подходящих для использования в генных конструкциях настоящего изобретения, являются промоторы, происходящие от генов вирусов, дрожжей, плесени, бактерий, насекомых, птиц, млекопитающих и растений, а предпочтительными промоторами являются промоторы, способные функционировать в клетках растений, а более предпочтительно, способные экспрессироваться в эндосперме пшеницы. Промотор может регулировать экспрессию конститутивно или индуцибельно, в зависимости от ткани, в которой происходит экспрессия. Альтернативно, экспрессия может быть дифференциальной, в зависимости от стадии развития, при которой происходит экспрессия, либо такая экспрессия может происходить в ответ на внешний стимул, такой как физиологические стрессы или изменение температуры.
Способ снижения активности гена SBEIIa или другого гена биосинтеза крахмала может включать стадию введения трансгена в регенерируемую клетку пшеницы и регенерации трансгенного растения пшеницы из трансформированной клетки. Ветвящими ферментами, участвующими в синтезе амилопектина, являются ферменты SBEI, SBEIIa и SBEIIb, и объем настоящего изобретения охватывает снижение уровня экспрессии лишь одного гена SBEIIa или в сочетании с изменением уровней экспрессии генов SBEIIb или SBEI. Поэтому трансген(ы) может(могут) инактивировать более чем один из этих генов. Кроме того, инактивация SBEIIb и/или SBEI может быть прямой, то есть, трансген (например, кодирующий дуплексную РНК, антисмысловую РНК или рибозимную РНК, см. ниже) непосредственно ориентирован на экспрессию генов SBEIIb или SBEI, либо он может опосредовать изменение уровня экспрессии SBEIIb или SBEI. Так, например, трансгенная РНК может быть направлена только на ген SBEIIa/РНК с точки зрения идентичности последовательностей или спаривания оснований, но она может также приводить к снижению активности SBEIIb или SBEI путем изменения стабильности белка или его распределения в эндосперме. В другом своем варианте, настоящее изобретение включает комбинацию измененной активности SBEIIa и модификации одного или нескольких ферментов синтеза амилопектина, где указанными ферментами могут быть SSI, SSII, SSIII и деветвящие ферменты, такие как изоамилаза или пуллуланаза. Экспрессия любого или всех этих ферментов может быть изменена путем введения трансгена.
Для генов синтеза амилопектина в пшенице известно несколько ДНК-последовательностей, и любая из них может служить основой для конструирования трансгенов в целях инактивации генов в пшенице. Такими генами являются SBEIIa (GenBank, рег.№№ Y11282, AF338431 и AF338432) и SBEIIb (WO 00/15810, WO 01/62934). Ген SBEI пшеницы описан Rahman et al. (1997) и Rahman et al. (1999). Последовательность SBEITriticum tauschii, которая является в высокой степени гомологичной последовательности SBEI генома D пшеницы, можно найти в описании опубликованной патентной заявки WO 99/14314. кДНК-последовательность гена SBEI пшеницы можно найти в базе данных GenBank под регистрационным номером AF076679. Гомологи других генов синтеза амилопектина, происходящих от ячменя или других близкородственных видов, могут быть также использованы для изменения уровней экспрессии генов в пшенице. Такие гены или их фрагменты могут быть получены методами, хорошо известными специалистам, включая ПЦР-амплификацию или гибридизацию с мечеными зондами.
Используемый здесь термин “жесткие условия гибридизации” означает, что гибридизация может осуществляться в том случае, если идентичность последовательностей зонда и последовательности-мишени составляет, по крайней мере, 90%, а предпочтительно, по крайней мере, 95%. В качестве примеров могут служить следующие условия жесткой гибридизации: инкубирование в течение ночи в растворе, содержащем 50% формамид, 5×SSС (1×SSС=150 мМ NаСl, 15 мМ цитрат тринатрия), 50 мМ фосфат натрия (рН 7,6), 5 × раствор Денхардта, 10% сульфат декстрана и 20 мкг/мл денатурированной фрагментированной ДНК носителя, такой как ДНК спермы лосося, и последующая промывка носителя для гибридизации в 0,1×SSС приблизительно при 65°С. Другие условия гибридизации и промывки хорошо известны специалистам и описаны в руководстве Sambrook et al., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor, NY (1989), а в частности, в главе 11.
Область(и) гомологии, используемая(ые) для получения трансгенной конструкции, должна быть, по крайней мере, на 85% идентична области соответствующего гена пшеницы, а предпочтительно, она должна быть идентична соответствующей области, по крайней мере, на 90%, и даже более предпочтительно, на 95-100%. Также предпочтительно, чтобы трансген был специфически нацелен на гены синтеза амилопектина, экспрессируемые в эндосперме пшеницы и не оказывающие какого-либо влияния, либо оказывающие минимальное влияние на синтез амилопектина в каких-либо других частях растения. Это может быть достигнуто с использованием подходящих регуляторных последовательностей, таких как эндосперм-специфические промоторы в трансгене.
Антисмысловые последовательности
Методы генной инженерии, позволяющие изменять, а в частности, специфически снижать активность гена в растениях, таких как пшеница, хорошо известны специалистам. Такие методы включают введение генных конструкций для экспрессии подходящей антисмысловой молекулы, которая является комплементарной РНК целевого гена и может гибридизоваться с ней. Предполагается, что антисмысловые молекулы предотвращают трансляцию или процессинг, либо негативно влияют на стабильность мРНК целевого гена, что приводит к инактивации экспрессии гена. Методы получения антисмысловых последовательностей хорошо известны специалистам, и их примеры можно найти в патенте США № 5190131, в описании европейской патентной заявки 0467349-А1, в описании европейской патентной заявки 0223399-А1 и в описании европейской патентной заявки 0240208, которые вводятся в настоящее описание посредством ссылки. Применение методов с использованием антисмысловых последовательностей в растениях описано Bourque (1995) и Senior (1998). В работе Bourque приводится много примеров инактивации генов с использованием антисмысловых последовательностей в системах растений. В этой работе также указывается, что совсем необязательно добиваться 100%-го ингибирования ферментативной активности, поскольку очевидно, что и частичное ингибирование будет приводить к значительным изменениям в данной системе. В работе Senior утверждается, что методы с использованием антисмысловых последовательностей представляют собой очень хорошо разработанную технику модификации экспрессии гена в растениях.
Антисмысловые молекулы для генов SBEIIa, SBEIIb, SBEI или других генов биосинтеза или модификации крахмала в пшенице могут быть основаны на мРНК-последовательностях пшеницы, либо они могут происходить от гомологичных ДНК- или мРНК-последовательностей, полученных от других видов, например ячменя. Антисмысловые последовательности могут соответствовать всем транскриптам или части транскриптов любого из этих генов, либо последовательностям, которые осуществляют контроль в процессе их экспрессии, например, их сплайсинг. Антисмысловые последовательности могут соответствовать целевой кодирующей области гена SBEIIa или другого гена пшеницы, либо 5'-нетранслируемой области (UTR) или 3'-UTR или их комбинации. Антисмысловая последовательность может быть комплементарна части интронных последовательностей, которые могут быть вырезаны во время или после транскрипции, а предпочтительно, только экзонным последовательностям целевого гена. Принимая во внимание, в основном, более высокую дивергенцию UTR, можно сказать, что нацеливание на эти области дает более высокую специфичность ингибирования гена. В конкретных вариантах изобретения, длина антисмысловой последовательности составляет, по крайней мере, 19 смежных нуклеотидов, по крайней мере, 50, по крайней мере, 100, по крайней мере, 200, по крайней мере, 500 или, по крайней мере, 1000 нуклеотидов, соответствующих комплементу РНК-последовательности гена. При этом может быть использована полноразмерная последовательность, комплементарная транскрипту целого гена. В конкретном варианте изобретения, длина антисмысловой последовательности составляет 100-2000 нуклеотидов. В других вариантах изобретения, степень идентичности антисмысловой последовательности комплементу целевого транскрипта составляет, по крайней мере, 85%, по крайней мере, 90% или 95-100%. Очевидно, что антисмысловая молекула РНК может содержать неродственные последовательности, которые могут стабилизировать данную молекулу.
Ко-супрессия
Другим методом молекулярной биологии, который может быть использован, является ко-супрессия. Механизм ко-супрессии не совсем ясен, но, очевидно, что он участвует в пост-транскрипционной инактивации (PTGS) гена и с этой точки зрения он очень напоминает многие примеры антисмысловой супрессии. Этот механизм обеспечивает введение дополнительной копии гена или его фрагмента в растение в смысловой ориентации по отношению к промотору для его экспрессии. Размер смыслового фрагмента, его соответствие областям целевого гена и степень идентичности его последовательности с последовательностью целевого гена являются такими же, как и у антисмысловых последовательностей, описанных выше. В некоторых случаях дополнительная копия генной последовательности препятствует экспрессии целевого гена растения. Методы осуществления ко-супрессии приводятся в описании патентной заявки WO 97/20936 и в описании Европатента 0465572.
Инактивация гена, опосредуемая двухцепочечной РНК
Другим методом, который может быть использован для введения генетической модификации в растение пшеницы, является инактивация гена, опосредуемая дуплексной или двухцепочечной РНК. Этот метод также предусматривает PTGS. В этом методе вводят ДНК, которая регулирует синтез, по крайней мере, частично, двухцепочечного(ых) РНК-продукта(ов), гомологичных инактивируемому целевому гену. Поэтому эта ДНК включает как смысловые, так и антисмысловые последовательности, которые при их транскрипции в РНК могут гибридизоваться с образованием двухцепочечной РНК-области. В предпочтительном варианте изобретения, смысловая и антисмысловая последовательности разделены спейсерной областью, содержащей интрон, который при транскрибировании в РНК, вырезается. Было показано, что такое расположение этих последовательностей приводит к увеличению эффективности инактивации гена. Указанная двухцепочечная область может содержать одну или две молекулы РНК, транскрибируемые из одной или из двух ДНК-областей. Присутствие двухцепочечной молекулы стимулирует ответ эндогенной системы растений, который приводит к разрушению как двухцепочечной РНК, так и гомологичного РНК-транскрипта в целевом гене растения и тем самым к эффективному снижению или элиминации активности целевого гена. Реализация этих методов описана в заявке на патент Австралии 99/29514-А и в патентной заявке WO 99/53050. В конкретных вариантах изобретения, длина гибридизируемых смысловой и антисмысловой последовательностей составляет, по крайней мере, 19 смежных нуклеотидов, по крайней мере, 30, по крайней мере, 50, по крайней мере, 100, по крайней мере, 200, по крайней мере, 500 или, по крайней мере, 1000 нуклеотидов. При этом может быть использована полноразмерная последовательность, соответствующая транскрипту целого гена. В конкретном варианте изобретения, длины этих последовательностей составляют 100-2000 нуклеотидов. В других вариантах изобретения, степень идентичности смысловой и антисмысловой последовательностей с последовательностью целевого транскрипта составляет, по крайней мере, 85%, по крайней мере, 90% или 95-100%. Очевидно, что молекула РНК может содержать неродственные последовательности, которые могут стабилизировать данную молекулу. Молекула РНК может экспрессироваться под контролем промотора РНК-полимеразы II или РНК-полимеразы III. Примерами последнего промотора являются промоторы тРНК или snРНК. Двухцепочечная РНК-молекула может также содержать последовательности из более чем одного гена, присоединенных друг к другу, и тем самым воздействовать на множество генов.
Рибозимы
Генетическая модификация, ответственная за нужную инактивацию экспрессии гена в пшенице, может содержать молекулу нуклеиновой кислоты, кодирующую один или несколько рибозимов. Рибозимы представляют собой РНК-молекулы, обладающие ферментативной или каталитической функцией, которая может расщеплять другие РНК-молекулы в специфических сайтах, определяемых одной, а часто, двумя гибридизующимися последовательностями. Расщепление РНК инактивирует экспрессию целевого гена. Рибозимы могут также действовать как антисмысловая молекула, которая может обеспечивать инактивацию гена. Рибозимы содержат один или несколько каталитических доменов, а предпочтительно, доменов типа “головки молотка” или шпильки, расположенных между гибридизующимися последовательностями. Могут быть использованы и другие мотивы рибозимов, включая РНКазу Р, интроны группы I или II, и мотивы вируса гепатита дельта. Их описание можно найти в Европатенте 0321201 и в патенте США № 6221661. Использование рибозимов для инактивации генов в трансгенных растениях продемонстрировано, например, Wegener et al. (1994).
Генетические конструкции/векторы
Настоящее изобретение также относится к выделенным молекулам нуклеиновой кислоты, содержащим РНК или ДНК, а предпочтительно, ДНК, которая кодирует ингибирующую ген молекулу. В некоторых вариантах изобретения, молекулы нуклеиновой кислоты кодируют антисмысловую, смысловую (ко-суппрессорную), двухцепочечную молекулу РНК или молекулу рибозима, которые нацелены на последовательность гена SBEIIa пшеницы и которые инактивируют его экспрессию в эндосперме зерна пшеницы. Настоящее изобретение также относится к генетическим конструкциям, содержащим или кодирующим выделенную молекулу нуклеиновой кислоты, содержащую один или несколько регуляторных элементов, таких как промоторы, энхансеры, последовательности терминации транскрипции или последовательности полиаденилирования. Такие элементы хорошо известны специалистам. Указанные генные конструкции могут также содержать интронные последовательности, стимулирующие экспрессию трансгена в растениях, а в частности, в однодольных растениях, таких как пшеница. Термин “интрон” употребляется здесь в его обычном значении и означает генный сегмент, который транскрибируется, но не кодирует белок, и который вырезается из РНК перед трансляцией. Интроны могут быть введены в 5'-UTR или в кодирующую область в том случае, если трансген кодирует транслируемый продукт, или в любой другой участок транскрибируемой области, если он не кодирует этот продукт.
Кроме того, настоящее изобретение относится к векторам, например к плазмидным векторам, содержащим генные конструкции. Термин “вектор” включает экспрессирующий вектор, способный к in vivo или in vitro экспрессии, и трансформирующий вектор, который может передаваться от одной клетки или организма в другую клетку или организм. Эти векторы содержат последовательности, обеспечивающие их репликацию в клетках, например, в прокариотических клетках, таких как E.coli или Agrobacterium. В конкретном варианте изобретения, указанным вектором является бинарный вектор, содержащий последовательность Т-ДНК, определяемую, по крайней мере, одной граничной последовательностью Т-ДНК, которая может быть введена в клетки пшеницы. Настоящее изобретение также относится к клеткам, содержащим векторы, например Agrobacterium, или к клеткам пшеницы, которые могут быть регенерируемыми клетками, такими как клетки щитка незрелого эмбриона. Альтернативно, эти клетки могут быть трансформированными клетками пшеницы, содержащими трансген.
Промоторы/терминаторы
В другом варианте изобретения, трансгенная или другая генетическая конструкция настоящего изобретения включает область инициации транскрипции (промотор), которая может обеспечивать регулированную или конститутивную экспрессию в эндосперме пшеницы. Промотор может быть выбран из эндосперм-специфического промотора (такого как промотор высокомолекулярного глютенина, промотора SSI пшеницы, промотора SBEII пшеницы, промотора GВSS пшеницы) или промоторов, не являющихся специфичными по отношению к эндосперму (таких как промотор убихитина или промотор СаМV35S или усиленный промотор 35S). Этот промотор может быть модулирован такими факторами, как температура, световое излучение или стресс. Обычно промотор должен находиться со стороны 5'-конца от экспрессируемой генной последовательности. Эта конструкция может также содержать другие элементы, которые усиливают транскрипцию, такие как nos-3'- или осs-3'-области полиаденилирования или терминаторы транскрипции. Указанные области ДНК вводят в векторы, содержащие соответствующие последовательности селективного маркерного гена или другие элементы, либо в векторы, которые подвергаются ко-трансформации с векторами, содержащими эти последовательности.
Методы трансформации пшеницы
Методы трансформации однодольных растений, таких как пшеница, которые применяются для введения генетической модификации в растение путем встраивания экзогенной нуклеиновой кислоты и для регенерации растений из протопластов или незрелых эмбрионов растений, хорошо известны специалистам, см., например, Becker et al., 1994, Cheng et al., 1997, He et al., 1994, Hess et al., 1990, Nehra et al., 1994, Vasil et al., 1992, Vasil et al., 1993, Weeks et al., 1993, Weir et al., 2001, заявку на патент Австралии № 75460/94, европейскую патентную заявку № 709462, публикацию международной патентной заявки №№ WO 93/04178, WO 89/12012, WO 94/13822 и WO 99/14314. Векторы, несущие нужную нуклеотидную последовательность или генетическую конструкцию и селективный маркер, могут быть введены в регенерируемые тканевые клетки культивируемых растений или эксплантатов пшеницы или в подходящие системы растений, такие как протопласты. Селективный маркерный ген может обеспечивать резистентность клеток пшеницы к антибиотикам или к гербицидам, либо он может обеспечивать утилизацию субстратов, таких как манноза. Селективный маркер преимущественно наделяет клетки пшеницы резистентностью к асуламу, генетицину или гигромицину. Регенерируемые клетки пшеницы преимущественно происходят от щитка незрелых эмбрионов, зрелых эмбрионов, каллуса, происходящего от этих эмбрионов, или из ткани меристемы.
Трансформированное растение может содержать селективный маркерный ген, либо такой ген может быть удален во время или после регенерации, например, путем вырезания селективного маркерного гена из генома или путем сегрегации селективного маркерного гена из SBEIIa-ингибирующего трансгена.
Растения, где трансген или мутация интегрировались в хромосому, могут быть скринированы на указанный трансген, например, с использованием подходящего нуклеиновокислотного зонда, специфичного к данному трансгену или фенотипу. Для установления наличия трансформированного растения могут быть применены любые из имеющихся методов. Так, например, для амплификации последовательностей, которые могут быть уникальными для трансформированного растения, может быть проведена полимеразная цепная реакция (ПЦР) с детекцией амплифицированных продуктов с помощью гель-электрофореза или другими методами. ДНК может быть экстрагирована из растений стандартными методами и с помощью ПЦР, осуществляемой с использованием праймеров, которые будут распознавать трансформированные и нетрансформированные растения. Так, например, могут быть сконструированы праймеры, которые будут амплифицировать область ДНК трансформирующего вектора в конструкцию, и обратный праймер, сконструированный из представляющего интерес гена. Эти праймеры будут амплифицировать фрагмент только в том случае, если данное растение является успешно трансформированным. Альтернативным методом подтверждения позитивного трансформанта является Саузерн-блот-гибридизация, хорошо известная специалистам. Растения, которые являются трансформированными или мутантными, могут быть также идентифицированы, то есть дифференцированы от нетрансформированных растений или растений дикого типа по их фенотипу, например, определяемому по присутствию селективного маркерного гена, или по присутствию конкретного белка иммунологическими методами, или по отсутствию белка, например, по отсутствию белка SBEIIa в эндосперме, детектируемому с помощью ELISA-анализа или Вестерн-блот-анализа. Показателями, используемыми при скрининге таких растений, могут быть фенотипические признаки зерна, определяемые, например, путем визуального наблюдения или оценки морщинистости зерна, или путем анализа на повышенное содержание амилозы или микроскопического анализа на наличие двояколучепреломления.
Мутация
Введение генетической модификации, которая приводит к снижению активности фермента SBEIIa или другого фермента биосинтеза крахмала в эндосперме пшеницы, может быть также достигнуто путем введения подходящих мутаций в соответствующий ген или в регуляторные последовательности гена. В контексте настоящего изобретения, термин “индуцированная мутация” означает искусственно индуцированную генетическую модификацию, которая может возникать в результате химического мутагенеза или мутагенеза, индуцированного излучением или биологическими механизмами, например инсерцией транспозона или Т-ДНК. Уровень ингибирования гена может до некоторой степени определять свойства полученного крахмала. Мутациями могут быть усечение или молчащие мутации; причем известно, что эти мутации оказывают значительное влияние на природу крахмала, однако, структура модифицированного крахмала может быть также результатом ликовой (растекающейся) мутации, которая в достаточной степени снижает активность фермента, ответственного за синтез амилопектина, и позволяет получить крахмал или зерно пшеницы с нужными свойствами. Могут также оказаться эффективными и другие хромосомные перестройки, и такими хромосомными перестройками могут быть инсерции, делеции, инверсии, дупликации или точковые мутации. Используемый здесь термин “нуль-мутация” (или “молчащая мутация”) означает мутацию, которая приводит к полной или почти полной потере активности представляющего интерес гена, например, до той степени, когда активность гена больше не детектируется.
Ген SBEIIa локализуется на длинном плече хромосомы 2. При этом предпочтительно, чтобы мутации в данном гене или в других генах, а в частности делеционные мутации, были локализованы в нужном гене, например в гене SBEIIa, или чтобы они распространялись на сцепленный с ним ген SBEIIb в случае двойной мутации. В этом случае ген включает промоторную область и сигналы терминации транскрипции/полиаденилирования, а также транскрибируемую область. Транскрибируемая область включает белок-кодирующую(ие) область(и) и 5'-нетранслируемые и 3'-нетранслируемые области мРНК, а также любые интронные области, которые могут присутствовать в этой области. Мутации в гене могут присутствовать в любой области или в комбинации областей гена и могут возникать в результате модификации лишь одного нуклеотида, например, в результате мутации со сдвигом рамки считывания в кодирующей области, или делеции всего гена. Предпочтительными являются растения, которые являются гомозиготными по указанной генетической модификации.
Размер делеций может быть ограничен порядка одним или несколькими сотнями, а, возможно, 500 тысячами пар нуклеотидов. В некоторых вариантах изобретения, такая делеция охватывает менее чем несколько тысяч пар нуклеотидов или менее чем 5 тысяч нуклеотидов. Хотя настоящее изобретение может включать и более крупные делеции, охватывающие большую часть длинного плеча хромосомы 2 соответствующего генома, однако, эти делеции не являются предпочтительными, поскольку длинное плечо хромосомы 2 имеет ряд других локализованных в нем генов, влияющих на мощность растения пшеницы. Таким образом, поскольку крупные делеции оказывают негативное воздействие на мощность растения, а следовательно, и на его коммерческую ценность, то желательно, чтобы сохранялась, по крайней мере, большая часть длинного плеча хромосомы 2. В предпочтительном варианте изобретения сохраняется большая часть плеча хромосомы 2А.
Мутагенез может быть достигнут путем воздействия химическим веществом или излучением, например, путем обработки семян EMS или азидом натрия (Zwar & Chandler, 1995) или гамма-излучением. Выделение мутантов может быть осуществлено путем скрининга растений или семян, подвергнутых мутагенезу. Так, например, мутагенизированная популяция пшеницы может быть подвергнута скринингу на высокое содержание амилозы в зерне и/или на распределение более длинных цепей амилопектина, превышающих нормальную длину, или на отсутствие белка SBEIIa, оцениваемое с помощью ELISA, или на измененную морфологию зерна (Green et al., 1997). Предпочтительно, проводят скрининг на генотип пшеницы, которая уже не содержит одну из SBE-активностей, например, на SBEIIb-негативный фенотип. Указанные мутации могут быть затем введены в растения с нужным генетическим фоном путем скрещивания мутантного растения с растением, имеющим нужный генетический фон, и проведения подходящего числа процедур возвратного скрещивания для исключения нежелательного родительского фенотипа.
В другом варианте изобретения, мутация влияет на экспрессию или активность обоих генов SBEIIa и SBEIIb в пшенице. Идентификация такой мутации была осуществлена благодаря неожиданному обнаружению того факта, что эти два гена тесно сцеплены в пшенице в отличие от кукурузы или риса. Делеции в одном гене могут легко распространяться на другой ген с образованием молчащего аллеля (молчащей мутации) для обоих генов. Эти данные также облегчают скрининг природных вариантов, которые являются мутантными в обоих генах, по крайней мере, в одном геноме пшеницы, и облегчают проведение скрининга на продуцирование пшеницы с комбинированными мутациями в обоих генах в двух или трех геномах. Такая пшеница имеет высокое содержание амилозы и является нетрансгенным источником для получения зерна пшеницы и продуктов из этого зерна.
Мутации в генах, кодирующих фермент SBEIIa или другие ферменты, участвующие в синтезе амилопектина, будут, в основном, обеспечивать повышенное содержание амилозы. Количество амилозы на одно зерно может быть увеличено в результате снижения потока углерода из амилопектина и его направления в амилозу, либо оно может быть снижено в том случае, если происходит значительное снижение продуцирования крахмала на зерно пшеницы. В любом случае относительный уровень амилозы увеличивается по мере увеличения процента содержания крахмала.
Сообщалось, что были получены семена ячменя с крахмальными гранулами, имеющими деформированную форму и высокое содержание амилозы (Morell et al., 2003), и семена кукурузы с крахмалом, имеющим низкое содержание амилопектина (LAPS) и примерно 90% амилозы (Sidebottom et al., 1998).
“Двойное лучепреломление” означает способность вещества преломлять луч света в двух направлениях, и такое лучепреломление можно наблюдать под поляризационным микроскопом в виде “темного” креста, называемого “мальтийский крест”, на каждой крахмальной грануле. Двойное лучепреломление является показателем степени упорядоченной структурной организации полимеров внутри указанных крахмальных гранул (Thomas & Atwell, 1999). Утрата способности крахмальных гранул к двойному лучепреломлению, вообще говоря, хорошо коррелирует с повышенным содержанием амилозы.
Пшеница для изготовления пищевых продуктов
В другом своем аспекте, настоящее изобретение относится к пшенице, которая может быть использована для получения пищевых продуктов и зерно которой содержит крахмал, имеющий высокое относительное содержание амилозы и пониженное содержание амилопектина. При этом, предпочтительно, чтобы растение пшеницы, от которого было получено зерно, имело пониженный уровень SBEIIa-активности в эндосперме во время его развития. Растение пшеницы настоящего изобретения может быть использовано для изготовления продовольственных продуктов. Изготовление таких продовольственных продуктов может предусматривать получение муки, теста или других продуктов, которые могут служить ингредиентами для изготовления продовольственных продуктов.
При выборе желательного генетического фона такой пшеницы следует учитывать урожайность и другие характеристики. Если необходимо вывести озимые или яровые виды пшеницы, то такими характеристиками могут быть агрономическая продуктивность, резистентность к болезням и резистентность к абиотическому стрессу. В Австралии может оказаться желательным скрещивание пшеницы, имеющей фенотипические признаки модифицированного крахмала, с такими сортами пшеницы как Baxter, Kennedy, Janz, Frame, Rosella, Cadoux, Diamondbird или другие известные сорта. Вышеперечисленные сорта являются подходящими для культивирования в конкретных регионах Австралии, а для других сельскохозяйственных регионов подходящими являются другие сорта. При этом, предпочтительно, чтобы сорт пшеницы настоящего изобретения давал урожай не менее чем 80%, более предпочтительно, не менее чем 90%, а еще более предпочтительно, не менее чем 95%, по сравнению с урожаем сортов дикого типа, по крайней мере, в некоторых сельскохозяйственных регионах. Этот урожай может быть легко измерен в испытаниях, проводимых в регулируемых полевых условиях.
В других вариантах изобретения, содержание крахмала в зерне составляет, по крайней мере, примерно 25%, 35%, 45% или 55-65% (мас./мас.). При промышленном возделывании пшеница дикого типа имеет содержание крахмала порядка 55-65%, которое отчасти зависит от культивируемого сорта. Альтернативно, зерно настоящего изобретения имеет содержание крахмала, по крайней мере, 90% по отношению к зерну эквивалентной, но немодифицированной пшеницы. Более низкое содержание крахмала по сравнению с содержанием крахмала в растении дикого типа обусловлено низкими уровнями амилопектина. Даже при более низком содержании крахмала такое зерно может быть использовано для изготовления промышленных продовольственных продуктов, поскольку эти продукты будут иметь относительно высокую ценность, что обусловлено высоким содержанием амилозы. Другими желательными характеристиками являются мукомольные свойства зерна, а в частности твердость зерна. Другим фактором, который может повышать ценность растения пшеницы, является более высокая степень экстракции крахмала из зерна, причем, чем выше скорость экстракции, тем более ценным является зерно. Другим признаком, который может влиять на коммерческую ценность растения, является форма зерна, поскольку от нее зависит легкость помола зерна или другие параметры. Так, например, зерно удлиненной формы труднее размалывать и обрабатывать.
Налитое зерно может быть предпочтительным с точки зрения достижения более высоких урожаев, и в этом случае могут быть достигнуты некоторые полезные эффекты настоящего изобретения, такие как продуцирование крахмала с более высокими уровнями амилозы, или, альтернативно, крахмала с измененным распределением длин его цепи. Таким образом, предпочтительно, чтобы данное зерно имело фенотип неморщинистого зерна. Однако в других аспектах настоящего изобретения, может быть получено зерно с меньшим наливом. Так, например, в менее налитом зерне содержание алейронового слоя, зародыша или белка по отношению к крахмалу в менее налитом зерне может быть выше, что дает возможность получить пшеничную муку или другой продукт с высоким содержанием ценных компонентов, таких как алейроновый слой или белок. Таким образом, продукт с высоким содержанием алейронового слоя может быть обогащен определенными витаминами, такими как фолат, либо он может быть обогащен минералами, такими как кальций, а в комбинации с повышенными уровнями резистентного крахмала может быть достигнут синергический эффект, такой как повышенное усвоение минералов толстым кишечником.
Крахмал может быть легко выделен из зерна пшеницы с применением стандартных методов, например метода Schulman et al., (1991). При крупномасштабном производстве может быть использован мокрый или сухой помол. Размер крахмальных гранул является важным фактором при промышленной обработке крахмала, где происходит разделение более крупных гранул А от более мелких гранул В. Крахмал, полученный из зерна растения пшеницы настоящего изобретения, имеет высокое относительное содержание амилозы.
Физические характеристики модифицированного крахмала
Желатинизация представляет собой терморегулируемый коллапс (дизрупцию) молекулярной структуры в крахмальных гранулах при избытке воды, с одновременными и необратимыми изменениями их свойств, таких как набухание зерен, плавление кристаллита, утрата способности к двойному лучепреломлению, увеличение вязкости и солюбилизации крахмала. Высокоамилозный крахмал, полученный из ае-мутантов (ае-удлинитель амилозной цепи) кукурузы, обнаруживал более высокую температуру желатинизации, чем крахмал нормальной кукурузы (Fuwa et al., 1999, Krueger et al., 1987). С другой стороны, крахмал, полученный из sex6-мутантов, у которых отсутствует активность крахмал-синтазы II, имеет более низкие температуры желатинизации, а энтальпия для пика желатинизации является более низкой по сравнению с энтальпией для контрольных растений (Morell et al., 2003).
В другом аспекте настоящего изобретения, крахмал имеет измененную температуру желатинизации, измеренную с помощью дифференциальной сканирующей калориметрии. Эта температура может быть более высокой либо более низкой по сравнению с температурой желатинизации крахмала растений дикого типа. Измененная температура желатинизации может сочетаться с относительно высоким содержанием амилозы. Температура желатинизации крахмала растений пшеницы дикого типа обычно составляет примерно 61°С (Rahman et al., 2000) для температуры первого пика, определяемой как температура начала пика, и измеряемая с помощью дифференциальной сканирующей калориметрии.
Крахмал может быть также охарактеризован по степени его набухания в избыточном количестве горячей воды по сравнению с крахмалом дикого типа. Объем набухания обычно измеряют путем смешивания крахмала или муки с избыточным количеством воды и нагревания до высоких температур, обычно более 90°С. Затем образец собирают путем центрифугирования, и объем набухания выражают как массу осажденного материала, деленную на сухую массу образца. Низкий уровень набухания является желательным, если необходимо увеличение содержания крахмала в пищевом продукте, а в частности в гидратированном пищевом продукте.
Структура крахмала в пшенице выбранных форм в соответствии с настоящим изобретением может также отличаться тем, что она имеет более низкую степень кристалличности, чем нормальный крахмал, выделенный из пшеницы. Более низкая степень кристалличности крахмала, очевидно, также ассоциируется с повышением органолептических свойств и придает крахмалу ощущение более мягкой консистенции при разжевывании. Таким образом, крахмал может также обладать более низкой степенью кристалличности, что обусловлено снижением уровней активности одного или нескольких ферментов синтеза амилопектина. Кристалличность обычно исследуют методами рентгеновской кристаллографии.
Одним из параметров модифицированной структуры амилопектина является распределение длин цепи или степень полимеризации крахмала. Распределение длин цепи может быть определено с помощью электрофореза в углеводе в присутствии флуорофора (FАСЕ) после деветвления изоамилазой. Амилопектин крахмала настоящего изобретения может иметь распределение длин цепи в интервале от 5 до 60, что превышает значения, полученные для распределения крахмала растений дикого типа, после деветвления. Крахмал с более длинной цепью будет также обнаруживать соответствующее снижение частоты ветвления. Таким образом, распределение длин цепей аминопектина в данном крахмале может также обнаруживать тенденцию к увеличению числа более длинных цепей в еще присутствующем.
Свойства пищевых продуктов
Крахмал является главным источником углеводов в пище человека, и для приготовления пищевых продуктов может быть использовано зерно настоящего изобретения и полученные из него продукты. Такой пищевой продукт может употребляться человеком или животными в пищу, например, в виде корма, используемого в животноводстве, или корма для домашних питомцев. Зерно, полученное от модифицированного растения пшеницы, может быть с успехом использовано в технологии производства пищевых продуктов, а поэтому настоящее изобретение включает помолотое, дробленое, измельченное, обрушенное или плющенное зерно или продукты, полученные из обработанного или целого зерна описанных выше растений пшеницы, включая муку. Эти продукты могут быть затем использованы для изготовления различных пищевых продуктов, например мучных продуктов, таких как хлеб, печенье, бисквиты и т.п., или пищевых добавок, таких как загустители или связующие вещества, либо для изготовления напитков, лапши, макаронных изделий или супов быстрого приготовления. Зерно или полученные из него продукты в соответствии с настоящим изобретением являются подходящими для приготовления зерновых завтраков или для использования в качестве прессованных продуктов. Крахмалы с высоким содержанием амилозы в соответствии с настоящим изобретением могут быть также использованы для получения сильно желирующихся гелей, которые могут быть использованы в кондитерской промышленности, или в тех случаях, когда необходимо снижение времени плавления и отверждения. Они могут быть также использованы в качестве покрытий, например, для снижения поглощения масла картофелем, жаренным во фритюре, или другими пищевыми продуктами.
Пищевые волокна
В настоящем описании, термин “пищевые волокна” означает углевод и продукты расщепления углевода, которые не абсорбируются в тонком кишечнике здорового человека, а попадают в толстый кишечник. Такие продукты включают резистентный крахмал, β-глюкан и другие растворимые и нерастворимые углеводные полимеры. При этом предполагается, что часть сбраживаемых углеводов утилизуются, по крайней мере, частично, в толстой кишке присутствующей там микрофлорой.
Крахмал настоящего изобретения, предпочтительно, содержит относительно высокие уровни пищевого волокна, а более предпочтительно, амилозы. В соответствии с настоящим изобретением, содержание пищевого волокна в зерне может зависеть, а может и не зависеть лишь от увеличения относительного содержания амилозы в эндосперме.
В некоторых аспектах изобретения рассматривается комбинация алейронового слоя и зародыша в сочетании с высокими уровнями пищевого волокна. В частности, это может относиться к тем случаям, где в зерне имеются повышенные относительные уровни алейрона или зародыша. Если зерно пшеницы является слегка морщинистым, то это означает, что эндосперм присутствует в небольших количествах, а алейроновый слой и зародыш присутствует в относительно повышенных количествах. Таким образом, такая пшеница имеет относительно высокий уровень некоторых ценных элементов или витаминов в комбинации с повышенным уровнем резистентного крахмала, где такими элементами являются двухвалентные катионы, биологически доступные Ca++, а витаминами являются фолат или антиоксиданты, такие как токоферолы или токотриенолы. Одной из конкретных форм продукта помола может быть молотый продукт, в котором присутствует алейроновый слой. Для увеличения количества алейронового слоя в молотом продукте может быть применена конкретная технология помола. Таким образом, любой продукт, полученный из помолотого зерна или зерна, обработанного каким-либо иным способом, так, чтобы оно включало алейроновый слой и зародыш, будет содержать дополнительные питательные вещества, что позволит избежать необходимости добавления этих элементов из отдельных источников.
Резистентный крахмал
Термин “резистентный крахмал” определяется как крахмал и продукты гидролиза крахмала, не абсорбируемые в тонком кишечнике здорового человека, но попадающие в толстый кишечник. Таким образом, резистентный крахмал не включает продукты, гидролизованные и абсорбированные в тонком кишечнике. Резистентные крахмалы включают физически недоступный крахмал (RS1-форма), резистентные крахмальные гранулы (RS2), крахмал, подвергнутый ретроградации (RS3), и химически модифицированный крахмал (RS4). В соответствии с настоящим изобретением, модифицированная структура крахмала, а в частности крахмала с высоким содержанием амилозы, приводит к увеличению уровня резистентного крахмала, употребляемого в пищу. Этот крахмал может иметь RS1-форму, которая является до некоторой степени недоступной для ферментативного гидролиза. Ассоциация крахмала и липида, оцениваемая по кристалличности V-комплекса, также способствует увеличению уровня резистентного крахмала.
Следует отметить, что преимущество настоящего изобретения заключается в том, что оно позволяет получить продукты, содержащие конкретные полезные питательные вещества, и, кроме того, не требует обязательной модификации крахмала или других компонентов зерна пшеницы. Однако такая модификация крахмала или других компонентов зерна может оказаться желательной, и настоящее изобретение также включает такие модифицированные компоненты. Методы модификации хорошо известны специалистам и предусматривают проведение экстракции крахмала или других компонентов стандартными способами и модификацию крахмала для увеличения уровней его резистентных форм. Крахмал может быть модифицирован путем термообработки и/или мокрой обработки, физической обработки (например, помола в шаровой мельнице), ферментативной обработки (с использованием, например, α- или β-амилазы, пуллуланазы или т.п.), химического гидролиза (мокрого или сухого с использованием жидких или газообразных реагентов), окисления, сшивания с бифункциональными реагентами (например, с триметафосфатом натрия, оксихлоридом фосфора) или карбоксиметилирования.
Гликемический индекс
Гликемический индекс (GI) означает скорость гидролиза пищевых продуктов, содержащих крахмал, и определяется путем сравнения влияния тестируемого пищевого продукта и влияния таких продуктов, как белый хлеб или глюкоза, на повышение концентрации глюкозы в крови. Гликемический индекс является показателем возможного влияния пищевого продукта на концентрацию глюкозы в сыворотке после приема пищи и потребность в инсулине для обеспечения гомеостаза глюкозы в крови. Одной из важных характеристик пищевых продуктов настоящего изобретения является низкое значение гликемического индекса. Кроме того, эти пищевые продукты могут иметь низкий уровень конечного гидролиза, а следовательно, и относительно низкую калорийность. Низкокалорийный продукт может быть получен из муки, продуцированной из помолотого зерна пшеницы. Такие пищевые продукты могут давать ощущение сытости, улучшают работу кишечника, снижают концентрацию глюкозы и липидов в сыворотке после приема пищи, а также могут служить основой для изготовления других низкокалорийных продуктов.
Применение в производстве непродовольственных товаров
Настоящее изобретение относится к модифицированным или улучшенным крахмалам, имеющим повышенные уровни амилозы или пониженные уровни амилопектина, то есть к крахмалам, свойства которых отвечают любому из различных требований промышленного производства. Крахмалы широко используются в производстве непродовольственных товаров, включая производство пленок, бумаги, текстильных изделий, гофрированных изделий и в производстве клеев (Young, 1984), например, в качестве шлихтующих агентов. Пшеничный крахмал может быть использован в качестве субстрата в производстве глюкозных сиропов или в производстве этанола. В некоторых областях применения крахмала использование немодифицированного крахмала ограничено его физическими свойствами и часто требует химической модификации, которая является дорогостоящей процедурой, либо имеет другие недостатки. Настоящее изобретение относится к крахмалу, который не требует модификации после его экстракции из зерна, что, в частности, обусловлено пониженным содержанием амилопектина в сочетании с другими физическими свойствами. Так, например, могут быть изменены такие свойства, как температура застывания, резистентность к сдвиговому напряжению, прочность пленки и/или водостойкость крахмалов и продуктов, изготовленных из зерна в соответствии с настоящим изобретением. Полученный крахмал может быть также использован для изготовления биологически разлагаемого амортизационного сыпучего упаковочного материала, который может служить заменой полистиролу или другим упаковочным материалам.
Следует отметить, что хотя в аспектах настоящего изобретения описаны его различные отличительные признаки, однако, настоящее изобретение может включать комбинацию из двух или более его аспектов.
Примеры
Пример 1. Материалы и методы
Определение и анализ уровней углеводов
Крахмал выделяли из зерна пшеницы методом Schulman et al. (1991). Содержание крахмала определяли с использованием набора для анализа на содержание общего крахмала, поставляемого Megazyme (Bray, Co Wicklow, Republic of Ireland). Затем содержание этого крахмала сравнивали с содержанием крахмала в контрольных растениях. После вычитания массы крахмала из общей массы зерна определяли общее количество зерна без крахмала, что позволяло определить, связано ли снижение общей массы зерна со снижением содержания крахмала.
Содержание амилозы в образцах крахмала определяли калориметрическим (йодометрическим) методом Morrison & Laignelet (1983), который был слегка модифицирован, как описано ниже. Приблизительно 2 мг крахмала точно взвешивали (с точностью до 0,1 мг) в 2 мл пробирке с завинчивающейся крышкой, снабженной резиновой прокладкой. Для удаления липида 1 мл 85% (об./об.) метанола смешивали с крахмалом, и пробирку нагревали при 65°С в водяной бане в течение 1 часа, периодически помешивая. После центрифугирования при 13000×g в течение 5 минут супернатант осторожно удаляли и стадии экстракции повторяли. Затем крахмал сушили при 65°С в течение 1 часа и растворяли в растворе мочевины-диметилсульфоксида (UDMSO; 9 объемов диметилсульфоксида на 1 объем 6М мочевины) с использованием 1 мл UDMSO на 2 мг крахмала (взвешенного, как указано выше). Полученную смесь сразу интенсивно перемешивали и инкубировали при 95°С в водяной бане в течение 1 часа с периодическим перемешиванием для полного растворения крахмала. Аликвоту раствора крахмала-UDMSO (50 мкл) обрабатывали 20 мкл реагента I2-KI, содержащего 2 мг йода и 20 мг иодида калия на 1 мл воды. Смесь доводили до 1 мл добавлением воды. Оптическую плотность смеси при 650 нм измеряли путем переноса 200 мкл смеси в микропланшет и считывания оптической плотности на микропланшет-ридере Emax Precision Microplate Reader (Molecular Devices, USA). Стандартные образцы, содержащие от 0 до 100% амилозы и от 100% до 0% амилопектина, получали из амилозы картофеля и амилопектина кукурузы (или картофеля) (Sigma) и обрабатывали так же, как и для тест-образцов. Содержание амилозы (процент амилозы) определяли по величинам оптической плотности с использованием уравнения регрессии, выведенного исходя из оптической плотности стандартных образцов. Анализ отношения амилозы/амилопектина крахмала, не подвергнутого деветвлению, может быть осуществлен, как описано Case et al. (1998), или ВЭЖХ-методом разделения деветвленных крахмалов, описанным Batey & Curtin (1996).
Распределение длин цепей в крахмале может быть проанализировано с помощью электрофореза в углеводе с флуорофором (FАСЕ) с использованием устройства для капиллярного электрофореза в соответствии с описанием Morell et al. (1998) после деветвления образцов крахмала. Профили температуры желатинизации образцов крахмала могут быть определены с помощью дифференциальной сканирующей калориметрии Pyris 1 (Perkin-Elmer, Norwalk, CТ, USA). Вязкость растворов крахмала может быть измерена на скоростном анализаторе вязкости (RVA, Newport Scientific Pty Ltd, Warriewood, Sydney), например, в условиях, описанных Batey et al., 1997. Измеряемыми параметрами могут быть максимальная вязкость (максимальная вязкость горячей пасты), стабильность при хранении, конечная вязкость и температура образования пасты. Объем набухания муки или крахмала может быть определен методом Konik-Rose et al. (2001). Поглощение воды измеряли путем взвешивания образца до и после смешивания образца муки или крахмала в воде при определенной температуре и после сбора желатинизированного материала.
Уровни β-глюкана могут быть определены с использованием набора, поставляемого фирмой Megazyme (Bray, Co Wicklow, Republic of Ireland).
Анализ на экспрессию белка в эндосперме
Специфическую экспрессию белка в эндосперме анализировали с помощью Вестерн-блот-анализов. Эндосперм иссекали из всех материнских тканей и образцы приблизительно 0,2 мг гомогенизировали в 600 мкл 50 мМ буфера KPi (42 мМ К2НРО4 и 8 мМ КН2РО4), рН 7,5, содержащего 5 мМ EDTA, 20% глицерина, 5 мМ DTT и 1 мМ Pefabloc. Измельченные образцы центрифугировали при 13000×g в течение 10 минут, а затем брали аликвоты супернатанта и замораживали при -80°С до использования. Для оценки общего содержания белка строили стандартную кривую для BSA с использованием 0, 20, 40, 60, 80 и 100 мкл аликвот 0,25 мг/мл BSA-стандарта. Образцы (3 мкл) доводили до объема 100 мкл добавлением дистиллированной воды и в каждый из этих образцов добавляли 1 мл кумасси + белковый реагент. Через 5 минут, исходя из стандартной кривой, считывали оптическую плотность при 595 нм с использованием образца без ВSA (0 мкл-аликвоты) в качестве контроля, и определяли уровни белка в образцах. Образцы, содержащие 20 мкг общего белка от каждого эндосперма, подвергали электрофорезу в 8%-ном неденатурирующем полиакриламидном геле, содержащем 0,34М Трис-HCl (рН 8,8), акриламида (8,0%), персульфата аммония (0,06%) и ТЕМЕD (0,1%). После электрофореза белки переносили на нитроцеллюлозную мембрану, как описано Morell et al. (1997), и подвергали иммунной реакции с антителами против SBEIIa или SBEIIb.
Пример 2. Генетические конструкции для модификации экспрессии SBEIIa и SBEIIb пшеницы
Для снижения уровня экспрессии генов SBEIIa или SBEIIb пшеницы создавали конструкции дуплексной РНК (дцРНК). В таких конструкциях нужная последовательность нуклеиновой кислоты, соответствующая части генов SBEIIa или SBEIIb, находилась как в смысловой, так и в антисмысловых ориентациях по отношению к промотору, в результате чего экспрессируемая РНК состояла из комплементарных областей, которые обладали способностью к спариванию оснований и образованию дуплексной или двухцепочечной РНК. Спейсерная область между смысловой и антисмысловой последовательностями содержала интронную последовательность, которая при ее транскрипции как части РНК в трансформированном растении должна быть сплайсирована с образованием жесткой “шпилечной” дуплексной структуры. Было обнаружено, что включение интрона повышает эффективность инактивации гена, сообщаемой конструкциями дуплексной РНК (Smith et al., 2000). Нужную нуклеиновую кислоту присоединяли к промоторной последовательности высокомолекулярного глютенина (HMWG) (промотор гена субъединицы Dх5, рег.№ Х12928, Anderson et al., 1989) и к последовательности терминатора гена нопалин-синтазы Agrobacterium (nos 3'). Эта конструкция обеспечивает эндосперм-специфическую экспрессию последовательностей дцРНК.
Конструкция дуплексной РНК для SBEIIa содержала нуклеотидную последовательность размером 1536 п.н., амплифицированную с помощью ПЦР из гена SBEIIa пшеницы (GenBank, рег.№ АF338431, см. фиг.1). Эта конструкция включала 468 п.н.-последовательность, содержащую целые экзоны 1 и 2 и часть экзона 3 (в положениях нуклеотидов 1058-1336, 1664-1761 и 2038-2219 на фиг.1) с рестрикционными EcoRI- и KpnI-сайтами по обеим сторонам (фрагмент 1); 512 п.н.-последовательность, состоящую из частей экзонов 3 и 4 и целого интрона 3 гена SBEIIa (в положениях нуклеотидов 2220-2731 на фиг.1) с KpnI- и SacI-сайтами по обеим сторонам (фрагмент 2); и 528 п.н.-фрагмент, состоящий из полноразмерных экзонов 1, 2 и 3 гена SBEIIa (в положениях нуклеотидов 1058-1336, 1664-1761 и 2038-2279 на фиг.1) с BamHI- и SacI-сайтами по обеим сторонам (фрагмент 3). Затем фрагменты 1, 2 и 3 были лигированы так, чтобы последовательность фрагмента 3 была присоединена к фрагменту 2 в антисмысловой ориентации по отношению к фрагменту 1. Сначала конструкции дуплексной РНК были генерированы в векторе pDVO3000, который содержал промоторную последовательность HMWG и nos-3'-терминатор. Генная конструкция в векторе pDVO3000 была обозначена pDVO3-IIa, а генная конструкция дуплексной РНК была обозначена дц-SBEIIa.
Стратегия получения конструкции дуплексной РНК SBEIIa была аналогичной. Конструкция SBEIIb содержала фрагмент, содержащий 1607 п.н.-амплифицированный с помощью ПЦР из гена SBEIIb пшеницы (последовательность указана на фиг.2). Эта конструкция включала 471 п.н.-последовательность, содержащую целые экзоны 1 и 2 и часть экзона 3 (в положениях нуклеотидов 489-640, 789-934 и 1598-1769 на фиг.2) с рестрикционными EcoRI- и KpnI-сайтами по обеим сторонам (фрагмент 1), 589 п.н.-последовательность, состоящую из частей экзонов 3 и 4 и целого интрона 3 гена SBEIIb (в положениях нуклеотидов 1770-2364 на фигуре 2) с KpnI- и SacI-сайтами по обеим сторонам (фрагмент 2) и 528 п.н.-фрагмент, состоящий из полноразмерных экзонов 1, 2 и 3 гена SBEIIb (в положениях нуклеотидов 489-640, 789-934 и 1598-1827 на фиг.2) с BamHI- и SacI-сайтами по обеим сторонам (фрагмент 3). Затем фрагменты 1, 2 и 3 были лигированы так, чтобы последовательность фрагмента 3 была присоединена к фрагменту 2 в антисмысловой ориентации по отношению к фрагменту 1. Генная конструкция дуплексной РНК SBEIIb в векторе pDVO3000 была обозначена pDVO3-IIb, а генная конструкция дуплексной РНК была обозначена дц-SBEIIb. Эти конструкции схематично показаны на фиг.3.
Затем каждый из экспрессионных кластеров дц-РНК разрезали рестриктирующим ферментом XhoI и встраивали в бинарные трансформирующие векторы рGB53 и pBIOS340. рGB53 конструировали из pSB11 (Komari et al., 1996) путем встраивания гена, кодирующего резистентность к асуламу (sul) и регулируемого промотором актина риса, с образованием уникального XhoI-сайта, смежного с правым концом Т-ДНК для введения представляющего интерес гена. Аналогичным образом, pBIOS340 конструировали из pSB1 (Komari et al., 1996) путем введения гена nptII, кодирующего резистентность к канамицину и генетицину и регулируемого промотором актина риса, с образованием уникального XhoI-сайта, смежного с правым концом. SBEIIa-конструкции в pGB53 и pBIOS340 обозначали pCL51 и pCL59 соответственно, а SBEIIb-конструкции в pGB53 и рBIOS340 обозначали pCL54 и pCL60 соответственно.
Пример 3: Трансформация пшеницы
Генные конструкции для трансформации пшеницы вводили путем электропорации в инактивированный штамм LBA4404 Agrobacterium tumefaciens, несущий плазмиду vir pAL4404 и pSB1 с последующим его отбором на среде со спектиномицином. Трансформированные штаммы Agrobacterium инкубировали в отвержденной среде YEP при 27°С в течение 2 дней. Затем бактерии собирали и ресуспендировали в среде TSIM1 (среде MS с 100 мг/л миоинозита, 10 г/л глюкозы, 50 мг/л MES-буфера, рН 5,5), содержащей 400 мМ ацетосирингона до оптической плотности 2,4 при 650 нм для инокуляции пшеницы.
Растения пшеницы (сорт NВ1, сорт яровой пшеницы, полученный от Nickerson Seeds Ltd. Rothwell, Lincs.) выращивали в теплице в режиме: день-ночь при 22/15°С с дневным освещением в течение 16 часов. Побеги собирали примерно через 14 дней после цветения (эмбрионы имели длину примерно 1 мм), когда побег пшеницы достигал 50 см. Все листья с побегов удаляли за исключением флагового листа, который промывали для удаления контаминирующих грибковых спор. Затем чешую каждого колоска и нижнюю цветковую чешую первых двух цветков осторожно удаляли для обнажения незрелого семени. Вообще говоря, только два этих семени в каждом колоске не имеют оболочки. Эту процедуру проводили по всей длине соцветия. Затем колосья обрабатывали путем опрыскивания 70% IMS для быстрой стерилизации поверхности.
Незрелые семена инокулировали суспензиями Agrobacterium (1 мкл) с помощью 10 мкл-шприца Гамильтона приблизительно в месте стыка щиток:эндосперм, так, чтобы все обнаженные семена были инокулированы. Затем побеги помещали в воду, покрывали прозрачным пластиковым пакетом для предупреждения дегидратации семян и помещали в освещаемый инкубатор на 3 дня при 23°С, при 16-часовом дневном освещении и освещенности 45 E·m-2·c-1РАR. После 3-дневного совместного культивирования инокулированные незрелые семена удаляли и поверхность стерилизовали 70% этанолом (30 сек), а затем обрабатывали 20% хлорной известью (Domestos, 20 мин), после чего их тщательно промывали в стерильной дистиллированной воде. Незрелые эмбрионы выделяли в асептических условиях и помещали щитком кверху (20 эмбрионов на чашку) в среду W3T (в среду МS, в которую было добавлено 20 г/л сахарозы и 2 мг/л 2,4-D и которую отверждали 6 г/л агарозы типа I, Sigma) с добавлением 150 мг/л тиментина (W3T). Культуры выдерживали при 25°С и при освещении (при 16-часовом дневном освещении и освещенности 80 E·m-2·c-2РАR). Развитие рубчика на эмбрионах оценивали через 5 дней после изолирования, и этот рубчик удаляли, если это было необходимо для ускорения продуцирования каллуса. Эмбрионы выдерживали на среде W3Т в течение 4 недель, а затем через 2 недели после изолирования их переносили на свежую среду и оценивали на эмбриогенез.
После культивирования в течение 4 недель каллус, происходящий от инокулированных эмбрионов, был аналогичен контрольному каллусу, полученному из неинокулированных эмбрионов, выращенных на среде W3Т. Очевидно, что присутствие бактерий не приводило к значительному снижению эмбриогенеза каллуса, полученного от инокулированных эмбрионов. Эмбриогенный каллус переносили в среду W3, содержащую 2 мг/л асулама (если использовали производное рGB53) или 25 мг/л генетицина (производные рBIOS340) и 150 мг/л тиментина (W32АТ). Каллусы выдерживали на этой среде еще 2 недели, а затем каждый каллус разрезали на 2-миллиметровые кусочки и снова высевали на среду W32АТ. Контрольные эмбрионы, полученные от инокулятов с LВА4404, не содержащих бинарных векторных конструкций, не продуцировали трансформированный каллус на селективных средах.
После культивирования еще в течение 2 недель всю ткань оценивали на развитие эмбриогенного каллуса: каждый каллус, обнаруживающий признаки непрерывного развития через 4 недели после его помещения на селективную среду, переносили в среду для регенерации (в среду RМТ-МS с 40 г/л мальтозы и 150 мг/л тиментина, рН 5,8, отвержденную 6 г/л агарозы типа I, Sigma). Побеги регенерировались на этой среде в течение 4 недель, а затем их переносили в среду МS30, содержащую 150 мг/л тиментина, для стимуляции роста побегов и для их укоренения. Затем молодые растения переносили в почвенную смесь и выдерживали на стеллаже с аэрозольным орошением в течение двух недель и, наконец, переносили в теплицу.
Этим методом было обработано всего 3217 эмбрионов с использованием рСL54 или рСL60 (дц-SBEIIb) и 2010 эмбрионов с использованием рСL51 или рСL59 (дц-SBEIIа), после чего из каллусов для IIb-трансформации было регенерировано 61 растение, а для IIа-трансформации было регенерировано 31 растение. Выживание на селективной среде позволяет предположить, что эти растения были успешно трансформированы генной конструкцией. При этом предполагается, что подавляющее большинство, но не все растения, которые были трансформированы селективным маркерным геном, имели интегрированный в их геном SBEIIa- или SBEIIb-ингибирующий ген, и эти растения могут быть легко идентифицированы, как описано в нижеследующих примерах.
Выделение множества стабильных интеграционных трансформантов с хорошей способностью к регенерации, полученных в этих экспериментах, показало, что используемый здесь способ трансформации семян путем инокуляции является таким же эффективным, как и другие ранее описанные методы трансформации пшеницы. В этом способе могут быть также использованы альтернативные штаммы Agrobacterium, такие как штамм АGL1, или селективные маркеры, такие как гены, кодирующие резистентность к гигромицину.
Пример 4. Анализ трансформантов пшеницы
Трансформацию определяли одним или несколькими из нижеследующих методов, таких как ПЦР-анализ на наличие одного или нескольких трансгенов. ПЦР-анализ проводили на геномной ДНК, экстрагированной из 1-2 см2 свежих листьев с применением минипрепаративного метода, описанного Stacey & Issac (1994). ПЦР-реакции осуществляли, например, с использованием праймеров SBEIIa: 5'-CCCGCTGCTTTCGCTCATTTTG-3' [SEQ ID NO:9] и 5'-GACTACCGGAGCTCCCACCTTC-3' [SEQ ID NO:10], сконструированных для амплификации фрагмента (462 п.н.) из гена SBEIIa; или праймеров SBEIIb-DupFor 5'-AGATGTGAATGGCTGCTTGCTG-3' [SEQ ID NO:11] и SBEIIb-DupRev: 5'-CAGGTCGACCATATGGGAGAGC-3' [SEQ ID NO:12] для SBEIIb (505 п.н.). Для проведения реакции использовали следующие условия: “горячий старт” (94°С, 3 мин), затем 30 циклов денатурации (95°С, 30 сек), отжиг (55°С, 30 сек), удлинение (73°С, 2 мин), а затем 1 цикл при 73°С (5 мин).
Анализ методом Саузерн-блот-гибридизации осуществляли на ДНК посредством крупномасштабной (9 мл) экстракции из лиофилизованной измельченной ткани (Stacey & Issac, 1994). ДНК-образцы доводили до концентрации 0,2 мг/мл и гидролизовали рестриктирующими ферментами, такими как HindIII, EcoRI и KpnI. Гидролиз рестриктирующими ферментами, гель-электрофорез и блоттинг в вакууме осуществляли, как описано Stacey & Issac (1994). Меченные дигоксигенином зонды, включающие область интрона 3 дц-SBEII-конструкций, продуцировали ПЦР-методом McCreery & Helenjaris (1994). Гибридизацию зондов с Саузерн-блотами и детекцию посредством хемилюминесценции осуществляли методом McCreery & Helenjaris (1994).
Результаты ПЦР-анализов были систематизированы в таблице 2. Растения, которые были позитивными по трансгенам, как было продемонстрировано с помощью ПЦР, включали 27 независимых трансформантов для дц-SBEIIa и 61 независимый трансформант для дц-SBEIIb.
Пример 5. Анализ зерна, полученного от растений, трансформированных конструкциями, содержащими дуплексную РНК
Морфология крахмальных гранул
Морфологию крахмальных гранул, происходящих от зрелых семян Т1, полученных от трансформированных растений пшеницы Т0, исследовали под оптическим микроскопом. Было проанализировано десять отдельных зерен, взятых от каждого из 25 растений Т0, которые были независимо трансформированы дц-SBEIIa, и 12 растений, которые были независимо трансформированы дц-SBEIIb. Каждый эндосперм осторожно дробили для высвобождения крахмальных гранул, которые были диспергированы в воде и визуализированы под оптическим микроскопом. Из 25 проанализированных дц-SBEIIa-линий 12 имели зерно с деформированными крахмальными гранулами (см., например, фиг.4), хотя визуальное наблюдение выявило различные уровни деформации в различных семенах. В противоположность этому, ни одна из 12 дц-SBEIIb-линий не обнаруживала заметную деформацию крахмальных гранул в эндосперме при наблюдении под оптическим микроскопом. Результаты систематизированы в таблицах 3 и 4.
Наблюдение крахмальных гранул в поляризованном свете выявило значимое снижение двойного лучепреломления у деформированных крахмальных гранул (фиг.5) для дц-SBEIIa-трансформированного зерна. Отсутствие двойного лучепреломления наблюдалось у 94% крахмальных гранул в семенах линии 50.1b, что коррелировало с их деформированным фенотипом, тогда как нормальные крахмальные гранулы других семян той же самой линии обнаруживали полное двойное лучепреломление (таблица 5). Предполагается, что семена с нормальными крахмальными гранулами являются сегрегантами, у которых отсутствует трансген, а поэтому они имеют нормальный фенотип.
Результаты оптической микроскопии были подтверждены с помощью сканирующей электронной микроскопии (СЭМ) крахмальных гранул. Для этого на очищенный крахмал напыляли золото и сканировали при 15 кВ при комнатной температуре.
Масса зерна
Отдельные зерна, полученные от дц-SBEIIa-трансформированных растений, выращенных в эквивалентных условиях в теплице, взвешивали (таблица 6). Зерна, имеющие сильно деформированные крахмальные гранулы и полученные от растений 50.1b, 58.2а, 61.2а и 109, не обнаруживали значимого снижения средней массы по сравнению с зерном растений дикого типа, выращенных в тех же самых условиях. Отсюда следует, что уровень продуцирования крахмала значительно не снижается даже в семенах с сильно деформированными крахмальными гранулами. Эти данные также позволяют предположить, что урожай пшеницы, выращенной в полевых условиях и имеющей пониженную SBEIIa-активность в эндосперме, должен быть почти в пределах нормы.
Анализ белков SBEIIa и SBEIIb в эндосперме трансгенной пшеницы Т2
Семена (Т2) от 13 дц-SBEIIa-трансформированных растений Т1, представляющих 5 независимо трансформированных линий, и от 9 дц-SBEIIa-трансформированных растений Т1, представляющих 3 независимо трансформированных линии, анализировали на экспрессию белков SBEIIa и SBEIIb в эндосперме с помощью электрофореза в неденатурирующем ПААГ и с помощью Вестерн-блоттинга. Все дц-SBEIIa-растения происходили от линий, имеющих аномальную морфологию крахмальных гранул, а все дц-SBEIIb-растения происходили от линий, имеющих нормальную морфологию крахмальных гранул, как описано выше. Антителом, используемым для детекции SBEIIa, было кроличье антитело 3KLH, вырабатываемое против синтетического пептида, имеющего аминокислотную последовательность AASPGKVLVPDESDDLGC [SEQ ID NO:13], соответствующую последовательности N-конца зрелого SBEIIa, и перед использованием это антитело разводили 1:5000. Антителом, используемым для детекции SBEIIb, было антитело R6, вырабатываемое против синтетического пептида, имеющего аминокислотную последовательность AGGPSGEVMIGC [SEQ ID NO:14], соответствующую выведенной последовательности N-конца зрелого SBEIIb, и перед использованием это антитело разводили 1:6000. “Вторым” используемым антителом было конъюгированное с пероксидазой хрена антитело против GAR (разведение 1:3000). Иммунореактивные полосы выявляли с использованием системы ЭХЛ-детекции Amersham.
Эндоспермы от каждого из семи развивающихся зерен (через 15 дней после цветения) каждого из 22 растений Т1 анализировали, поскольку предполагалось, что некоторые из этих растений могут быть гетерозиготными по трансгену. Двенадцать из 13 дц-SBEIIa-трансформированных растений продуцировали потомство Т2, что свидетельствовало о снижении уровней белка SBEIIa в эндосперме. Очевидно, что у всех семи семян от одной линии (50,3×0,9) полностью отсутствовал SBEIIa, а у всех семи семян от четырех других растений наблюдалось явное снижение уровней экспрессии SBEIIa (таблица 7). Эти растения представляют собой линии, гомозиготные по трансгену. Семь линий обнаруживали сегрегацию по отсутствию SBEIIa или по пониженным уровням SBEIIa, но в некоторых случаях снижения уровня белка не наблюдалось, и эти линии, возможно, являются гомозиготными по трансгену. Тринадцатая линия (50,3×0,6) была гомозиготной по экспрессии дикого типа (таблица 7).
Из девяти протестированных дц-SBEIIa-трансгенных линий три линии (110.16b.2, 110.16b.5 и 110.16b.19) были однородными (т.е. не сегрегированными) по отсутствию экспрессии SBEIIb в каждом из семи семян потомства, две линии были однородными по экспрессии дикого типа, а остальные четыре линии обнаруживали сегрегацию по отсутствию экспрессии, по пониженной экспрессии или по экспрессии дикого типа (таблица 7). Эмбрионы семян могут быть выращены (“спасение” эмбриона) с получением растений Т2 и семян Т3, которые затем скринируют с помощью ПЦР и анализируют на экспрессию белка для подтверждения генетического статуса семян Т2 в отношении трансгена.
Эти данные показали, что конструкции дуплексной РНК обеспечивают эффективное снижение уровня экспрессии генов SBEIIa и SBEIIb в эндосперме пшеницы. Эти данные также показали, что снижение уровня экспрессии только гена SBEIIb не оказывает существенного влияния на изменение морфологии крахмальных гранул.
Экспрессию гена SBEIIb в трансгенных семенах, содержащих дц-SBEIIa-трансген и не содержащих белок SBEIIa, и экспрессию гена SBEIIа в семенах, содержащих дц-SBEIIb, также анализировали с помощью Вестерн-блот-анализа. Неожиданно было обнаружено, что трансгенные семена, содержащие дц-SBEIIa, имели гораздо более низкий уровень SBEIIb. Однако в семенах, трансгенных по дц-SBEIIb, обратный эффект не наблюдался. Экспрессия SBEIIa не изменялась в семенах, в которых SBEIIb был полностью инактивирован под действием дц-SBEIIb. Возможно, что экспрессия SBEIIb подавлялась под действием конструкции дц-SBEIIa, что обусловлено гомологией последовательностей генов в области, используемой для конструирования дуплекса, а также возможно, что активность SBEIIb была снижена под действием дц-SBEIIa-трансгена в соответствии с некоторыми другими механизмами.
Уровни экспрессии генов SBEIIa и SBEIIb могут быть также конкретно определены на уровнях мРНК стандартными методами, такими как Нозерн-гибридизация или ОТ-ПЦР, например, с использованием зондов от неконсервативных областей или пар праймеров, которые гибридизуются с уникальными сайтами в одном из этих генов, но не в других участках, например в 3'-нетранслируемых областях. Такие области или сайты могут быть легко идентифицированы путем сравнения последовательностей двух генов.
Пример 6. Анализ крахмала, полученного от трансформированной пшеницы
Уровни амилозы и амилопектина в зерне трансгенной пшеницы
Содержание амилозы в крахмале от объединенных пул шести образцов семян Т1 определяли, как описано в примере 1. Объединенные в пул образцы семян получали от трансгенных линий пшеницы, как описано ниже.
Пул 1: семена с деформированными крахмальными гранулами от дц-SBEIIa-трансгенной линии 85.2с
Пул 2: семена с нормальными крахмальными гранулами от дц-SBEIIa-трансгенной линии 85.1а
Пул 3: семена с нормальными крахмальными гранулами от дц-SBEIIb-трансгенной линии 110.18а
Пул 4: объединенные в пул семена с деформированными крахмальными гранулами от дц-SBEIIa-трансгенных линий 58.1а, 58.2а и 61.2а
Пул 5: семена с нормальными крахмальными гранулами от дц-SBEIIa-трансгенной линии 83.1b
Пул 6: семена с нормальными крахмальными гранулами от дц-SBEIIb-трансгенной линии 75.3х
Каждый анализ образцов крахмала проводили с четырьмя повторностями. В этих анализах для преобразования оптической плотности в величину содержания амилозы использовали следующее уравнение регрессии: Y = 57,548х - 8,793, где Y - содержание амилозы (%), а х - оптическая плотность.
Результаты представлены в таблице 8. Присутствие деформированных крахмальных гранул четко коррелирует с увеличением содержания амилозы. Крахмал из зерна с деформированными крахмальными гранулами, полученного от дц-SBEIIa-трансгенных линий (пулы 1 и 4), имел содержание амилозы более чем 50%, а другие крахмальные пулы, полученные из зерна с нормальными крахмальными гранулами, имели содержание амилозы в пределах 21-26%. Эти пулы включали крахмал от линии IIb 110.18а, которая имела пониженный уровень экспрессии SBEIIb (таблица 8), что позволяет предположить, что инактивация одного гена SBEIIb в пшенице на приводит к значительному увеличению уровней амилозы в крахмале зерна пшеницы.
Вторую серию анализов проводили йодометрическим методом с использованием образца пула 4 и крахмала пшеницы, которая является дефицитной по SSII (Yamamori et al., 2000), и ячменя линии М292, который является мутантным по SSIIa. Содержание амилозы, определенное для крахмала из пула 4 семян пшеницы (дц-SBEIIa-трансгенных линий), было значительно выше, чем содержание амилозы в крахмале, полученном от SSII-мутантов пшеницы и ячменя.
Из этого следует, что содержание амилопектина в крахмале, полученном от этого зерна, по сравнению с содержанием амилопектина в зерне дикого типа, значительно уменьшилось примерно от 75% до менее чем 50% или даже менее чем 20%.
Линии, содержащие оба дц-SBEIIa- и дц-SBEIIb-трансгена, генерировали путем скрещивания трансгенных растений, описанных выше. Содержание амилозы в крахмале зерна, полученного от такого потомства, превышало содержание амилозы в крахмале растений, содержащих только дц-SBEIIa, например, на 75 или 80%, что указывает на то, что ингибирование SBEIIb, помимо ингибирования SBEIIa, также приводит к увеличению уровней амилозы.
Пример 7. Сравнение SBEIIa от геномов А, В и D
Конструирование кДНК и геномных библиотек пшеницы
кДНК и геномные библиотеки для эндосперма пшеницы получали стандартными методами в фаговых векторах (Sambrook et al., 1989). Были получены две библиотеки кДНК, одна - из РНК сорта Rosella (Rahman et al., 1999), а другая - из сорта Wyuna (Rahman et al., 2001). Библиотека для сорта Rosella была создана в векторе ZAPII с использованием EcoRI- и NotI-праймеров, а библиотека для сорта Wyuna была создана в векторе ZipLox (Life Technology) в соответствии с протоколами, прилагаемыми к поставляемым реагентам. Титры этих библиотек составляли 2×106 б.о.е. и были протестированы с использованием штамма Y1090(ZL) E.coli. Геномную библиотеку конструировали из ДНК A. tauschii сорта 10097. ДНК гидролизовали ферментом Sau3А и лигировали с частично достроенным вектором lambdaGEM12 (Promega). Клонированные фрагменты могут быть выделены путем гидролиза ферментами SacI или XhoI. Геномные библиотеки ДНК T.aestivum были описаны Turner et al. (1999).
Выделение кДНК-последовательностей SBEIIa
кДНК выделяли из библиотеки, полученной от сорта Rosella, с использованием зонда для последовательности гена SBEI пшеницы в условиях низкой жесткости (Rahman et al., 2001). Самый длинный из полученных клонов, обозначенный sbe9, был секвенирован, и было установлено, что он кодирует последовательность типа SBEIIa (GenBank AF338432.1). Затем из кДНК-библиотеки эндосперма пшеницы сорта Wyuna (Rahman et al., 2001) было выделено три клона с использованием зонда, соответствующего положениям 536-890 клона sbe9. Скрининг библиотеки проводили в следующих условиях гибридизации: 25% формамид, 5×SSС, 0,1% SDS, 10 × раствор Денхардта, 100 мкг/мл ДНК спермы лосося, при 42°С в течение 16 часов с последующей промывкой в 2×SSС, 0,1% SDS, при 65°С в течение 1 часа (3×)(средняя жесткость). При секвенировании клонов были получены три различных последовательности, которые представлены ниже как sr995 и sr997 (фиг.6).
Исследование этих последовательностей кДНК показало, что в эндосперме пшеницы были экспрессированы различные последовательности, и эти последовательности, вероятно, соответствуют последовательностям транскриптов SBEIIa от различных геномов пшеницы. Сравнение этих последовательностей с другими известными кДНК-последовательностями SBEIIa пшеницы с использованием программы PILEUP показало, что последовательности sr995 и sr996 образуют кластеры с мРНК-последовательностью, происходящей от D-геномной последовательности wSBE-D1 (sr854)(фиг.7), что позволяет предположить, что sr995 и sr996 представляют собой транскрипты, происходящие от SBEIIa генома D. Последовательность sr997 образовывала кластер с последовательностью Y11282 (Nair et al., 1997), что указывало на то, что они, вероятно, происходят от одного и того же генома, либо А, либо В. Ранее описанный клон sbe9 (AF338432.1), вероятно, происходит от того же генома, что и Y11282, но представляет собой вариант альтернативного сплайсинга, в результате которого был вырезан один экзон вблизи 5'-конца.
Идентификация генов SBEIIa от геномов А, В и D пшеницыT.aestivum
Различия в последовательностях генов или РНК-транскриптов могут быть взяты за основу при конструировании праймеров, специфичных к геному А, В и D, для скрининга на мутации либо на уровне гена, либо на уровне РНК. Так, например, на фиг.6 приводится сравнение нуклеотидных последовательностей SBEIIa от кДНК, включая последовательность GenBank рег.№ Y11282, и неполных последовательностей кДНК клонов sbe9 (AF338432.1), sr997 и sr995. Геномные последовательности для генов SBEIIaT.aestivum, представленные, например, в таблице 1. Эти геномные последовательности были приписаны геномам А, В и D. Сравнение указывало на полиморфизм, каждый из которых может быть использован для идентификации последовательностей молекулярными методами.
Для идентификации продуктов от геномов А, В и D были использованы прямой праймер, сконструированный на основе области экзона 5 (5'-ATCACTTACCGAGAATGGG-3')[SEQ ID NO:15], и обратный праймер, сконструированный на основе последовательности в экзоне 6 (5'-CTGCATTTGGATTCCAATTG-3')[SEQ ID NO:16]. Такие праймеры могут быть использованы в ПЦР-реакциях для скрининга сортов или линий, которые являются мутантными по одному или нескольким генам SBEIIa, происходящих от геномов А, В или D (см. ниже).
Для идентификации генов SBEIIb от геномов пшеницы А, В или D были также получены ПЦР-маркеры. Так, например, ПЦР-реакции с использованием пары праймеров АRA19F (5'-СACCCATTGTAATTGGGTACACTG-3') [SEQ ID NO:17] и АRA15R (5'-TCCATGCCTCCTTCGTGTTCATCA-3')[SEQ ID NO:18] и последующий гидролиз амплифицированных продуктов рестриктирующим ферментом RsaI позволяют идентифицировать гены SBEIIb от трех геномов.
Различия в кДНК-последовательностях отражены в выведенных последовательностях белков. Так, например, выведенные полноразмерные аминокислотные последовательности для полипептидов генома D (sr854) и геномов А или В (Y11282) сравнивали, как показано на фиг.8. Заметные различия наблюдались в областях 688-698 и 735-6, которые могут быть использованы для продуцирования геном-специфических антител против белков SBEIIa в целях скрининга сортов пшеницы, не обладающих одной или несколькими геном-специфическими активностями. Другие различия наблюдались в транспортных пептидных последовательностях, которые соответствуют положениям аминокислот 1-54 на фиг.8.
Пример 8. Идентификация сортов пшеницы, имеющих мутации в одном или нескольких генах SBEII.
Идентификация молчащих мутаций SBEIIb в геномах В и D
Всего 1500 линий пшеницы, включая 300 сортов австралийской пшеницы, 900 линий пшеницы, взятых из Коллекции Австралийских озимых зерновых культур (AWCC, Tamworth, NSW Australia), и 300 местных сортов пшеницы было скринировано путем ПЦР-амплификации SBEIIb-маркера, соответствующего полиморфной области интрона 3, с использованием праймеров ARA19F (см. выше) и ARA23R (5'-CTGCGCATAAATCCAAACTTCTCG-3')[SEQ ID NO:19]. Условия ПЦР-амплификации описаны выше. Продукты амплификации гидролизовали рестриктирующим ферментом RsaI и подвергали электрофорезу в полиакриламидных гелях. В трех линиях (Aus12745, Aus17340 и Aus10103) отсутствовал маркер генома D, а в двух линиях (Aus12509 и Aus12565) отсутствовал маркер генома В (фиг.9). Эти линии представляют собой предполагаемые нуль-мутанты в генах SBEIIb от геномов В или D.
Для подтверждения результатов ПЦР проводили анализ методом Саузерн-блот-гибридизации на ДНК от нуль-мутантных линий. HindIII-гидролизованную ДНК, полученную из растений стандартными методами, подвергали электрофорезу в 1% агарозных гелях и блоттингу на найлоновой мембране Hybond N+ (Amersham). Радиоактивно меченные зонды генерировали из области интрона 3 гена SBEIIb (положения 2019-2391, см. фиг.2) с применением системы мечения ДНК Megaprime (Amersham Pharmacia Biotech UK Ltd) и использовали для гибридизации в жестких условиях. Aus17340 и Aus10103 не содержали полосу ~4,8 т.п.н. генома D, а Aus12509 и Aus12565 не содержали полосу ~3,4 т.п.н. генома В (фиг.10). Было подтверждено, что эти линии представляют собой нуль-мутанты по генам SBEIIb генома D или B соответственно.
Генерирование двойных нуль-мутантов В+D
Были получены следующие кроссы:
Aus17340а х Aus12509
Aus17340b х Aus12509
Aus17340а х Aus12565
Aus17340b х Aus12565
Aus12745 х Aus12509
Aus12745 х Aus12565
Aus17340а и Aus17340b представляют собой два различных биологических типа одного и того же сорта Aus17340, и было подтверждено, что оба они являются нуль-мутантными по маркерному гену SBEIIb в геноме D. Растения F1 подвергали самоопылению и потомство F2 скринировали ПЦР-методом на растения, которые были мутантными по генам SBEIIb в геноме В и D (двойные нуль-мутанты). Сегрегацию по SBEIIb-мутациям наблюдали с помощью ПЦР-амплификации с использованием пар праймеров АR2b19cF (5'-СTATGCCAATTGAACAACAATGC-3')[SEQ ID NO:20] и АR2b23cR (5'-CGTGTTCATCAATGTCTGAACG-3')[SEQ ID NO:21] (которые амплифицируют такую же область, как и ARA19F/ARA23R) с последующим гидролизом рестриктирующим ферментом RsaI. Типичная картина сегрегации представлена на фиг.11. Анализ с использованием критерия “хи-квадрат” выявил, что картина сегрегации кроссов Aus17340а х Aus12509 и Aus17340а х Aus12565 соответствует ожидаемому отношению 9:3:3:1 (таблица 9). Сегрегация в других кроссах была сильно измененной.
Растения-альбиносы детектировали во всех кроссах, независимо от родительских линий, в результате чего было обнаружено, что мутантный ген, родственный гену хлорофилла, был также сегрегирующимся в данных популяциях. Из 24 проанализированных растений-альбиносов 23 растения имели двойные нуль-мутации В+D, а одно растение, очевидно, было дикого типа. Пять нормальных зеленых на вид растений с двойными нуль-мутациями В+D были идентифицированы из 718 протестированных линий. Три из них происходили от кросса Aus17340b х Aus12509 (BD219, BD303, BD341), одно растение происходило от кросса Aus17340а х Aus12509 (BD54), а одно - от Aus17340b х Aus12565 (BD636). Результаты показали, что мутации в генах SBEIIb генома В и D были тесно сцеплены с мутацией в гене, родственном гену хлорофилла, который давал фенотип альбиноса в случае, если передавались два мутированных локуса. Однако были идентифицированы события рекомбинации между геном SBEIIb и геном, родственным гену хлорофилла, что приводило к продуцированию нормальных линий с двойной нуль-мутацией В+D, хотя и с очень низкой частотой. Это указывает на то, что два этих гена, хотя и являются тесно сцепленными, могут быть разделены.
Пример 9. SBEIIa и SBEIIb являются сцепленными в растении пшеницы
Выделение клонов ВАС
Бинарную космидную библиотеку с крупной вставкой (ВАС), сконструированную из пшеницы A. tauschii сорта meyeri (Moullet et al., 1999), зондировали областью интрона 3 гена SBEIIb (положения 2019-2391, фиг.2) для выделения ВАС, содержащих ген SBEIIb. Было выделено четыре позитивных клона, которые обозначали ВАС-4, -5 и -9 и -12. Для подтверждения того, что они содержат ген SBEIIb, ДНК этих клонов экстрагировали, гидролизовали ферментами HindIII или EcoR1 и осуществляли Саузерн-блот-гибридизацию с использованием одного и того же зонда (фиг.12). Клон ВАС-5 обнаруживал одну сильную гибридизующуюся полосу размером ~7,5 т.п.н. с EcoR1 и четыре полосы размером ~6,1, 3,6, 2,3 и 1,7 с HindIII (фиг.12). Это указывало на присутствие SBEIIb на ВАС-5. Для анализа на присутствие 3'-области гена на ВАС-5 на этом клоне осуществляли ПЦР-амплификацию с использованием специфических праймеров, сконструированных на основе кДНК-последовательности SBEIIb для амплификации экзонов 17 (АR2b3pr2F, 5'-GGATATGTATGATTTCATGG -3')[SEQ ID NO:22] и АR2b3pr2R, 5'-CCATAAAGTTAAGATAACCC-3')[SEQ ID NO:23]) и 20 (АR2b3pr1F, 5'-GACATCAGACCACCAGTACG -3')[SEQ ID NO:24] и АR2b3pr1R, 5'-CTTCCCAGGCTTTAAACAGC-3')[SEQ ID NO:25]). Обе пары праймеров амплифицировали ожидаемые продукты размером 128 п.н. для экзона 17 и размером 145 п.н. для экзона 20, что указывало на то, что ВАС-5 содержал 3'-конец гена SBEIIb. Это было дополнительно подтверждено путем секвенирования ПЦР-продукта из экзона 20.
ВАС-5 был также протестирован на присутствие гена SBEIIa помимо гена SBEIIb. Реакции нуклеотидного секвенирования с использованием праймера AR2akpnIF 5'-GGTACCGCAGAAAATATACGAGATTGACCC-3' [SEQ ID NO:26] выявили последовательность, соответствующую области интрона 3 гена SBEIIa, и эта последовательность была аналогична последовательности, простирающейся от положения 2265 до положения 2478 (фиг.1) гена wSBEII-D1. Этот результат позволяет предположить, что SBEIIa также присутствует на ВАС-5, а это означает, что гены SBEIIa и SBEIIb, вероятно, тесно сцеплены в растении пшеницы.
Флуоресценция при гибридизации in situ (FISH)
Гибридизацию in situ с геномным клоном F2 wSBEII-D1 (Rahman et al., 2001) и с клоном wSBEII-D2 (Rahman et al., 2001) осуществляли методом давленых препаратов на хромосомах пшеницы Aegilops tauschii и пшеницы, описанной Turner et al. (1999). Идентичность гибридизированной хромосомы проверяли путем двойного мечения рSc119.2, повторяющейся последовательностью, используемой для идентификации хромосом (Mukai et al., 1990). Оба клона wSBEII гибридизовались с проксимальной областью хромосомы 2 (фиг.13), что указывало на близость двух генов SBEII в пшенице.
Нуль-мутанты по SBEIIb пшеницы являются также мутантами по SBEIIa
Нуль-мутанты по SBEIIb, идентифицированные, как описано выше, скринировали на мутации в гене SBEIIa с использованием праймеров Sr913F (5'-ATCACTTACCGAGAATGGG-3') [SEQ ID NO:27] и E6R (5'-CTGCATTTGGATTCCAATTG-3')[SEQ ID NO:28]. Эти праймеры были сконструированы для амплификации области интрона 5 гена wSBE II-D1 и идентификации генов SBEIIa на геномах А, В и D.
Было обнаружено, что нуль-мутанты по гену SBEIIb, Aus12565 и Aus12509 в геноме В также представляют собой нуль-мутанты по гену SBEIIa в геноме В. Аналогичным образом нуль-мутанты SBEIIb в геноме D, Aus17340 и Aus10103 также являются нуль-мутантами SBEIIa в геноме D. Кроме того, двойные мутантные линии SBEIIb в геномах B+D, BD341 и BD636 также представляют собой двойные нуль-мутанты гена SBEIIa в геноме B+D. Полученные данные подтверждают, что в растении пшеницы, в отличие от риса и кукурузы, гены SBEIIa и SBEIIb тесно сцеплены друг с другом и это указывает на то, что мутации копий этих генов в геномах B и D, описанных выше, представляют собой делеционные мутации.
Растение пшеницы с тремя нуль-мутациями по гену SBEIIa
Описанные выше методы могут быть использованы для выделения мутантов SBEIIa и/или SBEIIb генома А. Так, например, области ВАС-5, тесно сцепленные с SBEIIa и/или SBEIIb, были использованы в качестве зондов или в целях конструирования ПЦР-праймеров для скрининга на мутации в генах генома А. Мутанты в геноме А скрещивали с линиями, имеющими двойные нуль-мутации в геномах B+D для продуцирования линии с тройной нуль-мутацией в геномах А+B+D. Альтернативно, мутагенез двойных нуль-мутантов генома B+D осуществляли путем облучения или другими методами, после чего был идентифицирован тройной нуль-мутант, в котором полностью отсутствовала SBEIIa-активность, и иногда отсутствовала SBEIIb-активность. Таким образом был получен нетрансгенный сорт пшеницы с очень высоким уровнем амилозы.
Пример 10. Мутация гена SBEIIA в пшенице
Мутация гена SBEIIa в пшенице, приводящая к снижению активности гена SBEIIa, может быть достигнута либо путем облучения гамма-лучами, либо путем проведения химического мутагенеза, например, с использованием этилметансульфоната (ЭМС). Для создания мутации, индуцированной гамма-излучением, семена подвергали облучению в дозе 20-50 кР, подаваемому от60С-источника (Zikiryaeva & Kasimov, 1972). ЭМС-мутагенез проводили путем обработки семян этилметансульфонатом (ЭМС)(0,03%, об./об.), как описано Mullins et al., (1999). Мутантные зерна с двойным нуль-фенотипом в геноме B+D идентифицировали по повышенному содержанию амилозы или по измененной морфологии крахмальных гранул и подтверждали описанными выше методами. Мутанты в SBEIIa, которые сохраняют SBEIIb-активность, могут быть подвергнуты повторному мутагенезу, и их потомство может быть скринировано на отсутствие SBEIIb-активности помимо отсутствия SBEIIa-активности, либо SBEIIa-мутант может быть скрещен с SBEIIb-мутантом для объединения мутаций и для продуцирования нетрансгенного сорта пшеницы, в эндосперме которой, в основном, отсутствует SBEII-активность.
Пример 11. Мутанты пшеницы SGP-1 имеют пониженную SBEIIa- и SBEIIb-активность
Гены для крахмал-синтазы II (SSII) в геномах А, В и D пшеницы (Triticum aestivum) кодируют полипептиды 100-105 кДа, которые также известны как белки-1 крахмальных гранул (SGP-1). SSII (SGP-1) состоит из трех полипептидов с молекулярной массой приблизительно 100, 104 и 105 кДа, которые кодируются гомологичной серией генов, расположенных на коротком плече хромосом 7В, 7А и 7D соответственно (Denyer et al., 1995, Yamamori & Endo, 1996). Yamamori et al.(2000) получили пшеницу, не содержащую SGP-1, путем скрещивания линий, в которых отсутствовали формы белка SGP-1, специфичные для генома А, В и D, как было проанализировано с помощью электрофореза белков. Оценка семян, не содержащих SGP-1, показала, что такая мутация приводит к изменению структуры амилопектина, к повышению содержания амилозы и к деформации крахмальных гранул (Yamamori et al., 2000). Кроме того, эксперименты, проводимые на зрелом зерне с применением электрофореза, выявили, что уровни ассоциированных с крахмальными гранулами SBEII (SGP-2) и SSII (SGP-3) значительно снижались. Молекулярные механизмы мутации(й), приводящей(их) к продуцированию линий, не содержащих SGP-1, неизвестны.
Авторами были проведены эксперименты в целях дополнительной характеризации линии пшеницы, у которой в крахмальных гранулах, полученных из зрелого зерна, полностью отсутствует SGP-1. Для того чтобы определить, присутствуют ли гены SSII в каждом из геномов А, В и D пшеницы, не содержащей SGP-1, ДНК экстрагировали из пшеницы, не содержащей SGP-1 и из пшеницы дикого типа (контроль) сорта Китайская яровая, а затем ее анализировали с помощью ПЦР с использованием комбинации праймеров ssIIa (5'-CCAAGTACCAGTGGTGAACGC-3') [SEQ ID NO:29] и ssIIb (5'-CGGTGGGATCCAACGGCCC-3')[SEQ ID NO:30] для генома В или ssIIa и ssIIс (5'-CATGTGAGCTAGCTTTCGCCC-3')[SEQ ID NO:31] для геномов А и D. Амплифицированная область находилась между положениями 2472 и 2821 п.н. wSSIIA (GenBank, рег. № AF155217) или соответствующих областей wSSIIВ или wSSIID. Амплифицированная область состояла из части экзона 8 и была выбрана потому, что она позволяет четко идентифицировать продукты геномов А, В и D. Амплификацию осуществляли в следующих условиях: 35 циклов при 94°С, 30 сек; при 60°С, 1 мин и при 72°С, 2 мин ПЦР-фрагменты, продуцированные из геномов А, В и D пшеницы, не содержащей SGP-1, имели такой же размер, как и соответствующие фрагменты, полученные от пшеницы сорта Китайская яровая. ПЦР-амплификация сегментов генов изоамилазы и генов SSI, которые представляют собой гены биосинтеза крахмала, наиболее близко расположенные от генов биосинтеза крахмала SSII и находящиеся с обеих сторон от SSII (Li et al., 2002), показала, что эти гены могут быть амплифицированы из каждого генома А, В и D пшеницы, не содержащей SGP-1. Поэтому нуль-фенотип по SGP-1 не был вызван делецией любого из этих генов на коротком плече хромосомы 7.
Оценка, проводимая путем сканирующей электронной микроскопии, показала, что крахмальные гранулы, полученные из развивающихся семян пшеницы, не содержащих SGP-1 в фазе роста, начинающейся через 10 дней после цветения и продолжающейся до их зрелости, были заметно деформированы. Распределение длин цепей неразветвленного крахмала в мутанте, оцененное с помощью капиллярного электрофореза, указывало на увеличение числа более коротких цепей (до DР 8) и снижение числа более длинных цепей DР 9-22.
Экспрессия крахмал-синтаз и ветвящих ферментов в SGP-1-эндосперме
Экспрессию крахмал-синтаз и ветвящих ферментов в крахмальных гранулах исследовали в растениях, не содержащих SGP-1, и сравнивали с уровнем экспрессии в пшенице дикого типа сорта Китайская яровая. Независимо от стадии развития семян наблюдалось значимое снижение, примерно на 90-96%, количества SBEII и SSI в крахмальных гранулах линии, не содержащей SGP-1, а также отсутствие SSII (фиг.14). Использование специфических антител показало, что полоса SBEII, полученная от крахмальных гранул пшеницы сорта Китайская яровая, состояла из SBEIIa и SBEIIb в отношении приблизительно 1:3. В нуль-мутанте по SGP-1 это количество было таким низким, что его относительное содержание невозможно было определить с использованием антител. Также наблюдалось снижение уровня GВSS I на ранней стадии развития зерна. Очевидно, что SGP-1-мутант имел пониженный уровень полипептидов, ассоциированных с крахмальными гранулами, включая SBEIIa и SBEIIb. Снижение количества полипептидов, ассоциированных с крахмальными гранулами (SBEIIa и SSI), не наблюдалось в зерне линий пшеницы, используемых для продуцирования нуль-мутанта по SGP-1 (Yamamori et al., 2000), и было высказано предположение, что этот эффект был, в частности, обусловлен отсутствием SSII.
Ветвящие ферменты и крахмал-синтазы также анализировали в растворимой фазе развивающегося эндосперма. Относительные количества растворимого SBEIIb были аналогичными у линии пшеницы сорта Китайская яровая и у линии пшеницы, не содержащей SGP-1, однако в растворимой фазе мутанта наблюдалось снижение количества SBEIIa (фиг.15). Однако это может быть частично обусловлено генеалогией линии, не содержащей SGP-1.
Эти данные продемонстрировали, что SBEIIa-активность может плейотропно снижаться из-за мутации в гене SSII. Хотя мутация только в одном гене SSII давала относительные уровни амилозы в крахмале менее чем 50%, однако предполагается, что мутации в других генах, то есть не являющихся SBEIIa, могут быть объединены с SBEII-мутациями с увеличением уровней амилозы и продуцированием модифицированного крахмала.
Пример 12. Множественные изоформы, дефицитные по SBEI
Очистка крахмал-ветвящих ферментов пшеницы с помощью анионообменной хроматографии выявила три пика активности (фиг.16, Morell et al., 1997). Экстракты эндосперма из пшеницы сорта Китайская яровая (СS) обнаруживали присутствие четырех полипептидов SBEI на неденатурирующем ПААГ, как было показано с использованием поликлонального анти-WBE-1 антитела, вырабатываемого против синтетического пептида с аминокислотной последовательностью, соответствующей N-концевой последовательности белка пика 1 (фиг.16В). Анализ нуллисомных-тетрасомных линий СS показал, что эти полипептиды кодируются на хромосоме 7, причем полосы на иммуноблоте были приписаны геномам А (полоса А), В (полоса В) и D (полосы Di и Dii), а их активности были названы А-мажорной, В-мажорной и D-мажорной активностями соответственно. Иммуноблот-анализ очищенных фракций, представляющих пики активности, полученные с помощью анионообменной хроматографии, показал, что первый пик содержал А-мажорную и D-мажорную SBEI-активности, а второй пик содержал В-мажорную SBEI-активность (фиг.16С).
Локализация гена, кодирующего мажорную SBEI-активность на хромосоме 7, соответствовала определенной локализации трех хорошо охарактеризованных и родственных генов wSBEI-D2, wSBEI-D3 и wSBEI-D4. Выведенная последовательность мажорного белка SBEI показала, что он кодируется последним из этих генов wSBEI-D4 (Rahman et al., 1997, Suzuki et al., 2003). Присутствие четвертого гена SBEI было предсказано исходя из данных Саузерн-блот-гибридизации (Suzuki et al., 2003).
Идентификация нуль-мутаций гена мажорного белка SBEI
Для идентификации нуль-мутаций, в которых отсутствовала экспрессия одной или нескольких изоформ SBEI, отобранные пулы зародышевой плазмы пшеницы скринировали путем иммуноблот-детекции мажорного белка SBEI после электрофореза в неденатурирующем геле. При этом было использовано описанное выше анти-wSBEI антитело. Из 182 проанализированных австралийских гексаплоидных линий пшеницы 13 линий были идентифицированы как линии, не экспрессирующие мажорный SBEI-D, 16 линий не содержали мажорный SBEI-В, 10 линий не содержали SBEI-А, а две линии (Bindawarra и Vectis) не содержали обе изоформы А и В. Эти линии рассматривались как линии, содержащие нуль-мутации соответствующих генов SBEI в геноме. Частота нуль-мутаций в гене мажорного SBEI (~23%) была аналогична частоте нуль-мутаций в гене GВSS (22%)(Boggini et al., 2001).
Генерирование линии с тройной нуль-матацией по гену мажорного SBEI
С помощью иммуноблот-анализа было обнаружено, что сорта Bindawarra и Vectis не имели А-мажорной и В-мажорной SBEI-активностей, а сорт Cadoux был идентифицирован как сорт, не имеющий D-мажорной активности. Популяцию потомства F2 от 185 линий, полученную путем скрещивания Vectis х Cadoux, скринировали с помощью иммуноблоттинга. Однако не было получено линий, в которых отсутствовали бы все три активности, что позволяет предположить, что каждое из этих потомств обладало низкой жизнеспособностью, либо обнаруживало определенное взаимодействие между геномами. Поэтому потомственная линия VС3.1.11, в которой отсутствовали В- и D-мажорные активности, была скрещена с линией сорта Китайская яровая, которая имела хромосому, модифицированную методами генной инженерии (СS7AL-15) и в которой отсутствовала А-мажорная активность. Двойные гаплоидные линии скринировали с помощью ПЦР с использованием праймеров АRBE1CF (5'-GGGCAAACGGAATCTGATCC-3')[SEQ ID NO:32] и ARA9R (5'-CCAGATCGTATATCGGAAGGTCG-3')[SEQ ID NO:33] и иммуноблоттинга, при этом 2 линии (А113 и D13) из 160 линий обнаруживали полное отсутствие SBEI-мажорной активности, как было определено с помощью иммуноблоттинга в неденатурирующих гелях. На фиг.17 показана репрезентативная картина сегрегации двойных гаплоидных линий, включая А113 (дорожка 6).
Эндосперм линии А113 оценивали на остаточную SBE-активность. Сорт пшеницы дикого типа, D28, обнаруживал два пика SBEI-активности. В противоположность этому, экстракты А113 давали первый пик активности, однако второй пик активности полностью отсутствовал. Аминокислотные последовательности, полученные из очищенной фракции, содержащей такую активность, указывали на присутствие белка SBEI-типа в А113. Однако эта фракция не обнаруживала реакции с анти-WBEI антителом в неденатурирующем геле. Активность ветвления в А113 соответствовала белку ~80 кДа, который может представлять собой фермент типа SBEII, поскольку он перекрестно реагировал с антителами против SBE картофеля и против SBEII кукурузы.
Эти данные продемонстрировали, что в пшенице могут быть генерированы мутантные линии SBEI. Комбинация SBEI-мутаций с SBEIIa-мутациями и, необязательно, с SBEIIb-мутациями приводила к продуцированию растений пшеницы, зерно которых содержало крахмал с очень высокими уровнями амилозы.
Пример 13. Идентификация мутантных линий пшеницы, содержащих хромосому 2А с мутацией в гене SBEII
В попытке идентифицировать линию пшеницы, имеющую мутацию в генах SBEIIa или SBEIIb, 2400 линий гексаплоидной пшеницы были скринированы на нуль-мутации по SBEIIb в геномах А, В или D. В ПЦР-реакциях на геномных ДНК-образцах растений пшеницы от каждой линии были использованы праймеры AR2b19cF/AR2b23cR, после чего проводили гидролиз амплифицированных продуктов ферментом RsaI и гель-электрофорез. Этот маркер амплифицировал область интрона 3 (положения нуклеотидов 2085-2336 в гене SBEIIb пшеницы, фиг.2) и был специфичным для SBEIIb. Этот скрининг позволял идентифицировать три нуль-мутанта по SBEII в геноме D и два нуль-мутанта по SBEII в геноме В, как описано выше в примерах. Каких-либо мутантных линий, в которых отсутствовала бы полоса генома А, соответствующая SBEIIb, обнаружено не было. Это дает основание предполагать, что линии пшеницы, содержащие хромосому 2А с мутантным геном SBEIIb, не встречаются в природе.
Мутантная популяция пшеницы, индуцированная гамма-излучением (60Со-источником) и генерированная Tony Prior & Rohit Mago (CSIRO), была использована для скрининга на индуцированные мутации в гене SBEII пшеницы. Эта популяция пшеницы была генерирована из потомства F2 кросса Gabo 1BL.1RS x Veery 3. Всего было скринировано 2694 мутантных семян этой популяции, как описано выше в ПЦР-реакциях с использованием праймеров AR2b19cF и AR2b23cR. Два семени, обозначенные МLT2B8 и МLT2D1 и происходящие от одного растения, были идентифицированы как не содержащие аллеля SBEIIb в геноме А (фиг.18). В этой популяции не были идентифицированы семена, содержащие нуль-мутации по SBEIIb в геномах В или D.
Как показано в вышеописанных примерах, гены SBEIIa и SBEIIb были тесно сцеплены в растении пшеницы на длинном плече хромосомы 2. В соответствии с этим, авторами были протестированы ДНК этих семян на присутствие или отсутствие гена SBEIIa в геноме А посредством ПЦР-реакций с использованием праймеров Sr913F/E6R. Эти праймеры амплифицируют область интрона 5 wSBEII-D1 (положения нуклеотидов 2959-3189, фиг.1 [SEQ ID NO:1]). После амплификации продукты подвергали электрофорезу в 5% секвенирующем геле (ДНК-секвенатор АВI Prism). Флуоресцентно меченые продукты анализировали с помощью компьютерной программы Genescan. Профили сканирования показали, что в амплифицированных продуктах обоих мутантных семян MLT2B8 и MLT2D1 отсутствовал продукт, соответствующий гену SBEIIa в геноме А, что указывало на то, что оба семени имеют в геноме А нуль-аллели по гену SBEIIa, а также по гену SBEIIb.
Нуль-мутации в этих семенах были дополнительно подтверждены с использованием специфичных к геному А маркеров для SBEIIa, ARIIaAF (5'-GCAAAAGCCAGATCATAAATTTAGAGC-3' [SEQ ID NO:34] и ARIIaAR (5'-CTTCCAATTCATTGTTAATGGTCACAC-3')[SEQ ID NO:35], которые амплифицируют только продукт гена SBEIIa в геноме А (положения нуклеотидов 3024-3131 в wSBEII-DA1, фиг.1). Хотя эта пара праймеров амплифицировала 110 п.н.-продукт из материала растения сорта Китайская яровая, однако этот продукт явно отсутствовал в этих двух семенах с предполагаемой мутацией. Этот результат был аналогичен результату, полученному для негативного контроля dt2AS, который представлял собой линию сорта Китайская яровая, имеющую генетически сконструированную хромосому 2А, в которой отсутствовало длинное плечо. Поскольку гены SBEIIa и SBEIIb были локализованы на длинном плече хромосомы 2, в этой линии отсутствовал аллель обоих указанных генов в геноме А, а поэтому эта линия может быть использована в качестве негативного контроля (фиг.19).
Эмбрионы из мутантных семян MLT2B8 и MLT2D1, идентифицированных как мутанты по SBEIIa и SBEIIb в геноме А, культивировали для генерирования растений. Крахмал, полученный из семян этих растений, анализировали на содержание амилозы, длину цепи и другие свойства для того, чтобы определить, влияют ли нуль-мутации по обоим генам SBEIIa и SBEIIb в геноме А на свойства крахмала.
Как описано выше, было генерировано пять линий, имеющих мутацию в генах SBEIIa и SBEIIb геномов В и D. Из них линии ВD 219 и ВD636 культивировали в теплице и скрещивали с нуль-мутантными линиями А, MLT2B8 и MLT2D1. Популяцию двойных гаплоидов генерировали из семян F1 этих кроссов и получали гомозиготные растения с тремя нуль-мутациями. Такие тройные нуль-мутанты должны встречаться в популяциях двойных гаплоидов с частотой 1 из 8. Нуль-мутации в геноме А могут быть объединены либо с мутациями в геноме В, либо с мутациями в геноме D путем аналогичного скрещивания. В других кроссах любой из нуль-аллелей может быть введен в любой подходящий генетический фон для сообщения растению нужных агрономических или других признаков.
Для получения пшеницы дурум (такой как, например, сорт Wollaroi), имеющей мутации в генах SBEIIa и SBEIIb генома А, проводили следующие скрещивания:
1) Wollaroi х MLT2B8 или MLT2D1 для продуцирования пшеницы дурум с нуль-мутацией по SBEIIa/SBEIIb в геноме А с фенотипом Wollaroi,
2) А-геномный нуль-мутант пшеницы дурум (Wollaroi) х В-геномный нуль-мутант по SBEIIa/SBEIIb, для продуцирования двойного АВ-нуль-мутанта по SBEIIa/SBEIIb пшеницы дурум (Wollaroi),
Альтернативно:
1) Wollaroi х В-геномный нуль-мутант линии пшеницы, для продуцирования В-геномного нуль-мутанта пшеницы дурум (Wollaroi),
2) В-геномный нуль-мутант пшеницы Wollaroi х А-геномный нуль-мутант линии пшеницы, для продуцирования двойного АВ-нуль-мутанта по SBEIIa/SBEIIb пшеницы дурум.
Такие скрещивания позволяют генерировать пшеницу дурум с высоким содержанием амилозы, употребление которой также благоприятно влияет на здоровье, как и употребление гексаплоидной пшеницы с высоким содержанием амилозы.
Пример 14. Подтверждение высокого содержания амилозы в зерне пшеницы методами разделения на колонке с сефарозой 2В
Содержание амилозы в крахмале, полученном из зерна растений трансгенной пшеницы, содержащей SBEIIa/SBEIIb-ингибирующие генные конструкции, определяли методом разделения на колонке с сефарозой. В этом методе молекулы крахмала разделяли на колонке по их молекулярной массе. Разделенные фракции анализировали с использованием набора для анализа крахмала (Sigma) в соответствии с инструкциями поставщиков.
Приблизительно 10 мг крахмала растворяли в 3,0 мл 1н NаОН (дегазированного) путем инкубирования при 37оС в течение 30 минут. Раствор крахмала центрифугировали в течение 15 минут для осаждения нерастворившихся компонентов. Супернатант загружали на колонку с сефарозой СL2В при скорости работы насоса 1 мл/мин. Колонку прогоняли с использованием 10 мМ NаОН в качестве буфера и собирали пятьдесят фракций по 2,5 мл каждая. рН фракций 9-50 доводили до 4,5 добавлением 35 мкл 1М HCl. Аликвоту (250 мкл) каждого образца переносили в пробирку, а затем добавляли 250 мкл крахмального реагента (набор для анализа крахмала, Sigma). Контроль включал контрольный реагент для анализа крахмала, содержащий только крахмальный реагент (250 мкл) и воду (250 мкл); контрольный реагент для анализа глюкозы, содержащий только 500 мкл воды; контрольный образец, содержащий только 250 мкл образца крахмала и 250 мкл воды; и тест-образец, содержащий только 250 мкл крахмального реагента и 250 мкл образца крахмала. Образцы и контроль инкубировали при 60°С в течение 60 минут, а затем 200 мкл каждого из них переносили в новую пробирку с последующим добавлением 1 мл глюкозного реагента (набор для анализа крахмала, Sigma) и инкубировали при 37оС в течение 30 минут. Оптическую плотность при 340 нм использовали для определения количества крахмала (мг) в каждой фракции в соответствии с инструкциями, прилагаемыми к набору.
Хроматограмма образцов крахмала выявила два пика, элюированных из колонки с сефарозой. Содержание амилозы (второй пик) каждого образца вычисляли как процент от общего содержания крахмала в обоих пиках.
С использованием этого метода было определено, что содержание амилозы в дц-SBEIIa-трансгенной линии Acc. 144087, являющейся гомозиготной по трансгену, составляет 78%, а содержание амилозы в дц-SBEIIb-трансгенной линии Acc.144008 (гомозиготной трансгенной линии трансформанта IIb 110.16b) составляет 23% (фиг.20). По сравнению с этим методом йодометрический метод дает содержание амилозы для этих линий 88,47% и 27,29% соответственно (таблица 10).
Функциональные свойства, такие как температура желатинизации, вязкость пасты и объем набухания крахмала, анализировали с помощью дифференциальной сканирующей калориметрии (DSC) на скоростном анализаторе вязкости (RVA) и с помощью теста на набухание крахмала соответственно. Структуру такого крахмала анализировали с помощью рентгеновской кристаллографии и гранулометрического анализа.
Пример 15. Анализ на распределение длин цепи
Распределение длин цепи образцов крахмала определяли с помощью электрофореза в углеводе с флуорофором (FАСЕ) после деветвления крахмала изоамилазой. Процент длин цепи DР 6-11, DР 12-30 и DР 31-60 в крахмале трансгенных семян сравнивали с процентом длин цепи нетрансгенного контроля. Полученные результаты приводятся в таблице 11. На фиг.21 представлены графики молярных разностей, где величины нормализованных распределений длин цепи для крахмала трансгенных линий с высоким содержанием амилозы вычитали из величины нормализованного распределения длин цепи для крахмала изогенного нетрансформированного контроля.
Наблюдалось значимое снижение соотношения числа цепей длиной DP 4-12 в крахмале дц-SBEIIa-трансгенных семян по сравнению с числом цепей с такой длиной в крахмале от нетрансформированных семян или дц-SBEIIb-трансгенных семян. Число цепей длиной >DР 13 было выше у дц-SBEIIa-трансгенных семян по сравнению с другими семенами. Эти результаты дают основание предположить о возможном селективном участии SBEIIa в синтезе более коротких цепей DР4-12 в крахмале пшеницы. Однако в крахмале SSIIа-мутанта наблюдалось увеличение содержания более коротких цепей амилозы.
Пример 16. Свойства крахмала трансгенной пшеницы
Физические свойства крахмала дц-SBEIIa- и дц-SBEIIb-трансгенных линий, включая температуру желатинизации, анализировали с помощью дифференциальной сканирующей калориметрии с использованием калориметра Perkin-Elmer Diamond. Приблизительно 20 мг каждого крахмала смешивали с водой в отношении 1:2, то есть до достижения содержания влаги 66,7%, и герметично закрывали в DSC-кювете. Скорость нагревания тест-образцов составляла 10°С в минуту, а контрольных образцов - от 0 до 150°С. Полученные данные анализировали с использованием имеющегося программного обеспечения.
В DSC-термограмме для каждого крахмала наблюдались два пика эндотермы. Первый пик представлял разрушение кристаллической структуры в процессе желатинизации крахмала. Второй пик представлял эндотерму диссоциации амилозы-липида. Максимальная температура желатинизации крахмала, полученного от дц-SBEIIa-трансгенных линий, была приблизительно на 7-10°С выше, чем максимальная температура крахмала нетрансформированного контроля, и примерно на 3-7°С выше, чем температура крахмала дц-SBEIIb-трансгенной линии.
В этих линиях наблюдалось заметное увеличение конечной температуры желатинизации (первый пик), составляющее примерно 16-19°С, по сравнению с температурой желатинизации нетрансформированного контроля и дц-SBEIIb-трансгенных линий. Очевидно, что температура начала желатинизации была меньше у дц-SBEIIa-трансгенных линий по сравнению с температурой контроля или дц-SBEIIb-трансгенных линий. Ng et al.(1997) сообщали, что температура начала желатинизации кукурузного крахмала, имеющего амилозу с удлиненной цепью (ае), была аналогична температуре начала желатинизации нормального кукурузного крахмала, но при этом наблюдалось значимое увеличение максимальной температуры желатинизации в ае-крахмале по сравнению с нормальным крахмалом. Энтальпия желатинизации крахмала от дц-SBEIIa-трансгенных линий была значительно ниже, чем энтальпия желатинизации контрольного крахмала и крахмала от дц-SBEIIb-линий. Это, очевидно, отражается на значительном снижении площади пика желатинизации, которая представляет собой пониженное количество амилопектина в дц-SBEIIa-трансгенных линиях. Во всех трансгенных линиях какого-либо значимого изменения пика диссоциации амилоза-липид не наблюдалось. Поэтому полученный авторами крахмал имел ряд указанных новых свойств.
БИБЛИОГРАФИЯ
Abel et al., (1996). The Plant Journal 10, 981-991.
Anderson et al., (1989). Nucl Acids Res 17,461-462.
Baba et al., (1991). Biochem Biophys Res Commun 181: 87-94.
Batey and Curtin. (1996). Starch 48, 338-344.
Batey et al., (1997). Cereal Chemistry 74,497-501.
Becker et al., (1994). Plant J.5: 299-307.
Blauth et al., (2001). Plant Physiology 125,1396-1405.
Bourque. (1995). Plant Science 105,125-149.
Boyer and Preiss, (1978). Carbohydrate Research 61, 321-334.
Boyer and Preiss, (1981). Plant Physiology 67, 1141-1145.
Boyer et al., (1980). Starch 32, 217-222.
Buleon et al., (1998). International Journal of Biological Macromolecules 23, 85-112.
Cao et al., (2000). Archives, of Biochemistry and Biophysics. 373, 135-146.
Case et al., (1998). Journal of Cereal Science 27, 301-314.
Cheng et al., (1997). Plant Physiol 115:971-980.
Craig et al., (1998). Plant Cell 10, 413-426.
Denyer et al., (1995). Planta 196: 256-265.
Denyer et al., (1996). Plant Physiology 112, 779-785.
Feldman.(***) pp 3-56 in The World Wheat Book, A history of wheat breeding. Eds Bonjean and Angus, Lavoisier Publishing, Paris.
Fergason. 1994. pp 55-77 in "Speciality Corns" eds, CRC Press Inc.
Filpse et al.,(1996). Planta 198, 340.
Fisher et al., (1993). Plant Physiol 102:1045-1046.
Fisher et al., (1996). Plant Physiol 110: 611-619.
Fuwa et al., (1999). Starch/Starke. 51, 147-151.
Gao et al., (1997). Plant Physiol 114:69-78.
Gao et al., (1998). Plant Cell 10, 399-412.
Giroux and Hannah. (1994). Molecular and General Genetics 243, 400-408.
Green et al., (1997). Plant Physiology 114, 203-212.
He et al., (1994). PlantCell Reports 14: 192-196.
Hedman and Boyer, (1982). Biochemical Genetics 20, 483-492.
Hess et al., (1990). Plant Science 72: 233-244.
James et al.,(1995). Plant Cell 7, 417-429.
Jobling et al., (1999). Plant Journal 18, 163-171.
Komari et al., (1996). Plant Journal 10:165-174.
Konik-Rose et al., (2001) Starch 53,14-20.
Krueger et al., (1987). Cereal Chemistry 64, 187-190.
Kubo et al., (1999). Plant physiology. 121, 399-409.
Li et al., (1999a). Plant physiology. 120, 1147-1155.
Li et al., (1999b). Theoretical and Applied Genetics 98, 1208-1216.
Li et al., (2000). Plant Physiology 122, 613-624.
Li et al., (2003). Funct Integr Genomics 3:76-85.
Maniatis et al., (1982). Molecular cloning: a laboratory manual. Cold Spring Harbour Laboratory Press New York.
McCreery and Helentjaris (1994). Methods in Molecular Biology, Vol.28: Protocols for nucleic acid analysis by non-radioactive probes, 67-71, Humana Press Inc., Totawa, NJ.
Mizuno et al., (1993). Journal of Biological Chemistry 268, 19084-19091.
Mizuno et al., (1992). Journal of Biochemistry 112, 643-651.
Morell et al., (1997). Plant Physiology 113, 201-208.
Morell et al., (1998). Electrophoresis l9, 2603-2611.
Morell et al., (2003). Plant J.34: 173-185.
Morrison and Laignelet (1983). Journal of Cereal Science 1:9-20.
Mullins et al., (1999). European Journal of Plant Pathology 105: 465-475.
Myers et al., (2000). Plant Physiology 122, 989-997.
Nakamura (2002). Plant Cell Physiology 43,718-725.
Nakamura and Yamanouchi (1992). Plant Physiol 99:1265-1266.
Nair et al., (1997). Plant Sci 122: 153-163.
Nehra et al., (1994). Plant J.5: 285-297.
Ng et al., (1997) Cereal Chemistry 74: 288-292.
Nishi et al., (2001). Plant Physiology 127,459-472.
Rahman et al., (1995). Australian Journal of Plant Physiology 22, 793-803.
Rahman et al., (1997). Genome 40: 465-474.
Rahman et al., (1999). Theor Appl Genet. 98:156-163.
Rahman et al., (2000). J Cereal Sci 31: 91-110.
Rahman et al., (2001). Plant Physiol 125:1314-1324.
Repellin et al., (1997). Plant Gene Reg 97-094.
Safford et al., (1998). Carbohydrate Polymers 35, 155-168.
Schulman and Kammiovirta, (1991). Starch 43, 387-389.
Schwall et al., (2000). Nature Biotechnology 18, 551-554.
Senior (1998). Biotechnology and Genetic Engineering Reviews 15,79-119.
Shannon and Garwood, (1984). In Starch: Chemistry and Technology, Whistler et al., eds, Academic Press, Orlando, FL, pp 25-86.
Shure et al., (1983). Cell 35, 225-233.
Sidebottom et al., (1998). Journal of Cereal Science 27, 279-287.
Stacey and Isaac (1994). Methods in Molecular Biology, Vol.28: Protocols for nucleic acid analysis by non-radioactive probes, pp 9-15, Humana Press Inc., Totawa, NJ.
Sun et al., (1997). The New Phytologist 137, 215-215.
Takeda et al., (1993a). Carbohydrate Research 240, 253-262.
Takeda et al., (1993b). Carbohydrate Research 246, 273-281.
Thomas and Atwell 1999 Starches Eagen Press, St Paul, Minnesota, USA pp:13-24.
Thorbjornsen et al., (1996). Plant Journal 10, 243-250.
Vasil et al., (1992). Bio/Technology 10: 667-674.
Vasil et al., (1993). Bio/Technology 11:1553-1558.
Wang et al., (1998). Journal of Experimental Botany 49, 481-502.
Weeks et al., (1993). Plant Physiol 102: 1077-1084.
Wegener et al., 1994. Mol. Gen Genet. 245, 465-470.
Weir et al., (2001). Aust J Plant Physiol 28: 807-818.
Yamamori and Endo, (1996). Theoretical and Applied Genetics 93, 275-281.
Yamamori et al., (2000). Theor. Appl. Genet. 101, 21-29.
Young. (1984). in Whistler et al. (eds), Academic Press, Orlando, FL, chap 8.
Zhao and Sharp, (1998). Plant Breeding 117: 488-490.
Zikiryaeva and Kasimov, (1972). Uzbekskii Biologicheskii Zhurnal 6,18-20.
Zwar and Chandler, (1995). Planta l97, 39-48.











Реферат
Генетическая модификация пшеницы в форме мутации в гене SBEIIa с понижением уровня его активности позволяет получать зерно с повышенным содержанием амилозы в его крахмале. Кроме того, эта пшеница может иметь пониженные уровни SBEIIb-активности. Зерно такой пшеницы может иметь неморщинистый фенотип, несмотря на нарушение пути синтеза амилопектина, и также может иметь относительно высокое содержание амилозы. 18 н. и 44 з.п. ф-лы, 21 ил., 12 табл.
Формула
i) введения генетической модификации в родительское растение пшеницы или семя, где указанная генетическая модификация содержит мутацию гена SBEIIa или встроенную нуклеиновую кислоту, кодирующую ингибитор экспрессии гена SBEIIa, и
ii) идентификации потомственного растения, или семян родительского растения пшеницы, или семени, которое имеет пониженный уровень экспрессии гена SBEIIa, активности фермента SBEIIa в эндосперме или того и другого по сравнению с зерном дикого типа,
где указанное зерно содержит крахмал и где содержание амилозы в крахмале зерна составляет, по крайней мере, 50%.
i) введения генетической модификации в родительское растение пшеницы или семя, где указанная генетическая модификация содержит мутацию гена SBEIIa,
ii) идентификации потомственного растения, или семени родительского растения пшеницы, или семени, которое имеет пониженный уровень экспрессии гена SBEIIa, активности фермента SBEIIa в эндосперме или того и другого по сравнению с зерном дикого типа,
iii) введения генетической модификации в родительское растение пшеницы или семя, где указанная генетическая модификация содержит мутацию гена SBEIIb,
iv) идентификации потомственного растения, или семени родительского растения пшеницы, или семени, которое имеет пониженный уровень экспрессии гена SBEIIb, активности фермента SBEIIb в эндосперме или того и другого по сравнению с зерном дикого типа;
v) скрещивания растения, имеющего пониженный уровень экспрессии гена SBEIIa, активности фермента SBEIIa в эндосперме или того и другого, с растением, имеющим пониженный уровень экспрессии гена SBEIIb, активности фермента SBEIIb в эндосперме или того и другого; и
идентификации растения пшеницы с пониженным уровнем экспрессии генов SBEIIa и SBEIIb, активности этих ферментов или того и другого.
Приоритет по пунктам:

Комментарии