Производные амидоксимов пропенкарбоновых кислот, способ их получения и содержащие их фармацевтические композиции - RU2264387C2
Код документа: RU2264387C2
Описание
Область техники изобретения
Изобретение относится к новым производным амидоксимов пропенкарбоновых кислот, способу их получения и содержащим их фармацевтическим композициям. Новые соединения обладают ценным фармацевтическим действием, так, они могут применяться при состояниях, связанных с энергетическим дефицитом клетки, при состояниях кислородной недостаточности сердца и мозга, при нейродегенеративных заболеваниях, при лечении аутоиммунных и/или вирусных заболеваний, более того, при заболеваниях, вызванных токсическими воздействиями.
Предпосылки к созданию изобретения
Получение некоторых производных Δ2-1,2,4-оксадиазолин-5-она описано в публикации Chem. Ber., 103, 2330-2335 (1970) без какой-либо ссылки на их возможные биологические свойства. Из упомянутых выше соединений получение производных 5,6-дигидро-4H-1,2,4-оксадиазина обсуждается в публикации Chem. Ber., 108, 1911-1923 (1975) и снова без какой-либо ссылки на биологические свойства.
Производные 1,2,4-оксадиазолин-5-она, обладающие периферическим сосудорасширяющим, антистенокардическим и антиаритмическим действиями, раскрыты в HU-P №179951. Производные 1,2,4-оксадиазина, обладающие периферическим сосудорасширяющим и снижающим кровяное давление, антиаритмическим, слабым противовоспалительным и диуретическим действиями, раскрыты в HU-P №180708. Однако известные производные 1,2,4-оксадиазолин-5-она и 1,2,4-оксадиазина не содержат никаких алкенильных заместителей, т.е. они не могут быть производными амидоксима пропенкарбоновой кислоты.
Целью изобретения является получение новых соединений, обладающих ценными фармацевтическими свойствами.
Краткое содержание изобретения
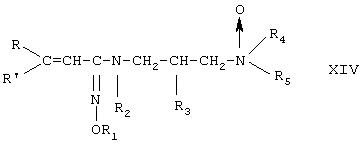
Было найдено, что упомянутая выше цель является достижимой, и, следовательно, изобретение относится к новым производным амидоксимов пропенкарбоновых кислот формулы

где
R означает (С1-С20)алкильную группу, фенильную группу, последняя необязательно замещена 1-3-заместителями, где заместителем является атом галоида и/или (С1-С2)алкильная группа, и/или (С1-С2)алкоксигруппа, и/или аминогруппа, и/или (С1-C4)алкиламиногруппа, и/или ди(С1-С4)алкиламиногруппа, и/или (С1-С4 )алканоиламиногруппа, кроме того, 5- или 6-членную насыщенную или ненасыщенную гетероциклическую группу, содержащую один или два атома азота или атом серы в качестве гетероатома, и упомянутая гетероциклическая группа необязательно является конденсированной с одним или несколькими бензольными кольцами и/или с одной или несколькими гетероциклическими группами, и
R' означает атом водорода, или
R вместе с R' образует (С5-С7)циклоалкильную группу, необязательно конденсированную с бензольным кольцом,
R4 и R5 независимо друг от друга означают атом водорода, (С1-С5)алкильную группу, (С1-С5)алканоильную группу или фенильную группу, последняя необязательно замещена 1-3-заместителями, где заместителем является атом галоида и/или (С1-С2)алкильная группа, и/или (С1-С2)алкоксигруппа, или
R4 и R5 образуют вместе со смежным атомом азота 5- или 6-членную
насыщенную или ненасыщенную гетероциклическую группу, которая может содержать дополнительный атом азота и/или атом кислорода, и/или атом серы в качестве гетероатома и может быть конденсированной с бензольным кольцом, и гетероциклическая группа и/или бензольное кольцо могут содержать один или два заместителя, где заместителем является атом галоида и/или (С1-С2)алкильная группа, и/или (С1-С2)алкоксигруппа,
R1 и R2 означают атом водорода, и
R3 означает атом водорода, гидроксигруппу или (С1-С5)алкоксигруппу, или R1 образует вместе с R2 карбонильную группу или тиокарбонильную группу, углеродный атом которой связан со смежным с R1 атомом кислорода и смежным с R2 атомом азота, и
R3 означает атом водорода, атом галоида, гидроксильную группу, (С1-С5)алкоксигруппу, (С1-С5)алкилтиогруппу, (C1-С20)алканоилоксигруппу, (С3-С22)алкеноилоксигруппу, содержащую одну или несколько двойных связей, метилсульфонилоксигруппу, бензолсульфонилоксигруппу или толуолсульфонилоксигруппу, или
R2 означает атом водорода, и
R1 вместе с R3 образует валентную связь между смежным с R1 атомом кислорода и смежным с R3 атомом углерода, кроме того, к N-оксидам или геометрическим изомерам и/или оптическим изомерам, и/или их фармацевтически приемлемым кислотно-аддитивным солям, и/или их четвертичным производным.
Описание предпочтительных вариантов воплощения изобретения
В описании и пунктах формулы изобретения под (С1-С20)алкильной группой подразумевается, например, метильная, этильная, н-пропильная, изопропильная, н-бутильная, втор.-бутильная, трет.-бутипъная, изобутильная, н-пентильная, н-гексильная, н-гептильная, н-децильная, додецильная, гексадецильная, октадецильная группа и т.д.
Атомом галоида является прежде всего атом фтора, хлора или брома, предпочтительно атом хлора или брома.
(С1-С2)алкильная группа означает метильную или этильную группу, тогда как (С1-С2)алкоксигруппа означает метоксильную или этоксильную группу.
(С1-С4)алкильная группа означает метильную, этильную, н-пропильную, изопропильную, н-бутильную, втор.-бутильную, трет.-бутилъную или изобутильную группу. В дополнение к перечисленным выше группам (C1-С5)алкильная группа может быть также, например, н-пентильной группой.
(С1-С4)алкиламиногруппа означает, например, метиламиногруппу, этиламиногруппу, изопропиламиногруппу и т.д. Ди(С1-С4)алкиламиногруппа означает, например, диметиламиногруппу, диэтиламиногруппу, метилизопропиламиногруппу и т.д.
(С1-С4)алканоильная группа означает предпочтительно формильную группу, ацетильную группу, н-пропионильную группу или н-бутирильную группу. В дополнение к перечисленным выше группам (С1-С5)алканоильная группа может быть также, например, н-пентаноильной группой.
Пяти- или шестичленные насыщенные или ненасыщенные гетероциклические группы, содержащие один или два атома азота или атом серы в качестве гетероатома, означают, например, пирролильную группу, пиразолильную группу, имидазолильную группу, тиенильную группу, пиридильную группу, пиперидильную группу, пиримидильную группу, пиперазинильную группу и т.д.
(С5-С7)циклоалкильная группа, необязательно конденсированная с бензольным кольцом, означает, например, циклопентильную группу, циклогексильную группу, циклогептильную группу, инданильную группу или тетралинильную группу.
Пяти- или шестичленная насыщенная или ненасыщенная гетероциклическая группа, которая в дополнение к атому азота, смежному с заместителями R4 и R5, может содержать дополнительный атом азота, и/или атом кислорода, и/или атом серы в качестве гетероатома, помимо перечисленных выше групп, может быть, например, морфолиногруппой.
(С1-С20)алканоилоксигруппа означает, например, формилоксигруппу, ацетоксигруппу, пропионилоксигруппу, бутирилоксигруппу, капроилоксигруппу, пальмитоилоксигруппу, стеароилоксигруппу и т.д.
Как правило, (С3-С32 )алкеноилоксигруппа может содержать 1-6 двойных связей и предпочтительно означает линоленоилоксигруппу, линолеилоксигруппу, докозагексаеноилоксигруппу, эйкозапентаеноилоксигруппу или арахидоноилоксигруппу.
Фармацевтически приемлемые кислотно-аддитивные соли производных амидоксимов пропенкарбоновых кислот формулы I и их N-оксиды означают кислотно-аддитивные соли, образованные с неорганическими кислотами, такими как хлористоводородная кислота, серная кислота, фосфорная кислота и т.д., или с органическими кислотами, такими как уксусная кислота, фумаровая кислота, молочная кислота, винная кислота, янтарная кислота, яблочная кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота и т.д.
В четвертичных производных соединений формулы I и их N-оксидах один атом азота или более амидоксима пропенкарбоновой кислоты кватернизуется, т.е., например, дополнительная (С1-С4)алкильная группа или фенил(С1-С4)алкильная группа связывается с данным атомом азота, следовательно, упомянутый атом азота становится заряженным положительно. Из атомов азота, присутствующих в соединении формулы I, соответственно кватернизуется один атом азота, смежный с заместителями R4 и R5. Если в формуле I заместитель R означает гетероциклическую группу, содержащую атом азота, такую как пиридильная группа, то атом азота упомянутой гетероциклической группы также может кватернизоваться.
В N-оксидах соединений формулы I один атом азота или несколько присутствует/присутствуют в окисленной форме, следовательно, атом кислорода также связан с данным атомом азота. Из атомов азота, присутствующих в соединении формулы I, соответственно атом азота, смежный с заместителями R4и R5, может присутствовать в виде N-оксида. Если в формуле I заместитель R означает гетероциклическую группу, содержащую атом азота, такую как пиридильная группа, то атом азота упомянутой гетероциклической группы также может присутствовать в виде N-оксида.
Благодаря наличию двойной связи в формуле I новые производные пропенкарбоновых кислот формулы I, а также их N-оксиды могут существовать в форме геометрических изомеров, т.е. цис- или транс-изомеров или их смесей. Изобретение включает чистые геометрические изомеры и любые их смеси.
В дополнение к геометрической изомерии некоторые соединения формулы I, а также их N-оксиды содержат один или несколько хиральных атомов углерода, следовательно, данные соединения могут существовать также в форме оптических изомеров. Изобретение включает также чистые оптические изомеры и любые их смеси.
Предпочтительную подгруппу соединений по изобретению составляют производные амидоксимов пропенкарбоновых кислот формулы

где
R1 и R2 означают атом водорода,
R3 означает атом водорода, гидроксигруппу или (С1-С5)алкоксигруппу,
R, R', R4 и R5 имеют приведенные выше значения, кроме того, их N-оксиды или геометрические изомеры, и/или оптические изомеры, и/или фармацевтически приемлемые кислотно-аддитивные соли, и/или четвертичные производные.
Другую предпочтительную подгруппу соединений по изобретению составляют производные оксадиазолина формулы

где
R1 и R2 вместе образуют карбонильную группу или тиокарбонильную группу, атом углерода которой связан с атомом кислорода, смежным с R1, и с атомом азота, смежным с R2,
R3 означает атом водорода, атом галоида, гидроксигруппу, (C1-С5)алкоксигруппу, (С1-С5)алкилтиогруппу, (С1-С20)алканоилоксигруппу, (С3-С22 )алкеноилоксигруппу, содержащую одну или несколько двойных связей, метансульфонилоксигруппу, бензолсульфонилоксигруппу или толуолсульфонилоксигруппу,
Х означает атом кислорода или атом серы,
R, R', R4 и R5 имеют значения в соответствии с формулой I,
кроме того, их N-оксиды или геометрические изомеры, и/или оптические изомеры, и/или фармацевтически приемлемые кислотно-аддитивные соли, и/или четвертичные производные.
Дополнительную предпочтительную подгруппу соединений по изобретению составляют производные оксадиазина формулы

где
R2 означает атом водорода, и
R1 и R3 вместе образуют валентную связь между атомом кислорода, смежным с R1, и атомом углерода, смежным с R3,
R, R', R4 и R5 имеют значения в соответствии с формулой I, кроме того, их N-оксиды или геометрические изомеры, и/или оптические изомеры, и/или фармацевтически приемлемые кислотно-аддитивные соли, и/или четвертичные производные.
Производные амидоксимов пропенкарбоновых кислот формулы I получают следующим образом:
(а) для получения производного амидоксима пропенкарбоновой кислоты формулы Ia, где R1, R2 и R3 означают атом водорода, R, R', R4 и R5 имеют значения в соответствии с формулой I, производное пропена формулы

где
R, R', R3, R4 и R5 имеют значения, приведенные выше,
Y означает атом галоида или группу формулы -SR6, в которой
R6 означает атом водорода или (С1-С4)алкильную группу, реагирует с гидроксиламином; или
(б) для получения производного амидоксима пропенкарбоновой кислоты формулы Ia, где R1 и R2 означают атом водорода, R3 означает атом водорода или гидроксигруппу, R, R', R4 и R5 имеют значения в соответствии с формулой I, производное оксадиазолина формулы Ib, где R, R', R3, R4 и R5 имеют значения, приведенные выше, Х означает атом кислорода или атом серы, реагирует с водным раствором гидроксида щелочного металла; или
(в) для получения производного оксадиазолина формулы Ib, где R3 означает атом водорода, Х означает атом кислорода, R, R', R4 и R5 имеют значения в соответствии с формулой I, производное Δ2-1,2,4-оксадиазолина формулы

где
R и R' имеют заявленные выше значения, реагирует с аминоалкилгалоидом формулы

где
Z означает атом галоида,
R3, R4 и R5 имеют приведенные выше значения; или
(г) для получения производного оксадиазолина формулы Ib, где R3 означает атом водорода или гидроксигруппу, Х означает атом кислорода, R, R', R4 и R5имеют значения в соответствии с формулой I, производное Δ2-1,2,4-оксадиазолина формулы III, где R и R' имеют заявленные выше значения, реагирует с 1,3-дигалоидпропаном формулы

где
Z и Z1 означают независимо друг от друга атом галоида,
R3 имеет приведенное выше значение,
и полученный Δ2-1,2,4-оксадиазолинилалкилгалоид формулы

где
R, R', R3 и Z имеют приведенные выше значения, реагирует с амином формулы

где R4 и R5 имеют приведенные выше значения; или
(д) для получения производного оксадиазолина формулы Ib, где R3 означает гидроксигруппу, Х означает атом кислорода, R, R', R4 и R5 имеют значения в соответствии с формулой I, производное Δ2-1,2,4-оксадиазолина формулы III, где
R и R' имеют приведенные выше значения, реагирует с эпихлоргидрином, и образовавшийся Δ2-1,2, 4-оксадиазолинилалкилхлорид формулы

где
R и R' имеют приведенные выше значения, реагирует с амином формулы VII, где
R4 и R5 имеют приведенные выше значения; или
(е) для получения производного оксадиазолина формулы Ib, где R3 означает гидроксигруппу, Х означает атом кислорода, R, R', R4 и R5 имеют значения в соответствии с формулой I, Δ2-1,2, 4-оксадиазолинилалкилхлорид формулы VIII,
где R и R' имеют значения, описанные выше, реагирует с агентом, связывающим кислоту, и образующийся эпоксид формулы

где R и R' имеют заявленные выше значения, реагирует с амином формулы VII, где R4 и R5 имеют заявленные выше значения; или
(ж) для получения производного оксадиазолина формулы Ib, где R3означает атом водорода или гидроксигруппу, Х означает атом кислорода или атом серы, R, R', R4 и R5 имеют значения в соответствии с формулой I, производное амидоксима пропенкарбоновой кислоты формулы Ia, где R, R', R3, R4 и R5 имеют значения, определенные выше, реагирует с производным карбоновой кислоты формулы

где
Х имеет определенное выше значение,
Z2 и Z3 означают независимо друг от друга атом галоида, (С1-С4)алкоксигруппу или (С1-С4)алкилмеркаптогруппу; или
(з) для получения производного оксадиазина формулы Ic, где R, R', R4 и R5имеют значения в соответствии с формулой I, производное оксадиазолина формулы Ib, где R, R', R4 и R5 имеют заявленные выше значения, Х означает атом кислорода или атом серы, R3 означает атом галоида, метансульфонилоксигруппу, бензолсульфонилоксигруппу или толуолсульфонилоксигруппу, реагирует с гидроксидом щелочного металла в присутствии воды; или
(и) для получения производного оксадиазина формулы Ic, где R, R', R4 и R5имеют значения в соответствии с формулой I, циклическое соединение формулы

где
R и R' имеют значения, определенные выше,
R7 означает атом галоида, метансульфонилоксигруппу, бензолсульфонилоксигруппу или толуолсульфонилоксигруппу, реагирует с амином формулы VII, где R4 и R5 имеют значения, заявленные выше; или
(к) для получения четвертичного производного формулы

где
R, R', R1, R2, R3, R4 и R5 имеют значения в соответствии с формулой I,
R8 означает (С1 -С4)алкильную группу или фенил(С1-С4)алкильную группу,
Y означает атом галоида или группу формулы R8-SO4, в которой R8 имеет заявленные выше значения,
производное Δ2-1,2,4-оксадиазолина формулы III, где R и R' имеют заявленные выше значения, реагирует с четвертичным алкилгалоидом формулы

где
R3, R4, R5, R8 и Y имеют заявленные выше значения,
Z означает атом галоида; или
(л) для получения N-оксида формулы
где
R, R', R1, R2, R3, R4 и R5 имеют значения в соответствии с формулой I, производное Δ2-1,2,4-оксадиазолина формулы III, где R и R' имеют заявленные выше значения, реагирует с соединением формулы

где
R3, R4 и R5 имеют заявленные выше значения,
Z означает атом галоида; и
при необходимости полученное соединение формулы Ib, где R3 означает гидроксигруппу, R, R', R4 и R5 имеют значения в соответствии с формулой I, X означает атом кислорода или атом серы, реагирует с галоидирующим агентом для получения соединения формулы Ib, где R3 означает атом галоида; или при необходимости полученное соединение формулы Ib. где R3 означает гидроксигруппу, R, R', R4 и R5 имеют значения в соответствии с формулой I, X означает атом кислорода или атом серы, реагирует с галоидангидридом (С1-С20)алканкарбоновой кислоты или с галоидангидридом (С3-С22)алкенкарбоновой кислоты, содержащим одну или несколько двойных связей, для получения соединения формулы Ib, где R3 означает (С1-С20)алканоилоксигруппу или (С3-С22)алкеноилоксигруппу; или при необходимости соединение формулы Ib, где R3 означает гидроксигруппу, R, R', R4 и R5 имеют значения в соответствии с формулой I, X означает атом кислорода или атом серы, реагирует с (С1-С5)алкилгалоидом для получения соединения формулы Ib, где R3 означает (С1-С5)алкоксигруппу; или при необходимости полученное соединение формулы Ib, где R3 означает атом галоида, R, R', R4 и R5 имеют значения в соответствии с формулой I, X означает
атом кислорода или атом серы, реагирует с алкоголятом щелочного металла (С1-С5)алканола
или (С1-С5)тиоалканола для получения соединения формулы Ib, где R3 означает (С1-С5)алкоксигруппу или (С1-С5)алкилтиогруппу; или
при необходимости полученное соединение формулы Ib, где R3 означает гидроксигруппу, R, R', R4 и R5 имеют значения в соответствии с формулой I, X означает атом кислорода или атом серы, реагирует с метансульфонилгалоидом, бензолсульфонилгалоидом или толуолсульфонилгалоидом для получения соединения формулы Ib, где R3 означает метансульфонильную группу, бензолсульфонильную группу или толуолсульфонильную группу; и при необходимости полученное соединение формулы I реагирует с неорганической или органической кислотой для получения фармацевтически приемлемой кислотно-аддитивной соли, или основание высвобождается из своей кислотно-аддитивной соли, и/или один или несколько атомов азота соединения формулы I образуют четвертичные соли с алкилирующим агентом, и/или
соединение формулы I реагирует с окисляющим агентом для превращения одного или
нескольких своих атомов азота в N-оксид.
В способе (а) по изобретению реакцию производного пропена формулы II с гидроксиламином проводят в растворителе или в смеси растворителей, используя гидроксиламин-основание, которое может быть также выделено в свободной форме in situ из его кислотно-аддитивной соли при добавлении сильного основания. Образовавшийся продукт формулы Ia выделяют известным по существу способом, например кристаллизацией из реакционной смеси или упариванием реакционной смеси, или осаждением его кислотно-аддитивной соли.
Если используют производное пропена формулы II, где Y означает атом галоида, то растворителем является безводный инертный органический
растворитель, например галоидированный углеводород, такой как хлороформ, дихлорметан и
т.д., углеводород, такой как бензол, толуол и т.д., или любой другой растворитель,
обычно используемый в реакциях ацилирования, такой, как пиридин.
Если используют производное пропена формулы II, где Y означает группу формулы -SR6, то в добавление к типам растворителей, перечисленных выше, в качестве органического растворителя могут быть также использованы, например, алканолы.
Производное пропена формулы II, где Y означает атом галоида, как
правило,
атом хлора, - в реальной действительности упомянутым соединением является имидоилгалоид, как правило, имидоилхлорид, - получают из соответствующего
амида кислоты формулы

где
R, R', R4 и R5 имеют значения в соответствии с формулой I,
R3 означает атом водорода или (С1-С5)алкоксигруппу,
реакцией с галоидирующим агентом, соответственно с тионилхлоридом,
трихлоридом фосфора, пентахлоридом фосфора и т.д. по способу, известному из литературы.
Производное пропена формулы II, где Y означает меркаптогруппу, может быть получено, например, из соответствующего амида кислоты формулы XVI и пентасульфида фосфора в органическом растворителе, таком как толуол, ксилол или пиридин, по способу, известному из литературы. Производное пропена формулы II, где Y означает алкилтиогруппу, получают взаимодействием производного пропена формулы II, где Y означает меркаптогруппу, с алкилирующим агентом.
В способе (б) по изобретению оксадиазолиновое кольцо раскрывают, используя методику, известную из Chem. Ber., 103. 2330-2335 (1970), которая заключается в щелочном гидролизе в водной среде. В качестве гидроксида щелочного металла соответственно используют гидроксид калия или гидроксид натрия, к водному раствору которого при необходимости добавляют также органический растворитель, предпочтительно алифатический спирт, такой как метанол или этанол. В способе по изобретению оксадиазолиновое кольцо раскрывают при температуре кипения реакционной смеси в краткий срок и соединение формулы Ia получают с хорошим выходом. Продукт реакции может быть выделен известным по существу способом, как описано в связи со способом (а).
В способе (в) по изобретению реакцию проводят в органическом растворителе, который является инертным с точки зрения участия в реакции, в присутствии агента, связывающего кислоту, как правило, при температуре кипения реакционной смеси. Инертным органическим растворителем является, например, алканол, такой как метанол или этанол, углеводород, такой как бензол, толуол или ксилол, или их смесь. В качестве акцептора кислоты могут быть использованы неорганические или органические основания. Реакционная смесь может быть обработана обычными способами, например, растворитель упаривают, и продукт кристаллизуется или осаждается в виде его кислотно-аддитивной соли.
Производные Δ2-1,2,4-оксадиазолина формулы III могут быть получены из соответствующих амидоксимов взаимодействием с производными карбоновых кислот. Некоторые представители амидоксимов известны из публикации Chem. Rew., 62, 155 (1962). Новые амидоксимы могут быть получены из соответствующего нитрила пропенкарбоновой кислоты взаимодействием с гидроксиламином по способу, описанному в данной статье. Большинство аминоалкилгалоидов формулы IV являются известными соединениями, которые или коммерчески доступны, или могут быть получены простым способом, взаимодействием 1,3-дигалоидпропана с амином формулы VII.
В способе (г) по изобретению как алкилирование, т.е. реакцию производного Δ2-1,2,4-оксадиазолина формулы III с 1,3-дигалоидпропаном формулы V, так и аминирование, т.е. реакцию образовавшегося Δ2-1, 2,4-оксадиазолинилалкилгалоида формулы VI с амином формулы VII, проводят в органическом растворителе, который является инертным с точки зрения участия в реакции, в присутствии связывающего кислоту агента, соответственно неорганического основания, такого как гидроксид натрия или карбонат натрия, как правило, при температуре кипения реакционной смеси. Образующийся при алкилировании Δ2-1,2,4-оксадиазолинилалкилгалоид формулы VI или кристаллизуется, или после упаривания реакционной смеси используется без кристаллизации в реакции аминирования. Полученный продукт реакции формулы Ib выделяют способом, по существу известным, используя любую из методик, описанных выше. Инертный органический растворитель может быть углеводородом или галоидированным алифатическим или ароматическим углеводородом, таким как хлороформ, алканолом, таким как метанол или этанол, кетоном, таким как ацетон, или смесью перечисленных типов растворителей.
В способе (д) по изобретению реакцию производного Δ2-1,2,4-оксадиазолина формулы III с эпихлоргидрином проводят в органическом растворителе, который является инертным с точки зрения участия в реакции, или в отсутствие какого-либо растворителя, предпочтительно в избытке эпихлоргидрина, соответственно при температуре кипения реакционной смеси. Инертный органический растворитель может быть, например, углеводородом, простым эфиром, таким как диоксан, тетрагидрофуран и т.д. В качестве катализатора используют основания, такие как гидроксид натрия, карбонат натрия и т.д. По окончании реакции растворитель упаривают и остаток кристаллизуют. Образовавшийся Δ2-1,2,4-оксадиазолинилалкилхлорид формулы VIII реагирует с амином формулы VII способом, подобным тому, который описан для реакции аминирования в методике (г). Полученный продукт реакции формулы Ib выделяют способом, по существу известным, используя любую из методик, описанных выше.
В способе (е) по изобретению при получении эпоксида формулы IX акцептором кислоты является, например, карбонат щелочного металла, такой как карбонат натрия, карбонат калия и т.д., или гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия и т.д. Реакцию проводят в органическом растворителе, который является инертным с точки зрения участия в реакции, соответственно при температуре кипения реакционной смеси. В качестве инертного органического растворителя используют, например, углеводород, ацетон, простой эфир, такой как тетрагидрофуран или диоксан, галоидированный алифатический или ароматический углеводород и т.д. Реакционную смесь фильтруют, фильтрат упаривают и образующийся эпоксид формулы IX кристаллизуют, затем вводят в реакцию с амином формулы VII способом, описанным в методике (г) для аминирования, предпочтительно в алканоле. В качестве альтернативной методики эпоксид формулы IX не выделяют, а прибавляют амин формулы VII непосредственно к реакционной смеси, в которой образовался эпоксид, и затем реакционную смесь нагревают. Полученный продукт реакции формулы Ib выделяют по существу известным способом, используя какую-либо из методик, описанных выше.
В способе (ж) по изобретению в реакции замыкания цикла может быть использовано любое производное карбоновой кислоты или тиокарбоновой кислоты формулы X, реагент, который способен к образованию карбонильной или тиокарбонильной группы, соответственно между атомом кислорода гидроксигруппы и атомом азота аминогруппы в случае, когда часть в формуле Ia имеет структуру -C(=N-OH)-NH-. Соответствующие соединения включают галоидангидриды карбоновой кислоты и тиокарбоновой кислоты, такие как фосген и тиофосген, галоидпроизводные сложных эфиров, такие как этиловый эфир хлормуравьиной кислоты или алкиловые эфиры хлортиомуравьиной кислоты, или простые эфиры, такие как диалкилкарбонаты, моно-, ди- и тритиокарбонаты, ксантогенаты и т.д. В реакции замыкания цикла используют органический растворитель, который является инертным с точки зрения участия в реакции, однако реакция может проводиться также и в отсутствие какого-либо растворителя. Реакционную смесь охлаждают или нагревают, соответственно замыкание цикла осуществляется при температуре кипения реакционной смеси. Образовавшийся продукт реакции формулы Ib отделяют по существу известным способом, используя какую-либо из методик, описанных выше.
Если в реакции используют карбоновую кислоту формулы X, где один или оба заместителя из Z2 и Z3 означают атом галоида, то в качестве инертного растворителя используют соответственно углеводород, галоидированный алифатический или ароматический углеводород или простой эфир. Если как Z2, так и Z3 означают алкоксигруппу или алкилмеркаптогруппу, то в дополнение к перечисленным инертным органическим растворителем может быть также алканол.
В способе (з) по изобретению в реальной действительности оксадиазолиновое кольцо трансформируют в оксадиазиновое кольцо. С этой целью используют способ, известный из Chem. Ber, 108, 1911-1923 (1975). Соответственно гидроксид натрия или гидроксид калия применяют в качестве гидроксида щелочного металла. Реакцию проводят в смеси органического растворителя, такого как алканол, и водного раствора гидроксида щелочного металла при температуре кипения реакционной смеси. Образовавшийся продукт реакции формулы Ic отделяют известным по существу способом, используя какую-либо из методик, описанных выше.
В способе (и) по изобретению реакцию осуществляют в органическом растворителе, который является инертным с точки зрения участия в реакции, или в смеси нескольких таких растворителей в присутствии или в отсутствие акцептора кислоты. Инертным органическим растворителем является, например, углеводород, галоидированный алифатический или ароматический углеводород, простой эфир или алканол, предпочтительно бутанол. Реакция может быть также осуществлена в отсутствие какого-либо растворителя, в данном случае можно использовать избыток амина формулы VII в качестве растворителя. Полученный продукт реакции формулы Ic отделяют известным по существу способом, используя какую-либо из методик, описанных выше.
В способах (к) и (л) по изобретению методика подобна той, которая описана в способе (в). Четвертичный алкилгалоид формулы XIII получают путем образования четвертичной соли соответствующего аминоалкилгалоида формулы IV. Соединение формулы XV может быть получено из соответствующего аминоалкилгалоида формулы IV и окисляющего агента.
Производное оксадиазолина формулы Ib, где R3 означает гидроксигруппу, может быть превращено в соответствующее соединение формулы Ib, где R3означает атом галоида, взаимодействием с галоидирующим агентом. В качестве галоидирующего агента предпочтительно используют тионилхлорид, трихлорид фосфора или пентахлорид фосфора и осуществляют галоидирование в органических растворителях, обычно применяемых в подобных реакциях, или в отсутствие какого-либо растворителя, например, в избытке галоидирующего агента. Реакционную смесь обрабатывают способами, обычно применяемыми после реакций галоидирования.
Производное оксадиазолина формулы Ib, где R3 означает гидроксигруппу, может реагировать с активным ацилирующим производным (C1-С20)алканкарбоновой кислоты или (С3-С22)алкенкарбоновой кислоты, таким как хлорангидрид, ангидрид, азид и т.д., или с метансульфонилгалоидом, бензолсульфонилгалоидом или толуолсульфонилгалоидом в инертном органическом растворителе, предпочтительно в ароматическом углеводороде или галоидированном ароматическом или алифатическом углеводороде в присутствии или в отсутствие акцептора кислоты. Соответствующий продукт реакции формулы Ib, который образуется, может быть отделен обычными способами, описанными выше.
Соединение формулы Ib, где R3 означает гидроксигруппу, может реагировать с (С1-С5)алкилгалоидом подобным способом. В этом случае один или несколько атомов азота соединения могут одновременно образовать четвертичные соли.
Реакция соединения формулы Ib, где R3 означает атом галоида, предпочтительно атом хлора, может быть проведена в реакционных условиях, описанных выше.
При необходимости соединение формулы I превращают в фармацевтически приемлемую кислотно-аддитивную соль или выделяют в свободной форме из его кислотно-аддитивной соли. Если для образования соли используют оптически активную органическую кислоту, например камфорную кислоту, камфорсульфоновую кислоту, винную кислоту или производное винной кислоты, то становится возможным разделение стереоизомеров соединений, имеющих хиральный центр. В данном случае разделение осуществляют известным по существу способом путем фракционной кристаллизации кислотно-аддитивных солей, образованных с оптически активной органической кислотой.
При необходимости один или несколько атомов азота производного амидоксима пропенкарбоновой кислоты формулы I кватернизуются. С этой целью соединение формулы I реагирует с алкилирующим агентом формулы R8-Y, где R8 означает (С1-С4)алкильную группу или фенил(С1-С4)алкильную группу, Y означает атом галоида, для получения четвертичного производного формулы XII, где R8 и Y имеют заявленные выше значения. Реакция образования четвертичной соли может также осуществляться с диалкилсульфатом формулы (R8)2SO4, где R8 имеет заявленное выше значение. В последнем случае получают четвертичное производное формулы XII, где Y означает группу формулы R8-SO4. Реакция образования четвертичной соли проводят в инертном органическом растворителе или в отсутствие какого-либо растворителя.
Альтернативно другой атом азота или дополнительный атом азота соединения формулы I может также кватернизоваться. Если в формуле I заместитель R означает гетероциклическую группу, содержащую атом азота, например пиридильную группу, то атом азота пиридильной группы может кватернизоваться или другой атом азота также может кватернизоваться.
Когда соединение формулы I превращают в N-оксид, соответственно окисляется атом азота, с которым связаны заместители R4 и R5. В данном случае окисление проводят, как правило, с перекисью водорода, предпочтительно в растворе, содержащем алканол, такой как метанол, соответственно при комнатной температуре. Если в формуле I заместитель R означает гетероциклическую группу, содержащую атом азота, например пиридильную группу, то атом азота пиридильной группы при действии окисляющего агента может одновременно или вместо вышеупомянутого атома азота превратиться в N-оксид. В данном случае окисляющим агентом является предпочтительно надкислота, например 3-хлорнадбензойная кислота, и реакцию окисления проводят в инертном органическом растворителе, как правило, в ароматическом углеводороде, таком как бензол или толуол, соответственно при комнатной температуре.
Разумеется, N-оксид соединения формулы I может быть также превращен в фармацетически приемлемую кислотно-аддитивную соль или его четвертичное производное известным по существу способом.
Фармакологическое действие соединений по изобретению определяется в следующих тестах.
Исследование ингибирования поли(аденозиндифосфатрибоза)полимеразы (PARP)
Известно, что реакционноспособные разновидности кислорода (ROS), например гидроксил-радикал. супероксид, пероксинитрит, перекись водорода, непрерывно образуются в живых организмах [Richter С., FEBS Lett., 241, 1-5 (1988)], и в небольшом количестве они участвуют в контроле важных физиологических процессов [Beck K.F. и др., J. Exp. Biol. 202, 645-53 (1999); McDonald L.J. и Murad F., Proc. Soc. Exp. Biol. Med., 211, 1-6 (1966)] (таких, как расширение сосудов, агрегация тромбоцитов, адгезия лейкоцитов). Концентрация реакционноспособных разновидностей кислорода и оксида азота значительно выше при острых и хронических воспалениях, например при большинстве аутоиммунных заболеваний [Taraza С. и др., Rom. J. Intern. Med., 35, 89-98 (1997)], в случае постишемической сердечной недостаточности, ишемии мозга (инсульта) [Brain Pathology, 9, 119-131 (1999)]. Источники ROS включают клетки нормальных тканей благодаря тому, что лейкоциты и макрофаги частично присутствуют в воспаленной ткани, частично из-за индуктивного эффекта воспалительных цитокинов.
Реакционноспособные разновидности кислорода, помимо прочего, повреждают и ДНК. Сложный защитный и восстановительный процесс инициируется в клетке с помощью поврежденной ДНК. Важным элементом данного процесса является активация фермента поли(аденозиндифосфатрибоза)полимеразы (PARP). PARP является ферментом ядерной структуры, который присутствует в большом количестве почти в каждой клетке и катализирует транспорт аденозиндифосфатрибозного звена от никотиадениндинуклеотида (NAD) к белкам и создание цепей на основе поли(аденозиндифосфатрибозы). Основные субстраты фермента включают самого себя [Gonzalez R. и др., Mol. Cell. Biochem., 138, 33-37 (1994)], ядерные белки, гистоны, топоизомеразу I и II, факторы транскрипции. Активность фермента PARP повышается примерно в 500 раз в случае разрыва цепи ДНК [Menissier de Murcia, J. и др., J. Mol. Biol., 210, 229-233 (1989)]. Критическое снижение концентрации NAD вызывается активацией фермента PARP вследствие чрезвычайно сильного повреждения ДНК. Как следствие в клетке снижается синтез аденозинтрифосфата (АТФ), и в то же время уровень использования АТФ становится выше, поскольку клетка пытается восстановить уровень NAD из аденозиндифосфатрибозы и никотинамида путем использования АТФ. Данные биохимические реакции наносят значительный урон терапии некоторых заболеваний, таких как аутоиммунные клинические формы [Szabo С. и др., Trends Pharmacol. Sci., 19, 287-98 (1988)], ишемические состояния сердца и мозга, а также нейродегенеративные заболевания. Катаболизм NAD можно исключить путем ингибирования фермента PARP, снижая таким образом уровни никотинамида и аденозиндифосфатрибозы в клетках и ингибируя потребление аденозинтрифосфата для синтеза NAD; то есть упомянутые выше повреждение и гибель клетки можно исключить путем ингибирования фермента.
Определение ингибирования PARP in vitro на выделенном ферменте
Поли(аденозиндифосфатрибоза)полимеразу выделяли их печени крысы в соответствии с публикацией Shah G.M. [Anal. Biochem., 227, 1-13 (1995)]. Активность PARP определяли в 130 мкл реакционной смеси, состоящей из 100 мМ буфера трис-HCl, рН 8,0, 10 мМ MgCl2, 10% глицерина, 1,5 мМ дитиотреита (DTT), 100 мкг32Р или3H-NAD+, 10 мкг активированной ДНК, 10 мкг гистона [трис-HCl означает гидрохлорид трис(гидроксиметил)аминометана]. Через 10 мин инкубации реакцию останавливали с 8% хлорной кислотой и отделяли белок центрифугированием (10 мин, 10000 g). Осадок трижды промывали 8% хлорной кислотой и радиоактивность белка измеряли со сцинтилляционным счетчиком. Результаты можно видеть в таблице.
Приведенные выше данные получены от четырех параллельных измерений. Из данных таблицы можно видеть, что часть исследованных соединений является очень хорошими ингибиторами PARP (l0,5<10 мг/мл). Большая часть исследованных соединений может быть классифицирована как хорошие ингибиторы PARP (l0,5=10-28 мг/мл).
Влияние соединений формулы I на ишемическую сердечную недостаточность и повторную перфузионную аритмию
Повреждение сердечной мышцы и гибель клеток сердечной мышцы в большинстве случаев происходят вследствие нарушений их питания. Наиболее часто встречающейся формой нарушения питания является недостаток кислорода. Развивающееся повреждение сердечной мышцы является ишемией сердечной мышцы, которая может сформироваться из-за острой гипоксии/кислородной недостаточности, коронарной окклюзии, спазмов или хронического сердечного заболевания. Ишемическая часть острого инфаркта сердечной мышцы сопровождается фазой избыточного кровотока, так называемой фазой повторной перфузии. В качестве летального последствия повторной перфузии могут случаться аритмии (вызываемые вентрикулярную тахикардию и фибрилляцию). Они являются первыми проявлениями нарушения повторной перфузии. Предотвращение нарушения повторной перфузии сердечной мышцы путем введения препарата означает предотвращение смертельной опасности на ранней постинфарктной стадии.
Опыты проводили на крысах-самцах линии SPRD (диапазон приемлемой массы тела 300-350 г). Животным давали наркоз, вводя пентобарбитал [5-этил-5-(1-метилбутил)-2,4, 6-(1H,3H,5H)пиримидинтрион] (60 мг/кг внутрибрюшинно) и оставляли на самопроизвольном дыхании. Животным проводили вспомогательное дыхание с респиратором (изготовленным Kutesz, Hungarian Academy of Sciences) с использованием трахеальной канюли, введенной после трахеотомии. Контролировали стандартное отведение электрокардиограммы (ЭКГ II). В правую бедренную артерию вводили катетер и соединяли с датчиком кровяного давления (BPR-01, Experimetria, Hungary) и с предусилителем. Пульсотахометр (HG-M, Experimetria, Hungary) начинал работать при пульсирующем сигнале артериального кровяного давления. Внешнюю шейную вену канюлировали для введения препарата. После торакотомии шелковую нить (плетеную, покрытие 4-0) помещали под левую переднюю коронарную (LAD) артерию. После нескольких минут стабилизационного периода проводили 5-минутную окклюзию LAD артерии, за которой следовал 10-минутный период повторной перфузии. Записывали ЭКГ в нормальном состоянии в начальный период и в описанные выше периоды. По данным ЭКГ определяли продолжительность времени вентрикулярной тахикардии и фибрилляции в сек. Кроме того, регистрировали коэффициенты выживаемости в группах обработанных животных.
Полученные результаты указывают на то, что соединения по изобретению применимы для предотвращения аритмии, индуцированной повторной перфузией. Например, у животных, обработанных соединением из примера 2, выживаемость после повторной перфузии была на 50% больше по сравнению с контрольной группой.
Исследование соединений формулы I при глобальной церебральной ишемии
После ишемического инсульта у человека пирамидальные клетки участка СА1 гиппокампа, по большей части, разрушаются, другие клетки участка (СА2, СА3) не столь чувствительны [Crain B.J. и др.: "Селективная гибель нейронов после транзиторной ишемии переднего мозга у когтистой монгольской песчанки, исследование с импрегнированием серебром". Neuroscience, 27, 402 (1988)]. В соответствии с данными некоторых авторов нарушения памяти связаны с гибелью клеток гиппокампа [Walker A.E. и др.: The national survey of stroke NINCDS, NIH: Clinical findings, Stroke, 12, Suppl., 1, 1-44 (1981)]. Центральная нервная система млекопитающих не в равной степени чувствительна к ишемическому повреждению. Монгольская когтистая песчанка (Meriones imguiculatus) благодаря своей анатомической особенности более пригодна для исследования церебральной ишемии, поскольку у данного вида 90% системы базилярного анастомоза (Circuius Willisi) отсутствует, следовательно, нет связи между системами сонной артерии и позвоночной артерии. Таким образом, обширная ишемия переднего мозга может быть индуцирована нажатием на сонную артерию.
Цель этого опыта состоит в том, чтобы определить, обладают ли новые соединения формулы I защитным действием при глобальной церебральной ишемии. Эксперименты проводили на самцах монгольской когтистой песчанки. Животным давали наркоз, используя смесь 2% галотана [2-бром-2-хлор-1,1,1,трифторэтана], 68% оксида азота и 30% кислорода. При наркозе сонную артерию сжимали с двух сторон в течение 5 мин. Нейроны не разрушались сразу, поэтому после нажатия следовал четырехдневный период повторной перфузии (клеточная гибель позднего типа). На четвертый день после вмешательства 80-90% клеток были повреждены в пирамидальном участке СА1.
Чтобы определить способности к обучению и запоминанию, а также гипермотильность, животных исследовали в Y-лабиринте.
Гибель клеток в участке СА1 изучали по гистологическим срезам. Животных перфузировали забуференным формалином, мозг удаляли и фиксировали в формалине. Распространение разрушенных участков СА1 определяли по мозговым срезам после окрашивания.
В опытах использовали следующие материалы:
GYKI-52466 (1-[4-аминофенил]-4-метил-7, 8-метилендиокси-5H-2,3-бензодиазепин) (контрольное вещество) в дозе 40 мг/кг внутрибрюшинно, введенный через 30 мин после ишемии;
Нимодинин [2-метоксиэтил-1-метилэтиловый эфир 1, 4-дигидро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридинкарбоновой кислоты] (контрольное вещество) в дозе 10 мг\кг внутрибрюшинно, введенный через 5 и 30 мин после ишемии;
новое соединение формулы I в дозе 25 мг/кг внутрибрюшинно, введенное через 5 и 30 мин после ишемии.
Опытные группы:
- ишемический контроль,
- обработанная контрольным веществом после ишемии,
- обработанная исследуемым веществом после ишемии,
- псевдовоздействие.
В опытах можно было установить, что соединения формулы I проявляют защитное действие при глобальной церебральной ишемии.
Влияние соединений формулы I на аутоиммунные заболевания
Аутоиммунные заболевания являются болезнями, при которых организм дает иммунную реакцию на свои нормальные компоненты [Ring G.H. и др., Semin. Nephrol., 19, 25-33 (1999); Theofilopoulos A.N., Ann. N.Y. Acad. Sci., 841, 225-235 (1998)]. Различные аутоиммунные заболевания отличаются друг друга антигеном, который начинает реакцию, однако огромное сходство может быть установлено в разрушающем клеточную ткань механизме проявившейся аутоиммунной реакции [Szabó С. и др., Proc. Natl. Acad. Sci. USA, 95, 3867-3872 (1998)]. Первоочередные аутоиммунные заболевания включают следующие:
Из перечисленных аутоиммунных заболеваний исследовали на мышах предотвращение сахарного диабета типа I, индуцированного стрептозотоцином.
Инсулин, основной регулятор углеводного метаболизма в организме, продуцируется и переносится в кровоток клетками поджелудочной железы - островками Лангерганса. Повреждение или деструкция β-клеток вызывает снижение или прекращение продуцирования инсулина, что приводит к развитию сахарного диабета типа I. Особенно чувствительны β-клетки к ROS и к токсическим эффектам оксида азота. Изучение повреждения ДНК, вызываемого оксидом азота, привело к предположению о том, что чрезмерная активация фермента PARP и снижение уровня NAD ответственны за гибель β-клеток [Heller В. и др., J. Biol. Chem., 270, 11176-180 (1995)]. По подобному механизму стрептозотоцин (SZ) [2-дезокси-2-(3-метил-3-нитрозоуреидо)-D-глюкопираноза] повреждает продуцирующие инсулин β-клетки, представляя таким образом модель диабета типа I при использовании в экспериментах на животных [Yamamoto H. и др., Nature, 294, 284-286 (1981)]. ДНК разрушается стрептозотоцином вследствие алкилирования и образования оксида азота, который вызывает активацию фермента PARP, как упомянуто выше. Было исследовано, могло ли воздействие однократной дозы стрептозотоцина, повышающее уровень глюкозы в крови у мышей, быть предотвращено однократной дозой производных амидоксима пропенкарбоновой кислоты формулы I. Эксперименты проводили на мышах-самцах линии CD-1. Животных разделяли на три группы, каждая из которых состояла из 8 животных. Первая группа получала 160 мг/кг стрептозотоцина (Sigma) внутрибрюшинно, вторая группа получала 160 мг/кг стрептозотоцина и 200 мг/кг соединения формулы I перорально, третья группа служила контролем. Концентрацию глюкозы в крови определяли на третий день после обработки. Затем животных забивали и брали образцы сыворотки для определения инсулина.
Было найдено, что исследуемое соединение по изобретению значительно снижало уровень глюкозы в крови, повышаемый при добавлении стрептозотоцина.
Влияние на устойчивость к инсулину
Сахарный диабет типа II является инсулиннезависимым. Сущностью патологического механизма этого последнего типа является снижение или потеря чувствительности к инсулину периферических тканей, особенно в полосатых (скелетных) мышцах и жировых тканях. Естественно, эта нечувствительность не может быть компенсирована сверхпродукцией (гиперсекрецией) β-клеток островка Лангерганса. Важно подчеркнуть, что устойчивость к инсулину, даже без начала реального сахарного диабета, приводит к некоторым регуляторным сердечно-сосудистым нарушениям. Следовательно, устойчивость к инсулину является независимым фактором риска сердечно-сосудистого заболевания. Благодаря основному патофизиологическому значению устойчивости к инсулину возможности фармакотерапии, нацеленные на повышение чувствительности к инсулину, очень важны при исследовании препаратов. Единственными реально существующими в клинической практике инсулиновыми сенсибилизаторами являются так называемые тиазолидиндионы. Их токсичность (которая, в основном, гепатотоксичность) является лимитирующим фактором при их применении. Инсулиновые сенсибилизаторы снижают уровни глюкозы в крови, триглицеридов и инсулина по механизму, который включает повышенную чувствительность к инсулину в тканях-мишенях (печень, скелетные мышцы, адипоциты) [Coica J.R., и Morton D.R.:
«Антигипергликемические тиазолидины: циглитазон и его аналоги» в «Новых антидиабетических препаратах», редакторы Bailey C.J. и Flatt P.R., изд-во Smith-Gordon, New York, 1990, стр.255-261].
Было исследовано, влияет ли обработка соединениями по изобретению на чувствительность к инсулину кроликов, нормальных и с гиперхолестеринемией, находящихся в сознании. Взрослых белых кроликов-самцов породы New Zealand с массой 3-3,5 кг размещали в помещении для животных (сутки с 12-часовыми периодами свет/темнота, температура 22-25°С, влажность 50-70%), подводимый промышленный корм для лабораторных животных и водопроводную воду при свободном доступе использовали на всем протяжении опыта. Экспериментальный период начинали после двухнедельного периода адаптации. Кроликов произвольно разделяли на две основные группы. Половине животных продолжали давать нормальный кроличий корм, в то время как вторая группа животных получала корм, обогащенный 1,5% холестерина в течение периода восьми недель. Каждую основную группу разделяли на четыре обрабатываемые группы:
- необработанная группа,
- группа, обработанная соединением по изобретению, в дозе 10 мг/кг
внутривенно дважды в день в течение 4 дней,
- группа, обработанная 7-нитроиндазолом в качестве ингибитора NOS:
введение 5 мг/кг 7-нитроиндазола в течение 5 мин предшествовало введению
инсулина с 5-минутным интервалом между инфузиями,
- группа, обработанная как 7-нитроиндазолом, так и соединением по
изобретению, как описано.
Животным давали наркоз и вставляли полиэтиленовые катетеры в две основные ветви правой шейной вены и левой сонной артерии. Катетеры вводили через тыльную часть шеи и заполняли физиологическим раствором, содержащим гепарин.
Исследования на изолированном сосуде
Из грудной аорты и сонных артерий кроликов подготавливали сосудистые кольца длиной 4 мм и помещали их горизонтально на два небольших L-образных крючка, из которых один был соединен с силовым измерительным преобразователем (SG-02, Experimetria, London, UK) для измерения и записи изометрического напряжения. Эксперименты проводили в камере для органа (5 мл), заполненной раствором Кребса с газовой смесью из 95% кислорода и 5% диоксида углерода. Начальное напряжение покоя устанавливали при 20 и 10 мН для колец аорты и сонной артерии соответственно. Время установления равновесия достигало 60 мин. Впоследствии сосудистые кольца были подвергнуты воздействию увеличивающихся концентраций норадреналина кумулятивным способом. После максимальной реакции норадреналин вымывали из камеры для органа до тех пор, пока напряжение не возвращалось к прежнему базовому уровню. Чтобы исследовать сосудистую реакцию на ацетилхолин, кольца предварительно сжимали с помощью ЕС50 (50%-ной эффективной концентрации) норадреналина. После того как соответствующее сжатие было получено, препараты подвергали воздействию с кумулятивным повышением уровня хлорида ацетилхолина.
По второму направлению исследований реактивности сосудов отдельную группу колец сонной артерии подвергали воздействию возбуждаемого электрического поля. После начального установленного напряжения 10 мН кольца в течение 1 ч приводили в состояние равновесия. Затем изучали контрактильные отклики на две последовательные серии импульсов возбуждения электрического поля (100 стимулов, 20 В, 0,1 мс и 20 Гц). Затем протокол возбуждения поля повторяли в присутствии 1 мкМ атропина и 4 мкМ гуанетидина (неадренергический нехолинергический (NANC) раствор). Весь протокол выполняли с кольцами с интактным эндотелием и с кольцами, у которых эндотелиальный слой был осторожно удален.
Определение содержания в ткани циклического ГМФ (гуанозинмонофосфата) в соответствии с Szilvássy [Szilvássy Z. и др., Coron art. Dis., 4, 443/452 (1993). Am. J. Physiol., H2033-H2041 (1994)].
Мышечные кольца моментально замораживали с использованием предварительно охлажденного зажима Волленбергера и измельчали в жидком азоте. Затем образцы гомогенизировали в 6% (об./об.) трихлоруксусной кислоте в количестве, превышающем в 10 раз массу образца в ступке, предварительно выдержанной при -70°С. После оттаивания образцы обрабатывали при 4°С. Осаждение при 15000 g в течение 10 мин с помощью центрифуги марки Janetzki K-24 (Leipzig, Germany) сопровождалось экстракцией супернатанта 5 мл насыщенного водой эфира в экстракторе Wortex в течение 5 мин. Эфирную фракцию отбрасывали и затем повторяли экстракцию пять раз. После этого образцы упаривали под азотом и анализировали на содержание циклического ГМФ с использованием наборов для радиоиммунологического анализа. Значения выражали в пмолях/мг массы сырой ткани.
Исследования гиперинсулинемического эугликемического фиксирования
Проводили инфузию человеческого обычного инсулина при постоянной скорости (13 мЕд/кг) через одну из венозных канюль в течение 120 мин. Данная скорость инфузии инсулина приводила к иммунореактивности инсулина плазмы 100±5 мкМ/мл в состоянии покоя. Образцы крови (0,3 мл) брали из артериальной канюли с 10-минутными интервалами для создания концентрации глюкозы в крови. Концентрацию глюкозы в крови поддерживали постоянной (5,5±0,5 ммоля/л) путем изменения скорости инфузии глюкозы через вторую венозную канюлю. Когда уровень глюкозы в крови стабилизовался в течение, по меньшей мере, 30 мин, данное состояние определяли как состояние покоя и дополнительные образцы крови (0,5 мл) брали для определения инсулина в плазме с 10-минутными интервалами. Скорость инфузии глюкозы в состоянии покоя использовали, чтобы охарактерировать чувствительность к инсулину.
В исследованиях получены следующие результаты.
1. Релаксационный отклик на кумулятивное повышение концентрации ацетилхолина (1 нМ -10 мкМ) в сосуде нормального кролика не изменялся под воздействием 1 мкМ соединений по изобретению.
2. При экспериментальной гиперхолестеринемии сосудистая релаксация с помощью ацетилхолина была значительно слабее в присутствии соединений по изобретению.
3. Возбуждение электрического поля индуцировало усиление напряжения в кольцах сонной артерии, инкубированных в растворе Кребса. Однако в NANC растворе релаксационный отклик наблюдался в ответ на примененный протокол возбуждения. Ни тот, ни другой отклик не испытывали влияния соединений по изобретению.
4. Удаление эндотелия значительно усиливало сжатие, вызываемое возбуждением электрического поля, и ослабляло NANC релаксацию. Соединения по изобретению смягчали сжатие, вызываемое возбуждением электрического поля, и увеличивали NANC релаксацию в сосудистых кольцах без эндотелия.
5. В сосудистых кольцах гиперхолестеринемических животных сжатия, индуцированные возбуждением поля, были увеличены, тогда как отклики на NANC релаксацию были ослаблены по сравнению с реакциями, наблюдаемыми в препаратах от нормальных кроликов. Соединения по изобретению значительно ослабляли сжатия, индуцированные электрическим возбуждением, и усиливали отклик на NANC релаксацию в сосудистых кольцах кроликов с гиперхолестеринемией независимо от присутствия эндотелия.
6. Базовая концентрация циклического ГМФ значительно снижается в кольцах от кроликов с гиперхолестеринемией по сравнению с таковой в нормальных кольцах. Данное снижение почти нормализовалось при инкубации с 1 мкМ соединений по изобретению. Однако исследуемые соединения не оказывали влияния на содержание циклического ГМФ в состоянии покоя в нормальных кольцах. Возбуждение электрического поля приводило к повышению концентрации циклического ГМФ в препаратах от нормальных животных. В кольцах от кроликов с гиперхолестеринемией примененный протокол возбуждения был недостаточным, чтобы установить какое-либо повышение концентрации циклического ГМФ. Соединения по изобретению были неэффективны в повышении индуцированного возбуждением поля содержания в тканях циклического ГМФ в нормальных кольцах, но в препаратах от кроликов с гиперхолестеринемией наблюдалось существенное повышение уровня циклического ГМФ.
7. Воздействие обогащенных холестерином кормов приводило к заметному снижению чувствительности к инсулину у кроликов, находящихся в сознании. Обработка соединениями по изобретению в течение 4 дней почти восстанавливала чувствительность к инсулину у животных с гиперхолестеринемией. Однако соединения по изобретению не оказывали влияния на чувствительность к инсулину нормальных животных.
8. Ингибитор невральной NO-синтазы, 7-нитроиндазол как таковой вызывает устойчивость к инсулину у нормальных животных. Соединения по изобретению неспособны влиять на данное состояние устойчивости к инсулину. Более того, 7-нитроиндазол блокирует улучшающее действие на устойчивость к инсулину, проявляемое соединениями по изобретению при экспериментальной гиперхолестеринемии.
Выводы
Результаты, представленные выше, показывают, что соединения по изобретению усиливают гипогликемический эффект инсулина в состоянии устойчивости к инсулину, связанном с экспериментальной гиперхолестеринемией у крыс, находящихся в сознании. Результаты также подтверждают доказательство, что данный эффект сенсибилизации к инсулину в значительной мере связан с нитрергическими метаболическими путями, влияние которых, как недавно было предположено, играет основную роль в регуляции чувствительности к инсулину [Shankar R.R. и др., Diabetes, 49, 684-687 (2000)]. Печеночная нейрогормональная регуляция периферической чувствительности к инсулину может быть описана следующим образом [Lautt W.W., Can. J. Physiol, 77, 553-562 (1999)].
- Существует возникающее после приема пищи повышение уровня инсулина в крови.
- В ответ на данное повышение уровня инсулина активируется печеночный парасимпатический рефлекс.
- Данный рефлекс вызывает высвобождение ацетилхолина, который активирует мускаринергические рецепторы.
- Мускаринергическое возбуждение приводит к выделению оксида азота (NO).
- Только в возбужденном состоянии оксид азота вызывает высвобождение печеночного инсулин-сенсибилизирующего фактора (HISS), который обладает синергентным или инсулиноподобным действием.
- HISS усиливает поглощение глюкозы скелетными мышцами.
Данный механизм с участием HISSS чувствителен к блокаде синтеза оксида азота и может активироваться экзогенным донором NO. Весьма вероятно, что механизм с участием HISS тесно связан с функцией печеночных сенсорных волокон. Возникающее после приема пищи повышение уровня инсулина в плазме активирует нитрергическую субпопуляцию печеночных сенсорных волокон нерва, которые вызывают высвобождение сенсорных нейромедиаторов из соседних волокон. Эти сенсорные нейромедиаторы благодаря их гормоноподобному характеру попадают в кровоток и повышают чувствительность тканей к инсулину.
В совсем недавней работе Steppan и др. удалось пролить свет на недостающую связь между ожирением и устойчивостью к инсулину. [Steppan C.M. и др., Nature, 409, 307-312 (2001)]. В кратком изложении гормон, называемый резистином, продуцируется адипоцитами. Было показано, что резистин снижает чувствительность тканей-мишеней (жировой ткани и скелетных мышцы) к гипогликемическому действию инсулина. Следовательно, фармакологическое подавление секреции резистина является возможным новым механизмом действия для использования в фармакологии при лечении инсулиннезависимого сахарного диабета и синдрома инсулинорезистентности. Из известных в настоящее время препаратов члены семейства тиазолидиндионов могут подавлять секрецию инсулина через посредство пероксисомального пролиферативного активаторного ядерного γ-рецептора в адипоцитах.
Соединения формулы I оказывают влияние на чувствительность к инсулину, и они способны ослаблять устойчивость к инсулину с помощью нитрергического механизма и сенсорных нейромедиаторов. Нормализация чувствительности к инсулину является причиной заболеваний с высокой распространенностью и смертностью, таких как диабет типа II, артериальная гипертензия, ишемическая болезнь сердца, ожирение и некоторые эндокринные заболевания.
Применение соединений по изобретению для предупреждения токсических эффектов
1) Влияние соединений на смертность, вызванную эндотоксином у мышей
Септический шок является одной из наиболее частых причин смерти в палатах интенсивной терапии. Инфекции, вызванные грамотрицательными бактериями, приводят к гипотензии, к недостаточной функции некоторых органов и, наконец, к коллапсу организма. При помощи инъекции липополисахарида (LPS), компонента бактериальной мембраны, у экспериментальных животных вызывают состояние, подобное шоку и, наконец, гибель. LPS активирует транскрипционное семейство NF-KB/Rel, которое регулирует продукцию нескольких медиаторов, принимающих участие в патологическом механизме шока (таких, как фактор некроза опухолей α (TNF-α), интерлейкины, NO-синтаза) [Oliver F.J. и др.: "Устойчивость к эндотоксическому шоку как следствие дефектной активации NF-κВ у мышей с недостаточностью поли(АДФ-рибоза)полимеразы-1", ЕМВО J., 18, (16) 4446-4454 (1999)]. Ген PARP-1 функционально связан с NF-κВ, таким образом, при утрате PARP транскрипции, зависящие от NF-κВ, также не происходят, следовательно, при эндотоксиновом шоке высвобождение медиаторов воспаления становится также недостаточно регулируемым. Целью исследования является выяснение, могла ли летальность, вызванная эндотоксином, быть предотвращена путем ингибирования PARP-1 соединениями формулы I.
В экспериментах использовали мышей линии c57BL/6 (Charles River Breeding Ltd.). В опыте доза и тип использованных LPS были идентичны таковым, которые описаны в статье Oliver F.J., упомянутой выше: липополисахариды из Escherichia coli 0111:B4 (Sigma). В опытах использовали также 3-аминобензамид (Sigma). Выживание в течение 24 ч отслеживали, по меньшей мере, дважды. Соединения формулы I вводили животным перорально через 1 и 6 ч после обработки с LPS.
Было найдено, что летальность, вызываемая эндотоксином, значительно снижалась исследуемыми соединениями формулы I.
2) Влияние соединений на гепатотоксичность, индуцируемую ацетаминофеном (парацетамолом)
Известно, что различные нестероидные противоревматические средства [Peters М. и др., Clin. Inves., 71, 875-881 (1993)] и обезболивающие средства, соответственно, имеют значительную гепатотоксичность [Kroger Н. и др., Gen. Pharmac., 27, 167-170 (1996)]. Недостаточность печени и почек индуцируется большой дозой парацетамола [Meredeth T.J. и др., Arch. Inter. Med., 141, 397-400 (1981)]. Недавно стало очевидным, что ингибиторы поли(АДФ-рибоза)полимеразы устраняют повреждение печени, индуцированное парацетамолом [Kröger Н. и др., Gen. Pharmac., 27, 167-170 (1996)]. Из литературы известно, что парацетамол является индуктором цитохрома Р-450. Действие парацетамола на систему цитохрома Р-450 приводит к образованию реакционноспособных хинониминов, которые связываются с сульфгидрильными группами белков, вызывая, таким образом, быстрое истощение внутриклеточного глутатиона [Jollow D.J. и др., Pharmacol., 12, 251-271 (1974)]. Инактивированные белки приводят к разрушению печеночных клеток и некрозу печени соответственно. Внутриклеточный глутатион является одним из наиболее важных антиоксидантов и сильнейшим ликвидатором реакционноспособных разновидностей кислорода соответственно. Ослабление антиоксидантной защитной системы, которая зависит от глутатиона, приводит к повышению внутриклеточного уровня кислородных радикалов [Miesel R. и др., Inflam., 17, 283-294 (1993)]. Свободные кислородные радикалы являются сильными индукторами PARP, влияющими на посттрансляцию белков. Благодаря усиленной активации PARP запасы NAD в клетках истощаются и может начаться апоптоз [Hoschino J. и др., J. Steroid Mol. Biol., 44, 113-119 (1993)]. Следовательно, никотинамид, селективный ингибитор фермента PARP, подавляет секрецию ферментов глутамат-оксалацетат-трансаминазы и глутамат-пируват-трансаминазы в печени, как показано на мышах в случае гепатита, индуцированного парацетамолом [Kröger Н. и Ehrlich W. в: «L-Триптофан: современные перспективы в медицине и лекарственной безопасности», ред. Kochen W. и Steinhart И., изд-во Verlag, Berlin, 1994].
Было исследовано, может ли быть предотвращено повреждение печени, индуцированное парацетамолом, с помощью новых соединений формулы I. Симптом повреждения печени характеризуется повышением индуцированных парацетамолом уровней ферментов GOT и GTP. Эксперименты проводили на мышах-самцах NMRI с массой тела 30-40 г. Животным предварительно давали перорально в течение 7 дней соединения формулы I. На день 8 мышей подвергали голоданию в течение 12 ч, давали дозу парацетамола 500 мг/кг перорально и вводили определенную дозу соединения формулы I. Через 16 ч животных умерщвляли кровопусканием и в сыворотке измеряли активность ферментов GOT и GPT. Результаты анализировали с помощью непараметрического критерия Манна-Уитни. Что касается результатов, то приведены среднее и стандартное отклонение, где значение р<0,05 рассматривали как достоверное.
Было найдено, что однократное пероральное введение парацетамола усиливало активность GOT и GPT у мышей-самцов NMRI по сравнению с контрольными животными, обработанными физиологическим раствором. Однако соединения формулы I после предварительного перорального введения, продолжавшегося 7 дней, снижали активность ферментов GOT и GPT очень значительно. Например, очень благоприятный гепатозащитный эффект наблюдали в случае соединения из примера 12, введенного в дозе 50 мг/кг.
3) Влияние соединений на токсичность параквата
Паракват (1,1'-диметил-4,4'-бипиридиний) - соединение, применявшееся ранее в качестве пестицида, обладает токсическим действием вследствие образования супероксидного радикала. В образовании супероксидного радикала принимают участие оксидоредуктазные ферменты, которые используют NADH и NAD(P)H в качестве доноров электронов. [NAD(P)H означает β-никотинамидадениндинуклеотидфосфат в восстановленной форме]. В передаче клеточного ответа на окислительный стресс, индуцированный паракватом, важную роль играет белок р66 [Migligaccio Е. и др., Nature, 402, 309-313]. Механизмы, вносящие вклад в инактивацию супероксида (такие, как повышение уровня супероксиддисмутазы), эффективно снижают токсичность параквата. Супероксидный радикал играет важную роль в патологическом механизме некоторых заболеваний (таких, как ишемическая реоксигенация, инфаркт, воспалительные заболевания). Простую модель экпериментальной супероксидной нагрузки при этих заболеваниях получают введением параквата.
Влияние на токсичность параквата in vitro
Клетки гепатомы Нера-1 выращивали в среде RPMI-1640 с добавлением 10% бычьей сыворотки, тогда как клетки PC-12 феохромоцитомы крысы выращивали в среде RPMI-1640 с добавлением 10% бычьей сыворотки и 5% лошадиной сыворотки при 37°С на воздухе, содержащем 5% диоксида углерода. Используя 100 мкл культуральной среды, 5×103 клеток помещали в лунки 96-луночного культурального планшета Costar. Часть культур не получала никакой обработки и была использована в качестве контроля. Часть клеток обрабатывали увеличивающимися концентрациями параквата, часть такими же концентрациями параквата и концентрациями 3, 10 и 30 мкг/мл исследуемых соединений. Клетки выращивали в течение дополнительных 3 дней, затем окрашивали SRB (сульфородамином В). Более высокие концентрации параквата приводили к гибели клеток, тогда как более низкие концентрации параквата частично подавляли рост клеток. Действие исследуемого соединения определяли на основании снижения токсичности параквата.
Влияние на токсичность параквата in vivo
Паракват проявляет значительную токсичность на мышах. Доза 70 мг/кг, введенная внутрибрюшинно, приводит к гибели животных в течение 2 дней. Механизмы, которые сдерживают образование супероксидов, нейтрализацию и воздействия окислительного стресса, способны также снизить токсичность параквата in vivo.
Мышей CFLP, имеющих массу тела 20-22 г, делили на группы, состоящие из 10 животных, и обрабатывали внутрибрюшинно 50 и 70 мг/кг параквата соответственно. Часть группы получала также исследуемое соединение за 6 ч до введения параквата. В случае исследуемых соединений использовали дозу 100 мг/кг перорально. Эффективность исследуемых соединений определяли на основании увеличения выживаемости мышей.
Было найдено, что соединения формулы I значительно снижают токсичность параквата.
Влияние соединений формулы I на нейродегенеративные заболевания
Как отмечено ранее, из-за повреждения ДНК действием ROS активируется фермент PARP, что сопровождается высвобождением клеточного NAD, приводя, таким образом, к гибели клеток. Экстремальная скорость активации PARP не может наблюдаться только при гибели нейронов, вызванной ишемией, подобно ишемии мозга, но имеются доказательства ее роли при других нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз [Love и др., Neuropathol. Appl. Neurobiol., 25, 98-108 (1999); Eliasson и др., Nat. Med, 10, 1089-1095 (1997)].
Влияние на экспериментальный боковой амиотрофический склероз
Амиотрофический боковой склероз (ALS) является летальным прогрессирующим нейродегенеративным заболеванием. Это наиболее часто встречающееся начало нарушения двигательного нейрона у взрослых в развитых странах. ALS включает дегенерацию двигательного нейрона в коре головного мозга, стволе головного мозга и в спинном мозге, что вызывает атрофию скелетных мышц, паралич и смерть [Roland L.P. в «Нейродегенеративных болезнях», стр.507-521 (1994)]. В части случаев ALS заболевание является семейным. Семейные случаи частично связаны с миссенс-мутацией гена Cu/Zn-супероксиддисмутазы-1 (SOD-1) [Deng R.H. и др., Science, 261, 1047 (1993)]. Цитозольный фермент SOD-1, изобилующий в нервной ткани, играет важную роль в защите клеток от повреждений, индуцированных кислородными радикалами. Мутированный фермент сохраняет почти нормальный уровень ферментной активности. Исследования in vitro показали, что мутации SOD-1 приводят к усилению функции фермента и увеличению выработки свободных радикалов.
У трансгенной мыши, имеющей мутированный ген AOD-1, развиваются симптомы, подобные таковым при ALS. Некоторые человеческие мутированные гены SOD-1 (G93A, V148G) уже были сверхэкспрессированы в трансгенной мыши, и генерированные модели заболеваний были использованы для скрининга препаратов против ALS [Gurney M.E., J. Neurol. Sci., 152. Suppl. 1, 67-73 (1997)].
Исследование на модели семейного ALS
В исследовании использовали трансгенных мышей, оверэкспрессирующих мутированный человеческий ген SOD-1 (G93A). Животных приобретали у Jackson Laboratory, USA. Обработку соединениями формулы I начинали до появления симптомов заболевания в возрасте 4 недель. Исследуемые соединения давали один раз в день перорально при 3 дозовых уровнях до окончания эксперимента.
Прогрессирование заболевания контролировали еженедельным исследованием двигательной функции (рефлекс растяжения, заряженная сетка, вращательный тест), по времени выживания и при окончании эксперимента (через 120 дней) путем гистологического и биохимического исследования областей двигательных нейронов.
Было найдено, что соединения формулы I приводят к умеренной задержке появления рефлекса, дефицита координации и мышечного усилия у трансгенных животных с ALS. Наблюдаемый эффект был дозозависимым. Наблюдалась также задержка в наступлении паралича и конечной стадии заболевания. Результаты гистологического исследования подтвердили наблюдаемый клинический эффект обработки. Дегенерация и утрата двигательных нейронов и substancia nigra были менее выраженными в обработанной группе, чем в контрольной группе. На основании результатов можно полагать, что соединения формулы I оказывают благоприятное терапевтическое воздействие при заболеваниях ALS.
Исследование на аутоиммунной модели ALS
В случае спорадических заболеваний ALS в гене SOD-1 не удалось обнаружить никакой мутации. Этот факт позволяет предположить, что другие причины приводят к такому же прогрессированию заболевания. У большинства пациентов, страдающих от спорадического ALS, можно обнаружить антитело против кальциевых каналов. Данное наблюдение подтверждает концепцию о том, что аутоиммунная реакция против двигательных нейронов и кальциевых каналов играет первопричинную роль в случаях формирования спорадического ALS. У экспериментальных животных Engelhardt сотрудники индуцировали заболевание со всеми специфическими изменениями при ALS путем иммунизации с двигательным нейроном, затем используя только иммунную сыворотку [Engelhardt J. и др., Synapse, 20, 185-199 (1995)]. Данную модель использовали для исследования эффективности соединений формулы I при спорадических заболеваниях ALS.
Морских свинок Hartley иммунизировали с гомогенизированным бычьим передним роговидным отростком спинного мозга. Для иммунизации нейроны суспендировали в полном адъюванте Фрейнда (CFA). Обработку проводили путем 10 подкожных или внутрикожных инъекций, вводя каждый раз 0,1 мл суспензии. Через месяц инъекции повторяли, однако для приготовления суспензии использовали неполный адъювант Фрейнда. Через две недели после второй иммунизации у животных в течение 1-3 дней развивалась сильная слабость, особенно в нижних конечностях. Увеличение массы тела прекращалось, подвижность уменьшалась. В течение следующих двух недель состояние животных не изменялось. Затем животных забивали путем кровопускания. Кровь собирали и центрифугировали, чтобы получить сыворотку, которую использовали для индукции ALS у мышей.
Опыты проводили на группах, состоящих из 5 самцов мышей-альбиносов (CFLP, масса тела 25-30 г). Каждому животному вводили путем внутрибрюшинной инъекции 1 мл описанной выше сыворотки, чтобы повредить двигательный нейрон. Одну из групп животных обрабатывали только сывороткой, тогда как другие, помимо сыворотки, обрабатывали также исследуемым соединением формулы I в дозе 100 мг/кг внутрибрюшинно. Другие группы животных обрабатывали только исследуемым соединением формулы I без инъекции сыворотки.
Подвижность животных, обработанных только сывороткой, становилась медленной, нижние конечности могли использоваться ими только с затруднением, потом они становились парализованными. В случае животных, обработанных как сывороткой, так и исследуемым соединением формулы I, невозможно было определить никакой синдром недостаточности подвижности. То же самое было установлено опытным путем в случае животных, обработанных только исследуемым соединением формулы I. Все это позволяет предположить, что соединения формулы I предотвращают развитие нарушений двигательной способности, индуцированных иммунизацией.
Влияние на экспериментальную модель болезни Паркинсона
Болезнь Паркинсона является общеизвестным приводящим к потере трудоспособности идиопатическим нейродегенеративным нарушением, характеризующимся тремором, брадикинезией, оцепенелостью, обусловленной напряжением мышц, и трудностями с равновесием. Эти двигательные аномалии вызываются истощением мозгового допамина, что является результатом потери допаминергических нейронов в substancia nigra pars compacta. Анализ действия 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МРТР), имеющего селективную нейротоксичность, проливает свет на возможный патологический механизм болезни Паркинсона. МРТР индуцирует двигательные симптомы болезни Паркинсона у человека и животных [Dexter А. и др., Ann. Neurol., 35, 38-44 (1994)]. Обработка МРТР приводит также к утрате допаминергических нейронов в substancia nigra pars compacta. Эозинофильные включения, подобные тельцу Lewy, появляются в поврежденных нейронах, и активность митохондриального комплекса в этих клетках также понижается. Эти изменения характерны для окислительного стресса [Shapira A., Adv. Neurol., 69, 161-165 (1996)]. Биологически активным метаболитом МРТР является МРР (1-метил-4-фенилпиридиний). МРР ингибирует непосредственно комплекс I в митихондриях, приводя к повышенному образованию супероксидного аниона. Данные указывают на то, что окислительный стресс играет центральную роль в патогенезе природной формы и индуцированной МРТР форме болезни Паркинсона. Фермент PARP активируется окислительным стрессом, и фермент, по-видимому, играет активную роль в патологическом механизме болезни Паркинсона. Мыши с крайне низким уровнем PARP обнаруживают значительно сниженную чувствительность к действию МРТР, индуцирующему болезнь Паркинсона [Mandrir F. и др., Proc. Natl. Acad. Sci. USA, 96, 5774-5779 (1999)]. Эти находки подтверждают, что ингибирование PARP может иметь результатом терапевтическое воздействие на болезнь Паркинсона.
Мыши С57В1, используемые в опытах, получали от Charles River, Hungary. Мышей с массой 20 г обрабатывали четыре раза с 20 мг/кг МРТР, введенными каждый раз внутрибрюшинно с 2-часовыми интервалами. Исследуемые соединения вводили перорально за 30 мин до инъекции МРТР. Контрольные животные получали обработку наполнителем с той же периодичностью. Через семь дней после инъекции МРТР мышей умерщвляли и мозги быстро удаляли. Полосатые тела расслаивали на охлажденной льдом чашке Петри. Иссеченные ткани быстро замораживали и хранили при -80°C до анализа. Образцы тканей облучали ультразвуком в 50 объемах 0,1 М хлорной кислоты для достижения гомогенизации. После центрифугирования (14000 g, 10 мин, 4°С) 20 мкл супернатанта впрыскивали в обращеннофазовую колонку с катехоламином (ESA, Bedford) и оценивали содержание допамина.
Через 2 ч после последней обработки с МРТР вентролатеральный средний мозг и полосатые тела иссекали и гомогенизировали в буфере сахароза/DTT (дитиотреит), затем центрифугировали (14000 g, 5 мин). Осадок снова суспендировали в буфере. После определения концентрации белка равное количество белка загружали на гель для SDS/PAGE (электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия). Белок переносили с геля на нитроцеллюлозную мембрану и окрашивали с помощью иммунной метки для полимера поли(АДФ-рибоза). Специфическое связывание обнаруживали с помощью хемилюминесценции.
В экспериментах было найдено, что обработка с МРТР вызывала резкое снижение (на 80%) содержания допамина в стриарной области. Исследуемые соединения формулы I частично (на 20-40%) подавляли потерю допамина, индуцированную МРТР. Обработка с МРТР приводила к появлению поли(АДФ-рибоза)полимерных аддуктов в стриарной области. Сопутствующая обработка исследуемыми соединениями производила подавление этого симптома (на 20-70%). Таким образом, можно ожидать, что соединения формулы I могут обладать терапевтической активностью при болезни Паркинсона.
Исследование цитозащитного действия
Некоторые препараты, применяемые постоянно или часто, могут вызвать повреждение нейронов в качестве побочного действия. Из большой серии таких препаратов, вызывающих данный побочный эффект (хлорамфеникол, дапсон, дисульфирам, дихлорацетат, этионамид, глутетимид, ауротиомалат натрия, гидразин, изониазид, метронидазол, нитрофурантоин, закись азота, цисплатин, пиридоксин, винкристин), лучше всех охарактеризованными и наиболее часто обсуждаемыми являются нейропатии, вызванные изониазидом, пиридоксином, винкристином или цисплатином. Хлорамфеникол может вызвать такую нейропатию, но его побочный эффект может исчезнуть после прекращения лечения. Однако почти во всех клинических случаях преждевременная остановка химиотерапии может препятствовать успеху лечения и может вызвать возобновление заболевания. Особенно высокой является опасность изменений из-за побочных эффектов в терапевтическом лечении в случае противоопухолевой терапии. Данный факт придает огромное значение так называемым хемозащитным или цитозащитным агентам, которые способны уменьшить повреждающее побочное действие важных, сохраняющих жизнь препаратов, не вызывая никакого снижения их терапевтической эффективности.
У большинства онкологических пациентов, получавших цисплатин, основным побочным эффектом является повреждение периферических нервов (периферическая нейропатия). Появление этого побочного эффекта может помешать проведению терапии цисплатином, может поставить под угрозу успех лечения и ухудшить качество жизни пациентов. Наличие и степень повреждения нейронов может быть определена путем измерения скорости нервной проводимости как в клинических, так и в экспериментальных исследованиях. Нейротоксический эффект цисплатина включает, прежде всего, образование большого миелинового слоя на периферических нервах и проявляется в сенсорном повреждении нейронов (сенсорная нейропатия). Недавно в некоторых сообщениях упоминалась автономная нейропатия и изредка также двигательная нейропатия, сопровождающие лечение цисплатином. Вследствие повреждения непосредственно дорсальных корешковых ганглий и больших чувствительных нервов цисплатин может часто вызывать функциональные нарушения чувствительных нервов. У крыс постоянная обработка цисплатином вызывает сенсорную нейропатию, которая отражается в замедлении скорости сенсорной нервной проводимости седалищного нерва смешанного типа.
На основании биохимического способа действия, упомянутого выше, главным образом, путем предотвращения повреждений, вызываемых свободными радикалами, считается, что соединения формулы I могут обладать цитозащитным потенциалом и могут предотвратить органотоксичные побочные эффекты противоопухолевых препаратов. Поэтому в опытах с крысами цисплатин давали в форме подострой обработки в течение 10 недель в дозах 1 и 2 мг/кг внутрибрюшинно и наблюдали развитие периферической нейропатии. Кроме того, исследовали, как различные дозы исследуемых соединений влияют на повреждение функции нерва (скорость нервной проводимости).
Чтобы определить сенсорное и двигательное повреждение нейронов, индуцированное цисплатином, измеряли скорость нервной проводимости на хвосте крыс в соответствии с модифицированной методикой Миеши. Модификация состояла в измерении скорости нервной проводимости при комнатной температуре вместо 37°С. Скорости сенсорной и двигательной проводимости определяли до обработки цисплатином (контроль) и на пятую и десятую недели обработки. В ходе измерений животным давали неглубокий эфирный наркоз и два штырьковых вывода электродной пары помещали в хвостовой нерв на расстоянии 50 мм друг от друга. Применяя силу стимула выше максимальной, регистрировали афферентный (двигательный) и афферентный (сенсорный) потенциалы нервного действия. Скорость нервной проводимости определяли независимо путем усреднения 10 потенциалов действия, используя формулу
NCV=v/1 [м/сек], где
v означает расстояние между триггерной и регистрирующей электродной парами в мм, 1 означает время ожидания появления потенциала действия в миллисекундах, NCV означает скорость нервной проводимости в м/сек.
В опытах было найдено, что 10-недельная обработка с 1-2 мг/кг цисплатина внутрибрюшинно значительно снижает массу тела обработанных животных по сравнению с таковой для контрольных животных. Это снижение массы тела изучалось также в случае животных, обработанных соединениями формулы I. Не было отличия в обычном поведении между обработанными и необработанными животными или животными, обработанными цисплатином, и исследуемым соединением. Не было отличия в NCV сенсорного и двигательного нервов в контрольной группе в три периода измерения. У животных, обработанных цисплатиом, NCV снижалась у всех и необычно, на пятой и также на десятой неделе благодаря обработке с 1 мг/кг цисплатина. После обработки с 2 мг/кг цисплатина исследовали более сильное снижение NCV. Нейропатия развивалась также в двигательных нервах.
В ходе обработки цисплатином в течение 10 недель двигательная NCV значительно понижалась в группах с дозой как 1 мг/кг, так и 2 мг/кг цисплатина. Понижение было дозозависимым. В группах, обработанных как с 1 мг/кг цисплатина, так и соединением формулы I, понижение скорости сенсорной нервной проводимости было значительно меньше, чем в группе, обработанной только 1 мг/кг цисплатина, следовательно, функция нейронов улучшалась после комбинированной обработки. Степень улучшения была тем выше, чем сильнее была степень повреждения. В группе, обработанной как 2 мг/кг цисплатина, так и соединением формулы I в различных дозах, на пятой неделе понижение скорости сенсорной нервной проводимости не отличалось от таковой в группе, обработанной только 2 мг/кг цисплатина. Однако на десятой неделе в группе животных, обработанных только 2 мг/кг цисплатина, NCV значительно понизилась дополнительно. Тогда как в случае животных, обработанных как цисплатином, так и соединением формулы I, понижение было дозозависимым по сравнению с животными, обработанными только 2 мг/кг цисплатина. Понижение скорости афферентной нервной проводимости было меньше в конце десятой недели, особенно в группах, обработанных также соединениями по изобретению.
Подводя итог, можно констатировать, что нарушение скоростей сенсорной и двигательной нервной проводимости, вызванное обработкой цисплатином, уменьшается при одновременном введении соединений формулы I, и прогрессирование нарушения от пятой до десятой недели предотвращается. Защитный эффект в некоторых группах был дозозависимым. Таким образом, нейрозащитный эффект соединений формулы I может быть продемонстрирован как для сенсорной, так и для двигательной нервных функциях.
Биологический эффект карнитинпальмитоилтрансферазы (CPTI)
Ключевым ферментом регуляции метаболизма жирных кислот является CPTI. Существуют две возможности получения сложных эфиров на основе коэнзима А (СоА) и свободных жирных кислот (FFA):
(1) синтез триглицеридов посредством реакции с глицерином или
(2) окисление, первым этапом которого является образование ацилкарнитина с помощью фермента CPTI [см. McGarry J.D. и др.. Diabetes, 5, 271-284 (1989); McGarry J.D. и Foster D. Ann. Rev. Biochem., 49, 395-420 (1980)]. Фермент CPTI локализован во внешней части внутренней митохондриальной мембраны (или во внешней мембране) и катализирует следующую реакцию:
FFA-CoA + L-карнитин → FFA-карнитин + СоА
Ингибирование окисления жирных кислот приводит к усилению расщепления и окисления глюкозы. Это превращение чрезвычайно важно и благоприятно, особенно при ишемии сердечной мышцы и диабете; оба эти патологические состояния характеризуются высокой распространенностью и смертностью. При ишемии сердечной мышцы и последующей реоксигенации усиленное окисление жирных кислот является пагубным для здоровья из-за высокой потребности в кислороде и повреждающего действия на мембраны, проявляемым образующимися ацилкарнитинами [Busselen Р. и др., J. Mol. Cell. Cardiol., 20, 905-916 (1988); Ford D.A. и др., Biochemistry, 35, 7903-7909 (1996); Reeves K.A., и др., J. Pharm. Pharmacol., 48, 245-248 (1995)]. На основании некоторых экспериментальных данных в настоящее время признанным является тот факт, что активация метаболизма глюкозы и одновременное подавление окисления жирных кислот имеют благоприятное воздействие с точки зрения как восстановления механической функции миокарда, так и параметров метаболизма (секреции фермента, перекисного окисления липидов) [Lopaschuk G.D. и др., Circ. Res., 66, 546-553 (1990); Kennedy J.A. и др., Biochem. Pharmacol., 52, 273-280 (1996)]. Эта субстратная селекция миокарда, т.е. выбор между глюкозой и жирной кислотой, может быть достигнут также с помощью ингибиторов CPTI, таким образом, утилизация глюкозы повышается, и энергетические показатели миокарда улучшаются [Lopaschuk G.D. и др., Circ. Res., 63, 1036-1043 (1988); Carregal М. и др., Arch. Phys. Biochem., 103, 45-49 (1995); Lopaschuk G.D. и др., Circ. Res., 65, 378-387 (1989); Pauly D.F. и др., Circ. Res., 68, 1085-1094(1991)].
Исследования заявителей показали, что фермент, который катализирует лимитирующую скорость реакцию окисления жирных кислот, может быть ингибирован соединениями формулы I в диапазоне концентраций ниже миллимолярных. Исследования указывают также на то, что исследуемые соединения влияют на субстратную селекцию сердечной и других тканей и путем изменения субстратной селекции также и на постишемические повреждения тканей.
Биологическая роль чувствительных к кислороду генов, регулиремых прежде всего, факторами транскрипции bHLH
Защита от пагубных эффектов гипоксии требует ряда организованных защитных реакций как на уровне отдельных клеток, так и на уровне всего организма. В регуляции экспрессии индуцирующих гипоксию генов транскрипционный комплекс HIF-1/ARNT играет центральную, но не исключительную роль. Чувствительные к кислороду координационно регулируемые гены включают эритропоэтин, который стимулирует продукцию эритроцитов [Wang G.L. и др., PNAS, 92, 5510 (1995)], VEGF (сосудистый эндотелиальный фактор роста), который стимулирует ангиогенез [Goldberg М.А. и Schneider T.J., J. Biol. Chem., 269, 4355 (1994)], гликолитические ферменты, подобные GAPDH (галактоза-6-фосфатдегидрогеназа), LDH (лактатдегидрогеназа) [Rolfs А. и др., J. Biol. Chem., 272, 20055 (1997)], а также переносчик глюкозы Glut-1.
Соединения формулы I предположительно связываются с факторами транскрипции ARNT и/или HIF-1, таким образом, они влияют на активацию генов, которые принимают участие в тревожных (чувствительных к гипоксии) состояниях. Считается, что посредством данного пути передачи сигнала соединения по изобретению экспрессируют белки теплового шока, играющие важную роль в тревожных ситуациях.
Синтез белков теплового шока (HSP) индуцируется различными стрессами, которые оказывают действие на клетки. Белки теплового шока помогают выживанию клеток в опасных ситуациях и вносят вклад в репарацию любых повреждений [Cardiovascular Res., 578 (1993); Neurosci. Lett., 163, 135-137 (1993)].
Агенты, которые могут содействовать тревожной реакции в адаптации к гипоксии, к реоксигенации и восстановлению истощенной адаптационной реакции, потенциально способны уменьшить повреждение ткани, вызванное гипоксией (гипоксия-реоксигенация) при заболеваниях, подобных инфаркту, артериосклерозу и диабету.
Определение HSP-70
Активность белка теплового шока HSP-70 изучали с помощью анализа репортерного гена, образующего гибрид с ДНК. Ген белка, который может быть определен хорошо измеряемой ферментной активностью, гибридизовали с промоторной последовательностью HSP-70, кодирующей белок теплового шока. Использовали биотехнологические методики. Фермент люциферазу выбрали в качестве репортерного гена, активность которого может хорошо определяться путем измерения люминесценции. Если промотор гена фермента люциферазы заменяется промотором гена HSP-70, то изменение активности фермента люциферазы, т.е. изменение частоты транскрипции от гена, коррелирует с частотой транскрипции гена HSP-70, которая происходит в данных обстоятельствах. Таким путем, если вещество или реакция влияет на экспрессию гена HSP-70, эффект может быть изучен посредством измерения активности фермента люциферазы. Влияние исследуемых соединений на экспрессию HSP-70 изучали в такой экспериментальной системе.
Двухцепочечная кольцевая молекула ДНК, т.е. плазмида, содержащая репортерный ген HSP-70, была сконструирована, чтобы провести измерения. Последовательность протяженностью почти 600 п.о. промотора мышиного гена HSP-70 (5'-направление от стартового сайта гена) гибридизовали с кодирующей последовательностью гена люциферазы, происходящего от Photumus pyralis. Примененная промоторная последовательность содержала несколько связывающих белок сайтов, способствующих экспрессии гена HSP-70. Конструкцию, состоящую из промотора HSP и гетерологичного люциферазного гена, встраивали в основанный на pBR плазмидный вектор, который может быть селектируемым для неомицина. Эту HSP-70-люциферазную плазмиду трансфицировали в клетки мышиных фибробластов L929. Анализ проводили следующим образом.
Клетки L929, которые содержат плазмиду HSP-70-люц., выращивали в DMEM (модифицированной Дюльбекко среде Игла) с добавлением 5% FCS (эмбриональной бычьей сыворотки). Помещали 104 клеток в 1 мл культуральной среды в планшетные лунки 24-луночного планшета Costar для клеточных культур. Исследуемые вещества растворяли в ЗФР в концентрации 10-2 М. После прикрепления клеток (3-4 ч после помещения в планшет) вносили в культуры 10 мкл раствора и клетки инкубировали в течение 30 мин при 37°С в термостате с СО2. Затем культуральную среду заменяли на свежую (без исследуемого вещества) и клеткам давали возможность регенерировать в течение 1 ч при 37°С, затем один раз промывали с ЗФР. После удаления ЗФР к клеткам прибавляли 40 мкл IX лизисного буфера и образцы выдерживали на льду в течение 30 мин. Затем клетки переносили в пробирки Эппендорфа и центрифугировали при 14000 об/мин в течение 20 мин при 4°С. Прибавляли 5 мкл супернатанта к 25 мкл буфера для анализа люциферазы и измеряли люминесценцию образцов в течение 25 сек в люминометре.
Состав буфера для анализа люциферазы:
20,00 мМ трицин [N-{2-гидпрокси-1,1-бис(гидроксиметил)этил}глицин], рН 7,8,
1,07 мМ (MgCO3)4 Mg(OH)2.5H2 O,
2,67 мМ MgSO4,
0,10 мМ EDTA (этилендиаминтетрауксусная кислота),
3,33 мМ DTT,
270 мкМ литиевая соль коэнзима А,
470 мкМ люциферин,
530 мкМ АТФ (аденозинтрифосфат).
Состав лизисного буфера 5Х:
125 мМ трис-Н3PO4, рН 7,8,
10 мМ CDTA (транс-1,2-диаминоциклогексан-N,N,N',N'-тетрауксусная кислота),
10 мМ DTT,
50% глицерин,
5% тритон Х-100.
Исследование чувствительных к гипоксии генов
Действие соединений формулы I изучали на ксенобиотике и гипоксии (1% кислорода), индуцированной экспрессией гена в клеточных культурах Нера и HepG2 на уровнях мРНК и белка. Наблюдали, что соединения формулы I приводят к 10-кратному повышению экспрессии HSP-70 в клетках Нера, индуцированной метилхолантреном. Кроме того, соединения по изобретению усиливают экспрессию чувствительных к гипоксии генов, как VEGF, GAPDH и LDH, в ответ на гипоксическую обработку в клетках Нера и HepG2.
Соединения формулы I в случае гипоксии усиливают экспрессию нескольких чувствительных к гипоксии генов. Это указывает на то, что исследуемые соединения влияют на общий метаболический путь регуляции чувствительных к кислороду генов. Соединения формулы I, способствующие адаптации к стрессу, вызванному гипоксией и гипоксией-реоксигенацией, применимы для защиты от опасного влияния гипоксии и гипоксии-реоксигенации. Ожидается, что соединения окажутся терапевтически полезными в условиях, когда повреждение ткани вызвано нарушением кровообращения, сжатием и спазмом артерий, артериосклерозом, инфарктом, эмболией, тромбозом, низким кровяным давлением, шоком, ожогом, обморожением. Соединения по изобретению могут быть эффективны также при вторичных гипоксических состояниях, ассоциированных с дегенеративными и метаболическими заболеваниями (болезнь Альцгеймера, диабет).
Влияние на уровень фермента LDH в подвергаемых гипоксии клетках HepG2
Клетки HepG2 культивировали в DMEM с добавлением 10% FCS на воздухе, содержащем 5% СО2 при 37°С. Помещали 10 клеток в 1 мл среды в планшетные лунки 24-луночного планшета Costar для клеточных культур. На следующий день клетки обрабатывали исследуемыми соединениями в концентрации 30 мкг/мл, затем клетки подвергали гипоксической обработке (1% 02, 5% СО2 в газообразном азоте) в течение 24 ч. Часть контрольных культур обрабатывали водой, применяемой в качестве растворителя, другую их часть не подвергали гипоксии. В конце гипоксической обработки среду удаляли и клетки дважды промывали холодным ЗФР. Клеточные лизаты готовили в 0,05% тритоне Х-100, содержащем фосфатный буфер (0,05 М). После центрифугирования (2 мин, 20000 g) активность LDH в супернатанте определяли на основании расхода NADH в присутствии пирувата натрия в качестве субстрата.
Примененная гипоксическая обработка индуцировала 3-кратное повышение содержания LDH в клетках. Помимо лечения гипоксии, соединения формулы I повышали уровень LDH в клетках дополнительным способом.
Противовирусное действие
Ретровирусный геном состоит из одноцепочечной молекулы РНК, которая реплицируется от промежуточной двухцепочечной ДНК. Вставка двухцепочечной ДНК в геном хозяина является решающим событием в жизненном цикле вируса. Механизм вставки подобен механизму транспозиции.
Фермент обратная транскриптаза производит ДНК-копию вирусной РНК. Двухцепочечная ДНК синтезируется в цитоплазме инфицированной клетки. Затем линейная ДНК транспортируется в ядро и одна или несколько копий интегрируются в геном клетки-хозяина. Интеграция опосредована ферментом интеграза. Когда провирусная ДНК интегрируется, она использует ферменты хозяйских клеток, чтобы продуцировать вирусную РНК, которая служит в качестве мРНК и в качестве генома после упаковки в вирионы.
В ходе вирусной репликации ненарушенная функция обратной транскриптазы является существенной. Следовательно, ингибирование обратной транскриптазы обеспечивает эффективный способ подавления репликации ретровирусов. Часть доступных в настоящее время препаратов против ВИЧ действует путем ингибирования обратной транскриптазы. В настоящее время наиболее эффективные виды терапии, направленные против вируса иммунодефицита человека, основаны на комбинациях различных препаратов против ВИЧ. Одним или двумя компонентами этих комбинаций являются ингибиторы обратной транскриптазы. Существуют два основных типа ингибиторов обратной транскриптазы. Один состоит из нуклеозидных аналогов, хорошо известным представителем этой группы является азидотимидин, т.е. AZT. Эти соединения ингибируют активность фермента путем соединения с нуклеотид-связывающим сайтом. Другой тип ингибиторов обратной транскриптазы представляют ненуклеозидные аналоги. Эти соединения также соединяются с ферментом, но не в нуклеотид-связывающем сайте. Связывание является специфичным, относительно устойчивым и приводит к деформации активного центра фермента, вызывая значительную потерю ферментной активности.
Ингибиторную активность соединений по изобретению в отношении обратной транскриптазы исследовали следующим образом. Данные соединения могут быть классифицированы как ненуклеозидные аналоги ингибиторов обратной транскриптазы. Опыты проводили на обратной транскриптазе вируса мышиного лейкоза Moloney, которая считается хорошей моделью фермента обратной транскриптазы ВИЧ. Постановка эксперимента была следующей.
С помощью анализов измеряли включение [3H]dTTP в кДНК, используя матрицу поли(dA) и праймер олиго(dT)12-18. Реакцию проводили в объеме 20 мкл.
Состав реакционной смеси:
2 мкл буфера 10 X,
20 мкл матричного праймера,
5 мкМ dTTP.
2 мКи [3H]dTTP,
исследуемое соединение, растворенное в буфере 1 X.
Реакцию начинали добавлением 5 ед. обратной транскриптазы.
Состав буфера 10 Х обратной транскриптазы:
500 мМ трис-HCl, рН 8,3,
80 мМ MgCl2,
300 мМ KCl,
100 мМ DTT.
Реакционную смесь инкубировали в течение 40 мин при 37°С. Затем 15 мкл реакционной смеси переносили на фильтровальные диски Whatman DE81, которые последовательно промывали 5% динатрийфосфатным буфером, водой и 96% (об./об.) этанолом. После высушивания фильтровальные диски помещали в 5 мл сцинтилляционной смеси (OptiPhase HiSafe 3, Wallac) и радиоактивность измеряли в сцинтилляционном счетчике Packard Tri-Carb CE.
В качестве положительного контроля в экспериментах использовали два соединения с известной ингибиторной активностью: нуклеозидный аналог AZT и ингибитор ненуклеозидного типа невирапин. Невирапин связывается с так называемым бензодиазепиновым связывающим сайтом фермента. Результаты экспериментов привели к следующим выводам. Соединения по изобретению ингибируют обратную транскриптазу вируса мышиного лейкоза Moloney. Исследуемые соединения использовали в концентрациях 0,2-2,0 мкг/мл. На основании дозозависимой ингибиторной активности в отношении обратной транскриптазы можно констатировать, что ингибирующее действие новых соединений выше, чем таковое для невирапина, но ниже, чем действие нуклеозидного аналога AZT. Поскольку использованный фермент рассматривается в качестве достоверной модели обратной транскриптазы ВИЧ, то наблюдаемые результаты могут рассматриваться как воздействия против ВИЧ.
Недавние данные показывают, что PARP необходим для интеграции в вирусный геном в клетку-хозяина и ингибирование PARP блокирует интеграцию в вирусный геном хозяйской ДНК. По этой причине нетоксичные ингибиторы PARP могут подавлять вирулентные ретровирусы и останавливать распространение ретровирусов, подобных ВИЧ и вирусов гепатита не типа В.
На основании приведенных выше экспериментальных результатов можно установить, что соединения по изобретению благодаря своему ингибиторному действию на обратную транскриптазу и PARP могут применяться также в качестве активных противовирусных веществ, имеющих несколько участков воздействия.
Таким образом, новые производные амидоксимов пропенкарбоновых кислот могут применяться в качестве активных ингредиентов фармацевтических композиций.
Следовательно, изобретение включает фармацевтическую композицию, содержащую в качестве активного ингредиента производное ненасыщенной гидроксамовой кислоты формулы I или N-оксид, или геометрические изомеры, и/или оптические изомеры, или фармацевтически приемлемую кислотно-аддитивную соль, и/или их четвертичное производное и один или несколько обычных носителей, применяемых в фармацевтических композициях.
Фармацевтическая композиция по изобретению, как правило, содержит 0,1-95% массовых, предпочтительно 1-50% массовых, приемлемо 5-30% массовых активного ингредиента и применима для лечения заболеваний, основу которых составляют состояния кислородной и энергетической недостаточности, ингибирование PARP, особенно аутоиммунных или нейродегенеративных и/или вирусных заболеваний, более того, для предотвращения токсических эффектов.
В связи с изобретением термин «активный ингредиент» означает соединение формулы I или его N-оксид, или один или несколько геометрических, и/или оптических изомеров соединения формулы I или N-оксида, фармацевтически приемлемую кислотно-аддитивную соль и/или четвертичную соль соединения формулы I или N-оксида, или фармацевтически приемлемую кислотно-аддитивную соль, и/или четвертичную соль изомеров соединения формулы I или N-оксида.
Фармацевтическая композиция по изобретению применима для перорального, парентерального или ректального введения или для местного лечения и может быть твердой или жидкой.
Твердые фармацевтические композиции, применимые для перорального введения, могут быть порошками, капсулами, таблетками, таблетками с нанесенным покрытием, микрокапсулами и т.д. и могут включать связывающие агенты, такие как желатин, сорбит, поли(винилпирролидон) и т.д.; наполнители, такие как лактоза, глюкоза, крахмал, фосфат кальция и т.д.; вспомогательные вещества для таблетирования, такие как стеарат магния, тальк, поли(этиленгликоль), двуокись кремния и т.д.; увлажняющие вещества, такие как лаурилсульфат натрия и т.д., в качестве носителя.
Жидкие фармацевтические композиции, применимые для перорального введения, могут быть растворами, суспензиями или эмульсиями и могут содержать, например, суспендирующие агенты, такие как желатин, карбоксиметилцеллюлоза и т.д.; эмульгаторы, такие как сорбитанмоноолеат и т.д.; растворители, такие как вода, масла, глицерин, пропиленгликоль, этанол и т.д.; консерванты, такие как метиловый эфир n-гидроксибензойной кислоты и т.д., в качестве носителя.
Фармацевтические композиции, применимые для парентерального введения, состоят, как правило, из стерильных растворов активного ингредиента.
Лекарственные формы, перечисленные выше, а также другие лекарственные формы являются по сути известными, смотри, например, Remington's Pharmaceutical Sciences, 18-oe издание, Mack Publishing Co., Easton, USA (1990).
Фармацевтическая композиция, как правило, содержит стандартную дозу. Типичная доза для взрослых пациентов составляет ежедневно 0,1-1000 мг соединения формулы I или N-оксида, или фармацевтически приемлемой кислотно-аддитивной соли, и/или четвертичного производного в расчете на 1 кг массы тела. Суточная доза может быть введена в виде одной или нескольких порций. Эффективная доза зависит от многих факторов и определяется врачом.
Фармацевтическая композиция приготавливается путем смешения активного ингредиента с одним или более носителями и превращения получаемой смеси в фармацевтическую композицию известным по существу способом. Применяемые методики известны из литературы, например, упомянутые выше Remington's Pharmaceutical Sciences.
Предпочтительная подгруппа фармацевтической композиции по изобретению содержит в качестве активного ингредиента производное амидоксима пропенкарбоновой кислоты формулы Ia, где R, R', R3, R4 и R5 имеют значения, определенные в связи с формулой Ia, или N-оксид, или геометрические изомеры, и/или оптические изомеры, или их фармацевтически приемлемую кислотно-аддитивную соль, и/или четвертичную соль.
Другая предпочтительная группа фармацевтической композиции по изобретению содержит в качестве активного ингредиента производное амидоксима пропенкарбоновой кислоты формулы Ib, где R, R', R3, R4, R5 и Х имеют значения, определенные в связи с формулой Ib, или N-оксид, или геометрические изомеры, и/или оптические изомеры, или их фармацевтически приемлемую кислотно-аддитивную соль, и/или четвертичную соль.
Дополнительная предпочтительная группа фармацевтической композиции по изобретению содержит в качестве активного ингредиента производное амидоксима пропенкарбоновой кислоты формулы Ic, где R, R', R4 и R5 имеют значения, определенные в связи с формулой Ic, или N-оксид, или геометрические изомеры, и/или оптические изомеры, или их фармацевтически приемлемую кислотно-аддитивную соль, и/или четвертичную соль.
Изобретение включает способ лечения, при котором пациент, страдающий особенно от состояния, связанного с кислородной недостаточностью и/или энергетической недостаточностью, или от заболевания, основанного на подавлении PARP, особенно аутоиммунного или нейродегенеративного заболевания, и/или вирусного заболевания, и/или болезни, вызванной токсическим эффектом, подвергается терапии нетоксичной дозой производного амидоксима пропенкарбоновой кислоты формулы I или N-оксида, или геометрического изомера, и/или оптического изомера, или их фармацевтически приемлемой кислотно-аддитивной соли, и/или четвертичного производного.
Кроме того, изобретение включает применение производного амидоксима пропенкарбоновой кислоты формулы I или N-оксида, или геометрического изомера, и/или оптического изомера, или их фармацевтически приемлемой кислотно-аддитивной соли, и/или четвертичного производного для получения фармацевтической композиции, применимой для лечения состояния, связанного с кислородной недостаточностью и/или энергетической недостаточностью, или заболевания, основанного на подавлении PARP, особенно аутоиммунного или нейродегенеративного заболевания, и/или вирусного заболевания, и/или болезни, вызванной токсическим воздействием.
В дальнейшем изобретение разъясняется посредством следующих примеров.
Примеры
Пример 1
Гидрохлорид 3-стирил-4-(3-пиперидинопропил)-Δ2-1,2,4-оксадиазолин-5-она
Растворяли 0,94 г (0,005 моля) 3-стирил-Δ2-1,2,4-оксадиазолин-5-она в 6 мл ацетона, к полученному раствору прибавляли 1,19 г (0,006 моля) гидрохлорида 1-хлор-3-пиперидинопропана, 0,76 г (0,0055 моля) безводного карбоната калия, 1 мл метанола и 0,05 г йодида калия. Реакционную смесь нагревали при кипении в течение 20 ч, неорганические соли отделяли фильтрованием и раствор упаривали при пониженном давлении. Оставшийся маслообразный неочищенный продукт растворяли в изопропаноле, полученный раствор подкисляли путем прибавления раствора хлористого водорода в изопропаноле, реакционную смесь оставляли стоять в холодильнике в течение ночи и осажденные кристаллы отделяли фильтрованием. Таким образом получали 1,05 г заглавного соединения; tпл: 203-205°С.
ИК (KBr, v, см-1): 2550-2650 (NH+), 1768 (СО), 1639 (C=N).
1Н-ЯМР (ДМСО-d6, δ): 1,3-1,85 (6Н, m, 3,4,5-СН2 пиперидина), 2,11 (2Н, m, CH2пропила), 2,82 (2Н, m, СН2 пиперидина), 3,09 (2Н, m, -CH2-N), 3,36 (2Н, m, CH2пиперидина), 3,87 (2Н, m, -ОСН2-), 7,12 (1Н, d, арил

Пример 2
Гидрохлорид 3-стирил-4-(3-пиперидино-2-гидроксипропил)-Δ2 -1,2,4-оксадиазолин-5-она
А) Растворяли 2,25 г (0,008 моля) 3-стирил-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она в 10 мл этанола, к полученному раствору прибавляли 0,68 г (0,008 моля) пиперидина, смесь нагревали до 50°С и при перемешивании прибавляли по каплям раствор 0,32 г (0,008 моля) гидроксида натрия в 2 мл воды. Реакционную смесь перемешивали при 50-55°С в течение дополнительных 2 ч, выпавшие кристаллы отделяли фильтрованием, сушили, затем растворяли в этаноле при нагревании и полученный раствор подкисляли добавлением раствора хлористого водорода в изопропаноле. Реакционную смесь оставляли стоять в холодильнике в течение ночи, выпавшие кристаллы отделяли фильтрованием и сушили. Таким образом получали 1,09 г заглавного соединения; tпл: 234-235°С.
3-Стирил-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-он, использованный в качестве исходного соединения, получали реакцией 3-стирил-Δ2-1,2,4-оксадиазолин-5-она и эпихлоргидрина в соответствии с методикой, описанной в литературе [Chem. Ber., 108, 1911 (1975)].
1Н-ЯМР (ДМСО-d6, δ): 1,3-1,9 (6Н, m, 3,4,5-СН2 пиперидина), 2,9-3,6 (6Н, m, 3СН2), 3,8 (2Н, m, 1-СН2 пропила), 4, 35 (1Н, m,




Б) Растворяли 0,65 г (0,0027 моля) 3-стирил-4-(2,3-эпоксипропил)-Δ2-1,2,4-оксадиазолин-5-она в 2 мл метанола и к полученному раствору прибавляли 0,24 г (0,0028 моля) пиперидина. Реакционную смесь, которая становилась теплой, оставляли на четыре ч. Выпавшие кристаллы отделяли фильтрованием, затем растворяли в изопропаноле. Раствор подкисляли, прибавляя раствор хлористого водорода в изопропаноле. Таким образом кристаллизовалось 0,38 г заглавного продукта, который идентичен соединению, полученному в разделе. A; tпл: 234-235°С. 3-Стирил-4-(2,3-эпоксипропил)-Δ2-1,2,4-оксадиазолин-5-он, использованный в качестве исходного соединения, получали следующим образом: растворяли 1,5 г (0,0053 моля) 3-стирил-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-он в 5 мл ацетона, к полученному раствору прибавляли 0,73 г безводного карбоната калия, реакционную смесь нагревали при кипении в течение 16 ч, затем фильтровали и упаривали при пониженном давлении. Таким образом получали 1,41 г 3-стирил-4-(2,3-хлор-2-эпоксипропил)Δ2-1,2,4-оксадиазолин-5-она в виде маслообразного вещества.
В) Растворяли 0,3 г (0,0016 моля) 3-стирил-Δ2-1,2, 4-оксадиазолин-5-она в 3 мл ацетона, к полученному раствору прибавляли 0,41 г (0,0019 моля) гидрохлорида 3-пиперидино-2-гидрокси-1-хлорпропана, 0,48 г безводного карбоната калия, 1 мл метанола и 0,05 г йодида калия. Реакционную смесь нагревали при кипении в течение 40 ч, затем фильтровали и растворитель отгоняли при пониженном давлении. Остаток растворяли в 5% водной соляной кислоте, раствор фильтровали и фильтрат подщелачивали прибавлением 10% водного раствора гидроксида натрия. Осажденный продукт экстрагировали хлороформом, раствор сушили над безводным сульфатом натрия, растворитель упаривали при пониженном давлении. Остаток растворяли в изопропаноле и полученный раствор подкисляли, добавляя раствор хлористого водорода в изопропаноле. Кристаллизовалось 0,18 г продукта, который идентичен заглавному соединению, полученному в разделе А; tпл: 234-235°С.
Пример 3
Гидрохлорид 3-стирил-4-(3-пирролидино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она
Растворяли 8,4 г (0,03 моля) 3-стирил-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она в 30 мл этанола, к полученному раствору прибавляли 2,55 г (0,036 моля) пирролидина, затем по каплям при перемешивании при 60°С раствор 1,2 г (0,03 моля) гидроксида натрия в 8 мл воды. Реакционную смесь перемешивали дополнительно в течение 1 ч при 60°С, затем этанол отгоняли при пониженном давлении. Остаток подкисляли, прибавляя концентрированную водную соляную кислоту, раствор обрабатывали активированным углем, фильтровали и подщелачивали, добавляя 2 н. водный раствор гидроксида натрия. Осажденное маслообразное вещество экстрагировали хлороформом, органический раствор сушили над безводным сульфатом натрия, фильтровали и упаривали. Остаток растворяли в изопропаноле, полученный раствор подкисляли, прибавляя раствор хлористого водорода в изопропаноле. Кристаллы отделяли фильтрованием и сушили. Таким образом получали 1,8 г заглавного соединения; tпл: 188-189°С.
1Н-ЯМР (ДМСО-d6, δ): 1,8-2,0 (4Н, m, 3,4-СН2 пирролидина), 3,06-3,55 (6Н, m, 3СН2), 3,82 (2Н, d, 1-СН2 пропила), 4,21 (1Н, m,




Пример 4
Гидрохлорид 3-стирил-4-(3-гексаметиленимино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она
Вводили в реакцию 2,8 г (0,01 моля) 3-стирил-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она с 1,19 г (0,012 моля) гексаметиленимина в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждали в растворе изопропанола, прибавляя раствор хлористого водорода в изопропаноле. Таким образом получали 1,0 г заглавного соединения; tпл: 202-203°С.
1Н-ЯМР (CDCl3 + ДМСО-d6, δ): 1,6-2,0 (8Н, m, 3,4,5,6-СН2 гесаметиленимина), 3,1-3,6 (6Н, m, 3СН2), 3,8 (2Н, m, 1-СН2 пропила), 4,35 (1Н, m,



Пример 5
Гидрохлорид 3-стирил-4-(3-морфолино-2-гидроксипропил)-Δ2 -1,2,4-оксадиазолин-5-она
Вводили в реакцию 4,2 г (0,015 моля) 3-стирил-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она с 1,6 г (0,018 моля) морфолина в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждали в этанольном растворе добавлением раствора хлористого водорода в изопропаноле. Таким образом получали 0,67 г заглавного соединения; tпл: 232-234°С.
1Н-ЯМР (ДМСО-d6, δ): 3,1-3,55 (6Н, m, 3,5-CH2 морфолина, 3-СН2 пропила), 3,8-4,0 (6Н, m, 2, 6-СН2 морфолина, 1-CH2 пропила), 4,37 (1Н, m,



Пример 6
Гидрохлорид 3-стирил-4-[3-(трет.-бутиламино)-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-5-она
Вводили в реакцию 6,6 г (0,024 моля) 3-стирил-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она с 2,63 г (0,036 моля)трет.-бутиламина в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждали в изопропанольном растворе, прибавляя раствор хлористого водорода в изопропаноле. Таким образом получали 1,8 г заглавного соединения; tпл: 244-246 С.
1Н-ЯМР (ДМСО-d6, δ): 1,3 (9Н, s, трет.-бутил), 2,9-3,15 (2Н, m, 3-CH2 пропила), 3,85 (2Н, m, 1-СН2 пропила), 4,15 (1Н, m,

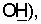


Пример 7
Дигидрохлорид 3-стирил-4-[3-(4-метил-1-пиперазинил)-2-гидроксипропил]-Δ2-1,2, 4-оксадиазолин-5-она
Вводили в реакцию 8,4 г (0,03 моля) 3-стирил-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она с 3,6 г (0,036 моля) N-метилпиперазина в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждали в изопропанольном растворе, прибавляя раствор хлористого водорода в изопропаноле. Таким образом получали 2,08 г заглавного соединения; tпл: 206-208°С.
1Н-ЯМР (ДМСО-d6, δ): 2,77 (3Н, s, СН3), 3,01-3,1 (2Н, m, 3-CH2 пропила), 3,6 (8Н, m, СН2 пиперазина), 3,8 (2Н, m, 1-СН2 пропила), 4,23 (1Н, m,

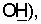


Пример 8
Гидрохлорид 3-стирил-4-[3-(1,2,3,4-тетрагидро-2-изохинолил)-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-5-она
Вводили в реакцию 2,8 г (0,01 моля) 3-стирил-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она с 1,6 г (0,012 моля) 1,2,3,4-тетрагидроизохинолина в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждали в изопропанольном растворе, прибавляя раствор хлористого водорода в изопропаноле. Таким образом получали 0,83 г заглавного соединения; tпл: 208-210°С.
1Н-ЯМР (ДМСО-d6, δ): 3,0-3,6 (8Н, m, CH2 изохинолина, 3СН2 пропила), 3,84 (2Н, m, 1-СН2 пропила), 4,4 (1Н, m,

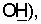


Пример 9
Гидрохлорид 3-стирил-4-[3-(2,6-диметиланилино)-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-5-она
Вводили в реакцию 8,4 г (0,03 моля) 3-стирил-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она с 4,36 г (0,036 моля) 2, 6-диметиланилина в 50 мл метанола в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждали в изопропанольном растворе, прибавляя раствор хлористого водорода в изопропаноле, затем кристаллизовали из смеси одного объема изопропанола и одного объема этанола. Таким образом получали 1,62 г заглавного соединения; tпл: 182-184°С.
1Н-ЯМР (ДМСО -d6, δ): 2,44 (6Н, s, 2СН3), 3,16-3,53 (2Н, m, 3-СН2 пропила), 3,86 (2Н, m, 1-СН2 пропила), 4,21 (1Н, m,

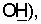


Пример 10
Гидрохлорид 3-(3, 4-диметоксистирил)-4-(3-пиперидино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она
Вводили в реакцию 3,4 г (0,01 моля) 3-(3, 4-диметоксистирил)-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-онас 1,02 г (0,012 моля) пиперидина в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждали в этанольном растворе, прибавляя раствор хлористого водорода в изопропаноле. Таким образом получали 1,8 г заглавного соединения; tпл: 187-188°С.
1Н-ЯМР (CDCl3 + ДМСО-d6, δ): 1,4-2,0 (6Н, m, 3,4,5-CH2 пиперидина), 3,18-3,31 (6Н, m, 2,6-СН2 пиперидина, 3-СН2 пропила), 3,85-3,92 (2Н, m, 1-CH2 пропила), 3,89 (3Н, s, -ОСН3), 3,96 (3Н, s, -ОСН3), 4,45 (1Н, m,

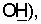


3-(3,4-Диметоксистирил)-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-он, использованный в качестве исходного соединения, получали из 3-(3, 4-диметоксистирил)-Δ2-1,2,4-оксадиазолин-5-она и эпихлоргидрина в соответствии с методикой, известной из литературы [Chem. Ber, 108, 1911 (1975)].
Пример 11
Гидрохлорид 3-стирил-4-[3-(1-метил-4-пиперазинил)-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-5-она
Вводили в реакцию 2,0 г (0,0059 моля) 3-(3,4-диметоксистирил)-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она с 0,71 г (0,0071 моля) N-метилпиперазина в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждали в изопропанольном растворе, прибавляя раствор хлористого водорода в изопропаноле. Таким образом получали 0,8 г заглавного соединения; tпл: 192-193°С.
1Н-ЯМР (ДМСО-d6, δ): 2,8 (3Н, s, N-СН3), 3,2-3,8 (10Н, m, CH2 пиперазина, 3-СН2 пропила), 3,80 (3Н, s, ОСН3), 3,83 (2Н, m, 1-СН2 пропила), 3,86 (3Н, s, -ОСН3), 4,31 (1Н, m,

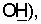


Пример 12
Амидоксим N-(пиперидино-2-гидроксипропил)коричной кислоты
В соответствии с методикой, описанной в примере 2, прибавляли к 1, 91 г (0,006 моля) 3-стирил-4-(3-пиперидино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она 10 мл этанола и 10 мл 10% водного раствора гидроксида натрия и реакционную смесь нагревали при кипении в течение 2 ч. Этанол упаривали при пониженном давлении, значение рН остатка доводили до 8 прибавлением соляной кислоты. Декантировали водную фазу с частично твердого продукта, остаток растворяли в метаноле. При разбавлении водой кристаллизовалось 0,79 г заглавного соединения; tпл: 114-115°С.
1Н-ЯМР (ДМСО-d6, δ): 1,7-1,9 (6Н, m, 3,4,5-СН2 пиперидина), 2,1-2,3 (6Н, m, 2,6-СН2 пиперидина, 3-СН2 пропила), 3,2-3,33 (2Н, m, 1-СН2 пропила), 3,83 (1Н, m,



Пример 13
Дималеат (моноаддитивный) амидоксима N-(3-морфолино-2-гидроксипропил)коричной кислоты
В соответствии с методикой, описанной в примере 5, прибавляли к 2,76 г (0,0075 моля) 3-стирил-4-(3-морфолино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она 10 мл этанола и 10 мл 10% водного раствора гидроксида натрия и реакционную смесь нагревали при кипении в течение 2 ч. Этанол упаривали при пониженном давлении, значение рН остатка доводили до 8 прибавлением соляной кислоты. Осажденный маслообразный продукт экстрагировали дихлорметаном, органический раствор сушили над безводным сульфатом натрия, растворитель упаривали. Малеат осаждали в ацетоновом растворе, прибавляя малеиновую кислоту. Таким образом получали заглавное соединение; tпл: 128-130°С.
1Н-ЯМР (CDCl3 + ДМСО-d6, δ): 2,8-3,2 (6Н, 3,5-СН2 морфолина, 3-СН2 пропила), 3,3-3,8 (6Н, m, 2,6-СН2 морфолина, 1-СН2 пропила), 4,10 (1Н, m,



Пример 14
Трималеат (моноаддитивный) амидоксима N-[3-(1-метил-4-пиперазинил)-2-гидроксипропил] коричной кислоты
В соответствии с методикой, описанной в примере 7, 1,17 г (0,0025 моля) 3-стирил-4-[3-(4-метил-1-пиперазинил)-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-5-она вводили в реакцию с гидроксидом натрия. Малеат осаждали в ацетоновом растворе, прибавляя малеиновую кислоту. Таким образом получали 0,63 г заглавного соединения; tпл: 142-143°С.
1Н-ЯМР (ДМСО-d6, δ): 2,7 (3Н, s, СН3), 2,5-3,2 (10Н, m, СН; пиперазина, 3-СН2пропила), 3,31-3,42 (2Н, m, 1-СН2 пропила), 3,81 (1Н, m,



Пример 15
Амидоксим N-(3-морфолино-2-гидроксипропил)-3,4-диметоксикоричной кислоты
В соответствии с методикой, описанной в примере 13, вводили в реакцию 3,91 г (0,01 моля) 3-(3,4-диметоксистирил)-4-(3-морфолино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она с гидроксидом натрия. Таким образом получали 1,2 г заглавного соединения в виде маслообразного продукта.
1Н-ЯМР (ДМСО-d6, δ): 3,18-3,35 (6Н, 3,5-СН2 морфолина, 3-СН2 пропила), 3,60 (2Н, m, 1-СН2 пропила), 3,60 (2Н, m, 1-СН2 пропила), 3,82 (3Н, s, ОСН3), 3,86 (3Н, s, ОСН3), 3,92 (4Н, m, 2,6-СН2 морфолина), 4,34 (1Н, m,




Пример 16
3-Стирил-6-(пиперидинометил)-4H-5,6-дигидро-1,2,4-оксадиазин
К 1,65 г (0, 0043 моля) гидрохлорида 3-стирил-4-(3-пиперидино-2-хлорпропил)-Δ2-1,2,4-оксадиазолин-5-она прибавляли смесь 33 мл этанола и 33 мл 2 н. водного раствора гидроксида натрия, реакционную смесь нагревали при кипении в течение 30 мин при перемешивании, затем упаривали при пониженном давлении и остаток суспендировали в 10 мл воды. Кристаллы отделяли фильтрованием, промывали водой и сушили. Таким образом получали 1,06 г заглавного соединения; tпл: 147-149°С.
1Н-ЯМР (ДМСО-d6, δ): 1,3-1,7 (6Н, m, 3,4,5-СН2 пиперидина), 2,3-2,7 (6Н, m, 2,6-СН2 пиперидина, 6-СН2), 3,25-3,6 (2Н, m, 5-СН2 оксадиазина), 3,95 (1Н, m, 6-СН оксадиазина), 5,0 (1Н, уш., 4-NH оксадиазина), 6,5 (1Н, d, арил


Используемый в качестве исходного гидрохлорид 3-стирил-4-(3-пиперидино-2-хлорпропил)-Δ2-1,2, 4-оксадиазолин-5-она получали из гидрохлорида 3-стирил-4-(3-пиперидино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она (полученного, как описано в примере 2) с тионилхлоридом в соответствии с методикой, известной из литературы [Chem. Ber., 108, 1911 (1975)].
Пример 17
Дималеат (моноаддитивный) 3-стирил-6-морфолинометил-4H-5,6-дигидро-1,2,4-оксадиазина
К 1,5 г (0,0039 моля) гидрохлорида 3-стирил-4-(3-морфолино-2-хлорпропил)-Δ2-1,2,4-оксадиазолин-5-она прибавляли 9 мл этанола и 9 мл 10% водного раствора гидроксида натрия, реакционную смесь нагревали при кипении в течение 30 мин. Этанол упаривали при пониженном давлении, остаток подкисляли 5% соляной кислотой. Полученный раствор обрабатывали активированным углем, фильтровали и подщелачивали путем прибавления 10% водного раствора гидроксида натрия. Осажденное маслянистое вещество экстрагировали хлороформом, органическую фазу сушили над безводным сульфатом натрия, фильтровали и растворитель упаривали. Остаток растворяли в этилацетате и прибавляли раствор 0,66 г малеиновой кислоты в этилацетате. Таким образом получали 1,0 г заглавного продукта; tпл:137°С.
1H-ЯМР (ДМСО-d6, δ):3,1-3,44 (8Н, m, 5-СН2, 6-СН2; 3- и 5-СН2 морфолина), 3,82 (4Н, m, 2- и 6-СН2 морфолина), 4,08 (1Н, m, 6-СН), 6,18 (4Н, s, CH малеиновой кислоты), 6,43 (1Н, d, арил

Использованный в качестве исходного соединения гидрохлорид 3-стирил-4-(3-морфолино-2-хлорпропил)-Δ2-1,2,4-оксадиазолин-5-она получали из гидрохлорида 3-стирил-4-(3-морфолино-2-гидроксипропил)-Δ2-1,2, 4-оксадиазолин-5-она (полученного в соответствии с примером 5) нагреванием с тионилхлоридом, затем упариванием реакционной смеси.
Пример 18
Дималеат (моноаддитивный) 3-стирил-6-(1,2,3,4-тетрагидро-2-изохинолил)метил-4H-5,6-дигидро-1,2,4-оксадиазина
К 1,1 г (0,0025 моля) гидрохлорида 3-стирил-4-[3-(1,2,3, 4-тетрагидро-2-изохинолил)-2-хлорпропил)-Δ2-1,2,4-оксадиазолин-5-она прибавляли 8 мл этанола и 8 мл 10% водного раствора гидроксида натрия и реакционную смесь нагревали при кипении в течение получаса. Этанол упаривали при пониженном давлении, остаток растворяли в 5% соляной кислоте. Раствор обрабатывали активированным углем, фильтровали, подщелачивали путем прибавления 10% водного раствора гидроксида натрия и экстрагировали этилацетатом. Объединенные этилацетатные растворы сушили над безводным сульфатом натрия, фильтровали и упаривали. Остаток растворяли в этилацетате и к полученному раствору прибавляли 0,36 г малеиновой кислоты. Таким образом получали 0,55 г заглавного соединения; tпл: 151-153°С.
1Н-ЯМР (ДМСО-d6, δ): 3,10 (2Н, m, 4-CH2 изохинолина), 3,15-3,50 (2Н, m, 5-CH2оксадиазина), 3,28-3,39 (2Н, m,

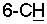


Пример 19
Гидрохлорид 3-(3,4-диметоксистирил)-4-[3-(трет.-бутиламино)-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-5-она
Растворяли 8,54 г (0,025 моля) 3-(3,4-диметоксистирил)-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она в 40 мл ацетона, к полученному раствору прибавляли 3,46 г (0,025 моля) безводного карбоната калия. Реакционную смесь нагревали при кипении в течение 6 ч, затем охлаждали, неорганические соли удаляли фильтрованием, растворитель упаривали при пониженном давлении. Остаток после упаривания растирали с 25 мл метанола, чтобы вызвать кристаллизацию. Таким образом получали 6,5 г 3-(3,4-диметоксистирил)-4-(2,3-эпоксипропил)-Δ2-1,2,4-оксадиазолин-5-она; tпл: 113-115° С.
К 3,04 г (0,01 моля) 3-(3,4-диметоксистирил)-4-(2,3-эпоксипропил)-Δ2-1,2,4-оксадиазолин-5-она прибавляли 15 мл метанола и 0,73 г (0,01 моля) трет.-бутиламина, реакционную смесь нагревали при кипении в течение 4 ч, затем растворитель упаривали при пониженном давлении. Остаток растворяли в 10 мл 5% соляной кислоты и растворитель декантировали с осадка, который не растворился. Водный раствор подщелачивали путем добавления 10% водного раствора гидроксида натрия, образовавшееся масло растворяли в дихлорметане, раствор сушили над безводным сульфатом натрия, фильтровали и растворитель упаривали при пониженном давлении. Получали 1,7 г маслообразного продукта, из которого гидрохлорид осаждали в этаноле при добавлении изопропанола, содержащего хлористый водород. Таким образом получали 1,0 г заглавного соединения; tпл: 225-227°С.
1Н-ЯМР (ДМСО-d6, δ): 1,3 (9Н, s, 3СН3), 2,93-3,17 (2Н, m, 3-CH2 пропила), 3,80 (3Н, s,





Пример 20
Гидрохлорид 3-(3, 4-диметоксистирил)-4-(3-морфолино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она
Вводили в реакцию 3,04 г (0,01 моля) 3-(3,4-диметоксистирил)-4-(2, 3-эпоксипропил)-Δ2-1,2,4-оксадиазолин-5-она (полученного, как описано в примере 19) с 0,96 г (0,11 моля) морфолина способом, описанным в примере 19. Таким образом получали 0,8 г заглавного соединения; tпл:228-230°С.
1Н-ЯМР (ДМСО-d6, δ): 3,2-3,34 (6Н, m, 3,5-CH2 морфолина, 3-CH2 пропила), 3,82 (3Н, s, -ОСН3), 3,86 (2Н, d, 1-СН2 пропила), 3,88 (3Н, s, -ОСН3), 3,90 (4Н, m, 2,6-СН2морфолина), 4,43 (1H, m,
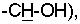


Пример 21
Амидоксим N-[3-(2,6-диметиланилино)-2-гидроксипропил]коричной кислоты
Следовали методике, описанной в примере 12, с тем отличием, что в качестве исходного соединения использовали 1,5 г (0,004 моля) 3-стирил-4-[3-(2,6-диметиланилино)-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-5-она (полученного в соответствии с примером 9).Таким образом получали 0,55 г заглавного соединения; tпл: 143-144°C.
1Н-ЯМР (ДМСО-d6, δ): 2,20 (6Н, s, 2СН3), 2,82-3,03 (2Н, m, 3-СН2 пропила), 3,15-3,27 (2Н, m, 1-СН2 пропила), 3,64 (1H, m,





Пример 22
Амидоксим N-(3-пирролидино-2-гидроксипропил)коричной кислоты
Следовали методике, описанной в примере 12, с тем исключением, что в качестве исходного соединения использовали гидрохлорид 3-стирил-4-(3-пирролидино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она (полученный в соответствии с примером 3). Таким образом получали 0,65 г заглавного соединения; tпл: 139-141°С (из 96% этанола).
1Н-ЯМР (CDCl3 + ДМСО-d6, δ): 1,74 (4Н, m, 3,4-CH2 пирролидина), 2,50-2,64 (6Н, m, 2,5-СН2 пирролидина, 3-СН2 пропила), 3,2-3,35 (2Н, m, 1-СН2 пропила), 3,75 (1Н, m,




Пример 23
Амидоксим N-[3-(1,2,3,4-тетрагидро-2-изохинолил)-2-гидроксипропил]коричной кислоты
3,83 г (0,009 молей) гидрохлорида стирил-4-[3-(1,2,3, 4-тетрагидро-2-изохинолил)-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-5-она, полученного в соответствии с методикой, описанной в примере 8, подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 13. Маслообразный продукт растворяют в этилацетате и оставляют стоять. Получают 2,51 г указанного в заголовке соединения в виде кристаллов, содержащих 1 моль этилацетата в виде кристаллической жидкости. Тпл.: 72°С.
ИК (KBr) ν=3100-3400 (NH, ОН), 1730 (-CO-OC2H5), 1640 (C=N) см-1.
Пример 24
Амидоксим N-(3-трет.-бутиламино-2-гидроксипропил)коричной кислоты
2,24 г (0,006 молей) гидрохлорида стирил-4-[(3-трет.-бутиламино)-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-5-она, полученного в соответствии с методикой, описанной в примере 6, подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 13. Получают 2,0 г указанного в заголовке соединения. После перекристаллизации из этилацетата Тпл.: 152-154°С.
1H-ЯМР (ДМСО-d6) δ=1,05 (9Н, s, трет.-бутил), 2,45-2,55 (2Н, m, пропил-3-СН2), 3,11-3,26 (2Н, m, пропил-1-CH2), 3,52 (1Н, m,
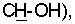



Пример 25
Дималеат N-(3-гексаметиленимино-2-гидроксипропил)коричной кислоты 3,62 г (0,01 молей) гидрохлорида стирил-4-[(3-гексаметиленимино-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-5-она, полученного в соответствии с методикой, описанной в примере 4, подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 13. Дималеат осаждают в растворе изопропанола при добавлении малеиновой кислоты. В результате получают 2,51 г указанного в заголовке соединения. Тпл.: 134°С.
1Н-ЯМР (ДМСО-d6) δ=1,5-1,9 (8Н, m, гексаметаленимин-3,4,5,6-СН2), 3,1-3,4 (8Н, m, 4×СН3), 4,02 (1Н, m,



Пример 26
Дималеат амидоксима N-(3-пиперидино-2-гидроксипропил)-3,4-диметоксикоричной кислоты
4,25 г (0,01 молей) гидрохлорида 3-(3,4-диметоксистирил)-4-(3-пиперидино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она, полученного в соответствии с методикой, описанной в примере 10, подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 13. Дималеат осаждают в растворе изопропанола при добавлении малеиновой кислоты. В результате получают 1,14 г указанного в заголовке соединения. Тпл.: 119-121°С.
1Н-ЯМР (ДМСО-d6) δ=1,4-1,9 (6Н, m, пиперидин, 3,4,5-СН2), 2,8-3,6 (8Н, m, пиперидин-2,6-СН2, пропил 1-и 3-СН2), 3,79 (3H, s, ОСН3) 3,81 (3H, s, ОСН3), 4,08 (1Н, m,



Пример 27
Дималеат амидоксима N-(3-пирролидино-2-гидроксипропил)-4-метоксикоричной кислоты
1,5 г (0,004 молей) гидрохлорида 3-(4-метоксистирил)-4-(3-пирролидино-2-гидроксипропил)-Δ2-1,2, 4-оксадиазолин-5-она, полученного в соответствии с методикой, описанной в примере 28, подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 13. Дималеат осаждают в растворе изопропанола при добавлении малеиновой кислоты. В результате получают 1,52 г указанного в заголовке соединения. Тпл.: 133°С.
1Н-ЯМР (ДМСО-d6) δ=1,8-2,05 (4Н, m, пирролидин-3,4-CH2), 3,1-3,25 (4Н, m, пирролидин-2,5-СН2), 3,25-3,35 (2Н, m, пропил 3-СН2), 3,80 (2Н, m, пропил-1-СН2), 3,85 (3H, s, ОСН3), 3,92-4,00 (1Н, m,



Пример 28
Гидрохлорид 3-(4-метоксистирил)-4-(3-пирролидино-2-гидроксипропил)-Δ2-1,2, 4-оксадиазолин-5-он
10,74 г (0,035 молей) 3-(4-метоксистирил)-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она подвергают взаимодействию с 3,32 г (0,047 молей) пирролидина в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждают в растворе изопропанола путем добавления хлористого водорода в изопропанол. В результате получают 2,67 г указанного в заголовке соединения. Тпл.: 171°С.
1Н-ЯМР (ДМСО-d6) δ=1,8-2,04 (4Н, m, пирролидин-3,4-СН2), 3,05-3,06 (4Н, m, пирролидин-2, 5-СН2), 3,21-3,36 (2Н, m, пропил 3-СН2), 3,80 (2Н, m, пропил-1-СН2), 3,81 (3H, s, ОСН3), 4,20 (1Н, m,



3-(4-метоксистирил)-4-(3-хлор-2-гидроксипропил)-Δ2 -1,2,4-оксадиазолин-5-он, используемый в качестве исходного соединения, получают путем взаимодействия 3-(4-метоксистирил)-Δ2-1,2,4-оксадиазолин-5-она с эпихлоргидрином по известной из литературы методике (Chem. Ber., 108,1911 (1975)).
Пример 29
Дималеат амидоксима N-(3-пиперидино-2-гидроксипропил)-4-метоксикоричной кислоты
1,83 г (0,005 молей) гидрохлорида 3-(4-метоксистирил)-4-(3-пиперидино-2-гидроксипропил)-Δ2-1,2, 4-оксадиазолин-5-она, полученного в соответствии с методикой, описанной в примере 30, подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 13. Дималеат осаждают в растворе изопропанола при добавлении малеиновой кислоты. В результате получают 1,77 г указанного в заголовке соединения. Тпл.: 129-132°С.
1Н-ЯМР (ДМСО-d6) δ=1,3-1,9 (6Н, m, пиперидин, 3,4,5-СН2), 2,98-3,40 (8Н, m, пиперидин-2,6-СН2, пропил 1,3-CH2), 3,79 (3H, s, -ОСН3) 4,10 (1Н, m,



Пример 30
Гидрохлорид 3-(4-метоксистирил)-4-(3-пиперидино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-он
5,6 г (0,018 молей) 3-(4-метоксистирил)-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она подвергают взаимодействию с 2,08 г (0,024 молей) пиперидина в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждают в растворе изопропанола путем добавления хлористого водорода в изопропанол. В результате получают 1,24 г указанного в заголовке соединения. Тпл.: 204° С.
1H-ЯМР (ДМСО-d6) δ=1,3-2,0 (6Н, m, пиперидин-3,4,5-СН2), 2,95-3,51 (6Н, m, пиперидин-2,6-СН2, пропил-3-СН2), 3,79 (2Н, m, пропил 1-CH2), 3,81 (3H, s, ОСН3), 4,33 (1Н, m,



Пример 31
Дималеат амидоксима N-(3-пирролидино-2-гидроксипропил)-3,4-диметоксикоричной кислоты
1,49 г (0,004 молей) 3-(3,4-диметоксистирил)-4-(3-пирролидино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она, полученного в соответствии с методикой, описанной в примере 32, подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 13. Дималеат осаждают в растворе изопропанола при добавлении малеиновой кислоты. В результате получают 0,87 г указанного в заголовке соединения. Тпл.: 125-127°С.
1Н-ЯМР (ДМСО-d6) δ=1,94 (4Н, m, пирролидин-3,4-СН2), 3,14-3,35 (8Н, m, пирролидин-2,5-СН2, пропил 1,3-СН2), 3,79 (3H, s, ОСН3), 3,81 (3H, s, ОСН3), 3,98 (1Н, m,



Пример 32
3-(3,4-диметоксистирил)-4-(3-пирролидино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-он
5,00 г (0,016 молей) 3-(3,4-диметоксистирил)-4-(2, 3-эпоксипропил)-Δ2-1,2,4-оксадиазолин-5-она подвергают взаимодействию с 1,28 г (0,018 молей) пирролидина в соответствии с методикой, описанной в примере 2Б. Вместо стадии образования соли неочищенное основание используют в качестве исходного продукта на следующей стадии синтеза.
Пример 33
Дималеат амидоксима N-(3-трет.-бутиламино-2-гидроксипропил)-3, 4-диметоксикоричной кислоты
3,42 г (0,009 молей) гидрохлорида 3-(3,4-диметоксистирил)-4-(3-трет.-бутиламино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она, полученного в соответствии с методикой, описанной в примере 19, подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 13. Дималеат осаждают в растворе изопропанола при добавлении малеиновой кислоты. В результате получают 1,29 г указанного в заголовке соединения. Тпл.: 95-99°С.
1H-ЯМР (ДМСО-d6) δ=1,27 (9Н, s, 3×СН3), 2,78-3,06 (2Н, m, пропил-3-CH2), 3,41 (2Н, m, пропил-1-СН2), 3,79 (3H, s, ОСН3), 3,81 (3H, s, ОСН3), 3,89 (1Н, m,




Пример 34
Дималеат амидоксима N-(3-гексаметиленимино-2-гидроксипропил)-4-метоксикоричной кислоты
4,5 г (0,011 молей) гидрохлорида 3-(4-метоксистирил)-4-[(3-гексаметиленимино-2-гидроксипропил)-Δ2-1, 2,4-оксадиазолин-5-она, полученного в соответствии с методикой, описанной в примере 35, подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 13. Дималеат осаждают в растворе изопропанола при добавлении малеиновой кислоты. В результате получают 2,96 г указанного в заголовке соединения. Тпл.: 125°С.
1Н-ЯМР (ДМСО-d6) δ=1,6-2,0 (8Н, m, гексаметиленимино-3,4,5,6-СН2), 3,05-3,4 (8Н, m, гексаметиленимино-2,7-СН2, пропил-1,3-СН2), 3,08 (3H, s,-ОСН3 ), 4,07 (1H, m,

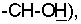


Пример 35
3-(4-Метоксистирил)-4-[(3-гексаметиленимино-2-гидроксипропил]-Δ2-1,2,4 оксадиазолин-5-он
23,08 г (0,074 молей) гидрохлорида 3-(4-метоксистирил)-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она подвергают взаимодействию с 11,42 г (0,115 молей) гексаметиленимина в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждают в растворе изопропанола путем добавления хлористого водорода в изопропанол. В результате получают 8,98 г указанного в заголовке соединения. Тпл.: 200-202°С.
1Н-ЯМР (ДМСО-d6) δ=1,5-2,0 (8Н, m, гексаметиленимино-3,4,5,6-СН2), 3,1-3,6 (6Н, m, гексаметиленимино-2,7-СН2, пропил-3-СН2), 3,79-3,81 (2Н, m, пропил 1-СН2), 3,82 (3H, s, ОСН3), 4,36 (1H, m,


Пример 36
Дималеат амидоксима N-(3-гексаметиленимино-2-гидроксипропил)-3,4-диметоксикоричной кислоты
1,5 г (0,003 молей) гидрохлорида 3-(3, 4-диметоксистирил)-4-(3-гексаметиленимино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она, полученного в соответствии с методикой, описанной в примере 37, подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 13. Дималеат осаждают в растворе изопропанола при добавлении малеиновой кислоты. В результате получают 1,38 г указанного в заголовке соединения. Тпл.: 120-123°С.
1Н-ЯМР (ДМСО-d6) δ=1,6-2,0 (8Н, m, гексаметиленимино-3,4,5,6-СН2), 3,4-3,6 (6Н, m, гексаметиленимино-2,7-СН2, пропил-1,3-СН2), 3,79 (3Н, s, -ОСН3), 3,81 (3H, s,-ОСН3), 4,1 (1Н, m,




Пример 37
Гидрохлорид 3-(3, 4-диметоксистирил)-4-[(3-гексаметиленимино-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-5-он
13,3 г (0,039 молей) 3-(3, 4-диметоксистирил)-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она подвергают взаимодействию с 4,76 г (0,048 молей) гексаметиленимина в соответствии с методикой, описанной в примере 3. Гидрохлорид осаждают в растворе изопропанола путем добавления хлористого водорода в изопропанол. В результате получают 3,25 г указанного в заголовке соединения. Тпл. :114-116°С.
1Н-ЯМР (ДМСО-d6) δ=1,5-2,0 (8Н, m, гексаметиленимино-3,4,5,6-СН2), 3,15-3,50 (6Н, m, гексаметиленимино-2,7-СН2, пропил-3-CH2), 3,84 (3H, s,-ОСН3), 3,31 (3H, s,-ОСН3), 3,87-3,91 (2Н, m, пропил-1-СН2), 4,34 (1Н, m,




Пример 38
Трималеат 3-стирил-6-(4-метил-1-пиперазинил)-4Н-5,6-дигидро-1,2, 4-оксадиазин
1,28 г (0,003 молей) дигидрохлорида 3-стирил-4-[3-(4-метил-1-пиперазинил)-2-хлорпропил)-Δ2-1,2,4-оксадиазолин-5-она подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 17. В результате получают 1,34 г указанногго в заголовке соединения. Тпл.: 153-154°С.
1 Н-ЯМР (ДМСО-d6) δ=2,64-2,68 2,76 (3H, s,-СН3), 2,8-3,18 (8Н, m, пиперазин-CH2), 3,06-3,39 (2Н, m, 5-CH2), 3,71 (1Н, m, 6-CH), 6,41 (1H, d, арил


Дигидрохлорид 3-стирил-4-[3-(4-метил-1-пиперазинил)-2-хлорпропил]-Δ2-1,2,4-оксадиазолин-5-она, используемый в качестве исходного продукта, получали взаимодействием дигидрохлорида 3-стирил-4-[3-(4-метил-1-пиперазинил)-2-гидроксипропил]-Δ2-1,2,4-оксадиазолин-3-она (приготовленного в соответствии с методикой, описанной в примере 7) с хлористым тионилом в соответствии с известной из литературы методикой. [Chem/Ber., 108, 1911 (1975)].
Пример 39
Малеат 3-стирил-6-(трет.-бутиламинометил)-4Н-5,6-дигидро-1,2,4-оксадиазин
1,59 г (0,0042 молей) гидрохлорида 3-стирил-4-[трет.-бутиламинометил-2-хлорпропил]-Δ2-1,2, 4-оксадиазолин-5-она подвергают взаимодействию с гидроксидом натрия в соответствии с методикой, описанной в примере 17. В результате получают 0,86 г указанного в заголовке соединения. Тпл.: 201-203°С.
1Н-ЯМР (ДМСО-d6) δ=1,32 (9Н s, трет.-бутил), 2,86-3,55 (4Н, m, оксадиазин-5-СН2, 6-СН2), 3,81 (1H, m, оксадиазин-6-СН), 6,10 (2Н, s, малеиновая кислота-СН), 6,47 (1H, d, арил


Гидрохлорид 3-стирил-4-(3-трет.-бутиламино-2-хлорпропил)-Δ2-1,2,4-оксадиазолин-5-она, используемый в качестве исходного продукта, получали взаимодействием гидрохлорида 3-стирил-4-(3-трет.-бутиламино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она (приготовленного в соответствии с методикой, описанной в примере 6) с хлористым тионилом в соответствии с известной из литературы методикой. [Chem/Ber., 108, 1911 (1975)].
Пример 40
Дигидрохлорид 3-стирил-6-(гексаметилениминометил)-4Н-5,6-дигидро-1,2, 4-оксадиазина
К 1,56 г (0,004 молей) гидрохлорида 3-стирил-4-(3-гексаметиленимино-2-хлорпропил)-Δ2-1,2,4-оксадиазолин-5-ону добавляют смесь 11 мл этанола и 11 мл 2н. водного раствора гидроксида натрия. Реакционную смесь кипятят с обратным холодильником в течение 15 минут при перемешивании, затем выпаривают при пониженном давлении. Остаток подвергают выщелачиванию путем добавления 10% водного раствора гидроксида натрия и экстрагируют этилацетатом. После выпаривания растворителя остаток растворяют в изопропаноле и полученный раствор подкисляют добавлением хлористого водорода, растворенного в изопропаноле. В результате осаждают 0,5 г указанного в заголовке соединения. Тпл.: 229-232°С.
1Н-ЯМР (ДМСО-d6) δ=1,5-2,0 (8Н, m, гексаметиленимино-3,4,5,6-СН2), 3,15-3,8 (8Н, m, гексаметиленимино-2,7-СН2, оксадиазин-5,6-СН2), 4,50 (1Н, m, оксадиазин-6-СН), 6,61 (1Н, d, арил


Гидрохлорид 3-стирил-4-(3-гексаметиленимино-2-хлорпропил)-Δ2-1,2,4-оксадиазолин-5-она, используемый в качестве исходного продукта, получали взаимодействием гидрохлорида 3-стирил-4-(3-гексаметиленимино-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она (приготовленного в соответствии с методикой, описанной в примере 4) с хлористым тионилом в соответствии с известной из литературы методикой. [Chem/Ber., 108, 1911 (1975)].
Пример 41
Малеат 3-стирил-6-гидроксиметил-4Н-5,6-дигидро-1,2,4-оксадиазина
К 5,83 г (0,02 молей) 3-стирил-4-(3-хлор-2-гидроксипропил)-Δ2-1,2,4-оксадиазолин-5-она, приготовленного в соответствии с методикой, описанной в примере 2А, добавляют 40 мл 10% гидроксида натрия и 10 мл этанола. Реакционную смесь кипятят с обратным холодильником в течение 15 минут, затем выпаривают при пониженном давлении. Остаток экстрагируют этилацетатом. Указанный в заголовке малеат осаждают при добавлении малеиновой кислоты. Тпл.: 132-133°С.
1H-ЯМР (ДМСО-d6) δ=3,17-3,50 (2Н, m, 5-CH2), 3,53-3,59 (2Н, m,



Реферат
Изобретение относится к новым производным амидоксимов пропенкарбоновой кислоты формулы I

где
R означает фенил, который необязательно замещен 1-3 заместителями, где заместителем является (С1-С2)алкил или (С1-С2)алкокси;
R' означает Н;
R4 и R5 независимо друг от друга означают Н, (С1-С5)алкил, фенил, последний необязательно замещен 1-3-заместителями, где заместителем является (С1-С2)алкил, (С1-С2)алкокси, или
R4 и R5 образуют вместе со смежным атомом азота 5- или 6-членную насыщенную или ненасыщенную гетероциклическую группу, которая может содержать дополнительный атом азота или атом кислорода в качестве гетероатома и может быть конденсированной с бензольным кольцом, и гетероциклическая группа и/или бензольное кольцо могут содержать один или два заместителя, где заместителем является (С1-С2)алкил, (С1-С2)алкокси;
R1 и R2 означают Н, и
R3 означает Н, ОН, или
R1 образует вместе с R2 карбонильную группу, углеродный атом которой связан со смежным с R1 атомом кислорода и смежным с R2 атомом азота, и
R3 означает Н, ОН, или
R2 означает Н, и
R1 образует вместе с R3 валентную связь между смежным с R1 атомом кислорода и смежным с R3 атомом углерода,
и, его геометрические изомеры и/или оптические изомеры, и/или его фармацевтически приемлемые кислотно-аддитивные соли.
Соединения I ингибируют поли(аденозиндифосфатрибоза)полимеразу и могут быть использованы в фармацевтической композиции при лечении состояний, основанных на подавлении этого фермента, а также для лечения состояний, связанных с кислородной недостаточностью сердца и мозга. Описаны способы получения соединения I. 3 н. и 6 з.п. ф-лы, 1 табл.
Формула


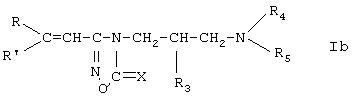


Комментарии