Способ получения α-диазокарбонильных соединений в водной среде - RU2686489C1
Код документа: RU2686489C1
Описание
Изобретение относится к области получения алифатических альфа-диазокарбонильных соединений (эфиров и амидов α-диазокарбоновых кислот и α-диазокетонов) общей формулы (1) путем реакции диазопереноса с использованием водорастворимого сульфонилазида (например, 3-карбоксифенилсульфонилазида), получаемого в водном растворе in situ в виде соли щелочного металла из сульфохлорида и азида натрия в присутствии основания.

α-Диазокарбонильные соединения представляют собой удивительно универсальные промежуточные реагенты в органическом синтезе, участвующие во множестве термических, фотохимических и металл-катализируемых реакциях (перегруппировки, реакции циклоприсоединения и внедрения (в том числе, энантиоселективные), обычно сопровождающиеся экструзией N2 [Ford, A.; Miel, Н.; Ring, A.; Slattery, C.N.; Maguire, A.R.; McKervey, M.A. Modern Organic Synthesis with α-Diazocarbonyl Compounds. Chemical Reviews (2015), 115, 9981-10080; b) Candeias, N.R.; Trindade, A.F.; Gois, P.M.P.; Afonso, C.A.M. The Wolff Rearrangement. Comprehensive Organic Synthesis II (Second Edition). Oxford: Elsevier, (2014). 944-991; c) Gurmessa, G.T.; Singh, G.S. Recent progress in insertion and cyclopropanation reactions of metal carbenoids from α-diazocarbonyl compounds. Research on Chemical Intermediates (2017), 43(11), 6447-6504; d) Burtoloso, A.C.B. Santiago, J.V.; Bernardim, В.; Talero, A.G. Advances in the Enantioselective Metal-catalyzed N-H and O-H Insertion Reactions with Diazocarbonyl Compounds. Current Organic Synthesis (2015), 12, 650-659.] В зависимости от их стабильности и присутствия функциональных групп получение и выделение диазосоединений могут представлять определенные трудности. Известные методы синтеза диазокарбонильных соединений включают (а) диазоперенос, [Regitz, М. New Methods of Preparative Organic Chemistry. Transfer of Diazo Groups. Angew. Chem. Int. Ed. (1967), 6, 733-749; b) Baum, J. S.; Shook, D. A.; Davies, H. M. L.; Smith, D. H. Diazotransfer Reactions with p-Acetamidobenzenesulfonyl Azide. Synth. Commun. (1987), 17, 1709-1716.]
(б) диазотирование α-аминокарбонильных соединений [Curtius, Т. Ueber die Einwirkung von salpetriger


(г) фрагментация 1,3-дизамещенных триазенов [Baumgarten, R. J. Preparation of ethyl diazoacetate via a triazene intermediate. J. Org. Chem. (1967), 32, 484-485; b) Schroen, M.; Brase, S. Polymer-bound diazonium salts for the synthesis of diazoacetic esters. Tetrahedron (2005), 61, 12186-12192; c) Raines, R. Т.; Myers, E. L. Preparation of Diazo and Diazonium Compounds. PCT WO 2010/057220, (2010).] и (д) синтез из более доступных диазосоединений [Ye, Т.; McKervey, М.А. Synthesis of chiral N-protected α-amino-β-diketones from α-diazoketones derived from natural amino acids. Tetrahedron (1992), 48, 8007-8022; b) Y. Zhao, J. Wang, Nucleophilic Addition to C=O and C=N Bonds by Nucleophiles Containing a Diazo Group. Synlett (2005), 2886-2892; c) Meyer, M. E.; Ferreira, E. M.; Stoltz, В. M. 2-Diazoacetoacetic acid, an efficient and convenient reagent for the synthesis of α-diazo-β-ketoesters. Chem. Commun. (2006), 1316-1318; d) Liu, Y.; Zhang, Y.; Jee, N.; Doyle, M. P. Construction of Highly Functionalized Diazoacetoacetates via Catalytic Mukaiyama-Michael Reactions. Org. Lett. (2008), 10, 1605-1608.], включая ацилирование диазоалканов [Bestmann, H.J.; Soliman, F.M. Synthesis and reactions of diazoacetyl chloride. Angewandte Chemie (1979), 91(12), 1012-13; b) Gupta, S.; Agarwal, A.K.; Garg, P. Synthesis of α-diazoketone by the action of diazoalkanes on propionic anhydride. Asian Journal of Chemistry (2010), 22(4), 2939-2942; c) Martin, L.J.; Marzinzik, A.L.; Ley, S.V.; Baxendale, I.R. Safe and Reliable Synthesis of Diazoketones and Quinoxalines in a Continuous Flow Reactor. Organic Letters (2011), 13(2), 320-323.]
Основным недостатком методов диазотирования α-аминокарбонильных соединений и фрагментации 1,3-дизамещенных триазенов является относительная труднодоступность исходных α-аминокарбонильных соединений (предшественников 1,3-дизамещенных триазенов). Коммерчески доступные α-аминокарбонильные соединения отличаются весьма узким разнообразием классов и типов. Как правило, это производные α-аминокислот. Таким образом, эти методы применимы в основном лишь для получения производных (эфиров или амидов) α-диазокарбоновых кислот.
Методы, основанные на использовании моногидразонов α-дикарбонильных соединений (их разложении или окислении), имеют следующие ограничения: во-первых, далеко не все классы α-дикарбонильных соединений коммерчески доступны; во-вторых, зачастую возникают трудности при их селективной трансформации в моногидразоны.
Ацилирование диазометана и других терминальных диазоалканов как метод получения α-диазокарбонильных также имеет ряд недостатков. Несмотря на свою синтетическую важность и универсальность, диазометан затруднительно использовать в крупномасштабных и, тем более, в промышленных синтезах из-за его высокой токсичности, канцерогенности и взрывоопасности. Наиболее доступными и дешевыми предшественниками диазометана и диазоэтана являются N-нитрозо-N-алкилмочевины. N-Нитрозо-N-метилмочевина (NMU) и ее гомологи - чрезвычайно канцерогенные соединения, обладающие мутагенными и тератогенными свойствами; они неустойчивы при температурах выше 20°С и чувствительны к механическому воздействию. Очевидно, что работы с подобными веществами, сопряженные с высокими рисками для жизни и здоровья, следует по возможности избегать.
В последнее время наиболее популярным методом получения α-диазокарбонильных соединений является реакция диазопереноса. Она заключается во взаимодействии сульфонилазида (например, тозилазида) с карбонильными соединениями в присутствии основания. Несмотря на высокую степень универсальности и простоту этот метод не лишен некоторых технологических неудобств. А именно, работа с потенциально взрывчатыми сульфонилазидами требует повышенной тщательности и осторожности; поскольку реакция диазопереноса проводится в среде органического растворителя (например, такого, как ацетонитрил), а для выделения конечного продукта в большинстве случаев используется колоночная хроматография, крупномасштабное или промышленное применение этого метода сопряжено с большими финансовыми и трудозатратами.
Недавно был предложен способ получения α-диазокарбонильных соединений по реакции диазопереноса с применением сульфонилазида на основе ионной жидкости [Muthyala, М.K.; Choudhary, S.; Kumar, A. Synthesis of ionic liquid-supported sulfonyl azide and its application in diazotransfer reaction. Journal of Organic Chemistry (2012), 77(19), 8787-8791.]. Достоинство метода заключается в том, что получающийся побочный продукт реакции диазопереноса - соответствующий сульфонамид не растворим в экстрагенте (гексан-этилацетат (1:1)), что позволяет отделять целевой продукт превращения путем экстракции без дополнительной очистки. Однако следует заметить, что ионные жидкости, содержащие сульфонилазидную группу являются синтетически труднодоступными.
Учитывая недостатки и ограничения известных методов получения α-диазокарбонильных соединений важное значение имеет поиск и разработка альтернативных способов синтеза этих важных реагентов.
Заявителями был неожиданно обнаружен новый способ получения α-диазокарбонильных соединений методом переноса диазо-функции от водорастворимого сульфонилазида (3-карбоксифенилсульфонилазида), получаемого в водном щелочном растворе in situ в виде соли щелочного металла.
Изобретение относится к способам получения α-диазокарбонильных соединений общей формулы (1)

методом переноса диазо-функции от водорастворимого сульфонилазида (3-карбоксифенилсульфонилазида) получаемого в водном щелочном растворе in situ в виде соли щелочного металла,
где R11, R12 представляют собой атом водорода; необязательно замещенный С1-С5 алкил; необязательно замещенный С3-С9 циклоалкил, необязательно замещенный С1-С5 алкилокси; необязательно замещенный арил; необязательно замещенную первичную, вторичную или третичную аминогруппу; необязательно замещенную первичную, вторичную или третичную аминокарбонильную группу; необязательно замещенную карбоксигруппу; нитрильную группу; необязательно замещенную алкил- или арилсульфонильную группу; необязательно замещенную первичную, вторичную или третичную аминосульфонильную группу; необязательно замещенный гетероарил с одним или двумя атомами азота, кислорода или серы в цикле; необязательно замещенный гетероциклил необязательно одновременно содержащий атом азота, серы или атом кислорода в цикле или
R11, R12 вместе образуют необязательно замещенную аннелированную циклическую систему или необязательно замещенный С3-С9 циклоалкил.
Получение водного раствора 3-карбоксифенилсульфонилазида в виде указанной соли осуществляется смешением 3-карбоксифенилсульфонилхлорида с азидом щелочного металла (например, натрия) в водном растворе карбоната щелочного металла.

Субстратами для диазопереноса являются разнообразные α-СН или α-СН2 карбонильные соединения, обладающие достаточно высокой СН-кислотностью. В случае соединений с низкой СН-кислотностью (монокетоны, сложные эфиры и другие) для успешного проведения реакции диазопереноса и синтеза α-диазомонокарбонильных соединений в молекулу субстрата предварительно вводится активирующая ацильная группа (например, формильная, этоксалильная или аналогичные). Эта модификация осуществляется in situ непосредственно перед проведением реакции диазопереноса без выделения промежуточного β-дикарбонильного соединения.
Предложенный способ получения отличается универсальностью, простотой исполнения, высокими выходами целевых продуктов и легкостью их выделения из реакционных смесей. Наиболее ярко преимущества данного способа получения проявляются при проведении средне- и крупномасштабных синтезов, что делает его перспективным для промышленного применения.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Азагетероцикл» означает ароматическую или неароматическую моноциклическую или полициклическую систему, содержащую в цикле, по крайней мере, один атом азота.
«Алкил» означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи. Разветвленная означает, что алкильная цепь имеет один или несколько «низших алкильных» (С1-С6)алкильных заместителей. Предпочтительными алкильными группами являются (С1-С6)алкил, еще более предпочтительными (С1-С3)алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, циклопропилметил, циклобутилметил, циклопентилметил, н-пентил, 2-пентил, 3-пентил, нео-пентил, н-гексил, циклогексил. Алкил может иметь заместители.
«Алкокси» означает (С1-С3)алкил-O- группу, в которой алкил определен в данном разделе. Предпочтительным алкилокси группами являются метокси, этокси, н-пропокси, изопропокси и н-бутокси.
«Аминогруппа» означает R1R2N- группу, замещенную или незамещенную необязательно одинаковыми заместителями R1 и R2. Аминогруппа может иметь заместители.
«Арил» означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, предпочтительно от 6 до 10 атомов углерода, более предпочтительно фенил, нафтил. Арил может содержать один или более «заместителей циклической системы», которые могут быть одинаковыми или разными.
«Ароматический цикл» (ароматическая система) означает планарную циклическую систему, в которой все атомы цикла участвуют в образовании единой системы сопряжения, включающей, согласно правилу Хюккеля, (4n+2) π-электронов (n - целое неотрицательное число). Примерами ароматических циклов являются бензол, нафталин, антрацен и т.п. В случае «гетероароматических циклов» в системе сопряжения участвуют π-электроны и р-электроны гетероатомов, их суммарное число также равняется (4n+2). Примерами таких циклов являются пиридин, тиофен, пиррол, фуран, тиазол и т.п. Ароматический цикл может иметь один или более «заместителей циклической системы» и может быть аннелирован с неароматическим циклом, гетероароматической или гетероциклической системой.
«Аннелированный цикл» (конденсированный цикл) означает би- или полициклическую систему, в которой аннелированный цикл и цикл или полицикл, с которым он «аннелирован», имеют как минимум два общих атома.
«Аннелированный арилгетероциклоалкенил» означает аннелированные арил и гетероциклоалкенил, значение которых определено в данном разделе. Аннелированный арилгетероциклоалкенил может связываться через любой возможный атом циклической системы. Приставка «аза», «окса» или «тиа» перед «гетероциклоалкенил» означает наличие в циклической системе, атома азота, атома кислорода или атома серы, соответственно. Аннелированный арилгетероциклоалкенил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Атомы азота и серы, находящиеся в гетероцикленильной части могут быть окислены до N-оксида, S-оксида или S-диоксида. Представителями анелированных арилгетероциклоалкенилов являются индолинил, 1H-2-оксохинолинил, 2Н-1-оксоизохинолинил, 1,2-дигидрохинолинил и т.п.
«Аннелированный арилгетероциклоалкил» означает аннелированные арил и гетероциклоалкил, значение которых определено в данном разделе. Аннелированный арилгетероциклоалкил может связываться через любой возможный атом циклической системы. Приставка «аза», «окса» или «тиа» перед «гетероциклоалкил» означает наличие в циклической системе, атома азота, атома кислорода или атома серы, соответственно. Аннелированный арилгетероциклоалкил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Атомы азота и серы, находящиеся в гетероциклильной части могут быть окисленными до N-оксида, S-оксида или S-диоксида. Представителями анелированных арилгетероциклоалкилов являются индолил, 1,2,3,4-тетрагидроизохинолин, 1,3-бензодиокол и т.п.
«Аннелированный арилциклоалкенил» означает аннелированные арил и циклоалкенил, значение которых определено в данном разделе. Аннелированный арилциклоалкенил может связываться через любой возможный атом циклической системы. Аннелированный арилциклоалкенил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Представителями аннелированных арилциклоалкенилов являются 1,2-дигидронафталин. инден и т.п.
«Галоген» означает фтор, хлор, бром и йод. Предпочтительными являются фтор, хлор и бром.
«Гетероарил» (гетарил) означает ароматическую моноциклическую или полициклическую систему, включающую от 3 до 14 атомов углерода, предпочтительно от 3 до 10, в которой один или больше атомов углерода замещены гетероатомом или гетероатомами, такими как азот, сера или кислород. Приставка «аза», «окса» или «тиа» перед «гетероарил» означает наличие в циклической системе, атома азота, атома кислорода или атома серы соответственно. Атом азота, находящийся в гетероариле, может быть окислен до N-оксида. Гетероарил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными.
«Гетероцикл» означает ароматическую или неароматическую насыщенную или частично насыщенную моноциклическую или полициклическую систему, включающую от 3 до 10 атомов углерода, преимущественно от 3 до 6 атомов углерода, в которой один или несколько атомов углерода заменены на гетероатом, такой как азот, кислород, сера, фосфор. Приставка «аза», «окса» или «тиа» перед гетероциклилом означает наличие в циклической системе атома азота, атома кислорода или атома серы соответственно. Гетероциклил может иметь один или несколько заместителей, которые могут быть одинаковыми или разными. Атомы азота и серы, находящиеся в гетероциклиле, могут быть окислены до N-оксида, S-оксида или S-диоксида. Представителями гетероциклилов являются пиперидинил, пирролидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,4-диоксан-2-ил, тетрагидрофурил, тетрагидротиенил и др.
«Замещенный алкил» замещенный алкил может иметь один или несколько одинаковых или различных заместителей, включая галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, ароил, гетероароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонил, гетероаралкилокси или RkaRk+1aN-, где Rka и Rk+1a независимо друг от друга представляют собой «заместители аминогруппы», значение которых определено в данном разделе, например, атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rka и Rk+1a вместе с атомом N, с которым они связаны, образуют через Rka и Rk+1a 4-7 членный гетероциклил или гетероцикленил. Предпочтительными «алкильными заместителями» являются арил, гетероарил, гетероциклил, гидрокси, С1-С5 алкокси, С1-С5 алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или RkaRk+1aN-, RkaRk+1aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил.
«Заместители циклической системы» могут быть представителями арильных групп, предпочтительно фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть аннелирован с неароматической циклической системой или гетероциклом. Предпочтительными заместителями циклической системы являются водород, галогены (хлор, фтор, бром), необязательно замещенный С1-С5алкил, необязательно замещенный циклоС1-С5алкил, С1-С5алкен, гидроксигруппа, С1-С5алкилоксигруппа (метокси, этокси, пропокси, диэфир этиленгликоль, диэфир метандиола), цианогруппа, C1-С5алкилоксикарбонил (метил, этил), алкилтиогруппа (метилтио), карбоксигруппа, аминокарбонил.
«Заместитель» означает химический радикал, который присоединяется к молекулярному остову (скэффолду, фрагменту), например, «заместитель алкильный», «заместитель аминогруппы», «заместитель карбамоильный», «заместитель циклической системы», значения которых определено в данном разделе.
«Заместители гетероцикла» могут быть представителями арильных групп, предпочтительно фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть аннелирован с неароматической циклической системой или гетероциклом. Предпочтительными заместителями циклической системы являются водород, галогены (хлор, фтор, бром), необязательно замещенный C1-С5алкил, необязательно замещенный циклоС1-С5алкил, C1-С5алкен, гидроксигруппа, C1-С5алкилоксигруппа (метокси, этокси, пропокси, диэфир этиленгликоля).
«Заместители аминогруппы» заместители аминогруппы R' и R'' представляют собой водород, необязательно замещенный С1-С5алкил, необязательно замещенный C1-С5циклоалкил (см. заместитель циклической системы), необязательно замещенный арил (см. заместитель циклической системы), необязательно замещенный гетероарил (см. заместитель циклической системы), необязательно замещенный гетероциклил (см. заместитель циклической системы), C1-С5алкенил, ацил, ароил, гетероароил, С1-С5алкилсульфонил, арилсульфонил, гетероарилсульфонил, алкоксикарбонил замещенный линейным или ненлинейным C1-С5алкилом, галогеном, гетероциклилом; арилоксикарбонил, аралкоксикарбонил, алкиламинокарбонил, ариламинокарбонил, гетероариламинокарбонил, гетероциклиламинокарбонил, алкиламинотиокарбонил, ариламинотиокарбонил, гетероариламинотиокарбонил, гетероциклиламинотиокарбонил, необязательно замещенный аминосульфонил. R'R''N-группа может представлять неароматический азагетероцикл, предпочтительно азетидин, пирролидин, пиперидин, морфолин, тиоморфолин, пиперазин, гомопиперидин, гомопиперазин. Предпочтительными заместителями аминогруппы являются водород, С1-С5алкил, C1-С5циклоалкил, замещенный C1-С5алкил («замещенный алкил»), необязательно одновременно замещенный 1-3 радикалами замещенный фенил (C1-С5алкилом, галогеном, C1-С5алкокси группой, С1-С5алкилоксикарбонилом), пиридинилом, необязательно замещенным тиофенилом, необязательно замещенным фуранилом (см. «заместители циклической системы»).
«Замещенная аминокарбонильная группа» (аминокарбонил) означает R'R''N-С(=O)- группу, в которой заместители R' и R'' могут быть представлены необязательно замещенными алкилом, алкенилом, алкинилом, циклоалкилом, арилом, гетарилом и гетероциклилом, значение которых определено в данном разделе. Предпочтительными аминокарбонильными группами являются необязательно замещенный C1-С5алкил, C1-С5алкенил, C1-С5циклоалкил, необязательно замещенный арил (см. заместитель циклической системы), необязательно замещенный гетарил (см. заместитель циклической системы), необязательно замещенный гетероциклил (см. заместитель гетероциклила) или аминогруппой R'R''N.
«Замещенная оксикарбонильная группа» (оксикарбонил) означает R-O-C(=O)-группу, в которой заместитель R может быть представлен необязательно замещенными алкилом, алкенилом, циклоалкилом, арилом, гетарилом и гетероциклилом, значение которых определено в данном разделе. Предпочтительными оксикарбонильными группами являются метоксикарбонил, этоксикарбонил, трет-бутилоксикарбонил и бензилоксикарбонил.
«Заместитель карбамоильный» означает заместитель, присоединенный к аминокарбонильной группе, значение которой определено в данном разделе. Заместитель карбамоильный представляет собой водород, алкил, циклоалкил, арил, гетероарил, гетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилокси-карбонилалкил или RkaRk+1aN-, RkaRk+1aNC(=O)-алкил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил. Предпочтительными «заместителями карбамоильными» являются алкил, циклоалкил, арил, гетероарил, гетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилокси-карбонилалкил или RkaRk+1aN-, RkaRk+1aNC(=O)-алкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил.
Предметом данного изобретения является способ получения алифатических а-диазокарбонильных соединений путем реакции диазопереноса с использованием водорастворимого сульфонилазида (например, 3-карбоксифенилсульфонилазида), получаемого в водном растворе in situ в виде соли щелочного металла из сульфохлорида и азида натрия в присутствии основания.
Получение диазосоединений методом прямого диазопереноса

Преимущества (особенности): отличительной особенностью заявляемого способа является универсальность предложенного метода (за счет широкого круга субстратов различной химической природы, способных давать диазосоединения в предложенных условиях); простота выделения продукта диазопереноса (α-диазокарбонильного соединения) из водного раствора (экстракцией органическим растворителем (например, хлороформом, дихлорметаном, этилацетатом; применение экстракции, как метода выделения конечного продукта, значительно проще и менее трудоемко, чем препаративная хроматография, обычно применяющаяся для этой цели); а также дешевизна (в разработанном методе используется сульфонилхлорид, а не значительно более дорогой сульфонилазид, кроме того применение простой экстракции вместо колоночной хроматографии значительно удешевляет весь процесс) и доступность реагентов (идея использования водорастворимого сульфонилазида, получаемого in situ в водном растворе, является оригинальной, такой подход к синтезу диазокарбонильных соединений, во-первых, избавляет от необходимости предварительного синтеза сульфонилазида (отпадает необходимость хранения токсичного, потенциально взрыво- и пожароопасного органического азида в чистом виде); во-вторых, позволяет проводить реакцию диазопереноса в воде (дешевый растворитель); в-третьих, позволяет выделять продукты методом простой экстракции, поскольку все побочные продукты реакции водорастворимы и остаются в водной фазе). Полученное по данному методу а-диазокарбонильное соединение не требует дополнительной очистки.
Дополнительные преимущества: получение сульфонилазида в водном растворе без выделения позволяет проводить синтез сразу нескольких диазосоединений с использованием одного приготовленного раствора. Учитывая легкость как приготовления раствора сульфонилазида, так и выделения конечных продуктов синтеза предлагаемая методика легко масштабируется для одновременного получения одним химиком-синтетиком 5-10 диазосоединений в количествах от сотен миллиграмм до десятков грамм в течение 1-2 дней.
Новизной способа является: 1) проведение реакции диазопереноса в воде; 2) приготовление водорастворимого сульфонилазида в водном растворе непосредственно перед проведением реакции диазопереноса (отсутствие стадии выделения и очистки сульфонилазида; отпадает необходимость хранения токсичного, потенциально взрыво- и пожароопасного органического азида в чистом виде); 3) экстракция конечного продукта (диазосоединения) из водного раствора органическим растворителем приводит к получению препаратов, не требующих дополнительной очистки.
Классы диазокарбонильных соединений, которые могут быть получены с помощью предложенного метода, включают, но не ограничиваются ими, следующие:
- 2-диазо-1,3-дикетоны общей формулы:

- циклические 2-диазо-1,3-дикетоны общей формулы:

- 2-диазо-1,3-кетоэфиры общей формулы:

- производные 2-диазомалоновой кислоты общей формулы:

- 2-диазо-1,3-кетонитрилы общей формулы:

- производные диазоциануксусной кислоты общей формулы:

- α-диазосульфоны общей формулы:
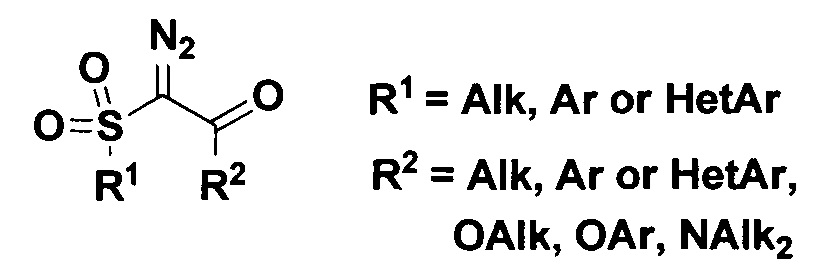
- производные диазофосфоновых кислот общей формулы:

- производные диазобарбитуровой и диазотиобарбитуровой кислот общей формулы:

- производные 4-диазоизохинолин-1,3-диона общей формулы:

- производные 3-диазохинолин-2,4-диона общей формулы:

- амиды диазоуксусной кислоты общей формулы:

Классы диазомонокарбонильных соединений, которые могут быть получены с помощью тандема реакций ацилирование-диазоперенос по данному методу, включают, но не ограничиваются ими, следующие:
- α-диазокетоны общей формулы:

- циклические α-диазокетоны общей формулы:

- эфиры 2-диазокарбоновых кислот общей формулы:

Примеры
Коммерчески доступные исходные соединения и растворители использовались без дополнительной очистки. Некоторые субстраты были синтезированы по известным литературным методикам. Тетрагидрофуран был абсолютирован кипячением над металлическим натрием в атмосфере аргона. Данные спектроскопии ЯМР получены с помощью спектрометра 400 МГц (1Н: 400.13 МГц,13С: 100.61 МГц); остаточные пики растворителя (CDCl3) использовались в качестве внутреннего стандарта: 7.26 м.д. для1H, 77.16 м.д. на13С; мультиплетности сигналов сокращены следующим образом: с=синглет, д=дублет, т=триплет, к=квартет, м=мультиплет, шс=широкий сигнал, константы ССВ J приведены в Гц). Температуры плавления определяли в открытых капиллярах на приборе автоматического плавления Stuart SMP50.
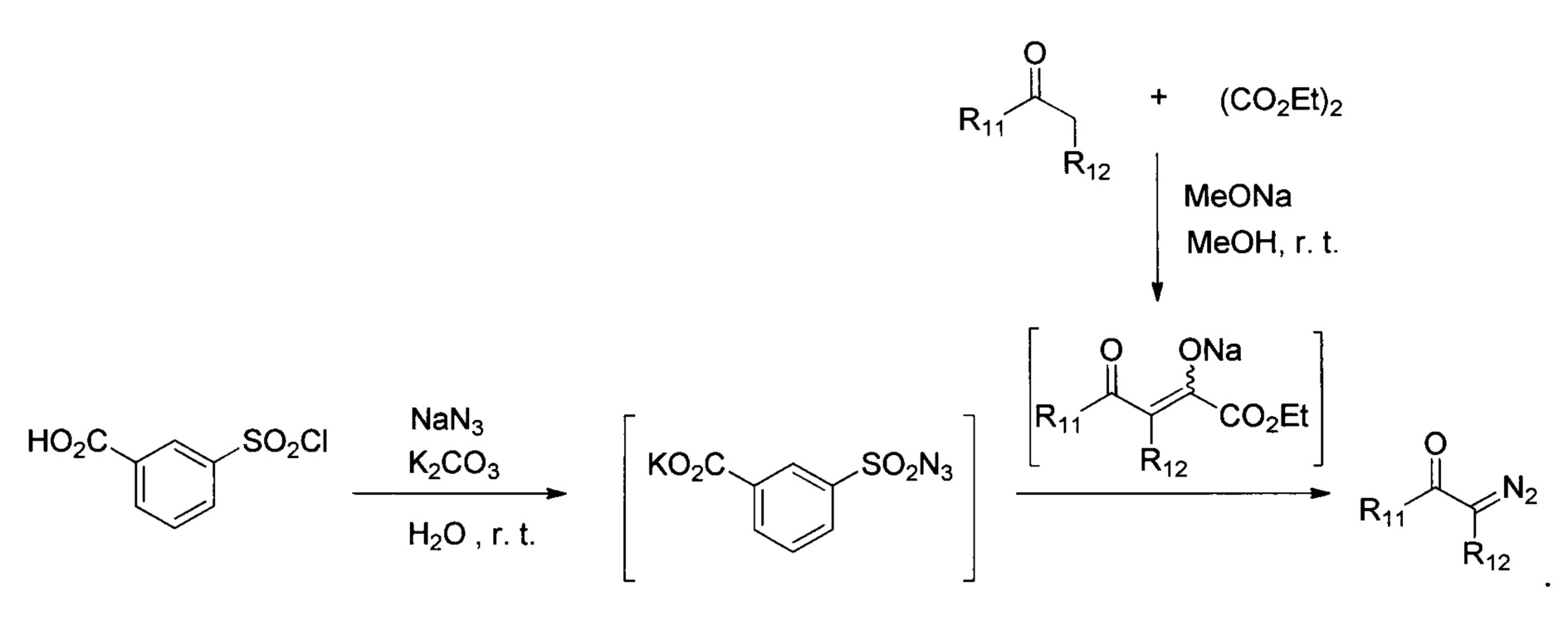
Пример 1. Синтез 3-(хлоросульфонил)бензойной кислоты:

В круглодонную колбу объемом 250 мл, снабженную воздушным холодильником, помещают 150 мл хлорсульфоновой кислоты и 36.6 г (0.3 моль) бензойной кислоты. Смесь перемешивают на магнитной мешалке при температуре 140°С в течение 6 часов. После охлаждения реакционной смеси до комнатной температуры ее переносят в делительную воронку и по каплям добавляли в стакан с 800 г мелко колотого льда (следят за тем, чтобы температура не поднималась выше 20°С; при необходимости добавляя лед). Образовавшийся осадок белого цвета отфильтровывают, промывают двумя порциями по 150 мл холодной воды и сушат в вакууме (10 мм рт.ст.) при 40°С. Получают 58.2 г (88%) в виде белых кристаллов. Чистота вещества согласно спектру ЯМР1H составляет 95%. Предположительно препарат содержит около 5% пара-изомера. ЯМР1Н (400 МГц, CDCl3, J/Гц): 11.12 (шс, 1H), 8.81 (т, J=1.6, 1Н), 8.51 (дт, J=7.8, 1.3, 1H), 8.33 (ддд, J=8.0, 2.0, 1.1, 1H), 7.83 (t, J=7.9, 1H).
Пример 2. Приготовление раствора сульфонилазида (калиевой соли 3-(азидосульфонил)бензойной кислоты): В стакан объемом 50 мл помещают 0.98 г (15 ммоль) азида натрия, 2.76 г (20 ммоль) поташа и 20 мл дистиллированной воды. При перемешивании на магнитной мешалке к получившемуся раствору добавляют 2.21 г (10 ммоль) 3-(хлоросульфонил)бензойной кислоты, и перемешивают смесь в течение 30 минут при комнатной температуре. Получают раствор калиевой соли 3-(азидосульфонил)бензойной кислоты, используемый для получения диазосоединений из расчета, что он содержит 10 ммоль реагента.
Изобретение (эффективность и универсальность разработанного метода) иллюстрируется следующими примерами:
Схема 1 - Получение диазосоединений методом прямого диазопереноса

Пример 3. 5-Диазо-1,3-диметилпиримидин-2,4,6(1H,3H,5H)-трион.
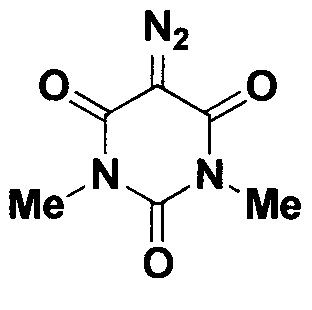
К водному раствору, полученному, как описано выше, взятому в объеме, содержащем 1 ммоль калиевой соли 3-(азидосульфонил)бензойной кислоты (1/10 общего объема), добавляют при перемешивании 117 мг (0.75 ммоль) N,N'-диметилбарбитуровой кислоты. Смесь перемешивают в течение 1 часа при комнатной температуре. Продукт реакции экстрагируют хлороформом (2×3 мл), объединенные органические фазы сушат над хлоридом кальция, растворитель удаляют в вакууме. Выход 124 мг (91%). Бесцветные кристаллы. Т. пл. 160.0-161.9°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 3.34 (с, 6Н, 2СН3). ЯМР13С (101 МГц, CDCl3): 158.2, 150.5, 71.7 (C=N2), 28.5 (2СН3).
Пример 4. 2-Диазо-1,3-дифенилпропан-1,3-дион.

К водному раствору, полученному, как описано выше, взятому в объеме, содержащем 1 ммоль калиевой соли 3-(азидосульфонил)бензойной кислоты (1/10), добавляют при перемешивании 138 мг (1 ммоль) поташа и 168 мг (0.75 ммоль) дибензоилметана и 2 мл ацетонитрила. Смесь перемешивают в течение 1.5 часа при комнатной температуре. Продукт реакции экстрагируют хлороформом (2×3 мл), объединенные органические фазы сушат над хлоридом кальция, растворитель удаляют в вакууме. Выход 161 мг (86%). Бледно-желтые кристаллы. Т. пл. 107.8-108.2°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.62-7.57 (м, 4Н, орто-Ph, 7.49-7.43 (м, 2Н, пара-Ph, 7.37-7.31 (м, 4Н, мета-Ph). ЯМР13С (101 МГц, CDCl3): 186.4 (2С=O), 137.0, 132.6, 128.4, 128.3, 84.4 (C=N2).
Пример 5. 1-Диазонафталин-2(1H)-он.

К водному раствору, полученному, как описано выше, взятому в объеме, содержащем 4 ммоль калиевой соли 3-(азидосульфонил)бензойной кислоты (4/10), добавляют при перемешивании 276 мг (2 ммоль) поташа и 216 мг (1.5 ммоль) бета-нафтола. Смесь перемешивают в течение 2 часов при комнатной температуре. Продукт реакции экстрагируют хлороформом (2×5 мл), объединенные органические фазы сушат над хлоридом кальция, растворитель удаляют в вакууме. Выход 163 мг (64%). Светло-коричневые кристаллы. Т. пл. 80.8-81.6°С (разл.). ЯМР1H (400 МГц, CDCl, J/Гц): 7.64 (д, J=9.8, 1Н), 7.62-7.57 (м, 1Н), 7.55-7.49 (м, 1H), 7.32-7.24 (м, 2Н), 6.67 (д, J=9.8, 1H). ЯМР13С (101 МГц, CDCl3): 180.2 (С=O), 140.3, 130.0, 129.8, 127.2, 125.9, 125.6, 124.7, 119.7, 77.2 (C=N2).
Пример 6. 2-Диазо-N,N-диэтилацетамид.

К водному раствору, полученному, как описано выше, взятому в объеме, содержащем 2 ммоль калиевой соли 3-(азидосульфонил)бензойной кислоты (2/10), добавляют при перемешивании 276 мг (2 ммоль) поташа и 236 мг (1.5 ммоль) N,N-диэтил-3-оксобутанамида. Смесь перемешивают в течение 1.5 часа при комнатной температуре, после чего добавляют 252 мг (4.5 ммоль) гидроксида калия и 5 мл ацетонитрила и продолжают перемешивание в течение 2 часов. Продукт реакции экстрагируют хлороформом (3×4 мл), объединенные органические фазы сушат над хлоридом кальция, растворитель удаляют в вакууме. Выход 139 мг (66%). Желтая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.94 (с, 1H, HC=N2), 3.27 (уш.с, 4Н, N(CH2CH3)2), 1.15 (т, J=7.2, 6Н, N(СН2СН3)2). ЯМР13С (101 МГц, CDCl3): 164.7 (С=O), 46.3 (C=N2), 41.4 (N(CH2CH3)2), 13.8 (N(CH2CH3)2).
2-Диазо-5,5-диметилциклогексан-1,3-Дион.

Получают по методу из примера 3 из 0.75 ммоль димедона. Время реакции 1 час. Выход 112 мг (90%). Бледно-желтые кристаллы. Т. пл. 105.9-107.0°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 2.44 (с, 4Н, 2СН2), 1.12 (с, 6Н, 2СН3). ЯМР13С (101 МГц, CDCl3): 189.8 (2С=O), 83.6 (C=N2), 50.5 (2СН2), 31.1 (С(СН3)2), 28.3 (2СН3).
2-Диазоциклогексан-1,3-дион.

Получают по методу из примера 3 из 1.5 ммоль циклогексан-1,3-диона. Время реакции 1.5 часа. Выход 178 мг (86%). Бледно-желтые кристаллы. Т. пл. 47.0-48.6°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 2.72-2.42 (м, 4Н, 2СН2), 2.11-1.95 (м, 2Н, 5-СН2). ЯМР13С (101 МГц, CDCl3): 190.3 (2С=O), 84.9 (C=N2), 36.8 (2СН2), 18.6 (5-СН2).
2-Диазо-5-фенилциклогексан-1,3-дион.
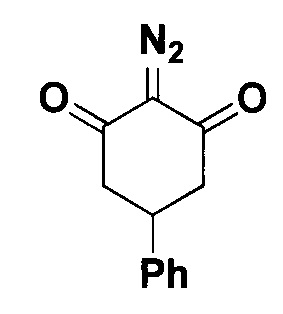
Получают по методу из примера 3 из 0.75 ммоль 5-фенилциклогексан-1,3-диона. Время реакции 2 часа. Выход 112 мг (88%). Бледно-желтые кристаллы. Т. пл. 122.0-122.6°С (разл.). ЯМР1Н (400 МГц, CDCL3, J/Гц): 7.39 (т, J=7.4, 2Н, мета-Ph), 7.34-7.27 (м, 1Н, пара-Ph), 7.26-7.20 (м, 2Н, орто-Ph), 3.44 (тт, J=11.6, 4.2, 1Н, CHPh), 2.90 (дд, J=17.2, 4.2, 2Н, 2СНН), 2.79 (дд, J=17.2, 11.7, 2Н, 2СНН). ЯМР13С (101 МГц, CDCl3): 189.2 (2С=O), 141.1, 129.1, 127.5, 126.5, 84.8 (C=N2), 44.2 (2СН2), 36.5 (CHPh).
5-Диазо-1,3-диметил-2-тиоксодигидропиримидин-4,6(1H,5H)-дион.

Получают по методу из примера 3 из 0.75 ммоль 2-тио-1,3-диметилбарбитуровой кислоты. Время реакции 1 час. Выход 107 мг (72%). Светло-бежевые кристаллы. Т. пл. 112.2-113.0°С. ЯМР1H (400 МГц, CDCl3, J/Гц): 3.72 (с, 6Н, 2СН3). ЯМР13С (101 МГц, CDCl3): 178.9 (C=S), 156.8 (2С=O), 73.9 (C=N2), 35.41 (2СН3).
5-Диазо-2,2-диметил-1,3-диоксан-4,6-дион.

Получают по методу из примера 3 из 0.75 ммоль кислоты Мельдрума. Время реакции 1 час. Выход 112 мг (88%). Бледно-желтые кристаллы. Т. пл. 95-96°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 1.80 (с, 6Н, 2СН3). ЯМР13С (101 МГц, CDCl3): 158.3 (2С=O), 107.1 (С(СН3)2), 64.9 (C=N2), 26.8 (2СН3).
2-Диазоиндан-1,3-дион.

Получают по методу из примера 3 из 0.75 ммоль индан-1,3-диона. Время реакции 1 час. Выход 104 мг (81%). Желтые кристаллы. Т. пл. 144.9-146.5°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.89-7.81 (m, 2Н), 7.80-7.70 (m, 2Н). ЯМР13С (101 МГц, CDCl3): 182.1 (2С=O), 137.1, 134.8, 122.7, 70.13 (C=N2).
3-Диазопентан-2,4-дион.

Получают по методу из примера 3 из 1.5 ммоль ацетилацетона. Время реакции 1 час. Выход 153 мг (81%). Прозрачная жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 2.42 (с, 6Н, 2СН3). ЯМР13С (101 МГц, CDCl3): 188.2 (2С=O), 84.5 (C=N2), 28.4 (2СН3).
Этиловый эфир 2-диазо-3-оксобутановой кислоты.

Получают по методу из примера 3 из 1.5 ммоль этилового эфира ацетоуксусной кислоты. Время реакции 1.5 часа. Выход 185 мг (79%). Прозрачная жидкость. ЯМР1H (400 МГц, CDCl3, J/Гц): 4.30 (к, J=7.1, 2Н, CHCH3), 2.48 (с, 3Н, 4-СН3), 1.33 (т, J=7.1, 3Н, СН2СН3). ЯМР13С (101 МГц, CDCl3): 190.1 (С=О), 161.4 (CO2), 76.3 (C=N2), 61.4 (СН2СН3), 28.2 (4-СН3), 14.3 (СН2СН3).
Диэтиловый эфир 2-диазомалоновой кислоты.

Получают по методу из примера 3 из 6.0 ммоль диэтилового эфира малоновой кислоты. Время реакции 2 часа. Выход 960 мг (86%). Прозрачная жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.31 (к, J=7.1, 4Н, 2СН2СН3), 1.32 (т, J=7.1, 6Н, 2СН2СН3). ЯМР13С (101 МГц, CDCl3): 161.0 (2CO2), 65.4 (C=N2), 61.6 (2СН2СН3), 14.3 (2СН2СН3).
трет-Бутиловый эфир 2-диазо-3-оксобутановой кислоты.

Получают по методу из примера 3 из 0.75 ммоль трет-бутилового эфира ацетоуксусной кислоты. Время реакции 2 часа. Выход 117 мг (85%). Прозрачная жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 2.45 (с, 3Н, 4-СН3), 1.54 (с, 9Н, С(СН3)3). ЯМР13С (101 МГц, CDCl3): 190.5 (С=O), 160.6 (CO2), 83.1 (С(СН3)3), 77.1 (C=N2), 28.3, 28.3.
Этиловый эфир 2-диазо-3-оксо-3-(пиридин-3-ил)пропановой кислоты.

Получают по методу из примера 3 из 0.75 ммоль этилового эфира никотиноилуксусной кислоты. Время реакции 2 часа. Выход 146 мг (89%). Прозрачная вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.84 (д, J=2.2, 1Н, 2'-Н), 8.74 (дд, J=4.9, 1.6, 1Н, 6'-Н), 7.93 (дт, J=7.9, 2.0, 1H, 4'-Н), 7.38 (дд, J=7.9, 4.9, 1Н, 5'-Н), 4.26 (к, J=7.1, 2Н, CH2CH3), 1.27 (т, J=7.1, 3Н, СН2СН3). ЯМР13С (101 МГц, CDCl3): 185.1 (С=O), 160.6 (CO2), 152.5, 149.2, 135.8, 132.9, 122.6, 77.0 (C=N2), 61.9 (СН2СН3), 14.2 (СН2СН3).
Метиловый эфир 2-диазо-3-оксобутановой кислоты.

Получают по методу из примера 3 из 1.5 ммоль метилового эфира ацетоуксусной кислоты. Время реакции 2 часа. Выход 177 мг (83%). Прозрачная жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 3.84 (с, 3Н, ОСН3), 2.48 (с, 3Н, 4-СН3). ЯМР13С (101 МГц, CDCl3): 190.0 (С=O), 161.8 (CO2), 76.2 (C=N2), 52.2 (ОСН3), 28.14 (4-СН3).
2-Диазо-3-оксо-3-фенилпропанонитрил.

Получают по методу из примера 3 из 1.5 ммоль бензоилацетонитрила. Время реакции 1 час. Выход 161 мг (63%). Светло-коричневые кристаллы. Т. пл. 47.2-48.1°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.93-7.88 (м, 2Н, 2',6'-Н), 7.68-7.61 (м, 1H, 4'-Н), 7.56-7.48 (м, 2Н, 3',5'-Н). ЯМР13С (101 МГц, CDCl3): 182.9 (С=O), 134.8, 133.8, 128.9, 128.1, 109.2, 59.0 (C=N2).
2-Диазо-3-оксо-3-(3-фторфенил)пропанонитрил.

Получают по методу из примера 3 из 1.5 ммоль (3-фторбензоил)ацетонитрила. Время реакции 1 час. Выход 170 мг (60%). Оранжевая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.71 (ддд, J=7.8, 1.6, 1.0, 1Н), 7.59 (ддд, J=9.0, 2.4, 1.9, 1H), 7.51 (тд, J=8.0, 5.4, 1Н), 7.34 (тдд, J=8.3, 2.6, 0.9, 1Н). ЯМР13С (101 МГц, CDCl3, J/Гц): 181.6 (д, J=2.6, С=O), 162.6 (д, J=249.5, 3'-С), 136.3 (д, J=7.0), 130.7 (д, J=7.9), 123.8 (д, J=3.2), 120.9 (д, J=21.3), 115.2 (д, J=23.4), 108.8 (C=N), 59.52 (C=N2).
2-Диазо-3-оксо-3-(3-метоксифенил)пропанонитрил.
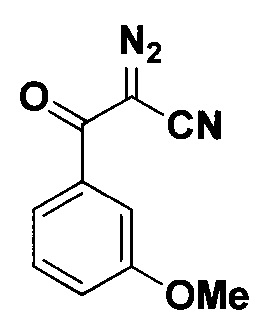
Получают по методу из примера 3 из 1.5 ммоль (3-метоксибензоил)ацетонитрила. Время реакции 2 часа. Выход 103 мг (68%). Светло-оранжевая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.52-7.48 (м, 1H), 7.42 (т, J=8.0, 1Н), 7.39-7.38 (м, 1Н), 7.17 (ддд, J=8.2, 2.6, 0.9, 1H), 3.87 (с, 3H, ОСН3). ЯМР13С (101 МГц, CDCl3): 182.7 (С=O), 159.8 (3'-С), 135.7, 129.9, 120.5, 120.4, 112.5, 109.1 (C≡N), 59.1 (C=N2), 55.5 (ОСН3).
2-Диазо-3-оксо-3-(тиофен-2-ил)пропанонитрил.

Получают по методу из примера 3 из 1.5 ммоль 3-оксо-3-(тиофен-2-ил)пропанонитрила. Время реакции 1.5 часа. Выход 170 мг (75%). Желтые кристаллы. Т. пл. 94.8-96.0°С. ЯМР1H (400 МГц, CDCl3, J/Гц): 8.04 (дд, J=4.0, 1.0, 1H), 7.78 (дд, J=5.0, 1.0, 1Н), 7.20 (дд, J=5.0, 4.0, 1H). ЯМР13С (101 МГц, CDCl3): 173.7 (С=O), 139.8, 135.2, 133.0, 128.7, 109.2 (C≡N), 58.6 (C=N2).
2-Диазо-4,4-диметил-3-оксопентанонитрил.
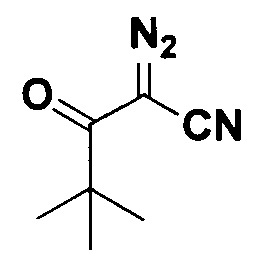
Получают по методу из примера 3 из 1.5 ммоль 4,4-диметил-3-оксопентанонитрила. Время реакции 1.5 часа. Выход 177 мг (78%). Желтая жидкость. ЯМР1H (400 МГц, CDCl3, J/Гц): 1.33 (с, 9Н). ЯМР13С (101 МГц, CDCl3): 195.3 (С=O), 109.4 (C≡N), 57.03 (C=N2), 44.7 (С(СН3)3), 26.2 (С(СН3)3).
3-(Адамантан-1-ил)-2-диазо-3-оксопропанонитрил.

Получают по методу из примера 3 из 0.75 ммоль 3-(адамантан-1-ил)-3-оксопропанонитрила. Время реакции 20 часов. Выход 165 мг (96%). Оранжевые кристаллы. Т. пл. 70.6-71.7°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 2.17-2.07 (м, 3H), 2.01 (д, J=2.8, 6Н), 1.82-1.70 (м, 6Н). ЯМР13С (101 МГц, CDCl3): 194.4 (С=O), 109.6 (C≡N), 57.1 (C=N2), 47.4, 37.7, 36.2, 28.0.
Этиловый эфир 2-диазо-3-оксо-3-(пирролидин-1-ил)пропановой кислоты.

Получают по методу из примера 3 из 0.75 ммоль этилового эфира 3-оксо-3-(пирролидин-1-ил)пропановой кислоты. Время реакции 30 часов. Выход 123 мг (84%). Желтая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.25 (к, J=7.1, 2Н, СН2СН3), 3.52 (т, J=6.8, 4Н, 2NCH2), 1.94-1.83 (м, 4Н, 2NCH2CH2), 130 (т, J=7.1 Hz, 3H, СН2СН3). ЯМР13С (101 МГц, CDCl3): 162.1, 159.6, 66.8 (C=N2), 61.2 (СН2СН3), 47.8 (шс, 2NCH2), 24.8 (шс, 2NCH2CH2), 14.4 (СН2СН3).
Диметиловый эфир 2-диазомалоновой кислоты.

Получают по методу из примера 3 из 1.5 ммоль диметилового эфира малоновой кислоты. Время реакции 2 часа. Выход 197 мг (83%). Прозрачная жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 3.85 (с, 6Н, 2СН3). ЯМР13С (101 МГц, CDCl3): 161.4 (2CO2), 65.7 (C=N2), 52.5 (2СН3).
Диметиловый эфир 2-диазоянтарной кислоты.
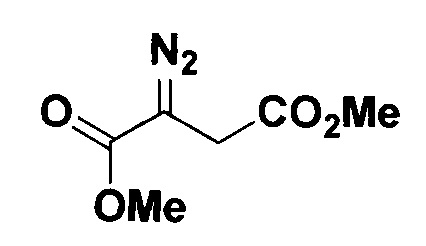
Получают по методу из примера 3 из 1.5 ммоль диметилового эфира 2-ацетилянтарной кислоты. Время реакции 2 часа. Выход 183 мг (71%). Желтая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 3.79 (с, 3H), 3.75 (с, 3H), 3.34 (с, 2Н). ЯМР13С (101 МГц, CDCl3): 170.0, 167.0, 52.4, 52.2, 28.7 (СН2).
4-Диазо-2-(диметиламино)изохинолин-1,3(2H,4H)-дион.

Получают по методу из примера 3 из 0.75 ммоль N-(диметиламино)гомофталимида. Время реакции 20 часов. Выход 155 мг (90%). Светло-оранжевые кристаллы. Т. пл. 130.7-132.4°С. ЯМР1H (400 МГц, CDCl3, J/Гц): 8.28 (ддд, J=8.0, 1.3, 0.5, 1H), 7.66 (ддд, J=7.9, 7.4, 1.4, 1Н), 7.36-7.32 (м, 1Н), 7.09 (ддд, J=7.9, 1.0, 0.6, 1H), 3.04 (с, 6Н, N(CH3)2). ЯМР13С (101 МГц, CDCl3): 162.8, 162.4, 134.2, 130.3, 126.2, 125.7, 121.3, 118.4, 68.5 (C=N2), 43.7 (N(CH3)2).
4-Диазо-2-(2-морфолиноэтил)изохинолин-1,3(2H,4H)-дион.

Получают по методу из примера 3 из 0.75 ммоль N-(2-морфолиноэтил)гомофталимида. Время реакции 20 часов. Выход 198 мг (88%). Светло-оранжевые кристаллы. Т. пл. 151.7-153.8°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.29 (ддд, J=8.0, 1.3, 0.4, 1Н), 7.68 (ддд, J=7.9, 7.4, 1.4, 1Н), 7.43-7.31 (м, 1H), 7.19-7.09 (м, 1H), 4.28-4.22 (м, 2Н), 3.70-3.66 (м, 4Н), 2.68-2.61 (м, 2Н), 2.60-2.55 (м, 4Н). ЯМР13С (101 МГц, CDCl3): 162.7, 162.6, 134.1, 130.2, 126.6, 125.7, 120.9, 118.6, 68.1 (C=N2), 67.0, 56.0, 53.8, 37.6.
3-Диазохроман-2,4-дион.

Получают по методу из примера 3 из 1.5 ммоль 4-гидроксикумарина. Время реакции 1.5 часа. Выход 175 мг (62%). Бежевые кристаллы. Т. пл. 157.6-158.9°С (разл.). ЯМР1H (400 МГц, CDCl3, J/Гц): 8.06 (дд, J=7.9, 1.5, 1Н), 7.73-7.64 (м, 1H), 7.37 (т, J=7.6, 1H), 7.31 (д, J=8.3, 1Н). ЯМР13С (101 МГц, CDCl3): 174.0, 158.0, 153.8, 136.1, 125.9, 125.3, 119.0. 117.9, 76.3 (C=N2).
3-Диазо-1-фенилхинолин-2,4(1H,3H)-дион.

Получают по методу из примера 3 из 1.5 ммоль 4-гидрокси-1-фенилхинолин-2(1H)-она. Время реакции 1.5 часа. Выход 331 мг (84%). Бежевые кристаллы. Т. пл. 215.1-217.5°С (разл.). ЯМР1H (400 МГц, CDCl3, J/Гц): 8.23 (дд, J=7.9, 1.4, 1H), 7.67-7.60 (м, 2Н, мета-Ph), 7.59-7.54 (м, 1H, пара-Ph), 7.45 (ддд, J=8.6, 7.2, 1.7, 1Н), 7.35-7.30 (м, 2Н, орто-Ph), 7.24 (тд, J=7.6, 0.9, 1Н), 6.60 (д, J=8.1, 1Н). ЯМР13С (101 МГц, CDCl3): 175.6, 159.1, 142.5, 136.2, 134.8, 130.4, 129.4, 129.3, 126.4, 123.2, 120.3, 117.0, 79.9 (C=N2).
3-Диазо-1-метилхинолин-2,4(1H,3H)-дион.

Получают по методу из примера 3 из 0.75 ммоль 4-гидрокси-1-метилхинолин-2(1H)-она. Время реакции 1.5 часа. Выход 140 мг (93%). Белые кристаллы. Т. пл. 164.2-165.8°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.20 (дд, J=8.0, 1.7, 1H), 7.68 (ддд, J=8.7, 7.3, 1.7, 1Н), 7.32-7.23 (м, 2Н), 3.59 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3): 175.5 (4-С), 159.2 (2-С), 141.5, 135.2, 126.6, 123.0, 120.7, 115.0, 79.8 (C=N2), 29.3 (СН3).
Диэтиловый эфир (1-диазо-2-оксопропил)фосфоновой кислоты.

Получают по методу из примера 3 из 1.5 ммоль диэтилового эфира (2-оксопропил)фосфоновой кислоты. Время реакции 2 часа. Выход 300 мг (91%). Прозрачная бесцветная жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.32-4.10 (м, 4Н, Р(O)(ОСН2СН3)2), 2.28 (с, 3H, СН3С=O), 1.38 (тд, J=7.1, 0.6, 6Н, Р(O)(ОСН2СН3)2), 1.31 (т, J=7.1, 3H, CO2CH2CH3). ЯМР13С (101 МГц, CDCl3, J/Гц): 190.0 (д, J=13.3, С=O), 64.4 (д, J=218.4, C=N2), 63.4 (д, J=5.6, , Р(O)(ОСН2СН3)2), 27.13 (д, J=1.5, СН3С=O), 16.1 (д, J=6.8, Р(O)(ОСН2СН3)2).
2-Диазо-1-фенилбутан-1,3-дион.

Получают по методу из примера 4 из 0.75 ммоль 1-фенилбутан-1,3-диона. Время реакции 1.5 часа. Выход 130 мг (92%). Бледно-желтые кристаллы. Т. пл. 59.4-61.0°С (разл.). ЯМР1H (400 МГц, CDCl3, J/Гц): 7.67-7.62 (м, 2Н, орто-Ph), 7.61-7.55 (м, 1Н, пара-Ph), 7.50 (т, J=7.5 Hz, 2Н, мета-Ph), 2.58 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3): 190.7, 185.0, 137.4, 132.7, 128.9, 127.3, 83.7 (C=N2), 29.2 (СН3).
2-Диазо-1-(4-фторфенил)бутан-1,3-дион.

Получают по методу из примера 4 из 1.5 ммоль 1-(4-фторфенил)бутан-1,3-диона. Время реакции 2 часа. Выход 287 мг (93%). Вязкая прозрачная желтоватая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.73-7.65 (м, 2Н), 7.19 (т, J=8.6, 2Н), 2.57 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3, J/Гц): 190.4, 183.6, 165.2 (д, J=254.7), 133.5 (д, J=3.3), 130.04 (д, J=9.2), 116.1 (д, J=22.2), 83.4 (C=N2), 29.1 (СН3).
Диметиловый эфир (E)-4-диазопент-2-ендиовой кислоты.

Получают по методу из примера 4 из 0.75 ммоль диметилового эфира (E)-пент-2-ендиовой кислоты. Время реакции 1.5 часа. Выход 94 мг (68%). Желтые кристаллы. Т. пл. 68.5-70.5°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.35 (д, J=15.7, 1Н), 5.74 (д, J=15.7, 1Н), 3.86 (с, 3H), 3.76 (с, 3H). ЯМР13С (101 МГц, CDCl3): 166.4, 163.5, 131.0, 111.3, 65.2 (C=N2), 52.6, 51.6.
Метиловый эфир 2-диазо-2-(4-нитрофенил)уксусной кислоты.

Получают по методу из примера 4 из 0.75 ммоль метилового эфира 2-(4-нитрофенил)уксусной кислоты. Время реакции 24 часа. Выход 101 мг (61%). Желтые кристаллы. Т. пл. 143.5-144.0°С (разл.). ЯМР1H (400 МГц, CDCl3, J/Гц): 8.25 (д, J=9.1, 2Н), 7.68 (д, J=9.1, 2Н), 3.93 (с, 3H, CO2CH3). ЯМР13С (101 МГц, CDCl3): 164.1 (CO2), 145.1, 133.8, 124.3, 123.1, 64.7 (C=N2), 52.4 (ОСН3).
2-Диазо-1-(4-метоксифенил)-3-фенилпропан-1,3-дион.

Получают по методу из примера 4 из 0.75 ммоль 1-фенилбутан-1,3-диона. Время реакции 4 часа. Выход 195 мг (93%). Бледно-желтые кристаллы. Т. пл. 86.4-87.6°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.65-7.58 (м, 4Н), 7.51-7.44 (м, 1Н, пара-Ph), 7.35 (т, J=7.7, 2Н, мета-Ph), 6.83 (д, J=8.9, 2Н), 3.83 (с, 3H, ОСН3). ЯМР13С (101 МГц, CDCl3): 186.7, 184.9, 163.3, 137.1, 132.5, 130.9, 129.4, 128.4, 128.3, 113.6, 83.5 (C=N2), 55.5 (ОСН3).
Этиловый эфир 2-диазо-2-(диэтоксифосфорил)уксусной кислоты.

Получают по методу из примера 4 из 1.5 ммоль этилового эфира 2-(диэтоксифосфорил)уксусной кислоты. Время реакции 50 часов. Выход 304 мг (81%). Прозрачная бесцветная жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.27 (к, J=7.1, 2Н, СО2СН2СН3), 4.27-4.12 (м, 4Н, Р(O)(ОСН2СН3)2), 1.37 (тд, J=7.1, 0.6, 6Н, Р(O)(ОСН2СН3)2), 1.31 (т, J=7.1, 3H, CO2CH2CH3). ЯМР13С (101 МГц, CDCl3, J/Гц): 163.4 (д, J=12.2, CO2), 63.6 (д, J=5.8, Р(O)(ОСН2СН3)2), 61.7 (CO2CH2CH3), 53.7 (д, J=227.4, C=N2), 16.1 (d, J=6.9, P(O)(OCH2CH3)2), 14.3 (CO2CH2CH3).
4-Диазо-2-метилизохинолин-1,3(2H,4H)-дион.

Получают по методу из примера 4 из 0.75 ммоль N-метилгомофталимида. Время реакции 4 часа. Выход 127 мг (84%). Желтые кристаллы. Т. пл. 146.5-147.7°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.29 (д, J=7.9, 1Н), 7.67 (т, J=7.9, 1Н), 7.34 (т, J=7.8 1Н), 7.13 (д, J=7.9, 1Н), 3.46 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3): 162.9, 162.7, 134.1, 130.1, 126.4, 125.7, 120.8, 118.6, 68.1 (C=N2), 27.4 (СН3). HRMS m/z [M+Na]+ вычислено для C10H8N3O2 [М+Н]+ 202.0611, найдено 202.0615.
Этиловый эфир 2-диазо-4,4-диметил-3-оксобутановой кислоты.

Получают по методу из примера 4 из 0.75 ммоль этилового эфира 4,4-диметил-3-оксобутановой кислоты. Время реакции 2 часа. Выход 128 мг (86%). Прозрачная бесцветная жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.28 (к, J=7.1, 2Н, СН2СН3), 1.33 (т, J=7.1, 3H, СН2СН3), 1.30 (с, 9Н, С(СН3)3). ЯМР13С (101 МГц, CDCl3): 197.3 (С=O), 160.9 (CO2), 77.5 (C=N2), 61.3 (СН2СН3), 44.3 (С(СН3)3), 25.8 (С(СН3)3), 14.3 (СН2СН3).
Этиловый эфир 2-диазо-3-оксо-3-фенилпропановой кислоты.

Получают по методу из примера 4 из 0.75 ммоль этилового эфира бензоилуксусной кислоты. Время реакции 2 часа. Выход 150 мг (92%). Прозрачная желтоватая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.72-7.60 (м, 2Н, орто-Ph), 7.55 (т, J=7.4, 1Н, пара-Ph), 7.44 (т, J=7.6, 2Н, мета-Ph), 4.27 (к, J=7.1, 2Н, СН2СН3), 1.27 (т, J=7.1, 3H, CH2CH3). ЯМР13С (101 МГц, CDCl3): 186.9 (С=O), 161.0 (CO2), 137.1, 132.2, 128.3, 127.9, 76.2 (C=N2), 61.6 (СН2СН3), 14.20 (СН2СН3).
2-Диазо-1-(4-хлорфенил)бутан-1,3-дион.

Получают по методу из примера 4 из 0.75 ммоль 1-фенилбутан-1,3-диона. Время реакции 2 часа. Выход 150 мг (90%). Бледно-желтые кристаллы. Т. пл. 57.1-58.4°С. ЯМР1H (400 МГц, CDCl3, J/Гц): 7.61 (д, J=8.6, 2Н), 7.49 (д, J=8.6, 2Н), 2.58 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3): 190.3, 183.8, 139.1, 135.6, 129.3, 128.9, 83.6 (C=N2), 29.1 (СН3).
Этиловый эфир 2-диазо-3-оксо-3-(тиофен-2-ил)пропановой кислоты.
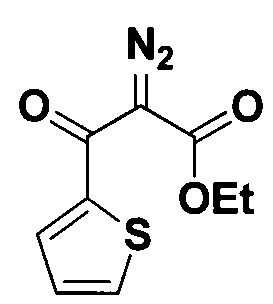
Получают по методу из примера 4 из 0.75 ммоль этилового эфира 3-оксо-3-(тиофен-2-ил)пропановой кислоты. Время реакции 2 часа. Выход 160 мг (95%). Прозрачная желтоватая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.08 (дд, J=3.9, 1.1, 1H), 7.68 (дд, J=5.0, 1.1, 1H), 7.13 (дд, J=5.0, 3.9, 1Н), 4.35 (к, J=7.1, 2Н, CH2CH3), 1.36 (т, J=7.1, 3H, СН2СН3). ЯМР13С (101 МГц, CDCl3): 176.7 (С=O), 160.9 (CO2), 141.5, 133.9, 133.8, 127.7, 77.1 (C=N2), 61.7 (СН2СН3), 14.3 (СН2СН3).
2-Диазо-1,3-бис-(4-фторфенил)пропан-1,3-дион.

Получают по методу из примера 4 из 0.75 ммоль 1,3-бис-(4-фторфенил)пропан-1,3-иона. Время реакции 2 часа. Выход 199 мг (93%). Светло-бежевые кристаллы. Т. пл. 101.1-102.1°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.62 (дд, J=8.8, 5.3, 4Н), 7.04 (т, J=8.6, 4Н). ЯМР13С (101 МГц, CDCl3): 184.7 (2С=O), 165.3 (д, J=255.2 Hz), 133.1 (д, J=3.2 Hz), 131.0 (д, J=9.3 Hz), 115.7 (д, J=22.2), 84.3 (C=N2).
Метиловый эфир 2-диазо-3-оксо-4-хлорбутановой кислоты.

Получают по методу из примера 4 из 0.75 ммоль метилового эфира γ-хлорацетоуксусной кислоты. Время реакции 1 час. Выход 94 мг (71%). Прозрачная желтоватая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.61 (с, 2Н, СН2), 3.87 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3): 183.9 (С=O), 161.2 (CO2), 75.8 (C=N2), 52.6 (СН3), 46.8 (СН2).
4-Диазо-2-фенилизохинолин-1,3(2H,4H)-дион.
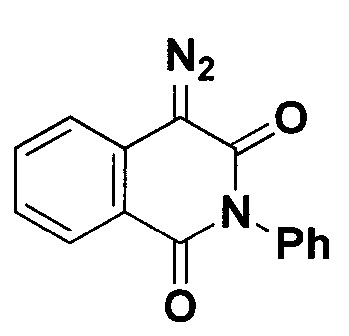
Получают по методу из примера 4 из 0.75 ммоль N-фенилгомофталимида. Время реакции 3 часа. Выход 183 мг (93%). Желтые кристаллы. Т. пл. 185.3-185.9°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.34 (ддд, J=8.0, 1.4, 0.5, 1Н), 7.74 (ддд, J=7.9, 7.4, 1.4, 1Н), 7.58-7.52 (м, 2Н), 7.51-7.46 (м, 1Н), 7.39 (ддд, J=8.0, 7.4, 1.1, 1Н), 7.30-7.25 (м, 2Н), 7.21 (ддд, J=8.0, 1.0, 0.6, 1Н). ЯМР13С (101 МГц, CDCl3): 162.9 (С=O), 162.6 (С=O), 134.8, 134.5, 130.6, 129.4, 128.9, 128.6, 126.8, 125.8, 121.2, 118.7, 68.6 (C=N2).
4-Диазо-2-(2,4-диметоксибензил)изохинолин-1,3(2H,4H)-дион.

Получают по методу из примера 4 из 1.5 ммоль N-(2,4-диметоксибензил)гомофталимида. Время реакции 4 часа. Выход 430 мг (85%). Желтая застывшая пена. ЯМР1H (400 МГц, CDCl3, J/Гц): 8.42-8.25 (м, 1Н), 7.74-7.62 (м, 1Н), 7.35 (ддд, J=8.2, 7.5, 1.1, 1H), 7.15 (д, J=7.9, 1Н), 7.01 (д, J=8.4, 1H), 6.47 (д, J=2.4, 1H), 6.40 (дд, J=8.4, 2.4, 1H), 5.28 (с, 2Н, СН2), 3.86 (с, 3H, ОСН3), 3.78 (с, 3H, ОСН3). ЯМР13С (101 МГц, CDCl3): 162.7, 162.6, 160.1, 158.2, 134.1, 130.4, 128.3, 126.6, 125.6, 121.0, 118.6, 117.2, 104.1, 98.6, 68.2 (C=N2), 55.6 (ОСН3), 55.3 (ОСН3), 39.0 (СН2).
Этиловый эфир 2-диазо-3-(4-метоксифенил)-3-оксопропановой кислоты.

Получают по методу из примера 4 из 0.75 ммоль этилового эфира бензоилуксусной кислоты. Время реакции 2 часа. Выход 182 мг (98%). Прозрачная желтая жидкость. ЯМР1H (400 МГц, CDCl3, J/Гц): 7.69 (д, J=8.8, 2Н), 6.93 (д, J=8.8, 2Н), 4.28 (к, J=7.1, 2Н, CH2CH3), 3.88 (с, 3H, ОСН3), 1.30 (т, J=7.1, 3H, СН2СН3). ЯМР13С (101 МГц, CDCl3): 185.3 (С=O), 163.2, 161.2, 131.0, 129.4, 113.1, 75.6 (C=N2), 61.5 (СН2СН3), 55.4 (ОСН3), 14.3 (СН2СН3).
2-Диазо-4-метил-1-фенилпентан-1,3-дион.

Получают по методу из примера 4 из 0.75 ммоль 4-метил-1-фенилпентан-1,3-диона. Время реакции 2 часа. Выход 141 мг (87%). Прозрачная бесцветная жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.68-7.63 (м, 2Н), 7.61-7.55 (м, 1H), 7.50 (т, J=7.4 Hz, 2Н), 3.66 (гепт, J=6.8 Hz, 1H, СН(СН3)2), 1.21 (т, J=6.8 Hz, 6Н, СН(СН3)2). ЯМР13С (101 МГц, CDCl3): 197.5, 184.9, 137.7, 132.5, 128.9, 127.3, 82.4 (C=N2), 37.8 (СН(СН3)2), 18.6 (СН(СН3)2).
Этиловый эфир 2-диазо-4-метил-3-оксопентановой кислоты.

Получают по методу из примера 4 из 0.75 ммоль этилового эфира 4-метил-3-оксопентановой кислоты. Время реакции 2 часа. Выход 117 мг (85%). Прозрачная бесцветная жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.30 (к, J=7.1, 2Н, СН2СН3), 3.58 (гепт, J=6.8, 1H, СН(СН3)2), 1.30 (т, J=7.1, 3H, СН2СН3), 1.13 (д, J=6.8, 6Н, СН(СН3)2). ЯМР13С (101 МГц, CDCl3): 197.0 (С=O), 161.1 (CO2), 75.2 (C=N2), 61.3 (СН2СН3), 36.7 (СН(СН3)2), 18.5 (СН(СН3)2), 14.3 (СН2СН3).
2-Диазо-1-(2,4-диметилфенил)-2-(4-нитрофенил)этанон.

Получают по методу из примера 4 из 0.75 ммоль 1-(2,4-диметилфенил)-2-(4-нитрофенил)этанона. Время реакции 2 часа. Выход 186 мг (84%). Желтые кристаллы. Т. пл. 108.9-109.7°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.27 (д, J=9.1, 2Н), 7.77 (д, J=9.1, 2Н), 7.30 (д, J=7.8, 1H), 7.13 (с, 1Н), 7.09 (д, J=7.8, 1H), 2.41 (с, 3H), 2.39 (с, 3H). ЯМР13С (101 МГц, CDCl3): 189.3 (С=O), 145.6, 141.3, 135.8, 134.7, 133.9, 132.2, 126.7, 126.6, 124.5, 124.2, 75.1 (C=N2), 21.4, 19.0.
Метиловый эфир 2-диазо-2-(фенилсульфонил)уксусной кислоты.

Получают по методу из примера 4 из 1.5 ммоль метилового эфира 2-(фенилсульфонил)уксусной кислоты. Время реакции 6 часов. Выход 274 мг (76%). Светло-желтые кристаллы. Т. пл. 67.8-69.9°С. ЯМР1H (400 МГц, CDCl3, J/Гц): 8.08-8.02 (м, 2Н, орто-Ph, 7.71-7.66 (м, 1Н, пара-Ph), 7.59 (т, J=7.7, 2Н, мета-Ph), 3.79 (с, 3H, ОСН3). ЯМР13С (101 МГц, CDCl3): 160.0 (CO2), 141.6, 134.1, 129.2, 127.8, 75.8 (C=N2), 52.9 (ОСН3).
Метиловый эфир 2-(адамандан-1-илсульфонил)-2-диазоуксусной кислоты.

Получают по методу из примера 4 из 1.5 ммоль метилового эфира 2-(адамандан-1-илсульфонил)уксусной кислоты. Время реакции 6 часов. Выход 389 мг (87%). Белые кристаллы. Т. пл. 103.0-105.1°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 3.87 (с, 3H, ОСН3), 2.25-2.20 (м, 3H), 2.08 (д, J=2.9, 6Н), 1.81-1.69 (м, 6Н). ЯМР13С (101 МГц, CDCl3): 160.8 (CO2), 68.9 (C=N2), 66.6, 52.9, 35.7, 35.2, 28.3.
2-(Адамандан-1-илсульфонил)-2-диазо-1-фенилэтанон.

Получают по методу из примера 4 из 1.5 ммоль 2-(адамандан-1-илсульфонил)-1-фенилэтанона. Время реакции 3 часа. Выход 459 мг (89%). Белые кристаллы. Т. пл. 145.3-146.2°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.73-7.67 (м, 2Н, орто-Ph), 7.63-7.57 (м, 1Н, пара-Ph), 7.50 (т, J=7.5, 2Н, мета-Ph), 2.25-2.20 (м, 3H), 2.10 (д, J=2.9, 6Н), 1.80-1.69 (м, 6Н). ЯМР13С (101 МГц, CDCl3): 183.5 (С=O), 136.4, 132.9, 128.8, 127.7, 67.7, 35.7, 35.4, 28.4.
Метиловый эфир 2-диазо-3-оксо-3-(4-фторфенил)пропановой кислоты.

Получают по методу из примера 4 из 1.5 ммоль метилового эфира (4-фторбензоил)уксусной кислоты. Время реакции 2 часа. Выход 306 мг (92%). Желтоватая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.76-7.64 (м, 2Н), 7.12 (т, J=8.6, 2Н), 3.82 (с, 3H, CO2CH3). ЯМР13С (101 МГц, CDCl3, J/Гц): 185.3 (С=O), 165.25 (д, J=253.7), 161.4 (CO2), 133.0 (д, J=3.1), 131.2 (д, J=9.2), 115.1 (д, J=22.1), 76.2 (C=N2), 52.4 (ОСН3).
Метиловый эфир 2-диазо-3-(2-метоксифенил)-3-оксопропановой кислоты.

Получают по методу из примера 4 из 1.5 ммоль метилового эфира (2-метоксибензоил)-уксусной кислоты. Время реакции 2 часа. Выход 340 мг (97%). Желтоватая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.45 (ддд, J =8.4, 7.5, 1.8, 1Н), 7.34 (дд, J=7.5, 1.7, 1Н), 7.03 (тд, J=7.5, 0.8, 1Н), 6.94 (д, J=8.4, 1Н), 3.84 (с, 3H), 3.77 (с, 3H). ЯМР13С (101 МГц, CDCl3): 185.9 (С=O, 161.4 (CO2), 156.8, 132.5, 128.7, 127.8, 120.7, 110.9, 77.0 (C=N2), 55.6, 52.2.
2-Диазо-1-(4-метоксифенил)-3-(4-фторфенил)пропан-1,3-дион.

Получают по методу из примера 4 из 1.5 ммоль 1-(4-метоксифенил)-3-(4-фторфенил)пропан-1,3-диона. Время реакции 2 часа. Выход 429 мг (96%). Светло-желтые кристаллы. Т. пл. 66.5-67.6°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.63 (дд, J=8.7, 5.3, 2Н), 7.60 (д, J=8.8, 2Н), 7.03 (т, J=8.6, 2Н), 6.85 (д, J=8.9, 2Н), 3.84 (с, 3H, ОСН3). ЯМР13С (101 МГц, CDCl3, J/Гц): 185.4, 184.6, 165.2 (д, J=254.5), 163.4, 133.3 (д, J=3.1), 131.1 (д, J=9.2), 130.8, 129.3, 115.5 (д, J=22.1), 113.8, 83.5 (C=N2), 55.5 (ОСН3).
Изопропиловый эфир 2-диазо-3-оксобутановой кислоты.
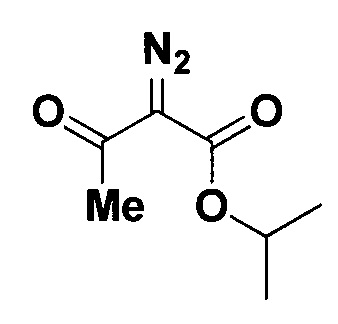
Получают по методу из примера 4 из 1.5 ммоль изопропилового эфира ацетоуксусной кислоты. Время реакции 2 часа. Выход 214 мг (84%). Прозрачная бесцветная жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 5.16 (гепт, J=6.3, 1Н, СН(СН3)2), 2.48 (с, 3H, СН3СО), 1.32 (д, J=6.3, 6Н, СН(СН3)2). ЯМР13С (101 МГц, CDCl3): 190.3 (С=O), 161.0 (CO2), 76.6 (C=N2), 69.4 (СН(СН3)2), 28.2 (СН3СО), 21.9 (СН(СН3)2).
Бензиловый эфир 2-диазо-3-оксобутановой кислоты.

Получают по методу из примера 4 из 1.5 ммоль бензилового эфира ацетоуксусной кислоты. Время реакции 2 часа. Выход 298 мг (91%). Бледно-желтые кристаллы. Т. пл. 41.3-3.1°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.43-7.36 (м, 5Н, Ph(H)), 5.29 (с, 2Н, СН2), 2.51 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3): 190.0 (С=O), 161.3 (CO2), 135.2, 128.8, 128.7, 128.4, 76.4 (C=N2), 67.0 (СН2), 28.3 (СН3).
2-Диазо-2,3-дигидро-6-фтор-1H-инден-1-он.

Получают по методу из примера 4 из 0.75 ммоль метилового эфира 2-(1-оксо-2,3-дигидро-6-фтор-1H-инден-2-ил)-2-оксоуксусной кислоты. Время реакции 2 часа. Выход 109 мг (83%). Бежевые кристаллы. Т. пл. 95.9-97.2°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.46 (дд, J=7.7, 2.5, 1H), 7.42 (дд, J=8.4, 4.5, 1Н), 7.29 (тд, J=8.6, 2.5, 1Н), 4.05 (с, 2Н, СН2). ЯМР13С (101 МГц, CDCl3, J/Гц): 187.2 (д, J=3.1, С=O), 162.9 (д, J=248.3), 139.51 (д, J=7.9), 138.5 (д, J=2.4), 126.8 (д, J=8.1), 120.5 (д, J=23.7), 109.3 (д, J=22.9), 61.6 (C=N2), 28.2 (СН2).
3-Диазо-1-(4-хлорфенил)пирролидин-2-он.

Получают по методу из примера 4 из 0.75 ммоль этилового эфира 2-оксо-2-(1-(4-хлорфенил)пирролидин-3-ил)-2-оксоуксусной кислоты. Время реакции 1.5 часа. Выход 129 мг (78%). Бежевые кристаллы. Т. пл. 133.1-134.8°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.56 (д, J=9.1 Hz, 2Н), 7.32 (д, J=9.1 Hz, 2Н), 3.89-3.82 (м, 2Н, СН2), 3.30-3.22 (м, 2Н, СН2). ЯМР13С (101 МГц, CDCl3, J/Гц): 166.8 (С=O), 138.6, 128.9, 128.8, 119.9, 53.9 (C=N2), 44.8 (СН2), 18.0 (СН2).
1,1-Диоксид 2-диазо-4-метил-2H-бензо[b][1,4]тиазин-3(4H)-она.

Получают по методу из примера 4 из 0.75 ммоль 1,1-диоксида 4-метил-2H-бензо[b][1,4]тиазин-3(4H)-она. Время реакции 2 часа. Выход 123 мг (69%). Бледно-оранжевые кристаллы. Т. пл. 153.3-155.0°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.98-7.95 (м, 1Н), 7.70 (ддд, J=8.5, 7.4, 1.6,1Н), 7.39-7.35 (м, 1Н), 7.33 (дд, J=8.4, 0.8, 1Н), 3.54 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3, J/Гц): 158.8 (С=O), 137.0, 134.5, 128.4, 123.9, 122.1, 117.1, 73.7 (C=N2), 32.2 (СН3).
2-Диазонафталин-1(2H)-он.

Получают по методу из примера 5 из 1.5 ммоль 1-нафтола. Время реакции 1.5 часа. Выход 104 мг (41%). Коричневые кристаллы. Т. пл. 74.9-76.3°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.38-8.33 (м, 1Н), 7.63 (ддд, J=8.0, 7.2, 1.4, 1H), 7.52-7.44 (м, 2Н), 6.90 (д, J=9.4, 1Н), 6.58 (д, J=9.3, 1Н). ЯМР13С (101 МГц, CDCl3): 180.1 (С=O), 137.5, 132.7, 129.6, 128.2, 127.2, 125.4, 117.3, 116.2, 77.2 (C=N2).
Этиловый эфир 2-диазо-2-цианоуксусной кислоты.

Получают по методу из примера 5 из 1.5 ммоль этилового эфира цианоуксусной кислоты. Время реакции 1 час. Выход 92 мг (44%). Светло-оранжевая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.31 (к, J=7.1, 2Н, CH2CH3), 1.32 (т, J=7.1, 3H, СН2СН3). ЯМР13С (101 МГц, CDCl3): 161.0 (С=O), 65.4 (C=N2), 61.6 (СН2СН3), 14.3 (СН2СН3).
трет-Бутиловый эфир 2-диазо-2-цианоуксусной кислоты.

Получают по методу из примера 5 из 1.5 ммоль трет-бутилового эфира цианоуксусной кислоты. Время реакции 1 час. Выход 178 мг (71%). Красноватая вязкая жидкость. ЯМР1H (400 МГц, CDCl3, J/Гц): 1.54 (с, 9Н). ЯМР13С (101 МГц, CDCl3): 160.1 (С=O), 107.7 (C≡N), 85.6 (С(СН3)3), 51.2 (C=N2), 28.1 (С(СН3)3).
2-Диазо-3-оксо-3-(пирролидин-1-ил)пропанонитрил.
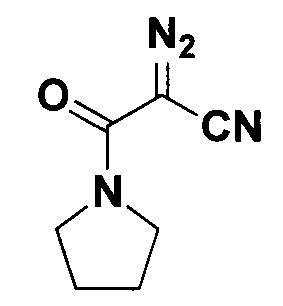
Получают по методу из примера 5 из 1.5 ммоль пирролидида циануксусной кислоты. Время реакции 1.5 часа. Выход 59 мг (24%). Оранжевая вязкая жидкость. ЯМР1H (400 МГц, CDCl3, J/Гц): 3.62-1.58 (м, 4Н), 2.00 (уш.с, 2Н), 1.91 (уш.с, 2Н). ЯМР13С (101 МГц, CDCl3): 157.0 (С=O), 109.8 (C≡N), 52.5 (C=N2), 48.0 (NCH2), 47.5 (NCH2), 26.5 (NCH2CH2), 23.9 (NCH2CH2).
Диметиловый эфир 2,4-бис(диазо)-3-оксопентандиовой кислоты.

Получают по методу из примера 5 из 0.75 ммоль диметилового эфира ацетондикарбоновой кислоты. Время реакции 2 часа. Выход 144 мг (85%). Прозрачная жидкость. ЯМР1H (400 МГц, CDCl3, J/Гц): 3.84 (с, 6Н, 2×ОСН3). ЯМР13С (101 МГц, CDCl3): 174.3 (С=O), 161.2 (2×CO2), 74.0 (2×C=N2), 52.6 (2×ОСН3).
2,6-Бис(диазо)циклогекс-4-ен-1,3-дион.
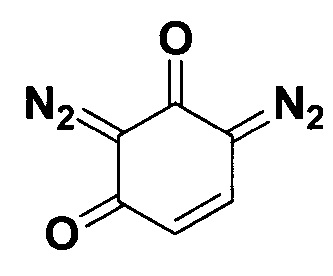
Получают по методу из примера 5 из 1.5 ммоль резорцина. Время реакции 2 часа. Выход 109 мг (45%). Коричневые кристаллы. Т. пл. 77.0-79.3°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.27 (д, J=10.3, 1Н), 5.90 (д, J=10.2, 1H). ЯМР13C (101 МГц, CDCl3): 177.8, 174.0, 129.8, 117.9, 85.5 (C=N2), 73.8 (C=N2).
2-Диазо-1-(пирролидин-1-ил)этанон.

Получают по методу из примера 6 из 1.5 ммоль пирролидида ацетоуксусной кислоты. Выход 173 мг (83%). Желтая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.82 (с, 1Н, HC=N2), 3.52 (уш.с, 2Н, NCH2), 3.21 (уш.с, 2Н, NCH2), 2.00-1.82 (уш.м, 4Н, 2×NCH2CH2). ЯМР13С (101 МГц, CDCl3): 163.9 (С=O), 46.5 (C=N2), 46.1 (NCH2), 45.9 (NCH2), 25.9 (NCH2CH2), 24.5 (NCH2CH2).
2-Диазо-1-морфолиноэтанон.

Получают по методу из примера 6 из 1.5 ммоль морфолида ацетоуксусной кислоты. Выход 218 мг (94%). Желтоватая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.99 (с, 1Н, HC=N2), 3.73-3.63 (м, 4Н), 3.41 (уш.с, 4Н). ЯМР13С (101 МГц, CDCl3): 165.0 (С=O), 66.6, 46.4 (C=N2), 44.1.
N-Бензил-2-диазо-N-метилацетамид.

Получают по методу из примера 6 из 1.5 ммоль N-бензил-N-метил-амида ацетоуксусной кислоты. Выход 244 мг (86%). Светло-коричневая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.36 (т, J=7.2 Hz, 2Н), 7.30 (т, J=7.3, 1H), 7.24 (д, J=7.3, 2Н), 5.01 (с, 1Н, HC=N2), 4.52 (уш.с, 2Н, NCH2), 2.89 (уш.с, 3H, NCH3). ЯМР13С (101 МГц, CDCl3): 166.1 (С=O), 137.0, 128.8, 127.5, 127.4, 51.8 (СН2), 46.5 (C=N2), 34.3 (СН3).
Схема 2 - Получение диазосоединений по способу с предварительным формилированием

Пример 7. 2-Диазо-1-фенилэтанон.

К охлажденному смесью льда с солью раствору 180 мг (1.5 ммоль) ацетофенона и 363 мкл (4.5 ммоль) этилформиата в 2 мл сухого тетрагидрофурана добавляют 336 мг (3 ммоль) трет-бутоксида калия. Смесь перемешивают в течение 1 часа, после чего удаляют баню и оставляют перемешиваться при комнатной температуре на ночь. К полученной смеси при охлаждении смесью льда с солью и перемешивании добавляют водный раствор калиевой соли 3-(азидосульфонил)бензойной кислоты, взятый в объеме, содержащем 2 ммоль реагента. Смесь перемешивают в течение 1 часа, после чего удаляют охлаждающую баню, добавляют 196 мг (3.5 ммоль) гидроксида калия и 2 мл ацетонитрила и продолжают перемешивание в течение 2 часов. Продукт реакции экстрагируют хлороформом (2×5 мл), объединенные органические фазы сушат над хлоридом кальция, растворитель удаляют в вакууме. Выход 182 мг (83%). Оранжевые кристаллы. Т. пл. 46.9-8.3°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.81-7.76 (м, 2Н), 7.59-7.53 (м, 1H), 7.50-7.43 (м, 2Н), 5.93 (с, 1Н, HC=N2). ЯМР13С (101 МГц, CDCl3): 186.3 (С=O), 136.7, 132.7, 128.6, 126.7, 54.1 (C=N2).
Пример 8. Этиловый эфир 2-диазо-2-фенилуксусной кислоты.

К охлажденному смесью льда с солью раствору 246 мг (1.5 ммоль) этилового эфира 2-фенилуксусной кислоты и 484 мкл (6 ммоль) этилформиата (или 367 мкл (6 ммоль) метилформиата в случае метиловых эфиров) в 2.5 мл сухого тетрагидрофурана добавляют 420 мг (3.75 ммоль) трет-бутоксида калия. Смесь перемешивают в течение 2 часов, после чего удаляют охлаждающую баню и оставляют перемешиваться при комнатной температуре на ночь. К полученной смеси при охлаждении смесью льда с солью и перемешивании добавляют водный раствор калиевой соли 3-(азидосульфонил)бензойной кислоты, взятый в объеме, содержащем 2 ммоль реагента. Смесь перемешивают в течение 1 часа, после чего удаляют баню и перемешивают смесь при комнатной температуре 2 часа. Продукт реакции экстрагируют хлороформом (2×5 мл), объединенные органические фазы сушат над хлоридом кальция, растворитель удаляют в вакууме. Выход 208 мг (73%). Оранжевая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.54-7.49 (м, 2Н), 7.44-7.37 (м, 2Н), 7.24-7.17 (м, 1H), 4.36 (к, J=7.1, 2Н, CH2CH3), 1.37 (т, J=7.1, 3H, СН2СН3). ЯМР13С (101 МГц, CDCl3): 165.2 (CO2), 128.9, 125.8, 125.7, 124.0, 63.3 (C=N2), 61.0 (СН2СН3), 14.5 (СН2СН3).
2-Диазо-1-(тиофен-2-ил)этанон.
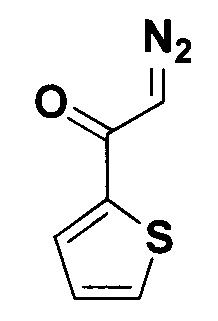
Получают по методу из примера 7 из 1.5 ммоль 2-ацетилтиофена. Выход 217 мг (95%). Желтые кристаллы. Т. пл. 62.4-64.4°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.60 (дд, J=5.0, 1.0, 1H), 7.53 (дд, J=3.8, 1.0, 1Н), 7.12 (дд, J=4.9, 3.9, 1H), 5.84 (с, 1Н, HC=N2). ЯМР13С (101 МГц, CDCl3): 178.9 (С=O), 142.5), 132.2, 129.0, 128.0, 54.2 (C=N2).
2-Диазо-3,4-дигидронафталин-1(2H)-он.

Получают по методу из примера 7 из 1.5 ммоль α-тетралона. Выход 163 мг (63%). Коричневые кристаллы. Т. пл. 43.6-5.4°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.04-8.00 (м, 1Н), 7.44 (тд, J=7.5, 1.5, 1H), 7.39-7.32 (м, 1H), 7.22 (ддк, J=7.5, 1.3, 0.8, 1H), 3.07-3.02 (м, 2Н), 3.02-2.97 (м, 2Н). ЯМР13С (101 МГц, CDCl3): 183.6 (С=O), 140.1, 133.3, 132.5, 128.2, 127.1, 126.0, 62.7 (C=N2), 27.8, 20.8.
2-Диазоциклооктанон.
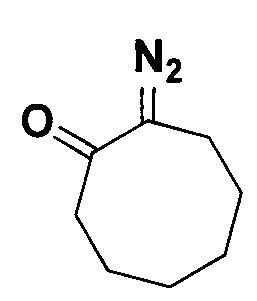
Получают по методу из примера 7 из 1.5 ммоль циклооктанона. Выход 125 мг (55%). Желтая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 2.61-2.57 (м, 2Н), 2.56-2.51 (м, 2Н), 1.81-1.74 (м, 2Н), 1.73-1.67 (м, 2Н), 1.64-1.58 (м, 4Н). ЯМР13С (101 МГц, CDCl3): 198.7 (С=O), 66.3 (C=N2), 43.9, 37.9, 29.7, 28.4, 25.8, 25.7, 24.5.
2-Диазоциклопентанон.

Получают по методу из примера 7 из 1.5 ммоль циклопентанона. Выход 125 мг (76%). Желтая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 3.06-3.02 (м, 2Н), 2.38 (т, J=7.9, 2Н), 2.10-1.97 (м, 2Н). ЯМР13С (101 МГц, CDCl3): 200.5 (С=O), 58.4 (C=N2), 37.5, 24.4, 19.8.
1-Диазо-3,3-диметилбутан-2-оне.

Получают по методу из примера 7 из 1.5 ммоль пинаколина. Выход 181 мг (96%). Оранжевые жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 5.43 (с, 1H), 1.15 (с, 9Н). ЯМР13С (101 МГц, CDCl3): 201.2 (С=O), 51.7 (C=N2), 42.5 (С(СН3)3), 27.02 (С(СН3)3).
2-Диазо-1-(4-фторфенил)этанон.

Получают по методу из примера 7 из 1.5 ммоль n-фторацетофенона. Выход 231 мг (94%). Оранжевые кристаллы. Т. пл. 66.5-68.2°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.80 (дд, J=8.9, 5.3, 2Н), 7.13 (т, J=8.6, 2Н), 5.89 (с, 1H, HC=N2). ЯМР13С (101 МГц, CDCl3, J/Гц): 184.8 (С=O), 165.5 (д, J=253.8), 132.9 (д, J=3.0), 129.15 (д, J=9.2), 115.74 (д, J=22.0), 54.1 (C=N2).
2-Диазо-1-(2,4,5-триметилфенил)этанон.

Получают по методу из примера 7 из 1.5 ммоль 2',4',5'-триметилацетофенона. Выход 217 мг (77%). Бежевые кристаллы. Т. пл. 67.4-69.2°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.19 (с, 1H), 7.03 (с, 1Н), 5.61 (с, 1H, HC=N2), 2.47 (с, 3H), 2.27 (с, 3H), 2.26 (с, 3H). ЯМР13С (101 МГц, CDCl3): 189.9 (С=O), 140.0, 134.9, 134.3, 133.8, 133.0, 128.6, 55.9 (C=N2), 19.8, 19.6, 19.2.
2-Диазо-1-(4-хлорфенил)этанон.

Получают по методу из примера 7 из 1.5 ммоль n-хлорацетофенона. Выход 208 мг (77%). Светло-коричневые кристаллы. Т. пл. 108.5-109.7°С. ЯМР1H (400 МГц, CDCl3, J/Гц): 7.72 (д, J=8.6, 2Н), 7.44 (д, J=8.6, 2Н), 5.89 (с, 1H, HC=N2). ЯМР13С (101 МГц, CDCl3): 184.9 (С=O), 139.0, 135.0, 128.9, 128.1, 54.3 (C=N2).
2-Диазо-1-(пиридин-3-ил)этанон.

Получают по методу из примера 7 из 1.5 ммоль 3-ацетилпиридина. Выход 161 мг (73%). Желтые кристаллы. Т. пл. 47.8-48.6°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.93 (дд, J=2.3, 0.8, 1Н), 8.74 (дд, J=4.8, 1.8, 1Н), 8.08 (ддд, J=8.0, 2.3, 1.8, 1Н), 7.39 (ддд, J=8.0, 4.8, 0.8, 1Н), 5.97 (с, 1Н, HC=N2). ЯМР13С (101 МГц, CDCl3): 184.3 (С=O), 153.2, 147.9, 134.3, 132.0, 123.6, 54.9 (C=N2).
1-(Бензо[d|[1,3]диоксол-5-ил)-2-диазоэтанон.

Получают по методу из примера 7 из 1.5 ммоль 3',4'-(метилендиокси)ацетофенона. Выход 242 мг (85%). Желтые кристаллы. Т. пл. 99.4-100.4°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.33-7.28 (м, 2Н), 6.84 (д, J=8.6, 1Н), 6.05 (с, 2Н, СН2), 5.83 (с, 1Н, HC=N2). ЯМР13С (101 МГц, CDCl3): 184.7 (С=O), 151.5, 148.2, 131.3, 122.1, 108.0, 107.0, 101.9, 53.8 (C=N2).
2-Диазо-1-(2,4-диметоксифенил)этанон.

Получают по методу из примера 7 из 1.5 ммоль 2',4'-диметоксиацетофенона. Выход 275 мг (89%). Желтые кристаллы. Т. пл. 88.5-89.9°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.99 (д, J=8.7, 1Н), 6.58 (дд, J=8.8, 2.3, 1Н), 6.46 (д, J=2.3, 1Н), 6.35 (уш.с, 1H, HC=N2), 3.90 (с, 3H), 3.87 (с, 3H). ЯМР13С (101 МГц, CDCl3): 184.0 (С=O), 164.2, 160.0, 132.3, 119.3, 105.2, 98.4, 57.3 (C=N2), 55.6, 55.5.
1-(4-(Бензилтио)фенил)2-диазоэтанон.

Получают по методу из примера 7 из 1.5 ммоль 4'-(бензилтио)ацетофенона. Выход 326 мг (81%). Светло-коричневые кристаллы. Т. пл. 112.7-114.5°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.66 (д, J=8.4, 2Н, 2',6'-Н), 7.40-7.28 (м, 7Н), 5.86 (с, 1Н, HC=N2), 4.22 (с, 2Н, СН2). ЯМР13С (101 МГц, CDCl3): 185.3 (С=O), 143.6, 136.3, 133.8, 128.8, 128.7, 127.5, 127.3, 127.1, 53.9 (C=N2), 37.4 (СН2).
1-(4-Бромфенил)-2-диазоэтанон.

Получают по методу из примера 7 из 1.5 ммоль n-бромацетофенона. Выход 245 мг (73%). Желтые кристаллы. Т. пл. 122.6-123.5°С. ЯМР1H (400 МГц, CDCl3, J/Гц): 7.65 (д, J=8.7, 2Н), 7.60 (д, J=8.6, 2Н), 5.89 (с, 1Н, HC=N2). ЯМР13С (101 МГц, CDCl3): 185.1 (С=O), 135.4, 131.9, 128.2, 127.6, 54.4 (C=N2).
2-Диазо-1-(3,4-дифторфенил)этанон.

Получают по методу из примера 7 из 1.5 ммоль 3',4'-дифторацетофенона. Выход 123 мг (51%). Желтые кристаллы. Т. пл. 61.3-62.4°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.65 (ддд, J=10.5, 7.6, 2.1, 1H), 7.52 (дддд, J=8.3, 4.0, 2.0, 1.4, 1H), 7.25 (ддд, J=9.6, 8.6, 7.7, 1Н), 5.88 (с, 1H, HC=N2). ЯМР13С (101 МГц, CDCl3, J/Гц): 183.6 (С=O), 153.3 (дд, J=256.0, 12.9), 150.4 (дд, J=250.9, 13.1), 133.6 (дд, J=4.6, 3.7), 123.3 (дд, J=7.3, 3.7), 117.6 (д, J=17.9), 116.2 (дд, J=18.4, 1.5), 54.5 (C=N2).
2-Диазо-1-(3,4-диметоксифенил)этанон.

Получают по методу из примера 7 из 1.5 ммоль 3',4'-диметоксиацетофенона. Выход 303 мг (98%). Бледно-розовые кристаллы. Т. пл. 73.3-75.4°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.43 (д, J=2.0, 1Н), 7.27 (дд, J=8.5, 2.1, 1Н), 6.86 (д, J=8.4, 1H), 5.88 (с, 1Н, HC=N2), 3.93 (с, 6Н). ЯМР13С (101 МГц, CDCl3): 185.2 (С=O), 152.9, 149.1, 129.8, 120.3, 110.2, 109.5, 56.04, 56.02, 53.6 (C=N2).
2-Диазо-1-(2-метоксифенил)этанон.

Получают по методу из примера 7 из 1.5 ммоль 2'-метоксиацетофенона. Выход 222 мг (84%). Желтая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.92 (уш.с, 1Н), 7.45 (ддд, J=8.4, 7.3, 1.9, 1Н), 7.04 (ддд, J=7.8, 7.3, 1.0, 1Н), 6.96 (дд, J=8.4, 1.0, 1H), 6.33 (уш.с, 1Н, HC=N2), 3.90 (с, 3H, ОСН3). ЯМР13С (101 МГц, CDCl3): 185.2 (С=O), 158.2, 133.4, 130.3, 126.1, 120.8, 111.6, 57.9 (C=N2), 55.7 (ОСН3).
2-Диазо-1-(3-метоксифенил)этанон.

Получают по методу из примера 7 из 1.5 ммоль 3'-метоксиацетофенона. Выход 201 мг (76%). Желтая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.38-7.33 (м, 2Н), 7.29 (дт, J=7.6, 1.2, 1Н), 7.09 (ддд, J=8.1, 2.7, 1.0, 1H), 5.91 (с, 1Н, HC=N2), 3.86 (с, 3H, ОСН3). ЯМР13С (101 МГц, CDCl3): 186.1 (С=O), 159.9, 138.1, 129.6, 118.9, 111.5, 55.4 (ОСН3), 54.3 (C=N2).
2-Диазо-1-(1-метил-1H-пиррол-2-ил)этанон.

Получают по методу из примера 7 из 1.5 ммоль 2-ацетил-1-метилпиррола. Выход 181 мг (81%). Желтые кристаллы. Т. пл. 91.5-92.6°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 6.83 (т, J=2.0, 1Н), 6.65 (дд, J=4.1, 1.6, 1H), 6.11 (дд, J=4.0, 2.6, 1H), 5.69 (с, 1Н, HC=N2), 3.99 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3): 177.7 (С=O), 130.4, 129.0, 115.3, 108.0, 53.6 (C=N2), 37.3 (СН3).
2-Диазо-1-фенилпропан-1-он.

Получают по методу из примера 7 из 1.5 ммоль пропиофенона. Выход 96 мг (40%). Желтая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.62-7.57 (м, 2Н), 7.53-7.47 (м, 1Н), 7.47-7.41 (м, 2Н), 2.16 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3): 190.1 (С=O), 137.7, 131.3, 128.5, 127.2, 62.8 (C=N2), 9.5 (СН3).
2-Диазоциклогептанон.

Получают по методу из примера 7 из 1.5 ммоль циклогептанона. Выход 89 мг (43%). Желтая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 2.57-2.51 (м, 4Н), 1.83-1.66 (м, 6Н). ЯМР13С (101 МГц, CDCl3): 199.1 (С=O), 66.8 (C=N2), 43.6, 31.3, 29.6, 25.3, 24.3.
2-Диазо-1-(4-фторфенил)пропан-1-он.

Получают по методу из примера 7 из 1.5 ммоль 4'-фторпропиофенона. Выход 109 мг (41%). Желтые кристаллы. Т. пл. 57.4-58.70С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.61 (дд, J=8.8, 5.3, 2Н), 7.12 (т, J=8.6, 2Н), 2.15 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3, J/Гц): 188.6 (С=O), 164.4 (д, J=252.1), 133.8 (д, J=3.3), 129.6 (д, J=8.9), 115.6 (д, J=21.9), 62.7 (C=N2), 9.6 (СН3).
Метиловый эфир 2-диазо-2-(3,4-дихлорфенил)уксусной кислоты.

Получают по методу из примера 8 из 1.5 ммоль метилового эфира 2-(3,4-дихлорфенил)уксусной кислоты. Выход 272 мг (74%). Светло-оранжевые кристаллы. Т. пл. 95.4-97.0°С (разл.). ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.66 (д, J=2.3, 1Н), 7.45 (д, J=8.6, 1Н), 7.31 (дд, J=8.6, 2.3, 1Н), 3.90 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3): 164.8 (CO2), 133.3, 130.7, 129.4, 126.0, 125.3, 122.7, 62.9 (C=N2), 52.2 (СН3).
Этиловый эфир 2-диазо-2-(3,4-диметоксифенил)уксусной кислоты.

Получают по методу из примера 8 из 1.5 ммоль этилового эфира 2-(3,4-дихлорфенил)уксусной кислоты. Выход 272 мг (74%). Оранжевые кристаллы. Т. пл. 69.7-71.4°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.22 (д, J=1.9, 1H), 6.91 (д, J=8.5, 1Н), 6.88 (дд, J=8.5, 1.9, 1Н), 4.34 (к, J=7.1, 2Н, CH2CH3), 3.92 (с, 3H), 3.90 (с, 3H), 1.36 (т, J=7.1, 3H, СН2СН3). ЯМР13С (101 МГц, CDCl3): 165.7 (CO2), 149.5, 147.4, 117.6, 116.4, 111.7, 108.4, 62.6 (C=N2), 60.9 (СН2СН3), 56.0, 55.9, 14.5 (СН2СН3).
Этиловый эфир 2-диазо-3-фенилпропановой кислоты.

Получают по методу из примера 8 из 1.5 ммоль этилового эфира β-фенилпропионовой кислоты. Выход 266 мг (87%). Желтая вязкая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 7.38-7.33 (м, 2Н), 7.31-7.25 (м, 3H), 4.28 (к, J=7.1, 2Н, СН2СН3), 3.66 (с, 2Н), 1.31 (т, J=7.1, 3H, СН2СН3). ЯМР13С (101 МГц, CDCl3): 167.2 (CO2), 137.3, 128.8, 128.4, 127.1, 60.9 (СН2СН3), 56.8 (C=N2), 29.3, 14.5 (СН2СН3).
Этиловый эфир 2-диазобутановой кислоты.

Получают по методу из примера 8 из 1.5 ммоль этилового эфира масляной кислоты. Выход 81 мг (37%). Желтая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.23 (к, J=7.1, 2Н, ОСН2СН3), 2.36 (к, J=7.5, 2Н, 3-СН2), 1.28 (т, J=7.1, 3H, OCH2CH3), 1-14 (т, J=7.5, 3H, 3-СН3). ЯМР13С (101 МГц, CDCl3): 167.5 (CO2), 60.6 (ОСН2), 57.0 (C=N2), 16.5, 14.4, 11.9.
Диметиловый эфир 2-диазопентандиовой кислоты.

Получают по методу из примера 8 из 1.5 ммоль диметилового эфира глутаровой кислоты. Выход 184 мг (66%). Желтая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 3.77 (с, 3H), 3.71 (с, 3H), 2.66-2.56 (м, 4Н). ЯМР13С (101 МГц, CDCl3): 172.8, 167.6, 54.9 (C=N2), 51.9, 51.8, 32.2, 19.6.
Диэтиловый эфир 2-диазобутандиовой кислоты.

Получают по методу из примера 8 из 1.5 ммоль диэтилового эфира янтарной кислоты. Выход 228 мг (76%). Желтая жидкость. ЯМР1Н (400 МГц, CDCl3, J/Гц): 4.25 (к, J=7.1, 2Н), 4.21 (к, J=7.1, 2Н), 3.33 (с, 2Н), 1.30 (т, J=7.1, 3H), 1.29 (т, J=7.1, 3H). ЯМР13С (101 МГц, CDCl3): 169.6, 166.7, 61.5, 61.1, 52.50 (C=N2), 28.8 (СН2), 14.4, 14.1.
Схема 3 - Получение диазосоединений по способу с предварительным этоксалилированием

Пример 9. 2-Диазо-1-(нафталин-1-ил)этанон.

К охлаждаемой льдом смеси 255 мг (1.5 ммоль) 1-ацетилнафталина и 305 мкл (2.25 ммоль) диэтилоксалата добавляют 2.5 мл свежеприготовленного и охлажденного льдом раствора, содержащего 3 ммоль метилата натрия. Смесь перемешивают в течение 1 часа, после чего удаляют баню и оставляют перемешиваться при комнатной температуре на ночь. К полученной смеси при охлаждении льдом и перемешивании добавляют водный раствор калиевой соли 3-(азидосульфонил)бензойной кислоты, взятый в объеме, содержащем 2 ммоль реагента. Смесь перемешивают в течение 1 часа, после чего удаляют охлаждающую баню, добавляют 124 мг (4 ммоль) гидроксида калия и 2 мл ацетонитрила и продолжают перемешивание в течение 2 часов. Продукт реакции экстрагируют хлороформом (2×5 мл), объединенные органические фазы сушат над хлоридом кальция, растворитель удаляют в вакууме. Выход 218 мг (74%). Желтые кристаллы. Т. пл. 49.7-51.6°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.53 (уш.д, J=6.9, 1Н), 7.98 (д, J=8.2, 1Н), 7.94-7.85 (м, 1Н), 7.65 (дд, J=7.1, 1.1, 1Н), 7.63-7.53 (м, 2Н), 7.49 (дд, J=8.2, 7.2, 1Н), 5.75 (с, 1Н, HC=N2). ЯМР13С (101 МГц, CDCl3): 189.6 (С=O), 135.6, 133.9, 131.9, 129.8, 128.4, 127.6, 126.6, 125.9, 125.4, 124.5, 57.2 (C=N2).
2-Диазо-1-(3-нитрофенил)этанон.

Получают по методу из примера 9 из 1.5 ммоль 3'-нитроацетофенона. Выход 246 мг (86%). Желтые кристаллы. Т. пл. 138.4-139.7°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.58 (т, J=2.0, 1Н), 8.41 (ддд, J=8.2, 2.3, 1.1, 1Н), 8.18-8.11 (м, 1Н), 7.69 (т, J=8.0, 1Н), 6.05 (с, 1Н, HC=N2). ЯМР13С (101 МГц, CDCl3): 183.5 (С=O), 148.4, 137.9, 132.5, 130.0, 127.0, 121.6, 55.3 (C=N2).
2-Диазо-1-(пиридин-2-ил)этанон.
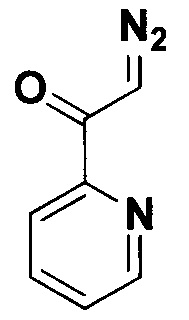
Получают по методу из примера 9 из 1.5 ммоль 2-ацетилпиридина. Выход 170 мг (77%). Желтые кристаллы. Т. пл. 39.8-41.6°С. ЯМР1Н (400 МГц, CDCl3, J/Гц): 8.57 (д, J=4.7, 1Н), 8.08 (д, J=7.8, 1H), 7.84 (тд, J=7.7, 1.7, 1H), 7.45 (ддд, J=7.5, 4.8, 1.1, 1H), 6.73 (с, 1Н, HC=N2). ЯМР13С (101 МГц, CDCl3): 186.1 (С=O), 152.3, 148.7, 137.0, 127.1, 120.8, 53.4 (C=N2).
2-Диазо-1-(4-метилфенил)этанон.

Получают по методу из примера 9 из 3.0 ммоль 4'-метилацетофенона. Выход 432 мг (90%). Желтые кристаллы. Т. пл. 49.5-50.9°С. ЯМР1H (400 МГц, CDCl3, J/Гц): 7.68 (д, J=8.2, 2Н), 7.26 (д, J=7.9, 2Н), 5.90 (с, 1Н, HC=N2), 2.42 (с, 3H, СН3). ЯМР13С (101 МГц, CDCl3): 186.0 (С=O), 143.4, 134.1, 129.3, 126.7, 53.8 (C=N2), 21.6 (СН3).
Реферат
Настоящее изобретение относится к способу получения алифатических α-диазокарбонильных соединений общей формулы (1), где R, Rимеют значения, представленные в п.1 формулы, путем реакции диазопереноса от водорастворимого сульфонилазида (3-карбоксифенилсульфонилазида), получаемого в водном растворе in situ в виде соли щелочного металла из сульфохлорида и азида натрия в присутствии основания. Технический результат – универсальность и простота исполнения способа, высокий выход целевых продуктов и легкость выделения их из реакционных смесей, вследствие чего этот метод подходит для промышленного применения. 2 з.п. ф-лы, 9 пр.
Формула



Документы, цитированные в отчёте о поиске
Способ получения замещенной бифенилилмасляной кислоты или ее эфиров или ее амидов или ее солей

Комментарии