Устройство и способы для культивирования клеток - RU2741806C2
Код документа: RU2741806C2
Чертежи

















Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу или устройству для 3D (трехмерной) культуры клеток, например, к многолуночному планшету, обеспечивающему контролируемую и надежную васкуляризацию и/или перфузию органоподобных образцов и/или клеточных культур. Оно в равной степени предоставляет способы получения 3D культивируемых клеток и васкуляризации/перфузии культивируемых клеток, и планшеты для анализа и их применения, обусловленные устройством и способами.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В продвижении ко все лучшим прогностическим фенотипическим моделям для тестирования лекарственных средств и имитации заболеваний в последние годы был сделан прогресс в области органоподобной культуры. Органоид представляет собой трехмерную заготовку органа, которая обычно содержит наиболее специализированные клетки, которые также доступны в человеческом организме. На практике культура и дифференциация ткани во время эмбрионального регенеративного развития имитируется средой in vitro таким образом, что стволовые клетки дифференцируются до разных дифференцированных клеток.
Хорошо известным примером таких органоидов являются органоиды тонкого кишечника (Shoichi Date and Toshiro Sato, Mini-Gut Organoids: Reconstitution of the Stem Cell Niche, Annu. Rev. Cell Dev. Biol., 2015, Vol. 31: 269-289). Смесь факторов роста и сигнальных молекул, таких как агонисты пути Wnt (например, Wnt3a, R-спондин, CHIR99021), ингибиторы пути BMP (костный морфогенетический белок - от англ. "bone morphogenetic protein") / TGF (трансформирующий фактор роста - от англ. "transforming growth factor") (например, ноггин), EGF (эпидермальный фактор роста - от англ. "epidermal growth factor") и среда экстракта базальной мембраны (матригель или аналогичные) обеспечивает культивирование первичных крипт кишечника, поддержание его ниши стволовых клеток и потенциала дифференциации клеток в направлении, например, бокаловидных клеток, энтероцитов и энтероэндокринных клеток. Это приводит к трехмерной структуре, имеющей вторичные аспекты морфологии кишечника, включающие образование крипт и ворсинок. Аналогичные трехмерные культуры были заложены для культуры первичного человеческого пищевода, желудка, толстой кишки, печени и поджелудочной железы.
Совсем недавно был достигнут прогресс в выращивании органоидов мозга из индуцированных плюрипотентных стволовых клеток. Долговременная культура суспендированных сфероидов при непрерывном встряхивании приводит к так называемым минимозгам со специализированными отделами, такими как отделы с характеристиками переднего и заднего мозга [Cerebral organoids model human brain development and microcephaly, M.A. Lancaster, et al. Nature 2013, 501, 373-379]. Совсем недавно был осуществлен прорыв в культивировании почечного клубочка с использованием сложного протокола культивирования, начиная с индуцированных плюрипотентных стволовых клеток на системах трансвелов, которые опять приводят к высокоспециализированным клеткам, которые присутствуют в клубочках человеческих почек [Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis, M. Takasato et al., Nature 2015, 526, 564-568].
Органоподобное культивирование или, в общем говоря, 3D культивирование клеток, может осуществляться разными способами. 3D сфероиды могут быть образованы в так называемых планшетах с висячей каплей (см., например, WO 2010/031194) или планшетах с низкой адгезией для микротитрования. Хотя и заявляют, что данные сфероиды имеют значительно улучшенную прогнозируемость по отношению к стандартным клеточным культурам, они не используются для большинства органоподобных культур. Причиной является то, что для органоидов обычно требуется компонент внеклеточного матрикса, такой как матригель или коллаген, который отсутствует в сфероидах планшетов с висячей каплей или планшетов с низкой адгезией. Параллельные усилия привели к разработке моделей 3D культуры клеток, в которых клетки выращиваются встроенными во внеклеточный матрикс. Данный подход усиливает выражение дифференцированных функций и улучшает организацию ткани (Pampaloni et al. (2007). Nat Rev Mol Cell Biol 8: 839-84).
Типичные платформы для выращивания органоидов включают стандартные чашки Петри, планшеты для микротитрования и, в некоторых случаях, планшеты Transwell® от Corning. В данных случаях органоиды выращивают во внеклеточном матриксе (ЕСМ- от англ. "extracellular matrix") или на лунке, покрытой ЕСМ. Как уже рассматривалось выше, у данных органоидов отсутствует сосудистая сеть, таким образом, ограничивая их рост, так как за пределами определенного размера могут формироваться гипоксические, а на более поздней стадии - некротические ядра. Также предполагается то, что присутствие эндотелия является решающим для развития в направлении физиологически релевантной ткани, так как эндотелий выделяет важные факторы для ткани-мишени.
Микрофлюидное культивирование клеток является все более важной технологией, находящей применение в скрининге лекарственных средств, культивировании тканей, скрининге на токсичность и в биологических исследованиях.
Известны многочисленные микрофлюидные системы, устройства, способы и изготовление, включая такие патентные документы, как WO 2008/079320, WO 2013/151616, WO 2010/086179, WO 2012/120101, или имеющиеся в продаже, например, у Mimetas, Лейден, Нидерланды (например, OrganoPlate; www.mimetas.com). В то время как конкретные ограничения из данных заявок и документов не следует включать в представленную в данном документе формулу изобретения, данные документы предоставляют полезный базовый материал.
В A Novel Dynamic Neonatal Blood-Brain Barrier on a Chip. S, Deosarkar, B. Prabhakarpandian, B. Wang, J.B. Sheffield, B. Krynska, M. Kiani. PLOS ONE, 2015 было разработано микрофлюидное устройство для получения сосудистой сети, и использована ситоподобная структура для отделения эндотелия от астроцитов в попытке получить структуру типа гематоэнцефалического барьера. В WO 2007/008609 А2 аналогичная ситоподобная структура используется для образования клеточных агрегатов для того, чтобы создать морфологию ткани, которая лучше имитирует, например, физиологию печени.
Ни один из приведенных выше примеров микрофлюидной клеточной культуры не обеспечивает культуру органоидов в ЕСМ с отдельной сосудистой сетью, которая может подвергаться перфузии.
Прогресс выращивания органоидов и эмбриональных телец затрудняется отсутствием технических средств для поддержки данного роста. Методики культивирования являются очень трудоемкими и могут значительно варьировать от органа к органу. Необходимо стандартное устройство, которое предпочтительно гармонизировано с современным стандартом многолуночного планшета для титрования. Во-вторых, перфузионный ток или встряхивание, по-видимому, является решающим для того, чтобы такие органоиды вырастали за пределы определенного размера, так как плотные группы клеток требуют обогащенной кислородом, обогащенной питательными веществами среды для того, чтобы предупреждать некротические ядра. В третьих, внеклеточный матрикс (ЕСМ) может быть решающим фактором для правильной дифференциации, но не все протоколы культивирования совместимы с культурой в геле ЕСМ. Самым важным из всего является то, что до сих пор рост эмбриональных телец и органоидов был сильно ограничен отсутствием сосудистой сети. Это ограничивает максимальный размер органоидов.
Соответственно, сохраняется потребность в системе, которая обеспечивает перфузионную культуру органоидов или эмбриональных телец, поддерживаемых ЕСМ, которая предпочтительно делает возможной васкуляризацию органоида и перфузию сосудистой сети. Данная платформа также должна быть совместимой с современным оборудованием для вывода данных и манипулирования.
Целью настоящего изобретения является решение некоторых или всех из вышеупомянутых потребностей.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно первому аспекту настоящего изобретения предложено устройство для культивирования клеток, содержащее микрофлюидную сеть, включающую:
микрофлюидный слой, содержащий основание, микрофлюидный канал и покрытие;
отсек для органоидов, проходящий в микрофлюидный слой через отверстие в указанном покрытии и сообщающийся по текучей среде с микрофлюидным каналом; и
барьер для капиллярного давления, по существу выровненный с указанным отверстием и делящий микрофлюидную сеть на первый подобьем, содержащий отсек для органоидов, и второй подобьем, содержащий по меньшей мере часть микрофлюидного канала.
Согласно второму аспекту настоящего изобретения предложен способ культивирования клеток или клеточных агрегатов, включающий:
a) введение в отсек для органоидов устройства по первому аспекту капли геля или предшественника геля, факультативно содержащей один или более типов клеток или клеточных агрегатов;
b) обеспечение того, чтобы капля удерживалась барьером для капиллярного давления;
c) обеспечение того, чтобы капля геля или предшественника геля отверждалась или желатинизировалась;
d) загрузка микрофлюидного канала текучей средой; и
е) факультативно культивирование одного или более типов клеток или клеточных агрегатов, присутствующих в отвержденном геле.
Согласно третьему аспекту настоящего изобретения предложен планшет для анализа, содержащий устройство по первому аспекту, предоставленное с гелем, удерживаемым барьером для капиллярного давления в отсеке для органоидов, где данный гель содержит одну или более клеток или клеточных агрегатов.
Согласно четвертому аспекту настоящего изобретения предложен набор, содержащий:
планшет для анализа по третьему аспекту изобретения; и
одно или более проангиогенных соединений для индуцирования ангиогенеза.
Согласно пятому аспекту настоящего изобретения предложен способ васкуляризации клеточного агрегата, включающий:
введение в микрофлюидное устройство для культивирования клеток капли геля или предшественника геля и обеспечение удерживания данной капли барьером для капиллярного давления, присутствующим в устройстве;
обеспечение отверждения или желатинизации геля или предшественника геля с образованием отвержденного геля;
введение суспензии эндотелиальных клеток в несущей текучей среде в микрофлюидный канал микрофлюидного устройства для культивирования клеток, причем данный микрофлюидный канал сообщается по текучей среде с отвержденным гелем;
обеспечение образования эндотелиальными клетками по меньшей мере одного микрососуда в по меньшей мере одном микрофлюидном канале;
введение на верхнюю поверхность отвержденного геля одной или более клеток или клеточных агрегатов; и
обеспечение или стимуляцию направленного ангиогенеза по меньшей мере между указанным одним микрососудом и одной или более клетками или клеточными агрегатами.
Согласно шестому аспекту настоящего изобретения предложено микрофлюидное устройство для культивирования клеток, содержащее перфузируемую сосудистую сеть, причем указанная сосудистая сеть содержит:
микрофлюидный канал, имеющий входное и выходное отверстие;
гель внеклеточного матрикса, сконфигурированный для получения по меньшей мере одной клетки, подлежащей васкуляризации на его верхней поверхности;
где микрофлюидный канал сообщается по текучей среде с гелем внеклеточного матрикса и содержит сосудистую сеть из эндотелиальных клеток, выстилающих внутренние поверхности микрофлюидного канала.
Согласно седьмому аспекту настоящего изобретения предложено микрофлюидное устройство для культивирования клеток, содержащее:
микрофлюидный канал, имеющий входное и выходное отверстие;
внеклеточный матрикс, имеющий биологическую ткань, расположенную на его верхней поверхности;
где микрофлюидный канал содержит сосудистую сеть из эндотелиальных клеток, выстилающих внутренние поверхности микрофлюидного канала и проходящую через внеклеточный матрикс в биологическую ткань.
Согласно восьмому аспекту настоящего изобретения предложен набор, содержащий:
микрофлюидное устройство для культивирования клеток по шестому или седьмому аспектам данного изобретения; и
одно или более проангиогенных соединений для индуцирования ангиогенеза.
Различные другие аспекты настоящего изобретения относятся к применениям первого, третьего, четвертого и шестого-восьмого аспектов.
Определения
Во всем описании и формуле изобретения используются различные термины, относящиеся к устройствам, способам, применениям и другим аспектам настоящего изобретения. Таким терминам следует придавать их обычное значение в области, к которой принадлежит изобретение, если не указано иное. Другие конкретно определенные термины следует истолковывать способом, согласующимся с определением, приведенным в данном документе. Хотя на практике для тестирования настоящего изобретения и можно использовать любые способы и материалы, аналогичные или эквивалентные способам и материалам, описанным в данном документе, в данном документе описаны предпочтительные материалы и способы.
Формы единственного числа в том виде, в котором они используются в данном документе, также включают объекты во множественном числе, если контекст явно не диктует иное. Таким образом, например, ссылка на «клетку» включает комбинацию двух или более чем двух клеток и тому подобное.
Подразумевается то, что термины «примерно» и «приблизительно» в том виде, в котором они используются в данном документе при отнесении к измеримому значению, такому как количество, продолжительность времени и тому подобное, охватывают изменения плюс/минус 20% или плюс/минус 10%, более предпочтительно плюс/минус 5%, даже более предпочтительно плюс/минус 1% и еще более предпочтительно плюс/минус 0,1% от определенного значения, так как такие изенения подходят для осуществления раскрытых способов.
Термин «содержащий» в том виде, в котором он используется в данном документе, истолковывается как включительный и неограничивающий, а не исключающий. В частности, данный термин и его вариации означают то, что включены определенные характеристики, стадии или компоненты. Данные термины не следует интерпретировать как исключающие присутствие других характеристик, стадий или компонентов.
Термин «типично» в том виде, в котором он используется в данном документе, означает «служащий в качестве примера, образца или иллюстрации», и его не следует истолковывать как исключающий другие конфигурации, раскрытые в данном документе.
Термин «микрофлюидный канал» в том виде, в котором он используется в данном документе, относится к каналу на или через слой вещества, который покрыт верхним субстратом или покрытием, с по меньшей мере одним из измерений длины, ширины или высоты, находящимся в субмиллиметровом интервале. Будет понятно, что данный термин охватывает каналы, которые представляют собой линейные каналы, а также каналы, которые являются разветвленными или имеют изгибы или углы в пределах их хода. Микрофлюидный канал обычно содержит входное отверстие для введения объема жидкости. Объем, заключенный микрофлюидным каналом, обычно находится в микролитровом или субмикролитровом интервале. Микрофлюидный канал обычно содержит основание, которое может представлять собой верхнюю поверхность нижележащего вещества, две боковые стенки и потолок, который может представлять собой нижнюю поверхность верхнего субстрата, расположенного над микрофлюидным каналом, с любой конфигурацией входных, выходных и/или вентиляционных отверстий, по необходимости.
Термины «структуры удерживания капли» и «барьеры для капиллярного давления» в том виде, в котором они используются в данном документе, используются взаимозаменяемо и используются в отношении характеристик устройства, которое удерживает мениск жидкость-воздух, зафиксированный в определенном положении капиллярными силами.
Термин «закрытая геометрическая конфигурация» в том виде, в котором он используется в данном документе, с конкретной ссылкой на барьеры для капиллярного давления, представляет собой конфигурацию, в которой барьер для капиллярного давления отличается от линейного барьера для капиллярного давления с двумя концами и, вместо этого, образует закрытую петлю. Например, при осмотре сверху, барьер для капиллярного давления с закрытой геометрической конфигурацией может включать кольцевой барьер для капиллярного давления или полигональный барьер для капиллярного давления, например, треугольный барьер для капиллярного давления или квадратный барьер для капиллярного давления, или пятиугольный барьер для капиллярного давления и так далее.
Термин «концентрический» в том виде, в котором он используется в данном документе, следует понимать как относящийся к любой закрытой геометрической конфигурации барьера для капиллярного давления, а не единственно к кольцевой конфигурации.
Термин «линейный» барьер для капиллярного давления в том виде, в котором он используется в данном документе, не следует истолковывать как представляющий собой прямую линию, но, вместо этого, следует истолковывать как отличающийся от закрытой геометрической конфигурации, т.е. как линию с двумя концами, но которая может содержать один или более изгибов или углов. Линейный барьер для капиллярного давления обычно пересекается на каждом конце с боковой стенкой микрофлюидного канала.
Термин «эндотелиальные клетки» в том виде, в котором он используется в данном документе, относится к клеткам эндотелиального происхождения, или к клеткам, которые дифференцируются до состояния, в котором они экспрессируют маркеры, идентифицирующие клетку в качестве эндотелиальной клетки.
Термин «эпителиальные клетки» в том виде, в котором он используется в данном документе, относится к клеткам эпителиального происхождения, или к клеткам, которые дифференцируются до состояния, в котором они экспрессируют маркеры, идентифицирующие клетку в качестве эпителиальной клетки.
Термин «капля» в том виде, в котором он используется в данном документе, относится к объему жидкости, который может превышать, или может не превышать высоту микрофлюидного канала и не обязательно имеет круглую, сферическую форму. В частности, ссылки на каплю геля относятся к объему геля в отсеке для органоидов.
Термин «биологическая ткань» в том виде, в котором он используется в данном документе, относится к набору идентичных, аналогичных или разных типов функционально взаимосвязанных клеток, которые подлежат культивированию и/или анализируются в способах, описанных в данном документе. Клетки могут представлять собой клеточный агрегат или конкретный образец ткани от пациента. Например, термин «биологическая ткань» охватывает органоиды, биопсии ткани, опухолевую ткань, подвергнутый резекции тканевой материал и эмбриональные тельца.
Термин «клеточный агрегат» в том виде, в котором он используется в данном документе, относится к 3D кластеру клеток, в отличие от клеток, присоединенных к поверхности, которые типично растут в монослоях. 3D кластеры клеток типично ассоциированы с ситуацией, более похожей на ситуацию in vivo. В отличие от этого клетки, присоединенные к поверхности, могут подвергаться сильному влиянию свойств субстрата и могут подвергаться дедифференциации или подвергаться превращению в другие типы клеток.
Термин «органоид» в том виде, в котором он используется в данном документе, относится к миниатюрной форме ткани, которая образуется in vitro и демонстрирует эндогенную трехмерную архитектуру органа.
Термин «трансплантат» или «трансплантация» в том виде, в котором он используется в данном документе, относится к переносу ткани, например, тканевого экспланта, или клеточных агргатов из одного места в другое, например, из контейнера для хранения в устройство для культивирования клеток.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Настоящее изобретение теперь будет описано лишь в качестве примера со ссылкой на графические материалы, в которых:
На Фиг. 1-3 показан вид вертикального поперечного среза (Фиг. 1), вид в горизонтальном положении сверху (Фиг. 2) и увеличенный вид вертикального поперечного среза (Фиг. 3) первой возможной конфигурации микрофлюидной сети в том виде, в котором она используется в устройстве согласно настоящему изобретению;
На Фиг. 4-6 показан вид вертикального поперечного среза (Фиг. 4), вид в горизонтальном положении сверху (Фиг. 5) и увеличенный вид вертикального поперечного среза (Фиг. 6) второй возможной конфигурации микрофлюидной сети в том виде, в котором она используется в устройстве согласно настоящему изобретению;
На Фиг. 7-9 показан вид вертикального поперечного среза (Фиг. 7), вид в горизонтальном положении сверху (Фиг. 8) и увеличенный вид вертикального поперечного среза (Фиг. 9) третьей возможной конфигурации микрофлюидной сети в том виде, в котором она используется в устройстве согласно настоящему изобретению;
На Фиг. 10-12 показан вид вертикального поперечного среза (Фиг. 10), вид в горизонтальном положении сверху (Фиг. 11) и увеличенный вид вертикального поперечного среза (Фиг. 12) четвертой возможной конфигурации микрофлюидной сети в том виде, в котором она используется в устройстве согласно настоящему изобретению;
На Фиг. 13-15 показан вид вертикального поперечного среза (Фиг. 13), вид в горизонтальном положении сверху (Фиг. 14) и увеличенный вид вертикального поперечного среза (Фиг. 15) пятой возможной конфигурации микрофлюидной сети в том виде, в котором она используется в устройстве согласно настоящему изобретению;
На Фиг. 16-18 показаны разные виды барьера для капиллярного давления в том виде, в котором он может использоваться в микрофлюидной сети в устройстве согласно настоящему изобретению;
На Фиг. 19 и 20 показан вид снизу (Фиг. 19) и вид вертикального поперечного среза (Фиг. 20) устройства согласно данному изобретению, состоящего из многолуночной конфигурации микрофлюидных сетей, как описано в данном документе;
На Фиг. 21 показано схематическое представление устройства, иллюстрирующее типичное направление и измерение поверхностного натяжения на границе жидкость-воздух на кривизне капли, удерживаемой на барьере для капиллярного давления;
На Фиг. 22 показано схематическое представление стадий способа культивирования по настоящему изобретению;
На Фиг. 23 показано схематическое представление индуцирования или обеспечения проявления ангиогенеза и инвазии эндотелиальных клеток в композицию органоида в удерживаемой капле;
На Фиг. 24 показано схематическое представление способа индуцирования потока через композицию васкуляризованного органоида посредством выравнивания уровня сред между расположенным выше по течению и ниже по течению резервуаром устройства;
На Фиг. 25 показано изображение высокого разрешения при виде сверху через отсек для органоидов устройства для культивирования клеток, показывающее рост ораганоидов в пределах геля внеклеточного матрикса, заключеного в отсек для органоидов барьером для капиллярного давления;
На Фиг. 26 показано изображение высокого разрешения при виде сверху через отсек для органоидов устройства для культивирования клеток, показывающее ангиогенез в пределах геля внеклеточного матрикса, заключеного в отсек для органоидов прибора Фиг. 8;
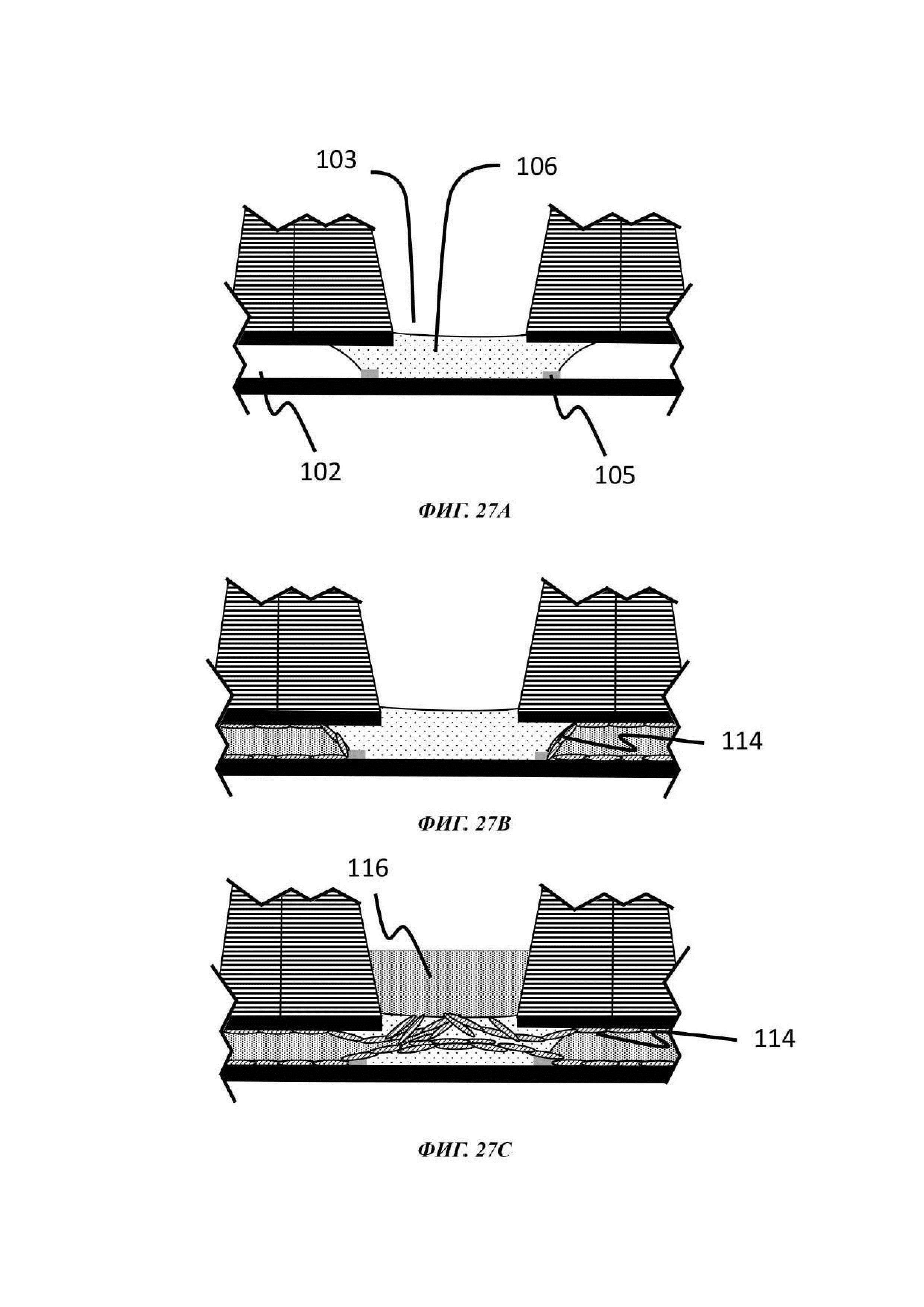
На Фиг. 27А-Е показано схематическое представление стадий способа культивирования по настоящему изобретению;
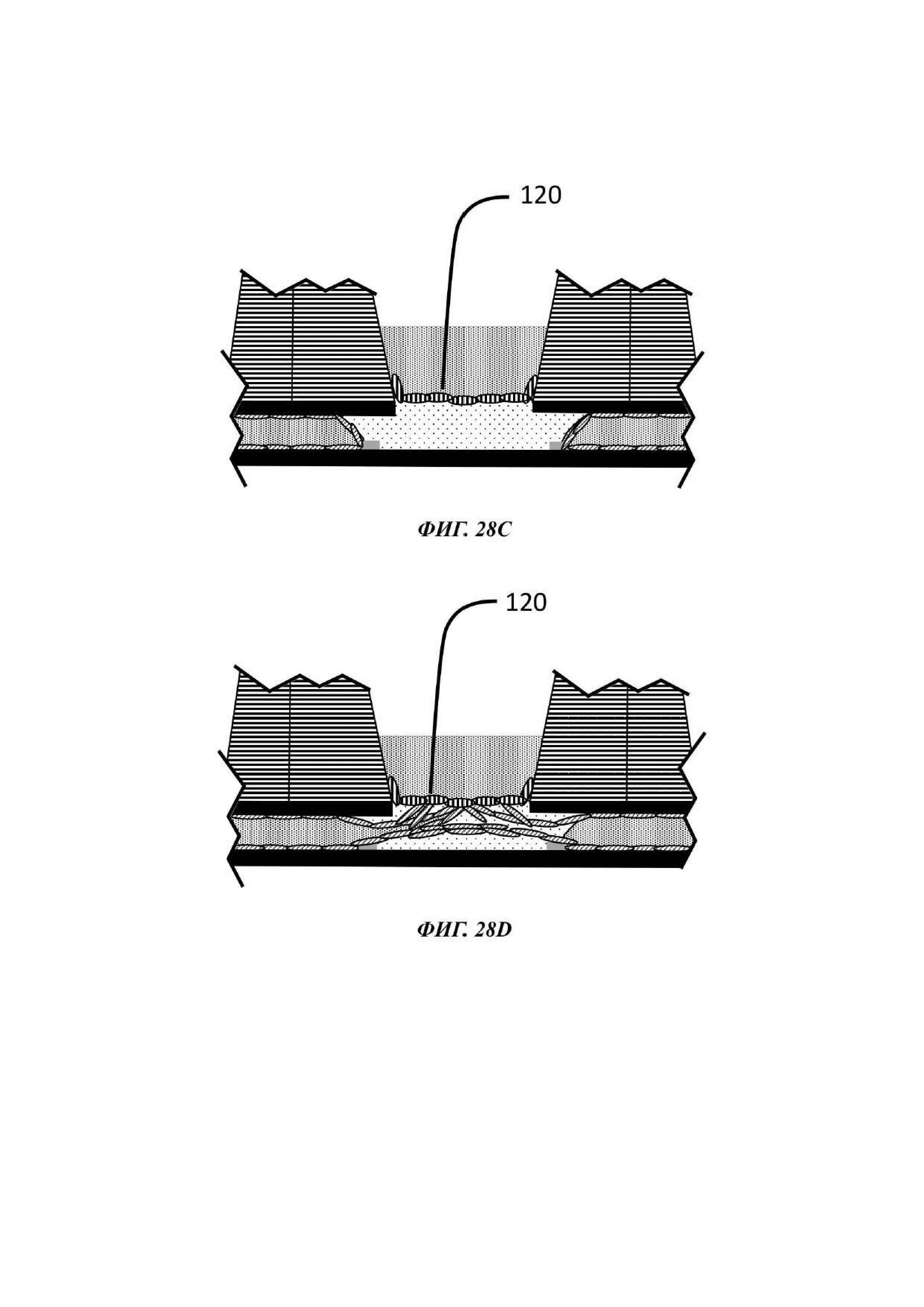
На Фиг. 28A-28D показан альтернативный способ по отношению к способу, описанному на Фиг. 27А-27Е;
На Фиг. 29 показано изображение высокого разрешения органоида почки, который помещен на сосудистый слой, в сутки пересадки органоида на данный слой;
На Фиг. 30 показано изображение высокого разрешения органоида почки спустя 7 суток после пересадки данного органоида на сосудистый слой;
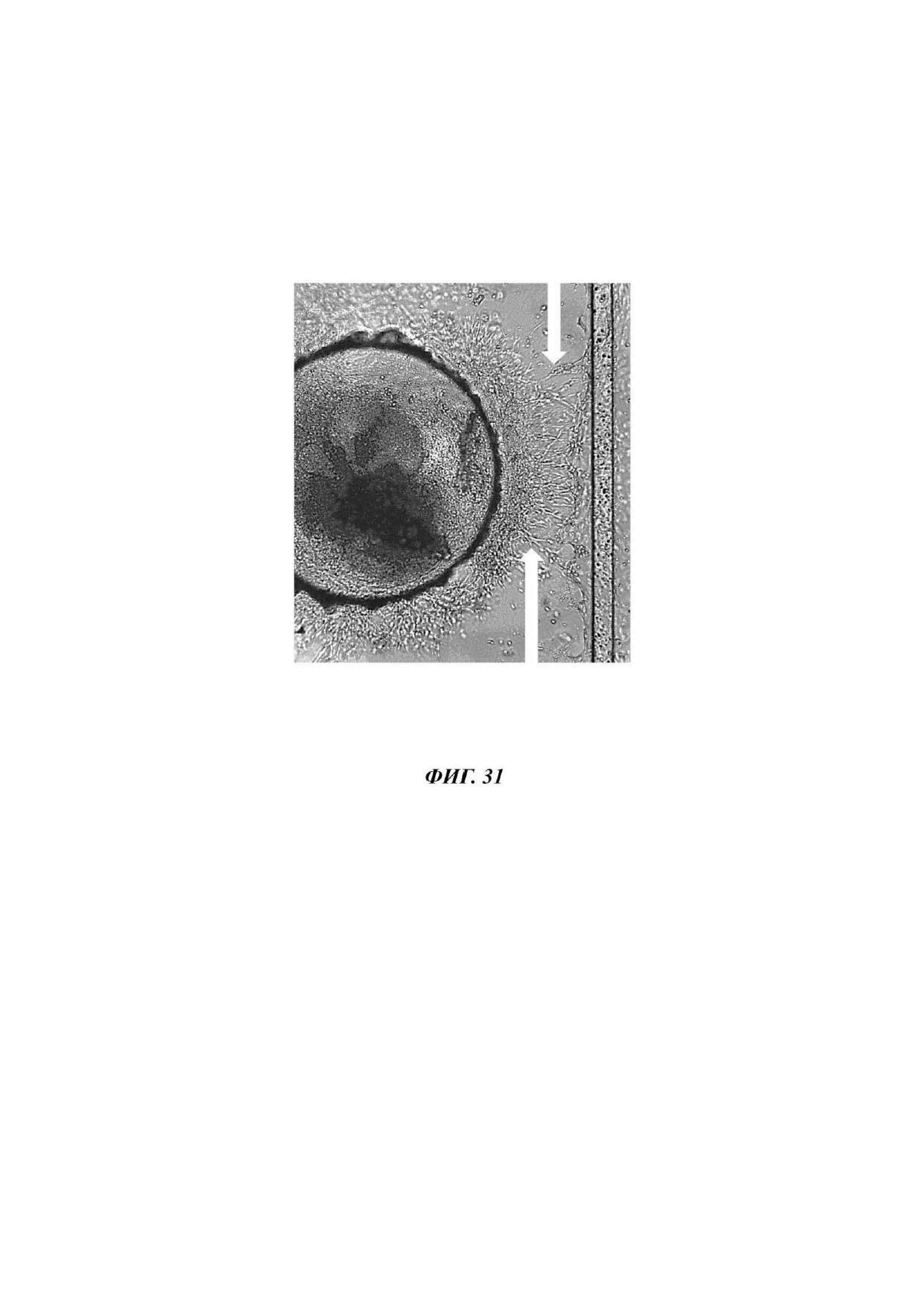
На Фиг. 31 показано изображение высокого разрешения экспланта мышиной эмбриональной почки через 7 суток после пересадки экспланта почки на сосудистый слой;
На Фиг. 32 показано изображение высокого разрешения сфероида печени, состоящего из гепатоцитов и меченных RFP (красный флуоресцентный белок - от англ - "red fluorescent protein") HUVEC (эндотелиальные клетки пупочной вены человека - от англ. "human umbilical vein endothelial cells") в сутки 7 после пересадки на сосудистый слой;
На Фиг. 33 показано изображение высокого разрешения той же самой системы, что и на Фиг. 32, демонстрирующее красную флуоресценцию эндотелия;
На Фиг. 34 показан вид сверху в горизонтальном положении на возможную альтернативную конфигурацию микрофлюидной сети в том виде, в котором она используется в устройстве согласно настоящему изобретению; и
На Фиг. 35 показаны еще две возможные конфигурации микрофлюидных сетей в том виде, в котором они используются в устройстве согласно настоящему изобретению.
С конкретной ссылкой на графические материалы подчеркивается то, что конкретные детали показаны только в качестве примера и с целью иллюстративного обсуждения разных воплощений настоящего изобретения. Они представлены с целью предложения того, что считается самым полезным, и для простого описания принципов и концептуальных аспектов изобретения. В данном отношении не делается попытки показать структурные детали изобретения более подробно, чем необходимо для фундаментального понимания изобретения.
Устройство для культивирования клеток
Описывается устройство для культивирования клеток. Данное устройство для культивирования клеток предпочтительно находится в чиповом/многолуночном формате для обеспечения его применения в анализах на основе клеток in vitro, анализах фармацевтического скрининга, анализах токсичности и тому подобном; в частности, в формате высокопроизводительного скрининга. Такие многолуночные культуральные планшеты доступны в виде 6, 12, 24, 48, 96, 384 и 1536 лунок для образцов, организованных в прямоугольную матрицу, где в контексте настоящего изобретения в устройстве для культивирования клеток присутствует чиповая конфигурация микрофлюидных сетей, как описано в данном документе. В одном примере устройство для культивирования клеток совместимо с одним или более измерениями формата стандартного планшета для микротитрования ANSI (Американский национальный институт стандартов)/SLAS.
Следовательно, устройство для культивирования клеток предпочтительно имеет множество микрофлюидных сетей, как описано в данном документе. В одном примере множество микрофлюидных сетей сообщаются друг с другом по текучей среде через микрофлюидный слой (который является таким, как описано в данном документе). В другом примере множество микрофлюидных сетей разъединены текучей средой друг от друга; другими словами, каждая микрофлюидная сеть работает независимо от любой другой микрофлюидной сети, присутствующей на устройстве для культивирования клеток.
В одном примере устройство для культивирования клеток содержит микрофлюидную сеть, при этом указанная микрофлюидная сеть содержит:
микрофлюидный слой, содержащий основание, микрофлюидный канал и покрытие;
отсек для органоидов, проходящий в микрофлюидный слой через отверстие в покрытии и сообщающийся по текучей среде с микрофлюидным каналом; и
барьер для капиллярного давления, по существу выровненный с отверстием и делящий микрофлюидную сеть на первый подобьем, содержащий отсек для органоидов, и второй подобьем, содержащий по меньшей мере часть микрофлюидного канала.
В одном примере устройство для культивирования клеток представляет собой микрофлюидное устройство для культивирования клеток, содержащее перфузируемую микрофлюидную или сосудистую сеть, содержащую:
микрофлюидный канал, имеющий входное и выходное отверстие;
гель внеклеточного матрикса, сконфигурированный для принятия по меньшей мере одной клетки, подлежащей васкуляризации на его верхней поверхности;
где микрофлюидный канал сообщается по текучей среде с гелем внеклеточного матрикса и содержит сосудистую сеть из эндотелиальных клеток, выстилающих внутренние поверхности микрофлюидного канала.
В одном примере гель внеклеточного матрикса сконфигурирован для принятия суспензии клеток или одного или более клеточных агрегатов.
В одном примере устройство для культивирования клеток представляет собой микрофлюидное устройство для культивирования клеток, содержащее:
микрофлюидный канал, имеющий входное и выходное отверстие;
внеклеточный матрикс, имеющий биологическую ткань, расположенную на его верхней поверхности;
где микрофлюидный канал содержит сосудистую сеть из эндотелиальных клеток, выстилающих внутренние поверхности микрофлюидного канала, и проходящую через внеклеточный матрикс в биологическую ткань.
В одном примере микрофлюидный канал сообщается по текучей среде с внеклеточным матриксом.
В общем, устройство для культивирования клеток представляет собой микрофлюидное устройство для культивирования клеток, которое содержит по меньшей мере один микрофлюидный канал. В пределах границ данного изобретения возможны разные конфигурации микрофлюидных каналов или сетей, но они могут включать, например, объем или подобьем в пределах или в сообщении по текучей среде с микрофлюидным каналом для принятия и удерживания геля, например, внеклеточного матрикса.
Одна или каждая микрофлюидная сеть одного примера устройства для культивирования клеток обычно содержит микрофлюидный слой; отсек для органоидов и барьер для капиллярного давления, каждый из которых теперь будет подробно описан.
Микрофлюидный слой
Микрофлюидный слой микрофлюидной сети содержит основание, микрофлюидный канал и покрытие, также именуемуемое в данном докумете покровным слоем, и может быть изготовлен множеством способов.
Типичным способом изготовления является отливка поддающегося отливке вещества, такого как полидиметилсилоксан, в форме, таким образом, отпечатывая микрофлюидный канал в материале на основе силиконовой резины. Резину с вделанным каналом затем помещают на слой основания из стекла или того же самого материала, таким образом, обеспечивая запечатывание. В качестве альтернативы, структура канала могла бы быть вытравлена в таком материале, как стекло или силикон, с последующим связыванием с верхним или нижним субстратом (также именуемым в данном документе слоем основания или покровным слоем). Другим способом изготовления сети микрофлюидных каналов является литьевое формование или выдавливание рельефа пластмасс, с последующим связыванием. Еще одной другой методикой, применяемой для изготовления сети микрофлюидных каналов, является формирование структуры сети микрофлюидных каналов посредством фотолитографии в полимере, поддающемся фотолитографии, таком как SU-8 или разные другие сухие пленки или жидкие резисты, с последующей стадией связывания. При ссылке на связывание подразумевается закрытие канала верхним или нижним субстратом. Методики связывания включают анодное связывание, связывание с использованием растворителя, адгезивное связывание и термическое связывание, наряду с прочими.
Основание, также именуемое в данном документе слой основания или нижний субстрат, предпочтительно образовано из твердого вещества, такого как стекло, и служит для предоставления поддерживающей поверхности для остальной микрофлюидной сети. В одном примере данное основание имеет такие же или аналогичные размеры относительно площади лунки стандартного планшета для микротитрования ANSI/SLAS.
Как следует из различных способов изготовления, приведенных выше, микрофлюидный слой может содержать подслой, содержащий микрофлюидный канал, расположенный на слое основания, или его структура формируется либо в покровном слое, либо в слое основания. В применяемой ориентации микрофлюидный подслой располагается на верхней поверхности слоя основания. Микрофлюидный канал может быть образован как канал через подслой вещества, расположенного на слое основания. В одном примере вещество подслоя представляет собой полимер, помещенный на слой основания, и в котором формируется структура микрофлюидного канала. В некоторых примерах микрофлюидный слой содержит два или более микрофлюидных каналов, которые могут находиться в сообщении по текучей среде друг с другом через отсек для органоидов.
Микрофлюидный слой содержит покрытие или покровный слой, покрывающий микрофлюидный канал. Покрытие или покровный слой может быть образована из любого подходящего материала, как известно в данной области, например, стеклянного слоя, связанного с подслоем, содержащим микрофлюидный канал. В одном примере, предоставлен покровный слой с предварительно образованными дырами или отверстиями в определенных точках. Данные отверстия обеспечивают сообщение по текучей среде между микрофлюидным каналом микрофлюидного слоя и другими компонентами микрофлюидной сети, расположенными на них.
Микрофлюидный канал может быть снабжен одним или более входными отверстиями и одним или более выходными или вентиляционными отверстиями, как требуется для любого конкретного применения микрофлюидной сети устройства для культивирования клеток. Для обеспечения заполнения, опустошения и перфузии текучей среды через микрофлюидную сеть, микрофлюидный канал предпочтительно обеспечивается по меньшей мере одним входным и по меньшей мере одним выходным или вентиляционным отверстием. В одном примере каждое из по меньшей мере одного входного отверстия и по меньшей мере одного выходного или вентиляционного отверстия предпочтительно образовано в виде или так, чтобы сообщаться по текучей среде с предварительно образованным отверстием в покровном слое.
Отсек для органоидов
В одном воплощении микрофлюидная сеть устройства для культивирования клеток содержит отсек для органоидов, проходящий в микрофлюидный слой через отверстие в покрытии и сообщающийся по текучей среде с микрофлюидным каналом. Отсек для органоидов может по меньшей мере частично присутствовать в отдельном слое относительно микрофлюидного слоя. В применяемой ориентации отсек для органоидов может по меньшей мере частично присутствовать в отдельном слое, расположенном на покрытии микрофлюидного слоя, например, в слое пользовательского интерфейса, содержащем лунку, не имеющую дна, как описано ниже.
Отсек для органоидов содержит определенный объем микрофлюидной сети и определяется, отчасти, как полость или лунка, которая способна принимать каплю жидкости. В одном примере отсек для органоидов обеспечен входным отверстием или горлышком на его верхнем конце (относительно применяемой ориентации), через которое он может принимать жидкости.
В одном примере отсек для органоидов содержит лунку, не имеющую дна, находящегося на некоторых планшетах для микротитрования типа, причем данная лунка имеет боковые стенки, которые в используемой ориентации проходят вниз до отверстия покрытия. Таким образом, в одном примере отсек для органоидов содержит лунку с идущими вниз боковыми стенками таким образом, что данный отсек для органоидов проходит в микрофлюидный слой через отверстие покрытия.
В одном примере лунка может представлять собой продолжение отверстия в покровном слое или специально сформированную структуру лунки на верхней части покровного слоя. В типичном воплощении лунка присутствует в виде одного планшета для микротитрования, например, с квадратным, прямоугольным или круглым поперечным срезом. В одном примере размеры внутреннего поперечного среза лунки по существу соответствуют размерам поперечного среза отверстия кроющего слоя. В одном примере идущие вниз стенки лунки выровнены с отверстием покровного слоя. В одном примере отверстие покровного слоя уже, чем внутренние размеры лунки. В одном примере отверстие покровного слоя больше, чем внутренние размеры лунки. В одном примере отсек для органоидов частично определяется идущими вниз стенками лунки, заканчивающимися отверстием, и частично присутствием капиллярного давления, выровненного с отверстием, как описано в данном документе.
Отсек для органоидов предпочтительно имеет определенный минимальный объем для того, чтобы принимать и удерживать каплю объемом больше, чем 1 микролитр, предпочтительно больше, чем 5 микролитров и наиболее предпочтительно больше, чем 10 микролитров. В соответствии с еще одним воплощением объем, охватываемый отсеком для органоидов, больше, чем объем жидкой композиции, подлежащей введению, для того, чтобы иметь дополнительную возможность удерживать, например, дополнительную ростовую среду, реактивы, соединения или хемоаттрактанты. В одном примере отсек для органоидов будет, таким образом, охватывать объем больше, чем 10 микролитров, предпочтительно больше, чем 50 микролитров и даже более предпочтительно больше, чем 100 микролитров.
В одном примере нижняя часть отсека для органоидов присутствует в микрофлюидном слое, сообщаясь по текучей среде с микрофлюидным каналом. Нижняя часть отсека для органоидов может определяться, по меньшей мере частично, присутствием барьера для капиллярного давления. Данный барьер для капиллярного давления может находиться на внутренней поверхности микрофлюидного канала, как описано в данном документе. В одном примере данный отсек для органоидов пересекает микрофлюидный канал посредством присутствия барьера для капиллярного давления на внутренней поверхности микрофлюидного канала. В одном примере отсек для органоидов частично определяется лункой, имеющей идущие вниз боковые стенки, и частично объемом микрофлюидной сети, частично определенным барьером для капиллярного давления, который будет сейчас описан.
Барьер для капиллярного давления
Микрофлюидная сеть устройства для культивирования клеток содержит барьер для капиллярного давления, по существу выровненный с отверстием в покровном слое и делящий микрофлюидную сеть на первый подобъем, содержащий отсек для органоидов, и второй подобъем, содержащий по меньшей мере часть микрофлюидного канала.
Функция и организация барьеров для капиллярного давления были описаны ранее, например, в WO 2014/038943 А1. Как станет очевидным из типичных воплощений, описанных далее, барьер для капиллярного давления, также именуемый в данном документе структурой удерживания капли, не следует понимать как стенку или полость, которая, например, может быть заполнена каплей, содержащей одну или более клеток или клеточных агрегатов, но состоит из или содержит структуру, которая обеспечивает то, что капля не растекается из-за поверхностного натяжения. Данная концепция называется удерживание мениска. По существу может быть достигнуто стабильное удерживание капли, содержащей одну или более клеткок или клеточных агрегатов, в отсеке для органоидов. В одном примере барьер для капиллярного давления может называться ограничивающей направляющей фазы, выполненной с возможностью недопущения перелива во время нормального применения устройства для культивирования клеток. Природа удерживания капли описывается позднее в связи с описанием способов по настоящему изобретению.
В одном примере барьер для капиллярного давления содержит или состоит из ободка или ребра материала, выступающего из внутренней поверхности микрофлюидного канала; или из бороздки на внутренней поверхности микрофлюидного канала. Боковая стенка ободка или ребра может иметь угол а с вершиной ободка или ребра, который предпочтительно является таким большим, как только возможно. Для обеспечения хорошего барьера угол α должен быть больше, чем 70°, типично около 90°. То же самое имеет значение для угла а между боковой стенкой ободка и внутренней поверхностью микрофлюидного канала, на котором расположен барьер для капиллярного давления. Аналогичные требования распространяются на барьер для капиллярного давления, образованный в виде бороздки.
Альтернативной формой барьера для капиллярного давления является область материала другой смачиваемости по отношению ко внутренней поверхности микрофлюидного канала, которая действует как тормоз растекания из-за капиллярных сил/поверхностного натяжения. В результате предотвращается растекание жидкости за пределы барьера для капиллярного давления и обеспечивается образование стабильно ограниченных объемов в отсеке для органоидов. В одном примере внутренние поверхности микрофлюидного канала содержат гидрофильный материал, а барьер для капиллярного давления представляет собой область гидрофобного или менее гидрофильного материала. В одном примере внутренние поверхности микрофлюидного канала содержат гидрофобный материал, а барьер для капиллярного давления представляет собой область гидрофильного или менее гидрофобного материала.
Таким образом, в конкретном воплощении настоящего изобретения барьер для капиллярного давления выбран из ободка или ребра, бороздки, отверстия или гидрофобной полоски материала или их комбинаций. В еще одном воплощении барьеры для капиллярного давления могут быть созданы столбиками, расположенными с выбранными интервалами, организация которых определяет первый подобъем или область, которая не занята гелем. В одном примере данные столбики распространяются на всю высоту микрофлюидного канала.
Барьер для капиллярного давления по существу выровнен с отверстием в покровном слое таким образом, чтобы ограничивать растекание капли текучей среды в пределах микрофлюидной сети. В одном примере барьер для капиллярного давления расположен на нижней стороне покровного слоя, по существу рядом с отверстием. В одном примере барьер для капиллярного давления по меньшей мере частично образуется самим отверстием.
В одном примере барьер для капиллярного давления предоставлен на внутренней поверхности микрофлюидного канала, направленной на отверстие в покрытии. В более конкретном воплощении барьер для капиллярного давления присутствует на основании микрофлюидного слоя или на внутренней поверхности микрофлюидного канала, по существу находящейся напротив или направленной на отверстие. В одном примере барьер для капиллярного давления расположен под лункой или под стенками лунки отсека для органоидов в применяемой ориетации. В одном примере барьер для капиллярного давления присутствует, как определено ранее по отношению к отверстию или лунке, для того, чтобы удерживать каплю текучей среды в области микрофлюидного слоя, выровненной с отверстием и/или лункой отсека для органоидов.
В одном примере барьер для капиллярного давления по меньшей мере частично определяет поверхность отсека для органоидов на основании микрофлюидного слоя или на основании микрофлюидного канала. Барьер для капиллярного давления выполнен с возможностью удерживания текучей среды в первом подобъеме, содержащем отсек для органоидов. В одном примере барьер для капиллярного давления имеет закрытую геометрическую конфигурацию. В одном примере барьер для капиллярного давления является концентрическим по отношению к отверстию кроющего слоя.
В одном примере диаметр или область, определенная окружностью барьера для капиллярного давления, больше, чем диаметр или площадь, определенная окружностью отверстия; другими словами, барьер для капиллярного давления является круговым и больше, чем отверстие. В другом примере диаметр или площадь, определенная окружностью отверстия, больше, чем диаметр или площадь, определенная окружностью барьера для капиллярного давления; другими словами, отверстие является круглым и больше, чем барьер для капиллярного давления. Независимо от формы, в предпочтительном воплощении барьер для капиллярного давления очерчивает контактную область капли жидкости или гелевой композиции, содержащей одну или более клеток или клеточных агрегатов, введенный в лунку отсека для органоидов, с основанием отсека для органоидов, т.е. является круговым по отношению к контактной области капли, содержащей одну или более клеткок или клеточных агрегатов, с основанием отсека для органоидов.
В одном примере барьер для капиллярного давления представляет собой по существу линейный барьер для капиллярного давления, который охватывает всю ширину микрофлюидного канала и пересекается на каждом конце с боковыми стенками микрофлюидного канала.
В качестве части микрофлюидной сети барьер для капиллярного давления делит данную сеть на по меньшей мере два подобъема, причем один из указанных подобъемов содержит отсек для органоидов, в котором культивируется тело органоида, а другой подобъем содержит микрофлюидный канал, соединяющий отсек для органоидов с остальной микрофлюидной сетью.
Второй барьер для капиллярного давления
В некоторых примерах предложена микрофлюидная сеть устройства для культивирования клеток со вторым барьером для капиллярного давления, форма и функция которого по существу являются такими же, как описано выше. Во избежание сомнений, ссылки на «барьер для капиллярного давления» следует понимать как ссылки на «первый барьер для капиллярного давления» при наличии в устройстве второго барьера для капиллярного давления.
В некоторых примерах второй барьер для капиллярного давления по существу выровнен с отверстием в покровном слое таким образом, чтобы ограничивать растекание капли текучей среды в пределах микрофлюидной сети. В одном примере второй барьер для капиллярного давления расположен на нижней стороне покровного слоя, по существу рядом с отверстием. В одном примере второй барьер для капиллярного давления по меньшей мере частично образован самим отверстием.
В одном примере второй барьер для капиллярного давления предоставлен на внутренней поверхности микрофлюидного канала, направленной на отверстие в покрытии. В более конкретном воплощении второй барьер для капиллярного давления присутствует на основании микрофлюидного слоя или на внутренней поверхности микрофлюидного канала, по существу находящейся напротив или направленной на отверстие. В одном примере второй барьер для капиллярного давления расположен под лункой или под стенками лунки отсека для органоидов. В одном примере второй барьер для капиллярного давления присутствует, как определено ранее по отношению к отверстию или лунке для того, чтобы удерживать каплю текучей среды в области микрофлюидного слоя, являясь выровненным с отверстием и/или лункой отсека для органоидов.
В одном примере второй барьер для капиллярного давления в комбинации с первым барьером для капиллярного давления по меньшей мере частично определяет поверхность отсека для органоидов на основании микрофлюидного слоя или на основании микрофлюидного канала. Второй барьер для капиллярного давления в комбинации с первым барьером для капиллярного давления выполнен с возможностью удерживания текучей среды в первом подобъеме, содержащем отсек для органоидов. В одном примере второй барьер для капиллярного давления имеет закрытую геометрическую конфигурацию. В одном примере второй барьер для капиллярного давления является концентрическим по отношению к отверстию кроющего слоя и/или первому барьеру для капиллярного давления. В одном примере диаметр или площадь, определенная окружностью второго барьера для капиллярного давления, больше, чем диаметр или площадь, определенная окружностью отверстия и/или первым барьером для капиллярного давления; другими словами, второй барьер для капиллярного давления является круговым и большим, чем первый барьер для капиллярного давления и/или отверстие. В одном примере второй барьер для капиллярного давления является концентрическим с первым барьером для капиллярного давления и находится в пределах окружности первого барьера для капиллярного давления. В другом примере диаметр или площадь, определенная окружностью отверстия, больше, чем диаметр или площадь, определенная окружностью второго барьера для капиллярного давления; другими словами, отверстие является круговым и большим, чем второй барьер для капиллярного давления. Независимо от формы, в предпочтительном воплощении второй барьер для капиллярного давления очерчивает контактную область капли жидкости или гелевой композиции, содержащей одну или более клеток или клеточных агрегатов, введенных в лунку отсека для органоидов, с основанием отсека для органоидов, т.е. является круговым по отношению к контактной области капли, содержащей одну или более чем одну клетку или клеточный агрегат, с основанием отсека для органоидов.
В одном примере второй барьер для капиллярного давления является по существу линейным барьером для капиллярного давления, который охватывает всю ширину микрофлюидного канала и пересекается на каждом конце с боковыми стенками микрофлюидного канала. В данном примере первый и второй барьеры для капиллярного давления могут определять площадь поперечного сечения, которая выровнена с отверстием покровного слоя, и которая также может быть концентрической по отношению к отверстию покрытия. В данном примере первый барьер для капиллярного давления может рассматриваться как делящий микрофлюидную сеть на первый подобъем, содержащий отсек для органоидов, и второй подобъем, содержащий микрофлюидный канал, причем второй барьер для капиллярного давления делит микрофлюидную сеть на первый подобъем, содержащий отсек для органоидов, и третий подобъем, содержащий второй микрофлюидный канал.
В качестве части микрофлюидной сети, второй барьер для капиллярного давления делит сеть по меньшей мере на два подобъема, причем первый представляет собой первый подобъем, на который давалась ссылка ранее, который содержит отсек для органоидов, в котором культивируется тело органоида, и третий подобъем. В одном примере третий подобъем содержит часть микрофлюидного канала, отдельную по отношению, т.е. не содержащуюся в пределах первого подобъема. В одном примере третий подобъем целиком содержится в пределах первого подобъема, т.е. и первый, и второй барьеры для капиллярного давления представляют собой закрытую геометрическую конфигурацию, и второй барьер для капиллярного давления полностью окружен первым барьером для капиллярного давления.
Резервуар
В некоторых примерах микрофлюидная сеть содержит резервуар, сообщающийся по текучей среде с входным отверстием микрофлюидного канала. Данный резервуар может по существу иметь такую же форму или конфигурацию, как и лунка отсека для органоидов, и присутствует для удерживания объема жидкости, например, культуральной среды. В типичном воплощении резервуар способен удерживать больший объем текучей среды, чем удерживаемый или который может удерживаться микрофлюидным каналом. Данный резервуар может представлять собой смежную лунку с лункой отсека для органоидов на планшете для микротитрования, не имеющем дна, расположеном поверх микрофлюидного слоя. В других примерах резервуар может представлять собой лунку на том же самом планшете для микротитрования, но пространственно удаленную от лунки отсека для органоидов. Будет понятно то, что близость резервуара к лунке отсека для органоидов не является критически важной для работы устройства для культивирования клеток, при условии, что оба сообщаются по текучей среде через микрофлюидный слой. В некоторых примерах микрофлюидная сеть содержит больше, чем один, например, два или более резервуара, сообщающиеся по текучей среде с микрофлюидным слоем, с отсеком для органоидов и с любым другим резервуаром, присутствующим в микрофлюидной сети. Каждый резервуар может сообщаться по текучей среде с микрофлюидным слоем через отверстие в покровном слое, которое может называться входным отверстием или выходным отверстием микрофлюидного слоя сообразно обстоятельствам. В одном воплощении, в котором в микрофлюидной сети присутствуют по меньшей мере два резервуара, первый резервуар может использоваться для введениятекучей среды, например, культуральной среды, в микрофлюидную сеть, тогда как второй резервуар может функционировать как вентиляционное отверстие или отсек перетока для принятия жидкости во время перфузии или уравновешивания, как описано ниже в связи со способами по настоящему изобретению.
В некоторых примерах микрофлюидное устройство для культивирования клеток содержит перфузируемую микрофлюидную или сосудистую сеть, причем данная сосудистая сеть содержит:
микрофлюидный канал, имеющий входное отверстие и выходное отверстие;
гель внеклеточного матрикса, сконфигурированный для принятия по меньшей мере одной клетки, подлежащей васкуляризации, на его верхней поверхности;
где микрофлюидный канал сообщается по текучей среде с гелем внеклеточного матрикса и содержит сосудистую сеть из эндотелиальных клеток, выстилающих внутренние поверхности микрофлюидного канала.
В некоторых примерах гель внеклеточного матрикса расположен с возможностью принятия суспензии клеток, одного или более клеточных агрегатов или образца ткани. В некоторых примерах по меньшей мере одна клетка, подлежащая васкуляризации, содержит клеточный агрегат или биологическую ткань, как описано в данном документе.
В некоторых примерах устройство для культивирования клеток представляет собой микрофлюидное устройство для культивирования клеток, содержащее:
микрофлюидный канал, имеющий входное отверстие и выходное отверстие;
внеклеточный матрикс, имеющий биологическую ткань, расположенную на его верхней поверхности;
где микрофлюидный канал содержит сосудистую сеть из эндотелиальных клеток, выстилающих внутренние поверхности микрофлюидного канала, и проходящую через внеклеточный матрикс в биологическую ткань.
Такие устройства также могут рассматриваться как планшеты для анализа из-за присутствия сосудистой сети и возможной биологической ткани, расположенной на верхней поверхности внеклеточного матрикса, таким образом, будучи готовыми для применения в анализах или способах, описанных в данном документе. Как будет понятно из настоящего раскрытия, получение таких устройств может быть осуществлено с использованием любого из способов, описанных ниже. В одном примере сосудистая сеть из эндотелиальных клеток проходит в гель внеклеточного матрикса. Факультативно удлинениями сосудистой сети являются микрососуды, которые являются результатом ангиогенеза.
В одном примере биологическая ткань содержит органоид, биопсию ткани, опухолевую ткань, подвергнутый резекции тканевой материал или эмбриональное тельце. Данная биологическая ткань может содержать одну или более эпителиальных клеток и/или клетки мезенхимного происхождения, или стромальные клетки, как описано ниже. Биологическая ткань также факультативно может включать эндотелиальные клетки. Биологическая ткань может содержать кластеризованные клетки, отпечатанные клетки, органоид, биопсию ткани, опухолевую ткань, подвергнутый резекции тканевой материал, эксплант органа или эмбриональное тельце, в зависимости от конечного применения васкуляризованной ткани. Биологическая ткань может содержать один или более типов клеток, полученных из, происходящих из или демонстрирущих фенотип, ассоциированный с конкретной тканью или органом, например, печенью, почкой, мозгом, молочной железой, легким, кожей, поджелудочной железой, кишечником, сетчаткой или волосом. Биологическая ткань может содержать или происходить из здоровой или больной ткани, и может быть получена из или происходить от пациента. Эндотелиальные клетки, образующие сосудистую сеть, могут быть получены из или происходить от пациента, например, от того же самого пациента, из которого была получена или происходит биологическая ткань. В одном примере эндотелиальные клетки содержат эндотелиальные клетки разрастания кровеносной системы (как, например, описано в Nature Protocols 7, 1709-1715 (2012)) или эндотелиальные клетки, полученные из стволовых клеток, включающих индуцированные плюрипотентные стволовые клетки, но не ограничивающиеся ими.
В одном воплощении микрофлюидный канал расположен в микрофлюидном устройстве, как описано в данном документе. Например, микрофлюидный канал может быть расположен в микрофлюидном слое, дополнительно содержащем основание и покрытие. Микрофлюидное устройство для культивирования клеток может дополнительно содержать отсек для органоидов, проходящий в микрофлюидный слой через отверстие в покрытии и сообщающийся по текучей среде с микрофлюидным каналом; и барьер для капиллярного давления, по существу выровненный с отверстием и делящий микрофлюидную сеть на первый подобъем, содержащий отсек для органоидов, и второй подобъем, содержащий по меньшей мере часть микрофлюидного канала. Гель внеклеточного матрикса может быть расположен в отсеке для органоидов и удерживаться в нем посредством барьера для капиллярного давления.
Способы культивирования клеток или клеточных агрегатов
Описывается способ культивирования клеток или клеточных агрегатов. В общем, данный способ включает введение в микрофлюидное устройство для культивирования клеток, например, в отсек для органоидов устройства, как описано в данном документе, капли геля или предшественника геля, содержащей один или более типов клеток или клеточных агрегатов; обеспечение удерживание капли по меньшей мере одним барьером для капиллярного давления в микрофлюидном устройстве для культивирования клеток; обеспечение отверждения или желатинизации капли геля или предшественника геля; загрузку микрофлюидного канала текучей средой; и культивирование одного или более типов клеток или клеточных агрегатов, присутствующих в отвержденном геле.
В одном примере способа микрофлюидное устройство для культивирования клеток является таким, как описано в данном документе. В данном способе каплю первой жидкой композиции, содержащей одну или более клеток или клеточных агрегатов, загружают в отсек для органоидов, например, через отверстие лунки, образующей часть отсека для органоидов, и удерживают одним или более барьерами для капиллярного давления, и гелю или предшественнику геля дают затвердеть или желатинизироваться. Условия для образования геля внеклеточного матрикса, содержащего один или более типов клеток или клеточных агрегатов, известны в данной области, как и условия для последующего культивирования, которые будут варьировать, в зависимости от природы используемых клеток и желательного результата.
Гель или предшественник геля включает любой гидрогель, известный в данной области, подходящий для культивирования клеток. Гидрогели, используемые для культивирования клеток, могут быть образованы из оргомного множества природных и синтетических веществ, предлагая широкий спектр механических и химических свойств. Относительно обзора веществ и способов, используемых для синтеза гидрогелей, см. Lee and Mooney (Chem Rev 2001; 101(7):1869-1880). Подходящие гидрогели, при образовании из природных веществ, стимулируют клеточную функцию и являются пермиссивными для клеточной функции при образовании из синтетических веществ. Природные гели для культивирования клеток типично образуются из белков и компонентов ЕСМ, таких как коллаген, фибрин, гиалуроновая кислота или матригель, а также из веществ, происходящих из других биологических источников, таких как хитозан, альгинат или волокна шелка. Поскольку они происходят из природных источников, данные гели по своей природе являются биосовместимыми и биоактивными. Пермиссивные синтетические гидрогели могут быть образованы из чисто неприродных молекул, таких как поли(этиленгликоль) (PEG), поли(виниловый спирт) и поли(2-гидроксиэтилметакрилат). Было показано, что гидрогели на основе PEG поддерживают жизнеспособность инкапсулированных клеток и обеспечивают возможность отложения ЕСМ по мере их деградации, демонстрируя то, что синтетические гели могут функционировать в качестве платформ 3D культуры клеток даже без лигандов, связывающихся с интегрином. Такие инертные гели являются высоковоспроизводимыми, обеспечивают возможность легкой настройки механических свойств и без труда обрабатываются и изготовляются.
В микрофлюидное устройство для культивирования клеток, например, в отсек для органоидов, как описано выше, может быть предоставлен предшественник геля. После предоставления геля вызывают его желатинизацию перед дальнейшим введением текучей среды. Подходящие гели (предшественники) хорошо известны в данной области. В качестве примера, предшественник геля может представлять собой гидрогель, и он обычно представляет собой гель на основе внеклеточного матрикса (ЕСМ). ЕСМ, например, может содержать коллаген, фибриноген, фибронектин и/или экстракты базальной мембраны, такие как матригель, или синтетический гель. Предшественник геля, в качестве примера, можно вводить в отсек для органоидов пипеткой.
Гель или предшественник геля может содержать экстракт базальной мембраны, внеклеточные матриксы человеческой или животной ткани, или происходящие из культуры клеток, внеклеточные матриксы, происходящие из животной ткани, синтетические внеклеточные матриксы, гидрогели, коллаген, мягкий агар, яичный белок и имеющиеся в продаже продукты, такие как матригель.
Базальные мембраны, содержащие базальную пластинку, представляют собой тонкие внеклеточные матриксы, которые лежат под эпителиальными клетками in vivo и состоят из внеклеточных матриксов, таких как белок и протеогликаны. В одном примере базальные мембраны состоят из коллагена IV, ламинина, энтактина, протеогликанов на основе гепарансульфида и многих других второстепенных компонентов (Quaranta et al, Curr. Opin. Cell Biol. 6, 674-681, 1994). Одни данные компоненты, а также интактные базальные мембраны являются биологически активными и стимулируют адгезию клеток, миграцию и, во многих случаях, рост и дифференциацию. Пример геля на основе базальных мембран называется матригелем (US 4829000). Данное вещество является очень биологически активным in vitro в качестве субстрата для эпителиальных клеток.
Многие разные подходящие гели для применения в способе по изобретению имеются в продаже и включают гели, включающие матригель rgf, ВМЕ1, BME1rgf, ВМЕ2, BME2rgf, ВМЕ3 (все - варианты матригеля), коллаген I, коллаген IV, смеси коллагена I и IV или смеси коллагена I и IV, и коллагена II и III), пураматрикс, гидрогели, Cell-Tak™, коллаген I, коллаген IV, Matrigel® Matrix, фибронектин, желатин, ламинин, остеопонтин, полилизин (PDL, PLL), PDL/LM и PLO/LM, PuraMatrix® или витронектин, но не ограничиваются ими. В одном предпочтительном воплощении компоненты матрикса получают в виде имеющегося в продаже Corning® MATRIGEL® Matrix (Corning, NY 14831, США).
Гель или предшественник геля вводится в микрофлюидное устройство, например, в лунку отсека для органоидов устройства, описанного в данном документе, и транспортируется в микрофлюидный слой капиллярными силами, потенциально с помощью силы тяжести. Гель или предшественник геля удерживается в микрофлюидном устройстве посредством барьера для капиллярного давления, например, в первом подобъеме сети, содержащей отсек для органоидов, и затем вызывают или обеспечивают его желатинизацию.
В одном примере гель или предшественник геля предварительно загружается нужной клеткой или клетками, т.е. данные клетки присутствуют в капле геля или предшественника геля до введения в микрофлюидное устройство для культивирования клеток, например, в отсек для органоидов устройства, описанного в данном документе, и перед желатинизацией. В другом примере клетки вставляют в частично или полностью отвержденную каплю после того, как она была введена в микрофлюидное устройство для культивирования клеток, например, в отсек для органоидов устройства, описанного в данном документе. Таким образом, альтернативный способ культивирования включает засевание интересующими клетками отвержденной капли гидрогеля для культивирования нужных клеток.
В одном примере гель или предшественник геля вводится в микрофлюидное устройство для культивирования клеток, например, в отсек для органоидов устройства, описанного в данном документе, и, после желатинизации, смесь клеток, ткань или клеточный агрегат помещается поверх геля.
В одном примере по меньшей мере один тип клетки или клеточного агрегата, присутствующего в или поверх капли геля или предшественника геля, включает эпителиальные клетки, которые во время культивирования могут пролиферировать и/или дифференцироваться, в зависимости от состава культуральной среды, других типов клеток, которые могут присутствовать, и внеклеточного матрикса. Таким образом, после введения в микрофлюидную сеть либо с использованием водной среды, предпочтительно ростовой среды, либо с использованием геля (предшественника), эпителиальным клеткам затем дают пролиферировать и/или дифференцироваться в отсеке для органоидов. Культивирование одного или более типов клеток или клеточных агрегатов, например, эпителиальных клеток, достигается посредством введения среды в микрофлюидный канал и продолжается при подходящих условиях таким образом, что клетки культивируются с образованием органоида или эмбрионального тельца.
Во втором примере по меньшей мере один тип клетки или клеточного агрегата, присутствующего в или поверх капли геля или предшественника геля, содержит эпителиальные клетки и клетки мезенхимного происхождения, такие как фибробласты, гладкомышечные клетки, миофибробласты, перициты, астроциты, олигодендроциты и тому подобное. Таким образом, после введения в микрофлюидную сеть, например, в отсек для органоидов, либо с использованием водной среды, предпочтительно ростовой среды, либо посредством применения геля (предшественника), эпителиальным клеткам и клеткам мезенхимного происхождения затем дают взаимодействовать и образовать ткань, которая может пролиферировать и/или дифференцироваться в отсеке для органоидов.
В еще одном примере по меньшей мере один тип клеки, например, в виде суспензии клеток или клеточного агрегата, присутствующего в или поверх капли геля или предшественника геля, содержит любую комбинацию эпителиальных клеток и клеток мезенхимного происхождения, иммунных клеток (таких как Т-клетки, макрофаги, клетки Купфера, дендритные клетки, В-клетки, гранулоциты, тучные клетки) и/или эндотелиальных клеток. Во избежание сомнений, применение термина «капля» не следует истолковывать как означающее то, что гель имеет типичный вид или форму капли. Вместо этого, его следует истолковывать как означающий объем геля, который вводится в и затем удерживается в устройствах для культивирования клеток, описанных в данном документе.
После образования геля данный способ включает введение или добавление второй текучей среды (второй жидкой композиции) в микрофлюидный канал, которая будет приводиться в контакт с гелем. В одном примере вторая текучая среда загружается через лунку отсека для органоидов. В другом примере вторая текучая среда вводится в микрофлюидный канал через резервуар, сообщающийся по текучей среде с микрофлюидным каналом. В одном примере объем добавленной текучей среды больше, чем может содержаться в микрофлюидном канале, что приводит к задержке избытка текучей среды в резервуаре. Желатинизированное состояние капли геля обеспечивает то, что клетки и гель остаются на месте, тогда как имеется свободный обмен метаболитов, питательных веществ и кислорода между текучей средой в микрофлюидном канале и отсеком для органоидов.
В примере, в котором суспензия клеток, ткань или клеточный агрегат располагается поверх геля, для инкапсуляции клеток, ткани или клеточного агрегата факультативно можно наносить второй объем геля.
Ссылки на клетки, которые «остаются на месте», следует понимать как находящиеся относительно исходного состояния, в отличие, например, от смыва силами вязкого сопротивления при заполнении второй текучей средой. Само собой разумеется то, что специалист в данной области понял бы то, что клетки в среде внеклеточного матрикса все еще являются подвижными через сеть геля. Подвижность обеспечивается взаимодействием матрикса клетки через фокальные контакты, такие как интегрины, ремоделирование актина, посредством коллагеназ и многих других механизмов, которые обеспечивают подвижность клеток в среде внеклеточного матрикса. Клетки также могут мигрировать в и из геля ЕСМ по ходу экспериментирования.
Микрофлюидный канал дополнительно содержит вентиляционное отверстие для обеспечения надлежащего заполнения микрофлюидного канала с использованием изгнания воздуха из канала. Это вентиляционное отверстие может быть образовано либо дополнительных входным отверстием, либо самим отсеком для органоидов.
Следует отметить то, что типично может присутствовать ток через гель, именуемый интерстициональным током. Также клетки обычно имеют способность мигрировать через, в и из геля из-за заякоривающих точек, таких как интегрины. Гель и жидкость, соответственно, приводят к поверхности обмена без потребности в искусственных мембранах. В контексте настоящего изобретения и имея целью предложение устройства для культивирования клеток, первая жидкая композиция будет типично содержать гидрогель для культивирования клеток, который, при отверждении, дает каплю с соответствующей структурой и жесткостью матрикса. Вторая текучая среда типично представляет собой водный раствор, такой как среда для культивирования клеток, раствор буфера или опытный раствор, и в некоторых примерах также может включать клетки, как будет объяснено позднее.
В одном примере капля достаточного объема вводится таким образом, что отвержденный гель по существу целиком располагается в пределах части отсека для органоидов, то есть, в пределах микрофлюидного слоя. В одном примере объем желатинизированной капли является таким, что данная капля не полностью блокирует отверстие в микрофлюидном кроющем слое, причем в данном случае незаблокированная или открытая область отверстия может использоваться как вентиляционное отверстие. Вентиляционное отверстие, таким образом, обычно содержит просвет или отверстие в кроющем слое, обеспечивающий удаление воздуха при загрузке микрофлюидного канала через входное отверстие. В одном примере капля достаточного объема вводится таким образом, что данная капля удерживается барьером для капиллярного давления, и большая часть объема капли содержится в пределах части отсека для органоидов, которая находится вне микрофлюидного слоя, например, где большая часть объема капли содержится в пределах лунки отсека для органоидов.
В конкретном воплощении отсек для органоидов фланкирован на противоположных сторонах двумя резервуарами, которые сообщаются по текучей среде посредством первого и второго входного отверстия в микрофлюидный канал. Таким образом, введение текучей среды, например, культуральной среды, в первый резервуар приводит к заполнению микрофлюидного канала. Сразу после заполнения может быть индуцирован ток текучей среды в микрофлюидном канале и резервуарах. Типичным способом осуществления этого является выравнивание уровня текучих сред между двумя резервуарами. Это осуществляется за счет наличия более высокого уровня жидкости в одном резервуаре по отношению к другому или посредством помещения микрофлюидного устройства под углом. С течением времени два мениска жидкости (по одному в каждом резервуаре) будут «уравновешиваться», так как система достигает равновесия с атмосферой. Для того чтобы обеспечить непрерывный ток, периодическое повторное уравновешивание может быть достигнуто помещением устройства на платформу качалки, которая периодически корректирует наклон устройства. В данном конкретном воплощении микрофлюидный канал типично заполняется из одного входного отверстия и резервуара, где второе входное отверстие и резервуар функционирует в качестве вентиляционного отверстия во время загрузки микрофлюидного канала в пределах микрофлюидной сети. В качестве альтернативы, ток в микрофлюидном канале может быть индуцирован посредством применения насоса.
В одном примере текучая среда, введенная в микрофлюидный канал, может содержать эндотелиальные клетки. В общем, эндотелиальные клетки известны как клетки, которые выстилают внутреннюю поверхность всей кровеносной системы от сердца до наименьших лимфатических капилляров. При нахождении в контакте с кровью данные клетки называются сосудистыми эндотелиальными клетками, и при нахождении в контакте с лимфатической системой они называются лимфатическими эндотелиальными клетками. В конкретном вплощении способ культивирования включает стадию введения эндотелиальных клеток в микрофлюидный канал микрофлюидной сети, предпочтительно с использованием второй жидкой композиции, и вызов или обеспечение выстилания указанными эндотелиальными клетками микрофлюидного канала, т.е. вызов или обеспечение образования данными эндотелиальными клетками сосуда в пределах микрофлюидного канала.
Введение эндотелиальных клеток в микрофлюидный канал при правильных условиях, например, подходящих условиях для стимуляции ангиогенеза, может приводить не только к образованию сосудистой ткани, выстилающей внутренние поверхности микрофлюидного канала и, в некоторых случаях, внутренние поверхности геля внеклеточного матрикса, который затем становится проницаемым, но также и к разрастанию новых микрососудов. Подходящие условия для стимуляции ангиогенеза включают добавление проангиогенных соединений, таких как, среди прочих, фактор роста фибробластов (FGF, от англ. -"Fibroblast growth factor"), фактор роста эндотелия сосудов (VEGF, от англ. "Vascular Endothelial Growth Factor"), ангиопоэтин-1 (Ang1), ангиопоэтин-2 (Ang2), форболмиристат-13-ацетат (PMA, от англ. "phorbol myristate-13-acetate"), сфингозин-1-фосфат (S1P, от англ. "Sphingosine-1-phosphate"), IGFBP-2 (белок 2, связывающий инсулиноподобный фактор роста, от англ. "Insulin-Like Growth Factor Binding Protein 2"), фактор роста гепатоцитов (HGF, "hepatocyte growth factor"), ингибиторы пролилгидроксилазы (Phi, от англ. "prolyl hydroxylase inhibitors"), хемотаксический белок-1 моноцитов (MCP-1, от англ. "monocyte chemotactic protein-1"), основной фактор роста фибробластов (bFGF, от англ. "basic fibroblast growth factor") и эфрины.
При применении в виде градиента может считаться, что одно или более проангиогенных соединениий действуют в качестве хемоаттрактанта, который стимулирует направленный ангиогенез в направлении и в пределах удерживаемой капли геля. Данным способом эндотелиальные клетки стимулируются к образованию слоя сосудистой ткани в микрофлюидном слое и в геле, который затем подвергается пермеабилизации и приводит к разрастанию новых микрососудов. Одно или более проангиогенных соединений можно добавлять к капле геля или предшественника геля перед ее введением в отсек для органоидов, или оно может быть добавлено в отсек для органоидов после образования капли геля. В еще одном примере одно или более проангиогенное соединение можно добавлять в микрофлюидную сеть через другое входное отверстие в микрофлюидном канале, например, через входное отверстие, расположенное ниже по течению от входного отверстия, через которое вводится культуральная среда, и/или ниже по течению от отсека для органоидов.
В одном примере эндотелиальные клетки вводятся в микрофлюидный канал после введения в отсек для органоидов геля (или предшественника геля), факультативно загруженного одним или более чем одним типом клеток или клеточного агрегата, подлежащего культивированию. В одном примере эндотелиальные клетки вводятся в микрофлюидный канал после того, как в отсек для органоидов был введен гель (или предшественник геля) и затем загружен или покрыт одним или более чем одним типом клеток или клеточного агрегата, подлежащего культивированию. В других примерах способы, описанные в данном документе, включают введение в отсек для органоидов капли геля или предшественника геля, не содержащего какой-либо клетки или клеточного агрегата, обеспечение или вызов желатинизации, введение эндотелиальных клеток в микрофлюидный канал и затем введение одного или более типов клеток или клеточного агрегата в отвержденный гель или поверх отвержденного геля. В одном примере вызывается или обеспечивается образование эндотелиальными клетками слоя сосудистой ткани в пределах микрофлюидного канала до введения в или поверх геля одного или более типов клеток или клеточного агрегата. В одном примере один или более типов клетки или клеточного агрегата вводится в гель посредством добавления подходящего количества предшественника геля, содержащего клетки, поверх отвержденного геля.
Как уже было объяснено в данном документе ранее, применение барьеров для капиллярного давления делает возможным образование стабильных ограниченных объемов в отсеке для органоидов таким образом, что добавление второй текучей среды может происходить без вытеснения геля или его содержимого. Устройство по настоящему изобретению, таким образом, выполнено с возможностью контролируемого в пространстве совместного культивирования с другими клетками, и обеспечивает средства контроля состава окружающей среды. По существу и в пределах способов культивирования по настоящему изобретению текучая среда, загруженная в резервуар (также именуемая в данном документе второй жидкостью), представляет собой любую из сред для культивирования клеток, опытные растворы, буферы, другие гидрогели и тому подобное, и, возможно, может содержать клетки или клеточные агрегаты.
Посредством осуществления контроля состава(вов), введенного(ных) в резервуар(ры), устройство для культивирования клеток по настоящему изобретению делает возможными разные способы органоподобной культуры. Например, состав текучих сред, вводимых в резервуары, можно изменять. Такая замена может представлять собой градиентную замену посредством введения нового состава в один из резервуаров и одновременного удаления текучей среды из другого резервуара в пределах той же самой микрофлюидной сети до осуществления полной замены. Такая замена может быть дискретной - посредством отсасывания текучей среды из резервуара и заполнения его новой композиций. Объем текучей среды в резервуаре гораздо больше, чем объем текучей среды в микрофлюидном канале, и уравновешивание между резервуарами происходит почти мгновенно, обеспечивая тем самым промывку микрофлюидной сети новой текучей средой без необходимости опустошения сети микрофлюидных каналов во время данной процедуры.
В одном примере присутствие второго барьера для капиллярного давления в устройстве даже обеспечивает образование слоистой гелевой композиции. В данном примере первый барьер для капиллярного давления, например, круговой барьер для капиллярного давления, удерживает жидкую композицию, содержащую первый гель или предшественник геля в виде стоячей капли на слое основания отсека для органоидов. После затвердевания этой первой жидкой композиции в отсек для органоидов загружается второй гель или предшественник геля, факультативно содержащий клетки. Эта вторая композиция будет удерживаться вторым барьером для капиллярного давления, например, круговым барьером для капиллярного давления большего диаметра, чем первый барьер для капиллярного давления, и концентрическим по отношению к и окружающим первый барьер для капиллярного давления. Посредством данной конфигурации второй барьер для капиллярного давления предотвращает утечку данной второй композиции в микрофлюидный канал и инкапсулирует первый гель. Соответственно, присутствие двух барьеров для капиллярного давления делит микрофлюидную сеть на индивидуальные пространственные объемы и дает пользователю возможность пространственного конфигурирования микрофлюидной сети.
Имея возможность контролировать не только состав, но, равным образом, и флюидное поведение жидкости в микрофлюидном канале, как описано ранее, данное устройство, например, обеспечивает возможность сокультивирования с эндотелиальными клетками в микрофлюидном канале, с образованием просвета и васкуляризацией органоподобной культуры. Затем возможна перфузия просвета, т.е. васкуляризация, посредством одного или более резервуаров и приведения в движение жидкости в пределах указанных отсеков (ниже).
Таким образом, также описан способ васкуляризации одной или более клеткок или клеточных агрегатов, обычно включающий: введение в микрофлюидное устройство для культивирования клеток капли геля или предшественника геля и обеспечение удерживания данной капли барьером для капиллярного давления, присуствующим в устройстве; обеспечение отверждения или желатинизации геля или предшественника геля с образованием по меньшей мере частично отвержденного геля; введение суспензии эндотелиальных клеток в несущей текучей среде в микрофлюидный канал микрофлюидного устройства для культивирования клеток, причем данный микрофлюидный канал сообщается по текучей среде с отвержденным гелем; обеспечение образования эндотелиальными клетками по меньшей мере одного микрососуда в по меньшей мере указанном микрофлюидном канале; введение на верхнюю поверхность отвержденного геля одной или более клеток или клеточных агрегатов; и обеспечение или стимуляция направленного ангиогенеза между по меньшей мере одним микрососудом и одной или более клетками или клеточными агрегатами.
Данный способ обычно проводится на микрофлюидном устройстве для культивирования клеток, имеющем барьер для капиллярного давления для удерживания одной или более текучих сред в отдельных подобъемах устройства. В одном воплощении данное устройство, как таковое, описано в данном документе. Однако будет понятно то, что данный способ можно было бы проводить на других конфигурациях микрофлюидного устройства для культивирования клеток, и следующее описание данного способа не следует интерпретировать как ограниченное работой на устройстве, как описано в данном документе.
На первом этапе способа капля геля или предшественника геля вводится в микрофлюидное устройство для культивирования клеток, удерживается барьером для капиллярного давления, и обеспечивается ее отверждение или желатинизация с образованием полностью или по меньшей мере частично отвержденого геля.
Приведенные в данном документе ссылки на отвержденный гель следует понимать как означающие гель, который по меньшей мере частично отвержден, а также целиком или полностью отвержден. В отличие от способа, описанного ранее, капля геля или предшественника геля в данном способе не содержит клеток и содержит любой гидрогель, известный в данной области, подходящий для культивирования клеток, как описано выше.
Как только капля геля или предшественника геля по меньшей мере частично, но факультативно полностью отверждается, эндотелиальные клетки вводятся в микрофлюидный канал устройства. Введение эндотелиальных клеток и условия для стимулирования образования сосудов и/или ангиогенза описываются выше и, таким образом, не будут повторяться. Эндотелиальные клетки могут вводиться в виде суспензии в подходящей несущей текучей среде, и будет обеспечиваться или вызываться образование по меньшей мере одного микрососуда в по меньшей мере одном микрофлюидном канале. В одном примере вызывается или обеспечивается образование эндотелиальными клетками слоя сосудистой ткани в пределах микрофлюидного канала перед введением одного или более чем одного типа клетки или клеточного агрегата в или на верхнюю поверхность по меньшей мере частично отвержденного геля.
В одном примере микрососуд выстилает внутренние стенки микроканала до поверхности контакта с отвержденным гелем и проходит до входного отверстия и выходного отверстия микроканала, обеспечивая, таким образом, полную васкуляризацию микрофлюидного канала. В другом воплощении микрососуд проходит в отвержденный гель. Образование микрососуда в микрофлюидном канале и, возможно, также в отвержденном геле обеспечивает, таким образом, сосудистое русло, которое может использоваться, например, для принятия биологической ткани.
Способы васкуляризации одной или более клеток или описанные в данном документе включают введение одной или более клеток или клеточных агрегатов, включающих один или более типов клеток, в или на верхнюю поверхность по меньшей мере частично отвержденного геля. В одном примере одна или более клеток или клеточных агрегатов, включающих один или более чем один типов клеток, вводится в или на верхнюю поверхность по меньшей мере частично отвержденного геля посредством добавления подходящего количества предшественника геля, содержащего клетки, на верхнюю часть отвержденного геля. В одном примере одна или более клеток или клеточных агрегатов, включающих один или более типов клеток, вводятся в или на верхнюю поверхность по меньшей мере частично отвержденного геля, с последующим добавлением подходящего количества предшественника геля на верхнюю поверхность отвержденного геля.
При правильных условиях затем может происходить направленный ангиогенез между одной или более клетками или клеточными агрегатами, включающими один или более типов клеток, и микрососудом, приводящий к васкуляризации одной или более клеток или клеточных агрегатов, включающих один или более типов клеток, на микрофлюидном устройстве. Ангиогенез может индуцироваться или стимулироваться с использованием одного или более проангиогенных соединений, как описано ранее. Данное одно или более одно проангиогенных соединений может быть добавлено на по меньшей мере частично отвержденный гель после введения одной или более клеток или клеточных агрегатов.
Данная одна или более клеток или клеточных агрегатов может содержать одну или более эпителиальных клеток и клетки мезенхимного происхождения или стромальные клетки, как описано ранее. Данная одна или более клеток или клеточных агрегатов могут содержать кластеризованные клетки, отпечатанные клетки, органоид, биопсию ткани, опухолевую ткань, резецированный опухолевый материал, эксплант органа или эмбриональное тельце, в зависимости от конечного применения васкуляризованной ткани. Одна или более клеток или клеточных агрегатов могут содержать один или более типов клеток, полученных из, происходящих из или демонстрирующих фенотип, ассоциированный с конкретной биологической тканью, например, печенью, почкой, мозгом, молочной железой, легким, кожей, поджелудочной железой, кишечником, сетчаткой или волосом. Одна или более клеток или клеточных агрегатов может содержать здоровую или больную ткань и может быть получена из или происходить от пациента.
В одном воплощении эндотелиальные клетки, используемые для васкуляризации микрофлуидного канала и ткани, также могут быть получены из или происходить от пациента. В одном воплощении эндотелиальные клетки, полученные из или происходящие от пациента, могут содержать эндотелиальные клетки разрастания кровеносной системы или эндотелиальные клетки, полученные из плюрипотентных стволовых клеток. Посредством применения аутологических эндотелиальных клеток в комбинации с биологической тканью, содержащей одну или более клеток или клеточных агрегатов от одного и того же пациента, васкуляризованная система является особенно подходящей для области персонализированной медицины и разработки клинических моделей и анализов для определения или прогнозирования вероятного ответа пациента на конкретный агент. Например, применение опухолевой ткани, полученной от пациента, наряду с васкуляризацией данной опухолевой ткани с использованием эндотелиальных клеток, полученных от пациента, как описано выше, обеспечивает полный анализ вероятного ответа пациента на химиотерапевтическое лечение. Кроме того, введение одного или более типов собственных иммунных клеток пациента в такую систему также обеспечивает осуществление определения вероятного иммунного ответа на заданный агент.
Одна или более клеток или клеточных агрегатов может подвергаться стадии культивирования, как обсуждалось ранее, для обеспечения пролиферации и/или дифференциации клеток.
В одном воплощении одна или более клеток или клеточных агрегатов полностью покрывают верхнюю поверхность по меньшей мере частично отвержденного геля, образуя тем самым барьерный слой ткани на верхней поверхности по меньшей мере частично отвержденного геля. Данный барьерный слой может содержать монослой клеток, мультислой клеток или клеточных агрегатов. В одном воплощении монослой клеток или мультислой может культивироваться для обеспечения пролиферации и/или дифференциации до или после ангиогенеза по меньшей мере одного микрососуда в по меньшей мере частично отвержденный гель. Примеры плоской слоистой ткани включают ткань кожи (содержащую, например, кератиноциты, жировую ткань и фибробласты), эпителий кишечника, а также другие эпителиальные ткани, такие как легкое и сетчатка.
Культуральную среду или среду для дифференциации можно добавлять в микрофлюидный канал, как описано выше, и установление тока текучей среды через сосудистую сеть также может достигаться, как описано выше, для обеспечения пролиферации и/или дифференциации клеток. Аналогичным образом, композиции текучих сред могут контролироваться, как описано выше. Таким образом, васкуляризированная, перфузируемая сеть, установленная описанным способом, обеспечивает свободный обмен метаболитов, питательных веществ и кислорода между текучей средой в микрососуде в пределах микрофлюидного канала и клетками или клеточными агрегатами на верхней части отвержденного геля.
Планшет для анализа
Согласно другому аспекту настоящего изобретения предложен планшет для анализа, содержащий любое из устройств, описанное в данном документе. Ссылки на устройства для культивирования клеток, содержащие сосудистую сеть и, возможно, также биологическую ткань следует понимать также как относящиеся к планшету для анализа.
На планшете для анализа может быть предоставлен гель, заключенный в данном устройстве барьером для капиллярного давления. В одном конкретном воплощении на планшете для анализа может быть предоставлен гель, заключенный в отсеке для органоидов данного устройства барьером для капиллярного давления, где данный гель или гелеподобное вещество содержит одну или более клеткок или клеточных агрегатов.
Планшет для анализа может содержать одну или более клеток или клеточных агрегатов, которые культивировали способами, описанными в данном документе. В одном примере по меньшей мере часть микрофлюидного канала устройства планшета для анализа содержит слой сосудистой ткани, содержащий эндотелиальные клетки, углубляющиеся в гель.
Размеры планшета для анализа могут быть согласующимися или совместимыми со стандартным форматом планшета для микротитрования ANSI/SLAS. В частности, размеры основания или окружности планшета для анализа могут согласоваться со стандартом ANSI/SLAS для планшетов для микротитрования.
Также описываются планшеты для анализа или устройства для культивирования клеток, получаемые любыми способами, описанными в данном документе.
Анализы
Описанный планшет для анализа можно использовать в анализе, в котором опытный раствор вводится в микрофлюидную сеть, и наблюдается воздействие опытного раствора на клетки, клеточные агрегаты или органоид, или эмбриональное тельце. Опытный раствор может содержать фармацевтическое лекарственное средство, фармацевтическое соединение-кандидат, токсин, пищевое соединение, химическое вещество, вирус, бактерии или наночастицы.
В одном примере планшет для анализа, подлежащий применению в анализах, содержит устройство для культивирования клеток, содержащее сосудистую сеть, факультативно с биологической тканью от пациента. Посредством применения аутологических эндотелиальных клеток васкуляризованная система особенно подходит для области персонализированной медицины и разработки клинических анализов для определения или прогнозирования вероятного ответа пациента на конкретный агент. Например, применение опухолевой ткани, полученной от пациента, наряду с васкуляризацией данной опухолевой ткани с использованием эндотелиальных клеток, происходящих от пациента, как описано выше, обеспечивает полный анализ вероятного ответа пациента на химиотерапевтическую обработку. Кроме того, введение одного или более типов собственных иммунных клеток пациента в такую систему также обеспечивает осуществление определения вероятного иммунного ответа на данный агент. Подходящим образом, одну или более собственных Т-клеток, В-клеток, лимфоцитов, дендритных клеток, микроглии и моноцитов пациента можно вводить в планшет для анализа на верхнюю часть геля и биологической ткани или через микрофлюидный канал, наряду с тестируемым агентом. В геле также факультативно могут присутствовать иммунные клетки.
Другие применения планшета для анализа включают анализ на основе клеток in vitro в фармацевтическом скрининговом анализе или в анализе токсичности.
Наборы
Согласно настоящему раскрытию также предложны наборы и производственные изделия для применения устройств для культивирования клеток и планшетов для анализа, описанных в данном документе. В одном воплощении данный набор содержит устройства для культивирования клеток или планшеты для анализа, описанные в данном документе; и одно или более проангиогенных соединений для индуцирования ангиогенеза.
Устройство для культивирования клеток или планшет для анализа данного набора содержит сосудистый слой, другими словами, содержит гель внеклеточного матрикса, сконфигурированный для принятия по меньшей мере одной клетки, подлежащей васкуляризации на его верхней поверхности; и сосудистую сеть из эндотелиальных клеток, выстилающую внутренние поверхности микрофлюидного канала.
Данный набор может дополнительно содержать упаковочный материал и этикетку или листок-вкладыш в упаковке, содержащийся в данном упаковочном материале, предоставляющий инструкции для индуцирования ангиогенеза в устройстве для культивирования клеток или планшете для анализа с использованием одного или более чем одного проангиогенного соединения.
Одно или более проангиогенных соединений могут содержать, среди прочих, один или более фактор роста фибробластов (FGF), фактор роста эндотелия сосудов (VEGF), ангиопоэтин-1 (Ang1), ангиопоэтин-2 (Ang2), форболмиристат-13-ацетат (РМА), сфингозин-1-фосфат (S1P), IGFBP-2, фактор роста гепатоцитов (HGF), ингибиторы пролилгидроксилазы (PHi), хемотаксический белок-1 моноцитов (МСР-1), основной фактор роста фибробластов (bFGF) и эфрины.
Наборы могут дополнительно включать вспомогательные компоненты, такие как второй контейнер, содержащий подходящую среду для введения одного или более проангиогенных соединений и инструкции по применению данной среды.
В связанных аспектах согласно настоящему изобретению предложено применение устройства для культивирования клеток, как описано в данном документе, для продуцирования и/или культивирования клеток или ткани, для конструирования ткани, для образования эмбриональных телец, для образования органоидов и тому подобного.
ПРИМЕРЫ
Настоящее изобретение теперь будет описано лишь в качестве примера со ссылкой на графические материалы.
Первый пример устройства для культивирования клеток схематически показан на Фиг. 1-3. На виде поперек устройства (Фиг. 1) показан центральный отсек для органоидов (103), фланкированный двумя резервуарами (101), и микрофлюидный канал (102) в микрофлюидном слое (показан непрерывной линией), соединяющий резервуары с отсеком для органоидов через входные отверстия (104) в покровном слое микрофлюидного слоя. Барьер для капиллярного давления (105) присутствует в основании отсека для органоидов и доступен через отверстие (100) в покровном слое микрофлюидного слоя (показан закрашенным). В данном конкретном примере отверстие имеет более узкий поперечный срез, чем идущие вниз стенки отсека для органоидов.
При загрузке достаточным объемом первой жидкости (гелем или предшественником геля (106) (содержащим один или более типов клеток или клеточных агрегатов, также именуемым композицией органоида) (106), и имея барьер для капиллярного давления, круговой по отношению к отверстию (100) и большего диаметра, первый будет закупоривать указанное отверстие (Фиг. 3), и, таким образом, будет происходить вентиляция окружающего микроканала (102) при добавлении второй текучей среды в первый резервуар (101) через микрофлюидный канал (102) и входное отверстие (104) другого резервуара (101).
Как показано на виде сверху (Фиг. 2), круговой барьер для капиллярного давления делит микрофлюидную сеть на два подобъема. Один подобъем - в данном воплощении центральный объем в пределах барьера для капиллярного давления - содержит отсек для органоидов (103) для принятия композиции органоида, а второй подобъем, определенный резервуарами (101) и микрофлюидным каналом (102), ведет к и окружает композицию органоида в отсеке для органоидов (103). Микрофлюидный канал (102) схематически показан на Фиг. 2 в виде непрерывного круга, окружающего барьер для капиллярного давления, и двух линейных каналов, тянущихся к резервуарам (101), с отверстием (100), показанным пунктирной линией.
Образование двух подобъемов, находящихся в непосредственном контакте друг с другом без какой-либо промежуточной структуры, такой как стенка или мембрана, является одной из ключевых характеристик данного устройства и планшета для анализа. Кроме того, через резервуар и микрофлюидный канал даже возможно контролировать и адаптировать среду, окружающую гель, например, композицию органоида. На Фиг. 3 приведен увеличенный вид вертикального поперечного среза части микрофлюидной сети, демонстрирующий барьер для капиллярного давления (105) на слое основания и то, как он удерживает каплю первой жидкости (106) (композиция органоида здесь для ясности показана без клеток или клеточных агрегатов). Присутствие барьера для капиллярного давления (105) предотвращает заполнение микрофлюидных каналов гелем или предшественником геля, например, композицией органоида, при загрузке в отсек для органоидов - другими словами, применяемый гель или предшественник геля удерживается барьером для капиллярного давления (105).
Отверстие (100) на Фиг. 2, а также на последующих Фиг. показано в виде отверстия круглой формы. Однако будет понятно то, что отверстие может иметь любую форму, причем предпочтительными являются круглое и квадратное.
В альтернативном воплощении, и как показано на Фиг. 4-6, отверстие (100) в покровном слое, через которое проходит отсек для органоидов, является увеличенным. Это обеспечивает выращивание более гомогеных органоидов большего диаметра, которому не мешает внезапное ограничение отверстия. Также оно обеспечивает более гомогенное распределение молекул, таких как факторы роста, морфогены, кислород, питательные вещества и другие, по всему объему органоида через диффузию или интерстициальный поток. Кроме того, для случая васкуляризации органоида, оно обеспечивает более гомогенную васкуляризацию объема органоида.
Будучи целью контроля окружающей среды композиции органоида, могут присутствовать дополнительные ветви микрофлюидного канала (102). Один такой пример приводится на Фиг. 7-9. В данном воплощении центральный отсек для органоидов (103) соединен с четырьмя резервуарами (101) в перекрестной комфигурации (см. Фиг. 8) с присутствующими двумя линейными барьерами для капиллярного давления (105), каждый из которых частично определяет первый подобъем, содержащий отсек для органоидов.
Во всех из вышеупомянутых примеров барьеры для капиллярного давления являются круговыми по отношению к отверстию отсека для органоидов (100) и имеют большие диаметры или площади, чем диаметр или площадь, определенная отверстием. По существу во всех этих примерах загрузка отсека для органоидов гелем или предшественником геля, например композицией органоида, будет приводить к закупорке отверстия. В альтернативном воплощении барьер для капиллярного давления (105) располагается в пределах окружности отверстия (100) (меньший диаметр окружности), как, например, показано на Фиг. 12.
С этой конфигурацией геля или предшественника геля, например, композиция органоида будет удерживаться на барьере в виде стабильно стоящей капли. Не только это, таким образом, приводит к большей площади поверхности контакта между двумя жидкостями, кроме того, и в отличие от вышеупомянутого воплощения, может происходить вентиляция окружающего микроканала через свободное пространство между каплей и отверстием (100) в кроющем слое. Таким образом, в одном примере барьер для капиллярного давления расположен на основании микрофлюидного канала, но в пределах окружности отверстия (барьер для капиллярного давления, имеющий меньший диаметр).
Добавление второго барьера для капиллярного давления закрытой геометической конфигурации даже обеспечивает образование объемной композиции слоистого геля, например, объемной композиции органоида. Такой пример предложен на Фиг. 13-15. В данном примере первый круговой барьер для капиллярного давления удерживает жидкую композицию, содержащую первый гель или предшественник геля, в виде стоящей капли на слое основания отсека для органоидов. После затвердевания первой жидкой композиции в отсек для органоидов загружается вторая композиция (107). Эта вторая композиция будет удерживаться вторым барьером для капиллярного давления (108), предотвращая тем самым заполнение микрофлюидного канала (102) данной второй жидкостью.
Присутствие данных барьеров для капиллярного давления, соответственно, делит микрофлюидную сеть на индивидуальные пространственные объемы и дает пользователю возможность пространственной конфигурации в микрофлюидной сети.
Любой барьер для капиллярного давления, используемый в устройстве, описанном в данном документе, может принимать разные формы или виды, как проиллюстрировано примерами на Фиг. 16-18, включающие выступающий ободок, бороздку или даже линию гидрофобного материала на основании или дне субстрата отсека для органоидов. На Фиг. 16 показан барьер для капиллярного давления, построенный в виде ободка, выступающего из субстрата дна, который может быть построен или не может быть построен из отличного материала по отношению к субстрату дна или слою основания. На Фиг. 17 приводится пример барьера для капиллярного давления, построенного в виде ребра или бороздки, вдающейся в субстрат дна или слой основания. На Фиг. 18 приводится пример барьера для капиллярного давления, сконструированного в виде линии материала отличной гидрофобности/гидрофильности. Удерживание происходит до данной линии, и угол контакта удерживающего барьера описывается относительно горизонтальной плоскости материала отличной гидрофобности/гидрофильности.
Как описано, данное устройство предпочтительно является совместимым с или основано на планшете для микротитрования, как определено размерами ANSI/SLAS, как показано на Фиг. 19, на которой изображен вид снизу такого планшета, содержащего 128 отдельных микрофлюидных сетей, таких как, например, описанные на Фиг. 1, 4 и 13. На Фиг. 20 показан поперечный срез многолуночной конфигурации Фиг. 19 с ободком (111), совпадающим с основанием планшета для микротитрования.
На Фиг. 21 показаны размеры, подлежащие рассмотрению в случае удерживания капли на структурах для удерживания капли, без капли, касающейся покровного слоя. В данном случае горизонтальное расстояние 51 между наружной поверхностью капли на высоте h кроющего слоя и наружной поверхностью барьера для капиллярного давления должно быть меньше, чем горизонтальное расстояние 52 между краем отверстия в покровном слое и барьером для капиллярного давления. Кривизна капли определяется углом контакта а с вертикальной поверхностью барьера для капиллярного давления, периметром барьера для капиллярного давления и объемом капли.
На Фиг. 22A-22F показаны разные стадии применения устройства, описанного в данном документе, и получения 3-D культуры клеток со способностью осуществления контроля окружающей среды. На первой стадии первая капля жидкости, содержащая клетки (112) (Фиг. 22А) или клеточные агрегаты (113) (Фиг. 22В) вводится в отсек для органоидов (103), удерживается на барьере для капиллярного давления и обеспечивается ее затвердевание (отверждение, желатинизация). Опять-таки, и как уже упоминалось выше, первая жидкая композиция будет типично содержать гель или предшественник геля, например, гидрогель для культивирования клеток (или его предшественник), и включает любой гидрогель, известный в данной области и подходящий для данной цели.
Как только капля геля, содержащая композицию органоида, затвердевает, микрофлюидный канал загружается второй жидкостью (115, Фиг. 22С); это типично водный раствор, такой как среда для культивирования клеток, буферный раствор, опытный раствор или неотвержденный гидрогель. По существу поверхность контакта геля в пределах устройства, содержащая клетки и вторую жидкость в микрофлюидном канале, приводит к поверхности обмена без искусственных границ.
Поскольку возможно введение среды для культивирования клеток в микрофлюидный канал, равным образом возможно введение клеток в микрофлюидный канал. Одно такое воплощение показано на Фиг. 22D, где эндотелиальные клетки (114) вводятся в микрофлюидный канал. Их можно вводить в качестве компонента культуры клеток или ростовой среды, или они могут вводиться последовательно. При осуществлении культивирования в устройстве, засеянном таким образом, и в зависимости от состава второй жидкости (жидкость, загруженная в микрофлюидный канал), эндотелиальные клетки (114) могут васкуляризоваться или выстилать внутренние поверхности микроканала, т.е. стенки, основание и верхнюю часть, и потенцильно также поверхности геля ЕСМ (см. Фиг. 22Е).
На другом этапе условия культивирования могли бы обеспечивать или индуцировать ангиогенез сосудов, образующихся в микрофлюидном канале (Фиг. 22F), с инвазией капли геля, содержащей композицию органоида, и/или образованием капиллярного сосуда в пределах клеточных агрегатов, органоида или сфероида, присутствующего в ней. Условия культивирования, обеспечивающие ангиогенез, известны специалисту и включают, например, нехватку кислорода, механическое стимулирование и химическое стимулирование с использованием проангиогенных агентов, таких как проангиогенные белки, описанные ранее.
Проангиогенные агенты можно было бы добавлять в жидкую композицию в микрофлюидном канале, но равным образом добавлять на верхнюю часть капли геля через отсек для органоидов. При добавлении на верхнюю часть капли геля, присутствующей в отсеке для органоидов, это привлекает эндотелиальные клетки в гель и композицию органоида.
Типичная смесь для прорастания сосудов содержит VEGF, МСР-1, HGF, bFGF, РМА, S1P в количествах от 37,5 нг/мл до 150 нг/мл для каждого из VEGF, МСР-1, HGF, bFGF и РМА, и от 250 нМ до 1000 нМ для S1P. Альтернативный типичный состав смеси для прорастания сосудов содержит 500 нМ S1P, 50 нг/мл VEGF, 20 нг/мл FGF, 20 нг/мл РМА.
Таким образом, в еще одном воплощении способ культивирования включает стадию культивирования клеток, обеспечивающую или индуцирующую ангиогенез эндотелиальных клеток, выстилающих стенки микрофлюидного канала и гель. Данным способом образуется сосуд, который соединяет входное и выходное отверстие микрофлюидного канала, выстилает поверхности канала и проходит в гель, содержащий органоид.
Хемоаттрактант или ангиогенный агент, или композицию разных ангиогеных агентов (116; Фиг. 23) для стимуляции ангиогенеза можно добавлять на гель в лунке отсека для органоидов или посредством другого входного отверстия микрофлюидной сети, которое находится в контакте с областью микрофлюидного канала, которая сообщается в областью канала, имеющей выстланный сосуд только через гель и, таким образом, находящейся практически напротив первой области канала. Ангиогенное(ные) соединение(ния) (или композиция) индуцирует(ют) проницаемость сосуда, индуцирует прорастание посредством пролиферации и миграции в направлении градиента. Возможно, как только органоид или объем геля для органоидов полностью васкуляризуется, структура сосуда также может формироваться во второй области микрофлюидного канала.
Предпочтительным результатом данного способа является органоид в геле, который васкуляризуется микрососудами, которые соединяются с большим сосудом посредством одного или более микрофлюидных каналов через которые может осуществляться ток ростовой среды, сыворотки или прочего. По существу и с использованием данного устройства возможно сокультивирование первого типа клеток в первом ограниченном подобъеме сети, содержащем отсек для органоидов, с культурой эндотелиальных клеток во втором подобъеме, содержащем микрофлюидный канал, с достижением васкуляризованной модели клеточных агрегатов, органоида или сфероида, присутствующего в капле геля композиции органоида, которая соединяется с резервуаром(рами) посредством эндотелиальных сосудов, образованных в пределах микрофлюидных каналов.
Сосуд, образованный васкуляризацией микрофлюидного канала, имеет просвет, который представляет собой апикальную сторону сосуда, тогда как снаружи сосуда находится базальная сторона. В одном примере проангиогенные соединения или их композицию наносят на базальную сторону сосуда для того, чтобы индуцировать направленный ангиогенез.
Таким образом, и в отличие от существующих моделей, применение данного устройства обеспечивает индукцию тока среды через васкуляризованную модель клеточных агрегатов, органоид или сфероид, присутствующий в пределах капли геля композиции органоида.
Стадии способа культивирования, на которых жидкость в резервуаре приводится в движение; а также способы, включающие стадии, на которых жидкость в микрофлюидном канале приводится в движение, находятся в пределах сферы охвата данных способов. На Фиг. 24 приводится простой пример, показывающий качающееся движение микрофлюидной сети, т.е. при котором помещение устройства под углом наклона индуцирует ток, и при котором ток поддерживается посредством периодического изменения угла наклона с соответствующим повышением (119) и снижением (117) уровня жидкости в резервуарах, сообщающихся (118) через микрофлюидные каналы и васкуляризованный отсек для органоидов.
На Фиг. 25 показан экспериментальный результат культивирования кишечных (кишки) органоидов в ЕСМ матригеле, удерживаемом барьером для капиллярного давления, с током ростовой среды, вводимой через микрофлюидный канал. От суток 3 до суток 6 ростовую среду не заменяли, что приводило к гибели клеток.
На Фиг. 26 показан экспериментальный результат индуцирования ангиогенеза в устройстве для культивирования клеток согласно Фиг. 8. Каплю геля вводили в отсек для органоидов (103), удерживали линейными барьерами для капиллярного давления (105) и давали ей желатинизироваться. Сразу после желатинизации в микрофлюидные каналы 102/102а вводили эндотелиальные клетки (HUVEC). Данным эндотелиальным клеткам давали образовать сосуд в пределах микрофлюидных каналов, выстилая тем самым стенки канала и гель. Затем на верхнюю часть геля добавляли композицию проангиогенных соединений (VEGF, FGF, РМА и S1P), стимулируя ангиогенез в геле, что подтверждается образованием микрососудов в пределах отсека для органоидов. Во избежание сомнений, данный конкретный эксперимент проводили в отсутствие любого органоида или сфероида в пределах или поверх геля, таким образом, что можно было видеть васкуляризацию в пределах геля.
Стадии способа васкуляризации клеточного агрегата показаны на Фиг. 27А-27Е. В то время как данное конкретное воплощение демонстрирует то, что способ проводится на конкретной конфигурации микрофлюидного устройства для культивирования клеток, будет понятно то, что данный способ, в общем, более применим к другим конфигурациям микрофлюидного устройства для культивирования клеток. На первой стадии капля геля или предшественника геля, не содержащая клеток или клеточных агрегатов (106) (Фиг. 27А) вводится в отсек для органоидов (103), удерживается на барьере для капиллярного давления (105), и обеспечивается ее затвердевание (отверждение, желатинизация).
Как только капля геля затвердевает, микрофлюидный канал (102) может быть загружен второй жидкостью, обычно водным раствором, таким как среда для культивирования клеток, буферный раствор, опытный раствор или неотвержденный гидрогель. По существу поверхность контакта геля и второй жидкости в пределах устройства в микрофлюидном канале приводит к поверхности обмена без искусственных границ.
Поскольку возможно введение среды для культивирования клеток в микрофлюидный канал, равным образом возможно введение клеток в микрофлюидный канал. Одно такое воплощение показано на Фиг. 27В, где эндотелиальные клетки (114) вводятся в микрофлюидный канал. Их можно вводить в качестве компонента культуры клеток или ростовой среды, или они могут вводиться последовательно. При осуществлении культивирования в устройстве, засеянном таким образом, и в зависимости от состава второй жидкости (жидкость, загруженная в микрофлюидный канал), эндотелиальные клетки (114) могут васкуляризоваться или выстилать внутренние поверхности микроканала, т.е. стенки, основание и верхнюю часть, и потенцильно также поверхности геля ЕСМ (см. Фиг. 27Б).
На другом этапе условия культивирования могли бы обеспечивать или индуцировать ангиогенез сосудов, образующихся в микрофлюидном канале (Фиг. 27В), с образованием капиллярного сосуда в пределах капли геля. Условия культивирования, обеспечивающие ангиогенез, известны специалисту и включают, например, нехватку кислорода, механическое стимулирование и химическое стимулирование с использованием проангиогенных агентов, таких как проангиогенные белки, описанные ранее.
Проангиогенные агенты можно было бы добавлять в жидкую композицию в микрофлюидном канале, но равным образом добавлять на верхнюю часть капли геля через отсек для органоидов. При добавлении на верхнюю часть капли геля, присутствующей в отсеке для органоидов, это привлекает эндотелиальные клетки в гель.
Таким образом, в другом воплощении способ включает стадию культивирования клеток, обеспечивающую или индуцирующую ангиогенез эндотелиальных клеток, выстилающих стенки микрофлюидного канала и гель. Данным способом образуется сосуд, который соединяет входное и выходное отверстие микрофлюидного канала, выстилает поверхности канала и проходит в гель.
Хемоаттрактант или ангиогенный агент, или композицию разных ангиогенных агентов (116; Фиг. 27С) для стимуляции ангиогенеза можно, следовательно, добавлять на гель. Ангиогенное(ные) соединение(ния) (или композиция) индуцирует(ют) проницаемость сосуда, индуцирует прорастание посредством пролиферации и миграции в направлении градиента.
После ангиогенеза по меньшей мере в части геля клеточный агрегат (113) может вводиться на верхнюю поверхность геля (Фиг. 27D). Данную стадию можно осуществлять посредством введения клеток в подходящей жидкости-носителе, такой как буфер или ростовая среда, таким образом, что клетки являются погруженными под поверхность контакта воздух-жидкость жидкости-носителя, как показано на Фиг. 27D. В качестве альтернативы, и особенно в примере клеточного агрегата, такого как органоид или эксплант ткани, данную стадию можно осуществлять в отсутствие любой жидкости-носителя с использованием методик для манипулирования с клетками и транспортирования клеток, которые являются известными в данной области, таких как методики микроотсоса.
Наконец, посредством применения одного или более проангиогенных соединений, как описано выше, и/или посредством природы самих клеток клеточных агрегатов (113) может быть обеспечен или индуцирован (Фиг. 27Е) ангиогенез между эндотелиальными клетками (114), образующими микрососуд, и клеточными агрегатами (113), приводя к соответствующим разрастающимся кровеносным сосудам, соединяющимся с образованием полностью васкуляризованной системы.
Альтернативный способ по отношению к способу, проиллюстрированному на Фиг. 27, показан на Фиг. 28A-28D. Стадии Фиг. 28А и 28В соответствуют стадиям Фиг. 27А и 27В, таким образом, они не будут дополнительно обсуждаться. После васкуляризации микроканала (102), но до ангиогенеза микрососуда в гель, на верхнюю часть геля добавляют монослой клеток (120), покрывая всю его верхнюю поверхность (Фиг. 28С). В то время как это показано как истинный монослой, будет понятно, что это также могло бы приводить к отложению многих слоев клеток, в частности ткани из многих слоев, возможно из разных типов клеток. Например, может быть введен образец ткани кожи, смесь разных типов клеток кожи или образец стволовых клеток, которые далее могут дифференцироваться в разные типы клеток кожи.
Ангиогенез микрососуда в гель и в слой клеток, покрывающий верхнюю поверхность геля, можно затем индуцировать или стимулировать, как описано ранее (Фиг. 28D).
Как и в случае со способом Фиг. 22, результат обоих способов, показанный на Фиг. 27 и 28, представляет собой биологическую ткань, образованную из одной или более клеток или клеточных агрегатов, например, органоид, на верхней поверхности геля, которая васкуляризована микрососудами, которые соединяются с большим сосудом посредством одного или более микрофлюидных каналов, через которые может осуществляться ток ростовой среды, сыворотки или прочего. В связи с этим и с использованием данного устройства возможно сокультивирование первого типа клеток в первом ограниченном подобъеме сети, содержащем отсек для органоидов, с культурой эндотелиальных клеток во втором подобъеме, содержащем микрофлюидный канал, с достижением васкуляризованной модели клеточных агрегатов, органоида или сфероида, присутствующего на верхней поверхности капли геля, которая соединена с резервуаром(рами) посредством эндотелиальных сосудов, образованных в пределах микрофлюидных каналов.
Таким образом, и в отличие от существующих моделей, применение данного устройства обеспечивает индукцию тока среды через васкуляризованную модель клеточных агрегатов, органоида или сфероида, присутствующего на верхней поверхности капли геля.
На Фиг. 29 показано изображение органоида почки высокого разрешения, который помещен на сосудистый слой в сутки трансплантации органоида на данный слой. На этом изображении, при виде сверху, белые линии, идущие сверху вниз, представляют собой расположения барьеров для капиллярного давления, представляющих границу между гелем внеклеточого матрикса и двумя васкуляризованными микроканалами на каждой стороне. Как можно видеть, сосудистая сеть от микроканалов уже начала прорастать в гель внеклеточного матрикса.
На Фиг. 30 показано изображение органоида почки высокого разрешения через 7 суток после трансплантации данного органоида на сосудистый слой. Как можно видеть на данном изображении, через 7 суток происходил обширный ангиогенез в геле внеклеточного матрикса, наряду с разрастанием сосудистой сети из органоида в такой степени, что органоид теперь является частью сосудистой сети, проходящей в микроканалы.
На Фиг. 31 показано изображение высокого разрешения экспланта мышиной эмбриональной почки через 7 суток после трансплантации данного органоида на сосудистый слой. Темные линии, идущие сверху вниз на правой стороне изображения, представляют собой барьер для капиллярного давления с микроканалом справа и отсеком для органоидов (содержащим эксплант почки) слева. Белые стрелки показывают сосуды из эндотелиальных клеток человеческой пупочной вены (HUVEC), соединяющиеся с разрастанием сосудистой сети эмбриональной мышиной почки.
На Фиг. 32 показано изображение высокого разрешения сфероида печени, состоящего из гепатоцитов и HUVEC, меченных RFP, в сутки 7 после трансплантации на сосудистый слой; эндотелий сфероида печени соединяется с сосудистым слоем. На иллюстрации показан фазовый контраст и красная флюоресценция.
На Фиг. 33 показано изображение высокого разрешения той же самой системы, что и показанная на Фиг. 32, показывающее красную флюоресценцию эндотелия; и
На Фиг. 34 показан вид сверху на горизонтальную плоскость возможной альтернативной конфигурации микрофлюидной сети в том виде, в котором она используется в устройстве согласно настоящему изобретению. Данная конфигурация представляет собой модификацию Фиг. 8, в которой каналы и входные отверстия выбраны таким образом, что все входные отверстия находятся в одном ряду. Эта конфигурация является особенно преимущественной по сравнению с другими конфигурациями, так как каждая сеть занимает меньше места на устройстве.
На Фиг. 35 показан вид сверху на горизонтальную плоскость двух альтернативных возможных конфигураций микрофлюидной сети в том виде, в котором она используется в устройстве согласно настоящему изобретению. Каждая конфигурация является особенно преимущественной при использовании многочисленных сетей каждого типа в формате 96-луночного планшета, так как все из соответствующих входных отверстий микроканалов сети расположены в линию с шагом 8-канальной пипетки, как и все из соответствующих входных отверстий геля и все из соответствующих выходных отверстий микроканала. Это обеспечивает применение многоканального пипетирования (например, посредством робота) для одновременного заполнения многих сетей за одну операцию.
Типичные протоколы
Теперь будет описан ряд типичных протоколов для осуществления способов по настоящему изобретению. Будет понятно то, что они приводятся лишь в качестве примера, и что также можно использовать другие реактивы или условия.
Получение геля для создания каркаса для сосудистой сети Для подавления преждевременной полимеризации коллагена стадии получения геля проводятся на льду. В данном способе гель состоит из 4 мг/мл коллагена I (коллаген I из крысиного хвоста AMSbio Cultrex 3D, 5 мг/мл, кат. 3447-020-01), 100 мМ HEPES (Life Technologies, 15630-122) и 3,7 мг/мл NaHCO3 (Sigma, кат. S5761-500G). Коллаген смешивали с HEPES, и дозировали NaHCO3 во входное отверстие геля отсека для органоидов микрофлюидной сети согласно Фиг. 8 и инкубировали при 37°С в течение по меньшей мере 20 минут. Объем геля будет зависеть от приложения, но в данное устройство можно дозировать всего-лишь 1 мкл коллагенового геля - в данном способе он будет создавать чашковидную форму (т.е. с вогнутой верхней поверхностью), которая позднее будет помогать расположению органоида, ткани или агрегата клеток.
Посев эндотелиальных клеток в микроканал
После желатинизации эндотелиальные клетки (например, HUVEC или из любого другого источника эндотелиальных клеток) в виде суспензии одиночных клеток в подходящей среде (например, ростовая среда для эндотелиальных клеток MV2 от PromoCell) дозируются во входное отверстие микроканала одного или обоих микроканалов. Подходящим образом, 2 мкл эндотелиальных клеток следует дозировать в каждый микроканал в концентрации по меньшей мере 0,5×106/мл.
Когда желательно, чтобы васкуляризовались оба микроканала, имеются два главных способа посева:
1. Последовательный посев, в данном способе 2 мкл эндотелиальных клеток дозируют в концентрации по меньшей мере 0,5×106/мл в первый микроканал. Данный планшет ставится на бок в инкубатор при 37°С по меньшей мере на 15 минут для помощи в адгезии эндотелиальных клеток с гелем. После данного периода времени в то же самое входное отверстие дозируют еще 20 мкл среды для того, чтобы избежать испарения внутри канала. Затем осуществляется посев во второй микроканал. Другие 2 мкл суспензии эндотелиальных клеток дозируются в концентрации по меньшей мере 0,5×106/мл во второй микроканал. Данный планшет ставится на бок по меньшей мере на 15 минут для помощи в адгезии эндотелиальных клеток с гелем. После данного периода времени в то же самое входное отверстие дозируют еще 20 мкл среды для того, чтобы избежать испарения внутри канала. Планшет инкубируют при 37°С в течение по меньшей мере 1 часа при стационарных условиях. Затем еще 30 мкл среды добавляют в каждое входное отверстие микроканала, и 50 мкл среды дозируют в каждое из выходных отверстий микроканала. Планшет помещают на качающуюся платформу при максимальных наклонах 7°С с 8-минутными интервалами.
2. Одновременный посев: в данном способе 2 мкл эндотелиальных клеток дозируют в концентрации по меньшей мере 1×106/мл в каждое входное отверстие обоих микроканалов. Планшет выдерживается в неподвижном состоянии в инкубаторе при 37°С. Через 15 минут в каждое из двух входных отверстий добавляют еще 20 мкл среды, и данный планшет инкубируют при 37°С в течение по меньшей мере 1 ч. Затем дополнительные 30 мкл среды добавляют в каждое входное отверстие микроканала, и 50 мкл среды дозируют в каждое выходное отверстие микроканала. Планшет помещают на качающуюся платформу при максимальных наклонах 7°С с 8-минутными интервалами.
В альтернативном способе одновременного посева 2 мкл эндотелиальных клеток дозируют в концентрации по меньшей мере 1×106/мл в каждое входное отверстие обоих микроканалов. Данный планшет помещают на 180° вращательное устройство (3 оборота в минуту) в инкубаторе при 37°С. Через 15 минут в каждое входное отверстие добавляют еще 20 мкл среды, и планшет инкубируют на 180° вращательном устройстве при 37°С в течение по меньшей мере 1 ч. Затем в каждое входное отверстие микроканала добавляют еще 30 мкл среды, и 50 мкл среды дозируют в каждое выходное отверстие микроканала. Планшет помещают на качающуюся платформу при максимальных наклонах 7° с 8-минутными интервалами.
В зависимости от поведения эндотелиальных клеток, сосуды культивируют в течение 1 или 2, или 3, или более суток перед индукцией ангиогенеза, или любой органоид/ткань/клеточный агрегат помещают на гель. Во время данного процесса можно добавлять проангиогенную композицию для создания градиента ангиогенных факторов, которые стимулируют образование отростков в направлении источника фактора.
Для образования отростков можно использовать, например, проангиогенные факторы, такие как фактор роста эндотелия сосудов (VEGF), хемотактический белок-1 моноцитов (МСР-1), фактор роста гепатоцитов (HGF), основной фактор роста фибробластов (bFGF), форболмиристатацетат (РМА), сфингозин-1-фосфат (S1P), раздельно или в комбинации.
В данном способе во входное отверстие геля можно дозировать по меньшей мере 20 мкл, например, вплоть до 50 мкл смеси проангиогенных факторов (например, 50 нг/мл VEGF, 20 нг/мл bFGF, 500 нМ S1P, 20 нг/мл РМА) в эндотелиальной среде (например, MV2), для индукции образования отростков. Сосуды индуцируются смесью ангиогенных факторов в течение по меньшей мере 1 суток, хотя данный период может быть продлен до 4 или более суток, в зависимости от требующейся степени образования отростков. Это приводит к сосудистому слою на чипе, который готов принимать клетки, клеточные агрегаты, органоиды или другую ткань.
Получение экспланта ткани:
В качестве примера, зачатки мышиной эмбриональной почки иссекают у эмбриона в сутки 11 эмбрионального развития. Все стадии иссечения проводятся в среде DMEM (среда Игла, модифицированная по Дульбекко), дополненной 1× пенициллином/стрептомицином, 25 мМ HEPES и 10% FCS (фетальная телячья сыворотка). В данном способе сначала на поверхность геля дозируется объем среды 20-30 мкл (культуральная среда: DMEM, дополненная 10% FCS, 1× glutamax, 1× пенициллина/стрептомицина).
Для переноса экспланта почки на гель можно использовать капиллярную микропипетку. Данный способ переноса ткани пипетированием будет предотвращать повреждение ткани. Перенесенная ткань будет тонуть на дно планшета, в центре просвета входного отверстия геля. Если положение ткани на геле не централизовано, можно использовать маленькую и узкую иглу (например, от 1 мл шприца BD MicroFine) или тонкий пинцет (например, Dumont #5) для корректировки положения путем подталкивания ткани до желательного положения.
Сокультивирование экспланта-сосуда
Ткань экспланта можно размещать на верхней части геля в сутки 0 или в любые другие сутки после индукции образования отростков.
Ткань экспланта можно помещать вместе с тканеспецифичной средой со смесью проангиогенных факторов или без нее. Клетки ткани в отсутствие проангиогенной смеси в сокультуре могут дополнительно привлекать отростки, например, если сама ткань продуцирует проангиогенные факторы. В ситуации, при которой проангиогенные факторы добавляют в среду после помещения экспланта в сокультуру, данные факторы могут стимулировать сосуды ткани.
Экспланты можно культивировать и отслеживать каждые двое суток. Замены среды через микроканалы можно осуществлять каждые сутки или через сутки, или даже каждые третьи сутки. Возможно, за любой один раз можно заменять только половину среды для того, чтобы избегать стрессового воздействия на клетки в сокультуре, которое могло бы запускаться внезапными изменениями рН, осмотических свойств, давления кислорода и т.д. во время замены полного объема среды.
После нескольких часов в устройстве для культивирования клеток ткань прикрепляется к верхней части геля, покрывая большую часть поверхности геля. Для сохранения положения ткани на верхней части ткани можно распределять поверхностный слой ЕСМ (например, можно использовать гель коллагена, матригеля или фибрина, смешанный со средой). Например: после исходных 12-24 ч культивирования всю среду удаляют из каналов для среды. Матригель смешивают с ледяной средой для доведения до концентрации матригеля 1-5 мг/мл. 20 мкл смеси гель/среда распределяют на верхней части ткани и инкубируют при 37°С в течение 10 минут. Затем на верхней части поверхностного слоя матригеля распределяют еще 30 мкл теплой среды.
Устройство для культивирования клеток теперь содержит органоид, эксплант ткани или другую биологическую ткань, соединенную с сосудистой сетью на чипе. Степень васкуляризации можно отслеживать с использованием микроскопии, например, с использованием флюоресцетно меченых эндотелиальных клеток, таких как HUVEC, меченные RFP. Система, полученная такими способами, теперь готова для применения в любом желательном анализе, таком как анализы, описанные в данном документе, в которых будет исследован эффект опытного соединения на ткань.
Приведенное выше описание служит для цели обучения обычного специалиста в данной области тому, как осуществлять на практике настоящее изобретение, и оно не предназначено для подробного описания всех тех модификаций и изменений, которые станут очевидными при прочтении данного описания. Однако подразумевается то, что все такие модификации и изменения включены в пределы объема настоящего изобретения, который определяется следующей формулой изобретения.
Реферат
Группа изобретений относится к области биотехнологии. Предложено устройство и способ культивирования клеток или клеточных агрегатов, а также способ васкуляризации клеточного агрегата. Устройство содержит микрофлюидную сеть, при этом микрофлюидная сеть включает микрофлюидный слой, отсек для органоидов, барьер для капиллярного давления. Микрофлюидный слой имеет основание, микрофлюидный канал и покрытие. Отсек для органоидов проходит в микрофлюидный слой через отверстие в покрытии и сообщается с микрофлюидным каналом. Барьер выровнен с отверстием и делит микрофлюидную сеть на первый содержащий отсек для органоидов подобъем и содержащий часть микрофлюидного канала второй подобъем. Способ культивирования включает введение в отсек для органоидов капли геля с клетками или клеточными агрегатами, удерживание капли геля барьером, отверждение капли геля, загрузку канала текучей средой и культивирование клеток или клеточных агрегатов. Способ васкуляризации включает введение в устройство капли геля, удерживание капли геля барьером, отверждение капли геля, введение суспензии эндотелиальных клеток, образование эндотелиальными клетками микрососуда, введение клеток или клеточных агрегатов на верхнюю поверхность отвержденного геля и стимуляцию ангиогенеза между микрососудом и клетками или клеточными агрегатами. Изобретения обеспечивают васкуляризацию органоидов или эмбриональных тел и перфузию этих васкуляризированных органоидов или эмбриональных тел. 3 н. и 17 з.п. ф-лы, 47 ил.
Формула
Документы, цитированные в отчёте о поиске
Микрофлюидный чип для создания клеточных моделей органов млекопитающих

Комментарии