Объединение процессов хранения образцов и управление образцами в медико-биологических науках - RU2418633C2
Код документа: RU2418633C2
Чертежи








Описание
Перекрестная ссылка на родственную заявку
Данная заявка на патент притязает на приоритет предварительной заявки на патент США № 60/560829, поданной 8 апреля 2004 г.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится, в общем случае, к процессам, при помощи которых получают биологические материалы и образцы и помещают их в системы учета и управления запасами. Настоящее изобретение также относится к использованию, организации, хранению, отслеживанию, восстановлению и анализу таких биологических материалов и образцов и к автоматизации этих процессов.
УРОВЕНЬ ТЕХНИКИ
Исследования в области медико-биологических наук основаны на проведении анализа биологических материалов и образцов, таких как ДНК, РНК, кровь, моча, буккальные мазки, бактерии, вирусы, продукты ПЦР, клонированные ДНК, белки, клетки и ткани и минералы или химические вещества. Такие образцы обычно собирают или получают из соответствующих источников и помещают для хранения и учета при дальнейшей обработке и анализе.
Контейнеры для хранения таких образцов включают бутыли, пробирки, пузырьки, сумки, ящики, штативы, многолуночные чашки, многолуночные планшеты, которые обычно закрывают отдельными завинчивающимися колпачками или фиксирующимися колпачками, фиксирующимися или герметичными запорными элементами, крышками, клейкими полосками или лентами или полосками с многочисленными колпачками. Стандартным форматом контейнера носителя, обеспечивающим высокую производительность обработки и автоматизации биологических процессов, а также хранения образцов, являются 96-, 384- или 1536-ти луночные планшеты или матрицы. Контейнеры и образцы, находящиеся в них, хранят при различных температурах, например, при температуре окружающей среды или при 4°С, или при температуре ниже 0°С, обычно при температуре примерно -20°С или при температуре от -70°С до -80°С. Образцы, помещенные и хранящиеся в указанных устройствах, наиболее часто содержатся в жидкой среде или буферном растворе, и такие образцы требуют хранения при температурах ниже нуля (например, -20°С или от -70°С до -80°С). В некоторых случаях образцы сначала сушат и затем хранят при температуре окружающей среды или при 4°С, -20°С, или от -70°С до -80°С.
Например, в настоящее время нуклеиновые кислоты хранят в жидком виде при низких температурах. В случае кратковременного хранения нуклеиновые кислоты могут храниться при 4°С. В случае длительного хранения обычно температуру понижают до -20°С - -70°С для предотвращения деградации генетического материала, особенно в случае геномной ДНК или РНК. Нуклеиновые кислоты также хранят при комнатной температуре на твердых матрицах, таких как целлюлозные мембраны. Обе системы хранения имеют определенные недостатки. Хранение при низкой температуре требует дорогостоящего оборудования, такого как холодные комнаты, морозильные камеры, системы аварийного электропитания; такое оборудование может быть ненадежным при неожиданных авариях в системе электроснабжения, или могут возникнуть трудности при его использовании в регионах без доступных источников электропитания или в случае ненадежной энергосистемы. Хранение нуклеиновых кислот на целлюлозных волокнах также приводит к существенным потерям материала во время процесса повторной гидратации, поскольку нуклеиновая кислота остается захваченной и, следовательно, связанной с целлюлозными волокнами вместо полного количественного восстановления. Хранение нуклеиновой кислоты в сухом виде (сухое хранение) на целлюлозе также требует отделения целлюлозы от биологического материала, поскольку в противном случае целлюлозные волокна будут загрязнять биологические образцы. Отделение нуклеиновых кислот от целлюлозных волокон требует дополнительной обработки, включая этапы отбора пипеткой, перенесения образцов в новые пробирки или контейнеры и центрифугирования, причем все эти этапы приводят к уменьшению выхода образца при восстановлении и к увеличению вероятности введения нежелательных контаминантов или нежелательного воздействия, вызывающего деградацию образцов, к тому же это также является дорогостоящим и трудозатратным процессом.
Белки в настоящее время обрабатывают, в основном, в жидких фазах в охлажденной или замороженной среде обычно в пределах температур хранения от -20°С до температуры жидкого азота. В некоторых исключительных случаях белки могут быть лиофилизированы или высушены при комнатной температуре в присутствии трегалозы и нанесены непосредственно на необработанную поверхность (Garcia de Castro et al., 2000 Appl. Environ. Microbiol. 66:4142; Manzanera et al., 2002 Appl. Environ. Microbiol. 68:4328). Белки часто деградируют и/или теряют свою активность, даже если хранятся в охлажденном (4°C), замороженном (-20°C или -80°C) виде. Под действием цикла заморозки-оттаивания снижается биологическая активность белков (например, ферментативная активность, специфичность связывания с родственным лигандом и т.д.), особенно, если необходим повторный цикл заморозки-оттаивания аликвот образцов белка. Связанное с этим снижение активности белка, которая может потребоваться для биологического анализа, обычно требует корректировки концентрации белка для получения сопоставимых результатов анализа или дорогостоящей отбраковки испорченных белковых реагентов и, как следствие, приобретения новых партий. Обычная практика, подразумевающая многочисленное использование хранящихся в лаборатории ферментативных реагентов, особенно различными пользователями в различное время, и использование их в нестандартных процедурах обработки, дополнительно уменьшает достоверность экспериментальных данных, получаемых с использованием таких реагентов. В результате время полужизни белков уменьшается и дорогостоящие реагенты должны часто заменяться, что ведет к значительным финансовым затратам пользователя. Что касается поставщика белков, то его высокие цены продиктованы необходимостью поддерживать непрерывную цепочку обеспечения низких температур, начиная с первичной подготовки белков в холодной комнате, и далее для перевозки, хранения образцов в замороженном виде и транспортировки белков в замороженном виде от места производства до места их использования. Например, задержки во время перевозки могут привести к инактивации белков, потери от которой впоследствии должны быть возмещены высокими ценами поставщика; получение неактивного продукта также может привести к негативной реакции покупателей.
Сушка белков и нуклеиновых кислот должна быть повсеместно принята научно-исследовательскими, биомедицинскими, биотехнологическими и другими промышленно-деловыми учреждениями из-за отсутствия стандартизованных и надежных процессов обработки, трудностей, связанных с количественным восстановлением образцов и восстановлением их функциональных свойств, различий в совместимости и толерантности буферов и растворителей, и с другими трудностями, возникающими в результате роста спроса на обработку нуклеиновых кислот и белков. Такие же проблемы возникают при обработке, хранении и использовании других биологических материалов, таких как вирусы, фаги, бактерии, клетки и многоклеточные организмы.
Современные контейнеры для хранения образцов представляют собой совокупность платформ, лишенных комплексного подхода по подготовке, хранению, учету, отслеживанию, восстановлению и анализу образцов. Очевидно, что ни один из современных способов обработки образцов и форм хранения не решает проблемы, возникающие в связи с использованием индивидуальных контейнеров для хранения, неадекватных запорных элементов и средств содержания, возникающие в связи с контаминацией образцов, использованием неадекватной организации, различных систем мечения, в связи с необходимостью больших объемов и требованиями, связанными с хранением, и температурными ограничениями.
Наступление эры генома и недавняя расшифровка человеческого и других геномов, протеом, транскриптом и т.д. привели к индустриализации исследований в медико-биологических науках. Миллионы биологических образцов, в том числе гены и/или генные продукты из множества организмов, анализируются для дальнейшего развития научных знаний и разработки коммерческих продуктов. Развитие высоких технологий привело к огромному количеству информации и образцов, в связи с чем возникла необходимость в объединении процессов хранения образцов, организации и анализа данных. Таким образом, в небольших и крупных лабораториях возникла значимая организационная проблема, связанная с генерацией многочисленных биологических образцов и данных. Ранее доступные возможности управления данными для образцов в медико-биологических науках, такие как LIMS (лабораторные системы управления информацией), не были способны объединять информацию, относящуюся к конкретному образцу или образцам и устройству для хранения образцов, и обычно хранили относящиеся к образцам данные на центральном сервере, который ни физически, ни электрически не соединен с устройством для хранения образцов. Более того, такие известные системы требуют неудобных конфигураций стоек хранения, которые обычно включают в себя громоздкие холодильные аппараты и/или дорогостоящее, сложное программное обеспечение, которое требует отдельной непрерывной поддержки специалиста по информационным технологиям независимо от того, должно ли быть приобретено программное обеспечение масштаба предприятия и сконфигурировано для конкретных нужд пользователя системы или должна быть выполнена независимая разработка программного обеспечения согласно требованиям заказчика.
Очевидно, что в данной области производства существует необходимость в универсальных устройствах и системах для хранения, восстановления, анализа и сравнения информации об образцах, относящихся к медико-биологическим наукам. Настоящее раскрытие относится к решению задач, связанных с такими потребностями, путем предоставления множества способов хранения образцов, относящихся к медико-биологическим наукам, и приложениям обработки данных и предлагает другие связанные с этим преимущества.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Одним из аспектов настоящего изобретения является предоставление системы для обработки данных, относящейся к хранению, организации, отслеживанию, восстановлению и анализу биологических образцов, причем система включает в себя устройство для биологических образцов; реализованную на базе компьютера систему для получения, хранения, обработки и обмена данными, относящимися к устройству для образцов; и радиочастотный интерфейс между устройством для образцов и указанной реализованной на базе компьютера системой для обеспечения связи между указанной реализованной на базе компьютера системой и устройством для образцов.
Согласно нескольким вариантам осуществления настоящего изобретения предоставляется следующее. Устройство для хранения биологических образцов для одного или множества биологических образцов, содержащее: (a) крышку; (b) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца, причем одна или несколько из указанных лунок содержит материал матрицы; и (c) по меньшей мере, одно радиочастотное устройство ретрансляции. Устройство для хранения биологических образцов, в котором материал матрицы растворяется или диссоциирует в растворителе или которое содержит запорное средство для запирания крышки на планшете для образцов, причем необязательно запорное средство дополнительно содержит магнитный запорный элемент. Устройство для хранения биологических образцов, которое содержит герметичную прокладку запорного элемента, или которое содержит герметичную прокладку запорного элемента вокруг каждой лунки, или которое содержит магнитный запорный элемент и герметичную прокладку запорного элемента вокруг каждой лунки. В некоторых вариантах осуществления предоставляется устройство для хранения биологических образцов, в котором материал матрицы выполнен с возможностью сухого хранения образца без охлаждения.
В других вариантах осуществления настоящее изобретение предоставляет устройство для хранения биологических образцов для одного или множества биологических образцов, содержащее: (a) крышку; (b) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца, причем одна или несколько из указанных лунок содержат материал матрицы, который растворяется или диссоциирует в растворителе; и (c) по меньшей мере, одно радиочастотное устройство ретрансляции. В некоторых дополнительных вариантах осуществления вышеописанного устройства для хранения биологических образцов, по меньшей мере, одна лунка содержит, по меньшей мере, один детектируемый индикатор, который в некоторых дополнительных вариантах осуществления содержит колориметрический индикатор, а в некоторых других вариантах осуществления представляет собой флуоресцентный индикатор, люминисцентный индикатор, фосфоресцирующий индикатор, радиометрический индикатор, краситель, фермент, субстрат фермента, переносящую энергию молекулу или аффинную метку. В некоторых дополнительных вариантах осуществления детектируемый индикатор способен указывать с возможностью детектирования на наличие, по меньшей мере, одного из: амина, спирта, альдегида, воды, тиола, сульфида, нитрита, авидина, биотина, иммуноглобулина, олигосахарида, нуклеиновой кислоты, полипептида, фермента, цитоскелетного белка, реакционно-способных видов кислорода, иона металла, pH, Na+, K+, Cl-, цианида, фосфата и селена. В некоторых других вариантах осуществления детектируемый индикатор выбирают из группы, состоящей из фенолового красного, этидиум бромида, ДНК-полимеразы, рестрикционной эндонуклеазы, хлорида кобальта, красителя Рейхардта и флуорогенного субстрата протеаз.
Согласно некоторым другим вариантам осуществления устройство для хранения биологических образцов содержит, по меньшей мере, одну лунку, которая содержит, по меньшей мере, один ингибитор, который представляет собой биологический ингибитор или биохимический ингибитор, который может представлять собой валидамицин A, TL-3, ортованадат натрия, фторид натрия, N-α-тозил-Phe-хлорметилкетон, N-α-тозил-Lys-хлорметилкетон, апротинин, фенилметилсульфонил фторид, диизопропил-фторфосфат, ингибитор киназ, ингибитор фосфатаз, ингибитор каспаз, ингибитор гранзимов, ингибитор клеточной адгезии, ингибитор клеточного деления, ингибитор клеточного цикла, ингибитор сигнальных липидов и ингибитор протеаз, восстановитель, алкилирующий агент или противомикробный агент. В некоторых вариантах осуществления материал матрицы выполнен с возможностью сухого хранения образца без охлаждения, в некоторых вариантах осуществления материал матрицы содержит поливиниловый спирт, а в некоторых вариантах осуществления материал матрицы содержит, по меньшей мере, один материал, выбранный из: полиэтиленгликоля, агарозы, поли-N-винилацетамида, поливинилпирролидона, поли(4-винилпиридина), полифинилен оксида, сшитого акриламида, полиметакрилата, углеродной нанотрубки, полилактида, сополимера лактид/гликолид, сополимера гидроксиметакрилата, пектината кальция, гидроксипропилметилцеллюлозы ацетата сукцината, гепарин сульфат протеогликана, гиалуроновой кислоты, глюкуроновой кислоты, тромбоспондина-1 N-терминального гепаринсвязывающего домена, фибронектина, конъюгата белок/водорастворимый полимерный модификатор, коллагена, гидроксиэктоина, полистерена или трегалозы. В другом варианте осуществления настоящее изобретение предоставляет набор, содержащий (I) устройство для хранения биологических образцов для одного или множества биологических образцов, содержащее (a) крышку; (b) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца, причем одна или несколько из указанных лунок содержат материал матрицы; и (c) по меньшей мере, одно радиочастотное устройство ретрансляции; и (II) один или несколько дополнительных реагентов. В других вариантах осуществления материал матрицы растворяется или диссоциирует в растворителе.
В другом варианте осуществления настоящего изобретения предоставляется способ хранения одного или множества биологических образцов, содержащий приведение в контакт одного или множества биологических образцов с устройством для хранения биологических образцов, причем указанное устройство для хранения биологических образцов содержит (i) крышку; (ii) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца, причем одна или несколько из указанных лунок содержат материал матрицы; и (iii) по меньшей мере, одно радиочастотное устройство ретрансляции, и таким образом осуществляет хранение биологических образцов, при этом способ в некоторых дополнительных вариантах осуществления включает в себя поддержание устройства для хранения биологических образцов без охлаждения после этапа приведения в контакт. Другой вариант осуществления настоящего изобретения предоставляет способ хранения одного или множества биологических образцов, содержащий (а) приведение в контакт одного или множества биологических образцов с устройством для хранения биологических образцов, причем указанное устройство для хранения биологических образцов содержит (i) крышку; (ii) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца, причем одна или несколько из указанных лунок содержат материал матрицы, который растворяется или диссоциирует в растворителе; и (iii) по меньшей мере, одно радиочастотное устройство ретрансляции; и (b) сушку одной или нескольких лунок для образцов, и, таким образом, осуществления хранения указанных биологических образцов, при этом способ в некоторых дополнительных вариантах осуществления включает в себя поддержание устройства для хранения биологических образцов без охлаждения после этапов приведения в контакт и сушки, при этом в некоторых других дополнительных вариантах осуществления биологическая активность образца после этапа поддержания по существу представляет собой такую же биологическую активность образца, что и до этапа приведения в контакт, и при этом в некоторых других дополнительных вариантах осуществления деградация биологического образца уменьшается относительно деградации контрольного биологического образца, содержащегося без охлаждения в отсутствии материала матрицы. В некоторых вариантах осуществления этап приведения в контакт содержит одновременное растворение или диссоциацию материала матрицы в растворителе, в то время как в некоторых других родственных вариантах осуществления этапу приведения в контакт предшествует растворение или диссоциация материала матрицы в растворителе, хотя в некоторых других вариантах осуществления растворение или диссоциация материала матрицы в растворителе следуют за этапом приведения в контакт.
В другом варианте осуществления настоящее изобретение предоставляет способ подготовки устройства для хранения биологических образцов для одного или множества биологических образцов, содержащий (a) введение материала матрицы, который растворяется или диссоциирует в растворителе, в одну или множество лунок для образцов устройства для хранения биологических образцов, причем указанное устройство для хранения биологических образцов содержит (i) крышку; (ii) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца; и (iii) по меньшей мере, одно радиочастотное устройство ретрансляции; и (b) сушку одной или нескольких лунок для образцов, и, таким образом, изготовления устройства для хранения биологических образцов. В некоторых дополнительных вариантах осуществления этап введения содержит введение жидкого раствора или жидкой суспензии, которая содержит материал матрицы и растворитель, в то время как в некоторых других дополнительных вариантах осуществления, по меньшей мере, одна лунка содержит, по меньшей мере, один детектируемый индикатор, хотя в некоторых других дополнительных вариантах осуществления, по меньшей мере, одна лунка содержит, по меньшей мере, один ингибитор, который представляет собой биологический ингибитор или биохимический ингибитор.
В другом варианте осуществления предоставляется способ восстановления сохраненного биологического образца, содержащий (a) одновременное или последовательное, или в каком-либо другом порядке, приведение в контакт одного или множества биологических образцов с материалом матрицы в устройстве для хранения биологических образцов, причем указанное устройство для хранения биологических образцов содержит (i) крышку; (ii) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца, причем одна или множество указанных лунок содержат материал матрицы, и при этом материал матрицы растворяется или диссоциирует в первом растворителе; и (iii) по меньшей мере, одно радиочастотное устройство ретрансляции; (b) сушку одной или нескольких лунок; (с) поддержание устройства для хранения биологических образцов без охлаждения после этапов приведения в контакт и сушки; и (d) ресуспендирование или повторное растворение биологического образца во втором растворителе, и, таким образом, восстановление сохраненного биологического образца, при этом в некоторых дополнительных вариантах осуществления биологическая активность образца после этапа поддержания по существу представляет собой такую же биологическую активность образца, что и до этапа приведения в контакт, при этом в другом дополнительном варианте осуществления второй растворитель выбирают из (i) растворителя, который является таким же, что и первый растворитель, и (ii) растворителя, который отличается от первого растворителя. В другом варианте осуществления, по меньшей мере, один из первого и второго растворителей представляет собой буфер активности (рабочий буфер).
В другом варианте осуществления настоящее изобретение предоставляет систему для обработки данных, относящихся к хранению, организации, отслеживанию, восстановлению и анализу биологических образцов, причем система содержит: устройство для биологических образцов; реализованную на базе компьютера систему для приема и передачи данных, относящихся к устройству для образцов; и радиочастотный интерфейс между устройством для образцов и упомянутой реализованной на базе компьютера системой для обеспечения связи между упомянутой реализованной на базе компьютера системой и устройством для образцов. В дополнительном варианте осуществления реализованная на базе компьютера система содержит связанную с устройством для образцов структуру данных для поддержания данных, относящихся к хранению, организации, отслеживанию, восстановлению и анализу биологических образцов. В варианте осуществления радиочастотный интерфейс содержит радиочастотное устройство запроса, соединенное с реализованной на базе компьютера системой, и, по меньшей мере, одно устройство ретрансляции, связанное с устройством для образцов для радиочастотной связи с устройством запроса.
В другом варианте осуществления предоставляется способ обработки данных, относящийся к хранению, организации, отслеживанию, восстановлению и анализу биологических образцов, причем способ содержит: предоставление устройства для хранения одного или нескольких биологических образцов; предоставление реализованной на базе компьютера системы для приема, хранения и передачи данных, относящихся к устройству для образцов или биологическим образцам или и к тому и к другому; предоставление радиочастотного интерфейса для обмена данными между устройством для образцов и реализованной на базе компьютера системой. В дополнительном варианте осуществления способ содержит генерацию управляющих сигналов в реализованной на базе компьютера системе, которые заставляют радиочастотный интерфейс извлекать данные из устройства для образцов, при этом в другом варианте осуществления способ содержит генерацию управляющих сигналов реализованной на базе компьютера системой для передачи данных в устройство для образцов через радиочастотный интерфейс.
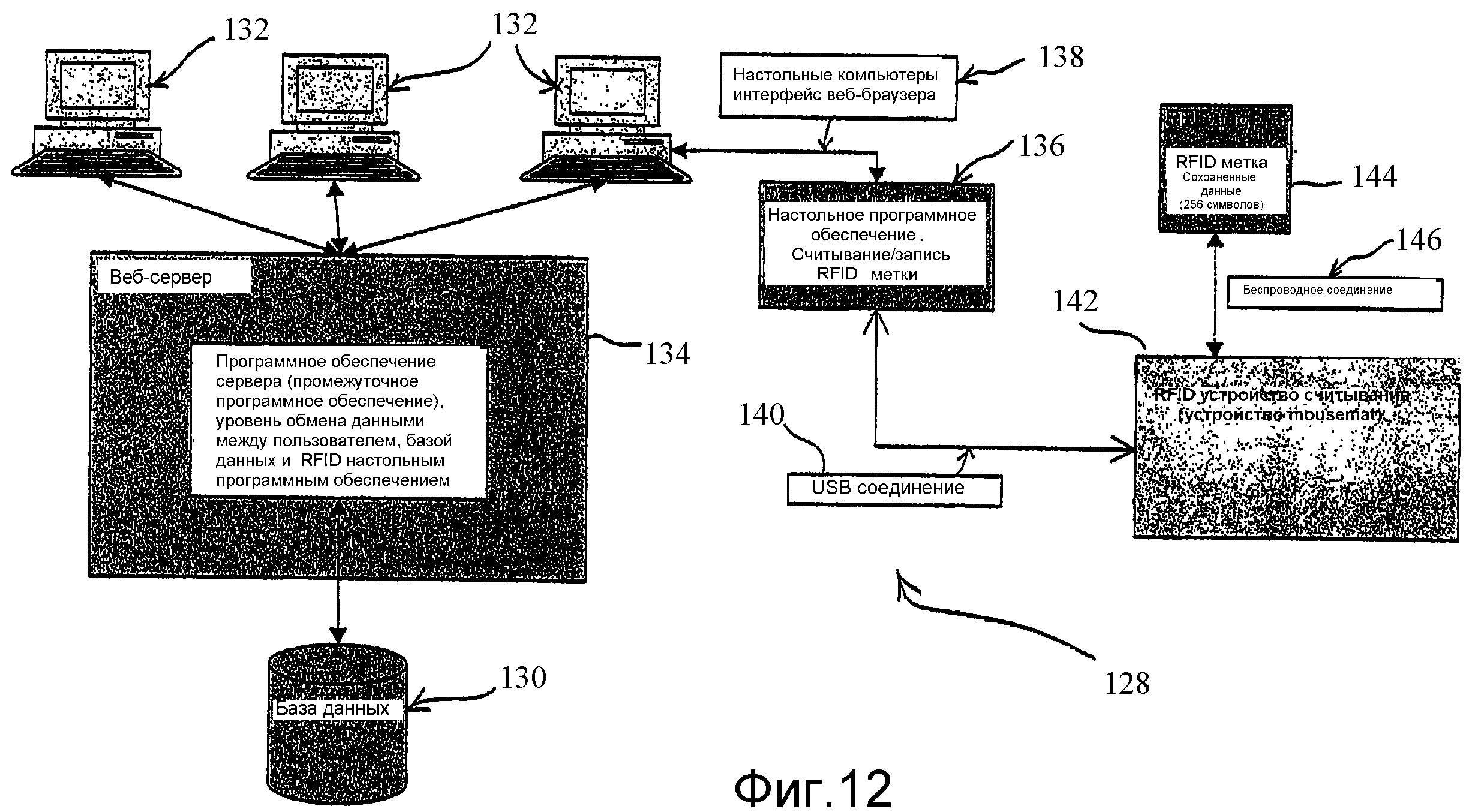
Согласно другому варианту осуществления настоящее изобретение предоставляет систему для обработки данных, относящихся к хранению, организации, отслеживанию, восстановлению и анализу биологических образцов, причем система содержит устройство для хранения биологических образцов, при этом указанное устройство для хранения образцов содержит крышку; планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца; и, по меньшей мере, одно радиочастотное устройство ретрансляции; реализованную на базе компьютера систему для приема и передачи данных, относящихся к устройству для хранения образцов; и радиочастотный интерфейс между устройством для образцов и реализованной на базе компьютера системой для обеспечения связи между реализованной на базе компьютера системой и устройством для образцов. В некоторых дополнительных вариантах осуществления реализованная на базе компьютера система содержит 3-х уровневую архитектуру, имеющую веб-браузер, программу веб-сервера и сервера базы данных и клиентское приложение, которое управляет работой радиочастотного интерфейса, а в некоторых других вариантах осуществления система содержит USB-интерфейс между веб-браузером и RFID считывающим устройством. В другом варианте осуществления реализованная на базе компьютера система содержит 2-х уровневую архитектуру, имеющую макропрограмму Excel со стороны клиента и сервер базы данных. В другом варианте осуществления реализованная на базе компьютера система содержит 2-х уровневую архитектуру, имеющую независимое клиентское приложение и сервер базы данных для обмена данными с клиентским приложением. В некоторых дополнительных вариантах осуществления клиентское приложение представляет собой скомпилированное приложение.
В другом варианте осуществления настоящее изобретение предоставляет устройство для хранения биологических образцов для одного или множества биологических образцов, содержащее (a) крышку; (b) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца; и (c) по меньшей мере, одно устройство ретрансляции. В дополнительном варианте осуществления устройство для хранения биологических образцов содержит запорное средство для запирания крышки на планшете для образцов, и в некоторых дополнительных вариантах осуществления запорное средство содержит магнитный запорный элемент. В другом варианте осуществления устройство для хранения биологических образцов содержит герметичную прокладку запорного элемента, а в другом варианте осуществления устройство для хранения содержит герметичную прокладку запорного элемента вокруг каждой лунки. В другом варианте осуществления устройство для хранения биологических образцов содержит магнитный запорный элемент и герметичную прокладку запорного элемента вокруг каждой лунки.
Эти и другие аспекты настоящего изобретения будут очевидны при прочтении нижеследующего описания осуществления изобретения и прилагаемых чертежей. Все ссылки, раскрытые в настоящем описании, включены в настоящее описание во всей своей полноте, как если бы каждая из них была включена отдельно.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
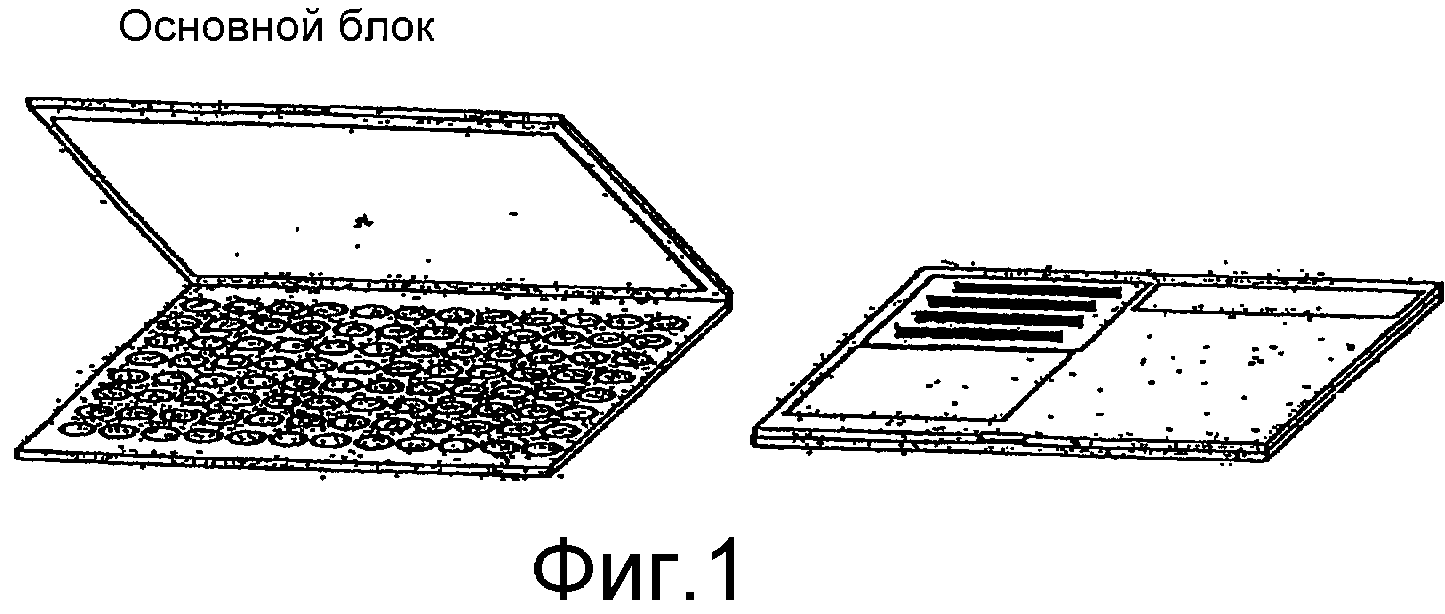
Фиг.1 представляет собой блок-схему планшеты для образцов для сухого хранения биологического материала.
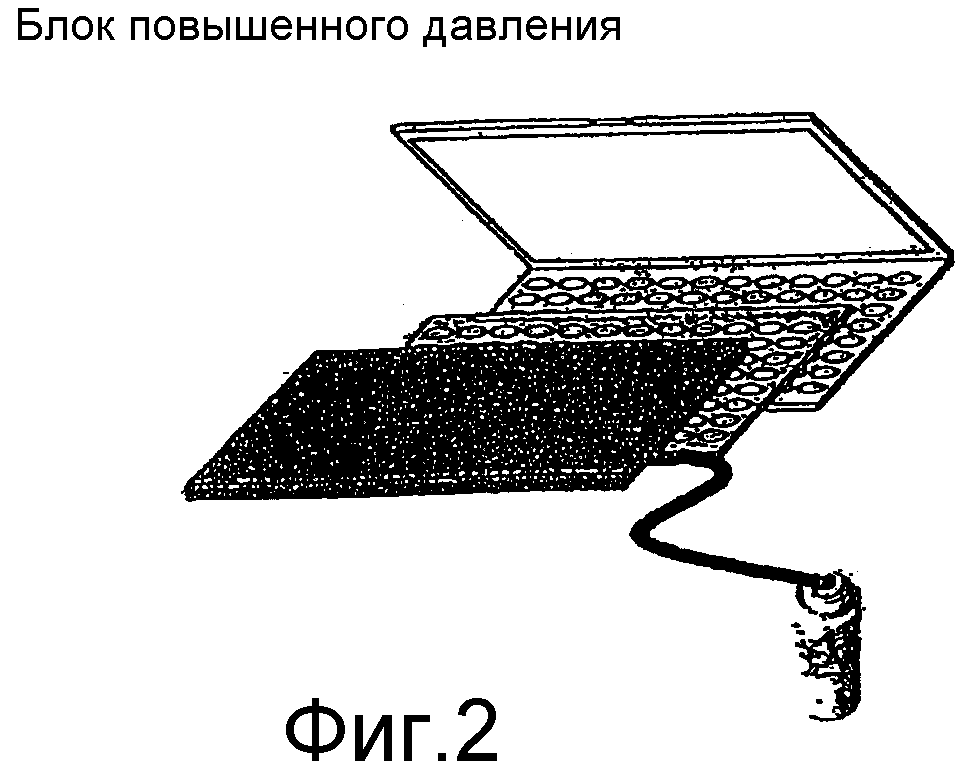
Фиг.2 представляет собой блок-схему блока повышенного давления и его модулей блокировки.
Фиг.3 представляет собой блок-схему воздушных каналов блока повышенного давления.
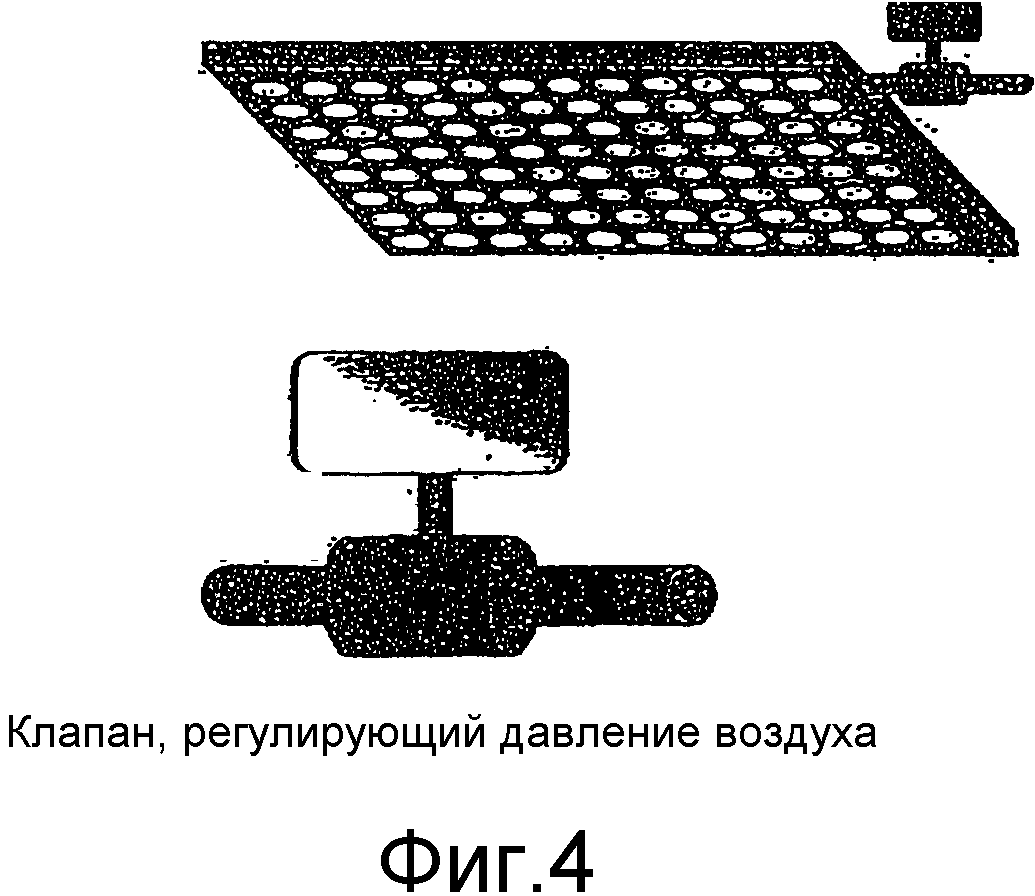
Фиг.4 представляет собой блок-схему блока повышенного давления и клапана регулировки воздушного потока.
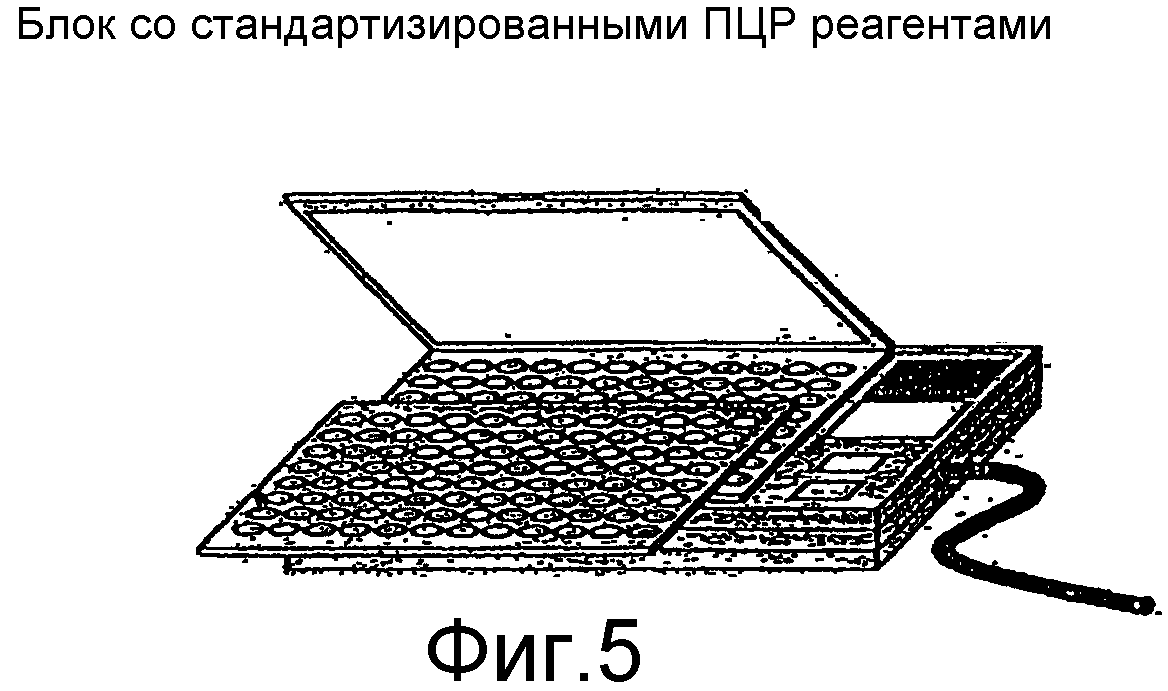
Фиг.5 представляет собой блок-схему портативного устройства ПЦР для обеспечения реагентами планшеты с образцами.
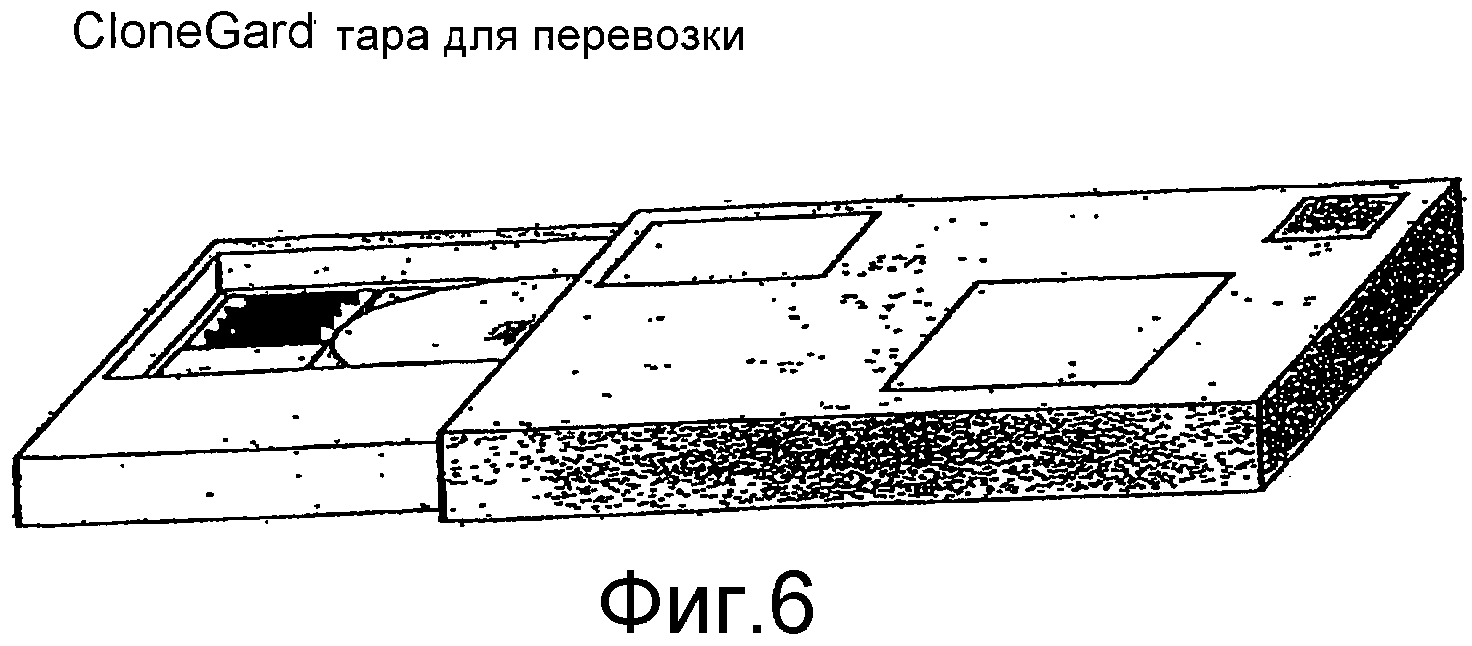
Фиг.6 представляет собой блок-схему тары для перевозки.
Фиг.7 представляет собой блок-схему стековой стойки.
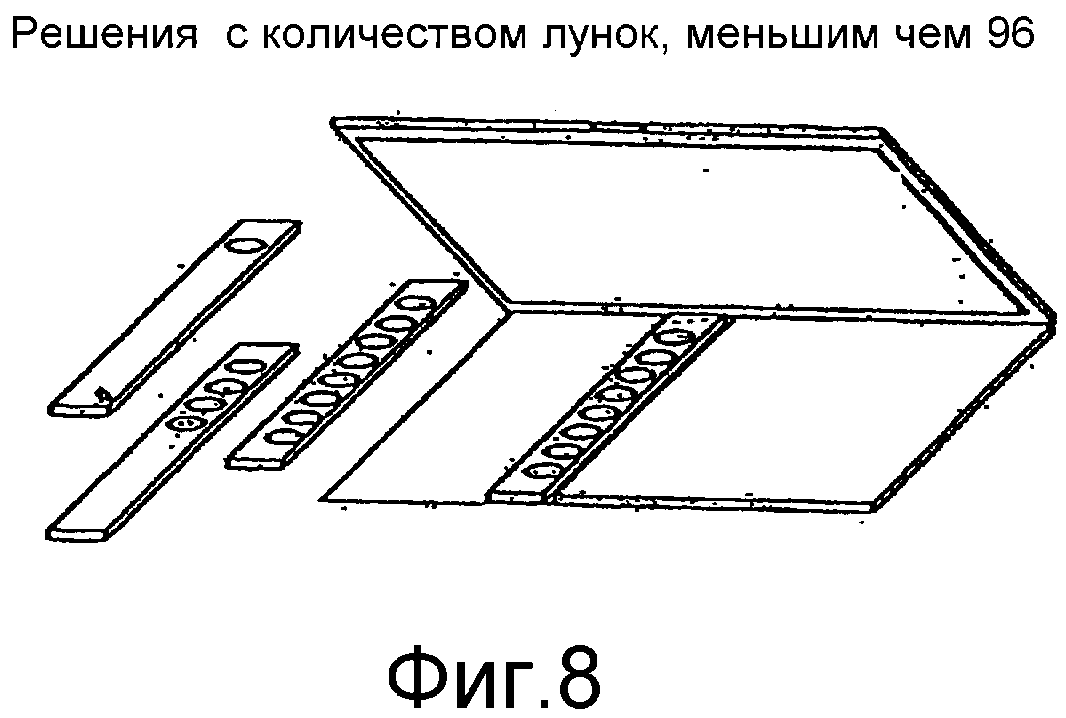
Фиг.8 представляет собой блок-схему однорядной планшеты с лунками для хранения образцов.
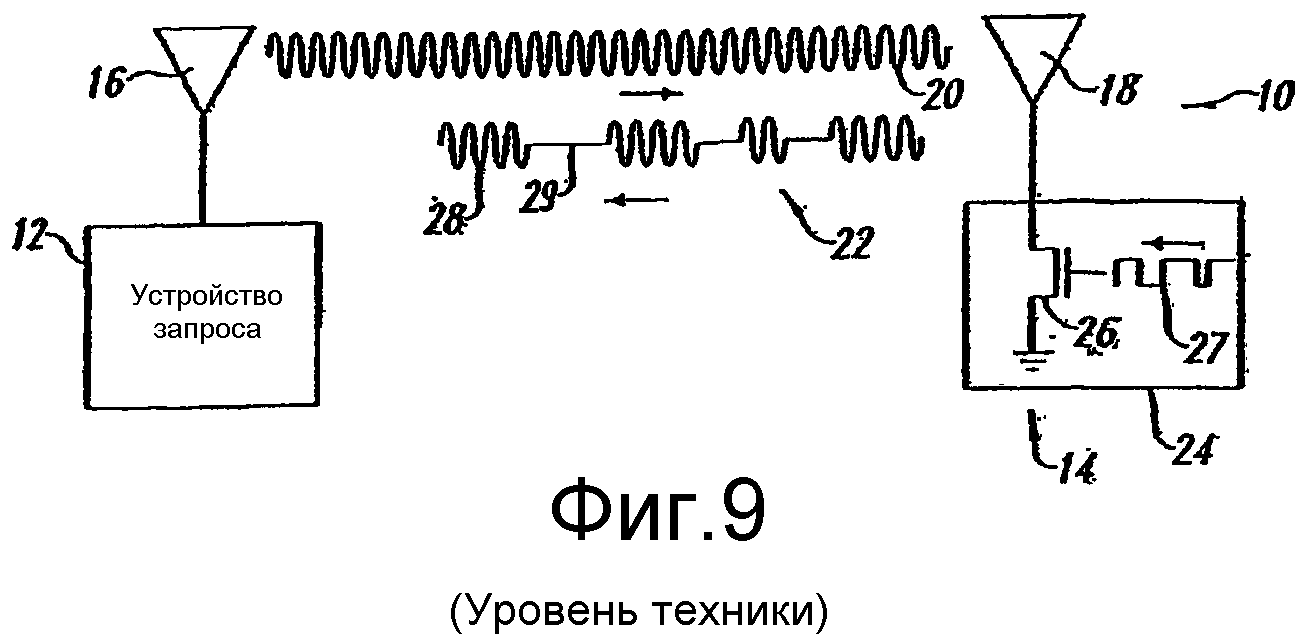
Фиг.9 представляет собой блок-схему известной радиочастотной системы обмена данными.
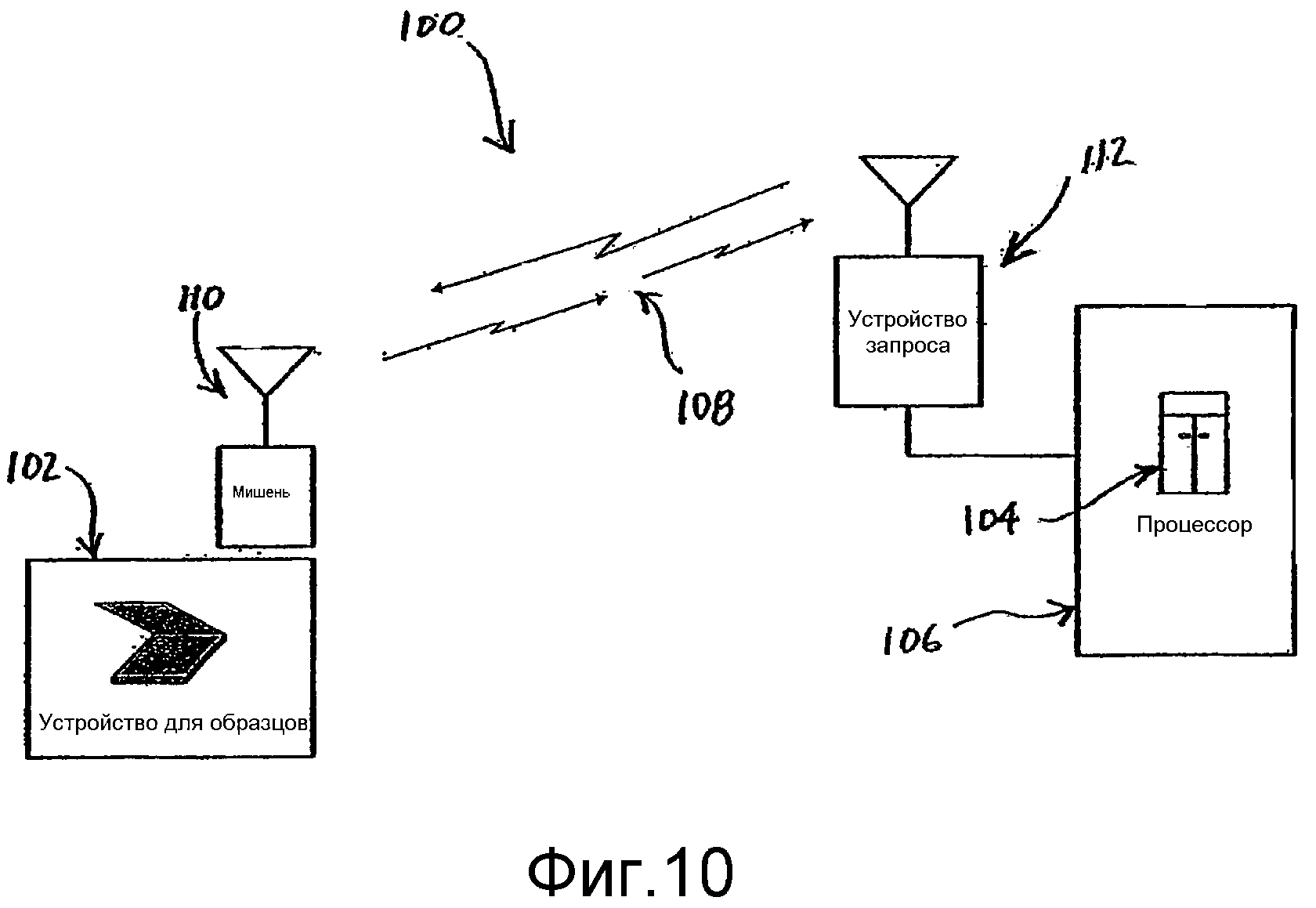
Фиг.10 представляет собой блок-схему системы, выполненной согласно одному из вариантов осуществления настоящего изобретения.
Фиг.11 представляет собой блок-схему архитектуры системы, реализованной на базе компьютера, сформированной согласно другому аспекту настоящего изобретения.
На Фиг.12 показана архитектура системы, реализованной на базе компьютера, согласно некоторым вариантам осуществления настоящего изобретения.
На Фиг.13 показана архитектура системы, реализованной на базе компьютера, согласно некоторым вариантам осуществления настоящего изобретения.
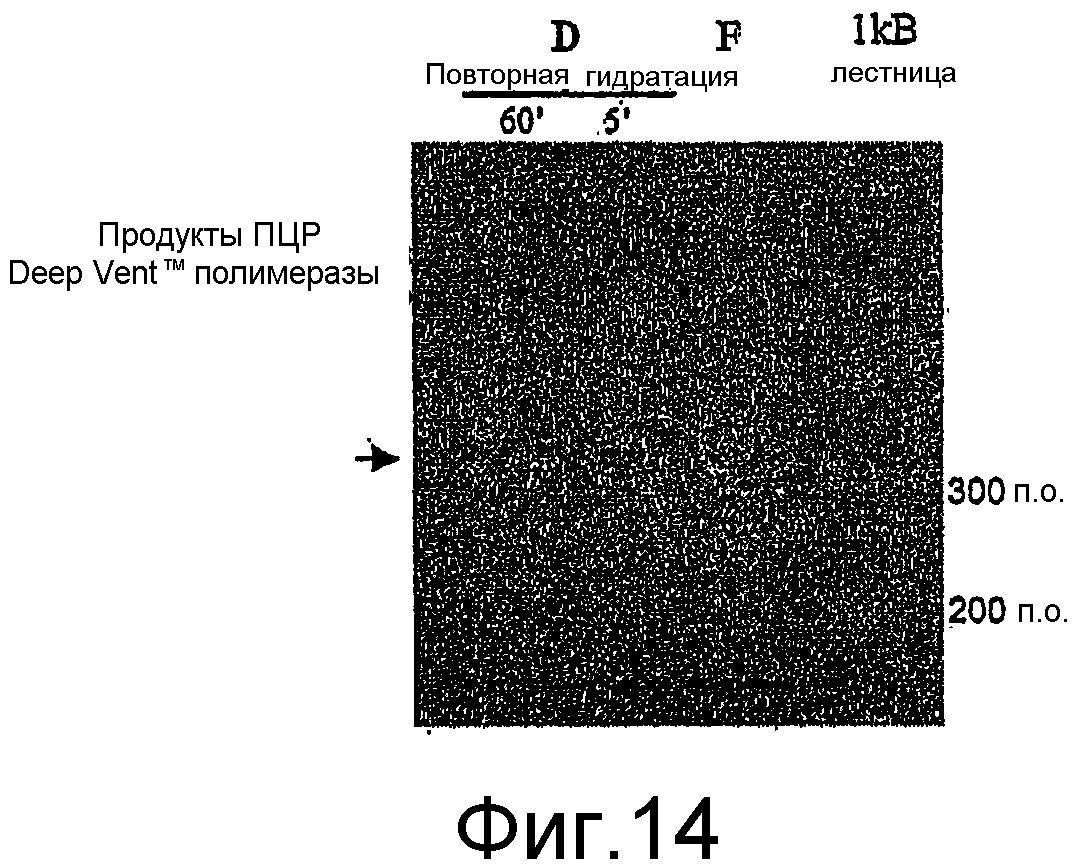
На Фиг.14 показан гель с продуктами ПЦР Deep VentTM полимеразы. Deep VentTM полимеразу хранили при температуре окружающей среды (D) и гидратировали через либо 60 минут (D 60'), либо через 5 минут (D 5') в присутствии реакционного буфера, темплаты, dNTP и праймеров. Deep Vent полимеразу, хранящуюся в замороженном виде (F), использовали в качестве контроля. Стрелка указывает на ПЦР продукт ожидаемого размера.
На Фиг.15 показана (A) длина считывания (количество оснований) для продуктов реакции ПЦР, амплифицированных с использованием Big DyeTM фермента, хранящегося в замороженном виде и хранящегося на растворяемой матрице при температуре окружающей среды; и (B) результаты циклического секвенирования.
На Фиг.16 показана кинетика ВИЧ-протеаз после сухого хранения на растворимой матрице.
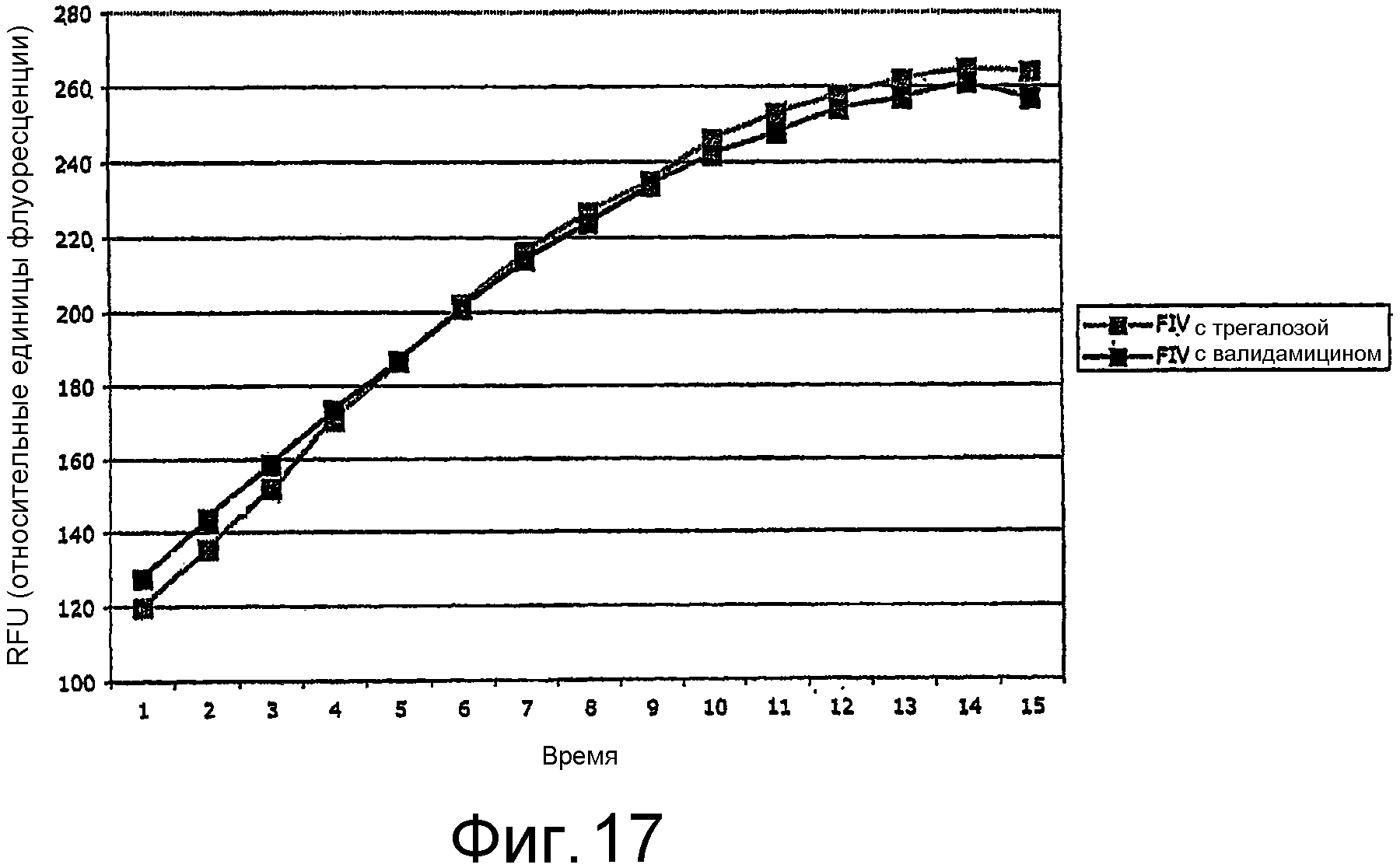
На Фиг.17 показана активность FIV-протеаз после сухого хранения на растворимой матрице.
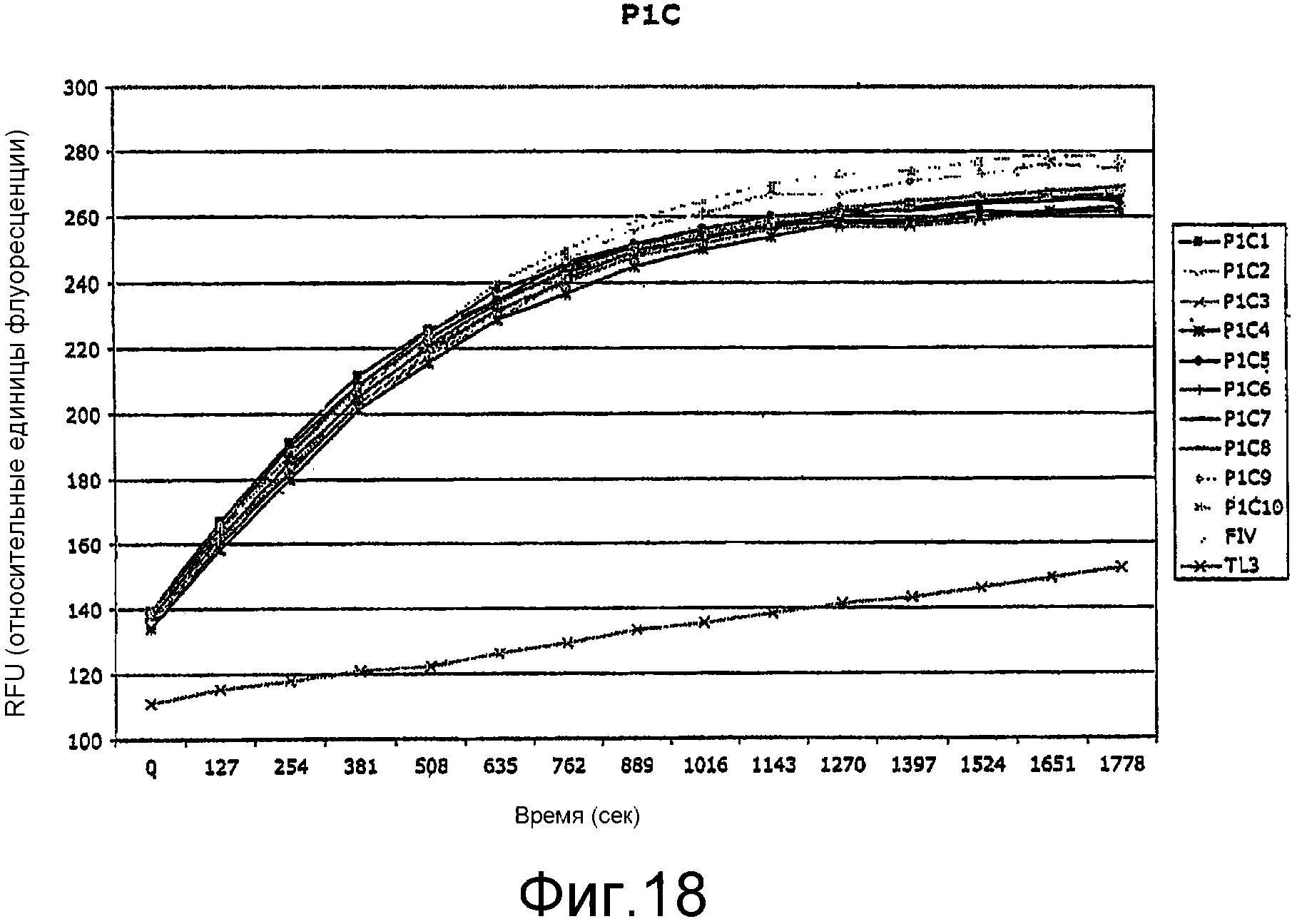
На Фиг.18 показана активность ВИЧ-протеаз после сухого хранения.
На Фиг.19 показана скорость трансформации E. coli после сухого хранения на растворимой матрице.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к многокомпонентной системе и способу выделения, очистки, консервации, хранения, отслеживания, восстановления, сопоставления данных, мониторинга и/или анализа биологических образцов и биологического материала, минералов и химических веществ, как раскрыто в настоящем описании. Настоящее изобретение может быть использовано для хранения сухих образцов и для хранения при температуре окружающей среды, а также может быть использовано для хранения различных биологических материалов и образцов, таких как, без ограничений, ДНК, РНК, кровь, моча, другие биологические жидкости (например, сыворотка, серозные жидкости, плазма, лимфа, спинномозговая жидкость, слюна, слизистые выделения секреторных тканей и органов, влагалищные выделения, асцитные жидкости, жидкости плевральной, перикардиальной, перитонеальной, брюшной и других полостей тела, среда для культур клеток и органов, включая среду для содержания клеток и органов, жидкости лаважа и т.п.) буккальные мазки, бактерии, вирусы, продукты ПЦР, улонированная ДНК, белки, клетки и ткани или другие биологические образцы. Следовательно, биологические образцы могут включать в себя образец крови, образец биопсии, тканевой эксплант, культуру органов, биологическую жидкость, или любой другой препарат ткани или клеток, или их фракции, или их производные, или их изолированные формы из субъекта или биологического источника. Субъектом или биологическим источником может быть человек или животное, не являющееся человеком, первичная культура клеток или культура адаптированной клеточной линии, включая, без ограничений, клеточные линии, полученные при помощи генетической инженерии, которые могут содержать интегрированные в хромосомы или эписомальные рекомбинантные последовательности нуклеиновых кислот, иммортализованные или иммортализуемые клеточные линии, гибридные клеточные линии соматических клеток, дифференцированные или дифференцируемые клеточные линии, трансформированные клеточные линии и т.п.
Таким образом, в некоторых вариантах осуществления настоящее изобретение относится к длительному хранению биологического, химического и биохимического материала в сухих условиях и в виде, готовом для немедленного использования после гидратации (например, при повторной гидратации). Как изложено в настоящем описании, существуют варианты осуществления, которые включают в себя a) специфические растворимые (или диссоциируемые) матрицы для хранения, b) изготовление и оптимизацию матрицы для хранения при помощи химических веществ, которые увеличивают надежность условий для длительного хранения, c) подготовку различных биологических материалов до процесса сушки, которая предоставляет возможность для немедленной активизации и применения материалов после гидратации, и d) процесс упрощения сложных биохимических процессов благодаря использованию биологически активных материалов, хранящихся в сухом виде. Таким образом, эти и родственные варианты осуществления предоставляют неочевидные преимущества, связанные с сухим хранением без охлаждения биологических материалов, включая увеличение стабилизации и сохранения биологической активности в биологических образцах, уменьшение деградации биологических образцов во время хранения при комнатной температуре в сухом виде (и, в частности, благодаря использованию защитной матрицы) и упрощение процессов подготовки биологических образцов для дальнейшего использования путем уменьшения или исключения необходимости в затратных по времени повторной калибровке и аликвотировании таких образцов.
Настоящее изобретение позволяет очистку и фракционирование по размеру ДНК, РНК, клеток, клеточных компонентов и других биологических материалов, минералов, химических веществ или композиций, полученных из биологического образца или другого образца, относящегося к биологическим наукам. Таким образом, настоящее изобретение действительно предоставляет возможность, например, для использования одного или множества биологических материалов и/или биологических образцов при выполнении процедур молекулярной биологии, включая, без ограничений, ПЦР, секвенирование биополимера (например, полинуклеотида, полипептида или другого биополимера), удлинение олигонуклеотида с использованием праймеров, гаплотипирование (например, гаплотипирование ДНК) и рестрикционное картирование на одной унифицированной, объединенной и легкой в использовании платформе. В некоторых вариантах осуществления настоящее изобретение также действительно предоставляет возможность, например, для выполнения кристаллографии белка, используя один или множество биологических образцов и/или биологических материалов. В других вариантах осуществления предоставляется платформа для использования, тестирования или детектирования (включая диагностические приложения) антитела или небольшой молекулы (либо природного происхождения, либо искусственной) или другой биологической молекулы, например, белка, полипептида, пептида, аминокислоты или их производных; липида, жирной кислоты и т.п. или их производных; углеводорода, сахарида или т.п. или их производных, нуклеиновой кислоты, нуклеотида, нуклеозида, пурина, пиримидина или родственной молекулы или их производных и т.п.; или другой биологической молекулы, которая составляет биологический образец.
Устройство для хранения биологических образцов
Устройство для хранения биологических образцов (“устройство для хранения”) настоящего изобретения включает в себя планшету для образцов и крышку. Размеры устройства для хранения могут составлять от примерно 2 мм до примерно 25 мм в высоту, от примерно 80 мм до примерно 200 мм в длину и от примерно 60 мм до примерно 150 мм в ширину. Предпочтительно устройство для хранения имеет высоту от примерно 3 мм до примерно 15 мм, длину от примерно 100 мм до примерно 140 мм и ширину от примерно 60 мм до примерно 100 мм. Устройство для хранения может быть изготовлено из цветного полипропилена и может содержать 96, 384, 1536 или больше лунок для образцов. Каждое устройство для хранения имеет свою собственную плотно закрывающуюся крышку. Устройство для хранения может быть изготовлено способом литьевого формования и может быть изготовлено в виде одной части или множества частей.
В предпочтительных вариантах осуществления и как раскрыто в настоящем описании, устройство для хранения биологических образцов выполнено с возможностью использования в системе для обработки данных об образцах, которая содержит радиочастотный интерфейс между устройством для хранения и реализованной на базе компьютера системой для получения, хранения и/или передачи данных. Данные могут иметь отношение к устройству для хранения и/или одному или нескольким образцам, содержащимся в нем. Следовательно, согласно некоторым вариантам осуществления устройство для хранения биологических образцов содержит, по меньшей мере, одно радиочастотное устройство ретрансляции, как раскрыто в настоящем описании, которое может представлять собой встроенный компонент устройства для хранения и/или может быть прикреплено к внутренней или внешней поверхности устройства для хранения. Дополнительно или в качестве альтернативы, устройство для хранения может иметь метку в виде штрихового кода, и/или может, необязательно, содержать одно или несколько полей для кодирования при помощи не стираемых разметочных карандашей, и/или может, необязательно, включать напечатанный на нем протокол обработки. Пластический материал планшеты для образцов может иметь толщину примерно от 1/10 мм до примерно 2 мм, мгновенно передавать тепло и быть теплостойким вплоть до примерно 100°C.
Планшета для образцов содержит области для содержания образца, или лунки, вид сверху которых по форме предпочтительно является круглым, но также может быть и квадратным, прямоугольным, овальным или иметь любую другую форму. Дно лунок может быть плоским, коническим, цилиндрическим, или круглым, или любой другой формы. Края лунок могут быть цилиндрическими, коническими или другой формы. Количество лунок на планшете для образцов может составлять от 1 лунки до нескольких тысяч лунок. Наиболее предпочтительно количество образцов размещенных на планшете для образцов составляет от примерно 96 до примерно 384 лунок. Лунки для образцов также могут быть разделены на группы по 1, 4 и 8 лунок, которые могут быть размещены на стандартной планшете для образцов, описанной в этом разделе. На планшете лунки расположены рядами. В планшетах с 96 лунками один ряд содержит 8 лунок. Уникальным аспектом является то, что планшета для образцов может представлять собой лоток для нескольких отдельных слайдов с образцами, имеющими различное количество лунок. Каждый слайд вставляется в лоток и обеспечивает возможность размещения на одной планшете различного количества лунок. Нижняя поверхность лунок является тонкой и предпочтительно имеет толщину примерно от 1/10 мм до примерно 2 мм.
Предполагается, что настоящее изобретение имеет важное значение для высокопроизводительного скрининга, т.е. для автоматизированного тестирования или скрининга большого количества биологических образцов. Это имеет особое значение, например, для скрининга библиотек синтетических и натуральных продуктов при поиске активных веществ. Следовательно, устройства и способы настоящего изобретения пригодны для автоматизированного, экономически выгодного, высокопроизводительного тестирования биологических образцов или для скрининга лекарственных веществ и могут быть непосредственно использованы в широком спектре фармацевтических программ по разработке лекарственных веществ. В предпочтительном варианте осуществления лунки организованы в формате для высокопроизводительного скрининга, таком как 96-луночная планшета, или имеют другое регулярное двумерное расположение, такое как 1536- или 384-луночный формат. Для высокопроизводительного скрининга формат предпочтительно должен быть пригоден для автоматизации. Предпочтительным является, например, то, что автоматизированное устройство для использования, согласно вариантам осуществления, высокопроизводительного скрининга настоящего изобретения управляется компьютером или другим программируемым контроллером. Контроллер может постоянно отображать результаты каждого этапа процесса и может автоматически менять парадигму тестирования в ответ на эти результаты.
Обычно и в некоторых вариантах осуществления, например при высокопроизводительном скрининге лекарств, агенты-кандидаты предоставляются в виде “библиотек” или коллекций соединений, композиций или молекул. Такие молекулы обычно включают в себя соединения, известные в данной области техники, как “небольшие молекулы”, имеющие молекулярный вес, меньший чем 105 дальтон, предпочтительно меньше чем 104 дальтон и более предпочтительно меньше чем 103 дальтон. Агенты-кандидаты дополнительно могут быть предоставлены как члены комбинаторных библиотек, которые предпочтительно включают в себя синтетические агенты, полученные согласно множеству заданных химических реакций, выполняемых во множестве реакционных сосудов, которые, согласно настоящему раскрытию, могут быть представлены в виде лунок на устройстве для хранения. Например, различные начальные соединения могут быть получены путем использования одной или нескольких реакций твердофазного синтеза, запротоколированных методов произвольного смешивания и запротоколированных методов разделения реакционной смеси, которые позволяют подвергнуть данный компонент большому количеству преобразований и/или комбинаций реакционных состояний доступным для отслеживания способом. Получающиеся продукты содержат библиотеку, которая может быть скринирована с последующими итеративными процедурами отбора и синтеза, такую как синтетические комбинаторные библиотеки пептидов (см., например, PCT/US91/08694 и PCT/US91/04666) или другие композиции, которые могут включать в себя небольшие молекулы, как представлено в настоящем описании (см., например, PCT/US94/08542, EP 0774464, U.S. 5798035, U.S. 5789172, U.S. 5751629). Для специалистов в данной области техники является очевидным, что широкий спектр таких библиотек может быть получен согласно установленным процедурам при помощи устройства для хранения, как раскрыто в настоящем описании, и/или тестирован при помощи устройств и способов согласно настоящему раскрытию. Например, члены библиотеки тестируемых соединений могут быть введены во множество биологических образцов в каждой из множества лунок в устройстве для хранения образцов для использования в качестве матрицы для высокопроизводительного скрининга, как раскрыто в настоящем описании.
Лунки могут быть приспособлены для содержания биологического образца или биологического материала, находящегося в виде либо жидкого, либо сухого материала, либо находящего и в том и другом виде. Твердый материал матрицы, такой как, без ограничений, губкоподобный материал, двуокись кремния, порошок двуокиси кремния, кремнеземная фильтровальная бумага, абсорбирующий порошок, или фильтровальная бумага, или другой материал матрицы, как раскрыто в настоящем описании, может быть добавлен в лунки и может обеспечить введение биологического материала, без ограничения, путем абсорбции, адсорбции, специфического или неспецифического связывания или другого механизма прикрепления, включая механизмы, включающие в себя образование нековалентных и/или ковалентных химических связей и/или ассоциативные межмолекулярные взаимодействия, такие как гидрофобные и/или гидрофильные взаимодействия, образование водородных связей, электростатические взаимодействия и т.п. Материал матрицы может быть введен в процессе изготовления блока планшеты для образца, или он может быть прикреплен при помощи адгезивных взаимодействий или введен в лунки, или может быть введен в лунки до введения, совместно с введением, или после введения одного или нескольких биологических образцов в одну или несколько лунок. Ободок лунок может быть прямым или может иметь выступающие края. В некоторых вариантах осуществления выступающие края могут удерживать материал матрицы внутри лунок при помощи или без адгезивных взаимодействий. Хранение в жидком виде может обеспечиваться благодаря форме лунок в виде перевернутого конуса с небольшим отверстием на поверхности нижней планшеты. Форма перевернутого конуса позволяет удерживать жидкость внутри лунок, предотвращая ее выплескивание через край.
Крышка может быть либо плоской, либо может иметь выступы, которые вставляются в лунки нижней планшеты для образцов. Крышка и планшета для образцов закрываются либо благодаря точной подгонке планшеты для образцов и крышки, либо благодаря герметичной прокладке запорного элемента, либо прокладке из сжимаемого материала. Прокладка может быть размещена либо по периметру планшеты для образцов и крышки, либо вокруг каждой лунки. Прокладка может быть прикреплена к планшете для образцов или к крышке. Предпочтительно прокладка расположена на ободке или приклеена к крышке при помощи адгезивного материала. Герметичность может быть достигнута при помощи вставки точно подогнанных и выполняющих роль уплотнителей выступов крышки в лунки планшеты для образцов.
Планшета для образцов может быть соединена с крышкой при помощи системы петель, расположенных на одной из сторон блока для хранения, но петли также могут быть расположены на двух противоположных сторонах. Петля соединяет два блока и позволяет открывать и закрывать блок для хранения. Устройство может быть изготовлено из пластического материала, учитывая, что тип пластика может быть определен в зависимости от его применения. Петля или петли позволяют снимать крышку с планшеты для образцов.
Запирание крышки и планшеты для образцов для длительного хранения биологического материала в некоторых предпочтительных вариантах осуществления может достигаться благодаря силам магнитного притяжения, хотя также могут использоваться другие средства запирания крышки на планшете согласно другим вариантам осуществления, предусмотренным согласно настоящему раскрытию, включая, в качестве неограничивающих примеров, защелки, затворы, клейкие вещества, крюки и петли, резьбовые запорные элементы, соленоиды, запорные элементы в виде усеченного конуса, байонетные замки, рычажные запорные элементы, пряжки и т.п. или другие средства для запирания. Таким образом, в предпочтительном варианте осуществления планшета для образцов и крышка блока для хранения содержат магниты, которые могут быть в виде магнитного листа или в виде небольших магнитов, расположенных внутри планшеты для образцов и крышки устройства для хранения. Сила магнитного притяжения между планшетой для образцов и крышкой является достаточной, чтобы обеспечить плотную герметизацию планшеты для хранения, но не до такой степени, чтобы затруднить открывание или привести к искривлению или деформации планшеты для образцов при открывании крышки. Магнитный запорный элемент может быть использован для прикрепления других устройств для хранения к блоку для хранения, что позволяет выполнить обработку биологического материала до помещения его в блок для хранения. Сила магнитного притяжения блока для хранения может быть использована для прикрепления устройства для хранения к дополнительным устройствам ниже этого блока. Магнитные силы обеспечивают механизм соединения основного блока с другими блоками устройства.
Устройство для хранения предпочтительно содержит, по меньшей мере, один идентификатор и метку хранения данных, такую как радиочастотное устройство ретрансляции или “РЧ метку”, для использования в качестве части радиочастотного интерфейса для обмена данными между биологическим устройством для хранения образцов и реализованными на базе компьютера системами, раскрытыми в настоящем описании. Некоторые варианты осуществления предусматривают включение множества РЧ меток внутрь или на устройстве для хранения. Устройство для хранения, согласно некоторым вариантам осуществления, также может содержать визуально узнаваемые части. Различные лунки могут, например, быть пронумерованы и промаркированы при помощи гравировки номеров или букв на планшете для образцов или путем применения процесса печати. Необязательно, по меньшей мере, одна сторона планшеты для образцов может иметь штриховой код, прикрепленный или выгравированный на ее поверхности. Крышка устройства для хранения может иметь область для записи примечаний и комментариев любого вида. Кроме того, верхняя поверхность крышки может иметь штриховой код, повторяющий штриховой код планшеты для образцов. Двойной штриховой код обеспечивает однозначную идентификацию биологического материала и связь планшеты для образцов с крышкой. Многочисленные РЧ метки и/или многочисленные участки со штриховыми кодами могут обеспечивать механизм защиты в случае разъединения, повреждения или невозможности считывания по каким-либо другим причинам одного из таких идентификаторов/данных устройства для хранения.
Устройство для сухого хранения
Устройство для сухого хранения представляет собой применение устройства для хранения, как раскрыто в настоящем описании, которое содержит обработанный материал матрицы для использования в качестве материала матрицы для сухого хранения, такой как, без ограничений, губкоподобный материал, оксид кремния, порошок оксида кремния, кремнеземная фильтровальная бумага, абсорбирующий порошок, хлопок, шерсть, льняное полотно, полиэстер или фильтровальная бумага, а также включает материал матрицы, который растворяется или диссоциирует, как раскрыто в настоящем описании, для длительного хранения биологического образца или биологического материала, такого как, без ограничений, кровь, бактерии, клетки, вирусы, химические соединения (либо природного происхождения, либо полученные искусственно), плазмидная ДНК, фрагменты ДНК, олигонуклеотиды, пептиды, флуорогенные субстраты, геномная ДНК, продукты ПЦР, клонированная ДНК, белки, РНК, минералы или химические вещества. Эти и другие родственные варианты осуществления разработаны основываясь на наблюдении, что стабильное, длительное хранение биологических образцов и материалов может быть эффективным без охлаждения, если такие образцы или материалы погружают в подходящий материал матрицы, как материал матрицы, раскрытый в настоящем описании, включая растворимый (или диссоциируемый) материал матрицы. Следовательно, настоящее изобретение предоставляет устройства для стабильного, длительного хранения биологических образцов при обычных комнатных температурах окружающей среды (например, обычно 20-27°C, но изменяющихся в зависимости от географического местоположения, сезона и физического оборудования от примерно 15-19°C до примерно 28-32°C) для использования в способах и системах обработки данных образцов, раскрытых в настоящем описании.
В предпочтительных вариантах осуществления, которые используют устройство для сухого хранения, введение образца приводит к сухому хранению, например, при котором жидкий образец абсорбируется, или адсорбируется, или каким-либо иным способом захватывается материалом матрицы так, что после введения захваченная жидкость является легко заметной в материале матрицы или на ней, или жидкость легко удаляется из материала матрицы, и при котором в некоторых других вариантах осуществления материал матрицы может представлять собой растворимый материал матрицы или растворимый материал матрицы, который может быть высушен до, во время или после приведения в контакт с образцом для обеспечения сухого хранения. Таким образом, родственные предпочтительные варианты осуществления включают использование устройств для хранения образцов, как раскрыто в настоящем описании, которые содержат материал матрицы, выполненный с возможностью сухого хранения биологического образца или биологического материала без охлаждения, например при комнатной температуре окружающей среды. В некоторых родственных вариантах осуществления для эффективного введения образца в материал матрицы для сухого хранения может быть выполнен этап сушки, например при помощи сушки воздухом, сушки при повышенной температуре или возгонкой растворителя путем воздействия на введенный в материал матрицы образец пониженным давлением (например, лиофилизацией или другим способом вакуумной сушки) или сушки в мягком потоке несмешивающегося газа, такого как азот. Образцы предпочтительно хранят сухими в условиях, которые стабилизируют образец, т.е. при которых происходит незначительная или недетектируемая (например, статистически значимая) деградация или при которых происходят нежелательные химические или физические модификации образца, согласно критериям, которые могут изменять фактор природы хранимого образца, и которые по каким-либо причинам знакомы специалисту в данной области техники.
Некоторые варианты осуществления предоставляют композиции и способы хранения биологического материала (геномной ДНК, плазмидной ДНК, фрагментов ДНК, РНК, олигонуклеотидов, белков, пептидов, флуорогенных субстратов, клеток, вирусов, химических соединений и т.д.) на матрице, содержащей материал, который растворяется или диссоциирует в растворителе, который предоставляет возможность для полного восстановления или значительного восстановления (например, восстановления, по меньшей мере, на 50 процентов, предпочтительно, по меньшей мере, на 60 процентов, более предпочтительно, по меньшей мере, на 70 процентов, более предпочтительно, по меньшей мере, на 80 процентов и обычно в более предпочтительных вариантах осуществления, по меньшей мере, на 85 процентов, более предпочтительно, по меньшей мере, на 90 процентов, более предпочтительно, по меньшей мере, на 95 процентов, еще более предпочтительно, по меньшей мере, на 97, 98 или 99 процентов) сухого материала образца после гидратации, повторной гидратации или другого восстановления образца при помощи растворителя. Например, растворимая матрица может быть способна к солюбилизации в подходящем растворителе, который может быть выбран, исходя из свойств материала матрицы и/или образца в зависимости от конкретного используемого способа, и в некоторой степени который разрешает восстановление одного или нескольких желательных структурных и функциональных свойств образца (например, биологической активности). Аналогично в качестве другого примера материал матрицы может диссоциировать в растворителе и может, но не без необходимости, стать полностью солюбилизированным так, чтобы получилась дисперсия, суспензия, коллоидный гель, экстракт, взвесь, сироп и т.п.
В некоторых из этих и родственных вариантов осуществления первый растворитель, который используется для введения материала матрицы и/или биологического образца в устройство для хранения биологических образцов до этапа сушки для сухого хранения образца может быть таким же, как и второй растворитель, который по существу используется для гидратации, повторной гидратации, восстановления или ресуспендирования сухой комбинации образец/матрица, а в других вариантах осуществления второй растворитель может отличаться от первого. Критерии отбора подходящего растворителя для растворения или диссоциации материала матрицы и/или биологического образца, известные специалистам в данной области техники, основаны, например, на физико-химических свойствах конкретного используемого материала матрицы и образца и на структурных или функциональных свойствах (например, биологической активности), которые, желательно, должны сохраниться во время сухого хранения и при последующем восстановлении, а также на других факторах (например, совместимости с другими материалами устройства для хранения или оборудования для обработки в жидком виде, с требованиями безопасности и т.д.). Растворители могут быть выбраны, например, исходя из значения по шкале полярности/поляризуемости растворителей (SPP) по системе Catalan et al. (e.g., 1995 Liebigs Ann. 241; см. также Catalan, 2001 In: Handbook of Solvents, Wypych (Ed.), Andrew Publ., NY, и приведенные там ссылки), согласно которой, например, вода имеет значение SPP, равное 0,962, толуол - значение SPP, равное 0,655, и 2-пропанол - значение SPP, равное 0,848. Описаны способы определения значения SPP растворителя, основанные на измерениях в ультрафиолетовом свете 2-N,N-диметил-7-нитрофлуорен/2-фтор-7-нитрофлуорен проба/гомоморфная пара (Catalan et al., 1995). Растворители с желаемыми значениями SPP (либо в качестве чистых однокомпонентных растворителей, либо в качестве смеси растворителей из двух, трех, четырех или более растворителей; для совместимости растворителей см., например, Godfrey 1972 Chem. Technol. 2:359), исходя из свойств растворимости конкретного материала матрицы, могут быть легко определены специалистами в данной области техники, с точки зрения настоящего раскрытия.
Согласно неограничивающей теории растворимый или диссоциируемый материал матрицы, следовательно, может представлять собой полимерную структуру, которая при формировании матрицы образует трехмерное пространство, что позволяет биологическому образцу связываться с матрицей. Растворимый или диссоциируемый материал матрицы может быть использован для введения стабилизирующих агентов, таких как соли или буферы, в условиях дегидрирования (например, сухих или по существу в отсутствии растворителя). Матрица также позволяет регулировать pH и другие параметры для создания оптимальных условий для сушки и хранения и может содержать один или множество детектируемых индикаторов, как предусмотрено в настоящем описании, например цветные pH индикаторы и/или индикаторы влажности. В некоторых предпочтительных вариантах осуществления материал матрицы содержит поливиниловый спирт (ПВС), растворимый материал матрицы.
Согласно некоторым другим вариантам осуществления растворимый или диссоциируемый материал матрицы может представлять собой любой подходящий материал, имеющий совместимые характеристики для хранения конкретного типа биологического образца способом, который удовлетворительно сохраняет желательные структурные и/или функциональные свойства, причем указанные характеристики включают в себя возможность сушки таким способом, при котором формируется матрица, между узлами которой расположены представляющие интерес биологические молекулы, и также включают в себя совместимость подходящего растворителя (например, биологического буфера), дополнительно включая способность к повторному растворению или ресуспендированию после сухого хранения способом, при котором молекулы матрицы не интерферируют ни с одной, ни с несколькими представляющими интерес биологическими активностями представляющего интерес образца. Дополнительные неограничивающие примеры материала матрицы, который растворяется или диссоциирует в растворителе, включают в себя полиэтиленгликоль, агарозу, поли-N-винилацетамид, поливинилпирролидон, поли(4-винилпиридин), полифенилен оксид, обратимо сшитый акриламид, полиметакрилат, углеродные нанотрубки (например, Dyke et al., 2003 JACS 125:1156; Mitchell et al., 2002 Macromolecules 35:8825; Dagani, 2003 C&EN 81:5), полилактид, сополимер лактид/гликолид, сополимер гидроксиметакрилата, пектинат кальция, гидроксипропилметилцеллюлозы ацетата сукцинат (например, Langer, 1990 Science 249:1527; Langer, 1993 Accounts Chem. Res. 26:537-542), гепарин сульфат протеогликан, гиалуроновая кислота, глюкуроновая кислота (например, Kirn-Safran et al., 2004 Birth Defects Res. C. Embryo Today 72:69-88), тромбоспондин-1 N-терминальный гепаринсвязывающий домен (например, Elzie et al., 2004 Int. J. Biochem. Cell Biol. 36:1090; Pavlov et al., 2004 Birth Defects Res. C. Embryo Today 72:12-24), фибронектин (например, Wierzbicka-Patynowski et al., 2003 J Cell Sci. 116(Pt 16):3269-76), конъюгат пептид/водорастворимый полимерный модификатор (например, Yamamoto et al., 2002 Curr Drug Targets 3(2):123-30) и коллаген или фрагменты коллагена, включая коллагеновые пептиды базальных мембран (например, Ortega et al., 2002 J Cell Sci. 115(Pt 22):4201-14).
Другие детектируемые индикаторы включают композиции, которые позволяют детектировать (например, статистически значимо относительно подходящего контроля, как известно специалистам в данной области техники) или аналогичным образом определять любой детектируемый параметр, который имеет непосредственное отношение к условию, процессу, пути, индукции, активации, ингибированию, регуляции, динамической структуре, состоянию, контаминации, деградации или другой активности или функциональному или структурному изменению в биологическом образце, включая, без ограничений, изменение ферментативной (включая протеолитическую и/или нуклеолитическую), респираторной, метаболической, катаболической, связывающей, каталитической, аллостерической, конформационной или другой биохимической или биофизической активности в биологическом образце, а также включая взаимодействия между промежуточными соединениями, которые могут быть образованы в результате таких активностей, включая метаболиты, катаболиты, субстраты, предшественники, кофакторы и т.п.
В данной области техники известно большое количество детектируемых индикаторов, которые могут быть выбраны для включения в раскрытые в настоящем описании композиции и способы в зависимости от конкретного параметра или параметров, которые могут быть интересны для применения для хранения конкретных биологических образцов. Нелимитирующие примеры параметров, которые могут быть детектируемы такими детектируемыми индикаторами, включают в себя детектирование наличия одного или нескольких из амина, спирта, альдегида, воды, тиола, сульфида, нитрита, авидина, биотина, иммуноглобулина, олигосахарида, нуклеиновой кислоты, полипептида, фермента, цитоскелетного белка, реакционно-способных видов кислорода, иона металла, pH, Na+, K+, Cl-, цианида, фосфата, селена, протеазы, нуклеазы, киназы, фосфатазы, гликозидазы, микробиологического контаминанта и т.д.
Примеры широкого спектра детектируемых индикаторов (включая колориметрические индикаторы), которые могут быть выбраны для специфических целей, описаны у Haugland, 2002 Handbook of Fluorescent Probes and Research Products- Ninth Ed., Molecular Probes, Eugene, OR; in Mohr, 1999 J. Mater. Chem., 9:2259-2264; у Suslick et al., 2004 Tetrahedron 60:11133-11138; и в патенте США. № 6323039. (Также см., например, Fluka Laboratory Products Catalog, 2001 Fluka, Milwaukee, WI; и Sigma Life Sciences Research Catalog, 2000, Sigma, St. Louis, MO.) Детектируемый индикатор может представлять собой флуоресцентный индикатор, люминисцентный индикатор, фосфоресцентный индикатор, радиометрический индикатор, краситель, фермент, субстрат фермента, переносящую энергию молекулу или аффинную метку. В некоторых предпочтительных вариантах осуществления детектируемый индикатор может представлять собой одно или несколько из фенолового красного, этидиума бромида, ДНК-полимеразы, рестрикционной эндонуклеазы (например, рестрикционного фермента, используемого в качестве рестрикционной эндонуклеазы, такой как сайт- или последовательность-специфическая рестрикционная эндонуклеаза), хлорида кобальта (индикатора влажности, который изменяется от голубого цвета в присутствии воды до розового в сухом состоянии), красителя Рейхардта (Aldrich Chemical) и флуорогенного субстрата протеазы.
В некоторых вариантах осуществления детектируемый индикатор может содержать полимеразу для полинуклеотида и/или соответствующий олигонуклеотид, любой или оба из которых могут использоваться в качестве индикатора или, в некоторых вариантах осуществления, в качестве компонентов других основанных на нуклеиновых кислотах применениях композиций и способов, раскрытых в настоящем описании. Полимеразы (включая ДНК-полимеразы и РНК-полимеразы), полезные согласно некоторым вариантам осуществления настоящего изобретения, включают в себя, без ограничений, Thermus thermophilus (Tth) ДНК-полимеразу, Thermus aquaticus (Taq) ДНК-полимеразу, Thermologa neopolitana (Tne) ДНК-полимеразу, Thermotoga maritima (Tma) ДНК-полимеразу, Thermococcus litoralis (Tli или VENTTM) ДНК-полимеразу, Pyrococcus furiosus (Pfu) ДНК-полимеразу, DEEPVENTTM ДНК-полимеразу, Pyrococcus woosii (Pwo) ДНК-полимеразу, Bacillus sterothermophilus (Bst) ДНК-полимеразу, Bacillus caldophilus (Bca) ДНК-полимеразу, Sulfolobus acidocaldarius (Sac) ДНК-полимеразу, Thermoplasma acidophilum (Tac) ДНК-полимеразу, Thermus flavus (Tfl/Tub) ДНК-полимеразу, Thermus ruber (Tru) ДНК-полимеразу, Thermus brockianus (DYNAZYME.TM.) ДНК-полимеразу, Methanobacterium thermoautotrophicum (Mth) ДНК-полимеразу, ДНК-полимеразу микобактерий (Mtb, Mlep) и их мутанты, варианты и производные. Согласно настоящему изобретению также могут использоваться РНК-полимеразы, такие как T3, T5 и SP6 и их мутанты, варианты и производные.
Полимеразы, используемые согласно настоящему изобретению, могут представлять собой фермент, который может синтезировать молекулу нуклеиновой кислоты из темплаты нуклеиновой кислоты, обычно в направлении от 5' конца к 3' концу. Полимеразы нуклеиновых кислот, используемые в настоящем изобретении, могут быть мезофильными или термостабильными, и предпочтительно термостабильными. Предпочтительные термостабильные ДНК-полимеразы включают в себя T7 ДНК-полимеразу, T5 ДНК-полимеразу, фрагмента Кленова ДНК-полимеразы, ДНК-полимеразу III и т.п. Предпочтительные термостабильные ДНК-полимеразы, которые могут быть использованы в способах настоящего изобретения, включают в себя Taq, Tne, Tma, Pfu, Tfl, Tth, Stoffel фрагмент, VENTTM и DEEPVENTTM ДНК-полимеразы и их мутанты, варианты и производные (патент США № 5436149; патент США № 4889818; патент США № 4965188; патент США № 5079352; патент США № 5614365; патент США № 5374553; патент США № 5270179; патент США № 5047342; патент США № 5512462; WO 92/06188; WO 92/06200; WO 96/10640; Barnes, W. M., Gene 112:29-35 (1992); Lawyer et al., PCR Meth. Appl. 2:275-287 (1993); Flaman et al., Nucl. Acids Res. 22(15):3259-3260 (1994)).
Другие детектируемые индикаторы для использования в некоторых вариантах осуществления, рассмотренные в настоящем описании, включают аффинные реагенты, такие как антитела, лектины, белки иммуноглобулинового Fc-рецептора (например, белок A, белок G или другие Fc-рецепторы Staphylococcus aureas), авидин, биотин, другие лиганды, рецепторы или контррецепторы или их аналоги или миметики и т.п. Для таких аффинных способов могут быть получены реагенты для иммунометрических измерений, такие как меченные соответствующим способом антитела и лектины, например реагенты, меченные радионуклидами, флуорофорами, аффинными тагами, биотином или последовательностями-миметиками биотина или таковыми, полученными в виде коньюгатов антитело-фермент (см., например, Weir, D.M., Handbook of Experimental Immunology, 1986, Blackwell Scientific, Boston; Scouten, W.H., Methods in Enzymology 135:30-65, 1987; Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988; Haugland, 2002 Handbook of Fluorescent Probes and Research Products- Ninth Ed., Molecular Probes, Eugene, OR; Scopes, R.K., Protein Purification: Principles and Practice, 1987, Springer-Verlag, NY; Hermanson, G.T. et al., Immobilized Affinity Ligand Techniques, 1992, Academic Press, Inc., NY; Luo et al., 1998 J. Biotechnol. 65:225 и приведенные там ссылки).
Растворимая (или диссоциируемая) матрица может быть применима для контейнеров для хранения биологических образцов, например, путем приведения в контакт или путем введения материала матрицы, который растворяется или диссоциирует в растворителе, в одну или во множество лунок для образцов устройства для хранения, как раскрыто в настоящем описании. Например, растворимый материал матрицы может легко прилипать к пробиркам или планшетам, изготовленным из стекла или пластика, такого как полипропилен, полистирен, или другого материала. Растворимый материал сушат, что может быть выполнено в виде неограничивающего примера способа сушки воздухом при температуре окружающей среды (обычно в пределах 20°C-30°C, например при 22°C, 23°C, 24°C, 25°C) и/или сушки при соответствующим образом повышенной температуре, и/или при пониженном давлении (например, под частичным или полным вакуумом), и/или под соответствующим потоком газа, такого как отфильтрованный воздух, CO2, или инертного газа, например азота или другого подходящего для сушки газа, или другим способом сушки. После этапа сушки, который может представлять собой сушку до полностью сухого состояния (например, статистически значимое, полное или по существу полное удаление детектируемого растворителя) или неполную сушку, растворимый/диссоциируемый материал матрицы легко акцептирует биологический образец, предназначенный для хранения.
Биологический материал, предоставленный или полученный из биологического образца, также может быть добавлен в лунки или пробирки в комбинации с матрицей для хранения в жидком виде (например, путем одновременного приведения в контакт лунки для образцов с образцом и матрицей, растворенной или диссоциированной в растворителе), что позволяет проводить сушку биологического материала и материала матрицы в одно и то же время. В предпочтительных вариантах осуществления растворимая матрица не интерферирует с биохимическими реакциями так, что перед дальнейшей обработкой образца могут быть не нужны этапы очистки для отделения матрицы от биологического образца, например, до проведения биохимических реакций, таких как для анализа и т.п., в лунках устройства для хранения образцов.
В растворимой матрице буферные условия могут быть подобраны таким образом, чтобы больше, по меньшей мере, 90 процентов, предпочтительно больше 95 процентов, более предпочтительно больше 96, 97, 98 или 99 процентов, биологической активности (например, ферментативной или аффинной активности, или структурной целостности или другой биологической активности, как раскрыто в настоящем описании и которые известны в данной области техники) биологического образца сохранилось при воссоздании растворителя (например, повторной гидратации водой), исключая необходимость тщательного удаления образца из контейнера для хранения и переноса его в реакционный буфер в отдельном контейнере. Некоторые такие варианты осуществления соответственно предоставляют неожиданные преимущества, заключающиеся в исключении необходимости проведения аликвотирования и/или калибровки некоторых биологических реагентов по отдельности каждый раз при проведении анализа сохраненного образца.
Растворимая/диссоциируемая матрица также может быть приготовлена в устройстве для хранения образцов таким образом, чтобы одна или несколько лунок содержали, по меньшей мере, один ингибитор, который представляет собой биологический ингибитор или биохимический ингибитор, причем такие ингибиторы включают в себя любой агент, который, по желанию, может быть включен для сохранения, стабилизации, поддержания, протективности или каким-либо иным способом восстановления из устройства для хранения биологических образцов биологического образца, который по существу имеет такую же биологическую активность, которая была до этапа приведения в контакт образца с устройством для хранения образцов. Следовательно, в некоторых предпочтительных вариантах осуществления устройство для хранения биологических образцов содержит, по меньшей мере, один ингибитор, например противомикробный агент, такой как (без ограничений) противогрибковый и/или антибактериальный агент, способный подавлять рост бактерий или грибков, ингибировать микробную контаминацию лунок и сохранять образец в период длительного хранения.
В некоторых вариантах осуществления ингибитор может представлять собой восстанавливающий агент, алкилирующий агент, противомикробный агент, ингибитор киназы, ингибитор фосфатазы, ингибитор каспазы, ингибитор гранзима, ингибитор клеточной адгезии, ингибитор клеточного деления, ингибитор клеточного цикла, ингибитор передачи липидных сигналов и/или ингибитор протеазы. Специалистам в данной области техники известен широкий спектр легко доступных ингибиторов, которые могут быть выбраны, в зависимости от природы представляющего интерес биологического образца и конкретной биологической активности. См., например, Calbiochem® Inhibitor SourceBookTM (2004, EMD Biosciences, La Jolla, CA). Для противомикробных агентов, см., например, Pickering, LK, Ed. 2003 Red Book: Report of the Committee on Infectious Diseases, 26th edition. Elk Grove Village, IL, pp. 695-97.; American Academy of Pediatrics, 1998, Pediatrics, 101(1), supplement; Disinfection Sterilization and Preservation, Seymour S. Block (Ed.), 2001 Lippincott Williams & Wilkins, Philadelphia; Antimicrobial Inhibitors, A.I. Laskin and H. A. Lechevalier, (Eds.), 1988 CRC Press, Boca Raton, FL; Principles and Practice of Disinfection, Preservation and Sterilization, A.D. Russell et al., (Eds.), 1999, Blackwell Science, Malden, MA; Antimicrobial/anti-infective materials, S.P. Sawan et al., (Eds.), 2000 Technomic Pub. Co., Lancaster, PA; Development of novel antimicrobial agents: emerging strategies, K. Lohner, (Ed.), 2001 Wymondham, Norfolk, UK; Conte, J.E. Manual of antibiotics and infectious diseases (9th Ed.), 2001, Lippincott Williams & Wilkins, Philadelphia.
В некоторых вариантах осуществления ингибитор может представлять собой фунгицидный валидамицин A (Research Products International Corp., Mt. Prospect, IL, catalog no. V21020), ингибитор TL-3 протеазы (Lee et al., 1998 Proc. Nat. Acad. Sci. USA 95:939; Lee et al., 1999 J. Amer. Chem. Soc. 121:1145; Buhler et al., 2001 J. Virol. 75:9502), ортованадат натрия, фторид натрия, N-α-тозил-Phe-хлорметилкетон, N-α-тозил-Lys-хлорметилкетон, апротинин, фенилметилсульфонил фторид или диизопропил-фторфосфат.
Как раскрыто в настоящем описании, дополнительное преимущество растворимой матрицы заключается в том, что контейнер для хранения может использоваться непосредственно как реакционная камера после растворения матрицы и повторной гидратации материала. Стабильность и активность белков в жидком виде может зависеть от необходимых условий для активности, например, pH, концентрации солей и кофакторов. В некоторых случаях стабильность многих белков может быть чрезвычайно изменчивой при повышенных температурах, и, следовательно, сушка белков при температуре окружающей среды (например, комнатной) может обеспечивать стабилизацию среды.
Также, как раскрыто в настоящем описании в примерах, наличие трегалозы, которая, как утверждается, способствует стабилизации биологических образцов (например, Garcia de Castro et al., 2000 Appl. Environ. Microbiol. 66:4142; Manzanera et al., 2002 Appl. Environ. Microbiol. 68:4328), в некоторых случаях было недостаточным для поддержания восстановления ферментативной активности в белках после сухого хранения. Как кратко описано в разделе “Область техники, к которой относится изобретение”, трегалоза представляет собой природный субстрат трегалазы, фермента, который расщепляет дисахариды. Трегалоза известна как стабилизирующая органический материал, такой как белки, но ее присутствие в условиях, близких к оптимальным, может быть неблагоприятным для длительного хранения белков при температуре окружающей среды, поскольку она представляет собой природный источник энергии для грибков и бактерий. Контаминация бактериями или грибками биологических образцов, хранящихся в присутствии трегалозы в условиях, худших, чем оптимальные условия для сухого хранения, будет приводить к росту микробов одного вида или разных видов, и в результате может происходить нежелательная микробная контаминация хранящегося образца. Валидамицин представляет собой ингибитор трегалозы, имеющий химическую структуру, слегка отличающуюся от структуры трегалозы. Валидамицин является нетоксичным фунгицидом, который ингибирует рост грибков, блокируя ферментативную активность трегалозы. Как раскрыто в настоящем описании и в примерах, валидамицин А способен стабилизировать биологический материал при температурах окружающей среды. Дополнительно к протективному эффекту при длительном хранении биологического материала валидамицин также может защищать хранящийся материал от контаминации микроорганизмами.
Следовательно, некоторые варианты настоящего изобретения специально рассматривают устройство для хранения биологических образцов, которое не включает трегалозу в качестве компонента лунки для образцов или материала матрицы, и аналогично некоторые варианты осуществления могут специально исключать из лунки для образцов или материала матрицы наличие полистирена и/или гидроксиэктоин. Однако в виду неочевидных преимуществ, раскрытых в настоящем описании, поскольку они относятся к включению в устройство для хранения биологических образцов валидамицина (например, валидамицина A) в качестве ингибитора, некоторые другие варианты осуществления, рассматриваемые в настоящем описании, могут включать одно или несколько из трегалозы, гидроксиэктоина и/или полистирена. Согласно не ограничивающей теории валидамицин A, ингибитор трегалозы, известный в сельском хозяйстве как фунгицид, обеспечивает удивительный стабилизирующий эффект, если его использовать в комбинации с растворимой матрицей в устройствах для хранения биологических образцов, как раскрыто в настоящем описании. В качестве альтернативы или дополнительно к использованию валидамицина, как раскрыто в настоящем описании, вместе с растворимой матрицей другие небольшие молекулы, которые имеют активность, как ингибиторы или активаторы трегалозы, также могут быть включены в устройства для хранения в качестве ингибиторов или добавок в материал матрицы и/или в образец, включая природные дисахариды, псевдосахара, которые также известны как карба-сахара, и/или другие ингибиторы/активаторы трегалозы. Кроме того, валидамицин обеспечивает преимущество согласно некоторым вариантам осуществления, раскрытым в настоящем описании, тем, что он защищает среду для длительного хранения от грибковой, бактериальной контаминации или контаминации другого типа.
Другие не лимитирующие примеры материалов матрицы, которые могут быть использованы в качестве материалов матрицы для сухого хранения, включают материалы, которые содержат одно или несколько из следующего: поликарбоната, целлюлозы (например, целлюлозной бумаги, такой как FTATM бумага, Whatman Corp., Florham Park, NJ), ацетата целлюлозы, нитрата целлюлозы, нитроцеллюлозы, агарозы, сшитой агарозы, такой как 2,3- сшитой дибромпропанолом агарозы, 3,6-ангидро-L-галактозы, декстранов и других полисахаридов, включающих химически сшитые полисахариды, такие как сшитый эпихлоргидрином декстран или сшитый N,N'-метиленбисакриламидом декстран, борсиликатное стекло из микротрубочек, волоконное стекло, асбест, полимеры и пластики, такие как полипропилен, полистирен, поливинилиден фторид (PVDF), найлон, полисульфон, полиэтерсульфон, политетрафторэтилен и производные этих материалов (например, U.S. 5496562), а также другие аналогичные материалы, которые известны в данной области техники, или которые легко могут быть определены, как подходящие для использования в устройствах и способах, раскрытых в настоящем описании. См. также, например, патенты США №№ 5089407, 4891319, 4806343 и 6610531.
Материал матрицы может быть обработан для хранения и консервации биологических материалов. Документально подтверждено, что подбор буферных условий и добавок химических веществ и ферментов и других реагентов может стабилизировать ДНК и РНК (например, Sambrook et al., 1989; Current Protocols, Nucleic Acid Chemistry, Molecular Biology, Wiley and Sons, 2003), белки и другие биологические материалы (например, кровь, ткань, жидкости тела) от деградации ферментами, протеазами и факторами окружающей среды (например, Current Protocols, Protein Sciences, Cell Biology, Wiley and Sons, 2003). Может быть применен способ, который объединяет некоторые химические компоненты и полезные эффекты. Различные химические компоненты могут включать в себя, без ограничений, додецилсульфат натрия (SDS), диэтилпирокарбонат, трис-буфер, буфер трис-ЭДТА (TE), буфер хлорид натрия/цитрат натрия (SSC), буфер MOPS/ацетат натрия/ЭДТА (MOPS), этилендиаминтетрауксусную кислоту (ЭДТА), буфер ацетата натрия при физиологическом pH, гуанидин тиоционат, этилендиаминтетрауксусную кислоту (ЭДТА), человеческий плацентарный ингибитор рибонуклеазы, телячий ингибитор рибонуклеазы, ингибитор рибонуклеазы свиньи, диэтилпирокарбонат, этанол, формамид, гуанидин тиоционат, комплекс ванадил-рибонуклеозид, макалоид, этилендиаминтетрауксусную кислоту (ЭДТА), протеиназу K, гепарин, гидроксиламин-кислород-медный ион, бентонит, сульфат аммония, дитиотрейтол (DTT), бета-меркаптоэтанол или специфическое ингибирование антител.
Каждая лунка содержит от примерно 5 мкл до примерно 100 мкл материала жидкого образца, предпочтительно от примерно 10 мкл до примерно 30 мкл материала жидкого образца. Количество образца может меняться от примерно 0,01 мкг до примерно 1000 мкг ДНК, РНК, белка, крови, мочевины, вирусов, бактерий, клеток, тканей, клеточного экстракта, тканевого экстракта, метаболитов, химических веществ или других материалов. Образцы вводят непосредственным нанесением, и нанесение может быть автоматизировано. Для лунок с образцами может быть предусмотрен цветной индикатор, который изменяет цвет, указывая на то, что лунка занята. Изменение цвета может происходить путем добавления цветного агента. Например, краситель понко красный, нитразин желтый, бром-тимол синий, бромкрезол зеленый, метиловый оранжевый, конго красный, бромхлорфенол может быть внесен одновременно, до или после материала образца, или при обработке материала матрицы до или после внесения материала образца в лунку. Может использоваться pH-зависимый цветной реагент, который изменяет цвет после внесения образца с биологическим pH от 6,5 до 8,5 в матрицу внутри лунки. Лунки с образцами сушат в пределах от примерно 1 до примерно 20 минут при температуре окружающей среды или в пределах от примерно 0,1 до примерно 10 минут при повышенных температурах. ДНК может повторно восстанавливаться путем повторной гидратации лунки вплоть до примерно 50-80 раз. Реагент повторной гидратации может представлять собой раствор или буфер для образца с биологическим pH 6,5-8,5, трис-буфер, буфер трис-ЭДТА (TE), буфер хлорид натрия/цитрат натрия (SSC), буфер MOPS/ацетат натрия/ЭДТА (MOPS), буфер с ацетатом натрия. Конструкция устройства для сухого хранения является применимой без дополнительных модификаций для хранения очищенной геномной ДНК из бактерий, дрожжей, человека, животных, растений и других источников. Дополнительные модификации, такие как, без ограничений, нанесение фильтров с денатурирующими агентами для протеаз, также могут быть использованы в устройстве для сухого хранения для образцов бактерий, буккальных мазков, тканей биопсии, семенной жидкости, мочи, крови, белков и других образцов.
Родственные варианты осуществления относятся к наборам, которые содержат устройство для хранения биологических образцов, как раскрыто в настоящем описании, одно или с одним или несколькими дополнительными реагентами, которые могут быть по желанию выбраны для использования. Наборы также необязательно могут включать в себя ящик, чемоданчик, сосуд, цилиндрический контейнер, выдвижной ящик, камеру, картонный ящик, поддерживающее или несущее приспособление, ручку, стойку, лоток, поддон, резервуар, сумку, чехол, тару, корпус и т.п., например, в виде любого подходящего контейнера. Дополнительные реагенты могут включать в себя один или несколько растворителей или буферов, как раскрыто в настоящем описании и известно в данной области техники, и в некоторых вариантах осуществления могут включать в себя буфер восстановления активности.
Буфер восстановления активности может содержать растворитель или раствор в жидком виде, включая концентрат или один или несколько сухих ингредиентов, которые при восстановлении, растворении и/или диссоциации с одним или несколькими соответствующими растворителями (например, обычно водой или, в качестве альтернативы, спиртом, таким как метанол, этанол, n-пропанол, изопропанол, бутанол и т.д., органическим растворителем, таким как диметилсульфоксид, ацетонитрил, фенол, хлороформ и т.д. или другим растворителем) в качестве подходящего для заданного использования дают в результате жидкость, которая соответствует желательному использованию биологического образца, такому как определение функциональных или структурных характеристик одного или нескольких компонентов образца.
Неограничивающие примеры такого использования могут включать определение одной или нескольких ферментативных активностей, определение взаимодействий межмолекулярного связывания, определение наличия специфического полинуклеотида, или аминокислотной последовательности, или иммунологически определяемого эпитопа, или структуры определенного олигосахарида, детектирование конкретных вирусов, или микробных клеток, или человеческих, или животных клеток, определение конкретных метаболитов или катаболитов и т.д., все из которых могут быть выполнены при помощи условий, которые определены и известны специалистам в данной области техники, включая соответствующие условия, которые могут быть обеспечены посредством приведения в контакт образца с подходящим буфером восстановления активности.
Устройство для жидкого хранения
Устройство для хранения может быть модифицировано для жидкого хранения образцов посредством одного или нескольких изменений в конструкции лунки. Кросс-контаминация лунок в результате разбрызгивания при открывании и закрывании лунок исключается благодаря конструкции, в которой предусмотрены небольшие отверстия в верхней части лунки, при этом жидкость в лунке удерживается при помощи сил поверхностного натяжения.
Небольшое отверстие в верхней части лунки может быть обеспечено благодаря конструкции в виде перевернутого конуса или благодаря гибким клапанам, выступающим из верхней части каждой лунки в открытое пространство, уменьшая отверстие каждой лунки. Устройство для жидкого хранения изготавливают литьевым прессованием, или оно может быть изготовлено в виде одной части или двух частей аналогично устройству для хранения. Устройство для жидкого хранения выдерживает температуры в пределах -80°C - примерно 100°C.
Блок с одним рядом лунок
Все устройства и применения, раскрытые в настоящем изобретении, могут быть использованы в формате, при котором лунки расположены в один ряд в виде полосы с 1, 4 или 8 лунками. Модуль с одним рядом лунок имеет такой же или аналогичный общий вид сверху, что и устройство для хранения. Это позволяет хранить меньшее количество образцов, чем в блоке 96 луночной планшеты. Блочная конструкция предусматривает крепление полос с лунками к тонкой основной платформе. Одна полоска может содержать любое количество лунок из 1, 4 или 8. Полоски могут быть прикреплены к тонкой основной платформе либо при помощи сил магнитного притяжения, либо при помощи скоб, расположенных на конце полос. Высота одной полоски, включая толщину основной планшеты, равна стандартному основному модулю для хранения, что позволяет закрывать устройство крышкой модуля.
Устройство повышенного давления
Устройство повышенного давления настоящего изобретения состоит из нескольких модулей, которые включают ранее описанное устройство для хранения, блок фильтрования, блок планшеты повышенного давления и систему сжатого воздуха. Все блоки имеют одинаковые размеры, равные стандартной 96-ти луночной, 384-х луночной или 1535-ти луночной планшете для биологических образцов. Размеры устройства повышенного давления составляют от примерно 2 мм до примерно 25 мм в высоту, от 80 мм до 200 мм в длину и от примерно 60 мм до примерно 150 мм в ширину. Устройство повышенного давления предпочтительно имеет высоту от примерно 3 мм до примерно 20 мм, длину от примерно 100 мм до примерно 140 мм и ширину от примерно 60 мм до примерно 100 мм, но также может быть меньших размеров, для размещения меньшего количества образцов или систем с меньшими размерами. Все модули могут менять размеры в зависимости от размера устройства для хранения образцов, с учетом того, что количество лунок может составлять от 1 лунки на планшете для образцов вплоть до десятков и тысяч. Наиболее предпочтительно, если на планшете для образцов может быть предусмотрено 96 или 384 лунок, что соответствует каждому блоку повышенного давления планшеты. Количество лунок для образцов в каждом устройстве повышенного давления также может быть разделено на группы по 1, 4 и 8 лункам, которые могут вставляться в стандартное устройство для хранения образцов, описанное в настоящем изобретении. Устройство повышенного давления изготавливают из цветного пластического материала, или из металла, или из комбинации пластического материала и металла. Корпус устройства повышенного давления и его блоки изготавливают литьевым прессованием или с использованием станочных инструментов или их комбинацией.
Блок фильтрования может быть прикреплен к устройству повышенного давления, устройству для хранения образцов и любому другому устройству, раскрытому в настоящем описании, при помощи сил магнитного притяжения. Может быть предусмотрена дополнительная пряжка для противостояния давлению воздуха во время работы. Блок фильтрования может быть изготовлен из цветного твердого материала, такого как полипропилен, акриловый полимер, и содержать бумагу или твердую матрицу для фильтрования. Предпочтительно блок фильтрования имеет толщину от примерно 1 мм до примерно 15 мм в зависимости от субстрата, используемого для фильтрования. Блок фильтрования имеет соответствующее количество отверстий/щелей, которые расположены точно над устройством для хранения и содержит 96, 384, 1536 или больше отверстий для образцов. Каждый блок фильтрования имеет свою собственную плотно закрывающуюся крышку. Ободок пор может быть либо прямым, либо может иметь выступающие края. Выступающие края могут удерживать материал матрицы внутри пор при помощи или без адгезивных взаимодействий.
Каждая пора внутри блока фильтрования может содержать материал матрицы, такой как, без ограничений, губкообразный материал, оксид кремния, абсорбирующий порошок и фильтровальную бумагу для фильтрования биологического материала, такого как, без ограничений, бактерии, геномная ДНК, митохондриальная ДНК, продукты ПЦР, клонированная ДНК, белки, РНК, белки, минералы или химические соединения. Матрицы могут быть выбраны для поддержания обработки биологических образцов, например, в качестве иллюстрации, а не ограничения, одной или нескольких очисток ДНК, амплификации при помощи ПЦР, фракционирования образцов по размеру (например, на основании молекулярного размера или размера клеток), обработки сыворотки, обработки крови, очистки белков и сортирования клеток. Материалы матрицы могут быть введены либо в процессе изготовления планшеты для образцов, либо прикреплены при помощи адгезивных взаимодействий, либо введены внутрь поры. Матрицы изготавливают при помощи стандартной технологии, необходимой для изготовления фильтров для фракционирования по размеру, или обработанного материала для уменьшения или удержания нежелательных биологических фракций (например, Current Protocols, Molecular Biology, Wiley and Sons, 2003). Материалы матрицы также могут быть обработаны антителами, лектинами, молекулами, обладающими другой аффинностью или зарядоселективными, ион-селективными, селективными относительно группы, (например, амино- или карбоксил-функциональными группами), гидрофобными, гидрофильными молекулами или молекулами с другим видом селективности или т.п. для удержания фракций материала образца, и/или небольшими химическими фрагментами, предоставляющими желательные биологические или химические функции или функциональные группы (см., например, Current Protocols in Molecular Biology, John Wiley and Sons, 2003; Scopes, R.K., Protein Purification: Principles and Practice, 1987, Springer-Verlag, NY; Weir, D.M., Handbook of Experimental Immunology, 1986, Blackwell Scientific, Boston; и Hermanson, G.T. et al., Immobilized Affinity Ligand Techniques, 1992, Academic Press, Inc., California). Материалы матрицы могут быть заранее обработаны для сохранения биологического материала путем подбора буферных условий и путем модификации химических добавок, стабилизаторов или разлагающих веществ (например, Sambrook et al., 1989; Current Protocols, Nucleic Acid Chemistry, Protein Science, Molecular Biology, Cell Biology, Wiley and Sons, 2003). Каждая пора может обрабатывать от примерно 5 мкл до примерно 1000 мкл объема образца. Количество образца может изменяться от примерно 0,1 мкг ДНК до примерно 1000 мкг ДНК, РНК, белка, крови, мочи, вирусов, бактерий, клеток, ткани, клеточного экстракта, тканевого экстракта, метаболитов, химических соединений или других материалов. Нанесение образцов осуществляется при помощи непосредственного точечного нанесения или может быть автоматизировано.
Блок планшеты повышенного давления использует давление воздуха сверху на поры блока фильтрования и продавливает образцы через матрицу в лунку устройства для хранения, расположенного ниже. Может использоваться давление лабораторной системы сжатого воздуха или из баллона со сжатым воздухом. Блок повышенного давления может использоваться для введения образца при помощи избыточного давления реагентов в лунки устройства для хранения, устройства ПЦР, устройства секвенирования, устройства для рестрикционного анализа, устройства белковой кристаллографии, диагностического устройства и луночного стрипового устройства. В блоке повышенного давления предусмотрены поры, соединенные со всеми порами воздухозаборного устройства. Воздухозаборное устройство прикреплено к клапану, который имеет герметичное уплотнение, соединяющее блок планшеты повышенного давления с источником сжатого воздуха. Блок повышенного давления прикрепляется к источнику воздуха при помощи вращающегося поворотного и защитного клапана. Клапан также может быть прикреплен к индикатору давления, показывающему необходимое давление для каждого конкретного блока фильтрования.
Все блоки устройства повышенного давления, раскрытые в настоящем описании, предпочтительно являются герметичными для достижения герметичности, которая выдерживает давление, требуемое для продавливания образца через систему фильтрования в лунки устройства для хранения. Каждый блок может быть плоским или иметь выступы, которые точно соответствуют примыкающему блоку. Герметичная насадка образуется при помощи прокладки или подстилающего слоя из сжимаемого материала. Прокладка может быть размещена по периметру каждого блока или вокруг каждой отдельной лунки. Предпочтительно прокладка расположена на ободке или прикреплена к крышке при помощи адгезивного материала. Герметичная насадка может быть получена при помощи вставки выступов из каждого блока в виде точного уплотнителя в блоке, или она может быть прикреплена снизу.
Скрепление всех модулей, включая блок повышенного давления, блок фильтрования и устройство для хранения предпочтительно достигается при помощи сил магнитного притяжения (но в качестве альтернативы, в этих и других вариантах осуществления устройств, которые следуют ниже, могут быть использованы другие запорные средства, как раскрыто в настоящем описании). Каждый блок содержит магниты либо в виде магнитного листа, либо в виде небольших магнитов. Силы магнитного притяжения между каждым из блоков достаточно сильны для предоставления герметичного уплотнения для обработки биологического материала до помещения его в устройство для образцов или другое устройство. Силы магнитного притяжения трех независимых блоков (блока давления, блока фильтрования и блока устройства для хранения) могут быть дополнительно застрахованы при помощи пряжек. Пряжки могут быть изготовлены из металла или пластического материала, который формируется для скрепления вместе трех модулей и для усиления механизма магнитного притяжения. Пряжка предпочтительно имеет размеры меньше, чем стороны блока фильтрования. Пряжки могут быть прикреплены путем приложения внешнего давления, которое открывает пряжку, или пряжки могут быть разработаны таким образом, чтобы скользить по внешней стороне модуля фильтрования. Для укрепления блока фильтрования могут использоваться две или более пряжек.
Каждый модуль имеет визуально опознаваемые части. Различные лунки могут быть пронумерованы и промаркированы путем выполнения гравировки номеров и букв на планшете для образцов или при помощи аппликации в процессе печати.
Портативное устройство ПЦР
Планшета для образцов может быть прикреплена к блоку термоциклирования (устройство ПЦР) при помощи сил магнитного притяжения. Планшета для образцов и устройство ПЦР содержат магниты либо в виде магнитного листа, либо в виде небольших магнитов, расположенных внутри планшеты для образцов. Силы магнитного притяжения между планшетой для образцов и устройством ПЦР обеспечивают точное размещение и плотное прикрепление планшеты для образцов к устройству ПЦР.
Устройство ПЦР содержит температурную платформу с отпечатком устройства для хранения. Устройство ПЦР генерирует температуры в пределах от примерно 4°C до примерно 100°C. Устройство ПЦР содержит вычислительный компонент, который может быть запрограммирован для протоколов с повторяющимися циклами, которые содержат большое количество температур, различное время удержания температур и многочисленные изменения температуры, которые могут находиться в пределах от 4°C до 100°C и которые удовлетворяют требованиям стандартных условий и условий горячего старта ПЦР амплификации (например, Qiagen “Taq PCR Handbook”, Qiagen “Critical Factors for Successful PCR”). Блок ПЦР может содержать встроенную нагреваемую крышку или покрытие, которое поддерживает и генерирует постоянные температуры вплоть до примерно 100°C. Крышка или покрытие могут быть изготовлены из металла или аналогичного материала и размещены или удерживаются на месте при помощи магнитных сил сверху планшеты для образцов. Энергия, предоставляемая для этого блока ПЦР, может подаваться от стандартной 110/220 В розетки питания, от блока батарей или от солнечного источника энергии.
Блок реагентов ПЦР
Блок реагентов ПЦР содержит все реагенты, необходимые ПЦР амплификации. Он может включать в себя реагенты, такие как, без ограничений, буферы, праймеры, полимеразные ферменты и дезоксинуклеотиды (например, Qiagen “Taq PCR Handbook”, Qiagen “Critical Factors for Successful PCR”). Реагенты предоставляют в 96, 384 или 1536-ти луночном формате или формате с большим количеством лунок, который соответствует формату и размерам планшеты для образцов. Размеры блока реагентов ПЦР составляют от примерно 2 мм до примерно 25 мм в высоту, от примерно 80 мм до примерно 200 мм в длину и от примерно 60 мм до примерно 150 мм в ширину. Предпочтительно блок реагентов ПЦР имеет высоту от примерно 3 мм до примерно 15 мм, длину от примерно 100 до примерно 140 мм и ширину от примерно 60 мм до примерно 100 мм. Блок реагентов ПЦР изготовлен из цветного полипропилена и содержит 96, 384, 1536 или более лунок для образцов. Блок реагентов ПЦР изготавливают литьевым прессованием.
Магнитные силы представляют собой механизм соединения планшеты для образцов с блоком реагентов ПЦР. Планшета для образцов и блок реагентов ПЦР содержат магниты предпочтительно в виде магнитного листа или небольших магнитов, расположенных на внутренней стороне планшеты для образцов. Силы магнитного притяжения между планшетой для образцов и блоком реагентов ПЦР обеспечивают точное расположение и плотное прикрепление планшеты для образцов к блоку реагентов ПЦР.
Блок реагентов ПЦР может иметь различные конструкции. Каждая лунка для образцов может иметь или может не иметь выступающие края, которые проникают в лунки планшеты для образца. Может потребоваться дополнительное давление воздуха, прикладываемое при помощи устройства повышенного давления, для перенесения реагентов из блока реагентов ПЦР в планшету для образцов.
Блок реагентов для секвенирования
Блок реагентов для секвенирования содержит все реагенты, необходимые для секвенирования ДНК или циклического секвенирования ДНК. Он может включать в себя реагенты, такие как, без ограничений, буферы, праймеры, ферменты для секвенирования, дезоксинуклеотиды и дидезоксинуклеотиды (например, Nucleic Acid Chemistry, Molecular Biology, Wiley and Sons, 2003). Реагенты предоставляют в 96, 384 или 1536 луночном формате или формате с большим количеством лунок, который соответствует формату и размерам планшеты для образцов. Размеры блока реагентов для секвенирования составляют примерно 2 мм - примерно 25 мм в высоту, примерно 80-200 мм в длину и примерно 60 мм - примерно 150 мм в ширину. Предпочтительно блок реагентов для секвенирования имеет высоту 3-15 мм, длину примерно 100 мм - примерно 140 мм и ширину примерно 60 мм - примерно 100 мм. Блок реагентов для секвенирования изготовлен из цветного полипропилена и содержит 96, 384, 1536 или более лунок. Блок реагентов для секвенирования производят литьевым прессованием.
Силы магнитного притяжения представляют собой механизм соединения планшеты для образцов с блоком реагентов для секвенирования. Планшета для образцов и блок реагентов для секвенирования содержат магниты предпочтительно в виде магнитного листа или в виде небольших магнитов, расположенных на внутренней стороне планшеты для образцов. Силы магнитного притяжения между планшетой для образцов и блоком реагентов для секвенирования обеспечивают точное размещение и плотное прикрепление планшеты для образцов к блоку реагентов для секвенирования.
Блок реагентов для секвенирования может иметь различные конструкции. Каждая лунка для образцов может иметь или может не иметь края, выступающие в лунки планшеты для образцов. Для переноса реагентов из блока реагентов для секвенирования в планшету для образцов может потребоваться давление воздуха, прикладываемое устройством повышенного давления.
Блок реагентов для удлинения праймеров
Блок реагентов для удлинения праймеров содержит все реагенты, необходимые для удлинения праймеров. Он может включать реагенты, такие как, без ограничений, буферы, праймеры, полимеразный фермент, дезоксинуклеотиды и дидезоксинуклеотиды (например, Current Protocols, Nucleic Acid Chemistry, Molecular Biology, Wiley and Sons, 2003). Реагенты предоставляют в 96, 384 или 1536 луночном формате или формате с большим количеством лунок, который соответствует формату и размерам планшеты для образцов. Размеры блока реагентов для удлинения праймеров составляют примерно 2-25 мм в высоту, примерно 80-200 мм в длину и примерно 60-150 мм в ширину. Предпочтительно блок реагентов для удлинения праймеров имеет высоту примерно 3-15 мм, длину примерно 100-140 мм и ширину примерно 60 мм - примерно 100 мм. Блок реагентов для удлинения праймеров изготовлен из цветного полипропилена и содержит 96, 384, 1536 или большее количество лунок для образцов. Блок реагентов для удлинения праймеров производят литьевым прессованием.
Силы магнитного притяжения представляют собой механизм соединения планшеты для образцов с блоком реагентов для удлинения праймеров. Планшета для образцов и блок реагентов для удлинения праймеров содержат магниты предпочтительно в виде магнитного листа или в виде небольших магнитов, расположенных на внутренней стороне планшеты для образцов. Силы магнитного притяжения между планшетой для образцов и блоком реагентов для удлинения праймеров обеспечивают точное размещение и плотное прикрепление планшеты для образцов к блоку реагентов для удлинения праймеров.
Блок реагентов для удлинения праймеров может иметь различные конструкции. Каждая лунка для образцов может иметь или может не иметь края, выступающие в лунки планшеты для образцов. Для переноса реагентов из блока реагентов для удлинения праймеров в планшету для образцов может потребоваться давление воздуха, прикладываемое устройством повышенного давления.
Блок реагентов для гаплотипирования
Блок реагентов для гаплотипирования содержит все реагенты, необходимые для гаплотипирования ДНК. Он может включать в себя реагенты, такие как, без ограничений, буферы, праймеры, фермент для секвенирования, дезоксинуклеотиды и дидезоксинуклеотиды (например, Current Protocols, Nucleic Acid Chemistry, Molecular Biology, Wiley and Sons, 2003). Реагенты предоставляют в 96, 384 или 1536 луночном формате или формате с большим количеством лунок, который соответствует формату и размерам планшеты для образцов. Размеры блока реагентов для гаплотипирования составляют примерно 2-25 мм в высоту, примерно 80-200 мм в длину и примерно 60-150 мм в ширину. Предпочтительно блок реагентов для гаплотипирования имеет высоту примерно 3-15 мм, длину примерно 100-140 мм и ширину примерно 60 мм - примерно 100 мм. Блок реагентов для гаплотипирования изготовлен из цветного полипропилена и содержит 96, 384, 1536 или большее количество лунок для образцов. Блок реагентов для гаплотипирования производят литьевым прессованием.
Силы магнитного притяжения представляют собой механизм соединения планшеты для образцов с блоком реагентов для гаплотипирования. Планшета для образцов и блок реагентов для гаплотипирования содержат магниты предпочтительно в виде магнитного листа или в виде небольших магнитов, расположенных на внутренней стороне планшеты для образцов. Силы магнитного притяжения между планшетой для образцов и блоком реагентов для гаплотипирования обеспечивают точное размещение и плотное прикрепление планшеты для образцов к блоку реагентов для гаплотипирования.
Блок реагентов для гаплотипирования может иметь различные конструкции. Каждая лунка для образцов может иметь или может не иметь края, выступающие в лунки планшеты для образцов. Для переноса реагентов из блока реагентов для гаплотипирования в планшету для образцов может потребоваться давление воздуха, прикладываемое устройством повышенного давления.
Блок реагентов для рестрикционного анализа
Блок реагентов для рестрикционного анализа содержит все реагенты, необходимые для рестрикционного анализа ДНК. Он может включать в себя реагенты, такие как, без ограничений, буферы, рестрикционный фермент и соль (например, Sambrook et al., 1989; Current Protocol, Nucleic Acid Chemistry, Molecular Biology, Wiley and Sons, 2003). Реагенты предоставляют в 96, 384 или 1536 луночном формате или формате с большим количеством лунок, который соответствует формату и размерам планшеты для образцов. Размеры блока реагентов для рестрикционного анализа составляют примерно 2-25 мм в высоту, примерно 80-200 мм в длину и примерно 60-150 мм в ширину. Предпочтительно блок реагентов для рестрикционного анализа имеет высоту примерно 3-15 мм, длину примерно 100-140 мм и ширину примерно 60 мм - примерно 100 мм. Блок реагентов для рестрикционного анализа изготовлен из цветного полипропилена и содержит 96, 384, 1536 или большее количество лунок для образцов. Блок реагентов для рестрикционного анализа производят литьевым прессованием.
Силы магнитного притяжения представляют собой механизм соединения планшеты для образцов с блоком реагентов для рестрикционного анализа. Планшета для образцов и блок реагентов для рестрикционного анализа содержат магниты предпочтительно в виде магнитного листа или в виде небольших магнитов, расположенных на внутренней стороне планшеты для образцов. Силы магнитного притяжения между планшетой для образцов и блоком реагентов для рестрикционного анализа обеспечивают точное размещение и плотное прикрепление планшеты для образцов к блоку реагентов для рестрикционного анализа.
Блок реагентов для рестрикционного анализа может иметь различные конструкции. Каждая лунка для образцов может иметь или может не иметь края, выступающие в лунки планшеты для образцов. Для переноса реагентов из блока реагентов для рестрикционного анализа в планшету для образцов может потребоваться давление воздуха, прикладываемое устройством повышенного давления.
Диагностическое устройство
Основное устройство для хранения образцов может быть модифицировано для функционирования в качестве аналитического устройства, используемого при детектировании уровней гормонов, физиологических состояний, заболеваний человека, животного и растения. Диагностическое устройство может быть в виде цилиндрического диагностического устройства, расположенного сверху устройства для хранения образцов. Диагностическое устройство может быть изготовлено двумя способами: 1) независимым процессом изготовления и дополнительно в виде комплектного устройства для устройства для хранения образцов или 2) наслоением в виде независимых блоков внутри каждой лунки устройства для хранения образцов.
Диагностическое устройство может содержать зону с, по меньшей мере, одним специфическим антителом или специфическим диагностическим реагентом внутри устройства. Реагенты могут давать визуально детектируемые реакции при формировании комплекса антитело-антиген.
Тара для перевозки
Тара для перевозки используется для безопасной транспортировки или пересылки по почте биологического материала. Тара для перевозки разработана для размещения в ней устройства для хранения образцов и запоминающего устройства, например компакт-диска (CD), содержащего информацию, имеющую отношение к материалу. В случаях опасности или инфицирования материала при перевозке лунки могут быть запечатаны клейкой пленкой до запечатывания устройства для хранения образцов. Тара для перевозки имеет две части - нижнюю часть или держатель устройства для хранения образцов и камеру. Нижняя часть может быть изготовлена из картона, пластического или пенопластового материала, который имеет точное очертание устройства для хранения образца и CD с программным обеспечением или другого запоминающего устройства. Для перевозки или транспортировки биологического материала образец наносят в лунки устройства для хранения образцов и закрывают крышку и закрепляют ее при помощи магнитных застежек, расположенных на крышке. Устройство для хранения образцов помещают внутрь нижней части тары для перевозки путем плотной посадки. Может быть добавлен CD.
Размер держателя устройства для хранения образцов может быть определен размером устройства для хранения образцов, но он не может быть меньше, чем устройство для хранения образцов, хотя может быть больше, чем 10 уложенных в стопку устройств для хранения образцов. Окружающий набивочный материал предпочтительно состоит из, по меньшей мере, примерно 5 мм дополнительной уплотнительной прокладки и может доходить до примерно 10 см. Держатель устройства для хранения образцов также содержит пространство для безопасной установки информационного устройства. Местоположение держателя информационного устройства в таре для перевозки зависит от типа информационного устройства. Оно разработано так, чтобы обеспечить плотную посадку либо одного, либо множества CD или плат памяти/карт памяти. Держатель устройства для хранения образцов предпочтительно изготавливают из формуемого материала, такого как картон или материала на пенопластовой основе. Держатель устройства для хранения образцов, включая набивной материал, либо окружен внешней оболочкой, либо включен в состав оболочки, окружающей устройство(устройства) для хранения образцов и устройство хранения информации со всех шести сторон, включая открывающуюся крышку, или окружающей держатель устройства для хранения образцов с 5 сторон. В этом случае держатель устройства для хранения образцов включает открывающуюся крышку, причем крышка прикреплена к одной из сторон держателя устройства для хранения образцов, покрывает одну из сторон держателя устройства для хранения образцов, закрепляется на противоположной стороне и надежно закрывает тару для транспортировки. Для 5-ти стороннего окружения держателя устройства для хранения образцов запорный элемент с 6-й стороны обеспечивается закрывающимся ящиком, в который полностью задвигается держатель устройства для хранения образцов. Запорный элемент может представлять собой упаковочный материал, обеспечивающий жесткость держателю устройства для хранения образцов. На внешней стороне тары для транспортировки предусмотрено пространство для этикеток с адресом и печатей почтового отделения.
Блок для белковой кристаллографии
Блок для белковой кристаллографии содержит лунки, которые могут быть заполнены различными растворами для кристаллизации и дегидратации белков. Основное устройство для хранения образцов может быть изготовлено из абсолютно прозрачного пластика, и каждая отдельная лунка обеспечивает условие для кристаллизации белка, учитывая область pH от примерно 4,6 до примерно 9,4. Каждая лунка может содержать различные буферы, такие как, без ограничений, ацетатный, виннокислый, фосфатный, трис, цитратный, HEPES, имидазольный, формиатный, какодилатный, MES, Bicine, трис, цитратный, HEPES, ацетатный, и различные соли для преципитации, такие как тартрат, фосфат, сульфат аммония и лития, хлорид кальция или магния, ацетат магния, аммония, натрия, цинка и кальция, цитрат натрия, формиат магния и натрия, хлорид магния и натрия, ацетат натрия, цитрат натрия, формиат аммония, сульфат лития и аммония, имидазол, CTAB и органические растворители для преципитации, например MPD, 2-пропанол, этиленгликоль, диоксан, этанол, 1,6-гександиол. Они также могут содержать PEG 400, 6000, 1000, 8000, 10000 и 20000, PEG MME 550, 2000, 5000 и 2000, Jeffamine M-600 или другие добавки, например трет-бутанол, глицерин, ионы Co2+, Cd2+, Fe3+, Ni2+ и Zn2+, диоксан, этиленгликоль, полиэтиленимин. Лунки могут быть заполнены растворами различной концентрации, упомянутой выше. Лунки дегидратируют, при этом вещества фиксируются на стенках лунок. Готовые для использования лунки могут быть повторно гидратированы водой, и в них могут быть добавлены белки.
Стековая стойка
Отдельный блок для хранения образцов может храниться либо при комнатной температуре, либо в охлажденной специально разработанной для хранения стойке. Стойка (см. чертежи) может содержать различное количество блоков для хранения образцов, штрих-код предпочтительно является видимым, а блоки могут легко скользить по пластмассовым направляющим. Стойка для хранения может быть либо открытой, либо помещена в пластмассовый ящик с закрывающейся дверцей.
Стековая стойка может быть изготовлена из пластмассы или металла. Она может содержать 10, 25 или 50 устройств для хранения образцов. Устройства для хранения образцов вставляются в направляющие в стековой стойке. Фиксирующее устройство предотвращает карты от выпадения из стековой стойки. Стековая стойка может быть либо открытой, либо полностью закрыта защитным материалом и иметь одну прикрепленную дверцу на передней стороне стековой стойки.
Система для хранения, отслеживания и извлечения данных, имеющих отношение к биологическому материалу
Вышеприведенное устройство для хранения в различных описанных выше вариантах осуществления может быть объединено с другими технологиями для обеспечения интеграции хранения образцов и управления образцами для применений в биологических науках. Этот вариант осуществления настоящего изобретения предоставляет возможность для интеграции хранения биологических образцов, размещения, отслеживания, обработки и управления данными образцов. Данные, относящиеся к образцам, могут быть связаны с местоположением образцов при помощи прямой физической связи данных с устройствами для хранения образцов. Сохраненная информация может обновляться дополнительными данными, которые формируются в результате инвентаризации и отслеживания образцов, в комбинации с многоэтапными протоколами биологических исследований, процессами продуцирования, скрининга, биологического анализа, историй болезней пациентов, клиническими экспериментальными данными и другими источниками получения информации. Данные, связанные с образцом, могут передаваться и распределяться при помощи программного обеспечения с иерархическим обеспечением безопасности и архитектурой сети, которая позволяет сопряжение с многопользовательскими средами и средами, содержащими множество сайтов.
В идеале, информация об образце интегрируется с устройством для хранения образцов посредством связанного электронного интерфейса, предпочтительно беспроводного интерфейса, такого как ретранслятор радиочастотного идентификатора (RFID). Несмотря на то, что в последнем использовались штрих-коды для идентификации образцов, эта технология имеет ограничения, которые делают его неподходящим для использования в настоящем изобретении. Эти ограничения включают в себя доступ с необходимой зоной прямой видимости штрих-кодов для передачи информации, ограниченную информационную емкость и помехи, связанные с факторами окружающей среды, такими как пыль, влажность и т.п. Технология радиочастотной идентификации покрывает эти недостатки.
Удаленный обмен данными с использованием беспроводного оборудования обычно рассчитан на радиочастотную (РЧ) технологию, которая используется во многих областях промышленности. Одним из применений РЧ технологии является определение местонахождения, идентификация и отслеживание объектов, таких как животные, материально-производственные запасы и средства передвижения. Примерами публикаций, раскрывающими системы идентификации на основе РЧ меток, являются публикации патентов США №№ 6696028, 6380858 и 5315505.
Системы идентификации на основе РЧ меток (RFID) разработаны для облегчения мониторинга передвижения объектов. Как показано на Фиг.9, основная RFID система 10 включает в себя два компьютера: устройство 12 запроса или считывания, и ретранслятор 14 (обычно называемый РЧ метка). РЧ метка 14 устройства 12 запроса включает в себя соответствующие антенны 16, 18. Во время работы устройство 12 запроса передает через свою антенну 16 радиочастотный сигнал 20 устройства запроса в антенну 18 РЧ метки 14. В ответ на получение сигнала 20 устройства запроса РЧ метка 14 выдает амплитудно-модулированный ответный сигнал 22, который передается назад в устройство 12 запроса через антенну 18 метки при помощи процесса, известного как обратное рассеяние.
Обычная РЧ метка 14 включает в себя модулятор 24 амплитуды с переключателем 26, таким как МОП-транзистор, подсоединенным между антенной 18 метки и землей. Если РЧ метка 14 активирована сигналом 20 устройства запроса, запускающее устройство (не показано) генерирует сигнал 27 включения/выключения модуляции на основании информационного кода, обычно кода идентификации, хранящегося в энергонезависимой памяти (не показано) РЧ метки 14. Модулирующий сигнал 27 подается на управляющий вывод переключателя 26, который включает/выключает переключатель 26. Если переключатель 26 разомкнут, антенна 18 метки отражает часть сигнала 20 устройства запроса назад в устройство 12 запроса в виде части 28 ответного сигнала 22. Если переключатель 26 замкнут, сигнал 20 устройства запроса проходит через переключатель 26 на землю, не отражаясь, таким образом, создавая нулевую часть 29 ответного сигнала 22. Другими словами, сигнал 20 устройства запроса является амплитудно-модулированным для того, чтобы генерировать ответные сигналы 22 путем поочередного отображения и поглощения сигнала 20 устройства запроса согласно модулирующему сигналу 27, который является характеристикой хранящегося информационного кода. РЧ метка 14 также может быть модифицирована таким образом, чтобы сигнал устройства запроса отражался, когда переключатель 26 замкнут, и поглощался, когда переключатель 26 разомкнут. При получении ответного сигнала 22 устройство 12 запроса демодулирует ответный сигнал 22 для декодирования информационного кода, представленного при помощи ответного сигнала. Обычные RFID системы, таким образом, работают на одночастотном генераторе, у которого РЧ метка 14 модулирует РЧ несущую частоту для обеспечения индикации устройства 12 запроса, на котором находится РЧ метка 14.
Значимым преимуществом систем RFID являются бесконтактные, не ограниченные линией видимости возможности технологии. Устройство 12 запроса испускает сигнал 20 запроса в пределах от одного дюйма до ста футов или более, в зависимости от выдаваемой мощности и используемой радиочастоты. Метки могут считываться через различные материалы, такие как налет, туман, лед, краска, грязь, а также в других условиях, изменяющих вид и состояние объекта, при которых штрих-код или другие оптически считываемые технологии бесполезны. РЧ метки также могут считываться с высокой скоростью, которая в большинстве случаев меньше одной сотой миллисекунды.
Обычная система 10 РЧ меток часто содержит несколько РЧ меток 14 и устройство 12 запроса. РЧ метки подразделяются на три основные категории. Эти категории представляют собой пассивные метки, получающие энергию из луча, полупассивные метки с аккумуляторным питанием и активные метки. Каждая из них работает принципиально отличным способом.
РЧ метку, получающую энергию от луча, часто называют пассивным устройством, поскольку она получает энергию, необходимую для своей работы, из сигнала запроса, направленного на нее в виде луча. Метка детектирует поле и изменяет характеристики отражения самой метки, создавая изменение в коэффициенте отражения, которое заметно для устройства запроса. Полупассивная РЧ метка с аккумуляторным питанием работает аналогичным образом, модулируя свою РЧ площадь поперечного сечения для отражения небольшого изменения в устройство запроса при установлении связи. В этом случае батарея является источником рабочей энергии метки. И, наконец, в случае активной РЧ метки используется передатчик с батарейным питанием для генерации ее собственной радиочастоты.
В предпочтительном варианте осуществления настоящего изобретения система состоит из трех частей: аппаратных средств, программного средства учета и управления и RFID интерфейса между аппаратными средствами и программным обеспечением. На Фиг.10 показана система 100, сформированная согласно одному из вариантов настоящего изобретения, которая включает в себя описанное выше устройство 102 для хранения, компонент 104 программного средства учета и управления, предпочтительно реализованную на базе компьютера систему 106 и радиочастотный интерфейс 108, соединенный с устройством 102 для хранения и программным средством 106. Предпочтительно RFID интерфейс 108 включает в себя ретранслятор 110, связанный с устройством 102 для хранения и устройством запроса 112, который соединен с реализованной на базе компьютера системой 106.
В этом варианте осуществления ретранслятор 110 связан с устройством 102 для хранения образцов путем прикрепления ретранслятора 110 к внешней поверхности устройства 102 для хранения. Однако очевидно, что ретранслятор 110 может быть прикреплен или связан с пробиркой, планшетой, штативом или даже комнатой, в которой хранится устройство 102 для хранения. Хотя более предпочтительным является, чтобы один ретранслятор 110 был связан с одним устройством 102 для хранения, существует возможность того, что каждый конкретный образец, хранящийся в устройстве 102 для хранения, может иметь связанный с ним ретранслятор 110.
Связь может осуществляться либо во время изготовления устройства 102 для хранения путем встраивания ретранслятора 110 в устройство 102 для хранения, либо после изготовления устройства 102 для хранения путем приклеивания к устройству 102 для хранения. Поскольку силы магнитного притяжения представляют собой предпочтительный механизм соединения, используемый в устройстве 102 для хранения и образцов в различных его вариантах осуществления, специалистам в данной области техники очевидна такая технология, при которой может возникнуть необходимость в подходящей экранирующей защите для предотвращения случайного изменения информации, хранящейся в ретрансляторе 110, и для предотвращения интерференции во время радиочастотного обмена данными между ретранслятором 110 и устройством 112 запроса.
Ретранслятор 110 может быть перепрограммирован при помощи данных об устройстве 102 для хранения и образцов, хранящихся в устройстве 102 для хранения, включая собственную информацию, местоположение информации, информацию анализа, процессов продуцирования, проведения клинических испытаний, процессов синтеза, сбора образцов и другую информацию, известную специалистам в данной области техники, которая может быть значимой в управлении образцами. Кроме того, для перепрограммирования таких данных ретранслятор 110 может быть выполнен с возможностью модификации и обновления данных, хранящихся в его памяти. Дополнительно ретранслятор 110 может иметь надежную архитектуру, которая устанавливает точные условия доступа для каждого типа данных, таким образом, ограничивая считывание, запись и обновление. Например, компоненты RFID интерфейса 108 могут быть выполнены с возможностью получения сигналов управления и ответа для конкретной реализованной на базе компьютера системы обработки данных, например приложение для программного обеспечения, описанное в настоящем описании ниже. Кроме того, данные, записанные в ретрансляторе 110, могут быть зашифрованы с целью идентификации и защиты.
Использование RFID ретрансляторов или микросхем обеспечивает использование в широком диапазоне температур (-25°C-+85°C) без потери функциональности. Кроме того, ретранслятор 110 может быть использован для управления удаленными устройствами, такими как световая сигнализация или генератор акустических сигналов для изменения и определения местоположения объекта, связанного с ретранслятором 110. Хранение информации в ретрансляторе 110 также предоставляет дополнительное резервное копирование данных в реализованной на базе компьютера системе 106, которые могут быть повреждены или потеряны.
Устройство 112 запроса представляет собой обычное радиочастотное идентификационное устройство считывания, которое соединено с реализованной на базе компьютера системой 106. Команда или управляющие сигналы генерируются системой 106 для инициализации запроса одного или нескольких ретрансляторов 110 и для получения ответа от них, которые обрабатываются при помощи программного обеспечения 104 в реализованной на базе компьютера системе 106. В одной из конфигураций ретранслятор 110 может быть перепрограммирован путем получения данных устройства 112 запроса для замены или обновления хранящихся в нем данных.
В одном из вариантов осуществления одно или несколько устройств 112 запроса расположены в пределах зоны, достаточной для обмена радиочастотными сигналами, например микроволновыми сигналами, с ретранслятором 110. Для многочисленных классов ретрансляторов 110 или для отдельных ретрансляторов 110 может быть использовано множество устройств 112 запроса. В качестве альтернативы одно устройство запроса, использующее известную технологию, может осуществлять обмен данными с множеством ретрансляторов 110 в большом диапазоне частот в последовательном или параллельном режимах. В приложениях, где обработке подвергается устройство 102 для хранения образцов или отдельные образцы, для отслеживания местонахождения и состояния образца могут использоваться множество устройств запроса, расположенные в различных местах в структуре или вдоль пути перемещения, такого как конвейерная система или система доставки, такая как линии отгрузки товара, составы и т.д. Это включает проверку факторов окружающей среды, таких как температура, влажность, давление и т.п., в которых находится образец или устройство 102 для хранения.
Таким образом, RFID интерфейс 108 может быть расширен до проведения мониторинга и обработки данных, имеющих отношение к перемещению и анализу образца или устройства 102 для хранения, находящегося в лаборатории, обрабатываемого лабораторными автоматическими манипуляторами и т.п., например, во время биологических процессов производства или выполнения экспериментальных этапов. Это также облегчает управление качеством и обработку биологических образцов при помощи автоматизированных или полуавтоматизированных протоколов исследований.
Как упомянуто выше, хранение образцов и отслеживание облегчаются посредством определения местоположения образца благодаря использованию РЧ интерфейса между РЧ ретранслятором на устройстве для хранения образцов и реализованной на базе компьютера системой, раскрытой в настоящем описании, что достигается при помощи мечения и мониторинга местоположения хранения, такого как стойка для хранения, комната для хранения, холодильник, место в лаборатории, стол или книжная полка.
Для того чтобы отследить конкретное устройство для хранения 102 или образец, ретранслятор 110 выполнен с возможностью активации удаленного устройства, такого как мигающий источник света, расположенный на устройстве для хранения, акустическое устройство, связанное с устройством для хранения, или изменение цвета устройства для хранения, которое может быть узнаваемым человеком или автоматизированной системой для быстрого восстановления образца. Кроме того, ретранслятор 110 выполнен с возможностью активации удаленного сигнализатора, если условия окружающей среды превысили заданную область значений параметров окружающей среды, включая, без ограничений, температуру, давление и влажность. В одном из вариантов осуществления ретранслятор 110 представляет собой пассивное устройство, которое активируется сигналом запроса, от которого оно получает рабочую энергию. Если ретранслятор 110 используется для активации удаленного устройства или для увеличения области связи, ретранслятор может быть полуактивным, как описано выше. В качестве альтернативы активный ретранслятор может использоваться, когда должно быть считано из ретранслятора 110 или записано на него большое количество данных или для увеличения области, как описано выше. Область также находится под влиянием частоты, как известно в данной области техники, и специалист в данной области техники может выбрать подходящую область частот согласно окружающей среде и функциональным показателям. Например, некоторые образцы могут быть чувствительными к конкретным частотам радиосигналов, и может возникнуть необходимость исключения таких частот, или при разработке системы 100 препарат соответствующим образом экранируют.
Программное обеспечение 104 учета и управления разрабатывают для использования с беспроводными системами связи и обработки данных, связанных с биологическими науками. В одном из вариантов осуществления она состоит из адаптированного пользовательского интерфейса и набора заданных таблиц для базы данных таблиц. Пользователь может вводить данные, связанные с образцом, или импортировать информацию из внешних источников. Заданные таблицы предусмотрены в базе данных для облегчения установки системы, но пользователь может иметь опцию настройки полей внутри таблиц. Родственная база данных может включать в себя таблицы для образца ДНК, клонов, олигонуклеотидов, фрагментов ПЦР, кДНК, химических веществ, белков, метаболитов, липидов, клеточных фракций, биологических образцов из различных организмов, таких как вирусы, бактерии или многоклеточные организмы, образцы пациентов, например кровь, моча или буккальные мазки. Подробную информацию об образце и данные, связанные с образцом, программируют в таблицы. Информация об образце может, например, включать в себя источник образца, название клона, название вставленного гена, размер вставки, последовательность вставки, модификации, название вектора, размер вектора, выбор антибиотиков, индукцию, терминатор, вид клонирования, 5'-метку, 3'-метку, метку очистки, название олигонуклеотида, очистку, контроль качества, прямой праймер, обратный праймер, значение Tm и выбор размера. Клиническая информация о пациенте может представлять собой, например, возраст, пол, место жительства, этническую группу, индекс массы тела, семейный анамнез, медикаментозное лечение, дату проявления симптомов, продолжительность заболевания и медицинские тесты. Данные, связанные с образцом, могут состоять из данных исследований из различных источников, например информации о последовательности из ДНК секвенатора, информации о профиле транскрипции из чипов микроматриц, данных о белках из вестерн-блот анализа или гибридизации in-situ, данных биотестирования для подбора лекарства, данных высокопроизводительного скрининга лекарств, данных библиотек химического синтеза и т.п. Данные могут представляться в виде текста, чисел, таблиц или изображений.
Программное обеспечение также может связываться с другими источниками данных и собирать информацию из свободно доступных источников, таких как GenBank, SwissProt и подобных им или проприетарных источников. В идеале программное обеспечение может взаимодействовать с автоматизированным оборудованием для отслеживания образца в пределах процесса, и отслеживание процесса может быть отображено в виде накапливаемой истории образца для хранения в устройстве для хранения, а также в базе данных, такой как запоминающее устройство в RFID ретрансляторе 110.
Программное обеспечение разрабатывают для создания информативной инфраструктуры, в которой один пользователь генерирует свой набор данных и информацию, которая сначала хранится на локальной рабочей станции в формате локальной базы данных. Однако программное обеспечение способно связываться с множеством пользователей в иерархичной среде. Информация, собранная одним пользователем, может быть передана наилучшим образом в систему централизованной базы данных на сервер. Взаимодействие сетевой среды также может представлять собой интерфейс веб-браузера. Многопользовательская среда может быть расширена до среды с множеством сайтов, и программное обеспечение и база данных могут находиться на персональном компьютере, на сервере во внутренней сети или в Интерненте, например на сайте электронной торговли. Программным обеспечением также предусмотрены системы управления доступом и управления журналом регистраций.
На Фиг.11 показана архитектура 114 реализованной на базе компьютера системы для использования локальной сети 116 для связи с прикладным процессором 118 с одним или несколькими устройствами 120 запроса, которые осуществляют обмен данными с одним или несколькими удаленными RFID метками 122. Прикладной процессор 118 соединен с базой данных 124. Очевидно, что вместо локальной сети может быть глобальная сеть, такая как Интернет, и в этом случае могли бы использоваться веб-приложения.
В идеале, в одном из вариантов осуществления программное обеспечение 104 учета и управления имеет три компонента: компонент программного обеспечения пользовательского интерфейса, компонент промежуточного программного обеспечения и компонент внутреннего программного обеспечения.
Предусмотрено, что программное обеспечение для пользовательского интерфейса используется для создания “пользовательского интерфейса”. Это может быть, например, веб-браузер или Microsoft Excel. Программное обеспечение веб-браузера могло бы использоваться для системы 100 веб-браузера, тогда как программное обеспечение Microsoft Excel могло бы использоваться для настольной системы. Веб-опция предусматривает множество пользователей, передачу данных по сети и может быть расширена для обслуживания нескольких тысяч пользователей. Настольная опция является достаточной для одного пользователя, которая не предполагает совместного использования данных или информации об образце через сеть.
Промежуточное программное обеспечение может включать в себя макрос Microsoft Excel, разработанный для использования в качестве настольной опции или программного обеспечения заказчика, разработанного при помощи языка программирования, используемого с веб-системами, такими как PHP. Промежуточное программное обеспечение выполнено в виде набора программ, которые способны получать данные, введенные пользователем, и запрашивать и возвращать информацию базы данных пользователю через известное устройство вывода, такое как принтер, дисплей или звуковое устройство вывода данных.
Внутреннее программное обеспечение представляет собой предпочтительно Microsoft Access, который представляет собой проприетарное программное обеспечение базы данных, предлагаемое Microsoft Corporation и управляемое Microsoft Excel. Эта конкретная программа обеспечивает достаточный объем базы данных, которая поддерживает до 50000 записей и, максимально, до 100000 записей с прогрессивным ухудшением производительности. Другая опция представляет собой MySQL, которая является бесплатной коллективно разработанной системой управления базами данных, которая работает на всех больших серверах, включая серверы, использующие платформы Windows и Linux. Эта база данных способна обрабатывать миллионы записей и может быть подходящей для пользователей больших учреждений, таких как государственные учреждения, университеты и международные организации.
Программное обеспечение 104 выполнено с возможностью предоставления сигналов управления в RFID интерфейс 108 и приема данных и информации из интерфейса 108. Кроме того, при передаче информации в ретранслятор программное обеспечение 104 выполнено с возможностью инициирования записи данных через устройство 112 запроса в ретранслятор 110, используя способы и оборудование, известное в данной области техники, которое является легко доступным.
На Фиг.12 показана другая архитектура 128 системы, в которой база данных 130 связана с множеством настольных компьютеров 132 через веб-сервер 134. Резидент на сервере 134 представляет собой программное обеспечение, которое обеспечивает уровень связи между пользователем, базой данных 130 и резидентом настольного программного обеспечения 136 на настольных компьютерах 132. При помощи интерфейса 138 веб-браузера пользователь может соединяться с RFID устройством 142 считывания через стандартное USB соединение 140. При этом пользователь может управлять операциями считывания и записи на RFID устройство 142 считывания и удаленную RFID метку 144, используя беспроводное соединение 146, обеспечиваемое при помощи радиосвязи.
Затем на Фиг.13 показан еще один вариант осуществления настоящего изобретения, использующий 3-уровневую архитектуру 148, которая имеет настольный компьютер 150 с веб-браузером 158 пользовательского интерфейса, соединенного с внутренней базой данных 154 через промежуточное программное обеспечение 156 веб-сервера на веб-сервере 152. Промежуточное программное обеспечение осуществляет поиск, извлекает и отображает характеристики пользователю. Более конкретно, бизнес-логика содержится в промежуточном программном обеспечении 156 на веб-сервере 152. Кроме того, существует (необязательно) RFID устройство 160 считывания, соединенное через USB соединение 162 с клиентской программой 164 на настольном компьютере 150. Клиентское приложение, которое считывает и записывает в RFID метке 166 через устройство 160 считывания, запускается из веб-браузера 158.
В альтернативной 2-уровневой структуре архитектуры 148 на настольном компьютере 150 существует программа пользовательского интерфейса Excel, которая осуществляет обмен данными непосредственно с базой 154 данных в выходном буфере. Здесь бизнес-логика выполнена в макропрограмме Excel. Этот способ по существу является достаточным для загрузки данных (например, 96 рядов данных, соответствующих каждой лунке на планшете) в базе данных для получения преимущества функций Excel, таких как копирование, перетаскивание и т.д.
В дополнительной 2-уровневой структуре архитектуры 148 автономное клиентское приложение 170 в клиентском интерфейсе осуществляет обмен данными непосредственно с базой данных 154 в выходном буфере. Бизнес-логика содержится внутри автономного клиентского приложения, и модуль считывания и записи на RFID метку 166 также может находиться внутри этого приложения 170. Здесь преимущество заключается в том, что это приложение является компилированным (исходный код не видим), и не требуется стороннее программное обеспечение (Excel, веб-сервер). Недостаток заключается в том, что она не является в той же степени совместимой с сетью, что и 3-уровневая архитектура, описанная выше.
Нижеприведенные примеры представлены в качестве иллюстрации, а не ограничения.
ПРИМЕРЫ
Пример 1
Изготовление матрицы для устройства для хранения биологических образцов
Этот пример описывает изготовление устройств для хранения биологических образцов, используя растворимый материал матрицы. В зависимости от биологического материала, подлежащего хранению в конкретном примере, матрицу готовили при помощи различных буферов для хранения. В этих примерах все реагенты были получены от Sigma (St. Louis, MO), кроме указанных каким-либо иным способом. Для сухого хранения нуклеиновых кислот использовали 20 мМ трис pH 6,5 для получения матрицы для хранения на основе 1% поливинилового спирта (ПВА, Sigma no. P8136). Концентрацию полимера тестировали в пределах от 0,1% до 10% (w/v). Величину pH матрицы тестировали в пределах pH от 5 до 8. Для обычного определения биологического образца в жидкую матрицу добавляли феноловый красный из расчета 0,0002% (w/v).
Матрицу в жидком виде наносили в лунки для образцов 96-луночной планшеты и полностью сушили при комнатной температуре либо при обычном давлении, либо под вакуумом в вакуумной камере. Время сушки для 50 мкл объема матрицы составляло всю ночь, а под вакуумом требовалось более короткое время сушки. После этого планшеты были готовы для хранения биологического материала.
Для стабилизации и активации после повторной гидратации в зависимости от биологической активности, предназначенной для тестирования, непосредственно в матрицу для хранения могут быть добавлены дополнительные добавки для хранения, например одна или несколько из следующих: ЭДТА, NaCl, MgCl2, KCl, (NH4)2SO4, MgSO4, CaCl2, Zn-ацетат, Na-ацетат, цистеин, дитиотрейтов (DTT, Cleland's reagent), ацетат калия, Трис-ацетат, ацетат магния, KPO4, глицерин, Тритон X-100®, додецилсульфат натрия (SDS), азид натрия, ингибиторы протеаз (PMSF, аминоэтил-бензолсульфонил фторид, пепстатин, E64, бестатин, леупептин, апротинин), 2-меркаптоэтанол, полиэтиленглиголь (PEG), бычий сывороточный альбумин (BSA), никотинадениндинуклеотид (НАД), АТФ. Для биологического материала, связанного с биологической активностью, такого как ферменты, реакционные условия могут подбираться непосредственно в матрице для хранения. В некоторых случаях только вода представляет собой вещество, которое добавляется для повторной гидратации перед реакцией активации. Матрица также может включать один или несколько ингибиторов, таких как антибактериальные и/или противогрибковые агенты. Матрица может быть стерилизована при помощи стерилизующего фильтрования или автоклавирования перед аликвотированием матрицы в отдельные лунки для хранения. Автоклавированная матрица наносится в аликвотах в лунки для хранения либо в единичные пробирки, либо в многолуночные планшеты в объеме жидкой фазы 10-100 мкл на лунку в случае 96-луночной планшеты.
Пример 2
Сухое хранение нуклеиновых кислот
Устройства для хранения биологических образцов изготавливали, как описано в примере 1. Использовали обычные материалы и способы молекулярной биологии, как описано (Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratories, Cold Spring Harbor, NY, 2001; Ausubel et al., 1993 Current Protocols in Molecular Biology, Greene Publ. Assoc. Inc. & John Wiley & Sons, Inc., Boston, MA). Тесты на стабильность выполняли для плазмид, олигонуклеотидов, фрагментов ДНК в виде 1 kB лестницы, продуктов ПЦР, геномной ДНК (кошачьих и человека) и РНК. Тесты на восстановление и стабильность выполняли, используя анализы на основе геля, ПЦР и степени трансформации.
A. Хранение плазмид
Кольцевую плазмиду (puc19) (New England Biolabs Inc., Beverly, MA) общим количеством 50 нг с концентрацией 10 нг/мкл в дважды дистиллированной воде (ddH2O) наносили на высушенную растворимую матрицу в каждую лунку 96-луночной полипропиленовой планшеты. Образец сушили и хранили при комнатной температуре. Контрольную плазмиду хранили в морозильнике в жидком виде при -20°C.
Для восстановления в лунку с сухим образцом вносили 50 мкл ddH2O. Образец подвергали повторной гидратации в течение 15 минут и 10 мкл аликвот использовали для трансформации DH5-альфа компетентных бактериальных клеток. Трансформированные клетки наносили на планшету с LB агаром и инкубировали в течение ночи при 37°C. Клетки подсчитывали на каждой планшете. Вычисляли процент восстановления ДНК на основании трансформации контрольной ДНК (10 нг puc19, сохраненной при -20°C). На 5% PVA матрице, которая хранилась более 8 месяцев, восстановление ДНК составило более 50%. 1% PVA матрицу тестировали в течение 1 месяца и в результате получили степень восстановления, которая была выше или равна степени восстановления ДНК, хранящейся в морозильнике.
Степень трансфекции при долговременном хранении была стабильной при восстановлении, 60% для 5% PVA матрицы и 100% для 1% матрицы. После 6-месячного хранения снижение степени восстановления не наблюдали. 5% PVA не переходила в раствор полностью.
Анализ ПЦР повторно гидратированного образца показывал постоянную стабильность образца в описанных условиях. Были разработаны два праймера ПЦР (прямой и обратный), амплифицирующих длину в 480 п.о. плазмиды puc19. В реакции амплификации 5 нг повторно гидратированного образца использовали для сравнения с 5 нг контрольной плазмиды. Реакции ПЦР выполняли с небольшим количеством циклов в условиях отсутствия насыщения. Материал после 8-месячного сухого хранения мог быть амплифицирован без детектируемой потери эффективности амплификации.
B. Хранение олигонуклеотидов
Два олигонуклеотида (прямой и обратный праймеры ПЦР) для амплификации puc19 в объеме 10 мкл с общей концентрацией 10 мкМ и 20 мкМ каждый наносили на 1% PVA сухую матрицу для хранения в каждую лунку 96-луночной планшеты. Олигонуклеотиды сушили в течение ночи при комнатной температуре и планшету хранили при комнатной температуре. Контрольные нуклеотиды хранили в жидком виде в морозильнике при -20°C.
Для восстановления лунки, содержащие оба нуклеотида (ПЦР праймеры), подвергли повторной гидратации в течение 15 минут, используя ПЦР реагенты, содержащие 1x PCR буфер, 5 нг плазмиды puc19 и dNTPs. Реакционную смесь после повторной гидратации переносили в пробирки ПЦР и добавляли Taq полимеразу. Реакцию циклически повторяли в 25 циклах и анализировали в 1% агарозном геле.
Анализ геля выявил амплификацию ПЦР продукта ожидаемого размера. При сравнении с контролем для получения такого же количества продуктов амплификации требовалось в два раза большее количество праймеров по сравнению с праймерами, хранящимися в жидком виде. Степень восстановления из 1% PVA матрицы была ниже, чем в контроле, хранящемся в жидком виде. Восстановление было улучшено путем уменьшения концентрации PVA в матрице.
C. Хранение фрагментов ДНК
Фрагменты в виде стандартной 1 kB лестницы ДНК (Invitrogen) (0,5 мкг) наносили на 1% PVA сухую матрицу для хранения в присутствии буфера для внесения ДНК, содержащего феноловый красный или другой красящий агент и 50% глицерина. В каждую лунку вносили по 10 мкл лестницы ДНК и красителя, что эквивалентно объему свежей лестницы ДНК, используемой для визуализации лестницы в одной лунке агарозного геля для электрофореза. Фрагменты ДНК с введенным красителем обезвоживали в течение ночи и хранили при комнатной температуре.
Для восстановления клетки со стандартного размера 1 kB лестницей ДНК и буфером для внесения ДНК подвергали повторной гидратации, используя 10 мкл ddH2O. До введения 10 мкл 1 kB лестницы в гель для электрофореза время повторной гидратации составляло 5 и 10 минут соответственно.
Для анализа 10 мкл контрольной лестницы, хранящейся в жидком виде в присутствии буфера для внесения ДНК при -20°C, сравнивали по интенсивности флуоресценции, используя краситель этидиум бромида, с лестницей стандартного размера после сухого хранения, подвергнутой 5-минутной и 10-минутной повторной гидратации. В интенсивности флуоресценции полос ДНК различного размера различие не наблюдалось. Ни одна из полос не показала деградацию ДНК после сухого хранения при комнатной температуре.
D. Хранение геномной ДНК
a) Геномная кошачья ДНК
Геномную кошачью ДНК общим количеством 20 нг в 10 мкл буфера TE pH 8 наносили на 5% PVA сухую матрицу для хранения в каждую лунку 96-луночной планшеты. Геномную ДНК сушили в течение ночи и хранили при комнатной температуре. Контрольную ДНК хранили в замороженном виде при -20oC.
Для восстановления лунки, содержащие геномную кошачью ДНК, подвергали повторной гидратации в течение 15 минут, используя реагенты ПЦР, содержащие 1x ПЦР буфер, 2 кошачьих специфических праймера с концентрацией 10 мкМ и dNTPs. Праймеры амплифицировали 600 п.о. фрагментами кошачьей ДНК. Реакционную смесь после повторной гидратации переносили в пробирки ПЦР и добавляли Taq полимеразу. Реакцию повторяли 35 циклов и анализировали в 1% агарозном геле.
Анализ ПЦР выполняли после недельного и 3,5-месячного сухого хранения. В обеих временных точках фрагмент ДНК ожидаемого размера мог быть амплифицирован без снижения степени амплификации по сравнению с геномной ДНК, хранящейся в замороженном виде.
b) Геномная человеческая ДНК
Общую геномную человеческую ДНК общим количеством 20 нг в 10 мкл буфера TE pH 8 наносили на 1% PVA сухую матрицу для хранения в каждую лунку 96-луночной планшеты. Геномную ДНК сушили в течение ночи и хранили при комнатной температуре. Контрольную ДНК хранили в замороженном виде при -20°C.
Лунки, содержащие геномную человеческую ДНК, подвергали повторной гидратации в течение 15 минут, используя реагенты ПЦР, содержащие 1x ПЦР буфер, 2 специфических человеческих праймера фактора 13 роста (hFGF13), с концентрацией 10 мкМ и dNTPs. Реакционную смесь после повторной гидратации переносили в пробирки ПЦР и добавляли Taq полимеразу. Реакцию повторяли 35 циклов и анализировали в 1% агарозном геле.
Анализ ПЦР выполняли после месячного сухого хранения. Фрагмент гена человеческого фактора роста ожидаемого размера амплифицировался без снижения степени амплификации при сравнении с геномной ДНК, хранящейся в замороженном виде.
Пример 3
Сухое хранение белков
Устройство для хранения биологических образцов изготавливали, как описано в примере 1. Этот пример показывает, что сухое хранение белков при температуре окружающей среды с полностью восстановленной активностью предоставляет огромные преимущества по сравнению с хранением белков, которые заморожены в виде жидких образцов.
Для демонстрации протективной природы растворимой матрицы представлены тесты на стабильность и активность для различных последовательностей, термостабильных полимераз, рестрикционных ферментов, лигаз, протеаз. Стабилизацию белков и их восстановление в виде активных молекул получали, используя матрицу для длительного хранения, описанную выше. Матрицу изготавливали в присутствии трис pH 5-8, фенолового красного в качестве индикатора pH и 1% PVA. Матрицу переводили в твердое состояние дегидратацией, а белки наносили в жидком виде на сухую матрицу в присутствии или в отсутствии трегалозы (Fluka, cat. no. 90210) или валидамицина A (Research Products International Corp., catalog no. V21020). Вода в растворе белков гидратировала и растворяла PVA. Смесь белков проникала в растворенную матрицу, полученную смесь сушили при температуре окружающей среды. В биологический материал добавляли валидамицин A в концентрации 0,5-10% w/v. Смесь биологического образца в присутствии валидамицина A наносили на растворимую PVA матрицу для образцов.
Пример 4
Длительное хранение белков с использованием растворимой PVA матрицы
Этот пример описывает восстановление активных белков после длительного сухого хранения на растворимых PVA матрицах, изготовленных, как описано в предыдущих примерах.
A. Полимеразы
1) SEQUENASETM - SequenaseTM (USB, Cleveland, OH) обычно хранится в морозильнике при температуре -20°C и с течением времени теряет активность из-за повторяющегося процесса заморозки-оттаивания, что приводит к уменьшению длины считывания и качества реакции секвенирования. SequenaseTM наносили на растворимую матрицу в 1x буфере для секвенирования в присутствии трегалозы или валидамицина A с конечной концентрацией 5%. Набор для секвенирования USB SequenaseTM версии 2.0, DNA (номер продукта 70770) использовали согласно протоколу производителя. Концентрация в лунке в 96-луночной планшете была эквивалентна концентрации хранящейся в замороженном виде SequenaseTM, использованной для одной реакции секвенирования. Контрольную SequenaseTM хранили обычным способом в морозильнике при температуре -20°C. Для восстановления лунки полностью гидратировали 20 мкл 1x буфера для секвенирования в течение 5-45 минут.
Для анализа на активность проводили реакции секвенирования, используя метку S35, и продукты реакции анализировали при помощи электрофореза на акриламидном геле для секвенирования. Последовательности секвеназы, хранящиеся в замороженном и сухом виде, сравнивали при помощи считывания лестниц последовательностей. Обе последовательности имели одинаковое качество считывания.
2) TAQ полимераза - Taq полимераза для реакций ПЦР хранится при температуре -20°C и с течением времени теряет активность из-за повторяющегося процесса заморозки-оттаивания, что приводит к более низкой эффективности амплификации. Taq полимеразу (5 ед. на лунку) наносили на растворимую матрицу в 1x ПЦР буфере в присутствии трегалозы или валидамицина А с конечной концентрацией 5%. Концентрация на лунку в 96-луночной планшете была эквивалентна концентрации хранящейся в замороженном виде Taq полимеразы, использованной для одной реакции ПЦР. Контрольную Taq полимеразу хранили обычным способом в морозильнике при температуре -20°C. Для восстановления лунку полностью гидратировали в течение 5-45 минут, используя 20 мкл 1x буфера ПЦР.
Для проведения анализа на активность реакции ПЦР проводили согласно стандартным протоколам ПЦР и продукт ПЦР подвергали электрофорезу в агарозном геле. Продукты ПЦР полимеразы, хранящейся в замороженном и сухом виде, сравнивали путем визуального осмотра. Оба продукта ПЦР имели равную интенсивность.
3) DEEP VENTTM полимераза высокой точности воспроизведения (New England Biolabs Inc, Beverly, MA.). Deep VentTM полимеразу для реакций ПЦР транспортировали с сухим льдом и хранили при температуре -20°C. Если при транспортировке прервать цепь хранения в замороженном виде, то фермент потеряет свою активность. Белок теряет активность с течением времени из-за повторяющегося процесса заморозки-оттаивания, что приводит к снижению ферментативной активности. Полностью активную Deep VentTM полимеразу наносили на растворимую PVA матрицу в 1x буфере ПЦР в присутствии трегалозы или валидамицина А с конечной концентрацией 5%. Концентрация на лунку (5 ед. на лунку) в 96-луночной планшете была эквивалентна концентрации хранящейся в замороженном виде Deep VentTM полимеразы, использованной для одной реакции ПЦР. Контрольную Deep VentTM полимеразу хранили в морозильнике при температуре -20°C. Лунку полностью гидратировали в течение 5-45 минут, используя 20 мкл 1x буфера ПЦР. Реакции ПЦР проводили при помощи стандартных протоколов ПЦР и продукт ПЦР подвергали электрофорезу в агарозном геле. Как показано на Фиг.14, продукты ПЦР секвеназ, хранящихся в замороженном и сухом виде, сравнивали путем визуального осмотра. Оба продукта ПЦР имели одинаковую интенсивность окраски в этидиум бромиде. При сравнении результатов повторного гидратирования через 5 минут с результатами повторного гидратирования через 60 минут количественных различий обнаружено не было.
B. Рестрикционные ферменты
По 20 ед. и 40 ед. на лунку HindIII наносили на растворимую матрицу в 1x буфера для расщепления в присутствии трегалозы и валидамицина А с конечной концентрацией 5%. Концентрация на лунку 96-луночной планшеты была равна концентрации хранящейся в замороженном виде Taq полимеразы, использованной для одной реакции ПЦР. Контрольную HindIII хранили обычным способом в морозильнике при температуре -20°C. Лунку полностью гидратировали в течение 5-45 минут, используя 20 мкл 1x буфера для рестрикционных ферментов. 1 мкг плазмиды puc19 расщепляли повторно гидратированным рестрикционным ферментом и расщепленную плазмиду подвергали электрофорезу в агарозном геле. Образцы полос ДНК хранящейся в замороженном и сухом виде HindIII сравнивали с нерасщепленной плазмидой путем визуального осмотра. Хранящиеся в замороженном и сухом виде ферменты показали одинаковую активность.
C. BIG DYETM циклическое секвенирование - фермент ABI Big DyeTM (Applied Biosystems Inc., Foster City, CA) для циклического секвенирования теряет активность с течением времени после повторяющихся процессов заморозки-оттаивания, что приводит к уменьшению длины считывания в реакции секвенирования и к снижению качества считывания.
Свежую, хранящуюся соответствующим образом, активную Big DyeTM (ABI) наносили на растворимую PVA матрицу в 1x реакционном буфере в присутствии трегалозы (Fluka #90210) с конечной концентрацией 5%. Для тестирования, если фермент Big DyeTM мог быть дегидратирован в присутствии плазмиды и праймеров для секвенирования без потери активности, Big DyeTM наносили в присутствии M13 прямого праймера и puc19. Концентрация на лунку в 96-луночной планшете была равна концентрации хранящейся в замороженном виде SequenaseTM (USB), использованной для одной реакции секвенирования. Контрольную SequenaseTM хранили в обычных условиях в морозильнике при температуре -20°C. Лунку полностью гидратировали в течение 30 минут, используя 20 мкл 1x реакционного буфера. Реакции ПЦР проводили согласно рекомендациям производителей для 35 циклов. Продукты ПЦР реакции циклического секвенирования очищали и анализировали при помощи ABI капиллярного прибора для секвенирования согласно инструкциям производителя. Последовательности хранящейся в замороженном и сухом виде Big DyeTM, а также высушенную Big DyeTM в присутствии или отсутствие плазмиды и праймеров для секвенирования сравнивали, используя программы для анализа последовательности Mac вектора. Качество последовательностей было одинаковым в первых 700 основаниях. Более длинное считывание получали, используя высушенные реагенты Big Dye, как показано на Фиг.15.
D. Протеазы
Протеазы представляют собой большие мишени для лекарственных препаратов. В настоящее время протеазы используются для скрининга небольших молекул для разработки новых лекарственных препаратов против вирусных заболеваний, таких как ВИЧ. Анализ протеаз часто является сложным для выполнения, поскольку активность протеаз представляет собой точную ферментативную реакцию, в которой для каждого анализа исходная активность хранящейся протеазы должна выверяться. Кинетика реакции изменяется на основании изменений активности протеазы после каждой процедуры заморозки-оттаивания. Этот раздел демонстрирует, что высушенные протеазы в присутствии растворимой матрицы были защищены от потери активности и могли быть активированы после повторной гидратации без изменений в профиле активности, что в результате дает возможность достаточно длительного хранения для любого использования фермента, такого как для проекта скрининга небольших молекул.
1) ВИЧ-протеаза - ВИЧ-протеазу наносили при концентрации 25 нМ на лунку 96-луночной планшеты заранее обработанной растворимой PVA матрицей в присутствии буфера активности (0,5 M MES, 25% глицерин, 1M NaCl, pH 5,25), содержащего трегалозу или валидамицин A с конечной концентрацией 2,5-10% (w/v). В качестве контроля ВИЧ-протеазу наносили в лунки полипропиленовых планшет в присутствии трегалозы или валидамицина без PVA матрицы. Высушенную ВИЧ-протеазу восстанавливали в 1x буфере активности в присутствии 150 мМ гуанидин гидрохлорида. Полного восстановления достигали через час после повторной гидратации. Активность ферментативной реакции регистрировалась при изучении кинетики с использованием флуорогенного пептида, содержащего две флуоресцентные молекулы, в FRET (флуоресцентный резонансный перенос энергии) анализе в течение 20-минутного курса. Реакцию анализировали на флуориметре с микротитр-планшетами Packard Fusion согласно инструкциям производителя.
Не могли восстановить ферментативную активность ВИЧ-протеазы, которую наносили только с трегалозой или валидамицином A без растворимой PVA матрицы. Напротив, 100% активность ВИЧ-протеазы восстанавливалась, если использовался фермент, который был нанесен на PVA матрицу в присутствии трегалозы, и 70% активность восстанавливалась у фермента, который был высушен с использованием только растворимой матрицы (PVA) без дополнительных стабилизирующих агентов.
2) FIV-протеаза - FIV (кошачий вирус иммунодефицита) представляет собой лентивирус, близкородственный ВИЧ. FIV-протеазу наносили в лунки, заранее обработанные высушенной растворимой матрицей, при концентрации 0,5 мкг на лунку в присутствии или без ингибитора пептидов, TL-3 (Lee et al., 1998 PNAS 95:939). Лунки, содержащие матрицу, протеазу и ингибитор TL-3, были полностью высушены и хранились при комнатной температуре. Высушенную FIV-протеазу повторно гидратировали в течение одного часа в 1x буфере активности в присутствии 150 мМ гуанидин гидрохлорида. Активность ферментативной реакции регистрировали при изучении кинетики с использованием флуорогенного пептида, содержащего две флуоресцентные молекулы, в FRET анализе в течение 20 минутного курса. Реакцию анализировали на флуориметре с микротитр-планшетами Packard Fusion согласно инструкциям производителя. Активность FIV-протеазы полностью восстанавливалась после процесса повторной гидратации, и ферментативная активность блокировалась TL-3, что показывает, что протеаза и ее ингибитор являются полностью активными после сухого хранения при температуре окружающей среды.
Трегалозу и валидамицин также сравнивали, как было описано выше, но относительно их воздействий на FIV протеазу при анализе протеазы на протективность ферментативной активности во время длительного сухого хранения с матрицей протеазы при температуре окружающей среды на растворимой матрице для хранения. Любая добавка протективно стабилизировала фермент, и относительно протективности фермента не было обнаружено различий (Фиг.17).
E. Лигаза - T4 ДНК лигазу (New England Biolabs, Beverly, MA, # M0202L) (400 ед. на лунку) наносили на растворимую PVA матрицу, изготовленную, как описано выше, в 1x буфере для лигирования в присутствии трегалозы или валидамицина А с конечной концентрацией 5%. Контрольную лигазу хранили в морозильнике при температуре -20°C. Лунку полностью гидратировали в течение 5-45 минут, используя 20 мкл 1x буфера для лигирования. 50 нг расщепленной SalI, плазмиды puc19, дефосфорилированной фосфатазой из кишок теленка, лигировали в течение ночи при помощи повторно гидратированной лигазы параллельно с лигазой, хранящейся в замороженном виде. Одну половину реакционной смеси после лигирования переносили в DH5-альфа компетентные бактериальные клетки. Клетки наносили на планшеты с LB агаром и степень трансформации анализировали путем подсчета колоний. В таких условиях могли формировать колонии только повторно лигированные плазмиды. Лигаза, хранящаяся в сухом виде, имела в 5 раз больше колоний, чем лигаза, хранящаяся в замороженном виде.
F. Анализ восстанавливаемой ВИЧ-протеазы - современный анализ ВИЧ-протеазы требует размораживания протеазы, ресуспендирования в буфере активности, ресуспендирования флуорогенного субстрата в его буферной системе, смешивания раствора и нанесения смеси на специальные флуоресцентные 96-луночные планшеты для предварительного тестирования активности размороженного фермента. После определения активности протеазы можно начинать анализ скрининга веществ ингибирования, и этот анализ обычно проводят в 96-луночном формате. Такая же процедура должна быть повторена, включая описанные выше этапы нанесения при помощи пипетки. Этот раздел показывает, как использовать протеазу, полученную согласно композициям и способам настоящего применения на растворимой матрице в сухом виде без обязательного для выполнения предварительного тестирования, поскольку в сухих условиях активность ВИЧ-протеазы остается стабильной.
Используя растворимую PVA матрицу, изготовленную, как описано выше, наносили ВИЧ-протеазу и FIV-протеазу и сушили в их соответствующих буферах активности при соответствующей реакционной концентрации. Флуорогенный субстрат для протеаз и лунку с отрицательным контролем, содержащую ингибитор протеаз, поставляли в их буфере в сухом виде в виде лунки на 96-луночных планшетах. Оператор скринирования должен был только добавлять одну воду или воду, содержащую вещество для скрининга, тестовый ингибитор, для повторной гидратации содержащей протеазу лунки, и воду в лунку с флуоресцентным субстратом. Соответственно, для повторной гидратации некоторых лунок с FIV-протеазой был включен TL-3 ингибитор, как показано выше. Время обработки для анализа было уменьшено более чем в 10 раз, и репрезентативные результаты показаны на Фиг.18. Аналогичное время сохранения может быть получено для других биохимических исследований, сортировки или экспериментальных протоколов.
Пример 5
Длительное хранение клеток при помощи растворимой PVA матрицы
Этот пример описывает длительное сухое хранение клеток E. coli на материале растворимой матрицы при температуре окружающей среды.
Равное количество бактерий Escherichia coli (DH5 альфа) ресуспендировали в LB среде роста и вносили в лунки 96-ти луночной планшеты: a) без растворимой матрицы в среде роста, b) с сухой растворимой PVA матрицей и c) смешивали с 5% валидамицином A и наносили на сухую растворимую матрицу. Планшеты сушили в течение ночи и хранили при температуре окружающей среды. Лунки с тремя различными условиями гидратировали в течение одного часа, используя среду роста, и содержимое лунок наносили на LB планшеты для бактериальных культур. Планшеты инкубировали при 37°C в течение ночи. Степень восстановления E. coli анализировали путем подсчета колоний бактерий, как показано на Фиг.19.
Растворимую матрицу также изготавливали и использовали для длительного сухого хранения клеток, включая другие бактериальные, растительные, животные или человеческие клетки, и для сухого хранения фагов, вирусов (например, лентивируса, бакуловируса и т.д.).
Варианты осуществления композиций и способов хранения на сухой матрице настоящего изобретения также предполагаются для использования с антибиотиками, РНК, ферментами и другими биологическими образцами, как представлено в настоящем описании.
Из вышесказанного очевидно, что хотя в настоящем описании с целью иллюстрации раскрыты определенные варианты осуществления настоящего изобретения, могут быть сделаны различные модификации без отступления от сущности и объема настоящего изобретения. Следовательно, настоящее изобретение не ограничено ничем кроме прилагаемой формулы изобретения.
Реферат
Группа изобретений относится к получению биологических материалов и образцов, помещению их в системы учета и управления запасами, использованию, хранению, отслеживанию, восстановлению, анализу биологических материалов и образцов, а также к автоматизации этих процессов. Раскрыты композиции и способы для автоматизированного хранения, отслеживания, восстановления и анализа биологических образцов, включая сухое хранение при температуре окружающей среды нуклеиновых кислот, белков (включая ферменты) и клеток, используя матрицу для сухого хранения, что позволяет восстановить биологически активный материал. Описано применение снабженного RFID меткой устройства для хранения биологических образцов, характеризующегося наличием растворимой или диссоциируемой матрицы, для поддержания биологических образцов, причем матрицы могут быть высушены и затем повторно гидратированы для восстановления образцов. Также раскрыты реализованные на базе компьютера системы и способы для поддержания данных об образцах. Достигается универсальность устройств и методик для хранения, восстановления, анализа и сравнения информации медико-биологических образцов. 9 н. и 58 з.п. ф-лы, 19 ил.
Формула
(а) крышку; и
(в) планшету для образцов, содержащую одну или множество лунок для образцов;
(с) по меньшей мере, одно радиочастотное устройство ретрансляции.
(a) крышку; и
(b) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца, причем одна или несколько из упомянутых лунок содержит материал матрицы, который растворяется или диссоциирует в растворителе; и
(c) по меньшей мере, одно радиочастотное устройство ретрансляции.
(I) устройство для хранения биологических образцов для одного или множества биологических образцов, содержащее:
(a) крышку;
(b) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца, причем одна или несколько из указанных лунок содержат материал матрицы, который растворяется или диссоциирует в растворителе; и
(c) по меньшей мере, одно радиочастотное устройство ретрансляции;
(II) один или несколько дополнительных реагентов.
приведение в контакт одного или множества биологических образцов с устройством для хранения биологических образцов, причем указанное устройство для хранения биологических образцов содержит (i) крышку, (ii) планшету для образцов, содержащую одну или множество лунок для образцов, которая выполнена с возможностью содержания биологического образца, причем одна или несколько из указанных лунок содержат материал матрицы, который растворяется или диссоциирует в растворителе и (iii) по меньшей мере, одно радиочастотное устройство ретрансляции; и хранения, тем самым, указанных биологических образцов.
(а) введение материала матрицы, который растворяется или диссоциирует в растворителе, в одну или множество лунок для образцов устройства для хранения биологических образцов, причем указанное устройство для хранения биологических образцов содержит (i) крышку и (ii) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца; (iii) по меньшей мере, одно радиочастотное устройство ретрансляции; и
(b) сушку одной или нескольких лунок для образцов, и подготовки, тем самым, устройства для хранения биологических образцов.
(a) приведение в контакт, одновременное или последовательное и в каком-либо ином порядке, в устройстве для хранения биологических образцов одного или множества биологических образцов с материалом матрицы, причем указанное устройство для хранения биологических образцов содержит (i) крышку и (ii) планшету для образцов, содержащую одну или множество лунок для образцов, которые выполнены с возможностью содержания биологического образца, причем одна или множество указанных лунок содержат материал матрицы, и при этом материал матрицы растворяется или диссоциирует в первом растворителе и (iii) по меньшей мере, одно радиочастотное устройство ретрансляции;
(b) сушку одной или нескольких лунок;
(c) поддержание устройства для хранения биологических образцов без охлаждения после этапов приведения в контакт и сушки; и
(а) ресуспендирование или повторное растворение биологического образца во втором растворителе, и на основании этого восстановление сохраненного биологического образца.
устройство для биологических образцов, содержащее одну или несколько лунок для образцов, которые выполнены с возможностью содержания биологического образца, причем одна или несколько упомянутых лунок содержат материал матрицы, которая растворяется или диссоциирует в растворителе;
реализованную на базе компьютера систему для приема и передачи данных, относящихся к устройству для образцов; и
радиочастотный интерфейс между устройством для образцов и реализованной на базе компьютера системой для обеспечения связи между реализованной на базе компьютера системой и устройством для образцов.
реализованную на базе компьютера систему для приема и передачи данных, относящихся к устройству для хранения образцов; и
радиочастотный интерфейс между устройством для образцов и реализованной на базе компьютера системой для обеспечения связи между реализованной на базе компьютера системой и устройством для образцов.
предоставление устройства для образцов для хранения одного или нескольких биологических образцов, причем упомянутое устройство для образцов содержит одну или несколько лунок для образцов, которые выполнены с возможностью содержания биологического образца, причем одна или несколько упомянутых лунок для образцов содержат материал матрицы, который растворяется или диссоциирует в растворителе;
предоставление реализованной на базе компьютера системы для приема, хранения и передачи данных, относящихся к устройству для образцов или биологическим образцам или и к тому и к другому;
предоставление радиочастотного интерфейса для обмена данными между устройством для образцов и реализованной на базе компьютера системой.
Документы, цитированные в отчёте о поиске
Тестирующее устройство, способ выполнения (био- и/или иммунно) химического теста (варианты), дозирующее устройство и набор

Комментарии