Фоторезистная композиция и полимер - RU2194295C2
Код документа: RU2194295C2
Чертежи







Описание
Изобретение относится к полимерам, содержащим полициклические мономерные звенья, и способам их использования в качестве фоторезистов при изготовлении интегральных схем. Более конкретно, изобретение относится к фоторезистным композициям, содержащим полимер, содержащий полициклические мономерные звенья, и, например, катионный фотоинициатор. Полимер содержит повторяющиеся боковые кислотно-лабильные группы, связанные с основной цепью полимера. Кислотно-лабильные группы могут быть селективно расщеплены с образованием повторяющихся полярных групп в основной полимерной цепи. Полимеры являются прозрачными по отношению к коротковолновому формирующему изображение излучению и проявляют устойчивость к реактивному ионному травлению.
Интегральные схемы (ИС) являются главными в производстве матриц электронных устройств. Их изготавливают последовательным образованием чередующихся и взаимосвязанных полос проводящих, полупроводниковых и непроводящих слоев на подходящей подложке (например, кремниевой пластине), которые селективно моделируются для образования схем и взаимосвязей с целью выполнения специфических электрических функций. Образование конфигурации ИС осуществляют различными известными в технике приемами литографии. Основным и важным технологическим методом в изготовлении ИС-устройств является фотолитография с использованием ультрафиолетового (УФ) излучения и излучения глубоко проникающего УФ-света или с использованием других излучений. На поверхность пластины наносят фоточувствительный полимерный слой (фоторезист) и высушивают его. Затем вплотную к фоторезистной пленке помещают фотомаску, содержащую в виде рисунка желаемую информацию. Фоторезист облучают через слой фотомаски одним или несколькими видами формирующего изображение излучения, включая УФ-излучение, электронное излучение, рентгеновское излучение или ионное излучение. Под воздействием облучения фоторезист претерпевает химические изменения, приводящие к изменению его растворимости. После облучения пластину погружают в раствор, проявляющий рисунок на фоточувствительной полимерной пленке (т. е. селективно удаляющей либо экспонированные, либо неэкспонированные зоны). В зависимости от вида используемого полимера или полярности проявляющего растворителя в процессе проявления удаляются либо экспонированные, либо неэкспонированные области пленки с раскрытием расположенной ниже подложки, после чего раскрытый или нежелательный материал подложки с нанесенной конфигурацией удаляется или изменяется в процессе травления с сохранением желаемого рисунка в функциональном слое пластины. Применяют плазменное травление, травление распылением и реактивное ионное травление (РИТ). Оставшийся фоторезистный материал действует как защитный барьер в процессе травления. Удаление оставшегося фоторезистного материала приводит к получению схем с нанесенным рисунком.
В производстве приборов, содержащих рисунок ИС, наиболее критической стадией является травление различных слоев на пластине. Одним из методов является погружение подложки и резиста с нанесенным рисунком в химическую ванну, в которой происходит воздействие на открытую поверхность подложки при сохранении неповрежденным самого резиста. Недостатком такого "мокрого" химического процесса является трудность достижения хорошо обозначенных краев на протравленных поверхностях. Это происходит вследствие химического подтравливания материала резиста и образования изотропного изображения. Иными словами, обычный химический процесс не обеспечивает селективности направления (анизотропии), что считается необходимым для достижения оптимальных функционально заданных размеров, соответствующих существующим технологическим требованиям. Помимо этого мокрый процесс приводит к нежелательным последствиям для окружающей среды и техники безопасности.
Для преодоления недостатков мокрого химического процесса были предложены различные "сухие" процессы. Такие сухие процессы включают пропускание газа через камеру и ионизацию газа путем наложения разности потенциалов между двумя электродами в присутствии газа. Плазму, содержащую ионизированное вещество, генерированное посредством создания напряжения, используют для травления помещенной в камеру подложки. Генерированное в плазме ионизированное вещество направляют на открытую подложку, где оно взаимодействует с поверхностью материала с образованием летучих продуктов, которые удаляют с поверхности. Типичными примерами сухого травления являются плазменное травление, травление распылением и реактивное ионное травление.
Реактивное ионное травление обеспечивает образование на подложке профилей с хорошо обозначенными вертикальными боковыми стенками, а также равномерность травления от подложки к подложке. Благодаря таким преимуществам реактивное ионное травление стало стандартным в производстве ИС.
В промышленности используют два типа фоторезистов: негативные и позитивные фоторезисты. Негативные резисты после облучения формирующим изображение излучением полимеризуются, сшиваются или изменяют растворимость таким образом, что подвергнутые облучению области становятся нерастворимыми по отношению к проявляющему раствору. Не подвергнутые облучению области остаются растворимыми и вымываются. Позитивные резисты действуют противоположным образом, приобретая растворимость в проявляющем растворе после облучения формирующим изображение излучением.
Основой одного из видов позитивного резистного материала являются новолачные фенолформальдегидные полимеры. Специфическим примером является используемый в промышленности материал Shipley AZ 1350, содержащий новолачную м-крезолформальдегидную полимерную композицию и диазокетон (эфир 2-диазо-1-нафтол-5-сульфокислоты). При облучении формирующим изображение излучением диазокетон превращается в карбоновую кислоту, которая в свою очередь превращает фенольный полимер в легко растворимый в проявляющем водном растворе слабого основания полимер.
В патенте US 4491628, выданном Ito и соавт., описаны позитивные и негативные фоторезистные композиции, содержащие генерирующие кислоту фотоинициаторы и полимеры с боковыми кислотно-лабильными группами. Поскольку каждая генерированная кислота снимает защиту у множества кислотно-лабильных групп, такой подход известен как химическая амплификация, служащая увеличению количественного выхода общего фотохимического процесса. Описанные полимеры включают виниловые полимеры, такие как полистиролы, поливинилбензоаты и полиакрилаты, замещенные повторяющимися боковыми группами, подверженными ацидолизу с получением продуктов, отличающихся растворимостью от своих предшественников. Предпочтительные кислотно-лабильные группы включают трет-бутиловые эфиры карбоновых кислот и трет-бутиловые карбонаты фенолов. В зависимости от природы используемого проявляющего раствора могут быть получены позитивные или негативные фоторезисты.
Тенденции развития электронной промышленности непрерывно требуют ИС, являющихся более быстродействующими и потребляющими меньше энергии. Для удовлетворения этим требованиям должны быть изготовлены ИС меньших размеров. Проводящие линии (т. е. линии связи) должны быть более тонкими и размещены ближе друг к другу. Значительное уменьшение размеров транзисторов и линий способствует увеличению эффективности ИС, например, увеличению объема хранимой информации и быстродействия микросхем. Для достижения более тонкой линии элемента ИС необходима более высокая разрешающая способность изображения. Более высокая разрешающая способность изображения возможна при более короткой длине волны источника, используемого для облучения фоторезистного материала. Однако известные ранее в технике фоторезисты, такие как новолачные фенолформальдегидные полимеры и замещенные стирольные полимеры содержат ароматические группы, которые по своей природе становятся более оптически плотными при длине световой волны менее приблизительно 300 нм. (ACS Symposium Series 537, Polymers for Microelectronics, Resists and Dielectrics, 203-rd National Meeting of the American Chemical Society, 1992, April 5-10, p. 2-24; Polymers for Electronic and Photonic Applications, Edited by C.P. Wong, Academic Press, p. 67-118). Источники с меньшей длиной волны обычно менее яркие, чем традиционные источники, требующие химической амплификации с использованием фотокислот. Непрозрачность ароматических полимеров по отношению к свету с короткой длиной волны является недостатком, так как под поверхностью полимера фотокислоты неравномерно облучаются источником света и, как следствие, полимер не проявляется. Для преодоления недостаточной прозрачности этих полимеров содержание ароматики в фоторезистных полимерах должно быть снижено. Если требуется прозрачность по отношению к глубокому УФ излучению (т. е. к облучению с длиной волны 248 нм и, особенно, 193 нм), то содержание ароматики в полимере должно быть минимальным.
Патент US 5372912 относится к фоторезистной композиции, содержащей акрилатный сополимер, фенольное связующее и фоточувствительный генератор кислоты. Акрилатный сополимер является продуктом сополимеризации акриловой кислоты, алкилакрилата или метакрилата и мономера, содержащего боковую кислотно-лабильную группу.
В то время, как композиция является достаточно прозрачной по отношению к УФ-излучению при длине волны около 240 нм, использование ароматического связующего ограничивает использование источников излучения с более короткой длиной волны. Как известно в области полимеров, улучшение одного свойства обычно достигается за счет другого свойства. При использовании акрилатных полимеров повышение прозрачности по отношению к УФ-излучению с более короткой длиной волны достигается за счет снижения устойчивости резиста по отношению к реактивному ионному травлению.
Во многих случаях улучшение прозрачности по отношению к формирующему изображение коротковолновому излучению приводит к эрозии резистного материала в последующем процессе сухого травления. Поскольку фоторезистные материалы обычно являются по своей природе органическими, а подложки, используемые при изготовлении ИС, являются обычно неорганическими, то фоторезистный материал по своей природе имеет более высокую скорость травления, чем материал подложки при использовании техники реактивного ионного травления (РИТ). При этом возникает необходимость в фоторезистном материале большей толщины, чем расположенная ниже подложка. В противном случае фоторезистный материал будет удален в процессе эрозии до того, как будет полностью завершено травление нижерасположенной подложки. Из этого следует, что резистный материал с меньшей скоростью эрозии может быть использован в виде более тонких слоев на поверхности подложки, подлежащей травлению. Более тонкие слои резистного материала позволяют достигнуть более высокой разрешающей способности, которая в конечном итоге, позволяет достигнуть более узких проводящих линий и транзисторов меньших размеров.
J. V. Crivello et al. (Chemically Amplified Electron-Beam Photoresists, Chem. Mater., 1996, 8, p. 376-381) описывают полимерную смесь, содержащую 20 вес.% полученного в процессе свободно-радикальной полимеризации гомополимера норборнена, содержащего лабильные кислотные группы, и 80 вес.% гомополимера 4-гидрокси-α-метилстирола, содержащего лабильные кислотные группы, предназначенную для использования в электронно-лучевых фоторезистах. Как указано авторами, повышенная оптическая плотность ароматических групп (особенно при высоких концентрациях) придает этим композициям непрозрачность и делает невозможным их использование при облучении формирующим изображение коротковолновым излучением с длиной волны менее 200 нм.
Описанные композиции являются пригодными лишь для электронно-лучевых фоторезистов и не могут быть использованы для формирования изображения посредством глубокого УФ-излучения (в особенности, для резистов с длиной волны 193 нм).
Crivello et al. использовали смесевые композиции, поскольку они обнаружили, что кислородная плазма имеет скорость травления, неприемлемо высокую для получения гомополимеров путем свободно-радикальной полимеризации норборненовых мономеров, содержащих лабильные кислотные группы.
Следовательно, существует потребность в фоторезистных композициях, совместимых с общей схемой химической амплификации и обеспечивающих прозрачность по отношению к коротковолновому формирующему.
Главной технической задачей изобретения является создание фоторезистной композиции, содержащей полимер, основная цепь которого содержит боковые кислотно-лабильные группы, генерирующий кислоту фотоинициатор.
Другой технической задачей изобретения является создание полимеров, имеющих повторяющиеся боковые кислотно-лабильные группы, которые могут быть расщеплены с образованием полярных групп.
Еще одной задачей изобретения является создание полимерных композиций, прозрачных по отношению к формирующему изображение коротковолновому излучению.
Следующей технической задачей изобретения является создание полимерных композиций, устойчивых к процессу сухого травления.
Еще одной задачей изобретения является создание полимерных композиций, прозрачных по отношению к формирующему изображение коротковолновому излучению и устойчивых к процессу сухого травления.
Другой задачей изобретения является создание полициклических мономеров, содержащих боковые кислотно-лабильные группы, способных полимеризоваться с образованием полимеров, поддающихся проявлению в водных растворах основания.
Эти и другие технические задачи изобретения достигаются полимеризацией реакционной смеси, содержащей полициклический мономер с функциональными кислотно-лабильными группами, растворитель, одно- или многокомпонентную каталитическую систему, содержащую источник ионов металла группы VIII Периодической системы. В многокомпонентных каталитических системах по изобретению источник ионов металла группы VIII используют в сочетании с одним или двумя металлоорганическими сокатализаторами и третьим компонентом. Одно- и многокомпонентные каталитические системы могут быть использованы с оптимальным агентом передачи цепи (АПЦ), выбранным из соединений, имеющих концевую олефиновую двойную связь между смежными атомами углерода, где, по меньшей мере, один из названных смежных атомов углерода содержит связанные с ним два атома водорода. АПЦ выбирают из ненасыщенных соединений, которые обычно являются не способными к катионной полимеризации, и поэтому исключают стиролы, виниловые простые эфиры и сопряженные диены.
Полученные полимеры используют в фоторезистных композициях, включающих генерирующий кислоту фотоинициатор, называемый иначе фоточувствительный генератор кислоты.
В изобретении предложена фоторезистная композиция, содержащая генерирующий кислоту фотоинициатор, растворитель, полимер, содержащий повторяющиеся полициклические
звенья, содержащие кислотно-лабильные группы, и, необязательно, ингибитор растворения. Другим объектом изобретения является полимер, представляющий собой продукт полимеризации мономерной композиции,
содержащей полициклический мономер и растворитель, в присутствии однокомпонентного катализатора формулы
EnNi(C6F5)2,
где Е означает
нейтральный лиганд-донор 2 электронов и n = 1 или 2, а указанный полициклический мономер выбран из мономеров, имеющих формулу

где заместители R1-R4, независимо друг от друга, выбраны из группы, включающей водород, нормальный и разветвленный алкил С1 -С10 и группы -(CH2)nC(O)OR*, -(CH2)n-C(O)OR, -(CH2)n-OR, -(CH2)n-ОС(O)R, -(CH2 )n-OC(O)OR, или -(CH2)n-C(O)R, -(CH2)nC(R)2CH(R)(C(O)OR**) и -(CH2)nC(R)2CH(C(O)OR**)2, при условии, что, по меньшей мере, один из заместителей R1-R4 выбран из группы, включающей кислотно-лабильную группу -(CH2)n -C(O)OR*, R означает водород или нормальный и разветвленный алкил С1-С10, m = 0 - 5 и n = 0 - 10, а R* означает группу, способную расщепляться генерирующим кислоту фотоинициатором и выбранную из группы радикалов, включающей -С(СН3)3, -Si(СН3)3, изоборнил, 2-метил-2-адамантил, тетрагидрофуранил, тетрагидропиранил, 3-оксо-циклогексанил, лактонил мевалоновой кислоты, дициклопропилметил и диметилпропилметил, R** независимо означает R и R*.
Настоящее изобретение относится к радиационно-чувствительной резистной композиции, содержащей генерирующий кислоту фотоинициатор и полимер, содержащий повторяющиеся боковые кислотно-лабильные группы вдоль основной полимерной цепи. Композицию, содержащую полимер и генерирующий кислоту фотоинициатор, наносят на подложку в виде тонкой пленки, высушивают в контролируемых условиях, облучают по смоделированной конфигурации рисунка и, в случае необходимости, дополнительно сушат в контролируемых условиях, чтобы способствовать дальнейшему снятию защиты. В тех местах пленки, которые подвергались облучению, повторяющиеся боковые кислотно-лабильные группы полимерной цепи расщепляются с образованием повторяющихся полярных групп. Обработанные таким образом облученные области селективно удаляют проявляющим щелочным раствором. Альтернативно, необлученные места полимера остаются неполярными и могут быть селективно удалены при обработке соответствующим неполярным растворителем для негативного проявления. Обращение изображения может быть легко достигнуто надлежащим выбором проявляющего раствора вследствие различия в растворимости облученных и необлученных частей полимера.
Полимеры по настоящему изобретению содержат повторяющиеся полициклические звенья, часть которых замещена кислотно-лабильными группами. Эти полимеры получают полимеризацией полициклических мономеров
согласно изобретению. Под термином "полициклические" (типа норборнен или функциональный норборнен) подразумевают мономер, содержащий, по меньшей мере, одну часть нонборнена, как показано ниже

Простейшим полициклическим мономером по изобретению является бициклический мономер бицикло[2.2.1]гепт-2-ен, обычно известный как нонборнен. Функциональные кислотно-лабильные группы вводят в полимерную цепь полимеризацией реакционной смеси, содержащей один или более полициклических мономеров с кислотно-лабильными заместителями, приведенных ниже под формулой I, в случае необходимости, в сочетании с одним или более полициклическим мономером, представленных ниже под формулами II, III, IV и V, в присутствии каталитической системы металла группы VIII Периодической системы.
Мономеры
Полициклические мономеры с кислотно-лабильными группами, используемые в
изобретении, выбирают из мономеров, имеющих указанную ниже формулу

где R1, R2, R3, R4 представляют собой заместители, выбранные из группы водород, линейный или разветвленный алкил С1-С10, -(CH2)n -C(O)OR*, -(CH2)n-C(O)R, -(CH2)n-OR, -(CH2)n-OC(O)R, -(CH2)n-C(O)R и -(CH2)n -OC(O)OR,
-(CH2)nC(R)2CH(R)(C(O)OR**) и -(CH2)nC(R)2CH(C(O)OR**)2, при условии,
что, по меньшей мере, один из заместителей от R1 до R4 представляет собой кислотно-лабильную группу -(CH2)nC(O)OR*, где R означает водород, линейный или разветвленный алкил С1-С10, а m = 0 - 5 и n = 0 - 10, предпочтительно 0; R* означает группу (т.е. блокирующую или защитную группу), которая способна расщепляться под действием генерирующего кислоту фотоинициатора, выбранную из групп -С(СН3)3, -Si(СН3)3, изоборнил, 2-метил-2-адамантил, тетрагидрофуранил, тетрагидропираноил, 3-оксоциклогексанонил, лактонил мевалоновой кислоты (3,5-диокси-3-метилвалериановая кислота), дициклопропилметил (Дцпм) и диметилциклопропилметил (Дмцп). R**, независимо друг от друга, означает R и R*, значение которых указано выше. Дцпм и Дмцп группы имеют соответственно следующие структуры

Полициклические мономеры указанных выше формул, содержащие заместители, выбранные из группы -(CH2)nC(R)2CH(R)(C(O)OR**) или -(CH2)nC(R)2CH(C(O)OR**)2, могут быть представлены следующими формулами


В приведенных выше формулах m предпочтительно имеет значение 0 или 1, более предпочтительно 0. Если m = 0, то предпочтительные структуры могут быть представлены следующей формулой

где заместители от R1 до R4 имеют указанное выше значение.
Специалисту в данной области техники очевидно, что для осуществления изобретения пригодны любые способные к фотокислотному расщеплению группы при условии, что они не ингибируют реакцию полимеризации.
Предпочтительными лабильными кислотными группами являются органические сложноэфирные группы, расщепляющиеся в присутствии кислоты. Предпочтительные лабильные кислотные группы включают сложноэфирные группы и карбонатные группы. Особенно предпочтительны группы трет-бутиловых эфиров карбоновых кислот.
При полимеризации мономеров формулы I получают полимер, основная цепь которого содержит боковые кислотно-чувствительные группы, которые затем расщепляют для придания полимеру полярности или растворимости.
Возможный, но необязательный второй мономер может быть представлен формулой
II

где нейтральные заместители R5-R8, независимо друг от друга, выбраны из группы -(CH2)n-C(O)OR'', -(CH2)n-OR'', -(CH2)n-OC(O)R'', -(CH2)n-OC(O)OR'', -(CH2)n -C(O)R'', -(CH2)nC(R*)2CH(R*)(C(O)OR*), и -(CH2)nC(R*)2CH(C(O)OR*)2, где p = 0 - 5, предпочтительно 0 или 1 и более предпочтительно 0, а n = 0 - 10, предпочтительно 0. Заместители от R5 до R8 могут, независимо друг от друга, означать водород, нормальный или разветвленный алкил С1-С10, при условии, что по меньшей мере, один из оставшихся заместителей от R5 до R8 выбран из одной из нейтральных групп, представленных выше. Заместители R, независимо друг от друга, означают водород, нормальный или разветвленный алкил С1-С10, R'' означает водород, прямой или разветвленный алкил С1-С10, моно- и полициклоалифатическую группу С4-С20, циклические простые эфиры, циклические кетоны и циклические эфиры (лактоны). Примерами моноциклоалифатических групп являются циклопропил, циклобутил, циклопентил, циклогексил и подобные. Примерами полициклоалифатических групп являются норборнил, адамантил, тетрагидродициклопентадиенил (трицикло[5.2.1.02,6]деканил) и подобные. Примеры простых циклических эфиров включают тетрагидрофуранил и тетрагидропиранил. Примером циклического кетона является 3-оксоциклогексанонил. Примером сложного циклического эфира или лактона является лактонил мевалоновой кислоты.
Предпочтительными мономерами формулы II являются С1-C5 алкиловые эфиры
карбоновой кислоты, предпочтительно метиловые и этиловые эфиры. Сложноэфирные функциональные группы придают гидрофильность, обеспечивая хорошую смачиваемость проявляющим раствором и улучшая
механические свойства пленки. Необязательный третий мономерный компонент представлен структурой формулы III

где заместители R9 - R12 независимо друг от друга, означают карбоксильную группу формулы -(CH2)nС(O)ОН, где q = 0 - 5, предпочтительно 0 или 1 и более предпочтительно 0, а n = 0 - 10, предпочтительно 0. Заместители от R9 - R12 независимо друг от друга могут означать водород, нормальный или разветвленный алкил С1-С10, при условии, что, по меньшей мере, один из оставшихся заместителей R9-R12 означает указанную выше карбоксильную группу.
Мономеры, содержащие карбоксильную функциональную группу, придают полимеру гидрофильность, что, как следствие, способствует высокой скорости проявления полимера в водном растворе основания.
Возможный мономер формулы IV представлен следующей формулой

где заместители R13 - R16, независимо друг от друга, означают нормальный или разветвленный алкил С1-С10, а r = 0 - 5, предпочтительно 0 или 1, особенно предпочтительно 0. Любой заместитель от R13 до R16 может означать водород при условии, что по меньшей мере, один из оставшихся заместителей от R13 до R16 выбраны из указанных выше алкильных групп. Особенно предпочтительным алкильным заместителем является децил.
Полимеризация алкилзамещенных мономеров в цепь полимера является методом регулирования температуры стеклования (Тg) полимера, как описано в патенте US 5468819, выданном Goodall et al.
Экономичной схемой получения полициклических мономеров с функциональными и углеводородными
заместителями согласно изобретению является реакция Дильса-Альдера, согласно которой циклопентадиен (ЦПД) или замещенный циклопентадиен взаимодействует с соответствующим образом замещенным диеном при
повышенной температуре с образованием замещенного полициклического аддукта по следующей реакционной схеме:

Другие полициклические аддукты получают термическим пиролизом дициклопентадиена в присутствии подходящего диена. Реакция протекает путем первоначального пиролиза дициклопентадиена (ДЦПД) в ЦПД с последующим взаимодействием ЦПД и диена по реакции Дильса-Альдера с образованием аддуктов по следующей схеме:

где заместители от R'' до R'''' независимо друг от друга имеют значения, указанные выше для заместителей от R1 до R16 в формулах I, II, III и IV.
Например, 2-норборнен-5-карбоновая кислота (бицикло[2.2.1]гепт-5-ен-2-карбоновая кислота) может быть получена по реакции Дильса-Альдера взаимодействием циклопентадиена с
акриловой кислотой по следующей реакционной схеме:

Соответствующий трет-бутиловый эфир карбоновой кислоты может быть получен взаимодействием функциональной карбоксильной группы с изобутиленом в присутствии небольшого количества кислоты при пониженной температуре (т.е. от (-30)oС до (-20)oС) по следующей схеме:

Другим предпочтительным методом получения трет-бутилового эфира норборнен карбоновой кислоты является взаимодействие циклопентадиена с трет-бутилакрилатом по реакции Дильса-Альдера.
Другим способом синтеза замещенных
кислотными и сложноэфирными группами мономеров по настоящему изобретению является получение полициклических мономеров, замещенных в орто-положении сложноэфирными группами, с последующим гидролизом их
с образованием функциональных карбоксильных групп, либо частичным гидролизом с образованием сложноэфирных функциональных групп. Карбоксильные функциональные группы могут быть этерифицированы с
образованием желаемого сложного эфира. Замещенные в орто-положении сложноэфирными группами мономеры по изобретению имеют формулу V

где заместители R17, R18 и R19 независимо друг от друга представлены нормальный или разветвленной С1-C5 алкильной группой или любой из R17, R18 и R19 вместе с атомом кислорода, к которому он присоединен, образует замещенное или незамещенное 5 - 10-членное циклическое или бициклическое кольцо, содержащее от 3 до 8 атомов (исключая замещающие группы), s = 0 - 5, предпочтительно 0, а t = 1 - 5, предпочтительно 1. Примерами структур, в которых s = 0, t = 1 и заместители R17, R18 и R19 вместе с атомами кислорода, к которым они прикреплены, образуют циклическое или бициклическое кольцо, приведены ниже в виде формул Va, Vb, Vc

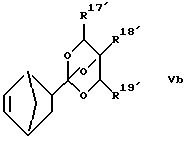

где заместители R17', R18' и R19' независимо друг от друга означают водород и нормальный, и разветвленный С1-C5 алкил. Мономеры, замещенные в орто-положении сложноэфирной группой по изобретению, могут быть получены согласно, так называемому, синтезу Пиннера (A. Pinner, Chem. Ber., 1883, 16, 1643) и способом, предложенным S.M. McElvain, J.T. Venerable (J. Am. Chem. Soc. , 1950, 72, p. 1661); SM. McElvain, C.L. Aldridge (J. Am. Chem. Soc., 1953, 75, р. 3987). Типичный пример синтеза соответствует представленной реакционной схеме I (см. в конце описания).
Альтернативный способ синтеза заключается в обработке алкилакрилата триалкилоксоний тетрафторборатной солью с последующей обработкой солью щелочного металла (алкоголятом натрия) с получением орто-триалкоксиметилового сложного эфира. (H. Meerwein, P. Borner, O. Fuchs, H.J. Sasse, H. Schrodt and J. Spille, Chem. Ber., 1956, 89, p. 2060).
Как уже отмечалось выше, орто-эфирные группы могут подвергаться реакции гидролиза в присутствии в качестве катализатора слабой кислоты, такой как бромистоводородная, йодистоводородная и уксусная кислота с образованием карбоновой кислоты. В свою очередь, карбоновая кислота может быть этерифицирована в присутствии алифатического спирта и кислотного катализатора с образованием соответствующего сложного эфира. Должно быть понятно, что в случае полициклических мономеров, замещенных в орто-положении на две и более сложноэфирные группы, последние могут быть частично гидролизованы в кислотные группы с образованием кислоты и обычного сложного эфира того же самого мономера (см. схему II).
Другим, более предпочтительным способом получения бифункциональных полициклических мономеров, является гидролиз и частичный гидролиз ангидрида эндо-5-норнборнен-2,3-дикарбоновой кислоты (надиевого
ангидрида). Надиевый ангидрид может быть полностью гидролизован в дикарбоновую кислоту, либо частично гидролизован до кислоты и сложного эфира или диэфира, как это показано на схеме III,
где
R17 независимо означает прямой или разветвленный алкил С1-С5. Предпочтительно R17 означает метил, этил или трет-бутил. Предпочтительно при синтезе надиевого
ангидрида в качестве исходного вещества используют экзо-изомер. Экзо-изомер легко получают нагреванием эндо-изомера при 190oС с последующей рекристаллизацией из соответствующего
растворителя (толуол). Для получения дикарбоновой кислоты по реакционной схеме 1 просто гидролизуют надиевый ангидрид в кипящей воде с получением почти что количественного выхода целевого продукта.
Для получения смеси мономеров с карбоксильными и алкилэфирными группами согласно схеме 3 надиевый ангидрид нагревают с обратным холодильником в течение от 3-х до 4-х часов в присутствии
соответствующего алифатического спирта (R17ОН). Альтернативно этот же продукт может быть получен взаимодействием сначала надиевого ангидрида с алифатическим спиртом и триалкиламином с
последующей обработкой разбавленной соляной кислотой. Диэфир, замещенный идентичными алкильными группами (R17) может быть получен из дикарбоновой кислоты взаимодействием ее с
триалкилоксонийтетраборатом, например, с R173О[ВF4] в метиленхлориде при комнатой температуре в присутствии диизопропилэтиламина. Для получения сложных эфиров
с различными алкильными группами R17 в качестве исходного вещества используют смешанный продукт из кислоты и сложного эфира, полученный по схеме 3. В этом случае кислотные группы
этерифицируют как показано на реакционной схеме 2. Однако используют триалкилоксонийтетрафторборат с другими алкильными группами, отличными от алкильных групп, уже имеющихся в сложноэфирных
функциональных группах.
Следует отметить, что мономеры предшествующей стадии, содержащие функциональные группы, соответствующие предшествующей стадии, могут быть превращены в мономеры с желаемыми функциональными группами до полимеризации, либо эти мономеры могут быть сначала полимеризованы, а затем полученные соответствующие полимеры, содержащие в качестве заместителей те же функциональные группы, что и на предшествующей стадии, могут быть подвергнуты последующей реакции для получения желаемых функциональных групп.
В объеме данного изобретения предполагается, что у мономеров формул от I до V, где m, p, q, r и s = 0, метиленовый мостик может быть замещен кислородом с получением производных 7-оксо-норборнена.
Предполагается также, что для использования при длине волны 248 нм заместители от R5 до R16 и R11 в формулах II, III и IV могут быть ароматическими, такими как фенил.
Полимеры
Один или более полициклических мономеров, замещенных лабильными кислотными группами, формулы I могут быть полимеризованы отдельно или в смеси с одним или более полициклическими
мономерами формулы II, III, IV и V. Предполагается также, что полициклические мономеры формулы I-V могут быть сополимеризованы с окисью углерода для получения сополимеров полициклических мономеров и
окиси углерода. Сополимеры норборнена, имеющие боковые карбоксильные группы, и окиси углерода описаны в патенте US 4960857, который приведен здесь в качестве ссылки. Мономеры формул I-V и окись
углерода сополимеризуют в присутствии каталитической системы, содержащей палладий, как описано в Chem. Rev., 1996, 96, р. 663-681. Специалисту понятно, что сополимеры из чередующихся звеньев
полициклических мономеров и окиси углерода могут существовать в кето- или спирокетальной изомерной форме. Соответственно, настоящее изобретение предполагает использование гомополимеров и сополимеров,
содержащих беспорядочно повторяющиеся звенья, полученные (полимеризованные) из мономера или мономеров формулы I, сополимеров, содержащих произвольно повторяющиеся звенья, полученных (полимеризованных)
из мономера(ов) формулы I, возможно, в смеси с любым мономером(ами) формул II-V. Кроме того, настоящее изобретение предполагает использование сополимеров, содержащих повторяющиеся звенья, полученные
(полимеризованные) из окиси углерода и мономера(ов), представленных формулами I-V.
Полимеры по настоящему изобретению являются главным компонентом композиции. Полимер обычно содержит от 5 до 100 мол.% мономера (повторяющееся звено), содержащего лабильные кислотные группы. Предпочтительно, полимер содержит около 20-90 мол.% мономера, содержащего лабильные кислотные группы. Более предпочтительно, полимер содержит около 30-70 мол.% мономера, содержащего лабильные функциональные кислотные группы. Остальная часть полимера состоит из повторяющихся звеньев, полимеризованных из возможных мономеров формулы II-V. Выбор и количество специфических мономеров, используемых в полимере, может изменяться в соответствии с желаемыми свойствами. Например, изменением количества карбоксильных функциональных групп в полимерной цепи может быть достигнута желаемая растворимость полимера в различных проявляющих растворителях. Для улучшения механических свойств полимера и радиационной чувствительности системы можно варьировать мономеры, содержащие сложноэфирные функциональные группы. Наконец, можно регулировать температуру стеклования полимера включением в полимерную цепь повторяющихся циклических звеньев, содержащих длинноцепочечные алкильные группы, такие как децил.
Существует несколько способов полимеризации циклических олефиновых мономеров, таких как норборнен и высшие циклические (полициклические) мономеры, содержащие группы норборнена. Они включают: (1) метатезисную полимеризацию с раскрытием цикла (МПРЦ); (2) МПРЦ с последующей гидрогенизацией и (3) аддитивную полимеризацию. Каждый из названных выше способов приводит к получению полимеров со специфической структурой как это показано на схеме 1.
МПРЦ-полимер имеет структуру, отличную от аддитивного полимера. МПРЦ-полимер содержит повторяющиеся звенья, содержащие на одно циклическое звено меньше по сравнению с исходным мономером. Повторяющиеся звенья соединены между собой в ненасыщенной полимерной цепи, как это показано на схеме 1. Вследствие этой ненасыщенности полимер, предпочтительно, должен быть подвергнут последующей гидрогенизации для придания полимерной цепи устойчивости к окислению. Напротив, аддитивные полимеры не имеют никакой С=С-ненасыщенности в полимерной цепи, несмотря на то, что они получены из того же самого мономера.
Мономеры по изобретению могут быть полимеризованы аддитивной полимеризацией и метатезисной полимеризацией с раскрытием кольца (МПРЦ), предпочтительно с последующей гидрогенизацией.
Циклические полимеры по настоящему изобретению имеют следующие структуры:


где заместители от R' до R'''', независимо друг от друга, представляют собой радикалы от R1 до R19, значение которых определено в приведенных выше формулах I-V, m = 0 - 5 и а означает количество повторяющихся звеньев в полимерной цепи.
МПРЦ-полимеры по настоящему изобретению получают полимеризацией в присутствии специфического катализатора для такой полимеризации в соответствующем растворителе. Способы МПРЦ полимеризации и последующей гидрогенизации полученных таким образом полимеров описаны в патентах US 5053471 и 5202388, приведенных здесь в качестве ссылки.
Согласно одному варианту МПРЦ полициклические мономеры по изобретению могут быть полимеризованы в присутствии однокомпонентного комплексного рутениевого или осмиевого карбенового катализатора, такого как описано в WO 95-US 9655. Сотношение мономера и катализатора должно составлять от приблизительно 100:1 до приблизительно 2000:1, преимущественно около 500:1. Реакция может быть проведена в галогенсодержащем углеводородном растворителе, таком как дихлорэтан, дихлорметан, хлорбензол и подобные или в углеводородном растворителе, таком как толуол. Количественное содержание растворителя в реакционной среде должно быть достаточным для достижения концентрации твердых веществ от приблизительно 5 мас.% до приблизительно 40 мас.%, предпочтительно от 6 мас.% до 25 мас.%. Реакция может быть проведена при температуре около от 0oС до 60oС, предпочтительно от 20oС до 50oС.
Предпочтительным металлкарбеновым катализатором является бис(трициклогексилфосфин)бензилиденрутений. Неожиданно было найдено, что этот катализатор может быть использован в качестве катализатора первоначальной МПРЦ-реакции и как эффективный катализатор гидрогенизации для получения практически насыщенного МПРЦ-полимера. Использования какого-либо дополнительного катализатора гидрогенизации не требуется. После первоначальной реакции МПРЦ для гидрогенизации полимерной цепи требуется лишь поддерживать давление водорода над реакционной средой при температуре выше около 100oС, но ниже около 220oС, предпочтительно от около 150oС до около 200oС.
Аддитивные полимеры по настоящему изобретению могут быть получены методами стандартной свободно-радикальной полимеризации в растворе, хорошо известными специалистам. Мономер формулы I-V может быть подвергнут гомо- или сополимеризации в присутствии малеинового ангидрида. Методы свободно-радикальной полимеризации описаны в Encyclopedia of Polymer Science, John Wiley & Sons, 1988, 13, р. 708.
В качестве альтернативы и, предпочтительно мономеры по настоящему изобретению полимеризуют в присутствии одно- или многокомпонентной каталитической системы, содержащей источник ионов металла группы VIII, предпочтительно палладия или никеля. Неожиданно было найдено, что полученные таким образом полимеры обладают превосходной прозрачностью по отношению к глубокому УФ-свету (193 нм) и проявляют прекрасную устойчивость к реактивному ионному травлению.
Предпочтительные полимеры по настоящему изобретению полимеризуют из реакционной смеси, содержащей, по меньшей мере, один полициклический мономер формулы I, растворитель, каталитическую систему, содержащую источник ионов металла группы VIII и, в случае необходимости, агент перевода цепи. Каталитическая система может содержать однокомпонентный катализатор на основе металла группы VIII или многокомпонентный катализатор на основе металла группы VIII.
Однокомпонентные системы
Согласно одному
варианту однокомпонентная каталитическая система по настоящему изобретению содержит катионный комплекс металла группы VIII и слабо связанный с ним донорно-акцепторной связью противоанион как это
представлено нижеследующей формулой
[LyMXz][СA]a
катионный комплекс противоанион
где L означает лиганд, содержащий 1, 2 или 3π-связи;
М означает переходный металл группы VIII; Х означает лиганд, содержащий одну σ-связь и от 0 до 3π-связей; у = 0, 1 или 2 и z = 0 или 1, причем у и z одновременно не могут оба означать 0
и если у = 0, то а = 2, и, если у = 1, то а = 1; СА означает слабо связанный анион.
Выражение "слабо связанный донорно-акцепторной связью противоион" означает анион, который лишь слабо координирован к катиону, вследствие чего он остается практически лабильным для замещения нейтральным основанием Льюиса. Более специфично это выражение означает анион, который при выполнении функции стабилизирующего аниона в каталитической системе по настоящему изобретению не переносит анионного заместителя или его части к катиону. Противоанион является не окисляющимся, не восстанавливающимся, не нуклеофильным и относительно инертным.
L является нейтральным лигандом, слабо координированным к катионному комплексу металла группы VIII. Другими словами, лиганд является относительно инертным и легко замещается в катионном комплексе металла внедряющимся мономером в растущей полимерной цепи. Подходящие содержащие π-связь лиганды включают моноолефины C2-С12 (например, 2,3-диметил-2-бутен), диолефины С4-С12 (например, норборнадиен) и ароматические соединения C6-C20. Предпочтительным лигандом L является хелатирующий бидентат цикло(С6-С12)диолефина, например, циклооктадиен (ЦОД) или дибензоциклооктадиен, или ароматическое соединение, такое как бензол, толуол или мезитилен.
Металл группы VIII выбран из металлов группы VIII Периодической системы. Предпочтительно М выбран из группы, включающей никель, палладий, кобальт, платину, железо и рутений. Наиболее предпочтительными металлами являются никель и палладий.
Лиганд X выбран из (i) группы, образующей в катионном комплексе одинарную σ-связь металл-углерод (при отсутствии π -связей) с металлом, или (ii) группы, образующей в катионном комплексе одинарную σ-связь металл-углерод и 1-3π-связей с металлом. Согласно (i) группа связана с металлом группы VIII одинарной σ-связью металл-углерод при отсутствии π-связей. Примерами лигандов в этом случае являются: С1-С10алкил такой, как метил, этил, нормальный или разветвленный алкил, такой как пропил, бутил, пентил, неопентил, гексил, гептил, октил, нонил и децил и С7-С15 аралкил, такой как бензил. В случае варианта (ii), описанном выше, катион содержит углеводородную группу, непосредственно связанную с металлом одинарной σ- связью металл-углерод, а также, по меньшей мере, одной, но не более трех π-связей. Под углеводородной группой подразумевают группу, способную стабилизировать катионный комплекс металла группы VIII за счет образования σ-связи углерод-металл и от одной до трех π-связей, которые могут быть коньюгированными и неконьюгированными. Представителями углеводородных групп является С3-С20 алкенил, который может быть нециклическим, моноциклическим или полициклическим и может быть замещенным нормальный или разветвленной С1-С20 алкокси-группой, C6-С15 арилокси-группой или галогеном (например, Сl и F).
Предпочтительно Х является единственным аллильным лигандом или его канонической формой, образующей σ-связь и π-связь, или соединением, образующим, по меньшей мере, одну олефиновую π-связь с металлом и σ-связь с металлом от отдаленного от центра углеродного атома, отделенного от олефинового углеродного атома, по меньшей мере, двумя простыми углерод-углеродными связями (вариант iii).
Специалисту должно быть совершенно ясно, что при отсутствии лиганда L или Х (т.е. у или z = 0) металлический катионный комплекс будет слабо связан с растворителем, в котором осуществлялась реакция. Примерами растворителей могут быть (но не ограничиваются ими) галогенированные углеводороды такие, как четыреххлористый углерод, хлороформ, дихлорметан, 1,2-дихлорэтан и ароматические растворители такие, как бензол, толуол, мезицилен, хлорбензол и нитробензол и подобные. Более подробное обсуждение пригодных растворителей будет проведено ниже.
Некоторые выбранные варианты катионных комплексов металлов группы VIII однокомпонентных каталитических систем по изобретению показаны ниже.
Структура VII иллюстрирует вариант (i), в котором лиганд Х означает метильную группу, связанную с металлом одинарной σ-связью металл-углерод, а лиганд L является циклооктадиеном (ЦОД), слабо координированным по отношению к палладиевому металлу двумя олефиновыми π-связями. В приведенной структуре М, предпочтительно представляет собой палладий или никель.

Структуры VIII, IX и X иллюстрируют различные примеры варианта (ii), где Х является аллильной группой, связанной с металлом (палладий показан исключительно с целью иллюстрации) одинарной σ-связью металл-углерод и, по меньшей мере, одной, но не более чем тремя π-связями.
В структуре VIII L отсутствует, но ароматическая группа, создающая три π-связи, слабо координирована по отношению к палладиевому металлу; Х означает аллильную группу, обеспечивающую одинарную σ-связь металл-углерод и олефиновую π-связь с палладием.
В структуре IX L означает циклооктадиен (ЦОД), а Х является аллильной группой, обеспечивающей σ-связь металл-углерод и олефиновую π-связь с палладием.
Структура Х иллюстрирует вариант, в котором лиганд Х является ненасыщенной углеводородной группой, обеспечивающей σ-связь металл-углерод, конъюгированную π-связь и две дополнительные π-связи с палладием; L отсутствует.
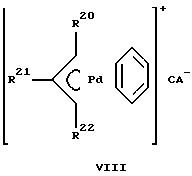


Заместители R20, R21, R22 будут подробно описаны ниже.
Структуры XI и XII иллюстрируют примеры варианта (iii), где L означает циклоотадиен и Х является лигандом, обеспечивающим, по меньшей мере одну олефиновую π-связь с металлом группы VIII и σ-связь с металлом от удаленного от центра атома углерода, отдаленного от любого олефинового атома углерода, по меньшей мере, двумя простыми связями углерод-углерод.


Описанные выше катионные комплексы металла группы VIII ассоциированы со слабо координирующим или не координирующим противоионом СА-, который является относительно инертным, слабонуклефильным и обеспечивает получение катионного комплекса, значительно растворимого в растворителе реакционной смеси. Анион выбирают с учетом требований лабильности, стабильности и инертности по отношению к катионному комплексу металла группы VIII в конечном образце катализатора и придания однокомпонентному катализатору по изобретению растворимости в растворителях, используемых по настоящему изобретению. Анионы, стабильные при взаимодействии с водой или кислотами Бренстеда и не имеющие протонов кислоты, расположенных на наружной стороне аниона (т. е. анионные комплексы, не взаимодействующие с сильными кислотами или основаниями), обладают необходимой стабильностью для квалификации их в качестве стабильного аниона для каталитической системы. Свойства аниона, важные для максимальной лабильности, включают общий размер и форму (т.е. большой радиус кривизны) и нуклефильность.
В общих чертах подходящим анионом может являться любой стабильный анион, позволяющий растворить катализатор в выбранном растворителе и удовлетворяющий следующим требованиям: (1) анион должен образовывать стабильные соли с упомянутыми выше кислотами Льюиса, кислотами Бренстеда, восстанавливающимися кислотами Льюиса, протонированными основаниями Льюиса, катионами таллия и серебра; (2) отрицательный заряд аниона должен быть делокализован по структуре аниона или локализован в ядре аниона; (3) анион должен быть относительно слабо нуклеофильным и (4) анион не должен являться сильным восстановителем или окислителем.
Анионами, удовлетворяющими названным критериям, являются анионы, выбранные из группы, включающей тетрафториды Ga, Al или В; гексафториды Р, Sb или As;
перфторацетаты, пропионаты и бутираты, гидрированные перхлораты, толуолсульфонаты, трифторметилсульфонаты и замещенные тетрафенилбораты, замещенные в фенильном кольце на фтор или трифторметил.
Выбранные примеры противоанионов включают ВF4-, PF6-, АlF3О3SСF3-, SbF6-, SbF5SO3F-, AsF6-, трифторацетат (СF3СО2-), пентафторпропионат (C2F5CO2-), гептафторбутират (CF3CF2CF2CO2-), перхлорат (СlO4-
•Н2О), п-толуолсульфонат (п-СН3С6Н4SО3-) и тетрафенилборат, имеющий формулу

где R'' независимо означает водород, фтор и трифторметил и n = 1 до 5.
Предпочтительный однокомпонентный катализатор в
названном выше варианте имеет формулу

Катализатор содержит π-аллильный комплекс металла группы VIII со слабокоординирующим противоанионом. Аллильные группы катионного комплекса металла создаются с помощью соединения, содержащего аллильные функциональные группы, связанные с атомом металла одинарной углерод-металл σ-связью и олефиновой π-связью. Металл М группы VIII, предпочтительно выбран из никеля и палладия. Наиболее предпочтительным металлом является палладий. Было неожиданно найдено, что такие однокомпонентные катализаторы, у которых М является палладием и катионный комплекс не содержит других лигандов, кроме аллильных функциональных групп (т.е. Ly=0), проявляют превосходную активность при полимеризации функциональных полициклических мономеров, таких как мономеры, содержащие силильные функциональные группы, согласно изобретению. Как обсуждалось выше, должно быть понятно, что катализаторы сольватированы разбавителем в реакционной среде, который может рассматриваться как очень слабый лиганд по отношению к металлу группы VIII в катионном комплексе.
Заместители R20, R21 и R22 в аллильной группе, представленной выше в структурах VIII, IX и XIII, независимо друг от друга, означают водород, разветвленный или неразветвленный алкил С1-C5 такой, как метил, этил, н-пропил, изопропил и трет-бутил, C6-C14 арил такой, как фенил и нафтил, С7-С10 аралкил такой, как бензил, -COOR16, -(CH2)nOR16, Cl и циклоалифатический радикал C5-С6, где R16 означает алкил С1-C5 такой, как метил, этил, н-пропил, изопропил, н-бутил и изобутил, а n = 1 - 5.
Любые два заместителя из R20, R21
и R22 могут быть соединены друг с другом с образованием циклических и полициклических кольцевых структур, но необязательно. Циклическая кольцевая структура может являться карбоциклической
или гетероциклической. Предпочтительно любые два заместителя R20, R21 и R22 вместе с атомами углерода, с которыми они связаны, образуют кольца, содержащие от 5 до 20
атомов. Представителями гетероатомов являются азот, сера и карбонил. Примерами циклических групп с аллильной функциональностью являются следующие структуры:

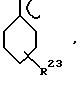





где R23 означает водород, нормальный или разветвленный алкил С1-С5, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил и пентил, R24 означает метилкарбонил и R25 означает нормальный или разветвленный алкил С1-C20. Противоанион СА- охарактеризован выше.
Дополнительные примеры π-аллильных комплексов металлов представлены в R. G. Guy and B.L. Shaw, Advances in Inorganic Chemistry and Radiochemistry, New York, Academic Press Inc., 1962, vol. 4; J. Birmingham, E. de Boer, M.L. H. Green, R. B. King,

Однокомпонентный катализатор вышеупомянутого варианта может быть получен соединением лигированного галоидного компонента металла группы VIII с солью, которая создает противоион для образующегося впоследствии катионного комплекса металла. Лигированное соединение галогенида металла группы VIII, соль, создающая противоанион и, возможно, соединение, содержащее π-связь, например, циклооктадиен, соединяют в растворителе, способном сольватировать образованный однокомпонентный катализатор. При этом используют, предпочтительно тот же самый растворитель, что и введенный в реакционную среду. Катализатор может быть образован предварительно в растворителе или непосредственно (in situ) в реакционной среде.
Пригодными солями, создающими противоанионы, являются любые соли, способные обеспечивать анионы, описанные выше. Например, соли натрия, лития, калия, серебра, таллия и аммония,
в которых анион выбран из противоанионов (СА-), охарактеризованных выше. Примерами противоанионов, образующих соли, являются TIPF6, AgPF6, AgSbF6, LiВF4, NН4PF6, KAsF6, AgC2F5CO2, AgBF4, АgСF3СО2, АgСlO4•Н2О,
AgAsF6, АgСF3СF2СF2СО2, AgC2F5CO2, (С4Н9)4NВ(С6F5)4 и

Специфический катализатор [аллил-Рd-циклооктадиен]+РF6- получают предварительным образованием лигированного соединения галогенида палладия, например, бис(аллил Pd бромида), которое затем подвергают расщеплению агентом отщепляющим галоген, в виде соли, создающей противоанион, т.е. TIPF6, в присутствии циклооктадиена. Схему реакции см. в конце описания.
После расщепления остается только один циклооктадиеновый лиганд, связанный двумя π-связями с палладием. Аллильная функциональная группа связана с палладием одной σ-связью металл-углерод и одной π-связью.
Для получения предпочтительных однокомпонентных катализаторов, содержащих комплексное соединение π-аллил металл группы VIII/противоанион, соответствующих структуре XIII, приведенной выше, в которой М означает палладий, аллилпалладий хлорид соединяют с желаемым противоионом, образующим соль, предпочтительно соли серебра с противоанионом в соответствующем растворителе. Хлоридный лиганд поступает от аллилпалладиевого комплекса в виде осажденного хлорида серебра (AgCl), который может быть отфильтрован из раствора. Однокомпонентный катализатор, содержащий аллилпалладиевый катионный комплекс/противоанион, остается в растворе. Палладий лишен какого-либо лиганда, кроме аллильной функциональной группы.
Альтернативный однокомпонентный катализатор, используемый в
изобретении, может быть представлен следующей формулой:
Pd[R27CN]4[СА-]2,
где R27 независимо означает нормальный или
разветвленный алкил С1-С10 и СА- означает охарактеризованный выше противоанион.
Другая однокомпонентная каталитическая система для получения полимеров,
используемых в изобретении, соответствует формуле
EnNi(C6F5)2,
где n = 1 или 2 и Е представляет собой нейтральный лиганд - донор 2
электронов. При n=1, Е предпочтительно является π-ареновым лигандом, таким как толуол, бензол и мезитилен. При n=2, E предпочтительно означает диэтиловый эфир, тетрагидрофуран (ТГФ) и диоксан.
Сотношение мономера и катализатора в реакционной среде может изменяться от около 2000:1 до около 100:1. Реакция может быть проведена в углеводородном растворителе, таком как циклогексан, толуол и
подобные при температуре от около 0oС до около 70oС, предпочтительно приблизительно от 10oС до 50oС и, более предпочтительно от около 20oС до
около 40oС. Предпочтительными катализаторами указанной выше формулы являются: толуолбис(перфторфенил)никель, мезитиленбис(перфторфенил)никель, бензолбис(перфторфенил)никель,
бис(тетрагидрофуран)бис(перфторфенил) никель и бис(диоксан)бис(перфторфенил)никель.
Многокомпонентные системы
Многокомпонентные каталитические системы по изобретению содержат
источник ионов металла группы VIII в сочетании с одним или более металлоорганическим катализатором и третьим компонентом. Сокатализатор выбирают из органоалюминиевых соединений, гидридов
диалкилалюминия, диалкилцинковых соединений, диалкилмагниевых соединений и алкиллитиевых соединений.
Источник ионов металла группы VIII, предпочтительно выбирают из соединений, содержащих никель, палладий, кобальт, железо и рутений, наиболее предпочтительно никель и палладий. Не существует каких-либо ограничений в отношении соединения металла группы VIII, при условии, что оно является источником каталитически активных ионов металла группы VIII. Предпочтительно, соединение металла группы VIII является растворимым или может стать растворимым в реакционной среде.
Соединение металла группы VIII содержит ионный и/или нейтральный лиганд(ы), связанный(ые) с металлом группы VIII. Ионные или нейтральные лиганды могут быть выбраны из различных монодентатов, бидентатов или полидентатов и их комбинаций.
Представителями ионных лигандов, которые могут быть связаны с металлом с образованием соединения металла группы VIII, являются анионные
лиганды, выбранные из ионов галогенов, таких как хлор, бром, йод и фтор; подобные галогенсодержащим соединениям, такие как цианиды, цианаты, тиоцианаты, гидриды; углеводородные анионы, такие как
разветвленные или неразветвленные С1-С40 алкильные анионы, фенильные анионы; циклопентадиенилидные анионы, π-аллильные группировки; еноляты β-дикарбонильных
соединений, такие как ацетилацетонат, 4-пентандионат, 2,2,6,6-тетраметил-3,5-гептандионат и галогенированные ацетилацетонаты, такие как 1,1,1,5,5,5-гексафтор-2,4-пентандионат, 1,1,1-трифтор-2,
4-пентандионат; анионы кислотных производных окислов углерода, таких как карбоксилаты и галогенированные карбоксилаты (например, ацетаты, 2-этилгексаноаты, неодеканоаты,трифторацетаты и т.д.) и
окислов азота (например, нитратов, нитритов и т.д.), висмута (например, висмутатов и т.д.), окислов алюминия (например, алюминатов и т.д.), кремния (например, силикатов и т.д.), фосфора (например,
фосфатов, фосфитов, фосфинов и т.д.), окислов серы (например, сульфатов, таких как трифлат, п-толуолсульфонат, сульфиты и т.д.); илиды; амиды; имиды, оксиды; фосфиды; сульфиды; С6-C24 арилоксиды, С1-С20 алкоксиды; гидроксиды, гидроксиалкилы С1-С20; катехолы; оксалаты; хелатирующие алкоксиды и арилоксиды. Соединения палладия также
могут содержать анионы, такие как PF6-, АlF3О3SСF3-, SbF6- и соединения, соответствующие
формуле
Аl(R''')-4; В(X)-4,
где R''' и X, независимо друг от друга, означают атом галогена, выбранный из группы Cl, F, J и
Вr, или замещенные или незамещенные углеводородные группы. Представителями углеводородных групп являются алкил С1-С25, такой как метил, этил, пропил, бутил, пентил, гексил,
гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил, нонодецил, эйкозил, генэйкозил, докозил, трикозил, тетракозил, пентакозил и их
изомеры; С2-С25 алкенил, такой как винил, аллил, кротил, бутенил, пентенил, гексенил, октенил, ноненил, деценил, ундеценил, додеценил, тридеценил, тетрадеценил, пентадеценил,
гексадеценил, гептадеценил, октадеценил, нонадеценил, пентакозенил и их изомеры; C6-С25 арил, такой как фенил, толил, ксилил, нафтил и подобные; С7-C25
аралкил, такой как бензил, фенэтил, фенпропил, фенбутил, фенгексил, нафтоктил и подобные; С3-С8 циклоалкил, такой как циклопропил, циклобутил, циклопентил, циклогексил,
циклогептил, циклооктил, 2-норборнил, 2-норборненил и подобные. Дополнительно к указанным выше значениям Х означает радикал

Термин "замещенный углеводород" означает углеводородную группу, определение которой приведено выше, у которой один или более атомов замещены на атом галогена, такого как Cl, F, Вr и J (например, как в перфторфенильном радикале); гидроксил; амино; алкил; нитро; меркапто и подобные. Соединения металла группы VIII могут также содержать катионы, такие как, например, органоаммониевые, органоарсониевые, органофосфониевые и пиридиновые соединения, соответствующие формуле
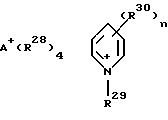
где А означает азот, мышьяк и фосфор, а радикалы R28 могут быть, независимо выбраны из водорода, разветвленнного или неразветвленного алкила С1-С20, разветвленного или неразветвленного алкенила C2-С20 и циклоалкила C5-С16, например, такого как циклопентил, циклогексил, циклогептил, циклооктил и подобные. R29 и R30 независимо друг от друга выбраны из водорода, разветвленного или неразветвленного алкила С1-C50, нормального или разветвленного алкенила С2-C50 и циклоалкильных групп C5-С16, таких как определено выше; n = 1 - 5, предпочтительно 1, 2 или 3, наиболее предпочтительно n = 1. Радикалы R30, предпочтительно присоединены в положениях 3, 4 и 5 пиридинового кольца.
Следует отметить, что увеличение суммарного количества атомов углерода в радикале R28 способствует лучшей растворимости соединения переходного металла в органической среде, такой как органические растворители и полициклические мономеры. Предпочтительно радикалы R28 выбраны из алкильных групп С1-С18, причем суммарное количество атомов углерода во всех радикалах R28 равно 15 - 72, предпочтительно 25 - 48, более предпочтительно 21 - 42. Радикал R21 предпочтительно выбран из нормального или разветвленного алкила С1-C50, более предпочтительно, алкила С10-C40 . Радикал R30, предпочтительно выбран из нормального или разветвленного алкила С1-C40, более предпочтительно алкила С2-С30.
Специфические примеры органоаммониевых катионов включают: тридодециламмоний, метилтрикаприламмоний, трис(тридецил)аммоний и триоктиламмоний. Специфические примеры органоарсониевых и органофосфониевых катионов включают тридодециларсоний и фосфоний, метилтрикаприларсоний и фосфоний, трис-(тридецил)арсоний и фосфоний, триоктиларсоний и фосфоний. Специфические пиридиниевые катионы включают: эйкозил-4-(1-бутилпентил)пиридиний, докозил-4-(13-пентакозил)пиридиний и эйкозил-4-(1-бутилпентил)пиридиний.
Подходящими нейтральными лигандами, которые могут быть связаны с переходным
металлом - палладием, являются олефины; ацетилены; окись углерода; окись азота; азотсодержащие соединения, такие как аммиак, алкилизоцианид, алкилизоцианат, алкилизотиоцианат; пиридины и производные
пиридина (например, 1,10-фенантролин, 2,2'-(дипиридил), 1,4-диалкил-1,3-диазабутадиены, 1,4-диарил-1,3-диазабутадиены и амины, такие как представлены формулами
N(R31)3,

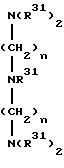
где радикалы R31 независимо означают углеводородный или замещенный углеводородный радикал, определенный выше, и n = 2 - 10. Мочевины, нитрилы, такие как ацетонитрил, бензонитрил и их галогенпроизводные; органические простые эфиры, такие как диметиловый эфир диэтиленгликоля, диоксан, тетрагидрофуран, фурандиаллиловый эфир, диэтиловый эфир, циклические простые эфиры, такие как циклические олигомеры диэтиленгликоля; органические сульфиды, такие как простые тиоэфиры (диэтилсульфид); арсины; стибины; фосфины, такие как триарилфосфины (например, трифенилфосфин), триалкилфосфины (например, триметилфосфин, триэтилфосфин, трипропилфосфин, трипентакозилфосфин и их галогенпроизводные), бис(дифенилфосфино)этан, бис(дифенилфосфино)пропан, бис(диметилфосфино)пропан, бис(дифенилфосфино)бутан, (S)-(-)2,2'-бис(дифенилфосфино)-1,1'-бинафтил, (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил и бис(2-дифенилфосфиноэтил)фенилфосфин; фосфиноксиды, галогениды фосфора; фосфиты формулы
P(OR31)3,
где R31 независимо означает углеводородный или замещенный углеводородный радикал, такой как указано выше; оксигалогениды фосфора; фосфонаты; фосфониты; фосфиниты; кетоны; сульфоксиды, такие как алкилсульфоксиды С1-С20; арилсульфоксиды C6-С20; алкарилсульфоксиды С7 -С40 и подобные. Должно быть понятно, что вышеназванные нейтральные лиганды могут быть использованы в качестве возможного третьего компонента, как это будет описано ниже.
Примерами соединений переходного металла группы VIII, пригодных в качестве источника ионов металла группы VIII являются: этилгексаноат палладия, транс-РdСl2(РРh3)2, бис(трифторацетат) палладия (II), бис(ацетилацетонат) палладия (II), 2-этилгексаноат палладия (II), Pd-(ацетат)2(РРh3)2, бромид палладия (II), хлорид палладия (II), иодид палладия (II), окись палладия (II), моноацетонитрилтрис(трифенилфосфин) палладия (II) тетрафторборат, тетракис(ацетонитрил) палладий (II) тетрафторборат, дихлорбис(ацетонитрил) палладий (II), дихлорбис(трифенилфосфин) палладий (II), дихлорбис(бензонитрил) палладий (II), ацетилацетонат палладия, бис(ацетонитрил)дихлорид палладия, бис(диметилсульфоксид)дихлорид палладия; ацетилацетонаты никеля, карбоксилаты никеля, диметилглиоксим никеля, этилгексаноат никеля, NiCl2(PPh3)2, NiCl2(PPh2CH2)2, (P(циклогексил)3)H-Ni(Ph2P(C6H4)CO2), (РРh3)(С6Н5)Ni(Рh2РСН= С(O)Рh), бис(2,2,6,6-тетраметил-3, 5-гептандионат) никеля (II), тетрагидрат гексафторацетилацетоната никеля (II), дигидрат трифторацетилацетоната никеля (II), тетрагидрат ацетилацетоната никеля (II), никельоцены, ацетат никеля (II), бромид никеля, хлорид никеля, дихлоргексилникельацетат, лактат никеля, окись никеля, тетрафторборат никеля, бис(аллил)никель, бис(циклопентадиенил)никель, неодеканоат кобальта, ацетат кобальта (II), ацетилацетонат кобальта (II), ацетилацетонат кобальта (III), бензоат кобальта (II), хлорид кобальта, бромид кобальта, дихлоргексилацетаты кобальта, стеарат кобальта (II), тетрафторбораты кобальта (II), нафтенат железа, хлорид железа (II), хлорид железа (III), бромид железа (II), бромид железа (III), ацетат железа (II), ацетилацетонат железа (III), ферроцен; рутений трис(трифенилфосфин) дихлорид, рутений трис(трифенилфосфин) гидридохлорид, трихлорид рутения, рутений тетракис(ацетонитрил) дихлорид, рутений тетракис(диметилсульфоксид) дихлорид; хлорид родия, родий трис(трифенилфосфин) трихлорид.
Органоалюминиевые соединения многокомпонентных каталитических систем по настоящему изобретению могут быть представлены формулой
AIR323-xQx,
где R32 независимо означают нормальный или разветвленный алкил С1-С20, арил C6-С24, аралкил С7-С20, циклоалкил С3-С10; Q означает галоидное соединение или псевдогалоидное соединение, выбранное из хлорина, фторина, бромина, иодина, нормального или разветвленного С1-С20 алкокси, C6-С24 арилокси, и х = 0 - 2,5, предпочтительно 0 - 2.
Представители органоалюминиевых соединений включают триалкилалюминий, такой как триметилалюминий, триэтилалюминий, трипропилалюминий, триизопропилалюминий, триизобутилалюминий, три-2-метилбутилалюминий, три-3-метил-бутилалюминий, три-2-метилпентилалюминий, три-3-метилпентилалюминий, три-4-метилпентилалюминий, три-2-метилгексилалюминий, три-3-метилгексилалюминий, триоктилалюминий, трис-2-норборнилалюминий и подобные; диалкилалюминий галогениды, такие как диметилалюминий хлорид, диэтилалюминий хлорид, диизопропилалюминий хлорид, диизобутилалюминий хлорид и подобные; моноалкилалюминий дигалогениды такие, как метилалюминийдихлорид, этилалюминийдихлорид, этилалюминий дийодид, пропилалюминий дихлорид, изопропилалюминий дихлорид, бутилалюминий дихлорид, изобутилалюминий дихлорид и подобные; алкилалюминиевые полуторахлористые галогениды, такие как метилалюминий полуторахлористый, этилалюминий полуторахлористый, пропилалюминий полуторахлористый, изобутилалюминий полуторахлористый и подобные.
Гидриды диалкилалюминия выбирают из нормальных и разветвленных гидридов (С1-С10) диалкилалюминия. Предпочтительным является гидрид диизобутилалюминия.
Соединения диалкилцинка выбирают из нормальных и разветвленных соединений (С1-С10)диалкилцинка. Предпочтительным является диэтилцинк. Соединения диалкилмагния выбирают из нормального и разветвленного (С1-С10)-диалкилмагния. Наиболее предпочтительным является дибутилмагний. Соединения алкиллития выбирают из нормальных и разветвленных соединений (С1-С10)-алкиллития. Предпочтительным является бутиллитий.
Гидриды диалкилалюминия выбирают из нормальных или разветвленных гидридов (С1-С10)-диалкилалюминия. Предпочтительным является гидрид диизобутилалюминия.
Диалкилцинковые соединения выбирают из нормальных или разветвленных соединений (С1-С10)-диалкилцинка. Предпочтительным является диэтилцинк. Диалкилмагниевые соединения выбирают из нормального или разветвленного (С1-С10)диалкилмагния. Предпочтительным является дибутилмагния. Алкиллитий выбирают из нормальных или разветвленных соединений (С1-С10)-алкиллития. Предпочтительным является бутиллития.
Согласно настоящему изобретению каталитическую систему, полученную из источника ионов металла группы VIII, используют с одним или двумя компонентами, выбранными из группы, включающей соединения - сокатализаторы и соединения третьего компонента.
Примерами третьих компонентов являются кислоты Льюиса, такие, как ВF3•эфират, TiCl4, SbF5, трис(перфторфенил)бор, ВСl3, В(ОСН2
СН3)3; сильные кислоты Бренстеда, такие как гексафторсурьмяная кислота (HSbF6), гидрат HPF6, трифторуксусная кислота (СF3СО2H) и
FSO3H•SbF5, Н2C(SО2CF3)2СF3SО3Н и паратолуолсульфоновая кислота; галогенированные соединения, такие как
гексахлорацетон, гексафторацетон, 2,2,3,4,4-пентахлорбутиловый эфир 3-бутеновой кислоты, гексафторглутаровая кислота, гексафторизопропанол и хлоранил, т.е. соединение формулы

Доноры электронов такие как фосфины и фосфиты и олефиновые доноры выбирают из алифатических С4 -С12 и циклоалифатических диолефинов C6-С12, таких как бутадиен, циклооктадиен и норборнадиен.
Кислотность сильных кислот Бренстеда, может быть оценена определением их функции кислотности по Hammett Нo, определение которой можно найти в Advanced Inorganic Chemistry, F.A. Cotton and G. Wilkinson, Wiley-lnterscience, 1988, p. 107.
Как отмечено выше, нейтральные лиганды могут быть использованы в качестве необязательного третьего компонента с электронно-донорными свойствами.
Согласно одному из вариантов воплощения изобретения многокомпонентная каталитическая система может быть приготовлена совместным смешением компонентов катализатора, т.е. соединения металла группы VIII, соединения - сокатализатора и третьего компонента, в случае использования последнего, в углеводородном или галоидированном углеводородном растворителе с последующим смешением каталитической системы, полученной в процессе предварительного смешения, с компонентами реакционной среды, содержащей, по меньшей мере, один полициклический мономер с сильной функциональной группой. Альтернативно, (в случае использования возможного третьего компонента) любые два компонента каталитической системы могут быть предварительно смешаны в углеводородном или галогенуглеводородном растворителе и затем введены в реакционную среду. Оставшийся компонент катализатора может быть введен в реакционную среду перед или после добавления предварительно смешанных компонентов.
Согласно другому варианту многокомпонентная каталитическая система может быть приготовлена in situ совместным смешением всех компонентов катализатора в реакционной среде. При этом порядок смешения не имеет значения.
Согласно одному из вариантов многокомпонентной каталитической системы по настоящему изобретению типичная каталитическая система содержит соль переходного металла группы VIII, например,
этилгексаноат никеля, органоалюминиевое соединение, например, триэтилалюминий, и смесь третьих компонентов, например, ВF3•эфирата и гексафторсурьмяной кислоты (HSbF6) в
предпочтительном молярном соотношении Аl/ВF3•эфират/Ni/кислота 10:9:1:0,5-2. Схема реакции имеет следующий вид:
1. Этилгексаноат никеля + HSbF6 + 9ВF3
•эфират + 10 триэтилалюминий -->Активный катализатор
Согласно другому варианту многокомпонентной каталитической системы по изобретению типичная каталитическая система содержит
соль никеля, например, этилгексаноатникеля, органоалюминиевое соединение, например, триэтилалюминий, и третий компонент - кислоту Льюиса, например, трис(перфторфенил)бор, как это показано на
нижеследующей схеме:
2. Этилгексаноат никеля + трис(перфторфенил)бор + триэтилалюминий -->Активный катализатор
В следующем варианте многокомпонентной каталитической системы по
изобретению третьим компонентом является галогенированное соединение, выбранное из различных галогенированных активаторов. Типичная каталитическая система содержит соль переходного металла группы VIII,
органоалюминий и в качестве третьего компонента галогенированное соединение, как это показано ниже
3. Этилгексаноат никеля + триэтилалюминий + хлоранил -->Активный катализатор
В еще одном варианте многокомпонентной каталитической системы по изобретению сокатализатор отсутствует. Каталитическая система содержит соль металла группы VIII (например, димер 3-аллилникельбромида
и кислоту Льюиса (например, трис(перфтор-фенил)бор) как показано ниже:
4. η3-Аллилникельхлорид + трис(перфторфенил)бор --> Активный катализатор
Нами было
обнаружено, что выбор металла группы VIII в катионном металлосодержащем комплексе как одно-, так и многокомпонентных каталитических систем по изобретению влияет на микроструктуру и физические свойства
полученных полимеров. Например, мы обнаружили, что палладиевые катализаторы обычно дают норборненовые звенья, исключительно присоединенные в положении 2,3 и демонстрирующие некоторую степень
регулярности. Полимеры, полученные в присутствии каталитических систем типа 2 и в присутствии однокомпонентных каталитических систем формулы EnNi(C6F5)2,
описанных выше, содержат, как мы надеемся, исключительно повторяющиеся звенья, присоединенные к полимерной цепи в положении 2,7. Эти полимеры также содержат перфторфенильные группы, по меньшей мере,
на одном конце полимерной цепи. Иными словами, перфторфенильные группы могут быть расположены на одном конце или на обоих концах полимера. В любом случае, перфторфенильные группы связаны ковалентными
связями и являются боковыми по отношению к концевым полициклическим повторяющимся звеньям основной полимерной цепи. Реакции с использованием одно- и многокомпонентных катализаторов по данному
изобретению осуществляют в органическом растворителе, который не оказывает вредного влияния на каталитическую систему и который является растворителем для мономера. Примерами для органических
мономеров являются алифатические неполярные углеводороды такие, как пентан, гексан, гептан, октан и декан; алициклические углеводороды такие, как циклопентан и циклогексан; ароматические углеводороды
такие, как бензол, хлорбензол, o-дихлорбензол, толуол и ксилол; полярные галогенированные углеводородные растворители такие, как метиленхлорид, хлороформ, четыреххлористый углерод, хлористый этил, 1,
1-дихлорэтан, 1,2-дихлорэтан, 1,2-дихлорэтилен, 1-хлорпропан, 2-хлорпропан, 1-хлорбутан, 2-хлорбутан, 1-хлор-2-метилпропан и 1-хлорпентан.
Выбор растворителя для проведения реакции осуществляют с учетом нескольких факторов, включая вид выбранного катализатора и тип процесса полимеризации (суспензионная полимеризация или полимеризация в растворе). Для большинства катализаторов по изобретению предпочтительными растворителями являются хлорированные углеводороды, такие как метиленхлорид и 1,2-дихлорэтан, и ароматические углеводороды такие, как хлорбензол и нитробензол. Простые углеводороды являются менее предпочтительными ввиду меньшей конверсии при этом мономеров с функциональными группами NB-типа. Неожиданно нами было обнаружено, что некоторые каталитические системы, наиболее заметно, многокомпонентные катализаторы на основе соединений металла группы VIII и галоидный алкилалюминий, особенно, дигалоидный моноалкилалюминий (например, дихлоридэтилалюминий) и катализаторы типа 2, указанные выше, также дают превосходные результаты (высокую степень конверсии мономера) при проведении реакции в гептане, циклогексане и толуоле.
Молярное соотношение всех мономеров и металла группы VIII для одно- и многокомпонентных катализаторов может составлять 20:1 - 100 000:1, предпочтительно 50:1 - 20 000:1 и наиболее предпочтительно 100:1 - 10000:1.
В многокомпонентных каталитических системах молярное соотношение металла сокатализатора (например, алюминий, цинк, магний и литий) и металла группы VIII составляет менее чем или равно 100:1, предпочтительно менее, чем или равно 30:1 и наиболее предпочтительно менее чем или равно 20:1.
Третий компонент используют в молярном соотношении с металлом группы VIII 0,25:1 - 20:1. В случае использования кислот в качестве третьего компонента молярное соотношение кислоты и металла группы VIII менее чем или равно 4:1, предпочтительно менее чем или равно 2:1.
Реакцию полимеризации по настоящему изобретению обычно осуществляют при температуре от (-100)oС до 120oС, предпочтительно от (-60)oС до 90oС, наиболее предпочтительно, от (-10)oС до 80oС.
Оптимальная температура по настоящему изобретению зависит от ряда изменяющихся факторов, прежде всего, от выбора катализатора и разбавителя реакционной смеси. Следовательно, для любого конкретного процесса полимеризации оптимальную температуру определяют экспериментально, с учетом названных изменяющихся факторов.
При разработке таких катализаторов и полимерных систем нами было обнаружено, что связь палладий-углерод, соединяющая палладиевый катализатор с растущей полимерной цепью, особенно устойчива. Это является главным достоинством при полимеризации полициклических мономеров, содержащих лабильные кислотные группы, сложноэфирные и карбоксильные функциональные группы, поскольку палладиевые катализаторы особенно устойчивы к таким функциональным группам. Однако эта стабильность, с другой стороны, значительно затрудняет удаление палладиевого катализатора из полученного полимера. При разработке таких новых компонентов нами было обнаружено, что связь палладий-углерод удобно расщепляется (в результате осаждения палладия, который может быть удален фильтрацией или центрифугированием) при использовании окиси углерода, предпочтительно в присутствии протонного растворителя, такого как спирт, влага или карбоновая кислота.
Полимеры, полученные способом в соответствии с изобретением имеют молекулярную массу (Мn) от около 1000 до около 1000000, предпочтительно от около 2000 до около 700000 и, более предпочтительно от около 5000 до 500000 и, наиболее предпочтительно от около 10000 до около 50000.
Молекулярную массу полимера можно регулировать изменением количественного соотношения катализатора к мономеру, т.е.,
изменяя соотношение инициатора к мономеру. Низкомолекулярные полимеры и олигомеры могут быть также получены в пределах от около 500 до около 500000 при проведении процесса полимеризации в присутствии
агента передачи цепи. Макромономеры и олигомеры, содержащие от 4 до 50 повторяющихся звеньев, могут быть получены в присутствии агента передачи цепи (АПЦ), выбранного из соединений, содержащих
концевые олефиновые двойные связи между смежными атомами углерода, у которых, по меньшей мере, один из смежных атомов углерода имеет два связанных с ним атома водорода. Агентом передачи цепи являются
соединения, исключающие стиролы (не стиролы), простые виниловые эфиры (не виниловые эфиры), и конъюгированные диены. Под соединениями, не являющимися стиролами и простыми виниловыми эфирами (не
стиролы и не простые виниловые эфиры), подразумевают соединения, имеющие указанные ниже структуры, которые исключаются из агентов передачи цепи по изобретению


где А означает ароматический заместитель и R означает углеводородный радикал.
Предпочтительными агентами передачи цепи по изобретению являются соединения, соответствующие нижеприведенной формуле

где R1 и R2, независимо друг от друга, означают водород, разветвленный или неразветвленный алкил С1-С40, разветвленный или неразветвленный алкенил С2-C40, галоген или группу.
Из представленных агентов передачи цепи предпочтительными являются α-олефины, содержащие от 2 до 10 атомов углерода, например, этилен, пропилен, 4-метил-1-пентен, 1-гексен, 1-децен, 1,7-октадиен и 1,6-октадиен или изобутилен.
Хотя оптимальные условия для достижения любого заранее заданного результата должны быть определены экспериментально специалистом с учетом всех названных выше факторов, существуют некоторые общие ориентиры, которые могут быть пригодными в соответствующих случаях. Нами установлено, что, в общем случае, α-олефины (например, этилен, пропилен, 1-гексен, 1-децен, 4-метил-1-пентен) являются наиболее эффективными агентами передачи цепи, по сравнению с 1,1-дизамещеннными олефинами, являющимися менее эффективными. Иными словами, при прочих равных условиях, для достижения заданной молекулярной массы потребуется гораздо более высокая концентрация изобутилена, чем при использовании этилена. Стирольные олефины, коньюгированные диены и простые виниловые эфиры не являются эффективными агентами передачи цепи вследствие их склонности полимеризоваться с катализатором, описанным выше.
Агент передачи цепи может быть использован в количестве от около 0,10 мол. % до более 50 мол.% от количества молей всех мономеров NB-типа. Предпочтительно агент передачи цепи используют в количестве 0,10 - 10,0 мол.% и наиболее предпочтительно 0,1 - 5,0 мол.%. Как отмечено выше, в зависимости от вида катализатора и чувствительности, эффективности агента передачи цепи и желаемых концевых групп, концентрация агента передачи цепи может быть свыше 50 мол. % (в расчете на общее количество присутствующих мономеров с NB-функциональностью), например, 60 - 80 мол.%. Для получения низкомолекулярных продуктов по изобретению, таких как олигомеры и макромономеры, может потребоваться более высокая концентрация агента передачи цепи (например, больше 100 мол. %). Важно отметить, что, на удивление, даже такие высокие концентрации агентов передачи цепи (за исключением изобутилена) не сополимеризуются в основную цепь полимера, а включаются в виде концевых групп каждой полимерной цепи. Способ по изобретению предлагает путь, при котором помимо агентов передачи цепи по концам полимерной цепи могут быть включены концевые α-олефиновые группы.
Полимеры по настоящему изобретению, полученные в присутствии агента передачи цепи, имеют молекулярную массу (Мn) от около 1000 до около 500000, предпочтительно от около 2000 до около 300000 и, наиболее предпочтительно от около 5000 до около 200000.
Фоторезистные композиции по настоящему изобретению содержат описанные полициклические композиции, растворитель и генерирующий кислоту фотоинициатор. В случае необходимости, может быть добавлен ингибитор растворения в количестве до около 20% от массы композиции. Подходящим ингибитором растворения является трет- бутилхолат (J.V. Crivello et al., Chemically Amplified Electron-Beam Photoresists, Chem. Mater., 1996, 8, p. 376-381).
При облучении фоточувствительный генератор кислоты генерирует сильную кислоту. Подходящие генерирующие кислоту фотоинициаторы включают трифлаты (например, трифенилсульфоний трифлат), пирогаллол (например, тримезилат пирогаллола); ониевые слои, такие как триарилсульфоний и диарилиодиум гексафторантимонаты, гексафторарсенаты, трифторметансульфонаты; сложные эфиры гидроксиимидов, α, α′-бис-сульфонил-диазометаны, сульфонатные эфиры нитрозамещенного бензилового спирта и нафтохинон-4-диазиды. Другие пригодные генерирующие кислоту фотоинициаторы описаны Reichmanis et al., Chem. Mater., 1991, 3, р. 395. Композиции, содержащие триарилсульфониевые или диарилсульфониевые соли, являются предпочтительными ввиду их чувствительности к глубокому УФ-излучению (от 193 нм до 300 нм) и очень высокой разрешающей способности изображений. Наиболее предпочтительными являются незамещенные и симметричные или несимметричные замещенные диарилиодиевые или триарилсульфониевые соли. Содержание генерирующего кислоту фотоинициаторного компонента составляет приблизительно 1 - 100 мас.% полимера. Предпочтительным является содержание 5 - 50% от массы полимера.
Фоторезистные композиции по настоящему изобретению необязательно содержат сенсибилизатор, способный сенсибилизировать генерирующий кислоту фотоинициатор по отношению к более длинноволновому излучению в области от средневолнового УФ-излучения до видимого света. В зависимости от предназначения такие сенсибилизаторы включают полициклические ароматические соединения, такие как перены и перлены. Сенсибилизация генерирующих кислоту фотоинициаторов хорошо известна и описана в патентах US 4250053, 4371605 и 4491628, приведенных здесь в качестве ссылки. Изобретение не ограничивается специфическим классом сенсибилизаторов и генерирующих кислоту фотоинициаторов.
Настоящее изобретение относится также к способу генерирования на подложке позитивных резистных изображений, включающем стадии: а) покрытия подложки пленкой, содержащей резистную композицию позитивного тона согласно изобретению, б) облучение пленки излучением, формирующим изображение и в) проявление изображения.
Первая стадия включает покрытие подложки пленкой, полученной из
позитивной резистной
композиции, растворенной в подходящем растворителе. Подходящие подложки выполнены из силикона, керамики, полимера и т.п. Подходящие растворители включают: ацетат метилового эфира пропиленгликоля
(АМЭПГ), циклогексанон, бутиролактат, этиллактат и подобные. Пленку наносят на подложку известными в технике методами нанесения покрытия, такими как центрифугирование или распыление, либо ракельным
ножом. Предпочтительно, перед облучением пленку нагревают при повышенной температуре от около 90oС до 150oС в течение короткого промежутка времени около 1 мин. На второй стадии
процесса пленку облучают излучением, формирующем изображение, например, электронными лучами или, предпочтительно, электромагнитным излучением, таким как УФ- или рентгеновское излучение,
предпочтительно УФ-излучение, например, с длиной волны около от 193 нм до 514 нм, предпочтительно, около от 193 нм до 248 нм. Пригодными источниками излучения являются: ртутные, ртутные/ксеноновые и
ксеноновые лампы, рентгеновские и электронно-лучевые. Генерирующий кислоту фотоинициатор абсорбирует излучение для образования в облученных областях свободной кислоты. Свободная кислота расщепляет
боковые кислотно-лабильные группы сополимера, в результате чего сополимер превращается из ингибитора растворения в усилитель растворения, повышая, таким образом, растворимость облученной резистной
композиции в водном растворе основания. Неожиданно оказалось, что облученная резистная композиция легко растворяется в водном растворе основания. Эта ее растворимость является удивительной и
неожиданной с учетом сложной природы циклоалифатической цепи и высокой молекулярной массы звеньев норборненового мономера, содержащего функциональные карбоксильные группы. Предпочтительно, после
облучения пленку вновь нагревают при повышенной температуре приблизительно от 90oС до 150oС в течение короткого промежутка времени около 1 мин.
Третья стадия состоит в получении позитивного тона изображения с помощью подходящего растворителя. Подходящие растворители включают, предпочтительно, водный раствор основания, несодержащего ионов металла, такого как гидроокись тетраметиламмония или холин. Композиция по изобретению создает высококонтрастные позитивные изображения с ровными стенками. Уникально, что растворимость композиции по настоящему изобретению может варьироваться простым изменением состава сополимера.
Настоящее изобретение также относится к блокам интегральных схем, таким как интегральная микросхема, модуль многокристальных интегральных схем или монтажная плата, изготовленные способом по настоящему изобретению. Блок интегральных схем содержит схему, полученную на подложке в результате стадий: а) покрытия подложки пленкой, полученной из позитивной резистной композиции по изобретению; б) облучения пленки излучением, формирующим изображение; в) проявление изображения для раскрытия подложки; г) образование схемы на проявленной пленке, находящейся на подложке, известными методами.
После раскрытия подложки в местах раскрытия может быть получено изображение схемы нанесением покрытия из проводящего материала, такого как проводящие металлы, с помощью известных приемов, таких как осаждение из газовой фазы, напыление, покрывание металлом, химическое осаждение из газовой фазы или лазерное осаждение. Поверхность пленки может быть подвергнута вальцеванию для удаления избытка проводящего материала. В процессе изготовления схем подобным образом на подложку могут быть нанесены также диэлектрические материалы. В процессе получения р или n легированных схемных транзисторов в подложку могут быть имплантированы неорганические ионы, такие как ионы бора, фосфора и мышьяка. Другие методы получения схем хорошо известны специалисту.
В нижеследующих примерах подробно описаны методы приготовления и использования некоторых композиций по изобретению. Подробное описание служит в качестве примера осуществления изобретения, в то время, как более общие способы приготовления изложены выше. Примеры приведены только с целью иллюстрации и не ограничивают объема изобретения.
Как отмечалось выше, фоторезисты используют для создания и мультиплицирования изображения с фотомаски на подложку. Эффективность переноса изображения определяется длиной волны формирующего изображение излучения, чувствительностью фоторезиста и способностью его противостоять условиям травления, при котором на освобожденных участках подложки создается изображение. Фоторезисты наиболее часто используют в потребительской форме, когда фоторезисты подвергают травлению в местах, не подвергнутых облучению (для позитивных фоторезистов), а подложку подвергают травлению в местах облучения. Поскольку фоторезист является органическим материалом, а подложка является типичным неорганическим материалом, то фоторезист по своей природе имеет более высокую скорость травления в процессе реактивного ионного травления, что требует увеличения толщины фоторезиста по сравнению с материалом подложки. Чем меньше скорость травления вещества фоторезиста, тем тоньше должен быть фоторезистный слой. В результате может быть достигнута высокая разрешающая способность изображения. Поэтому, чем меньше скорость реактивного ионного травления фоторезиста, тем он привлекательней с технологической точки зрения. Скорость травления прежде всего определяется основной полимерной цепью, как показано ниже для процесса хлорного плазменного травления, представляющего собой обычно используемый метод реактивного ионного травления в изготовлении полупроводников.
В примерах и в описании приведено молярное соотношение мономера к катализатору (см. табл. А).
Полимеры 1 и 2 являются изначально ароматическими, тогда как полимер 3 получен сополимеризацией с небольшим количеством акрилата, повышающем скорость травления полимера. Полимер 4 является полностью основанным на акрилате для обеспечения прозрачности при 193 нм (ароматические кольца придают материалу светонепроницаемость в этой области, поэтому не существует практически приемлемых резистных материалов для 193 нм на основе традиционных новолаков или п-гидроксистиролов). У этих полимеров скорость травления почти удваивается. Полимер 5 имеет скорость травления даже меньшую, чем у стандартных фоторезистных материалов (1 и 2), дополнительно к обеспечению прозрачности при 193 нм. Следовательно, основная цепь полимера 5 (аддитивный циклический олефин), полученного в присутствии поликомпонентного никелевого катализатора по изобретению, представляет собой достижение по сравнению со всеми ранее предпринятыми попытками, описанными в технической литературе, получить резист, функционирующий при 193 нм при характеристиках реактивного ионного травления, сравнимого с товарными материалами, облученными при более длинных волнах. Действительно, аддитивный циклический олефиновый полимер может предложить преимущества в отношении устойчивости к травлению также при более длинных волнах. Из литературы известно (Н. Gokan, S. Esho and Y. Ohnishi, J. Electrochem. Soc., 1983, 130 (1), р. 143), что повышение величины отношения С/Н уменьшает скорость травления полимерных материалов. Исходя из этого предположения, скорость травления полимера 5 должна была бы находиться между скоростью травления систем на ароматической основе и акрилатными системами. Является удивительным, что аддитивный циклический олефин проявляет супер-устойчивость к травлению даже в сравнении с ароматическими системами.
Пример 1. В стеклянную пробирку, емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют трет-бутиловый эфир 5-норборнен-карбоновую кислоты (карбо-трет-бутоксинорборнен) (2,0 г, 10,3 ммоль, экзо, эндо 44/56). К этому перемешиваемому мономеру при комнатной температуре добавляют в течение 30 мин раствор катализатора, полученный прибавлением димера η3-аллилпалладий хлорида (38 мг, 103 мкмоль) в хлорбензоле (5 мл) к гексафторантимонату серебра (99 мг, 290 мкмоль) в хлорбензоле (5 мл), затем смесь фильтруют через микропористый фильтр (для удаления осажденного хлорида серебра). Реакцию проводят в течение 36 ч. К этому времени реакционная смесь желатинизируется, превращаясь в прозрачный желтый гель. После добавления геля к избытку метанола полимер осаждается в виде белого порошка, полимер промывают избытком метанола и сушат. Выход полимера составляет 1,5 г (75%). Присутствие мономера с эфирными группами в полимере подтверждается инфракрасным анализом, показывающим сильные полосы при 1728 см-1 (С=0 полоса), 1251 см-1 (С-О-С полоса) и 1369 см-1 и 1392 см-1 (характеристика трет-бутиловых групп), а отсутствие неконвертированного мономера - протонным ЯМР. Найденная молекулярная масса полимера (Mw) 22 500. Термогравиметрический анализ (ТГА) в атмосфере азота (скорость нагрева 10oС/мин) указывает на термостабильность полимера до около 210oС и затем потерю, приблизительно, 28% массы при 260oС (проявляющуюся в потере трет-бутиловых групп в виде изобутена с получением гомополимера 5-норборненкарбоновой кислоты) и деградацию полимера (потеря 90% общей массы) при около 400oС.
Пример 2. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют норборнен (0,8 г, 8,6 ммоль), 1, 2-дихлорэтан (8 мл) и трет-бутиловый эфир 5-норборненкарбоновой кислоты (карбо-трет-бутоксинорборнен) (0,2 г, 1 ммоль, экзо, эндо 44/56). К этому перемешиваемому раствору при комнатной температуре прибавляют этилгексаноат никеля (3 мкмоль), трисперфторфенилбор (23 мкмоль) и триэтилалюминий (27 мкмоль). В этих условиях немедленно протекает реакция с осаждением из раствора полимера менее чем через 10 с. После 60 мин проведения реакции содержимое реактора растворяют в циклогексане и вливают в избыток метанола. Полимер промывают избытком метанола и сушат в течение ночи в вакуумной печи при 80oС. Выход полимера составил 0,9 г (90%). Найденная методом гельпроникающей хроматографии молекулярная масса полимера равна 535000 (Mw) со степенью полидисперсности 4,7.
Пример 3. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют трет-бутиловый эфир 5-норборненкарбоновой кислоты (карбо-трет-бутоксинорборнен) (2,2 г, 11,3 ммоль, экзо, эндо 44/56). К этому перемешиваемому мономеру при комнатной температуре прибавляют раствор катализатора, полученный добавлением димера η3-аллилпалладий хлорида (29 мг, 74 мкмоль) в дихлорэтане (6 мл) к тетрафторборату серебра (61 мг, 311 мкмоль) в дихлорэтане (6 мл) в течение 30 мин с последующим фильтрованием через микропористый фильтр (для удаления осажденного хлорида серебра). После проведения реакции в течение 36 ч смесь желатинирует, с образованием прозрачного желтого геля. После добавления геля к избытку метанола полимер осаждается в виде белого порошка. Полимер промывают избытком метанола и сушат. Выход полимера составляет 1,4 г (64%). Присутствие звеньев мономера с эфирными группами в полимере подтверждается инфракрасным анализом, показывающим сильные полосы при 1728 см-1 (С=0 полоса), 1251 см-1 (С-О-С полоса) и 1369 см-1 и 1392 см-1 (характеристика трет-бутиловых групп), а отсутствие неконвертированного мономера или карбоксильных функциональных групп (протон ЯМР и ИК). Найденная молекулярная масса полимера (Мw) равна 54100. Термогравиметрический анализ (ТГА) в атмосфере азота (скорость нагрева 10oС/мин) показывает на термостабильность полимера до около 210oС и затем потерю около 29% массы при 250oС (что указывает на потерю трет-бутиловых групп в виде изобутена с образованием гомополимера 5-норборненкарбоновой кислоты) с последующей деградацией полимера (потеря 80% массы) при около 400oС.
Пример 4. В стеклянную пробирку емкостью 100 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют норборнен (1,16 г, 12,3 ммоль), 1,2-дихлорэтан (50 мл) и трет-бутиловый эфир 5-норборненкарбоновой кислоты (карбо-трет-бутоксинорборнен) (0,6 г, 3,1 ммоль, экзо, эндо 44/56). К этому перемешиваемому раствору при комнатной температуре прибавляют палладий бис(2,2,6,6-тетраметил-3,5-пентадионат) (31 ммоль), трисперфторфенилбор (279 ммоль). После 16 ч проведения реакции содержимое реактора вливают в избыток метанола. Полимер промывают избытком метанола и сушат в течение ночи в вакуумной печи при 80oС. Выход полимера составил 0,54 г (31%).
Пример 5. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют трет-бутиловый эфир 5-норборненкарбоновой кислоты (карбо-трет-бутоксинорборнен) (4,4 г, 22,7 ммоль, экзо, эндо 44/56). К этому перемешиваемому мономеру при комнатной температуре добавляют раствор катализатора, полученный добавлением димера η3-аллилпалладий хлорида (41,5 мг, 113 мкмоль) в дихлорэтане (7 мл) к тетрафторборату серебра (42 мг, 215 мкмоль) в дихлорэтане (7 мл) в течение 30 мин с последующим фильтрованием через микропористый фильтр (для удаления осажденного хлорида серебра). Затем реакционную смесь нагревают на масляной бане при 75oС. После 90 мин обнаруживается, что смесь затвердела в серую полимерную массу. Массу растворяют в ацетоне с получением темноокращенного раствора. Через раствор в течение 30 мин барботируют газообразную окись углерода, в результате чего, обильно осаждается тонко измельченный черный осадок (металлический палладий и, возможно, другие остатки катализатора). Осадок удаляют центрифугированием, и этот процесс повторяют еще два раза. В заключение полученный бесцветный раствор фильтруют через микродиск 45 микрон, и полимер осаждают добавлением раствора ацетона к избытку гексана. Белый полимер отделяют посредством центрифуги и сушат в течение ночи для получения сополимера в виде белого порошка (2,21 г, 50%). Термогравиметрический анализ под азотом (скорость нагрева 10oС/мин) показывает на термостабильность полимера вплоть до около 210oС и затем потерю его массы, приблизительно, 28% при 260oС (указывая на потерю трет-бутиловых групп в виде изобутена с получением гомополимера 5-норборненкарбоновой кислоты) с последующей деградацией полимера (потеря 90% общей массы) при приблизительно 400oС. Молекулярная масса Мn= 3300 г/моль и Мw=6 900 г/моль (найдена методом гельпроникающей хроматографии в тетрагидрофуране, полистирольные стандарты).
Пример 6. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют чистый экзо-изомер трет-бутилового эфира 5-норборненкарбоновой кислоты (карбо-трет-бутоксинорборнен) (0,6 г). К этому перемешиваемому мономеру при комнатной температуре добавляют раствор катализатора, полученный добавлением димера η3-аллилпалладий хлорида (30 мг), в дихлорэтане (10 мл) к гексафторантимонату серебра (50 мг) в дихлорэтане (20 мл) в течение 30 мин с последующим фильтрованием через микропористый фильтр (для удаления осажденного хлорида серебра). После 15 ч проведения реакции смесь добавляют к избытку метанола для осаждения полимера в виде белого порошка. Полимер промывают избытком метанола и сушат, выход полимера 0,5 г (85%). Найденная молекулярная масса полимера Mw = 46900 и полидисперсность 2,4.
Пример 7. В стеклянную пробирку емкостью 100 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют норборнен (4,01 г, 42,6 ммоль), 1,2-дихлорэтан (50 мл) и трет-бутиловый эфир 5-норборненкарбоновой кислоты (карбо-трет-бутоксинорборнен) (2 г, 10,3 ммоль, экзо, эндо смесь). К этому перемешиваемому раствору при комнатной температуре добавляют раствор катализатора, полученный взаимодействием димера η3-аллилпалладий хлорида (10 мг, 27,3 мкмоль) с гексафторантимонатом серебра (19,6 мг, 57 мкмоль) в 1,2-дихлорэтане (3 мл) в течение 30 мин с последующим фильтрованием через микропористый фильтр. После 20 ч проведения реакции содержимое реактора выливают в избыток метанола. Полимер промывают избытком метанола и сушат. Выход полимера 4,15 г. Найденное значение молекулярной массы сополимера, определенное методом гельпроникающей хроматографии, Mw = 618000 с полидисперсностью 7,1.
Пример 8. В стеклянную пробирку емкостью 100 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют норборнен (3,75 г, 39,8 ммоль), 1,2-дихлорэтан (50 мл) и трет-бутиловый эфир 5-норборненкарбоновой кислоты (карбо-трет-бутоксинорборнен) (2 г, 10,3 ммоль, экзо, эндо смесь). К этому перемешиваемому раствору при комнатной температуре добавляют этилгексаноат палладия (12 мкмоль), трис(перфторфенил)бор (108 мкмоль) и триэтилалюминий (120 мкмоль). После 72 ч реакции содержимое реактора выливают в избыток метанола. Полимер промывают избытком метанола и сушат, повторно растворяют в хлорбензоле и осаждают избытком метанола, фильтруют и промывают метанолом перед заключительной сушкой в вакуумной печи в течение ночи при 80oС. Выход сополимера 1,66 г. Молекулярная масса сополимера, определенная методом гельпроникающей хроматографии Mw = 194000 с полидисперсностью 2,3. Наличие в сополимере мономера с эфирными группами подтверждено инфракрасным анализом, показавшим полосы при 1730 см-1 (С=0 полоса) и 1154 см-1 (С-О-С полоса) при отсутствии неконвертированного мономера (протон ЯМР).
Пример 9. В стеклянную пробирку емкостью 100 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют 1,2-дихлорэтан (25 мл) и трет-бутиловый эфир 5-норборненкарбоновой кислоты (карбо-трет-бутоксинорборнен) (10 г, 51,5 ммоль, экзо, эндо смесь). К этому перемешиваемому раствору при комнатной температуре добавляют раствор катализатора, полученный взаимодействием димера η3-аллилпалладий хлорида (82 мг, 223 мкмоль) с гексафторантимонатом серебра (200 мг, 581 мкмоль) в 1,2-дихлорэтане (10 мл) в течение 30 мин с последующим фильтрованием через микропористый фильтр. После 48 ч проведения реакции содержимое реактора выливают в избыток метанола. Полимер промывают избытком метанола и сушат. Выход гомополимера 4,5 г.
Пример 10. В стеклянную пробирку емкостью 100 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют 1,2-дихлорэтан (50 мл), трет-бутиловый эфир 5-норборненкарбоновой кислоты (карбо-трет-бутоксинорборнен) (5 г, 25,8 ммоль, экзо, эндо смесь) нонборнен (0,82 г, 8,7 ммоль) и 5-триэтоксисилилнонборнен (0,47 г, 1,8 ммоль). К этому перемешиваемому раствору при комнатной температуре добавляют раствор катализатора, полученный взаимодействием димера η3 -аллилпалладий хлорида (47,2 мг, 128 мкмоль) с тетрафторборатом серебра (138 мг, 700 мкмоль), в 1,2-дихлорэтане (10 мл) в течение 30 мин с последующим фильтрованием через микропористый фильтр. После 48 ч реакции содержимое реактора выливают в избыток метанола. Полимер промывают избытком метанола и сушат. Выход термополимера 5,3 г. Значение величины молекулярной массы, найденное методом гельпроникающей хромотографии, 39900 (Mw) при полидисперсности 3,2.
Пример 11. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют 7,25 г (37,5 ммоль) трет-бутилового эфира нонборнена, 1,9 г (12,5 ммоль) метилового эфира норборнена, 50 мл свежедистиллированного дихлорэтана, и раствор дегазируют в атмосфере аргона. В 10 мл стеклянную пробирку, снабженную покрытым Тефлоном® перемешивающим стержнем загружают 0,0365 г (0,1 ммоль) димера η3-аллилпалладий хлорида (для получения в итоге соотношения мономера к катализатору 500:1) и 2 мл дихлорэтана. В другую 10 мл стеклянную пробирку загружают 0,0344 г (0,1 ммоль) гексафторантимоната серебра и 2 мл дихлорэтана. Раствор катализатора готовят смешением димера аллилпалладий хлорида с раствором гексафторантимоната серебра внутри бокса с осушенной атмосферой. Наблюдается немедленное осаждение хлорида серебра, который отфильтровывают для получения прозрачного желтого раствора. Раствор активного желтого катализатора добавляют к раствору мономера шприцем, и реакционную смесь перемешивают в течение 20 ч при 60oС. Какого-либо значительного увеличения вязкости не наблюдается, но из раствора осаждается твердое вещество. Раствор охлаждают, концентрируют в роторном испарителе и осаждают в гексане для получения белого полимера. Выход 2,3 г, 26%. Полимер сушат в вакууме при комнатной температуре и определяют его молекулярную массу методом гельпроникающей хроматографии в тетрагидрофуране с полистирольными стандартами. Найденное значение молекулярной массы Мn= 1950 г/моль и Мw=3150 г/моль.1H-ЯМР указывает на присутствие как метилового, так и трет-бутилового эфира норборнена и небольшого количества кислоты - продукта гидролиза трет-бутилового эфира.
Пример 12. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют 2,42 г (12,5 ммоль) трет-бутилового эфира нонборнена, 5,7 г (37,5 ммоль) метилового эфира норборнена, 50 мл свежедистиллированного дихлорэтана, и раствор дегазируют в атмосфере аргона. В 10 мл стеклянную пробирку, снабженную покрытым Тефлоном® перемешивающим стержнем, загружают 0,0365 г (0,1 ммоль) димера аллилпалладий хлорида, при отношении мономера к катализатору 500:1, и 2 мл дихлорэтана. В другую 10 мл стеклянную пробирку загружают 0,0344 (0,1 ммоль) гексафторалюмината серебра и 2 мл дихлорэтана. Раствор катализатора готовят смешением раствора димера аллилпалладий хлорида с раствором гексафторантимоната серебра внутри бокса с осушенной атмосферой. Наблюдается немедленное осаждение хлорида серебра, который отфильтровывают для получения прозрачного желтого раствора. Раствор активного желтого катализатора добавляют к раствору мономера шприцем, и реакционную смесь перемешивают в течение 20 ч при 60oС. Какого-либо значительного увеличения вязкости не наблюдается, но из раствора осаждается твердое вещество. Раствор охлаждают, концентрируют в роторном испарителе и осаждают в гексане для получения белого полимера. Выход 2,05 г, 25%. Полимер сушат в вакууме при комнатной температуре и определяют его молекулярную массу методом гельпроникающей хроматографии в тетрагидрофуране с полистирольными стандартами. Найденное значение молекулярной массы Мn=1440 г/моль и Мw=2000 г/моль.1H-ЯМР указывает на присутствие как метилового, так и трет-бутилового эфира норборнена и небольшого количества кислоты - продукта гидролиза трет-бутилового эфира.
Пример 13. В стеклянную пробирку емкостью 25 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют 2 г (7,94 ммоль) чистого бицикло[2.2.1]гепт-5-ен-экзо-2-трет-бутил-экзо-3-метилового эфира дикарбоновой кислоты, а затем 15 мл свежедистиллированного метиленхлорида и 10 мл метанола, и раствор дегазируют в атмосфере аргона. В 10 мл стеклянную пробирку, снабженную покрытым Тефлоном® перемешивающим стержнем, загружают 0,00588 г (0,0158 ммоль) димера η3-аллилпалладий хлорида при соотношении мономера к катализатору 500:1 и 2 мл метиленхлорида. В другую 10 мл стеклянную пробирку загружают 0, 0108 г (0,0312 ммоль) гексафторантимоната серебра и 2 мл метиленхлорида. Раствор катализатора готовят смешением раствора димера η3-аллилпалладий хлорида с раствором гексафторантимоната серебра внутри бокса с осушенной атмосферой. Наблюдается немедленное осаждение хлорида серебра, который отфильтровывают для получения прозрачного желтого раствора. Раствор активного желтого катализатора добавляют к раствору мономера шприцем при 50oС, и реакционную смесь перемешивают в течение 16 ч при комнатной температуре. Какого-либо значительного увеличения вязкости не наблюдается, и раствор фильтруют через 0,5 микронный фильтр, а затем концентрируют в роторном испарителе. Вязкий раствор растворяют в метаноле и осаждают в смеси метанола с водой для получения белого твердого вещества. Выход 65%. Найденное значение молекулярной массы (определенное методом гельпроникающей хроматографии в тетрагидрофуране с полистирольными стандартами) Мn=10250 г/моль и Мw= 19700 г/моль.1Н-ЯМР указывает на присутствие как метилового, так и трет-бутилового эфира норборнена.
Пример 14. В стеклянную пробирку емкостью 25 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют 3,06 г (12,8 ммоль) чистого диэтилового эфира бицикло[2.2.1]гепт-5-ен-экзо, экзо-2, 3-дикарбоновой кислоты, 2,5 г (12,8 ммоль) трет-бутилового эфира норборнена, а затем 15 мл свежедистиллированного метиленхлорида и 10 мл метанола, и раствор дегазируют в атмосфере аргона. В 10 мл стеклянную пробирку, снабженную покрытым Тефлоном® перемешивающим стержнем, загружают 0,0188 г (0,052 ммоль) димера аллилпалладий хлорида (при отношении мономера к катализатору 500:1) и 2 мл метиленхлорида. В другую 10 мл стеклянную пробирку загружают 0,0357 г (0,104 ммоль) гексафторантимоната серебра и 2 мл метиленхлорида. Раствор катализатора готовят смешением раствора димера аллилпалладий хлорида с раствором гексафторантимоната серебра внутри бокса с осушенной атмосферой. Наблюдается немедленное осаждение хлорида серебра, который отфильтровывают для получения прозрачного желтого раствора. Раствор активного желтого катализатора добавляют к раствору мономера шприцем при 50oС, и реакционную смесь перемешивают в течение 16 ч при комнатной температуре. Какого-либо значительного увеличения вязкости раствора не наблюдается, и раствор фильтруют через 0,5 мк фильтр, а затем концентрируют в ротационном испарителе. Полученный вязкий раствор растворяют в метаноле и осаждают в смеси метанола с водой для получения белого твердого вещества. Выход 23%. Найденное значение молекулярной массы (определенное методом гельпроникающей хроматографии в тетрагидрофуране с полистирольными стандартами) Мn= 15 700 г/моль и Мw=32 100 г/моль. Термогравиметрический анализ (ТГА) под азотом (скорость нагрева 10oС/мин) показывает на термостабильность полимера до около 155oС с последующей потерей, приблизительно, 20% массы при 290oС (указывая на потерю трет-бутильных групп в виде изобутилена с образованием гомополимера 5-норборненкарбоновой кислоты) с последующей деградацией полимера при около 450oС.
Пример 15. Синтез диэтилового эфира бицикло[2.2.1]гепт-5-ен-экзо, экзо-2,3-дикарбоновой кислоты.
Экзо, экзо-диэтиловый эфир норборнена синтезируют из экзо-5-норборнен-2,3-дикарбоновой кислоты. Экзо-изомер получают термической конверсией ангидрида эндо-5-норборнен-2,3-дикарбоновой кислоты при 190oС с последующей перекристаллизацией из толуола несколько раз, как в ссылке 1 для получения чистого ангидрида экзо-5-норборнен-2,3-дикарбоновой кислоты. Часть экзо-ангидрида гидролизуют в кипящей воде, и раствор охлаждают для получения чистой дикарбоновой кислоты почти с количественным выходом. Дикарбоновую кислоту превращают в диэтиловый эфир, используя триэтилоксониевую соль, как это изложено ниже.
В 250 мл трехгорлую колбу, снабженную магнитным перемешивающим стержнем, загружают 16,0 г (0,0824 моль) чистой экзо-норборненовой дикарбоновой кислоты и 35 г (0,1846 моль) триэтилоксоний тетрафторбората. Колбу закупоривают пробками и добавляют 300 мл дихлорэтана в атмосфере аргона. Заменяют пробку на конденсатор в атмосфере азота, а в другое горлышко вставляют дополнительную воронку. Через эту воронку по каплям медленно добавляют 35 мл этилдиизопропиламина. Наблюдается небольшой разогрев (экзотермическая реакция) и раствору позволяют стечь обратно. После завершения введения амина раствор выдерживают при комнатной температуре в течение 15 ч. Затем реакционную смесь экстрагируют тремя порциями по 50 мл каждая раствора соляной кислоты с последующей троекратной экстракцией порциями по 50 мл бикарбоната натрия и в заключение промывают два раза водой. Органический раствор сушат над сульфатом магния, обрабатывают углем, фильтруют и концентрируют на ротационном испарителе. После очистки остатка дистилляцией при 110oС получают 15 г (75%) чистого экзо-диэтилового эфира норборнена в виде бесцветной вязкой жидкости с фруктовым запахом.
1H-ЯМР (СDСl3): d= 1,22 (3Н; t, СН3), d=1,47
(1Н), d=2,15 (1Н), d=2,58 (2H; s,

Пример 16. Синтез бицикло[2.2.1]гепт-5-ен-экзо-2-трет-бутилового эфира, экзо-3-карбоновой кислоты.
В 50 мл круглодонную колбу с одним горлом, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют 1,5 г (9,15 ммоль) чистого экзо-надикангидрида, 10 мл свежедистиллированного метиленхлорида, 20 мл трет-бутанола (0,209 моль). К раствору добавляют 7,5 г (0,061 моль) диметиламинопиридина и раствор нагревают с обратным холодильником при 75oС в течение 8 ч. Вначале ангидрид не растворяется, но после некоторого периода времени твердое вещество растворяется, и раствор приобретает коричневый цвет. Раствор охлаждают, концентрируют на ротационном испарителе для удаления метиленхлорида, и вязкий раствор медленно добавляют в подкисленную соляной кислотой воду. Осадок твердого вещества отфильтровывают, промывают водой и вновь растворяют в простом эфире, обработанном сульфатом магния, с последующей обработкой сажей. Раствор фильтруют на циолите (Celite). Удаляют простой эфир на ротационном испарителе для получения твердого вещества. Выход 8,5 г, 60%.
1H-ЯМР (СDСl3): d=1,47 (9Н; s, трет-бутил), d=1,60 (1Н), d=2,15 (1Н), d= 2,58 (2Н; m,

Пример 17. Синтез бицикло[2.2.1]гепт-5-ен-экзо-2-трет-бутил, экзо-3-метиловый эфир дикарбоновой кислоты.
В круглодонную трехгорлую колбу емкостью 100 мл, снабженную магнитным перемешивающим стержнем, загружают 9,7 г (0,0408 моль) чистого экзо-трет-бутилового полуэфира норборненкарбоновой кислоты и 6,05 г (0,0408 моль) триметилоксоний тетрафторбората. Колбу закупоривают пробками и добавляют 100 мл дихлорметана через воронку в атмосфере аргона. Заменяют резиновую пробку на конденсатор в атмосфере аргона, а в другое горло вставляют дополнительную воронку. Через эту воронку по каплям медленно добавляют 7,3 мл этилдиизопропиламина. Наблюдается экзотермическая реакция, и раствору позволяют сконденсироваться обратно. После завершения введения амина раствор выдерживают при комнатной температуре в течение 15 ч. Затем реакционную смесь экстрагируют тремя порциями по 50 мл каждая раствора соляной кислоты с последующей троекратной экстракцией порциями по 50 мл бикарбоната натрия и в заключение промывают два раза водой. Органический раствор сушат над сульфатом магния, обрабатывают углем, фильтруют и концентрируют на ротационном испарителе. Получают бесцветную жидкость, которая начинает кристаллизоваться. Твердое вещество промывают холодным пентаном, и пентановый раствор концентрируют на ротационном испарителе для получения бесцветной жидкости, кристаллизующейся при охлаждении. Выход 5,1 г.
1H-ЯМР (СDСl3): d=1,45 (9Н; s, трет-бутил), d=1,47 (1Н), d=2,15 (1Н), d= 2,54 (2Н; m,

Пример 18. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют 5-норборненкарбоновой кислоту (2,0 г, 14,5 ммоль, экзо, эндо смесь) и дихлорэтан (20 мл). К этой перемешиваемой смеси при комнатной температуре добавляют раствор катализатора, полученный добавлением димера η3-аллилпалладий хлорида (6 мг, 16 мкмоль) в дихлорэтане (5 мл) к гексафторантимонату серебра (50 мг, 146 мкмоль) в течение 30 мин с последующим фильтрованием через микропористый фильтр (для удаления осажденного хлорида серебра). После 18 ч проведения реакции смесь желатинизируется с образованием прозрачного желтого геля. После добавления геля к избытку гексана полимер осаждается в виде белого порошка. Полимер промывают избытком гексана и сушат. Выход полимера 1,2 г (60%). Найденная молекулярная масса полимера Мw = 22 000 и полидисперсность 2,3.
После добавления части этого полимера (0,5 г) к 0,1 N водному раствору КОН (10 мл) при перемешивании полимер немедленно растворяется с образованием невязкого бесцветного раствора. Это демонстрирует способность к проявлению этих материалов в водном растворе основания, поскольку никакие другие гомополимеры трет-бутилового эфира 5-норборненкарбоновой кислоты не проявляют тенденции к растворению в тех же условиях.
Пример 19. Синтез Пиннера (The Pinner syntesis) сложных орто-эфиров состоит из двух стадий.
Стадия 1. Синтез гидрохлорида имидового эфира.
Реакцию проводят в двугорлой круглодонной колбе емкостью 1 л, снабженной мешалкой, масляным барботером и трубкой с безводным хлоридом кальция. В колбу загружают следующие реагенты: 100 г (0,84 моль) норборненкарбонитрила (NB-CN), 37 мл (0,91 моль) безводного метанола и 200 мл безводного диэтилового эфира. Колбу помещают в ледяную баню и через смесь барботируют 61 г (1,67 моль) сухого хлористого водорода при перемешивании в течение 1,5 ч. Колбу помещают на ночь в холодильник при 0oС. Утром смесь затвердевает в "кулич". Его разбивают на куски и добавляют еще 200 мл диэтилового эфира. Колбу выдерживают в холодильнике еще 10 дней при периодическом перемешивании. По окончании этого процесса осажденный гидрохлорид имидиевого эфира фильтруют отсасыванием и промывают пятикратно приблизительно 300 мл диэтилового эфира. Из фильтрата выделяют примерно 20 г непрореагировавшего NB-CN.
Выход гидрохлорида имидиевого эфира - 76% (120 г, 0,64 моль).
Структуры продукта подтверждаются1H-ЯМР спектроскопией.
Стадия 2. Синтез орто-эфиров.
В колбу емкостью 0, 5 л загружают 56,7 г (0,30 моль) гидрохлорида имидиевого эфира, 37 мл (0,91 моль) безводного метанола и 250 мл безводного петролейного эфира. Реакцию осуществляют при комнатной температуре в течение 5 дней с периодическим перемешиванием. Осажденный аммонийхлорид отфильтровывают и промывают трижды петролейным эфиром. Фильтрат и промывные воды собирают, петролейный эфир отгоняют и продукт разделяют на фракции дистилляцией в вакууме. Фракцию с температурой кипения 68oС-69oС/3 мм Нg охлаждают. Выход - 50%, 30 г, 0,15 моль). Согласно1H-ЯМР спектру продукт содержит 97% 5-норборнен-2-триметоксиметана (орто-эфир).
Пример 20. В раствор 2,16 г (10,9 ммоль) С7Н9С(ОСН3)3 (норборнентриметилортоэфира) в 16 мл 1,2-дихлорэтана добавляют раствор продукта реакции, полученный смешением 1 моля димера аллилпалладий хлорида с 2 моль гексафторантимоната серебра в дихлорэтане и фильтрацией образованного осадка хлорида серебра. Количество добавленного катализатора соответствует 0,08 ммоль палладия, растворенного в 2 мл дихлорэтана. Перемешиваемую реакционную смесь помещают в масляную баню при 70oС и проводят реакцию в течение 20 ч.
По окончании реакции добавляют 2 мл метанола, удаляют растворитель на ротационном испарителе и полимер сушат в вакууме до постоянного веса. Выход 1, 28 г (60%).
Пример 21. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют бицикло[2.2.1]гепт-5-ен-2-метилацетат (18,44 г, 0,1109 моль) и трет-бутиловый эфир норборнена (21,55 г, 0,1109 моль) и 75 мл толуола. Раствор никелевого катализатора [толуоловый комплекс бис(перфторфенил)никеля, (Toл)Ni(C6F5)2] готовят в боксе с осушенной атмосферой растворением 0,5367 г (1,109 ммоль (Тол)Ni(С6F5)2) в 15 мл толуола. Раствор активного катализатора добавляют к раствору мономера посредством шприца при комнатной температуре. Реакционную смесь перемешивают в течение 6 часов при комнатной температуре. Раствор разбавляют толуолом и полимер осаждают избытком метанола. Осажденный полимер фильтруют, промывают ацетоном и сушат в течение ночи под вакуумом. Выход выделенного полимера 24,9 г (63%). Молекулярную массу определяют гельпроникающей хроматографией. Найдено: Мn=21 000 и Мw=52 000. ЯМР-анализ сополимера показывает на присутствие 51 мол.% трет-бутиловых групп. ИК-анализ сополимера указывает на отсутствие кислотных групп.
Пример 22. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют бицикло[2.2.1]гепт-5-ен-2-метил-этилкарбонат (4,03 г, 0,0205 моль) и трет-бутиловый эфир норборнена (3,98 г, 0,0205 моль) и 50 мл толуола. Раствор никелевого катализатора [толуоловый комплекс бис(перфторфенил)никеля, (Тол)Ni(С6F5)2] готовят в боксе с осушенной атмосферой растворением 0,0991 г (0,2049 ммоль (Тол)Ni(С6F5)2 в 15 мл толуола. Раствор активного катализатора добавляют к раствору мономера через воронку при комнатной температуре. Реакцию проводят при комнатной температуре. Раствор разбавляют толуолом и полимер осаждают избытком метанола. Осажденный полимер фильтруют, промывают ацетоном и сушат в течение ночи под вакуумом. Выход выделенного полимера 4,16 г (52%). Молекулярную массу полимера определяют гельпроникающей хроматографией. Найдено: Мn=22 000 и Мw=58 000. ЯМР-анализ сополимера показывает на присутствие 50 мол.% трет-бутиловых групп. ИК-анализ сополимера указывает на отсутствие кислотных групп.
Пример 23. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют бицикло[2.2.1]гепт-5-ен-2-метил-бутилкарбонат (17,15 г, 0,0764 моль) и трет-бутиловый эфир норборнена (14,85 г, 0,0764 моль) и 72 мл толуола. Раствор никелевого катализатора [толуоловый комплекс бис(перфторфенил)никеля, (Тол)Ni(С6F5)2] готовят в боксе с осушенной и очищенной атмосферой растворением 0,3699 г (0,7644 ммоль (Тол)Ni(С6F5)2 в 15 мл толуола. Раствор активного катализатора добавляют к раствору мономера через воронку при комнатной температуре. Реакцию проводят при премешивании в течение 6 ч при компотной температуре. Раствор разбавляют толуолом, и полимер осаждают избытком метанола. Осажденный полимер фильтруют, промывают ацетоном и сушат в течение ночи под вакуумом. Выход выделенного полимера 17,53 г (54%). Молекулярную массу полимера определяют гельпроникающей хроматографией. Найдено: Мn=22 000 и Мw=58 000. ЯМР-анализ сополимера показывает на присутствие 54 мол.% трет-бутиловых групп. ИК-анализ сополимера указывает на отсутствие кислотных групп.
Пример 24. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют трет-бутиловый эфир норборнена (29,92 г, 0,154 моль) с последующим добавлением сухого малеинового ангидрида (15,10 г, 0,154 моль) и 90 мл хлорбензола. Эту смесь трижды дегазируют для удаления следов кислорода. Затем реакционную смесь нагревают до 80oС. К реакционной смеси с помощью сухого шприца добавляют дегазированный раствор перекиси бензоила в качестве свободно-радикального инициатора полимеризации, содержащий 0,9948 г (0,04 моль) перекиси бензоила в 10 мл хлорбензола. После завершения реакции раствор полимера выливают непосредственно в гексан для осаждения полимера. Осаждается белый осадок. Осажденный полимер отделяют от непрореагировавшего малеинового ангидрида, который может присутствовать в смеси. Затем полимер сушат в течение ночи в вакуумной печи при комнатной температуре. Масса полученного сухого полимера равна 20,62 г, выход 45,8%. Молекулярную массу полимера определяют гельпроникающей хроматографией. Найдено: Мn= 4 200 и Мw=8 800. ЯМР-анализ сополимера показывает на присутствие как трет-бутильных групп, так и групп малеинового ангидрида.
Пример 25. В стеклянную пробирку емкостью 50 мл, снабженную покрытым Тефлоном® перемешивающим стержнем, добавляют бицикло[2.2.1]гепт-5-ен-2-метилацетат (13,3 г, 0,0799 моль), трет-бутиловый эфир норборнена (15,70 г, 0,0808 моль) с последующим добавлением сухого малеинового ангидрида (15,85 г, 0,162 моль) и 90 мл хлорбензола. Эту смесь трижды дегазируют для удаления следов кислорода. Затем реакционную смесь нагревают до 80oС. В реакционную смесь сухим шприцем добавляют дегазированный раствор перекиси бензоила в качестве свободно-радикального инициатора полимеризации, содержащий 1,0438 г (0,041 моль) перекиси бензоила в 10 мл хлорбензола. Реакцию проводят при перемешивании в течение 19 часов. После завершения реакции раствор полимера выливают непосредственно в гексан для осаждения полимера. Осаждается белый осадок. Осажденный полимер отделяют от непрореагировавшего малеинового ангидрида, который может там присутствовать. Затем полимер сушат в течение ночи в вакуумной печи при комнатной температуре. Масса полученного сухого полимера равна 21,89 г, выход 48,7%. Молекулярную массу полимера определяют гельпроникающей хроматографией. Найдено: Мn=3 000 и Мw=6 600. ЯМР-анализ сополимера указывает на присутствие ацетатных и трет-бутиловых групп. ИК-анализ сополимера указывает на присутствие ацетатных, трет-бутиловых групп и групп малеинового ангидрида.
Пример 26. Сополимер трет-бутилового эфира норборнена с норборненовой карбоновой кислотой, 50:50.
В стеклянную пробирку емкостью 50 мл, снабженную магнитным перемешивающим стержнем, в атмосфере азота добавляют трет-бутиловый эфир норборненкарбоновой кислоты (2 г, 10 ммоль) и норборненовую карбоновую кислоту (1,38 г, 10 ммоль). К этой перемешиваемой смеси добавляют инициатор (перекись трет-бутила) (2,9 г) и полученную смесь нагревают до 130oС. Перемешивание продолжают в течение 16 ч. Полученный полимер (растворимый как в тетрагидрофуране, так и в толуоле) высаждают в гексан и фильтруют с получением продукта. Масса высушенного продукта равна 2,91 г (86% конверсия). Полученный твердый полимер имеет молекулярную массу Мn=3 000 и Мw=20 000. ИК, ЯМР и ТГА-анализы сополимеров подтверждают, что получен аддитивный сополимер из двух мономеров, имеющий нерегулярную структуру.
Пример 27. Сополимер трет-бутилового эфира норборненовой карбоновой кислоты с метиловым эфиром норборненовой карбоновой кислоты, 50:50. В стеклянную пробирку емкостью 50 мл, снабженную магнитным перемешивающим стержнем в атмосфере азота, добавляют трет-бутиловый эфир норборненкарбоновой кислоты (2 г, 10 ммоль) и метиловый эфир норборненовой карбоновой кислоты (1,5 г, 10 ммоль). К этой перемешиваемой смеси при комнатной температуре добавляют инициатор (перекись трет-бутила) (2,9 г) и полученную смесь нагревают до 130oС. Перемешивание продолжают в течение 16 часов. Полученный полимер (растворимый в толуоле) высаждают в метанол и фильтруют с получением продукта. Масса высушенного продукта равна 0,82 г (степень конверсии 23%). Полученный твердый полимер имеет молекулярную массу Мn=6 000 и Мw=35 000. ИК, ЯМР и ТГА-анализы подтверждают, что получен аддитивный сополимер из двух мономеров, имеющий нерегулярную структуру.
Пример 28. Сополимер трет-бутилового эфира норборненовой карбоновой кислоты с этиловым эфиром тетрациклододекеновой карбоновой кислоты, 50:50.
В стеклянную пробирку емкостью 100 мл, снабженную магнитным перемешивающим стержнем в атмосфере азота, добавляют толуол (40 мл), трет-бутиловый эфир норборненкарбоновой кислоты (1,94 г, 10 ммоль) и этиловый эфир тетрациклододекеновой карбоновой кислоты (2,32 г, 10 ммоль). К этому перемешиваемому раствору при комнатной температуре добавляют раствор дихлорида бис(трициклогексилфосфин)бензилиденрутения (34 мг, 0,042 ммоль) в 5 мл толуола. Через 1 ч добавляют этилвиниловый эфир (0,015 мл, 0,156 ммоль) и перемешивают в течение 1 ч. Полимерный раствор осаждают добавлением избытка метанола, собирают фильтрацией и сушат в вакууме. Выделяется 3,46 г (выход 81%) сополимера. Найдено: Мn=133 000 и Мw=221 000.
Сополимер повторно растворяют в толуоле и пропускают через колонку с силикагелем. При этом исчезает заметная окраска (рутения). Полимер вновь осаждают в избытке метанола с получением чистого белого сополимера.
Пример 29. Сополимер трет-бутилового эфира норборнена с этиловым эфиром тетрациклододекеновой карбоновой кислоты, 50:50.
В стеклянную пробирку емкостью 100 мл, снабженную магнитным перемешивающим стержнем в атмосфере азота, добавляют толуол (80 мл), трет-бутиловый эфир норборненкарбоновой кислоты (3,9 г, 20 ммоль) и этиловый эфир тетрациклододекенкарбоновой кислоты (4,64 г, 20 ммоль). К этому перемешиваемому раствору при комнатной температуре добавляют раствор дихлорида бис(трициклогексилфосфин)бензилиденрутения (68 мг, 0,083 ммоль) в 5 мл толуола. Через 2 ч добавляют этилвиниловый эфир (0,030 мл, 0,31 ммоль) и перемешивают в течение 2 ч.
Органо-смоляной раствор пропускают через силикагельную колонку для получения прозрачного бесцветного раствора. Раствор осаждают добавлением избытка метанола, собирают фильтрацией и сушат под вакуумом. Выделяют 6,54 г (выход 77%) сополимера. Найдено: Мn=182 000 и Мw=244 000. Измеренная методом DSC температура стеклования равна 220oС.
Пример 30. Сополимер трет-бутилового эфира норборненкарбоновой кислоты с этиловым эфиром тетрациклододекенкарбоновой кислоты, 50:50.
В реактор из нержавеющей стали емкостью
300 мл, снабженный механической мешалкой и содержащий азот, добавляют толуол (90 мл), трет-бутиловый эфир норборненкарбоновой кислоты (3,9 г, 20 ммоль) и этиловый
эфир
тетрациклододекенкарбоновой кислоты (4,64 г, 20 ммоль). К этому перемешиваемому раствору при комнатной температуре добавляют раствор дихлорида бис(трициклогексилфосфин)бензилиденрутения (68 мг, 0,083
ммоль) в 5 мл толуола. Через 2 ч добавляют этилвиниловый эфир (0,030 мл, 0,31 ммоль) и перемешивают в течение 16 ч. В реактор подают водород (давление 2410 кПа (350 psig)) и поддерживают температуру
при 175oС в течение 7 ч. По окончании реакции раствор пропускают через силикагелевую колонку и выделяют гидрированный сополимер. Методом ЯМР определяют, что степень гидрогенизации
сополимера составляет 95%. Найдено: Мn=163 000 и Мw=237 000.
Пример 31. Сополимер трет-бутилового эфира норборненкарбоновой кислоты с этиловым эфиром тетрациклододекенкарбоновой кислоты, 50:50.
В стальной реактор из нержавеющей стали емкостью 300 мл, снабженный механической мешалкой и содержащий азот, добавляют толуол (90 мл), трет-бутиловый эфир норборненкарбоновой кислоты (2,9 г, 15 ммоль) и этиловый эфир тетрациклододекенкарбоновой кислоты (3,5 г, 15 ммоль). К этому перемешиваемому раствору при температуре окружающей среды добавляют раствор дихлорида бис(трициклогексилфосфин)бензилиденрутения (50 мг, 0,060 ммоль) в 5 мл толуола. Через 2 ч в реактор вводят водород (давление 5510 кПа (800 psig)) и поддерживают температуру при 175oС в течение 7 ч. По окончании реакции раствор пропускают через силикагельную колонку и выделяют гидрированный сополимер. ЯМР-методом определяют, что полимер имеет степень гидрогенизации 96%. Найдено: Мn=172 000 и Мw=278 000.
Пример 32. Сополимер трет-бутилового эфира норборненкарбоновой кислоты с этиловым эфиром тетрациклододекенкарбоновой кислоты, 50:50.
В стеклянную пробирку емкостью 100 мл, снабженную магнитным перемешивающим стержнем и содержащую азот, добавляют толуол (40 мл), трет-бутиловый эфир норборненкарбоновой кислоты (1,94 г, 10 ммоль), этиловый эфир тетрациклододекенкарбоновой кислоты (2,32 г, 10 ммоль) и 1-гексен (0,050 мл, 0,4 ммоль). К этому перемешиваемому раствору при температуре окружающей среды добавляют раствор дихлорида бис(трициклогексилфосфин)бензилиденрутения (34 мг, 0,042 ммоль) в 5 мл толуола. Через 2 ч раствор полимера добавляют в избыток метанола, собирают фильтрацией и сушат под вакуумом. Получают 3,1 г (выход 73%) полимера. Найдено: Мn=22 000 и Мw=35 000.
Пример 33. Сополимер трет-бутилового эфира норборненкарбоновой кислоты с этиловым эфиром тетрациклододекенкарбоновой кислоты, 50:50.
В стеклянную пробирку емкостью 100 мл, снабженную магнитным перемешивающим стержнем и содержащую азот, добавляют толуол (40 мл), трет-бутиловый эфир норборненкарбоновой кислоты (1,94 г, 10 ммоль), этиловый эфир тетрациклододекенкарбоновой кислоты (2,32 г, 10 ммоль) и 1-гексен (0,275 мл, 2,2 ммоль). К этому перемешиваемому раствору при температуре окружающей среды добавляют раствор дихлорида бис(трициклогексилфосфин)бензилиденрутения (34 мг, 0,042 ммоль) в 5 мл толуола. Через 2 ч раствор полимера добавляют в избыток метанола, собирают фильтрацией и сушат под вакуумом. Выделяют 3,45 г (выход 81%) полимера. Найдено: Мn=6 000 и Мw=8 000.
Пример 34. Сополимер трет-бутилового эфира норборненкарбоновой кислоты с этиловым эфиром тетрациклододекенкарбоновой кислоты, 50:50.
В стеклянную пробирку емкость 100 мл, снабженную магнитным перемешивающим стержнем и содержащую азот, добавляют толуол (40 мл), трет-бутиловый эфир норборненкарбоновой кислоты (1,94 г, 10 ммоль), этиловый эфир тетрациклододекенкарбоновой кислоты (2, 32 г, 10 ммоль) и 1-гексен (0,62 мл, 5,0 ммоль). К этому перемешиваемому раствору при температуре окружающей среды добавляют раствор дихлорида бис(трициклогексилфосфин)бензилиденрутения (34 мг, 0,042 ммоль) в 5 мл толуола. Через 2 ч раствор полимера добавляют в избыток метанола, собирают фильтрацией и сушат под вакуумом. Выделяют 2,75 г (выход 65%) полимера.
Пример 35. Сополимер трет-бутилового эфира норборненкарбоновой кислоты с этиловым эфиром тетрациклододекенкарбоновой кислоты, 50:50.
В стеклянную пробирку емкостью 100 мл, снабженную магнитным перемешивающим стержнем и содержащую азот, добавляют толуол (80 мл), трет-бутиловый эфир норборненкарбоновой кислоты (3,9 г, 20 ммоль), этиловый эфир тетрациклододекенкарбоновой кислоты (4,64 г, 20 ммоль) и 1-гексен (0,088 мл, 0,7 ммоль). К этому перемешиваемому раствору при температуре окружающей среды добавляют раствор дихлорида бис(трициклогексилфосфин)бензилиденрутения (68 мг, 0,083 ммоль) в 5 мл толуола. Через 2 ч добавляют этилвиниловый эфир (0,030 мл, 0,31 ммоль) и перемешивают в течение 2 ч.
Янтарно-оранжевый раствор полимера пропускают через силикагельную колонку, устраняющую темную окраску (рутений). Раствор осаждают добавлением избытка метанола, собирают фильтрацией и сушат в течение ночи при 80oС под вакуумом.
Выделяют 2,6 г (выход 30%) полимера. Найдено: Мn=3 000 и Мw=4 000.
Пример 36. Сополимер трет-бутилового эфира норборненкарбоновой кислоты с этиловым эфиром тетрациклододекенкарбоновой кислоты, 50:50.
В реактор из нержавеющей стали емкостью 300 мл, снабженный механической мешалкой и содержащий азот, добавляют толуол (80 мл), трет-бутиловый эфир норборненкарбоновой кислоты (3,9 г, 20 ммоль), этиловый эфир тетрациклододекенкарбоновой кислоты (4,64 г, 20 ммоль) и 1-гексен (0,088 мл, 0,7 ммоль). К этому перемешиваемому раствору при температуре окружающей среды добавляют раствор дихлорида бис(трициклогексилфосфин)бензилиденрутения (68 мг, 0,042 ммоль) в 5 мл толуола. Через 2 ч в реактор подают водород (давление 5170 кПа (750 psig)) и поддерживают температуру при 175oС в течение 20 ч.
Раствор осаждают добавлением избытка метанола, собирают фильтрацией и сушат в течение ночи при 80oС под вакуумом. Выделяют приблизительно 5 г (выход 59%) полимера. Найдено: Мn=20 000 и Мw=30 000. ЯМР-методом определяют, что степень гидрогенизации сополимера составляет более 99%.
Пример 37. Сополимер трет-бутилового эфира норборненкарбоновой кислоты с этиловым эфиром тетрациклододекенкарбоновой кислоты, 65:35.
В круглодонную колбу емкостью 250 мл, снабженную магнитным перемешивающим стержнем и содержащую азот, добавляют толуол (160 мл), трет-бутиловый эфир норборненкарбоновой кислоты (10,1 г, 52 ммоль), этиловый эфир тетрациклододекенкарбоновой кислоты (6,5 г, 28 ммоль) и 1-гексен (0,176 мл, 1,4 ммоль). К этому перемешиваемому раствору при комнатной температуре добавляют раствор дихлорида бис(трициклогексилфосфин)бензилиденрутения (131 мг, 0,160 ммоль) в 5 мл толуола. Через 16 ч добавляют этилвиниловый эфир (0,060 мл., 0,62 ммоль) и перемешивают в течение 1,5 ч. Раствор полимера пропускают через силикагелевую колонку для удаления рутения. Раствор добавляют в избыток метанола, собирают фильтрацией и сушат под вакуумом. Выделяют 9,69 г (выход 58%) полимера.
Найдено: Мn= 31 000 и Мw=42 000. Для измерения температуры стеклования полимера используют методы DSC. Найденное значение температуры стеклования составляет 110oС.
Пример 38. В стеклянной пробирке емкостью 100 мл, содержащей азот, растворяют 5,0 г полимера из примера 37 в тетрагидрофуране (80 мл). Раствор переносят в стальной реактор емкостью 300 мл. В реактор добавляют 2,25 г 5 мас. % катализатора палладий на алюминии (приобретенного от Aldrich). Затем реактор нагревают до 175oС и подают водород с давлением 5510 кПа (800 psig)). Температуру и давление поддерживают в течение 9,5 ч. Полученный раствор полимера центрифугируют, отделяют бесцветный раствор и осаждают полимер в избытке метанола. Методами ЯМР обнаружено, что полученный сополимер имеет степень гидрогенизации свыше 99%.
Пример 39. Сополимер трет-бутилового эфира норборненкарбоновой кислоты с этиловым эфиром тетрациклододекенкарбоновой кислоты, 50:50.
В стеклянную пробирку емкостью 100 мл, снабженную магнитным перемешивающим стержнем и содержащую азот, добавляют толуол (80 мл), трет-бутиловый эфир норборненкарбоновой кислоты (3,9 г, 20 ммоль), этиловый эфир тетрациклододекенкарбоновой кислоты (4,64 г, 20 ммоль) и 1-гексен (0,088 мл, 0,7 ммоль). К этому перемешиваемому раствору при температуре окружающей среды добавляют раствор дихлорида бис(трициклогексилфосфин)бензилиденрутения (68 мг, 0,084 ммоль) в 5 мл толуола. Через 2 ч добавляют этилвиниловый эфир (30 мкл) для приостановления дальнейшей реакции, и смесь перемешивают в течение 1,5 ч. Раствор полимера пропускают через силикагелевую колонку для удаления остатков рутения, и осаждением в метаноле выделяют полимер в виде чистого белого твердого вещества. Найденное значение молекулярной массы полимера равно Мn=33 700 и Мw=46 000. Полимер полностью охарактеризован методами ИК, ЯМР и ТГА.
Пример 40. В автоклав из нержавеющей стали с внутренним объемом 300 мл добавляют этил-2-метил-4-пентаноат (99 г, 0,7 моль) и свежекрекированный циклопентадиен (46,4 г, 0,7 моль). Перемешиваемую смесь нагревают до 200oС и оставляют на ночь. Затем реактор охлаждают и содержимое удаляют. Полученный норборнен с функциональными группами (норборнен-СН2СН(СН3)С(O)ОС2Н5) очищают вакуумной дистилляцией и определяют температуру кипения около 46-47oС при давлении 0,02 мм рт.ст. Методом газовой хроматографии определено, что продукт имеет степень чистоты 98,4-99,3% (различные фракции). Выход выделенного высоко чистого продукта около 33 г.
Пример 41. Сополимер трет-бутилового эфира норборненкарбоновой кислоты с эфиром формулы (норборнен-СН2СН(СН3)С(O)ОС2Н5), 40:60.
В стеклянную пробирку емкостью 100 мл, снабженную магнитным перемешивающим стержнем в атмосфере азота, добавляют толуол (50 мл), трет-бутиловый эфир норборненкарбоновой кислоты (2,7 г, 14 ммоль), и эфир из примера 40 (норборнен-СН2СН(СН3)С(O)ОС2Н5) (4,4 г, 21 ммоль). К этому перемешиваемому раствору при температуре окружающей среды добавляют раствор (толуол)Ni(C6F6)2 в толуоле (1 мл) и полученный раствор нагревают до 50oС. Перемешивание продолжают в течение 3 ч. Полимер осаждают в метаноле и фильтруют. Полученное твердое вещество перерастворяют в тетрагидрофуране, фильтруют и осаждают вновь метанолом и фильтруют. Полученный белый твердый полимер сушат. Масса полученного полимера 2,66 г. Найденное значение молекулярной массы полимера равно Мn=39 800 и Мw=70 000. Верхний слой раствора упаривают до суха с получением дополнительного количества белого полимера с массой в сухом состоянии 1,52 г. Найдено: Мn=31 000 и Мw=60 650. Общий выход полимера указывает на степень конверсии мономеров 59%. ИК, ЯМР и ТГА-анализы сополимера подтверждают получение аддитивного сополимера из двух мономеров с нерегулярной структурой.
Пример 42. Сополимер трет-бутилового эфира норборнена с эфиром формулы (норборнен-СН2СН(СН3)С(O)ОС2Н5), 40:60.
В стеклянную пробирку емкостью 250 мл, снабженную магнитным перемешивающим стержнем в атмосфере азота, добавляют дихлорэтан (200 мл), трет-бутиловый эфир норборненкарбоновой кислоты (7,76 г, 40 ммоль), и эфир из примера 40 (норборнен-СН2СН(СН3)С(O)ОС2Н5) (12,5 г, 60 ммоль) и 2,6-ди-трет-бутилпиридин (28,8 мг, 0,26 ммоль). К этому перемешиваемому раствору при температуре окружающей среды добавляют раствор катализатора, полученный смешением димера хлорида аллилпалладия (0,183 г, 0,5 ммоль) с гексафторантимонатом серебра (эквивалентное количество) в дихлорэтане (3 мл) и фильтрованием для удаления осажденного хлорида серебра. Полученный раствор нагревают до 50oС Перемешивание продолжают в течение 16 ч. Раствор полимера обрабатывают окисью углерода (давление 28 кПа (4 psig)) в течение 48 ч для осаждения в осадок палладия, фильтруют через фильтр с размером ячеек 0,45 мкм, уменьшают в объеме и осаждают избытком метанола с получением 7,9 г сополимера (степень конверсии 39%). Найденное значение молекулярной массы равно Мn=7 000 и Мw= 11 600. Сополимер полностью охарактеризован методами ИК, ЯМР и ТГА-анализов.
Пример 43. Сополимеризация окиси углерода с норборнен-5-трет-бутиловым эфиром.
Деоксигенированный раствор бипиридина (0,025 г, 0,16 ммоль) в метаноле добавляют к ацетату палладия (II) (0,012 г, 0,053 ммоль), растворенному в деоксигенированном метаноле. К этому раствору добавляют п-толуолсульфокислоту (0,045 г, 0,27 ммоль), растворенную в деоксигенированном метаноле. Полученный коричневый раствор добавляют к раствору бензохинона (1,72 г, 1,59 ммоль) в деоксигенированном метаноле. Этот раствор вводят в реактор из нержавеющей стали, предварительно нагретый до 50oС. Затем в этот реактор добавляют норборнен-5-трет-бутиловый эфир (5,14 г, 0,027 моль) в 100 мл метанола, деоксигенированного в аргоне. Давление в реакторе повышают окисью углерода до 4130 кПа (600 psig) и нагревают до 65oС. Через 4,5 ч удаляют из реактора окись углерода, и реактор охлаждают. Фильтруют розовый раствор для удаления остатков палладия и раствор упаривают. Полученную смесь растворяют в минимальном количестве тетрагидрофурана и медленно вливают в смесь воды с метанолом 25: 75 для осаждения полимера. Эту процедуру повторяют дважды. Полученный белый полимер фильтруют и сушат при комнатной температуре под вакуумом. Выход продукта 2,9 г.
Пример 43А. Деоксигенированный и высушенный тетрагидрофуран/метанольный (35 мл/15 мл) раствор бензохинона (0,43 г, 0,40 ммоль), бипиридин (0,0062 г, 0,0040 ммоль) и Рd(MеСN)2(п-толуолсульфонат)2 (0,0070 г, 0,0013 ммоль) помещают в сухой реактор из нержавеющей стали на 500 мл, нагретый до 50oС. В реактор добавляют норборнен-5-трет-бутиловый эфир (5,14 г, 0,027 моль) в 100 мл тетрагидрофурана (деоксигенированного и высушенного). Реактор наполняют окисью углерода до давления 4130 кПа (600 psig) и нагревают до 65oС. Через 12,5 ч реактор нагревают до 90oС за 1,5 ч. Затем удаляют из реактора окись углерода, и реактор охлаждают. Раствор из реактора пурпурного цвета фильтруют для удаления остатков палладия и упаривают. Полученную смесь растворяют в минимальном количестве тетрагидрофурана и медленно вливают в смесь воды с метанолом, 25: 75 для осаждения полимера. Эту процедуру повторяют дважды. Полученный белый полимер фильтруют и сушат под вакуумом. Выход продукта 2,9 г.
Примеры 44-50. Измерения оптической плотности циклических олефиновых гомо- и сополимеров при 193 нм.
Оптическая плотность является критической характеристикой эффективных фоторезистов, поскольку она определяет равномерность проникания энергии через толщину пленки. Полимерная цепь обычно используемых в литографии полимеров имеет оптическую плотность менее 0,2 оптических единиц/микрон перед добавлением генерирующих кислоту фотоинициаторов. (Т. Neenan, E. Chandross, J. Kometani and O. Nalamasu, "Styrylmethylsulfonamides: Versatile Base-Solubilizing Components of Photoresist Resins", pg. 199 in Microelectronics Technology, Polymers for Advanced Imaging and Packaging, ACS Symposium Series 614, Eds: E. Reichmanis, C. Ober, S. MacDonald, T. Iwayanagai and T. Nishikubo, 1995, April). Полигидроксистирол, исходный компонент обычных длинноволновых 248 нм УФ-фоторезистов, имеет оптическую плотность 2,8 оптических единиц/микрон при 193 нм и поэтому является непригодным в качестве полимерной цепи резиста при этой длине волны.
Приготовление образца раствора
Образцы различных полимеров, приведенные в описанных выше примерах (0,016±0,001 г полимера), взвешивают и растворяют в 4 мл
хлороформа. Растворы полимеров отбирают пипеткой и формуют из них на чистых одинаковых кварцевых предметных стеклах тонкие пленки методом полива. Пленки сушат в течение ночи. Полученные на кварцевых
предметных стеклах круглые пленки далее сушат при 70oС в печке, продуваемой азотом, в течение 10 мин.
На Perkin-Elmer-Lambda 9UV/VIS/IR спектрофотометре при скорости сканирования 120 нм/мин получают УФ-спектры пленок. Область спектра установлена от 300 нм до 180 нм. Измерением оптической плотности пленок при 193 нм и приведением ее к нормальной толщине пленок измеряют оптическую плотность пленок при 193 нм. Результаты испытаний приведены в таблице 1.
Приготовление раствора резиста, облучение и проявление.
Полученные в описанных выше примерах полимеры растворяют в ацетате монометилового эфира пропиленгликоля (АМЭПГ) при концентрации 15 мас.% в расчете на твердое вещество. К полученным при этом растворам добавляют ониевую соль согласно примерам в концентрации 5% от массы полимера или 10% от массы полимеры.
Растворы фильтруют через Тефлоновый® фильтр 0,2 мкм. На поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины формуют резистный слой из каждого раствора методом центрифугирования. Пленочное покрытие сушат при 95oС в течение 1 мин. Затем пленки облучают через кварцевый шаблон УФ-излучением на приборе Karl Suss MJB3 UV 250 при длине волны 230 - 250 нм. Облученные пленки нагревают до 125-150oС в течение 1 мин. Затем облученные и термообработанные пленки проявляют в водном растворе основания с получением изображений позитивного тона с высокой разрешающей способностью без уменьшения толщины пленки в необлученных зонах.
При проявлении в неполярном растворителе могут быть легко получены негативные работающие системы. Такие материалы легко сенсибилизируют для более длинных волн (365 нм) добавлением небольшого количества сенсибилизаторов, таких как пирен, перилен или тиоксантоны, либо для более коротких волн (193 нм), поскольку эти материалы, как показано выше имеют очень низкую оптическую плотность при 193 нм.
Пример 51. Сополимер бицикло[2.2.1]гепт-5-ен-2-метилацетата с трет-бутиловым эфиром норборнена (полимер по примеру 2) со среднечисловой молекулярной массой 21 000 растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 10 мас.% в расчете на твердое вещество. В раствор добавляют 10% от массы полимера трифенилсульфоний гексафторарсената. Фильтруют раствор через Тефлоновый® фильтр 0,2 мкм, и после фильтрования из раствора формуют методом центрифугирования пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. Получают слой толщиной 0,7 мкм. Пленку сушат при 95oС в течение 1 мин над поверхностью горячей пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 50 мДж/см2. После пост-термообработки при 125oС в течение 1 мин, в процессе проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 52. Сополимер бицикло[2.2.1]гепт-5-ен-2-метилацетата с трет-бутиловым эфиром норборнена (полимер по примеру 21) со среднечисловой молекулярной массой 21 000 растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 10 мас.% в расчете на твердое вещество. Добавляют диарилйодоний гексафторантимоната (Sartomer 1012) в количестве 10% от массы полимера. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм и после фильтрования из раствора формуют методом центрифугирования пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают толщину слоя покрытия 0,7 мкм. Пленку сушат при 95oС в течение 1 мин над поверхностью горячей пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 50 мДж/см2. После пост-термообработки при 125oС в течение 1 мин и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 53. Сополимер бицикло[2.2.1]гепт-5-ен-2-метилацетата с трет-бутиловым эфиром норборнена (полимер по примеру 21) со среднечисловой молекулярной массой 21 000 растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 10 мас.% в расчете на твердое вещество. Добавляют к раствору диарилйодоний гексафторантимоната (Sartomer 1012) в количестве 10% от массы полимера. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 0,7 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый фотошаблон УФ-излучением (240 нм) дозой 100 мДж/см2. После пост-термообработки при 125oС в течение 1 мин и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 54. Сополимер бицикло[2.2.1]гепт-5-ен-2-метилацетата с трет-бутиловым эфиром норборнена (полимер по примеру 21) со среднечисловой молекулярной массой 21 000 растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 10 мас.% в расчете на твердое вещество. В раствор добавляют трифенилсульфоний гексафторарсенат в количестве 10% в расчете на твердое вещество. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 0,7 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый фотошаблон УФ-излучением (240 нм) дозой 10 мДж/см2. После пост-термообработки при 125oС в течение 1 мин и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 55. Сополимер бицикло[2.2.1]гепт-5-ен-2-метилацетата с трет-бутиловым эфиром норборнена (полимер по примеру 21) со среднечисловой молекулярной массой 21 000 растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 10 мас.% в расчете на твердое вещество. В раствор добавляют трифенилсульфоний гексафторарсенат в количестве 10% от массы полимера. Полученный при этом раствор фильтруют через Тефлоновый® фильтр 0,2 мкм, и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 0,7 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 30 мДж/см2. После пост-термообработки при 125oС в течение 1 мин и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 56. Сополимер малеинового ангидрида с трет-бутиловым эфиром норборнена, полученный способом свободно-радикальной полимеризации (полимер по примеру 24) со среднечисловой молекулярной массой 4 000 растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 15 мас.% в расчете на твердое вещество. В полученный раствор добавляют триарилсульфоний гексафторантимонат (Sаrtоmеr СD 1010 50%-ный раствор в пропиленкарбонате) в количестве 5% от массы полимера. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 0,6 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 30 мДж/см2. После пост-термообработки при 125oС в течение 1 мин и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 57. Сополимер малеинового ангидрида с трет-бутиловым эфиром норборнена, полученный способом свободно-радикальной полимеризации (полимер по примеру 24) со среднечисловой молекулярной массой 4 000 растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 15 мас.% в расчете на твердое вещество. В полученный раствор добавляют триарилсульфоний гексафторантимонат (Sartomer CD 1010, 50%-ный раствор в пропиленкарбонате) в количестве 5% от массы полимера. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 0,6 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 30 мДж/см2. После пост-термообработки при 95oС в течение 1 мин и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 58. Терполимер малеинового ангидрида с бицикло[2.2.1]гепт-5-ен-2-метилацетата и с трет-бутиловым эфиром норборнена, полученный способом свободно-радикальной полимеризации (полимер по примеру 25) со среднечисловой молекулярной массой 3 000, растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 10 мас.% в расчете на твердое вещество. В полученный раствор добавляют диарилйодоний гексафторантимонат (Sartomer 1012) в количестве 10% от массы полимера. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 0,5 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 50 мДж/см2. После пост-термообработки при 125oС в течение 1 мин и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 59. Сополимер бицикло[2.2.1] гепт-5-ен-2-метилэтилкарбоната с трет-бутиловым эфиром норборнена, (полимер по примеру 22) со среднечисловой молекулярной массой 22 000 растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 15 мас.% в расчете на твердое вещество. В полученный раствор добавляют триарилсульфоний гексафторантимонат (Sartomer CD 1010 50%-ный раствор в пропиленкарбонате) в количестве 5% от массы полимера. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм, и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 1,1 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 30 мДж/см2. После пост-термообработки при 95oС в течение 1 мин и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 60. Сополимер бицикло[2.2.1]гепт-5-ен-2-метилэтилкарбоната с трет-бутиловым эфиром норборнена (полимер по примеру 22) со среднечисловой молекулярной массой 22 000 растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 15 мас.% в расчете на твердое вещество. В полученный раствор добавляют триарилсульфоний гексафторантимонат (Sartomer CD 1010, 50%-ный раствор в пропиленкарбонате) в количестве 5% от массы полимера. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм, и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 1,1 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 15 мДж/см2. После пост-термообработки при 95oС в течение 1 мин и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 61. Сополимер бицикло[2.2.1] гепт-5-ен-2-метилбутилкарбоната с трет-бутиловым эфиром норборнена (полимер по примеру 23) со среднечисловой молекулярной массой 22 000 растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 15 мас.% в расчете на твердое вещество. В полученный раствор добавляют триарилсульфоний гексафторантимонат (Sartomer CD 1010, 50%-ный раствор в пропиленкарбонате) в количестве 5% от массы полимера. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 1 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 30 мДж/см2. После пост-термообработки при 125oС в течение 0,5 мин и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 62. Сополимер бицикло[2.2.1] гепт-5-ен-2-метилбутилкарбоната с трет-бутиловым эфиром норборнена (полимер по примеру 23) со среднечисловой молекулярной массой 22 000 растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 15 мас.% в расчете на твердое вещество. В полученный раствор добавляют триарилсульфоний гексафторантимонат (Sartomer CD 1010, 50%-ный раствор в пропиленкарбонате) в количестве 5% от массы полимера. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 1,0 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 30 мДж/см2. После пост-термообработки при 150oС в течение 0,5 мин и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Пример 63. Гидрированный сополимер 35 мол.% этилового эфира тетрациклодекена с 65 мол.% трет-бутилового эфира норборнена (полимер по примеру 37) со среднечисловой молекулярной массой 23 000, полученный способом полимеризации с перестановкой и раскрытием колец, растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 15 мас.% в расчете на твердое вещество. В полученный раствор добавляют триарилсульфоний гексафторантимонат (Sаrtоmеr СD 1010, 50%-ный раствор в пропиленкарбонате) в количестве 5% от массы полимера. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 1,1 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 30 мДж/см2. После пост-термообработки при 125oС в течение 1 мин и проявления в водном растворе основания в течение 30 с получают позитивные изображения с высокой разрешающей способностью.
Пример 64. Негидрированный сополимер 50 мол.% этилового эфира тетрациклодекена с 50 мол.% трет-бутилового эфира норборнена (полимер по примеру 39) со среднечисловой молекулярной массой 34 000, полученный способом полимеризации с перестановкой и раскрытием колец, растворяют в ацетате монометилового эфира пропиленгликоля при концентрации 15 мас.% в расчете на твердое вещество. В полученный раствор добавляют триарилсульфоний гексафторантимонат (Sаrtоmеr СD 1010, 50%-ный раствор в пропиленкарбонате) в количестве 5% от массы полимера. Раствор фильтруют через Тефлоновый® фильтр 0,2 мкм и после фильтрования из раствора формуют пленку резиста на поверхности, грунтованной гексаметилдисилазаном, силиконовой пластины методом центрифугирования при 500 об/мин в течение 30 с, а затем при 2000 об/мин в течение 25 с. При этом получают пленочное покрытие с толщиной слоя 1,25 мкм. Пленку сушат при 95oС в течение 1 мин над горячей поверхностью пластины, а затем облучают через кварцевый шаблон УФ-излучением (240 нм) дозой 50 мДж/см2. После пост-термообработки при 150oС в течение 30 с и проявления в водном растворе основания в течение 60 с получают позитивные изображения с высокой разрешающей способностью.
Реферат
Изобретение относится к радиационно-чувствительной фоторезистной композиции. Описывается фоторезистная композиция, содержащая генерирующий кислоту фотоинициатор, растворитель, необязательно, ингибитор растворения и полимер, содержащий повторяющиеся полициклические звенья, содержащие кислотно-лабильные группы, с молекулярной массой от около 500 до около 1000000, являющийся продуктом полимеризации полициклических мономеров, замещенных по меньшей мере одной кислотно-лабильной группой, и необязательно в сочетании с мономером, выбранным из группы, включающей малеиновый ангидрид, окись углерода, полициклический мономер, замещенный карбоксильной группой, алкилзамещенный полициклический мономер и их смеси. При облучении формирующим изображение источником излучения кислотный фотоинициатор генерирует кислоту, расщепляющую боковые лабильные кислотные группы, что приводит к изменению полярности полимера. Полимер приобретает растворимость в водном растворе основания в местах облучения формирующим изображение источником излучения. Предложенная фоторезистная композиция обеспечивает совместимость с общей схемой химической амплификации и прозрачность по отношению к формирующему изображение коротковолновому излучению. 2 с. и 33 з.п.ф-лы, 2 табл.
Формула

где заместители R1-R4 независимо друг от друга выбраны из группы, включающей водород, нормальный или разветвленный алкил С1-С10 и группы -(СН2)n-С(O)ОR*, -(СН2)n-C(O)OR, -(СН2)n-OR, -(СН2)n-OC(O)R, -(СН2)n-OC(O)OR или -(СН2)n -C(O)R, -(СН2)nC(R)2CH(R)(C(O)OR**) и -(СН2)n-C(R)2CH(C(O)OR**)2, при условии, что по меньшей мере один из заместителей R1-R4 выбран из группы, включающей кислотно-лабильную группу, -(СН2)n-C(O)OR*, где R - водород или нормальный или разветвленный алкил С1-С10, m = 0 - 5 и n = 0 - 10, R* означает группу, способную расщепляться под действием генерирующего кислоту фотоинициатора и выбранную из группы радикалов, включающей -С(СН3)3, -Si(СН3)3, изоборнил, 2-метил-2-адамантил, тетрагидрофуранил, тетрагидропиранил, 3-оксо-циклогексанил, лактонил мевалоновой кислоты, дициклопропилметил и диметилпропилметил, R** независимо означает R и R*,
при этом указанный мономер, замещенный нейтральной группой, имеет формулу II
где R5-R8 независимо друг от друга - нейтральный заместитель, выбранный из группы, включающей -(СН2)n-C(O)OR'', -(СН2)n-OR'', -(СН2)n-OC(O)R'', -(СН2)n-OC(O)OR'', -(СН2)n-C(O)R'', -(СН2)n-C(R)2CH(R)(C(O)OR'') и -(СН2)nC(R)2CH(C(O)OR'')2, где R - водород или нормальный или разветвленный алкил С1-С10, R'' - водород или нормальный или разветвленный алкил С1-С10, моно- или полициклоалифатические радикалы C4-С20, циклические сложные эфиры, циклические кетоны и циклические простые эфиры при условии, что если группа R'' - водород, то по меньшей мере один из оставшихся R5-R8 содержит заместитель, в котором R'' - алкил С1 -С10, р = 0 - 5 и n = 0 - 10,
при этом указанный мономер, замещенный карбоксильной группой, имеет формулу III

где заместители R9-R12 независимо друг от друга - водород, нормальный или разветвленный алкил С1-С10, а замещающая карбоксильная группа имеет формулу -(СН2)nС(O)ОH при условии, что по меньшей мере один из заместителей R9-R12 представляет собой карбоксильную группу, q = 0 - 5 и n = 0 - 10,
причем указанный алкилзамещенный мономер имеет формулу IV

где заместители R13-R16 независимо друг от друга - водород или нормальный либо разветвленный алкил С1-С10 при условии, что по меньшей мере один из заместителей R13-R16 является алкилом С1-С10 и r = 0 - 5.

где Е - нейтральный лиганд-донор 2 электронов;
n = 1 или 2;
L - лиганд, содержащий 1, 2 или 3 π-связи;
М - палладий или никель;
Х - лиганд, содержащий одну σ -связь и от 0 до 3 π-связей;
у = 0, 1 или 2;
z = 0 или 1, причем у и z оба одновременно не могут означать 0 и если z = 0, то а = 2, и если z = 1, то а = 1;
R27 независимо - нормальный или разветвленный алкил С1-С10;
СА - противоанион, выбранный из группы, состоящей из BF4-, PF6-, АlF3O3SСF3-, SbF6-, SbF5SO3F-, AsF6-, перфторацетат (СF3СОО-), перфторпропионат (C2F5COO-), перфторбутират (CF3CF2CF2COO-), перхлорат (ClO4-•H2O), п-толуолсульфат (р-СН3С6Н4SО3-) и тетрафенилборат формулы

где R'' независимо - водород, фтор, трифторметил и n = 1 - 5,
а указанная многокомпонентная каталитическая система содержит а) источник ионов металла группы VIII в сочетании с одним или обоими компонентами б) и в), б) металлорганическим сокатализатором, в) третьим компонентом, выбранным из группы, включающей кислоты Льюиса, сильные кислоты Бренстеда, галогенированные соединения, электронно-донорные соединения, выбранные из алифатических или циклоалифатических диолефинов и их смесей, при этом молярное соотношение компонента б), металлорганического сокатализатора и компонента а), источника ионов металла группы VIII составляет не более 100: 1, а молярное соотношение компонента а), источника ионов металла группы VIII и компонента в), кислот Льюиса и сильных кислот Бренстеда составляет не более 4: 1.
EnNi(C6F5)2,
в которой n= 1;
лиганд Е выбран из группы, включающей бензол, мезитилен и толуол.
EnNi(C6F5)2,
в которой n= 2;
лиганд Е выбран из группы, включающей тетрагидрофуран, диоксан и диэтиловый эфир.

где заместители R1-R4 независимо друг от друга выбраны из группы, включающей водород, нормальный или разветвленный алкил С1-С10 и группы -(СН2)n-C(O)OR*, -(СН2)n-C(O)OR, -(СН2)n-OR, -(СН2)n-OC(O)R, -(СН2)n-OC(O)OR, -(СН2)n-C(O)R, -(СН2)nC(R)2CH(R)(C(O)OR**) и -(СН2)nC(R)2CH(C(O)OR**)2, при условии, что по меньшей мере один из заместителей R1-R4 представляет собой кислотно-лабильную группу, -(СН2)n-C(O)OR*, где R - водород или нормальный или разветвленный алкил С1-С10, m = 0 - 5 и n = 0 - 10, R* представляет собой группу, способную расщепляться под действием генерирующего кислоту фотоинициатора, выбранную из группы радикалов, включающей -С(СН3)3, -Si(СН3)3, изоборнил, 2-метил-2-адамантил, тетрагидрофуранил, тетрагидропиранил, 3-оксоциклогексанил, лактонил мевалоновой кислоты, дициклопропилметил и диметилпропилметил, R** независимо - R и R*.



где R5-R8 независимо друг от друга представляют собой нейтральный заместитель, выбранный из группы, включающей -(СН2)n-C(O)OR'', -(СН2)n -OR'', -(СН2)n-OC(O)R'', -(СН2)n-OC(O)OR'', -(СН2)n-C(O)R'', -(СН2)n-C(R)2CH(R)(C(O)OR'') и -(СН2)nC(R)2CH(C(O)OR'')2, где R - водород или нормальный или разветвленный алкил С1-С10; R'' - водород, нормальный либо разветвленный алкил С1-С10, моно- или полициклоалифатический радикал С4-С20, циклические сложные эфиры, циклические кетоны и циклические простые эфиры, при условии, что если группа R'' - водород, то по меньшей мере один из оставшихся R5-R8 содержит заместитель, у которого R'' является алкилом С1-C10, р = 0 - 5 и n = 0 - 10; R9-R12 независимо друг от друга - водород, нормальный или разветвленный алкил С1-C10 и карбоксильная группа -(СН2)nС(O)ОН при условии, что по меньшей мере один из заместителей R9-R12 является указанной карбоксильной группой, q = 0 - 5 и n = 0 - 10;
заместители R13-R16 независимо друг от друга - водород или нормальный либо разветвленный алкил С1-C10, при условии, что по меньшей мере один из заместителей R13-R16 - алкил С1 -C10 и r = 0 - 5.

где заместители R1-R4 независимо друг от друга выбраны из группы, включающей водород, нормальный или разветвленный алкил С1 -С10 и группы -(СН2)n-С(O)ОR*, -(СН2)n-C(O)OR, -(СН2)n-OR, -(СН2)n-OC(O)R, -(СН2)n-OC(O)OR, -(СН2)n-C(O)R, -(СН2)nC(R)2CH(R)(C(O)OR**) и -(СН2)nC(R)2CH(C(O)OR**)2, при условии, что по меньшей мере один из заместителей R1-R4 представляет собой кислотно-лабильную группу, -(СН2)n-C(O)OR*, где R - водород или нормальный либо разветвленный алкил С1-С10, m = 0 - 5 и n = 0 - 10, R* означает группу, способную расщепляться под действием генерирующего кислоту фотоинициатора и выбранную из группы радикалов, включающей -С(СН3)3, -Si(СН3)3, изоборнил, 2-метил-2-адамантил, тетрагидрофуранил, тетрагидропиранил, 3-оксоциклогексанил, лактонил мевалоновой кислоты, дициклопропилметил и диметилпропилметил, R** независимо - R и R*.



где R5-R8 независимо друг от друга - нейтральный заместитель, выбранный из группы, включающей -(СН2)n-C(O)OR'', -(СН2)n-OR'', -(СН2)n-OC(O)R'', -(СН2)n-OC(O)OR'', -(СН2)n-C(O)R'', -(СН2)n-C(R)2CH(R)(C(O)OR'') и -(СН2)nC(R)2 CH(C(O)OR'')2, где R - водород или нормальный и разветвленный алкил С1-С10; R'' - водород или нормальный и разветвленный алкил С1-С10, моно- или полициклоалифатический радикал С4-С20, циклические сложные эфиры, циклические кетоны и циклические простые эфиры, при условии, что если группа R'' - водород, то по меньшей мере один из оставшихся R5-R8 содержит заместитель, у которого R'' является алкилом С1-С10, p = 0 - 5 и n = 0 - 10;
R9-R12 независимо друг от друга - водород, нормальный или разветвленный алкил С1-С10, а карбоксильный заместитель представлен формулой -(СН2)nС(O)ОН при условии, что по меньшей мере один из заместителей R9-R12 является указанным карбоксильным заместителем, q = 0 - 5 и n = 0 - 10;
заместители R13-R16 независимо друг от друга - водород или нормальный либо разветвленный алкил С1-С10 при условии, что по меньшей мере один из заместителей R13-R16 является алкилом С1-С10, а r = 0 - 5.

где заместители R1-R4 независимо друг от друга выбраны из группы, включающей водород, нормальный и разветвленный алкил С1-С10 и группу -(CH2)n-C(O)OR*, -(CH2)n-C(O)OR, -(CH2)n-OR, -(CH2 )n-OC(O)R, -(CH2)n-OC(O)OR или -(CH2)n-С(О)R, -(CH2)nC(R)2CH(R)(C(O)OR**) и -(CH2)n C(R)2CH(C(O)OR**)2, при условии, что по меньшей мере один из заместителей R1-R4 выбран из кислотно-лабильной группы формулы -(CH2)n -C(O)OR*, R - водород или нормальный и разветвленный алкил С1-С10, m = 0 - 5 и n = 0 - 10, а R* представлен группой, способной расщепляться под действием генерирующего кислоту фотоинициатора и выбранной из группы радикалов, включающей -С(СН3)3, -Si(СН3)3, изоборнил, 2-метил-2-адамантил, тетрагидрофуранил, тетрагидропиранил, 3-оксо-циклогексанил, лактонил мевалоновой кислоты, дициклопропилметил и диметилпропилметил, R** независимо означает R и R*.



где R5-R8 независимо друг от друга представляют собой нейтральный заместитель, выбранный из группы, включающей -(CH2)n-С(O)ОR'', -(CH2)n-OR'', -(CH2)n-OC(O)R'', -(CH2)n-OC(O)OR'', -(CH2)n-C(O)R'', -(CH2)nC(R)2-CH(R)(C(O)OR'') и -(CH2)nC(R)2CH(C(O)OR'')2, где R - водород или нормальный и разветвленный алкил С1-С10, R'' - водород или нормальный и разветвленный алкил С1-С10, моно- или полициклоалифатический радикал С4-С20, циклические сложные эфиры, циклические кетоны и циклические простые эфиры, при условии, что когда группа R'' - водород, то по меньшей мере один из оставшихся R5-R8 содержит заместитель, у которого R'' является алкилом С1-С10, p = 0 - 5 и n = 0 - 10;
R9-R12 независимо друг от друга - водород, нормальный и разветвленный алкил С1-С10, и карбоксильный заместитель представлен формулой -(CH2)nС(O)ОН при условии, что по меньшей мере один из заместителей R9-R12 является указанным карбоксильным заместителем, q = 0 - 5 и n = 0 - 10;
заместители R13-R16 независимо друг от друга - водород или нормальный либо разветвленный алкил С1-С10 при условии, что по меньшей мере один из заместителей R13-R16 является алкилом С1-С10,
r = 0 - 5.


где R - водород или нормальный и разветвленный алкил С1-С10;
m и m' = 0 - 5 независимо друг от друга;
n = 0 - 10;
R* означает группу, способную расщепляться под действием генерирующего кислоту фотоинициатора и выбранную из группы радикалов, включающей -С(СН3)3, -Si(СН3)3, изоборнил, 2-метил-2-адамантил, тетрагидрофуранил, тетрагидропиранил, 3-оксоциклогексанил, лактонил мевалоновой кислоты, дициклопропилметил и диметилпропилметил.


23. Композиция по любому из пп. 18-20 или 22, отличающаяся тем, что ненасыщенные связи в основной полимерной цепи гидрированы более чем на 90%.
EnNi(C6F5)2,
где Е - нейтральный лиганд-донор 2 электронов;
n = 1 или 2,
причем указанный полициклический мономер выбран из мономеров, имеющих формулу

где заместители R1 -R4 независимо друг от друга выбраны из группы, включающей водород, нормальный и разветвленный алкил С1-С10 и группы -(CH2)nC(O)OR*, -(CH2)n-C(O)OR, -(CH2)n-OR, -(CH2)n-OC(O)R, -(CH2)n-ОС(O)ОR, или -(CH2)n-C(O)R, -(CH2 )nC(R)2CH(R)(C(O)OR**) и -(CH2)nC(R)2CH(C(O)OR**)2, при условии, что по меньшей мере один из заместителей R1-R4 выбран из группы, включающей кислотно-лабильную группу -(CH2)n-C(O)OR*, R - водород или нормальный и разветвленный алкил С1-С10, m = 0 - 5 и n = 0 - 10, а R* означает группу, способную расщепляться под действием генерирующего кислоту фотоинициатора и выбранную из группы радикалов, включающей -С(СН3)3, -Si(СН3)3 , изоборнил, 2-метил-2-адамантил, тетрагидрофуранил, тетрагидропиранил, 3-оксо-циклогексанил, лактонил мевалоновой кислоты, дициклопропилметил и диметил-пропилметил, R** независимо - R и R*.

где R5-R8 независимо друг от друга означают нейтральный заместитель, выбранный из группы, включающей -(CH2)n-C(O)OR'', -(CH2)n-OR'', -(CH2)n-OC(O)R'', -(CH2)n-OC(O)OR'', -(CH2)n-C(O)R'', -(CH2)nC(R)2-CH(R)(C(O)OR'') и -(CH2)nC(R)2CH(C(O)OR'')2, где R означает водород или нормальный и разветвленный алкил С1 -С10, R'' означает водород или нормальный и разветвленный алкил С1-С10, моно- или полициклоалифатические радикалы, содержащие 4-20 атомов С, циклические сложные эфиры, циклические кетоны и циклические простые эфиры, при условии, что в том случае, когда группа R'' означает водород, то, по меньшей мере, один из оставшихся R5-R8 содержит заместитель, в котором R'' означает алкил С1-C10, р = 0 - 5, а n = 0 - 10.

и

где R8 означает группу -(CH2)n-C(O)OR'', -(CH2)n-OC(O)R'', -(CH2)n -OC(O)OR'', где n = 0 - 5, а R'' - водород или нормальный алкил С1-С10.

Комментарии