Синтез и применение 2-оксо-4-метилтиобутановой кислоты, ее солей и производных - RU2385862C2
Код документа: RU2385862C2
Чертежи

Описание
Изобретение относится к получению 2-оксо-4-метилтиобутановой кислоты (далее обозначаемой как КМБ), ее солей, производных и их использованию, в особенности при кормлении животных.
Метионин представляет собой важную серосодержащую аминокислоту, участвующую во многих процессах метаболизма, прежде всего таких, как:
синтез белков: метионин является не только компонентом белков, наряду с другими аминокислотами, но и аминокислотой, инициирующей процесс белкового синтеза, что делает ее еще более необходимой;
липидный метаболизм: метионин участвует в синтезе компонентов сывороточных липопротеинов, и, как следствие, играет роль в переносе липидов в крови, в их использовании и отложении в тканях.
У домашней птицы метионин представляет собой важную аминокислоту и должен добавляться в пищу.
У коров молочных пород он является аминокислотой, регулирующей производство молока. Кроме того, метионин благоприятно воздействует на фертильность и печеночную функцию коров.
Удовлетворительные удои молока, и, вообще говоря, лучшее общее состояние коров, обусловлены соответствующим рационом, включающим метионин. Удои молока могут возрасти при увеличении содержания метионина в рационе.
Однако свободная форма метионина быстро разлагается бактериальной флорой рубца коров, и лишь очень малая доля метионина участвует в кровообращении.
Для решения этой проблемы были предложены замена метионина метионином, защищенным химически или покрытием, либо использование модифицированного метионина, характеризующегося предпочтительным бионакоплением в крови. Так, известны, в частности, защищенный метионин, Smartamine®, производимый и реализуемый компанией-заявителем, и два аналога метионина, 2-гидроксо-4-метилтиобутановая кислота (ГМБ) и изопропиловый эфир ГМБ, которые не подвергаются разложению в рубце.
Авторы изобретения открыли, что 2-оксо-4-метилтиобутановая кислота (КМБ) представляет собой выгодный аналог метионина, характеризующийся высоким бионакоплением, причем указанный аналог можно синтезировать простым способом, пригодным и для получения в промышленном масштабе.
Согласно К. Mosbach et al., Enzyme and Microbial Technology (1982) 4, №6, 409-413, K.J. Clemetson et al., Toxicon (2002) 40, 659-665, 2-оксо-4-метилтиобутановую кислоту получают в лабораторных условиях путем ферментативного синтеза. Этот синтез, однако, не применим для промышленного производства указанной кислоты, вследствие неудобств, присущих процессу ферментации, таких как сложность инфраструктуры, необходимой для его осуществления, риск микробиологического загрязнения, увеличенная длительность реакции и потери выхода из-за энантиоселективности выбранного микроорганизма (Н. Simon et al., Tetrahedron (1990) 47, №43, 9019-9034).
H.Rapoport, J. Label. Compds. Radiopharm. (19.94) Vol.36, №5, p.431-437, описывают синтез 2-оксо-4-метилтиобутановой кислоты из хлорида этилоксалила в шесть стадий. В этом синтезе метилмеркаптан добавляют к этил-4-хлоро-3-оксо-3-бутеноату перед его гидрогенизацией или после нее.
Авторы разработали способ получения вышеупомянутой кислоты в две стадии и в определенных условиях, позволяющих ограничить время реакции и, кроме того, улучшающих селективность реакции.
Таким образом, первым объектом изобретения является способ получения 2-оксо-4-метилтиобутановой кислоты формулы (I):
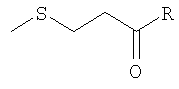
где R представляет собой карбоксильную группу и ее соли, причем указанный способ включает следующие стадии:
проведение каталитического и селективного окисления бут-3-ен-1,2-диола (II) с получением 2-оксо-бут-3-еновой кислоты (III) согласно следующей реакционной схеме (i):

и осуществление селективной конденсации метилмеркаптана с 2-оксо-бут-3-еновой кислотой (III) согласно следующей реакционной схеме (ii):

Этот способ позволяет также получить производные 2-оксо-4-метилтиобутановой кислоты и соли ее производных, причем указанные производные соответствуют формуле (I):

в которой R представляет собой группу, выбранную из COOR', CONH2, CONHR' или CONR'R'', где R' и R'' выбраны, независимо друг от друга, из группы линейных алкильных радикалов, таких как, например, радикалы метила, этила, n-пропила, n-бутила и n-пентила, разветвленных алкильных радикалов, таких как, например, радикалы изопропила, изобутила, втор-бутила, трет-бутила, изопентила и изогексила, причем указанные алкильные радикалы содержат от 1 до 12 атомов углерода, а циклоалкильные содержат от 3 до 12 атомов углерода; способ, согласно которому получение 2-оксо-4-метилтиобутановой кислоты (I), как указано выше, дополняется стадией преобразования в сложный эфир или амидирования, которую может выполнить специалист, сведущий в данной области техники.
Согласно изобретению, под термином «соли 2-оксо-4-метилтиобутановой кислоты и ее производных» понимают соли кальция, натрия, магния, марганца, цинка.
Предпочтительные варианты и способы реализации способа согласно изобретению изложены ниже, и, в рамках изобретения, их характеристики могут рассматриваться отдельно или в сочетании.
Для стадии каталитического окисления бут-3-ен-1,2-диола (II) в 2-оксо-бут-3-еновую кислоту (III) желательно, чтобы катализатор отвечал следующим характеристикам.
Указанный катализатор содержит, по меньшей мере, один благородный металл, выбранный из палладия, платины, рутения, иридия, родия и их смесей.
Катализатор на основе благородных металлов содержит, по меньшей мере, один промотор, выбранный из висмута, свинца, сурьмы, олова, ниобия, теллура, индия, галлия, цинка, меди, никеля, кобальта, золота, серебра, вольфрама, молибдена, рения, ванадия, хрома, марганца, железа и их смесей.
Содержание благородного металла или металлов находится в пределах от 0,1 до 10 мас.% по отношению к носителю катализатора и предпочтительно в пределах от 0,5 до 5 мас.%.
Катализатор содержит, кроме того, инертный носитель, выбранный из оксида алюминия, диоксида кремния, активированного угля, графита, оксида титана, диоксида циркония, карбида кремния, смешанных оксидов на основе циркония и церия, ацетиленовой сажи.
Процентное содержание промотора находится в пределах от 0,005 до 500 мас.%, предпочтительно от 0,005 до 100 мас.%, по отношению к массе благородного металла или металлов и/или может достигать 100 мас.% по отношению к массе катализатора. Осаждение промотора на катализатор на основе благородных металлов предпочтительно осуществлять путем импрегнирования промотора на каталитический носитель.
Предпочтительный катализатор содержит благородный металл, выбранный из палладия, платины и их смесей, промотор, выбранный из висмута, свинца и их смесей, и носитель, выбранный из активированного угля или графита.
Благоприятные условия реакции окисления следующие: ее проводят в щелочной или нейтральной среде, при pH, поддерживаемом в интервале от 4 до 11, предпочтительно от 5,5 до 7,5. Для этого добавляют щелочной реагент, выбранный из гидроксида кальция, гидроксида натрия, гидроксида калия, гидроксида лития, гидроксида магния, аммиака, карбоната натрия, карбоната цинка, карбоната марганца и их смесей. Реакцию проводят при температуре от 10 до 95°С, предпочтительно от 20 до 95°С, еще лучше от 25 до 70°С; продолжительность окисления обычно находится в пределах от 20 минут до 15 часов.
Стадию окисления можно инициировать, начиная обдув газовой смесью, содержащей кислород, например воздух.
Предпочтительные условия реакции конденсации метилмеркаптана с 2-оксо-бут-3-еновой кислотой следующие: используют метилмеркаптан в газообразном или жидком состоянии; реакцию проводят в присутствии основного катализатора. Катализатор выбирают из алифатических аминов, таких как метиламин, этиламин, пропиламин, бутиламин, пентиламин, гексиламин, гептиламин и октиламин, ароматических аминов, таких как анилин или пиридин, гексаметилентетрамин, триэтиламин, диизопропилэтиламин, диазабицикло[2,2,2]октан, N,N-диметилбензиламин, N-метилдифениламин, N-этил-3,3-дифенилдипропиламин, и N-алкилморфолин, такого как N-метилморфолин, или тритона В. Эти органические амины желательно, а даже предпочтительно, сочетать с органической или неорганической кислотой; органическую кислоту предпочтительно выбирать из муравьиной кислоты, уксусной кислоты, пропионовой кислоты или бутановой кислоты, а неорганическую кислоту предпочтительно выбирать из фосфорной или серной.
Другим объектом изобретения является способ получения 2-оксо-бут-3-еновой кислоты (III) и ее солей, в частности, как промежуточного соединения для синтеза 2-оксо-4-метилтиобутановой кислоты, при котором осуществляют каталитическое и селективное окисление бут-3-ен-1,2-диола (II) согласно реакционной схеме (i) при любом из условий, указанных выше, отдельно или в комбинации.
Как отмечено выше, 2-оксо-4-метилтиобутановая кислота и ее соли представляют собой аналоги метионина, обладающие высокой биодостопностью для коров и домашней птицы. Таким образом, еще одним объектом изобретения является пищевая добавка, состоящая из соединения и/или его солей, где указанное соединение соответствует приведенной формуле (I):

где R представляет собой группу, выбранную из COOR', CONH2, CONHR' или CONHR'R'', где R' и R'' выбраны, независимо друг от друга, из группы линейных алкильных радикалов, таких как, например, метиловый, этиловый, n-пропиловый, n-бутиловый, n-пентиловый радикалы, разветвленных алкильных радикалов, таких как, например, изопропиловый, изобутиловый, втор-бутиловый, трет-бутиловый, изопентиловый, изогексиловый радикалы, причем указанные алкильные радикалы содержат от 1 до 12 атомов углерода, а циклоалкильные от 3 до 12 атомов углерода. Предпочтительно, добавка согласно изобретению состоит из 2-оксо-4-метилтиобутановой кислоты (I) и/или ее солей.
Изобретение также относится к пищевому рациону, содержащему долю злаков, долю пищевого концентрата и добавку согласно изобретению, как определено выше.
Другими объектами изобретения являются способ введения биодоступного метионина корове, включающий введение корове вышеуказанной добавки, а также применение в качестве пищевой добавки для кормления животных соединения и/или его солей, где указанное соединение соответствует формуле (I)

где R представляет собой группу, выбранную из COOR', CONH2, CONHR' и CONR'R'', где R' и R'' выбраны, независимо друг от друга, из группы линейных алкильных радикалов, таких как, например, метиловый, этиловый, n-пропиловый, n-бутиловый, n-пентиловый радикалы, разветвленных алкильных радикалов, таких как, например, изопропиловый, изобутиловый, втор-бутиловый, трет-бутиловый, изопентиловый, изогексиловый радикалы, причем указанные алкильные радикалы содержат от 1 до 12 атомов углерода, а циклоалкильные от 3 до 12 атомов углерода.
Изобретение далее изложено более детально, а затем проиллюстрировано на примерах, демонстрирующих его преимущества.
1) Стадия окисления (i):
1.а) Получение бут-3-ен-1,2-диола (II):
Диол (II) можно получить из бутадиена (IV) его моноэпоксидированием в 3,4-эпокси-1-бутен (V), который преобразуется в диол (II) путем химического раскрытия эпоксидной функциональной группы.
Это получение иллюстрируется нижеприведенными схемами реакций (iii) и (iv):
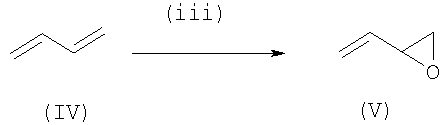
Реакция моноэпоксидирования осуществляется путем гетерогенного катализа исходя из катализаторов, нанесенных на серебро, и активированных промотором, выбранным из щелочных металлов, таких как калий, цезий и рубидий, как описано, например, в документе US-5 081 096, или активированных таллием, как описано в документе US-5 138 077. Эти катализаторы получают обычными способами, такими как импрегнирование и соосаждение.
Селективность этой реакции для 3,4-эпокси-1-бутена (V), при указанных выше условиях, может превосходить 95%, а выход конверсии (iii) колеблется в пределах от 12 до 15%. На промышленной стадии непрореагировавший бутадиен (iv) можно использовать повторно, по крайней мере частично.
Химическое раскрытие функциональной эпоксидной группы, проиллюстрированное ниже, осуществляется обычно в водной среде.

Это раскрытие лучше проводить при кислотном катализе, в присутствии, например, кислых смол в условиях, описанных в документах WO-A-91/15471 или WO-A-00/24702.
1.b) Окисление бут-3-ен-1,2-диола (II):
Диол (II) может быть в жидком виде, очищенным или нет, или в виде неочищенного водного раствора, то есть низкой степени чистоты, например, в результате вышеуказанного этапа 1.а).
Независимо от вида, диол можно использовать непосредственно для реакции каталитического окисления с получением α-кетокислоты (III). Выгодно использовать водный раствор, образовавшийся в результате раскрытия эпоксида (V), непосредственно в стадии окисления диола (II).
Катализатор окисления диола (II) содержит, по меньшей мере, один благородный металл, выбранный из палладия, платины, рутения, иридия, родия и их смесей. Содержание благородного металла или металлов находится в пределах от 0,1 до 10% по весу по отношению к носителю катализатора, и предпочтительно в пределах между 0,5 и 5% по весу.
Носитель катализатора выбирают из оксида алюминия, диоксида кремния, активированного угля, графита, оксида титана, диоксида циркония, карбида кремния, смешанных оксидов на основе циркония и церия, ацетиленовой сажи.
Катализатор окисления диола (II) на основе благородных металлов содержит, по меньшей мере, один промотор, выбранный из висмута, свинца, сурьмы, олова, ниобия, теллура, индия, галлия, цинка, меди, никеля, кобальта, золота, серебра, вольфрама, молибдена, рения, ванадия, хрома, марганца, железа и их сочетания.
Содержание промотора составляет от 0,005 до 500%, предпочтительно в диапазоне между 0,005 и 100% по весу по отношению к весу благородного металла или металлов. Осаждение промотора на носитель катализатора эффективно реализуется путем импрегнирования.
Предпочтительный катализатор содержит один или несколько благородных металлов, выбранных из палладия, платины и их смесей, которые активируются висмутом и/или свинцом на носителе из активированного угля или графита.
Получение катализатора осуществляется путем импрегнирования при перемешивании смеси носителя катализатора и раствора, содержащего благородные металлы, в течение промежутка времени от, по меньшей мере, нескольких секунд до нескольких часов, обычно в пределах от 15 минут до 2 часов. Катализатор на основе благородных металлов затем высушивается и после импрегнируется раствором промотора. Эта операция предшествует стадии восстановления катализатора, осуществляемой при температуре между 20 и 400°С, при помощи реагентов-восстановителей типа формалина, формиата натрия, боргидрида натрия, водорода, фосфорноватистой кислоты, гидразина, глюкозы или других сахаров-восстановителей.
Альтернативный способ получения катализатора состоит в реализации первого импрегнирования промотора, за которым следует второй этап импрегнирования благородного металла или металлов. Затем выполняется восстановление катализатора.
Другой альтернативный способ получения катализатора состоит в реализации единого импрегнирования благородного металла или металлов и промотора. Затем выполняется восстановление катализатора.
Подробности выполнения стадии окисления согласно изобретению изложены ниже и будут проиллюстрированы на примерах:
- в реактор, снабженный мешалкой, вводят водный раствор диола (II), где концентрация диола (II) предпочтительно составляет от 1 до 70% по массе. Нижний предел концентрации диола определяется рентабельностью способа, а верхний предел учитывает растворимость кислорода в рассмотренных средах и риск кристаллизации соли кислоты (III), образовавшейся при реакции;
- в этом растворе размешивается количество катализатора на носителе, активированного как указано выше;
- реакция окисления инициируется одновременным продувом газа, содержащим кислород, например воздухом. Значение pH среды регулируется добавлением щелочного реагента, температура реакции обычно находится в пределах между 10 и 95°С, предпочтительно между 20 и 95°С, еще предпочтительней между 25 и 70°С; время реакции обычно находится в пределах от 20 минут до 15 часов.
Используемый щелочной реагент лучше выбирать из гидроксида кальция, гидроксида натрия, гидроксида калия, гидроксида лития, гидроксида магния, аммиака, карбоната натрия, карбоната цинка, карбоната марганца и их смесей в зависимости от желаемого результата. Можно также использовать карбонат цинка или марганца или любую другую соль цинка или марганца, для которых соответствующие гидроксиды получаются in situ добавлением щелочного реагента, такого как гидроксид натрия или гидроксид калия. Щелочной агент также предназначен для нейтрализации образующейся кислоты (III), для поддержания постоянной каталитической активности. Щелочной агент должен, фактически, поддерживать уровень pH на достаточном уровне для обеспечения десорбции образующейся кислоты (III). Эта предосторожность позволяет, кроме того, избежать образования побочных продуктов, например, от переокисления диола.
На практике значение pH поддерживается между 4 и 11, предпочтительно между 5,5 и 7,5. Способ согласно изобретению позволяет достичь высокой селективности, превосходящей 90%. Эти показатели не ухудшаются многократным повторным использованием и/или реактивацией катализатора окисления, выполненной согласно данному изобретению. В самом деле, используемые катализаторы обладают большой долговечностью и легко регенерируются in situ путем осаждения новой дозы промотора или восстановлением in situ дезактивированного катализатора.
Этот первый этап окисления эффективно проводить в водном растворе. Можно также использовать органический растворитель или смесь органических растворителей. Водная/органическая среда также может оказаться пригодной. Органический растворитель, представляя собой среду, в которой осуществляется реакция окисления диола (II), выбирается из любых растворителей, по меньшей мере частичных, указанного диола (II), инертного в рабочих условиях. Растворители выбираются среди алифатических, циклоалифатических или ароматических углеводородов; сложных алкильных или алкениловых эфиров алифатических карбоновых кислот; сложных алифатических, ароматических или циклических эфиров; алифатических, циклоалифатических или ароматических нитрилов; алифатических, циклоалифатических или ароматических кетонов. В качестве примеров, не исчерпывающих возможные случаи, можно указать:
- углеводороды, такие как n-гексан, n-гептан, n-октан, n-нонан, бензол, стирол, этилбензол, толуол, метаксилен, изопропилбензол, циклогексан, метил-4-пентен-2;
- сложные эфиры, такие как формиат этила, формиат бутила, формиат изобутила, ацетат этила, ацетат аллила, ацетат пропила, ацетат бутила, ацетат гексила, пропионат этила, пропионат винила, акрилат этила, бутират бутила, изобутират метила, бутират метила;
- эфиры, такие как цис-этокси-1-бутен, транс-этокси-1-бутен-1, дибутиловый эфир, 1-изопропоксибутан, 1,1-диметоксиэтан, 1,1-диэтоксиэтан, 1,1-диметоксипропан, 1-этоксибутан, диизопропиловый эфир, 1-этоксигексан, 2-этоксипропан, 1-метоксибутадиен-1,3, бутил виниловый эфир, фуран или 2,5-диметилфуран;
- нитрилы, такие как бутиронитрил, ацетонитрил, акрилонитрил, пропионитрил, тетрагидробензонитрил;
- кетоны, такие как циклопентанон, дипропилкетон, гептанон, метилизопропилкетон, 5-метилгексанон-2, пентанон-2, 4-метилпент-3-ен-2-он.
Кислород, используемый для инициирования реакции окисления, может быть в виде молекулярного кислорода, воздуха, обогащенного или обедненного кислородом, или любой другой смесью кислорода с инертным газом.
Общее давление, при котором осуществляется реакция, может быть выше или ниже атмосферного или равно ему; обычно оно составляет от 0,5 до 5 бар. Парциальное давление кислорода предпочтительно составляет от 0,05 бар до 2 бар. Окисление диола (II) в α-кетокислоте (III) можно выполнять либо при поддержке постоянного давления, либо при циркуляции кислорода или содержащего его газа в аппарате, где проводится реакция, либо еще при барботировании кислорода или содержащего его газа в реакционной смеси.
Установка, в которой осуществляется способ согласно изобретению, может, разумеется, не быть специфической для данного способа.
2) Стадия конденсации (ii):
Согласно этой стадии, один моль метилмеркаптана (MeSH) в виде газа или жидкости и один моль α-кетокислоты (III), полученной выше, конденсируют согласно схеме реакции (ii):

Областью изобретения является область получения кислоты (I) в качестве конечного или промежуточного продукта. Реакционная способность тиолов во многих смыслах сходна с реакционной способностью спиртов. Их можно, в соответствии с условиями катализа, добавлять к α,β-ненасыщенным альдегидам, α,β-ненасыщенным кетонам и α,β-ненасыщенным кислотам в положение 1,2, что приводит к образованию моногемитиоацеталя, или в положение 1,4, что приводит к образованию 3-алкилтиопропионового альдегида. По аналогии структур, кислота (III) полностью подпадает в категорию активированных олефинов.
Традиционно рекомендуют два пути катализа для избирательного и эффективного добавления тиолов в положение 4 к α,β-ненасыщенным карбониловым производным. Первый представляет собой ионное присоединение, катализируемое основаниями. Второй представляет собой радикальное присоединение, инициируемое азосоединениями или пероксидами. Однако этот способ инициирования приводит, как правило, к образованию нежелательных полимеров.
На известном уровне техники подробно описывают различные катализаторы, позволяющие направлять региоселективность присоединения в положение 1,2 или 1,4. Однако присоединение тиолов в положение 1,4 по типу Майкла к α,β-ненасыщенным кетонам остается наиболее частым.
Исходный неочищенный материал, содержащий кислоту (III), превращенную или нет в соль, подвергают, при необходимости, первичной обработке, позволяющей удалить примеси, образовавшиеся в ходе окисления диола (II). Этот исходный продукт может также быть подвержен дегазации. Избыток диола (II), соответствующий не прореагировавшему диолу, можно эффективно использовать повторно в стадии окисления, например, регенерируя путем дистилляции или экстрагирования. Водный раствор кислоты (III) можно, по желанию, предварительно сконцентрировать до взаимодействия с метилмеркаптаном в газообразном или жидком состоянии. Этот водный раствор кислоты (III) затем приводят в контакт с метилмеркаптаном в газообразном или жидком состоянии, для получения кислоты (I).
Эту стадию можно, по желанию, проводить в присутствии основного катализатора или смеси основных катализаторов. Подходящими основными катализаторами являются, например, алифатические амины, такие как метиламин, этиламин, пропиламин, бутиламин, пентиламин, гексиламин, гептиламин, октиламин, изопропиламин; ароматические амины, такие как анилин, бензиламин или пиридин, гексаметилентетрамин, триэтиламин, диизопропилэтиламин, диазабицикло[2,2,2]октан, N,N-диметилбензиламин, N-метилдифениламин, N-этил-3,3-дифенилдипропиламин, и N-алкилморфолин, такой как N-метилморфолин, или тритон В, эти амины, по желанию, предварительно смешивают с органической или неорганической кислотой; кислота предпочтительно выбирается из муравьиной кислоты, уксусной кислоты, пропионовой кислоты или бутановой кислоты, фосфорной или серной кислоты.
Добавление метилмеркаптана к α-кетокислоте (III) эффективно выполнять при кислотном/щелочном катализе, например, используя катализатор, состоящий из смеси органической или неорганической кислоты и органического или неорганического основания. Предпочтительно использовать уксусную кислоту.
В промышленном масштабе метилмеркаптан, в жидком или газообразном состоянии, подается в реактор, содержащий водный раствор кислоты (III), предварительно концентрированный или нет, дегазированный или нет.
Конденсацию кислоты (III) и метилмеркаптана можно осуществлять постадийно или непрерывно. Кислоту (III) и метилмеркаптан вводят одновременно или поочередно, с соблюдением стехиометрического соотношения. Можно, тем не менее, предусмотреть получение при недостатке или в избытке метилмеркаптана, в соответствии с проводимой реакцией.
Реакцию можно проводить, непрерывно вводя водный раствор кислоты (III) и газообразный метилмеркаптан в газожидкостный реактор. В этом случае метилмеркаптан можно добавлять в режиме прямотока или противотока. Иначе, реакцию можно проводить путем непрерывного ввода водного раствора кислоты (III) и жидкого метилмеркаптана в плунжерный реактор или реактор периодического действия. Температура реактора не должна превышать 80°С.
Катализаторы для конденсации кислоты (III) и метилмеркаптана обычно выбирают, учитывая несколько критериев:
- конверсия и выход кислоты (I);
- кинетика реакции;
- избирательность и тенденция к образованию нежелательных примесей, которые обычно являются соединениями с высокой молекулярной массой, образующимися при побочной полимеризации при синтезе, а также при хранении желаемого продукта;
- способность к стабилизации продукта при его длительном хранении.
Установка, в которой осуществляется способ согласно изобретению, не является специфической для данного способа.
Для иллюстрации изобретения приводятся следующие примеры, не ограничивая его область. Примеры 1-7 иллюстрируют синтез соединений согласно изобретению, а примеры 8 и 9 иллюстрируют пищевую ценность соединений согласно изобретению, при помощи рисунка, где показана эффективность DL-метионина и КМБ в зависимости от применяемой дозы в испытаниях Примера 9.
ПРИМЕР 1. Получение катализатора (A): 1% Bi/5% Pt на оксиде алюминия
100 граммов шариков γ-оксида алюминия получают способом, описанным в патентной заявке Франции FR-A-1449904, путем автоклавирования активированных агломератов оксида алюминия в присутствии кислоты, а затем их высушивают и обжигают. Эти шарики имеют удельную поверхность 100 м2/г, общий объем пор 0,90 см3/г, состоящий из макропор с диаметром свыше 100 нм.
Эти шарики затем пропитывают 90 см3 раствора нитрата висмута, содержащим 1 г висмута. I
После 30 минут контакта шарики высушивают при 150°С, затем обжигают в воздухе при 600°С в течение 3 часов.
Затем их пропитывают 90 см3 раствора хлороплатиновой кислоты, содержащим 5 г платины.
После 30 минут контакта шарики высушивают при 150°С, затем активируют в течение 3 часов при 300°С в потоке водорода с расходом 200 литров в час.
Полученный таким образом катализатор (А) содержит, по весу по отношению к носителю из оксида алюминия, 5% платины и 1% висмута.
ПРИМЕР 2. Получение катализатора (В): 1% Bi/5% Pt на активированном угле
100 граммов активированного угля, поставляемого компанией СЕСА под наименованием СЕСА 3S, промывают последовательно в растворе соляной кислоты, затем в деионизованной воде для удаления растворимых примесей. Носитель затем просушивают в сушильном шкафу при 120°С в течение 24 часов.
Эти таблетки затем пропитывают раствором нитрата висмута, содержащим 5 г висмута.
После 4 часов контакта таблетки высушивают при 120°С в течение 24 часов.
Затем их пропитывают в растворе хлороплатиновой кислоты, содержащим 5 г платины.
После 4 часов контакта таблетки высушивают при 120°С, затем активируют в течение 3 часов при 300°С в потоке водорода с расходом 200 литров в час.
Полученный таким образом катализатор (В) содержит, по весу по отношению к носителю из активированного угля, 5% платины и 5% висмута.
ПРИМЕР 3. Получение катализатора (С): 5% Pt/5% Bi на активированном угле
100 граммов активированного угля, поставляемого компанией СЕСА под наименованием СЕСА 3S, промывают последовательно в растворе соляной кислоты, затем в деионизованной воде для удаления растворимых примесей. Носитель затем просушивают в сушильном шкафу при 120°С в течение 24 часов.
Эти таблетки затем пропитывают раствором гексахлороплатиновой кислоты, содержащим 5 г платины.
После 4 часов контакта таблетки высушивают при 120°С в течение 24 часов. Затем их пропитывают раствором нитрата висмута, содержащим 5 г висмута. После 4 часов контакта таблетки высушивают при 120°С, затем активируют в течение 3 часов при 300°С в потоке водорода с расходом 200 литров в час.
Полученный таким образом катализатор (С) содержит, по весу по отношению к носителю из активированного угля, 5% висмута и 5% платины.
ПРИМЕР 4. Получение катализатора (D): 5% Bi/4% Pd/1% Pt на активированном угле
100 граммов активированного угля, поставляемой компанией СЕСА под наименованием СЕСА 3S, промывают последовательно в растворе соляной кислоты, затем в деионизованной воде для удаления растворимых примесей. Носитель затем просушивают в сушильном шкафу при 120°С в течение 24 часов.
Таблетки затем пропитывают раствором нитрата висмута, содержащим 5 г висмута.
После 4 часов контакта таблетки высушивают при 120°С в течение 24 часов.
Затем их пропитывают раствором нитрата палладия и хлороплатиновой кислоты, содержащим 4 грамма палладия и 1 грамм платины.
После 4 часов контакта таблетки высушивают при 120°С, затем активируют в течение 3 часов при 300°С в потоке водорода с расходом 200 литров в час.
Полученный таким образом катализатор (D) содержит, по весу по отношению к носителю из активированного угля, 4% палладия, 1% платины и 5% висмута.
ПРИМЕР 5. Получение катализатора (Е): 1% Bi/5% Pt на графите
100 граммов графита, поставляемого компанией SN2A под наименованием Y 200 (ацетиленовая сажа) используют, не очищая, для синтеза катализатора (Е). Носитель предварительно просушивают в сушильном шкафу при 120°С в течение 24 часов.
Этот носитель в виде порошка затем пропитывают раствором нитрата висмута, содержащим 1 г висмута.
После 4 часов контакта пропитанный носитель высушивают при 120°С в течение 24 часов.
Катализатор в порошкообразном состоянии затем пропитывают раствором хлороплатиновой кислоты, содержащим 5 г платины.
После 4 часов контакта катализатор высушивают при 120°С, затем активируют в течение 3 часов при 300°С в потоке водорода с расходом 20 литров в час.
Полученный таким образом катализатор (Е) содержит, по весу по отношению к графитовому носителю, 5% платины и 1% висмута.
ПРИМЕР 6. Окисление бут-3-ен-1,2-диола (II) в 2-оксо-бут-3-еновую кислоту (III) в присутствии катализатора (D):
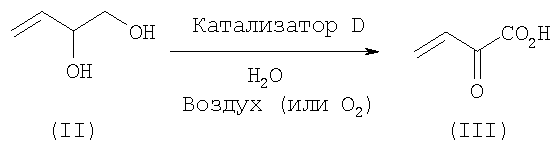
Окисление водных растворов с содержанием бут-3-ен-1,2-диола (II) от 0,1 до 50% по весу проводится в стеклянном реакторе с рубашкой емкостью 500 мл при тщательном перемешивании. Воздух вводится в реакционную среду через погружаемую трубку, возможно с фильтром из пористого стекла. Значение pH регулируется путем контролируемого добавления разбавленного гидроксида натрия при помощи насоса с pH-метром. Значение pH, расход гидроксида натрия, температура (50°С) и парциальное давление кислорода в газовой среде (при помощи оксиметра) регистрируют непрерывно.
Проводится регулярный отбор проб из реакционной среды, и продукты реакции анализируются способом высокоэффективной жидкостной хроматографии (ВЭЖХ) и хроматографии в газовой фазе (ГХ).
Предварительно восстановленный катализатор и воду вводят в реактор, суспензию подогревают при перемешивании до желаемой температуры реакции в потоке азота для удаления растворенного кислорода. Вводят бут-3-ен-1,2-диол (II) и, в начальный момент времени, азот заменяют на воздух, pH доводят до требуемого значения, и начинают окисление.
Степень превращения бут-3-ен-1,2-диола определяется как процент израсходованного бут-3-ен-1,2-диола. Выход продукта определяется процентом бут-3-ен-1,2-диола, преобразованного в этот продукт. Кинетику реакции можно отслеживать по:
- расходу бут-3-ен-1,2-диола (II);
- количеству гидроксида натрия, необходимого для поддержания постоянного pH во время образования кислоты (III).
Этот пример проводится в присутствии катализатора (D), полученного в примере 4, время реакции 12 часов в атмосфере кислорода, обедненной и контролируемой.

В реактор с рубашкой емкостью 500 мл, предварительно заполненный азотом и снабженный механической мешалкой, температурным зондом и зондом pH, загружают:
Масса введенного катализатора: 0,302 г
Реакционную среду доводят до температуры 50°С.
Расход воздуха фиксируют на уровне 2,6 л/час, азота 8 л/час.
Содержание 02, измеряемое при помощи оксиметра, составляет около 5% по объему.
Скорость перемешивания составляет 300 об/мин. Значение pH реакционной среды регулируют в диапазоне 6-7 путем добавления водного раствора гидроксида натрия (0,15% по весу). Скорость расхода бут-3-ен-1,2-диола измеряют способом хроматографии в газовой фазе. Появление α-кетокислоты (III) определяют способом высокоэффективной жидкостной хроматографии. Результаты:
- Степень превращения (диол II)=38% через 6 часов
- Степень превращения (диол II)=64% через 12 часов
ПРИМЕР 7. Окисление бут-3-ен-1,2-диола (II) в 2-оксо-бут-3-еновую кислоту (III) в присутствии катализатора (D):
Этот пример реализуется в присутствии катализатора (D), полученного в примере 4, время реакции 4 часа в присутствии воздуха при pH 7,5.

В реактор с рубашкой, емкостью 100 мл, предварительно заполненный азотом и снабженный механической мешалкой, температурным зондом и зондом pH, загружают:
Катализатор (D): 0,5 г
Диол (II): 0,5 г
Реакционную среду поддерживают при температуре 30°С. Расход воздуха фиксируют на уровне 12 л/час, азота 9 л/час. Скорость перемешивания составляет 1300 об/мин. Значение pH реакционной среды устанавливают на 7,5 добавлением водного раствора гидроксида натрия (0,5% р/р). Скорость расхода бут-3-ен-1,2-диола (II) измеряют способом хроматографии в газовой фазе. Появление 2-оксо-бут-3-еновой кислоты (III) определяется способом высокоэффективной жидкостной хроматографии.
Получены следующие результаты:
- степень превращения (диол II)=75% через 1 час;
- степень превращения (диол II)>99% через 4,5 часа;
- выход 2-оксо-бут-3-еновой кислоты (III)>85%.
ПРИМЕР 8. Пример пищевой ценности 2-оксо-4-метилтиобутановой кислоты (КМБ) как источника метионина для цыплят
8.1) Принцип эксперимента
Применена экспериментальная модель, называемая "отклик на дозу".
Исходно используют пищевую основу, лишенную метионина, поскольку метионин является питательным элементом, отклик на который изучается, затем вводят упомянутый недостающий питательный элемент в форме 2-гидроксо-4-метилтиобутановой кислоты (продукт, поставляемый компанией-заявителем под наименованием Rhodimet™ АТ88) по режиму питания R2 и в форме 2-оксо-4-метилтиобутановой кислоты (КМБ) по режиму питания R3 в тех же дозах, затем сравнивают полученные для каждого режима показатели, где режим питания R1 соответствует отсутствию ввода метионина.
8.2) Экспериментальная схема
Тестирование проводили на цыплятах в количестве 4 на клетку.
Были проведены три курса по режиму R1 (без добавления метионина), R2 (+Rhodimet™ АТ88) и R3 (+КМБ), повторенные по 9 раз каждый, согласно следующей таблице.
Таблица 2 представляет результаты, полученные в период 7-21 день.

Примечание: значения, помеченные буквой а или b, значительно отличаются на уровне 5%.
Индекс потребления за указанный период является отношением потребленного корма к прибавлению веса за тот же период, что соответствует количеству пищи, необходимой для достижения прибавления веса в 1 кг.
Подача метионина в форме КМБ (R3) позволяет улучшить прибавление веса за период на приблизительно 90 г и уменьшает индекс потребления на 9%, что незначительно отличается от значений, полученных при помощи гидроксианалога метионина (Rhodimet™ АТ88, R2).
Таким образом, КМБ имеет пищевую ценность, эквивалентную ценности гидроксианалога метионина.
ПРИМЕР 9. Другой пример пищевой ценности 2-оксо-4-метилтиобутановой кислоты (КМБ) как источника метионина для цыплят
9.1) Принцип эксперимента
Использовали пищевую основу, лишенную метионина, поскольку метионин является питательным элементом, отклик на который изучается, затем вводят упомянутый недостающий питательный элемент в контрольной и испытываемой формах, затем сравнивают полученные для каждого режима показатели, где режим R1 соответствует отсутствию ввода метионина.
Цыплята в испытании были в количестве 2 особей на клетку, со случайной контролируемой выборкой.
Было проведено 7 опытов:
R1: без добавления метионина,
R2 и R3:+Rhodimet™ NP99 (D,L-метионин в виде порошка, продаваемый Demanderesse) в двух различных дозировках,
R4 и R5:+Rhodimet™ АТ88, в двух различных дозировках,
R6 и R7:+КМБ, в двух различных дозировках.
Они были повторены 14 раз каждый и отражены в следующей Таблице 3.
Полученные результаты представлены в Таблице 4. Полученные результаты показывают, что добавление 0,1% метионина в форме NP99 позволяет значительно увеличить прибавление веса (+90 г) и значительно уменьшить индекс потребления (-11%). Отсутствие влияния дополнительной дозы позволяет предположить, что потребность в метионине покрывается, начиная с дозы 0,1%.
Результаты, полученные с добавлением АТ88 или КМБ, сходны и мало отличаются от результатов, полученных с DL-метионином (NP99). Таким образом, КМБ как и ТАТ88, имеет пищевую ценность, эквивалентную ценности DL-метионина.
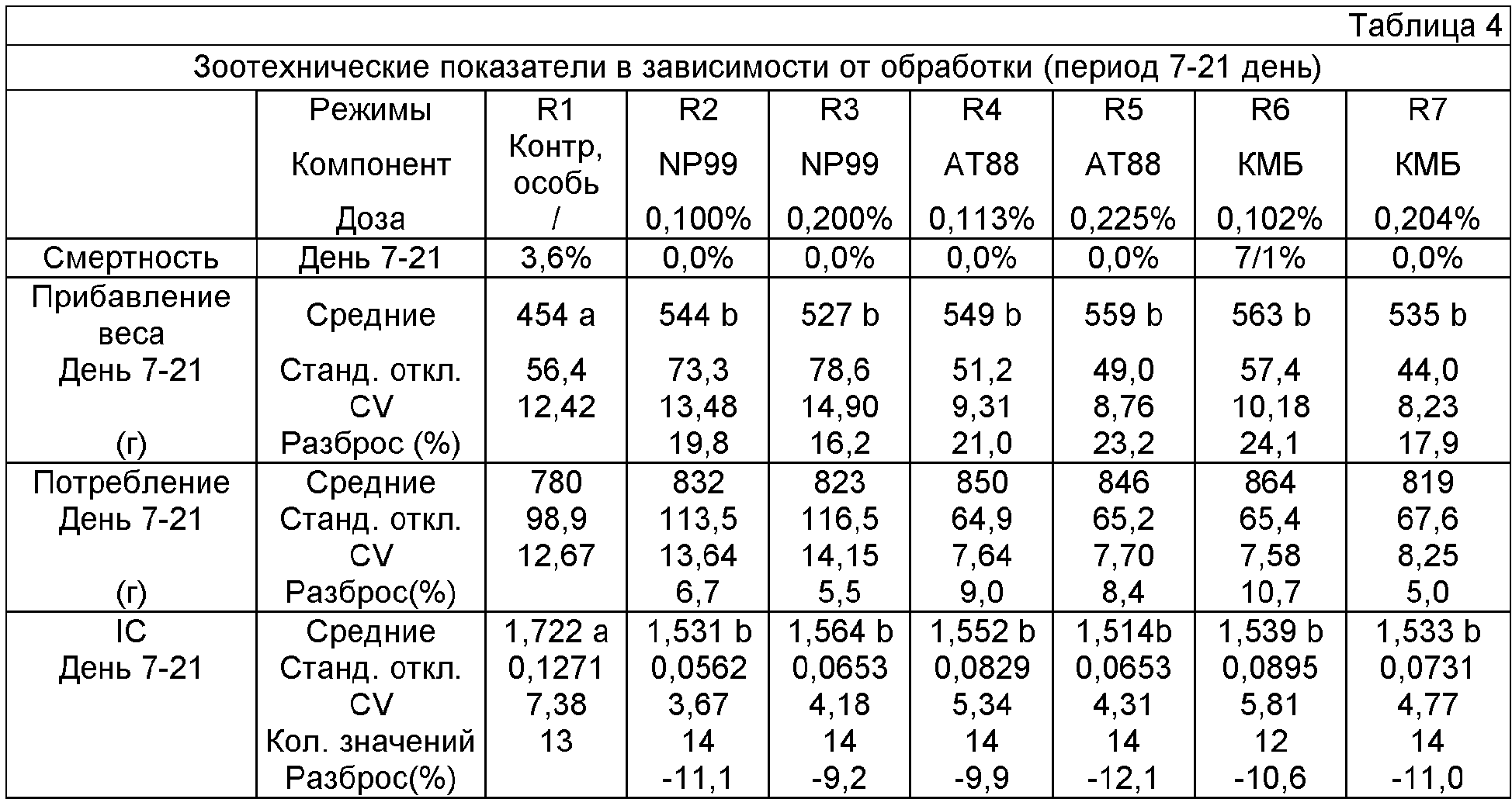
Биологическая ценность КМБ:
Полученные результаты согласно Таблице 4 позволяют также вычислить "приблизительную" биологическую ценность КМБ. Поскольку кривая зависимости отклика от дозы основывается только на двух точках, она не может рассматриваться как окончательная, однако позволяет получить более количественное приближение касательно биологической ценности КМБ, хотя и не предрешая ее рабочего значения.
Для сравнения обоих продуктов используется расчет эффективности превращения метионина, что состоит в определении среднего количества активного вещества (метионин или КМБ в мг), необходимого для получения граммов дополнительного прибавления веса по отношению к прибавлению веса контрольных особей, не получавших активного вещества. Чем меньше число граммов, необходимое для получения одного грамма прибавления веса, тем выше эффективность продукта, как показано на чертеже.
Отношение эффективности КМБ по отношению к DL-метионину вычисляется затем как отношение значений эффективности превращения, вычисленного при двух использованных дозах. Так, значения относительной эффективности показывают, что КМБ проявляет более высокую эффективность, чем DL-метионин, соответственно 118,5 и 111,5% для доз 0,1 и 0,2%.
В заключение, примеры 8 и 9 показывают, что КМБ, добавленная в пищу, усваивается животным на кишечном уровне и она используется как источник метионина, по меньшей мере равноценный DL-метионину для роста.
Реферат
Изобретение относится к способу получения 2-оксо-4-метилтиобутановой кислоты формулы (I) и ее солей, ! ! где R представляет собой карбоксильную группу и ее соли, отличающийся тем, что он включает следующие стадии: проведение каталитического и селективного окисления бут-3-ен-1,2-диола (II) с получением 2-оксо-бут-3-еновой кислоты (III) согласно следующей реакционной схеме (i): ! ! и осуществление селективной конденсации метилмеркаптана с 2-оксо-бут-3-еновой кислотой (III) согласно следующей реакционной схеме (ii): ! ! Изобретение также относится к способу получения соединения формулы (I), к способу получения 2-оксо-бут-3-еновой кислоты (III), к пищевой добавке, к пищевому рациону, к способу введения корове биологически доступного метионина, а также к применению 2-оксо-4-метилтиобутановой кислоты формулы (I). Технический результат - получение 2-оксо-4-метилтиобутановой кислоты, ее солей, и их использование при кормлении животных. 7 н. и 17 з.п. формулы, 4 табл., 1 ил.
Формула

где R представляет собой карбоксильную группу и ее соли, отличающийся тем, что он включает следующие стадии:
проведение каталитического и селективного окисления бут-3-ен-1,2-диола (II) с получением 2-оксо-бут-3-еновой кислоты (III) согласно следующей реакционной схеме (i):

и осуществление селективной конденсации метилмеркаптана с 2-оксо-бут-3-еновой кислотой (III) согласно следующей реакционной схеме (ii):


где R представляет собой группу, выбранную из COOR', CONH2, CONHR' и CONR'R'', где R' и R'' выбраны, независимо друг от друга, из группы линейных или разветвленных алкильных радикалов, содержащих от 1 до 12 атомов углерода, и циклоалкильных радикалов, содержащих от 3 до 12 атомов углерода, отличающийся тем, что 2-оксо-4-метилтиобутановую кислоту (I) получают способом по п.1, а затем проводят стадию преобразования в сложный эфир или амидирования.
дифенилдипропиламин, и N-алкилморфолина, такого как N-метилморфолин, или тритона В.
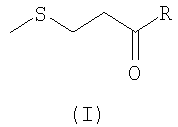
где R представляет собой карбоксильную группу, или ее соли.
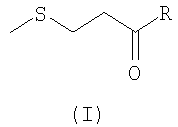
где R представляет собой карбоксильную группу, или ее солей в качестве пищевой добавки для кормления животных.
Документы, цитированные в отчёте о поиске
Способ получения 2-гидрокси-4-метилтиобутановой кислоты

Комментарии