Флуоресцентные конъюгаты и их применение для диагностики опухоли - RU2720976C2
Код документа: RU2720976C2
Чертежи






Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области биомедицинских исследований, в частности, к соединениям и способам, которые можно применять для диагностики, например, диагностики опухолей in vitro или in vivo.
УРОВЕНЬ ТЕХНИКИ
На сегодняшний день рак является причиной примерно 13% всех смертей в мире. Несмотря на интенсивные исследования в течение десятилетий, рак остается второй ведущей причиной смертности в высоко развитых странах, вызывая примерно 25% смертей. Для многих типов рака хирургическое лечение - часто в комбинации с химиотерапией, радиационным лечением или гипертермическим лечением - является основой терапевтического воздействия.
Рак также называется злокачественным новообразованием или злокачественной опухолью. Новообразование представляет собой аномальный рост ткани. Новообразования подразделяют на доброкачественные, предраковые (или новообразования in situ) и злокачественные новообразования. Многие, но не все новообразования также образуют опухоли, представляющие собой солидные или заполненные жидкостью очаги поражения, которые можно отличить анатомически от неповрежденной ткани. Подобно новообразованиям, опухоли могут быть доброкачественными, предраковыми или злокачественными. Однако в разговорном языке, а также в описании настоящего изобретения термин «опухоль» может использоваться как синоним злокачественной опухоли.
Прогноз жизни у пациентов с раком зависит от того, на какой стадии заболевание было впервые диагностировано. У двадцати-тридцати процентов пациентов, страдающих раком желудочно-кишечного тракта, развивается единственное осложнение в виде местно-регионарного рецидива. Опухоли эпителия яичников также вызывают местно-регионарные осложнения при достижении III стадии. Несколько лет назад было показано, что полная хирургическая резекция является очень важным фактором улучшения прогноза для пациентов. Эта стратегия максимальной циторедукции является частью протоколов терапевтического лечения, которые включают системную или внутрибрюшинную химиотерапию, возможно, в комбинации с гипертермическим лечением.
План хирургического лечения является основным параметром, от которого зависит будущее пациентов. Выявление всех опухолевых узлов и их распространения является главным пунктом, влияющим на послеоперационный прогноз. Опухолевую ткань не всегда легко отличить от нормальных тканей, в особенности если пациенты подвергались лечению неоадъювантами. В таких случаях хирурги руководствуются только своими визуальными и тактильными ощущениями, а также собственным опытом; на сегодняшний день не существует доступного интраоперационного метода, помогающего визуализировать распространение опухоли.
Было сделано предположение, что резекционное хирургическое лечение рака можно усовершенствовать путем применения фотодетекции in situ. В основе фотодетекции лежит воздействие на потенциально пораженные ткани соединения, обладающего аффинностью в отношении опухолей и поддающегося оптической визуализации при выбранной длине световой волны.
Метод фотодетекции опухолей первоначально был разработан в 1980-х годах с применением производных гематопорфирина, таких как фотофрин. Основные ограничения фотодиагностики с использованием указанных молекул связаны с их низкой селективностью в отношении раковых тканей и способностью вступать в химические реакции и вызывать высокую фотосенсибилизацию или некроз. Последнее указанное ограничение фактически является преимуществом для фотохимиотерапии, для которой также предполагалось использование указанных соединений.
Фолли с соавторами (Folli et al.) использовали конъюгат антитела против раково-эмбрионального антигена (РЭА) с флуоресцеином для визуализации опухолей у пациентов, страдающих колоректальной карциномой (Proc. Natl. Acad. Sci. USA, vol. 89, pp. 7973-7977, 1992). Гутовски и соавторы (Gutowsky et al., Clin. Рак Res., vol. 7, pp. 1142-1148, 2001) продемонстрировали на мышиной модели иммунофотодетекцию очаговых поражений, вызванных карциномой толстой кишки LS174T, с помощью конъюгата mAb против РЭА 35А7 и индоцианина (Су5).
Однако клиническое применение указанных конъюгатов довольно ограничено. Конъюгаты антител с флуоресцеином характеризуются довольно низкой длиной волны возбуждения и испускания, что приводит к низкой проникающей способности в ткани и значительной степени неспецифической аутофлуоресценции неопухолевых тканей, вызванной лазерным излучением, используемым для возбуждения красящего компонента. Токсикологический профиль конъюгатов Су5 неизвестен и еще не установлен в литературе.
Настоящее изобретение направлено на решение указанных и других связанных проблем и недостатков методов фотодетекции опухолей. Одной из целей изобретения является получение улучшенных конъюгатов, подходящих для фотодетекции злокачественных или предраковых опухолей, которые являются клинически эффективными и позволяют преодолеть один или более недостатков предшествующего уровня техники и которые обладают одним или более из следующих свойств: высокая степень специфичности в отношении опухоли, высокая чувствительность, позволяющая выявлять очень маленькие очаги опухолевого поражения, хорошая клиническая переносимость, высокая стабильность, слабое перекрывание с другими красителями и высокая технологичность изготовления.
Дополнительной целью изобретения является обеспечение улучшенных способов диагностики опухолей in vitro и in vivo с применением таких конъюгатов. При применении in vivo указанные способы диагностики могут являться частью новых методов лечения, таких как улучшенные методы резекции опухолей.
Дополнительной целью изобретения являются способы получения таких конъюгатов.
Дополнительные цели настоящего изобретения будут очевидны из следующего далее описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
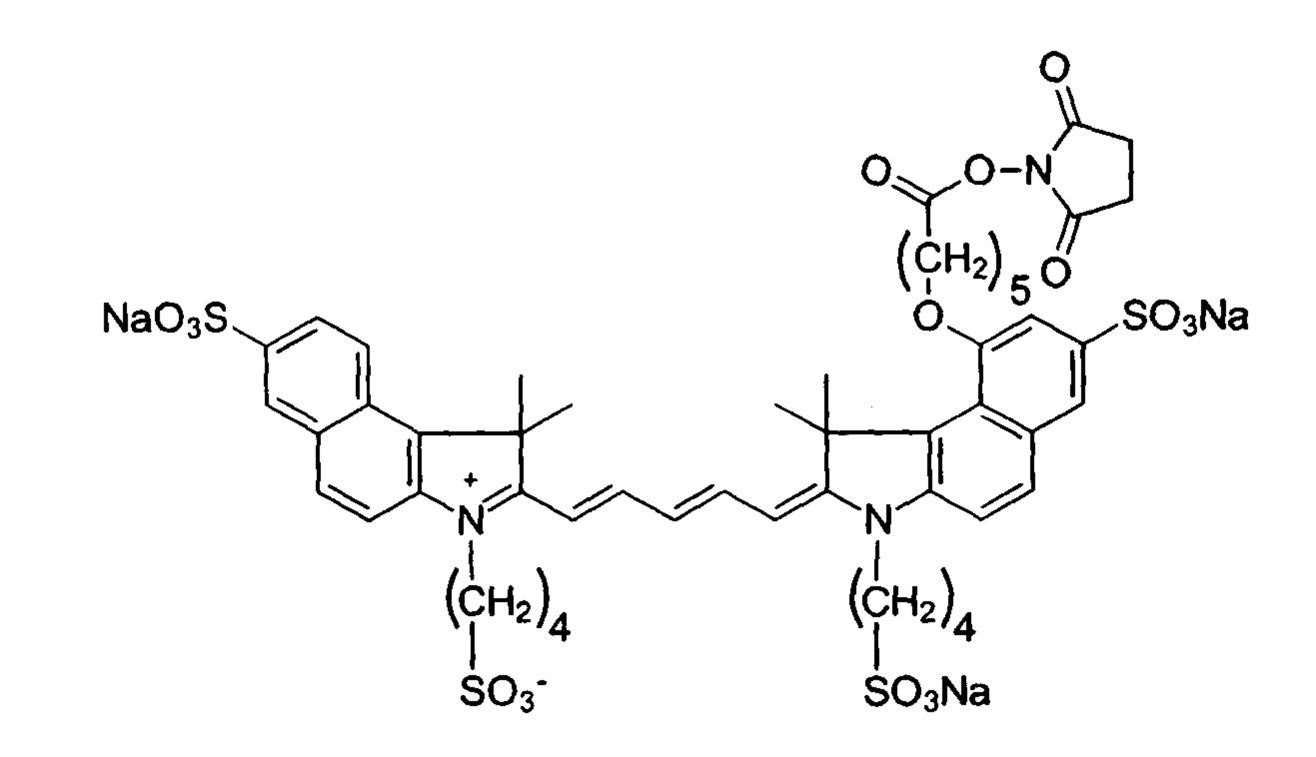
Вкратце, в настоящем изобретении предложен флуоресцентный конъюгат, содержащий флуорохромный фрагмент F, соединенный с нацеливающим фрагментом Т, где указанный фрагмент F имеет формулу (I), как определено в настоящей заявке ниже, где Y для каждого случая независимо выбран из SO3H, SO3- и SO3M; М представляет собой одновалентный катион; х, z и y независимо выбраны из целого числа от 1 до 8; и фрагмент Т обладает аффинностью в отношении опухолевого маркера. Согласно одному варианту реализации изобретения, флуорохромный фрагмент F может иметь формулу (II), как определено ниже.
Опухолевый маркер, к которому нацеливающий фрагмент Т обладает аффинностью, может представлять собой опухолевый антиген, такой как антиген, который экспрессируется или экспрессируется на повышенном уровне определенными опухолевыми клетками. Пример такого антигена представляет собой раково-эмбриональный антиген (РЭА). Нацеливающий фрагмент Т сам по себе может представлять собой непептидный лиганд, антитело, фрагмент антитела или гибридный белок, содержащий по меньшей мере одну вариабельную область антитела. Согласно одному варианту реализации изобретения, нацеливающий фрагмент Т представляет собой антитело, в частности, химерное, гуманизированное или человеческое моноклональное антитело.
Согласно дополнительному аспекту, в изобретении предложена композиция, содержащая такой конъюгат, необязательно в комбинации с дополнительными активными или неактивными ингредиентами. Например, композиция может быть стерильной и содержать неактивные ингредиенты, такие как вода для инъекции, буферные компоненты, один или более стабилизаторов, таких как аминокислоты, добавки для лиофилизации, такие как моно-, ди- или олигосахариды, изотонирующие агенты и т.д. Композиция также может содержать небольшое количество нацеливающего фрагмента Т в неконъюгированной форме.
Согласно дополнительному аспекту, в изобретении предложен способ получения конъюгата. Способ включает этапы (а) обеспечения флуорохрома, имеющего формулу (III), как определено ниже, где Y для каждого случая независимо выбран из SO3H, SO3- и SO3M; М представляет собой одновалентный катион, х, z и y независимо выбраны из целого числа от 1 до 8, и Z выбран из противоиона, водорода, сукцинимидила, сульфосукцинимидила и нитрофенила; (b) обеспечения нацеливающего агента, обладающего аффинностью к опухолевому маркеру; и (с) соединения флуорохрома с указанным нацеливающим агентом. Согласно одному варианту реализации изобретения, флуорохром имеет формулу (IV), как определено ниже.
Кроме того, в изобретении предложены способы клинического и неклинического применения конъюгата и композиции, содержащей указанный конъюгат. Применение in vitro включает применение для детекции опухолевой клетки или опухолевых клеток в образце или для диагностики и/или мониторинга опухоли in vitro. Клинически применимый конъюгат и/или композицию, содержащую указанный конъюгат, можно использовать для детекции у пациента опухолевых очагов, экспрессирующих опухолевый маркер, или для определения положения опухоли, экспрессирующей опухолевый маркер. Например, их можно использовать для детекции опухолевых клеток или опухолевой ткани по краю резекции у пациента, подвергающегося или подвергавшегося резекционному хирургическому лечению. Согласно одному варианту реализации изобретения, композицию, содержащую конъюгат, вводят пациенту, имеющему опухоль, экспрессирующую опухолевый маркер, к которому нацеливающий фрагмент Т обладает аффинностью, например, путем внутривенной, внутрибрюшинной, подкожной или внутримышечной инъекции или перфузии или путем ингаляции или путем местного введения, например, в виде спрея, с последующей инициацией резекционного хирургического лечения указанной опухоли у пациента в пределах не более чем примерно 72 часов после указанного введения и освещением ткани в области резекции у указанного пациента, подвергающегося резекционному хирургическому лечению светом имеющим длину волны от примерно 660 до 700 нм. Таким образом, возможна визуализация положения опухоли, включая положение очень мелких узелков и повреждений, которые в противном случае не видны невооруженным глазом, обеспечивающая руководство для хирурга для возможности полного удаления опухолевой ткани и/или подтверждения полной резекции.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фигуре 1 показана флуоресценция опухолевых микроузлов in situ (колонка А) и вырезанных микроузлов (колонка В) на мышиной модели перитонеального канцероматоза LS-174T, визуализируемая при 700 нм после введения 20 мкг флуоресцентного конъюгата согласно Примеру 3.
На Фигуре 2А представлены изображения опухолей, полученных на мышиной модели подкожной опухоли толстой и прямой кишки человека (НТ-29), экспрессирующей РЭА на повышенном уровне, и отобранных через 48 часов после введения 30 мкг флуоресцентных конъюгатов (А - флуоресцентный конъюгат согласно Примеру 3; В - контрольный конъюгат). Колонки представляют собой изображения, полученные в проходящем свете, в режиме флуоресценции (визуализация при 700 нм) и при наложении (слева направо).
На Фигуре 2В представлены изображения опухолей, полученных на мышиной модели ортотопической опухоли рака толстой и прямой кишки человека (НТ-29), экспрессирующей РЭА на повышенном уровне, и отобранных через 48 часов после введения 30 мкг флуоресцентного конъюгата согласно Примеру 3 (А - до лапаратомии, В - после лапаратомии, С - после экспозиции опухоли). Колонки представляют собой изображения, полученные в проходящем свете, в режиме флуоресценции (визуализация при 700 нм) и при наложении (слева направо).
На Фигуре 3 представлены изображения, полученные во время хирургического лечения первичной опухоли поджелудочной железы у пациента через 48 часов после введения 5 мг флуоресцентного конъюгата согласно Примеру 3 (А - в проходящем свете, В - в режиме флуоресценции, наложение изображений). Пунктирная линия обозначает предполагаемый край резекции, определенный только на основе визуализации и пальпации, тогда как сплошная линия представляет собой предполагаемый край резекции на основе визуализации флуоресценции. Точечная линия обозначает приблизительный контур опухоли, как показано с помощью флуоресценции.
На Фигуре 4 представлены изображения метастаза в брюшине у пациента, страдающего раком поджелудочной железы, через 48 ч после введения 5 мг флуоресцентного конъюгата согласно Примеру 3. Изображения ряда А были получены во время операции in vivo, изображения ряда В - ex vivo после резекции (левая колонка - в проходящем свете, правая колонка - в режиме флуоресценции в виде наложения изображений).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно первому аспекту, в настоящем изобретении предложен флуоресцентный конъюгат, содержащий флуорохромный фрагмент F, соединенный с нацеливающим фрагментом Т, где указанный фрагмент F имеет формулу (I):

где Y независимо для каждого случая выбран из SO3H, SO3- и SO3M; М представляет собой одновалентный катион; х, z и y независимо выбраны из целого числа от 1 до 8 и фрагмент Т обладает аффинностью к опухолевому маркеру.
Примеры одновалентных катионов включают, но не ограничиваются указанными, Na, K или аммоний. Согласно одному предпочтительному варианту реализации изобретения, Y выбран из SO3- и SO3Na.
Флуорохромный фрагмент F (который также может называться флуоресцентным красителем или меткой или флуорофорным фрагментом) флуоресцентного конъюгата согласно изобретению поглощает электромагнитную энергию в диапазоне длин волн, находящемся предпочтительно в ультрафиолетовом, видимом или инфракрасном спектре, и испускает в целом в более высоком диапазоне длин волн, предпочтительно в видимом или ближнем инфракрасном диапазоне. Следует понимать, что термин «длина волны возбуждения» (которая выражается в нм) в настоящей заявке относится к пику, т.е. максимальной или специфической длине волны поглощения флуорохрома или флуоресцентного конъюгата, содержащего флуорохромный фрагмент, соединенный с нацеливающим фрагментом Т. Термин «длина волны испускания» (которая выражается в нм) относится к пику, т.е. максимальной или специфической длине волны испускания флуорохрома или флуоресцентного конъюгата, содержащего флуорохромный фрагмент, соединенный с нацеливающим фрагментом согласно изобретению.
Флуорохромный фрагмент F представляет собой цианиновое производное формулы (I), как описано выше, и предпочтительно характеризуется длиной волны испускания в дальнем видимом или ближнем инфракрасном (БИК) спектре с пиком длины волны испускания в диапазоне между 650 и 750 нм. При связывании с нацеливающим фрагментом Т полученный конъюгат также предпочтительно характеризуется длиной волны испускания с пиком в диапазоне между 650 и 750 нм.
Авторами настоящего изобретения было обнаружено, что указанные флуорохромные фрагменты обладают, в частности, благоприятными флуоресцентными характеристики, такими как гашение, квантовый выход и, в частности, устойчивость к фотообесцвечиванию, что обеспечивает возможность их надежного применения для конъюгации с нацеливающими фрагментами, активными в отношении антигенов.
Специалисту в данной области техники очевидно, что в контексте заместителя Y группы SO3H, SO3-, SO3M и/или SO3Na могут также динамично превращаться друг в друга в зависимости от химического окружения конъюгата. Например, при растворении в водной среде и в зависимости от рН и доступности других катионов группа, представленная Y и выбранная из SO3-, SO3M и/или SO3Na, также может протонироваться с образованием SO3H или превращаться в другую форму соли, например, из SO3Na в SO3K или наоборот. Настоящее изобретение, соответственно, включает такие альтернативные формы соединения формулы (I).
В частности, предпочтительные конъюгаты представляют собой конъюгаты, содержащие флуорохромный фрагмент F формулы (II):

Флуорохромный фрагмент F флуоресцентных конъюгатов соединен с нацеливающим фрагментом Т, предпочтительно, ковалентно связан, т.е. конъюгирован с нацеливающим фрагментом Т с помощью ковалентной связи, такой как амидная или сложноэфирная связь.
Следует понимать, что, как и в случае формулы (I), в формуле (II) группы, обозначенные Y, включают альтернативные формы сульфоновой кислоты, такие как SO3H или SO3K, которые образуются in situ при химическом равновесии, в зависимости, например, от состава и/или значения рН водной среды, в которой конъюгат может быть растворен. Более того, следует понимать, что каждая из четырех групп на основе сульфоновой кислоты в Формуле (II) может быть представлена в виде соли Na или внутренней соли и что изображенная Формула (II) представляет собой только один из различных возможных вариантов типичного соединения.
Нацеливающие фрагменты Т флуоресцентных конъюгатов обладают аффинностью в отношении опухолевых маркеров и могут связываться или ассоциировать с опухолевым маркером. Следует понимать, что опухолевый маркер представляет собой продукт или молекулу, продуцируемую опухолью или присутствующую в опухоли или продуцируемую в результате нормальных клеточных механизмов пациента в ответ на присутствие опухоли. При использовании в настоящей заявке опухоль означает новообразование, представляющее собой группу или массу клеток или ткань, возникающую в результате аномального или неконтролируемого клеточного роста, если иное значение очевидно не следует из конкретного контекста. В частности, опухолевый маркер продуцируется опухолью, которая является раковой или злокачественной.
Опухолевый маркер может быть представлен, например, в виде белка, гликопротеина, рецептора, гормона, фермента, антигена или онкогена или его продукта. Опухолевый маркер может экспрессироваться на повышенном уровне в опухолевых клеток по сравнению с нормальными клетками или может представлять собой опухоль-специфическое вещество, которое продуцируется только опухолевыми клетками. В частности, предпочтительными опухолевыми маркерами, на которые может быть нацелен или направлен нацеливающий фрагмент Т, являются такие маркеры, которые представляют собой белки клеточной поверхности или рецепторы, которые присутствуют на поверхности опухолевых клеток и/или которые, в частности, экспрессируются в эпителиальных клетках или в солидных опухолях, таких как карциномы или саркомы.
Согласно предпочтительному варианту реализации изобретения, опухолевый маркер представляет собой опухолевый антиген. Опухолевый антиген представляет собой молекулу или продукт, специфичный для опухолевых клеток или связанный с опухолевыми клетками (например, экспрессируется на повышенном уровне в опухолевых клетках), который может вызывать или стимулировать иммунную реакцию, такую как продукция антител и Т-клеточный и/или В-клеточный ответ. Опухолевый антиген может представлять собой или содержать белок или липид. Указанный опухолевый антиген может быть гликозилирован (например, представлять собой гликопротеин) и может содержать один или более эпитопов, т.е. областей или доменов, с которым антитело, В-клетка или Т-клетка может предпочтительно связываться или в отношении которых может иметь особую аффинность.
Примеры опухолевых антигенов включают опухолевые антигены, происходящие или полученные из онковирусных белков, онкофетальных антигенов, которые в норме продуцируются на более высоком уровне только во время эмбрионального развития, антигены, экспрессируемые на повышенном уровне или накапливаемые опухолевыми клетками по сравнению с нормальными клетками, или антигены, которые являются мутантными или включают посттрансляционные изменения. Предпочтительно опухолевый маркер представляет собой опухолевый антиген, выбранный из раково-эмбрионального антигена (РЭА), рецептора эпидермального фактора роста (EGFR) и рецептора эпидермального фактора роста человека-2 (HER2).
Согласно предпочтительному варианту реализации изобретения, опухолевый антиген представляет собой раково-эмбриональный антиген (РЭА). РЭА представляет собой онкофетальный гликопротеин с молекулярной массой 180-200 кДа, который экспрессируется в эпителиальных клетках. РЭА экспрессируется на высоком уровне на клеточной поверхности, в частности, в злокачественных опухолях толстой и прямой кишки (экспрессируется на повышенном уровне в 95% раковых опухолей толстой и прямой кишки), а также злокачественных опухолях желудка, тонкой кишки, поджелудочной железы, печени, молочной железы, яичников, шейки матки, мочевого пузыря, желчного пузыря и легкого. РЭА, как правило, не локализован и может экспрессироваться по всей поверхности клетки, а также во внутрижелезистом и внутриклеточном просвете. Антиген РЭА содержит пять основных эпитопов, подразделяющихся на GOLD-1 - GOLD-5, как определено в источнике
Согласно одному предпочтительному варианту реализации изобретения, нацеливающий фрагмент Т флуоресцентного конъюгата согласно изобретению направлен и связывается с опухолью, экспрессирующей антиген РЭА, расположенной в одной или более тканях или органах пациента, выбранных из толстой кишки, прямой кишки, желудка, тонкого кишечника, поджелудочной железы, печени, молочной железы, яичников, шейки матки, мочевого пузыря, желчного пузыря, легкого и пищевода.
Согласно другому предпочтительному варианту реализации изобретения, нацеливающий фрагмент Т флуоресцентного конъюгата может связываться с опухолевым маркером, который представляет собой рецептор. Рецептор может быть специфичным для опухолевой клетки или может экспрессироваться на повышенном уровне и присутствовать на повышенном уровне в опухолевых клетках. Нацеливающий фрагмент Т может действовать в качестве лиганда в отношении таких рецепторов и может представлять собой малую непептидную молекулу, т.е. химическое вещество или соединение, которое не содержит или не состоит из каких-либо аминокислотных последовательностей.
Согласно предпочтительному варианту реализации изобретения, флуоресцентный конъюгат согласно изобретению содержит флуорохром формулы (I) или (II) и нацеливающий фрагмент Т, выбранный из непептидного лиганда, антитела, фрагмента антитела и гибридного белка, содержащего по меньшей мере одну вариабельную область антитела. Предпочтительно, любой из таких нацеливающих фрагментов способен специфично связываться с опухолевым антигеном, таким как РЭА, HER2 или EGFR. Согласно одному конкретному варианту реализации изобретения, флуоресцентный конъюгат содержит флуорохром формулы (I) или (II) и нацеливающий фрагмент Т, выбранный из непептидного лиганда, антитела, фрагмента антитела и гибридного белка, содержащего по меньшей мере одну вариабельную область антитела, где указанный нацеливающий фрагмент специфично связывается с РЭА.
Согласно одному конкретному варианту реализации изобретения, нацеливающий фрагмент Т представляет собой антитело или фрагмент антитела или гибридный белок, содержащий по меньшей мере одну вариабельную область антитела. В этом случае антитело, фрагмент антитела или по меньшей мере одна вариабельная область антитела гибридного белка может происходить или принадлежать любому из изотипов или классов иммуноглобулина IgG, IgA, IgD или IgM. Полноразмерное антитело, как правило, представляет собой Y-образный гликопротеин, содержащий Fc-домен (кристаллизуемый фрагмент) и Fab-домен (антиген-связывающий фрагмент). Указанные домены состоят из пары полипептидных последовательностей тяжелой цепи (Н) и легкой цепи (L), связанных через дисульфидные связи с образованием Y-образных структур. Каждая цепь содержит вариабельную область (V) и константную область (С). Тяжелая цепь содержит вариабельную область цепи (VH) и различные константные области (имеющие аббревиатуры CH1, CH2 и т.д.); тогда как легкая цепь содержит только вариабельную область цепи (VL) и константную область (CL). Вариабельные области связаны со специфичностью распознавания и связывания антитела с конкретным эпитопом антигена и формируют антиген-связывающие Fab-домены.
Фрагменты антитела относятся к любому участку, цепи или домену антитела или любой конструкции, ее стабилизированной форме или конъюгату, который способен специфично взаимодействовать и связываться с антигеном. Примеры фрагментов антител включают фрагменты антиген-связывающих доменов (Fab, или Fab'), Fab-конструкции, одноцепочечные вариабельные фрагменты (scFv), однодоменные антитела, такие как VHH, миниантитела, диатела и т.д. Гибридный белок относится к конструкции, содержащей фрагмент антитела, слитый с другим биоактивным белком или полипептидом.
Согласно предпочтительному варианту реализации, нацеливающий фрагмент Т флуоресцентного конъюгата согласно изобретению представляет собой моноклональное антитело (mAb). Указанное моноклональное антитело может быть получено с помощью способов, известных в данной области техники. Химерные моноклональные антитела, в частности, являются предпочтительными. Они представляют собой гибридные моноклональные антитела, содержащие домены или области тяжелых или легких цепей, происходящие из более чем одного вида, например, из человеческих и мышиных антител. Нацеливающий фрагмент Т флуоресцентного конъюгата необязательно может представлять собой гуманизированное антитело (в целом, состоящее в основном по меньшей мере из 85-95% последовательностей человеческого происхождения) или человеческое антитело, происходящее только из последовательностей антитела зародышевых линий человека.
Предпочтительно, любой такой нацеливающий фрагмент Т способен специфично связываться с опухолевым антигеном РЭА.
Согласно одному варианту реализации изобретения, нацеливающий фрагмент Т флуоресцентного конъюгата, содержащий флуорохромный фрагмент F формулы (I), представляет собой химерное моноклональное антитело, обладающее специфичностью связывания с одним или более эпитопов антигена РЭА, например, эпитопом GOLD-1, GOLD-2, GOLD-3, GOLD-4 или GOLD-5. Согласно одному конкретному варианту реализации изобретения, нацеливающий фрагмент Т обладает аффинностью и/или специфичностью в отношении эпитопа GOLD-2. Согласно дополнительному варианту реализации изобретения, флуорохромный фрагмент F таких конъюгатов имеет формулу (II), как описано выше.
Согласно особо предпочтительному варианту реализации, в изобретении предложен флуоресцентный конъюгат, содержащий флуорохромный фрагмент F, соединенный с нацеливающим фрагментом Т, где указанный фрагмент F имеет формулу (II) и фрагмент Т представляет собой химерное mAb, направленное против эпитопа GOLD-2 РЭА, содержащего тяжелые цепи аллотипа Glm3 и легкие цепи аллотипа km3, где каждая тяжелая цепь и каждая легкая цепь содержит по меньшей мере один вариабельный домен IgG1 мыши и по меньшей мере один константный домен человеческого иммуноглобулина. Указанное химерное моноклональное антитело обладает специфичностью связывания с эпитопом GOLD-2 РЭА по результатам исследований конкурентного связывания/ингибирования, известных в данной области техники.
В частности, флуоресцентный конъюгат может быть присоединен к химерному mAb, направленному против РЭА, которое экспрессируют и получают из следующих нуклеотидных последовательностей:
(A) Тяжелая цепь (SEQ ID NO: 1):

(B) Легкая цепь (SEQ ID NO: 2):

Нуклеотидная последовательность вариабельной тяжелой цепи (А), указанная выше, содержит последовательности сайтов рестрикции KpnI и NheI на 5' и 3' конце соответственно. Нуклеотидная последовательность вариабельной легкой цепи (В) содержит последовательности сайтов рестрикции SalI и BSiWI на 5' и 3' конце соответственно.
Аминокислотная последовательность вариабельных участков указанного mAb соответствует следующей последовательности:
(А) Тяжелая цепь (SEQ ID NO: 3):


(В) Легкая цепь (SEQ ID NO: 4):

Согласно предпочтительному варианту реализации изобретения, флуоресцентный конъюгат может содержать фрагмент F, имеющий формулу (II), соединенный с нацеливающим фрагментом Т, где Т представляет собой химерное mAb, направленное против РЭА, содержащее вариабельную область легкой цепи SEQ ID NO: 4 и вариабельную область тяжелой цепи SEQ ID NO: 3.
Флуоресцентный конъюгат согласно изобретению может содержать более одного флуоресцентного фрагмента F, конъюгированного с одним нацеливающим фрагментом Т, например, от 1 до примерно 10 фрагментов F на один нацеливающий фрагмент Т. Количество флуорохромных фрагментов F, присоединенных к одному нацеливающему фрагменту Т, предпочтительно выбрано из 1-4. Другими словами, в молекуле такого предпочтительного конъюгата n фрагментов F присоединено к одному фрагменту Т, и n представляет собой целое число, выбранное из 1-4.
Тогда как описанная молекула конъюгата характеризуется n, представляющим собой целое число, соединение, содержащее множество молекул конъюгата может характеризоваться степенью конъюгирования, или средним числом фрагментов F на фрагмент Т, которое не обязательно является целым числом, но которое предпочтительно представляет собой любое значение в диапазоне от примерно 1 до примерно 4.
В указанном контексте нацеливающий фрагмент Т предпочтительно выбран из антитела, фрагмента антитела и гибридного белка, содержащего по меньшей мере одну вариабельную область антитела и от одного до четырех конъюгированных с ней флуорохромных фрагментов F формулы (I). Согласно одному варианту реализации изобретения, нацеливающий фрагмент Т представляет собой химерное моноклональное антитело против РЭА, присоединенное к n фрагментам флуорохрома F формулы (II), где n находится в диапазоне от 1 до 4.
Дополнительный аспект согласно изобретению включает композицию, содержащую флуоресцентный конъюгат, описанный выше.
Согласно одному варианту реализации изобретения, композиция содержит смесь различных флуоресцентных конъюгатов, которые различаются исключительно или главным образом по степени их конъюгирования. Согласно другому конкретному варианту реализации изобретения, композиция содержит смесь по меньшей мере 3 или 4 конъюгатов, все из которых содержат флуорохромный фрагмент F, имеющий формулу (II), присоединенный к химерному mAb, обладающему аффинностью в отношении эпитопа GOLD-2 РЭА, где указанные по меньшей мере 3 или 4 конъюгата отличаются друг от друга тем, что количество флуорохромных фрагментов F, присоединенных к одному нацеливающему фрагменту Т, равно 1, 2 и 3 соответственно или 1, 2, 3 и 4 соответственно.
Композиция может дополнительно содержать соединение, предоставляющее нацеливающий фрагмент Т в неконъюгированной форме (или, теоретически, конъюгат со степенью замещения ноль). Такая композиция, например, в комбинации с ранее описанным вариантом реализации изобретения, содержит неконъюгированное химерное mAb, обладающее аффинностью в отношении эпитопа GOLD-2 РЭА наряду с по меньшей мере тремя или четырьмя конъюгатами того же mAb, соединенного с 1, 2, 3, и необязательно 4 или более фрагментами флуорохрома F согласно формуле (II) соответственно. Популяции конъюгатов этой смеси можно определить с помощью способов, известных в данной области техники, например, с помощью масс-спектрометрии (например, MALDI-TOF).
Средняя степень конъюгирования конъюгатов в композиции составляет предпочтительно от примерно 0,5 до примерно 3. Степень конъюгирования представляет собой молярное отношение флуорохрома к антителу, которое можно определить спектрофотометрическим методом. Таким образом, следует понимать, что данный показатель отражает среднюю степень конъюгирования конъюгатов и любого неконъюгированного антитела, присутствующего в композиции. Согласно другому варианту реализации изобретения, средняя степень замещения составляет от примерно 1 до примерно 2. Авторы изобретения обнаружили, что тогда как более высокая степень замещения может обеспечивать улучшенную визуализацию, аффинность в отношении опухолевого маркера нацеливающего фрагмента снижается с повышением количества конъюгированных с ним флуорохромных фрагментов. Было определено, что степень замещения, составляющая от примерно 0,5 до примерно 3, в частности, для композиции, содержащей конъюгаты химерного mAb, обладающего аффинностью в отношении эпитопа GOLD-2 РЭА, с флуорохромом в соответствии с формулой (II), наиболее благоприятна для обеспечения превосходной визуализации даже маленьких опухолевых узлов, экспрессирующих РЭА, во время хирургического лечения.
Композиция согласно изобретению может дополнительно содержать вспомогательные вещества, такие как буферы, стабилизаторы, криопротекторы, изотонические агенты и агенты, регулирующие рН. В частности, предпочтительные вспомогательные вещества представляют собой основные аминокислоты, такие как L-аргинин и их соли, соли, такие как цитрат, фосфаты натрия или калия, хлорид натрия, хлорид калия, сахариды, такие как трегалоза, маннит, мальтоза, сахароза или декстран, или неионное поверхностно-активное вещество, такое как полисорбат или полоксамер. Значение рН композиции составляет предпочтительно между 5,2 и 7,2. Предпочтительно, композиция получена в стерильных условиях, известных в данной области техники, и является стерильной.
Согласно конкретному варианту реализации, композиция, содержащая любой из определенных выше флуоресцентных конъюгатов, является стерильной и также содержит водный буфер и L-аргинин и/или содержит соединение, содержащее фрагмент Т, который не присоединен к фрагменту F. Согласно дополнительному варианту реализации изобретения, композиция, содержащая любой из определенных выше флуоресцентных конъюгатов, является стерильной и содержит водный буфер, значение рН которого доведено примерно до 6,0, гидрохлорид L-аргинина и полисорбат, предпочтительно полисорбат 20. Сахарид, такой как трегалоза, маннит, мальтоза или сахароза, может также необязательно быть включен в указанные композиции.
Согласно другому конкретному варианту реализации изобретения, концентрация флуоресцентного конъюгата в композиции на основе содержания нацеливающего фрагмента, например, mAb против РЭА, составляет между 1 мг/мл и 10 мг/мл (как определено с помощью методов спектрофотометрии или ВЭЖХ, известных в данной области техники).
В еще одном аспекте изобретения предложен способ получения флуоресцентного конъюгата, включающий этапы (а) обеспечения флуорохрома, имеющего формулу (III):

где Y независимо для каждого случая выбран из SO3H, SO3- и SO3M, М представляет собой одновалентный катион; х, z и у независимо выбраны из целого числа от 1 до 8 и Z выбран из противоиона, водорода, сукцинимидила, сульфосукцинимидила и нитрофенила; (b) обеспечения нацеливающего агента, обладающего аффинностью к опухолевому маркеру; и (с) соединения указанного флуорохрома с указанным нацеливающим агентом.
Примеры одновалентных катионов включают, но не ограничиваются указанными, Na, K, или аммоний. Согласно одному предпочтительному варианту реализации изобретения, Y выбран из SO3- и SO3Na.
Флуоресцентные конъюгаты согласно изобретению, содержащие флуорохромный фрагмент F, соединенный с нацеливающим фрагментом Т, где фрагмент F имеет формулу (I) и где нацеливающий фрагмент Т обладает аффинностью к опухолевому маркеру, можно получать с помощью указанных способов.
Характеристики и предпочтения для нацеливающего фрагмента Т и флуорохромного фрагмента F, описанные в контексте непосредственно конъюгата в любом из предшествующих параграфов, также применимы к нацеливающему агенту и флуорохрому для применения согласно способу. Таким образом, нацеливающий агент предпочтительно представляет собой соединение, содержащее нацеливающий фрагмент Т конъюгата, и флуорохром, используемый согласно способу, предпочтительно представляет собой соединение, содержащие или приводящие к получению флуорохромного фрагмента F конъюгата. Нацеливающий агент предпочтительно обладает аффинностью в отношении опухолевого антигена, такого как раково-эмбриональный антиген (РЭА). Аффинность в отношении РЭА может представлять собой аффинность в отношении любого из его известных эпитопов, таких как эпитоп GOLD-2. Согласно особо предпочтительным вариантам реализации изобретения, нацеливающий агент представляет собой химерное моноклональное антитело, обладающее аффинностью в отношении РЭА.
Химерное моноклональное антитело (mAb), обладающее аффинностью в отношении РЭА, может быть получено путем экспрессии в клетках СНО, трансфицированных вектором экспрессии, кодирующим указанное гибридное mAb. Предпочтительно, вектор экспрессии содержит нуклеотидные последовательности, кодирующие константные домены антитела человека и анти-РЭА вариабельные домены мышиного антитела, предпочтительно, вариабельные домены, имеющие последовательности, описанные выше.
Флуорохромы, применимые для получения конъюгатов, могут быть получены по аналогии со схемой реакции на Рисунке Ia и способами, описанными в патенте США 8034626. Например, флуорохромы можно синтезировать путем конденсации двух производных индоленина, содержащих необходимые сульфонатные и (алкил)окси замены, где одно из производных индоленина представлено в виде ацетанилидного производного. Согласно одному варианту реализации изобретения, индолениновое промежуточное соединение может быть получено из амино-ароматического предшественника через этапы диазотирования/восстановления с последующими этапами сульфонирования, гидроксилирования, циклизации кетона в индоленин по Фишеру, карбоксилалкилирования гидроксильного заместителя и кватернизации с сультоном.
Согласно другому варианту реализации изобретения, флуорохром представляет собой соединение формулы (IV):
Флуорохромы согласно изобретению могут быть активированными, предпочтительно, представленными в виде активного сложного эфира (например, сложного сукцинимидилэфира), для конъюгирования с нацеливающим фрагментом Т. Согласно одному варианту реализации изобретения, флуорохром формулы (I) или (II) присоединен к нацеливающему фрагменту Т с помощью амидной, сложноэфирной, сложной тиоэфирной, дисульфидной или карбаматной связи с применением способов ковалентного сочетания, известных в данной области техники. Согласно другому варианту реализации изобретения, в котором нацеливающий фрагмент Т представляет собой антитело, фрагмент антитела или пептидную последовательность, флуорохром предпочтительно конъюгирован через свободные аминогруппы нацеливающего фрагмента Т с помощью амидной связи.
В другом аспекте изобретения предложено применение in vitro флуоресцентных конъюгатов, содержащих флуорохромный фрагмент F, соединенный с нацеливающим фрагментом Т, обладающим аффинностью к опухолевому маркеру, где указанный фрагмент F имеет формулу (I) или (II), или применение in vitro композиции, содержащей указанные флуоресцентные конъюгаты, для детекции опухолевой клетки в образце или для диагностики и/или мониторинга опухоли.
В частности, флуоресцентные конъюгаты можно использовать для детекции опухолевых клеток и опухолей, экспрессирующих опухолевый антиген, такой как РЭА. В таких случаях нацеливающий фрагмент Т предпочтительно выбран из непептидного лиганда, антитела, фрагмента антитела и гибридного белка, содержащего по меньшей мере одну вариабельную область антитела, такую как область, определенную согласно любому из ранее описанных предпочтений и характеристик. Флуоресцентный конъюгат можно применять для детекции опухолевой клетки или для диагностики или помощи в диагностике раковых заболеваний с помощью исследования in vitro образца, полученного из биологических жидкостей пациента, таких как сыворотка крови, или из тканевой биопсии. Предпочтительно, опухоль представляет собой солидную тканевую опухоль, такую как опухоли, полученные или происходящие из толстой кишки, прямой кишки, желудка, кишечника, желчных протока, поджелудочной железы, пищевода, яичника, молочной железы, предстательной железы, печени или легкого. Флуоресцентные конъюгаты могут быть также применимы для мониторинга наличия или прогрессирования опухоли, например, для оценки наличия любых остаточных опухолевых клеток или опухолевой ткани после резекционного хирургического лечения и/или химиотерапевтического лечения.
Согласно дополнительному аспекту, в изобретении предложено применение конъюгата и/или композиции, содержащей конъюгат, описанной в настоящей заявке, в качестве лекарственного средства. При использовании в настоящей заявке, лекарственное средство означает материал или продукт, который вводят для любой медицинской цели, такой как диагностика или лечение, включая профилактическое лечение заболевания или состояния субъекта, представляющего собой человека или животное. В частности, в изобретении предложено применение конъюгата и/или композиции, содержащей конъюгат, описанный в настоящей заявке, в качестве диагностического лекарственного средства или агента. Применение включает однократное или повторяющееся введение указанного конъюгата или композиции субъекту, нуждающемуся в указанном введении. Согласно одному варианту реализации изобретения, субъект, нуждающийся во введении конъюгата или композиции, представляет собой субъекта, страдающего раком или имеющего риск развития рака.
Более того, в изобретении предложено применение флуоресцентного конъюгата и/или его композиции для детекции у пациента опухолевых очагов, которые экспрессируют опухолевый маркер, или для определения положения опухоли, экспрессирующей опухолевый маркер. Применение, в частности, может быть благоприятным у пациентов, страдающих раком, с прогрессированием заболевания, таким как рецидив, метастазы или имплантация опухолевых клеток. Такое прогрессирование рака может приводить к более широкому распределению опухолевых клеток или тканевых масс. В частности, флуоресцентный конъюгат или композиция могут применяться для детекции очагов или для определения положения опухоли, экспрессирующей опухолевый маркер или опухолевый антиген, т.е. опухолевый маркер (предпочтительно, на клеточной поверхности), к которому указанный фрагмент Т обладает аффинностью. Следует понимать, что в настоящей заявке термин «очаги» означает группу или кластеры клеток или ткань, определяющую опухоль или повреждение, которое может развиться в опухоль, и отличающую ее от окружающей нормальной ткани.
Согласно предпочтительному варианту реализации, опухоль экспрессирует РЭА. Согласно другому предпочтительному варианту реализации изобретения, пациент страдает колоректальным раком или раком желудочно-кишечного тракта. При осложнении таких раковых заболеваний пациент может страдать перитонеальным канцероматозом, при котором распространенные метастазы раковой опухоли возникают на выстилке брюшной полости. Согласно конкретному варианту реализации изобретения, флуоресцентный конъюгат, содержащий флуорохромный фрагмент формулы (I) или (II) и нацеливающий фрагмент Т, который представляет собой химерное моноклональное антитело, используется для детекции у пациента опухолевых очагов, экспрессирующих РЭА, или для определения положения опухоли, экспрессирующей РЭА.
Во время хирургической резекции опухолевой ткани различение между опухолевой и нормальной тканью происходит на основе визуальных и тактильных ощущений хирурга. Хирургическая резекция представляет собой полное или частичное удаление хирургическим путем опухолевой ткани, присутствующей в ткани, структуре или органе пациента. Раковая и злокачественная опухолевая ткань часто может присутствовать в виде мелких узелков или очаговых поражений (например, субмиллиметрового диапазона), которые не видны невооруженным глазом. Полная резекция опухоли часто является критичной для прогноза жизни пациента. В связи с этим важно, чтобы хирург мог правильно идентифицировать границы и края ткани злокачественной опухоли, отличить их от здоровой ткани и вырезать указанную опухолевую ткань, а также избежать нецелесообразного удаления или повреждения здоровой ткани или структур во время хирургического удаления опухоли и/или проведения циторедуктивного хирургического лечения у пациента.
Было обнаружено, что флуоресцентный конъюгат, описанный выше, и/или композиция, содержащая указанный конъюгат, применимы, в частности, для детекции опухолевых клеток или опухолевой ткани по краю резекции у пациента, подвергающегося или подвергавшегося резекционному хирургическому лечению опухоли, экспрессирующей опухолевый маркер. Следует понимать, что термин «край резекции» в настоящей заявке относится к краю или границе ткани, окружающей опухолевую ткань. Край ткани, окружающей вырезанную опухоль, в норме должен представлять собой нераковую ткань, которую вырезают наряду с опухолью для гарантии достаточной степени удаления всей злокачественной опухолевой ткани. Однако, как описано выше, границы края и/или границы опухоли по отношению к нормальной ткани может быть сложно определить. Край резекции необязательно также рассматривается как предполагаемый край резекции, который может быть определен или изменен на основе способа применения согласно изобретению.
Способ детекции опухолевых клеток или опухолевой ткани по краю резекции или вблизи края резекции у пациента, подвергающегося или подвергавшегося резекционному хирургическому лечению опухоли, экспрессирующей опухолевый маркер, где указанный опухолевый маркер предпочтительно представляет собой опухолевый антиген, с использованием флуоресцентного конъюгата согласно изобретению или его композиции может применяться для помощи хирургам во время и после хирургической операции, например, циторедуктивной операции, таким образом, чтобы гарантировать полное удаление опухолевой ткани и обеспечить получение «чистых» (или отрицательных) краев, т.е. краев, в которых не выявляется опухолевых клеток. Согласно предпочтительному варианту реализации изобретения, резекционное хирургическое лечение представляет собой резекционное хирургическое лечение опухоли, которая экспрессирует или экспрессирует на повышенном уровне РЭА.
Флуоресцентный конъюгат или композиция согласно изобретению, описанная в любом из предшествующих параграфов, может применяться для детекции опухолевых клеток или опухолевой ткани, например, для детекции опухолевых очагов и/или для определения области (областей) их расположения, а также для их выявления по краю резекции опухоли во время или после резекционной хирургической операции у пациента, где указанный пациент страдает колоректальным раком, раком желудка, раком желчных протоков, раком поджелудочной железы, раком пищевода, раком яичников, раком молочной железы, раком предстательной железы, раком печени или раком легких. Опухолевые клетки или ткань, подлежащие детекции или определению положения, могут представлять собой форму карциномы или саркомы, экспрессирующей РЭА. Предпочтительно, флуоресцентные конъюгаты используются для выявления опухолевых узлов или очаговых поражений, имеющих размер субмиллиметрового диапазона, например, у пациентов, страдающих перитонеальным канцероматозом.
Согласно конкретному варианту реализации применения флуоресцентного конъюгата или композиции согласно изобретению для детекции или для определения положения опухолевой клетки или опухолевой ткани или для выявления краев резекции опухоли во время или после резекционного хирургического лечения, опухоль представляет собой злокачественную опухоль желудочно-кишечного тракта, и флуоресцентный конъюгат содержит флуорохромный фрагмент F формулы (I) или, предпочтительно, формулы (II), соединенный с нацеливающим фрагментом Т, который представляет собой химерное моноклональное антитело, направленное против эпитопа GOLD-2 РЭА, содержащее тяжелые цепи аллотипа Glm3 и легкие цепи аллотипа km3, где каждая тяжелая цепь и каждая легкая цепь содержит по меньшей мере один вариабельный домен IgG1 мыши и по меньшей мере один константный домен человеческого иммуноглобулина. Опухоль желудочно-кишечного тракта может относиться к опухоли, расположенной в любой части желудочно-кишечного тракта, например, в пищеводе, желудке, тонком кишечнике, толстом кишечнике, прямой кишке, а также органах, связанных с пищеварением, такие как поджелудочная железа, печень и желчный пузырь, и может иметь размер в субмиллиметровом диапазоне. В частности, для такого применения предпочтительными являются конъюгаты, в которых указанное химерное моноклональное антитело содержит вариабельный участок легкой цепи последовательности SEQ ID NO: 4 и вариабельный участок тяжелой цепи последовательности SEQ ID NO: 3.
Согласно другому конкретному варианту реализации применения флуоресцентных конъюгатов согласно изобретению для детекции или для определения расположения опухолевой клетки или опухолевой ткани или для выявления краев резекции опухоли во время или после резекционного хирургического лечения, опухоль представляет собой (злокачественную) опухоль молочной железы, и используемый флуоресцентный конъюгат содержит флуорохромный фрагмент F формулы (I) или, предпочтительно, формулы (II), соединенный с нацеливающим фрагментом Т, который представляет собой химерное моноклональное антитело, направленное против эпитопа GOLD-2 РЭА, содержащее тяжелые цепи аллотипа Glm3 и легкие цепи аллотипа km3, где каждая тяжелая цепь и каждая легкая цепь содержит по меньшей мере один вариабельный домен IgG1 мыши и по меньшей мере один константный домен человеческого иммуноглобулина. В частности, для такого применения предпочтительными являются конъюгаты, в которых указанное химерное моноклональное антитело содержит вариабельный участок легкой цепи последовательности SEQ ID NO: 4 и вариабельный участок тяжелой цепи последовательности SEQ ID NO: 3. Опухоль молочной железы при использовании в настоящей заявке может относиться к опухоли, расположенной в любой ткани, связанной с молочной железой или тканью молочной железы, включая ткань желез или протоков, и может также включать регионарные лимфатические узлы, такие как лимфатические узлы, встречающиеся в подмышечных областях. Такие опухоли могут иметь размер в субмиллиметровом диапазоне.
Согласно дополнительному аспекту, применение флуоресцентных конъюгатов или композиций согласно изобретению, например, для детекции очагов опухолей и определения их расположения или для детекции опухолевых клеток или опухолевой ткани по краю резекции у пациента, подвергающегося или подвергавшегося резекционному хирургическому лечению опухоли, включает следующие этапы:
(a) введение конъюгата или композиции пациенту, пораженного опухолью;
(b) инициация резекционного хирургического лечения опухоли у указанного пациента;
(c) освещение ткани в области резекции у пациента, подвергающегося резекционному хирургическому лечению светом имеющим длину волны от примерно 660 до 700 нм,
где этап (b) осуществляют в пределах не более чем примерно 96 часов или 72 часов после этапа (а).
Все варианты применения конъюгата или композиции, описанные в настоящей заявке, могут также альтернативно рассматриваться как способы, в частности, способ диагностики или лечения пациента. Например, применение для детекции у пациента опухолевых очагов, экспрессирующих опухолевый маркер, или для определения положения опухоли, экспрессирующей опухолевый маркер, также можно рассматривать как способ детекции у пациента опухолевых очагов, экспрессирующих опухолевый маркер, или определения положения опухоли, экспрессирующей опухолевый маркер.
Кроме того, все способы диагностического и/или терапевтического применения конъюгата или композиции, описанные в настоящей заявке, могут альтернативно рассматриваться как варианты применения конъюгата или композиции в изготовлении лекарственного средства или диагностического агента (применимого) для конкретных способов диагностического и/или терапевтического применения.
В этапе (а) способа лечения пациентов, страдающих опухолью, флуоресцентные конъюгаты или их композиции можно вводить с помощью способов инъекции или перфузии, известных в данной области техники. В частности, конъюгаты или композиции можно вводить с помощью внутривенной, внутрибрюшинной, подкожной или внутримышечной инъекции или перфузии. Альтернативно, флуоресцентные конъюгаты или их композиции можно вводить путем ингаляции или местным путем. В данном контексте местное введение включает непосредственное нанесение на кожу или на внешнюю или внутреннюю слизистую оболочку. Ингаляция может быть применима для лечения пациентов, страдающих опухолью в дыхательной системе, например, в легком. При введении местным путем флуоресцентные конъюгаты или их композиции предпочтительно вводят в виде спрея.
Конъюгат предпочтительно вводят пациенту в дозе от 0,1 до 50 мг или в дозе от 5 мг до 100 мг. В указанном контексте доза означает количество конъюгата и (при наличии) неконъюгированного антитела, которое вводят, например, до хирургической или диагностической процедуры. Дозу можно необязательно разделять и вводить с интервалами. В случае введения путем инъекции пациенту, страдающему колоректальным раком, раком желудка, раком желчных протоков, раком поджелудочной железы, раком пищевода, раком яичников, раком молочной железы, раком предстательной железы, раком печени или раком легких и проходящему резекционное хирургическое лечение, доза предпочтительно составляет в диапазоне от примерно 0,2 до 15 мг, например, от 0,5 до 10 мг или от 5 до 15 мг. Предпочтительно, вводимая доза составляет по меньшей мере 5 мг. Указанные диапазоны доз, в частности, применимы к конъюгатам и композициям, имеющим предпочтительную степень замещения, как описано выше.
Предпочтительно этап (b) осуществляют в пределах не более чем примерно 96 часов после этапа (а). Согласно другим вариантам реализации изобретения, этап (b) осуществляют в пределах не более чем 72 часов или не более чем 48 часов или не более чем 36 часов или не более чем 24 часов или не более чем 12 часов после завершения этапа (а).
В этапе (с) указанного способа ткань в области резекции у пациента, проходящего резекционное хирургическое лечение, освещается при длине волны в пределах ближней инфракрасной области. Оптические устройства для освещения, используемые в этапе (с), предпочтительно настроены на длину волны возбуждения флуоресцентных конъюгатов, предпочтительно, на длину волны между 660 и 700 нм. Согласно варианту реализации способа, этап (с) осуществляют путем освещения ткани в области резекции у пациента, проходящего резекционное хирургическое лечение, при длине волны возбуждения 680 нм.
Согласно конкретному предпочтительному варианту реализации способа для лечения пациента, страдающего опухолью, указанная опухоль представляет собой злокачественную опухоль желудочно-кишечного тракта, и флуоресцентный конъюгат содержит флуорохромный фрагмент F формулы (I) или, предпочтительно, формулы (II), соединенный с нацеливающим фрагментом Т, который представляет собой химерное моноклональное антитело, направленное против эпитопа GOLD-2 РЭА, содержащее тяжелые цепи аллотипа Glm3 и легкие цепи аллотипа km3, где каждая тяжелая цепь и каждая легкая цепь содержит по меньшей мере один вариабельный домен IgG1 мыши и по меньшей мере один константный домен человеческого иммуноглобулина.
Согласно дополнительному аспекту изобретения, флуоресцентный конъюгат, как описано в любом из указанных выше вариантов реализации, также может содержать или включать радиоактивный изотоп, радиоактивную метку или радиоактивный индикатор. Радиоактивно меченный флуоресцентный конъюгат может, например, быть получен путем прямого радиоактивного мечения конъюгата или путем присоединения радиоактивной метки к нацеливающему фрагменту Т до конъюгирования. Радиоактивно меченные флуоресцентные конъюгаты и их композиции можно использовать в качестве лекарственных средств в способах терапевтического и/или диагностического применения. Согласно одному варианту реализации изобретения, субъект, которому вводят радиоактивно меченный конъюгат или его композицию, представляет собой субъекта, страдающего раком или имеющего риск развития рака.
ПРИМЕРЫ
Пример 1 - Получение химерного моноклонального антитела против РЭА
Конструирование и синтез генов
Приведенные ниже нуклеотидные последовательности (А) и (В), кодирующие нативные мышиные вариабельные домены VH и VL соответственно, получали из антител против РЭА из мышиной гибридомы и синтезировали de novo и клонировали в хозяйских pVVS-тандемных векторах экспрессии. Эти последовательности включают ряд нуклеотидных модификаций (без изменения нативной последовательности белка) для обеспечения оптимизированного клонирования и оптимизированной экспрессии в клетках СНО. Сайты рестрикции KpnI и NheI встраивали соответственно на 5' и 3' конце последовательности, кодирующей домен VH. Сходным образом последовательности двух рестрикционных сайтов SalI и BSiWI встраивали соответственно на 5' и 3' конце последовательности, кодирующей домен VL.
(A) Тяжелая цепь (SEQ ID NO: 1):

(B) Легкая цепь (SEQ ID NO: 2):

Синтез вектора
pVVS-тандемный вектор, который был выбран в качестве хозяйского вектора для генов VH и VL, получали путем последовательных двойных расщеплений с помощью SalI/BsiWI и KpnI/NheI. Указанный вектор экспрессии кодирует последовательности константных доменов IgG1 человека аллотипа Glm3 для тяжелой цепи и IgG1 человека аллотипа Km3. Вектор также содержит следующие функциональные элементы: промотор pCMV (для обоих тяжелой и легкой цепи), химерный интрон между промотором и кодоном инициации трансляции, ориджин репликации pUC, сайт полиаденилирования BGH, полиаденилированный инсулятор HS4 TK, промотор SV40 и гены устойчивости к канамицину/неомицину для селекции клеток в ходе амплификации вектора и после трансфекции. После расщепления полученные каркасные фрагменты вектора восстанавливали путем очистки в геле.
Инсерционные фрагменты, содержащие синтетические генные вставки VH и VL, кодирующие нативные мышиные домены VH и VL, как описано выше, выделяли из соответствующих PVVS-тандемных векторов экспрессии с применением KpnI/NheI и SalI/BsiWI соответственно и восстанавливали путем очистки в геле.
Все восстановленные фрагменты объединяли и лигировали для получения конечного вектора для трансфекции.
Трансфекция/селекция
Клетки СНО, трансфицированные вектором, как описано выше, происходят из клеточной линии СНО (очищенная от белка, идентификационный номер # 00102307, лот 02K/008), полученной из Европейской коллекции клеточных культур (ЕСАСС). Указанная клеточная линия, первоначально полученная в Европейской коллекции клеточных культур животных ЕСАСС в 1985, представляет собой субклон исходной клеточной линии СНО, происходящей из ткани яичников хомячка и первоначально установленной Паком с соавторами (Puck et al., 1958).
Банк, полученный из ампулы ЕСАСС, был назван Bk1998. Клетки адаптировали к росту в отсутствие эмбриональной бычьей сыворотки, затем клонировали путем предельных разведений. Субклон PF 3В9 был выбран на основе ростовых характеристик и способности к трансфекции и банкирован (банк клеток Bk4164). Банк клеток BK4164, используемый для создания клеточного субстрата для продукции антитела, получали из ампулы Bk21146.
Клетки СНО, полученные из субклона 3В9, сначала размораживали в среде ЕХ-CELL® ACF СНО с добавлением 4 мМ L-глутамина и растили при 37°С в атмосфере с 5% СО2 и увлажнением при перемешивании на орбитальном шейкере. Трансфекцию осуществляли через 2 дня после пятого пассажа. Линейность вектора экспрессии, полученного выше, достигали путем расщепления с помощью рестрикционного фермента SWaI. Трансфекцию осуществляли в трех повторностях с помощью метода нуклеофекции (Nucleofection™, Amaxa) с использованием 10 мкг ДНК и клетки инкубировали при 37°С, 5% СО2 без встряхивания в течение 3 дней. После 3-дневного восстановительного периода инициировали селекцию путем добавления генетицина (0,5 г/л). Клетки, подверженные условиям нуклеофекции в отсутствие ДНК, использовали в качестве контроля селекции антибиотиками.
Клонирование путем предельного разведения осуществляли после достижения выживаемости клеток по меньшей мере 80% под селекционным давлением генетицина. Для каждого из 3 трансфекционных пулов сорок 96-луночных планшетов засевали клетками в требуемой плотности 0,5 клеток/лунку. Из указанных пулов было получено 475 клонов, происходящих из одной клетки. Через примерно 18 дней культивирования концентрацию антитела оценивали с помощью ИФА для селекции 150 клонов с наилучшей продукцией для перевода на большие 24-луночные планшеты. При достижении достаточной плотности клетки переносили в 6-луночные планшеты. Дополнительную селекцию осуществляли на основе кинетических параметров культивирования в течение 10 дней и продукции mAb по результатам оценки с помощью FastELISA для перевода во встряхиваемые колбы большего объема. Дополнительная селекция на основе кинетических параметров культивирования с подпиткой и продукции mAb по результатам оценки с помощью ВЭЖХ на основе белка А (перевод в биореакторы на 2 л) приводила к выбору клона-лидера для продукции антитела.
Продукция антител
Клетки из клона-лидера размораживали и переносили в восстанавливающую среду (среда EX-CELL® ACF СНО, 4 мМ L-глутамин). Определяли плотность жизнеспособных клеток и клеточный осадок ресуспендировали в среде после центрифугирования до достижения плотности 2×106 клеток/мл после помещения опухолевых клеток во флакон 75 см2. Клетки растили при 37°С±1°С, 8%±2% СО2при перемешивании на орбитальном шейкере. Со 2 дня культуру переносили во встряхиваемые флаконы увеличивающегося объема в среде EX-CELL® ACF СНО, 4 мМ L-глутамин при 37°С±1°С, 8%±2% СО2 при перемешивании на орбитальном шейкере. Выживаемость, плотность и рост клеток оценивали на каждом пассаже и отсутствие контаминации проверяли путем контроля под микроскопом. На 17 день после 7 пассажей содержимое встряхиваемых флаконов объединяли. Клетки считали и использовали для засева двух биореакторов на 15 л в плотности 0,5×106 жизнеспособных клеток/мл в объеме 7 л. Клетки растили в подпитываемой культуре в среде EX-CELL® ACF СНО, содержавшей 5 мМ L-глутамина и 0,2% плюроника, при 37°С с регулируемым рН и содержанием кислорода в течение 20 дней. Среду BalanCD™ СНО Feed 3, глюкозу и L-глутамин добавляли по необходимости. Плотность и выживаемость клеток и значение рН оценивали ежедневно; кроме того, с 6 дня также отбирали образцы для определения концентрации глюкозы, а с 10 дня - для оценки концентрации антитела (ВЭЖХ с использованием белка А).
На 20 день клеточную суспензию из каждого биореактора очищали путем пропускания через три объемных параллельных фильтра с последующим непосредственным фильтрованием через фильтр с размером пор 0,2 мкм. Очищенный пул клеточного материала собирали и исследовали на содержание антител с помощью ВЭЖХ на основе белка А, на подлинность рекомбинантного белка с помощью Вестерн-блоттинга, на биологическую нагрузку, заражение микоплазмой и спироплазмой. Пул клеточного материала распределяли по флаконам из полиэтилентерефталата на 2 л и хранили при температуре от -70°С до -90°С.
Проводили дополнительную обработку пула клеточного материала следующим образом: очищенный пул клеточного материала размораживали в течение 24 ч при 15-25°С и содержимое разных флаконов объединяли и гомогенизировали путем перемешивания с помощью магнитной мешалки. Объединенный пул клеточного материала сначала очищали на колонке для аффинной хроматографии на основе белка А, уравновешенной с помощью буфера, содержащего 50 мМ фосфат натрия, 300 мМ NaCl, рН 7,0. После отмывки уравновешивающим буфером и затем буфером, содержавшим 25 мМ фосфат натрия, рН 7,0, антитело элюировали с помощью буфера на основе 25 мМ ацетата натрия, рН 3,5. Собирали фракцию, соответствующую пику антитела (на основе поглощения элюента при 280 нм), и элюат антитела хранили при 15-25°С до этапа подведения рН.
рН элюата антитела доводили до значения рН 3,8 с помощью 0,2 М лимонной кислоты и смесь инкубировали в течение 60-65 мин при 15-25°С при перемешивании. После нейтрализации 0,5 М Na2HPO4 с достижением значения рН 6,5 раствор фильтровали на фильтре с размером пор 0,2 мкм, собирали и хранили при 2-8°С.
рН-инактивированный раствор антитела дополнительно очищали с помощью катионообменной хроматографии с применением сульфонатной лиганд-функционализированной смолы. рН раствора доводили до 5,0 с помощью 0,2 М лимонной кислоты и смесь наносили на колонку, предварительно уравновешенную буфером на основе 25 мМ ацетата натрия, рН 5,0. После отмывки уравновешивающим буфером антитело элюировали буфером, содержавшим 25 мМ ацетат натрия, 195,2 мМ NaCl, рН 5,0. Сбор осуществляли на основе поглощения при 280 нм.
Полученный раствор антитела дополнительно очищали с помощью анионообменной хроматографии с применением ионообменных мембран на основе групп четвертичного аммония, уравновешенных в буфере, содержавшем 24 мМ фосфат натрия, 53,4 мМ NaCl, рН 7,0. рН элюата катионообменной хроматографии доводили до значения рН 7,0 с применением 0,5 М Na2HPO4 и разбавляли буфером на основе 25 мМ фосфата натрия, рН 7,0, для достижения конечной проводимости 11 мСм/см. Раствор наносили на мембраны и осуществляли проточный сбор антитела из элюата на основе поглощения при 280 нм. Собранный раствор фильтровали на фильтре с размером пор 0,2 мкм в стерильный одноразовый полиэтилентерефталатный контейнер и хранили при 2-8°С.
Раствор антитела затем концентрировали с помощью ультрафильтрования и подвергали диафильтрованию против буфера на основе 10 мМ раствора Трис-HCl, рН 7,2 с применением мембран с исключением по молекулярной массе (30 кДа). Полученный в результате фильтрования концентрат собирали и хранили при 15-25°С.
Концентрат затем разводили до 1 мг/мл буфером на основе 10 мМ Трис-HCl, рН 7,2, и пропускали через фильтр с размером пор 0,2 мкм с последующим нанофильтрованием с использованием мембраны Planova (15 N), предварительно уравновешенной тем же буфером. Фильтрат хранили при 15-25°С. На конечном этапе полученный очищенный объем раствора антитела фильтровали через фильтр с размером пор 0,2 мкм, распределяли в стерильные флаконы из полиэтилентерефталата и хранили при температуре от -70 до 90°С.
Образцы отбирали для определения концентрации антитела с помощью ВЭЖХ на основе белка А во время каждого из этапов очистки.
Полученный продукт, представляющий собой антитело, характеризовали с помощью способов, известных в данной области техники, таких как СВЭЖХ-УФ-МС. Молекулярная масса антитела составляла 148,6 кДа по результатам масс-спектрометрии на MALDI-TOF.
Пример 2 - Получение флуорохрома формулы (IV)
Ацетанилидное промежуточное соединение (В):

Сульфонированный индоленин А подвергали реакции с 1,4-бутансультоном. Полученное промежуточное соединение подвергали реакции с бета-анилиноакролеином с получением ацетанилидного промежуточного соединения В.
Промежуточное соединение (D):

Промежуточное соединение D получали посредством конденсации Вильямсона с образованием производного карбоксиалкилокси-предшественника индоленина С с последующей кватернизацией с 1,4-бутансультоном. Индоленин С получали путем диазотирования/восстановления аминированного ароматического предшественника с последующим образованием сульфоната, гидроксилированием и циклизацией по Фишеру с кетоном.
Флуорохром формулы (IV):

Соединение В конденсировали с индольным соединением D. Полученное дикарбоцианиновое соединение активировали с помощью N-гидроксисукцинимида (NHS) с получением флуорохрома формулы (IV).
Пример 3 - Конъюгирование флуорохрома с химерным mAb против РЭА
Очищенное антитело из Примера 1 размораживали в течение примерно 24 часов при 15-25°С. Проводили ультрафильтрование/диафильтрование через мембраны с исключением по молекулярной массе (30 кДа) для замены буфера (0,1 М фосфат натрия/карбонат натрия, рН 9.3). Флуорохром (формула (IV) из Примера 2) растворяли в ДМФА при концентрации 2,25 мг/мл путем перемешивания в течение ночи при 15-25°С. К раствору антител (разведенных до конечной концентрации 1 мг/мл 0,1 М буфером на основе фосфата натрия/карбоната натрия, рН 9.3) добавляли ДМФА до достижения конечной концентрации 10% (по объему). Затем к раствору антитела добавляли раствор флуорохрома при скорости потока 20 мл/мин с молярным избытком 4,5. Полученную реакционную смесь инкубировали при перемешивании на орбитальном шейкере при температуре окружающей среды в течение примерно 45 мин.
Проводили второй этап ультрафильтрования/диафильтрования (мембраны с исключением по молекулярной массе, 30 кДа) сначала с помощью раствора PBS-135 мМ L-аргинин с добавлением 10% ДМФА (по объему) с последующим применением рецептурного буфера PBS-135 мМ L-аргинин для удаления ДМФА. Затем концентрат разводили до конечной концентрации 1,0-1,1 мг/мл (по результатам определения с помощью спектрофотометрического анализа) с помощью рецептурного буфера и фильтровали (0,2 мкм).
Полученным раствором флуоресцентного конъюгата заполняли флаконы из полиэтилентерефталата на 0,5 л, очень плотно закрывали полиэтиленовыми крышками, помещали в желтые полиэтиленовые пакеты и хранили при -20°С±5°С.
Молярное отношение флуорохром/антитело определяли с помощью спектрофотометрии. Наблюдаемое среднее отношение конъюгирования составляло 1,5-1,6.
Конъюгирование флуорохрома с антителом можно альтернативно проводить с использованием ДМСО в качестве растворителя для конъюгирования. В результате добавления флуорохрома в молярном избытке, равном 4, к антителу (при концентрации раствора 1 мг/мл) с конечной реакционной концентрацией 10% по объему ДМСО и времени реакции, составляющего между 5 и 120 мин получали конъюгат со средним отношением конъюгирования, составляющим между 1,5 и 1,6, как определено с помощью спектрофотометрии. Не наблюдали значительного различия с точки зрения значений интенсивности испускания флуоресценции, фотообесцвечивания и показателя квантового выхода, полученных для указанных флуоресцентных конъюгатов, приготовленных с использованием ДМСО, по сравнению с конъюгатами, приготовленными с использованием ДМФА при аналогичных концентрациях и условиях.
Пример 4 - Получение лекарственных форм
Буфер, используемый для получения лекарственной формы флуоресцентного конъюгата, полученного в соответствии с Примером 3, можно адаптировать по необходимости для способов и вариантов применения в контексте настоящего изобретения. Например, флуоресцентный конъюгат может быть предпочтительно представлен в буфере, содержащем 10 мМ KH2PO4 (VWR Prolabo), 10 мМ цитрат Na3/лимонную кислоту (Fluka), 300 мМ аргинин-HCl (Sigma), 0,02% (масса/объем), Tween 20 (Merck), где значение рН доведено до 6,0.
Пример 5 - Характеристика конъюгата
Исследования флуоресценции
Гашение, фотообесцвечивание и квантовый выход флуоресценции флуорохрома формулы (IV) и флуоресцентного конъюгата, полученного в соответствии с Примером 3, определяли при длине волны возбуждения 680 нм (производимой оптическим устройством Fluobeam700), подходящей для клинического применения.
Образцы флуорохрома формулы (IV) в ДМФА и образцы флуоресцентного конъюгата Примера 3 в PBS, содержавшем 135 мМ аргинин, получали в различных концентрациях, варьирующих от 0,05 до 500 мкМ.
Максимальную интенсивность флуоресценции и максимальную концентрацию флуорохрома до выявления гашения (т.е. аутоингибирования испускаемой флуоресценции самим флуорохромом в определенной концентрации) определяли с применением флуориметра.
Значения флуоресценции получали путем вычитания значений фоновой флуоресценции буферов. Для флуоресцентного конъюгата максимальная измеренная интенсивность флуоресценции составляла 70 УЕ (условных единиц) с максимальной концентрацией, составляющей 5 мкМ, до наблюдаемое гашения. Для флуорохрома максимальная измеренная интенсивность флуоресценции составляла 120 УЕ с максимальной концентрацией 10 мкМ.
Для образцов в концентрации 5 мкМ рассчитывали квантовый выход как показатель эффективности превращения поглощенного света в испускаемый при клинической длине волны 680 нм. Для неконъюгированного флуорохрома формулы (IV) измеренный квантовый выход составлял 0,26, тогда как для конъюгированного флуорохрома наблюдаемый квантовый выход составлял 0,15 и достигал снижения только на 43%.
В рамках клинического применения, в частности, во время резекционного хирургического лечения опухолей, флуорохром флуоресцентного конъюгата должен поддерживать стабильную и подходящую интенсивность флуоресценции в течение максимального возможного периода времени.
Фотообесцвечивание, или потерю флуоресцентной активности, также оценивали при клинической длине волны возбуждения 680 нм для образцов флуорохрома и конъюгата, а также коммерчески доступного карбоцианинового флуорохрома, Alexa Fluor® 680, который представляет собой краситель, испускающий в дальнем красном диапазоне, с максимальной длиной волны поглощения и длиной волны испускания, сходными с длиной волны поглощения и испускания флуорохрома формулы (IV) (максимальное поглощение при 679 нм и максимальное испускание при 702 нм). Фотообесцвечивание также оценивали для конъюгата, полученного по аналогии со способом конъюгирования, описанным в Примере 3, химерного mAb против РЭА из Примера 1 и Alexa Fluor® 680 (полученное среднее значение отношения флуорохрома к антителу составляло примерно 1.46). Образцы указанных конъюгатов готовили в 1×PBS.
Получали образцы в концентрации 5 мкМ и подвергали воздействию света при 680 нм. Интенсивность испускаемой флуоресценции измеряли при экспозиции на свету с интервалами в 0 ч, 30 мин и 1, 1,5 и 2 ч.

Через 30 минут непрерывной экспозиции при клинически релевантной длине волны 680 нм флуоресценция флуоресцентного конъюгата составляла около 70%, тогда как испускаемая флуоресценция коммерческого красителя, конъюгированного с тем же антителом, составляла только примерно 9%. Через 1 час интенсивность флуоресценции коммерческого красителя, а также его конъюгата практически исчезала, тогда как флуоресцентная активность флуоресцентного конъюгата и неконъюгированного флуорохрома все еще сохранялась.
Тканевая кросс-реактивность
Исследование тканевой кросс-реактивности флуоресцентного конъюгата, полученного, как описано в Примере 3, с применением меченного биотином конъюгата осуществляли на панели из 42 образцов замороженных тканей человека и мазков крови от трех независимых субъектов с применением стандартных иммуногистохимических методов. Было обнаружено, что специфическое окрашивание с помощью конъюгата антитела ограничивалось пищеварительным трактом и эпителиальными компонентами некоторых других тканей (в первую очередь на апикальной границе клеток или со стороны просвета), которые, как описано в литературе, экспрессирует РЭА, что подтверждает только мишень-специфичное связывание антител.
Аффинность в отношении антигена
Также определяли аффинность флуоресцентного конъюгата, полученного в Примере 3, в отношении раково-эмбрионального антигена-мишени с помощью поверхностного плазмонного резонанса (SPR) на устройстве BIACORE 3000. Раково-эмбриональный антиген присоединяли к матрице СМ5 через тиоловые группы (Surface Tiol Coupling GE healthcare; Instruction 22-0618-10AB). Скорость проточной ассоциации и диссоциации измеряли для 6 различных концентраций (от 50 нМ до 1,5 нМ) химерного моноклонального антитела согласно Примеру 1, моноклонального антитела m511 (исходное мышиное антитело, на основе которого получены вариабельные участки химерного моноклонального антитела согласно Примеру 1) и флуоресцентного конъюгата. Получение данных и расчет параметров проводили с использованием программного обеспечения Bia и программ оценки Bia. Аффинность химерного моноклонального антитела из Примера 1 в отношении РЭА (3,27×10-11 нМ) оставалась очень близкой к аффинности исходного мышиного антитела 511 (3,82×10-11 нМ) и не изменялась после его мечения флуорохромным красителем с испусканием в ближнем инфракрасном спектре (измеренное KD флуоресцентного конъюгата Примера 3 оставляло 3,21×10-11 нМ).
Пример 6 - Исследования in vivo
Эффективность флуоресцентного конъюгата согласно Примеру 3 оценивали in vivo на четырех различных мышиных моделях, экспрессирующих РЭА человека.
Тканевое распределение флуоресцентного конъюгата оценивали на основе измерения радиоактивности с применением однофотонного эмиссионного компьютерного томографа (SPECT) на мышиной модели перитонеального канцероматоза LS-174T, которую устанавливали в соответствии с общепринятыми протоколами. Бестимусным мышам NMRI с иммуносупрессией трансплантировали клетки LS-174T путем внутрибрюшинной инъекции клеток LS-174T, экспресирующих РЭА на повышенном уровне. Через 10 дней мышам вводили внутривенно 30 и 50 мкг125I-радиоактивно меченного флуоресцентного конъюгата (который получали путем инкубации флуоресцентного конъюгата с реагентами для радиоактивного мечения йодированием). Визуализирующее исследование мышей через 48 часов после лечения 50 мкг конъюгата (проводили с использованием камеры Nano-SPECT-CT, Bioscan®) выявило, что радиоактивность по существу ограничивалась опухолевыми узлами, присутствующими в брюшной полости мышей. Указанный результат соответствовал результатам измерения биораспределения радиоактивности в различных органах, полученных после умерщвления животных.
Исследования по визуализацию флуоресценции in vivo также проводили с помощью инъекции не меченного радиоактивно флуоресцентного конъюгата бестимусным мышам NMRI с иммуносупрессией, страдающим перитонеальным канцероматозом после внутрибрюшинных инъекций опухолевых клеток LS-174T человека, экспрессирующих РЭА на повышенном уровне. Через 12 дней развития канцероматоза животным вводили внутривенно 20 или 30 мкг флуоресцентного конъюгата. Через 48 часов животных умерщвляли и флуоресценцию визуализировали с применением оптимального зонда с длинами волн возбуждения и испускания 680 нм и 700 нм соответственно. При обеих дозах распределение флуоресценции было четко ограничено опухолями брюшной полости и обеспечивало отчетливую визуализацию микроузелков в брюшной полости, включая область поджелудочной железы (Фигура 1, колонка А, опухоли in situ визуализировали при 700 нм). Узелки размером менее 1 мм и весом менее 1 мг (0,2-1,7 мг) поддавались идентификации и флуоресцировали (Фигура 1, в колонке В показаны отдельные вырезанные опухоли от животных, показанных в колонке А, визуализированные при 700 нм). Инъекция флуоресцентного конъюгата здоровым животным и нерелевантного флуоресцентного конъюгата (с антителом РХ, т.е. моноклональным антителом IgG1, очищенным из мышиной миеломы МОРС21 (ссылка:

Примечательно, что флуоресцентный конъюгат позволял визуализировать опухолевые узлы, экспрессирующие РЭА на повышенном уровне, независимо от расположения указанных опухолевых узлов, что, таким образом, имитирует клинические состояния.
Использовали модель на основе мышиной модели ортотопического рака толстой и прямой кишки человека, экспрессирующего человеческий РЭА (Tseng et al, Vis. Exp. 2007 (10) 484). Клетки HT29, экспрессирующие РЭА на повышенном уровне, инъецировали подкожно в 4 участка на спине шестинедельным самкам мышей CD1-FOxnlnu с иммуносупрессией для индукции развития подкожной опухоли толстой кишки человека. Маленькие фрагменты опухоли (примерно 3 мм в диаметре) затем удаляли и трансплантировали в стенку слепой кишки животных для инициации развития ортотопических опухолей. Стенку слепой кишки слабо повреждали для стимуляции иммунной реакции и для облегчения инфильтрации опухолевых клеток. После развития указанных опухолей животном вводили внутривенно 30 мкг флуоресцентного конъюгата согласно изобретению (или флуоресцентного конъюгата с нерелевантным антителом РХ в качестве контроля). Флуоресцентный сигнал в ближнем инфракрасном диапазоне (700 нм) измеряли через 0, 4, 24 и 48 часов после инъекции с использованием системы визуализации PEARL (Li-Cor Biosciences) для подкожных опухолей или интраоперационной системы визуализации FLARE (Curadel) для ортотопических опухолей.
В результате наблюдалась очевидная интраоперационная иммунофотодетекция как подкожных, так и ортотопических опухолей при длине волны 700 нм (Фигура 2А и 2В соответственно). Уровень флуоресценции подкожных опухолей был настолько высок, что флуоресценция была видна через кожу животных (Фигура 2А. Ряд А) через 48 часов после инъекции антител.
Также при использовании флуоресцентного конъюгата согласно изобретению наблюдали печеночные метастазы опухолей человека, экспрессирующие РЭА на повышенном уровне. Клетки LS-174T или клетки аденокарциномы толстой кишки LoVo человека инъецировали в селезенку бестимусным мышам Balb/c с иммуносупрессией, как описано в публикациях протоколов (ссылка: Tibbetts et al, Cancer 1993, (71), 315-21). Оба типа клеток экспрессируют РЭА на повышенном уровне и вызывают развитие печеночных метастазов, но с разными паттернами их возникновения. Клетки LoVo вызывают распространение множества мелких метастазов по поверхности печени, тогда как клетки LS-174T вызывают образование только нескольких более крупных метастазов. Субъектам, представляющим собой мышей, водили 30 мкг флуоресцентного конъюгата за 48 ч до визуализации флуоресценции при 700 нм. В качестве контроля мышам инъецировали нерелевантный конъюгат на основе РХ-антитела. Было обнаружено, что опухолевые узелки очень маленького размера, например, микрометастазы на поверхности печени, которые не поддавались выявлению, т.е. были невидимы невооруженным глазом, можно было выявить в режиме флуоресценции у мышей, которым вводили флуоресцентный конъюгат, который определял при этом контур указанных опухолей. Более того, было установлено, что визуализация метастазов печени обеспечивается независимо от клеточной линии опухолевой модели. При использовании контролей опухоли не выявлялись.
Подобное исследование проводили на модели опухолей поджелудочной железы. В исследовании использовали шестинедельных бестимусных самок мышей CD1-Foxnlnu с иммуносупрессией, которым проводили анестезию изофураном во время инокуляции опухоли и процедур визуализации. Ортотопические опухоли поджелудочной железы получали, как описано в источнике Kim et al, Nat. Protoc., 2009, 4, 1670-80. Селезенку и поджелудочную железу животных латерально выводили наружу через боковой разрез для полноразмерной проекции поджелудочной железы. Хирургическую тонкую иглу, через которую инъецировали 500000 клеток ВХРС-3-luc2 (трансфицированная люциферазой клеточная линия), вводили в поджелудочную железу параллельно сосудистой сети. За ростом ортотопических опухолей наблюдали еженедельно с помощью биолюминесцентной визуализации (BLI), которую проводили путем внутрибрюшинной инъекции раствора D-люциферина (SynChem, Inc) в PBS в концентрации 150 мг/кг в общем объеме 50 мкл за 10 мин до визуализации с помощью системы IVIS Spectrum (Perkin Elmer Life Sciences). Когда ортотопические опухоли начинали выявляться с помощью BLI, животным инъецировали внутривенно 30 мкг флуоресцентного конъюгата через хвостовую вену. Животных умерщвляли через 48 часов после инъекции и исследовали в ближнем инфракрасном диапазоне при 700 нм. Наблюдали четкую визуализацию опухолей ортотопического рака поджелудочной железы. Визуализация не наблюдалась у контрольных мышей, которым инъецировали неспецифичный конъюгат или только флуорохромный краситель.
Отношение сигнала к фоновому уровню рассчитывали на основе флуоресцентных сигналов NIR, измеренных с использованием системы визуализации для мелких животных Pearl Impulse (LI-COR). Изображения нормировали и интересующие области выбирали для анализа. Среднее значение специфического для опухоли сигнала делили на среднее значение сигнала от окружающей ткани с получением средних отношений сигнал/шум. Двусторонний дисперсионный анализ повторных измерений с использованием поправки Бонферрони использовали для оценки значимости отношений сигнал/фоновый уровень для различных групп во все точки времени. В отличие от красителя, содержащего только флуорохром, или нерелевантного контрольного конъюгата, для которых значения отношения сигнал/фоновый уровень было близко к 1, отношение сигнал/фоновый уровень для флуоресцентного конъюгата составляло более 3.
Иммуногистохимический анализ вырезанных подкожных опухолей ВХРС-3 с окраской гематоксилин-эозином подтвердил, что флуоресцентный конъюгат был связан с опухолью в отличие от контролей, которые проявлялись только в виде неспецифического окрашивания вокруг опухолевых клеток.
Таким образом, было обнаружено, что флуоресцентный конъюгат, такой как конъюгат, полученный в соответствии с Примером 3, обеспечивал идентификацию in vivo опухолевых узлов, экспрессирующих РЭА на повышенном уровне, независимо от расположения опухолей и органа происхождения опухоли (т.е. колоректальный рак или рак поджелудочной железы), подтверждая направленность флуоресцентного конъюгата. Наблюдалось высокое отношение сигнала к шуму, что обеспечивало детекцию очень маленьких узелков, невидимых невооруженным глазом.
Фармакологические исследования для оценки безопасности и токсичности флуоресцентного конъюгата при внутривенном введении также показали отсутствие значительных нежелательных явлений как со стороны центральной и периферической нервной системы у крыс Wistar, так и со стороны функций сердечно-сосудистой и дыхательной системы у собак Beagle и хорошую переносимость конъюгата в дозах вплоть до максимальных исследуемых величин до 40 мг/кг в день у крыс (85-кратная предполагаемая клиническая доза) и 5 мг/кг у собак (10-кратная предполагаемая клиническая доза).
Пример 7 - Клинические исследования
(a) Перитонеальный канцероматоз - Клиническое исследование для оценки безопасности и эффективности конъюгата согласно Примеру 3 у 15 пациентов, представляющих собой людей, страдающих перитонеальным канцероматозом (метастатическими опухолями) желудочно-кишечного происхождения.
Флуоресцентный конъюгат из Примера 3 вводили путем внутривенной инъекции в дозах в диапазоне от 5 до 15 мг. Предварительные результаты показали отсутствие нежелательных реакций при использовании любой их указанных доз.
(b) Колоректальный рак и рак поджелудочной железы - Клиническое исследование для оценки безопасности и эффективности флуоресцентного конъюгата антитела из Примера 3 у 30 пациентов, представляющих собой людей, страдающих раком прямой кишки или поджелудочной железы.
Проводили исследование с применением флуоресцентного конъюгата в дозе 5 мг, которую вводили внутривенно за 48 часов до хирургического лечения. У пациентов, исследованных на сегодняшний день, не было отмечено нежелательных эффектов во время или непосредственно после введения дозы. В целом, не наблюдали клинически значимых изменений в основных показателях жизнедеятельности по сравнению с исходными значениями.
Предварительные результаты указывают на очень четкую локализацию флуоресценции в предполагаемых участках расположения опухоли. Визуализацию во время операции осуществляли с применением системы Artemis Open Imaging (Quest Medical Imaging) с установленными настройками, подходящими для оценки флуоресцентного конъюгата.
У одного пациента, страдающего раком поджелудочной железы, применение флуоресцентного конъюгата привело к идентификации опухолевых клеток, расположенных в области, которая при обычных условиях выявления на основе только визуального наблюдения и пальпации считалась бы не содержащим опухолевых клеток краем резекции вокруг первичной опухоли, расположенной в теле поджелудочной железы, т.е. приводила бы к сохранению опухолевой ткани (Фигура 3 - предполагаемый край резекции, определенный на основе только визуального наблюдения и пальпации, обозначенный пунктирной линией, располагался бы слишком близко к опухолевой ткани, размер которой обозначен точечной линией. Предполагаемый край резекции, определенный по флуоресценции, обозначен сплошными линиями). Из-за наличия множества метастазов в брюшной полости проводили только исследование и определение стадии, т.е. только метастазы вырезали для биопсии и дополнительного анализа в операционной непосредственно после получения. Флуоресцентный конъюгат обеспечивал четкое определение границ очагов, а также краев метастазов как in vivo, так и ex vivo в вырезанной опухоли после резекции (Фигура 3, ряд А: изображение метастаза in vivo в проходящем свете и в режиме флуоресценции (наложение изображений); Фигура 3, ряд В: изображение вырезанного метастаза ex vivo в проходящем свете и в режиме флуоресценции (наложение изображений)).
Сходные результаты наблюдались у другого пациента, страдающего раком поджелудочной железы, после введения флуоресцентного конъюгата. Наблюдали флуоресценцию, явно четко очерчивающую предполагаемую опухоль, которая была расположена около головки поджелудочной железы.
Пациенту с диагностированным метастазированием колоректального рака вводили флуоресцентный конъюгат в дозе 5 мг за 48 часов до резекции опухоли. Доза хорошо переносилась без наблюдаемых нежелательных явлений. Отчетливый флуоресцентный сигнал, повторяющий контуры метастаза, выявляли в лимфатических узлах левой околоподвздошной области, в которой предполагалось наличие метастаза. Была проведена успешная резекция.
Пациенту, страдающему местнораспространенной карциномой прямой кишки, также вводили флуоресцентный конъюгат в дозе 5 мг. Доза хорошо переносилась без выявленных нежелательных явлений. Проводили лапароскопическую низкую переднюю резекцию прямой кишки. Вырезанную ткань прямой кишки подвергали визуализации в операционной непосредственно после ее получения. В вырезанной ткани наблюдали четкое повторение контуров опухолевой ткани.
Реферат
Группа изобретений относится к области биомедицинских исследований, в частности к соединениям, которые можно применять для диагностики опухолей. Предложен флуоресцентный конъюгат, содержащий флуорохромный фрагмент F, соединенный c нацеливающим фрагментом T, где фрагмент F имеет формулу (I):Нацеливающий фрагмент Т обладает аффинностью в отношении опухолевого маркера. Также предложены применения конъюгата для диагностики опухолей in vitro или in vivo, включая фотодетекцию опухолевых узлов во время резекционного хирургического лечения. 6 н. и 18 з.п. ф-лы, 4 ил., 1 табл., 7 пр.
Формула





Комментарии