Конъюгаты rgd-(бактерио)хлорофилл для фотодинамической терапии и визуализации некротических опухолей - RU2518296C2
Код документа: RU2518296C2
Чертежи









































































Описание
Область техники
Настоящее изобретение создано в области онкологии и относится к обнаружению некротических доменов опухолей путем нацеленной на опухоль фотодинамической визуализации и к лечению указанных опухолей нацеленной на опухоль фотодинамической терапией с использованием фотосенсибилизаторов, в частности, конъюгатов производных хлорофилла и бактериохлорофилла с пептидами, содержащими мотив RGD, или с пептидомиметиками RGD.
Определения и сокращения
Bchl a: бактериохлорофилл a: пентациклический 7,8,17,18-тетрагидропорфирин с 5-м изоциклическим кольцом, центральным атомом Mg, пентильной или геранилгеранильной группой в положении 17, группой COOCH3 в положении 13, атомом H в положении 13, метильными группами в положениях 2, 7, 12, 18, ацетильной группой в положении 3 и этильной группой в положении 8, в настоящем документе соединение 1; Bphe: бактериофеофитин a (Bchl, в котором центральный Mg заменен двумя атомами H); Bpheid: бактериофеофорбид a (C-172-свободная карбоновая кислота, образованная из Bphe без центрального атома металла); Chl: хлорофилл; родобактериохлорин: тетрациклический 7,8,17,18-тетрагидропорфирин, имеющий группу -CH2CH2COOH в положении 17, -COOH в положении 13, метильные группы в положениях 2, 7, 12, 8, и этильные группы в положениях 3 и 8; Pd-Bpheid: Pd-бактериофеофорбид a; EC: эндотелиальные клетки; ECM: внеклеточный матрикс; NIR: ближняя инфракрасная область; PDT: фотодинамическая терапия; RGD-4C: циклический нонапептид CDCRGDCFC-NH2; ROS: активные формы кислорода.
На протяжении описания для производных бактериохлорофилла используют нумерацию IUPAC. При использовании этой номенклатуры природные бактериохлорофиллы несут два сложных эфира карбоновых кислот в положениях 132 и 172, однако они этерифицированы в положениях 133 и 173.
Уровень техники
Некроз и гипоксия первичных и метастатических опухолей высоко связаны с агрессивностью опухоли и с плохим прогнозом у больных злокачественными опухолями. Солидные опухоли, которые достигают определенного размера, опережают снабжение кислородом и становятся гипоксическими, и, в конечном итоге, некротическими. В областях опухолей, расположенных на расстоянии более 70 мкм от питающего кровеносного сосуда, давление кислорода в интерстиции снижается и на расстоянии более 150-180 мкм клетки становятся практически аноксическими (Vaupel et al. 2001). Полагают, что некроз является результатом хронической ишемии, которую вызывает сосудистый коллапс и быстрый рост опухолевых клеток, превышающий скорость ангиогенеза (Leek et al. 1999).
Некротические области в солидных опухолях претерпевают морфологические модификации. Сначала первоначальная структура в целом сохраняется, и некротические клетки сохраняют общую форму, но становятся более высоко эозинофильными. Через некоторое время эта картина изменяется на разжижающий некроз, при котором клеточные структуры разрушаются (Leek et al. 1999).
Как некроз, так и гипоксия являются общеизвестными индикаторами плохого прогноза. Для переходно-клеточной карциномы верхних мочевыводящих путей, злокачественной мезотелиомы и почечноклеточного рака (RCC) некроз был предложен в качестве независимого прогностического фактора исхода злокачественной опухоли и в качестве очень мощного инструмента для прогностических целей (Edwards et al. 2003; Sengupta et al. 2005; Lee et al. 2007).
При инвазивной карциноме молочной железы некроз был связан с высокой плотностью сосудов и ангиогенезом, высокими уровнями очаговой инфильтрации макрофагов и сниженной выживаемостью пациентов (Kato et al. 1997; Lee et al. 1997; Leek et al. 1999; Tomes et al. 2003). Центральный некроз, который является частым признаком рака молочной железы, связывали с плохим исходом и агрессивным поведением опухоли. Было показано, что макрофаги привлекаются в некротические опухоли хемотактическими факторами, высвобождаемыми гипоксическими или погибающими опухолевыми клетками (Leek et al. 1999). Большие некротические области в просвете протоков наблюдали в угревидной (инвазивной) карциноме протоков in situ (DCIS) в противоположность не угревидной (неинвазивной) DCIS (Cutuli et al. 2002). Некроз и гипоксия в центре очагов повреждения DCIS с диаметром вплоть до 360 мкм показали значительные биологические отличия в природе и поведении неопластических клеток. Таким образом, было обнаружено, что присутствие или отсутствие некроза в протоках является надежным критерием для классификации DCIS (Bussolati et al. 2000).
Было показано, что некроз в большинстве из этих типов опухолей связан с гипоксией (Tomes et al. 2003). Гипоксия и аноксия подвергают опухолевые клетки окислительному стрессу. Было показано, что длительные гипоксические условия повышают частоту мутаций, ускоряют прогрессирование опухоли, усиливают ангиогенез и метастатический потенциал и активируют запускающие рост каскады передачи сигнала. Адаптация к окислительному стрессу часто делает опухолевые клетки устойчивыми к определенным терапевтическим воздействиям (Brown et al., 2001).
Связь между некрозом и гипоксией твердо установлена, однако могут существовать гипоксические состояния, которые не достигают некроза, или некроз, который не обязательно отражает острую или тяжелую гипоксию (Dewhirst 1998). Существует несколько маркерных генов гипоксии, среди них: ген индуцируемого гипоксией фактора 1 (HIF1), переносчика глюкозы 1 и карбоангидразы IX. Только детекция всех трех маркеров позволяет классификацию некроза (Tomes et al. 2003), что делает идентификацию области в качестве некротической по экспрессии генов довольно сложной.
Известно, что некротические и гипоксические состояния создают существенную проблему при терапии злокачественной опухоли. Гипоксические домены опухоли являются относительно устойчивыми к лучевой терапии, поскольку активация лучевой атаки является слабой и поскольку стволовые клетки, которые возможно могут присутствовать в объеме опухоли, не отвечают на лечение хорошо, что приводит к повторному росту опухоли (Brown et al., 1998; Dean et al., 2005). Поскольку большинство химиотерапевтических реагентов обеспечивают гибель клеток вследствие взаимодействий с проходящими жизненный цикл клетками, арест клеток вследствие гипоксии приводит к устойчивости к общепринятой химиотерапии, оставляя непролиферирующие или медленно пролиферирующие клетки неповрежденными (Tannock, 1978). Более того, гипоксические состояния обычно создают кислую среду, которая может изменить свойства лекарственного средства, делая его менее активным (Tannock et al., 1989).
Один из наиболее проблематичных аспектов химиотерапии солидных опухолей связан с доставкой лекарственных средств в опухоли и особенно в гипоксические и некротические домены. Обычно опухоли содержат нерегулярные и пропускающие микрососуды с гетерогенным кровотоком и большими межсосудистыми расстояниями. Эти признаки, в дополнение к отсутствию надлежащего лимфатического дренажа и высокому давлению в интерстиции, делают диффузию наиболее важным механизмом внесосудистого транспорта питательных веществ и лекарственных средств в опухоли. Однако вследствие нерегулярной васкуляризации, многие из опухолевых клеток находятся на больших расстояниях от капилляров, чем клетки в нормальных тканях, что приводит к наличию недостаточных концентраций противоопухолевых средств в этих клеточных областях. Более того, усиленное давление интерстициальной жидкости вследствие недостаточности лимфатического дренажа приводит к конвекционному поглощению и далее ингибирует распределение лекарственных средств, в частности, макромолекул, в опухолевые клетки (Minchinton et al, 2006).
Таким образом, способность выявлять гипоксические и некротические области в опухолях in vivo является крайне важной. Знание о гипоксических опухолевых доменах может помочь в выборе правильного лечения, либо путем повышения доставки кислорода до или в процессе лечения, либо с использованием стратегий, в которых используется гипоксия (Weinmann et al., 2004). С использованием этого подхода применение активированных гипоксией цитотоксинов, таких как 2-циклопропилиндолхиноны, AQ4N, тирапазамин (TPZ) и PR-104 может помочь улучшить исход лечения (Brown et al., 2004; Lee et al., 2007; Patterson et al. 2007).
Для идентификации некроза и гипоксии обычно используют гистопатологию и иммуногистохимию; однако эти методы являются инвазивными и не обеспечивают возможность детекции in situ. Способы in situ включают магнитно-резонансную томографию (MRI) (Kamel et al. 2003; Metz et al. 2003), зависимую от уровня оксигенации крови MRI (Kennan et al. 1997), позитронную эмиссионную томографию (PET) (Lehtio et al. 2004) и диффузионно-взвешенную MRI (Lang et al. 1998).
Авидные к некрозу контрастные средства (NACA) для MRI можно подразделить на основанные на порфирине и основанные не на порфирине средства. Одним из наиболее известных основанных на порфирине NACA является гадофрин-2, который демонстрирует специфичное к некрозу накопление по краям некротической области. Было предположено, что механизм накопления основан на транспорте сывороточного альбумина (SA), однако недавние исследования подвергли этот подход сомнению (Hofmann et al. 1999; Ni et al. 2005).
Большинство злокачественных клеток не могут расти до поддающихся клинической детекции опухолевых масс в отсутствие кровеносных сосудов. Поэтому опухоли, достигающие определенного размера (приблизительно 2-3 мм3) для поддержания их роста должны переключаться на ангиогенный фенотип. Переключение на ангиогенный фенотип может выражаться в несбалансированной экспрессии ангиогенных факторов и ингибиторов ангиогенеза. Для индукции роста новых кровеносных сосудов необходимы и достаточны как сверхэкспрессия ангиогенных факторов, так и подавление ингибиторов ангиогенеза, и для переключения на ангиогенез опухоли эти два процесса обычно протекают одновременно (Cao 2005).
Биохимические признаки, которые указывают на кровеносные сосуды в опухолях, могут включать связанные с ангиогенезом молекулы, такие как некоторые интегрины. Интегриновое семейство рецепторов адгезии клеток включает различные 24 αβ гетеродимеры, которые распознают гликопротеиновые лиганды во внеклеточном матриксе и на поверхностях клеток. Многие представители семейства интегринов, включая α5β1, α8β1, αIIbβ3, αVβ3, αVβ5, αVβ6 и αVβ8, распознают мотив Arg-Gly-Asp (RGD) на их лигандах. Эти лиганды включают фибронектин, фибриноген, витронектин, фактор фон-Виллебранда и многие другие крупные гликопротеины (Takagi 2004). Таким образом, было предположено, что молекулы, содержащие мотив RGD, обеспечивают новые возможности для селективного захвата и последующей визуализации и детекции первичных очагов повреждения опухоли, некротических областей и нацеленных лекарственных средств. Эта область исследования привлекает возрастающее внимание. Существует множество данных об использовании RGD-меченных соединений для визуализации (Temming et al. 2005). Основным недостатком, описанным в литературе, является недостаточная концентрация репортерного элемента в области опухолей менее 4-5 мм. Поэтому применение RGD-нацеленной визуализации, главным образом, ограничено сканированием PET, которое является более чувствительным способом.
Понимание механизма роста опухоли, образования метастазов и взаимодействия опухоль-хозяин и ангиогенеза требует моделей опухолей, которые позволяют легко отслеживать опухолевые клетки, даже на их индивидуальном уровне. Предшествующие способы, используемые для прямого измерения наиболее значимых биологических параметров опухолей, доступны только посредством инвазивных конечных процедур (Lyons 2005). Большинство таких способов включает гистопатологическое исследование или иммуногистохимию, которые являются медленными, инвазивными и не всегда чувствительными подходами (Yang et al. 2000). Таким образом, необходимо внедрение новых способов, которые обеспечивают прямую визуализацию опухолевых тканей, являются неинвазивными и обеспечивают измерение связанных с опухолью параметров как на клеточном, так и на молекулярном уровне.
За последние несколько лет были разработаны неинвазивные способы: MRI и спектроскопия, PET, однофотонная эмиссионная компьютерная томография и компьютерная томография (Lyons 2005).
Существует несколько способов визуализации, которые основаны на трансгенах. Эти способы обеспечивают неинвазивное измерение широкого диапазона биологических параметров с превосходной специфичностью к опухоли, визуализацию всего организма в моделях на живых животных и детекцию метастазов. Двумя из этих способов являются: биолюминесцентная визуализация и флуоресцентная визуализация.
Оптическая биолюминесценция основана на трех компонентах: фермент люцифераза, субстрат люциферин и аденозинтрифосфат (ATP). В этом способе для получения эмиссии света не требуется светового возбуждения. Однако если один из этих компонентов отсутствует, детекция невозможна. Способ обеспечивает мониторинг жизнеспособности клеток или функции клеток с высокой эффективностью вследствие высокого значения сигнал/шум (Lyons 2005). Основным недостатком способа с люциферазой/люциферином является низкое анатомическое разрешение и четкость изображения, таким образом, требуя значительного количества времени для того, чтобы собрать достаточное количество фотонов для формирования изображения от животного под анестезией. Более того, повышенная глубина тканей и необходимость в экзогенной доставке вещества ослабляют эмиссию света in vivo (Yang et al., 2000; Lyons, 2005). Кроме того, эксперименты ex vivo трудно проводить, поскольку для активности фермента требуется ATP. Важно, что способ вовлекает субъективный выбор параметров, который снижает его количественную ценность.
Другой способ мониторинга прогрессии опухоли путем оптической флуоресцентной визуализации основан на трансфекции опухолевых клеток стабильным флуоресцентным белком, таким как зеленый флуоресцентный белок (GFP) и красный флуоресцентный белок (RFP). В этом способе имеется необходимость во внешнем возбуждении перед тем, как можно проводить детекцию эмиссии. Основными недостатками этого способа являются следующие: (1) возбуждающий и эмиссионный свет имеет тенденцию к ослаблению при увеличении глубины ткани и (2) аутофлуоресценция немеченых клеток повышает шум (Lyons, 2005). Основные преимущества включают: множество репортерных длин волн, обеспечивающих мультиплексную визуализацию; высокая совместимость с рядом подходов ex vivo для аналитических способов, таких как анализ свежей ткани; отсутствие необходимости в подготовительных процедурах для визуализации, что делает этот способ особенно пригодным для визуализации в живой ткани; способ является внешним и неинвазивным; способ обеспечивает флуоресцентную оптическую визуализацию в реальном времени внутренних растущих опухолей и метастазов у животных после их трансплантации, которая может дать изображение всего организма, а также изображение отдельных клеток, извлеченных из первичного очага повреждения или метастазов (Yang et al., 2000; Lyons, 2005). Визуализация всего организма является одним из наиболее требуемых инструментов для понимания развития опухоли. Таким образом, путем генетического мечения опухолевых клеток посредством GFP или RPP, можно достигать наружной визуализации первичных и метастатических опухолей по всему организму (Yang et al. 2000).
Флуоресцентное мечение подходит для детекции in vivo, свежей ткани и in vitro. Использование опухолевых клеток, экспрессирующих флуоресцентные белки, обеспечивает визуализацию живых животных и наблюдение за прогрессией опухоли в различные моменты времени. RPP имеет испускание с большей длиной волны, чем GFP, таким образом, обеспечивая более высокую чувствительность и разрешение в отношении роста микроскопических опухолей (длина волны возбуждения GFP - 489 нм, длина волны испускания - 508 нм, длина волны возбуждения RFP - 558 нм, длина волны испускания - 583 нм).
Карцинома протоков in situ (DCIS) включает клональную пролиферацию клеток, которые являются злокачественными и накапливаются в просвете протоков молочной железы без признаков инвазии в соседнюю строму молочной железы и за пределы эпителиальной базальной мембраны. Существует большая вероятность трансформации ненвазивных очагов DCIS в инвазивное, угрожающее жизни заболевание, если их не лечить на ранней стадии. После широкого распространения маммографии значительно выросло число пациентов, у которых диагностируют DCIS на ранней стадии, и рекомендованный способ лечения продвинулся от мастэктомии (с уровнем излечения, близким к 100%) до хирургической операции (BCS) с сохранением молочной железы (BC), например, удаления опухоли молочной железы или минимально инвазивной хирургической операции на молочной железе (Kepple et al., 2004), необязательно в сопровождении RT и адъювантной эндокринной терапии. Однако недавно было выявлено, что частоты рецидивов после BCS, как ипсилатерально (та же молочная железа), так и контрлатерально (другая молочная железа), даже в сопровождении RT, являются значительно более высокими, чем после мастэктомии, в частности, для пациентов в возрасте ≤40 (уровень регрессии 25-35%; Bijker N et al., 2006; Cutuli et al., 2002). Более того, многоочаговое поражение приводит к затруднению неполного иссечения, так же как и постоянное вовлечение краев, которое, как было выявлено, является критическим для полной регрессии опухоли (Cellini et al., 2005). Кроме того, существенными являются физическая и психологическая нагрузка и возможные косметические исходы удаления опухоли молочной железы с последующим RT. Эти недостатки делают лечение и управление течением DCIS в настоящее время спорными вопросами в терапии рака молочной железы и стимулируют поиск новых и/или дополнительных возможностей лечения и прогнозирования.
DCIS представляет собой биологически гетерогенную форму злокачественной опухоли с разнообразными клиническими проявлениями, гистологией, клеточными признаками и биологическим потенциалом. Ее подразделяют на угревидную (инвазивную) и неугревидную (неинвазивную) карциномы, где угревидная является более высокозлокачественным, потенциально более инвазивным субтипом, обычно содержащим большую некротическую область в просвете протоков с выраженной цитологической атипией. Согласно ожиданиям, приблизительно две трети пациентов с DCIS от промежуточной до низкозлокачественной имеют многоочаговое ипсилатеральное заболевание с расстояниями между различными очагами, которые могут достигать 1 см (Cutuli et al., 2002). Высокозлокачественные очаги имеют тенденцию к непрерывности с расстояниями между ними менее 5 мм (Cellini et al., 2005).
Естественное развитие неинвазивной DCIS в инвазивную опухоль молочной железы занимает 15-20 лет и вовлекает от 14 до 60 процентов женщин, у которых поставлен этот диагноз (Burstein et al., 2004). В действительности, DCIS, по-видимому, является стадией развития рака молочной железы, на которой многие из молекулярных явлений, которые определяют инвазивный рак молочной железы, уже присутствуют (Cutuli et al., 2002; Holland et al., 1990). Конкретно, из ~30% низкозлокачественных очагов в отсутствие лечения развивается инвазивная карцинома (Sanders et al., 2005). Очаги с диаметром более 2,5 см часто сопровождаются скрытыми микроинвазивными опухолями, которые могут не превышать 0,1 мм. Вовлечение краев опухоли является важным прогностическим маркером. Близкие к области удаления (менее 1 мм) или положительные края, высокозлокачественные и/или угревидные области связаны с более высоким риском рецидива.
Аналогично многим другим злокачественным опухолям, образование новых кровеносных сосудов (ангиогенез) при раке молочной железы играет центральную роль как в локальной прогрессии опухоли, так и в развитии различных метастазов (Boehm-Viswanathan, 2000; Kieran et al., 2003). В ткани DCIS была выявлена значительно более высокая плотность микрососудов (MVD) по сравнению с окружающей нормальной тканью (Guidi et al., 1994; Guidi et al., 1997; Guinebretiere et al., 1994). Фиброзно-кистозные очаги с наиболее высокой плотностью сосудов ассоциированы с более высоким риском рака молочной железы (Guidi et al., 1994; Guidi et al., 1997; Guinebretiere et al., 1994). При гистопатологическом исследовании агрессивные очаги повреждения DCIS связаны с повышенной MVD и экспрессией сосудисто-эндотелиального фактора роста (VEGF) (Guidi et al., 1997; Schneider et al., 2005). Клинико-патологические связи также подтверждают основную роль ангиогенеза в прогрессировании рака молочной железы, что делает его привлекательной мишенью для терапии и прогнозирования DCIS (Folkman, 1997; Krippl et al., 2003; Relf et al., 1997). Кооптация сосудов, рост путем врастания (Patan et al., 1996), сосудистая мимикрия и васкулогенез являются встречающимися в природе процессами, которые могут снизить зависимость опухоли от классического ангиогенеза. Особенно важным является открытие, что воспалительный рак молочной железы практически полностью зависит от васкулогенеза, по-видимому, вследствие неспособности злокачественных клеток связываться с эндотелиальными клетками.
Критическая зависимость DCIS от высоко плотного сосудистого ложа сделала антиангиогенную (ингибирование образование новых кровеносных сосудов) и антиваскулярную (окклюзия/разрушение существующих кровеносных сосудов) терапии (Shimizu et al., 2005; Thorpe, 2004) привлекательными вариантами локализованной терапии BC (Schneider et al., 2005; Folkman, 1996). Действительно, антиангиогенные лекарственные средства, такие как бевацизумаб (антитело против рецептора VEGF-A) и SU011248 (ингибитор тирозина рецептора VEGF) находятся на фазе II клинических испытаний. Интересно, что также было выявлено, что тамоксифен обладает антиангиогенной активностью. Кроме того, накапливающиеся данные указывают на недостаточность антиангиогенного подхода. Они включают необходимость в длительном лечении, частичный отказ от "теории устойчивости к устойчивости" (Schneider et al., 2005; Streubel et al., 2004) и фармакокинетическую устойчивость. Вследствие этих препятствий, антиваскулярный подход в настоящее время является более перспективным, и, как ожидается, приводящим к устранению всей опухоли без необходимости в длительном лечении (Folkman, 2004) Недавно появившимся перспективным способом нацеленного на сосуды лечения является фотодинамическая терапия (VTP).
Аналогично, нацеливание парамагнитных металлов с соответствующей способностью к релаксации, позитронно-активных химических групп (например,64Cu), или флуоресцентных зондов на плотное сосудистое ложе DCIS, должно обеспечить новые способы детекции соответствующих очагов, определения краев и прогнозирование, как объяснено ниже. Было показано, что флуоресцентная детекция очагов рака молочной железы является пригодной на глубине вплоть до 10 мм (Britton, 2006). Динамическая MRI с Gd в качестве контрастного средства основана на усиленной проницаемости сосудов опухоли и ее в настоящее время используют для локализации опухоли в молочной железе (Rankin, 2000). Однако использование MRI в настоящее время ограничено коротким временем интеграции доступных контрастных средств, которые действуют кратковременно, но не захватываются опухолевой тканью селективно.
Фотодинамическая терапия (PDT) создает всплеск цитотоксических активных форм кислорода (ROS) в выбранной области лечения. Вследствие их короткого времени жизни, токсичность ROS ограничивается областью облучения. PDT, как правило, состоит из пяти стадий: 1. Внутривенное (IV) введение фотосенсибилизатора; 2. Период времени, который обеспечивает достижения в ткани-мишени желательной концентрации фотосенсибилизаторов; 3. Чрескожное или интерстициальное облучения ткани-мишени высокоинтенсивным лазерным излучением (вплоть до 1 Вт для непрерывного излучения) через тонкие (диаметром 0,4 мм или менее) оптические волокна для облучения глубоких тканей с последующим локальным образованием цитотоксических ROS; 4. Развитие некроза опухоли или эрадикация опухоли; 5. Ремоделирование и заживление ткани.
Нацеленная на сосуды PDT (VTP) направлена на образование ROS в кровеносных сосудах обрабатываемой ткани, которое можно проводить либо путем облучения ткани светом сразу после введения сенсибилизатора, либо с использованием сенсибилизаторов, которые не подвергаются экстравазации из кровотока. В лаборатории авторов настоящего изобретения было разработано несколько поколений бактериохлорофилльных сенсибилизаторов, называемых в настоящем документе "производными Bchl" или "BchlD". Синтезированные соединения (Rosenbach-Belkin et al., 1996; US 5650292) обладают сильным поглощением в NIR (750-765 нм), обеспечивая глубокое проникновение света в ткани субъекта и диаметр лечения вплоть до 4 см вокруг цилиндрического волокна с высокой плотностью потока (20 мВт-1 Вт). При облучении светом, в опухоли и вблизи нее циркулирующие BchlD создают локальную высокую концентрацию ROS (радикалы OH• и O2-), приводят к сворачиванию крови и перфорации сосудов опухоли с последующем полным блокированием сосудов опухоли после облучения в течение нескольких минут. В случае некоторых производных Bchl наблюдали прямую интоксикацию эндотелиальных клеток (Gross et al., 2003; Mazor et al., 2005). По исследуемым в настоящее время причинам, ответ сосудов опухоли является значительно более быстрым и агрессивным по сравнению с ответом сосудов в окружающей нормальной ткани. Эффективность обработки приводит к высоким уровням излечения (выживание животных 60-90%) (Mazor et al., 2005). Важно, что внутривенно инъецированные сенсибилизаторы быстро выводятся из кровотока подвергаемых лечению животных (T1/2 составляет порядка от нескольких минут до нескольких часов (Mazor et al.,2005)), позволяя избегать длительной токсичности кожи и позволяя повторение обработки, при необходимости. В фазе II клинических испытаний на локализованном раке предстательной железы у пациентов, где лучевая терапия оказалась неуспешной (Weersink et al., 2005), VTP на основе BchlD, как правило, приводила к успешной эрадикации очагов опухоли у 50-60% подвергавшихся обработке пациентов и ремоделированию ткани. Повторная обработка как на моделях животных, так и у человека (клинические испытания фазы II/III), привела к сходным и более высоким уровням излечения на сеанс (в зависимости от дозы лекарственного средства и света), повышая ожидаемый общий уровень успеха до ~90% после 2-3 сеансов. Важно, что в исследованиях на животных были выявлены значительно более высокие уровни излечения на сеанс при более высоких дозах применяемого сенсибилизатора.
Фотодинамическая терапия (PDT) опухолей вовлекает комбинацию вводимого фотосенсибилизатора и локальной доставки света, оба из которых самостоятельно являются безвредными средствами, но в присутствии молекулярного кислорода они способны продуцировать цитотоксические активные формы кислорода (ROS), которые могут устранить клетки. Являясь двойным лечебным воздействием, PDT позволяет большую специфичность и имеет потенциал к тому, чтобы быть более селективной, и в то же время менее деструктивной по сравнению с обычно используемыми химиотерапией или лучевой терапией (Dougherty et al. 1998).
Использование новых производных бактериохлорофилла (Bchl) в качестве сенсибилизаторов при PDT было описано авторами настоящего изобретения в последние годы (Zilberstein et al., 2001; Schreiber et al., 2002; Gross et al., 1997; Zilberstein et al., 1997; Rosenbach-Belkin et al., 1996; Gross et al., 2003a; Koudinova et al., 2003; Preise et al., 2003; Gross et al., 2003b) и в патентных публикациях US 5726169, US 5650292, US 5955585, US 6147195, US 6740637, US 6333319, US 6569846, US 7045117, DE 41 21 876, EP 1 246 826, WO 2004/045492, WO 2005/120573. Спектры, фотофизика и фотохимия производных Bchl делают их оптимальными светособирающими молекулами с очевидными преимуществами над другими сенсибилизаторами, используемыми в настоящее время в PDT. Эти производные Bchl, главным образом, являются полярными и остаются в кровотоке в течение очень короткого периода времени практически без экстравазации в другие ткани (Brandis, 2003; Mazor et al. 2005). Таким образом, эти соединения являются хорошими кандидатами для нацеленной на сосуды PDT (VTP), в основе которой лежит кратковременная (5-10 мин) внутрисосудистая встреча со светом и более высокая чувствительность сосудов опухоли к образованным при PDT цитотоксическим ROS.
Недавние исследования, проведенные группой авторов настоящего изобретения, показали, что первичная фотосенсибилизация является внутрисосудистой с быстрым развитием ишемической окклюзии и стаза в ходе периода облучения. Этот процесс также обеспечивает индуцируемое фотохимически перекисное окисление липидов (LPO) и раннюю гибель эндотелиальных клеток, которая ограничена, главным образом, сосудами опухоли (Koudinova et al. 2003). Вследствие независимого от света прогрессирования цепных реакции свободных радикалов совместно с развитием гипоксии, LPO и гибель клеток распространяются за сосудистый отдел, охватывая весь интерстиций опухоли до достижения полного некроза опухоли приблизительно через 24 часа после PDT. Таким образом, первичное действие PDT блокирует кровоснабжение и индуцирует гипоксию, которая вторично инициирует серию молекулярных и патофизиологических явлений, которые завершаются эрадикацией опухоли. Важно, что этот подход основан на различиях между ответом нормальных и опухолевых кровеносных сосудов на образованные ROS.
В международной заявке WO 2008/023378 тех же заявителей, приведенной в настоящий документ в качестве ссылки в полном объеме, описаны новые конъюгаты производных порфирина, хлорофилла и бактериохлорофилла (Bchl) с пептидами, содержащими мотив RGD или с пептидомиметиками RGD, и их применение в способах фотодинамической терапии и диагностике in vivo опухолей и различных сосудистых заболеваний, таких как связанная со старением дегенерация желтого пятна. В частности, производное Bchl с(RGDfK)-Pd-MLT (соединение 24) показало накопление вплоть до 4-8 мкМ в ксенотрансплантатах первичных опухолей и оно остается в области опухоли в течение длительного периода времени, обеспечивая накопление сигнала и хорошее отношение сигнала к шуму.
Флуоресцентное мечение подходит для детекции in vivo, в свежей ткани и in vitro. c(RGDfK)-Pd-MLT имеет собственную флуоресценцию в нижней инфракрасной области (NIR), которую можно выявлять. c(RGDfK)-2H-MLT имеет способность к свечению на три порядка выше и, таким образом, оно может быть еще лучшим кандидатом для нацеленной визуализации. В этом исследовании авторы настоящего изобретения показали, что эти молекулы открывают возможность для точной детекции краев опухоли и некроза в модели аденокарциномы молочной железы человека. Детекция краев опухолей и детекция некроза на сегодняшний день представляют собой две из наиболее затруднительных проблем в лечении опухоли. Более того, оба эти признака являются достоверными прогностическими факторами повторного роста опухоли после лечения. Таким образом, в будущем, при клиническом применении, ожидается, что указанные выше производные RGD будут пригодны для детекции опухоли и некроза на операционном столе.
Сущность изобретения
В настоящее время в соответствии с настоящим изобретением выявлено, что конъюгаты RGD-(бактерио)хлорофилл, описанные в указанной выше WO 2008/023378, направляются в некротические домены опухоли и накапливаются в них значительно дольше, чем в ненекротических доменах опухоли.
Таким образом, настоящее изобретение относится к применению указанных конъюгатов RGD-бактериохлорофилл и RGD-хлорофилл для минимально инвазивной визуализации опухоли, нацеленной на опухоль фотодинамической терапии и/или интерактивного прогноза некротических опухолей, и к соответствующим способам.
Краткое описание фигур
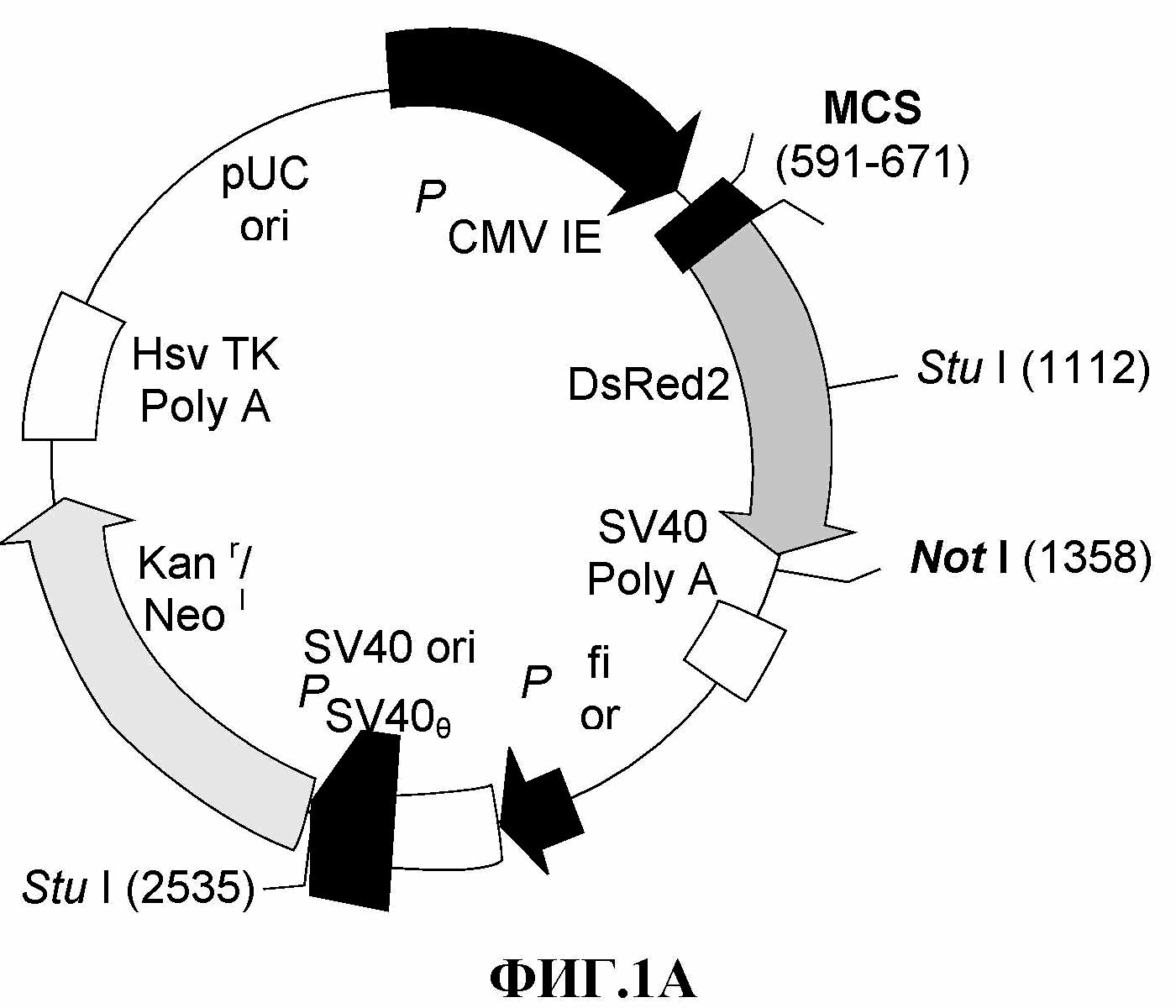
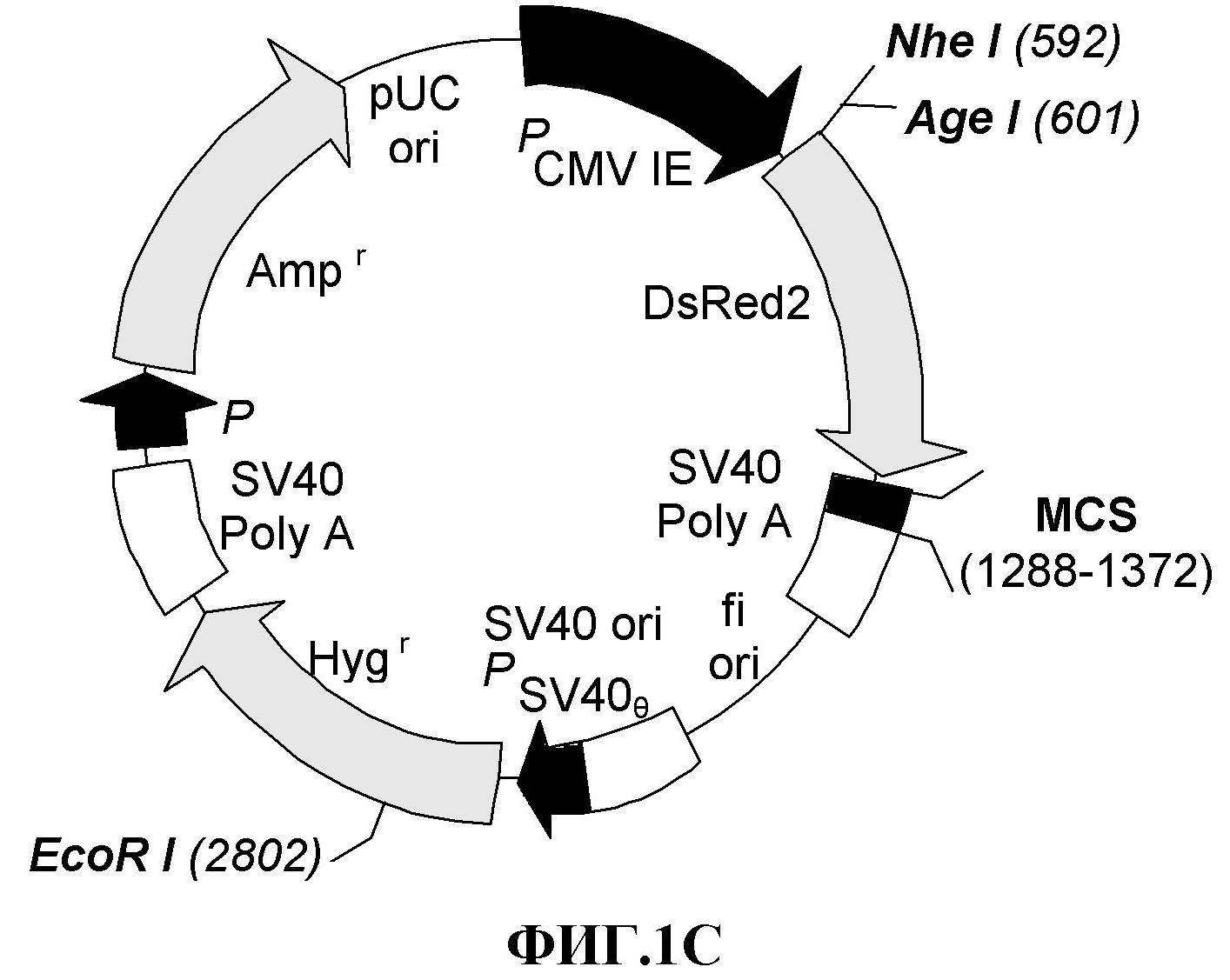
На фиг.1 представлены плазмиды, использованные для трансфекции опухолевых клеточных линий красным флуоресцентным белком (RFP). 1A: плазмида pDsRed2-N1 (Clontech, Palo Alto. CA). 1B: pDsRed-Monomer-Hyg-C1 (Clontech, Palo Alto, CA), 1C: модифицированная pDsRed-Monomer-Hyg-C1.
На фиг.2A-2B представлены флуоресцентные клоны трансфицированных клеток, представленных на фиг.1, выявленные с помощью флуоресцентного микроскопа (Nikon, увеличение X10) после воздействия в течение 3 с. 2A: MDA-MB-231 RFP клон 1 (устойчивый к G418). 2B: MDA-MB-231 RFP клон 3 (устойчивый к гигромицину).
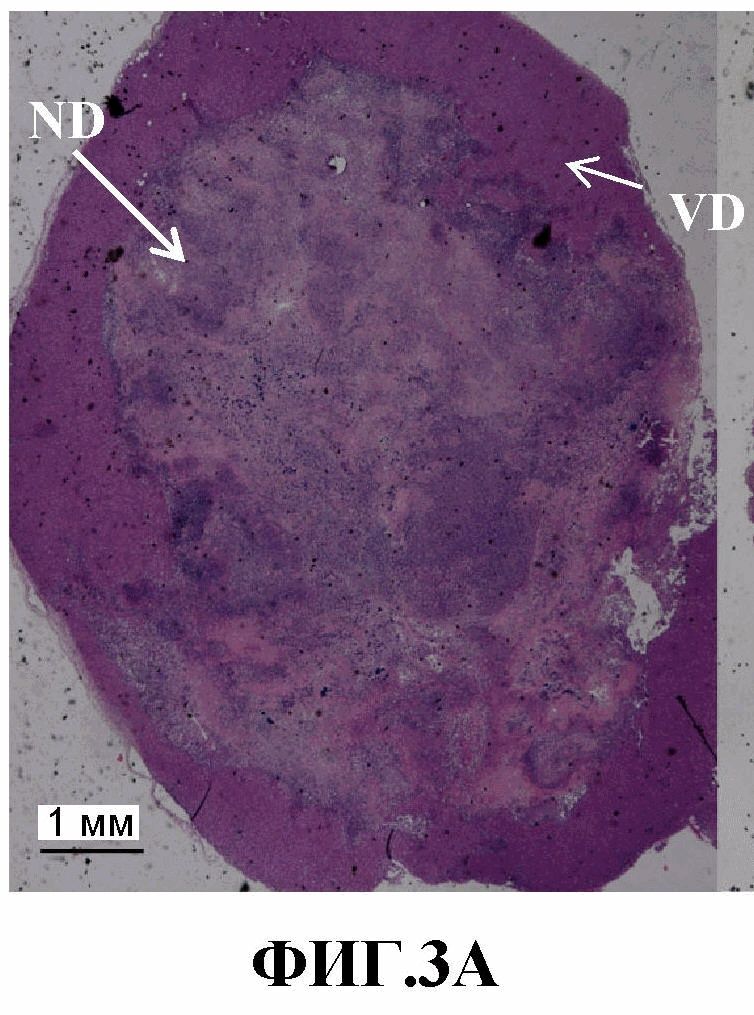
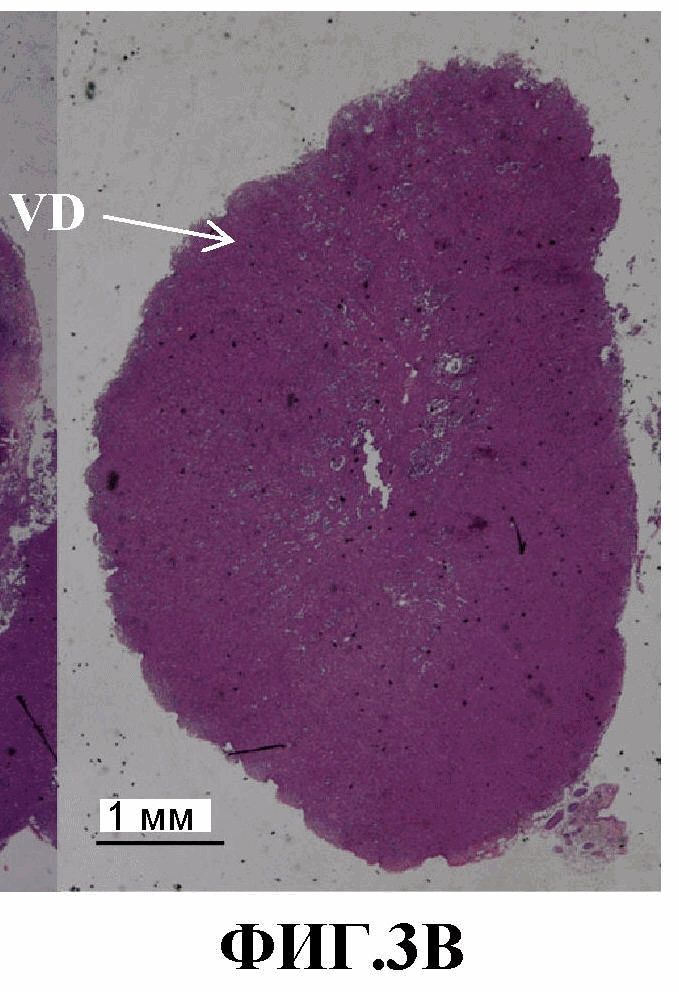
На фиг.3A-3B представлены изображения удаленных опухолей и гистологический анализ (окрашивание H&E) поперечных срезов опухолей MDA-MB-231-RFP. 3A: большая опухоль (~1 см3). 3B: небольшая опухоль (~0,5 см3) (ND - некротический домен, VD - жизнеспособный домен).
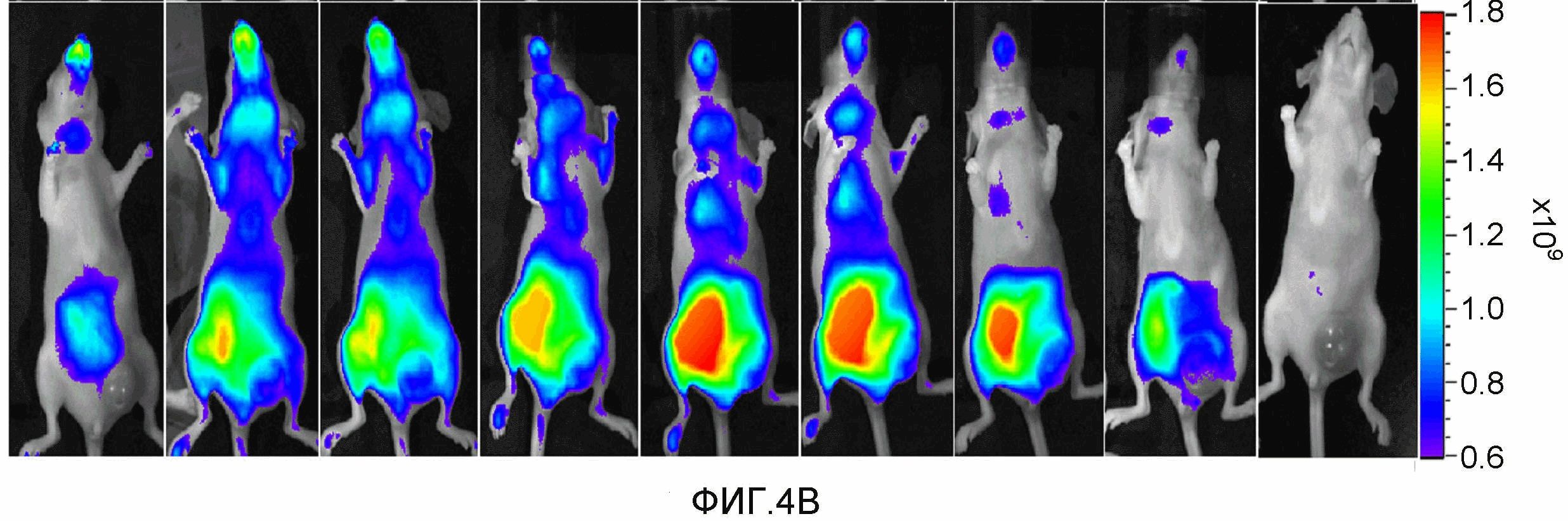
На фиг.4A-4B представлено накопление описанного в настоящем документе ниже соединения 13 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~1 см3). Мышам инъецировали соединение 13. Изображения получали от 15 мин до 24 ч после инъекции лекарственного средства. 4A (верхняя панель): визуализация красной флуоресценции. 4B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.5A-5B представлено накопление соединения 13 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~1 см3). Мышам инъецировали соединение 13. Изображения получали с 1 по 7 сутки после инъекции лекарственного средства. 5A (верхняя панель): визуализация красной флуоресценции. 5B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.6A-6B представлено накопление соединения 13 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~0,5 см3). Мышам инъецировали соединение 13. Изображения получали от 20 мин до 24 ч после инъекции лекарственного средства. 6A (верхняя панель): визуализация красной флуоресценции. 6B (нижняя панель): визуализация флуоресценции в NIR.
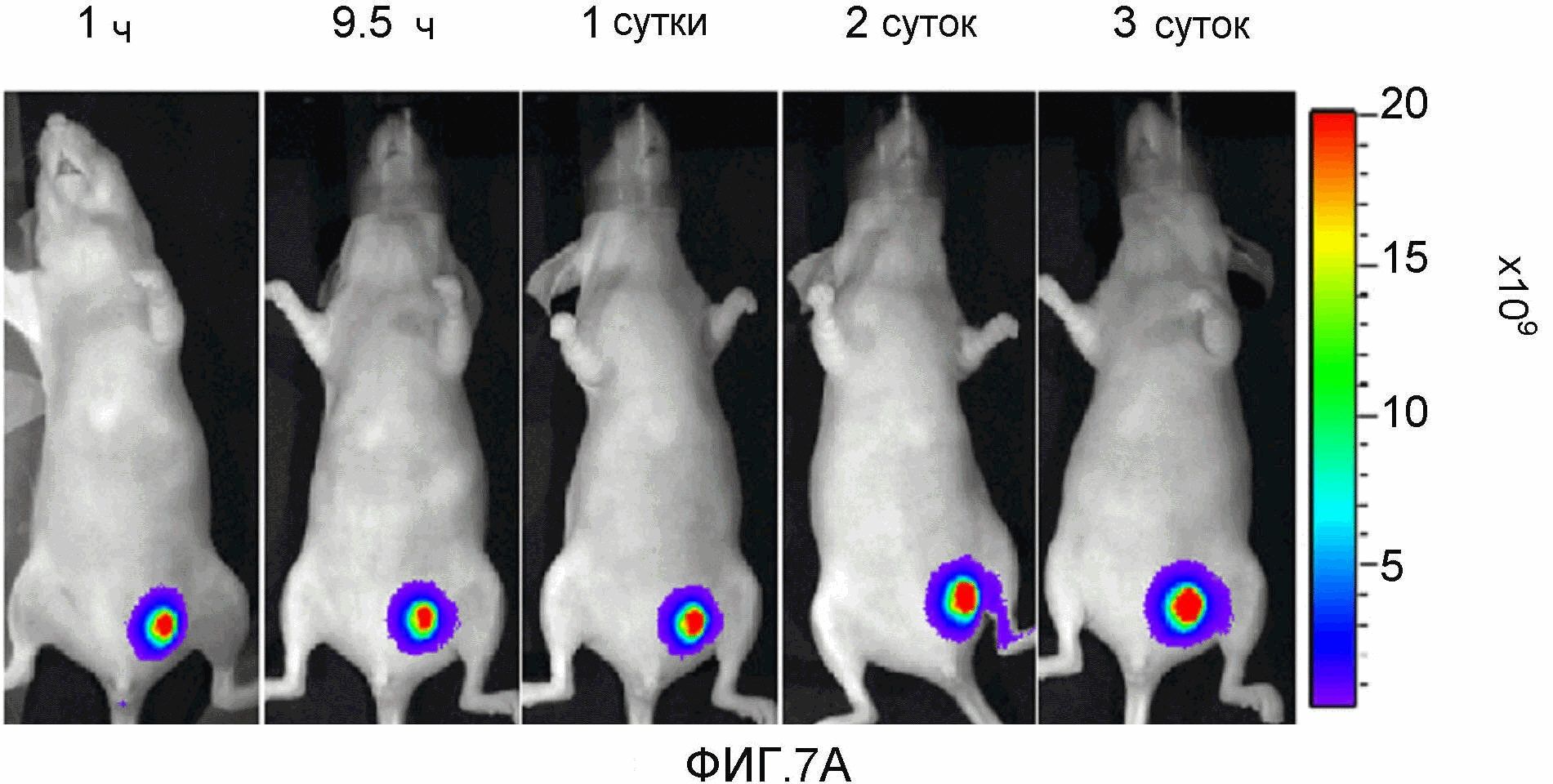
На фиг.7A-7B представлено накопление соединения 13 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~0,5 см3). Мышам инъецировали соединение 13. Изображения получали с 1 по 3 сутки после инъекции лекарственного средства. 7A (верхняя панель): визуализация красной флуоресценции. 7B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.8 представлен график, на котором показано измерение флуоресцентного сигнала соединения 13 в опухоли относительно противоположной стороны. Флуоресцентный сигнал в фотонах/с/см2 измеряли у 9 животных как для стороны опухоли, так и для противоположной стороны. Результаты получали от 15 мин до 216 ч после инъекции соединения 13. Представлен средний результат для всех животных в каждый момент, а также соотношение флуоресценции между опухолью и противоположной стороной.
На фиг.9A-9B представлено накопление соединения 24 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~1 см3). Мышам инъецировали соединение 24. Изображения получали от 1 ч до 24 ч после инъекции лекарственного средства. 9A (верхняя панель): визуализация красной флуоресценции. 9B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.10A-10B представлено накопление соединения 24 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~1 см3). Мышам инъецировали соединение 24, и изображения получали с 1 по 7 сутки после инъекции лекарственного средства. 10A (верхняя панель): визуализация красной флуоресценции. 10B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.11A-11B представлено накопление соединения 24 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~0,5 см3). Мышам инъецировали соединение 24, и изображения получали от 20 мин до 24 ч после инъекции лекарственного средства. 11A (верхняя панель): визуализация красной флуоресценции. 11B (нижняя панель): визуализация флуоресценции в NIR.
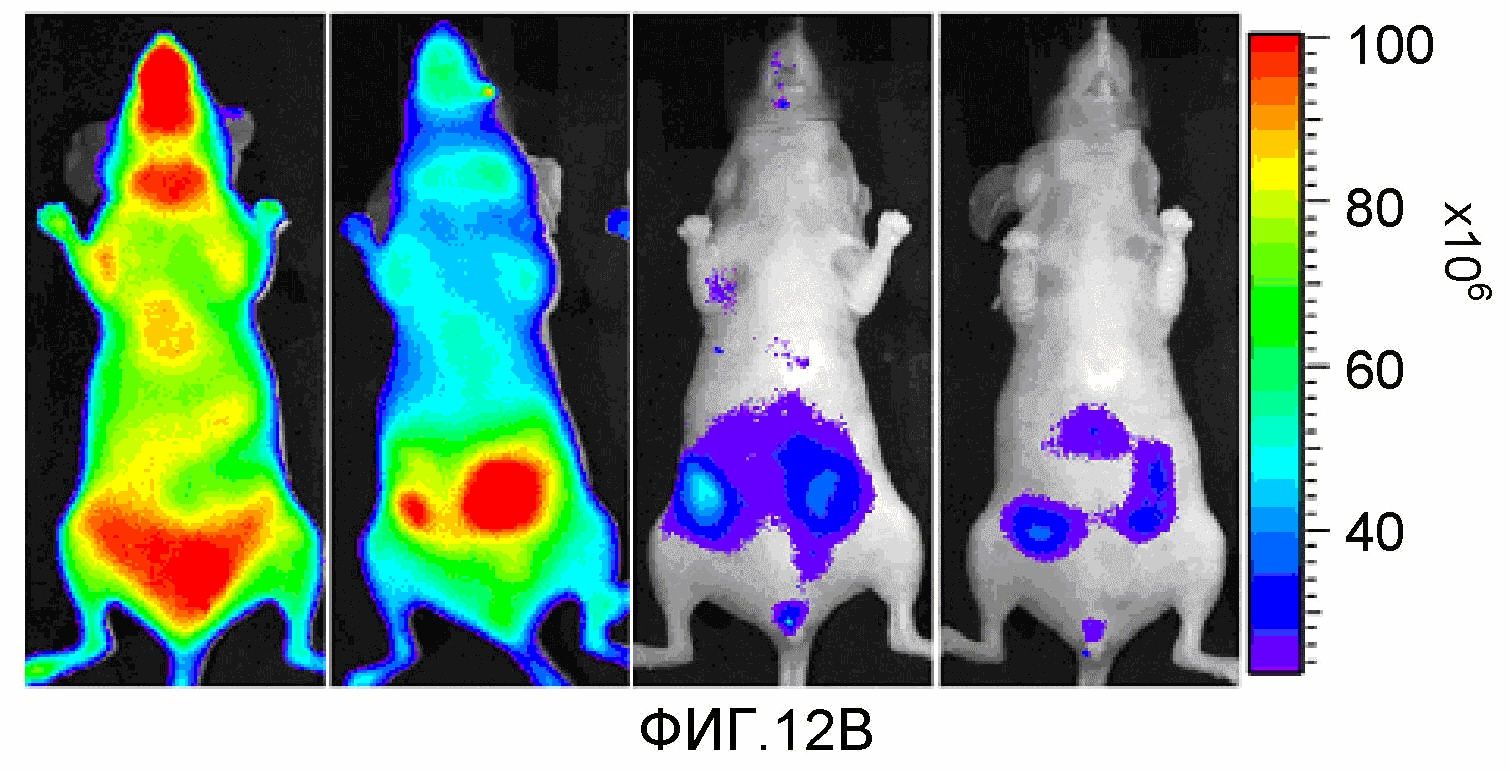
На фиг.12A-12B представлено накопление соединения 24 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~0,5 см3). Мышам инъецировали соединение 24, и изображения получали с 1 по 2 сутки после инъекции лекарственного средства. 12A (верхняя панель): визуализация красной флуоресценции. 12B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.13A-13B представлено накопление соединения 13 в ортотопной опухоли MLS-mBanana (размер опухоли ~1 см3). Мышам инъецировали соединение 13. Изображения получали от 1 ч до 24 ч после инъекции лекарственного средства. 13A (верхняя панель): визуализация красной флуоресценции. 13B (нижняя панель): визуализация флуоресценции в NIR.
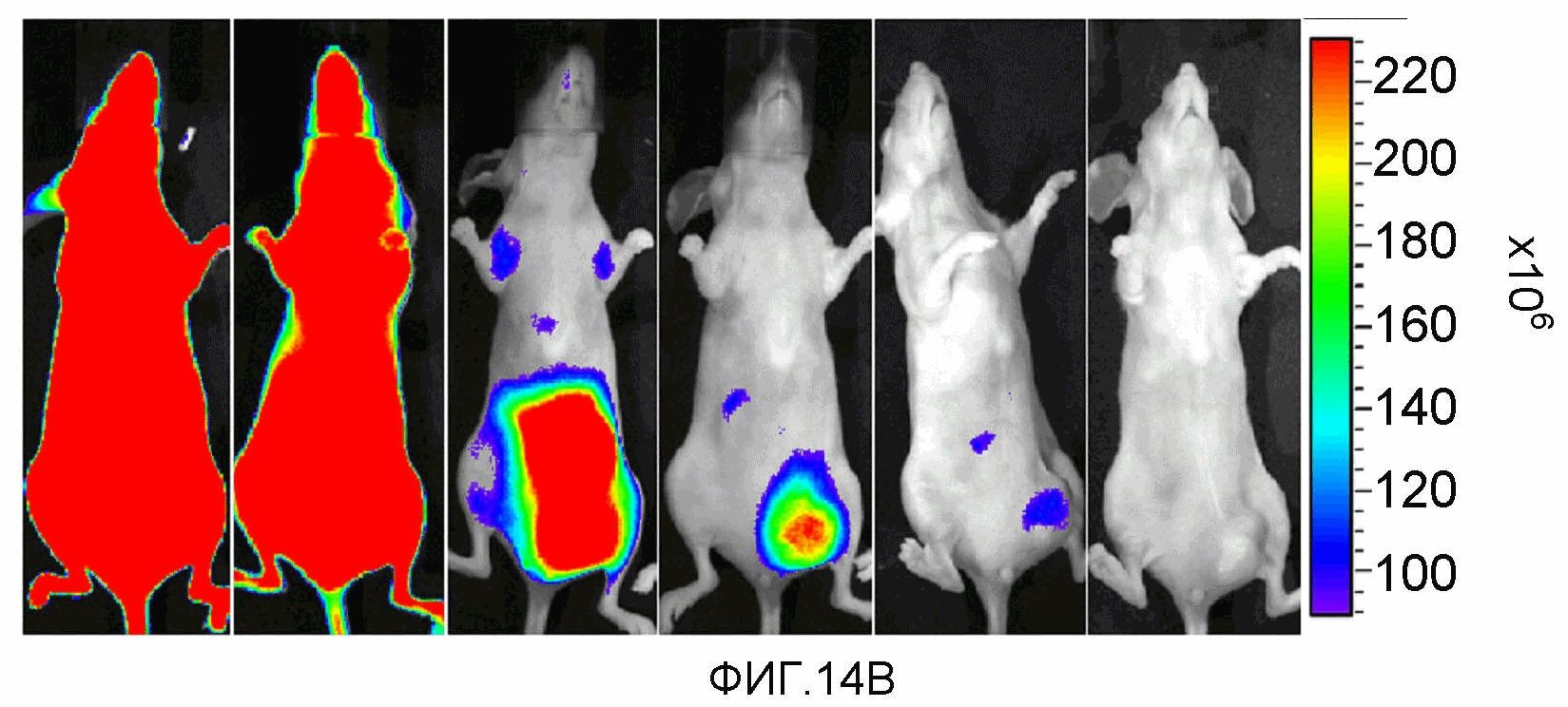
На фиг.14A-14B представлено накопление соединения 13 в ортотопной опухоли MLS-mBanana (размер опухоли ~1 см3). Мышам инъецировали соединение 13. Изображения получали с 1 по 4 сутки после инъекции лекарственного средства. 14A (верхняя панель): визуализация красной флуоресценции. 14B (нижняя панель): визуализация флуоресценции в NIR.
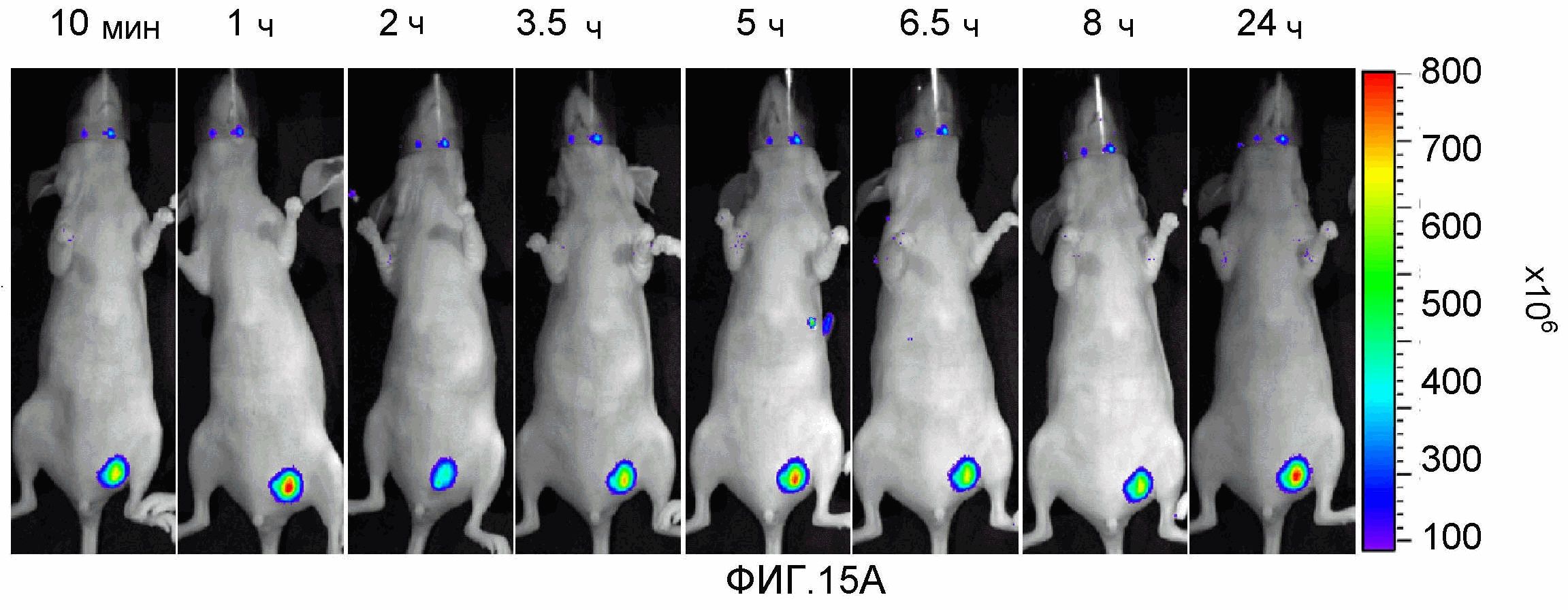
На фиг.15A-15B представлено накопление соединения 13 в ортотопной опухоли MLS-mBanana (размер опухоли ~0,5 см3). Мышам инъецировали соединение 13. Изображения получали от 10 мин до 24 часов после инъекции лекарственного средства. 15A (верхняя панель): визуализация красной флуоресценции. 15B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.16A-16B представлено накопление соединения 13 в ортотопной опухоли MLS-mBanana (размер опухоли ~0,5 см3). Мышам инъецировали соединение 13. Изображения получали с 1 по 4 сутки после инъекции лекарственного средства. 16A (верхняя панель): визуализация красной флуоресценции. 16B (нижняя панель): визуализация флуоресценции в NIR.
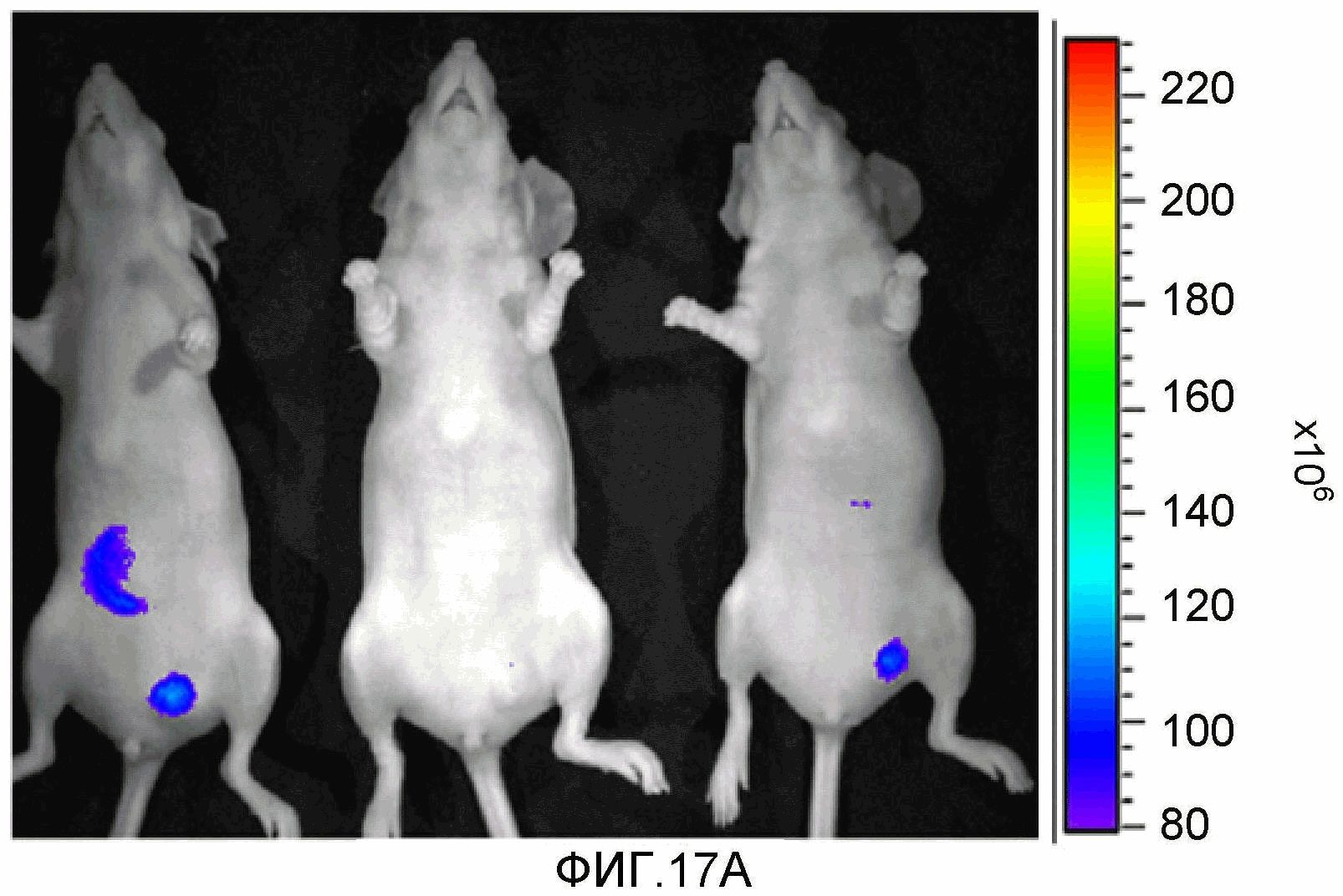
На фиг.17A-17B представлено сравнение накопления соединения 13 в первичных некротических и ненекротических опухолях яичника человека MLS-mBanana. Изображения получали через 2 суток после инъекции соединения 13. Получали изображения флуоресценции в NIR соединения 13 во всем организме in vivo. 17A: ненекротические опухоли (~0,5 см3). 17B: некротические опухоли (~1 см3).
На фиг.18A-18B представлено накопление соединения 25 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~1 см3). Мышам инъецировали соединение 25 и получали изображения от 5 мин до 24 часов после инъекции лекарственного средства. 18A (верхняя панель): визуализация красной флуоресценции. 18B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.19A-19B представлено накопление соединения 25 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~1 см3). Мышам инъецировали соединение 25, и получали изображения с 1 по 3 сутки после инъекции лекарственного средства. 19A (верхняя панель): визуализация красной флуоресценции. 19B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.20A-20B представлено накопление соединения 25 в ортотопной ненекротической опухоли MDA-MB-231-RFP (размер опухоли ~0,5 см3). Мышам инъецировали соединение 25, и получали изображения от 10 мин до 24 часов после инъекции лекарственного средства. 20A (верхняя панель): визуализация красной флуоресценции. 20B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.21A-21B представлено накопление соединения 25 в ортотопной ненекротической опухоли MDA-MB-231-RFP (размер опухоли ~0,5 см3). Мышам инъецировали соединение 25 и получали изображения с 1 по 3 сутки после инъекции лекарственного средства. 21A (верхняя панель): визуализация красной флуоресценции. 21B (нижняя панель): визуализация флуоресценции в NIR.
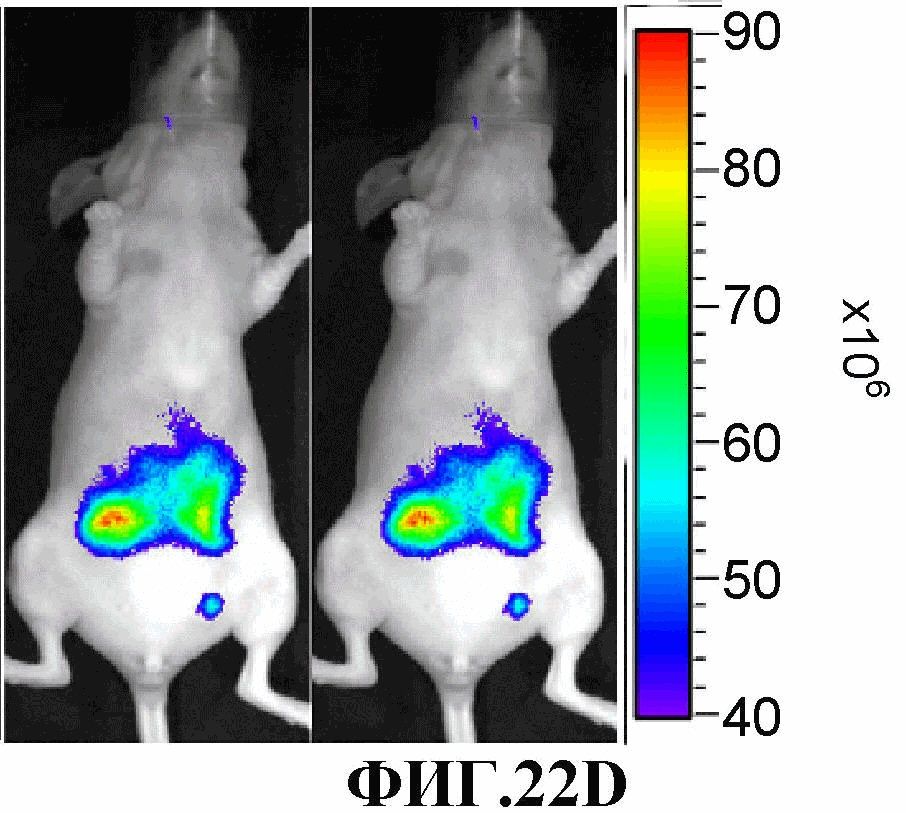
На фиг.22A-22D представлен конкурентный анализ накопления соединения 13 в ортотопной первичной опухоли молочной железы человека MDA-MB-231-RFP (размер опухоли ~0,5 см3) при введении через 1 ч после введения свободного c(RGDfK). Изображения получали через 24 часов после введения соединения 13. 22A, 22B - визуализация красной флуоресценции; 22C, 22D - визуализация флуоресценции в NIR. 22A, 22C: соединение 13 вводили через 1 ч после введения свободного c(RGDfK) (конкуренция). 22B, 22D: контроль, вводили только соединение 13.
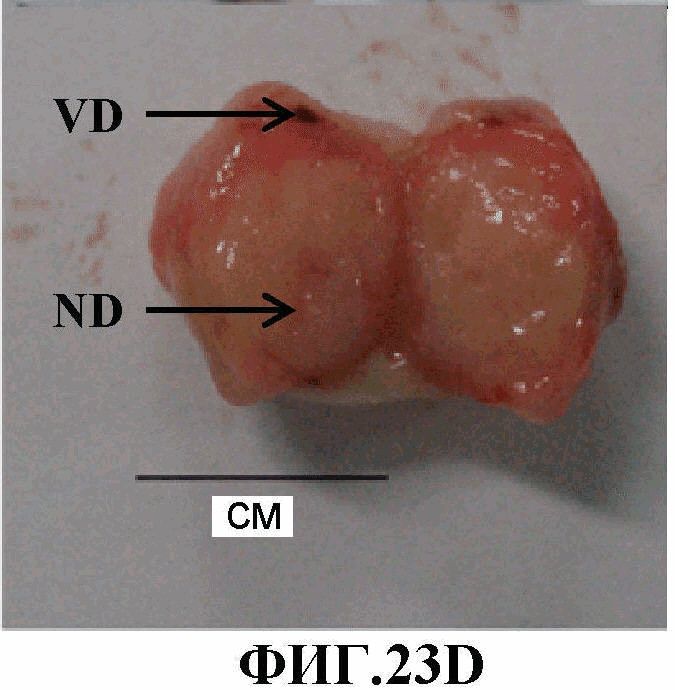
На фиг.23A-23F представлено накопление соединения 13 в жизнеспособной области относительно некротической в ортотопной опухоли MDA-MB-231-RFP, измеренное через 10 мин после инъекции лекарственного средства. 23A, 23B и 23C (верхняя панель), представляют собой фотографии всего организма in vivo, изображение красной флуоресценции и изображение флуоресценции в NIR, соответственно, для интактного животного; 23D, 23E и 23F (нижняя панель) представляют собой фотографию, изображение красной флуоресценции и изображение флуоресценции в NIR, соответственно, удаленной опухоли (опухоль разрезана пополам) (ND - некротический домен, VD - жизнеспособный домен).
На фиг.24A-24F представлено накопление соединения 13 в жизнеспособных областях против некротических областей ортотопной опухоли MDA-MB-231-RFP, измеренное через 1 час после инъекции лекарственного средства. Фиг.24A, 24B, 24C (верхняя панель) и 24D, 24E, 24F (нижняя панель) являются такими, как описано выше для фиг.23A, 23B, 23C и 23D, 23E, 23F, соответственно.
На фиг.25A-25F представлено накопление соединения 13 в жизнеспособных областях относительно некротических в ортотопной опухоли MDA-MB-231-RFP, измеренное через 4 часа после инъекции лекарственного средства. Фиг.25A, 25B, 25C (верхняя панель) и 25D, 25E, 25F (нижняя панель) являются такими, как описано выше для фиг.23A, 23B, 23C и 23D, 23E, 23F, соответственно.
На фиг.26A-26F представлено накопление соединения 13 в жизнеспособных областях относительно некротических в ортотопной опухоли MDA-MB-231-RFP, измеренное через 24 часа после инъекции лекарственного средства. Фиг.26A, 26B, 26C (верхняя панель) и 26D, 26E, 26F (нижняя панель) являются такими, как описано выше для фиг.23A, 23B, 23C и 23D, 23E, 23F, соответственно.
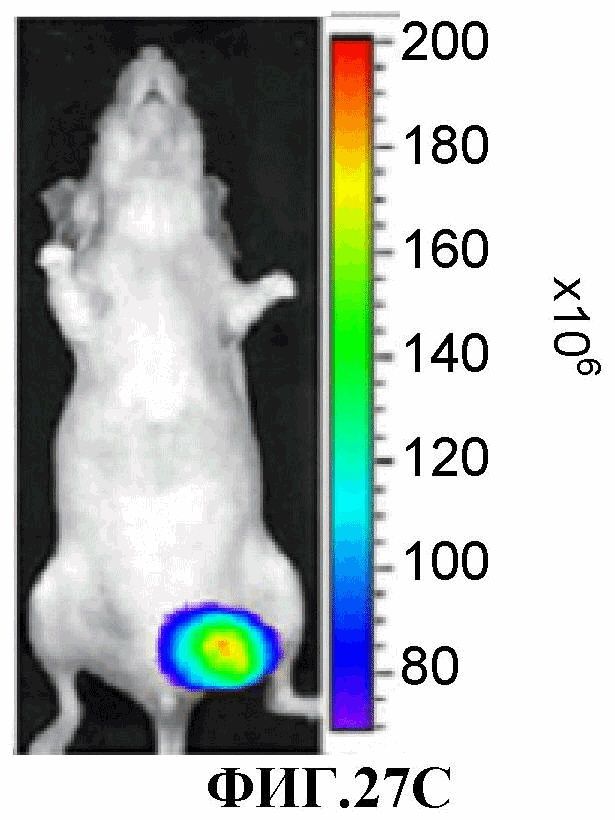
На фиг.27A-27F представлено накопление соединения 13 в жизнеспособных областях относительно некротических в ортотопной опухоли MDA-MB-231-RFP, измеренное через 3 суток после инъекции лекарственного средства. Фиг.27A, 27B, 27C (верхняя панель) и 27D, 27E, 27F (нижняя панель) являются такими, как описано выше для фиг.23A, 23B, 23C и 23D, 23E, 23F, соответственно.
На фиг.28A-28F представлено накопление соединения 13 в жизнеспособных областях против некротических в ортотопной опухоли MDA-MB-231-RFP, измеренное через 5 суток после инъекции лекарственного средства. Фиг.28A, 28B, 28C (верхняя панель) и 28D, 28E, 28F (нижняя панель) являются такими, как описано выше для фиг.23A, 23B, 23C и 23D, 23E, 23F, соответственно.
На фиг.29A-29F представлено накопление соединения 13 в жизнеспособных областях относительно некротических в ортотопной опухоли MDA-MB-231-RFP, измеренное через 7 суток после инъекции лекарственного средства. Фиг.29A, 29B, 29C (верхняя панель) и 29D, 29E, 29F (нижняя панель) являются такими, как описано выше для фиг.23A, 23B, 23C и 23D, 23E, 23F, соответственно.
На фиг.30A-30F представлено накопление соединения 24 в жизнеспособных областях относительно некротических в ортотопной опухоли MDA-MB-231-RFP, измеренное через 9 суток после инъекции лекарственного средства. Фиг.30A, 30B, 30C (верхняя панель) и 30D, 30E, 30F (нижняя панель) являются такими, как описано выше для фиг.23A, 23B, 23C и 23D, 23E, 23F, соответственно.
На фиг.31A-31F представлено накопление соединения 13 в центральном некрозе опухоли MLS-mBanana, измеренное через 7 суток после инъекции. Фиг.31A, 32B, 33C (верхняя панель) и 34D, 35E, 36F (нижняя панель) являются такими, как описано выше для фиг.23A, 23B, 23C и 23D, 23E, 23F, соответственно.
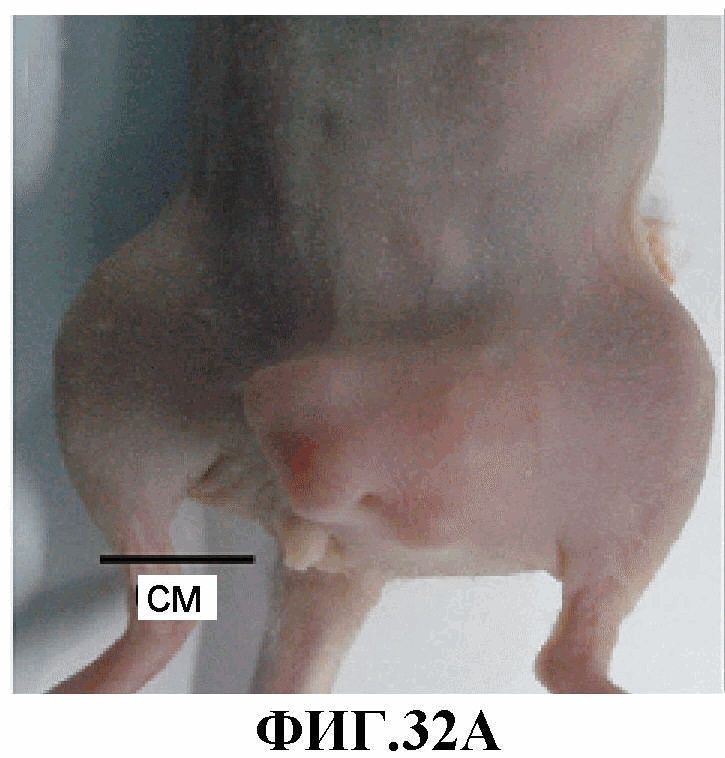
На фиг.32A-32F представлено накопление соединения 13 в нецентральном некрозе опухоли MLS-mBanana, измеренное через 7 суток после инъекции лекарственного средства. Фиг.30A, 30B, 30C (верхняя панель) и 30D, 30E, 30F (нижняя панель) являются такими, как описано выше для фиг.23A, 23B, 23C и 23D, 23E, 23F, соответственно.
На фиг.33A-33D представлено изображение удаленной опухоли и гистологический анализ (окрашивание H&E) поперечного среза опухоли MDA-MB-231-RFP. 33A: фотография поверхности поперечного среза опухоли (макроскопическая картина). 33B: гистологическое изображение поверхности поперечного среза (макроскопическая картина). 33C: вид при среднем увеличении заключенной в рамку области на 33B. 33D: вид при высоком увеличении области границы между некротической и жизнеспособной тканью.
На фиг.34A-34B представлен репрезентативный пример локального ответа MDA-MB-231-RFP человека на PDT. Мыши с ксенотрансплантатом MDA-MB-231-RFP (~0,5 см3) на спине внутривенно инъецировали 7,5 мг/кг соединения 13 и облучали светом через 8 ч после этого через кожу. 34A: фотографии, полученные на 0 сутки (до введения) и через 1, 4, 7, 12 и 90 суток после введения. 34B: визуализация красной флуоресценции всего организма in vivo.
Варианты осуществления изобретения
Основной задачей настоящего изобретения является получение конъюгатов фотосенсибилизаторов, которые, главным образом, нацеливают сенсибилизатор на некротические домены некротических опухолей. Существуют некоторые преимущества нацеленной на опухоль фотодинамической терапии (PDT) по сравнению с нацеленной на опухоль общепринятой химиотерапией. Во-первых, в процессе накопления нацеленного общепринятого лекарственного средства, оно часто является активным, если оно не является пролекарством, в то время как нацеленный фотосенсибилизатор не является активным до тех пор, пока его локально не облучить светом. Во-вторых, нацеленное общепринятое лекарственное средство связывается и действует также в нежелательных мишенях, предоставляющих объект нацеливания, в то время как нацеленный фотосенсибилизатор активируется только в соответствующей облученной области.
Таким образом, в широком аспекте настоящее изобретение относится к применению конъюгата содержащего RGD пептида или пептидомиметика RGD и хлорофилльного или бактериохлорофилльного фотосенсибилизатора для минимально инвазивной нацеленной на опухоль визуализации, нацеленной на опухоль PDT и/или интерактивного прогнозирования некротических опухолей.
Термины "содержащий RGD пептид" или "пептид RGD" используют в настоящем документе взаимозаменяемо, и они означают пептид, содержащий последовательность Arg-Gly-Asp (RGD), также называемую мотивом RGD. Термин "пептидомиметик RGD", как используют в настоящем документе, относится к соединениям, в частности, непептидным соединениям, которые имитируют пептиды и имеют мотив RGD.
Известно, что пептиды RGD взаимодействуют с интегриновыми рецепторами клеток и имеют потенциал к инициации процессов передачи сигнала в клетках и влиянию на многие заболевания. По этим причинам, участок связывания интегрина RGD считается привлекательной фармацевтической мишенью.
Содержащий RGD пептид может представлять собой линейный или циклический пептид, состоящий из 4-100, предпочтительно, 5-50, 5-30, 5-20 или, более предпочтительно, 5-10, аминокислотных остатков. В предпочтительных вариантах осуществления, пептид RGD состоит из 4, 5, 6, 7, 9 или 25, наиболее предпочтительно, из 5 аминокислотных остатков.
Как используют в настоящем документе, термин "аминокислота" включает 20 природных аминокислот, а также неприродные аминокислоты.
Примеры природных аминокислот, подходящих для изобретения, включают, но ими не ограничиваются, Ala, Arg, Asp, Asn, Cys, His, Gln, Glu, Gly, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr и Val.
Примеры неприродных аминокислот включают, но ими не ограничиваются, 4-аминомасляную кислоту (Abu), 2-аминоадипиновую кислоту, диаминопропионовую (Dap) кислоту, гидроксилизин, гомосерин, гомовалин, гомолейцин, норлейцин (Nle), норвалин (Nva), орнитин (Orn), TIC, нафтилаланин (Nal), производные Phe с метилированным кольцом, галогенированные производные Phe или o-метил-Tyr.
Термин "аминокислота" в настоящем документе также включает модифицированные аминокислоты, с такими модификациями, которые происходят посттрансляционно in vivo, например, гидроксипролин, фосфосерин и фосфотреонин; D-модификацией; ацилированием или алкилированием, предпочтительно, метилированием, N-концевой группы или свободной аминогруппы Lys; этерификацией или амидацией C-концевой группы или свободной карбоксигруппы Asp или Glu; и образование сложного или простого эфира гидроксильной группы Ser или Tyr.
Термин "аминокислота" включает как D-, так и L-аминокислоты. Таким образом, пептиды, используемые в конъюгатах по изобретению, могут иметь полностью D- (за исключением глицина), полностью L- или L,D-аминокислоты. D-модификации аминокислот и N-алкилирование пептидной связи являются наиболее полезными для предотвращения расщепления пептида ферментами в организме. В настоящем изобретении D-аминокислота обозначается строчной буквой, как в случае остатка "f" D-фенилаланина в пептиде цикло-RGDfK с SEQ ID NO:1, используемом в настоящем документе.
Настоящее изобретение также включает циклические пептиды. Пептиды можно подвергать циклизации различными способами, такими как образование дисульфидов, сульфидов и, особенно, образование лактамов между карбоксильными и аминогруппами N- и C-концов или боковых цепей аминокислот. Циклизацию можно проводить любым способом, известным в данной области, например, посредством образования амидной связи, например, путем включения Glu, Asp, Lys, Orn, диаминомасляной (Dab) кислоты, диаминопропионовой (Dap) кислоты в различные положения в цепи (связи -CO-NH или -NH-CO). Циклизацию основной цепи с основной цепью также можно проводить путем включения модифицированных аминокислот формул H-N((CH2)n-COOH)-C(R)H-COOH или H-N((CH2)n-NH2)-C(R)H-COOH, где n=1-4, и, кроме того, где R представляет собой любую природную или неприродную боковую цепь аминокислоты.
Циклизацию также можно проводить путем образования связей S-S посредством встраивания двух остатков Cys. Кроме того, циклизацию боковой цепи с боковой цепью можно проводить путем образования связи взаимодействия формулы -(CH2)n-S-CH2-CO-, где n=1 или 2, которое возможно, например, путем включения Cys или гомо-Cys и реакцией свободной SH-группы, например, с бромацетилированным Lys, Orn, Dab или Dap.
В некоторых вариантах осуществления пептиды RGD могут представлять собой пептиды, описанные в документах US 6576239, EP 0927045 и WO 2008/023378, которые включены в настоящий документ в качестве ссылок в полном объеме. В одном из предпочтительных вариантов осуществления пептид, используемый в соответствии с изобретением, представляет собой циклический пентапептид RGDfK с SEQ ID NO:1, где "f" указывает на остаток D-Phe.
В другом предпочтительном варианте осуществления пептид представляет собой циклический пентапептид RADfK SEQ ID NO:2, его используют в настоящем документе для того, чтобы показать значение мотива RGD для связывания с рецепторами интегринов. Другой циклопептид, пригодный согласно изобретению, представляет собой нонапептид CDCRGDCGC с SEQ ID NO:9, обозначаемый в настоящем документе как "RGD-4C", который содержит четыре остатка цистеина, образующих две дисульфидные связи в молекуле.
Остаток аспарагиновой кислоты мотива RGD является высоко чувствительным к химической деградации, ведущей к потере биологической активности, и эту деградацию можно предотвращать циклизацией через дисульфидную связь. Вместе с повышенной стабильностью, циклические пептиды демонстрируют более высокую эффективность по сравнению с линейными пептидами в отношении ингибирования присоединения витронектина к клеткам. Количество и структура остатков, фланкирующих последовательность RGD в синтетических пептидах, имеют значительное влияние на то, как последовательность распознается отдельными рецепторами интегринов. Ароматический остаток может иметь особое значение в создании пригодных контактов в участке связывания интегрина. Циклические пептиды RGD, нацеленные на αvβ3, интернализуются путем независимого от интегрина каскада жидкофазного эндоцитоза, который не изменяет количество функциональных рецепторов интегринов на клеточной поверхности. Кроме того, циклические пептиды RGD остаются или деградируют в лизосоме в процессе, который достигает насыщения через 15 минут, и только небольшая часть может выходить из лизосомы и достигать цитоплазмы клетки.
В других предпочтительных вариантах осуществления пептид RGD выбран из циклических пептидов: (i) тетрапептида цикло-RGDK (SEQ ID NO:3), пентапептида цикло-RGDf-n(Me)K (SEQ ID NO:4), где f указывает на D-Phe и пептидная связь между f и K является метилированной; и пентапептида цикло-RGDyK (SEQ ID NO:5), где y указывает на D-Tyr.
В другом варианте осуществления содержащий RGD пептид является линейным и может быть выбран из гексапептида GRGDSP (SEQ ID NO:6), гептапептида GRGDSPK (SEQ ID NO:7) и 25-мера(GRGDSP)4K (SEQ ID NO:8). В одном из предпочтительных вариантов осуществления, линейный пептид представляет собой GRGDSP.
В одном варианте осуществления изобретения пептид RGD связан прямо с хлорофилльным или бактериохлорофилльным макроциклом фотосенсибилизатора через функциональную группу на его периферии, например, COOH, образуя амидную группу CO-NH2 с N-концевой группой или свободной аминогруппой пептида RGD.
В другом варианте осуществления пептид RGD связан с макроциклом фотосенсибилизатора через спейсерное звено/связывающую группу, такую как, но не ограничиваясь ими, C1-C25-гидрокарбилен, предпочтительно, C1-C10алкилен или фенилен, замещенный концевой функциональной группой, такой как OH, COOH, SO3H, COSH или NH2, таким образом, образуя простую эфирную, сложную эфирную, амидную, тиоамидную или сульфонамидную группу.
В некоторых вариантах осуществления фотосенсибилизатор конъюгирован с пептидомиметиком RGd.
В одном из предпочтительных вариантов осуществления пептидомиметик RGD представляет собой непептидное соединение, содержащее гуанидин и С-концевые группы, разделенные цепью из 11 атомов, причем по меньшей мере 5 из указанных атомов представляют собой атомы углерода, и указанная цепь содержит один или несколько атомов O, S или N и необязательно может быть замещена оксо, тиоксо, галогеном, амино, C1-C6-алкилом, гидроксилом или карбокси, или один или несколько атомов указанной цепи могут образовывать 3-6-членное карбоциклическое или гетероциклическое кольцо. Соединения этого типа описаны в WO 93/09795 и WO 2008/023378 того же заявителя, включенных в настоящий документ в качестве ссылок в полном объеме, как полностью раскрытые в настоящем документе. В предпочтительных вариантах осуществления указанный выше пептидомиметик RGD содержит в цепи атомы N и замещен оксогруппой. В более предпочтительном варианте осуществления пептидомиметик RGD имеет формулу:
H2N-C(=NH)NH-(CH2)5-CO-NH-CH(CH2)-(CH2)2-COOH или -NH-RGD-CO-NH-(CH2)2-пиперазино-(CH2)2-NH-.
Фотосенсибилизатор, который можно использовать в изобретении, представляет собой производное хлорофилла или бактериохлорофилла, которое может быть природным или синтетическим неприродным производным хлорофилла или бактериохлорофилла, включая соединения, в которых внесены модификации в макроцикл и/или на периферии, и/или центральный атом Mg может отсутствовать или он заменен атомом другого металла, подходящего для диагностики и/или для PDT.
В предпочтительных вариантах осуществления изобретение относится к конъюгату, где фотосенсибилизатор представляет собой хлорофилл или бактериохлорофилл формулы I, II или III:



где M представляет собой 2H или атом, выбранный из группы, состоящей из Mg, Pd, Pt, Co, Ni, Sn, Cu, Zn, Mn, In, Eu, Fe, Au, Al, Gd, Dy, Er, Yb, Lu, Ga, Y, Rh, Ru, Si, Ge, Cr, Mo, P, Re, Tl и Tc и их изотопов и радиоизотопов;
X представляет собой O или N-R7;
каждый из R1, R′2 и R6 независимо представляет собой Y-R8, -NR9R′9 или -N+R9R′9R″9A- или R1 и R6 в формуле II вместе с атомами углерода, к которым они присоединены, образуют кольцо, содержащее пептид RGD или пептидомиметик RGD;
Y представляет собой O или S;
R2 представляет собой H, OH или COOR9;
R3 представляет собой H, OH, C1-C12алкил или C1-C12алкокси;
R4 представляет собой -CH=CR9R′9, -CH=CR9Hal, -CH=CH-CH2-NR9R′9, -CH=CH-CH2-N+R9R′9R″9A-, -CHO, -CH=NR9, -CH=N+R9R′9A-, -CH2-OR9, -CH2-SR9, -CH2-Hal, -CH2-R9, -CH2-NR9R′9, -CH2-N+R9R′9R″9A-, -CH2-CH2R9, -CH2-CH2Hal, -CH2-CH2OR9, -CH2-CH2SR9, -CH2-CH2-NR9R′9, -CH2-CH2-N+R9R′9R″9A-, -COCH3, C(CH3)=CR9R′9, -C(CH3)=CR9Hal, -C(CH3)=NR9, -CH(CH3)=N+R9R′9A-, -CH(CH3)-Hal, -CH(CH3)-OR9, -CH(CH3)-SR9, -CH(CH3)-NR9R′9, -CH(CH3)-N+R9R′9R′9A- или -C≡CR9;
R′4 представляет собой метил или формил;
R5 представляет собой =O, =S, =N-R9, =N+R9R′9A-, =CR9R′9 или =CR9-Hal;
каждый из R7, R8, R9, R′9 и R″9 независимо представляет собой:
(a) H;
(b) C1-C25гидрокарбил;
(c) C1-C25 гидрокарбил, предпочтительно, C1-C25алкил, алкенил или алкинил, более предпочтительно, C1-C10 или C1-C6алкил, замещенный одной или несколькими функциональными группами, выбранными из группы, состоящей из галогена, нитро, оксо, OR, SR, эпокси, эпитио, -CONRR′, -COR, COOR, -OSO3R, -SO3R, -SO2R, -NHSO2R, - SO2NRR′-NRR′, =N-OR, =N-NRR′, -C(=NR)-NRR′-NR-NRR′, -(R)N-C(=NR)-NRR′, O←NR-, >C=NR, -(CH2)n-NR-COR′, -(CH2)n-CO-NRR′, -O-(CH2)n-OR, -O-(CH2)n-O-(CH2)n-R, -PRR′, -OPO3RR′, -PO2HR и -PO3RR′, где каждый из R и R′ независимо представляет собой H, гидрокарбил или гетероциклил и R″ представляет собой гидрокарбил или гетероциклил;
(d) C1-C25гидрокарбил, предпочтительно, C1-C25алкил, более предпочтительно, C1-C10 или C1-C6алкил, замещенный одной или несколькими функциональными группами, выбранными из группы, состоящей из положительно заряженных групп, отрицательно заряженных групп, основных групп, которые в физиологических условиях превращаются в положительно заряженные группы, и кислотных групп, которые в физиологических условиях превращаются в отрицательно заряженные группы;
(e) C1-C25гидрокарбил, предпочтительно, C1-C25алкил, более предпочтительно, C1-C10 или C1-C6алкил, содержащий один или несколько гетероатомов и/или одну или несколько карбоциклических или гетероциклических групп;
(f) C1-C25гидрокарбил, предпочтительно, C1-C25алкил, более предпочтительно, C1-C10 или C1-C6алкил, содержащий один или несколько гетероатомов и/или одну или несколько карбоциклических или гетероциклических групп и замещенный одной или несколькими функциональными группами, как определено в (c) и (d), выше;
(g) C1-C25гидрокарбил, предпочтительно, C1-C25алкил, более предпочтительно, C1-C10 или C1-C6алкил, замещенный остатком аминокислоты, пептида, предпочтительно, пептида RGD, белка, моносахарида, олигосахарида, полисахарида или полидентатного лиганда и его хелатирующего комплекса с металлами; или
(h) остаток аминокислоты, пептида, предпочтительно, пептида RGD, белка, моносахарида, олигосахарида, полисахарида или полидентатного лиганда и его хелатирующего комплекса с металлами;
R7, кроме того, может представлять собой -NRR′, где каждый из R и R′ представляет собой H или C1-C25гидрокарбил, предпочтительно, C1-C25алкил, более предпочтительно, C1-C10 или C1-C6алкил, необязательно замещенный отрицательно заряженной группой, предпочтительно, SO3-;
R8, кроме того, может представлять собой H+ или катион , когда каждый из R1, R′2 и R6 независимо представляет собой Y-R8;

A представляет собой физиологически приемлемый анион;
m равно 0 или 1;
пунктирная линия в положениях 7-8 представляет собой необязательную двойную связь; и
их фармацевтически приемлемые соли и оптические изомеры;
и указанное производное хлорофилла или бактериохлорофилла формулы I, II или III содержит по меньшей мере один содержащий RGD пептидный остаток.
В одном из вариантов осуществления пунктирная линия в положениях 7-8 представляет собой двойную связь и фотосенсибилизатор представляет собой хлорофилл формулы I, II или III. Соединения формулы I, где M представляет собой Mg, R1 в положении 173 представляет собой фитилокси, R2 в положении 132 представляет собой COOCH3, R3 в положении 132 представляет собой атом H, R5 представляет собой O, R4 в положении 3 представляет собой винил, пунктирная линия в положениях 7-8 представляет собой двойную связь, и либо R′4 представляет собой метил в положении 7 и R4 представляет собой этил в положении 8, либо R′4 представляет собой формил в положении 7 и R4 представляет собой этил в положении 8, представляют собой хлорофилл a и b, соответственно, и их производные могут иметь различные атомы металлов и/или различные заместители R1, R2, R3, R4, R′4 и/или R5.
В другом варианте осуществления положения 7-8 являются гидрогенизированными и фотосенсибилизатор представляет собой бактериохлорофилл формул I, II или III. Соединения формулы I, где M представляет собой Mg, R1 положении 173 представляет собой фитилокси или геранилгеранилокси, R2 в положении 132 представляет собой COOCH3, R3 в положении 132 представляет собой атом H, R5 представляет собой O, R4 в положении 3 представляет собой ацетил и в положении 8 представляет собой этил, и пунктирная линия в положениях 7-8 отсутствует, представляют собой бактериохлорофилл a, и их производные могут иметь различные атомы металлов и/или различные заместители R1, R2, R3, R4 и/или R5.
Как используют в настоящем документе, термин "гидрокарбил" означает прямые или разветвленные, насыщенные или ненасыщенные, нециклические или циклические, в том числе ароматические, гидрокарбильные радикалы, из 1-25 атомов углерода, предпочтительно, из 1-20, более предпочтительно, 1-6, наиболее предпочтительно, 2-3 атомов углерода. Гидрокарбил может представлять собой алкильный радикал, предпочтительно, из 1-4 атомов углерода, например, метил, этил, пропил, бутил, или алкенил, алкинил, циклоалкил, арил, такой как фенильная или аралкильная группа, такая как бензил, или в положении 17 соединений формулы I, II или III он представляет собой радикал, образованный из природных соединений Chl и Bchl, например, геранилгеранил-(2,6-диметил-2,6-октадфенил) или фитил-(2,6,10,14-тетраметилгексадец-14-ен-16-ил).
Как используют в настоящем документе, термин "карбоциклическая группа" относится к моноциклическому или полициклическому соединению, содержащему только атомы углерода в кольце(ах). Карбоциклическая группа может быть насыщенной, т.е. циклоалкильной, или ненасыщенной, т.е. циклоалкенильной, или ароматической, т.е. арильной.
Термин "алкокси", как используют в настоящем документе, относится к группе (C1-C25)алкил-O-, где C1-C25алкил является таким, как определено выше. Примерами алкокси являются метокси, этокси, н-пропокси, изопропокси, бутокси, изобутокси, трет-бутокси, пентокси, гексоки, -OC15H31, -OC16H33, -OC17H35, -OC18H37 и т.п. Термин "арилокси", как используют в настоящем документе, относится к группе (C6-C18)арил-O-, где C6-C18арил является таким, как определено выше, например, фенокси и нафтокси.
Термины "гетероарил" или "гетероциклическая группа" или "гетероароматический" или "гетероциклил", как используют в настоящем документе, означает радикал, образованный из моно- или полициклического гетероароматического кольца, содержащего от одного до трех гетероатомов, выбранных из группы, состоящей из O, S и N. Конкретными примерами являются пирролил, фурил, тиенил, пиразолил, имидазолил, оксазолил, тиазолил, пиридил, хинолинил, пиримидинил, 1,3,4-триазинил, 1,2,3-триазинил, 1,3,5-триазинил, бензофурил, изобензофурил, индолил, имидазо[1,2-a]пиридил, бензимидазолил, бензтиазолил и бензоксазолил.
Любые "карбоциклическая группа", "арил" или "гетероарил" могут быть замещены одним или несколькими радикалами, такими как галоген, C6-C14арил, C1-C25алкил, нитро, OR, SR, -COR, -COOR, -SO3R, -SO2R, -NHSO2R, -NRR′, -(CH2)n-NR-COR′ и -(CH2)n-CO-NRR′. Следует понимать, что когда полициклическое гетероароматическое кольцо является замещенным, замены могут быть в любом из карбоциклических и/или гетероциклических колец.
Термин "галоген", как используют в настоящем документе, относится к фтору, хлору, брому или йоду.
В одном из вариантов осуществления изобретения фотосенсибилизатор конъюгата представляет собой хлорофилл или бактериохлорофилл формулы I, II или III, содержащий по меньшей мере одну отрицательно заряженную группу и/или по меньшей мере одну кислотную группу, которая превращается в отрицательно заряженную группу при физиологических pH. Как определено в настоящем документе, "отрицательно заряженная группа" представляет собой анион, образованный из кислоты, и она включает карбоксилат (COO-), тиокарбоксилат (COS-), сульфонат (SO3-) и фосфонат (PO3-), и "кислотная группа, которая превращается в отрицательно заряженную группу в физиологических условиях", включает группы карбоновых (-COOH), тиокарбоновых (-COSH), сульфоновых (-SO3H) и фосфоновых (-PO3H2) кислот. Производные BChl с отрицательно заряженными группами, или группами, превращающимися в них в физиологических условиях, описаны в WO 2004/045492 того же заявителя, включенной в настоящий документ в качестве ссылки в полном объеме как полностью раскрытая в настоящем документе.
В более предпочтительном варианте осуществления фотосенсибилизатор в конъюгате по изобретению представляет собой хлорофилл или бактериохлорофилл формулы II, где R6 представляет собой -NR9R′9, R9 представляет собой H и R′9 представляет собой C1-C10алкил, замещенный SO3H или его щелочной солью. Наиболее предпочтительно, конъюгат содержит производное бактериохлорофилла формулы II, где R6 представляет собой -NH-(CH2)2-SO3K или -NH-(CH2)3-SO3K.
В другом варианте осуществления изобретения фотосенсибилизатор конъюгата представляет собой хлорофилл или бактериохлорофилл формулы I, II или III, содержащий по меньшей мере одну положительно заряженную группу и/или по меньшей мере одну основную группу, которая превращается в положительно заряженную группу при физиологических pH.
Как определено в настоящем документе, "положительно заряженная группа" означает катион, образованный из N-содержащей группы или из ониевой группы, не содержащей N. Поскольку эндотелий опухоли характеризуется повышенным количеством анионных областей, положительно заряженные группы или основные группы, которые превращаются в положительно заряженные группы в физиологических условиях, могут усиливать эффективность нацеливания конъюгатов по настоящему изобретению.
"Катион, образованный из N-содержащей группы", как используют в настоящем документе, означает, например, но не ограничивается ими, аммонийную группу -N+(RR′R″), гидразиния -(R)N-N+(R′R″), аммонийокси O←N+(RR′)-, иминия >C=N+(RR′), амидиния -C(=RN)-N+R′R″ или гуанидиния -(R)N-C(=NR)-N+R′R″, где каждый из R, R′ и R″ независимо представляет собой H, гидрокарбил, предпочтительно, C1-C6алкил, как определено в настоящем документе, фенил или бензил, или гетероциклил, или в аммонийной группе один из R, R′ и R″ может представлять собой OH, или два из R, R′ и R″ в аммонийной группе или R и R′ в группах гидразиния, аммонийокси, иминия, амидиния или гуанидиния, вместе с атомом N, к которому они присоединены, образуют 3-7-членное насыщенное кольцо, необязательно содержащее один или несколько гетероатомов, выбранных из группы, состоящей из O, S или N, и, кроме того, необязательно замещенных в дополнительном атоме N, или указанный катион образован из соединения, содержащего один или несколько атомов N в гетероароматическом кольце.
В одном более предпочтительном варианте осуществления конъюгат по настоящему изобретению содержит аммонийную группу формулы -N+(RR′R″), где каждый из R, R′ и R″ независимо представляет собой H или необязательно замещенный гидрокарбил или гетероциклил, как определено в настоящем документе, или один из них может представлять собой OH. Аммонийная группа -N+(RR′R″) может представлять собой вторичный аммоний, где любые два из радикалов R, R′ или R″ представляют собой H; третичный аммоний, где только один из R, R′ или R″ представляет собой H; или четвертичный аммоний, где каждый из R, R′ или R″ представляет собой необязательно замещенную гидрокарбильную или гетероциклильную группу, как определено в настоящем документе. Когда один из R, R′ или R″ представляет собой OH, группа представляет собой группу гидроксиламмония. Предпочтительно, аммонийная группа представляет собой группу четвертичного аммония, где каждый из R, R′ и R″ представляет собой C1-C6алкил, такой как метил, этил, пропил, бутил, гексил. Аммонийная группа может представлять собой концевую группу в молекуле или она может находиться в алкильной цепи в молекуле.
В группах гидразиния -(R)N-N+(R′R″), амидиния -C(=NR)-N+R′R″ и гуанидиния -(R)N-C(=NR)-N+R′R″, каждый из R, R′ и R″ может независимо представлять собой H или гидрокарбил или гетероциклил, или R′ и R″ вместе с атомом N, к которому они присоединены, образуют 3-7-членное насыщенное кольцо, как определено в настоящем документе. Примеры таких групп включают группы, где R представляет собой H, и каждый из R′ и R″ представляет собой C1-C6алкил, такой как метил, этил, пропил, бутил, гексил.
В группах аммонийокси O←N+(RR′)- и иминия >C=N+(RR′), каждый из R и R′ может независимо представлять собой H или гидрокарбил, предпочтительно, C1-C6алкил, или гетероциклил, или R и R′ вместе с атомом N, к которому они присоединены, образуют 3-7-членное насыщенное кольцо, как определено в настоящем документе.
В другом предпочтительном варианте осуществления, производное хлорофилла или бактериохлорофилла содержит циклическую аммонийную группу формулы -N+(RR′R″), где два из R, R′ и R″ вместе с атомом N образуют 3-7-членное насыщенное кольцо, определенное в настоящем документе ниже.
Как определено в настоящем документе, "3-7-членное насыщенное кольцо", образованное двумя из R, R′ и R″ вместе с атомом N, к которому они присоединены, может представлять собой кольцо, содержащее только N, такое как азиридин, пирролидин, пиперидин, пиперазин или азепин, или оно может содержать другой гетероатом, выбранный из O и S, такое как морфолин или тиоморфолин. Кроме того, атом N в кольце пиперазина необязательно может быть замещен алкилом, например C1-C6алкилом, который может быть замещен галогеном, OH или амино. Ониевые группы, образованные из указанных насыщенных колец, включают азиридиний, пирролидиний, пиперидиний, пиперазиний, морфолиний, тиоморфолиний и азепиний.
Как определено в настоящем документе "катион, образованный из N-содержащего гетероароматического радикала", означает катион, образованный из N-гетероароматического соединения, которое может представлять собой моно- или полициклическое соединение, необязательно содержащее O, S или дополнительные атомы N. Кольцо, из которого образован катион, должно содержать по меньшей мере один атом N и должно быть ароматическим, но другое кольцо(а), в случае их наличия, может быть частично насыщенным. Примеры N-гетероароматических катионов включают пиразолий, имидазолий, оксазолий, тиазолий, пиридиний, пиримидиний, хинолиний, изохинолиний, 1,2,4-триазиний, 1,3,5-триазиний и пуриний.
Положительно заряженная группа также может представлять собой ониевую группу, не содержащую азот, такую как, но не ограничиваясь ими, группа фосфония [-P+(RR′R″)], арсония [-As+(RR′R″)], оксония [-O+(RR′)], сульфония [-S+(RR′)], селенония [-Se+(RR′)], теллурония [-Te+(RR′)], стибония [-Sb+(RR′R″)], или висмутония [-Bi+(RR′R″)], где каждый из R, R′и R″ независимо представляет собой H, гидрокарбил или гетероциклил, предпочтительно, C1-C6алкил, такой как метил, этил, пропил, бутил, пентил или гексил или арил, предпочтительно, фенил.
Примеры групп фосфония формулы -P+(RR′R″) включают группы, где каждый из R, R′ и R″ представляет собой метил, этил, пропил, бутил или фенил, или R представляет собой метил, этил, пропил, бутил или гексил, и оба из R′ и R″ представляют собой фенил. Примеры групп арсония формулы -As+(RR′R″) включают группы, где каждый из R, R′ и R″ представляет собой метил, этил, пропил, бутил или фенил. Примеры групп сульфония формулы -S+(RR′) включают группы, где каждый из R и R′ представляет собой метил, этил, пропил, бутил, фенил, бензил, фенэтил или замещенную гидрокарбильную группу.
Как определено в настоящем документе, "основная группа, которая превращается в положительно заряженную группу в физиологических условиях," представляет собой по меньшей мере теоретически, любую основную группу, которая образует в физиологических условиях положительно заряженную группу, как определено в настоящем документе. Следует отметить, что физиологические условия, как используют в настоящем документе, относятся не только к сыворотке, но к различным тканям и клеточным компартментам в организме.
Примеры таких N-содержащих основных групп включают, но ими не ограничиваются, любую аминогруппу, которая образует аммонийную группу, любую иминогруппу, которая образует группу иминия, любую группу гидразина, которая образует группу гидразиния, любую аминоксигруппу, которая образует группу аммонийокси, любую амидиногруппу, которая образует группу амидиния, любую группу гуанидина, которая образует группу гуанидиния, все из них, как определено в настоящем документе. Другие примеры включают фосфино и меркаптогруппы.
Таким образом, конъюгаты по настоящему изобретению могут содержать по меньшей мере одну основную группу, которая превращается в положительно заряженную группу в физиологических условиях, такую как -NRR′, -C(=NR)-NR′R″, -NR-NR′R″, -(R)N-C(=NR)-NR′R″, O←NR- или >C=NR, где каждый из R, R′ и R″ независимо представляет собой H, гидрокарбил, предпочтительно, C1-C25алкил, более предпочтительно, C1-C10 или C1-C6алкил, или гетероциклил, или два из R, R′ и R″ вместе с атомом N образует 3-7-членное насыщенное кольцо, необязательно содержащее атом O, S или N и необязательно дополнительно замещенное на дополнительном атоме N, или основная группа представляет собой N-содержащий гетероароматический радикал.
3-7-членное насыщенное кольцо может представлять собой азиридин, пирролидин, пиперидин, морфолин, тиоморфолин, азепин или пиперазин, необязательно замещенный на дополнительном атоме N C1-C6алкилом, необязательно замещенным галогеном, гидроксилом или амино, и N-содержащий гетероароматический радикал может представлять собой пиразолил, имидазолил, оксазолил, тиазолил, пиридил, хинолинил, изохинолинил, пиримидил, 1,2,4-триазинил, 1,3,5-триазинил или пуринил.
Производные BChl с положительно заряженными группами или группами, превращающимся в них в физиологических условиях, описаны в WO 2005/120573 того же заявителя, включенной в настоящий документ в качестве ссылки в полном объеме как полностью раскрытая в настоящем документе.
В одном варианте осуществления фотосенсибилизатор представляет собой хлорофилл или бактериохлорофилл формулы II и R6 представляет собой основную группу -NR9R′9, где R9 представляет собой H и R′9 представляет собой C1-C6алкил, замещенный основной группой -NRR′ или -NH-(CH2)2-6-NRR′, где каждый из R и R′ независимо представляет собой H, C1-C6алкил, необязательно замещенный NH2, или R и R′ вместе с атомом N образуют 5-6-членное насыщенное кольцо, необязательно содержащее атом O или N и, кроме того, необязательно замещенное на атоме N посредством -(CH2)2-6-NH2.
В другом варианте осуществления фотосенсибилизатор представляет собой бактериохлорофилл формулы II и R6 представляет собой -NH-(CH2)3-NH-(CH2)3-NH2, -NH-(CH2)2-1-морфолино или -NH-(CH2)3-пиперазино-(CH2)3-NH2.
В следующем варианте осуществления R1 и R6 вместе образуют циклическое кольцо, содержащее пептид RGD или пептидомиметик RGD.
В другом варианте осуществления фотосенсибилизатор представляет собой хлорофилл или бактериохлорофилл формулы III, X представляет собой -NR7, R7 представляет собой -NRR′, R представляет собой H, и R′ представляет собой C1-C6алкил, замещенный SO3- или его щелочной солью, предпочтительно, фотосенсибилизатор представляет собой бактериохлорофилл, и X представляет собой -NR7, и R7 представляет собой -NH-(CH2)3-SO3K.
В другом варианте осуществления каждый из R7, R8, R9 или R′9 представляет собой C1-C6алкил, замещенный одной или несколькими группами -OH. Например, фотосенсибилизатор представляет собой хлорофилл или бактериохлорофилл формулы II и R6 представляет собой -NR9R′9, R9 представляет собой H, и R′9 представляет собой HOCH2-CH(OH)-CH2-.
В другом варианте осуществления фотосенсибилизатор представляет собой хлорофилл или бактериохлорофилл формулы II и R6 представляет собой -NR9R′9; R9 представляет собой H, и R′9 представляет собой C1-C6алкил, замещенный полидентатным лигандом или его хелатирующими комплексами с металлами. Примеры полидентатных лигандов включают, но ими не ограничиваются, EDTA (этилендиаминтетрауксусная кислота), DTPA (диэтилентриаминпентауксусная кислота) или макроциклический лиганд DOTA. В одном из предпочтительных вариантов осуществления полидентатный лиганд представляет собой DTPA, R6 представляет собой -NH-(CH2)3-NH-DTPA и металл представляет собой Gd.
Катион 

Как определено в настоящем документе, C1-C25гидрокарбил, определенный для R7, R8, R9 и R′9, необязательно может быть замещен одной или несколькими функциональными группами, выбранными из галогена, нитро, оксо, OR, SR, эпокси, эпитио, азиридин, -CONRR′, -COR, COOR, -OSO3R, -SO3R, -SO2R, -NHSO2R, -SO2NRR′-NRR′, =N-OR, =N-NRR′, -C(=NR)-NRR′-NR-NRR′, -(R)N-C(=NR)-NRR', O←NR-, >C=NR, -(CH2)n-NR-COR′-(CH2)n-CO-NRR′, -O-(CH2)n-OR, -O-(CH2)n-O-(CH2)n-R, -PRR′, -OPO3RR′, -PO2HR, -PO3RR′; одной или несколькими отрицательно заряженными группами, такими как COO-, COS-, -OSO3-, -SO3-, -OPO3R-, -PO2H-, -PO32- и -PO3R-; и/или одной или несколькими положительно заряженными группами, такими как -P+(RR′R″), -As+(RR′R″), -O+(RR′), -S+(RR′), -Se+(RR′), -Te+(RR′), -Sb+(RR′R″), -Bi+(RR′R″), O←N+(RR′), >C=N+(RR″), -N+(RR′R″), -(R)N-N+(RR′R″), -(R)N-C(=HN)-N+RR′R″, -C(=NH)-N+(RR′R″), или N-гетероароматический катион, такой как пиразолий, имидазолий, оксазолий, тиазолий, пиридиний, хинолиний, пиримидиний, 1,2,4-триазиний, 1,3,5-триазиний и пуриний; где n представляет собой целое число от 1 до 6, каждый из R, R′ и R″ независимо представляет собой H, гидрокарбил или гетероциклил, или два из R, R′ и R″ вместе с атомом N, к которому они присоединены, образуют 3-7-членное насыщенное кольцо, необязательно содержащее один или несколько гетероатомов, выбранных из группы, состоящей из O, S или N, и, кроме того, необязательно замещенные на дополнительном атоме N. C1-C25гидрокарбил, определенный для R7, R8, R9 и R′9, также может быть замещен остатком моно-, олиго- или полисахарида, таким как гликозил, или аминокислоты, пептида или белка, предпочтительно, пептида RGD. Кроме того, каждый из R8, R9 и R′9 может независимо представлять собой остаток моно-, олиго- или полисахарида, такой как гликозил, или аминокислоты, пептида или белка, или полидентантный лиганд, такой как DTPA, DOTA, EDTA и т.п. и их хелатирующие комплексы с металлами.
Группы OR и SR, когда R представляет собой H, являются группами гидрокси и меркапто, соответственно, и когда R отличен от H, они являются простыми эфирами и сульфидами. Группа -PRR′ является группой фосфино, когда R и R′ представляют собой H. Группа -COR, когда R представляет собой H, является формильной группой -CHO альдегида, в то время как, когда R отличен от H, она является остатком кетона, таким как алкилкарбонильная и арилкарбонильная группы. Группа COOR, когда R не является H, представляет собой группу сложного эфира карбоновой кислоты, такую как алкоксикарбонильная и арилоксикарбонильная группы. Аналогично, в группах -OSO3R, -SO3R, -SO2R, - OPO3RR′, -PO2HR и -PO3RR′ представлены сложные эфиры, когда R и R′ отличны от H.
В одном из предпочтительных вариантов осуществления изобретения фотосенсибилизатор не имеет металла, а именно, M представляет собой 2H. В других предпочтительных вариантах осуществления, фотосенсибилизатор содержит металл, как определено в настоящем документе выше, более предпочтительно, M представляет собой Pd, Cu или Mn, наиболее предпочтительно, Pd или Cu.
В некоторых предпочтительных вариантах осуществления изобретения фотосенсибилизатор представляет собой Bchl формулы I, II или III, более предпочтительно, формулы II, и M представляет собой 2H, Cu, Mn или Pd. В других вариантах осуществления фотосенсибилизатор представляет собой Chl формулы I, II или III, более предпочтительно, формулы II, и M представляет собой 2H, Cu или Mn.
В некоторых предпочтительных вариантах осуществления конъюгат содержит фотосенсибилизатор Bchl формулы II, где M представляет собой Pd, Mn, Cu или 2H; m равно 0; R1 представляет собой NH-P, где P представляет собой остаток содержащего RGD пептида или пептидомиметика RGD, связанный с NH- прямо или через спейсер; R′2 представляет собой метокси; R4 в положении 3 представляет собой ацетил и в положении 8 представляет собой этил; R′4 представляет собой метил; и R6 представляет собой -NH-(CH2)n-SO3-Me+, где n равно 2 или 3 и Me+ представляет собой Na+ или K+.
В наиболее предпочтительном варианте осуществления изобретения конъюгат содержит Bchl формулы II, где M представляет собой 2H, R1 представляет собой NH-P, где P представляет собой остаток содержащего RGD пептида c(RGDfK) с SEQ ID NO:1, R′2 представляет собой метокси, R4 в положении 3 представляет собой ацетил и в положении 8 представляет собой этил, R′4 представляет собой метил и R6 представляет собой -NH-(CH2)2-SO3K, что представляет собой соединение, обозначаемое в настоящем документе как соединение 13 или c(RGDfK)-2H-MLT.
В другом наиболее предпочтительном варианте осуществления M представляет собой Pd и R1, R′2, R4, R′4, R6 являются такими, как определено выше, и P представляет собой c(RGDfK) с SEQ ID NO:1, что представляет собой соединение, обозначаемое в настоящем документе как соединение 24 или C(RGDfK)-Pd-MLT.
В более предпочтительном варианте осуществления M представляет собой Mn, R1, R′2, R4, R′4, R6 являются такими, как определено выше, и P представляет собой c(RGDfK), что представляет собой соединение, обозначаемое в настоящем документе как соединение 14 или c(RGDfK)-Mn-MLT, или M представляет собой Cu и конъюгат представляет собой соединение, обозначаемое в настоящем документе как соединение 15 или c(RGDfK)-Cu-MLT.
В следующем более предпочтительном варианте осуществления M в Bchl формулы II представляет собой 2H, R′2, R4, R′4 и R6 являются такими, как определено выше, и R1 представляет собой NH-P, где P представляет собой c(RADfK) с SEQ ID NO:2, что представляет собой соединение, обозначаемое в настоящем документе как соединение 45 или c(RADfK)-2H-MLT, или P представляет собой c(RGDyK) с SEQ ID NO:5.
В других предпочтительных вариантах осуществления M представляет собой 2H, R1, R′2, R4, R′4 и R6 являются такими, как определено выше, и P представляет собой линейный пептид, выбранный из GRGDSP с SEQ ID NO:6, или GRGDSPK с SEQ ID NO:7 или (GRGDSP)4 с SEQ ID NO:8, наиболее предпочтительно, P представляет собой GRGDSP и конъюгат представляет собой соединение, обозначаемое в настоящем документе как соединение 26 или линейный GRGDSP-2H-MLT.
В более предпочтительных вариантах осуществления в Bchl формулы II M представляет собой Pd, m равно 0, R1 представляет собой NH-P, где P представляет собой c(RGDfK), R′2 представляет собой метокси, R4 в положении 3 представляет собой ацетил и в положении 8 представляет собой этил, R′4 представляет собой метил, и R6 представляет собой -NH-(CH2)3-SO3 K, или P представляет собой циклопептид RGDf-n(Me)K с SEQ ID NO:4 и R6 представляет собой -NH-(CH2)2-SO3 K.
Более предпочтительные варианты осуществления, где центральный атом металла в Bchl формулы II представляет собой Pd; m, R′2, R4, R′4 являются такими, как определено выше, R1 представляет собой HH-P и R6 представляет собой -NH-(CH2)2-SO3K, относятся к конъюгатам с линейными пептидами GRGDSPK с SEQ ID NO:7 или (GRGDSP)4 с SEQ ID NO:8.
В другом более предпочтительном варианте осуществления конъюгат содержит Bchl формулы II, где M представляет собой Pd; m, R′2, R4, R′4 являются такими, как определено выше, R1 представляет собой NH-CH[(-(CH2)2-CO-NH-P]2, где P представляет собой остаток содержащего RGD пептида c(RGDyK) с SEQ ID NO:5, и R6 представляет собой -NH-(CH2)2-SO3K, что представляет собой соединение, обозначаемое в настоящем документе как соединение 36 или c(RGDyK)2-2H-MLT.
В двух других более предпочтительных вариантах осуществления изобретения в Bchl формулы II M представляет собой Pd или 2H; m равно 0; R1 представляет собой NH-P, где P представляет собой остаток c(RGDfK) (SEQ ID NO:1), R′2 представляет собой метокси; R4 в положении 3 представляет собой ацетил и в положении 8 представляет собой этил; R′4 представляет собой метил и R6 представляет собой -NH-CH2-CH(OH)-CH2OH.
В других более предпочтительных вариантах осуществления конъюгаты содержат пептид RGD, как указано выше, предпочтительно, c(RGDfK), конъюгированный с Bchl формулы II, где M представляет собой 2H; m, R1, R′2, R4, R′4 являются такими, как определено выше, и R6 представляет собой либо NH-(CH2)3-NH-(CH2)3-NH2, либо -NH-(CH2)2-морфолино, либо -NH-(CH2)3-пиперазино-(CH2)3-NH2.
Более предпочтительные варианты осуществления относятся к конъюгатам, содержащим Bchl формулы II, где M представляет собой 2H; m равно 0; R1 представляет собой NH-c(RGDfK), R′2 представляет собой метокси, R4 в положении 3 представляет собой ацетил и в положении 8 представляет собой этил, R′4 представляет собой метил; и R6 представляет собой -NH-(CH2)3-NH-CO-DTPA или его хелатный комплекс с Gd.
Кроме того, изобретение относится к предпочтительным конъюгатам, которые содержат фотосенсибилизатор Bchl формулы II, где M представляет собой Pd или 2H; m равно 0; R1 представляет собой NH-P, где P представляет собой остаток пептидомиметика RGD, связанный прямо или через спейсер с NH-; R′2 представляет собой метокси; R4 в положении 3 представляет собой ацетил и в положении 8 представляет собой этил; R′4 представляет собой метил; и R6 представляет собой -NH-CH2-CH(OH)-CH2-OH или -NH-(CH2)2-SO3K.
В другом варианте осуществления изобретения конъюгат содержит Bchl формулы III, где M представляет собой Pd; R1 представляет собой NH-P, где P представляет собой остаток содержащего RGD пептида или пептидомиметика RGD, связанный прямо или через спейсер с NH-; R4 в положении 3 представляет собой ацетил и в положении 8 представляет собой этил; R′4 представляет собой метил; X представляет собой N-R7 и R7 представляет собой -NH-(CH2)3-SO3″Me+, где Me+ представляет собой Na+ или K+.
В другом варианте осуществления конъюгат содержит Bchl формулы I, где M представляет собой Mn; R1 представляет собой NH-P, где P представляет собой остаток содержащего RGD пептида или пептидомиметика RGD, связанный прямо или через спейсер с NH-; R2 представляет собой OH; R3 представляет собой COOCH3; R4 в положении 3 представляет собой ацетил и в положении 8 представляет собой этил; R′4 представляет собой метил; и R5 представляет собой O. В более предпочтительных вариантах осуществления, M представляет собой 2H или Mn, и P представляет собой остаток содержащего RGD пептида c(RGDfK) с SEQ ID NO:1 или c(RGDK) с SEQ ID NO:3.
В другом варианте осуществления конъюгат содержит Chl формулы II, где M выбран из Mn, Cu или 2H; R1 представляет собой NH-P, где P представляет собой остаток содержащего RGD пептида или пептидомиметика RGD, связанный прямо или через спейсер с NH-; R4 в положении 3 представляет собой винил и в положении 8 представляет собой этил; R′4 представляет собой метил; и R6 представляет собой -NH-(CH2)2-SO3″Me+, где Me+ представляет собой Na+ или K+.
В более предпочтительных вариантах осуществления в Chl формулы II, M представляет собой 2H или Cu или Mn, и R4, R′4 и R6 являются такими, как определено выше, и фотосенсибилизатор конъюгирован с пентациклическим содержащим RGD пептидом c(RGDfK) с SEQ ID NO:1.
В другом варианте осуществления R1 и R6 вместе образуют циклическое кольцо, содержащее - NH-RGD-CO-NH-(CH2)2-NH- или -NH-RGD-CO-NH-(CH2)2-пиперазино-(CH2)2-NH-. В одном варианте осуществления конъюгат содержит Bchl формулы II, где m равно 0; R′2 представляет собой метокси; R4 в положении 3 представляет собой ацетил и в положении 8 представляет собой этил; R′4 представляет собой метил; и либо R1 и R6 вместе образуют циклическое кольцо, содержащее -NH-RGD-CO-NH-(CH2)2-NH-, и M представляет собой Pd или M представляет собой 2H, либо или R1 и R6 вместе образуют циклическое кольцо, содержащее -NH-RGD-CO-NH-(CH2)2-пиперазино-(CH2)2-NH- и M представляет собой Pd.
Промышленная применимость
Для применения в настоящем изобретении конъюгаты изготавливают в фармацевтической композиции, содержащей фармацевтически приемлемый носитель.
В одном варианте осуществления фармацевтическая композиция предназначена для применения в фотодинамической терапии (PDT), более конкретно, в нацеленной на опухоль PDT. В другом варианте осуществления фармацевтическая композиция предназначена для применения в диагностических целях для визуализации некротических доменов опухоли.
В соответствии с изобретением можно применять несколько диагностических способов путем подбора центрального атома металла для конкретного способа.
Для диагностики некротических доменов опухоли динамической флуоресцентной визуализацией, M в фотосенсибилизаторе представляет собой 2H или металл, выбранный из Pd и Zn.
Для диагностики некротических доменов опухоли радиодиагностическим способом M в фотосенсибилизаторе представляет собой радиоизотоп, выбранный из64Cu,67Cu,99mTc,67Ga,201Tl,195Pt,60Co,111In и51Cr. В одном варианте осуществления радиодиагностический способ представляет собой позитронную эмиссионную томографию (PET) и M представляет собой64Cu или67Cu. В другом варианте осуществления радиодиагностический способ представляет собой однофотонную эмиссионную томографию (SPET) и M представляет собой радиоизотоп, выбранный из99mTc,67Ga,195Pt,111In,51Cr и60Co.
Для диагностики некротических доменов опухоли молекулярной магнитно-резонансной томографией (MRI), M представляет собой парамагнитный металл, выбранный из Mn3+, Cu2+, Fe3+, Eu3+, Gd3+ и Dy3+, или фотосенсибилизатор замещен хелатным комплексом металла и полидентатного лиганда, и метал является таким, как определено в настоящем документе выше.
В одном варианте осуществления изобретение относится к способу визуализации некротических доменов опухоли динамической флуоресцентной визуализацией, который включает:
(a) введение субъекту, предположительно имеющему опухоль с некротическими доменами, конъюгата по изобретению, где M представляет собой 2H или металл, выбранный из Pd и Zn;
(b) облучение светом субъекта и измерения флуоресценции предполагаемых областей в течение по меньшей мере 24-48 часов после введения конъюгата с временными интервалами 1-8 часов, где области, которые проявляют флуоресценцию через 24-48 часов или более, указывают на присутствие некротических доменов опухоли.
В предпочтительных вариантах осуществления конъюгат для указанного выше способа представляет собой соединение 13 или соединение 24, опухоль представляет собой опухоль млекопитающего или опухоль яичника, и некротические домены визуализируют в течение от 3 до 8 суток, предпочтительно, 5-8 суток, после инъекции лекарственного средства (конъюгата).
В другом варианте осуществления изобретение относится к способу диагностики некротических доменов опухоли радиодиагностическим способом, который включает:
(a) введение субъекту, предположительно имеющему опухоль, конъюгата по изобретению, где M представляет собой радиоизотоп, выбранный из группы, состоящей из64Cu,67Cu,99mTc,67Ga,201Tl,195Pt,60Co,111In или51Cr.
(b) сканирование субъекта на визуализирующем сканере в течение по меньшей мере 24-48 часов после введения конъюгата с временными интервалами 1-8 часов, и измерение уровня радиации в предполагаемых областях, где области, которые проявляют излучение через 24-48 часов или более, указывают на наличие некротических доменов опухоли.
Изобретение также относится к способу молекулярной магнитно-резонансной томографии (MRI) для диагностики некротических доменов опухоли, включающему стадии:
(a) введения субъекту, предположительно имеющему опухоль, конъюгата, как определено в настоящем документе, где M представляет собой парамагнитный металл, выбранный из Mn3+, Cu2+, Fe3+, Eu3+, Gd3+ или Dy3+; и
(b) проведение магнитно-резонансной визуализации у пациента путем получения по меньшей мере одного MR-изображения представляющей интерес области-мишени в организме пациента перед указанным введением (нулевой момент времени) и одного или нескольких MR-изображений во второй или последующий моменты времени, по меньшей мере через 24-48, предпочтительно, через 96 часов после указанного введения; и
(c) обработку и анализ данных для диагностики наличия или отсутствия указанных некротических доменов опухоли.
Кроме того, изобретение относится к способу картирования краев опухоли перед хирургической операцией, включающему введение субъекту, нуждающемуся в этом, конъюгата, как определено в настоящем документе, облучение субъекта светом и сканирование путем визуализации опухоли, предпочтительно, опухоли молочной железы, в первые 2-24 ч после введения конъюгата, таким образом, картируя края опухоли при подготовке к хирургической операции.
Кроме того, изобретение относится к минимально инвазивной стратегии лечения, детекции и прогнозирования локализованного рака молочной железы, в частности, карциномы протоков in situ (DCIS), включающему (i) введение субъекту конъюгата, как определено в настоящем документе, предпочтительно, конъюгата RGD-Bchl, где конъюгат RGD-Bchl специфично направляется в некротические домены опухоли и накапливается в них, (ii) нацеленную на опухоль визуализацию субъекта, которому ввели производное RGD-BChl, любым из описанных выше способов детекции опухоли и определения краев опухоли с высокой точностью, а также для прогнозирования с помощью подходов MRI, флуоресценции и PET SCAN; и (iii) нацеленную на опухоль фотодинамическую терапию (PDT) локализованных некротических областей, позволяющую сохранение и ремоделирование молочной железы.
Конъюгаты пептид RGD-фотосенсибилизатор, используемые в изобретении, особенно пригодны для нацеленной не опухоль PDT некротических опухолей и пригодны для лечения злокачественных заболеваний.
Таким образом, в одном варианте осуществления конъюгаты по изобретению пригодны в онкологической области для лечения посредством PDT предзлокачественных состояний и нескольких типов злокачественной опухоли, таких как, но не ограничиваясь ими, меланома, опухоли и раки предстательной железы, головного мозга, толстого кишечника, яичника, молочной железы, толстой и прямой кишки, головы и шеи, опухоли грудной стенки, возникающие из рака молочной железы, опухоли и раки кожи, легкого, пищевода и мочевого пузыря. Соединения пригодны для лечения первичных, а также метастатических некротических опухолей.
В одном из предпочтительных вариантов осуществления, способ используют для лечения локализованного рака молочной железы, в частности, карциномы протоков in situ. Согласно изобретению предусматривается способ фотодинамической терапии некротических опухолей, который включает: (a) введение индивиду, нуждающемуся в этом, конъюгата пептид RGD-фотосенсибилизатор по изобретению; и (b) облучение светом области опухоли и ее некротических доменов после определения наличия некротических доменов через по меньшей мере 24 часа, предпочтительно, через 2, 3, 4, 5, 6, 7 или 8 суток после инъекции конъюгата, любым из способов, описанных в настоящем документе.
В одном аспекте настоящее изобретение относится к новому способу детекции некроза опухоли, который основан на селективном захвате и длительном накоплении флуоресцентных конъюгатов Chl/Bchl-RGD в некротических доменах опухоли. Сенсибилизатор Chl/Bchl конъюгируют с лигандами, которые направлены на конкретные рецепторы эндотелиальных и опухолевых клеток. Затем после накопления Chl/Bchl в достаточно высоких концентрациях и выведения его из окружающей ткани запускают фотодинамическое образование ROS путем облучения светом объема опухоли и прилегающей области.
Bchl-компонент соединения 24 имеет собственную флуоресценцию в близкой инфракрасной области (NIR), которую можно подвергать детекции. Недавние эксперименты с использованием соединения 24 показали накопление вплоть до 4-8 мкМ в ксенотрансплантатах первичных опухолей. Соединение 24 остается в области опухоли в течение длительного времени, обеспечивая накопление сигнала и хорошее отношение сигнала к шуму. Эти способности молекулы, вероятно, основаны на взаимодействии между Bchl и сывороточным альбумином, что делает эту молекулу хорошим кандидатом для направленной визуализации и, в итоге, для направленной терапии. Другое производное Bchl, соединение 13, имеет на три порядка большую способность к свечению и, таким образом, оно может быть еще лучшим кандидатом для направленной визуализации. Эти молекулы открывают возможность для точной детекции краев опухоли и некроза в модели аденокарциномы молочной железы человека. Детекция краев и некроза опухоли представляет на сегодняшний день две из наиболее трудных проблем при лечении опухоли. Более того, они обе являются достоверными прогностическими факторами повторного роста опухоли после лечения. Таким образом, ожидается, что в будущем, при клиническом применении, указанные выше производные RGD будут пригодными для детекции опухоли и некроза на операционном столе.
Настоящее изобретение обеспечивает новый подход для достижения длительного накопления производных Chl/Bchl, которые конъюгированы с пептидами RGD, в некротических доменах опухоли после временного нахождения в жизнеспособной ткани опухоли. Накопленные соединения можно использовать для визуализации in vivo жизнеспособных (через короткое время после введения) или некротических (через более длительное время) доменов опухоли, а также для терапии опухоли посредством PDT, хемотерапии или лучевой терапии изотопом путем замены центрального металла Bchl или путем дальнейшей конъюгации с низкомолекулярными лекарственными средствами. Новый подход проиллюстрирован с помощью соединений 13 и 24. c(RGDfK) уже был признан в качестве высоко специфичного лиганда для интегринов αvβ3 и αvβ5, которые активируются при ангиогенезе. Группа соединения 25 обеспечивает конъюгат с сильной аутофлуоресценцией в NIR, что делает ее пригодной для флуоресцентной визуализации после захвата в ткани.
Экспериментальные данные демонстрируют, что группа RGD необходима для специфичного накопления соединения 13 и 24 как в небольших (ненекротических), так и в больших (некротических) опухолях, поскольку в случае неконъюгированного соединения 25 не наблюдали ни короткого, ни длительного накопления. Более того, общее выведение соединения 25 из мыши, которой его вводили, было значительно более быстрым, чем выведение конъюгированного соединения. Рассматриваемый механизм RGD подтверждается конкурентным экспериментом, описанным в настоящем документе, где избыток свободного c(RGDfK), инъецированного незадолго до соединения 13 или одновременно с ним, предотвращал захват последнего из них опухолевой тканью.
Наблюдали значительную разницу в накоплении соединения 13 между некротическими и ненекротическими опухолями. Таким образом, небольшие опухоли MDA-MB-231-RFP (~0,5 см3), в которых еще не развился некроз, показали быстрое накопление соединения 13 в опухоли в течение 1-6,5 ч после инъекции лекарственного средства с последующим быстрым (<24 ч) выведением. Только очень небольшие количества лекарственного средства можно было выявить в опухоли позднее, когда большая часть оставшегося лекарственного средства была ограничена органами выведения (главным образом почками, но также печенью). Крупные опухоли MDA-MB-231-RFP (>1 см3), в которых развился некроз, показали более медленное накопление, которое достигало пикового отношения концентрации в опухоли по сравнению с другими органами, начиная с 48 ч после инъекции лекарственного средства. Средняя концентрация лекарственного средства в опухолевой массе только немного снижалась, начиная с 24 ч после инъекции лекарственного средства. Эти результаты являются общими для некротических областей опухоли, но они отличаются, в зависимости от типа опухоли. Более того, сходные различия между паттернами накопления в некротических и ненекротических опухолях наблюдали для соединения 24, за исключением более медленных скоростей выведения, наблюдаемых в печени, что делает соединение 13 лучшим кандидатом для клинических применений.
Возможно, различие, наблюдаемое в настоящем документе, в скоростях накопления соединения 13 в некротических и ненекротических областях в модели рака молочной железы и модели рака яичника связано с различными свойствами микроокружения в двух типах опухолей. Обратная взаимосвязь между объемом опухоли и плотностью микрососудов была выявлена в опухолях молочной железы: по мере увеличения объема опухоли происходит значительное снижение плотности микрососудов на кубический сантиметр. Таким образом, концентрация интегринов становится пропорционально более низкой, и таким образом скорость зависимого от интегринов накопления лекарственного средства должна пропорционально снижаться.
Наиболее удивительным признаком представленных данных является явное смещение флуоресценции лекарственного средства из жизнеспособного в некротический объем опухоли, показанное по флуоресцентной визуализации удаленных некротических опухолей MDA-MB-231-RFP в различные моменты времени после введения соединения 13. Вследствие зависимости накопления лекарственного средства от группы RGD, может быть возможным многостадийное накопление, где первая стадия вовлекает диссоциацию группы соединения 25 (2H-MLT) от молекулы сывороточного альбумина и активный захват интегринами αVβ3 микрососудами, живыми опухолевыми клетками, и, возможно макрофагами или нейтрофилами. Предполагают, что за этой стадией следует пассивный перенос или миграция путем трансцитоза доступного соединения 13 в некротический домен и отсутствие дренажа из него в течение длительного времени. В ненекротических опухолях лекарственное средство накапливается быстро в жизнеспособных областях, состоящих из целой опухоли, но, поскольку отсутствует некроз, лекарственное средство быстро выводится. Когда инъецировали соединение 24, результаты флуоресценции удаленной опухоли были сходными с результатами, полученными для соединения 13.
Сходные отличия в скорости накопления в некротических и ненекротических опухолях были выявлены в других моделях опухолей, т.е. MLS-mBanana, рака яичника человека. Однако существует некоторая вариация в скоростях и паттерне накопления, вероятно, отражающая различные типы опухолей. Соединение 13 быстро накапливается в ненекротических опухолях MLS-mBanana, а затем медленно выводится. В некротических опухолях лекарственное средство достигает максимальной концентрации в жизнеспособных краях в пределах первого часа, а затем перемещается в некротическую зону, где достигает максимальной концентрации через 24 ч после введения. Быстрое накопление в MLS-mBanana в высоких концентрациях по сравнению с MDA-MB-231-RFP, возможно, отражает более высокую концентрацию рецепторов интегринов в клетках MLS-mBanana.
Гистология больших и небольших опухолей от животных, которым вводили соединение 13, по-видимому, подтверждает предположение о паттерне накопления и предоставляет некоторые ключи к основополагающему механизму. Существует высокое перекрывание между жизнеспособным доменом опухоли и флуоресценцией соединения 13 в первые несколько часов, и высокое перекрывание между флуоресценцией соединения 13 и некротическими доменами через 24 ч и более после введения.
Существует множество данных о накоплении лекарственных средств и контрастных средств в опухолях, связанном с плохим лимфооттоком и медленным венозным оттоком. Это явление, названное эффектом усиленной проницаемости и удержания (EPR), ранее было предложено в качестве средства для нацеливания на опухолевую ткань неспецифическим образом. Возможно, что EPR объясняет паттерн накопления соединения 13 или соединения 24 в некротическом домене и ненекротических опухолях. Недавно было предположено, что проникновение комплекса сывороточный альбумин (SA)-лекарственное средство через сосуды опухоли в интерстициальную опухолевую ткань объясняет такое накопление (Tanaka, Shiramoto et al. 2004). В литературе существует несколько примеров, которые показали, что конъюгированные с SA молекулы приводили к доставке молекулы в опухоль и даже в некротический домен. Действительно, ранее авторами настоящего изобретения было показано, что отрицательно заряженные растворимые в воде производные Bchl имеют высокую аффинность к SA. Таким образом, соединение 13 или соединение 24, вероятно, ассоциирует с SA через группу Bchl после введения, циркулирует в крови и выходит из сосудов с SA в опухолевую ткань посредством эффекта EPR, как объяснено выше. В этом случае, можно ожидать накопления соединения 25 в качестве отдельного химического соединения в некротической области, однако поскольку удержание соединения 25 в исследованных опухолях является кратковременным, возможное накопление посредством эффекта EPR может быть исключено.
Альтернативно, когда производное Bchl-RGD встречает интегрины αVβ3 или αVβ5, оно должно отсоединиться от носителя SA и связаться через часть RGD с интегрином с большей аффинностью, чем с молекулой SA. После этого первичного присоединения, соединение 13 или соединение 24 может диффундировать путем эндоцитоза в эпителиальные клетки, или путем трансцитоза через эпителиальные клетки. Также возможно, что лекарственное средство перемещается прямо во внеклеточный матрикс (ECM). В этих случаях перемещение лекарственного средства в зависимости от градиента концентрации, будет склоняться в сторону некротической области, где соединение 13 или соединение 24 исходно находится в его наиболее низкой концентрации.
Предполагаемые взаимодействия c(RGDfK)-2H/Pd-MLT с интегрином могут подразумевать, что накопление в некротическом домене опухоли является зависимым от нейтрофилов/макрофагов. В течение некоторого времени известно, что активированные нейтрофилы и макрофаги экспрессируют интегрины. Результаты гистологии показывают, что нейтрофилы присутствуют в некротическом домене (хотя, главным образом, по краям). Из литературы известно, что при инвазивной карциноме молочной железы происходит высокая инфильтрация макрофагов (Leek, Landers et al. 1999). Для NACA (Necrosis Avid Contrast Agents) было выявлено, что конечное выведение из некротических очагов занимает несколько суток после введения и соответствует природному процессу заживления, в ходе которого некротические ткани в возрастающей степени инфильтрируются и фагоцитируются воспалительными клетками, главным образом, нейтрофилами, моноцитами и/или макрофагами, и заменяются грануляционными тканями. Таким образом, полагают, что удерживаемые в некрозе NACA удаляются вместе с некротическими материалами фагоцитозом. Таким образом, вторичный захват макрофагами после связывания NACA в области некроза также может объяснять их локальное увеличение содержания. Таким образом, полагают, что, возможно, привлечение в некротический домен и удержание в нем основано на привлечении нейтрофилов и/или макрофагов, которые занимают некротический домен.
Возможное нацеливание и длительнее удержание флуоресцентных Chl/Bchl в некротическом домене может обеспечить их раннюю детекцию и помочь прогнозировать опухоль и способы лечения. Более того, оно открывает путь для доставки активируемых гипоксией лекарственных средств.
Далее изобретение проиллюстрировано с помощью следующих неограничивающих примеров.
ПРИМЕРЫ
Материалы и способы
(i) Соединения - производные Bchl, RGD-пептиды и их конъюгаты получали, как описано в WO 2008/023378 тех же заявителей. Эти конъюгаты и соединения представлены в настоящем документе под теми же арабскими числами, что и в WO 2008/023378 (за исключением соединения 45 и 46).
Соединение 11: палладий 31-оксо-15-метоксикарбонилметилродобактериохлорин 131-(2,3-сульфоэтил)амид-173-(RGD-4С)амид калиевая соль
Соединение 13 [с(RGDfK)-2H-MLT]: 31-оксо-15-метоксикарбонилметилродобактериохлорин 131-(2-сульфоэтил)амид-173-с(RGDfK)амид, калиевая соль.
Соединение 14 [с(RGDfK)-Mn-MLT]: марганец (III) 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид-173-(цикло-RGDfK)амид, калиевая соль.
Соединение 15 [с(RGDfK)-Cu-MLT]: медь (II) 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид-173-(цикло-RGDfK)амид, калиевая соль.
Соединение 23: палладий 31-оксо-15-метоксикарбонилметил-родобактериохлорин- 131-(2,3-дигидроксипропил)амид-173-(циклоRGDfK)амид
Соединение 24 [с(RGDfK)-Pd-MLT]: палладий 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид-173-c(RGDfK)амид, калиевая соль.
Соединение 25 [2H-MLT]: 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид, калиевая соль.
Соединение 26 [линейный GRGDSP-2H-MLT]: 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил) амид-173-(GRGDSP)амид, калиевая соль.
Соединение 27: бактериофеофорбид-173-(циклоRGDfК)амид
Соединение 28: 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(3-[(3-аминопропил)амино]пропил)амид-173-(циклоRGDfK)амид
Соединение 29: 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2,3-дигидроксипропил)амид-173-(циклоRGDfK)амид
Соединение 30: 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-морфолино-N-этил)амид-173-(циклоRGDfK)амид
Соединение 31: 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-{3-[4-(3-аминопропил)пиперазин-1-ил]пропил}амид-173-(циклоRGDfК)амид
Соединение 32: бактериофеофорбид-173-(2-циклоRGDК-амидо-N-этил)амид
Соединение 33: палладий 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид-173-(GRGDSPK)амид калиевая соль
Соединение 34: палладий 31-оксо-3-Б-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид-173-[(GRGDSP)4K]амид калиевая соль
Соединение 35: палладий 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид-173-(циклоRGDf-N(Me)K)амид калиевая соль
Соединение 36: палладий 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)-173-N-[4-гептандикислота бис(циклоRGDyK-амидо)]амид калиевая соль
Соединение 37: палладий 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131,173-цикло(2-RGD-амидо-N-этил)диамид
Соединение 38: 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131,173-цикло(2-RGD-амидо-N-этил)диамид
Соединение 39: палладий 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131,173-цикло{3-[4-(3-аминопропил-DGR-амидо)пиперазин-1-ил]пропил}диамид
Соединение 40: палладий 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид-173-[4-(метил-5-(6-гуанидиногексаноиламино)пентановая кислота)]амид калиевая соль
Соединение 41: палладий 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид-173-[7-амидо-3-[[1-(4-гуанидинобутирил)пиперидин-3-карбонил]амино]гептановая кислота]калиевая соль
Соединение 42: палладий 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид-173-(циклоRADfK)амид калиевая соль
Соединение 43: 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(3-DTPA-амидо-N-пропил)амид-173-(циклоRGDfK)амид
Соединение 44: 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(3-Gd-DTPA-амидо-N-пропил)амид-173-(циклоRADfK)амид
Соединение 46 [с(RGDyK)2-2H-MLT]: 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид-173-бис(цикло-RGDfK)амид, калиевая соль.
Соединение 45 [с(RADfK)-2H-MLT]: 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид-173-(цикло-RADfK)амид, калиевая соль.
(ii) 31-Оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид дикалиевая соль, соединение 25, синтезировали взаимодействием Bpheid с таурином, как описано в заявке WO 2004/045492 (пример 2, синтез соединения 5).
(iii) Смолу, аминокислотные производные, N-гидроксибензотриазол (HOBt) и бензотриазол-1-ил-окси-трис-пирролидино-фосфоний гексафторфосфат (PyBOP) получали от Novabiochem; N,N-диизопропилэтиламин (DIEA), N,N′-диизопропилкарбодиимид (DIC) этилендиамин, 1,4-бис(3-аминопропил)пиперазин, 1,3-диметилбарбитуровую кислоту (DMBA), диэтилдитиокарбаминовую кислоту, натриевую соль (DEDTC), 2,2,2-трифторэтанол (TFE), триизопропилсилан (TIS), 1,2-этандитиол (EDT), трифторуксусную кислоту (ТФК), мезо-тетра(4-карбоксифенил)порфин, L-аскорбат натрия и 4-оксогептандикислоту получали от Aldrich (США); N-гидроксисукцинимид (NHS) получали от Sigma (США); N-гидроксисукцинимид (сульфо-NHS), 1,3-дициклогексилкарбодиимид (DCC), N-(3-диметиламинопропил)-N′-этилкарбодиимид (EDC), N-Fmoc-6-аминогексановую кислоту, N□-Fmoc-Nω-Boc-□-L-гомолизин и N-Fmoc-пиперидин-3-карбоновую кислоту получали от Fluca (Швейцария); ацетат кадмия, ацетат меди и хлорид марганца (II) получали от Merck (Германия); и тетракис(трифенилфосфин)палладий получали от Acros.
В основном использовали химические реактивы и растворители аналитической чистоты, за исключением проведения ВЭЖХ, когда применяли растворители для ВЭЖХ.
(iv) Синтез пептидов - пептиды синтезировали твердо-фазным методом посредством получения Fmoc-производных с использованием защищенных аминокислот и с проведением циклизации согласно методам, известным в данной области. Удаление Fmoc-группы и завершение взаимодействия прослеживали с использованием нингидриновой реакции (Kaiser). ТФК и раствор смеси ТФК/тиоанизол/H2O/триизопропилсилан (TIS) использовали для удаления пептидов со смолы одновременно со снятием защиты (Arg-пентаметилхроман-6-илсульфонил (Pmc) или 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил (Pbf); Asp-OtBu; Ser-трет-бутил (tBu); Lys-трет-бутилоксикарбонил (Boc), аллилоксикарбонил (Alloc) или Dde).
1. Линейные пептиды GRGDSPK, (GRGDSP)4K или GRGDSP получали с использованием соответственно Fmoc-Lys(Boc)-Wang-смолы или 2-хлортритилхлоридной смолы.
2. Циклические пептиды (циклоRGDfK), (циклоRGDyK), (циклоRADfK) и (циклоRGDf-N(Me)K) получали синтезом пентапептидов на 2-хлортритилхлоридной смоле и их последующую циклизацию проводили в растворе, как описано Haubner et al., 1999. N□-метилзащищенный лизин получали из 2-аминогептандикислоты, как описано ранее (Freidinger et al., 1983). Другой способ синтеза циклоRGDfK циклизацией на смоле описан в примере 13 в данном документе.
3. Циклический пептид RGD-4C получали синтезом CDCRGDCFCG с использованием обычного протокола твердо-фазного синтеза и его циклизацию проводили спонтанным окислительным образованием дисульфидных связей (Koivunen et al., 1995).
4. Циклический пептидил-амин циклоRGDК-NH2 синтезировали на хлортритиловой смоле (защиты: Arg-Pbf; Asp-OtBu; N□-Lys-Alloc). Затем отщепляли N-концевую Fmoc-группу и Alloc-защитную группу на □-аминогруппе остатка лизина и проводили циклизацию по двум аминогруппам через уретановую связь с использованием N,N'-карбонилдиимидазола (CDI) в течение 12-16 ч. Циклический пептид отщепляли с подложки и лизин карбоксилат подвергали взаимодействию с 1,2-диаминоэтаном (активация DCC) c получением желаемого пептидиламина.
5. Циклопептид димер (циклоRGDyK)2. 4-Оксогептандикислоту превращали в 4-аминогептандикислоту с использованием метода Wanunu et al., 2005. Затем аминогруппу подвергали Boc-защите и карбоксильные группы активировали смесью NHS/DCC в ДМФА. Диэфир очищали на колонке с силикагелем с использованием смеси хлороформ-метанол и затем подвергали взаимодействию с циклоRGDyK в ДМФА, содержащем DIEA, в течение ночи. Защитную Boc-группу отщепляли смесью ТФК-вода-дихлорметан (DCM) (90:5:5). Желаемое соединение очищали ВЭЖХ.
6. RGD-пептидомиметики (RGD-PM1, RGD-PM2) получали, как описано в заявке WO 93/09795. То есть, одну аминогруппу этил (5-амино-4-аминометил)пентановой кислоты (Vaillancourt et al., 2001 и цитированные в данном документе источники) защищали эквимолярным количеством Boc-ангидрида и карбоксильную группу защищали трет-бутиловым спиртом. Продукт очищали на колонке с силикагелем и сочетали с N-Fmoc-6-аминогексановой кислотой с последующим снятием Fmoc-защиты и превращением амина в гуанидиний с использованием 3,5-диметилпиразол 1-карбоксамидина нитрата (pH 9,5; 50°C). Наконец, N-Boc и O-tBu удаляли обработкой ТФК и продукт RGD-PM1 очищали ВЭЖХ. Синтез RGD-PM1 представлен на схеме 3. Для синтеза RGD-PM2 (см. схему 3) N□-Fmoc-Nω-Boc-□-L-гомолизин присоединяли к смоле Wang. Затем проводили сочетание с N-Fmoc-пиперидин-3-карбоновой кислотой и N-Fmoc-4-аминомасляной кислотой с использованием твердо-фазных методов. После образования гуанидиния (как описано выше) с полученного вещества снимали защиту и удаляли со смолы обработкой ТФК и продукт RGD-PM2 очищали ВЭЖХ.
(v) TCX: пластинки с силикагелем (Kieselgel-60, Merck, Германия); смесь хлороформ-метанол (4:1, об./об.).
(vi) Коэффициенты экстинкции металлокомплексов определяли на основе корреляции концентрации центрального атома металла (с использованием пламенной фотометрии с солью металла в качестве стандарта) с оптической плотностью анализируемого раствора при определенной длине волны.
(vii) Масс-спектры. Масс-спектры электрораспылительной ионизацией (ESI-MS) получали на спектрометре LCZ (Micromass, Англия). Определение масс-спектров матрикс-вспомогательной лазерной десорбцией/ионизацией (MALDI-TOF-MS) получали на аппарате Bruker REFLEX по времени полета (Bruker Daltonics, США).
(viii) Спектры оптического поглощения (УФ-VIS) различных комплексов снимали на спектрофотометрах Genesis-2 (Milton Roy, Англия), V-570 (JASCO, Япония) или Shimadzu UV-1650PC (Япония).
(ix) ВЭЖХ проводили с использованием хроматографа LC-900 (JASCO, Япония), снабженного УФ-915 диодным детектором, или системы Waters Delta Prep 4000, снабженной детектором поглощения Waters 486 и коллектором фракций Waters, контролируемыми программой Millennium v3.05. Скорость потока устанавливали на 75 мл/мин с использованием препаративной колонки (Vydac C18, 218ТР101550, 50×250 мм, 10-15 мкм), детектор устанавливали на длине волны 380 нм и коллектор фракций устанавливали на временном режиме 6 сек/фракция. Растворители, использованные при очистке соединений с помощью ВЭЖХ, были следующими: растворитель А: 50 мМ раствор ацетата аммония в H2O; растворитель В: ацетонитрил.
(x) LC-MS API 150EX (Applied Biosystems/MDS SCIEX) проводили с использованием колонки YMS-Pack Pro C18. Подвижная фаза: растворитель А: 0,2% АсОН/0,12% NH4OH/H2O; растворитель B: 4,75% А/0,2% АсОН/ацетонитрил. Скорость потока: 200 мкл/мин. Градиент: 20% В (0-20 мин) до 95% В (25-30 мин).
(xi) Клеточные линии - клетки рака молочной железы человека MDA-MB-231 приобретали в American Type Culture Collection (ATCC, Manassas, VA). Трансфицированные клетки MLS-pRSETB-mBanana рака яичника человека, устойчивые к пуромицину, были любезно предоставлены Prof. Michal Neeman (Department of Biological Regulation, Weizmann - Institute of Science, Rehovot, Israel).
(xii) Трансфекция MDA-MB-231 красным флуоресцентным белком (RFP) - Для трансфекции использовали две плазмиды: pDsRed2-N1 (Clontech, Palo Alto, CA) (фиг.1A), которая имеет ген устойчивости к неомицину, и модифицированную pDsRed-Monomer-Hyg-C1 (Clontech, Palo Alto, CA), которая имеет ген устойчивости к гигромицину, в которой ген DsRed-Monomer плазмиды, представленной на фиг.1B, был заменен pDsRed2 (из плазмиды pDsRed2-N1, фиг.1C). Для трансфекции использовали Lipofectamine™ 2000 (Invitrogen™) в соответствии с протоколом изготовителя.
(xiii) Культура ткани - клетки MDA-MB-231-RFP поддерживали в среде RPMI 1640, дополненной 1 ммоль/л пирувата натрия, 10% эмбриональной телячьей сывороткой (FCS), 250 мкг/мл гигромицина, 0,06 мг/мл пенициллина и 0,1 мг/мл стрептомицина. Клетки выращивали в качестве монослоев при 37°C в увлажненной атмосфере (5% CO2, 95% воздух). Клетки MLS-mBanana поддерживали в среде МЕМ-α, дополненной 1 ммоль/л пирувата натрия, 10% эмбриональной телячьей сывороткой (FCS), 10 мкг/мл пуромицина, 0,06 мг/мл пенициллина и 0,1 мг/мл стрептомицина. Клетки выращивали в качестве монослоев при 37°C в увлажненной атмосфере (5% CO2, 95% воздух).
(xiv) Животные - самок мышей CD1 nude (в возрасте 7-8 недель, ~25 г) содержали и ухаживали за ними со свободным доступом к корму и воде в помещении для животных согласно руководствам (1996) Institutional Animal Care and Use Committee of the Weizmann Institute of Science (Rehovot, Israel).
(xv) Модель опухоли на мышах - Флуоресцентные клетки рака молочной железы человека MDA-MB-231-RFP и флуоресцентные клетки рака яичника человека MLS-mBanana (5×106 в 100 мкл физиологического раствора) трипсинизировали и собирали в субконфлюэнтном состоянии, а затем инокулировали в спину или в жировое тело молочной железы самок мышей. Опухолям позволяли развиваться до двух желательных размеров - некротические опухоли (~1 см, в течение 3-4 недель) и ненекротические опухоли (~0,5 см3 в течение 1-2 недель).
(xvi) Флуоресцентная визуализация всего организма - мышей подвергали анестезии путем внутрибрюшинной инъекции 30-мкл смеси 85:15 кетамин:ксилазин. Для мониторинга накопления лекарственного средства в жировом теле молочной железы мышам внутривенно инъецировали в хвостовую вену соединение 13, соединение 25 или соединение 24 в количестве 15 мг лекарственного средства/кг массы тела. Мониторинг флуоресценции красного флуоресцентного белка (RFP), pRSETB-mBanana и фотосенсибилизаторов проводили с помощью оптической системы визуализации in vivo IVIS®100 (Xenogen Corp., Alameda, CA). Основной набор фильтров для визуализации опухоли включал фильтр возбуждения при 500-550 нм и фильтр эмиссии при 575-650 нм; фоновый набор фильтров для вычитания аутофлуоресценции ткани включал фильтр возбуждения при 460-490 нм и фильтр эмиссии при 575-650 нм. Основной набор фильтров для визуализации лекарственных средств включал фильтр возбуждения при 665-695 нм и фильтр эмиссии при 810-875 нм. Изображения получали в ходе одинакового времени воздействия и они иллюстрируются на одной и той же линейной цветовой шкале, чтобы позволить качественное сравнение.
(xvii) Измерение флуоресцентного сигнала в некротических опухолях - Края опухоли, представляющую интерес область (ROI), из изображений всего организма in vivo, отмечали, и флуоресцентный сигнал в пределах отмеченных кругом краев выражали в фотон/с. Ту же ROI использовали для измерения фотон/с на противоположной стороне. Кроме того, для фоновых измерений проводили измерения ROI опухоли и на противоположной стороне у трех мышей без введения и усредняли их. Измеренные величины флуоресценции для каждой ROI делили на площадь для предоставления нормализованной интенсивности флуоресцентного сигнала в фотон/с/см2. Измерение сигнала проводили от 15 мин до 216 ч после инъекции соединения 13. Для каждого момента времени вычитали фоновый уровень и вычисляли среднее значение как соотношение между флуоресценцией в пределах краев опухоли и на противоположной стороне.
(xviii) Конкурентный анализ связывания соединения 13 и свободного с(RGDfK) - Мышам инъецировали избыток (8,5 мкмоль) свободного пептида с(RGDfK) за один час до инъекции соединения 13 (140 нмоль). В контрольной группе инъецировали только соединение 13 (140 нмоль). Флуоресцентные изображения получали через 24 ч после инъекции соединения 13. Использовали основной набор фильтров для флуоресцентной визуализации, как описано в (vii).
(xix) Визуализация флуоресценции удаленных опухолей - Мышам внутривенно инъецировали в хвостовую вену 15 мг/кг соединения 13. Мышей умерщвляли, опухоли удаляли, нарезали пополам и визуализировали в различные временные интервалы: 10 мин, 1, 4 и 24 ч, 3, 5 и 7 суток для MDA-MB-231-RFP и 7 суток для MLS-mBanana с использованием системы Xenogen IVIS® System. Набор фильтров, используемый для визуализации флуоресценции, описан в (vii).
(xx) Гистология - После экспериментов с удалением, опухоли фиксировали в 3,7% формальдегиде и погружали в парафиновые блоки. Срезы окрашивали гематоксилином-эозином (Н&Е) в стандартных условиях.
(xxi) Протокол PDT - Мышам под анестезией внутривенно инъецировали 7,5 или 15 мг/кг соединения 13. Опухоли облучали светом в течение 10 или 30 мин. Интервал между лекарственным средством и облучением составил 8 или 24 ч после инъекции лекарственного средства. Использовали чрескожное облучение светом диодным лазером с длиной волны 755 при 100 мВт/см2(CeramOptec, Germany). В группе темного контроля, мышам внутривенно инъецировали лекарственное средство и помещали их в темную клетку на 24 ч. В световой контрольной группе, мышам не инъецировали лекарственное средство, но облучали их светом в течение 10 мин при 100 мВт/см2. В ходе первых двух суток после PDT, мышам при необходимости проводили обезболивание (2,5 мг/кг флунексина раз в сутки).
Пример 1. Трансфекция опухолевых клеток флуоресцентными белками
Способ трансфекции проводили для создания клеточной линии, которая экспрессирует RFP стабильным образом. Такую клеточную линию можно выявлять флуоресцентной микроскопией и другими средствами визуализации флуоресценции in vivo и in vitro (ткани/клетки). Для этой цели выбрали клеточную линию рака молочной железы человека MDA-MB-231, известную формированием спонтанного центрального некроза. Использовали две плазмиды (фиг.1A, 1C) и получали стабильные клоны и выявляли их с помощью флуоресцентного микроскопа (см. фиг.2A-2B). Клоны, полученные из модифицированной плазмиды pDsRed-Monomer-Hyg-C1 (фиг.1C), проявляли более сильную флуоресценцию. Клон 3 (фиг.2B), трансфицированный модифицированным pDsRed-Monomer-Hyg-C1, выбрали для дальнейшего применения. Трансфицированные клетки конститутивно экспрессировали RFP без снижения интенсивности флуоресценции с течением времени как in vitro, так и in vivo. Нетрансфицированные клетки не имели красной аутофлуоресценции.
Пример 2. Модель некротической опухоли - гистопатологический анализ
Для подтверждения того, что клетки MDA-MB-231-RFP формируют пригодную некротическую модель, опухолям MDA-MB-231-RFP позволяли развиться до двух размеров. Гистологический и гистопатологический анализ проводили, как описано в разделе "Материалы и способы" (xi). Результаты представлены на фиг.3A и 3B. Большие опухоли ~1 см3 продемонстрировали очень заметный некротический домен (фиг.3A), в то время как небольшие опухоли размером ~0,5 см3 продемонстрировали отсутствие некротического домена (фиг.3B).
Пример 3. Флуоресцентная визуализация in vivo захвата соединения 13 в первичных некротических ксенотрансплантированных опухолях MDA-MB-231-RFP
Исследовали паттерн накопления соединения 13 в некротических опухолях MDA-MB-231-RFP (>1 см3) in vivo. На фиг.4A-4B и 5A-5B проиллюстрировано накопление флуоресцентного сигнала соединения 13 в ортотопной первичной опухоли молочной железы человека MDA-MB-231-RFP в жировом теле молочной железы у самок мышей CD-1 nude, с использованием системы Xenogen IVIS® System. Одновременно получали изображения всего организма животного с использованием наборов фильтров, как описано в разделе "Материалы и способы" (vii), выше. Динамические флуоресцентные изображения получали каждые 1-1,5 ч в течение 9 ч, и через 24 ч после инъекции соединения 13 (фиг.4A-4B), а затем каждые 24 ч в течение последующих 7 суток (фиг.5A-5B). Вскоре после инъекции соединения 13 можно было выявить флуоресценцию NIR всего организма животного, отражающую высокую концентрацию лекарственного средства в кровотоке. Быстрое выведение из кровотока, сопровождавшееся накоплением в печени, и до некоторой степени в опухоли, наблюдали в течение первых 9 ч после инъекции (фиг.4B). В последующие дни соединение 13 продолжало накапливаться в опухоли при полном выведении из печени, обеспечивая селективную визуализацию опухоли от ≥3 до конца периода наблюдения через 7 суток после инъекции (фиг.5B), и крайне медленное выведение после этого. Размер и расположение опухоли не изменялись на протяжении эксперимента, как можно видеть по красным изображениям всего организма in vivo (фиг.4A и 5A). Сходные результаты получали у 9 исследованных животных с размером опухоли ≥1 см3.
Пример 4. Флуоресцентная визуализация in vivo захвата соединения 13 в первичных некротических ксенотрансплантированных опухолях MDA-MB-231-RFP
Те же параметры далее исследовали для опухолей ≤0,5 см3, которые являются ненекротическими. На фиг.6A-6B и 7A-7B представлен флуоресцентный сигнал соединения 13 и RFP у самок мышей CD-1, которым трансплантировали MDA-MB-231-RFP. Паттерн накопления лекарственного средства визуализировали с использованием системы IVIS®, как описано выше, и при временных интервалах, аналогичных примеру 3, но ограниченных 3 сутками вследствие полного выведения лекарственного средства к этому времени. Паттерн накопления в этих ненекротических опухолях значительно отличался от паттерна, наблюдаемого в некротических опухолях. Флуоресценция в NIR соединения 13 достигала максимальных значений в опухоли через ~2 ч после инъекции и вскоре после этого в печени (через 3,5 ч после инъекции лекарственного средства) (фиг.6B). В противоположность полученной флуоресценции соединения 13 из некротических опухолей, через 2 суток после инъекции в ненекротических опухолях практически нельзя было выявить флуоресценцию (фиг.7A). В усредненных показателях флуоресценции от 16 животных, пиковая флуоресценция была выявлена через 1-6,5 ч после инъекции лекарственного средства.
Пример 5. Кинетика захвата и выведения соединения 13 в некротических опухолях MDA-MB-231-RFP
Для полуколичественной оценки паттерна накопления соединения 13 в некротических опухолях вычисляли и наносили на график средний сигнал флуоресценции для соединения 13 в некротических опухолях 9 мышей в несколько моментов времени до 216 ч (фиг.8). Начиная с 12 ч после инъекции и позднее флуоресцентный сигнал от опухоли становился определенно более сильным, чем сигнал в эквивалентной контрольной области на противоположной стороне. Отношение флуоресценции между опухолью и противоположной стороной возрастало со временем и достигло плато через от ~8 до 192 ч.
Пример 6. Захват соединения 24 в ортотопных первичных ксенотрансплантированных некротических опухолях MDA-MB-231-RFP
Паттерн накопления in vivo метилированного конъюгата соединения 24 (c(RGDfK)-Pd-MLT) в некротической первичной опухоли MDA-MB-231-RFP исследовали с использованием того же набора экспериментов, что описан в примере 3.
Результаты, представленные на фиг.9A-9B и 10A-10B, демонстрируют, что флуоресценцию нельзя было выявить вскоре после инъекции соединения 24, что отражает высокую концентрацию лекарственного средства в кровотоке. Быстрое выведение из кровотока, сопровождавшееся накоплением в печени и до некоторой степени в опухоли, наблюдали в первые 8 ч после инъекции (фиг.9B). На следующие сутки, соединение 24 продолжало накапливаться в опухоли, однако полного выведения из печени не наблюдали (фиг.10B). По-видимому, соединение 24 может действовать в качестве селективной молекулы для визуализации опухоли, начиная с ~3 суток после инъекции с крайне низким выведением после этого. Однако оно является в некоторой степени менее специфичным, чем соединение 13. Размер и расположение опухоли не изменялись на протяжении эксперимента, как можно видеть по красным изображениям всего организма in vivo (фиг.9A и 10A). Эти результаты с размером опухоли ≥1 см3 наблюдали для 3 животных.
Пример 7. Захват соединения 24 в ортотопных первичных ксенотрансплантированных ненекротических опухолях MDA-MB-231-RFP
Флуоресцентный сигнал от соединения 24 и RFP далее исследовали в ненекротических опухолях MDA-MB-231-RFP (~0,5 см3), трансплантированных самкам мышей CD-1 nude, как описано в примере 4, выше, с использованием временных интервалов, сходных с примером 6, но ограниченных 2 сутками вследствие полного выведения лекарственного средства из опухоли к этому времени. Результаты, представленные на фиг.11A-11B и 12A-12B, демонстрируют, что, в отношении соединения 13, паттерн накопления в ненекротических опухолях значительно отличался от паттерна, наблюдаемого в некротических опухолях. Флуоресценция в NIR соединения 24 достигала пиковых значений в опухоли через ~2,5 ч после инъекции и вскоре после нее в печени (через 5,5 ч после инъекции лекарственного средства, фиг.11B). В противоположность полученной флуоресценции соединения 24 в некротических опухолях, через 24 часа после инъекции в ненекротических опухолях практически нельзя было выявить флуоресценцию (фиг.12B). Пиковая флуоресценция опухоли (средние показатели флуоресценции для 5 животных) выявлялась через 1-4,5 ч после инъекции лекарственного средства.
Пример 8. Захват соединения 13 в первичных некротических опухолях MLS-mBanana, имплантированных в жировое тело молочной железы мыши
Для установления общности результатов, полученных в приведенных выше экспериментах, накопление соединения 13 в некротическом домене далее исследовали в другом типе опухоли, образованной из клеточной линии рака яичника человека MLS-mBanana. Результаты, представленные на фиг.13A-13B и 14A-14B, иллюстрируют накопление флуоресцентного сигнала от соединения 13 в подкожных (s.c.) первичных опухолях яичника человека MLS-mBanana, которые трансплантировали в жировое тело молочной железы самок мышей CD-1 nude с использованием системы Xenogen IVIS® System, как описано в разделе "Материалы и способы" (vii). Мониторинг паттерна накопления проводили с временными интервалами, сходными с временными интервалами, описанными в настоящем документе выше в примере 3, ограниченными 4 сутками вследствие полного выведения лекарственного средства к этому времени. Вскоре после инъекции, флуоресценция в NIR соединения 13, главным образом, выявлялась в печени и опухоли. Быстрое выведение из кровотока, сопровождавшееся накоплением в печени и опухоли, происходит в первые 8 ч после инъекции (фиг.13B). Через 2 суток, соединение 13 продолжало накапливаться в опухоли при полном выведении из печени, обеспечивая селективную визуализацию опухоли без окружающих помех (фиг.14B). Выведение из некротических опухолей MLS-mBanana происходило значительно более быстро, чем выведение из некротических опухолей MDA-MB-231-RFP, и практически завершилось на 3 сутки. Размер и расположение опухоли не изменялись на протяжении эксперимента, как можно видеть на красных изображениях всего организма in vivo (фиг.13A и 14A). Эти результаты наблюдали для 3 животных с размером опухоли ≥1 см3.
Пример 9. Захват соединения 13 в первичных ненекротических опухолях MLS-mBanana, имплантированных в жировое тело молочной железы мыши
Ввиду результатов в ненекротических опухолях MDA-MB-231-RFP, показавших отсутствие длительного накопления лекарственного средства, исследовали длительное накопление в ненекротических опухолях MLS-mBanana. Результаты, представленные на фиг.15A-15B и 16A-16B, представляют собой флуоресцентный сигнал соединения 13 в ненекротических опухолях MLS-mBanana. Мониторинг паттерна накопления проводили, как описано в разделе "Материалы и способы" (vi) с временными интервалами, сходными с интервалами, описанными в примере 4, ограниченными 4 сутками вследствие практически полного выведения лекарственного средства к этому времени. Паттерн накопления в ненекротических опухолях был в некоторой степени сходным с паттерном в некротических опухолях. Флуоресценция в NIR соединения 13 достигала пиковых значений в опухоли через ~1 ч после инъекции (фиг.15B). Накопление в печени выявляли, начиная после первого часа.
При сравнении некротических и ненекротических опухолей на одной линейной шкале флуоресценции, концентрация соединения 13 в некротических опухолях оказалась значительно более высокой, чем в ненекротических опухолях, как представлено на фиг.17A-17B. Пиковая флуоресценция в опухоли (средний показатель флуоресценции для 4 животных) была выявлена через 1-3,5 ч после инъекции лекарственного средства.
Пример 10. Зависимость накопления соединения 13 от группы c(RGDfK)
Для определения того, захватывает ли опухоль соединение 13 и запускает ли группа RGB полученное накопление флуоресцентного сигнала NIR, проводили два эксперимента. В первом эксперименте накопление флуоресцентного сигнала в различные моменты времени после инъекции соединения 13 сравнивали с накоплением после инъекции свободного 2H-MLT (соединение 25) мышам CD1-nude, которым трансплантировали ненекротические (≤0,5 см3) и некротические (~1 см3) опухоли MDA-MB-231-RFP в жировое тело молочной железы. Второй эксперимент представлял собой конкурентный анализ между соединением 13 и свободным c(RGDfK).
10.1 Захват соединения 25 в первичных некротических и ненекротичеких опухолях MDA-MB-231-RFP
Динамические флуоресцентные изображения получали как для некротических, так и для ненекротических опухолей каждые 1-1,5 ч в течение 8,5-9 ч, и через 24 ч после исходной инъекции соединения 25 (фиг.18A-18B и 20A-20B) и каждые 24 ч в течение последующих трех суток (фиг.19A-19B и 21A-21B). Флуоресцентный сигнал в NIR соединения 25 достигал максимальной концентрации в опухоли через 5-10 мин после инъекции, если выявлялась какая-либо концентрация. Величины флуоресцентного сигнала были на ~2 порядка ниже максимально величин, наблюдаемых для соединения 13 (при более длительных временных интервалах). Флуоресцентный сигнал падал до несущественных значений уже через 20 мин после инъекции. В то же время, флуоресцентный сигнал накапливался, главным образом, в печени и в сердце. То же поведение наблюдали у 3 животных с некротическими опухолями (фиг.18B) и у 2 животных с ненекротическими опухолями (фиг.20B).
10.2 Конкурентный анализ связывания соединения 13 и свободного с(RGDfK) с первичными ненекротическими опухолями MDA-MB-231-RFP
Для того чтобы подтвердить специфичное связывание проводили эксперименты, в которых предпринимали попытку блокировать накопление соединения 13 с помощью свободного лиганда c(RGDfK). Соединение 13 вводили после предшествующей инъекции c(RGDfK) или без нее, как описано в примере 3. Результаты представлены на фиг.22A-22D. Когда соединение 13 вводили после введения свободного c(RGDfK), не было выявлено накопления в опухоли через 24 ч (фиг.22C), в то время как соединение 13 вводили отдельно, в контрольной группе, накопление в опухоли поддавалось детекции (фиг.22D), указывая на специфичное связывание соединения 13 с опухолью через группу c(RGDfK).
Пример 11. Специфическое накопление соединения 13 в некротических доменах опухоли MDA-MB-231-RFP
Значительно отличающиеся динамические флуоресцентные паттерны некротических и ненекротических ксенотранплантатов опухолей молочной железы, имплантированных в жировые тела молочных желез, обусловили исследование корреляции между гистологией опухоли и накоплением флуоресцентного сигнала соединения 13. Таким образом, опухоли удаляли в указанные моменты времени после инъекции соединения 13 и разрезали пополам. Изображения получали в несколько моментов времени (10 мин, 1, 4 и 24 ч, 3, 5 и 7 суток после инъекции) с использованием Xenogen IVIS® System, как описано в разделе "Материалы и способы" (vii). Результаты, представленные на фиг.23-29, показывают накопление флуоресценции соединения 13 в различные моменты времени. Для каждого момента времени тестировали 3 животных. Начиная с 10 мин до 4 ч после инъекции лекарственного средства, флуоресценцию лекарственного средства наблюдали только в жизнеспособной области (фиг.23-25). Через 4 ч происходила некоторая диффузия в направлении некротического домена. Начиная с трех суток после инъекции, паттерн накопления стал обратным: флуоресценция сместилась полностью в некротическую зону с некоторой остаточной диффузией флуоресценции в сторону окружающих жизнеспособных клеток (фиг.27F). Эти результаты также наблюдали для пяти и семи суток (фиг.28-29). Важно, что через 24 ч после инъекции, специфичную флуоресценцию опухоли уже отчетливо наблюдали с более высокой флуоресценцией лекарственного средства из некротического домена, но границы опухоли были менее четко определены по сравнению с интервалом в трое суток (фиг.26F). В этой группе экспериментов было показано, что с течением времени соединение 13 перемещается через жизнеспособный домен в некротический домен и накапливается там специфично в течение длительного периода времени.
Пример 12. Специфичное накопление соединения 24 в некротических доменах опухоли MDA-MB-231-RFP
С учетом паттерна накопления, наблюдаемого для соединения 13, тестировали другие производные Bchl. Проводили мониторинг паттерна накопления соединения 24 и получили сходные результаты. Результаты для опухолей, удаленных через 9 суток после инъекции лекарственного средства, представлены на фиг.30A-30F. Изображения получали с использованием Xenogen IVIS® System, как описано выше. Как представлено на фиг.30F, через девять суток после инъекции лекарственного средства лекарственное средство отчетливо присутствовало в некротическом домене опухоли. Эти результаты наблюдали у всех исследованных животных (N=3). Сходные результаты наблюдали, когда опухоли удаляли через 3 и 5 суток после инъекции лекарственного средства (N=3 для каждого момента времени).
Пример 13. Специфичное накопление соединения 13 в некротических доменах опухоли MLS-mBanana
Наблюдаемое накопление как соединения 13, так и соединения 24, в некротическом домене опухолей MDA-MB-231-RFP побудило к исследованию общности этого явления и его потенциального применения в лечении и визуализации. Таким образом, использовали отличающийся тип опухоли - рак яичника человека MLS-mBanana. В этом случае результаты несколько отличались. В большинстве случаев паттерн некроза в этом типе опухоли не был центральным, а именно, отсутствовал широко распространенный некроз, который не был расположен специфично в центре опухоли или не образовывался в одном месте в опухоли. В этих случаях накопление не было настолько длительным. В нескольких случаях, когда наблюдали центральный некроз, паттерн накопления был сходен с паттерном в опухолях MDA-MB-231-RFP. На фиг.31-32 представлены результаты, полученные через 7 суток после инъекции лекарственного средства. Как видно, лекарственное средство явно присутствовало в некротическом домене опухоли, когда наблюдали центральный некроз (фиг.31F), и не присутствовало, когда центрального некроза не было (фиг.32F).
Пример 14. Изображение удаленной опухоли и гистологические срезы некротических опухолей
Некротическую опухоль MDA-MB-231-RFP удаляли и гистологические срезы опухоли окрашивали (гематоксилин и эозин (H&E)). На фиг.33A-33D представлены гистологические срезы жизнеспособных и некротических доменов опухоли, удаленной через 4 часа после инъекции лекарственного средства. Эти наблюдения должны дополнить визуализацию распределения RFP и соединения 13 в ткани, проведенную ранее. Как видно на фиг.33A, основная часть массы состоит из непроницаемой коричневой некротической ткани. Из фиг.33B, можно отметить корреляцию между макроскопическими и микроскопическими признаками. Некротическая ткань в центре была от эозинофильной до гиперэозинофильной с широко распространенным кариолизисом и в меньшей степени пикнозом и кариорексисом. В некротической ткани была мягкая многоочаговая инфильтрация нейтрофилов, главным образом, по краям некротического домена. Жизнеспособные области были ограничены периферией опухоли. Они состояли из дезорганизованной пролиферации неопластических клеток, расположенных в виде плотных клеточных слоев (фиг.33D). Неопластические клетки имели форму от круглой до неправильной с высоким отношением ядро:цитоплазма и нерегулярными везикулярными ядрами. Флуоресценция соединения 13 через 4 ч после инъекции точно соответствовала гистологическим результатам, как для жизнеспособных, так и для некротических доменов (фиг.25F). Сходную корреляцию получали для всех исследованных некротических опухолей, включая контрольные опухоли, в случае которых не инъецировали лекарственное средство.
Пример 15. Исследования PDT in vivo с использованием соединения 13
Главным образом, для исследований PDT in vivo создают модели опухолей на мышах путем инокуляции флуоресцентных клеток рака молочной железы MDA-MB-231-RFP или клеток рака яичника MLS-mBanana подкожно в спину или жировое тело молочной железы самок мышей, как описано выше, и позволяя им расти до некротического (≥1 см3) или ненекротического (~0,5 см3) размера. Мышам под анестезией инъецировали внутривенно лекарственное средство в различных концентрациях между 7,5-15 мг/кг. Опухоли облучали освещением в течение 10 или 30 мин, и интервал между лекарственным средством и облучением светом составлял 4-24 ч после инъекции лекарственного средства.
Для получения оптимальных условий лечения применяли несколько протоколов, исследующих эффект соединения 13 на опухоли MDA-MB-231-RFP у мышей nude CD-1, и результаты обобщенно представлены в таблице 1.
Как видно из таблицы 1, 7,5 мг лекарственного средства/кг массы тела и 10 мин облучения обеспечивают наилучшие результаты фотодинамического лечения как для некротических, так и для ненекротических опухолей. Результаты, представленные на фиг.34A-34B, демонстрируют полное излечение от ненекротической опухоли MDA-MB-231-RFP. Через одни сутки после лечения был выявлен отек, с последующим мягким, а затем более обширным некрозом в последующие 4 суток. К 7 суткам наблюдали сглаживание опухоли. Рана заживала и животное излечивалось через 90 суток после PDT. Также результаты исследовали с использованием Xenogen IVIS® System, как описано ранее для флуоресценции RFP. Через 90 суток не было флуоресцентного сигнала опухоли.
Пример 16. Создание модели локализованной карциномы протоков in situ (DCIS) в молочной железе мышей/крыс nude
Для создания модели DCIS на мышах и крысах используют несколько клеточных линий. Во-первых, клетки MADB106, которые являются сингенными с крысами F-344, уже успешно имплантировали (ортотопно), в жировое тело молочной железы крыс. Эту модель до настоящего времени использовали для скрининга эффективности PDT с помощью различных производных RGD-Bchl и последующего развития противоопухолевого длительного иммунитета. Тот же протокол, что и для карцином молочной железы крысы, используют для имплантации двух клеточных линий и дополнительной клеточной линии мышей ортотопно и для получения метастазов в легких и лимфатических узлах. Первые две, hT47D и HCC1395, представляют собой клеточные линии карциномы протоков (HCC1395 представляет собой первичную карциному протоков стадии 1, которая максимально приближена к DCIS), которые выращивают согласно правилам ATCC и литературе (Gazdar et al., 1998), и их инъецируют в качестве аллотрансплантатов в жировое тело молочной железы животных nude. Третья (4T1) представляет собой клеточную линию молочной железы мыши, которая дает метастазы в легких через несколько недель после инъекции клеток в хвостовую вену. Это разнообразие клеточных линий позволяет исследовать эффект конъюгатов (производное Bchl/Bchl-RGD)-PDT на первичные очаги, локально рецидивирующие очаги и отдаленные метастазы карциномы молочной железы в качестве моделей рака молочной железы. Клетки 4T1 трансфицируют люциферазой, а также другими двумя клеточными линиями. Трансфекцию 4T1 посредством pDsRed1-C1 проводят в настоящее время. Такая флуоресценция обеспечивает: (1) Оценку точности детекции с использованием флуоресценции на основе Bchl-RGD или MRJ; (2) Интерактивный мониторинг роста и регрессии опухоли в случае Bchl-PDT у интактных животных при очень высокой чувствительности.
Пример 17. Установление концепции накопления в области некроза в качестве общей концепции
Существуют типы опухолей, в которых при развитии формируется центральный некроз. Две таких опухоли выбраны для исследования опухолей, развившихся из следующих клеточных линий: рак молочной железы DCIS человека MCF7, DCIS человека MCF10DCIS (Tait et al., 2007), глиобластома человека U87, воспалительный рак молочной железы человека (IBC) WIBC-9 (Shirakawa et al. 2001) и RCC.
Выбранные клеточные линии подвергают трансфекции с использованием модифицированной плазмиды pDsRed-Monomer-Hyg-C1 и реагента для трансфекции Lipofectamine™ 2000 (Invitrogen™) как описано в разделе "Материалы и способы" (iii), выше. Клетки имплантируют (1-5×106 клеток, согласно требованием для каждого типа клеток) ортотопно, если возможно, или подкожно мышам CD-1 nude, позволяют расти до требуемого предельного размера (приблизительно 1 см3) и в них развивается некроз. Некротическую область исследуют гистологически. Для дальнейшего исследования выбирают две пригодные модели опухолей, развившиеся из указанных выше клеточных линий, исходя из параметров зоны некроза, скорости роста и визуализации.
Для флуоресцентной визуализации всего организма, мышей подвергают анестезии, как описано выше, и внутривенно инъецируют им соединение 13 в хвостовую вену (15 мг/кг). Мониторинг флуоресценции лекарственного средства и опухоли проводят с помощью системы IVIS®100 Imaging system (Xenogen), как описано выше. Для визуализации удаленной опухоли, мышам внутривенно инъецируют в хвостовую вену 15 мг/кг соединения 13. Затем мышей умерщвляют в различные моменты времени, и опухоли удаляют и разрезают пополам. Визуализацию удаленных опухолей и их гистологическое окрашивание для оценки некротических доменов проводят согласно разделам "Материалы и способы" (x) и (xi), выше. Ожидается накопление соединения 13 в центральных некротических доменах опухолей, независимо от происхождения клеточной линии.
Пример 18. Паттерн накопления соединения 25, конъюгированного с различными группами RGD
Для дальнейшего установления актуальности нацеливания с помощью RGD, различные пептиды RGD и отрицательные контроли используют для оценки паттерна накопления в опухолях MDA-MB-231-RFP.
Клетки MDA-MB-231-RFP имплантируют (5×106 клеток) ортотопно самкам мышей CD-1 nude и позволяют им расти до некротического размера 1 см3. Мышей подвергают анестезии и инъецируют им внутривенно в хвостовую вену 15 мг/кг соединения 26 (линейный GRGDSP-2H-MLT), соединения 45 (c(RADfK)-2H-MLT) и соединения 36 (c(RGDyK)2-2H-MLT). Флуоресцентную визуализацию лекарственного средства in vivo у интактного животного и в удаленной опухоли и гистологию проводят, как описано выше в разделах "Материалы и способы" (vii), (x) и (xi), соответственно.
Пример 19. Накопление других производных Bchl-RGD в некротической области
Дополнительные производные Bchl-RGD исследовали для определения того, является ли паттерн накопления в некрозе общим явлением для всех производных Bchl-RGD, которые имеют потенциал для лечения и/или визуализации. Конкретно, исследовали следующие производные: соединение 15 (c(RGDfK)-Cu-MLT) и соединение 14 (c(RGDfK)-Mn-MLT).
Клетки MDA-MB-231-RFP имплантируют (5×106 клеток) ортотопно самкам мышей CD-1 nude и позволяют им расти до размера опухоли 1 см3. В случае, когда происходит тушение флуоресценции Bchl вследствие наличия металла (например, Cu и Mn), концентрации соединений в опухоли и в неопухолевых тканях определяют масс-спектрометрией с индуктивно связанной плазмой (ICP-MS), с использованием устройства ELAN-6000 (Perkin Elmer, CT), как описано Brandis et al. (Brandis et al., 2005).
Пример 20. Анализ биораспределения
Этот эксперимент нацелен на количественное определение распространения и накопления с течением времени лекарственного средства в различных органах организма и на беспристрастную демонстрацию того, что лекарственное средство действительно накапливается в конечном итоге в опухоли.
Мышам под анестезией, имеющим опухоли MDA-MB-231-RFP, внутривенно инъецируют соединение 13, 15 мг/кг. Мышей умерщвляют через различные моменты времени после инъекции. Ткани (кровь, почки, печень, кожа, жир, мышца, селезенка, кишечник, головной мозг, сердце, легкие и опухоль) собирают в предварительно взвешенные флаконы и замораживают. Образцы тканей гомогенизируют и лекарственное средство экстрагируют в метаноле (~1 мл метанола на 100 мг ткани). Затем образцы анализируют посредством флуоресцентного анализа в отношении содержания лекарственного средства.
Количественное определение накопления соединения 13 в различных тканях проводят путем измерения интенсивности флуоресценции и оценки концентрации лекарственного средства с использованием, в качестве эталона, калибровочной кривой, полученной путем измерения интенсивности флуоресценции различных концентраций соединения 13 в этаноле. Флуоресцентные изображения в NIR in vivo, полученные по примеру 3, выше, в различные моменты времени сравнивают с интенсивностью флуоресценции экстрактов из анализа биораспределения. Результаты используют для подтверждения показателей in vivo.
Ожидается, что может быть найдена корреляция между показателями флуоресценции in vivo и in vitro. Также ожидается, что количественный анализ может продемонстрировать более точно отличающееся накопление и выведение в опухолевых и нормальных тканях. Такое определение может быть очень полезно в клинической области.
Пример 21. Содержащие металл производные RGD-бактериохлорофилла с радиоизотопом для визуализации и лечения
Другим вариантом лечения является замена центрального металла лекарственного средства радиоактивным металлом. Накопление такого производного RGD-M-Bchl, где M имеет относительно длительное время жизни (для терапии), можно использовать для лучевой терапии опухоли. Лекарственное средство также можно вводить с такими интервалами, при которых лекарственное средство остается в организме в низких концентрациях, но в возрастающей степени накапливается в некротической области.
Включение Cu в лекарственное средство проводят способом, разработанным в лаборатории авторов настоящего изобретения, который позволяет количественное замещение металлом 2H-Bchl-RGD в течение 10-20 мин при температуре окружающей среды. Полученное соединение является высоко стабильным и в физиологических условиях удаления металла не происходит.
Ожидается, что можно продемонстрировать накопление радиоактивного соединения в опухолевой ткани и выявить регрессию опухоли после одного или двух введений.
Bacteriophephorbide (Bpheid; в описании соединение 3) (40 мг), синтезированный, как описано в Wasielewski и Svec, 1980, путем деметаллирования-деэстерификации соответствующего Bchl с помощью 80% водного раствора трифторукусусной кислоты. Очистку синтезированного Bpheid проводили на колонке с силикагелем («Kieselgel 60», Германия) с градиентом метанола в хлороформе (0 до 15/25% об.) в качестве элюента.
Сорок (40 мг) соединения 3 активировали с использованием NHS (80 мг) и DCC (60 мг) в хлороформе (5 мл) при перемешивании при комнатной температуре в течение ночи. Полученный активированный эфир очищали на колонке с силикагелем с использованием хлороформа в качестве элюента и затем подвергали взаимодействию с циклоRGDfK (40 мг) в ДМСО (5 мл) при перемешивании в атмосфере аргона в течение ночи. Затем к реакционной смеси добавляли таурин (50 мг), растворенный в 1М вторичном кислом фосфате калия (1,5 мл, при pH, доведенном до 8,2), и смесь упаривали с получением предполагаемого соединения 13. Продукт очищали ВЭЖХ на обращенной фазе с использованием градиентного элюирования с 5 мМ фосфатным буфером, pH 8,0 и метанолом, как описано ранее (Brandis et al., 2005). Выход: 52%.
(ii) Синтез конъюгата, 14
Марганец вводили в соединение 13 с использованием ацетата кадмия (85 мг, 10 экв. к 3) и реакционную смесь нагревали до 110°C. Ход реакции контролировали спектральным анализом (в ацетоне). Металлирование проходило в течение 5 мин. MnCl2□2H2O (55 мг, 10 экв) добавляли при перемешивании до окончания реакции (еще в течение 5-10 мин). Для удаления неорганических солей реакционный раствор упаривали; твердое вещество вновь растворяли в ацетонитриле, раствор фильтровали через ватмановскую бумагу на воронке Бюхнера и упаривали. Продукт, конъюгат 14, очищали с использованием градиентного элюирования с ацетонитрилом и водой, как описано ранее (Brandis et al., 2005).
Пример 24. Синтез конъюгата 15
Водный раствор ацетата меди (2 мг) добавляли к смеси конъюгата 13 (3 мг) (полученного в примере 23 (i)) и аскорбата натрия (2 мг) в воде. Ход реакции немедленно прослеживали спектрофотометрией. После введения меди в макроцикл продукт очищали на картридже RP-18 (Lichrolut, Merck), вначале с использованием воды для вымывания непрореагировавшего ацетата меди и аскорбатов, и затем метанолом для элюирования основного соединения, конъюгата 15, который собирали и выпаривали. Выход: 86%.
Для получения радиоактивных конъюгатов использовали аналогичный способ с другими водорастворимыми солями, чем ацетат свежеприготовленного радиоактивного изотопа64Cu или67Cu (t1/2 равняется соответственно 12,70 ч и 2,58 суток).
Пример 25. Синтез конъюгата 23
Конъюгат 23 получали, начиная с синтеза соединения 10.
(i) Синтез соединения 10
Сначала палладий бактериофеофорбид a (Pd-Bpheid a; в описании - соединение 7) синтезировали, как описано в WO 2000/033833 (в описании - пример 2). Затем, соединение 7 (100 мг) растворяли в N-метилпирролидоне (1 мл) и 3-амино-2-пропандиоле (405 мг) и раствор перемешивали в течение 3 ч при комнатной температуре в атмосфере аргона. Продукт 10 очищали ВЭЖХ с использованием препаративной колонки YMC-C18 со смесью 0,2% уксусная кислота/ацетонитрил в качестве подвижной фазы. Выход: 86%. Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 со смесью ацетат аммония, pH 4,5/ацетонитрил. ESI-MS в режиме регистрации положительных ионов 805 m/z.
(ii) Синтез конъюгата 23
Соединение 10 (50 мг), NHS (80 мг) и DCC (216 мг) растворяли в сухом N,N-диметилформамиде (8 мл). Раствор перемешивали в течение 90 мин при комнатной температуре в атмосфере аргона. Образовавшийся активный эфир очищали ВЭЖХ с использованием препаративной колонки YMC-C18 со смесью 0,2% уксусная кислота/ацетонитрил в качестве подвижной фазы, анализировали на LC-MS с использованием аналитической колонки YMC-C18. со смесью ацетат аммония, pH 4,5/ацетонитрил и идентифицировали масс-спектроскопией: ESI-MS в режиме регистрации положительных ионов 902 m/z.
Активный эфир (10 мг) растворяли в сухом N-метилпирролидоне (1 мл). Добавляли циклоRGDfK (8 мг) и триэтиламин (10 мкл) и раствор перемешивали в течение 75 мин. Продукт очищали ВЭЖХ с использованием препаративной колонки YMC-C18 со смесью 0,2% уксусная кислота/ацетонитрил в качестве подвижной фазы. Выход: 50%. Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 со смесью ацетат аммония, pH 4,5/ацетонитрил: ESI-MS в режиме регистрации положительных ионов 1393 m/z.
Пример 26. Синтез конъюгата 24
Сначала, палладий 31-оксо-3-3-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид калиевая соль (в описании соединение 8) синтезировали, как описано в WO 2004/045492 (пример 1, синтез соединения 4). Затем, соединение 8 (100 мг) активировали NHS (70 мг) и N-циклогексилкарбодиимид-N′-метилполистиролом (120 мг) в ДМФА (5 мл). Раствор перемешивали при 50°C в течение 15 ч и фильтровали через металлокерамический фильтр. ЦиклоRGDfK (100 мг) растворяли в ДМФА (5 мл), содержащем N-метилморфолин (100 мкл), и добавляли к фильтрату. Смесь перемешивали в атмосфере аргона при комнатной температуре в течение 24 ч, растворитель выпаривали в вакууме и продукт 24 очищали ВЭЖХ с использованием препаративной колонки YMC-C18 со смесью ацетат аммония, pH 4,5/ацетонитрил в качестве подвижной фазы. Выход: 23%. Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 в тех же условиях. UV-VIS спектр (ВЭЖХ): 332, 386, 516 и 750 нм. ESI-MS в режиме регистрации положительных ионов 1425 m/z.
Пример 27. Синтез конъюгата 26
К GRGDSP-смоле со снятой Fmoc-защитой (0,35 ммоль) добавляли смесь соединения 25 (31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид калиевая соль; 2H-MLT) (530 мг, 0,7 ммоль), HOBt, PyBOP (оба 0,7 ммоль) и DIEA (2,1 ммоль) в 6 мл ДМФА и реакционную смесь перемешивали в течение 2 ч в атмосфере аргона. После промывания ДМФА (10×5 мл) и DCM (5×5 мл) смолу высушивали в вакууме в течение, по меньшей мере, 3 ч. Затем комплекс пептид-конъюгат отщепляли от смолы и снимали защиту (Arg, Pbf; Asp, OtBu) с использованием раствора смеси ТФК/тиоанизол/H2O/триизопропилсилан (TIS) 85:5:5:5 (10 мл) в течение 10 мин при 0°C и затем в течение 1 ч при комнатной температуре в атмосфере Ar. Смолу отфильтровывали и промывали раствором смеси (4 мл) и объединенный фильтрат упаривали в атмосфере N2 примерно до половины объема. При добавлении холодного Et2O (30 мл) выпадал темный осадок. Центрифугирование и декантация слоя Et2O и дополнительная обработка холодным Et2O (2×30 мл) давали сырое твердое темное вещество, которое затем очищали ОФ-ВЭЖХ (264 мг; 58%). Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 со смесью ацетат аммония, pH 4,5/ацетонитрил. ESI-MS в режиме регистрации положительных ионов 1306 m/z.
Пример 28. Синтез конъюгатов 28-31
Указанные в заголовке соединения получали, начиная с синтеза неметаллированного конъюгата 27 Bpheid-циклоRGDfK, следующим образом.
(1) Твердо-фазный синтез циклоRGDfK
Fmoc-Cα-аллил-защищенную аспарагиновую кислоту присоединяли к 2-хлортритилхлоридной смоле. Затем глицин, NG-Pbf аргинин, Nε-Dde лизин и фенилаланин присоединяли к смоле с использованием обычной Fmoc-химии с получением комплекса fKRGD-пептидил-смола. Затем N-концевую Fmoc-группу удаляли обработкой смесью 2% пиперидин/ДМФА и удаляли Cα-аллил-группу на остатке аспарагиновой кислоты с использованием тетракис(трифенилфосфин)палладия и 1,3-диметилбарбитуровой кислоты (DMBA) в DCM. Пептид подвергали циклизации в присутствии HOBt/PyBOP и DIEA. ε-амин остатка лизина отщепляли смесью 4% гидразин/ДМФА.
(ii) Синтез конюгата 27
Bpheid (соединение 3, 0,6 ммоль; полученное как описано в примере 23 (i)) связывали с ε-NH2-Lys комплекса fKRGD-пептидил-смола (0,3 ммоль) в ДМФА с использованием PyBOP/HOBt (0,6 ммоль) в качестве сочетающих агентов и DIEA (1,8 ммоль) в качестве основания, с получением таким образом конъюгата 27.
(iii) Синтез конъюгатов 28-31
Конъюгат 27 (0,1 ммоль) обрабатывали на смоле соответствующим амином, приведенным в таблице 1 (5-6 ммоль), в ДМФА при комнатной температуре в течение 2 ч. Затем избыток амина отмывали, продукт отделяли от смолы, снимали защиту с ТФК-содержащей смеси и, наконец, очищали ОФ-ВЭЖХ. Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 со смесью ацетат аммония, pH 4,5/ацетонитрил. Результаты приведены в таблице 2.
Пример 29. Синтез конъюгата 32
Конъюгат 32 получали сочетанием пептидиламина циклоRGDK-NH2 (полученного, как описано в разделе «Материалы и методы») и Bpheid (соединение 3, полученного как описано в примере 23 (i)) в ДМФА в присутствии DCC с последующим снятием защиты с Pbf и O-tBu с использованием ТФК. Продукт очищали ОФ-ВЭЖХ. Выход: 53%. Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 со смесью ацетат аммония, pH 4,5/ацетонитрил: ESI-MS в режиме регистрации положительных ионов 1135 m/z.
Пример 30. Синтез конъюгата 34
Конъюгат 34 получали конъюгированием соединения 8 (полученным, как описано в примере 22) с линейным пептидом (GRGDSP)4K (полученным, как описано в разделе «Материалы и методы») аналогично способу, описанному для получения конъюгата 24 в примере 26. Выход: 41%. Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 со смесью ацетат аммония, pH 4,5/ацетонитрил. MALDI-MS в режиме регистрации положительных ионов, 3291 (M+2Na) m/z.
Пример 31. Синтез конъюгата 35
Конъюгат 35 получали конъюгированием соединения 8 (пример 22) с циклоRGDf-N(Me)K (получен, как описано в разделе «Материалы и методы»), аналогично способу, описанному для конъюгата 24 в примере 2.6. Выход: 58%. Анализ проводили на LC-MS с использованием аналитической колонки LC-MS, используя аналитическую колонку YMC-C18 с ацетатом аммония, pH 4,5/ацетонитрил:ESI-MS в режиме регистрации положительных ионов, 1439 m/z.
Пример 32. Синтез конъюгата 36
Конъюгат 36 получали конъюгированием соединения 8 (пример 22) с циклическим димерным пептидом (cycloRGDyK)2 (полученным, как описано в разделе «Материалы и методы») аналогично способу, описанному для получения конъюгата 24 в примере 26. Выход: 27%. Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 со смесью ацетат аммония, pH 4,5/ацетонитрил: MALDI-MS в режиме регистрации положительных ионов, 2245 (M+2Na) m/z.
Пример 33. Синтез конъюгата 37
Конъюгат 37 синтезировали из Pd-Bpheid (соединения 7, полученного как описано в примере 25 (i)) и RGD-пептида. Пептид получали твердо-фазным методом сочетанием Fmoc-Arg(Pbf)-Gly-OH со смолой со связанным остатком H-Asp-O-аллил.
(i) Получение защищенного дипептида Arg-Gly
Раствор Fmoc-Gly-OH (4,162 г; 14 ммоль) и DIEA (9,755 г; 56 ммоль) в 100 мл сухого DCM перемешивали с 10 г 2-хлортритилхлоридной смолы (1,4 ммоль/г) в течение 1 ч при комнатной температуре. Затем Fmoc-группу удаляли обработкой смесью 5% пиперидина в ДМФА/DCM (1:1), затем 20% пиперидином в ДМФА. Затем Fmoc-Arg(Pbf)-ОН (18,17 г; 28 ммоль) в ДМФА (130 мл) активировали HOBt (4,29 г; 28 ммоль) и DIC (4,34 г; 28 ммоль) в течение 15 мин при комнатной температуре и вносили в реакционный сосуд. Смесь перемешивали в течение 2 ч при комнатной температуре. Пептидил-смолу промывали и высушивали в вакууме в течение 3 ч. Защищенный дипептид отщепляли от смолы перемешиванием с раствором смеси AcOH/2,2,2-трифторэтанол (TFE)/DCM (1:1:3) в течение 1 ч при комнатной температуре. При обработке холодным Et2O (1:1) маслянистый остаток затвердевал. Фильтрование и промывание холодным Et2O давало белый осадок (8,64 г; 87,5%) с гомогенностью, равной примерно 99% (ВЭЖХ).
(ii) Синтез RGD-трипептида.
Присоединение третьей аминокислоты к дипептиду, полученному на стадии (i) выше, начинали с перемешивания 2-хлортритилхлоридной смолы (0,5 г; 1,4 ммоль/г) с раствором Fmoc-Asp-O-аллила (138,4 мг; 0,35 ммоль) и DIEA (244 мкл; 1,4 ммоль) в DCM в течение 1 ч при комнатной температуре с получением нагрузки, равной 0,7 ммоль/г. Затем смолу отмывали и Fmoc удаляли, как описано выше. Fmoc-Arg(Pbf)-Gly-OH (371 мг; 0,525 ммоль), HOBt (80,4 мг; 0,525 ммоль) и DIC (81 мкл; 0,525 ммоль) растворяли в 2,5 мл ДМФА и перемешивали при комнатной температуре в течение 20 мин. Полученный раствор добавляли к промытой H-Asp-O-аллил-смоле и смесь перемешивали в течение 2 ч при комнатной температуре. Пептидил-смолу отмывали и Fmoc удаляли.
(iii) Синтез конъюгата 37
Смесь соединения 7 (268 мг, 0,375 ммоль), HOBT (57,4 мг; 0,375 ммоль) и DIC (58 мкл; 0,375 ммоль) в 3 мл ДМФА перемешивали в течение 30 мин при комнатной температуре и добавляли к аликвотной порции трипептидил-смолы со снятой Fmoc-защитой, полученной как описано в п. ii) выше (примерно 0,125 ммоль). Смесь перемешивали в течение 2 ч при комнатной температуре и получали конъюгат 7 с линейным RGD-трипептидом. Данную реакцию и все последующие операции с модифицированной пептидил-смолой проводили в атмосфере аргона в темноте. После промывания смолу обрабатывали этилендиамином (251 мкл; 375 ммоль) в ДМФА в течение 1 ч при комнатной температуре, затем промывали. Для удаления аллил-защитной группы смолу подвергали взаимодействию с раствором [(C6H5)3]4Pd0 (87 мг; 0,075 ммоль) и DMBA (137 мг; 0,875 ммоль) в DCM в течение 2 ч при комнатной температуре.
Циклизацию на смоле проводили связыванием остатка Asp со снятой защитой с этилендиаминогруппой с использованием раствора PyBOP (195 мг; 0,375 ммоль) и DIEA (131 мкл; 0,75 ммоль) в ДМФА в течение 2 ч при комнатной температуре. Смолу промывали и высушивали в вакууме в течение 3 ч. Пептидный конъюгат отщепляли от смолы с использованием раствора смеси ТФК/тиоанизол/Н2О/TIS/ЭДТ (82,5:5:5:5:2,5) в течение 10 мин при 0°C и затем в течение 1 ч при комнатной температуре. При добавлении холодного Et2O (25 мл) получали темное твердое вещество. Сырой продукт (95 мг) очищали ОФ-ВЭЖХ с получением 2 мг чистого (98%) циклического RGD-конъюгата 37. ESI-MS 1087 (M+H) m/z.
Пример 34. Синтез конъюгата 38
Синтез проводили в объеме 0,175 ммоль с использованием способа, описанного в примере 19, но начиная с соединения Bpheid 3 вместо Pd-Bpheid 7. Сырой продукт (160 мг) очищали ОФ-ВЭЖХ с получением 17 мг чистого (98%) циклического RGD-конъюгата 38. ESI-MS 982 (M+H) m/z.
Пример 35. Синтез конъюгата 39
Способ был аналогичным описанному в примере 33, но использовали 1,4-бис(3-аминопропил)пиперазин для образования «мостика» между остатком Bpheid и остатком Asp вместо этилендиамина. Сырой продукт (158 мг) очищали ОФ-ВЭЖХ с получением 12,5 мг чистого (99%) циклического RGD-конъюгата 39. ESI-MS 1122 (M+H) m/z.
Пример 36. Синтез конъюгата 40
Конъюгат 40 получали способом, аналогичным описанному для конъюгата 24, но с использованием RGD-пептидомиметика 5- (6-гуанидиногексаноиламино)пентановой кислоты (RGD-PM1). Выход: 42%. Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 со смесью ацетат аммония, pH 4,5/ацетонитрил: ESI-MS в режиме регистрации положительных ионов 1123 m/z.
Пример 37. Синтез конъюгата 41
Конъюгат 41 получали способом, аналогичным описанному для конъюгата 24, но с использованием линейного RGD-пептидомиметика 1-(4-гуанидинобутирил)пиперидин-3-карбонил)амино)гептановой кислоты (RGD-PM2). Выход: 66%. Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 со смесью ацетат аммония, pH 4,5/ацетонитрил: ESI-MS в режиме регистрации положительных ионов 1120 m/z.
Пример 38. Синтез конъюгата 42
Конъюгат 42 получали способом, аналогичным описанному для конъюгата 24 в примере 26, но с пептида циклоRADfK. Выход: 30%. Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 со смесью ацетат аммония, pH 4,5/ацетонитрил: ESI-MS в режиме регистрации положительных ионов 1439 m/z.
Пример 39. Синтез конъюгата 43
Указанное в заголовке соединение получали, начиная с синтеза бактериофеофорбид-173-(циклоRGDfK)амида, конъюгата 27, как описано в примере 28.
Конъюгат 27 (0,1 ммоль) обрабатывали на смоле 1,3-пропилендиамином (6 ммоль) в ДМФА при комнатной температуре в течение 2 ч. Затем отмывали избыток амина и добавляли DTPA диангидрид (0,2 ммоль) и триэтиламин (100 мл) в безводном ДМФА (30 мл). Через 1 ч перемешивания в атмосфере аргона добавляли дистиллированную воду (50 мл) с последующим перемешиванием еще в течение 30 мин. Продукт 43 отделяли от смолы, снимали защиту с использованием содержащей ТФК смеси и, наконец, очищали ОФ-ВЭЖХ (61 мг, 37%). Анализ проводили на LC-MS с использованием аналитической колонки YMC-C18 со смесью вода/ацетонитрил: ESI-MS в режиме регистрации отрицательных ионов 1643 m/z.
Пример 40. Синтез конъюгата 44
Хлорид гадолиния (0,1 ммоль) в буферном водном растворе ацетата натрия (0,1н, pH 5,5) добавляли к раствору конъюгата 43 (6 мкмоль) в 2 мл ДМФА. Смесь выдерживали при комнатной температуре в течение ночи при перемешивании. Образование хелатов металла подтверждали LC-MS (1799 m/z). Реакционную смесь выпаривали, и продукт очищали на картридже ОФ-18 (Lichrolut, Merck) вначале с использованием воды для отмывки непрореагировавшей соли гадолиния и затем метанолом для элюирования основного соединения, конъюгата 44, который собирали и упаривали (8 мг, 73%).
Ссылки:
Alfsen, A., H. Yu, et al. (2005). "HIV-1-infected blood mononuclear cells form an integrin- and agrin-dependent viral synapse to induce efficient HIV-1 transcytosis across epithelial cell monolayer." Mol Biol Cell 16(9): 4267-79.
Bauminger S. and Wilchek M. (1980) "The use of carbodiimides in the preparation of immunizing conjugates. Methods Enzymol", 70(A): 151-159.
Becker, A., B. Riefke, et al. (2000). "Macromolecular contrast agents for optical imaging of tumors: comparison of indotricarbocyanine-labeled human serum albumin and transferrin." Photochem Photobiol 72(2): 234-41.
Berton, G. and C. A. Lowell (1999). "Integrin signalling in neutrophils and macrophages." Cell Signal 11(9): 621-35.
Bijker N et al. (2006) "Breast-conserving treatment with or without radiotherapy in ductal carcinoma-in-situ: ten-year results of European Organisation for Research and Treatment of Cancer randomized phase III trial 10853" -- a study by the EORTC Breast Cancer Cooperative Group and EORTC Radiotherapy Group. J Clin Oncol. 24(21): 3381-7
Boehm-Viswanathan T. (2000) "Is angiogenesis inhibition the Holy Grail of cancer therapy?" Curr Opin Oncol. 12(1): 89-94
Brandis A., Mazor O., Gross S., Koudinova N., Hami R., Kalin-Kammhuber N., Rosenbach-Belkin V., Greenwald M.,. Bondon A., Simonneaux G., Scheer H., Salomon Y. and Scherz A. (2003) "Novel palladium-bacteriochlorophyll derivatives for antivascular Photodynamic therapy: synthesis, phototoxicity, pharmacokinetics and efficacy", J. Med. Chem. submitted.
Brandis, A., O. Mazor, et al. (2005). "Novel water-soluble bacteriochlorophyll derivatives for vascular-targeted photodynamic therapy: synthesis, solubility, phototoxicity and the effect of serum proteins." Photochem Photobiol 81(4): 983-93.
Britton MM. (2006) "Nuclear magnetic resonance studies of convection in the 1,4-cyclohexanedione-bromate-acid reaction. J Phys Chem A." 110(15): 5075-80.
Brown, J.M. and A.J. Giaccia (1998). "The unique physiology of solid tumors: opportunities (and problems) for cancer therapy." Cancer Res 58(7): 1408-16.
Brown, J.M. and W.R. Wilson (2004). "Exploiting tumour hypoxia in cancer treatment." Nat Rev Cancer 4(6): 437-47.
Brown, N.S. and R. Bicknell (2001). "Hypoxia and oxidative stress in breast cancer. Oxidative stress: its effects on the growth, metastatic potential and response to therapy of breast cancer." Breast Cancer Res 3(5): 323-7.
Burstein HJ, Polyak K, Wong JS, Lester SC, Kaelin CM. (2004) "Ductal carcinoma in situ of the breast." N Engl J Med. 350(14): 1430-41. Review
Bussolati, G., M. Bongiovanni, et al. (2000). "Assessment of necrosis and hypoxia in ductal carcinoma in situ of the breast: basis for a new classification." Virchows Arch 437(4): 360-4.
Cao, Y. (2005). "Tumor angiogenesis and therapy." Biomed Pharmacother 59 Suppl 2: S340-3.
Cellini C, Huston TL, Martins D, Christos P, Carson J, Kemper S, Simmons RM. (2005) "Multiple re-excisions versus mastectomy in patients with persistent residual disease following breast conservation surgery." Am J Surg. 189(6): 662-6.
Cutuli, B., C. Cohen-Solal-le Nir, et al. (2002). "Breast-conserving therapy for ductal carcinoma in situ of the breast: the French Cancer Centers' experience." Int J Radiat Oncol Biol Phys 53(4): 868-79.
Dean, M., T. Fojo, et al. (2005). "Tumour stem cells and drug resistance." Nat Rev Cancer 5(4): 275-84.
Dewhirst, M.W. (1998). "Concepts of oxygen transport at the microcirculatory level." Semin Radiat Oncol 8(3): 143-50.
Dougherty, Т.J., С.J. Gomer, et al. (1998). "Photodynamic therapy." J Natl Cancer Inst 90(12): 889-905.
Edwards, J.G., D.E. Swinson, et al. (2003). "Tumor necrosis correlates with angiogenesis and is a predictor of poor prognosis in malignant mesothelioma." Chest 124(5): 1916-23.
Folkman J. (1996) "Endogenous inhibitors of angiogenesis." Harvey Lect. 92:65-82.
Folkman J. (1997) "Angiogenesis and angiogenesis inhibition: an overview." EXS. 79: 1-8. Review.
Folkman J. (2004) "A novel anti-vascular therapy for cancer." Cancer Biol Ther. 3(3):338-9.
Freidinger R.M., Hinkle J.S., Perlow D.S., and Arison B.H. (1983) "Synthesis of 9-Fluorenylmethyloxycarbonyl-Protected N-Alkyl Amino Acids by Reduction of Oxazolidinones", J. Org. Chem. 48: 77-81.
Gazdar AF, Kurvari V, Virmani A, Gollahon L, Sakaguchi M, Westerfield M, Kodagoda D, Stasny V, Cunningham HT, Wistuba II, Tomlinson G, Tonk V, Ashfaq R, Leitch AM, Minna JD, Shay JW. (1998) "Characterization of paired tumor and non-tumor cell lines established from patients with breast cancer." Int J Cancer. 78(6): 766-74.
Gross S., Brandis A., et al. (1997). "Protein-A-mediated targeting of bacteriochlorophyll-IgG to Staphylococcus aureus: a model for enhanced site-specific photocytotoxicity." Photochem Photobiol 66(6): 872-8.
Gross S., Gilead A., Brandis A., Schreiber S., Machluf Y., Neeman M., Scherz A. and Salomon Y. (2003a) "Selective vascular and tumor responses of photodynamic therapy (PDT) with Pd bacteriopheophorbide (TOOKAD®): online and offline analyses", Proceedings of the 94th annual meeting of the American association for cancer research (AACR), Toronto, April 5-9, 44: 27.
Gross S, Gilead A, Scherz A, Neeman M, Salomon Y. (2003b) Monitoring photodynamic therapy of solid tumors online by BOLD-contrast MRI. Nat Med. 9(10): 1327-31
Guidi AJ, Fischer L, Harris JR, Schnitt SJ. (1994) "Microvessel density and distribution in ductal carcinoma in situ of the breast." J Natl Cancer Inst. 86(8): 614-9.
Guidi AJ, Schnitt SJ, Fischer L, Tognazzi K, Harris JR, Dvorak HF, Brown LF. (1997) "Vascular permeability factor (vascular endothelial growth factor) expression and angiogenesis in patients with ductal carcinoma in situ of the breast." Cancer. 80(10): 1945-53.
Guinebretiere JM, Le Monique G, Gavoille A, Bahi J, Contesso G (1994) "Angiogenesis and risk of breast cancer in women with fibrocystic disease." J Natl Cancer Inst. 86(8): 635-6.
Haubner R. et al. (1999) "Radiolabeled vβ3 integrin antagonists: a new class of tracers for tumor targeting", J Nucl Med. 40: 1061-1071
He, X., P.E. Brenchley, et al. (2004). "Hypoxia increases heparanase-dependent tumor cell invasion, which can be inhibited by antiheparanase antibodies." Cancer Res 64(11): 3928-33.
Hendey, В., M. Lawson, et al. (1996). "Intracellular calcium and calcineurin regulate neutrophil motility on vitronectin through a receptor identified by antibodies to integrins alphav and beta3." Blood 87(5): 2038-48.
Hofmann, В., A. Bogdanov, Jr., et al. (1999). "Mechanism of gadophrin-2 accumulation in tumor necrosis." J Magn Reson Imaging 9(2): 336-41.
Holland R, Hendriks JH, Vebeek AL, Mravunac M, Schuurmans Stekhoven JH (1990) "Extent, distribution, and mammographic/histological correlations of breast ductal carcinoma in situ." Lancet. 335(8688): 519-22.
Iyer, А.K., G. Khaled, et al. (2006). "Exploiting the enhanced permeability and retention effect for tumor targeting." Drug Discov Today 11(17-18): 812-8.
Kamel, I.R., D.A. Bluemke, et al. (2003). "Role of diffusion-weighted imaging in estimating tumor necrosis after chemoembolization of hepatocellular carcinoma." AJR Am J Roentgenol 181(3): 708-10.
Kato, Т., Т. Kimura, et al. (1997). "Clinicopathologic study of angiogenesis in Japanese patients with breast cancer." World J Surg 21(1): 49-56.
Kennan, R.P., B.E. Scanley, et al. (1997). "Physiologic basis for BOLD MR signal changes due to hypoxia/hyperoxia: separation of blood volume and magnetic susceptibility effects." Magn Reson Med 37(6): 953-6.
Kepple J, Van Zee KJ, Dowlatshahi K, Henry-Tillman RS, Israel PZ, Klimberg VS. (2004) "Minimally invasive breast surgery." J Am Coll Surg. 199(6): 961-75. Review
Kieran MW, Folkman J, Heymach J. (2003) "Angiogenesis inhibitors and hypoxia." Nat Med. 9(9): 1 104; author reply 1104-5
Koivunen E., Wang B. and Ruoslahti E. (1995) "Phage libraries displaying cyclic peptides with different ring sizes: ligand specificities of the RGD-directed integrins", Biotechnology (N Y), 13(3): 265-70.
Koudinova, N.V., J.H. Pinthus, et al. (2003). "Photodynamic therapy with Pd-Bacteriopheophorbide (TOOKAD): successful in vivo treatment of human prostatic small cell carcinoma xenografts." Int J Cancer 104(6): 782-9.
Krippl P, Langsenlehner U, Renner W, Yazdani-Biuki B, Wolf G, Wascher TC, Paulweber B, Haas J, Samonigg H. (2003) "A common 936 C/T gene polymorphism of vascular endothelial growth factor is associated with decreased breast cancer risk." Int J Cancer. 106(4): 468-71.
Lang, P., M.F. Wendland, et al. (1998). "Osteogenic sarcoma: noninvasive in vivo assessment of tumor necrosis with diffusion-weighted MR imaging." Radiology 206(1): 227-35.
Lee, A.H., L.C. Happerfield, et al. (1997). "Angiogenesis and inflammation in invasive carcinoma of the breast." J Clin Pathol 50(8): 669-73.
Lee, K., R.A. Roth, et al. (2007). "Hypoxia, drug therapy and toxicity." Pharmacol Ther 113(2): 229-46.
Lee, S.E., S.K. Hong, et al. (2007). "Prognostic significance of tumor necrosis in primary transitional cell carcinoma of upper urinary tract." Jpn J Clin Oncol 37(1): 49-55.
Leek, R.D., R.J. Landers, et al. (1999). "Necrosis correlates with high vascular density and focal macrophage infiltration in invasive carcinoma of the breast." Br J Cancer 79(5-6): 991-5.
Lehtio, K., O. Eskola, et al. (2004). "Imaging perfusion and hypoxia with PET to predict radiotherapy response in head-and-neck cancer." Int J Radiat Oncol Biol Phys 59(4): 971-82.
Lyons, S.K. (2005). "Advances in imaging mouse tumour models in vivo." J Pathol 205(2): 194-205.
Maeda, H., J. Wu, et al. (2000). "Tumor vascular permeability and the EPR effect in macromolecular therapeutics: a review." J Control Release 65(1-2): 271-84.
Maeshima, Y., P.C. Colorado, et al. (2000). "Two RGD-independent alpha vbeta 3 integrin binding sites on tumstatin regulate distinct anti-tumor properties." J Biol Chem 275(31): 23745-50.
Marugan, J.J., C. Manthey, et al. (2005). "Design, synthesis, and biological evaluation of novel potent and selective alphavbeta3/alphavbeta5 integrin dual inhibitors with improved bioavailability. Selection of the molecular core." J Med Chem 48(4): 926-34.
Mazor, O., A. Brandis, et al. (2005). "WSTI l, a novel water-soluble bacteriochlorophyll derivative; cellular uptake, pharmacokinetics, biodistribution and vascular-targeted photodynamic activity using melanoma tumors as a model." Photochem Photobiol 81(2): 342-51.
Metz, S., H.E. Daldrup-Unk, et al. (2003). "Detection and quantification of breast tumor necrosis with MR imaging: value of the necrosis-avid contrast agent Gadophrin-3." Acad Radiol 10(5): 484-90.
Minchinton, A.I. and I.F. Tannock (2006). "Drug penetration in solid tumours." Nat Rev Cancer 6(8): 583-92.
Ni, Y., G. Bormans, et al. (2005). "Necrosis avid contrast agents: functional similarity versus structural diversity." Invest Radiol 40(8): 526-35.
Nyberg, P., M. Ylipalosaari, et al. (2006). "Trypsins and their role in carcinoma growth." Exp Cell Res 312(8): 1219-28.
Patan S, Munn LL, Jain RK. (1996) "Intussusceptive microvascular growth in a human colon adenocarcinoma xenograft: a novel mechanism of tumor angiogenesis." Microvasc Res. 51(2): 260-72.
Patterson, A.V., D.M. Ferry, et al. (2007). "Mechanism of action and preclinical antitumor activity of the novel hypoxia-activated DNA cross-linking agent PR-104." Clin Cancer Res 13(13): 3922-32.
Plaks V, Kalchenko V, Dekel N, Neeman M. (2006) "MRI analysis of angiogenesis during mouse embryo implantation." Magn Reson Med. 55(5): 1013-22.
Preise D., Mazor O., Koudinova N., Liscovitch M., Scherz A. and Salomon Y. (2003) "Bypass Of Tumor Drug Resistance By Antivascular Therapy", Neopliasia 5(6): 475-80
Rankin SC. (2000) "MRI of the breast." Br J Radiol. 73(872): 806-18. Review.
Relf M, LeJeune S, Scott PA, Fox S, Smith K, Leek R, Moghaddam A, Whitehouse R, Bicknell R, Harris AL. (1997) "Expression of the angiogenic factors vascular endothelial cell growth factor, acidic and basic fibroblast growth factor, tumor growth factor beta-1, platelet-derived endothelial cell growth factor, placenta growth factor, and pleiotrophin in human primary breast cancer and its relation to angiogenesis." Cancer Res. 57(5): 963-9.
Rosenbach-Belkin V, Chen L, Fiedor L, Tregub I, Paviotsky F, Brumfeld V, Salomon Y, Scherz A. (1996) "Serine conjugates of chlorophyll and bacteriochlorophyll: photocytotoxicity in vitro and tissue distribution in mice bearing melanoma tumors." Photochem Photobiol. 64(1): 174-81.
Rubinstein, E., A. Brandis, et al. "Vascular-Targeted Photodynamic Therapy (VTP), Imaging (VTI) and localization of primary lesions and metastases by novel Bacteriochlorophyll (BCL)-RGD conjugates." In preparation.
Sanders ME, Schuyler PA, Dupont WD, Page DL. (2005) "The natural history of low-grade ductal carcinoma in situ of the breast in women treated by biopsy only revealed over 30 years of long-term follow-up." Cancer. 103(12): 2481-4
Schaffner, P. and M.M. Dard (2003). "Structure and function of RGD peptides involved in bone biology." Cell Mol Life Sci 60(1): 119-32.
Schneider BP, Miller KD. (2005) "Angiogenesis of breast cancer." J Clin Oncol. 23(8): 1782-90. Review
Schreiber S., Gross S., Brandis A., Harmelin A., Rosenbach-Belkin V., Scherz A. and Salomon Y. (2002) "Local photodynamic therapy (PDT) of rat C6 glioma xenografts with Pd-bacteriopheophorbide leads to decreased metastases and increase of animal cure compared with surgery". Int. J. Cancer, 99: 279-285.
Sengupta, S., С.M. Lohse. et al. (2005). "Histologic coagulative tumor necrosis as a prognostic indicator of renal cell carcinoma aggressiveness." Cancer 104(3): 511-20.
Shimizu K, Asai T, Oku N. (2005) "Antineovascular therapy, a novel antiangiogenic approach." Expert Opin Ther Targets. 9(1): 63-76.
Shirakawa, K., H. Tsuda, et al. (2001). "Absence of endothelial cells, central necrosis, and fibrosis are associated with aggressive inflammatory breast cancer." Cancer Res 61(2): 445-51.
Streubel В, Chott A, Huber D, Exner M, Jager U, Wagner O, Schwarzinger I. (v) "Lymphoma-specific genetic aberrations in microvascular endothelial cells in B-cell lymphomas." N Engl J Med. 351(3): 250-9.
Tait, L.R., R.J. Pauley, et al. (2007). "Dynamic stromal-epithelial interactions during progression of MCF10DCIS.com xenografts." Int J Cancer 120(10): 2127-34.
Takagi, J. (2004). "Structural basis for ligand recognition by RGD (Arg-Gly-Asp)-dependent integrins." Biochem Soc Trans 32(Pt3): 403-6.
Tanaka, Т., S. Shiramoto, et al. (2004). "Tumor targeting based on the effect of enhanced permeability and retention (EPR) and the mechanism of receptor-mediated endocytosis (RME)." Int J Pharm 277(1-2): 39-61.
Tannock, I. (1978). "Cell kinetics and chemotherapy: a critical review." Cancer Treat Rep 62(8): 1117-33.
Tannock, I.F. and D. Rotin (1989). "Acid pH in tumors and its potential for therapeutic exploitation." Cancer Res 49(16): 4373-84.
Temming, K., R.M. Schiffelers, et al. (2005). "RGD-based strategies for selective delivery of therapeutics and imaging agents to the tumour vasculature." Drug Resist Updat 8(6): 381-402.
Thorpe PE (2004) "Vascular targeting agents as cancer therapeutics." Clin Cancer Res. 10(2): 415-27. Review.
Tomes, L., E. Emberley, et al. (2003). "Necrosis and hypoxia in invasive breast carcinoma." Breast Cancer Res Treat 81(1): 61-9.
Vaillancourt V.A. et al. (2001) "Synthesis and Biological Activity of Aminoguanidine and Diaminoguanidine Analogues of the Antidiabetic/Antiobesity Agent 3-Guanidinopropionic Acid", J. Med. Chem., 44: 1231-1248.
Vaupel, P., D.K. Kelleher, et al. (2001). "Oxygen status of malignant tumors: pathogenesis of hypoxia and significance for tumor therapy." Semin Oncol 28(2 Suppl 8): 29-35.
Wanunu M., Vaskevich A., Cohen S.R., Cohen H., Arad-Yellin R., Shanzer A., Rubinstein I. (2005) "Branched Coordination Multilayers on Gold", JACS, 127: 17877-17887.
Wapnir, I.L., N. Barnard, et al. (2001). "The inverse relationship between microvessel counts and tumor volume in breast cancer." Breast J 7(3): 184-8.
Wasielewski M.R. and Svec W.A. (1980) "Synthesis of Covalently Linked Dimeric Derivatives of Chlorophyll a, Pyrochlorophyll a, Chlorophyll b, and Bacteriochlorophyll a", J. Org. Chem., 45(10): 1969-1974.
Weersink RA, Bogaards A, Gertner M, Davidson SR, Zhang K, Netchev G, Trachtenberg J, Wilson ВС. (2005) "Techniques for delivery and monitoring of TOOKAD (WST09)-mediated photodynamic therapy of the prostate: clinical experience and practicalities." J Photochem Photobiol B. 79(3): 211-22.
Weinmann, M., С.Belka, et al. (2004). "Tumour hypoxia: impact on biology, prognosis and treatment of solid malignant tumours." Onkologie 27(1): 83-90.
Yang, M., E. Baranov, et al. (2000). "Whole-body optical imaging of green fluorescent protein-expressing tumors and metastases." Proc Nati Acad Sci U S A 97(3): 1206-11.
Zilberstein J., Bromberg A., Frantz A., Rosenbach-Belkin V., Kritzmann A., Pfefermann R., Salomon Y. and Scherz A. (1997) "Light-dependent oxygen consumption in bacteriochlorophyll-serine-treated melanoma tumors: on-line determination using a tissue-inserted oxygen microsensor", Photochem Photobiol., 65(6): 1012-1019.
Zilberstein J., Schreiber S., Bloemers M.C. W.M., Bendel P., Neeman M., Schechtman E., Kohen F., Scherz A. and Salomon Y. (2001) "Antivascular treatment of solid melanoma tumors with bacteriochlorophyll-serine-based photodynamic therapy", Photochem. Photobiol., 73: 257-266.
Реферат
Изобретение относится к фармацевтической промышленности, а именно к конъюгатам RGD-бактриохлорофилл, которые направляются в некротические домены опухоли и накапливаются в них значительно дольше, чем в ненекротических доменах, для применения в минимально инвазивной нацеленной на опухоль визуализации, нацеленной на опухоль фотодинамической терапии и/или интерактивного прогнозирования некротических опухолей. 5 н. и 11 з.п. ф-лы, 38 пр., 34 ил., 2 табл.
Формула

где M представляет собой 2H или атом, выбранный из группы, состоящей из Mg, Pd, Pt, Co, Ni, Sn, Cu, Zn, Mn, In, Eu, Fe, Au, Al, Gd, Dy, Er, Yb, Lu, Ga, Y, Rh, Ru, Ge, Cr, Mo, Re, Tc и Tl и их изотопов и радиоизотопов;
каждый из R1,



Y представляет собой O;
R4 представляет собой


каждый R8, R9,


(a) H;
(b) C1-C10 алкил, замещенный одной или несколькими функциональными группами, выбранными из группы, состоящей из галогена, нитро, оксо, OR, SR, эпокси, эпитио, -CONRR′, -COR, COOR, -OSO3R, -SO3R, -SO2R, -NHSO2R, -SO2NRR′-NRR′, =N-OR, =N-NRR′, -C(=NR)-NRR′-NR-NRR′, -(R)N-C(=NR)-NRR′, O←NR-, >C=NR, -(CH2)n-NR-COR′, -(CH2)n-CO-NRR′, -O-(CH2)n-OR, -O-(CH2)n-O-(CH2)n-R, -PRR′, -OPO3RR′, -PO2HR и -PO3RR′, где n равен целому числу от 1 до 6, каждый из R и R′ независимо представляет собой H, гидрокарбил или гетероциклил, R′ может дополнительно быть остатком пептида RGD или пептидомиметика RGD, или R и R′ вместе с атомом N, к которому они присоединены, образуют 3-7-членное насыщенное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из J, S и N, где дополнительный атом N может быть замещен;
(c) C1-C10 алкил, замещенный одной или несколькими функциональными группами, выбранными из группы, состоящей из положительно заряженных групп, отрицательно заряженных групп, основных групп, которые в физиологических условиях превращаются в положительно заряженные группы, и кислотных групп, которые в физиологических условиях превращаются в отрицательно заряженные группы;
(d) C1-C10 алкил, содержащий один или несколько гетероатомов и/или одну или несколько гетероциклических групп и замещенный одной или несколькими функциональными группами, как определено в (b) и (c) выше;
(e) C1-C10 алкил, замещенный остатком аминокислоты, пептида, пептида RGD, белка, моносахарида, олигосахарида, полисахарида или полидентатного лиганда и его хелатирующего комплекса с металлами; или (f) остаток аминокислоты, пептида, пептида RGD или пептидомиметика RGD, белка, моносахарида, олигосахарида, полисахарида или полидентатного лиганда и его хелатирующего комплекса с металлами;
R8, кроме того, может представлять собой H+ или катион



A- представляет собой физиологически приемлемый анион;
m равно 0 или 1;
и его фармацевтически приемлемые соли или оптические изомеры,
где указанный RGD-содержащий пептид представляет собой линейный или циклический пептид, состоящий из 4-100 аминокислот.
(a) отрицательно заряженной группы, выбранной из COO-, COS-,


(b) кислотной группы, которая превращается в отрицательно заряженную группу при физиологических pH, выбранной из COOH, COSH, SO3H или PO3H2 или их соли;
(c) положительно заряженной группы, выбранной из ониевой группы, такой как -O+(RR′), -S+(RR′), -Se+(RR′), -Te+(RR′), -P+(RR′R′′), -As+(RR′R′′), -Sb+(RR′R′′) и -Bi+(RR′R′′), катиона, образованного из N-содержащей группы, выбранной из группы -N+(RR′R′′), -(R)N-N+(RR′R′′), O←N+(RR′)-, >C=N+(RR′), -C(=NR)-N+RR′R′′ или -(R)N-C(=NR)-N+RR′R′′, предпочтительно -N+(RR′R′′), или катиона, образованного из гетероароматического соединения, содержащего один или несколько атомов N и необязательно атомы O или S, такого как пиразолий, имидазолий, оксазолий, тиазолий, пиридиний, хинолиний, изохинолиний, пиримидиний, 1,2,4-триазиний, 1,3,5-триазиний и пуриний, где указанный катион представляет собой концевую группу или группу, расположенную в пределах алкильной цепи; или
(d) основной группы, которая превращается в положительную группу в физиологических условиях, где основная группа представляет собой концевую группу или группу, расположенную в алкильной цепи, и выбрана из -NRR′, -C(=NR)-NR′R′′, -NR-NR′-R′′, -(R)N-C(=NR)-NR′R′′, O←-NR- или >C=NR, или основная группа представляет собой N-содержащий гетероароматический радикал, выбранный из пиразолила, имидазолила, оксазолила, тиазолила, пиридила, хинолинила, изохинолинила, пиримидила, 1,2,4-триазинила, 1,3,5-триазинила или пуринила,
где каждый из R, R′ и R′′ независимо представляет собой H, необязательно замещенный гидрокарбил или гетероциклил, или два из R, R′ и R′′ вместе с атомом N, к которому они присоединены, образуют 3-7-членное насыщенное кольцо, необязательно содержащее один или несколько гетероатомов, выбранных из O, S или N, и необязательно далее замещенное на дополнительном атоме N, причем указанное 3-7-членное кольцо выбрано из группы, состоящей из азиридина, пирролидина, пиперидина, морфолина, тиоморфолина, азепина или пиперазина, необязательно замещенного на дополнительном атоме N C1-C6алкилом, необязательно замещенным галогеном, гидроксилом или амино.


(a) введение субъекту, предположительно имеющему опухоль с некротическими доменами, конъюгата по п.1, где M представляет собой 2H или металл, выбранный из Pd и Zn;
(b) облучение светом субъекта и измерение флуоресценции предполагаемых областей в течение по меньшей мере 24-48 часов после введения конъюгата с временными интервалами 1-8 часов, где области, которые проявляют флуоресценцию через 24-48 часов или более, указывают на присутствие указанных некротических доменов опухоли.
(a) введение субъекту, предположительно имеющему опухоль, конъюгата по п.1, где M представляет собой радиоизотоп, выбранный из группы, состоящей из64Cu,67Cu,99mTc,67Ga,201Tl,195Pt,60Co,111In или51Cr;
(b) сканирование субъекта на визуализирующем сканере в течение по меньшей мере 24-48 часов после введения конъюгата с временными интервалами 1-8 часов и измерение уровня радиации в предполагаемых областях, где области, которые проявляют излучение через 24-48 часов или более, указывают на наличие указанных некротических доменов опухоли.
(a) введения субъекту, предположительно имеющему опухоль, конъюгата по п.1, где M представляет собой парамагнитный металл, выбранный из Mn3+, Cu2+, Fe3+, Eu3+, Gd3+ или Dy3+; и
(b) проведение магнитно-резонансной визуализации у пациента путем получения по меньшей мере одного MR-изображения представляющей интерес области-мишени в организме пациента перед указанным введением (нулевой момент времени) и одного или нескольких MR-изображений во второй или последующий моменты времени, по меньшей мере через 24-48, предпочтительно через 96 часов после указанного введения; и
(c) обработку и анализ данных для диагностики наличия или отсутствия указанных некротических доменов опухоли.

Комментарии