Конъюгаты антител с лекарственными средствами, связывающиеся с белками cd37 - RU2679657C2
Код документа: RU2679657C2
Чертежи




































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивает приоритет согласно предварительной заявке на патент США U.S.S.N № 61/861321, поданной 1 августа 2013 г., содержание которой полностью включено в настоящую заявку посредством ссылки.
ПРЕДСТАВЛЕНИЕ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ТЕКСТОВОМ ФАЙЛЕ ASCII
[0002] Представление текстового файла ASCII полностью включено в настоящую заявку посредством ссылки: машиночитаемая форма списка последовательностей (название файла: 511582008940SeqList.txt, дата записи: 30 июля 2014 г.; размер: 32329 байт).
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
[0003] Настоящее изобретение, описанное в настоящей заявке, относится в некоторых аспектах к антителам, их антигенсвязывающим фрагментам и конъюгатов антител с лекарственным средством, которые связывают белки, называемые CD37. Настоящее изобретение также относится в некоторых аспектах к прогностическим, профилактическим и терапевтическим способам и композициям, применимым в лечении рака с экспрессией CD37.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0004] По оценкам, в 2013 г. во всех центрах рак диагностируют у 1660290 мужчин и женщин (854790 мужчин и 805500 женщин), с летальным исходом у 580350 мужчин и женщин. С 2006 г. по 2010 г. медианный возраст диагностики рака во всех центрах составил 66 лет. Стандартизованный по возрасту уровень заболеваемости составил 463,0 на 100000 мужчин и женщин в год. Эти уровни основаны на случаях, диагностированных в 2006-2010 гг. в 18 географических областях, где проводили наблюдение по программе SEER (Surveillance, Epidemiology, and End Results, течение, распространенность и исходы злокачественных новообразований). С 2006 г. по 2010 г. медианный возраст смерти от рака во всех центрах составлял 72 года. Стандартизованный по возрасту уровень смертности составлял 176,4 на 100000 мужчин и женщин в год. Эти уровни основаны на пациентах, умерших в 2006-2010 гг. в США. Общий уровень 5-летней относительной выживаемости в 2003-2009 гг. в 18 географических областях, где проводили наблюдение по программе SEER, составлял 65,8%.
[0005] Неходжкинские лимфомы (NHL, Non-Hodgkin lymphoma) могут возникнуть в любом возрасте и часто характеризуются увеличением лимфатических узлов по сравнению с нормой, повышенной температурой и потерей веса. Существует множество различных типов неходжкинской лимфомы. Эти типы можно разделить на агрессивные (быстро растущие) и вялотекущие (медленно растущие) типы, образованные либо В-, либо Т-клетками. В-клеточные неходжкинские лимфомы включают лимфому Беркитта, хроническую лимфоцитарную лейкемию/мелкоклеточную лимфоцитарную лимфому, диффузную крупноклеточную В-клеточную лимфому, фолликулярную лимфому, иммунобластную крупноклеточную лимфому, лимфобластную лимфому из клеток-предшественников В-лимфоцитов и мантийноклеточную лимфому. Т-клеточные неходжкинские лимфомы включают фунгоидную гранулему, анапластическую крупноклеточную лимфому и лимфобластную лимфому из клеток-предшественников Т-лимфоцитов. Лимфомы, возникающие после пересадки костного мозга или стволовых клеток, как правило, являются В-клеточными неходжкинскими лимфомами. Прогноз и лечение зависят от стадии и типа заболевания.
[0006] По оценкам, в 2013 г. неходжкинскую лимфому диагностируют у 69740 мужчин и женщин (37600 мужчин и 32140 женщин), с летальным исходом у 19020 мужчин и женщин. С 2006 г. по 2010 г. медианный возраст диагностики неходжкинской лимфомы составил 66 лет. Стандартизованный по возрасту уровень заболеваемости составил 19,7 на 100000 мужчин и женщин в год. Эти уровни основаны на случаях, диагностированных в 2006-2010 гг. в 18 географических областях, где проводили наблюдение по программе SEER. С 2006 г. по 2010 г. медианный возраст смерти от неходжкинской лимфомы составлял 76 лет. Стандартизованный по возрасту уровень смертности составлял 6,4 на 100000 мужчин и женщин в год. Эти уровни основаны на пациентах, умерших в 2006-2010 гг. в США. Общий уровень 5-летней относительной выживаемости в 2003-2009 гг. в 18 географических областях, где проводили наблюдение по программе SEER, составлял 69,0%.
[0007] Лейкемия является раком, который начинается в кроветворной ткани, такой как костный мозг, и вызывает образование большого количества клеток крови и их попадание в кровоток. Основные типы лейкемии представлены острой лимфобластной, острой миелоидной, хронической лимфоцитарной, хронической миелогенной лейкемиями и злокачественным ретикулоэндотелиозом.
[0008] Для всей группы лейкемий, по оценкам, в 2013 г. лейкемию диагностируют у 48610 мужчин и женщин (27880 мужчин и 20730 женщин), с летальным исходом у 23720 мужчин и женщин. С 2006 г. по 2010 г. медианный возраст диагностики лейкемии составил 66 лет. Стандартизованный по возрасту уровень заболеваемости составил 12,8 на 100000 мужчин и женщин в год. Эти уровни основаны на случаях, диагностированных в 2006-2010 гг. в 18 географических областях, где проводили наблюдение по программе SEER. С 2006 г. по 2010 г. медианный возраст смерти от лейкемии составлял 75 лет. Стандартизованный по возрасту уровень смертности составлял 7,1 на 100000 мужчин и женщин в год. Эти уровни основаны на пациентах, умерших в 2006-2010 гг. в США. Общий уровень 5-летней относительной выживаемости в 2003-2009 гг. в 18 географических областях, где проводили наблюдение по программе SEER, составлял 56,0%.
[0009] Хроническая лимфоцитарная лейкемия является вторым по распространенности типом лейкемии у взрослых и, как правило, она медленно ухудшается. Часто она возникает у людей среднего возраста или старше и редко возникает у детей. Пациентам с ранней стадией хронической лимфоцитарной лейкемии не проводят химиотерапию по появления симптомов или свидетельств быстрой прогрессии заболевания. Было показано, что раннее применение химиотерапии не дает преимуществ или даже может повысить смертность. В начале применения химиотерапии для лечения хронической лимфоцитарной лейкемии в качестве препарата первой линии наиболее часто применяют нуклеозидный аналог флударабин. В рамках нескольких клинических исследований было показано, что комбинированные режимы улучшали уровень ответа и включали следующее: флударабин, циклофосфамид и ритуксимаб (FCR, fludarabine, cyclophosphamide, rituximab); пентостатин, циклофосфамид и ритуксимаб (PCR, pentostatin, cyclophosphamide, rituximab); флударабин, циклофосфамид и митоксантрон (FCM, fludarabine, cyclophosphamide, mitoxantrone); циклофосфамид, винкристин и преднизон (CVP, cyclophosphamide, vincristine, prednisone); циклофосфамид, доксорубицин, винкристин и преднизон (CHOP, cyclophosphamide, doxorubicin, vincristine, prednisone). По оценкам, в 2013 г. хроническую лимфоцитарную лейкемию диагностируют у 15680 мужчин и женщин (9720 мужчин и 5960 женщин), с летальным исходом у 4580 мужчин и женщин. С 2006 г. по 2010 г. медианный возраст диагностики хронической лимфоцитарной лейкемии составил 71 год. Стандартизованный по возрасту уровень заболеваемости составил 4,3 на 100000 мужчин и женщин в год. Эти уровни основаны на случаях, диагностированных в 2006-2010 гг. в 18 географических областях, где проводили наблюдение по программе SEER. С 2006 г. по 2010 г. медианный возраст смерти от хронической лимфоцитарной лейкемии составлял 79 лет. Стандартизованный по возрасту уровень смертности составлял 1,4 на 100000 мужчин и женщин в год. Эти уровни основаны на пациентах, умерших в 2006-2010 гг. в США. Общий уровень 5-летней относительной выживаемости в 2003-2009 гг. в 18 географических областях, где проводили наблюдение по программе SEER, составлял 79,2%.
[0010] Острая миелоидная лейкемия является наиболее распространенным типом острой лейкемии у взрослых. Современное лечение острой миелоидной лейкемии должно быть достаточно агрессивным для достижения полной ремиссии, поскольку частичная ремиссия не обеспечивает значительного преимущества в выживании. Уровни ремиссии у взрослых с острой миелоидной лейкемией обратно пропорциональны возрасту с расчетным уровнем ремиссии пациентов моложе 60 лет равным 65%. Данные предполагают, что при достижении ремиссии ее продолжительность может быть меньше у пациентов старшего возраста. У пациентов, у которых экспрессируется антиген клеток-предшественников CD34 и/или P-гликопротеин (продукт гена MDR1), прогноз хуже. Цитогенетический анализ является одним из наиболее надежных из доступных средств предоставления прогностической информации, предсказывающий исход как индукции ремиссии, так и постремиссионной терапии. Цитогенетические аномалии, указывающие не хороший прогноз, включают t(8; 21), inv(16) или t(16;16) и t(15;17). Нормальная цитогенетика предсказывает острую миелоидную лейкемию среднего риска. У пациентов с острой миелоидной лейкемией, характеризующейся делециями длинных плеч или моносомией по хромосомам 5 или 7, транслокациями или инверсиями хромосомы 3, t(6; 9), t(9; 22), или аномалиями хромосомы 11q23, прогноз химиотерапии особенно плохой. По оценкам, в 2013 г. острую миелоидную лейкемию диагностируют у 14590 мужчин и женщин (7820 мужчин и 6770 женщин), с летальным исходом у 10370 мужчин и женщин. С 2006 г. по 2010 г. медианный возраст диагностики острой миелоидной лейкемии составил 67 лет. Стандартизованный по возрасту уровень заболеваемости составил 3,7 на 100000 мужчин и женщин в год. Эти уровни основаны на случаях, диагностированных в 2006-2010 гг. в 18 географических областях, где проводили наблюдение по программе SEER. С 2006 г. по 2010 г. медианный возраст смерти от острой миелоидной лейкемии составлял 72 года. Стандартизованный по возрасту уровень смертности составлял 2,8 на 100000 мужчин и женщин в год. Эти уровни основаны на пациентах, умерших в 2006-2010 гг. в США. Общий уровень 5-летней относительной выживаемости в 2003-2009 гг. в 18 географических областях, где проводили наблюдение по программе SEER, составлял 24,2%. Следует отметить, что общая информация о раке была получена на сайте Национального института исследования рака (NCI, National Cancer Institute) (www.cancer.gov) и все статистические данные основаны на данных о частоте заболеваемости, полученых в рамках программы SEER, и на данных о летальных исходах Национального цента медицинской статистики (NCHS, National Center for Health Statistics), полученных в Howlader N., et. al., SEER Cancer Statistics Review, 1975-2010, National Cancer Institute. Bethesda, MD, http://seer.cancer.gov/csr/1975_2010/, на основании данных SEER, поданных в ноябре 2012 г., размещенных на сайте SEER в 2013 г.
[0011] Получены представления о терапевтической пользе моноклональных антител (G. Kohler and C. Milstein, Nature 256:495-497 (1975)). В настоящее время моноклональные антитела были одобрены как средства терапии при трансплантации, раке, инфекционных заболеваниях, сердечно-сосудистых заболеваниях и воспалении. Разные изотипы выполняют разные эффекторные функции. Такие отличия функций отражены в определенных трехмерных структурах разных изотипов иммуноглобулинов (P.M. Alzari et al., Annual Rev. Immunol., 6:555-580 (1988)).
[0012] Поскольку мышей удобно иммунизировать и поскольку они узнают большинство человеческих антигенов как чужеродные, моноклональные антитела к человеческим целевым антигенам с терапевтическим потенциалом, как правило, имеют мышиное происхождение. Однако мышиные моноклональные антитела в качестве лекарственных средств для человека обладают характерными недостатками. Они требуют более частого дозирования, поскольку моноклональные антитела обладают более коротким периодов полувыведения из крови, чем человеческие антитела. Важнее то, что повторное введение мышиных антител в иммунную систему человека вызывает ответ иммунной системы человека, распознающий мышиный белок как чужеродный и вызывающий развитие ответа в виде выработки человеческих антимышиных антител. Такой ответ в виде выработки человеческих антимышиных антител может привести в аллергической реакции и быстрому удалению мышиного антитела из системы, делая лечение мышиным антителом бесполезным. Чтобы избежать таких эффектов предпринимают попытки создания человеческой иммунной системы в мыши.
[0013] Первоначальные попытки были нацелены на создание трансгенных мышей, способных отвечать на антигены выработкой антител с человеческими последовательностями (см. Bruggemann et al., Proc. Nat’l. Acad. Sci. USA 86:6709-6713 (1989)), но они ограничивались количеством ДНК, которое можно стабильно поддерживать посредством доступных векторов для клонирования. Применение векторов для клонирования на основе искусственной хромосомы дрожжей (YAC, yeast artificial chromosome) позволило ввести крупные фрагменты человеческого локуса иммуноглобулинов (Ig, immunoglobulin) зародышевой линии трансгенным млекопитающим. Фактически большинство человеческих генов V, D и J областей, расположенных через такие же промежутки, как и в человеческом геноме, и человеческих константных областей ввели мышам с помощью YAC. Одна из таких линий трансгенных мышей называется XenoMouse® и является коммерчески доступной в Amgen Fremont Inc. (Фремонт, штат Калифорния).
[0014] Дополнительно антитела можно получить с помощью трансгенных мышей VelocImmune, в которых геномные последовательности, несущие эндогенные мышиные вариабельные сегменты тяжелой цепи иммуноглобулина (сегменты VH, DH и JH) и/или локусы каппа легкой цепи (VK и JK), были частично или полностью заменены человеческими геномными последовательностями, несущими нереорганизованные вариабельные сегменты тяжелой цепи иммуноглобулина зародышевой линии человека (VH, DH, and JH) и/или локусы каппа легкой цепи (VK и JK) (Regeneron, Tarrytown, NY). См., например, патенты США № 6586251, 6596541, 7105348, 6528313, 6638768 и 6528314.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
[0015] Настоящее изобретение в некоторых аспектах представляет антитела, антигенсвязывающие фрагменты и конъюгаты антител с лекарственными средствами, которые связывают белки CD37 и полипептидные фрагменты белков CD37. В некоторых вариантах осуществления изобретения настоящее изобретение содержит полностью человеческие антитела, конъюгированные с терапевтическим агентом. В определенных вариантах осуществления настоящего изобретения оговаривают, что вся последовательность нуклеиновой кислоты на Фигуре 2 не кодируется и/или всю последовательность нуклеиновой кислоты на Фигуре 3 не получают. В определенных вариантах осуществления настоящего изобретения вся последовательность нуклеиновой кислоты на Фигуре 2 кодируется и/или всю аминокислотную последовательность на Фигуре 3 получают, при этом каждая из последовательностей находится в соответствующей форме разовой дозы для человека.
[0016] Настоящее изобретение в некоторых аспектах далее представляет различные иммуногенные или терапевтические композиции, такие как конъюгаты антитела с лекарственным средством, и стратегии лечения рака, экспрессирующего CD37, такого как рак тканей, перечисленных в Таблице I (например, острой миелоидной лейкемии, хронической лимфоцитарной лейкемии, неходжкинской лимфомы и множественной миеломы).
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
[0017] Фигура 1. Последовательность кДНК и аминокислотная последовательность CD37 показаны на Фигуре 1. Стартовый кодон метионина подчеркнут. Открытая рамка считывания расположена в положениях с 122 по 967 нуклеиновой кислоты, включая стоп-кодон.
[0018] Фигура 2. Последовательность нуклеиновой кислоты и аминокислотная последовательность антител к CD37.
[0019] Фигура 2A. Последовательность кДНК и аминокислотная последовательность тяжелой цепи HvCD37-6b15.1.1. Двойным подчеркиванием отмечена вариабельная область тяжелой цепи, подчеркиванием отмечена вариабельная область тяжелой цепи и подчеркиванием отмечена константная область тяжелой цепи человеческого IgG2.
[0020] Фигура 2B. Последовательность кДНК и аминокислотная последовательность легкой цепи HvCD37-6b15.1.1. Двойным подчеркиванием отмечена вариабельная область легкой цепи, подчеркиванием отмечена каппа константная область человека.
[0021] Фигура 3. Аминокислотные последовательности антител к CD37.
[0022] Фигура 3A. Аминокислотная последовательность тяжелой цепи HvCD37-6b15.1.1. Двойным подчеркиванием отмечена вариабельная область тяжелой цепи, а подчеркиванием отмечена константная область человеческого IgG2.
[0023] Фигура 3B. Аминокислотная последовательность легкой цепи HvCD37-6b15.1.1. Двойным подчеркиванием отмечена вариабельная область легкой цепи, подчеркиванием отмечена каппа константная область человека.
[0024] Фигура 4. Выравнивание антител HvCD37-6b15.1.1 с Ig зародышевой линии человека.
[0025] Фигура 4A. Выравнивание тяжелой цепи HvCD37-6b15.1.1 с Ig зародышевой линии человека.
[0026] Фигура 4B. Выравнивание легкой цепи HvCD37-6b15.1.1 с Ig зародышевой линии человека.
[0027] Фигура 5. Исследование эффективности HvCD37-6b15.1.1.vcMMAE в отношении введенной подкожно фолликулярной В-клеточной лимфомы человека DoHH2, имплантированной мышам CB17/SCID.
[0028] Фигура 6. Исследование эффективности HvCD37-6b15.1.1.vcMMAE в отношении введенной подкожно ксенотрансплантатной модели человеческой лимфомы Ramos-RR-XCL, имплантированной мышам CB17/SCID.
[0029] Фигура 7. Исследование эффективности HvCD37-6b15.1.1.vcMMAE в отношении подкожной человеческой хронической лимфоцитарной лейкемии JVM3, имплантированной мышам CB17/SCID.
[0030] Фигура 8. Исследование эффективности HvCD37-6b15.1.1.vcMMAE в отношении подкожной человеческой острой миелогенной лейкемии MV-4-11, имплантированной мышам CB17/SCID.
[0031] Фигура 9. Исследование эффективности нескольких конъюгатов антител к CD37 с лекарственным средством в отношении подкожной клеточной линии человеческой устойчивой к ритуксану лимфомы Ramos-RR-XCL, имплантированной мышам SCID.
[0032] Фигура 10. Определение белка CD37 в образцах пациентов с раком с помощью иммуногистохимии. Фигура 10(A) и 10(B) показывает образцы пациентов с неходжкинской лимфомой. Фигура 10(C) и 10(D) показывает образцы пациентов с множественной миеломой.
[0033] Фигура 11. Исследование эффективности HvCD37-6b15.1.1vcMMAE (также известного как AGS67E) и моноклонального антитела HvCD37-6b15.1.1 (также известного как AGS67C) в отношении введенной подкожно ксенотрансплантатной модели клеточной линии острой моноцитарнойо лейкемии человека MOLM-13, имплантированной мышам SCID.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПЛАН РАЗДЕЛОВ
I.) Определения
II.) Антитела к CD37
III.) Общая информация о конъюгатах антител с лекарственным средством
III(A). Майтанзиноиды
III(B). Ауристатины и доластатины
III(C). Калхеамицин
III(D). Другие цитотоксические агенты
IV.) Конъюгаты антител с лекарственным средством, связывающие CD37
V.) Линкерные компоненты
VI.) Удлиняющий компонент
VII.) Аминокислотный компонент
VIII.) Спейсерный компонент
IX.) Компонент «лекарственное средство»
X.) Нагрузка лекарственного средства
XI.) Способы определения цитотоксического эффекта конъюгата антител с лекарственным средством
XII.) Лечение рака с экспрессией CD37
XIII.) CD37 как мишень терапии на основе антител
XIV.) Коктейли антител к CD37 с лекарственным средством
XV.) Комбинированная терапия
XVI.) Наборы/готовые изделия
I.) ОПРЕДЕЛЕНИЯ:
[0034] Если иное не определено, все специальные термины, обозначения и другие научные термины или терминология, применяемые в настоящей заявке, имеют значения, которые понятны специалистам в области техники, к которой относится изобретение. В некоторых случаях термины с общеупотребимыми значениями определяют в настоящей заявке для внесения ясности и/или для справки, и включение таких определений в данную заявку не следует истолковывать как представление существенных отличий от общеупотребимых значений в данной области техники. Многие техники и процедуры, описанные или процитированные в настоящей заявке, хорошо понятны и часто применяются с помощью стандартной методологии специалистами в данной области техники, такие как, например, широко применяемые методологии молекулярного клонирования, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 2nd. Edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. В установленном порядке процедуры с применением коммерчески доступных наборов и реагентов, как правило, проводят в соответствии с определенными производителем протоколами и/или параметрами, если иное не указано.
[0035] При указании торгового названия в настоящей заявке ссылка на торговое название также относится к составу продукта, непатентованному лекарственному средству и к активным фармацевтическим ингредиентам продукта с торговым названием, если иное не определено контекстом.
[0036] Термины «распространенный рак» и «местнораспространенный рак», «распространенное заболевание» и «местнораспространенное заболевание» обозначают рак, который распространился за пределы соответствующей тканевой капсулы, и включают заболевание стадии C по классификации системы Американской урологической ассоциации (AUA, American Urological Association), стадии C1-C2 по классификации системы Уитмора-Джуитта (Whitmore-Jewett) и заболевание стадии T3-T4 и N+ по классификации системы TNM (TNM, tumor, node, metastasis, опухоль, узел, метастаз). Как правило, хирургическое лечение не рекомендуют пациентам с местнораспространенным заболеванием, и у таких пациентов исходы существенно менее благоприятные по сравнению с пациентами с клинически локализованным (в рамках одного органа) раком.
[0037] Аббревиатура «AFP» обозначает диметилвалин-валин-долаизолейин-долапроин-фенилаланин-п-фенилендиамин (см. Формулу XVI ниже).
[0038] Аббревиатура «MMAE» обозначает монометилауристатин E (см. Формулу XI ниже).
[0039] Аббревиатура «AEB» обозначает сложный эфир, полученный реакцией ауристатина E с пара-ацетилбензойной кислотой (см. Формулу XX ниже).
[0040] Аббревиатура «AEVB» обозначает сложный эфир, полученный реакцией ауристатина E с бензоилвалериановой кислотой (см. Формулу XXI ниже).
[0041] Аббревиатура «MMAF» обозначает довалин-валин-долаизолейин-долапроин-фенилаланин (см. Формулу XVIV ниже).
[0042] Если иное не указано, термин «алкил» обозначает насыщенный прямой или разветвленный углеводород, содержащий приблизительно от 1 до приблизительно 20 атомов углерода (и все комбинации и субкомбинации диапазона и конкретного количества атомов углерода в этом интервале), предпочтительно, содержащий приблизительно от 1 до приблизительно 8 атомов углерода. Примерами алкильных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, 2-пентил, 3-пентил, 2-метил-2-бутил, н-гексил, н-гептил, н-октил, н-нонил, н-децил, 3-метил-2-бутил, 3-метил-1-бутил, 2-метил-1-бутил, 1-гексил, 2-гексил, 3-гексил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 3-метил-3-пентил, 2-метил-3-пентил, 2,3-диметил-2-бутил, и 3,3-диметил-2-бутил.
[0043] Алкильные группы, по отдельности или как часть другой группы можно, при желании, заменить одной или несколькими группами, предпочтительно от 1 до 3 группа (и любой дополнительной замещающей группой, выбираемой из галогенов), включая, но не ограничиваясь -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2 , -C(O)NHR’, -C(O)N(R’)2,-NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -N3 , -NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила, и где названные -O-(C1-C8 алкильные), -O-(C2-C8 алкенильные), -O-(C2-C8 алкинильные), -арильные, -C1-C8 алкильные, -C2-C8 алкенильные и -C2-C8 алкинильные группы можно при желании далее заменить одной или несколькими группами, включающими, но не ограничивающимися -C1-C8 алкилом, -C2-C8 алкенилом, -C2-C8 алкинилом, -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’’, -OC(O)R’’, -C(O)OR’’, -C(O)NH2 , -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, -SR’’, -SO3R’’, -S(O)2R’’, -S(O)R’’, -OH, -N3 , -NH2, -NH(R’’), -N(R’’)2 и -CN, где каждый R’’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила.
[0044] Если иное не указано, термины «алкенил» и «алкинил» обозначают прямые или разветвленные углеродные цепи, содержащие от приблизительно 2 до приблизительно 20 атомов углерода (и все комбинации и субкомбинации диапазона и конкретного количества атомов углерода в этом интервале), предпочтительно, содержащий приблизительно от 2 до приблизительно 8 атомов углерода. Алкенильная цепь содержит по меньшей мере одну двойную связь в цепи, а алкинильная цепь содержит по меньшей мере одну тройную связь в цепи. Примеры алкенильных групп включают, но не ограничиваются этиленом или винилом, аллилом, -1-бутенилом, -2-бутенилом, -изобутенилом, -1-пентенилом, -2-пентенилом, -3-метил-1-бутенилом, -2-метил-2-бутенилом и -2,3-диметил-2-бутенилом. Примеры алкинильных групп включают, но не ограничиваются ацетиленовой группой, пропаргилом, ацетиленилом, пропинилом, -1-бутинилом, -2-бутинилом, -1-пентинилом, -2-пентинилом и -3-метил-1-бутинилом.
[0045] Алкенильные и алкинильные группы, по отдельности или как часть другой группы, можно, при желании, заменить одной или несколькими группами, предпочтительно от 1 до 3 группа (и любой дополнительной замещающей группой, выбираемой из галогенов), включая, но не ограничиваясь -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2 , -C(O)NHR’, -C(O)N(R’)2,-NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -N3, -NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила, и где названные -O-(C1-C8 алкильные), -O-(C2-C8 алкенильные), -O-(C2-C8 алкинильные), -арильные, -C1-C8 алкильные, -C2-C8 алкенильные и -C2-C8 алкинильные группы можно при желании далее заменить одной или несколькими группами, включающими, но не ограничивающимися -C1-C8 алкилом, -C2-C8 алкенилом, -C2-C8 алкинилом, -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’’, -OC(O)R’’, -C(O)OR’’, -C(O)NH2 , -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, -SR’’, -SO3R’’, -S(O)2R’’, -S(O)R’’, -OH, -N3 , -NH2, -NH(R’’), -N(R’’)2 и -CN, где каждый R’’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила.
[0046] Если иное не указано, термин «алкилен» обозначает насыщенный углеводородный радикал с разветвленной или прямой цепью, содержащий от приблизительно 1 до приблизительно 20 атомов углерода (и все комбинации и субкомбинации диапазона и конкретного количества атомов углерода в этом интервале), предпочтительно, содержащий приблизительно от 1 до приблизительно 8 атомов углерода и имеющий два моновалентных радикальных центра, образованных в результате удаления двух атомов водорода с одного и того же или с двух разных атомов углерода исходного алкана. Типичные алкилены включают, но не ограничиваются метиленом, этиленом, пропиленом, бутиленом, пентиленом, гексиленом, гептиленом, октиленом, нониленом, декаленом, 1,4-циклогексиленом и подобными. Алкиленовые группы, по отдельности или как часть другой группы, можно, при желании, заменить одной или несколькими группами, предпочтительно от 1 до 3 групп (и любой дополнительной замещающей группой, выбираемой из галогенов), включая, но не ограничиваясь -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2 , -C(O)NHR’, -C(O)N(R’)2,-NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -N3 , -NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила, и где названные -O-(C1-C8 алкильные), -O-(C2-C8 алкенильные), -O-(C2-C8 алкинильные), -арильные, -C1-C8 алкильные, -C2-C8 алкенильные и -C2-C8 алкинильные группы можно при желании далее заменить одной или несколькими группами, включающими, но не ограничивающимися -C1-C8 алкилом, -C2-C8 алкенилом, -C2-C8 алкинилом, -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’’, -OC(O)R’’, -C(O)OR’’, -C(O)NH2 , -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, -SR’’, -SO3R’’, -S(O)2R’’, -S(O)R’’, -OH, -N3 , -NH2, -NH(R’’), -N(R’’)2 и -CN, где каждый R’’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила.
[0047] Если иное не указано, термин «алкенилен» обозначает замещенную при желании алкиленовую группу, содержащую по меньшей мере одну углерод-углеродную двойную связь. Примеры алкениленовых групп включают, например этенилен (-CH=CH-) и пропенилен (-CH=CHCH2-).
[0048] Если иное не указано, термин «алкинилен» обозначает замещенную при желании алкиленовую группу, содержащую по меньшей мере одну углерод-углеродную тройную связь. Примеры алкиниловых групп включают, например ацетилен (-C
[0049] Если иное не указано, термин «арил» обозначает моновалентный ароматический углеводородный радикал из 6-20 атомов углерода (и все комбинации и субкомбинации диапазона и конкретного количества атомов углерода в этом интервале), полученный при удалении одного атома водорода с одного атома углерода системы исходного ароматического кольца. Некоторые арильные группы представлены в примерах структур как «Ar». Типичные арильные группы включают, но не ограничиваются радикалами, полученными из бензола, замещенного бензола, фенила, нафталина, антрацена, бифенила и подобных.
[0050] Арильную группу, по отдельности или как часть другой группы, можно, при желании, заменить одной или несколькими группами, предпочтительно от 1 до 5 групп, или даже от 1 или 2 групп, включая, но не ограничиваясь -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2 , -C(O)NHR’, -C(O)N(R’)2,-NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -N3 , -NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила, и где названные -O-(C1-C8 алкильные), -O-(C2-C8 алкенильные), -O-(C2-C8 алкинильные), -арильные, -C1-C8 алкильные, -C2-C8 алкенильные и -C2-C8 алкинильные группы можно при желании далее заменить одной или несколькими группами, включающими, но не ограничивающимися -C1-C8 алкилом, -C2-C8 алкенилом, -C2-C8 алкинилом, -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’’, -OC(O)R’’, -C(O)OR’’, -C(O)NH2 , -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, -SR’’, -SO3R’’, -S(O)2R’’, -S(O)R’’, -OH, -N3 , -NH2, -NH(R’’), -N(R’’)2 и -CN, где каждый R’’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила.
[0051] Если иное не указано, термин «арилен» обозначает замещенную при желании арильную группу, которая является дивалентной (т.е. полученной при удалении двух атомов водорода с одного и того же или с двух разных атомов углерода исходной системы ароматического кольца) и может быть в орто-, мета- или пара-конфигурациях, как показано в следующих структурах с фенилом в качестве примера арильной группы.

Типичные «-(C1-C8 алкилен)арильные», «-(C2-C8 алкинелен)арильные» и «-(C2-C8 алкинилен)арильные» группы включают, но не ограничиваются бензилом, 2-фенилэтан-1-илом, 2-фенилэтен-1-илом, нафтилметилом, 2-нафтилэтан-1-илом, 2-нафтилэтен-1-илом, нафтобензилом, 2-нафтофенилэтан-1-илом и подобными.
[0052] Если иное не указано, термин «гетероцикл» обозначает моноциклическую, бициклическую или полициклическую кольцевую систему, содержащую от 3 до 14 кольцевых атомов (также называемых кольцевыми членами), где по меньшей мере один кольцевой атом является гетероатомом, выбираемым из N, O, P или S (и все комбинации и субкомбинации диапазона и конкретного количества атомов углерода в этом интервале). Гетероцикл может содержать от 1 до 4 кольцевых гетероатомов, независимо выбираемых из N, O, P или S. Один или несколько атомов N, C или S в гетероцикле могут быть окислены. Моноциклический гетероцикл предпочтительно содержит от 3 до 7 кольцевых членов (например, от 2 до 6 атомов углерода и от 1 до 3 гетероатомов, независимо выбираемых из N, O, P или S), а бициклический гетероцикл предпочтительно содержит от 5 до 10 кольцевых членов (например, от 4 до 9 атомов углерода и от 1 до 3 гетероатомов, независимо выбираемых из N, O, P или S). Кольцо, включающее гетероатом, может быть ароматическим или неароматическим. Если иное не указано, гетероцикл присоединен к боковой группе любым гетероатомом или атомом углерода, что приводит к образованию стабильной структуры.
[0053] Гетероциклы описаны в Paquette, "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), особенно в главах 1, 3, 4, 6, 7 и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 по настоящее время), особенно в томах 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. 82:5566 (1960).
[0054] Примеры «гетероциклических» групп включают в качестве примера, но не с целью ограничения, пиридил, дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталенил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, бис-тетрагидрофуранил, тетрагидропиранил, бис- тетрагидропиранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил, 6H-1,2,5-тиадиазинил, 2H,6H-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксатинил, 2H-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, 1H-индазолил, пуринил, 4H-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4H-карбазолил, карбазолил, β-карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразанил,феноксазинил, изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил,бензотриазолил, бензоизоксазолил, оксиндолил, бензоксазолинил и изатиноил. Предпочтительные «гетероциклические» группы включают, но не ограничиваются бензофуранилом, бензотиофенилом, индолилом, бензопиразолилом, кумаринилом, изохинолинилом, пирролилом, тиофенилом, фуранилом, тиазолилом, имидазолилом, пиразолилом, триазолилом, хинолинилом, пиримидинилом, пиридинилом, пиридонилом, пиразинилом, пиридазинилом, изотиазолилом, изоксазолилом и тетразолилом.
[0055] Гетероциклическаю группа, по отдельности или как часть другой группы, можно, при желании, заменить одной или несколькими группами, предпочтительно от 1 до 2 групп, включая, но не ограничиваясь -C1-C8 алкилом, -C2-C8 алкенилом и -C2-C8 алкинилом -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2 , -C(O)NHR’, -C(O)N(R’)2,-NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -N3 , -NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила, и где названные -O-(C1-C8 алкильные), -O-(C2-C8 алкенильные), -O-(C2-C8 алкинильные), -C1-C8 алкильные, -C2-C8 алкенильные и -C2-C8 алкинильные и -арильные группы можно при желании далее заменить одной или несколькими группами, включающими, но не ограничивающимися -C1-C8 алкилом, -C2-C8 алкенилом, -C2-C8 алкинилом, -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’’, -OC(O)R’’, -C(O)OR’’, -C(O)NH2 , -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, -SR’’, -SO3R’’, -S(O)2R’’, -S(O)R’’, -OH, -N3 , -NH2, -NH(R’’), -N(R’’)2 и -CN, где каждый R’’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила.
[0056] В качестве примера, но не с целью ограничения, углерод-связанные гетероциклы могут быть связаны в следующих положениях: в положениях 2, 3, 4, 5 или 6 пиридина; в положениях 3, 4, 5 или 6 пиридазина; в положениях 2, 4, 5 или 6 пиримидина; в положениях 2, 3, 5 или 6 пиразина; в положениях 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола; в положениях 2, 4 или 5 оксазола, имидазола или тиазола; в положениях 3, 4 или 5 изоксазола, пиразола или изотиазола; в положениях 2 или 3 азиридина; в положениях 2, 3 или 4 азетидина; в положениях 2, 3, 4, 5, 6, 7 или 8 хинолина; или в положениях 1, 3, 4, 5, 6, 7 или 8 изохинолина. Еще чаще углерод-связанные гетероциклы включают 2-пиридил, 3-пиридил, 4-пиридил, 5-пиридил, 6-пиридил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 6-пиридазинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил, 2-пиразинил, 3-пиразинил, 5-пиразинил, 6-пиразинил, 2-тиазолил, 4-тиазолил или 5-тиазолил.
[0057] В качестве примера, но не с целью ограничения, азот-связанные гетероциклы могут быть связаны в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3- пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина или 1H-индазола; в положении 2 изоиндола или изоиндолина; в положении 4 морфолина; и в положении 9 карбазола или β-карболина. Еще чаще азот-связанные гетероциклы включают 1-азиридил, 1-азетедил, 1-пирролил, 1-имидазолил, 1-пиразолил и 1-пиперидинил.
[0058] Если иное не указано, термин «карбоцикл» обозначает насыщенную или ненасыщенную моноциклическую, бициклическую или полициклическую кольцевую систему, содержащую от 3 до 14 кольцевых атомов (и все комбинации и субкомбинации диапазона и конкретного количества атомов углерода в этом интервале), где все кольцевые атомы являются атомами углерода. Моноциклические карбоциклы, предпочтительно, содержат от 3 до 6 кольцевых атомов, еще более предпочтительно, 5 или 6 кольцевых атомов. Бициклические карбоциклы, предпочтительно, содержат от 7 до 12 кольцевых атомов, например, организованных в бициклическую [4,5], [5,5], [5,6] или [6,6] систему, или 9 или 10 кольцевых атомов, организованных в бициклическую [5,6] или [6,6] систему. Термин «карбоцикл» включает, например, моноциклический карбоцикл, слитый с арильным кольцом (например, моноциклический карбоцикл, слитый с бензольным кольцом). Карбоциклы, предпочтительно, содержат от 3 до 8 атомов углеродного кольца.
[0059] Карбоциклические группы, по отдельности или как часть другой группы, можно, при желании, заменить, например, одной или несколькими группами, предпочтительно 1 или 2 группами (и любой дополнительной замещающей группой, выбираемой из галогенов), включая, но не ограничиваясь -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2 , -C(O)NHR’, -C(O)N(R’)2,-NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -N3 , -NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила, и где названные -C1-C8 алкильные, -C2-C8 алкенильные и -C2-C8 алкинильные, -O-(C1-C8 алкильные), -O-(C2-C8 алкенильные), -O-(C2-C8 алкинильные) и -арильные, группы можно при желании далее заменить одной или несколькими группами, включающими, но не ограничивающимися -C1-C8 алкилом, -C2-C8 алкенилом, -C2-C8 алкинилом, -галогеном, -O-(C1-C8 алкилом), -O-(C2-C8 алкенилом), -O-(C2-C8 алкинилом), -арилом, -C(O)R’’, -OC(O)R’’, -C(O)OR’’, -C(O)NH2 , -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, -SR’’, -SO3R’’, -S(O)2R’’, -S(O)R’’, -OH, -N3 , -NH2, -NH(R’’), -N(R’’)2 и -CN, где каждый R’’ независимо выбирают из -H, -C1-C8 алкила, -C2-C8 алкенила, -C2-C8 алкинила или -арила.
[0060] Примеры моноциклических карбоциклических заместителей включают -циклопропил, -циклобутил, -циклопентил, -1-циклопент-1-енил, -1-циклопент-2-енил, -1- циклопент -3-енил, циклогексил, -1-циклогекс-1-енил, -1-циклогекс-2-енил, -1-циклогекс-3-енил, -циклогептил, -циклооктил. -1,3-циклогексадиенил, -1,4- циклогексадиенил, -1,3-циклогептадиенил, -1,3,5-циклогептатриенил и -циклооктадиенил.
[0061] «Карбоцикло», по отдельности или как часть другой группы, обозначает замещенную при желании карбоциклическую группу, как определено выше, которая является диваленнтной (т.е. образованной при удалении двух атомов водорода с одного и того же или с двух разных атомов углерода исходной карбоциклической кольцевой системы).
[0062] Если иное не определено контекстом, дефис (-) обозначает точку прикрепления боковой молекулы. Соответственно, термин «-(C1-C8 алкилен)арил» или «-C1-C8 алкилен(арил)» обозначает C1-C8 алкиленовый радикал, как определено в настоящей заявке, где алкиленовый радикал присоединен к боковой молекуле по любому из атомов углерода алкиленового радикала, а один из атомов водорода, связанный с атомом углерода алкиленового радикала заменен арильным радикалом, как определено в настоящей заявке.
[0063] Когда определенная группа «заменена», эта группа может иметь один или несколько заместителей, предпочтительно, от одного до пяти заместителей, более предпочтительно от одного до трех заместителей, наиболее предпочтительно от одного до двух заместителей, независимо выбираемых из списка заместителей. Однако группа, как правило, может содержать любое количество заместителей, выбираемых из галогенов. Также указаны замененные группы.
[0064] Подразумевают, что определение любого заместителя или переменной в конкретном положении в молекуле не зависит от его определений в других положениях молекулы. Подразумевают, что заместители и профили заместителей на соединениях, представленных в настоящей заявке, может выбрать специалист в данной области техники, чтобы получить соединения, которые являются химически стабильными и которые можно легко синтезировать с помощью техник, известных в данной области техники, и способов, изложенных в настоящей заявке.
[0065] Защитные группы, как применяют в настоящей заявке, обозначают группы, которые селективно блокируют, временно или перманентно, один реакционный центр многофункционального соединения. Подходящие гидрокси-защитные группы для применения в представленных вариантах осуществления настоящего изобретения являются фармацевтически приемлемыми и могут нуждаться или не нуждаться в отщеплении от исходного соединения после введения субъекту для активации соединения. Отщепление осуществляется посредством нормальных метаболических процессов в организме. Гидрокси-защитные группы хорошо известны в данной области техники, см. Protective Groups in Organic Synthesis by T. W. Greene and P. G. M. Wuts (John Wiley & sons, 3rd Edition), включенной в настоящую заявку в полном объеме посредством ссылки с любыми целями, и включают, например, эфирные (например, алкильные эфиры и силильные эфиры, включая, например, диалкилсилиловый эфир, триалкилсилиловый эфир, диалкилалкоксисилиловый эфир), сложноэфирные, карбонатные, карбаматные, сульфонатные и фосфатные защитные группы. Примеры гидрокси-защитных групп включают, но не ограничиваются метиловым эфиром, метоксиметиловым эфиром, метилтиометиловым эфиром, (фенилдиметилсилил)метоксиметиловым эфиром, бензилоксиметиловым эфиром, п-метоксибензилоксиметиловым эфиром, п-нитробензилоксиметиловым эфиром, о-нитробензилоксиметиловым эфиром, (4-метоксифенокси)метиловым эфиром, гваяколметиловым эфиром, т-бутоксиметиловым эфиром, 4-пентенилоксиметиловым эфиром, силоксиметиловым эфиром, 2-метоксиэтоксиметиловым эфиром, 2,2,2-трихлорэтоксиметиловым эфиром, бис(2-хлорэтокси)метиловым эфиром, 2-(триметилсилил)этоксиметиловым эфиром, ментоксиметиловым эфиром, тетрагидропираниловым эфиром, 1-метоксициклогексиловым эфиром, 4- метокситертагидротиопираниловым эфиром, 4- метокситертагидротиопиранилового эфира S,S-диоксидом, 1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин-4-иловым эфиром, 1-(2-фторфенил)-4-метоксипиперидин -4-иловым эфиром, 1,4-диоксан-2-иловым эфиром, тетрагидрофураниловым эфиром, тетрагидротиофураниловым эфиром; замещенными этиловыми эфирами, такими как 1-этоксиэтиловый эфир, 1-(2-хлорэтокси)этиловый эфир, 1-[2-(триметилсилил)этокси]этиловый эфир, 1-метил-1-метоксиэтиловый эфир, 1-метил-1-бензилоксиэтиловый эфир, 1-метил-1-бензилокси-2-фторэтиловый эфир, 1-метил-1-феноксиэтиловый эфир, 2-триметилсилиловый эфир, т-бутиловый эфир, аллиловый эфир, пропаргиловые эфиры, п-хлорфениловый эфир, п-метоксифениловый эфир, бензиловый эфир, п-метоксибензиловый эфир, 3,4-диметоксибензиловый эфир, триметилсилиловый эфир, триэтилсилиловый эфир, трипропилсилиловый эфир, диметилизопропилсилиловый эфир, диэтилизопропилсилиловый эфир, диметилгексилсилиловый эфир, т-бутилдиметилсилиловый эфир, дифенилметилсилиловый эфир, бензоилформиатный сложный эфир, сложные эфиры уксусной кислоты, хлорацетатный сложный эфир, дихлорацетатный сложный эфир, трихлорацетатный сложный эфир, трифторацетатный сложный эфир, метоксиацетатный сложный эфир, трифенилметоксиацетатный сложный эфир, фенилацетатный сложный эфир, сложный эфир бензойной кислоты, алкилметилкарбонат, алкил-9-флуоренилметилкарбонат, алкилэтилкарбонат, алкил-2,2,2,-трихлорэтилкарбонат, 1,1,-диметил-2,2,2-трихлорэтилкарбонат, алкилсульфонат, метансульфонат, бензилсульфонат, тозилат, метиленацеталь, этилиденацеталь и т-бутилметилиденкеталь. Предпочтительные защитные группы представлены формулами -Ra, -Si(Ra)(Ra)(Ra), -C(O)Ra, -C(O)ORa, -C(O)NH(Ra), -S(O)2Ra, -S(O)2OH, P(O)(OH)2 и -P(O)(OH)ORa, где Ra является C1-C20 алкилом, C2-C20 алкенилом, C2-C20 алкинилом, -C1-C20 алкилен(карбоциклом), -C2-C20 алкенилен(карбоциклом), -C2-C20 алкинилен (карбоциклом), -C6-C10 арилом, -C1-C20 алкилен(арилом), -C2-C20 алкенилен(арилом), -C2-C20 алкинилен(арилом), -C1-C20 алкилен(гетероциклом), -C2-C20 алкенилен(гетероциклом) или -C2-C20 алкинилен(гетероциклом), где указанные алкиловые, алкениловые, алкиниловые, алкиленовые, алкениленовые, алкиниленовые, ариловые, карбоциклические и гетероциклические радикалы, по отдельности или как часть другой группы, при желании заменены.
[0066] «Изменение нативного профиля гликозилирования» предназначено для обозначения делеции одной или нескольких углеводных групп в нативной последовательности CD37 (либо посредством удаления участка гликозилирования, либо посредством удаления гликозилирования химическими и/или ферментативными средствами) и/или добавления одного или нескольких участков гликозилирования, которых нет в нативной последовательности CD37. Дополнительно, выражение включает количественное изменение гликозилирования нативных белков, включая изменение природы и соотношения различных присутствующих углеводных остатков.
[0067] Термин «аналог» обозначает молекулу, которая является структурно схожей или обладает похожими или соответствующими свойствами другой молекулы (например, CD37-родственный белок). Например, аналог белка CD37 может специфично связываться с антителом или с Т-клетками, которые специфично связывают CD37.
[0068] Термин «антитело» применяют в широком смысле, если иное не указано явным образом. Таким образом, «антитело» может быть природным или искусственным, таким как моноклональные антитела, полученное посредством стандартной гибридомной технологии. Антитела к CD37 содержат моноклональные и поликлональные антитела, а также фрагменты, содержащие антигенсвязывающий домен и/или один или несколько определяющих комплементарность участков этих антител. Как применяют в настоящей заявке, термин «антитело» обозначает любую форму антитела или его фрагмента, которая специфично связывает CD37 и/или обладает желаемой биологической активностью и специфично охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, если они специфично связывают CD37 и/или обладают желаемой биологической активностью. Любое специфичное антитело можно применять в способах и композициях, представленных в настоящей заявке. Таким образом, в одном варианте осуществления настоящего изобретения термин «антитело» включает молекулу, содержащую по меньшей мере одну вариабельную область из молекулы легкой цепи иммуноглобулина и по меньшей мере одну вариабельную область из молекулы тяжелой цепи, которые в комбинации образуют специфичный сайт связывания целевого антигена. В одном варианте осуществления настоящего изобретения антитело является антителом IgG. Например, антитело является IgG1, IgG2, IgG3 или IgG4 антителом. Антитела, применимые в настоящих способах и композициях, можно получить в клеточной культуре, в фагах или в различных животных, включая, но не ограничиваясь коровами, кроликами, козами, мышами, крысами, хомяками, морскими свинками, овцами, собаками, кошками, мартышками, шимпанзе и высшими обезьянами. Таким образом, в одном варианте осуществления настоящего изобретения, антитело настоящего изобретения в некоторых вариантах осуществления настоящего изобретения является антителом млекопитающего. Фаговые техники можно применять для изоляции исходного антитела или для получения вариантов с измененными характеристиками специфичности или авидности. Такие техники являются рутинными и хорошо известными специалистам в данной области техники. В одном варианте осуществления настоящего изобретения антитело образуют рекомбинантными средствами, известными в данной области техники. Например, рекомбинантное антитело можно получить посредством трансфекции клетки-хозяина вектором, содержащим последовательность ДНК, кодирующую антитело. Можно применять один или несколько векторов для трансфекции последовательности ДНК, экспрессирующей по меньшей мере одну VL и одну VH область в клетке-хозяине. Примеры описаний рекомбинантных способов продукции и получения антител включают Delves, ANTIBODY PRODUCTION: ESSENTIAL TECHNIQUES (Wiley, 1997); Shephard, et al., MONOCLONAL ANTIBODIES (Oxford University Press, 2000); Goding, MONOCLONAL ANTIBODIES: PRINCIPLES AND PRACTICE (Academic Press, 1993); и CURRENT PROTOCOLS IN IMMUNOLOGY (John Wiley & Sons, most recent edition). Антитело настоящего изобретения можно модифицировать рекомбинантными средствами для увеличения эффективности антитела в осуществлении желаемой функции. Таким обзор, настоящее изобретение подразумевает, что антитела можно модифицировать посредством внесения замен с помощью рекомбинантных способов. Как правило, замены являются консервативными заменами. Например, по меньшей мере одну аминокислоту в константной области антитела можно заменить другим остатком. См., например, патент США № 5624821, патент США № 6194551, заявку № WO 9958572; и Angal, et al., Mol. Immunol. 30: 105-08 (1993). Модификация аминокислот включает делеции, вставки и замены аминокислот. В некоторых случаях такие изменения вносят для снижения нежелательной активности, например, комплементзависимой цитотоксичности. Часто антитела метят, присоединяя ковалентно или нековалентно вещество, которое обеспечивает образование детектируемого сигнала. Широкий спектр меток и техник конъюгации известен в данной области техники и подробно описан как в научной, так и в патентной литературе. Можно проводить скрининг таких антител на предмет связывания с нормальным или дефектным CD37. См., например, ANTIBODY ENGINEERING: A PRACTICAL APPROACH (Oxford University Press, 1996). Подходящие антитела с желаемыми биологическими активностями можно идентифицировать с помощью следующих in vitro исследований, включая, но не ограничиваясь исследованием пролиферации, миграции, адгезии, роста на мягком агаре, ангиогенеза, межклеточных взаимодействий, апоптоза, транспорта, передачи сигнала, и следующих in vivo исследований, таких как исследование ингибирования роста опухоли. Антитела, представленные в настоящей заявке, также могут быть полезны в диагностических областях применения. В качестве связывающих или ненейтрализующих антител, эти антитела можно скринировать на предмет их способности связывать специфичный антиген без ингибирования связывания рецептора или биологической активности антигена. В качестве нейтрализующих антител эти антитела можно применять в исследованиях конкурентного связывания. Они также могут быть полезны для количественной оценки CD37 или его рецептора.
[0069] Термин «антигенсвязывающая часть» антитела или «фрагмент антитела» (или просто «часть антитела»), как применяют в настоящей заявке, обозначает один или несколько фрагментов антитела к CD37, которые сохраняют способность специфично связывать антиген (например, CD37 и его варианты; Фигура 1). Было показано, что антигенсвязывающую функцию антитела могут выполнять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, определенных термином «антигенсвязывающая часть» антитела, включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, бивалентный фрагмент, состоящий из двух Fab-фрагментов, связанных дисульфидным мостиком в области петли; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), который состоит из домена VH; и (vi) выделенный определяющий комплементарность участок (CDR, complementarily determining region). Более того, хотя два домена Fv-фрагмента, VLи VH, кодируются отдельными генами, их можно соединить с помощью рекомбинантных способов посредством искусственного линкера, который обеспечивает их синтез в виде единой белковой цепи, в которой области VL и VH объединяются в пару с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также охватывает термин «антигенсвязывающая часть» антитела. Такие фрагменты антител получают с помощью стандартных техник, известных специалистам в данной области техники, и проводят скрининг фрагментов на предмет их функциональности, так же как для интактных антител.
[0070] Как применяют в настоящей заявке, любую форму «антигена» можно принять для получения антитела, специфичного к CD37. Так, искомый антиген может быть одноэпитопным, многоэпитопным или целым белком по отдельности или в комбинации с одним или несколькими усиливающими иммуногенность агентами, известными в данной области техники. Искомый антиген может быть выделенным полноразмерным белком, белком клеточной поверхности (например, при иммунизации клетками, трансфицированными по меньшей мере частью антигена) или растворимым белком (например, при иммунизации только частью внеклеточного домена белка). Антиген можно получить в генетически модифицированных клетках. ДНК, кодирующая антиген, может быть геномной или негеномной (например, кДНК), и она кодирует по меньшей мере часть внеклеточного домена. Как применяют в настоящей заявке, термин «часть» в контексте антигена обозначает минимальное количество аминокислот или нуклеиновых кислот, в соответствующих случаях, для создания иммуногенного эпитопа заданного антигена. Можно применять любые генетические векторы, подходящие для трансформации заданных клеток, включая, но не ограничиваясь аденовирусными векторами, плазмидами и невирусными векторами, такими как катионные липиды. В одном варианте осуществления настоящего изобретения антитело способов и композиций настоящей заявки специфично связывает по меньшей мере часть внеклеточного домена заданного CD37.
[0071] Антитела или их антигенсвязывающие фрагменты, представленные в настоящей заявке, можно конъюгировать с «биоактивным агентом». Как применяют в настоящей заявке, термин «биоактивный агент» обозначает любое синтетическое или встречающееся в природе соединение, которое связывает антиген и/или усиливает или опосредует желаемый биологический эффект усиления действия убивающих клетки токсинов. В одном варианте осуществления настоящего изобретения связывающие фрагменты, применимые в настоящем изобретении, являются биологически активными фрагментами. Как применяют в настоящей заявке, термин «биологически активный» обозначает антитело или фрагмент антитела, способный связывать желаемый антигенный эпитоп и прямо или косвенно оказывать биологический эффект. Прямые эффекты включают, но не ограничиваются модулированием, стимуляцией и/или ингибированием ростового сигнала, модулированием, стимуляцией и/или ингибированием антиапоптотического сигнала, модулированием, стимуляцией и/или ингибированием апоптотического или некротического сигнала, модулированием, стимуляцией и/или ингибированием каскада антителозависимой цитотоксичности (ADCC, antibody-dependent cellular cytotoxicity) и модулированием, стимуляцией и/или ингибированием каскада комплементзависимой цитотоксичности (CDC, complement-dependent cytotoxicity).
[0072] «Биспецифичные» антитела также применимы в настоящих способах и композициях. Как применяют в настоящей заявке, термин «биспецифичное антитело» обозначает антитело, как правило, моноклональное антитело, со специфичностью связывания по меньшей мере двух разных эпитопов антигена. В одном варианте осуществления настоящего изобретения эпитопы происходят из одного и того же антигена. В другом варианте осуществления настоящего изобретения эпитопы происходят из двух разных антигенов. Способы создания биспецифичных антител известны в данной области техники. Например, биспецифичные антитела можно получить рекомбинантно с помощью коэкспрессии двух пар легкой/тяжелой цепей иммуноглобулинов. См., например, Milstein et al., Nature 305:537-39 (1983). Альтернативно, биспецифичные антитела можно получить посредством химической связи. См., например, Brennan, et al., Science 229:81 (1985). Биспецифичные антитела включают фрагменты биспецифичных антител. См., например, Hollinger, et al., Proc. Natl. Acad. Sci. U.S.A. 90:6444-48 (1993), Gruber, et al., J. Immunol. 152:5368 (1994).
[0073] Моноклональные антитела, описанные в настоящей заявке, в конкретном случае включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, полученных из конкретного вида или принадлежащих конкретному классу или подклассу антител, в то время как остальная цепь (цепи) идентична или гомологична соответствующим последовательностям антител, полученных из других видов или принадлежащих другому классу или подклассу антител, а также фрагментов таких антител, если они специфично связывают целевой антиген и/или обладают желаемой биологической активностью (патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)).
[0074] Термин «химиотерапевтический агент» обозначает все химические соединения, которые эффективно ингибируют рост опухоли. Неограничивающие примеры химиотерапевтических агентов включают алкилирующие агенты, например, азотистый иприт, этилениминовые соединения и алкилсульфонаты; антиметаболиты, например, антагонисты фолиевой кислоты, пурина или пиримидина антагонисты; митотические ингибиторы, например, анти-тубулиновые агенты, такие как алкалоиды барвинка, ауристатины и производные подофиллотоксина; цитотоксические антибиотики; соединения, которые повреждают или препятствуют экспрессии ДНК или репликации, например, связывающие малую бороздку ДНК; и антагонисты рецепторов ростовых факторов. Кроме того, химиотерапевтические агенты включают цитотоксические агенты (как определено в настоящей заявке), антитела, биологические молекулы и малые молекулы.
[0075] Термин «соединение» обозначает и включает в себя химическое соединение само по себе, а также, независимо от наличия исчерпывающего описания, если контекст четко не определяет, что следующее необходимо исключить: аморфную и кристаллическую формы соединения, включая полиморфные формы, где эти формы могут быть частью смеси или в выделенном виде; свободные кислотные и основные формы соединения, которые как правило являются формами, показанными в структурах, представленных в настоящей заявке; изомеры соединения, которое относятся к оптическим изомерам и таутомерным изомерам, где оптические изомеры включают энантиомеры и диастереомеры, хиральные изомеры и нехиральные изомеры, и оптические изомеры включают выделенные оптические изомеры, а также смеси оптических изомеров, включая рацемические и нерацемические смеси: где изомер можно выделить из смеси одного или нескольких изомеров; изотопы соединения, включая соединения, содержащие дейтерий и тритий, и включая соединения, содержащие радиоизотопы, включая терапевтически и диагностически эффективные радиоизотопы; мультимерные формы соединения, включая димерные, тримерные и пр. формы; соли соединения, предпочтительно, фармацевтически приемлемые соли, включая кислотно-аддитивные соли и основно-аддитивные соли, включая соли, содержащие органические противоионы и неорганические противоионы, и включая цвиттерионные формы, где при ассоциации соединения с двумя или более противоионами два или более противоионов могут быть одинаковыми или разными; и сольваты соединения, включая полусольваты, моносольваты, дисольваты и пр., включая органические сольваты и неорганические сольваты, при этом указанные неорганические сольваты включают гидраты; где, если соединение ассоциировано с двумя или более молекулами растворителя, две или более молекулы растворителя могут быть одинаковыми или разными. В некоторых случаях ссылка, сделанная в настоящей заявке, на соединение настоящего изобретения будет включать исчерпывающую ссылку на одну или несколько указанных выше форм, например, на соли и/или сольваты, однако эта ссылка приведена только в качестве акцента и не должна быть истолкована как исключающая другие указанные выше формы, как определено выше.
[0076] Термины «определяющий комплементарность участок» и «CDR» известны в данной области техники как обозначающие ненепрерывные последовательности аминокислот внутри вариабельных областей антитела, которые сохраняют специфичность по отношению к антигену и аффинность связывания. Как правило, в каждой вариабельной области тяжелой цепи содержатся три (3) CDR (CDR-H1, CDR-H2, CDR-H3) и три (3) CDR содержатся в каждой вариабельной области легкой цепи (CDR-L1, CDR-L2, CDR-L3).
[0077] Аминокислотные границы заданного CDR можно определить, применяя любое количество известных схем, включая описанные в Kabat et al. (1991), “Sequences of Proteins of Immunological Interest,” 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (система нумерации «Kabat»), Al-Lazikani et al., (1997) JMB 273,927-948 (система нумерации «Chothia»), MacCallum et al., J. Mol. Biol. 262:732-745 (1996), “Antibody-antigen interactions: Contact analysis and binding site topography,” J. Mol. Biol. 262, 732-745.” (система нумерации «Контакт»)), Lefranc MP et al., “IMGT unique numbering for immunoglobulin and T cell receptor variable domains and Ig superfamily V-like domains,” Dev Comp Immunol, 2003 Jan;27(1):55-77 (система нумерации «IMGT») и Honegger A and Plückthun A, “Yet another numbering scheme for immunoglobulin variable domains: an automatic modeling and analysis tool,” J Mol Biol, 2001 Jun 8;309(3):657-70, (система нумерации «AHo»).
[0078] Границы заданного CDR могут варьировать в зависимости от схемы, применяемой в Таблице V, ниже, в которой перечислены примеры позиций CDR-L1, CDR-L2, CDR-L3 и CDR-H1, CDR-H2, CDR-H3 в соответствии со схемами Kabat, Chothia и Contact, соответственно. Для CDR-H1 нумерация остатков дана в соответствии как со схемой нумерации по Kabat, так и со схемой Chothia.
[0079] Таким образом, если иное не определено, термины «CDR» и «определяющий комплементарность участок» заданного антитела или его участка, такого как вариабельная область, а также отдельные CDR (например, CDR-H1, CDR-H2) и каркасные участки (FR) антитела или его участка следует понимать как включающие соответствующую область (например, определяющий комплементарность участок), как определено любыми известными схемами, описанными в настоящей заявке выше. В некоторых случаях схема для идентификации конкретного CDR или нескольких CDR определена, так что CDR определяют по способу Kabat, Chothia или «Контакт». В других случаях конкретная аминокислотная последовательность CDR задана.
[0080] Как применяют в настоящей заявке, термин «консервативная замена» обозначает аминокислотные замены, известные специалистам в данной области техники, которые можно внести, как правило, без изменения биологической активности образующейся в результате молекулы. Специалисты в данной области техники знают, что, как правило, одиночные аминокислотные замены в неважных областях полипептида не меняют в значительной степени биологическую активность (см., например, Watson, et al., MOLECULAR BIOLOGY OF THE GENE, The Benjamin/Cummings Pub. Co., p. 224 (4th Edition 1987)). Такие примеры замен предпочтительно вносят в соответствии с заменами, указанными в Таблице II и Таблице (Таблицах) III(a-b). Например, такие изменения включают замену любого из изолейцина (I), валина (V)и лейцина (L) любой другой из этих гидрофобных аминокислот; аспарагиновой кислоты (D) глутаминовой кислотой (E) и наоборот; глутамина (Q) аспарагином (N) и наоборот; и серина (S) треонином (T) и наоборот. Другие замены также можно считать консервативными в зависимости от окружения конкретной аминокислоты и ее роли в трехмерной структуре белка. Например, глицин (G) и аланин (A) часто могут быть взаимозаменяемыми, как аланин (A) и валин (V). Метионин (M), который является относительно гидрофобным, можно часто заменять лейцином и изолейцином и иногда валином. Лизин (K) и аргинин (R) часто являются взаимозаменяемыми в положениях, где важным свойством аминокислотного остатка является его заряд, а различающиеся pK этих двух аминокислот не важны. Другие изменения можно считать «консервативными» в определенном окружении (см., например, Таблицу III(a) в настоящей заявке; pages 13-15 “Biochemistry” 2nd ED. Lubert Stryer ed (Stanford University); Henikoff et al., PNAS 1992 Vol 89 10915-10919; Lei et al., J Biol Chem 1995 May 19; 270(20):11882-6). Другие замены также допустимы, и их можно определить эмпирически или в соответствии с известными консервативными заменами.
[0081] Термин «цитотоксический агент» обозначает вещество, которое ингибирует или предотвращает экспрессионную активность клеток, клеточные функции и/или вызывает разрушение клеток. Подразумевают, что термин включает радиоактивные изотопы, химиотерапевтические агенты и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты. Примеры цитотоксических агентов включают, но не ограничиваются ауристатинами (например, ауристатином E, ауристатином F, MMAE и MMAF), ауромицинами, майтанзиноидами, А-цепью рицина, комбрестатином, дуокармицинами, доластатинами, доксорубицином, даунорубицином, таксолами, цисплатином, cc1065, этидия бромидом, митомицином, этопозидом, тенопозидом, винкристином, винбластином, колхицином, дигидроксиантрациндионом, актиномицином, дифтерийным токсином, экзотоксином А Pseudomonas (PE), PE40, абрином, А-цепью абрина, А-цепью модессина, альфа-сарцином, гелонином, митогеллином, рестриктоцином, феномицином, эномицином, курицином, кротином, калихеамицином, ингибитором Sapaonaria officinalis и глюкокортикоидом и другими химиотерапевтическими агентами, а также радиоизотопами, такими как At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212 или213, P32 и радиоактивными изотопами Lu, включая Lu177. Антитела также можно конъюгировать с ферментом, активирующим противораковое неактивное лекарственное средство, способным превращать неактивное лекарственное средство в активную форму.
[0082] Как применяют в настоящей заявке, термин «диантитела» обозначает небольшие фрагменты антитела с двумя антигенсвязывающими сайтами, при этом фрагменты содержат вариабельную область тяжелой цепи (VH), связанную с вариабельной областью легкой цепи (VL) в той же полипептидной цепи (VH-VL). Применяя линкер, слишком короткий, чтобы обеспечить спаривание двух доменов одной цепи, вынуждают домены спариваться с комплементарными доменами другой цепи и формировать два антигенсвязывающих сайта. Диантитела описаны более подробно, например, в EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-48 (1993).
[0083] Термин «уничтожать» в контексте эффекта связывающего CD37 агента на CD37-экспрессирующие клетки обозначает уменьшение количества или элиминацию CD37-экспрессирующих клеток.
[0084] Термин «продукт гена» применяют в настоящей заявке для указания на пептид/белок или мРНК. Например, «продукт гена настоящего изобретения» иногда обозначают в настоящей заявке как «раковая аминокислотная последовательность», «раковый белок», «белок рака, описанного в Таблице I», «раковая мРНК», «мРНК рака, описанного в Таблице I» и пр. В одном варианте осуществления настоящего изобретения раковый белок кодируется нуклеиновой кислотой из Фигуры 1. Раковый белок может быть фрагментом или, альтернативно, полноразмерным белком, кодируемым нуклеиновыми кислотами из Фигуры 1. В одном варианте осуществления настоящего изобретения раковую аминокислотную последовательность применяют для определения идентичности или сходства последовательности. В другом варианте осуществления настоящего изобретения последовательности являются встречающимися в природе аллельными вариантами белка, кодируемого нуклеиновой кислотой с Фигуры 1. В другом варианте осуществления настоящего изобретения последовательности являются вариантами последовательности, как описано далее в настоящей заявке.
[0085] «Гетероконъюгированные» антитела применимы в настоящих способах и композициях. Как применяют в настоящей заявке, термин «гетероконъюгированное антитело» обозначает два ковалентно связанных антитела. Такие антитела можно получить с помощью известных способов синтетической белковой химии, включая образующие поперечные сшивки агенты. См., например, патент США № 4676980.
[0086] Термин «гомолог» обозначает молекулу, имеющую гомологию с другой молекулой за счет, например, содержания последовательностей химических остатков, таких же или схожих в соответствующих положениях.
[0087] В одном варианте осуществления настоящего изобретения антитело, представленное в настоящей заявке, является «человеческим антителом». Как применяют в настоящей заявке, термин «человеческое антитело» обозначает антитело, в котором почти вся последовательность последовательностей легкой цепи и тяжелой цепей, включая определяющие комплементарность участки (CDR), кодируется человеческими генами. В одном варианте осуществления настоящего изобретения человеческие моноклональные антитела получают по триомной технологии, по технологии с применением человеческих В-клеток (см., например, Kozbor, et al., Immunol. Today 4: 72 (1983), по технологии трансформации вирусом Эпштейна-Барр (см., например, Cole et al. MONOCLONAL ANTIBODIES AND CANCER THERAPY 77-96 (1985)) или с помощью фагового дисплея (см., например, Marks et al., J. Mol. Biol. 222:581 (1991)). В конкретном варианте осуществления настоящего изобретения человеческое антитело получают в трансгенных мышах. Техники создания таких частично или полностью человеческих антител известны в данной области техники, и можно применять любые из таких техник. В соответствии с одним особенно предпочтительным вариантом осуществления настоящего изобретения последовательности полностью человеческого антитела получают в трансгенных мышах, созданных для экспрессии генов человеческих тяжелой и легкой цепей. Пример описания получения трансгенных мышей, которые образуют человеческие антитела, приведен в заявке №. WO 02/43478 и в патенте США 6657103 (Abgenix) и их продолжении. B-клетки из трансгенных мышей, которые образуют желаемое антитело, можно затем слить для образования гибридомных клеточных линий для непрерывного продуцирования антитела. См., например, патенты США № 5569825; 5625126; 5633425; 5661016; и 5545806; и Jakobovits, Adv. Drug Del. Rev. 31:33-42 (1998); Green, et al., J. Exp. Med. 188:483-95 (1998).
[0088] Как применяют в настоящей заявке, термин «гуманизированное антитело» обозначает формы антител, которые содержат последовательности нечеловеческих (например, мышиных) антител, а также человеческих антител. Такие антитела являются химерными антителами, которые содержат минимальную последовательность, происходящую из нечеловеческого иммуноглобулина. Как правило, гуманизированное антитело будет содержать в основном все из по меньшей мере одного, а обычно из двух, вариабельных доменов, в которых все или в основном все гипервариабельные петли соответствуют таковым в нечеловеческом иммуноглобулине, и все или в основном все участки FR имеют последовательность человеческого иммуноглобулина. Гуманизированное антитело, при желании, также будет включать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, человеческого иммуноглобулина. См., например, патент США № 4816567 автора Cabilly; Queen et al. (1989) Proc. Nat'l Acad. Sci. USA 86:10029-10033; и ANTIBODY ENGINEERING: A PRACTICAL APPROACH (Oxford University Press 1996).
[0089] Термины «ингибировать» или «ингибирование», как применяют в настоящей заявке, обозначают детектируемое уменьшение количество или полное прекращение.
[0090] Выражения «выделенный» или «биологически чистый» обозначают материал, который в основном или практически свободен от компонентов, которые в норме ассоциированы с этим материалом в нативном состоянии. Так, выделенные пептиды в соответствии с настоящим изобретением, предпочтительно не содержат материалы, в норме ассоциированные с пептидами в окружении in situ. Например, полинуклеотид называют «выделенным», когда он в основном отделен от загрязняющих полинуклеотидов, которые соответствуют или комплементарны генам, отличным от генов CD37, или которые кодируют полипептиды, отличные от продукта гена CD37, или их фрагменты. Специалист в данной области техники может легко применить процедуры выделения нуклеиновых кислот для получения выделенного полинуклеотида CD37. Белок называют «выделенным», например, когда применяют физические, механические или химические способы для отделения белков CD37 от клеточных составляющих, которые в норме ассоциированы с белком. Специалист в данной области техники может легко применить стандартные способы выделения для получения выделенного белка CD37. Альтернативно, выделенный белок можно получить химическими способами.
[0091] Подходящие «метки» включают радионуклиды, ферменты, субстраты, кофакторы, ингибиторы, флуоресцентные группы, хемилюминесцентные группы, магнитные частицы и подобное. Патенты, обучающие применению таких меток включают патенты США № 3817837, 3850752, 3939350, 3996345, 4277437, 4275149 и 4366241. Кроме того, антитела, представленные в настоящей заявке, могут быть полезны в качестве антигенсвязывающих компонентов флуоротел. См., напр, Zeytun et al., Nat. Biotechnol. 21:1473-79 (2003).
[0092] Термин «млекопитающее» обозначает любой организм, классифицированный как млекопитающее, включая мышей, крыс, собак, кошек, коров, лошадей и людей. В одном варианте осуществления настоящего изобретения млекопитающее является мышью. В другом варианте осуществления настоящего изобретения млекопитающее является человеком.
[0093] Термины «метастазирующий рак» и «метастазирующее заболевание» обозначают рак, распространившийся в региональные лимфоузлы или в отдаленные места, и предполагают включение заболевания стадии D в системе AUA и стадии TxNxM+ в системе TNM.
[0094] Термины «модулятор» или «тестируемое соединение» или «кандидатное лекарственное средство» или их грамматические эквиваленты, как применяют в настоящей заявке, описывают любую молекулу, например, белок, олигопептид, малую органическую молекулу, полисахарид, полинуклеотид и пр., которую будут тестировать на предмет способности прямо или косвенно изменять раковый фенотип или экспрессировать раковую последовательность, например, последовательности нуклеиновой кислоты или белка, или эффекты раковых последовательностей (например, передачу сигнала, экспрессию генов, белковые взаимодействия и пр.). В одном аспекте модулятор будет нейтрализовать эффект ракового белка настоящего изобретения. Под «нейтрализовать» понимают ингибирование или блокирование активности белка и последующий эффект на клетку. В другом аспекте модулятор будет нейтрализовать эффект гена и соответствующего белка настоящего изобретения, нормализуя уровень названного белка. В предпочтительных вариантах осуществления настоящего изобретения модуляторы изменяют профили экспрессии или профили экспрессии нуклеиновых кислот или белков, представленных в настоящей заявке, или расположенных далее эффекторных путей. В одном варианте осуществления настоящего изобретения модулятор подавляет раковый фенотип, например, до профиля нормальной ткани. В другом варианте осуществления настоящего изобретения модулятор индуцировал раковый фенотип. Как правило, исследуют множество тестовых смесей параллельно с разными концентрациями агента, чтобы получить разный ответ на различные концентрации. Обычно одна из этих концентраций служит отрицательным контролем, т.е. при нулевой концентрации или при уровне ниже определяемого.
[0095] Модуляторы, кандидатные лекарственные средства или тестируемые соединения охватывают многочисленные химические классы, хотя обычно они являются органическими молекулами, предпочтительно, малыми органическими соединениями, имеющими молекулярный ЕС более 100 и менее 2500 Дальтон. Предпочтительные малые молекулы весят менее 2000 или менее 1500, или менее 1000, или менее 500 Да. Кандидатные агенты включают функциональные группы, необходимые для структурных взаимодействий с белками, особенно для образования водородных связей, и обычно включают по меньшей мере амино-, карбонильную, гидроксильную или карбоксильную группу, предпочтительно, по меньшей мере две функциональные химические группы. Кандидатные агенты часто содержат циклические углеродные или гетероциклические структуры и/или ароматические или полиароматические структуры, замененные одной или несколькими из указанных выше функциональных групп. Модуляторы также включают биомолекулы, такие как пептиды, сахариды, жирные кислоты, стероиды, пурины, пиримидины, производные, структурные аналоги или их комбинации. Особенно предпочтительными являются пептиды. Один класс модуляторов представлен пептидами, например, от приблизительно пяти до приблизительно 35 аминокислот, предпочтительно, от приблизительно пяти до приблизительно 20 аминокислот и, особенно предпочтительно, от приблизительно 7 до приблизительно 15 аминокислот. Предпочтительно, чтобы раковый модулирующий белок был растворимым, включал нетрансмембранную область и/или N-концевой Cys, что способствует растворимости. В одном варианте осуществления настоящего изобретения C-конец фрагмента остается в виде свободной кислоты, а N-конец - в виде свободного амина, что способствует спариванию, т.е. спариванию с цистеином. В одном варианте осуществления настоящего изобретения раковый белок настоящего изобретения конъюгирован с иммуногенным агентом, как обсуждают в настоящей заявке. В одном варианте осуществления настоящего изобретения раковый белок настоящего изобретения конъюгирован с БСА (бычьим сывороточным альбумином). Пептиды настоящего изобретения например, предпочтительной длины, в некоторых вариантах осуществления настоящего изобретения могут быть связаны друг с другом или с другими аминокислотами для создания более протяженного пептида/белка. Модулирующие пептиды могут быть продуктами расщепления встречающихся в природе белков, как изложено выше, случайными пептидами или «направленно» случайными пептидами. В предпочтительном варианте осуществления настоящего изобретения модуляторы на основе пептида/белка являются антителами и их фрагментами, как определено в настоящей заявке.
[0096] Термин «моноклональное антитело», как применяют в настоящей заявке, обозначает антитело, полученное из популяции в основном гомогенных антител, т.е. отдельные антитела, составляющие популяцию, идентичны за исключением возможно встречающихся в природе мутаций, которые могут присутствовать в малых количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными на единственный антигенный эпитоп. Напротив, препараты стандартных (поликлональных) антител обычно включают множество антител, направленных (или специфичных к) на разные эпитопы. В одном варианте осуществления настоящего изобретения поликлональные антитела содержат множество моноклональных антител с разной эпитопной специфичностью, аффинностью или авидностью в пределах одного антигена, который содержит множество антигенных эпитопов. Определение «моноклональное» указывает на свойство антитела как полученного из в основном гомогенной популяции антител, и его не следует рассматривать как требующее получения антитела каким-либо определенным способом. Например, моноклональные антитела для применения в соответствии с настоящим изобретением в некоторых вариантах осуществления настоящего изобретения можно получить гибридомным способом, впервые описанным Kohler et al., Nature 256: 495 (1975), или можно получить способами с применением рекомбинантной ДНК (см., например, патент США № 4816567). «Моноклональные антитела» также можно выделить из фаговых библиотек антител с помощью техник, описанных в Clackson et al., Nature 352: 624-628 (1991) и Marks et al., J. Mol. Biol. 222: 581-597 (1991), например. Такие моноклональные антитела обычно будут связываться с Kd равной по меньшей мере приблизительно 1 мкМ, чаще равной по меньшей мере приблизительно 300 нМ, как правило, равной по меньшей мере приблизительно 30 нМ, предпочтительно, по меньшей мере приблизительно 10 нМ, более предпочтительно, по меньшей мере приблизительно 3 нМ или лучше, что обычно определяют с помощью твердофазного иммуноферментного анализа ELISA (enzyme linked immunosorbent assay).
[0097] «Фармацевтический эксципиент» содержит материал, такой как адъювант, носитель, модифицирующий pH и буферный агенты, регулирующие тоничность агенты, увлажняющие агенты, консерванты и подобное.
[0098] «Фармацевтически приемлемый» обозначает нетоксичный, инертный и/или композицию, которая физиологически совместима с человеком или другими млекопитающими.
[0099] Термин «полинуклеотид» обозначает полимерную форму нуклеотидов длиной по меньшей мере из 10 оснований или пар оснований, либо рибонуклеотидов, либо дезоксинуклеотидов или модифицированной формы любого типа нуклеотидов, и включает одноцепочечные и двухцепочечные формы ДНК и/или РНК. В данной области техники этот термин часто применяют взаимозаменяемо с «олигонуклеотидом». Полинуклеотид может включать нуклеотидную последовательность, раскрытую в настоящей заявке, где тимидин (T), как показано, например, на Фигуре 1, также может быть урацилом (U); это определение относится к различиям химической структуры ДНК и РНК, в частности к тому факту, что одним из четырех основных оснований в РНК является урацил (U) вместо тимидина (T).
[0100] Термин «полипептид» обозначает полимер из по меньшей мере 4, 5, 6, 7 или 8 аминокислот. На протяжении всего настоящего описания применяют стандартные трехбуквенные (см. Таблицу III) или однобуквенные обозначения аминокислот. В данной области техники этот термин часто применяют взаимозаменяемо с «пептидом» или «белком».
[0101] «Рекомбинантная» молекула ДНК или РНК является молекулой ДНК или РНК, подвергнутой молекулярной манипуляции in vitro.
[0102] Как применяют в настоящей заявке, термин «одноцепочечныйFv» или «scFv» или «одноцепочечное» антитело обозначает фрагменты антитела, содержащие домены антитела VH и VL, где эти домены присутствуют в единой полипептидной цепи. Как правило, полипептид Fv далее содержит полипептидный линкер между доменами VH и VL, который позволяет sFv сформировать желаемую структуру для связывания антигена. Обзор sFv см. в Pluckthun, THE PHARMACOLOGY OF MONOCLONAL ANTIBODIES, vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315 (1994).
[0103] Как применяют в настоящей заявке, термины «специфичный», «специфично связывает» и «связывает специфично» обозначают селективное связывание антитела с целевым эпитопом антигена. Антитела можно исследовать на специфичность связывания, сравнивая связывание с подходящим антигеном со связыванием с посторонним антигеном или смесью антигенов в заданных условиях. Если антитело связывает подходящий антиген по меньшей мере в 2, 5, 7, а предпочтительно, в 10 раз сильнее, чем посторонний антиген или смесь антигенов, то его считают специфичным. В одном варианте осуществления настоящего изобретения специфичное антитело является антителом, которое связывает только антиген CD37, но не связывает посторонний антиген. В другом варианте осуществления настоящего изобретения специфичное антитело является антителом, которое связывает человеческий антиген CD37, но не связывает нечеловеческий антиген CD37 с 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей аминокислотной гомологией с антигеном CD37. В другом варианте осуществления настоящего изобретения специфичное антитело является антителом, которое связывает человеческий антиген CD37 и связывает мышиный антиген CD37, но сильнее связывает человеческий антиген. В другом варианте осуществления настоящего изобретения специфичное антитело является антителом, которое связывает человеческий антиген CD37 и связывает антиген CD37 приматов, но сильнее связывает человеческий антиген. В другом варианте осуществления настоящего изобретения специфичное антитело является антителом, которое связывает человеческий антиген CD37 и любой нечеловеческий антиген CD37 приматов, но сильнее связывает человеческий антиген или любую его комбинацию.
[0104] Как применяют в настоящей заявке, «лечить» или «средство лечения» и грамматически родственные термины обозначают любое улучшение любых последствий заболевания, такое как более продолжительная выживаемость, более низкая смертность и/или уменьшение побочных эффектов, которые являются побочными продуктами альтернативного лечебного воздействия; как принято считать в данной области техники, полное излечение заболевания является предпочтительным, хотя и не необходимым требованием процесса лечения.
[0105] Термин «вариант» обозначает молекулу, которая отличается от описанного типа или нормы, такую как белок, содержащий один или несколько отличающихся аминокислотных остатков в соответствующих положениях специально описанного белка (например, белка CD37, показанного на Фигуре 1). Аналог является примером варианта белка. Изоформы, образованные в результате сплайсинга, и однонуклеотидные полиморфизмы (SNP, single nucleotides polymorphisms) являются дальнейшими примерами вариантов.
[0106] «Белки CD37» и/или «CD37-родственные белки» настоящего изобретения включают белки, специально определенные в настоящей заявке (см. Фигуру 1), а также аллельные варианты, варианты консервативных замен, аналоги и гомологи, которые можно выделить/получить и охарактеризовать без ненужной экспериментальной работы после применения способов, изложенных в настоящей заявке или легко доступных в данной области техники. Также включены слитые белки, которые сочетают части разных белков CD37 или их фрагментов, а также слитые белки белка CD37 и гетерологичные полипептиды. Такие белки CD37 вместе обозначают как CD37-родственные белки, белки настоящего изобретения или CD37. Термин «CD37-родственный белок» обозначает полипептидный фрагмент последовательности белка CD37 из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более чем 25 аминокислот; или из по меньшей мере 30, 35, 40, 45, 50, 55, 60, 65, 70, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 225, 250, 275, 276, 277, 278, 279, 280 или 281 или более аминокислот.
II) Антитела к CD37
[0107] Другой аспект настоящего изобретения представляет антитела к CD37-родственным белкам (см. Фигуру 1). В одном варианте осуществления настоящего изобретения антитело, которое связывает CD37-родственные белки, является антителом, которое специфично связывает белок CD37, содержащий аминокислотную последовательность SEQ ID NO.: 2. Антитело, которое специфично связывает белок CD37, содержащий аминокислотную последовательность SEQ ID NO.: 2, включает антитела, которые могут связывать другие CD37-родственные белки. Например, антитела, которые связывают белок CD37, содержащий аминокислотную последовательность SEQ ID NO.: 2, может связывать CD37-родственные белки, такие как варианты CD37 и его гомологи и аналоги.
[0108] В некоторых вариантах осуществления настоящего изобретения антитела к CD37 настоящего изобретения особенно полезны в прогностических исследованиях рака (см., например, Таблицу I), в получении изображений, диагностике рака и терапевтических методологиях. Схожим образом такие антитела применимы в лечении и/или прогнозировании острой миелоидной лейкемии, хронической лимфоцитарной лейкемии, неходжкинской лимфомы и других видов рака, если CD37 также экспрессируется или сверхэкспрессируется в указанных других видах рака. Более того, экспрессирующиеся внутриклеточно антитела (например, одноцепочечные антитела) являются терапевтически применимыми в лечении рака, при котором экспрессируется CD37, такого как распространенная или метастазирующая острая миелоидная лейкемия, хроническая лимфоцитарная лейкемия, неходжкинская лимфома или множественная миелома или другой распространенный или метастазирующий рак.
[0109] Различные способы получения антител, особенно моноклональных антител хорошо известны в данной области техники. Например, антитела можно получить посредством иммунизации подходящего хозяина, относящегося к млекопитающим, с помощью CD37-родственного белка, пептида или фрагмента в выделенной или иммуноконъюгированной форме (Antibodies: A Laboratory Manual, CSH Press, Eds., Harlow, and Lane (1988); Harlow, Antibodies, Cold Spring Harbor Press, NY (1989)). Кроме того, также можно применять слитые белки CD37, такие как CD37 GST-слитый белок. В частном варианте осуществления настоящего изобретения получают GST-слитый белок, содержащий всю или большую часть аминокислотной последовательности с Фигуры 1, а затем применяют его в качестве иммуногена для получения соответствующих антител. В другом варианте осуществления настоящего изобретения CD37-родственный белок синтезируют и применяют в качестве иммуногена.
[0110] Кроме того, применяют хорошо известные в данной области техники иммунизации депротеинизированной ДНК (с или без очищенного CD37- родственного белка или экспрессирующих CD37 клеток), чтобы вызвать иммунный ответ на закодированный иммуноген (обзор см. в Donnelly et al., 1997, Ann. Rev. Immunol. 15: 617-648).
[0111] Аминокислотную последовательность белка CD37, как показанную на Фигуре 1 можно проанализировать для отбора специфичных областей белка CD37 для получения антител. Например, применяют анализ гидрофобности и гидрофильности аминокислотной последовательности CD37 для идентификации гидрофильных областей в структуре CD37. Области белка CD37, обладающие иммуногенной структурой, а также другие области и домены, можно легко идентифицировать с помощью разных других способов, известных в данной области техники, таких как анализ по Chou-Fasman, Garnier-Robson, Kyte-Doolittle, Eisenberg, Karplus-Schultz или Jameson-Wolf. Профили гидрофильности можно получить по способу Hopp, T.P. and Woods, K.R., 1981, Proc. Natl. Acad. Sci. U.S.A. 78:3824-3828. Профили гидропатичности можно получить по способу Kyte, J. and Doolittle, R.F., 1982, J. Mol. Biol. 157:105-132. Процент (%) доступных остатков можно получить по способу Janin J., 1979, Nature 277:491-492. Профили средней гибкости можно получить по способу Bhaskaran R., Ponnuswamy P.K., 1988, Int. J. Pept. Protein Res. 32:242-255. Профили бета-изгибов можно получить по способу Deleage, G., Roux B., 1987, Protein Engineering 1:289-294. Таким образом, каждая область, идентифицированная любой из этих программ или способов, включена в объем настоящего изобретения. Предпочтительные способы продукции антител к CD37 проиллюстрированы далее с помощью представленных в настоящей заявке примеров. Способы получения белка или полипептида для применения в качестве иммуногена хорошо известны в данной области техники. Также хорошо известны в данной области техники способы получения иммуногенных конъюгатов белка с носителем, таким как БСА (бычий сывороточный альбумин), KLH (keyhole limpet hemocyanin, гемцианин фисуреллы) или белок-носитель. В некоторых случаях применяют прямую конъюгацию, например, с помощью карбодиимидных агентов; в других случаях эффективны сшивающие агенты, такие как производимые Pierce Chemical Co., Рокфорд, штат Иллинойс. Введение иммуногена CD37 часто осуществляют посредством инъекции в течение подходящего периода времени и с применением подходящего адъюванта, как это принято в данной области техники. В рамках графика иммунизации можно отбирать титры антител для определения соответствия продукции антител.
[0112] Моноклональные антитела к CD37 можно получать разными способами, хорошо известными в данной области техники. Например, иммортализованные клеточные линии, которые секретируют желаемое моноклональное антитело, получают с помощью стандартной гибридомной технологии по Kohler и Milstein или с модификациями, которые иммортализуют образующие антитела В-клетки, что является общеизвестным. Проводят скрининг иммортализованных клеточных линий, которые секретируют желаемые антитела, с помощью иммунологического анализа, в котором антиген является CD37-родственным белком. После идентификации подходящей иммортализованной клеточной культуры можно нарастить клетки и получить антитела либо из культур in vitro, либо из асцитной жидкости.
[0113] Также антитела или фрагменты настоящего изобретения в некоторых вариантах осуществления настоящего изобретения можно получить рекомбинантными способами. Области, которые специфично связывают заданные области белка CD37, также можно получить в виде химерных антител или антител с привитым определяющим комплементарность участком (CDR, complementarity-determining region), полученных из разных видов. Также можно получить гуманизированные или человеческие антитела к CD37, которые являются предпочтительными для применения в терапии. Хорошо известны способы гуманизации мышиных или других нечеловеческих антител посредством замены одного или нескольких CDR нечеловеческого антитела соответствующими последовательностями человеческого антитела (см., например, Jones et al., 1986, Nature 321: 522-525; Riechmann et al., 1988, Nature 332: 323-327; Verhoeyen et al., 1988, Science 239: 1534-1536). См. также Carter et al., 1993, Proc. Natl. Acad. Sci. USA 89: 4285 и Sims et al., 1993, J. Immunol. 151: 2296.
[0114] В предпочтительном варианте осуществления настоящего изобретения человеческие моноклональные антитела настоящего изобретения можно получить с помощью мышей VelocImmune, у которых геномные последовательности, несущие локусы эндогенных мышиных вариабельных сегментов тяжелой цепи (сегменты VH, DH и JH) и/или легкой каппа цепи иммуноглобулина (VK и JK), были заменены, полностью или частично, человеческими геномными последовательностями, несущими нереорганизованные локусы вариабельных сегментов зародышевой линии человеческой тяжелой цепи (VH, DH и JH) и/или легкой каппа цепи иммуноглобулина (VK и JK) (Regeneron, Tarrytown, NY). См., например, патенты США № 6586251, 6596541, 7105348, 6528313, 6638768 и 6528314.
[0115] Кроме того, человеческие антитела настоящего изобретения в некоторых вариантах осуществления настоящего изобретения можно получить с помощью мышей HuMAb (Medarex, Inc.), содержащих минилокусы человеческого гена иммуноглобулина, которые кодируют нереорганизованные последовательности человеческой тяжелой цепи (мю и гамма) и легкой каппа цепи иммуноглобулина наряду с целевыми мутациями, инактивирующими локусы эндогенных мю и каппа цепей (см., например, Lonberg, et al. (1994) Nature 368(6474): 856-859).
[0116] В другом варианте осуществления настоящего изобретения полностью человеческие антитела настоящего изобретения можно получить с помощью мыши, несущей последовательности человеческого иммуноглобулина в трансгенах или трансхромосомах, такой как мышь, несущая трансген человеческой тяжелой цепи и трансхромосому человеческой легкой цепи. Такие мыши, называемые в настоящей заявке, «мыши KM mice», описаны в Tomizuka et al. (2000) Proc. Natl. Acad. Sci. USA 97:722-727 и PCT Publication WO 02/43478 to Tomizuka, et al.
[0117] Человеческие моноклональные антитела настоящего изобретения в некоторых вариантах осуществления настоящего изобретения также можно получить с помощью способов фагового дисплея для скрининга библиотек генов человеческого иммуноглобулина. Такие способы фагового дисплея для выделения человеческих антител существуют в данной области техники. См., например, патенты США № 5223409, 5403484, и 5571698 для Ladner et al.; патенты США № 5427908 и 5580717 для Dower et al.; патенты США № 5969108 и 6172197 для McCafferty et al.; и патенты США № 5885793, 6521404, 6544731; 6555313, 6582915 и 6593081 для Griffiths et al.
[0118] Человеческие моноклональные антитела настоящего изобретения в некоторых вариантах осуществления настоящего изобретения также можно получить с помощью мышей SCID, в которых были введены человеческие иммунные клетки так, что при иммунизации можно получить человеческий иммунный ответ. Такие мыши описаны, например, в патентах США № 5476996 и 5698767 для Wilson et al.
[0119] Дополнительно, человеческие антитела настоящего изобретения в некоторых вариантах осуществления настоящего изобретения можно получить с помощью техники с применением трансгенных мышей с инактивированной продукцией антител, созданных с локусами человеческой тяжелой и легкой цепей, называемыми ксеномышами (Xenomouse) (Amgen Fremont, Inc.). Пример описания получения трансгенных мышей, которые образуют человеческие антитела, можно найти в патенте США № 6657103. См. также патенты США № 5569825, 5625126, 5633425, 5661016 и 5545806; и Mendez, et. al. Nature Genetics, 15: 146-156 (1998); Kellerman, S.A. & Green, L.L., Curr. Opin. Biotechnol 13, 593-597 (2002).
[0120] В предпочтительном варианте осуществления настоящего изобретения моноклональные антитела к CD37 настоящего изобретения содержат вариабельные области тяжелой и легкой цепей антитела, обозначаемые HvCD37-6b15.1.1, продуцируемые клетками яичника китайского хомяка (CHO, Chinese Hamster Ovary), размещенными в Американской коллекции клеточных культур (ATCC, American Type Culture Collection) с учетным номером PTA-120464 (см. Фигуру 3), или вариабельные области тяжелой и легкой цепей, содержащие аминокислотные последовательности, гомологичные аминокислотным последовательностям вариабельных областей тяжелой и легкой цепей HvCD37-6b15.1.1, и при этом антитела сохраняют желаемые функциональные свойства моноклональных антител к CD37 настоящего изобретения. Вариабельная область тяжелой цепи HvCD37-6b15.1.1 состоит их аминокислотной последовательности в пределах от 1 остатка (Q) до 115 остатка (S) последовательности SEQ ID NO: 7, а вариабельная область легкой цепи HvCD37-6b15.1.1 состоит их аминокислотной последовательности в пределах от 1 остатка до 106 остатка (R) последовательности SEQ ID NO: 8. В одном варианте осуществления настоящего изобретения CDR1-3 (по Kabat) вариабельной области тяжелой цепи HvCD37-6b15.1.1 состоят, соответственно, из аминокислотной последовательностив пределах от 31 до 35, от 50 до 65 и от 98 до 104 SEQ ID NO: 7, соответственно, а CDR1-3 вариабельной области легкой цепи HvCD37-6b15.1.1 состоят из аминокислотной последовательности пределах от 24 до 34, от 50 до 56 и от 89 до 95 SEQ ID NO: 8 (См. Фигуру 4 и Таблицу V). В некоторых вариантах осуществления настоящего изобретения CDR-H1 содержит или состоит из PYYWS; CDR-H2 содержит или состоит из EINHSGSTNYNPSLKS; CDR-H3 содержит или состоит из RAGDFDY, CDR-L1 содержит или состоит из RASQSISSWLA, CDR-L2 содержит или состоит из KASSLES и/или CDR-L3 содержит или состоит из QQYNSYI. В качестве константной области антитела настоящего изобретения можно выбрать константную область любого подкласса. В одном варианте осуществления настоящего изобретения можно применять константную область человеческого IgG2 в качестве константной области тяжелой цепи и константную область человеческого Ig каппа в качестве константной области легкой цепи.
[0121] Например, в некоторых вариантах осуществления настоящее изобретения представляет выделенное моноклональное антитело или его антигенсвязывающую часть, содержащую вариабельную область тяжелой цепи и вариабельную область легкой цепи, где:
(a) вариабельная область тяжелой цепи содержит аминокислотную последовательность, которая по меньшей мере на 80% гомологична аминокислотной последовательности вариабельной области тяжелой цепи, описанной на Фигуре 3; и
(b) вариабельная область легкой цепи содержит аминокислотную последовательность, которая по меньшей мере на 80% гомологична аминокислотной последовательности вариабельной области легкой цепи, представленной на Фигуре 3.
[0122] В других вариантах осуществления настоящего изобретения аминокислотные последовательности VH и/или аминокислотные последовательности VL могут быть на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% гомологичны последовательностям VH и VL, описанным на Фигуре 3.
[0123] В другом варианте осуществления настоящее изобретения представляет выделенное моноклональное антитело или его антигенсвязывающую часть, содержащее вариабельную область гуманизированной тяжелой цепи и вариабельную область гуманизированной легкой цепи, где:
(a) вариабельная область тяжелой цепи содержит определяющие комплементарность участки (CDR, complementarity determining region), имеющие аминокислотные последовательности CDR вариабельной области тяжелой цепи, описанные на Фигуре 3;
(b) вариабельная область легкой цепи содержит CDR, имеющие аминокислотные последовательности CDR вариабельной области легкой цепи, описанные на Фигуре 3.
[0124] В некоторых вариантах осуществления настоящего изобретения антитело имеет CDR-H1, который содержит или состоит из PYYWS; CDR-H2, который содержит или состоит из EINHSGSTNYNPSLKS; CDR-H3, который содержит или состоит из RAGDFDY, CDR-L1, который содержит или состоит из RASQSISSWLA, CDR-L2, который содержит или состоит из KASSLES, и/или CDR-L3, который содержит или состоит из QQYNSYI.
[0125] Сконструированные антитела настоящего изобретения в некоторых вариантах осуществления настоящего изобретения включают антитела, с модифицированными каркасными остатками внутри VH и/или VL (например, для улучшения свойств антитела). Как правило, такие модификации каркаса вносят для снижения иммуногенности антитела. Например, одним из подходов является «мутация к первоначальному виду» одного или нескольких каркасных остатков до соответствующей последовательности зародышевой линии. В частности, антитело, в котором произошла соматическая мутация, может содержать каркасные остатки, отличающиеся о последовательности зародышевой линии, из которой было получено антитело. Такие остатки можно идентифицировать, сравнивая последовательности каркасных областей антитела с последовательностями зародышевой линии, из которой было получено антитело. Для возврата последовательностей каркасного участка к конфигурации зародышевой линии соматические мутации можно «мутировать к первоначальному виду» последовательности зародышевой линии, например, посредством сайт-направленного мутагенеза или ПЦР-опосредованного мутагенеза (например, «мутировать к первоначальному виду» лейцин до метионина). Такие «мутированные к первоначальному виду» антитела также предназначены для включения в объем настоящего изобретения.
[0126] Другой тип каркасных модификаций включает мутирование одного или нескольких остатков внутри каркасного участка или даже внутри одного или нескольких участков CDR для удаления Т-клеточных эпитопов с целью снижения потенциальной иммуногенности антитела. Данный подход также называют «деиммунизацией» и описывают более подробно в публикации патента США № 2003/0153043 Carr et al.
[0127] Дополнительно или альтернативно, модификациям, внесенным внутрь каркасных участков или участков CDR антитела настоящего изобретения в некоторых вариантах осуществления настоящего изобретения можно сконструировать так, чтобы они включали модификации внутри Fc-области, обычно для изменения одного или нескольких функциональных свойств антитела, таких как период полувыведения из крови, фиксация комплемента, связывание Fc-рецептора и/или антиген-зависимая клеточная цитотоксичность. Более того, моноклональное антитело к CD37 настоящего изобретения в некоторых вариантах осуществления настоящего изобретения можно химически модифицировать (например, можно присоединить к антителу одну или несколько химических остатков) или модифицировать для изменения гликозилирования, опять же для того, чтобы изменить одно или несколько функциональных свойств моноклонального антитела. Каждый из таких вариантов осуществления настоящего изобретения описан более подробно ниже.
[0128] В одном варианте осуществления настоящего изобретения область петли CH1 модифицирована так, что число остатков цистеина в области петли изменено, например, увеличено или уменьшено. Данный подход описан подробнее в патенте США № 5677425 Bodmer et al. Число остатков цистеина в области петли CH1 изменено, например, для облегчения сборки легкой и тяжелой цепей или для повышения или понижения стабильности моноклонального антитела к CD37.
[0129] В другом варианте осуществления настоящего изобретения область петли Fc антитела мутирована для снижения биологического времени полужизни моноклонального антитела к CD37. В частности, внесена одна или несколько мутаций в область на границе раздела доменов CH2-CH3 фрагмента Fc-петли так, что связывание белка А Staphylococcyl (SpA, Staphylococcyl protein A) нарушено по сравнению со связыванием SpA доменом Fc-петли. Данный подход описан подробнее в патенте США № 6165745 Ward et al.
[0130] В другом варианте осуществления настоящего изобретения моноклональное антитело к CD37 модифицировано для повышения биологического времени полужизни. Возможно применение разных подходов. Например, мутации можно внести, как описано в патенте США № 6277375 Ward. Альтернативно, для повышения биологического времени полужизни антитело можно изменить внутри области CH1 или CL, включив эпитоп связывания рецептора реутилизации, взятый из двух петель домена CH2 Fc-области IgG, как описано в патентах США № 5869046 и 6121022 Presta et al.
[0131] В других вариантах осуществления настоящего изобретения Fc-область изменена посредством замены по меньшей мере одного аминокислотного остатка другим аминокислотным остатком для изменения эффекторной функции (функций) моноклонального антитела к CD37. Например, одну или несколько аминокислот, выбираемых из конкретных аминокислотных остатков, можно заменени другим аминокислотным остатком так, чтобы антитело обладало измененной аффинностью по отношению к эффекторному лиганду, но сохраняло антигенсвязывающую способность исходного антитела. Эффекторный лиганд, аффинность к которому изменена, может быть, например, Fc-рецептором или компонентом комплемента C1. Данный подход описан подробнее в патентах США № 5624821 и 5648260, автор каждого из которых Winter et al.
[0132] Реактивность антител к CD37 по отношению к CD37-родственному белку можно определить рядом хорошо известных способов, включая Вестен-блот, иммунопреципитацию, твердофазный иммуноферментный анализ (ELISA, enzyme linked immunosorbent assay) и сортировку клеток с активированной флуоресценцией (FACS, fluorescence activated cell sorting), применяя, где уместно, CD37-родственные белки, CD37-экспрессирующие клетки или их экстракты. Антитело к CD37 или его фрагмент можно пометить детектируемой меткой или конъюгировать со второй молекулой. Подходящие детектируемые метки включают, но не ограничиваются, радиоизотопом, флуоресцентным соединением, биолюминесцентным соединением, хемилюминесцентным соединением, хелатором металлов или ферментом. Далее, биспецифичные антитела, специфичные к двум или более эпитопам CD37 получают с помощью способов, общеизвестных в данной области техники. Гомодимерные антитела также можно получить с помощью техник перекрестной сшивки, известных в данной области техники (например, Wolff et al., Cancer Res. 53: 2560-2565).
[0133] В другом предпочтительном варианте осуществления настоящего изобретения моноклональное антитело к CD37 настоящего изобретения является антителом, содержащим тяжелую и легкую цепи антитела, обозначаемым HvCD37-6b15.1.1. Тяжелая цепь HvCD37-6b15.1.1 состоит из аминокислотной последовательности в пределах от 1 остатка (Q) до 441 остатка (K) SEQ ID NO: 7, а легкая цепь HvCD37-6b15.1.1 состоит их аминокислотной последовательности в пределах от 1 остатка (D) до 212 остатка (C) последовательности SEQ ID NO: 8. Их последовательности описаны на Фигуре 2 и Фигуре 3. В предпочтительном варианте осуществления настоящего изобретения HvCD37-6b15.1.1 конъюгировано с цитотоксическим агентом.
[0134] В другом предпочтительном варианте осуществления настоящего изобретения моноклональное антитело к CD37 настоящего изобретения получают способом получения антитела или антигенсвязывающего фрагмента, включающим культивирование клетки-хозяина для обеспечения экспрессии антитела или антигенсвязывающего фрагмента, где клетку-хозяина выбирают из группы, состоящей из следующих пунктов с (a) по (d):
(a) клетка-хозяин, трансформированная экспрессионным вектором, содержащим полинуклеотид, содержащий последовательность оснований, кодирующую вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности в пределах от 1 Q до 115 S SEQ ID NO: 7, и полинуклеотид, содержащий последовательность оснований, кодирующую вариабельную область легкой цепи, состоящую из аминокислотной последовательности в пределах от 1 D до 106 R SEQ ID NO: 8;
(b) клетка-хозяин, трансформированная экспрессионным вектором, содержащим полинуклеотид, содержащий последовательность оснований, кодирующую вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности в пределах от 1 Q до 115 S SEQ ID NO: 7, и экспрессионным вектором, содержащим полинуклеотид, содержащий последовательность оснований, кодирующую вариабельную область легкой цепи, состоящую из аминокислотной последовательности в пределах от 1 D до 106 R SEQ ID NO: 8;
(c) клетка-хозяин, трансформированная экспрессионным вектором, содержащим полинуклеотид, содержащий последовательность оснований, кодирующую вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности в пределах от 1 Q до 115 S SEQ ID NO: 7; и
(d) клетка-хозяин, трансформированная экспрессионным вектором, содержащим полинуклеотид, содержащий последовательность оснований, кодирующую вариабельную область легкой цепи, состоящую из аминокислотной последовательности в пределах от 1 D до 106 R SEQ ID NO: 8.
[0135] В другом предпочтительном варианте осуществления настоящего изобретения моноклональное антитело к CD37 настоящего изобретения получают способом получения антитела, включающим культивирование клетки-хозяина для обеспечения экспрессии антитела, где клетку-хозяина выбирают из группы, состоящей из следующих пунктов с (a) по (d):
(a) клетка-хозяин, трансформированная экспрессионным вектором, содержащим полинуклеотид, содержащий последовательность оснований, кодирующую тяжелую цепь, состоящую из аминокислотной последовательности в пределах от 1 Q до 441 K SEQ ID NO: 7, и полинуклеотид, содержащий последовательность оснований, кодирующую легкую цепь, состоящую из аминокислотной последовательности в пределах от 1 D до 212 C SEQ ID NO: 8;
(b) клетка-хозяин, трансформированная экспрессионным вектором, содержащим полинуклеотид, содержащий последовательность оснований, кодирующую тяжелую цепь, состоящую из аминокислотной последовательности в пределах от 1 Q до 441 K SEQ ID NO: 7, и экспрессионным вектором, содержащим полинуклеотид, содержащий последовательность оснований, кодирующую легкую цепь, состоящую из аминокислотной последовательности в пределах от 1 D до 212 C SEQ ID NO: 8;
(c) клетка-хозяин, трансформированная экспрессионным вектором, содержащим полинуклеотид, содержащий последовательность оснований, кодирующую тяжелую цепь, состоящую из аминокислотной последовательности в пределах от 1 Q до 441 K SEQ ID NO: 7; и
(d) клетка-хозяин, трансформированная экспрессионным вектором, содержащим полинуклеотид, содержащий последовательность оснований, кодирующую легкую цепь, состоящую из аминокислотной последовательности в пределах от 1 D до 212 C SEQ ID NO: 8.
[0136] Клетки яичника китайского хомяка (CHO, Chinese Hamster Ovary), образующие антитело, обозначаемое как HvCD37-6b15.1.1, отправили (почтой Federal Express) в Американскую коллекцию клеточных культур (ATCC, American Type Culture Collection), P.O. Box 1549, Manassas, VA 20108 8 июля 2013 г., и им присвоили учетный номер PTA-120464.
[0137] Альтернативно или дополнительно, в другом варианте осуществления настоящего изобретения моноклональные антитела, которые связывают CD37, в данном случае моноклональное антитело HvCD37-6b15.1.1, можно подвергнуть посттрансляционным модификациям, известным в данной области техники. Примеры посттрансляционных модификаций включают, но не ограничиваются химическими модификациями, такими как дисульфидные связи, олигосахариды, образование N-концевого пироглутамата, процессинг C-концевого лизина, дезамидирование, изомеризация, окисление, гликирование, расщепление пептидной связи, невосстановительное образование перекрестных сшивок, укорачивание и другие известные в данной области техники модификации. См. Liu, et. al., Heterogeneity of Monoclonal Antibodies, J. Pharma. Sci. vol. 97, no. 7, pp. 2426-2447 (July 2008). Другие типы модификаций включают нековалентное взаимодействие, конформационную гетерогенность и аггрегацию. Там же.
[0138] В следующем варианте осуществления настоящего изобретения в моноклональном антителе HvCD37-6b15.1.1 происходит циклизация N-концевого глутамина тяжелой цепи в положении 1 до пироглутамата. Специалист в данной области техники поймет и согласится с тем, что такая циклизация считается возникшей спонтанно. См. Dick, et. al., Determination of the Origin of the N-Terminal Pyro-Glutamtate Variation in Monoclonal Antibodies Using Model Peptides, Biotechnology and Bioengineering, vol. 97, no. 3, pp 544-553 (June 15, 2007).
[0139] Дополнительно или альтернативно, аминокислоты моноклонального антитела HvCD37-6b15.1.1 можно подвергнуть посттрансляционным модификациям, включая, но не ограничиваясь дезамидированием, изомеризацией, гликированием и /или окислением. Полипептиды настоящего изобретения или их фрагменты можно подвергнуть дополнительным посттрансляционным модификациям, включая гликозилирование, например, специалистам в данной области техники хорошо известны участки N-сцепленного или O- сцепленного гликозилирования. Как описано выше, изменения можно вносить в аминокислотную последовательность полипептида или в условия процесса (такие как изменения условий культивирования, очистки и/или хранения), чтобы предотвратить или минимизировать такие изменения или чтобы усилить их в тех обстоятельствах, когда такие модификации дают преимущества. Более того, такие препараты могут содержать полипептиды с варьирующим уровнем нескольких типов связанных с производством модификаций, например, у полипептида могут быть удалены некоторые, большинство или практически все С-концевые лизины и/или некоторые, большинство или практически все N-концевые аминокислоты могут быть превращены в пироглутаминовую кислоту (например, полипептиды, показанные на Фигуре 2 или на Фигуре 3 или в консенсусных последовательностях, или антигенсвязывающие фрагменты). Условия производственного процесса, такие как варьирующий состав буфера и температура, оказывают значительные эффекты на расространенность таких модификаций.
[0140] В следующем варианте осуществления настоящего изобретения у моноклонального антитела HvCD37-6b15.1.1 удален С-концевой лизин в положении 445 тяжелой цепи.
[0141] В следующем варианте осуществления настоящего изобретения моноклональное антитело HvCD37-6b15.1.1 дополнительно гликозилировано по аспарагину в положении 295 тяжелой цепи, включая, но не ограничиваясь G0 (асиало-, агалакто, афукозилированный биантенный N-гликан комплексного типа; G0F (асиало-, агалакто, корофукозилированный биантенный N-гликан комплексного типа); манноза-5 (N-связанная олигоманноза-5); G1F (асиало-, моногалакто, корофукозилированный биантенный N-гликан комплексного типа); G2 (асиало-, бигалакто, афукозилированный биантенный N-гликан комплексного типа); G2F (асиало-, бигалакто, корофукозилированный биантенный N-гликан комплексного типа); A1 (моносиалированный, биантенный N-связанный олигосахарид, N-ацетилнейраминовая кислота); и/или A2 (дисиалированный, биантенный N-связанный олигосахарид N-ацетилнейраминовая кислота).
[0142] Дополнительно или альтернативно, в другом варианте осуществления настоящего изобретения моноклональное антитело HvCD37-6b15.1.1 дополнительно гликировано по одному или нескольким остаткам серина легкой цепи. Как правило, гликирование происходит в результате неферментативной реакции между восстанавливающими сахарами и N-концевым первичным амином или аминогруппой боковых цепей лизина. Специалист в данной области техники поймет и согласится с тем, что гликирование может маскировать положительный заряд N-концевой первичной аминокислотной группы или боковой цепи остатков лизина, что сделает антитело более кислым.
[0143] Аминокислотную последовательность полипептидов настоящего изобретения можно проверить любыми способами, известными в данной области техники (например, масс-спектрометрией), и она может быть идентична последовательностям, раскрытым в настоящей заявке (см. Фигуру 2 и Фигуру 3), или может отличаться от данных последовательностей одним или несколькими аминокислотными остатками, что является результатом внесения посттрансляционных модификаций. В качестве неограничивающего примера, у всех или у части в основном гомогенных полипептидов может быть удалена С-концевая аминокислота либо с легкой цепи, либо с тяжелой цепи посредством протеолитического процессинга или другого процессинга, происходящего во время культивирования. Аналогично могут отсутствовать N-концевые аминокислоты, например, могут отсутствовать одна (1), две (2), три (3), четыре (4) или пять (5) N-концевых аминокислот.
[0144] В другом варианте осуществления настоящего изобретения вариабельную область тяжелой цепи моноклонального антитела HvCD37-6b15.1.1 выбирают из группы, состоящей из аминокислотной последовательности в пределах от остатка 1 (Q) до остатка 115 (S) SEQ ID NO: 7, и аминокислотной последовательности от остатка 1 (Q) до остатка 115 (S) of SEQ ID NO: 7, где N-концевой остаток 1 (Q) превращен в пироглутаминовую кислоту.
[0145] В другом варианте осуществления настоящего изобретения тяжелую цепь моноклонального антитела HvCD37-6b15.1.1 выбирают из группы, состоящей из аминокислотной последовательности в пределах от остатка 1 (Q) до остатка 441 (K) SEQ ID NO: 7, аминокислотной последовательности в пределах от остатка 1 (Q) до остатка 441 (K) SEQ ID NO: 7, где N-концевой остаток 1 (Q) превращен в пироглутаминовую кислоту, аминокислотной последовательности в пределах от остатка 1 (Q) до остатка 441 (K) SEQ ID NO: 7, где C-концевой остаток 441 (K) удален, и аминокислотной последовательности в пределах от остатка 1 (Q) до остатка 441 (K) SEQ ID NO: 7, где N-концевой остаток 1 (Q) превращен в пироглутаминовую кислоту и C-концевой остаток 441 (K) удален.
[0146] В другом варианте осуществления настоящего изобретения моноклональное антитело HvCD37-6b15.1.1 или его антигенсвязывающий фрагмент являются образованной рекомбинантно смесью белков, полученной при экспрессии в клетке-хозяине, где вариабельную область тяжелой цепи антитела или его антигенсвязывающего фрагмента выбирают из группы, состоящей из аминокислотной последовательности в пределах от остатка 1 (Q) до остатка 115 (S) SEQ ID NO: 7, и аминокислотной последовательности от остатка 1 (Q) до остатка 115 (S) of SEQ ID NO: 7, где N-концевой остаток 1 (Q) превращен в пироглутаминовую кислоту.
[0147] В другом варианте осуществления настоящего изобретения моноклональное антитело HvCD37-6b15.1.1 содержит тяжелую цепь, состоящую из аминокислотной последовательности в пределах от 1 Q до 440 G SEQ ID NO: 7, где 1ый Q модифицирован до пироглутамата, и легкую цепь, состоящую из аминокислотной последовательности в пределах от 1 D до 212 C SEQ ID NO: 8.
III.) Общая информация о конъюгатах антитела с лекарственным средством
[0148] В другом аспекте настоящее изобретение представляет конъюгаты антитела с лекарственным средством, содержащие антитело, конъюгированное с цитотоксическим агентом, таким как химиотерапевтический агент, лекарственное средство, ингибирующий рост агент, токсин (например, ферментативно активный токсин бактериального, грибкового или животного происхождения или его фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат). В другом аспекте настоящее изобретение далее представляет способы применения конъюгатов антитела с лекарственным средством. В одном аспекте конъюгат антитела с лекарственным средством содержит любое из указанных выше моноклональных антител к CD37, ковалентно связанное с цитотоксическим агентом или с детектируемым агентом.
[0149] Применение конъюгатов антитела с лекарственным средством для местной доставки цитотоксических или цитостатических агентов, т.е. лекарственных средств для уничтожения или ингибирования опухолевых клеток в лечении рака (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26:151-172; патент США 4975278) обеспечивает целевую доставку остатков лекарственного средства в опухоль и внутриклеточное накопление там, когда системное введение данных неконъюгированных лекарственных агентов может вызвать неприемлемый уровень токсичности в отношении нормальных клеток, а также опухолевых клеток, которые необходимо уничтожить (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," in Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al. (ed.s), pp. 475-506). Таким образом, стремятся достичь максимальной эффективности при минимальной токсичности. Было показано, что и поликлональные антитела, и моноклональные антитела применимы в данных стратегиях (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лекарственные средства, применимые в данных способах, включают дауномицин, доксорубицин, метотрексат и виндесин (Rowland et al., (1986) см. выше). Токсины, применяемые в конъюгатах антитела с токсином, включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al (2000) Jour. of the Nat. Cancer Inst. 92(19):1573-1581; Mandler et al (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al (2002) Bioconjugate Chem. 13:786-791), майтанзиноиды (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихеамицин (Lode et al (1998) Cancer Res. 58:2928; Hinman et al (1993) Cancer Res. 53:3336-3342). Токсины могут проявлять свое цитотоксическое и цитостатическое действие посредством механизмов, включающих связывание тубулина, связывание ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства могут быть неактивными или менее активными при конъюгировании с крупными антителами или лигандами белковых рецепторов.
[0150] Примерами конъюгатов антитела с лекарственным средством являются ZEVALIN™ (ибритумомаб тиуксетан, Biogen/Idec), который является конъюгатом антитела с радиоизотопом, состоящий из IgG1 каппа мышиного моноклонального антитела против антигена CD20, обнаруживаемого на поверхности нормальных и опухолевых В-лимфоцитов, и радиоизотопа111In или90Y, связанного линкерным хелатором тиомчевины (Wiseman et al (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al (2002) Blood 99(12):4336-42; Witzig et al (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al (2002) J. Clin. Oncol. 20(15):3262-69).
[0151] Также MYLOTARG™ (гемтузумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитела с лекарственным средством, состоящий из антитела huCD33, связанного с калихеамицином, был одобрен в 2000 г. Для лечения острой миелоидной лейкемии посредством инъекции (Drugs of the Future (2000) 25(7):686; патенты США № 4970198, 5079233, 5585089, 5606040, 5693762, 5739116, 5767285, 5773001).
[0152] Дополнительно, CD37-связывающие агенты тестируют в качестве потенциальных терапевтических средств против В-клеточного рака. Emergent Biosolutions (прежнее название Trubion Pharmaceuticals) разработал CD37- связывающие агенты SMIP-016 и TRU-016 (Zhao et al., 2007, Blood, 110.2569-2577). SMIP-016 является одноцепочечным полипептидом, который включает вариабельные области из гибридомы и сконструированные человеческие константные области. TRU-016 является гуманизированной версией белка анти-CD37 SMIP. См., например, опубликованную заявку на патент США № 2007/0059306. TRU-016 проходит клинические испытания для лечения хронической лимфоцитарной лейкемии. Boehringer Ingelheim также раскрыл CD37-связывающий агент в международной публикации патентной заявки № WO 2009/019312. Однако активность CDC (complement-dependent cytotoxicity, комплементзависимая цитотоксичность) не была описана ни для одного из этих связывающих агентов, и не была описана in vitro проапоптотическя активность в отсутствие образующих перекрестные ссылки агентов.
[0153] Также предпринимали попытки применения радиоиммунотерапии (РИТ) с помощью радиомеченого анти-CD37 антитела MB-1 в рамках двух отдельных исследований. Терапевтические дозы131I-MB-1 вводили шести пациентам с рецидивом неходжкинской лимфомы (Press et al. 1989 J Clin Oncol. 7(8):1027-38; Press at el. 1993, N Engl J Med. 329(17):1219-24). Все шесть пациентов достигли полной ремиссии продолжительностью от четырех до тридцати одного месяца. В другом исследовании131I-MB-1 вводили десяти пациентам с рецидивом неходжкинской лимфомы (Kaminski et al. 1992 J Clin Oncol. 10(11):1696-711). Всего у четырех пациентов развился ответ, варьирующий по продолжительности от двух до шести месяцев, хотя, как сообщали, лишь один пациент достиг полной ремиссии. Однако не всех пациентов можно было лечить из-за неблагоприятного биораспределения радиометки, что вызывало вопрос о действии радиации на жизненно важные нецелевые органы. Действительно, в рамках этих исследований наблюдали связанную с РИТ токсичность, включая тяжелую миелосупрессию и кардиопульмонарную токсичность. В то время как эти клинические данные предполагают, что анти-CD37 радиоиммуноконъюгаты могут быть эффективны, введение данной терапия является трудоемким, а рецидив у пациентов, прошедших РИТ, нельзя лечить с помощью РИТ из-за рисков, связанных с высокими дозами радиации.
[0154] Кроме того, кантузумаб мертансин (Immunogen, Inc.), конъюгат антитела с лекарственным средством, состоящий из антитела huC242, связанного дисульфидным линкером SPP с остатком майтанзиноидного лекарственного средства, DM1, переходит в фазу II исследований лечения видов рака с экспрессией CanAg, таких как рак толстой кишки, поджелудочной железы и другие.
[0155] Дополнительно, MLN-2704 (Millennium Pharm., BZL Biologics, Immunogen Inc.), конъюгат антитела с лекарственным средством, состоящий из моноклонального антитела к специфичному для простаты мембранному антигену (PSMA, prostate specific membrane antigen), связанного с остатком майтанзиноидного лекарственного средства, DM1, находится на стадии разработки для возможного лечения рака простаты.
[0156] Наконец, ауристатиновые пептиды, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, конъюгировали с химерными моноклональными антителами cBR96 (специфичными в отношении антигена Lewis Y при карциноме) и cAC10 (специфичными в отношении CD30 при раке крови) (Doronina et al (2003) Nature Biotechnology 21(7):778-784).
[0157] Моноклональное антитело к CD30, конъюгированное с MMAE, сейчас коммерчески доступно как АДЦЕТРИС (Seattle Genetics, Ботелл, штат Вашингтон). АДЦЕТРИС (брентуксимаб ведотин) является конъюгатом антитела к CD-30 с лекарственным средством, состоящим из трех компонентов: 1) химерного антитела IgG1, обозначаемого как AC10, специфичного к человеческому CD30, 2) разрушающего микротрубочки агента MMAE и 3) разрезаемого протеазой линкера, который ковалентно соединяет MMAE с caC10. См. инструкцию по применению АДЦЕТРИСа.
[0158] Далее, в настоящей заявке описаны химиотерапевтические агенты, применяемые для образования конъюгатов антитела с лекарственным средством. Ферментативно активные токсины и их фрагменты, которые можно применять, включают А-цепь дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модеццина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из момордики харантской, курцин, кротин, ингибитор из мыльнянки лекарственной, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, WO 93/21232 опубликованную 28 октября 1993 г. Ряд радионуклидов доступен для образования радиоконъюгированных антител. Примеры включают212Bi,131I,131In,90Y и186Re. Конъюгаты антитела и цитотоксического агента получают с помощью ряда бифункциональных связывающих белок агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP, N-succinimidyl-3-(2-pyridyldithiol) propionate), иминотиолан (IT, iminothiolane), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидила суберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис (p-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(p-диазониумбензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин можно получить, как описано в Vitetta et al (1987) Science, 238:1098. Меченая углеродом14 1-изотиоцианатобензил-3-метилдиэтилендиэтилентриаминпентауксусная кислота (MX-DTPA, methyldiethylene triaminepentaacetic acid) является примером хелатирующего агента для конъюгации радионуклеида с антителом (WO94/11026).
[0159] Также настоящее изобретение предполагает конъюгаты антитела с одним или несколькими низкомолекулярными токсинами, такими как калихеамицин, майтанзиноиды, доластатины, ауристатины, трихотецен и CC1065, и производные этих токсинов, обладающие активностью токсинов.
III(A). Майтанзиноиды
[0160] Майтанзиновые соединения, подходящие для применения в качестве остатков майтанзиноидного лекарственного средства, хорошо известны в данной области техники, и их можно выделить из природных источников в соответствии с известными способами, получить с помощью генно-инженерных техник (см. Yu et al (2002) PNAS 99:7968-7973) или из майтанзинола или майтанзиноловых аналогов, полученных синтетически в соответствии с известными способами.
[0161] Примеры остатков майтанзиноидного лекарственного средства включают группы с модифицированным ароматическим кольцом, такие как: C-19-дехлоро (US 4256746) (полученный восстановлением анзамитоцина P2 алюмогидридом лития); C-20-гидрокси (ли C-20-деметил) ±C-19-дехлоро (патенты США № 4361650 и 4307016) (полученный деметилированием с помощью Streptomyces или Actinomyces или отщеплением хлора с помощью алюмогидрида лития); и C-20-деметокси, C-20-ацилокси (-OCOR), ±дехлоро (патент США № 4294757) (полученный ацилированием с помощью ацилхлоридов) и группы с модификациями в других положениях.
[0162] Примеры остатков майтанзиноидного лекарственного средства также включают группы, несущие модификации, такие как: C-9-SH (US 4424219) (полученные реакцией майтанзинола с H2S или P2S5); C-14-алкоксиметил(деметокси/CH2OR)(US 4331598); C-14-гидроксиметил или ацилоксиметил (CH2OH или CH2OAc) (US 4450254) (полученные из нокардии); C-15-гидрокси/ацилокси (US 4364866) (полученные конверсией майтанзинола стрептомицетами); C-15-метокси (патенты США № 4313946 и 4315929) (выделенные из Trewia nudlflora); C-18-N-деметил (патенты США № 4362663 и 4322348) (полученные деметилированием майтанзинола стрептомицетами); и 4,5-дезокси (US 4371533) (полученные восстановлением майтанзинола трихлоридом титана/алюмогидридом лития).
[0163] Конъюгаты антитела с лекарственным средством, способы их получения и их терапевтическое применение раскрыты, например, в патентах США № 5208020; 5416064; 6441163 и в Европейском патенте EP 0 425 235 B1, раскрытие которых полностью включено в настоящую заявку посредством ссылки. Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описали конъюгаты антитела с лекарственным средством, содержащие майтанзиноид, обозначаемый DM1, связанный с моноклональным антителом к C242, направленные против рака толстой кишки. Было обнаружено, что конъюгат является высокотоксичным в отношении культивируемых клеток рака толстой кишки и демонстрирует противоопухолевую активность в исследования роста опухоли in vivo. Chari et al., Cancer Research 52:127-131 (1992) описывают конъюгаты антитела с лекарственным средством, в которых майтанзиноид конъюгировали дисульфидным линкером с мышиным антителом A7, связывающим антиген клеточных линий рака толстой кишки человека, или с другим мышиным моноклональным антителом TA.1, которое связывает онкоген HER-2/neu. Цитотоксичность конъюгата TA.1-майтанзиноид исследовали in vitro на клеточной линии рака молочной железы человека SK-BR-3, которая экспрессирует 3×105 HER-2 поверхностных антигена на клетку. Цитотоксичность конъюгата лекарственного средства достигла уровня, схожего со свободным майтанзиноидным лекарственным средством, за счет повышения числа майтанзиноидных молекул на молекулу антитела. Конъюгат A7-майтанзиноид демонстрировал низкую системную токсичность в мышах.
III(B). Ауристатины и доластатины
[0164] В некоторых вариантах осуществления настоящего изобретения конъюгат антитела с лекарственным средством содержит антитело настоящего изобретения, конъюгированное с доластатинами или пептидными аналогами и производными доластатина, ауристатинами (патенты США № 5635483; 5780588). Было показано, что доластатины и ауристатины влияют на динамику микротрубочек, гидролиз ГТФ и на ядерное и клеточное деление (Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584), и обладают противораковой (US 5663149) и противогрибковой активностью (Pettit et al (1998) Antimicrob. Agents Chemother. 42:2961-2965). Остаток доластатинового или ауристатинового лекарственного средства можно присоединить к антителу через N (амино) конец или C (карбоксильный) конец пептидной остатка лекарственного средства (WO 02/088172).
[0165] Примеры вариантов применения ауристатина включают N-связанные монометиллауристатиновые остатки лекарственного средства DE и DF, раскрытые в “Senter et al, Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, представленном 28 марта 2004 г., и описанные в публикации патентной заявки США № 2005/0238649, включенной в настоящую заявку в полном объеме посредством ссылки.
[0166] Примером вариантов применения ауристатина является MMAE (где волнистая линия указывает на ковалентное присоединение к линкеру (L, linker) конъюгата антитела с лекарственным средством).

[0167] Другим примером вариантов применения ауристатина является MMAF, где волнистая линия указывает на ковалентное присоединение к линкеру (L) конъюгата антитела с лекарственным средством (US 2005/0238649):

[0168] Дополнительные варианты применения, содержащие MMAE или MMAF и разные линкерные компоненты (описанные далее в настоящей заявке) имеют следующие структуры и сокращения (где Ab обозначает антитело (antibody) и p является числом от 1 до приблизительно 8):

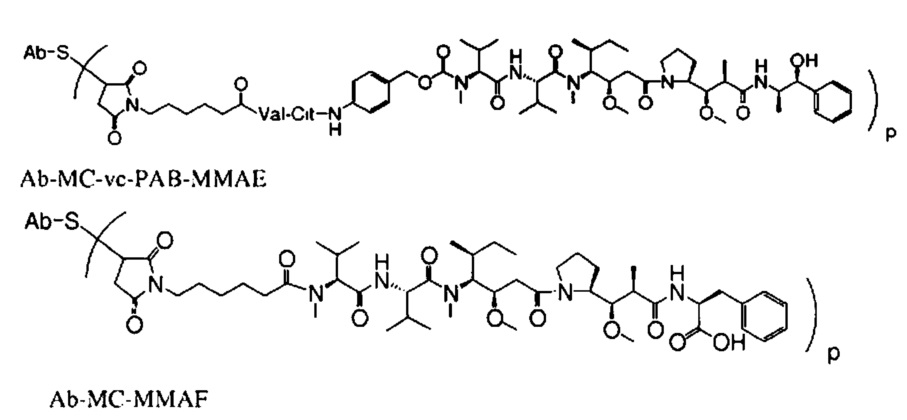
[0169] Обычно остатки лекарственного средства на основе пептидов можно получить посредством образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи можно получить, например, по способу жидкофазного синтеза (см. E. Schröder and K. Lübke, “The Peptides”, volume 1, pp 76-136, 1965, Academic Press), хорошо известного в области пептидной химии. Ауристатиновые/доластатиновые остатки лекарственного средства можно получить в соответствии со способами по: US 5635483; US 5780588; Pettit et al (1989) J. Am. Chem. Soc. 111:5463-5465; Pettit et al (1998) Anti-Cancer Drug Design 13:243-277; Pettit, G.R., et al. Synthesis, 1996, 719-725; Pettit et al (1996) J. Chem. Soc. Perkin Trans. 1 5:859-863; и Doronina (2003) Nat Biotechnol 21(7):778-784.
III(C). Калихеамицин
[0170] В других вариантах осуществления настоящего изобретения конъюгат антитела с лекарственным средством содержит антитело настоящего изобретения, конъюгированное с одной или несколькими молекулами калихеамицина. Калихеамициновые семейства антибиотиков способны вносить двухцепочечные разрывы в ДНК при субпикомолярных концентрациях. Для получения конъюгатов калихеамицинового семейства см. патент США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все American Cyanamid Company). Структурные аналоги калихеамицина, которые можно применять, включают, но не ограничиваются γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и θI1 (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и вышеупомянутые патенты США American Cyanamid). Другим противораковым лекарственным средством, с которым можно конъюгировать антитело, является QFA, которое представляет собой антифолат. И калихеамицин, и QFA работают во внутриклеточных участках и не легко переносятся через мембрану. Таким образом, клеточный захват этих агентов за счет опосредованной антителом интернализации значительно усиливает их цитотоксические эффекты.
III(D). Другие цитотоксические агенты
[0171] Другие противораковые агенты, которые можно конъюгировать с антителами настоящего изобретения, включают в некоторых вариантах осуществления настоящего изобретения BCNU, стрептозоицин, винкристин и 5-фторурацил, семейство агентов под общим названием LL-E33288 комплекс, описанное в патентах США 5053394, 5770710, а также эсперамицины (патент США 5877296).
[0172] Ферментативно активные токсины и их фрагменты, которые можно применять, включают А-цепь дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из момордики харантской, курцин, кротин, ингибитор из мыльнянки лекарственной, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, WO 93/21232 (опубликована 28 октября 1993 г.).
[0173] Настоящее изобретение в некоторых вариантах осуществления далее предусматривает конъюгат антитела с лекарственным средством, образованный между антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза, ДНКаза).
[0174] Для селективного разрушения опухоли антитело может содержать высокорадиоактивный атом. Ряд радиоактивных изотопов доступен для получения радиоконъюгированных антител. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Если конъюгат применяют для детектирования, он может содержать радиоактивный атом для сцинтиграфических исследований, например, tc99m или I123, или спиновую метку для изображений с помощью ядерного магнитного резонанса (ЯМР) (также известного как магнитно-резонансная томография), такую как йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
[0175] Радио- или иные метки можно встраивать в конъюгат известными способами. Например, пептид можно биосинтезировать или синтезировать с помощью химического синтеза аминокислот, применяя предшественники аминокислот, включая, например фтор-19 на месте водорода. Такие метки, как Tc99m или I123, Re186, Re188 и In111 можно присоединить через цистеиновый остаток в пептиде. Иттрий-90 можно присоединить через остаток лизина. Способ йодирования (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80: 49-57) можно применять для включения йода-123. "Monoclonal Antibodies in Immunoscintigraphy" (Chatal, CRC Press 1989) описывает подробно другие способы.
IV.) Соединения конъюгатов антитела и лекарственного средства, связывающие CD37
[0176] Настоящее изобретение представляет, в числе прочего, соединения конъюгатов антитела и лекарственного средства для целевой доставки лекарственных средств. Исследователи открыли, что соединения конъюгатов антитела и лекарственного средства обладают потенциальной цитотоксической и/или цитостатической активностью в отношении клеток, экспрессирующих CD37. Соединения конъюгатов антитела и лекарственного средства содержат компонент «антитело», ковалентно связанный по меньшей мере с одним компонентом «лекарственноео средство». Компоненты «лекарственное средство» могут быть ковалентно соединены напрямую или через линкерный компонент (-LU-, linker unit).
[0177] В некоторых вариантах осуществления настоящего изобретения соединение конъюгата антитела и лекарственного средства имеет следующую формулу:
L-(LU-D)p(I)
или его фармацевтически приемлемой соли или сольвата, где:
L является компонентом «антитело», например, моноклональным антителом к CD37 настоящего изобретения, и
(LU-D) является остатком «линкерный компонент-лекарственное средство», где:
LU- является линкерным компонентом, и
-D является компонентом «лекарственное средство», обладающим цитостатической или цитотоксической активностью в отношении клетки-мишени; и
p является целым числом от 1 до 20.
[0178] В некоторых вариантах осуществления настоящего изобретения p варьирует от 1 до 10, от 1 до 9, от 1 до 8, от 1 до 7, от 1 до 6, от 1 до 5, от 1 до 4, от 1 до 3 или от 1 до 2. В некоторых вариантах осуществления настоящего изобретения p варьирует от 2 до 10, от 2 до 9, от 2 до 8, от 2 до 7, от 2 до 6, от 2 до 5, от 2 до 4 или от 2 до 3. В других вариантах осуществления настоящего изобретения p является 1, 2, 3, 4, 5 или 6. В некоторых вариантах осуществления настоящего изобретения p является 2 или 4.
[0179] В некоторых вариантах осуществления настоящего изобретения соединение конъюгата антитела и лекарственного средства имеет следующую формулу:
L-(Aa-Ww-Yy-D)p(II)
или его фармацевтически приемлемой соли или сольвата, где:
L является компонентом «антитело», например, моноклональным антителом к CD37, и
-Aa-Ww-Yy- является линкерным компонентом (LU), где:
-A- является удлиняющим компонентом,
a является 0 или 1,
каждое -W- независимо является аминокислотным компонентом,
w является целым числом от 0 до 12,
-Y- является саморасщепляющимся спейсерным компонентом,
y является 0, 1 или 2;
-D является компонентом «лекарственноео средство», обладающим цитостатической или цитотоксической активностью в отношении клетки-мишени; и
p является целым числом от 1 до 20.
[0180] В некоторых вариантах осуществления настоящего изобретения a является 0 или 1, w является 0 или 1 и y является 0, 1 или 2. В некоторых вариантах осуществления настоящего изобретения a является 0 или 1, w является 0 или 1 и y является 0 или 1. В некоторых вариантах осуществления настоящего изобретения p варьирует от 1 до 10, от 1 до 9, от 1 до 8, от 1 до 7, от 1 до 6, от 1 до 5, от 1 до 4, от 1 до 3 или от 1 до 2. В некоторых вариантах осуществления настоящего изобретения p варьирует от 2 до 8, от 2 до 7, от 2 до 6, от 2 до 5, от 2 до 4 или от 2 до 3. В других вариантах осуществления настоящего изобретения p является 1, 2, 3, 4, 5 или 6. В некоторых вариантах осуществления настоящего изобретения p является 2 или 4. В некоторых вариантах осуществления настоящего изобретения, когда w не равно нулю, y является 1 или 2. В некоторых вариантах осуществления настоящего изобретения, когда w составляет от 1 до 12, y является 1 или 2. В некоторых вариантах осуществления настоящего изобретения w составляет от 2 до 12 и y является 1 или 2. В некоторых вариантах осуществления настоящего изобретения a является 1, а w и y равны 0.
[0181] В композициях, содержащих множество антител, нагрузка лекарственного средства представлена p, средним количеством молекул лекарственного средства на антитело. Нагрузка лекарственного средства может варьировать от 1 до 20 лекарственных средств (D) на антитело. Среднее количество лекарственного средства на антитело в препарате реакции конъюгации можно охарактеризовать традиционными способами, такими как масс-спектрометрия, исследование ELISA и ВЭЖХ. Также можно определить количественное распределение конъюгатов антитела с лекарственным средством в единицах p. В некоторых случаях разделение, очистку и характеристику гомогенного конъюгата антитела с лекарственным средством, где p представляет собой определенное значение из других конъюгатов антитела с лекарственным средством с другими нагрузками лекарственного средства, можно проводить такими способами, как обращенно-фазовая ВЭЖХ или электрофорез. В примерах вариантов осуществления настоящего изобретения p составляет от 2 до 8.
[0182] Соединения конъюгатов антитела с лекарственным средством можно получить любой техникой, известной специалистам в данной области техники. Вкратце, соединения конъюгатов антитела с лекарственным средством содержат моноклональное антитело к CD37 в качестве компонента «антитело», лекарственное средство и, при желании, линкер, который соединяет лекарственное средство и связывающий агент. В предпочтительном варианте осуществления настоящего изобретения антитело является моноклональным антителом к CD37, содержащим вариабельные области тяжелой и легкой цепей антитела, обозначаемого HvCD37-6b15.1.1, описанного выше. В более предпочтительном варианте осуществления настоящего изобретения антитело является моноклональным антителом к CD37, содержащим тяжелую и легкую цепи антитела, обозначаемого HvCD37-6b15.1.1, описанного выше. Ряд различных реакций пригоден для ковалентного присоединения лекарственных средств и/или линкеров к связывающим агентам. Такое присоединение часто проводят с помощью реакции аминокислотных остатков связывающего агента, например, молекулы антитела, включая аминогруппы лизина, свободные карбоксильные группы глутаминовой и аспарагиновой кислоты, сульфгидрильные группы цистеина и различные группы ароматических аминокислот. Одним из наиболее распространенных неспецифичных способов ковалентного присоединения является карбодиимидная реакция для связывания карбоксильной (или амино-) группы соединения с амино- (или карбоксильной) группой антитела. Дополнительно бифункциональные агенты, такие как диальдегиды или имидоэфиры, применяют для связывания аминогруппы соединения с аминогруппами молекулы антитела. Также возможно присоединение лекарственных средств к связывающим агентам посредством реакции Шиффовых оснований. Данный способ включает перйодатное окисление лекарственного средства, содержащего гликолевые и гидроксильные группы, с образованием альдегида, который затем реагирует со связывающим агентом. Присоединение происходит через образование основания Шиффа с аминогруппами связывающего агента. Изотиоцианаты также можно применять в качестве образующих связки агентов для ковалентного присоединения лекарственных средств к связывающим агентам. Другие техники известны специалистам в данной области и включены в объем настоящего изобретения.
[0183] В определенных вариантах осуществления настоящего изобретения интермедиат, являющийся предшественником линкера, реагирует с лекарственным средством в подходящих условиях. В определенных вариантах осуществления настоящего изобретения реакционно-способные группы применяют для лекарственных средств и/или интермедиатов. Продукт реакции лекарственного средства и интермедиата или производного лекарственного средства впоследствии реагирует с моноклональным антителом к CD37 в подходящих условиях.
[0184] Каждый конкретный компонент соединений конъюгатов антитела с лекарственным средством описана более подробно в настоящей заявке. Синтез и структура примеров линкерных компонентов, удлиняющих компонентов, аминокислотных компонентов, саморасщепляющегося спейсерного компонента и компонента «лекарственное средство» также описаны в публикации заявок на патент США № 2003/0083263, 2005/0238649 и 2005/0009751, каждая из которых включена в настоящую заявку в полном объеме и с любыми целями посредством ссылки.
V.) Линкерные компоненты
[0185] Обычно соединения конъюгатов антитела с лекарственным средством содержат линкерный компонент между компонентом «лекарственное средство» и компонентом «антитело». В некоторых вариантах осуществления настоящего изобретения линкер расщепляется при внутриклеточных условиях так, что расщепление линкера освобождает лекарственное средство от антитела во внутриклеточной среде. В других вариантах осуществления настоящего изобретения линкерный компонент нерасщепляемый, и лекарственное средство высвобождается, например, при деградации антитела.
[0186] В некоторых вариантах осуществления настоящего изобретения линкер расщепляется расщепляющим агентов, который присутствует во внутриклеточной среде (например, внутри лизосомы или эндосомы, или кавеолы). Линкер может быть, например, пептидильным линкером, который расщепляется внутриклеточным пептидазным или протеазным ферментом, включая, но не ограничиваясь лизосомной или эндосомной протеазой. В некоторых вариантах осуществления настоящего изобретения пептидильный линкер составляет по меньшей мере две аминокислоты в длину или по меньшей мере три аминокислоты в длину. Расщепляющие агенты могут включать катепсины B и D, и плазмин, которые, как известно, гидролизуют дипептидные производные лекарственного средства, приводя к высвобождению активного лекарственного средства внутрь клеток-мишеней (см., например, Dubowchik and Walker, 1999, Pharm. Therapeutics 83:67-123). Наиболее распространенными являются пептидильные линкеры, расщепляющиеся ферментами, которые присутствуют в экспрессирующих CD37 клетках. Например, можно применять пептидильный линкер, расщепляющийся тиол-зависимой протеазой катепсином B, которая экспрессируется в опухолевой ткани на высоком уровне (например, линкер Phe-Leu или Gly-Phe-Leu-Gly (SEQ ID NO: 9)). Другие примеры таких линкеров описаны, например, в патенте США № 6214345, включенном в настоящую заявку в полном объеме и с любыми целями посредством ссылки. В конкретном варианте осуществления настоящего изобретения пептидильный линкер, расщепляющийся внутриклеточными протеазами, является линкером Val-Cit или линкером Phe-Lys (см., например, патент США 6214345, который описывает синтез доксорубицина с линкером val-cit). Одним преимуществом применения внутриклеточного протеолитического высвобождения терапевтического агента является то, что агент, как правило, аттенуирован в конъюгированном состоянии, а стабильность конъюгатов в сыворотке крови обычно высока.
[0187] В других вариантах осуществления настоящего изобретения расщепляемый линкер является pH-чувствительным, т.е. чувствительным к гидролизу при определенных значениях рН. Как правило, pH- чувствительный линкер может гидролизоваться в кислых условиях. Например, можно применять кислотолабильный линкер, который может гидролизоваться в лизосомах (например, гидразон, семикарбазон, тиосемикарбазон, цис-аконита амид, ортоэфир, ацеталь, кеталь или подобные). (См., например, патенты США № 5122368; 5824805; 5622929; Dubowchik and Walker, 1999, Pharm. Therapeutics 83:67-123; Neville et al., 1989, Biol. Chem. 264:14653-14661.) Такие линкеры являются относительно стабильными в условиях нейтрального pH, таких как условия в крови, но нестабильными при значениях ниже pH 5,5 или 5,0, приблизительно равных pH лизосом. В определенных вариантах осуществления настоящего изобретения гидролизуемый линкер является тиоэфирным линкером (таким как, например, тиоэфир, присоединенный к терапевтическому агенту через ацилгидразоновую связь (см., например, патент США № 5622929).
[0188] В других вариантах осуществления настоящего изобретения линкер может расщепляться в восстановительных условиях (например, дисульфидный линкер). Ряд дисульфидных линкеров известен в данной области техники, включая, например, линкеры, которые можно получить с помощью SATA (N-succinimidyl-S-acetylthioacetate, N-сукцинимидил-S-ацетилтиоацетат), SPDP (N-succinimidyl-3-(2-pyridyldithio)propionate, N- сукцинимидил-3-(2-пиридилдитио)пропионат), SPDB (N-succinimidyl-3-(2-pyridyldithio)butyrate, N-сукцинимидил-3-(2-пиридилдитио)бутират) и SMPT (N-succinimidyl-oxycarbonyl-alpha-methyl-alpha-(2-pyridyl-dithio)toluene, N- сукцинимидил-оксикарбонил-альфа-метил- альфа-(2-пиридил-дитио)толуол), SPDB и SMPT. (См., например, Thorpe et al., 1987, Cancer Res. 47:5924-5931; Wawrzynczak et al., In Immunoconjugates: Antibody Conjugates in Radioimagery and TherapyofCancer (C. W. Vogel ed., Oxford U. Press, 1987. См. также патент США № 4880935.)
[0189] В других вариантах осуществления настоящего изобретения линкерный компонент является малонатным линкером (Johnson et al., 1995, Anticancer Res. 15:1387-93), малеимиобензоильным линкером (Lau et al., 1995, Bioorg-Med-Chem. 3(10):1299-1304) или 3’-N-амидным аналогом (Lau et al., 1995, Bioorg-Med-Chem. 3(10):1305-12).
[0190] В других вариантах осуществления настоящего изобретения линкерный компонент является нерасщепляемым, и лекарственное средство высвобождается при деградации антитела (См. публикацию заявки на патент США № 2005/0238649, включенную в настоящую заявку в полном объеме и с любыми целями посредством ссылки).
[0191] Как правило, линкер в основном нечувствителен к внеклеточному окружению. Как применяют в настоящей заявке, «в основном нечувствителен к внеклеточному окружению» в контексте линкера обозначает, что не более приблизительно 20%, обычно не более приблизительно 15%, более обычно не более приблизительно 10%, и еще более обычно не более приблизительно 5%, не более приблизительно 3% или не более приблизительно 1% линкеров в образце соединения конъюгатов антитела с лекарственным средством присутствует во внеклеточной среде (например, в плазме). Можно определить, является ли линкер в основном нечувствительным к внеклеточному окружению, например, с помощью инкубации с плазмой соединения конъюгатов антитела с лекарственным средством в течение заранее определенного периода времени (например, 2, 4, 8, 16 или 24 часов), а затем подсчета количества свободного лекарственного средства, находящегося в плазме крови.
[0192] В других, не являющихся взаимоисключающими вариантах осуществления настоящего изобретения линкер способствует клеточной интернализации. В определенных вариантах осуществления настоящего изобретения линкер способствует клеточной интернализации будучи конъюгированным с терапевтическим агентом (т.е. в окружении остатка линкер-терапевтический агент соединения конъюгатов антитела с лекарственным средством, как описано в настоящей заявке). В других вариантах осуществления настоящего изобретения линкер способствует клеточной интернализации будучи конъюгированным как с ауристатиновым соединением, так и с моноклональным антителом к CD37.
[0193] Ряд примеров линкеров, которые можно применять с настоящими композициями и способами, описан в WO 2004-010957, публикация США № 2006/0074008, публикация США № 20050238649и публикация США № 2006/0024317 (каждая из которых включена в настоящую заявку в полном объеме и с любыми целями посредством ссылки).
[0194] «Линкерный компонент» (LU, linker unit) является бифункциональным соединением, которое можно применять для связывания компонента «лекарственное средство» с компонентом «антитело» для образования соединения конъюгатов антитела с лекарственным средством. В некоторых вариантах осуществления настоящего изобретения линкерный компонент имеет формулу:
-Aa-Ww-Yy-
где:-A- является удлиняющим компонентом,
a является 0 или 1,
каждое -W- независимо является аминокислотным компонентом,
w является целым числом от 0 до 12,
-Y- является саморасщепляющимся спейсерным компонентом и
y является 0, 1 или 2.
[0195] В некоторых вариантах осуществления настоящего изобретения a является 0 или 1, w является 0 или 1 и y является 0, 1 или 2. В некоторых вариантах осуществления настоящего изобретения a является 0 или 1, w является 0 или 1 и y является 0 или 1. В некоторых вариантах осуществления настоящего изобретения, когда w составляет от 1 до 12, y является 1 или 2. В некоторых вариантах осуществления настоящего изобретения w составляет от 2 до 12 и y является 1 или 2. В некоторых вариантах осуществления настоящего изобретения a является 1, а w и y равны 0.
V.) Удлиняющий компонент
[0196] Удлиняющий компонент (A), когда он присутствует, способен связывать компонент «антитело» с аминокислотным компонентом (-W-), когда он присутствует, со спейсерным компонентом (-Y-), когда он присутствует; или с компонентом «лекарственное средство» (-D). Полезные функциональные группы, которые могут присутствовать на моноклональном антителе к CD37 (например, HvCD37-6b15.1.1), либо природные, либо полученные в результате химических манипуляций, включают, но не ограничиваются сульфгидрильной, амино-, гидроксильной и аномерной гидроксильной группой углевода и карбоксилом. Подходящими функциональными группами являются сульфгидрильная и аминогруппы. В одном примере сульфгидрильные группы можно получить восстановлением внутримолекулярных дисулфидных связей моноклонального антитела к CD37. В другом варианте осуществления настоящего изобретения сульфгидрильные группы можно получитьреакцией аминогруппы лизинового остатка моноклонального антитела к CD37 с иминотиоланом (реагентом Трота) или с другими образующими сульфгдрил реагентами. В определенных вариантах осуществления настоящего изобретения моноклональное антитело к CD37 является рекомбинантным антителом, созданным так, чтобы содержать один или несколько лизинов. В определенных вариантах осуществления настоящего изобретения рекомбинантное моноклональное антитело к CD37 создают так, что оно содержит дополнительные сульфгидрильные группы, например, дополнительные цистеины.
[0197] В одном варианте осуществления настоящего изобретения удлиняющий компонент образует связь с атомом серы компонента «антитело». Атом серы может происходить из сульфгидрильной группы антитела. Репрезентативные удлиняющие компоненты данного варианта осуществления настоящего изобретения показаны в квадратных скобках в Формулах IIIa и IIIb, где L-, -W-, -Y-, -D, w и y определены выше и R17 выбирают из -C1-C10 алкилен-, -C1-C10 алкенилен-, -C1-C10 алкинилен-, карбоцикло-, -O-(C1-C8 алкилен)-, O-(C1-C8 алкенилен)-, -O-(C1-C8 алкинилен)-, -арилен-, -C1-C10 алкилен-арилен-, -C2-C10 алкенилен-арилен, -C2-C10 алкинилен-арилен, -арилен -C1-C10 алкилен -, -арилен-C2-C10 алкенилен-, -арилен-C2-C10 алкинилен-, -C1-C10 алкилен-(карбоцикло)-, -C2-C10 алкенилен-(карбоцикло)-, -C2-C10 алкинилен-(карбоцикло)-, -(карбоцикло)-C1-C10 алкилен-, -(карбоцикло)-C2-C10 алкенилен-, -(карбоцикло)-C2-C10 алкинилен, -гетероцикло-, -C1-C10 алкилен-(гетероцикло)-, -C2-C10 алкенилен-(гетероцикло)-, -C2-C10 алкинилен-(гетероцикло)-, -(гетероцикло)-C1-C10 алкилен-, -(гетероцикло)-C2-C10 алкенилен-, -(гетероцикло)-C1-C10 алкинилен-, -(CH2CH2O)r- или -(CH2CH2O)r-CH2-, и r является целым числом от 1 до 10, где указанные алкиловые, алкениловые, алкиниловые, алкиленовые, алкениленовые, алкиниленовые, ариловые, карбоциклические и гетероциклические и ариленовые радикалы, по отдельности или как часть другой группы, при желании заменены. В некоторых вариантах осуществления настоящего изобретения указанные алкиловые, алкениловые, алкиниловые, алкиленовые, алкениленовые, алкиниленовые, ариловые, карбоциклические, гетероциклические и ариленовые радикалы, по отдельности или как часть другой группы, заменены. В некоторых вариантах осуществления настоящего изобретения R17 выбирают из -C1-C10 алкилен-, -карбоцикло-, -O-(C1-C8 алкилен)-, -арилен-, -C1-C10 алкилен-арилен-, -арилен-C1-C10 алкилен-, -C1-C10 алкилен-(карбоцикло)-, -(карбоцикло)-C1-C10 алкилен-, -C3-C8 гетероцикло-, -C1-C10алкилен-(гетероцикло)-, -(гетероцикло)-C1-C10алкилен-, -(CH2CH2O)r- и -(CH2CH2O)r-CH2-; и r является числом, варьирующим от 1 до 10, где указанные алкиленовые группы не заменены, а оставшиеся группы заменены, при желании.
[0198] Следует понимать из примеров вариантов осуществления настоящего изобретения, что даже в отсутствие избыточного определения, от 1 до 20 остатков лекарственного средства можно присоединить к антителу (p=1-20).
[0199]

[0200]
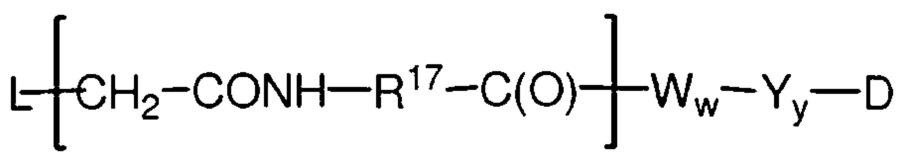
[0201] Типичным удлиняющим компонентом является компонент по Формуле IIIa, где R17 является -(CH2)5-:
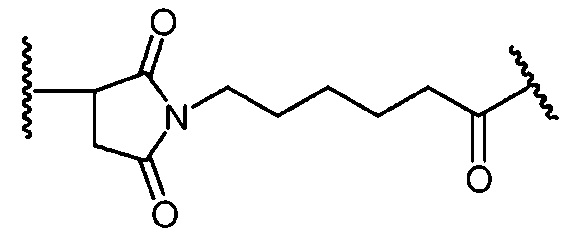
[0202] Другим типичным удлиняющим компонентом является компонент по Формуле IIIa, где R17 -(CH2CH2O)r-CH2-; и r является 2:
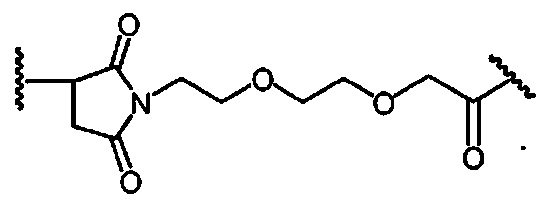
[0203] Типичным удлиняющим компонентом является компонент по Формуле IIIa, где R17 является -ариленом- или арилен-C1-C10 алкиленом-. В некоторых вариантах осуществления настоящего изобретения ариловая группа является незамещенной фенильной группой.
[0204] Другим типичным удлиняющим компонентом является компонент по Формуле IIIb, где R17 является -(CH2)5-:

[0205] В определенных вариантах осуществления настоящего изобретения удлиняющий компонент присоединен к компоненту «антитело» через дисульфидную связь между атомом серы компонента «антитело» и атомом серы удлиняющего компонента. Типичный удлиняющий компонент данного варианта осуществления настоящего изобретения показан в квадратных скобках в Формуле IV, где R17, L-, -W-, -Y-, -D, w и y определены выше.
[0206]

[0207] Следует отметить, что на протяжении всей настоящей заявки функциональная группа S в формуле ниже обозначает атом серы компонента «антитело», если иное не определено контекстом.
[0208]

[0209] В других вариантах осуществления настоящего изобретения удлиняющий компонент содержит реакционноспособный центр, который может образовать связь с первичной или вторичной аминогруппой антитела. Примеры таких реакционноспособных центров включают, но не ограничиваются активированными сложными эфирами, сукцинимидными эфирами, 4 нитрофениловыми эфирами, пентафторфениловыми эфирами, тетрафторфениловыми эфирами, ангидридами, хлорангидридами, сульфонилхлоридами, изоцианатами и изотиоцианатами. Типичные удлиняющие компоненты данного варианта осуществления настоящего изобретения показаны в квадратных скобках в Формулах Va и Vb, где R17, L-, -W-, -Y-, -D, w и y определены выше;

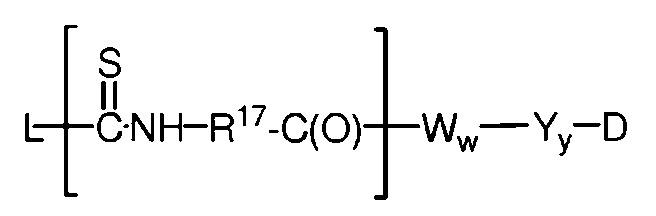
[0210] В некоторых вариантах осуществления настоящего изобретения удлиняющий компонент содержит реакционноспособный сайт, реагирующий с модифицированной углеводной группой (-CHO), которая может присутствовать на антителе. Например, углевод может быть умеренно окисленным с помощью таких реактивов, как натрия перйодат, и образующуюся в результате группу (-CHO) окисленного углевода можно конденсировать с удлиняющим компонентом, содержащим функциональную группу, например, гидразид, оксим, первичный или вторичный амин, гидразин, тиосемикарбазон, гидразина карбоксилат и арилгидразид, такие как описанные Kaneko et al., 1991, Bioconjugate Chem. 2:133-41. Репрезентативные удлиняющие компоненты данного варианта осуществления настоящего изобретения указаны в квадратных скобках в Формулах VIa, Vib и VIc, где -R17-, L-, -W-, -Y-, -D, w и y определены выше.

VII.) Аминокислотный компонент
[0211] Аминокислотный компонент (-W-), при наличии, связывает удлиняющий компонент со спейсером при наличии спейсера, связывает удлиняющий компонент с остатком лекарственного средства в отсутствие спейсера и связывает компонен «антитело» с компонентом «лекарственное средство» в отсутствие удлиняющего компонента и спейсера.
[0212] Ww- может быть, например, монопептидным, дипептидным, трипептидным, тетрапептидным, пентапептидным, гексапептидным, гептапептидным, октапептидным, нонапептидным, декапептидным, ундекапептидным или додекапептидным компонентом. Каждый компонент -W- независимо имеет формулу, указанную ниже в квадратных скобках, и w является целым числом от 0 до 12:
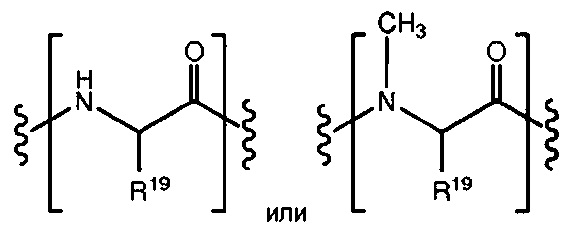
где R19является водородом, метилом, изопропилом, изобутилом, втор-бутилом, бензилом, п-гидроксибензилом, -CH2OH, -CH(OH)CH3, -CH2CH2SCH3, -CH2CONH2, -CH2COOH, -CH2CH2CONH2, -CH2CH2COOH, -(CH2)3NHC(=NH)NH2, -(CH2)3NH2, -(CH2)3NHCOCH3, -(CH2)3NHCHO, -(CH2)4NHC(=NH)NH2, -(CH2)4NH2, -(CH2)4NHCOCH3, -(CH2)4NHCHO, -(CH2)3NHCONH2, -(CH2)4NHCONH2, -CH2CH2CH(OH)CH2NH2, 2-пиридилметилом-, 3- пиридилметилом-, 4- пиридилметилом-, фенилом, циклогексилом,

[0213] В некоторых вариантах осуществления настоящего изобретения аминокислотный компонент можно ферментативно отщепить одним или несколькими ферментами, включая раковую или ассоциированную с опухолями протеазу, чтобы высвободить компонент «лекарственное средство» (-D), которая в одном варианте осуществления настоящего изобретения протонируется in vivo при высвобождении с образованием лекарственного средства (D).
[0214] В определенных вариантах осуществления настоящего изобретения аминокислотный компонент может содержать природные аминокислоты. В других вариантах осуществления настоящего изобретения аминокислотный компонент может содержать неприродные аминокислоты. Репрезентативные компоненты Ww представлены формулами (VII)-(IX):
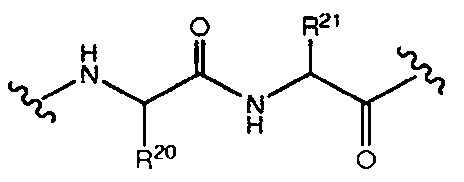
где R20 и R21 представляют собой следующее:
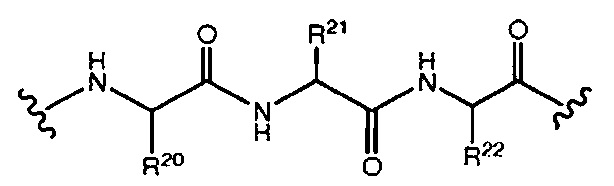
где R20, R21 и R22 представляют собой следующее:

где R20, R21, R22 и R23 представляют собой следующее:
[0215] Примеры аминокислотных компонентов включают, но не ограничиваются компонентами формулы VII, где: R20 является бензилом и R21 является -(CH2)4NH2; R20 является изопропилом и R21 является -(CH2)4NH2; или R20 является изопропилом и R21 является -(CH2)3NHCONH2. Другим примером аминокислотного компонента является компонент формулы VIII, где R20 является бензилом, R21 является бензилом и R22 является -(CH2)4NH2.
[0216] Можно спланировать и оптимизировать селективность полезных компонентов -Ww- в отношении ферментативного расщепления конкретным ферментом, например, ассоциированной с опухолями протеазой. В одном варианте осуществления настоящего изобретения компонент -Ww- является компонентом, расщепление которого катализируют катепсины B, C и D или протеаза плазмин.
[0217] В одном варианте осуществления настоящего изобретения -Ww- является дипетидом, трипептидом, тетрапептидом или пентапептидом. Когда R19, R20, R21, R22 или R23 отличны от водорода, атом углерода, к которому присоединен R19, R20, R21, R22 или R23, является хиральным.
[0218] Каждый атом углерода, к которому присоединен R19, R20, R21, R22 или R23, независимо находится в (S) или (R) конфигурации.
[0219] В одном аспекте аминокислотного компонента аминокислотный компонент является валин-цитрулином (vc или val-cit, valine-citrulline). В другом аспекте аминокислотный компонент является фенилаланин-лизином (т.е. fk). В другом аспекте аминокислотного компонента аминокислотный компонент является N-метилвалин- цитрулином. В другом аспекте аминокислотный компонент является 5-аминовалериановой кислотой, гомофенилаланин-лизином, тетраизохинолинкарбоксилат-лизином, циклогексилаланин-лизином, изонипекотиновой кислотой-лизином, бета-аланин- лизином, глицин-серин-валин-глутаминои и изонипекотиновой кислотой.
VIII.) Спейсерный компонент
[0220] Спейсерный компонент (-Y-), если он присутствует, связывает аминокислотный компонент с молекулой лекарственного средства, если такой аминокислотный компонент присутствует. Альтернативно, спейсерный компонент связывает удлиняющий компонент с компонентом «лекарственное средство», если такой аминокислотный компонент отсутствует. Спейсерный компонент также связывает компонент «лекарственное средство» с компонентом «антитело», если отсутствует как аминокислотный компонент, так и удлиняющий компонент.
[0221] Спейсерными компонентами являются компоненты двух общих типов: не-самоэлиминирующиеся и самоэлиминирующиеся. Не-самоэлиминирующийся спейсерный компонент представляет собой компонент, где весь спейсерный компонент или его часть остается связанным с остатком лекарственного средства после отщепления, а в частности ферментативного отщепления аминокислотного компонента от конъюгата антитело с лекарственным средством. Примеры не-самоэлиминирующегося спейсерного компонента включают, но не ограничиваются глицин-глициновым спейсерным компонентом и глициновым спейсерным компонентом (оба они представлены на схеме 1) (см. ниже). Если конъюгат, содержащий глицин-глициновый спейсерный компонент или глициновый спейсерный компонент, подвергается ферментативному расщеплению посредством фермента (например, ассоциированной с опухолями протеазы, ассоциированной с раковыми клетками протеазы или ассоциированной с лимфоцитами протеазы), то остаток глицин-глицин-лекарственное средство или остаток глицин-лекарственное средство отщепляется от L-Aa-Ww-. В одном из вариантов осуществления настоящего изобретения независимая реакция гидролиза происходит в клетках-мишенях, расщепляя связь в остатке глицин-лекарственное средство и высвобождая лекарственное средство.
Схема 1

[0222] В некоторых вариантах осуществления настоящего изобретения не-самоэлиминирующийся спейсерный компонент (-Y-) является -Gly-. В некоторых вариантах осуществления настоящего изобретения не-самоэлиминирующийся спейсерный компонент (-Y-) является -Gly-Gly-.
[0223] В одном варианте осуществления настоящего изобретения представлен конъюгат лекарственного средства с линкером, в котором отсутствует спейсерный компонент (у=0), или к его фармацевтически приемлемая соль или сольват.
[0224] Альтернативно, конъюгат, содержащий самоэлиминирующийся спейсерный компонент, может высвобождать -D. Как применяют в настоящей заявке, термин «самоэлиминирующийся спейсерный компонент» обозначает бифункциональную химическую группу, способную ковалентно связывать две разделенные в пространстве химические группы в стабильную трехчленную молекулу. Он спонтанно отделиться от второй химической группы после расщепления связи с первой группой.
[0225] В некоторых вариантах осуществления настоящего изобретения -Yy- является п-аминобензиловым спиртом (PAB) (см. схемы 2 и 3), фениленовая часть которого заменена Qm, где Q представляет собой -С1-С8алкил, -C1-C8 алкенил, -C1-C8 алкинил, -O-(C1-C8 алкил), -O-(C1-C8 алкенил), -O-(C1-C8 алкинил), галоген, нитро- или цианогруппой, а m является целым числом от 0 от 4. Алкиловую, алкениловую и алкиниловую группы, по отдельности или как часть другой группы, можно при желании заменить.
[0226] В некоторых вариантах осуществления настоящего изобретения -Y- является группой PAB, связанной с -Ww-через атом азота аминогруппы группы PAB и напрямую связанной с -D через карбонатную, карбаматную или эфирную группу. Не ограничиваясь какой-либо конкретной теорией или механизмом, авторы представляют схему 2, на которой проиллюстрирован возможный механизм высвобождения лекарственного средства от группы РАВ, которая напрямую присоединена к -D через карбаматную или карбонатную группу, как описано Toki et al., 2002, J. Org. Chem. 67:1866-1872.
Схема 2

[0227] На схеме 2, Q является -C1-C8 алкилом, -C1-C8 алкенилом, -C1-C8 алкинилом, -O-(C1-C8 алкилом), -O-(C1-C8 алкенилом), -O-(C1-C8 алкинилом), -галогеном, -нитро или -цианогруппой; m является целым числом от 0 до 4; и p варьирует от 1 приблизительно до 20. Алкиловую, алкениловую и алкиниловую группы, по отдельности или как часть другой группы, можно при желании заменить.
[0228] Не ограничиваясь какой-либо конкретной теорией или механизмом, авторы представляют схему 3, на которой проиллюстрирован возможный механизм высвобождения лекарственного средства от группы РАВ, которая напрямую присоединена к -D через эфирную или аминную связь, где D включает группу кислорода или азота, являющуюся частью компонента «лекарственное средство».
Схема 3

[0229] На схеме 3, Q является -C1-C8 алкилом, -C1-C8 алкенилом, -C1-C8 алкинилом, -O-(C1-C8 алкилом), -O-(C1-C8 алкенилом), -O-(C1-C8 алкинилом), -галогеном, -нитро или -цианогруппой; m является целым числом от 0 до 4; и p варьирует от 1 приблизительно до 20. Алкиловую, алкениловую и алкиниловую группы, по отдельности или как часть другой группы, можно при желании заменить.
[0230] Другие примеры самоэлиминирующихся спейсеров включают, но не ограничиваются, ароматическими соединениями, которые, по своим электронным свойствам, аналогичны группе РАВ, такими как производные 2-аминоимидазол-5-метанола (Hay et al., 1999, Bioorg. Med. Chem. Lett. 9:2237) и орто- или пара-аминобензилацетали. Также можно применять спейсеры, которые подвергаются циклизации после гидролиза амидной связи, такие как замещенные и незамещенные амиды 4-аминомасляной кислоты (Rodrigues et al., 1995, Chemistry Biology 2:223), соответствующим образом замещенные бицикло[2.2.1]- и бицикло[2.2.2]-циклические системы (Storm et al., 1972, J. Amer. Chem. Soc. 94:5815) и амиды 2-аминофенилпропионовой кислоты (Amsberry et al., 1990, J. Org. Chem. 55:5867). Элиминция амин-содержащих лекарственных средств, которые замещены в α-положении глицина (Kingsbury et al., 1984, J. Med. Chem. 27:1447), также является примером самоэлиминирующихся спейсеров.
[0231] В одном варианте осуществления настоящего изобретения спейсерный компонент представляет собой разветвленный бис(гидроксиметил)стироловый компонент (BHMS), показанный на схеме 4, который можно применять для включения и высвобождения множества лекарственных средств.
Схема 4
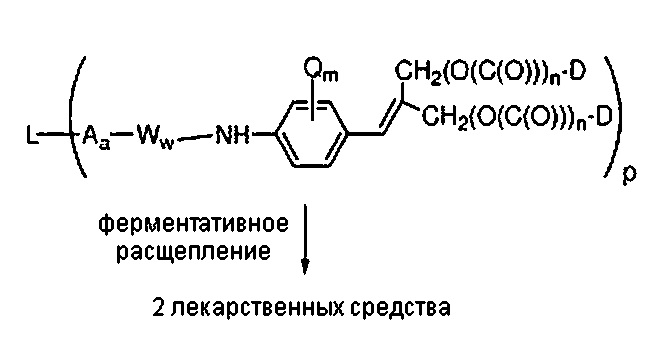
[0232] На схеме 4, Q является -C1-C8 алкилом, -C1-C8 алкенилом, -C1-C8 алкинилом, -O-(C1-C8 алкилом), -O-(C1-C8 алкенилом), -O-(C1-C8 алкинилом), -галогеном, -нитро или -цианогруппой; m является целым числом от 0 до 4, n равно 0 или 1 и p варьирует от 1 приблизительно до 20. Алкиловую, алкениловую и алкиниловую группы, по отдельности или как часть другой группы, можно при желании заменить.
[0233] В некоторых вариантах осуществления настоящего изобретения группы -D являются одинаковыми. В другом варианте осуществления настоящего изобретения группы -D являются разными.
[0234] В одном аспекте настоящего изобретения спейсерные компоненты (-Yy-) представлены формулами (X)-(XII):
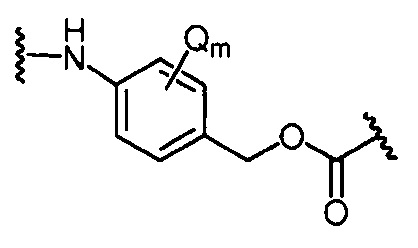
где Q является -C1-C8 алкилом, -C1-C8 алкенилом, -C1-C8 алкинилом, -O-(C1-C8 алкилом), -O-(C1-C8 алкенилом), -O-(C1-C8 алкинилом), -галогеном, -нитро или -цианогруппой; m является целым числом от 0 до 4. Алкиловую, алкениловую и алкиниловую группы, по отдельности или как часть другой группы, можно при желании заменить.
[0235]

и
[0236]
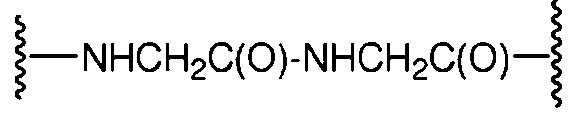
[0237] Вариантами формул I и II, содержащих конъюгаты антитела с лекарственным средством, могут включать:
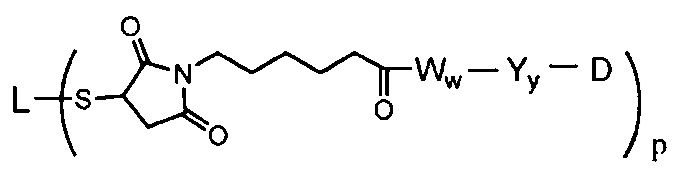
где каждый из w и y равен 0, 1 или 2, и,

где каждый из w и y равен 0,
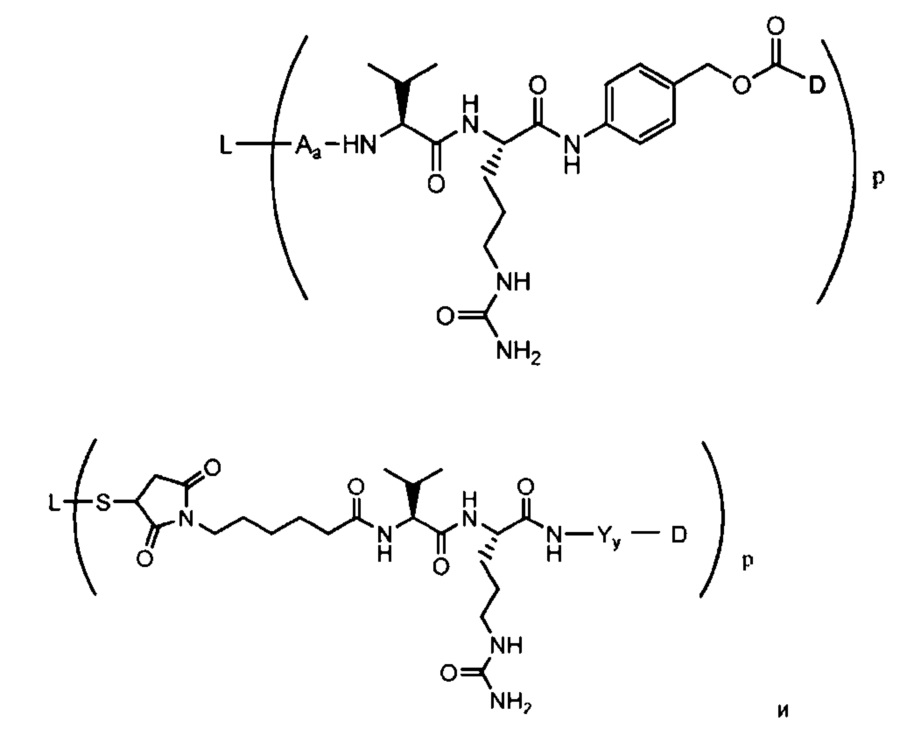

IX.) Компонент «лекарственное средство»
[0238] Остаток лекарственного средства (D) может быть цитотоксическим, цитостатическим или иммуномодулирующим (например, иммуносупрессорным) или лекарственным средством. D является компонентом «лекарственное средство» (остатком), имеющим атом, способный образовать связь со спейсерным компонентом, с аминокислотным компонентом, с удлиняющим компонентом или с компонентом «антитело». В некоторых вариантах осуществления настоящего изобретения компонент «лекарственное средство» D содержит атом азота, способный образовать связь со спейсерным компонентом. Как применяют в настоящей заявке, термины «компонент «лекарственное средство» и «остаток лекарственного средства» являются синонимами и применяются взаимозаменяемо.
[0239] Применимые классы цитотоксических или иммуномодулирующих агентов включают, например, антитубулиновые агенты, агенты, связывающие малую бороздку ДНК, ингибиторы репликации ДНК и алкилирующие агенты.
[0240] В некоторых вариантах осуществления настоящего изобретения лекарственное средство является ауристатином, таким как ауристатин Е (также известный в данной области техники как производное доластатина-10), или его производным. Ауристатин может быть, например, сложным эфиром, образованным аристатином Е и кетокислотой. Например, ауристатин Е может реагировать с параацетобензойной кислотой или с бензоилвалериановой кислотой с образованием AEB и AEVB, соответственно. Другие типичные ауристатины включают AFP, MMAF и MMAE. Синтез и структура примеров ауристатинов описаны в публикации заявок на патент США № 2003-0083263, 2005-0238649 и 2005-0009751, в международной публикации патента № WO 04/010957, в международной публикации патента № WO 02/088172 и в патентах США № 6323315, 6239104, 6034065, 5780588, 5665860, 5663149, 5635483, 5599902, 5554725, 5530097, 5521284, 5504191, 5410024, 5138036, 5076973, 4986988, 4978744, 4879278, 4816444 и 4486414, каждый из которых включен в настоящую заявку в полном объеме и с любыми целями посредством ссылки.
[0241] Было показано, что ауристатины влияют на динамику микротрубочек, на ядерное и клеточное деление и обладают противораковой активностью. Ауристатины связывают тубулин и могут вызвать цитотоксический или цитостатический эффект в экспрессирующих CD37 клетках. Существует ряд различных исследований, известных в данной области техники, которые можно применять чтобы определить, вызывает ли ауристатин или образующийся в результате конъюгат антитела с лекарственным средством цитотоксический или цитостатический эффект в заданной клеточной линии.
[0242] Способы определения связывания соединения с тубулином известны в данной области техники. См., например, Muller et al., Anal. Chem 2006, 78, 4390-4397; Hamel et al., Molecular Pharmacology, 1995 47: 965-976; и Hamel et al., The Journal of Biological Chemistry, 1990 265:28, 17141-17149. В целях настоящего изобретения можно определить относительную аффинность соединения к тубулину. Некоторые предпочтительные ауристатины настоящего изобретения связывают тубулин с аффинностью, варьирующей в пределах от в 10 раз более низкой (более слабая аффинность), чем аффинность связывания MMAE с тубулином, до в 10 раз, в 20 раз или даже в 100 раз более сильной (повышенная аффинность), чем аффинность связывания MMAE с тубулином.
[0243]
В некоторых вариантах осуществления настоящего изобретения -D является ауристатином с формулой DE или DF:
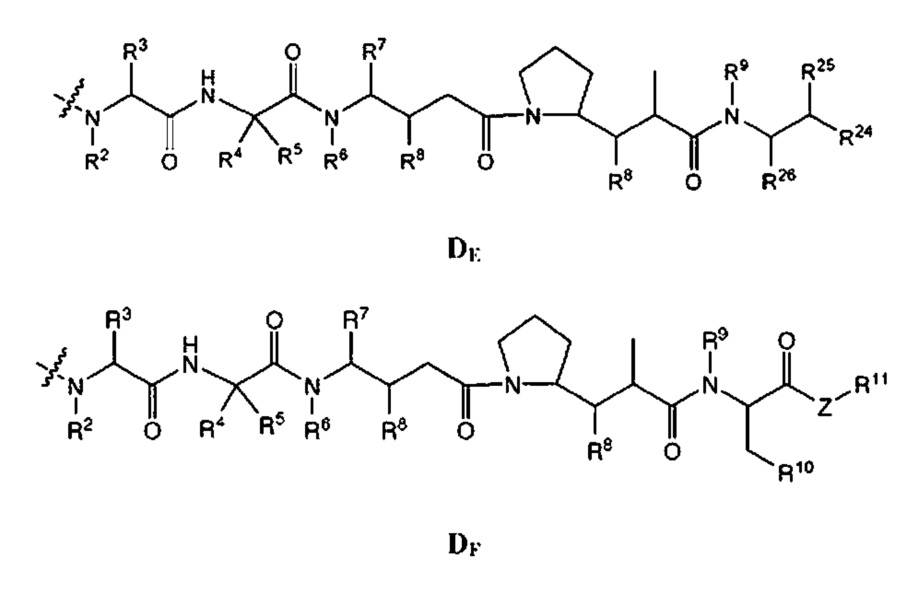
или их фармацевтически приемлемой солью или сольватом,
где независимо в каждом положении:
волнистая линия обозначает связь;
R2 является -C1-C20 алкилом, -C2-C20 алкенилом, или -C2-C20 алкинилом;
R3 является -H, -C1-C20 алкилом, -C2-C20 алкенилом, -C2-C20 алкинилом, -карбоциклом, -C1-C20 алкилен(карбоциклом), -C2-C20 алкенилен(карбоциклом), -C2-C20 алкинилен(карбоциклом), -арилом, -C1-C20 алкилен(арилом), -C2-C20 алкенилен(арилом), -C2-C20 алкинилен(арилом), гетероциклом, -C1-C20 алкилен(гетероциклом), -C2-C20 алкенилен(гетероциклом) или -C2-C20 алкинилен(гетероциклом);
R4 является -H, -C1-C20 алкилом, -C2-C20 алкенилом, -C2-C20 алкинилом, карбоциклом, -C1-C20 алкилен(карбоциклом), -C2-C20 алкенилен(карбоциклом), -C2-C20 алкинилен(карбоциклом), арилом, -C1-C20 алкилен(арилом), -C2-C20 алкенилен(арилом), -C2-C20 алкинилен(арилом), -гетероциклом, -C1-C20 алкилен(гетероциклом), -C2-C20 алкенилен(гетероциклом) или -C2-C20 алкинилен(гетероциклом);
R5 является -H или -C1-C8 алкилом;
или R4 и R5, взятые вместе, образуют карбоциклическое кольцо и имеют формулу -(CRaRb)s-, где Ra и Rb независимо являются -H, -C1-C20алкилом, -C2-C20алкенилом, -C2-C20алкинилом или -карбоцикломи s является 2, 3, 4, 5 или 6,
R6 является -H, -C1-C20алкилом, -C2-C20алкенилом или -C2-C20 алкинилом;
R7 является -H, -C1-C20 алкилом, -C2-C20 алкенилом, -C2-C20 алкинилом, карбоциклом, -C1-C20 алкилен(карбоциклом), -C2-C20 алкенилен(карбоциклом), -C2-C20 алкинилен(карбоциклом), -арилом, -C1-C20 алкилен(арилом), -C2-C20 алкенилен(арилом), -C2-C20 алкинилен(арилом), гетероциклом, -C1-C20 алкилен(гетероциклом), -C2-C20 алкенилен(гетероциклом) или -C2-C20 алкинилен(гетероциклом);
каждый R8 независимо является -H, -OH, -C1-C20 алкилом, -C2-C20 алкенилом, -C2-C20 алкинилом, -O-(C1-C20 алкилом), -O-(C2-C20 алкенилом), -O-(C1-C20 алкинилом) или -карбоциклом;
R9является -H, -C1-C20алкилом, -C2-C20алкенилом или -C2-C20алкинилом;
R24 является -арилом, -гетероциклом или -карбоциклом;
R25 является -H, C1-C20 алкилом, -C2-C20 алкенилом, -C2-C20 алкинилом, -карбоциклом, -O-(C1-C20 алкилом), -O-(C2-C20 алкенилом), -O-(C2-C20 алкинилом) или OR18, где R18 является -H, гидроксильной защитной группой или прямой связью, где OR18 представляет собой =O;
R26 является -H, -C1-C20 алкилом, -C2-C20 алкенилом или -C2-C20 алкинилом, -арилом, -гетероциклом или -карбоциклом;
R10 является -арилом или -гетероциклом;
Z является -O, -S, -NH или -NR12, где R12является -C1-C20 алкилом, -C2-C20 алкенилом или -C2-C20 алкинилом;
R11 является -H, -C1-C20 алкилом, --C2-C20 алкенилом, -C2-C20 алкинилом, -арилом, -гетероциклом, -(R13O)m-R14 или -(R13O)m-CH(R15)2;
m является целым числом от 1 до 1000;
R13 является -C2-C20 алкиленом, -C2-C20 алкениленом или -C2-C20 алкиниленом;
R14является -H, -C1-C20 алкилом, -C2-C20 алкенилом или -C2-C20 алкинилом;
каждый R15 независимо является -H, -COOH, -(CH2)n-N(R16)2, -(CH2)n-SO3H, -(CH2)n-SO3-C1-C20 алкилом, -(CH2)n-SO3-C2-C20 алкенилом или -(CH2)n-SO3-C2-C20 алкинилом;
каждый R16 независимо является -H, -C1-C20 алкилом, -C2-C20 алкенилом, -C2-C20 алкинилом или -(CH2)n-COOH; и
n является целым числом от 1 до 6;
где указанные алкиловые, алкениловые, алкиниловые, алкиленовые, алкиниленовые, ариловые, карбоциклические и гетероциклические радикалы, по отдельности или как часть другой группы, при желании заменены.
[0244] Ауристатины по формуле DE включают ауристатины, в которых указанные алкиловые, алкениловые, алкиниловые, алкиленовые, алкениленовые, алкиниленовые, ариловые, карбоциклические и гетероциклические радикалы не заменены.
[0245] Ауристатины по формуле DE включают ауристатины, в которых группы R2, R3, R4, R5, R6, R7, R8 и R9 не заменены, а группы R19, R20и R21при желании заменены, как описано в настоящей заявке.
[0246] Ауристатины по формуле DE включают ауристатины, где
R2 является C1-C8 алкилом;
R3, R4 и R7 независимо выбирают из -H, -C1-C20 алкила, -C2-C20 алкенила, -C2-C20 алкинила, моноциклического C3-C6 карбоцикла, -C1-C20 алкилен(моноциклического C3-C6 карбоцикла), -C2-C20 алкенилен(моноциклического C3-C6 карбоцикла), -C2-C20 алкинилен(моноциклического C3-C6 карбоцикла), C6-C10 арила, -C1-C20 алкилен(C6-C10 арила), -C2-C20 алкенилен(C6-C10 арила), -C2-C20 алкинилен(C6-C10 арила), гетероцикла, -C1-C20 алкилен(гетероцикла), -C2-C20 алкенилен(гетероцикла) или -C2-C20 алкинилен(гетероцикла); где указанные алкиловые, алкениловые, алкиниловые, алкиленовые, алкениленовые, алкиниленовые, карбоциклические, ариловые и гетероциклические радикалы при желании заменены;
R5 является -H;
R6 является -C1-C8 алкилом;
каждый R8 независимо выбирают из -OH, -O-(C1-C20 алкила), -O-(C2-C20 алкенила) или -O-(C2-C20 алкинила), где указанные алкиловые, алкениловые, алкиниловые радикалы при желании заменены;
R9 является -H или -C1-C8 алкилом;
R24 является замещенным при желании -фенилом;
R25 является -OR18, где R18 является H, гидроксильной защитной группой или прямой связью, где OR18 представляет собой =O;
R26 выбирают из -H, -C1-C20 алкила, -C2-C20 алкенила, -C2-C20 алкинила или -карбоцикла, где указанные алкиловые, алкениловые, алкиниловые и карбоциклические радикалы при желании заменены, или их фармацевтически приемлемой соли или сольвата.
[0247] Ауристатины по формуле DE включают ауристатины, где
R2 является метилом;
R3 является -H, -C1-C8 алкилом, -C2-C8 алкенилом или C2-C8 алкинилом, где указанные алкиловые, алкениловые, алкиниловые радикалы при желании заменены;
R4 является -H, -C1-C8 алкилом, -C2-C8 алкенилом, -C2-C8 алкинилом, моноциклическим C3-C6 карбоциклом, -C6-C10 арилом, -C1-C8 алкилен(C6-C10 арилом), -C2-C8 алкенилен(C6-C10 арилом), -C2-C8 алкинилен(C6-C10 арилом), -C1-C8 алкиленом (моноциклическим C3-C6 карбоциклом), -C2-C8 алкенилен(моноциклическим C3-C6 карбоциклом), -C2-C8 алкинилен(моноциклическим C3-C6 карбоциклом); где указанные алкиловые, алкениловые, алкиниловые, алкиленовые, алкениленовые, алкиниленовые, ариловые и карбоциклические радикалы, по отдельности или как часть другой группы, при желании заменены;
R5 является -H;
R6 является метилом;
R7 является -C1-C8 алкилом, -C2-C8 алкенилом или -C2-C8 алкинилом;
каждый R8 является метокси;
R9 является -H или -C1-C8 алкилом;
R24 является -фенилом;
R25является -OR18; где R18 является H, гидроксильной защитной группой или прямой связью, где OR18 представляет собой =O;
R26 является метилом;
или их фармацевтически приемлемой солью.
[0248] Ауристатины по формуле DE включают ауристатины, где:
R2 является метилом; R3 является -H или -C1-C3 алкилом; R4 является -C1-C5 алкилом; R5 является -H; R6 является метилом; R7 является изопропилом или втор-бутилом; R8 является метокси; R9 является -H или -C1-C8 алкилом; R24 является фенилом; R25является -OR18; где R18 является -H, гидроксильной защитной группой или прямой связью, где OR18 представляет собой =O; и R26 является метилом; или их фармацевтически приемлемой солью или сольватом.
[0249] Ауристатины по формуле DE включают ауристатины, где:
R2 является метилом или C1-C3 алкилом,
R3 является -H или -C1-C3 алкилом;
R4 является -C1-C5 алкилом;
R5 является H;
R6 является C1-C3 алкилом;
R7 является -C1-C5 алкилом;
R8 является -C1-C3 алкокси;
R9 является -H или -C1-C8 алкилом;
R24 является фенилом;
R25 является -OR18; где R18 является -H, гидроксильной защитной группой или прямой связью, где OR18 представляет собой =O; и
R26 является -C1-C3 алкилом;
или их фармацевтически приемлемой солью.
[0250] Ауристатины по формуле DF включают ауристатины, где
R2 является метилом;
R3, R4и R7независимо выбирают из -H, -C1-C20 алкила, -C2-C20 алкенила, -C2-C20 алкинила, моноциклического C3-C6 карбоцикла, -C1-C20 алкилен(моноциклического C3-C6 карбоцикла), -C2-C20 алкенилен(моноциклического C3-C6 карбоцикла), -C2-C20 алкинилен(моноциклического C3-C6 карбоцикла), -C6-C10 арила, -C1-C20 алкилен(C6-C10 арила), -C2-C20 алкенилен(C6-C10 арила), -C2-C20 алкинилен(C6-C10 арила), гетероцикла, -C1-C20 алкилен(гетероцикла), -C2-C20 алкенилен(гетероцикла) или -C2-C20 алкинилен(гетероцикла); где указанные алкиловые, алкениловые, алкиниловые, алкиленовые, алкениленовые, алкиниленовые, карбоциклические, ариловые и гетероциклические радикалы, по отдельности или как часть другой группы, при желании заменены;
R5 является -H;
R6 является метилом;
каждый R8 является метокси;
R9является -H, -C1-C20алкилом, -C2-C20алкенилом или -C2-C20алкинилом; где указанные алкиловые, алкениловые, алкиниловые радикалы при желании заменены;
R10 является при желании замещенным арилом при желании замещенным гетероциклом;
Z является -O-, -S-, -NH- или -NR12, где R12является -C1-C20 алкилом, -C2-C20 алкенилом или -C2-C20 алкинилом, каждый из которых является при желании замещенным;
R11 является -H, -C1-C20 алкилом, -C2-C20 алкенилом, -C2-C20 алкинилом, -арилом, -гетероциклом, -(R13O)m-R14 или -(R13O)m-CH(R15)2, где указанные алкиловые, алкениловые, алкиниловые, ариловые и гетероциклическое радикалы при желании заменены;
m является целым числом от 1 до 1000 или m=0;
R13 является -C2-C20 алкиленом, -C2-C20 алкениленом или -C2-C20 алкиниленом, каждый их которых является при желании замещенным;
R14является -H, -C1-C20 алкилом, -C2-C20 алкенилом или -C2-C20 алкинилом, где указанные алкиловые, алкениловые и алкиниловые радикалы при желании заменены;
каждый R15 независимо является -H, -COOH, -(CH2)n-N(R16)2, -(CH2)n-SO3H, -(CH2)n-SO3-C1-C20 алкилом, -(CH2)n-SO3-C2-C20 алкенилом или -(CH2)n-SO3-C2-C20 алкинилом, где указанные алкиловые, алкениловые и алкиниловые радикалы при желании заменены;
каждый R16 независимо является -H, -C1-C20 алкилом, -C2-C20 алкенилом, -C2-C20 алкинилом или -(CH2)n-COOH, где указанные алкиловые, алкениловые и алкиниловые радикалы при желании заменены;
n является целым числом от 0 до 6;
или их фармацевтически приемлемой солью.
[0251] В конкретном из данных вариантов осуществления настоящего изобретения R10 является при желании замещенным фенилом.
[0252] Ауристатины по формуле DF включают ауристатины, где группы R2, R3, R4, R5, R6, R7, R8 и R9 являются незамещенными, а группы R10 и R11являются такими, как описано в настоящей заявке.
[0253] Ауристатины по формуле DF включают ауристатины, где указанные алкиловые, алкениловые, алкиниловые, алкиленовые, алкениленовые, алкиниленовые, ариловые, карбоциклические и гетероциклические радикалы являются незамещенными.
[0254] Ауристатины по формуле DF включают ауристатины, где
R2 является -C1-C3 алкилом; R3 является -H или -C1-C3 алкилом; R4 является -C1-C5 алкилом; R5 является -H; R6 является -C1-C3 алкилом; R7 является -C1-C5 алкилом; R8 является -C1-C3 алкокси; R9 является -H или -C1-C8 алкилом; R10 является при желании замещенным фенилом; Z является -O-, -S- или -NH-; R11 является таким, как описано в настоящей заявке; или их фармацевтически приемлемой солью.
[0255] Ауристатины по формуле DF включают ауристатины, где
R2 является метилом; R3 является -H или -C1-C3 алкилом; R4 является -C1-C5 алкилом; R5 является -H; R6 является метилом; R7 является является изопропилом или втор-бутилом; R8 является метокси; R9 является -H или -C1-C8 алкилом; R10 является при желании замещенным фенилом; Z является -O-, -S- или -NH-; и R11 является таким, как описано в настоящей заявке; или их фармацевтически приемлемой солью.
[0256] Ауристатины по формуле DF включают ауристатины, где
R2 является метилом; R3 является -H или -C1-C3 алкилом; R4 является -C1-C5 алкилом; R5 является -H; R6 является метилом; R7 является изопропилом или sec-butyl; R8 является метокси; R9 является -H или C1-C8 алкилом; R10 является фенилом; и Z является -O- или -NH- и R11 является таким, как описано в настоящей заявке, предпочтительно, водородом; или их фармацевтически приемлемой солью.
[0257] Ауристатины по формуле DF включают ауристатины, где
R2 является -C1-C3 алкилом; R3 является -H или -C1-C3 алкилом; R4 является -C1-C5 алкилом; R5 является -H; R6 является -C1-C3 алкилом; R7 является -C1-C5 алкилом; R8 является -C1-C3 алкокси; R9 является -H или -C1-C8 алкилом; R10 является фенилом; и Z является -O- или -NH- и R11 является таким, как описано в настоящей заявке, предпочтительно, водородом; или их фармацевтически приемлемой солью.
[0258] Ауристатины по формуле DE или DF включают ауристатины, где R3, R4 и R7 независимо являются изопропилом или втор-бутилом и R5 является -H. В примере варианта осуществления настоящего изобретения каждый из R3 и R4 является изопропилом, R5является H и R7 является втор-бутилом. Остальные заместители являются такими, как описано в настоящей заявке.
[0259] Ауристатины по формуле DE или DF включают ауристатины, где каждый из R2 и R6 является метилом, а R9 является H. Остальные заместители являются такими, как описано в настоящей заявке.
[0260] Ауристатины по формуле DE или DF включают ауристатины, где каждый R8 является -OCH3. Остальные заместители являются такими, как описано в настоящей заявке.
[0261] Ауристатины по формуле DE или DF включают ауристатины, где каждый из R3 и R4 является изопропилом, каждый из R2 и R6 является метилом, R5 является H, R7 является втор-бутилом, каждый R8 является -OCH3, а R9 является H. Остальные заместители являются такими, как описано в настоящей заявке.
[0262] Ауристатины по формуле DF включают ауристатины, гдеZ является -O- или -NH-. Остальные заместители являются такими, как описано в настоящей заявке.
[0263] Ауристатины по формуле DF включают ауристатины, где R10 является арилом. Остальные заместители являются такими, как описано в настоящей заявке.
[0264] Ауристатины по формуле DF включают ауристатины, где R10 является -фенилом. Остальные заместители являются такими, как описано в настоящей заявке.
[0265] Ауристатины по формуле DF включают ауристатины, где Z является -O-, а R11 является H, метилом или терт-бутилом. Остальные заместители являются такими, как описано в настоящей заявке.
[0266] Ауристатины по формуле DF включают ауристатины, где, если Z является -NH-, R11 является -(R13O)m-CH(R15)2, где R15 является -(CH2)n-N(R16)2 и R16 является -C1-C8 алкилом или -(CH2)n-COOH. Остальные заместители являются такими, как описано в настоящей заявке.
[0267] Ауристатины по формуле DF включают ауристатины, где, если Z является -NH-, R11 является -(R13O)m-CH(R15)2, где R15 является -(CH2)n-SO3H. Остальные заместители являются такими, как описано в настоящей заявке.
[0268] В предпочтительных вариантах осуществления настоящего изобретения, если D является ауристатином по формуле DE, w является целым числом от 1 до 12, предпочтительно от 2 до 12, y составляет 1 или 2, и a, предпочтительно является 1.
[0269] В некоторых вариантах осуществления настоящего изобретения, если D является ауристатином по формуле DF, a равно 1 и w и y равны 0.
[0270] Репрезентативные компоненты «лекарственное средство» (-D) включают компоненты «лекарственное средство» со следующими структурами:



или их фармацевтически приемлемые соли или сольваты.
[0271] В одном аспекте гидрофильные группы, такие как, но не ограничивающиеся ими, сложные эфиры триэтиленгликоля (ТЭГ), можно присоединить к компоненту «лекарственное средство» в положении R11. Не претендуя на какую-либо конкретную теорию, авторы считают, что гидрофильные группы способствуют интернализации и препятствуют агломерации компонента «лекарственное средство».
[0272] В некоторых вариантах осуществления настоящего изобретения компонент «лекарственное средство» не является TZT-1027. В некоторых вариантах осуществления настоящего изобретения компонент «лекарственное средство» не является ауристатином Е, доластатином 10 или ауристатином PE.
[0273] Примеры соединений конъюгата антитела с лекарственным средством имеют следующие структуры, где «L» или «mAb-s-» представляет собой моноклональное антитело к CD37, обозначаемое HvCD37-6b15.1.1, описанное в настоящей заявке:
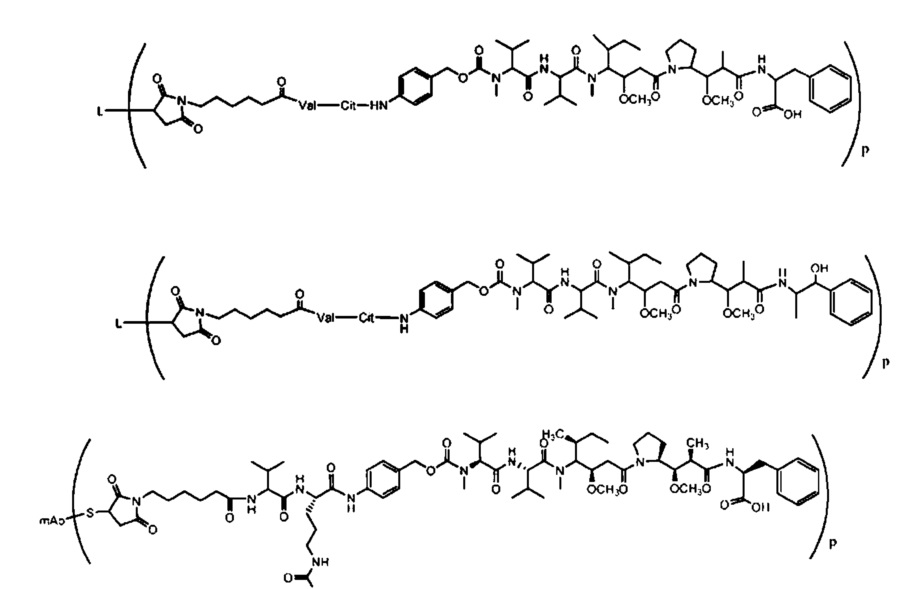
L-MC-vc-PAB-MMAF
или
L-MC-vc-PAB-MMAE.
или

L-MC-MMAF
или их фармацевтически приемлемая соль.
[0274] В некоторых вариантах осуществления настоящего изобретения компонент «лекарственное средство» является калихеамицином, камптотецином, майтанзиноидом или антрациклином. В некоторых вариантах осуществления настоящего изобретения лекарственное средство является таксаном, ингибитором топоизомеразы, алкалоидом барвинка или подобным.
[0275] В некоторых характерных вариантах осуществления настоящего изобретения подходящие цитотоксические агенты включают, например, связывающиеся с малой бороздкой ДНК (например, ендиины и лекситропсины, циклопропабензиндоловые (CBI, cyclopropabenzindole) соединения; см. также патент США № 6130237), дуокармицины, таксаны (например, паклитаксел и доцетаксел), пуромицины и алкалоиды барвинка. Другие цитотоксические агенты включают, например, CC-1065, SN-38, топотекан, морфолино-доксорубицин, ризоксин, цианоморфолино-доксорубицин, эхиномицин, комбретастатин, нетропсин, эпотилон A и B, эстрамустин, криптофизины, цемадотин, майтанзиноиды, дискодермолид, элеутеробин и митоксантрон.
[0276] В некоторых вариантах осуществления настоящего изобретения лекарственное средство является антитубулиновым агентом. Примеры антитубулиновых агентов включают ауристатины, таксаны (например, таксол (Taxol®) (паксилаксел), таксотер (Taxotere®) (доцетаксел)), T67 (Tularik) и алкалоиды барвинка (например, винкристин, винбластин, виндесин и винорелбин). Другие антитубулиновые агенты включают, например, производные баккатина, аналоги таксана (например, эпотилон A и B), нокодазол, колхицин и колцемид, эстрамустин, криптофицины, цемадотин, майтанзиноиды, комбретастатины, дискодермолид и элеутеробин.
[0277] В определенных вариантах осуществления настоящего изобретения цитотоксический агент является майтанзиноидом, другой группой антитубулиновых агентов. Например, в конкретных вариантах осуществления настоящего изобретения майтанзиноид является майтанзином или DM-1 (ImmunoGen, Inc.; см. также Chari et al., 1992, Cancer Res. 52:127-131).
[0278] В определенных вариантах осуществления настоящего изобретения цитотоксический или цитостатический агент является доластатином. В определенных вариантах осуществления настоящего изобретения цитотоксический или цитостатический агент принадлежит к классу ауристатинов. Таким образом, в конкретном варианте осуществления настоящего изобретения цитотоксический или цитостатический агент является MMAE (Формула XI). В другом конкретном варианте осуществления настоящего изобретения цитотоксический или цитостатический агент является AFP (Формула XVI).

[0279] В определенных вариантах осуществления настоящего изобретения цитотоксический или цитостатический агент являются соединениями с формулами XII-XXI или их фармацевтически приемлемой солью:

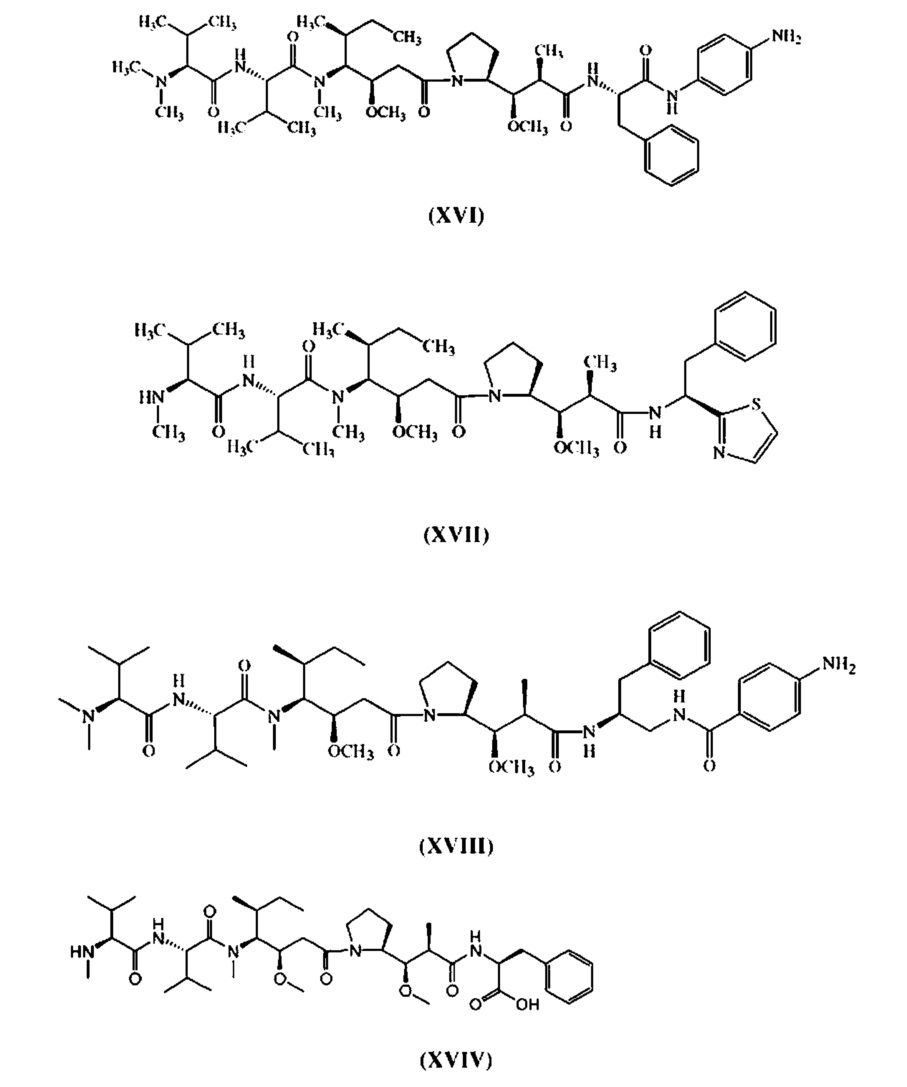




X.) Нагрузка лекарственного средства
[0280] Нагрузка лекарственного средства обозначают как p, и оно представляет собой среднее количество остатков лекарственного средства на антитело в молекуле. Нагрузка лекарственного средства может варьировать в диапазоне от 1 до 20 остатков лекарственного средства (D) на антитело. Конъюгаты антитела с лекарственным средством настоящего изобретения в некоторых вариантах осуществления настоящего изобретения включают совокупность антител, конъюгированных с остатками лекарственного средства в диапазоне от 1 до 20. Среднее количество остатков лекарственного средства на антитело в препаратах конъюгата антитела с лекарственным средством после реакций конъюгации можно охарактеризовать традиционными способами, такими как масс-спектроскопия и ELISA. Также можно определять количественное распределение конъюгата антитела с лекарственным средством с точки зрения p. В некоторых случаях разделение, очистку и характеристику гомогенного конъюгата антитела с лекарственным средством, где p представляет собой определенное значение из другого конъюгата антитела с лекарственным средством с другими нагрузками лекарственного средства, можно проводить такими способами, как электрофорез.
[0281] Для некоторых конъюгатов антитела с лекарственным средством p может быть ограничено количеством участков присоединения на антителе. Например, там, где присоединение происходит по тиолу цистеина, как в примерах вариантов осуществления настоящего изобретения, представленных выше, антитело может нести только одну или несколько тиольных групп цистеина, или оно может нести только одну или несколько достаточно реакционноспособных тиольных групп, через которые можно присоединять линкер. В определенных вариантах осуществления настоящего изобретения более высокая нагрузка лекарственного средства, например, p>5, может приводить к агрегации, нерастворимому состоянию, токсичности или потере клеточной проницаемости определенных конъюгатов антитела с лекарственным средством. В определенных вариантах осуществления настоящего изобретения нагрузка лекарственного средства в конъюгате антитела с лекарственным средством настоящего изобретения находится в диапазоне от 1 до приблизительно 8; от приблизительно 2 до приблизительно 6; от приблизительно 3 до приблизительно 5; от приблизительно 3 до приблизительно 4; от приблизительно 3,1 до приблизительно 3,9; от приблизительно 3,2 до приблизительно 3,8; от приблизительно 3,2 до приблизительно 3,7; от приблизительно 3,2 до приблизительно 3,6; от приблизительно 3,3 до приблизительно 3,8; или от приблизительно 3,3 до приблизительно 3,7. В действительности, было показано, что для определенных конъюгатов антитела с лекарственным средством оптимальное соотношение остатков лекарственного средства на антитело может составлять менее 8, и может составлять от приблизительно 2 до приблизительно 5. См. патент США 2005-0238649 A1 (включенный в настоящий документ в качестве ссылки в полном объеме).
[0282] В определенных вариантах осуществления настоящего изобретения в ходе реакции конъюгации с антителом конъюгируется количество остатков лекарственного средства, меньшее чем теоретический максимум остатков лекарственного средства. Например, антитело может содержать остатки лизина, которые не реагируют с промежуточным соединением лекарственного средства с линкером или с линкерным реагентом, как обсуждают ниже. Как правило, антитела не содержат множества свободных и реакционноспособных тиольных групп цистеина, которые могут связываться с остатком лекарственного средства; в действительности, большинство тиольных остатков цистеина находятся в антителах в виде дисульфидных мостиков. В определенных вариантах осуществления настоящего изобретения антитело можно восстанавливать восстановителем, таким как дитиотреитол (DTT) или трикарбонилэтилфосфин (TCEP), в условиях частичного или полного восстановления, с получением реакционноспособных тиольных групп цистеина. В определенных вариантах осуществления настоящего изобретения антитело подвергают воздействию денатурирующих условий для выявления реакционноспособных нуклеофильных групп, таких как лизин или цистеин.
[0283] Нагрузку (отношение лекарственное средство/антитело) конъюгата антитела с лекарственным средством можно контролировать различными способами, например, посредством (i) ограничения молярного избытка промежуточного соединения лекарственного средства с линкером или линкерного реагента относительно антитела, (ii) ограничения времени реакции конъюгации или температуры, (iii) условий частичного или ограниченного восстановления для модификации тиола цистеина, (iv) конструирования рекомбинантными способами аминокислотной последовательности антитела так, чтобы модифицировать количество и положение остатков цистеина для контроля количества и/или положения присоединений линкер-лекарственное средство (такое как thioMab или thioFab, полученные, как описано в настоящем документе и в WO 2006/034488 (включенной в настоящий документ в качестве ссылки в полном объеме)).
[0284] Следует понимать, что если с промежуточным соединением лекарственного средства с линкером или линкерным реагентом реагирует более одной нуклеофильной группы с последуюшим взаимодействием с реагентом остатка лекарственного средства, то полученный продукт представляет собой смесь соединений конъюгата антитела с лекарственным средством с распределением одной или нескольких остатков лекарственного средства, присоединенных к антителу. Среднее количество лекарственных средств на антитело можно вычислить в смеси с помощью ELISA с двумя антителами, специфичными к антителу и специфичными к лекарственному средству. Отдельные молекулы конъюгата антитела с лекарственным средством можно идентифицировать в смеси посредством масс-спектроскопии и разделять посредством ВЭЖХ, например, хроматографией гидрофобного взаимодействия (например, см. Hamblett, K.J., et al. “Effect of drug loading on the pharmacology, pharmacokinetics, and toxicity of an anti-CD30 antibody-drug conjugate,” Abstract No. 624, American Association for Cancer Research, 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004; Alley, S.C., et al. “Controlling the location of drug attachment in antibody-drug conjugates,” Abstract No. 627, American Association for Cancer Research, 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004). В определенных вариантах осуществления настоящего изобретения гомогенный конъюгат антитела с лекарственным средством с одним значением нагрузки можно выделять из смеси конъюгатов посредством электрофореза или хроматографии.
XI.) Способы определения цитотоксического эффекта конъюгатов антитела с лекарственным средством
[0285] Известны способы определения, вызывает ли лекарственное средство или конъюгат антитела с лекарственным средством цитостатический и/или цитотоксический эффект в клетке. Как правило, цитотоксическую или цитостатическую активность конъюгата антитела с лекарственным средством можно измерить: помещая клетки млекопитающих, экспрессирующих целевой белок конъюгата антитела с лекарственным средством, в культуральную среду; культивируя клетки в течение периода времени приблизительно от 6 часов до приблизительно 5 дней; и измеряя жизнеспособность клеток. Клеточные in vitro исследования можно применять для измерения жизнеспособности (пролиферации), цитотоксичности и индукции апоптоза (активации каспаз) конъюгата антитела с лекарственным средством.
[0286] Чтобы определить, вызывает ли конъюгат антитела с лекарственным средством цитостатический эффект, можно применять исследование включения тимидина. Например, можно культивировать раковые клетки, экспрессирующие целевой антиген, при плотности 5000 клеток/лунка 96-луночного планшета в течение 72 часов и обрабатывать их 0,5 мкКи of3H-тимидина в течение последних 8 часов 72-часового периода. Включение3H-тимидина в клетки культуры измеряют в присутствии и в отсутствие конъюгата антитела с лекарственным средством.
[0287] Для определения цитотоксичности можно измерять некроз или апоптоз (программируемую клеточную смерть). Некроз, как правило, сопровождается повышенной проницаемостью плазматической мембраны, набуханием клетки и разрывом плазматической мембраны. Апоптоз, как правило, характеризуется образованием мембранных пузырей, конденсацией цитоплазмы и активацией эндогенных эндонуклеаз. Выявление любого из этих действий на раковые клетки указывает на то, что конъюгат антитела с лекарственным средством применим для лечения рака.
[0288] Клеточную жизнеспособность можно измерить, определяя захват красителя клеткой, такого как нейтральный красный, трипановый синий или ALAMAR™ синий (см., например, Page et al., 1993, Intl. J. Oncology 3:473-476). В таком исследовании клетки инкубируют в среде, содержащей краситель, промывают клетки и спектрофотометрически измеряют количество оставшегося красителя, отражающее уровень поглощения красителя клеткой. Для измерения цитотоксичности также можно применять связывающий белок краситель сульфородамин B (SRB) (Skehan et al., 1990, J. Natl. Cancer Inst. 82:1107-12).
[0289] Альтернативно, применяют соль тетразолия, такую как MTT, для количественного колориметрического анализа выживания и пролиферации клеток млекопитающих с помощью детектирования живых, а не мертвых клеток (см., например, Mosmann, 1983, J. Immunol. Methods 65:55-63).
[0290] Апоптоз можно количественно оценить, измеряя, например, фрагментацию ДНК. Доступны коммерческие фотометрические способы количественного определения фрагментации ДНК in vitro. Примеры таких исследований, включая TUNEL (который детектирует включение меченых нуклеотидов в фрагментированную ДНК) и исследования на основе ELISA, описаны в Biochemica, 1999, no. 2, pp. 34-37 (Roche Molecular Biochemicals).
[0291] Апоптоз также можно определить, измеряя морфологические изменения в клетке. Например, как и в случае с некрозом, потерю целостности плазматической мембраны можно определить, измеряя захват определенных красителей (например, флуоресцентного красителя, такого как акридиновый оранжевый или бромид этидия). Способ измерения количества апоптотических клеток был описан Duke and Cohen, Current Protocols in Immunology (Coligan et al. eds., 1992, pp. 3.17.1-3.17.16). Также клетки можно пометить красителем для ДНК (например, акридиновым оранжевым, бромидом этидия или пропидийиодидом) и оценить конденсацию хроматина и периферическое расположение хроматина вдль внутренней ядерной мембраны. Другие морфологические изменения, которые можно измерить для определения апоптоза, включают, например, конденсацию цитоплазмы, повышенное образование мембранных пузырей и ошаривание клеток.
[0292] Присутствие апоптотических клеток можно измерить как в прикрепленной, так и в жидкой части культуры. Например, обе части можно собрать, удалив супернатант, трипсинизировав прикрепленные клетки, объединив препараты после стадии промывки и центрифугирования (например, 10 минут при 2000 об/мин) и измерив апоптоз (например, измерив фрагментацию ДНК). (См., например, Piazza et al., 1995, Cancer Research 55:3110-16).
[0293]In vivo эффект терапевтической композиции CD37 можно оценить в подходящей животной модели. Например, можно применять ксеногенные модели рака, где раковые экспланты или пересаженные ксенотрансплантатные ткани вводят животным с подавленным иммунитетом, таким как бестимусные мыши или мыши SCID (Klein et al., 1997, Nature Medicine 3: 402-408). Например, патентная заявка PCT WO98/16628 и патент США № 6107540 описывают разные ксенотрансплантатные модели рака простаты человека, способные воспроизводить развитие первичных опухолей, микрометастазов и образование остеобластных метастазов, характерных для поздней стадии заболевания. Эффективность можно предсказать с помощью исследований, которые измеряют ингибирование образования опухоли, регрессию опухоли или метастазов и подобное.
[0294]In vivo исследования, оценивающие распространение апоптоза, применимы в оценке терапевтических композиций. В одном варианте осуществления настоящего изобретения ксенотрансплантаты из мышей с опухолью, обработанных терапевтической композицией, можно исследовать на предмет наличия очагов апоптоза и сравнивать с необработанными контрольными мышами с ксенотрансплантатами. Уровень распространения очагов апоптоза, обнаруженных в опухолях прошедших лечение мышей указывает на терапевтическую эффективность композиции.
[0295] Терапевтические композиции, применяемые на практике описанных выше способов, можно составляют в форме фармацевтических композиций, содержащих носитель, подходящий для желаемого способа доставки. Подходящие носители включают любой материал, который в комбинации с терапевтической композицией сохраняет противоопухолевую функцию терапевтической композиции и, как правило, не является реакционноспособным в отношении иммунной системы пациента. Примеры включают, но не ограничиваются любым из ряда стандартных фармацевтических носителей, таких как стерильные растворы фосфатно-солевого буфера, бактериостатическая вода и подобное (см. общую информацию в Remington’s Pharmaceutical Sciences 16th Edition, A. Osal., Ed., 1980).
[0296] Терапевтические составы могут быть растворимыми, и их можно вводить любым способом, позволяющим доставить терапевтическую композицию к опухоли. Потенциально эффективные способы введения включают, но не ограничиваются внутривенным, парентеральным, внутрибрюшинным, внутримышечным, внутриопухолевым, интрадермальным, внутриорганным, ортотопческим и подобными. Предпочтительный состав для внутривенной инъекции содержит терапевтическую композицию в растворе бактериостатической воды с консервантами, стерильной воды без консервантов и/или разведенную в поливинилхлоридных или полиэтиленовых пакетах, содержащих 0,9% стерильный хлорид натрия для инъекций, согласно требованиям Фармакопеи США. Терапевтические препараты белка могут быть лиофилизированными, и их можно хранить в виде стерильных порошков, предпочтительно в вакууме, а затем растворять в бактериостатической воде (содержащей, например, консервант бензиловый спирт) или в стерильной воде перед инъекцией.
[0297] Дозы и протоколы введения для лечения рака с помощью описанных выше способов будут различаться в зависимости от способа и целевого рака и, как правило, будут зависеть от ряда других факторов, известных в данной области техники.
[0298] В одном варианте осуществления настоящего изобретения фармацевтическая композиция настоящего изобретения может содержать несколько видов конъюгатов антитела с лекарственным средством настоящего изобретения вследствие модификации моноклонального антитела HvCD37-6b15.1.1. Например, настоящее изобретение включает фармацевтическую композицию, содержащую конъюгат антитела с лекарственным средством настоящего изобретения, где моноклональное антитело HvCD37-6b15.1.1 является антителом, лишенным С-концевого лизина тяжелой цепи, антителом, содержащим N-концевую посттрансляционную модификацию, антителом, лишенным С-концевого лизина тяжелой цепи и содержащим N-концевую посттрансляционную модификацию, и/или антителом, содержащим С-концевой лизин тяжелой цепи и не имеющим N-концевую посттрансляционную модификацию.
[0299] Например, фармацевтическая композиция настоящего изобретения в некоторых вариантах осуществления настоящего изобретения включает фармацевтическую композицию, содержащую два или более видов конъюгатов антитела с лекарственным средством настоящего изобретения, где моноклональное антитело HvCD37-6b15.1.1 конъюгата антитела с лекарственным средством выбирают из группы, состоящей из следующего (с 1 по 4):
1) моноклональное антитело HvCD37-6b15.1.1 MAb, содержащее тяжелую цепь, состоящую из аминокислотной последовательности в пределах от остатка 1 (Q) до остатка 441 (K) SEQ ID NO: 7, и легкую цепь, состоящую из аминокислотной последовательности в пределах от остатка 1 (D) до остатка 212 (C) SEQ ID NO: 8;
2) моноклональное антитело HvCD37-6b15.1.1, содержащее тяжелую цепь, состоящую из аминокислотной последовательности в пределах от остатка 1 (Q) до остатка 441 (K) SEQ ID NO: 7, где N-концевой остаток 1 (Q) превращен в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности в пределах от остатка 1 (D) до остатка 212 (C) SEQ ID NO: 8;
3) моноклональное антитело HvCD37-6b15.1.1, содержащее тяжелую цепь, состоящую из аминокислотной последовательности в пределах от остатка 1 (Q) до остатка 441 (K) SEQ ID NO: 7, где C-концевой остаток 441 (K) удален, и легкую цепь, состоящую из аминокислотной последовательности в пределах от остатка 1 (D) до остатка 212 (C) SEQ ID NO: 8; и
4) моноклональное антитело HvCD37-6b15.1.11, содержащее тяжелую цепь, состоящую из аминокислотной последовательности в пределах от остатка 1 (Q) до остатка 441 (K) SEQ ID NO: 7, где N-концевой остаток 1 (Q) превращен в пироглутаминовую кислоту и C-концевой остаток 441 (K) удален, и легкую цепь, состоящую из аминокислотной последовательности в пределах от остатка 1 (D) до остатка 212 (C) SEQ ID NO: 8.
XII.) Лечение рака с экспрессией CD37
[0300] Обнаружение CD37 как белка, который в норме экспрессируется в ограниченном наборе тканей, но также экспрессируется при раке, таком как перечисленные в Таблице, открывает ряд терапевтических подходов к лечению такого рака.
[0301] Следует отметить, что целевая противоопухолевая терапия полезна даже тогда, когда целевой белок экспрессируется в нормальных тканях, даже в тканях жизненно важных органов. Жизненно важный орган является органом, необходимым для поддержания жизни, таким как сердце или толстая кишка. Не являющийся жизненно важным органом представляет собой орган, который можно удалить, и при этом индивидуум может выжить. Примерами органов, не являющихся жизненно важными, являются яичники, молочная железа и простата.
[0302] Экспрессия целевого белка в нормальной ткани, даже в жизненно важной нормальной ткани не отменяет практическую ценность целевого агента для данного белка как терапевтического средства для определенных опухолей, в которых данный белок также сверхэкспрессирован. Например, экспрессия в жизненно важных органах сама по себе не является вредной. Кроме того, органы, считающиеся необязательными, такие как простата и яичники, можно удалить, не повлияв на смертность. Наконец, на некоторые жизненно важные органы не влияет экспрессия в нормальных органах из-за из привилегированного иммунологического статуса. Иммунологически привилегированные органы являются органами, защищенными от крови гемато-органным барьером, и поэтому недоступны для иммунотерапии. Примерами иммунологически привилегированных органов являются мозг и семенники.
[0303] Соответственно, терапевтические подходы, ингибирующие активность белка CD37, применимы для пациентов, страдающих раком с экспрессией CD37. Данные терапевтические подходы, как правило, разделяют на три класса. Первый класс модулирует функцию CD37, имеющего отношение я к росту опухоли, приводя к ингибированию или торможению роста опухолевых клеток или индуцируя его уничтожение. Второй класс включает разные способы ингибирования связывания или ассоциации белка CD37 со своим партнером связывания или с другими белками. Третий класс содержит ряд способов ингибирования транскрипции гена CD37 или трансляции мРНК CD37.
[0304] Соответственно, можно оценивать пациентов с раком на предмет наличия и уровня экспрессии CD37, предпочтительно, с помощью иммуногистохимических анализов опухолевой ткани, количественной съемки CD37 или других техник, которые надежно указывают на присутствие и уровень экспрессии CD37. Иммуногистохимический анализ биопсий опухоли или хирургических образцов предпочтителен для данной цели. Способы иммуногистохимического анализа опухолевых тканей хорошо известны в данной области техники.
XIII.) CD37 как мишень терапии на основе антител
[0305] CD37 представляет собой привлекательную мишень терапевтических стратегий на основе антител. Ряд стратегий на основе антител хорошо известен в данной области техники как действующий как на внеклеточные, так и на внутриклеточные молекулы (см., например, уничтожение, опосредованное комплементзависимой и антителозависимой цитотоксичностью, а также применение внутриклеточных антител). Поскольку CD37 экспрессируется именно раковыми клетками различных линий относительно соответствующих нормальных клеток, получаемые CD37-иммунореактивные композиции для системного введения обладают превосходной чувствительностью при отсутствии токсичности, неспецифичности и/или нецелевых эффектов, вызванных связыванием иммунореактивной композиции с нецелевыми органами и тканями. Антитела, специфично реагирующие с доменами CD37, применимы для лечения экспрессирующего CD37 рака, предпочтительно, в виде конъюгатов антитела (т.е. конъюгатов антитела с лекарственным средством), где конъюгат представляет собой конъюгат с токсином или терапевтическим агентом.
[0306] Специалистам в данной области техники будет ясно, что антитела можно применять для специфичного действия и связывания иммуногенных молекул, таких как иммуногенная область последовательности CD37, показанная на Фигуре 1. Кроме того, специалисты в данной области техники понимают, что конъюгирование антител с цитотоксическими агентами является рутинной процедурой (см., например, Slevers et al. Blood 93:11 3678-3684 (June 1, 1999)). Когда цитотоксические и/или терапевтические агенты доставляют напрямую в клетки, таким способом как конъюгирование их с антителами, специфичными к молекуле, экспрессирующийся данной клеткой (например, CD37), цитотоксический агент будет проявлять в отношении этих клеток известный биологический эффект (т.е. цитотоксичность).
[0307] Широкий спектр композиций и способов применения конъюгатов антитела с цитотоксическим агентом для уничтожения клеток известен в данной области техники. В контексте рака типичные способы предусматривают введение млекопитающему с опухолью биологически эффективного количества конъюгата, содержащего выбранный цитотоксический и/или терапевтический агент, связанный с целевым агентом (например, с моноклональным антителом к CD37, предпочтительно, HvCD37-6b15.1.1), который связывает экспрессирующийся антиген (например, CD37), доступный для связывания или локализованный на поверхности клеток. Типичным вариантом осуществления является способ доставки цитотоксического и/или терапевтического агента в клетку, экспрессирующую CD37, включающий конъюгирование цитотоксического агента с антителом, которое иммуноспецифично связывает эпитоп CD37, и обработку клетки конъюгатом антитела с лекарственным средством. Другим иллюстративным вариантом осуществления является способ лечения индивидуума с подозрением на метастазирующий рак, включающий стадию парентерального введения названному индивидууму фармацевтической композиции, содержащей терапевтически эффективное количество антитела, конъюгированного с цитотоксическим и/или терапевтическим агентом.
[0308] Иммунотерапию рака с применением антител к CD37 можно проводить в соответствии с различными подходами, которые успешно применяли для лечения других типов рака, включая, но не ограничиваясь раком толстого кишечника (Arlen et al., 1998, Crit. Rev. Immunol. 18:133-138), множественной миеломой (Ozaki et al., 1997, Blood 90:3179-3186, Tsunenari et al., 1997, Blood 90:2437-2444), раком желудка (Kasprzyk et al., 1992, Cancer Res. 52:2771-2776), B-клеточной лимфомой (Funakoshi et al., 1996, J. Immunother. Emphasis Tumor Immunol. 19:93-101), лейкемией (Zhong et al., 1996, Leuk. Res. 20:581-589), колоректальным раком (Moun et al., 1994, Cancer Res. 54:6160-6166; Velders et al., 1995, Cancer Res. 55:4398-4403) и раком молочной железы (Shepard et al., 1991, J. Clin. Immunol. 11:117-127). Некоторые терапевтические подходы включают конъюгирование свободного антитела с токсином или радиоизотопом, такое как конъюгирование Y91 или I131 с антителами к CD20 (например, ZevalinTM, IDEC Pharmaceuticals Corp. или Bexxar™, Coulter Pharmaceuticals) соответственно, в то время как другие включают совместное введение антител и других терапевтических агентов, таких как герцептин (HerceptinTM) (трастузумаб) с паклитакселом (Genentech, Inc.). В предпочтительном варианте осуществления настоящего изобретения антитела конъюгируют с цитотоксическим агентом, см. выше, предпочтительно, с производным ауристатина, называемым MMAE (Seattle Genetics).
[0309] Хотя терапия антителами к CD37 применима на всех стадиях рака, терапия антителами может особенно подходить для распространенного или метастазирующего рака. Лечение с помощью терапии антителами настоящего изобретения в некоторых вариантах осуществления настоящего изобретения показана пациентам, которые прошли один или несколько курсов химиотерапии. Альтернативно, терапию антителами настоящего изобретения в некоторых вариантах осуществления настоящего изобретения комбинируют с курсом химиотерапии или лучевой терапии для пациентов, прошедших химиотерапию. Дополнительно терапия антителами может позволить применять пониженные дозы сопутствующей химиотерапии, особенно для пациентов, которые плохо переносят токсичность химиотерапевтического агента. Fan et al. (Cancer Res. 53:4637-4642, 1993), Prewett et al. (International J. of Onco. 9:217-224, 1996) и Hancock et al. (Cancer Res. 51:4575-4580, 1991) описывают применение различных антител вместе с химиотерапевтическими агентами.
[0310] Моноклональные антитела к CD37, которые лечат виды рака, представленные в Таблице I, включают антитела, инициирующие сильный иммунный ответ против опухоли, или антитела, которые являются напрямую цитотоксическими. В этом случае моноклональные антитела к CD37 могут вызывать лизис опухолевых клеток либо по комплементзависимому, либо по антителозависимомуу цитотоксическому механизму, каждый их которых требует наличия интактной Fc-части молекулы иммуноглобулина для взаимодействия с местами Fc-рецептора на комплементарных белках эффекторных клеток. Дополнительно, моноклональные антитела к CD3, оказывающие биологический эффект на рост опухоли, применимы в лечении рака с экспрессией CD37. Механизмы действия цитотоксических моноклональных антител включают: ингибирование клеточного роста, модулирование клеточной дифференцировки, модулирование профилей опухолевых факторов ангиогенеза и индукцию апоптоза. Механизм(ы), через которые конкретное моноклональное антитело к CD37 оказывает противоопухолевый эффект, оценивают с помощью любого числа in vitro исследований для оценки клеточной смерти, такой как антителозависимой клеточной цитотоксичности, комплемензависимого лизиса клеток и так далее, как широко известно в данной области техники.
[0311] Соответственно, предпочтительные моноклональные антитела, применяемые в терапевтических способах настоящего изобретения, включают антитела, которые и являются полностью человеческими и специфично связывают целевой антиген CD37 с высокой аффинностью.
XIV.) Коктейли конъюгатов антител к CD37 с лекарственным средством
[0312] Терапевтические способы настоящего изобретения в некоторых вариантах осуществления настоящего изобретения включают введение конъюгатов антител только к CD37 с лекарственным средством, а также комбинации или коктейли различных моноклональных антител (т.е. моноклональных антител к CD37 или моноклональных антител, которые связывают другой белок). Такие коктейли моноклональных антител могут обладать определенными преимуществами, поскольку они содержат моноклональные антитела, которые действуют на разные эпитопы, задействуют различные эффекторные механизмы или комбинируют напрямую цитотоксические моноклональные антитела с моноклональными антителами, которые опираются на функциональность иммунных эффекторов. Такие моноклональные антитела в комбинации могут оказывать синергические терапевтические эффекты. Кроме того, моноклональные антитела к CD37 можно вводить совместно с другими терапевтическими средствами, включая, но не ограничиваясь различными химиотерапевтическими и биологическими агентами, антиандргенами, иммуномодуляторами (например, IL-2, GM-CSF), хирургическим вмешательством или лучевой терапией. В предпочтительном варианте осуществления настоящего изобретения моноклональные антитела к CD37 вводят в конъюгированной форме.
[0313] Составы конъюгатов антител к CD37 с лекарственным средством вводят любым способом, пригодным для доставки антител к опухолевой клетке. Способы введения включают, но не ограничиваются внутривенным, внутрибрюшинным, внутримышечным, внутриопухолевым, интрадермальным и подобными. Лечение, как правило, включает повторное введение препарата конъюгата антител к CD37 с лекарственным средством с помощью приемлемого способа введения, такого как внутривенная инъекция (в/в), как правило в дозировке в интервале, включая, но не ограничиваясь 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20 или 25 мг/кг веса тела. Как правило, дозы в интервале 10-1000 мг моноклонального антитела в неделю эффективны и хорошо переносимы.
[0314] На основании клинического опыта с герцептином (Herceptin®) (трастузумабом) для лечения метастазирующего рака молочной железы начальная нагрузочная доза, составляющая приблизительно 4 мг/кг веса тела пациента в/в, а затем еженедельные дозы, составляющие приблизительно 2 мг/кг препарата моноклонального антитела в/в, представляют собой приемлемый режим дозирования. Предпочтительно, чтобы первоначальную ударную дозу вводили в виде инфузии в течение 90 минут или более. Периодическую поддерживающую дозу вводят в виде инфузии в течение 30 минут или более, при условии хорошей переносимости первоначальной дозы. Как считают специалисты в данной области техники, различные факторы могут оказывать влияние на идеальный режим дозирования в конкретном случае. Такие факторы включают, например, аффинность связывания и время полужизни применяемых моноклональных антител, уровень экспрессии CD37 у пациента, уровень вышедшего в кровоток антигена CD37, желаемый уровень концентрации антитела в стационарном состоянии, частоту лечения и влияние химиотерапевтических или других агентов, применяемых в комбинации с представленными способами лечения, а также состояние здоровья конкретного пациента.
[0315] При возможности, следует оценить пациентов на предмет уровня CD37 в заданном образце (например, уровней циркулирующего в кровотоке антигена CD37 и/или экспрессирующих CD37 клеток), чтобы определить наиболее эффективный режим дозирования и т.п. Такие оценки также применяют в целях мониторинга на протяжении всей терапии, и они полезны для определения терапевтического успеха в комбинации с повышением других параметров (например, цитологии мочи и/или уровни ImmunoCyt при лечении рака мочевого пузыря или, по аналогии, уровни простата-специфичного антигена в сыворотке при лечении рака простаты).
[0316] Целью настоящего изобретения является представление конъюгатов антител к CD37 с лекарственным средством, которые ингибируют или замедляют рост опухолевых клеток, экспрессирующих CD37. Дальнейшей целью настоящего изобретения является представление способов ингибирования ангиогенеза и других биологических функций и, таким образом, уменьшение роста опухоли у млекопитающих, предпочтительно, у людей, с помощью конъюгатов антител к CD37 с лекарственным средством и, в частности, с помощью таких конъюгатов антител к CD37 с лекарственным средством, комбинированных с другими лекарственными средствами или иммунологически активным лечением.
XV.) Комбинированная терапия
[0317] В одном варианте осуществления настоящего изобретения существует синергия при лечении опухолей, включая опухоли человека, конъюгатом антител к CD37 с лекарственным средством вместе с химиотерапевтическими агентами или с лучевой терапией или с их комбинациями. Иными словами ингибирование роста опухоли конъюгатом антител к CD37 с лекарственным средством усиливается выше ожидаемого уровня в комбинации с химиотерапевтическими агентами или с лучевой терапией или с их комбинациями. Синергия может проявляться, например, как более сильное ингибирование роста опухоли при комбинированном лечении, чем ожидали при лечении только конъюгатом антител к CD37 с лекарственным средством или при аддитивном эффекте лечения конъюгатом антител к CD37 с лекарственным средством и химиотерапевтическим агентом или лучевой терапией. Предпочтительно, чтобы синегрия проявлялась в виде ремиссии рака, когда не ожидают, что лечение либо конъюгатом антител к CD37 с лекарственным средством, либо аддитивной комбинацией конъюгата антител к CD37 с лекарственным средством и химиотерапевтического агента или лучевой терапии вызовет ремиссию.
[0318] Способ ингибирования роста опухолевых клеток с помощью конъюгата антител к CD37 с лекарственным средством и комбинации с химиотерапевтическим агентом или лучевой терапией, или обоих вариантов включает введение конъюгата антител к CD37 с лекарственным средством перед, во время или после начала химиотерапии или лучевой терапии, а также в комбинации (т.е. перед и во время, перед и после, во время и после или перед, во время и после начала химиотерапии и/или лучевой терапии). Например, конъюгат антител к CD37 с лекарственным средством, как правило, вводят между 1 и 60 днями, предпочтительно, между 3 и 40 днями, более предпочтительно, между 5 и 12 днями перед началом лучевой терапии и/или химиотерапии. Однако в зависимости от протокола исследования и конкретных нужд пациента способ реализуют таким образом, чтобы предоставить наиболее эффективное лечение и в конечном счете продлить жизнь пациента.
[0319] Введение химиотерапевтических агентов можно осуществить рядом способов, включая системное введение парентеральным или энтеральным путем. В одном варианте осуществления настоящего изобретения конъюгаты антител к CD37 с лекарственным средством и химиотерапевтический агент вводят в виде отдельных молекул. Конкретные примеры химиотерапевтических агентов или химиотерапии включают цисплатин, дакарбазин (DTIC), дактиномицин, мехлорэтамин (азотистый иприт), стрептозоцин, циклофосфамид, кармустин (BCNU), ломустин (CCNU), доксорубицин (адриамицин), даунорубицин, прокарбазин, митомицин, цитарабин, этопозид, метотрексат, 5-фторурацил, винбластин, винкристин, блеомицин, паклитаксел (таксол), доцетаксел (таксотер), алдеслейкин, аспарагиназу, бусульфан, карбоплатин, кладрибин, дакарбазин, флоксуридин, флударабин, гидроксимочевину, ифосфамид, интерферон альфа, лейпролид, мегестрол, мелфалан, меркаптопурин, пликамицин, митотан, пегаспаргазу, пентостатин, пипоброман, пликамицин, стрептозоцин, тамоксифен, тенипозид, тестолактон, тиогуанин, тиотепа, урациловый иприт, винорелбин, гимцитабин, хлорамбуцил, таксол и их комбинации.
[0320] Источник радиации, применяемой в комбинации с конъюгатом антител к CD37 с лекарственным средством может быть либо наружным, либо внутренним для пациента, проходящего лечение. Когда источник является наружным для пациента, терапию называют наружной дистанционной лучевой терапией (EBRT, external beam radiation therapy). Когда источник является внутренним для пациента, терапию называют брахитерапией (BT, brachytherapy).
[0321] Описанные выше терапевтические режимы можно далее комбинировать с дополнительными противораковыми терапевтическими агентами и/или режимами, например, с дополнительной химиотерапией, противораковыми вакцинами, ингибиторами передачи сигнала, агентами, применимым для лечения аномального роста клеток или рака, антителами (например, анти-CTLA-4 антителами, как описано в WO/2005/092380 (Pfizer)) или другими лигандами, которые ингибируют рост опухоли, связываясь с IGF-1R, и цитокинами.
[0322] Когда животное подвергают дополнительной химиотерапии, можно применять химиотерапевтические агенты, описанные выше. Дополнительно можно применять ингибиторы факторов роста, модификаторы биологического ответа, антигормональную терапию, селективные модуляторы рецептора эстрогена (SERM, selective estrogen receptor modulator), ингибиторы ангиогенеза и антиандрогены. Например, можно применять антигормоны, например, антиэстрогены, такие как Nolvadex (тамоксифен), или антиандрогены, такие как Casodex (4'-циано-3-(4-фторфенилсульфонил)-2-гидрокси-2-метил-3-'-трифторметил)пропионанилид).
[0323] Указанные выше терапевтические подходы можно комбинировать с любым из множества хирургических, химиотерапевтических режимов или режимов лучевой терапии. Терапевтические подходы настоящего изобретения в некоторых вариантах осуществления настоящего изобретения могут позволить применять пониженные дозы химиотерапии (или других терапий) и/или более редкое введение, что является преимуществом для всех пациентов и особенно для пациентов, которые плохо переносят токсичность химиотерапевтического агента.
XVI.) Наборы/готовые изделия
[0324] В объем настоящего изобретения входят наборы для применения в лаборатории, в прогностических, профилактических, диагностических и терапевтических сферах применения. Такие наборы могут содержать носитель, упаковку или контейнер, разделенный на отсеки для хранения одного или нескольких контейнеров, таких как флаконы, пробирки и подобное, при этом каждый контейнер содержит один из отдельных элементов для применения в способе, а также этикетку или вкладыш с инструкцией по применению, такому как применение, описанное в настоящей заявке. Например, контейнер(ы) может содержать антитело, которое является или может быть помечено детектируемой меткой. Наборы могут содержать контейнер, содержащий компонент «лекарственное средство». Набор может содержать все или часть аминокислотных последовательностей с Фигуры 2 или Фигуры 3 или их аналогов, или молекулу нуклеиновой кислоты, которая кодирует такие аминокислотные последовательности.
[0325] Набор настоящего изобретения в некоторых вариантах осуществления настоящего изобретения, как правило, будет содержать контейнер, описанный выше, и один или несколько других контейнеров, связанных с ними, содержащих материалы, подходящие с точки зрения производителя или пользователя, включая буферы, растворители, фильтры, иглы, шприцы; этикетки на носителе, упаковке, контейнере, флаконе и/или пробирке с перечислением содержимого и/или инструкции по применению и вкладыши с инструкцией по применению.
[0326] Этикета может находиться на контейнере или с контейнером, указывая на то, что композицию применяют для конкретной терапии или для нетерапевтической сферы применения, такой как прогностическая, профилактическая, диагностическая или лабораторная сфера применения, а также может содержать указания для применения либо in vivo, либо in vitro, такого как описанное в настоящей заявке. Указания и/или другая информация также может быть включена во вкладыш(и) или в этикетку(и), входящую в состав набора или расположенную на наборе. Этикетка может находиться на контейнере или быть связанной с контейнером. Этикетка может находиться на контейнере, когда буквы, числа или другие знаки, образующие этикетку, выбиты или выгравированы на самом контейнере; этикетка может быть связана с контейнером, когда она присутствует внутри емкости или носителя, который также удерживает контейнер, например, как вкладыш. На этикетке можно указать, что композицию применяют для диагностики, лечения, профилактики или прогнозирования состояния, такого как рак ткани, представленной в Таблице I.
[0327] Термины «набор» и «готовое изделие» можно применять как синонимы.
[0328] В другом варианте осуществления настоящего изобретения представлено готовое изделие (изделия), содержащие композиции, такие как антитело (антитела), конъюгаты антител с лекарственным средством, например, материалы, применимые для диагностики, прогнозирования, профилактики и/или лечения рака тканей, таких как представленные в Таблице I. Готовое изделие, как правило, содержит по меньшей мере один контейнер и по меньшей мере одну этикетку. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы и лабораторные пробирки. Контейнеры могут быть сделаны из множества материалов, таких как стекло, металл или пластик. В контейнере моно держать аминокислотною последовательность (последовательности), малую молекулу (молекулы), последовательности нуклеиновой кислоты (кислот), клеточную популяцию (популяции) и/или антитело (антитела). В другом варианте осуществления настоящего изобретения контейнер содержит антитело, его связывающий фрагмент или специфичный связывающий белок для применения в оценке экспрессии белка CD37 в клетках и тканях или для подходящих лабораторных, прогностических, диагностических, профилактических и терапевтических целей; показания и/или указания по такому применению могут находиться на контейнере или с контейнером, как и реактивы и другие композиции или приспособления, применяемые для этих целей.
[0329] Альтернативно, контейнер может содержать композицию, эффективную для лечения, диагностики, прогнозирования или профилактики состояния, и может иметь стерильное входное отверстие (например, контейнер может быть пакетом с раствором для внутривенного введения или флаконом с пробкой, проницаемой для иглы для подкожной инъекции). Активным агентом в композиции может быть антитело, способное специфично связывать CD37, или конъюгат антитела, специфично связывающий CD37.
[0330] Готовое изделие может далее содержать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как фосфатно-солевой буфер, раствор Рингера и/или раствор декстрозы. Оно может далее включать другие материалы, подходящие с точки зрения производителя или пользователя, включая другие буферы, растворители, фильтры, мешалки, иглы, шприцы и/или вкладыши с показаниями и/или инструкциями по применению.
ПРИМЕРЫ:
[0331] Далее описаны различные аспекты настоящего изобретения и проиллюстрированы с помощью нескольких следующих примеров, ни один из которых не предназначен для ограничения объема настоящего изобретения.
Пример 1
Антиген CD37
[0332] CD37, также известный как лейкоцитарный антиген CD37 (а также, среди прочего, как тетраспанин-26 (Tetraspanin-26)), является белком, который кодируется геном CD37. Белок, кодирующийся данным геном, является частью суперсемейства трансмембранных белков 4, также известного как семейство тетраспанинов. Большинство членов этого семейства являются белками клеточной поверхности, характеризующимися наличием гидрофобных доменов. Эти белки опосредуют передачу сигнала, вовлеченную в регуляцию развития, активации, роста и подвижности клетки. Данный кодируемый белок является поверхностным гликопротеином, который, как известно, образует комплекс с интегринами и другими членами суперсемейства трансмембранных белков 4. См. Virtaneva KI, et. al., Immunogenetics 37(6): 461-465 (Mar. 1993). См. также Horejsi, et. al., FEBS Letters, Vol. 288 no. 1,2 pp. 1-4 (Aug. 1991). См. также Link, et. al., J. Immun., vol. 137 no. 9, pp. 3013-3018 (Nov. 1968). Также отмечали, что альтернативный сплайсинг приводит к образованию множества вариантов транскрипта, кодирующих разные изоформы. Tomlinson, et. al., Mol. Immun., vol 33, No. 10 pp 867-872 (1996). кДНК CD37 составляет 1263 п.о. в длину и кодирует 281 аминокислоту в открытой рамке считывания (См. Фигуру 1). Примеры вариантов применения антигена CD37 см. на Фигуре 1.
Пример 2
Получение моноклональных антител к CD37
[0333] В одном варианте осуществления настоящего изобретения терапевтические моноклональные антитела к CD37 содержат моноклональные антител, которые реагируют с эпитопами, специфичными для CD37, которые будут связывать CD37, экспрессирующийся на клетках. Иммуногены для получения таких моноклональных антител включают иммуногены, созданные так, что они кодируют или содержат внеклеточные домены последовательности полноразмерного белка CD37, области, для которых предсказано наличие функциональных мотивов, и антигенные области CD37, согласно предсказанию с помощью компьютерного анализа аминокислотной последовательности. Иммуногены включают пептиды рекомбинантные белки и клетки, которые эндогенно экспрессируют CD37 или которые сконструировали так, чтобы они экспрессировали CD37 (такие как 293T-CD37).
[0334] Моноклональные антитела к CD37 был получены с помощью технологии VelocImmune® (Regeneron, Tarrytown, NY), в которой генно-инженерные мыши производят антитела, имеющие полностью человеческие вариабельные области и мышиные константные области. Моноклональное антитело, названное HvCD37-6b15.1.1, было получено после иммунизации мышей Velocimmune рекомбинантными клетками 293T, экспрессирующими CD37. Моноклональное антитело к CD37 HvCD37-6b15.1.1 специфично связывает экспрессирующие CD37 клетки (рекомбинантные и эндогенные).
[0335] После селекции моноклональное антитело HvCD37-6b15.1.1 (естественно образованное гибридомной клеточной линией) превращали в экспрессирующееся к клетках яичника китайского хомяка (CHO, Chinese Hamster Ovary) полностью человеческое антитело, комбинируя последовательности человеческой вариабельной области из антитела velocimmune с человеческими константными областями.
[0336] Последовательности ДНК, кодирующие моноклональное антитело к CD37 HvCD37-6b15.1.1, определяли после выделения мРНК из соответствующих гибридомных клеток с помощью реактива Trizol (Life Technologies, Gibco BRL).
[0337] Последовательности нуклеиновых кислот вариабельных областей тяжелой и легкой цепей анти-CD37 HvCD37-6b15.1.1 секвенировали из гибридомных клеток по следующему протоколу. Секретирующие HvCD37-6b15.1.1 гибридомные клетки лизировали реактивом Trizol (Life Technologies, Gibco BRL). Проводили очистку и определяли количество общей РНК. Первую цепь кДНК получали из общей РНК с помощью олиго(dT)12-18 праймеров, применяя систему Gibco-BRL Superscript Preamplification system. Первую цепь кДНК амплифицировали с помощью праймеров к вариабельной области тяжелой цепи человеческого иммуноглобулина и праймеров к вариабельной области легкой цепи человеческого иммуноглобулина. ПЦР-продукты секвенировали и определяли вариабельные области тяжелой и легкой цепей.
[0338] Последовательности нуклеиновых кислот и аминокислот вариабельных областей тяжелой и легкой цепей перечислены на Фигуре 2 и Фигуре 3. Выравнивание моноклонального антитела HvCD37-6b15.1.1 с человеческим Ig зародышевой линии приведено на Фигуре 4A-4B.
Пример 3
Экспрессия HvCD37-6b15.1.1 с помощью способов рекомбинантной ДНК
[0339] Для рекомбинантной экспрессии моноклональных антител HvCD37-6b15.1.1 в трансфицированных клетках последовательности вариабельной области тяжелой и легкой цепей моноклонального антитела HvCD37-6b15.1.1 клонировали перед константными областями тяжелой цепи человеческого IgG2 и легкой цепи человеческого Igκ, соответственно. Полные кассеты человеческой тяжелой и легкой цепей моноклонального антитела HvCD37-6b15.1.1 клонировали после промотора/энхансера ЦМВ в вектор для клонирования. Сайт полиаденилирования вводили после кодирующей последовательности моноклонального антитела. Конструкцией для экспрессии рекомбинантного моноклонального антитела HvCD37-6b15.1.1 трансфицировали клетки CHO. Моноклональное антитело HvCD37-6b15.1.1, секретируемое рекомбинантными клетками, оценивали на предмет связывания клеточных линий рака человека, экспрессирующих CD37, с помощью сортировки клеток с активированной флуоресценцией (FACS, fluorescence activated cell sorting) (см. Таблицу VI). Связывание детектировали с помощью проточной цитометрии. Результаты показывают, что рекомбинантно экспрессирующееся HvCD37-6b15.1.1, экспрессирующееся в клетках CHO, связывает CD37 на поверхности клеток.
[0340] Результаты показывают, что рекомбинантно экспрессирующееся HvCD37-6b15.1.1, экспрессирующееся в клетках CHO, связывает CD37 схожим образом с HvCD37-6b15.1.1, очищенным из гибридомы. Моноклональное антитело HvCD37-6b15.1.1, секретируемое рекомбинантными клетками, также оценивали на предмет связывания рекомбинантного белка CD37 с помощью ELISA. Связывание HvCD37-6b15.1.1 с белком CD37 было идентичным у препарата моноклональных антител, полученных из клеток CHO и из гибридомных клеток.
[0341] Клетки яичника китайского хомяка (CHO, Chinese Hamster Ovary), образующие антитело, называемое HvCD37-6b15.1.1, отправили (почтой Federal Express) в Американскую коллекцию клеточных культур (ATCC, American Type Culture Collection), P.O. Box 1549, Manassas, VA 20108 8 июля 2013 г., и им присвоили учетный номер 120464.
[0342] По результатам экспериментального анализа с применением известных в данной области техники способов (например, протеазного расщепления, жидкостной хроматографической масс-спектрометрии и т.п.) аминокислотные модификации моноклонального антитела HvCD37-6b15.1.1, полученного из клеток CHO, показали, что обычная тяжелая цепь содержит модификацию N-концевого глутамина до пироглутамата и делецию C-концевого лизина тяжелой цепи в препаратах очищенных моноклональных антител HvCD37-6b15.1.1.
Пример 4
Образование конъюгата моноклонального антитела HvCD37-6b15.1.1 с лекарственным средством
[0343] Моноклональное антитело HvCD37-6b15.1.1 (Фигура 2) конъюгировали с производным ауристатина, обозначаемым MMAE (Формула XI), применяя vc (Val-Cit, Валин-цитрулиновый) линкер, описанный в настоящей заявке для создания конъюгата антитела с лекарственным средством, обозначаемого HvCD37-6b15.1.1vcMMAE, применяя следующие протоколы. Конъюгирование линкера vc (Val-Cit) с MMAE (Seattle Genetics, Seattle, WA) завершали, применяя стандартный способ, представленный в Таблице IV, для создания цитотоксического vcMMAE (см. US/2006/0074008).
[0344] Затем получали конъюгат антитела с лекарственным средством, обозначаемый HvCD37-6b15.1.1vcMMAE, применяя следующие протоколы.
[0345] Вкратце, 2,7 мг/мл моноклональных антител HvCD37-6b15,1,1 добавляют в 35,5 мл фосфатно-солевого буфера при pH 7,4 с 1% объема 5Н NaCl, 11% объема of 0,5 Н натриевоборатного буфера pH 9,0 и 1% объема 0,5M ЭДТА, чтобы довести pH раствора до 8,9, 5мМ ЭДТА и 50 мМ хлорида натрия. Затем моноклональное антитело частично восстанавливают, добавляя 11,5 молярных эквивалентов TCEP (относительно молей моноклонального антитела), а затем перемешивают при 37°C в течение 2,5 часов. Раствор частично восстановленного моноклонального антитела затем остужают до комнатной температуры и добавляют 5,2 молярных эквивалентов vcММAE (относительно молей антитела) в виде 8% (об/об) раствора в ДМСО. Смесь перемешивают в течение шестидесяти (60) минут при комнатной температуре, а затем в течение дополнительных десяти (10) минут после добавления пять (5) молярных эквивалентов N-ацетилцистеина относительно моноклонального антитела. Избыток инактивированного vcММAE и другие компоненты реакции удаляют ультрафильтрацией/диафильтрацией конъюгата антитела с лекарственным средством с помощью 6 диаобъемов 20 мМ гистидина, pH 5,2, а затем добавляли 40% концентрированный раствор сахарозы, чтобы довести концентрацию сахарозы до 5%.
[0346] Образующийся в результате конъюгат антитела с лекарственным средством обозначают HvCD37-6b15.1.1vcMMAE, и он имеет следующую формулу:
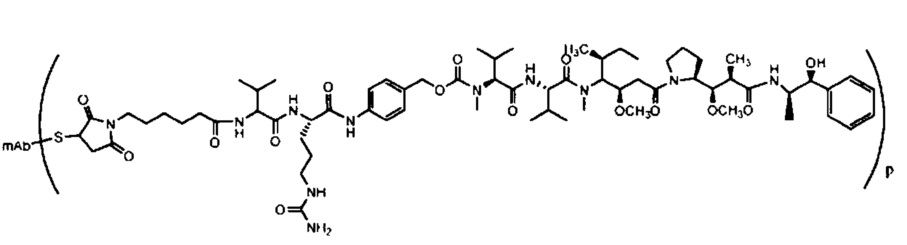
где MAb является HvCD37-6b15.1.1 (Фигура 2 и Фигура 3) и p составляет от 1 до 10. Предпочтительное значение p конъюгата антитела с лекарственным средством, описанного в данном примере, составляет от 3,5 до 3,7.
Пример 5
Характеристика моноклонального антитела HvCD37-6b15.1.1
[0347] Моноклональные антитела, связывающиеся с CD37, получали с помощью процедур, описанных в примере «Получение моноклональных антител к CD37», и проводили их скрининг, идентифицировали и характеризовали при помощи комбинации исследований, известных в данной области техники.
A. Связывание в исследовании FACS (fluorescence activated cell sorting, сортировка клеток с активированной флуоресценцией)
[0348] HvCD37-6b15.1.1 тестировали на предмет связывания с различными клеточными линиями неходжкинской лимфомы, хронической лейкоцитарной лейкемии и острой миелоидной лейкемии (см. Таблицу VI), выращенными in-vitro. HvCD37-6b15.1.1 и подобранное по изотипу контрольное антитело биотинилировали с помощью NHS LC биотина. Во всех экспериментах применяли in vitro раковые линии, растущие экспоненциально. Вкратце, клетки собирали и промывали центрифугированием. Антитела растворяли до конечной концентрации 5 мкг/мл и коинкубировали с клетками при 4°C в течение 1 часа. В конце инкубации клетки промывали и инкубировали с вторичным идентифицирующим антителом со стрептавидин-фикоэритрином в конечном разведении 1:400 (1, мкг/мл) в течение 1 ч при 4°C. После отмывки несвязавшегося вторичного антитела клетки анализировали с помощью FACS, всего в образца детектировали 10000 событий. Файлы с данными анализировали с помощью FlowJo и определяли и регистрировали среднее геометрическое флуоресценции. Отношение флуоресценции рассчитывали следующим образом: среднее геометрическое AGS67C/среднее геометрическое изотипического контроля=отношение средней флуоресценции, меры кратности превышения экспрессии над изотипическим контролем.
[0349] Получали значения среднего геометрического и отношения средней флуоресценции (Таблица VI) и строили гистограммы (Таблица VII). Результаты показывают, что HVCD37-6b15.1.1 связывает несколько клеточных линий рака человека, неходжкинской лимфмы, хронической лимфоцитарной лейкемии и острой миелоидной лейкемии.
Пример 6
HvCD37-6b15.1.1vcMMAE ингибирует рост опухолей In Vivo
[0350] Значительный уровень экспрессии CD37 в раковых клетках вместе с ограниченной экспрессией в нормальных клетках делает CD37 хорошей мишенью для терапии антителами и также для терапии конъюгатами антитела с лекарственным средством. Таким образом, оценивают терапевтическую эффективность HvCD37-6b15.1.1vcMMAE в ксенотрансплантатных мышиных моделях человеческой хронической лейкоцитарной лейкемии, острой миелоидной лейкемии и неходжскинской лимфомы.
[0351] Эффективность конъюгата антитела с лекарственным средством в отношении роста опухоли и образования метастазов исследуют на ксенотрансплантатных мышиных моделях например, подкожных или ортотопических).
[0352] Подкожные (п/к) опухоли получают инъекцией 5×104-106 раковых клеток, разведенных 1:1 матригелем (Matrigel) (Collaborative Research), в правый бок самцов мышей SCID. Для оценки эффективности конъюгата антитела с лекарственным средством в отношении образования опухоли инъекции конъюгата антитела с лекарственным средством начинают в тот же день, что и инъекции раковых клеток. В контроле мышей инъецируют либо очищенным человеческим IgG, либо фосфатно-солевым буфером; или очищенным моноклональным антителом, которое узнает посторонний антиген, не экспрессирующийся на человеческих клетках. В предварительных исследованиях не обнаруживают различий между контрольными IgG или фосфатно-солевым буфером в отношении роста опухоли. Размеры опухоли определяют, делая измерения циркулем, а объем опухоли рассчитывают как ширина2×длина/2, где ширина является наименьшим измерением и длина является набольшим измерением. Мышей с подкожной опухолью более 1,5 см в диаметре умерщвляют.
[0353] Преимуществом ксенотрансплантатных моделей рака является возможность исследования неоваскуляризации и ангиогенеза. Рост опухоли частично зависит от развития новых кровеносных сосудов. Хотя система капилляров и развивающаяся сеть кровеносных сосудов происходят от хозяина, начало образования и архитектуру новообразованных сосудов регулирует ксенотрансплантатная опухоль (Davidoff et al., Clin Cancer Res. (2001) 7:2870; Solesvik et al., Eur J Cancer Clin Oncol. (1984) 20:1295). Эффект антител и малых молекул на неоваскуляризацию исследуют в соответствии с процедурами, известными в данной области техники, такими как иммуногистохимический анализ опухолевых тканей и расположенного вокруг них микроокружения.
[0354] HvCD37-6b15.1.1ADC ингибирует формирование раковых ксенотрансплантатов в случае раковых клеточных линий DoHH2, Ramos-RR-XCL, CLL-JVM3, AML-MV-4-11 и человеческой лимфомы Раджи. Эти результаты указывают на применимость HvCD37-6b15.1.1ADC в лечении локализованной и распространенной стадий рака и, предпочтительно, видов рака, представленных в Таблице I.
Конъюгаты антитела к CD37 с лекарственным средством:
[0355] Моноклональные антитела к CD37 получали, как описано в Примере «Получение моноклональных антител к CD37». Далее моноклональные антитела конъюгировали с токсином, как описано в Примере «Образование конъюгата моноклонального антитела HvCD37-6b15.1.1 с лекарственным средством», для образования HvCD37-6b15.1.1vcMMAE. HvCD37-6b15.1.1 и HvCD37-6b15.1.1vcMMAE характеризуют с помощью FACS и других способов, известных в данной области техники, для определения способности связывать CD37.
Клеточные линии и ксенотрансплантаты:
[0356] Клетки поддерживали в модифицированной по способу Дульбекко среде Игла (Dulbecco modified Eagle’s medium) DMEM с добавлением L-глутамина и 10% фетальной бычьей сыворотки, как известно в данной области техники. Ксенотрансплантаты DoHH2, Ramos-RR-XCL, CLL-JVM3, AML-MV-4-11 и человеческой лимфомы Раджи поддерживали серийным размножением в мышах.
Оценка HvCD37-6b15.1.1.vcMMAE в подкожной человеческой фолликулярной В-клеточной лимфоме DoHH2, имплантированной мышам CB17/SCID.
[0357] В данном эксперименте клетки человеческой фолликулярной В-клеточной лимфомы DoHH2 (10×106 клеток на мышь) инъецировали в бока отдельных мышей CB17/SCID и давали расти опухоли без обработки, пока размер опухоли не достигал приблизительно 200 мм3(измерения проводили 2 раза в неделю). В этой точке животных разделяли на группы по объему опухоли на момент начала лечения, чтобы обеспечить сходный средний размер опухоли и вариабельность в каждой группе, с помощью программы Study Director (v.1.7; Studylog Systems, Inc., Южный Сан-Франциско, штат Калифорния). Все группы, обработанные конъюгатом антител с лекарственным средством, получили две (2) дозы в день ноль (0) и на седьмой (7) день посредством внутривенной болюсной инъекции. За ростом опухоли в каждой группе наблюдали дважды в неделю, проводя измерения циркулем, до окончания исследования. Статистический анализ объема опухоли проводили в последней временной точке, когда данные всех групп были доступны, применяя непараметрический дисперсионный анализ (ANOVA) упорядоченных данных.
[0358] Результаты показывают, что HvCD37-6b15.1.1vcMMAE проявлял сильный ингибирующий эффект с повышением дозы при сравнении с необработанным контролем (p<0,0001) (Фигура 5).
Оценка HvCD37-6b15.1.1.vcMMAE в подкожной ксенотрансплантатной модели человеческой лимфомы Ramos-RR-XCL, имплантированной мышам CB17/SCID.
[0359] В другом эксперименте клетки человеческой лимфомы Ramos-RR-XCL (3×106 клеток на мышь) инъецировали в бока отдельных мышей CB17/SCID и давали расти опухоли без обработки, пока размер опухоли не достигал приблизительно 200 мм3(измерения проводили 2 раза в неделю). В этой точке животных разделяли на группы по объему опухоли на момент начала лечения, чтобы обеспечить сходный средний размер опухоли и вариабельность в каждой группе, с помощью программы Study Director (v.1.7; Studylog Systems, Inc., Южный Сан-Франциско, штат Калифорния). Все группы, обработанные конъюгатом антител с лекарственным средством, получили две (2) дозы в день ноль (0) и на шестой (6) день посредством внутривенной болюсной инъекции. Дополнительно четыре дозы ритуксана вводили в дни 0, 3, 6 и 9 (Ramos-RR-XCL является устойчивой к ритуксану клеточной линией). За ростом опухоли в каждой группе наблюдали дважды в неделю, проводя измерения циркулем, до окончания исследования. Статистический анализ объема опухоли проводили в последней временной точке, когда данные всех групп были доступны, применяя непараметрический дисперсионный анализ (ANOVA) упорядоченных данных.
[0360] Результаты показывают, что HvCD37-6b15.1.1vcMMAE проявлял сильный ингибирующий эффект с повышением дозы при сравнении с необработанным контролем или с соответствующим контрольным конъюгатом антитела с лекарственным средством H3-12bc1.1vcMMAE (оба p<0,0001) (Фигура 6).
Исследование эффективности HvCD37-6b15.1.1.vcMMAE в отношении подкожной человеческой хронической лимфоцитарной лейкемии JVM3, имплантированной мышам CB17/SCID
[0361] В другом эксперименте клетки хронической лимфоцитарной лейкемии JVM3 (10×106 клеток на мышь) инъецировали в бока отдельных мышей CB17/SCID и давали расти опухоли без обработки, пока размер опухоли не достигал приблизительно 200 мм3(измерения проводили 3 раза в неделю). В этой точке животных разделяли на группы по объему опухоли на момент начала лечения, чтобы обеспечить сходный средний размер опухоли и вариабельность в каждой группе, с помощью программы Study Director (v.1.7; Studylog Systems, Inc., Южный Сан-Франциско, штат Калифорния). Все группы, обработанные конъюгатом антител с лекарственным средством, получили три (3) дозы в день ноль (0), на седьмой (7) день и на четырнадцатый (14) день посредством внутривенной болюсной инъекции. За ростом опухоли в каждой группе наблюдали дважды в неделю, проводя измерения циркулем, до окончания исследования. Статистический анализ объема опухоли проводили в последней временной точке, когда данные всех групп были доступны, применяя непараметрический дисперсионный анализ (ANOVA) упорядоченных данных.
[0362] Результаты показывают, что HvCD37-6b15.1.1vcMMAE проявлял сильный ингибирующий эффект с повышением дозы при сравнении с контролем с инертным носителем (p<0,0001) или с соответствующим контрольным конъюгатом антитела с лекарственным средством H3-12bc1.1vcMMAE (p<0,0001) (Фигура 7).
Исследование эффективности HvCD37-6b15.1.1.vcMMAE в отношении подкожной человеческой острой миелогенной лейкемии MV-4-11, имплантированной мышам CB17/SCID
[0363] В другом эксперименте клетки хронической миелогенной лейкемии MV-4-11 (3×106 клеток на мышь) инъецировали в бока отдельных мышей CB17/SCID и давали расти опухоли без обработки, пока размер опухоли не достигал приблизительно 200-250 мм3(измерения проводили 3 раза в неделю). В этой точке животных разделяли на группы по объему опухоли на момент начала лечения, чтобы обеспечить сходный средний размер опухоли и вариабельность в каждой группе, с помощью программы Study Director (v.1.7; Studylog Systems, Inc., Южный Сан-Франциско, штат Калифорния). Все группы, обработанные конъюгатом антител с лекарственным средством, получили три (3) дозы в день ноль (0), на седьмой (7) день и на четырнадцатый (14) день посредством внутривенной болюсной инъекции. За ростом опухоли в каждой группе наблюдали дважды в неделю, проводя измерения циркулем, до окончания исследования. Статистический анализ объема опухоли проводили в последней временной точке, когда данные всех групп были доступны, применяя непараметрический дисперсионный анализ (ANOVA) упорядоченных данных.
[0364] Результаты показывают, что HvCD37-6b15.1.1vcMMAE проявлял сильный дозозависимый ингибирующий эффект при сравнении с контролем с инертным носителем (p<0,0001) или с соответствующим контрольным конъюгатом антитела с лекарственным средством H3-12bc1.1vcMMAE (p=0,0001) (Фигура 8).
Исследование эффективности HvCD37-6b15.1.1.vcMMAE в отношении подкожной клеточной линии человеческой устойчивой к ритуксану лимфомы Ramos-RR-XCL, имплантированной мышам SCID.
[0365] В другом эксперименте клетки человеческой лимфомы Ramos-RR-XCL (3×106 клеток на мышь) инъецировали в бока отдельных мышей ICR/SCID и давали расти опухоли без обработки, пока размер опухоли не достигал приблизительно 200 мм3(измерения проводили 2 раза в неделю). В этой точке животных разделяли на группы по объему опухоли на момент начала лечения, чтобы обеспечить сходный средний размер опухоли и вариабельность в каждой группе, с помощью программы Study Director (v.1.7; Studylog Systems, Inc., Южный Сан-Франциско, штат Калифорния). Все группы, обработанные конъюгатом антител с лекарственным средством, получили четыре (4) дозы в день ноль (0), на четвертый (4) день, на седьмой (7) день и на одиннадцатый (11) день посредством внутривенной болюсной инъекции. За ростом опухоли в каждой группе наблюдали дважды в неделю, проводя измерения циркулем, до окончания исследования. Статистический анализ объема опухоли проводили в последней временной точке, когда данные всех групп были доступны, применяя непараметрический дисперсионный анализ (ANOVA) упорядоченных данных.
[0366] Результаты показывают, что HvCD37-6b15.1.1vcMMAE проявлял значительно более выраженный ингибирующий эффект по сравнению с конъюгатом антител к CD37 с лекарственным средством в дозе 1 мг/кг (Фигура 9).
Исследование эффективности HvCD37-6b15.1.1.vcMMAE и HvCD37-6b15.1.1 в отношении подкожной ксенотрансплантатной модели клеточной линии человеческой острой моноцитарной лейкемии MOLM-13, имплантированной мышам SCID.
[0367] В другом эксперименте клетки человеческой острой моноцитарной лейкемии MOLM-13 (1,0×106 клеток на мышь) инъецировали в бока отдельных мышей SCID и давали расти опухоли. Когда средний объем опухоли достигал заранее определенного значения (например, 200 мм3), животных распределяли в соответствии с размером и рандомизировали в группу получающих лечение и контрольную группу со схожим средним размером опухоли и вариабельностью в каждой группе с помощью программы Study Director (v.2.1; Studylog Systems, Inc., Южный Сан-Франциско, штат Калифорния). HvCD37-6b15.1.1vcMMAE и HvCD37-6b15.1.1 давали в дозировке 1,0 мг/кг либо в виде однократной дозы, либо раз в неделю всего две (2) дозы посредством внутривенной болюсной инъекции. Контрольный конъюгат антитела с лекарственным средством и контрольное моноклональное антитело, Ha8-7acd6.1-vcMMAE и Ha8-7acd6.1, давали в дозировке 1,0 мг/кг раз в неделю всего две (2) дозы посредством внутривенной болюсной инъекции. Пятипроцентную (5)% декстрозу применяли в качестве контроля с инертным носителем. Все агенты вводили на основании индивидуального веса тела каждого животного, определенного непосредственно перед введением каждой дозы. За ростом опухоли в каждой группе наблюдали дважды (2х) в неделю, проводя измерения циркулем, до окончания исследования. Статистический анализ объема опухоли в последний день перед умерщвлением животного проводили, применяя критерий Краскела-Уоллиса. Парные сравнения проводили с помощью критерия Тьюки (2-стороннего), чтобы минимизировать групповую вероятность ошибки. Исследование оценивало эффективность HvCD37-6b15.1.1vcMMAE и сравнивало ее с чистым компонентом «антитело» HvCD37-6b15.1.1 в ксенотрансплантатной модели человеческой острой моноцитарной лейкемии MOLM-13.
[0368] Результаты показывают, что чистое моноклональное антитело HvCD37-6b15.1.1 не эффективно по сравнению с конъюгатом антитела с лекарственным средством HvCD37-6b15.1.1vcMMAE, который проявлял значительно более выраженный ингибирующий эффект (Фигура 11).
Заключение
[0369] Подводя итог вышеизложенного, следует отметить, что Фигуры 5-9 и 11 показывают, что конъюгат антитела к CD37 с лекарственным средством, обозначаемый HvCD37-6b15.1.1vcMMAE, в значительной степени ингибировал рост опухолевых клеток, экспрессирующих CD37, по сравнению с контрольными конъюгатами антитела с лекарственным средством. Таким образом, HvCD37-6b15.1.1vcMMAE можно применять в терапевтических целях для лечения и контроля видов рака, представленных в Таблице I. Дополнительно можно продемонстрировать, что конъюгат антитела с лекарственным средством, обозначаемый HvCD37-6b15.1.1, проявляет значительно более выраженный ингибирующий, чем другие конъюгаты антитела с лекарственным средством, направленные на CD37, и другие антитела к CD37. Соответственно, значительные эффекты HvCD37-6b15.1.1 демонстрируют его важность как терапевтического агента для лечения и контроля видов рака, представленных в Таблице I.
Пример 7
Человеческие клинические исследования для лечения и диагностики карцином человека с помощью конъюгатов антител к CD37 с лекарственным средством
[0370] В некоторых вариантах осуществления настоящего изобретения конъюгаты антител к CD37 с лекарственным средством применяют в соответствии с настоящим изобретением, специфически связывая CD37, и применяют в лечении определенных опухолей, предпочтительно, перечисленных в Таблице I. в связи с каждым из этих показаний успешно применяют два клинических подхода.
[0371] I.) Вспомогательная терапия: при вспомогательной терапии пациентов лечат конъюгатами антител к CD37 с лекарственным средством в комбинации с химиотерапевтическим или антинеопластическим агентом и/или с лучевой терапией или с их комбинацией. Первичные опухолевые мишени, такие как перечисленные в Таблице I, лечат по стандартным протоколам, добавляя конъюгаты антител к CD37 с лекарственным средством к стандартным терапиям первой и второй линии. Дизайн протоколов направлен на достижение эффективности, как оценивают по следующим примерам, включая, но не ограничиваясь уменьшением массы опухоли первичного очага или метастазов, увеличением продолжительности выживания без прогрессии, общей выживаемости, улучшением состояния здоровья пациентов, стабилизацией заболевания, а также возможностью уменьшать дозы стандартной химиотерапии или других биологических агентов. Такое уменьшение доз позволяет проводить дополнительную и/или более длительную терапию за счет уменьшения связанной с дозой токсичности химиотерапевтического или биологического агента. Конъюгаты антител к CD37 с лекарственным средством применяют в нескольких вспомогательных клинических исследованиях в комбинации с химиотерапевтическими или антинеопластическими агентами.
[0372] II.) Монотерапия: в случаях применения конъюгатов антител к CD37 с лекарственным средством в монотерапии рака конъюгаты антител к CD37 с лекарственным средством вводят пациентам без химиотерапевтического или антинеопластического агента. В одном варианте осуществления настоящего изобретения монотерапию проводят клинически для пациентов на последней стадии рака при распространенном метастазирующем заболевании. Дизайн протоколов направлен на достижение эффективности, как оценивают по следующим примерам, включая, но не ограничиваясь уменьшением массы опухоли первичного очага или метастазов, увеличением продолжительности выживания без прогрессии, общей выживаемости, улучшением состояния здоровья пациентов, стабилизацией заболевания, а также возможностью уменьшать дозы стандартной химиотерапии или других биологических агентов.
Дозировка
[0373] Режимы дозирования можно подбирать для обеспечения оптимального желаемого ответа. Например, можно вводить разовую дозу, можно вводить несколько разделенных доз в течение периода времени или дозу можно пропорционально уменьшить или увеличить, как того требует терапевтическая ситуация. Особенным преимуществом является составление в форме парентеральных композиций в дозированной форме для легкого введения и единообразия доз. Дозированная форма, как применяют в настоящей заявке, обозначает физически отдельные единицы, подходящие в качестве однократных доз подлежащим лечению субъектам, являющимся млекопитающими; каждая единица содержит заранее определенное количество активного соединения, рассчитанное таким образом, чтобы вызвать желаемый терапевтический эффект будучи ассоциированным с необходимым фармацевтическим носителем. Описание дозированных форм настоящего изобретения в некоторых вариантах осуществления настоящего изобретения было продиктовано и напрямую зависело от (a) уникальных характеристик антитела и/или конъюгата антитела с лекарственным препаратом и конкретного терапевтического или профилактического эффекта, который необходимо достигнуть, и (b) ограничений, присущих области техники приготовления лекарственного средства, такого как соединение для лечения чувствительности у индивидуумов.
[0374] Примерным неограничивающим интервалом терапевтически эффективного количества конъюгата антител к CD37 с лекарственным средством, вводимого в комбинации в соответствии с настоящим изобретением, является интервал от приблизительно 0,5 до приблизительно 10 мг/кг, от приблизительно 1 до приблизительно 5 мг/кг, по меньшей мере 1 мг/кг, по меньшей мере 2 мг/кг, по меньшей мере 3 мг/к или по меньшей мере 4 мг/кг. Другие примерные неограничивающие интервалы составляют, например, от приблизительно 0,5 до приблизительно 5 мг/кг или, например, от приблизительно 0,8 до приблизительно 5 мг/кг или, например, от приблизительно 1 до приблизительно 7,5мг/кг. Высокодозовый вариант применения настоящего изобретения относится к дозировке, превышающей 10 мг/кг. Следует отметить, что значения доз могут варьировать в зависимости от типа и тяжести состояния, которое нужно облегчить, и могут включать однократные ил многократные дозы. Также следует понимать, что под каждого конкретного субъекта следует подбирать конкретные режимы дозирования в течение времени в соответствии с индивидуальными потребностями и профессиональным мнением человека, осуществляющего введение или руководящего ведением композиций, и что дозовые интервалы, описанные в настоящей заявке, являются лишь иллюстративными и не должны ограничивать объем или практическое применения заявленной композиции.
План клинических исследований (CDP)
[0375] План клинических исследований отслеживает и разрабатывает лечение конъюгатами антител к CD37 с лекарственным средством в связи с вспомогательной терапией или монотерапией. Исследования сначала демонстрируют безопасность, а затем подтверждают эффективность повторных доз. Исследования являются открытыми, сравнивающими стандартную химиотерапию со стандартной химиотерапией плюс конъюгаты антител к CD37 с лекарственным средством. Следует принимать во внимание, что одним неограничивающим критерием, который можно применять в связи с включением пациентов, является уровень экспрессии CD37 в их опухолях, определенный с помощью биопсии.
[0376] Как и с любым терапевтическим средством на основе инфузии белка или антитела, вопросы, связанные с безопасностью, относятся в первую очередь к (i) синдрому высвобождения цитокинов, т.е. гипотензии, лихорадке, дрожи, ознобе; (ii) развитию иммуногенного ответа на материал (т.е. выработка пациентом человеческих антител к терапевтическому антителу или ответ выработкой человеческих антител к мышиным антителам); и (iii) токсичности по отношения к нормальным клеткам, экспрессирующим CD37. Для контроля каждого из этих вопросов, связанных с безопасностью, применяют стандартные тесты и наблюдения. Обнаружено, что конъюгаты антител к CD37 с лекарственным средством являются безопасными при введении людям.
Пример 8
Определение белка CD37 в образцах пациентов с раком с помощью иммуногистохимии
[0377] Экспрессию белка CD37 исследовали с помощью иммуногистохимии в образцах опухоли пациентов с неходжкинской лимфомой и множественной миеломой. Вкратце, фиксированные формалином залитые в парафин ткани резали на четырехмикронные (4) срезы и приклеивали к покровным стеклам. Срезы депарафинизировали, регидратировали и обрабатывали раствором для демаскирования антигена Citra (Biogenex, San Ramon, CA) в микроволновой установке EZ-Retriever (Biogenex, San Ramon, CA) в течение 45 минут при 95°C. Затем срезы обрабатывали 3% раствором пероксида водорода для инактивации активности эндогенной пероксидазы. Применяли бессывороточное белковое блокирование (Dako, Carpenteria, CA) для ингибирования неспецифичного связывания перед инкубацией с мышиным моноклональным антителом к CD37 или изотипическим контролем. Впоследствии срезы обрабатывали системой детектирования с пероксидазой хрена Super Sensitive™ Polymer-horseradish peroxidase (HRP) Detection System, состоящей из инкубации с реагентом Super Enhancer™ и последующей инкубации с конъюгатом вторичного антитела с полимером-пероксидазой хрена (BioGenex, San Ramon, CA). Затем срезы проявляли с помощью диаминобензидинового набора DAB kit (BioGenex, San Ramon, CA), ядра окрашивали гематоксилином и анализировали с помощью светлопольной микроскопии. Специфичное окрашивание детектировали в образцах пациентов с помощью иммунореактивного антитела к CD37, как видно по окрашиванию коричневым (см. Фигуру 10(A) и 10(C)). Контрольное антитело, напротив, не окрашивало образцы пациентов (см. Фигуру 10 (B) и 10(D)).
[0378] Эти результаты демонстрируют экспрессию CD37 в раковых клетках неходжкинской лимфомы и множественной миеломы. Эти результаты указывают на то, что CD37 экспрессируется при неходжкинской лимфоме и множественной миеломе человека и что антитела, направленные на этот антиген (например, HvCD37-6b15.1.1) и конъюгаты антител с лекарственным средством, обозначаемые HvCD37-6b15.1.1vcMMAE) применимы в диагностических и терапевтических целях (Фигура 10).
Пример 9
Связывание моноклональных антител HvCD37-6b15.1.1 с полученными у пациентов образцами
[0379] Связывание моноклональных антител HvCD37-6b15.1.1 оценивали в образцах мононуклеарных клеток периферической крови (МКПК) пациентов с острой лимфоцитарной лейкемией и клеточных популяциях миелоидных (острая миелоидная лейкемия), лейкемических стволовых клеток, Т-клеток и В-лимфоцитов.
А. Материалы и способы связывания в исследовании FACS
[0380] В данном эксперименте HvCD37-6b15.1.1 и подобранные по изотипу контрольные антитела биотинилировали с помощью NHS LC биотина (Thermo Scientific, Rockford, IL). Фиколл-паковые (Ficoll-Paque (GE Healthcare, Pittsburg, PA)) изоляты клеток периферической крови (МКПК) получал у пациентов с острой миелоидной лейкемией после получения согласия и одобрения. Свежеразмороженные МКПК инкубировали с коктейлем CD45, CD33, CD 38 (BD Biosciences, San Jose, CA) CD34, CD3 (Beckman Coulter, Brea, CA) и либо с HvCD37-6b15.1.1-биотин (анти-CD37), либо с изотипический контроль-биотиновыми моноклональными антителами. Коктейли для контроля флуоресценции «минус один канал» (Fluorescense minus one (FMO)) готовили с применением стрептавидин-фикоэритринового реагента для детекции (Streptavidin-PE (SAv-PE) (BD Biosciences, San Jose, CA)) и применяли для установки дискриминационного окна для клеточных популяций. Вторичное детектирование биотинилированных моноклональных антител HvCD37-6b15.1.1 и изотипического контроля проводили с помощью SAv-PE или SAv-PC5. Для сбора данных применяли проточный цитофлуориметр LSRII (BD Biosciences, San Jose, CA). Лимфоциты отбирали как CD45+ популяцию (общий лейкоцитарный антиген), в которой выделяли четыре (4) отдельные популяции: CD33+/3-/20- (миелобласты), CD33+/3-/34+/38- (лейкоцитарные стволовые клетки), CD33-/3+ (Т-лимфоциты) и CD33-/20+ (B-лимфоциты). Анализ проводили с помощью программы FlowJo версии 9.5.4 (Tri Star, Ashland, OR). Отношение средней интенсивности флуоресценции для каждого образца острой миелоидной лейкемии рассчитывали, деля среднюю интенсивность флуоресценции HvCD37-6b15.1.1 на среднюю интенсивность флуоресценции подходящего изотипического контроля.
B. Результаты
[0381] Значения среднего геометрического и отношение средней интенсивности флуоресценции получали, деля среднюю интенсивность флуоресценции HvCD37-6b15.1.1 на среднюю интенсивность флуоресценции подходящего изотипического контроля. Результаты, описанные в Таблице VIII для образцов пациентов с острой миелоидной лейкемией, демонстрируют, что моноклональные антитела HvCD37-6b15.1.1 связываются с популяциями миелоидных клеток, лейкоцитарных стволовых клеток, Т- и В-клеток в исследуемых образцах.
[0382] Более того, как показано в Таблице IX, графики распределения отношения средней интенсивности флуоресценции для всех исследуемых образцов демонстрируют высокую вариабельность в популяциях лейкоцитарных стволовых клеток и В-клеток, в то время как миелобласты и Т-клетки демонстрируют меньшую вариабельность отношения средней интенсивности флуоресценции. Отношение средней интенсивности флуоресценции миелобластов составляло около восьмидесяти пяти (85), и связывание наблюдали во всех образцах, в то время как отношение средней интенсивности флуоресценции для лейкоцитарных стволовых клеток составляло сто двадцать шесть (126), и в трех образцах наблюдали высокие уровни связывания HvCD37-6b15.1.1. Окрашивание HvCD37-6b15.1.1 В-клеток было наиболее интенсивным во всех популяциях с отношением средней интенсивности флуоресценции равным 1548, в то время как среднее связывание Т-клеток было ниже (отношение средней интенсивности флуоресценции 246), чем В-клеток (см. Таблицу IX).
[0383] Дополнительно, как показано в Таблице X, распределение клеточной популяции лимфоцитов пациента показывает, что большинство клеток представляют собой CD33+ (миелоидные) положительные, что характерно для острой миелоидной лейкемии. Также наблюдали небольшие популяции лейкоцитарных стволовых клеток (VD34+/38-), T- (CD3+) и В-клеток (CD20+). Все четыре популяции являются CD37-положительными, что подтверждает связывание HvCD37-6b15.1.1.
[0384] Совокупность результатов, представленных в Таблицах VIII, IX и X, показывает, что моноклональное антитело HvCD37-6b15.1.1 специфично связывается с тканями пациента, содержащими клетки острой миелоидной лейкемии, лейкоцитарные стволовые клетки, Т- и В-лимфоциты.
[0385] На протяжении настоящей заявки приведены ссылки на содержимое данных различных вебсайтов, публикации, патентные заявки и патенты. (Ссылки на вебсайты даны в виде унифицированных определителей местонахождения ресурса или URL (Uniform Resource Locator) во Всемирной сети Интернет). Раскрытие каждой из этих ссылок включено в настоящую заявку в полном объеме посредством ссылки.
[0386] Также объем настоящего изобретения не должен ограничиваться раскрытыми в настоящей заявке вариантами осуществления настоящего изобретения, предназначенными только для иллюстрации отдельных аспектов настоящего изобретения, и все, что является функционально эквивалентным, включено в объем настоящего изобретения. Различные модификации моделей и способов настоящего изобретения, дополнительно к описанным в настоящей заявке, станут очевидными для специалистов в данной области техники из вышеизложенного описания и принципов, и также, как предполагают, входит в объем настоящего изобретения. Также модификации или другие варианты осуществления настоящего изобретения можно внедрять в практику без отступления от существа и объема настоящего изобретения.
Таблицы
Реферат
Настоящее изобретение относится к медицине, в частности к конъюгату антитела с лекарственным средством, фармацевтической композиции для лечения злокачественного заболевания, а также к способу лечения злокачественного новообразования, экспрессирующего CD37. Осуществление изобретения расширяет арсенал средств, применяемых в лечении рака с экспрессией CD37. 5 н. и 14 з.п. ф-лы, 10 табл., 9 пр., 11 ил.
Формула

Документы, цитированные в отчёте о поиске
Антитела и иммуноконъюгаты и их применения




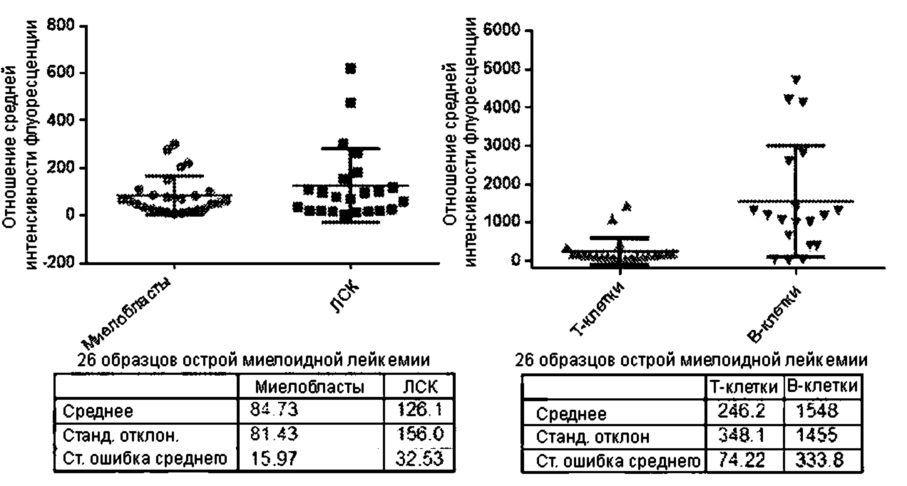


Комментарии