Новые люциферазы и способы их использования - RU2674894C2
Код документа: RU2674894C2
Чертежи














































Описание
Область изобретения
[001] Это изобретение относится в основном к области биологии и химии. В частности, изобретение относится к люциферазам.
Уровень техники
[002] Биолюминесценцией называется способность биологических организмов или биомолекул к производству и эмиссии света. Способность к биолюминесценции определяется наличием специфического белка люциферазы или фотопротеина. Люциферазы - это ферменты, которые катализируют окисление низкомолекулярных соединений - люциферинов, превращая их в оксилюциферины. Окисление сопровождается выделением света и высвобождением оксилюциферина.
[003] Фотопротеины также катализируют окисление люциферинов, однако, в этом случае люциферин выступает в роли простетической группы и образует стабильный комплекс с фотопротеином. Количество света, производимого фотопротеином, примерно пропорционально его концентрации, в то время как для люциферазы оно зависит от концентраций как фермента, так и люциферина. Активация биолюминесцентной реакции, катализируемой фотопротеином, во многих случаях происходит в ответ на появление в среде ионов металлов. Например, фотопротеин акворин катализирует окисление люциферина (целентеразина) в ответ на высвобождение ионов кальция, что приводит к появлению коротких вспышек света.
[004] Люциферазы находят применение как репортерные гены во многих приложениях биомедицины и биотехнологии. В частности, они используются в методах диагностики, способах выявления в среде микроорганизмов, токсических агентов, при определении концентрации различных веществ, при выявлении активации сигнальных каскадов и т.д. [Scott et al., Annu Rev Anal Chem, 2011, 4: 297-319; Badr and Tannous, Trends Biotechnol. 2011, 29: 624-33; Andreu et al., FEMS Microbiol Rev. 2011, 35: 360-94]. Многие способы применения люцифераз описаны в обзорах [Kaskova et al., Chem Soc Rev., 2016, 45: 6048-6077; Scott et al., Annu Rev Anal Chem, 2011, 4: 297-319; Widder and Falls, IEEE Journal of Selected Topics in Quantum Electronics, 2014, 20: 232-241].
[005] В настоящее время известны несколько типов биолюминесцентных систем, показано, что у различных организмов они возникали в эволюции независимо более сорока раз [Herring, Journal of Bioluminescence and Chemiluminescence, 1987, 1: 147-63; Haddock et al., Annual Review of Marine Science, 2010; 2: 443-93].
[006] Описана люцифераза североамериканского светлячка Photinus pyralis, катализирующая окисление D-люциферина [de Wet et al., Proc. Natl. Acad. Sci. USA, 1985, 82: 7870-3; de Wet et al., Proc. Natl. Acad. Sci. USA, 1987, 7: 725-37]. Окисление D-люциферина сопровождается выделением желто-зеленого света с максимумом эмиссии при 560 нм. Тот же D-люциферин окисляется другими люциферазами насекомых: в настоящее время клонировано более 30 ферментов из различных видов насекомых из семейств Phengodidae, Elateridae and Lampyridae, излучающих свет с максимумами эмиссии в диапазоне от 536 до 630 нм. Также описаны мутантные формы люцифераз насекомых и изготовлены синтетические аналоги D-люциферина, позволяющие получать пары люциферин-люцифераза с различными свойствами [Thorne et al., Chem Biol., 2010, 17: 646-57. Несмотря на значительное разнообразие аналогов, сам D-люциферин остается наиболее предпочтительным субстратом биолюминесценции in vivo вследствие высокого квантового выхода реакции (0.88+-0.25 [Seliger and McElroy, Arch Biochem Biophys, 1960, 88: 136-141]). Значительным затруднением при использовании данной системы является относительно большой размер люциферазы Photinus pyralis (61 кДа), что делает ее непригодной для создания ряда химерных конструкций (например, при изучении вирусов) вследствие низкой стабильности их увеличенного генома [Tran et al., J Virol, 2013, 87: 13321-13329; Tran et al., Viruses, 2015, 7: 5319-5327], а также необходимость получения D-люциферина в чистой энантиомерной форме, поскольку его изомер L-люциферин является сильным конкурентным ингибитором реакции [Lembert, Biochem J, 1996, 317: 273-277]. Тот факт, что люцифераза Photinus pyralis не является секретируемой, вносит дополнительные ограничения для количественной оценки сигнала биолюминесценции in vivo.
[007] Описана также большая группа люцифераз и фотопротеинов, катализирующих окисление целентеразина. Целентеразин-зависимые биолюминесцентные системы описаны, например, у Renilla, Gaussia и Metridia longa [О. Shimomura, Bioluminescence: Chemical Principles and Methods, World Scientific Publishing Co. Pte. Ltd, Singapore, 2006, 470 p.] и имеют широкое практическое применение. Также получены мутантные формы целентеразин-зависимых люцифераз и фотопротеинов и синтетические аналоги целентеразина [Kaskova et al., Chem Soc Rev., 2016, 45: 6048-6077]. Несмотря на наличие большого числа преимуществ целентеразиновой системы (секретируемость, малые размеры и большое разнообразие доступных люцифераз), основные ограничения для ее применения связаны в первую очередь с нахождением максимума биолюминесценции в зоне голубого света, вследствие чего большая его часть in vivo поглощается исследуемыми тканями. Кроме того, сам субстрат биолюминесценции может испускать свет в процессе неферментативного окисления кислородом воздуха (этот процесс усиливается в присутствии супероксид-анионов и ионов пероксинитрита в тканях), внося шум в измеряемый биолюминесцентный сигнал.
[008] Другой пример биолюминесцентной системы описан у морских бактерий. Эта система значительно отличается от других биолюминесцентных систем. Бактериальный люциферин (миристиновый альдегид), окисляется в процессе реакции, но не является эмиттером биолюминесценции [О. Shimomura, Bioluminescence: Chemical Principles and Methods, World Scientific Publishing Co. Pte. Ltd, Singapore, 2006? 470 р.]. Помимо люциферина в качестве ключевых компонентов люминесцентной реакции выступают НАДН (никотинамидадениндинуклеотид) и ФМН-Н2 (флавинмононуклеотид), окисленноепроизводное которого и выступает в качестве истинного источника света. Биолюминесцентные системы морских бактерий имеют ограничение по использованию, так как пригодны только для прокариотических систем экспрессии.
[009] Также известны биолюминесцентные системы остракод рода Cypridina, которые характеризуются химически высокоактивным люциферином и высокостабильной люциферазой. [Shimomura et al., Science, 1969, 164: 1299-300]. Одним из основных недостатков данной биолюминесцентной системы является исключительно низкая стабильность самого люциферина Cypridina на воздухе, особенно в присутствии примесей. Пик биолюминесценции люциферина лежит в диапазоне 448-463 нм (в зависимости от ионной силы раствора), что делает данную систему неподходящей для применения в неизменной форме в глубоких тканях in vivo.
[010] Также известны биолюминесцентные системы динофлагеллят и эвфаузиид. В настоящее время клонированы гены, кодирующие три люциферазы из этой группы [О. Shimomura, Bioluminescence: Chemical Principles and Methods, World Scientific Publishing Co. Pte. Ltd, Singapore, 2006]. Существенным недостатком данной системы является ее неполная изученность: полные люциферазные последовательности еще не были установлены, и спектр возможных применений данной системы не определен. Сведения о механизме биолюминесценции динофлагеллят и эвфаузиид пока что отрывочны.
[011] Несмотря на большое количество биолюминесцентных систем, используемых на сегодняшний день, сохраняется потребность в расширении линейки люциферин-люциферазных пар, обладающих новыми свойствами. В частности, интерес представляют АТФ- и NAD(Р)H-независимые люциферазы, способные к окислению проникающих в клетки водорастворимых люциферинов.
[012] В этом плане большой интерес представляют люциферазы из грибов. Биолюминесценция грибов хорошо известна и упоминается еще в трактатах Аристотеля. Однако, биолюминесцентные системы грибов описаны весьма слабо. В 1959 году Airth and McElroy показали, что в состав биолюминесцентной системы грибов входят по крайней мере теплочувствительный компонент - люцифераза и тепло-нечувствительный компонент - люциферин, и НАД(Ф)Н [Airth and McElroy, Journal of Bacteriology, 1959, 77: 249-50]. В 2015 году Purtov и коллеги определили люциферин грибов: им оказалась способная проникать через мембраны клеток молекула - 3-гидроксигиспидин [Purtov et al., Angewandte Chemie, 2015, 54: 8124-28]. Однако ни одной люциферазы грибов не было идентифицировано.
Сущность изобретения
[013] Настоящее изобретение обеспечивает выделенные молекулы нуклеиновых кислот, кодирующих новые люциферазы и их функциональные мутанты. Указанные люциферазы окисляют 3-гидроксигиспидин, что приводит к появлению света. Указанные люциферазы не зависят от АТФ и НАД(Ф)Н. В преимущественных воплощениях указанные нуклеиновые кислоты выделены из грибов или получены с помощью генно-инженерных методов.
[014] В некоторых воплощениях нуклеиновая кислота настоящего изобретения кодирует люциферазу, выбранную из группы SEQ ID NO: 02, 04, 06, 08, 10, 12, 14, 16 или 18. Примеры нуклеотидных последовательностей показаны в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17.
[015] В некоторых воплощениях нуклеиновая кислота настоящего изобретения кодирует люциферазу, содержащую характерную консенсусную аминокислотную последовательность, показанную в SEQ ID NO: 35.
[016] В некоторых воплощениях нуклеиновая кислота настоящего изобретения кодирует функциональный фрагмент люциферазы, который короче с С- и/или N-конца природной люциферазы.
[017] В некоторых воплощениях нуклеиновая кислота настоящего изобретения кодирует люциферазу, аминокислотная последовательность которой по существу сходна люциферазе, выбранной из группы SEQ ID NO: 02, 04, 06, 08, 10, 12, 14, 16 или 18. В некоторых воплощениях нуклеиновая кислота настоящего изобретения кодирует функциональный фрагмент люциферазы, аминокислотная последовательность которого по существу сходна функциональному фрагменту, выбранному из группы в SEQ ID NO: 20, 22, 24, 26, 28, 30, 32 или 34.
[018] Молекулы нуклеиновых кислот, которые отличаются от представленных нуклеотидных последовательностей вследствие вырожденности генетического кода или гибридизуются с ними, также входят в рамки настоящего изобретения.
[019] В других воплощениях также обеспечиваются векторы, включающие нуклеиновую кислоту настоящего изобретения. Кроме того, настоящее изобретение обеспечивает кассеты экспрессии, включающие нуклеиновую кислоту настоящего изобретения и регуляторные элементы, необходимые для экспрессии нуклеиновой кислоты в выбранной клетке-хозяине. Кроме того, обеспечиваются клетки, стабильные клеточные линии, трансгенные организмы (например, растения, животные, грибы, микроорганизмы), включающие нуклеиновые кислоты, векторы или экспрессионные кассеты настоящего изобретения.
[020] В других воплощениях обеспечиваются функциональные люциферазы настоящего изобретения, которые кодируются нуклеиновыми кислотами указанными выше.
[021] Кроме того, обеспечивается набор, содержащий нуклеиновые кислоты или векторы или экспрессионные кассеты, содержащие нуклеиновые кислоты настоящего изобретения.
[022] Кроме того, обеспечиваются антитела, специфически связывающие белки настоящего изобретения или их фрагменты.
[023] Кроме того, обеспечиваются способы мечения клеток, клеточных структур и биомолекул с помощью нуклеиновых кислот и белков настоящего изобретения.
[024] Технический результат состоит в расширении технических средств в области применения биолюминесцентных систем и достигается за счет идентификации аминокислотных и нуклеотидных последовательностей новой группы ферментов, обладающих способностью катализировать окисление 3-гидроксигиспидина, сопровождающееся испусканием света.
Краткое описание фигур
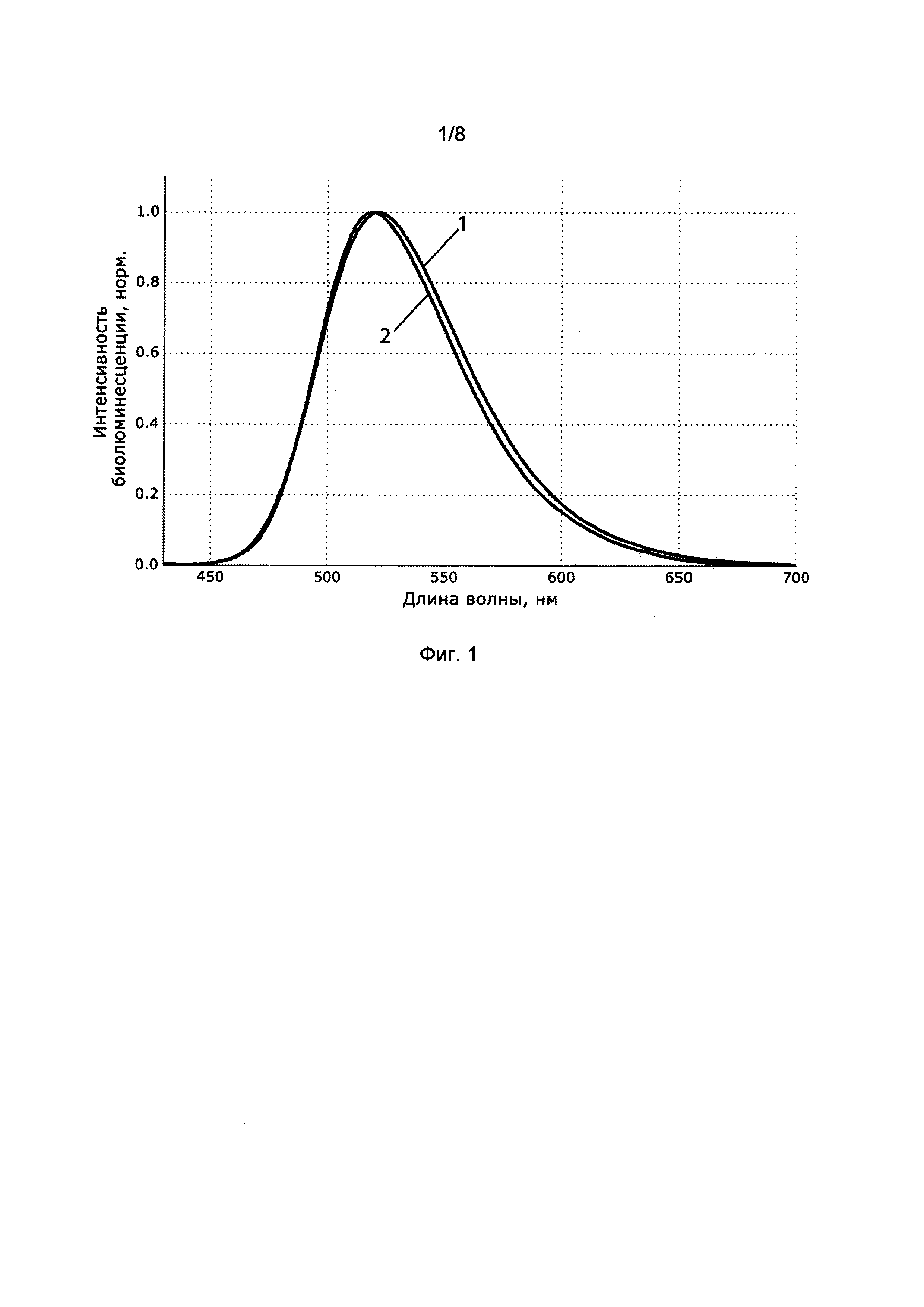
[025] Фигура 1 показывает спектры биолюминесценции люциферазы из Neonothopanus nambi при экспрессии в естественной (1) и гетерологической (2) системах.
[026] Фигуры 2 и 3 иллюстрируют характер изменения интенсивности биолюминесценции клетками линии HeLa Kyoto (Фиг. 2) и HEK293T (Фиг. 3), экспрессирующими люциферазы Neonothopanus nambi (1), Armillaria mellea (2), Mycena citricolor (3), Armillaria ostoyae (4), Mycena chlorophos (5), Armillaria gallica (6), Panellus stipticus (7), Omphalotus olearius (8), а также нетрансфицированными контрольными клетками (9) со временем.
[027] Фигура 4 показывает фотографию вестерн-блота с антителами к гистидиновой метке, конъюгированными с пероксидазой хрена. Дорожка 1: пост-ядерный супернатант клеток, экспрессирующих люциферазу Neonothopanus nambi, не несущую гистидиновой метки. Дорожка 2: пост-ядерный супернатант клеток, экспрессирующих люциферазу Neonothopanus nambi, имеющую гистидиновую метку. Дорожка 3: супернатант, полученный центрифугированием при 140000 g. Дорожка 4: осадок, полученный центрифугированием при 140000 g.
[028] Фигура 5 иллюстрирует множественное выравнивание аминокислотных последовательностей люцифераз настоящего изобретения. Трансмембранный N-концевой домен подчеркнут. Сверху показана консенсусная последовательность.
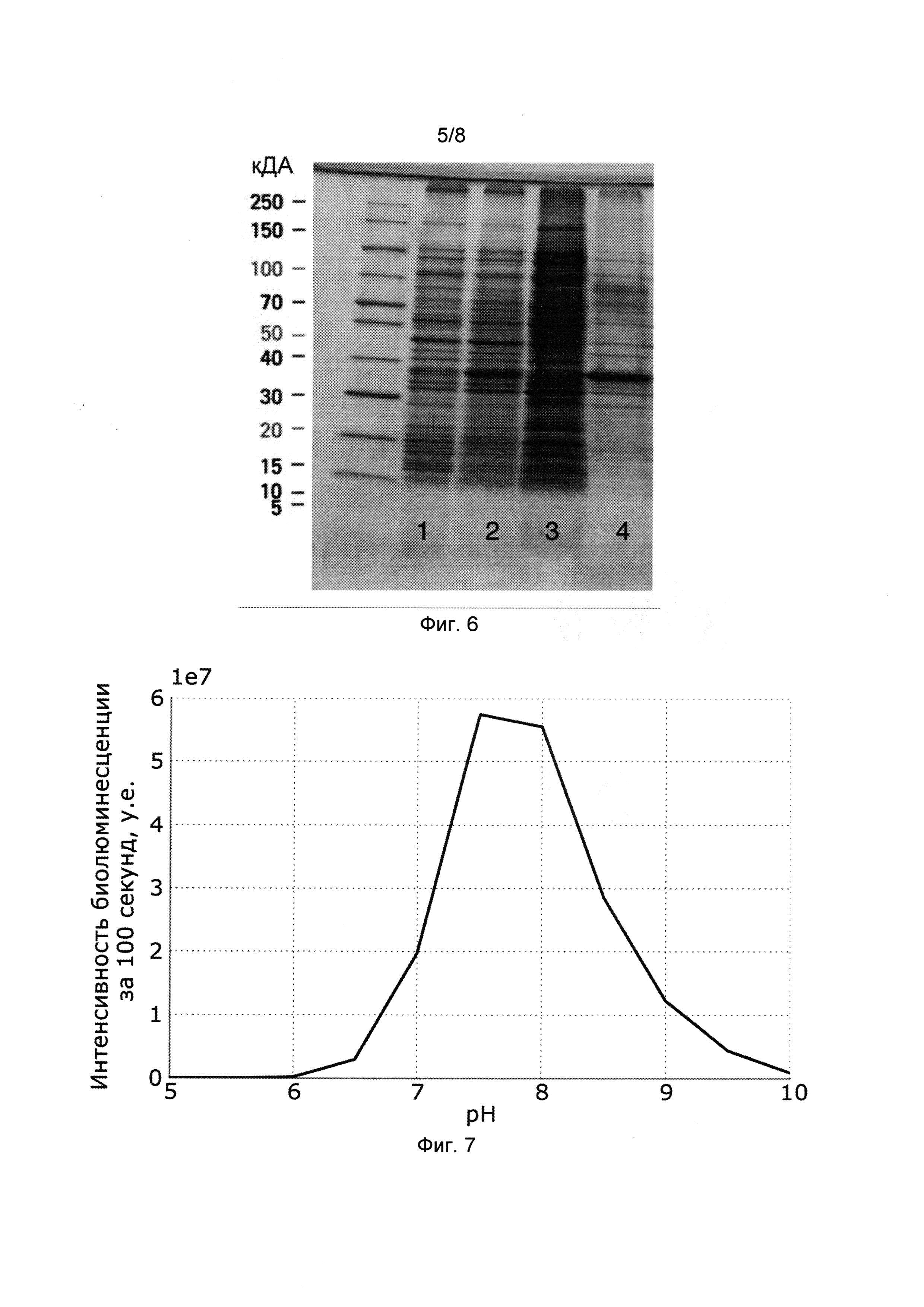
[029] Фигура 6 показывает фотографию градиентного полиакриламидного геля (10-25%), окрашенного Coomassie Blue с нанесением лизата клеток Е. colli до индукции IPTG (дорожка 1); лизата клеток Е. coli после ночной экспрессии при комнатной температуре (дорожка 2), супернатанта после лизиса клеток и центрифугирования при 35000 g (дорожка 3); экстракта из телец включения Е. Coli (дорожка 4).
[030] Фигура 7 иллюстрирует зависимость интенсивности биолюминесценции рекомбинантой люциферазы из Neonothopanus nambi от pH.
[031] Фигура 8 показывает наложение микрофотографий, снятых в проходящем свете с микрофотографиями, снятыми в красном канале пропускания (сверху, mKate2) и в зеленом канале пропускания (снизу, люцифераза).
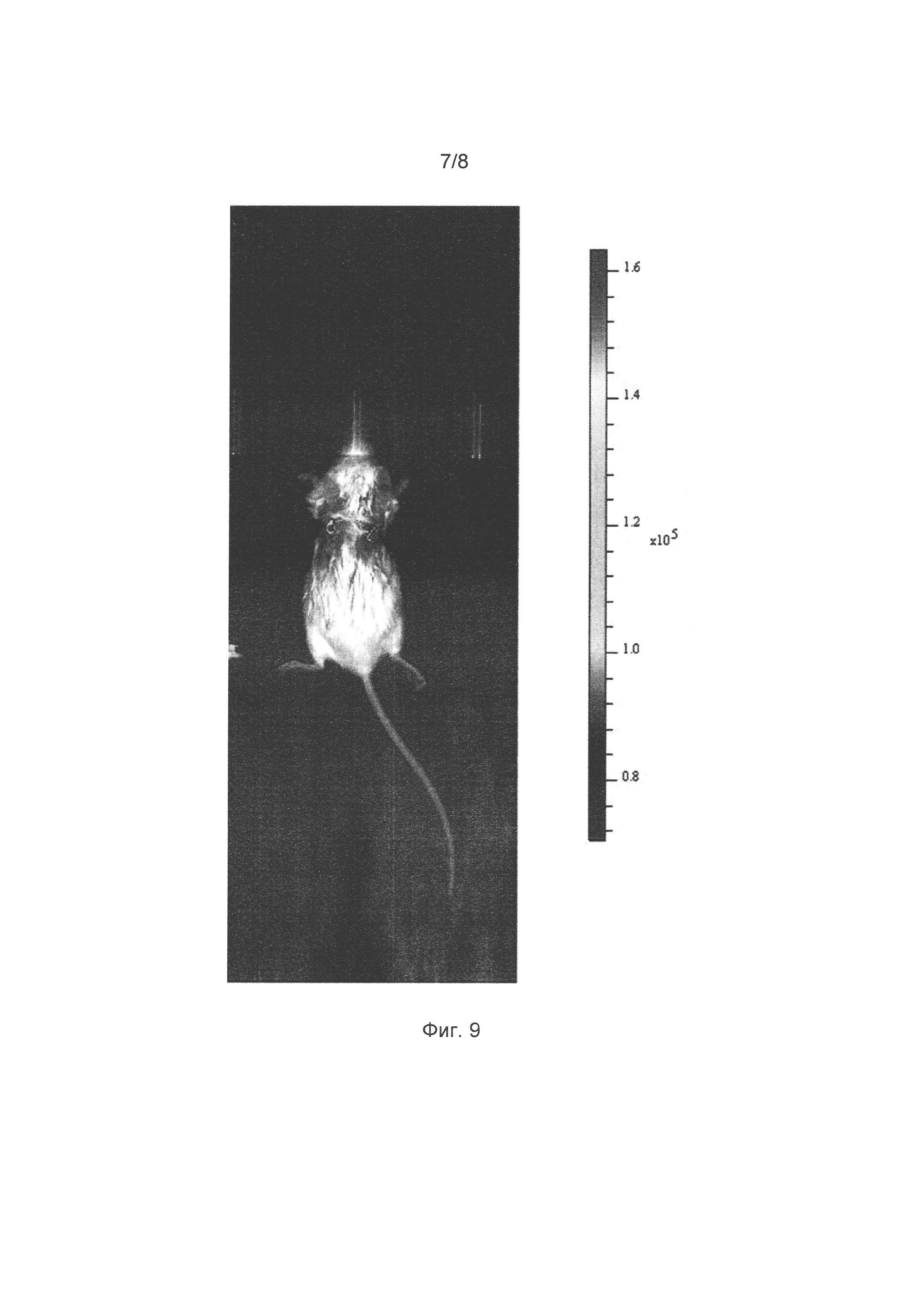
[032] Фигура 9 иллюстрирует мечение клеток опухоли внутри живой мыши с помощью люциферазы Neonothopanus nambi (вживлена в левую часть спины мыши) и люциферазы Photinus pyralis (вживлена в правую часть). Показано наложение фотографий мыши и зарегистрированного светового сигнала от вживленных опухолей.
[033] Фигура 10 иллюстрирует мечение нервной системы эмбриона Xenopus laevis (стадии 16-17 нейруляции) с помощью люциферазы Neonothopanus nambi. Показана биолюминесценция от люциферазы.
Подробное описание изобретения
[034] Настоящее изобретение направлено на молекулы нуклеиновых кислот, которые кодируют новые люциферазы, их функциональные фрагменты, гомологи и мутанты, а также на белки, кодируемые указанными нуклеиновыми кислотами. Молекулы нуклеиновых кислот, представляющие интерес, выделены из грибов или получены методами генной инженерии. Также обеспечиваются клетки-хозяева, стабильные клеточные линии и трансгенные организмы, содержащие указанные молекулы нуклеиновых кислот. Кроме того, обеспечиваются антитела, специфичные к белкам настоящего изобретения.
[035] Указанные белковые и нуклеотидные композиции применяются во многих приложениях и методах, в частности, в приложениях мечения организмов, клеток, клеточных органелл или белков. Также указанные белковые и нуклеотидные композиции применяются в методах выявления белок-белковых взаимодействий, при тестировании активности промоторов в различных условиях. Наконец, обеспечиваются наборы для их использования в таких методах и приложениях.
Определения
[036] Различные термины, относящиеся к объектам настоящего изобретения, используются выше и также в описании и в формуле изобретения.
[037] Как здесь используется, термин "люцифераза" означает белок, который обладает способностью к окислению люциферина, где реакция окисления сопровождается выделением света (люминесценцией) и происходит освобождение окисленного люциферина.
[038] Термин "гуманизированный" относится к изменению нуклеотидной последовательности белка, сделанной для оптимизации генетического кода кодонов для экспрессии в клетках млекопитающих (Yang et al., 1996, Nucleic Acids Research 24: 4592-4593).
[039] Как здесь используется, термин "выделенный" означает молекулу или клетку, которые находятся в среде, отличной от среды, в которой молекула или клетка находятся в естественных условиях.
[040] Как здесь используется, термин "мутант" или "производное" относятся к белку, раскрытому в настоящем изобретении, в котором одна или более аминокислот добавлены и/или замещены и/или удалены (делетированы) и/или вставлены (инсертированы) в N-конец и/или С-конец, и/или в пределах нативных аминокислотных последовательностей белков настоящего изобретения. Как здесь используется, термин "мутант" относится к молекуле нуклеиновой кислоты, которая кодирует мутантный белок. Кроме того, термин "мутант" здесь относится к любому варианту, который короче или длиннее белка или нуклеиновой кислоты.
[041] Термин "гомология" используется для описания взаимосвязи последовательностей нуклеотидов или аминокислот с другими последовательностями нуклеотидов или аминокислот, которая определена степенью идентичности и/или сходства между указанными сравниваемыми последовательностями.
[042] Как здесь используется, аминокислотная или нуклеотидная последовательности "по существу сходны" или "по существу такие же" как референсная последовательность, если аминокислотная или нуклеотидная последовательности имеют по крайней мере 40% идентичности с указанной последовательностью внутри выбранного для сравнения региона. Таким образом, по существу сходные последовательности включают те, которые имеют, например, по крайней мере, 45% идентичности, или по крайней мере, 50% идентичности, или по крайней мере, 55% идентичности, или по крайней мере, 60% идентичности, или по крайней мере, 62% идентичности, или по крайней мере 65% идентичности, или по крайней мере 70% идентичности, или по крайней мере, 75% идентичности, например, по крайней мере, 80% идентичности, по крайней мере, 85% идентичности, по крайней мере, 90% идентичности (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 98% или 99% идентичности). Две последовательности, которые идентичны одна другой, так же по существу сходны. Для целей настоящего изобретения длина сравниваемых последовательностей люцифераз составляет по крайней мере 100 аминокислот, предпочтительно, по крайней мере, 200 аминокислот, например, 200-230 аминокислот или полную длину аминокислотной последовательности белка или функционального фрагмента. Для нуклеиновых кислот длина сравниваемых последовательностей в основном составляет, по крайней мере, 300 нуклеотидов; предпочтительно, по крайней мере, 600 нуклеотидов.
[043] Идентичность последовательностей определяется на основании референсной последовательности. Алгоритмы для анализа последовательности известны в данной области, такие как BLAST, описанный в Altschul et al., J. Mol. Biol., 215, pp. 403-10 (1990). Для целей настоящего изобретения для определения уровня идентичности и сходства между нуклеотидными последовательностями и аминокислотными последовательностями может быть использовано сравнение нуклеотидных и аминокислотных последовательностей, производимое с помощью пакета программ Blast, предоставляемого National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/blast) с использованием содержащего разрывы выравнивания со стандартными параметрами.
[044] Как здесь используется, термин "функциональный" означает, что нуклеотидная или аминокислотная последовательность может функционировать для указанного испытания или задачи. Термин "функциональный", используемый для описания люцифераз, означает, что белок обладает способностью производить сопровождающуюся люминесценцией реакцию окисления люциферина.
[045] Как здесь используется, "биохимические свойства" относятся к белковому фолдингу (сворачиванию) и скорости созревания, времени полужизни, скорости катализа, pH и температурной стабильности, и другим подобным свойствам.
[046] Как здесь используется, "спектральные свойства" относятся к спектрам, квантовому выходу и интенсивности люминесценции и другим подобным свойствам.
[001] Термин "оперативно связанный" или ему подобный при описании химерных белков относиться к полипептидным последовательностям, которые находятся в физической и функциональной связи одна с другой. В наиболее предпочтительных воплощениях, функции полипептидных компонентов химерной молекулы не изменены по сравнению с функциональными свойствами выделенных полипептидных компонентов. Например, люцифераза настоящего изобретения может быть сшита с представляющим интерес партнером слияния. В этом случае химерный белок сохраняет свойства люциферазы, а представляющий интерес полипептид сохраняет его оригинальную биологическую активность. В некоторых воплощениях настоящего изобретения, активность как люциферазы, так и партнера слияния могут быть снижены по сравнению с активностями изолированных белков. Такие химерные белки также находят применение в рамках настоящего изобретения. Термин "оперативно связанный" или ему подобный при описании нуклеиновых кислот означает, что нуклеиновые кислоты ковалентно связаны таким образом, что в местах их соединения отсутствуют 'сбои' рамки считывания и стоп-кодоны. Как очевидно для любого специалиста в данной области техники, нуклеотидные последовательности, кодирующие химерный белок, включающий "оперативно связанные" компоненты (белки, полипептиды, линкерные последовательности, белковые домены и т.д.), состоят из фрагментов, кодирующих указанные компоненты, где эти фрагменты ковалентно связаны таким образом, что в ходе транскрипции и трансляции нуклеотидной последовательности продуцируется полноразмерный химерный белок.
[047] Как здесь используется, термин "специфически гибридизуется" относится к ассоциации между двумя одноцепочечными молекулами нуклеиновых кислот или в достаточной степени комплементарными последовательностями, что разрешает такую гибридизацию в предопределенных условиях, обычно использующихся в данной области (иногда используется термин "по существу комплементарный").
[048] Ссылка на нуклеотидную последовательность, "кодирующую" полипептид, означает, что с нуклеотидной последовательности в ходе транскрипции мРНК и трансляции продуцируется этот полипептид. При этом может быть указана как кодирующая цепь, идентичная мРНК и обычно используемая в списке последовательностей, так и комплементарная цепь, которая используется как матрица при транскрипции. Как очевидно для любого специалиста в данной области техники, термин также включает любые вырожденные нуклеотидные последовательности, кодирующие одинаковую аминокислотную последовательность. Нуклеотидные последовательности, кодирующие полипептид, включают последовательности, содержащие интроны.
Молекулы нуклеиновых кислот
[049] Настоящее изобретение обеспечивает молекулы нуклеиновых кислот кодирующие люциферазы и их функциональные фрагменты (например кодирующие укороченные или удлиненные варианты люциферазы). В преимущественных воплощениях нуклеиновая кислота настоящего изобретения кодирует люциферазу, аминокислотная последовательность которой выбрана из групп SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18. Молекулы нуклеиновых кислот, кодирующие гомологи и мутанты указанных люцифераз, по существу сходные с вышеперечисленными люциферазами, также находятся в рамках настоящего изобретения. Каждый из этих специфических типов молекул нуклеиновой кислоты, представляющей интерес, раскрывается более детально ниже в экспериментальной части.
[050] Как здесь используется, молекула нуклеиновой кислоты - это молекула ДНК, такая как геномная ДНК или кДНК, или молекула РНК, такая как молекула мРНК. В некоторых воплощениях, молекула нуклеиновой кислоты настоящего изобретения - это молекула ДНК (или кДНК), содержащая открытую рамку считывания, которая кодирует люциферазу настоящего изобретения и способна в подходящих условиях (например, при физиологических внутриклеточных условиях) быть использована для экспрессии люциферазы в гетерологической системе экспрессии.
[051] В некоторых воплощениях молекула нуклеиновой кислоты настоящего изобретения, кодирующая люциферазу, выделена из гриба. Особый интерес представляют нуклеиновые кислоты, кодирующие люциферазы из Neonothopanus nambi (SEQ ID NO: 2), Armillaria gallica (SEQ ID NO: 4), Armillaria mellea (SEQ ID NO: 6), Armillaria ostoyae (SEQ ID NO: 8), Mycena chlorophos (SEQ ID NO: 10), Mycena citricolor (SEQ ID NO: 12), Omphalotus olearius (SEQ ID NO: 14), и Panellus stipticus (SEQ ID NO: 16 и 18). Нуклеотидные последовательности таких нуклеиновых кислот показаны в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17.
[052] В некоторых воплощениях молекула нуклеиновой кислоты настоящего изобретения, кодирующая люциферазу, получена методами генной инженерии. Способы получения нуклеиновых кислот хорошо известны из области техники. Например, доступность информации о последовательности аминокислот (например, SEQ ID NO: 2-18) или информации о нуклеотидной последовательности (например, SEQ ID NO: 3, 5, 7, 9, 11, 13, 15 или 17) дает возможность изготовить выделенные молекулы нуклеиновых кислот настоящего изобретении с помощью олигонуклеотидного синтеза. В случае информации о последовательности аминокислот, может быть синтезировано несколько нуклеиновых кислот отличающихся друг от друга вследствие вырожденности генетического кода. Методы выбора вариантов кодонов для требуемого хозяина хорошо известны в данной области.
[053] Синтетические олигонуклеотиды могут быть приготовлены с помощью фосфорамидитного метода, и полученные конструкты могут быть очищены с помощью методов хорошо известных в данной области, таких как высокоэффективная жидкостная хроматография (ВЭЖХ) или других методов как описано, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., (1989) Cold Spring Harbor Press, Cold Spring Harbor, NY, и по инструкции, описанной в, например, United States Dept. of HHS, National Institute of Health (NIH) Guidelines for Recombinant DNA Research. Длинные двухцепочечные молекулы ДНК настоящего изобретения могут быть синтезированы следующим образом: могут быть синтезированы несколько меньших фрагментов с необходимой комплементарностью, которые содержат подходящие концы, способные к когезии с соседним фрагментом. Соседние фрагменты могут быть сшиты с помощью ДНК-лигазы, методов, основанных на рекомбинации, или метода, основанного на ПЦР.
[054] Молекулы нуклеиновой кислоты, кодирующие люциферазы настоящего изобретения, могут быть также клонированы из биологических источников из гриба, относящегося к типу Basidiomycota, преимущественно к классу Basidiomycetes, в частности, к отряду Agaricales.
[055] Настоящее изобретение также охватывает нуклеиновые кислоты, которые гомологичны, по существу сходны, идентичны, или получены из нуклеиновых кислот, кодирующих белки настоящего изобретения.
[056] Нуклеиновые кислоты изобретения находятся в среде, отличной от среды, в которой они находятся в естественных условиях, например, они выделены, представлены в увеличенном количестве, находятся или экспрессированы в системах in vitro или в клетках или организмах, отличных от тех, в которой они находятся в естественных условиях.
[057] Изменения или различия в нуклеотидной последовательности между высоко сходными нуклеотидными последовательностями могут представлять нуклеотидные замены в последовательности, которые возникают в процессе нормальной репликации или дупликации. Другие замены могут быть специально рассчитаны и вставлены в последовательность для определенных целей, таких, как изменение кодонов определенных аминокислот или нуклеотидной последовательности регуляторного региона. Такие специальные замены могут быть произведены in vitro с помощью различных технологий мутагенеза или получены в организмах-хозяевах, находящихся в специфических селекционных условиях, которые индуцируют или отбирают эти изменения. Такие специально полученные варианты последовательности могут быть названы "мутантами" или "производными" исходной последовательности.
[058] Нуклеиновая кислота, кодирующая люциферазу, по существу сходную с люциферазой, аминокислотная последовательность которой показана в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, также обеспечивается настоящим изобретением. Нуклеиновая кислота, кодирующая такой полипептид или его фрагмент, может быть выделена любым из многих известных методов. Фрагмент кДНК настоящего изобретения может использоваться как гибридизационная проба против библиотеки кДНК из целевого организма в условиях высокой строгости. Проба может быть большим фрагментом или более коротким вырожденным праймером. Нуклеиновые кислоты, имеющие сходство последовательности, могут быть детектированы гибридизацией в условиях высокой строгости, например, при 50°C или выше (например, 60°C или 65°C), 50% формамид, 0.1 × SSC (15 mM хлорид натрия / 1.5 mM натрия цитрат), 0.1% SDS. Нуклеиновые кислоты, имеющие области, по существу идентичные к референсной последовательности, например, аллельные варианты, генетически-измененные варианты нуклеиновых кислот и т.д., связываются с референсной последовательностью в гибридизационных условиях высокой строгости. Используя пробы, в частности меченые пробы комплементарные к референсной последовательности ДНК, можно выделить подобные нуклеотидные последовательности.
[059] Нуклеиновая кислота, кодирующая такой полипептид или его фрагмент, может быть также идентифицирована в ходе геномного или транскриптомного секвенирования. В частности, по существу сходная люцифераза может быть идентифицирована среди последовательностей гипотетических белков, предсказанных на основе данных, полученных при секвенировании организмов, например, при секвенировании грибов различных видов, преимущественно относящихся к типу Basidiomycota, например, к классу Basidiomycetes, в частности, к отряду Agaricales.
[060] Нуклеиновая кислота, кодирующая люциферазу, содержащую специфическую консенсусную аминокислотную последовательность, по существу сходную с последовательностью, показанной в SEQ ID NO: 35, также обеспечивается настоящим изобретением. Термин «консенсусная последовательность» означает здесь усредненную аминокислотную последовательность, регулярно встречающуюся (с небольшими вариациями по отдельным аминокислотам) в разных люциферазах настоящего изобретения.
[061] Мутантные или производные нуклеиновые кислоты могут быть получены на матричной нуклеиновой кислоте, выбранной из вышеописанных нуклеиновых кислот, путем модификации, делеции или добавления одного или более нуклеотидов в матричной последовательности или их комбинации, для получения варианта матричной нуклеиновой кислоты. Модификации, добавления или делеции могут быть выполнены любым способом, известным в данной области (см. например, Gustin et al., Biotechniques (1993) 14: 22; Barany, Gene (1985) 37: 111-123; и Colicelli et al., Mol. Gen. Genet. (1985) 199: 537-539, Sambrook et al., Molecular Cloning: A Laboratory Manual, (1989), CSH Press, pp. 15.3-15.108), включая подверженный ошибкам ПЦР (error-prone PCR), shuffling, олигонуклеотид-направленный мутагенез, ПЦР со сборкой, парный ПЦР мутагенез, мутагенез in vivo, кассетный мутагенез, рекурсивный множественный мутагенез, экспоненциальный множественный мутагенез, сайт-специфический мутагенез, случайный мутагенез, генное реассемблирование (gene reassembly), генный сайт-насыщающий мутагенез (GSSM), искусственную перестройку с лигированием (SLR) или их комбинации. Модификации, добавления или делеции могут быть также выполнены методом, включающим рекомбинацию, рекурсивную рекомбинацию последовательностей, фосфотиоат-модифицированный мутагенез ДНК, мутагенез на урацил-содержащей матрице, мутагенез с двойным пропуском, точечный восстановительный по рассогласованию мутагенез, мутагенез штамма, дефицитного по восстановлениям, химический мутагенез, радоактивный мутагенез, делетационный мутагенез, рестрикционно-избирательный мутагенез, рестрикционный мутагенез с очисткой, синтез искусственных генов, множественный мутагенез, создание химерных множественных нуклеиновых кислот и их комбинации. В некоторых воплощениях люциферазы, кодируемые мутантными или производными нуклеиновыми кислотами, имеют те же самые спектральные или биохимические свойства как люцифераза дикого типа. В других воплощениях, мутантные или производные нуклеиновые кислоты кодируют люциферазы с измененными свойствами.
[062] Также обеспечиваются вырожденные варианты нуклеиновых кислот, которые кодируют белки настоящего изобретения. Вырожденные варианты нуклеиновых кислот включают замены кодонов нуклеиновой кислоты на другие кодоны, кодирующие те же самые аминокислоты. В частности, вырожденные варианты нуклеиновых кислот создаются, чтобы увеличить экспрессию в клетке-хозяине. В этом воплощении, кодоны нуклеиновой кислоты, которые не являются предпочтительными или являются менее предпочтительными в генах клетки-хозяина, заменены кодонами, которые обильно представлены в кодирующих последовательностях генов в клетке-хозяине, где указанные замененные кодоны кодируют ту же самую аминокислоту. Примеры вырожденных вариантов, представляющих интерес, описаны более подробно в экспериментальной части ниже.
[063] Нуклеиновые кислоты, кодирующие укороченные и удлиненные варианты указанных люцифераз, также входят в рамки настоящего изобретения. Как здесь используется, эти варианты белков содержат аминокислотные последовательности с измененными С-, N-, или обоими концами полипептидной цепи.
[064] В укороченных вариантах один или более (обычно до 39, чаще 37 или менее) аминокислотных остатков могут быть удалены из последовательности или заменены на любые другие аминокислотные остатки. В частности, может быть полностью или частично удалена последовательность, кодирующая трансмембранный домен и предшествующую ему аминокислотную последовательность с N-конца люциферазы. Трансмембранный домен может быть идентифицирован с помощью способов, известных из уровня техники: например, с использованием алгоритмов, описанных в [Krogh et al., Journal of Molecular Biology 2001, 305(3): 567-580] и [Sonnhammer et al., Proceedings of the Sixth International Conference on Intelligent Systems for Molecular Biology, pages 175-182, Menlo Park, CA, 1998. AAAI Press]. Для анализа может быть использовано основанное на указанном алгоритме программное обеспечение, приведенное в [http://www.cbs.dtu.dk/services/TMHMM/]. В удлиненных вариантах, С- или N-конец белка может содержать дополнительные аминокислотные остатки. Примеры аминокислотных последовательностей функциональных фрагментов и кодирующие их нуклеотидные последовательности показаны в SEQ ID NO: 19-34. Для экспрессии функциональных фрагментов кодирующие их нуклеиновые кислоты оперативно сшивают с нуклеиновыми кислотами, содержащими, по крайней мере, регуляторные последовательности и сайт начала транскрипции. Также эти нуклеиновые кислоты могут содержать последовательности, кодирующие гистидиновую метку (6 His tag), сигнальный пептид или функциональные белковые домены.
[065] Вышеуказанные модификации не изменяют по существу спектральные свойства люцифераз, но могут изменять внутриклеточную локализацию, облегчать белковый фолдинг в клетке-хозяине, снижать способность к агрегации или модулировать другие биохимические свойства белков, например, период полураспада. В некоторых воплощениях, эти модификации не изменяют биохимические свойства белка. Все виды модификаций и мутаций, указанные выше, как правило осуществляются на уровне нуклеиновой кислоты.
[066] Молекулы нуклеиновой кислоты изобретения могут кодировать весь или часть заявленного белка. Двух- и одноцепочечные фрагменты могут быть получены из последовательности ДНК путем химического синтеза олигонуклеотидов в соответствии со стандартными способами, энзиматической рестрикцией, амплификацией ПЦР и т.д. В основном, фрагменты ДНК будут иметь размер по меньшей мере приблизительно 15 нуклеотидов, обычно по меньшей мере приблизительно 18 нуклеотидов или приблизительно 25 нуклеотидов и могут быть по меньшей мере приблизительно 50 нуклеотидов. В некоторых воплощениях, заявленные молекулы нуклеиновой кислоты могут иметь размер приблизительно 100, приблизительно 200, приблизительно 300, приблизительно 400, приблизительно 500, приблизительно 600 или более. Заявленные нуклеиновые кислоты могут кодировать фрагменты заявленных белков или полные белки; например, заявленные нуклеиновые кислоты могут кодировать полипептиды приблизительно из 25 аминокислот, приблизительно из 50, приблизительно из 75, приблизительно из 100, приблизительно из 125, приблизительно из 150, приблизительно из 200 аминокислот вплоть до полной длины белка.
[067] Заявленные нуклеиновые кислоты могут быть выделены и получены по существу в очищенной форме. По существу очищенная форма означает, что нуклеиновые кислоты являются по меньшей мере приблизительно на 50% чистыми, обычно по меньшей мере приблизительно на 90% чистыми и обычно являются "рекомбинантными", то есть фланкированными одним или более нуклеотидами, с которыми последовательность обычно не связана в хромосоме, встречающейся в природе в ее естественном организме-хозяине.
[068] Также обеспечиваются нуклеиновые кислоты, которые кодируют слитые белки, включающие белок настоящего изобретения, или их фрагменты, которые ниже рассматриваются более детально.
[069] Также обеспечиваются вектор и другие конструкции нуклеиновой кислоты, содержащие заявленные нуклеиновые кислоты. Подходящие векторы включают вирусные и невирусные векторы, плазмиды, космиды, фаги и т.д., предпочтительно плазмиды, и используются для клонирования, амплификации, экспрессии, переноса и т.д., последовательности нуклеиновой кислоты настоящего изобретения в подходящего хозяина. Выбор подходящего вектора является понятным для квалифицированного специалиста в данной области. Полноразмерная нуклеиновая кислота или ее часть обычно вставляются в вектор посредством прикрепления ДНК-лигазой к расщепленному ферментами рестрикции сайту в векторе. Альтернативно, желательная нуклеотидная последовательность может быть вставлена гомологичной рекомбинацией in vivo, обычно, присоединением гомологичных участков к вектору на флангах желательной нуклеотидной последовательности. Гомологичные участки добавляются лигированием олигонуклеотидов или полимеразной цепной реакцией, с использованием праймеров, включающих, например, как гомологичные участки, так и часть желательной нуклеотидной последовательности. Вектор, как правило, имеет ориджин репликации, обеспечивающий его размножение в клетках-хозяевах в результате его введения в клетку как внехромосомного элемента. Вектор также может содержать регуляторные элементы, обеспечивающие экспрессию нуклеиновой кислоты в клетке-хозяине и получение рекомбинантной функциональной люциферазы. В экспрессионном векторе, указанная нуклеиновая кислота является функционально связанной с регуляторной последовательностью, которая может включить промоторы, энхансеры, терминаторы, операторы, репрессоры, сайленсеры, инсуляторы и индукторы.
[070] Также обеспечиваются кассеты экспрессии или системы, использованные inter alia для получения заявленных люцифераз или химерных белков на их основе или для репликации заявленных молекул нуклеиновой кислоты. Кассета экспрессии может существовать как внехромосомный элемент или может быть включена в геном клетки в результате введения указанной кассеты экспрессии в клетку. Для экспрессии белковый продукт, кодируемый нуклеиновой кислотой изобретения, экспрессируется в любой удобной системе экспрессии, включая, например, бактериальные системы, дрожжи, растения, насекомых, земноводных или клетки млекопитающих. В кассете экспрессии целевая нуклеиновая кислота оперативно соединяется с регуляторными последовательностями, которые могут включать промоторы, энхансеры, терминирующие последовательности, операторы, репрессоры и индукторы. Способы получения кассет или систем экспрессии, способных экспрессировать желательный продукт, известны специалистам в данной области.
[071] Клеточные линии, которые устойчиво экспрессируют белки настоящего изобретения, могут быть выбраны способами, известными в данной области (например, ко-трансфекция с селектируемым маркером, таким как dhfr, gpt, генами устойчивости к неомицину или гигромицину, что делает возможным выявление и выделение транфицированных клеток, которые содержат ген, включенный в геном).
[072] Вышеописанные системы экспрессии могут использоваться в прокариотических или эукариотических хозяевах. Для получения белка могут использоваться клетки-хозяева, такие как Е. coli, В. subtilis, S. cerevisiae, клетки насекомого, или клетки высшего организма, не являющиеся эмбриональными клетками человека, такие как дрожжи, растения (например, Arabidopsis thaliana, Nicotiana benthamiana, Physcomitrella patens), позвоночные, например, COS 7 клетки, НЕК 293, CHO, ооциты Xenopus и т.д.
[073] Если используется любая вышеупомянутая клетка-хозяин или другие подходящие для репликации и/или экспрессии нуклеиновых кислот изобретения клетки-хозяева или организмы, то полученная реплицированная нуклеиновая кислота, экспрессированный белок или полипептид находятся в рамках притязания изобретения как продукт клетки-хозяина или организма. Продукт может быть выделен подходящим способом, известным в данной области.
[074] Также обеспечиваются короткие фрагменты ДНК заявленных нуклеиновых кислот, которые применяются как праймеры для ПЦР, амплификации rolling circle, гибридизационные скрининговые пробы и т.д. Длинные фрагменты ДНК применяются для получения кодируемых полипептидов, как ранее описано. Однако, для использования в геометрических реакциях амплификации, таких как ПЦР, используется пара коротких фрагментов ДНК, то есть праймеров. Точная последовательность праймера не является критической для изобретения, но для большинства применений праймеры будут гибридизоваться с заявленной последовательностью в условиях строгости, как известно в данной области. Предпочтительно выбрать пару праймеров, которые дадут продукт амплификации по меньшей мере приблизительно из 50 нуклеотидов, предпочтительно по меньшей мере приблизительно из 100 нуклеотидов и могут простираться на полную последовательность нуклеиновой кислоты. Алгоритмы отбора последовательностей праймеров обычно известны и доступны в коммерческих пакетах программ. Праймеры для амплификации гибридизуются с комплементарными цепочками ДНК и будут затравлять встречные реакции амплификации.
[075] Молекулы нуклеиновых кислот настоящего изобретения также могут применяться для определения экспрессии гена в биологическом образце. Способ, в котором исследуются клетки на наличие специфических нуклеотидных последовательностей, таких как геномная ДНК или РНК, хорошо отработан в данной области. Кратко, выделяют ДНК или мРНК из образца клетки. мРНК может быть амплифицирована с помощью ОТ-ПЦР, с использованием обратной транскриптазы для формирования комплементарной цепочки ДНК, с последующей амплификацией с помощью полимеразной цепной реакцией с использованием праймеров, специфических для заявленных последовательностей ДНК. Альтернативно, образец мРНК отделяют с помощью гель-электрофореза, переносят на подходящий носитель, например, нитроцеллюлозу, нейлон и т.д., и затем тестируют фрагментом заявленной ДНК в качестве пробы. Могут также использоваться другие способы, такие как анализы сшивания олигонуклеотидов, гибридизация in situ и гибридизация ДНК-пробами, иммобилизованными на твердый чип. Обнаружение мРНК, гибридизующейся с заявленной последовательностью указывает на экспрессию гена в образце.
Белки
[076] Также обеспечиваются в соответствии с заявленным изобретением люциферазы, их гомологи, производные и мутанты, включая полноразмерные белки и их части или фрагменты.
[077] Заявленные белки являются люциферазами, способными катализировать окисление люциферина в присутствии кислорода. Реакция окисления не зависит от присутствия в среде АТФ, NAD(P)H и других метаболитов. Заявленные белки отличаются от известных ранее люцифераз, так как окисляют 3-гидроксигиспидин, имеющий структуру:
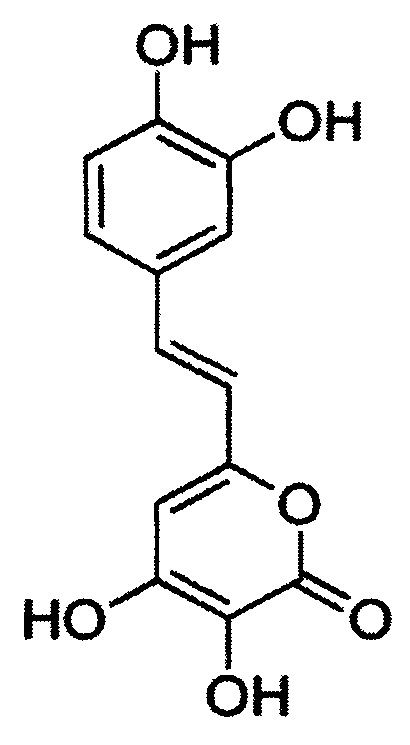
[078] Заявленные люциферазы могут катализировать окисление других химических соединений. Выявление таких соединений производится путем объединения выделенной люциферазы и указанного химического соединения в подходящих условиях и выявлении испускаемого в ходе реакции окисления света. Примерами соединений, способных выступать в качестве люциферинов для заявленных люцифераз, являются, например
[079] (Е)-6-(4-(диэтиламино)стирил)-3,4-дигидрокси-2Н-пиран-2-он, имеющий структуру:
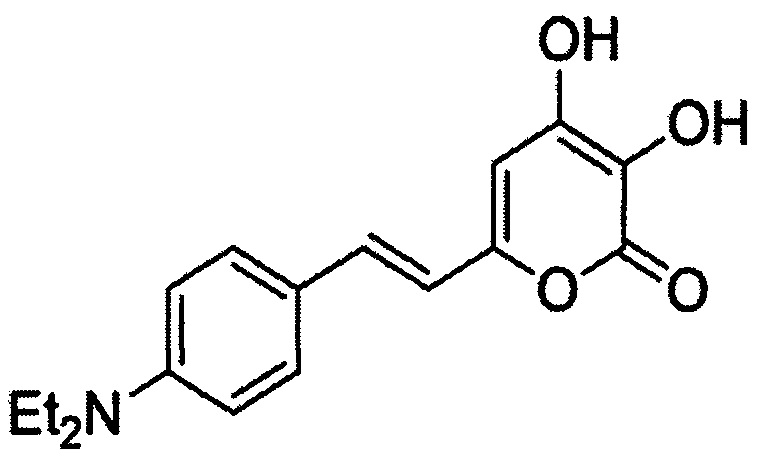
[080] (Е)-3,4-дигидрокси-6-(4-гидроксистирил)-2Н-пиран-2-он, имеющий структуру:
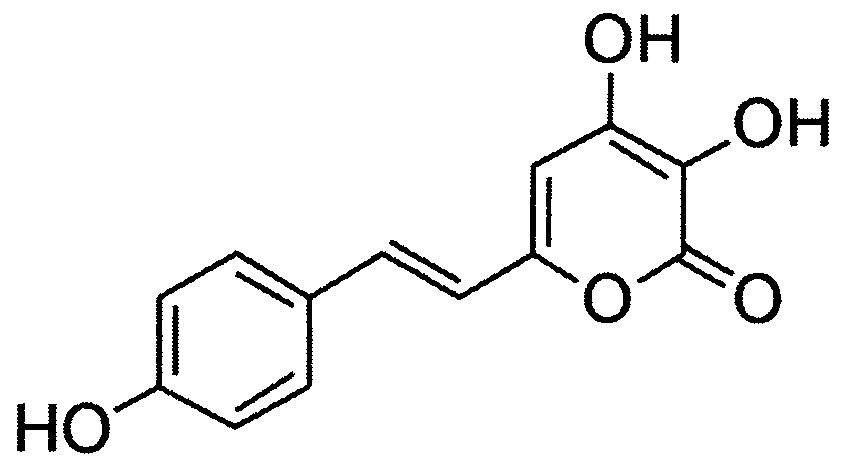
[081] (Е)-6-(2-(1Н-индол-3-ил)винил)-3,4-дигидрокси-2Н-пиран-2-он, имеющий структуру:

[082] (Е)-6-(2-(1,2,3,5,6,7-гексагидропиридо[3,2,1-ij]хинолин-9-ил)винил)-3,4-дигидрокси-2Н-пиран-2-он, имеющий структуру:
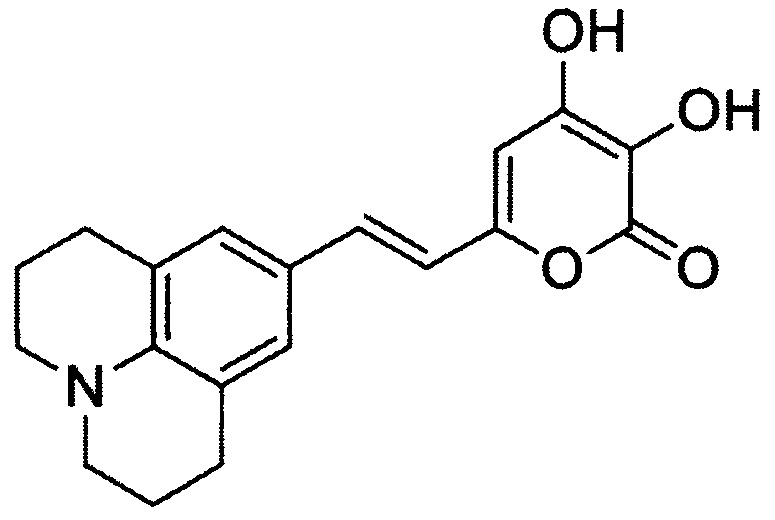
[083] и (Е)-3,4-дигидрокси-6-(2-(6-гидроксинафталин-2-ил)винил)-2Н-пиран-2-он, имеющий структуру:
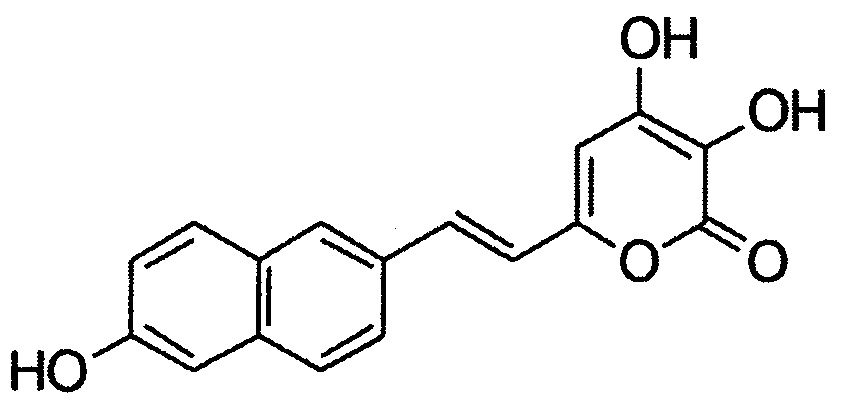
[084] Реакция окисления люциферинов люциферазой настоящего изобретения сопровождается выделением детектируемого света.
[085] В некоторых вариантах осуществления настоящего изобретения выделяемый в процессе реакции свет может быть выявлен обычными методами (например, при визуальном осмотре, осмотре с помощью приборов ночного видения, спектрофотометрией, спектрофлуориметрией, с использованием фотографической регистрации изображения, с использованием специализированного оборудования для детекции люминесценции и флуоресценции, такого, как, например, IVIS Spectrum In Vivo Imaging System (Perkin Elmer) и т.п.). Регистрируемый свет может испускаться в диапазоне интенсивностей от одного фотона до легко заметного глазу света, например, с интенсивностью 1 кд, и яркого света с интенсивностью, например, 100 кд, и более.
[086] Испускаемый при окислении 3-гидроксигиспидина свет обладает находится в диапазоне от 400 до 700 нм, чаще в диапазоне от 450 до 650 нм, с максимумом эмиссии при 520-590 нм.
[087] Заявленные белки сохраняют активность при температурах ниже 50°C, чаще при температурах до 45°C, то есть они сохраняют активность при температурах 30-42°C и могут быть использованы в системах гетерологической экспрессии in vitro и in vivo.
[088] Заявленные белки обладают pH стабильностью в диапазоне от 4 до 10, чаще в диапазоне от 6.5 до 9.5. Оптимум pH стабильности заявленных белков лежит в диапазоне между 7.0 и 8.0, например, между 7.3-7.5.
[089] Белки, представляющие интерес, включают природные люциферазы из из Neonothopanus nambi (SEQ ID NO: 2), Armillaria gallica (SEQ ID NO: 4), Armillaria mellea (SEQ ID NO: 6), Armillaria ostoyae (SEQ ID NO: 8), Mycena chlorophos (SEQ ID NO: 10), Mycena citricolor (SEQ ID NO: 12), Omphalotus olearius (SEQ ID NO: 14), и Panellus stipticus (SEQ ID NO: 16 и 18), их рекомбинантные и укороченные варианты, например, содержащие аминокислотные последовательности, показанные в SEQ ID NO: 20, 22, 24, 26, 28, 30, 32, 34 и детально описанные в экспериментальной секции, ниже.
[090] Также обеспечиваются люциферазы, по существу сходные вышеуказанным люциферазам и их функциональным фрагментам. Во многих вариантах осуществления настоящего изобретения представляющие интерес аминокислотные последовательности характеризуются значительной идентичностью по последовательности, которая составляет, например, не менее 40% идентичности, например, не менее 45% идентичности, или не менее 50% идентичности, или не менее 55% идентичности, или не менее 60% идентичности, или не менее 65% идентичности, или не менее 70% идентичности, или не менее 75% идентичности, например, не менее 80% идентичности, не менее 85% идентичности, не менее 90% идентичности (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 98% или 99% идентичности). В особенности это относится к последовательности аминокислот, которые обеспечивают функциональные участки белка, то есть к последовательности белка, расположенной после последовательности трансмембранного домена, входящего в состав природных люцифераз настоящего изобретения.
[091] Также обеспечиваются люциферазы, которые содержат характерную консенсусную последовательность, присущую природным люциферазам настоящего изобретения и показанную в SEQ ID NO: 35. Консенсусная последовательность создается с помощью множественного сравнения люцифераз настоящего изобретения путем выявления аминокислот, наиболее часто встречающихся в данном положении во всей совокупности родственных последовательностей.
[092] Белки, представляющие собой мутанты указанных выше белков, также рассматриваются в настоящем изобретении. Мутанты могут сохранять биологические свойства белков, из которого они были получены, или могут обладать биологическим свойствами, которые отличаются от свойств белков дикого типа. Термин «биологическое свойство» белков согласно настоящему изобретению относится, без ограничения, к способности окислять различные люциферины; биохимическим свойствам, таким, как стабильность in vivo и/или in vitro (например, период полувыведения); скорость созревания; тенденция к агрегации или олигомеризации, а также другие подобные свойства. Мутации включают изменения одной или нескольких аминокислот, делеции или вставки одной или нескольких аминокислот; N-концевые усечения или расширения, C-концевые усечения или расширения и т.п.
[093] Мутанты могут быть получены с использованием стандартных методик молекулярной биологии, таких как подробно описанные выше в разделе «Молекулы нуклеиновой кислоты».
[094] Белки согласно настоящему изобретению находятся в изолированной форме, то есть это означает, что данный белок по существу свободен от присутствия других белков или других природных биологических молекул, таких как олигосахариды, нуклеиновые кислоты и их фрагменты и т.п., где термин «по существу свободен» в данном случае означает, что менее чем 70%, обычно менее чем 60% и чаще менее чем 50% указанной композиции, содержащей выделенный белок, представляет собой другую природную биологическую молекулу. В некоторых вариантах указанные белки присутствуют по существу в очищенной форме, где термин «по существу очищенная форма» обозначает чистоту, равную по меньшей мере 95%, обычно равную по меньшей мере 97% и чаще равную по меньшей мере 99%.
[095] В предпочтительном варианте целевые белки получают методом синтеза, например, путем экспрессии рекомбинантной нуклеиновой кислоты, кодирующей последовательность, которая кодирует представляющий интерес белок в подходящей клетке-хозяине, как было указано выше. Может использоваться любая удобная процедура очистки белка, где подходящие методики очистки белка описаны в соответствующем руководстве Guide to Protein Purification, (Deuthser ed.) (Academic Press, 1990). Например, может быть получен лизат из исходного источника и далее подвергнут очистке с использованием методики ВЭЖХ, вытеснительной хроматографии, гель-электрофореза, аффинной хроматографии и т.п.
[096] В настоящем изобретении также описываются белки слияния, включающие белок согласно настоящему изобретению или его функциональные фрагменты, слитые, например, с последовательностью субклеточной локализации (например, с сигналом ядерной локализации, сигналом локализации в пероксисомах, митохондриях, аппарате Гольджи и т.п.), с сигнальным пептидом или любым белком или полипептидом, представляющим интерес. Белки слияния могут включать, например, люциферазу настоящего изобретения и второй полипептид («партнер слияния»), оперативно слитые в рамке считывания с N-концом и/или С-концом люциферазы. Партнеры слияния включают, без ограничения, полипептиды, которые могут связываться с антителами, специфичными к партнеру слияния (например, эпитопными метками), с антителами или их связывающими фрагментами, с полипептидами, которые обеспечивают каталитическую функцию или индуцируют клеточный ответ, лигандами или рецепторами или их миметиками и т.п.
[097] В настоящем изобретении также рассматриваются антитела, которые специфически связываются с люциферазами согласно настоящему изобретению. Подходящие антитела могут быть получены с использованием методик, известных в данной области. Например, поликлональные антитела могут быть получены по методике, описанной в работе (Harlow and Lane Antibodies: A Laboratory Manual, (1988) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York). Моноклональные антитела могут быть получены по методике, описанной в работе (Goding Monoclonal Antibodies: Principles and Practice: Production and Application of Monoclonal Antibodies in Cell Biology, Biochemistry and Immunology; 3rd edition, (1996) Academic Press). Химерные антитела, включающие гуманизированные антитела, а также одноцепочечные антитела и фрагменты антител, такие как Fv, F(ab')2 и FAb, также представляют интерес.
Трансгенные организмы
[098] Нуклеиновые кислоты настоящего изобретения могут использоваться для создания трансгенных организмов или для сайт-специфических генных модификаций клеточных линий. Трансгенные клетки согласно настоящему изобретению включают одну или несколько нуклеиновых кислот, рассматриваемых в настоящем изобретении, которые присутствуют в качестве трансгена. Для целей настоящего изобретения может использоваться любая подходящая клетка-хозяин, включающая прокариотические (например, Escherichia coli, Streptomyces sp., Bacillus subtilis, Lactobacillus acidophilus и т.п.) или эукариотические клетки-хозяева, не являющиеся эмбриональными клетками человека. Трансгенные организмы согласно настоящему изобретению могут представлять прокариотические или эукариотические организмы, включающие бактерии, цианобактерии, грибы, растения и животные, в которые вводится одна или большее число клеток организма, содержащего гетерологичную нуклеиновую кислоту согласно настоящему изобретению, путем встраивания ее за счет манипуляции человеком, например, в рамках трансгенных методик, известных в данной области.
[099] Выделенная нуклеиновая кислота согласно настоящему изобретению может быть встроена в организм-хозяин с использованием методик, известных в данной области, например, путем инфекции, трансфекции, трансформации, доставки с помощью генной пушки или трансконъюгации. Методики переноса молекул нуклеиновой кислоты (например, ДНК) в такие организмы хорошо известны и описаны в стандартных руководствах таких, как Sambrook et al. (Molecular Cloning: A Laboratory Manual, 3nd Ed., (2001) Cold Spring Harbor Press, Cold Spring Harbor, NY).
[0100] В одном варианте осуществления настоящего изобретения трансгенный организм может представлять собой прокариотический организм. Способы трансформации прокариотических хозяйских клеток хорошо известны в данной области (см., например, Sambrook et al. (Molecular Cloning: A Laboratory Manual, 2nd Ed., (1989) Cold Spring Harbor Laboratory Press и Ausubel et al., Current Protocols in Molecular Biology (1995) John Wiley & Sons, Inc).
[0101] В другом варианте осуществления настоящего изобретения указанный трансгенный организм может представлять собой гриб, например, дрожжи. Дрожжи широко используются в качестве носителя для гетерологичной генной экспрессии (см., например, Goodey et al., Yeast biotechnology, D R Berry et al., eds, (1987) Allen and Unwin, London, pp. 401-429, и Kong et al., Molecular and Cell Biology of Yeasts, E.F. Walton and G.T. Yarronton, eds, Blackie, Glasgow (1989) pp. 107-133). Доступно несколько типов дрожжевых векторов, включающих интегрирующиеся векторы, которые требуют рекомбинации с геномом-хозяином для своего поддержания, а также автономно реплицирующиеся плазмидные векторы.
[0102] Другим организмом-хозяином является организм животного. Трансгенные животные могут быть получены с использованием трансгенных методик, известных в данной области и описанных в стандартных руководствах (таких как: Pinkert, Transgenic Animal Technology: A Laboratory Handbook, 2nd edition (2003) San Diego: Academic Press; Gersenstein and Vinterstein, Manipulating the Mouse Embryo: A Laboratory Manual, 3rd ed, (2002) Nagy A. (Ed), Cold Spring Harbor Laboratory; Blau et al., Laboratory Animal Medicine, 2nd Ed., (2002) Fox J.G., Anderson L.C., Loew F.M., Quimby F.W. (Eds), American Medical Association, American Psychological Association; Gene Targeting: A Ptactical Approach by Alexandra L. Joyner (Ed.) Oxford University Press; 2nd edition (2000)). Например, трансгенные животные могут быть получены посредством гомологичной рекомбинации, в рамках которой меняется эндогенный локус. Альтернативно, конструкцию нуклеиновой кислоты интегрируют в случайном режиме в геном. Векторы для стабильной интеграции включают плазмиды, ретровирусы и другие вирусы животных, YAC и т.п.
[0103] Нуклеиновая кислота может быть введена в клетку, непосредственно или опосредованно, за счет введения в предшественник клетки, с помощью осторожной генетической манипуляции, такой как микроинъекция, или с помощью инфекции рекомбинантным вирусом или с использованием рекомбинантного вирусного вектора и т.п. Термин «генетическая манипуляция» не включает классический кроссбридинг или оплодотворение in vitro, но, скорее, обозначает введение рекомбинантный молекулы нуклеиновой кислоты. Указанная молекула нуклеиновой кислоты может быть интегрирована в хромосому или может представлять собой внехромосомно реплицирующуюся ДНК.
[0104] Конструкции ДНК для гомологичной рекомбинации включают по меньшей мере часть нуклеиновой кислоты согласно настоящему изобретению, где указанный ген содержит желательную одну или несколько генетических модификаций и включает участки гомологии к целевому локусу. В конструкции ДНК для проведения случайной интеграции нет необходимости включать участки гомологии для облегчения рекомбинации. Могут быть также включены маркеры позитивной и негативной селекции. Способы получения клеток, содержащих целевые генные модификации, посредством гомологической рекомбинации, известны в данной области. Различные методики трансфекции клеток млекопитающих описаны, например, в работе Keown et al., Meth. Enzymol. (1990) 185: 527-537).
[0105] В случае эмбриональных стволовых клеток (ES), может быть использована клеточная линия ES или эмбриональные клетки могут быть получены в свежем виде от организма-хозяина, такого как мышь, крыса, морская свинка и т.п. Такие клетки выращивают на соответствующем питательном слое для фибробластов или выращивают в присутствии фактора ингибирования лейкозных клеток (LIF). Трансформированные ES или эмбриональные клетки могут быть использованы для создания трансгенных животных с использованием соответствующей методики, известной в данной области.
[0106] Трансгенные животные могут представлять собой любых животных, отличных от человека, включая млекопитающее, отличное от человека (например, мышь, крыса), птицу или земноводное и т.п., и используются в функциональных исследованиях, при скрининге лекарственных препаратов и т.п.
[0107] Могут быть также получены трансгенные растения. Способы получения трансгенных растительных клеток и растений описаны в патентах №№5767367, 5750870, 5739409, 5689049, 5689045, 5674731, 5656466, 5633155, 5629470, 5595896, 5576198, 5538879 и 5484956, описание которых включено в настоящее изобретение в качестве ссылок. Способы получения трансгенных растений обобщены также в следующих обзорах: Plant Biochemistry and Molecular Biology (eds. Lea and Leegood, John Wiley & Sons (1993) pp. 275-295 и в Plant Biotechnology and Transgenic Plants (eds. Oksman-Caldentey and Barz) (2002) 719 p.
[0108] Для получения трансгенного организма-хозяина могут использоваться, например, эмбриогенные эксплантаты, содержащие соматические клетки. После сбора клеток или тканей интересующую экзогенную ДНК вводят в растительные клетки, и для такого введения доступно множество различных методик. При наличии выделенных протопластов возникает возможность введения с использованием ДНК-опосредованных протоколов генного переноса, включающих инкубирование протопластов с оголенной ДНК, такой как плазмида, включающей экзогенную кодирующую последовательность, представляющую интерес, в присутствии поливалентных катионов (например, ПЭГ или PLO); или по методу электропорации протопластов в присутствии оголенной ДНК, включающей интересующую экзогенную последовательность. Далее отбирают протопласты, которые успешно захватили экзогенную ДНК, растят их до образования калюса и в итоге получают трансгенные растения посредством контакта с соответствующими количествами и взятыми в соответствующих соотношениях стимулирующих факторов, таких как ауксины и цитокинины.
[0109] Могут использоваться другие подходящие методы получения растений, такие как подход, основанный на использовании «генной пушки» или трансформация, опосредованная использованием Agrobacterium, известные специалистам в данной области.
Способы использования
[0110] Полипептиды и нуклеиновые кислоты настоящего изобретения находят применение в различных приложениях. Например, они используются в качестве реагентов для диагностики, контроля качества, экологического тестирования и других подобных исследований в биотехнологии и медицине. Кроме того, они находят применение в бытовых и ориентированных на развлечения приложениях, например, при получении биолюминесцентных трансгенных растений и животных, которые могут быть использованы в качестве источников света.
[0111] Например, нуклеиновые кислоты композиции могут быть применены для детекции различных внешних сигналов в среде. Например, для выявления сигналов в кишечнике млекопитающих. Для реализации применения в геном микроорганизма-хозяина вводят кассеты экспрессии, кодирующие сигнальный каскад, в котором триггером выступает анализируемый сигнал внешней среды, а репортером - экспрессия гена люциферазы. Экспрессия гена люциферазы может вызываться как непосредственно прохождением сигнального каскада, так и через индукцию генетических изменений в геноме клетки, с помощью методик, описанных, например, в [Kotula et al., Proc. Natl. Acad. Sci. USA, 2014, 111: 4838-4843]. Так, например, для создания штамма E. coli, регистрирующего присутствие во внешней среде тетрациклина, в геном E. coli вводят кодирующую последовательность люциферазы под контролем промотора гена tetA, а также также последовательность, кодирующую тетрациклин-чувствительный репрессор TetR из транспозона Tn10, под контролем конститутивного промотора. Геномное редактирование E. coli обеспечивается за счет методик, хорошо известных в области, например, описанных в [Sabri et al., Microbial Cell Factories, 2013, 12: 60]. Детекция присутствия в среде тетрациклина достигается сравнением интенсивности биолюминесценции при добавлении раствора 3-гидроксигиспидина к генетически модифицированным клеткам E. coli, прошедшим инкубацию в анализируемой среде, и к контрольным клеткам, не прошедших такую инкубацию. Аналогичным образом могут быть созданы другие штаммы микроорганизмов, чувствительные к другим сигналам внешней среды, путем замены соответствующих элементов сигнального каскада на элементы, специфически чувствительные к желаемым сигналам. Независимость эмиссии света заявленными люциферазами от внутриклеточной доступности АТФ, NAD(P)H и других метаболитов обеспечивают стабильность репортерного сигнала в различных физиологических состояниях клетки.
[0112] Также нуклеиновые кислоты настоящего изобретения находят применение в способах определения наличия в воде токсических веществ, например, производных гексахлорциклогексана и других. В микроорганизм-хозяин (например, в E. coli) вводят кассету экспрессии, обеспечивающую конститутивную продукцию люциферазы, оперативно слитой с сигналом быстрой белковой деградации. Для определения токсичности лиофилизированных бактерий инкубируют в течение 90 минут с анализируемой жидкостью в кювете для определения биолюминесценции, и в то же время другую аликвоту бактерий инкубируют с контрольной жидкостью. Критерием токсического действия является изменение интенсивности биолюминесценции в исследуемой пробе по сравнению с таковой для образца с раствором, не содержащим токсических веществ. По уменьшению интенсивности люминесценции судят о размере токсического эффекта.
[0113] Также молекулы настоящего изобретения могут быть использованы для определения концентрации 3-гидроксигиспидина в анализируемом растворе. Для этого, реагент, содержащий очищенную люциферазу в известной концентрации помещают в кювету и регистрируют фоновый сигнал биолюминесценции с помощью люминометра. Затем проводят контрольные калибровочные измерения: в кювету добавляют раствор 3-гидроксигиспидина с известной концентрацией, не прерывая регистрации интенсивности биолюминесценции. Разность между величиной сигнала интенсивности биолюминесценции в присутствии и в отсутствие 3-гидроксигиспидина является величиной, пропорциональной концентрации 3-гидроксигиспидина. Операцию повторяют для растворов 3-гидроксигиспидина в том диапазоне концентраций, в котором предполагается проводить измерения. На основании полученных данных строят калибровочный график зависимости интенсивности биолюминесценции от концентрации 3-гидроксигиспидина. Концентрацию 3-гидроксигиспидина в неизвестном образце определяют по интенсивности биолюминесценции, возникающей при добавлении раствора 3-гидроксигиспидина неизвестной концентрации к реагенту, используя калибровочный график, описанный выше. Заявленные белки и нуклеиновые кислоты - единственные существующие на сегодняшний день реагенты, способные специфически определять концентрацию 3-гидроксигиспидина в сложных смесях с другими соединениями.
[0114] Также нуклеиновые кислоты композиции могут быть использованы для создания трансгенных растений или животных, излучающих свет. Например, для создания трансгенного мха Physcomitrella patens необходимо интегрировать в его геном кодирующую последовательность люциферазы, оптимизированной для экспрессии в клетках организма-хозяина, под контролем конститутивного промотора, например, промотора гена Aktl риса, или индуцируемого промотора, например, термочувствительного промотора гена Gmhsp17.3B сои. Интеграция в геном может быть произведена с помощью любого из методов, известных в области, например, с помощью гомологичной рекомбинации, индуцируемой возникновением двуцепочечного разрыва в геномной ДНК мха с помощью нуклеазы Cas9 Streptococcus pyogenes и гидовой РНК, комплементарной геномному локусу. В этом случае, интегрируемая генетическая конструкция должна быть фланкирована участками, гомологичными участкам генома в области двуцепочечного разрыва, длиной около 250 нуклеотидов. Для доставки ДНК в клетки мха может также применяться любая из известных методик, например, трансформация протопластов мха оголенной ДНК с помощью полиэтиленгликоля. После проведения трансформации, протопласты мха должны подращиваться в питательной среде для регенерации клеточной стенки, а затем высеваться на твердую среду для регенерации гаметофитов. Генетически модифицированные растения могут служить источниками света в случае добавления 3-гидроксигиспидина или родственных молекул в среду или в почву, или автономно биолюминесцировать, если биосинтез 3-гидроксигиспидина происходит в клетках хозяина. Заявленные люциферазы излучают преимущественно зеленый свет и, таким образом, оптимально подходят для эмиссии света сквозь ткани фотосинтезирующих растений в связи со сниженным поглощением таких тканей в зеленой области видимого спектра.
[0115] Нуклеиновые кислоты композиции также могут быть применены для визуализации клеточных белков, органелл, отдельных клеток или тканей. Например, для визуализации миграции раковых клеток в организме нуклеиновые последовательности люцифераз вводят в составе кассеты экспрессии или экспрессионного вектора в раковые клетки. Доставка может осуществляться любым из способов, известных в области. Например, нуклеиновые кислоты, кодирующие люциферазу, могут быть интегрированы в геном раковых клеток перед имплантацией в организм хозяина. В других вариантах, нуклеиновые кислоты водятся во все клетки организма, но быть помещены под контроль промоторов, активных только в раковых клетках. Так как 3-гидроксигиспидин способен проникать через клеточные мембраны, заявленные люциферазы можно визуализировать in vivo в живых организмах без фиксации и пермеабилизации тканей. Для визуализации развития раковых опухолей и метастазирования в исследуемый организм должен быть введен раствор люциферина, а ткани визуализированы с помощью подходящего для детекции биолюминесценции оборудования.
Наборы
[0116] В настоящем изобретении также обеспечиваются наборы для осуществления одного или нескольких направлений применения нуклеиновых кислот и белков настоящего изобретения.
[0117] Указанные наборы в типичном случае включают белок согласно настоящему изобретению или нуклеиновую кислоту, кодирующую данный белок, предпочтительно с элементами для обеспечения экспрессии целевого белка в клетке-хозяине, например, вектор или кассету экспрессии, содержащую нуклеиновую кислоту, кодирующую целевой белок. Указанные наборы также включают люциферин для проведения люминесцентной реакции с люциферазой настоящего изобретения.
[0118] В некоторых воплощениях люциферин выбран из группы, включающей 3-гидроксигиспидин, (Е)-6-(4-(диэтиламино)стирил)-3,4-дигидрокси-2Н-пиран-2-он, (Е)-3,4-дигидрокси-6-(4-гидроксистирил)-2Н-пиран-2-он, (Е)-6-(2-(1Н-индол-3-ил)винил)-3,4-дигидрокси-2Н-пиран-2-он, (Е)-6-(2-(1,2,3,5,6,7-гексагидропиридо[3,2,1-ij]хинолин-9-ил)винил)-3,4-дигидрокси-2Н-пиран-2-он и (Е)-3,4-дигидрокси-6-(2-(6-гидроксинафталин-2-ил)винил)-2Н-пиран-2-он.
[0119] Указанные компоненты набора обычно присутствуют в подходящей для хранения среде, такой как буферный раствор, обычно в подходящем контейнере. Указанные компоненты могут присутствовать в наборе в лиофилизированной форме.
[0120] Также в наборе могут содержаться антитела, специфичные для предлагаемого белка. В некоторых вариантах указанный набор включает множество различных векторов, каждый из которых кодирует целевой белок, где указанные векторы разработаны для целей экспрессии в разных средах и/или в разных условиях, таких как, например, конститутивная экспрессия, где указанный вектор включает сильный промотор для экспрессии в клетках млекопитающих, или беспромоторный вектор с сайтом множественного клонирования для обычного встраивания промотора и пролонгированной экспрессии и т.п.
[0121] Кроме указанных выше компонентов, целевые наборы также включают инструкции для осуществления предлагаемых методов. Инструкции могут присутствовать в целевых наборах в разных формах, где в каждом наборе может присутствовать одна или несколько таких форм.
[0122] Приведенные ниже примеры даны для целей иллюстрации и не должны быть интерпретированы в плане ограничения.
Примеры (экспериментальная часть)
Пример 1. Выделение кодирующей последовательности люциферазы из Neonothopanus nambi
[0123] Суммарная РНК из мицелия Neonothopanus nambi была выделена по методу, описанному в [Chomczynski and Sacchi, Anal. Biochem., 1987, 162, 156-159]. кДНК была амплифицирована с помощью SMART PCR cDNA Synthesis Kit (Clontech, США) согласно протоколу производителя. ПЦР-продукт был клонирован в вектор pGAPZ (Invitrogen, США) и трансформирован в компетентные клетки E. coli штамма XL1 Blue. Бактерии выращивали на чашках Петри в присутствии антибиотика зеоцина. Через 16 ч колонии были смыты с чашек, интенсивно перемешаны, и из них была выделена плазмидная ДНК с помощью набора для выделения плазмидной ДНК (Евроген, Россия). Выделенная плазмидная ДНК была линеаризована по сайту рестрикции Avrll и использована для трансформации клеток Pichia pastoris GS115. Электропорация была проведена по методу с использованием ацетата лития и дитиотреитола, описанному в [Wu and Letchworth, Biotechniques, 2004, 36: 152-4]. Электропорированные клетки были рассеяны на чашки Петри со средой RDB medium, содержащей 1 М сорбитола, 2% (w/v) глюкозы, 1.34% (w/v) дрожжевую основу азотного агара (YNB), 0.005% (w/v) смеси аминокислот, 0.00004% (w/v) биотина и 2% (w/v) агара. Разнообразие итоговой библиотеки кДНК Neonothopanus nambi в дрожжах составило порядка одного миллиона клонов. Полученные колонии опрыскивали раствором 3-гидроксигиспидина, детектируя присутствие в клетках люциферазы по появлению света. Испускаемый колониями свет детектировали с помощью IVIS Spectrum СТ (PerkinElmer, США). Колонии, в которых детектировалось свечение в ответ на добавление 3-гидроксигиспидина отбирали и использовали для ПЦР в качестве матрицы со стандартными плазмидными праймерами. Продукты ПЦР секвенировали по методу Сенгера. Полученная последовательность нуклеиновой кислоты показана в SEQ ID NO: 01. Кодируемая ею аминокислотная последовательность показана в SEQ ID NO: 02.
[0124] Для анализа биолюминесценции экспрессированной люциферазы, колонии Pichia pastoris, в которых наблюдалось свечение, изолировали и растили в колбах объемом 750 мл, заполненных 250 мл среды YPD, в течение 72 часов при температуре 30°C и перемешивании со скоростью 200 об/мин. Затем клетки, экспрессирующих люциферазу, осаждали центрифугированием при 5000 g в течение 15 минут при 4°C. Полученный осадок ресуспендировали в фофсатном буфере с ионной силой 0.1 М и pH 7.4, содержащем 0.1% DDM, в течение двух часов при 4°C. Суспензию центрифугировали при 21000 g в течение 30 min при 4°C. Реакцию биолюминесценции активировали добавляя 750 мкл полученного супернатанта к 250 мкл раствора 3-гидроксигиспидина (25 мкМ) в 1% DDM. Биолюминесценцию детектировали с помощью спектрофлюориметра Varian Саrу Eclipse Spectrofluorimeter. Полученный спектр в целом совпадал со спектром биолюминесценции мицелия Noeonothopanus nambi (Фиг. 1).
Пример 2. Выделение кодирующих последовательностей люцифераз из различных видов грибов
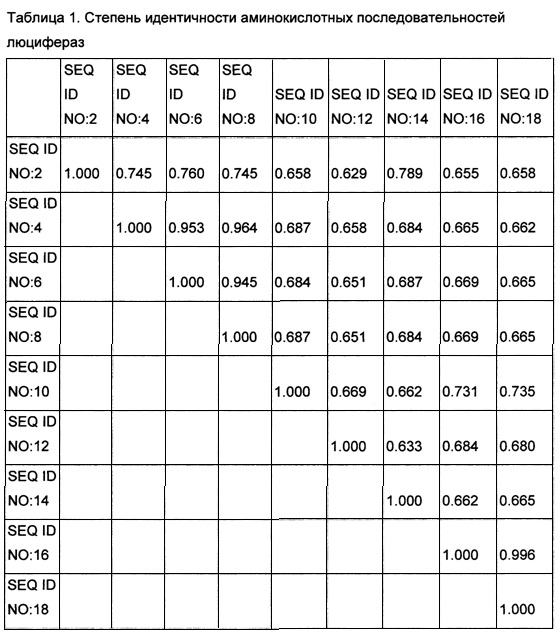
[0125] Из грибов Armillaria gallica, Armillaria mellea, Armillaria ostoyae, Mycena chlorophos, Omphalotus olearius и Panellus stipticus была выделена геномная ДНК и проведено полногеномное секвенирование по технологии Illumina HiSeq (Illumina, США) согласно рекомендациям производителя. Результаты секвенирования были использованы для предсказания аминокислотных последовательностей гипотетических белков и использованы для поиска гомологов люциферазы из Noeonothopanus nambi, выявленной как описано в Примере 1. Поиск гомологов осуществлялся с помощью алгоритма для анализа последовательности, описанного в Altschul et al., J. Mol. Biol., 215, pp. 403-10 (1990) и программного обеспечения, предоставляемого National Center for Biotechnology Information. Был также проведен поиск аминокислотных последовательностей в данных геномного секвенирования грибов в базе данных NCBI Genbank. При поиске использовали стандартные параметры поиска blastp. В результате были идентифицированы последовательности гипотетических белков - гомологов люциферазы из Noeonothopanus nambi в Armillaria gallica, Armillaria mellea, Armillaria ostoyae, Mycena chlorophos, Omphalotus olearius, Panellus stipticus и Mycena citricolor. Bсe выявленные люциферазы по существу сходны друг с другом. Степень идентичности аминокислотных последовательностей показан в Таблице 1.
[0126] На основании множественного выравнивания на консервативные участки нуклеотидных последовательностей были сконструированы вырожденные праймеры. Структуры праймеров показаны в SEQ ID No: 36-43. Из плодовых тел и мицелия грибов Armillaria gallica, Armillaria mellea, Armillaria ostoyae, Mycena chlorophos, Mycena citricolor, Omphalotus olearius, and Panellus stipticus была выделена суммарная РНК и приготовлена кДНК как описано в Примере 1. Полученная кДНК была использована для ПЦР с вышеуказанными праймерами. ПЦР проводили в реакционной смеси объемом 50 мкл, содержащей 1 мкл 20-кратно амплифицированной «ДНК, смесь полимераз Encyclo (Евроген), однократный буфер, предоставленный производителем, 200 мкМ dNTPs и 0.5 мкМ одного из праймеров 1711-1714 и 0.5 мкМ одного из праймеров 1715-1718. 30 циклов ПЦР были проведены в амплификаторе РТС-200 MJ Research Thermal Cycler в режиме расчета температуры блока (каждый цикл проводили в условиях 95°C - 10 сек; 55°C - 10 сек; 72°C - 1 мин). ПЦР-продукт был клонирован в вектор pTAdv (Clontech), плазмидную ДНК выделяли и секвенировали по методу Сенгера с помощью универсальных праймеров М13. Во всех случаях в кДНК исследованных грибов были обнаружены последовательности ллюцифераз.
[0127] При амплификации «ДНК Panellus stipticus были обнаружены два варианта последовательности люциферазы, отличающиеся единичной аминокислотной заменой валина на изолейцин в положении 146 (SEQ ID No: 15-18).
Пример 3. Экспрессия люцифераз в клетках млекопитающих
[0128] Кодирующие последовательности люцифераз, полученные как описано в примерах 1 и 2, оптимизировали для экспрессии в клетках млекопитающих (гуманизировали). Гуманизированные нуклеиновые кислоты получали методом олигонуклеотидного синтеза по стандартным методикам. Нуклеотидный состав гуманизированных нуклеиновых кислот показан в SEQ ID NOs: 44-51, аминокислотный состав соответствующих белков идентичен белкам дикого типа, показанным в SEQ ID NOs: 2, 4, 6, 8, 10, 12, 14, 16. Полученные нуклеиновые кислоты клонировали в вектор pmKate2-keratin (Евроген, Россия), используя сайты рестрикции Nhel и Notl вместо последовательности, кодирующий белок слияния mKate2-keratin. Плазмидную ДНК очищали и трансфицировали в клетки HEK293NT и HeLa с помощью трансфекционного реагента FuGENE HD (Promega, США) по протоколу производителя. Спустя 24 часа после трансфекции в среду добавляли 3-гидроксигиспидин в концентрации 660 мкг/мл, а свечение клеток детектировали с помощью IVIS Spectrum СТ (PerkinElmer). Все проанализированные образцы испускали свет с интенсивностью на порядок и более превышающей сигнал, исходящий от нетрансфицированных контрольных клеток (Фиг. 2).
[0129] Нуклеотидную последовательность SEQ ID No: 51 в составе вектора подвергли сайт-направленному мутагенезу, внеся замену валина на изолейцин в положении 146. Вектор, содержащий полученную последовательность трансфицировали в клетки HEK293NT. Спустя 24 часа после трансфекции, в среду добавляли 3-гидроксигиспидин в концентрации 660 мкг/мл, а свечение клеток детектировали с помощью IVIS Spectrum СТ (PerkinElmer). Было показано, что этот вариант также способен к биолюминесцентной реакции окисления 3-гидроксигиспидина.
Пример 4. Экспрессия люциферазы Neonothopanus nambi в клетках Pichia pastoris
[0130] ДНК, кодирущая люциферазу Neonothopanus nambi, была получена как описано в Примере 1. Ген люциферазы был амплифицирован с помощью ген-специфичных концевых праймеров и клонирован в экспрессионный вектор GAP-pPicZA (Invitrogen) и использованием сайтов рестрикции эндонуклеаз BstBI и Sall, в одну рамку считывания с последовательностью, кодирующей С-концевую гистидиновую метку. Полученная генетическая конструкция была трансформирована в штамм Pichia pink, характеризующийся со сниженной активностью протеаз, с помощью электропорации. Электропорация осуществлялась по методу с использованием ацетата лития и дитиотреитола, описанному в [Wu and Letchworth, Biotechniques, 2004, 36: 152-4]. Электропорированные клетки рассевали на чашки Петри, содержащие среду YPD (2% (w/v) пептона, 1% (w/v) дрожжевого экстракта, 2% (w/v) глюкозы, 2% (w/v) агара) и антибиотик зеоцин в концентрации 100 мкг/мл.
[0131] Клоны Pichia pink, производящие люциферазу, были идентифицированы опрыскиванием колоний раствором 3-гидроксигиспидина и визуализацией биолюминесценции (испускаемого света) с помощью IVIS Spectrum СТ (PerkinElmer). Были отобраны клоны, для которых интенсивность свечения была наибольшей. Клоны изолировали и растили в колбах объемом 750 мл, заполненных 250 мл среды YPD, в течение 72 часов при температуре 30°C и перемешивании со скоростью 200 об/мин. Клетки, экспрессирующие люциферазу, были осаждены центрифугированием при 5000 g в течение 15 минут при 4°C. Осадок затем был ресуспендирован в 100 мл лизирующего буфера (0.1 М фосфата натрия, 0.1 М KCl, 4 мМ EDTA, 2 мМ ТСЕР, 1 мМ PMSF, pH 7.4) и разрушены пропусканием через гомогенизатор высокого давления (APV2000, SPX) 20 раз при давлении в 600 бар. Лизат центрифугировали при 8000 g в течение 15 мин при температуре 4°C. Полученный пост-ядерный супернатант центрифугировали при 140000 g в течение 2 ч при температуре 4°C. Полученный осадок (микросомальная фракция) ресуспендировали в 10 мл воды. Образцы разрешали с помощью денатурирующего электрофореза по Лэммли в полиакриламидном геле (10-25%), окрашенного Coomassie Blue. и использовали для вестерн-блота с коньюгатом антител на гистидиновую метку и пероксидазы хрена, с хемилюминесцентной детекцией сигнала. (Фиг. 4). Вестерн-блот продемонстрировал специфическое окрашивание люциферазы, перемещающейся в геле в области белков с массой 28 кДа, что примерно соответствует ожидаемой молекулярной массе люциферазы Neonothopanus nambi. Также Вестерн-блот показал соосаждение рекомбинантной люциферазы с осадком, полученным центрифугированием при 140000 g.
Пример 5. Получение функциональных фрагментов люцифераз
[0132] Открытые рамки считывание, кодирующие укороченные фрагменты люциферазы из Neonothopanus nambi, получали с помощью олигонуклеотидного синтеза. Нуклеиновые кислоты, кодирующие фрагменты люциферазы с отрезанными N-концевыми 6, 9, 12, 15, 21, 25, 31, 33, 35, 37 и 40 аминокислотными остатками, оперативно сшивали с нуклеиновой кислотой, кодирующей сайт инициации транскрипции и гистидиновую метку и клонировали в в вектор рЕТ-23 с помощью эндонуклеаз рестрикции BamHI and HindIII. Вектор использовали для трансформации клеток Escherichia coli штамма BL21-CodonPlus (производного высокопроизводительного штамма Stratagene BL21-Gold). Клетки высевали на чашки Петри со средой (1% NaCl, 1% триптон, 0.5% дрожжевой экстракт, 1.5% агар, ампициллин 100 мкг/мл, хлорамфеникол 100 мкг/мл и вода), и инкубировали в течение ночи при 37°C. Колонии Escherichia coli затем опрыскивали раствором люциферина и визуализировали в IVIS Spectrum СТ (PerkinElmer, США) для определения функциональности экспрессируемых фрагментов люцифераз. Было обнаружено, что фрагменты люцифераз с отрезанными N-концевыми 6, 9, 12, 15, 21, 25, 31, 33, 35, 37 аминокислотными остатками испускают свет при опрыскивании раствором люциферина.
[0133] Нуклеотидная и аминокислотная последовательности N-конца, с которым оперативно сшивали фрагменты люциферазы показаны в SEQ ID No: 52 и 53, соответственно.
[0134] Анализ аминокислотной последовательности люциферазы из Neonothopanus nambi с помощью программного обеспечения, приведенного в [http://www.cbs.dtu.dk/services/TMHMM/] показал, что в состав первых 39 аминокислот входит трансмембранный домен (фиг. 5). На основании полученных данных был сделан вывод, что удаление последовательности, содержащей трансмембранный домен, не влияет на способность люцифераз грибов катализировать реакцию окисления 3-гидроксигиспидина, сопровождающуюся испусканием света.
[0135] С помощью программного обеспечения, приведенного на сайте [http://www.cbs.dtu.dk/services/TMHMM/] был проведен анализ люцифераз из Armillaria gallica, Armillaria mellea, Armillaria ostoyae, Mycena chlorophos, Mycena citricolor, Omphalotus olearius и Panellus stipticus, клонированных как описано в Примере 2. Во всех случаях в составе аминокислотной последовательности были выявлены N-концевые фрагменты, содержащие трансмембранные домены (фиг. 5). Нуклеотидные и аминокислотные последовательности фрагментов люцифераз, полученные после удаления N-концевых последовательностей, содержащих трансмембранные домены, показаны в SEQ ID NO: 19-34.
[0136] Множественное выравнивание люцифераз показано на фиг. 5. Видно, что на С-конце белки содержат неконсервативный фрагмент длиной 8-11 аминокислот, который также может быть удален или заменен на другой С-конец без потери функциональности люцифераз. Также видно, что люциферазы содержат высокогомологичный центральный участок, содержащий консенсусную последовательность, показанную в SEQ ID No: 35.
Пример 6. Использование люцифераз с другими люциферинами
[0137] Плазмиды, содержащие кодирующие последовательности грибных люцифераз для экспрессии в клетках млекопитающих, были получены как описано в примере 3 и использованы для трансфекции клеток HEK293NT. Спустя 24 часа после трансфекции клетки смывали с чашек с помощью раствора Версена с добавлением 0.025% трипсина, меняли среду на фосфатно-солевой буфер с pH 8.0 центрифугированием, ресуспендировали клетки, лизировали ультразвуком, а в среду добавляли 3-гидроксигиспидин или один из его аналогов ((Е)-6-(4-(диэтиламино)стирил)-3,4-дигидрокси-2Н-пиран-2-он, (Е)-3,4-дигидрокси-6-(4-гидроксистирил)-2Н-пиран-2-он, (Е)-6-(2-(1Н-индол-3-ил)винил)-3,4-дигидрокси-2Н-пиран-2-он, (Е)-6-(2-(1,2,3,5,6,7-гексагидропиридо[3,2,1-ij]хинолин-9-ил)винил)-3,4-дигидрокси-2Н-пиран-2-он или (Е)-3,4-дигидрокси-6-(2-(6-гидроксинафталин-2-ил)винил)-2Н-пиран-2-он) в концентрации 660 мкг/мл.
[0138] Спектры биолюминесценции детектировали с помощью спектрофлюориметра Varian Саrу Eclipse. Все проанализированные образцы испускали свет со всеми проверенными люциферинами В зависимости от используемого люциферина наблюдалось смещение оптимума люминесценции: так при окислении (Е)-3,4-дигидрокси-6-(2-(6-гидроксинафталин-2-ил)винил)-2Н-пиран-2-она наблюдался сдвиг в длиноволновую область со значительным испусканием фотонов с длиной волны более 580 нм, а при окислении (Е)-6-(2-(1Н-индол-3-ил)винил)-3,4-дигидрокси-2Н-пиран-2-она - в коротковолновую область.
Пример 7. Получение рекомбинантных люцифераз
[0139] На 5'-конец нуклеиновых кислот, кодирующих функциональные фрагменты люцифераз (SEQ ID NOs: 19, 21, 23, 25, 27, 29, 31, 33), была оперативно присоединена последовательность SEQ ID No: 52 и полученные конструкции были клонированы в вектор рЕТ-23 с помощью эндонуклеаз рестрикции BamHI and HindIII. Вектор использовали для трансформации клеток Escherichia coli штамма BL21-CodonPlus (производного высокопроизводительного штамма Stratagene BL21-Gold). Клетки высевали на чашки Петри со средой LB, содержащей 1.5% агар, ампициллин 100 мкг/мл и хлорамфеникол 100 мкг/мл, и инкубировали в течение ночи при 37°C. Колонии Escherichia coli затем переносили в 4 мл жидкой среды LB с добавлением ампициллина и хлофамфеникола, инкубировали в течение ночи при покачивании при 37°C. 1 мл ночной культуры переносили в 100 мл среду Overnight Express Autoinduction medium (Novagen), в которую были предварительно добавлены ампициллин и хлофамфеникол. Культуру растили при 37°C в течение 2.5 часов до достижения ей оптической плотности 0.6 ОЕ при 600 нм, а затем растили на комнатной температуре в течение 16 часов. Затем клетки осаждали центрифугированием при 4500 об/мин в течение 20 минут в центрифуге Eppendorf 5810R, ресуспендировали в 35 мл буфера (50 мМ Tris HCl pH 8.0, 150 мМ NaCl) и разрушали ультразвуком. Клеточный лизат центрифугировали при 7500 об/мин в течение 15 минут, сохраняли осадок, в то время как супернатант дополнительно подвергали центрифугированию при 35000 об/мин в течение одного часа для разделения микросомальной и растворимой фракций. Осадок растворяли в 10 мл буфера, содержащего мочевину (8 М urea, 50 мМ Tris, pH 8.0) в течение ночи при комнатной температуре.
[0140] Наличие ожидаемого рекомбинантного продукта подтверждали с помощью электрофореза. Пример подобного анализа для фрагмента люциферазы Neonothopanus nambi показан на фиг. 6. Видно наличие полосы в области 28 kDa, примерно соответствующей ожидаемой молекулярной массе люциферазы Neonothopanus nambi.
Аликвоты выделенных рекомбинантных белков наносили на полиакриламидный гель-элетрофорз, а также использовали для проверки функциональности и стабильности рекомбинантных белков. Выделенные рекомбинантные белки испускали свет при соединении с 3-гидроксигиспидином с максимумами эмиссии в области 520-535 нм, причем интенсивность испускаемого света была наибольшей у функционального фрагмента люциферазы Neonothopanus nambi, и наименьшей - у функционального фрагмента Omphalotus olearius. Рекомбинантные белки были активны в буферных растворах с pH в дапазоне 7-9 и демонстрировали максимальную интенсивность биолюминесцентной реакции при pH 7.3-8. Пример графика зависимости интенсивности биолюминесцентного свечения от pH раствора показан на фиг. 7.
[0141] Для анализа температурной стабильности люциферазы инкубировали при различных температурах в течение 10 мин при pH 7.4. По окончании инкубации к белкам добавляли 3-гидроксигиспидин и анализировали интенсивоность биолюминесценции как описано выше. Люциферазы сохраняли более 10% максимальной активности после инкубации при температурах ниже 50°C, более 30% активности при температурах ниже 40°C, более 70% при температурах ниже 38°C и 100% активности при температурах ниже 34°C включительно.
Пример 8. Использование люциферазы Neonothopanus nambi для мечения клеток
[0142] Вектор, содержащий люциферазу Neonothopanus nambi под контролем цитомегаловирусного промотора, полученный как описано в Примере 3, котрансфицировали с вектором pTurboFP635-N (Евроген, Россия), кодирующим красный флуоресцентный белок, в клетки линии HEK293NT. Трансфекцию проводили трансфекционным реагентом FuGENE HD (Promega) по протоколу, рекомендованному производителем. Спустя 24 часа после трансфекции в среду добавляли 3-гидроксигиспидин до конечной концентрации 660 мкг/мл, а свечение клеток анализировали с помощью микроскопа Leica DM6000 с объективом 20х. Клетки визуализировали в проходящем свете, в канале для детекции зеленой флуоресценции и в канале для детекции красной флуоресценции (Фигура 6). Экспрессия люциферазы Neonothopanus nambi в клетках человека приводила к появлению отчетливого светового сигнала в зеленой области спектра. Никаких проявлений токсичности экспрессии люциферазы для клеток обнаружено не было.
Пример 9. Мечение белков с помощью люциферазы Neonothopanus nambi
[0143] Гуманизированную нуклеиновую кислоту, кодирующую люциферазу Neonothopanus nambi, полученную как описано в Примере 3, оперативно сшивали (клонировали в одну рамку считывания) с нуклеиновыми кислотами, кодирующими цитоплазматический бета-актин и фибрилларин человека. Полученные конструкции клонировали в вектор pmKate2-keratin, как описано в Примере 3. Спустя 24 часа после трансфекции, в среду культивирования был добавлен 3-гидроксигиспидин до конечной концентрации 660 мкг/мл. Регистрируемая при этом биолюминесценция соответствовала паттернам внутриклеточной локализации, характерным для соответствующих клеточных белков.
Пример 10. Мечение органелл с помощью люциферазы Neonothopanus nambi
[0144] Вариант последовательности люциферазы Neonothopanus nambi, оптимизированный для экспрессии в клетках человека, полученный как описано в Примере 3, оперативно сшивали считывания со следующими сигналами внутриклеточной локализации: сигналом локализации в митохондриях (MTS) из 7-ой субъединицы человеческой цитохром-оксидазы; сигналом, кодируемым N-концевыми 81 аминокислотами человеческой бета-1,4-галактозил-трансферазы [Watzele and Berger, Nucleic Acids. Res., 1990, 18: 7174]; сигналом пероксисомальной локализации [Gould et al. J. Biol. Chem., 1989, 108: 1657-1664; Gould et al. EMBO J., 1990, 9: 85-90; Monosov et al., J. Histo. Cytochem., 1996, 44: 581-589]; тремя копиями сигнала внутриядерной локализации (NLS) Т-антигена вируса SV40 [Kalderon et al., Cell, 1984, 39: 499-509; Lanford et al., Cell, 1986, 46: 575-582]. Трансфекция клеток HeLa Kyoto плазмидами, экспрессирующими химерные конструкции с люциферазой Neonothopanus nambi приводила к эффективному перемещению химерных белков в соответствующие органеллы внутри клеток. Биолюминесценция была детектирована через 24 часа после трансфекции при добавлению в среду 3-гидроксигиспидина в конечной концентрации 660 мкг/мл.
Пример 11. Мечение клеток внутри целого организма
[0145] Вектор, содержащий кодирующую последовательность люциферазы Neonothopanus nambi под контролем цитомегаловирусного промотора, был получен как описано в Примере 3. Дополнительно была синтезирована гуманизированная нуклеотидная последовательность, кодирующая люциферазу светлячка Photinus pyralis, и клонирована в такой же вектор.
[0146] Полученные конструкции использовали для трансфекции клеток линии СТ26 (клетки карциномы Mus musculus). Клетки, экспрессирующие люциферазу Neonothopanus nambi, были инъецированы подкожно в левую часть спины мыши, в то время, как клетки, экспрессирующие люциферазу Photinus pyralis, - инъецированы таким же образом в правую половину спины мыши. Спустя 10 минут после инъекции, смесь грибного люциферина (0.5 мг) и люциферина светлячка Photinus pyralis (0.5 мг) была введена мыши внутрибрюшинно. Биолюминесценция мыши была затем визуализирована с помощью IVIS Spectrum СТ (PerkinElmer). Опухоль, экспрессирующая люциферазу Neonothopanus nambi, демонстрировала интенсивность испускаемого света в 2040000 у.е., а опухоль, экспрессирующая люциферазу Photinus pyralis - 21000000 у.е. (Фиг. 9).
[0147] мРНК люциферазы Neonothopanus nambi была получена путем транскрипции in vitro линеаризованного по сайту Acc65I вектора pCS2+, содержащего ген люциферазы, с помощью полимеразы SP6 из набора SP6 mMessage mMachine Kits (Ambion, США). мРНК далее очищали с помощью CleanRNA Standard Kit (Evrogen) и инъецировали в эмбрионы Xenopus laevis на двухклеточной стадии в оба бластомера, по 500 пг мРНК на бластомер. Для визуализации, на стадии ранней гаструлы (стадия 10.5) в эмбрионы инъецировали раствор люциферина 660 мкг/мл в бластоцель. Свечение эмбриона после окрашивания родамином детектировали во время нейруляции (стадии 16-17) при помощи микроскопа Leica DM6000, в каналах микроскопа для детекции зеленой и красной флуоресценции, с использованием объектива 5х (Фигура 10). Биолюминесцентный сигнал был выявлен в нервной ткани эмбриона.
Пример 12. Приготовление поликлональных антител
[0148] Кодирующая последовательность люциферазы Neonothopanus nambi с удаленным трансмембранным доменом, показанная в SEQ ID No: 19 была синтетически получена в виде двуцепочечной ДНК и клонирована в экспрессионный вектор pQE-30 (Qiagen, Германия) таким образом, что полученный рекомбинантный белок содержал на N-конце гистидиновую метку. После экспрессии в Е. coli, рекомбинантный белок был очищен с помощью металл-аффинной смолы TALON (Clontech) в денатурирующих условиях. Препарат очищенного белка, эмульсифицированный в адъюванте Фрейнда, был использован для четырех иммунизаций кроликов с месячными интервалами. Кровь кроликов отбирали на десятый или одиннадцатый дни после иммунизаций. Активность полученной поликлональной антисыворотки была продемонстрирорвана на рекомбинантном белке с помощью методов ELISA и Вестерн-иммуноблоттинга.
Пример 13. Получение трансгенных растений
[0149] Кодирующая последовательность люциферазы Neonothopanus nambi была оптимизирована для экспрессии как в клетках мха Physcomitrella patens (SEQ ID No: 54). Затем in silico была создана транскрипционная единица, содержащую промотор гена aktl риса, 5'-нетранслируемую область цитомегаловируса человека, кодирующую последовательность люциферазы, стоп-кодон, и последовательность терминатора из гена osc агробактерии Agrobacterium tumefaciens. Полученная последовательность была создана синтетически и клонирована с помощью методики Gibson assembly [Gibson et al., Nat Methods, 2009, 6: 343-5] в экспрессионный вектор pLand#1 между фрагментами ДНК, совпадающими с локусом геномной ДНК мха Physcomitrella patens между последовательностями высокоэкспрессируемых генов мха Pp3c16_6440V3.1 и Pp3c16_6460V3.1. Вектор pLand#1 также содержал последовательность гидовой РНК (sgRNA) для нуклеазы Cas9, комплементарную участку того же локуса ДНК. Препарат плазмидной ДНК был котрансформирован вместе с экспрессионным вектором, содержащим последовательность нуклеазы Cas9, в протопласты Physcotmitrella patens согласно протоколу полиэтиленгликольной трансформации, описанному в [Cove et al., Cold Spring Harb Protoc, 2009, 2]. Протопласты затем инкубировали в среде BCD в течение двух дней в темноте при покачивании с интенсивностью 50 об/мин для регенерации клеточной стенки. Протопласты затем переносили на чашки Петри, содержащие агар и среду BCD и выращивали при 16-часовом освещении в течение недели. Трансформированные колонии мха скринировали с внешних геномных праймеров с помощью ПЦР для определения успешности интеграции генетической конструкции в геном, переносили на свежие чашки Петри и выращивали в тех же условиях освещения в течение 30 дней.
[0150] Полученные гаметофиты мха вымачивали в среде BCD, содержащей 3-гидроксигиспидин в концентрации 660 мкг/мл, и анализировали с помощью IVIS Spectrum In Vivo Imaging System (Perkin Elmer). Все проанализированные трансгенные растения демонстрировали биолюминесценцию с интенсивностью, как минимум на два порядка превышающую интенсивность сигнала контрольных растений дикого типа, инкубированных в том же растворе с 3-гидроксигиспидином.
Пример 14. Получение трансгенных животных
[0151] Трансгенные рыбы Danio rerio, содержащие ген люциферазы Neonothopanus nambi, были созданы по методу, описанному в [Hisano et al., Sci Rep., 2015, 5: 8841]. Для создания трансгенных животных были синтетически созданы фрагменты ДНК, содержащие последовательности гидовой РНК и мРНК нуклеазы Cas9 под контролем промотора полимераз бактериофага Т7. Полученные фрагменты использовались для транскрипции in vitro с помощью реагентов из набора MAXIscript Т7 kit (Life Technologies, USA), а синтезированная РНК очищалась с помощью набора для выделения РНК (Евроген, Россия). Также была синтетически получена последовательность донорного вектора, содержащая ген люциферазы Neonothopanus nambi, фланкированный 50-нуклеотидными последовательностями из гена krtt1c19e Danio rerio. Донорный вектор, мРНК нуклеазы Cas9 и гидовая РНК были растворены в инъекционном буфере (40 мМ HEPES (pH 7.4), 240 мМ KCl с добавлением 0.5% фенольного красного) и инъецированы в зародыши 1-2-клеточные зародыши Danio rerio в объеме около 1-2 нл. Из 70 зародышей, около 50 зародышей пережило инъекцию и демонстрировало нормальное развитие на четвертый день после оплодотворения.
[0152] Для регистрации биолюминесцентного сигнала, раствор 3-гидроксигиспидина инъецировали внутривенно в личинки Danio rerio согласно методике, описанной в [Cosentino et al., J Vis Exp. 2010; (42): 2079]. Биолюминесценцию регистрировали с помощью IVIS Spectrum In Vivo Imaging System (Perkin Elmer). После регистрации из личинок выделяли геномную ДНК для подтверждения интеграции гена люциферазы в геном. Все личинки с корректной интеграцией гена люциферазы Neonothopanus nambi в геном демонстрировали биолюминесценцию с интенсивностью, как минимум на порядок превышающую интенсивность сигнала, исходящего от рыб дикого типа после инъекции раствора 3-гидроксигиспидина.
[0153] Все публикации, патентные заявки, процитированные в данном описании, включены в качестве ссылки в той мере, в какой каждая отдельная публикация или отдельная патентная заявка специфически и индивидуально соответствует включению в качестве ссылки. Цитирование каждой публикации приводится для целей иллюстрации текста и лучшего понимания настоящего изобретения, и не должно рассматриваться как допущение, что каждая такая публикация соответствует достигнутому уровню в данной области.
>SEQ ID NO:1
ATGCGCATTAACATTAGCCTCTCGTCTCTCTTCGAACGTCTCTCCAAACTTAGCAGTCGCAGCATAGCGATTACATGTGGAGTTGTTCTCGCCTCCGCAATCGCCTTTCCCATCATCCGCAGAGACTACCAGACTTTCCTAGAAGTGGGACCCTCGTACGCTCCGCAGAACTTTAGAGGATACATCATCGTCTGTGTCCTCTCGCTATTCCGCCAAGAGCAGAAAGGGCTCGCCATCTATGATCGTCTTCCCGAGAAACGCAGGTGGTTGGCCGACCTTCCCTTTCGTGAAGGAACCAGACCCAGCATTACCAGCCATATCATTCAGCGACAGCGCACTCAACTGGTCGATCAGGAGTTTGCCACCAGGGAGCTCATAGACAAGGTCATCCCTCGCGTGCAAGCACGACACACCGACAAAACGTTCCTCAGCACATCAAAGTTCGAGTTTCATGCGAAGGCCATATTTCTCTTGCCTTCTATCCCAATCAACGACCCTCTGAATATCCCTAGCCACGACACTGTCCGCCGAACGAAGCGCGAGATTGCACATATGCATGATTATCATGATTGCACACTTCATCTTGCTCTCGCTGCGCAGGATGGAAAGGAGGTGCTGAAGAAAGGTTGGGGACAACGACATCCTTTGGCTGGTCCTGGAGTTCCTGGTCCACCAACGGAATGGACTTTTCTTTATGCGCCTCGCAACGAAGAAGAGGCTCGAGTAGTGGAGATGATCGTTGAGGCTTCCATAGGGTATATGACGAACGATCCTGCAGGAAAGATTGTAGAAAACGCCAAG
>SEQ ID NO:2
MRINISLSSLFERLSKLSSRSIAITCGVVLASAIAFPIIRRDYQTFLEVGPSYAPQNFRGYIIVCVLSLFRQEQKGLAIYDRLPEKRRWLADLPFREGTRPSITSHIIQRQRTQLVDQEFATRELIDKVIPRVQARHTDKTFLSTSKFEFHAKAIFLLPSIPINDPLNIPSHDTVRRTKREIAHMHDYHDCTLHLALAAQDGKEVLKKGWGQRHPLAGPGVPGPPTEWTFLYAPRNEEEARVVEMIVEASIGYMTNDPAGKIVENAK
>SEQ ID NO:3
ATGTCCTTCATCGACAGCATGAAACTTGACCTCGTCGGACACCTCTTTGGCATCAGGAATCGCGGCTTAGCCGCCGCTTGTTGTGCTCTAGCAGTCGCCTCTACTATCGCCTTCCCTTACATTCGTAGGGACTACCAGACATTTTTATCTGGCGGTCCCTCTTACGCTCCCCAGAATATCAGAGGATATTTCATCGTCTGCGTTCTGGCCTTGTTCCGTCAGGAGCAAAAGGGCCTTGCGATATATGATCGCCTTCCCGAGAAGCGCAGGTGGCTGCCTGACTTGCCTCCTCGCAATGGCCCGCGGCCGATCACGACCAGCCATATAATCCAAAGACAGCGCAACCAGGCGCCGGACCCCAAGTTCGCCCTCGAGGAACTCAAGGCCACGGTTATTCCACGGGTGCAGGCTCGCCATACTGACCTCACCCATCTCAGCCTATCCAAATTCGAGTTCCATGCTGAAGCAATTTTCCTGCTCCCCTCTGTACCCATCGATGATCCAAAAAATGTTCCAAGTCACGACACGGTGCGCAGGACGAAAAGGGAGATCGCGCATATGCACGACTACCATGACTTCACGCTGCATCTTGCACTGGCCGCCCAAGACGGGAAGGAAGTCGTGTCGAAGGGATGGGGGCAGCGACACCCCCTAGCAGGCCCTGGCGTTCCTGGTCCACCTACGGAGTGGACATTTATTTATGCGCCACGTAACGAAGAGGAACTGGCAGTGGTGGAAATGATTATCGAGGCATCAATAGGCTATATGACCAATGACCCTGCTGGAGTAGTTATCGCA
>SEQ ID NO:4
MSFIDSMKLDLVGHLFGIRNRGLAAACCALAVASTIAFPYIRRDYQTFLSGGPSYAPQNIRGYFIVCVLALFRQEQKGLAIYDRLPEKRRWLPDLPPRNGPRPITTSHIIQRQRNQAPDPKFALEELKATVIPRVQARHTDLTHLSLSKFEFHAEAIFLLPSVPIDDPKNVPSHDTVRRTKREIAHMHDYHDFTLHLALAAQDGKEVVSKGWGQRHPLAGPGVPGPPTEWTFIYAPRNEEELAVVEMIIEASIGYMTNDPAGVVIA
>SEQ ID NO:5
ATGTCCTTCTTCGACAGCGTGAAACTTGACCTCGTCGGACGCCTCTTTGGCATCAGGAATCGCGGCTTAGCTGTTACTTGTTGTGCTGTGGCAGTCGCCTCTATCATCGCGTTCCCTTACATTCGTAGGGACTACCAGACATTTTTATCTGGGGGTCCCTCCTACGCTCCCCAGAACATCAGAGGATACCTCATTGTCTGCGTCCTGGCCTTGTTCCGTCAGGAGCAAAAAGGCCTTGCGATATACGACCGCCTTCCCGAGAAGCGCAGGTGGCTACCTGACTTGCCTCCTCGCGATGGCCCACGGCCCATCACGACCAGCCATATAATCCAAAGACAGCGCAACCAGGCGCCGGACCTCAAGTTCGCCCTCGAGGAACTCAAGGCCACGGTCATTCCACGGGTGCAGGCTCGCCACACTGACCTCACCCATCTCAGCCTATCCAAGTTCGAGTTCCATGCTGAAGCAATCTTCCTGCTCCCCTCTGTACCCATCGATGATCCAAAGAATGTGCCAAGTCACGACACGGTGCGCAGGACGAAGAGGGAAATTGCGCATATGCACGACTACCATGACTACACGCTGCATCTTGCGTTGGCCGCCCAAGACGGGAAGGAAGTCGTATCAAAGGGATGGGGGCAGCGACACCCGCTGGCAGGCCCTGGCGTTCCTGGTCCACCGACGGAGTGGACGTTTATTTATGCGCCACGTAACGAAGAGGAGCTGGCAGTGGTGGAAATGATTATCGAGGCATCGATAGGCTATATGACCAATGACCCTGCAGGAAAAACTATCGCATAG
>SEQ ID NO:6
MSFFDSVKLDLVGRLFGIRNRGLAVTCCAVAVASIIAFPYIRRDYQTFLSGGPSYAPQNIRGYLIVCVLALFRQEQKGLAIYDRLPEKRRWLPDLPPRDGPRPITTSHIIQRQRNQAPDLKFALEELKATVIPRVQARHTDLTHLSLSKFEFHAEAIFLLPSVPIDDPKNVPSHDTVRRTKREIAHMHDYHDYTLHLALAAQDGKEVVSKGWGQRHPLAGPGVPGPPTEWTFIYAPRNEEELAVVEMIIEASIGYMTNDPAGKTIA
>SEQ ID NO:7
ATGTCCTTCATCGACAGCATGAAACTTGACTTCGTCGGACACCTCTTTGGCATCAGGAATCGCGGCTTAGCCACCGCTTGTTGTGCTGTGGCAGTCGCTTCTGCCATCGCCTTCCCTTACATTCGTAGGGACTACCAGACATTCTTATCTGGCGGTCCCTCTTACGCTCCCCAGAACATCAAAGGATATCTCATCGTCTGCGTCCTGGCCTTGTTCCGTCAGGAGCAAAAGGGCCTTGCGATATATGACCGCCTTCCCGAGAAGCGCAGGTGGCTACCTGACTTGCCTCCTCGCAATGGCCCGCGGCCCATCACGACCAGCCATATAATCCAAAGACAGCGCAACCAGGCGCCAGACTCCAAGTTCGCCCTCGAGGAACTCAAGGCTACGGTCATTCCACGGGTGCAGGCTCGCCACACTGACCTCACCCATCTCAGCCTATCCAAGTTCGAGTTCCATGCTGAAGCAATCTTCCTGCTCCCCTCTGTACCCATCGATGATCCAAAAAATGTTCCAAGTCATGACACGGTGCGCAGGACGAAGAGGGAGATCGCGCATATGCACGACTACCATGACTTTACGTTGCATCTTGCACTGGCCGCCCAAGACGGGAAGGAAGTCGTGGCGAAGGGATGGGGGCAGCGACACCCGCTGGCAGGCCCTGGCGTTCCTGGTCCACCTACGGAGTGGACGTTTATTTATGCGCCACGTAACGAAGAGGAACTGGCAGTGGTGGAAATGATTATCGAGGCATCAATAGGCTATATGACCAATGACCCTGCTGGAACAGTTATCGTATAG
>SEQ ID NO:8
MSFIDSMKLDFVGHLFGIRNRGLATACCAVAVASAIAFPYIRRDYQTFLSGGPSYAPQNIKGYLIVCVLALFRQEQKGLAIYDRLPEKRRWLPDLPPRNGPRPITTSHIIQRQRNQAPDSKFALEELKATVIPRVQARHTDLTHLSLSKFEFHAEAIFLLPSVPIDDPKNVPSHDTVRRTKREIAHMHDYHDFTLHLALAAQDGKEVVAKGWGQRHPLAGPGVPGPPTEWTFIYAPRNEEELAVVEMIIEASIGYMTNDPAGTVIV
>SEQ ID NO:9
ATGGTCCAACTCACCCGAACCTCCGGATTCATCGCCGCTGCGGCCATTGTTGCTGCCATCGCCTTCCCGTTCATTCGTCGAGACTACCAGACGTTCCTTCGTGGTGGGCCGTCCTATGCCCCACAGAACATCCGCGGCTATATCATCGTCCTGGTTCTGTCCCTCTTCCGCGGCGAGGAGAAGGGTCTTGCAATCTACGAGCCCCTTCCTGAGAAGCGCACATGGCTGCCGGAGCTTCCGCGGCGCGCGGGAGACCGGCCCAAGACGACGAGCCACATCATCCAACGGCAGCTCGACCAGTACCCCGACCCGGACTTTGTCCTCAAAGCCCTGAAAGCGACGGTCATCCCGCGTGTCCAAGCCCGGCACACAGACAAGACTCACCTCGCGCTGTCCAAGTTCGAGTTCCATGCTGAGGCCATCTTCGTGCGCCCGGAAATCGCCATCGACGACCCGAAGCATATCCCCAGCCACGACACGGTGCGACGGACGAAGCGCGAGATTGCGCACATGCACGACTATCACGACTGCACGCTGCATTTGGCGCTAGCGGCGCAGGACGCGAAGCAGGTGCTGCAGAAGGGCTGGGGCCAGCGCCATCCGCTGGCAGGGCCTGGGATGCCCGGGCCGCCCACGGAGTGGACGTTCTTGTATGCCCCGAGGACCGAGGAGGAAGTGAAGGTTGTGGAGACCATTGTCGAGGCCTCTATCGCGTACATGACGAACGCGGAGAAGCCGGTCGAGCTGGTGCAG
>SEQ ID NO:10
MVQLTRTSGFIAAAAIVAAIAFPFIRRDYQTFLRGGPSYAPQNIRGYIIVLVLSLFRGEEKGLAIYEPLPEKRTWLPELPRRAGDRPKTTSHIIQRQLDQYPDPDFVLKALKATVIPRVQARHTDKTHLALSKFEFHAEAIFVRPEIAIDDPKHIPSHDTVRRTKREIAHMHDYHDCTLHLALAAQDAKQVLQKGWGQRHPLAGPGMPGPPTEWTFLYAPRTEEEVKVVETIVEASIAYMTNAEKPVELVQ
>SEQ ID NO:11
ATGGCTTATCAGCTCACTTGGATTCAGACTCTCGTGCTGGGTGCCCTTGTGGCAATGGCAGTAGCGTTCCCCTTCATCAAGAAAGACTACGAGACGTTCCTGAAGGGCGGCCCCTCCTATGCGCCCCAAAACGTTCGCGGATACATCATCGTGCTCGTGCTCGCGCTCTTCCGCCAAGAGCAGCTCGGGCTGGAGATCTACGACCGCATGCCCGAGAAACGTCGCTGGCTCGCGAATCTCCCTCAGCGCGAGGGCCCCCGCCCCAAGACCACAAGTCACATCATCCAGCGGCAGCTCAGCCAGCACACGGACCCCGCATTCGGCGCCGCGTACCTCAAAGACACCGTCATTCCGCGCGTCCAGGCGCGGCACGCAGCCAACACGCACATCGCGCGCTCGACGTTCGAGTTCCACGCCGCCGCGATCTTCCTGAACGCGGACGTGCCGCTGCCCGAGGGCCTGCCCGCAAGCGAGACGGTGCGGCGGACCAAGGGCGAGATCGCGCACATGCACGACTACCACGACTTCACGCTGCACCTCGCGCTCGCAGCAGCGGATGGGAAGGAGGTGGTCGGCAAGGGCTGGGGGCAGCGCCATCCGCTGGCGGGACCCGGCGTGCCGGGTCCGCCGAACGAGTGGACCTTTGTGTATGCGCCGAGGAATGAAGAGGAGATGGGCGTGGTCGAGCAGATCGTAGAGGCGGCGATTGGGTACATGTCGAACGTGCCTGCGCTGGAA
>SEQ ID NO:12
MAYQLTWIQTLVLGALVAMAVAFPFIKKDYETFLKGGPSYAPQNVRGYIIVLVLALFRQEQLGLEIYDRMPEKRRWLANLPQREGPRPKTTSHIIQRQLSQHTDPAFGAAYLKDTVIPRVQARHAANTHIARSTFEFHAAAIFLNADVPLPEGLPASETVRRTKGEIAHMHDYHDFTLHLALAAADGKEVVGKGWGQRHPLAGPGVPGPPNEWTFVYAPRNEEEMGVVEQIVEAAIGYMSNVPALE
>SEQ ID NO:13
ATGCTCCCAGCTTTCATCTACAAACCAAGGCTAGTGATCACTTGTGTATTCGTTCTGGCCTCCGCACTCGCATTTCCCTTCATACGCAAAGATTACCAGACTTTCCTGGAGGTGGGACCCTCGTACGCCCCGCAGAACCTCCAAGGATACATCATCGTCTGTGTACTCTCTCTGTTCCGGCAAGAACAGAAAGACGTAGCGATTTATGATCGCCTTCCTGAGAAAAGGAGGTGGTTAGGAGACCTCCCGTTTCGCGAGGGGCCAAGACCGAGTATCACTAGCCATATCATCCAGCGACAGCGCACCCAATTGGCTGACGCCGAGTTCGCTACCAAAGAGCTGATAGGCAAAATCATCCCTCGCGTCCAAGCCCGACACACCAACACAACATTCCTCAGCACATCTAAATTCGAATTCCACGCCCAGGCCATCTTCCTTTTGCCCTCTATCCCAATCAACGACCCTCAAAACATTCCAAGCCACGATACCGTTCGTCGCACGAAACGCGAGATCGCGCATATGCATGATTATCACGACTGTACGTTGCATCTCGCACTTGCTGCTCAAGATGGGAAGGAGGTTTTAGAGAAAGGATGGGGTCAGCGACATCCTCTTGCTGGACCTGGTGTTCCTGGCCCGCCGACGGAGTGGACGTTTCTTTATGCACCGCGCAGCGAAGAGGAGGTTCGGGTTGTGGAGATGATTGTTGAGGCATCAGTTGTGTATATGACGAATGATCCTGCGGATAAAATCGTAGAAGCTACTGTGCAGGGTACTGAAGAATAG
>SEQ ID NO:14
MLPAFIYKPRLVITCVFVLASALAFPFIRKDYQTFLEVGPSYAPQNLQGYIIVCVLSLFRQEQKDVAIYDRLPEKRRWLGDLPFREGPRPSITSHIIQRQRTQLADAEFATKELIGKIIPRVQARHTNTTFLSTSKFEFHAQAIFLLPSIPINDPQNIPSHDTVRRTKREIAHMHDYHDCTLHLALAAQDGKEVLEKGWGQRHPLAGPGVPGPPTEWTFLYAPRSEEEVRVVEMIVEASVVYMTNDPADKIVEATVQGTEE
>SEQ ID NO:15
ATGAACATCAACCTGAAAGCTCTGATCGGAGTCTGTGCCGTGCTCATCACCGCTGCAGTGTTCCCCTTCGTTCGTAAAGACTATCACACCTTTCTTGAAGGTGGACCATCCTACGCGCCGCAGAATTTGCAAGGCTATATCATCGTGTTGGTGCTCTCACTCTTTCGAGGGGAGGAGACGGGATTGGAAATATACGACCGCTTGCCCGAAAAACGCCGCTGGCTCGAGGAGCTGCCTGTTCGCGAAGGCCCGCGCCCAAAGACAACCAGCCACATCATTCAGAGACAGTTGAATCAGCACGTTGACCCGGACTTCGGAATGAACTCTTTGAAAGGCTCCGTCATCCGGCGCCTTCAATCCCGCCACCAGGACATAACTCAACTCGCACTCTCGAAATTCGAATTCCACGCCGAGGCCATATTTCTGCGCCCCGATGTCGCGATCAACGATCCCAAACACGTCCCGAGCCACGACACGGTGCGCCGCACAAAGCGCGAGATAGCTCACATGCACGACTACCATGATTACACGTGTCATTTGGCGCTCGCAGCGCAGGATGGGAAGCAAGTGATTGCAAAAGGGTGGGGCCAGAGACATCCGCTCGCCGGACCGGGCATGCCGGGGCCGCCGACGGAGTGGACATTTTTGTATGCGCCGAGGAATGAGGCGGAGGTTCAAGTGTTGGAGACGATTATCGAAGCGTCAATCGGGTACATGTCGAACGCACCAGCCTTGGGTGGGAGCGAG
>SEQ ID NO:16
MNINLKALIGVCAVLITAAVFPFVRKDYHTFLEGGPSYAPQNLQGYIIVLVLSLFRGEETGLEIYDRLPEKRRWLEELPVREGPRPKTTSHIIQRQLNQHVDPDFGMNSLKGSVIRRLQSRHQDITQLALSKFEFHAEAIFLRPDVAINDPKHVPSHDTVRRTKREIAHMHDYHDYTCHLALAAQDGKQVIAKGWGQRHPLAGPGMPGPPTEWTFLYAPRNEAEVQVLETIIEASIGYMSNAPALGGSE
>SEQ ID NO:17
ATGAACATCAACCTGAAAGCTCTGATCGGAGTCTGTGCCGTGCTCATCACCGCTGCAGTGTTCCCCTTCGTTCGTAAAGACTATCACACCTTTCTTGAAGGTGGACCATCCTACGCGCCGCAGAATTTGCAAGGCTATATCATCGTGTTGGTGCTCTCACTCTTTCGAGGGGAGGAGACGGGATTGGAAATATACGACCGCTTGCCCGAAAAACGCCGCTGGCTCGAGGAGCTGCCTGTTCGCGAAGGCCCGCGCCCAAAGACAACCAGCCACATCATTCAGAGACAGTTGAATCAGCACGTTGACCCGGACTTCGGAATGAACTCTTTGAAAGGCTCCGTCATCCGGCGCCTTCAATCCCGCCACCAGGACATAACTCAACTCGCACTCTCGAAATTCGAATTCCACGCCGAGGCCATATTTCTGCGCCCCGATATCGCGATCAACGATCCCAAACACGTCCCGAGCCACGACACGGTGCGCCGCACAAAGCGCGAGATAGCTCACATGCACGACTACCATGATTACACGTGTCATTTGGCGCTCGCAGCGCAGGATGGGAAGCAAGTGATTGCAAAAGGGTGGGGCCAGAGACATCCGCTCGCCGGACCGGGCATGCCGGGGCCGCCGACGGAGTGGACATTTTTGTATGCGCCGAGGAATGAGGCGGAGGTTCAAGTGTTGGAGACGATTATCGAAGCGTCAATCGGGTACATGTCGAACGCACCAGCCTTGGGTGGGAGCGAG
>SEQ ID NO:18
MNINLKALIGVCAVLITAAVFPFVRKDYHTFLEGGPSYAPQNLQGYIIVLVLSLFRGEETGLEIYDRLPEKRRWLEELPVREGPRPKTTSHIIQRQLNQHVDPDFGMNSLKGSVIRRLQSRHQDITQLALSKFEFHAEAIFLRPDIAINDPKHVPSHDTVRRTKREIAHMHDYHDYTCHLALAAQDGKQVIAKGWGQRHPLAGPGMPGPPTEWTFLYAPRNEAEVQVLETIIEASIGYMSNAPALGGSE
>SEQ ID NO: 19
ATCATCCGCAGAGACTACCAGACTTTCCTAGAAGTGGGACCCTCGTACGCTCCGCAGAACTTTAGAGGATACATCATCGTCTGTGTCCTCTCGCTATTCCGCCAAGAGCAGAAAGGGCTCGCCATCTATGATCGTCTTCCCGAGAAACGCAGGTGGTTGGCCGACCTTCCCTTTCGTGAAGGAACCAGACCCAGCATTACCAGCCATATCATTCAGCGACAGCGCACTCAACTGGTCGATCAGGAGTTTGCCACCAGGGAGCTCATAGACAAGGTCATCCCTCGCGTGCAAGCACGACACACCGACAAAACGTTCCTCAGCACATCAAAGTTCGAGTTTCATGCGAAGGCCATATTTCTCTTGCCTTCTATCCCAATCAACGACCCTCTGAATATCCCTAGCCACGACACTGTCCGCCGAACGAAGCGCGAGATTGCACATATGCATGATTATCATGATTGCACACTTCATCTTGCTCTCGCTGCGCAGGATGGAAAGGAGGTGCTGAAGAAAGGTTGGGGACAACGACATCCTTTGGCTGGTCCTGGAGTTCCTGGTCCACCAACGGAATGGACTTTTCTTTATGCGCCTCGCAACGAAGAAGAGGCTCGAGTAGTGGAGATGATCGTTGAGGCTTCCATAGGGTATATGACGAACGATCCTGCAGGAAAGATTGTAGAAAACGCCAAG
>SEQ ID NO:20
IIRRDYQTFLEVGPSYAPQNFRGYIIVCVLSLFRQEQKGLAIYDRLPEKRRWLADLPFREGTRPSITSHIIQRQRTQLVDQEFATRELIDKVIPRVQARHTDKTFLSTSKFEFHAKAIFLLPSIPINDPLNIPSHDTVRRTKREIAHMHDYHDCTLHLALAAQDGKEVLKKGWGQRHPLAGPGVPGPPTEWTFLYAPRNEEEARVVEMIVEASIGYMTNDPAGKIVENAK
>SEQ ID NO:21
TACATTCGTAGGGACTACCAGACATTTTTATCTGGCGGTCCCTCTTACGCTCCCCAGAATATCAGAGGATATTTCATCGTCTGCGTTCTGGCCTTGTTCCGTCAGGAGCAAAAGGGCCTTGCGATATATGATCGCCTTCCCGAGAAGCGCAGGTGGCTGCCTGACTTGCCTCCTCGCAATGGCCCGCGGCCGATCACGACCAGCCATATAATCCAAAGACAGCGCAACCAGGCGCCGGACCCCAAGTTCGCCCTCGAGGAACTCAAGGCCACGGTTATTCCACGGGTGCAGGCTCGCCATACTGACCTCACCCATCTCAGCCTATCCAAATTCGAGTTCCATGCTGAAGCAATTTTCCTGCTCCCCTCTGTACCCATCGATGATCCAAAAAATGTTCCAAGTCACGACACGGTGCGCAGGACGAAAAGGGAGATCGCGCATATGCACGACTACCATGACTTCACGCTGCATCTTGCACTGGCCGCCCAAGACGGGAAGGAAGTCGTGTCGAAGGGATGGGGGCAGCGACACCCCCTAGCAGGCCCTGGCGTTCCTGGTCCACCTACGGAGTGGACATTTATTTATGCGCCACGTAACGAAGAGGAACTGGCAGTGGTGGAAATGATTATCGAGGCATCAATAGGCTATATGACCAATGACCCTGCTGGAGTAGTTATCGCA
>SEQ ID NO:22
YIRRDYQTFLSGGPSYAPQNIRGYFIVCVLALFRQEQKGLAIYDRLPEKRRWLPDLPPRNGPRPITTSHIIQRQRNQAPDPKFALEELKATVIPRVQARHTDLTHLSLSKFEFHAEAIFLLPSVPIDDPKNVPSHDTVRRTKREIAHMHDYHDFTLHLALAAQDGKEVVSKGWGQRHPLAGPGVPGPPTEWTFIYAPRNEEELAVVEMIIEASIGYMTNDPAGVVIA
>SEQ ID NO:23
TACATTCGTAGGGACTACCAGACATTTTTATCTGGGGGTCCCTCCTACGCTCCCCAGAACATCAGAGGATACCTCATTGTCTGCGTCCTGGCCTTGTTCCGTCAGGAGCAAAAAGGCCTTGCGATATACGACCGCCTTCCCGAGAAGCGCAGGTGGCTACCTGACTTGCCTCCTCGCGATGGCCCACGGCCCATCACGACCAGCCATATAATCCAAAGACAGCGCAACCAGGCGCCGGACCTCAAGTTCGCCCTCGAGGAACTCAAGGCCACGGTCATTCCACGGGTGCAGGCTCGCCACACTGACCTCACCCATCTCAGCCTATCCAAGTTCGAGTTCCATGCTGAAGCAATCTTCCTGCTCCCCTCTGTACCCATCGATGATCCAAAGAATGTGCCAAGTCACGACACGGTGCGCAGGACGAAGAGGGAAATTGCGCATATGCACGACTACCATGACTACACGCTGCATCTTGCGTTGGCCGCCCAAGACGGGAAGGAAGTCGTATCAAAGGGATGGGGGCAGCGACACCCGCTGGCAGGCCCTGGCGTTCCTGGTCCACCGACGGAGTGGACGTTTATTTATGCGCCACGTAACGAAGAGGAGCTGGCAGTGGTGGAAATGATTATCGAGGCATCGATAGGCTATATGACCAATGACCCTGCAGGAAAAACTATCGCA
>SEQ ID NO:24
>YIRRDYQTFLSGGPSYAPQNIRGYLIVCVLALFRQEQKGLAIYDRLPEKRRWLPDLPPRDGPRPITTSHIIQRQRNQAPDLKFALEELKATVIPRVQARHTDLTHLSLSKFEFHAEAIFLLPSVPIDDPKNVPSHDTVRRTKREIAHMHDYHDYTLHLALAAQDGKEVVSKGWGQRHPLAGPGVPGPPTEWTFIYAPRNEEELAVVEMIIEASIGYMTNDPAGKTIA
>SEQ ID NO:25
ATGTCCTTCATCGACAGCATGAAACTTGACTTCGTCGGACACCTCTTTGGCATCAGGAATCGCGGCTTAGCCACCGCTTGTTGTGCTGTGGCAGTCGCTTCTGCCATCGCCTTCCCTTACATTCGTAGGGACTACCAGACATTCTTATCTGGCGGTCCCTCTTACGCTCCCCAGAACATCAAAGGATATCTCATCGTCTGCGTCCTGGCCTTGTTCCGTCAGGAGCAAAAGGGCCTTGCGATATATGACCGCCTTCCCGAGAAGCGCAGGTGGCTACCTGACTTGCCTCCTCGCAATGGCCCGCGGCCCATCACGACCAGCCATATAATCCAAAGACAGCGCAACCAGGCGCCAGACTCCAAGTTCGCCCTCGAGGAACTCAAGGCTACGGTCATTCCACGGGTGCAGGCTCGCCACACTGACCTCACCCATCTCAGCCTATCCAAGTTCGAGTTCCATGCTGAAGCAATCTTCCTGCTCCCCTCTGTACCCATCGATGATCCAAAAAATGTTCCAAGTCATGACACGGTGCGCAGGACGAAGAGGGAGATCGCGCATATGCACGACTACCATGACTTTACGTTGCATCTTGCACTGGCCGCCCAAGACGGGAAGGAAGTCGTGGCGAAGGGATGGGGGCAGCGACACCCGCTGGCAGGCCCTGGCGTTCCTGGTCCACCTACGGAGTGGACGTTTATTTATGCGCCACGTAACGAAGAGGAACTGGCAGTGGTGGAAATGATTATCGAGGCATCAATAGGCTATATGACCAATGACCCTGCTGGAACAGTTATCGTA
>SEQ ID NO:26
MSFIDSMKLDFVGHLFGIRNRGLATACCAVAVASAIAFPYIRRDYQTFLSGGPSYAPQNIKGYLIVCVLALFRQEQKGLAIYDRLPEKRRWLPDLPPRNGPRPITTSHIIQRQRNQAPDSKFALEELKATVIPRVQARHTDLTHLSLSKFEFHAEAIFLLPSVPIDDPKNVPSHDTVRRTKREIAHMHDYHDFTLHLALAAQDGKEVVAKGWGQRHPLAGPGVPGPPTEWTFIYAPRNEEELAVVEMIIEASIGYMTNDPAGTVIV
>SEQ ID NO:27
TTCATTCGTCGAGACTACCAGACGTTCCTTCGTGGTGGGCCGTCCTATGCCCCACAGAACATCCGCGGCTATATCATCGTCCTGGTTCTGTCCCTCTTCCGCGGCGAGGAGAAGGGTCTTGCAATCTACGAGCCCCTTCCTGAGAAGCGCACATGGCTGCCGGAGCTTCCGCGGCGCGCGGGAGACCGGCCCAAGACGACGAGCCACATCATCCAACGGCAGCTCGACCAGTACCCCGACCCGGACTTTGTCCTCAAAGCCCTGAAAGCGACGGTCATCCCGCGTGTCCAAGCCCGGCACACAGACAAGACTCACCTCGCGCTGTCCAAGTTCGAGTTCCATGCTGAGGCCATCTTCGTGCGCCCGGAAATCGCCATCGACGACCCGAAGCATATCCCCAGCCACGACACGGTGCGACGGACGAAGCGCGAGATTGCGCACATGCACGACTATCACGACTGCACGCTGCATTTGGCGCTAGCGGCGCAGGACGCGAAGCAGGTGCTGCAGAAGGGCTGGGGCCAGCGCCATCCGCTGGCAGGGCCTGGGATGCCCGGGCCGCCCACGGAGTGGACGTTCTTGTATGCCCCGAGGACCGAGGAGGAAGTGAAGGTTGTGGAGACCATTGTCGAGGCCTCTATCGCGTACATGACGAACGCGGAGAAGCCGGTCGAGCTGGTGCAG
>SEQ ID NO:28
FIRRDYQTFLRGGPSYAPQNIRGYIIVLVLSLFRGEEKGLAIYEPLPEKRTWLPELPRRAGDRPKTTSHIIQRQLDQYPDPDFVLKALKATVIPRVQARHTDKTHLALSKFEFHAEAIFVRPEIAIDDPKHIPSHDTVRRTKREIAHMHDYHDCTLHLALAAQDAKQVLQKGWGQRHPLAGPGMPGPPTEWTFLYAPRTEEEVKVVETIVEASIAYMTNAEKPVELVQ
>SEQ ID NO:29
TTCATCAAGAAAGACTACGAGACGTTCCTGAAGGGCGGCCCCTCCTATGCGCCCCAAAACGTTCGCGGATACATCATCGTGCTCGTGCTCGCGCTCTTCCGCCAAGAGCAGCTCGGGCTGGAGATCTACGACCGCATGCCCGAGAAACGTCGCTGGCTCGCGAATCTCCCTCAGCGCGAGGGCCCCCGCCCCAAGACCACAAGTCACATCATCCAGCGGCAGCTCAGCCAGCACACGGACCCCGCATTCGGCGCCGCGTACCTCAAAGACACCGTCATTCCGCGCGTCCAGGCGCGGCACGCAGCCAACACGCACATCGCGCGCTCGACGTTCGAGTTCCACGCCGCCGCGATCTTCCTGAACGCGGACGTGCCGCTGCCCGAGGGCCTGCCCGCAAGCGAGACGGTGCGGCGGACCAAGGGCGAGATCGCGCACATGCACGACTACCACGACTTCACGCTGCACCTCGCGCTCGCAGCAGCGGATGGGAAGGAGGTGGTCGGCAAGGGCTGGGGGCAGCGCCATCCGCTGGCGGGACCCGGCGTGCCGGGTCCGCCGAACGAGTGGACCTTTGTGTATGCGCCGAGGAATGAAGAGGAGATGGGCGTGGTCGAGCAGATCGTAGAGGCGGCGATTGGGTACATGTCGAACGTGCCTGCGCTGGAA
>SEQ ID NO:30
FIKKDYETFLKGGPSYAPQNVRGYIIVLVLALFRQEQLGLEIYDRMPEKRRWLANLPQREGPRPKTTSHIIQRQLSQHTDPAFGAAYLKDTVIPRVQARHAANTHIARSTFEFHAAAIFLNADVPLPEGLPASETVRRTKGEIAHMHDYHDFTLHLALAAADGKEVVGKGWGQRHPLAGPGVPGPPNEWTFVYAPRNEEEMGVVEQIVEAAIGYMSNVPALE
>SEQ ID NO:31
TTCATACGCAAAGATTACCAGACTTTCCTGGAGGTGGGACCCTCGTACGCCCCGCAGAACCTCCAAGGATACATCATCGTCTGTGTACTCTCTCTGTTCCGGCAAGAACAGAAAGACGTAGCGATTTATGATCGCCTTCCTGAGAAAAGGAGGTGGTTAGGAGACCTCCCGTTTCGCGAGGGGCCAAGACCGAGTATCACTAGCCATATCATCCAGCGACAGCGCACCCAATTGGCTGACGCCGAGTTCGCTACCAAAGAGCTGATAGGCAAAATCATCCCTCGCGTCCAAGCCCGACACACCAACACAACATTCCTCAGCACATCTAAATTCGAATTCCACGCCCAGGCCATCTTCCTTTTGCCCTCTATCCCAATCAACGACCCTCAAAACATTCCAAGCCACGATACCGTTCGTCGCACGAAACGCGAGATCGCGCATATGCATGATTATCACGACTGTACGTTGCATCTCGCACTTGCTGCTCAAGATGGGAAGGAGGTTTTAGAGAAAGGATGGGGTCAGCGACATCCTCTTGCTGGACCTGGTGTTCCTGGCCCGCCGACGGAGTGGACGTTTCTTTATGCACCGCGCAGCGAAGAGGAGGTTCGGGTTGTGGAGATGATTGTTGAGGCATCAGTTGTGTATATGACGAATGATCCTGCGGATAAAATCGTAGAAGCTACTGTGCAGGGTACTGAAGAA
>SEQ ID NO:32
FIRKDYQTFLEVGPSYAPQNLQGYIIVCVLSLFRQEQKDVAIYDRLPEKRRWLGDLPFREGPRPSITSHIIQRQRTQLADAEFATKELIGKIIPRVQARHTNTTFLSTSKFEFHAQAIFLLPSIPINDPQNIPSHDTVRRTKREIAHMHDYHDCTLHLALAAQDGKEVLEKGWGQRHPLAGPGVPGPPTEWTFLYAPRSEEEVRVVEMIVEASVVYMTNDPADKIVEATVQGTEE
>SEQ ID NO:33
TTCGTTCGTAAAGACTATCACACCTTTCTTGAAGGTGGACCATCCTACGCGCCGCAGAATTTGCAAGGCTATATCATCGTGTTGGTGCTCTCACTCTTTCGAGGGGAGGAGACGGGATTGGAAATATACGACCGCTTGCCCGAAAAACGCCGCTGGCTCGAGGAGCTGCCTGTTCGCGAAGGCCCGCGCCCAAAGACAACCAGCCACATCATTCAGAGACAGTTGAATCAGCACGTTGACCCGGACTTCGGAATGAACTCTTTGAAAGGCTCCGTCATCCGGCGCCTTCAATCCCGCCACCAGGACATAACTCAACTCGCACTCTCGAAATTCGAATTCCACGCCGAGGCCATATTTCTGCGCCCCGATGTCGCGATCAACGATCCCAAACACGTCCCGAGCCACGACACGGTGCGCCGCACAAAGCGCGAGATAGCTCACATGCACGACTACCATGATTACACGTGTCATTTGGCGCTCGCAGCGCAGGATGGGAAGCAAGTGATTGCAAAAGGGTGGGGCCAGAGACATCCGCTCGCCGGACCGGGCATGCCGGGGCCGCCGACGGAGTGGACATTTTTGTATGCGCCGAGGAATGAGGCGGAGGTTCAAGTGTTGGAGACGATTATCGAAGCGTCAATCGGGTACATGTCGAACGCACCAGCCTTGGGTGGGAGCGAG
>SEQ ID NO:34
FVRKDYHTFLEGGPSYAPQNLQGYIIVLVLSLFRGEETGLEIYDRLPEKRRWLEELPVREGPRPKTTSHIIQRQLNQHVDPDFGMNSLKGSVIRRLQSRHQDITQLALSKFEFHAEAIFLRPDVAINDPKHVPSHDTVRRTKREIAHMHDYHDYTCHLALAAQDGKQVIAKGWGQRHPLAGPGMPGPPTEWTFLYAPRNEAEVQVLETIIEASIGYMSNAPALGGSE
>SEQ ID NO: 35
DYXTFLXXGPSYAPQNXXGYXIVXVLXLFRXEXXXXIYXXXPEKRXWLXXLPXRXGXRPXXTSHIIQRQXXQXXDXXFXXXXLXXXXIXRXQXRHXXXTXXXSXFEFHAXAIFXXXXXXXXPXXXPXXXTVRRTKXEIAHMHDYHDXTXHLALAAXDXKVXXKGWGQRHPLAGPGXPGPPXEWTFXYAPRXEXEXXVXEXIXEAXXXYMXN
>SEQ ID NO:36
ATCGCNTTYCCNTWCATHCCNARRGAYTACSARACNTT
>SEQ ID NO:37
ATCGCNTTYCCNTWCATHCCNARRGAYTACSARAC
>SEQ ID NO:38
ATCGCNTTYCCNTWCATHCCNARRGAYTACSA
>SEQ ID NO:39
ATCGCNTTYCCNTWCATHCCNARRGAYTA
>SEQ ID NO:40
NGCAGGGNCNTTSGTCATATASCCNATNGANGCYTCNAYNAT
>SEQ ID NO:41
NGCAGGGNCNTTSGTCATATASCCNATNGANGCYTC
>SEQ ID NO:42
NGCAGGGNCNTTSGTCATATASCCNATNGANGC
>SEQ ID NO:43
NGCAGGGNCNTTSGTCATATASCCNATNGA
>SEQ ID NO:44
ATGCGCATTAACATCTCCCTTTCATCTCTTTTCGAGCGATTGAGCAAACTGAGTTCCAGGAGTATTGCAATCACTTGTGGGGTTGTCCTCGCGAGCGCCATCGCATTCCCCATCATCCGGAGAGATTATCAGACGTTTCTTGAGGTGGGCCCTAGCTATGCACCACAGAACTTCCGAGGATATATCATCGTGTGTGTACTGTCACTGTTTAGGCAAGAACAAAAGGGATTGGCTATCTATGATAGGTTGCCTGAGAAACGGCGGTGGCTCGCTGATCTCCCATTTAGAGAGGGGACACGACCGAGCATCACTTCACACATCATACAAAGACAGCGAACGCAGCTCGTTGACCAAGAGTTCGCAACTAGGGAACTGATTGATAAGGTGATACCCAGAGTACAGGCGCGACACACCGATAAAACTTTTCTTTCCACCTCTAAATTCGAGTTCCATGCCAAAGCTATTTTCTTGTTGCCTTCCATACCGATTAATGATCCTCTGAATATTCCATCCCACGACACAGTTCGACGGACGAAACGCGAAATTGCGCACATGCACGACTATCACGATTGCACTTTGCACCTGGCACTGGCTGCTCAAGACGGAAAAGAAGTTCTGAAAAAGGGTTGGGGGCAAAGACATCCGCTGGCGGGACCCGGTGTACCTGGGCCGCCTACGGAATGGACATTTTTGTACGCACCGAGGAACGAAGAGGAGGCCAGGGTCGTTGAGATGATTGTTGAGGCTAGTATTGGGTACATGACGAATGATCCGGCTGGTAAAATTGTTGAAAATGCAAAG
>SEQ ID NO:45
ATGAGCTTTATAGACTCAATGAAACTTGATCTTGTAGGACACCTCTTCGGCATACGCAACAGAGGACTCGCAGCAGCCTGTTGCGCCCTTGCAGTAGCTTCCACGATAGCTTTCCCTTATATCCGCCGGGATTACCAAACGTTCCTTAGCGGTGGCCCTTCTTACGCGCCACAGAACATACGAGGCTATTTTATCGTGTGTGTGCTCGCTCTGTTTCGCCAAGAACAGAAAGGGCTGGCGATTTATGACCGACTTCCTGAGAAACGAAGGTGGCTTCCTGACCTTCCTCCCCGGAATGGCCCTCGCCCGATTACGACCTCTCATATTATACAAAGACAGAGGAACCAAGCGCCAGATCCGAAATTTGCCCTGGAGGAGCTCAAGGCCACTGTGATTCCACGAGTCCAAGCCCGCCATACGGATCTTACACATCTCAGTCTTAGCAAATTTGAGTTTCATGCCGAGGCAATTTTTCTTTTGCCGTCCGTTCCGATAGACGACCCCAAAAATGTACCCTCACACGATACGGTCAGGCGCACAAAGAGGGAGATCGCCCATATGCATGACTATCACGACTTTACCCTGCATCTCGCTCTGGCGGCACAAGACGGCAAGGAGGTAGTCAGCAAAGGCTGGGGCCAAAGGCATCCGCTCGCGGGCCCAGGGGTTCCGGGGCCACCTACAGAGTGGACTTTCATCTATGCGCCGCGAAACGAGGAAGAACTCGCAGTAGTTGAGATGATCATAGAGGCATCAATTGGCTACATGACGAACGATCCTGCCGGAGTCGTTATAGCC
>SEQ ID NO: 46
ATGAGTTTTTTTGACTCTGTCAAACTTGATCTGGTGGGACGGCTCTTCGGCATCCGAAACAGGGGACTTGCGGTTACTTGCTGCGCGGTAGCGGTCGCCTCTATTATCGCCTTCCCATACATTCGCCGCGACTATCAGACCTTCCTGTCAGGCGGACCTTCTTATGCACCGCAGAATATAAGGGGCTATCTTATTGTTTGTGTACTGGCTCTCTTTCGGCAAGAACAAAAAGGTCTGGCTATCTACGATAGACTTCCTGAGAAACGACGCTGGCTGCCAGATCTTCCCCCCCGCGACGGCCCAAGGCCCATAACAACAAGTCATATTATACAGAGACAACGGAACCAGGCCCCAGACCTCAAGTTTGCCCTCGAGGAGCTGAAAGCGACTGTTATACCTAGAGTACAGGCGAGACATACAGACTTGACCCATTTGAGCCTGAGCAAGTTTGAATTCCATGCCGAAGCAATCTTTCTTCTGCCTTCCGTACCCATTGACGATCCAAAAAACGTCCCCTCACATGATACTGTAAGACGCACGAAGCGAGAGATCGCACACATGCACGACTACCATGACTACACTCTGCACCTTGCCTTGGCAGCTCAGGATGGCAAGGAAGTTGTATCCAAGGGGTGGGGCCAAAGACACCCCTTGGCTGGCCCGGGAGTGCCTGGACCCCCGACCGAATGGACGTTTATTTACGCACCAAGGAACGAGGAAGAATTGGCCGTCGTTGAAATGATTATTGAAGCGTCCATAGGATATATGACCAACGATCCGGCCGGAAAGACAATCGCG
>SEQ ID NO: 47
ATGTCTTTTATTGACAGTATGAAGCTTGATTTCGTAGGTCACTTGTTTGGTATACGAAACCGAGGTCTCGCTACTGCGTGCTGCGCGGTGGCAGTAGCGAGTGCTATAGCATTCCCGTATATCCGCCGAGATTACCAGACATTTCTTAGCGGTGGACCTAGCTATGCACCCCAGAATATTAAAGGGTATTTGATCGTTTGTGTGCTTGCACTGTTTCGCCAGGAGCAGAAGGGTCTTGCTATTTACGACCGACTGCCTGAGAAAAGGCGATGGTTGCCTGACCTTCCACCCAGAAACGGTCCCAGGCCCATCACGACCTCACACATAATCCAACGGCAGAGGAACCAGGCTCCAGATTCAAAGTTTGCGCTTGAGGAACTCAAGGCTACTGTAATACCTAGAGTCCAGGCCAGACATACGGATCTCACCCATCTCAGCCTCAGTAAGTTTGAGTTTCATGCGGAAGCTATTTTCCTGCTCCCGAGCGTACCCATTGATGACCCCAAGAATGTCCCCTCACATGATACGGTACGACGCACGAAGCGGGAGATAGCTCACATGCACGACTACCATGATTTCACTCTGCATCTCGCCTTGGCAGCGCAGGATGGCAAGGAGGTAGTAGCGAAAGGATGGGGGCAGAGACACCCGCTGGCAGGCCCTGGGGTTCCCGGCCCTCCGACCGAATGGACATTTATCTATGCGCCCCGCAACGAAGAGGAGCTCGCAGTTGTTGAGATGATCATTGAAGCATCCATTGGGTACATGACAAATGACCCAGCCGGTACAGTCATTGTT
>SEQ ID NO: 48
ATGGTACAGCTCACGCGAACCTCAGGGTTTATTGCAGCGGCTGCGATTGTTGCCGCCATCGCGTTCCCGTTTATTCGACGGGACTATCAGACTTTTCTGCGAGGGGGCCCCTCATATGCCCCACAGAATATTCGCGGCTATATCATTGTCCTGGTCTTGTCCCTCTTCAGAGGAGAAGAAAAGGGTCTGGCTATCTATGAGCCGCTTCCAGAGAAACGGACGTGGTTGCCAGAGTTGCCTAGACGGGCGGGCGATAGACCCAAAACTACCAGCCATATAATACAACGACAACTCGACCAATATCCCGACCCGGACTTCGTACTTAAAGCATTGAAAGCAACTGTAATACCGAGAGTTCAGGCAAGGCACACTGATAAAACCCATCTTGCACTTTCCAAGTTTGAATTCCACGCCGAGGCAATCTTCGTCCGACCAGAGATAGCCATAGACGATCCGAAACATATCCCAAGTCATGACACAGTCAGACGAACGAAACGGGAGATAGCCCATATGCATGATTATCATGACTGCACCCTGCACCTTGCGCTTGCGGCACAGGACGCAAAACAGGTCTTGCAAAAAGGATGGGGACAGAGACACCCCCTTGCCGGACCTGGCATGCCGGGTCCGCCTACTGAATGGACATTCCTCTACGCCCCGAGAACTGAGGAGGAGGTGAAAGTGGTTGAAACCATAGTGGAGGCGAGTATAGCTTACATGACCAATGCAGAAAAACCAGTAGAACTCGTACAA
>SEQ ID NO: 49
ATGGCTTATCAGTTGACATGGATTCAGACTCTTGTATTGGGTGCTCTCGTGGCTATGGCTGTTGCATTTCCATTCATCAAAAAAGATTATGAGACCTTCCTCAAGGGCGGCCCTTCATACGCCCCCCAGAATGTCCGCGGTTATATTATCGTACTCGTCCTCGCGCTGTTCAGACAAGAACAATTGGGGCTTGAGATATATGACCGCATGCCCGAAAAACGCAGGTGGCTCGCTAACCTCCCTCAACGGGAAGGTCCGCGACCGAAAACCACTAGCCATATCATTCAGCGCCAGCTCTCTCAGCATACCGACCCCGCCTTTGGAGCGGCTTATCTGAAAGACACCGTAATCCCGCGAGTGCAGGCGCGGCATGCAGCGAACACTCACATAGCGCGAAGTACGTTCGAATTTCACGCAGCGGCTATCTTTCTCAACGCAGACGTGCCGTTGCCCGAAGGACTGCCAGCTAGCGAAACAGTGAGACGAACCAAAGGAGAAATCGCGCACATGCACGATTACCACGATTTTACGCTGCACCTGGCACTTGCGGCAGCGGACGGGAAAGAGGTGGTCGGCAAAGGATGGGGACAGAGACATCCACTCGCTGGCCCTGGGGTGCCTGGCCCTCCGAATGAGTGGACATTCGTGTACGCTCCCAGGAACGAGGAAGAGATGGGCGTAGTAGAGCAGATTGTAGAGGCTGCAATCGGTTACATGTCAAATGTCCCTGCTCTCGAG
>SEQ ID NO: 50
ATGCTCCCGGCTTTCATATATAAACCGAGATTGGTCATTACGTGCGTTTTTGTTCTCGCTAGTGCATTGGCTTTTCCCTTCATAAGAAAGGACTATCAGACTTTCCTCGAAGTCGGGCCGTCTTATGCTCCTCAAAACCTTCAAGGGTATATCATAGTCTGCGTATTGTCACTCTTCAGACAAGAGCAAAAAGATGTAGCCATATACGATAGACTCCCCGAGAAAAGAAGGTGGCTTGGTGACCTGCCGTTCAGAGAAGGGCCGCGCCCGTCTATTACCTCCCACATTATCCAACGCCAAAGAACGCAACTTGCTGATGCAGAGTTCGCAACAAAGGAGTTGATTGGGAAGATCATTCCGAGGGTGCAGGCAAGGCATACAAATACCACTTTCTTGTCAACGAGTAAATTTGAGTTTCACGCCCAGGCAATCTTTCTGCTTCCTTCAATTCCCATAAACGATCCACAAAATATCCCAAGTCACGATACGGTACGGCGCACGAAGCGCGAGATCGCCCACATGCATGATTATCATGATTGCACGCTTCACTTGGCTCTCGCCGCGCAGGACGGGAAAGAGGTGCTTGAGAAGGGGTGGGGTCAGCGGCATCCACTCGCCGGGCCAGGTGTTCCCGGTCCCCCAACCGAATGGACATTTCTCTATGCGCCCCGCTCTGAAGAAGAGGTACGGGTCGTGGAAATGATAGTCGAGGCTAGCGTGGTTTATATGACGAATGATCCTGCGGACAAGATTGTAGAGGCCACCGTCCAGGGCACCGAAGAG
>SEQ ID NO: 51
ATGAATATAAATCTGAAAGCACTTATTGGTGTCTGTGCGGTACTCATCACCGCTGCTGTCTTTCCTTTTGTACGGAAAGACTATCACACCTTTTTGGAGGGCGGCCCTTCCTATGCTCCACAGAACTTGCAGGGCTACATAATAGTCCTCGTCTTGTCACTCTTCAGGGGAGAGGAGACTGGTTTGGAAATTTATGATCGCTTGCCAGAAAAGCGGCGATGGCTGGAAGAACTGCCAGTGCGGGAGGGACCGCGGCCTAAGACTACGAGTCACATCATCCAACGCCAGCTCAACCAGCACGTTGACCCCGACTTCGGCATGAATAGCTTGAAAGGCTCTGTGATACGGAGGCTTCAATCCCGCCACCAAGATATAACGCAGCTTGCTCTTTCCAAGTTTGAGTTTCACGCCGAAGCAATTTTTCTCCGGCCTGACGTCGCAATCAATGACCCCAAACACGTGCCATCTCATGACACTGTCCGACGCACAAAGAGGGAGATCGCTCACATGCACGACTACCACGATTACACTTGCCATTTGGCCCTTGCCGCCCAAGATGGCAAACAAGTGATAGCGAAGGGCTGGGGTCAAAGACATCCGCTTGCTGGGCCCGGTATGCCTGGACCTCCTACCGAGTGGACCTTCCTTTATGCCCCACGCAACGAAGCAGAGGTGCAAGTGCTGGAAACTATTATTGAGGCAAGTATAGGATATATGAGTAACGCACCTGCCCTGGGAGGTTCCGAA
>SEQ ID NO: 52
ATGGCTAGCATGACTGGTGGACAGCAAATGGGTCGCGGATCCCACCACCACCACCACCAC
>SEQ ID NO: 53
MASMTGGQQMGRGSHHHHHH
>SEQ ID NO: 54
ATGAGGATAAATATCTCTTTGTCTAGTCTCTTTGAGAGACTGAGCAAATTGTCATCCCGATCCATCGCAATTACCTGCGGCGTAGTCTTGGCAAGTGCAATAGCATTCCCAATTATCCGAAGAGACTATCAAACGTTCCTTGAAGTCGGTCCGAGCTATGCCCCACAGAACTTCCGAGGCTATATCATCGTTTGTGTCTTGTCACTTTTTAGGCAAGAGCAGAAAGGGTTGGCAATCTATGACAGGCTTCCAGAAAAGAGGCGTTGGCTTGCCGACTTGCCGTTTCGTGAAGGGACGAGGCCATCCATAACCTCCCACATTATACAGCGTCAGCGTACTCAGCTGGTAGATCAAGAGTTTGCAACCAGAGAACTTATCGATAAGGTGATCCCACGTGTGCAAGCAAGACACACAGACAAAACTTTTCTCAGTACGTCAAAATTTGAGTTTCATGCAAAGGCCATCTTCCTTCTCCCCTCTATCCCTATTAATGATCCTCTTAACATTCCCTCACACGATACGGTAAGAAGAACCAAGCGTGAGATCGCTCACATGCATGATTACCATGATTGCACTCTGCACTTGGCTCTTGCTGCTCAGGATGGTAAGGAAGTTTTGAAGAAGGGGTGGGGCCAGCGTCACCCACTGGCCGGACCAGGAGTCCCAGGCCCTCCTACTGAGTGGACCTTCCTTTACGCACCAAGGAACGAAGAGGAGGCCAGAGTTGTCGAGATGATAGTCGAAGCTAGTATTGGCTACATGACTAACGATCCTGCTGGTAAGATTGTCGAAAATGCCAAG
Реферат
Группа изобретений относится к биохимии. Предложена нуклеиновая кислота, кодирующая люциферазу или ее функциональный фрагмент и выбранная из группы, состоящей из нуклеиновой кислоты, кодирующей белок, характеризующийся аминокислотной последовательностью, представленной в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32 или 34, нуклеиновой кислоты, кодирующей белок, имеющий последовательность, которая по крайней мере на 65% идентична аминокислотной последовательности, представленной в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32 или 34, и нуклеиновой кислоты, кодирующей белок, в состав которого входит консенсусная последовательность SEQ ID NO: 35. Предложены также люцифераза или ее функциональный фрагмент, кодируемые указанной нуклеиновой кислотой. Также предложены экспрессионная кассета, клетка-хозяин, трансгенный организм, содержащие указанные молекулы нуклеиновых кислот. Кроме того, предложены набор для мечения организмов и способ мечения клеток и клеточных органелл. Группа изобретений обеспечивает расширение технических средств в области применения биолюминесцентных систем. 8 н. и 18 з.п. ф-лы, 10 ил., 1 табл., 14 пр.
Формула
Документы, цитированные в отчёте о поиске
Животная модель, экспрессирующая люциферазу под контролем промотора основного белка миелина (mbp-luci), и применение модели для визуализации биолюминесценции in vivo

Комментарии