Аналоги витамина d, их применение, фармацевтическая и косметическая композиция на их основе - RU2266274C2
Код документа: RU2266274C2
Чертежи





Описание
Изобретение относится к биароматическим аналогам витамина D как новым полезным продуктам, применяемым в промышленности.
Изобретение также относится к способу их получения и применению в фармацевтических композициях, предназначенных для использования при лечении людей и животных, а также в косметических композициях.
Соединения согласно изобретению обладают активностью по отношению к пролиферации и дифференцировке клеток и могут найти применение, в частности, при местном и системном лечении дерматологических (или других) заболеваний, связанных с нарушением кератинизации, или нарушений с воспалительной и/или иммуноаллергической компонентой, а также гиперпролиферации тканей эктодермического происхождения (кожа, эпителий...), которая может быть доброкачественной или злокачественной. Указанные соединения могут применяться также для борьбы со старением кожи под действием света или от времени и для лечения нарушений при рубцевании ран.
Соединения согласно изобретению можно также использовать в косметических композициях для ухода за телом и волосами.
Витамин D является важным витамином для профилактики и лечения дефицита минерализации хрящей (рахит) и костей (остеомаляция) и даже некоторых форм остеопороза у пожилых пациентов. Но в настоящее время признано, что его действие выходит за пределы регулирования костного метаболизма и кальциевого гомеостаза. Так, среди прочих воздействий витамина D можно привести воздействие на пролиферацию и дифференцировку клеток, а также контролирование защитных функций организма. Открытие дополнительных эффектов привело к разработке новых терапевтических методов в области дерматологии, онкологии, в области аутоиммунных заболеваний, а также в области трансплантации органов или тканей.
Эффективное терапевтическое применение указанного витамина долгое время наталкивалось на его токсичность (иногда наблюдались случаи смертельной гиперкальцемии). В настоящее время синтезированы структурные аналоги витамина D, некоторые из которых имеют только дифференцирующие свойства и не оказывают воздействия на метаболизм кальция.
В заявке на патент WO 00/26167 (D1) заявителем предложены новые соединения, являющиеся аналогами витамина D, которые оказывают избирательное воздействие на пролиферацию и дифференцировку клеток и не проявляют гиперкальцемических свойств. Указанные аналоги витамина D могут быть легче синтезированы и, следовательно, являются более экономичными по сравнению с известными соединениями.
Недавно заявитель неожиданно обнаружил, что некоторые соединения, в частности соединения, не описанные специально в заявке на патент WO 00/26167 (D1), но соответствующие общей приведенной формуле, проявляют биологическую активность, намного превосходящую, в частности, активность известных соединений. Указанная активность является настолько сильной, что она приближается к активности натурального витамина D.
Таким образом, настоящее изобретение относится, по меньшей мере, к одному соединению, которое выбирают из следующих соединений:
- (4Е,6Е)-7-{3-[2-(3,4-бис-гидроксиметилфенил)этил]фенил}-3-этил-нона-4,6-диен-3-ол,
- (Е)-6-[3-(3,4-бис-гидроксиметил-бензилокси)фенил]-1,1, 1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ол,
- (3Е,5Е)-6-[3-(3,4-бис-гидроксиметил-бензилокси)фенил]-1,1,1-трифтор-2-трифторметилокта-3,5-диен-2-ол,
- (Е)-6-{3-[2-(3, 4-бис-гидроксиметилфенил)этил]фенил}-1,1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ол,
- (3Е,5Е)-6-{3-[2-(3,4-бис-гидроксиметилфенил)этил]фенил}-1,1,1-трифтор-2-трифторметилокта-3, 5-диен-2-ол,
а также к их геометрическим изомерам и соединениям, в которых одна или несколько гидроксильных групп имеют защитную группу типа -(С=О)-R, где R обозначает линейный или разветвленный алкильный радикал, содержащий от 1 до 6 атомов углерода, или арильный радикал, содержащий от 6 до 10 атомов углерода, или аралкильный радикал, содержащий от 7 до 11 атомов углерода; при этом арильный радикал или аралкильный радикал могут быть замещены одной или двумя гидроксильными группами, алкоксигруппами, содержащими от 1 до 3 атомов углерода, атомами галогена, нитро- или аминогруппами, и к их смесям.
Под линейным или разветвленным алкильным радикалом, содержащим от 1 до 6 атомов углерода, понимают метильный, этильный, изопропильный, трет-бутильный или гексильный радикал.
Под арильным радикалом, содержащим от 6 до 10 атомов углерода, понимают фенильный или нафтильный радикал.
Под аралкильным радикалом, содержащим от 7 до 11 атомов углерода, понимают бензильный или метил-нафтильный радикал.
Под атомом галогена понимают атом фтора, брома или хлора.
Настоящее изобретение относится также к способам получения указанных выше соединений.
На фиг.1-4 представлены схемы реакций, по которым могут быть получены соединения согласно изобретению.
Так, соединение согласно примеру 1 может быть получено (фиг.1) из производного (6) в результате реакции с этиллитием при температуре -78°С в растворителе, таком как тетрагидрофуран (ТГФ), а затем гидроксильные группы освобождают от защиты в присутствии фторида тетрабутиламмония.
Соединение (6) может быть получено из 3-бромпропиофенона (1) путем последовательного осуществления ряда реакций, включающих:
- Образование производного (2) путем защиты кетогруппы в форме диоксолана и последующее образование альдегидной группы из соответствующего литиевого производного в присутствии диметилформамида.
- Образование производного (3) по реакции Хорнера-Эммонса между фосфонатным производным (соединение А) и бензальдегидом (2) с последующим гидрированием в присутствии палладия на угле.
- Образование производного (4) восстановлением сложноэфирных групп в присутствии литийалюмогидрида, с последующим удалением защитной кетогруппы в присутствии пара-толуолсульфокислоты и защитой спиртовых групп в виде трет-бутилдиметилсилила.
- Образование производного (5) по реакции Хорнера-Эммонса с триэтилфосфоноацетатом, последующее восстановление сложноэфирной группы в присутствии литийалюмогидрида и окисление спиртовой группы в присутствии диоксида марганца.
- Образование производного (6) по реакции Хорнера-Эммонса между триэтилфосфоноацетатом и альдегидным производным (5) или непосредственно по реакции Хорнера-Эммонса между триэтилфосфонокротонатом и кетопроизводным (4).
Соединение А может быть получено из ангидрида тримеллитовой кислоты по схеме, представленной на фиг.4.
Соединения согласно примерам 2 и 4 могут быть получены (фиг.2 и 3) соответственно из производного (13) и производного (15) путем удаления защиты спиртовых групп в присутствии фторида тетрабутиламмония.
Соединения согласно примерам 3 и 5 могут быть получены (фиг.2 и 3) соответственно из производного (13) и производного (15) путем восстановления тройной связи до двойной связи, имеющей транс-конфигурацию, литийалюмогидридом в присутствии метилата натрия в растворителе, таком как ТГФ, и последующим удалением защиты спиртовых групп в присутствии фторида тетрабутиламмония.
Соединение (13) может быть получено из 3-гидроксипропиофенона (7) путем осуществления ряда реакций, включающих:
- Образование производного (8) путем защиты фенольной группы в виде трет-бутилдиметилсилила.
- Образование производного (9) по реакции Хорнера-Эммонса с триэтилфосфоноацетатом с последующим восстановлением сложноэфирной группы в присутствии литийалюмогидрида и окислением спиртовой группы в присутствии диоксида марганца.
- Образование производного (10) по реакции Кори-Фукса (Corey-Fuchs).
- Образование производного (11) путем удаления защиты фенольной группы и последующую реакцию конденсации с бромпроизводным (соединение В) в присутствии гидрида натрия в растворителе, таком как диметилформамид (ДМФА).
- Образование производного (12) путем удаления защитных бензоатных групп с последующей повторной защитой в виде трет-бутилдиметилсилилоксигрупп.
- Образование производного (13) по реакции с бутиллитием, а затем с гексафторацетоном.
Соединение В может быть получено из ангидрида тримеллитовой кислоты по схеме на фиг.4.
Соединение (15) может быть получено из производного (5) превращением альдегидной группы в ацетиленовую группу (14) по реакции Кори-Фукса с последующим образованием литиевого производного с помощью бутиллития и взаимодействием с гексафторацетоном.
Защита гидроксигрупп осуществляется обычным способом, описанном в литературе, например, по реакции соответствующего хлорангидрида кислоты типа RCOCl в растворителе, таком как ТГФ или дихлорметан, в присутствии основания, такого как пиридин или триэтиламин.
Соединения согласно изобретению обладают биологическими свойствами, аналогичными свойствам витамина D, в частности свойствами трансактивации элементов ответной реакции организма на действие витамина D (VDRE), такими как агонистическая активность по отношению к рецепторам витамина D или его производным. Под витаминами D или их производными понимают, например, производные витамина D2 или D3 и, в частности, 1,25-дигидроксивитамин D3 (кальцитриол).
Указанная агонистическая активность по отношению к рецепторам витамина D или его производным может быть выявлена в тесте "in vitro" методами, известными в области исследования генной транскрипции (Hansen et al., The Society For Investigative Dermatologie, vol.1, № 1, April 1996).
В качестве примера, агонистическая активность VDR может быть исследована на линии клеток HeLa путем контрансфекции вектора экспрессии рецептора VDR человека и транспортной плазмиды p240Hase-CAT. Агонистическая активность может характеризоваться в указанной системе контрансфекции определением дозы, необходимой для достижения 50%-ной максимальной активности продукта (АС50). Подробный отчет испытаний, а также результаты, полученные с использованием соединений согласно изобретению, описаны в примере 7 настоящей заявки.
Биологические свойства, аналогичные свойствам витамина D, могут быть также определены с помощью способности продукта ингибировать пролиферацию нормальных кератиноцитов человека (культура KHN). Продукт добавляют к культивированным клеткам KHN в условиях, способствующих пролиферации. Продукт оставляют контактировать с клетками в течение пяти суток. Количество пролиферированных клеток измеряется введением бромдеоксиуридина (BRdU) в ДНК. Отчет об испытаниях, а также результаты, полученные с использованием соединений согласно изобретению, описаны в примере 8 настоящей заявки.
Биологические свойства, аналогичные свойствам витамина D, могут быть также определены с помощью способности продукта вызывать дифференцировку клеток промиелоцитарной лейкемии HL60. Отчет об испытаниях, а также результаты, полученные с использованием соединений согласно изобретению, описаны в примере 9 настоящей заявки.
Агонистическая активность по отношению к рецепторам витамина D соединений согласно изобретению может быть оценена в тесте "in vivo" индуцированием у мыши SKH 24-гидроксилазы (Voorhees and al. 1997, 108:513-518). Отчет об этом тесте, а также результаты, полученные с применением соединений по изобретению, описаны в примере 10 настоящей заявки.
Объектом настоящего изобретения является также применение описанных выше соединений в качестве лекарственного средства.
Соединения согласно изобретению особенно пригодны для лечения следующих заболеваний:
- дерматологических заболеваний, связанных с нарушением кератинизации, вызванной дифференцировкой и пролиферацией клеток, таких как угри обыкновенные, комедоны, угри полиморфные, розовые, узелково-кистозные, шаровидные, старческие, вторичные угри, такие как солнечные, медикаментозные или вызванные профессиональными заболеваниями;
- ихтиоза, ихтиозоподобных состояний, болезни Дамьера, пальмовидного кератодермита, лейкоплазии и лейкоплазоподобных состояний, кожного или слизистого (слизистой оболочки рта) лишая;
- воспалительных иммунно-аллергических дерматологических заболеваний, сопровождающихся или не сопровождающихся нарушениями пролиферации клеток, а также всех форм псориаза, кожного, слизистого или ногтевого, и даже псориатического ревматизма, а также кожной атопии, например экземы, дыхательной атопии или гипертрофии десен;
- доброкачественных или злокачественных кожных или эпидермических пролифераций вирусного или невирусного происхождения, таких как бородавки обыкновенные, плоские юношеские бородавки и бородавочная эпидермодисплазия, ротовых или флоридовых множественных папиллом, лимфоны Т; пролифераций, вызванных ультрафиолетовым воздействием, в частности, в случае базальной и спинно-клеточной эпителиомы, а также кожных предраковых заболеваний, таких как кератоакантомы;
- иммунных дерматозов, таких как красная волчанка, визикулезных иммунных заболеваний или болезней коллагена, например склеродермии;
- дерматологических или общих заболеваний с иммунологической составляющей;
- нарушений функции сальных желез, таких как угревая гиперсеборея или простая себорея;
- кожных расстройств, вызванных воздействием ультрафиолетового излучения, старением кожи, как под действием света, так и возрастным, пигментаций и актинических кератоз или любых патологий, связанных с возрастным старением или старением под действием излучения;
- нарушений при заживлении рубцов на коже или растяжек;
- воспалительных заболеваний, таких как артрит, кожных или общих заболеваний вирусного происхождения, таких как синдром Капозиса (Kaposis);
- офтальмологических нарушений, в частности корнеопатий;
- раковых или предраковых состояний, которые могут быть вызваны рецепторами витамина D, таких как рак молочной железы, лейкемия, миелодисплазные синдромы и лимфомы, карциномы клеток эпителия и рак желудочно-кишечного тракта, меланомы и остеосаркома;
- алопеции различного происхождения, в частности алопеции, вызванной химиотерапией или облучением;
- иммунных заболеваний, таких как аутоиммунные болезни, сахарный диабет первого типа, рассеянный склероз, волчанка и заболевания типа волчанки, астма, гломерулонефрит; селективные дисфункции иммунной системы, такие как СПИД, иммунное отторжение;
- заболеваний эндокринной системы;
- заболеваний, характеризующихся анормальным контролем за внутриклеточным кальцием, патологий, в которых участвует метаболизм кальция, таких как ишемия мышц;
- недостатка витамина D и других заболеваний гомеостаза минералов в плазме или костях, таких как рахит, остеомаляция, в частности, у женщин в период менопаузы, почечная остеодистрофия или нарушения паратиреоидной функции;
- заболеваний сердечно-сосудистой системы, таких как артериосклероз или гипертония, а также инсулинонезависимого диабета.
В упомянутых выше терапевтических областях соединения согласно изобретению могут, предпочтительно, использоваться в сочетании с ретиноидами, кортикостероидами или эстрогенами, в сочетании с антиоксидантами, альфа-оксикислотами, бета-оксикислотами или альфа-кетокислотами или их производными, с блокираторами ионных каналов, а также в сочетании с другими известными лекарственными средствами, взаимодействующими на иммунную систему (например, циклоспорином, FK 506, глюкокортикоидами, моноклональными антителами, цитокинами или регуляторами роста...).
Под ретиноидами понимают природные или синтетические лиганды рецепторов RAR или RXR.
Под антиоксидантами понимают, например, альфа-токоферол, супероксиддисмутазу, убихинол или некоторые хелаты металлов.
Под альфа-окси- или альфа-кетокислотами или их производными понимают, например, молочную, яблочную, лимонную, гликолевую, миндальную, винную, глицериновую, аскорбиновую кислоты, а также их соли, амиды или сложные эфиры.
Под бета-оксикислотами понимают, например, салициловую кислоту, а также ее соли, амиды или сложные эфиры.
Под блокаторами ионных каналов понимают, например, блокаторы калиевых каналов, в частности миноксидил (2, 4-диамино-6-пиперидино-пиримидин-3-оксид) и его производные.
Объектом настоящего изобретения является фармацевтическая композиция, содержащая, по крайней мере, одно соединение, которое определено выше.
Введение соединений согласно изобретению может осуществляться энтеральным, парентеральным, местным или внутриглазным способом.
При энтеральном введении фармацевтические композиции могут иметь форму таблеток, желатиновых капсул, драже, сиропов, суспензий, растворов, порошков, гранул, эмульсий, микросфер или наносфер или липидных или полимерных везикул, осуществляющих постепенное выделение лекарства. При парентеральном введении, фармацевтические композиции могут иметь форму растворов или суспензий для перфузии или для инъекции. Соединения согласно изобретению назначаются, в общем случае, ежедневной дозой приблизительно от 0,001 мкг/кг до 1000 мкг/кг и предпочтительно приблизительно от 0,01 мкг/кг до 100 мкг/кг в один или три приема.
При местном нанесении, фармацевтические композиции на основе соединений согласно изобретению используются для лечения кожи и слизистых оболочек в форме мазей, кремов, молочка, помадок, пропитанных тампонов, растворов, гелей, спреев, лосьонов или суспензий. Они могут также иметь форму микросфер или наносфер или липидных или полимерных везикул или полимерных липких пластырей и гидрогелей, осуществляющих регулируемое высвобождение активного начала. Указанные композиции для топического нанесения в соответствии с клиническими указаниями могут быть либо в виде раствора, либо в твердой форме.
При внутриглазном способе используют, главным образом, глазные капли.
Указанные композиции для топического нанесения или для внутриглазного введения включают, по крайней мере, одно соединение согласно изобретению, концентрация которого составляет предпочтительно от 0,0001 до 5% и еще более предпочтительно от 0,001 до 1% по отношению к общему весу композиции.
Соединения согласно изобретению находят также применение в косметической области, особенно для ухода за телом и волосами, в частности для лечения кожи, подверженной угревой сыпи, для быстрого роста волос, для борьбы против выпадения волос, для ухода за жирной кожей или жирными волосами, для защиты от вредных воздействий солнца или для лечения физиологически сухой кожи, для предотвращения и/или борьбы со старением кожи под действием света или от времени.
В косметической области соединения согласно изобретению могут быть предпочтительно использованы в сочетании с ретиноидами, кортикостероидами, в сочетании с антиоксидантами, альфа-окси- или альфа-кетокислотами или их производными, а также с блокираторами ионных каналов.
Различные продукты, применяемые в сочетании с соединениями согласно настоящему изобретению, описаны выше.
Таким образом, настоящее изобретение касается также косметической композиции, содержащей в косметически приемлемом носителе, по меньшей мере, одно соединение, которое определено выше. Указанная косметическая композиция может, в частности, иметь форму крема, молочка, лосьона, геля, микросфер или наносфер или липидных или полимерных везикул, мыла или шампуня.
Соединения согласно изобретению находятся в косметических композициях в количестве от 0,001 до 3% от общего веса композиции.
Фармацевтические и косметические композиции согласно изобретению могут дополнительно содержать инертные или фармакодинамические или косметически активные добавки или их комбинации и, в частности, смачиватели; депигментирующие агенты, такие как гидрохинон, азелаиновая кислота, кофейная кислота или койевая кислота; умягчители; гидратирующие агенты, такие как глицерин, полиэтиленгликоль PEG 400, тиаморфолинон и его производные или мочевина; противосеборейные или противоугревые агенты, такие как S-карбоксиметилцистеин, S-бензилцистамин, их соли и их производные, или пероксид бензоила; антибиотики, такие как эритромицин и его сложные эфиры, неомицин, клиндамицин и его сложные эфиры, тетрациклины; противогрибковые агенты, такие как кетоконазол или полиметилен-4, 5-изотиазолин-3-оны; агенты, способствующие росту волос, такие как миноксидил (2,4-диамино-6-пиперидино-пиримидин-3-оксид) и его производные, диазоксид (7-хлор-3-метил-1,2,4-бензотиадиазин-1, 1-диоксид) и фенитоин (5,4-дифенил-имидазолидин-2,4-дион); противовоспалительные нестероидные агенты; каротеноиды и, в частности, β-каротин; противопсориазные агенты, такие как антралин и его производные и, наконец, эйкоза-5,8,11,14-тетраноиновая и эйкоза-5,8,11-триноиновая кислоты, их сложные эфиры и амиды.
Композиции согласно изобретению могут также содержать агенты, улучшающие вкусовые качества, консерванты, такие как сложные эфиры пара-оксибензойной кислоты, стабилизаторы, агенты-регуляторы влажности, агенты-регуляторы рН, модификаторы осмотического давления, эмульгаторы, фильтры УФ-А и УФ-В, антиоксиданты, такие как альфа-токоферол, бутилгидроксианизол или бутилгидрокситолуол.
В качестве иллюстрации приводятся примеры получения соединений согласно изобретению, которые не ограничивают изобретение, а также различные конкретные составы на основе этих соединений и примеры проведения испытаний на биологическую активность соединений согласно изобретению.
Пример 1
(4Е,6Е)-7-{3-[2-(3,4-Бис-гидроксиметил-фенил)этил]фенил}-3-этил-нона-4,6-диен-3-ол
а) 2-(3-Бромфенил)-2-этил-[1,3]диоксолан
15 г (70 ммоль) 3-бромпропиофенона растворяют в 250 мл толуола и добавляют 20 мл (350 ммоль) этиленгликоля, а также добавляют 660 мг (3,5 ммоль) паратолуолсульфокислоты. Снабжают установку насадкой Дина-Старка, и реакционную смесь кипятят с обратным холодильником в течение 20 ч. Охлаждают, обрабатывают раствором бикарбоната калия и экстрагируют продукт с помощью этилового эфира; целевой продукт является чистым, не требующим дополнительной очистки и получен в виде масла желтоватого цвета (выход 17,8 г или 99%).
b) 3-(2-Этил-[1,3]диоксолан-2-ил)бензальдегид
17,8 г (70 ммоль) 2-(3-бромфенил)-2-этил-[1,3]диоксолана растворяют в 300 мл ТГФ и охлаждают смесь до температуры -78°С. Медленно добавляют 34 мл (85 ммоль) 2,5 М раствора бутиллития и перемешивают смесь в течение 30 минут. Затем добавляют 8,1 мл (105 ммоль) ДМФА и нагревают смесь до 0°С, а затем ее обрабатывают насыщенным раствором хлорида аммония. После экстракции с использованием этилового эфира, получают целевой альдегид в виде масла желтого цвета (выход 14 г или 97%).
с) Диметиловый эфир 4-{(Е)-2-[3-(2-этил-[1, 3]диоксолан-2-ил)фенилвинил)фталевой кислоты
10,3 г (30 ммоль) диметилового эфира 4-(диэтоксифосфорилметил)фталевой кислоты растворяют в 100 мл безводного ТГФ и охлаждают смесь до 0°С. Порциями добавляют 3,4 г (30 ммоль) трет-бутилата калия и смесь перемешивают в течение 30 минут. Затем по каплям добавляют раствор 5,6 г (27,3 ммоль) 3-(2-этил-[1, 3]диоксолан-2-ил)бензальдегида и смесь перемешивают еще в течение 2 часов при температуре 0°С. После обычной обработки остаток очищают хроматографией на колонке, наполненной диоксидом кремния (элюент гептан 80 - этилацетат 20). Получают масло желтого цвета (выход 9,6 г или 89%).
d) Диметиловый эфир 4-{2-[3-(2-этил-[1,3]диоксолан-2-ил)фенил]этил}фталевой кислоты
9,5 г (24 ммоль) диметилового эфира 4-{(Е)-2-[3-(2-этил-[1,3]диоксолан-2-ил)фенил]винил}фталевой кислоты растворяют в смеси 120 мл этилацетата и 5 мл триэтиламина. Реакционную смесь дегазируют продуванием азотом в течение 10 минут, затем добавляют 1 г 5% палладия на угле. Далее реакционную смесь нагревают до температуры 80°С и в течение 4 часов гидрируют под давлением водорода в 4 бар. Остаток очищают хроматографией на колонке, наполненной диоксидом кремния. Получают бесцветное масло (выход 7,5 г или 80%).
е) (4-{2-[3-(2-Этил-[1, 3]диоксолан-2-ил)фенил]этил}-2-гидроксиметилфенил)метанол
2,9 г (75 ммоль) литийалюмогидрида суспендируют в 20 мл этилового эфира. Добавляют по каплям раствор 7,5 г (19 ммоль) диметилового эфира 4-{2-[3-(2-этил-[1,3]диоксолан-2-ил)фенил]этил}фталевой кислоты в 100 мл этилового эфира. После перемешивания в течение 20 минут при комнатной температуре в реакционную смесь добавляют 15 мл воды, 1,5 мл 15%-ного раствора едкого натра в 4,5 мл воды, затем смесь фильтруют и концентрируют при пониженном давлении. Получают бесцветное масло (выход 6,4 г или 99%).
f) 1-{3-[2-(3,4-Бис-гидроксиметилфенил)этил]фенил}пропан-1-он
6,4 г (18,7 ммоль) (4-{2-[3-(2-этил-[1,3]диоксолан-2-ил)фенил]этил}-2-гидроксиметилфенил)метанола растворяют в смеси 40 мл воды и 40 мл ацетона. Добавляют 650 мг паратолуолсульфокислоты и перемешивают смесь в течение 5 часов. После обычной обработки целевой продукт является чистым, не требующим дополнительной очистки; получен в виде бесцветного масла (выход 5,57 г или 100%).
g) 1-(3-{2-[3,4-Бис-(трет-бутилдиметилсиланилоксиметил)-фенил]этил}фенил)пропан-1-он 5,5 г (18,5 ммоль) 1-{3-[2-(3, 4-бис-гидроксиметилфенил)этил]фенил}пропан-1-она растворяют в 50 мл безводного диметилформамида и охлаждают смесь до 0°С. Добавляют 6,7 г (45 ммоль) трет-бутилдиметилхлоросилана и 3,5 г (52 ммоль) имидазола. Дают смеси нагреться до комнатной температуры и перемешивают еще в течение 2 часов. После обработки насыщенным раствором хлорида аммония и экстракции с использованием этилацетата органические фазы объединяют, промывают водой, сушат и концентрируют при пониженном давлении. Получают бесцветное масло (выход 9,6 г или 99%).
h) Этиловый эфир (Е)-3-(3-{2-[3, 4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)пент-2-еновой кислоты
11,1 мл (56 ммоль) триэтилфосфоноацетата растворяют в 100 мл ТГФ. Затем добавляют 2,2 г (55 ммоль) 60%-ного гидрида натрия и перемешивают смесь в течение 30 минут при комнатной температуре. Затем прикапывают раствор 9,5 г (18 ммоль) 1-(3-{2-[3, 4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)пропан-1-она в 100 мл ТГФ. Смесь взбалтывают в течение 6 часов, затем обрабатывают водой и экстрагируют с использованием этилацетата. Полученный остаток очищают хроматографией на силикагеле (элюент этилацетат 10 - гептан 90). Получают масло желтого цвета (выход 5,8 г или 56%).
i) (Е)-3-(3-{2-[3, 4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)пент-2-ен-1-ол
0,75 г (19 ммоль) литийалюмогидрида суспендируют в 10 мл этилового эфира. Прикапывают раствор 5,6 г (9,6 ммоль) этилового эфира (Е)-3-(3-{2-[3,4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)пент-2-еновой кислоты в 50 мл этилового эфира. Перемешивают в течение 20 минут при комнатной температуре и реакционную смесь обрабатывают, добавляя 0,75 мл воды, 0,75 мл 15%-ного раствора едкого натра в 1,5 мл воды, затем фильтруют и концентрируют при пониженном давлении. Получают бесцветное масло (выход 5, 26 г или 99%).
j) (Е)-3-(3-{2-[3,4-Бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)пент-2-еналь
2,8 г (5 ммоль) (Е)-3-(3-{2-[3, 4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)пент-2-ен-1-ола растворяют в 50 мл дихлорметана. Добавляют 4,3 г (50 ммоль) диоксида марганца и смесь перемешивают в течение 12 часов, затем фильтруют и концентрируют при пониженном давлении. Целевой продукт получают в виде масла желтого цвета (выход 2,8 г или 100%).
k) Диэтиловый эфир (2Е,4Е)-5-(3-{2-[3, 4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)гепта-2,4-диеновой кислоты
1,3 мл (6,5 ммоль) триэтилфосфоноацетата растворяют в 20 мл ТГФ. Затем добавляют 260 мг (6,5 ммоль) 60%-ного гидрида натрия и смесь перемешивают в течение 30 минут при комнатной температуре. Затем добавляют по каплям раствор 2,8 г (5 ммоль) (Е)-3-(3-{2-[3, 4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]-этил}фенил)пент-2-еналя в 30 мл ТГФ. Смесь перемешивают в течение 6 часов, затем обрабатывают водой и экстрагируют этилацетатом. Полученный остаток очищают хроматографией на силикагеле (элюент этилацетат 10 - гептан 90). Получают масло желтого цвета (выход 2,52 г или 81%).
l) (4Е,6Е)-7-{3-[2-(3, 4-Бис-гидроксиметилфенил)этил]фенил}-3-этилнона-4,6-диен-3-ол
1,7 г диэтилового эфира (2,7 ммоль) (2Е,4Е)-5-(3-{2-[3,4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)гепта-2, 4-диеновой кислоты растворяют в 120 мл безводного ТГФ и смесь охлаждают до температуры -78°С. Добавляют 13,5 мл (13,5 ммоль) раствора этиллития (1,0-1,5 М) и смесь перемешивают при указанной температуре в течение 1 часа, затем дают смеси нагреться до 0°С, и смесь обрабатывают насыщенным раствором хлорида аммония. Полученный остаток растворяют в 50 мл ТГФ, затем добавляют 6,5 мл (6, 5 ммоль) раствора фторида тетрабутиламмония. После перемешивания в течение 30 минут и обычной обработки полученный остаток очищают хроматографией на колонке, наполненной диоксидом кремния. Получают целевой продукт в виде бесцветного масла (выход 200 мг или 18%).
1Н ЯМР (ДМСО): 0,82 (т, 6H, J=7,5 Гц); 0,89 (т, 3H, J=7,4 Гц); 1,41-1,53 (м, 4H); 2,41 (кв, 2H, J=7,4 Гц); 2, 83 (с, 4H); 4,01 (с, 1H); 4,41 (т, 2H, J=8 Гц); 4,45 (т, 2H, J=8 Гц); 4,94-4,98 (м, 2H); 6,31 (д, 1H, J=15,0 Гц); 6,46 (д, 1H, J=11,0 Гц); 7,08-7,29 (м, 7H); 7,42-7,45 (м, 1H).
Пример 2
(Е)-6-[3-(3,4-Бис-гидроксиметил-бензилокси)фенил]-1,1,1-трифтор-2-трифторметил-окт-5-ен-3-ин-2-ол
а) 3-(Трет-бутилдиметилсиланилокси)бензальдегид
Получают аналогично примеру 1g, взаимодействием 42,7 г (0,275 моль) трет-бутилдиметилхлоросилана с 30,5 г (0,2 моль) 3-гидроксибензальдегида и (20,4 г, 0,3 моль) имидазола. После очищения на колонке, наполненной диоксидом кремния (дихлорметан 20 - гептан 80), получают масло желтого цвета (выход 55,9 мг или 95%).
b) 1-[3-(Трет-бутилдиметилсиланилокси)фенил]пропан-1-ол
50 г (0,21 моль) 3-(трет-бутилдиметилсиланилокси)-бензальдегида растворяют в 500 мл этилового эфира и охлаждают смесь до 0°С. Медленно добавляют 80 мл (0,24 моль) 3,0 М раствора этилмагнийбромида и перемешивают смесь в течение 5 часов. После обычной обработки полученный остаток очищают хроматографией на колонке, наполненной диоксидом кремния (элюент этилацетат 20 -гептан 80). Получают бесцветное масло (выход 45,8 г или 82%).
c) 1-[3-(трет-бутилдиметилсиланилокси)фенил]пропан-1-он
Получают аналогично примеру 1j, взаимодействием 45 г (0,17 моль) 1-[3-(трет-бутилдиметилсиланилокси)фенил]пропан-1-ола с 148 г (1,7 моль) диоксида марганца. Получают масло желтого цвета (выход 45 г или 100%).
d) Этиловый эфир (Е)-3-[3-(трет-бутилдиметилсиланилокси)фенил]пент-2-еновой кислоты
22,5 мл (113 ммоль) триэтилфосфоноацетата растворяют в 100 мл ТГФ. Затем добавляют 4,5 г (113 ммоль) 60%-ного гидрида натрия и смесь перемешивают в течение 30 минут при комнатной температуре. Добавляют по каплям раствор 20 г (75,6 ммоль) 3-(трет-бутилдиметилсиланилокси)пропан-1-она в 100 мл ТГФ. Смесь перемешивают в течение 6 часов, затем обрабатывают водой и экстрагируют этилацетатом. Полученный остаток очищают хроматографией на силикагеле (элюент этилацетат 10 - гептан 90). Получают масло желтого цвета (выход 7, 6 г или 30%).
e) (Е)-3-[3-(трет-бутилдиметилсиланилокси)фенил)пент-2-ен-1-ол
Получают аналогично примеру 1е, взаимодействием 7,6 г (23 ммоль) этилового эфира (Е)-3-[3-(трет-бутилдиметилсиланилокси)фенилпент-2-еновой кислоты с 1,05 г (25 ммоль) литийалюмогидрида. Получают бесцветное масло (выход 6,7 г или 100%).
f) (Е)-3-[3-(трет-бутилдиметилсиланилокси)фенил)пент-2-ен-1-аль
Получают аналогично примеру 1j, взаимодействием 6,7 г (23 ммоль) (Е)-3-[3-(трет-бутилдиметилсиланилокси)фенил)пент-2-ен-1-ола с 10 г (115 ммоль) диоксида марганца. Получают масло желтого цвета (выход 4,7 г или 71%).
g) Трет-бутил-[3-((Е)-4, 4-дибром-1-этил-бута-1,3-диенил)фенокси]диметилсилан
1,17 г (18 ммоль) порошка цинка, 4,7 г (18 ммоль) трифенилфосфина и 5,9 г (18 ммоль) четырехбромистого углерода перемешивают в течение 45 минут в 150 мл дихлорметана. Добавляют по каплям раствор 2,6 г (9 ммоль) (Е)-3-[3-(трет-бутилдиметилсиланилокси)фенил)пент-2-ен-1-аля в 10 мл дихлорметана. Реакционную смесь перемешивают в течение 1 часа, затем экстрагируют смесью воды и дихлорметана. Остаток фильтруют на колонке, наполненной диоксидом кремния (элюент дихлорметан). Получают масло желтого цвета (выход 3,3 г или 83%).
h) Трет-бутил-[3-((Е)-1-этил-бут-1-ен-3-инил)фенокси]диметилсилан
3,2 г (7,2 ммоль) трет-бутил-[3-((Е)-4,4-дибром-1-этил-бута-1,3-диенил)фенокси]диметилсилана растворяют в 50 мл и охлаждают смесь до -78°С. Добавляют 5,7 мл (14,4 ммоль) 2,5 М раствора бутиллития и перемешивают смесь в течение 2 часов, а затем обрабатывают ее насыщенным раствором хлорида аммония. Остаток очищают хроматографией на колонке, наполненной диоксидом кремния. Получают масло желтого цвета (выход 1,0 г или 49%).
i) 3-((Е)-1-этил-бут-1-ен-3-инил)фенол
1 г (3,5 ммоль) трет-бутил-[3-((Е)-1-этил-бут-1-ен-3-инил)фенокси]диметилсилана растворяют в 50 мл ТГФ и по каплям добавляют 3,8 мл (38 ммоль) 1,0 М раствора фторида тетрабутиламмония. Смесь перемешивают в течение 30 минут, затем обрабатывают насыщенным раствором хлорида аммония и экстрагируют этилацетатом. Получают масло желтого цвета (выход 690 мг или 100%).
j) 2-Бензоилоксиметил-5-[3-((Е)-1-этил-бут-1-ен-3-инил)феноксиметил]бензилбензоат
610 мг (3,5 ммоль) 3-((Е)-1-этил-бут-1-ен-3-инил)фенола растворяют в 80 мл диметилформамида. Добавляют 150 мг (3,7 ммоль) гидрида натрия и перемешивают смесь при комнатной температуре. Затем добавляют 1,5 г (6,2 ммоль) 2-бензоилоксиметил-5-бромометил-бензилбензоата и перемешивают смесь в течение 2 часов. После обычной обработки и очищения хроматографией на колонке с силикагелем получают бесцветное масло (выход 1,66 г или 88%).
k) 1-(3, 4-Бис-трет-бутилдиметилсилоксиметилбензилокси)-3-((Е)-1-этил-бут-1-ен-3-инил)бензол
1,6 г (3 ммоль) 2-бензоилоксиметил-5-[3-((Е)-1-этил-бут-1-ен-3-инил)феноксиметил]бензилабензоата растворяют в 15 мл 2%-ного раствора карбоната калия в метаноле. Реакционную смесь перемешивают в течение 2 часов, затем обрабатывают насыщенным раствором хлорида аммония и экстрагируют этилацетатом. Полученный остаток растворяют в 20 мл безводного ДМФА, добавляют 900 мг (6 ммоль) трет-бутилдиметилхлоросилана и 450 мг (6,6 ммоль) имидазола. Смесь перемешивают в течение 10 часов при комнатной температуре. После обычной обработки полученный остаток очищают хроматографией на колонке, наполненной диоксидом кремния (элюент гептан 85 - этилацетат 85). Получают масло оранжевого цвета (выход 1,16 г или 70%).
l) (Е)-6-{3-[3,4-Бис-(трет-бутилдиметилсиланилоксиметил)бензилокси]фенил}-1,1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ол
1,16 г (2,1 ммоль) 1-(3, 4-бис-трет-бутилдиметилсилилоксиметил-бензилокси)-3-((Е)-1-этил-бут-1-ен-3-инил)бензола растворяют в 30 мл безводного ТГФ и охлаждают смесь до температуры -78°С. Добавляют по каплям 930 мкл (2, 3 ммоль) 2,5 М раствора бутиллития и перемешивают смесь в течение 15 минут. Через раствор в течение 10 минут барботируют гексафтороацетон (газообразный) и реакционную смесь обрабатывают насыщенным раствором хлорида аммония. Полученный остаток очищают хроматографией на колонке, наполненной диоксидом кремния (элюент гептан 80 - этилацетат 20). Получают масло желтого цвета (выход 1,35 г или 89%).
m) (Е)-6-[3-(3,4-Бис-гидроксиметилбензилокси)фенил]-1,1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ол
Получают аналогично примеру 2i, взаимодействием 350 мг (0,5 ммоль) (Е)-6-{3-[3,4-бис-(трет-бутилдиметилсиланилоксиметил)бензилокси]фенил}-1,1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ола с 1,2 мл (1,2 ммоль) 1,0 М раствора фторида тетрабутиламмония. Получают бесцветное масло (выход 210 мг или 80%).
1Н ЯМР (CDCl3): 1,05 (т, 3H, J=7,4 Гц); 2,72 (кв, 2H, J=7,4 Гц); 4,74 (с, 4H); 5,05 (с, 2H); 5,69 (с, 1H); 6,91-7,01 (м, 3H); 7,24 (м, 1H); 7,37 (с, 2H); 7,42 (с, 1H).
Пример 3
(3Е,5Е)-6-[3-(3,4-Бис-гидроксиметилбензилокси)фенил]-1,1,1-трифтор-2-трифторметилокта-3,5-диен-2-ол
а) (3Е,5Е)-6-{3-[3,4-Бис-(трет-бутилдиметилсиланилоксиметил)бензилокси]фенил}-1,1,1-трифтор-2-трифторметилокта-3,5-диен-2-ол
135 мг (3,55 ммоль) литийалюмогидрида растворяют в 10 мл безводного ТГФ. Добавляют 385 мг (7,1 ммоль) метилата натрия и смесь перемешивают в течение 10 минут при комнатной температуре. Добавляют по каплям раствор 860 мг (1,2 ммоль) (Е)-6-{3-[3, 4-бис-(трет-бутилдиметилсиланилоксиметил)бензилокси]фенил}-1,1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ола (описанного в примере 21) в 7 мл ТГФ. Смесь кипятят с обратным холодильником в течение 2 часов, затем обрабатывают последовательным добавлением 120 мкл воды, 120 мкл 15%-ного раствора NaOH и 35 мкл воды. После фильтрации получают вязкое масло желтоватого цвета (выход 650 мг или 76%).
b) (3Е,5Е)-6-[3-[3,4-Бис-гидроксиметилбензилокси)фенил]-1,1,1-трифтор-2-трифторметилокта-3,5-диен-2-ол
Получают аналогично примеру 2m, взаимодействием 640 мг (0,89 ммоль) (3Е,5Е)-6-{3-[3,4-бис-(трет-бутилдиметилсиланилоксиметил)бензилокси]фенил}-1,1,1-трифтор-2-трифторметилокта-3,5-диен-2-ола с 2,1 мл (2,1 ммоль) 1,0 М раствора фторида тетрабутиламмония. Получают бесцветное масло (выход 260 мг или 60%).
1НЯМР (ДМСО): 1,10 (т, 3H, J=7,5 Гц); 2,65 (кв, 2H, J=7,4 Гц); 4,55 (т, 4H, J=5,2 Гц); 5,08-5,17 (м, 4H); 6,05 (д, 1H, J=15,1 Гц); 6,64 (д, 1H, J=11,2 Гц); 6,96 (дд, 1H, J1=11,2 Гц, J2=2 Гц); 7,08-7,51 (м, 6H); 8,27 (с, 1H).
Пример 4
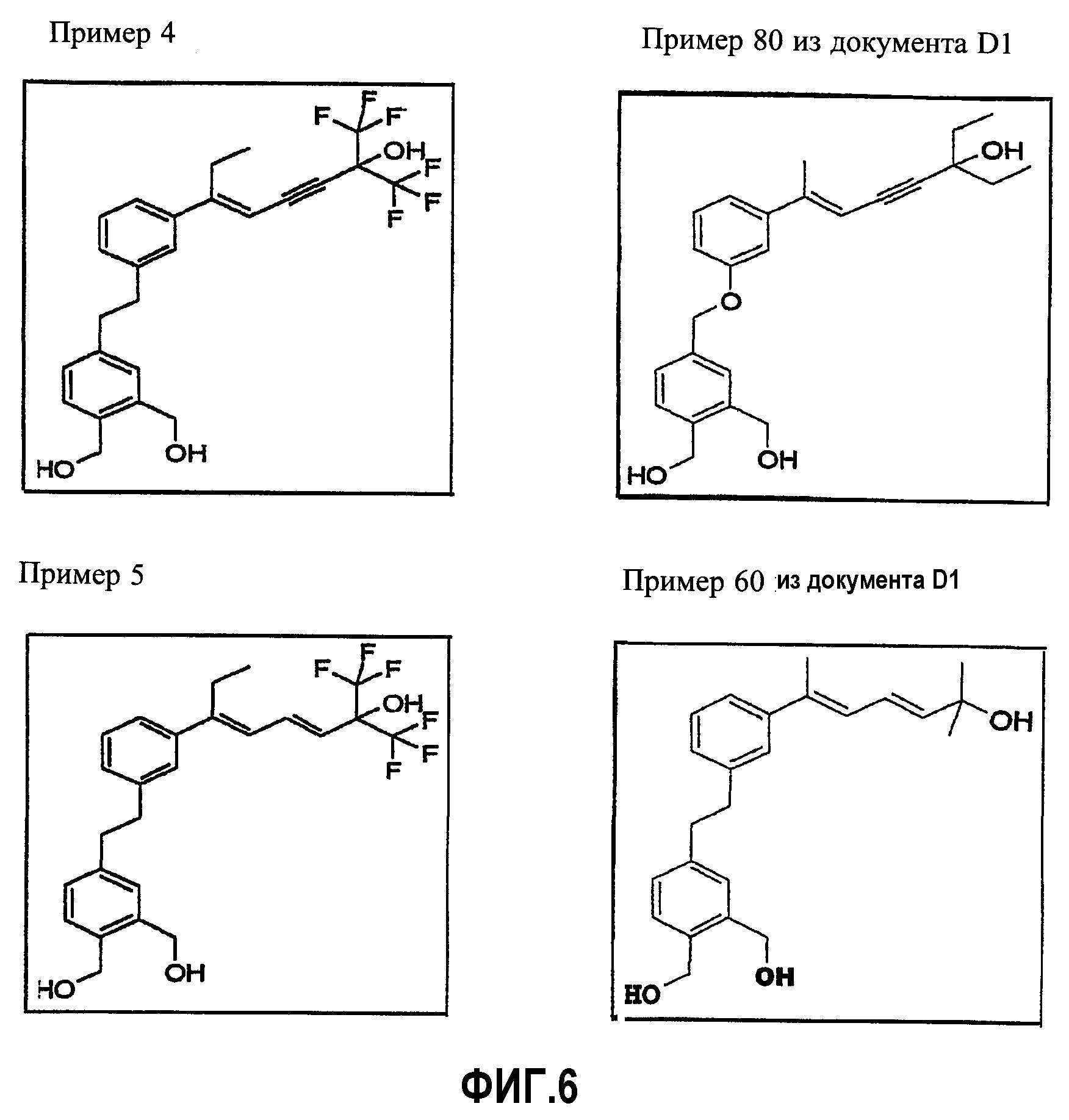
(Е)-6-{3-[2-(3,4-Бис-гидроксиметилфенил)этил]фенил}-1, 1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ол
a) (Е)-1-(3-{2-[3,4-Бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)-4,4-дибром-1-этил-бута-1,3-диен
Получают аналогично примеру 2g, взаимодействием 9 г (16,3 ммоль) (Е)-3-(3-{2-[3,4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)пент-2-еналя (полученного в примере 1j) с 2,1 г (32,5 ммоль) порошка цинка, 8,5 г (32,5 ммоль) трифенилфосфина и 108 г (32,5 ммоль) четырехбромистого углерода. Получают масло желтого цвета (выход 11,3 г или 98%).
b) (Е)-1-(3-{2-[3, 4-бис-(трет-бутилдиметилсилилоксиметил)фенил]этил}фенил)-1-этил-бут-1-ен-3-ин
Получают аналогично примеру 2h, взаимодействием 11,3 г (15,9 ммоль) (Е)-1-(3-{2-[3, 4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)-4,4-дибром-1-этил-бута-1,3-диена с 128 мл (32 ммоль) 2,5 М раствора бутиллития. Получают масло желтого цвета (выход 8,5 г или 97%).
c) (Е)-6-(3-{2-[3,4-Бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)-1,1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ол
Получают аналогично примеру 21, взаимодействием 5 г (9,1 ммоль) (Е)-1-(3-{2-[3,4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)-1-этил-бут-1-ен-3-ина с 4 мл (10 ммоль) 2,5 М раствора бутиллития и барботированием гексафтороацетоном. Получают целевой продукт в виде масла желтого цвета (выход 3,7 г или 57%).
d) (Е)-6-(3-[2-(3,4-Бис-гидроксиметилфенил)этил]фенил)-1,1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ол
Получают аналогично примеру 2m, взаимодействием 1 г (1,4 ммоль) (Е)-6-(3-{2-[3,4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)-1,1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ола с 3,3 мл (3,3 ммоль) 1,0 М раствора фторида тетрабутиламмония. Получают твердое желтоватое вещество (т.пл.=123°С; выход 570 мг или 84%).
1НЯМР (CDCl3): 1,05 (т, 3H, J=7,5 Гц); 2,75 (кв, 2H, J=7,5 Гц); 2,92 (с, 4H); 4,69 (с, 4H); 5,67 (с, 1H); 7,05-7,31 (м, 7H).
Пример 5
(3Е,5Е)-6-{3-[2-(3, 4-Бис-гидроксиметилфенил)этил]фенил}-1,1,1-трифтор-2-трифторметилокта-3,5-диен-2-ол
a) (3Е,5Е)-6-(3-{2-[3,4-Бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)-1,1, 1-трифтор-2-трифторметилокта-3,5-диен-2-ол
Получают аналогично примеру 3а, взаимодействием 2,5 г (3,5 ммоль) (Е)-6-(3-{2-[3,4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)-1, 1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ола (описанного в примере 4с) с 400 мг (10,4 ммоль) литийалюмогидрида и 1,13 г (21 ммоль) метилата натрия. Получают масло желтого цвета (выход 1,27 г или 51%).
b) (3Е,5Е)-6-{3-[2-(3,4-Бис-гидроксиметилфенил)этил]фенил}-1,1,1-трифтор-2-трифторметилокта-3,5-диен-2-ол
Получают аналогично примеру 2m, взаимодействием 1,2 г (1, 67 ммоль) (3Е,5Е)-6-(3-{2-[3,4-бис-(трет-бутилдиметилсиланилоксиметил)фенил]этил}фенил)-1,1,1-трифтор-2-трифторметилокта-3,5-диен-2-ола с 4 мл (4 ммоль) 1,0 М раствора фторида тетрабутиламмония. Получают твердое вещество белого цвета (т.пл.=104°С; выход 715 мг или 87%).
1НЯМР (ДМСО): 1,02 (т, 3H, J=7,5 Гц); 2,66 (кв, 2H, J=7,5 Гц); 2,93 (с, 4H); 4, 71 (с, 2H); 4,72 (с, 2H); 5,79 (д, 1H, J=15,0 Гц); 6,24 (д, 1H, J=11,0 Гц); 7,08-7,30 (м, 8H).
Пример 6
Примеры состава
1) Для орального введения
(а) Готовят следующую композицию в виде таблетки весом 0,2 г
Для лечения ихтиоза взрослому человеку назначают от 1 до 3 таблеток в день в течение от 1 до 12 месяцев в зависимости от сложности конкретного случая заболевания.
(b) Готовят суспензию для приема внутрь, предназначенную для упаковки в ампулы объемом 5 мл
Для лечения угрей взрослому человеку назначают 1 ампулу в день в течение от 1 до 12 месяцев в зависимости от сложности конкретного случая заболевания.
(с) Готовят следующий состав, предназначенный для упаковки в желатиновые капсулы:
Используемые желатиновые капсулы состоят из желатина, оксида титана и консерванта.
Для лечения псориаза взрослому человеку назначают 1 желатиновую капсулу в день в течение от 1 до 12 месяцев.
(d) Готовят следующий состав, предназначенный для упаковки в желатиновые капсулы:
Используемые желатиновые капсулы состоят из желатина, оксида титана и консерванта.
Для лечения псориаза взрослому человеку назначают 1 желатиновую капсулу в день в течение от 1 до 12 месяцев.
2) Для нанесения топическим путем
(а) Готовят следующий неионный крем типа вода в масле:
Указанный крем наносят на кожу, пораженную псориазом, от 1 до 2 раз в день в течение от 1 до 12 месяцев.
(b) Готовят гель, применяя следующий состав:
Указанный гель наносят на кожу, пораженную дерматозом или угрями, от 1 до 3 раз в день в течение от 6 до 12 недель в зависимости от сложности конкретного случая заболевания.
(с) Готовят противосеборейный лосьон, применяя смесь следующих ингредиентов:
Указанный лосьон наносят 2 раза в день на волосяной покров, пораженный себореей, и по прошествии от 2 до 6 недель констатируют значительное улучшение.
(d) Готовят косметическую композицию, предназначенную для использования против вредных воздействий солнца, применяя смесь следующих ингредиентов:
Указанную композицию наносят ежедневно, она помогает бороться против старения кожи под действием света.
(е) Готовят следующий неионный крем типа масло в воде:
Указанный крем наносят на кожу, пораженную псориазом, от 1 до 2 раз в день в течение 30 дней для лечения обострения и неограниченное время для поддержания кожи в хорошем состоянии.
(f) Готовят гель для топического нанесения, используя смесь следующих ингредиентов:
Указанный гель применяют для лечения угрей от 1 до 3 раз в день в течение от 6 до 12 недель в зависимости от сложности конкретного случая заболевания.
(g) Готовят лосьон для борьбы с выпадением волос и для быстрого роста волос, применяя смесь следующих ингредиентов:
Указанный лосьон наносят на волосяной покров, подверженный выпадению волос, от 1 до 2 раз в день в течение 3 месяцев и неограниченное время для поддержания волосяного покрова в хорошем состоянии.
(h) Готовят крем против угрей, применяя смесь следующих ингредиентов:
Указанный крем наносят на кожу, пораженную дерматозом или угрями, от 1 до 3 раз в день в течение от 6 до 12 недель.
(i) Готовят крем типа масло в воде, применяя следующий состав:
Указанный крем наносят 2 раза в день на кожу, пораженную воспалительным дерматозом, в течение 30 дней.
(j) Готовят следующий крем типа масло в воде:
Указанный крем наносят 1 раз в день; он помогает бороться со старением кожи под действием света или от времени.
(k) Готовят следующую безводную мазь:
Указанную мазь наносят 2 раза в день на кожу, пораженную чешуйчатым дерматозом, в течение 30 дней.
3) Для введения в место поражения
(а) Готовят следующую композицию:
При лечении злокачественной меланомы композицию вводят взрослому человеку с частотой от 1 до 7 раз в неделю в течение от 1 до 12 месяцев.
(b) Готовят следующую композицию:
При лечении базально-клеточной карциномы композицию вводят взрослому человеку с частотой от 1 до 7 раз в неделю в течение от 1 до 12 месяцев.
(c) Готовят следующую композицию:
При лечении спинно-клеточной карциномы композицию вводят взрослому человеку с частотой от 1 до 7 раз в неделю в течение от 1 до 12 месяцев.
(d) Готовят следующую композицию:
При лечении карциномы толстой кишки композицию вводят взрослому человеку с частотой от 1 до 7 раз в неделю в течение от 1 до 12 месяцев.
4) Для внутривенного введения
(а) Готовят следующую липидную эмульсию для инъекций:
При лечении псориаза, композицию вводят взрослому человеку с частотой от 1 до 7 раз в неделю в течение от 1 до 12 месяцев.
(b) Готовят следующую липидную эмульсию для инъекций:
При лечении ихтиоза, композицию вводят взрослому человеку с частотой от 1 до 7 раз в неделю в течение от 1 до 12 месяцев.
(с) Готовят следующую липидную эмульсию для инъекций:
При лечении лейкемии, композицию вводят взрослому человеку с частотой от 1 до 7 раз в неделю в течение от 1 до 12 месяцев.
(d) Готовят следующую смешанную мицеллярную композицию:
При лечении злокачественной меланомы композицию вводят взрослому человеку с частотой от 1 до 7 раз в неделю в течение от 1 до 12 месяцев.
(е) Готовят следующую композицию на основе циклодекстрина:
Для предотвращения отторжения трансплантанта композицию вводят взрослому человеку с частотой от 1 до 7 раз в неделю в течение от 1 до 12 месяцев.
(f) Готовят следующую композицию на основе циклодекстрина:
При лечении рака почек композицию вводят взрослому человеку с частотой от 1 до 7 раз в неделю в течение от 1 до 12 месяцев.
Пример 7
Пример проведения испытаний на биологическую активность соединений согласно изобретению: потенциал трансактивности
Агонистическая активность VDR была исследована на линии клеток HeLa контрансфекцией вектора экспрессии рецептора VDR и плазмиды-носителя p240Hase-CAT, которая содержит область от -1399 до +76 промотора 24-гидроксилазы крысы, клонированную перед началом кодирования гена хлорамфеникол-ацетил-трансферазы (САТ). По прошествии 18 часов после контрансфекции в среду вводят исследуемый продукт. После 18 часов обработки осуществляют анализ активности САТ клеточных лизатов методом твердофазного иммуноферментного анализа ELISA (Enzyme Linked Immuno Sorbent Essay, тест-препарат выпускается компанией Roche Molecular Biochemicals).
Агонистическую активность в системе контрансфекции можно оценить путем определения необходимой дозы для достижения 50%-ной максимальной активности продукта (АС50).
Каждое соединение согласно изобретению сравнивают с соединением, наиболее близким по структуре к соединению, описанному в заявке на патент WO 00/26167 (D1). Для облегчения сравнения на фиг.5 и 6 сгруппированы структуры соединений согласно изобретению и сравнительные примеры документа D1. Результаты показывают значительно более сильную активность соединений согласно изобретению по сравнению с соединениями по документу D1. Разницу между двумя значениями АС50 рассматривают как значительную, если она имеет коэффициент 3, предпочтительно коэффициент 5 и еще более предпочтительно коэффициент 10.
Пример 8
Пример испытаний на определение биологической активности соединений согласно изобретению: активность в отношении пролиферации кератиноцитов человека
Известно, что 1,25-дигидроксивитамин согласно документу D3, названный кальцитриолом, который соответствует природному витамину D, ингибирует пролиферацию культивированных кератиноцитов человека. Используют следующий метод: нормальные кератиноциты человека высевают с низкой плотностью на пластину с 24 ячейками. По прошествии 4 часов в полученную культуру добавляют исследуемые соединения. Культуру выращивают в течение 5 дней, а затем определяют пролиферацию кератиноцитов по встраиванию 5-бром-2-деоксиуридина (BRdU) в ДНК. Затем количество встроенного 5-бром-2-деоксиуридина определяют методом твердофазного иммуноферментного анализа ELISA (препарат для тестирования выпускается компанией Roche Molecular Biochemicals).
Данные о степени ингибирующего воздействия соединений согласно изобретению и кальцитриола, используемого в качестве соединения для сравнения на пролиферацию кератиноцитов приведены в таблице II. Значение IC50 обозначает концентрацию исследуемого соединения, которая на 50% ингибирует пролиферацию кератиноцитов.
Указанные результаты позволяют обнаружить для соединений согласно изобретению ингибирующую активность по отношению к пролиферации кератиноцитов в том же диапазоне значений, что и для кальцитриола (природный витамин D). Кроме того, результаты показывают значительные различия между соединениями согласно изобретению и соединениями, наиболее близкими по структуре к соединениям заявки на патент D1. Разницу рассматривают как значительную между двумя значениями АС50, если она имеет, по крайней мере, коэффициент 3, предпочтительно коэффициент 5 и еще более предпочтительно коэффициент 10.
Пример 9
Пример испытаний на определение биологической активности соединений согласно изобретению: активность в отношении дифференцировки клеток HL60
Кальцитриол инициирует дифференцировку клеток промиелоцитарной лейкемии (HL60) на моноциты/макрофаги. Указанное индуктивное воздействие на дифференцировку является маркером, хорошо характеризующим клеточную активность витамина D. Одним из наиболее важных антибактериальных продуктов макрофагов является пероксид водорода, который можно проанализировать экспериментально восстановлением NBT (тетразолий нитро-голубой).
Используют следующий метод: клетки HL60 высевают на пластину с 6 ячейками и затем сразу же обрабатывают исследуемыми соединениями. Культуру выращивают в течение 4 дней, затем клетки инкубируют вместе с форболовым эфиром АТФ и NBT в течение короткого периода, а затем подсчитывают дифференцированные клетки, т.е. клетки, позитивные к действию NBT.
Данные о степени индуцирующего воздействия соединений по изобретению, а также кальцитрола, используемого в качестве соединения для сравнения воздействия, на дифференцировку клеток HL60 приведены в нижеследующей таблице.
Указанные результаты показывают, что примеры 3 и 5 согласно изобретению имеют активность индуцирования дифференцировки на клетки HL60, аналогичную кальцитриолу.
Пример 10
Пример испытаний на определение биологической активности соединений согласно изобретению: индуцирование 24-гидроксилазы в тесте «in vivo» у мыши SKH
24-гидроксилаза является цитохромным энзимом Р450, который гидроксилирует 1,25-дигидроксивитамин D3 (кальцитриол) в положение 24 и получают метаболит, 1,24,25-тригидроксивитамин D3. Авторами Voorhees and al. было показано (JID 1997. 108:513-518), что экспрессия гена 24-гидроксилазы была вызвана кальцитриолом на коже человека.
Следовательно, агонистическая активность к рецепторам витамина D соединений согласно изобретению может быть оценена "in vivo" введением 24-гидроксилазы мыши SKH.
Используют следующий метод: мышам XII только топическим путем наносят раствор исследуемого соединения в этаноле с возрастающими концентрациями.
Объем 50 мкл исследуемого продукта или только растворитель наносят на спину мыши при помощи пипетки.
Другим мышам SKH только топическим путем наносят раствор кальцитриола в этаноле с возрастающими концентрациями. Объем 50 мкл исследуемого продукта или только растворитель наносят на спину мыши при помощи пипетки.
По прошествии 8 часов после местного нанесения мышь умерщвляют, отбирают обработанную кожу и эпидерму отделяют от дермы. Количество ARNm 24-гидроксилазы определяют методом полуколичественного анализа PCR. Результаты являются нормальными, по сравнению с экспрессией ARNm GAPDH, и значения для различных концентраций кальцитриола и для различных исследуемых соединений согласно изобретению выражены в коэффициенте индукции по отношению к кальцитриолу.
Результаты сведены в следующую таблицу IV:
Указанные результаты показывают, что кальцитриол, вводимый путем топического нанесения, индуцирует у мыши дозозависимую экспрессию ARNm 24-гидроксилазы в эпидерме.
Биологическая активность соединений согласно изобретению оценена путем сравнения полученных коэффициентов индукции с соединениями согласно изобретению и коэффициентов индукции, полученных с кальцитриолом. Результаты представлены в следующей таблице V:
Таким образом, результаты показывают, что примеры согласно изобретению имеют активность, сравнимую или превосходящую (пример 3 и 5) активность кальцитриола.
Реферат
Изобретение относится к новым биароматическим аналогам витамина D, представляющим собой соединения, выбранные из группы, состоящей из (Е)-6-[3-(3,4-бис-гидроксиметилбензилокси)фенил]-1,1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ол, (3Е,5Е)-6-[3-(3, 4-бис-гидроксиметилбензилокси)фенил]-1,1,1-трифтор-2-трифторметилокта-3,5-диен-2-ол, (Е)-6-{3-[2-(3,4-бис-гидроксиметилфенил)этил]фенил}-1,1,1-трифтор-2-трифторметилокт-5-ен-3-ин-2-ол, (3Е, 5Е)-6-{3-[2-(3,4-бис-гидроксиметилфенил)этил]фенил}-1,1,1-трифтор-2-трифторметилокта-3,5-диен-2-ол, а также указанных выше соединений, в которых одна или несколько гидроксильных групп имеют защитную группу типа -(С=О)-R, где R обозначает линейный или разветвленный алкильный радикал, содержащий от 1 до 6 атомов углерода, или арильный радикал, содержащий от 6 до 10 атомов углерода, или аралкильный радикал, содержащий от 7 до 11 атомов углерода; при этом арильный радикал или аралкильный радикал может быть замещен одной или двумя гидроксильными группами, алкоксигруппами, содержащими от 1 до 3 атомов углерода, атомами галогена, нитро- или аминогруппами. Изобретение также относится к их применению в фармацевтических композициях, обладающих активностью по отношению к пролиферации и дифференцировке клеток и предназначенных для использования при лечении людей и животных (в дерматологии, онкологии, в области аутоиммунных заболеваний, а также в области трансплантации органов или тканей), а также в косметических композициях. 5 н. и 7 з.п. ф-лы, 5 табл., 6 ил.
Формула
Документы, цитированные в отчёте о поиске
Пропинил-диароматические соединения, фармацевтические и косметические составы на их основе

Комментарии