Пропинил-диароматические соединения, фармацевтические и косметические составы на их основе - RU2111204C1
Код документа: RU2111204C1
Чертежи


Описание
Изобретение относится к новым диароматическим соединениям, имеющим пропинильное звено, а также к использованию этих новых соединений в фармацевтических составах, предназначенных для применения в медицине или в косметических составах.
Соединения по изобретению имеют ярко выраженную активность в областях дифференцирования и пролиферации клеток и находят применение особенно при топическом и систематическом лечении кожных заболеваний, связанных с нарушением кератинизации, кожных заболеваний (или других) с воспалительной компонентой и/или иммуноаллергических заболеваний, и кожных или эпидермических пролифераций, которые бывают доброкачественными или злокачественными. Кроме того, эти соединения могут быть использованы для лечения заболеваний перерождения соединительной ткани для борьбы против старения кожи под действием света и возрастного происхождения и для лечения расстройств цикатризации. С другой стороны, соединения находят применение в области офтальмологии, особенно в лечении корнеопатий.
Соединения по изобретению можно также использовать в косметических составах для гигиены тела и волос.
Соединения по изобретению могут быть представлены следующей общей формулой (1):

в которой Ar представляет радикал, выбираемый среди радикалов следующей формулы:

R1 - является атомом водорода или радикалами -CH3 или -CH2OR6, или -OR6, или COR7, или -S(O)tR9;
R5, R6, R7, R9, t имеют нижеприведенные значения;
X - радикал формулы:

или

R10 и R11 определены ниже;
R2 и R3 - являются атомами водорода, низшим алкилом с прямой или разветвленной цепью или радикалом -OR6 или R2 и R3, вместе взятые, могут образовывать со смежным ароматическим циклом цикл с 5 или 6 звеньями, в случае необходимости, прерванный атомом серы;
R4 - является атомом водорода или низшим алкилом, или радикалом -OR6;
R5 имеет такое же значение как R4;
R6 - является атомом водорода или низшим алкильным радикалом, или радикалом COR9, где значения R9 определены ниже;
R7 - является атомом водорода, или низшим алкильным радикалом или радикалом -CR8 или радикалом формулы

где
R' и R'' являются атомами водорода или низшим алкилом или вместе взятые образуют кислородсодержащий шестичленный гетероцикл;
R8 - является атомом водорода или низшим алкилом с прямой или разветвленной цепью;
R9 - является низшим алкилом;
R10 - является атомом водорода или низшим алкилом, или радикалом -OR6;
R11 - является радикалом -OR6;
при этом радикалы R10 и R11, вместе взятые, могут образовывать оксогруппу (C = O), а также их соли с щелочными или щелочноземельными металлами или цинком.
Изобретение относится к солям вышеуказанных соединений формулы (1). В этом случае речь идет преимущественно о солях щелочного или щелочноземельного металла или цинка, или органического амина.
Согласно изобретению под низшим алкильным радикалом подразумевают радикал, имеющий 1 - 6 атомов углерода, преимущественно радикалы метила, этила, изопропила, бутила, трет.-бутила и гексила.
Из соединений согласно изобретению можно назвать, в частности, следующие:
4-[3-оксо-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]метиолбензоат;
4-[3-гидроси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]метилбензоат;
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]бензойная кислота;
4-[3-оксо-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]бензойная кислота;
2-гидрокси-4-[3-оксо-3-(5,6,7,8-тетрагидро-5,5,8,
8- тетраметил-2-нафтил)-1-пропинил]бензойная кислота;
2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]метилбензоат;
2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]бензойная кислота;
2-гидрокси-4-[3-оксо-3-(3-трет. бутил-4-метоксифенил)-1- пропинил]бензойная кислота;
4-[1-оксо-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-2- пропинил]бензойная кислота;
4-[1-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-2-пропинил]бензойная
кислота;
2-гидрокси-4-[3-гидрокси-3-(4,4-диметилтиохроман-6-ил)-1- пропинил]метилбензоат;
2-гидрокси-4-[3-оксо-3-(4,4-диметилтиохроман-6-ил)-1- пропинил]бензойная кислота;
4-[3-гидрокси-3-(3-трет. бутил-4-метоксифенил)-1-пропинил] бензойная кислота;
N-метил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]-2-пирролметилкарбоксилат;
N-метил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]-2-пирролкарбоновая кислота;
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2- нафтил)-1-пропинил]-2-пиррометилкарбоксилат;
2-гидрокси-4-[3-гидрокси-3-(4,4-диметилтиохроман-7-ил)-1- пропинил]метилбензоат;
4-[1-гидрокси-3-(4,
4-диметилтиохроман-6-ил)-2-пропинил] бензойная кислота;
2-гидрокси-4-[3-гидрокси-3-(4,4-диметилтиохроман-6-ил)-1- пропинил]бензойная кислота;
2-гидрокси-4-[3-гидрокси-3-(4,
4-диметилтиохроман-7-ил)-1- пропинил]бензойная кислота;
изомер (+) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]метилбензоата;
изомер (-)
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]бензойной кислоты;
изомер (+) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8- тетраметил-2-нафтил)-1-пропинил]метилбензоата;
изомер (-) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]бензойной кислоты;
изомер (-)
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]метилбензоата;
изомер (-) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8- тетраметил-2-нафтил)-1-пропинил]метилбензоата;
изомер (+) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]бензойной кислоты;
изомер (+)
2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]бензойной кислоты;
2-гидрокси-4-[3-гидрокси-3-метил-3-(5,6,7,8-тетрагидро-5,5,8,
8- тетраметил-2-нафтил)-1-пропинил]метилбензоат;
2-гидрокси-4-[3-гидрокси-3-метил-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]бензойная кислота;
2-метокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]бензойная кислота;
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2-нафтил)-1- пропинил]бензальдегид;
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1- пропинил]бензилацетат;
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2-нафтил)-1- пропинил]бензолметанол;
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1- пропинил]толуол;
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-3,5,5,8,
8-пентаметил-2-нафтил)-1- пропинил]фенилацетат;
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-3,5,8,8-пентаметил-2-нафтил)-1- пропинил]фенол;
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2-нафтил)-1- пропинил]фенилсульфинилметан;
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1- пропинил]фенилсульфонилметан;
N-этил-4-[3-гидрокси-3-(5,6,
7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]бензамид;
N, N'-диэтил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]бензамид;
морфолид-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]бензойной кислоты;
5-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2- нафтил)-1-пропинил]2-метилтиофенкарбоксилат;
2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-3,5,5,8,8-пентаметил-2-нафтил)-1- пропинил]метилбензоат;
2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-3,5,5,8,8-пентаметил-2- нафтил)-1-пропинил]бензойная кислота;
2-гидрокси-4-[3-гидрокси-3-(3-метокси-5,6,7,8-тетрагидро-5,5,8,
8- тетраметил-2-нафтил)-1-пропинил]метилбензоат;
2-гидрокси-4-[3-гидрокси-3-(3-метокси-5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]бензойная кислота;
4-[3-гидрокси-3-(4,4-диметилтиохроман-6-ил)-1-пропинил] бензойная кислота;
4-[3-гидрокси-3-(4,4-диметилтиохроман-7-ил)-1-пропинил] бензойная кислота;
3-метил-4-[3-гидрокси-3-(5,6,7,
8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]метилбензоат;
3-метил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]бензойная кислота;
2-хлор-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]бензойная кислота;
2-ацетокси-4-[3-ацетокси-3-(5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2- нафтил)-1-пропинил]бензойная кислота;
4-[3-гидрокси-3-(3-трет. бутил-4-пропилоксифенил)-1-пропинил] метилбензоат;
4-[3-гидрокси-3-(3-трет.
бутил-4-гексилоксифенил)-1-пропинил] метилбензоат;
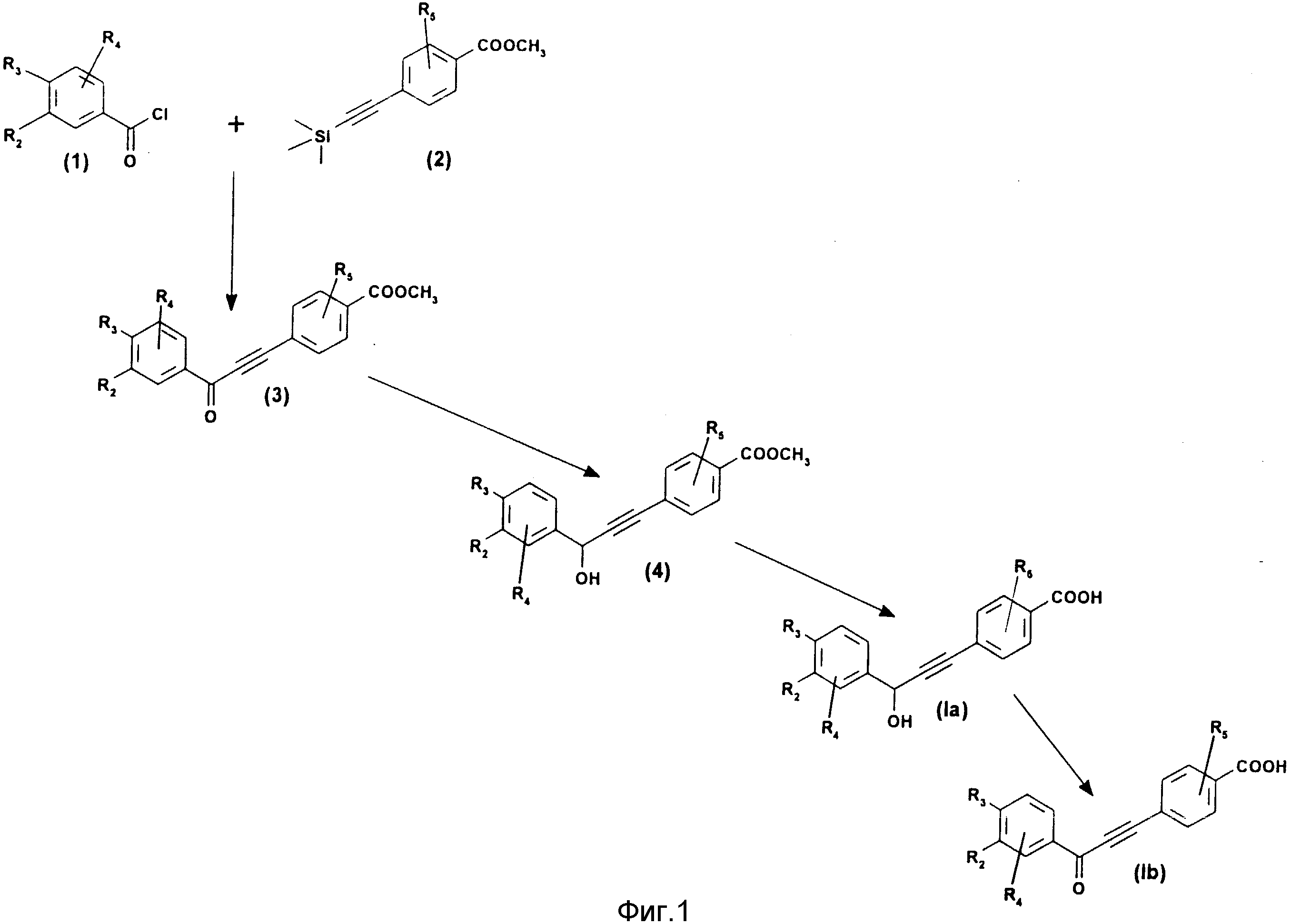
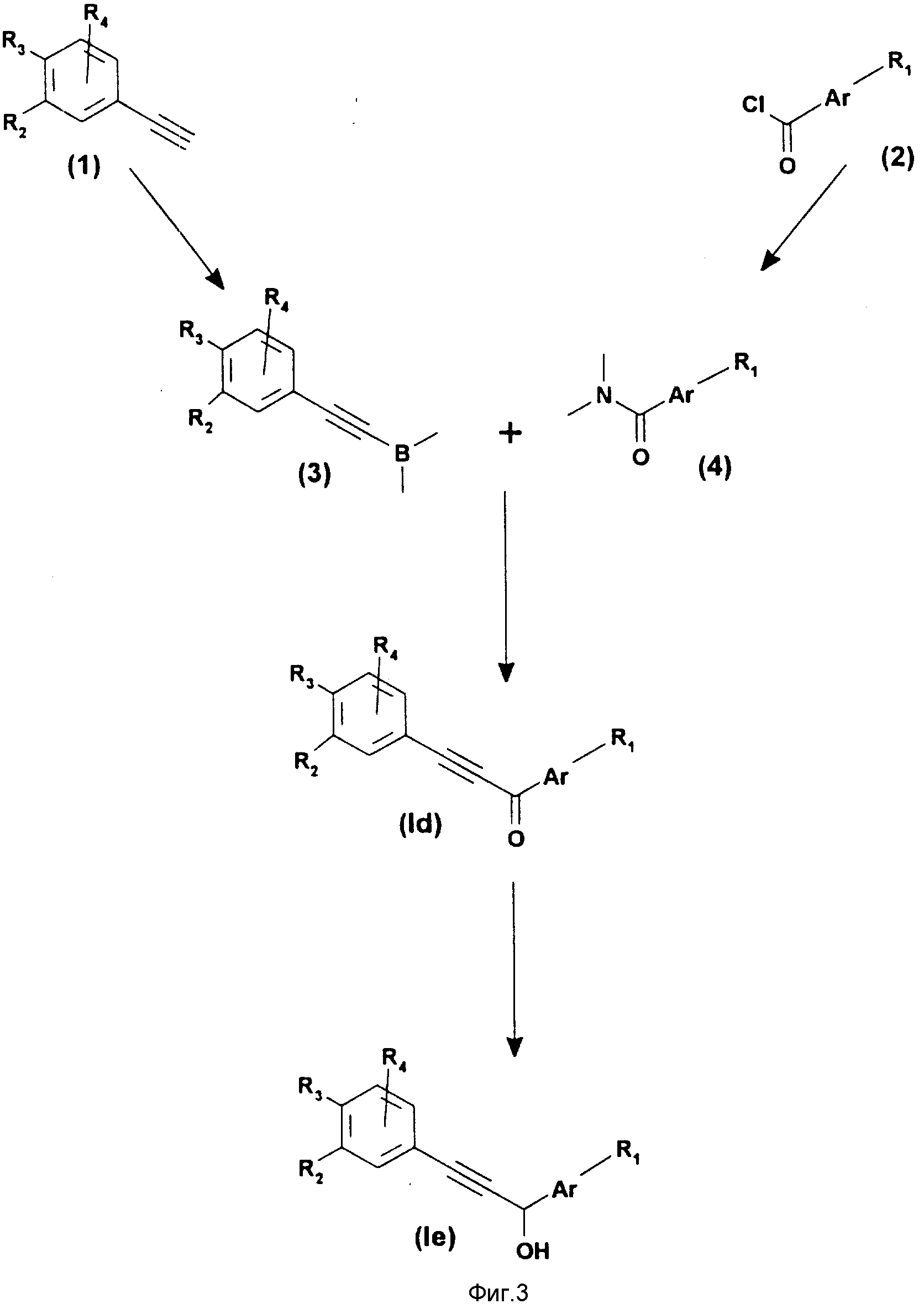
Соединения формулы (1) могут быть получены согласно схемам реакций, данным на фиг. 1, 2 и 3.
Производные формулы (1a) на фиг. 1 могут быть получены путем реакций, включающих взаимодействие хлористого бензоила формулы (I) с производным ацетилена формулы (II) в присутствии кислоты Льюиса (например, AlCl3) в таком хлорированном растворителе, как дихлорметан. Полученный таким путем кетон (3) восстанавливают в спирт (4) действием щелочного гидрида, такого как борогидрид натрия, в спиртовом растворителе (например, в метаноле). Затем проводят омыление сложноэфирной функции в присутствии основания, например гидроокиси натрия или лития, в спиртовом растворителе или в тетрагидрофуране (ТГФ).
Производные формулы (1b) [фиг. 1] получают окислением производного формулы (1a) в присутствии бихромата пиридиния или окиси марганца в таком органическом растворителе, как дихлорметан.
Производные формулы (1c) на фиг. 2 могут быть получены сочетанием галогенпроизводного (4), преимущественно йод- или бромпроизводного, с α -гидрокси-ацетиленовым производным (3) в присутствии катализатора на основе палладия, например хлористого бис-(трифенилфосфин)-палладия (II) в таком растворителе как триэтиламин. Альфа-гидрокси-ацетиленовое производное (3) получают взаимодействием хлористого бензоила формулы (1) с триметилсилилацетиленом в присутствии кислоты Льюиса (например, AlCl3) в хлорированном растворителе, затем производят восстановление полученного кетона (2) со щелочным гидридом (например, борогидридом натрия) в спиртовом растворителе.
Если R1 отличается от -COOR8, то производные формулы (1c) могут быть получены взаимодействием фенилацетиленида лития формулы (6) с производным бензальдегида формулы (5) в органическом растворителе, таком как простой этиловый эфир или тетрагидрофуран.
Производные формулы (1d) на фиг. 3 могут быть получены взаимодействием ацетиленида бора (3) (полученного по месту из фенилацетиленида лития и трехфтористого бора при -78oC в тетрагидрофуране) с третичным бензамидом формулы (4) в таком органическом растворителе, как тетрагидрофуран. Восстановлением полученного соединения щелочным гидридом получают соединения формулы (1e).
Новые соединения проявляют активность в тексте на дифференцирование клеток (F9) тератокарциномы эмбриона мыши (Cancer Research 43, 1983, с. 5268) и/или в тесте торможения орнитина декарбоксилазы после индуцирования терефталевой кислотой на мыши (Cancer Research 38, 1978, с. 793 - 801). Эти тесты иллюстрируют активность соединений соответственно в областях дифференцирования и пролиферации клеток.
Соединения согласно изобретению могут быть использованы для следующих областей медицины:
для лечения кожных заболеваний, связанных с нарушением кератинизации, вызванных
дифференцированием и пролиферацией клеток, в частности для лечения обыкновенных угрей, черных угрей, полиморфных угрей, розовидных угрей, узловато-кистозных угрей, шаровидных угрей, старческих угрей,
вторичных угрей, таких как солнечные угри, медикаментозные угри или профессиональные угри;
для лечения других типов расстройств кератинизации, например ихтиозов, ихтиозных состояний, болезни
Даррье, пальмоподошвенных кератозов, лейкоплазий и лейкоплазных заболеваний, кожного или роторного лишая (буккульного);
для лечения других кожных заболеваний, связанных с нарушением
кератинизации с воспалительной и/или иммуноаллергической компонентой, и особенно всех форм псориаза (как кожный, слизистый или ногтевой) и даже псориазного ревматизма, или кожной атопии, как экзема
или дыхательная атопия или гингивальной гипертрофии; соединения могут использоваться также при некоторых воспалительных заболеваниях, не связанных с нарушением кератинизации;
для лечения всех
кожных или эпидермических пролифераций, которые бывают доброкачественными или злокачественными, вирусного или невирусного происхождения, такие как обыкновенные бородавки, плоские бородавки, и
эпидермодисплазии в форме бородавки, папилломатозы, оральные или флоридные, и пролиферации, которые могут быть вызваны ультрафиолетовыми лучами, особенно в случае базоэпителиомы и клеток спинного
мозга;
для лечения других кожных заболеваний, как пузырчатые дерматозы и болезни, связанные с коллагеном;
для лечения некоторых офтальмологических заболеваний, особенно корнеопатий;
для восстановления кожи или для борьбы против старения кожи, что связано с действием света или возраста, или для уменьшения пигментаций и актинических кератозов, или всех патологий,
связанных с хронологическим и актиническим старением,
для предупреждения или вылечивания признаков эпидермической и/или кожной атрофии, вызванной местными или системными кортикостероидами,
или любой другой формы кожной атрофии;
для предупреждения или лечения расстройств цикатризации или для предупреждения, или для восстановления рубцов на коже;
для борьбы против
нарушений функции сальных желез, как гиперсеборея угрей или простая себорея;
при лечении или предупреждении раковых или предраковых состояний;
при лечении воспалительных заболеваний,
как артрит;
при лечении любого заболевания вирусного происхождения на уровне кожного заболевания или общего заболевания;
при предупреждении или при лечении алопеции,
при
лечении кожных заболеваний или общих заболеваний с иммунологической компонентой;
при лечении заболеваний сердечно-сосудистой системы, как артериосклероз.
В вышеупомянутых областях терапии соединения, согласно изобретению можно с успехом применять в комбинации с другими соединениями, имеющими активность ретиноидного типа, с витаминами D или их производными, с кортикостероидами, со свободными антирадикалами, с α -гидрокси - или α -кетокислотами или их производными, или с блокаторами ионных каналов. Под витаминами D или их производными подразумевают, например, производные витамина D2 или D3 и, в частности, 1,25 - дигидроксивитамин D3. Под свободными антирадикалами подразумевают, например α -токоферол, Супер Оксид Дисмутат, Убихиноль или некоторые хелатные соединения металлов. Под α -гидрокси- или α -кетокислотами или их производными подразумевают, например, молочную, яблочную, лимонную, гликолевую, миндальную, винную, глицериновую или аскорбиновую кислоты или их соли, амиды или сложные эфиры. Наконец, под блокаторами ионных каналов подразумевают, например, миноксидил (2,4-диамино-6-пиперидино-пиримидин-3-оксид) и его производные.
Изобретение относится к фармакомпозициям, содержащим по меньшей мере одно соединение формулы (1), которое определено выше, или одну из его солей и фармацевтически приемлемый носитель.
Введение соединений согласно изобретению может быть осуществлено через кишечник, парентеральным путем, локально или через глаза.
При энтеральном введении фармкомпозиции могут иметь форму таблеток, пилюль, драже, сиропов, суспензий, растворов, порошков, гранул, эмульсий, микрошариков или наношариков или липидных или полимерных пузырьков, позволяющих регулировать дозу введения. При парентеральном приеме составы могут иметь форму растворов или суспензий для перфузии или для инъекций.
Соединения по изобретению можно принимать с ежедневной дозой приблизительно 0,01 мг/кг - 100 мг/кг веса, причем из расчета от 1 до 3 приемов.
При локальном введении фармацевтические составы, предназначенные для лечения кожи и слизистой оболочки, могут иметь форму мазей, кремов, молочка, унгвентов, порошков, смачивающих тампонов, растворов, гелей, аэрозолей, лосьонов или суспензий. Составы могут иметь также форму микрошариков или наношариков или липидных или полимерных пузырьков, или полимерных накладок и гидрогелей, позволяющих регулировать дозировку. С другой стороны, эти составы при локальном введении могут иметь или безводную форму, или водную форму в зависимости от клинического показания.
При глазном названии эти составы выпускают главным образом, в виде глазных капель.
Составы для локального или глазного введения содержат, по меньшей мере, соединение формулы (1), которое определено выше, или одну из его солей, при концентрации преимущественно 0,001 - 5 мас.% по отношению к общему весу состава.
Соединения формулы (1) по изобретению находят применение также в области косметики, в частности для гигиены тела и ухода за волосами, особенно для лечения кожи с тенденцией образования угрей, для отращивания волос, против выпадения волос, для борьбы против сального вида кожи или волос, для защиты против пагубных эффектов солнца или при обработке физиологически сухой кожи, для предупреждения и/или для борьбы против старения, вызванного светом или возрастом.
С другой стороны, в области косметики соединения согласно изобретению могут быть с успехом использованы в комбинации с другими соединениями, имеющими активность ретиноидного типа, с витаминами D или их производными, с кортикостероидами, со свободными антирадикалами, с α -гидрокси или α -кетокислотами или их производными, или с блокаторами ионных каналов; все эти различные продукты определены выше.
Изобретение относится к косметическому составу, который отличается тем что он содержит в приемлемом для косметики носителе и подходящем для локального применения по меньшей мере одно соединение формулы (1) или одну из его солей. Этот косметический состав может иметь форму крема, молока, лосьона, геля, микрошариков или наношариков или липидных или полимерных пузырьков, мыла или шампуня.
Концентрация соединения формулы (1) в косметических составах по изобретению составляет преимущественно между 0,001 - 3 мас.% по отношению ко всему составу.
Фармацевтические и косметические составы согласно изобретению могут, кроме того, содержать инертные или фармакодинамически- или косметически активные добавки, или комбинации этих добавок, в частности: смачивающие средства, агенты депигментации, такие как гидрохинон, азелаиновая кислота, кофейная кислота или койевая кислота, смягчающие агенты, агенты гидратации, например глицерин, PEG 400, тиаморфолинон и его производные или мочевину, средства против себореи или против угрей, такие как S-карбоксиметилцистеин, S-бензилцистеамин, их соли или их производные, или перекись бензоила; антибиотики, как например, эритромицин и его сложные эфиры, неомицин, клиндамицин и его сложные эфиры, тетрациклины; противогрибковые агенты, как, например, кетоконазол или 4, 5-полиметилен-3-изотиазолидоны, агенты, благоприятствующие росту волос, как, например, миноксидил (2,4-диамино-6-пиперидино- пиримидин-3-оксид) и его производные, диазоксид (7-хлор-3-метил- 1,2, 4-бензотиадизин-1,1-диоксид) и фенитоин (5,4-дифенилмидазолидин-2,4-дион), нестероидные противовоспалительные средства, каротеноиды и в частности, β -каротен; антипсориатические средства, такие как антралин и его производные, и, наконец эйкоза-5,8,11,14-тетранойная и эйкоза-5,8,11-тринойная кислота, их сложные эфиры и амиды.
Соединения согласно изобретению могут содержать также агенты улучшения вкуса, консерванты, например сложные эфиры парагидроксибензойной кислоты, стабилизаторы, регуляторы влажности, регуляторы pH, модификаторы осмотического давления, эмульгаторы, фильтры УФ-А и УФ-В, антиоксиданты, такие как α -токоферол, бутилгидроксианизолы или бутилгидрокситолуол.
Далее в качестве иллюстрации и без ограничительного характера даны примеры получения соединений формулы (1) по изобретению, а также различные конкретные составы на основе этих соединений.
Пример 1.4-[3-оксо-3-(5,6,7,8-тетрагидро-5,5,8,
8- тетраметил-2-нафтил)-1-пропинил]метилбензоат
(a) 4-триметилсилилэтинилметилбензоат
В трехгорлую колбу и в атмосфере азота вводят 21,5 г (0,1 моль) 4-бромметилбензоата, 300 мл
триэтиламина и смесь 200 мг ацетата палладия и 400 мг трифенилфосфина, затем добавляют 20 г (0,204 моль) триметилсилилацетилена, нагревают постепенно до 90oC в течение 1 ч и оставляют при
этой температуре в течение 5 ч. После этого охлаждают реакционную среду, фильтруют соль и выпаривают, поглощают остаток в 200 мл соляной кислоты (5%) и 400 мл простого этилового эфира, а затем
декантируют эфирную фазу, промывают водой, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют дихлорметаном.
После выпаривания растворителей получают 23 г (100% целевого производного в форме бесцветного масла.
(b) 4-[3-оксо-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2- нафтил)-1-пропинил]метилбензоат.
В колбу вводят 8,4 г (36 ммоль) хлористого 5,6,7,8-тетрагидро- 5,6,8,8-тетраметил-2-нафтоила, 6,9 г (29,7 ммоль) полученного выше производного и 100 мл дихлорметана, затем добавляют при 0oC небольшими порциями 168 г (125 ммоль) AlCl3 и перемешивают при комнатной температуре в течение 8 ч. После этого выливают реакционную среду на лед, экстрагируют дихлорметаном, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют смесью дихлорметана и гексана (50 - 50). При этом получают 6,8 г (61%) целевого продукта; точка плавления 113 - 114oC.
Пример 2. 4-[3-гидрокси-3-(5,6,7, 8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил)метилбензоат.
В колбу вводят 4,7 г (125 ммоль) продукта, полученного в примере 1 (b) и 100 мл метанола. Затем охлаждая до 0oC, добавляют последовательно 5,7 г (150 ммоль) CeCl3•7H2O и 530 мг (125 ммоль) борогидрида натрия и перемешивают при комнатной температуре в течение 4 ч. Затем выливают реакционную среду в смесь воды и простого этилового эфира, декантируют органическую фазу, промывают водой, сушат на сульфате магния и выпаривают. Полученный остаток растирают в 100 мл гексана, фильтруют и сушат. При этом получают 4 г (85%) целевого продукта; точка плавления 142 - 143oC.
Пример 3. 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8- тетраметил-2-нафтил)-1-пропинил]бензойная кислота.
В колбу вводят 3,5 г (93 ммоль) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1- пропинил] метилбензоата, 200 мл метанола и 200 мл раствора щелочи натрия в метаноле (2н). Затем перемешивают при комнатной температуре в течение 8 ч, выпаривают реакционную среду, поглощают остаток в воде, подкисляют соляной кислотой. После этого экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Полученный остаток перекристаллизовывают из смеси циклогексана - простого изопропилового эфира и получают 1,7 г (50%) целевой кислоты; точка плавления 134 - 135oC.
Пример 4. 4-[3-оксо-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил- 2-нафтил)-1-пропинил]бензойная кислота.
Вводят 500 мг (1,38 ммоль) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро- 5,5,8,8-тетраметил-2-нафтил)-1-пропинил] бензойной кислоты, 50 мл дихлорметана и 2,4 г (27,6 ммоль) окиси марганца в колбу, которую помещают в ванну с ультразвуком на 4 ч. Затем фильтруют реакционную среду, выпаривают фильтрат и очищают остаток простым фильтрованием на двуокиси кремния в простом этиловом эфире. При этом получают 90 мг (18%) целевого продукта с точкой плавления 208 - 209oC.
Пример 5. 2-гидрокси-4-[3-оксо-3-(5,6,7, 8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]бензойная кислота.
(a) 2-гидрокси-4-триметилсилилэтинилметилбензоат
По способу, аналогичному примеру 1 (a), реакцией 34 г
(122 ммоль) 2-гидрокси-4-йодометилбензоата с 34 мл (244 ммоль) триметилсилилацетилена получают 25,9 г (85%) целевого продукта в форме масла каштанового цвета.
(b)
2-гидрокси-4-[3-оксо-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]метилбензоат
По способу, аналогичному примеру 1 (b), реакцией 2,4 г (0,01 моль) хлористого 5,6,7,
8-тетрагидро-5,5,8,8-тетраметил-2-нафтоила с 2,5 г (0,01 моль) 2-гидрокси-4-триметилсилилэтинилметилбензоата получают 2,9 г (74%) целевого сложного эфира с точкой плавления 189oC.
(c) 2-гидрокси-4-[3-оксо-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]бензойная кислота
В колбу вводят 1,5 г (3,8 ммоль) полученного выше сложного эфира, 100 мл
тетрагидрофурана и 485 мг (11,4 ммоль) моногидрата гидроокиси лития, затем нагревают при флегме в течение 8 ч, выпаривают досуха, поглощают водой, подкисляют соляной кислотой. После этого экстрагируют
простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Перекристаллизовывают полученный остаток из смеси циклогексана и простого изопропилового эфира, фильтруют
и сушат. Получают 700 мг (48%) целевого продукта с точкой плавления 183 - 184oC.
Пример 6. 2-гидрокси-4-[3-гидркоси-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2- нафтил)-1-пропинил]метилбензоат.
В колбу вводят 2,9 г (7,4 ммоль) 2-гидрокси-4-[3-оксо-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропенил]метилбензоата, 100 мл смеси метанола-тетрагидрофурана (50 - 50), добавляя небольшими порциями 140 мг (3,7 ммоль) борогидрида натрия. Перемешивают при комнатной температуре в течение 2 ч, выливают реакционную среду в воду, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют смесью дихлорметана и гексана (50 - 50). Получают после выпаривания растворителей 1,6 г (55%) целевого продукта с точкой плавления 92 - 93oC.
Пример 7. 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро- 5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота.
Работают аналогично примеру 6, исходя из 1 г (2,7 ммоль) 2-гидрокси-4-[3-оксо-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил] бензойной кислоты, получают 915 мг (91%) целевой кислоты с точкой плавления 203 - 204oC.
Пример 8. 2-гидрокси-4-[3-оксо-3-(3-трет.бутил-4- метоксифенил)-1-пропинил]бензойная кислота.
(a) 2-гидрокси-4-[3-оксо-3-(3-трет.бутил-4-метоксифенил)-1- пропинил]метилбензоат
Работают аналогично примеру 1 (b), осуществляя реакцию 4,2 г (0,02 моль) хлористого 3-трет. бутил-4-метоксибензоила с 5 г (0,02 моль)-2-гидрокси-4-триметилсилилэтинилметилбензоата и получают после
очистки хроматографией на колонке с двуокисью кремния, после элюирования дихлорметаном 6 г (81%) целевого продукта в форме масла каштанового цвета.
(b) 2-гидрокси-4-[3-оксо-3-(3-трет.бутил-4-метоксифенил)-1- пропинил]бензойная кислота.
Работают аналогично примеру 5 (c), исходя из 6 г (16,4 ммоль) полученного выше продукта и получают 4, 2 г (73%) целевой кислоты с точкой плавления 204 - 205oC.
Пример 9. 4-[1-оксо-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил- 2-нафтил)-2-пропинил]бензойная кислота.
(a) 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- триметилсилилэтинилнафталин
По способу, описанному в примере 1 (a), проводят реакцию 26,7 г (0,1 моль) 2-бром-5,6,7,8-тетрагидро-5,5,8,
8-тетраметилнафталина с 20 г (0,204 моль) триметилсилилацетилена и получают 18,8 г (66%) целевого продукта в форме бесцветного масла.
(b) 5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-6-этинил-нафталин
В колбу вводят 5,7 г (0,02 моль) полученного выше продукта, 75 мл метанола и добавляют 100 мг карбоната калия. Перемешивают при комнатной температуре в течение
3 ч, выпаривают досуха, поглощают остаток в воде и простом этиловом эфире, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Получают 4,1 г (100%) ацетилового производного в форме
желтого масла.
(c) 4-N,N'-диметилкарбамоилаллилбензоат
В колбу вводят 20 мл диметиламина (40% в воде) и добавляют по каплям раствор 2,5 г (11,6 ммоль) хлористого
4-(аллилоксикарбонил) бензоила в 50 мл тетрагидрофурана и перемешивают при комнатной температуре в течение 1 ч. Выливают реакционную смесь в воду, экстрагируют простым этиловым эфиром, декантируют
органическую фазу, сушат на сульфате магния, выпаривают. Получают 2,7 г (100%) целевого амида в форме слегка желтого масла.
(d) 4-[1-оксо-3-(5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2- нафтил)-2-пропинил]аллилбензоат
В трехгорлую колбу вводят, в атмосфере азота, 4,3 г (20 ммоль) и 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-6-этинилнафталина и 20 мл
тетрагидрофурана. При -78oC добавляют по каплям 12,5 мл (20 ммоль) раствора н-бутиллития (1,6 М в гексане) и перемешивают в течение 10 мин. Затем при этой же температуре добавляют 2,7 мл
BF3-Et2O и перемешивают в течение 30 мин.
В этот раствор при той же температуре -78oC добавляют раствор 2,5 г (10 ммоль) 4-N, N'-диметилкарбамоилаллилбензоата в 10 мл тетрагидрофурана и перемешивают в течение 1 часа. Выливают реакционную среду в водный раствор хлористого аммония, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют смесью дихлорметана и гексана (10 - 90). После выпаривания растворителей получают 4,2 г (52%) целевого сложного эфира в форме масла.
(e) 4-[1-оксо-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-2-пропинил]бензойная кислота
По способу, описанному в примере 5 (c), но исходя из 1,4 г (3,5 ммоль) полученного выше сложного эфира, получают 940 мл (75% целевой кислоты с точкой плавления 191 - 192oC).
Пример 10. 4-[1-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил) -2-пропинил]бензойная кислота.
(a) 4-[1-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2-нафтил)-2-пропинил] аллилбензонат
Аналогично примеру 6, но исходя из 1,7 г (4,2 ммоль) 4-[1-оксо-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил] - 2-пропинил]аллилбензоата,
получают 1,6 г (94%) целевого сложного эфира в форме бесцветного масла.
(b) 4-[1-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-2- пропинил]бензойная кислота
В
колбу в атмосфере азота вводят 950 мг (2,4 ммоль) полученного выше сложного эфира, 50 мл тетрагидрофурана и 75 мг тетракис (трифенилфосфин) палладия (0). При 0oC добавляют по каплям 2,1 мл
(24 ммоль) морфолина и перемешивают при комнатной температуре в течение 1 ч. Выпаривают реакционную среду, поглощают остаток водой, подкисляют до pH 1 соляной кислотой, экстрагируют простым этиловым
эфиром, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Полученный остаток растирают в смеси гексана - простого этилового эфира (80-20), фильтруют и сушат. Получают 530 мг (62%)
целевой кислоты с точкой плавления 161 - 162oC.
Пример 11. 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилтиохроман-6-ил)-1-пропинил] метилбензоат.
(a) 4,
4-диметил-6-тиохроманкарбоксальдегид
В трехгорлую колбу в атмосфере азота вводят 9,4 г (36,6 ммоль) 4,4-диметил-6-бромтиохромана и 100 мл тетрагидрофурана. При -78oC добавляют по
каплям 16,1 мл раствора н-бутиллития (2,5 М гексана) и перемешивают 30 мин. Затем добавляют по каплям 2,7 мл (38,4 ммоль) диметилформамида и оставляют реакционную среду повышаться до комнатной
температуры. Выливают реакционную среду в водный раствор хлористого аммония, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный
остаток очищают хроматографией на колонке с двуокисью кремния, элюируют смесью дихлорметана и гексана (50-50). После выпаривания растворителей получают 6,1 г (81%) целевого альдегида в форме желтого
масла.
(b) Альфа-триметилсилилэтинил-(4,4-диметил-6-тиохроман) метанол
В трехгорлую колбу вводят 3 мл (21,3 ммоль) триметилсилилацетилена и 50 мл тетрагидрофурана. При -78oC и в атмосфере азота добавляют по каплям раствор 8,6 мл (21,3 ммоль) н-бутиллития (2,5 М в гексане) и оставляют смесь повышаться при комнатной температуре.
Полученный раствор вводят по каплям в раствор 4 г (19,4 ммоль) 4,4-диметил-6-тиохроманкарбоксальдегида в 50 мл тетрагидрофурана при -78oC. Оставляют реакционную среду до возвращения к комнатной температуре, выливают в водный раствор хлористого аммония, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Получают 5,9 г (100%) целевого спирта в форме желтого масла.
(c) Альфа-этинил-(4,4-диметил-6-тиохроман)метанол
В колбу вводят 5,9 (19,4 ммоль) альфа-триметилсилилэтинил (4,4-диметил-6-тиохроман)метанола, 50 мл
тетрагидрофурана и добавляют по каплям 21,3 мл (23,3 ммоль) раствора фторида тетрабутиламмония (1,1 М в тетрагидрофуране). Перемешивают при комнатной температуре один час, выливают реакционную среду в
воду, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют
смесью этилацетата и гексана (1-4). После выпаривания растворителей получают 3,9 (87%) альфа-этинил (4,4-диметил-6-тиохроман)метанола в форме бесцветного масла.
(d)
2-гидрокси-4-[3-гидрокси-3-(4,4-диметилтиохроман- 6-ил)-1-пропинил] метилбензоат
В трехгорлую колбу вводят 2,5 г (10,8 ммоль) альфа-этинил-(4,4-диметил-6-тиохроман) метанола, 3 г (10,8 ммоль)
2-гидрокси-4-йодометилбензоата и 50 мл триэтиламина. Дегазируют реакционную среду азотом в течение 30 мин, затем добавляют последовательно 600 мг (0,86 ммоль) хлористого бис(трифенилфосфин) палладия
(11) и 240 мг (1,3 ммоль) йодида меди. Перемешивают при комнатной температуре в течение 4 ч, выпаривают досуха реакционную среду, поглощают полученный остаток в воде и простом этиловом эфире.
Декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируя дихлорметаном, получают 3,2 г (80%)
2-гидрокси-4-[3-гидрокси-3-(4,4-диметилтиохроман-6-ил) -1-пропинил]метилбензоата с точкой плавления 105 - 106oC.
Пример 12. 2-гидрокси-4-[3-оксо-3-(4, 4-диметилтиохроман-6-ил)-1- пропинил]бензойная кислота.
(a) 2-гидрокси-4-[3-оксо-3-(4,4-диметилтиохроман-6-ил)- 1-пропинил]метилбензоат.
В колбу вводят 2 г (5,2 ммоль) 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилтиохроман-6-ил)-1-пропинил] метилбензоата и 50 мл дихлорметана. Добавляют 2,6 г (6,9 ммоль) дихроматпиридиния и перемешивают при комнатной температуре 8 ч. Выпаривают реакционную среду досуха и очищают полученный осадок хроматографией на колонке с двуокисью кремния, элюируют смесью дихлорметана и гексана (50-50). После выпаривания растворителей получают 1,3 г (65%) целевого сложного эфира в форме коричневого масла.
(b) 2-гидрокси-4-[3-оксо-3-(4,4-диметилтиохроман-6-ил)-1-пропинил]бензойная кислота.
В колбу вводят 1,3 г (3,42 ммоль) полученного выше сложного эфира, 430 мг (10,2 ммоль) гидрокси лития и 50 мл тетрагидрофурана.
Нагревают при флегме в течение 8 ч, выпаривают досуха реакционную среду. Остаток поглощают в воде и простом этиловом эфире и окисляют. Декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют смесью дихлорметана и метанола (95-5). Получают 600 мг (48%) целевой кислоты с точкой плавления 253 - 254oC.
Пример 13. 4-[3-гидрокси-3-(3-трет.бутил-4-метоксифенил-1-пропинил]бензойная кислота.
(a) Альфа-триметилсилилэтинил-(3-трет.бутил-4-метоксибензол)метанол.
Аналогично примеру 11 (b), осуществляют реакцию 7,7 г (40 ммоль) 3-трет. бутил-4-метоксибензальдегида с одним эквивалентом триметилсилилацетиленида лития и получают 11,1 г (98%) целевого спирта в форме бесцветного масла.
(b) альфа-этинил-(3-трет.бутил-4-метоксибензол)метанол
Аналогично примеру 11 (c), исходя из 11,1 г (38,2 ммоль) альфа-триметилсилилэтинил-(3-трет.
бутил-4-метоксибензол)метанола, получают 8,1 г (96%) альфа-этинил-(3-трет.бутил-4-метоксибензол)метанола в форме желтого масла.
(c)
4-[3-гидрокси-3-(3-трет.бутил-4-метоксифенил)-1-пропинил]метилбензоат
Аналогично примеру 11 (d) осуществляют реакцию 2,5 г (11,4 ммоль) альфа-этинил-(3-трет.бутил-4-метоксибензол) метанола с
3,17 г (11,4 ммоль) 2-гидрокси-4-йодометилбензоата и получают 3 г (71%) целевого сложного эфира в форме коричневого масла.
(d) 4-[3-гидрокси-3-(3-трет.
бутил-4-метоксифенил)-1-пропинил]бензойная кислота
Аналогично примеру 12 (b) исходя из 4,5 г (12,8 ммоль) 4-[3-гидрокси-3-(3-трет. бутил-4-метоксифенил)-1-пропинил] метилбензоата, получают 2,
45 г (57%) целевой кислоты с точкой плавления 114 - 115oC.
Пример 14. N-метил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8- тетраметил-2-нафтил)-1-пропинил]-2-пирролметилкарбоксилат.
(a) Альфа-триметилсилилэтинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафталин)метанол
В трехгорлую колбу
вводят 17, 13 мл (0,121 ммоль) триметилсилилацетилена и 100 мл тетрагидрофурана. При -78oC и в потоке азота добавляют по каплям раствор 48,5 мл (0,121 ммоль) н-бутиллития (2,5 М в гексане)
и оставляют до возврата к комнатной температуре.
Этот раствор вводят по каплям в раствор 23,8 г (0,11 моль) 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинкарбоксальдегида в 100 мл тетрагидрофурана при -78oC. Оставляют реакционную среду до возврата и комнатной температуре, выливают в водный раствор хлористого аммония, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируя смесью дихлорметана и гексана (50-50). После выпаривания растворителей получают 29,9 г (86%) целевого спирта в форме желтого масла.
(b) Альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанол
В колбу вводят 29,9 г (95,
2 ммоль) альфа-триметилсилилэтинил (5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанола, 100 мл тетрагидрофурана и добавляют по каплям 103,8 мл (114,2 ммоль) раствора фтористого
тетрабутиламмония (1,1 М в тетрагидрофуране). Перемешивают при комнатной температуре один час, выливают реакционную среду в воду, экстрагируют простым этиловым эфиром, декантируют органическую фазу,
сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют смесью этилацетата и гексана (1-4). После выпаривания растворителей получают 18,
1 г (79%) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанола с точкой плавления 55-57oC.
(c) 2-трихлорацетилпиррол
В трехгорлую колбу вводят 45
г (247 ммоль) хлористого трихлорацетила и 100 мл простого этилового эфира. Добавляют по каплям раствор 15,4 г (230 ммоль) пиррола в 100 мл простого этилового эфира и перемешивают при комнатной
температуре 1 ч, затем медленно добавляют раствор 20 г карбоната калия в 60 мл воды. Декантируют органическую фазу, сушат на сульфате магния, выпаривают, растирают остаток в гексане и фильтруют.
Получают 42,7 (87%) целевого продукта с точкой плавления 78 - 79oC.
(d) 4-йодо-2-трихлорацетилпиррол
В трехгорлую колбу в потоке азота вводят 8,4 г (39,5 ммоль)
2-трихлорацетилпиррола и 100 мл хлороформа и добавляют последовательно 8,8 г (39,5 ммоль) трифторацетата серебра и 10,16 г (39,5 ммоль) йода. Перемешивают при комнатной температуре в течение 1 ч,
выливают реакционную среду на лед, экстрагируют дихлорметаном, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток растирают в гексане и фильтруют, получают 8,2 г
(61%) целевого продукта с точкой плавления 118 - 119oC.
(e) 4-йод-2-пирролметилкарбоксилат
В колбу вводят 8,2 г (24 ммоль) 4-йодо-2-трихлорацетилпиррола, 100 мл
метанола и добавляют 2 г (36 ммоль) метилата натрия. Перемешивают при комнатной температуре в течение 4 ч, выпаривают досуха реакционную среду, поглощают полученный остаток в воде и простом этиловом
эфире, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток растирают в гептане, фильтруют, получают 4,9 г (81%) целевого сложного эфира с точкой плавления 77
- 78oC.
(f) N- метил-4-йод-2-пирролметилкарбоксилат
В трехгорлую колбу вводят 780 г (25,9 ммоль) гидрида натрия (80% в масле) и 20 мл диметилформамида, добавляют по
каплям 6,5 г (25,9 ммоль) 4-йод-2-пирролметилкарбоксилата в 50 мл диметилформамида и перемешивают до прекращения выделения газа. Затем добавляют 2,1 мл (33,6 ммоль) йодометана и перемешивают при
комнатной температуре 2 ч. Выливают реакционную среду в воду, экстрагируют простым этиловым спиртом, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают
хроматографией на колонке с двуокисью кремния, элюируют смесью дихлорметана и гексана (40 - 60). Получают 4,5 г (65%) N-метил-4-йод-2-пирролметилкарбоксилата с точкой плавления 64 - 65o
C.
(g) N-метил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]-пирролметилкарбоксилат
Аналогично примеру 11 (d) реакцией 2,9 г (12 ммоль)
альфа-этинил (5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанола с 3,2 г (12,1 ммоль) N-метил-4-йод-2-пирролметилкарбоксилата получают растиранием в простом изопропиловом эфире 2,8 г (61%)
целевого сложного эфира с точкой плавления 150 - 152oC.
Пример 15. N-метил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]-2-пирролкарбоновая кислота.
Аналогично примеру 12 (b), исходя из 2 г (5,2 ммоль) N-метил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил] -2-пирролметилкарбоксилата, получают 440 мг (22%) целевой кислоты с точкой плавления 112 - 113oC.
Пример 16. 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8- тетраметил-2-нафтил)-1-пропинил]-2-пирролеметилкарбоксилат.
(a) N-трет.бутоксикарбонил-4-йод-2-пирролметилкарбоксилат
В трехгорлую колбу вводят 780 г (25,9 ммоль) гидрида
натрия (80% в масле) и 20 мл диметилформамида, добавляют по каплям раствор 6,5 г (25,9 ммоль) 4-йод-2-пирролметилкарбоксилата в 50 мл диметилформамида и перемешивают до прекращения выделения газа.
Затем добавляют небольшими количествами 5,6 г (25,9 момль) ди-трет.бутилдикарбоната и перемешивают при комнатной температуре 2 ч. Выливают реакционную среду в воду, экстрагируют простым этиловым
эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют смесью дихлорметана и гексана (60 - 40).
Получают 6,8 г (75%) N-трет.бутоксикарбонил-4-йод-2-пирролметилкарбоксилата в форме желтого масла.
(b) N-трет. бутоксикарбонил-4-[3-гидрокси-3-(5,6,7,8- тетрагидро-5,5,8,
8-тетраметил-2-нафтил)-1-пропинил]-2- пирролметилкарбоксилат
Аналогично примеру 11 (d) реакцией 2 г (8,2 ммоль) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин) метанола с 3 г
(8,5 ммоль) N-трет.бутоксикарбонил-4-йод-2- пирролметилкарбоксилата, получают 3,8 г (98%) целевого сложного эфира в форме коричневого масла.
(c) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,
8,8- тетраметил-2-нафтил)-1-пропинил]-2-пирролметилкарбоксилат
В колбу вводят 2,4 г (5,1 ммоль) полученного выше сложного эфира, 20 мл тетрагидрофурана и 20 мл метанола. Добавляют 278 мг (5,1
ммоль) метилата натрия и перемешивают при комнатной температуре в течение четырех часов. Выпаривают досуха реакционную среду, поглощают в воде и простом этиловом эфире, декантируют органическую фазу,
сушат на сульфате магния, выпаривают. Полученный остаток растирают в смеси простого диизопропилового эфира и гептана, фильтруют. Получают 1,22 г (65%) целевого сложного эфира с точкой плавления 95
- 100oC.
Пример 17. 2-гидрокси-4-[3-гидрокси-3-(4,4-диметил- тиохроман-7-ил)-1-пропинил]метилбензоат.
(a) 4,4-диметил-7-тиохроманкарбоксальдегид
Аналогично примеру 11 (a), исходя из 5,6 г (21,8 ммоль) 4,4-диметил-7-бромотиохромана, получают 3,3 г (74%) целевого альдегида в форме желтого масла.
(b) Aльфа-триметилсилилэтинил-(4,
4-диметил-7-тиохромана)метанол
Аналогично примеру 11 (b), исходя из 5,4 г (26,2 ммоль) 4,4-диметил-7-тиохроманкарбоксальдегида, получают 8 г (100%) альфа-триметилсилилэтинил-(4,
4-диметил-7-тиохроман) метанола в форме желтого масла.
(c) Aльфа-этинил-(4,4-диметил-7-тиохроман)метанол
Аналогично примеру 11 (c), исходя из 8 г (26,3 ммоль)
альфа-триметилсилилэтинил-(4,4-диметил-7-тиохроман)метанола, получают после очистки 4,3 г (70%) целевого спирта в форме бесцветного масла.
(d) 2-гидрокси-4-[3-гидрокси-3-(4,
4-диметилтиохроман-7-ил)- 1-пропинил] метилбензоат
В трехгорлую колбу вводят 2,5 г (10,8 ммоль) альфа-этинил-(4,4-диметил-7-тиохроман)метанола, 3 г (10,8 ммоль) 2-гидрокси-4-йодометилбензоата
и 50 мл триэтиламина. Дегазируют реакционную среду азотом в течение 30 мин, затем добавляют последовательно 600 мг (0,86 ммоль) бис (трифенилфосфин) палладия (11)-хлорида и 240 мл (1,3 ммоль) йодида
меди. Перемешивают при комнатной температуре в течение 4 ч., выпаривают досуха реакционную среду, поглощают полученный остаток водой и простым этиловым эфиром. Декантируют органическую фазу, сушат на
сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют дихлорметаном, получают 3,2 г (80%) 2-гидрокси-4-[3-гидрокси-3-(4,
4-диметилтиохроман-7-ил)-1-пропинил метилбензоата с точкой плавления 101 - 102oC.
Пример 18. 4-[1-гидрокси-3-(4,4-диметилтиохроман-6-ил)-1-пропинил бензойная кислота.
(a) 2'-2'-дибром-(4,4-диметилтиохроман-6-ил)этилен.
В колбу вводят 5 г (24,2 ммоль) 4,4-диметил-6-тиохроманкарбоксальдегида, полученного в примере 11 (a), и 50 мл дихлорметана. Добавляют последовательно 16,1 г (48,4 ммоль) тетрабромистого углерода, 12,7 г (48,4 ммоль) трифенилфосфина и 3,16 г (48,4 ммоль) порошкообразного цинка и перемешивают при комнатной температуре в течение двух часов. Выпаривают реакционную среду и очищают полученный остаток хроматографией на колонке с двуокисью кремния, элюируют гексаном. Получают 7,75 г (88%) целевого продукта.
(b) (4,4-диметилтиохроман-6-ил)ацетилен
В трехгорлую колбу в потоке азота вводят 7,7 г (21,2 ммоль) 2'-2'-дибром-(4,4-диметилтиохроман-6-ил)этилена и 80 мл
тетрагидрофурана. При -78oC добавляют по каплям 17 мл (26,6 ммоль) раствора н-бутиллития (2,5 М в гексане) и оставляют повышаться до комнатной температуры на 1 ч. Выливают реакционную среду
в воду, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют
гептаном. Получают 3,9 г (90%) целевого ацетиленового производного в форме желтого масла.
(c) 4[1-гидрокси-3-(4,4-диметилтиохроман-6-ил)-2-пропинил] бензойная кислота
В
трехгорлую колбу в потоке азота вводят 2 г (9,9 ммоль) (4,4-диметилтилхроман- -ил)ацетилена и 25 мл тетрагидрофурана, при -50oC добавляют по каплям 4 мл (9,9 ммоль) раствора н-бутиллития (2,
5 М в гексане) и перемешивают 30 мин. Затем добавляют раствор 743 мг (4,9 ммоль) 4-карбоксибензальдегида в 25 мл тетрагидрофурана и перемешивают при комнатной температуре 1 ч. Выливают реакционную
среду в воду, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Остаток перекристаллизовывают из простого диизопропилового эфира, получают
после фильтрования 730 мг (42%) целевой кислоты с точкой плавления 168 - 169oC.
Пример 19. 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилтиохроман-6-ил)1-пропинил] бензойная
кислота
Аналогично примеру 12 (b), исходя из 2 г (5,2 ммоль) 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилтиохроман-6-ил)-1-пропинил] метилбензоата, получают 1,66 г (86%) целевой кислоты с точкой
плавления 240 - 245oC.
Пример 20. 2-гидрокси-4-[3-гидрокси-3-(4,4-диметил-тиохроман-7-ил)-1- пропинил]бензойная кислота.
Аналогично примеру 12 (b), исходя из 2 г (5,2 ммоль) 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилтиолхроман-7-ил)-1-пропинил] метилбензоата, получают 1,55 г (80%) кислоты с точкой плавления 144 - 145oC.
Пример 21. Изомер (+) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5, 8,8-тетраметил-2-нафтил)-1-пропинил]метилбензоат.
(a) Диастереоизомер (-) (R)-альфа-метоксифенилацетата 1-(5,6,7,8-тетрагидро-5,
5,8,8-тетраметил-2-нафтил)-2-пропинила
В колбу вводят 9,7 г (40 ммоль) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин) метанола, 6,7 г (40 ммоль) (R) (-)
альфа-метоксифенилуксусной кислоты и 100 мл дихлорметана. Добавляют последовательно 8,3 г (40 ммоль) дициклогексилкарбодиимида, 4,9 г (40 ммоль) 4-диметиламинопиридина и перемешивают при комнатной
температуре 24 ч. Выливают реакционную среду в воду, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают
хроматографией на колонке с двуокисью кремния, элюируют смесью дихлорметана и гептана (60 - 40). После выпаривания растворителей получают 3,8 г (97%) смеси диастереоизомеров в форме масла.
Разделение двух диастереоизомеров осуществляют двумя последовательными перекристаллизациями из изооктана. Таким путем получают 6 г (38,4%) диастереоизомера (-) с точкой плавления 94 - 95oC.
[α] = -14,8o (c = 1, CH2Cl2)
(b) Изомер (-) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2-нафталин)метанол
В колбу вводят 5,7 г (14,6 ммоль) диастереоизомера (-), полученного выше, 20 мл
тетрагидрофурана и добавляют 10 мл раствора щелочи натрия в метаноле (2H). Перемешивают при комнатной температуре в течение 1 ч, выпаривают досуха реакционную среду, поглощают водой и простым этиловым
эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют дихлорметаном. После выпаривания
растворителей получают 3,4 г (97%) изомера (-) альфа -этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанола с точкой плавления 77 - 78oC.
[α]
(c) Изомер (+) 4-[3-гидрокси-3-(5,6,7,
8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]метилбензоата
Аналогично примеру 11 (d) осуществляют реакцию 1,6 г (6,6 ммоль) изомера (-) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2-нафталин) метанола с 1,7 г (6,6 ммоль) 4-иодметилбензоата, получают после хроматографии на колонке с двуокисью кремния и элюирования смесью дихлорметана и гептана (60 - 40) 2,1 г (84,
6%) изомера (+) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил) -1-пропинил] метилбензоата с точкой плавления 128 - 129oC.
[α]
Пример 22. Изомер (-)4-[3-гидрокси-3-(5,6,7,
8-тетрагидро-5,5,8,8-тетраметил-2-нафтил) -1-пропинил]бензойной кислоты.
Аналогично примеру 12 (b), исходя из 1,6 г изомера (+) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2-нафтил) -1-пропинил]метилбензоата, получают 1,1 г (73%) изомера (-) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1- пропинил]бензойной кислоты, точка плавления 183 - 184oC.
[α]
Пример 23. Изомер (+) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8- тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]метилбензоата.
Аналогично примеру 11 (d) осуществляют реакцию 1,5 г
(6,2 ммоль) изомера (-) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанола с 1,7 г (6,2 ммоль) 2-гидрокси-4-йодометилбензоата и получают после хроматографии на колонке с двуокисью
кремния, элюирования смесью дихлорметана и гептана (70 - 30), 2,2 г (91%) изомера (+) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил- 2-нафтил)-1-пропинил]метилбензоата с точкой
плавления 100 - 101oC
[α]
Пример 24. Изомер (-) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8- тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]-бензойной кислоты.
Аналогично примеру 12 (b),
исходя из 1,8 г изомера (+) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил- 2-нафтил)-1-пропинил] метилбензоата, получают 1,5 г (88%) изомера (-) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,
8-тетрагидро-5,5,8,8-тетраметил- 2-нафтил)-1-пропинил]бензойной кислоты с точкой плавления 220oC с разложением
[α]
Пример 25. Изомер (-) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2-нафтил)- 1-пропинил]метилбензоата.
(a) Диастереоизомер (+) (S) -альфа-меткосифенилацетата 1-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-2-пропинила
В
колбу вводят 9,3 г (38,4 ммоль) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин) метанола, 6,4 г (38,4 ммоль) (S) (+)-альфа-метоксифенилуксусной кислоты и 100 мл дихлорметана. Добавляют
последовательно 7,9 г (38,4 моль) дициклогексилкарбодиимида, 4,7 г (38,4 ммоль) 4-диметиламинопиридина и перемешивают при комнатной температуре 24 ч. Выливают реакционную смесь в воду, экстрагируют
простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют смесью дихлорметана и
гептана (60-40). После выпаривания растворителей получают 12,5 г (84%) смеси диастереоизомеров в форме масла.
Разделение двух диастереоизомеров осуществляют двумя последовательными
перекристаллизациями из изооктана. Таким путем получают 4 г (27%) диастереоизомера (+) с точкой плавления 93 - 94oC
[α]
(b) Изомер (+) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)
метанол
В колбу вводят 3,7 г (9,5 ммоль) диастереоизомера (+), полученного выше, 20 мл тетрагидрофурана и добавляют 10 мл раствора щелочи натрия в метаноле (2 н). Перемешивают при комнатной
температуре в течение одного часа, выпаривают досуха реакционную среду, поглощают водой и простым этиловым эфиром, декантируют органическую фазу сушат на сульфате магния, выпаривают. Полученный
остаток очищают хроматографией на колонке с двуокисью кремния, элюируют дихлорметаном. После выпаривания растворителей получают 1 г (87%) изомера (+) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2-нафталин) метанола с точкой плавления 77 - 78oC
[α]
(c) Изомер (-) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)- 1-пропинил]метилбензоата
Аналогично примеру
11 (d) осуществляют реакцию 700 мг (2,9 ммоль) изомера (+) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанола с 760 мг (2,9 ммоль) 4-йодометилбензоата и получают после
хроматографии на колонке с двуокосью кремния, элюирования смесью дихлорметана и гептана (60-40), 1 г (92,5%) изомера (-) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)
-1-пропинил]метилбензоата с точкой плавления 128 - 129oC
[α]
Пример 26. Изомер (-) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил- 2-нафтил)-1-пропинил]метилбензоат.
Аналогично примеру 11 (d) осуществляют реакцию 1 г (4,1 ммоль) изомера (+) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин) метанола с 1,1 г (4,1 ммоль) 2-гидрокси-4-йодометилбензоата и получают после хроматографии на колонке с двуокосью кремния, элюирования смесью дихлорметана и гептана (70-30), 1,45 г (90%) изомера (-) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8- тетраметил-2-нафтил)-1-пропинил]метилбензоата с точкой плавления 100 - 101oC.
[α]
Пример 27. Изомер (+) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)- 1-пропинил]бензойной
кислоты.
Аналогично примеру 12 (b), исходя из 800 мг изомера (-) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)- 1-пропинил]метилбензоата, получают 600 мг (78%)
изомера (+) 4-[3- гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1- пропинил]бензойной кислоты с точкой плавления 180 - 181oC
[α]
Пример 28. Изомер (+) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,
8,8-тетраметил-2- нафтил)-1-пропинил]бензойной кислоты.
Аналогично примеру 12 (b), исходя из 1,2 г изомера (-) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил- 2-нафтил)-1-пропинил] метилбензоата, получают 1 г (87%) изомера (+) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил] бензойной кислоты с точкой плавления 220oC с разложением.
[α]
Пример 29. 2-гидрокси-4-[3-гидрокси-3-метил-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]метилбензоат.
(a) 1-триметилсилилэтинил-1-(5,6,7,
8-тетрагидро-5,5,8,8-тетраметил- 2-нафтил)этанол
Аналогично примеру 11 (b) осуществляют реакцию 5 г (21,7 ммоль) 2-ацетил-5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталина с одним
эквивалентом
триметилсилилацетиленида лития и получают 6,8 г (95%) целевого спирта в форме бесцветного масла.
(b) 1-этинил-1-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил- 2-нафтил)этанол
Аналогично примеру 11 (c), исходя из 6,8 г (20,7 ммоль) 1-триметилсилилэтинил-1-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)этанола, получают 4,22 г (75%) целевого продукта с точкой плавления 84
- 85oC.
(c) 2-гидрокси-4-[3-гидрокси-3-метил-3-(5,6,7,8-тетрагидро- 5,5,8,8-тетраметил-2-нафтил)-1-пропинил]метилбензоат
Аналогично примеру 11 (d) осуществляют
реакцию 2 г (7,8 ммоль) 1-этинил-1-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)этанола с 2,2 г (7,9 ммоль) 2-гидрокси-4-йодометилбензоата и получают после хроматографии на колонке с двуокисью
дихлорметана и гептана (50-50), 2,77 г (87%) целевого сложного эфира с точкой плавления 110 - 115oC.
Пример 30. 2-гидрокси-4-[3-гидрокси-3-метил-3-(5,6,7,8-тетрагидро- 5,5, 8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота.
Аналогично примеру 12 (b), исходя из 2,2 г (5,4 ммоль) 2-гидрокси-4-[3-гидрокси-3-метил-3-(5,6,7,8-тетрагидро- 5,5,8, 8-тетраметил-2-нафтил)-1-пропинил] метилбензоата, получают 1,9 г (89%) целевой кислоты с точкой плавления 265 - 270oC.
Пример 31. 2-метокси-4-[3-гидрокси-3-(5,6,7, 8-тетрагидро- 5,5,8,8-тетраметил-2-нафтил)-1-пропинил] бензойная кислота.
(a) 4-йод-2-метоксиметилбензоат
В трехгорлую колбу вводят 238 мг (7,9 ммоль) гидрида натрия (80% в
масле) и 20 мл диметилформамида, добавляют по каплям раствор 2 г (7,2 ммоль) 2-гидрокси-4-йодометилбензоата в 50 мл диметилформамида и перемешивают до прекращения выделения газа. Затем добавляют 540
мкл (8,6 ммоль) йодометана и перемешивают при комнатной температуре 2 ч. Выливают реакционную среду в воду, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате
магния, выпаривают. Получают 2,1 г (100%) 4-йод-2-метоксиметилбензоата.
(b) 2-метокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро -5,5,8,8-тетраметил-2-нафтил)-1-пропинил]метилбензоат
Аналогично примеру 11 (d) осуществляют реакцию 1,66 г (6,8 ммоль альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2 - нафталин)метанола с 2 г (6,9 ммоль) 4-йод-2-метоксиметилбензоата и получают
после хроматографии на колонке двуокисью кремния, элюирования дихлорметаном, 2,1 г (75%) целевого сложного эфира в форме желтого масла.
(c) 2-метокси-4-[3-гидрокси-3-(5,6,7,
8-тетрагидро -5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота
Аналогичному примеру 12 (b), исходя из 2,1 г (5,2 ммоль) предыдущего сложного эфира, получают 1 г (50%) целевой кислоты
с точкой плавления 100 - 102oC.
Пример 32. 4-[3-гидрокси-3-(5,6,7,8-тетрагидро -5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензальдегид.
В трехгорлую колбу вводят 2,42 г (10 ммоль) альфа-этинил- (5,6,7,8,-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанола, 2 г (11 ммоль) 4-бромбензальдегида и 50 мл триэтиламина. Дегазируют реакционную среду азотом в течение 30 мин, затем добавляют последовательно 169 мг (0,75 ммоль) ацетата палладия (11) и 393 мг (1,5 ммоль) трифенилфосфина. Нагревают до 60oC в течение 1 ч, выпаривают досуха реакционную среду, поглощают полученный остаток в воде и простом этиловом эфире. Декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируя смесью дихлорметана и гептана (70-30) и получают 1,23 г (35,5%) 4-[3-гидрокси-3- (5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил] бензальдегида с точкой плавления 104 - 105oC.
Пример 33. 4-[3-гидрокси-3-(5,6,7,8,-тетрагидро -5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензилацетат.
Аналогично примеру 32 осуществляют реакцию 2,42 г (10 ммоль) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил -2-нафталин)метанола с 2,52 г (11 ммоль) 4-бромбензилацетата и получают 790 мг (20%) целевого продукта в форме коричневого масла.
Пример 34. 4-[3-гидрокси-3-(5,6,7,8-тетрагидро- 5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензолметанол.
В колбу вводят 780 мг (2 ммоль) 4-[3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил] бензилацетата и 30 мл тетрагидрофурана. Добавляют 5 мл 2н раствора щелочи натрия в метаноле и перемешивают 30 мин, выливают реакционную среду в воду, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток растирают в гептане, фильтруют и получают 419 мг (60%) целевого продукта с точкой плавления 85 - 86oC.
Пример 35. 4-[3-гидрокси-3-(5,6,7,8-тетрагидро -5,5,8,8-тетраметил-2-нафтил)-1-пропинил]толуол.
Аналогично примеру 11 (d) осуществляют реакцию 1,2 г (5 ммоль) альфа-этинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил -2-нафталин)метанола с 1,1 г (5 ммоль) 4-йодотолуола и после хроматографии на колонке с двуокисью кремния, элюирования дихлорметаном, получают 1,49 г (45%) целевого продукта в форме масла каштанового цвета.
Пример 36. 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-3,5, 5,8,8-пентаметил-2-нафтил) -1-пропинил]фенилацетат.
(a) 2-бром-5,6,7,8-тетрагидро-3,5,5,8,8-пентаметилнафталин
В трехгорлую колбу вводят 30 мл 2-бромтолуола и 14 г (0,11
ммоль) AlCl3, охлаждают до 0oC т добавляют по каплям раствор 50 г (0,27 ммоль) 2,5-дихлор-2,5-диметилгексана в 100 мл 2-бромтолуола и оставляют для повышения до комнатной
температуры. Выливают реакционную среду в воду, экстрагируют дихлорметаном, декантируют органическую фазу, промывают водным раствором бикарбоната натрия, выпаривают. Перемешиванием в метаноле
кристаллизуют продукт и после фильтрования получают 56,9 г (75%) 2-бром-5,6,7,8-тетрагидро -3,5,5,8,8-пентаметилнафталина с точкой плавления 92 - 93oC.
(b) 5,6,7,
8-тетрагидро-3,5,5,8,8-пентаметил-2-нафталинкарбоксальдегид
Аналогично примеру 11 (a), исходя из 8,44 г (30 ммоль) 2-бром -5,6,7,8-тетрагидро-3,5,5,8,8-пентаметилнафталина, получают 6,9 г
(100%) целевого альдегида с точкой плавления 75 - 76oC.
(c) Альфа-триметилсилилэтнил-(5,6,7,8-тетрагидро -3,5,5,8,8-пентаметил-2-нафтил)метанол
Аналогично примеру
11 (b) осуществляют реакцию 6,66 г (29 ммоль) 5,6,7,8-тетрагидро-3,5,5,8,8-пентаметил -2-нафталинкарбоксальдегида с одним эквивалентом триметилсилилацетиленида лития получают 8,8 г (92%) целевого
спирта с точкой плавления 95 - 96oC.
(d) Альфа-этинил-(5,6,7,8-тетрагидро -3,5,5,8,8-пентаметил-2-нафталин)метанол.
Аналогично примеру 11 (c), исходя из 8, 6 г (26 ммоль) альфа-триметилсилилэтинил-(5,6,7,8-тетрагидро-3,5,5,8,8 -пентаметил-2-нафталин)метанола, получают 4,8 г (72%) целевого продукта с точкой плавления 101 - 102oC.
(e) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро -3,5,5,8,8-пентаметил-2-нафтил)-1-пропинил]фенилацетат
Аналогично примеру 11 (d) осуществляют реакцию 1,28 г (5 ммоль) альфа-этинил-(5,6,7,
8-тетрагидро-3,5,5,8,8-пентаметил -2-нафталин)метанола с 1,44 г (5,5 ммоль) 4-йодофенилацетата и получают 480 мг (25%) целевого продукта с точкой плавления 129 - 130oC.
Пример 37. 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-3,5,5,8, 8-пентаметил-2-нафтил)-2-пропинил] фенол.
Аналогично примеру 34, исходя из 300 мг (0,77 ммоль) 4-[3-гидрокси-3-(5,6,7, 8-тетрагидро-3,5,5,8, 8-пентаметил-2-нафтил)-1-пропинил]фенилацетата, получают 207 мг (77%) [4-3-гидрокси-3-(5,6,7,8-тетрагидро-3,5,5,8, 8-пентаметил-2-нафтил)-1-пропинил]фенола с точкой плавления 158 - 159oC.
Пример 38. 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2-нафтил)-1-пропинил]фенилсульфиналметан.
(a) 4-бромфенилсульфиналметан
В колбу вводят 4,06 г (20 ммоль 4-бромтиоанизола и 75 мл дихлорметана и добавляют 6,3 г (20 ммоль мета-хлорпербензойной кислоты. Перемешивают при комнатной температуре в течение четырех часов,
выливают реакционную смесь в воду, декантируют органическую фазу, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют смесью
дихлорметана и гептана (70-30). После выпаривания растворителей получают 1,22 г (28%) целевого сульфоксида с точкой плавления 80 - 81oC.
(b) 4-[3-гидрокси-3-(5,6,7, 8-тетрагидро-5,5,8, 8-тетраметил-2-нафтил)-1-пропинил]фенилсульфинилметан.
Аналогично примеру 32 осуществляют реакцию 1,21 г (5 ммоль) альфа-этинил-(5,6,7,8-тетрагидро-5,5,3, 8-тетраметил-2-нафталин)метанола с 1,1 г (5 ммоль) 4-бромфенилсульфинилметана получают 177 мг (9%) целевого производного сульфоксида с точкой плавления 121 - 122oC.
Пример 39. 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2-нафтил)-1-пропинил]фенилсульфонилметан.
(a) 4-бромфенилсульфонилметан
Аналогично примеру 38 (a) осуществляют
реакцию 2,03 г (10 ммоль) 4-бромтиоанизола с 10,35 г (30 ммоль) мета-хлорпербензойной кислоты и получают 1,72 г (73%) целевого сульфона с точкой плавления 94-95oC.
(b)
4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2-нафтил)-1-пропинил]фенилсульфонилметан
Аналогично примеру 32 реакцией 1,21 г (5 ммоль) альфа-этинил-(5, 6,7,8-тетрагидро-5,5,8,
8-тетраметил-2-нафталин)метанола с 1,18 г (5 ммоль) 4-бромфенилсульфинилметана получают 610 мг (31%) производного сульфона с точкой плавления 112 - 113oC.
Пример 40.
N-этил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5, 8,8-тетраметил-2-нафтил)-1-пропинил]бензамид
(a) хлористый 4-йодобензоил
В колбу вводят 5 г (20 ммоль) 4-йодобензойной кислоты, 30 мл
толуола и 5 капель диметилформамида. Нагревают до 40oC, добавляют 1,74 мл (24 ммоль) хлористого тионила и перемешивают в течение 30 мин. Выпаривают досуха и получают 5,5 г (100%) сырого
хлорангидрида, который используют в том же виде в последующем синтезе.
(b) N-этил-4-йодобензамид
В колбу вводят 90 мл (45 ммоль) 0,5 н раствора этиламида в тетрагидрофуране и
добавляют по каплям раствор 4 г (15 ммоль) хлористого 4-йодобензоила в 20 мл дихлорметана. Перемешивают при комнатной температуре 1 ч, выливают реакционную среду в воду, экстрагируют простым этиловым
эфиром, декантируют органическую среду, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют дихлорметаном. После выпаривания
растворителей получают 3,41 г (82%) целевого амида.
(c) N-этил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2-нафтил)-1-пропинил]бензамид.
Аналогично примеру 11 (d), реакцией 1,21 г (5 ммоль) альфа-этинил-(5,6,7,8-тетрагидро-3,5,5,8, 8-пентаметил-2-нафталин)метанола с 1,37 г (5,1 ммоль) N-этил-4-йодобензамида получают 596 мг (31%) целевого амида с точкой плавления 153 - 154oC.
Пример 41. N,N'-диэтил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5, 5,8,8-тетраметил-2-нафтил)-1-пропинил]бензамид.
(a) N, N'-диэтил-4-йодобензамид.
Аналогично примеру 40 (b), реакцией 5 г (18 ммоль) хлористого 4-йодобензоила с 5,6 мл (54 ммоль) диэтиламина получают 3,4 г (62%) целевого амида.
(b) N, N'-диэтил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2-нафтил)-1-пропинил]бензамид.
Аналогично примеру 11 (d) реакцией 970 мг (4 ммоль) альфа-этинил-(5, 6,7,8-тетрагидро-3,5,5,8, 8-пентаметил-2-нафталин)метанола с 1,25 г (4,1 ммоль) N, N'-диэтил-4-йодобензамида получают 584 мг (35%) целевого амида в форме масла каштанового цвета.
Пример 42. Морфолид 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5, 8,8-тетраметил-2-нафтил)-1-пропинил]бензойной кислоты.
(a) морфолид 4-йодобензойной кислоты
Аналогично примеру 40
(b) осуществляют реакцию 4 г (15 ммоль) хлористого 4-йодобензоила с 3,9 мл морфолина и получают 3,64 г (76%) целевого амида.
(b) морфолид 4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2-нафтил)-1-пропинил]бензойной кислоты.
Аналогично примеру 11 (d) осуществляют реакцию 1,21 г (5 ммоль) альфа-этинил-(5,6,7,8-тетрагидро-3,5,5,8, 8-пентаметил-2-нафталин)метанола с 1,62 г (5,1 ммоль) морфолина 4-йодобензойной кислоты получают 423 мг (20% целевого амида с точкой плавления 122 - 123oC.
Пример 43. 5-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2-нафтил)-1-пропинил]2-тиофенметилкарбоксилат.
Аналогично примеру 32 осуществляют реакцию 1,21 г (5 ммоль) альфа-этинил-(5,6,7, 8-тетрагидро-5,5,8, 8-тетраметил-2-нафталин)метанола с 1,1 г (5 ммоль) 5-бром-2-тиофенметилкарбоксилата получают 371 мг (19%) целевого сложного метилового эфира с точкой плавления 84 - 85o C.
Пример 44. 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-3, 5, 5, 8, 8-пентаметил-2-нафтил)-1-пропинил]метилбензоат.
Аналогично примеру 11 (d) осуществляют реакцию 1,28 г (5 ммоль) альфа-этинил-(5,6,7,8-тетрогидро-3,5,5,8, 8-пентаметил-2-нафталин)метанола [полученного в примере 37 (d)] с 1,5 г (5,5 ммоль) 2-гидрокси-4-йодометилбензоата получают 739 мг (36%) целевого продукта с точкой плавления 112 - 113oC.
Пример 45. 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-3, 5,5,8,8-пентаметил-2-нафтил)-1-пропинил]бензойная кислота.
Аналогично примеру 12 (b), исходя из 600 мг (1,5 ммоль) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-3,5,5,8,8- пентаметил-2-нафтил)-1-пропинил] метилбензоата, получают 132 мг (23%) целевой кислоты с точкой плавления 88 - 89oC.
Пример 46. 2-гидрокси-4-[3-гидрокси-3-(3-метокси-5,6,7,8-тетрагидро-5,5,8, 8- тетрамил-2-нафтил)-1-пропинил]метилбензоат.
(a) 2-бром-3-гилрокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталин
В трехгорлую колбу вводят последовательно 36,6 г (0,2 моль)
2,5-дихлор-2,5-диметилгексана, 34,6 г (0,2 моль) 2-бромфенола и 400 мл дихлорметана. При 0oC добавляют небольшими количествами 26,6 г (0,2 моль) AlCl3 и перемешивают до
прекращения выделения газа (бурная реакция). Выливают реакционную среду в воду, декантируют органическую фазу, промывают водным раствором бикарбоната натрия, сушат на сульфате магния, выпаривают.
Остаток очищают хроматографией на колонке с двуокисью кремния, элюируют смесью этилацетата и гептана (10-90). После выпаривания растворителей получают 20,6 г (36%) целевого фенола.
(b) 2-бром-3-метокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталин
В трехгорловую колбу вводят 720 мг (24 ммоль) гидрида натрия (80% в масле) и 20 мл диметилформамида, добавляют по каплям
раствор 5,7 г (20 ммоль) 2-бром-3-гидрокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталина в 75 мг диметилформамида и перемешивают до прекращения выделения газа. Затем добавляют 1,5 мл (24 ммоль)
йодометана и перемешивают при комнатной температуре 2 ч. Выливают реакционную среду в воду, экстрагируют простым этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния, выпаривают.
Полученный остаток растирают в гептане, фильтруют. Получают 5,5 г (93%) 2-бром-3-метоки-5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталина с точкой плавления 70 - 71oC.
(c)
3-метокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2- нафталинкарбоксальдегид
По способу, аналогичному примеру 11 (a), исходя из 5,3 г (17,8 ммоль) 2-бром-3-метокси-5,6,7,8-тетрагидро-5,5,8,
8-тетраметилнафталина, получают 3,5 г (80%) целевого альдегида с точкой плавления 125 - 126oC.
(d) Альфа-триметилсилилэтинил-(3-метокси-5,6,7,8-тетрагидро-5,5,8,
8-тетраметил-2-нафталин)метанол
Аналогично примеру 11 (b) осуществляют реакцию 3,21 г (13 ммоль) 3-метокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинкарбоксальдегида с одним
эквивалентом триметилсилилацетиленида лития и получают 4,4 г (99%) ожидаемого спирта в форме желтого масла.
(e) Альфа-этинил-(3-метокси-5,6,7,8-тетрагидро-5,5,8,
8- тетраметил-2-нафталин)метанол
Аналогично примеру 11 (c), исходя из 4,4 г (12,7 ммоль) альфа-триметилсилилэтинил-(3-метокси-5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафталин)метанола,
получают 1,15 г (33%) целевого продукта.
(f) 2-гидрокси-4-[3-гидрокси-3-(3-метокси-5,6,7,8-тетрагидро- 5,5,8,8-тетраметил-2-нафтил)-1-пропинил]метилбензоат
Аналогично примеру
11 (d) осуществляют реакцию 1,15 г (4,2 ммоль) альфа-этинил-(3-метокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин) метанола с 1,21 г (4,64 ммоль) 2-гидрокси-4-йодометилбензоата и получают 1,36 г
(76%) целевого продукта с точкой плавления 125 - 126oC.
Пример 47. 2-гидрокси-4-[3-гидрокси-3-(3-метокси-5,6,7,8- тетрагидро-5,5,8, 8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота.
По способу, аналогичному примеру 12 (b), исходя из 1,1 г (2,6 ммоль) 2-гидрокси-4-[3-гидрокси-3-(3-метокси-5,6,7,8-тетрагидро-5,5, 8,8- тетраметил-2-нафтил)-1-пропинил]метилбензоата, получают 890 мг (84%) целевой кислоты с точкой плавления 225 - 228oC.
Пример 48. 4-[3-гидрокси-3-(4, 4-диметилтиохроман-6-ил)-1-пропинил]бензойная кислота.
(a) 4-[3-гидрокси-3-(4,4-диметилтиохроман-6-ил)-1-пропинил] метилбензоат
По способу, аналогичному примеру 11 (d),
реакцией 1,4 г (6 ммоль) альфа-этинил-(4,4-диметил-6-тиохроман)метанола с 1,6 г (6 ммоль) 4-йодометилбензоата получают 1,5 г (68%) целевого сложного эфира в форме оранжевого масла.
(b) 4-[3-гидрокси-3-(4,4-диметилтиохроман-6-ил)-1-пропинил]бензойная кислота
По способу, аналогичному примеру 12 (b), исходя из 1 г (2,7 ммоль) 4-[3-гидрокси-3-(4,
4-диметилтиохроман-6-ил)-1-пропинил]метилбензоата, получают 450 мг (47%) целевой кислоты с точкой плавления 147 - 149oC.
Пример 49. 4-[3-гидрокси-3-(4, 4-диметилтиохроман-7-ил)-1-пропинил]бензойная кислота.
(a) 4-[3-гидрокси-3-(4,4-диметилтихроман-7-ил)-1-пропинил]метилбензоат
По способу, аналогичному примеру 11 (d),
реакцией 2 г (8,6 ммоль) альфа-этинил-(4,4-диметил-7-тиохроман)метанола с 2,25 г (8,6 ммоль) 4-йодометилбензоата получают 1,8 г (57%) целевого сложного эфира в форме желтого масла.
(b) 4-[3-гидрокси-3-(4,4-диметилтиохроман-7-ил)-1-пропинил] бензойная кислота
По способу, аналогичному примеру 12 (b), исходя из 1,2 г (3,3 ммоль), 4-[3-гидрокси-3-(4,
4-диметилтиохроман-7-ил)- 1-пропинил]метилбензоата, получают 300 мг (26%) целевой кислоты с точкой плавления 151 - 153oC.
Пример 50. 3-метил-4-[3-гидрокси-3-(5,6,7, 8-тетрагидро-5,5,8,8-тетраметил-2- нафтил)-1-пропинил]метилбензоат.
(a) 3-метил-4-йодобензойная кислота
В трехгорлую колбу вводят 20 г (0,132 моль 3-метил-4-аминобензойной
кислоты и 175 мл серной кислоты (20%). При -10oC добавляют по каплям раствор 11,9 г (0,172 моль) нитрита натрия в 50 мл воды и перемешивают в течение 2 ч. Этот раствор вводят по каплям
через пипетку, охлаждаемую до -5oC, в раствор 35 г (0,211 моль йодистого калия, 35,2 г (0,185 моль) йодистой меди и 175 мл серной кислоты (20%). Перемешивают в течение 8 ч, фильтруют
реакционную среду, растворяют полученное твердое вещество в этилацетате, промывают водой, затем раствором сульфита натрия, сушат на сульфате магния, выпаривают. Получают 24,4 г (70%)
3-метил-4-йодобензойной кислоты с точкой плавления 205 - 210oC.
(b) 3-метил-4-йодометилбензоат
В колбу вводят 24,4 г (0,093 моль) 3-метил-4-йодобензойной кислоты,
250 мл метанола и добавляют по каплям 2,5 мл концентрированной серной кислоты. Нагревают с обратным холодильником в течение 12 ч, выпаривают реакционную среду, поглощают этилацетатом и водой,
декантируют органическую фазу, сушат на сульфате магния, выпаривают. Остаток растирают в метаноле, фильтруют и получают 21,9 г (85%) целевого сложного метилового эфира с точкой плавления 58 - 59oC.
(c) 3-метил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил]метилбензоат
По способу, аналогичному примеру 11 (d), реакцией 2,4 г (10
ммоль) альфа-этинил-(5,6,7,8-тетрагидро-3,5,5,8,8-пентаметил-2- нафталин)метанола с 2,7 г (10 ммоль) 3-метил-4-йодометилбензоата получают 3,2 г (83%) целевого сложного эфира с точкой плавления 130
- 131oC.
Пример 51. 3-метил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро- 5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота.
По способу, аналогичному примеру 12(b), исходя из 2,2 г (5,6 ммоль) 3-метил-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8- тетраметил-2-нафтил)-1-пропинил] метилбензоата, получают 1,5 г (71%) 3-метил-4[3-гидрокси-3-(5,6,7, 8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)- 1-пропинил]бензойной кислоты с точкой плавления 189 - 190oC.
Пример 52. 2-хлор-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8, 8- тетраметил-2-нафтил)-1-пропинил]бензойная кислота.
(а) 2-хлор-4-йодобензойная кислота
По способу, аналогичному примеру 50 (а), исходя из 10 г (58,3 ммоль)
2-хлор-4-аминобензойной кислоты, получают 14,26 г (86%) 2-хлор-4-йодобензойной кислоты.
(b) 2-хлор-4-йодометилбензоат
По способу, аналогичному примеру 50 (b), исходя из 13,9
г (49,2 ммоль) 2-хлор-4-йодобензойной кислоты, получают 11,52 г (79%) целевого сложного метилового эфира в форме масла.
(c) 2-хлор-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8- тетраметил-2-нафтил)-1-пропинил метилбензоат
По способу, аналогичному примеру 11 (d), реакцией 1,2 г (5 ммоль) альфа-этинил-(5,6,7,8-тетрагидро-3,5,5,8,8-пентаметил- 2-нафталин)метанола с
1,6 г (5 ммоль) 2-хлор-4-йодлометиилбензоата получают 1,7 г (83%) целевого сложного эфира в форме масла каштанового цвета.
(d) 2-хлор-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8- тетраметил-2-нафтил)-1-пропинил]бензойная кислота
По способу, аналогичному примеру 12 (b), исходя из 1,7 г (4,1 ммоль) 2-хлор-4[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,
8- тетраметил-2-нафтил)-1-пропинил] метилбензоата, получают 730 мг (44%) 2-хлор-4-[3-гидрокси-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)- пропинил]бензойной кислоты с точкой плавления 145
- 148oC.
Пример 53. 2-ацетокси-4-[3-ацетокси-3-(5,6,7,8-тетрагидро- 5,5,8,8-тетраметил-2-нафтил)-1-пропинил]-бензойная кислота.
В колбу вводят 500 мг (1,3 ммоль) 2-гидрокси-4-[3-гидрокси- 3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил] бензойной кислоты, 10 мл пиридина и добавляют по каплям 150 мкл (1,56 ммоль) уксусного ангидрида. Перемешивают при комнатной температуре в течение 2 ч, выпаривают досуха реакционную среду, поглощают остаток водой, подкисляют до pH 4, экстрагируют простым этиловым эфиром, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния, элюируют простым этиловым эфиром и получают 230 мг (39%) 2-ацетокси-4-[3- ацетокси-3-(5,6,7,8-тетрагидро-5,5,8, 8-тетраметил-2-нафтил)- 1-пропинил] бензойной кислоты с точкой плавления 113 - 115oC.
Пример 54. 4-[3-гидрокси-3-(3-трет.тутил-4-пропилоксифенил)- 1-пропинил] метилбензоат.
(а) 3-трет.бутил-4-пропилоксибромбензол
По способу, аналогичному примеру 46 (b), реакцией 4,58 г (0,02 ммоль) 3-трет. бутил-4-гидроксибромбензола с 2,2 мл (0,
022 ммоль) 1-йодопропана получают 4,7 г (87%) 3-трет.бутил-4-пропилоксибромбензола в форме бесцветного масла.
(b) 3-трет.бутил-4-пропилоксибензальдегид
По способу,
аналогичному примеру 11 (а), исходя из 4,5 г (16,6 ммоль) 3-трет.бутил-4-пропилоксибромбензола, получают 3,65 г (100%) целевого альдегида в форме слегка желтого масла.
(c) Альфа-триметилсилилэтинил-(3-трет.бутил-4-пропилоксибензол) метанол.
По способу, аналогичному примеру 11 (b), реакцией 3,6 г (16,4 ммоль) 3-трет.бутил-4-пропилоксибензальдегида с одним эквивалентом триметилсилилацетиленида лития получают 5,2 г (100%) целевого спирта в форме бесцветного масла.
(c) Альфа-этинил-(3-трет.бутил-4-пропилоксибензол)метанол
По способу, аналогичному примеру 11 (c), исходя из 5,1 г (14,1 ммоль) альфа-триметилсилилэтинил-(3-трет.бутил-4-пропилоксибензол) метанола, получают после хроматографии на колонке с двуокисью кремния,
элюирования смесью дихлорметана и гептана (60-40), 3,3 г (80%) альфа-этинил-(3-трет.бутил-4-пропилоксибензол)метанола в форме желтого масла.
(e) 4-[3-гидрокси-3-(3-трет.
бутил-4-пропилоксифенил)-1- пропинил] метилбензоат
По способу, аналогичному примеру 11 (d), реакцией 3,3 г (13,4 ммоль) альфа-этинил-(3-трет. бутил-4-пропилоксибензол) метанола с 3,8 г (13,4
ммоль) 2-гидрокси-4-йодометилбензоата получают 4,4 г (83%) 4-[3-гидрокси-(3-трет. бутил-4-пропилоксифенил)-1-пропинил] метилбензоата в форме масла темно-каштанового цвета.
Пример 55. 4-[3-гидрокси-3-(3-трет.бутил-4-гексилоксифенил)-1- пропинил] метилбензоат.
(а) 3-трет.бутил-гексилоксибромбензол
По способу, аналогичному примеру 46 (b), реакцией 4,58 г (0,
02 ммоль) 3-трет. бутил-4-гидроксибромбензола с 3,3 мл (0,022 ммоль) 1-йодгексана получают 6 г (97%) 3-трет-бутил-4-гексилоксибромбензола в форме бесцветного масла.
(b)
3-трет.бутил-4-гексилоксибензальдегид
По способу, аналогичному примеру 11 (а), исходя из 5,9 г (18,8 ммоль) 3-трет.бутил-4-гексилоксибромбензола, получают 4,9 г (100%) целевого альдегида в
форме слегка желтого масла.
(c) Альфа-триметилсилилэтинил-(3-трет.бутил-4-гексилоксибензол) метанол
По способу, аналогичному примеру 11 (b), реакцией 4,8 г (18,3 ммоль)
3-трет. бутил-4-гексилоксибензальдегида с одним эквивалентом триметилсилилацетиленида лития получают 6,6 г (100%) целевого спирта в форме бесцветного масла.
(d)
Альфа-этинил-(3-трет.бутил-4-гексилоксибензол)метанол
По способу, аналогичному примеру 11 (c), исходя из 6,6 г (18,3 ммоль) альфа-триметилсилилэтинил-(3-трет.бутил-4-гексилоксибензол)
метанола, получают после хроматографии на колонке с двуокисью кремния, элюирования смесью дихлорметана и гептана (60-40), 4,3 г (81%) альфа-этинил-(3-трет.бутил-4-гексилоксибензол)метанола в форме
желтого масла.
(e) 4-[3-гидрокси-3-(3-трет. бутил-4-гексилоксифенил)-1- пропинил] метилбензоат
По способу, аналогичному примеру 11 (d), реакцией 3,8 г (13,2 ммоль)
альфа-этинил-(3-трет. бутил-4-гексилоксибензол) метанола с 3,7 г (13,7 ммоль) 2-гидрокси-4-йодометилбензоата получают 4 г (69%) 4-[3-гидрокси-3-(3-трет. бутил-4-гексилоксифенил)-1-пропинил]
метилбензоата в форме масла темно-каштанового цвета.
Пример 56. В этом примере приведены различные конкретные составы на основе соединений по изобретению.
А
- оральное введение
(a) Таблетка - 0,2 г, г:
Соединение, полученное в примере 7 - 0,001
Крахмал - 0,114
Дикальцийфосфат - 0,020
Двуокись кремния - 0,020
Лактоза - 0,030
Тальк - 0,010
Стеарат магния - 0,005
(b) Питьевая суспензия в ампулах 5 мл, г:
Соединение, полученное в примере 3 - 0,001
Глицерин
- 0,500
Сорбит 70% - 0,500
Сахаринат натрия - 0,010
Метилпарагидроксибензоат - 0,040
Ароматическое соединение, достаточное количество
Очищенная вода,
достаточное количество для 5 мл
(c) таблетка 0,8 г, г:
Соединение примера 6 - 0,500
Предварительно желатинизированный крахмал - 0,100
Микрокристаллическая целлюлоза
- 0,115
Лактоза - 0,075
Стеарат магния - 0,010
(d) Питьевая суспензия в ампулах 10 мл, г:
Соединение примера 2 - 0,200
Глицерин - 1,000
Сорбит 70%
- 1,000
Сахаринат натрия - 0,010
Метилпарагидроксибензоат - 0,080
Ароматическое соединение, достаточное количество
Очищенная вода, достаточное количество для - 10
мл
B-топическое нанесение
(a) мазь, г:
Соединение примера 9 - 0,020
Миристат изопропила - 81,700
Жидкое вазелиновое масло - 9,100
Двуокись кремния
("Аэрозил 200", продаваемая фирмой ДЕГУССА) - 9,180
(b) мазь, г:
Соединение примера 10 - 0,300
Белый вазелин, фармакопея - 100
(c) крем вода-в-масле, неионный,
г:
2-гидрокси-4-[3-гидрокси-3-(3-трет. бутил-4-гидроксифенил)-1- пропинил] бензойная кислота - 0,100
Смесь эмульсионных спиртов ланолина, восков и масел ("безводный эйцерин",
продаваемый фирмой БДФ) - 39,900
Метилпарагидроксибензоат - 0,075
Пропилпарагидроксибензоат - 0,075
Стерильная деминерализованная вода, достаточное количество для - 100
(d) лосьон, г:
Соединение примера 8 - 0,100
Полиэтиленгликоль (PEG400) - 69,900
Этанол 95% - 30,000
(e) гидрофобная мазь, г:
Соединение примера 7 - 0,
300
Миристат изопропила - 36,400
Силиконовое масло ("родорзил 47v300", продаваемое фирмой РОН-ПУЛЕНК) - 36,400
Пчелиный воск - 13,600
Силиконовое масло ("Абил 300
000 ост", продаваемое фирмой ГОЛДШМИДТ) - 100
(f) крем масло-в-воде, неионный, г:
Соединение примера 3 - 1,000
Цетиловый спирт - 4,000
Моностеарат глицерина - 2,
500
Стеарат PEG 50 - 2,500
Масло семян растения Butyrosperum Parkii - 9,200
Пропиленгликоль - 2,000
Метилпарагидроксибензоат - 0,075
Пропилпарагидроксибензоат - 0,075
Стерильная деминерализованная вода - 100
Авторы провели ряд исследований по биологической активности и токсичности различных представителей
соединений формулы (1). Результаты тестов сведены в нижеследующую табл. 1.
Тест F9 является основным тестом для определения ретиноидной активности соединения. В этом тесте измеряют концентрацию, обеспечивающую 50% максимального ответа (CAD50), причем выбранный маркер показывает активность активатора плазминогена (Strickland et col., Cancer Research, 43, 268-5272, нояб. 1983).
Два следующих теста - "ухо мыши" и "вагинальная дифференциация у крысы" - являются фармакологическим тестом ретиноидов in vivo, протоколы этих тестов описаны в примерах 57 и 58.
Последний тест табл.1 является тестом, оценивающим тератогенность ретиноидов, протокол этого теста описан в примере 59.
Известно, что ретиноиды в большей или меньшей степени тератогенны, поэтому в области ретиноидов исследования ученых были направлены на поиск компромисса между их эффективностью (биологической активностью) и токсичностью, такой как тератогенность.
Такой компромисс найден с помощью предлагаемых соединений, которые имеют хорошую биологическую активность или благоприятное соотношение эффективности и токсичности.
Пример 57.
1. Название исследования - оценка активности CD после одноразового нанесения на ушную раковину мыши BALB/C
2. Цель - первичный скрининг in vivo для
оценки потенциальной биологической активности ретиноидов после местного применения.
3. Принцип. Ретинойная кислота при одноразовом местном применении у мыши (hairless) вызывает дозозависимую ответную реакцию эпидермической пролиферации, с максимальной реакцией через 4 дня после нанесения ("Retinoic acid provokes a regeneration-like proliferativ respons in murine epidermis", Arch Dermatol Res., 1992, 284; 418-423).
Эта воспалительная компонента ответной реакции, вызванной местным применением ретиноидов, используется для оценки их потенциальной биологической активности в рамках первичного скрининга.
CD270, растворенная в ацетоне, после одноразового местного нанесения на ушную раковину мыши вызывает воспалительную реакцию, которая выражается в клинически выраженной эритеме и отечности, изменяемой с помощью одитестирования. Утолщение ушной раковины начинается спустя 48-72 ч после применения и достигает максимума на 5 - 7-й день. DE50 CD14 (трансретиноидная кислота), растворенная в ацетоне, составляет 0,05% (предварительное исследование Cird Galderma MIT005), а DE50 CD270, растворенная в ацетоне состав 0,005% (предварительное исследование Cird Galderma SPR9033).
4. Тест на животных. Для этого теста используются мыши Balb/c, самки, (Iffa credo, Франция), в возрасте 8 недель. Эта родственная линия мышей выбрана из-за более чувствительной ответной реакции, чем линия мышей OF1, при индуцировании отека ушной раковины в результате местного применения ретиноидов (предварительное исследование MIT003).
Перед проведением исследования мыши прошли акклиматизацию в течение 10 дней.
Животные, имевшие аномалии, ранения и рубцы (шрамы) на правой ушной раковине, были изъяты из исследования.
В ходе исследования мыши содержались в поликарбонатной клетке "типа I". Они идентифицировались с помощью этикеток, прикрепленных на клетку, с указанием номера животных, номера опыта, кода тестируемого соединения и дозы.
Условия среды идентичны условиям содержания в виварии SOP.0110.R03.
5. Экспериментальные группы (табл. 2).
6. Обработка. Тестируемые продукты растворяют в ацетоне (ацетон для спектроскопии Merck) непосредственно перед применением.
20 мкл тестируемого продукта или одного вектора наносят с помощью пипетки на внутреннюю поверхность правого уха каждого животного.
Лаборант удерживает мышь до тех пор, пока продукт не проникнет в слуховой проход.
7. Измерение отечности. Обозначают JO - день обработки, толщину правого уха измеряют с помощью микрометра (одитест Kroplin) на J3, J4, J5, J6, J7 и J10.
Для каждого момента и для каждого животного измерения толщины (ушной раковины) сведены в "листок измерений одитестирования".
8. Наблюдение за животными. В ходе опытов животные, у которых была отмечена ответная воспалительная реакция на уровне ушной раковины (сильное шелушение, корки) или ухудшение общего состояния (прострация, пилоэрекция), подверглись эутаназии в соответствии с процедурой SOP008.R01.
9. Результаты. В каждой обработанной группе и для каждого момента регистрации изменения толщины ушной раковины выражались в среднем проценте (± половина) утолщения по сравнению со средней величиной в контрольной группе, которой вводили только вектор. Эти результаты приведены в сводной таблице, и для каждой протестированной группы вычерчивается кривая кинетики отечности.
Результаты утолщения ушной раковины (среднее значение ± половина) в тестируемой группе и в группе положительного контроля заносят в информационную карточку теста банка данных ACCESS.
10. Допустимые значения результатов. Результаты не учитывались (опыт признавался недействительным), если среднее значение в контрольной положительной группе ниже 60% или выше 130%, и/или если среднее значение утолщения в группе, которой вводился вектор, ниже 18 или выше 24.
Пример 58. Протокол исследования.
Протокол N 91110/1.
1. Название исследования. Оценка антикератинизационной активности CD*, применяемого орально, на модели "вагинального эпителия крысы".
2. Цель исследования. Выявление активности веществ, применяемых орально, на дифференциацию вагинального эпиталия крысы.
3. Введение. Терапевтическая активность ретионоидов в случаях нарушения кератинизации эпидермиса, может быть частично объяснена их антикератинизационными свойствами.
Одно из ранних исследований воздействия витамина A на слизистые оболочки показало наличие антиэстрогенного эффекта на слизистую поверхность ротовой области самок макаки-резус (Ziskin D.E. Interrelation of large perenteral doses of estrogen and vitamin A and their effect on oral mucosa. Am. J. Orthod, oral Surg 1943 29, 163).
Позже была установлена подобная антиэстрогенная активность на слизистой поверхности влагалища у взрослых крыс, подвернутых овариэктомии (Kahn, R.H. Antifolliculoid activity of vitamin A. 1950 Science 111, 516).
Geiger J.M. и Weiser H. использовали взрослых крыс с дефицитом витамина A, подвергнутых овариэктомии для установления модели скрининга ретиноидов (Rat vaginal epithelium assy for ascreening retionoid. Pharmocol Skin. 1989, 3, 141).
Так как последняя модель достаточно сложна в применении (отсутствие животных самого раннего возраста и проведение овариэктомии), мы решили использовать крыс, не достигших половой зрелости, и вызвать ороговение вагинального эпителия, вызывая псевдоэструс введением эстрадиола.
Предварительное исследование CIRD GALDERMA RVE 003 показывает, что подкожное введение бензоата эстрадиола в дозе 5 мг/кг ведет к ороговению вагинального эпителия крысы, не достигшей половой зрелости.
Это ороговение выявляется присутствием корнеоцитов в жидкости после промывания влагалища. Содержание корнеоцитов достигает 90-100% спустя 72 ч после введения эстрадиола и сохраняется на этом уровне в течение 3-4 дней.
CD 137 (13-цис ретинойная кислота), введенная орально, сокращает содержание корнеоцитов с максимальной активностью спустя 24 часа после введения (Исследования AIRD GALDERMA RVE005 и RVE009).
Исследование CIRD GALDERMA RVE014 показывает, что DE50 CD137, после двух оральных введений с интервалом 6 ч, составляет приблизительно 10 мг/кг.
Авторы отмечают при этом тестировании сокращение содержания кортеоцитов в вагинальной промывной жидкости как показателя биологической активности синтезированных производных витамина A и других веществ. 13-цис ретинойная кислота используется в качестве контрольного позитивного вещества с дозой 30 мг/кг при 2-х кратном введении по 15 мг/кг с интервалом 7 часов.
4. Место испытания. CIRD GALDERMA, Sophia Antipolis, 06565 VALBONNE, Cedex, France (Франция).
5. Лабораторные методы. Настоящее исследование осуществлялось в соответствии с обычными экспериментальными методами (BPE) и действующими методами CIRD GALDERMA (M-CIRD).
Любое отклонение от стандартного протокола согласуется со старшим научным сотрудником.
6. Схема исследования (см. табл. 3).
7. Тестируемые вещества.
7.1 Продукт в качестве вектора (носителя) 25%-ый водный раствор Кремофора EL для инекций.
7.2 Тестируемое вещество и продукт в качестве положительного контроля. Определенные количества продукта, взятого в качестве положительного контроля, и тестируемого вещества суспендируют в кремофоре, непосредственно перед использованием (BPE PA 005/3).
7.3 Анализ. Предварительно определяют идентичность и чистоту продуктов, их относительную растворимость и стабильность в водном растворе кремофора.
7.4 Хранение. Если не дано особых указаний (выдерживание в атмосфере аргона и т. д. ), тестируемые и сходные соединения хранят в течение всего исследования в темноте при температуре приблизительно 4oC в закрытых флаконах из темного стекла.
8. Животные - условия содержания
- внешняя среда
8.1 Животные. Для опытов использовались самки крыс OFA (IFFA CREDO, Франция) в возрасте 28 дней на момент начала опытов.
Самочувствие животных контролировалось в виарии при поступлении крыс и в течение акклиматизации (BPE ANI003/3).
Животные были разделены на экспериментальные группы произвольно.
Каждое животное идентифицировалось с помощью этикетки, помещенной на клетку, на которой указывался номер, название и доза тестируемого соединения, а также номер опыта.
Накануне инициации псевдо-экструса шерсть на спине животных выстригали для облегчения процедуры подкожного введения.
Перед обработкой животных выдерживали на голодной диете.
8.2. Содержание - внешние условия. Животные помещались в индивидуальные клетки "типа 2" из макролона, в качестве подстилки - древесные опилки, из которых удалена пыль и которые выдержаны в автоклаве.
Они получают ad libitym питание A04c от YAR и воду из водопроводной городской сети, ультрафильтрованную системой CIRD GALDERMA.
Температура внешней среды составляет 22±1oC при влажности 60±15%. Продолжительность освещения составляет 12 ч из 24, от 7 до 19 ч (BPE ANI005/2).
9. Индуцирование псевдоэструса. Ороговение вагинального эпидермиса было индуцировано подкожным введением в межлопаточную область бензоата эстрадиола (3-БЕНЗОАТ В-ЭСТРАДИОЛА фирмы SIGMA) в дозе 5 мг/кг в масляной суспензии сезама, из расчета 5 мл/кг. Соединение приготавливают непосредственно перед использованием.
10. Обработка. Обработку проводили путем введения продукта через зонд (BPE PA006/2, через 72 ч после введения эстрадиола.
Первую инъекцию осуществляют от 9 до 10 ч, а вторую - от 15 до 16 ч из расчета 10 мл/кг каждый раз. Поглощение из следуемых продуктов не контролировалось.
11. Вагинальное промывание. Вагинальное промывание осуществляют на следующий день, через 24 ч после первой инъекции.
Во влагалище вводят по каплям с помощью пипетки 100 мкл 0,5%-ного раствора метиленовой сини в физиологической сыворотке, затем раствор отсасывают и помещают в пробирку Эппендорфа (метод CIRD-M211/1).
12. Определение содержания корнеоцитов. Небольшое количество вагинального лаважа в растворе отбирают из пробирки Эппендорфа и помещают в камеру Malassez.
Подсчитывают число корнеоцитов, с одной стороны, и другие типы клеток (эпителиальные и многоядерные клетки), с другой стороны (метод CIRD-M211/1).
При K, означающем количество корнеоцитов, а Т - общее количество клеток, процентное содержание корнеоцитов определяется соотношением К*100/Т.
13. Анализ и объяснение результатов. Результаты групп тестируемых соединений и положительного контроля сравнивают с результатами контрольной группы, которой вводили вектор, с помощью теста t программного обеспечения RSE.
Результаты в группе выражают средним значением содержания корнеоцитов и регистрируются в этом виде в информативном листке теста.
Поскольку среднее значение негативного контроля близко 100, и является воспроизводимым и точным (незначительные индивидуальные отклонения), а результаты групп тестируемых соединений имеют относительно большие индивидуальные отклонения, то результаты групп тестируемых соединений не выражают в процентах от негативного контроля. Фактически, это уточнение не улучшает точность конечного результата.
14. Допустимые границы результатов. С учетом полученных результатов 12 опытов, проведенных в стандартных условиях настоящего протокола в течение приблизительно 6 мес, при последующем анализе, результаты не принимались в расчет, если среднее значение в контрольный негативной группе было ниже 90 и/или если среднее значение контрольной положительной группы было выше 50.
15. После тестирования. Среднее значение и стандартное отклонение от отрицательного и положительного контроля записывались в таблицу после каждого опыта, затем выводился график.
Пример 59. CERB-ПРОТОКОЛ N 91.02.04.01
Тератологический скрининг "ин виво", проведенный на мышах, при оральном введении
соединений.
1. Цель. Цель скрининга является исследование эмбриотоксического и/или плодотоксического эффекта, наведенного у мышей исследуемыми соединениями при их оральном введении в течение критического периода органогенеза, т.е. с 8-го дня (J8) по 12-й день (J12) беременности.
2. Методология. Исследования велись на самках мышей. Ведущая Линия O.C. D.E. 414, адаптированные 26 мая 1983 г.
Это исследование не входит в рамки Обычной Лабораторной Практики.
Используемые животные были получены в состоянии беременности и сразу же включались в испытания, без периода акклиматизации.
Операционные методы и методы наблюдения были теми же, что и в испытаниях тератогенеза (Сегмент II), за исключением того, что период приема тестируемых соединений и наблюдения более краток.
3. Тестируемые соединения. Данные, для заполнения заказчиком.
В карточки заполняются сведения о соединениях, и каждое соединение сопровождается аналитическим бюллетенем (на 1 соединение один листок).
Необходимое количество соединений.
Для проведения опытов по настоящему протоколу достаточно по 100 мг каждого соединения.
4. Общие характеристики опытов
4.1 Животные
Вид. Мыши C.D.O-1 E.O.P.S. (кроме Специфических Патогенных
Организмов).
Преимущественно использовались мыши другого вида этого типа, так как этот вид используется одновременно для исследований сегмента II и, кроме того, благодаря небольшим размерам он имеет определенные преимущества при осуществлении первичного-тератологического скрининга при введении оральным путем минимального количества тестируемого соединения.
Происхождение: Charles RIVER-76410 SAINT AUBIN LES ELEBEUF.
Пол: самки.
К началу исследований самки были беременные и первородящие.
Вес: при их поступлении вес самок колебался от 25 г до 30 г, приблизительно.
Количество. По крайней мере 120 беременных самок были разделены на 8 групп по 15 животных, из которых 1 отрицательная контрольная группа и 1 положительная контрольная группа.
Акклиматизация. Животные были получены на 5 день беременности (J5) и сразу же включены в испытания, не проходя акклиматизации. Критерием отбора животных являлось их общее состояние здоровья.
Распределение на партии: распределение на различные группы (партии) осуществлялось методом случайной выборки по критерию веса тела на 6 день беременности.
Идентификация. Индивидуальные клетки, в которых содержались животные, маркировались пикриновой кислотой.
Содержание животных. Животные содержались в индивидуальных клетках из МАКРОЛОНА SAFI стандартных размеров, с подстилкой из белых древесных стружек, обеспыленных и стерилизованных облучением.
Эти клетки помещались в кондиционированный виварий (19oC+1oC) при относительной степени влажности, поддерживаемой при 55+10%, кроме того, во время чистки воздух фильтровался и удалялся (не рециркулировался). Искусственный суточный цикл составлял 12 световых и 12 сумеречных часов.
Спаривание. Спаривание осуществлялось в Центре животноводства Charles RIVER. Самок оставляли в клетках с самцом в течение ночи. На следующее утро их разделяли. День появления влагалищной пробки у самок считался первым днем беременности (J1).
Питание. Корм - UAR A04-C10 (подвергнутый контролю). Каждая партия корма имела сертификат производителя. К отчету опыта прилагалась карточка питания.
Питье. Отфильтрованная вода из городской водопроводной сети подавалась, по необходимости, в поилки из поликарбоната с соском из нержавеющей стали.
Вода регулярно тестировалась на наличие нежелательных химических веществ и для осуществления микробиологического контроля. Забор воды осуществлялся каждые три месяца и отправлялся на анализ в Дирекцию Ветеринарных Служб в BOURGES.
Бюллетень анализа прилагается к отчету исследования.
Специальный анализ пищи и воды не проводился. Фактически, ни одна известная примесь не могла содержаться в таких количествах, которые могли бы повлиять на результаты опытов.
4.2. Ведение тестируемых соединений.
Лечение животных. Самкам вводили вещества для исследования оральным путем в течение основного периода органеза, т.е. с 8 по 12 день беременности, причем день появления вагинальной пробки считается первым днем беременности (J1).
Тестируемые соединения вводились животным, разделенным на группы, ежедневно утром путем кормления через желудочный зонд, используя соответствующую канюлю.
Дозировка. Водимая доза устанавливается из расчета веса конкретного животного, измеряемого ежедневно (табл. 4).
Вводимые соединения. Каждое соединение вводилось в виде суспензии в водном растворе кремофора 25/100. Животные отрицательного контроля получали только носитель в том же объеме, что и обработанные животные, которые получали тестируемые соединения.
Суспензии для введения животным в течение всего исследования приготавливались для каждой группы накануне первого дня обработки. Для этого определенное количество каждого тестируемого соединения смешивалось с минимальным количеством носителя до получения суспензии. Полученную суспензию переливали в мерную колбу и доводили до калибровочной метки носителем. В течение 20 минут суспензию подвергали обработке ультразвуком, затем переливали в химический стакан. При перемешивании магнитной мешалкой каждую суспензию разделяли на столько аликвотных частей, столько было дней обработок, и хранили в пластиковых флаконах, идентифицированных и закрытых с помощью алюминиевой фольги. Флаконы хранили в холодильнике в темноте при 4oC.
Перед обработкой каждую аликвотную часть обрабатывали ультрозвуком в течение 2 минут, затем перемешивали магнитной мешалкой в течение исследования лечения для введения однородной суспензии.
Стабильность вводимых соединений. Тестирование вводимых соединений на стабильность не входило в рамки настоящего исследования.
Контроль концентраций вводимых суспензий. Контроль концентраций вводимых суспензий не входил в рамки настоящего исследования.
Контроль за поглощением вводимых суспензий. Контроль степени абсорбции вводимых суспензий не входил в рамки настоящего исследования.
Вводимый объем. 10 мл/кг веса тела животного.
4.3. Взвешивание. Животные систематически взвешивались по следующей схеме:
6-й день беременности (J6),
с J8 по J12 - ежедневно,
J18, день забоя.
4.4 Наблюдение за животными
4.4.1. Во время опыта. Тщательный клинический контроль осуществляется один раз в день с J6 по J18. Данные контроля систематически заносились в листок
клинических наблюдений, заведенный на каждое животное.
Самки, у которых обнаруживались признаки абортирования или преждевременных родов, забивались в тот же день, и проводились исследования в рамках этого протокола.
4.4.2. После аутопсии. Всех выживших самок умерщвляли к J18 и делали кесарево сечение для изъятия плода. Умерщвление проводили путем субтотальной пункции крови из брюшной части аорты, после анестезии эфиром.
Исследование самок:
микроскопическое исследование основных органов брюшной полости;
количество и локализация на матке точек имплантации;
количество и локализации в матке живых и умерших плодов (преждевременно или с задержкой);
количество случаев рассасывания плода
(раннего или запоздалого).
Все органы брюшной полости, имеющие значительные макроскопические аномалии, консервировали в формалине Carson с целью дальнейшего паталогоанатомического исследования (сверх сметы).
Исследование плодов:
в анализе результатов принимались в расчет плоды любой продолжительности ношения;
в случае родов до умерщвления,
плоды, по мере возможности, подсчитываются и исследуются; по крайней мере, уточняется день абортирования.
В случае кесарева сечения проводят микроскопическое исследование плодов и
уточняются следующие сведения:
количество живых и мертвых плодов;
вес живых плодов;
внешнее морфологическое исследование плодов;
определение пола и исследование
внешних аномалей плодов при кратковременной консервации в 70o спирте.
После проведения исследований все плоды помещаются и хранятся в формальдегиде Carson до утверждения Заказчиком окончательного отчета исследований, затем уничтожаются.
5. Статистический анализ результатов. Результаты увеличения веса самок-матерей анализировались путем анализа разброса данных, повторяющихся во времени, с учетом фактором времени и обработок.
При статистически значимом результате обработки на фиксированную дату сравнивают средние значения в группах обработанных животных с контрольными группами, с помощью теста NEWMANN KEULS.
Сравнивают в целом соотношение родов, классифицированных как абортирование или умерщвление на J18, во всех обработанных группах одновременно с теми же показателями в контрольной группе, с помощью теста Khi2.
При статистически значимых результатах этого тестирования сравнивают это соотношение в каждой обработанной группе с этим соотношением в контрольной группе, с помощью того же теста.
Сравнивают в целом соотношение точек имплантирования, классифицированных как нормальные живые плоды, анормальные живые плоды, преждевременно умершие плоды, запоздало умершие плоды, рассасывание плодов; эти соотношения во всех обработанных группах сравнивают с этими данными в контрольной группе с помощью теста Khi2.
При статистически значимых результатах этого тестирования сравнивают эти соотношения в каждой обработанной группе с соотношениями в контрольной группе, с помощью этого же теста. Сравнивают средний вес плодов, одинаковых по срокам вынашивания, и средний вес группы живых плодов, с помощью анализа, учитывая факторы обработки и сроков вынашивания.
Соотношение плодов разного пола подсчитывается по срокам ношения плода, и результаты между группами сравнивают по критерию kruskhal и Wallis.
Соотношение
плодов подсчитывают по следующим формулам:

Ежедневные клинические наблюдения за самками-матерями и макроскопические исследования плодов и/или изъятых органов являются предметом обсуждения, однако статистически не анализировались.
6. Отчет. Все результаты, по мере их получения, были внесены в листки, классифицированные по номеру опыта.
В отчет испытаний входят все элементы и все наблюдения, полученные во время опытов, включая статистический
анализ и, особенно, следующие данные:
исследования животных;
изменения веса тела;
кинетика смертности;
результаты практических исследований в течение опытов,
проводимых на самках-матерях и плодах;
результаты всех макроскопических исследований;
результаты исследований внешних аномалий плодов.
Отчет в виде графика по каждому опыту оценивался заказчиком.
При соглашении сторон, окончательная версия отчета печатается CERB на французском языке и утверждается CIRD GALDERMA.
7. Гарантия качества. Гарантия качества гарантирует, что рабочие методы, свойственные этому типу исследований, соблюдались точно и периодически проверялись в течение года по принципу случайной выборки.
8. Хранение результатов. Протокол, возможные изменения (дополнения), вся переписка, необработанные и отчет хранятся в течение 10 лет в CERB -Chemin de Montifault - 18800 BAUGY.
Оставшиеся образцы тестируемых соединений возвращаются заказчику.
Гистологические блоки, пластины (мембраны) и другие гистологические материалы хранятся в гистологической лаборатории.
9. График опытов:
спаривание (GO);
диагностика беременности на следующий день после спаривания либо на первый день беременности (Gl);
отбор
беременных самок в CERB на 5-й день беременности (G5);
случайная выборка на G6 день беременности;
период орального введения соединений с G8 по G12 беременности;
умерщвление
выживших самок на G18 беременности;
некротическое исследование самок-мышей и плодов;
составление и печать графика-отчета испытаний;
комментарии заказчика;
Печать
окончательного отчета, утверждаемого обеими сторонами.
Реферат
Изобретение относится к новым пропинил-диароматическим соединениям, имеющим звено пропинила общей формулы (I)

в котором Ar представляет радикал, выбираемый среди радикалов следующей формулы:

где R1-H, -CH3, CH2OR6, -OR6 или -COR7; R6 • X - радикал формулы

или

R2 и R3-H, низший алкил с прямой или разветвленной цепью или -OR6 или вместе R2 и R3 образуют 5 или 6-членный цикл; R4-H или низший алкил или -OR6, R5 = R4, R6-H или низший алкил или -OR9, R7-H, низший алкил или OR8 или


Формула
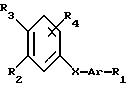
в которой Ar - радикал, выбираемый среди радикалов следующей формулы:

R1 - водород или радикал -CH3, или -CH2OR6, или -OR6, или COR7, или -S(O)tR9, где R5, R6, R7, R9 и t имеют нижеприведенные значения;
X - радикал общей формулы

или общей формулы

R10 и R11 определены ниже;
R2 и R3 - водород, низший алкил с прямой или разветвленной цепью или радикал -OR6 или R2 и R3, вместе взятые, могут образовывать со смежным ароматическим циклом цикл с 5 или 6 звеньями, в случае необходимости прерванный атом серы;
R4 - водород или низший алкил, или радикал -OR6;
R5 имеет такое же значение, как R4;
R6 - водород или низший алкильный радикал, или радикал COR9, где значения R9 определены ниже;
R7 - водород или низший алкильный радикал, или радикал -OR8, или радикал общей формулы

где R' и R'' - водород или низший алкил или, вместе взятые, образуют кислородсодержащий шестичленный гетероцикл;
R8 - водород или низший алкил с прямой или разветвленной цепью;
R9 - низший алкил;
R10 - водород или низший алкил, или радикал -OR6;
R11 - радикал -OR6;
при этом радикалы R10 и R11, вместе взятые, могут образовывать оксогруппу C = O,
а также их соли с щелочными или щелочноземельными металлами или цинком.
4-[3-оксо-3- (5,6,7,8-тетрагидро- 5,5,8,8-тетраметил -2-нафтил) -1-пропинил]метилбензоат;
4-[3-гидрокси -3-(5,6,7, 8-тетрагидро -5,5,8,8-тетраметил -2-нафтил)-1- пропинил]метилбензоат;
4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8-тетраметил -2-нафтил) -1-пропинил]бензойная кислота;
4- [3-оксо-3-(5,6,7,8 -тетрагидро-5,5,8,8-тетраметил -2-нафтил)-1-пропинил] бензойная кислота;
2- гидрокси-4-[3-оксо-3- (5,6,7,8-тетрагидро-5,5,8,8 -тетраметил-2-нафтил) -1-пропинил]бензойная кислота;
2-гидрокси-4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8 -тетраметил-2- нафтил)-1-пропинил] метилбензоат;
2- гидрокси-4-[3-гидрокси-3- (5,6,7,8-тетрагидро- 5,5,8, 8-тетраметил-2- нафтил)-1-пропинил]бензойная кислота;
2- гидрокси-4-[3-оксо-3- (3-трет-бутил-4-метоксифенил) -1-пропинил]бензойная кислота;
4- [1-оксо-3-(5,6,7,8-тетрагидро- 5,5,8, 8-тетраметил -2-нафтил)-2-пропинил] бензойная кислота;
4- [1-гидрокси-3-(5,6,7,8-тетрагидро -5,5,8,8-тетраметил -2-нафтил)-2- пропинил]бензойная кислота;
2-гидрокси-4- [3-гидрокси-3-(4,4 -диметилтиохроман-6-ил) -1-пропинил] метилбензоат;
2- гидрокси-4-[3-оксо-3- (4,4-диметилтиохроман-6-ил) -1-пропил]бензойная кислота;
4- [3-гидрокси-3-(3-трет-бутил -4-метоксифенил) -1-пропинил]бензойная кислота;
N-метил-4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8 -тетраметил -2-нафтил)-1-пропинил] -2-пиррол-метилкарбоксилат;
N-метил-4- [3-гидрокси-3-(5,6,7,8- тетрагидро-5,5,8,8 -тетраметил-2- нафтил)-1-пропинил] -2-пирролкарбоновая кислота;
4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8 -тетраметил-2-нафтил) -1-пропинил]-2- пирролметилкарбоксилат;
2-гидрокси-4- [3-гидрокси-3-(4,4 -диметилтиохроман-7-ил) -1-пропинил] -метилбензоат;
4- [1-гидрокси-3- (4,4-диметилтиохроман-6-ил) -2-пропинил]бензойная кислота;
2-гидрокси-4- [3-гидрокси-3-(4,4- диметилтиохроман-6-ил) -пропинил] бензойная кислота;
2-гидрокси-4- [3-гидрокси-3- (4,4-диметилтиохроман -7-ил)-1-пропинил] -бензойная кислота;
изомер (+) 4-[3-гидрокси-3- (5,6,7,8-тетрагидро-5,5,8,8 -тетраметил-2- нафтил)-1-пропинил] метилбензоата;
изомер (-) 4-[3-гидрокси-3- (5,6,7,8-тетрагидро- 5,5,8,8-тетраметил-2 -нафтил)-1-пропинил] бензойной кислоты;
изомер (+) 2-гидрокси-4-[3- гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8 -тетраметил-2-нафтил)-1-пропинил] метилбензоата;
изомер (-) 2-гидрокси-4-[3-гидрокси-3- (5,6,7,8-тетрагидро- 5,5,8,8-тетраметил-2-нафтил) -1-пропинил]бензойной кислоты;
изомер (-) 4-[3-гидрокси-3- (5,6,7,8-тетрагидро-5,5,8,8 -тетраметил-2- нафтил)-1-пропинил] метилбензоата;
изомер (-) 2-гидрокси-4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8 -тетраметил-2-нафтил) -1-пропинил]метилбензоата;
изомер (+) 4-[3-гидрокси-3- (5,6,7,8-тетрагидро -5,5,8,8-тетраметил -2-нафтил)-1-пропинил] бензойной кислоты;
изомер (+) 2-гидрокси-4-[3- гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8 -тетраметил-2-нафтил) -1-пропинил]бензойной кислоты;
2-гидрокси-4- [3-гидрокси-3-метил-3- (5,6,7,8-тетрагидро -5,5,8,8-тетраметил -2-нафтил)-1-пропинил] метилбензоат;
2-гидрокси-4- [3-гидрокси-3-метил -3-(5,6,7,8-тетрагидро -5,5,8,8 -тетраметил-2-нафтил)-1-пропинил] бензойная кислота;
2-метокси-4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8 -тетраметил-2- нафтил)-1-пропинил] бензойная кислота;
4- [3-гидрокси-3- (5,6,7,8-тетрагидро-5,5,8,8 -тетраметил-2- нафтил)-1-пропинил]бензальдегид;
4- [3-гидрокси-3-(5,6,7,8-тетрагидро -5,5,8,8-тетраметил -2-нафтил) -1-пропинил]бензилацетат;
4- [3-гидрокси-3-(5,6,7,8-тетрагидро -5, 5,8,8-тетраметил -2-нафтил) -1-пропинил]бензолметанол;
4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8-тетраметил -2-нафтил)-1-пропинил]толуол;
4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-3, 5,5,8,8 -пентаметил-2-нафтил) -1-пропинил]фенилацетат;
4- [3-гидрокси-3-(5,6,7,8- тетрагидро-3,5,5,8,8-пентаметил -2-нафтил)-1-пропинил]фенол;
4- [3-гидрокси-3-(5,6,7,8- тетрагидро-5, 5,8,8-тетраметил -2-нафтил)-1- пропинил]фенилсульфинилметан;
4- [3-гидрокси-3- (5,6,7,8-тетрагидро-5,5,8,8 -тетраметил-2-нафтил) -1-пропинил] фенилсульфонилметан;
N-этил-4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8 -тетраметил-2- нафтил)-1-пропинил] бензамид;
N, N'- диэтил-4-[3-гидрокси-3- (5,6,7,8-тетрагидро -5,5,8,8- тетраметил-2-нафтил) -1-пропинил]бензамид;
морфолид 4-[3-гидрокси-3- (5,6,7,8-тетрагидро-5,5,8,8 -тетраметил-2-нафтил) -1-пропинил]бензойной кислоты;
5-[3-гидрокси -3-(5,6,7,8-тетрагидро -5,5,8, 8-тетраметил -2-нафтил) -1-пропинил]-2- метилтиофенкарбоксилат;
2-гидрокси-4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-3,5,5,8,8 -пентаметил-2-нафтил) -1-пропинил]метилбензоат;
2-гидрокси-4- [3-гидрокси-3-[5,6,7,8 -тетрагидро-3,5,5,8,8- пентаметил-2-нафтил)-1-пропинил] бензойная кислота;
2-гидрокси-4- [3-гидрокси-3- (3-метокси-5,6,7,8 -тетрагидро-5,5,8, 8- тетраметил-2-нафтил) -1-пропинил]метилбензоат;
2-гидрокси -4-[3-гидрокси-3-(3- метокси-5,6,7,8-тетрагидро -5,5,8,8-тетраметил-2-нафтил) -1-пропинил]бензойная кислота;
4- [3-гидрокси-3-(4,4 -диметилтиохроман-6-ил) -1-пропинил] бензойная кислота;
4- [3-гидрокси-3-(4,4- диметилтиохроман-7-ил) -1-пропинил] бензойная кислота;
3-метил-4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8 -тетраметил-2-нафтил) -1-пропинил]метилбензоат;
3-метил-4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8 -тетраметил-2- нафтил)-1-пропинил] бензойная кислота;
2-хлор-4- [3-гидрокси-3-(5,6,7,8 -тетрагидро-5,5,8,8-тетраметил -2-нафтил)-1-пропинил] бензойная кислота;
2-ацетокси-4- [3-ацетокси-3-(5,6,7,8 -тетрагидро-5,5,8,8 -тетраметил-2- нафтил)-1-пропинил] бензойная кислота;
4- [3-гидрокси-3-(3-трет-бутил -4-пропилоксифенил)-1- пропинил]метилбензоат;
4-[3-гидрокси -3-(3-трет-бутил-4- гексилоксифенил) -1-пропинил]метилбензоат.

Комментарии