Катализаторы дегидрирования алканов на основе сульфидов - RU2734917C2
Код документа: RU2734917C2
Описание
Описание
Настоящее изобретение относится к применению катализаторов на основе сульфидов в процессах дегидрирования алканов до соответствующих алкенов.
В основном, каталитическое дегидрирование низших алканов является простой, но все же важной реакцией, которая может быть проиллюстрирована дегидрированием пропана до пропена в соответствии с реакцией:

При все возрастающем спросе на легкие олефины, то есть, низшие алифатические углеводороды с открытой цепью, имеющие углерод-углеродную двойную связь, возрастает важность каталитического дегидрирования. В частности, дегидрирование пропана и изобутана являются важными реакциями, коммерчески используемыми для производства пропилена и изобутилена соответственно. Пропилен представляет собой важный базовый химический строительный блок для пластиков и смол, и мировой спрос на пропилен неуклонно растет в течение десятилетий. Ожидается, что рост спроса на пропилен в скором времени будет равен или даже выше, чем спрос на этилен. Одним из основных применений изобутилена является использование в качестве исходного сырья при производстве простого метилтретбутилового эфира (МТВЕ).
Процесс, показанный выше, является эндотермическим и требует примерно 125 кДж/моль в качестве теплоты реакции. Таким образом, чтобы достичь разумной степени конверсии, процесс дегидрирования происходит при температуре примерно 600°С. Дегидрирование изобутена аналогично дегидрированию пропена во всех отношениях, кроме требования несколько более низкой температуры.
Существует 3-4 коммерческих способа для дегидрирования алканов, с использованием 3 различных катализаторов. Различия между этими способами касаются обеспечения теплоты реакции. Эти способы и катализаторы будут кратко описаны ниже.
a) Процесс Catdfin (Катофин) (Гудри)
Этот процесс характеризуется теплотой реакции, обеспечиваемой предварительным нагревом катализатора. Процесс Catofin осуществляют в 3-8 адиабатических реакторах с неподвижным слоем, с использованием катализатора из оксида хрома/оксида алюминия, содержащего примерно 20% масс. оксида хрома. Этот катализатор может быть дополнен инертным материалом, имеющим высокую теплоемкость, или, в качестве альтернативы, материалом, который будет избирательно сгорать или реагировать с образовавшимся водородом, так называемым тепловыделяющим материалом (HGM). Могут добавляться промоторы, такие как калий.
Процесс Catofin является очень хорошо зарекомендовавшим себя способом и по-прежнему является доминирующим промышленным процессом дегидрирования. Поскольку теплота реакции обеспечивается с помощью катализатора, используется последовательное выполнение операций, во время которого слой катализатора используется для дегидрирования. Затем газ удаляют и катализатор регенерируют/нагревают, а оксид Cr(VI) восстанавливают водородом. Наконец, этот слой перед другим дегидрированием продувают водяным паром.
b) Процесс Snamprogetti-Yarzintez (Снампрогетти-Ярсинтез)
Этот процесс представляет собой вариант вышеуказанного способа с псевдоожиженным слоем, с использованием двойных псевдоожиженных слоев, по одному на процесс и режим регенерации, причем катализатор циркулирует между ними. В эксплуатации находятся многочисленные установки, например, в бывшем Советском Союзе и в Саудовской Аравии.
Деактивация катализатора может быть обусловлена механическими причинами, напряжением, вызванным в процессе циклов нагревания - охлаждения, и твердофазными реакциями, такими как диффузия хрома в решетку оксида алюминия. Это, однако, является вторичным по отношению к желанию избавиться от хрома, что является реальной сложностью в этом процессе, поскольку токсичность хрома представляет собой проблему. Более конкретно, присутствие хрома в катализаторе делает его опасным для окружающей среды и здоровья при обращении с ним. Это тем более так, потому что оксид хрома(VI), CrO3, и соответствующие соединения хрома в степени окисления VI легко образуются при окислении катализатора. Таким образом, каждый вид обращения с катализатором во время производства, транспортировки, загрузки и разгрузки представляет собой потенциальную опасность, и при растущем спросе на способы дегидрирования желательно найти эффективные, менее токсичные катализаторы дегидрирования.
с) Процесс Oleflex (Олефлекс)
В процессе Oleflex используют катализаторы из благородных металлов, в частности, промотированный катализатор из Pt/Al2O3, в реакционной системе из 3-4 реакторов с подвижным слоем, причем катализатор непрерывно регенерируется в отдельном регенерационном контуре. Теплота реакции обеспечивается предварительным нагреванием потока углеводорода. Катализатор из благородного металла подвергается медленной деактивации. Таким образом, в процессе Oleflex катализатор опускается вниз в слое с радиальным течением. Внизу катализатор транспортируется в реактор регенерации, где углерод на катализаторе сжигается и платина повторно диспергируется с помощью обработки хлором. Регенерированный катализатор возвращается обратно в цикл в верхнюю часть реактора дегидрирования. Время цикла составляет до одной недели.
Благородный металл нанесен на носитель из оксида алюминия и является стабилизированным с помощью олова и, возможно, других промоторов. Платина является хорошим выбором катализатора с технической точки зрения и образует стабильные сплавы с оловом. Основной проблемой с этим типом катализаторов является высокая цена, которой в настоящее время противодействуют стремлением уменьшить содержание платины.
d) Процесс STAR
Процесс STAR® (STAR является аббревиатурой для STeam Assisted Reforming) представляет собой общепризнанную коммерческую технологию дегидрирования, которая имеет некоторые привлекательные характеристики.
В качестве разбавителя используют водяной пар, и процесс протекает в трубчатом реакторе, таком как установка для парового риформинга, размещенном в печи. Теплота реакции обеспечивается путем обжига с помощью природного газа. Катализатор представляет собой платину (Pt), нанесенную на шпинель ZnAl2O4. Цинк (Zn) и Pt образуют некоторые очень устойчивые сплавы. Некоторое осаждение углерода имеет место, и катализатор необходимо регенерировать каждые восемь часов. Этот процесс иногда рассматривается со вторым реактором, в котором происходит селективное сжигание водорода наряду с дальнейшим дегидрированием. Очевидно, здесь также используется катализатор из благородного металла.
Как и в описанном выше процессе Oleflex, проблемой в данном случае является стоимость благородного металла. Поэтому было бы желательно заменить благородный металл основным металлом, то есть, обычным и недорогим металлом.
В настоящее время установлено, что дегидрирование алканов возможно с использованием нового поколения катализаторов из сульфидов металлов, которые являются простыми в изготовлении и остаются в своей активной фазе во время работы. Эти сульфиды металлов представляют собой сульфиды металлов, выбранных из железа (Fe), кобальта (Со), никеля (Ni), меди (Cu), молибдена (Мо) и вольфрама (W) или любых комбинаций двух или нескольких металлов, выбранных из свинца (Pb), олова (Sn), Zn, Fe, Со, Ni, Cu, Мо и W.
Таким образом, настоящее изобретение относится к катализатору для дегидрирования алканов до алкенов, причем указанный катализатор содержит каталитически активный материал, нанесенный на носитель, где этот каталитически активный материал содержит сульфид металла (MeS), который является полупроводником, и где катализатор регенерируется в несколько стадий.
Регенерация включает в себя следующие реакции:
(a) превращение сульфида в сульфат и
(b) превращение углерода в оксиды углерода.
Обе реакции представляют собой высокоэкзотермичные реакции окисления. Чтобы избежать любого неконтролируемого изменения температуры, их предпочтительно проводят с использованием разбавленного воздуха.
Таким образом, стадии регенерации включают окисление в разбавленном воздухе для превращения сульфида в соответствующий сульфат и превращение обратно в сульфид путем восстановления в разбавленном водороде, содержащем некоторое количество сероводорода. Предпочтительно, окисление проводят при температуре между 350 и 750°С, наиболее предпочтительно, при температуре между 400 и 600°С.
Кроме того, изобретение относится к способу дегидрирования алканов до соответствующих ненасыщенных алкенов и водорода (Н2), включающему в себя контактирование алкана с катализатором, нанесенным на носитель, причем указанный катализатор содержит сульфид металла (MeS), нанесенный на носитель, и содержит Fe, Со, Ni, Cu, Мо или W или любую комбинацию из двух или нескольких металлов, выбранных из Pb, Sn, Zn, Fe, Со, Ni, Cu, Мо и W.
Дегидрирование проводят при температуре между 450 и 650°С, предпочтительно, при температуре между 520 и 620°С.
Дегидрирование проводят при давлении от на 0,9 бар ниже давления окружающей среды до на 5 бар выше давления окружающей среды, предпочтительно при давлении окружающей среды или при давлении от на 0,5 бар ниже давления окружающей среды до давления окружающей среды.
В этом способе подаваемый газ содержит серу в количестве, определенном так, что
(a) равновесная реакция

(b) содержание серы является достаточным, чтобы избежать образования карбида на всем протяжении реактора.
Причиной присвоения определенной полупроводниковой характеристики сульфиду металла является то, что интенсивное изучение заявителем катализаторов на основе сульфидов металлов, выбранных из Fe, Со, Ni, Cu, Мо и W и комбинации двух или нескольких металлов, выбранных из Pb, Sn, Zn, Fe, Со, Ni, Cu, Мо и W, показали, что активность и селективность этих катализаторов являются функцией как фазы серы, которая определяется газовой композицией, в первую очередь, соотношением H2/H2S, так и температуры. В связи с этим было обнаружено, что катализаторы, или, более конкретно, сульфиды металлов, являются полупроводниками.
Как указывалось выше, два класса катализаторов на сегодняшний момент нашли значительное промышленное применение: один, применяемый в процессе Oleflex, имеет в основе платину и, следовательно, является довольно дорогим. Другой, который используется в процессе Catofin, основан на оксиде хрома, который является токсичным и поэтому нежелательным с точки зрения здоровья и окружающей среды. Сульфидные катализаторы согласно изобретению могут применяться как в процессе Oleflex, так и в процессе Catofin, а также в новых технологических решениях.
Катализаторы дегидрирования широко описаны в данной области техники. Так, патент США US 3.560.060 А описывает катализатор дегидрирования, содержащий смеси сульфида никеля и сульфида вольфрама, сульфида кобальта и сульфида молибдена или сульфида никеля и сульфида молибдена, нанесенные на носители из адсорбента, такие как оксид алюминия, диоксид кремния - оксид алюминия и диоксид кремния - диоксид циркония. Также раскрывается способ дегидрирования изобутана до изобутена при температурах от 370 до 565°С и давлениях ниже атмосферного.
Патент США US 3.718.607 А описывает катализатор дегидрирования, содержащий сульфид никеля или сульфид кобальта или их комбинации, нанесенные на активированный оксид алюминия. Кроме того, раскрывается способ дегидрирования алканов до алкенов при температуре от 550 до 625°С с добавлением серы к потоку исходного сырья.
Европейский патент ЕР 0568303 А2 раскрывает катализатор дегидрирования органических соединений, таких как алканы, до алкенов, который содержит сульфидированную комбинацию никеля и свинца на обработанном основанием некислотном носителе. Сера добавляется к потоку исходного сырья для поддержания селективности катализатора, но не раскрывается, что это добавление сдвигает равновесие в сторону сульфида металла.
В патенте США US 3.387.054 А описывается катализатор дегидрирования алканов, например, содержащий сульфид никеля и сульфид молибдена, нанесенный на активированный оксид алюминия, содержащий 5% диоксида кремния. Также раскрывается способ дегидрирования алканов до алкенов с помощью H2S в качестве побочного продукта с использованием катализатора из сульфида металла.
Международная заявка WO 01/70655 A1 также описывает катализатор дегидрирования, содержащий сульфиды металлов на носителе, такие как сульфиды W, Ni, Mo, Cu и Co или их смеси. Также раскрывается способ дегидрирования для превращения алканов в алкены с помощью H2S в качестве побочного продукта при температурах от 300 до 650 °С и давлениях от 0,05 до 50 бар.
Как таковое, использование катализаторов из сульфидов металлов для дегидрирования алканов известно в данной области техники. Например, способы получения алкенов из алканов с использованием катализаторов из сульфидов металлов описываются в патенте Великобритании GB 488.651 A (1938) и в патенте США US 3.280.210 A (1966). Совсем недавно в статье Guowei Wang, Chunyi Li и Honghong Shan (ACS Catal. 4 (4), 1139 - 1143, 2014) описано использование катализаторов из сульфида металла, нанесенных на диоксид кремния, в которых металл представляет собой Zn, Cu, Mn , Mo, Fe, Co или Ni, для дегидрирования изобутана до изобутена. Заявляют, что эти катализаторы являются высокоэффективными при активации связей С-Н для дегидрирования изобутана, и сообщают, что эффективность дегидрирования лучше, чем эффективность двух коммерческих катализаторов Cr2O3/Al2O3 и Pt-Sn/Al2O3. Однако сульфиды металлов, описанные в статье Guowei с соавт., демонстрируют очень низкую устойчивость, как показано в статье на Фигуре 2, поскольку изначально высокая каталитическая активность очень резко падает после первой точки измерения, то есть, примерно через час.
Ряд находящихся на рассмотрении китайских заявок на патент касаются дегидрирования алканов и катализаторов для этой цели. Так например, китайский патент CN 104607168 A описывает катализаторы и способ получения для каталитического дегидрирования алканов, где катализаторы содержат компоненты A и B, причем компонент A выбирается из оксидов Fe, Zn, Cu, Co или Ce, а компонент B выбирается из SiO2, Al2O3, ZrO2, Ga2O3 и MgO. Заявляют, что эти катализаторы имеют высокую степень превращения и высокую селективность по олефину, что делает их полезными в реакторе с циркулирующим псевдоожиженным слоем.
Китайский патент CN 104069778 A раскрывает реактор с псевдоожиженным слоем и способ дегидрирования алканов с помощью катализатора, содержащего активный ингредиент из элемента Fe, Co, Ni, Cu, Zn, Mo, W или Mn в одном или нескольких смешанных оксидах или композитных оксидах, где носителем является SiO2, Al2O3, ZrO2, CeO2, CaO, P2O5, MgO или Nb2O5. Очень похожий реактор и способ описываются в китайском патенте CN 104069779 A.
Китайский патент CN 104607168 A описывает катализатор каталитического дегидрирования алканов и способ его получения, где эти катализаторы содержат компоненты A и B, в которых компонент A выбирается из оксидов одного или нескольких элементов из La, Fe, Zn, Cu, Co или Ce, а компонент B выбирается из смешанного оксида или композитного оксида, образованного из одного или нескольких материалов из SiO2, Al2O3, ZrO2, Ga2O3 и MgO.
Китайский патент CN 103861619 A раскрывает сульфидные катализаторы для дегидрирования алканов, содержащие активный компонент и носитель, где активным компонентом является один или несколько элементов, выбранных из Fe, Co, Ni, Cu, Zn, Mo, W и Mn. Содержание активного компонента в катализаторе (рассчитанного как оксид, имеющий наивысшую валентность) составляет 0,5 – 40 % масс., носитель представляет собой смешанный оксид или композитный оксид, образованный из одного или нескольких материалов, выбранных из SiO2, Al2O3, ZrO2, La2O3, CeO2, CaO, P2O5, Nb2O5 и MgO, а содержание носителя составляет 60 - 99,5 % масс. Активный компонент на поверхности сульфидного катализатора дегидрирования алканов существует в сульфидной форме.
В процессах дегидрирования, таких как процесс Oleflex, обычной практикой является добавление в процесс значительных количеств серы для защиты материала. Таким образом, на в основном стандартной установке будет использоваться количество диметилдисульфида, соответствующее концентрации H2S в газовой фазе, составляющей 70 м.д.
Свойства сульфидных катализаторов, применяемых в соответствии с настоящим изобретением, суммированы в Таблице 1 ниже.
Таблица 1
Свойства сульфидных катализаторов

В равновесном состоянии большинство сульфидов металлов будет оставаться в виде сульфидов, в частности, если концентрация серы превышает 100 м.д. Кроме того, они, в частности, близки к нестехиометрическому соединению с границей раздела фаз, а концентрация дефектов сильно зависит от соотношения H2S/H2. Делается ссылка на фазовые диаграммы и термодинамические данные, приведенные в издании «Landolt Bornstein Numerical Data and Functional Relationship in Science and Technology New Series, eds. O. Madelung and W. Martienssen. Group IV: Macroscopic Properties of Matter». Термодинамические обсуждения основаны на HSC Chemistry for Windows, Outokompi, Finland (2002).
Некоторые из сульфидов будут иметь диапазон гомогенности, в частности, Со, Cu, Ni и Fe. Дефекты могут относиться к активным центрам и металлоподобному поведению по отношению к переносу водорода.
Таблица 2
Парциальное давление H2S на границе раздела сульфид - карбид при 600°С
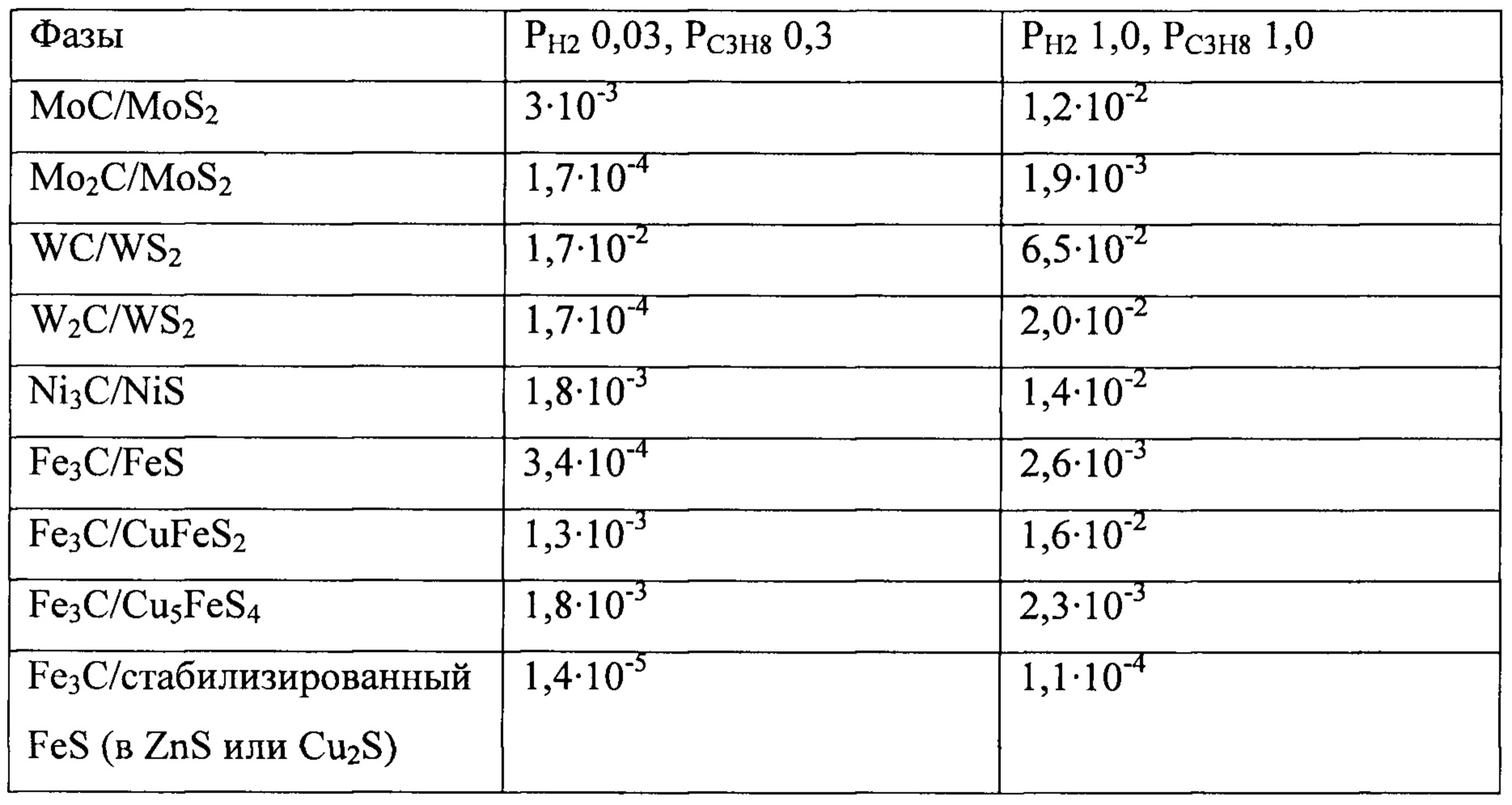
Некоторые данные в приведенной выше Таблице 1 взяты из Pearce et al., Rev. Mineral Geochem. 61, 127-180 (2006). Следует отметить, что некоторые из сульфидов железа являются металлоподобными. Энергия запрещенной зоны полупроводника будет уменьшаться при повышении температуры, как обсуждается O'Donnell and Chen, Appl. Phys. Lett. 58, 2924-2926 (1991), и увеличиваться для малых частиц, как рассчитано Kane, Cohen and Silbey, Chem. Mater. 8, 1919-1924 (1996), для малых частиц PbS. Также следует озвучить зависимость от формы для энергии запрещенной зоны для MoS2 и WS2, в частности, для монослоев, где сообщалось о значениях, близких к нулю (Splendiani et al., Nano Lett. 10, 1271-1275 (2010), Mak et al, Phys. Rev. Lett. 105, 136805 (2010) и Zhao et al., ACS Nano 7 (1), 791-797 (2013)).
Mo, W и Fe могут образовывать карбиды, обычно при уровнях H2S около 1000 м.д. при 600°С, смотрите Таблицу 2 выше. При более низких температурах требуется меньше серы; обратите внимание на реакции


МоС существует только при очень высоких температурах. Возможно, это также может относиться к WC. Железо образует смешанные сульфиды с несколькими элементами. Трехкомпонентные соединения с Cu являются хорошо известными, см. Таблицу 2 выше. В CuFeS2 (халькопирите) и Cu5FeS4 (борните) оно находится в степени окисления 3 (~Fe2S3), но известно стабильное соединение (CuFe2S3, кубанит), в котором железо находится в степени окисления 2. Доступных термодинамических данных нет. В последней строке в Таблице 2 предполагалась стабилизация, соответствующая стабилизации в борните.
Столбец 2 приведенной выше Таблицы 2 соответствует случаю Catofin, в то время как столбец 3 главным образом является характеризующим для случая Oleflex.
Традиционные катализаторы гидроочистки основаны на сульфидах Co/Ni-Mo/W, а активные фазы рассматриваются как MoS2, содержащий некоторое количество Со, что приводит к серным дефектам на краях кристаллитов. Другими словами, существует синергетический эффект между Со и Мо.
Реакции серы и углеводородов составляют область, которая подвергалась большим исследованиям. Сера известна как яд для ряда катализаторов, но также хорошо известно, что многие реакции могут контролироваться путем осторожного добавления серы. Паровой риформинг метана является лишь одним примером, в котором небольшие количества серы подавляют образование углерода (J.R. Rostrup-Nielsen, J. Cat., 85, 31-43 (1984)). В промышленной практике часто добавляют серу для защиты технологического оборудования, например, при паровом крекинге углеводородов или в процессе дегидрирования Oleflex. Патент США US 5.489.722 Resasco с соавт.описывает процесс, в котором для дегидрирования используются частично замещенные поверхности из никеля, и может быть вполне возможным, что сера также контролирует селективность процесса дегидрирования, катализируемого платиной.
Универсальность сульфидных катализаторов велика. В дополнение к реакциям дегидрирования, обсуждаемым выше, известно также, что сульфидные катализаторы катализируют ряд реакций синтеза различных углеводородов, таких как реакции синтеза метанола и высших спиртов. Эти реакции обычно протекают в диапазоне 300°С при повышенном давлении, а активная фаза может представлять собой карбид. Реакция конверсии водяного газа (WGS) также катализируется сульфидными катализаторами и происходит при гораздо более высокой скорости, чем реакции синтеза углеводородов. Коммерческие катализаторы для реакции WGS являются доступными на протяжении десятилетий.
Изобретение далее иллюстрируется в следующих примерах. Первые примеры (1-14) иллюстрируют получение сульфидных катализаторов в соответствии с изобретением, а примеры 15-20 описывают последующие испытания некоторых из этих катализаторов.
Испытания катализатора проводились в трубчатом реакторе, специально построенном для применения при высокой температуре, такого как риформинг смолы, и поэтому он подходит для испытаний, требующих газов, содержащих сульфиды. Реактор имеет длину примерно 100 см и внутренний диаметр 10 мм. Катализаторы, которые подлежат испытаниям, помещают на решетку, соединенную с термопарой, которая измеряет температуры на входе. Изотермический контроль обеспечивается с помощью четырех независимых зон нагрева. Испытания проводятся с использованием 10% пропана в смеси с азотом, к которой могут быть добавлены водород, азот и H2S. Типичная концентрация H2S может варьироваться от 50 м.д. до 0,5%, хотя низкие значения связаны с некоторой неточностью вследствие пристеночных эффектов. Это означает, что соотношение H2S/H2 может варьироваться от 10-3 до 10-1. Возможное образование карбида требует отдельного рассмотрения, как это сделано позже для Fe и Мо.
Типичными условиями испытаний были температура между 560 и 600°С, с использованием 5 г катализатора, подлежащего испытанию, во фракциях 2-5 мм. Некоторые из газов для испытаний перечислены в Таблице 3 ниже. В идеальном случае давление должно быть низким, но вследствие случаев падения давления в системе типичное давление находилось между 0,2 и 0,3 МПа.
Таблица 3
Составы газов для испытаний

В Таблице 3 расход измеряется в нл/ч; ост. представляет собой остальную часть; вх = на входе; вых = на выходе
Цикл испытаний, как правило, заканчивается газом 1 при 600°С, и оценка активностей будет основана на их эффективности при этом условии.
Газы на выходе анализируют с помощью газовой хроматографии.
Контрольные испытания, проведенные как с пустым реактором, так и с 5 г носителя катализатора, дали тот же неожиданный результат, что образование СН4, С2Н4 было почти исключительно благодаря пустому реактору, а также что некоторое дегидрирование имело место, скорее всего, на стенке реактора. Для типичных условий испытаний, 560-600°С, количество пропена соответствовало, в пересчете на углерод, количеству С1 и С2. Расчеты диссоциации вследствие пустого пространства в реакторе хорошо согласуются с экспериментальными результатами. Следует отметить, что эти гомогенные реакции, протекающие при повышенных температурах, скорее всего, являются причиной пониженной селективности промышленных реакций, в частности, процесса Oleflex, в котором газ перед входом в реактор дегидрирования предварительно четыре раза нагревают до температуры выше 600°С. Каталитическая реакция является высокоселективной; на самом деле, когда результаты корректируются с учетом вклада пустого реактора, достигается селективность, близкая к 100%. Образование этана было констатировано в присутствии катализаторов. Однако по сравнению с количеством, которое должно было бы присутствовать при образовании равновесного количества, гидрирование этилена было далеко не полным, указывая на то, что этилен является первичным продуктом из гомогенной диссоциации пропана.
Первые испытания проводились с использованием реактора с гильзой для термопары, изготовленной из того же материала. Испытания показали значительную сульфидную коррозию. Таким образом, в другой реактор и гильзу для термопары было внесено изменение. Этот реактор имел внутренний диаметр 15 мм, по сравнению с диаметром 10 мм в предыдущем. Это увеличило количество C1 и С2 на 50%.
Полученный результат был скорректирован с учетом селективности 50% в пустом реакторе. Таким образом, в пересчете на углерод, углерод в C1 и С2 оказывается равным пропилену, образованному с помощью пустого реактора. Показатель для катализатора была скорректирован с учетом этого вклада.
Катализаторы, испытываемые в примерах 14-18, представляют собой сульфиды Cu, Fe, Ni, Со и Мо соответственно. В примере 19 тестируют традиционный катализатор Со-Мо.
Пример 1
13,9 г Cu(NO3)2⋅2,5H2O растворяют в 37,5 г воды. Раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Затем образец промывают в 100 мл 2%-ного раствора K2CO3 в течение 1 часа (доска для прокатывания). После этого образец дважды промывают 200 мл воды (каждый раз по одному часу, доска для прокатывания). Образец отфильтровывают и сушат в течение ночи при 100°С.
Пример 2
13,9 г Cu(NO3)2⋅2,5Н2О растворяют в 37,5 г воды. Раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Стадию пропитывания повторяют еще раз с последующей сушкой и прокаливанием.
Затем образец промывают в 100 мл 2%-ного раствора K2CO3 в течение 1 часа (доска для прокатывания). После этого образец дважды промывают 200 мл воды (каждый раз по одному часу, доска для прокатывания). Образец отфильтровывают и сушат в течение ночи при 100°С.
Пример 3
24 г Fe(NO3)3⋅9Н2О растворяют в 37,5 г воды. Раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Затем образец промывают в 100 мл 2%-ного раствора K2CO3 в течение 1 часа (доска для прокатывания). После этого образец дважды промывают 200 мл воды (каждый раз по одному часу, доска для прокатывания). Образец отфильтровывают и сушат в течение ночи при 100°С.
Пример 4
24 г Fe(NO3)3⋅9H2O растворяют в 37,5 г воды. Раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Стадию пропитывания повторяют еще раз с последующей сушкой и прокаливанием.
Затем образец промывают в 100 мл 2%-ного раствора K2CO3 в течение 1 часа (доска для прокатывания). После этого образец дважды промывают 200 мл воды (каждый раз по одному часу, доска для прокатывания). Образец отфильтровывают и сушат в течение ночи при 100°С.
Пример 5
24 г Fe(NO3)3⋅9H2O и 0,34 г KNO3 растворяют в 37,5 г воды. Раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Стадию пропитывания повторяют еще раз с последующей сушкой и прокаливанием.
Пример 6
16,5 г FeSO4⋅7H2O и 0,9 г KHSO4 растворяют в 37,5 г воды. Раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Стадию пропитывания повторяют еще раз с последующей сушкой и прокаливанием.
Пример 7
17.3 г Ni(NO3)2⋅6H2O растворяют в 37,5 г воды. Раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Затем образец промывают в 100 мл 2%-ного раствора K2CO3 в течение 1 часа (доска для прокатывания). После этого образец дважды промывают 200 мл воды (каждый раз по одному часу, доска для прокатывания). Образец отфильтровывают и сушат в течение ночи при 100°С.
Пример 8
17.4 г Со(NO3)2⋅6H2O растворяют в 37,5 г воды. Раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Затем образец промывают в 100 мл 2%-ного раствора K2CO3 в течение 1 часа (доска для прокатывания). После этого образец дважды промывают 200 мл воды (каждый раз по одному часу, доска для прокатывания). Образец отфильтровывают и сушат в течение ночи при 100°С.
Пример 9
9 г MoO3 растворяют в 37,5 г раствора NH4OH. Полученный раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Затем образец промывают в 100 мл 2%-ного раствора KNO3 в течение 1 часа (доска для прокатывания). После этого образец дважды промывают 200 мл воды (каждый раз по одному часу, доска для прокатывания). Образец отфильтровывают и сушат в течение ночи при 100°С.
Пример 10
17,5 г H2WO4 растворяют в 37,5 г раствора NH4OH. Полученный раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Затем образец промывают в 100 мл 2%-ного раствора K2CO3 в течение 1 часа (доска для прокатывания). После этого образец дважды промывают 200 мл воды (каждый раз по одному часу, доска для прокатывания). Образец отфильтровывают и сушат в течение ночи при 100°С.
Пример 11
14,5 г SnCl2⋅2H2O растворяют в 37,5 г раствора NH4OH. Полученный раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Затем образец промывают в 100 мл 2%-ного раствора K2CO3 в течение 1 часа (доска для прокатывания). После этого образец дважды промывают 200 мл воды (каждый раз по одному часу, доска для прокатывания). Образец отфильтровывают и сушат в течение ночи при 100°С.
Пример 12
18 г Zn(NO3)2⋅6H2O растворяют в 37,5 г раствора NH4OH. Полученный раствор используют для пропитывания 50 г носителя (pv=1 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Затем образец промывают в 100 мл 2%-ного раствора K2CO3 в течение 1 часа (доска для прокатывания). После этого образец дважды промывают 200 мл воды (каждый раз по одному часу, доска для прокатывания). Образец отфильтровывают и сушат в течение ночи при 100°С.
Пример 13
7,9 г MoO3 растворяют в 37,5 г NH4OH (25%). Этот раствор используют для пропитывания 50 г носителя (pv=0,75 мл/г). Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Затем образец пропитывают 7,7 г Со(NO3)2⋅6Н2О и 0,8 г KNO3, растворенного в 37,5 г воды. Образец прокатывают в течение 1 часа, сушат в течение ночи при 100°С и прокаливают при 500°С в течение 2 часов (период повышения температуры 4 часа).
Пример 14
Результаты, катализаторы на основе Cu
Эти катализаторы были испытаны ранее, как указано в патенте США US 3.275.705, в соответствии с которым была использована температура между 649 и 660°С. Настоящие испытания проводили при значительно более низкой температуре с использованием разбавленной смеси 10% пропана в азоте.
Катализатор, приготовленный в соответствии с Примером 1, испытывали после восстановления и сульфидирования. Результатом для Си была активность 72 нл/ч/кг катализатора для пропилена при температуре 600°С. При 560°С активность составляла 35 нл/ч/кг катализатора, соответствуя энергии активации 1,13 эВ.
Результаты, представленные в патенте США US 3.275.705, составляют до 320 нл/ч/кг катализатора. При этой температуре ожидается значительный термический крекинг. Если результаты настоящего испытания экстраполируют до 660°С, то получают активность 190 нл/ч/кг катализатора. Однако это не начальная активность. Результаты испытаний, приведенные в патенте США US 3.275.705, соответствуют короткой продолжительности и, следовательно, сообщают о начальной активности и не сообщают о сроке службы. Кроме этого, содержание Cu в катализаторе, приготовленном в соответствии с Примером 1, может быть легко увеличено.
Порошковая рентгеновская дифракция отработанного образца показала дигенит Cu1,78S со средним размером кристаллитов 18 нм.
Пример 15
Результаты, катализаторы на основе Fe
Катализаторы из железа, изготовленные в соответствии с Примером 3, запускаются в работу в виде оксида и медленно восстанавливаются и активируются во время первого испытания по дегидрированию пропана (PDH). После второго испытания они просто регенерируются, а затем подвергаются воздействию пропаносодержащего газа. FeSO4 восстанавливается до FeS, отмечается пик СО2, и в течение следующих 12 часов активность увеличивается, после чего она медленно снижается. Этот цикл повторяется дважды. Интегрирование пика СО2 в течение примерно 75 часов давало 0,3 г углерода, что соответствовало 6% на катализаторе, и еще 3% превращенного углерода оказывалось на катализаторе. Активность катализатора спустя 100 часов составляла 265 нл/ч/кг катализатора для пропилена. Отработанный катализатор показал присутствие FeS с размером кристаллитов 10 нм.
12%-ный катализатор из железа был получен из сульфатов, которые во время запуска были восстановлены до сульфидов. Это дало довольно стабильную активность для пропилена, составляющую 160 нл/ч/кг катализатора.
В газе с низким содержанием серы активность снизилась для пропилена до 40 нл/ч/кг катализатора. Термодинамика показывает, что карбид железа, Fe3C, мог бы быть стабильной фазой при условии, что уровень H2S будет ниже ~100 м.д. Действительно, порошковая рентгеновская дифракция показала, что железо находилось в карбидной фазе Fe3C с размером кристаллитов 100 нм.
Sun с соавт. (Chem. Eng. J. 244, 145-151 (2014)) исследовали сульфатированный железный катализатор, нанесенный на оксид алюминия, при 560°С, и обнаружили начальную активность 70 нл/ч/катализатор. После 6 циклов регенерации она снизилась до 50 нл/ч/катализатор. Исследование изобутана Wang с соавт. для Fe, нанесенного на диоксид кремния, при температуре 560°С, дало начальную активность 17 нл/ч/катализатор. Условия были довольно близкими к равновесию.
Пример 16
Результаты, катализаторы на основе Ni
Катализатор из никеля, полученный в соответствии с Примером 7, показал высокую активность и в некоторой степени зависимость активности от уровня содержания серы. Конечная активность составляла для пропилена 330 нл/ч/катализатор при 600°С. При 560°С была обнаружена активность 140 нл/ч/катализатор. Это соответствует энергии активации 1,3 эВ. Это чрезвычайно высокая активность, выявленная близко к температуре плавления NiS. Испытания с газом 4 проводились в условиях, когда может происходить фазовый переход в системе NiS. Фазовая диаграмма показывает некоторую сложность выше 800°К. Конверсия пропана до водорода и пропена изменит соотношение H2S/H2 и тем самым изменит стабильность для определенной фазы.
После регенерации отработанный катализатор с помощью порошковой рентгеновской дифракции показал фазу NiO с размером кристаллитов 17 нм Для никеля Wang с соавт.обнаружили активность по изобутилену, составляющую 15 нл/ч/кг катализатора при 560°С.
Пример 17
Результаты, катализаторы на основе Со
Катализатор из кобальта был изготовлен в соответствии с Примером 8. Его запускали в газе с низким содержанием серы. Однако после ряда фазовых переходов активность постепенно увеличивалась. В газе с низким содержанием серы состояние Со больше похоже на CoS или должен был образоваться Co9S8. При высокой концентрации серы может образовываться Co3S4. Сульфид кобальта имеет область гомогенности. Отмечают, что CoSO4 реагирует с пропаном, давая СО2. Примерно 3% конвертированного углерода остается на катализаторе.
Конечная активность при 600°С составляла 170 нл/ч/кг катализатора для пропилена. При 560°С активность составляла 70 нл/ч/кг катализатора, соответствуя энергии активации 0,7 эВ. Регенерированный отработанный катализатор показал присутствие Co3O4 с размером кристаллитов 10 нм.
В связи с дегидрированием изобутана над катализатором из CoS в китайских публикациях Wang с соавт. приводили соответственно 42 и 15 нл/ч/кг катализатора для изобутилена. В настоящем эксперименте серу добавляли в виде сульфата аммония к катализатору Co/Al2O3, тогда как Wang с соавт. также использовали совместную подачу с H2S.
Пример 18
Результаты, катализаторы на основе Мо
Катализатор на основе Мо был изготовлен в соответствии с Примером 9. Во время испытаний была проверена поверхность раздела карбид-сульфид. В течение времени до 140 часов эксперименты проводились с низким (~100 м.д.) уровнем содержания серы. Наблюдается быстро снижающаяся активность, вероятно, из-за образования карбида молибдена. При 150 часах уровень серы увеличивается, а сульфидная фаза стабилизируется вместе с активностью. Активность при крекинге выше фонового уровня для катализатора на основе сульфида/карбида. Максимальная активность составляла для пропена 60 нл/ч/катализатор при 600°С.
Отработанный катализатор исследовали с использованием порошковой рентгеновской дифракции. Никаких фаз молибдена не наблюдалось, хотя химический анализ показал содержание молибдена в 7,25% масс.
Пример 19
Результаты, катализаторы на основе Со-Мо
Подвергали испытаниям 5 г катализатора, приготовленного, как описано в Примере 14. Испытание продолжалось 3 недели и включало 10 регенераций и тесты с температурами от 520 до 640°С. Уровень содержания серы в любом случае не был ниже 1000 м.д. Таким образом, образование карбида может быть исключено.
Начальная активность составляла 260 нл/ч/катализатор, а конечная активность составляла 210 нл/ч/кг катализатора при 600°С. При других температурах соответствующие максимальные активности составляли 104 нл/ч/катализатор при 580°С, 100 нл/ч/катализатор при 560°С и 42 нл/ч/катализатор при 520°С. Это соответствует энергии активации 0,27 эВ.
При более низких температурах активность снижалась медленнее, чем при высокой температуре. Были проведены эксперименты вплоть до 64 часов, в ходе которых наблюдалось снижение активности от 1,31% до 0,57% С3Н6.
Таблица 4 ниже показывает, что существует связь между энергией запрещенной зоны и активностью, но также в некоторой степени между энергией активации и запрещенной зоной, в частности, для более низких активностей. Это могло бы иметь смысл, принимая во внимание то, что для высоких активностей давать ограничения по скорости могут механизмы, отличающиеся от доступных электронов/дырок, такие как простые ограничения переноса. Катализаторы на основе железа и никеля и, возможно, также кобальта и меди, будут иметь достаточную активность для работы в процессе Oleflex. В случае работы в процессе Catofin они могут быть менее подходящими. Может потребоваться предварительное восстановление, чтобы избежать потери пропана при восстановлении сульфата до сульфида. Тем не менее, активность для железа и никеля довольно велика, так что, возможно, может потребоваться меньше металла и, следовательно, меньше сульфата.
Таблица 4 Обобщение результатов

Катализаторы медленно деактивируются в результате осаждения углерода и поэтому их необходимо регенерировать, подобно коммерчески доступным катализаторам на основе платины или оксида хрома. Регенерация происходит путем обжигания в разбавленном воздухе, то есть, 1% О2 и 99% N2, при 560-600°С.
Регенерация сульфидов Fe, Со, Ni и Cu с использованием N2 с 1% О2 приведет к образованию соответствующего сульфата, по крайней мере для Fe и Со, тогда как Ni и Cu, скорее всего, будут образовывать оксиды, что подтверждено порошковой рентгеновской дифракцией отработанных образцов. Сульфиды Мо и W превращаются в оксиды. В связи с этим необходимо принимать в расчет возможную потерю активного материала в виде летучего оксида (MoO3). Чтобы сохранить серу на катализаторе, регенерация должна начинаться при 400°С с последующим удалением углерода при 600°С.
Повторное сульфидирование с использованием смеси Н2 и H2S в N2 часто проводилось перед испытаниями на дегидрирование. В некоторых случаях это было опущено, в результате чего вначале отмечалось большое образование СО2. Некоторые сульфаты, в частности MnSO4, показали хорошую селективность в отношении окислительного дегидрирования пропана.
Регенерация заставляет катализатор пройти через две стадии фазового перехода: от сульфида до сульфата или оксида и снова обратно в сульфид. Фазовые переходы включают не только структурные преобразования, но также изменения объема. Таким образом, в случае перехода NiS в NiSO4 происходит расширение на 250%. Ожидается, что спекание/диспергирование системы достигнет стационарного состояния после ряда регенераций.
Во время дегидрирования на катализаторе осаждается некоторое количество углерода, что приводит к медленной деактивации. Дегидрирование происходит в течение нескольких часов с последующей регенерацией катализатора в N2, содержащем 1% О2. За этим обычно следует сульфидирование или прямое возвращение к дегидрированию. В этом случае имеет место прямая реакция между сульфатом и пропаном, что приводит к большому образованию СО2.
Носитель обрабатывают разбавленным щелочным соединением и затем промывают для удаления кислотных центров. Предпочтительно, разбавленное щелочное соединение представляет собой карбонат калия или любое другое соединение калия.
В экспериментах носитель погружали в разбавленный раствор карбоната калия с последующей двухстадийной промывкой в деминерализованной воде, получая в результате содержание калия 0,15% масс. Кислотные центры были удалены, но не обязательно все из них. Результаты показывают влияние давления на образование углерода, а также они указывают на то, что образование углерода происходит из пропилена, а не из пропана. Кроме того, результаты показывают, что во время регенерации происходит полное удаление углерода.
Реферат
Настоящее изобретение относится к катализатору для дегидрирования алканов до алкенов, причем указанный катализатор содержит каталитически активный материал, нанесенный на носитель, где каталитически активный материал содержит сульфид металла (MeS), который является полупроводником, металл сульфида металла включает Fe, Co, Ni, Cu, Mo или W или любую комбинацию из двух или нескольких металлов, выбранных из Pb, Sn, Zn, Fe, Co, Ni, Cu, Mo и W, катализатор выполнен с возможностью регенерации, и стадии регенерации включают окисление в разбавленном воздухе, превращение сульфида в соответствующий сульфат и превращение обратно в сульфид путем восстановления в разбавленном водороде, содержащем некоторое количество сероводорода. Также настоящее изобретение относится к способу дегидрирования алканов до соответствующих ненасыщенных алкенов и водорода (H). Техническим результатом настоящего изобретения является использование нового поколения катализаторов из сульфидов металлов, которые являются простыми в изготовлении и остаются в своей активной фазе во время работы. 2 н. и 7 з.п. ф-лы, 4 табл., 19 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ дегидрирования углеводородов

Комментарии