Производные сульфамида, применяемые при лечении сибирской язвы и ингибирующие летальный фактор - RU2289575C2
Код документа: RU2289575C2
Описание
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Цитированные в настоящей заявке ссылки не следует рассматривать в качестве предшествующего уровня для заявленного изобретения.
Сибирская язва представляет собой бактериальную инфекцию, продуцируемую Bacillus anthracis. Эндоспоры Bacillus anthracis могут попадать в организм через ссадины на коже, путем дыхания или глотания. Bacillus anthracis продуцирует сибиреязвенный токсин, который часто является летальным (Dixon et al. (1999) N. Engl. J. Med. 341, 815-26).
Сибиреязвеннный токсин состоит из трех белков: компонента, связывающего рецептор, обозначенного как защитный антиген, и двух ферментативных компонентов, названных отечный фактор и летальный фактор («ЛФ»). (Mock et al. (2001) Annu. Rev. Microbiol. 55, 647-71). Летальный фактор представляет собой цинкозависимую металлопротеазу, которая вызывает возникновение токсических эффектов за счет расщепления митоген-активируемых киназ протеинкиназы (МКК) (Vitale et al. (1998) Biochem. Biophys. Res. Commun. 248, 706-11, Vitale et al. (2000) Biochem. J. 352 Pt 3, 739-45, Duesbery et al. (1998) Science 280, 734-7, Duesbery et al., опубликованная международная заявка № WO 99/50439, опубл. 7 октября 1999 г.).
Для идентификации сайта в различных МКК, которые расщепляются летальным фактором, Vitale и сотрудники использовали микросеквенирование (смотри таблицу 1, Vitale et al. (2000) Biochem. J. 352 Pt 3, 739-45). Расщепление летальным фактором различных МКК происходило в N-концевой области, предшествующей домену киназы. Выравнивание последовательностей, фланкирующих сайт расщепления, выявило некоторые мотивы согласованности: гидрофобный остаток в положении Р2 и Р1' и, по меньшей мере, один остаток между Р4 и Р7 (Vitale et al. (2000) Biochem. J. 352 Pt 3, 739-45).
Было показано, что летальный фактор расщепляет синтетические пептиды in vitro (Hammond et al. (1998) Infect. Immun. 66, 2374-8). Расщепление in vitro ингибировалось 1,10-фенантролином или 10 мМ EDTA, оба из которых образуют хелатное соединение с цинком.
Bacillus anthracis представляет собой спорообразующую грамположительную бациллу, которая является этиологическим агентом сибирской язвы. Сибирская язва представляет собой заболевание, которое может быть повсеместно найдено в зонах с умеренным климатом (например, в Южной и Центральной Америке, в Южной и Восточной Европе, Азии, Африке, на Среднем Востоке и Карибских островах) и передается людям через контакты или потребление загрязненных продуктов животного происхождения (например, через употребление недостаточно прожаренного мяса инфицированных животных). Дикие млекопитающие, такие как олень, гну, слоны, и домашние животные, такие как козы, овцы, крупный рогатый скот, лошади и свиньи, представляют большую опасность для заражения. Заражение обычно возникает при содержании скота на зараженном пастбище, при приеме загрязненной пищи или употреблении воды из загрязненных скважин. Споры Bacillus anthracis могут оставаться жизнеспособными в почве в течение многих лет. Смотри: Helgason et al. Applied and Environmental Microbiology 2000 66(6) pgs. 2627-2630; Wiber et al. Antimicrob Agents and Chemotherapy 1988 32(5):642-645; и Doganay et al. Scand. J. Inf. Dis. 1991 23:333-335 для дополнительного обсуждения Bacillus anthracis.
У людей могут встречаться три формы сибиреязвенной инфекции: кожная, желудочно-кишечная и легочная. При кожной форме инфицирование происходит в том случае, когда бактерия или спора попадает в порез или царапину на коже. Смотри: Synder, J.W., Shapiro, D.S., Gilchrist, M.J.R., et al. «Basic Diagnostic Testing Protocols for Level A Laboratories (For The Presumptive Identification of Bacillus Anthracis)» на: www.ban.asm.la.cp.102401f, Oct.24, 2001, pgs. 1-20 и Dixon et al., NEJM 341:815-826 Sept 9, 1999 Number 11. Симптомы кожной инфекции обычно включают вызывающие зуд наросты или шишку, похожую на укус насекомого. В течение от одного до двух дней наросты или шишка развиваются в наполненный жидкостью пузырек, который разрывается с образованием безболезненной язвы с характерным черным некротическим (омертвевшим) участком в середине. Если не провести лечение, может наступить смерть, однако, если провести антибиотикотерапию, смертельные случаи редки.
Желудочно-кишечная форма сибирской язвы обычно возникает в результате потребления загрязненного бактериями мяса, что приводит к острому воспалению кишечного тракта. Такие симптомы, как тошнота, потеря аппетита, рвота, жар вместе с болью в области брюшной полости, рвотой с кровью и сильной диареей, являются показателями желудочно-кишечной язвы. Летальность вследствие данной формы сибирской язвы у людей составляет 25-60%.
Легочная форма сибирской язвы наиболее вероятно является результатом преднамеренного аэрозольного применения Bacillus anthracis, например, в результате биотерроризма. Данная форма человеческой сибиреязвенной инфекции обычно имеет инкубационный период от одного до шести дней, при этом первоначальными признаками являются жар, недомогание, непродуктивный кашель и/или иногда небольшой дискомфорт в области грудной клетки. После указанных первоначальных симптомов часто следует короткий период улучшения, после которого возникает внезапное развитие тяжелого респираторного дистресс-синдрома с затрудненным дыханием, потоотделением и посинением кожи. Несмотря на интенсивное лечение, через 24-36 часов после возникновения респираторного дистресс-синдрома обычно наступает смерть.
Большинство штаммов Bacillus anthracis восприимчиво к широкому диапазону антибиотиков. Наиболее часто используемые в настоящее время лекарственные средства включают ципрофлоксацин, пенициллин или доксициклин. Однако профили эффективности и побочных действий данных лекарственных средств не являются идеальными.
Хотя антибиотики могут убивать бактерии, вызывающие сибирскую язву, сибиреязвенный токсин, состоящий из трех частей, продолжает поражать организм, даже когда сами бактерии погибают. Поэтому все еще существует потребность в новых и эффективных лекарственных препаратах с улучшенной эффективностью, оказывающих незначительное побочное действие или не имеющих такового, которые ингибируют «ножницеподобную» способность летального фактора отрезать значимые молекулы хозяина.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым соединениям формулы I

или к фармацевтически приемлемой соли, энантиомеру, диастереоизомеру или гидролизуемому in vivo сложному эфиру или их смеси, где
R1 представляет собой С6-10арил, С5-10 гетероарил или С5-10гетероциклил, причем указанный арил, гетероарил и гетероциклил необязательно замещен 1-3 группами Ra;
Ra представляет собой С1-6алкил, галоген, ОН, арил(С1-6)алкил, (С1-6)алкокси, (С1-6)алкокси(С1-6)алкил, галоген(С1-6)алкил, нитро, амино, моно- или ди-N-(С1-6)алкиламино, ациламино, ацилокси, карбокси, соли карбоновых кислот, сложные эфиры карбоновых кислот, карбамоил, моно- и ди-N-(С1-6)алкилкарбамоил, (С1-6)алкоксикарбонил, арилоксикарбонил, уреидо, гуанидино, сульфониламино, аминосульфонил, (С1-6)алкилтио, (С1-6)алкилсульфинил, (С1-6)алкилсульфонил, гетероциклил, гетероциклил(С1-6)алкил; и
R представляет собой С1-8алкил, С3-10циклоалкил, С3-10гетероциклоалкил, С5-10гетероарил или С5-11гетероциклил, причем гетероарил и гетероциклил необязательно замещены 1-3 группами Ra и указанный алкил необязательно замещен 1-3 группами, выбранными из группы, состоящей из арила, гетероциклила, (С1-6)алкилтио, циано, гетероарила, гуанидино, ((1-аминоэтил)карбонил)амино, ((аминометил)карбонил)амино, ((2-амино)проп-2-ил)карбонил)амино, ацетамидо, 4-(аминометил)фенила, тио, трет-бутилсульфонила, (С2-6)алкенилтио, (С2-6)алкинилтио, амино, моно- или ди-(С1-6)алкиламино, арилтио, гетероциклилтио, (С1-6)алкокси, арил(С1-6 )алкокси, арил(С1-6)алкилтио, циклоалкила, циклоалкенила, карбокси и сложных эфиров карбоновых кислот, гидрокси и галогена.
Данное изобретение относится также к применению соединений формулы I при лечении сибирской язвы и других состояний, которые связаны с сибиреязвенной инфекцией.
Указанные и другие аспекты изобретения станут более ясными при внимательном рассмотрении изобретения в целом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям формулы I и способу лечения сибирской язвы или к ингибированию летального фактора путем введения композиции, содержащей соединение формулы I и фармацевтически приемлемый носитель, предпочтительно внутривенно или внутримышечно.
Изобретение описано подробно с использованием нижеопределенных терминов, если не указано иное.
Когда любая переменная (например, арил, гетероцикл, R1, R и т.д.) встречается в любой составляющей более одного раза, ее определение в каждом месте является независимым от определения в каждом другом месте. Кроме того, комбинации заместителей/или переменных допустимы только в том случае, если такие комбинации приводят к получению устойчивых соединений.
Термин «алкил» относится к радикалу, произведенному из одновалентного алкана (углеводорода), содержащему от 1 до 10 атомов углерода, если не определено иное. Он может быть прямым, разветвленным или циклическим. Предпочтительные алкильные группы включают метил, этил, пропил, изопропил, бутил, трет-бутил, циклопентил и циклогексил. Когда говорится, что алкильная группа замещена алкильной группой, это означает, что ее используют взамозаменяемо с «разветвленной алкильной группой».
Алкенил предпочтительно представляет собой С2-6алкенил.
Алкинил предпочтительно представляет собой С2-6алкинил.
Циклоалкил является разновидностью алкила, содержащего от 3 до 15 атомов углерода, если не указано иное, при этом он не имеет чередующихся или резонансных двойных связей между атомами углерода. Он может содержать от 1 до 4-х колец, которые являются конденсированными. Примерами циклоалкильных групп являются циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
Гетероциклоалкил означает циклоалкильные циклические группы, состоящие из атомов углерода и одного-четырех гетероатомов, выбранных из группы, состоящей из N, O и S, и включающие бициклические группы. Указанный гетероциклоалкил может быть необязательно замещен представленными в данном описании 1-3 группами Ra. Примерами гетероциклоалкилов являются оксан, метилоксан, диоксан, пиран, тиолан, пиперидин, пирролидин, азиридин, азетидин и т.д.
Алкокси относится к С1-6алкил-О-, при этом алкильная группа необязательно замещена, как указано выше. Примерами алкоксигрупп являются метокси, этокси, пропокси, бутокси и их изомерные группы.
«Гало» является сокращенным названием галогена и относится к хлориду, фториду, бромиду и иодиду.
Использованный в данном описании термин «арил» означает любое устойчивое моноциклическое или бициклическое углеродное кольцо, содержащее до 7 членов в каждом кольце, причем по меньшей мере одно кольцо является ароматическим. Примеры таких арильных фрагментов включают фенил, нафтил, тетрагидронафтил, инданил, бифенил, фенантрил, антрил или аценафтил.
Использованный в данном описании термин «гетероциклил» или «гетероциклический» представляет собой устойчивое 5-7-членное моноциклическое или устойчивое 8-11-членное бициклическое гетероциклическое кольцо, которое является насыщенным или ненасыщенным и которое состоит из атомов углерода и одного-четырех гетероатомов, выбранных из группы, состоящей из N, O и S, и включает любую бициклическую группу, в которой любое из вышеопределенных гетероциклических колец конденсировано с бензольным кольцом. Гетероциклическое кольцо может быть присоединено к любому гетероатому или атому углерода, что приводит к созданию устойчивой структуры. Конденсированная гетероциклическая кольцевая система может включать карбоциклические кольца и при необходимости может включать только одно гетероциклическое кольцо. Термин «гетероцикл» или «гетероциклический» включает гетероарильные группы. Примеры таких гетероциклических фрагментов включают, но без ограничения, азепинил, бензимидазолил, бензизоксазолил, бензофуразанил, бензопиранил, бензотиопиранил, бензофурил, бензотиазолил, бензотиенил, бензоксазолил, хроманил, циннолинил, дигидробензофурил, дигидробензотиенил, дигидробензотиопиранил, дигидробензотиопиранилсульфон, 1,3-диоксоланил, фурил, имидазолидинил, имидазолинил, имидазолил, индолинил, индолил, изохроманил, изоиндолинил, изохинолинил, изотиазолил, изотиазолидинил, морфолинил, нафтиридинил, оксадиазолил, 2-оксоазепинил, оксазолил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, пиперидил, пиперазинил, пиридил, пиразинил, пиразолидинил, пиразолил, пиридазинил, пиримидинил, пирролидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетрагидрофурил, тетрагидроизохинолинил, тетрагидрохинолинил, тиаморфолинил, тиаморфолинилсульфоксид, тиазолил, тиазолинил, тиенофурил, тиенотиенил и тиенил. Вариант примеров таких гетероциклических фрагментов включает, но без ограничения, азепинил, бензимидазолил, бензизоксазолил, бензофуразанил, бензопиранил, бензотиопиранил, бензофурил, бензотиазолил, бензотиенил, бензоксазолил, хроманил, циннолинил, дигидробензофурил, дигидробензотиенил, дигидробензотиопиранил, дигидробензотиопиранилсульфон, фурил, имидазолидинил, имидазолинил, имидазолил, индолинил, индолил, изохроманил, изоиндолинил, изохинолинил, изотиазолил, изотиазолидинил, морфолинил, нафтиридинил, оксадиазолил, 2-оксазепинил, оксазолил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, пиперидил, пиперазинил, пиридил, 2-пиридинонил, пиразинил, пиразолидинил, пиразолил, пиридазинил, пиримидинил, пирролидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетрагидрофурил, тетрагидроизохинолинил, тетрагидрохинолинил, тиаморфолинил, тиаморфолинилсульфоксид, тиазолил, тиазолинил, тиенофурил, тиенотиенил, тиенил и триазолил.
Гетероцикл предпочтительно выбран из 2-азепинонила, бензимидазолила, 2-диазапинонила, имидазолила, 2-имидазолидинонила, индолила, изохинолинила, морфолинила, пиперидила, пиперазинила, пиридила, пирролидинила, 2-пиперидинонила, 2-пиримидинонила, 2-пирролидинонила, хинолинила, тетрагидрофурила, тетрагидроизохинолинила и тиенила.
Использованный в данном описании термин «гетероарил» означает любое устойчивое моноциклическое и бициклическое углеродное кольцо, содержащее до 7 членов в каждом кольце, где по меньшей мере одно кольцо является ароматическим и где от одного до четырех атомов углерода замещено гетероатомами, выбранными из группы, состоящей из N, O и S. Примеры таких гетероциклических фрагментов включают, но без ограничения, бензимидазолил, бензизоксазолил, бензофуразанил, бензопиранил, бензотиопиранил, бензофурил, бензотиазолил, бензотиенил, бензоксазолил, хроманил, циннолинил, дигидробензофурил, дигидробензофуранил, дигидробензотиенил, дигидробензотиопиранил, дигидробензотиопиранилсульфон, фурил, имидазолил, индолинил, индолил, изохроманил, изоиндолинил, изохинолинил, изотиазолил, нафтиридинил, оксадиазолил, пиридил, пиразинил, пиразолил, пиридазинил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетрагидроизохинолинил, тетрагидрохинолинил, тиазолил, тиенофурил, тиенотиенил, тиенил и триазолил.
В одном варианте данного изобретения, относящегося к соединениям формулы I, R представляет собой гетероциклоалкил, а все другие переменные являются такими, как они описаны выше.
В другом варианте данного изобретения, относящегося к соединениям формулы I, R представляет собой гетероарил, а все другие переменные являются такими, как они описаны выше.
В еще одном другом варианте данного изобретения, относящегося к соединениям формулы I, R1 представляет собой фенильную группу, необязательно замещенную 1-3 группами Ra, и R представляет собой гетероциклоалкильную или гетероарильную группу.
В еще другом варианте данного изобретения, относящегося к соединениям формулы I, R1 представляет собой фенильную группу, замещенную 1-3 группами, выбранными из метокси, галогена, метила, этила, пропила, бутила, нафтила, 5-(2-пиридил)тиофен-2-ила или их смеси, и R представляет собой гетероциклоалкил или гетероарил.
В еще одном другом варианте данного изобретения, относящегося к соединениям формулы Ia, R представляет собой гетероциклоалкил, а все другие переменные являются такими, как они описаны выше.
В другом варианте данного изобретения, относящегося к соединениям формулы Ia, R представляет собой гетероарил, а все другие переменные являются такими, как они описаны выше.
В другом варианте данного изобретения, относящегося к соединениям формулы Ia, R представляет собой С1-4алкил, а все другие переменные являются такими, как они описаны выше.
В еще одном другом варианте данного изобретения, относящегося к соединениям формулы Ia, R1 представляет собой фенильную группу, необязательно замещенную 1-3 группами Ra, и R представляет собой алкильную, гетероциклоалкильную или гетероарильную группу.
В еще одном другом варианте данного изобретения, относящегося к соединениям формулы Ia, R1 представляет собой фенильную группу, замещенную 1-3 группами, выбранными из метокси, галогена, метила, этила, пропила, бутила, нафтила, 5-(2-пиридил)тиофен-2-ила или их смеси, и R представляет собой алкил, гетероциклоалкил или гетероарил.
Другой вариант данного изобретения относится к фармацевтической композиции, содержащей соединение формулы I и фармацевтически приемлемый носитель.
Другой вариант данного изобретения включает применение соединения формулы I для получения лекарственного препарата, предназначенного для лечения или профилактики сибирской язвы и связанных с ней состояний. Еще один другой вариант изобретения включает применение соединения формулы I для получения лекарственного препарата, предназначенного для ингибирования летального фактора.
Соединения формулы I могут быть объединены с одним или несколькими известными лекарственными средствами, выбранными из клинически применимых антибактериальных средств (например, других бета-лактамов или аминогликозидов), ингибиторов бета-лактамазы, блокаторов почечных канальцев (например, пробенецида) и ингибиторов метаболических ферментов (например, ингибиторов дегидропептидаз, например Z-2-ациламино-3-замещенных пропеноатов, таких как циластатин) и N-ацилированных аминокислот (смотри, например, EP-A-178911), которые уменьшают нежелательное действие на почки. Примерами лекарственных средств, которые могут быть объединены с соединениями формулы I, являются имипенем, меропенем, ванкомицин, циластатин, цефокситин, пенициллин, клавулановая кислота, пробенецид, тетрациклин, ципрофлоксацин, норфлоксацин или их смесь. Когда в качестве лекарственного средства используется имипенем, его предпочтительно использовать в комбинации с циластатином (данная комбинация представлена на рынке под торговой маркой PRIMAXIN®).
Подходящие фармацевтически приемлемые соли соединений, использованных в данном изобретении, включают аддитивные кислотные соли, такие как гидрохлорид, гидробромид, цитрат, малеат, и соли, образованные фосфорной и серной кислотами. В соответствии с другим аспектом подходящие соли представляют собой основные соли, такие как соль щелочного металла, например натрия или калия, соль щелочноземельного металла, например кальция или магния, органическую соль амина, например триэтиламина, морфолина, N-метилпиперидина, N-этилпиперидина, прокаина, дибензиламина, N,N-дибензилэтиламина, или аминокислот, например лизина. Предпочтительными фармацевтически приемлемыми солями являются соли натрия и калия.
Гидролизуемые in vivo сложные эфиры представляют собой такие фармацевтически приемлемые сложные эфиры, которые гидролизуются в организме человека с продуцированием исходного соединения. Такие сложные эфиры могут быть идентифицированы введением подопытному животному, например, внутривенно испытуемого соединения и последующим исследованием жидкостей организма подопытного животного. Подходящие гидролизуемые in vivo сложные эфиры карбоновых кислот включают С1-6алкоксиметиловые эфиры, например метоксиметиловый, С1-6алканоилоксиметиловые эфиры, например пивалоилоксиметиловый, фталидиловый эфиры и дополнительные сложные эфиры, раскрытые в патенте США № 5478820, включенном в данное описание во всей своей полноте в качестве ссылки.
Использованные в данном изобретении соединения представляют собой:
N-трет-бутокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-3-метилбутирамид;
N-гидрокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-3-метилбутирамид;
N-трет-бутокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-2-(4'-тетрагидропиранил)ацетамид;
N-гидрокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-2-(4'-тетрагидропиранил)ацетамид;
N-гидрокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-3-(S)-циклопропилбутирамид;
и их фармацевтически приемлемые соли, энантиомеры, диастереомеры или гидролизуемые in vivo сложные эфиры или их смеси.
Дополнительные соединения данного изобретения раскрыты в таблице 1:
Таблица 1


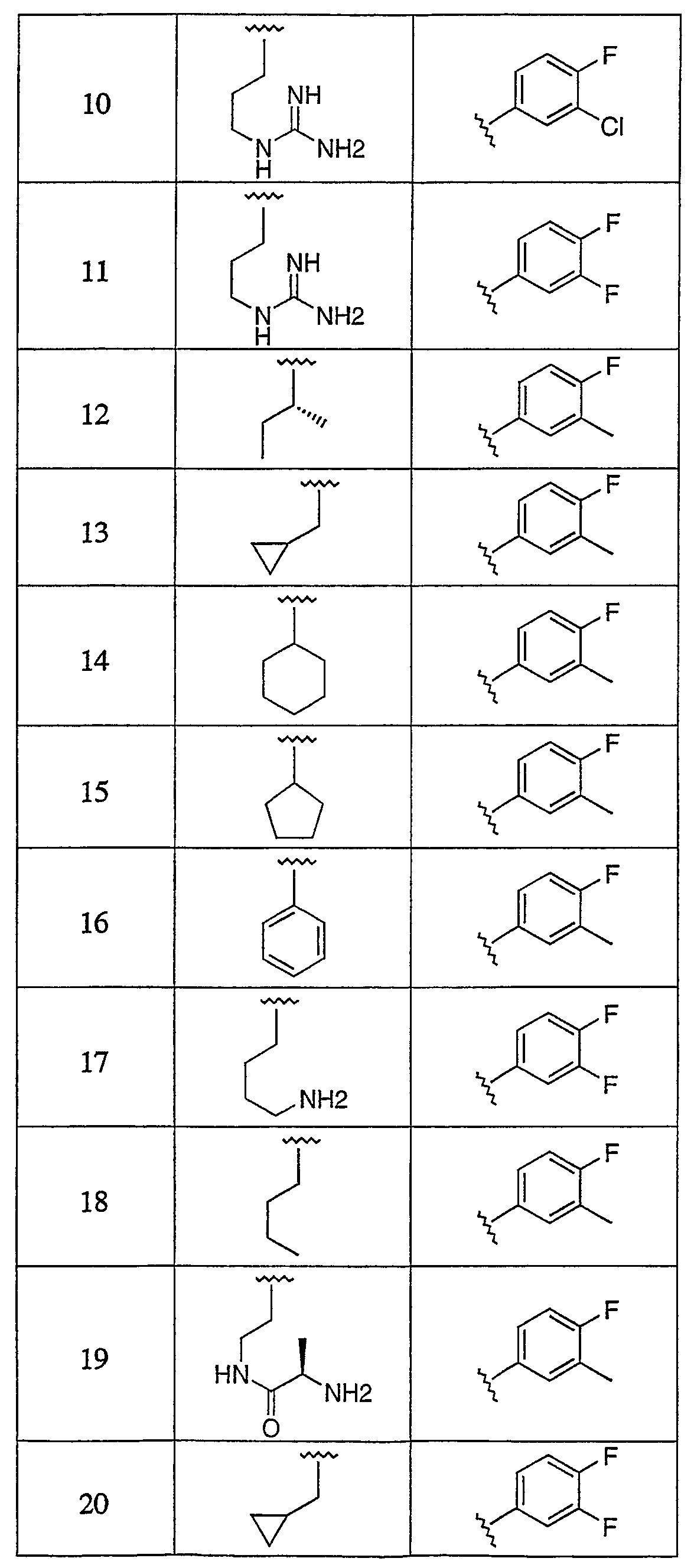
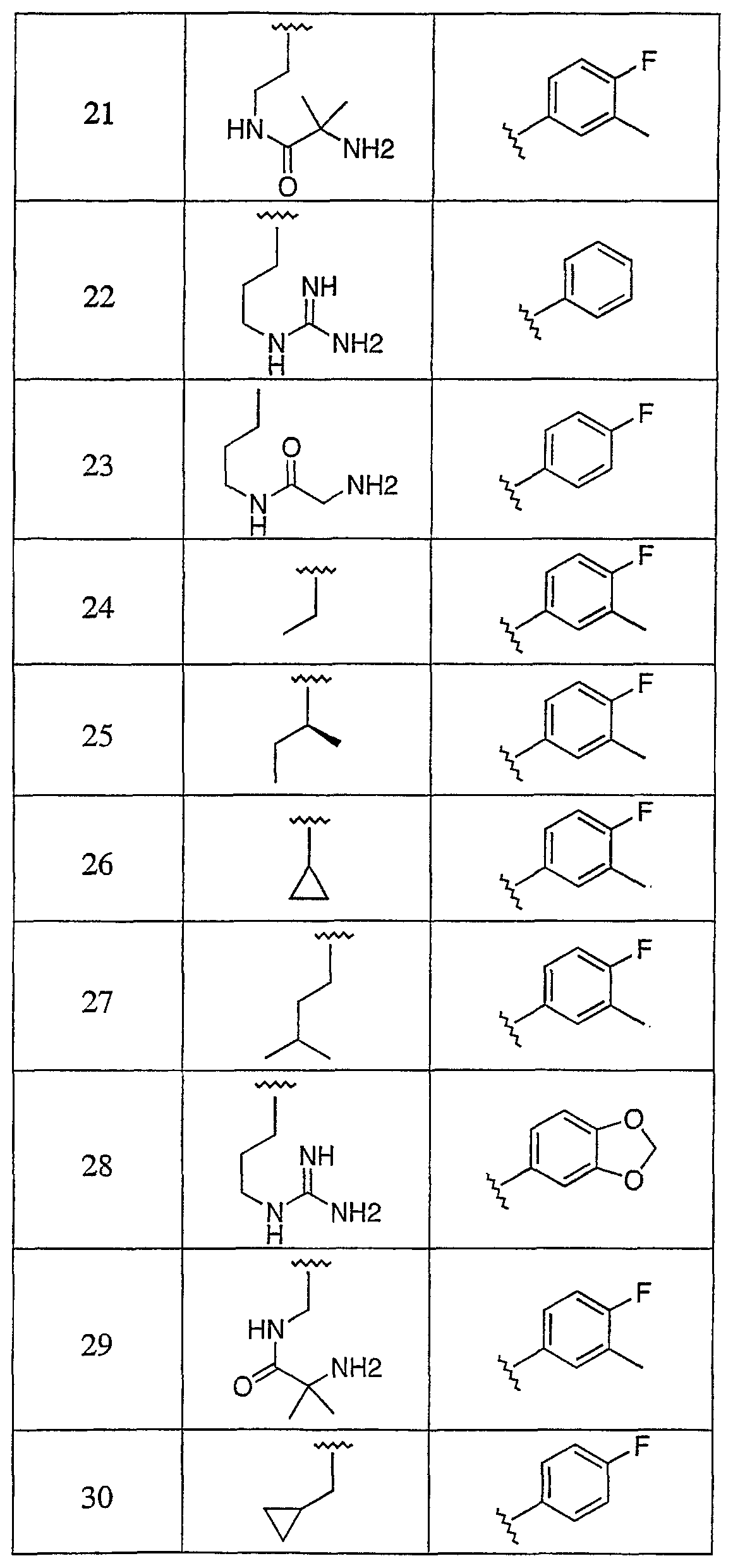

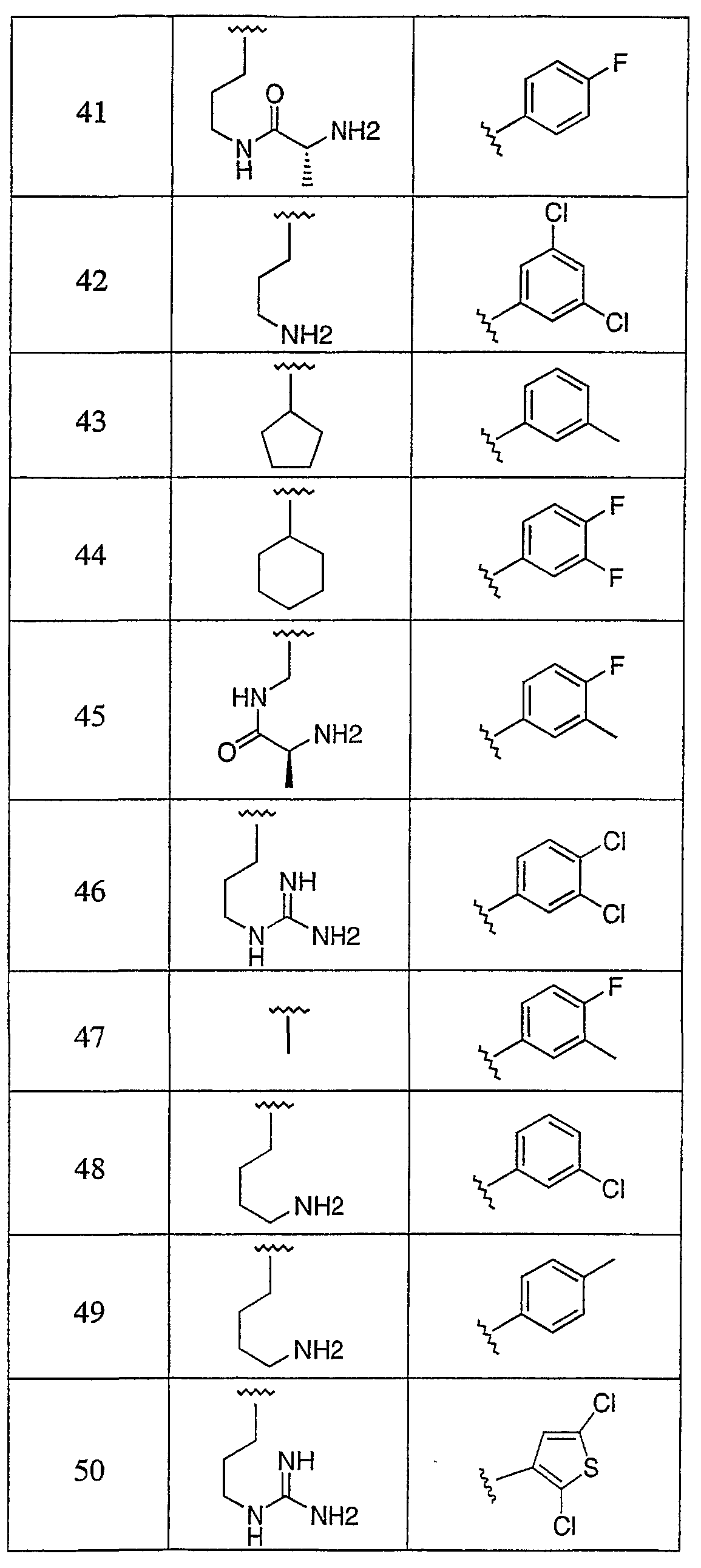
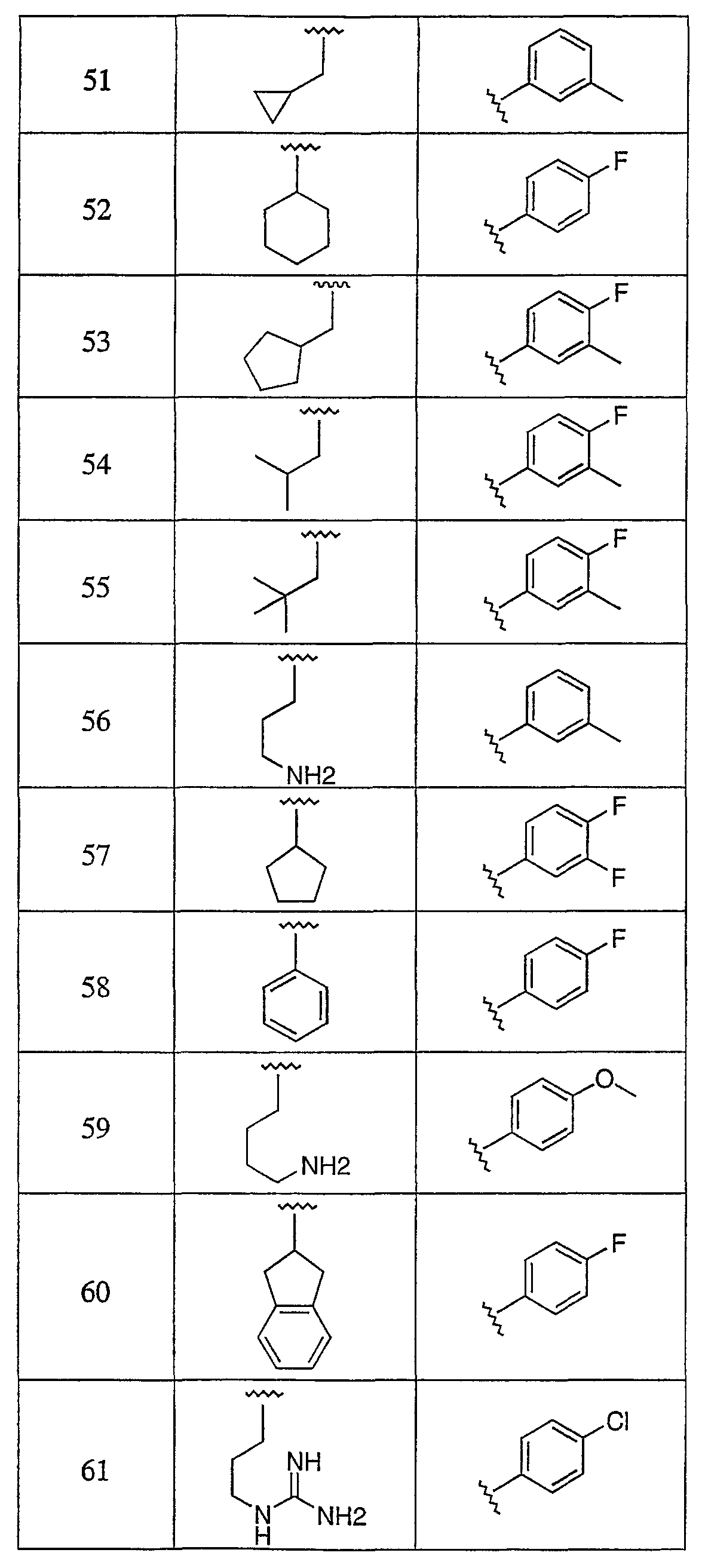



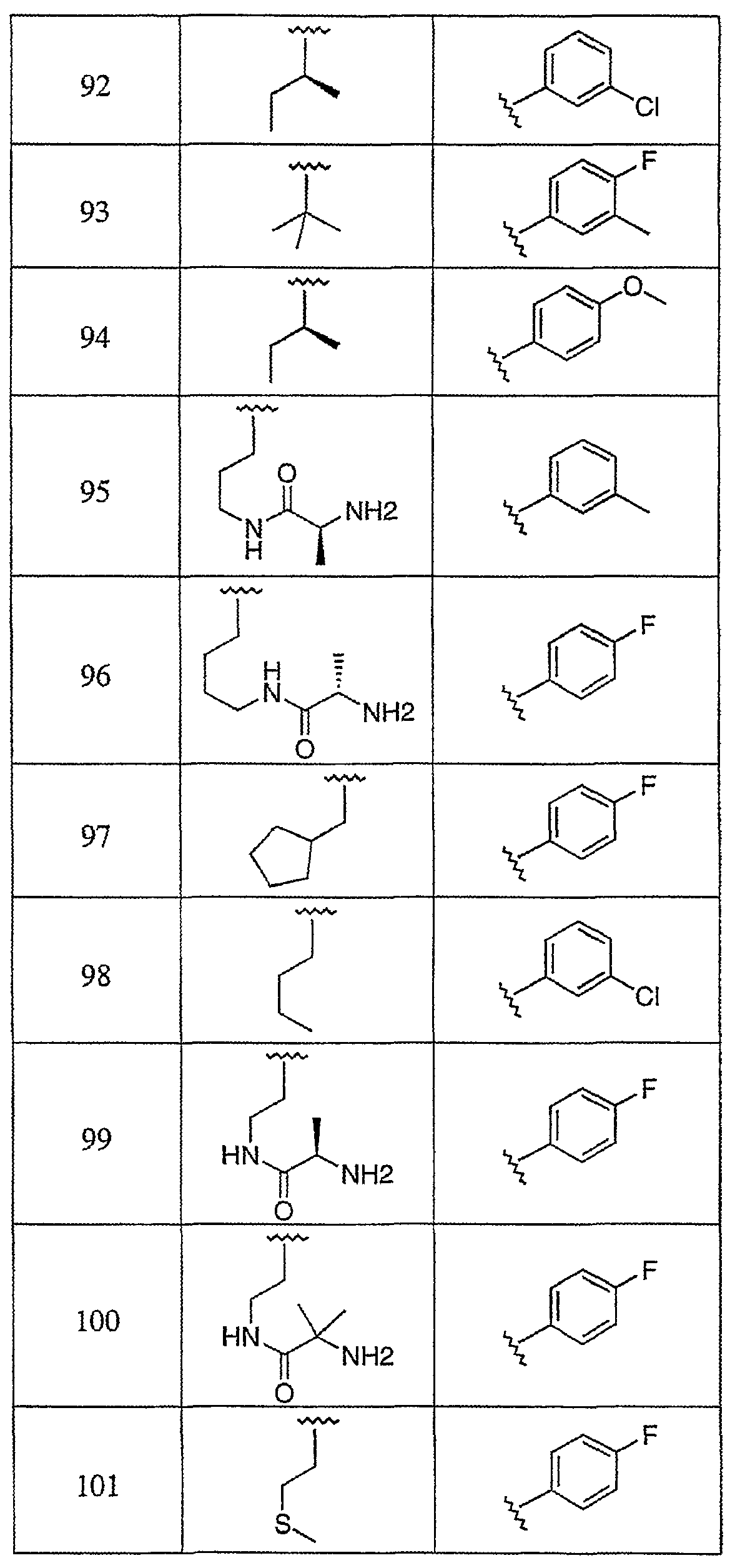
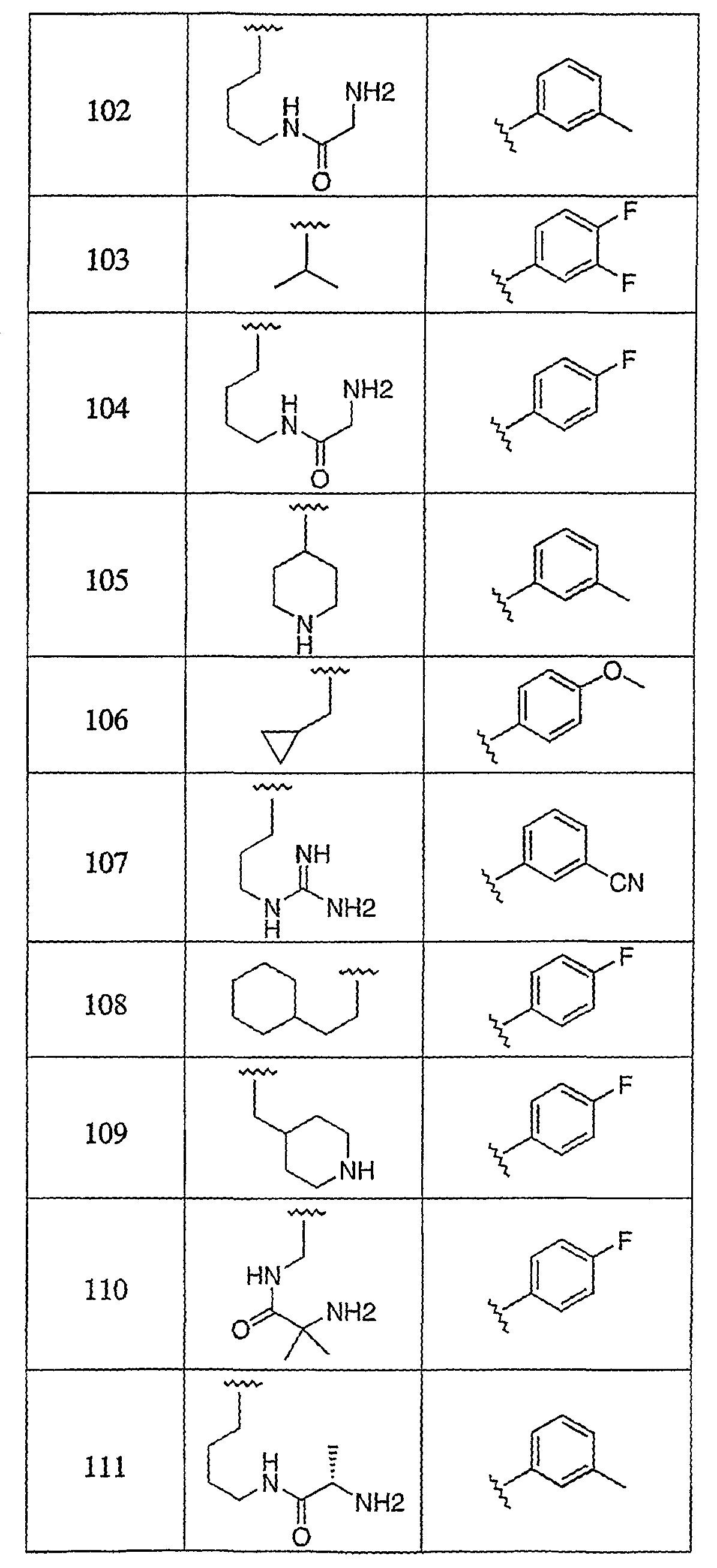
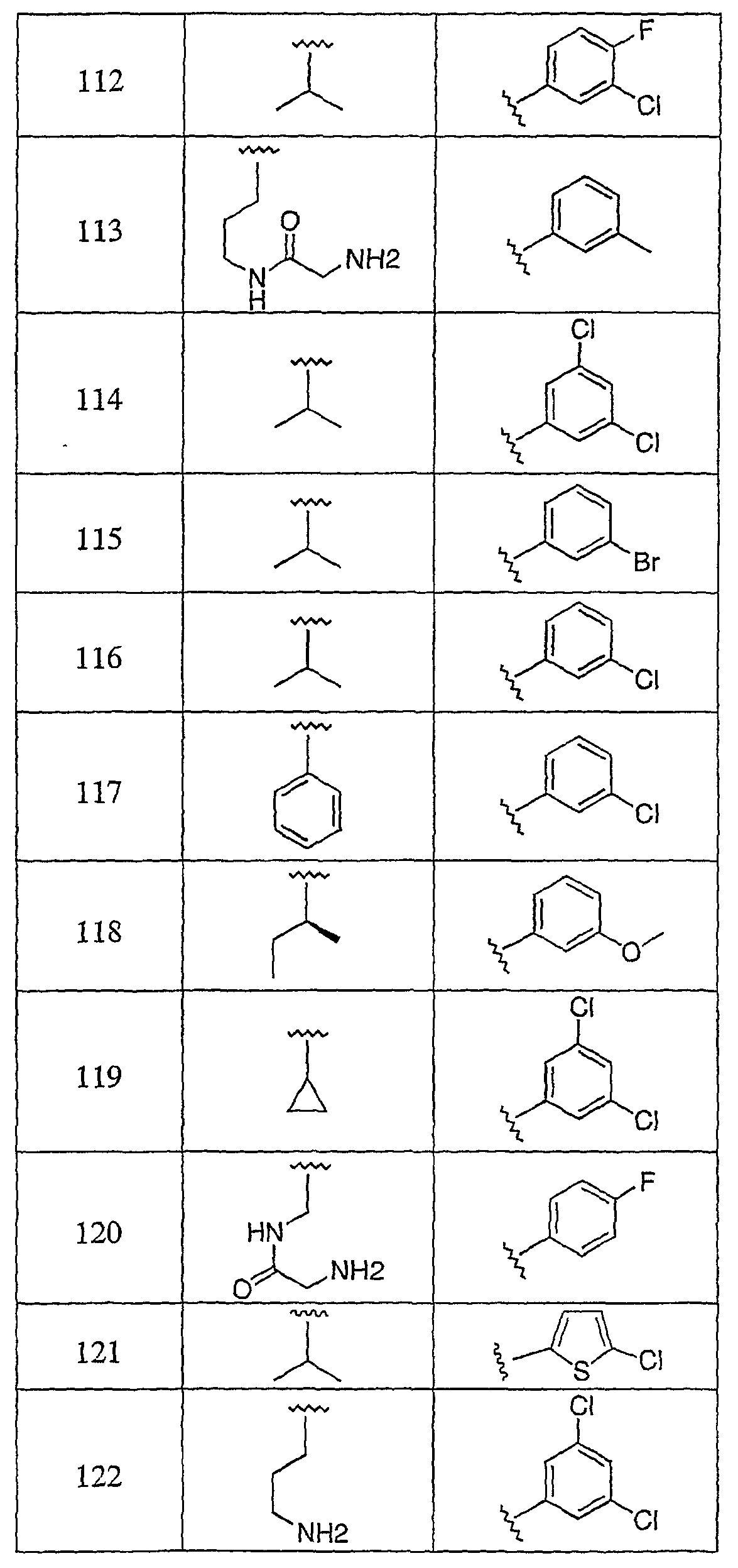


и их фармацевтически приемлемые соли, энантиомеры, диастереомеры или гидролизуемые in vivo сложные эфиры или их смеси.
Другие дополнительные соединения данного изобретения раскрыты в таблице 2:
Таблица 2


и их фармацевтически приемлемые соли, энантиомеры, диастереомеры или гидролизуемые in vivo сложные эфиры или их смеси.
Использованные в данном описании предпочтительные соединения представляют собой:
N-трет-бутокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-3-метилбутирамид;
N-гидрокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-3-метилбутирамид;
N-трет-бутокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-2-(4'-тетрагидропиранил)ацетамид;
N-гидрокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-2-(4'-тетрагидропиранил)ацетамид;
N-гидрокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-3-(S)-циклопропилбутирамид;
и их фармацевтически приемлемые соли, энантиомеры, диастереомеры или гидролизуемые in vivo сложные эфиры или их смеси.
Для применения соединения формулы I или его фармацевтически приемлемой соли, энантиомера, диастереомера или гидролизуемого in vivo сложного эфира или их смеси для терапевтического лечения млекопитающих, включая человека, в особенности для лечения сибирской язвы или ингибирования летального фактора, его обычно приготавливают в соответствии со стандартной фармацевтической практикой в виде фармацевтической композиции.
Использованные в настоящем изобретении соединения могут быть введены в терапевтически эффективном количестве внутривенно, подкожно, внутримышечно или любым другим путем, известным специалистам в данной области (например, ректально, перорально, парентерально). Подходящая фармацевтическая композиция, использованная в данном изобретении, является такой, которая приготовлена как стерильный инъекционный раствор, содержащий от 1 до 50 мас./мас.% соединений, использованных в данном изобретении.
Подходящие субъекты для введения препарата настоящего изобретения включают приматов, человека и других животных, в особенности человека и домашних животных, таких как кошки, кролики и собаки.
Следующие неограничительные примеры, данные с целью иллюстрации, наглядно показывают, что соединения, использованные в данном изобретении, применимы для лечения сибирской язвы и ингибирования летального фактора.
Определения терминов:
HOBT - гидроксибензотриазол
DMF - диметилформамид
DIEA - диизопропилэтиламин
TMSONH2 - O-триметилсилилгидроксиламин
PyBOP - бензотриазол-1-илокси-трис-пирролидинофосфонийгексафторфосфат
TFA - трифторуксусная кислота
HPLC - высокоэффективная жидкостная хроматография
DCM - дихлорметан
EDC - 1-(3-диметиламинопропил)-3-этилкарбодиимид
THF - тетрагидрофуран
DIC - N,N'-диизопропилкарбодиимид
DMAP - 4-диметиламинопиридин
NMP - 1-метил-2-пирролидинон
EDTA - этилендиаминтетрауксусная кислота.
Пример 1
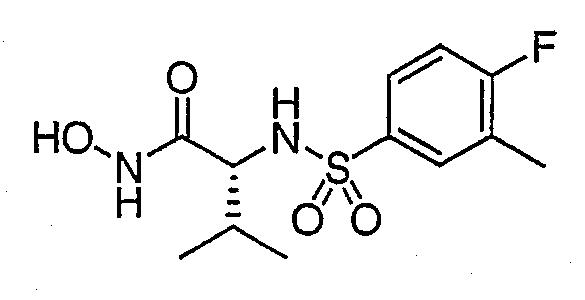
N-трет-бутокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-3-метилбутирамид (1,8 г, 4,99 ммоль) растворяли при 0°С в 75 мл безводного дихлорэтана, содержащего этанол (0,30 мл, 5 ммоль). В течение 30 минут через смесь барботировали газообразный хлористый водород. Колбу закрывали мембраной и реакционная смесь перемешивалась в течение 2-х дней. После удаления растворителя в роторном испарителе остаток растворяли в метаноле (1˜2 мл) и разбавляли DCM (20 мл). Собирали образовавшиеся кристаллы и промывали дополнительным количеством DCM с получением после вакуумной сушки N-гидрокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-3-метилбутирамида. ЯМР (500 МГц, CD3OD) δ: 0,86 (д, 3H), 0,91 (д, 3H), 1,86 (м, 1H), 2,30 (д, 3H), 3,30 (д, 1H), 7,16 (т, 1H), 7, 67 (м, 1H), 7,72 (м, 1H).
Исходные продукты для примера 1 получали следующим образом:
D-Валин (1,39 г, 11,9 ммоль) растворяли в 80 мл смеси диоксан/вода (1:1), содержащей K2CO3 (3,3 г, 24 ммоль). При тщательном перемешивании добавляли по каплям раствор 4-фтор-3-метилфенилсульфонилхлорида (10 ммоль) в диоксане (4 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли этилацетат (80 мл), 1н. HCl (50 мл). Органический слой два раза промывали 1н HCl и экстрагировали 5% K2CO3 (3×25 мл). Объединенные основные экстракты подкисляли и экстрагировали этилацетатом (80 мл). Органический слой промывали насыщенным раствором соли (2 раза), сушили над Na2SO4. В роторном испарителе удаляли растворитель и остаток растирали в гексане. Образовавшееся твердое вещество сушили с получением 2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-3-метилмаслянной кислоты.
2(R)-[(4-Фтор-3-метилфенилсульфонил)]амино-3-метилмаслянную кислоту (2,64 г, 9,12 ммоль) растворяли в DCM (30 мл) и затем добавляли DIEA (3,18 мл, 2 экв.) и гидрохлорид О-трет-бутилгидроксиламина (2,3 г, 2 экв.). Затем порциями добавляли EDC.HCl (2,1 г, 1,2 экв.) в виде твердого вещества. Через 40 минут добавляли дополнительное количество EDC (0,6 г, 0,5 экв.) и реакционную смесь перемешивали в течение еще 30 минут. В роторном испарителе при комнатной температуре удаляли растворитель и остаток распределяли между этилацетатом (80 мл) и 1н. HCl (50 мл). Органический слой промывали 1н. HCl, насыщенным раствором соли, и сушили над Na2SO4. Неочищенный продукт очищали флэш-хроматографией на колонках при элюировании растворителем с градиентом, которым являлся 5-12% этилацетат в DCM, с получением продукта N-трет-бутокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-3-метилбутирамида в виде белой пены. ТСХ (TLC) (этилацетат:DCM 1:10) Rf 0,16. ЯМР (500 МГц, CD3OD) δ: 0,89 (д, 3H), 0,90 (д, 3H), 1,08 (с, 9H), 1,86 (м, 1H), 2,30 (д, 3H), 3,44 (д, 1H), 7,18 (т, 1H), 7,70 (м, 1H), 7,77 (м, 1H).
Пример 2
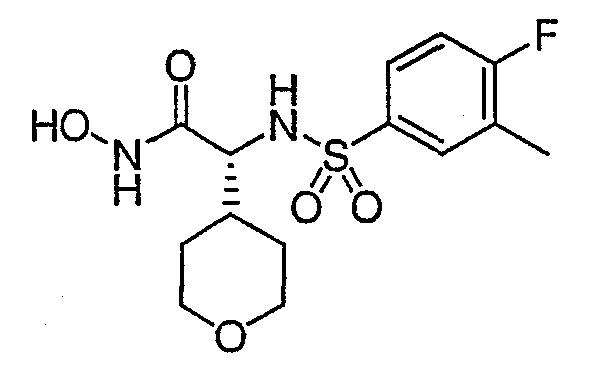
В примере 2, следуя методике примера 1, из D-4'-тетрагидропиранилглицина получали N-гидрокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-2-(4'-тетрагидропиранил)ацетамид. ЯМР (500 МГц, CD3OD) δ: 1,19 (м, 1H), 1,34 (м, 1H), 1, 40 (м, 1H), 1,74 (м, 1H), 1,80 (м, 1H), 2,32 (д, 3H), 3,31 (м, 2H), 3,37 (д, 1H), 3,90 (м, 2H), 7,18 (т, 1H), 7,65 (м, 1H), 7,72 (м, 1H).
Примеры 3-144
Примеры 3-144, представленные в таблице 1, осуществляли в твердой фазе следующим образом.
Стадия 1. Структурирование смолы

Раствор N-гидроксифталимида (2,8 г, 17 ммоль), DIEA (3,0 мл, 17 ммоль) в дихлорметане (30 мл) и DMF (15 мл) быстро добавляли к 4,39 г 2-хлортритиловой смолы (загрузка 1,1 ммоль/г) в снабженном фриттой картридже. Суспензию смолы прерывисто встряхивали и оставляли на столе на ночь. Смолу пятикратно промывали DMF и затем обрабатывали 40 мл раствора гидразина (0,5 М в THF) в течение 2-х часов. Вокруг смолы образовывалось большое количество белого твердого вещества. Его два раза промывали смесью DMF-вода (1:1) и четыре раза - DMF. Обработку гидразином повторяли более одного раза в течение еще 3-х часов. Смолу два раза промывали смесью DMF-вода (1:1), четыре раза - DMF, пять раз - DCM, сушили в вакууме всю ночь с получением 4,53 г смолы 1. Привес составлял примерно 1,0 ммоль/г изменения массы.
Стадия 2. Загрузка аминокислоты
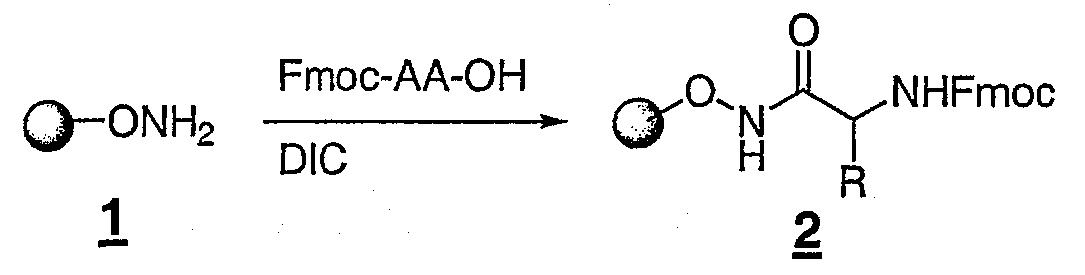
500 мг (загрузка ˜ 1,0 ммоль/г) О-связаннной гидроксиламиновой смолы 1 подвергали набуханию в DCM в картридже, снабженном фриттой, и дренировали. Добавляли раствор Fmoc-D-аллоизолейцина (530 мг, 1,5 ммоль, 3 экв.), DIC (0,120 мл, 0,75 ммоль, 1,5 экв.) в 3 мл DMF. Недолго встряхивали картридж и оставляли на столе в течение 1 часа. Добавляли еще одну порцию DIC (0,04 мл, 0,25 ммоль, 0,5 экв.). Через час смолу четыре раза промывали DMF, четыре раза - DCM и всю ночь сушили в вакууме с получением смолы 2. Примерный привес составлял 0,70 ммоль/г прироста массы.
Стадия 3
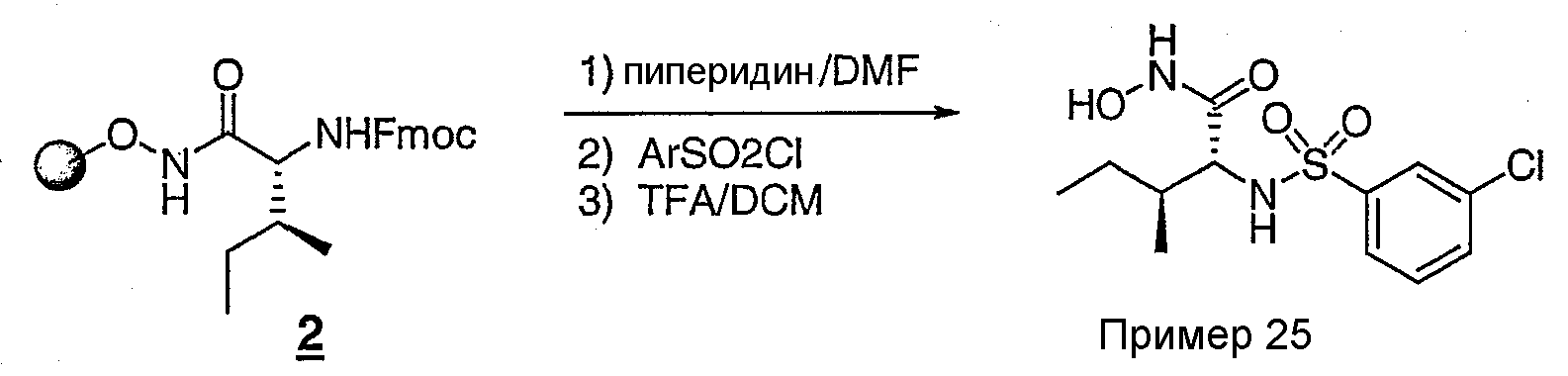
150 мг смолы 2, загрузка ˜ 0,7 ммоль/г, обрабатывали 2 мл смеси пиперидин/DMF (25%) в течение 2-х часов. Смолу три раза промывали DMF и три раза - DCM. К смоле добавляли раствор DIEA (73 мкл, 0,42 ммоль, 4 экв.) в смеси THF-DCM (0,5 мл, 1:1), содержащей DMAP (˜2 мг), затем добавляли раствор 3-хлорфенилсульфонилхлорида (66 мг, 3 экв.) в смеси THF-DCM (0,5 мл). Через 3 часа смолу три раза промывали DMF, три раза - DCM и дважды расщепляли смесью 5% TFA/DCM (0,5 мл) в течение 30 минут. Выпаривали полученный при расщеплении объединенный раствор и остаток растворяли в смеси CH3CN:Н2О и очищали ВЭЖХ с обращенной фазой с получением соединения примера 25, которым является амид N-гидрокси-2(R)-(3-хлорфенилсульфонил)амино-3(S)-метилвалериановой кислоты. ЯМР (500 МГц, CD3OD) δ: 0,82 (д, д, 6H), 1,04 (м, 1H), 1,35 (м, 1H), 1,64 (м, 1H), 3,52 (д, 1H), 7,50 (т, 1H), 7,60 (д, 1H), 7,76 (д, 1H), 7,84 (м, 1H).
В таблице 1 перечислены структуры соединений примеров 3-144. Специалистам в данной области понятно, что, следуя методике получения соединения примера 3, с некоторыми изменениями могут быть получены соединения примеров 4-144. Для некоторых соединений после отщепления смолы необходима стадия удаления защитной группы (обработка смесью 50% TFA/DCM).
Пример 145
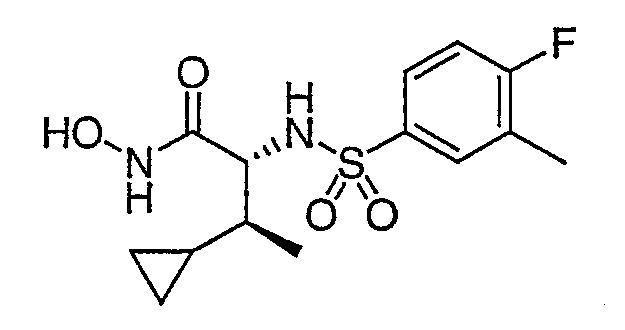
2(R)-[(4-фтор-3-метилфенил)сульфонил]амино-3-(S)-циклопропилмасляную кислоту (10 мг, 31 мкмоль) растворяли в DMF (0,3 мл) в присутствии HOBT (4,5 мг, 0,031 ммоль), DIEA (11 мкл, 0,062 ммоль), О-триметилсилилгидроксиламина (20 мкл, 0,16 ммоль). Добавляли раствор PyBOP (20 мг, 0,038 ммоль) в DMF (0,3 мл). Через 30 минут реакционную смесь гасили смесью CH3CN:Н2О (1:1, 5% TFA) и обрабатывали ВЭЖХ с обращенной фазой с получением после лиофилизации N-гидрокси-2-(R)-[(4-фтор-3-метилфенил)сульфонил]амино-3-(S)-циклопропилбутирамида. ЯМР (500 МГц, CD3OD) δ : -0,04 (м, 1H), 0,20 (м, 1H), 0,35 (м, 1H), 0,41 (м, 1H), 0,54 (м, 1H), 0,90 (д, 3H), 1,08 (м, 1H), 2,32 (д, 3H), 3,60 (д, 1H), 7,17 (т, 1H), 7,68 (м, 1H), 7,75 (м, 1H). MC: 331,1 (M+Н+ ).
Исходные продукты для примера 145 получали следующим образом:
Метилгликолят (10,4 г, 114 ммоль), кротиловый спирт (100 мл, избыток) кипятили с обратным холодильником в присутствии К2СО3 (0,8 г) в течение 1 часа, при этом в течение указанного времени через ловушку Дина-Стока было удалено примерно 10 мл конденсата. После разбавления гексаном (100 мл) твердое вещество фильтровали через короткую колонку с силикагелем (50 г), промывали смесью этилацетат:гексан (250 мл) при соотношении компонентов в смеси 1:5. Объединенный фильтрат и промывки концентрировали до 100 мл и опять разбавляли гексаном (100 мл), пропускали через колонку с силикагелем и промывали. Раствор концентрировали с получением ˜12,5 г масла, которое перегоняли в вакууме с получением кротилгликолята: 9,3 г (97°С/20 мм Hg) в виде смеси цис-:транс-изомеров (1:10). ЯМР (500 МГц, CDCl3) δ: 1,3 (м, 3H), 4,15 (с, 2H), 4,62 (д, 2H), 5,6 (м, 1H), 5,84 (м, 1H), остальные пики перекрываются транс-изомером.
Вышеуказанный полученный кротилгликолят (9,3 г, 71 ммоль) в THF (10 мл) медленно добавляли при -78°С к раствору LiN(TMS)2 (200 мл, 1,0 М) в THF (200 мл). Через 40 минут при указанной температуре добавляли триметилсилилхлорид (25,5 мл, 200 ммоль). Удаляли охлаждающую ванну и реакционная смесь перемешивалась всю ночь. Реакционную смесь концентрировали до ˜150 мл и разбавляли этилацетатом (500 мл). Ее дважды промывали 2н. HCl. Промывки реэкстрагировали дополнительным количеством этилацетата. Объединенный органический слой трижды экстрагировали 5% К2СО3. Объединенный щелочной раствор подкисляли холодной концентрированной HCl, экстрагировали этилацетатом. Этилацетатный раствор промывали насыщенным NaCl, сушили над Na2SO4. В результате выпаривания растворителя и вакуумной сушки получали 2-гидрокси-3-метилпропен-4-еновую кислоту в виде смеси диастереоизомеров. ЯМР (500 МГц, CD3OD) для диастереомера 1 [(2R, 3S) и (2S, 3R)] δ: 1,02 (д, 3H), 2,60 (м, 1H), 4,05 (д, 1H), 5,02 (м, 1H), 5,09 (м, 1H), 5,87 (м, 1H); диастереомер 2 [(2R, 3R) и (2S, 3S)] δ: 1,11 (д, 3H), 2,6 (м, 1H), 4,03 (д, 1H), 5,0 (м, 1H), 5,09 (м, 1H), 5,80 (м, 1H).
Отношение диастереоизомеров, определенное ЯМР, составляло примерно 7:1, при этом основным был диастереоизомер 1.
Вышеуказанную полученную кислоту (8,5 г, 65 ммоль) растворяли в сухом DMF (100 мл) и DIEA (16 мл, 91 ммоль). Добавляли метилиодид (11,7 мл, 85 ммоль). Полученная смесь перемешивалась в течение 15 часов и ее разбавляли этилацетатом (500 мл), промывали три раза 0,1н. HCl, два раза - насыщенным раствором соли и сушили над Na2SO4. После выпаривания растворителя оставался сложный метил-2-гидрокси-3-метилпентен-4-еновый эфир. ЯМР (500 МГц, CD3OD) для диастереомера 1 [(2R, 3S) и (2S, 3R)] δ: 1,02 (д, 3H), 2,55 (м, 1H), 3,70 (с, 3H), 4,04 (д, 1H), 5,02 (м, 1H), 5,06 (м, 1H), 5,81 (м, 1H); диастереомер 2 [(2R, 3R) и (2S, 3S)] δ: 1,08 (д, 3H), 2,58 (м, 1H), 3,70 (с, 3H), 4,07 (д, 1H), 5,00 (м, 1H), 5,06 (м, 1H), 5,80 (м, 1H).
Вышеуказанный полученный сложный метиловый эфир (2,9 г, 20 ммоль) растворяли в сухом DCM (100 мл) в присутствии дииодметана (8, 1 мл, 100 ммоль) и охлаждали до 0°С. Добавляли раствор диэтилцинка (100 мл, 1,0М в гексане). Удаляли охлаждающую ванну и смесь перемешивалась под азотом в течение 3-х дней. Для гашения реакции добавляли раствор NH4Cl. Органический слой два раза промывали HCl, два раза - насыщенным раствором соли и сушили над Na2SO4. После выпаривания растворителя оставалось масло, содержащее 70% продукта, которым являлся метил-2-гидрокси-3-циклопропилбутират, и 30% исходного продукта. Его использовали без дальнейшей очистки.
Раствор вышеуказанного полученного сложного эфира (3 г, 20 ммоль), пиридина (2,0 мл, 24 ммоль) в сухом DCM (10 мл) при 0°С медленно добавляли к перемешиваемому раствору Tf2O (4 мл, 24 ммоль) в DCM (100 мл). Для гашения реакции через 1 час при 0°С добавляли воду. Затем смесь промывали разбавленной HCl (0,1н.), насыщенным раствором соли и сушили над Na2SO4. В результате выпаривания растворителя получали 5,3 г трифлата в виде масла. Его перемешивали в течение 15 ч с NaN3 (2,4 г, 36 ммоль) в DMF (80 мл). Реакционную смесь разбавляли этилацетатом (400 мл), промывали три раза разбавленной HCl, два раза - насыщенным раствором соли и сушили над Na2SO4. После выпаривания растворителя оставалось 2,96 г масла. В результате осуществления флэш-хроматографии в колонке с силикагелем с использованием в качестве элюента 5% простого эфира в гексане получали метил-2-азидо-3-циклопропилбутират в виде бесцветного масла. Требуемый диастереоизомер 1 [(2R, 3S) и (2S, 3R)] может быть выделен препаративной ВЭЖХ с обращенной фазой при элюировании растворителем с градиентом, которым являлась смесь CH3CN:Н2О. ЯМР (500 МГц, CDCl3) для диастереомера 1 [(2R, 3S) и (2S, 3R)] δ: 0,04 (м, 1H), 0,18 (м, 1H), 0,48 (м, 2H), 0,74 (м, 1H), 1,09 (д, 3H), 1,35 (м, 1H), 3,80 (с, 3H), 3,92 (д, 1H).
Вышеуказанный выделенный диастереоизомер [(2R, 3S) и (2S, 3R)]азида (400 мг, 2,2 ммоль) растворяли в MeOH (10 мл), охлажденном на водяной бане при 20°С. Добавляли хлорид олова (II) (860 мг, 4,4 ммоль). Смесь перемешивалась в течение 15 час. К реакционной смеси добавляли диоксан (10 мл), смесь К2СО3 (1,5 г, 10,1 ммоль)/Н2О (10 мл). Отфильтровали твердое вещество и промывали диоксаном (5 мл). К объединенным фильтрату и промывкам добавляли раствор 4-фтор-3-метилфенилсульфонилхлорида (560 мг, 2,4 ммоль) в диоксане (5 мл). Через 30 минут реакционную смесь подкисляли HCl до рН 3 и разбавляли смесью CH3CN:Н2О. В результате препаративной ВЭЖХ с обращенной фазой (повторные инжекции) выделяли продукт, которым являлся метил-2-(4-фтор-3-метилфенилсульфонамидо)-3-циклопропилбутират. После дополнительного разделения через колонку Chiralpk AD при элюировании 7% EtOH в гептане получали два энантиомера, причем требуемый изомер 1 (2R, 3S) экстрагировался первым. ЯМР (500 МГц, CD3OD) δ: 0,01 (м, 2H), 0,39 (м, 2H), 0,62 (м, 1H), 1,01 (д, 3H), 1,19 (м, 1H), 2,312 (д, 3H), 3,23 (с, 3H), 3,90 (д, 1H), 7, 18 (т, 1H), 7,68 (м, 1H), 7,73 (м, 1H).
Сложный метиловый эфир 2(R)-[(4-фтор-3-метилфенил)сульфонил]амино-3-(S)-циклопропилмасляной кислоты (20 мг, 0,061 ммоль) растворяли в МеОН (0,2 мл), затем добавляли смесь LiOH (8 мг, избыток)/Н2О (0,15 мл). Через 2 часа реакционную смесь подкисляли 1,5 мл смеси CH3CN:Н2О (1:1, 5% TFA) и подвергали ВЭЖХ с обращенной фазой с получением 2(R)-(4-фтор-3-метилфенилсульфонамидо)-3-(S)-циклопропилмасляной кислоты. ЯМР (500 МГц, CD3OD) δ: -0,01 (м, 1H), 0,15 (м, 1H), 0,40 (м, 2H), 0,65 (м, 1H), 1,02 (д, 3H), 1,22 (м, 1H), 2,31 (д, 3H), 4,83 (д, 1H), 7,16 (т, 1H), 7,69 (м, 1H), 7,75 (м, 1H).
Пример 146

2(R)-[(4-Фтор-3-метилфенил)сульфонил]амино-3(R)-циклопентоксилмасляную кислоту (11 мг, 0,03 ммоль) растворяли в DMF (200 мкл) в присутствии DIEA (12 мкл, 0,12 ммоль), HOBT (8 мг, 0,06 ммоль) и TMSONH2 (10 мкл, 0,08 ммоль). Добавляли раствор PyBOP (31 мг, 0,06 ммоль) в DMF (100 мкл). Через 20 минут реакцию гасили смесью 5% TFA/Н2О и в результате ВЭЖХ с обращенной фазой после лиофилизации выделяли продукт, которым являлся N-гидрокси-2(R)-[(4-фтор-3-метилфенил)сульфонил]амино-3(R)-циклопентоксилбутирамид. ЯМР (500 МГц, CD3OD) δ: 0,97 (д, 3H), 1,44˜1,68 (м, 8H), 2,32 (д, JH-F, 3H), 3, 61 (д, 1H), 3,72 (м, 1H), 3,67 (м, 1H), 7,18 (м, 1H), 7,70 (м, 1H), 7,76 (м, 1H).
Исходные продукты для примера 146 получали следующим образом:
N-Тритил-D-треонинбензиловый эфир (2,5 г, 5,5 ммоль), TEA (2,8 мл, 20 ммоль) растворяли при -50°С в 100 мл сухого толуола. В течение 15 минут добавляли раствор сульфурилхлорида (800 мкл, 8 ммоль) в толуоле (20 мл). Реакционной смеси давали возможность нагреваться до к.т. Добавляли этилацетат (100 мл) и смесь промывали насыщенным раствором NaCl и сушили над Na2SO4. Продукт кристаллизовали в МеОН (10 мл) с получением бензил-N-тритил-3(S)-метилазиридин-2(R)-карбоксилата. ЯМР (500 МГц, CDCl3) δ: 1,37 (д, 3H), 1,64 (м, 1H), 1,95 (д, 1H), 5,15 (д, J=12 Гц, 1H), 5,28 (д, J=12 Гц, 1H), 7,19˜7,28 (м, 12 H), 7,33˜7,36 (м, 1H), 7,36˜7,39 (м, 3H), 7,51˜7,54 (м, 4H).
Бензил-N-тритил-3(S)-метилазиридин-2(R)-карбоксилат (2,13 г, 4,92 ммоль) при 0°С растворяли в 20 мл смеси МеОН:DCM (1:1), затем добавляли TFA (20 мл). После перемешивания при комнатной температуре в течение 1 часа в роторном испарителе удаляли избыток реагента и растворитель (T<25°C). Остаток распределяли между DCM (50 мл) и Н2О (100 мл). Водную фазу один раз промывали DCM и с использованием NaHCO3 доводили рН до щелочного значения, экстрагировали этилацетатом и сушили над Na2SO4. В результате удаления растворителя оставалось 650 мг бензил-3(S)-метилазиридин-2(R)-карбоксилата. Его растворяли в DMF (15 мл) при 0°С. Добавляли ТЕА (2,1 мл, 15 ммоль), затем Boc2O (1,64 г, 7,5 ммоль). Реакционная смесь перемешивалась при комнатной температуре всю ночь. Добавляли этилацетат (100 мл), Н2О (100 мл) и органический слой дважды промывали 10% лимонной кислотой, насыщенным раствором соли и сушили над Na2SO4. Неочищенный продукт подвергали колоночной флэш-хроматографии при элюировании растворителем с градиентом, которым являлась смесь 5˜10% ЕА/гексан, содержащая 0,1% TEA, с получением бензил-N-Вос-3(S)-метилазиридин-2(R)-карбоксилата. ЯМР (500 МГц, CD3OD) δ: 1,21 (д, 3H), 1,44 (с, 9H), 2,82 (м, 1H), 3,21 (д, 1H), 5,2 (кв, 2H), 7, 30˜7,38 (м, 5H).
Бензил-N-Вос-3(S)-метилазиридин-2(R)-карбоксилат (50 мг, 0,17 ммоль), циклопентиловый спирт (0,5 мл, 5,5 ммоль) растворяли в DCM (0,5 мл) и затем добавляли несколько капель BF3·Et2O. Смесь перемешивалась при к.т. в течение 10 часов. Растворитель удаляли и остаток очищали ВЭЖХ с обращенной фазой. Продукт собирали и обрабатывали смесью 50% TFA/DCM с получением трифторацетата бензил-2(R)-амино-3(R)-циклопентоксилбутирата. ЯМР (500 МГц, CD3OD) δ: 1,28 (д, 3H), 1,4˜1,7 (м, 8H), 3,92 (м, 1H), 4,06 (д, 1H), 4,14 (d кв, 1H), 5,26 (д, J=12 Гц, 1H), 5,31 (д, J=12 Гц, 1H), 7,38 (м, 3H), 7,43 (м, 2H).
Трифторацетат бензил-2(R)-амино-3(R)-циклопентоксилбутирата (63 мг, 0,16 ммоль), DIEA (174 мкл, 1,0 моль), DMAP (1 мг) растворяли в диоксане (2 мл), после чего медленно добавляли раствор 4-фтор-3-метилфенилсульфонилхлорида (˜0,33 ммоль) в диоксане (1 мл). Через 15 минут реакцию гасили смесью 5% TFA/Н2О и очищали ВЭЖХ с обращенной фазой с получением бензил-2(R)-[(4-фтор-3-метилфенил)сульфонил]амино-3(R)-циклопентоксилбутирата. Защитную группу для сложного бензилового эфира удаляли гидрированием в смеси МеОН:ЕА (1 мл) с использованием 10% Pd/C (2 мг) в течение ночи с получением при этом 2(R)-[(4-фтор-3-метилфенил)сульфонил]амино-3(R)-циклопентоксилмаслянной кислоты.
Следуя методике примера 146, с использованием модификаций, известных специалистам в данной области, получали соединения примеров 147-153, представленных в таблице 2.
Анализ для определения ингибирования летального фактора
Представленный ниже анализ раскрыт в: Cummings et al., PNAS, May 14, 2002, vol. 99, № 10, page 6603-6606 и в заявке США 03/05552 от 2/21/2003, поданной в соответствии с договором РСТ (заявка на патент США № 60/359707, поданная 2/25/2002), включенной в данное описание в качестве ссылки во всей своей полноте. Термин «ингибирование летального фактора» означает, что летальный фактор провзаимодействовал с соединением и считается, что такое соединение является ингибитором летального фактора.
Соединения, ингибирующие летальный фактор, могут быть использованы для дополнительного исследования активности летального фактора и такие ингибирующие соединения, имеющие соответствующие фармакологические свойства, могут быть применены для способствования лечению или профилактике сибирской язвы. Соответствующие фармакологические свойства включают действенность, метаболизм и отсутствие неприемлемых побочных действий.
Для отбора большого количества соединений с целью идентификации таких, которые оказывают воздействие на активность летального фактора, может быть использован высокопроизводительный скрининг ингибиторов летального фактора. Высокопроизводительный скрининг может быть облегчен анализом, который легко автоматизировать и в котором используются низкие уровни очищенного фермента.
Измерение активности
В способах измерения активности летального фактора Bacillus anthracis и действия соединения на указанную активность могут быть использованы субстраты летального фактора. Такие способы включают инкубирование указанного в данном описании субстрата летального фактора с летальным фактором Bacillus anthracis с использованием инкубационной среды, в которой летальный фактор Bacillus anthracis является активным, и могут включать присутствие испытуемого соединения. В качестве меры активности летального фактора Bacillus anthracis или действия соединения на активность летального фактора может служить расщепление субстрата. Измерение может быть качественным или количественным. Анализ связывания фермента летального фактора показывает, что значение IC50для соединений изобретения находится в диапазоне значений 15 мкМ или менее. Значения IC50для N-гидрокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-3-метилбутирамида и N-гидрокси-2(R)-[(4-фтор-3-метилфенилсульфонил)]амино-2-(4'-тетрагидропиранил)ацетамида составляют соответственно 0,13 мкМ и 0,06 мкМ.
Реферат
Настоящее изобретение относится к производным сульфамида общей формулы I
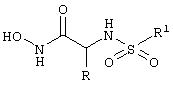
или их фармацевтически приемлемым солям, энантиомерам, диастереоизомерам или их смесям, где R1 - С6-арил, необязательно замещенный 1-3 группами Ra, где Ra - галоген; R - С1-8алкил, который может быть замещен циклоалкилом, С6-гетероциклоалкил, содержащий в качестве гетероатома кислород, С1-6алкокси. Соединения могут быть использованы для получения лекарственного средства для ингибирования активности летального фактора Bacillus anthracis. Описаны также фармкомпозиция на основе соединений формулы I и применение соединений. 3 н. и 4 з.п. ф-лы, 1 табл.
Формула



Комментарии