Соединение для специфического связывания с β-амилоидом - RU2721845C2
Код документа: RU2721845C2
Чертежи



Описание
Область техники, к которой относится изобретение
Данное изобретение относится к области медицинской технологии, особенно касается соединения, специфически связывающего бета-амилоид, его способов получения и применения при получении лекарств.
Уровень техники
Текущие исследования показали, что отложение бета-амилоида имеет тесную связь с патогенезом Болезни Альцгеймера, поэтому исследования сфокусированы на детекции бета-амилоида и его устранении или снижении его уровня. Для того, чтобы глубже исследовать и устранять бета-амилоид, нужно соединение, которое может специфически связывать бета-амилоид.
По мере развития техники нейтронно-захватной терапии использование нейтронно-захватной терапии для устранения бета-амилоида имеет хорошее нацеливание и лучший лечебный эффект, но в настоящее время ещё не открыто соединение, которое может не только использоваться совместно с устройством нейтронно-захватной терапии, но и специфически связывать бета-амилоид.
Краткое описание изобретения
Для того, чтобы решить вышеуказанные технические проблемы, с одной стороны, настоящее изобретение предоставляет соединение, которое может специфически связывать бета-амилоид, упомянутое соединение представляет собой 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазол, данное соединение имеет структуру, как показано в формуле I:

формула I
где R1 представляет собой -B(OH)2, R2 представляет собой -NHCH3,
бор в R1 представляет собой нуклид10B с большим сечением захвата тепловых нейтронов.
Нуклид с большим сечением захвата тепловых нейтронов содержит10B,155Gd и157Gd но не ограничивается ими. Нуклид с большим сечением захвата тепловых нейтронов имеет в виду нуклид, сечение захвата нейтронов которого в 100 раз больше, чем сечение захвата нейтронов основных составляющих элементов человеческого тела (C, H, O, N, P, S) при облучении тепловых нейтронов с одинаковой энергией. В том числе в основных составляющих элементов человеческого тела элемент H имеет самое большое сечение захвата нейтронов при облучении тепловых нейтронов с одинаковой энергией. Когда энергия тепловых нейтронов – 0.025 эВ, сечение захвата тепловых нейтронов H – 0.2 барн, сечение захвата тепловых нейтронов10B – 3800 барн, сечение захвата тепловых нейтронов155Gd – 60700 барн, сечение захвата тепловых нейтронов157Gd – 254000 барн, при облучении тепловых нейтронов с одинаковой энергией их сечение захвата тепловых нейтронов в 100 раз больше, чем сечение захвата нейтронов элемент H.
Этот нуклид с большим сечением захвата тепловых нейтронов может реагировать с тепловыми нейтронами для получения атомных реакций, и освободить по меньше мере один луч с убойным действием, данный луч имеет короткий радиус действия, в основном он только нарушает структуру бета-амилоида, который специфически связывается упомянутым соединением, но не нарушает другие нормальные ткани и имеет меньший вред для нормальных тканей.
При облучении луч нейтронов10B реагирует следующем образом и излучает энергию:

Использование специфики соединения с бором(10B), которое имеет большое сечение захвата тепловых нейтронов, с помощью захвата нейтронов и реакции ядерного деления10B(n,α)7Li возникают тяжелые частицы4He и7Li. Как показано в уравнении I, средняя энергия этих двух заряженной частицы около 2.33 МэВ, и имеют такие специфики, как высокая линейная передача энергии, короткий радиус действия. Линейная передача энергии частицы α-150 кэВ/мкм, радиус действия – 8 мкм, а линейная передача энергии тяжелой частицы - 175 кэВ/мкм, радиус действия – 5 мкм. Общий радиус действия двух частицы составляет приблизительно размер клетки, поэтому радиационный вред для организма ограничивается уровнем клетки.
Данное соединение обладает свойством специфического связывания с бета-амилоидом, и содержит нуклид10B с большим сечением захвата тепловых нейтронов. Поэтому можно использовать данное соединение и бета-амилоида для получения конъюгата, и потом облучать конъюгат нейтронным пучком, создаваемым устройством для нейтронно-захватной терапии, элемент10B в упомянутом соединении и нейтрон подвергаются атомному реакции, и возникшая энергия может портить структуру бета-амилоида.
Предпочтительно, среди упомянутых соединений, которые специфически связывают бета-амилоид, углерод в R2упомянутого соединения представляет собой11C.
11C в качестве радионуклида часто используется для обозначения соединения для медицинской диагностики и использования. В данном изобретении соединение 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазол имеет свойство специфического связывания бета-амилоида, после обозначения данного соединения радионуклидом11C, упомянутое соединение может использоваться в ПЭТ/КТ для отслеживания и определения места отложения бета-амилоида в головном мозге и для диагностики Болезни Альцгеймера.
С другой стороны, данное изобретение поставило способ получения соединения, которое может специфически связывать бета-амилоид, соединение, показанное в формуле I получается из соединения 2-(4-нитрофенил)-6-бромбензотиазол, как показано в формуле II:

формула II
Показанное в формуле I соединение, которое может специфически связывать бета-амилоид, представляет собой 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазол.
Предпочтительно, среди способов получения соединения, которые могут специфически связывать бета-амилоид, способы получения 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазол из 2-(4-нитрофенил)-6-бромбензотиазол включают:
восстановление 2-(4-нитрофенил)-6-бромбензотиазол формулы II с получением 2-(4-аминофенил)-6-бромбензотиазола;
взаимодействие 2-(4-аминофенил)-6-бромбензотиазола и формальдегида с получением 2-(4-метиламинофенил)-6-бромбензотиазола;
взаимодействие 2-(4-метиламинофенил)-6-бромбензотиазола и бис(пинаколато)дибора с получением 2-(4-метиламинофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-бензотиазола;
окисление 2-(4-метиламинофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензотиазола с помощью окислителя с образованием 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазола формулы I.
Предпочтительно, получение 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазол из 2-(4-нитрофенил)-6-бромбензотиазол ещё можно через следующие реакции :
взаимодействие 2-(4-нитрофенил)-6-бромбензотиазола и бис(пинаколат)дибора с получением 2-(4-нитрофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-бензотиазола, бор в упомянутом бис(пинаколат)диборе представляет собой10B;
окисление 2-(4-нитрофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-бензотиазола окислителем с получением 2-(4-нитрофенил)-6-(дигидроксиборил)-бензотиазола;
восстановление 2-(4-нитрофенил)-6-(дигидроксиборил)-бензотиазола с помощью восстанавителя с получением 2-(4-аминофенил)-6-(дигидроксиборил)-бензотиазола;
взаимодействие 2-(4-аминофенил)-6-(дигидроксиборил)-бензотиазола, иодметана и трифторметансульфоната серебра с получением соединения 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазола формулы I.
Среди вышеуказанных двух способов синтеза 2-(метиламинофенил)-6-(дигидроксиборил)-бензотиазола,10B в соединении формулы I происходит из10B используемого реагента бис(пинаколат)дибора. Как уже упоминалось выше, при получении показанного в формуле I соединения количество реагента бис(пинаколат)дибора, который содержит10B, следует выбирать в соответствии с чистотой соединения10B, требуемого для фактического применения.
Кроме того, C в иодметане может быть12C или11C. Предпочтительно, среди способов получения соединения, которое может специфически связывать бета-амилоид, углерод в упомянутом иодметане представляет собой11C. 2-(метиламинофенил)-6-(дигидроксиборил)-бензотиазол, синтезированный из радиоактивного иодметана, тоже обладает радиоактивностью. И радиоактивный11C метили на метиламине R2 соединении, которое показано в формуле I.
Соединение формулы I может быть мечено с помощью11C и использовано его для отслеживания места отложения бета-амилоида в головном мозге и для диагностики Болезни Альцгеймера, путем использования его радиоактивности в комбинации с Позитронно-эмиссионной компьютерной томографией (ПЭТ). Нужно объяснить, что хотя с помощью11C метили показанное в формуле соединение, упомянутое соединение ещё обладает свойством специфически связывать бета-амилоид, и упомянутое соединение всё ещё содержит нуклид10B с большим сечением захвата тепловых нейтронов. Поэтому показанное в формуле I соединение, которое метили с помощью11C, все ещё имеет свойство элиминирования бета-амилоида в системе для нейтронно-захватной терапии.
Предпочтительно, среди способов получения соединений, которые могут специфически связывать бета-амилоид, в качестве упомянутого окислителя может предпочтительно выбирать метапериодат натрия или другой окислитель, в отношении окисляемости похож на метапериодат натрия.
В-третьих, данное изобретение поставило применение 2-(метиламинофенил)-6-(дигидроксиборил)-бензотиазол в получении лекарственного средства, которое специфически связывает бета-амилоид. Получение из 2-(метиламинофенил)-6-(дигидроксиборил)-бензотиазол лекарственного средства формируется комбинация с бета-амилоидом, и потом облучается упомянутая комбинация нейтронным излучением, излучаемый из устройства для нейтронно-захватной терапии, энергия из реакции нейтронов с элементом10B портит бета-амилоид.
В-четвёртых, данное изобретение поставило применение 2-(метиламинофенил)-6-(дигидроксиборил)-бензотиазол, который метили11C, в получении агента, визуализирующего бета-амилоид при ПЭТ.
Полезные результаты данного изобретения заключаются в том, что, с одной стороны, путем представления нового соединения, которое специфически связывает бета-амилоид, осуществили устранение специфичностью связывающегося с соединением бета-амилоида с помощью устройства для нейтронно-захватной терапии, что представило новую мысль и новый способ для устранения бета-амилоида. С другой стороны, путем представления 2-(метиламинофенил)-6-(дигидроксиборил)-бензотиазол, который метили радиоактивным изотопом11C, представили новый выбор для агента, визуализирующего бета-амилоид при ПЭТ.
Краткое описание графических материалов
Фиг. 1 представлен атлас1H ЯМР 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазола;
Фиг. 2 представлена схема устройства для нейтронно-захватной терапии в нейтронном источнике ускорителя;
Фиг. 3 представлена схема устройства для нейтронно-захватной терапии в нейтронном источнике реактора;
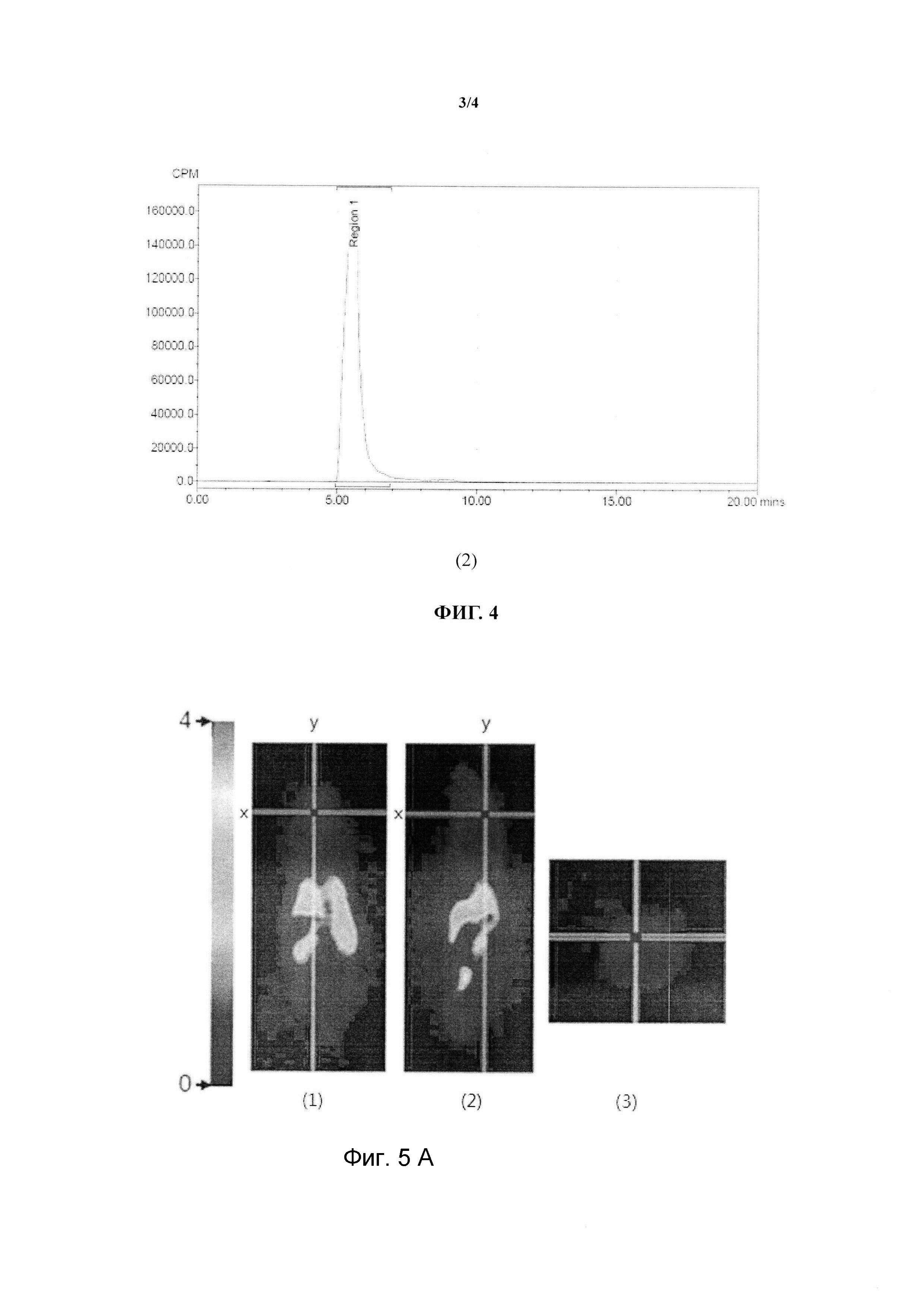
Фиг. (1) и Фиг. (2) в Фиг. 4 относительно представлены атласы стабильности 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазол, метимый11C, соответственно при 30 мин и 60 мин;
Фиг. A и Фиг. B в Фиг. 5 относительно представлены ПЭТ сравнительной мыши и мыши модели SAMP8 после 30 мин, как им впрыснули 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазол, меченный11C;
Фиг. 6 представлена электрофореграмма SDS-PAGE смешанных растворов бычьего сывороточного альбумина и H310BO3, облучаемых излучением в разных положениях выхода коллиматора.
Подробное описание изобретения
Приложенная внизу комбинированная схема производит дальнейшее подробное разъяснение к данному изобретению для того, чтобы обладающий мастерством в данной области технический персонал, сверяясь с текстом инструкции, мог предпринимать действия по приведенным данным.
Следует понимать, что все используемые в данном тексте термины вроде “обладает”, “содержит в себе”, а также “включает в себя” никоим образом не исключают наличие или добавление одного или нескольких других составляющих или их соединений.
Энергетическая зона упомянутых в данном тексте быстрых нейтронов более 40 кэВ, энергетическая зона надтепловых нейтронов – между 0.5 эВ и 40 кэВ, а энергетическая зона тепловых нейтронов - менее 0.5 кэВ.
Настоящее изобретение предполагает соединение, специфически связывающее бета-амилоид, представляет собой 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазол, структура которого действительно показана в чертеже 1. Данное соединение может применяться совместно с устройством для нейтронно-захватной терапии, чтобы устранять связанную молекулу бета-амилоида.
Как показано на фиг. 2 или фиг. 3: упомянутая установка нейтронозахватной терапии включает в себя источник нейтронов, блок формирования пучка и коллиматор. При этом блок формирования пучка включает в себя рефлектор, замедлитель, абсорбер тепловых нейтронов и установку экрана излучения. В том числе источник нейтронов включает в себя источник нейтронов ускорителя и источник нейтронов реактора.
В реальном применении системы нейтронозахватной терапии в процессе удаления β-амилоидного белка, в обычной ситуации необходимо внутри блока формирования пучка установки нейтронозахватной терапии отрегулировать быстрые нейтроны поля смешанных излучений до надтепловых нейтронов, а также снизить содержание других вредных лучей поля смешанных излучений. Хотя нуклеиды химического соединения, специфически связывающего β-амилоидный белок, - это нуклеиды с крупным сечением захвата тепловых нейтронов, но учитывая то, что пучок нейтронов из коллиматора установки нейтронозахватной терапии в процессе достижения химического соединения, специфически связывающего β-амилоидный белок, энергия пучка нейтронов может в определенной степени ослабеть вслед за увеличением энергии химического вещества. При этом пучок нейтронов в процессе достижения химического соединения, специфически связывающего β-амилоидный белок, часто может производить замедление скорости других веществ в неоднородной степени по отношению к энергии нейтронов. Поэтому в целях обеспечения достижения химическим соединением, специфически связывающим β-амилоидный белок, энергии и интенсивности нейтронов, в обычной ситуации необходимо замедлить быстрые нейтроны внутри блока формирования пучка до надтепловых нейтронов и повысить содержание надтепловых нейтронов в вышедшем из коллиматора пучке нейтронов.
Пожалуйста еще раз обратитесь к фиг. 2. Установка нейтронозахватной терапии в системе нейтронозахватной терапии – это установка нейтронозахватной терапии источника нейтронов в ускорителе. При этом источник нейтронов в ускорителе 10b посредством лучерасширительного устройства расширяет площадь поперечного сечения протонного пучка P, отчего упомянутый протонный пучок P достигает материала мишени T и производит нейтроны. Принцип действия данной реакции таков: протоны, дейтроны и другие заряженные частицы ускоряются ускорителем до энергии, достаточной для сопротивления кулоновскому отталкиванию атомного ядра мишени. В результате ядерной реакции с металлической мишенью образуется дочернее ядро и протоны. При этом как правило материалом металлической мишени служат литий и бериллий. Как правило данным методом образуется поле смешанных излучений. Во время использования данной установки нейтронозахватной терапии к β-амилоидному белку 53, необходимо по возможности снизить лучи других типов, чтобы замедлитель 32a в сформированном теле луча 30a обладал действием регулирования энергии в упомянутом поле смешанных излучений. Рефлектор 31a отражает обратно рассеянное в других направлениях поле смешанных излучений, чтобы снизить потери нейтронов. Блок формирования пучка 30a также может включать в себя абсорбер тепловых нейтронов 33a, который может абсорбировать тепловые нейтроны с низким уровнем энергии. На внешней части упомянутого блока формирования пучка 30a имеется однослойная установка экрана излучения 34a, позволяющая избежать утечки излучения и нанесения вреда находящимся вблизи людям. В задней части блока формирования пучка 30a установлен коллиматор 40a. Отрегулированный в блоке формирования пучка 30a луч снова проходит коллиматор 40a для сбора, а также для еще более точного облучения химического соединения 52, содержащего нуклиды с крупным сечением захвата тепловых нейтронов 51, и способного специфически связывать патогенный белок 53. Это дополняет использование пучка надтепловых нейтронов.
Пожалуйста, еще раз обратитесь к фиг. 3. Установка нейтронозахватной терапии в системе нейтронозахватной терапии - это установка нейтронозахватной терапии источника нейтронов в реакторе. При этом источник нейтронов реактора 10b передает по трубопроводу проведенный пучок нейтронов на блок формирования пучка 30b. Источник нейтронов реактора 10b и источник нейтронов ускорителя 10a в одинаковой степени производят поле смешанных излучений. Быстрые нейтроны с достаточно высокой энергией в поле смешанных излучений проходят замедлитель 32b в блоке формирования пучка 30b, где замедляются до нейтронов, могущих разрушить конструкцию β- амилоидного белка. Лучи, рассеянные в других направлениях отражаются в рефлекторе 31b и возвращаются в замедлитель 32b для повышения коэффициента использования лучей. Абсорбирующее тело тепловых нейтронов в сформированном теле луча может впитать тепловые нейтроны с низкой энергией поля смешанных излучений, чтобы еще более увеличить содержание надтепловых нейтронов в пучке нейтронов N. Упомянутый пучок нейтронов N благодаря сбору и формированию в коллиматоре 40b может использоваться для еще более точного облучения химического соединения 52, содержащего нуклиды с крупным сечением захвата тепловых нейтронов 51, и способного специфически связывать патогенный белок 53. Это дополняет использование пучка надтепловых нейтронов.
Далее на примерах осуществления приводятся дальнейшие разъяснения технического проекта данного изобретения.
Под упомянутым химическим соединением, специфически связывающемся с β-амилоидным белком, отобранным для примера осуществления данного изобретения подразумевается 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол. При этом элемент бора в данном химическом соединении -10B. Также в данном химическом соединении может содержаться радиоактивный элемент11C. Если не было сделано особых пояснений, то содержание элемента бора в упомянутом борном химическом соединении примера осуществления данного изобретения -10B.
Вариант осуществления 1
Метод получения химического соединения, специфически связывающегося с β-амилоидным белком
Показанное в формуле I химическое соединение 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол получали следующими стадиями:

формула I
1 г 2-(4-нитрофенил)-6-бромобензотиазола растворить в 10 мл этанола, затем добавить 5.39 г SnCl2·2H2O. В данной реакционной системе при 100 °C после 1 часа помешивания образуется 2-(4-аминофенил)-6-бромобензотиазол;
1H ЯМР: 400 МГц DMSO
δ 8.29 (s, 1H), 7.80-7.82 (d, J = 8.8Гц, 1H), 7.74-7.76 (d,J = 8.8Гц, 2H), 7.58-7.60 (m, 1H), 6.65-6.67 (d, J = 8.4Гц, 2H), 5.95 (s,2H). В 1 г 2-(4-аминофенил)-6-бромобензотиазола добавить 16.4 ммоль формальдегида, затем туда же добавить 10 мл тетрагидрофурана (THF) и 20 мл метанола. После этого однократно добавить 0.886 г натрий метилата для составления реакционного раствора. Упомянутый реакционный раствор при 65 °C в течение 12 часов подвергать реакции смешивания, затем остудить реакционный раствор до 25°C, добавить 620.41 мг борогидрита натрия (NaBH4). Затем повысить температуру реакции до 65°C, и после часа реакции смешения образуется 2-(4-метиламинофенил)-6-бромобензотиазол;
1H ЯМР: 400 МГц CDCl3
δ 7.97 (s, 1H), 7.89-7.91 (d, J = 8.8Гц, 2H), 7.81-7.83 (d, J = 8.8Гц, 1H), 7.52-7.54 (m,1H), 6.64-6.66 (d, J = 8.8Гц, 2H), 2.93 (s, 3H).
Из 100 мг 2-(4-метиламинофенил)-6-бромобензотиазола, 95.46 мг биспинаколатодибора и 92.23 мг ацетата калия составить реакционную систему, добавить в нее 4 мл и 2 мл диметилсульфоксида (DMSO). В условиях азотозаполнения при 20°C добавить 26.39 мг дихлорида (трифенилфосфин) палладия (Pd (PPh3)2Cl2). На 12 часе реакции смешивания при 90°C образуется 2-(4-метиламинофенил)- 6-пинаколатодиборонобензотиазол, , при этом содержание бора в биспинаколатодиборе -10B;
1H ЯМР:400 МГц MeOH
δ 8.26 (s, 1H), 7.82-7.86 (m, 4H), 7.76-7.93 (m, 2H), 4.07 (s, 1H), 2.63 (s, 3H), 1.2 (s, 12H).
В 300 мг 2-(4-метиламинофенил)-6-пинаколатодиборонобензотиазола добавить 20 мл THF и 10 мл воды, затем добавить 875.93 мг метапериодата натрия (NaIO4) для составления реакционной системы, В упомянутой реакционной системе на 12 часу реакции смешивания при 25°C образуется показанное в формуле I химическое соединение: 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол. Спектры сканирования1H ЯМР данного химического соединения показаны на фиг. 1.
1H ЯМР: 400 МГц MeOH
δ 8.27 (s, 1H), 7.83-7.85 (m, 4H), 6.66-6.68 (d, J = 7.6 Гц, 2H), 2.85 (s, 3H).
При этом, 2-(4-нитрофенил)-6-бромобензотиазол может пройти следующие этапы подготовки:
В 25 мл калиевого щелока с концентрацией 10 M добавить 5 г 2-амино-6-бромин-бензотиазола, затем добавить 5 мл этиленгликоля для составления смешанного раствора. В результате реакции смешивания упомянутого реактивного раствора при 125°C в течение 2 часов образуется 2-амино-5-бромотиофенол;
1H ЯМР: 400 МГц DMSO
δ 7.21-7.26 (m, 1H), 6.99 (s, 1H), 6.81-6.72 (m, 1H), 6.39 (s, 1H), 5.72 (s, 2H).
В 2 г 2-амино-5-бромотиофенола добавить 1,48 г нитрофенилформальдегида, затем добавить 40 мл DMSO для составления реактивного раствора. В результате реакции смешивания упомянутого реактивного раствора при 180°C в течение получаса образуется 2-(4-нитрофенил)-6-бромобензотиазол;
1H ЯМР: 400 МГцDMSO
δ 8.54 (s, 1H), 8.34-8.41 (m, 4H), 8.07-8.09 (d, J = 8.8Гц, 1H), 7.74-7.77 (m, 1H).
Конкретный процесс реакции синтеза упомянутого 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазола в данном примере осуществления показан в формуле реакции II (B в данной формуле реакции -10B):

Вариант осуществления 2
Метод подготовки химического соединения, специфически связывающегося с β-амилоидным белком.
Метод синтеза 2-(4-нитрофенил)-6-бромобензотиазола, использованный в данном варианте осуществления, аналогичен методу, показанному в <примере осуществления 1>.
В 100 мг 2-(4-нитрофенил)-6-бромобензотиазола добавляется 90.91 мг биспинаколатодибора и 87.84 мг ацетата калия, затем добавляется 4 мл THF и 2 мл DMSO. В условиях азотозаполнения при 20°C добавляется 25 мг дихлорида (трифенилфосфин) палладия. В упомянутой реакционной системе на 23 часе реакции при 25°C образуется 2-(4-нитрофенил)-6-пинаколатодиборонобензотиазол, при этом содержание бора в биспинаколатодиборе -10B;
1H ЯМР: 400 МГц CDCl3
δ 8.44 (s, 1H), 8.35-8.37 (d, J = 8.8Гц, 2H), 8.28-8.30 (d, J = 8.8Гц, 2H), 8.11-8.13 (d, J = 8Гц, 1H), 7.96-7.98 (d, J = 8Гц, 1H), 1.40 (s, 12H).
В 539.7 мг 2-(4-нитрофенил)-6-пинаколатодиборонобензотиазола добавляется 30 мл THF и 10 мл воды, затем добавляется 1.51 г метапериодата натрия. В упомянутой реакционной системе на 23 часе реакции при 25°C образуется 2-(4-нитрофенил)-6-дигидроксиборилбензотиазол;
1H ЯМР: 400 МГц DMSO
δ 8.56 (s, 1H), 8.36-8.42 (m, 4H), 8.29 (m, 2H), 8.10-8.12 (d, J = 8.4Гц, 1H), 8.00 (m, 1H).
В 100 мл метилового спирта добавляется 200 мг активатора Pd/C, затем добавляется 180 мг 2-(4-нитрофенил)-6-дигидроксиборилбензотиазола, что образует реакционную систему. В упомянутой реакционной системе в среде водородного газа происходит вакуумная дегазация, и на 10 минуте реакции при 25°C образуется 2-(4-аминофенил)-6-дигидроксиборилбензотиазол;
1H ЯМР: 400 МГц MeOH
δ 8.29 (s, 1H), 7.80-7.84 (m, 4H), 6.74-6.76 (d,J = 8.8 Гц, 2H).
После прохождения несущего йодистый метил азота через нагретую до 200 °C трубу трифлата серебра с последующим вхождением на разложение в обезвоженный ацетон 2-(4-аминофенил)-6-дигидроксиборилбензотиазола образуется реакционный раствор, в который после 5 минут реакции при 80 °C добавляется вода для гашения, отчего получается 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол.
При этом C в составе йодистого метила можно рассматривать как радиоактивный11C, поэтому составленный им 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол аналогично обладает радиоактивным элементом11C. По этой причине данное обладающее радиоактивностью химическое соединение может сочетаться с PET в применении для отслеживания скопления β-амилоидного белка в местах области головного мозга, а также для диагностики AD.
1H ЯМР: 400 МГц MeOH
δ 8.27 (s, 1H), 7.83-7.85 (m, 4H), 6.66-6.68 (d,J = 7.6 Гц, 2H), 2.85 (s, 3H).
При этом уголь в составе йодистого метила можно рассматривать как радиоактивный 11C, поэтому составленный им 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол аналогично обладает радиоактивным элементом11C. По этой причине данное обладающее радиоактивностью химическое соединение может сочетаться с Micro-PET в применении для отслеживания скопления β-амилоидного белка в местах области головного мозга, а также для диагностики AD.
1H ЯМР:400 МГц MeOH
δ 8.27 (s, 1H), 7.83-7.85 (m, 4H), 6.66-6.68 (d, J = 7.6 Гц, 2H), 2.85 (s, 3H).
Процесс реакции в данном примере осуществления показан в формуле реакции III(B в данной формуле реакции -10B):

Применение меченного 2-(4-аминофенил)-6-((2-гидроксил)бор)-бензотиазола по варианту осуществления 3 при получения ПЭТ-визуализатора бета-амилоида. На основе привычных экспериментальных методов для технического персонала в области очистит препаративным HPLC 2-(4-метиламинофенил)-6-(дигидроксиборил) -бензотиазол в варианте осуществления 2, после этого его радиоактивная химическая чистота составляет 98,15%, и его время хранения HPLC составляет 5.43 мин, которое совпадает со временем хранения 2-(4-метиламинофенил)-6-(дигидроксиборил)-бензотиазола, поэтому можно определять то, что очищенный продукт представляет собой нужное радиоактивное соединение.
Используя HPLC измерять in vitro стабильность 2-(4-метиламинбензол)-6-((2- гидроксил)бор)-бензотиазола, отмеченный11C, время составляет 30 мин и 60 мин, фиг. (1) в фигуре 4 представляет собой радиоактивный атлас состабильностью 30 мин, фиг. (2) представляет собой радиоактивный атлас со стабильностью 60 мин, радиоактивные химические чистоты в 30 мин и 60 мин составляют 100%, в связи с этим, радиоактивная химическая чистота радиоактивного соединения, отмеченная11C соответствует требованием эксперимента.
Вариант осуществления 4
Испытание на специфическое связывание 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазола с маркером 11C и β-амилоидного белка.
Мышь SAMP8(senescenceacceleratedmouseprone 8) - самая распространенная в настоящее время животная модель для изучения AD (болезни Альцгеймера). В ее мозгу присутствует большой объем бляшек отложения амилоидного белка. В данном варианте осуществления мышь SAMP8 используется в качестве мышиной модели, а обычная лабораторная мышь - в качестве контрольной мыши. Мышиной модели и контрольной мыши одинаково по 10 месяцев. Обеим мышам по отдельности вливается 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол с содержанием маркера11C. Затем с помощью сканирования производится исследование - имеют ли 2-(4-метиламинофенил)-6дигидроксиборилбензотиазол и β-амилоидный белок специфический характер связывания. По отдельности отбираются мышиная модель и контрольная мышь с весом по 31.5±0.3 г. По отдельности им вливается 31.0±0.6 мкКи 2-(4-метиламинофенил) дигидроксиборилбензотиазол с маркером11C. Также с помощью Micro-PET модели INVEON от Siemens производится сканирование, при этом окно сканирования составляет 350-650 кэВ.
Как хорошо знает технический персонал данной области, основной причиной заболевания, приводящей к болезни Альцгеймера, является скопление бляшек отложения β-амилоидного белка в коре головного мозга и гиппокампе. В данном примере осуществления с помощью сканирования Micro-PET и с использованием программы PMOD производится сопоставление областей мозга мышиной модели и контрольной мыши. Также анализируется и определяется абсорбция радиоактивного 2-(4-метиламинофенил)-6дигидроксиборилбензотиазола в коре головного мозга и гиппокампе мышиной модели SAMP8 и контрольной мыши, чтобы еще больше разъяснить, что данное химическое соединение может специфично связываться с бляшками отложения β-амилоидного белка. Конкретные результаты этого показаны в таблицах 1 и 2:
Таблица 1, Впитывание радиоактивного 2-(4-метиламинофенил)- 6-
дигидроксиборилбензотиазола в кору головного мозга мышиной модели и
контрольной мыши
По таблице 1 можно видеть, что: на 35 минуте после вливания радиоактивного препарата, удельное значение объема впитывания в коре головного мозга у мышиной модели и контрольной мыши может достигать 2.7, что выше маркированного и немаркированного значений концентрации бора при борной нейтронозахватывающей терапии (2.5). Данные результаты также свидетельствуют о том, что радиоактивный 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол может эффективно вступать в сочетание с бляшками отложения β-амилоидного белка, а также накапливаться в очагах болезни. Самое обнадеживающее - то, что при использовании терапии по захвату нейтронов бора к больным болезнью Альцгеймера, места очагов болезни могут принимать большой объем доз излучения, благодаря чему и достигается цель терапии, а также снижается радиоактивное поражение нормальных мозговых тканей.
Таблица 2. Впитывание радиоактивного 2-(4-метиламинофенил)- 6-
дигидроксиборилбензотиазола в гиппокамп мышиной модели и
контрольной мыши
По таблице 2 можно видеть, что на 25 и 35 минутах после вливания радиоактивного препарата значение в гиппокампе у мышиной модели по сравнению с аналогичным значением у контрольной мыши составляет 3.2, что выше маркированного и немаркированного значений концентрации бора при борной нейтронозахватывающей терапии (2.5). Данные результаты также свидетельствуют о том, что радиоактивный 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол может эффективно вступать в сочетание с бляшками отложения β-амилоидного белка, а также накапливаться в очагах болезни.
Мышиная модель SAMP8 - это мышь, заболевшая болезнью Альцгеймера с ускоренным старением, в очагах заболевания, которые локализуются в ее мозговой коре и гиппокампе скоплен большой объем β-амилоидного белка. На примере данных испытаний мышиной модели и контрольной мыши в таблицах 1 и 2, можно увидеть, что у мышиной модели SAMP8, при сравнении с нормальной контрольной мышью, мозговая кора и гиппокамп обладают более мощной абсорбцией 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазола. Это также еще больше объясняет специфичность 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазола и β-амилоидного белка. В будущем можно будет еще больше использовать борную нейтронозахватную терапию для излечения болезни Альцгеймера, предоставив тем самым страдающим болезнью Альцгеймера пациентам еще один передовой метод лечения.
На основании результатов анализа таблицы 2, в промежуток времени с 25 по 35 минуту после вливания в мышей радиоактивного 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазола, сравнительное значение радиоактивного препарата в гиппокампе мышиных моделей по сравнению с аналогичным значением у контрольной мыши составило 3.2. Поэтому были отобраны снимки Micro-PET с промежуточным значением 30 минут для дальнейшего сопоставления состояния накапливания в области мозга 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазола.
На фиг. 5 показан PET-сканирование на 30 минуте вливания радиоактивного 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазола, а также снимок, обработанный программой AMIDE. При этом фиг. A - снимок на 30 минуте вливания контрольной мыши радиоактивного препарата. Изображение на фиг. A (1) - снимок сканирования коронарного среза контрольной мыши, изображение (2) - плоскостное сканирование вдоль оси Y изображения (1), изображение (3) плоскостное сканирование вдоль оси X изображения (1); на фиг. B показано влияние вливания радиоактивного препарата в мышиную модель SAMP8 на 30 минуте. Аналогичным образом, изображение (1) на фиг. B - снимок плоскостного сканирования мышиной модели, изображение (2) - плоскостное сканирование вдоль оси Y изображения (1), изображение (3) плоскостное сканирование вдоль оси X изображения (1).
Причем находящееся на фиг. A (3) и фиг. B (3) может отражать состояние абсорбции радиоактивного препарата в области мозга. При сопоставлении двух этих изображений, можно увидеть, что область мозга мышиной модели SAMP8 на фиг. B (3) в сравнении с областью мозга контрольной мыши на фиг. A (3) имеет большой объем скопления радиоактивного препарата. При этом известно, что в области мозга мышиной модели имеется большой объем бляшек отложений β-амилоидного белка. Таким образом, можно разъяснить, что 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол имеет специфическое воздействие на бляшки отложения β-амилоидного белка, а 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол в будущем может применяться для борной нейтронозахватывающей терапии.
Пример осуществления 5
Испытания по имитации удаления белка системой нейтронозахватной терапии.
В данном примере осуществления борная кислота (H310BO3) используется для замены 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазола, при этом элемент бор в борной кислоте (H310BO3) - 10B. С помощью альбумина бычьей сыворотки (BSA) производится имитация β-амилоидного белка. Смешанный раствор, составленный из борной кислоты и альбумина бычьей сыворотки, размещается в среду пучка нейтронов, произведенного установкой нейтронозахватной терапии. Благодаря SDS-PAGE гель-электрофорезу анализируется воздействие нейтронов на альбумин бычьей сыворотки, а также воздействие нейтронов на альбумин бычьей сыворотки в условиях наличия H310BO3.
I. Воздействие нейтронов на альбумин бычьей сыворотки
С помощью сверхчистой воды составить раствор BSA с концентрацией 0.01% (масс./масс.). Составленный раствор хранятся и используются в испытаниях при 4 °C. Отобрать 1 мл раствор BSA и поместить его по осевой линии выходного отверстия коллиматора установки нейтронозахватной терапии. При этом упомянутый раствор находится на расстоянии 2 см. от выходного отверстия коллиматора. Настроить установку нейтронозахватной терапии так, чтобы интенсивность нейтронов на выходном отверстии коллиматора составляла 2.4*1011 шт./с. Упомянутый раствор BSA подвергается облучению в данной нейтронной среде в течение двух часов. Кроме того, из упомянутого раствора BSA отбирается 1 мл в качестве контрольного раствора, который не подвергается нейтронному облучению.
Подвергнуть по отдельности раствор BSA и 8 контрольный раствор, подвергшихся нейтронному излучению в течение двух часов, окрашиванию с помощью кумасси бриллиантового голубого красителя и сделать SDS-PAGE гель-электрофорез. С помощью программы Image J произвести по отдельности количественное определение цветов белковых зон на электрофореграммах, соответствующих вышеописанному раствору-образцу и контрольному раствору. Их цифровые значения используются для отображения соответствующего содержания белка, в том числе, содержание BSA в контрольном растворе определяется как 1. При экспериментальных условиях вышеописанного нейтронного излучения, содержание BSA после двух часов нейтронного излучения равно 0.8, то есть содержание снизилось примерно на 20%. Отсюда можно видеть, что радиационное излучение, содержащее в себе пучок нейтронов может влиять на содержание белка.
II. Воздействие нейтронов на альбумин бычьей сыворотки при условии наличия H310BO3
С помощью сверхчистой воды составить растворы BSA и H310BO3, в том числе для упомянутых растворов, концентрация BSA должна быть 0.01 % (масс./масс.), а концентрация H310BO3 - 0.18 M. Составленные растворы хранятся и используются в испытаниях при 4 °C, из упомянутого раствора по отдельности отбирается 8 доз (которые нумеруются по отдельности как A, B, C, D, E, F, G и H). Каждая 1 мл доза раствора подвергается облучению с помощью установки нейтронозахватной терапии. 8 растворов по отдельности размещаются по осевой линии выходного отверстия коллиматора установки нейтронозахватной терапии. Раствор A находится на расстоянии 2 см. от выходного отверстия коллиматора, раствор B - на 4 см. от выхода коллиматора, раствор C - на 6 см., и так далее таким же образом. Помимо того, что пучок на выходном отверстии коллиматора включает в себя нейтронный луч, он также включает в себя гамма-лучи и другие радиационные лучи. В действительности же, основное разрушающее воздействие на белок производит нейтронный луч. Описываемая интенсивность нейтронов в пучке, используемом в данном примере осуществления, и в том числе, интенсивность нейтронов в данном примере осуществления - 2.4*1011 шт./с. 8 растворов подвергаются облучению в данной нейтронной среде в течение двух часов. Кроме того, из упомянутых растворов BSA и H310BO3отбирается по 1 мл в качестве контрольного раствора, который не подвергается нейтронному облучению.
Подвергнуть по отдельности контрольный раствор и 8 растворов, подвергшихся радиационному излучению, испускаемому установкой нейтронозахватной терапии, окрашиванию с помощью кумасси бриллиантового голубого красителя и сделать SDS-PAGE гель-электрофорез. На фиг. 6 показан SDS-PAGE гель-электрофорез контрольного раствора и 8 растворов.
Первые две белковые зоны на фигуре 6 - это BSA в контрольном растворе, остальные по отдельности - подвергшиеся упомянутому радиационному облучению BSA, 8 растворов размещены по центральной линии выходного отверстия коллиматора. Растворы по упомянутой осевой линии содержат H310BO3, а элемент10B имеет достаточно большое сечение задержания тепловых нейтронов. Поэтому после прохождения нейтронов радиационного излучения, выходящего из выходного отверстия коллиматора, через растворы с содержанием H310BO3, нейтронное облучение в значительной степени снижается. Чем дальше раствор находится от выходного отверстия коллиматора, тем меньше BSA получают дозу нейтронного облучения.
На фигуре 6 можно увидеть, что в сравнении с контрольным образцом, цвета белковых зон подвергшихся нейтронному излучению 8 растворов выцветают в неоднородной степени. Также, чем ближе к выходному отверстию коллиматора, тем бледней цвет белковой зоны раствора. Это говорит о том, что чем больше снижается содержание белка и чем ближе к выходному отверстию коллиматора, тем больше получает раствор дозу нейтронного облучения. Это еще больше объясняет влияние величины объема дозы облучения на содержание BSA. Чем мощней доза облучения, тем меньше содержание BSA в растворе, подвергшемся нейтронному облучению.
С помощью программы Image J производится количественное определение цвета белковых зон BSA на электрофореграммах, соответствующих контрольному раствору и 8 растворам по отдельности. Их цифровые значения используются для отображения соответствующего содержания белка, в том числе, содержание BSA в контрольном растворе определяется как 1. При экспериментальных условиях вышеописанного нейтронного излучения, содержание BSA после двух часов нейтронного излучения показано в таблице 3.
На таблице 3 можно увидеть, что под воздействием нейтронного излучения содержание BSA в растворе снижается в неравномерной степени. После двухчасового нейтронного излучения с интенсивностью нейтронов 2,4*1011 шт./с раствора на расстоянии в 2 см. от выходного отверстия коллиматора, содержание BSA в нем составляет всего 5.3%. Это говорит о том, что при условии наличия H310BO3, нейтроны могут в значительной степени разрушить структуру BSA и снизить объем содержания BSA; кроме того, в пределах допустимой экспериментальной погрешности, чем дальше находятся каждый из 8 растворов от выходного отверстия коллиматора, тем больше проявляется общая тенденция снижения содержания в них BSA. Это еще больше объясняет влияние величины объема дозы облучения на содержание BSA.
Таблица 3. Воздействие нейтронов на альбумин бычьей сыворотки при
условии наличия H310BO3
Предоставляемое данным изобретением химическое соединение 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол и H310BO3 в одинаковой мере несут с собой нуклиды с большим сечением для задержания тепловых нейтронов10B, а также могут специфически связывать β-амилоидный белок, помещая упомянутые выше химические соединения в среду, содержащую β-амилоидный белок. Упомянутые выше химические соединения может сформировать вокруг β-амилоидного белка довольно высокую концентрацию, после чего используя пучок нейтронов из установки нейтронозахватной терапии облучить области накопления упомянутых выше химических соединений. Высвобождаемая при этом энергия может разрушить белковую структуру.
Выше были приведен конкретный пример осуществления для разъяснения данного изобретения. Необходимо отметить то, что вышеприведенный пример осуществления применяется только для последующего разъяснения изобретения и не представляет собой область защиты данного изобретения. Не несущие существенного характера исправления и пересмотр, произведенные другими лицами в соответствии с указаниями данного изобретения также относятся к области защиты данного изобретения.
Реферат
Изобретение относится к соединению, специфически связывающему бета-амилоид, имеющему структуру, как показано в формуле I:формула Iгде Rпредставляет собой -B(OH), Rпредставляет собой –NHCH; и бор в Rпредставляет собой нуклидB с большим сечением захвата тепловых нейтронов, а также к способам его получения и промежуточным соединениям. Технический результат: получено новое соединение, которое специфически связывает бета-амилоид, а также визуализирует бета-амилоид при ПЭТ. 7 н. и 5 з.п. ф-лы, 6 ил., 3 табл., 5 пр.
Формула




Документы, цитированные в отчёте о поиске
Лиганды для агрегированных молекул тау-белка

Комментарии