Лиганды для агрегированных молекул тау-белка - RU2518892C2
Код документа: RU2518892C2
Чертежи






Описание
Родственная заявка
Настоящая заявка испрашивает приоритет на основании патентной заявки США №61/099,376, поданной 23 сентября 2008 года, содержание которой включено в настоящую заявку по всей полноте посредством ссылки.
Область техники
Настоящее изобретение относится в общем к материалам, способам и моделям, относящимся к маркировке и обнаружению нейрофибриллярных клубков. В дополнение, настоящее изобретение относится к лигандам, подходящим для определения стадии невропатологического заболевания, и их применению в диагностике, прогнозировании или лечении заболеваний, таких как болезнь Альцгеймера (БА).
Уровень техники
В настоящей патентной заявке представлены многочисленные патенты и публикации для более полного определения и описания изобретения и уровня области техники, к которой относится настоящее изобретение. Содержание каждой из указанных ссылок включено в настоящую патентную заявку во всей полноте посредством ссылки в описании настоящего изобретения в том же объеме, что и в случае если конкретно указано, что каждая из индивидуальных ссылок включена в настоящую патентную заявку посредством ссылки.
В настоящем описании, включая нижеследующие пункты формулы изобретения, в случае если в контексте не указано обратное, следует понимать, что термин «содержать» и его вариации, такие как «содержит» и «содержащий», подразумевают включение указанного числа или стадии или группы чисел или стадий, но не исключение любых других чисел или стадий или групп чисел или стадий.
Следует отметить, что используемые в описании и пунктах прилагаемой формулы изобретения, формы единственного числа включают также формы множественного числа если в контексте явно не указано обратное. Таким образом, например, указание на «фармацевтический носитель» может относиться также к смеси двух или более указанных носителей и т.д.
Диапазоны часто представлены в настоящей патентной заявке в виде от «примерно» одного конкретного значения и/или до «примерно» другого конкретного значения. В другом варианте реализации описание указанного диапазона включает диапазон от одного конкретного значения и/или до другого конкретного значения. Аналогично, когда значения выражены в виде примерных значений с применением определения «примерно» следует понимать, что конкретное значение образует другой вариант реализации.
Настоящее описание включает данные, которые могут быть полезны для понимания настоящего изобретения. При этом будет неправильным предположение о том, что любая информация, приведенная здесь, относится к уровню техники или имеет непосредственное отношение к заявленному настоящему изобретению, или, что конкретно или косвенно указанные публикации относятся к уровню техники.
Состояния слабоумия, такие как болезнь Альцгеймера (БА) часто характеризуют как прогрессирующее накопление внутриклеточных и/или внеклеточных отложений белковых структур, таких как β-амилоидные бляшки и нейрофибриллярные клубки (НФК) в мозгу пораженных пациентов. Проявление указанных поражений в значительной степени связано с патологической нейрофибриллярной дегенерацией и атрофией мозга, так же как и с нарушением когнитивных функций (см, например, работу Е.Б.Мукетовой-Ладинской с соавторами (Mukaetova-Ladinska ЕВ, et al.), 2000).
При БА нейритические бляшки и НФК содержат парные спиральные филаменты (PHF), основной компонент которых представляет собой тау-белки, ассоциированные с микротрубочками (см, например, работу Вишика с соавторами (Wischik et al.), 1988). Бляшки также содержат внеклеточные β-амилоидные волокна, полученные в результате аномального преобразования предшественника бета-амилоида (ПБА) (см, например, работу Кэнга с соавторами (Kang et al.), 1987). В статье Вишика с соавторами (Wischik et al.) (в «Neurobiology of Alzheimer's Disease») подробно обсуждают предполагаемое влияние тау-белка на патогенез нейродегенеративной деменции. Потеря нормальной формы тау-белков, накопление патологических PHF и потеря синапса среднелобной области коры связаны с ассоциированными нарушениями когнитивных функций. Кроме того, потеря синапса и потеря пирамидальных клеток согласуются с морфометрическими измерениями тау-реактивной нейрофибриллярной патологии, которая соответствует, на молекулярном уровне, практически полному перераспределению имеющегося в организме тау-белка из растворимой в полимеризованную форму (например, PHF) при болезни Альцгеймера.
Тау-белок существует в альтернативно спланированных изоформах, которые содержат три или четыре копии повторяющейся последовательности, соответствующей домену связывания с микротрубочками (см., например, работу М.Годера с соавторами (Goedert M, et al.), 1989 и работу М.Годера с соавторами (Goedert М., et al.), 1989). Тау-белок в PHF является процессированным расщепляющим белком, связанным с ядерным доменом (см., например, работу К.М.Вишика с соавторами (Wischik C.M., et al.), 1988; работу Вишика с соавторами (Wischik et al.), 1988; работу М.Новака с соавторами (Novak М., et al.), 1993), который состоит из сдвинутой по фазе версии повторяющегося домена; в стабильном тау-тау взаимодействии участвуют только три повторения (см., например, работу Р.Джейкса с соавторами (Jakes R., et al.), 1991). Образуясь один раз, PHF-подобные тау-белковые образования выступают в качестве центра для дальнейшего захвата и обеспечивают матрицу для протеолитического процессинга полноразмерного тау-белка (см, например, работу Вишика с соавторами (Wischik et al.), 1996).
Фазовый сдвиг, который наблюдают в повторяющемся домене тау-белка, включенного в PHF, предполагает, что повторяющийся домен подвергается индуцированному конформационному изменению в течение включения в филамент. В течение дебюта БА полагают, что указанное конформационное изменение может быть вызвано связыванием тау-белка с субстратом патологии, таким как поврежденные или мутировавшие мембранные белки (см., например, работу К.М.Вишика с соавторами (Wischik C.M., et al.), 1997, в «Microtubule-associated proteins: modifications in disease»).
В течение образования и накопления PHF сначала накапливаются с образованием аморфных агрегатов в цитоплазме, возможно из ранних олигомеров тау-белков, которые укорачиваются перед или в течение накопления PHF (см, например, работу Р. Мена с соавторами (Mena R., et al.), 1995; работу Р.Мена с соавторами (Mena R., et al.), 1996). Указанные филаменты затем образуют классические внутриклеточные НФК. В указанном состоянии PHF состоят из ядра укороченного тау-белка и пористой внешней оболочки, состоящей из полноразмерного тау-белка (см, например, работу Вишика с соавторами (Wischik et al.), 1996). Процесс накопления является экспоненциальным, потребляющим пул нормально функционирующего тау-белка в клетке и вызывающим новый синтез тау-белка для восполнения дефицита тау-белка (см, например, работу Р.И.К.Лай с соавторами (Lai R.Y.K., et al.), 1995). В результате, функциональное нарушение нейрона приводит к смерти клетки с получением внеклеточного НФК. Смертность клеток тесно связана с количеством внеклеточных НФК (см, например, работу Вишика с соавторами (Wischik et al.) в «Neurobiology of Alzheimer's Disease»). Так как клубки выдавливаются во внеклеточное пространство, существует прогрессирующая потеря пористой внешней оболочки нейрона с соответствующей потерей иммунореактивности N-терминального тау-белка, но с сохранением иммунореактивности тау-белка, связанного с ядром PHF (см, например, работу В.Бондарева с соавторами (BondareffW., et al.), 1994).
Результаты исследования тау-белков и β-амилоидных белков в образцах ЦСЖ, взятых при помощи люмбарной пункции, объединили для повышения эффективности диагностики БА (см., например, работу Галашко с соавторами (Galasko et al.), 1998; работу Хулстарта с соавторами (Hulstaert et al.), 1999; работу Андреасена с соавторами (Andreasen et al.), 2001) и для определения различий между БА и контрольным испытанием и между БА и другими дегенеративными деменциями (работа Гэмпела с соавторами (Hampel et al.), 2004). Соответствие указанных испытаний с невропатологически подтвержденными случаями и случаями при различных стадиях развития, тем не менее, является в настоящее время ограниченным (работа Кларка с соавторами (dark et al.), 2003; работа Гроссманна с соавторами (Grossmann et al.), 2005; работа Энгельборгс с соавторами (Engelborghs et al.), 2008). Хотя указанные и другие (работа Вишика с соавторами (Wischik et al.), 2001; работа Карретеро с соавторами (Carretero et al.), 1995) испытания могут представить дополнительные данные в поддержку диагностики, люмбарная пункция является более инвазивной по сравнению с подходами радиационной медицины и обладает повышенным риском (см, например, работу Д.Т.Вильяреала с соавторами (Villareal D.T. et al.), 1998; работу Д.Б.Марина с соавторами (Marin D.B. et al.), 1998; и работу Л.Х.Кюллера с соавторами (Kuller L.H. et al). 1998). Также развита ЭЭГ-неврологическая диагностика (см, например, работу Ф.Варга-Хадем с соавторами (Vargha-Khadem F. et al.), 1997; работу Д.Б.Уиллингема с соавторами (Willmgham D.B. et al.), 1997; работу И.Лакмаха с соавторами (Lakmache Y. et al.), 1995; и работу Дж.Р.Ходжса с соавторами (Hodges J.R. et al.), 1999), но в данном случае существует необходимость в недорогом оборудовании, которое можно применять в месте врачебного воздействия.
При разработке лечения, направленного, в частности, на предотвращение нейрофибриллярной дегенерации типа Альцгеймера существует острая необходимость в одновременной разработке неинвазивных способов выбора пациентов для лечения и исследования их реакции на лечение в соответствии с определенным и воспроизводимым определением прогрессирования болезни.
В WO 02/075318 описаны лиганды для агрегированных парных спиральных филаментов (PHF). Лиганды можно применять для маркировки агрегированных тау-белков и в частности внеклеточных агрегированных тау-белков, присутствующих в нейрофибриллярных клубках.
Представленные структуры включают сульфонированные бензотиазольные соединения, приведенные ниже:


В СН 542266 описаны бензотиазольные соединения, применяемые в текстильной промышленности. Описанное соединение представляет собой приведенную ниже бензотиазольную структуру (определенную как соединение 73):
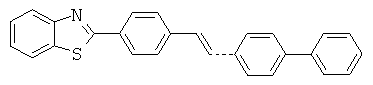
В WO 01/10845 описаны бензотиазольные соединения, применяемые в качестве оптических отбеливателей. Описанное соединение представляет собой приведенную ниже бензотиазольную структуру (определенную как соединение 10):
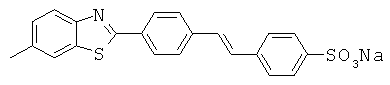
В WO 2006/014382 описаны бензотиазольные соединения, применяемые в способах отображения участков отложения амилоидного белка у пациентов, страдающих деменцией в предварительно диагностированном состоянии. Описанное соединение представляет собой приведенную ниже бензотиазольную структуру (определенную как соединение 43);
В работе Ли с соавторами (Lee et al.) Bioorg. Med. Chem. Lett. 2008, 18, 1534 описаны бензотиазольные соединения, применяемые для обнаружения β-амилоидных волокон. Различные соединения описаны в качестве промежуточных соединений для получения бензотиазольных визуализирующих агентов, два примера промежуточных соединений которых приведены ниже:
В WO 2007/020400 описаны бензотиазольные соединения, применяемые в качестве визуализирующих агентов для обнаружения амилоидных белков in vivo. Описанное соединение представляет собой приведенную ниже бензотиазольную структуру (определенную как соединение 8):
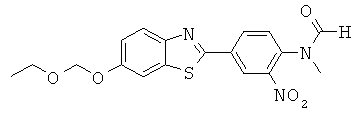
Также описаны промежуточные соединения получения бензотиазольных визуализирующих агентов. Промежуточные соединения обладают общей формулой, приведенной ниже (определенные как соединения формулы (IIa)):

где:
-R1 выбран из С1-6 алкила, С2-6 алкенила и С2-6 алкинила;
-R2 выбран из водорода, C1-10 алкила, C1-10 галоалкила, С6-14 арила, С6-14 арилалкила, -(CH2CH2O)q-CH3, где q представляет собой целое число от 1 до 10;
-R3 представляет собой уходящую группу; и
-R7, -R8, -R9 и -R10 выбраны из списка заместителей.
Несмотря на указанные описания, следует понимать, что добавление одного или более соединений, ранее не определенных в качестве эффективных меток PHF, внесет вклад в данную область техники.
Раскрытие изобретения
Авторы настоящего изобретения определили конкретные соединения, которые, например, связываются с парными спиральными филаментами и/или являются применимыми для обнаружения болезней, таких как болезнь Альцгеймера (БА). В настоящем изобретении предложены новые и альтернативные лиганды для обнаружения указанных структур.
Следовательно, настоящее изобретение относится к способам, применению, композициям и других веществам, в которых применяют указанные соединения в качестве лигандов PHF. В изобретении также предложены способы получения указанных соединений.
Эти и другие аспекты настоящего изобретения более подробно обсуждаются ниже.
Краткая схема чертежей
На Фигуре 1 представлен пример клеточной пробы для исследования агрегирования тау-белков. Низкоуровневая конституциональная экспрессия укороченного тау-белка увеличивается, когда экспрессия полноразмерного тау-белка вызвана ИПТГ. Укороченный тау-белок получен из полноразмерного тау-белка, который захватывает укороченный тау-белок и подвергается протеолизу и повторному захвату тау-белком.
На Фигуре 2А представлено связывание примулина (a), SK2033-30 (ВЕМА-08) (b) и mAb 7/51 (с) с наполненной парафином передней долей мозга у мышей линии 66.
На Фигуре 2В представлено связывание SK2033-30 (ВЕМА-08) и mAb 7/51 с наполненной парафином передней долей мозга у мышей линии 66. СО-1 и СО-2 представляют собой срезы коры головного мозга, наполненные mAb 7/51 и SK2033-30 соответственно, а НС-1 и НС-2 представляют собой срезы гиппокампальной формации, наполненные mAb 7/51 и SK2033-30 соответственно.
На Фигуре 3 представлено связывание LST-213 (BDF-04) с замороженными секциями головного мозга у мышей. В тканях диких мышей (А, кора; В, миндалина) наблюдают минимальную флуоресценцию по сравнению с тканями трансгенных мышей линии 66 (С и Е, кора; D и F, миндалина), в которых флуоресцентный лиганд применяли в избытке. Нижняя пара (Е и F) представляет собой секции, представленные в верхней паре (С и D), в более крупном масштабе. Помеченные структуры проявляют схему распределения, аналогичную распределению тау-позитивных нейронов (которые представлены на Фигуре 1).
На Фигуре 4 представлено включение LST-213 (BDF-04) в структуру клетки. Клетки инкубировали в присутствии LST-213 в течение 18 часов. Значительное количество нерастворенного вещества, так же как и включение в структуру клетки, можно наблюдать в виде фона (верхние изображения). Включение можно четко увидеть после промывания PBS, при котором удаляют большинство нерастворившегося вещества из внешней оболочки клеток (нижние изображения).
На Фигуре 5 представлено селективное связывание двух различных лигандов настоящего изобретения (LS-T213 [BDF-04] и SK2033-30 [ВЕМА-08]) с агрегированным тау-белком внутри клеток. Лиганды наблюдают при помощи флуоресцентной микроскопии. На верхнем левом изображении представлено связывание LS-T213 с агрегированным тау-белком внутри индуцированных клеток. На нижнем левом изображении представлено связывание SK2033-30 с агрегированным тау-белком внутри индуцированных клеток. Верхнее правое изображение представляет собой контрольное изображение, на котором представлены неиндуцированные клетки, которые подвергли воздействию LS-T213.
Соединения
Согласно одному аспекту, настоящее изобретение относится к конкретным 1,4-дизамещенным бензольным соединениям (для удобства, называемым в настоящей патентной заявке общим собирательным термином «ДЗБ соединения»), которые структурно связаны с N-(4-бензотиазол-2-илфенил)бензамидом.

В одном варианте реализации соединения выбраны из соединений следующей формулы и их фармацевтически и физиологически приемлемых солей, гидратов и сольватов:
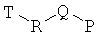
где
-R- независимо выбран из:



где (Т) представляет собой место присоединения -Т;
и (Q) представляет собой место присоединения -Q-;
-Q- независимо выбран из:
-NHC(O)-; -NR1C(O)-;
-C(O)NH-; -C(O)NR1-;
-N=N-;
-CH=CH-;
-CR1=CH-; -CH=CR1-;
-CR1=CR1-;
-N=CH-; -CH=N-;
каждый из R1 представляет собой независимо незамещенный насыщенный алифатическии С1-4 алкил;
-Р независимо выбран из:
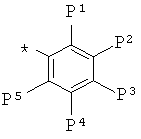


где * обозначает место присоединения;
-Т- независимо выбран из:



где * обозначает место присоединения;
и Х представляет собой независимо N или СН;
-W1 представляет собой независимо -Н или -WA;
-W2 представляет собой независимо -Н или -WA;
-W3 представляет собой независимо -Н или -WA;
-W4 представляет собой независимо -Н или -WA;
-W5 представляет собой независимо -Н или -WA;
-W6 представляет собой независимо -Н или -WA;
где -WA независимо выбран из:
-F, -Cl, -Br, -I,
-ОН, -WA1, -O-WA1,
-NH2, -NHWA1 и -N(WA1)2;
и -WA1 независимо выбран из:
незамещенного насыщенного алифатического С1-4 алкила,
-CF3,
-CH2CH2OH и
-CH2CH2N(Me)2;
-G1 независимо представляет собой -Н или -GA;
-G2 независимо представляет собой -Н или -GA;
где -GA независимо выбран из:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН, -OR2;
-[O-CH2CH2]n-RB2, где n принимает значения от 2 до 6;
-G3 независимо представляет собой -Н или -GB;
-G4 независимо представляет собой -Н или -GB,
где -GB независимо выбран из:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН, -OR2;
-[O-CH2CH2]n-RB2, где n принимает значения от 2 до 6;
где:
-Р1 независимо представляет собой -Н или -PA;
-Р2 независимо представляет собой -Н или -PB;
-Р3 независимо представляет собой -Н или -PC;
-Р4 независимо представляет собой -Н или -PB;
-Р5 независимо представляет собой -Н или -PA;
и где:
каждый из -PA, каждый из -PB и каждый из -PC независимо представляет собой:
-F, -Cl, -Br, -I,
-R2,
-CF3, -OCF3,
-ОН, -L1-OH,
-OR2, -L1-OR2, -O-L1-OR2,
-SH, -SR2,
-CN,
-NO2,
-NH2, -NHR2, -NR22, -NR3R4,
-NHOH,
-L1-NH2, -L1-NHR2, -L1-NR22, -L1-NR3R4,
-O-L1-NH2, -O-L1-NHR2, -O-L1-NR22, -O-L1-NR3R4,
-C(=O)OH, -C(=O)OR2,
-OC(=O)R2,
-C(=O)NH2, -C(=O)NHR2, -C(=O)NR22, -C(=O)NR3R4,
-NHC(=O)R2, -NR2C(=O)R2,
-C(=O)NHOR2, -C(=O)NR2OR2,
-NHC(=O)OR2, -NR2C(=O)OR2,
-OC(=O)NH2, -OC(=O)NHR2, -OC(=O)NR22, -OC(=O)NR3R4,
-C(=O)R2,
-NHC(=O)NH2, -NHC(=O)NHR2,
-NHC(=O)NR22, -NHC(=O)NR3R4,
-NR2C(=O)NH2, -NR2C(=O)NHR2,
-NR2C(=O)NR22, -NR2C(=O)NR3R4,
-NHS(=O)2R2, -NR2S(=O)2R2,
-S(=O)2NH2, -S(=O)2NHR2, -S(=O)2NR22, -S(=O)2NR3R4,
-S(=O)R2, -S(=O)2R2, -OS(=O)2R2 или -S(=O)2OR2
где:
каждый из -L1- независимо представляет собой насыщенный алифатический С1-5 алкилен;
в каждой из групп -NR3R4, -R3 и -R4, взятые вместе с атомом азота, к которому они присоединены, образуют 4-, 5-, 6- или 7-членное неароматическое кольцо, содержащее ровно 1 гетероатом в кольце, ровно 2 гетероатома в кольце, где один из указанных 2 гетероатомов кольца представляет собой N, а другой из указанных 2 гетероатомов кольца независимо представляет собой N, О или S;
каждый из -R2 независимо представляет собой:
-RA1, -RA2, -RA3, -RA4, -RA5, -RA6, -RA7, -RA8,
-LA-RA4, -LA-RA5, -LA-RA6, -LA-RA7, или -LA-RA8;
где:
каждый из -RA1 независимо представляет собой насыщенный алифатический С1-6 алкил;
каждый из -RA2 независимо представляет собой алифатический С2-6 алкенил;
каждый из -RA3 независимо представляет собой алифатический C2-6 алкинил;
каждый из -RA4 независимо представляет собой насыщенный С3-6 циклоалкил;
каждый из -RA5 независимо представляет собой С3-6 циклоалкенил;
каждый из -RA6 независимо представляет собой неароматический С3-7 гетероциклил;
каждый из -RA7 независимо представляет собой С6-10 карбоарил;
каждый из -RA8 независимо представляет собой C5-10 гетероарил;
каждый из -LA- независимо представляет собой насыщенный алифатический С1-3 алкилен;
и где:
каждый из -RA4, -RA5, -RA6, -RA7 и -RA8 возможно замещен, например, одним или более заместителем -RB1 и/или одним или более заместителем -RB2 и
каждый из -RA1, -RA2, -RA3 и -LA- возможно замещен, например, одним или более заместителем -RB2,
где:
каждый из -RB1 независимо представляет собой насыщенный алифатический С1-4 алкил, фенил или бензил;
каждый из -RB2 независимо представляет собой:
-F, -Cl, -Br, -I,
-CF3, -OCF3.
-ОН, -LC-OH, -O-LC-OH,
-ORC1, -LC-ORC1, -O-LC-ORC1,
-SH, -SRC1,
-CN,
-NO2,
-NH2, -NHRC1, -NRC12, -NRC2RC3,
-LC-NH2, -LC-NHRC1, -LC-NRC12, or -LC-NRC2RC3,
-O-LC-NH2, -O-LC-NHRC1, -O-LC-NRC12, -O-LC-NRC2RC3,
-C(=O)OH, -C(=O)ORC1,
-OC(=O)RC1,
-C(=O)RC1,
-C(=O)NH2, -C(=O)NHRC1, -C(=O)NRC12, -C(=O)NRC2RC3,
-NHC(=O)RC1, -NRC1C(=O)RC1,
-NHS(=O)2RC1, -NRC1S(=O)2RC1,
-S(=O)2NH2, -S(=O)2NHRC1, -S(=O)2NRC12, -S(=O)2NRC2RC3, или
-S(=O)2RC1;
где:
каждый из -RC1 независимо представляет собой незамещенный насыщенный алифатический С1-4 алкил, фенил или бензил;
каждый из -LC- независимо представляет собой незамещенный насыщенный алифатический С1-5 алкилен; и
в каждой из групп -NRC2RC3, -RC2 и -RC3, взятые вместе с атомом азота, к которому они присоединены, образуют 4-, 5-, 6- или 7-членное неароматическое кольцо, содержащее ровно 1 гетероатом в кольце или ровно 2 гетероатома в кольце, где один из указанных 2 гетероатомов кольца представляет собой N, а другой из указанных 2 гетероатомов кольца независимо представляет собой N, О или S.
Возможные ограничения
В одном или более аспектах настоящего изобретения (например, соединениях, композициях, соединениях, применяемых для лечения, применении соединений для получения лекарственного средства, способах, способах лечения и т.д.) соединения возможно являются аналогичными представленным в настоящей патентной заявке, но с одним или более возможным ограничением, описанным в настоящей патентной заявке.
Согласно одному варианту реализации соединение представляет собой соединение, определенное в настоящей патентной заявке, с тем ограничением, что соединение не представляет собой соединение, выбранное из соединений от Р-001 до Р-015.
Согласно одному варианту реализации соединение представляет собой соединение, определенное в настоящей патентной заявке, с тем ограничением, что соединение не представляет собой соединение, выбранное из соединений от Р-001 до Р-015.
Согласно одному варианту реализации соединение представляет собой соединение, определенное в настоящей патентной заявке, с тем ограничением, что соединение не представляет собой соединение, выбранное из соединений от Р-001 до Р-015 и их солей, гидратов и сольватов.
В одном или более аспектах настоящего изобретения (например, связанных с конкретными применениями и способами, такими как соединения, применяемые для маркировки агрегатов тау-белков, применение соединений для проведения диагностики, способы прогнозирования или диагностики или определения стадии заболевания и т.д.) соединения возможно являются соединениями, определенными в настоящей патентной заявке, но без любых ограничений, которые представляют собой ограничения, относящиеся к соединениям от Р-001 до Р-015.
Например, ссылку на конкретную группу соединений «без ограничений, относящихся к соединениям от Р-001 до Р-015» (например, для применения в диагностике) используют в качестве ссылки на соединения, которые определены в настоящей патентной заявке, но в которых определение не содержит указанного ограничения. В указанных случаях, как и в случае если указанное ограничение удалено из определения соединений, определение охватывает те соединения, которые в противном случае исключены указанным ограничением.
Согласно одному варианту реализации соединение представляет собой соединение, определенное в настоящей патентной заявке, с тем ограничением, что соединение не представляет собой соединение, где - Т представляет собой:

-R- представляет собой

и - Р представляет собой:

и -W4 представляет собой -Н, -Q- представляет собой -СН=СН-, -G1, -G2 и -G3 представляют собой -Н и
(i) -P1, -P2, -P4 и -Р5 представляют собой -Н, а -Р3 представляет собой -RA1; или
(ii) один из -Р1, -Р2, -Р3, -Р4 и Р5 представляет собой -RA7, а остальные из -Р1, -Р2, -Р3, -Р4 и -Р5 представляют собой -Н.
Предпочтительные соединения
Согласно одному варианту реализации соединение независимо выбрано из:

где -Q-, -Р, -Т-, -G1, -G2, -G3 и -G4 определены выше.
Согласно одному варианту реализации соединение независимо выбрано из:



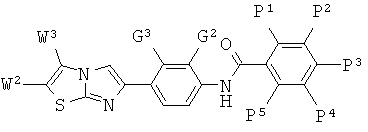
где -Q-, -Р, X, -W1, -W2, -W3, -W4, -G2 и -G3 определены выше.
Бензотиазольные соединения
Согласно одному варианту реализации соединение независимо представляет собой:

где -Q-, -Р, -W4, -G2 и -G3 определены выше.
Согласно одному варианту реализации соединение независимо выбрано из:

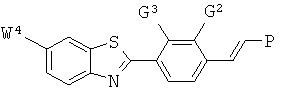

Согласно одному варианту реализации соединение независимо представляет собой:

Согласно одному варианту реализации соединение независимо представляет собой:

где -Р1, -Р2, -Р3, -Р4 и -Р5 определены выше.
Согласно одному варианту реализации соединение независимо представляет собой:

Согласно одному варианту реализации соединение независимо представляет собой:

где -Р1, -Р2, -Р3, -Р4 и -Р5 определены выше.
Согласно одному варианту реализации соединение независимо представляет собой:

Согласно одному варианту реализации соединение независимо представляет собой:

где -Р1, -Р2, -Р3, -Р4 и -Р5 определены выше. Согласно одному варианту реализации соединение независимо представляет собой:

где -Р1, -Р2, -Р3, -Р4 и -Р5 определены выше.
Имидазо[2,1-b][1,3]тиазольные соединения
Согласно одному варианту реализации соединение независимо представляет собой:

где -Р, -W2, -W3, -G2 и -G3 определены выше.
Согласно одному варианту реализации соединение независимо представляет собой:
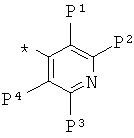
где W2, -W3, -G2, -G3, -P1, -P2, -P3, -P4 и -Р5 определены выше.
Имидазо[2,1-b][1,3]тиазольные и имидазо[1,2-а]пиридиновые соединения
Согласно одному варианту реализации соединение независимо представляет собой:

где -Q-, -Р, -W1, X, -G2 и -G3 определены выше.
Согласно одному варианту реализации соединение независимо представляет собой:

где -Q-, -P, -W1, -G2 и -G3 определены выше.
Согласно одному варианту реализации соединение независимо представляет собой:

где -Q-, -P, -W, -G2 и -G3 определены выше.
Согласно одному варианту реализации соединение независимо выбрано из:



где -P, -W1, X, -G2 и -G3 определены выше.
Согласно одному варианту реализации соединение независимо представляет собой:

где -P, -W1, X, -G2 и -G3 определены выше.
Согласно одному варианту реализации соединение независимо представляет собой:

где -P1, -P2, -P3, -P4 и -P5 определены выше.
Согласно одному варианту реализации соединение независимо представляет собой:

где -P, -W1, X, -G2 и -G3 определены выше.
Согласно одному варианту реализации соединение независимо представляет собой:

где -P, -W1, X, -G2 и -G3 определены выше.
Галогенированные соединения
Согласно одному варианту реализации ДЗБ соединение представляет собой соединение формулы (I) с тем ограничением, что соединение содержит -F, -Cl, -Br или -I группу.
Согласно одному варианту реализации ДЗБ соединение представляет собой соединение формулы (I) с тем ограничением, что соединение содержит -F группу.
Согласно одному варианту реализации ДЗБ соединение представляет собой соединение формулы (I) с тем ограничением, что соединение содержит -19F группу.
Согласно одному варианту реализации ДЗБ соединение представляет собой соединение формулы (I) с тем ограничением, что соединение содержит -Cl, -Br или -I группу.
Согласно одному варианту реализации группа -Р является замещенной -F группой или замещенной группой, содержащей -F группу. Таким образом один из -Р1, -Р2, -Р3, -Р4 или -Р5, в случае если присутствует, может представлять собой -F или один из -PA, -PB или -PC содержит -F группу.
Согласно одному варианту реализации группа -Т является замещенной -F группой или замещенной группой, содержащей -F группу. Таким образом -WA представляет собой -F или -WA1 содержит -F группу.
Согласно одному варианту реализации группа -R является замещенной -F группой или замещенной группой, содержащей -F группу. Таким образом -GA представляет собой -F или -GA содержит -F группу.
Группа -R-
Согласно одному варианту реализации -R- независимо выбран из:



Согласно одному варианту реализации -R- независимо выбран из:

Согласно одному варианту реализации -R- независимо выбран из:


Группа -Q-
Согласно одному варианту реализации -Q- независимо выбран из:
-NHC(O)-; -NR1C(O)-;
-C(O)NH-; -C(O)NR1-;
-N=N-;
-CH=CH-;
-CR1=CH-; -CH=CR1-;
-CR1=CR1-;
-N=C-; -C=N-.
Согласно одному варианту реализации -Q- независимо выбран из:
-NHC(O)-; -NR1C(O)-;
-N=N-;
-СН=СН-;
-N=C-; -C=N-.
Согласно одному варианту реализации -Q- независимо выбран из:
-NHC(O)-;
-N=N-;
-CH=CH-;
-N=C-.
Согласно одному варианту реализации -Q- независимо выбран из:
-NHC(O)-;
-N=N-;
-CH=CH-.
Согласно одному варианту реализации -Q- независимо выбран из -NHC(O)- и -NR1C(O)-.
Согласно одному варианту реализации -Q- независимо представляет собой -NHC(O)-.
Согласно одному варианту реализации -Q- независимо выбран из -N=N-, -СН=СН- и -N=C-.
Согласно одному варианту реализации -Q- независимо представляет собой -N=N-.
Согласно одному варианту реализации -Q- независимо представляет собой:

где * обозначает место присоединения.
Согласно одному варианту реализации -Q- независимо представляет собой -СН=СН-.
Согласно одному варианту реализации -Q- независимо представляет собой:

где * обозначает место присоединения.
Согласно одному варианту реализации -Q- независимо представляет собой -N=C-.
Согласно одному варианту реализации -Q- независимо представляет собой:
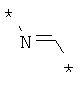
где * обозначает место присоединения.
Группа -R1
Согласно одному варианту реализации, каждый из -R1, в случае если присутствует, независимо представляет собой незамещенный, насыщенный алифатический С1-4 алкил.
Согласно одному варианту реализации, каждый из -R1, в случае если присутствует, независимо представляет собой -Me.
Согласно одному варианту реализации, каждый из -R1, в случае если присутствует, независимо представляет собой -Et.
Группа -Р
Согласно одному варианту реализации, -Р независимо выбран из:




где * обозначает место присоединения.
Согласно одному варианту реализации, -Р независимо представляет собой:

Согласно одному варианту реализации, -Р независимо выбран из:



Согласно одному варианту реализации, -Р независимо представляет собой:

Согласно одному варианту реализации, -Р независимо представляет собой:

Согласно одному варианту реализации, -Р независимо представляет собой:

Группа -Т
Согласно одному варианту реализации -Т независимо выбран из:



где Х независимо представляет собой N или СН.
Согласно одному варианту реализации -Т независимо представляет собой:

где Х независимо представляет собой N или СН.
Согласно одному варианту реализации -Т независимо представляет собой:

Согласно одному варианту реализации -Т независимо представляет собой:

Согласно одному варианту реализации -Т независимо представляет собой:

Согласно одному варианту реализации -Т независимо представляет собой:

Группа -W1
Согласно одному варианту реализации -W1 независимо представляет собой -Н или -WA.
Согласно одному варианту реализации -W1 независимо представляет собой -Н.
Согласно одному варианту реализации -W1 независимо представляет собой -WA.
Группа -W2
Согласно одному варианту реализации -W2 независимо представляет собой -Н или -WA.
Согласно одному варианту реализации -W2 независимо представляет собой -Н.
Согласно одному варианту реализации -W2 независимо представляет собой -WA.
Группа -W3
Согласно одному варианту реализации -W3 независимо представляет собой -Н или -WA.
Согласно одному варианту реализации -W3 независимо представляет собой -Н.
Согласно одному варианту реализации -W3 независимо представляет собой -WA.
Группа -W4
Согласно одному варианту реализации -W4 независимо представляет собой -Н или -WA.
Согласно одному варианту реализации -W4 независимо представляет собой -Н.
Согласно одному варианту реализации -W4 независимо представляет собой -WA.
Группа -W5
Согласно одному варианту реализации -W5 независимо представляет собой -Н или -WA.
Согласно одному варианту реализации -W5 независимо представляет собой -Н.
Согласно одному варианту реализации -W5 независимо представляет собой -WA.
Группа -W6
Согласно одному варианту реализации -W6 независимо представляет собой -Н или -WA.
Согласно одному варианту реализации -W6 независимо представляет собой -Н.
Согласно одному варианту реализации -W6 независимо представляет собой -WA.
Группы -W2 и -W3
Согласно одному варианту реализации по меньшей мере один из -W2 и -W3 представляет собой -WA.
Согласно одному варианту реализации один из -W2 и -W3 представляет собой -WA.
Согласно одному варианту реализации -W2 представляет собой -WA.
Согласно одному варианту реализации -W3 представляет собой -WA.
Группы -W4, -W5 и -W6
Согласно одному варианту реализации по меньшей мере один из -W4, -W5 и -W6представляет собой -WA.
Согласно одному варианту реализации один из -W4, -W5 и -W6 представляет собой -WA.
Согласно одному варианту реализации -W4 представляет собой -WA.
Согласно одному варианту реализации -W5 представляет собой -WA.
Согласно одному варианту реализации -W6 представляет собой -WA.
Группа -WA
Согласно одному варианту реализации -WA, в случае если присутствует, независимо выбран из:
-F, -Cl, -Br, -I,
-ОН, -WA1, -O-WA1,
-NH2, -NHWA1 и -N(WA1)2.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо выбран из:
-OH, -WA1, -O-WA1,
-NH2, -NHWA1 и -N(WA1)2.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо выбран из -ОН, -WA1 и -О-WA1.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо выбран из -WA1 и -О-WA1.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо выбран из -ОН и -О-WA1.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо представляет собой -WA1.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо представляет собой -O-WA1.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо представляет собой -ОН.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо выбран из -NH2, -NHWA1 и -N(WA1)2.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо представляет собой -NH2.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо представляет собой -NHWA1.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо представляет собой -N(WA1)2.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо выбран из -F, -Cl, -Br и -I.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо представляет собой -F или -I.
Согласно одному варианту реализации -WA, в случае если присутствует, независимо представляет собой -F.
Группа -WA1
Согласно одному варианту реализации -WA1, в случае если присутствует, независимо выбран из:
незамещенного насыщенного алифатического С1-4 алкила,
-CF3,
-CH2CH2OH и
-CH2CH2N(Me)2.
Согласно одному варианту реализации -WA1, в случае если присутствует, независимо выбран из незамещенного насыщенного алифатического С1-4 алкила и -CF3.
Согласно одному варианту реализации -WA1, в случае если присутствует, независимо представляет собой незамещенный насыщенный алифатический С1-4 алкил.
Согласно одному варианту реализации -WA1, в случае если присутствует, независимо представляет собой -Me.
Согласно одному варианту реализации -WA1, в случае если присутствует, независимо представляет собой -Et.
Согласно одному варианту реализации -WA1, в случае если присутствует, представляет собой -CF3.
Согласно одному варианту реализации -WA1, в случае если присутствует, представляет собой -CH2CH2OH.
Согласно одному варианту реализации -WA1, в случае если присутствует, представляет собой -CH2CH2N(Me)2.
Группы -G1, -G2, -G3 и -G4
Согласно одному варианту реализации по меньшей мере один из -G1, -G4 и -G2 и G3 в случае если присутствует, не является -Н.
Согласно одному варианту реализации один из -G1, -G4 и -G2 и G3, в случае если присутствует, не является -Н.
Согласно одному варианту реализации каждый из -G1, -G4 и -G2 и G3, в случае если присутствует, независимо представляет собой -Н.
Группа -G1
Согласно одному варианту реализации -G1 независимо представляет собой -Н или -GA.
Согласно одному варианту реализации -G1 независимо представляет собой -Н.
Согласно одному варианту реализации -G1 независимо представляет собой -GA.
Группа -G2
Согласно одному варианту реализации -G2 независимо представляет собой -Н или -GA.
Согласно одному варианту реализации -G независимо представляет собой -Н.
Согласно одному варианту реализации -G2 независимо представляет собой -GA.
Группа -G3
Согласно одному варианту реализации -G3 независимо представляет собой -Н или -GB.
Согласно одному варианту реализации -G3 независимо представляет собой -Н.
Согласно одному варианту реализации -G3 независимо представляет собой -GB.
Группа -G4
Согласно одному варианту реализации -G4 независимо представляет собой -Н или -GB.
Согласно одному варианту реализации -G4 независимо представляет собой -Н.
Согласно одному варианту реализации -G4 независимо представляет собой -GB.
Группа -GA
Согласно одному варианту реализации -GA, в случае если присутствует, независимо выбран из
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН, -OR2;
-[O-CH2CH2]n-RB2, где n принимает значения от 2 до 6.
Согласно одному варианту реализации -GA, в случае если присутствует, независимо выбран из
-F,
-CF3, -OCF3,
-ОН, -OR2;
-[О-CH2CH2]n-RB2, где n принимает значения от 2 до 6.
Согласно одному варианту реализации -GA, в случае если присутствует, независимо выбран из
-F,
-CF3, -OCF3,
-ОН, -OR2.
Согласно одному варианту реализации -GA, в случае если присутствует, независимо выбран из
-F, -Cl, -Br, -I,
-ОН, -OR2.
Согласно одному варианту реализации -GA, в случае если присутствует, независимо выбран из -F, -Cl, -Br и -I.
Согласно одному варианту реализации -GA, в случае если присутствует, независимо представляет собой -F.
Согласно одному варианту реализации -GA, в случае если присутствует, независимо выбран из -ОН и -OR2.
Согласно одному варианту реализации -GA, в случае если присутствует, независимо представляет собой -ОН.
Согласно одному варианту реализации -GA, в случае если присутствует, независимо представляет собой -OR2.
Согласно одному варианту реализации -GA, в случае если присутствует, независимо представляет собой -[O-CH2CH2]n-RB2, где n принимает значения от 2 до 6.
Группа -GB
Согласно одному варианту реализации -GB, в случае если присутствует, независимо выбран из
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН, -OR2;
-[O-CH2CH2]n-RB2, где n принимает значения от 2 до 6.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо выбран из
-F,
-CF3, -OCF3,
-ОН, -OR2;
-[O-CH2CH2]n-RB2, где n принимает значения от 2 до 6.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо выбран из
-CF3, -OCF3,
-ОН, -OR2;
-[O-CH2CH2]n-RB2, где n принимает значения от 2 до 6.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо выбран из
-CF3, -OCF3,
-ОН, -OR2.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо выбран из -F, -Cl, -Br и -I.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо представляет собой -F.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо выбран из -CF3 и -OCF3.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо представляет собой -CF3 и -OCF3.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо представляет собой -OCF3.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо выбран из -ОН и -OR2.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо представляет собой -ОН.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо представляет собой -OR2.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо представляет собой -OCH2CH2N(Ме)2.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо представляет собой -[О-СН2СН2]n-RB2, где n принимает значения от 2 до 6.
Согласно одному варианту реализации -GB, в случае если присутствует, независимо представляет собой -[O-СН2СН2]3-ОМе.
Группа n
Согласно одному варианту реализации n, в случае применения, независимо означает число от 2 до 6.
Согласно одному варианту реализации n, в случае применения, независимо означает число от 2 до 4.
Согласно одному варианту реализации n, в случае применения, независимо означает 2.
Согласно одному варианту реализации n, в случае применения, независимо означает 3.
Группы -Р1, -Р2, -Р3, -Р4 и -Р5
Согласно одному варианту реализации по меньшей мере один из -Р1, -Р2, -Р3, -Р4 и -Р5, в случае если присутствует, представляет собой -PA, -PB или -PC в соответствующих случаях.
Согласно одному варианту реализации один из -Р1, -Р2, -Р3, -Р4 и -Р5, в случае если присутствует, представляет собой -PA, -PB или -PC в соответствующих случаях.
Согласно одному варианту реализации по меньшей мере один из -Р1, -Р2, -Р3, -Р4 и -Р5, в случае если присутствует, не является -Н.
Согласно одному варианту реализации один из -Р1, -Р2, -Р3, -Р4 и -Р5, в случае если присутствует, не является -Н.
Согласно одному варианту реализации каждый из -Р1, -Р2, -Р3, -Р4 и -Р5, в случае если присутствует, независимо представляет собой -Н.
Согласно одному варианту реализации один из -Р1, -Р2, -Р3, -Р4 и -Р5, в случае если присутствует, независимо представляет собой -F.
Группа -Р1
Согласно одному варианту реализации -Р1 независимо представляет собой -Н или -PA.
Согласно одному варианту реализации -Р1 независимо представляет собой -Н.
Согласно одному варианту реализации -Р1 независимо представляет собой -PA.
Согласно одному варианту реализации -Р1 совпадает с -Р5, в случае если присутствует.
Группа -Р2
Согласно одному варианту реализации -Р2 независимо представляет собой -Н или -PB.
Согласно одному варианту реализации -Р2 независимо представляет собой -Н.
Согласно одному варианту реализации -Р2 независимо представляет собой -PB.
Согласно одному варианту реализации -Р2 совпадает с -Р4, в случае если присутствует.
Группа -Р3
Согласно одному варианту реализации -Р3 независимо представляет собой -Н или -PC.
Согласно одному варианту реализации -Р3 независимо представляет собой -Н.
Согласно одному варианту реализации -Р независимо представляет собой -PC.
Группа -Р4
Согласно одному варианту реализации -Р4 независимо представляет собой -Н или -PB.
Согласно одному варианту реализации -Р4 независимо представляет собой -Н.
Согласно одному варианту реализации -Р4 независимо представляет собой -PB.
Группа -Р5
Согласно одному варианту реализации -Р5, в случае если присутствует, независимо представляет собой -Н или -PA.
Согласно одному варианту реализации -Р5, в случае если присутствует, независимо представляет собой -Н.
Согласно одному варианту реализации -Р5, в случае если присутствует, независимо представляет собой -PA.
Группы -PA, -PB и -PC
Согласно одному варианту реализации каждый из -PA, каждый из -PB и каждый из -PC, в случае если присутствует, независимо выбран из:
-F, -Cl, -Br, -I,
-R2,
-CF3, -OCF3,
-ОН, -L1-ОН,
-OR2, -L1-OR2, -O-L1-OR2,
-NO2,
-NH2, -NHR2, -NR22, -NR3R4,
-NHOH,
-C(=O)OH, -C(=O)OR2,
-OC(=O)R2,
-C(=O)NH2, -C(=O)NHR2, -C(=O)NR22, -C(=O)NR3R4,
-NHC(=O)R2, -NR2C(=O)R2,
-C(=O)NHOR2, -C(=O)NR2OR2,
-NHC(=O)OR2, -NR2C(=O)OR2,
-OC(=O)NH2, -OC(=O)NHR2, -OC(=O)NR22, -OC(=O)NR3R4,
-C(=O)R2,
-S(=O)R2, -S(=O)2R2, -OS(=O)2R2 или -S(=O)2OR2.
Согласно одному варианту реализации каждый из -PA, каждый из -PB и каждый из -PC, в случае если присутствует, независимо выбран из:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН, -L1-OH,
-OR2, -L1-OR2, -O-L1-OR2,
-NO2,
-NH2, -NHR2, -NR22, -NR3R4,
-NHOH,
-C(=O)OH, -C(=O)OR2,
-OC(=O)R2,
-NHC(=O)R2, -NR2C(=O)R2.
Группа -PA
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН, -L1-OH,
-OR2, -L1-OR2, -O-L1-OR2,
-NO2,
-NH2, -NHR2, -NR22, -NR3R4.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из:
-F,
-CF3, -OCF3,
-ОН,
-OR2,
-NO2,
-NH2, -NHR2, -NR22, -NR3R4.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из -F, -Cl, -Br и -I.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из -F.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из -CF3 и -OCF3.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -CF3.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -OCF3.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из -ОН и -L1-OH.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -ОН.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -L1-ОН.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из -OR2, -L1-OR2 и -O-L1-OR2.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -OR2.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -ОМе.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -O(СН2)3-CF3.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -O(СН2)n-F, где n принимает значения от 2 до 6.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -O(CH2)2-F.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из -L1-OR2 и -O-L1-OR2.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из:
-NO2,
-NH2, -NHR2, -NR22, -NR3R4.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -NO2.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из -NH2, -NHR2, -NR22 и -NR3R4.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из -NH2, -NHR2 и -NR22.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -NR3R4.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо выбран из -NH2, -NHR2 и -NR22.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -NH2.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -NHR2.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -NHMe.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой - NH-(CH2)n-F, где n принимает значения от 2 до 6.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой - NH-(CH2)n-F, где n принимает значения 2, 3 или 4.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -NR22.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -NMe2.
Согласно одному варианту реализации, каждый из -PA, в случае если присутствует, независимо представляет собой -R2.
Группа -PB
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН, -L1-OH,
-OR2, -L1-OR2, -O-L1-OR2,
-NO2,
-NH2, -NHR2, -NR22, -NR3R4.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из:
-F,
-CF3, -OCF3,
-ОН,
-OR2,
-NO2,
-NH2, -NHR2, -NR22, -NR3R4.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из:
-F,
-CF3, -OCF3,
-NO2,
-NH2, -NHR2, -NR22, -NR3R4.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из -F, -Cl, -Br и -I.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -F.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из -CF3 и -OCF3.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -CF3.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -OCF3.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из -ОН и -L1-OH.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -ОН.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -L1-ОН.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из -OR2, -L1-OR2 и -O-L1-OR2.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -OR2.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из -L1-OR2 и -O-L1-OR2.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой - O-(CH2)n-F, где n принимает значения от 2 до 6.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой - O-(CH2)2-F.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из
-NO2,
-NH2, -NHR2, -NR22, -NR3R4.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -NO2.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из -NH2, -NHR2, -NR22 и -NR3R4.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из -NH2, -NHR2 и -NR22.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -NR3R4.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо выбран из -NH2, -NHR2 и -NR22.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -NH2.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -NHR2.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -NHMe.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой - NH-(CH2)n-F, где n принимает значения от 2 до 6.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой - NH-(CH2)n-F, где n принимает значения 2, 3 или 4.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -NR22.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -NMe2.
Согласно одному варианту реализации, каждый из -PB, в случае если присутствует, независимо представляет собой -R2.
Группа -PC
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН, -L1-OH,
-OR2, -L1-OR2, -O-L1-OR2,
-NO2,
-NH2, -NHR2, -NR22, -NR3R4,
-NHOH,
-C(=O)OH, -C(=O)OR2,
-OC(=O)R2,
-NHC(=O)R2, -NR2C(=O)R2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН,
-OR2,
-NO2,
-NH2, -NHR2, -NR22, -NR3R4,
-NHOH,
-OC(=O)R2,
-NHC(=O)R2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -F, -Cl, -Br и -I.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -F, -Cl и -Br.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -F.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -CF3 и -OCF3.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -CF3.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -OCF3.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -ОН и -L1-ОН.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -ОН.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -L1-ОН.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -OR2, -L1-OR2 и -O-L1-OR2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -OR2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -ОМе.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -O(СН2)2-ОН.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой - O-(CH2)n-F, где n принимает значения от 2 до 6.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой - O-(CH2)2-F.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой - O-(СН2)n-CF3, где n принимает значения от 1 до 6.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой - O-(СН2)n-CF3, где n принимает значения от 1, 2 или 3.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -L1-OR2 и -O-L1-OR2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из:
-NO2,
-NH2, -NHR2, -NR22, -NR3R4,
-NHOH.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -NO2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -NHOH.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -NH2, -NHR2, -NR22, -NR3R4 и -NHOH.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -NH2, -NHR2, -NR22 и -NR3R4.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -NH2, -NHR2 и -NR22.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -NR3R4.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -NH2, -NHR2 и -NR22.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -NH2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -NHR2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -NHMe.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой - NH-(CH2)n-CF3, где n принимает значения от 1 до 6.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой - NH-(CH2)n-CF3, где n принимает значения 2, 3 или 4.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой - NH-(CH2)n-F, где n принимает значения от 2 до 6.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой - NH-(CH2)n-F, где n принимает значения 2, 3 или 4.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -NR22.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -NMe2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -С(=O)ОН и -C(=O)OR.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -С(=O)ОН.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -C(=O)OR2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -С(=O)ОМе.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо выбран из -NHC(=O)R2 и -NR2C(=O)R2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -NHC(=O)R2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -NHC(=O)CF3.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -NR2C(=O)R2.
Согласно одному варианту реализации, каждый из -PC, в случае если присутствует, независимо представляет собой -R2.
Группа -L1-
Согласно одному варианту реализации каждый из -L1-, в случае если присутствует, независимо представляет собой незамещенный насыщенный алифатический С1-5 алкилен.
Согласно одному варианту реализации каждый из -L1-, в случае если присутствует, независимо представляет собой -СН2-.
Согласно одному варианту реализации каждый из -L1-, в случае если присутствует, независимо представляет собой -CH2CH2-.
Группа -R2
Согласно одному варианту реализации, каждый из -R2, в случае если присутствует, независимо представляет собой:
-RA1, -RA2, -RA3, -RA4, -RA5, -RA6, -RA7, -RA8,
-LA-RA4, -LA-RA5, -LA-RA6, -LA-RA7 или -LA-RA8;
и каждый из -RA4, -RA5, -RA6, -RA7 и -RA8 является возможно замещенным, например, одним или более заместителем -RB1 и/или одним или более заместителем -RB2, и
каждый из -RA1, -RA2, -RA3 и -LA- является возможно замещенным, например, одним или более заместителем -RB2.
Согласно одному варианту реализации, каждый из -R2, в случае если присутствует, независимо представляет собой -RA1.
Группа -RA1
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой возможно замещенный насыщенный алифатический C1-6 алкил.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой возможно замещенный насыщенный алифатический С1-4 алкил.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой незамещенный насыщенный алифатический C1-6 алкил.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой незамещенный насыщенный алифатический С1-4 алкил.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой незамещенный -Me.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой незамещенный -Et.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой незамещенный -Pr.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой возможно замещенный -Me.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой возможно замещенный -Et.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой возможно замещенный -Pr.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой возможно замещенный -Bu.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой -CF3.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой -CH2CF3.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой -CH2CH2CF3.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой -CH2CH2CH2CF3.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой -CH2F.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой -CH2CH2F.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой -CH2CH2CH2F.
Согласно одному варианту реализации, каждый из -RA1, в случае если присутствует, независимо представляет собой -CH2CH2N(Me)2.
Группа -RB2
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо выбран из:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН, -LC-OH, -O-LC-OH,
-ORC1, -LC-ORC1, -O-LC-ORC1,
-NHS(=O)2RC1, -NR2S(=O)2RC1.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо выбран из:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН, -LC-OH, -O-LC-OH,
-ORC1, -LC-ORC1, -O-LC-ORC1.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо выбран из:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-ОН, -O-LC-OH,
-ORC1, -LC-ORC1, -O-LC-ORC1.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо выбран из:
-F, -Cl, -Br, -I,
-CF3, -OCF3.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо выбран из -F, -Cl, -Br и -I.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо выбран из -CF3 и -OCF3.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо выбран из -F и -CF3.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо представляет собой -F.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо представляет собой -CF3.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо выбран из:
-ОН, -LC-OH, -O-LC-OH,
-ORC1, -LC-ORC1, -O-LC-ORC1.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо выбран из:
-ОН, -O-LC-OH,
-ORC1, -O-LC1-ORC1.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо выбран из -ОН и -ORC1.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо выбран из -O-LC-OH и -О-LC-ORC1.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо представляет собой -О-LC-ОН.
Согласно одному варианту реализации, каждый из -RB2, в случае если присутствует, независимо представляет собой -О-LC-ORC1.
Группа -LC-
Согласно одному варианту реализации, каждый из -LC-, в случае если присутствует, независимо представляет собой незамещенный насыщенный алифатический С1-5 алкилен.
Согласно одному варианту реализации, каждый из -LC-, в случае если присутствует, независимо представляет собой -CH2CH2-.
Группа -RC1
Согласно одному варианту реализации, каждый из -RC1, в случае если присутствует, независимо представляет собой незамещенный насыщенный алифатический С1-4 алкил, фенил или бензил.
Согласно одному варианту реализации, каждый из -RC1, в случае если присутствует, независимо представляет собой незамещенный насыщенный алифатический С1-4 алкил.
Согласно одному варианту реализации, каждый из -RC1, в случае если присутствует, независимо представляет собой -Me.
Согласно одному варианту реализации, каждый из -RC1, в случае если присутствует, независимо представляет собой незамещенный фенил.
Согласно одному варианту реализации, каждый из -RC1, в случае если присутствует, независимо представляет собой незамещенный бензил.
Комбинации
Все совместимые комбинации вариантов реализации, описанные выше, явным образом раскрыты в настоящем описание, как в случае если бы каждая из комбинаций была индивидуально и явным образом описана.
Физико-химические свойства
Предпочтительные диапазоны физико-химических свойств для увеличения проникновения через гематоэнцефалический барьер более подробно обсуждают далее. Тем не менее на основании существующих CNS активных агентов ниже описаны следующие предпочтительные критерии для ДЗБ соединений:
Молекулярная масса
Согласно одному варианту реализации ДЗБ соединение обладает молекулярной массой, равной от 330 до 600.
Согласно одному варианту реализации нижняя граница диапазона составляет от 350, 375, 400 или 425.
Согласно одному варианту реализации верхняя граница диапазона составляет 600, 575, 550, 525, 500 или 450.
Согласно одному варианту реализации диапазон составляет от 375 до 575.
Согласно одному варианту реализации ДЗБ соединение обладает молекулярной массой, равной 500 или менее.
Согласно одному варианту реализации ДЗБ соединение обладает молекулярной массой, равной 450 или менее.
miLog P
Согласно одному варианту реализации ДЗБ соединение обладает значением miLog P, равным от 2,0 до 5,3.
Согласно одному варианту реализации нижняя граница диапазона составляет от 2,8, 2,9, 3,0 или 3,1.
Согласно одному варианту реализации верхняя граница диапазона составляет 5,0, 5,1, 5,2, 5,3, 4,5 или 4,0.
Согласно одному варианту реализации диапазон составляет от 3,0 до 5,1.
Согласно одному варианту реализации ДЗБ соединение обладает значением miLog P, равным от 2,0 до 5,0.
Согласно одному варианту реализации ДЗБ соединение обладает значением miLog P, равным от 2,0 до 4,0.
Log D
Согласно одному варианту реализации ДЗБ соединение обладает значением Log D, равным от 2,0 до 5,0.
Согласно одному варианту реализации ДЗБ соединение обладает значением Log D, равным от 2,0 до 4,0.
Log D представляет собой отношение равновесной концентрации всех фрагментов (неионизированных и ионизированных) молекул в октаноле к содержанию указанных молекул в водной фазе при 25°С.
Согласно одному варианту реализации Log D представляет собой отношение равновесной концентрации всех фрагментов (неионизированных и ионизированных) молекул в октаноле к содержанию указанных молекул в водной фазе при 25°С и рН 7,4.
Площадь поверхности топологической полярной области
Согласно одному варианту реализации ДЗБ соединение обладает площадью поверхности топологической полярной области, равно от 45 до 95 Å2.
Согласно одному варианту реализации нижняя граница диапазона составляет от 50, 55 или 60.
Согласно одному варианту реализации верхняя граница диапазона составляет 70, 75, 80, 85 или 90.
Согласно одному варианту реализации диапазон составляет от 55 до 75.
Согласно одному варианту реализации ДЗБ соединение обладает площадью поверхности топологической полярной области, равной 90 Å2 или менее.
Согласно одному варианту реализации ДЗБ соединение обладает площадью поверхности топологической полярной области, равной 70 Å2 или менее.
Доноры водородной связи
Согласно одному варианту реализации ДЗБ соединение содержит 3 или менее донора водородной связи.
Согласно одному варианту реализации ДЗБ соединение содержит 2 или менее донора водородной связи.
Согласно одному варианту реализации ДЗБ соединение содержит 1 или не содержит донор водородной связи.
Примеры конкретных вариантов реализации
Согласно одному варианту реализации соединения выбраны из соединений, имеющие формулы, представленные ниже, и их фармацевтически приемлемых солей, гидратов ил сольватов.
Соединения, в которых -Q- представляет собой -NHC(O)-; -NR1C(O)-; -C(O)NH- или -C(O)NR1-
Бензотиазольные соединения
Нефторированные метоксиамиды
Согласно одному варианту реализации соединение независимо выбрано из:
АВМА-04; АВМА-05; АВМА-06; АВМА-07; АВМА-08; АВМА-09; АВМА-10; АВМА-11; АВМА-13; АВМА-14; АВМА-15 и АВМА-16.
Согласно одному варианту реализации соединение независимо выбрано из:
АВМА-04; АВМА-05; АВМА-06; АВМА-07; АВМА-08; АВМА-09; АВМА-10; АВМА-11 и АВМА-13.
Фторированные метоксиамиды
Согласно одному варианту реализации соединение независимо выбрано из:
ABFMA-04; ABFMA-05; ABFMA-06; ABFMA-07; ABFMA-08; ABFMA-09; ABFMA-11; ABFMA-12; ABFMA-14; ABFMA-15 и ABFMA-17.
Согласно одному варианту реализации соединение независимо выбрано из ABFMA-15 и ABFMA-12.
Моногалогенированные метоксиамиды
Согласно одному варианту реализации соединение независимо выбрано из:
ABMFMA-02; ABMFMA-03; ABMFMA-04; ABMFMA-05; ABMFMA-07; ABMFMA-08; ABMFMA-09 и ABMFMA-10.
Согласно одному варианту реализации соединение независимо выбрано из:
ABMFMA-02; ABMFMA-03; ABMFMA-05; ABMFMA-08 и ABMFMA-09.
Нефторированные гидроксиамиды
Согласно одному варианту реализации соединение независимо выбрано из:
АВНА-01; АВНА-02; АВНА-03 и АВНА-05.
Согласно одному варианту реализации соединение независимо выбрано из:
АВНА-01; АВНА-02 и АВНА-03.
Фторированные гидроксиамиды
Согласно одному варианту реализации соединение независимо выбрано из:
ABFHA-01; ABFHA-02; ABFHA-03; ABFHA-05; ABFHA-06; ABFHA-07; ABFHA-08; ABFHA-09; ABFHA-10 и ABFHA-11.
Согласно одному варианту реализации соединение независимо выбрано из:
ABFHA-01; ABFHA-02; ABFHA-03; ABFHA-05; ABFHA-06; ABFHA-08; ABFHA-09; ABFHA-10 и ABFHA-11.
Нефторированные метиламиды
Согласно одному варианту реализации соединение независимо выбрано из:
АВАА-01; АВАА-02; АВАА-03; АВАА-06; АВАА-09; АВАА-10 и АВАА-11.
Согласно одному варианту реализации соединение независимо выбрано из:
АВАА-06; АВАА-10 и АВАА-11.
Диметиламинамиды
Незамещенные амиды
Имидазо[1,2-а] пиридиновые соединения
Согласно одному варианту реализации соединение независимо выбрано из:
AIPN-01; AIPN-02; AIPN-05; AIPN-07; AIPN-08; AIPN-09; AIPN-10; AIPN-11; AIPN-12; AIPN-13; AIPN-14; AIPN-15; AIPN-16; AIPN-18; AIPN-19; AIPN-20; AIPN-21; AIPN-22; AIPN-23; AIPN-24; AIPN-25; AIPN-26; AIPN-27; AIPN-28; AIPN-29; AIPN-30 и AIPN-31.
Согласно одному варианту реализации соединение независимо выбрано из:
AIPN-01; AIPN-02; AIPN-05; AIPN-07; AIPN-08; AIPN-09; AIPN-10; AIPN-11; AIPN-12; AIPN-13; AIPN-14; AIPN-16; AIPN-18; AIPN-20; AIPN-21; AIPN-22; AIPN-23; AIPN-24; AIPN-25; AIPN-26; AIPN-27; AIPN-28; AIPN-29; AIPN-30 и AIPN-31.
Как дополнение или в качестве альтернативы имидазо[1,2-а]пиридиновое соединение независимо выбрано из:
Согласно одному варианту реализации соединение независимо дополнительно или в качестве альтернативы выбрано из AIPN-38 и AIPN-39.
Имидазо[1,2-a]пиримидиновые соединения
Имидазо[2,1-b][1,3]тиазольные соединения
Соединения, в которых -Q- представляет собой -СН=СН-; -CR1=CH-; -CH=CR1- или -CR1=CR1
Бензотиазольные соединения
Нефторированные метилалкены
Согласно одному варианту реализации соединение независимо выбрано из:
ВЕМА-02; ВЕМА-03; ВЕМА-04; ВЕМА-07 и ВЕМА-10.
Согласно одному варианту реализации соединение независимо представляет собой ВЕМА-10.
Нефторированные метоксиалкены
Согласно одному варианту реализации соединение независимо выбрано из:
ВЕМОА-01; ВЕМОА-02; ВЕМОА-03; ВЕМОА-04; ВЕМОА-05; ВЕМОА-07 и ВЕМОА-08.
Согласно одному варианту реализации соединение независимо выбрано из ВЕМОА-03 и ВЕМОА-05.
Как дополнение или в качестве альтернативы нефторированное метоксиалкеновое соединение независимо выбрано из:
Фторированные метоксиалкены
Согласно одному варианту реализации соединение независимо выбрано из:
BEFA-05; BEFA-06; BEFA-07; BEFA-08; BEFA-10; BEFA-11; BEFA-13 и BEFA-14.
Согласно одному варианту реализации соединение независимо выбрано из:
BEFA-06 и BEFA-10.
Монофтор- и фторированные гидроксиалкены
Согласно одному варианту реализации соединение независимо выбрано из:
BEHF-01; BEHF-02; BEHF-03; BEHF-05; BEHF-06 и BEHF-07.
Согласно одному варианту реализации соединение независимо выбрано из:
BEHF-01; BEHF-02; BEHF-06 и BEHF-07.
Имидазо[1,2-а]пиридиновые соединения
Как дополнение или в качестве альтернативы имидазо[1,2-а]пиридиновое соединение выбрано из:
Соединения, в которых -Q- представляет собой -N=N-
Бензотиазольные соединения

Согласно одному варианту реализации соединение независимо выбрано из:
BDF-01; BDF-02; BDF-03; BDF-04; BDF-05; BDF-06; BDF-07; BDF-10; BDF-11; BDF-12; BDF-13; BDF-14; BDF-15; BDF-16 и BDF-17.
Как дополнение или в качестве альтернативы бензотиазольное соединение независимо выбрано из:
Имидазо[1,2-а]пиридиновые соединения
По существу очищенные формы
Согласно одному аспекту настоящее изобретение относится к ДЗБ соединениям, описанным в настоящей патентной заявке, в по существу очищенной форме и/или в форме, по существу не содержащей примеси.
Согласно одному варианту реализации по существу очищенная форма является равной по меньшей мере 50% по массе, например, по меньшей мере 60% по массе, например, по меньшей мере 70% по массе, например, по меньшей мере 80% по массе, например, по меньшей мере 90% по массе, например, по меньшей мере 95% по массе, например, по меньшей мере 97% по массе, например, по меньшей мере 98% по массе, например, по меньшей мере 99% по массе.
Если не приведено уточнение, по существу очищенная форма относится к соединению в любой стереоизомерной или энантиомерной формах. Например, согласно одному варианту реализации, по существу очищенная форма относится к смеси стереоизомеров, т.е. очищенной от других соединений. Согласно одному варианту реализации, по существу очищенная форма относится к одному стереоизомеру, например, оптически чистому стереоизомеру. Согласно одному варианту реализации, по существу очищенная форма относится к смеси энантиомеров. Согласно одному варианту реализации по существу очищенная форма относится к эквимолярной смеси энантиомеров (т.е. рацемической смеси, рацемату). Согласно одному варианту реализации по существу очищенная форма относится к одному из энантиомеров, например, к оптически чистому энантиомеру.
Согласно одному варианту реализации примеси составляют не более чем 50% по массе, например, не более чем 40% по массе, например, не более чем 30% по массе, например, не более чем 20% по массе, например, не более чем 10% по массе, например, не более чем 5% по массе, например, не более чем 3% по массе, например, не более чем 2% по массе, например, не более чем 1% по массе.
Если не приведено уточнение, примеси относятся к другим соединениям, которые отличны от стереоизомеров или энантиомеров. Согласно одному варианту реализации примеси относятся в другим соединениям и другим стереоизомерам. Согласно одному варианту реализации примеси относятся к другим соединениям или другому энантиомеру.
Согласно одному варианту реализации по существу очищенная форма является по меньшей мере на 60% оптически чистой (т.е. 60% соединения, в мольном содержании, представляют собой целевой стереоизомер или энантиомер, а 40% представляет собой нежелательный стереоизомер или энантиомер), например, по меньшей мере на 70% оптически чистой, например, по меньшей мере на 80% оптически чистой, например, по меньшей мере на 90% оптически чистой, например, по меньшей мере на 95% оптически чистой, например, по меньшей мере на 97% оптически чистой, например, по меньшей мере на 98% оптически чистой, например, по меньшей мере на 99% оптически чистой.
Изомеры
Конкретные соединения могут существовать с одной или более конкретной геометрической, оптической, энантиомерной, диастереомерной, эпимерной, атроповой, стереоизомерной, таутомерией, конформационной или аномерной форме, включая, но не ограничиваясь только ими, цис- и транс-формы; Е- и Z-формы; с-, t- и r-формы; эндо- и экзо-формы; R-, S- и мезо-формы; D- и L-формы; d- и l-формы; (+) и (-) формы; кето-, енол- и енолятные формы; син- и анти-формы; синклинальные и антиклинальные формы; α- и β-формы; аксиальные и экваториальные формы; конформации ванна, кресло, твист, конверт и полукресло; и их комбинации, далее в целом называемые «изомеры» (или «изомерные формы»).
Отметим, что за исключением обсуждаемых ниже конкретных таутомерных форм, исключенных из термина «изомеры», термин «изомеры», используемый в настоящей патентной заявке, представляет собой структурные (или изомеры состава) изомеры (т.е. изомеры, которые отличаются порядком связей между атомами, а не положением атомов в пространстве). Например, ссылку на метоксигруппу, -ОСН3, не следует рассматривать как ссылку на ее структурный изомер, гидроксиметильную группу, -СН2ОН. Аналогично, ссылку на орто-хлорфенил не следует рассматривать как ссылку на его структурный изомер, мета-хлорфенил. Тем не менее, ссылка на класс структур может успешно включать структурные изомерные формы, подпадающие в рамки указанного класса (например, С1-7 алкил включает н-пропил и изо-пропил; бутил включает н-, изо-, втор- и трет-бутил; метоксифенил включает орто-, мета- и пара-метоксифенил).
Вышеуказанные исключения не относятся к таутомерным формам, например, кето-, енол- и енолятным формам, как, например, в следующих таутомерных парах: кето/енол (представлена ниже), имин/енамин, амид/иминоспирт, амидин/амидин, нитрозо/оксим, тиокетон/ентиол, N-нитрозо/гидроксиазо и нитро/аци-нитро.

Отметим, что в термин «изомер» конкретно включены соединения с одной или более изотропными заменами. Например, Н может находиться в любой изотопной форме, включая1H,2H (D) и3H (Т); С может находиться в любой изотопной форме, включая12С,13С и14С; О может находиться в любой изотопной форме, включая16О и18О; и т.д. Также F может находиться в любой изотопной форме, включая18F и19F.
Если не указано обратное ссылка на конкретное соединение включает все указанные изомерные формы, включая их смеси (например, рацемические смеси). Способы получения (например, асимметрический синтез) и разделения (например, способами фракционной кристаллизации и хроматографии) указанных изомерных форм также известны в данной области техники или с легкостью получены при помощи адаптации исследуемых в настоящей патентной заявке способов или известных способов известным образом.
Если не указано обратное, группы -N=N-, -CH=CH-; -CR1=CH-; -CH=CR1- и -CR1=CR1- могут находиться в цис- или транс-формах.
Согласно одному варианту реализации, группа -N=N-, в случае если присутствует, может находиться в цис- или транс-форме.
Согласно одному варианту реализации, группа -N=N-, в случае если присутствует, находится в цис-форме.
Согласно одному варианту реализации, группа -N=N-, в случае если присутствует, находится в транс-форме.
Например:


где * означает места присоединения.
Согласно одному варианту реализации группы -СН=СН-; -CR1=CH-; -CH=CR1- и -CR1=CR1-, в случае если присутствуют, могут находиться в цис- или транс- формах.
Согласно одному варианту реализации группы -СН=СН-; -CR1=CH-; -CH=CR1- и -CR=CR1-, в случае если присутствуют, находятся в цис-форме.
Согласно одному варианту реализации группы -СН=СН-; -CR1=CH-; -CH=CR1- и -CR=CR1-, в случае если присутствуют, находятся в транс-форме.
Например,

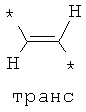

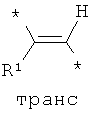



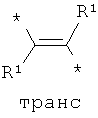
где * означает места присоединения.
Соли
Может быть удобным или необходимым получение, очистка и/или хранение соответствующей соли соединения, например, фармацевтически приемлемой соли. Примеры фармацевтически приемлемых солей обсуждают в работе Бержа с соавторами (Berge et al.), 1977, «Pharmaceutically Acceptable Salts», J. Pharm. Sci., Vol.66, pp 1-19.
Например, в случае если соединение является анионным или содержит функциональную группу, которая может быть анионной (например, -СООН может находиться в виде -СОО-), соль может быть получена с подходящим катионом. Примеры подходящих неорганических катионов включают, но не ограничиваются только ими, ионы щелочных металлов, таких как Na+ и К+, катионы щелочноземельных металлов, таких как Са2+ и Mg2+ и другие катионы, такие как Al3+. Примеры подходящих органических катионов включают, но не ограничиваются только ими, ион аммония (т.е. NH4+) и замещенные ионы аммония (например, NH3R+, NH2R2+, NHR3+, NR4+). Примеры некоторых подходящих замещенных ионов аммония представляют собой ионы аммония, являющиеся производными: этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, так же как и аминокислот, таких как лизин и аргинин. Пример типичного иона четвертичного аммония представляет собой N(СН3)4+.
В случае если соединения является катионным или содержит функциональную группу, которая может быть катионной (например, NH2 может находиться в форме NH3+ может быть получена соль с подходящим анионом. Примеры подходящих неорганических анионов включают, но не ограничиваются только ими, анионы, являющиеся производными следующих неорганических кислот: хлороводородной, бромоводородной, йодоводородной, серной, сернистой, азотной, азотистой, фосфорной и фосфористой.
Примеры подходящих органических анионов включают, но не ограничиваются только ими, анионы, которые являются производными следующих органических кислот: 2-ацетилоксибензойной, уксусной, аскорбиновой, аспарагиновой, бензойной, камфорсульфоновой, коричной, лимонной, этилендиаминтетрауксусной, этандисульфоновойй, этансульфоновой, фумаровой, глюкогептоновой, глюконовой, глутаминовой, гликолевой, гидроксималеиновой, гидроксинафталинкарбоксильной, изетионовой, молочной, лактобионовой, лауриновой, малеиновой, яблочной, метансульфоновой, муциновой, олеиновой, щавелевой, пальмитиновой, памовой, пантотеновой, фенилуксусной, фенилсульфоновой, пропионовой, пировиноградной, салициловой, стеариновой, янтарной, сульфаниловой, винной, толуолсульфоновой и валериановой. Примеры подходящих полимерных органических анионов включают, но не ограничиваются только ими, анионы, являющиеся производными следующих полимерных кислот: дубильной кислоты, карбоксиметилцеллюлозы.
Согласно одному варианту реализации соль независимо выбрана из солей следующих кислот: хлороводородной и метансульфоновой.
Если не указано обратное, ссылка на конкретное соединение также включает указанное соединение в форме соли.
Сольваты и гидраты
Может быть удобным или необходимым получение, очищение и/или хранение соответствующего сольвата соединения. Термин «сольват» используют в настоящей патентной заявке в общепринятом значении для ссылки на комплекс растворенного вещества (например, соединения, соли соединения) и растворителя. В случае если растворитель представляет собой воду, сольват можно называть гидратом, например, моногидратом, дигидратом, тригидратом и т.д.
Если не указано обратное, ссылка на конкретное соединение также включает его сольватную и гидратную форму.
Химически защищенные формы
Может быть удобным или необходимым получение, очищение и/или хранение соединения в химически защищенной форме. Термин «химически защищенная форма» используют в настоящей патентной заявке в общепринятом значении, и указанный термин относится к соединению, в котором одну или более реакционноспособную группу защищают от нежелательных химических реакций в конкретных условиях (например, рН, температура, уровень излучения, растворитель и т.д.). На практике хорошо известны способы, которые применяют для обратимого перевода в неактивное состояние функциональной группы, которая в противном случае является реакционноспособной в конкретных условиях. В химически защищенной форме одна или более функциональная группа находятся в форме защищенной или защищающей группы (также известной как скрытой или скрывающей группы или блокированной или блокирующей группы). За счет защиты реакционноспособной функциональной группы можно проводить реакции с участием других незащищенных реакционноспособных функциональных групп без воздействия на защищенную группу; защищающая группа может быть удалена, как правило, на следующей стадии без существенного воздействия на остаток молекулы. См, например, Protective Groups in Organic Synthesis (Т.Green and P.Wuts; 3rd Edition; John Wiley and Sons, 1999).
Большое количество указанных способов «защиты», «блокирования», «маскировки» широко применяют и хорошо известны в органическом синтезе. Например, соединение, которое содержит две неэквивалентные реакционноспособные группы, каждая из которых является реакционноспособной в конкретных условиях, может быть подвергнуто превращению с переводом одной из функциональных групп в «защищенную форму», соответственно в неактивное состояние, в конкретных условиях; таким образом, защищенное соединение можно применять в качестве реагента, который обладает только одной эффективной реакционноспособной группой. После завершения проведения целевой реакции (с участием другой функциональной группы) с защищенной группы можно «снять защиту» с возвращением первоначальной функциональности указанной группы.
Например, гидроксильная группа может быть защищена в виде простого эфира (-OR) или сложного эфира (-OC(=O)R), например, в виде т-бутилового эфира; бензилового, бензгидрилового (дифенилметилового) или тритилового (трифенилметилового) эфира; триметилсилилового или т-бутилдиметилсилилового эфира; или ацетилового эфира (-ОС(=O)СН3, -ОАс).
Например, альдегидная или кетоновая группа может быть защищена в виде ацеталя (R-CH(OR)2) или кеталя (R2C(OR)2), соответственно, в которых карбонильную группу (>С=O) превращают в диэфирную (>C(OR)2) при помощи взаимодействия с, например, первичным спиртом. Альдегидная или кетоновая группа с легкостью регенерируются при помощи гидролиза с применением значительного избытка воды в присутствии кислоты.
Например, аминогруппа может быть защищена, например, в виде амида (-NRCO-R) или уретана (-NRCO-OR), например, в виде: метиламида (-NHCO-СН3); бензилоксиамида (-NHCO-OCH2C6H5, -NH-Cbz); в виде т-бутоксиамида (-NHCO-ОС(СН3)3, -NH-Boc); 2-бифенил-2-пропоксиамида (-NHCO-ОС(СН3)2С6Н4С6Н5, -NH-Bpoc), в виде 9-флуоренилметоксиамида (-NH-Fmoc), в виде 6-нитровератрилоксиамида (-NH-Nvoc), в виде 2-триметилсилилэтоксиамида (-NH-Teoc), в виде 2,2,2-трихлорэтоксиамида (-NH-Troc), в виде аллоксиамида (-NH-Alloc), в виде 2-(фенилсульфонил)этоксиамида (-NH-Psec) или в подходящих случаях (например, для циклических аминов) в виде радикала нитроксида (>N-O·).
Например, карбоксильная группа может быть защищена в виде сложного эфира, например, в виде: С1-7 алкильного сложного эфира (например, метилового сложного эфира; т-бутилового сложного эфира); C1-7 галоалкильного сложного эфира (например, C1-7 тригалогеналкильного сложного эфира); триС1-7 алкилсилил-С1-7 алкильного сложного эфира; или C5-20 арил-С1-7 алкильного сложного эфира (например, бензилового сложного эфира, нитробензилового сложного эфира); или в виде амида, например, в виде метиламида.
Например, тиольная группа может быть защищена в виде тиоэфира (-SR), например, в виде:
бензилового тиоэфира; ацетамидометилового эфира (-S-CH2NHC(=O)СН3).
Пролекарство
Может быть удобным или необходимым получение, очистка и/или хранение соединения в виде пролекарства. Термин «Пролекарство», используемый в настоящей патентной заявке, относится к соединению, которое в результате метаболизма (например, in vivo) приводит в получению целевого активного соединения. Как правило, Пролекарство является неактивным или менее активным по сравнению с целевым активным соединением, но может обеспечить преимущества в хранении, введении или в метаболических свойствах.
Например, некоторые пролекарства представляют собой сложные эфиры активного соединения (например, физиологически приемлемый метаболически лабильный сложный эфир). При метаболизме сложноэфирная группа (-C(=O)OR) разрушается с получением активного лекарственного средства. Указанные сложные эфиры могут быть получены при помощи этерификации, например, любой карбоксильной кислотной группы (-С(=O)ОН) исходного соединения, с предварительной защитой любых других реакционноспособных групп, присутствующих в исходном соединении, с последующим снятием защиты в случае необходимости.
Также некоторые пролекарства активируются ферментами с получением активного соединения или соединения, которое в результате дополнительной химической реакции приводит к получению активного соединения (например, как в случаях ADEPT, GDEPT, LIDEPT и т.д.). Например, Пролекарство может представлять собой производное сахара или другого гликозидного конъюгата или может представлять собой сложноэфирное производное аминокислоты.
Композиции
Один из аспектов настоящего изобретения относится к композиции (например, диагностической композиции), содержащей ДЗБ соединение, описанное в настоящей патентной заявке, и физиологически приемлемый носитель, разбавитель или наполнитель.
Другой аспект настоящего изобретения относится к способу получения композиции (например, диагностической композиции), включающий перемешивание ДЗБ соединения описанного в настоящей патентной заявке, и физиологически приемлемого носителя, разбавителя или наполнителя.
Фармацевтические и диагностические композиции
Другой аспект настоящего изобретения относится к фармацевтической или диагностической композиции, содержащей ДЗБ соединение, описанное в настоящей патентной заявке.
Другой аспект настоящего изобретения относится к фармацевтической или диагностической композиции, содержащей ДЗБ соединение, описанное в настоящей патентной заявке, и физиологически приемлемый носитель, разбавитель или наполнитель.
Другой аспект настоящего изобретения относится к способу получения фармацевтической или диагностической композиции, включающий перемешивание ДЗБ соединения, описанного в настоящей патентной заявке, и физиологически приемлемого носителя, разбавителя или наполнителя.
Примеры подходящих физиологически приемлемых носителей, разбавителей и наполнителей представляют собой фармацевтически приемлемые носители, разбавители и наполнители, описанные ниже.
Применения
Соединения, описанные в настоящей патентной заявке (например, без ограничений), являются пригодными, например, в способах и моделях, относящихся к маркировке и обнаружению нейрофибриллярных клубков и в частности парных спиральных филаментов.
Способы маркировки PHF и агрегированных тау-белков
Согласно одному аспекту в настоящем изобретении предложен способ маркировки PHF, включающий приведение в контакт PHF с ДЗБ соединением и обнаружение присутствия указанного соединения. Способы применения могут быть проведены, например, аналогично применению лигандов, описанных ранее (см, например, работу Мена с соавторами (Mena et al.), 1995; работу Мена с соавторами (Mena et al.), 1996; Работу Р.Лай с соавторами (Lai R. et al.); работу В.Бондарева с соавторами (Bondareff W. et al.); работу Дж.Ф.Реша с соавторами (Resch J.F. et al.); работу М.Новака с соавторами (Novak М. et al.); Работу К.В.Вишика с соавторами (Wischik C.W. et al.), 1996; и работу К.В.Вишика с соавторами (Wischik C.W. et al.), 1989).
Таким образом, согласно одному аспекту в настоящем изобретении предложен способ маркировки агрегированных тау-белков или молекул, подобных тау-белкам, включающий приведение в контакт агрегированных молекул тау-белка с ДЗБ соединением и обнаружение присутствия указанного соединения. Способы применения могут быть проведены, например, аналогично применению лигандов, описанному ранее (см, например, работу Мена с соавторами (Mena et al.), 1995; работу Мена с соавторами (Mena et al.), 1996; Работу Р.Лай с соавторами (Lai R. et al.); работу В.Бондарева с соавторами (Bondareff W. et al.); работу Дж.Ф.Реша с соавторами (Resch J.F. et al.); работу М.Новака с соавторами (Novak M. et al.); Работу К.В.Вишика с соавторами (Wischik C.W. et al.), 1996; и работу К.В.Вишика с соавторами (Wischik C.W. et al.), 1989).
В случае использования в настоящей патентной заявке термин «тау-белок» относится в целом к любому белку семейства тау-белков. Тау-белки характеризуются как одно из наиболее многочисленных семейств, которые соочищаются с микротрубочками в течение повторяющихся циклов накопления и разрушения (работа Шелански с соавторами (Shelanski et al.), 1973 Proc. Natil. Acad. Sci. USA, 70., 765-768) и известны как белки, ассоциированные с микротрубочками (MAP). Члены семейства тау-белков обладают общими свойствами, заключающимися в содержании характерного N-терминального сегмента, последовательности примерно 50 аминокислот, содержащихся в N-терминальном сегменте, который широко регулируется мозгом, характерной областью тандемных повторов, содержащей 3 или 4 тандемных повтора 31-32 аминокислот и С-терминальный хвост. См., например, работу Вишика с соавторами (Wischik et al.), 2001 и loc. cit..
Молекулы, «подобные тау-белкам», включают, например, МАР2, которая представляет собой преобладающий белок, ассоциированный с микротрубочками, в соматодендрическом отделе (работа А.Матуса (Matus A.) in «Microtubules» [Hyams and Lloyd, eds.] pp 155-166, John Wiley and Sons, NY). Изоформы МАР2 являются практически идентичными тау-белку в области тандемного повтора, но отличаются по существу от последовательности и размера N-терминального домена (работа Киндлера и Гарнера (Kindler and Garner), 1994, Mol. Brain Res. 26. 218-224). Тем не менее, агрегирование в области тандемного повтора не является селективным для домена с повтором тау-белков. Таким образом, следует понимать, что любое обсуждение в настоящей патентной заявке, относящееся к тау-белкам или тау-тау агрегированию, следует рассматривать как относящееся также к тау-МАР2 агрегированию, МАР2-МАР2 агрегированию и т.д.
ДЗБ соединение может быть сопряжено, образовать комплекс или другим образом связано с дополнительной группой или частицей, которая обладает диагностическим, прогностическим или терапевтическим назначением или действием, например, с флуоресцентной группой, которая, таким образом, обеспечивает визуализацию нейрофибриллярных клубков, с которым связывается лиганд.
Диагностические лиганды
ДЗБ соединения способны к действию в качестве лигандов или меток тау-белков (или агрегированных тау-белков). В частности, ДЗБ соединения применимы в способах медицинской визуализации.
Существуют различные способы, при помощи которых агрегированный тау-белок может быть визуализирован in vivo, которые включают применение лигандов, в которых ДЗБ соединение содержит19F (МРТ-скан),18F (скан позитронно-эмиссионной томографии (ПЭТ)) или стабильный нитроксильный свободный радикал (контрастное вещество для МРТ и протон-электронного двойного резонанса (PEDRI)). Также включено применение лигандов, содержащих радиоактивный изотоп I (однофотонная эмиссионная компьютерная томография, ОЭКТ).
Применение агентов, описанных в настоящей патентной заявке, в любом из указанных способов включено в объем настоящего изобретения.
Таким образом, согласно одному варианту реализации, ДЗБ соединение представляет собой лиганд тау-белка (или агрегированного тау-белка).
Указанные ДЗБ соединения (лиганды) могут включать, быть сопряженными, образовывать комплекс или другим способом быть связаны с другими химическими группами, такими как стабильные и нестабильные детектируемые изотопы, радиоактивные изотопы, позитронно-активные атомы, метки магнитного резонанса, красители, флуоресцентные маркеры, антигенные группы, терапевтические группы или любые другие группы, которые могут способствовать прогностическому, диагностическому или терапевтическому применению.
Например, как указано выше. Согласно одному варианту реализации, ДЗБ соединение является определенным выше, но с тем дополнительным ограничением, что соединение включает, сопряжено или образует комплекс или другим образом связано с одним или более (например, 1, 2, 3, 4 и т.д.) изотопом, радиоактивным изотопом, позитрон-активным атомом, меткой магнитного резонанса, красителем, флуоресцентным маркером, антигенной группой или терапевтической группой.
Согласно одному варианту реализации ДЗБ соединение представляет собой лиганд, а также метку, например, метку тау-белка (или агрегированного тау-белка) и включает, сопряжено, образует комплекс или другим образом связано с одной или более (например, 1, 2, 3, 4 и т.д.) детектируемой меткой.
Например, Согласно одному варианту реализации ДЗБ соединение является определенным выше, но с тем дополнительным ограничением, что соединение включает, сопряжено, образует комплекс или другим образом связано с одной или более (например, 1, 2, 3, 4 и т.д.) детектируемой меткой.
Меченые ДЗБ соединения (например, связанные с тау-белком или агрегированным тау-белком) могут быть визуализированы или обнаружены любыми подходящими способами, и специалисту в данной области техники станет понятно, что можно применять любой подходящий способ обнаружения, известный в данной области техники.
Например, ДЗБ соединение (лиганд-метка) может быть подходящим образом обнаружено при помощи включения позитрон-активного атома (например,11С) (например, в виде атома углерода одного или более заместителя алкильной группы, например, заместителя метильной группы) и обнаружения соединения с применением позитронно-эмиссионной томографии (ПЭТ) в соответствии со способом, известным в данной области техники.
Как правило, радиометки, применяемые в исследованиях ПЭТ могут быть получены и визуализированы в течение временного промежутка, сравнимого с периодом полураспада изотопа, как правило, в течение двух периодов полураспада после получения радиоактивного изотопа.
18F обладает периодом полураспада, равным 110 минут, который обеспечивает достаточное время для относительно сложного синтеза и для биологических исследований. Дополнительным преимуществом является то, что18F обладает низкой энергией позитрона и его максимальное значение (2,4 мм) обеспечивает наиболее четкое изображение с наивысшим разрешением ПЭТ. По указанным причинам F-содержащие ДЗБ соединения, описанные в настоящей патентной заявке, включают соединения, в которых один или более атом F, в случае если присутствует, представляет собой атом18F.
18F может быть включен в лиганд с применением, например, фторид-иона или [18F]F2. Фторид-ион является более желательным из двух указанных ионов, т.к. может быть получен без дополнительного носителя. По существу, 100% изотопа могут быть включены в метку. Напротив, максимальный радиохимический выход в случае применения [18F]F2 в качестве предшественника составляет примерно 50%, так как только один из атомов фтора в молекуле фтора является меченым и, как правило, включается только один из атомов фтора.
Ключевым требованием для успешного радиофторирования является поддержание растворимости [18F]фторида. [18F]фторид сначала получают в водном растворе карбоната калия. Затем воду удаляют в виде азеотропа, как правило, с ацетонитрилом. Тем не менее, ион калия приводит к ограниченной растворимости в некоторых растворителях реакционной смеси. Добавление аминополиэфира Kryptofix 2.2.2 (К222) улучшает растворимость иона калия и следовательно значительно способствует нуклеофильному радиофторированию [18F]фторидом в алифатических и ароматических носителях.
В качестве конечного исследования меченый продукт может быть отделен от любых непрореагировавших веществ при помощи ВЭЖХ, что, как правило, является необходимым для получения вещества с высокой специфической активностью.
В одном из аспектов настоящего изобретения предложено применение ДЗБ соединений в качестве визуализирующих in vivo PHF и PHF тау-белок агентов.
ДЗБ соединения можно применять в способе определения стадии нейрофибриллярной дегенерации, связанной с таупатией, у субъекта, достоверно страдающего от указанного заболевания, который включает стадии:
(i) введения субъекту ДЗБ соединений, способных к маркировке парных спиральных филаментов (PHF) тау-белка,
(ii) обнаружение присутствия и/или количества ДЗБ соединения, связанного с внеклеточным агрегированным PHF тау-белка в медиальной височной доле мозга субъекта,
(iii) соотнесения результата определения, осуществленного на стадии (ii) со стадией нейрофибриллярной дегенерации субъекта.
Определение на стадии (ii) можно применять для определения плотности связывания лиганда.
Соотнесение на стадии (iii) может быть проведено при помощи ссылки на известные данные.
Таупатия может представлять собой болезнь Альцгеймера (БА).
ДЗБ соединения могут быть способны пересекать гематоэнцефалический барьер.
Определение на вышеуказанной стадии (ii) проводят в расчете на внеклеточный агрегированный тау-белок. В целом, для задач настоящего изобретения, определение можно проводить для внеклеточных клубков.
В гистологических исследованиях ранее было показано, что в течение агрегирования тау-белок требует места связывания соединений, таких как тиазин красный и тиофлавин-S (см работу Мена с соавторами (Mena et al.), 1995; работу Мена с соавторами (Mena et al.), 1996). Можно показать, что место связывания находится внутри клубка, а не во внешних белках (работа К.В.Вишика с соавторами (Wischik C.W. et al.), 1989). Таким образом внутриклеточные и внеклеточные клубки помечены в некоторой степени указанными лигандами, как показано при помощи гистологических исследований.
Тем не менее, для большей точности лиганды могут быть визуализированы или обнаружены при помощи любых подходящих способов, и специалисту станет понятно, что в указанных примерах можно использовать любые подходящие способы обнаружения, известные в данной области техники.
Указанные способы могут быть основаны на способах, описанных в WO 02/075318. Примеры диагностических лигандов
Согласно одному варианту реализации диагностические лиганды выбраны из соединений представленных ниже формул и их фармацевтически приемлемых солей, гидратов и сольватов.
Дополнительные способы маркировки PHF и тау-белков
В настоящем изобретении предложен способ маркировки парных спиральных филаментов (PHF), включающий приведение в контакт PHF с ДЗБ соединением, описанным в настоящей патентной заявке, и обнаружение присутствия указанного соединения.
Способ может быть проведен in vivo. В случае если способ представляет собой способ, проводимый in vivo, соединение вводят субъекту. Субъект может быть млекопитающим. Согласно одному варианту реализации субъект представляет собой грызуна. В другом варианте реализации субъект представляет собой человека.
Как альтернатива способ может быть проведен in vitro.
PHF могут быть выделены у субъекта, описанного в настоящей патентной заявке. Согласно одному варианту реализации PHF выделяют из мозга субъекта. PHF могут быть взяты из IFII фракции образца мозга, например, в соответствии с описанием, данным в работе К.М.Вишика (С.М.Wischik, Thesis «The structure and biochemistry of paired helical filaments in Alzheimer's disease» Part I and II; Cambridge University, 1989).
Согласно одному варианту реализации образец мозга содержит образец медиальной височной доли, т.е. E2/Trans (слой энторинальной коры 2/транзитная энторинальная кора) и Е4/НС (слой энторинальной коры 4 и гиппокамп) области, а также неокортикальные структуры (F/T/P области - передняя, височная, теменная) мозга.
Согласно одному варианту реализации PHF выделяют из мозга субъекта, страдающего от болезни Альцгеймера, или субъекта, у которого подозревают болезнь Альцгеймера. Субъект может являться человеком.
ДЗБ соединение может быть применено индивидуально или включено в состав композиции с подходящими носителями, разбавителями, наполнителями и т.д., описанными в настоящей патентной заявке.
Присутствие ДЗБ соединения может быть обнаружено с применением методов, которые являются подходящими для используемого типа соединения.
ДЗБ соединение может быть обнаружено при помощи флуоресцентной спектроскопии. Такие способы удобны для применения при определении ДЗБ соединений, способных к флуоресценции.
ДЗБ соединение может быть обнаружено при помощи счетчика радиации. Такие способы удобны для применения при определении ДЗБ соединений, содержащих радиоактивную метку.
Присутствие ДЗБ соединения может быть обнаружено при помощи конкурентного исследования, в котором отслеживают замещение известного лиганда PHF на ДЗБ соединение, включая количества, при помощи определения изменений в определяемых данных. Известный лиганд может представлять собой флуоресцентный лиганд. Замещение известного лиганда PHF можно отслеживать, возможно с количественной оценкой, при помощи флуоресцентной спектроскопии. Указанные способы удобны для применения при определении ДЗБ соединений, которые не способны к флуоресценции, или соединений, которые флуоресцируют в условиях или при длине волны, которые не перекрываются с сигналом флуоресценции, определяемым для известного лиганда.
Согласно одному варианту реализации присутствие ДЗБ соединения определяют при помощи замещения детектируемого известного лиганда PHF. Известный лиганд может представлять собой флуоресцентный лиганд.
Замещение известного лиганда PHF на ДЗБ соединение можно обнаружить при помощи уменьшения активности флуоресценции. Согласно одному варианту реализации известный лиганд способен к увеличенной флуоресценции при связывании с PHF.
Согласно одному варианту реализации известный лиганд представляет собой примулин.
Согласно одному варианту реализации ДЗБ соединение обладает большим сродством к PHF по сравнению с примулином.
Согласно одному варианту реализации соединение, содержащее18F радиоактивную метку, может быть обнаружено с применением счетчика радиации, например, счетчика гамма-частиц.
Другие способы обнаружения ДЗБ соединений настоящего изобретения включают способы, представленные в разделе Диагностические лиганды настоящей патентной заявки.
В настоящем изобретении также предложен способ маркировки агрегированных тау-белков или молекул, сходных с тау-белком, включающий приведение в контакт агрегированных молекул тау-белка с ДЗБ соединением и обнаружение присутствия указанного соединения.
Способ может быть проведен in vivo или in vitro. В случае если способ является способом, проводимым в организме, соединение вводят субъекту. Субъект может быть млекопитающим. Согласно одному варианту реализации субъект представляет собой грызуна. В другом варианте реализации субъект представляет собой человека.
Согласно одному варианту реализации ДЗБ соединение приводят в контакт с агрегированным тау-белком или молекулами, сходными с тау-белком, в образце мозга субъекта. Согласно одному варианту реализации субъект представляет собой субъекта, не являющегося человеком, способным к экспрессии полноразмерного человеческого тау-белка. Субъект может являться трансгенным грызуном, экспрессирующим полноразмерный человеческий тау-белок, обладающий двойной мутацией P301S/G335D.
Согласно одному варианту реализации, агрегированные тау-белок или молекулы, сходные с тау-белком, получают в клеточной линии, экспрессирующей полноразмерный тау-белок («Т40») и/или фрагмент тау-белка с PHF-ядром (фрагмент с массой 12 кД). Клеточная линия может представлять собой клеточную линию фибробласта. Согласно одному варианту реализации клеточная линия представляет собой клеточную линию ЗТ6.
Согласно одному варианту реализации ДЗБ соединение получают, а затем приводят в контакт с PHF или агрегированным тау-белком или молекулами, сходными с тау-белком, или вводят субъекту в течение 14 дней после получения.
ДЗБ соединение может быть подвергнуто взаимодействию или введено в течение 7 дней, 2 дней, 24 часов, 12 часов, 6 часов или 3 часов после получения.
ДЗБ соединение может быть введено субъекту, и распределение ДЗБ соединения в одном или более органе субъекта может быть исследовано.
Согласно одному варианту реализации исследуют распределение ДЗБ соединения в мозге.
ДЗБ соединение может достигать максимальной концентрации в мозгу по меньшей мере через 10 минут, 5 минут или 2 минуты после введения субъекту.
Содержание ДЗБ соединения, оставшегося в мозге, может достигать уровня, равного 50% от максимальной концентрации в мозге, не более чем через 120 минут, не более чем через 60 минут или не более чем через 30 минут после введения.
Общее содержание ДЗБ соединения в мозге, в процентном содержании от первоначальной дозы, введенной субъекту, составляет по меньшей мере 1%, по меньшей мере 2%, по меньшей мере 3% или по меньшей мере 4% от общего содержания введенного ДЗБ соединения. Временной интервал для измерения общего содержания может представлять собой временной интервал, в котором содержание в мозге достигает максимальной концентрации. В качестве альтернативы временной интервал может составлять 1, 2, 5 или 10 минут после введения.
Согласно одному варианту реализации ДЗБ соединение является по меньшей мере по существу растворенным в растворе, содержащем апротонный растворитель. Апротонный растворитель может представлять собой ДМСО. ДЗБ соединение может быть по меньшей мере по существу растворенным в растворе, содержащем по меньшей мере 1% ДМСО, по меньшей мере 5% ДМСО или по меньшей мере 10% ДМСО. Раствор может представлять собой водный раствор.
Согласно одному варианту реализации ДЗБ соединение является по меньшей мере по существу растворенным в растворе, содержащем протонный растворитель. Протонный растворитель может представлять собой метанол или этанол. ДЗБ соединение может быть по меньшей мере по существу растворенным в растворе, содержащем по меньшей мере 10% протонного растворителя, по меньшей мере 25% протонного растворителя или по меньшей мере 50% протонного растворителя. Согласно одному варианту реализации раствор представляет собой раствор, содержащий протонный растворитель и апротонный растворитель.
Наборы
Согласно одному аспекту, настоящее изобретение относится к набору, содержащему (а) ДЗБ соединение, описанное в настоящей патентной заявке, или композицию, содержащую ДЗБ соединение, описанное в настоящей патентной заявке, например, предпочтительно поставляемую в подходящем контейнере и/или в подходящей упаковке; и (b) инструкцию по применению, например, письменные инструкции по способу введения соединения или состава.
Применения для диагностики
ДЗБ соединение, или композиция, содержащая указанное соединение, могут быть применены в способе диагностики, прогнозирования или лечения организма человека или животного при помощи терапии, особенно в отношении состояния, такого как БА, описанного в настоящей патентной заявке.
Согласно другому аспекту настоящее изобретение обеспечивает способ диагностики или прогнозирования, включающий введение млекопитающему одного или более ДЗБ соединения, описанного в настоящей патентной заявке, в диагностически или прогностически эффективном количестве. Указанный аспект охватывает указанные соединения, применяемые в способе диагностики или прогнозирования. В указанном аспекте описаны применения in vivo и in vitro. Способы, проводимые in vitro, проводят при помощи (i) получения образца соответствующей ткани субъекта; (ii) приведение в контакт образца и ДЗБ соединения; (iii) обнаружения количества и/или локализации ДЗБ соединения связанного с образцом; (iv) соотнесения результата стадии (iii) со стадией или степенью заболевания субъекта.
Способ может быть проведен в рамках клинических испытаний для определения эффективности ингибитора агрегирования тау-белков.
Согласно другому аспекту настоящее изобретение обеспечивает применение ДЗБ соединения для получения композиции для диагностики, прогнозирования или лечения заболевания, описанного выше.
Заболевание или состояние может представлять собой, например, БА или состояние, связанное с БА, или другое состояние, которое вызвано агрегированием молекул белка.
Следует отметить, что тау-белок (и его аберрантная функция или образование) имеет значение не только в случае болезни Альцгеймера. Показано, что патогенез нейродегенеративных нарушений, таких как болезнь Пика и прогрессирующий надъядерный паралич (ПНП) связан с накоплением патологических укороченных агрегатов тау-белка в зубчатой извилине и звездообразных пирамидальных клетках неокортекса, соответственно. Другие деменции включают деменцию лобной доли (ДЛД); паркинсонизм, связанный с хромосомой 17 (FTDP-17); комплекс расторможенность-деменция-паркинсонизм-амиотрофия (DDPAC); паллидо-понто-нигральную дегенерацию (PPND); гуамский синдром АЛС; паллидо-нигро-люзиановую дегенерацию (PNLD); кортикобазальную дегенерацию (КБД) и другие (см. работу Вишика с соавторами (Wischik et al.), 2001, loc.cit, для подробного обсуждения - конкретно в Таблице 5.1). На все указанные болезни, которые характеризуются главным образом или частично аномальным агрегированием тау-белка, ссылаются в настоящей патентной заявке, как «таупатии».
Способы введения
ДЗБ соединение или фармацевтическая композиция, содержащая ДЗБ соединение, могут быть введены субъекту при помощи любого подходящего способа введения, систематического/периферического или местного (т.е. в месте необходимого действия).
Способы введения включают, но не ограничиваются только ими, оральное (например, при помощи приема внутрь); трансбуккальное; подъязычное; подкожное (включающее, например, введение при помощи пластыря или лейкопластыря и т.д.); трансмукозальное (включающее, например, введение при помощи пластыря или лейкопластыря и т.д.); интраназальное (например, при помощи спрея в нос); глазное (например, при помощи глазных капель); легочное (например, при помощи ингаляции или инсуффляционной терапии с применением, например, аэрозоля, например, через рот или нос); ректально (например, при помощи суппозиторий или клизмы); вагинально (например, при помощи пессария); парентерально, например, при помощи инъекции, включая подкожное, внутрикожное, внутримышечное, внутривенное, внутриартериальное, внутрисердечное, интратекальное, интраспинальное, интракапсулярное, подкапсулярное, внутриглазничное, интраперитонеальное, внутритрахеальное, субкутикулярное, внутрисуставное, субарахноидальное и надчревное; при помощи имплантирования депо или резервуара, например, подкожно или внутримышечно.
Субъект/Пациент
Субъект/пациент может представлять собой животное, млекопитающее, плацентарное животное, грызуна (например, морскую свинку, хомяка, крысу, мышь), мышиных (например, мышь), зайцеобразных (например, кролика), птичьих (например, птицу), псовых (например, собаку), кошачьих (например, кошку), лошадиных (например, лошадь), свиных (например, свинью), овечьих (например, овцу), бычьих (например, корову), примата, обезьяну (например, мартышкообразную обезьяну или человекообразную обезьяну), мартышкообразную обезьяну (например, игрунку или павиана), человекообразную обезьяну (например, гориллу, шимпанзе, орангутанга, гиббона) или человека.
Кроме того субъект/пациент может представлять собой одну из форм развития, например, эмбрион.
В одном из предпочтительных вариантов реализации субъект/пациент представляет собой человека. В других вариантах реализации субъект/пациент не является человеком.
Подходящие субъекты могут быть выбраны на основании общепринятых факторов. Таким образом, первоначальный выбор пациента может включать любой один или более фактор: экспертная оценка опытным врачом; максимально возможное исключение диагноза, отличного от БА, при помощи дополнительных лабораторных и других исследований; объективная оценка уровня когнитивной функции с применением невропатологически утвержденного тестов.
Составы
В случае если возможно индивидуальное введение ДЗБ соединения, предпочтительно его введение в виде физиологически приемлемого состава.
Следующие комментарии относятся к фармацевтическим составам, но с соответствующими изменениями могут быть применены к диагностическим составам.
Таким образом предложен фармацевтический состав (например, композиция, препарат, лекарственное средство), содержащий по меньшей мере одно ДЗБ соединение, описанное в настоящей патентной заявке, совместно с одним или более другим фармацевтически приемлемым ингредиентом, хорошо известным специалистам в данной области техники, включающим, но не ограничивающимся только ими, фармацевтически приемлемые носители, разбавители, наполнители, адъюванты, вещества-наполнители, буферы, консерванты, анти-оксиданты, смазывающие вещества, стабилизаторы, солюбилизаторы, поверхностно-активные вещества (например, увлажнители), маскирующие вещества, красители, ароматизаторы и подсластители. Состав может дополнительно содержать другие активные вещества, например, другие терапевтические или профилактические средства.
Таким образом, в настоящем изобретении дополнительно предложены фармацевтические композиции, определенные выше, и способы получения фармацевтической композиции, включающие смешение по меньшей мере одного ДЗБ соединения, описанного в настоящей патентной заявке, совместно с одним или более другим фармацевтически доступным ингредиентом, хорошо известным специалистам в данной области техники, например, носителем, разбавителем, наполнителем и т.д. В случае включения соединения в состав отдельных частиц (например, таблеток и т.д.) каждая из частиц содержит заранее определенное количество (дозировку) указанного соединения.
Термин «фармацевтически приемлемый», используемый в настоящей патентной заявке, относится к соединениям, ингредиентам, веществам, композициям, лекарственным формам и т.д., которые в рамках тщательного медицинского обследования являются подходящими для применения для взаимодействия с тканями обследуемого субъекта (например, человека), не проявляющие избыточной токсичности, раздражения, аллергической реакции или других проблем или осложнений, и сопоставимы с допустимым отношением польза/риск. Каждый из носителей, разбавителей, наполнителей и т.д., также должен быть «приемлемым» в отношении совместимости с другими ингредиентами состава.
Подходящие носители, разбавители, наполнители и т.д. можно найти в обычных фармацевтических справочниках, например, Remington's Pharmaceutical Sciences, 18th edition, Mack Publishing Company, Easton, Pa., 1990; и Handbook of Pharmaceutical Excipients, 5thedition, 2005.
Составы могут быть получены любыми способами, хорошо известными в фармацевтике. Указанные способы включают стадию приведения во взаимодействие соединения с носителем, который содержит один или более дополнительный ингредиент. Как правило, составы получают при помощи непрерывного и тщательного взаимодействия соединения с носителями (например, жидкими носителями, мелкодисперсным твердым носителем и т.д.) и последующего придания формы при необходимости.
Состав может быть получен для обеспечения быстрого или медленного высвобождения; немедленного, отсроченного, отложенного или замедленного высвобождения; или их комбинации.
Составы могут подходящим образом представлять собой жидкости, растворы (например, водные, неводные), суспензии (например, водные, неводные), эмульсии (например, масло в воде, вода в масле), эликсиры, сиропы, электуарии, жидкости для полоскания рта, капли, таблетки (включая, например, таблетки, покрытые оболочкой), гранулы, порошки, таблетки для рассасывания, пастилки, капсулы (включая, например, твердые и мягкие желатиновые капсулы), крахмальные капсулы, драже, ампулы, таблетки большого размера, суппозитории, пессарии, настойки, гели, пасты, мази, кремы, лосьоны, масла, пены, спреи, взвеси или аэрозоли.
Составы могут подходящим образом поставлены в виде пластыря, лейкопластыря, повязки или перевязки или другом виде, которые насыщены одним или более соединением и возможно один или более другим фармацевтически приемлемым ингредиентом, включающим, например, усилителем проникновения, проницаемости или абсорбции. Составы также могут быть подходящим образом поставлены в форме депо или резервуара.
Соединение может быть растворено, суспендировано или смешано с одним или более фармацевтически приемлемым ингредиентом. Соединение может присутствовать в липосоме или другой микрочастице, которая разработана для доставления соединения, например, к компонентам крови или в один или более орган.
Составы, подходящие для орального введения (например, при помощи приема внутрь) включают жидкости, растворы (например, водные, неводные), суспензии (например, водные, неводные), эмульсии (например, масло в воде, вода в масле), эликсиры, сиропы, электуарии, таблетки, гранулы, порошки, капсулы, крахмальные капсулы, драже, ампулы, таблетки большого размера.
Составы, подходящие для трансбуккального введения включают жидкости для полоскания рта, таблетки для рассасывания, пастилки, так же как и пластыри, лейкопластыри, депо и резервуары. Таблетки для рассасывания, как правило, содержит соединение в ароматизированной основе, как правило, сахарозе и камеди или трагакантовой камеди. Пастилки, как правило, содержат соединение в инертной матрице, такой как желатин и глицерин или сахароза и камедь. Жидкости для полоскания рта, как правило, содержат соединение в подходящем жидком носителе.
Составы, подходящие для подъязычного введения, включают таблетки, таблетки для рассасывания, пастилки, капсулы и драже.
Составы, подходящие для неорального трансмукозального введения, включают жидкости, растворы (например, водные, неводные), суспензии (например, водные, неводные), эмульсии (например, масло в воде, вода в масле), суппозитории, пессарии, гели, пасты, мази, кремы, лосьоны, масла, так же как и пластыри, лейкопластыри, депо и резервуары.
Химический синтез
Некоторые способы химического синтеза ДЗБ соединений настоящего изобретения описаны в настоящей патентной заявке. Указанные и/или другие хорошо известные способы могут быть модифицированы и/или адаптированы известными способами для упрощения синтеза дополнительных соединений в рамках настоящего изобретения.
Стандартные процедуры
В одном из подходов ДЗБ соединения могут быть получены согласно способу, включающему соединение соединения А с соединением В:

где -PA и -PB представляют собой реакционноспособные функциональные группы, а -Т, -Р и группы от -G1 до -G4 являются определенными в соответствии с ДЗБ соединениями настоящего изобретения и их защищенные формы.
Согласно одному варианту реализации -PA и -PB представляют собой амидные связывающие группы. Продукт реакции связывания представляет собой амидную связь, т.е. -Q- представляет собой -NHC(O)-; -NR1C(O)-; -C(O)NH- или -C(O)NR1-. Таким образом, один из -PA и -PB может представлять собой -С(O)ОН или ее активированную форму, а другая может представлять собой -NH2 или -NHR1.
Согласно одному варианту реализации -PA представляет собой -NH2 или -NHR1. Согласно одному варианту реализации, -PA представляет собой -NH2.
Согласно одному варианту реализации -PB представляет собой -С(O)ОН или -С(O)Cl.
Согласно одному варианту реализации -PA и -PB представляют собой алкеновые связывающие группы. Продукт реакции связывания представляет собой алкеновую связь, т.е. -Q- представляет собой -СН=СН-; -CR1=CH-; -CH=CR1- или -CR1=CR1-.
Согласно одному варианту реализации алкеновые связывающие группы -PA и -PB могут представлять собой связывающие группы Виттига или группы, аналогичные группам Виттига, например, связывающие группы Хорнера-Уотсфорда-Эммонса. Таким образом, один из -PA и PB может представлять собой -С(O)Н или -C(O)R1, а другой может представлять собой фосфонат.
Согласно одному варианту реализации один из -PA и -PB представляет собой -С(O)Н.
Согласно одному варианту реализации другой из -PA и -PB представляет собой -P(O)(OEt)2.
Согласно одному варианту реализации -PB представляет собой -С(O)Н.
Согласно одному варианту реализации другой из -PA представляет собой -P(O)(OEt)2.
Согласно одному варианту реализации алкеновые связывающие группы -PA и -PB могут представлять собой связывающие группы Хека или группы, аналогичные группам Хека.
Таким образом, один из -PA и -PB может представлять собой алкенил, например, Н2С=СН-, а другой может представлять собой -Cl, -Br, -I, -N2+X- (где Х представляет собой Cl или BF4) или -OTf.
А и В связываются в присутствии катализатора, как правило, палладиевого катализатора, такого как Pd или Pd(OAc)2. Также можно применять основание.
Согласно одному варианту реализации -PA и -PB представляют собой диазо-связывающие группы. Продукт реакции связывания представляет собой диазо-связь, т.е. -Q- представляет собой -N=N-.
Согласно одному варианту реализации -PA и -PB представляют собой иминовые связывающие группы. Продукт реакции связывания представляет собой иминовую связь, т.е. -Q- представляет собой -N-CH- или -CH=N-. Таким образом, один из -PA и -PB может представлять собой -NH2, а другой может представлять собой -С(=O)Н.
Получение фторированных соединений
Конкретные варианты реализации настоящего соединения относятся к ДЗБ соединениям, содержащим -F группу, в других вариантах реализации предложены ДЗБ соединения, содержащие -18F группу.
В одном из общих способов ДЗБ соединения, содержащие -F группу, могут быть получены из ДЗБ соединений, содержащих -ОН группу. -ОН группа может быть превращена в активированную уходящую группу. Активированную уходящую группу активируют для замещения -F нуклеофилом. Взаимодействие соединения, содержащую активированную группу, с источником фторидного нуклеофила приводит к получению ДЗБ соединений, содержащих -F группу. В случае если фторидный нуклеофил представляет собой -18F нуклеофил, продукт взаимодействия представляет собой ДЗБ соединение, содержащее -18F группу.
Активированная уходящая группа включает группы, аналогичные группам, таким как мезилат (-OS(O)2СН3) и тозилат (-OS(O)2PhCH3). ДЗБ соединение, содержащее -ОН группу, может взаимодействовать с мезилатгалидом или тозилатгалидом с образованием ДЗБ соединения, содержащего
Согласно одному варианту реализации -ОН группа представляет собой заместитель насыщенной алифатической алкильной группы, например, насыщенной алифатической C1-6 алкильной группы, замещенной -ОН, или группу, связывающую -ОН группу, такую как насыщенную алифатическую C1-5 алкиленовую группу, связывающую -ОН группу.
Примеры групп, подходящих для применения, включают группы, в которых -WA1 представляет собой -CH2CH2OH, один из -PA, -PB или -PC представляет собой -L1-OH, -GA или -GB представляет собой -[О-CH2CH2]n-RB2 и -RB2 представляет собой -LC-OH, -O-LC-OH или -ОН, или в которых -RB2 представляет собой -LC-OH или -O-LC-OH, в случае если указанные группы присутствуют.
В настоящем изобретении предложены способы получения ДЗБ соединений, в которых соединение А связывается с соединением В, в соответствии с вышеуказанным описанием, с образованием конечного соединения, содержащего группу -Q-. Соединение А или соединение В могут содержать -F группу. Указанная -F группа может участвовать во всех оставшихся стадиях синтеза и остаться в конечном ДЗБ продукте. Примеры соединений формулы А и В, содержащие -F группу, представлены в настоящем описании.
Примеры
Следующие примеры представлены исключительно для иллюстрации настоящего изобретения и которые не следует рассматривать, как ограничивающие рамки изобретения, описанного в настоящей патентной заявке.
Общие способы
Амидное связывание
В указанной реакции амин и хлорангидрид связываются с получением соответствующего амида, как показано ниже на схеме

где Т-, -R- и -Р определены ранее.
В стандартной реакции амин (1 экв.) взаимодействует с хлорангидридом (X экв.) в присутствии избытка основания, как правило, органического основания, такого как пиридин или диизопропилэтиламин, с получением соответствующего амидного продукта, который может быть выделен в результате обработки, включая, например, экстракцию, фильтрование, колоночную хроматографию, кристаллизацию и/или сушку. Реакцию можно проводить при повышенной температуре, например, при температуре кипения, и возможно в инертной атмосфере, например, в атмосфере аргона. Реакцию можно проводить в органическом растворителе, например, ТГФ, или можно проводить в чистом органическом основании.
Хлорангидрид может быть получен из карбоксильной кислоты и, например, тионилхлорида. В реакции амидного связывания можно применять неочищенный хлорангидрид.
В типичном примере 2-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид был получен в соответствии с нижеуказанным описанием.
2-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-13
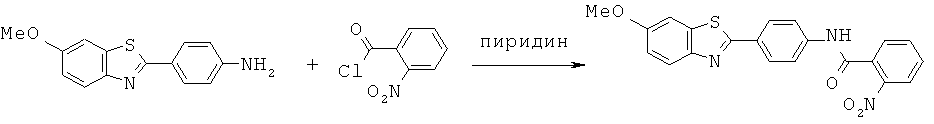
К перемешиваемому раствору 2-(4-аминофенил)-6-метоксибензотиазола (0,30 г, 1,17 ммоль) в сухом пиридине (15 мл) при комнатной температуре добавили одну порцию 2-нитробензолхлорида (0,24 г, 1,29 ммоль) в атмосфере аргона. Реакционную смесь нагревали при 90°С в течение 7 ч и при охлаждении до комнатной температуры смесь добавили в воду (150 мл). Осадок собрали при помощи фильтрования и осушили в вакууме при 50°С в течение ночи с получением титульного соединения (0,42 г, 88%) в виде бесцветного твердого вещества.
Восстановление нитрогруппы
В указанной реакции функциональную нитрогруппу превращают в соответствующую аминогруппу. Как правило, нитросоединение (1 экв.) взаимодействует с дигидратом хлорида олова (II) (8 экв.) в растворителе, например, этаноле, с получением после соответствующей обработки, соответствующего аминосоединения. Обработка может включать стадии получения свободного основания, разделения, экстракции, фильтрования, колоночной хроматографии, кристаллизации и/или сушки. Реакцию можно проводить при повышенной температуре, например, при температуре кипения, и возможно в инертной атмосфере, например, в атмосфере аргона.
В типичном примере 2-амино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид был получен в соответствии с нижеуказанным описанием.
2-амино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-99

Смесь 2-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (1,0 г, 2,47 ммоль) и дигидрата хлорида олова (II) (4,45 г, 19,74 ммоль) в EtOH (20 мл) кипятили с обратным холодильником в течение 6 часов. При охлаждении до комнатной температуры реакционную смесь ощелочили при помощи добавления насыщенного раствора NaHCO3, а затем экстрагировали EtOAc (4×50 мл). Объединенные органические экстракты промыли солевым раствором (80 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением титульного соединения (0,79 г, 85%) в виде бледно-желтых игольчатых частиц в результате перекристаллизации из EtOH.
Деметилирование
В указанной реакции функциональную метоксигруппу арильного кольца превращают в соответствующую гидроксильную группу арильного кольца. Как правило, метоксиарильное соединение (1 экв.) взаимодействует с BBr3 в растворителе, например, в ДХМ, с получением после обработки, соответствующего гидроксиарильного соединения. Обработка может включать стадии получения свободного основания, разделения, подкисления, экстракции, фильтрования, колоночной хроматограф ии, кристаллизации и/или сушки. Реакцию можно проводить при пониженной температуре, например, при температуре от 0°С до -78°С.
В типичном примере 2-амино-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид получают в соответствии с нижеуказанным описанием.
4-амино-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-57

К перемешиваемой суспензии 4-амино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (50 мг, 0,13 ммоль) в сухом ДХМ (3 мл) при комнатной температуре по каплям добавили BBr3 (1,0 М раствор в ДХМ, 0,67 мл, 0,67 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов. Реакцию погасили при помощи добавления МеОН по каплям, и реакционную смесь поместили в раствор аммиака (25 мл), водную фазу отделили, нейтрализовали при помощи добавления 1М HCl и экстрагировали EtOAc (4×60 мл). Объединенные органические экстракты осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением твердого вещества, которое очистили при помощи флэш-хроматографии (1:1 гексан/EtOAc, затем EtOAc) с получением титульного соединения (27 мг, 56%) в виде коричневого твердого вещества.
Получение алкена
В указанной реакции фосфонат и альдегид взаимодействуют в присутствии основания с получением алкенового продукта, например, как показано на нижеуказанной схеме

где Т-, -R- и -Р описаны ранее.
В типичной реакции фосфонат (1 экв.) взаимодействует с альдегидом (1 экв.) в присутствии основания (2 экв.), например, метоксида натрия, гидрида натрия или т-бутоксида калия, в органическом растворителе, например, МеОН или ТГФ, с получением соответствующего алкенового продукта, который может быть выделен после обработки, включающей, например, подкисление, экстракцию, фильтрование, колоночную хроматографию, кристаллизацию и/или сушку. Реакцию можно проводить при пониженной температуре, например, при температуре от 0°С до -78°С или при повышенной температуре, например, при температуре кипения.
В типичном примере 2-{4-[2-(нитрофенил)винил]фенил}-6-метоксибензотиазол получили в соответствии с нижеуказанным описанием.
2-{4-[2-(нитрофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT01-71
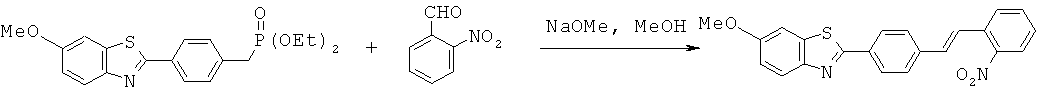
К перемешиваемому раствору диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,10 г, 0,25 ммоль) и 2-нитробензальдегида (0,39 г, 0,25 ммоль) в сухом МеОН (10 мл) при 0°С по каплям добавили раствор 0,5М метоксида натрия (1,02 мл, 0,51 ммоль). Затем реакционную смесь оставили нагреваться до комнатной температуры и кипятили с обратным холодильником в течение 18 часов. Реакционную смесь охладили до комнатной температуры и добавили воду (30 мл) с последующим добавлением 1М HCl для достижения кислотности реакционной смеси. Затем реакционную смесь экстрагировали ДХМ (3×80 мл) и объединенные органические экстракты промыли солевым раствором (50 мл), и осушили (Na2SO4). Удалили растворитель при пониженном давлении с получением твердого вещества, которое очистили при помощи флэш-хроматографии (ДХМ) с получением титульного соединения (0,043 г, 43%) в виде желтого твердого вещества.
Аминирование
В указанной реакции первичный амин превращают в третичный амин. В типичной реакции первичный амин (1 экв.) взаимодействует с альдегидом (10 экв.), например, параформальдегидом, в присутствии восстановителя, например, цианоборгидрида натрия (5 экв.) с получением соответствующего продукта третичного амина, который может быть выделен после обработки, включающей, например, получения свободного основания, экстракцию, фильтрование, колоночную хроматографию, кристаллизацию и/или сушку. Реакцию можно проводить в органическом растворителе, таком как АсОН.
В типичном примере, 2-диметиламино-N-(6-метоксибензотиазол-2-ил)фенил]бензамид получили в соответствии с нижеуказанным описанием.
2-диметиламино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-103

Одну порцию цианоборгидрида натрия (84 мг, 1,33 ммоль) добавили к перемешиваемой смеси 2-амино-N-[4-(б-метоксибензотиазол-2-ил)фенил]бензамида (100 мг, 0,266 ммоль) и параформальдегида (80 мг, 2,66 ммоль) в АсОН (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, а затем добавили в воду (30 мл) и довели до щелочной среды (рН 8-9) при помощи добавления бикарбоната натрия. Смесь экстрагировали ДХМ (3×30 мл) и объединенные органические экстракты промыли солевым раствором (25 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением желтого остатке, который очистили при помощи флэш-хроматографии (2:1 гексан/EtOAc) с получением титульного соединения (63 мг, 59%) в виде бесцветного твердого вещества.
Получение тиоамида
В указанной реакции амид превращают в тиоамид. В типичной реакции амид (1 экв.) растворяют в нагретом толуоле (сухой, 40 об.) и добавляют реагент Лоуссона (1,5 экв.). Реакционную смесь нагревают до 80°С в атмосфера азота в течение 2 часов. Реакционную смесь затем охлаждают до комнатной температуры и фильтруют. Полученный осадок промывают EtOAc, затем сушат при пониженном давлении с получением соответствующего неочищенного тиоамидного продукта. Для получения чистого целевого вещества проводят колоночную хроматографию.
Получение бензотиазола с применением феррицианида калия
В указанной реакции тиобензамид превращают в бензотиазол в присутствии феррицианида калия. В типичной реакции тиобензамид (1 экв.) растворяют в NaOH (1,5M, 39 экв.) и раствор охлаждают до 5°С при помощи льда. Добавляют феррицианат калия в воде (20%, 15 об.) и реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Смесь фильтруют, и твердое вещество промывают H2O- Твердое вещество растворяют в ДХМ (20 об.), сушат (Na2SO4) и удаляют растворитель при пониженном давлении с получением неочищенного продукта бензотиазола. Для получения чистого целевого вещества можно применить колоночную хроматографию.
Диазосвязывание
В указанной реакции ариламин и арен, например, фенол, связываются посредством образования диазосвязи. В типичной реакции ариламин (1 экв.) растворяют в МеОН (10 об.) и раствор охлаждают до 5°С при помощи льда. Затем к раствору добавляют HCl (3 экв., 2М). По каплям добавляют NaNO2 в H2O (10 об.). Реакционную смесь перемешивают при 5°С в течение 10 минут. В отдельной колбе арен (1 экв.) добавляют к H2O (20 об.). Добавляют Na2CO3 (2 экв.), а затем NaOH (1 экв.) и полученную суспензию по каплям добавляют к соли диазония. Реакционную смесь перемешивают в течение 30 минут перед экстракцией EtOAc (3×20 об.). Объединенные органические слои промывают H2O (10 об.), солевым раствором (10 об.) и сушат (Na2SO4). Удаляют растворитель при пониженном давлении с получением неочищенного целевого вещества, которое может быть очищено при помощи колоночной хроматографии.
Соединения, в которых -Q- представляет собой -NHC(O)-; -NR1C(O)-; -C(O)NH; или -C(O)NR1-
Промежуточные соединения 5-метокси-2-аминобензотиол

Смесь 2-амино-6-метоксибензотиазола (15 г, 83,2 ммоль), этиленгликоля (20,23 г, 0,33 моль) и 50% масс./об. КОН (100 мл) кипятили с обратным холодильником в течение 24 часов. При охлаждении до комнатной температуры добавили толуол (60 мл) и реакционную смесь охладили в ледяной бане и подкислили уксусной кислотой (конечный рН 5-6). Реакционную смесь экстрагировали толуолом (5×300 мл) и объединенные органические слои промыли солевым раствором (2×200 мл), осушили (MgSO4) и удалили растворитель при пониженном давлении с получением титульного соединения (11,1 г, 86%) в виде желтого твердого вещества, которое применяли без дополнительной очистки.
1H ЯМР (250 МГц, CDCl3/ДМСО-d6) δ 3,21 (s, 3Н), 6,13 (d, J=8,8 Гц, 1H), 6,30 (d, J=8,8 Гц, 1H), 6,39 (s, 1H);13С ЯМР (62,5 МГц, CDCl3) δ 55,87, 113,61, 115,41, 116,47, 119,00, 140,58, 152,52.
Экспериментальные данные согласуются с данными, полученными ранее Матисом с соавторами (Mathis et al.) и Хогвицем с соавторами (Haugwitz et al.).
2-(4-нитрофенил)-6-метоксибензотиазол

Смесь 2-амино-5-метоксибензотиола (5,0 г, 32,2 ммоль) и 4-нитробензоилхлорида (6,0 г, 32,2 ммоль) в толуоле (250 мл) кипятили с обратным холодильником с каталитическим количеством 4-толуолсульфоновой кислоты в насадке Дина-Старка в течение 6 часов. После охлаждения до комнатной температуры осадок собрали при помощи фильтрования, промыли толуолом и перекристаллизовали из АсОН с получением титульного соединения (7,0 г, 76%) в виде светло-желтого твердого вещества.
1Н ЯМР (400МГц, CDCl3) δ 3.88 (s, 3Н), 7.11 (dd, J=8.9, 2.4 Гц, 1H), 7.34 (d, J=2.4 Гц, 1Н), 7.96 (d, J=8.9 Гц, 1H), 8.16 (d, J=Г8.9 Гц, 2Н), 8.29 (d, J=8.9 Гц, 2Н);13С ЯМР (100 МГц, CDCl3) δ 55.88, 104.00, 116.64, 124.32, 124.51, 127.83, 137.09, 139.39, 148.69, 148.73, 158.58, 162.19.
Экспериментальные данные согласуются с данными, полученными ранее Касиямой с соавторами (Kashiyama et al.) и Ши с соавторами (Shi et al.).
2-(4-нитрофенил-2-трифторметил)-6-метоксибензотиазол
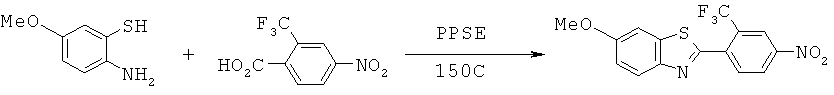
Тщательно перемешанную пасту 2-амино-5-метоксибензотиола (1,0 г, 6,44 ммоль) и 4-нитро-2-трифторметилбензойной кислоты (1,51 г, 6,44 ммоль) в триметилсилилполифосфате (PPSE) (5 мл) нагревали при перемешивании при 150°С в атмосфере аргона в течение 3 часов. После охлаждения до комнатной температуры реакционная смесь представляла собой твердую массу, которую растворили в ДХМ и адсорбировали на оксид кремния и очистили в небольшой колонке, наполненной оксидом кремния (1:1 гексан/EtOAc). Первые элюируемые фракции собрали и удалили растворитель при пониженном давлении с получением оранжевого твердого вещества (1,5 г), которое дополнительно очистили при помощи флэш-хроматографии (3:1 гексан/EtOAc) с получением титульного соединения (0,85 г, 37%) в виде желтого твердого вещества.
PPSE был получен из коммерческих источников. Как альтернатива, PPSE может быть получен в соответствии со способами, описанными в работе Имамото с соавторами (Imamoto et al.).
1Н ЯМР (400 МГц, CDCl3) 5 3.88 (s, 3Н), 7.14 (dd, J=8.9, 2.4 Гц, 1Н), 7.36 (d, J=2.7 Гц, 1Н), 7.94 (d, J=8.5 Гц, 1Н), 8.01 (d, J=8.9 Гц, 1Н), 8.46 (dd, J=8.5, 2.0 Гц, 1Н), 8.67 (d, J=2.4 Гц, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 55.93, 103.50, 116.75, 122.41 (q, JCF=274 Гц), 122.63 (q, JCF=5.9 Гц), 124.81, 126.39, 130.61 (q, JCF=33 Гц), 133.98, 137.85, 138.95, 148.06, 158.59, 158.87.
2-(4-нитрофенил-3-трифторметил)-6-метоксибензотиазол

Тщательно перемешанную кашицу 2-амино-5-метоксибензотиола (2,0 г, 12,88 ммоль) и 4-нитро-3-трифторметилбензойной кислоты (3,03 г, 12,88 ммоль) в триметилсилилполифосфате (10 мл) нагревали при перемешивании при 150°С в атмосфере аргона в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь растворили в ДХМ (100 мл) и промыли 1М HCl (2×50 мл), насыщенным NaHCO3 (2×50 мл), солевым раствором (80 мл) и осушили (Na2SO4). Удалили растворитель при пониженном давлении с получением коричневого твердого вещества, которое очистили при помощи флэш-хроматографии (2:1 гексан/EtOAc) с получением титульного соединения (2,36 г, 52%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 3.90 (s, 3Н), 7.14 (dd, J=9.1, 2.4 Гц, 1Н), 7.34 (d, J=2.1 Гц, 1Н), 7.95 (d, J=8.5 Гц, 1Н), 7.97 (d, J=8.8 Гц, 1Н), 8.24 (d. J=8.5 Гц, 1Н), 8.47 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 55.88, 103.95, 116.95, 121.75 (q, JCF=274 Гц), 124.68, 124.75 (q, JCF=35 Гц), 126.00, 126.30, 130.83, 137.10, 137.97, 148.17, 148.55, 158.84, 160.38.
2-(2-метокси-4-нитрофенил)-6-метоксибензотиазол

Тщательно перемешанную пасту 2-амино-5-метоксибензотиола (2,0 г, 12,88 ммоль) и 2-метокси-4-нитробензойной кислоты (2,54 г, 12,88 ммоль) в триметилсилилполифосфате (10 мл) нагревали при перемешивании при 150°С в атмосфере аргона в течение 30 минут. После охлаждения до комнатной температуры реакционную смесь суспендировали в ДХМ/МеОН и при помощи фильтрования собрали оранжевое твердое вещество. Фильтрат промыли 1М HCl (2×50 мл), насыщенным NaHCO3 (2×50 мл), солевым раствором (70 мл) и осушили (Na2SO4). Растворитель удалили при пониженном давлении с получением твердого вещества, которое объединили с собранным ранее твердым веществом и перекристаллизовали из АсОН с получением титульного соединения (3,43 г, 83%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 3.90 (s, 3Н), 4.15 (s, 3H), 7.13 (dd, J=9.1, 2.1 Гц, 1Н), 7.36 (d, J=2.1 Гц, 1Н), 7.89 (s, 1Н), 7.97 (m, 2H), 8.66 (d, J=8.5 Гц, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 55.84, 56.38, 103.24, 106.87, 116.22, 116.45, 124.09, 128.27, 129.79, 138.00, 146.84, 149.09, 156.71, 157.97, 158.13.
2-(3-метокси-4-нитрофенил)-6-метоксибензотиазол

Тщательно перемешанную пасту 2-амино-5-метоксибензотиола (2,0 г, 12,88 ммоль) и 3-метокси-4-нитробензойной кислоты (2,54 г, 12,88 ммоль) в триметилсилилполифосфате (10 мл) нагревали при перемешивании при 150°С в атмосфере аргона в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь суспендировали в ДХМ (300 мл) и адсорбировали в оксиде кремния для флэш-хроматографии и первично очистили с применением колонки оксида кремния для флэш-хроматографии с элюированием ДХМ, а затем ДХМ/EtOAc (6:1). Дополнительная очистка собранных фракций при помощи флэш-хроматографии (20:1 ДХМ/гексан) привела к получению титульного соединения (1,32 г, 32%) в виде желтого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ 3.88 (s, 3Н), 4.07 (s, 3Н), 7.10 (dd, J=8.9, 2.4 Гц, 1Н), 7.34 (d, J=2.4 Гц, 1Н), 7.54 (dd, J=8.5, 1.7 Гц, 1Н), 7.84 (d, 1Н, J=1.7 Гц, 1Н), 7.92 (d, J=8.5 Гц, 1Н), 7.95 (d, J=8.5 Гц, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 55.88, 56.86, 104.02, 111.50, 116.56, 119.08, 124.37, 126.56, 137.01. 139.15, 140.24, 148.58, 153.50, 158.51, 162.44.
2-(2-метокси-4-нитрофенил)бензотиазол

Тщательно перемешанную кашицу 2-аминобензотиола (0,63 г, 5,07 ммоль) и 2-метокси-4-нитробензойной кислоты (1,0 г, 5,07 ммоль) в триметилсилилполифосфате (5 мл) нагревали при перемешивании при 150°С в атмосфере аргона в течение 1,5 часов. После охлаждения до комнатной температуры реакционная смесь представляла собой твердую массу, к которой добавили ДХМ (35 мл) и Et2O (50 мл). Твердое вещество измельчили и собрали при помощи фильтрования, затем перекристаллизовали из АсОН и осушали в глубоком вакууме в течение 18 часов с получением титульного соединения (0,90 г, 62%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 4.16 (s, 3H), 7.40-7.46 (m, 1Н), 7.51-7.56 (m, 1Н), 7.91 (s, 1Н), 7.93-8.05 (m, 2H), 8.12 (d, J=7.9 Гц, 1Н), 8.72 (d, J=8.5 Гц, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 56.39, 106.84, 116.11, 121.42, 123.42, 125.61, 126.49, 127.93, 130.21, 136.37, 149.40, 152.05, 157.04, 160.45.
2-(4-амино-2-метоксифенил)бензотиазол

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 2-(2-метокси-4-нитрофенил)бензотиазола (0,1 г, 0,35 ммоль) и дигидрата хлорида олова (II) (0,63 г, 2,8 ммоль) в EtOH (12 мл) с получением титульного соединения (0,086 г, 96%) в виде светло-оранжевого твердого вещества после обработки и флэш-хроматографии (2:1 гексан/ТГФ).
1Н ЯМР (250 МГц, CDCl3) δ 3.99 (br s, 5H), 6.30 (d, J=1.5 Гц, 1Н), 6.41 (dd, J=8.5, 1.5 Гц, 1Н), 7.25-7.32 (m, 1Н), 7.39-7.46 (m, 1Н), 7.85 (d, J=7.9 Гц, 1Н), 7.99 (d, J=7.9 Гц, 1Н), 8.31 (d,J=8.5 Гц, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 55.51, 97.48, 107.97, 113.01, 121.06, 121.98, 123.83, 125.69, 130.95, 135.49, 150.42, 152.21, 158.90, 163.89
2-(2-гидрокси-4-нитрофенил)бензотиазол

Получен в соответствии с описанием вышеприведенного раздела Демвтилирование с применением 2-(2-метокси-4-нитрофенил)бензотиазола (0,5 г, 1,75 ммоль) в сухом ДХМ (30 мл) с добавленным по каплям ВВгз (1,0М раствор в ДХМ, 8,8 мл, 8,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь погасили при помощи добавления МеОН (5 мл) и экстрагировали 8% масс./об. NaOH (5×35 мл). Объединенные водные экстракты подкислили 6М HCl и экстрагировали EtOAc (3×70 мл). Объединенные органические экстракты промыли солевым раствором (40 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением твердого вещества, которое очистили при помощи флэш-хроматографии (1:1 гексан/EtOAc) с получением титульного соединения (0,47 г, 99%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (1:1 гексан/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 7.49-7.53 (m, 1Н), 7.55-7.61 (m, 1H), 7.78-7.95 (m, 2H), 7.95-7.98 (m, 2H), 8.06 (d, J=7.9 Гц, 1H), 12.95 (s, 1H);13C ЯМР (62.5 МГц, CDCl3) δ 113.24, 114.14, 121.78, 122.79, 126.65, 127.34, 129.03, 132.99, 149.79, 151.40, 158.28, 166.88 (1 отсутствует).
2-[2-(1,3-бензотиазол-2-ил)-5-нитрофенокси]-N,N-диметилэтанамин

N,N-диметилэтаноламин К перемешиваемой смеси 2-(2-гидрокси-4-нитрофенил)бензотиазола (0,15 г, 0,55 ммоль), трифенилфосфина (0,216 г, 0,825 ммоль) и N,N-диметилэтаноламина (0,059 г, 0,66 ммоль) в сухом ТГФ (10 мл) при 0°С по каплям добавили DIAD (0,167 г, 0,825 ммоль). Реакционную смесь перемешивали при 0°C в течение 0,5 часов, затем оставили нагреваться до комнатной температуры в течение ночи. Растворитель удалили при пониженном давлении и остаток очистили при помощи флэш-хроматографии (20:1 ДХМ/МеОН) с получением титульного соединения (0,089 г, 47%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 2.41 (s, 6H), 2.98-3.03 (m, 2H), 4.36-4.40 (m, 2H), 7.39-7.45 (m, 1H), 7.49-7.55 (m, 1H), 7.89-7.96 (m, 3Н), 8.10 (d, J=7.6 Гц, 1H), 8.71 (d, J=8.5 Гц, 1H);13С ЯМР (62.5 МГц, CDCl3) δ 46.18, 57.93, 68.47, 107.63, 116.11, 121.42, 123.42, 125.60, 126.48, 128.05, 130.30, 136.36, 149.34, 151.99, 156.37, 160.47.
Применявшиеся условия проведения реакции основаны на способах, описанных в работах Маламаса с соавторами (Malamas et al.) и Манна с соавторами (Mann et al.) для реакции 4-гидроксибензальдегидов с алифатическими спиртами.
2-[2-{2-(2-(2-метоксиэтокси)этокси)этокси}-4-нитрофенил]-1,3-бензотиазол

К перемешиваемой смеси 2-(2-гидрокси-4-нитрофенил)бензотиазола (0,15 г, 0,55 ммоль), трифенилфосфина (0,216 г, 0,825 ммоль) и монометилового эфира триэтиленгликоля (0,108 г, 0,66 ммоль) в сухом ТГФ (10 мл) при 0°С добавили по каплям DIAD (0,167 г, 0,825 ммоль). Реакционную смесь перемешивали при 0°С в течение 0,5 часов, затем оставили нагреваться до комнатной температуры на ночь. Растворитель удалили при пониженном давлении и остаток очистили при помощи флэш-хроматографии (1:1 гексан/EtOAc) с получением титульного соединения (0,176 г, 76%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 3.32 (s, 3Н), 3.47-3.52 (m, 2H), 3.61-3.67 (m, 2H), 3.68-3.75 (m, 2H), 3.76-3.84 (m, 2H), 4.06-4.10 (m, 2H), 4.44 -4.48 (m, 2H), 7.39-7.45 (m, 1H), 7.49-7.55 (m, 1H), 7.92-7.96 (m, 3Н), 8.10 (d, J=7.9 Гц, 1H), 8.71 (d, J=8.5 Гц, 1H);13С ЯМР (62.5 МГц, CDCl3) δ 59.05, 69.34 (2×С), 70.68, 70.79, 70.99, 71.94, 107.91, 116.19, 121.44, 123.41, 125.58, 126.45, 128.11, 130.22, 136.48, 149.31, 152.02, 156.39, 160.56.
Применявшиеся условия проведения реакции основаны на способах, описанных Жангом с соавторами (Zhang et al.) для реакции полиэтиленгликолей с фенольными соединениями.
2-(4-аминофенил)-6-метоксибензотиазол

Получен в соответствии с описанием раздела Восстановление Нитрогруппы с применением 2-(4-нитрофенил)-6-метоксибензотиазола (5,0 г, 17,5 ммоль) и дигидрата хлорида олова (II) (31,5 г, 0,14 моль) в EtOH (150 мл) с получением титульного соединения (4,2 г, 93%) в виде бесцветного твердого вещества после обработки и перекристаллизации из EtOH.
1Н ЯМР (250 МГц, CDCl3) δ 3.86 (s, 3H), 3.96 (s, 2H), 6.71 (d, J=8.5 Гц, 2Н), 7.04 (dd, J=8.5, 2.4 Гц, 1Н), 7.31 (d, J=2.4 Гц, 1Н), 7.83 (d, J=8.5 Гц, 2H), 7.87 (d, J=8.5 Гц, 2H);13C ЯМР (62.5 МГц, CDCl3) δ 55.82, 104.34, 114.84, 115.10, 123.00, 124.20, 128.81, 135.92, 148.84, 148.87, 157.29, 166.15. Экспериментальные данные согласовались с данными, полученными ранее Матисом с соавторами (Mathis et al.) и Ши с соавторами (Shi et al.).
2-(4-амино-2-трифторметилфенил)-6-метоксибензотиазол

Получен в соответствии с описанием раздела Восстановление Нитрогруппы с применением 2-(4-нитро-2-трифторметилфенил)-6-метоксибензотиазола (0,6 г, 1,69 ммоль) и дигидрата хлорида олова (II) (3,06 г, 13,56 ммоль) в ЕЮН (35 мл) с получением титульного соединения (0,51 г, 93%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (30:1 ДХМ/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 3.88 (s, 3H), 4.08 (br s,2H), 6.83 (d, J=8.2 Гц, 1Н), 7.04 (s, 1Н), 7.10 (dd, J=8.8, 2.4 Гц, 1Н), 7.34 (d, J=2.4 Гц, 1Н), 7.48 (d, J=8.2 Гц, 1Н), 7.96 (d, J=8.8 Гц, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 55.85, 103.69, 112.69 (q, JCF=4.9 Гц), 115.61, 116.78, 122.01, 123.59 (q, JCF=274 Гц), 124.00, 130.00 (q, JCF=31 Гц), 133.73, 137.55, 147.89, 148.02, 157.75, 162.86.
2-(4-амино-3-трифторметилфенил)-6-метоксибензотиазол
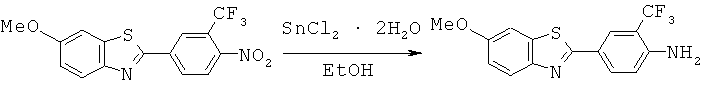
Получен в соответствии с описанием раздела Восстановление Нитрогруппы с применением 2-(4-нитро-3-трифторметилфенил)-6-метоксибензотиазола (1,0 г, 2,82 ммоль) и дигидрата хлорида олова (II) (5,1 г, 22,6 ммоль) в EtOH (50 мл) с получением титульного соединения (0,84 г, 91%) в виде светло-оранжевого твердого вещества после обработки и флэш-хроматографии (2:1 гексан/EtOAc).
1Н ЯМР (400 МГц, CDCl3) δ 3.84 (s, 3Н), 4.44 (br s, 2H), 6.76 (d, J=8.4 Гц, 1Н), 7.03 (dd, J=8.8, 2.4 Гц, 1Н), 7.28 (d, J=2.4 Гц, 1Н), 7.85 (d, J=8.8 Гц, 1Н), 7.91 (dd, J=8.4, 2.0 Гц, 1Н), 8.07 (d, J=2.0 Гц, 1Н);13С ЯИР (62.5 МГц, CDCl3) δ 55.84, 104.26, 113.70 (q, JCF=30.3 Гц), 115.54, 117.26, 123.22, 123.41, 124.55 (q, JCF=272 Гц), 125.99 (q, JCF=3.9 Гц), 131.71, 135.88, 146.33, 148.44, 157.60, 164.59.
2-(4-амино-2-метоксифенил)-6-метоксибензотиазол

Получен в соответствии с описанием раздела Восстановление Нитрогруппы с применением 2-(2-метокси-4-нитрофенил)-6-метоксибензотиазола (1,0 г, 3,13 ммоль) и дигидрата хлорида олова (II) (5,66 г, 25,08 ммоль) в EtOH (50 мл) с получением титульного соединения (0,79 г, 89%) в виде светло-желтого твердого вещества после очистки и перекристаллизации из EtOH.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.76 (s, 3Н), 3.87 (s, 3Н), 5.82, (br s, 2H), 6.27 (dd, J=8.5, 1.7 Гц, 1Н), 6.29 (d, J=1.7 Гц, 1Н), 6.98 (dd, J=8.9, 2.4 Гц, 1Н), 7.50 (d, J=2.4 Гц, 1Н), 7.71 (d, J=8.9 Гц, 1Н), 7.99 (d, J=8.5 Гц, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 56.01, 56.24, 96.71, 104.78, 107.72, 110.09, 115.43, 122.43, 130.18, 136.59, 147.01, 153.53, 156.85, 158.99, 161.62.
2-(4-амино-3-метоксифенил)-6-метоксибензотиазол

Получен в соответствии с описанием раздела Восстановление Нитрогруппы с применением 2-(3-метокси-4-нитрофенил)-6-метоксибензотиазола (0,5 г, 1,56 ммоль) и дигидрата хлорида олова (II) (2,61 г, 11,58 ммоль) в EtOH (35 мл) с получением титульного соединения (0,41 г, 91%) в виде светло-оранжевого твердого вещества после обработки и флэш-хроматографии (2:1 гексан/ТГФ).
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.87 (s, 3Н), 3.97 (s, 3Н), 4.12 (br s, 2H), 6.72 (d, J=7.9 Гц, 1Н), 7.04 (dd, J=8.8, 2.4 Гц, 1Н), 7.31 (d, J=2.4 Гц, 1Н), 7.40 (dd, J=7.9, 1.2, Гц 1Н), 7.56 (d, J=1.2 Гц, 1Н), 7.87 (d, J=8.8 Гц, 1Н);13С NMR (62.5 МГц, CDCl3) δ 55.74, 55.81, 104.33, 108.55, 114.06, 115.09, 121.48, 122.93, 124.12, 135.95, 139.17, 147.12, 148.76, 157.27, 166.46.
4-(1,3-бензотиазол-2-ил)-3-[2-(диметиламино)этокси]анилин

Получен в соответствии с описанием раздела Восстановление Нитрогруппы с применением 2-[2-(1,3-бензотиазол-2-ил)-5-нитрофенокси]-N,N-диметилэтанамина (0,073 г, 0,21 ммоль) и дигидрата хлорида олова (II) (0,38 г, 1,7 ммоль) в EtOH (7 мл) с получением титульного соединения (0,05 г, 75%) в виде твердого вещества кремового цвета после обработки и флэш-хроматографии (МеОН).
1H ЯМР (400 МГц, CDCl3) δ 2.36 (s, 6Н), 2.94 (t, J=6.5 Гц, 2H), 3.98 (br s, 2H), 4.21 (t, J=6.5 Гц, 2H), 6.25 (d, J=2.4 Гц, 1H), 6.37 (dd, J=8.5, 2.4 Гц, 1Н), 7.24-7.28 (m, 1H), 7.37-7.41 (s, 1H), 7.84 (d, J=8.2 Гц, 1H), 7.95 (d, J=8.2 Гц, 1H), 8.29 (d, J=8.5 Гц, 1H);13С ЯМР (62.5 МГц, CDCl3) δ 46.15, 58.05, 67.52, 98.25, 108.03, 113.26, 120.95, 121.93, 123.72, 125.59, 130.97, 135.46, 150.21, 152.18, 158.04, 163.74.
4-(1,3-бензотиазол-2-ил)-3-[2-{2-(2-метоксиэтокси)этокси}этокси]анилин

Получен в соответствии с описанием раздела Восстановление Нитрогруппы с применением 2-[2-{2-(2-(2-метоксиэтокси)этокси)этокси}-4-нитрофенил]-1,3-бензотиазола (0,15 г, 0,36 ммоль) и дигидрата хлорида олова (II) (0,65 г, 2,87 ммоль) в EtOH (12 мл) с получением титульного соединения (0,13 г, 92%) в виде вязкой желтой маслянистой жидкости после обработки и флэш-хроматографии (EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 3.30 (s, 3Н), 3.47-3.49 (m, 2H), 3.59-3.62 (m, 2H), 3.62-3.65 (m, 2H), 3.73-3.75 (m, 2H), 3.95-3.97 (m, 2H), 4.10-4.28 (m, 4H), 6.19 (s, 1H), 6.33 (d, J=8.5 Гц, 1H), 7.23-7.29 (m, 1H), 7.37-7.43 (m, 1H), 7.84 (d, J=7.9 Гц, 1H), 7.96 (d, J=7.9 Гц, 1H), 8.27 (d, J=8.5 Гц, 1H);13С ЯМР (62.5 МГц, CDCb) δ 58.99, 68.23, 69.55, 70.54, 70.69, 70.80, 71.89, 98.26, 108.15, 112.79, 121.05, 121.89, 123.73, 125.66, 130.81, 135.55, 150.75, 152.11, 158.09, 164.03.
2-метокси-5-(трифторметокси)бензойная кислота

К перемешиваемому раствору 2-метокси-5-трифторметоксибензальдегида (2,0 г, 9,09 ммоль) и 50% КОН (4,1 мл) в МеОН (15 мл) при 65°С по каплям добавили пероксид водорода (30%, 7,4 мл) в течение 20 минут. Реакционную смесь перемешивали при 65°С в течение 10 минут, охладили до комнатной температуры, подкислили 1М HCl и экстрагировали Et2O (3×40 мл). Объединенные органические экстракты промыли солевым раствором (35 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением светло-желтой вязкой маслянистой жидкости, которую оставили отверждаться при комнатной температуре на ночь с получением титульного соединения (1,95 г, 91%) в виде светло-желтого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 4.07 (s, 3Н), 7.07 (d, J=9.2 Гц, 1Н), 7.41 (dd, J=9.2, 2.1 Гц, 1Н), 7.99 (d, J=2.1 Гц, 1Н), 8.80-11.0 (vbr s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 57.22, 113.13, 118.95, 120.41 (q, jcf=258 Гц), 126.20, 127.83, 143.22, 156.68, 164.82.
Окисление ароматических альдегидов до ароматических кислот описано в работе Конга с соавторами (Cong et al.).
4-(2,2,2-трифторэтокси)бензальдегид

К перемешиваемой суспензии гидрида натрия (60% дисперсия в минеральном масле, 0,87 г, 21,8 ммоль) в ДМСО (20 мл) при 10-15°С в атмосфере аргона добавили трифторэтанол (3,97 г, 39,7 ммоль). Реакционную смесь перемешивали при указанной температуре в течение 20 минут, затем добавили одну порцию 4-нитробензальдегида (3,0 г, 19,85 ммоль). Реакционную смесь перемешивали при 10-15°С в течение 3 часов, а затем при комнатной температуре в течение 60 часов. Осторожно добавили к смеси солевой раствор (100 мл), а затем экстрагировали Et2O (3×70 мл). Объединенные органические экстракты промыли водой, осушили (MgSO4) и удалили растворитель при пониженном давлении с получением маслянистой жидкости, которую очистили при помощи флэш-хроматографии (3:1 гексан/EtOAc) с получением желтой маслянистой жидкости, которую оставили отверждаться при комнатной температуре с получением титульного соединения (1,76 г, 43%) в виде желтого твердого вещества.
1H ЯМР (250 МГц, CDCl3) δ 4.42 (q, J=7.9 Гц, 2Н), 7.04 (d, J=8.5 Гц, 2Н), 7.85 (d, J=8.5 Гц, 2H);13С ЯМР (62.5 МГц, CDCl3) δ 65.5 (q, JCF=36 Гц), 115.02, 123.02 (q, JCF=277 Гц), 131.34, 132.01, 161.82, 190.62.
Экспериментальные данные соответствовали данным, полученным ранее Иду с соавторами (Idaux et al.) (1983) и Иду с соавторами (Idaux et al.) (1985).
4-(2,2,2-трифторэтокси)бензойная кислота

К перемешиваемому раствору 50% масс./об. КОН (1,2 мл) и 4-(2,2,2-трифторэтокси)бензальдегида (0,6 г, 2,94 ммоль) в МеОН (5 мл) при 65°С по каплям добавили водный раствор пероксида водорода (30% масс. в воде, 2,4 мл) в течение 20 минут. После завершения добавления реакционную смесь дополнительно нагревали до 65°С в течение 10 минут. После охлаждения до комнатной температуры реакционную смесь подкислили 1М HCl и экстрагировали Et2O (3×30 мл). Объединенные органические экстракты промыли солевым раствором (20 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением титульного соединения (0,59 г, 91%) в виде светло-желтого твердого вещества, которое применяли без дополнительной очистки.
1Н ЯМР (250 МГц, ацетон-d6) δ 4.80 (q, J=7.9 Гц, 2Н), 7.18 (d, J=8.5 Гц, 2Н), 8.05 (d, J=8.5 Гц, 2Н);13С ЯМР (62.5 МГц, ацетон-d6) δ 66.34 (q, JCF=35 Гц), 115.36, 124.72 (q, JCF=277 Гц), 125.31, 132.78, 161.79, 167.00.
Применявшиеся условия проведения реакции основаны на способах, описанных в работе Конга с соавторами (Cong et al.).
4-(3,3,3-трифторпропокси)бензальдегид

К перемешиваемому раствору 4-гидроксибензальдегида (0,36 г, 2,93 ммоль), 3,3,3-трифторпропанола (0,5 г, 4,39 ммоль) и трифенилфосфина (1,15 г, 4,39 ммоль) в сухом ТГФ при 0°С в атмосфере аргона по каплям добавили диизопропилазодикарбоксилат (0,89 г, 4,39 ммоль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 60 часов. Удалили растворитель при пониженном давлении и остаток очистили при помощи флэш-хроматографии (4:1 гексан/EtOAc) с получением титульного соединения (0,25 г, 46%) в виде бесцветного твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 2.57-2.75 (m, 2H), 4.27 (t, J=6.4 Гц, 2Н), 6.99 (d, J=8.5 Гц, 2Н), 7.84 (d, J=8.5 Гц, 2Н), 9.89 (s, 1H);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 33.82 (q, JCF=28.3 Гц), 60.87, 113.87, 123.91, 125.79 (q, JCF=276 Гц), 131.78, 161.50, 168.12.
Применявшиеся условия проведения реакции основаны на способах, описанных в работах Маламаса с соавторами (Malamas et al.) и Манна с соавторами (Mann et al.).
4-(3,3,3-трифторпропокси)бензойная кислота

К перемешиваемому раствору 50% масс./об. КОН (0,8 мл) и 4-(3,3,3-трифторэтокси)бензальдегида (0,4 г, 1,83 ммоль) в МеОН (4 мл) при 65°С по каплям добавили водный раствор пероксида водорода (30% масс. в воде, 1,5 мл) в течение 20 минут. После завершения добавления реакционную смесь дополнительно нагревали до 65°С в течение 10 минут. После охлаждения до комнатной температуры реакционную смесь подкислили 1М HCl и экстрагировали Et2O (3×25 мл). Объединенные органические экстракты промыли солевым раствором (25 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением титульного соединения (0,36 г, 83%) в виде бесцветного твердого вещества, которое применяли без дополнительной очистки.
1Н ЯМР (250 МГц, CDCl3/ДМСО-d6) δ 2.42-2.60 (m, 2Н), 4.10 (t, J=6.4 Гц, 2Н), 6.76 (d, J=8.8 Гц, 2Н), 7.85 (d, J=8.8 Гц, 2Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 33.71 (q, JCF=29.3 Гц), 60.80, 113.83, 123.84, 125.78 (q, JCF=276 Гц), 131.67, 161.42, 167.92.
Этил 4-(4,4,4-трифторбутокси)бензоат
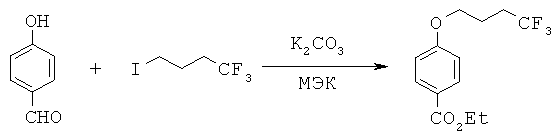
Смесь 4-гидроксибензальдегида (0,46 г, 2,80 ммоль), 1-йод-4,4,4-трифторбутана (0,67 г, 2,80 ммоль) и безводного К2СО3 (1,16 г, 8,40 ммоль) в метилэтилкетоне (5 мл) кипятили с обратным холодильником в течение 4 часов в атмосфере аргона. После охлаждения до комнатной температуры удалили растворитель при пониженном давлении и остаток разделили водой (15 мл) и Et2O (30 мл). Органический слой отделили, а водную фазу экстрагировали Et2O (2×20 мл), объединенные органические экстракты промыли солевым раствором (15 мл) и осушили (Na2SO4). Удалили растворитель при пониженном давлении с получением твердого вещества, которое очистили при помощи флэш-хроматографии (3:1 гексан/EtOAc) с получением титульного соединения (0,67 г, 87%) в виде бесцветного твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 1.36 (t, J=7.0 Гц, 3Н), 2.00-2.11 (m, 2H), 2.21-2.40 (m, 2H), 4.05 (t, J=5.8 Гц, 2H), 4.33 (q, J=7.0 Гц, 2H), 6.88 (d, J=8.8 Гц, 2H), 7.98 (d, J=8.8 Гц, 2H);13C ЯМР (62.5 МГц, CDCl3) δ 14.36, 22.09 (q, JCF=2.9 Гц), 30.67 (q, JCF=29 Гц), 60.70, 66.15, 113.95, 123.30, 127.06 (q, JCF=276 Гц), 131.61, 162.22, 166.31.
Применявшиеся условия проведения реакции основаны на способах, описанных в работе Пеза с соавторами (Fez et al.), алкилирования 4-гидроксибензальдегида йодалканами.
4-(4,4,4-трифторбутокси)бензойная кислота

К перемешиваемому раствору этил-4-(4,4,4-трифторбутокси)бензоата (0,60 г, 2,17 ммоль) в смеси ТГФ/вода (3:1 об./об., 15 мл) при комнатной температуре добавили одну порцию LiOH (0,11 г, 4,34 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, затем добавили (15 мл) с получением прозрачного раствора и продолжали перемешивание в течение 48 часов. Удалили растворители при пониженном давлении и к остатку добавили воду (30 мл). Полученную смесь экстрагировали ДХМ (30 мл) и водную фазу подкислили 1М HCl и экстрагировали EtOAc (3×30 мл). Объединенные органические экстракты промыли солевым раствором (30 мл) и осушили (Na2SO4). Удалили растворитель при пониженном давлении с получением титульного соединения (0,51 г, 95%) в виде бесцветного твердого вещества, которое применяли без дополнительной очистки.
1Н ЯМР (250 МГц, ацетон-d6) δ 2.03-2.14 (m, 2Н), 2.37-2.56 (m, 2Н), 4.21 (t, J=5.8 Гц, 2Н), 7.05 (d, J=8.8 Гц, 2Н), 7.99 (d, J=8.8 Гц, 2Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 21.88 (q, JCF=1.9 Гц), 30.41 (q, JCF=29 Гц), 65.93, 113.77, 123.39, 127.00 (q, JCF=276 Гц), 131.65, 161.98, 168.03.
4-(2-фторэтокси)бензальдегид

К смеси 4-гидроксибензальдегида (1,45 г, 11,9 ммоль), трифенилфосфина (6,87 г, 26,2 ммоль) и 2-фторэтанола (1,68 г, 26,2 ммоль) в сухом ТГФ (70 мл) при 0°С по каплям добавили DIAD (5,29 г, 26,2 ммоль). Реакционную смесь перемешивали при 0°С в течение 1 часа, затем оставили нагреваться до комнатной температуры и перемешивали в течение 48 часов. Удалили растворитель при пониженном давлении и остаток очистили при помощи флэш-хроматографии (5:1 ДХМ/гексан) с получением титульного соединения (0,807 г, 40%) в виде бесцветного твердого соединения.
1Н ЯМР (250 МГц, CDCl3) δ 4.28 (dist d oft, JHF=28 Гц, JHH=4.0 Гц, 2Н), 4.77 (dist d oft, JHF=47 Гц, JHH=4.0 Гц, 2Н), 7.01 (d, J=8.8 Гц, 2Н), 7.83 (d, J=8.8 Гц, 2Н), 9.87 (s, 1H);13C ЯМР (62.5 МГц, CDCl3) δ 67.33 (d, JCF=19.5 Гц), 81.59 (d, JCF=172 Гц), 114.85, 130.38, 132.06, 163.36, 190.86.
Применявшиеся условия проведения реакции основаны на способах, описанных в работах Маламаса с соавторами (Malamas et al.) и Манна с соавторами (Mann et al.).
4-(2-фторэтокси)бензойная кислота

К перемешиваемому раствору 50% масс./об. КОН (1,3 мл) и 4-(2-фторэтокси)бензальдегида (0,5 г, 2,98 ммоль) в МеОН (6 мл) при 65°С по каплям добавили водный раствор пероксида водорода (30% масс.в воде, 2,45 мл) в течение 20 минут. После завершения добавления реакционную смесь дополнительно нагревали до 65°С в течение 10 минут. После охлаждения до комнатной температуры реакционную смесь подкислили 1М HCl и экстрагировали Et2O (3×30 мл). Объединенные органические экстракты промыли солевым раствором (30 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением твердого вещества, которое очистили при помощи флэш-хроматографии (1:1 гексан/EtOAc) с получением титульного соединения (0,278 г, 63%) в виде бесцветного твердого вещества.
1Н ЯМР (250 МГц, CDCl3/DMSO-d6) δ 4.09 (dist d of t, JHF=28 Гц, JHH=3.0 Гц, 2Н), 4.59 (dist d of t, JHF=47 Гц, JHH=3.0 Гц, 2Н), 6.76 (d, J=8.2 Гц, 2Н), 7.82 (d, J=8.2 Гц, 2Н);13C ЯМР (62.5 МГц, CDCl3/DMSO-d6) δ 67.06 (d, JCF=19.5 Гц), 81.64 (d, JCF=170 Гц), 113.94, 123.73, 131.73, 161.82, 168.08.
Применявшиеся условия проведения реакции основаны на способах, описанных в работе Конга с соавторами (Cong et al.), окисления ароматических альдегидов до ароматических кислот.
Бензотиазольные соединения Нефторированные метоксиамиды 2-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-13

Получено в соответствии с описанием вышеприведенного раздела Амидное связывание.
1Н ЯМР (250 МГц, CDCl3/ДМСО-d6) δ 3.15 (s, 3Н), 6.34 (dd, J=8.8, 1.8 Гц, 1Н), 6.74 (d, J=1.8 Гц, 1Н), 6.96-7.02 (m, 2Н), 7.07-7.15 (m, 4H), 7.27 (d, J=8.5 Гц, 2Н), 7.40 (d, J=8.5 Гц, 1Н), 10.08 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.26, 103.91, 115.21, 119.54, 122.79, 123.72, 127.17, 128.52, 128.87, 130.26, 132.52, 133.38, 135.61, 140.78, 146.08, 147.91, 157.09, 163.98, 164.10 (расщепление карбонила).
3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-23

Получено в соответствии с описанием вышеприведенного раздела Амидное связывание с применением 2-(4-аминофенил)-6-метоксибензотиазола (0,25 г, 0,98 ммоль) и 3-нитробензоилхлорида (0,20 г, 1,07 ммоль) в сухом пиридине (15 мл) с получением титульного соединения (0,38 г, 96%) в виде бесцветного твердого вещества после обработки.
1Н ЯМР (250 МГц, CDCl3/ДМСО-d6) δ 3.22 (s, 3H), 6.41 (dd, J=8.8, 1.8 Гц, 1Н), 6.79 (d, J=1.8 Гц, 1Н), 7.10 (t, J=7.9 Гц, 1Н), 7.21 (d, J=8.8 Гц, 1Н), 7.34 (m, 4H), 7.74 (d, J=8.8 Гц, 1Н), 7.78 (d, J=8.8 Гц, 1Н), 8.29 (br s, 1Н), 10.01 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.31, 103.89, 115.24, 120.38, 122.37, 122.82, 125.69, 127.07, 128.70, 129.31, 133.92, 135.69, 135.92, 140.74, 147.52, 147.97, 157.15, 163.19, 164.13.
4-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-9
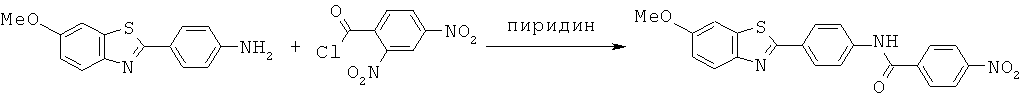
Получено в соответствии с описанием вышеприведенного раздела Амидное связывание с применением 2-(4-аминофенил)-6-метоксибензотиазола (0,30 г, 1,17 ммоль) и 4-нитробензоилхлорида (0,24 г, 1,29 ммоль) в сухом пиридине (15 мл) с получением титульного соединения (0,369 г, 78%) в виде мелкодисперсных желтых игольчатых частиц после обработки и перекристаллизации из 1,2-дихлорэтана.
1Н ЯМР (250 МГц, CDCl3/ДМСО-d6) δ 3.15 (s, 3H), 6.34 (dd, J=8.8, 1.8 Гц, 1Н), 6.73 (d, J=1.8 Гц, 1Н), 7.13 (d, J=8.8 Гц, 1Н), 7.26 (m, 4H), 7.51 (d, J=8.5 Гц, 2Н), 7.60 (d, J=8.8 Гц, 2Н), 9.92, (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.25. 103.89, 115.23, 120.26. 122.79, 122.90, 127.01, 128.64, 128.87, 135.63, 140.02, 140.69, 147.91, 148.90, 157.09, 163.59, 163.99.
2-амино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-99

Получено в соответствии с описанием вышеприведенного раздела Восстановление нитрогруппы.
1Н ЯМР (250 МГц, CDCl3/ДМСО-d6) δ 3.31 (s, 3Н), 6.08 (t, J=7.6 Гц, 1Н), 6.21 (d, J=8.2 Гц, 1Н), 6.50 (dd, J=8.8, 2.1 Гц, 1Н), 6.64 (t, J=7.6 Гц, 1Н), 6.84 (d, J=2.1 Гц, 1Н), 7.10 (d, J=7.9 Гц, 1Н), 7.30 (d, J=9.1 Гц, 1Н), 7.35 (d, J=8.8 Гц, 2Н), 7.41 (d, J=8.8 Гц, 2Н), 9.51 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.39, 103.92, 115.149, 115.211, 115.47, 116.55, 120.23, 122.85, 127.10, 128.07, 128.58, 132.07, 135.74, 141.50, 148.13, 149.21, 157.15, 164.57, 168.03.
3-амино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-41

Получено в соответствии с описанием раздела Восстановление нитрогруппы с применением 3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,33 г, 0,81 ммоль) и дигидрата хлорида олова (II) (1,47 г, 6,51 ммоль) в EtOH (20 мл) с получением титульного соединения (0,24 г, 79%) в виде светло-желтого твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.79 (s, 3Н), 5.30 (s, 2Н), 6.71 (dd, J=7.9, 2.1 Гц, 1Н), 7.02-7.08 (m, 3Н), 7.09-7.13 (m, 1Н), 7.64 (d, J=2.7 Гц, 1Н), 7.86 (d, J=8.8 Гц, 1Н), 7.91 (d, J=8.8 Гц, 2Н), 7.96 (d, J=8.8 Гц, 2Н), 10.31 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.32, 103.89, 113.42, 115.19, 115.85, 117.31, 119.95, 122.79, 127.06, 128.00, 128.56, 135.64, 141.51, 147.33, 147.46, 148.02, 157.09, 164.41, 166.56.
4-амино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-21

Получено в соответствии с описанием раздела Восстановление нитрогруппы с применением 4-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,31 г, 0,765 ммоль) и дигидрата хлорида олова (II) (1,38 г, 6,12 ммоль) в EtOH (5 мл) с получением титульного соединения (0,212 г, 74%) в виде светло-желтого твердого вещества после обработки.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.84 (s, 3Н), 5.84 (s, 2H), 6.61 (d, J=8.5 Гц, 2Н), 7.11 (dd, J=8.8, 2.4 Гц, 1Н), 7.69 (d, J=2.4 Гц, 1Н), 7.75 (d, J=8.2 Гц, 2H), 7.90 (d, J=8.8 Гц, 1Н), 7.96 (dist d, J=8.8 Гц, 2H), 7.99 (dist d, J=8.8 Гц, 2H), 10.06 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 55.18, 103.94, 112.45, 115.07, 119.65, 120.99, 122.59, 126.84, 127.26, 129.14, 135.44, 141.93, 147.85, 151.57, 156.90, 164.23, 165.36.
2-диметиламино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-103
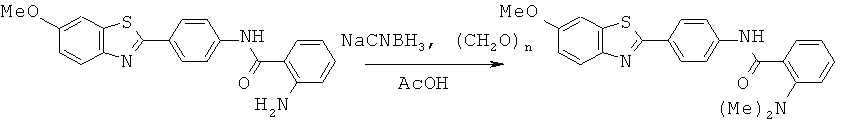
Получено в соответствии с описанием раздела Аминирование.
1Н ЯМР (250 МГц, CDCl3) δ 2.84 (s, 6H), 3.87 (s, 3Н), 7.08 (dd, J=8.9, 2.4 Гц, 1Н), 7.27 (d, J=8.2 Гц, 1Н), 7.32 (m, 2H), 7.50 (dt, J=8.5, 1.5 Гц, 1Н), 7.80 (d, J=8.8 Гц, 2H), 7.92 (d, J=8.8 Гц, 1Н), 8.03 (d, J=8.5 Гц, 2H), 8.28 (dd, J=7.6, 1.5 Гц, 1Н), 12.57 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 45.60, 55.84, 104.20, 115.54, 120.00, 120.55, 123.47, 125.32, 127.40, 128.17, 129.12, 131.75, 132.74, 135.31, 141.11, 148.78, 152.21, 157.63, 164.27, 165.28.
Диметилирование анилиновых соединений описано в работе Оно с соавторами (Ono et al.).
3-диметиламино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-63

Получено в соответствии с описанием раздела Аминирование с применением цианоборгидрида натрия (67 мг, 1,06 ммоль), 3-амино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (80 мг, 0,213 ммоль) и параформальдегида (64 мг, 2,13 ммоль) в AcOH (2 мл) с получением титульного соединения в виде бесцветных пластинок (53 мг, 62%) после перекристаллизации в EtOH.
1H ЯМР (250 МГц, CDCl3) δ 3.02 (s, 6H), 3.88 (s, 3H), 6.91 (dd, J=8.2, 2.1 Гц, 1Н), 6.78 (d, J=8.8 Гц, 2Н), 7.05-7.12 (m, 2Н), 7.29-7.36 (m, 3H), 7.92 (d, J=8.8 Гц, 1Н), 8.03 (dist d, J=8.8 Гц, 3H);13C ЯМР (62.5 МГц, CDCl3) δ 40.68, 55.85, 104.20, 111.55, 114.14, 115.61, 115.96, 120.01, 123.53, 128.14, 129.46, 129.67, 135.61, 136.33, 140.25, 148.70, 150.61, 157.69, 166.48 (1 отсутствует).
Диметилирование анилиновых соединений описано в работе Оно с соавторами (Ono et al.).
4-диметиламино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-61
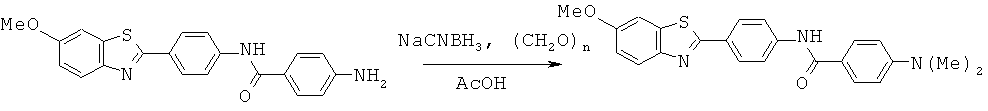
Получено в соответствии с описанием раздела Аминирование с применением цианоборгидрида натрия (67 мг, 1,06 ммоль), 4-амино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (80 мг, 0,213 ммоль) и параформальдегида (64 мг, 2,13 ммоль) в АсОН (2 мл) с получением титульного соединения в виде бесцветных игольчатых частиц (49 мг, 57%) после перекристаллизации в EtOH.
1Н ЯМР (250 МГц, CDCl3/ДМСО-d6) δ 2.19 (s, 6H), 3.02 (s, 3H), 5.88 (d, J=8.8 Гц, 2Н), 6.22 (dd, J=8.8, 2.1 Гц, 1H), 6.66 (d, J=2.1 Гц, 1H),7.01 (d, J=8.8 Гц, 1Н), 7.06 (d, J=8.8 Гц, 2Н), 7.12 (m, 4H), 9.21 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 39.41, 55.17, 103.95, 110.16, 115.09, 119.68, 120.50, 122.57, 126.82, 127.27, 128.94, 135.41, 141.85, 147.82, 151.99, 156.88, 164.18, 165.22.
4-ацетокси-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-155

Получен в соответствии с описание вышеприведенного раздела Амидное связывание с применением 2-(4-аминофенил)-6-метоксибензотиазола (0,25 г, 0,976 ммоль) и 4-ацетоксибензоилхлорида (0,22 г, 1,07 ммоль) в сухом пиридине (10 мл) с получением титульного соединения (0,385 г, 94%) в виде бесцветного твердого вещества после обработки.
1Н ЯМР (250 МГц, ДМСО-d6) δ 1.55 (s, 3Н), 3.10 (s, 3H), 6.30 (dd, J=9.1, 2.1 Гц, 1Н), 6.46 (d, J=8.5 Гц, 2H), 6.71 (d, J=2.1 Гц, 1Н), 7.09 (d, J=8.8 Гц, 1Н), 7.21 (m, 4H), 7.27 (d, J=8.2 Гц, 2Н), 9.66 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 20.56, 55.22, 103.91, 115.15, 119.96, 121.17, 122.69, 126.95, 128.10, 128.89, 132.01, 135.55, 141.20, 147.88, 152.66, 157.01, 164.07, 164.79, 168.19.
4-гидрокси-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-161

Смесь 4-ацетокси-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,31 г, 0,74 ммоль) и NazCOs (0,24 г, 2,22 ммоль) в МеОН (15 мл) и воды перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавили воду (25 мл), затем смесь подкислили 1М HCl, осадок собрали при помощи фильтрования. Очистка при помощи флэш-хроматографии (3:1 ДХМ/EtOAc) привела к получению титульного соединения (0,22 г, 78%) в виде бесцветного твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.84 (s, 3Н), 6.87 (d, J=7.9 Гц, 2H), 7.10 (d, J=9.1 Гц, 1Н), 7.68 (s, 1Н), 7.86-7.94 (m, 3Н), 7.94-8.01 (m, 4H), 10.16 (s, 1Н), 10.27 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.18, 103.91, 114.53, 115.10, 119.82, 122.62, 124.88, 126.87, 127.62, 129.39, 135.49, 141.62, 147.85, 156.93, 160.44, 164.17, 165.21.
4-ацетокси-3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT04-87
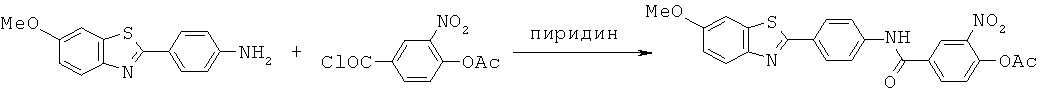
Смесь 4-ацетокси-3-нитробензойной кислоты (0,44 г, 1,95 ммоль) и тионилхлорида (5 мл) кипятили с обратным холодильником в течение 1,5 часов. Реакционную смесь охладили до комнатной температуры и избыток реагентов удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид был получен в соответствии с описанием вышеприведенного раздела Амидное связывание с применением хлорангидрида и 2-(4-аминофенил)-6-метоксибензотиазола (0,50 г, 1,95 ммоль) в сухом ТГФ (25 мл), содержащем диизопропилэтиламин (0,302 г, 2,34 ммоль), с получением титульного соединения (0,728 г, 86%) в виде твердого вещества коричневого цвета после обработки.
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.38 (s, 3Н), 3.85 (s, 3Н), 7.12 (dd, J=8.8, 2.1 Гц, 1Н), 7.68 (d, J=8.8 Гц, 1Н), 7.71 (d, J=2.1 Гц, 1Н), 7.92 (d, J=8.8 Гц, 1Н), 7.97 (d, J=8.8 Гц, 2Н), 0.07 (d, J=8.8 Гц, 2Н), 8.40 (dd, J=8.5, 1.8 Гц, 1Н), 8.73 (d, J=1.8 Гц, 1Н), 10.83 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 20.44, 55.39, 103.91, 115.32, 120.43, 122.91, 125.02, 127.20, 128.84, 133.17, 134.29, 135.78, 140.72, 140.95, 145.60, 148.03, 157.24, 162.66, 164.31, 167.69 (1 отсутствует).
4-гидрокси-3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT04-89
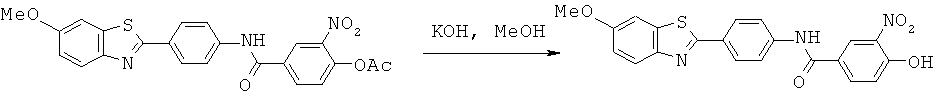
Смесь 4-ацетокси-3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,20 г, 0,464 ммоль) и гидроксида калия (0,081 г, 1,45 ммоль) в MeOH (10 мл) интенсивно перемешивали при комнатной температуре в течение 1,5 часов. Затем реакционную смесь подкислили 1М HCl и экстрагировали EtOAc (3×20 мл). Объединенные органически экстракты промыли водой (20 мл), солевым раствором (20 мл) и осушили Na2SO4. Растворитель удалили при пониженном давлении с получением твердого вещества, которое очистили при помощи флэш-хроматографии (3:2 гексан/ТГФ) с получением титульного соединения (0,052 г, 29%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.84 (s, 3Н), 7.12 (dd, J=8.8, 1.8 Гц, 1Н), 7.26 (d, J=8.8 Гц, 1Н), 7.70 (d, J=1.8 Гц, 1Н), 7.91 (d, J=8.8 Гц, 1Н), 7.96 (d, J=8.8 Гц, 2Н), 8.04 (d, J=8.8 Гц, 2Н), 8.17 (dd, J=8.8, 1.8 Гц, 1Н), 8.59 (d, J=1.8 Гц, 1Н), 10.57 (s, 1Н), 11.84 (br s, 1Н);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.28, 103.88, 115.21, 119.15, 120.23, 122.77, 124.95, 125.49, 127.01, 128.33, 134.85, 134.94, 135.63, 141.03, 147.94, 155.36, 157.09, 163.06, 164.20.
Фторированные метоксиамиды
2-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT2033-50

Получен в соответствии с описанием раздела Амидное связывание с применением 2-(4-аминофенил)-6-метоксибензотиазола (0,06 г, 0,23 ммоль) и 2-трифторметилбензоилхлорида (0,054 г, 0,26 ммоль) в сухом пиридине (7,5 мл) с получением титульного соединения (0,093 г, 93%) в виде светло-желтого твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.85 (s, 3Н), 7.12 (dd, J=9.0, 2.0 Гц, 1Н), 7.69-7.58 (m, 3H), 7.79-7.83 (m, 1Н), 7.87-7.89 (m, 3Н), 7.92 (d, J=8.6 Гц, 1Н), 8.04 (d, J=8.2 Гц, 2Н), 10.87 (s, 1Н);13C ЯМР (100 МГц, ДМСО-d6) δ 56.19, 105.32, 116.29, 120.33, 123.66, 124.23 (q, JCF=274 Гц), 126.30 (q, JCF=31.1 Гц), 126.86 (q, JCF=4.6 Гц), 128.12, 128.96, 129.02, 130.71, 133.15, 136.32, 141.68, 148.53, 157.85, 164.71, 166.29 (1 отсутствует).
3-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SK2033-49
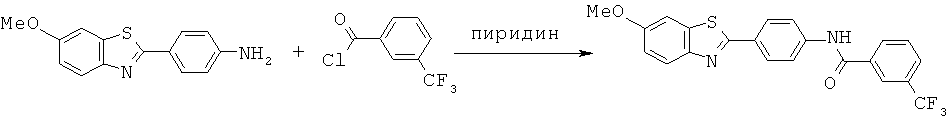
Получен в соответствии с описанием раздела Амидное связывание с применением 2-(4-аминофенил)-6-метоксибензотиазола (0,06 г, 0,23 ммоль) и 3-трифторметилбензоилхлорида (0,054 г, 0,26 ммоль) в сухом пиридине (7,5 мл) с получением титульного соединения (0,085 г, 85%) в виде бесцветного твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.84 (s, 3Н), 7.11 (dd, J=9.0, 2.0 Гц, 1Н), 7.69 (d, J=2.0 Гц, 1Н), 7.79 (t, J=7.8 Гц, 1Н), 7.91 (d, J=9.0 Гц, 1Н), 7.97-7.99 (m, 3Н), 8.05 (d, J=8.6 Гц, 2Н), 8.29 (d, J=7.8 Гц, 1Н), 8.32 (s, 1Н), 10.73 (s, 1Н);13С ЯМР (100 МГц, ДМСО-d6) δ 56.18, 105.32, 116.29, 121.09, 123.64, 124.42 (q, JCF=272.5 Гц), 124.81 (q, JCF=3.9 Гц), 127.99, 128.79, 128.99, 129.66 (q, JCF=32.7 Гц), 130.23, 132.42, 135.98, 136.32, 141.72, 148.53, 157.85, 164.73, 164.75.
4-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SK2033-47

Получен в соответствии с описанием раздела Амидное связывание с применением 2-(4-аминофенил)-6-метоксибензотиазола (0,06 г, 0,23 ммоль) и 3-трифторметилбензоилхлорида (38 мкл, 0,054 г, 0,26 ммоль) в сухом пиридине (8 мл) с получением титульного соединения (0,093 г, 93%) в виде бесцветного твердого вещества после обработки.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.85 (s, 3Н), 7.12 (d, J=8.8 Гц, 1H), 7.69 (s, 1H), 7.85-7.97 (m, 3H), 7.97-8.07 (m, 4H), 8.18 (d, J=7.6 Гц, 2Н), 10.75 (s, 1H);13С ЯМР (100 МГц, ДМСО-d6) δ 56.20, 105.33, 114.06, 116.31, 121.04, 123.65, 124.35 (q, JCF=272.4 Гц), 125.91 (q, JCF=3.9 Гц), 127.98, 128.79, 129.01, 129.17, 131.99 (q, JCF=31.9 Гц), 136.32, 141.69, 148.51, 157.85, 164.75.
3-трифторметил-N-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]-4-(метокси)бензамид
№ соединения SKT04-155

Получен в соответствии с описанием раздела Амидное связывание с применением 2-(4-аминофенил)-6-метоксибензотиазола (0,5 г, 1,95 ммоль) и 4-метокси-3-трифторметилбензоилхлорида (0,47 г, 1,95 ммоль) в сухом пиридине (15 мл) с получением титульного соединения (0,77 г, 93%) в виде светло-желтых перистых кристаллов после обработки и перекристаллизации из уксусной кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.79 (s, 3Н), 3.94 (s, 3Н), 7.06 (dd, J=8.9, 2.4 Гц, 1H), 7.37 (d, J=8.9 Гц, 1H), 7.63 (d, J=2.4 Гц, 1H), 7.85 (d, J=8.9 Гц, 1H), 7.92 (d, J=8.9 Гц, 2Н), 7.98 (d, J=8.9 Гц. 2Н), 8.23 (s, 1H), 8.25 (d, J=8.9 Гц, 1H), 10.5 (s, 1H);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.46, 56.01, 103.94, 111.47, 115.33, 117.49 (q, JCF=31.2 Гц), 120.40, 122.93, 123.12 (q, JCF=273 Гц), 126.27, 126.87 (q, JCF=3.9 Гц), 127.23, 128.49, 133.62, 135.81, 141.25, 148.10, 157.27, 159.55, 164.24, 164.62.
2-трифторметил-N-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]-4-(метокси)бензамид
№ соединения SKT05-7

Перемешиваемую смесь 4-метокси-2-трифторметилбензойной кислоты (0,50 г, 2,27 ммоль) и тионилхлорида (9 мл) кипятили с обратным холодильником в течение 4 часов. После охлаждения до комнатной температуры избыток реагентов удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного 4-метокси-5-трифторметилбензоилхлорида и 2-(4-аминофенил)-6-метоксибензотиазола (0,58 г, 2,27 ммоль) в сухом пиридине (15 мл) с получением титульного соединения (0,478 г, 46%) в виде светло-желтых игольчатых частиц после обработки и перекристаллизации из уксусной кислоты.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.85 (s, 3Н), 3.89 (s, 3H), 7.12 (dd, J=8.8, 2.4 Гц, 1Н), 7.30-7.38 (m, 2H), 7.64-7.77 (m, 2H), 7.88 (d, J=8.8 Гц, 2Н), 7.92 (d, J=8.8 Гц, 1Н), 8.03 (d, J=8.8 Гц, 2H), 10.81 (s, 1H);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.35, 55.45, 103.91, 112.08 (q, JCF=4.9 Гц), 115.26, 116.02, 119.65, 122.85, 122.99 (q, JCF=274 Гц), 127.20, 128.04, 128.40 (q, JCF=32 Гц), 128.45, 130.13, 135.71, 141.08, 148.02, 157.16, 159.91, 164.32, 165.64.
2-метокси-N-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]-5-(трифторметокси)бензамид
№ соединения SKT05-9
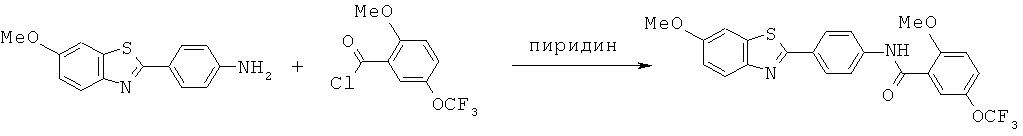
Перемешиваемую смесь 2-метокси-5-трифторметоксибензойной кислоты (0,50 г, 2,12 ммоль) и тионилхлорида (9 мл) кипятили с обратным холодильником в течение 4 часов. После охлаждения до комнатной температуры избыток реагентов удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 2-(4-аминофенил)-6-метоксибензотиазола (0,54 г, 2,12 ммоль) в сухом пиридине (15 мл) с получением титульного соединения (0,607 г, 60%) в виде светло-желтых кристаллов после перекристаллизации из диоксана.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.85 (s, 3Н), 3.91 (s, 3Н), 7.12 (dd, J=8.8, 2.4 Гц, 1Н), 7.29 (d, J=8.8 Гц, 1Н), 7.53 (dd, J=8.8, 2.1 Гц, 1Н), 7.59 (br s, 1Н), 7.71 (d, J=2.4 Гц, 1Н), 7.90 (d, J=8.5 Гц, 1Н), 7.92 (d, J=8.8 Гц, 2Н), 8.03 (d, J=8.8 Гц, 2Н), 10.55 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 55.82, 56.91, 104.14, 112.80, 115.63, 120.40, 120.52 (q, JCF=258 Гц), 122.77, 123.52, 125.33, 126.14, 128.10, 129.73, 136.33, 140.11, 143.38, 148.69, 155.50, 157.69, 161.73, 165.00.
N-[3-трифторметил-4-(6-метокси-1,3-бензотиазол-2-ил)фенил]-4-(метокси)бензамид
№ соединения SKT04-173

Получен в соответствии с описанием раздела Амидное связывание с применением 2-(4-амино-2-трифторметилфенил)-6-метоксибензотиазола (0,10 г, 0,31 ммоль) и 4-метоксибензоилхлорида (0,053 г, 0,31 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (0,12 г, 85%) в виде твердого вещества кремового цвета после обработки о перекристаллизации из уксусной кислоты.
1Н ЯМР (250 МГц, CDCl3) δ 3.86 (s, 3Н), 3.89 (s, 3Н), 6.95 (d, J=8.8 Гц, 2Н), 7.12 (dd, J=8.8, 2.4 Гц, 1Н), 7.36 (d, J=2.4 Гц, 1Н), 7.67 (d, J=8.2 Гц, 1Н), 7.86 (d, J=8.8 Гц, 2Н), 7.97 (d, J=8.2 Гц, 1Н), 8.01 (d, J=8.8 Гц, 1Н), 8.05 (s, 1Н), 8.21 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3) δ 55.56, 55.88, 103.61, 114.15, 116.00, 118.11 (q, JCF=4.9 Гц), 122.45, 123.32 (q, JCF=274 Гц), 124.22, 126.14, 127.94, 129.15, 129.69 (q, JCF=31 Гц), 133.36, 137.63, 139.84, 147.92, 157.99, 161.81, 162.95, 165.49.
2-метокси-N-(3-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)фенил]-5-(трифторметокси)бензамид
№ соединения SKT05-33

Перемешиваемую смесь 2-метокси-5-трифторметоксибензойной кислоты (0,248 г, 1,05 ммоль) и тионилхлорида (4 мл) кипятили с обратным холодильником в течение 4 часов. После охлаждения до комнатной температуры избыток реагентов удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 3-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)анилина (0,30 г, 1,05 ммоль) в сухом пиридине (8 мл) с получением титульного соединения (0,389 г, 73%) в виде практически бесцветного твердого вещества после обработки и перекристаллизации из уксусной кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.79 (s, 3Н), 3.88 (s, 3H), 3.98 (s, 3Н), 7.06 (dd, J=8.8, 2.4 Гц, 1Н), 7.25 (d, J=8.8 Гц, 1Н), 7.41 (dd, J=8.8, 2.4 Гц, 1Н), 7.49 (dd, J=8.8, 2.4 Гц, 1Н), 7.55 (d, J=2.4 Гц, 1Н), 7.61 (d, J=2.4 Гц, 1Н), 7.76 (d, J=2.4 Гц, 1Н), 7.85 (d, J=8.8 Гц, 1Н), 8.29 (d, J=8.8 Гц, 1Н), 10.48 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 55.79 (2×С), 56.89, 103.46, 103.63, 112.26, 112.80, 115.41, 118.37, 120.51 (q, JCF=258 Гц), 122.68, 123.00, 125.21, 126.20, 129.23, 137.29, 141.02, 143.34, 146.78, 155.52, 157.21, 157.72, 160.59, 161.85.
2-трифторметил-N-[3-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)фенил]-4-(метокси)бензамид
№ соединения SKT05-31

Перемешиваемую смесь 4-метокси-2-трифторметилбензойной кислоты (0,23 г, 1,05 ммоль) и тионилхлорида (4 мл) кипятили с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры избыток реагентов удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 3-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)анилина (0,30 г, 1,05 ммоль) в сухом пиридине (8 мл) с получением титульного соединения (0,398 г, 78%) в виде светло-желтых перистых кристаллов после обработки и перекристаллизации из уксусной кислоты.
1Н ЯМР (250 МГц, CDCl3/ДМСО-d6) δ 3.49 (s, 3Н), 3.51 (s, 3Н), 3.67 (s, 3H), 6.67 (d, J=8.8 Гц, 1Н), 6.76 (d, J=8.5 Гц, 1Н), 6.86 (s, 1Н), 6.95 (d, J=8.8 Гц, 1Н), 6.99 (s, 1Н), 7.22 (d, J=8.8 Гц, 1Н), 7.46 (s, 1Н), 7.49 (d, J=8.8 Гц, 1Н), 7.97 (d, J=8.5 Гц, 1Н), 9.98 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.49 (2×С), 55.57, 102.90, 103.22, 112.10, 112.28 (q, JCF=5 Гц), 115.19, 116.06, 117.32, 122.55, 123.14 (q, JCF=274 Гц), 128.19, 128.76 (q, JCF=32 Гц), 128.84, 130.29, 136.76, 142.15, 146.17, 156.90, 157.13, 160.13, 160.25, 166.00.
2-трифторметил-N-[2-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)фенил]-4-(метокси)бензамид
№ соединения SKT05-21

Перемешиваемую смесь 4-метокси-2-трифторметилбензойной кислоты (0,15 г, 0,69 ммоль) и тионилхлорида (4 мл) кипятили с обратным холодильником в течение 3,5 часов. После охлаждения до комнатной температуры избыток реагентов удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 3-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)анилина (0,20 г, 0,69 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (0,13 г, 38%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (2:1 гексан/EtOAc).
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.81 (s, 3Н), 3.84 (s, 3Н), 3.90 (s, 3H), 7.08 (dd, J=8.8, 2.4 Гц, 1Н), 7.25-7.27 (m, 2H), 7.57 (d, J=8.2 Гц, 1Н), 7.61 (d, J=8.5 Гц, 1Н), 7.65 (d, J=8.2 Гц, 1Н), 7.65 (d, J=8.8 Гц, 1Н), 7.90 (d, J=8.8 Гц, 1Н), 8.13 (d, J=8.2 Гц, 1Н), 9.73 (s, 1H);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.40, 55.46, 55.74, 103.92, 108.01, 112.32 (q, JCF=3.9 Гц), 115.23, 116.33, 119.81, 120.16, 122.88, 122.97 (q, JCF=273 Гц), 127.40, 128.14 (q, JCF=32 Гц), 129.23, 129.37, 130.21, 135.75, 147.79, 148.81, 157.24, 160.13, 164.34, 165.31.
3-трифторметил-N-[2-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)фенил]-4-(метокси)бензамид
№ соединения SKT04-175

Получен в соответствии с описанием раздела Амидное связывание с применением 2-(4-амино-3-метоксифенил)-6-метоксибензотиазола (0,13 г, 0,45 ммоль), 4-метокси-3-трифторметилбензоилхлорида (0,11 г, 0,45 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (0,18 г, 79%) в виде бесцветного твердого вещества после обработки и перекристаллизации из уксусной кислоты.
1Н ЯМР (400 МГц, CDCl3) δ 3.88 (s, 3Н), 3.98 (s, 3Н), 4.07 (s, 3Н), 7.07 (dd, J=8.8, 2.4 Гц, 1Н), 7.09 (d, J=8.8 Гц, 1Н), 7.33 (d, J=2.1 Гц, 1Н), 7.57 (dd, J=8.5, 1.2 Гц, 1Н), 7.73 (s, 1Н), 7.91 (d, J=8.8 Гц, 1Н), 8.05 (dd, J=8.8, 2.1 Гц, 1Н), 8.12 (s, 1Н), 8.58 (s, 1Н), 8.59 (d, J=8.2 Гц, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 55.83, 56.32 (2×С), 104.17, 107.96, 111.98, 115.69, 119.05 (q, JCF=32 Гц), 119.56, 121.16, 123.12 (q, JCF=273 Гц), 123.44, 126.55 (q, JCF=4.9 Гц), 126.68, 129.37, 129.88, 132.55, 136.33, 148.30, 148.45, 157.75, 160.25, 163.62, 165.30.
4-нитро-3-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT02-103

Смесь 4-нитро-3-трифторметилбензойной кислоты (0,46 г, 1,95 ммоль) и тионилхлорида (0,47 г, 4,0 ммоль) в хлороформе (5 мл) кипятили с обратным холодильником в течение 5 часов. Реакционную смесь охладили до комнатной температуры и избыток реагентов и растворитель удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием вышеприведенного раздела Амидное связывание с применением неочищенного хлорангидрида и 2-(4-аминофенил)-6-метоксибензотиазола (0,50 г, 1,95 ммоль) в сухом пиридине (25 мл) с получением титульного соединения (0,84 г, 91%) в виде оранжевого твердого вещества после обработки.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.85 (s, 3Н), 7.13 (dd, J=2.1, 8.8 Гц, 1Н), 7.71 (d, J=2.1 Гц, 1Н), 7.92 (d, J=8.8 Гц, 1Н), 7.97 (d, J=8.8 Гц, 2Н), 8.08 (d, J=8.8 Гц, 2Н), 8.35 (d, J=8.5 Гц, 1Н), 8.50 (d, J=8.8 Гц, 1Н), 8.54 (s, 1Н), 10.94 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 56.23, 105.42, 116.26, 121.24, 121.88 (q, JCF=33.5 Гц), 122.37 (q, JCF=274 Гц), 123.67, 126.13, 127.86 (q, JCF=5.4 Гц), 127.99, 129.45. 134.37, 136.39, 139.16, 141.28, 148.60, 149.24, 157.95, 163.12, 164.64.
4-нитро-3-трифторметил-N-[4-(6-(2-диметиламиноэтокси)бензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-171

К перемешиваемой смеси 4-нитро-3-фторметил-Н-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамида (0,05 г, 0,109 ммоль), трифенилфосфина (0,043 г, 0,163 ммоль) и N,N-диметилэтанолдиамина (0,015 г, 0,163 ммоль) в сухом ТГФ (5 мл) при 0°С по каплям добавили DIAD (0,033 г, 0,163 ммоль) Реакционную смесь перемешивали при 0°С в течение 1 часа, затем оставили нагреваться до комнатной температуры на ночь. Растворитель удалили при пониженном давлении, а остаток очистили при помощи флэш-хроматографии (1:1 гексан/EtOAc, затем 3:1 EtOAc/MeOH) с получением титульного соединения (0,029 г, 50%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.50 (s, 6Н), 2.70 (t, J=5.8 Гц, 2H), 4.15 (t, J=5.8 Гц, 2Н), 7.14 (dd, J=8.5, 2.7 Гц, 1Н), 7.75 (d, J=2.7 Гц, 1Н), 7.92 (d, J=8.5 Гц, 1Н), 7.98 (d, J=8.5 Гц, 2H), 8.09 (d, J=8.5 Гц, 2H), 8.36 (d, J=8.5 Гц, 1Н), 8.51 (d, J=8.5 Гц, 1Н), 8.54 (s, 1Н), 10.96 (s, 1Н).
N-[4-(1,3-бензотиазол-2-ил)-3-(2-(диметиламино)этокси)фенил]-4-фтор-3-нитробензамид
№ соединения SKT04-163

Смесь 4-нитро-2-фторбензойной кислоты (0,030 г, 0,128 ммоль) и тионилхлорида (1,5 мл) кипятили с обратным холодильником в течение 5 часов. Реакционную смесь охладили до комнатной температуры и избыток реагентов удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид был получен в соответствии с описанием раздела Амидное связывание с применением хлорангидрид а и 4-(1,3-бензотиазол-2-ил)-3-[2-(диметиламино)этокси]анилина (0,040 г, 0,128 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (0,045 г, 66%) в виде желтого твердого вещества после обработки и флэш-хроматографии (12:1 ДХМ/МеОН).
ИКС 3437,3058, 2951,2831,2784,1681, 1602, 1540, 1460, 1429, 1359, 1320, 1253, 1184, 1145, 1047, 967, 923, 856, 760, 731 см-1;1Н ЯМР (400 МГц, CDCl3) δ 2.39 (s, 6Н), 2.97 (t, J=6.0 Гц, 2H), 4.33 (t, J=6.0 Гц, 2H), 7.08 (dd, J=8.5, 2.0 Гц, 1Н), 7.32 (t, J=7.5 Гц, 1Н), 7.43 (t, J=7.2 Гц, 1Н), 7.81-7.87 (m, 3H), 7.97 (d, J=8.2 Гц, 1Н), 8.11 (d, J=7.9 Гц, 1Н), 8.29 (s, 1Н), 8.44 (d, J=8.5 Гц, 2Н).
4-нитро-2-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-137

Смесь 4-нитро-2-трифторметилбензойной кислоты (0,50 г, 2,13 ммоль) и тионилхлорида (0,46 г, 3,83 ммоль) в хлороформе (5 мл) кипятили с обратным холодильником в течение 5 часов. Реакционную смесь охладили до комнатной температуры и избыток реагентов и растворителя удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 2-(4-аминофенил)-6-метоксибензотиазола (0,54 г, 2,13 ммоль) в сухом пиридине (20 мл) с получением титульного соединения (0,84 г, 83%) в виде желтого твердого вещества после обработки.
1Н ЯМР (250 МГц, CDCl3) δ 3.90 (s, 3Н), 7.09 (dd, J=2.4, 8.8 Гц, 1Н), 7.35 (d, J=2.1 Гц, 1Н), 7.67 (s, 1Н), 7.73 (d, J=8.5 Гц, 2H), 7.93 (d, J=8.2 Гц, 1Н), 7.93 (d, J=8.8 Гц, 1Н), 8.07 (d, J=8.5 Гц, 2H), 8.51 (dd, J=8.5, 2.1 Гц, 1Н), 8.63 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.54, 103.97, 115.46, 120.13, 121.58, 122.23 (q, JCF=274 Гц), 123.11, 126.62, 127.52, 128.71 (q, JCF=33 Гц), 129.42, 130.24, 135.97, 140.32, 141.31, 147.61, 148.20, 157.43, 163.86, 164.40.
4-амино-3-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-157

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 4-нитро-3-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,35 г, 0,74 ммоль) и дигидрата хлорида олова (II) (1,33 г, 5,91 ммоль) в EtOH (7 мл) с получением титульного соединения (0,24 г, 73%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (3:2 гексан/EtOAc).
ИКС 3385, 3328, 3069, 2939, 2837, 1661, 1607, 1523, 1488, 1463, 1437, 1407, 1314, 1264, 1225, 1173, 1137, 1056, 1027, 968, 829 см-1.1H ЯМР (250 МГц, ацетон-d6) δ 3.94 (s, 3Н), 5.88 (br s, 2H), 7.01 (d, J=8.2 Гц, 1H), 7.15 (dd, J=8.2, 1.6 Гц, 1Н), 7.60 (s, 1H), 7.92 (d, J=8.2 Гц, 1Н), 8.03-8.11 (m, 5H), 8.16 (s, 1Н), 9.72 (s, 1Н).
4-амино-2-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-149

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 4-нитро-2-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,50 г, 1,05 ммоль) и дигидрата хлорида олова (II) (1,90 г, 8,40 ммоль) в EtOH (8 мл) с получением титульного соединения (0,32 г, 69%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (1:1 гексан/ЕЮАс).
ИКС 3365-3050 (br), 3446, 3261, 3007, 2966, 2936, 2831, 1660, 1631, 1607, 1530, 1490, 1464, 1406, 1325, 1266, 1225, 1168, 1122, 1045, 1024, 969, 831 см-1.1H ЯМР (250 МГц, ДМСО-d6) δ 3.83 (s, 3Н), 5.62 (br s, 2H), 6.78 (d, J=8.5 Гц, 1Н), 6.95 (s, 1Н), 7.02 (dd, J=8.8, 2.1 Гц, 1Н), 7.32 (d, J=8.5 Гц, 1Н), 7.43 (d, J=1.8 Гц, 1Н), 7.79-7.92 (m, 4H), 7.96 (s, 1Н), 10.36 (s, 1H).
4-диметиламино-3-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT02-31

Получен в соответствии с описанием раздела Аминирование с применением цианоборгидрида натрия (71 мг, 1,13 ммоль), 4-амино-3-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (100 мг, 0,226 ммоль) и параформальдегида (68 мг, 2,26 ммоль) в АсОН (3 мл) с получением титульного соединения (54 мг, 51%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (20:1 ДХМ/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 2.91 (s, 6H), 3.89 (s, 3H), 7.08 (dd, J=8.8, 2.4 Гц, 1H), 7.19 (d, J=8.5 Гц, 1H), 7.34 (d, J=2.4 Гц, 1H), 7.78 (d, J=8.8 Гц, 2H), 7.91-7.96 (m, 3H), 8.04 (d, J=8.8 Гц, 2H), 8.10 (s, 1H);13C ЯМР (62.5 МГц, CDCl3) δ 44.44, 55.84, 104.20, 115.66, 120.26, 120.41, 121.51 (q, JCF=30.3 Гц), 123.50, 124.08 (q, JCF=273.4 Гц), 126.37, 127.74 (q, JCF=5.9 Гц), 128.11, 129.77, 131.22, 136.33, 140.05, 148.61, 155.33, 157.72, 164.40, 164.97.
4-диметиламино-2-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-159

Получен в соответствии с описанием раздела Аминирование с применением цианоборгидрида натрия (66 мг, 1,05 ммоль), 4-амино-2-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (100 мг, 0,226 ммоль) и параформальдегида (63 мг, 2,11 ммоль) в АсОН (3 мл) с получением титульного соединения (39 мг, 37%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (20:1 ДХМ/EtOAc).
1H ЯМР (400 МГц, ДМСО-d6) δ 2.97 (s, 6Н), 3.80 (s, 3H), 6.93-6.95 (m, 2H), 7.07 (dd, J=8.8, 2.4 Гц, 1Н), 7.50 (d, J=8.5 Гц, 1Н), 7.65 (d, J=2.4 Гц, 1Н), 7.83 (d, J=8.8 Гц, 2H), 7.86 (d, J=8.5 Гц, 1Н), 7.96 (d, J=8.8 Гц, 2H), 10.57 (s, 1Н);13C ЯМР (100 МГц, ДМСО-d6) δ 40.24, 56.25, 105.49, 109.20 (q, JCF=5.4 Гц), 114.41, 116.18, 120.25, 122.91, 123.60, 124.45 (q, JCF=274 Гц), 127.99, 128.07 (q, JCF=30.4 Гц), 128.58, 130.59, 136.32, 142.29, 148.63, 151.35, 157.89, 164.87, 166.74.
4-(2,2,2-трифторэтокси)-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT02-25
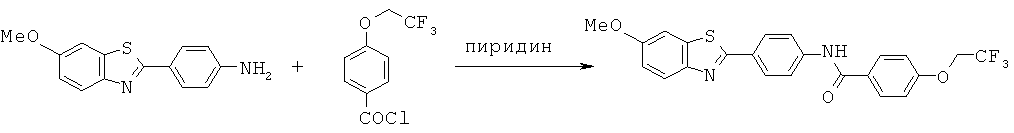
Смесь 4-(2,2,2-трифторэтокси)бензойной кислоты (0,30 г, 1,35 ммоль) и тионилхлорида (0,32 г, 2,72 ммоль) в хлороформе (5 мл) кипятили с обратным холодильником в течение 4 часов. Реакционную смесь охладили до комнатной температуры и избыток реагентов и растворителя удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 2-(4-аминофенил)-6-метоксибензотиазола (0,34 г, 1,35 ммоль) в сухом пиридине (15 мл) с получением титульного соединения (0,56 г, 91%) в виде светло-желтого твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.79 (s, 3H), 4.82 (q, J=9.0 Гц, 2H), 7.06 (dd, J=9.0, 2.7 Гц, 1Н), 7.16 (d, J=9.0 Гц, 2H), 7.63 (d, J=2.7 Гц, 1Н), 7.85 (d, J=9.0 Гц, 1Н), 7.91 (dist d, J=9.0 Гц, 2Н), 7.94-7.98 (m, 4Н), 10.38 (s, 1H);13C ЯМР (100.5 МГц, ДМСО-d6) δ 56.38 (q, JCF=8 Гц), 65.21 (q, JCF=34 Гц), 105.50 (q, JCF=6 Гц), 115.19, 116.45, 121.12, 123.82, 124.55 (q, JCF=278 Гц), 128.09, 128.74, 128.81, 130.50 (q, JCF=6 Гц), 136.46, 142.32, 148.69, 158.00, 160.19, 165.10, 165.63.
4-(3,3,3-трифторпропокси)-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-39

Смесь 4-(3,3,3-трифторпропокси)бензойной кислоты (0,32 г, 1,39 ммоль) и тионилхлорида (0,33 г, 2,78 ммоль) в хлороформе (5 мл) кипятили с обратным холодильником в течение 5 часов. Реакционную смесь охладили до комнатной температуры и избыток реагентов и растворителя удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 2-(4-аминофенил)-6-метоксибензотиазола (0,36 г, 1,39 ммоль) в сухом пиридине (10 мл) с получением титульного соединения (0,59 г, 90%) в виде светло-желтого твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.74-2.83 (m, 2H), 3.80 (s, 3Н), 4.26 (t, J=5.9 Гц, 2Н), 7.07 (d, J=9.0 Гц, 2H), 7.07 (dd, J=9.0, 2.7 Гц, 1H), 7.65 (d, J=2.7 Гц, 1H), 7.86 (d, J=9.0 Гц, 1H), 7.92-7.99 (m, 6H), 10.33 (s, 1H);13C ЯМР (100.5 МГц, ДМСО-d6) δ 33.40 (q, JCF=27 Гц), 56.40, 61.85, 105.56, 114.85, 116.44, 121.85, 123.79, 127.34 (q, JCF=277 Гц), 127.78, 128.09, 128.65, 130.47, 136.48, 142.48, 148.75, 158.01, 161.34, 165.07, 165.70.
4-(4,4,4-трифторбутокси)-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT02-169

Смесь 4-(4,4,4-трифторбутокси)бензойной кислоты (0,20 г, 0,806 ммоль) и тионилхлорида (0,42 г, 3,54 ммоль) в хлороформе (5 мл) кипятили с обратным холодильником в течение 8 часов. Реакционную смесь охладили до комнатной температуры и избыток реагентов и растворителя удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 2-(4-аминофенил)-6-метоксибензотиазола (0,206 г, 0,806 ммоль) в сухом пиридине (10 мл) с получением титульного соединения (0,343 г, 87%) в виде бесцветного твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 1.89-1.96 (m, 2H), 2.33-2.45 (m, 2H), 3.80 (s, 3H), 4.09 (t, J=6.1 Гц, 2H), 7.04 (d, J=8.8 Гц, 2H), 7.07 (dd, J=9.1, 2.4 Гц, 1Н), 7.64 (d, J=2.4 Гц, 1Н), 7.86 (d, J=8.8 Гц, 1Н), 7.93 (d, J=8.8 Гц, 2H), 7.94 (d, J=9.1 Гц, 2H), 7.97 (d, J=8.8 Гц, 2H), 10.30 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 22.03 (q, JCF=6.3 Гц), 29.97 (q, JCF=28.05 Гц), 56.24, 66.60, 105.46, 114.66, 116.16, 120.86, 123.58, 127.38, 127.85, 128.05 (q, JCF=276.4 Гц), 128.51, 130.21. 136.32, 142.32, 148.63, 157.86, 161.63, 164.89, 165.54.
Моногалогвнированные метоксиамиды
4-фтор-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT02-135

Смесь 4-фторбензойной кислоты (0,20 г, 1,43 ммоль) и тионилхлорида (0,93 г, 7,81 ммоль) в хлороформе (5 мл) кипятили с обратным холодильником в течение 3,5 часов. Реакционную смесь охладили до комнатной температуры и избыток реагентов и растворителя удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 2-(4-аминофенил)-6-метоксибензотиазола (0,36 г, 1,43 ммоль) в сухом пиридине (15 мл) с получением титульного соединения (0,26 г, 48%) в виде бесцветных игольчатых частиц после перекристаллизации из EtOAc.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.85 (s, 3H), 7.12 (dd, J=2.1, 8.8 Гц, 1Н), 7.40 (t, JCF=8.8 Гц, 2H), 7.70 (d, J=2.1 Гц, 1Н), 7.92 (d, J=8.8 Гц, 1Н), 7.98 (d, J=8.8 Гц, 2H), 8.04 (d, J=8.8 Гц, 2H), 8.00-8.10 (m, 2H), 10.55 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.22, 103.89, 114.73 (d, JCF=21.5 Гц), 115.16, 120.01, 122.68, 126.93, 128.10, 130.03 (d, JCF=8.8 Гц), 130.67 (d, JCF=2.9 Гц), 135.53, 141.16, 147.86, 156.99, 163.97 (d, JCF=251 Гц), 164.06, 164.38.
6-фтор-N-(4-[6-метокси-1,3-бензотиазол-2-ил]фенил)пиридин-3-карбоксамид
№ соединения SKT04-137
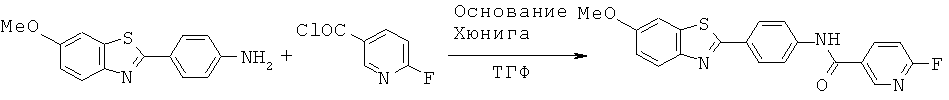
Смесь 6-фторникотиновой кислоты (0,125 г, 0,647 ммоль) и тионилхлорида (3 мл) кипятили с обратным холодильником в течение 4 часов. Реакционную смесь охладили до комнатной температуры и избыток реагентов удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 2-(4-аминофенил)-6-метоксибензотиазола (0,166 г, 0,647 ммоль) в сухом ТГФ (5 мл), содержащем диизопропилэтиламин (0,10 г, 0,776 ммоль), с получением титульного соединения (0,195 г, 79%) в виде бесцветных кристаллов после обработки и перекристаллизации из диоксана.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.80, (s, 3Н), 7.07 (dd, J=8.9, 2.7 Гц, 1Н), 7.34 (dd, J=8.5, 2.0 Гц, 1Н), 7.66 (d, J=2.4 Гц, 1Н), 7.87 (d, J=8.9 Гц, 1Н), 7.91 (dd, J=8.9, 2.0 Гц, 2Н), 8.01 (dd, J=8.9, 2.0 Гц, 2Н), 8.47 (dt, J=8.5, 2.7 Гц, 1Н), 8.79 (d, J=2.7 Гц, 1Н), 10.67 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 56.40, 105.52, 110.22 (d, JCF=37 Гц), 116.51, 121.14, 123.85, 128.20, 129.20, 129.77 (d, JCF=3.8 Гц), 136.51, 141.79, 142.72 (d, JCF=9.2 Гц), 148.58 (d, JCF=16.8 Гц), 148.69, 158.04, 163.79, 164.90, 165.04 (d, JCF=241 Гц).
6-хлор-N-(4-[6-метокси-1,3-бензотиазол-2-ил]фенил)пиридин-3-карбоксамид
№ соединения SKT04-111

Получен в соответствии с описанием раздела Амидное связывание с применением 2-(4-аминофенил)-6-метоксибензотиазола (0,75 г, 2,93 ммоль) и 6-хлорникотиноилхлорида (0,515 г, 2,93 ммоль) в сухом ТГФ (20 мл), содержащем диизопропилэтиламин (0,45 г, 3,52 ммоль) с получением титульного соединения (0,784 г, 68%) в виде небольших бесцветных кристаллов после обработки и перекристаллизации из диоксана.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.73 (s, 3Н), 6.93 (dd, J=8.8, 2.4 Гц, 1Н), 7.22 (d, J=2.4 Гц, 1Н), 7.25 (s, 1Н), 7.35 (d, J=8.5 Гц, 1Н), 7.70 (d, J=8.8 Гц, 2Н), 7.73 (d, J=8.5 Гц, 1Н), 7.85 (d, J=8.5 Гц, 2Н), 8.13 (dd, J=8.2, 2.4 Гц, 1Н), 8.77, (d, J=1.8 Гц, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) 5 55.22, 103.86, 115.21, 120.16, 122.76, 123.53, 127.00, 128.55, 129.14, 135.58, 138.39, 140.63, 147.86, 148.97, 153.08, 157.05, 162.68, 163.95.
6-бром-N-(4-[6-метокси-1,3-бензотиазол-2-ил]фенил)пиридин-3-карбоксамид
№ соединения SKT05-63

К раствору 6-бромникотиновой кислоты (0,16 г, 0,78 ммоль) в сухом ТГФ (5 мл) в атмосфере аргона добавили 1,1'-карбонилдиимидазол (0,13 г, 0,78 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавили 2-(4-аминофенил)-6-метоксибензотиазол (0,2 г, 0,78 ммоль) в течение 2 минут, перемешивание продолжали при комнатной температуре в течение 1 часа, затем кипятили с обратным холодильником в течение 18 часов. После охлаждения до комнатной температуры реакционную смесь разбавили Et2O (30 мл) и осадок собрали при помощи фильтрования, промыли Et2O (50 мл) и осушили в глубоком вакууме с получением титульного соединения (0,101 г, 29%) в виде оранжевого твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.86 (s, 3Н), 7.14 (d, J=8.8 Гц, 1Н), 7.72 (s, 1Н), 7.87 (d, J=8.2 Гц, 1Н), 7.92 (d, J=8.8 Гц, 1Н), 7.97 (d, J=8.5 Гц, 2Н), 8.07 (d, J=8.5 Гц, 2Н), 8.28 (d, J=8.2 Гц, 1Н), 8.96 (s, 1Н), 10.78 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.17, 103.91, 115.18, 120.07, 122.69, 126.95, 127.32, 128.44, 129.42, 135.50, 138.02, 140.60, 144.14, 147.79, 149.31, 156.98, 162.71, 163.81.
Применявшиеся условия проведения реакции основаны на способах, описанных в работе Боскелли с соавторами (Boschelli et al.), связывания 6-бромникотиновой кислоты с N-метилпиперазином с применением КДИ.
4-фтор-3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-99

Смесь 4-фтор-3-нитробензойной кислоты (0,36 г, 1,95 ммоль) и тионилхлорида (0,93 г, 7,81 ммоль) в хлороформе (5 мл) кипятили с обратным холодильником в течение 4 часов. Реакционную смесь охладили до комнатной температуры и удалили избыток реагентов и растворителя при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида, 2-(4-аминофенил)-6-метоксибензотиазола (0,50 г, 1,95 ммоль) в основания Хюнига (0,28 г, 2,15 ммоль) в сухом ТГФ (20 мл) с получением титульного соединения (0,49 г, 59%) в виде светло-желтого твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.80 (s, 3Н), 7.06 (dd, J=8.9, 2.7 Гц, 1Н), 7.63 (d, J=2.4 Гц, 1H), 7.73 (dd, J=11.3, 8.9 Гц, 1Н), 7.85 (d, J=8.9 Гц, 1Н), 7.91 (d, J=8.9 Гц, 2H), 7.99 (d, J=8.9 Гц, 2H), 8.36 (m, 1Н), 8.72 (dd, J=7.5, 2.4 Гц, 1Н), 10.72 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 56.38, 105.52, 116.48, 119.54 (d, JCF=21 Гц), 121.30, 123.84, 126.53, 128.16, 129.33, 132.02 (d, JCF=3.8 Гц), 136.42, 136.53, 137.31 (d, JCF=8 Гц), 141.69, 148.72, 157.13 (d, JCF=267 Гц), 158.06, 163.27, 164.87.
N-[4-(1,3-бензотиазол-2-ил)-3-метоксифенил]-4-фтор-3-нитробензамид
№ соединения SKT04-127

Смесь 4-фтор-3-нитробензойной кислоты (0,062 г, 0,336 ммоль) и тионилхлорида (5 мл) кипятили с обратным холодильником в течение 2 часов. Реакционную смесь охладили до комнатной температуры и удалили избыток реагентов при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида, 2-(4-амино-2-метоксифенил)бензотиазола (0,086 г, 0,336 ммоль) и основания Хюнига (0,052 г, 0,403 ммоль) в сухом ТГФ (5 мл) с получением титульного соединения (0,105 г, 74%) в виде светло-желтого твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 4.02 (s, 3Н), 7.34-7.38 (m, 1Н), 7.45-7.49 (m, 1Н), 7.58 (dd, J=8.8, 1.9 Гц, 1Н), 7.73-7.78 (m, 2H), 9.97 (d, J=7.8 Гц, 1Н), 8.05 (d, J=7.6 Гц, 1Н), 8.36-8.39 (m, 1Н), 8.89 (d, J=8.8 Гц, 1Н), 8.74 (dd, J=7.1, 2.2 Гц, 1Н), 10.77 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 61.14, 108.85, 117.97. 122.11, 124.08 (d, JCF=19.4 Гц), 126.89 (d, JCF=10.9 Гц), 127.32 (d, JCF=8.5 Гц), 129.80, 131.03, 131.35, 134.28, 136.44 (d, JCF=3.9 Гц), 140.29, 141.05, 141.82 (d, JCF=7.8 Гц), 147.69, 156.79, 161.72 (d, JCF=267 Гц), 162.43, 167.07, 167.86.
N-[4-(1,3-бензотиазол-2-ил)-3-[2-{2-(2-метоксиэтокси)этокси}этокси]фенил]-4-фтор-3-нитробензамид
№ соединения SKT04-143

Смесь 4-фтор-3-нитробензойной кислоты (0,048 г, 0,257 ммоль) и тионилхлорида (2 мл) кипятили с обратным холодильником в течение 4 часов. Реакционную смесь охладили до комнатной температуры и удалили избыток реагентов при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием вышеприведенного раздела Амидное связывание с применением неочищенного хлорангидрида, 4-(1,3-бензотиазол-2-ил)-3-[2- {2-(2-метоксиэтокси)этокси} этокси] анилина (0,10 г, 0,257 ммоль) и основания Хюнига (0,040 г, 0,308 ммоль) в сухом ТГФ (5 мл) с получением титульного соединения (0,140 г, 98%) в виде желтого твердого вещества после обработки и флэш-хроматографии (EtOAc).
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.22 (s, 3H), 3.41-3.43 (m, 2H), 3.54-3.57 (m, 2H), 3.62-3.64 (m, 2H), 3.73-3.76 (m, 2H), 4.04-4.06 (m, 2H), 4.42-4.44 (m, 2H), 7.45 (dt, J=7.0, 1.2 Гц, 1Н), 7.55 (dt, J=7.0, 1.2 Гц, 1Н), 7.64 (dd, J=8.6, 1.9 Гц 1Н), 7.82 (dd, J=10.9, 9.0 Гц, 1Н), 7.86 (d, J=1.9 Гц, 1Н), 8.06 (d, J=8.2 Гц, 1Н), 8.11 (d, J=7.8 Гц, 1Н), 8.44-8.48 (m, 1Н), 8.48 (d, J=8.6 Гц, 1Н), 8.82 (dd, J=7.0, 2.3 Гц, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 58.44, 68.87, 69.15, 70.07, 70.35, 70.48, 71.69, 104.85, 113.38, 117.62, 119.39 (d, JCF=21 Гц), 122.05, 122.59, 125.07, 126.28, 126.58, 129.63, 131.72 (d, JCF=3.9 Гц), 135.76, 136.26 (d, JCF=10 Гц), 137.10 (d, JCF=7.7 Гц), 142.82, 152.02, 156.93, 156.98 (d, JCF=267 Гц), 162.49, 163.14.
4-хлор-3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-93

Получен в соответствии с описанием раздела Амидное связывание с применением 2-(4-аминофенил)-6-метоксибензотиазола (0,50 г, 1,95 ммоль), 4-хлор-3-нитробензоилхлорида (0,43 г, 1,95 ммоль) и основания Хюнига (0,28 г, 2,15 ммоль) в сухом ТГФ (20 мл) с получением титульного соединения (0,83 г, 97%) в виде желтого твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.79 (s, 3Н), 7.07 (dd, J=8.8, 2.7 Гц, 1Н), 7.64 (d, J=2.4 Гц, 1Н), 7.86 (d, J=9.0 Гц, 1Н), 7.92 (d, J=8.5 Гц, 2H), 8.00, dd, J=8.8, 1.9 Гц, 2Н), 8.25 (dd, J=8.5, 1.9 Гц, 1Н), 8.62 (d, J=1.9 Гц, 1Н), 10.81 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.14, 103.92, 115.21, 120.13, 122.57, 124.50, 126.90, 128.28, 131.34, 132.44, 133.98, 135.38, 140.57, 146.87, 147.47, 156.96, 161.95, 163.84 (1 отсутствует).
4-бром-3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT04-33

Смесь 4-бром-3-нитробензойной кислоты (0,24 г, 0,976 ммоль) и тионилхлорида (5 мл) кипятили с обратным холодильником в течение 3 часов. Реакционную смесь охладили до комнатной температуры и удалили избыток реагентов и растворителя при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида, 2-(4-аминофенил)-6-метоксибензотиазола (0,25 г, 0,976 ммоль) и основания Хюнига (0,151 г, 1,17 ммоль) в сухом ТГФ (10 мл) с получением титульного соединения (0,368 г, 78%) в виде небольших желтых кристаллов после обработки и перекристаллизации из ДМФ.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.85 (s, 3Н), 7.13 (dd, J=8.8, 2.4 Гц, 1Н), 7.71 (d, J=2.4 Гц, 1Н), 7.92 (d, J=8.8 Гц, 1Н), 7.96 (d, J=8.8 Гц, 2H), 8.07 (d, J=8.5 Гц, 2H), 8.15 (d, J=8.8 Гц, 1Н), 8.18 (dd, J=8.5, 1.8 Гц, 1Н), 8.61 (d, J=1.5 Гц, 1Н), 10.80 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.39, 103.89, 115.32, 117.01, 120.44, 122.91, 124.53, 127.18, 128.92, 132.46, 134.71, 134.85, 135.77, 140.58, 148.03, 149.15, 157.24, 162.35, 164.24.
4-йод-3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT04-29

Смесь 4-йод-3-нитробензойной кислоты (0,286 г, 0,976 ммоль) и тионилхлорида (5 мл) кипятили с обратным холодильником в течение 3 часов. Реакционную смесь охладили до комнатной температуры и удалили избыток реагентов и растворителя при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида, 2-(4-аминофенил)-6-метоксибензотиазола (0,25 г, 0,976 ммоль) и основания Хюнига (0,151 г, 1,17 ммоль) в сухом ТГФ (10 мл) с получением титульного соединения (0,403 г, 78%) в виде желтого твердого вещества после обработки.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.85 (s, 3Н), 7.13 (dd, J=8.8, 2.4 Гц, 1Н), 7.70 (d, J=2.1 Гц, 1Н), 7.91 (d, J=8.8 Гц, 1Н), 7.94-7.99 (m, 3Н), 8.05 (d, J=8.8 Гц, 2Н), 8.32 (d, J=8.2 Гц, 1Н), 8.52 (d, J=1.8 Гц, 1Н), 10.78 (s, 1H);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.29, 91.17, 103.88, 115.26, 120.33, 122.82, 123.86, 127.06, 128.73, 132.15, 135.35, 135.67, 140.58, 141.37, 147.94, 152.64, 157.13, 162.50, 164.06.
4-диметиламино-3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-141

Смесь 4-фтор-3-нитро^-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,10 г, 0,237 ммоль), гидрохлорида диметиламина (0,039 г, 0,474 ммоль) и карбоната калия (0,085 г, 0,616 ммоль) в ДМСО (4 мл) и воде (1 мл) перемешивали и кипятили с обратным холодильником в течение 3 дней. Реакционную смесь охладили до комнатной температуры и добавили воду (10 мл), полученный осадок собрали при помощи фильтрования. Очистка при помощи флэш-хроматографии (2:1 EtOAc/гексан) привела к получению титульного соединения (0,029 г, 27%) в виде оранжевого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.94 (s, 6Н), 3.85 (s, 3Н), 7.12 (dd, J=8.8, 2.4 Гц, 1Н), 7.27 (d, 7=9.1 Гц, 1Н), 7.71 (d, J=2.1 Гц, 1Н), 7.91 (d, J=9.1 Гц, 1Н),.7.96 (d, J=8.2 Гц, 2Н), 8.04 (d, J=8.2 Гц, 2Н), 8.10 (dd, J=9.1, 2.1 Гц, 1Н), 8.50 (d, J=1.5 Гц, 1Н), 10.46 (s, 1H);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 41.68, 55.31, 103.86, 115.19, 116.56, 120.12, 121.93, 122.77, 126.50, 127.03, 128.13, 132.44, 135.66, 136.31, 141.29, 147.15, 148.00, 157.09, 163.47, 164.34.
Применявшиеся условия проведения реакции основаны на способах, описанных в работе Эрмерта с соавторами (Ermert et al.), включения диметиламиногруппы в результате нуклеофильного замещения в ДМСО.
3,4-динитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-137

Смесь 3,4-динитробензойной кислоты (0,21 г, 0,976 ммоль) и тионилхлорида (1 мл) в хлороформе (5 мл) кипятили с обратным холодильником в течение 4 часов. Реакционную смесь охладили до комнатной температуры и удалили избыток реагентов и растворителя при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида, 2-(4-аминофенил)-6-метоксибензотиазола (0,25 г, 0,976 ммоль) в сухом ТГФ (20 мл), содержащем диизопропилэтиламин (0,14 г, 1,07 ммоль), с получением титульного соединения (0,334 г, 76%) в виде оранжевого твердого вещества после обработки и флэш-хроматографии (EtOAc, затем 1:1 EtOAc/MeOH).
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.86 (s, 3Н), 7.13 (dd, J=8.8, 2.1 Гц, 1Н), 7.72 (d, J=2.1 Гц, 1Н), 7.93 (d, J=8.8 Гц, 1Н), 8.00 (d, J=8.8 Гц, 2Н), 8.09 (d. J=8.5 Гц, 2Н), 8.43 (d, J=8.5 Гц, 1Н), 8.54 (d, J=7.9 Гц, 1Н), 8.79 (s, 1Н), 11.08 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.18, 103.88, 115.21, 120.32, 122.74, 124.45, 125.21, 126.96. 128.83, 133.42, 135.55, 139.06, 140.25, 141.50, 143.19, 147.79, 157.02, 161.18, 163.75.
4-(2-фторэтокси)-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-75

Смесь 4-(2-фторэтокси)бензойной кислоты (0,20 г, 1,11 ммоль) и тионилхлорида (0,53 г, 4,44 ммоль) в хлороформе (5 мл) кипятили с обратным холодильником в течение 5 часов. Реакционную смесь охладили до комнатной температуры и удалили избыток реагентов и растворителя при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида, 2-(4-аминофенил)-6-метоксибензотиазола (0,28 г, 1,11 ммоль) в сухом пиридине (10 мл) с получением титульного соединения (0,34 г, 72%) в виде светло-желтого твердого вещества после обработки.
1H ЯМР (400 МГц, ДМСО-d6) δ 3.80 (s, 3Н), 4.29 (dist d of t, JHF=30 Гц, JHH=3.7 Гц, 2Н), 4.73 (dist d of t, JHF=48 Гц, JHH=3.7 Гц, 2Н), 7.06 (m, 3Н), 7.65 (d, J=2.7 Гц, 1H), 7.86 (d, J=8.8 Гц, 1H), 7.91-7.98 (m, 6H), 10.33 (s, 1H);13C ЯМР (100.5 МГц, ДМСО-d6) δ 56.40, 67.97 (d, JCF=19 Гц), 82.70 (d, JCF=167 Гц), 105.56, 114.86, 116.44, 121.04, 123.79, 127.63, 128.09, 128.64, 130.47, 136.47, 142.48, 148.73, 158.01, 161.65, 165.08, 165.75; MCHP (ESI-) 421 (М+-Н, 100%).
4-(2-гидроксиэтокси)-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-33

Смесь 4-гидрокси-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,20 г, 0,53 ммоль), хлорэтанола (0,064 г, 0,80 ммоль) и карбоната калия (0,26 г, 1,86 ммоль) нагревали при 100°С в сухом ДМФ (10 мл) в течение 18 часов. После охлаждения до комнатной температуры добавили воду (30 мл) и реакционную смесь экстрагировали EtOAc (7×40 мл). Объединенные органические экстракты промыли солевым раствором (80 мл) и осушили (Na2SO4). Растворитель удалили при пониженном давлении с получением титульного соединения (0,17 г, 76%) в виде бесцветного твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.70 (q, J=4.8 Гц, 2Н), 3.80 (s, 3Н), 4.03 (t, J=4.8 Гц, 2Н), 4.87 (t, J=5.1 Гц, 1H), 7.03 (d, J=8.9 Гц, 2Н), 7.07 (dd, J=2.4, 8.9 Гц, 1H), 7.64 (d, J=2.7 Гц, 1H), 7.86 (d, J=8.9 Гц, 1H), 7.93-7.98 (m, 6H), 10.33 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 56.40. 60.11, 70.48, 105.56, 114.78, 116.42, 121.00, 123.78, 127.18, 128.06. 128.59, 130.43, 136.47, 142.56, 148.75, 158.00, 162.25, 165.09, 165.79.
Применявшиеся условия проведения реакции основаны на способах, описанных в работе Жанга с соавторами (Zhang et al.), реакции фенольных соединений с хлорсодержащими спиртами.
4-диметиламино-N-[4-(6-(2-гидроксиэтокси)бензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-19

Смесь 4-диметиламино-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамида (0,20 г, 0,51 ммоль), хлорэтанола (0,05 г, 0,62 ммоль) и карбоната калия (0,23 г, 1,63 ммоль) нагревали при 100°С в сухом ДМФ (10 мл) в течение 18 часов. После охлаждения до комнатной температуры добавили воду (30 мл) и реакционную смесь экстрагировали EtOAc (7×40 мл). Объединенные органические экстракты промыли солевым раствором (80 мл) и осушили (Na2SO4). Удалили растворитель при пониженном давлении с получением титульного соединения (0,117 г, 53%) в виде светло-желтого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.96 (s, 6Н), 3.71 (m, 2H), 4.03 (m, 2H), 4.86 (br s, 1H), 6.72 (d, J=9.2 Гц, 2H), 7.07 (dd, J=8.9, 2.4 Гц, 1H), 7.64 (d, J=2.4 Гц, 1H), 7.85 (d, J=9.2 Гц, 3Н), 7.93 (m, 4H), 10.08 (s, 1H);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 39.50, 59.55, 69.79, 104.70, 110.21, 115.58, 119.77, 120.55, 122.60, 126.89, 127.40, 128.98, 135.44, 141.85, 147.88, 152.04, 156.39, 164.32, 165.39.
Применявшиеся условия проведения реакции основаны на способах, описанных в работе Жанга с соавторами (Zhang et al.), проведения реакции фенольных соединений с хлорсодержащими спиртами.
4-фтор-3-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT05-37
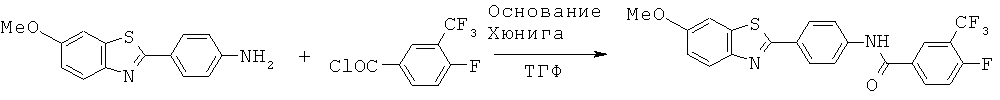
Смесь 4-фтор-6-трифторметилбензойной кислоты (0,32 г, 1,56 ммоль) и тионилхлорида (5 мл) кипятили с обратным холодильником в течение 4 часов. Реакционную смесь охладили до комнатной температуры и избыток реагентов удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 2-(4-аминофенил)-6-метоксибензотиазола (0,40 г, 1,56 ммоль) в сухом пиридине (12 мл) с получением титульного соединения (0,502 г, 72%) в виде бесцветного твердого вещества после перекристаллизации из АсОН.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.84 (s, 3Н), 7.10 (dd, J=8.8, 2.4 Гц, 1Н), 7.66 (s, 1H), 7.72 (m, 1H), 7.90 (d, J=8.8 Гц, 1H), 7.95 (d, J=8.5 Гц, 2Н), 8.03 (d, J=8.5 Гц, 2Н), 8.38 (d, J=6.1 Гц, 1H), 8.30-8.43 (m, 1H), 10.71 (s, 1H);13С ЯМР (100 МГц, ДМСО-d6) δ 56.22, 105.42, 116.21, 117.13 (d of q, JCF=32.7, 13.3 Гц), 117.99 (d, JCF=21.0 Гц), 121.14, 122.84 (q, JCF=272.5 Гц), 123.63, 127.54 (d of q, JCF=4.6, 1.5 Гц), 127.92, 129.14, 131.97 (d, JCF=3.8 Гц), 135.58 (d, JCF=10.1 Гц), 136.37, 141.60, 148.61, 157.92, 161.19 (d of q, JCF=258.5, 1.6 Гц), 163.74, 164.71.
Нефторированные гидроксиамиды
2-амино-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-101

Получен в соответствии с описанием раздела Деметширование с применением 2-амино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (50 мг, 0,13 ммоль) в сухом ДХМ (3 мл) и BBr3 (1,0М раствор в ДХМ, 0,67 мл, 0,67 ммоль) с получением титульного соединения (31 мг, 64%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (6:1 Et2O/гексан).
1Н ЯМР (400 МГц, ДМСО-d6) δ 6.42 (br s, 2Н), 6.65 (t, J=7.5 Гц, 1H), 6.82 (d, J=8.2 Гц, 1H), 7.03 (dd, J=8.6, 1.2 Гц, 1H), 7.26 (t, J=7.5 Гц, 1H), 7.45 (d, J=1.2 Гц, 1H), 7.71 (d, J=7.5 Гц, 1H), 7.87 (d, J=8.6 Гц, 1H), 7.96 (d, J=8.6 Гц, 2Н), 8.03 (d, J=8.6 Гц, 2Н), 9.89 (s, 1H), 10.30 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 107.25, 115.16, 115.31, 116.46, 116.91, 120.96, 123.65, 127.69, 128.50, 129.29, 132.85, 136.26, 142.13, 147.69, 150.38, 156.04. 163.75, 168.48.
3-амино-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-77
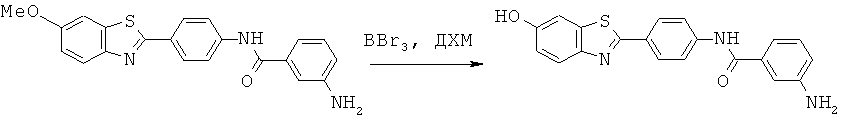
Получен в соответствии с описанием раздела Деметилирование с применением 3-амино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (50 мг, 0,13 ммоль) в сухом ДХМ (3 мл) и BBr3 (1,0М раствор в ДХМ, 0,67 мл, 0,67 ммоль) с получением титульного соединения (29 мг, 60%) в виде светло-коричневого твердого вещества после обработки и флэш-хроматографии (1:1 гексан/EtOAc, затем EtOAc).
1Н ЯМР (250 МГц, ДМСО-d6) δ 5.37 (s, 2Н), 6.77 (d, J=7.3 Гц, 1Н), 6.98 (dd, J=8.5, 2.1 Гц, 1Н), 7.07-7.20 (m, 3Н), 7.40 (d, J=2.1 Гц, 1Н), 7.82 (d, J=8.5 Гц, 1Н), 7.93-8.00 (m, 4H), 9.92 (s, 1Н), 10.37 (s, 1Н);13С ЯМР (62.5 МГц, ДМСО-d6) δ 106.80, 112.92, 114.87, 116.04, 117.19, 135.65, 123.21, 147.20, 155.60, 128.88, 163.35, 166.72, 141.71, 147.20, 148.85, 155.60, 163.35, 166.72
4-амино-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-57

Получен в соответствии с описанием раздела Деметилирование с применением 4-амино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (50 мг, 0,13 ммоль) в сухом ДХМ (3 мл) и BBr3 (1,0М раствор в ДХМ, 0,67 мл, 0,67 ммоль) с получением титульного соединения (27 мг, 56%) в виде коричневого твердого вещества после обработки и флэш-хроматографии (1:1 гексан/EtOAc, затем EtOAc).
1Н ЯМР (250 МГц, ДМСО-d6) δ 5.84 (s, 2Н), 6.62 (d, J=8.5 Гц, 2Н), 6.98 (dd, J=1.5, 8.8 Гц, 1Н), 7.39 (d, J=1.5 Гц, 1Н), 7.75 (d, J=8.5 Гц, 2Н), 7.82 (d, J=8.8 Гц, 1Н), 7.95 (br s, 4H), 9,90 (vbr s, 1Н), 10.05 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 106.17, 112.65, 115.54, 119.82, 121.00, 122.60, 126.79, 127.48, 129.15, 135.38, 141.64, 146.88, 151.51, 155.11, 163.30, 165.56.
2-диметиламино-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-111
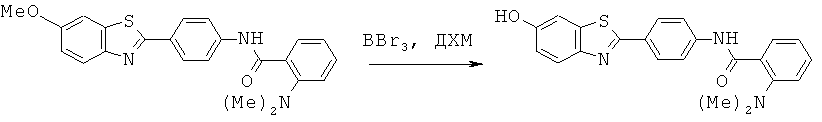
Получен в соответствии с описанием раздела Деметилирование с применением 2-диметиламино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (40 мг, 0,09 ммоль) в сухом ДХМ (3 мл) и BBr3 (1,0М раствор в ДХМ, 0,5 мл, 0,5 ммоль) с получением титульного соединения (23 мг, 59%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (4:1 ДХМ/EtOAc, затем EtOAc).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.82 (s, 6Н), 6.93 (d, J=8.5 Гц, 1H), 7.11 (m, 1H), 7.23 (d, J=8.5 Гц, 1H), 7.28 (s, 1H), 7.44 (m, 1H), 7.74 (d, J=8.5 Гц, 1H), 7.78-7.85 (m, 3Н), 7.85-7.95 (m, 2H), 9.69 (s, 1H), 11.81 (s, 1H);13С ЯМР (100.5 МГц, CDCl3/ДМСО-d6) δ 44.88, 107.08, 116.46, 119.91, 120.32, 123.21, 123.58, 127.73, 127.98, 129.00, 130.88, 132.48, 136.35, 141.74, 147.85, 152.12, 156.14, 163.74, 165.87.
4-диметиламино-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT02-177

Получен в соответствии с описанием раздела Деметилирование с применением 4-диметиламино-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,50 г, 1,24 ммоль) в сухом ДХМ (50 мл) и BBr3 (1,0М раствор в ДХМ, 6,2 мл, 6,2 ммоль) с получением титульного соединения (0,45 г, 93%) в виде желтого твердого вещества после обработки и флэш-хроматографии (4:1 ДХМ/EtOAc, затем EtOAc).
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.00 (s, 6Н). 6.75 (d, J=8.5 Гц, 2H), 7.00 (d, J=9.1 Гц, 1H), 7.43 (s, 1H), 7.79 (d, J=8.5 Гц, 1H), 7.92-8.02 (m, 5H), 10.07 (s, 1H), 10.24 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 40.59, 107.23, 111.20, 116.50, 120.68, 121.07, 123.51, 127.61, 128.10, 129.87, 136.11, 142.63, 147.57, 152.98, 156.21, 163.68, 165.85
Фторированные гидроксиамиды
4-нитро-3-трифторметил-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-7

Получен в соответствии с описанием раздела Деметилирование с применением 4-нитро-3-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,10 г, 0,21 ммоль) в сухом ДХМ (10 мл) и BBr3 (1,0М раствор в ДХМ, 1,1 мл, 1,1 ммоль) с получением титульного соединения (0,07 г, 71%) в виде желтого твердого вещества после обработки и флэш-хроматографии (3:1 EtOAc/гексан).
1Н ЯМР (400 МГц, ДМСО-d6) δ 6.93 (dd, J=8.5, 2.4 Гц, 1Н), 7.35 (d, J=2.4 Гц, 1Н), 7.78 (d, J=8.5 Гц, 1Н), 7.91 (dd, J=8.9, 2.0 Гц, 2Н), 8.00 (dd, J=8.9, 2.0 Гц, 2Н), 8.30 (d, J=8.2 Гц, 1H), 8.44 (dd, J=8.2, 1.7 Гц, 1Н), 8.48 (s, 1Н), 9.82 (s, 1Н), 10.86 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 107.46, 116.74, 121.20, 121.35, 122.01 (q, J=33 Гц), 123.92, 126.44, 128.09, 129.69, 134.65, 136.52, 139.39, 141.32, 147.82, 149.38, 156.33, 163.41, 163.66 (1 отсутствует).
4-амино-3-трифторметил-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT02-45

Получен в соответствии с описанием раздела Деметилирование с применением 4-амино-3-трифторметил-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,30 г, 0,68 ммоль) в сухом ДХМ (10 мл) и BBr3 (1,0М раствор в ДХМ, 5,42 мл, 5,42 ммоль) с получением титульного соединения (0,064 г, 22%) в виде оранжевого твердого вещества после обработки и флэш-хроматографии (3:1 ДХМ/EtOAc).
ИКС 3610-2880 (br), 3378. 3259, 1650, 1611, 1525, 1502, 1486, 1456, 1439, 1406, 1318, 1277, 1243, 1181, 1144, 1110, 1051, 974, 907, 832 cm-1;1H ЯМР (250 МГц, ацетон-d6) δ 5.85 (s, 2H), 7.02 (d, J=8.8 Гц, 1Н), 7.07 (dd, J=8.8, 2.1 Гц, 1Н), 7.45 (d, J=2.1 Гц, 1Н), 7.84 (d, J=8.8 Гц, 1Н), 7.98-8.08 (m, 5H), 8.16 (s, 1Н), 8.81 (br s, 1Н). 9.71 (s, 1H).
4-(2,2,2-трифторэтокси)-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT02-149

Получен в соответствии с описанием раздела Деметилирование с применением 4-(2,2,2-трифторэтокси)-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,20 г, 0,437 ммоль) в сухом ДХМ (15 мл) и BBr3 (1,0М раствор в ДХМ, 2,18 мл, 2,18 ммоль) с получением титульного соединения (0,174 г, 89%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (3:1 EtOAc/гексан).
1Н ЯМР (250 МГц, ДМСО-d6) δ 4.90 (q, J=8.8 Гц, 2Н), 6.98 (dd, J=8.8, 2.1 Гц, 1Н), 7.22 (d, J=8.5 Гц, 2Н), 7.40 (d, J=2.1 Гц, 1Н), 7.83 (d, J=8.5 Гц, 1Н), 7.95-8.04 (m, 6H), 9.86 (s, 1Н), 10.42 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 64.81 (q, JCF=35 Гц), 106.24, 113.94, 115.63, 120.10, 122.74, 123.07 (q, JCF=278 Гц), 126.95, 128.30, 128.36, 129.62, 135.63, 141.19, 147.12, 155.28, 159.27, 163.28, 164.90.
4-(3,3,3-трифторпропокси)-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-41

Получен в соответствии с описанием раздела Деметилирование с применением 4-(3,3,3-трифторпропокси)-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,30 г, 0,63 ммоль) в сухом ДХМ (30 мл) и BBr3 (1,0М раствор в ДХМ, 3,2 мл, 3,2 ммоль) с получением титульного соединения (0,103 г, 35%) в виде светло-оранжевого твердого вещества после обработки и флэш-хроматографии (20:1 ДХМ/МеОН).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.74-2.83 (m, 2Н), 4.26 (t, J=5.8 Гц, 2Н), 6.93 (dd, J=8.8, 2.4 Гц, 1Н), 7.07 (d, J=8.8 Гц, 2Н), 7.35 (d, J=2.4 Гц, 1Н), 7.77 (d, J=8.8 Гц, 1Н), 7.91-7.97 (m, 6H), 9.81 (s, 1Н), 10.33 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 33.22 (q, JCF=28 Гц), 60.67 (q, JCF=3.9 Гц), 106.27, 113.61, 115.63, 120.10, 122.76, 125.73 (q, JCF=276 Гц), 126.96, 127.31, 128.27, 129.54, 135.64, 141.26, 147.16, 155.28, 160.36, 163.34, 165.14.
4-(4,4,4-трифторбутокси)-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT02-171

Получен в соответствии с описанием раздела Деметилирование с применением 4-(4,4,4-трифторбутокси)-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,10 г, 0,206 ммоль) в сухом ДХМ (10 мл) и BBr3 (1,0М раствор в ДХМ, 1,0 мл, 1,0 ммоль) с получением титульного соединения (17 мг, 17%) в виде желтого твердого вещества после обработки, флэш-хроматографии (3:1 EtOAc/гексан) и перекристаллизации из EtOAc.
1Н ЯМР (250 МГц, ДМСО-d6) δ 1.94-2.01 (m, 2Н), 2.40-2.55 (m, 2H), 4.13 (t, J=5.5 Гц, 2Н), 6.97 (d, J=8.8 Гц, 1Н), 7.08 (d, J=8.2 Гц, 2Н), 7.39 (s, 1H), 7.81 (d, J=8.8 Гц, 1Н), 7.91-8.05 (m., 6Н), 9.84 (s, 1Н), 10.35 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 22.01 (q, JCF=3.1 Гц), 29.95 (q, JCF=28.0 Гц), 66.60, 107.24, 114.69, 116.53, 120.94, 123.64, 127.34, 127.73, 128.04 (q, JCF=276 Гц), 128.68, 130.20, 136.27, 142.06, 147.70, 156.03, 161.63, 163.79, 165.63.
2-гидрокси-N-[3-гидрокси-4-(6-гидрокси-1,3-бензотиазол-2-ил)фенил]-5-(трифторметокси)бензамид
№ соединения SKT05-39

Получен в соответствии с описанием раздела Деметилирование с применением 2-метокси-N-[3-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)фенил]-5-(трифторметокси)бензамида (0,30 г, 0,595 ммоль) в сухом ДХМ (12 мл) и BBr3 (1,0М раствор в ДХМ, 1,9 мл, 1,9 ммоль) при -78°С в атмосфере аргона. По каплям дополнительно добавили BBr3 (1,0М раствор в ДХМ, 1,9 мл, 1,9 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 дней с получением титульного соединения (88 мг, 32%) в виде светло-желтого твердого соединения после обработки и флэш-хроматографии (4,2:0,3 гексан/EtOAc/MeOH).
1Н ЯМР (400 МГц, ДМСО-d6) δ 6.98 (dd, J=9.0, 2.3 Гц, 1Н), 7.09 (d, J=9.0 Гц, 1Н), 7.26 (dd, J=8.6, 0.9 Гц, 1Н), 7.39 (d, J=2.3 Гц, 1Н), 7.43 (dd, J=9.0, 2.3 Гц, 1Н), 7.62 (d, J=0.9 Гц, 1Н), 7.82 (d, J=9.0 Гц, 1Н), 7.84 (d, J=2.3 Гц, 1Н), 7.96 (d, J=8.6 Гц, 1Н), 9.74 (s, 1H), 10.54 (s, 1H), 11.68 (s, 1H), 11.2-12.2 (br s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 106.96, 108.30, 112.56, 114.88, 116.55, 119.08, 120.39, 120.70 (q, JCF=255 Гц). 122.50, 122.91, 126.76, 129.05, 135.54, 140.87, 141.67, 145.45, 155.96, 156.69, 157.00, 162.73, 164.92.
4-фтор-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT02-163

Получен в соответствии с описанием раздела Деметилирование с применением 4-фтор-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (100 мг, 0,26 ммоль) в сухом ДХМ (10 мл) и BBr3 (1,0М раствор в ДХМ, 1,3 мл, 1,3 ммоль) с получением титульного соединения (96 мг, 99%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (1:1 гексан/EtOAc).
1Н ЯМР (400 МГц, ДМСО-d6) δ 6.93 (dd, J=8.5, 2.4 Гц, 1Н), 7.34 (t, J=8.8 Гц, 2Н), 7.35 (d, J=2.4 Гц, 1Н), 7.77 (d, J=8.5 Гц, 1Н), 7.91 (d, J=8.8 Гц, 2Н), 7.96 (d, J=8.8 Гц, 2Н), 8.01 (dd, J=8.8, 5.5 Гц, 2Н), 9.82 (s, 1Н), 10.48 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 106.30, 114.86 (d, JCF=22.5 Гц). 115.69, 120.23, 122.80, 127.04, 128.56, 130.12 (d, JCF=8.8 Гц), 130.84 (d, JCF=1.9rn), 135.71, 141.03, 147.18, 155.33, 163.34, 164.21 (d, JCF=252 Гц), 164.74.
Титульное соединение представлено в WO 2006/014382.
2-трифторметил-N-[4-(6-гидрокси-1,3-бензотиазол-2-ил)фенил]-4-(гидрокси)бензамид
№ соединения SKT05-17
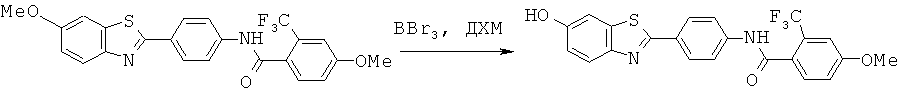
Получен в соответствии с описанием раздела Деметилирование с применением 2-трифторметил-N-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]-4-(метокси)бензамида (0,30 г, 0,655 ммоль) в сухом ДХМ (15 мл) и BBr3 (1,0М раствор в ДХМ, 1,4 мл, 1,4 ммоль) при -78°С в атмосфере аргона. Перемешивание продолжали при -78°С в течение 1 часа, затем реакционную смесь оставили нагреваться до комнатной температуры на ночь. Дополнительно добавили BBr3 (1,0М в ДХМ, 1,4 мл, 1,4 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 24 часов с получением титульного соединения (0,175 г, 62%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (15:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 6.99 (dd, J=8.5, 2.1 Гц, 1Н), 7.13 (d, J=8.5 Гц, 1Н), 7.17 (s, 1H), 7.41 (d, J=2.1 Гц, 1Н), 7.59 (d, J=8.5 Гц, 1Н), 7.83 (d, J=8.5 Гц, 2Н), 7.88 (s, 1Н), 7.99 (d, J=8.5 Гц, 2Н), 9.60-10.64 (vbr s, 2Н), 10.70 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 106.16, 112.96 (q, JCF=3.9 Гц), 115.55, 117.77, 119.43, 122.71, 123.04 (q, JCF=274 Гц), 126.37, 126.93, 128.04 (q, JCF=32 Гц), 128.31, 129.99, 135.52, 140.98, 147.01, 155.25, 158.48, 162.94, 165.78.
Синтез 2-гидрокси-N-[4-(6-гидрокси-1,3-бензотиазол-2-ил)фенил]-5-(трифторметокси)бензамида
№ соединения SKT05-13

Получен в соответствии с описанием раздела Деметилирование с применением 2-метокси-N-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]-5-(трифторметокси)бензамида (0,30 г, 0,633 ммоль) в сухом ДХМ (15 мл) и BBr3 (1,0М раствор в ДХМ, 1,4 мл, 1,4 ммоль) при -78°С в атмосфере аргона. Дополнительно добавили ВВгз (1,ОМ в ДХМ, 1,4 мл, 1,4 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 24 часов с получением титульного соединения (0,255 г, 90%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (10:1 ДХМ/МеОН).
1Н ЯМР (400 МГц, ДМСО-d6) δ 6.93 (dd, J=8.9, 2.4 Гц, 1Н), 7.05 (d, J=8.9 Гц, 1Н), 7.40 (d, J=2.4 Гц, 1Н), 7.39-7.42 (m, 1Н), 7.78 (d, J=8.9 Гц, 1Н), 7.80 (m, 1Н), 7.84 (d, J=8.5 Гц, 2Н), 7.97 (d, J=8.5 Гц, 2Н), 9.83 (s, 1Н), 10.58 (s, 1Н), 11.35-12.08 (vbr s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 107.44, 116.73, 119.21, 120.65, 120.85 (q, JCF=256 Гц,), 121.39, 122.79, 123.94, 127.10, 128.10, 129.50, 136.50, 140.92, 140.99, 147.82, 156.31, 156.87, 163.69, 165.09.
4-гидрокси-N-[4-(6-гидрокси-1,3-бензотиазол-2-ил)-3-(трифторметил)фенил]бензамид
№ соединения SKT04-179
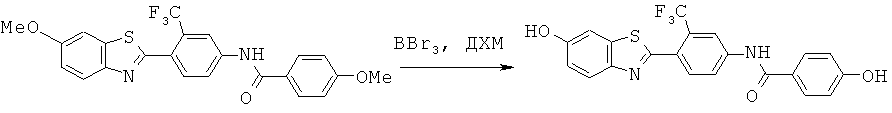
Получен в соответствии с описанием раздела Деметилированив с применением N-[3-трифторметил-4-(6-метоксибензотиазол-2-ил)фенил]-4-(метокси)бензамида (90 мг, 0,196 ммоль) в сухом ДХМ (5 мл) и BBr3 (1,0М раствор в ДХМ, 0,413 мл, 0,413 ммоль) при -78°С с получением титульного соединения (68 мг, 81%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (1:1 гексан/EtOAc).
1Н ЯМР (250 МГц, CD3OD) δ 6.90 (d, J=8.2 Гц, 2Н), 7.05 (d, J=8.8 Гц, 1Н), 7.34 (s, 1H), 7.70 (d, J=8.2 Гц, 1H), 7.85 (d, J=8.2 Гц, 1H), 7.88 (d, J=8.2 Гц, 2Н), 8.11 (d, 7=8.2 Гц, 1Н), 8.36 (s, 1H);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 106.20, 115.32, 116.22, 118.31 (q, JCF=2.9 Гц), 122.54, 123.54 (q, JCF=274 Гц), 123.83. 125.41, 126.98, 128.87 (q, JCF=31 Гц), 129.87, 132.86, 137.44, 141.06, 147.06, 155.69, 161.01, 161.17, 166.43.
4-фтор-3-нитро-N-[4-(6-гидроксибензотиазол-2-ил)фенил]бензамид
№ соединения SKT03-129
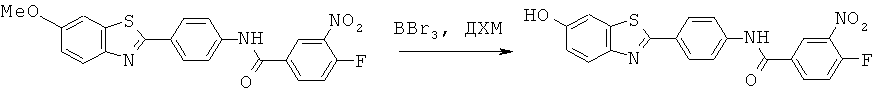
Получен в соответствии с описанием раздела Деметилирование с применением 4-фтор-3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (0,10 г, 0,24 ммоль) в сухом ДХМ (10 мл) и BBr3 (1,0М раствор в ДХМ, 1,2 мл, 1,2 ммоль) с получением титульного соединения (0,062 г, 63%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (2:1 гексан/EtOAc, затем 2:1:0,1 EtOAc/гексан/МеОН и заключительное элюирование 4:1 EtOAc/MeOH).
1Н ЯМР (250 МГц, ДМСО-d6) δ 6.99 (dd, J=8.8, 2.1 Гц, 1H), 7.42 (d, J=2.1 Гц, 1H), 7.83 (d, J=8.8 Гц, 2Н), 7.97 (d, J=8.8 Гц, 2Н), 8.04 (d, J=8.5 Гц, 2Н), 8.40-8.45 (m, 1H), 8.79 (dd, JHH=1.2, JHF=7.0 Гц, 1H), 9.91 (s, 1H), 10.83 (s, 1H);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 106.24, 115.68, 118.18 (d, JCF=21.5 Гц), 120.46, 122.77, 125.68, 126.90, 128.92, 131.16 (d, JCF=3.9 Гц), 135.52 (d, JCF=11.7 Гц), 135.61, 136.36 (d, JCF=7.8 Гц), 140.43, 147.09, 155.33, 156.41 (JCF=269 Гц), 162.18, 162.97.
Нвфторированные метиламиды
N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамид
№ соединения SK696-32

Получен в соответствии с описанием раздела Амидное связывание с применением 2-(4-аминофенил)-6-метилбензотиазола (1,0 г, 4,16 ммоль) и бензоилхлорида (0,58 г, 4,16 ммоль) в сухом ТГФ (10 мл), содержащем триэтиламин (0,46 г, 4,58 ммоль), с получением титульного соединения (1,23 г, 86%) в виде бесцветного твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.44 (s, 3Н), 7.34 (dd, J=8.2, 1.2 Гц, 1Н), 7.53-7.56 (m, 2H), 7.59-7.63 (m, 1Н), 7.89-7.91 (m, 2H), 7.96-7.99 (m, 4H), 8.06 (d, J=9.0 Гц, 2H), 10.55 (s, 1Н);13C ЯМР (100 МГц, ДМСО-d6) δ 21.47, 120.95, 122.19, 122.65, 128.12, 128.21, 128.45, 128.64, 128.87, 132.21, 135.00, 135.19, 135.48, 142.38, 152.32, 166.29, 166.32.
2-нитро-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамид
№ соединения SK2033-51

Получен в соответствии с описанием раздела Амидное связывание с применением 2-(4-аминофенил)-6-метилбензотиазола (0,59 г, 2,45 ммоль) и 2-нитробензоилхлорида (0,50 г, 2,69 ммоль) в сухом пиридине (10 мл) с получением титульного соединения (0,94 г, 98%) в виде коричневых кристаллов после перекристаллизации из 1,2-дихлорэтана.
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.45 (s, ЗН), 7.34 (d, J=8.2 Гц, 1Н), 7.75-7.93 (m, 7H), 8.08 (d, J=8.2 Гц, 2H), 8.18 (d, J=7.9 Гц, 1Н), 10.99 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 21.15, 119.73, 121.11, 121.949, 123.83, 127.55, 128.98, 130.29, 132.76, 133.47, 134.48, 134.80, 141.08, 146.17, 151.68, 164.38, 165.80.
3-нитро-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамид
№ соединения SK2033-46
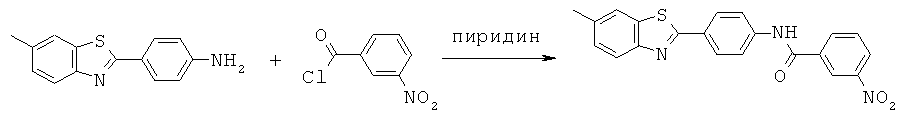
Получен в соответствии с описанием раздела Амидное связывание с применением 2-(4-аминофенил)-6-метилбензотиазола (0,5 г, 2,08 ммоль) и 3-нитробензоилхлорида (0,77 г, 4,06 ммоль) в сухом пиридине (10 мл) с получением титульного соединения (0,75 г, 93%) после обработки и флэш-хроматографии (2:1 гексан/EtOAc, затем 1:1 гексан/EtOAc, затем EtOAc).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.43 (s, 3Н), 7.32 (d, J=8.2 Гц, 1Н), 7.80-7.84 (m, 2H), 7.88 (d, J=8.5 Гц, 1Н), 7.98 (d, J=8.8 Гц, 2H), 8.06 (d, J=8.8 Гц, 2H), 8.41-8.43 (m, 2H), 8.80 (s, 1Н), 10.82 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 21.1, 120.46, 121.09, 121.95, 122.46, 125.77, 127.38, 127.57, 128.73, 129.32, 134.49, 134.79, 136.00, 141.02, 147.60, 151.68, 163.31, 165.78.
4-нитро-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамид
№ соединения SK2033-67

Получен в соответствии с описанием раздела Амидное связывание с применением 1,2-дихлорэтан 2-(4-аминофенил)-6-метилбензотиазола (2,5 г, 10,4 ммоль) и 4-нитробензоилхлорида (2,12 г, 11,4 ммоль) в сухом пиридине (30 мл) с получением титульного соединения (4,0 г, 99%) в виде небольших коричневых игольчатых частиц после перекристаллизации из смеси ДМФ/вода.
1Н ЯМР (250 МГц, CDCl3/ДМСО-d6) δ 1.79 (s, 3Н), 6.59 (d, J=8.5 Гц, 1Н), 7.04 (s, 1Н), 7.15 (d,J=8.2 Гц, 1Н), 7.28 (d, J=8.8 Гц, 2H), 7.34 (d, J=8.5 Гц, 2H), 7.54 (d, J=8.5 Гц, 2H), 7.63 (d, J=8.5 Гц, 2H), 9.96 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 20.98, 120.27, 121.05, 121.86, 122.91, 127.27, 127.48, 128.59, 128.89, 134.35, 134.65, 140.04, 140.94, 148.92, 151.60, 163.65, 165.53.
Для ссылки см. работу Вайссванга с соавторами (Weisswange et al.).
2-амино-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамид
№ соединения SK2033-55
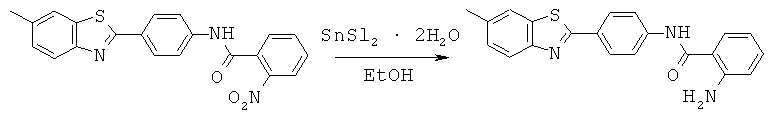
Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 2-нитро-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамида (0,5 г, 1,28 ммоль) и дигидрата хлорида олова (II) (1,45 г, 6,42 ммоль) в EtOH (50 мл) с получением титульного соединения (0,063 г, 14%) в виде коричневых игольчатых частиц после перекристаллизации из EtOH.
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.44 (s, 3Н), 6.40 (s, 2H), 6.57-6.63 (m, 1H), 6.77 (d, J=8.2 Гц, 1H), 7.19-7.25 (m, 1H), 7.34 (d, J=8.5 Гц, 1H), 7.66 (d, J=8.2 Гц, 1H), 7.89-7.92 (m, 2H), 7.94 (d, J=8.5 Гц, 2H), 8.04 (d, J=8.5 Гц, 2H), 10.30 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 21.40, 116.00, 116.22, 116.99, 120.46, 121.25, 122.17, 127.71 (С×2), 128.55, 128.70, 132.40, 134.82, 134.94, 141.64, 148.98, 152.05, 166.49, 168.25.
3-амино-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамид
№ соединения SK2033-72

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 3-нитро-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамида (0,30 г, 0,77 ммоль) и дигидрата хлорида олова (II) (1,39 г, 6,16 ммоль) в EtOH (25 мл) с получением титульного соединения (0,131 г, 47%) в виде светло-желтого твердого вещества после флэш-хроматографии (1:1 гексан/EtOAc).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.39 (s, ЗН), 5.31 (s, 2H), 6.72 (dd, J=7.9, 2.1 Гц, 1H), 7.03-7.07 (m, 2H), 7.08-7.12 (m, 1H), 7.28 (d, J=8.5 Гц, 1H), 7.83-7.86 (m, 2H), 7.94 (d, J=8.8 Гц, 2H), 7.98 (d, J=8.8 Гц, 2H), 10.37 (s, 1H);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 20.96, 113.13, 115.38, 117.03, 119.85, 121.02, 121.76, 127.17, 127.41, 127.79, 128.42, 134.29, 134.51, 135.49, 141.78, 147.83, 151.62, 165.76, 166.53.
4-амино-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамид
№ соединения LS-T107

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 4-нитро-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамида (0,39 г, 1,0 ммоль) и дигидрата хлорида олова (II) (1,13 г, 5,00 ммоль) в EtOH (20 мл) с получением титульного соединения (0,30 г, 83%) в виде светло-желтого твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.44 (s, 3Н), 5.85 (s, 2H), 6.61 (d, J=8.2 Гц, 2Н), 7.33 (d, J=8.5 Гц, 1H), 7.75 (d, J=8.2 Гц, 2H), 7.80-7.92 (m, 2H), 7.97 (d, J=8.5 Гц, 2H), 8.02 (d, J=8.5 Гц, 2H), 10.07 (s, 1H);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 20.98, 112.73, 119.73, 121.02, 121.48, 121.73, 127.17, 127.38, 129.23, 134.29, 134.45, 142.18, 151.33, 151.65, 165.58, 165.87 (1 отсутствует).
2-диметиламино-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамид
№ соединения SKT01-5

Получен в соответствии с описанием раздела Аминирование с применением цианоборгидрида натрия (0,35 г, 5,55 ммоль), 2-амино-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамида (0,40 г, 1,11 ммоль) и параформальдегида (0,34 г, 11,13 ммоль) в АсОН (10 мл) с получением титульного соединения (0,312 г, 73%) в виде светло-желтых кристаллов после перекристаллизации из ЕЮН.
1Н ЯМР (250 МГц, CDCl3) δ 2.49 (s, 3Н), 2.86 (s, 6H), 7.25-7.35 (m, 3Н), 7.48-7.55 (m, 1H), 7.67 (s, 1H), 7.81 (d, J=8.5 Гц, 2H), 7.93 (d, J=8.2 Гц, 1H), 8.08 (d, J=8.5 Гц, 2H), 8.28 (dd, J=7.6, 1.5, Гц 1H), 12.58 (s, 1H);13С ЯМР (62.5 МГц, CDCl3) δ 21.60, 45.60, 120.01, 120.57, 121.39, 122.43, 125.35, 127.40, 127.93, 128.41, 129.01, 131.76, 132.76, 135.04, 135.19, 141.34, 152.18, 164.31, 166.74 (1 отсутствует).
Применявшиеся условия проведения реакции основаны на способах, описанных в работе Оно с соавторами (Ono et al.), диметилирования анилиновых соединений.
3-диметиламино-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамид
№ соединения SK2033-93

Получен в соответствии с описанием раздела Аминирование с применением цианоборгидрида натрия (0,44 г, 6,95 ммоль), 3-амино-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамида (0,50 г, 1,39 ммоль) и параформальдегида (0,42 г, 13,9 ммоль) в AcOH (8 мл) с получением титульного соединения (0,15 г, 28%) в виде бесцветного твердого вещества обработки и флэш-хроматографии (2:1 гексан/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 2.48 (s, 3H), 2.99 (s, 6H), 6.88 (dd, J=8.2, 2.1 Гц, 1Н), 7.09 (d, J=7.3 Гц, 1Н), 7.26 (m, 2H), 7.32 (d, J=8.5 Гц, 1Н), 7.66 (s, 1Н), 7.78 (d, J=8.5 Гц, 2H), 7.91 (d, J=8.2 Гц, 1Н), 8.05 (d, J=8.5 Гц, 2H), 8.08 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 21.60, 40.54, 111.38, 113.91, 115.82, 120.02, 121.41, 122.52, 127.94, 128.33, 129.45, 129.60, 135.13, 135.26, 135.55, 140.50, 150.75, 152.29, 166.45, 166.63.
Применявшиеся условия проведения реакции основаны на способах, описанных в работе Оно с соавторами (Ono et al.), диметилирования анилиновых соединений.
4-диметиламино-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамид
№ соединения SK2033-71

Получен в соответствии с описанием раздела Аминирование с применением цианоборгидрида натрия (0,44 г, 6,95 ммоль), 3-амино-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамида (0,50 г, 1,39 ммоль) и параформальдегида (0,42 г, 13,9 ммоль) в AcOH (8 мл) с получением титульного соединения (0,04 г, 7%) в виде бесцветного твердого вещества обработки и флэш-хроматографии (3:1 гексан/EtOAc).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.44 (s, 3H), 3.00 (s, 6H), 6.77 (d, J=7.9 Гц, 2H), 7.33 (d, J=8.2 Гц, 1Н), 7.84-7.92 (m, 4H), 7.98 (dist d, J=8.5 Гц, 2H), 8.03 (dist d, J=8.5 Гц, 2H), 10.17 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 39.42, 110.04, 110.15, 119.64, 120.49, 120.99, 121.61, 127.03, 127.17, 127.31, 128.92, 129.06, 134.11, 134.31, 142.10, 151.50, 151.96, 165.22, 165.64.
Применявшиеся условия проведения реакции основаны на способах, описанных в работе Оно с соавторами (Ono et al.), диметилирования анилиновых соединений. 3-гидрокси-N-[4-(6-метил-1,3-бензотиазол-2-ил)фенил]бензамид
№ соединения SK696-54

К перемешиваемому раствору 3-гидроксибензойной кислоты (0,69 г, 5,0 ммоль) в 1:1 ТГФ/ДХМ (20 мл) добавили тионилхлорид (0,65 г, 5,5 ммоль) и каплю ДМФ. Реакционную смесь кипятили с обратным холодильником в течение 2,5 часов. Реакционную смесь охладили до комнатной температуры и смесь перенесли при помощи катетера в перемешиваемый раствор дегидротиотолуидина (1,20 г, 5,0 ммоль) в ТГФ (20 мл) при 0°С. Смесь перемешивали при 0°С в течение 2 часов, затем оставили нагреваться до комнатной температуры на ночь. Желтый осадок собрали при помощи фильтрования в вакууме и промыли ТГФ и водой (600 мл). Твердое вещество осушили при 80°С в сушильном шкафу в течение 5 часов с получением титульного соединения (0,59 г, 33%) в виде светло-желтого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.44 (s, 3Н), 7.02 (dd, J=7.8, 1.6 Гц, 1Н), 7.32 (d, J=7.8 Гц, 1Н), 7.35-7.37 (m, 2H), 7.42 (d, J=7.8 Гц, 1Н), 7.85 (s, 1Н), 7.89 (d, J=8.3 Гц, 1Н), 7.99 (d, J=8.6 Гц, 2H), 8.04 (d, J=8.6 Гц, 2H), 9.69 (br s, 1Н), 10.38 (s, 1Н);13C ЯМР (100 МГц, ДМСО-d6) δ 21.47, 115.14, 118.77, 119.23, 120.90, 122.16, 122.64, 128.09, 128.43, 128.57, 129.89, 134.99, 135.46, 136.61, 142.42, 152.33, 157.89, 166.33 (1 отсутствует).
3-(метиламино)-N-[4-(6-метил-1,3-бензотиазол-2-ил)фенил]бензамид
№ соединения SK2033-94
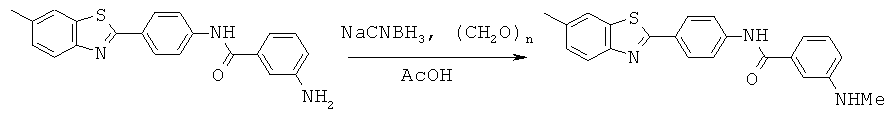
К перемешиваемой смеси 3-амино-N-[4-(6-метилбензотиазол-2-ил)фенил]бензамида (0,50 г, 1,39 ммоль) и параформальдегида (0,059 г, 1,95 ммоль) в МеОН (15 мл) при 0°C по каплям добавили раствор метоксида натрия в МеОН (0,5М, 3,9 мл, 1,95 ммоль). Реакционную смесь затем кипятили с обратным холодильником в течение 1 часа. Реакционную смесь охладили до комнатной температуры, добавили боргидрид натрия (0,081 г, 2,09 ммоль) и продолжили кипячение с обратным холодильником в течение 1 часа. Реакционную смесь охладили до 0°С и добавили 1М раствор NaOH, затем экстрагировали ДХМ (3×70 мл). Объединенные органические экстракты осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением практически бесцветного твердого вещества, которое очистили при помощи флэш-хроматографии (1:1 гексан/EtOAc) с получением титульного соединения (0,096 г, 18%) в виде бесцветного твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.45 (s, 3Н), 2.75 (d, J=5.2 Гц, 3Н), 5.82 (q, J=5.1 Гц, 1Н), 6.75 (dd, J=8.2, 2.0 Гц, 1Н), 7.08 (m, 1Н), 7.14 (d, J=7.4 Гц, 1Н), 7.21-7.25 (m, 1Н), 7.33 (dd, J=8.6, 1.6 Гц, 1H), 7.88 (s, 1Н), 7.89 (d, J=8.6 Гц, 1Н), 7.98 (d, J=8.6 Гц, 2Н), 8.04 (d, J=8.6 Гц, 2Н), 10.31 (s, 1Н);13C ЯМР (100 МГц, ДМСО-d6) 21.47, 30.20, 111.07, 115.16, 115.47, 120.87, 122.19, 122.63, 128.09, 128.44, 129.27, 134.98, 135.46, 136.08, 142.56, 150.45, 152.33, 166.36, 167.100.
Имидазо[2,1-b][1,3]тиазольные промежуточные соединения
2-метил-6-(4-нитрофенил)имидазо[2,1-b][1,3]тиазол
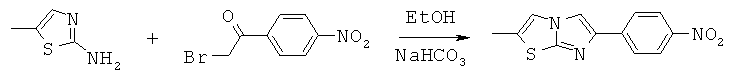
Смесь 2-амино-5-метилтиазола (0,24 г, 2,11 ммоль) и 2-бром-4'-нитроацетофенона (0,5 г, 2,05 ммоль) в EtOH (20 мл) кипятили с обратным холодильником в течение 16 часов. Реакционную смесь охладили и добавили бикарбонат натрия (200 мг, 2,38 ммоль) и нагревание продолжали в течение 1 часа. После охлаждения до комнатной температуры удалили растворитель при пониженном давлении и остаток растворили в ДХМ (75 мл) и промыли водой (30 мл), солевым раствором (30 мл) и осушили (Na2SO4). Удалили растворитель при пониженном давлении и остаток очистили при помощи флэш-хроматографии (50:1 ДХМ/МеОН) с получением титульного соединения (0,143 г, 26%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 2.45 (s, 3Н), 6.49 (s, 1Н), 7.76 (s, 1Н), 7.97 (d, J=8.5 Гц), 2Н), 8.25 (d, J=8.5 Гц, 2Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 13.20, 108.67, 111.25, 124.54, 125.67, 128.65, 141.43, 144.53, 146.37, 150.06.
4-(2-метилимидазо[2,1-b][1,3]тиазол-6-ил)анилин

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 2-метил-6-(4-нитрофенил)имидазо[2.1-b][1,3]тиазола (0,10 г, 0,386 ммоль) и дигидрата хлорида олова (II) (0,69 г, 3,09 ммоль) в ЕЮН (15 мл) с получением светло-оранжевого твердого вещества (66 мг, 75%) после обработки и флэш-хроматографии (1:1 ДХМ/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 2.39 (s, 3Н), 3.44 (br s, 2H), 6.70 (d, J=8.5 Гц, 2Н), 7.08 (s, 1H), 7.47 (s, 1H), 7.59 (d, J=8.5 Гц, 2H);13C ЯМР (62.5 МГц, CDCl3) δ 14.09, 106.20, 115.15, 115.30, 125.04, 125.80, 126.25, 145.69, 146.98, 149.29.
3-метил-6-(4-нитрофенил)имидазо[2,1-b][1,3]тиазол

Смесь 2-амино-4-метилтиазола (0,24 г, 2,11 ммоль) и 2-бром-4'-нитроацетофенона (0,5 г, 2,05 ммоль) в EtOH (20 мл) кипятили с обратным холодильником в течение 16 часов. Реакционную смесь охладили и добавили бикарбонат натрия (200 мг, 2,38 ммоль) и нагревание продолжали в течение 1 часа. После охлаждения до комнатной температуры удалили растворитель при пониженном давлении и к остатку добавили ДХМ. Нерастворимое вещество собрали при помощи фильтрования и очистили при помощи флэш-хроматографии (50:1 ДХМ/МеОН) с получением титульного соединения (0,266 г, 50%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 2.40 (s, 3Н), 7.72 (s, 1H), 8.02 (d, J=8.5 Гц), 2H), 8.21 (d, J=8.5 Гц, 2H), 8.37 (s, 1H);13C ЯМР (100.5 МГц, ДМСО-d6) δ 14.07, 112.53, 117.16, 124.54, 125.60, 127.20, 141.38, 143.56, 146.29, 149.82
4-(3-метилимидазо[2,1-b][1,3]тиазол-6-ил)анилин

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 3-метил-6-(4-нитрофенил)имидазо[2,1-b][1,3]тиазола (0,20 г, 0,772 ммоль) и дигидрата хлорида олова (II) (0,87 г, 3,86 ммоль) в ЕЮН (20 мл) с получением титульного соединения (88 мг, 50%) в виде светло-оранжевого твердого вещества после обработки и флэш-хроматографии (1:1 ДХМ/EtOAc).
1H ЯМР (250 МГц, CDCl3) δ 2.39 (s, 3Н), 3.69 (s, 2H), 6.70 (d, J=8.5 Гц, 2H), 7.07 (s, 1H), 7.46 (s, 1H), 7.59 (d, J=8.5 Гц, 2H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 13.97, 107.10, 114.38, 117.08, 122.91, 124.78, 126.07, 146.98, 148.04, 148.22.
Имидазо[2,1-b][1,3]тиазольные соединения
4-(диметиламино)-N-[4-(2-метилимидазо[2,1-b][1,3]тиазол-6-ил)фенил]бензамид
№ соединения SKT05-149

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(2-метилимидазо[2,1-b][1,3]тиазол-6-ил)анилина (53 мг, 0,231 ммоль) и 4-диметиламинобензоилхлорида (42 мг, 0,231 ммоль) в сухом пиридине (4 мл) с получением титульного соединения (76 мг, 87%)в виде бесцветного твердого вещества после обработки и флэш-хроматографии (25:1 ДХМ/МеОН).
1H ЯМР (250 МГц, ДМСО-d6) δ 2.43 (s, 3Н), 3.01(s, 6H), 6.78 (d, J=8.5 Гц, 2H), 6.89 (s, 1H), 7.81 (s, 4H), 7.89 (d, J=8.5 Гц, 2H), 8.21 (s, 1H), 9.94 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 13.31, 40.16, 107.21, 107.64, 111.22, 120.68, 121.53, 125.27, 128.59, 129.56, 129.65, 139.10, 146.74, 148.81, 152.82, 165.55.
4-(диметиламино)-N-[4-(3-метилимидазо[2,1-b][1,3]тиазол-6-ил)фенил]бензамид
№ соединения SKT05-143

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(3-метилимидазо[2,1-b][1,3]тиазол-6-ил)анилина (68 мг, 0,297 ммоль) и 4-диметиламинобензоилхлорида (55 мг, 0,297 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (74 мг, 66%)в виде бесцветного твердого вещества после обработки и флэш-хроматографии (25:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.41 (s, 3Н), 3.00 (s, 6H), 6.76 (d, J=8.8 Гц, 2Н), 7.70 (s, 1H), 7.77 (m, 4H), 7.88 (d, J=8.8 Гц, 2Н), 8.08 (s, 1H), 9.92 (s, 1H);13C ЯМР (100.5 МГц, ДМСО-d6) δ 14.06, 40.17, 109.00, 111.22, 117.15, 120.66, 121.54, 125.17, 125.63, 129.56, 129.60, 139.00, 145.72, 148.55, 152.81, 165.54.
Имидазо[1,2-а]пиримидиновые промежуточные соединения
Гидробромид 2-(4-нитрофенил)имидазо[1,2-а]пиримидина

Смесь 2-аминопиримидина (0,40 г, 4,22 ммоль) и 2-бром-4'-нитроацетофенона (1,03 г, 4,22 ммоль) в ДМФ (8 мл) перемешивали при комнатной температуре в течение 16 часов. К полученной желтой вязкой смеси добавили EtOAc (15 мл) и осадок собрали при помощи фильтрования и промыли EtOAc (50 мл). После сушки в глубоком вакууме получили желтое твердое вещество (0,67 г, 51%).
ИКС 3107, 3073, 1601, 1522, 1508, 1345, 1313, 1241, 1209, 1110, 855, 799, 745 см-1;1H NMR (400 МГц, ДМСО-d6) δ 7.09 (dd, J=6.6, 3.9 Гц, 1H), 8.26 (d, J=9.0 Гц, 2Н), 8.32 (d, J=9.0 Гц, 2Н), 8.58 (s, 1H), 8.59 (dd,J=3.9, 1.9 Гц, 1Н), 8.99 (dd,J=6.6, 1.9 Гц, 1Н)
4-(имидазо[1,2-а]пиримидин-2-ил)анилин
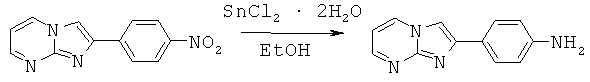
Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением гидробромида 2-(4-нитрофенил)имидазо[1,2-а]пиримидина (0,673 г, 2,18 ммоль) и дигидрата хлорида олова (II) (2,46 г, 10,89 ммоль) в EtOH (50 мл) с получением титульного соединения (0,337 г, 74%) в виде светло-оранжевого твердого вещества после обработки и флэш-хроматографии (4:1 EtOAc/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 5.35 (s, 2Н), 6.64 (d, J=8.5 Гц, 2Н), 6.95-7.00 (m, 1H), 7.67 (d, J=8.5 Гц, 2Н), 8.10 (s, 1H), 8.41-8.44 (m, 1H), 8.86-8.89 (m, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 105.57, 108.98, 114.48, 121.50, 127.49, 134.86, 147.49, 148.58, 149.67, 149.83.
Имидазо[1,2-а]пиримидиновые соединения
4-(диметиламино)-N-(4-имидазо[1,2-а]пиримидин-2-илфенил)бензамид
№ соединения SKT05-95

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(имидазо[1,2-а]пиримидин-2-ил)анилина (80 мг, 0,381 ммоль) и 4-диметиаминобензоилхлорида (70 мг, 0,381 ммоль) в сухом пиридине (8 мл) с получением титульного соединения (49 мг, 36%) в виде практически бесцветного твердого вещества после обработки и флэш-хроматографии (15:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.00 (s, 6H), 6.77 (d, J=8.5 Гц, 2Н), 7.01-7.06 (m, 1H), 7.87-7.98 (m, 6H), 8.31 (s, 1H), 8.49 (bs, 1H), 8.95 (d, J=6.4 Гц, 1H), 9.99 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 40.15, 107.22, 109.15, 111.28, 120.73, 121.59, 126.46, 128.59, 129.62, 135.18, 140.34, 145.99, 148.55, 150.37, 152.95, 165.68
Имидазо[1,2-а]пиридиновые промежуточные соединения
2-(4-нитрофенил)имидазо[1,2-а]пиридин

Смесь 2-аминопиридина (0,20 г, 2,11 ммоль) и бром-4'-нитроацетофенона (0,5 г, 2,05 ммоль) в EtOH (25 мл) кипятили с обратным холодильником в течение 18 часов. Реакционную смесь оставили охлаждаться и добавили бикарбонат натрия (88 мг, 1,05 ммоль) и нагревание продолжали в течение 2 часов. После охлаждения до комнатной температуры удалили растворитель при пониженном давлении и остаток растворили в ДХМ (40 мл), промыли водой (40 мл) и осушили (Na2SO4). Растворитель удалили при пониженном давлении с получением коричневого твердого вещества, которое очистили при помощи флэш-хроматографии (15:1 ДХМ/МеОН) с получением титульного соединения (0,27 г, 54%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 6.82-6.87 (m, 1H), 7.21-7.25 (m, 1H), 7.65 (d, J=8.8 Гц, 1H), 7.99 (s, 1H), 8.11 (d, J=8.8 Гц, 2Н), 8.12-8.17 (m, 1H), 8.29 (d, J=8.8 Гц, 2Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 112.07, 113.31, 117.46, 124.55, 126.28, 126.78, 127.67, 141.02, 142.53, 145.75, 147.02.
4-(имидазо[1,2-а]пиридин-2-ил)анилин

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 2-(4-нитрофенил)имидазо[1,2-а]пиридина (0,216 г, 0,90 ммоль) и дигидратахлорида олова (II) (1,02 г, 4,52 ммоль) в EtOH (25 мл) с получением титульного соединения (0,144 г, 76%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (9:1 EtOAc/ДХМ).
1H ЯМР (400 МГц, ДМСО-d6) δ 5.21 (br s, 2H), 6.60 (d, J=7.9 Гц, 2Н), 6.79 (m, 1H), 7.14 (m, 1H), 7.46 (d, J=8.6 Гц, 1H), 7.61 (d, J=7.9 Гц, 2H), 8.08 (s, 1H), 8.42 (d, J=6.3 Гц, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 107.11, 112.06, 114.40, 116.52, 122.24, 124.46, 126.80, 127.07, 145.06, 146.26, 149.01
6-метил-2-(4-нитрофенил)имидазо[1,2-а]пиридин

Смесь 2-амино-5-пиколина (0,88 г, 8,19 ммоль) и 2-бром-4'-нитроацетофенона (2,0 г, 8,19 ммоль) в ETOH (50 мл) кипятили с обратным холодильником в течение 17 часов. Реакционную смесь оставили охлаждаться и добавили бикарбонат натрия (840 мг, 9,99 ммоль) и нагревание продолжали в течение 18 часов. После охлаждения до комнатной температуры растворитель удалили при пониженном давлении и остаток очистили при помощи флэш-хроматографии (1:1 гексан/EtOAc) с получением титульного соединения (0,84 г, 40%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3Н), 7.16 (d, J=9.1 Гц, 1H), 7.52 (d, J=9.1 Гц, 1H), 8.19 (d, J=8.8 Гц, 2H), 8.28 (d, J=8.8 Гц, 2H), 8.34 (s, 1H), 8.54 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.94, 111.74, 116.85, 122.60, 124.50, 124.92, 126.61, 129.29, 141.19, 142.34, 144.84, 146.87.
4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилин

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 6-метил-2-(4-нитрофенил)имидазо[1,2-а]пиридина (0,423 г, 1,67 ммоль) и дигидрата хлорида олова (II) (1,89 г, 8,36 ммоль) в ETOH (45 мл) с получением титульного соединения (0,216 г, 58%) в виде светло-оранжевого твердого вещества после обработки и, флэш-хроматографии (EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 2.29 (s, 3Н), 3.74 (s, 2H), 6.74 (d, J=8.5 Гц, 2Н), 6.95 (d, J=9.1 Гц, 1Н), 7.47 (d, J=9.1 Гц, 1Н), 7.64 (s, 1H), 7.73 (d, J=8.5 Гц, 2H), 7.85 (s, 1H);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 17.47, 105.99, 113.97, 115.21, 120.74, 122.06, 123.24, 126.23, 126.79, 143.56, 145.25, 147.55.
6-фтор-2-(4-нитрофенил)имидазо[1,2-а]пиридин

К перемешиваемой смеси 2-амино-5-фторпиридина (0,80 г, 7,13 ммоль) и бикарбоната натрия (0,60 г, 7,14 ммоль) добавили суспензию 2-бром-4'-нитроацетофенона (1,74 г, 7,13 ммоль) в хлороформе (10 мл). Перемешиваемую реакционную смесь кипятили с обратным холодильником в течение 20 часов. После охлаждения до комнатной температуры осадок собрали при помощи фильтрования в вакууме и промыли хлороформом (2×40 мл). Твердое вещество затем очистили при помощи флэш-хроматографии (1:1 гексан/EtOAc) с получением титульного соединения (0,596 г, 32%) в виде коричневого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 7.13-7.21 (m, 1H), 7.59-7.66 (m, 1H), 7.99 (s, 1H), 8.07-8.10 (m, 3Н), 8.30 (d, J=8.8 Гц, 2H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 113.43 (d, JCF=Гц), 114.30 (d, JCF=42.0 Гц), 118.17 (d, JCF=26.4 Гц), 118.23 (d, JCF=10.2 Гц), 124.51, 126.77, 140.61, 143.66, 143.75 (d, JCF=Гц), 147.08, 153.26 (d, JCF=233.6 Гц).
4-(6-фторимидазо[1,2-а]пиридин-2-ил)анилин

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 6-фтор-2-(4-нитрофенил)имидазо[1,2-а]пиридина (0,45 г, 1,75 ммоль) и дигидрата хлорида олова (II) (1,97 г, 8,75 ммоль) в EtOH (25 мл) с получением титульного соединения (0,325 г, 82%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (4:1 EtOAc/ДХМ).
1Н ЯМР (250 МГц, ДМСО-d6) δ 5.26 (s, 2H), 6.61 (d J=8.2 Гц, 2H), 7.21-7.28 (m, 1H), 7.51-7.60 (m, 1H), 7.62 (d, J=8.2 Гц, 2H), 8.12 (s, 1H), 8.68 (br s, 1H);13C ЯМР (100.5 МГц, ДМСО-d6) δ 108.73 (d, JCF=1.5 Гц), 113.48 (d, JCF=41 Гц), 114.39, 115.90 (d, JCF=25.7 Гц), 117.00 (d, JCF=10.1 Гц), 121.90, 142.99, 147.63, 149.18, 152.80 (d, JCF=231 Гц).
6-йод-2-(4-нитрофенил)имидазо[1,2-а]пиридин

К перемешиваемой смеси 2-амино-5-йодпиридина (0,80 г, 3,64 ммоль) и бикарбоната натрия (0,34 г, 3,99 ммоль) добавили суспензию 2-бром-4'-бромацетофенона(0,89 г, 3,64 ммоль) в хлороформе (15 мл). Перемешиваемую реакционную смесь кипятили с обратным холодильником в течение 24 часов. После охлаждения до комнатной температуры осадок собрали при помощи фильтрования в вакууме и промыли хлороформом (2×40 мл), водой (40 мл) и затем осушили при 90°С в течение 24 часов с получением титульного соединения (0,827 г, 62%) в виде светло-зеленого твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 7.49 (s, 2Н), 8.22 (d, J=8.8 Гц, 2Н), 8.31 (d, J=8.2 Гц, 2Н), 8.55 (s, 1Н), 8.96 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 77.10, 111.73, 118.66, 124.53, 126.88, 132.22, 133.78, 140.43, 142.73, 144.27, 147.13.
4-(6-йодимидазо[1,2-а]пиридин-2-ил)анилин

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 6-йод-2-(4-нитрофенил)имидазо[1,2-а]пиридина (0,45 г, 1,23 ммоль) и дигидрата хлорида олова (II) (1,39 г, 6,16 ммоль) в EtOH (25 мл) с получением титульного соединения (0,301 г, 73%) в виде желтого твердого вещества после обработки и флэш-хроматографии (4:1 EtOAc/ДХМ).
1Н ЯМР (250 МГц, ДМСО-d6) δ 5.27 (s, 2Н), 6.60 (d, J=7.6 Гц, 2Н), 7.34 (s, 2Н), 7.60 (d, J=7.6 Гц, 2Н), 8.04 (s, 1H), 8.82 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 75.32, 107.03, 114.40, 117.79, 121.57, 127.19, 131.37, 131.93, 143.66, 146.62, 149.28.
6-метил-2-фенилимидазо[1,2-а]пиридин
№ соединения SK2033-32

Перемешиваемую смесь 2-амино-5-пиколина (0,56 г, 5,22 ммоль) и 2-бромацетофенона (1,0 г, 5,02 ммоль) в EtOH (50 мл) кипятили с обратным холодильником в течение 2 часов. Реакционную смесь оставили охлаждаться до комнатной температуры и затем добавили бикарбонат натрия (0,76 г, 9,04 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 15 часов. Затем удалили растворитель при пониженном давлении и остаток растворили в EtOAc (70 мл) и промыли водой (40 мл). Органическую фазу осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением оранжевого твердого вещества. Указанное твердое вещество очистили при помощи флэш-хроматографии (1:1 гексан/EtOAc) с получением титульного соединения (0,753 г, 70%) в виде светло-оранжевого твердого вещества.
1H ЯМР (250 МГц, CDCl3) δ 2.30 (s, 3Н), 7.01 (d, J=9.5 Гц, 1Н), 7.32 (d, J=7.5 Гц, 1Н), 7.39-7.45 (m, 2H), 7.53 (d, J=9.5 Гц, 1Н), 7.76 (s, 1Н), 7.88 (s, 1Н), 7.93 (d, J=7.5 Гц, 2Н);13С ЯМР (62.5 МГц, CDCl3) δ 18.09, 107.91, 116.75, 121.99, 123.36, 125.92, 127.80, 127.85, 128.72, 133.95, 144.73, 145.39.
2-фторэтил-п-толуолсульфонат

К перемешиваемому раствору 2-фторэтанола (1,92 г, 29,97 ммоль) в сухом пиридине (15 мл) в атмосфере аргона при 0°С добавили п-толуолсульфонилхлорид в течение 15 минут, поддерживая температуру, не превышающую 5°С. Затем реакционную смесь перемешивали при 0°С в течение 4 часов, затем при комнатной температуре в течение 12 часов. Реакционную смесь охладили до 0°С и добавили лед (15 г), а затем воду (40 мл) и EtOAc (50 мл). Органический экстракт промыли водой (30 мл), 1М HCl (до достижения кислотной среды водных экстрактов), 10% карбонатом натрия (2×30 мл), солевым раствором (40 мл) и осушили (Na2SO4). Удалили растворитель при пониженном давлении с получением титульного соединения (5,10 г, 78%) в виде бесцветной маслянистой жидкости.
1Н ЯМР (250 МГц, CDCl3) δ 2.44 (s, 3Н), 4.25 (dist d of t, JHF=27 Гц, JHH=4.3 Гц, 2H), 4.56 (dist d of t, JHF=47 Гц, JHH=4.3 Гц, 2H), 7.35 (d, J=8.2 Гц, 2H), 7.79 (d, J=8.2 Гц, 2H);13C ЯМР (62.5 МГц, CDCl3) δ 21.68, 68.52 (d, JCF=21.5 Гц), 80.57 (d, JCF=174 Гц), 127.99, 129.98, 132.65, 145.21.
Имидазо[1,2-а]пиридиновые соединения
4-(диметиламино)-N-[4-(имидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT05-123

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(имидазо[1,2-а]пиридин-2-ил)анилина (70 мг, 0,335 ммоль) и 4-диметиламинобензоилхлорида (62 мг, 0,335 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (70 мг, 59%) в виде светло-желтого твердого соединения после обработки и флэш-хроматографии (20:1 ДХМ/МеОН).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.98 (s, 6H), 6.75 (d, J=9.0 Гц, 2Н), 6.85 (dd, J=6.7, 0.7 Гц, 1Н), 7.21 (dd, J=9.0, 0.7 Гц, 1Н), 7.54 (d, J=9.0 Гц, 1H), 7.84 (d, J=8.7 Гц, 2Н), 7.88 (d, J=9.0 Гц, 2Н), 7.91 (d, J=8.7 Гц, 2Н), 8.31 (s, 1Н), 8.49 (d, J=6.7 Гц, 1Н), 9.93 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 40.16, 108.88, 111.23, 112.55, 116.91, 120.68, 121.49, 125.16, 126.22, 127.20, 129.10, 129.61, 139.81, 144.90, 145.23, 152.85, 165.62.
4-(диметиламино)-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT05-93

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (70 мг, 0,314 ммоль) и 4-диметиламинобензоилхлорида (58 мг, 0,314 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (63 мг, 54%) в виде светло-желтого твердого соединения после обработки и флэш-хроматографии (20:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.27 (s, 3Н), 3.00 (s, 6H), 6.76 (d, J=8.5 Гц, 2Н), 7.08 (d, J=9.5 Гц, 1Н), 7.46 (d, J=9.5 Гц, 1Н), 7.82-7.92 (m, 6H), 8.23 (s, 1Н), 8.30 (s, 1Н), 9.95 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.97, 40.15, 108.62, 111.23, 116.26, 120.67, 121.44, 121.81, 124.60, 126.10, 128.23, 129.16, 129.60, 139.66, 144.24, 144.58, 152.85, 165.64.
N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]пиридин-4-карбоксамид
№ соединения SKT05-107

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (70 мг, 0,314 ммоль) и гидрохлорида изоникотиноилхлорида (56 мг, 0,314 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (92 мг, 89%) в виде светло-желтого твердого соединения после обработки и флэш-хроматографии (10:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3Н), 7.10 (d,.7=9.2 Гц, 1Н), 7.48 (d, J=9.2 Гц, 1Н), 7.85 (d, J=8.2 Гц, 2Н), 7.87-7.89 (m, 2Н), 7.96 (d, J=8.2 Гц, 2H), 8.27 (s, 1Н), 8.32 (s, 1Н), 8.80 (d, J=0.6 Гц, 2H), 10.60 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 17.24, 107.80, 115.41, 120.12, 120.89, 121.09, 123.58, 125.30, 127.26, 129.46, 137.62, 141.48, 143.48, 143.58, 149.62, 163.30.
N-[4-(6-метилимидазо[1,2-a]пиридин-2-ил)фенил]пиридин-3-карбоксамид
№ соединения SKT05-171

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (70 мг, 0,314 ммоль) и гидрохлорида никотиноилхлорида (56 мг, 0,314 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (62 мг, 60%) в виде светло-желтого твердого соединения после обработки и флэш-хроматографии (EtOAc, затем 20:1 EtOAc/МеОН).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.22 (s, 3Н), 7.04 (d, J=9.2 Гц, 1Н), 7.42 (d, J=9.2 Гц, 1Н), 7.53 (dd, J=7.9, 4.9 Гц, 1Н), 7.80 (d, J=8.5 Гц, 2Н), 7.90 (d, J=8.5 Гц, 2Н), 8.20 (s, 1Н), 8.25-8.27 (m, 2Н), 8.72 (d, J=4.8 Гц, 1Н), 9.07 (d, J=2.1 Гц. 1Н), 10.48 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 18.17, 109.05, 116.59, 121.08, 122.02, 124.17, 124.83, 126.45, 128.45, 130.45, 131.27, 136.12, 138.93, 144.52, 144.63, 149.33, 152.76, 164.66.
N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]пиридин-2-карбоксамид
№ соединения SKT06-5

К перемешиваемой суспензии пиколиновой кислоты (56 мг, 0,45 ммоль) в ДХМ (1 мл) добавили тионилхлорид (2 мл), а затем каплю ДМФ. Смесь перемешивали при комнатной температуре в течение 4 часов, затем избыток реагентов и растворителя удалили при пониженном давлении с получением зеленого твердого вещества. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного твердого вещества и 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (70 мг, 0,314 ммоль) в сухом пиридине (4,5 мл) с получением титульного соединения (65 мг, 44%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (20:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3Н), 7.10 (d, J=9.2 Гц, 1H), 7.49 (d, J=9.2 Гц, 1Н), 7.67-7.72 (m, 1H), 7.95 (d, J=8.8 Гц, 2Н), 8.00 (d, J=8.8 Гц, 2Н), 8.05-8.11 (m, 1H), 8.19 (d, J=7.3 Гц, 1H), 8.27 (s, 1H), 8.31 (s, 1H), 8.76 (d, J=4.6 Гц, 1H), 10.74 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.94, 108.81, 116.42, 120.80, 121.76, 122.77, 124.61, 126.29, 127.31, 128.16, 130.34, 138.17, 138.55, 144.38, 144.58, 148.87, 150.41, 162.84.
6-фтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]пиридин-3-карбоксамид
№ соединения SKT05-169

Перемешиваемую суспензию 6-фторникотиновой кислоты (80 мг, 0,414 ммоль) в тионилхлориде (2 мл) кипятили с обратным холодильником в течение 4 часов. Затем удалили избыток реагентов при пониженном давлении с получением неочищенного твердого вещества. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного твердого вещества и 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (92 мг, 0,414 ммоль) в сухом ТГФ (13 мл) и диизопропилэтиламине (106 мкл, 0,608 ммоль) с получением титульного соединения (86 мг, 60%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (EtOAc).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.22 (s, 3Н), 7.05 (dd, J=9.2, 1.2 Гц, 1Н), 7.32 (dd, J=8.5, 2.4 Гц, 1H), 7.42 (d, J=9.2 Гц, 1H), 7.77 (d, J=8.8 Гц, 2Н), 7.90 (d, J=8.8 Гц, 2Н), 8.20 (s, 1H), 8.26 (s, 1H), 8.46 (dt, J=8.5, 2.4 Гц, 1H), 8.78 (d, J=2.1 Гц, 1H), 10.48 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 18.17, 109.06, 109.97, 110.34, 116.58, 121.11, 122.03, 124.84, 126.47, 128.47, 130.00 (d, JCF=3.8 Гц), 130.51, 138.80, 142.58 (d, JCF=9.1 Гц), 144.56 (d, JCF=7.6 Гц), 148.42 (d, JCF=16.0 Гц), 163.43, 164.95 (d, JCF=239 Гц).
6-фтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]пиридин-2-карбоксамид
№ соединения SKT06-53

Перемешиваемую суспензию 2-фторпиридин-6-карбоксильной кислоты (86 мг, 0,448 ммоль) в тионилхлориде (2 мл) кипятили с обратным холодильником в течение 5 часов. Затем удалили избыток реагентов при пониженном давлении с получением неочищенного твердого вещества. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного твердого вещества и 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (100 мг, 0,448 ммоль) в сухом ТГФ (20 мл) и диизопропилэтиламине (94 мкл, 0,539 ммоль) с получением титульного соединения (85 мг, 55%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (2:1 EtOAc/гексан).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.23 (s, 3Н), 7.05 (dd, J=9.2, 1.7 Гц, 1Н), 7.43 (d, J=9.2 Гц, 1Н), 7.45 (dd, J=8.3, 1.7 Гц, 1Н), 7.87-7.92 (m, 4H), 8.04 (dd, J=7.3, 1.7 Гц, 1Н), 8.18-8.24 (m, 1Н), 8.22 (s, 1Н), 8.27 (s, 1Н), 10.48 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 17.94, 108.86, 113.54 (d, JCF=36.5 Гц), 116.43, 121.05 (d, JCF=3.9 Гц), 121.17, 121.76, 124.61, 126.23, 128.17, 130.58, 137.97, 144.30, 144.38, 144.53, 149.23 (d, JCF=11.7 Гц), 161.77, 162.12 (d, JCF=240.6 Гц).
N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-4-нитробензамид
№ соединения SKT06-63

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,20 г, 0,897 ммоль) и 4-нитробензоилхлорида (0,166 г, 0,897 ммоль) в сухом пиридине (13 мл) с получением титульного соединения (0,266 г, 80%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (1:1 EtOAc/MeOH).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.23 (s, 3Н), 7.04 (dd, J=9.3, 1.5 Гц, 1Н), 7.42 (d, J=9.3 Гц, 1H), 7.81 (d, J=8.8 Гц, 2H), 7.90 (d, J=8.8 Гц, 2H), 8.15 (d, J=8.8 Гц, 2H), 8.21 (s, 1Н), 8.26 (s, 1Н), 8.33 (d, J=8.8 Гц, 2H), 10.62 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.95, 108.85, 116.42, 121.09, 121.78, 123.94, 124.63, 126.28, 128.20, 129.66, 130.56, 138.60, 141.12, 144.52, 149.66, 164.27.
N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-4-нитро-3-(трифторметил)бензамид
№ соединения SKT05-165
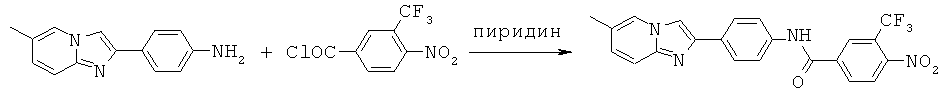
Перемешиваемую суспензию 4-нитро-3-трифторметилбензойной кислоты (0,239 г, 0,986 ммоль) в тионилхлориде (4 мл) кипятили с обратным холодильником в течение 5 часов. Затем удалили избыток реагентов при пониженном давлении с получением неочищенного твердого вещества. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного твердого вещества и 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,20 г, 0,897 ммоль) в сухом пиридине (8 мл) с получением титульного соединения (0,337 г, 85%) в виде желтого твердого вещества после обработки и флэш-хроматографии (25:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3Н), 7.10 (d, J=9.2 Гц, 1Н), 7.48 (d, J=9.2 Гц, 1Н), 7.85 (d, J=8.5 Гц, 2H), 7.98 (d, J=8.5 Гц, 2H), 8.27 (s, 1Н), 8.32 (s, 1Н), 8.35 (d, J=8.8 Гц, 1Н), 8.49 (d, J=8.8 Гц, 1Н), 8.53 (s, 1Н), 10.76 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 17.94, 108.91, 116.43, 121.19, 121.80, 121.86 (JCF=34 Гц), 122.72 (JCF=273 Гц), 124.63, 126.12, 126.33, 127.75 (JCF=5.5 Гц), 128.22, 130.80, 134.26, 138.31, 139.47, 144.40, 144.45, 149.14, 162.81; МСНР (ESI+) 486 (M++Na, 100%), 441 (M++H, 34).
N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-4-гидроксиламино-3-(трифторметил)бензамид
№ соединения SKT05-173

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-4-нитро-3-(трифторметил)бензамида (0,25 г, 0,568 ммоль) и дигидрата хлорида олова (II) (0,64 г, 2,84 ммоль) в ETOH (30 мл) с получением титульного соединения (0,20 г, 87%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (15:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3Н), 7.10 (d, J=9.2 Гц, 1H), 7.40 (d, J=8.5 Гц, 1H), 7.47 (d, J=9.2 Гц, 1H), 7.82 (d, J=8.5 Гц, 2Н), 7.93 (d, J=8.5 Гц, 2Н), 8.13-8.18 (m, 2H), 8.25 (s, 1H), 8.32 (s, 1H), 9.04 (s, 1H), 9.08 (s, 1H), 10.23 (s, 1H);13C ЯМР (67.5 МГц, CDCl3/ДМСО-d6) δ 17.67, 107.55, 111.42 (q, JCF=31.2 Гц), 112.94, 115.83, 120.49, 121.47, 123.42, 123.97 (q, JCF=272 Гц), 124.62, 125.63, 125.97 (q, JCF=5.9 Гц), 127.57, 129.08. 132.51, 138.55, 144.09, 144.40, 150.91, 164.29.
4-амино-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-71

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением Т-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-4-нитробензамида (0,10 г, 0,269 ммоль) и дигидрата хлорида олова (II) (0,30 г, 1,34 ммоль) в EtOH (15 мл) с получением титульного содединения (0,072 г, 78%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (15:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.29 (s, 3Н), 5.79 (s, 2Н), 6.62 (d, J=8.2 Гц, 2Н), 7.10 (d, J=9.2 Гц, 1H), 7.47 (d, J=9.2 Гц, 1H), 7.74 (d, J=8.2 Гц, 2Н), 7.83 (d, J=8.8 Гц, 2Н), 7.90 (d, J=8.8 Гц, 2Н), 8.24 (s, 1H), 8.31 (s, 1H), 9.85 (s, 1H);13С ЯМР (100.5 МГц ДМСО-d6) δ 17.97, 108.54, 113.00, 116.33, 120.56, 121.53, 121.69, 124.58, 126.08, 128.08, 129.17, 129.82, 139.75, 144.27, 144.73, 152.61, 165.69.
4-(метиламино)-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-67

К перемешиваемому раствору 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,10 г, 0,448 ммоль), 1-гидроксибензотриазола (0,06 г, 0,448 ммоль), 4-метиламинобензойной кислоты (0,068 г, 0,448 ммоль) и триэтиламина (62 мкл, 0,045 г, 0,448 ммоль) в сухом ДМФ (5 мл) при 0°С добавили гидрохлорид 1-этил-3-[3-(диметиламино)пропил)]карбодиимида (0,086 г, 0,448 ммоль) в атмосфере аргона. Через 10 минут удалили охлаждающую баню и реакционную смесь перемешивали при комнатной температуре в течении 4 дней. Реакционную смесь затем добавили к воде (150 мл) при перемешивании и осадок собрали при помощи фильтрования. Очистка при помощи флэш-хроматографии (25:1 ДХМ/МеОН) привела к получению титульного соединения (0,053 г, 33%) в виде практически бесцветного твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.23 (s, 3Н), 2.69 (d, J=4.9 Гц, 3Н), 6.30 (q, J=4.9 Гц, 1Н), 6.54 (d, J=8.8 Гц, 2H), 7.04 (dd, J=9.3, 1.5 Гц, 1Н), 7.41 (d, J=9.3 Гц, 1Н), 7.76 (d, J=8.8 Гц, 2Н), 7.77 (d, J=8.8 Гц, 2H), 7.84 (d, J=8.8 Гц, 2H), 8.18 (s, 1Н), 8.25 (s, 1Н), 9.82 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 17.93, 29.79, 108.51, 110.94, 116.34, 120.66, 121.48, 121.65, 124.56, 126.10, 128.03, 129.27, 129.73, 139.75, 144.33, 144.83, 153.10, 165.71.
4-метокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-7

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (70 мг, 0,314 ммоль) и 4-метоксибензоилхлорида (54 мг, 0,314 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (89 мг, 79%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (15:1ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3Н), 3.85 (s, 3Н), 7.08 (d, J=8.5 Гц, 2H), 7.10 (d, J=9.2 Гц, 1Н), 7.48 (d, J=9.2 Гц, 1Н), 7.85 (d, J=8.5 Гц, 2H), 7.93 (d, J=8.5 Гц, 2H), 7.90 (d, J=8.5 Гц, 2H), 8.25 (s, 1Н), 8.32 (s, 1Н), 10.19 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.94, 55.90, 108.65, 114.10, 116.39, 120.89, 121.71, 124.59, 126.18, 127.54, 128.10, 129.81, 130.04, 139.30, 144.37, 144.72, 162.42, 165.32.
4-гидрокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-11
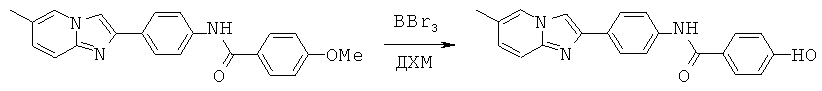
Получен в соответствии с описанием раздела Деметилирование с применением 4-метокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамида (0,07 г, 0,196 ммоль) в сухом ДХМ (5 мл), трибромида бора в ДХМ (1,0М, 0,24 мл, 0,24 ммоль) при -78°С. Реакционную смесь перемешивали при -78°С в течение 1 часа, затем оставили нагреваться до комнатной температуры. Через 18 часов нахождения при комнатной температуре добавили дополнительный объем трибромида бора в ДХМ (1,0М, 0,7 мл, 0,7 ммоль) и перемешивание продолжили при комнатной температуре с получением титульного соединения (0,043 г, 64%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (10:1 ДХМ/МеОН).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.22 (s, 3Н), 6.82 (d, J=8.5 Гц, 2Н), 7.04 (dd, J=9.0, 1.5 Гц, 1Н), 7.41 (d, J=9.0 Гц, 1Н), 7.77 (d, J=8.8 Гц, 2Н), 7.82 (d, J=8.5 Гц, 2Н), 7.85 (d, J=8.8 Гц, 2Н), 8.18 (s, 1Н), 8.25 (s, 1Н), 10.02 (s, 1Н) 9.80-10.81 (br s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 18.17, 108.86, 115.57, 116.53, 120.93, 121.96, 124.79, 126.00, 126.32, 128.37, 129.72, 130.37, 139.60, 144.49, 144.80, 161.25, 165.72.
3,4,5-трифтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-25

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,50 г, 2,24 ммоль) и 3,4,5-трифторбензоилхлорида (0,436 г, 2,24 ммоль) в сухом пиридине (20 мл) с получением титульного соединения (0,617 г, 72%) в виде бесцветного твердого вещества после обработки и перекристаллизации из АсОН.
1Н ЯМР (250 МГц, DMSO-d6) δ 2.32 (s, ЗН), 7.45 (d, J=9.2 Гц, 1Н), 6.65 (d, J=9.2 Гц, 1Н), 7.86 (d, J=8.8 Гц, 2Н), 7.90-7.96 (m, 2Н), 7.93 (d, J=8.8 Гц, 2H), 8.43 (s, 1Н), 8.48 (s, 1Н), 10.51 (s, 1Н).
4-(диметиламино)-3,5-дифтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил] бензамид
№ соединения SKT06-29
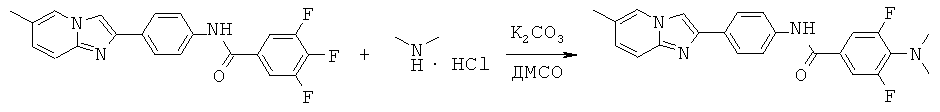
Перемешиваемую смесь 3,4,5-трифтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамида (0,10 г, 0,26 ммоль), гидрохлорида диметиламина (0,087 г, 1,07 ммоль) и карбоната калия (0,147 г, 1,07 ммоль) в сухом ДМСО (3 мл) нагревали при 120°С в течение 22,5 часов. После охлаждения до комнатной температуры реакционную смесь добавили в воду (100 мл) и собрали осадок при помощи вакуумного фильтрования и промыли водой (40 мл). Осадок осушили в сушильном шкафу при 95°С, затем очистили при помощи флэш-хроматографии (25:1 ДХМ/МеОН) с получением титульного соединения (0,084 г, 80%) в виде бесцветного твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3Н), 2.92 (s, 6H), 7.10 (d, J=8.9 Гц, 1Н), 7.47 (d, J=8.9 Гц, 1Н), 7.68 (d, JH,F=10.1 Гц, 2Н), 7.82 (d, J=8.5 Гц, 2Н), 7.94 (d, J=8.5 Гц, 2Н), 8.26 (s, 1Н), 8.32 (s, 1Н), 10.22 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.53, 42.72 (t, JCF=3.9 Гц), 107.60, 111.59 (m), 115.67, 120.26, 121.22, 123.45, 125.46, 126.98 (t, JCF=7.8 Гц), 127.40, 129.22, 131.58 (t, JCF=12.7 Гц), 138.16, 143.89, 144.14, 155.84 (dd, JCF=246 Гц, JCF=7.8 Гц), 162.68.
4-фтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-3-(трифторметил)бензамид
№ соединения SKT06-15

К перемешиваемому раствору 4-фтор-3-трифторметилбензойной кислоты (0,103 г, 0,493 ммоль) в тионилхлориде (3 мл) добавили каплю ДМФ и реакционную смесь кипятили с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры избыток реагентов удалили при пониженном давлении с получением неочищенного остатка. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного остатка и 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,10 г, 0,448 ммоль) в сухой смеси пиридин/ТГФ (1:1, 10 мл) с получением титульного соединения (0,146 г, 78%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (ДХМ/EtOAc 1:1).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.26 (s, 3Н), 7.08 (dd, J=9.0, 1.2 Гц, 1Н), 7.46 (d, J=9.0 Гц, 1Н), 7.68-7.76 (m, 1Н), 7.82 (d, J=9.0 Гц, 2Н), 7.95 (d, J=9.0 Гц, 2Н), 8.23 (s, 1Н), 8.29 (br s, 1Н), 8.33-8.37 (m, 2Н), 10.52 (s, 1Н);13C ЯМР (100 МГц, ДМСО-d6) δ 17.96, 108.85, 116.39, 117.02 (d of q, JCF=32.7, 12.5 Гц), 117.99 (d, JCF=21.0 Гц), 121.04, 121.80, 122.85 (q, JCF=272.4 Гц), 124.63, 126.25, 127.42 (d of q, JCF=4.6, 1.6 Гц), 128.23, 130.35, 132.19 (d, JCF=3.9 Гц), 135.53 (d, JCF=10.2 Гц), 138.62, 144.32, 144.43, 161.08 (d of q, JCF=258.4, 1.6 Гц), 163.44 17.96, 108.85, 116.39.
6-хлор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]пиридин-3-карбоксамид
№ соединения SKT06-13

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,08 г, 0,359 ммоль) и 6-хлорникотиноилхлорида (0,063 г, 0,359 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (0,087 г, 67%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (20:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3Н), 7.10 (d, J=9.1 Гц, 1Н), 7.47 (d, J=9.1 Гц, 1Н), 7.72 (d, J=8.8 Гц, 1Н), 7.82 (d, J=8.5 Гц, 2Н), 7.95 (d, J=8.5 Гц, 2Н), 8.26 (s, 1Н), 8.32 (s, 1Н), 8.36 (d, J=8.8 Гц, 1Н), 8.96 (s, 1Н), 10.56 (s, 1Н);13С ЯМР (100.5 МГц, DMSO-d6) δ 17.97, 108.86, 116.40, 120.92, 121.79, 124.59, 124.63, 126.27, 128.23, 130.42, 130.43, 138.51, 139.50, 144.32, 144.41, 149.77, 153.19, 163.27.
3,4-дифтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]пиридин-3-карбоксамид
№ соединения SKT06-35
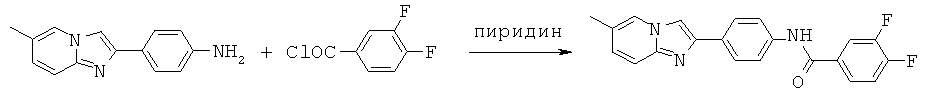
Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,50 г, 2,24 ммоль) и 3,4-дифторбензоилхлорида (0,395 г, 2,24 ммоль) в сухом пиридине (20 мл) с получением титульного соединения (0,556 г, 68%) в виде бесцветного твердого вещества после обработки и перекристаллизации из АсОН.
1Н ЯМР (250 МГц, ДМСО-d6) 8 2.27 (s, 3Н), 7.09 (d, J=9.2 Гц, 1H), 7.46 (d, J=9.2 Гц, 1Н), 7.57-7.68 (m, 1H), 7.81 (d, J=8.8 Гц, 2H), 7.83-7.92 (m, 1H), 7.93 (d, J=8.8 Гц, 2Н), 8.00-8.08 (m, 1H), 8.24 (s, 1H), 8.30 (s, 1H), 10.38 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.94, 108.79, 116.39, 117.57 (d, JCF=18.7 Гц), 118.04 (d, JCF=18.1 Гц), 121.04, 121.76, 124.62, 125.68 (dd, JCF=7.0 Гц, JCF=3.1 Гц), 126.24, 128.18, 130.34, 132.77 (m), 138.69, 144.37, 144.55, 149.57 (dd, JCF=237.4 Гц, JCF=12.5 Гц), 152.04 (dd, JCF=242.1 Гц, JCF=13.3 Гц), 163.60.
3-фтор-4-(диметиламино)-N-[4-(6-метилимидазо [1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-55
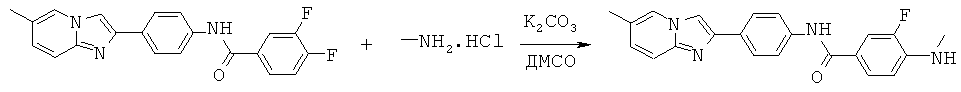
Перемешиваемую смесь 3,4-дифтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамида (0,10 г, 0,275 ммоль), гидрохлорида метиламина (0,37 г, 5,50 ммоль) и карбоната калия (0,76 г, 5,50 ммоль) в сухом ДМСО (2 мл) нагревали при 120°С в течение 60 часов. После охлаждения до комнатной температуры реакционную смесь добавили в воду (100 мл) и собрали осадок при помощи вакуумного фильтрования и промыли водой (40 мл). Осадок осушили в сушильном шкафу при 95°С, затем очистили при помощи флэш-хроматографии (EtOAc) с получением титульного соединения (0,077 г, 75%) в виде бесцветного твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.22 (s, 3Н), 2.74 (d, J=4.9 Гц, 3Н), 6.19-6.21 (m, 1H), 6.68 (t, J=8.8 Гц, 1H), 7.04 (dd, J=9.0, 1.5 Гц, 1H), 7.41 (d, J=9.0 Гц, 1H), 7.65 (dd, J=13.2, 1.7 Гц, 1H), 7.71 (dd, J=8.5, 1.7 Гц, 1H), 7.77 (d, J=8.5 Гц, 2H), 7.85 (d, J=8.5 Гц, 2H), 8.18 (s, 1H), 8.25 (s, 1H), 9.91 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.95, 29.72, 108.61, 110.39 (d, JCF=4.6 Гц), 113.89 (d, JCF=19.5 Гц), 116.38, 120.78, 121.21 (d, JCF=5.4 Гц), 121.70, 124.59, 125.86 (d, JCF=1.6 Гц), 126.15, 128.09, 129.58, 139.44, 141.41 (d, JCF=12.5 Гц), 144.36, 144.76, 150.29 (d, JCF=238 Гц), 164.68 (d, JCF=2.3 Гц).
3,5-дифтор-4-(диметиламино)-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил] бензамид
№ соединения SKT06-59

Перемешиваемую смесь 3,4,5-трифтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамида (0,10 г, 0,275 ммоль), гидрохлорида метиламина (0,44 г, 6,50 ммоль) и карбоната калия (0,90 г, 6,50 ммоль) в сухом ДМСО (2 мл) нагревали при 120°С в течение 47 часов. После охлаждения до комнатной температуры реакционную смесь добавили в воду (150 мл) и собрали осадок при помощи вакуумного фильтрования и промыли водой (40 мл). Осадок осушили в сушильном шкафу при 95°С, затем очистили при помощи флэш-хроматографии (EtOAc/гексан 3:1) с получением титульного соединения (0,046 г, 63%) в виде бесцветного твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ 2.23 (s, 3Н), 2.93-2.95 (m, 3H), 5.88-5.91 (m, 1H), 7.04 (dd, J=9.0, 1.5 Гц, 1H), 7.41 (d, J=9.0 Гц, 1H), 7.56 (dist dd, J=9.0, 2.7 Гц, 1H), 7.61 (dist dd, J=9.0, 2.7 Гц, 1H), 7.76 (d, J=8.8 Гц, 2Н), 7.86 (d, J=8.8 Гц, 2Н), 8.19 (s, 1H), 8.26 (d, J=0.49 Гц, 1H), 9.99 (s, 1H);13C ЯМР (100.5 МГц, ДМСО-d6) δ 17.97, 32.31 (t, JCF=3.8 Гц), 108.71, 111.93 (m), 116.36, 120.55 (t, JCF=7.8 Гц), 120.78, 121.75, 124.62, 126.17, 128.16, 129.79, 130.91 (t, JCF=14 Гц), 139.03, 144.29, 144.55, 150.97 (dd, JCF=239 Гц, JCF=10.1 Гц), 163.40.
4-(диметиламино)-3-фтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-39
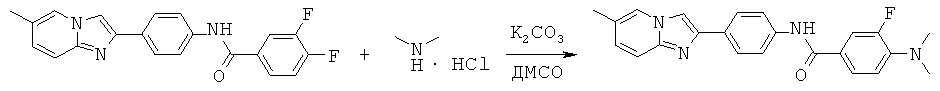
Перемешиваемую смесь 3,4-дифтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамида (0,10 г, 0,275 ммоль), гидрохлорида метиламина (0,045 г, 0,551 ммоль) и карбоната калия (0,080 г, 0,577 ммоль) в сухом ДМСО (3 мл) нагревали при 100°С в течение 18 часов. После охлаждения до комнатной температуры реакционную смесь добавили в воду (100 мл) и собрали осадок при помощи вакуумного фильтрования и промыли водой (50 мл). Осушенное на воздухе твердое вещество затем очистили при помощи флэш-хроматографии (25:1 ДХМ/МеОН) с получением титульного соединения (0,066 г, 62%) в виде бесцветного твердого вещества.
1H ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3Н), 2.93 (s, 6H), 7.01 (t, J=9.2 Гц, 1Н), 7.10 (d, J=9.2 Гц, 1Н), 7.47 (d, J=9.2 Гц, 1Н), 7.73-7.79 (m, 2H), 7.83 (d, J=8.5 Гц, 2H), 7.92 (d, J=8.5 Гц, 2H), 8.25 (s, 1Н), 8.32 (s, 1Н), 10.10 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 17.94, 42.36 (d, J=4.7 Гц), 108.65, 115.92 (d, JCF=23.3 Гц), 116.37, 117.20 (d, JCF=4.7 Гц), 120.86, 121.71, 124.59, 125.13, 125.15, 125.77 (d, JCF=6.2 Гц), 126.17, 128.10, 129.82, 139.19, 143.20 (d, JCF=7.7 Гц), 144.52 (d, JCF=34.3 Гц), 152.81 (d, JCF=243 Гц), 164.30.
3-фтор-4-метокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-49
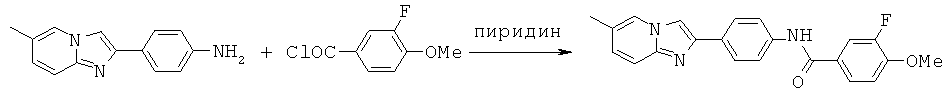
Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,30 г, 1,34 ммоль) и 3-фтор-4-метоксибензоилхлорида (0,25 г, 1,34 ммоль) в сухом пиридине (14 мл) с получением титульного соединения (0,357 г, 71%) в виде небольших бесцветных игольчатых частиц после обработки, флэш-хроматографии (ДХМ/МеОН 18:1) и перекристаллизации из 1,4-диоксана.
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, ЗН), 3.93 (s, ЗН), 7.10 (d, J=9.2 Гц, 1Н), 7.33 (m, 1Н), 7.47 (d, J=9.2 Гц, 1Н), 7.83 (d, J=8.5 Гц, 2H), 7.85-7.91 (m, 2H), 7.93 (d, J=8.5 Гц, 2H), 8.26 (s, 1Н), 8.32 (s, 1Н), 10.23 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) 5 17.96, 56.70, 108.74, 113.71 (d, JCF=2.3 Гц), 115.66 (d, JCF=19.5 Гц), 116.37, 120.89, 121.75, 124.60, 125.40 (d, JCF=3.1 Гц), 126.17, 127.65 (d, JCF=5.4 Гц), 128.16, 129.94, 138.98, 144.31, 144.54, 150.39 (d, JCF=10.8 Гц), 151.28 (d, JCF=244.4 Гц), 164.13.
3,5-дифтор-4-метокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-45
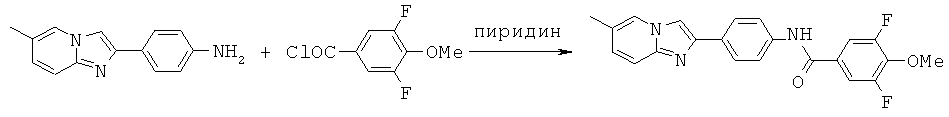
К перемешиваемому раствору 3,5-дифтор-4-метоксибензойной кислоты (0,25 г, 1,34 ммоль) в тионилхлориде (4 мл) добавили каплю ДМФ и реакционную смесь кипятили с обратным холодильником в течение 5 часов. После охлаждения до комнатной температуры избыток реагентов удалили при пониженном давлении с получением неочищенного остатка. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного остатка и 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,30 г, 1,34 ммоль) в сухом пиридине (14 мл) с получением титульного соединения (0,33 г, 62%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (ДХМ/МеОН 20:1).
1H ЯМР (400 МГц, ДМСО-d6) δ 2.22 (s, 3Н), 3.98 (s, 3H), 7.04 (dd, J=9.2, 1.5 Гц, 1Н), 7.41 (d, J=9.2 Гц, 1Н), 7.78-7.85 (m, 2H), 7.81 (d, J=8.8 Гц, 2H), 7.88 (d, J=8.8 Гц, 2Н), 8.21 (s, 1Н), 8.26 (s, 1Н), 10.44 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 18.18, 62.42, 109.06, 113.04 (m), 116.58, 121.22, 121.97, 124.84, 126.35, 128.41, 129.87 (t, JCF=Гц), 130.42, 138.87, 139.09 (t, JCF=Гц), 144.50, 144.63, 154.86 (dd, JCF=246 Гц, JCF=6 Гц), 163.12.
2,6-дифтор-4-метокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-79

К перемешиваемому раствору 2,6-дифтор-4-метоксибензойной кислоты (0,25 г, 1,34 ммоль) в тионилхлориде (7 мл) добавили каплю ДМФ и реакционную смесь кипятили с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры избыток реагентов удалили при пониженном давлении с получением неочищенного остатка. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного остатка и 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,30 г, 1,34 ммоль) в сухом пиридине (15 мл) с получением титульного соединения (0,24 г, 45%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (2:1 EtOAc/гексан, затем EtOAc, затем МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3Н), 3.84 (s, 3Н), 6.90 (d, J=10.1 Гц, 2Н), 7.10 (d, J=9.2 Гц, 1Н), 7.47 (d, J=9.2 Гц, 1Н), 7.74 (d, J=8.2 Гц, 2Н), 7.93 (d, J=8.2 Гц, 2Н), 8.26 (s, 1Н), 8.32 (d, J=0.6 Гц, 1Н), 10.72 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.98, 56.88, 98.98 (d, JCF 28.7), 108.58 (t, JCF 22.6), 108.85, 116.39, 119.98, 121.80, 124.63, 126.40, 128.23, 130.31, 138.55, 144.31, 144.38, 158.57, 160.34 (dd, JCF 246 и 11.7), 162.21 (t, JCF 14.8).
3,5-дифтор-4-гидрокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-51
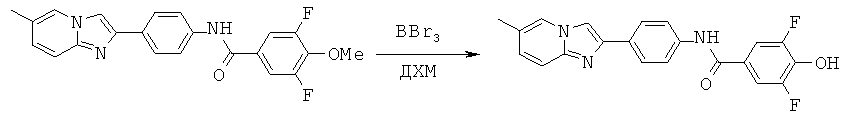
Получен в соответствии с описанием вышеприведенного раздела Деметилирование с применением 3,5-дифтор-4-метокси-М-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамида (0,20 г, 0,509 ммоль) в сухом ДХМ (10 мл) и трибромида бора в ДХМ (1,ОМ, 0,62 мл, 0,62 ммоль) при -78°С с получением титульного соединения (0,057 г, 29%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (12:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.27 (s, 3H), 7.09 (d, J=9.2 Гц, 1Н), 7.46 (d, J=9.2 Гц, 1Н), 7.73 (d, J=7.9 Гц, 2Н), 7.81 (d, J=8.5 Гц, 2Н), 7.93 (d, J=8.5 Гц, 2Н), 8.25 (s, 1Н), 8.31 (s, 1Н), 10.19 (s, 1Н), 11.05 (brs, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.95, 108.76, 112.08 (m), 116.39, 120.99, 121.77, 124.63, 125.10 (t, JCF=7.0 Гц), 126.23, 128.18, 130.16, 137.61 (t, JCF=16.3 Гц), 138.81, 144.37, 144.58, 152.20 (dd, JCF=242 Гц, JCF=7.0 Гц), 163.31.
3-фтор-4-гидрокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-57

Получен в соответствии с описанием вышеприведенного раздела Деметилирование с применением 3-фтор-4-метокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамида (0,20 г, 0,53 ммоль) в сухом ДХМ (15 мл) и BBr3 (1,ОМ, 1,3 мл, 1,3 ммоль) при -78°С с получением титульного соединения (0,070 г, 36%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (10:1 ДХМ/МеОН).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.23 (s, 3Н), 7.01 (t, J=8.5 Гц, 1Н), 7.05 (dd, J=9.3, 1.5 Гц, 1Н), 7.42 (d, J=9.3 Гц, 1Н), 7.66 (dd, J=8.5, 1.5 Гц, 1Н), 7.75-7.78 (m, 1Н), 7.77 d, J=8.8 Гц, 2Н), 7.86 (d. J=8.8 Гц, 2Н), 8.20 (s, 1Н), 8.27 (s, 1Н), 10.08 (s, 1Н), 10.57 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.97, 108.71, 116.17 (d, JCF=19.5 Гц), 116.36, 117.73 (d, JCF=3.1 Гц), 120.85, 121.77, 124.60, 125.38 (d, JCF=2.3 Гц), 126.17, 126.33 (d, JCF=4.6 Гц), 128.18, 129.81, 139.12, 144.31, 144.57, 148.76 (d, JCF=12.5 Гц), 150.83 (d, JCF=241.3 Гц), 164.38 (d, JCF=1.6 Гц).
4-метокси-3-трифторметил-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-61

Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,20 г, 0,897 ммоль) и 4-метокси-3-трифторметилбензоилхлорида (0,21 г, 0,897 ммоль) в сухом пиридине (15 мл) с получением титульного соединения (0,147 г, 38%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (15:1 EtOAc/гексан).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.23 (s, 3Н), 3.94 (s, 3Н), 7.04 (dd, J=9.0, 1.5 Гц, 1Н), 7.38 (d, J=8.8 Гц, 1Н), 7.42 (d, J=9.0 Гц, 1Н), 7.78 (d, J=8.8 Гц, 2Н), 7.89 (d, J=8.8 Гц, 2Н), 8.20 (s, 1Н), 8.22 (dd, J=10.7, 1.9 Гц, 2Н), 8.26 (d,J=1.5 Гц, 1Н), 10.33 (s, 1Н);13С ЯМР (100.5 МГц, CDCl3/ДМСО-d6) δ 17.80,56.05, 107.66, 111.53, 115.97, 117.63 (q, JCF=31 Гц), 120.77, 121.73, 123.20 (q, JCF=272 Гц), 123.45, 125.85, 126.58, 126.90 (q, JCF=3.9 Гц), 127.79, 129.37, 133.45, 138.38, 144.28, 144.43, 159.49, 164.26.
6-(диметиламино)-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]пиридин-3-карбоксамид
№ соединения SKT06-155

Перемешиваемую смесь 6-хлор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]пиридин-3-карбоксамида (0,15 г, 0,414 ммоль), гидрохлорида диметиламина (0,845 г, 10,36 ммоль) и К2СО3 (1,43 г, 10,36 ммоль) в сухом ДМСО (10 мл) нагревали при 170°С в течение 16 часов в атмосфере аргона. Охлажденную реакционную смесь добавили в воду (200 мл) и собрали осадок при помощи вакуумного фильтрования и осушили на воздухе. Твердое вещество очистили при помощи флэш-хроматографии (12:1 ДХМ/МеОН) с получением титульного соединения (0,113 г, 73%) в виде светло-желтого твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.27 (s, 3Н), 3.11 (s, 6H), 6.71 (d, J=9.2 Гц, 1Н), 7.09 (d, J=9.2 Гц, 1Н), 7.46 (d, J=9.2 Гц, 1Н), 7.81 (d, J=8.5 Гц, 2Н), 7.90 (d, J=8.5 Гц, 2Н), 8.07 (dd, J=1.5, 8.5 Гц, 1Н), 8.23 (s, 1Н), 8.30 (s, 1Н), 8.74 (s, 1Н), 10.03 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.98, 38.04, 105.05, 108.64, 116.36, 117.89, 120.68, 121.72, 124.60, 126.14, 128.12, 129.53, 136.99, 139.35, 144.29, 144.63, 148.99, 160.48, 164.66.
6-(метиламино)-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]пиридин-3-карбоксамид
№ соединения SKT06-153
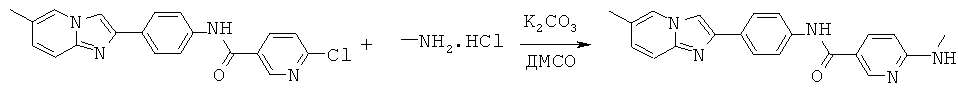
Перемешиваемую смесь 6-хлор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]пиридин-3-карбоксамида (0,15 г, 0,414 ммоль), гидрохлорида метиламина (0,69 г, 10,36 ммоль) и К2СО3 (1,43 г, 10,36 ммоль) в сухом ДМСО (10 мл) нагревали при 170°С в течение 17,5 часов в атмосфере аргона. Охлажденную реакционную смесь добавили в воду (150 мл) и собрали осадок при помощи фильтрования и осушили на воздухе. Твердое вещество очистили при помощи флэш-хроматографии (10:1 ДХМ/МеОН) с получением титульного соединения (0,059 г, 40%) в виде светло-желтого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.26 (s, 3Н), 2.82 (d, J=4.7 Гц, 3Н), 6.49 (d, J=9.0 Гц, 1Н), 7.08 (dd, J=9.0, 1.6 Гц, 1Н), 7.13 (q, J=4.7 Гц, 1Н), 7.45 (d, J=9.4 Гц, 1Н), 7.79 (d, J=8.6 Гц, 2Н), 7.88 (d, J=8.6 Гц, 2Н), 7.93 (dd, J=9.0, 2.4 Гц, 1Н), 8.22 (s, 1Н), 8.29 (s, 1Н), 8.66 (d, J-2.4 Гц, 1Н), 9.96 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 17.98, 28.30, 108.64, 116.36, 118.21, 120.66, 121.73, 124.60, 126.13, 128.12, 129.46, 136.41, 139.41, 144.29, 144.65, 149.38, 161.36, 164.80 (1 отсутствует).
4-метокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-2-(трифторметил)бензамид
№ соединения SKT06-141

Перемешиваемый раствор 4-метокси-2-трифторметилбензойной кислоты (0,197 г, 0,897 ммоль) в тионилхлориде (5 мл), содержащий каплю ДМФ, кипятили с обратным холодильником в течение 3 часов. Избыток реагентов удалили при пониженном давлении с получением неочищенного твердого вещества. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного твердого вещества и 4-(6-метилиидазо[1,2-а]пиридин-2-ил)анилина (0,20 г, 0,897 ммоль) в сухом пиридине (15 мл) с получением титульного соединения (0,087 г, 23%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (1:1:0,1 ДХМ/EtOAc/МеОН).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.25 (s, 3Н), 3.88 (s, 3H), 7.07 (dd, J=9.4, 1.5 Гц, 1Н), 7.30-7.34 (m, 2H), 7.45 (d, J=9.4 Гц, 1Н), 7.64 (d, J=9.4 Гц, 1Н), 7.74 (d, J=8.6 Гц, 2Н), 7.91 (d, J=8.6 Гц, 2H), 8.22 (s, 1Н), 8.28 (d, J=0.7 Гц, 1Н), 10.51 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 17.97, 56.38, 108.77, 112.59 (q, JCF=5.4 Гц), 116.38, 117.65, 120.16, 121.77, 123.92 (q, JCF=274 Гц), 124.61, 126.29, 128.12 (q, JCF=32 Гц), 128.19, 129.05 (q, JCF=2.3 Гц), 130.05, 131.04, 138.98, 144.31, 144.48. 160.39, 165.82.
N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-2,6-дифтор-4-гидроксибензамид
№ соединения SKT06-137

Получен в соответствии с описанием вышеприведенного раздела Деметилирование с применением 2,6-дифтор-4-метокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамида (0,10 г, 0,254 ммоль) в сухом ДХМ (9 мл) и BBr3 в ДХМ (1,ОМ, 1,3 мл, 1,3 ммоль) при 0°С с получением титульного соединения (0,055 г, 57%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (15:1 ДХМ/МеОН, затем 10:1 ДХМ/МеОН и, наконец, 5:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3Н), 6.53 (d, JHF=10.7 Гц, 2H), 7.09 (d, J=9.8 Гц, 1Н), 7.47 (d, J=9.8 Гц, 1Н), 7.73 (d, J=7.9 Гц, 2H), 7.91 (d, J=7.9 Гц, 2H), 8.24 (s, 1Н), 8.31 (s, 1Н), 10.60 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.97, 99.73 (d, JCF=25.7 Гц), 107.07 (t, JCF=22.6 Гц), 108.84, 116.36, 119.93, 121.81, 124.63, 126.38, 128.26, 130.18, 138.62, 144.29, 144.36, 158.85, 160.34 (dd, JCF=246 и 11.7 Гц), 160.91 (t, JCF=14.8 Гц).
2-фтор-4-метокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-81

Перемешиваемый раствор 2-фтор-4-метоксибензойной кислоты (0,23 г, 1,34 ммоль) в тионилхлориде (7 мл), содержащий каплю ДМФ, кипятили с обратным холодильником в течение 4 часов. Избыток реагентов удалили при пониженном давлении с получением неочищенного твердого вещества. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного твердого вещества и 4-(6-метилиидазо[1,2-а]пиридин-2-ил)анилина (0,30 г, 1,34 ммоль) в сухом пиридине (15 мл) с получением титульного соединения (0,323 г, 80%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (EtOAc).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3H), 3.85 (s, 3H), 6.91 (d, J=9.0 Гц, 1Н), 6.97 (d, J=13.1 Гц, 1Н), 7.10 (d, J=9.6 Гц, 1Н), 7.47 (d, J=8.8 Гц, 1Н), 7.66 (t, J=8.8 Гц, 1Н), 7.78 (d, J=8.5 Гц, 2Н), 7.92 (d, J=7.9 Гц, 2Н), 8.25 (s, 1Н), 8.31 (s, 1Н), 10.26 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 17.94, 56.44, 102.34 (d, JCF=26.4 Гц), 108.71, 110.99 (d, JCF=2.3 Гц), 116.39, 117.28 (d, JCF=14.1 Гц), 120.45, 121.73, 124.59, 126.28, 128.12, 130.06, 131.63 (d, JCF=4.7 Гц), 138.90, 144.48 (d, JCF=24.8 Гц), 160.82 (d, JCF=249 Гц), 162.79, 163.00, 163.10.
2-фтор-4-гидрокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-103

Получен в соответствии с описанием вышеприведенного раздела Деметилирование с применением 2-фтор-4-метокси-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]бензамида (100 мг, 0,267 ммоль) в сухом ДХМ (10 мл) и BBr3 в ДХМ (1,0М, 1,4 мл, 1,4 ммоль) при -78°С с получением титульного соединения (30 мг, 31%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (10:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3H), 6.63-6.73 (m, 2H), 7.09 (d, J=9.2 Гц, 1Н), 7.46 (d, J=9.2 Гц, 1Н), 7.55 (t, J=8.5 Гц, 1Н), 7.76 (d, J=8.5 Гц, 2H), 7.90 (d, J=8.2 Гц, 2H), 8.23 (s, 1Н), 8.31 (s, 1Н), 10.13 (s, 1Н), 10.47 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.95, 103.31 (d, JCF=24.9 Гц), 108.70, 112.15, 115.68 (d, JCF=13.2 Гц), 116.39, 120.43, 121.73, 124.60, 126.27, 128.13, 129.94, 131.83 (d, JCF=4.6 Гц), 139.01, 144.50 (d, JCF=28.8 Гц), 160.92 (d, JCF=248 Гц), 161.73, 161.86, 163.01.
4-(метиламино)-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-3-(трифторметил)бензамид
№ соединения SKT06-99

Перемешиваемую смесь 4-фтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-3-(трифторметил)бензамида (0,05 г, 0,121 ммоль), гидрохлорида метиламина (0,20 г, 3,02 ммоль) и К2СО3 (0,42 г, 3,02 ммоль) в сухом ДМСО (5 мл) нагревали при 160°С в течение 22 часов в атмосфере аргона. Охлажденную реакционную смесь добавили в воду (100 мл) и собрали осадок при помощи вакуумного фильтрования и осушили на воздухе. Твердое вещество очистили при помощи флэш-хроматографии (5:1 EtOAc/гексан) с получением титульного соединения (0,032 г, 62%) в виде светло-желтого твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.28 (s, 3H), 2.86 (d, J=4.3 Гц, 3H), 6.29-6.31 (q, J=3.9 Гц, 1Н), 6.84 (d, J=9.2 Гц, 1Н), 7.09 (d, J=9.1 Гц, 1Н), 7.47 (d, J=8.8 Гц, 1Н), 7.82 (d, J=8.5 Гц, 2H), 7.92 (d, J=8.5 Гц, 2H), 8.12 (br s, 2H), 8.24 (s, 1Н), 8.31 (s, 1Н), 10.13 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 17.96, 30.40, 108.74, 110.86 (q, JCF=29.6 Гц), 111.25, 116.20, 119.99, 120.58, 120.87, 121.94, 124.66, 125.21 (q, JCF=270 Гц), 126.16, 126.94 (q, JCF=6.1 Гц), 128.41, 129.36, 130.80, 133.71, 139.34, 144.17, 144.34, 149.07, 164.60.
4-(диметиламино)-N-[4-(6-фторимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-131
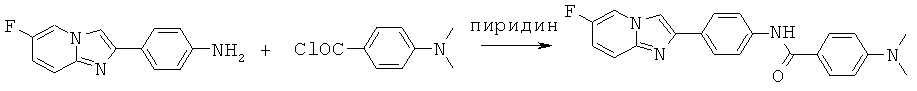
Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-фторимидазо[1,2-а]пиридин-2-ил)анилина (100 мг, 0,44 ммоль) и 4-диметиламинобензоилхлорида (81 мг, 0,44 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (59 мг, 36%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (1:1 ДХМ/EtOAc).
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.01 (s, 6Н), 6.77 (d, J=8.5 Гц, 2Н), 7.31 (t, J=9.2 Гц, 1Н), 7.63 (dd, J=9.2, 4.9 Гц, 1Н), 7.82-7.93 (m, 6Н), 8.33 (s, 1Н), 8.75 (br s, 1Н), 9.95 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 40.15, 110.42 (d, jcf=1.5 Гц), 111.28, 113.85 (d, JCF=41.2 Гц), 116.75 (d, JCF=25.6 Гц), 117.53 (d, JCF=9.3 Гц), 120.75, 121.62, 126.26, 128.87, 129.60, 139.99, 143.21, 146.30, 152.94, 152.98 (d, JCF=232.8 Гц), 165.66.
4-(диметиламино)-N-[4-(6-йодимидазо[1,2-а]пиридин-2-ил)фенил]бензамид
№ соединения SKT06-165
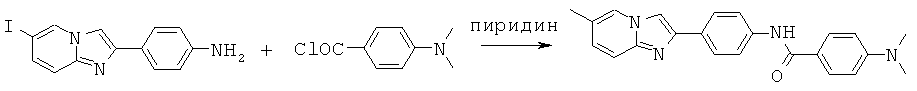
Получен в соответствии с описанием раздела Амидное связывание с применением 4-(6-йодимидазо[1,2-а]пиридин-2-ил)анилина (100 мг, 0,298 ммоль) и 4-диметиламинобензоилхлорида (55 мг, 0,298 ммоль) в сухом пиридине (5 мл) с получением титульного соединения (45 мг, 31%) в виде светло-желтого твердого вещества после флэш-хроматографии (20:10:1 ДХМ/EtOAc/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.01 (s, 6Н), 6.77 (d, J=8.5 Гц, 2Н), 7.42 (s, 2Н), 7.84-7.89 (m, 6Н), 8.26 (s, 1Н), 8.90 (s, 1Н), 9.96 (s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 76.19, 108.72, 111.21, 118.13, 120.57, 121.44, 126.33, 128.46, 129.61, 131.76, 132.68, 140.06, 143.80, 145.13, 152.85, 165.64 (1 отсутствует).
4-бром-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-3-нитробензамид
№ соединения SKT08-153
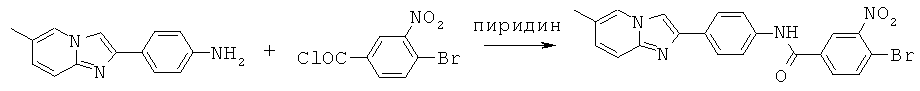
К перемешиваемой суспензии 4-бром-3-нитробензойной кислоты (0,330 г, 1,344 ммоль) в тионилхлориде (7 мл) добавили каплю ДМФ и реакционную смесь кипятили с обратным холодильником в течение 3 часов. Избыток реагентов затем удалили при пониженном давлении с получением неочищенного твердого вещества. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного твердого вещества и 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,300 г, 1,344 ммоль) в сухом пиридине (16 мл) с получением титульного соединения (0,448 г, 74%) в виде желтого твердого вещества после обработки и перекристаллизации из смеси ДМФ/вода (1:0,76 об./об.).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.27 (s, 3H), 7.10 (d, J=9.5 Гц, 1H), 7.47 (d, J=9.5 Гц, 1Н), 7.83 (d, J=8.2 Гц, 2Н), 7.95 (d, J=8.2 Гц, 2Н), 8.09-8.18 (m, 2H), 8.26 (s, 1H), 8.31 (s, 1H), 8.59 (s, 1H), 10.60 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.95, 108.90, 116.33, 116.87, 121.10, 121.89, 124.67, 124.97, 126.32, 128.36, 130.46, 133.06, 135.49, 135.96, 138.48, 144.30, 144.34, 149.99, 162.93.
4-фтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-3-нитробензамид
№ соединения SKT08-165

К перемешиваемой суспензии 4-фтор-3-нитробензойной кислоты (0,254 г, 1,344 ммоль) в тионилхлориде (7 мл) добавили каплю ДМФ и реакционную смесь кипятили с обратным холодильником в течение 3 часов. Избыток реагентов затем удалили при пониженном давлении с получением неочищенного хлорангидрида. Амид получили в соответствии с описанием раздела Амидное связывание с применением неочищенного хлорангидрида и 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (0,300 г, 1,344 ммоль) в сухом пиридине (16 мл) с получением титульного соединения (0,334 г, 64%) в виде светло-оранжевого твердого вещества после обработки и перекристаллизации из смеси 1,4-диоксан/вода (3,75:1 об./об.).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.27 (s, 3H), 7.09 (d, J=9.1 Гц, 1H), 7.47 (d, J=9.1 Гц, 1H), 7.78 (m, 1H), 7.84 (d, J=8.2 Гц, 2Н). 7.96 (d, J=8.2 Гц, 2Н), 8.25 (s, 1H), 8.30 (s, 1H), 8.35-8.47 (m, 1H), 8.77 (d, J=7.3 Гц, 1H), 10.61 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.94, 108.85, 116.42, 119.24 (d, JCF=21.8 Гц), 121.15, 121.78, 124.63, 126.16, 126.29, 128.19, 130.57, 132.23 (d, JCF=3.9 Гц), 136.08 (d, JCF=10.2 Гц), 137.18 (d, JCF=7.7 Гц), 138.49, 144.392, 144.51, 156.77 (d, JCF=266 Гц), 162.77.
Соединения, в которых -Q- представляет собой -СН=СН-; -CR1=CH-; -CH=CR1-; или -CR1=CR1-
Бензотиазольные промежуточные соединения
5-метил-2-аминобензотиол

Смесь 2-амино-6-метилбензотиазола (15 г, 91,3 ммоль), этиленгликоля (22,26 г, 0,36 моль) и 50% масс./об. КОН (180 мл) кипятили с обратным холодильником в течение 62 часов. После охлаждения до комнатной температуры добавили толуол (60 мл) и реакционную смесь охладили в ледяной бане и подкислили уксусной кислотой (конечный рН 5-6). Реакционную смесь экстрагировали толуолом (5×300 мл) и объединенные органические экстракты промыли солевым раствором (2×200 мл), осушили (MgSO4) и удалили растворитель при пониженном давлении с получением титульного соединения (11,1 г, 86%) в виде желтого твердого вещества, которое применяли без дополнительной очистки.
1Н ЯМР (250 МГц, CDCl3) δ 2.13 (s, 3H), 4.19 (br s, 2H), 6.64 (d, J=7.9 Гц, 1H), 6.95 (s, 1H), 6.97 (d, J=7.9 Гц, 1H);13С ЯМР (62.5 МГц, CDCl3) δ 20.09, 115.35, 118.92, 127.54, 132.37, 137.09, 146.22.
2-(4-бромметил)фенил-6-метилбензотиазол

Смесь 2-амино-5-метилбензотиола (0,518 г, 3,73 ммоль), 4-бромметилбензойной кислоты (0,80 г, 3,73 ммоль) и триметилсилилполифосфата (11,2 мл) кипятили с обратным холодильником в толуоле (20 мл) в атмосфере аргона в течение 15 часов. Реакционную смесь охладили до комнатной температуры и добавили воду (100 мл), затем экстрагировали хлороформом (3×60 мл). Объединенные органические экстракты промыли солевым раствором (60 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением светло-коричневого твердого вещества, которое промыли Et2O (60 мл) с получением титульного соединения (0,816 г, 69%) в виде бесцветного твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 2.49 (s, 3H), 4.52 (s, 2H), 7.29 (d, J=8.2 Гц, 1H), 7.49 (d, J=8.2 Гц, 2H), 7.67 (s, 1H), 7.94 (d, J=8.2 Гц, 1H), 8.03 (d, J=8.2 Гц, 2H);13C ЯМР (62.5 МГц, CDCl3) δ 21.62, 32.70, 121.42, 122.82, 127.85, 128.11, 129.71, 133.70, 135.22, 135.66, 140.39, 152.16, 166.17; MCHP (ESI) 319.9 (M+(81Br)+H, 100%), 317.9 (М+(79Br)+Н, 93%).
2-(4-бромметил)фенил-6-метоксибензотиазол

Смесь 2-амино-5-метоксибензотиола (9,25 г, 59,7 ммоль) и 4-бромметилбензойной кислоты (12,8 г, 59,7 ммоль) в триметилсилилполифосфате (70 мл) тшательно перемешали и нагревали при 110°С в атмосфере аргона в течение 3 часов. Реакционную смесь охладили до 60°С и добавили воду (25 мл), затем экстрагировали хлороформом (5×80 мл). Объединенные органические экстракты промыли солевым раствором (150 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением коричневого твердого вещества, которое очистили при помощи флэш-хроматографии (4:1 ДХМ/гексан) с получением титульного соединения (10,9 г, 55%) в виде бесцветного твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 3.88 (s, 3H), 4.52 (s, 2Н), 7.09 (dd, J=8.9, 2.4 Гц, 1Н), 7.33 (d, J=2.4 Гц, 1Н), 7.48 (d, J=8.2 Гц, 2Н), 7.94 (d, J=8.9 Гц, 1Н), 8.00 (d, J=8.2 Гц, 2Н);13C ЯМР (62.5 МГц, CDCl3) δ 32.75, 55.85, 104.16, 115.85, 123.84, 127.63, 129.70, 133.78, 136.50, 140.13, 148.69, 157.94, 164.66.
Синтез описан в работе Йосино с соавторами (Yoshino et al.).
Диэтил 4-(6-метилбензотиазол-2-ил)бензилфосфонат
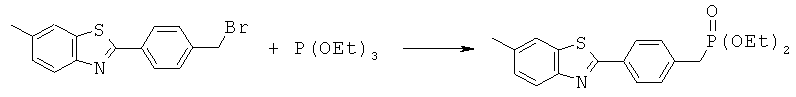
Смесь 2-(4-бромметил)фенил-6-метилбензотиазола (0,30 г, 0,94 ммоль) и триэтилфосфита (3,5 мл) нагревали при 170°С в течение 15 минут в атмосфере аргона. После охлаждения до комнатной температуры избыток триэтилфосфита удалили при помощи перегонки с получением коричневой маслянистой жидкости, которая затвердела при охлаждении. Указанное твердое вещество очистили при помощи флэш-хроматографии (3:1 EtOAc/гексан) с получением титульного соединения (0,319 г, 90%) в виде бесцветного твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 1.22 (t, J=7.0 Гц, 6Н), 2.45 (s, 3H), 3.18 (d, JHP=22 Гц, 2Н), 4.01 (m, 4H), 7.25 (dd, J=8.2, 1.2 Гц, 1Н), 7.39 (dd, J=8.2, 2.4 Гц, 2Н), 7.64 (s, 1Н), 7.90 (d, J=8.2 Гц, 1Н), 7.99 (d, J=8.2 Гц, 2Н);13С ЯМР (62.5 МГц, CDCl3) δ 16.41 (d, JCP=5.8 Гц), 21.57, 33.86 (d, JCP=138 Гц), 62.29 (d, JCP=6.8 Гц), 121.37, 122.66, 127.54, 127.94, 130.40 (d, JCP=6.8 Гц), 132.44 (d, JCP=1.9 Гц), 134.74 (d, JCP=9.8 Гц), 135.28 (d, JCP=12.7 Гц), 135.38, 152.23, 166.60.
Синтез описан в работе Йосино с соавторами (Yoshino et al.).
Диэтил 4-(6-метоксибезотиазол-2-ил)бензилфосфонат

Смесь 2-(4-бромметил)фенил-6-метоксибензотиазола (10,0 г, 29,95 ммоль) и триэтилфосфита (20 мл) нагревали при 130°С в течение 4 часов в атмосфере аргона. После охлаждения до комнатной температуры полученное твердое вещество перекристаллизовали из циклогексана с получением титульного соединения (11,25 г, 96%) в виде бесцветного твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 1.23 (t, J=7.3 Гц, 6Н), 3.18 (d, JHP=22 Гц, 2Н), 3.86 (s, 3H), 4.01 (m, 4H), 7.06 (dd, J=8.8, 2.4 Гц, 1Н), 7.32 (d, J=2.4 Гц, 1Н), 7.39 (dd, J=8.2, 2.1 Гц, 2Н), 7.91 (d, J=8.8 Гц, 1Н), 7.96 (d, J=8.2 Гц, 2Н);13C ЯМР (100.5 МГц, CDCl3) δ 16.39 (d, JCP=6.2 Гц), 33.83 (d, JCP=138 Гц), 55.79, 62.26 (d, JCP=7.0 Гц), 104.15, 115.65, 123.65, 127.35 (d, JCP=3.1 Гц), 130.38 (d, JCP=6.2 Гц), 132.43 (d, JCP=3.1 Гц), 134.48 (d, JCP=9.3 Гц), 136.37, 148.64, 157.78, 165.16 (d, JCP=2.3 Гц).
2-бром-1-трет-бутилдиметилсилоксиэтан

К перемешиваемому раствору бромэтанола (9,912 г, 79,32 ммоль) в сухом ДХМ (25 мл) добавили одну порцию трет-бутилдиметилсилилхлорида (13,212 г, 85,03 ммоль) и реакционную смесь перемешивали при комнатной температуре. Затем по каплям добавили раствор триэтиламина (8,865 г, 12,3 мл, 87,61 ммоль) в сухом ДХМ (40 мл) в течение 1 часа 20 минут. Реакционную смесь перемешивали при комнатной температуре в течение 3 дней, затем добавили воду (30 мл). Органическую фазу отделили, а водную фазу экстрагировали ДХМ (2×20 мл). Объединенные органические экстракты промыли солевым раствором (30 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением светло-желтой маслянистой жидкости. Перегонка при пониженном давлении привела к получению титульного соединения (10,54 г, 55%) в виде бесцветной маслянистой жидкости.
1Н ЯМР (250 МГц, CDCl3) δ 0.08 (s, 6Н), 0.90 (s, 9H), 3.34 (t, J=6.41 Гц, 2Н), 3.88 (t, J=6.4 Гц);l3C ЯМР (62.5 МГц, CDCl3) δ -5.23, 18.35, 25.85, 33.31, 63.54.
Получен в соответствии со способом, адаптированным из работы Кувабе с соавторами (Kuwabe et al.).
4-([2-трет-бутилдиметилсилокси]этокси)бензальдегид

К перемешиваемой суспензии 4-гидроксибензальдегида (0,500 г, 4,012 ммоль) и безводного карбоната калия (0,833 г, 6,019 ммоль) в сухом MeCN (15 мл) при комнатной температуре добавили 2-бром-1-трет-бутилдиметилсилоксиэтан (83%, 1,730 г, 6,019 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 20,5 часов. Добавили воду (25 мл) и реакционную смесь экстрагировали Et2O (4×25 мл). Объединенные органические экстракты промыли солевым раствором (50 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением светло-желтой маслянистой жидкости, которую очистили при помощи флэш-хроматографии (3:1 гексан/Et2O) с получением титульного соединения (0,895 г, 79,5%) в виде бесцветной маслянистой жидкости.
1Н ЯМР (250 МГц, CDCl3) δ 0.08 (s, 6Н), 0.89 (s, 9H), 3.98 (t, J=4.3 Гц, 2Н), 4.11 (t, J=4.3 Гц, 2H), 7.00 (d, J=8.5 Гц, 2Н), 7.81 (d, J=8.5 Гц, 2Н), 9.87 (s, 1H);13C ЯМР (62.5 МГц, CDCl3) δ -5.20, 18.42, 25.90, 61.81, 69.67, 114.88, 129.96, 131.99, 164.09, 190.78.
Получен в соответствии со способом, адаптированным из работы Кувабе с соавторами (Kuwabe et al.).
6-метокси-2-(4-{(Е)-2-[4-(2-трет-бутилдиметилсилоксиэтокси)фенил]этенил}фенил)-1,3-бензотиазол
№ соединения SKT08-101

В прокаленную круглодонную колбу в атмосфере аргона добавили гидрид натрия (68 мг, 60% дисперсия в минеральном масле, 1,71 ммоль), который промыли сухим гексаном (3х8 мл) и колбу поместили в глубокий вакуум в течение 5 минут.После помещения колбы в атмосферу аргона добавили сухой ТГФ (35 мл) и суспензию перемешивали при комнатной температуре в течение 5 минут.Затем добавили диэтил [4-(6-метокси-1,3-бензотиазол-2-ил)бензил]фосфонат (0,558 г, 1,43 ммоль) в виде твердого вещества несколькими порциями в течение 1 минут и реакционную смесь перемешивали при комнатной температуре в течение 30 минут перед добавлением по каплям в течение 1 минуты 4-([2-третбутилдиметилсилокси]этокси)бензальдегида (0,400 г, 1,43 ммоль). Реакционную смесь затем кипятили с обратным холодильником в течение 16,5 часов. После охлаждения до комнатной температуры добавили воду (1 мл) и удалили растворитель при пониженном давлении с получением желтого твердого вещества, которое перекристаллизовали из смеси ДМФ/вода (15:1) с получением титульного соединения (0,549 г, 74%) в виде желтого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 0.06 (s, 6Н), 0.86 (s, 9H), 3.85 (s, 3H), 3.91 (t, J=4.7 Гц, 2Н), 4.06 (t, J=4.7 Гц, 2Н), 6.95 (d, J=8.2 Гц, 2Н), 7.12 (d, J=9.0 Гц, 1H), 7.15 (d, J=16.4 Гц, 1Н), 7.32 (d, J=16.4 Гц, 1H), 7.56 (d, J=8.2 Гц, 2Н), 7.69 (m, 1H), 7.71 (d, J=8.2 Гц, 2Н), 7.91 (d, J=9.0 Гц, 1H), 8.00 (d, J=8.2 Гц, 2Н).
2-(4-{(E)-2-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]винил}фенокси)этиловый эфир метансульфоновой кислоты
№ соединения SKT08-179

К перемешиваемому раствору 2-(4-{(Е)-2-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]этенил}фенокси)этанола (55,2 мг, 0,137 ммоль) в сухом пиридине (10 мл) при комнатной температуре добавили метансульфонилхлорид (22,4 цл, 0,287 ммоль). После выстаивания в течение 15 часов при комнатной температуре реакционную смесь охладили до 0-5°С и добавили ледяную воду (25 мл) с получением желтого осадка, который собрали при помощи вакуумного фильтрования и промыли водой (4×30 мл) и осушили в сушильном шкафу при 85°С в течение 1,5 часов. Желтое твердое вещество промыли Et2O и осушили при 85°С в течение 2 часов с получением титульного соединения (53,5 мг, 81%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.25 (s, 3H), 3.86 (s, 3H), 4.30 (m, 2H), 4.55 (m, 2H), 7.02 (d, J=8.5 Гц, 2H), 7.15 (m, 1H), 7.21 (d, J=16.5 Гц, 1Н), 7.37 (d, J=16.5 Гц, 1Н), 7.62 (d, J=8.2 Гц, 2H), 7.72 (m, 1Н), 7.74 (d, J=8.5 Гц, 2H), 7.94 (d, J=8.8 Гц, 1Н), 8.03 (d, J=8.2 Гц, 2H).
Бензотиазольные соединения
Нефторированные метоксиалкены
2-{4-[2-(2-нитрофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT01-71

Получен в соответствии с описанием раздела Получение алкена.
1Н ЯМР (250 МГц, CDCl3) δ 3.89 (s, 3H), 7.07-7.13 (m. 2H), 7.35 (s, 1Н), 7.39-7.45 (m, 1Н), 7.59-7.64 (m, 4H), 7.72-7.79 (m, 1Н), 7.93-8.00 (m, 2H), 8.04 (d, J=7.9 Гц, 2H);13С ЯМР (62.5 МГц, CDCl3) δ 55.85, 104.14, 115.83, 123.81, 124.95, 127.65, 128.28, 128.33, 132.80, 132.89, 133.25, 133.72, 136.51, 138.61, 148.05, 148.79, 157.89, 164.88 (2 отсутствуют).
2-{4-[2-(3-нитрофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT01-73

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,10 г, 0,25 ммоль) и 3-нитробензальдегида (0,39 г, 0,25 ммоль) в сухом MeOH (10 мл) и 0,5М метоксида натрия (1,02 мл, 0,51 ммоль) с получением титульного соединения (0,079 г, 80%) в виде желтых перистых кристаллов после обработки и перекристаллизации из СНС1з.
ИКС 3120, 1603, 1560, 1521, 1489, 1464, 1403, 1358, 1287, 1264, 1225, 1062, 1026. 967, 815 см-1;1H ЯМР (250 МГц, CDCl3) δ 3.89 (s, 3H), 7.09 (dd, J=8.8, 2.1 Гц, 1Н), 7.20 (dist d, J=18 Гц, 1H), 2.27 (dist d, J=18 Гц, 1H), 7.35 (d, J=2.1 Гц, 1H), 7.50-7.57 (m, 1H), 7.63 (d, J=8.5 Гц, 2Н), 7.81 (d, J=7.6 Гц, 1H), 7.95 (d, J=8.8 Гц, 1H), 8.06 (d, J=8.5 Гц, 2Н), 8.11 (d, J=8.5 Гц, 1H), 8.39 (s, 1H).
2-{4-[2-(4-нитрофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT02-67

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (3,0 г, 7,66 ммоль) в сухом MeOH (60 мл) и 0,5М метоксида натрия (30,6 мл, 15,3 ммоль) с получением титульного соединения (2,189 г, 74%) в виде оранжевого твердого вещества после обработки.
1H ЯМР (250 МГц, CDCl3) δ 3.89 (s, 3H), 7.10 (dd, J=9.2, 2.1 Гц, 1H), 7.21 (dist d, J=17.7 Гц, 1H), 7.30 (dist d, J=17.7 Гц, 1H), 7.35 (d, J=2.1 Гц, 1H), 7.64 (d, J=8.2 Гц, 2Н), 7.65 (d, J=8.5 Гц, 2Н), 7.95 (d, J=9.1 Гц, 1H), 8.06 (d, J=8.2 Гц, 2Н), 8.23 (d, J=8.5 Гц, 2Н);13С ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.79, 104.09, 115.83, 123.66, 124.12, 127.09, 127.55, 127.71, 132.21, 133.73, 136.40, 138.24, 143.45, 146.84, 148.61, 157.86, 164.58 (1 отсутствует).
2-{4-[2-(2-аминофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT01-109

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 2-{4-[2-(2-нитрофенил)винил]фенил}-6-метоксибензотиазола (0,03 г, 0,077 ммоль) и дигидрата хлорида олова (II) (0,139 г, 0,618 ммоль) в EtOH (3 мл) с получением титульного соединения в виде бесцветного твердого вещества (0,019 г, 68%) после обработки и флэш-хроматографии (ДХМ, затем 6:3:1 ДХМ/гексан/EtOAc).
13С ЯМР (100 МГц, ДМСО-d6) δ 56.23, 97.72, 105.34, 109.42, 116.51, 120.44, 120.96, 122.85, 123.39, 123.89, 127.52, 128.53, 132.37, 133.57, 136.18, 136.30, 136.53, 148.56, 158.03, 164.61.
2-{4-[2-(3-аминофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT01-107
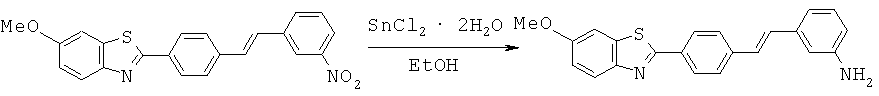
Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 2-{4-[2-(3-нитрофенил)винил]фенил}-6-метоксибензотиазола (0,046 г, 0,118 ммоль) и дигидрата хлорида олова (II) (0,214 г, 0,947 ммоль) в ЕЮН (3 мл) с получением бесцветного твердого вещества (0,023 г, 54%) после обработки и флэш-хроматографии (3:1 ДХМ/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 3.71 (br s, 2H), 3.91 (s, 3H), 6.71 (dd, J=8.8, 2.1 Гц, 1Н), 6.85 (s, 1Н), 6.92 (d, J=8.2 Гц, 1Н), 7.06-7.20 (m, 4H), 7.34 (d, J=2.1 Гц, 1Н), 7.58 (d, J=8.2 Гц, 2H), 7.94 (d, J=8.8 Гц, 1Н), 8.01 (d, J=8.5 Гц, 2H);13C ЯМР (62.5 МГц, CDCl3) δ 55.84, 104.16, 113.02, 115.10, 115.71, 117.52, 123.67, 126.98, 127.58, 129.71, 130.36, 132.68, 136.42, 138.05, 139.68, 146.73, 148.79, 157.77, 165.24 (1 отсутствует).
2-{4-[2-(4-аминофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT01-189

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 2-{4-[2-(4-нитрофенил)винил]фенил}-6-метоксибензотиазола (0,10 г, 0,28 ммоль) и дигидрата хлорида олова (II) (0,5 г, 2,23 ммоль) в ЕЮН (7 мл) с получением титульного соединения в виде желтого твердого вещества (0,04 г, 43%) после обработки и флэш-хроматографии (2:1 гексан/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 3.79 (br s, 2H), 3.89 (s, 3H), 6.68 (d, J=8.2 Гц, 2H), 6.94 (dist d, J=16.2 Гц, 1Н), 7.07 (d, J=8.5 Гц, 1Н), 7.12 (dist d, J=16.2 Гц, 1Н), 7.34 (s, 1Н), 7.36 (d, J=8.5 Гц, 2H), 7.55 (d, J=8.2 Гц, 2H), 7.93 (d, J=8.8 Гц, 1Н), 7.99 (d, J=8.2 Гц, 2H);13C ЯМР (62.5 МГц, CDCl3/ДМСО-d6) δ 55.20, 103.84, 113.98, 115.24, 121.72, 122.77, 124.70, 125.80, 126.75, 127.51, 130.32, 130.78, 135.58, 140.04, 147.89, 148.06, 157.05, 164.13.
2-{4-[2-(4-диметиламинофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT03-57

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,50 г, 1,28 ммоль) и 4-диметиламинобензальдегида (0,21 г, 1,41 ммоль) в сухом МеОН (10 мл) и 0,5М метоксида натрия (3,48 мл, 1,74 ммоль) с получением титульного соединения (0,187 г, 38%) в виде желтого твердого вещества после обработки.
1Н ЯМР (250 МГц, CDCl3) δ 2.99 (s, 6Н), 3.89 (s, 3H), 6.72 (d, J=8.5 Гц, 2Н), 6.93 (d, J=16.2 Гц, 1Н), 7.08 (dd, J=8.8, 2.1 Гц, 1Н), 7.15 (d, J=16.2 Гц, 1H), 7.35 (d, J=2.1 Гц, 1H), 7.44 (d, J=8.5 Гц, 2Н), 7.56 (d, J=8.2 Гц, 2Н), 7.93 (d, J=8.8 Гц, 1H), 7.99 (d, J=8.2 Гц, 2Н).
2-(4-{(Е)-2-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]этенил}фенокси)этанол
№ соединения SKT08-143

К перемешиваемому раствору 6-метокси-2-(4-{(Е)-2-[4-(2-трет-бутилдиметилсилоксиэтокси)фенил]этенил}фенил)-1,3-бензотиазола (0,200 г, 0,386 ммоль) в сухом ДМФ (5 мл) и сухом ТГФ (15 мл) при комнатной температуре по каплям добавили TBAF (1M в ТГФ 0,85 мл, 0,85 ммоль) в течение 2 минут. После выстаивания в течение 2 часов при комнатной температуре добавили насыщенный раствор NH4Cl (30 мл) с получением желтого осадка, который собрали при помощи вакуумного фильтрования. Желтое твердое вещество промыли водой (2×20 мл) и затем оставили для осушения на воздухе в течение 2 часов. Дополнительное осушение при 65°С в течение 17 часов привело к получению титульного соединения (0,136 г, 87%) в виде желтого твердого вещества.
ИКС 3500-3100 (br), 3017, 2941, 2864, 1601, 1558, 1513, 1485, 1462, 1435, 1299, 1252, 1225, 1175, 1083, 1052, 1022, 967, 830, 816 см-1;1H ЯМР (250 МГц, ДМСО-d6) δ 3.69-3.80 (m, 2Н), 3.86 (s, 3H), 4.00-4.08 (m, 2Н), 4.88 (m, 1H), 6.97 (d, J=8.2 Гц, 2Н), 7.13 (d, J=8.8 Гц, 1H), 7.18 9d, J=15.6 Гц, 1H), 7.35 (d, J=15.6 Гц, 1H), 7.59 (d, J=8.2 Гц, 2Н), 7.70-7.78 (m, 3H), 7.94 (d, J=8.8 Гц, 1H), 8.02 (d, J=8.2 Гц, 2Н).
Фторированные метоксиалкены
2-{4-[2-(2-трифторметилфенил)винил]фенил}-6-метоксибензотиазол
№ соединения SK2033-44
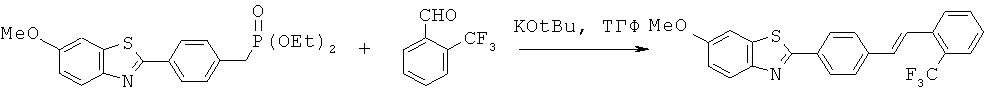
Получен в соответствии с описанием раздела Получение алквна с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (100 мг, 0,255 ммоль) в сухом ТГФ (10 мл), 2-трифторбензальдегида (44 мг, 0,255 ммоль) в сухом ТГФ (5 мл) и т-бутоксида калия (32 мг, 0,280 ммоль) в сухом ТГФ (5 мл) с получением титульного соединения (77 мг, 73%) в виде светло-желтых пластинок после обработки, флэш-хроматографии (3:1ДХМ/гексан) и перекристаллизации из ацетона.
1Н ЯМР (250 МГц, CDCl3) δ 3.89 (s, 3H), 7.07-7.09 (m, 1H), 7.11-7.14 (m, 1H), 7.35 (d, J=2.1 Гц, 1H), 7.39 (d, J=7.6 Гц, 1H), 7.51-7.55 (m, 1H), 7.55-7.65 (m, 3H), 7.68 (d, J=7.9 Гц, 1H), 7.79 (d, J=7.9 Гц, 1H), 7.95 (d, J=8.8 Гц, 1H), 8.04 (d, J=8.2 Гц, 2Н); МСНР (ESI+) m/z 412 (M++H, 100%).
2-{4-[2-(4-хлор-3-нитрофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT03-91

Получен в соответствии с описанием раздела Получение алкена с применением гидрида натрия (60% дисперсия в минеральном масле, 0,077 г, 1,92 ммоль), диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,5 г, 1,28 ммоль) и 4-хлор-3-нитробензальдегида (0,26 г, 1,41 ммоль) в сухом ТГФ (20 мл) с получением титульного соединения (0,251 г, 46%) в виде светло-оранжевых игольчатых частиц после обработки и перекристаллизации из 1,2-дихлорэтана.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.85 (s, 3H), 7.13 (d, J=8.5 Гц, 1H), 7.45 (d, J=17.7 Гц, 1H), 7.60 (d, J=17.7 Гц, 1H), 7.71-7.81 (m, 4H), 7.94 (d, J=8.2 Гц, 2Н), 8.05 (d, J=7.0 Гц, 2Н), 8.34 (s, 1H);13С ЯМР (100.5 МГц, ДМСО-d6) δ 56.23, 105.35, 116.42, 123.38, 123.80, 123.87, 127.20, 127.70, 128.08, 131.55, 131.81, 132.29, 133.21, 136.55, 138.16, 139.10, 148.53, 148.60, 158.09, 164.51.
2-{4-[2-(3-трифторметилфенил)винил]фенил}-6-метоксибензотиазол
№ соединения SK2033-42

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (100 мг, 0,255 ммоль) в сухом ТГФ (10 мл), т-бутоксида калия (32 мг, 0,280 ммоль) в сухом ТГФ (5 мл) и 3-трифторбензальдегида (44 мг, 0,255 ммоль) в сухом ТГФ (5 мл) с получением титульного соединения (78 мг, 74%) в виде бесцветного твердого вещества после обработки и флэш-хроматографии (4:1 ДХМ/гексан).
1Н ЯМР (250 МГц, ацетон-d6) δ 3.87 (s, 3H), 7.08 (d, J=8.5 Гц, 1H), 7.36 (s, 2H), 7.47-7.59 (m, 3H), 7.75 (d, J=8.2 Гц, 2H), 7.80-7.90 (m, 3H), 8.06 (d, J=8.2 Гц, 2H);13C ЯМР (62.5 МГц, CDCl3) δ 55.86, 104.19, 115.83, 123.25, 123.73, 124.40, 127.24, 127.68, 128.56, 129.25, 129.59, 129.76, 131.23 (q, JCF=33.2 Гц), 133.22, 136.40, 137.79, 138.90, 148.65, 157.89, 165.02 (1 отсутствует).
2-{4-[2-(4-трифторметилфенил)винил]фенил}-6-метоксибензотиазол
№ соединения SK2033-40

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (100 мг, 0,255 ммоль) в сухом ТГФ (10 мл), т-бутоксида калия (32 мг, 0,280 ммоль) в сухом ТГФ (5 мл) и 4-трифторбензальдегида (44 мг, 0,255 ммоль) в сухом ТГФ (5 мл) с получением титульного соединения (51 мг, 49%) в виде светло-желтого твердого вещества после обработки, флэш-хроматографии (4:1 ДХМ/гексан) и перекристаллизации из ацетона.
ИКС 3022,2942,2839, 1606,1556,1487,1462,1437, 1418, 1326, 1268, 1215, 1164, 1120, 1068, 1028, 1014, 966, 844, 829, 812 см-1;1Н ЯМР (400 МГц, ДМСО-d6) δ 3.86 (s, 3H), 7.09 (d, J=8.2 Гц, 1H), 7.39 (s, 2H), 7.56 (s, 1H), 7.65 (d, J=8.2 Гц, 2H), 7.74 (d, J=7.9 Гц, 2H), 7.78 (d, J=8.6 Гц, 2H), 7.88 (d, J=8.6 Гц, 1H), 8.02 (d, J=7.9 Гц, 2Н).
2-{4-[2-(4-(2,2,2-трифторэтокси)фенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT02-17

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,15 г, 0,38 ммоль) в сухом МеОН (5 мл), раствора 0,5М метоксида натрия (1,54 мл, 0,77 ммоль) и 4-(2,2,2-трифторэтокси)бензальдегида (0,078 г, 0,38 ммоль) с получением титульного соединения (0,132 г, 78%) в виде небольших желтых игольчатых частиц после обработки перекристаллизации из 1,2-дихлорэтана.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.85 (s, 3H), 4.80 (q, J=9.0 H, 2Н), 7.09 (d, J=8.6 Гц, 2Н), 7.13 (dd, J=9.0, 2.3 Гц, 1Н), 7.24 (d, J=16.5 Гц, 1H), 7.37 (d, J=16.5 Гц, 1H), 7.63 (d, J=9.0 Гц, 2Н), 7.71 (d, J=2.3 Гц, 1H), 7.74 (d, J=8.2 Гц, 2Н), 7.93 (d, J=9.0 Гц, 1H), 8.02 (d, J=8.2 Гц, 2Н);13С ЯМР (100 МГц, ДМСО-d6) δ 56.28, 65.26 (q, JCF=34.3 Гц), 105.46, 115.75, 116.38, 123.79, 126.63, 127.47, 127.67, 128.64, 129.97, 131.54, 132.26, 136.46, 140.30, 148.64, 157.37, 158.04, 164.78 (1 отсутствует).
2-{4-[2-(4-(4,4,4-трифторбутокси)фенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT02-11

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,15 г, 0,38 ммоль) в сухом МеОН (5 мл), раствора 0,5М метоксида натрия (1,54 мл, 0,77 ммоль) и 4-(4,4,4-трифторбутокси)бензальдегида (0,089 г, 0,38 ммоль) с получением титульного соединения (0,108 г, 60%) в виде небольших желтых игольчатых частиц после обработки перекристаллизации из 1,2-дихлорэтана.
ИКС 3019, 2942, 2878, 2837, 1603, 1558, 1510, 1462, 1437, 1386, 1247, 1227, 1176, 1151, 1061, 1025, 966, 832 см-1;1Н ЯМР (400 МГц, ДМСО-d6) δ 1.90-2.00 (m, 2H), 2.36-2.51 (m, 2H), 3.86 (s, 3H), 4.08 (t, J=6.2 Гц, 2H), 6.98 (d, J=8.6 Гц, 2H), 7.11-7.17 (m, 1H), 7.17 (d, J=16.8 Гц, 1H), 7.33 (d, J=16.8 Гц, 1H), 7.58 (d, J=8.6 Гц, 2H), 7.69 (m, 1H), 7.72 (d, J=8.2 Гц, 2H), 7.93 (d, J=8.6 Гц, 1H), 8.10 (d, J=8.2 Гц, 2H).
2-{4-[2-(4-(N-трифторацетил)аминофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT02-117

К перемешиваемой суспензии 2-{4-[2-(4-аминофенил)винил]фенил}-6-метоксибензотиазола (0,20 г, 0,558 ммоль) в толуоле (10 мл) добавили TFAA (0,26 г, 1,23 ммоль) и реакционную смесь нагревали при 80°С в течение 18 часов. Реакционную смесь охладили до комнатной температуры и добавили ДХМ (15 мл) и Et2O (40 мл), собрали осадок при помощи фильтрования, промыли Et2O и осушили в вакууме при комнатной температуре в течение 6 часов с получением титульного соединения (0,183 г, 72%) в виде светло-оранжевого твердого вещества.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.86 (s, 3H), 7.15 (dd, J=8.8, 2.4 Гц, 1H), 7.32 (dist d, J=17.4 Гц, 1H), (7.41 (dist d, J=17.4 Гц, 1H), 7.67-7.76 (m, 5H), 7.77 (d, J=8.2 Гц, 2H), 7.95 (d, J=8.8 Гц, 1H), 8.05 (d, J=8.2 Гц, 2H), 11.34 (s, 1H);13С ЯМР (100 МГц, ДМСО-d6) δ 56.28, 105.45, 116.25 (q, JCF=289 Гц), 116.40, 121.69, 123.83. 127.68, 127.69, 127.76, 127.97, 129.84, 132.53, 134.67, 136.49, 140.03, 148.64, 154.88 (q, JCF=36.5 Гц), 158.06, 164.71 (1 отсутствует).
2-{4-[2-(4-(N-2,2,2-трифторэтил)аминофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT02-153

К перемешиваемой суспензии 2-{4-[2-(4-(N-трифторацетил)аминофенил)винил]фенил}-6-метоксибензотиазола (0,10 г, 0,22 ммоль) в сухом ТГФ (20 мл) при комнатной температуре порциями добавили алюмогидрид лития (0,033 г, 0,88 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 0,5 часа, затем кипятили с обратным холодильником в течение 18 часов. Реакционную смесь охладили до 0-5°С и разбавили Et2O (5 мл). Медленно добавили воду (1 мл), затем добавили 15% NaOH (0,2 мл) и реакционную смесь оставили нагреваться до комнатной температуры. К реакционной смеси добавили MgSO4 (30 мг) и через 15 минут соли собрали при помощи фильтрования. Фильтрат концентрировали с получением твердого вещества, которое перемешивали с каталитическим количеством йода в ДХМ (5 мл). Реакционную смесь промыли водой (10 мл), 10% раствором сульфита натрия (10 мл) и солевым раствором (10 мл) и удалили растворитель при пониженном давлении с получением твердого вещества, которое очистили при помощи флэш-хроматографии (ДХМ) с получением титульного соединения (0,060 г, 62%) в виде оранжевого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 3.76-3.88 (m, 2H), 3.89 (s, 3H), 4.04 (t, J=2.1 Гц, 1Н), 6.69 (d, J=8.5 Гц, 2H), 6.95 (dist d, J=17.1 Гц, 1Н), 7.08 (d, J=8.8 Гц, 1Н), 7.12 (dist d, J=17.1 Гц, 1Н), 7.35 (d, J=2.7 Гц, 1Н), 7.42 (d, J=8.5 Гц, 2H), 7.56 (d, J=8.2 Гц, 2H), 7.93 (d, J=8.5 Гц, 1Н), 8.00 (d, J=8.2 Гц, 2H);13C ЯМР (100.5 МГц, ДМСО-d6) δ 44.49 (q, JCF=32.7 Гц), 56.26, 105.45, 113.09, 116.31, 123.38, 123.72, 126.24 (q, JCF=281 Гц), 126.49, 127.00, 127.64, 128.40, 131.07, 131.59, 136.39, 140.97, 148.25, 148.66, 157.99, 164.91.
2-{4-[2-(4-(N-3,3,3-трифторпропил)аминофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT02-119

К перемешиваемому раствору 2-{4-[2-(4-аминофенил)винил]фенил}-6-метоксибензотиазола (0,30 г, 0,838 ммоль) в ТГФ (13 мл) при комнатной температуре добавили одну порцию 3,3,3-трифторпропаналя (0,094 г, 0,838 ммоль). Затем добавили уксусную кислоту (48 цл, 0,838 ммоль) и реакционную смесь перемешивали в течение 5 минут перед добавлением триацетоксиборгидрида натрия (0,25 г, 1,17 ммоль) порциями в течение 15 минут. Затем продолжили перемешивание при комнатной температуре. Через 48 часов провели дополнительное добавление 3,3,3-трифторпропаналя (0,094 г, 0,838 ммоль) и продолжали перемешивание в течение 24 часов. Затем добавили бикарбонат натрия (15 мл) и реакционную смесь экстрагировали EtOAc (4×30 мл), объединенные экстракты промыли солевым раствором (40 мл) и осушили (Na2SO4). Удалили растворитель при пониженном давлении и остаток очистили при помощи флэш-хроматографии (10:1 ДХМ/гексан) с получением титульного соединения (0,149 г, 39%) в виде оранжевого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.47-2.59 (m, 2Н), 3.33 (q, J=6.7 Гц, 2Н), 3.85 (s, 3H), 5.99 (t, J=5.8 Гц, 1Н), 6.62 (d, J=8.6 Гц, 2Н), 6.99 (d, J=16.4 Гц, 1Н), 7.12 (dd, J=8.6, 2.3 Гц, 1Н), 7.23 (d, J=16.4 Гц, 1Н), 7.41 (d, J=8.2 Гц, 2Н), 7.65 (d, J=8.2 Гц, 2Н), 7.66 (d, J=2.3 Гц, 1Н), 7.91 (d, J=8.6 Гц, 1Н), 7.97 (d, J=8.6 Гц, 2Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 32.97 (q, JCF=26.4 Гц), 36.49 (q, JCF=3.1 Гц), 105.43, 112.70, 116.29, 122.78, 123.70, 125.59, 126.91, 127.44 (q, JCF=277 Гц), 127.63, 128.59, 131.28, 131.46, 136.38, 141.08, 148.67, 148.80, 157.97, 164.92.
2-{4-[2-(4-(N-4,4,4-трифторбутил)аминофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT02-81

К перемешиваемому раствору 2-{4-[2-(4-аминофенил)винил]фенил}-6-метоксибензотиазола (0,10 г, 0,28 ммоль) в 1,2-дихлорэтане (5 мл) при комнатной температуре добавили одну порцию 4,4,4-трифторбутаналя (0,035 г, 0,28 ммоль). Затем добавили уксусную кислоту (48 µл, 0,28 ммоль) и реакционную смесь перемешивали в течение 10 минут перед добавлением триацетоксиборгидрида натрия (0,083 г, 0,39 ммоль) порциями в течение 15 минут. Затем продолжили перемешивание при комнатной температуре. Через 24 часа провели дополнительное добавление 4,4,4-трифторбутаналя (0,035 г, 0,28 ммоль) и продолжали перемешивание в течение 72 часов. Затем добавили бикарбонат натрия (15 мл) и реакционную смесь экстрагировали EtOAc (3×30 мл), объединенные экстракты промыли солевым раствором (30 мл) и осушили (Na2SO4). Неочищенное твердое вещество растворили в CHCl3 (8 мл) и перемешивали с каталитическим количеством йода в течение 24 часов. Реакционную смесь промыли водой (10 мл), 10% раствором сульфита натрия (10 мл) и солевым раствором (10 мл) и удалили растворитель при пониженном давлении с получением твердого вещества, которое очистили при помощи флэш-хроматографии (ДХМ) с получением титульного соединения (0,06 г, 46%) в виде желтого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 1.72-1.79 (m, 2Н), 2.27-2.40 (m, 2Н), 3.10-3.18 (m, 2Н), 3.84 (s, 3H), 5.85-5.97 (m, 1Н), 6.59 (d, J=8.6 Гц, 2Н), 6.97 (d, J=16.4 Гц, 1Н), 7.11 (dd, J=9.0, 2.8 Гц, 1Н), 7.21 (d, J=16.4 Гц, 1Н), 7.37 (d, J=8.6 Гц, 2Н), 7.64 (d, J=8.6 Гц, 2Н), 7.66 (d, J=2.8 Гц, 1Н), 7.90 (d, J=9.0 Гц, 1Н), 7.96 (d, J=8.6 Гц, 2Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 21.85 (q, JCF=6.2 Гц), 30.89 (q, JCF=28.0 Гц), 41.81, 56.25, 105.43, 112.55, 116.27, 122.42, 123.68, 125.07, 126.84, 127.61, 128.55, 129.59. 131.37, 131.39, 136.36, 141.15, 148.66, 149.44, 157.95, 164.93.
2-{4-[2-(4-фторфенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT02-137
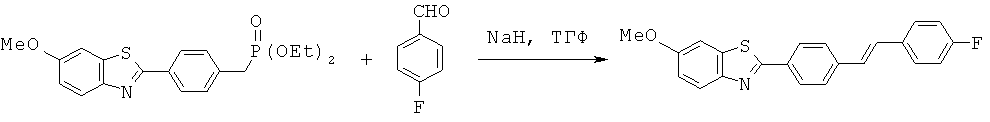
Получен в соответствии с описанием раздела Получение алкена с применением NaH (60% дисперсия, 0,050 г, 1,02 ммоль), диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,25 г, 0,64 ммоль) и 4-фторбензальдегида (0,08 г, 0,64 ммоль) в сухом ТГФ (5 мл) с получением титульного соединения (0,122 г, 53%) в виде светло-желтого твердого вещества после обработки и перекристаллизации из 1,2-дихлорэтана.
ИКС 3021, 2963, 2941, 2837, 1600, 1556, 1507, 1487, 1460, 1435, 1319, 1266, 1237, 1212, 1065, 1026, 966, 840, 822, 807 см-1;1Н ЯМР (250 МГц, CDCl3) δ 3.89 (s, 3H), 7.00-7.11 (m, 4H), 7.17 (dist d, J=15.9 Гц, 1H), 7.35 (d, J=2.1 Гц, 1H), 7.49 (d, J=8.5 Гц, 1H), 7.52 (d, J=8.5 Гц, 1Н), 7.59 (d, J=8.2 Гц, 2H), 7.94 (d, J=8.8 Гц, 1H), 8.02 (d, J=8.2 Гц, 2Н).
2-{4-[2-(4-гидрокси-3-нитрофенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT03-107
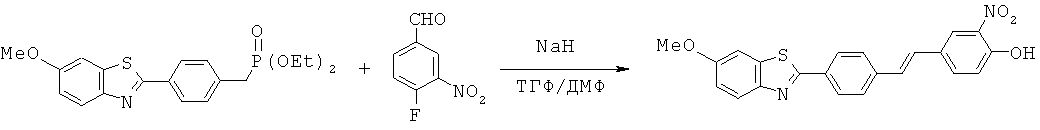
Получен в соответствии с описанием раздела Получение алкена с применением гидрида натрия (60% дисперсия в минеральном масле, 0,286 г, 7,15 ммоль), диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,5 г, 1,28 ммоль) и 4-фтор-3-нитробензальдегида (0,24 г, 1,41 ммоль) в смеси сухого ДМФ (5 мл) и ТГФ (20 мл) с получением титульного соединения (0,10 г, 19%) в виде красного твердого вещества после обработки и флэш-хроматографии (ДХМ).
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.80 (s, 3H), 7.08 (dd, J=8.9, 2.4 Гц, 1H), 7.11 (d, J=8.5 Гц, 1H), 7.25 (d, J=16.4 Гц, 1H), 7.35 (d, J=16.4 Гц, 1H), 7.66 (d, J=2.4 Гц, 1H), 7.69 (d, J=8.5 Гц, 2Н), 7.81 (dd,J=8.9, 2.4 Гц, 1Н), 7.88 (d, J=8.9 Гц, 1Н), 7.98 (d, J=8.2 Гц, 2Н), 8.09 (d, J=2.4 Гц, 1Н), 11.2 (br s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 56.41, 105.52, 116.65, 120.18, 123.84, 124.01, 127.82, 127.88, 128.65, 129.23, 132.63, 133.45, 136.64, 137.74, 140.11, 148.75, 152.36, 158.19, 164.89 (1 отсутствует).
2-{4-[2-(4-(2-фторэтокси)фенил)винил]фенил}-6-метоксибензотиазол
№ соединения SKT03-77
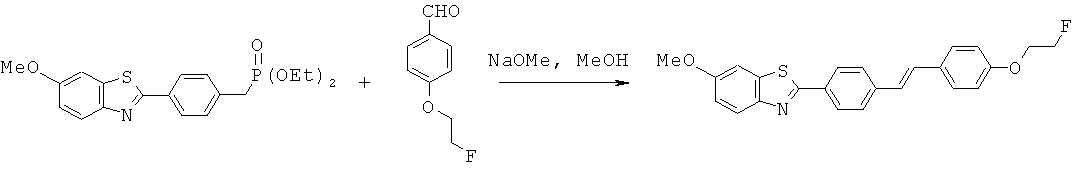
Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,06 г, 0,153 ммоль), метоксида натрия (0,5М раствор в MeOH, 0,46 мл, 0,23 ммоль) и 4-(2-фторэтокси)бензальдегида (0,028 г, 0,168 ммоль) в сухом MeOH (5 мл) с получением титульного соединения (0,048 г, 77%) в виде светло-желтого твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.85 (s, 3H), 4.27 (dist d of t, JHF=30.1 Гц, JHH=3.9 Гц, 2Н), 4.74 (dist d of t, JHF=48.1 Гц, JHH=3.9 Гц, 2Н), 7.00 (d, J=8.6 Гц, 2Н), 7.13 (dd, J=9.0, 2.7 Гц, 1Н), 7.18 (d, J=16.4 Гц, 1Н), 7.33 (d, J=16.4 Гц, 1Н), 7.59 (d, J=9.0 Гц, 2Н), 7.69 (d, J=2.7 Гц, 1Н), 7.72 (d, J=8.6 Гц, 2Н), 7.93 (d, J=9.0 Гц, 1Н), 8.01 (d, J=8.6 Гц, 2Н).
6-метокси-2-(4-{(Е)-2-[2-метокси-5-(трифторметокси)фенил]этенил}фенил)-1,3-бензотиазол
№ соединения SKT04-187
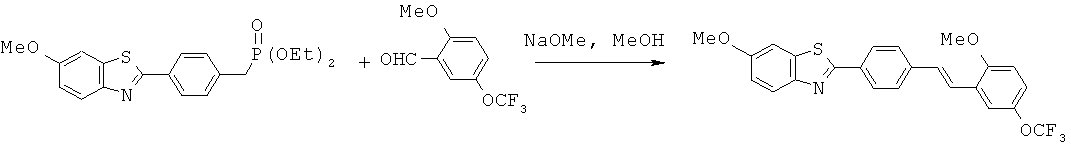
Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,75 г, 1,92 ммоль), 0,5М раствора метоксида натрия (7,7 мл, 3,84 ммоль) и 2-метокси-5-трифторметоксибензальдегида (0,42 г, 1,92 ммоль) в сухом MeOH (10 мл) с получением титульного соединения (0,732 г, 83%) в виде светло-желтого твердого вещества после обработки.
1Н ЯМР (250 МГц, CDCl3) δ 3.87 (s, 3H), 3.89 (s, 3H), 6.86 (d, J=8.8 Гц, 1H), 7.06-7.14 (m, 3H), 7.33 (d, J=2.1 Гц, 1H), 7.45 (s, 1H), 7.49 (d, J=17 Гц, 1H), 7.60 (d, J=8.2 Гц, 2Н), 7.94 (d, J=8.8 Гц, 1H), 8.01 (d, J=8.2 Гц, 2Н);13С ЯМР (62.5 МГц, CDCl3) δ 55.81, 55.98, 104.16, 111.61, 115.71, 119.26, 120.67 (q, JCF=256 Гц), 121.39, 123.58, 123.69, 127.21. 127.40, 127.54, 129.53, 132.96, 136.45, 139.57, 142.88, 148.81, 155.46, 157.82, 165.13.
6-метокси-2-(4-{(Е)-2-[4-метокси-2-(трифторметил)фенил]этенил}фенил)-1,3-бензотиазол
№ соединения SKT04-159

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,89 г, 2,28 ммоль), 0,5М раствора метоксида натрия (9,2 мл, 4,56 ммоль) и 4-метокси-2-трифторметоксибензальдегида (0,47 г, 2,28 ммоль) в сухом MeOH (10 мл) с получением титульного соединения (0,67 г, 67%) в виде желтого/зеленого твердого вещества после обработки.
1Н ЯМР (250 МГц, ДМСО-d6) δ 3.86 (s, 3H), 3.89 (s, 3H), 6.99 (d, J=16.2 Гц, 1H), 7.05-7.11 (m, 2Н), 7.19 (d, J=2.1 Гц, 1H), 7.34 (d, J=2.1 Гц, 1H), 7.48 (d, J=16.2 Гц, 1H), 7.58 (d, J=8.2 Гц, 2Н), 7.73 (d, J=8.8 Гц, 1H), 7.94 (d, J=8.8 Гц, 1H), 8.02 (d, J=8.2 Гц, 2Н);13C ЯМР (62.5 МГц, CDCl3) δ 55.62, 55.84, 104.16, 111.61 (q, JCF=5.9 Гц), 115.72, 117.51, 123.73, 124.16 (q, JCF=274 Гц), 125.32, 127.18, 127.60, 128.31, 128.49, 128.79 (q, JCF=29.8 Гц), 129.77, 133.03, 136.47, 139.35, 148.83, 157.82, 158.98, 165.08.
6-метокси-2-(4-{(Е)-2-[4-метокси-3-(трифторметил)фенил]этенил}фенил)-1,3-бензотиазол
№ соединения SKT03-167

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,89 г, 2,28 ммоль), 0,5М раствора метоксида натрия (9,2 мл, 4,56 ммоль) и 4-метокси-3-трифторметоксибензальдегида (0,47 г, 2,28 ммоль) в сухом МеОН (15 мл) с получением титульного соединения (0,683 г, 68%) в виде светло-желтого твердого вещества после обработки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.85 (s, 3H), 3.92 (s, 3H), 7.13 (dd, J=8.6, 2.3 Гц, 1Н), 7.29 (d, J=8.6 Гц, 1Н), 7.30 (d, J=16.4 Гц, 1Н), 7.40 (d, J=16.4 Гц, 1Н), 7.68 (d, J=2.3 Гц, 1Н), 7.74 (d, J=8.2 Гц, 2Н), 7.86-7.91 (m, 2H), 7.92 (d, J=8.6 Гц, 1Н), 8.01 (d, J=8.2 Гц, 2Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 56.28, 56.83, 105.46, 113.91, 116.39, 117.87 (q, JCF=30.4 Гц), 123.81, 124.14 (q, JCF=272 Гц), 125.51 (q, JCF=5.4 Гц), 127.51, 127.60, 127.68, 128.96, 128.98, 129.87, 132.45, 132.51, 136.48, 140.06, 148.63, 157.18, 158.06, 163.79, 164.74.
Монофтор- и фторированные гидроксиалкены
2-{4-[2-(4-фторфенил)винил]фенил}-6-гидроксибензотиазол
№ соединения SKT02-165

Получен в соответствии с описанием вышеприведенного раздела Деметилирование с применением 2-{4-[2-(4-фторфенил)винил]фенил}-6-метоксибензотиазола (0,080 г, 0,222 ммоль) в сухом ДХМ (10 мл) и BBr3 в ДХМ (1,ОМ, 1,10 мл, 1,10 ммоль) с получением титульного соединения (0,087 г, 78%) в виде желтого твердого вещества после обработки и флэш-хроматографии (15:1 ДХМ/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 5.11 (br s, 1Н), 6.96-7.09 (m, 4H), 7.17 (d, J=16.2 Гц, 1Н), 7.32 (s, 1Н), 7.48-7.53 (m, 2Н), 7.59 (d, J=8.2 Гц, 2Н), 7.91 (d, J=8.8 Гц, 1Н), 8.02 (d, J=7.9 Гц, 2Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 107.24, 116.13 (d, JCF=21.0 Гц), 116.67, 123.91, 127.54, 127.63, 127.86 (d, JCF=2.3 Гц), 129.06, 129.14, 129.32, 132.59, 133.86 (d, JCF=3.1 Гц), 136.43, 139.78, 147.68, 156.28, 162.31 (d, JCF=242.9 Гц).
2-{4-[2-(4-(N-2,2,2-трифторэтил)аминофенил)винил]фенил}-6-гидроксибензотиазол
№ соединения SKT02-155

Получен в соответствии с описанием вышеприведенного раздела Деметилирование с применением 2-{4-[2-(4-(N-2,2,2-трифторэтил)аминофенил)винил]фенил}-6-метоксибензотиазола (0,049 г, 0,111 ммоль) в сухом ДХМ (10 мл) и BBr3 в ДХМ (1,ОМ, 0,6 мл, 0,60 ммоль) с получением титульного соединения (0,037 г, 78%) в виде желтого твердого вещества после обработки и флэш-хроматографии (15:1 ДХМ/EtOAc).
1Н ЯМР (400 МГц, ДМСО-d6) δ 3.90-4.02 (m, 2H), 6.50 (t, J=1.5 Гц, 1Н), 6.76 (d, J=8.2 Гц, 2Н), 6.99 (dd, J=1.6, 8.0 Гц, 1Н), 7.04 (d, J=16.4 Гц, 1Н), 7.24 (d, J=16.4 Гц, 1Н), 7.38-7.45 (m, 3H), 7.66 (d, J=8.2 Гц, 2H), 7.83 (d, J=9.0 Гц, 1Н), 7.95 (d, J=8.2 Гц, 2H), 9.88 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 44.49 (q, JCF=32.8 Гц), 107.24, 113.10, 116.61, 123.41, 123.77, 126.24 (q, JCF=281 Гц), 126.51, 126.98, 127.51, 128.38, 130.95, 131.75, 136.36, 140.75, 147.77, 148.23, 156.20, 163.72.
2-{4-[2-(4-(N-3,3,3-трифторпропил)аминофенил)винил]фенил}-6-гидроксибешотиазол
№ соединения SKT02-127

Получен в соответствии с описанием вышеприведенного раздела Двметилирование с применением 2-{4-[2-(4-(N-3,3,3-трифторпропил)аминофенил)винил]фенил}-6-метоксибензотиазола (0,10 г, 0,22 ммоль) в сухом ДХМ (10 мл) и BBr3 в ДХМ (1,0М, 1,10 мл, 1,10 ммоль) с получением титульного соединения (0,050 г, 52%) в виде желтого твердого вещества после обработки и флэш-хроматографии (4:3 гексан/EtOAc).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.53-2.66 (m, 2H), 3.37-3.51 (m, 2H), 6.14 (br s, 1Н), 6.68 (d, J=8.6 Гц, 2H), 7.05 (dd, J=9.0, 2.3 Гц, 1Н), 7.07 (d, J=16.5 Гц, 1Н), 7.30 (d, J=16.5 Гц, 1Н), 7.46 (s, 1Н), 7.47 (d, J=8.6 Гц, 1Н), 7.47 (s, 1Н), 7.72 (d, J=8.6 Гц, 2H), 7.89 (d, J=9.0 Гц, 1Н), 8.01 (d, J=8.6 Гц, 2H), 9.95 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 32.98 (q, JCF=27.2 Гц), 36.49 (q, JCF=3.8 Гц), 107.24, 112.71, 116.60, 122.82, 123.76, 125.62, 126.89, 127.44 (q, JCF=277.1 Гц), 127.51, 128.57, 131.17, 131.62, 136.35, 140.88, 147.78, 148.77, 156.19, 163.74.
2-{4-[2-(4-(N-4,4,4-трифторбутил)аминофенил)винил]фенил}-6-гидроксибензотиазол
№ соединения SKT02-111

Получен в соответствии с описанием вышеприведенного раздела Деметилирование с применением 2-{4-[2-(4-(N-4,4,4-трифторбутил)аминофенил)винил]фенил}-6-метоксибензотиазола (0,138 г, 0,295 ммоль) в сухом ДХМ (10 мл) и BBr3 в ДХМ (1,0М, 1,50 мл, 1,50 ммоль) с получением титульного соединения (0,095 г, 71%) в виде желтого твердого вещества после обработки и флэш-хроматографии (3:2 гексан/EtOAc).
1Н ЯМР (400 МГц, ДМГО-d6) δ 1.71-1.79 (m, 2Н), 2.27-2.40 (m, 2H), 3.13 (q, J=6.3 Гц, 2Н), 5.94 (t, J=5.9 Гц, 1Н), 6.59 (d, J=8.6 Гц, 2Н), 6.96 (d, J=16.0 Гц, 1Н), 6.98 (dd, J=8.6, 2.4 Гц, 1Н), 7.20 (d, J=16.0 Гц, 1Н), 7.37 (d, J=8.6 Гц, 2Н), 7.38 (d, J=2.4 Гц, 1Н), 7.63 (d, J=8.2 Гц, 2Н), 7.81 (d, J=8.6 Гц, 1Н), 7.93 (d, J=8.2 Гц, 2Н), 9.76 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 21.84 (q, J=Гц), 30.89 (q, J=28.05 Гц), 41.81, 107.23, 112.55, 116.58, 122.45, 123.74, 125.09, 126.82, 127.50, 128.53, 131.27, 131.53, 136.33, 140.94, 147.77, 149.42, 156.17, 163.74.
2-{4-[2-(4-(2,2,2-трифторэтокси)фенил)винил]фенил}-6-гидроксибензотиазол
№ соединения SKT02-51

Получен в соответствии с описанием вышеприведенного раздела Деметилирование с применением 2-{4-[2-(4-(2,2,2-трифторэтокси)фенил)винил]фенил}-6-метоксибензотиазола (0,097 г, 0,22 ммоль) в сухом ДХМ (5 мл) и BBr3 в ДХМ (1,0М, 1,10 мл, 1,10 ммоль) с получением титульного соединения (0,078 г, 83%) в виде желтого твердого вещества после обработки и флэш-хроматографии (100:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ацетон-d6) δ 4.72 (q, J=9.1 Гц, 2Н), 7.01-7.18 (m, 3H), 7.23 (d, J=15.9 Гц, 1Н), 7.38 (d, J=15.9 Гц, 1Н), 7.47 (d, J=1.8 Гц, 1Н), 7.67 (d, J=8.2 Гц, 2Н), 7.75 (d, J=8.2 Гц, 2Н), 7.87 (d, J=8.5 Гц, 1Н), 8.07 (d, J=8.2 Гц, 2Н), 8.83 (s, 1Н)
2-(4-{(E)-2-[2-гидрокси-5-(трифторметокси)фенил]этенил}фенил)-1,3-бензотиазол-6-ол
№ соединения SKT05-5
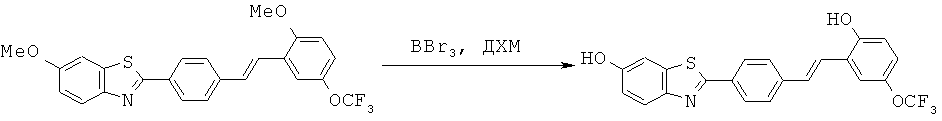
Получен в соответствии с описанием вышеприведенного раздела Деметилирование с применением 6-метокси-2-(4-{(Е)-2-[2-метокси-5-(трифторметокси)фенил]этенил} фенил). 1,3-бензотиазола (0,097 г, 0,22 ммоль) в сухом ДХМ (5 мл) и BBr3 в ДХМ (1,0М, 1,90 мл, 1,90 ммоль) при -78°С с получением титульного соединения (0,308 г, 82%) в виде желтого твердого вещества после обработки и флэш-хроматографии (20:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, CD3OD) δ 6.86 (d, J=8.8 Гц, 1Н), 7.01 (d, J=8.8 Гц, 1Н), 7.01 (d, J=8.8 Гц, 1Н), 7.26 (d, J=16.5 Гц, 1Н), 7.31 (d, J=2.1 Гц, 1Н), 7.47 (d, J=2.1 Гц, 1Н), 7.55 (d, J=16.5 Гц, 1Н), 7.67 (d,J=8.2 Гц, 1Н), 7.81 (d,J=8.8 Гц, 1Н), 7.98 (d,J=8.2 Гц, 1Н);13С ЯМР (100 МГц, ДМСО-d6) δ 107.24, 116.69, 117.39, 119.69, 120.80 (q, JCF=255 Гц), 121.92, 123.89, 124.45, 125.42, 127.58, 127.62, 129.21, 132.75, 136.49, 140.06, 141.56, 147.79, 154.65, 156.33, 163.54.
2-(4-{(Е)-2-[4-гидрокси-2-(трифторметил)фенил]этенил}фенил)-1,3-бензотиазол-6-ол
№ соединения SKT04-169

Получен в соответствии с описанием вышеприведенного раздела Деметилирование с применением 6-метокси-2-(4- {(Е)-2- [4-метокси-2-(трифторметил)фенил]этенил} фенил)-1,3-бензотиазола (0,30 г, 0,68 ммоль) в сухом ДХМ (10 мл) и BBr3 в ДХМ (1,0М, 1,40 мл, 1,40 ммоль) при -78°С с получением титульного соединения (0,229 г, 81%) в виде желтого твердого вещества после обработки и флэш-хроматографии (1:1 гексан/EtOAc).
1Н ЯМР (250 МГц, ДМСО-d6) δ 6.99 (dd, J=2.1, 8.5 Гц, 1Н), 7.09 (d, J=8.5 Гц, 1Н), 7.11 (s, 1Н), 7.24 (d, J=17.1 Гц, 1Н), 7.31-7.44 (m, 2H), 7.70 (d,J=8.5 Гц, 2Н), 7.83-7.91 (m, 2H), 8.03 (d, J=8.5 Гц, 2H), 9.97 (br s, 1Н), 10.30 (br s, 1Н);13C ЯМР (100.5 МГц, ДМСО-d6) δ 107.24, 112.97 (q, JCF=6.2 Гц), 116.72, 120.06, 123.92, 124.70 (q, JCF=274 Гц), 124.97 (q, JCF=1.6 Гц), 126.30 (q, JCF=1.6 Гц), 127.62, 127.70, 127.72 (q, JCF=29.6 Гц), 129.60, 129.73, 132.93, 136.48, 139.55, 147.75, 156.32, 157.86, 163.44.
Нефторированные метилалкены
6-метил-2-{4-[(Е)-2-фенилэтенил]фенил}-1,3-бензотиазол
№ соединения SK696-39

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метилбензотиазол-2-ил)бензилфосфоната (0,30 г, 0,80 ммоль) в сухом ТГФ (15 мл), трет-бутоксида калия (0,10 г, 0,88 ммоль) и бензальдегида (0,085 г, 0,80 ммоль) в сухом ТГФ (5 мл) с получением титульного соединения (0,16 г, 60%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (2:1 гексан/EtOAc).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.47 (s, 3H), 7.28-7.42 (m, 6H), 7.65 (d, J=7.4 Гц, 2Н), 7.78 (d, J=7.8 Гц, 2Н), 7.92 (s, 1H), 7.93 (d, J=7.8 Гц, 1Н), 8.07 (d, J=8.2 Гц, 2Н).
2-{4-[2-(2-нитрофенил)винил]фенил}-6-метилбензотиазол
№ соединения SKT01-15
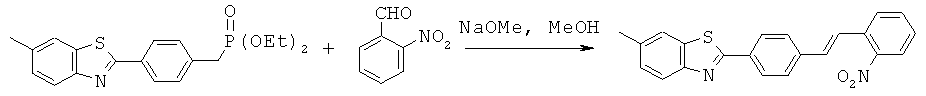
Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метилбензотиазол-2-ил)бензилфосфоната (0,30 г, 0,80 ммоль), 2-нитробензальдегида (0,12 г, 0,80 ммоль) и 0,5М раствора метоксида натрия (3,2 мл, 1,60 ммоль) в сухом МеОН (10 мл) с получением титульного соединения (0,185 г, 62%) в виде небольших желтых игольчатых частиц после обработки и перекристаллизации из 1,2-дихлорэтана.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.46 (s, 3H), 7.36 (dd, J=8.2, 1.2 Гц, 1H), 7.39 (d,.7=16.0 Гц, 1H), 7.54-7.58 (m, 1H), 7.60 (d, J=16.0 Гц, 1H), 7.74-7.77 (m, 1H), 7.78 (d, J=8.2 Гц, 2Н), 7.92 (brs, 1H), 7.93 (d, J=8.6 Гц, 1Н), 7.99 (d, J=7.5 Гц, 1Н), 8.00 (dd, J=8.2, 1.2 Гц, 1Н), 8.09 (d, J=8.2 Гц, 2Н);13С ЯМР (100 МГц, ДМСО-d6) δ 21.51, 122.28, 122.92, 124.97, 125.14, 128.00, 128.27, 128.65, 128.74, 129.37, 132.00. 132.85, 133.24, 133.93, 135.16, 135.91, 139.53, 148.50, 152.30, 166.05.
2-{4-[2-(3-нитрофенил)винил]фенил}-6-метилбензотиазол
№ соединения SKT01-53
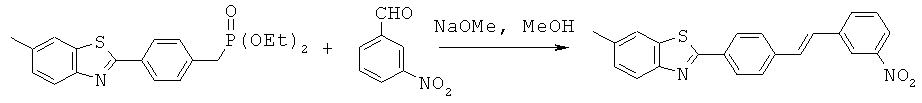
Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метилбензотиазол-2-ил)бензилфосфоната (0,16 г, 0,43 ммоль), 3-нитробензальдегида (0,064 г, 0,43 ммоль) и 0,5М раствора метоксида натрия (1,7 мл, 0,85 ммоль) в сухом МеОН (10 мл) с получением титульного соединения (0,149 г, 94%) в виде небольших желтых игольчатых частиц после обработки и перекристаллизации из 1,2-дихлорэтана.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.45 (s, 3H), 7.36 (d, J=8.6 Гц, 1H), 7.55 (d, J=17.2 Гц, 1Н), 7.59 (d, J=17.2 Гц, 1H), 7.66-7.70 (m, 1H), 7.82 (d, J=8.2 Гц, 2Н), 7.92 (s, 1H), 7.93 (d, J=8.6 Гц, 1H), 8.08 (d, J=8.2 Гц, 2Н), 8.11-8.13 (m, 2Н), 8.47 (s, 1H);13С ЯМР (100 МГц, ДМСО-d6) δ 21.54, 121.49, 122.31, 122.79, 122.88, 127.92, 128.12, 128.49, 128.65, 130.69, 130.79, 132.90, 133.23, 135.09, 135.86, 139.22, 139.67, 148.83, 152.24, 166.12.
2-{4-[2-(4-нитрофенил)винил]фенил}-6-метилбензотиазол
№ соединения SKT01-3

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метилбензотиазол-2-ил)бензилфосфоната (0,324 г, 0,86 ммоль), 4-нитробензальдегида (0,13 г, 0,86 ммоль) и 0,5М раствора метоксида натрия (3,5 мл, 1,75 ммоль) в сухом MeOH (10 мл) с получением титульного соединения (0,221 г, 69%) в виде небольших желтых игольчатых частиц после обработки и перекристаллизации из 1,2-дихлорэтана.
ИКС 3023, 1635, 1596, 1587, 1502, 1483, 1332, 1258, 1194, 1109, 968, 943, 873, 834, 825, 810, 748, 722 см-1;1Н ЯМР (250 МГц, ДМСО-d6) δ 2.47 (s, 3H), 7.38 (d, J=7.9 Гц, 1H), 7.57 (d, J=17.4 Гц, 1H), 7.65 (d, J=17.4 Гц, 1H), 7.86 (d, J=7.9 Гц, 2Н), 7.90-7.97 (m, 4H), 8.12 (d, J=8.2 Гц, 2Н), 8.26 (d, J=8.2 Гц, 2Н).
2-{4-[2-(2-аминофенил)винил]фенил}-6-метилбензотиазол
№ соединения SKT01-55

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 2-{4-[2-(2-нитрофенил)винил]фенил}-6-метилбензотиазола (0,10 г, 0,268 ммоль) и дигидрата хлорида олова (II) (0,48 г, 2,15 ммоль) в ЕЮН (3 мл) с получением титульного соединения (0,036 г, 39%) в виде желтого твердого вещества после обработки и флэш-хроматографии (20:1 ДХМ/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 2.49 (s, 3H), 3.84 (br s, 2H), 6.73 (d, J=7.9 Гц, 1Н), 6.79-6.85 (m, 1H), 7.02 (d, J=16.2 Гц, 1Н), 7.09-7.15 (m, 1Н), 7.27 (d, J=16.2 Гц, 1Н), 7.29 (d, J=7.6 Гц, 1Н), 7.43 (d, J=7.6 Гц, 1Н), 7.59 (d, J=8.2 Гц, 2H), 7.68 (s, 1Н), 7.94 (d, J=8.2 Гц, 1Н), 8.05 (d, J=8.2 Гц, 2H);13С ЯМР (62.5 МГц, CDCl3) δ 21.62, 116.47, 119.29, 121.39, 122.65, 125.64, 125.78, 126.92, 127.29, 127.77, 128.00, 129.11, 129.32, 132.69, 135.19, 135.39, 140.10, 144.18, 152.35, 166.63.
2-{4-[2-(3-аминофенил)винил]фенил}-6-метилбензотиазол
№ соединения SKT01-69
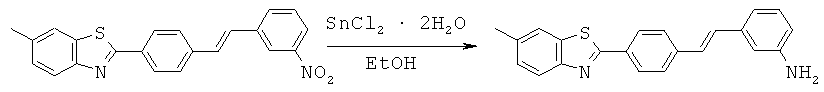
Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 2-{4-[2-(3-нитрофенил)винил]фенил}-6-метилбензотиазола (0,12 г, 0,322 ммоль) и дигидрата хлорида олова (II) (0,58 г, 2,58 ммоль) в EtOH (3 мл) с получением титульного соединения (0,078 г, 71%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (20:1 ДХМ/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 2.49 (s, 3H), 3.71 (br s, 2H), 6.63 (dd, J=7.9, 1.8 Гц, 1Н), 6.87 (s, 1Н), 6.95 (d, J=7.6 Гц, 1Н), 7.05-7.20 (m, 3H), 7.29 (dd, J=8.2, 1.8 Гц, 1Н), 7.59 (d, J=8.2 Гц, 2H), 7.68 (s, 1Н), 7.94 (d, J=8.2 Гц, 1Н), 8.05 (d, J=8.5 Гц, 2H);13С ЯМР (62.5 МГц, CDCl3) δ 21.63, 113.02, 115.12, 117.54, 121.41, 122.66, 126.98, 127.58, 127.76, 127.99, 129.71, 130.46, 132.66, 135.19, 135.38, 138.03, 139.90, 146.73, 152.37, 166.68.
2-{4-[2-(4-аминофенил)винил]фенил}-6-метилбензотиазол
№ соединения SKT01-17

Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 2-{4-[2-(4-нитрофенил)винил]фенил}-6-метилбензотиазола (0,15 г, 0,403 ммоль) и дигидрата хлорида олова (II) (0,73 г, 3,22 ммоль) в EtOH (5 мл) с получением титульного соединения (0,113 г, 82%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (20:1 ДХМ/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 2.48 (s, 3H), 3.73 (br s, 2H), 6.68 (d, J=8.2 Гц, 2Н), 6.94 (d, J=16.0 Гц, 1Н), 7.12 (d, J=16.0 Гц, 1H), 7.22-7.41 (m, 3H), 7.57 (d, J=8.2 Гц, 2H), 7.69 (s, 1H), 7.91 (d, J=8.2 Гц, 1H), 8.04 (d, J=8.2 Гц, 2H).
2-{4-[2-(4-диметиламинофенил)винил]фенил}-6-метилбензотиазол
№ соединения SK2033-30

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метилбензотиазол-2-ил)бензилфосфоната (0,05 г, 0,133 ммоль) в сухом ТГФ (5 мл), трет-бутоксида калия (0,03 г, 0,266 ммоль) и 4-диметиламинобензальдегида (0,02 г, 0,133 ммоль) в сухом ТГФ (5 мл) с получением титульного соединения (0,037 г, 75%) в виде оранжевого твердого вещества после обработки и флэш-хроматографии (4:1 гексан/ЫзО).
ИКС 3020, 2915, 1605, 1591. 1554, 1523, 1479, 1452, 1415, 1359, 1309, 1256, 1224, 1190, 1180, 1164, 1115, 1062, 965, 949, 827, 812 см-1;1Н ЯМР (400 МГц, ацетон-d6) δ 2.49 (s, 3H), 3.00 (s, 6Н), 6.77 (d, J=8.6 Гц, 2H), 7.08 (d, J=16.4 Гц, 1H), 7.32 (d, J=16.4 Гц, 1H), 7.36 (d, J=7.4 Гц, 1H), 7.51 (d, J=8.6 Гц, 2H), 7.71 (d, J=8.2 Гц, 2H), 7.86 (s, 1H), 7.90 (d, J=8.2 Гц, 1Н), 8.08 (d, J=8.2 Гц, 2Н).
2-{(Е)-2-[4-(6-метил-1,3-бензотиазол-2-ил)фенил]этенил}фенол
№ соединения SK696-62

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метилбензотиазол-2-ил)бензилфосфоната (0,30 г, 0,80 ммоль) в сухом ТГФ (25 мл), трет-бутоксида калия (0,19 г, 1,68 ммоль) и 2-гидроксибензальдегида (0,097 г, 0,80 ммоль) в сухом ТГФ (10 мл) с получением титульного соединения (0,16 г, 60%) в виде желтого твердого вещества после обработки и флэш-хроматографии (1:1 гексан/EtOAc).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.44 (s, 3H), 6.81-6.85 (m, 1H). 6.89 (d, J=7.8 Гц, 1H), 7.10-7.14 (m, 1H), 7.29 (d, J=16.5 Гц, 1H), 7.35 (d, J=8.6 Гц, 1H), 7.56 (d, J=16.5 Гц, 1H), 7.61 (d, J=7.4 Гц, 1H), 7.71 (d, J=8.2 Гц, 2H), 7.89 (s, 1H), 7.92 (d, J=8.6 Гц, 1H), 8.04 (d, J=8.2 Гц, 2H),9.87(s, 1H);13С ЯМР (100 МГц, ДМСО-d6) δ 21.54, 116.39, 119.81, 122.29, 122.79, 123.87, 126.01, 127.23, 127.42, 127.92, 128.59, 129.63, 131.96, 135.00, 135.72, 141.02, 152.27, 155.76, 166.29 (1 отсутствует).
3-{(Е)-2-[4-(6-метил-1,3-бензотиазол-2-ил)фенил]этенил}фенол
№ соединения SK696-57

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метилбензотиазол-2-ил)бензилфосфоната (0,30 г, 0,80 ммоль) в сухом ТГФ (25 мл), трет-бутоксида калия (0,19 г, 1,68 ммоль) и 3-гидроксибензальдегида (0,097 г, 0,80 ммоль) в сухом ТГФ (10 мл) с получением титульного соединения (0,12 г, 44%) в виде желтого твердого вещества после обработки и флэш-хроматографии (2:1 гексан/EtOAc).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.43 (s, 3H), 6.72 (dd, J=7.8, 1.6 Гц, 1H), 7.02 (s, 1H), 7.06 (d, J=7.8 Гц, 1Н), 7.17 (d, J=7.9 Гц, 1Н), 7.22 (d, J=16.0 Гц, 1Н), 7.31 (d, J=16.0 Гц, 1Н), 7.34 (d, J=7.8 Гц, 1H), 7.75 (d, J=8.2 Гц, 2H), 7.87 (s, 1H), 7.91 (d, J=8.2 Гц, 1H), 8.03 (d, J=8.2 Гц, 2H), 9.48 (s, 1H);13С ЯМР (100 МГц, ДМСО-d6) δ 21.53, 113.79, 115.78, 118.26, 122.26, 122.82, 127.65, 127.71, 127.83, 128.59, 130.16, 130.98, 132.27, 135.03, 135.75, 138.51, 140.33, 152.26, 158.13, 166.23.
4-{(Е)-2-[4-(6-метил-1,3-бензотиазол-2-ил)фенил]этенил}фенол
№ соединения SK696-43

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метилбензотиазол-2-ил)бензилфосфоната (0,10 г, 0,266 ммоль) в сухом ТГФ (10 мл), трет-бутоксида калия (0,063 г, 0,559 ммоль) и 4-гидроксибензальдегида (0,033 г, 0,266 ммоль) в сухом ТГФ (5 мл) с получением титульного соединения (0,061 г, 67%) в виде светло-оранжевого твердого вещества после обработки и флэш-хроматографии (2:1 гексан/EtOAc).
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.45 (s, 3H), 6.79 (d, J=8.3 Гц, 2H), 7.08 (d, J=16.5 Гц, 1Н), 7.28 (d, J=16.5 Гц, 1Н), 7.34 (d, J=8.2 Гц, 1Н), 7.46 (d, J=8.3 Гц, 2H), 7.69 (d, J=8.2 Гц. 2H), 7.88 (s, 1Н), 7.91 (d, J=8.2 Гц, 1Н), 8.02 (d, J=8.2 Гц, 2H), 9.57 (s, 1Н);13C ЯМР (100 МГц, ДМСО-d6) δ 21.49, 116.14, 122.21, 122.77, 124.61, 127.19, 127.71, 127.85, 128.33, 128.53, 128.69, 130.96, 131.76, 135.67, 140.98, 152.33, 158.25, 166.34.
2-{4-[2-(3-метоксифенил)винил]фенил}-6-метилбензотиазол
№ соединения SK2033-29

Получен в соответствии с описанием раздела Получение алкена с применением диэтил 4-(6-метоксибензотиазол-2-ил)бензилфосфоната (0,05 г, 0,133 ммоль) в сухом ТГФ (5 мл), трет-бутоксида калия (0,03 г, 0,266 ммоль) и 3-метоксибензальдегида (0,018 г, 0,133 ммоль) в сухом ТГФ (5 мл) с получением титульного соединения (0,016 г, 34%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (4:1 гексан/Et2O).
1Н ЯМР (250 МГц, CDCl3) δ 2.49 (s, 3H), 3.86 (s, 3H), 6.85 (dd, J=8.2, 1.8 Гц, 1Н), 7.61 (d, J=8.2 Гц, 2H), 7.68 (s, 1Н), 7.94 (d, J=8.2 Гц, 1Н), 8.06 (d, J=8.2 Гц, 2H);13C ЯМР (62.5 МГц, CDCl3) δ 21.6, 55.31, 111.90, 113.81, 119.46, 121.39, 122.68, 127.04, 127.77, 128.00, 129.76, 130.18, 132.82, 135.21, 135.41, 138.44, 139.71, 152.35, 159.96, 166.62.
Промежуточные соединения при получении имидазо[1,2-а]пиридиновых соединений
4-бромметилацетофенон
№ соединения SKT05-187

К перемешиваемому раствору 4-метилацетофенона (2,16 г, 15,32 ммоль) в MeCN (20 мл) добавили N-бромсукцинимид (3,00 г, 16,85 ммоль) и AIBN (0,25 г, 1,53 ммоль) в атмосфере аргона. Затем реакционную смесь нагревали при 90°С в течение 1,5 часов. После охлаждения до комнатной температуры удалили растворитель при пониженном давлении и добавили толуол (25 мл) к остатку, который потом отфильтровали в вакууме. Фильтрат концентрировали и очистили при помощи флэш-хроматографии (10:1 гексан/EtOAc, затем 5:1 гексан/EtOAc) с получением титульного соединения (2,80 г, 86%) в виде бесцветной маслянистой жидкости.
ИКС 3034, 3003, 2969, 1683, 1606, 1573, 1412, 1358, 1267, 1229, 1202, 1181, 1102, 1075, 1017, 959, 843, 821 см-1;1Н ЯМР (250 МГц, CDCl3) δ 2.59 (s, 3H), 4.49 (s, 2H), 7.47 (d, J=8.2 Гц, 2Н), 7.92 (d, J=8.2 Гц, 2H);13С ЯМР (62.5 МГц, CDCl3) δ 26.77, 32.22, 128.89, 129.29, 136.87, 142.85, 197.50.
Диэтиловый эфир (4-ацетилбензил)фосфоновой кислоты
№ соединения SKT05-191
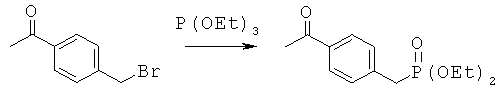
Перемешиваемую смесь 4-бромметилацетофенона (2,50 г, 11,74 ммоль) и триэтилфосфита (10 мл) нагревали при 140°С в течение 3 часов. После охлаждения до комнатной температуры избыток триэтилфосфита удалили при помощи перегонки и остаток очистили при помощи флэш-хроматографии (EtOAc) с получением титульного соединения (2,49 г, 79%) в виде бесцветной маслянистой жидкости.
1Н ЯМР (250 МГц, CDCl3) δ 1.19 (t, J=7.0 Гц, 6Н), 2.53 (s, 3H), 3.15 (d, JHP=22.2 Гц, 2H), 3.91-4.02 (m, 4H), 7.34 (d, J=7.9 Гц, 2H), 7.85 (d, J=7.9 Гц, 2H);13С ЯМР (62.5 МГц, CDCl3) δ 16.37 (d, JCP=5.9 Гц), 26.62, 33.94 (d, JCP=137.7 Гц), 62.27 (d, JCP=6.8 Гц), 128.56, 129.99 (d, JCP=5.9 Гц), 135.73 (d, JCP=2.9 Гц), 137.43 (d, JCP=9.8 Гц), 197.70.
Диэтиловый эфир (4-бромацетилбензил)фосфоновой кислоты
№ соединения SKT06-87

К перемешиваемому раствору диэтилового эфира (4-ацетилбензил)фосфоновой кислоты (2,56 г, 9,48 ммоль) в ДХМ (100 мл) и МеОН (40 мл) при комнатной температуре добавили трибромид тетра-н-бутиламмония (5,03 г, 10,43 ммоль) с последующим добавлением капли концентрированной хлороводородной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Затем удалили растворители при пониженном давлении и остаток разделили в Et2O (100 мл) и насыщенном растворе NaHCO3 (60 мл). Водную фазу отделили, а органическую фазу промыли солевым раствором (60 мл) и осушили (Na2SO4). Удалили растворитель при пониженном давлении с получением светло-желтой маслянистой жидкости, которую очистили при помощи флэш-хроматографии (3:1 EtOAc/ДХМ) с получением титульного соединения (2,01 г, 61%) в виде бесцветной маслянистой жидкости.
1Н ЯМР (250 МГц, CDCl3) δ 1.23 (t, J=7.0 Гц, 6Н), 3.19 (d, JHP=22.3 Гц, 2Н), 3.95-4.10 (m, 4H), 4.42 (s, 2Н), 7.41 (d, J=8.2 Гц, 2Н), 7.92 (d, J=8.2 Гц, 2Н);13С ЯМР (62.5 МГц, CDCl3) δ 16.38 (d, JCP=5.9 Гц), 31.01, 34.08 (d, JCP=137 Гц), 39.78, 62.35 (d, JCP=6.8 Гц), 129.17, 129.94, 130.24, 130.33, 132.58 (d, JCP=2.9 Гц), 138.55 (d, JCP=8.8 Гц), 139.21 (d, JCP=8.8 Гц), 190.84.
Диэтил-[4-(6-метилиидазо[1,2-а]пиридин-2-ил)бензил]фосфонат
№ соединения SKT06-31
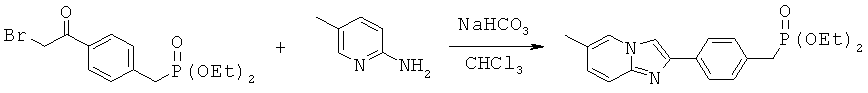
К перемешиваемой смеси 2-амино-5-пиколина (0,62 г, 5,76 ммоль) и бикарбоната натрия (0,48 г, 5,76 ммоль) в CHCl3 (35 мл) добавили раствор диэтилового эфира (4-бромацетилбензил)фосфоновой кислоты в CHCl3 (8 мл). Перемешиваемую реакционную смесь кипятили с обратным холодильником в течение 17 часов. После охлаждения до комнатной температуры к реакционной смеси добавили CHCl3 (20 мл), затем промыли водой (60 мл). Отделенную водную фазу экстрагировали CHCl3 (2×50 мл) и объединенные органические фазы промыли солевым раствором (80 мл) и осушили (Na2SO4). Удалили растворитель при пониженном давлении с получением оранжевой вязкой маслянистой жидкости, которую очистили при помощи флэш-хроматографии (EtOAc, затем EtOAc/МеОН 20:1) с получением титульного соединения (1,29 г, 63%) в виде бесцветного твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 1.23 (t, J=7.0 Гц, 6Н), 2.32 (s, 3H), 3.18 (d, JH,P=21.7 Гц, 2Н), 4.00 (m, 4H), 7.05 (d, J=9.2 Гц, 1Н), 7.35 (d, J=7.9 Гц, 2Н), 7.57 (d, J=9.2 Гц, 1Н), 7.76 (s, 1H), 7.89 (d, J=7.9 Гц, 2Н), 7.90 (s, 1Н);13С ЯМР (62.5 МГц, CDCl3) δ 16.41 (d, JC,P=5.8 Гц), 18.15, 33.65 (d, JC,P=138.7 Гц), 62.24 (d, JC,P=6.8 Гц), 107.87, 116.76, 122.10, 123.33, 126.05, 127.96. 130.15 (d, JC,P=6.8 Гц), 131.13 (d, JC,P=8.8 Гц), 132.57 (d, JC,P=3.9 Гц), 144.73, 145.08.
2-гидрокси-4-нитробензальдегид

Получен в соответствии с описанием вышеприведенного раздела Деметилирование с применением 2-метокси-4-нитробензальдегида (1,0 г, 5,52 ммоль) в сухом ДХМ (25 мл) и BBr3 в ДХМ (1,0М, 16 мл, 16 ммоль) с получением титульного соединения (0,70 г, 78%) в виде коричневатых пластинок после перекристаллизации из EtOH.
1Н ЯМР (250 МГц, CDCl3) δ 7.76-7.85 (m, 3H), 10.04 (s, 1H), 11.14 (s, 1H);13C ЯМР (100.5 МГц, CDCl3) δ 113.49, 114.36, 123.70, 134.79, 152.47, 161.91, 196.01.
2-(2-фторэтокси)-4-нитробензальдегид

К перемешиваемому раствору 2-гидрокси-4-нитробензальдегида (0,50 г, 2,99 ммоль) в сухом ДМФ (15 мл) добавили К2СО3 (1,24 г, 8,98 ммоль) при комнатной температуре в атмосфере аргона. К указанной перемешиваемой суспензии по каплям добавили 2-фторэтил-(4-метилбензол)сульфонат (0,78 г, 3,59 ммоль). Реакционную смесь нагревали при 100°С в течение 6 часов. Охлажденную реакционную смесь добавили в воду (250 мл) и экстрагировали EtOAc (3×75 мл). Объединенные органические фазы промыли солевым раствором (50 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением коричневого твердого вещества, которое очистили при помощи флэш-хроматографии (3:1 ДХМ/гексан) с получением титульного соединения (0,493 г, 77%) в виде желтого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 4.47 (dist d of t, JHF=27 Гц, JHH=3.7 Гц, 2Н), 4.87 (dist d of t, JHF=47 Гц, JHH=3.6 Гц, 2Н), 7.86 (s, 1H), 7.91 (d, J=9.1 Гц, 1H), 8.01 (d, J=8.2 Гц, 1H), 10.56 (s, 1Н);13С ЯМР (100.5 МГц, CDCl3) δ 68.58 (d, JCF=20.5 Гц), 81.15 (d, JCF=173 Гц), 108.05, 116.25, 128.87, 129.70, 152.05, 160.64, 188.11.
2-([2-трет-бутилдиметилсилокси]этокси)-4-нитробензальдегид
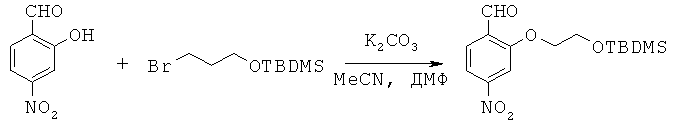
К перемешиваемой суспензии 2-гидрокси-4-нитробензальдегида (0,500 г, 2,992 ммоль) и безводного карбоната калия (0,621 г, 4,488 ммоль) в сухом MeCN (20 мл) при комнатной температуре добавили 2-бром-1-трет-бутилдиметилсилоксиэтан (83%, 1,293 г, 4,488 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 40 минут с получением вязкого темно-красного осадка. Реакционную смесь оставили охлаждаться до комнатной температуры и добавили сухой ДМФ (10 мл). Реакционную смесь нагревали при 100°С в течение 4 часов и после охлаждения добавили в воду (250 мл) и экстрагировали EtOAc (3×80 мл). Объединенные органические экстракты промыли водой (3×100 мл), солевым раствором (100 мл) и осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением светло-коричневого твердого вещества, которое очистили при помощи флэш-хроматограф ии (2:1 гексан/Et2O). Перекристаллизация из гексан привела к получению титульного соединения (0,621 г, 64%) в виде светло-желтых кристаллов.
1Н ЯМР (250 МГц, CDCl3) δ 0.08 (s, 6Н), 0.87 (s, 9H), 4.05 (t, J=4.6 Гц, 2Н), 4.30 (t, J=4.6 Гц, 2Н), 7.83-7.98 (m, 3H), 10.54 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3) δ -5.34, 18.32, 25.79, 61.61, 71.08, 108.64, 115.63, 128.81, 129.37, 152.12, 161.53, 188.43.
Способ адаптирован из работы Кувабе с соавторами (Kuwabe et al.).
4-[2-(гидроксиэтил)(метил)амино]бензальдегид

К перемешиваемому раствору 4-фторбензальдегида (5,0 г, 40,29 ммоль) и 2-(метиламино)этанола (3,63 г, 48,34 ммоль) в сухом ДМСО (35 мл) добавили К2СО3 (6,68 г, 48,34 ммоль) в атмосфере аргона. Затем реакционную смесь нагревали при 120°С в течение 3дней. Охлажденную реакционную смесь добавили в воду (400 мл) и экстрагировали EtOAc (7×100 мл). Объединенные органические фазы промыли солевым раствором (2×10 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением вязкой оранжевой маслянистой жидкости, которая медленно отвердела при комнатной температуре. Указанное твердое вещество растворили в ДХМ (40 мл) и указанный раствор затем добавили к гексан (200 мл) с осаждением желтого твердого вещества, которое собрали при помощи фильтрования в вакууме. Перекристаллизация из толуола привела к получению титульного соединения (4,47 г, 62%) в виде небольших желтых пластинок.
1Н ЯМР (250 МГц, CDCl3) δ 2.73 (br s, 1H), 3.07 (s, 3H), 3.58 (t, J=5.5 Гц, 2H), 3.82 (t, J=5.5 Гц, 2H), 6.69 (d, J=8.8 Гц, 2H), 7.62 (d, J=8.8 Гц, 2H), 9.60 (s, 1H);13С ЯМР (100.5 МГц, CDCl3) δ 39.25, 54.38, 59.92, 111.16, 125.05, 132.24, 153.96, 190.58.
Способ адаптирован из работы Ло Мео с соавторами (Lo Meo et al.).
4-[N-(2-трет-бутилдиметилсиланилоксиэтил)-N-метиламино]бензальдегид
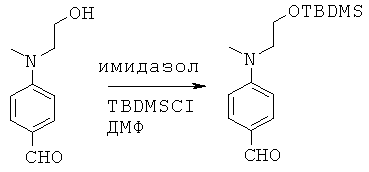
К перемешиваемому раствору 4-[2-(гидроксиэтил)(метил)амино]бензальдегида (1,50 г, 8,38 ммоль) в сухом ДМФ (35 мл) добавили имидазол (1,71 г, 25,14 ммоль) в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре до полного растворения всех компонентов раствора, затем добавили трет-бутилдиметилсилилхлорид (2,53 г, 16,76 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней, добавили в воду (300 мл) и экстрагировали Et2O (3×40 мл). Объединенные органические фазы промыли водой (3×60 мл), солевым раствором (60 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением желтой маслянистой жидкости, которую очистили при помощи флэш-хроматографии с получением титульного соединения (2,22 г, 90%) в виде желтой маслянистой жидкости.
1Н ЯМР (250 МГц, CDCl3) δ -0.01 (s, 6H), 0.85 (s, 9H), 3.09 (s, 3H), 3.57 (t, J=5.5 Гц, 2H), 3.79 (t, J=5.5 Гц. 2H), 6.71 (d, J=8.8 Гц, 2H), 7.71 (d, J=8.8 Гц, 2H), 9.72 (s, 1H);13С ЯМР (100.5 МГц, CDCl3) δ -5.42, 18.23, 25.85, 39.56, 54.52, 60.43, 111.03, 125.16, 132.10, 153.64, 190.31.
4-N-(2-трет-бутилдиметилсиланилоксиэтил)-N-метил-4-{(Е)-2-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]этенил}анилин
№ соединения SKT07-107

Получен в соответствии с описанием раздела Получение алкена с применением гидрида натрия (60% дисперсия в масле, 27 мг, 0,67 ммоль), диэтил 4-(6-метилимидазо[1,2-а]пиридин-2-ил)бензилфосфоната (200 мг, 0,559 ммоль) и 4-[N-(2-трет-бутилдиметилсиланилоксиэтил)-N-(метил)амино]бензальдегида (164 мг, 0,559 ммоль) в сухом ТГФ (15 мл) с получением титульного соединения (210 мг, 75%) в виде светло-желтого твердого вещества после обработки и флэш-хроматографии (4:1 ДХМ/EtOAc).
1Н ЯМР (250 МГц, CDCl3) δ 0.02 (s, 6Н), 0.88 (s, 9H), 2.32 (s, 3H), 3.02 (s, 3H), 3.49 (t, J=5.5 Гц, 2Н), 3.77 (t, J=5.5 Гц, 2Н), 6.68 (d, J=7.9 Гц, 2Н), 6.91 (d, J=15.6 Гц, 1Н), 7.04 (d, J=7.9 Гц, 1Н), 7.08 (d, J=15.6 Гц, 1Н), 7.40 (d, J=8.5 Гц, 2Н), 7.53 (d, J=8.5 Гц, 2Н), 7.54-7.59 (m, 1Н), 7.76 (s, 1Н), 7.89-7.92 (m, 3H);13С ЯМР (100.5 МГц, CDCl3) δ -5.32, 18.20, 18.32, 25.95, 39.30, 54.78, 60.51, 107.79, 111.86, 116.65, 122.15, 123.35, 123.73, 125.29, 126.11, 126.33, 127.74, 127.99, 128.80, 131.89, 137.86, 144.65, 145.19, 148.81.
6-метил-2-(4-{(Е)-2-[4-нитро-2-(2-третбутилдиметилсилоксиэтокси)фенил]этенил}фенил)имидазо[1,2-а]пиридин
№ соединения SKT08-115
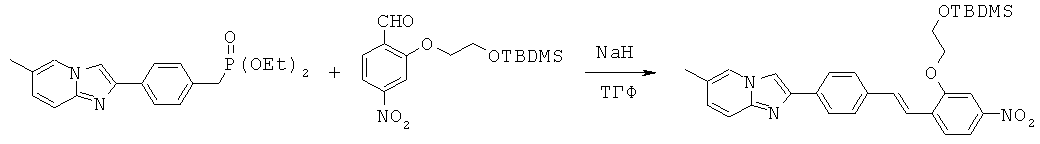
Получен в соответствии с описанием раздела Получение алкена с применением гидрида натрия (40 мг, 60% дисперсия в минеральном масле, 1,00 ммоль), диэтил [4-(6-метилимидазо[1,2-а]пиридин-2-ил)бензил]фосфоната (0,300 г, 0,837 ммоль) и 2-([трет-бутилдиметилсилокси]этокси)-4-нитробензальдегида (0,272 г, 0,837 ммоль) в сухом ТГФ (30 мл) с получением титульного соединения (0,285 г, 64%) в виде оранжевого твердого вещества после обработки и флэш-хроматографии (2:1 EtOAc/гексан).
1Н ЯМР (400 МГц, ДМСО-d6) δ 0.13 (s, 6Н), 0.92 (s, 9H), 3.96 (t, J=5.1 Гц, 2Н), 4.10 (t, J=5.1 Гц, 2Н), 7.29 (d, J=16.4 Гц, 1Н), 7.54 (d, J=16.4 Гц, 1Н), 7.63 (d, J=8.2 Гц, 2Н), 7.72 (d, J=8.6 Гц, 1Н), 7.79 (d, J=2.0 Гц, 1Н), 7.83 (s, 1Н), 7.86 (dd, J=8.2, 2.0 Гц, 1Н), 7.93 (br s, 1Н), 7.98 (d, J=8.2 Гц, 2Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ -5.20, 18.17, 18.40, 25.90, 61.78, 70.57, 107.17, 108.19, 116.27, 116.82, 121.30, 122.32, 123.33, 126.08, 126.19, 127.51, 128.17, 132.89, 133.58, 133.97, 136.40, 144.85, 147.37, 156.20 (1 отсутствует).
2-(2-{(Е)-2-[4-(6-метил-1Н-имидазо[1,2-а]пиридин-2-ил)фенил]винил}-5-нитрофенокси)этиловый эфир метансульфоновой кислоты
№ соединения SKT08-175
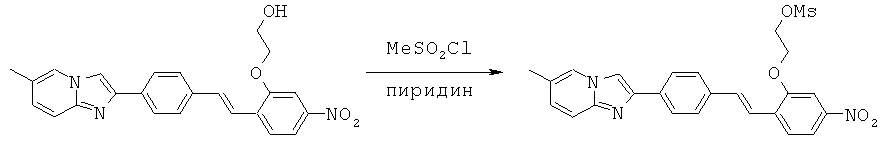
К перемешиваемому раствору 2-(2-{(Е)-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]этенил}-5-нитрофенокси)этанола (40,2 мг, 0,0968 ммоль) в сухом пиридине (4 мл) при комнатной температуре добавили метансульфонилхлорид (15,9 µл, 0,203 ммоль). Через 2,25 часа при комнатной температуре добавили воду (25 мл) с получением желтого осадка, который собрали при помощи вакуумного фильтрования, промыли водой (2×10 мл) и затем осушили в сушильном шкафу при 85°С в течение 3 часов. Желтое твердое вещество очистили при помощи флэш-хроматографии (1:1 EtOAc/ДХМ) с получением титульного соединения (31 мг, 65%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ 2.28 (s, 3H), 3.29 (s, 3H), 4.49-4.52 (m, 2Н), 4.69-4.71 (m, 2Н), 7.11 (dd, J=9.0, 1.9 Гц, 1Н), 7.49 (d, J=9.0 Гц, 1Н), 7.55 (d, J=16.4 Гц, 1Н), 7.60 (d, J=16.4 Гц, 1Н), 7.71 (d, J=8.6 Гц, 2Н), 7.84 (d, J=2.4 Гц, 1Н), 7.90 (dd, J=8.6, 1.9 Гц, 1Н), 7.98 (d, J=8.6 Гц, 2Н), 7.60-8.00 (m, 1Н), 8.31 (br s, 1Н), 8.35 (s, 1Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.95, 37.54, 67.63, 68.98, 108.18, 109.72, 116.46, 116.99, 121.30, 122.09, 124.70, 126.31, 127.54, 127.87, 128.59, 133.61, 133.93, 134.67, 136.42, 144.14, 144.45, 147.39, 155.69.
Имидазо[1,2-а]пиридиновые соединения
6-метил-2-{4-[(Е)-2-(4-нитрофенил)этенил]фенил}имидазо[1,2-а]пиридин
№ соединения SKT06-117

Получен в соответствии с описанием раздела Получение алкена с применением гидрида натрия (60% дисперсия в минеральном масле, 7 мг, 0,307 ммоль), диэтил 4-(6-метилимидазо[1,2-а]пиридин-2-ил)бензилфосфоната (100 мг, 0,279 ммоль) и 4-нитробензальдегида (42 мг, 0,279 ммоль) в ТГФ (5 мл) с получением титульного соединения (24 мг, 24%) в виде желтого твердого вещества после обработки и флэш-хроматографии (100:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, ДМСО-d6) δ 2.29 (s, 3H), 7.12 (d, J=8.8 Гц, 1H), 7.49 (d, J=15.6 Гц, 1Н), 7.50 (d, J=8.5 Гц, 1H), 7.58 (d, J=15.6 Гц, 1H), 7.75 (d, J=8.2 Гц, 2Н), 7.88 (d, J=8.5 Гц, 2H), 8.01 (d, J=7.5 Гц, 2Н), 8.25 (d, J=8.5 Гц, 2Н), 8.33 (s, 1H), 8.37 (s, 1H).
6-метил-2-{4-[(Е)-2-пиридин-4-илэтенил]фенил}имидазо[1,2-а]пиридин
№ соединения SKT06-161

Получен в соответствии с описанием раздела Получение алкена с применением гидрида натрия (60% дисперсия в минеральном масле, 25 мг, 0,615 ммоль), диэтил 4-(6-метилимидазо[1,2-а]пиридин-2-ил)бензилфосфоната (0,20 г, 0,559 ммоль) и пиридин-4-альдегида (0,06 г, 0,559 ммоль) в сухом ТГФ (10 мл) с получением титульного соединения (0,074 г, 42%) в виде светло-оранжевого твердого вещества после обработки и флэш-хроматографии (7:7:1 ДХМ/EtOAc/МеОН).
ИКС 3132, 3022, 2919, 1629, 1606, 1590, 1417, 1340, 1273, 1213, 1186, 980, 971, 874, 844, 813, 803, 750 см-1;1Н ЯМР (250 МГц, ДМСО-d6) δ 2.29 (s, 3H), 7.12 (dd, J=9.5, 0.6 Гц, 1Н), 7.29 (d, J=16.8 Гц, 1H), 7.50 (dd, J=9.5, 0.9 Гц, 1H), 7.52-7.65 (m, 3H), 7.73 (d, J=7.3 Гц, 2Н), 8.00 (d, J=7.3 Гц, 2Н), 8.34 (dd, J=8.9, 0.6 Гц, 2Н), 8.53-8.56 (m, 2Н).
2-{4-[(Е)2-(2-метокси-4-нитрофенил)этенил]фенил}-6-метилимидазо[1,2-а]пиридин
№ соединения SKT07-81

Получен в соответствии с описанием раздела Получение алкена с применением гидрида натрия (60% дисперсия в минеральном масле, 33 мг, 0,838 ммоль), диэтил 4-(6-метилимидазо[1,2-а]пиридин-2-ил)бензилфосфоната (250 мг, 0,698 ммоль) и 2-метокси-4-нитробензальдегида (126 мг, 0,698 ммоль) в сухом ТГФ (15 мл) с получением титульного соединения (199 мг, 74%) в виде оранжевого твердого вещества после обработки и флэш-хроматографии (25:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, CDCl3) δ 2.33 (s, 3H), 3.99 (s, 3H), 7.05 (d, J=8.8 Гц, 1Н), 7.28 (d, J=16.2 Гц, 1Н), 7.50 (d, J=16.2 Гц, 1Н), 7.58 (d, J=8.8 Гц, 1Н), 7.63 (d, J=8.2 Гц, 2Н), 7.71 (d, J=8.8 Гц, 1Н), 7.75 (br s, 1Н), 7.81 (s, 1Н), 7.87 (d, J=8.8 Гц, 1Н), 7.91 (s, 1Н), 7.97 (d, J=8.2 Гц, 2Н);13С ЯМР (62.5 МГц, CDCl3) δ 18.17, 56.08, 105.99, 108.18, 116.27, 116.78, 121.28, 122.45, 123.35, 126.16, 126.27, 127.51, 128.31, 133.03, 133.39, 133.86, 136.45, 144.73, 147.49, 156.81 (1 отсутствует).
2-(4-{(Е)-2-[4-нитро-2-(2-фторэтокси)фенил]этенил}фенил)-6-метилимидазо[1,2-а]пиридин
№ соединения SKT07-115

Получен в соответствии с описанием раздела Получение алкена с применением гидрида натрия (60% дисперсия в минеральном масле, 27 мг, 0,67 ммоль), диэтил 4-(6-метилимидазо[1,2-а]пиридин-2-ил)бензилфосфоната (200 мг, 0,559 ммоль) и 2-(2-фторэтокси)-4-нитробензальдегида (119 мг, 0,559 ммоль) в сухом ТГФ (15 мл) с получением титульного соединения (174 мг, 74%) в виде оранжевого твердого вещества после обработки и флэш-хроматографии (50:1 ДХМ/МеОН).
1Н ЯМР (250 МГц, CDCl3) δ 2.32 (s, 3H), 4.39 (dist d of t, JHF=28 Гц, JHH=3.7 Гц, 2Н), 4.89 (dist d of t, JHF=47 Гц, JHH=3.7 Гц, 2Н), 7.04 (d, J=8.8 Гц, 1Н), 7.33 (d, J=16.8 Гц, 1Н), 7.51 (d, J=16.2 Гц, 1Н), 7.55 (d, J=9.2 Гц, 1Н), 7.62 (d, J=7.9 Гц, 2Н), 7.71-7.75 (m, 2Н), 7.82 (s, 1Н), 7.88-7.91 (m, 2Н), 7.96 (d, J=8.2 Гц, 2Н);13C ЯМР (100.5 МГц, CDCl3) δ 18.22, 68.25 (d, JCF=20.5 Гц), 81.52 (d, JCF=172 Гц), 96.13, 107.15, 108.24, 116.79, 116.92, 121.05, 122.46, 123.36, 126.28, 126.56, 127.60, 128.35, 133.52, 133.86, 136.33, 144.74, 147.23, 155.53 (1 отсутствует).
3-(2-фторэтокси)-4-{(Е)-2-[4-(6-метилимвдазо[1,2-а]пиридин-2-ил)фенил]этенил}анилин
№ соединения SKT07-131
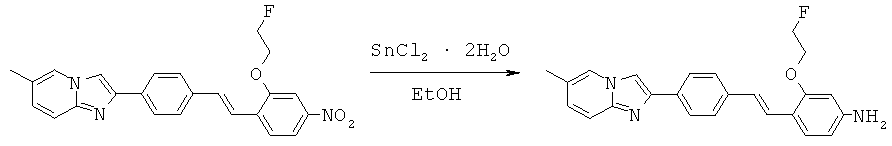
Получен в соответствии с описанием раздела Восстановление нитрогруппы с применением 2-(4-{(Е)-2-[4-нитро-2-(2-фторэтокси)фенил]этенил}фенил)-6-метилимидазо[1,2-а]пиридина (81 мг, 0,194 ммоль) и дигидрата хлорида олова (II) (219 мг, 0,970 ммоль) в EtOH (12 мл) с получением титульного соединения (36 мг, 48%) в виде оранжевого твердого вещества после обработки и флэш-хроматографии (2:1 EtOAc/ДХМ).
1Н ЯМР (250 МГц, CDCl3) δ 2.31 (s, 3H), 3.79 (br s, 2H), 4.22 (dist d of t, JHF=27 Гц, JHH=3.7 Гц, 2H), 4.81 (dist d of t, JHF=48 Гц, JHH=3.7 Гц, 2H), 6.23 (s, 1H), 6.34 (d, J=7.3 Гц, 1Н), 6.99 (d, J=16.5 Гц, 1H), 7.02 (m, 1H), 7.39 (d, J=3.7 Гц, 1H), 7.44 (d, J=3.7 Гц, 1H), 7.55 (d, J=16.5 Гц, 1H), 7.55 (m, 2H), 7.77 (s, 1H), 7.88-7.91 (m, 3H);13С ЯМР (100 МГц, ДМСО-d6) δ 17.97, 68.02 (d, JCF=18.7 Гц), 82.76 (d, JCF=166.5 Гц), 98.94, 107.89, 109.04, 114.47, 116.42, 121.81, 123.63, 124.21, 124.63, 126.24, 126.33, 128.18, 128.24, 132.55, 138.34, 144.69, 150.64, 157.41 (1 отсутствует).
N-(2-гидроксиэтил)-N-метил-4-{(Е)-2-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]этенил}анилин
№ соединения SKT07-113

К перемешиваемой суспензии 4-N-(2-третбутилдиметилсиланилоксиэтил)-N-метил-4-{(Е)-2-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]этенил}анилина (0,18 г, 0,362 ммоль) в смеси сухого ТГФ (5 мл) и сухого ДМФ (3 мл) при 0-5°С добавили раствор TBAF в ТГФ (1М, 800 µл, 0,800 ммоль). Реакционную смесь перемешивали при 0-5°С в течение 5 минут, а затем оставили нагреваться до комнатной температуры и дополнительно перемешивали в течение 50 минут. К реакционной смеси добавили насыщенный раствор хлорида аммония (25 мл), полученный раствор экстрагировали смесью ДХМ/МеОН (1:1, 5×30 мл). Объединенные органические фазы промыли солевым раствором (40 мл), осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением желтой маслянистой жидкости, которая медленно отвердевала при комнатной температуре. Твердое вещество очистили при помощи флэш-хроматографии (10:1 ДХМ/МеОН) с получением титульного соединения (0,136 г, 98%) в виде желтого твердого вещества.
1H ЯМР (250 МГц, CDCl3) δ 2.28 (s, 3H), 2.96 (s, 3H), 3.42 (t, J=5.2 Гц, 2Н), 3.54 (t, J=5.2 Гц, 2Н), 4.71 (t, J=5.2 Гц, 1Н), 6.70 (d, J=8.5 Гц, 2Н), 6.96 (d, J=16.2 Гц, 1Н), 7.08-7.19 (m, 2Н), 7.42 (d, J=8.5 Гц, 2Н), 7.48 (d, J=9.5 Гц, 1Н), 7.57 (d,J=8.2 Гц, 2Н), 7.90 (d, J=8.2 Гц, 2Н), 8.29 (s, 2Н);13С ЯМР (100.5 МГц, ДМСО-d6) δ 17.96, 39.04, 54.66, 58.68, 109.09, 112.24, 116.44, 121.80, 123.47, 124.60, 124.99, 126.19, 126.53, 128.07, 128.23, 129.13, 132.75, 137.70, 144.42, 144.69, 149.42
2-(2-{(Е)-2-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]этенил}-5-нитрофенокси)этанол
№ соединения SKT08-137
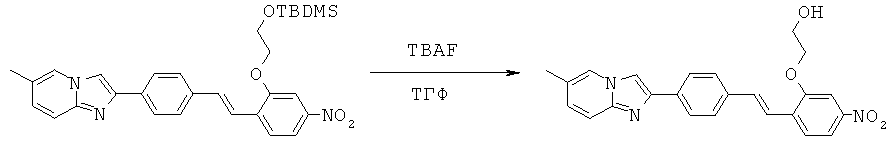
К перемешиваемому раствору 6-метил-2-(4-{(Е)-2-[4-нитро-2-(2-трет-бутилметилсилоксиэтокси)фенил]этенил}фенил)имидазо[1,2-а]пиридина (0,200 г, 0,377 ммоль) в сухом ТГФ (7 мл) при 0-5°С по каплям добавили TBAF (1M раствор в ТГФ, 0,83 мл, 0,83 ммоль) в течение 5 минут. Реакционную смесь перемешивали при 0-5°С в течение 5 минут, а затем удалили охлаждающую баню. Через 1,5 часа добавили насыщенный раствор NH4Cl (15 мл) и смесь перенесли в делительную воронку и экстрагировали смесью ДХМ/МеОН (3:1, 5×40 мл). Объединенные органические экстракты промыли солевым раствором (2×60 мл) и осушили (Na2SO4) и удалили растворитель при пониженном давлении с получением оранжевого остатка, который очистили при помощи флэш-хроматографии (10:1 EtOAc/гексан) с получением титульного соединения (0,102 г, 65%) в виде оранжевого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ 2.27 (s, 3H), 3.81-3.88 (m, 2H), 4.19-4.24 (m, 2H), 5.11 (t, J=5.5 Гц, 1Н), 7.11 (d, J=9.0 Гц, 1Н), 7.49 (d, J=9.0 Гц, 1Н), 7.57 (s, 2H), 7.70 (d, J=7.8 Гц, 2H), 7.81 (s, 1Н), 7.85 (d, J=8.2 Гц, 1Н), 7.95 (d, J=8.6 Гц, 1Н), 7.98 (d, J=7.8 Гц, 2H), 8.30 (s, 1Н), 8.34 (s, 1Н);13С ЯМР (100 МГц, ДМСО-d6) δ 17.99, 59.95, 71.52, 107.75, 109.72, 116.41, 116.53, 121.44, 122.02, 124.69, 126.25, 127.27, 127.95, 128.50, 133.51, 133.67, 134.67, 136.40, 144.18, 144.45, 147.35, 156.44.
Соединения, в которых -Q- представляет собой -N=N-
Промежуточные соединения получения бензотиазола
N-(3-метоксифенил)-4-нитробензамид
№ соединения LS-T203

Получен в соответствии с описанием раздела Амидное связывание.
Оранжевое твердое вещество (87%).1Н ЯМР (400 МГц, CDCl3) δ 3.83 (s, 3H), 6.74 (dd, J=2.4 Гц, 8.3 Гц, 1Н), 7.10 (d, J=8.3 Гц, 1Н), 7.28-7.38 (m, 1Н), 7.38 (s, 1Н), 7.86 (s, 1Н), 8.03 (d, J=8.5 Гц, 2H), 8.35 (d, J=8.5 Гц, 2H); МСНР (ESI-) m/z 271.09 (М+-Н, 41%), 325.03 (100%).
4-нитро-N-[3-(трифторметокси)фенил]бензамид
№ соединения LS-T204
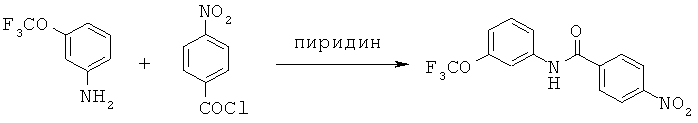
Получен в соответствии с описанием раздела Амидное связывание.
Беловатое твердое вещество (98%).1Н ЯМР (400 МГц, CDCl3) δ 7.05 (d, J=7.7 Гц, 1Н), 7.41 (m, 1Н), 7.51 (d, J=8.0 Гц, 1Н), 7.69 (s, 1Н), 7.89 (s, 1Н), 8.02 (d, J=8.5 Гц, 2H), 8.34 (d, J=8.5 Гц, 2H); МСНР (ESI-) m/z 325.02 (M+-H, 100%).
4-нитро-N-[4-(трифторметокси)фенил]бензамид
№ соединения LS-T197
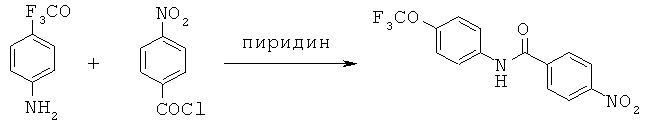
Получен в соответствии с описанием раздела Амидное связывание.
Беловатое твердое вещество (97%).1Н ЯМР (250 МГц, CDCl3) δ 7.20-7.28 (m, 2H), 7.67 (d, J=9.1 Гц, 2H), 7.88 (bs, 1H), 8.03 (d, J=8.9 Гц, 2H), 8.35 (d, J=8.9 Гц, 2Н).
4-нитро-N-(3-метоксифенил)бензкарботиамид
№ соединения LS-T205
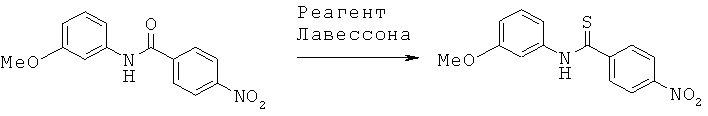
Колоночная хроматография (1:5 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде красного/оранжевого твердого вещества (82%).1Н ЯМР (400 МГц, CDCl3) δ 3.85 (s, 3H), 6.91-7.07 (m, 2H), 7.17-7.37 (m, 1H), 7.54 (s, 1H), 7.95-8.11 (m, 2H), 8.11-8.29 (m, 2H), 9.09 (s, 1H).
4-нитро-N-[3-(трифторметокси)фенил]бензкарботиамид
№ соединения LS-T206

Получен в соответствии с описанием раздела Получение тиоамида.
Колоночная хроматография (1:5 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (87%). МСНР (ESI-) m/z 341.00 (М+-Н, 85%), 466.92 (100%).
4-нитро-N-[4-(трифторметокси)фенил]бензкарботиамид
№ соединения LS-T198

Получен в соответствии с описанием раздела
Получение тиоамида.
Колоночная хроматография (1:5 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (89%).1Н ЯМР (250 МГц, CDCl3) δ 7.29 (d, J=8.3 Гц, 2Н), 7.84 (d, J=8.3 Гц, 2Н), 7.93 (d, J=8.5 Гц, 2Н), 8.22 (d, J=8.5 Гц, 2Н), 9.30 (bs, 1Н);13C ЯМР (62.5 МГц, CDCl3) δ 121.3 (2C), 121.9 (2C), 125.2 (2C), 126.1 (2C), 137.4, 147.1, 147.8, 148.7; MCHP (ESI-) m/z 341.04 (M+-H, 100%).
5-метокси-2-(4-нитрофенил)-1,3-бензотиазол
№ соединения LS-T232

Получен в соответствии с описанием раздела
Получение бензотиазола с применением феррицианида калия.
Колоночная хроматография (100% толуол) привела к получению продукта в виде желтого твердого вещества (13%). ИКС (KBr)/см-1: 1603, 1517, 1457, 1344, 1311, 1281, 1159, 1149, 852;1Н ЯМР (250 МГц, CDCl3) δ 3.90 (s, 3H), 7.08 (dd, J=Гц, 2.4 Гц, 8.8 Гц, 1Н), 7.55 (d, J=2.4 Гц, 1Н), 7.76 (d, J=8.8 Гц, 1Н), 8.19 (d, J=8.5 Гц, 2Н), 8.30 (d, J=8.5 Гц, 2Н);13C ЯМР (100 МГц, CDCl3) δ 55.6, 105.7, 116.8, 122.0, 124.3, 127.4, 128.0, 139.2, 148.9, 155.4, 159.5, 165.9; MCHP (ESI+) m/z 287.42 (M+, 97%), 309.40 (100%).
2-(4-нитрофенил)-5-(трифторметокси)-1,3-бензотиазол
№ соединения LS-T208

Получен в соответствии с описанием раздела
Получение бензотиазола с применением феррицианида калия.
Колоночная хроматография (1:4 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде желтого твердого вещества (10%). ИКС (KBr)/см-1: 1607, 1514, 1356, 1302, 1260, 1211, 1151, 1109;1Н ЯМР (250 МГц, CDCl3) δ 7.33 (d, J=8.9 Гц, 1H), 7.93 (d, J=8.9 Гц, 1Н), 7.96 (s, 1H), 8.23 (d, J=8.5 Гц, 2Н), 8.34 (d, J=8.5 Гц, 2Н).
2-(4-нитрофенил)-6-(трифторметокси)-1,3-бензотиазол
№ соединения LS-T199

Получен в соответствии с описанием раздела
Получение бензотиазола с применением феррицианида калия.
Колоночная хроматография (1:5 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде желтого твердого вещества (10%).1H ЯМР (250 МГц, CDCl3) δ 6.43 (dd, J=1.5 Гц, 9.1 Гц, 1H), 7.81 (d, J=0.9 Гц, 1H), 8.11 (d, J=9.1 Гц, 1H), 8.24 (d, J=8.8 Гц, 2Н), 8.36 (d, J=8.8 Гц, 2Н); MCHP (ESI+) m/z 340.94 (M++H, 100%).
4-[5-метокси-1,3-бензотиазол-2-ил]анилин
№ соединения LS-T226B

Получен в соответствии с описанием раздела Восстановление нитрогруппы.
Колоночная хроматография (1:3 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде желтого твердого вещества (45%).1Н ЯМР (400 МГц, CDCl3) δ 3.85 (s, 3H), 3.91 (bs, 2Н), 6.68 (d, J=Гц, 8.5 Гц, 2Н), 6.92 (dd, J=2.7 Гц, 8.9 Гц, 1H), 7.46 (d, J=2.7 Гц, 1H), 7.64 (d, J=8.9 Гц, 2Н), 7.83 (d, J=8.5 Гц, 1H);13С ЯМР (100 МГц, CDCl3) δ 55.5, 105.2, 114.4, 114.7, 121.6, 124.0, 126.3, 128.9, 149.2, 155.4, 158.9, 169.8.
4-[4-метокси-1,3-бензотиазол-2-ил]анилин
№ соединения LS-T234

Получен в соответствии с описанием раздела Восстановление нитрогруппы.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде желтого твердого вещества (39%). ИКС (КВг)/см-1: 3345, 3211, 1620, 1602, 1567, 1433, 1333, 1308, 1262, 1177, 1051, 973, 826, 729;1Н ЯМР (400 МГц, CDCl3) δ3.92 (bs, 2H), 4.03 (s, 3H), 6.68 (d, J=Гц, 8.5 Гц, 2Н), 6.85 (dd, J=1.0 Гц, 8.6 Гц, 1Н), 7.20-7.24 (m, 2H), 7.40 (dd, J=1.0 Гц, 8.5 Гц, 1Н), 7.90 (d, J=8.5 Гц, 2H); МСНР (ESI+) m/z 257.48 (М++Н, 100%).
4-[5-(трифторметокси)-1,3-бензотиазол-2-ил]анилин
№ соединения LS-T225

Получен в соответствии с описанием раздела Восстановление нитрогруппы.
Колоночная хроматография (1:2,8 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (33%).1Н ЯМР (400 МГц, CDCl3) δ 4.06 (bs, 2H), 6.71 (d,J=8.5 Гц, 2H), 7.16 (d,J=8.5 Гц, 1Н), 7.79 (d,J=8.5 Гц, 1Н), 7.86 (d,J=8.5 Гц, 2H), 7.77-7.88 (скрытый, 1Н).
4-[6-(трифторметокси)-1,3-бензотиазол-2-ил]анилин
№ соединения LS-T201

Получен в соответствии с описанием раздела Восстановление нитрогруппы.
Желтое твердое вещество (37%).1Н ЯМР (250 МГц, CDCl3) δ 4.02 (bs, 2H), 6.72 (d, J=Гц, 8.5 Гц, 2H), 7.31 (d, J=8.9 Гц, 1Н), 7.72 (s, 1Н), 7.86 (d, J=8.5 Гц, 2H), 7.93 (d,J=8.9 Гц, 1Н); МСНР (ESI+) m7z 310.99 (М++Н, 20%), 455.95 (100%).
4-[6-(диметиламино)-1,3-беизотиазол-2-ил]анилин
№ соединения LS-T247
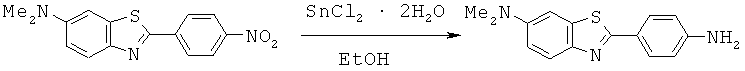
Получен в соответствии с описанием раздела Восстановление нитрогруппы.
Желтое твердое вещество (47%). %).1Н ЯМР (250 МГц, CDCl3) δ 3.00 (s, 6H), 6.71 (d, J=8.5 Гц, 2H), 6.93 (dd, J=2.7 Гц, 8.9 Гц, 1Н). 7.08 (d, J=2.7 Гц, 1H), 7.74-7.85 (m, 1H), 7.82 (d, J=8.5 Гц, 2H).
2-(4-{(Е)-[4-(6-метоксибензотиазол-2-ил)фенил]диазенил}фенокси)этилметансульфонат
№ соединения SC597

2-(4-{(Е)-[4-(6-метоксибензотиазол-2-ил)фенил]диазенил}фенокси)этанол (260 мг, 0,642 ммоль) добавили в пиридин (26 мл) в атмосфере N2. Охладили до 6°C и по каплям добавили метансульфонилхлорид (441 мг, 3,85 ммоль). Оставили нагреваться до комнатной температуры, затем перемешивали в течение 6 часов. Добавили H2O (60 мл) и полученный осадок собрали при помощи фильтрования, промыли H2O (2×5 мл) и затем осушили в вакууме в течение ночи с получением продукта в виде оранжевого твердого вещества. Выход: 251 мг, 81%;1Н ЯМР (250 МГц, ДМСО-d6) δ 3.26 (s, 3H), 3.87 (s, 3H), 4.39-4.41 (m, 2H), 4.57-4.59 (m, 2H), 7.12-7.26 (m, 3H), 7.75 (s, 1H), 7.88-8.06 (m, 5H), 8.23 (d, J=8.5 Гц, 2H).
Бензотиазольные соединения
2-(4-{(Е)-[4-(2-фторэтокси)фенил]диазенил}фенил)-6-метокси-1,3-бензотиазол
№ соединения SC598

Сухой ТГФ (6 мл) добавили в 2-(4-{(Е)-[4-(6-метоксибензотиазол-2-ил)фенил]диазенил}фенокси)этилметансульфонат (50 мг, 0,103 ммоль) в атмосфере N2. Добавили TBAF (310 µл, 1М раствор в ТГФ) и реакционную смесь нагревали при 50°С в течение 1 часа. Реакционную смесь охладили до комнатной температуры и добавили в H2O (15 мл). Твердое вещество собрали при помощи фильтрования, промыли H2O (2×2 мл) и осушили в вакууме в течение ночи. Колоночная хроматография (3:7 EtOAc/гексан) привела к получению продукта (24 мг, 57%) в виде оранжевого твердого вещества.
4-{(Е)-[4-(6-метил-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметил)фенол
№ соединения LS-T192
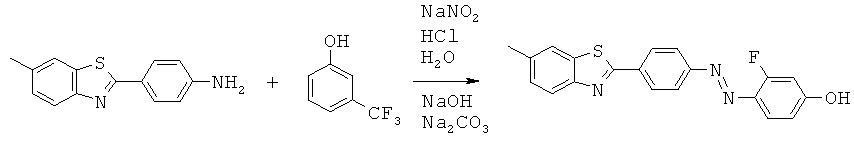
Получен в соответствии с описанием раздела Диазосвязывание.
Колоночная хроматография (1:3 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде желтого твердого вещества (24%). ИКС (KBr)/см-1: 1616, 1481, 1326, 1263, 1225, 1167, 1126;1Н ЯМР (250 МГц, метанол-d4) δ 2.52 (s, 3H), 7.09 (d, J=8.9 Гц, 1Н), 7.26 (s, 1H), 7.38 (d, J=8.9 Гц, 1Н), 7.83 (s, 1Н), 7.91-7.98 (m, 2H), 8.02 (d, J=7.9 Гц, 2H), 8.25 (d, J=7.9 Гц, 2H); MCHP (ESI+) m/z 413.87 (M++H, 45%), 326.09 (100%).
2-{(Е)-[4-(6-метил-1,3-бензотиазол-2-ил)фенил]диазенил}-4-(трифторметил)фенол
№ соединения LS-T191

Получен в соответствии с описанием раздела Диазосвязывание.
Колоночная хроматография (1:20 EtOAc/40:60 петролейный эфир, затем 100% EtOAc) привела к получению продукта в виде желтого твердого вещества (29%).1Н ЯМР (250 МГц, CDCl3) δ 2.50 (s, 3H), 7.13 (d, J=8.9 Гц, 1Н), 7.32 (d, J=8.2 Гц, 1Н), 7.59 (d, J=8.2 Гц, 1Н), 7.71 (s, 1Н), 7.91-8.04 (m, 3H), 8.17-8.29 (m, 3H), 13.07 (s, 1Н);13C ЯМР (62.5 МГц, CDCl3) δ 21.6, 119.2, 121.5, 123.1, 127.9, 128.1, 128.4, 128.5, 129.0, 130.0 (2C), 130.8 (2C), 135.5, 136.1, 136.4, 136.7, 151.3, 152.4, 155.3, 165.2; MCHP (ESI-) m/z 411.99 (M+-H, 100%).
4-{(Е)-[4-(6-метил-1,3-бензотиазол-2-ил)фенил]диазенил}-3,5-бис(трифторметил)фенол
№ соединения LS-T214

Получен в соответствии с описанием раздела Диазосвязывание.
Колоночная хроматография (3:2 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (20%).1Н ЯМР (250 МГц, CDCl3) δ 2.51 (s, 3Н), 7.32 (d, J=8.9 Гц, 1H), 7.53 (s, 1H), 7.62 (s, 1H), 7.72 (s. 1H), 7.98 (d, J=8.9 Гц, 1Н), 8.02 (d, J=8.5 Гц, 2H), 8.26 (d, J=8.5 Гц, 2Н); МСНР (ESI-) m/z 480.00 (М+-Н, 100%).
4-{(Е)-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметил)фенол
№ соединения LS-T209

Получен в соответствии с описанием раздела Диазосвязывание.
Колоночная хроматография (1:3 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (32%). ИКС (KBr)/см-1: 1604, 1484, 1326, 1264, 1226, 1165, 1127, 1043, 1029;1Н ЯМР (400 МГц, ацетон-d6) δ 3.89 (s, 3Н), 7.13 (dd, J=2.4 Гц, 8.9 Гц, 1H), 7.21 (dd, J=2.4 Гц, 8.9 Гц, 1H), 7.34 (d, J=2.7 Гц, 1H), 7.61 (d, J=3.4 Гц, 1H), 7.93 (d, J=8.90 Гц, 1H), 8.01 (d, J=8.9 Гц, 2H), 8.25 (d, J=8.9 Гц, 2H), 9.80 (bs, 1H);13C ЯМР (62.5 МГц, ацетон-d6) δ 60.7, 109.7, 118.6 (2С), 121.6, 123.5, 125.0, 129.0 (2С), 129.3, 133.4 (2С), 141.4, 142.2, 147.7, 154.2, 159.0, 163.8, 166.1, 168.9; МСНР (ESI+) m/z 429.96 (М+-Н, 100%).
№ соединения LS-T235A и LS-T235B
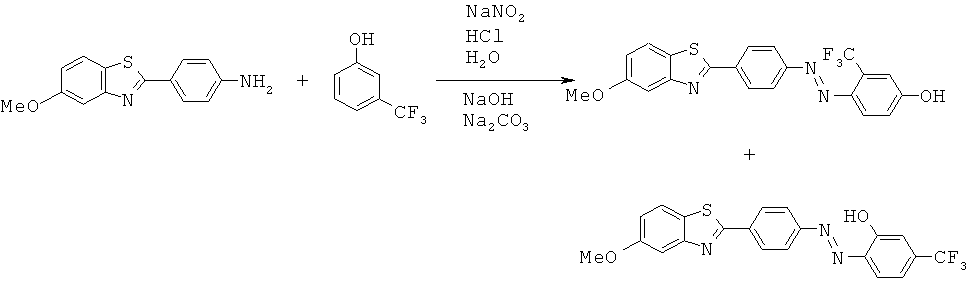
4-{(Е)-[4-(5-метокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметил)фенол
№ соединения LS-T235A
Получен в соответствии с описанием раздела Диазосвязывание.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (11%).1Н ЯМР (250 МГц, CDCl3) δ 3.92 (s, 3Н), 7.07 (d, J=7.6 Гц, 1Н), 7.25-7.30 (m, 1H), 7.32 (d, J=6.1 Гц, 1H), 7.42 (s, 1H), 7.58 (d, J=1.9 Гц, 1H), 7.77 (d, J=8.8 Гц, 1H), 8.01 (d, J=8.5 Гц, 2H), 8.24 (d, J=8.5 Гц, 2Н).
2-{(Е)-[4-(5-метокси-1,3-бензотиазол-2-ил)фенил]диазенил}-5-(трифторметил)фенол
№ соединения LS-T235B
Получен в соответствии с описанием раздела Диазосвязывание.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (43%).1Н ЯМР (250 МГц, CDCl3) δ 3.91 (s, 3Н), 7.03 (dd, J=2.4 Гц, 8.9 Гц, 1H), 7.04-7.10 (m, 1H), 7.53-7.64 (m, 4H), 7.74 (d, J=8.9 Гц, 1H), 8.11 (d, J=8.5 Гц, 2H), 7.25-7.30 (m, 1H), 7.32 (d,J=6.1 Гц, 1H), 7.42 (s, 1H), 7.58 (d, J=1.9 Гц, 1H), 7.75-7.78 (m, 1H), 7.77 (1H, d, J=8.8 Гц, 1H), 8.01 (d, J=8.5 Гц, 2H), 8.24 (d, J=8.5 Гц, 2H).
4-{(Е)-[4-(4-метокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметил)фенол
№ соединения LS-T236

Получен в соответствии с описанием раздела Диазосвязывание.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (40%). ИКС (KBr)/см-1: 3121, 1606, 1465, 1335, 1265, 1226, 1155, 1127;1Н ЯМР (400 МГц, ацетон-d6) δ 4.04 (s, 3Н), 7.06 (dd, J=0.7 Гц, 8.2 Гц, 1H), 7.22 (dd, J=2.7 Гц, 8.9 Гц, 1H), 7.34 (d, J=17 Гц, 1H), 7.39 (t, J=8.0 Гц, 2Н), 7.62 (dd, J=1.0 Гц, 8.2 Гц, 1H), 7.94 (d, J=8.9 Гц, 1H), 8.03 (d, J=8.9 Гц, 2H), 8.30 (d, J=8.5 Гц, 2H);13С ЯМР (62.5 МГц, ацетон-d6) δ 55.8, 107.9, 108.1, 114.0, 118.1, 119.7, 123.6, 124.0, 128.3 (2С), 128.7 (2С), 130.8, 136.1, 137.2, 142.5, 144.7, 153.9, 154.4, 161.0, 164.4; МСНР (ESI+) m/z 430.41 (M++H, 70%), 64.42 (100%).
4-{(Е)-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]диазенил}фенол
№ соединения LS-T210a
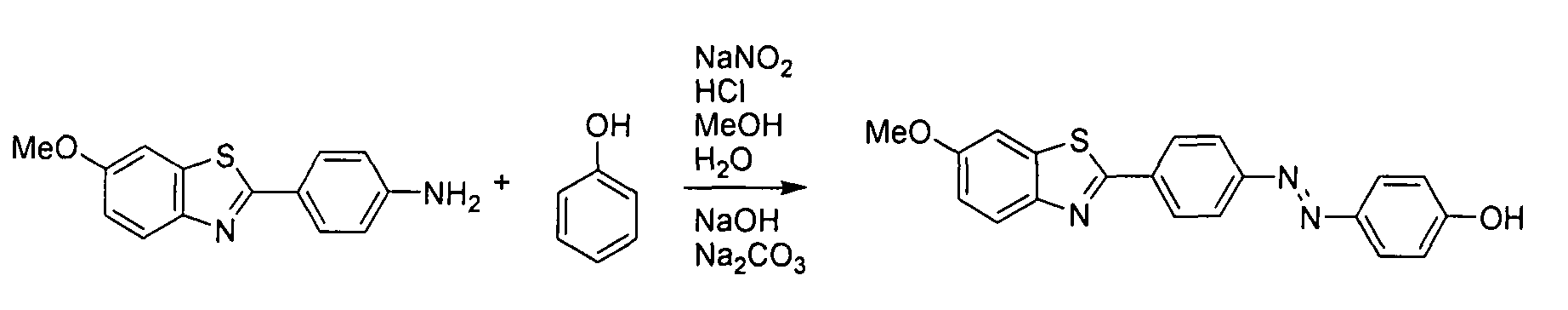
Получен в соответствии с описанием раздела Диазосвязывание.
Вещество кристаллизовано из ацетона (80 об. долей) с получением продукта в виде оранжевого твердого вещества (70%).1Н ЯМР (250 МГц, ДМСО-d6) δ 3.85 (s, 3Н), 6.96 (d, J=8.5 Гц, 2Н), 7.14 (d, J=8.9 Гц, 1Н), 7.71 (s, 1H), 7.84 (d, J=8.0 Гц, 2Н), 7.84-7.95 (m, ЗН), 8.19 (d,.7=8.0 Гц, 2Н).
4-[(Е)-{4-[5-(трифторметокси)-1,3-бензотиазол-2-ил]фенил}диазенил]фенол
№ соединения LS-T229

Получен в соответствии с описанием раздела Диазосвязывание.
Колоночная хроматография (1:2 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (37%).1Н ЯМР (250 МГц, ацетон-d6 и CDCl3) 5 6.92 (d, J=8.9 Гц, 1H), 7.22 (m, 1H), 7.71-7.96 (m, 6H), 8.01-8.19 (m, 2Н), 8.44 (bs, 1H).
4-[(Е)-{4-[6-(трифторметокси)-1,3-бензотиазол-2-ил]фенил}диазенил]фенол
№ соединения LS-T210b
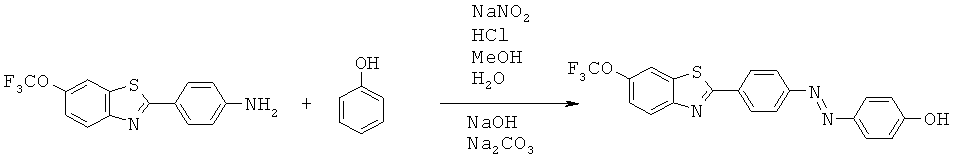
Получен в соответствии с описанием раздела Диазосвязывание.
Колоночная хроматография (1:2 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (32%). ИКС (KBr)/см-1: 1633, 1595, 1454, 1324, 1297, 1247, 1219, 1163, 1106;1Н ЯМР (250 МГц, ацетон-d6) δ 7.06, (d, J=8.9 Гц, 2Н), 7.55 (d, J=9.2 Гц, 1H), 7.93 (d, J=8.5 Гц, 2Н), 8.04 (d, J=8.5 Гц, 2Н), 8.14-8.20 (m, 2Н), 8.33 (d, J=8.2 Гц, 2Н), 9.38 (bs, 1H); MCHP (ESI-) m/z 413.99 (M+-H, 100%).
4-{(Е)-[4-(6-диметиламино-1,3-бензотиазол-2-ид)фенил]диазенил}-3-(трифторметил)фенол
№ соединения LS-T256

Получен в соответствии с описанием раздела Диазосвязывание.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (26%).1Н ЯМР (250 МГц, ацетон-d6) δ 3.07 (s, 6Н), 7.08 (dd, J=2.7 Гц, 9.1 Гц, 1H), 7.26 (dd, J=2.7 Гц, 9.1 Гц, 1H), 7.33 (d, J=2.7 Гц, 1H), 7.38 (d, J=2.4 Гц, 1H), 7.88 (d, J=9.1 Гц, 1H), 7.98 (d, J=9.1 Гц, 1H), 8.05 (d, J=8.5 Гц, 2Н), 8.26 (d, J=8.5 Гц, 2Н).
2-(4-{(Е)-[4-(6-метоксибензотиазол-2-ил)фенил]диазенил}фенокси)этанол
№ соединения SC588

4-[(Е)-{4-[6-(трифторметокси)-1,3-бензотиазол-2-ил]фенил}диазенил]-3-(трифторметил)фенол (400 мг, 1,11 ммоль) добавили в ДМФ (5 мл). Добавили К2СО3 (535 мг, 3,88 ммоль), затем 2-хлорэтанол (134 мг, 1,66 ммоль) и реакционную смесь нагревали при 80°С в течение 48 часов. Охладили до комнатной температуры и добавили H2O (20 мл). Полученное твердое вещество собрали при помощи фильтрования, промыли H2O (2×5 мл) и осушили в вакууме в течение ночи с получением продукта в виде оранжевого твердого вещества. Выход: 397 мг, 88%;1Н ЯМР (250 МГц, ДМСО-d6) δ 3.69-3.78 (m, 2Н), 3.86 (s, 3Н), 4.07-4.16 (m, 2Н), 7.08-7.20 (m, 3Н), 7.75 (s, 1H), 7.85-8.04 (m, 5H), 8.22 (d, J=8 Гц, 2Н).
1H ЯМР (250 МГц, ДМСО-d6) δ 3.69-3.78 (m, 2Н), 3.86 (s, 3Н), 4.07-4.16 (m, 2Н), 7.08-7.20 (m, 3Н), 7.75 (s, 1H), 7.85-8.04 (m, 5H), 8.22 (d, J=8 Гц, 2Н).
4-{(Е)-[4-(6-гидрокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметил)фенол
№ соединения LS-T213

Получен в соответствии с описанием раздела Деметилирование.
Колоночная хроматография (1:2 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (36%). ИКС (KBr)/см-1: 1600, 1481, 1454, 1327, 1264, 1229, 1158, 1131, 1043;1Н ЯМР (400 МГц, ацетон-d6) δ 7.08 (dd, J=8.9 Гц, 2.4 Гц, 1H), 7.22 (dd, J=2.4 Гц, 8.9 Гц, 1H), 7.34 (d, J=2.7 Гц, 1H), 7.46 (d, J=2.4 Гц, 1H), 7.88 (d, J=8.9 Гц, 1H), 7.93 (d, J=8.9 Гц, 1H), 8.01 (d, J=8.5 Гц, 2Н), 8.24 (d, J=8.9 Гц, 2Н);13С ЯМР (62.5 МГц, ацетон-d6) δ 106.9, 113.4, 116.7, 118.6, 119.7, 124.0 (2С), 124.4, 128.3 (2С), 130.8, 136.3, 137.1, 142.5, 148.5, 153.7, 156.4, 160.9, 163.0; MCHP (ESI-) m/z 414.05 (M+-H, 100%).
4-{(Е)-[4-(5-гидрокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметил)фенол
№ соединения LS-T245

Получен в соответствии с описанием раздела Деметилирование.
Колоночная хроматография (1:2 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде оранжевого твердого вещества (39%).1Н ЯМР (250 МГц, ацетон-d6) δ 7.09 (dd, J=2.1 Гц, 8.5 Гц, 1H), 7.28 (dd, J=2.4 Гц, 8.85 Гц, 1H), 7.40 (d, J=2.4 Гц, 1H). 7.53 (d, J=2.1 Гц, 1H), 7.94 (d, J=8.9 Гц, 1H), 8.00 (d, J=8.9 Гц, 1H), 8.08 (d, J=8.5 Гц, 2Н), 8.34 (d, J=8.5 Гц, 2Н), 8.83 (s, 1H), 9.84 (s, 1H).
4-{(Е)-[3-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметил)фенол
№ соединения LS-T273
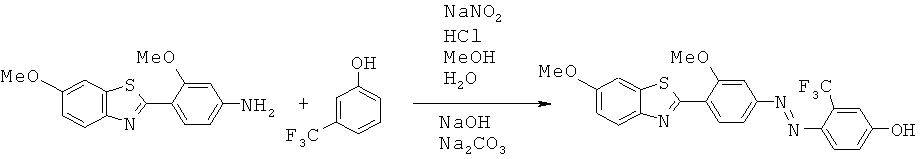
Получен в соответствии с разделом Диазосвязывание.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде розового твердого вещества (25%). ИКС (KBr)/см-1: 1609, 1498, 1476, 1403, 1338, 1263, 1234, 1138, 1123, 1043, 1027;1Н ЯМР (400 МГц, ацетон-d6) δ 3.89 (s, 3H), 4.18 (s, 3Н), 7.13 (dd, J=2.7 Гц, 8.8 Гц, 1Н), 7.23 (dd, J=2.4 Гц, 8.8 Гц, 1Н), 7.35 (d, J=2.7 Гц, 1Н), 7.59 (d,J=2.7 Гц, 1Н), 7.68 (dd, J=1.7 Гц, 8.8 Гц, 1Н), 7.71 (d, J=1.7 Гц, 1Н), 7.93 (d, J=8.9 Гц, 2H), 8.66 (d, J=8.2 Гц, 1Н);13С ЯМР (100 МГц, ацетон-d6) δ 55.5, 55.7, 103.6, 105.9, 113.5, 116.3, 118.3, 119.8, 123.7, 124.8, 129.7, 138.0, 142.5, 147.1, 154.6, 157.8, 158.2, 159.2, 160.9.
4-{(Е)-[3-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(4,4,4-трифторбутокси)фенол
№ соединения LS-T271

Получен в соответствии с разделом Диазосвязывание.
Колоночная хроматография (1:2 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде розового твердого вещества (3%).1Н ЯМР (250 МГц, ацетон-d6) δ 2.15-2.22 (m, 2H), 2.56-2.68 (m, 2H), 3.93 (s, 3Н), 4.19 (s, 3Н), 4.33 (t, J=6.0 Гц, 2Н), 6.60 (dd, J=2.1 Гц, 8.5 Гц, 1Н), 6.71 (d, J=2.1 Гц, 1Н), 7.16 (dd, J=2.4 Гц. 8.5 Гц, 1Н), 7.63-7.68 (m, 3Н), 7.77 (d, J=8.5 Гц, 1Н), 7.96 (d, J=8.9 Гц, 1Н), 8.66 (d, J=8.9 Гц, 1Н), 9.36 (bs, 1Н).
4-{(Е)-[2-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметил)фенол
№ соединения LS-T286

Получен в соответствии с разделом Диазосвязывание.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде розового твердого вещества (21%).1Н ЯМР (250 МГц, ацетон-d6) δ 3.92 (s, 3Н), 4.16 (s, 3Н), 7.16 (d, J=8.9 Гц, 1H), 7.22 (d, J=8.5 Гц, 1H), 7.36 (s, 1H), 7.64 (s, 1H), 7.65-7.78 (m, 2H), 7.88-7.98 (m, 3Н).
4-{(Е)-[2-метокси-4-(6-метокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметокси)фенол
№ соединения LS-T287

Получен в соответствии с разделом Диазосвязывание.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде розового твердого вещества (24%).1Н ЯМР (400 МГц, ацетон-d6) δ 3.88 (s, 3Н), 4.11 (s, 3Н), 6.97-7.00 (m, 2H), 7.13 (dd, J=2.4 Гц, 8.9 Гц, 1H), 7.60 (d, J=2.4 Гц, 1H), 7.65-7.68 (m, 2H), 7.80 (d, J=9.2 Гц, 1H), 7.89 (d, J=1.4 Гц, 1H), 7.93 (d, J=8.9 Гц, 1H); ЯМР (100 МГц, ацетон-d6) δ 55.5, 56.1, 104.5, 109.6, 111.2, 115.5, 116.4, 117.4, 119.0, 119.6, 120.0, 122.2, 124.0, 137.0, 137.3, 139.1, 143.7, 148.6, 148.9, 157.7, 158.6, 161.8, 163.9.
4-{(Е)-[3-гидрокси-4-(6-гидрокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметил)фенол
№ соединения LS-T274

Получен в соответствии с описанием раздела Деметилирование.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде пурпурного твердого вещества (31%). ИКС (KBr)/см-1: 1651, 1615, 1486, 1427, 1324, 1226, 1130, 1041;1H ЯМР (250 МГц, ацетон-d6) δ 7.17 (dd, J=2.4 Гц, 8.9 Гц, 1Н), 7.26 (dd, J=2.4 Гц, 8.9 Гц, 1Н), 7.38 (d, J=2.1 Гц, 1Н), 7.56 (m, 3H), 7.97 (m, 3H), 9.13 (bs, 1Н).
4-{(Е)-[3-гидрокси-4-(6-гидрокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(4,4,4-трифторбутокси)фенол
№ соединения LS-T272

Получен в соответствии с описанием раздела Двметилирование.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде пурпурного твердого вещества (29%). ИКС (KBr)/см-1: 1626, 1564, 1505, 1417, 1271, 1135, 1049, 1012;1Н ЯМР (400 МГц, ацетон-d6) δ 2.13 (m, 2H, 2.54 (m, 2H), 4.28 (t, J=6.2 Гц, 2H), 6.54 (dd, J=2.4 Гц, 8.8 Гц, 1Н), 6.66 (d, J=2.4 Гц, 1Н), 7.11 (dd, J=2.4 Гц, 8.9 Гц, 1Н), 7.43 (d, J=1.7 Гц, 1Н), 7.46 (dd, J=1.9 Гц, 8.9 Гц, 1Н), 7.50 (d, J=2.4 Гц, 1Н), 7.70 (d, J=8.9 Гц, 1Н), 7.85 (d, J=8.55 Гц, 1Н), 7.92 (d, J=8.9 Гц, 1Н), 9.04 (bs, 1H), 9.34 (bs, 1Н);13С ЯМР (100 МГц, ацетон-d6) δ 22.4, 30.4, 67.7, 101.8, 107.0, 108.9, 110.6, 114.5, 116.8, 118.3, 123.1, 129.0, 134.7, 136.5, 145.8, 155.7, 156.6, 158.4, 159.4, 163.3, 165.5.
4-{(Е)-[2-гидрок:си-4-(6-гидрокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметил)фенол
№ соединения LS-T288

Получен в соответствии с описанием раздела Деметилирование.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде пурпурного твердого вещества (31%). ИКС (KBr)/см-1: 1603, 1562, 1483, 1323, 1248, 1159, 1126, 1043;1Н ЯМР (250 МГц, ацетон-d6) δ 7.09-7.24 (m, 2H), 7.28 (d, J=8.6 Гц, 1Н), 7.36 (s, 1Н), 7.47 (s, 1H), 7.63 (s, 1H), 7.79 (d, J=8.9 Гц, 1Н), 7.92 (d, J=8.6 Гц, 1Н), 7.99-8.13 (m, 1H).
4-{(Е)-[2-гидрокси-4-(6-гидрокси-1,3-бензотиазол-2-ил)фенил]диазенил}-3-(трифторметокси)фенол
№ соединения LS-T289

Получен в соответствии с описанием раздела Деметилирование.
Колоночная хроматография (1:1 EtOAc/40:60 петролейный эфир) привела к получению продукта в виде пурпурного твердого вещества (20%). ИКС (KBr)/см-1: 1614, 1564, 1484, 1463, 1383, 1261, 1125, 1101;1Н ЯМР (250 МГц, ацетон-d6) δ 6.97-7.29 (m, 3H), 7.43 (s, 1H), 7.62 (s, 1H), 7.70-7.82 (m, 1H), 7.83-8.09 (m, 3H).
Имидазо[1,2-а]пиридиновые соединения
N,N-диметил-4-{(Е)-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]диазенил}анилин
№ соединения SKT05-163

К перемешиваемому раствору концентрированной HCl (0,4 мл) в воде (20 мл) при 0°С добавили суспензию 4-(6-метилимидазо[1,2-а]пиридин-2-ил)анилина (80 мг, 0,359 ммоль) в ацетоне (5 мл). Реакционную смесь перемешивали при 0°С в течение 15 минут, затем по каплям добавили предварительно охлажденный раствор NaNO2 (26 мг, 0,380 ммоль) в воде (2 мл). Через 15 минут добавили несколько кристаллов мочевины. К указанному светло-желтому раствору по каплям добавили раствор N,N-диметиланилина (43 мг, 0,359 ммоль) в АсОН (1,5 мл). Реакционную смесь дополнительно перемешивали в течение 10 минут при 0°С, затем добавили насыщенный раствор NaOAc (10 мл), собрали оранжевый осадок при помощи фильтрования в вакууме и осушили на воздухе. Твердое вещество очистили при помощи флэш-хроматографии (1:1 ДХМ/EtOAc) с получением титульного соединения (40 мг, 31%) в виде красного/оранжевого твердого вещества.
1Н ЯМР (250 МГц, CDCl3) δ 2.32 (s, 3Н), 3.09 (s, 6Н), 6.76 (d,J=9.2 Гц, 1Н), 7.02 (d, J=9.5 Гц, 1Н), 7.54 (d, J=9.2 Гц, 1Н), 7.84-7.92 (m, 7H), 8.05 (d, J=8.5 Гц, 2Н);13С ЯМР (62.5 МГц, CDCl3) δ 18.17, 40.36, 108.39, 111.56, 116.86, 122.31, 122.77, 123.35, 124.99, 126.45, 128.17, 128.73, 134.76, 143.86, 144.88, 152.40, 152.74.
Диагностические лиганды
4-[18F]фтор-N-[4-(6-метоксибензотиазол-2-ил)фенил]-3-нитробензамид

Водный [18F]Фторид (1,8 ГБк) поместили в картридж QMA (Waters, Sep Pak Light QMA Part. No.: WAT023525) и элюировали 5 мг К2.2.2 в 0,95 мл MeCN + 1 мг К2СО3 в 50 µл воды в ампуле Уитона (5 мл). Растворитель удалили при помощи нагревания при 120°С в течение 10 минут в потоке азота. Добавили безводный MeCN (1 мл) и выпарили, как описано выше. Добавили раствор предшественника 4-бром-3-нитро-N-[4-(6-метоксибензотиазол-2-ил)фенил]бензамида (SKT04-33) (5 мг) в 500 (ал безводного ДМСО. После нагревания при 180°С в течение 20 минут неочищенную реакционную смесь разбавили смесью вода/MeCN (1/1) до достижения общего объема, равного 5 мл, и очистили при помощи препаративной ВЭЖХ: АСЕ 5-C18-HL 250 мм × 10 мм, Advanced Chromatography Technologies; Cat. No. АСЕ 321-2510; градиент от 50% ацетонитрила в 0,1% трифторуксусной кислоте до 80% ацетонитрила в 0,1% трифторуксусной кислоте в течение 20 минут, от 20 до 30 минут в изократическом режиме 80% ацетонитрил в 0,1% трифторуксусной кислоте; поток: 4 мл/мин, tR=22,5 мин. Собранную в результате ВЭЖХ фракцию разбавили 40 мл воды и иммобилизовали на Sep-Pak light С 18 картридж (Waters, WAT023501), который промыли 5 мл воды и элюировали 1 мл этанолас получением 134 МБк продукта (12%, поправка на распад; радиохимическая чистота >95%). Целевой продукт охарактеризовали при помощи совместного введения с нерадиоактивным F-19 стандартом фтора (SKT03-99) с применением аналитической ВЭЖХ: АСЕ3-С18 50 мм × 4,6 мм; градиент растворителя: начало 5% ацетонитрил - 95% ацетонитрил в 0,1% трифторуксусной кислоте через 7 минут, поток: 2 мл/мин (tR=5,6 мин), РХЧ>95% (ВЭЖХ).
6-[18F]фтор-N-[4-(6-метоксибензотиазол-2-ил)фенил]никотинамид

Водный [18F]Фторид (1,8 ГБк) поместили в картридж QMA (Waters, Sep Pak Light QMA Part. No.: WAT023525) и элюировали 5 мг К2.2.2 в 0,95 мл MeCN + 1 мг К2СО3 в 50 µл воды в ампуле Уитона (5 мл). Растворитель удалили при помощи нагревания при 120°С в течение 10 минут в потоке азота. Добавили безводный MeCN (1 мл) и выпарили, как описано выше. Добавили раствор предшественника 6-хлор-N-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]пиридин-3-карбоксамида (SKT04-111) (5 мг) в 500 цл безводного ДМСО. После нагревания при 180°С в течение 20 минут неочищенную реакционную смесь разбавили смесью вода/MeCN (1/1) до достижения общего объема, равного 5 мл, и очистили при помощи препаративной ВЭЖХ: АСЕ 5-C18-HL 250 мм × 10 мм. Advanced Chromatography Technologies; Cat. No. АСЕ 321-2510; градиент от 50% ацетонитрила в 0,1% трифторуксусной кислоте до 80% ацетонитрила в 0,1% трифторуксусной кислоте в течение 20 минут; поток: 4 мл/мин, tR=17,5 мин. Собранную в результате ВЭЖХ фракцию разбавили 40 мл воды и иммобилизовали на Sep-Pak light C18 картридж (Waters, WAT023501), который промыли 5 мл воды и элюировали 1 мл этанола с получением 168 МБк продукта (15%, поправка на распад; радиохимическая чистота >95%). Целевой продукт охарактеризовали при помощи совместного введения с нерадиоактивным F-19 стандартом фтора (SKT04-137) с применением аналитической ВЭЖХ: АСЕ3-С18 50 мм × 4,6 мм; градиент растворителя: начало 5% ацетонитрил - 95% ацетонитрил в 0,1% трифторуксусной кислоте через 7 минут, поток: 2 мл/мин (tR=5,1 мин), РХЧ>95% (ВЭЖХ).
4-[+F]фтор-N-[4-(6-метоксиимидазо[1,2-а]пиридин-2-ил)фенил]-3-нитробензамид

Водный [18F]Фторид (2,4 ГБк) поместили в картридж QMA (Waters, Sep Pak Light QMA Part. No.: WAT023525) и элюировали 5 мг К2.2.2 в 0,95 мл MeCN + 1 мг К2СО3 в 50 µл воды в ампуле Уитона (5 мл). Растворитель удалили при помощи нагревания при 120°С в течение 10 минут в потоке азота. Добавили безводный MeCN (1 мл) и выпарили, как описано выше. Добавили раствор предшественника 4-бром-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]-3-нитробензамида (SKT08-153) (5 мг) в 500 цл безводного ДМСО. После нагревания при 130°С в течение 20 минут неочищенную реакционную смесь разбавили смесью вода/MeCN (1/1) до достижения общего объема, равного 5 мл, и очистили при помощи препаративной ВЭЖХ: АСЕ 5-C18-HL 250 мм × 10 мм. Advanced Chromatography Technologies; Cat. No. АСЕ 321-2510; градиент от 40% ацетонитрила в 0,1% трифторуксусной кислоте до 70% ацетонитрила в 0,1% трифторуксусной кислоте в течение 20 минут; поток: 4 мл/мин, tR=9 мин. Собранную в результате ВЭЖХ фракцию разбавили 40 мл воды и иммобилизовали на Sep-Pak light С18 картридж (Waters, WAT023501), который промыли 5 мл воды и элюировали 1 мл этанола с получением 80 МБк продукта (5%, поправка на распад; радиохимическая чистота >95%). Целевой продукт охарактеризовали при помощи совместного введения с нерадиоактивным F-19 стандартом фтора (SKT08-165) с применением аналитической ВЭЖХ: АСЕ3-С18 50 мм × 4,6 мм; градиент растворителя: начало 5% ацетонитрил - 95% ацетонитрил в 0,1% трифторуксусной кислоте через 7 минут, поток: 2 мл/мин (tR=3,8 мин), РХЧ>95% (ВЭЖХ).
6-[18F]фтор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]никотинамид

Водный [18F]Фторид (1,1 ГБк) поместили в картридж QMA (Waters, Sep Pak Light QMA Part. No.: WAT023525) и элюировали 2 мл ТБАГ-раствора (8 µл ТБАГ (40%) в 1,5 мл MeCN + 0,5 мл воды) в ампуле Уитона (5 мл). Растворитель удалили при помощи нагревания при 120°С в течение 10 минут в потоке азота. Добавили безводный MeCN (1 мл) и выпарили, как описано выше. Добавили раствор предшественника 6-хлор-N-[4-(6-метилимидазо[1,2-а]пиридин-2-ил)фенил]пиридин-3-карбоксамида (SKT06-13) (5 мг) в 500 µл безводного ДМСО. После нагревания при 180°С в течение 10 минут неочищенную реакционную смесь разбавили смесью вода/MeCN (1/1) до достижения общего объема, равного 5 мл, и очистили при помощи препаративной ВЭЖХ: АСЕ 5-C18-HL 250 мм × 10 мм, Advanced Chromatography Technologies; Cat. No. АСЕ 321-2510; градиент от 30% ацетонитрила в 0,1% трифторуксусной кислоте до 70% ацетонитрила в 0,1% трифторуксусной кислоте в течение 20 минут; поток: 4 мл/мин, tR=7 мин. Собранную в результате ВЭЖХ фракцию разбавили 40 мл воды и иммобилизовали на Sep-Pak light C18 картридж (Waters, WAT023501), который промыли 5 мл воды и элюировали 1 мл этанола с получением 296 МБк продукта (38%, поправка на распад; радиохимическая чистота >99%). Целевой продукт охарактеризовали при помощи совместного введения с нерадиоактивным F-19 стандартом фтора (SKT05-169) с применением аналитической ВЭЖХ: АСЕ3-С18 50 мм × 4,6 мм; градиент растворителя: начало 5% ацетонитрил - 95% ацетонитрил в 0,1М K2HPO4 через 7 минут, поток: 2 мл/мин (tR=5,0 мин), РХЧ>99% (ВЭЖХ).
2-(4-{(Е)-2-[2-(2-[18F]фторэтокси)-4-нитрофенил]винил}фенил)-6-метил-3Н-имидазо[1,2-а]пиридин

Водный [18F]Фторид (0,255 ГБк) поместили в картридж QMA (Waters, Sep Pak Light QMA Part. No.: WAT023525) и элюировали 1,5 мл раствора К2.2.2/К2СО3 (5 мг К222 В 0,95 мл MeCN, 1 мг К2СО3 в 0,05 мл воды) в ампуле Уитона (5 мл). Растворитель удалили при помощи нагревания при 120°С в течение 10 минут в потоке азота. Добавили безводный MeCN (1 мл) и выпарили, как описано выше. Добавили раствор предшественника 2-(2-{(Е)-2-[4-(6-метил-1Н-имидазо[1,2-а]пиридин-2-ил)фенил]винил}-5-нитрофенокси)этилового эфира метансульфононовой кислоты (SKT08-175) (3 мг) в 500 µл безводного ДМФ. После нагревания при 130°С в течение 15 минут неочищенную реакционную смесь разбавили смесью вода/MeCN (1/1) до достижения общего объема, равного 5 мл, и очистили при помощи препаративной ВЭЖХ: АСЕ 5-C18-HL 250 мм × 10 мм, Advanced Chromatography Technologies; Cat. No. АСЕ 321-2510; градиент от 40% ацетонитрила в 0,1% трифторуксусной кислоте до 70% ацетонитрила в 0,1% трифторуксусной кислоте в течение 20 минут; поток: 4 мл/мин, tR=14 мин. Собранную в результате ВЭЖХ фракцию разбавили 40 мл воды и иммобилизовали на Sep-Pak Plus tC18 картридж (Waters, WAT036810), который промыли 5 мл воды и элюировали 2 мл этанола с получением 55 МБк продукта (40%, поправка на распад; радиохимическая чистота >95%). Целевой продукт охарактеризовали при помощи совместного введения с нерадиоактивным F-19 стандартом фтора (SKT07-115) с применением аналитической ВЭЖХ: АСЕ3-С18 50 мм × 4,6 мм; градиент растворителя: начало 5% ацетонитрил - 95% ацетонитрил в 10 мМ Na2HPO4 (pH 7,4) через 7 минут, поток: 2 мл/мин (tR=5,7 мин), РХЧ>95% (ВЭЖХ).
2-(4-{(E)-2-[4-(2-[18F]фторэтокси)фенил]винил}фенил)-6-метоксибензотиазол

Водный [18F]Фторид (0,250 ГБк) поместили в картридж QMA (Waters, Sep Pak Light QMA Part. No.: WAT023525) и элюировали 1,5 мл раствора К2СО3 (5 мг К222 в 0,95 мл MeCN, 1 мг К2СО3 в 0,05 мл воды) в ампуле Уитона (5 мл). Растворитель удалили при помощи нагревания при 120°С в течение 10 минут в потоке азота. Добавили безводный MeCN (1 мл) и выпарили, как описано выше. Добавили раствор предшественника 2-(4-{(Е)-2-[4-(6-метокси-1,3-бензотиазол-2-ил)фенил]винил} фенокси)этилового эфира метансульфононовой кислоты (SKT08-179) (3 мг) в 500 µл безводного ДМФ. После нагревания при 130°С в течение 15 минут неочищенную реакционную смесь разбавили смесью вода/MeCN (1/1) до достижения общего объема, равного 5 мл, и очистили при помощи препаративной ВЭЖХ: АСЕ 5-C18-HL 250 мм × 10 мм, Advanced Chromatography Technologies; Cat. No. АСЕ 321-2510; градиент от 60% ацетонитрила в 0,1% трифторуксусной кислоте до 90% ацетонитрила в 0,1% трифторуксусной кислоте в течение 30 минут; 30-40 минут 100% ацетонитрил (0,1% трифторуксусная кислота), поток: 4 мл/мин, tR=31 мин. Собранную в результате ВЭЖХ фракцию разбавили 40 мл воды и иммобилизовали на Sep-Pak Plus tC18 картридж (Waters, WAT036810), который промыли 5 мл воды и элюировали 2 мл этанола с получением 13 МБк продукта (9%, поправка на распад; радиохимическая чистота >95%). Целевой продукт охарактеризовали при помощи совместного введения с нерадиоактивным F-19 стандартом фтора (SKT03-77) с применением аналитической ВЭЖХ: АСЕ3-С18 50 мм × 4,6 мм; градиент растворителя: начало 5% ацетонитрил - 95% ацетонитрил в 10 мМ Na2HPO4 (pH 7,4) через 7 минут, поток: 2 мл/мин (tR=6,9 мин), РХЧ>95% (ВЭЖХ).
[4-(2-[l8F]фторэтокси)фенил}-[4-(6-метоксибензотиазол-2-ил)фенил}диазен
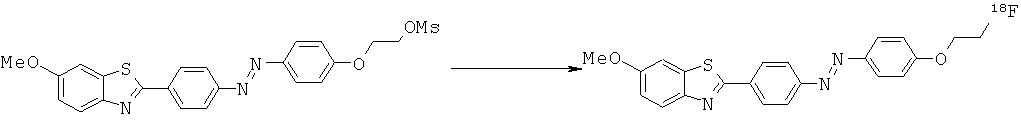
Водный [18F]Фторид (0,350 ГБк) поместили в картридж QMA (Waters, Sep Pak Light QMA Part. No.: WAT023525) и элюировали 1,5 мл раствора К2.2.2/К2СО3 (5 мг К222 в 0,95 мл MeCN, 1 мг К2СО3 в 0,05 мл воды) в ампуле Уитона (5 мл). Растворитель удалили при помощи нагревания при 120°С в течение 10 минут в потоке азота. Добавили безводный MeCN (1 мл) и выпарили, как описано выше. Добавили раствор предшественника 2-(4-{(Е)-2-[4-(6-метоксибензотиазол-2-ил)фенил]диазенил}фенокси)этилметансульфоната (SC597) (1 мг) в 500 цл безводного ДМФ. После нагревания при 130°С в течение 10 минут неочищенную реакционную смесь разбавили смесью вода/MeCN (1/1) до достижения общего объема, равного 5 мл, и очистили при помощи препаративной ВЭЖХ: Phenomenex Synergy Hydro-RP 250 мм × 10 мм; градиент от 80% ацетонитрила в 0,1% трифторуксусной кислоте до 85% ацетонитрила в 0,1% трифторуксусной кислоте в течение 20 минут, поток: 4 мл/мин, tR=19 мин. Собранную в результате ВЭЖХ фракцию разбавили 40 мл воды и иммобилизовали на Sep-Pak Plus tC18 картридж (Waters, WAT036810), который промыли 5 мл воды и элюировали 2 мл этанола с получением 65 МБк продукта (35%, поправка на распад; радиохимическая чистота >85%). Целевой продукт охарактеризовали при помощи совместного введения с нерадиоактивным F-19 стандартом фтора (SC598) с применением аналитической ВЭЖХ: АСЕ3-С18 50 мм × 4,6 мм; градиент растворителя: начало 5% ацетонитрил - 95% ацетонитрил в ЮмМ Na2HPO4 (рН 7,4) через 7 минут, поток: 2 мл/мин (tR=7,1 мин), РХЧ>85% (ВЭЖХ).
Биологические результаты
Исследование конкурентного связывания
Исследовали способность ДЗБ соединений связываться с PHF в условияхконкурентного связывания.
В исследовании лиганда применяют контрольный лиганд, который проявляет повышенную флуоресценцию в случае связывания указанного лиганда с PHF. При добавлении исследуемого соединения, которое также связывается с PHF с аналогичным или более высоким сродством, данное соединение замещает контрольный лиганд и уменьшает сигнал флуоресценции. В настоящем исследовании контрольный лиганд представляет собой примулин, который добавляли в 1цМ концентрации. Исследуемые соединения добавляли в концентрациях от 0,05 до 1 µМ. Значение Р50 для исследуемого соединения определено как концентрация соединения, которая снижает сигнал примулина до 50% от начального значения. Указанное значение, таким образом, не является абсолютнымсродоством, но относительным сродством по сравнению со сродством примулина.
Способ
Выделяли PHF из мозга пациента, страдающего болезнью Альцгеймера, по существу в соответствии с описанием, предложенным в работе Вишика с соавторами (Wischik et al.) (Neurobiology of Aging, Vol.16, pp.409-431, 1995). IFII фракцию выделили при помощи центрифугирования в градиенте плотности сахарозы в соответствии с описанием предложенным в докторской диссертации К.М.Вишика, и дополнительно экстрагировали в «abc-sup» в соответствии с описанием, предложенным в работе К.М.Вишика (Thesis «The structure and biochemistry of paired helical filaments in Alzheimer's disease» Part I and II; Cambridge University, 1989).
Исследование активности лигандов проводили в 96-луночных планшетах (Nunc Cat. No. 236108). Исследуемые соединения в требуемой концентрации смешивали с PHF, затем добавляли примулин для достижения конечной концентрации, равной 1 µМ и общего объема, равного 100 µл. Концентрация добавляемого PHF была определена для каждого опыта для получения адекватного сигнала флуоресценции и находилась, как правило, в диапазоне 1-2 µл/100 µл. Исследуемые соединения, как правило, растворяли в ДМСО для достижения конечной концентрации 10% ДМСО в исследовании. Фоновую флуоресценцию, в отсутствие PHF, также измерили в присутствии 10% ДМСО.
Флуоресценцию измеряли на Varian Carey Eclipse Fluorescence Spectrophotometer с длиной волны испускания, равной 480 нм. Получили спектры возбуждения, которые скорректировали при помощи вычитания сигнала, измеренного в отсутствие PHF, с применением программного обеспечения Varian. Для скорректированных спектров измерили сигнал флуоресценции в пиковой длине волны испускания при 420 нм. Значения флуоресценции построили на графике как функцию от концентрации исследуемого соединения, и значения Р50 определили из графиков.
Значения P50
Данные P50, представленные в скобках, измеряли в 10% ДМСО)
Контрольное соединение
ДЗБ соединения
Соединения, в которых -Q- представляет собой -NHC(O)-; -NR1C(O)-; -C(O)NH-; или -C(O)NR1-
Бензотиазольные соединения
Нефторированные метоксиамиды
Фторированные метоксиамиды
Монофтор-метоксиамиды
Нефторированные гидроксиамиды
Фторированные гидроксиамиды
Нефторированные метиламиды
Диметиламин-амиды
Незамещенные амиды
Имидазо[1,2-а]пиридиновые соединения
Имидазо[2,1-а]пиримидиновые соединения
Соединения, в которых -Q- представляет собой -СН=СН-; -CR1=CH-; -CH=CR1-; или -CR1=CR1-
Бензотиазольные соединения Нефторированные метилалкены
Фл. означает, что соединение является флуоресцентным. Следовательно, уровень связывания соединения в исследовании конкурентного связывания не может быть определен при помощи флуоресцентной спектроскопии. Как альтернатива, связывание лиганда с агрегированным тау-белком может быть определено с применением клеточного исследования или анализа срезов ткани, подвергнутых воздействию лиганда, как описано в настоящей патентной заявке.
Нефторированные метоксиалкены
Фторированные метоксиалкены
Фл. означает, что соединение является флуоресцентным. Следовательно, уровень связывания соединения в исследовании конкурентного связывания не может быть определен при помощи флуоресцентной спектроскопии. Как альтернатива, связывание лиганда с агрегированным тау-белком может быть определено с применением клеточного исследования или анализа срезов ткани, подвергнутых воздействию лиганда, как описано в настоящей патентной заявке.
Монофтор- и фторированныв гидроксиалкены
Фл. означает, что соединение является флуоресцентным. Следовательно, уровень связывания соединения в исследовании конкурентного связывания не может быть определен при помощи флуоресцентной спектроскопии. Как альтернатива, связывание лиганда с агрегированным тау-белком может быть определено с применением клеточного исследования или анализа срезов ткани, подвергнутых воздействию лиганда, как описано в настоящей патентной заявке.
Имидазо[1,2-а]пиридиновые соединения
Соединения, в которых -Q- представляет собой -N=N-
Бензотиазольные соединения
Имидазо[1,2-а]пиридиновые соединения
Вычисленные logP и TPSA (Å2)
Площадь полярной поверхности молекулы (PSA) или общая площадь полярной поверхности (TPSA), т.е., поверхности, принадлежащей полярным атомам (главным образом, N, О и связанные с ними атомы водорода) представляет собой дескриптор, который, как было показано, хорошо коррелирует с пассивным молекулярным переносом через мембраны, и таким образом делает возможным предсказание свойств переноса лекарств, что было успешно применено для предсказания внутренней абсорбции и проникновения через гематоэнцефалический барьер. Различия между CNS и не-CNS лекарствами исследовали с применением PHF, и было показано, что в среднем значение PSA для лекарств, которые действуют на CNS является более низким.
Вычислительные методы для оценки logP являются высокопроизводительными, но их база данных ограничена тем, что значения, вычисляемые для каждой структуры, зависят от информации, содержащейся в библиотеке программы. В дополнение большинство вычислений отражает только распределение нейтральных частиц, и, следовательно, часто значение вычисленного logP является выше по сравнению с экспериментально определенными значениями для указанного соединения.
Опубликованы различные работы по вычислению PSA, отличающиеся в определении «полярных атомов», различных методиках получения 3D структур или непосредственно поверхности. Тем не менее, результаты указанных многочисленных подходов хорошо коррелируют друг с другом, даже если абсолютные значения могут отличаться вследствие различий в вычислительных протоколах и различных наборов применяющихся атомных радиусов. Вычисление топологической PSA (TPSA) основано на суммировании занесенных в таблицу вкладов полярных фрагментов (т.е., атомов, рассматриваемых с учетом способа связывания) в поверхность и обеспечивает быстрое прямое вычисление PSA на основе 2D структуры. Предпочтительной является вычислительная система «molinspirations cheminformatics» (http://www.molinspiration.com/).
Таким образом, в представленных ниже таблицах miLog Р относится к значениям log Р, вычисленным с применением вычислительных средств Molinspiration.
Имидазо[1,2-а]пиридиновые соединения
Исследования срезов ткани и клеток
Связывание лигандов с агрегированным тау-белком в срезах тканей или клетках, содержащих указанные агрегаты, также можно применять для определения того, что указанные соединения могут (i) поступать в клетки и (ii) связываться с агрегированным тау-белком. В дополнение указанное исследование является подходящим для определения флуоресцентных лигандов, которые не могут быть исследованы во флуоресцентном исследовании конкурентного связывания.
Применяли срезы ткани мозга трансгенных мышей, экспрессирующих полноразмерный человеческий тау-белок, который содержал двойную мутацию P301S/G335D (мыши линии 66). Патологические агрегированные тау-белки накапливаются в нейронах указанных животных. Указанную ткань применяли после включения в парафин или после заморозки в присутствии криозащитного вещества.
Агрегированный тау-белок получили в клеточных линиях, в соответствии с описанием WO 02/055720. По существу клетки фибробласта (3Т6) экспрессируют полноразмерный тау-белок («Т40») под контролем индуцируемого промотора и небольшое количество PHF-ядерного фрагмента тау-белка (12 кД фрагмент). Затем экспрессия Т40 снижается, так как указанный белок подвергается зависящему от агрегирования процессингу внутри клетки, N-терминально в ~ αα 295 и С-терминально в ~ αα 390, приводя, таким образом, к повышенным уровням 12 кД PHF-ядерного фрагмента домена.
Включенные в парафин срезы мозга
Срезы мозгов мышей, экспрессирующих полноразмерный тау-белок, который содержит двойную мутацию P301S/G335D, находящиеся в лобно-височных долях мозга, срезали слоем толщиной 5 µм. Срезы депарафинировали и регидратировали в воде. Характерную флуоресценцию погасили перманганатом натрия с последующим применением боргидрида натрия. Добавили примулин или SK2033-30 в 50% этаноле. Во втором эксперименте добавили SK2033-30 в 50% этаноле, содержащем 10% ДМСО. Срезы сравнили со срезами, окрашенными при помощи стандартной иммуногистохимической обработки с применением mAb 7/51, антитела, распознающего повторяющийся домен укороченного тау-белка (работа Новака с соавторами (Novak et al.), 1993; работа Вишика с соавторами (Wischik et al.), 1996).
Соединение SK2033-30 является флуоресцентным, но не было никаких оснований полагать о включении указанного соединения в клетки срезов мозга мышей линии 66 по сравнению с примулином или иммунным окрашиванием антителами (Фигура 2А). В случае, когда растворимость соединения увеличили при помощи включения ДМСО (10%) SK2033-30 привело к окрашиванию, сходному с окрашиванием, наблюдаемым в случае примулина или антитела (Фигура 2В).
Срезы замороженного мозга
Взяли срезы мышей линии 6, которые смешали с 4% формальдегидом и затем подвергли криозащите в 30% сахарозе. Срезы (30 µм) собрали и применяли в свободноплавающем состоянии. Лиганд LST-213 растворили в 1% тринитротолуоле или 50% этаноле (остаточная ДМСО концентрация маточного раствора составляла 1%).
Когда срезы замороженного мозга инкубировали с LST-213, срезы стали желтыми и, через 24 часа, адсорбировали практически все соединение, что было показано с учетом того, что среда стала бесцветной. Указанные срезы исследовали с применением BioRad конфокального лазерного сканирующего микроскопа с настройками, применяемыми для обнаружения флуоресцеина. Наблюдали определенное окрашивание структур в коре и гиппокампе (Фигура 3), которое согласуется участками тау-позитивных нейронов в указанных срезах.
Клетки культуры тканей
В исследовании культуры тканей применяют ЗТ6 клетки мышей, разработанных для экспрессирования полноразмерного человеческого тау-белка (htau40) под контролем индуцируемого промотора (pOPRSVI) и для экспрессирования небольшого количества укороченного тау-белка (295-390 dGA) под контролем конститутивного промотора (pcDNA3.1). Экспрессию больших количеств htau40 индуцируют при помощи добавления изопропил β-D-1-тиогалактопиранозида (IPTG, 10-50 µМ), которые в свою очередь приводят к получению дополнительных количеств укороченного тау-белка за счет процесса, в котором агрегирование и формированиеполноразмерного тау-белка проходят в присутствии dGA тау-белка, который выступает в качестве матрицы. Агрегирование тау-белка в указанном исследовании представлено на Фигуре 1.
Мышиные 3Т6 клетки фибробласта вырастили до ~80% заселенности в 10-см планшетах, перед разделением в 2×24-луночные планшеты и оставили для дополнительного роста в течение 24 часов, затем добавили IPTG. После инкубирования в течение ночи удалили среду и клетки промыли PBS.
При исследовании световой микроскопией наблюдали значительное увеличение захвата LST-213 культивированными клетками через 24 часа по сравнению с захватом через 2-4 часа (Фигура 4). На верхних срезах фигуры можно наблюдать большое количество нерастворенного вещества в окружающей среде. После промывания, тем не менее, было обнаружено, что некоторая часть соединения захвачена клетками.
Аналогичный эксперимент провели с клетками, помещенными на покровные стекла в 24-луночные планшеты. Через 24 часа клетки инкубировали с лигандом в течение 20 часов в присутствии или отсутствии IPTG (100 µМ), т.е. индуцированными или неиндуцированными.
LST-213 проявил гораздо более интенсивное окрашивание в клетках, индуцированных IPTG, по сравнению с неиндуцированными клетками (Фигура 5). LST-213, в присутствии β-циклодекстрина (применяемого для помощи в переносе гидрофобных соединений через мембраны), не проявил значительного улучшения в маркировке. Также определены захват и маркировка агрегированных тау-белков в индуцированных клетках для SK2033-30 (Фигура 5).
Можно показать, что лиганды связываются с агрегированным тау-белком in vivo и что они способны к включению в клетки, что может быть показано для агрегированного тау-белка с применением конкретных тканей или клеток, выращенных в культуре.
Исследование биораспределения
Исследования биораспределения и экскреции лигандов проводили на самцах NMRI мышей (масса тела, приблизительно 30 г, 3 животных в единицу времени). Животных содержали в нормальных лабораторных условиях при температуре, равной 22±2°С и с режимом тьма/свет, равным 12 часов. Еду и воду поставляли в полном объеме. В течение периода акклиматизациине менее 3 дней перед началом исследования проводили клинические обследования животных для достоверного определения отсутствия отклоняющихся от нормы клинических показаний.
Через 2, 5, 30, 60 и 120 минут после внутривенной инъекции в хвостовую вену приблизительно 150 кБк в 100 µл исследуемого соединения количественно собрали мочу и кал. В те же временные интервалы животных анестезировали изофлураном, умертвили при помощи декапитации и удалили для определения радиоактивности, с применением счетчика гамма-излучения следующие органы и ткани: селезенку, печень, почку, легкое, кость, сердце, мозг, жир, щитовидную железу, мышцу, кожу, кровь, хвост, желудок (без содержимого), яичко, кишечник (с содержимым), поджелудочную железу, надпочечники, череп и оставшееся тело. Для анализа вычисляли процентное содержание введенной дозы относительно массы ткани (% ВД/г ± стандартное отклонение) с поправкой на распад.
Биораспределение SKT04-137, меченого18F (представлен ниже), у мышей указывает на хорошее включение в мозг (3,99% введенной дозы/г ткани через 2 минуты) и значительное выведение из мозга (осталось 1,43% введенной дозы/г ткани через 60 минут, т.е.64% выведение).

Распределение сигнала F-18 SKT04-137 в органах мышей (% ВД. % введенной дозы)
Ссылки
Andreasen, N, Minthon, L, Davidsson, P, Vanmechelen, E, Vanderstichele, H et al. (2001) Evaluation of CSF-tau and CSF-Aβ42 as diagnostic markers for Alzheimer disease in clinical practice. Arch. Neurol. 58:373-379.
Bondareff, W, Harrington, C, Wischik, CM, Hauser, DL, Roth, M (1994) Immunohistochemical staging of neurofibrillary degeneration in Alzheimer's disease. J. Neuropathol. Exptl. Neurol. 53:158-164.
Boschelli, Diane H.; Wu, Biqi; Sosa, Ana Carolina Barrios; Chen, Joan J.; Golas, Jennifer M.; Boschelli, Frank; Bioorganic & Medicinal Chemistry Letters, 2005, 15, 4681-4684.
Carretero, MT, Harrington, CR, Wischik, CM (1995) Changes in a CSF antigen associated with dementia. Dementia 6:281-285.
Clark, CM, Xie, S, Chittams, J, Ewbank, D, Peskind, E et al. (2003) Cerebrospinal fluid tau and β-amyloid: how well do these biomarkers reflect autopsy-confirmed dementia diagnoses? Arch. Neurol. 60:1696-1702.
Cong, Zhi-Qi; Wang, Chun-Ian; Chen, Tie; Yin, Bing-Zhu; Synthetic Communications, 2006, 36, 679-683. Efficient and rapid method for the oxidation of electron-rich aromatic aldehydes to carboxylic acids using improved basic hydrogen peroxide.
Engelborghs, S, De Vreese, K, Van de Casteele, T, Vanderstichele, H, Van Everbroeck, A et al. (2008) Diagnostic performance of a CSF-biomarker panel in autopsy-confirmed dementia. Neurobiol. Aging 29:1143-1159.
Ermert, J.; Hamacher, К.; Coenen, H.H.; J. Labelled Cpd. Radiopharm. 2000, 43, 1345-1363. N.C.A.18F-labelled norepinephrine derivatives via α-aminopropiophenones.
Galasko, D, Chang, L, Motter, R, dark, CM, Kaye, J et al. (1998) High cerebrospinal fluid tau and low amyloid β42 levels in the clinical diagnosis of Alzheimer disease and relation to apolipoprotein E genotype. Arch. Neurol. 55:937-945.
Grossman, M, Farmer, J, Leight, S, Work, M, Moore, P et al. (2005) Cerebrospinal fluid profile in frontotemporal dementia and Alzheimer's disease Ann. Neurol. 57:721-729.
Goedert, M, Spillantini, MG, Jakes, R, Rutherford, D, Crowther, RA (1989) Multiple isoforms of human microtubule-associated protein tau: sequences and localisation in neurofibrillary tangles of Alzheimer's disease. Neuron 3:519-526.
Goedert, M, Spillantini, MG, Potter, MC, Ulrich, J, Crowther, RA (1989) Cloning and sequencing of the cDNA encoding an isoform of microtubule-associated protein tau containing four tandem repeats: differential expressing of tau protein mRNAs in human brain. EMBO J. 8:393-399.
Hampel, H, Buerger, K, Zinkowski, R, Teipel, SJ, Goemitz, A et al. (2004) Measurement of phosphorylated tau epitopes in the differential diagnosis of Alzheimer disease: a comparative cerebrospinal fluid study. Arch. Gen. Psychiatry 61:95-102.
Haugwitz, R.D.; Angel, R.G.; Jacobs, G.A.; Maurer, B.V.; Narayanan, V.L.; Cruthers, L.R.; Szanto, J..; J. Med. Chem., 1982, 25, 8, 969-974. Antiparasitic agents. 5. Synthesis and anthelmintic activities of novel 2-heteroaromatic-substituted isothiocyanatobenzoxazoles and benzothiazoles.
Hodges, JR, Spatt, J, Patterson, К (1999) «What» and «how»: Evidence for the dissociation of object knowledge and mechanical problem-solving skills in the human brain. Proc. Natl. Acad. Sci. USA 96:9444-9448.
Hulstaert, F, Blennow, K, Ivanoiu, A, Schoonderwaldt, HC, Riemenschneider, M et al. (1999) Improved discrimination of AD patients using β-amyloid(1-42) and tau levels in CSF. Neurology 52:1555-1562.
Idoux, John P.; Gupton, John Т.; McCurry, Cynthia K.; Crews, Donald; Jurss, Cindy D.; Colon, Cesar; Rampi, Richard C.; J. Org. Chem., 1983, 48, 3771-3773. Aromatic fluoroalkoxylation via direct aromatic nucleophilic substitution.
Idoux, John P.; Madenwald, Mark L.; Garcia, Brent S.; Chu, Der-Lun; J. Org. Chem., 1985, 50, 1876-1878. Aromatic fluoroalkoxylation via direct displacement ofanitro or fluoro group.
Imamoto, Tsuneo; Matsumoto, Teruyo; Yokoyama, Hideki; Yokoyama, Masataka; Yamaguchi, Kei-ichi; J. Org. Chem., 1984, 49, 1105-1110. Preparation and synthetic use of trimethylsilyl polyphosphate. A new stereoselective aldol-type reaction in the presence of trimethylsilyl polyphosphate.
Jakes, R, Novak, M, Davison, M, Wischik, CM (1991) Identification of 3- and 4-repeat tau isoforms within the PHF in Alzheimer's disease. EMBO J. 10:2725-2729
Kang J., Lemaire H.-G., Unterbeck A., Salbaum J.M., Masters C.L., Grzeschik K.-H., Multhaup G., Beyreuther K. and Müller-Hill B. (1987) The precursor of Alzheimer's disease amyloid A4 protein resembles a cell-surface receptor. Nature, 325, 733-736.
Kashiyama, Eiji; Hutchinson, lan; Chua, Mei-Sze; Stinson, Sherman F.; Phillips, Lawrence R.; Kaur, Gurmeet; Sausville, Edward A.; Bradshaw, Tracey D.; Westwell, Andrew D.; Stevens, Malcolm F. G.; J. Med. Chem., 42; 1999, 20, 4172 - 4184. Antitumor benzothiazoles. 8. Synthesis, metabolic formation, and biological properties of the C- and N-oxidation products of antitumor 2-(4-aminophenyl)benzothiazoles.
Kuller LH, Shemanski L, Manolio T, Haan M, Fried L, Bryan N, Burke GL, Tracy R, Bhadelia R. Relationship between ApoE, MRI findings, and cognitive function in the Cardiovascular Health Study. Stroke. 1998 29:388-398.
Kuwabe, Shin-itsu; Torraca, Karen E.; and Buchwald, Stephen L. J. Am. Chem. Soc. 2001, 123, 12202-12206
Lai, RYK, Gertz, H-J, Wischik, DJ, Xuereb, JH, Mukaetova-Ladinska, EB et al. (1995) Examination of phosphorylated tau protein as a PHF-precursor at early stage Alzheimer's disease. Neurobiol. Aging 16:433-445
Lakmache, Y, Lassonde, M, Gauthier, S, Frigon, J-Y, Lepore, F. (1998) Interhemispheric disconnection syndrome in Alzheimer's disease. Proceedings of the National Academy of Sciences USA 95:9042-9046
Lo Meo, Paolo; D'Anna, Francesca; Gruttadauria, Michelangelo; Riela, Serena and Noto, Renato Tetrahedron 60 (2004) 9099-9111
Malamas, Michael S.; Carlson, Richard P.; Grimes, David; Howell, Ralph; Glaser, Keith; Gunawan, Iwan; Nelson, James A.; Kanzelberger, Mira; Shah, Uresh; Hartman, David A.; J. Med. Chem., 1996, 39, 237-245. Azole phenoxy hydroxyureas as selective and orally active inhibitors of 5-lipoxygenase.
Mann, John; Baron, Anne; Opoku-Boahen, Yaw; Johansson, Eric; Parkinson, Gary; Kelland, Lloyd R.; Neidle, Stephen; J. Med. Chem., 2001, 44, 138-144. A new class of symmetric bisbenzimidazole-based DNA minor groove-binding agents showing antitumour activity.
Marin DB, Breuer B, Marin ML, Silverman J, Schmeidler J, Greenberg D, Flynn S, Mare M, Lantz M, Libow L, Neufeld R, Altstiel L, Davis KL, Mohs RC. The relationship between apolipoprotein E, dementia, and vascular illness. Atherosclerosis. 1998 140:173-180.
Mathis, Chester A.; Wang, Yanming; Holt, Daniel P.; Huang, Guo-Feng; Debnath, Manik L.; Klunk, William E.; J. Med. Chem., 2003, 46, 13, 2740 - 2754. Synthesis and evaluation of C-11-labeled 6-substituted 2-arylbenzothiazoles as amyloid imaging agents.
Mena, R, Edwards, P, Perez-Olvera, O, Wischik, CM (1995) Monitoring pathological assembly of tau and β-amyloid proteins in Alzheimer's disease. Acta Neuropathol. 89:50-56.
Mena, R, Edwards, PC, Harrington, CR, Mukaetova-Ladinska, EB, Wischik, CM (1996) Staging the pathological assembly of truncated tau protein into paired helical filaments in Alzheimer's disease. Acta Neuropathol. 91:633-б41.
Mukaetova-Ladinska, EB, Garcia-Sierra, F, Hurt, J, Gertz, HJ, Xuereb, JH et al. (2000) Staging of cytoskeletal and p-amyloid changes in human isocortex reveals biphasic synaptic protein response during progression of Alzheimer's disease. Am. J. Pathol. 157:623-636.
Novak, M, Kabat, J, Wischik, CM (1993) Molecular characterization of the minimal protease resistant tau unit of the Alzheimer's disease paired helical filament. EMBO J. 12:365-370.
Ono, Masahiro; Wilson, Alan; Nobrega, Jose; Westaway, David; Verhoeff, Paul; Zhuang, Zhi-Ping;
Kung, Mei-Ping; Kung, Hank F.; Nuclear Medicine and Biology, 2003, 30, 565-571. C-l 1-labeled stilbene derivatives as Aβ-aggregate-specific PET imaging agents for Alzheimer's disease.
Pez, Didier; Leal, Isabel; Zuccotto, Fabio; Boussard, Cyrille; Brun, Reto; Croft, Simon L.; Yardley, Vanessa; Ruiz Perez, Luis M.; Pacanowska, Dolores Gonzalez; Gilbert, lan H.; Bioorganic & Medicinal Chemistry, 2003, 11, 4693-4711. 2,4-Aminopyrimidines as Inhibitors of Leishmanial and Trypanosomal Dihydrofolate Reductase.
Shi, Dong-Fang; Bradshaw, Tracey D.; Wrigley, Samantha; McCall, Carol J.; Leiieveld, Peter; Fichtner, Iduna; Stevens, Malcolm F.G.; J. Med. Chem., 1996, 39, 17, 3375-3384. Antitumor benzothiazoles. 3. Synthesis of 2-(4-aminophenyl)benzothiazoles and evaluation of their activities against breast cancer cell lines in vitro and in vivo.
Vargha-Khadem F, Gadian DG, Watkins KE, Connelly A, Van Paesschen W, Mishkin M. Differential effects of early hippocampal pathology on episodic and semantic memory. Science. 1997 277:376-380.
Villareal, DT, Morris, JC (1998) The diagnosis of Alzheimer's disease. Alzheimer's Dis. Rev. 3:142-152
Willingham D.B. (1997) Systems of memory in the human brain. Neuron, 18, 5-8.
Wischik, CM; Thesis «The structure and biochemistry of paired helical filaments in Alzheimer's disease» Part I and II; Cambridge University, 1989.
Wischik, CM, Novak, M, Thogersen, HC, Edwards, PC, Runswick, MJ et al. (1988) Isolation of a fragment of tau derived from the core of the paired helical filament of Alzheimer's disease. Proc. Natl. Acad. Sci. USA 85:4506-4510.
Wischik, CM, Edwards, PC, Lai, RYK, Roth, M, Harrington, CR (1996) Selective inhibition of Alzheimer disease-like tau aggregation by phenothiazines. Proc. Natl. Acad. Sci. USA 93:11213-11218.
Wischik, CM, Novak, M, Edwards, PC, Klug, A, Tichelaar, W, Crowther, RA (1988) Structural characterization of the core of the paired helical filament of Alzheimer disease. Proc. Natl. Acad. Sci. USA 85:4884-4888.
Wischik C.W. et al. (1989), Curr. Opin. Cell Biol. 1, 115-122.
Wischik, CM, Lai, RYK, Harrington, CR. 1997. Modelling prion-like processing of tau protein in Alzheimer's disease for pharmaceutical development. In Microtubule-Associated Proteins: Modifications in Disease., ed. J.Avila, R.Brandt, K.S.Kosik. pp.185-241. Amsterdam: Harwood Academic Publishers.
Wischik, CM, Theuring, F, Harrington, CR. (2001). The molecular basis of tau protein pathology in Alzheimer's disease and related neurodegenerative dementias. In: «Neurobiology of Alzheimer's Disease», Eds. Dawbam, D and Alien, SJ, The Molecular and Cellular Neurobiology Series, Bios Scientific Publishers, Oxford).
WO 02/055720
Yoshino, Kohichiro; Kohno, Toshihiko; Uno, Toshio; Morita, Tominori; and Tsukamoto, Goro J. Med. Chem., 1986, 29, 820-825. Organic phosphorus compounds. 1. 4-(Benzothiazol-2-yl)benzylphosphonate as potent calcium antagonistic vasodilator.
Zhang, Wei; Oya, Shunichi; Kung, Mei-Ping; Hou, Catherine; Maier, Donna L.; Kung, Hank F.;
Nuclear Medicine and Biology, 2005, 32, 799-809. F-18 Polyethyleneglycol stilbenes as PET imaging agents targeting Aβ aggregates in the brain.
Реферат
Изобретение относится к способу маркировки парных спиральных филаментов (PHF), включающему взаимодействие PHF с соединением и детектирование присутствия указанного соединения, где соединение имеет формулу, в которой -R- означает,-Q- выбран из: -NHC(O)-, -N=N-, -CH=CH-; -P выбран из:;-T выбран из:; X представляет собой N или CH; -W, -G, -Рявляются такими, как указано в формуле изобретения. Также изобретение относится к способу маркировки агрегированного тау-белка, включающему взаимодействие агрегированных молекул тау-белка с соединением и детектирование присутствия указанного соединения, и к самим соединениям формулы, в которой значения заместителей являются такими, как указано в формуле изобретения. Технический результат - соединения формулыв качестве меток тау-белка и парных спиральных филаментов (PHF). 6 н. и 22 з.п. ф-лы, 5 ил., 225 пр.
Формула

где
-R- независимо выбран из:

где (T) обозначает место присоединения к -T;
и (Q) обозначает место присоединения к -Q-;
-Q- независимо выбран из:
-NHC(O)-;
-N=N-;
-CH=CH-;
-P независимо выбран из:

где * обозначает место присоединения;
-T независимо выбран из:

где * обозначает место присоединения;
и X независимо представляет собой N или CH;
-W1 независимо представляет собой -H или -WA;
-W2 независимо представляет собой -H или -WA;
-W3 независимо представляет собой -H или -WA;
-W4 независимо представляет собой -H или -WA;
-W5 независимо представляет собой -H или -WA;
-W6 независимо представляет собой -H или -WA;
где -WA независимо выбран из:
-F, -Cl, -Br, -I,
-OH, -WA1, -O-WA1,
-N(WA1)2;
и -WA1 независимо выбран из:
незамещенного насыщенного алифатического C1-4алкила;
-CF3 и
-CH2CH2N(Me)2;
-G1 независимо представляет собой -H или -GA;
-G2 независимо представляет собой -H или -GA;
где -GA представляет собой -OR2;
-G3 независимо представляет собой -H или -GB;
-G4 независимо представляет собой -H или -GB;
где -GB независимо выбран из:
-CF3,
-OH, -OR2;
-[O-CH2CH2]n-RB2, где n равно от 2 до 6;
где:
-P1 независимо представляет собой -H или -PA;
-P2 независимо представляет собой -H или -PB;
-P3 независимо представляет собой -H или -PC;
-P4 независимо представляет собой -H или -PB;
-P5 независимо представляет собой -H или -PA;
и где:
каждый из -PA, каждый из -PB и каждый из -PC независимо представляет собой:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-OH,
-OR2,
-NO2,
-NH2, -NHR2, -NR22,
-NHOH,
-OC(=O)R2,
-NHC(=O)R2,
где:
каждый из -R2 независимо представляет собой -RA1,
где:
каждый из -RA1 независимо представляет собой насыщенный алифатический C1-6алкил;
и где:
каждый из -RA1 является возможно замещенным, например, одним или более заместителем -RB2;
где:
каждый из -RB2 независимо представляет собой:
-F, -Cl, -Br, -I,
-CF3,
-OH,
-ORC1,
-NRС12,
где:
каждый из -RC1 независимо представляет собой незамещенный насыщенный алифатический C1-4алкил;
и их фармацевтически и физиологически приемлемые соли.



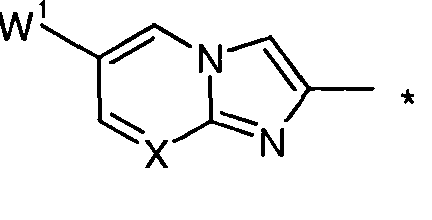




где
-R- независимо выбран из:

где (T) обозначает место присоединения к -T;
и (Q) обозначает место присоединения к -Q-;
-Q- независимо выбран из:
-N=N-;
-CH=CH-;
каждый из -R1 независимо представляет собой незамещенный насыщенный алифатический C1-4алкил;
-P независимо выбран из:

где * обозначает место присоединения;
-T независимо выбран из:

где * обозначает место присоединения;
и X независимо представляет собой CH;
-W1 независимо представляет собой -WA;
-W2 независимо представляет собой -H или -WA;
-W3 независимо представляет собой -H или -WA;
-W4 независимо представляет собой -H или -WA;
-W5 независимо представляет собой -H или -WA;
-W6 независимо представляет собой -H или -WA;
при условии, что по меньшей мере один из -W4, -W5 и -W6 представляет собой -WA,
где -WA независимо выбран из:
-F, -Cl, -Br, -I,
-OH, -WA1, -O-WA1,
-N(WA1)2;
и -WA1 независимо выбран из:
незамещенного насыщенного алифатического C1-4алкила,
-CF3, и
-CH2CH2N(Me)2;
-G1 независимо представляет собой -H или -GA;
-G2 независимо представляет собой -H или -GA;
где -GA представляет собой -OR2;
-G3 независимо представляет собой -H или -GB;
-G4 независимо представляет собой -H или -GB
где -GB независимо выбран из:
-CF3,
-OH, -OR2;
-[O-CH2CH2]n-RB2, где n равно от 2 до 6;
где:
-P1 независимо представляет собой -H или -PA;
-P2 независимо представляет собой -H или -PB;
-P3 независимо представляет собой -H или -PC;
-P4 независимо представляет собой -H или -PB;
-P5 независимо представляет собой -H или -PA;
и где:
каждый из -PA, каждый из -PB и каждый из -PC независимо представляет собой:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-OH,
-OR2,
-NO2,
-NH2, -NHR2, -NR22,
-NHOH,
-OC(=O)R2,
-NHC(=O)R2,
где:
каждый из -R2 независимо представляет собой -RA1;
где:
каждый из -RA1 независимо представляет собой насыщенный алифатический C1-6алкил;
и где:
каждый из -RA1 является возможно замещенным, например, одним или более заместителем -RB2;
где
каждый из -RB2 независимо представляет собой:
-F, -Cl, -Br, -I,
-CF3,
-OH,
-ORC1,
-NRС12,
где:
каждый из -RC1 независимо представляет собой незамещенный насыщенный алифатический C1-4алкил;
и их фармацевтически и физиологически приемлемые соли, с тем условием, что указанное соединение не представляет собой соединение:
(a)
и
(b) где -T представляет собой:

-R- представляет собой
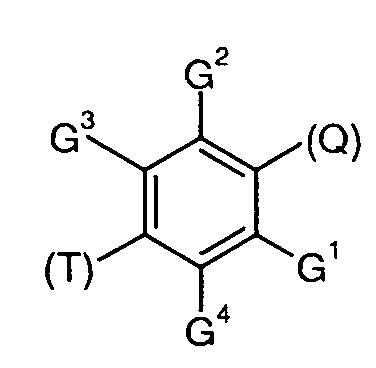
и -P представляет собой:

и -W4 представляет собой -H, -Q- представляет собой -CH=CH-, все из -G1, -G2, -G3 и -G4 представляют собой -H, и
(i) все из -P1, -P2, -P4 и -P5 представляют собой -H, и -P3 представляет собой -RA1; или
(ii) один из -P1, -P2, -P3, -P4 и -P5 представляет собой -RA7, а другие из -P1, -P2, -P3, -P4 и -P5 представляют собой -H.

где
-R- независимо выбран из:

где (T) обозначает место присоединения к -T;
и (Q) обозначает место присоединения к -Q-;
-Q- независимо выбран из:
-NHC(O)-;
каждый из -R1 независимо представляет собой незамещенный насыщенный алифатический C1-4алкил;
-P независимо выбран из:
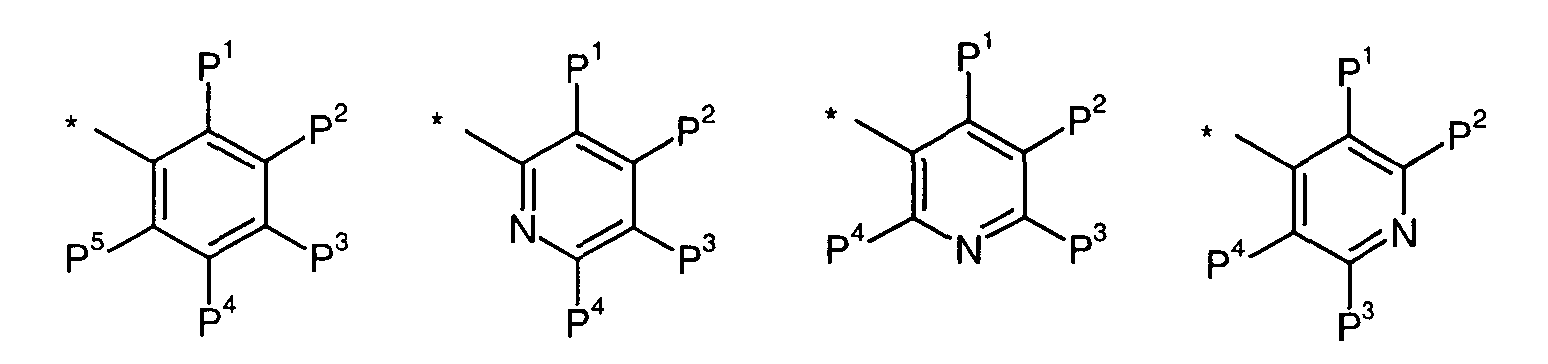
где * обозначает место присоединения;
-T независимо выбран из:
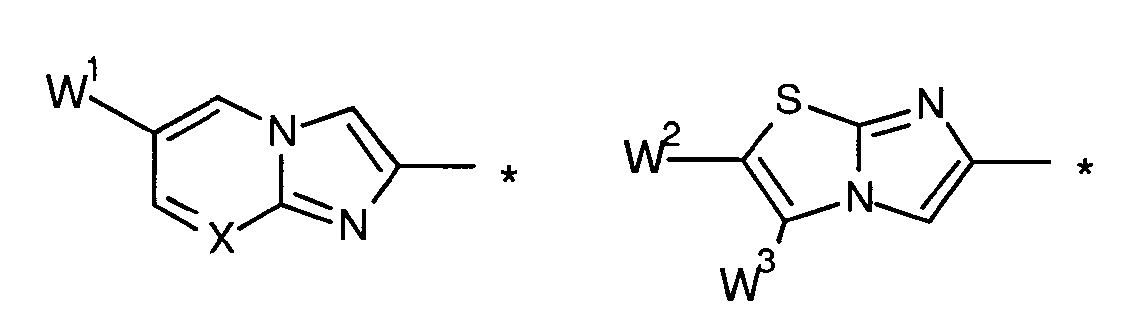
где * обозначает место присоединения;
и X независимо представляет собой CH;
-W1 независимо представляет собой -WA;
-W2 независимо представляет собой -H или -WA;
-W3 независимо представляет собой -H или -WA;
где -WA независимо выбран из:
-F, -Cl, -Br, -I,
-OH, -WA1, -O-WA1 и
-N(WA1)2;
и -WA1 независимо выбран из:
незамещенного насыщенного алифатического C1-4алкила;
-CF3,
-CH2CH2OH и
-CH2CH2N(Me)2;
-G1 независимо представляет собой -H или -GA;
-G2 независимо представляет собой -H или -GA;
где -GA представляет собой -OR2;
-G3 независимо представляет собой -H или -GB;
-G4 независимо представляет собой -H или -GB;
где -GB независимо выбран из:
-CF3,
-OH, -OR2;
-[O-CH2CH2]n-RB2, где n равно от 2 до 6;
где:
-P1 независимо представляет собой -H или -PA;
-P2 независимо представляет собой -H или -PB;
-P3 независимо представляет собой -H или -PC;
-P4 независимо представляет собой -H или -PB;
-P5 независимо представляет собой -H или -PA;
и где:
каждый из -PA, каждый из -PB и каждый из -PC независимо представляет собой:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-OH,
-OR2,
-NO2,
-NH2, -NHR2, -NR22,
-NHOH,
-OC(=O)R2,
-NHC(=O)R2,
где:
каждый из -R2 независимо представляет собой -RA1,
где:
каждый из -RA1 независимо представляет собой насыщенный алифатический C1-6алкил;
и где:
каждый из -RA1 является возможно замещенным, например, одним или более заместителем -RB2;
где:
каждый из -RB2 независимо представляет собой:
-F, -Cl, -Br, -I,
-CF3,
-OH,
-ORC1,
-NRС12,
где:
каждый из -RC1 независимо представляет собой незамещенный насыщенный алифатический C1-4алкил;
и его фармацевтически и физиологически приемлемые соли.

где
-R- независимо выбран из:

где (T) обозначает место присоединения к -T;
и (Q) обозначает место присоединения к -Q-;
-Q- независимо выбран из:
-NHC(O)-;
каждый из -R1 независимо представляет собой незамещенный насыщенный алифатический C1-4алкил;
-P независимо выбран из:

где * обозначает место присоединения;
-T независимо выбран из:

где * обозначает место присоединения;
-W4 независимо представляет собой -H или -WA;
-W5 независимо представляет собой -H или -WA;
-W6 независимо представляет собой -H или -WA;
при условии, что по меньшей мере один из -W4, -W5 и -W6 представляет собой -WA,
где -WA независимо выбран из:
-F, -Cl, -Br, -I,
-OH, -WA1, -O-WA1,
-N(WA1)2;
и -WA1 независимо выбран из:
незамещенного насыщенного алифатического C1-4алкила;
-CF3 и
-CH2CH2N(Me)2;
-G1 независимо представляет собой -H или -GA;
-G2 независимо представляет собой -H или -GA;
где -GA представляет собой -OR2;
-G3 независимо представляет собой -H или -GB;
-G4 независимо представляет собой -H или -GB;
где -GB независимо выбран из:
-F, -Cl, -Br, -I.
-CF3,
-OH, -OR2;
-[O-CH2CH2]n-RB2, где n равно от 2 до 6;
где:
-P1 независимо представляет собой -H или -PA;
-P2 независимо представляет собой -H или -PB;
-P3 независимо представляет собой -H или -PC;
-P4 независимо представляет собой -H или -PB;
-P5 независимо представляет собой -H или -PA;
и где:
каждый из -PA, каждый из -PB и каждый из -PC независимо представляет собой:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-OH,
-OR2,
-NO2,
-NH2, -NHR2, -NR22,
-NHOH,
-OC(=O)R2,
-NHC(=O)R2,
где:
каждый из -R2 независимо представляет собой -RA1;
где:
каждый из -RA1 независимо представляет собой насыщенный алифатический C1-6алкил;
и где:
каждый из -RA1 является возможно замещенным, например, одним или более заместителем -RB2;
где:
каждый из -RB2 независимо представляет собой:
-F, -Cl, -Br, -I,
-CF3,
-OH,
-ORC1,
-NRС12,
где:
каждый из -RC1 независимо представляет собой незамещенный насыщенный алифатический C1-4алкил;
причем указанное соединение содержит группу -F;
и его фармацевтически и физиологически приемлемые соли;
при условии, что указанное соединение не является соединением

где
-R- независимо выбран из:
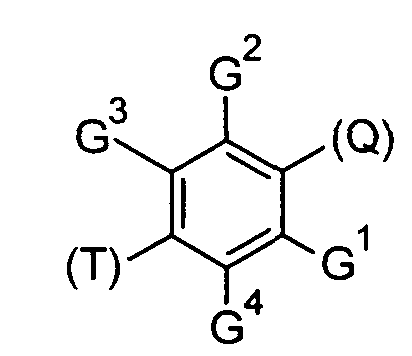
где (T) обозначает место присоединения к -T;
и (Q) обозначает место присоединения к -Q-;
-Q- независимо выбран из:
-NHC(O)-;
-N=N-;
-CH=CH-;
каждый из -R1 независимо представляет собой незамещенный насыщенный алифатический C1-4алкил;
-P независимо выбран из:

где * обозначает место присоединения;
-T независимо выбран из:

где * обозначает место присоединения;
и X независимо представляет собой N;
-W1 независимо представляет собой -H или -WA;
где -WA независимо выбран из:
-F, -Cl, -Br, -I,
-OH, -WA1, -O-WA1,
-N(WA1)2;
и -WA1 независимо выбран из:
незамещенного насыщенного алифатического C1-4алкила;
-CF3 и
-CH2CH2N(Me)2;
-G1 независимо представляет собой -H или -GA;
-G2 независимо представляет собой -H или -GA;
где -GA представляет собой -OR2;
-G3 независимо представляет собой -H или -GB;
-G4 независимо представляет собой -H или -GB;
где -GB независимо выбран из:
-CF3,
-OH, -OR2;
-[O-CH2CH2]n-RB2, где n равно от 2 до 6;
где:
-P1 независимо представляет собой -H или -PA;
-P2 независимо представляет собой -H или -PB;
-P3 независимо представляет собой -H или -PC;
-P4 независимо представляет собой -H или -PB;
-P5 независимо представляет собой -H или -PA;
и где:
каждый из -PA, каждый из -PB и каждый из -PC независимо представляет собой:
-F, -Cl, -Br, -I,
-CF3, -OCF3,
-OH,
-OR2,
-NO2,
-NH2, -NHR2, -NR22,
-NHOH,
-OC(=O)R2,
-NHC(=O)R2,
где:
каждый из -R2 независимо представляет собой -RA1,
где:
каждый из -RA1 независимо представляет собой насыщенный алифатический C1-6алкил;
и где:
каждый из -RA1 является возможно замещенным, например, одним или более заместителем -RB2;
где:
каждый из -RB2 независимо представляет собой:
-F, -Cl, -Br, -I,
-CF3,
-OH,
-ORC1,
-NRС12,
где:
каждый из -RC1 независимо представляет собой незамещенный насыщенный алифатический C1-4алкил;
и их фармацевтически и физиологически приемлемые соли.
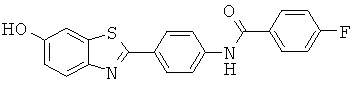



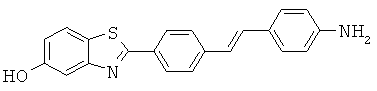


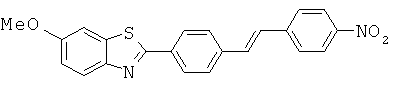


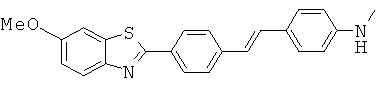












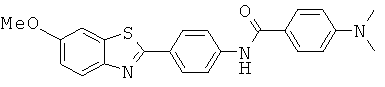
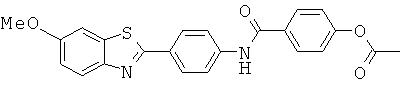











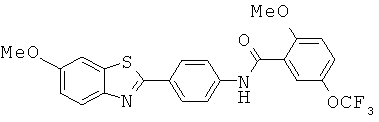

















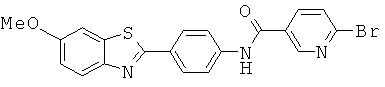







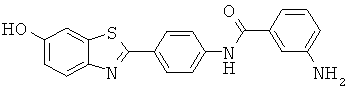





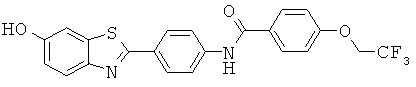





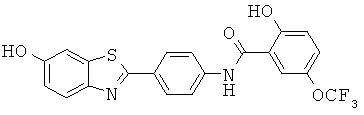

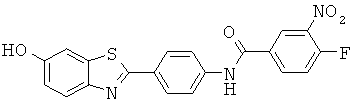




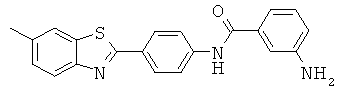
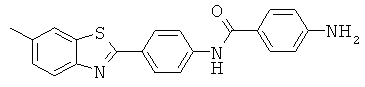









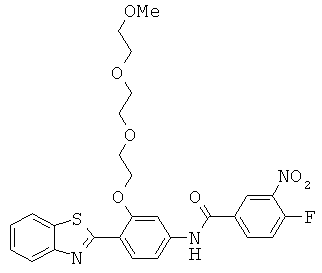
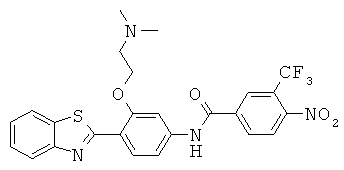







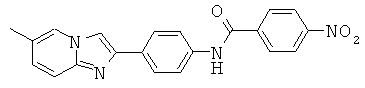
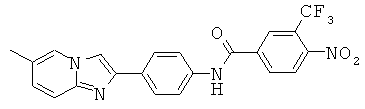

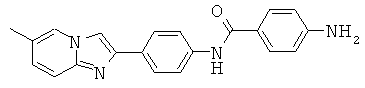



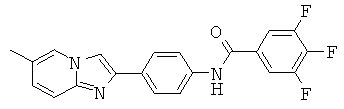













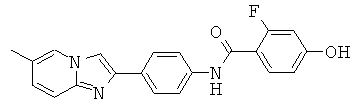

















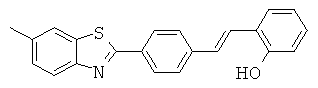



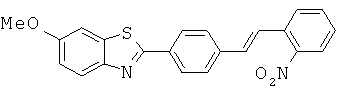

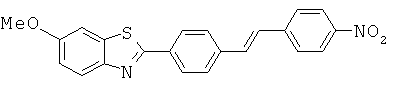


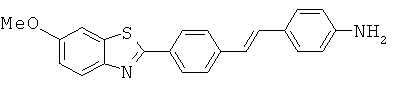



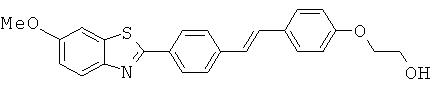



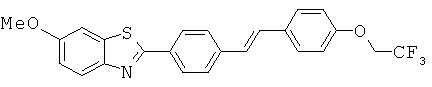


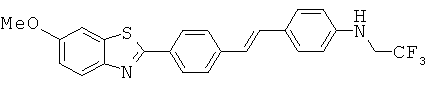

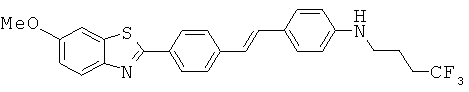
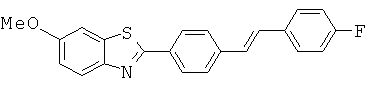


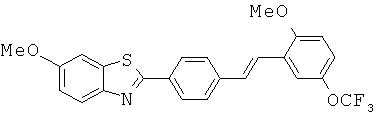
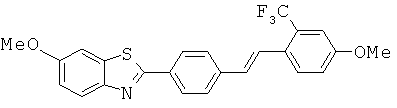

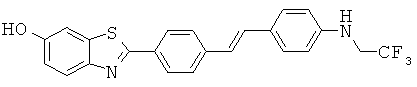






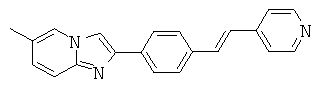




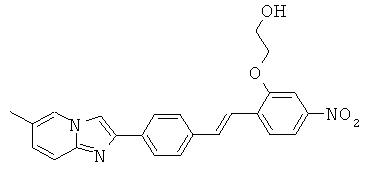


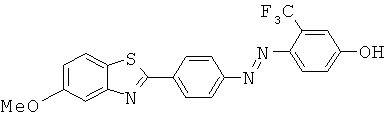





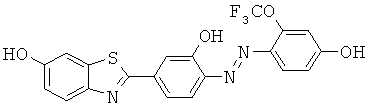

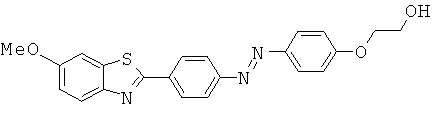
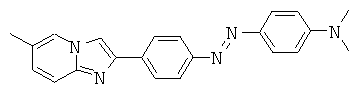







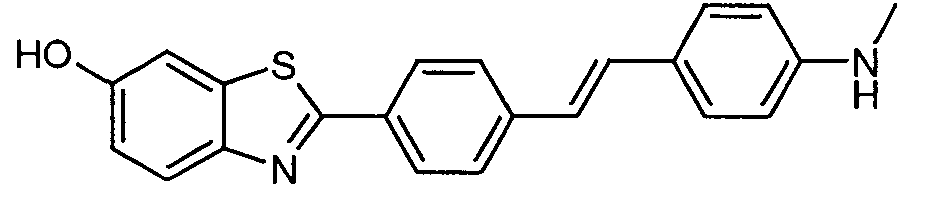


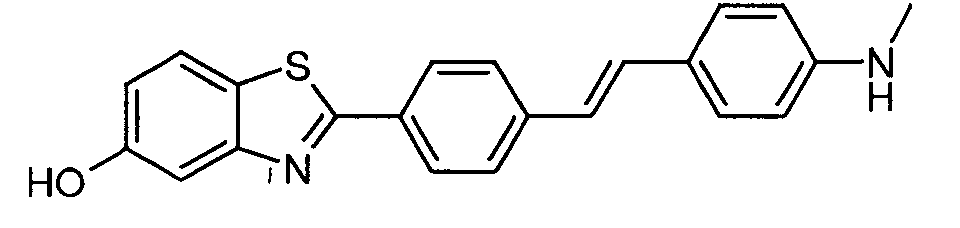





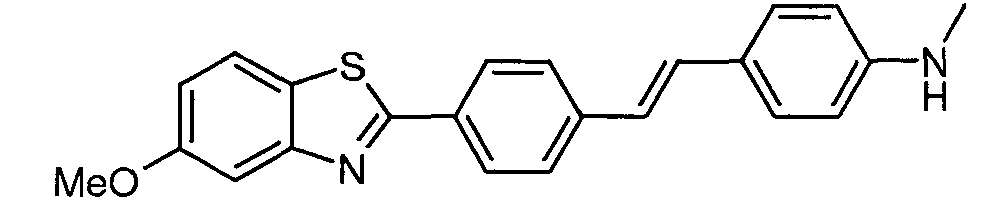


Комментарии