Способ получения электрохимического катализатора на основе восстановленного золота - RU2784199C1
Код документа: RU2784199C1
Чертежи
Описание
Изобретение касается функциональных полимерных композитных материалов, содержащих наночастицы металлов, и, более конкретно, относится к способу получения электрохимического катализатора окисления перекиси водорода (H2O2), содержащего наночастицы золота, с функцией электрохимического сенсора. Изобретение может быть использовано в аналитической практике для точного определения уровня H2O2в медицине, фармакологии, экологии и на пищевых производствах.
Перекись водорода является наилболее часто используемым окислителем во многих областях, таких как текстильная и бумажная промышленности, для обработки пищевых продуктов. Помимо этого, она естественным образом вырабатывается живыми организмами в качестве побочного продукта окислительного метаболизма. В связи с этим аналитическое определение H2O2 имеет важное значение для многих производств. Поэтому надежное, точное, чувствительное, быстрое и недорогое определение уровня перекиси водорода является практически важной задачей. Для этого используются титриметрия, хемилюминесценция, флуоресценция и спектрофотометрия, электрохимия. В электрохимических сенсорах аналитический сигнал обеспечивается протеканием электрохимического процесса, в ходе которого определяемый аналит реагирует с чувствительным слоем непосредственно на электроде или в объеме слоя раствора около электрода. В качестве материалов рабочих электродов используют твердые электроды (углерод, золото, платина и т.д.) из-за их универсального окна потенциалов, низкого фонового тока, химической инертности и пригодности для различных применений. Несмотря на развитие различных подходов к изготовлению электродов, основными материалами по-прежнему остаются электроды на основе благородных металлов - платины и золота. Выбор данных материалов основан на их коррозийной стойкости и стабильности при поляризации. Электрохимические методы (циклическая вольтамперометрия, потенциометрия, амперометрия) имеют большие преимущества из-за их относительной инструментальной простоты, высокой селективности и низкой стоимости, а также возможности измерений в полевых условиях от долей ПДК до концентраций выбросов, быстрого отклика, высокой точности и стабильности измерений. При этом амперометрические датчики позволяют контролировать производственные процессы в режиме реального времени и не требуют высокой квалификации обслуживающего персонала.
Большинство электрохимических сенсоров для определения содержания перекиси водорода основано на использовании ферментов (биосенсоры), в связи с чем обладают рядом недостатков таких как сложность иммобилизации, поддержание стабильности фермента, зависимость активности фермента от pH и температуры, а также высокой стоимостью ферментов.
В последнее время большой интерес вызывают бесферментные электрохимические сенсоры на основе наноматериалов благодаря их уникальным оптическим, электрическим, термическим и каталитическим свойствам. В этих сенсорах для уменьшения себестоимости с целью получения электрохимических свойств, сопоставимых с электродами из благородных металлов, широко используются модифицированные наночастицами золота стеклоуглеродные или углеродсодержащие электроды как аналоги золото-графитового и золотого электродов. Путем модифицирования поверхности электрода получают микроэлектродные ансамбли, отличающиеся высокими чувствительностью и стабильностью работы.
Каталитическая активность наночастиц золота, прежде всего, зависит от способа их получения, степени окисления, количества, распределения в композите, формы и размера наночастиц, а также свойств поверхности. Синтез наночастиц основан на восстановлении ионов золота с образованием наночастиц химическими, физическими или электрохимическими методами.
Известен способ получения электрохимического катализатора [пат. CN №103792271, опубл. 14.05.2014] и его применение в качестве электрохимического бесферментного сенсора на перекись водорода [пат. CN №112305050, опубл. 02.02.2021]. Изобретение представляет собой электрод, модифицированный наночастицами драгоценных металлов такими как золото, серебро, платина, палладий или иридий. Наночастицы драгоценных металлов осаждали на стеклоуглеродном электроде или электродном материале из нанографена. Для этого предварительно обрабатывали электрод наждачной бумагой и порошком для полировки из глинозема с зерном от 0,3 до 0,05 мкм. После полировки электрод промывали водой и дополнительно очищали в ультразвуковой водяной ванне в течение 2-3 мин. Затем электрод помещали в раствор 0,5 моль/л H2SO4, активировали его методом циклирования потенциала, добиваясь снижения потенциала пика с 80 мВ до 64 мВ, после чего электрод можно использовать.
Формирование наночастиц проводили методом ионного травления. Данный способ также придает пористость электроду. Для осаждения наночастиц использовали установку с несколькими буферными газами с вакуумом 1⋅10-3 Па или выше. Затем осуществляли магнетронное распыление по принципу разности вакуума, которая образуется на нанометровом пучке частиц благородного металла при подаваемом на электрод напряжении порядка 1000 В. Такой подход обеспечивал адгезию наночастиц для осаждения частиц толщиной в 0,7 слоя на стеклоуглеродном электроде. Общую толщину покрытия контролировали в пределах 0,3 слоя - 5 слоев. Модифицированный электрод, изготовленный известным способом, позволяет получить катализатор с хорошей дисперсностью, кристалличностью и чистой от примесей поверхностью, что ускоряет передачу электронов между электродом и катализатором.
Недостатками указанного способа являются многостадийная технология, использование дорогостоящей аппаратуры, энергоемкость процесса, а также отсутствие информации о требованиях к хранению и сроках хранения модифицированного наночастицами электрода для электрокатализа перекиси водорода, так как отсутствие полимерных связующих может ограничивать стабильность электрода.
Использование гибридных композиций, состоящих из полимерной матрицы с включенной активной фазой, выполняющей функцию медиатора электродного процесса, увеличивает дисперсность, площадь поверхности и придает стабильность электрокатализатору. Так, известно получение эффективной каталитической многослойной электродной системы на основе поливиологена и наночастиц золота [Zanardi Ch. Et al. «Effective catalytic electrode system based on polyviologen and Au nanoparticles multilayer»// Sensors and Actuators B, 2010, V.144, p.92-98]. Создание многослойной системы проводили в несколько стадий. На первой стадии свежеприготовленный водный раствор 48 мМ NaBH4 добавляли к 1 мМ NaAuCl4 (0,01 л водного раствора) при интенсивном перемешивании. В результате взаимодействия BH4- и AuCl4- получали наночастицы AuNPsCl. На второй стадии рабочий электрод из золота 2 мм в диаметре предварительно подвергали механической и электрохимической очистке. Для этого электрод очищали порошком алюминия с диаметром частиц 1 и 0,3 мкм, затем ополаскивали ультрачистой водой в ультразвуковой ванне в течение 5 мин. Процедуру завершали циклированием потенциала электрода в интервале (-0,20) В ÷ (+1,15) В относительно Hg/HgSO4 электрода со скоростью развертки потенциала 0,1 В/с в растворе 0,5 M H2SO4 до получения воспроизводимой циклической вольтамперограммы, типичной для чистого Au-электрода.
На следующей стадии формировали многослойный электрохимический катализатор. В качестве предварительной операции поверхность Au-электрода заряжали отрицательно за счет погружения на 30 минут в 1 мМ водный раствор 2-меркаптоэтансульфоната натрия. Мультислои получали путем поочередного погружения электрода в раствор катионного поливиологена (1,0 мг/мл в 0,1М фосфатном буферном растворе, pH 7,0) на 20 мин и в анионный раствор AuNPsCl (0,17 мг/мл золота) на 10 или 20 мин. После каждого этапа осаждения электрод тщательно промывали водой и погружали в водяную баню на 1 мин. В результате получали электродную систему, состоящую из шести бислоев поливиологена и AuNPsCl.
Электрохимическая ячейка была дополнена вспомогательным стеклянным углеродным электродом и электродом сравнения Ag/AgCl, 3M KCl. Электрохимическое восстановление перекиси водорода проводили с использованием циклической вольтамперометрии в 0,1М фосфатном буфере, содержащем H2O2 в качестве электроактивных частиц. Электрохимические испытания проводили с помощью потенциостата/гальваностата Autolab PGSTAT12 (Ecochemie), оснащенного стендом Metrohm663VA диаметром 2 мм.
Основными недостатками указанного способа являются его многостадийность и длительность всех стадий получения многослойного полимерного покрытия с наночастицами Au, использование дорогостоящего электрода из золота. Помимо этого, к существенным недостаткам можно отнести использование токсичных борогидрида натрия при приготовлении наночастиц золота и меркаптоэтансульфоната натрия при формировании катализатора. Недостатком также является то, что при таких условиях невозможно получить композитное покрытие одинаковой толщины с равномерно распределенными наночастицами.
Известен способ получения электрокатализатора восстановления пероксида водорода на основе композитного электрода графен/полиалиламин - наночастицы золота [Zhang Q. et al. «One-step synthesis of graphene/polyallylamine-Au nanocomposites and their electrocatalysis toward oxygen reduction» // Talanta, 2012, V.89, p. 391- 395]. Для этого 10 мг оксида графена диспергировали с помощью ультразвука в 20 мл дистиллированной воды в течение 15 минут. Затем к этой коллоидной суспензии при постоянном перемешивании по каплям добавляли 400 мкл 0,01 М HAuCl4 3H2O и 10 мл 0,08 М полиалиламина (ПАА) в виде 20 мас.% водной суспензии (Mw =17000). Далее смесь непрерывно перемешивали при 95°C в течение 3 часов. Полученные нанокомпозиты графен/ПАА-Au собирали центрифугированием и трижды промывали дистиллированной водой. После ресуспендирования в дистиллированной воде образцы оставались стабильными в течение нескольких месяцев без какой-либо наблюдаемой агрегации.
Для электрокаталитического восстановления пероксида водорода электроды из стеклоуглерода диаметром 3 мм полировали с помощью суспензии оксида алюминия фракций 1,0; 0,3 и 0,05 мкм, а затем несколько раз обрабатывали ультразвуком в воде. Затем для модификации рабочего электрода на его поверхность наносили с помощью микрошприца аликвоту приготовленной ранее суспензии графен/ПАА-Au (8 мкл в 2,0 мг/мл) и высушивали в течение 9 ч при 4°C. Затем электрод несколько раз промывали дистиллированной водой и просушивали на воздухе перед использованием.
Недостатком предложенного способа является многостадийность, что приводит к длительности процесса, а нанесение композита предложенным способом не гарантирует однородность распределения активной фазы наночастиц и толщину поверхности композита.
В [Kolzunova L.G., et al. «Electrochemical one-step synthesis of hybrid nanocomposites Au/polymer»// IOP Conf. Series: Materials Science and Engineering, 2018, V.369, p. 012027] предложен способ одностадийного электрохимического формирования композитной полимерной пленки с наночастицами золота. Композитную пленку формировали из электролита состава: 3 моль/л CH2=CHC(O)NH2, 3 моль/л HCHO, 0,05 моль/л CH2(NHCOCH=CH2)2, 0,2 моль/л ZnCl2, 1 ммоль/л HAuCl4. Синтез композитов проводили на потенциостате/гальваностате в стеклянных ячейках объемом 10 см3 в течение 3 минут при катодном потенциале -1,2 В без разделения анодного и катодного пространства на рабочем электроде (катоде) титана или нержавеющей стали (S=1,0-1,5 см2). В качестве вспомогательного электрода (анода) использовали платиновую пластину площадью 7,5 см2. Электрод сравнения - насыщенный хлорсеребряный электрод с капилляром Луггина. Титановые электроды предварительно подвергали электрохимической полировке в течение 2-3 секунд в горячей смеси (3:1) кислот HNO3 и HF. Стержни из нержавеющей стали шлифовали и обезжиривали пастой из мелкодисперсного оксида магния. Композитную пленку полиметилолакриламида с AuNPs (ПМАА/ AuNPs) отделяли от поверхности электрода погружением в 0,1 моль/л HCl на ~90-100 с.
Основной недостаток известного способа заключается в том, что указанным способом были получены пленки, а не композитное покрытие на электроде. Помимо этого, при указанном низком содержании ионов золота в электролите сформированы только наночастицы золота размером 10 нм, и не был сформирован подслой золота на поверхности обращенной к электроду, что потенциально может влиять на каталитические свойства электрохимического сенсора.
Наиболее близким техническим решением является способ электрохимической полимеризации молекул анилинового красителя (бриллиантовый крезиловый синий (ВСВ)) на электроде с получением композита поли(BCB)/наночастицы золота (AuNPs) [Kumar S.A. et al. «Poly(BCB)/Au-nanoparticles hybrid film modified electrode: Preparation, characterization and its application as a non-enzymatic sensor» // Thin Solid Films, 2010, V.518, p. 5832-5838]. Электрод, модифицированный поли(BCB)/AuNPs использовали в качестве электрохимического сенсора амперометрического датчика для обнаружения пероксида водорода при более низком потенциале (-0,2 В). Процесс осуществляли следующим образом. Стеклоуглеродный электрод диаметром 3 мм полировали суспензией оксида алюминия фракции 0,05 мкм с последующей тщательной промывкой дистиллированной водой. Затем электрод последовательно обрабатывали ультразвуком в этаноле и бидистиллированной воде. Перед тем как приступить к электроосаждению, электрод анодировали в буферном растворе с pH 7,2 при 2,0 В в течение 20 с и оставляли сушиться в потоке высокоочищенного аргона при комнатной температуре.
Наночастицы золота AuNPs электрохимически наносили на анодированный стеклоуглеродный электрод путем сканирования потенциала от 0,2 В до -1,0 В (скорость сканирования = 50 мВ/с) в 0,1 М растворе KCl, содержащем 0,5 мМ HAuCl4, в течение 10 циклов. После этого проводили электрохимическую полимеризацию BCB на AuNPs электроде в режиме циклирования потенциала в интервале (-0,7 ÷ 1,05) В в буферном растворе с pH 9,4 (0,1 M Na2HPO4 + 0,1 M NaOH) с 1,0 мМ BCB в течение 20 циклов. Для электрополимеризации BCB использовали скорость сканирования 50 мВ/с.
Описанным способом получили необратимо прикрепленную к электроду пленку поли(BCB), модифицированную AuNPs. Полученный электрод был электрохимически активен в диапазоне pH от 2 до 11 и обладал хорошими электрокаталитическими свойствами в отношении восстановления H2O2, такими как чувствительность, потенциал восстановления, а также соответствующий предел обнаружения.
Указанным способом был сформирован композит, в котором слой наночастиц золота покрыт слоем полимера. К недостаткам способа можно отнести прежде всего многостадийность технологии и длительность формирования модифицированного электрода, а также необходимость использования режима циклирования потенциала как для получения подслоя золота (10 циклов), так и для формирования поли(BCB) пленки (20 циклов), что требует более сложного оборудования, чем при проведении процесса при постоянном потенциале. Кроме того, способ требует сложной подготовки рабочего электрода перед модификацией: использование ультразвуковой обработки и анодирование в атмосфере высокоочищенного аргона.
К недостаткам можно отнести также то, что по указанному способу формирования в композитном покрытии наночастицы золота не включены в объем полимера, а представляют собой лишь подслой металлического золота на электроде под полимерной пленкой. Это с одной стороны снижает суммарную каталитическую активность наночастиц золота, а с другой - для начала каталитической реакции аналиту необходимо преодолеть полимерный слой поли(BCB) пленки бриллиантового крезилового синего, лимитирующий диффузию восстанавливающегося вещества к поверхности золота, что может ухудшить чувствительность электрохимического сенсора. Таким образом в предложенном способе полимерная пленка выполняет только функцию механического фиксатора наночастиц золота на электроде.
В связи с этим задачей заявляемого изобретения является разработка одностадийного и кратковременного способа получения композитного покрытия Au/ПМАА/AuNPs для золотосодержащего электрокатализатора восстановления пероксида водорода, эффективного и удобного в применении, пористого, с равномерно распределенными в объеме полимера наночастицами активного металла, а также подслоем золота на поверхности электрода.
Технический результат предлагаемого способа заключается в упрощении технологии, сокращении до нескольких минут общего времени на его осуществление за счет объединения в одном процессе всех промежуточных стадий формирования полимерной матрицы методом электрополимеризации и внедрения в нее наночастиц золота с одновременным формированием подслоя золота на поверхности рабочего электрода. В заявляемом способе при постоянном потенциале в отличие от сканирования потенциала, как в прототипе, с использованием в качестве катода стали - доступного и дешевого металла, без специальной подготовки электрода (ультразвук, анодирование в среде высокоочищенного аргона и т.д.), в одну стадию в течение 3-5 мин получают высокоэффективный электрохимический катализатор с возможностью использования для определения содержания пероксида водорода в растворе. проведение процесса;
Указанный технический результат подтверждается на следующих графиках:
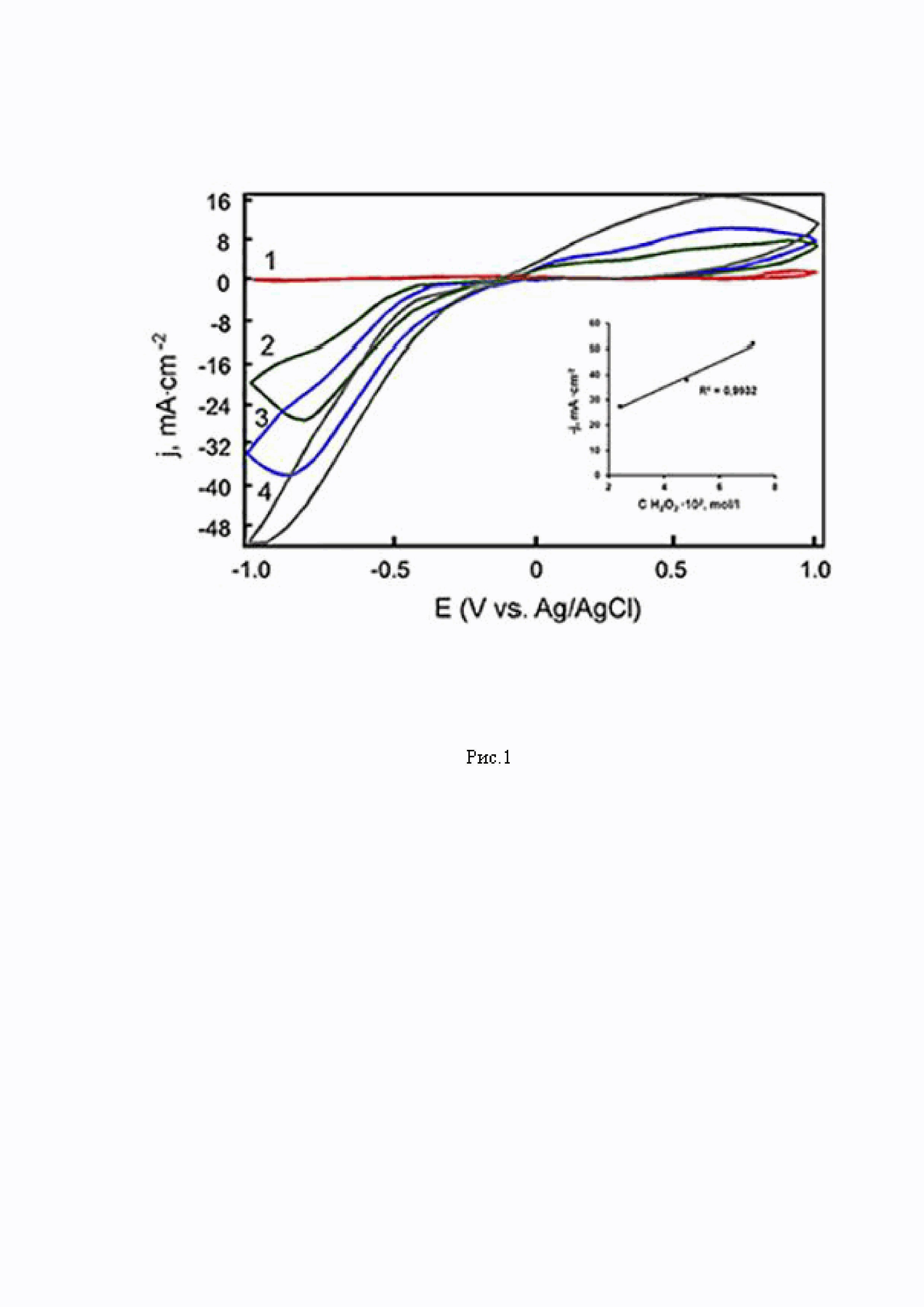
Рис.1 - Циклические вольтамперограммы электрода с композитным покрытием Au/ПMAA/AuNPs в PBS. Концентрация H2O2 (моль/л): 0 (1), 2,4 ⋅ 10-2 - (2), 4,8 ⋅ 10-2 - (3), 7,2 ⋅ 10-2 - (4). Скорость сканирования потенциала 100 мВ/с.
Заявляемый в настоящем изобретении способ осуществляли следующим образом. Электрохимический синтез композитов Au/полиметилолакриламид/АuNРs проводили с использованием потенциостата/гальваностата в стеклянных ячейках объемом 10 см3 без разделения катодного и анодного пространства, без дегазации, при комнатной температуре. Ячейка была подключена к потенциостату по трехэлектродной схеме. Потенциал катода (-1,16) В - (-1,2) В. Время электролиза 1-5 минут.
Рабочими электродами (катод) служили стержни из нержавеющей стали марки AISI 304 и 12Х18Н10. Стержни из нержавеющей стали шлифовали и обезжиривали пастой из мелкодисперсного оксида магния. Все электроды тщательно промывали деионизированной водой. Площадь рабочего электрода составила 1-1,5 см2. В качестве вспомогательного электрода (анод) использовали коаксиально расположенную платиновую пластину S=7,5 см2. Электродом сравнения служил насыщенный хлорсеребряный электрод ЭВЛ-1М3, снабженный капилляром Луггина.
Композитное покрытие Au/ПМАА/AuNPs, синтезировали на поверхности рабочего электрода в режиме потенциостатического электролиза из электролитов следующего состава:
Акриламид - 3 моль/л
N,N'-метилен-бис-акриламид - 0,05 моль/л
Формальдегид - 3 моль/л
Хлорид цинка - 0,2 моль/л
Золотохлористоводородная кислота - 2-6 ммоль/л.
Растворы для получения композитов готовили непосредственно перед началом эксперимента. Хлорид цинка использовали в виде 2-4 М раствора, рН 3-4. Точную концентрацию хлорида цинка устанавливали комплексонометрическим титрованием трилоном Б. В качестве растворителя использовали деионизированную воду. Формирование композитов проводили при комнатной температуре.
В результате электролиза на электроде формировали однородную по толщине пленку, имеющую сиренево-розовую окраску.
Спектры плазмонного резонанса снимали на спектрофотометре при комнатной температуре на влажных пленках в дальней ультрафиолетовой и видимой областях в диапазоне 250-800 нм на спектрофотометре Shimadzu UV-2550.
Исследование структуры, морфологии и микрогеометрии проводили на сканирующем автоэмиссионном электронном микроскопе Hitachi S5500 и Hitachi TM 3000 и атомносиловом микроскопе BioScope Catalyst. Локальное содержание золота, иммобилизованного в полимерную пленку, определяли на энергодисперсионном спектрометре Therma Scientific, установленном в виде приставки к микроскопу Hitachi S5500.
Для определения общего содержания золота в композитной пленке электрод с композитным покрытием погружали в 0,5 моль/л HCl, отделяли пленку от подложки, промывали деионизированной водой, высушивали при 95°С и помещали на 3 часа в пробирки с 5 мл раствора, содержащего 5 мг/мл персульфата аммония и 0,36 мг/мл тиомочевины. После растворения золота полученный раствор анализировали на атомно-абсорбционном спектрофотометре Shimadzu aa-7000.
Для определения содержания золота на электроде модифицированный электрод с композитным покрытием погружали в 0,5 моль/л HCl, отделяли пленку от подложки, промывали деионизированной водой, высушивали на воздухе и помещали в 1-1,5 мл смеси концентрированной азотной и соляной кислот (соотношение 1:3, температура 50°С) до полного растворения золота. Полученный раствор упаривали в керамических тиглях до образования твердого осадка. Осадок растворяли в концентрированной азотной кислоте и доводили деионизированной водой до объема, одинакового для всех проб. Содержание золота определяли атомно-абсорбционным методом.
Рентгенограммы композитных пленок регистрировали на рентгеновском дифрактометре D8 ADVANCE в СuКа-излучении. Для обработки рентгенограмм использовали программу поиска и сглаживания шумов EVA с базой данных PDF-2. Распределение частиц золота по размерам оценивали методом малоуглового рентгеновского рассеяния на дифрактометре HECUSS3-MICRO-PIX.
Механизм формирования композитного электрокатализатора сложный, поскольку в указанной области рабочих потенциалов возможно одновременное протекание нескольких электрохимических, химических и физических процессов, приводящих в совокупности к формированию композита ПМАА/AuNPs. Эти процессы включают: восстановление ионов цинка до металла; восстановление ионов золота до наночастиц AuNPs и металла Au0; формирование комплекса акриламида и цинка и восстановление комплекса с образованием активных радикалов, инициирующих полимеризацию; метилолирование акриламида с образованием полиметилолакриламида; электрохимическое инициирование полимеризации акриламида с образованием полимерной пленки на металлическом субстрате.
Сочетание вышеперечисленных стадий приводит к тому, что в одном цикле происходит: 1) выделение на катоде подслоя цинка и золота, 2) образование и рост полимерной пленки, 3) образование наночастиц золота AuNPs и 4) захват AuNPs растущей полимерной матрицей. В результате формируется композит, который включает слой Zn0, слой Au0 и слой ПМAA/AuNPs. Такая сложная структура обеспечивает высокую адгезию металл-полимерного композита к подложке, поскольку ПМАА пленка копирует кристаллический микрорельеф электроосажденных металлов, проникая во все выступы и впадины и прочно удерживаясь в них. Во-вторых, подслой золота не только участвует в электрокатализе, но и позволяет использовать в качестве рабочих электродов металлы более дешевые и уступающие по электрохимическим свойствам золотым электродам.
Окраска пленок косвенно указывает на то, что электросинтезированный материал является композитом на основе полимера с включением наночастиц золота ПМАА/AuNPs. Этот факт подтверждают результаты рентгенофазового анализа. Наличие на рентгенограмме серии полос, соответствующих золоту, свидетельствует о включении кристаллов золота в непроводящую аморфную полимерную матрицу при электрохимическом формировании полимера.
На спектре плазморезонансного поглощения ПMAA/AuNPs пленки, наблюдается хорошо выраженная полоса поглощения в диапазоне 460-640 нм, где регистрируется плазмонный резонанс наночастиц золота. Форма полосы поглощения свидетельствует о небольшом диапазоне распределения наночастиц по размерам, а точка максимума при 536 нм соответствует размеру частиц золота 30-50 нм. Эти данные также подтверждают, что формирование композита Au/ПМAA/AuNPs происходит непосредственно в процессе электролиза.
Иммобилизация наночастиц золота в матрице ПМАА приводит к увеличению общей массы композита по сравнению с пленками без золота. При времени синтеза 60 с эта разница достигает 10-15 мг/см2, что составляет 26-40% от массы композита.
В предлагаемом способе при формировании композита золото электрохимически восстанавливается в двух формах: гальванически осажденное Au0 и наночастицы AuNPs. При включении поляризации Au0 выделяется на катоде в виде сплошного равномерного покрытия при концентрации HAuCl4 2 ммоль/л и выше. Тогда как наночастицы AuNPs равномерно распределены в объеме полимерной матрицы и на поверхности композита как в слое, прилегающем к электроду, так и на границе раздела композитная пленка/раствор.
Такой эффект обусловлен тем, что электровосстановление золота и формирование ПМАА матрицы начинается одновременно, причем непосредственно на катоде, формируя плотный слой, обогащенный наночастицами AuNPs. Последующее восстановление золота продолжается в объеме полимерной матрицы, которая имеет пористую структуру. Причем процесс идет при более низкой плотности тока вследствие изоляции катода непроводящим полимером, что приводит к уменьшению концентрации AuNPs частиц в объеме композита и на границе раздела композит/раствор по сравнению с приэлектродным слоем. С увеличением времени электролиза увеличивается количество электровосстановленного золота в этом слое и, соответственно, общая масса композитной пленки. Точно так же увеличивается удельный вес формируемого композиционного покрытия, в котором увеличивается доля металлических AuNPs.
Примеры конкретного осуществления способа.
Пример 1.
Композитное покрытие, представляющее собой полиметилолакриламидную матрицу с внедренными наночастицами AuNPs с подслоем золота, получали как описано выше на электроде из нержавеющей стали при концентрации HAuCl4 в электролите 2 ммоль/л при постоянном потенциале (-1,16) В. Время электролиза 5 мин.
Сформированный композит содержал наночастицы золота с радиусом 5,78±0,15 нм. Масса композита составила 32,12 мг/см2, толщина покрытия на электроде 39 мкм.
Пример 2
Композитное покрытие Au/ПМAA/AuNPs получали как описано в общей на электроде из нержавеющей стали при концентрации HAuCl4 в электролите 4 ммоль/л при постоянном потенциале (-1,2) В. Время электролиза 3 мин.
В результате был сформирован композит, содержащий наночастицы золота с радиусом 6,90 ÷ 0,47. Масса композита составила 41,31 мг/см2. Толщина покрытия - 57 мкм.
Сравнение данных элементного анализа показало, что при формировании Au/ПМAA/AuNPs композита среднее содержание золота на поверхности, прилегающей к электроду, в ~(4,5-5) раз больше (1,05±0,16 ат.%), чем на поверхности пленки со стороны раствора (0,2 ат. %). При этом общее содержание золота в композитной пленке составило 7,16 мкг/мг, а на электроде 1176 мкг/см2.
Добавление 0,08 моль/л H2O2 в фосфатном буфере (pH=6,86) приводит к заметному скачку потенциала в области восстановления H2O2 для электрода с композитом ПМAA/AuNPs, что свидетельствует о селективном поведении по отношению к пероксиду водорода. Методом циклической вольтамперометрии исследована зависимость скорости восстановления пероксида водорода от его концентрации на модифицированных электродах. Последовательное добавление 2,4·102 моль/л H2O2 приводит к резкому увеличению плотности тока при E=(-0,85)-(-0,95) В, в области потенциалов электровосстановления пероксида водорода (Рис.1). Получены следующие зависимости плотности тока пика восстановления Н2О2 от концентрации: 2,4⋅10-2 моль/л - 18,0 мА/см2; 4,8⋅10-2 моль/л - 34,0 мА/см2; 7,2⋅10-2моль/л - 50,0 мА/см2.
Методом циклической вольтамперометрии изучена зависимость скорости восстановления пероксида водорода от его концентрации. Обнаружено, что плотность тока восстановления в точке максимума пропорциональна концентрации Н2О2 (см. вкладку на Рис.1 - прямая линия).
Реферат
Изобретение относится к способу получения электрохимического катализатора, обладающего электрокаталитической активностью к пероксиду водорода, путём электрохимического формирования полимерной матрицы и наночастиц золота, а именно в процессе одностадийного электролиза в течение 3 минут на катоде из нержавеющей стали при постоянном потенциале (-0,16)-(-1,2) В из электролита следующего состава: акриламид - 3 моль/л, N,N’-метилен-бисакриламид - 0,05 моль/л, формальдегид - 3 моль/л, хлорид цинка - 0,2 моль/л, золотохлористоводородная кислота - 2-6 ммоль/л. Технический результат - разработка одностадийного и кратковременного способа получения композитного покрытия для золотосодержащего электрокатализатора восстановления пероксида водорода, эффективного и удобного в применении, пористого с равномерно распределёнными в объёме полимера наночастицами активного металла, а также подслоем золота на поверхности электрода. 1 ил., 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ получения композиционных покрытий на основе золота

Комментарии