Способ получения соединения, соединения, комплексный металлоорганический катализатор - RU2652807C2
Код документа: RU2652807C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым Р-хирогенным фосфорорганическим соединениям с общей формулой (I). Настоящее изобретение также обеспечивает способ синтеза указанных соединений с формулой (I). Настоящее изобретение также относится к промежуточным продуктам с общей формулой (II), (III) или (IV), представленной ниже, которые участвуют в синтезе соединений (I).

Соединения с общей формулой (I) могут применяться в качестве агрохимикатов или терапевтических веществ, или в качестве реагентов или полупродуктов в тонком химическом синтезе.
Кроме того, изобретение относится к комплексам металлов, содержащим соединения (I) в качестве лигандов. Новые соединения и комплексы настоящего изобретения применяются в асимметрическом катализе комплексами переходных металлов или органическом катализе, в особенности, для асимметрического гидрирования или аллилирования.
Уровень техники
В последние десятилетия в асимметрическом органическом катализе и металлоорганическом катализе достигнуты большие достижения, что сделало указанный катализ предпочтительной методологией при синтезе хиральных веществ в лабораторном и промышленном масштабах. Получено большое количество хиральных катализаторов за счет образования комплексов фосфорного лиганда с переходным металлом. Иногда фосфоорганические соединения могут сами непосредственно выступать в качестве органических катализаторов. В последнем случае фосфоорганические производные могут применяться в виде противоионов, органических катализаторов в асимметрических реакциях в условиях межфазного катализа или в качестве основний Льюиса.
Поскольку не существует универсальных лигандов для асимметрического катализа, синтез и исследование новых хиральных лигандов продолжает оставаться областью, находяющейся на стадии постоянных разработок.
В большинстве случае фосфорорганические соединения, используемые в асимметрических реакциях, получают из природных веществ или легко доступных предшественников (таких как бинафтол, винная кислота, аминокислоты, углеводы и т.д.), в которых углеродный скелет содержит хиральные центры. В фосфорорганических металлоорганических катализаторах хиральность углеродного скелета переносится на координационную сферу металла через фосфорсодержащие заместители. Наиболее распространенные хиральные фосфоорганические соединения, используемые в асимметрических реакциях, такие как Quinap, Binap, XyliPhos или DuPhos, обладают аксиальной или планарной хиральностью или, кроме этого, хиральностью за счет цикла.
Фосфорорганические соединения с хиральностью на фосфорных центрах (Р-хирогенные соединения), такие как Dipamp или MiniPhos, очень интересны с промышленной и стереохимической точек зрения в отношении металлоорганического катализа. В действительности они позволяют непосредственно создавать вокруг металлоцентра стерически и электронно четко выраженные структуры в зависимости от природы заместителей при атоме фосфора. Получающееся хиральное окружение оказывается более эффективным, чем окружение, получаемое при переносе хиральности с углеродного скелета.
Р-хирогенные фосфоорганические соединения также интересны в качестве органокатализаторов. Они могут использоваться в качестве фосфониевых солей, кислотно-основных производных или соединений, способствующих образованию низковалетных хиральных комплексов.
Однако, Р-хирогенные фосфорорганические соединения не часто Используются в асимметрическом катализе из-за сложностей их синтеза и тонких операций по разделению оптически активных соединений.
В последние годы в асимметрическом синтезе фосфорорганических лигандов произошел существенный прогресс благодаря введению борана в качестве защитной группы по отношению к атому фосфора. Комплексы борана с фосфорорганическими соединениями представляют собой устойчивые, зачастую кристаллические соединения, которые позволяют проводить чистые реакции по Р-центру или по альфа- или бета-положению заместителя при атоме фосфора. Борановая группа легко снимается с количественным образованием соответствующих P(III)-соединений при полном сохранении конфигурации при фосфорном центре (Uziel J., Darcel С, Moulin D., Bauduin С. и Juge S., Tempahedron: Asymmetry, 2001, 12, 1441-1449).
На сегодняшний день энантиоселективный синтез P-хирогенных фосфорорганических соединений главным образом осуществляется по двум способам с использованием фосфинборанов либо в качестве электрофильных, либо нуклеофильных реагентов.
В электрофильном способе фосфинборан 1 или хлорфосфинборан (VII) могут быть получены по методике, в которой в качестве исходного соединения выступает эфедрин (Jugé S., Stephan М., Laffitte J.A., Genêt J.P., Tempahedron Lem.m., 1990, 31, 6357-6360; Bauduin C., Moulin D., Kaloun E.B., Darcel C., Jugé S., J. Org. Chem., 2003, 68, 4293-4301). Затем эти электрофильные реагенты могут быть использованы для получения дифосфинов с мостиковой ферроценильной или силильной группой.

В нуклеофильном способе карбанионы в альфа-положении фосфинборанов 3 могут быть получены либо за счет депротонирования метилфосфинборана, либо за счет динамического кинетического расщепления диметилфосфинборана в присутствии спартеина (Muci A.R., Campos K.R., Evans D.A., J. Am. Chem. Soc, 1995, 117, 9075-9076; Yamada Y., Imamoto Т., J. Org Chem., 1999, 64, 2988-2989). Реакция данных карбанионов с различными электрофилами приводит к образованию дифосфинов с этановыми или метановыми мостиками.
В другом нуклеофильном способе используется динамическое кинетическое расщепление рацемической смеси вторичных фосфинборанов в присутствии спартеина. Борановый комплекс с фосфидом лития 4 (М=Li), полученный в данных условиях, может быть использован для синтеза пинцерных лигандов за счет образования двух Р-С связей. Металлофосфидбораны 4 являются очень важными строительными блоками для синтеза новых классов Р-хирогенных лигандов. Однако получение данных соединений с высокой стереоселективностью до недавнего времени было ограничено примерами литерованных соединений с пространственно затрудненными заместителями, такими как трет-бутильная или адамантильная группа (Crepy K.V.L., Imamoto Т., Top. Curr. Chem., 2003, 229, 1-40; Imamoto Т., J. Synth. Org. Chem., Jpn., 2007, 65, 1060-1069).
Поэтому существует необходимость в разработке новых способов синтеза оптически активных фосфиновых лигандов. Такие способы должны быть достаточно универсальны, чтобы их можно было с легкостью распространить на обширную библиотеку оптически активных фосфиновых лигандов, которые могут быть испытаны на предмет применения их в ассиметрическом синтезе.
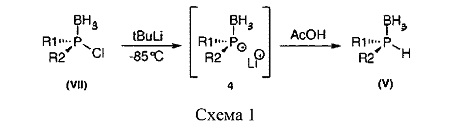
Совсем недавно авторы разработали новую методологию получения Р-хирогенных вторичных фосфинборанов (V), исходя из хлорфосфинборанов (VII). Это беспрецедентная методология основана на низкотемпературной реакции обмена галогена на металл, которая протекает с полным сохранением конфигурации при атоме Р (Схема 1). Последующее протонирование промежуточного фосфидборана 4 дает вторичные фосфинбораны с общей формулой (V), при этом реакция протекает с отличным энантиомерным избытком (ее >90%).
В результате интенсивных исследований по разработке новых оптически активных фосфиновых соединений авторы обнаружили, что новые классы лигандов или органокатализаторов с общей формулой (I), могут быть получены с очень высоким энантиомерным избытком, исходя из хлорфосфинборанов (VII) (Схема 2). Синтетический подход, приводящий к соединениям (I), оказался очень гибким, открыв путь к получению разнообразных продуктов и к легкой модификации заместителей в этих продуктах.
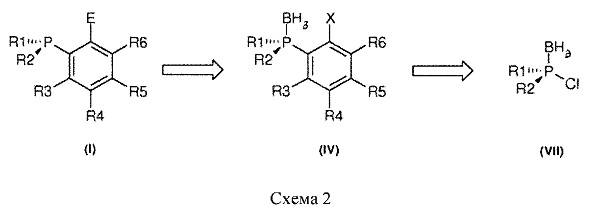
Способ, разработанный авторами для получения соединений (I), включает синтез промежуточных фосфинборанов с общей формулой (IV), содержащих активированную группу в орто-положении (Схема 2).
Способ изобретения, в частности, позволяет синтезировать энантиообогащенные фосфины с функциональной группой в орто-положении, например, о-боронат, о-силилфосфины и о-гидроксиметил-замещенные фосфины.
Фосфин о-боронаты являются амфифильными соединениями, т.е. выступают как кислоты, так и основания Льюиса, и представляют особый интерес в области синтеза и катализа для использования их в качестве лиганда. К настоящему времени хиральные фосфинбораны или боранаты не были описаны.
Хиральные энатиомерно чистые о-гидроксиметилфосфины также представляют особый интерес, поскольку могут быть использованы как в качестве асимметрического органокатализатора, так и в качестве лиганда в металлоорганическом катализе. Например, Nakamura сообщает об использовании Р-нехирогенных фосфинов, содержащих гидроксиметилированную хелатную цепь, в Ni-катализируемых реакциях сочетания (Yoshikai N., Matsuda Н. и Nakamura E.,J. Am. Chem. Soc. 2009, 131, 9590-9599).
О единственном примере получения Р-хирогенных фосфинов, содержащих гидроксиметилированную хелатную цепь, сообщал Beak и соавт. (Tollefson М., Li J., Beak P., J. Am. Chem. Soc. 1996, 118, 9052-9061). Этот способ синтеза включает перегруппировку фосфинита и не являются универсальным.
о-Гидроксиметилфосфины могут быть также использованы в качестве предшественников о-гидроксиметилфосфониевых солей, которые, как известно, находят синтетическое применение в реакциях Виттига (Marcoux D., Charette А., Adv. Synth. Catal. 2008, 350, 2967-2974; McNulty J., Keskar K., Tempahedron Letters, 2008, 49, 7054-7057). Также можно рассмотреть использование о-гидроксиметилфосфониевых солей в качестве новых интересных органокатализаторов.
Изучено применение Р-хирогенных фосфорорганических соединений (I) в качестве лигандов в асимметрическом катализе. В частности, соединения (I) могут быть использованы в качестве лигандов для переходных металлов, таких как родий или палладий, а получающиеся в результате комплексы могут оказаться пригодными в катализируемых реакциях асимметрического гидрирования, аллилирования, гидроформилирования или карбонилирования. Фосфониевые соли соединений (I) могут быть также использованы в асимметрических реакциях в условиях межфазного катализа, например, в реакциях фторирования или цианирования.
Определения
В настоящем изобретении используемые термины имеют следующие значения:
Термин «Р-хирогенный» относится к соединениям фосфора, для которых стереоизомер исходной молекулы получается при перестановке заместителей при фосфорном центре.
Термин «фосфорорганический» относится к органическим соединениям, содержащим связи углерод-фосфор;
Термин «органокатализ» относистя к виду катализу, при котором скорость химической реакции повышается за счет органического катализатора, именуемого «органокатализатором», состоящего из атомов углерода, водорода, серы и других элементов-неметаллов, входящих в состав органических соединений;
Термин «катализ комплексами переходных металлов» относится к виду катализа, при котором скорость химической реакции повышается за счет металлоорганических соединений, т.е. за счет химических соединений, содержащих связь металл-элемент, которая несет в большей степени ковалентный характер;
Термин «электрофильное сочетание» относится к образованию связи, такой как P-C, при реакции с электрофильным реагентом, например, арином;
Термин «электрофильный реагент» относится к реагирующему веществу, которое принимает пару электронов от молекулы, с которой это вещество образует ковалентную связь;
Термин «окислительное сочетание» относится к образованию связи за счет окислительного процесса;
Термин «окислитель» относится к реагирующему веществу, которое принимает электроны в окислительно-восстановительной химической реакции;
Термин «алкил» относится к любой насыщенной линейной или разветвленной углеводородной цепи, содержащей от 1 до 12 атомов углерода, предпочтительно, от 1 до 6 атомов углерода и, более предпочтительно, представляет собой метальную, этильную, пропильную, изопропильную, н-бутильную, втор-бутильную, изобутильную и трет-бутильную группу.
Термин «циклоалкил» относится к замещенному или незамещенному циклическому алкильному заместителю, такому как циклопропил, циклопентил или циклогексил;
Термин «арил» относится к моно- или полициклической системе, содержащей от 5 до 20 атомов, предпочтительно, от 6 до 12 атомов, в которой атомы углерода объединены в одно или несколько ароматических циклов (при наличии двух колец, такая группа именуется биарилом), из которых можно упомянуть фенильную группу, бифенильную группу, 1-нафтильную группу, 2-нафтильную группу, тетрагидронафтильную группу, инданильную группу и бинафтильную группу. Термин арил также означает любое ароматическое кольцо, содержащее, по меньшей мере, один гетероатом, выбранный из атома кислорода, азота или серы. Арильная группа может быть замещена 1-3 заместителями, выбранными независимо друг от друга из гидроксильной группы, линейной или разветвленной алкильной группы, содержащей 1, 2, 3, 4, 5 или 6 атомов углерода, в частности, метальной, этильной, пропильной, бутильной, алкокси-группы, или атом галогена, в частности, атом брома, хлора и йода;
Термин "алкокси" относится к О-алкильной или О-арильной группе;
Термин "алкилокси" относится к О-алкильной группе;
Термин "циклоалкилокси" относится к О-циклоалкильной группе;
Термин "арилокси" относится к О-арильной группе;
Термин "алкиламино" относится к N-алкильной группе;
Термин "циклоалкиламино" относится к N-циклоалкильной группе;
Термин "ариламино" относится к N-арильной группе;
Термин «хлорангидрид» относится к органическому соединению с общей формулой RCOCl, где R представляет собой замещенную или незамещенную группу, выбранную из алкильной или арильной группы;
Термин «альдегид» относится к органическому соединению, содержащему формильную группу, структура которого описывается общей формулой R-CHO, где R представляет собой замещенную или незамещенную группу, выбранную из алкильной или арильной группы;
Термин «кетон» относится к органическому соединению с общей формулой RC(=O)R', где R и R' могут быть одинаковыми или различными и в отдельности представляют собой замещенную или незамещенную группу, выбранную из алкильной или арильной группы;
Термин «галоидсилан» относится к любому галоген-замещенному силану;
Термин «галоидалкан» относится к химическому соединению, являющемуся производным алкана и содержащему один или несколько галогеновых групп;
Термин «галофосфин» относится к любому галоген-замещенному фосфину;
Термин «металлоценил» относится к группе, содержащей метал посередение между двумя циклопентадиенильными группами, или к группе, содержащей металл, связанный с π-системой циклопенительной группы или схожего заместителя;
Термин «боронатный реагент» относится к реагентам, являющимся производными бора, в частности, борана, борановых комплексов, сложных эфиров бороновых кислот или галоборанов;
Термин «фосфинборан» относится к комплексу фосфина с бораном (BH3);
Термин «орто-положение» в контексте настоящего изобретения относится к положению в ароматическом кольце, ближайшему по отношению к атому фосфора;
Термин «соль переходного металла» относится к соли с ионом переходного металла, такого как железо, медь, палладий или родий, связанного с противоионом, таким как хлорид-, сульфат-, нитрат-, ацетокетонат-, тетрафторборат-, гексафторфосфат-, гексафторантимонат-, трифлат-анион; термин «комплекс переходного металла» относится к частице, состоящей из переходного металла, координированного (связанного) с одним или несколькими лигандами (нейтральной или анионной неметаллической частицей);
«о-An» обозначает о-анизильную группу, «о-Tol» - о-толильную группу, «сНех» - циклогексильную группу, «Fc» - ферроценильную группу, «Ph» - фенильную группу, а «i-Pr» обозначает изопропильную группу.
Раскрытие изобретения
Настоящее изобретение относится к селективному способу синтеза Р-хирогенных фосфорорганических соединений с общей формулой (I), которая в общем представлена на Схеме 3.

Таким образом, настоящее изобретение относится к способу получения соединеия с формулой:

в которой:
R1 и R2 могут быть одинаковыми или различными и по отдельности представляют собой замещенную или незамещенную группу, выбранную из алкильной, циклоалкильной, арильной, алкилокси-, циклоалкилокси-, арилокси-, алкиламино-, циклоалкиламино-, ариламино-, металлоценильной группы;
R3, R4, R5, R6 могут быть одинаковыми или различными и по отдельности представляют собой атом водорода либо замещенную или незамещенную группу, выбранную из алкильной, циклоалкильной, арильной, алкилокси-, циклоалкилокси-, арилокси-, алкиламино-, циклоалкиламино-, ариламино-группы;
Е представляет собой замещенную или незамещенную группу, выбранную из PR7R8, P(BH3)R7R8, -C6H4-PR7R8, -C6H4-P(BH3)R7R8, -BR9R10, -CR11R12OH, -COR11, -SiR11R12R13; -SiR11R12-C6H4-PR7R8;
в которой:
R7 и R8 могут быть одинаковыми или различными и по отдельности представляют собой водород, замещенную или незамещенную группу, выбранную из алкильной, циклоалкильной, арильной, алкилокси-, циклоалкилокси-, арилокси-, алкиламино-, циклоалкиламино-, ариламино и металлоценильной группы;
R9 и R10 могут быть одинаковыми или различными и по отдельности представляют собой галоген, гидроксил, замещенную или незамещенную группу, выбранную из алкилокси-, арилокси-, циклоалкилокси-, алкиламино-, ариламино-, циклоалкиламино-, алкильной, циклоалкильной или арильной группы; R9 и R10 - это [(СН3)2С-O-]2 или циклогексил; в предпочтительном варианте осуществления, R9 и R10 являются одинаковыми;
R11, R12 и R13 могут быть одинаковыми или различными и по отдельности представляют собой атом водорода либо замещенную или незамещенную группу, выбранную из алкильной, циклоалкильной, арильной, алкилокси-, арилокси-, циклоалкилокси-группы;
который включает в себя:
i) взаимодействие хлорфосфинборана (VII)

в котором R1 и R2 имеют вышеуказанные значения,
с реагентом RM, в котором M - это металл, предпочтительно, Li и R - это алкильная или арильная группа; с последующим взаимодействием продукта обмена галогена на металл с ароматическим соединением, имеющим общую формулу (VI)

в которой X и Y могут быть одинаковыми или различными и по отдельности представляют собой F, CI, Br, I, a R3, R4, R5 и R6 имеют значения, указанные выше,
приводящее к соответствующему P-хирогенному фосфинборану с формулой (IV)

в которой X, R1, R2, R3, R4, R5, R6 имеют значения, указанные выше;
и
ii) проведение двух химических превращений на соединении (IV), которое приводит к соединению (I), при этом указанные химические превращения включают стадию (ii-a) снятия борановой группы и стадию (ii-b) сочетания электрофильного реагента по орто-положению или окислительного сочетания с окислителем по орто-положению, необязательно, с последующим электрофильным сочетанием по орто-положению; стадии (ii-a) и (ii-b) проводятся в любом порядке.
Согласно способу настоящего изобретения соединения (VII), (IV) и (I) - это такие соединения, в которых если R1 - это Me или t-Bu, то R2 - это не t-Bu или Me, соответственно.
Согласно одному варианту осуществления электрофил выбран из группы, состоящей из боронатных реагентов, альдегидов, кетонов, хлорангидридов, галоидсиланов, галоидалканов, галофосфинов или фосфинитов.
Согласно другому варианту осуществления окислитель выбран из группы, состоящей из солей переходных металлов, комплексов переходных металлов, в которых металл выбран из группы, включающей железо и медь.
Согласно одному из вариантов осуществления соединение (VII) являются хиральным.
Согласно одному варианту осуществления соединение (IV) вначале реагирует в условиях стадии (ii-a), приводя к промежуточному соединению с общей формулой (II),

в которой R1, R2, R3, R4, R5, R6 и X имеют значения, указанные выше.
Согласно другому варианту осуществления соединение (IV) вначале реагирует в условиях стадии (ii-b), приводя к промежуточному соединению с общей формулой (III),

в которой R1, R2, R3, R4, R5, R6 и Е имеют значения, указанные выше.
Согласно еще одному варианту осуществления соединение (IV) вначале реагирует в условиях стадии (ii-a), приводя к промежуточному соединению с общей формулой (II), после чего соединение (II) реагирует в условиях стадии (ii-b) в присутствии окислителя и избытка соединения (II), приводя к образованию продукта гомосочетания с общей формулой (I')

в которой R1, R2, R3, R4, R5 и R6 имеют значения, указанные выше.
Настоящее изобретение также относится к соединению с общей формулой (I)

в которой
Е представляет собой замещенную или незамещенную группу, выбранную из PR7R8, P(BH3)R7R8, -C6H4-PR7R8, -C6H4-P(BH3)R7R8, -BR9R10, -CR11R12OH, -COR11, -SiR11R12R13; -SiR11R12-C6H4-PR7R8;
где R7 и R8 могут быть одинаковыми или различными и по отдельности представляют собой водород, замещенную или незамещенную группу, выбранную из алкильной, циклоалкильной, арильной, алкилокси-, циклоалкилокси-, арилокси-, алкиламино-, циклоалкиламино-, ариламино- и металлоценильной группы;
R9 и R10 могут быть одинаковыми или различными и по отдельности представляют собой галоген, гидроксил, замещенную или незамещенную группу, выбранную из алкилокси-, арилокси-, циклоалкилокси-, алкиламино-, ариламино-, циклоалкиламино-, алкильной, циклоалкильной или арильной группы; R9 и R10 - это [(СН3)2С-O-]2 или циклогексил; в предпочтительном варианте осуществления, R9 и R10 являются одинаковыми;
R11, R12 и R13 могут быть одинаковыми или различными и по отдельности представляют собой атом водорода либо замещенную или незамещенную группу, выбранную из алкильной, циклоалкильной, арильной, алкилокси-, арилокси-, циклоалкилокси-группы;
R1 и R2 могут быть одинаковыми или различными и по отдельности представляют собой замещенную или незамещенную группу, выбранную из алкильной, циклоалкильной, арильной, алкилокси-, циклоалкилокси-, арилокси-, алкиламино-, циклоалкиламино, ариламино-, металлоценильной группы; предпочтительно группы R1 и R2 отличаются друг от друга;
R3, R4, R5, R6 могут быть одинаковыми или различными и по отдельности представляют собой атом водорода либо замещенную или незамещенную группу, выбранную из алкильной, циклоалкильной, арильной, алкилокси-, циклоалкилокси-, арилокси-, алкиламино-, циклоалкиламино-, ариламино-группы;
при условии что E - это PR7R8 или P(BH3)R7R8,
когда R1 и R2 представляют собой Ph и Me или Me и Ph, соответственно, а каждая из групп R3, R4, R5 и R6 представляет собой водород, то R7 и R8 не могут быть Ph и Me, соответственно;
когда R1 и R2 представляют собой Me и C2-C6-алкил или C2-C6-алкил и Me, соответственно, а каждая из групп R3, R4, R5 и R6 представляет собой водород, то R7 и R8 не могут быть Me и C2-C6-алкилом; когда каждая из групп R1 и R2 представляют собой t-Bu, а каждая из групп R3, R4, R5 и R6 представляют собой водород, то каждая из групп R7 и R8 не являются t-Bu.
В одном варианте осуществления, если E представляет собой -С6Н4-(PR7R8)орто, а каждая из групп R3, R4, R5 и R6 представляет собой водород, и если {R1, R2} - это {Ph, Ph}, {o-Tol, o-Tol}, {Fc, Ph} или {o-An, Ph}, то {R7, R8} - это, соответственно, не {Ph, Ph}, {o-Tol, o-Tol}, {Fc, Ph} или не {o-An, Ph}.
В другом варианте осуществления, если E представляет собой CR11R12OH, а каждая из групп R3, R4, R5, R6 и R12 представляет собой водород, то {R1, R2, R11} - это не {Fc, Ph, tBu}, {o-An, Ph, t-Bu}, {Fc, Ph, Ph}, {o-An, Ph, Ph}, {Ph, Fc, Ph}, {Ph, Fc, t-Bu}, {Ph, o-An, Ph}, {Ph, o-An, t-Bu}.
В еще одном варианте осуществления, если E представляет собой CR11R12OH, а каждая из групп R3, R4, R5, R6 и R12 представляет собой водород, то {R1, R2, R11, R12} - это не {Ph, Ph, H, H}, {Ph, Ph, Me, H}, {Ph, Ph, Me, Me}, {Ph, Ph, H, -CHMeNBn2}, {Ph, Ph, H, 2-(1-бензил)пирролидинил}.
В варианте осуществления, если E представляет собой BR9R10, а каждая из групп R3, R4, R5 и R6 представляет собой водород, то {R1, R2, R9, R10} - это не {Ph, Ph, [(CH3)2C-O-]2}, {Me, Me, [(СН3)2С-O-]2}, {Ph, Ph, [-O-CH2-C(CH3)2-CH2-O-]}, {Me, Me, [-O-CH2-C(CH3)2-CH2-O-]}, {Ph, Ph, [-O-CH2-CH2-O-]}, {Me, Me, [-O-CH2-CH2-O-]}.
В варианте осуществления, если E представляет собой -SiR11R12R13, а каждая из групп R3, R4, R5 и R6 представляет собой водород, то {R1, R2, R11, R12, R13} - это не {Ph, Ph, Me, Me, Me}, {Me, Me, Me, Me, Me}.
Согласно одному из вариантов осуществления группы R1 и R2 являются разными. В данном варианте осуществления соединение (I) являются P-хирогенным.
Настоящее изобретение также относится к промежуточному соединению с общей формулой (II)

в которой
X представляет собой F, CI, Br, I; а
R1, R2, R3, R4, R5 и R6 имеют значения, указанные выше,
при условии, что, когда X - это Br, каждая из групп R3, R4, R5 и R6 представляет собой водород, a R1 - это Me или t-Bu, то R2 - это не t-Bu или Me, соответственно.
В варианте осуществления, если X - это Br, а каждая из групп R3, R4, R5 и R6 представляет собой водород, то {R1, R2} - это не {Ph, Ph}, {o-Tol, o-Tol}, {Fc, Ph}, {o-An, Ph} или {Ph, o-An}.
Согласно одному варианту осуществления группы R1 и R2 являются разными. В данном варианте осуществления соединение (II) являются P-хирогенным.
Настоящее изобретение также относится к промежуточному соединению с общей формулой (III)

в которой R1, R2, R3, R4, R5, R6 и E имеют значения, указанные выше.
В варианте осуществления, если E представляет собой -CR11R12OH, а каждая из групп R3, R4, R5 и R6 представляет собой водород, то {R1, R2, R11, R12} - это не {Ph, Ph, Н, Н}.
Согласно одному варианту осуществления группы R1 и R2 являются разными. В данном варианте осуществления соединение (III) являются хиральным.
Настоящее изобретение также относится к промежуточному соединению с общей формулой (IV)

в которой
X представляет собой F, CI, Br, I; а
R1, R2, R3, R4, R5 и R6 имеют значения, указанные выше,
при условии что когда X - это Br, каждая из групп R3, R4, R5 и R6 представляет собой водород, a R1 - это Me или t-Bu, то R2 - это не t-Bu или Me, соответственно.
В варианте осуществления, если X - это Br, а каждая из групп R3, R4, R5 и R6 представляет собой водород, то {R1, R2} - это не {Ph, Ph}, {o-Tol, o-Tol}, {i-Pr, i-Pr}, {cHex, cHex}, {Me, Me}, {o-An, Ph}, {Fc, Ph}, {i-Pr, Ph}, {cHex, Ph}, {Ph, Fc} или {Ph, o-An}.
В варианте осуществления, если X - это I, а каждая из групп R3, R4, R5 и R6 представляет собой водород, то {R1, R2} - это не {Ph, Ph}, {cHex, cHex}, {Fc, Ph} или {o-An, Ph}.
Согласно одному варианту осуществления группы R1 и R2 являются разными. В данном варианте осуществления соединение (IV) являются P-хирогенным.
Настоящее изобретение также относится к соединению с комплексам металлов, содержащим, по меньшей мере, одно соединение с общей формулой (I), (II), (III) или (IV). В варианте осуществления металлокомплекс настоящего изобретения содержат родий и одно соединение с общей формулой (I), (II), (III) или (IV) в качестве лиганда, при условии, что, если лиганд являются соединением с общей формулой (I), в которой R1 - это Fc, R2 - это Ph, каждая из групп R3, R4, R5 и R6 представляет собой водород, а E - это -C6H4-(PR7R8)орто, то {R7, R8} - это не {Ph, Fc} или {Fc, Ph}.
В одном из вариантов осуществления металлокомплексы настоящего изобретения содержат палладий и одно соединение с общей формулой (I), (II), (III) или (IV) в качестве лиганда.
Осуществление изобретения
Надо принимать во внимание, что в любой из указанных реакций любая реакционная группа в молекулах субстратов может быть защищена по любому традиционному химическому способу защиты функциональных групп. Подходящими защитными группами в любой из упомянутых реакций являются защитные группы, обычно используемые в данной области техники. Под способами образования и снятия таких защитных групп подразумеваются традиционные способы, пригодные для молекулы, в которой необходимо произвести защиту функциональной группы.
Стадия (i) - Синтез соединения (IV) из хлорфосфинборана (VII)

Синтез соединения (IV) включает обмен галогена на металл с последующим взаимодействием образующегося интермедиата с ароматическим соединением с общей формулой (VI):

в которой R1, R2, R3, R4, R5, R6 и X имеют значения, указанные выше.
В одном из вариантов осуществления соединение с общей формулой (VII) - это такое соединение, в котором R1 - это фенил, циклогексил, метил, изопропил, орто-толил, орто-анизил или металлоценил, a R2 имеет значение, указанное выше; в предпочтительном аспекте данного варианта осуществления R2 - это также фенил, циклогексил, метил, изопропил, орто-толил, орто-анизил, ферроценил, a R1 и R2 являются одинаковыми или различными.
Согласно предпочтительному варианту осуществления реагент RM - это изо-BuLi.
В другом варианте осуществления соединение с общей формулой (VI) - это соединение, в котором X - это Br или I, a Y - это Br или I. Согласно одному варианту осуществления группы X и Y соединения (VI) являются одинаковыми. Согласно предпочтительному варианту осуществления как группа X, так и группа Y представляет собой атом бора. Согласно другому варианту осуществления X и Y представляют собой атомы йода. В данных вариантах осуществления R3, R4, R5 и R6 - это предпочтительно H или метил; более предпочтительно, R4 и/или R5 - это метил, а остальные группы представляют собой Н. Согласно особому варианту осуществления соединение (VI) - это 1,2-дибромбензол.
В еще одном варианте осуществления соединение с общей формулой (IV) - это соединение, в котором X - это Br или I, предпочтительно Br, R1 - это фенил, циклогексил, метил, изопропил, орто-толил, орто-анизил, ферроценил, R2 представляет собой замещенную или незамещенную группу, выбранную из алкильной, циклоалкильной, алкилокси-, циклоалкилокси-, арилокси-, алкиламино-, циклоалкиламино-, ариламино- или ферроценильной группы, при условии что если R1 - это Me, то R2 - это не трет-Bu; предпочтительно, R2 - это фенил, циклогексил, метил, изопропил, орто-толил, орто-анизил или ферроценил; R1 и R2 являются одинаковыми или разными; R3, R4, R5 и R6 - это, предпочтительно, Н или метил; более предпочтительно, R4 и/или R5 - это метил, а остальные группы - это Н.
Согласно одному из вариантов осуществления стадии (i) осуществляется в условиях охлаждения при температуре в диапазоне от -110°C до -10°C, предпочтительно, от -90°C до -60°C, а еще более предпочтительно, при температуре -78°C.
Согласно одному из вариантов осуществления обмен галогена на металл осуществляется в присутствии реагента RM, в котором М - это металл, предпочтительно, Li, a R - это алкильная или арильная группа. В предпочтительном варианте осуществления RM - это трет-BuLi.
В одном из вариантов осуществления реагент RM находится в виде раствора в пентане, гептане или ТГФ. В другом варианте осуществления концентрация реагента RM варьируется в диапазоне от 1,0 до 2,0 М и предпочтительно составляет 1,6 М.
Согласно одному из вариантов обмен галогена на металл осуществляется в присутствии 2-6 эквивалентов, предпочтительно, 2-3 эквивалентов реагента RM, а еще более предпочтительно в присутствии 2,4 эквивалентов реагента RM.
В одном варианте осуществления растворитель, используемый при последующем добавлении ароматического реагента с общей формулой (VI) выбран из группы, включающей тетрагидрофуран, диэтиловый эфир, диметиловый эфир, диоксан, бензол, толуол, ксилолы, диметилсульфоксид или их смеси. Согласно предпочтительному варианту осуществления используемый растворитель - это тетрагидрофуран.
Согласно одному из вариантов осуществления соединение (IV) получается без рацемизации. Согласно одному варианту осуществления соединение (IV) получается с энантиомерным избытком от 0 до 100%, предпочтительно, от 85 до 100%.
Синтез хлорфосфинборана (VII) кислотным расщеплением аминофосфинборана (VIII)

В одном варианте осуществления соединение (VII) может быть получено кислотным расщеплением (ацидолизом) соединения с общей формулой (VIII)

в которой R1 и R2 имеют вышеуказанные значения.
В другом варианте осуществления способ изобретения включает предварительную стадию ацидолиза соединения (VIII) с образованием соединения (VII).
Согласно одному варианту осуществления ацидолиз соединения (VIII) осуществляется в присутствии 2-20 эквивалентов, предпочтительно 4-16 эквивалентов реагента, а еще более предпочтительно в присутствии 4,0 эквивалентов кислотного реагента.
В одном из вариантов осуществления растворитель, используемый при ацидолизе, выбран из группы, включающей тетрагидрофуран, диэтиловый эфир, диметиловый эфир, диоксан, бензол, толуол, ксилолы, диметилсульфоксид или их смеси. Согласно предпочтительному варианту осуществления растворитель, используемый при ацидолизе, - это толуол.
Согласно другому варианту осуществления растворитель, используемый при ацидолизе, представляет собой кислоту, которая выбрана из группы, включающей H2SO4/NaCl, газообразный HBr, HI, MsOH, TsOH, раствор сухого HCl или их смеси.
Согласно одному из вариантов осуществления сухой HCl находится в виде раствора в растворителе, который выбран из группы, включающей толуол, диэтиловый эфир, диоксан, циклопентилметиловый эфир, этилацетат, метанол, этанол, 2-пропанол, бутанол и уксусную кислоту. В предпочтительном варианте осуществления сухой HCl растворен в толуоле.
В одном из вариантов осуществления ацидолиз проводится предпочтительно при температуре 20°C.
В одном варианте осуществления промежуточное соединение (VII) выделяют после фильтрования реакционной смеси и упаривания растворителя наполовину при пониженном давлении.
В одном из вариантов осуществления соединение (VII) получается без рацемизации. Согласно одному из вариантов осуществления соединение (VII) получается с энантиомерным избытком от 0 до 100%, предпочтительно, от 85 до 100%.
Альтернативный способ синтеза соединения (IV)
В одном варианте осуществления стадия (i), кроме того, включает первую промежуточную стадию (a) протонирования продукта обмена галогена на металл, которая приводит к соединению (V)

в котором группы R1 и R2 могут быть одинаковыми или различными и каждая в отдельности представляет собой замещенную или незамещенную группу, выбранную из алкильной, циклоалкильной, арильной, алкилокси-, циклоалкилокси-, арилокси-, алкиламино-, циклоалкиламино-, ариламино-, металлоценильной группы, при условии что если R1 - это Me или трет-Bu, то R2 - это не трет-Bu или Me, соответственно;
и, кроме того, включает вторую промежуточную стадию (b) взаимодействия соединения (V) с реагентом RM, в котором М - это металл, предпочтительно Li, или магнийорганическое соединение MgZ, в котором Z - это галогенид, a R - это алкильная или арильная группа;
перед последующим взаимодействием данного промежуточного соединения с соединением (VI).
Данный альтернативый способ (i) представлен на схеме ниже:

Одно из преимуществ данного альтернативного способа синтеза заключается в том, что соединение (V) может быть очищено. Это особенно интересно в том случае, когда соединение (VII) получается из соединения (VIII), как описано выше.
Согласно одному варианту осуществления способ настоящего изобретения включает, кроме того, промежуточные стадии (а) и(b), а соединения (VII), (V), (IV) и (I) - это такие соединения, в которых если R1 - это Me или трет-Bu, то R2 - это трет-Bu или Me, соответственно.
Полагают, что соединение (VI) образует in situ бензиновый интермедиат в присутствии металлоорганического реагента RM. Предполагается, что бензиновый интермедиат образуется в результате обмена группы X или Y соединения (VI) на металл M с последующим элиминированием соли MX или MY. В то же время соединение (V) депротонируется металлоорганическим реагентом RM с образованием соответствующего аниона. Бензин, являясь очень элекрофильным соединением, далее реагирует с депротонированным соединением (V) с образованием соответствующего орто-металлированного фосфинборана, который превращается в (IV) за счет дополнительного обмена между металлом и группой X.
В одном варианте осуществления соединение с общей формулой (V) - это такое соединение, в котором R1 - это фенил, циклогексил, метил, изопропил, орто-толил, орто-анизил или металлоценил, a R2 имеет значение, указанное выше; в предпочтительном аспекте данного варианта осуществления R2 - это также фенил, циклогексил, метил, изопропил, орто-толил, орто-анизил, ферроценил, при этом R1 и R2 являются одинаковыми или различными.
Согласно предпочтительном уварианту осуществления реагент RM - это н-BuLi.
В другом варианте осуществления соединение с общей формулой (VI) - это соединение, в котором X - это Br или I, a Y - это Br или I. Согласно одному варианту осуществления группы X и Y соединения (VI) являются одинаковыми. Согласно предпочтительному варианту осуществления как группа X, так и группа Y представляет собой атом бора. Согласно другому варианту осуществления X и Y представляют собой атомы йода. В данных вариантах осуществления R3, R4, R5 и R6 - это предпочтительно H или метил; более предпочтительно, R4 и/или R5 - это метил, а остальные группы представляют собой H. Согласно особому варианту осуществления соединение (VI) - это 1,2-дибромбензол.
В еще одном варианте осуществления соединение с общей формулой (IV) - это соединение, в котором X - это Br или I, предпочтительно Br, R1 - это фенил, циклогексил, метил, изопропил, орто-толил, орто-анизил, ферроценил, R2 представляет собой замещенную или незамещенную группу, выбранную из алкильной, циклоалкильной, алкилокси-, циклоалкилокси-, арилокси-, алкиламино-, циклоалкиламино-, ариламино- или ферроценильной группы, при условии что если R1 - это Me, то R2 - это не трет-Bu; предпочтительно, R2 - это фенил, циклогексил, метил, изопропил, орто-толил, орто-анизил или ферроценил; R1 и R2 являются одинаковыми или разными; R3, R4, R5 и R6 - это, предпочтительно, H или метил; более предпочтительно, R4 и/или R5 - это метил, а остальные группы - это H.
Согласно одному варианту осуществления стадия (i) обычно осуществляется в условиях охлаждения при температуре в диапазоне от -90°C до 50°C, предпочтительно, от -78°C до -60°C.
Согласно другому варианту осуществления стадия (i) обычно осуществляется в присутствии 0,5-3 эквивалентов, предпочтительно 1,1-1,2 эквивалентов реагента RM.
Согласно одному варианту осуществления растворитель, используемый на стадии (i), выбран из группы, включающей тетрагидрофуран, диэтиловый эфир, диметиловый эфир, диоксан, бензол, толуол, ксилолы, диметилсульфоксид или их смеси. Согласно предпочтительном уварианту осуществления растворитель, используемый на стадии (i), - это тетрагидрофуран.
Согласно одному из вариантов осуществления промежуточное соединение (IV) очищают хроматографическим способом или перекристаллизацией.
В одном из вариантов осуществления соединение (IV) получается с энантиомерным избытком от 0 до 100%, предпочтительно, от 85 до 100%.
Согласно одному варианту осуществления соединение (IV) получается без рацемизации, предпочтительно с энатиомерным избытком более 85%, предпочтительно более 90%.
Стадия (ii) - Синтез соединения (I) из соединения (IV)
Стадия (ii-a) - Снятие борановой группы

Синтез соединения (I) из промежуточного соединения (III) и синтез промежуточного соединения (II) из промежуточного соединения (IV) на стадии (ii-a) включает снятие борановой защитной группы с атома фосфора.
Согласно одному варианту осуществления снятие борановой группы на стадии (ii-a) осуществляется по классическим способам удаления борановой группы. Согласно предпочтительному варианту осуществления снятие борановой группы на стадии (ii-a) осуществляется с использованием 1,4-диазабицикло[2.2.2]октана (ДАБЦО) в качестве реагента по методике, описанной в Brisset Н., Gourdel Y., Pellon P., Le Corre M., Tetrahedron Lett., 1993, 34, 4523-4526. Согласно другому варианту осуществления снятие борановой группы на стадии (ii-a) осуществляется нагреванием соединения (III) в этаноле, аминах или олефинах с последующей перекристаллизацией получающегося соединения (I).
Согласно одному из вариантов осуществления снятие борановой группы на стадии (ii-a) происходит без рацемизации.
В одном из вариантов осуществления соединение (II) получают по методике «в одном горшке», исходя из соединения (VIII), т.е. без выделения промежуточных соединений (VII) и (IV). Стадия (ii-b) - Электрофильное или окислительное сочетание
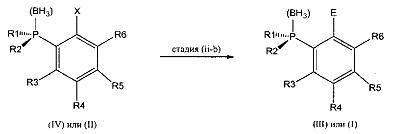
Синтез соединения (I) из промежуточного соединения (II) и синтез промежуточного соединения (III) из промежуточного соединения (IV) на стадии (ii-b) включает электрофильное сочетание или окислительное сочетание, необязательно, с последующим электрофильным сочетанием.
Согласно одному варианту осуществления стадия (ii-b) включает использование металлоорганического реагента RM и электрофильного реагента. Согласно одному варианту осуществления стадия (ii-b) включает использование металлоорганического реагента RM и окислителя. Согласно дополнительному варианту осуществления стадия (ii-b) включает использование металлоорганического реагента RM, окислителя и электрофильного реагента.
Согласно одному из вариантов осуществления металлоорганическое вещество RM выбрано из группы, включающей н-BuLi, втор-Buhi, изо-BuLi, PhLi, и реагент Гриньяра, например, изо-PrMgCl. Согласно предпочтительном уварианту осуществления металлоорганическое вещество RM - это н-BuLi.
Согласно одному варианту осуществления электрофильный реагент выбран из группы, состоящей из борсодержащих реагентов, альдегидов, кетонов, хлорангидридов, галоидсиланов, галоидалканов, галофосфинов, фосфинитов и акцепторов Михаэля, таких как α,β-ненасыщенные сложные эфиры, α,β-ненасыщенные кетоны, α,β-ненасыщенные фосфиновые производные. Согласно предпочтительному варианту осуществления электрофильный реагент выбран из группы, включающей ClB(с-Нех)2, PhCHO, изо-BuCHO, изо-BuCOCl, (Me)3SiCl, (Me)2SiCl2, MeI, ClP(Ph)2, ClP(с-Нех)2, ClP(i-Pr)2, ClP(o-Tol)2, ClP(p-Tol)2, ClP(p-CF3Ph)2, PhO-P(Ph)(o-Tol), PhO-P(Ph)(o-An).
Согласно одному варианту осуществления окислитель выбран из группы, состоящей из солей переходных металлов, комплексов переходных металлов, в которых металл выбран из группы, включающей железо, медь, церий и палладий. Согласно предпочтительному варианту осуществления окислитель выбран из группы, содержащей Fe(acac)3, FeCl3, Cu(AcO)2.
Полагают, что реакционноспособная группа X соединения (IV) или (II) обменивается на металл металлоорганического реагента RM. Последующее взаимодействие получающегося аниона с электрофильным реагентом приводит к образованию соединения с общей формулой (I) или (III). Анион может также реагировать с солью металла с образованием продукта трансметаллирования, который превращается в продукт гомосочетания (III), (I) или (I') за счет окислительного сочетания, или в орто-замещенные соединения (III) или (I) по реакции с электрофильным реагентом. Если анион, полученный из соединения (IV) или (II), вначале реагирует с окислителем при избытке соединения (IV) или (II), то происходит реакция гомосочетания, которая приводит к дифосфиновым производным с бифенильным мостиком, описываемых формулой (I').
Согласно одному из вариантов осуществления реакция гомосочетания не происходит.
Согласно одному варианту осуществления стадия (ii-b) обычно осуществляется при температуре в диапазоне от -90°C до 50°C, предпочтительно, от -78°C до 20°C.
В одном варианте осуществления растворитель, используемый на стадии (ii-b), выбран из группы, включающей тетрагидрофуран, диэтиловый эфир, диметиловый эфир, диоксан, бензол, толуол, ксилол, диметилсульфоксид или их смеси. Согласно предпочтительном уварианту осуществления растворитель, используемый на стадии (ii-b), - это тетрагидрофуран.
Использование соединений (I) в асимметрическом катализе
Соединения (I) настоящего изобретения применимы в асимметрическом катализе комплексами переходных металлов или органокатализе. В особенности, соединения (I) могут быть использованы в катализируемых асимметрических реакциях, например, в реакциях гидрирования, аллилирования, образования связи C-C, гидроформилирования или карбонилирования.
Согласно одному варианту осуществления соединение (I) используется в качестве лиганда для переходного металла, такого как родий, палладий, рутений или иридий. Комплексы переходных металлов согласно данному варианту осуществления могут быть пригодны для асимметрических катализируемых реакций, предпочтительно, для реакций аллилирования или гидрирования.
Промежуточные соединения (II), (III) и (IV) могут быть также применимы в асимметрическом катализе комплексами переходных металлов, органокатализе или стереоселективном синтезе.
Примеры
Настоящее изобретение дополнительно иллюстрируется следующими примерами, которые представлены лишь с целью иллюстрации, и их не следует рассматривать как ограничивающие объем изобретения.
А. Общие положения.
Материалы и способы.
Все реакции проводят в атмосфере аргона в высушенной лабораторной посуде. Растворители высушивают и используют в свежеперегнанном виде после перегонки в атмосфере аргона над натрий-бензофенонкетилом в случае ТГФ, диэтилового эфира, толуола, бензола или над СаН2 в случае CH2Cl2. Для ВЭЖХ использовали гексан и изопропанол хроматографического качества без дополнительной очистки. втор-Бутиллитий (1,4 М раствор в циклогексане), изобутиллитий (1,6 М раствор в пентане), изопропиллитий (0,7 М раствор в пентане), ферроцен, 2-броманизол, йодистый метил, BH3⋅SMe2, 1,4-диазабицикло [2.2.2]-октан (ДАБЦО), 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан получены из коммерчески доступных источников Aldrich, Acros или AltR Aesar и использовались в том виде, в каком были получены. (+)- и (-)-Эфедрин, полученный от фирмы Aldrich, высушивают азеотропной разгонкой с толуолом на роторном испарителе. Толуольный раствор HCl (0,2-0,4 М) получают барботированием газообразного HCl через толуол и оттитровывают методом ацидиметрии перед использованием. {2S, 4R, 5S)-(-)-3,4-диметил-2,5-дифенил-1,3,2-оксазафосфолидин-2-боран и его энантиомер (2R, 4S, 5R)-(+) получают из соответствующего (+)- или (-)-эфедрина, как описано ранее (S. Juge, Phosphorus, Sulfur and Silicon & Related Compounds, 2008, 183(2-3), 233-248; Darcel C, Uziel J., Juge S., Phosphorus Ligands in Asymetric Catalysis and Applications, A. Borner (Ed.), 208, Wiley-VCH; Chaux F., Frynas S., Laureano H., Salomon C, Morata G., Auclair M-L., Stephan M., Merdes R., Richard P., Ondel M-J., Henry J.C, Bayardon J., Darcel C., Juge S., C.R. Chimie, 2010, 13, 1213-1226).
Анализ методом хиральной ВЭЖХ проводят на приборе серии SHIMADZU 10 с использованием хиральных колонок (Chiralcel OD-H, Chiralcel AD, Chiralcel OJ, Lux 5 мкм целлюлоза-2) и смесей гексан-пропан-2-ол в качестве подвижной фазы (скорость потока 1 мл/мин; УФ детектирование при λ=254 нм). Тонкослойную хроматографию (ТСХ) проводят на пластинах, предварительно покрытых силикагелем (0,25 мм, Е. Merck), а затем подвергают обработке УФ светом, пермангантом калия или йодом.
Проводят флэш-хроматографию с использованием указанных растворителей на силикагеле 60 Å, (35-70 мкм; Acros) или стандартизованном оксиде алюминия 90 (Merck). Все данные по спектрам ЯМР регистрируют на спектрометах BRUKER AM 250, 300 AVANCE, 500 AVANCE DRX и 600 AVANCE II при температуре окружающей среды. Данные представляют с использованием следующих сокращений: c = синглет, д = дублет, т = триплет, кв. = квартет, м = мультиплет, ш.с. = широкий синглет, ш.д. = широкий дублет, д.гепт = дублет гептетов, с указанием констант спин-спинового взаимодействия в Герцах. Температуры плавления измеряют на столике Кофлера - приборе для измерения температуры плавления - и представлены без поправок. Значения углов вращения плоскости поляризации определяли при температуре 20°C на поляриметре Perkin-Elmer 341 с использованием 10-см кварцевой ампулы. Инфракрасные спектры снимали на приборе Bruker Vector 22. Масс-спектры и масс-спектры высокого разрешения снимали на времяпролетном масс-спектрометре Bruker ESI micro TOF-Q при Университете Бургундии (г. Дижон). Главный пик m/z приведен с указанием интенсивности в процентах от основного пика в квадратных скобках. Элементный анализ выполнен с точностью до 0,3% в Лаборатории микроанализа Университета Пьера и Марии Кюрю (Париж) и Университета Бургундии (прибор ЕА 1108 CHNS-O FISONS). Рентгеновский анализ проводили в Университете Бургундии, данные собирали при 115 К на системе Bruker Nonius Apex II CCD с использованием графитового монохроматора (излучение Мо-Kα). Структуры разрешены прямым методом (SIR92) и уточнены полноматричным методом наименьших квадратов по F (SHELXL-97) с помощью программы WINGX. Все неводородные атомы уточнены с анизотропными термальными параметрами. Атомы водорода были либо включены в рассчитанные для них положения, либо находили на разностных картах Фурье (СН3 и ВН3).
А.1. Получение аминофосфинборанов
Получение литийорганических реагентов
Получение ариллитиевых реагентов обменом галогена на металл: В двухгорлую колбу, снабженную магнитной мешалкой и вводом аргона, добавляют 1 экв. втор-бутиллития. Смесь охлаждают до 0°C и медленно добавляют шприцом 1 экв. 2-броманизола при перемешивании. После образования белого осадка смесь перемешивают в течение 1 ч при 0°C. Литийорганический реагент перед использованием растворяют в минимальном количестве сухого ТГФ.
Получение ферроцениллития депротонированием ферроцена
В трехгорлую колбу объемом 250 мл, снабженную магнитной мешалкой, в атмосфере аргона помещают ферроцен (0,74 г, 4 ммоль) и ТГФ (10 мл). Добавляют по каплям изо-BuLi (2,75 мл, 1,6 М в гексане, 4,4 ммоль) и реакционную смесь перед использованием перемешивают при 0°C в течение 1 ч.
Общая методика
В трехгорлой колбе объемом 100 мл, снабженной магнитной мешалкой и вводом аргона, растворяют 5 ммоль оксазафосфолидин-боранового комплекса в 5 мл безводного ТГФ. Смесь охлаждают до -78°C и медленно добавляют 2 экв. (10 ммоль) литийорганического реагента. Получающуюся в результате смесь отогревают до 0°C (или комнатной температуры) и перемешивают до тех пор, пока исходное вещество не прореагирует полностью. За реакцией наблюдают методом ТСХ на диоксиде кремния (элюент - CH2Cl2) и под конец гидролизуют при 0°C добавлением 2 мл воды. ТГФ отгоняют при пониженном давлении, и водный слой экстрагируют несколько раз дихлорметаном. Объединенные органические вытяжки сушат над MgSO4 и отгоняют растворитель. Остаток очищают на короткой колонке с силикагелем используя в качестве элюента смесь толуол-AcOEt (95:5), получая аминофосфинбораны. Аминофосфинбораны можно перекристаллизовать из смеси гексан-изопропанол (7:3).
(Sp)-(+)-N-метил-N-[(1R,2S)(1-гидрокси-2-метил-1-фенил-2-пропил)]амино-о-анизилфенилфосфинборан получают из (-)-эфедрина по опубликованной методике.
(Sp)-(+)-N-метил-N-[(1R,2S)(1-гидрокси-1-фенилпропил-2-ил)]-аминоферроценилфенил-фосфинборан
Выход = 80%; оранжевые кристаллы; [α]D20=+113.9 (с=1,0, CHCl3); Rf=0.62 (толуол/EtOAc, 9:1); ИК-спектр (KBr, ν, см-1): 3500 (О-Н), 2372 (В-Н), 1455, 1437, 1386, 1367, 1217, 1163, 1106, 1063, 1022, 998, 956, 884, 822, 763, 746, 721, 698, 646, 614. Спектр ЯМР1Н (CDCl3, 300.13 МГц) δ 0.20-2.00 (м, 3Н), 0.91 (д, J=6.3 Гц, 3Н), 2.05 (ш.с, 1Н), 2.38 (д, J=8.4 Гц, 3Н), 4.16-4.25 (м, 1H), 4.23-4.27 (м, 1Н), 4.30 (ш.с, 5Н), 4.51 (д, J=11.7 Гц, 2Н), 4.58-4.62 (м, 1Н), 4.87 (д, J=5.7 Гц, 1Н), 7.28-7.46 (м, 10Н). Спектр ЯМР31P (CDCl3, 121.5 МГц) δ+70.7 (м). Спектр ЯМР13С (CDCl3, 75.0 МГц) δ 13.7, 31.3, 40.3, 58.4 (д, J=10.6 Гц), 70.9, 71.9, 73.0, 79.6, 127.3, 128.4, 128.8, 128.9, 129.1, 131.1, 132.2 (д, J=9.8 Гц), 143.3; Вычислено для C26H31BFeNOP (471.17): С 66.28, Н 6.63, N 2.97; Найдено: С 66.33, Н 6.83, N 3.02.
(Rp)-(-)-N-метил-[(1R,2S)(2-гидрокси-1-фенил)этил]-аминоциклогексилфенилфосфинборан
Выход = 87%; белые кристаллы; Тпл=98°С; [α]20D=-28.5 (с=0.7, CHCl3); Rf=0.26 (толуол). ИК-спектр (KBr, ν/см-1): 3538 (О-Н), 3029-2857 (С-Н), 2369 (В-Н), 1492, 1452, 1436, 1368, 1257, 1221, 1159, 1109, 1086, 1000, 961, 887, 758, 742, 695. Спектр ЯМР1Н (CDCl3) δ (м.д.) 0.10-1.60 (м, 3Н, BH3), 1.15 (д, 3Н,3JHH=6.9 Гц, C-CH3), 1.20-1.90 (м, 10Н, CH2), 2.27-2.34 (м, 1Н, CyH-Р), 2.63 (д, 3Н,3JPH=7.2 Гц, N-CH3), 4.02-4.20 (м, 1H, CHN), 4.80 (д, 1Н,3JHH=4.0, CHO), 7.10-7.65 (м, 10Н, Н аром.). Спектр ЯМР13С (CDCl3) δ (м.д.) 12.2 (д, JPC=3.8, С-СН3), 25.9 (СН2), 26.6-27.0 (СН2), 29.3 (д, JPC=3.3, N-CH3), 32.6 (д, JPC=43.7, СуСН-Р), 58.3 (д,2JPC=8.1, CHN), 78.6 (д,3JPC=2.3, СНО), 126.0 (С аром.), 127.4 (С аром.), 128.2 (С аром.), 128.3 (д, JPC=9.4 Гц, С аром.), 130.5 (д, JPC=2.1, С аром.), 130.8 (д, JPC=55.7, С аром.), 131.2 (д, JPC=9.1, С аром.), 142.5 (С аром.). Спектр ЯМР31Р (CDCl3) δ (м.д.)+73.7 (м); МС (ЭУ) m/z (относительная интенсивность) 368 (М+-Н; 100), 356 (М++Н-ВН3; 25), 312 (10), 262 (15), 248 (15), 209 (10), 193 (25), 166 (10), 148 (20); МСВР (ДХИ, СН4) Вычислено для C22H32BNOP [М+-Н] 368.2315; Найдено: 368.2319; Вычислено для C22H32BNOP (369.2883): С 71.55, Н 9.01, N 3.79; Найдено: С 71.71, Н 9.13, N 3.67.
(RP)-(+)-N-метил-N-[(1R,2S)(1-гидрокси-1-фенил-проп-2-ил]аминофенилизопропил-фосфинборан
Выход = 80%; бесцветное масло; [α]D20=+31.7 (с=0,6, CHCl3); Rf=0.25 (CH2Cl2); ИК-спектр (ν/см-1): 3510 (О-Н), 2974-2874 (С-Н), 2380 (В-Н), 1453, 1436, 1386, 1220, 1173, 1107, 1071, 1023, 1005, 955, 914, 884, 742, 727, 698, 645, 619, 582. Спектр ЯМР1Н (CDCl3, 300.13 МГц) δ 0.10-0.90 (м, 3Н), 0.96 (д.д, J=17.1 и 7.2 Гц, 3Н), 1.03 (д, J=6.9 Гц, 3Н), 1.09 (д.д, J=15.3 и 7.2 Гц, 3Н), 2.50 (д, J=7.2 Гц, 3Н), 2.47-2.61 (м, 1H), 3.97-4.09 (м, 1H), 4.68 (д, J=4.8 Гц, 1H), 7.07-7.19 (м, 3Н), 7.23-7.37 (м, 5Н), 7.46 (м, 2Н). Спектр ЯМР31Р (CDCl3, 121.5 МГц) δ+76.4. Спектр ЯМР13С (CDCl3, 75.0 МГц) δ 12.9 (д, J=3.8 Гц), 17.5 (д, J=5.3 Гц), 22.8 (д, J=44.5 Гц), 29.9 (д, J=3.0 Гц), 59.1 (д, J=7.6 Гц), 79.2 (д, J=2.3 Гц), 126.7, 128.1, 128.9, 129.0 (д, J=2.3 Гц), 131,7 (д, J=55.9 Гц), 131.8 (д, J=9.1 Гц), 143.2; МС (ЭУ) m/z (относительная интенсивность) 352 (М++Na; 100), 338 (М+-ВН3+Na; 95); МСВР (ЭСИ) вычислено для C19H29BNNaOP [М+Na]+ 352.1962; Найдено: 352.1976.
А.2. Получение вторичных фосфинборанов (V).
Общая методика
В двухгорлую колбу на 250 мл, снабженную магнитной мешалкой и вводом аргона, каучуковой септой помещают 6 ммоль аминофосфинборана. Затем при перемешивании добавляют раствор HCl в толуоле (36 ммоль, 10 (в случае изо-Pr)-15 (в случае Fc) экв.) при комнатной температуре без предварительного растворения аминофосфинборана. Через 1-48 ч наблюдают за ходом реакции методом ТСХ, после чего отфильтровывают осадок гидрохлорида эфедрина на фильтре Millipore 4 мкм, и удаляют избыток HCl, совершая несколько циклов вакуумирование-заполнение аргоном. Добавляют по каплям трет-бутиллитий (12 ммоль, 2 экв.) в течение 4 мин при -85°С к быстро перемешиваемому раствору хлорфосфинборана в толуоле. После перемешивания в течение 5 минут при -85°С добавляют 6 мл ТГФ на протяжении 1 минуты, в результате чего реакционная смесь приобретает темно-желтую окраску. Добавляют быстро за раз уксусную кислоту (2,8 мл). Реакционная смесь становится ярко-белой, затем ее гидролизуют (50 мл воды). Водную фазу экстрагируют несколько раз CH2Cl2. Объединенные органические вытяжки сушат над MgSO4 и отгоняют растворитель. Остаток очищают хроматографией на силикагеле, получая чистый вторичный фосфинборан (V).
А.2.1. (S)-(-)-о-Анизилфенилфосфинборан (V-f)
Выход = 98% (ее=97%); белое твердое вещество; Rf=0.50 (петролейный эфир/толуол, 1:1); [α]20D=-92 (с=0,4, CHCl3); ИК-спектр (ν/см-1) 3206, 3001-2837 (С-Н), 2379 и 2259 (В-Н), 1588, 1575, 1477, 1463, 1454, 1438, 1433, 1296, 1278, 1247, 1186, 1159, 1134, 1112, 1084, 1072, 1061, 1042, 1023, 974, 953, 912, 899, 858, 797, 767, 739, 728, 696. Спектр ЯМР1Н (CDCl3): δ (м.д.) 0.50-1.70 (м, 3Н), 3.83 (с, 3Н), 6.54 (д.кв, J=396 Гц, J=6.8 Гц, 1H), 6.93 (д.д, J=8.3 Гц, J=3.5 Гц, 1H), 7.04-7.08 (м, 1Н), 7.36-7.54 (м, 4Н), 7.64-7.80 (м, 3Н). Спектр ЯМР13С (CDCl3): δ (м.д.) 55.9, 110.9 (д, J=3.9 Гц), 114.6 (д, J=55.6 Гц), 121.4 (д, J=12.4 Гц), 126.9 (д, J=58.3 Гц), 128.8 (д, JPC=10.4 Гц), 131.2 (д, J=2.3 Гц), 132.9 (д, J=9.5 Гц), 134.0 (д, J=2.2 Гц), 135.0 (д, J=13.6 Гц), 160.7 (д, J=1.1 Гц). Спектр ЯМР31Р (CDCl3): δ (м.д.) - 15.3. МС (ЭУ) m/z (относительная интенсивность) 229 (М+-Н), 294 (М+-ВН3; 100), 226 (15), 217 (50), 186 (55), 170 (10), 121 (20), 56 (10); МСВР (ЭРИ) вычислено для C13H16BNaOP: 253.0924. Найдено: 253.0926. Энантиомерный избыток о-анизилфенилфосфинборана (V-f) определяют по данным ВЭЖХ анализа на колонке Chiralcel OD-H, используя в качестве элюента смесь гексан/изопропиловый спирт (98:2), 1 мл/мин, λ=254 нм: (R), tR=9,75 мин; (S)-энантиомер, tR=10,50 мин.
А.2.2. (S)-Ферроценилфенилфосфинборан (V-g)
Выход = 60% (94% ее); оранжевое масло; Rf=0.5 (петролейный эфир/толуол, 1:1); ИК-спектр (ν/см-1) 3200-3000 (С-Н), 2385 и 2346 (ВН), 2253, 1665, 1484, 1437, 1412, 1387, 1366, 1313, 1157, 1133, 1107, 1061, 1027, 1001, 913, 886, 824, 741, 696. Спектр ЯМР1Н (CDCl3): δ (м.д.) 0.87-1.67 (м, 3Н), 4.29 (с, 5Н), 4.49.4.54 (М; 4Н), 6.23 (кв.д, J=381 Гц, J=6.7 Гц, 1Н), 7.42-7.54 (м, 3Н), 7.65-7.71 (м, 2Н). Спектр ЯМР13С (CDCl3): δ (м.д.) 64.1 (д, J=67 Гц), 69.8, 72.1 (т.д, J=22.3 Гц, J=7.1 Гц), 73.0 (д, J=15 Гц), 128.0 (д, J=57.2 Гц), 128.7 (д, J=10.1 Гц), 131.1 (д, J=2.0 Гц), 132.1 (д, J=9.2 Гц). Спектр ЯМР31Р (CDCl3): δ (м.д.) - 6.5. Энантиомерный избыток ферроценилфенилфосфинборана (V-g) определяют по данным ВЭЖХ анализа на колонке Chiralpack AD, используя в качестве элюента смесь гексан/изопропиловый спирт (95:5), 1 мл/мин, λ=254 нм: (R), tR=8,64 мин; (S)-энантиомер, tR=13,06 мин.
А.2.3. (R)-(-)-Фенил-изопропилфосфинборан (V-h)
Выход = 41% (ее=95%); бесцветное масло; Rf=0.70 (петролейный эфир/этилацетат, 3:1); [α]20D=-5.0 (с=0,4, CHCl3); ИК-спектр (ν/см-1) 3218, 2966-2873 (С-Н), 2386-2348 (В-Н), 1439, 1117, 1070, 914, 879, 656. Спектр ЯМР1Н (CDCl3): δ (м.д.) 0.10-0.90 (м, 3Н), 1.19 (д.д.д, J=16.6 Гц, J=13.8 Гц, J=1.1 Гц, 6Н), 2.23-2.28 (м, 1Н), 5.26 (д.д.кв, J=365.3 Гц, J=6.8 Гц, J=4.1 Гц, 1Н), 7.46-7.56 (м, 3Н), 7.66-7.72 (м, 2Н). Спектр ЯМР13С (CDCl3): δ (м.д.) 17.8 (д, J=38.5 Гц), 23.8 (д, J=35.5 Гц), 124.8 (д, J=53.6 Гц), 128.9 (д, J=9.8 Гц), 131.7 (д, J=3.0 Гц), 133.4 (д, J=8.3 Гц). Спектр ЯМР31Р (CDCl3) δ (м.д.):+15.6; МС (ЭУ) m/z (относительная интенсивность) 191 (М-ВН3+O+Na+; 100); МСВР (ЭРИ) вычислено для C9H16BNaP 189.0977; Найдено: 189.0940. Энантиомерный избыток фенил-изопропилфосфинборана (V-h) определяют по данным ВЭЖХ анализа на колонке Lux 5 мкм целлюлоза 2, используя в качестве элюента смесь гексан/изопропиловый спирт (99:1), 0,5 мл/мин, λ=210 нм: (R), tR=27,06 мин; (S)-энантиомер, tR=29,87 мин.
А.2.4. (R)-Циклогексилфенилфосфинборан (V-i)
Выход = 91% (95% ее); бесцветное масло; Rf=0.75 (толуол); ИК-спектр (ν, см-1) 3341, 3056, 2930-2854 (С-Н), 2388-2251, 1486, 1450,1437, 1346, 1293, 1272, 1203, 1179, 1123, 1059, 1047, 1028, 1002, 911, 875, 845, 822, 748, 702, 675, 592, 508, 488, 480, 429, 406. Спектр ЯМР1Н (CDCl3): δ (м.д.) 0.40-1.0 (м, 3Н), 1.15-1.40 (м, 5Н), 1.68-1.73 (м, 1Н), 1.79-1.90 (м, 4Н), 1.93-2.02 (м, 1H), 5.23 (д.кв.д, J=365 Гц, J=6.8 Гц, J=4.5 Гц, 1H), 7.47-7.51 (м, 2H), 7.53-7.57 (м, 1H), 7.66-7.70 (м, 2Н). Спектр ЯМР13C (CDCl3): δ (м.д.) 26.0, 26.7-26.8 (м), 28.1, 28.6, 33.7 (д, J=34.8 Гц), 125.2 (д, J=53.1 Гц), 129.2 (д, J=9.6 Гц), 131.9, 133.8 (д, J=7.8 Гц). Спектр ЯМР31Р (CDCl3) δ (м.д.):+11.6; МС (МАЛДИ) m/z (относительная интенсивность) 229 (М+Na+; 100), 215 (М-ВН3+Na+; 5), 193 (М-ВН3+H+, 15); МСВР (ЭРИ) вычислено для C12H17NaP 215.0960; Найдено: 215.0953. Энантиомерный избыток циклогексилфенилфосфинборана (V-i) определяют по данным ВЭЖХ анализа на колонке Chiralcel OJ, используя в качестве элюента смесь гексан/изопропиловый спирт (99:1), 1 мл/мин, λ=210 нм: (R), tR=12,54 мин; (S)-энантиомер, tR=13,54 мин.
А.2.5. (S)-(-)-Фенил-о-толилфосфинборан (V-i)
Выход = 83%, (94% ее); белое масло; Rf=0.58 (петролейный эфир/толуол, 1:1); ИК-спектр (ν, см-1): 3444, 3058-2854 (С-Н), 2391-2345 (В-Н), 2252, 1635-1592, 1474, 1454, 1438, 1384, 1285, 1138, 1112, 1060, 1028, 907, 806, 751, 714, 698, 587, 549, 510, 472, 440. Спектр ЯМР1Н (CDCl3): δ (м.д.) 0.50-1.50 (м, 3Н), 2.29 (с, 3Н), 6.35 (д.кв, J=379 Гц, J=6.9 Гц, 1Н), 7.18-7.24 (м, 2Н), 7.34-7.37 (м, 3Н), 7.40-7.43 (м, 1Н), 7.50-7.54 (м, 2Н), 7.60 (д.д.д, J=13.8 Гц, J=7.6 Гц, J=0.95 Гц, 1H). Спектр ЯМР13С (CDCl3): δ (м.д.) 21.4 (д, J=5.4 Гц), 125.2 (д, J=55.8 Гц), 126.3 (д, J=56.1 Гц), 126.9 (д, J=11.8 Гц), 129.4 (д, J=10.2 Гц), 131.4 (д, J=1.1 Гц), 131.8 (д, J=2.8 Гц), 132.3 (д, J=2.6 Гц), 133.1 (д, J=9.3 Гц), 134.7 (д, J=13.8 Гц), 142.1 (д, J=5.3 Гц). Спектр ЯМР31Р (CDCl3): δ (м.д.) - 5.4; МС (ЭУ) m/z (относительная интенсивность) 237 (М+Na+, 100), 223 (М-ВН3+Na+, 40), 206 (9); МСВР (ЭРИ) вычислено для C13H16BNaP: 237.09749; Найдено: 237.09772. Энантиомерный избыток фенил-о-толилфосфинборана (V-j) определяют по данным ВЭЖХ анализа на колонке Chiralcel OD-H, используя в качестве элюента смесь гексан/изопропиловый спирт (98:2), 1 мл/мин, λ=254 нм: (R), tR=8,29 мин; (S)-энантиомер, tR=8,71 мин.
В. Синтез (S)-(2-бромфенил)-(2-метоксифенил)-фенилфосфина (II-n) по методике «в одном горшке»
Синтез (VII).
11,0 мл (3,30 ммоль) свежеоттитрованного раствора сухого HCl в толуоле добавляют к 0,33 г (0,83 ммоль) (Rp)-N-метил-[(1R,2S)(2-гидрокси-1-фенил)этил]-амино-о-анизилфенилфосфинборана (VIII) и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Гидрохлорид эфедрина отфильтровывают с помощью фильтра Millipore 4 мкм.
Стадия (i).
Собирают полученный раствор о-анизилхлорфенилфосфинборана (VII), дегазируют его, проводя четыре цикла вакуумирование-заполнение аргоном и охлаждают до -80°C. Затем добавляют по каплям 1,20 мл (2,00 ммоль) трет-BuLi (1,6 М раствор в пентане) в атмосфере аргона и реакционную смесь перемешивают 5 минут при -80°C. Медленно добавляют 2 мл сухого ТГФ, а затем добавляют 0,14 мл (1,16 ммоль) 1,2-дибромбензола (VI), и полученный раствор перемешивают в течение 1 ч при температуре -78°C. Затем добавляют 5 мл воды и водную фазу экстрагируют дихлорметаном (3×10 мл). Объединенные органические вытяжки сушат над MgSO4, фильтруют и упаривают растворитель, получая остаток (IV-i), который разбавляют 3 мл сухого толуола в атмосфере аргона.
Стадия (ii-a).
Добавляют 0,28 г (2,49 ммоль) ДАБЦО и полученный раствор перемешивают при комнатной температуре в течение 2 ч. Растворитель упаривают под вакуумом и сырой продукт (II-i) очищают колоночной хроматографией на силикагеле, используя смесь петролейный эфир/этилацетат (3:1) в качестве элюента. Аналитически чистый образец можно получить перекристаллизацией из смеси хлористый метилен-метиловый спирт. Бесцветное твердое вещество; Суммарный выход 51% (0,22 г); Энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (chiralpak AD, 0,2 мл/мин, гексан/2-пропанол (99:1), tR (R)=30,8 мин, tR (S)=35,0 мин); Rf 0.41 (петролейный эфир/этилацетат, 3:1); Тпл = 128-130°C; [α]D+20.6 (с=0,5, CHCl3); ИК-спектр (чистое вещество) 3063, 2930, 2833, 1581, 1571, 1553, 1458, 1428, 1298, 1271, 1239, 1162, 1128, 1093, 1069, 1041, 1017, 864, 793, 752 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 3.77 (с, 3Н), 6.78-6.82 (м, 1H), 6.65-6.70 (м, 1H), 6.87-6.96 (м, 2Н), 7.18-7.24 (м, 2Н), 7.28-7.43 (м, 6Н), 7.58-7.63 (м, 1Н). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 55.7, 110.3 (д, J=1.5 Гц), 121.2, 124.5 (д, J=12.4 Гц), 127.3, 128.5 (д, J=7.4 Гц), 129.0, 130.0, 130.1 (д, J=32.0 Гц), 130.6, 132.8 (д, J=2.4 Гц), 133.9, 134.1, 134.4, 135.4 (д, J=10.5 Гц), 138.5 (д, J=11.4 Гц), 161.3 (д, J=15.8 Гц). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 15.3 (с); МСВР вычислено для C19H16PBrONa [M+Na]+ 393.0014, найдено 393.0006; Вычислено для C19H16PBrO: С, 61.48; Н, 4.34; Найдено: С, 61.37; Н, 4.59.
С. Синтез о-галогенофенилфосфинборанов (IV) из вторичных фосфинборанов (V)



С.1. Синтез орто-бромарилфосфинборанов (IV):
Общая методика
К раствору вторичного фосфинборана (V) (0,83 ммоль) в сухом ТГФ (2 мл) добавляют по каплям н-BuLi (0,83 ммоль) в атмосфере аргона при температуре - 78°C. Полученный раствор перемешивают при данной температуре в течение 1 ч и затем добавляют по каплям 1,2-дибромбензол (VI-a) (1,16 ммоль), после чего добавляют н-BuLi (0,17 ммоль). После одночасового перемешивания при температуре - 78°С реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая остаток, который очищают колоночной хроматографией на силикагеле и/или перекристаллизацией.
С.1.1. (2-Бромфенил)-дифенилфосфинборан (IV-а)
Из вторичного фосфинборана (V-a); Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 2:1) и/или перекристаллизация из смеси гексан/хлористый метилен. Белое твердое вещество; выход: 75%; Rf 0.62 (петролейный эфир/этилацетат, 2:1); ИК-спектр (чистое вещество) 3052, 2924, 2854, 2814, 2379, 2340, 1558, 1480, 1436, 1424, 1128, 1106, 1058, 1025, 998, 738, 690 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 7.20-7.31 (м, 3Н, Наром), 7.36-7.49 (м, 6Н, Наром), 7.57-7.64 (м, 5Н, Наром);1JC NMR (75.5 МГц, CDCl3) δ 127.3 (д, J=9.1 Гц, Саром), 128.0 (д, J=5.9 Гц, Саром), 128.1 (д, J=58.7 Гц, Саром), 128.8 (д, J=10.4 Гц, Саром), 130.1 (д, J=57.3 Гц, Саром), 131.3 (д, J=2.4 Гц, Саром), 132.7 (д, J=2.1 Гц, Саром), 133.3 (д, J=9.6 Гц, Саром), 135.1 (д, 5.9 Гц, Саром), 136.6 (д, J=10.1 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 26.6; МСВР вычислено для C18H17PBBrNa (M+Na)+ 379.0221, найдено 379.0197; Вычислено для C18H17PBBr: С, 60.90; Н, 4.83; Найдено: С, 61.06; Н, 5.13.
С.1.2. (2-Бромфенил)-дициклогексилфосфинборан (IV-b)
Из вторичного фосфинборана (V-b); используют ту же самую методику, за исключением того, что после добавления н-BuLi при температуре - 78°C полученный раствор перемешивают 30 минут при данной температуре, а затем 30 минут при комнатной температуре.
Очистка: колоночная хроматография (элюирование смесью петролейный эфир/хлористый метилен, 3:1) и/или перекристаллизация из смеси метиловый спирт/хлористый метилен. Белое твердое вещество; выход: 63%; Rf 0.24 (петролейный эфир/хлористый метилен, 3:1); ИК-спектр (чистое вещество) 2930, 2851, 2379, 1446, 1418, 1274, 1061, 890, 854, 758, 736 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.16-1.37 (м, 1 ОН, сНех), 1.55-1.70 (м, 6Н, сНех), 1.80-1.85 (м, 2Н, сНех), 1.93-1.97 (м, 2Н, сНех), 2.77-2.85 (м, 2Н, сНех), 7.27-7.40 (м, 2Н, Наром), 7.60 (д.т., J=1.8, 7.7 Гц, Наром), 8.07 (д.д.д, J=1.7, 7.6, 12.6 Гц, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 25.7 (д, J=1.3 Гц, СН2), 26.8 (д, J=9.5 Гц, СН2), 27.0 (д, J=8.5 Гц, СН2), 27.8 (СН2), 28.8 (СН2), 32.9 (д, J=32.3 Гц, СН), 127.1 (д, J=3.1 Гц, Саром), 127.3 (д, J=10.9 Гц, Саром), 128.0 (д, J=46.3 Гц, Саром), 132.4 (д, J=2.1 Гц, Саром), 134.0 (д, J=4.4 Гц, Саром), 140.1 (д, J=15.0 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 40.9; МСВР вычислено для C18H29PBrBNa (M+Na)+ 389.1179, найдено 389.1157; Вычислено для C18H29PBrB: С, 58.89; Н, 7.96; Найдено: С, 58.68; Н, 8.29.
С.1.3. (2-бромфенил)-диметилфосфинборан (IV-с)
Синтезируют по той же самой методике, исходя из вторичного фосфинборана (V-c), за исключением того, что после добавления н-BuLi при температуре -78°C полученный раствор перемешивают 30 минут при данной температуре, а затем 30 минут при комнатной температуре.
Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 3:1). Бесцветное масло; выход: 42%; Rf 0.49 (петролейный эфир/этилацетат, 3:1); ИК-спектр (чистое вещество) 3077, 2375, 2360, 2335, 1580, 1559, 1453, 1413, 1302, 1289, 1273, 1256, 1144, 1109, 1071, 1022, 946, 919, 755 см-1. Спектр ЯМР1Н (300 МГц, ацетон-d6) δ 1.55 (д, J=10.4 Гц, 6Н, CH3), 7.24-7.33 (м, 2Н, Наром), 7.52-7.59 (м, 1Н, Наром), 7.70-7.77 (м, 1Н, Наром). Спектр ЯМР13С (75.5 МГц, ацетон-d6) δ 12.0 (д, J=40.1 Гц, СН3), 127.5 (Саром), 128.6 (д, J=10.9 Гц, Саром), 131.8 (д, J=50.6 Гц, Саром), 134.2 (д, J=2.2 Гц, Саром), 135.4 (д, J=4.7 Гц, Саром), 137.0 (д, J=15.7 Гц, Саром). Спектр ЯМР31Р (121 МГц, ацетон-d6) δ 11.1-12.5 (м); МСВР вычислено для C8H13PBrBNa (M+Na)+ 252.9925, найдено 252.9923; Вычислено для C8H13PBrB: С, 41.62; Н, 5.68; Найдено: С, 41.29; Н, 6.07.
С.1.4. (2-бромфенил)-диизопропилфосфинборан (IV-d)
Синтезируют по той же самой методике, исходя из вторичного фосфинборана (V-d), за исключением того, что после добавления н-BuLi при температуре -78°C полученный раствор перемешивают 30 минут при данной температуре, а затем 30 минут при комнатной температуре.
Очистка: колоночная хроматография (элюирование смесью петролейный эфир/хлористый метилен, 3:1). Белое твердое вещество; выход: 55%; Rf 0.26 (петролейный эфир/хлористый метилен, 3:1); ИК-спектр (чистое вещество) 2974, 2932, 2871, 2393, 2373, 2349, 1574, 1557, 1453, 1422, 1389, 1370, 1261, 1110, 1071, 1046, 1021, 931 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.86 (д.д, J=7.1, 15.9 Гц, 6Н, CH3), 1.27 (д.д, J=7.0, 15.8 Гц, 6Н, CH3), 2.95-3.09 (м, 2Н, CH), 7.22-7.35 (м, 2Н, Наром), 7.55 (т.т, J=1.8, 7.7 Гц, 1H, Наром), 8.04 (д.д.д, J=1.5, 7.5, 12.6 Гц, 1H, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 18.5 (д, J=2.8 Гц, СН3), 18.7 (СН3), 22.8 (д, J=33.1 Гц, СН) 126.7 (д, J=3.1 Гц, Саром), 127.3 (д, J=10.9 Гц, Саром), 128.7 (д, J=46.6 Гц, Саром), 132.6 (д, J=2.2 Гц, Саром), 134.2 (д, J=4.4 Гц, Саром), 139.8 (д, J=14.8 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 48.4-49.9 (м); МСВР вычислено для C12H21PBrBNa (M+Na)+ 309.0552, найдено 309.0545; Вычислено для C12H21PBrB: С, 50.22; Н, 7.38; Найдено: С, 50.57; Н, 7.53.
С.1.5. (2-бромфенил)-ди(о-толил)фосфинборан (IV-е) и свободный фосфин (II-е)
К раствору ди(о-толил)фосфинборана 37е (0,19 г, 0,83 ммоль) в сухом ТГФ (2 мл) добавляют по каплям н-BuLi (0,83 ммоль) в атмосфере аргона при температуре -78°C. Полученный раствор перемешивают при данной температуре в течение 1 ч и затем добавляют по каплям 1,2-дибромбензол (VI-a) (0,15 мл, 1,16 ммоль), после чего добавляют н-BuLi (0,17 ммоль). После одночасового перемешивания при температуре -78°C реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая сырой продукт (IV-e), который разбавляют сухим толуолом (5 мл) в атмосфере аргона. Добавляют 0,28 г (2,49 ммоль) ДАБЦО и полученный раствор перемешивают при комнатной температуре на протяжении ночи. Растворитель упаривают под вакуумом и сырой декомплексованный продукт (II-е) очищают колоночной хроматографией на силикагеле, используя смесь петролейный эфир/этилацетат (3:1) в качестве элюента. Белое твердое вещество; выход 40%; Rf 0.59 (петролейный эфир/этилацетат, 3:1); ИК-спектр (чистое вещество) 3055, 3002, 2973, 1588, 1554, 1466, 1445, 1422, 1377, 1271, 1250, 1201, 1161, 1130, 1099, 1017, 867, 746, 715 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 2.46 (2 с, 6Н, СН3), 6.76-6.78 (м, 3Н, Наром), 7.12-7.14 (м, 2Н, Наром), 7.22-7.24 (м, 2Н, Наром), 7.27-7.29 (м, 2Н, Наром), 7.32 (т.д, J=1.3, 7.4 Гц, 2Н, Наром), 7.64-7.66 (м, 1H, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 21.1 (СН3), 21.3 (СН3), 126.3 (Саром), 127.6 (Саром), 129.0 (Саром), 130.1 (Саром), 130.2 (д, J=4.6 Гц, Саром), 130.6 (д, J=32.5 Гц, Саром), 133.1 (д, J=2.9 Гц, Саром), 133.2 (Саром), 134.0 (д, J=11.4 Гц, Саром), 134.7 (Саром), 137.7 (д, J=10.8 Гц, Саром), 142.8 (д, J=27.4 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 19.7; МСВР вычислено для C20H18PBrNa (M+Na)+ 391.0222, найдено 391.0203; Вычислено для C20H18PBr: С, 65.06; Н, 4.91; Найдено: С, 65.14; Н, 5.00.
С.1.6. (2-бром-4,5-диметилфенил)-дифенилфосфинборан (IV-f)
К раствору дифенилфосфинборана (V-a) (0,17 г, 0,83 ммоль) в сухом ТГФ (2 мл) добавляют по каплям н-BuLi (0,83 ммоль) в атмосфере аргона при температуре -78°C. Полученный раствор перемешивают при данной температуре в течение 1 ч и затем добавляют по каплям 4,5-дибром-о-ксилол (VI-b) (0,31 г, 1,16 ммоль), после чего добавляют н-BuLi (0,17 ммоль). После одночасового перемешивания при температуре -78°C реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая остаток, который очищают колоночной хроматографией на силикагеле, используя смесь петролейный эфир/хлористый метилен (3:1) в качестве элюента. Аналитически чистый образец может быть получен перекристаллизацией из смеси хлористый метилен/гексан. Белое твердое вещество; выход 56%; Rf 0.45 (петролейный эфир/этилацетат, 3:1); ИК-спектр (чистое вещество) 3050, 2986, 2946, 2917, 2417, 2388, 2357, 1588, 1481, 1471, 1436, 1343, 1136, 1125, 1102, 1062, 1028, 999, 923, 877, 749, 734, 701, 692 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 2.17 (с, 3Н, СН3), 2.29 (с, 3Н, СН3), 7.21 (д, J=12.3 Гц, Наром), 7.43-7.56 (м, 7Н, Наром), 7.65-7.72 (м, 4Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 19.4 (СН3), 19.5 (СН3), 124.7 (д, J=4.4 Гц, Саром), 131.1 (д, J=2.5 Гц, Саром), 133.2 (д, J=9.6 Гц, Саром), 135.9 (д, J=6.1 Гц, Саром), 136.3 (д, J=9.9 Гц, Саром), 137.8 (д, J=11.8 Гц, Саром), 142.6 (д, J=2.2 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 25.5; МСВР вычислено для C20H21PBBrNa (M+Na)+ 405.0553, найдено 405.0563; Вычислено для C20H21PBBr: С, 62.71; Н, 5.53; Найдено: С, 62.86; Н, 5.58.
С.1.7. (R)-(2-бромфенил)-(2-метоксифенил)-фенилфосфинборан (IV-i)
Исходя из вторичного фосфинборана (S)-(V-f); Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 3:1). Белое твердое вещество; выход: 53%; Энантиомерный избыток составляет 95% согласно данным ВЭЖХ анализа (chiralpak AD, 0,2 мл/мин, гексан-2-пропанол (99:1), tR (R)=29,4 мин, tR (S)=32,2 мин; Rf 0.18 (петролейный эфир/этилацетат, 3:1); [α]D=-1.3 (с=1.6, CHCl3); ИК-спектр (чистое вещество) 3054, 2940, 2838, 2384, 1589, 1575, 1559, 1478, 1454, 1431, 1277, 1265, 1252, 1164, 1134, 1103, 1059, 1021, 854, 802, 733 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 3.56 (с, 3Н, ОСН3), 6.94 (д.д, J=3.8, 8.3 Гц, 1Н, Наром), 7.08 (т.д.д, J=0.8, 2.1, 7.5 Гц, 1H, Наром), 7.28-7.33 (м, 3Н, Наром), 7.44-7.54 (м, 4Н, Наром), 7.60-7.64 (м, 1H, Наром), 7.80-7.87 (м, 3Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 55.4 (ОСН3), 111.5 (д, J=4.6 Гц, Саром), 116.5 (д, J=57.8 Гц, Саром), 121.5 (д, J=12.2 Гц, Саром), 126.7 (д, J =6.4 Гц, Саром), 127.0 (д, J=9.2 Гц, Саром), 128.3 (д, J=59.9 Гц, Саром), 128.4 (д, J=10.5 Гц, Саром), 131.0 (д, J=61.4 Гц, Саром), 131.1, (д, J=2.4 Гц, Саром), 131.7 (д, J=2.1 Гц, Саром), 133.8 (д, J=1.9 Гц, Саром), 133.9 (д, J=9.8 Гц, Саром), 134.5, (д, J=6.0 Гц, Саром), 135.0 (д, J=9.8 Гц, Саром), 135.6 (д, J=9.8 Гц, Саром), 161.2 (Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 23.7; МСВР вычислено для C19H19PBrBONa (M+Na)+ 407.0346, найдено 407.0333; Вычислено для C19H19BBrOP: С, 59.27; Н, 4.97; Найдено: С, 58.79; Н, 5.25.
С.1.8. (R)-Ферроценил-(2-бромфенил)-фенилфосфинборан (IV-k)
Исходя из вторичного фосфинборана (S)-(V-g); Очистка: перекристаллизация из смеси гексан/хлористый метилен. Оранжевое твердое вещество; выход: 47%; Энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (chiralcel OD-H, 0,5 мл/мин, гексан-2-пропанол (98:2), tR (R)=19,6 мин, tR (S)=23.2 мин; Rf 0.39 (петролейный эфир/этилацетат, 3:1); [α]D=+162.9 (с=0.5, CHCl3); ИК-спектр (чистое вещество) 3092, 3074, 3054, 2408, 2382, 2350, 1571, 1555, 1483, 1450, 1437, 1417, 1387, 1334, 1308, 1271, 1249, 1169, 1130, 1105, 1060, 1053, 1022, 998, 844, 765, 753, 739, 721 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 4.09 (с, 5Н, Ср), 4.14-4.16 (м, 1H, Ср), 4.51-4.53 (м, 1H, Ср), 4.61-4.62 (м, 1H, Ср), 4.84-4.87 (м, 1Н, Ср), 7.22-7.31 (м, 3Н, Наром), 7.48-7.59 (м, 4Н, Наром), 7.73-7.80 (м, 2Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 69.2 (д, J=70.1 Гц, Ср), 69.9 (Ср), 72.0 (Ср), 72.1 (д, J=5.0 Гц, Ср), 72.2 (д, J=6.7 Гц, Ср), 74.7 (д, J=14.5 Гц, Ср), 126.9 (д, J=8.6 Гц, Саром), 127.0 (д, J=7.2 Гц, Саром), 128.5 (д, J=10.5 Гц, Саром), 129.7 (д, J=61.4 Гц, Саром), 131.1 (д, J=2.4 Гц, Саром), 132.1 (д, J=2.0 Гц, Саром), 132.6 (д, J=9.8 Гц, Саром), 132.9 (д, J=58.1 Гц, Саром), 134.7 (д, J=5.7 Гц, Саром), 135.6 (д, J=8.8 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 23.3; МСВР вычислено для C22H21PBrBFeNa (M+Na)+ 484.9905, найдено 484.9912; Вычислено для C22H21PBrBFe: С, 57.08; Н, 4.57; Найдено: С, 56.78; Н, 4.61.
С.1.9. (S)-(2-бромфенил)-фенилизопропилфосфинборан (IV-m)
Исходя из вторичного фосфинборана (R)-(V-h); Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 3:1). Бесцветное масло; выход: 48%; Энантиомерный избыток составляет 95% согласно данным ВЭЖХ анализа (lux 5u-целлюлоза 2, 0,2 мл/мин, гексан-2-пропанол (98:2), tR (S)=35,2 мин, tR (S)=37,1 мин; Rf 0.52 (петролейный эфир/этилацетат, 3:1); [α]D=-45.0 (с=0.3, CHCl3); ИК-спектр (чистое вещество) 2971, 2932, 2872, 2381, 1576, 1453, 1436, 1417, 1271, 1254, 1108, 1065, 1039, 1024, 739, 696 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.02 (д.д, J=7.1, 17.1 Гц, 3Н, СН3), 1.32 (д.д, J=7.0, 16.4 Гц, 3Н, СН3), 3.31-3.45 (м, 1H, СН), 7.23-7.40 (м, 5Н, Наром), 7.48 (д.д.д, J=1.3, 2.5, 7.9 Гц, 1H, Наром), 7.55-7.61 (м, 2Н, Наром), 8.08 (д.д.д, J=1.6, 7.7, 12.5 Гц, 1Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 17.3 (д, J=2.3 Гц, СН3), 18.0 (д, J=2.1 Гц, СН3), 21.3 (д, J=35.7 Гц, СН), 127.4 (д, J=10.8 Гц, Саром), 127.7 (Саром), 128.3 (д, J=55.2 Гц, Саром), 128.4 (Саром), 128.5 (Саром), 129.6 (д, J=50.6 Гц, Саром), 130.6 (д, J=2.3 Гц, Саром), 132.4 (Саром), 132.6 (Саром), 132.8 (д, J=2.2 Гц, Саром), 134.6 (д, J=4.8 Гц, Саром), 138.1 (д, J=14.6 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 35.0-35.6 (м); МСВР вычислено для C15H19PBBrNa (M+Na)+ 343.0396, найдено 343.0407; Вычислено для Ci5H19PBBr: С, 56.12; Н, 5.97; Найдено: С, 56.50; Н, 6.16.
С.1.10. (S)-(2-бромфенил)-циклогексилфенилфосфинборан (IV-n)
Исходя из вторичного фосфинборана (R)-(V-i); Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 4:1). Белое твердое вещество; выход: 47%; Энантиомерный избыток составляет 95% согласно данным ВЭЖХ анализа (chiralcel OD-H, 0,2 мл/мин, гексан-2-пропанол (98:2), tR (S)=26,1 мин, tR (S)=28,1 мин; Rf 0.46 (петролейный эфир/этилацетат, 4:1); [α]D=-21.6 (с=0.2, CHCl3); ИК-спектр (чистое вещество) 2936, 2853, 2385, 2348, 1577, 1559, 1489, 1453, 1439, 1421, 1133, 1110, 1057, 1021, 1003, 762, 737 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.29-1.50 (м, 5Н, СН2), 1.74-1.83 (м, 3Н, СН2), 1.90-1.92 (м, 1H, СН2), 2.03-2.05 (м, 1H, СН2), 3.18-3.24 (м, 1Н, СН), 7.35 (т, J=7.5 Гц, 1Н, Наром), 7.41-7.48 (м, 4Н, Наром), 7.58 (д, J=7.8 Гц, 1H, Наром), 7.65-7.68 (м, 2Н, Наром), 8.17-8.20 (м, 1H, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 25.8 (д, J=1.5 Гц, СН2), 26.7 (СН2), 26.8 (СН2), 27.0 (д, J=12.6 Гц, СН2), 28.1 (СН2), 31.3 (д, J=34.7 Гц, СН), 127.4 (д, J=11.0 Гц, Саром), 128.0 (д, J=12.6 Гц, Саром), 128.4 (д, J=67.3 Гц, Саром), 128.5 (д, J=9.9 Гц, Саром), 129.1 (д, J=51.1 Гц, Саром), 130.6 (д, J=2.4 Гц, Саром), 132.4 (д, J=8.7 Гц, Саром), 132.8 (д, J=2.2 Гц, Саром), 134.5 (д, J=4.7 Гц, Саром), 138.3 (д, J=15.1 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 31.3-31.6 (м); МСВР вычислено для C18H23PBBrNa (M+Na)+ 383.0071, найдено 383.0723; Вычислено для C18H23PBBr: С, 59.88; Н, 6.42; Найдено: С, 66.10; Н, 6.16.
С.2. Синтез орто-йодфенилфосфинборана (IV-g, h, i, l):
Общая методика
К раствору вторичного фосфинборана (V) (0,83 ммоль) в сухом ТГФ (2 мл) добавляют по каплям н-BuLi (0,83 ммоль) в атмосфере аргона при температуре -78°C. Полученный раствор перемешивают при данной температуре в течение 1 ч и затем добавляют по каплям 1,2-дийодбензол (VI-c) (1,16 ммоль), после чего добавляют н-BuLi (0,17 ммоль). После одночасового перемешивания при температуре -78°C реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая остаток, который очищают колоночной хроматографией на силикагеле и/или перекристаллизацией. С.2.1. (2-йодфенил)-дифенилфосфинборан (IV-g)
Исходя из вторичного фосфинборана (V-a); Очистка: колоночная хроматография (элюирование смесью петролейный эфир/хлористый метилен, 1:1) и/или перекристаллизация из этилацетата. Белое твердое вещество; выход: 50%; Rf 0.45 (петролейный эфир/хлористый метилен, 1:1); ИК-спектр (чистое вещество) 3051, 2401, 2342, 2245, 1570, 1555, 1480, 1436, 1420, 1311, 1255, 1188, 1165, 1126, 1101, 1054, 1028, 999, 972, 737, 688 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 7.13-7.19 (м, 1H, Наром), 7.20-7.27 (м, 1H, Наром), 7.33-7.40 (м, 1Н, Наром), 7.46-7.60 (м, 6Н, Наром), 7.68-7.75 (м, 4Н, Наром), 8.03 (д.д.д, J=1.1, 3.2, 7.8 Гц, 1H, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 101.2 (д, J=8.4 Гц, Саром), 127.9 (д, J=9.0 Гц, Саром), 128.1 (д, J=58.8 Гц, Саром), 128.9 (д, J=10.2 Гц, Саром), 131.3 (д, J=2.4 Гц, Саром), 132.3 (д, J=2.2 Гц, Саром), 133.3 (д, J=58.6 Гц, Саром), 133.6 (д, J=9.5 Гц, Саром), 136.5 (д, J=10.5 Гц, Саром), 142.7 (д, J=7.1 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 30.5; МСВР вычислено для C18H17PIBNa (M+Na)+ 425.0101, найдено 425.0096; Вычислено для C18H17PIB: С, 53.78; Н, 4.26; Найдено: С, 53.97; Н, 4.36.
С.2.2. (2-йодфенил)-дициклогексилфосфинборан (IV-h)
Синтезируют по той же самой методике, исходя из вторичного фосфинборана (V-b), за исключением того, что после добавления н-BuLi при температуре -78°C полученный раствор перемешивают 10 минут при данной температуре, а затем 20 минут при комнатной температуре.
Очистка: колоночная хроматография (элюирование смесью петролейный эфир/хлористый метилен, 2:1). Белое твердое вещество; выход: 56%; Rf 0.33 (петролейный эфир/хлористый метилен, 2:1); ИК-спектр (чистое вещество) 2919, 2851, 2397, 2352, 1573, 1556, 1447, 1414, 1345, 1064, 1040, 1004, 918, 887, 852, 818, 762, 734, 714, 639 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.00-1.17 (м, 10Н, Нцг), 1.44-1.56 (м, 6Н, Нцг), 1.63-1.67 (м, 2Н, Нцг), 1.76-1.80 (м, 2Н, Нцг), 2.73-2.85 (м, 2Н, Нцг), 6.92 (т.т, J=1.5, 7.5 Гц, 1H, Наром), 7.22 (т.т, J=1.3, 7.5 Гц, 1H, Наром), 7.77 (д.т., J=1.5, 7.9 Гц, 1H, Наром), 7.86 (д.д.д, J=0.9, 7.7, 12.9 Гц, 1H, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 25.7 (д, J=1.2 Гц, СН2), 26.9 (д, J=3.5 Гц, CH2), 27.1 (д, J=2.7 Гц, CH2), 27.8 (CH2), 28.7 (д, J=1.2 Гц, CH2), 32.5 (д, J=31.8 Гц, CH), 99.8 (д, J=2.3 Гц, Наром), 127.9 (д, J=11.2 Гц, Саром), 131.2 (д, J=47.2 Гц, Саром), 132.2 (д, J=2.2 Гц, Саром), 140.8 (д, J=16.0 Гц, Саром), 141.7 (д, J=5.2 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 41.6; МСВР вычислено для C18H29PIBNa (M+Na)+ 437.1040, найдено 437.1012; Вычислено для C18H29PIB: С, 52.21; Н, 7.06; Найдено: С, 52.19; Н, 6.98.
С.2.3. (R)-(2-йодфенил)-(2-метоксифенил)-фенилфосфинборан (IV-j) и свободный фосфин (II-j)
К раствору вторичного фосфинборана (S)-(V-f) (0,19 г, 0,83 ммоль) в сухом ТГФ (2 мл) добавляют по каплям н-BuLi (0,83 ммоль) в атмосфере аргона при температуре -78°C. Полученный раствор перемешивают при данной температуре в течение 1 ч и затем добавляют по каплям 1,2-дийодбензол (VI-c) (0,15 мл, 1,16 ммоль), после чего добавляют н-BuLi (0,17 ммоль). После одночасового перемешивания при температуре -78°C реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая сырой продукт (IV-j), который разбавляют в сухом толуоле (5 мл) в атмосфере аргона. Затем добавляют ДАБЦО (0,28 г, 2,49 ммоль) и полученный раствор перемешивают при комнатной температуре на протяжении ночи. Растворитель упаривают под вакуумом и сырой продукт (II-j) очищают колоночной хроматографией на силикагеле, используя смесь петролейный эфир/этилацетат 3:1 в качестве элюента. Белое твердое вещество; выход 42%; Энантиомерный избыток составляет 95% согласно данным ЯМР1Н и/или31Р спектроскопии соответствующего фосфиноксида с (R)-3,5-динитро-N-(1-фенил-этил)-бензамидом в качестве хирального вещества; Rf 0.45 (петролейный эфир/этилацетат, 3:1); [α]D-24.2 (с=0.4, CHCl3); ИК-спектр (чистое вещество) 3050, 2933, 2835, 1584, 1573, 1554, 1472, 1462, 1431, 1300, 1274, 1241, 1183, 1163, 1130, 1094, 1071, 1043, 1024, 796, 753, 698 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 3.67 (с, 3Н, ОСН3), 6.56 (д.д.д, J=1.7, 4.4, 7.4 Гц, 1Н, Наром), 6.72 (д.т., J=1.9, 7.7 Гц, 1H, Наром), 6.77-6.86 (м, 2Н, Наром), 6.92 (т.д, J=1.7, 7.6 Гц, 1Н, Наром), 7.13-7.32 (м, 7Н, Наром), 7.81 (д.д.д, J=1.1, 3.1, 7.8 Гц, 1Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 55.8 (ОСН3), 107.2 (д, J=41.4 Гц, Саром), 110.4 (д, J=1.5 Гц, Саром), 121.2 (Саром), 125.0 (д, J=12.7 Гц, Саром), 128.1 (Саром), 128.5 (Саром), 128.6 (Саром), 128.9 (Саром), 130.0 (Саром), 130.6 (Саром), 133.9 (Саром), 134.1 (Саром), 134.2 (Саром), 134.5 (Саром), 135.8 (д, J=10.9 Гц, Саром), 139.6 (д, J=3.8 Гц, Саром), 141.9 (д, J=9.0 Гц, Саром), 161.2 (д, J=15.6 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 1.8; МСВР вычислено для C19H16PIONa (M+Na)+ 440.9876, найдено 440.9891; Вычислено для C19H16PIO: С, 54.57; Н, 3.86; Найдено: С, 54.55; Н, 3.90.
С.2.4. (R)-Ферроценил-(2-йодфенил)-фенилфосфинборан (IV-l)
Исходя из вторичного фосфинборана (S)-(V-g); Очистка: Перекристаллизация из смеси гексан/хлористый метилен. Оранжевое твердое вещество; выход 55%; Энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (chiralcel OD-H, 0,5 мл/мин, гексан-2-пропанол (98:2), tR (R)=19.2мин, tR (S)=25,2 мин; Rf 0.54 (петролейный эфир/этилацетат, 3:1); [α]D+207.1 (с=0.6, CHCl3); ИК-спектр (чистое вещество) 3124, 3086, 3052, 2407, 2380, 2350, 1553, 1483, 1426, 1387, 1368, 1335, 1100, 1059, 1027, 1010, 821, 739, 716, 693 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 4.07-4.08 (м, 1H, Ср), 4.09 (с, 5Н, Ср), 4.51-4.52 (м, 1H, Ср), 4.62-4.63 (м, 1Н, Ср), 7.07 (т.т, J=1.6, 7.5 Гц, Наром), 7.14 (д.д.д, J=1.7, 7.8, 11.0 Гц, 1H, Наром), 7.28-7.33 (м, 2Н, Наром), 7.50-7.63 (м, 3Н, Наром), 7.77-7.83 (м, 2Н, Наром), 7.91 (д.д.д, J=1.0, 3.1, 7.8 Гц, 1Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 69.8 (д, J=70.0 Гц, Ср), 70.0 (Ср), 71.7 (д, J=3.7 Гц, Ср), 72.1 (д, J=8.4 Гц, Ср), 72.3 (д, J=6.5 Гц, Ср), 74.9 (д, J=14.9 Гц, Ср), 100.2 (д, J=9.8 Гц, Саром), 127.6 (д, J=8.3 Гц, Саром), 128.6 (д, J=10.5 Гц, Саром), 129.2 (д, J=60.8 Гц, Саром), 131.3 (д, J=2.4 Гц, Саром), 131.7 (д, J=2.1 Гц, Саром), 133.4 (д, J=9.5 Гц, Саром), 135.4 (д, J=9.0 Гц, Саром), 136.0 (д, J=58.3 Гц, Саром), 142.2 (д, J=7.1 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 27.5; МСВР вычислено для C22H21PIBFeNa (M+Na)+ 532.9764, найдено 532.9747; Вычислено для C22H21PIBFe: С, 51.82; Н, 4.15; Найдено: С, 52.03; Н, 4.12.
С.3 Синтез (5)-о-анизилфенил-о-толилфосфинборана прямым алкилированием по орто-положению:

К раствору вторичного фосфинборана (V) (0,5 ммоль) в сухом ТГФ (3 мл) добавляют по каплям н-BuLi (1,25 ммоль; 2,5 экв.) в атмосфере аргона при температуре -78°C. Полученный раствор перемешивают при данной температуре в течение 5 мин и затем добавляют по каплям 1,2-дибромбензол (0,75 ммоль; 1,5 экв.). Через 10 мин перемешивания при температуре -78°C, реакционную смесь гасят MeI (0,5 мл) и перемешивают 10 мин. После гидролиза (1 мл) растворитель отгоняют под вакуумом, а остаток экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая сырой продукт 40, который очищают фильтрованием на коротком слое силикагеля.
Спектр ЯМР1Н (CDCl3): δ (м.д.) 0.80-2.0 (3Н, m), 2.30 (3Н, s), 3.57 (3Н, s), 6.9-8.0 (13Н, m). Спектр ЯМР31Р (121 МГц, CDCl3) δ+18.6 (JPB=56 Гц)
Однако после выделения продукта реакции получена смесь свободного фосфина 41 и его боранового комплекса 40. Эту смесь поместили в этанол и перемешивали на протяжении ночи для проведения полной декомплексации. Выход = 92%.
(S)-(-)-о-Анизилфенил-о-толилфосфин 41
Белые кристаллы (EtOH); Rf=0.68 (толуол). Спектр ЯМР1Н (CDCl3): δ (м.д.) 2.33 (с, 3Н), 3.68 (с, 3Н), 6.53-6.58 (м, 1Н), 6.66-6.70 (м, 1Н), 6.74-6.85 (м, 2Н), 6.95-7.05 (м, 1H), 7.08-7.30 (м, 8Н). Спектр ЯМР13С (CDCl3): δ (м.д.) 21.2 (д,3JPC=21.3), 55.7, 110.2 (д,.JPC=1.7), 121.1, 124.7 (д, JPC=11.6), 125.9, 128.3-128.6, 129.9 (д, JPC=4.6), 130.3, 132.8, 133.7, 134.0, 134.3, 135.3-136.0, 142.3 (д, JPC=26.0), 161.3 (д, JPC=15.7). Спектр ЯМР31Р (CDCl3): δ (м.д.) - 23.1.
Энантиомерную чистоту 41 определяют путем сравнения с рацемическим образцом методом спектроскопии ЯМР31Р в присутствии (+)-ди-μ-хлорбис{2-[1-(диметиламино)-этил]фенил-C,N}дипалладия.
D. Декомпенсация фосфинборанов (IV) с превращением в фосфины (II)



Типовая методика
К раствору орто-бромфосфинборана (IV) (0,5 ммоль) в толуоле (3 мл) добавляют ДАБЦО (1,5 ммоль). Полученный раствор перемешивают в атмосфере аргона при комнатной температуре на протяжении ночи, а затем упаривают растворитель под ваккумом. Сырой продукт (II) очищают флэш-хроматографией на силикагеле и/или перекристаллизацией.
D.1. (R)-(2-бромфенил)-(2-метоксифенил)-фенилфосфин (II-i)
Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 3:1) и перекристаллизация из смеси хлористый метилен/метиловый спирт. Белое твердое вещество; выход 90%; Энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (chiralpak AD, 0,2 мл/мин, гексан/2-пропанол (99:1), tR (R)=30,8 мин, tR (S)=35,0 мин; Rf 0.41 (петролейный эфир/этилацетат, 3:1); [α]D - 20.6 (с=0.5, CHCl3); ИК-спектр (чистое вещество) 3063, 2930, 2833, 1581, 1571, 1553, 1458, 1428, 1298, 1271, 1239, 1162, 1128, 1093, 1069, 1041, 1017, 864, 793, 752 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 3.77 (с, 3Н, ОСН3), 6.78-6.82 (м, 1Н, Наром), 6.65-6.70 (м, 1H, Наром), 6.87-6.96 (м, 2Н, Наром), 7.18-7.24 (м, 2Н, Наром), 7.28-7.43 (м, 6Н, Наром), 7.58-7.63 (м, 1H, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 55.7 (ОСН3), 110.3 (д, J=1.5 Гц, Саром), 121.2 (Саром), 124.5 (д, J=12.4 Гц, Саром), 127.3 (Саром), 128.5 (д, J=7.4 Гц, Саром), 129.0 (Саром), 130.0 (Саром), 130.1 (д, J=32.0 Гц, Саром), 130.6 (Саром), 132.8 (д, J=2.4 Гц, Саром), 133.9 (Саром), 134.1 (Саром), 134.4 (Саром), 135.4 (д, J=10.5 Гц, Саром), 138.5 (д, J=11.4 Гц, Саром), 161.3 (д, J=15.8 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 15.3 (с); МСВР вычислено для C19H16PBrONa [M+Na]+ 393.0014, найдено 393.0006; Вычислено для C19H16PBrO: С, 61.48; Н, 4.34; Найдено: С, 61.37; Н, 4.59.
D.2. (R)-(2-бромфенил)-ферроценилфенилфосфин (II-k)
Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 3:1). Оранжевое твердое вещество; выход 75%; Энантиомерный избыток (после образования комплекса с ВН3) составляет 99% согласно данным ВЭЖХ анализа (chiralcel OD-H, 0,5 мл/мин, гексан/2-пропанол (98:2), tR (R)=19,6 мин, tR (S)=23,2 мин); Rf 0.50 (петролейный эфир/этилацетат, 3:1); [α]D20+207.1 (с=0.6; CHCl3). ИК-спектр (чистое вещество) 3104, 3045, 2926, 2855, 1741, 1552, 1481, 1446, 1436, 1420, 1308, 1270, 1248, 1192, 1163, 1108, 1098, 1016, 1003, 890, 821, 748, 698 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 3.60-3.61 (м, 1Н, Нфер), 3.98 (ш.с, 5Н, Нфер), 4.21-4.23 (м, 1Н, Нфер), 4.29-4.31 (м, 1Н, Нфер), 4.36-4.39 (м, 1H, Нфер), 6.84 (д.т., J=2.1, 7.4 Гц, 1H, Наром), 7.06-7.19 (м, 2Н, Наром), 7.28-7.32 (м, 3Н, Наром), 7.34-7.42 (м, 3Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 69.9 (Сфер), 71.7 (Сфер), 72.3 (Сфер), 72.4 (д, J=7.1 Гц, Сфер), 75.3 (д, J=31.8 Гц, Сфер), 76.5 (д, J=7.6 Гц, Сфер), 128.1 (Саром), 129.0 (д, J=8.0 Гц, Саром), 129.4 (д, J=30.3 Гц, Саром), 129.9 (Саром), 130.9 (Саром), 133.6 (д, J=1.7 Гц, Саром), 134.8 (д, J=1.5 Гц, Саром), 135.2 (д, J=20.6 Гц, Саром), 137.3 (д, J=8.6 Гц, Саром), 142.6 (д, J=14.8 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 16.6 (с); МСВР вычислено для C22H18PBrFe [М]+ 447.9675, найдено 447.9686; Вычислено для C22H18PBrFe: С, 58.84; Н, 4.04; Найдено: С, 59.19; Н,4.05.
D.3. (S)-(2-бромфенил)-изопропилфенилфосфин (II-m)
Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 3:1). Бесцветное масло; выход 82%; Энантиомерный избыток (после образования комплекса с ВН3) 95% согласно данным ВЭЖХ анализа (lux 5 мкм целлюлоза-2, 0,2 мл/мин, гексан/2-пропанол (98:2), tR (S)=39,6 мин, tR (R)=42,3 мин); Rf 0.59 (петролейный эфир/этилацетат, 3:1); [α]D20 - 52.9 (с=0,4; CHCl3) ИК-спектр (чистое вещество) 3054, 2952, 2865, 1556, 1449, 1421, 1384, 1365, 1250, 1228, 1155, 1124, 1096, 1018, 878, 746, 697 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.06 (д.д, J=6.8, 15.5 Гц, 3Н, СН3), 1.20 (д.д, J=6.9, 16.0 Гц, 3Н, СН3), 2.41-2.47 (м, 1Н, СН), 7.19-7.22 (м, 1Н, Наром), 7.32-7.35 (м, 3Н, Наром), 7.37 (т.д, J=1.3, 7.6 Гц, 1H, Наром), 7.46-7.50 (м, 3Н, Наром), 7.59 (д.д.д, J=1.2, 3.4, 8.0 Гц, 1Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 19.3 (д, J=19.6 Гц, СН3), 19.8 (д, J=19.6 Гц, СН3), 25.3 (д, J=9.1 Гц, СН), 127.3 (Саром), 128.3 (2 с, Саром), 128.9 (Саром), 130.0 (Саром), 131.4 (д, J=30.2 Гц, Саром), 132.8 (Саром), 133.3 (д, J=2.6 Гц, Саром), 133.7 (Саром), 133.8 (Саром), 136.6 (д, J=13.0 Гц, Саром), 138.6 (д, J=14.8 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 1.4 (с); МСВР вычислено для C15H16PBrNa [M+Na]+ 329.0065, найдено 329.0057.
Е. Синтез о-боратфосфиновых производных (III-42) и (I-43)
Е.1. Синтез о-боронатфосфинборанов (III-42)

E.1.1. [1, 3, 2]-диоксаборолан-2-ильные производные
Общая методика
К раствору о-бромфосфинборана (IV) (0,50 ммоль) в сухом ТГФ (2 мл) добавляют по каплям н-BuLi (0,55 ммоль) в атмосфере аргона при температуре - 78°C. Полученный раствор перемешивают при данной температуре в течение 1 ч, а затем добавляют по каплям 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан (0,80 ммоль). После перемешивания в течение 30 минут при температуре -78°C и 20 ч при комнатной температуре реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая остаток, который очищают колоночной хроматографией на силикагеле и/или перекристаллизацией.
Е.1.1.1. Дифенил-[2-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]фосфинборан 42а
Исходя из орто-бромфенилфосфинборана (IV-a); Очистка: колоночная хроматография (элюирование смесью петролейный эфир/хлористый метилен, 1:1). Белое твердое вещество; выход: 51%; Rf 0.28 (петролейный эфир/хлористый метилен, 1:1); ИК-спектр (чистое вещество) 2976, 2415, 2373, 2349, 1584, 1481, 1435, 1356, 1320, 1262, 1215, 1144, 1107, 1059, 964, 861, 733, 697, 667, 650 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.95 (с, 12Н, СН3), 7.15-7.22 (м, 2Н, Наром), 7.27-7.42 (м, 8Н, Наром), 7.55-7.62 (м, 4Н, Наром), 7.84 (д.д.д, J=1.4, 2.9, 7.2 Гц, 1H, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 24.7 (СН3), 83.9 (С(СН3)2), 128.3 (д, J=10.3 Гц, Саром), 129.9 (д, J=2.5 Гц, Саром), 130.1 (д, J=10.0 Гц, Саром), 130.6 (д, J=2.5 Гц, Саром), 130.7 (д, J=57.7 Гц, Саром), 133.5 (д, J=9.3 Гц, Саром), 134.4 (д, J=10.5 Гц, Саром), 134.5 (д, J=55.4 Гц, Саром), 136.7 (д, J=11.4 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 25.0; МСВР вычислено для C24H21PB2O2Na (M+Na)+ 425.1991, найдено 425.1975; Вычислено для C24H21PB2O2: С, 71.69; Н, 7.27; Найдено: С, 71.70; Н, 7.06.
Е.1.1.2. Дициклогексил-[2-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]-фосфинборан 42b
Исходя из орто-бромфенилфосфинборана (IV-b); Очистка: колоночная хроматография (элюирование смесью петролейный эфир/хлористый метилен, 1:1) и/или перекристаллизация из смеси метиловый спирт/хлористый метилен. Белое твердое вещество; выход 66%; Rf 0.45 (петролейный эфир/хлористый метилен, 1:1); ИК-спектр (чистое вещество) 2986, 2922, 2849, 2371, 2347, 1446, 1373, 1339, 1317, 1266, 1139, 1107, 1053, 960, 855, 823, 764, 749, 674 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.94-0.99 (м, 10Н, сНех), 1.20 (с, 12Н, СН3), 1.36-1.42 (м, 6Н, сНех), 1.60-1.62 (м, 2Н, сНех), 1.72-1.76 (м, 2Н, сНех), 2.39-2.52 (м, 2Н, сНех), 7.21-7.25 (м, 2Н, Наром), 7.66-7.70 (м, 1Н, Наром), 7.88 (д.д.д, J=1.7, 6.9, 13.3 Гц, 1H, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 25.1 (СН3), 25.8 (д, J=1.0 ГЦ, СН2), 27.0 (д, J=8.3 Гц, СН2), 27.2 (д, J=8.5 Гц, СН2), 27.6 (СН2), 28.6 (СН2), 33.8 (д, J=32.9 Гц, СН), 84.4 (С(СН3)2), 129.6 (д, J=2.4 Гц, Наром), 130.4 (д, J=12.1 Гц, Наром), 133.1 (д, J=47.7 Гц, Наром), 136.7 (д, J=8.1 Гц, Наром), 137.4 (д, J=16.9 Гц, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 34.0; МСВР вычислено для C24H41PB2O2Na (M+Na)+ 437.2931, найдено 437.2905; Вычислено для C24H41PB2O2: С, 69.60; Н, 9.98; Найдено: С, 69.49; Н, 10.06.
Е.1.1.3. (S)-Ферроценил-фенил-[2-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]фосфинборан 42с
Исходя из орто-бромфенилфосфинборана (R)-(IV-k); Очистка: колоночная хроматография (элюирование смесью петролейный эфир/хлористый метилен, 2:1). Оранжевое твердое вещество; выход 43%; Энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (chiralcel OD-H, 0,2 мл/мин, гексан-2-пропанол (98:2), tR (R)=27,2 мин, tR (S)=29,7 мин; Rf=0.32 (петролейный эфир/хлористый метилен, 2:1); [α]D+116.7 (с=0.3, CHCl3); ИК-спектр (чистое вещество) 2979, 2927, 2855, 2396, 1480, 1352, 1320, 1266, 1171, 1145, 1109, 1054, 1028, 860, 824, 740, 697 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.93-1.03 (2 с, 12Н, СН3), 3.91-3.92 (м, 1H, Ср), 4.06 (с, 5Н, Ср), 4.38-4.39 (м, 1H, Ср), 4.47-4.48 (м, 1H, Ср), 4.69-4.70 (м, 1H, Ср), 7.14-7.40 (м, 6Н, Наром), 7.57-7.63 (м, 2Н, Наром), 7.73-7.77 (м, 1H, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 24.6-24.7 (2 с, СН3), 69.8 (Ср), 71.2 (д, J=68.6 Гц, Ср), 71.6 (д, J=4.0 Гц, Ср), 71.8 (д, J=5.7 Гц, Ср), 72.3 (д, J=4.6 Гц, Ср), 74.4 (д, J=13.6 Гц, Ср), 83.8 (С(СН3)2), 127.8 (д, J=10.4 Гц, Саром), 129.4 (д, J=2.4 Гц, Саром), 129.7 (д, J=9.4 Гц, Саром), 130.2 (д, J=2.4 Гц, Саром), 132.2 (д, J=60.6 Гц, Саром), 133.0 (д, J=9.6 Гц, Саром), 133.6 (д, J=9.2 Гц, Саром), 136.4 (д, J=11.3 Гц, Саром), 137.2 (д, J=54.9 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 20.8; МСВР вычислено для C28H33PB2O2FeNa (M+Na)+ 533.1656, найдено 533.1654; Вычислено для C28H33PB2O2Fe: С, 65.94; Н, 6.52; Найдено: С, 65.73; Н, 6.45.
Е.1.2. Дициклогексилборанильные производные
Общая методика
К раствору орто-бромфосфинборана (IV) (0,50 ммоль) в сухом ТГФ (2 мл) добавляют по каплям н-BuLi (0,55 ммоль) в атмосфере аргона при температуре -78°C. Полученный раствор перемешивают при данной температуре в течение 1 ч, а затем добавляют по каплям хлордициклогексилборан 56b (1М раствор в гексане) (0,80 ммоль). После перемешивания в течение 30 минут при температуре -78°C и 20 ч при комнатной температуре реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая остаток, который очищают колоночной хроматографией на силикагеле.
Е.1.2.1. (2-Дициклогексилборанилфенил)-дифенилфосфинборан 42d
Исходя из орто-бромфенилфосфинборана (IV-a). Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 3:1). Белое твердое вещество; выход: 71%; Rf 0.57 (петролейный эфир/этилацетат, 3:1); ИК-спектр (чистое вещество) 2914, 2842, 2779, 2494, 2449, 2158, 1437, 1106, 688 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.78-0.95 (м, 2Н, Нцг), 1.05-1.09 (м, 10Н, Нцг), 1.50-1.69 (м, 10Н, Нцг), 7.14-7.26 (м, 2Н, Наром), 7.29-7.32 (м, 1H, Наром), 7.43-7.57 (м, 11H, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 27.4 (СН2), 28.4 (СН2), 28.7 (СН2), 31.0 (СН2), 31.9 (СН2), 33.5 (СН), 125.5 (д, J=8.7 Гц, Саром), 127.8 (Саром), 128.4 (д, J=62.8 Гц, Саром), 128.7 (д, J=10.6 Гц, Саром), 130.3 (д, J= 2.9 Гц, Саром), 130.5 (д, J=8.5 Гц, Саром), 131.3 (д, J=2.6 Гц, Саром), 132.8 (д, J=5.8 Гц, Саром), 133.3 (д, J=9.6 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 13.6; МСВР вычислено для C30H39PB2Na (M+Na)+ 475.2878, найдено 475.2869; Вычислено для С30Н39РВ2: С, 79.68; Н, 8.69; Найдено: С, 79.80; Н, 8.99.
Е.1.2.2. Дициклогексил-(2-дициклогексилборанилфенил)фосфинборан 42е
Исходя из орто-бромфенилдициклогексилфосфинборана (IV-b). Очистка: колоночная хроматография (элюирование смесью петролейный эфир/хлористый метилен, 3:1). Белое твердое вещество; выход 55%; Rf 0.63 (петролейный эфир/хлористый метилен, 3:1); ИК-спектр (чистое вещество) 2918, 2845, 2455, 2412, 2148, 1442, 1272, 1169, 1128, 1082, 1004, 889, 852, 755 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.88-1.08 (м, 4Н, Нцг), 1.15-1.50 (м, 20Н, Нцг), 1.65-1.85 (м, 16Н, Нцг), 1.98-2.15 (м, 4Н, Нцг), 7.20-7.27 (м, 2Н, Наром), 7.31-7.41 (м, 2Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 25.8 (СН2), 26.7 (СН2), 26.9-27.0 (м, СН2), 27.5 (м, СН2), 28.8 (д, J=25.3 Гц, СН2), 31.7 (д, J=16.8 Гц, СН2), 33.0 (д, J=36.0 Гц, СН), 34.0 (СН), 124.8 (д, J=8.0 Гц, Наром), 126.5 (д, J=60.8 Гц, Наром), 129.7 (д, J=2.8 Гц, Наром), 130.4 (д, J=4.8 Гц, Наром), 130.7 (д, J=14.7 Гц, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 18.0; МСВР вычислено для C30H51PB2Na (M+Na)+ 487.3817, найдено 487.3789; Вычислено для C30H51PB2: С, 77.60; Н, 11.07; Найдено: С, 77.41; Н, 11.20.
Е.1.2.3. (S)-Ферроценил-(2-дициклогексилборанил-фенил)фосфинборан 42f
Исходя из ферроценил-(о-бромфенил)-фенилфосфинборана (R)-(IV-k).
Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 3:1). Оранжевое твердое вещество; выход 60%; Энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (chiralpak AD, 0,2 мл/мин, гексан-2-пропанол (98:2), tR (R)=21,2 мин, tR (S)=24,7 мин; Rf 0.62 (петролейный эфир/этилацетат, 3:1); [α]D - 51.4 (с=0.4, CHCl3). ИК-спектр (чистое вещество) 2915, 2843, 2468, 2418, 2200, 1436, 1179, 1171, 1108, 1027, 1000, 967, 838, 751, 742, 691 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.77-0.80 (м, 6Н, Нцг), 0.98-0.99 (м, 2Н, Нцг), 1.10-1.19 (м, 5Н, Нцг), 1.32-1.40 (м, 4Н, Нцг), 1.46-1.47 (м, 1Н, Нцг), 1.59-1.66 (м, 4Н, Нцг), 3.80-3.81 (м, 1Н, Нфер), 4.20 (с, 5Н, Нфер), 4.31-4.32 (м, 1Н, Нфер), 4.38-4.39 (м, 1Н, Нфер), 4.41-4.42 (м, 1H, Нфер), 7.11-7.14 (м, 3Н, Наром), 7.27-7.32 (м, 1Н, Наром), 7.36-7.44 (м, 3Н, Наром), 7.66-7.72 (м, 2Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 27.3 (д, J=27.8 Гц, СН2), 28.4 (д, J=24.5 Гц, СН2), 28.8 (д, J=19.5 Гц, СН2), 31.0 (д, J=12.9 Гц, СН2), 31.8 (д, J=15.3 Гц, СН2), 33.4 (СН), 69.7 (Сфер), 70.0 (д, J=75.6 Гц, Сфер), 70.9 (д, J=7.3 Гц, Сфер), 72.2 (д, J=14.8 Гц, Сфер), 72.7 (д, J=8.7 Гц, Сфер), 73.0 (д, J=6.1 Гц, Сфер), 125.2 (д, J=8.5 Гц, Саром), 128.2 (д, J=64.4 Гц, Саром), 128.4 (д, J=10.5 Гц, Саром), 129.9 (д, J=2.7 Гц, Саром), 130.3 (д, J=15.5 Гц, Саром), 130.6 (д, J=68.9 Гц, Саром), 131.0 (д, J=2.4 Гц, Саром), 132.1 (д, J=5.5 Гц, Саром), 132.7 (д, J=9.4 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 8.3; МСВР вычислено для C34H43PB2FeNa (M+Na)+ 583.2542, найдено 583.2550; Вычислено для C34H43PB2Fe: С, 72.90; Н, 7.74; Найдено: С, 73.20; Н, 7.94.
Е.2. Синтез свободного о-боронатфосфина (I-43)

Синтез (S)-(2-метоксифенил)-фенил-[2-(4,4,5,5-тетраметил-[1,3,2] диоксаборолан-2-ил)-фенил]фосфин 43i
К раствору орто-бромфенилфосфина (R)-(II-i) (0,15 г, 0.41 ммоль) в сухом ТГФ (2 мл) добавляют по каплям н-BuLi (0,45 ммоль) в атмосфере аргона при температуре -78°C. Полученный раствор перемешивают при данной температуре в течение 30 минут, а затем по каплям добавляют борпроизводное (2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан) (0,13 мл, 0,66 ммоль).

После перемешивания в течение 30 минут при температуре -78°C и 20 ч при комнатной температуре реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая остаток, который очищают колоночной хроматографией на силикагеле, используя смесь петролейный эфир/этилацетат (5:1) в качестве элюента. Получено белое твердое вещество с выходом 58%. Энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (chiralpak AD, 0,2 мл/мин, гексан-2-пропанол (99:1), tR (R)=26,4 мин, tR (S)=34,1 мин; Rf 0.33 (петролейный эфир/этилацетат, 5:1); [α]D=-21.2 (с=0,3, CHCl3); ИК-спектр (чистое вещество) 3053, 2978, 2932, 1583, 1471, 1430, 1379, 1347, 1313, 1271, 1240, 1143, 1101, 1047, 1024, 963, 858, 744, 697 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.01-1.02 (2 с, 12Н, СН3), 3.68 (с, 3Н, ОСН3), 6.60 (д.д.д, J=1.7, 4.3, 7.4 Гц, 1Н, Наром), 6.71-6.82 (м, 3Н, Наром), 7.18-7.24 (м, 8Н, Наром), 7.72-7.76 (м, 1Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 24.5-24.6 (2 с, СН3), 55.7 (ОСН3), 83.8 (С(СН3)2), 110.0 (д, J=1.5 Гц, Саром), 121.0 (Саром), 127.0 (Саром), 127.2 (д, J=13.9 Гц, Саром), 128.3 (д, J=7.3 Гц, Саром), 128.4 (Саром), 130.0 (Саром), 130.4 (Саром), 132.1 (д, J=1.2 Гц, Саром), 134.0 (Саром), 134.4 (Саром), 134.7 (Саром), 135.5 (д, J=9.0 Гц, Саром), 138.0 (д, J=11.7 Гц, Саром), 143.5 (д, J=19.0 Гц, Саром), 161.4 (д, J=15.8 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 15.4; МСВР вычислено для C25H28PBO3Na (M+Na)+ 419.1946, найдено 419.1932; Вычислено для C25H28PBO3: С, 71.79; Н, 6.75; Найдено: С, 71.60; Н, 6.56.
F. Синтез о-карбинолфосфиновых производных (III-44) и (I-45)
F.1. Синтез о-карбинолфосфинборанов (III-44)


Общая методика
К раствору орто-бромфосфинборана (IV) (0,4 ммоль) в сухом ТГФ (2 мл) добавляют н-бутиллитий при температуре -78°C (0,44 ммоль, 1,1 экв.). После перемешивания в течение 1 ч при температуре -78°C добавляют по каплям раствор альдегида (0,8 ммоль, 2 экв. (бензальдегид 57а) или 1,6 ммоль, 4 экв. (триметилуксусный альдегид 57b)) в сухом ТГФ (0,5 мл). Реакционную смесь перемешивают в течение 1,5 ч, постепенно отогревая ее до комнатной температуры, затем гидролизуют водой (2 мл) и экстрагируют хлористым метиленом (3×5 мл). Объединенные органические вытяжки высушивают над MgSO4 и упаривают растворитель на вакууме, получая диастереомерную смесь, которую очищают и разделяют на хроматографической колонке с силикагелем, используя смесь этилацетат/петролейный эфир в качестве элюента.
F.1.1. (Sp)-[2-(Ферроценилфенилфосфинборан)-фенил]фенилметанол 44а/44а'
Из 185 мг (R)-ферроценил-о-бромфенилфосфинборана (IV-k) и 170 мг бензальдегида получают соответствующий гидроксифосфинборан 44b и 44b' с суммарным выходом 71% и диастереомерным соотношением 44а/44а' (45:55).
(Sp,S)-[2-(Ферроценилфенилфосфиноборан)фенил]фенилметанол 44а
Оранжевое твердое вещество - Rf=0.65 (этилацетат/петролейный эфир, 1:9).
Тпл=70-72°C.
Энантиомерный избыток составляет >99%*; [α]D=+31.0 (с=0,2; CHCl3).
ИК-спектр (см-1): 3499 (ОН), 3057-2855 (С-Н), 2429 (ВН), 2053, 1983, 1950, 1886, 1670, 1590, 1570, 1499, 1471, 1453, 1438, 1412, 1381, 1348, 1314, 1264, 1226, 1197, 1185, 1172, ИЗО, 1107, 1065, 1034, 1019, 1003, 958, 887, 816, 768, 699.
Спектр ЯМР1Н (300 МГц, CDCl3): δ (м.д.)=1.35-1.91 (м, 3Н, ВН3), 4.10 (с, 5Н, Fc), 4.13 (с, 1H, Fc), 4.20 (с, 1Н, Fc), 4.56 (с, 1H, Fc), 6.14 (с, 1Н, СНОН), 6.76-6.79 (м, 2Н, Наром), 6.78-7.04 (м, 1Н, Наром), 7.09-7.15 (м, 3Н, Наром), 7.17-7.21 (м, 2Н, Наром), 7.33-7.38 (м, 1Н, Наром), 7.47-7.65 (м, 2Н, Наром).
Спектр ЯМР13С (75 МГц, CDCl3): δ (м.д.)=69.8 (д, J=3.8 Гц, Fc), 69.9 (Fc), 70.7 (д, J=7.5 Гц, Fc), 71.6 (д, J=2.3 Гц, Fc), 72.2 (д, J=2.3 Гц, Fc), 72.3 (д, J=17.3 Гц, Fc), 74.8 (д, J=16.6 Гц, СНОН), 126.0 (Саром), 126.7 (Саром), 127.3 (Саром), 127.8 (Саром), 128.5 (д, J=3.8 Гц, Саром), 129 (д, J=8.3 Гц, Саром), 130.3 (д, J=16.6 Гц, Саром), 130.7 (д, J=8.3 Гц, Саром), 131.0 (д, J=12.0 Гц, Саром), 131.5 (д, J=2.3 Гц, Саром), 131.7 (д, J=2.3 Гц, Саром), 132.4 (д, J=6.0 Гц, Саром), 132.6 (д, J=9.8 Гц, Саром), 133.1 (д, J=9.8 Гц, Саром).
Спектр ЯМР31Р (121 МГц, CDCl3): δ (м.д.)=+13.7 (с).
Мол. масса вычислена для C29H28BFeNaOP [M+Na]+: 513.1218, найдено 513.1214.
* Энантиомерную чистоту определяют методом ВЭЖХ на хиральной колонке (Chiralcel OD-H, гексан/изопропанол (98:2), 0,8 мл/мин, λ=254 нм, 20°C, tR (Rp, Rc)=21,7 мин, tR (Sp, Rc)=25,9 мин, tR (Sp, Sc)=34,9 мин, tR (Rp, Sc)=49 мин.
(Sp,R)-[2-(Ферроценилфенилфосфиноборан)-фенил]фенилметанол 44a'
Оранжевое твердое вещество - Rf=0.65 (этилацетат/петролейный эфир, 1:9); Тпл=172-174°С.
Энантиомерный избыток составляет >99%*; [α]D=-85 (с=0,2; CHCl3).
ИК-спектр (см-1):3509 (ОН), 3088-2907 (С-Н), 2394 (ВН), 1705, 1606, 1568, 1495, 1472, 1449, 1437, 1371, 1318, 1262, 1232, 1171, 1126, 1107, 1068, 1017, 1003, 935, 919, 897, 839, 817, 768, 749, 735, 700, 654.
Спектр ЯМР1Н (300 МГц, CDCl3): δ (м.д.)=1.23-1.30 (м, 3Н, ВН3), 4.10 (с, 5Н, Fc), 4.12 (с, 1H, Fc), 4.56 (с, 1H, Fc), 4.66 (с, 1H, Fc), 4.79 (с, 1Н, Fc), 6.14 (с, 1H, СНОН), 6.76-6.79 (м, 2Н, Наром), 6.98-7.09 (м, 1H, Наром), 7.12-7.18 (м, 3Н, Наром), 7.20-7.21 (м, 2Н, Наром), 7.33-7.38 (м, 1H, Наром), 7.51-7.63 (м, 3Н, Наром), 7.86-7.93 (м, 2Н, Наром).
Спектр ЯМР13С (75 МГц, CDCl3): δ (м.д.)=69.8 (д, J=3.8 Гц, Fc), 69.9 (Fc), 70.7 (д, J=7.5 Гц, Fc), 71.6 (д, J=2.3 Гц, Fc), 72.1 (д, J=2.3 Гц, Fc), 72.2 (д, J=17.3 Гц, Fc), 74.8 (д, J=16.5 Гц, СНОН), 126 (Саром), 126.7 (Саром), 127.3 (Саром), 127.8 (Саром), 128.5 (д, J=3.8 Гц, Саром), 129.0 (д, J=8.3 Гц, Саром), 130.3 (д, J=16.6 Гц, Саром), 130.7 (д, J=8.3 Гц, Саром), 131.1 (д, J=12 Гц, Саром), 131.0 (д, J=2.5 Гц, Саром), 131.8 (д, J=2.2 Гц, Саром), 132.1 (д, J=6.1 Гц, Саром), 132.6 (д, J=9.7 Гц, Саром), 133.1 (д, J=9.7 Гц, Саром).
Спектр ЯМР31Р (121 МГц, CDCl3): δ (м.д.)=+14.2 (с).
Мол. масса вычислена для C29H28BFeNaOP [M+Na]+: 513.1218, найдено 513.1214.
* Энантиомерную чистоту определяют методом ВЭЖХ на хиральной колонке (Chiralcel OD-H, гексан/изопропанол (98:2), 0,8 мл/мин, λ=254 нм, 20°C, tR (Rp, Rc)=21,7 мин, tR (Sp, Rc)=25,9 мин, tR (Sp, Sc)=34,9 мин, tR (Rp, Sc)=49 мин.
F.1.2. (Rp)-[2-(Ферроценилфенилфосфиноборан)-фенил]фенилметанол 44b и 44b'
Из 185 мг (S)-ферроценил-о-бромфенилфосфинборана (IV-k) и 170 мг бензальдегида получают соответствующий гидроксифосфинборан 44b и 44b' с суммарным выходом 72% и диастереомерным соотношением 44b/44b' 64:26.
(Rp,R)-[2-(Ферроценилфенилфосфиноборан)-фенил]фенилметанол 44b'
Оранжевое твердое вещество - Rf 0.65 (этилацетат/петролейный эфир, 1:9);
Тпл=172-174°C.
Энантиомерный избыток составляет >99%*; [α]D=-30.1 (с=0.2; CHCl3).
ИК-спектр (см-1):3572 (ОН), 3057-2922 (С-Н), 2391 (ВН), 1590, 1494, 1436, 1412, 1367, 1313, 1171, 1130, 1108, 1060, 1025, 823,763,744, 730, 698.
Спектр ЯМР1Н (300 МГц, CDCl3): δ (м.д.)=1.23-1.70 (м, 3Н, ВН3), 4.08 (с, 5Н, Fc), 4.17 (с, 1Н, Fc), 4.56 (с, 1Н, Fc), 4.66 (с, 1H, Fc), 4.90 (с, 1Н, Fc), 6.33 (д, J=2.7 Гц, 1H, СНОН), 7.05-7.10 (м, 1H, Наром), 7.17-7.24 (м, 1H, Наром), 7.27-7.30 (м, 2Н, Наром), 7.31-7.32 (м, 2Н, Наром), 7.33-7.40 (м, 3Н, Наром) 7.57-7.64 (м, 3Н, Harrom), 7.89-7.96 (м, 2Н, Наром).
Спектр ЯМР13С (75 МГц, CDCl3): δ (м.д.)=69.4 (д, J=70.2 Гц, Fc), 69.9 (Fc), 71.1 (д, J=6.8 Гц, Fc), 71.4 (д, J=3 Гц, Fc), 72.1 (д, J=6.8 Гц, Fc), 72.4 (д, J=8.3 Гц, Fc), 75 (д, J=16.6 Гц, СНОН), 126.2 (Саром), 126.8 (Саром), 127.4 (д, J=51 Гц, Саром), 127.6 (д, J=13.6 Гц, Саром), 127.9 (Саром), 128.6 (Саром), 129.1 (д, J=9.8 Гц, Саром), 130.8 (д, J=8.3 Гц, Саром), 131.0 (д, J=27.9 Гц, Саром), 131.6 (Саром), 131.9 (д, J=2.3 Гц, Саром), 132.0 (Саром), 132.7 (д, J=7.5 Гц, Саром), 132.9 (д, J=2.3 Гц, Саром).
Спектр ЯМР31Р (121 МГц, CDCl3): δ (м.д.)=+16.19 (с).
Мол. масса вычислена для C29H28BFeNaOP [M+Na]+: 513.1218, найдено 513.1221.
* Энантиомерную чистоту определяют методом ВЭЖХ на хиральной колонке (Chiralcel OD-H, гексан/изопропанол (98:2), 0,8 мл/мин, λ=254 нм, 20°C, tR (Rp, Rc)=21,7 мин, tR (Sp, Rc)=25,9 мин, tR (Sp, Sc)=34,9 мин, tR (Rp, Sc)=49 мин.
(Rp,S)-[2-(Ферроценилфенилфосфинборан)фенил]фенилметанол 44b
Оранжевое твердое вещество - Rf 0.66 (этилацетат/петролейный эфир, 1:9);
Тпл=92-94°С.
Энантиомерный избыток составляет >99%*-[α]D=+62 (с=0.2; CHCl3).
ИК-спектр (см-1): 3498 (ОН), 3055 (С-Н), 2424 (ВН), 1588, 1470, 1436, 1410, 137, 1312, 1261, 1182, 1170, 1105, 1063, 1031, 1017, 1001, 828, 766, 738, 697, 657, 639.
Спектр ЯМР1Н (300 МГц, CDCl3): δ (м.д.)=0.86-1.34 (м, 3Н, ВН), 4.11 (с, 5Н, Fc), 4.14 (с, 1H, Fc), 4.57 (с, 1H, Fc), 4.66 (с, 1H, Fc), 4.80 (с, 1H, Fc), 6.15 (д, J=3 Гц, 1Н, СНОН), 6.78-6.99 (м, 2Н, Наром), 7.01-7.20 (м, 1Н, Наром), 7.14-7.22 (м, 5Н, Наром), 7.33-7.42 (м, 1Н, Наром), 7.51-7.63 (м, 3Н, Наром), 7.87-7.94 (м, 2Н, Наром).
Спектр ЯМР13С (75 МГц,CDCl3): δ (м.д.)=69.0 (д, J=72.4 Гц, Fc), 69.9 (Fc), 70.7 (д, J=7.5 Гц, Fc), 71.6 d, J=2.3 Гц, Fc), 72.2 (д, J=2.3 Гц, Fc), 72.3 (д, J=17.3 Гц, Fc), 74.8 (д, J=17.4 Гц, СНОН), 126.0 (Саром), 126.7 (Саром), 127.3 (д, J=8.3 Гц, Саром), 127.7 (Саром), 128.8 (д, J=10.6 Гц, Саром), 130.3 (д, J=17.4 Гц, Саром), 130.7 (д, J=8.3 Гц, Саром), 131.0 (д, J=12.1 Гц, Саром), 131.5 (д, J=2.3 Гц, Саром), 131.7 (д, J=2.3 Гц, Саром), 132.4 (д, J=6 Гц, Саром), 133.1 (д, J=9.8 Гц, Саром), 141.0 (д, J=11.3 Гц, Саром), 146.6 (д, J=11.3 Гц, Саром).
Спектр ЯМР31Р (121 МГц, CDCl3): δ (м.д.)=+12.8 (с).
Мол. масса вычислена для C29H28BFeNaOP [M+Na]+: 513.1218, Найдено: 513.1233.
Энантиомерную чистоту определяют методом ВЭЖХ на хиральной колонке (Chiralcel OD-H, гексан/изопропанол (98:2), 0,8 мл/мин, λ=254 нм, 20°C, tR (Rp, Rc)=21,7 мин, tR (Sp, Rc)=25,9 мин, tR (Sp, Sc)=34,9 мин, tR (Rp, Sc)=49 мин.
F.1.3. Синтез (R)-трет-6утил-(2-ферроценилфенилфосфинборан)фенилметанола 44c и 44c'
Из 185 мг (S)-ферроценилфенил-о-бромфенилфосфинборана (IV-k) и 138 мг триметилуксусного альдегида получают соответствующий гидроксифосфинборан 44с и 44с' с суммарным выходом 66% и диастереомерным соотношением 44с/44с' 60:40.
(Rp,Rc)-изо-Бутил-(2-ферроценилфенилфосфиноборан)фенилметанол 44с':
Оранжевое твердое вещество - Rf 0.56 (этилацетат/петролейный эфир, 1:9);
Тпл=170-172°C
Энантиомерный избыток составляет >99%*-[α]D=-214 (с=0,2; CHCl3).
ИК-спектр (см-1):3553 (ОН), 2957-2900 (СН), 2396 (ВН), 1568, 1464, 1438, 1416, 1395, 1362, 1311, 1292, 1235, 1197, 1171 (ОСН3), 1108, 1062, 1027, 1001, 829, 741, 699.
Спектр ЯМР1Н (300 МГц, CDCl3): δ (м.д.)=0.61 (с, 9Н, СН3) 1.44-1.72 (м, 3Н, ВН3), 4.05 (с, 5Н, Fc), 4.23 (с, IH, Fc), 4.55 (с, 1Н, Fc), 4.61 (с, 1H, Fc), 4.68 (с, 1H, Fc), 4.86 (д, J=3.9 Гц, 1Н, СНОН), 7.0-7.07 (м, 1Н, Наром), 7.14-7.20 (м, 1Н, Наром), 7.39-7.45 (м, 1H, Наром), 7.55-7.57 (м, 3Н, Наром) 7.70-7.77 (м, 1Н, Наром), 7.89-7.94 (м, 2Н, Наром).
Спектр ЯМР13С (75 МГц, CDCl3): δ (м.д.)=26.7 (СН3), 69.9 (Fc), 70.1 (д, J=72.4 Гц, Fc), 71.7 (д, J=2.3 Гц, С(СН3)3), 72.0 (д, J=6 Гц, Fc), 72.2 (д, J=9 Гц, Fc), 74.9 (д, J=16.6 Гц, СНОН), 76 (д, J=8.3 Гц, Fc), 127.0 (д, J=8.3 Гц, Саром), 128.4 (д, J=10.6 Гц, Саром), 128.7 (д, J=8.3 Гц, Саром), 130.3 (Саром), 130.8 (д, J=2.3 Гц, Саром), 130.9 (Саром), 131.5 (д, J=2.3 Гц, Саром), 131.6 (Саром), 132.7 (д, J=6.8 Гц, Саром), 133.4 (д, J=9 Гц, Саром).
Спектр ЯМР31Р (121 МГц, CDCl3): δ (м.д.)=+13.3 (м).
Мол. масса вычислена для C27H32BFeOPNa [M+Na]+: 493.1531, найдено 493.1547.
* Энантиомерную чистоту определяют методом ВЭЖХ на хиральной колонке (Chiralpack AD, гексан/изопропанол (99:1), 1 мл/мин, λ=254 нм, 20°C, tR (Sp, Rc или Sc)=13,4 мин, tR (Rp, Sc)=14,7 мин), tR (Sp, Rc или Sc)=34,9 мин, tR (Rp, Rc)=50,9 мин).
(Rp,S)-изо-Бутил-(2-ферроценилфенилфосфиноборан)фенилметанол 44с:
Оранжевое твердое вещество - Rf 0.35 (этилацетат/петролейный эфир, 1:9); Тпл=160-162°C.
Энантиомерный избыток составляет >99%*-[α]D=-232 (с=0.2; CHCl3).
ИК-спектр (см-1): 3585 (ОН), 2950 (С-Н), 2420 (ВН), 2364, 2161, 2069, 1587, 1479, 1435, 1261, 1230, 1205, 1171, 107, 1070, 1056, 1026, 1002, 907, 857, 826, 781, 764, 749, 728, 704,683.
Спектр ЯМР1Н (300 МГц,CDCl3): δ (м.д.)=0.94 (с, 9Н, СН3) 1.33-1.74 (м, 3Н, ВН3), 4.01 (с, 5Н, Fc), 4.04 (с, 1H, Fc), 4.50 (с, 1Н, Fc), 4.62 (с, 1H, Fc), 4.73 (с, 1Н, Fc), 4.88 (д, J=3.9 Гц, 1H, СНОН), 6.98-7.05 (м, 1H, Наром), 7.16-7.21 (м, 1H, Наром), 7.40-7.45 (м, 1H, Наром), 7.53-7.63 (м, 4Н, Наром), 7.73-7.85 (м, 2Н, Наром).
Спектр ЯМР13С (75 МГц,CDCl3): δ (м.д.)=26.7 (СН3), 69.9 (Fc), 70.8 (д, J=70.2 Гц, Fc), 71.3 (д, J=9.8 Гц, Fc), 72.1 (д, J=6 Гц, Fc), 75.2 (д, J=16.6 Гц, СНОН), 76.9 (СН3)3), 127.0 (д, J=9 Гц, Fc), 128.5 (д, J=7.5 Гц, Саром), 128.8 (д, J=9.7 Гц, Саром), 131.0 (д, J=78.5 Гц, Саром), 132.0 (д, J=35.5 Гц, Саром), 132.6 (д, J=9 Гц, Саром), 133.4 (д, J=7.5 Гц, Саром), 146.4 (д, J=7.6 Гц, Саром).
Спектр ЯМР31Р (121 МГц, CDCl3): δ (м.д.)=+17.1 (м).
Мол. масса вычислена для C27H32BFeNaOP [M+Na]+: 493.1531, найдено 493.1528.
* Энантиомерную чистоту определяют методом ВЭЖХ на хиральной колонке (Chiralpack AD, гексан/изопропанол (98:2), 0,5 мл/мин, λ=254 нм, 20°C, tR (Sp, Rc или Sc)=13,4 мин, tR (Rp, Sc)=14,7 мин, tR ((Sp, Rc или Sc)=34,9 мин, tR (Rp, Rc)=50,9 мин).
F.2. Синтез свободных о-карбинолфосфинов


F.2.1. Синтез (R)-[2-(о-анизилфенилфосфин)фенил]фенилметанолов 45d и 45d'
Из 135 мг (S)-о-анизил-о-бромфенилфенилфосфина (II-i) и 170 мг бензальдегида 57а получают соответствующие гидроксифосфины 45d и 45d' с суммарным выходм 45% и диастереомерным соотношением 45d/45d' 78:22.
(R)-[2-(о-анизилфенилфосфин)-фенил]фенилметанол 45d:
Белое твердое вещество - Rf 0.46 (этилацетат/петролейный эфир, 1:9); Тпл=68-70°C.
Энантиомерный избыток составляет >99%*-[α]D=+123 (с=0.2; CHCl3).
ИК-спектр (см-1):3409 (ОН), 3054-2834 (С-Н), 2332, 2157, 2037, 1882, 1583, 1573, 1493, 1461, 1430, 1296, 1272, 1240, 1179, 1160, 1128, 1069, 1019, 916, 881, 850, 824, 793, 746, 696. Спектр ЯМР1Н (300 МГц, CDCl3): δ (м.д.)=3.71 (с, 3Н, ОСН3), 6.31 (с, 1H, СНОН), 6.59-6.64 (м, 1Н, Наром), 6.70 (д, J=6.9 Гц, 1Н, Наром), 6.78-6.88 (м, 2Н, Наром), 6.96-7.0 (м, 1H, Наром), 7.13-7.22 (м, 4Н, Наром), 7.32-7.38 (м, 5Н, Наром), 7.47-7.50 (м, 2Н, Наром), 7.51-7.60 (м, 1Н, Наром), 7.67-7.74 (м, 1Н, Наром).
Спектр ЯМР13С (75 МГц, CDCl3): δ (м.д.)=55.7 (ОСН3), 73.4 (д, J=24.9 Гц, СНОН), 110.2 (д, J=2.3 Гц, Саром), 111.8 (д, J=6.8 Гц, Саром), 121.0 (Саром), 121.2 (д, J=11.3 Гц, Саром), 124.8 (д, J=9.8 Гц, Саром), 126.7 (д, J=2.3 Гц, Саром), 126.8 (д, J=6.8 Гц, Саром), 127.8 (д, J=15.0 Гц, Саром), 127.9 (Саром), 128.5 (д, J=18.8 Гц, Саром), 128.6 (Саром), 129.5 (Саром), 130.4 (Саром), 131.2 (Саром), 133.9 (д, J=7.5 Гц, Саром), 134.2 (д, J=8.3 Гц, Саром), 136.0 (д, J=9.0 Гц, Саром), 141.8 (Саром), 143.5 (Саром), 148.7 (д, J=24.1 Гц, Саром).
Спектр ЯМР31Р (121 МГц, CDCl3): δ (м.д.)=-28.1 (с).
Мол. масса вычислена для C24H27NaO2P [M+Na]+: 421.1328, найдено 421.1345.
* Энантиомерную чистоту определяют методом ВЭЖХ на хиральной колонке (Lux 5 мкм целлюлоза-2, гексан/изопропанол (90:10), 1 мл/мин, λ=254 нм, 20°C, tR ((Sp, Rc или Sc)=8,7 мин, tR (Rp, Rc или Sc)=10,9 мин, tR (Sp, Rc или Sc)=15,7 мин, tR (Rp, Rc или Sc)=21,3 мин).
(R)-[2-(о-анизилфенилфосфин)фенил]фенилметанол 45d':
Белое масло - Rf 0.30 (этилацетат/петролейный эфир, 1:9). Энантиомерный избыток составляет >99%*-[α]D=-47 (с=0.2; CHCl3).
ИК-спектр (см-1):3355 (ОН), 3058-2836 (С-Н), 1952, 1899, 1812, 1584, 1573, 1494; 1471, 1453, 1431, 1296, 1273, 1240, 1179, 1162, 1128, 1107, 1069, 1019, 915, 881, 852, 821, 794, 742, 695, 649.
Спектр ЯМР1Н (300 МГц, CDCl3): δ (м.д.)=3.66 (с, 3Н, ОСН3), 5.52 (д, J=8 Гц, 1H, СНОН), 6.74-6.80 (м, 1H, Наром), 6.81-7.08 (м, 2Н, Наром), 7.12-7.24 (м, 6Н, Наром), 7.27-7.42 (м, 5Н, Наром), 7.47-7.67 (м, 2Н, Наром), 7.72-7.78 (м, 2Н, Наром).
Спектр ЯМР13С (75 МГц, CDCl3): δ (м.д.)=55.8 (ОСН3), 73 (д, J=24.9 Гц, СНОН), 110.4 (д, J=2.4 Гц, Саром), 111.5 (д, J=6.8 Гц, Саром), 121 (Саром), 121.2 (д, J=11.2 Гц, Саром), 124.3 (Саром), 126.8 (д, J=2.3 Гц, Саром), 126.9 (д, J=6.7 Гц, Саром), 127.8 (д, J=15 Гц, Саром), 128 (Саром), 128.5 (д, J=18.8 Гц, Саром), 128.6 (Саром), 129.5 (Саром), 130.2 (Саром), 133.2 (Саром), 133.6 (д, J=18.1 Гц, Саром), 134.1 (д, J=9.8 Гц, Саром), 134.7 (д, J=10.7 Гц, Саром), 141.8 (Саром), 142.8 (Саром), 149 (д, J=23.8 Гц, Саром).
Спектр ЯМР31Р (121 МГц,CDCl3): δ (м.д.)=-26.8 (с).
Мол. масса вычислена для C24H27NaO2P [M+Na]+: 421.1328, найдено 421.1346.
* Энантиомерную чистоту определяют методом ВЭЖХ на хиральной колонке (Lux 5 мкм целлюлоза-2, гексан/изопропанол (90:10), 1 мл/мин, λ=254 нм, 20°C, tR(Sp,Rc или Sc)=8,7 мин, tR (Rp, Rc или Sc)=10,9 мин, tR (Sp, Rc или Sc)=15,7 мин, tR (Rp, Rc или Sc)=21,3 мин).
F.2.2. Синтез (R)-трет-бутил-(2-о-анизилфенилфосфин)фенилметанолов 45е и 45е'
Из 135 мг (S)-о-анизил-о-бромфенилфенилфосфина (IV-i) и 138 мг триметилуксусного альдегида 57b получают соответствующие гидроксифосфины 45е и 45е' с суммарным выходом 50% и диастереомерным соотношением 45е/45е' 38:62.
(R)-трет-Бутил-(2-о-анизилфенилфосфин)фенилметанола 45е:
Белое твердое вещество - Rf 0.46 (этилацетат/петролейный эфир, 1:9); Тпл=76-78°C.
Энантиомерный избыток составляет >99%*-[α]D=+189 (с=0.2; CHCl3).
ИК-спектр (см-1):3594 (ОН), 2952-2835 (С-Н), 1573, 1462, 1430, 1361, 1273, 1462, 1430, 1361, 1273, 1240, 1161, 1069, 1002, 745, 696.
Спектр ЯМР1Н (300 МГц, CDCl3): δ (м.д.)=1.04 (с, 9Н, СН3) 3.74 (с, 1Н, ОСН3), 5.5 (д, J=7.5 Гц, 1H, СНОН), 6.69-6.88 (м, 1H, Наром), 6.90-6.97 (м, 3Н, Наром), 7.14-7.21 (м, 3Н, Наром), 7.31-7.36 (м, 5Н, Наром), 7.61-7.63 (м, 1H, Наром).
Спектр ЯМР13С (75 МГц, CDCl3): δ (м.д.)=26.4 (СН3), 55.8 (ОСН3), 78.1 (д, J=25.6 Гц, СНОН), 110.4 (д, J=1.5 Гц, Саром), 112.0 (д, J=6.8 Гц, Саром), 121.1 (Саром), 121.3 (д, J=11.3 Гц, Саром), 126.8 (д, J=12.8 Гц, Саром), 127.4 (Саром), 128.3 (д, J=6.0 Гц, Саром), 128.6 (Саром), 130.1 (Саром), 132.9 (Саром), 133.7 (д, J=20.4 Гц, Саром), 134.7 (д, J=2.3 Гц, Саром), 135.4 (д, J=14.3 Гц, Саром), 136.2 (д, J=11.3 Гц, Саром), 147.8 (д, J=23.4 Гц, Саром) 160.7 (д, J=15.8 Гц, Саром).
Спектр ЯМР31Р (121 МГц, CDCl3): δ (м.д.)=-24.6 (с).
Мол. масса вычислена для C24H27NaO2P [M+Na]+: 401.1641, найдено 401.1653.
* Энантиомерную чистоту определяют методом ВЭЖХ на хиральной колонке (Lux 5u целлюлоза-2, гексан/изопропанол (98:2), 1 мл/мин, λ=254 нм, 20°C, tR (Rp, Rc или Sc)=7,3 мин, tR (Sp, Rc или Sc)=8,4 мин, tR (Sp, Rc или Sc)=10,2 мин, tR (Rp, Rc или Sc)=12,7 мин).
(R)-трет-Бутил-(2-о-анизилфенилфосфин)фенилметанол 45е':
Белое твердое вещество; Rf 0.34 (этилацетат/петролейный эфир, 1:9); Тпл=70-72°C.
Энантиомерный избыток составляет >99%*-[α]D=+108 (с=0.2; CHCl3).
ИК-спектр (см-1):3576-3448 (ОН), 3054-2834 (С-Н), 2340, 1725, 1583, 1573, 1461, 1430, 1393, 1361, 1271, 1240, 1180, 1161, 1128, 1089, 1068, 1041, 1024, 1001, 935, 903, 879, 850, 824, 794, 746, 732, 697.
Спектр ЯМР1Н (300 МГц,CDCl3): δ (м.д.)=1.01 (с, 9Н, СН3) 3.07 (с, 1Н, ОСН3), 5.58 (д, J=8.1 Гц, 1Н, СНОН), 6.61-6.65 (м, 1Н, Наром), 6.84-6.89 (м, 2Н, Наром), 6.96-7.19 (м, 1H, Наром), 7.14-7.19 (м, 1Н, Наром), 7.32-7.40 (м, 7Н, Наром), 7.62-7.64 (м, 1Н, Наром).
Спектр ЯМР13С (75 МГц, CDCl3): δ (м.д.)=27.0 (СН3), 52.4 (С(СН3)3), 54.4 (ОСН3), 80.3 (д, J=4.7 Гц, СНОН), 110.4 (д, J=6.8 Гц, Саром), 110.7 (д, J=6.0 Гц, Саром), 119.8 (д, J=12.0 Гц, Саром), 125 (д, J=13.6 Гц, Саром), 128.1 (д, J=12.1 Гц, Саром), 128.2 (д, J=12.8 Гц, Саром), 129.1 (д, J=10.6 Гц, Саром), 129.6 (д, J=8.3 Гц, Саром), 130.2 (д, J=18.9 Гц, Саром), 130.9 (д, J=3.0 Гц, Саром), 131.4 (д, J=2.3 Гц, Саром), 132.0 (д, J=9.8 Гц, Саром), 132.9 (д, J=14.3 Гц, Саром), 133.7 (д, J=16.6 Гц, Саром) 134.2 (д, J=1.5 Гц, Саром), 134.4 (д, J=8.3 Гц, Саром).
Спектр ЯМР31Р (121 МГц, CDCl3): δ (м.д.)=-26.8 (с).
Мол. масса вычислена для C24H27NaO2P [M+Na]+: 401.1641, найдено 401.1629.
* Энантиомерную чистоту определяют методом ВЭЖХ на хиральной колонке (Lux 5 мкм целлюлоза-2, гексан/изопропанол (98:2), 1 мл/мин, λ=254 нм, 20°C, tR (Rp, Rc или Sc)=7,3 мин, tR ((Sp, Rc или Sc)=8,4 мин, tR (Sp, Rc или Sc)=10.2 мин, tR (Rp, Rc или Sc)=12,7 мин).
G. Синтез о-ациларилфосфиновых производных (I-46)

о-(трет-бутилкарбонил)фенил]дифенилфосфин (I-46)
К раствору (2-бромфенил)дифенилфосфина (II-а) (0,50 ммоль) в сухом ТГФ (2 мл) добавляют по каплям н-BuLi (0,55 ммоль) в атмосфере аргона при температуре -78°C. Полученный раствор перемешивают при данной температуре в течение 1 ч и затем добавляют по каплям хлорангидрид пивалиновой кислоты (0,80 ммоль). После перемешивания при комнатной температуре на протяжении ночи реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая остаток, который очищают колоночной хроматографией на силикагеле, используя смесь петролейный эфир/этилацетат (3:1) в качестве элюента. Получено белое твердое вещество с выходом 78%; Rf=0.43 (петролейный эфир/этилацетат, 3:1); ИК-спектр (чистое вещество) 3049, 2967, 2928, 2867, 1686, 1585, 1477, 1458, 1431, 1389, 1361, 1283, 1192, 967, 947, 778, 741, 691 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.35 (с, 9Н, CH3), 7.18-7.22 (м, 1H, Наром), 7.25-7.40 (м, 13Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 27.7 (д, J=3.3 Гц, СН3), 44.7 (С(СН3)3), 124.8 (д, J=8.6 Гц, Саром), 128.3 (Саром), 128.5 (д, J=4.9 Гц, Саром), 128.7 (Саром), 133.3 (Саром), 133.5 (Саром), 134.6 (д, J=15.8 Гц, Саром), 134.8 (д, J=2.2 Гц, Саром), 137.0 (д, J=10.4 Гц, Саром), 148.0 (д, J=35.8 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 10.4; МСВР вычислено для C23H23PONa [M+Na]+ 369.1379, найдено 369.1382.
Н. Синтез о-силилфосфиновых производных (I-47)

H.1. Синтез о-силилфосфинов 47a, d
H.1.1. (R)-(2-метоксифенил)фенил-(2-триметилсилилфенил)фосфин 47a
К раствору (R)-(2-бромфенил)-(2-метоксифенил)фенилфосфина (II-i) (0,19 г, 0,50 ммоль) в сухом ТГФ (2 мл) добавляют по каплям н-BuLi (0,55 ммоль) в атмосфере аргона при температуре -78°C. Полученный раствор перемешивают при данной температуре в течение 1 ч и затем добавляют по каплям триметилсилилхлорид (0,10 мл, 0,80 ммоль). После отогревания до комнатной температуры и перемешивания в течение 20 ч реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая остаток, который очищают колоночной хроматографией на силикагеле, используя смесь петролейный эфир/хлористый метилен (2:1) в качестве элюента.
Белое твердое вещество; выход 49%; Энантиомерный избыток составляет >95% по данным спектроскопии ЯМР31Р соответствующего фосфиноксида с (R)-3,5-динитро-N-(1-фенил-этил)-бензамидом в качестве хирального вещества; Rf 0.38 (петролейный эфир/хлористый метилен, 2:1); [α]D+1.6 (с=0,9, CHCl3); ИК-спектр (чистое вещество) 3057, 2960, 2900, 1583, 1572, 1472, 1431, 1272, 1242, 1182, 1160, 1125, 1114, 1021, 834, 753, 743 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.20 (д, J=1.5 Гц, SiCH3), 3.53 (с, 3Н, OCH3), 6.48 (д.д.д, J=1.8, 4.2, 7.5 Гц, 1Н, Наром), 6.65-6.71 (м, 2Н, Наром), 6.91-6.93 (м, 1H, Наром), 7.00-7.06 (м, 4Н, Наром), 7.10-7.17 (м, 4Н, Наром), 7.44-7.45 (м, 1H, Наром), Спектр ЯМР13С (75.5 МГц, CDCl3) δ - 0.1 (д, J=9.6 Гц, SiCH3), 54.3 (ОСН3), 109.0 (д, J=1.4 Гц, Саром), 119.6 (Саром), 125.9 (д, J=13.3 Гц, Саром), 126.7 (Саром), 126.8 (д, J=0.9 Гц, Саром), 126.9 (Саром), 127.0 (Саром), 127.7 (Саром), 128.7 (Саром), 132.1 (Саром), 132.4 (Саром), 133.3 (д, J=16.2 Гц, Саром), 133.7 (д, J=1.2 Гц, Саром), 136.3 (д, J=11.4 Гц, Саром), 141.7 (д, J=11.3 Гц, Саром), 146.3 (д, J=47.2 Гц, Саром), 159.6 (д, J=15.5 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 20.6; МСВР вычислено для C22H25POSiNa (M+Na)+ 387.1304, найдено 387.1296; Вычислено для C22H25POSi: С, 72.49; Н, 6.91; Найдено: С, 72.19; Н, 7.02.
Н.1.2. Дифенил-(2-триметилсилилфенил)фосфин 47d
К раствору о-йодфосфинборана (IV-g) (0,19 г, 0,47 ммоль) в сухом ТГФ (2 мл) добавляют по каплям изо-PrMgCl⋅LiCl (0,28 мл, 0,52 ммоль) в атмосфере аргона при -20°C. Полученный раствор перемешивают при данной температуре в течение 1 ч и затем добавляют по каплям триметилсилилхлорид (0,09 мл, 0,71 ммоль). После перемешивания в течение 30 минут при -20°C и 20 ч при комнатной температуре реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая остаток, который очищают колоночной хроматографией на силикагеле, используя смесь петролейный эфир/этилацетат (3/1) в качестве элюента, получая соответствующий силилированный фосфин. Бесцветное масло; выход 25%. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.26 (д, J=1.5 Гц, 9Н, CH3Si), 7.08-7.18 (м, 13Н, Наром), 7.50-7.54 (м, 1H, Наром); Спектр ЯМР31Р (121 МГц, CDCl3) δ - 10.2 (с).
Н.2. Синтез дифосфина 47b с мостиковой силановой группой
Общая методика:
К раствору орто-бромфосфина (II) (0,50 ммоль) в сухом ТГФ (3 мл) добавляют по каплям н-BuLi (0,55 ммоль) в атмосфере аргона при температуре -78°C. Полученный раствор перемешивают при данной температуре в течение 1 ч и затем добавляют по каплям дихлордиметилсилан (0,23 ммоль). После перемешивания при комнатной температуре на протяжении ночи реакционную смесь гасят водой (10 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4, фильтруют и упаривают растворитель, получая остаток, который очищают колоночной хроматографией на силикагеле и/или перекристаллизацией.
Н.2.1. Дифосфин 47b:
Очистка: колоночная хроматография (элюирование смесью хлористый метилен/петролейный эфир, 3:1) и перекристаллизация из смеси метиловый спирт/хлористый метилен. Белое твердое вещество; выход: 52%; Rf 0.28 (хлористый метилен/петролейный эфир, 3:1); ИК-спектр (чистое вещество) 3045, 2966, 1583, 1478, 1431, 1251, 1108, 831, 809, 737, 694 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.63 (т, J=1.5 Гц, 6Н, SiCH3), 6.90-6.95 (м, 8Н, Наром), 7.06-7.21 (м, 18Н, Наром), 7.64-7.68 (м, 2Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 2.58 (т, J=10.1 Гц, SiCH3), 127.9 (Саром), 128.1 (д, J=6.1 Гц, Саром), 128.2 (Саром), 129.1 (Саром), 133.2 (д, J=18.8 Гц, Саром), 135.2 (Саром), 136.3 (д.д, J=2.8, 16.0 Гц, Саром), 138.4 (д, J=13.3 Гц, Саром), 143.0 (д, J=12.0 Гц, Саром), 148.0 (д.д, J=3.3, 47.5 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 11.2; МСВР вычислено для C38H34P2SiNa [M+Na]+ 603.1797, найдено 603.1778.
Н.2.2. Дифосфин 47с
Очистка: колоночная хроматография (элюирование смесью хлористый метилен/петролейный эфир, 3:1). Белое твердое вещество; выход: 61%; Rf 0.10 (хлористый метилен/петролейный эфир, 3:1); [α]D-34.0 (с=0,3, CHCl3) (ее=99%); ИК-спектр (чистое вещество) 3049, 2954, 2833, 1575, 1467, 1271, 1239, 1110, 1023, 814, 741, 695 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.74-0.75 (м, 6Н, SiCH3), 3.66 (с, 6Н, OCH3), 6.66 (д.д.д, J=1.7, 4.1, 7.3 Гц, 2Н, Наром), 6.82-6.86 (м, 4Н, Наром), 7.04-7.07 (м, 6Н, Наром), 7.17-7.32 (м, 12Н, Наром), 7.64-7.66 (м, 2Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 2.62 (д.д, J=8.7, 12.6 Гц, SiCH3), 55.5 (ОСН3), 110.3 (Саром), 120.8 (Саром), 127.3 (д, J=14.2 Гц, Саром), 127.8 (Саром), 127.9 (д, J=6.2 Гц, Саром), 128.7 (Саром), 129.7 (Саром), 133.5 (Саром), 133.6 (Саром), 133.9 (Саром), 134.9 (Саром), 136.4 (д.д, J=2.1, 15.7 Гц, Саром), 137.5 (д, J=11.9 Гц, Саром), 142.7 (д, J=11.3 Гц, Саром), 147.1 (д.д, J=2.5, 47.1 Гц, Саром), 160.8 (д, J=17.7 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 20.0.
I. Синтез 1,2-дифосфинбензолов (I-48)


I.1. Синтез с использованием хлорфосфинов
Общая методика
К раствору орто-бромарилфосфина (II) (0,54 ммоль) в ТГФ (2 мл) добавляют при температуре -78°C в атмосфере аргона н-BuLi (1,6 М раствор в гексане) (0,37 мл, 0,59 ммоль) и полученный раствор перемешивают при данной температуре в течение 1 ч. После чего добавляют хлорфосфин (0,65 ммоль) при температуре -78°C и раствор перемешивают при комнатной температуре на протяжении ночи. После гашения водой смесь экстрагируют хлористым метиленом (3×5 мл) и органические вытяжки высушивают над MgSO4. Растворитель упаривают под вакуумом, получая остаток, который очищают на хроматографической колонке с силикагелем и/или перекристаллизацией.
I.1.1. (Sp)-1-Дифенилфосфин-2-(о-анизилфенилфосфин)бензол 48а
Очистка: колоночная хроматография (элюирование смесью петролейный эфир/хлористый метилен, 3:1). Аналитически чистый образец получают перекристаллизацией из смеси хлористый метилен/метиловый спирт. Белое твердое вещество; выход 70%; Энантиомерный избыток 99% согласно данным ВЭЖХ анализа (chiralpak AD, 0,2 мл/мин, гексан/2-пропанол (99:1), tR (S)=44,5 мин, tR (R)=61,9 мин); Rf 0.18 (петролейный эфир/хлористый метилен, 3:1); [α]D+58.6 (с=0.3, CHCl3); ИК-спектр (чистое вещество): 3048, 1581, 1571, 1469, 1431, 1299, 1272, 1240, 1180, 1160, 1129, 1090, 1069, 1022, 793, 743, 719 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 3.57 (с, 3Н, OCH3), 6.56 (д.д.д, J=1.7, 4.4, 7.4 Гц, 1H, Наром), 6.67-6.75 (м, 2Н, Наром), 6.90-7.00 (м, 2Н, Наром), 7.04-7.22 (м, 18Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 55.6 (ОСН3), 110.2 (д, J=1.5 Гц, Саром), 120.8 (Саром), 125.9 (д.д, J=6.7, 13.9 Гц, Саром), 128.1 (Саром), 128.2 (Саром), 128.3 (Саром), 129.0 (Саром), 130.0 (Саром), 133.6 (Саром), 133.7 (Саром), 133.8 (Саром), 133.9 (Саром), 134.0 (Саром), 134.1 (Саром), 134.2 (Саром), 134.3 (Саром), 136.5 (д.д, J=4.9, 11.0 Гц, Саром), 137.4 (д.д, J=5.1, 12.1 Гц, Саром), 143.3 (д.д, J=10.7, 21.7 Гц, Саром), 143.6 (д.д, J=9.5, 32.5 Гц, Саром), 161.0 (д, J=15.3 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 14.0 (д, J=164.8 Гц), - 23.6 (д, J=164.8 Гц); МСВР вычислено для C31H26OP2Na [M+Na]+ 499.1351, найдено 499.1375.
I.1.2. (Sp)-1-дициклогексилфосфин-2-(о-анизилфенилфосфин)бензол 48b
Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 3:1). Белое твердое вещество; выход 47%; Энантиомерный избыток 99% согласно данным ВЭЖХ анализа (Lux 5 мкм целлюлоза 2, 0,5 мл/мин, гексан/2-пропанол (98:2), tR (S)=7,6 мин, tR (R)=10,7 мин); Rf 0.62 (петролейный эфир/этилацетат, 3:1); [α]D+57.1 (с=0.3, CHCl3); ИК-спектр (чистое вещество) 2922, 2847, 1582, 1571, 1471, 1445, 1430, 1241, 1041, 836, 752, 695 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.00-1.20 (м, 10Н, Нцг), 1.48-1.79 (м, 12Н, Нцг), 3.62 (с, 3Н, OCH3), 6.54 (д.д.д, J=1.5, 3.6, 7.2 Гц, 1Н, Наром), 6.73-6.85 (м, 3Н, Наром), 7.09-7.7.27 (м, 9Н, Наром), 7.43-7.47 (м, 1Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 26.4 (д, J=8.6 Гц, СН2), 27.0-27.5 (м, СН2), 28.8 (д, J=7.8 Гц, СН2), 29.1 (д, J=10.5 Гц, СН2), 34.0 (д.д, J=5.4, 14.7 Гц, СН), 34.9 (д.д, J=4.3, 15.4 Гц, СН), 55.6 (ОСН3), 110.1 (Саром), 120.8 (Саром), 127.5 (д.д, J=9.1, 17.7 Гц, Саром), 127.8 (Саром), 128.0-128.1 (м, Саром), 128.6 (Саром), 129.7 (Саром), 132.4 (д.д, J=2.2, 6.2 Гц, Саром), 133.4 (д, J=7.5 Гц, Саром), 134.2 (Саром), 134.3 (Саром), 134.6 (Саром), 137.3 (д.д, J=3.8, 15.2 Гц, Саром), 141.7 (д.д, J=17.0, 31.2 Гц, Саром), 146.2 (д.д, J=8.2, 32.4 Гц, Саром), 160.8 (д, J=15.8 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 12.2 (д, J=167.8 Гц), - 23.2 (д, J=167.8 Гц); МСВР вычислено для C31H38OP2Na [M+Na]+ 511.2290, найдено 511.2295.
I.1.3. (Sp)-1-диизопропилфосфин-2-(о-анизилфенилфосфин)бензол 48с
Очистка: колоночная хроматография (элюирование смесью петролейный эфир/этилацетат, 3:1). Бесцветное вязкое масло; выход 43%; энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (Lux 5 мкм целлюлоза 2, 0.3 мл/мин, гексан/2-пропанол (98:2), tR (S)=12,8 мин, tR (R)=14,7 мин); Rf 0.63 (петролейный эфир/этилацетат, 3:1); [α]D+85.0 (с=0.5 CHCl3); ИК-спектр (чистое вещество) 2948, 2864, 1572, 1461, 1429, 1271, 1240, 1180, 1104, 1070, 1025, 879, 746 см-1. Спектр ЯМР1Н (300 МГц, C6D6) δ 0.90 (д.д, J=7.2, 12.0 Гц, 3Н, CH3), 1.12 (д.д5 J=7.2, 10.8 Гц, 3Н, CH3), 1.24 (д.д, J=7.2, 13.8 Гц, 3Н, CH3), 1.36 (д.д, J=7.2, 14.4 Гц, 3Н, CH3), 2.12-2.18 (м, 2Н, СН), 3.30 (с, 3Н, OCH3), 6.61 (д.д, J=4.4, 8.1 Гц, 1H, Наром), 6.86 (т, J=7.4 Гц, 1Н, Наром), 7.06-7.11 (м, 2Н, Наром), 7.18-7.24 (м, 5Н, Наром), 7.31-7.33 (м, 1H, Наром), 7.46-7.48 (м, 1Н, Наром), 7.57-7.60 (м, 2Н, Наром). Спектр ЯМР13С (75.5 МГц, C6D6) δ 19.2 (д, J=9.3 Гц, СН3), 19.5 (д, J=12.5 Гц, СН3), 20.1 (д, J=18.7, СН3), 20.2 (д.д, J=1.9, 18.6 Гц, СН3), 24.3 (д.д, J=5.6, 15.7 Гц, СН), 25.0 (д.д, J=4.5, 16.6 Гц, СН), 54.9 (ОСН3), 110.1 (Саром), 121.0 (Саром), 128.1 (Саром), 128.2 (Саром), 128.3 (Саром), 128.8 (Саром), 129.7 (Саром), 132.2 (д, J=2.3 Гц, Саром), 132.3 (д, J=2.8 Гц, Саром), 133.4 (д, J=7.8 Гц, Саром), 134.6 (Саром), 134.9 (Саром), 135.0 (Саром), 138.2 (д.д, J=4.9, 14.7 Гц, Саром), 142.1 (д, J=19.4 Гц, Саром), 142.3 (д, J=18.8 Гц, Саром), 147.1 (д.д, J=11.2, 32.7 Гц, Саром), 161.2 (д, J=15.1 Гц, Саром). Спектр ЯМР31Р (121 МГц, C6D6) δ - 3.7 (д, J=165.0 Гц), - 20.7 (д, J=165.0 Гц); МСВР вычислено для C25H30OP2Na [M+Na]+ 431.1664, найдено 431.1682.
I.1.4. (Sp)-1-ди(о-толил)фосфин-2-(о-анизил-фенилфосфин)бензол 48d
Очистка: колоночная хроматография (элюирование смесью толуол/петролейный эфир, 3:1) и перекристаллизация из смеси хлористый метилен/метиловый спирт.Белое твердое вещество; выход 37%; Энантиомерный избыток 99% согласно данным ВЭЖХ анализа (Lux 5 мкм целлюлоза 2, 0,5 мл/мин, гексан/2-пропанол (98:2), tR (с)=8,2 мин, tR (R)=9,6 мин); Rf 0.39 (толуол/петролейный эфир, 3:1); [α]D+73.0 (с=0.2, CHCl2); ИК-спектр (чистое вещество) 3050, 2929, 2834, 1573, 1469, 1429, 1272, 1241, 1130, 1108, 1070, 1025, 745 см-1. Спектр ЯМР1Н (300 МГц, C6D6) δ 2.38 (с, 3Н, CH3), 2.54 (с, 3Н, CH3), 3.23 (с, 3Н, OCH3), 6.56 (д.д, J=4.2, 7.8 Гц, 1Н, Наром), 6.82-6.85 (м, 1Н, Наром), 7.01-7.26 (м, 14Н, Наром), 7.27-7.30 (м, 2Н, Наром), 7.38-7.39 (м, 1H, Наром), 7.53-7.55 (м, 1H, Наром). Спектр ЯМР13С (75.5 МГц, C6D6) δ 21.1 (д, J=21.1 Гц, СН3), 21.3 (д, J=21.1 Гц, СН3), 54.9 (ОСН3), 126.0 (д, J=5.7 Гц, Саром), 126.9 (д.д, J=6.9, 16.0 Гц, Саром), 128.1 (Саром), 128.2 (Саром), 128.3 (д, J=3.1 Гц, Саром), 128.5 (д, J=6.9 Гц, Саром), 129.1 (д, 4.6 Гц, Саром), 129.8 (Саром), 130.2 (2d, J=5.1 Гц; J=4.7 Гц, 2Саром), 133.7 (Саром), 133.9 (Саром), 134.0 (д, J=6.9 Гц, Саром), 134.1 (д, J=7.0 Гц, Саром), 134.2 (Саром), 134.4 (Саром), 134.6 (Саром), 136.1-136.3 (м, Саром), 137.5 (д.д, J=4.7, 13.6 Гц, Саром), 142.7 (2 д.д., J=9.9, 34.0 Гц; J=15.2, 26.7 Гц, 2Саром), 155.7 (д.д, J=11.1, 32.8 Гц, Саром), 162.2 (д, J=15.3 Гц, Саром). Спектр ЯМР31Р (121 МГц, C6D6) δ - 22.0 (д, J=172.5 Гц), - 26.3 (д, J=172.5 Гц); МСВР вычислено для С33Н31ОР2 [М+Н]+ 505.1845, найдено 505.1841.
I.1.5. (Sp)-1-ди(пара-толил)фосфин-2-(орто-анизил-фенилфосфин)бензол 48е
Очистка: колоночная хроматография (элюирование смесью толуол/петролейный эфир, 2:1). Белое твердое вещество; выход 52%; Энантиомерный избыток 99% согласно данным ВЭЖХ анализа (Lux 5 мкм целлюлоза 2, 0,5 мл/мин, гексан/2-пропанол (90:10), tR (S)=8,0 мин, tR (R)=10,9 мин); Rf 0.17 (толуол/петролейный эфир, 2:1); [α]D+58.0 (с=0,3, CHCl3); ИК-спектр (чистое вещество) 3046, 2963, 2919, 1572, 1496, 1470, 1429, 1396, 1260, 1240, 1184, 1090, 1020, 803, 750, 696 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 2.32-2.33 (2 с, 6Н, CH3), 3.67 (с, 3Н, OCH3), 6.62 (д.д.д, J=1.7, 4.3, 7.4 Гц, 1H, Наром), 6.76-6.84 (м, 2Н, Наром), 6.99-7.31 (м, 18Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 20.2 (СН3), 20.3 (СН3), 54.5 (ОСН3), 109.1 (д, J=1.3 Гц, Саром), 119.7 (Саром), 125.0 (д.д, J=6.5, 13.9 Гц, Саром), 127.0 (Саром), 127.1 (Саром), 127.6 (Саром), 127.8 (Саром), 127.9 (д, J=3.0 Гц, Саром), 128.0 (д, J=2.7 Гц, Саром), 128.8 (Саром), 132.6 (д, J=7.6 Гц, Саром), 132.7-133.2 (м, Саром), 135.6 (д.д, J=4.8, 11.5 Гц, Саром), 136.9 5Саром), 137.0 (Саром), 142.2 (д.д, J=10.1, 31.6 Гц, Саром), 143.2 (д.д, J=11.2, 32.4 Гц, Саром), 160.0 (д, J=15.4 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 15.4 (д, J=162.8 Гц), - 24.1 (д, J=162.8 Гц); МСВР вычислено для C33H30OP2Na [M+Na]+ 527.1664, найдено 527.1687.
I.1.6. (Sp)-1-ди(пара-трифторметилфенил)фосфин-2-(о-анизилфенилфосфин)бензол 48f
Очистка: колоночная хроматография (элюирование смесью толуол/петролейный эфир, 2:1). Белое твердое вещество; выход 58%; энантиомерный избыток 99% согласно данным ВЭЖХ анализа (Lux 5 мкм целлюлоза 2, 0,3 мл/мин, гексан/2-пропанол (90:10), tR (S)=11,3 мин, tR (R)=13,1мин); Rf 0.56 (толуол/петролейный эфир, 2:1); [α]D+52.9 (с=0,3, CHCl3); ИК-спектр (чистое вещество) 3050, 2933, 1431, 1397, 1320, 1242, 1163, 1120, 1105, 1059, 1015, 830, 750, 696 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 3.57 (с, 3Н, OCH3), 6.48-6.52 (м, 1Н, Наром), 6.65-6.74 (м, 2Н, Наром), 6.90-7.01 (м, 2Н, Наром), 7.06-7.25 (м, 12Н, Наром), 7.35 (д, J=7.8 Гц, 2Н, Наром), 7.41 (д, J=7.8 Гц, 2Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 55.6 (ОСН3), 120.9 (Саром), 124.0 (2q, J=272.4 Гц, 2CF3), 124.9-125.1 (м, Саром), 128.2 (Саром), 128.4 (д, J=7.3 Гц, Саром), 128.7 (Саром), 129.1 (Саром), 129.3 (Саром), 129.6 (Саром), 130.4 (Саром), 130.5 (q, J=32.4 Гц, Саром), 133.9-134.2 (м, Саром), 134.5 (Саром), 135.6 (д.д, J=4.5, 10.1 Гц, Саром), 140.8 (д, J=9.8 Гц, Саром), 141.3-141.8 (м, Саром), 144.2 (д.д, J=10.5, 32.8 Гц, Саром), 161.0 (д, J=15.4 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 14.5 (д, J=164.5 Гц), - 24.0 (д, J=164.5 Гц); Спектр ЯМР19F (282 МГц, CDCl3) δ - 62.8 (2 с, CF3); МСВР вычислено для C33H24OF6P2Na [M+Na]+ 635.1099, найдено 635.1103.
I.1.7. (Rp)-1-дифенилфосфин-2-(ферроценилфенилфосфин)бензол 48g
К раствору (S)-ферроценил-(2-бромфенил)фенилфосфина (II-k) (0,20 г, 0,45 ммоль) в ТГФ (2 мл) добавляют при температуре -78°C в атмосфере аргона н-BuLi (1,6 М раствор в гексане) (0,37 мл, 0.50 ммоль) и полученный раствор перемешивают при данной температуре в течение 1 ч. После чего добавляют хлордифенилфосфин (0,09 мл, 0,54 ммоль) при температуре -78°C и раствор перемешивают при комнатной температуре на протяжении ночи. После гашения водой смесь экстрагируют хлористым метиленом (3×5 мл) и органические вытяжки высушивают над MgSO4. Растворитель упаривают под вакуумом, получая остаток, который очищают на хроматографической колонке с силикагелем, используя смесь толуол/петролейный эфир (1:1) в качестве элюента, и перекристаллизацией из смеси хлористый метилен/ацетон.
Очистка: колоночная хроматография (элюирование смесью толуол/петролейный эфир, 1:1) и перекристаллизация из смеси хлористый метилен/ацетон. Оранжевое твердое вещество; выход: 56%; Энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (Lux 5 мкм целлюлоза 2, 1,0 мл/мин, гексан/2-пропанол (98:2), tR (S)=5,5 мин, tR (R)=7,9 мин); Rf 0.34 (толуол/петролейный эфир, 1:1); [α]D-55.5 (с=0,2, CHCl3); ИК-спектр (чистое вещество) 3048, 1585, 1567, 1478, 1433, 1307, 1193, 1158, 1106, 1069, 1025, 1000, 888 см-1. Спектр ЯМР1Н (300 МГц, C6D6) δ 4.04 (с, 1H, Ср), 4.19 (с, 5Н, Ср), 4.22 (с, 1Н, Ср), 4.26 (с, Ср), 4.37 (с, 1H, Ср), 7.04-7.18 (м, 11Н, Наром), 7.30-7.34 (м, 3Н, Наром), 7.54-7.56 (м, 5Н, Наром). Спектр ЯМР13С (75.5 МГц, C6D6) δ 69.4 (Сфер), 70.6 (Сфер), 71.2 (д, J=5.3 Гц, Сфер), 72.7 (д, J=5.4 Гц, Сфер), 73.8 (д, J=24.1 Гц, Сфер), 77.4 (д, J=11.1 Гц, Сфер), 128.1 (Саром), 128.2 (2 с, 2Саром), 128.3 (Саром), 128.5 (д, J=5.8 Гц, Саром), 128.8 (д, J=6.3 Гц, Саром), 133.6 (Саром), 133.7 (Саром), 133.8 (Саром), 134.2 (Саром), 134.4 (2с, 2Саром), 134.5 (Саром), 137.4 (д.д, J=4.0, 12.5 Гц, Саром), 138.6 (д.д, J=7.9, 14.0 Гц, Саром), 139.1 (д, J=9.8 Гц, Саром), 142.9 (д.д, J=12.3, 30.8 Гц, Саром), 146.9 (д.д, J=13.7, 32.3 Гц, Саром). Спектр ЯМР31Р (121 МГц, C6D6) δ - 13.6 (д, J=155.5 Гц), - 24.6 (д, J=155.5 Гц); МСВР вычислено для C34H28FeP2Na [M+Na]+ 577.0908, найдено 577.0935.
I.1.8. (Rp)-1-дифенилфосфин-2-(изопропилфенилфосфин)бензол 48h
К раствору (R)-(2-бромфенил)изопропилфенилфосфина (II-m) (0,14 г, 0,45 ммоль) в ТГФ (2 мл) добавляют при температуре -78°C в атмосфере аргона н-BuLi (1,6 М раствор в гексане) (0,37 мл, 0,50 ммоль) и полученный раствор перемешивают при данной температуре в течение 1 ч. После чего добавляют хлордифенилфосфин (0,09 мл, 0,54 ммоль) при температуре -78°C и раствор перемешивают при комнатной температуре на протяжении ночи. После гашения водой смесь экстрагируют хлористым метиленом (3×5 мл) и органические вытяжки высушивают над MgSO4. Растворитель упаривают под вакуумом, получая остаток, который очищают на хроматографической колонке с силикагелем, используя смесь петролейный эфир/толуол (2:1) в качестве элюента.
Белое твердое вещество; выход: 54%; энантиомерный избыток составляет 98% согласно данным ВЭЖХ анализа после превращения в соответствующий дитиофосфин (Lux 5 мкм целлюлоза 2, 0,8 мл/мин, гексан/2-пропанол (80:20), tR (R)=16,2 мин, tR (S)=18,2 мин; Rf 0.39 (петролейный эфир/толуол, 2:1); [α]D+61.7 (с=0,3, CHCl3); ИК-спектр (чистое вещество) 3050, 2962, 2923, 2864, 1477, 1433, 1381, 1363, 1305, 1270, 1229, 1181, 1155, 1091, 1069, 1025, 999, 745, 695, 648 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.07 (д.д.д, J=2.6, 6.8, 13.6 Гц, 3Н, CH3), 1.11 (д.д.д, J=2.9, 6.8, 12.8 Гц, 3Н, CH3), 2.48-2.55 (м, 1Н, СН), 6.94-6.97 (м, 1Н, Наром), 7.07-7.35 (м, 16Н, Наром), 7.38 (т.д, J=1.3, 7.5 Гц, 1Н, Наром), 7.66-7.68 (м, 1Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 19.5 (д.д, J=3.4, 18.4 Гц, СН3), 19.7 (д.д, J=3.4, 16.2 Гц, СН3), 25.9 (д.д, J=4.6, 7.1 Гц, СН), 127.9 (Саром), 128.0 (Саром), 128.1 (Саром), 128.2 (2с, Саром), 128.3 (Саром), 128.4 (Саром), 128.7 (Саром), 128.9 (Саром), 131.9 (д, J=5.1 Гц, Саром), 133.3 (д, J=3.4 Гц, Саром), 133.4 (д, J=3.7 Гц, Саром), 133.9 (д, J=6.1 Гц, Саром), 134.0 (т, J=4.1 Гц, Саром), 134.2 (т, J=4.4 Гц, Саром), 136.9 (д, J=9.5 Гц, Саром), 137.7 (д, J=11.8 Гц, Саром), 138.0 (д.д, J=5.3, 10.2 Гц, Саром), 143.5 (д.д, J=6.5, 22.8 Гц, Саром), 144.8 (д.д, J=3.9, 25.0 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 13.1 (д, J=155.8 Гц), - 14.2 (д, J=155.8 Гц); МСВР вычислено для С27Н27Р2 [М+Н]+ 413.1582, найдено 413.1586.
I.2. Синтез с использованием фенилфосфинитов
I.2.1. (Sp)-1-дифенилфосфин-2-(о-толилфенилфосфин)бензол 48i
К раствору opmo-бромдифенилфосфина (II-а) (0,20 г, 0,59 ммоль) в ТГФ (3 мл) добавляют при температуре -78°C в атмосфере аргона н-BuLi (1,6 М раствор в гексане) (0,41 мл, 0,65 ммоль) и полученный раствор перемешивают при данной температуре в течение 1 ч. После чего добавляют по каплям раствор (R)-фенил-о-толилфенилфосфинита (0,17 г, 0,59 ммоль) в ТГФ (2 мл) при температуре -78°C, и смесь перемешивают при комнатной температуре на протяжении ночи. После гашения водой смесь экстрагируют хлористым метиленом (3×5 мл) и органические вытяжки высушивают над MgSO4. Растворитель упаривают под вакуумом, получая остаток, который очищают на хроматографической колонке с силикагелем, используя смесь толуол/петролейный эфир (1:1) в качестве элюента.
Бесцветное вязкое твердое вещество; выход: 54%; Энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (Lux 5 мкм целлюлоза 2, 0,2 мл/мин, гексан/2-пропанол (98:2), tR (S)=19,5 мин, tR (R)=20,8 мин; Rf 0.43 (петролейный эфир/толуол, 1:1); [α]D+33.0 (с=0,3, CHCl3); ИК-спектр (чистое вещество) 3051, 1584, 1477, 1433, 1269, 1068, 998, 739, 693 см-1. Спектр ЯМР1Н (300 МГц, C6D6) δ 2.45 (д, J=0.8 Гц, 3Н, CH3), 7.00-7.07 (м, 3Н, Наром), 7.08-7.19 (м, 12Н, Наром), 7.30-7.32 (м, 1Н, Наром), 7.36-7.38 (м, 1H, Наром), 7.43-7.48 (м, 6Н, Наром). Спектр ЯМР13С (75.5 МГц, C6D6) δ 21.2 (д, J=22.6 Гц, СН3), 126.0 (Саром), 128.3 (Саром), 128.4 (м, Саром), 128.5 (Саром), 128.6 (д, J=7.3 Гц, Саром), 129.2 (д, J=6.2 Гц, Саром), 130.2 (д, J=4.5 Гц, Саром), 133.7 (Саром), 133.8 (Саром), 134.0 (Саром), 134.1 (Саром), 134.2 (д, J=18.7 Гц, Саром), 134.3 (Саром), 134.4 (Саром), 134.5 (Саром), 136.7 (д.д, J=5.6, 13.3 Гц, Саром), 137.0 (д.д, J=5.6, 13.3 Гц, Саром), 137.7 (д.д, J=6.1, 12.8 Гц, Саром), 138.0 (д.д, J=6.1, 12.8 Гц, Саром), 142.4 (д, J=26.2 Гц, Саром), 143.8 (д.д, J=11.7, 32.9 Гц, Саром), 144.4 (д.д, J=12.2, 33.2 Гц, Саром). Спектр ЯМР31Р (121 МГц, C6D6) δ - 12.7 (д, J=154.0 Гц), - 19.8 (д, J=154.0 Гц); МСВР вычислено для C31H26P2Na [M+Na]+ 483.1402, найдено 483.1423.
I.2.2. (S,S)-Бис[1,2-(о-анизилфенил)фосфин]бензол 48j
К раствору (S)-о-анизил-(о-бром)фенилфосфина (II-i) (0,22 г, 0,59 ммоль) в ТГФ (3 мл) добавляют при температуре -78°C в атмосфере аргона н-BuLi (1,6 М раствор в гексане) (0,41 мл, 0,65 ммоль) и полученный раствор перемешивают при данной температуре в течение 1 ч. После чего добавляют по каплям раствор (R)-фенил-о-анизилфенилфосфинита (0,18 г, 0,59 ммоль) в ТГФ (2 мл) при температуре -78°C и смесь перемешивают при комнатной температуре на протяжении ночи. После гашения водой смесь экстрагируют хлористым метиленом (3×5 Мл) и органические вытяжки высушивают над MgSO4 Растворитель упаривают под вакуумом, получая остаток, который очищают на хроматографической колонке с силикагелем, используя смесь хлористый метилен/петролейный эфир (2:1) в качестве элюента, и перекристаллизацией из смеси хлористый метилен/метиловый спирт.
Белое твердое вещество; выход: 52%; энантиомерный избыток составляет 99% согласно данным спектроскопии ЯМР31Р в присутствии (+)-ди-μ-хлорбис{2[1-(диметаламино)-этил]фенил-C,N}дипалладия; Rf 0.39 (хлористый метилен/петролейный эфир, 2:1); [α]D+116.2 (с=0,4, CHCl3); ИК-спектр (чистое вещество) 3055, 2937, 2832, 1571, 1469, 1429, 1295, 1270, 1239, 1178, 1157, 1130, 1093, 1069, 1039, 1023, 1012, 792, 745, 730, 690 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 3.57 (с, 6Н, OCH3), 6.69-6.72 (м, 2Н, Наром), 6.80-6.84 (м, 4Н, Наром), 6.99-7.02 (м, 2Н, Наром), 7.24-7.32 (м, 14Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 55.5 (ОСН3), 110.2 (Саром), 120.8 (Саром), 126.6 (т, J=3.6 Гц, Саром), 128.1 (3 с, Саром), 128.9 (Саром), 129.8 (Саром), 133.5 (т, J=3.2 Гц, Саром), 133.9 (Саром), 134.0 (Саром), 134.1 (Саром), 134.2 (Саром), 136.9 (т, J=3.9 Гц, Саром), 143.3 (т, J=11.9 Гц, Саром), 161.0 (д, J=6.9 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 23.4 (с); МСВР вычислено для C32H38O2P2Na[M+Na]+ 507.1637, найдено 507.1637.
I.2.3. (1R,2S)-(+)-1-(изопропилфенилфосфин)-2-(о-анизилфенилфосфин)бензол 48k
К раствору (R)-изопропил-(2-бромфенил)фенилфосфина (II-m) (0,18 г, 0,59 ммоль) в ТГФ (3 мл) добавляют при температуре -78°C в атмосфере аргона н-BuLi (1,6 М раствор в гексане) (0,41 мл, 0,65 ммоль) и полученный раствор перемешивают при данной температуре в течение 1 ч. После чего добавляют по каплям раствор (R)-фенил-о-анизилфенилфосфинита (0,18 г, 0.59 ммоль) в ТГФ (2 мл) добавляют при температуре -78°C и смесь перемешивают при комнатной температуре на протяжении ночи. После гашения водой смесь экстрагируют хлористым метиленом (3×5 мл) и органические вытяжки высушивают над MgSO4. Растворитель упаривают под вакуумом, получая остаток, который очищают на хроматографической колонке с силикагелем, используя смесь хлористый метилен/петролейный эфир (2:1) в качестве элюента.
Белое вязкое твердое вещество; выход: 56%; энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (Chiralpak AD, 0,2 мл/мин, гексан/2-пропанол (98:2), tR (RS)=24,5 мин, tR (SS)=27,5 мин; Rf 0.44 (петролейный эфир/хлористый метилен, 1:2); [α]D+85.0 (с=0,2, CHCl3); ИК-спектр (чистое вещество) 2954, 1575, 1461, 1429, 1271, 1239, 1179, 1129, 1070, 1023, 745, 695 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 6.81 (т.д, J=6.8, 15.4 Гц, 6Н, CH3), 2.47-2.57 (м, 1H, СН), 3.61 (с, 3Н, OCH3), 6.47 (д.д.д, J=1.5, 3.8, 7.2 Гц, 1Н, Наром), 6.65 (т, J=7.4 Гц, 1Н, Наром), 6.79 (д.д.д, J=0.7, 4.7, 8.2 Гц, 1H, Наром), 6.89-6.92 (м, 1H, Наром), 7.14-7.24 (м, 5Н, Наром), 7.30-7.39 (м, 8Н, Наром), 7.61-7.64 (м, 1Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 19.5 (СН3), 19.7 (СН3), 25.6 (д.д, J=8.1, 10.7 Гц, СН), 55.6 (ОСН3), 110.1 (д, J=1.4 Гц, Саром), 120.7 (Саром), 126.0 (д.д, J=5.2, 13.7 Гц, Саром), 127.8 (д, J=7.2 Гц, Саром), 128.0 (Саром), 128.2 (2с, Саром), 128.8 (д, J=17.2 Гц, Саром), 129.8 (Саром), 131.7 (д, J=6.4 Гц, Саром), 133.3 (д, J=19.2 Гц, Саром), 134.0 (Саром), 134.0 (д, J=7.2 Гц, Саром), 134.2 (Саром), 134.4 (Саром), 137.3 (д.д, J=7.3, 13.8 Гц, Саром), 138.3 (д, J=2.9 Гц, Саром), 143.8 (д.д, J=13.9, 31.6 Гц, Саром), 144.9 (д, J=10.1 Гц, Саром), 160.9 (д, J=13.5 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 13.5 (д, J=163.2 Гц), - 24.6 (д, J=163.2 Гц); МСВР вычислено для C28H29OP2[М+Н]+ 443.1688, найдено 443.1667.
J. Синтез дифосфинов с бифенильным мостиком (I-49)


J.1. Бис-2,2'-(дифенилфосфин)бифенил 49a
К раствору (2-бромфенил)-дифенилфосфина (II-а) (0,41 г, 1,20 ммоль) в ТГФ (5 мл) добавляют при температуре -78°C в атмосфере аргона н-BuLi (1,6 М раствор в гексане) (0,75 мл, 1,20 ммоль) и полученный раствор перемешивают при данной температуре в течение 1 ч. Затем добавляют раствор Fe(acac)3 (0,52 г, 1,44 ммоль) в ТГФ (7 мл) и продолжают перемешивание в течение 1 ч при температуре -78°C. Раствор гасят водой (2 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4 и упаривают растворитель под вакуумом, получая остаток, который очищают на хроматографической колонке с силикагелем, используя смесь петролейный эфир/хлористый метилен (2:1) в качестве элюента. Соединение 49а получено в виде белого твердого вещества. Выход: 46%; Rf 0.32 (петролейный эфир/CH2Cl2, 2:1). Спектр ЯМР1Н (300 МГц, CDCl3) δ 6.80-6.84 (м, 2Н, Наром), 6.98-7.01 (м, 2Н, Наром), 7.04-7.22 (м, 24Н, Н arom). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 14.4. Стоит отметить, что проводилось также сочетание (II-а) с FeCl3 или Cu(ОАс)2, при этом дифосфин 49а получен с удовлетворительными выходами (30-45%).
J.2. Бис-2,2'-(ди-о-толилфосфин)бифенил 49b
К раствору (2-бромфенил)-ди(о-толил)фосфина (II-е) (0,44 г, 1,20 ммоль) в ТГФ (5 мл) добавляют при температуре -78°C в атмосфере аргона н-BuLi (1,6 М раствор в гексане) (0,82 мл, 1,32 ммоль) и полученный раствор перемешивают при данной температуре в течение 1 ч. Затем добавляют раствор Fe(acac)3 (0,52 г, 1,44 ммоль) в ТГФ (7 мл) и продолжают перемешивание в течение 1 ч при температуре -78°C. Раствор гасят водой (2 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4 и упаривают растворитель под вакуумом, получая остаток, который очищают на хроматографической колонке с силикагелем, используя смесь петролейный эфир/толуол (20:1) в качестве элюента. Соединение 49b получено в виде белого твердого вещества. Выход: 36%; Rf 0.41 (петролейный эфир/толуол, 20:1); ИК-спектр (чистое вещество) 3050, 3002, 1450, 1428, 1380, 1267, 1201, 1129, 1034, 951, 877, 801, 751, 717 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 2.11 (с, 6Н, CH3), 2.44 (с, 6Н, CH3), 6.77-6.78 (м, 2Н, Наром), 6.92-6.93 (м, 2Н, Наром), 6.97-7.01 (м, 4Н, Наром), 7.06-7.09 (м, 2Н, Наром), 7.12-7.15 (м, 4Н, Наром), 7.19 (т.д, J=1.4, 7.5 Гц, 2Н, Наром), 7.23-7.29 (м, 6Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 20.9 (д, J=24.1 Гц, СН3), 21.5 (т, J=12.1 Гц, СН3), 125.7 (д, J=6.6 Гц, Саром), 127.2 (Саром), 127.4 (Саром), 128.2 (Саром), 128.6 (Саром), 129.6 (т, J=3.0 Гц, Саром), 129.9 (т, J=2.0 Гц, Саром), 131.2 (д.д, J=4.2, 3.7 Гц, Саром), 132.6 (Саром), 133.1 (Саром), 135.2 (Саром), 135.6 (д, J=14.4 Гц, Саром), 135.7 (Саром), 136.1 (д, J=24.1 Гц, Саром), 143.0 (д, J=25.7 Гц, Саром), 143.3 (д, J=28.3 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 28.5. МСВР вычислено для C40H36P2Na (M+Na)+ 601.2185, найдено 601.2164.
J.3. Синтез (S,S)-бис-2,2'-(ферроценилфенилфосфин)бифенилдиборана и свободного дифосфина 49с
К раствору (S)-ферроценил-(2-бромфенил)фенилфосфина (II-k) (0,20 г, 0,44 ммоль) в ТГФ (4 мл) добавляют при температуре -78°C в атмосфере аргона н-BuLi (1,6 М раствор в гексане) (0,30 мл, 0,48 ммоль) и полученный раствор перемешивают при данной температуре в течение 1 ч. Затем добавляют раствор Fe(acac)3 (0,19 г, 0,53 ммоль) в ТГФ (5 мл) и перемешивание продолжают в течение 1 ч при температуре -78°C. Раствор гасят водой (2 мл) и экстрагируют хлористым метиленом (3×10 мл). Органические вытяжки высушивают над MgSO4 и упаривают растворитель под вакуумом, получая остаток, который очищают на хроматографической колонке с силикагелем, используя смесь петролейный эфир/этилацетат (20:1) в качестве элюента. Полученный оранжевый порошок растворяют в ТГФ и добавляют ВН3⋅SMe2. После перемешивания на протяжении ночи добавляют 1 мл воды и раствор экстрагируют хлористым метиленом (3×5 Мл). Органические вытяжки высушивают над MgSO4 и упаривают растворитель, получая оранжевое твердое вещество, которое перекристаллизовывают из смеси гексана и хлористого метилена. Соединение 49с получено в виде оранжевых кристаллов. Выход: 35%; энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (chiralcel OD-H, 0,5 мл/мин, гексан-2-пропанол (98:2), tR (S,S)=27,2 мин, tR (R,R)=30,9 мин; Rf 0.42 (петролейный эфир/этилацетат, 3:1); [α]D-58.3 (с=0,3, CHCl3); ИК-спектр (чистое вещество): 3053, 2435, 2371, 2338, 1459, 1435, 1171, 1106, 1057, 1026, 1001, 823, 742, 697 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 3.89 (с, 10Н, Ср), 4.16 (с, 2Н, Ср), 4.21 (с, 2Н, Ср), 4.32-4.34 (м, 4Н, Ср), 6.67-6.68 (м, 2Н, Наром), 6.97-7.14 (м, 6Н, Наром), 7.52-7.57 (м, 6Н, Наром), 7.91-7.97 (м, 4Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 69.7 (Ср), 69.8 (д, J=68.1 Гц, Ср), 70.9 (д, J=5.3 Гц, Ср), 71.0 (д, J=7.9 Гц, Ср), 72.7 (д, J=1.6 Гц, Ср), 75.0 (д, J=18.2 Гц, Ср), 127.2 (д, J=9.0 Гц, Саром), 128.3 (д, J=10.2 Гц, Саром), 129.2 (д, J=2.1 Гц, Саром), 130.3 (д, J=54.0 Гц, Саром), 131.0 (д, J=2.2 Гц, Саром), 132.2 (д, J=61.5 Гц, Саром), 132.6 (д, J=7.7 Гц, Саром), 133.5 (д, J=9.2 Гц, Саром), 134.0 (д, J=8.3 Гц, Саром), 143.6 (д.д, J=3.2, 9.7 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 17.2; МСВР вычислено для C44H42P2B2Fe2Na (M+Na)+ 789.1539, найдено 789.1549; Вычислено для C44H42P2B2Fe2: С, 68.99; Н, 5.53; Найдено: С, 69.27; Н, 5.43.
(S,S)-бис-2,2'-(Ферроценилфенилфосфин)бифенил 49с
Раствор дифосфиндиборана (0,06 г, 0,08 ммоль) и ДАБЦО (0,05 г, 0,48 ммоль) в сухом толуоле (4 мл) перемешивают при комнатной температуре на протяжении ночи. После упаривания растворителя на вакууме остаток очищают на хроматографической колонке с силикагелем, используя смесь петролейный эфир/этилацетат (3:1) в качестве элюента, получая соединение 49с в виде оранжевого твердого вещества. Выход: 90%; Энантиомерный избыток составляет 99% согласно данным ВЭЖХ анализа (chiralcel OD-H, 0,3 мл/мин, гексан-2-пропанол (98:2), tR (R,R)=19,6 мин, tR (S,S)=22,3 мин; Rf 0.21 (петролейный эфир/этилацетат, 20:1); [α]D-129.3 (с=0,2, CHCl3); ИК-спектр (чистое вещество): 3069, 2925, 1477, 1454, 1431, 1411, 1306, 1260, 1192, 1158, 1107, 1019, 1000, 815, 747, 699 см-1. Спектр ЯМР1Н (300 МГц, CDCl3) δ 3.82 (с, 2Н, Ср), 4.20 (с, 10Н, Ср), 4.43-4.44 (м, 2Н, Ср), 4.55 (с, 2Н, Ср), 4.82-4.83 (м, 2Н, Ср), 6.53-6.54 (м, 2Н, Наром), 7.05 (т.д, J=1.3, 7.4 Гц, 2Н, Наром), 7.20-7.22 (м, 2Н, Наром), 7.27 (т.д, J=1.2, 7.4 Гц, 2Н, Наром), 7.28-7.34 (м, 10Н, Наром). Спектр ЯМР13С (75.5 МГц, CDCl3) δ 69.2 (Ср), 69.8 (Ср), 71.0 (т, J=3.5 Гц, Ср), 71.5 (Ср), 74.5 (т, J=17.1 Гц, Ср), 127.1 (Саром), 127.5 (Саром), 127.7 (т, J=3.7 Гц, Саром), 128.3 (Саром), 130.2 (т, J=3.8 Гц, Саром), 132.4 (Саром), 134.4 (т, J=10.7 Гц, Саром), 137.9 (д.д, J=4.0, 4.7 Гц, Саром), 138.9 (т, J=4.7 Гц, Саром), 145.6 (т, J=17.1 Гц, Саром). Спектр ЯМР31Р (121 МГц, CDCl3) δ - 23.6; МСВР вычислено для C44H36P2Fe2Na (M+Na)+ 761.0883, найдено 761.0846; Вычислено для C44H36P2Fe2: С, 71.57; Н, 4.91; Найдено: С, 71.12; Н, 5.06.
J.4. (R,R)-Бис-2,2'-(циклогексилфенилфосфин)бифенил 49d
Получают по такой же методике, как описана для 49а, исходя из (R)-(2-бромфенил)-циклогексилфенилфосфина (II-о). Прдоукт очищают колоночной хроматографией на силикагеле, используя смесь гексан/CH2Cl2 в качестве элюента.
Спектр ЯМР31Р (CDCl3):δ=-17.1
J.5. (S,S)-Бис-2,2'-(фенил-о-толилфосфин)бифенил 49е
Получают по такой же методике, как описана для 49а, исходя из (S)-(2-бромфенил)-фенил(о-толил)фосфина (II-о). Продукт очищают колоночной хроматографией на силикагеле, используя смесь гексан/EtOAc (50:1) в качестве элюента.
Спектр ЯМР31Р (CDCl3): δ=-18.7 и -23.0.
K. Катализ ассиметрического гидрирования хиральными комплексами родия
Хиральные дифосфины (I-48) и (I'-49с) испытывают в реакциях асимметрического гидрирования в виде комплексов с родием. В качестве субстратов используют метиловый эфир α-ацетамидокоричной кислоты 63, диметиловый эфир итаконовой кислоты 65, предшественник 67 леветирацетама 69 и сложные дегидроэфиры (α,β-ненасыщенные сложные эфиры) 70 и 72:





K.1. Получение комплексов родия с 1,2-дифосфинбензольными лигандами (I-48)
Общая методика
К раствору [Rh(COD)2]BF4 (0,09 ммоль) в хлористом метилене (2,5 мл) добавляют по каплям в атмосфере аргона раствор дифосфина (0,1 ммоль) в хлористом метилене (3,5 мл). Полученный раствор перемешивают при данной температуре в течение 1 ч, а затем добавляют диэтиловый эфир (10 мл). Выпавший осадок отфильтровывают и промывают диэтиловым эфиром (3×5 мл), получая комплекс родия.
Тетрафторборат (циклоокта-1,5-диен)-(Sp)-[1-дифенилфосфин-2-(о-анизил-фенилфосфино)бензол 48а]родия
Получают по общей методике; оранжевое твердое вещество; выход 80%. Спектр ЯМР1Н (300 МГц, CDCl3) δ 2.35-2.45 (м, 8Н, CH2), 3.66 (с, 3Н, OCH3), 4.83-5.21 (м, 4Н, CH), 6.99-7.00 (м, 2Н, Наром), 7.12-7.14 (м, 1H, Наром), 7.45-7.60 (м, 20Н, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 49.9 (д.д, J=27.6, 150.7 Гц), 57.0 (д.д, J=27.6, 150.7 Гц); МСВР вычислено для C39H38OP2Rh [M-BF4]+ 687.1447, найдено 687.1436.
Тетрафторборат (циклоокта-1,5-диен)-(Sp)-[1-дициклогексилфосфин-2-(о-анизил-фенилфосфин)-бензол 48b]родия
Получают по общей методике; оранжевое твердое вещество; выход 63%. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.85-1.40 (м, 12, Нцг), 1.66-1.76 (м, 6Н, Нцг), 1.93-1.97 (м, 1H, Нцг), 2.17-2.51 (м, 11Н, Нцг/CH2), 3.55 (с, 3Н, OCH3), 4.66-4.73 (м, 2Н, CH), 5.57 (с, 1H, CH), 5.92 (с, 1H, CH), 6.93-7.02 (м, 3Н, Наром), 7.36-7.62 (м, 9Н, Наром), 7.71-7.75 (м, 1H, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 53.2 (д.д, J=24.9, 150.6 Гц), 62.5 (д.д, J=24.9, 145.4 Гц); МСВР вычислено для C39H50OP2Rh [M-BF4]+ 699.2386, найдено 699.2362.
Тетрафторборат (циклоокта-1,5-диен)-(Sp)-[1-диизопропилфосфин-2-(о-анизил-фенилфосфин)-бензол 48с]родия
Получают по общей методике; оранжевое твердое вещество; выход 53%. Спектр ЯМР1Н (300 МГц, CDCl3) δ 0.89 (д.д, J=7.0, 16.3 Гц, 3Н, CH3), 1.18 (д.д, J=7.2, 16.4 Гц, 3Н, CH3), 1.25-1.29 (м, 6Н, CH3), 2.29-2.46 (м, 6Н, CH2/CH), 2.53-2.60 (м, 2Н, CH2), 2.66-2.82 (м, 2Н, CH2), 3.60 (с, 3Н, OCH3), 4.75-4.79 (2с, 2Н, СНЦОД), 5.67 (с, 1Н, СНЦОД), 6.05 (с, 1H, СНЦОД), 6.98-7.07 (м, 3Н, Наром), 7.41-7.47 (м, 3Н, Наром), 7.51-7.69 (м, 3Н, Наром), 7.64-7.67 (м, 3Н, Наром), 7.78-7.80 (м, 1H, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 52.5 (д.д, J=23.9, 152.3 Гц), 69.5 (д.д, J=23.9, 146.3 Гц); МСВР вычислено для C33H42OP2Rh [M-BF4]+ 619.1760, найдено 619.1758.
Тетрафторборат(циклоокта-1,5-диен)-(Sp)-[1-ди(пара-толил)фосфин-2-(о-анизил-фенилфосфин)-бензол 48е]родия
Получают по общей методике; оранжевое твердое вещество; выход 54%. Спектр ЯМР1Н (300 МГц, CDCl3) δ 2.31-2.43 (м, 8Н, CH2), 2.42 (с, 3Н, CH3), 2.44 (с, 3Н, CH3), 3.66 (с, 3Н, OCH3), 4.83-5.21 (м, 4Н, CH), 6.97-7.02 (м, 2Н, Наром), 7.12-7.15 (м, 1Н, Наром), 7.25-7.26 (м, 2Н, Наром), 7.31-7.35 (м, 4Н, Наром), 7.42-7.54 (м, 5Н, Наром), 7.55-7.61 (м, 7Н, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 49.8 (д.д, J=26.7, 148.2 Гц), 56.2 (д.д, J=26.7, 150.7 Гц); МСВР вычислено для C41H42OP2Rh [М-BF4]+ 715.1760, найдено 715.1733.
Тетрафторборат(циклоокта-1,5-диен)-(Sp)-[1-ди(пара-трифторметилфенил)фосфин-2-(о-анизилфенилфосфин)бензол 48f]родия
Получают по общей методике; желтое твердое вещество; выход 66%. Спектр ЯМР1Н (300 МГц, CDCl3) δ 2.38-2.50 (м, 8Н, CH2), 3.70 (с, 3Н, OCH3), 4.90-5.31 (м, 4Н, CH), 6.96-6.98 (м, 2Н, Наром), 7.12 (д.д, J=5.1, 8.4 Гц, 1Н, Наром), 7.47-7.63 (м, 12Н, Наром), 7.69-7.72 (м, 4Н, Наром), 7.81-7.82 (м, 2Н, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 49.7 (д.д, J=29.2, 148.2 Гц), 56.0 (д.д, J=29.2, 153.0 Гц); МСВР вычислено для C41H36OF6P2Rh [M-BF4]+ 823.1195, найдено 823.1192.
Тетрафторборат(циклоокта-1,5-диен)-(Rp)-[1-дифенилфосфин-2-(ферроценил-фенилфосфин)-бензол 48g]родия
Получают по общей методике; темно-оранжевое твердое вещество; выход 73%. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.91-2.00 (м, 2Н, CH2), 2.23-2.25 (м, 2Н, CH2), 2.51-2.64 (м, 4Н, CH2), 3.61 (с, 5Н, Ср), 4.42 (с, 1Н, Ср), 4.51 (с, 1H, Ср), 4.62-4.65 (м, 4Н, Ср/CH), 5.22-5.23 (м, 1H, CH), 5.61-5.62 (м, 1H, CH), 7.35-7.42 (м, 4Н, Наром), 7.45-7.47 (м, 3Н, Наром), 7.52-7.55 (м, 3Н, Наром), 7.61-7.69 (м, 6Н, Наром), 7.74-7.76 (м, 1H, Наром), 7.90-7.93 (м, 2Н, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 51.0 (д.д, J=29.1, 148.2 Гц), 58.2 (д.д, J=29.1, 153.0 Гц); МСВР вычислено для C42H40FeP2Rh [M-BF4]+ 765.1005, найдено 765.0987.
Тетрафторборат (циклоокта-1,5-диен)-(Rp)-(1-дифенилфосфин-2-(изопропил-фенилфосфин)-бензол 48h]родия
Получают по общей методике; оранжевое твердое вещество; выход 60%. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.22 (д.д, J=7.0, 14.7 Гц, 3Н, CH3), 1.28 (д.д, J=7.0, 19.5 Гц, 3Н, CH3), 2.13-2.16 (м, 2Н, CH2), 2.32-2.58 (м, 6Н, CH2), 3.29-3.33 (м, 1H, CH), 4.84-4.85 (м, 1H, CH), 4.92-4.93 (м, 1Н, CH), 5.04-5.05 (м, 1H, CH), 5.69-5.70 (м, 1H, CH), 7.49-7.71 (м, 19Н, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 57.8 (д.д, J=28.5, 154.9 Гц), 67.8 (д.д, J=28.5, 148.6 Гц); МСВР вычислено для C35H38P2Rh [M-BF4]+ 623.1498, найдено 623.1500.
Тетрафторборат (циклоокта-1,5-диен)-(1S,2S)-[1,2-(о-анизилфенилфосфин)-бензол 48j]родия
К суспензии [Rh(COD)2]BF4 (0,055 ммоль) в ТГФ (1,2 мл) добавляют по каплям в атмосфере аргона раствор дифосфина 48j (0,059 ммоль) в ТГФ (1,7 мл). Полученный раствор перемешивают при данной температуре в течение 1 ч, а затем упаривают растворитель примерно до объема 1 мл. Добавляют диэтиловый эфир (5 мл) и выпавший осадок отфильтровывают, а затем промывают диэтиловым эфиром (3×5 мл), получая соответствующий комплекс родия.
Оранжевое твердое вещество; выход 64%. Спектр ЯМР1Н (300 МГц, CDCl3) δ 2.33-2.51 (м, 8Н, CH2), 3.60 (с, 6Н, OCH3), 5.07 (с, 4Н, CH), 6.89-6.93 (м, 4Н, Наром), 7.09-7.11 (м, 2Н, Наром), 7.42-7.58 (м, 12Н, Наром), 7.67-7.70 (м, 4Н, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 50.7 (д, J=149.8 Гц); МСВР вычислено для C40H40O2P2Rh [M-BF4]+ 717.1553, найдено 717.1522.
Тетрафторборат(циклоокта-1,5-диен)-(1S,2R)-[2-(изопропилфенилфосфин)-1-(о-анизил-фенилфосфин)-бензол 48k]родия
К суспензии [Rh(COD)2]BF4 (0,055 ммоль) в ТГФ (1.2 мл) добавляют по каплям в атмосфере аргона раствор дифосфина 48k (0,059 ммоль) в ТГФ (1,7 мл). Полученный раствор перемешивают при данной температуре в течение 1 ч, а затем растворитель упаривают примерно до объема 1 мл. Добавляют диэтиловый эфир (5 мл) и выпавший осадок отфильтровывают, а затем промывают диэтиловым эфиром (3×5 мл), получая соответствующий комплекс родия.
Оранжевое твердое вещество; выход 70%. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.07 (д.д, J=6.8, 15.0 Гц, 3Н, CH3), 1.17 (д.д, J=6.8, 19.1 Гц, 3Н, CH3), 2.05-2.17 (м, 2Н, CH2), 2.28-2.30 (м, 2Н, CH2), 2.45-2.47 (м, 2Н, CH2), 2.56-2.58 (м, 2Н, CH2), 3.10-3.14 (м, 1H, CH), 3.60 (с, 3Н, OCH3), 4.70 (с, 2Н, CH), 5.00 (с, 1H, CH), 5.70 (с, 1H, CH), 7.04-7.13 (м, 3Н, Наром), 7.52-7.61 (м, 13Н, Наром), 7.76-7.79 (м, 2Н, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 50.4 (д.д, J=26.9, 150.1 Гц), 64.0 (д.д, J=26.9, 146.3 Гц); МСВР вычислено для C36H40OP2Rh [M-BF4]+ 653.1604, найдено 653.1591.
K.2. Получение комплексов родия с дифосфиновыми лигандами (I'-49с)
Тетрафторборат(циклоокта-1,5-диен)-[(S,S)-2,2'-бис(ферроценилфенилфосфин)-1,1'-бифенил 49с]родия
К раствору [Rh(COD)2]BF4 (0,036 г, 0,09 ммоль) в хлористом метилене (2,5 мл) добавляют по каплям в атмосфере аргона раствор дифосфина 49с (0,074 г, 0,1 ммоль) в хлористом метилене (3,5 мл). Полученный раствор перемешивают при данной температуре в течение 1 ч, а затем добавляют диэтиловый эфир (10 мл). Выпавший осадок отфильтровывают, а затем промывают диэтиловым эфиром (3×5 мл), получая комплекс родия 5 в виде оранжевого порошка.
Выход 65%. Спектр ЯМР1Н (300 МГц, CDCl3) δ 2.00-2.02 (м, 2Н, CH2), 2.17-2.22 (м, 2Н, CH2), 2.47-2.51 (м, 2Н, CH2), 2.59-2.64 (м, 2Н, CH2), 3.08 (с, 2Н, Нфер), 4.09 (с, 10Н, Нфер), 4.30 (ш.с, 2Н, Нфер), 4.64-4.72 (м, 8Н, Нфер/CH), 6.63 (д, J=7.1 Гц, 2Н, Наром), 7.11 (т, J=7.5 Гц, 2Н, Наром), 7.25-7.27 (м, 10Н, Наром), 7.37 (т, J=7.3 Гц, Наром), 8.18 (ш.с, 2Н, Наром). Спектр ЯМР31Р (121 МГц, CDCl3) δ 21.0 (д, J=145.6 Гц); МСВР вычислено для C52H48Fe2P2Rh [M-BF4]+ 949.0982, найдено 949.0999.
K.3. Асимметрическое катализируемое гидрирование
Типовая методика
Раствор [Rh(COD)L*]BF4 (0,005 ммоль, 1 мол.%) и субстрата (0,5 ммоль) в абсолютированном растворителе (7,5 мл) помещают в автоклав из нержавеющей стали. Автоклав закрывают, продувают водородом, а затем создают избыточное давление водорода. После 16 ч перемешивания при комнатной температуре давление снижают до атмосферного и раствор переносят в круглодонную колбу. Растворитель отгоняют на роторном испарителе, полученный остаток очищают колоночной хроматографией на силикагеле, получая гидрированный продукт. Энантиомерный избыток определяют методом ВЭЖХ на хиральной колонке.
Результаты асимметрического гидрирования, катализируемого комплексами родия с лигандами (I-48) или (I-49) представлены в Таблицах 9 и 10.



Метил-2-ацетамидо-3-фенилпропианат 64
Энантиомерный избыток 64 определяют методом ВЭЖХ на колонке Chiralcel OD-H, элюент - гексан/2-пропанол (95:5), 1 мл/мин, tR (R)=21,4 мин, tR (S)=34.7 мин. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.97 (с, 3Н, CH3), 3.06-3.08 (м, 2Н, CH2Ph), 3.64 (с, 3Н, CH3), 4.86-4.88 (м, 1H, CH), 6.11 (ш.с, 1H, NH), 7.19-7.22 (м, 5Н, Наром).
Диметиловый эфир 3-метилянтарной кислоты 66.
Энантиомерный избыток 66 определяют методом ВЭЖХ на колонке Chiralcel OD-H, элюент - гексан/2-пропанол (95:5), 0,5 мл/мин, tR (R)=13,0 мин, tR (S)=21.8 мин. Спектр ЯМР1Н (300 МГц, CDCl3) δ 1.14 (д, J=7.1 Гц, 3Н, CH3), 2.31 (д.д, J=3.0, 16.5 Гц, 1H, CH2), 2.66 (д.д, J=8.1, 16.5 Гц, 1Н, CH2), 2.84-2.86 (м, 1H, CH), 3.60 (с, 3Н, CH3), 3.62 (с, 3Н, CH3).
L. Катализ ассиметрического аллилирования хиральными комплексами палладия
Хиральные дифосфины (I-48) испытывали в катализируемых реакциях аллилирования диметилмалоната 74 с образованием производного 76 в присутствии хиральных комплексов палладия. Реакции проводили при температуре окружающей среды, результаты, полученные через 18 ч протекания реакции, представлены в Таблице 11.



Стандартная методика аллильного алкилирования диметилмалоната 74 1,3-дифенилпропенилацетатом 75
В сосуде Шленка растворяют лиганд (12 мкмоль, 1,2 мол.%) и [Pd(η3-С3Н5)Cl]2 (5 мкмоль, 0,5 мол.%) в 2 мл дихлорметана в атмосфере аргона. Реакционную смесь перемешивают 1 ч при комнатной температуре и добавляют к ней раствор (E)-1,3-дифенилпроп-2-ен-1-илацетата 75 (0,25 г, 1 ммоль) в 1 мл дихлорметана. Через 20 минут данный раствор переносят в другой реакционный сосуд, содержащий N,O-бис(триметилсилил)ацетамид (0,49 мл, 2 ммоль), каталитическое количество KOAc и диметилмалонат 74 (0,23 мл, 2 ммоль) в CH2Cl2 (4 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Затем реакционную смесь разбавляют диэтиловым эфиром и промывают органический слой насыщенным водным раствором NH4Cl (2×5 мл), а затем высушивают над MgSO4. После упаривания при пониженном давленнии получают остаток, который очищают хроматографией на силикагеле, используя смесь петролейный эфир/этилацетат (10:1) в качестве элюента, получая в результате алкилированный продукт.
Метил-2-карбоксиметокси-3,5-дифенилпент-4-еноат 76
Энантиомерный избыток 76 определяют методом ВЭЖХ на колонке Chiralpak AD, элюент - гексан/2-пропанол (90:10), 0,5 мл/мин, tR (R)=15,8 мин, tR (S)=22,7 мин. Спектр ЯМР1Н (CDCl3) δ (м.д.), 3.56 (с, 3Н, CH3), 3.75 (с, 3Н, CH3), 4.02 (д, J=10.9 Гц, 1H, CH), 4.27 (д.д, J=8.8, J=10.8 Гц, 1Н, CH), 6.40 (д.д, J=8.6, 15.7 Гц, 1Н, HC=), 6.54 (д, J=15.7 Гц, 1Н, HC=), 7.10-7.40 (1 ОН, м, Наром).
Реферат
Настоящее изобретение относится к новым соединениям, пригодным для использования в химической промышленности, формул (I)-(IV)где Е выбран из -BR9R10, -CR11R12OH, -COR11; -SiR11R12R13; -SiR11R12-CH-PR7R8; R9 и R10 представляют собой галоген, гидроксил, алкилокси, арилокси, циклоалкилокси, алкил и циклоалкил; R11, R12 и R13 представляют собой атом водорода, алкил, циклоалкил и арил; R1 и R2 представляют собой алкил, циклоалкил, арил, алкилокси, циклоалкилокси, арилокси, алкиламино, циклоалкиламино, ариламино, металлоценильную группы; R3, R4, R5, R6 представляют собой атом водорода, алкилокси, циклоалкилокси, арилокси, алкиламино, циклоалкиламино и ариламиногруппы; причем алкильная группа как таковая или как часть другого заместителя включает от 1 до 12 атомов углерода, арильная группа как таковая или как часть другого заместителя содержит от 5 до 20 атомов в кольце, циклоалкоксильная группа как таковая или как часть другого заместителя содержит 3, 5 или 6 атомов в кольце; X представляет собой F, Cl, Br, I; при условии, что, когда X - это Br, каждая из групп R3, R4, R5 и R6 представляет собой водород, a R1 - это Me или трет-Bu, то R2 - это не трет-Bu или Me, соответственно; X представляет собой F, Cl, Br, I. Предложены новые соединения для использования в каталитическом гидрировании или аллилировании, а также эффективные способы их получения. 6 н. и 4 з.п. ф-лы, 11 табл., 76 пр.
Формула
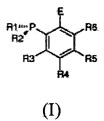







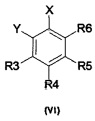


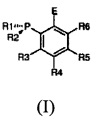



Документы, цитированные в отчёте о поиске
Способ энантиоселективного получения оптически активных замещенных производных 5,6-дигидро-2н-пиран-2-она




Комментарии