Способ энантиоселективного получения оптически активных замещенных производных 5,6-дигидро-2н-пиран-2-она - RU2127267C1
Код документа: RU2127267C1
Чертежи
Описание
Изобретение относится к новому каталитическому способу получения оптически активных соединений общей формулы
I
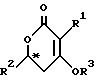
где R1 и R2 обозначают алкил, который может быть разорван атомом кислорода в ином положении, чем α- или β- положение, или необязательно замещенный бензил,
R3 обозначает водород, низший алкил, необязательно замещенный бензил, -CO-R4, -COOR4 или -CONR24 и
R4 обозначает низший алкил или арил.
Соединения формулы 1 являются известными соединениями и ценными промежуточными продуктами для фармакологически применимых конечных продуктов. Они могут быть преобразованы, согласно описанному в Европейском патенте 443449, и использованы в фармацевтике для подавления липазы поджелудочной железы. Патент ЕР 443449 является наиболее близким аналогом заявленного изобретения.
Задача настоящего изобретения состоит в том, чтобы найти прямой доступ к оптически активным соединениям формулы I, благодаря которым излишним является последующее расщепление рацематов.
Поставленная задача решается тем, что соединение
общей формулы II
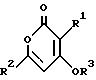
где R1, R2, R3 имеют вышеуказанные значения, асимметрично гидрируют в присутствии комплекса оптически активного атропоизомерного дифосфин-лиганда с металлом группы VIII.
В качестве оптически активного комплекса металл-дифосфин
для предложенного в изобретении способа рассматриваются, в частности, оптически активные комплексы рутения общих формул
[RuL]2+(X)2 III-а
[RuLX2]2 + (X)2 III-b
[RuLX1Х2] +(Х)3 Ill-c
RuL(X4)2 III-d
где X1 обозначает BF, ClO
X1 обозначает галогенид,
X2 обозначает бензол, гексаметилбензол или пара-цимол,
Х3 обозначает
галогенид, ClO
X4 обозначает анион Z2-COO- или анион Z3-SO
Z1 обозначает галогенированный низший алкил или галогенированный низший фенил,
Z2 обозначает низший алкил, фенил, галогенированный низший алкил или галогенированный фенил,
Z3 обозначает низший алкил или фенил,
L представляет собой оптически
активные, атропоизомерные дифосфин-лиганды формулы IV
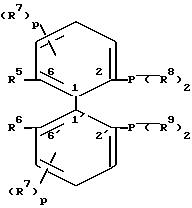
или общей формулы V
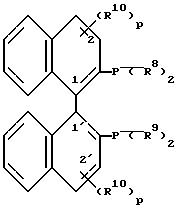
в (S)- или (R)- форме, где R5 и R6 независимо друг от друга обозначают низший алкил, низший алкокси, ди(низший алкил) амино, гидроксильную группу, защищенную гидроксильную группу, гидроксиметил или защищенный гидроксиметил, или R5 и R6 вместе обозначают двухвалентную группу
- (CH2)q-,-CH2-O-CH2-,
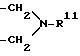
или
R7 обозначает водород, низший алкил или низший алкокси,
R8 и R9 независимо друг от друга обозначают цикло-алкил, незамещенный или замещенный фенил или пятичленный гетероароматический углеводород, с оговоркой, что по меньшей мере один из радикалов R8 и R9 представляет замещенное фенильное кольцо или пятичленный гетероароматический углеводород,
R10 представляет собой предпочтительно в положении 5,5' галоген, гидроксильную группу, низший алкил, амино, ацетамидо, нитро или сульфо, R11 обозначает низший алкил, фенил или бензил,
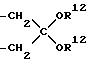
R12 обозначает низший алкил или оба R12 представляют вместе ди- или триметиленгруппу,
р обозначает ноль или число 1, 2 или 3, и
q обозначает число 3, 4 или 5.
В соответствии с соединениями формул 1-V нижеследующие определения общих выражений имеют свое значение независимо от того появляются ли данные выражения самостоятельно или в сочетаниях.
Выражение "алкил, который может быть разорван атомом кислорода в ином положении, чем в α- или β- положении" обозначает в рамках настоящей заявки алкильные группы с 1 до 17 атомами углерода, как например, метил, этил, пропил, изопропил, бутил, изобутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, этоксипропил, этоксибутил, пропилоксиэтил и тому подобное.
Выражение "необязательно замещенный бензил" обозначает бензил или бензил, замещенный во 2-, 3-, 4-, 5- и/или 6-положении низшим алкилом или низшим алкокси, как например, 4-метилбензил, 4-метоксибензил, З-метилбензил и тому подобное.
Низший алкил обозначает в рамках настоящего изобретения алкильные группы с прямой или разветвленной цепью, содержащие от 1 до 5 атомов углерода, как например, метил, этил, пропил, изопропил, бутил, изобутил, трет.-бутил, пентил, изопентил или трет.-пентил. Выражение "низший алкокси" обозначает группы, в которых алкильный радикал имеет предыдущее значение.
Арил обозначает в рамках настоящей заявки фенильный радикал, который может быть как незамещенным, так и однократно или многократно замещенным в положении орто, мета или пара. В качестве заместителей рассматриваются, в частности, низшие алкил- или низшие алкоксигруппы или галоген, в частности, хлор. Особенно предпочтительными арильными группами являются фенил и пара-толил.
В качестве галогена или галогенида применяют фтор, хлор, бром или йод, в частности, хлор, бром или йод.
Выражение "галогенированный низший алкил" обозначает в рамках настоящей заявки алкильные группы, содержащие от 1 до 4 атомов углерода и переменное количество атомов галогена, в частности, хлор или фтор. Особенно предпочтительными галогенированными низшими алкильными группами являются, например, перфторированные и перхлорированные низшие алкильные группы, как например, трифторметил, пентафторзтил и тому подобное.
Выражение "галогенированный фенил" обозначает предпочтительно перфторфенил или перфторбифенил.
Выражение "ди(низший алкил)амино" обозначает в рамках настоящего изобретения, например, диметиламино, диэтиламино и тому подобное.
В качестве защищенных групп для гидроксильных групп в рамках настоящего изобретения рассматриваются, в частности, обычные группы, образующие простой эфир, как например, бензил, аллил, бензилоксиметил, низший алкоксиметил или также 2-метоксиэтоксиметил.
Циклоалкил в рамках настоящего изобретения охватывает циклические алкильные группы, содержащие от 5 до 8 атомов углерода, в частности циклопентил или циклогексил.
Замещенный фенил обозначает в связи с соединениями
формулы IV и V фенил, замещенный группами-донорами электронов предпочтительно в 3-й 5-положении, как, например, группы формул
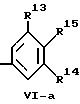
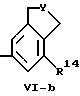
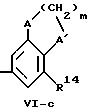
где
Y обозначает (-CH2-)m, кислород, серу или -N-R17,
А и А' независимо друг от друга обозначает -H2-, -CR13R14-, кислород, серу или -N-R17,
R13 и R14 независимо друг от друга обозначают низший алкил (как метил, этил, изопропил, изобутил, трет.-бутил, изопентил или трет.-пентил), низший алкокси (как метокси, этокси), триалкилсилил (как триметилсилил, триэтилсилил), циклоалкил (как циклопентил, циклогексил), бензил или один из радикалов R13 или R14 также обозначает водород,
R15 обозначает водород, низший алкил, низший алкокси, триалкилсилил (как триметилсилил или триэтилсилил), ди(низший алкил) амино или низший тиоалкил,
R17 обозначает низший алкил, в частности метил,
m обозначает целое число 1, 2 или 3.
Выражение "пятичленный
гетероароматический углеводород" в рамках настоящей заявки обозначает заместитель формулы,
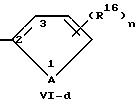
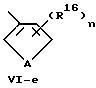
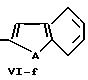
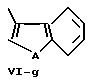
В формулах Vl-d - Vl-g
А обозначает кислород, серу или -N-R17,
R16 обозначает водород, низший алкил, в частности, метил или низший алкокси, в частности, метокси,
R17 обозначает низший алкил, в частности метил,
n обозначает 0, 1 или 2.
Предложенное в изобретении асимметричное гидрирование соединений формулы II в соединения формулы I осуществляют в подходящем в условиях реакции инертном органическом растворителе. В качестве подобных растворителей рассматриваются, в частности, низшие спирты, как например, метанол, этанол, изопропанол; или смеси подобных спиртов с галогенированными углеводородами, как например, метиленхлорид, хлороформ, гексафторбензол и тому подобное; или смеси с простым эфиром, как например, простой диэтиловый эфир, тетрагидрофуран или диоксан, кроме того, применяют смеси вышеуказанных спиртов со сложными эфирами, как например, сложный этиловый эфир уксусной кислоты, или с карбоновыми кислотами, как, например, муравьиная кислота, уксусная кислота и тому подобное, или также с кетонами, как например, ацетон, метилэтилкетон или диэтилкетон, или с водой.
Предпочтительно реакцию осуществляют в метаноле, этаноле или изопропаноле, или смесях подобных спиртов с вышеуказанными галогенированными углеводородами, с вышеуказанными простыми эфирами или также с водой. Для предложенного в изобретении способа подходят, в частности, вышеуказанные спирты или смеси, как метанол/вода или метанол/диэтиловый эфир/тетрагидрофуран и тому подобное.
Гидрирование проводят предпочтительно при температуре в пределах примерно от 0oC до 100o C, предпочтительно в диапазоне температур примерно от 20oC до 80oC и при давлении примерно от 1 до 100 бар, предпочтительно примерно от 5 до 70 бар.
Молярное соотношение между гидрируемыми соединениями формулы II и рутением в комплексах формул Ill-a-lll-d находится в пределах между примерно 20000 и примерно 20, предпочтительно в пределах между примерно 10000 и примерно 100.
Лиганды формул IV и V являются известными соединениями или аналогами известных соединений, которые могут быть легко получены аналогичным образом для получения известных лигандов.
Соединения формул IV и V, где R8 и R9 являются одинаковыми, могут быть получены, например, согласно описанию в Европейском патенте 104 375, а также в Европейском патенте 398 132. Получение соединений, где R8 и R9 отличаются друг от друга, осуществляется двумя этапами, как это описывается, например, в Европейском патенте 543 245.
Комплексы формул III-Ь и III-c могут быть получены известным способом. Комплексы формул III-d могут быть получены, например, так, что соединения формул IV или V
преобразуют с помощью соединений, которые могут отдавать рутений в концентрированном, инертном органическом или водном растворителе. Комплексы формулы III-a могут быть получены из соединений III-d
путем преобразования с помощью НХ, где Х имеет вышеуказанное значение, в частности, BF
Энантиоселективное гидрирование соединений формулы II осуществляют предпочтительно в присутствии комплексов рутений-дифосфин формулы III-а, в частности, в присутствии комплексов формулы III-а и избытка НХ или другой подходящей кислоты, как например, перфторированной карбоновой кислоты.
Из лигандов формул IV и V, применяемых в рамках настоящего изобретения, предпочтительными являются лиганды формулы IV. Особенно предпочтительными лигандами формулы IV являются лиганды, где R5 и R6 являются одинаковыми и обозначают метил или метокси, р равно 0, и R8 и R9 имеют одинаковое значение и обозначают замещенный фенил, предпочтительно группы формулы Vl-a, где R13 и R14 являются одинаковыми и обозначают метил, изопропил, трет.-бутил, трет. -пентил, метокси, триметилсилил или триэтилсилил, и R15 обозначает водород, метокси или диметиламино.
Примеры особенно предпочтительных лигандов формулы IV:
(6,6'-диметоксибифенил-2,2'-диил)бис[бис(3,4,
5-триметоксифенил)- фосфин] (3,4,5-MeO-MeOBIPHEP)
(6,6'-диметоксибифенил-2,2'-диил)бис[бис(3,5-диметил-4-диметиламино- фенил)фосфин] (DMAXyl-MeOBIPHEP)
(6,6'-диметоксибифенил-2,
2'-диил)бис[бис(3,5-бис(триметилсилил) -фенил)фосфин] (3,5-TMS-MeOBIPHEP)
(6,6'-диметоксибифенил-2,2'-диил)бис[бис(3,5-бис(триэтилсилил) фенил)фосфин] (3,5-TES-MeOBIPHEP)
(6,
6'-диметоксибифенил-2,2'-диил)бис[бис(3,5-диизоприлфенил) фосфин] (3,5-iPr-MeOBIPHEP)
(6,6' -диметоксибифенил-2,2'-диил)бис[бис(3,5 -дитрет. - бутилфенил)фосфин] (3,5-tBu-MeOBIPHEP)
(6,6'-диметоксибифенил-2,2'-диил)бис[бис(3,5-дитрет. - пентилфенил)фосфин] (3,5-tPen-MeOBIPHEP)
(6,6'-диметоксибифенил-2,2'-диил)бис[бис(3,5-диметилфенил)- фосфин] (Xyl-MeOBIPHEP)
(6,
6'-диметоксибифенил-2,2'-диил)бис[бис(3,5-диизопропил-4- метоксифенил)фосфин] (3,5-iPr-4-MeO-MeOBIPHEP)
(6,6'-диметоксибифенил-2,2'-диил)бис[бис(3,5-дитрет.-бутил-4- метоксифенил)фосфин] (3,
5-tBu-4-MeO-MeOBIPHEP)
(6,6'-диметоксибифенил-2,2'-диил)бис[бис(3,5-дитрет. -пентил-4- метоксифенил)фосфин] (3,5-tPen-4-MeO-MeOBIPHEP)
Следующие примеры служат для пояснения
изобретения и никоим образом не ограничивают его. Использованные в этих примерах сокращения имеют следующие значения:
ОАс Ацетокси
ЖХВД Жидкостная хроматография высокого давления
КТ Комнатная температура
ВВ Высокий вакуум: ≈ 0,1 мбар
ГХ 7 Капиллярная газовая хроматография.
Пробы продуктов ацетилируют с помощью ацетангидрид/пиридина или силилируют с помощью N,O-бис(триметилсилил)ацетамид/5% трихлорсилана в пиридине. Пробы, содержащие катализатор, растворяют в метиленхлориде и раствор фильтруют через небольшое количество силикагеля, для того чтобы отделить катализатор.
о. ч. Оптическая чистота (R)-3-гексил-5,6-дигидро-4-окси-6-ундецил-2Н-пиран-2-он, [α]
ее Энантиомерный избыток 3-гексил-5, 6-дигидро-4-метокси-6- ундецил-2Н-пиран-2-она. Простой метиловый эфир получают гидрированием или метилированием соответствующего дигидропирона с помощью простого метилового эфира ортомуравьиной кислоты/метанола и п-толуолсульфокислоты в качестве катализатора. Определение энантиомерного избытка осуществляется с помощью жидкостной хроматографии высокого давления (ЖХВД) в фазе Chiralcel-OD.
ДГП 3-гексил-5,6-дигидро-4-окси-б-ундецил-2Н-пиран-2-он (дигидропирон)
ДГПМ 3-гексил-5,6-дигидро-4-метокси-6-ундецил-2Н-пиран-2-он (дигидропирон-простой метиловый эфир).
Все температуры указаны в градусах Цельсия.
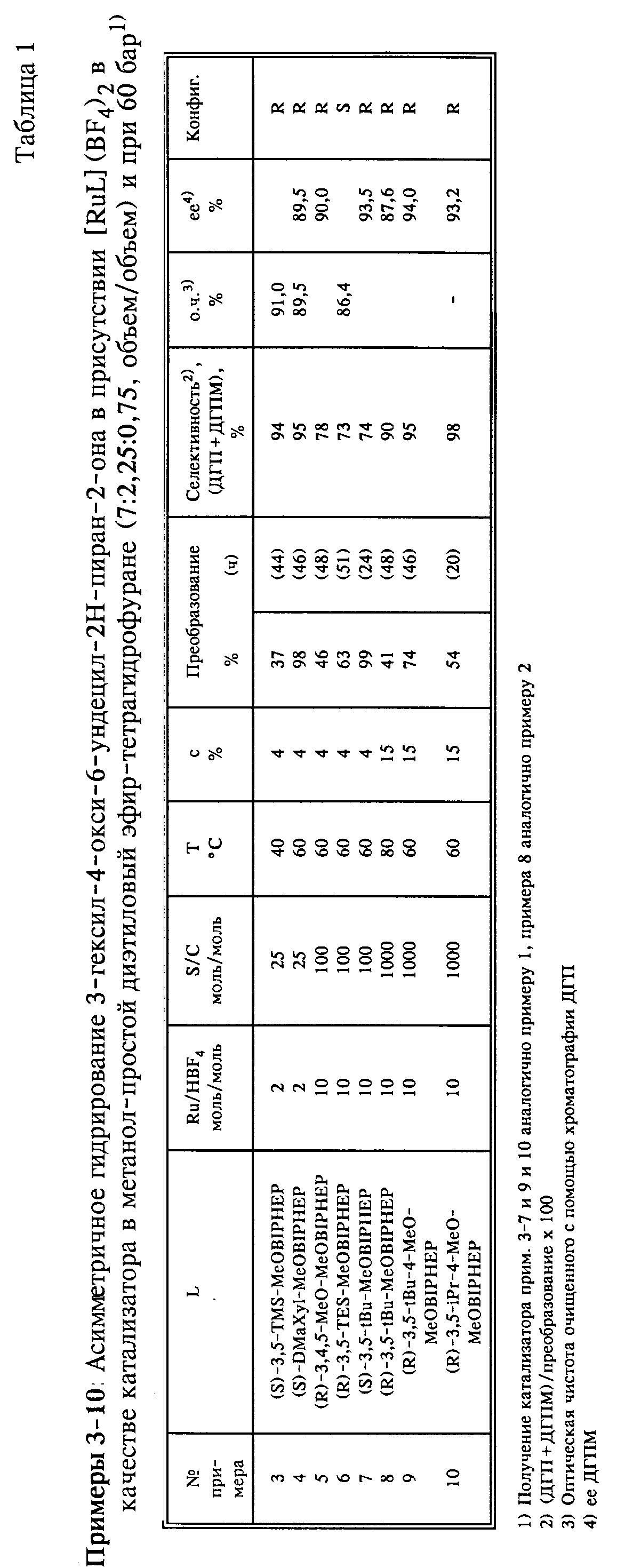
Пример 1.
а) В реакторе Glove Box (аргон, < 1 части на миллион кислорода) растворяют 19,6 мг (0,06 ммолей) Ди(η2-ацетато)-(η4- циклоокта-1,5-диен)рутения(II) и 61,9 мг (0,060 ммолей) (S)-3,5-tBu-MeOBIPHEP в 7,5 мл простого диэтилового эфира и 2,5 мл тетрагидрофурана в трубке и раствор перемешивают при температуре 40oC в течение ночи. После охлаждения добавляют 2,5 мл (0,015 ммолей) катализаторного раствора в 6,5 мл простого диэтилового эфира/тетрагидрофурана (3:1, объем/объем) и полученный раствор смешивают с раствором из 26,3 мг (0,15 ммолей) 50%-ного водного HBF4 в 7,5 мл метанола. Желтый катализаторный раствор перемешивают в течение 1,5 часов при комнатной температуре.
б) В реактор Glove Box помещают ЗО-миллилитровый автоклав со стеклянной насадкой с 1,05 г (3,00 ммоля) 3-гексил-4-окси-6-ундецил-2Н-пиран-2-она, 13,5 мл метанола и катализаторным раствором (S/C 200), полученным согласно а). Гидрирование осуществляется при помешивании магнитным стержнем в течение 48 часов при температуре 60oC и давлении 60 бар.
Желтый гидрированный раствор выпаривают на ротационном испарителе при температуре 35oC и давлении 20 мбар. Остаток
(1,02 г желтых кристаллов) состоит согласно капиллярному ГХ-анализу из 59% З-гексил-5,6-дигидро-4-окси-6-ундецил-2Н-пиран-2-она, 10% 3-гексил-5,6-дигидро-4-метокси-6-ундецил-2Н-пиран-2-она, 5% смеси 4
диастереомерных насыщенных лактонов и 22% исходного вещества. Для определения энантиоселективности 0,71 г остатка хроматографируют на 40 г силикагеля. Метиленхлорид элюирует 320 мг (R)-дигидропирона,
[α]
Пример 2.
а) В реакторе Glove Box перемешивают раствор из 15,0 мг (0,012 ммолей) Ru(OAc)2[(S)-3,5-tBu-MeOBIPHEP) в 12,5 мл метанола с раствором из 21,1 мг (0,12 ммолей) 50%-го водного HBF4 в 2,5 мл метанола и катализаторный раствор перемешивают в течение 1,5 часов при комнатной температуре.
б) В реактор Glove Box помещают 185-мл-автоклав с 4,21 г (12,0 ммолей) 3-гексил-4-окси-6-ундецил-2Н-пиран-2-она, 15
мл метанола и катализаторного раствора (S/C 1'000), полученного согласно а). Гидрирование осуществляется при температуре 60oC и давлении 60 бар и при сильном перемешивании в течение 48
часов. После охлаждения выпаривают желтый кристаллический раствор при температуре 40oC и давлении 18 мбар на ротационном испарителе. Остаток (4,3 г желтого кристаллизата), состоящий,
согласно капиллярному ГХ-анализу, из 73% 3-гексил-5,6-дигидро-4-окси-6-ундецил-2Н-пиран-2-она, 20% 3-гексил-5,6-дигидро-4-метокси-6-ундецил-2Н-пиран-2-она и 5% смеси 4 диастереомерных насыщенных
лактонов, хроматографируют на 150 г силикагеля. Метиленхлорид элюирует 210 мг (R) - дигидропирона, [α]
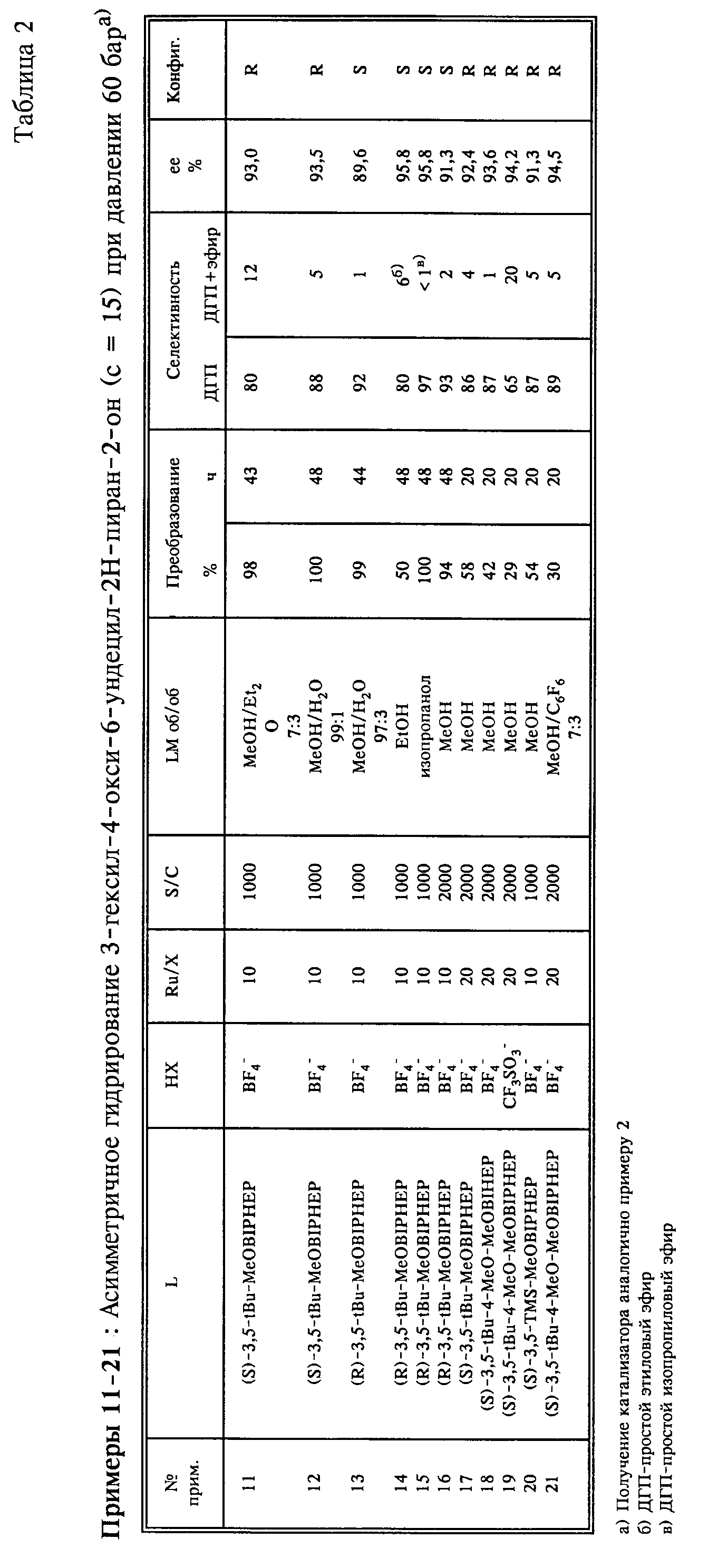
Пример 22.
а) В реакторе Glove Box (аргон, < 1 части на миллион кислорода) растворяют 13,1 мг (0,040 ммолей)/ Ди(η2-ацетато)-(η4- циклоокта-1,5-ди- ен)рутения(11) и 41,3 мг (0,040 ммолей) (S)-3,5-tBu-MeBIPHEP в 2,25 мл простого диэтилового эфира и 0,75 мл тетрагидрофурана в трубке Шленка и раствор перемешивают в течение ночи при температуре 40oC. После охлаждения добавляют раствор из 14 мг (0,08 ммолей) 50%-ного водного HBF4 в 2,5 мл метанола. Желтый катализаторный раствор перемешивают в течение 1,5 часов при комнатной температуре.
б) В реактор Glove Box помещают ЗО-мл-автоклав со стеклянной насадкой с 0,36 г (1,00 ммолей) 3-гексил-4-метокси-6-ундецил-2Н-пиран-2-она, 4,5 мл метанола и катализаторный раствор, полученный согласно а). Гидрирование осуществляется при помешивании с помощью магнитного стержня в течение 40 часов при температуре 60oC и давлении 60 бар.
Желтый гидрированный раствор выпаривают на ротационном испарителе при температуре 35oC при давлении 20 мбар. Остаток (0,35 г желтых кристаллов) состоит согласно капиллярному ТХ-анализу из 71% З-гексил- 5,6-дигидро-4-метокси-6-ундецил-2Н-пиран-2-она и 21% исходного вещества. Для определения энантиоселективности раствор остатка фильтруют в метиленхлориде через небольшое количество силикагеля и элюат анализируют после выпаривания с помощью ЖХВД: 53% энантиомерного избытка З-гексил-5,6-дигидро-4-метокси-6-ундецил-2Н-пиран-2-она.
Пример 23.
а) В реакторе Glove Box раствор из 16,4 мг (0,012 ммолей) Ru(OAc)2[(S)-3, 5-tBu-4-MeO-MeOBIPHEP] в 12,5 мл метанола смешивают с раствором из 13,7 мг (0,12 ммолей) трифторуксусной кислоты в 2,5 мл метанола и катализаторный раствор перемешивают в течение 1,5 часов при комнатной температуре.
б) В реактор Glove Box помещают 185-мл-автоклав с 4,21 г (12,0 ммолей) 3-гексил-4-окси-6-ундецил-2Н-пиран-2-она, 15 мл метанола и с катализаторным раствором (S/C 1 '000), полученным согласно а). Гидрирование осуществляется при температуре 60oC, давлении 60 бар и при сильном перемешивании в течение 24 часов. После охлаждения желтый кристаллический раствор выпаривают на ротационном испарителе при температуре 40oC и давлении 18 мбар. Остаток (4,2 г желтого кристаллизата) состоит согласно капиллярному ГХ-анализу из 46% исходного вещества, 48% З-гексил-5,6-дигидро-4-окси-6-ундецил-2Н-пиран-2-она и 1% смеси 4 диастереомерных насыщенных лактонов.
Для определения энантиомерного избытка 3-гексил-5, 6-дигидро-4- метокси-6-ундецил-2Н-пиран-2-она смесь обрабатывают сложным метиловым эфиром ортомуравьиной кислоты/метанолом и каталитическим количеством п-толуолсульфокислоты и анализируют с помощью ЖХВД: 87,8% энантио- мерного избытка 3-гексил-5,6-дигидро-4-метокси-6-ундецил-2Н-пиран-2-она (R).
Пример 24.
а) В реакторе Glove Box раствор из 16,4 мг (0,012 ммолей) Ru(OAc)2[(S)-3,5-tBu-4-MeO-MeOBIPHEP] в 12,5 мл метанола смешивают с раствором из 4,2 мг (0,024 ммолей) 50%-ного водного HBF4 в 2,5 мл метанола и раствор перемешивают в течение 1,5 часов при комнатной температуре. Затем добавляют 44,6 мг (0,096 ммолей) перфторпеларгоновой кислоты и перемешивают катализаторный раствор в течение 15 минут.
б) В реактор Glove Box помещают 185-мл-автоклав с 4,21 г (12,0 ммолей) 3-гексил-4-окси-6-ундецил-2Н-пиран-2-она, 15 мл метанола и с катализаторным раствором (S/C 1 '000), полученным согласно примеру а). Гидрирование осуществляется при температуре 60°С, давлении 60 бар и сильном перемешивании в течение 20 часов. После охлаждения выпаривают желтый кристаллический раствор на ротационном испарителе при температуре 40oC и давлении 18 мбар. Остаток (4,2 г желтого кристаллизата) состоит согласно капиллярному ГХ-анализу из 51% исходного вещества, 44% З-гексил-5,6-дигидро-4-окси-6-ундецил-2Н-пиран-2-она, 2% 3-гексил-5, 6-дигидро-4-метокси-6-ундецил-2Н-пиран-2-она и 1% смеси 4 диастереомерных насыщенных лактонов.
Для определения энантиомерного избытка 3-гексил-5, 6-дигидро-4- окси-6-ундецил-2Н-пиран-2-она смесь обрабатывают сложным метиловым эфиром ортомуравьиной кислоты/метанолом и каталитическим количеством п-толуолсульфокислоты и анализируют с помощью ЖХВД: 92,8% энантиомерного избытка 3-гексил-5, б-дигидро-4-метокси-6-ундецил- 2Н-пиран2-она (R).
Реферат
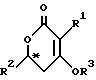
Изобретение относится к новому каталитическому способу получения оптически активных соединений общей формулы (I),
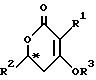
где R1 и R2 обозначают алкил, который может быть разорван атомом кислорода в ином положении, чем α или β- -положение, или необязательно замещенный бензил;
R3 обозначает водород, низший алкил, необязательно замещенный бензил, -CO R4, -COOR4 или -CONR24 ;
R4 обозначает низший алкил или арил,
асимметричным гидрированием соединения формулы (II)
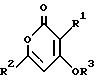
где R1, R2, R3 имеют вышеуказанные значения,
асимметричнно гидрируют в присутствии комплекса оптически активного, предпочтительно атропоизомерного дифосфинлиганда с металлом группы VIII. Задача состоит в том, чтобы найти прямой доступ к оптически активным соединениям формулы (I), благодаря которым излишним является последующее расщепление рацематов. 6 з.п. ф-лы, 2 табл.
Формула
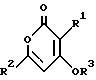
где R1 и R2 обозначают алкил, который может быть разорван атомом кислорода в ином положении, чем α- или β- положение, или необязательно замещенный бензил;
R3 обозначает водород, низший алкил, необязательно замещенный бензил, -CO-R4, -COOR4 или -CONR42;
R4 обозначает низший алкил или арил,
асимметричным гидрированием соединения формулы II
где R1, R2, R3 имеют вышеуказанные значения, отличающийся тем, что асимметричное гидрирование проводят в присутствии комплекса оптически активного атропоизомерного дифосфин-лиганда с металлом VIII группы.
[RuL]2+ (X)2 III-a
[RuLX2-]2+ (X)2 III-b
[RuLX1X2]+ X3 III-c
RuL(X4)2 III-d
где X обозначает BF
X1 обозначает галоген;
X2 обозначает бензол, гексаметилбензол или пара-цимол;
X3 обозначает галогенид, ClO
X4 обозначает анион Z2 -COO- или анион Z3-SO
Z1 обозначает галогенированный низший алкил или галогенированный низший фенил;
Z2 обозначает низший алкил, фенил, галогенированный низший алкил или галогенированный низший фенил;
Z3 обозначает низший алкил или фенил;
L представляет собой оптически активные антропоизомерные дифосфин-лиганды формулы IV
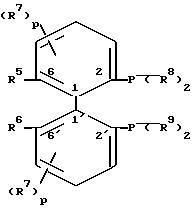
или общей формулы V
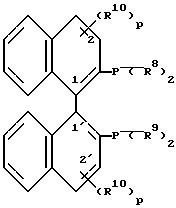
в (S)- либо (R)-форме,
где R5 и R6 независимо друг от друга обозначают низший алкил, низший алкокси, ди(низший алкил)амино, гидроксильную группу, защищенную гидроксильную группу, гидроксиметил или защищенный гидроксиметил, или
R5 и R6 вместе обозначают двухвалентную группу
-(CH2)q-, -CH2-O-CH2-,
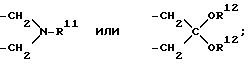
R7 обозначает водород, низший алкил или низший алкокси;
R8 и R9 независимо друг от друга обозначают циклоалкил, незамещенный или замещенный фенил или пятичленный гетероароматический углеводород, при условии, что по меньшей мере один из радикалов R8 и R9 представляет собой замещенное фенильное кольцо или пятичленный гетероароматический углеводород;
R10 представляет собой предпочтительно в 5,5'-положении галоген, гидроксильную группу, низший алкил, амино, ацетамидо, нитро или сульфо;
R11 обозначает низший алкил, фенил или бензил;
R12 обозначает низший алкил или оба R12 представляют вместе ди- или триметиленгруппу;
p обозначает 0 или число 1, 2 или 3;
q обозначает число 3, 4 или 5.
[RuL]2+ (X)2,
где X обозначает
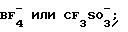
L обозначает оптически активный атропоизомерный лиганд формулы IV
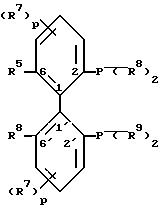
в (R)- или (S)-форме,
где R5 и R6 являются одинаковыми и обозначают метил или метокси;
p равно 0,
R8 и R9 являются одинаковыми и представляют собой замещенный фенил.
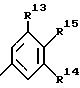
где R13 и R14 независимо друг от друга обозначают низший алкил, низший алкокси, триалкилсилил, циклоалкил, бензил или один из радикалов R13 или R14 обозначает также водород;
R15 обозначает водород, гидроксильную группу, низший алкил, низший алкокси, триалкилсилил или ди(низший алкил)-амино.

Комментарии