Варианты химозина с улучшенными свойствами - RU2740317C2
Код документа: RU2740317C2
Чертежи


Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к вариантам химозина с улучшенными свойствами.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Химозин (ЕС 3.4.23.4) и пепсин (ЕС 3.4.23.1) - молокосвертывающие ферменты желудка млекопитающих - представляют собой аспартатпротеазы, принадлежащие к широкому классу пептидаз.
При продуцировании в клетках слизистой желудка химозин и пепсин появляются в виде ферментативно неактивных пре-прохимозина и пре-пепсиногена, соответственно. При экскреции химозина N-концевой пептидный фрагмент, пре-фрагмент (сигнальный пептид), отщепляется с образованием прохимозина, включающего про-фрагмент. Прохимозин представляет собой по существу неактивную форму фермента, которая, однако, активируется в кислотных условиях до активного химозина посредством автокаталитического удаления про-фрагмента. Данная активация происходит in vivo в полости желудка при подходящих условиях рН или in vitro в кислых условиях.
Структурные и функциональные характеристики коровьего, т.е. Bos taurus, пре-прохимозина, прохимозина и химозина были всесторонне изучены. Пре-часть молекулы коровьего пре-прохимозина содержит 16 ак (аминокислотных) остатков, а про-часть соответствующего прохимозина имеет длину 42 ак остатка. Активный коровий химозин содержит 323 ак.
Химозин продуцируется в природе у таких видов млекопитающих как жвачные животные, верблюды, козы, буйволовые, овцы, свиньи, человек, обезьяны и крысы.
Коровий и верблюжий химозин в течение многих лет имеется в продаже для молочной промышленности.
Ферментативное свертывание молока молокосвертывающими ферментами, такими как химозин и пепсин, является одним из самых важных процессов в изготовлении сыров. Ферментативное свертывание молока представляет собой двухфазный процесс: первую фазу, когда протеолитический фермент, химозин или пепсин, атакует κ-казеин, приводя к метастабильному состоянию мицелярной структуры казеина, и вторую фазу, когда молоко затем свертывается и образует коагулят (ссылка 1). Помимо облегчения свертывания молока посредством расщепления κ-казеина, химозины расщепляют β-казеин (β-казеин), главным образом, между Leu192 и Tyr193, приводя к образованию β(193-209) пептида. Дальнейший протеолиз β(193-209) и образование коротких гидрофобных пептидов может приводить к нежелательному горькому вкусу продукта.
В WO 02/36752 A2 (Chr. Hansen) описана рекомбинантная продукция верблюжьего химозина.
В WO 2013/174840 A1 (Chr. Hansen) описаны мутанты/варианты коровьего и верблюжьего химозина.
В WO 2013/164479 A2 (DSM) описаны мутанты коровьего химозина.
Ссылки, перечисленные сразу ниже, в настоящем контексте можно рассматривать как ссылки, описывающие мутантов химозина:
- Suzuki et al: Site directed mutagenesis reveals functional contribution of Thr218, Lys220 and Asp304 in chymosin, Protein Engineering, vol. 4, January 1990, pp. 69-71;
- Suzuki et al: Alteration of catalytic properties of chymosin by site-directed mutagenesis, Protein Engineering, vol. 2, May 1989, pp. 563-569;
- van den Brink et al: Increased production of chymosin by glycosylation, Journal of biotechnology, vol. 125, September 2006, pp. 304-310;
- Pitts et al: Expression and characterisation of chymosin pH optima mutants produced in Tricoderma reesei, Journal of biotechnology, vol. 28, March 1993, pp. 69-83;
- M.G. Williams et al: Mutagenesis, biochemical characterization and X-ray structural analysis of point mutants of bovine chymosin, Protein engineering design and selection, vol. 10, September 1997, pp. 991-997;
- Strop et al: Engineering enzyme subsite specificity: preparation, kinetic characterization, and x-ray analysis at 2.0 ANG resolution of Val111phe site mutated calf chymosin, Biochemistry, vol. 29, October 1990, pp. 9863-9871;
- Chitpinityol et al: Site-specific mutations of calf chymosin В which influence milk-clotting activity, Food Chemistry, vol. 62, June 1998, pp. 133-139;
- Zhang et al: Functional implications of disulfide bond, Cys45-Cys50, in recombinant prochymosin, Biochimica et biophysica acta, vol. 1343, December 1997, pp. 278-286.
Ни одна из ссылок предшествующего уровня техники, упомянутая выше, не описывает прямо и недвусмысленно какие-либо варианты химозина с пониженной частотой расщепления β-казеина при аналогичной свертывающей активности по сравнению с родительской формой, из которой происходит вариант, как описано ниже.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Проблемой, подлежащей решению настоящим изобретением, является предложение вариантов химозина, которые, по сравнению с родительским полипептидом, имеют пониженную частоту расщепления β-казеина, по существу поддерживая его свертывающую эффективность.
Соответственно, согласно настоящему изобретению предложены выделенные варианты полипептида химозина, отличающиеся тем, что:
(а) выделенный вариант полипептида химозина имеет удельную свертывающую активность (IMCU(международная молокосвертывающая единица)/мг общего белка), которая составляет по меньшей мере 80% удельной свертывающей активности выделенного полипептида верблюжьего химозина, характеризующегося SEQ ID NO: 4; и
(б) выделенный вариант полипептида химозина расщепляет β-казеин с частотой меньше, чем 50% от частоты расщепления β-казеина выделенного полипептида верблюжьего химозина, характеризующегося SEQ ID NO: 4, где расщепление β-казеина определяют посредством количественного измерения пептидов β-казеина, полученных инкубированием обезжиренного молока с вариантом химозина или верблюжьим химозином, где количественное измерение осуществляют посредством RP-HPLC (высокоэффективная жидкостная хроматография с обращенной фазой) в сочетании с ESI-Q-TOF масс-спектрометром (времяпролетный квадрупольный масс-спектрометр с электрораспылительной ионизацией).
Выделенный вариант полипептида химозина по настоящему изобретению может происходить из родительского полипептида, который имеет по меньшей мере 80%-ую, например по меньшей мере 85%-ую, 95%-ую, 97%-ую 98%-ую, 99%-ую, 100%-ую идентичность последовательности с полипептидом с SEQ ID NO: 4 (верблюжий химозин).
В родственном аспекте выделенный вариант полипептида химозина по настоящему изобретению обладает по меньшей мере 70%, например, по меньшей мере например 75%, 80%, 90%, 100%, 110%, 120%, 130% или 150% удельной свертывающей активности выделенного полипептида верблюжьего химозина, характеризующегося SEQ ID NO: 4.
В еще одном другом родственном аспекте выделенный вариант полипептида химозина по настоящему изобретению предпочтительно обладает по меньшей мере менее чем 50%, например, менее чем например 40%, менее чем 30%, менее чем 20%, менее чем 15%, менее чем 10% или менее чем 6% неспецифической протеолитической активности (Р) выделенного полипептида верблюжьего химозина, характеризующегося SEQ ID NO: 4.
В другом родственном аспекте выделенный вариант полипептида химозина по настоящему изобретению имеет отношение С/Р по меньшей мере 300%, 400%, 500%, 600%, 700%, 800%, 1000%, 1200%, 1400% или 1600% от отношения С/Р выделенного полипептида верблюжьего химозина, характеризующегося SEQ ID NO: 4.
Выделенный вариант полипептида химозина по настоящему изобретению может содержать одну или более чем одну замену, делецию или вставку аминокислоты, где данная одна или более чем одна замена, делеция или вставка определена по отношению к аминокислотной последовательности SEQ ID NO: 4: Y11, L130, S132, V32, S226, R266, L12, V221, S255, S277, L222, L253, М157, V260, S271, Н76, K19, V183, S164, I263, V51, Т239, Y307, R67, G251, R61, Q288, Е83, D59, V309, S273, G251, S154, Y21, V203, L180, Е294, G289, L215, D144, I303, L105, Т284, Y127, V248, K321, V205, Е262, K231, R316, М256, D158, D59, N249, L166, R242 или I96, и, более конкретно, такая как например, Y11I, Y11V, L130I, S132A, V32L, S226T, R266V, L12M, V221M, S255Y, S277N, L222I, L253I, M157L, V260T, S271P, H76Q, K19T, V183I, S164G, I263L, V51L, T239S, Y307F, R67Q, G251D, R61Q, Q288E, E83S, D59N, V309I, S273Y, G251W, S154A, Y21S, V203A, L180I, E294Q, G289S, L215V, D144Q, I303L, L105E, T284S, Y127F, V248I, K321P, V205I, Е262Т, K231N, R316L, M256L, D158S, D59N, N249E, L166V, R242E и/или I96L.
Согласно настоящему изобретению дополнительно предложены способы получения выделенных вариантов полипептида химозина по настоящему изобретению, способы получения пищевого или кормового продукта с использованием выделенных вариантов полипептида химозина, пищевые или кормовые продукты, содержащие данные варианты, а также применение данных вариантов для получения пищевых и кормовых продуктов.
В родственном альтернативном аспекте данное изобретение относится к способам получения выделенного полипептида химозина с пониженной частотой расщепления β-казеина, включающим следующие стадии:
(а): получение изменения в одном или более чем одном положении в последовательности ДНК, кодирующей полипептид с SEQ ID NO: 4, где данное изменение включает замену, делецию или вставку в по меньшей мере одном аминокислотном положении, соответствующем любому из положений:
Y11, L130, S132, V32, S226, R266, L12, V221, S255, S277, L222, L253, М157, V260, S271, Н76, K19, V183, S164, I263, V51, Т239, Y307, R67, G251, R61, Q288, Е83, D59, V309, S273, G251, S154, Y21, V203, L180, Е294, G289, L215, D144, I303, L105, Т284, Y127, V248, K321, V205, Е262, K231, R316, М256, D158, D59, N249, L166, R242 или I96 в SEQ ID NO: 4;
(б) продуцирование и выделение измененного полипептида стадии (а).
Выделенный химозин, полученный приведенными выше способами, может содержать одну или более чем одну из следующих замен:
Y11I, Y11V, L130I, S132A, V32L, S226T, R266V, L12M, V221M, S255Y, S277N, L222I, L253I, M157L, V260T, S271P, H76Q, K19T, V183I, S164G, I263L, V51L, T239S, Y307F, R67Q, G251D, R61Q, Q288E, E83S, D59N, V309I, S273Y, G251W, S154A, Y21S, V203A, L180I, E294Q, G289S, L215V, D144Q, I303L, L105E, T284S, Y127F, V248I, K321P, V205I, Е262Т, K231N, R316L, M256L, D158S, D59N, N249E, L166V, R242E и/или I96L.
В родственном аспекте выделенный вариант полипептида химозина по настоящему изобретению и вариант, полученный описанными выше способами, может содержать комбинацию замен, где каждая замена определяется по отношению к аминокислотной последовательности SEQ ID NO: 4:
















Альтернативный аспект относится к способам изготовления пищевого или кормового продукта, включающим добавление эффективного количества выделенного варианта полипептида химозина по настоящему изобретению к пищевому(ым) или кормовому(ым) ингредиенту(ам) и проведение дальнейших стадий производства с получением пищевого или кормового продукта, такого как, например, продукт на основе молока, и, возможно, более конкретно к способам изготовления сыра, такого как, например, «паста филата», чеддар, сыры континентального типа, мягкий сыр или белый рассольный сыр.
Соответственно, настоящее изобретение относится к пищевому или кормовому продукту, содержащему вариант полипептида химозина, как здесь описано.
Вариант полипептида по настоящему изобретению также может быть использован для уменьшения горечи в сыре и других молочных продуктах, таких как, например, йогурт.
При созревании сыра химозин расщепляет β-казеин главным образом между Leu192 и Tyr193 (ссылки 2, 3). Образующийся в результате пептид β(193-209) будет далее подвергаться деградации протеазами до коротких гидрофобных пептидов, которые имеют горький вкус (ссылка 4). Поскольку горечь в продуктах молочного производства чаще всего считается нежелательной характеристикой, желательно разрабатывать варианты химозина с меньшей частотой расщепления β-казеина.
На основе продуманного проектирования и сравнительного анализа разных вариантов авторы настоящего изобретения идентифицировали целый ряд аминокислотных положений, которые являются важными в том смысле, что посредством создания варианта в одном или более чем одном из данных положений можно получать улучшенный вариант химозина с меньшей частотой расщепления β-казеина.
Нумерация аминокислот в том виде, в котором она здесь используется для определения варианта или мутации, осуществляется по нумерации зрелого пептида. Для пояснения зрелый полипептид SEQ ID NO: 2 соответствует SEQ ID NO: 4.
Как известно в данной области, разные природные последовательности полипептида химозина дикого типа, полученные из разных видов млекопитающих (таких как, например, жвачные, верблюды, овцы, свиньи или крысы), имеют относительно высокое сходство/идентичность последовательности.
На Фиг. 1 это проиллюстрировано примером выравнивания релевантных последовательностей разных химозинов.
Принимая во внимание эту относительно близкую связь последовательностей, считается, что 3D (трехмерные) структуры разных природных химозинов дикого типа также являются относительно сходными.
В настоящем контексте полученный природный химозин дикого типа (такой как коровий химозин или верблюжий химозин) может быть примером родительского полипептида, т.е. родительского полипептида, в котором делается изменение с получением варианта полипептида химозина по настоящему изобретению.
Не будучи ограниченными теорией, считается, что обсуждаемые здесь аминокислотные положения, связанные с химозином, имеют общую важность в любом релевантном представляющем интерес ферменте химозине (например химозинах жвачных, верблюдов, овец, свиней, крыс и т.д.) в том смысле, что посредством получения варианта в одном или более чем одном из данных положений можно получать в общем улучшенный вариант химозина (например улучшенный вариант коровьего, верблюжьего, овечьего, свиного или крысиного химозина).
Как здесь обсуждалось, в качестве эталонной последовательности для определения положения аминокислоты представляющего интерес полипептида родительского химозина (например верблюжьего, овечьего, коровьего и т.д.) здесь используется общеизвестная последовательность SEQ ID NO: 2 зрелого химозина Camelius dromedarius. В качестве альтернативы она может в данном описании именоваться верблюжьим химозином. Данная последовательность также показана на Фиг. 1.
В настоящем контексте считается, что полипептид родительского химозина (например из овцы или крысы), который имеет по меньшей мере 65%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), может здесь рассматриваться как достаточно структурно родственный, например, коровьему или верблюжьему химозину, для того, чтобы быть улучшенным посредством получения варианта в любом из описанных здесь аминокислотных положений.
Воплощения настоящего изобретения описаны ниже.
ОПРЕДЕЛЕНИЯ
Все определения приведенных здесь релевантных терминов согласуются с тем, что было бы понятно специалисту в связи с релевантным здесь техническим контекстом.
Термин «β-расщепление» или «расщепление β-казеина» означает любое ферментативное расщеление β-казеина. Такое как, например, расщепление между Leu192 и Tyr193, приводящее к образованию β(193-209) пептида. В одном аспекте β-расщепление определяют количественным измерением β(193-209) пептида, полученного посредством инкубирования обезжиренного молока с полипептидом варианта химозина или верблюжьим химозином, где количественное измерение проводится посредством RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF. Полные подробности предпочтительного способа определения расщеления β-казеина описываются в Примерах.
Термин «химозин» относится к ферменту класса ЕС 3.4.23.4. Химозин имеет высокую специфичность и предпочтительно свертывает молоко посредством расщепления одной связи 104-Ser-Phe-|-Met-Ala-108 в κ-цепи казеина. В качестве побочной активности химозин также расщепляет β-казеин предпочтительно между Leu192 и Tyr193 (ссылки 2, 3). Образующийся пептид β(193-209) будет далее подвергаться деградации протеазами до коротких гидрофобных пептидов, которые имеют горький вкус (ссылка 4). Альтернативным названием химозина, используемым в данной области, является реннин.
Термин «химозиновая активность» относится к химозиновой активности фермента химозин, как понятно специалисту в настоящем контексте. Специалисту известно, как определять релевантную химозиновую активность.
Термин «удельная свертывающая активность» описывает активность свертывания молока полипептида химозина, и она может быть определена согласно хорошо известным в данной области анализам. Предпочтительным способом определения удельной свертывающей активности в показателях IMCU/мг белка является стандартный способ, разработанный Международной молочной федерацией (IDF) (способ IDF), который включает стадии, на которых активность свертывания молока определяют из времени, необходимого для видимого хлопьеобразования молочного субстрата, и время свертывания образца сравнивают с временем свертывания эталонного стандарта, имеющего известную молокосвертывающую активность и такой же состав фермента, согласно стандарту 110В IDF, что и образец. Образцы и эталонные стандарты измеряют при идентичных химических и физических условиях. Полные подробности способа IDF описываются в Примерах.
Как известно в данной области, релевантное здесь так называемое отношение С/Р определяется делением удельной свертывающей активности (С) на протеолитическую активность (Р). Как известно в данной области, более высокое отношение С/Р обычно подразумевает, что потеря белка в ходе, например, изготовления сыра, из-за неспецифической деградации белка уменьшена, т.е. выход сыра улучшается.
Термин «выделенный вариант» означает вариант, который модифицирован действием человека. В одном аспекте данный вариант является по меньшей мере на 1% чистым, например, по меньшей мере на 5% чистым, по меньшей мере на 10% чистым, по меньшей мере на 20% чистым, по меньшей мере на 40% чистым, по меньшей мере на 60% чистым, по меньшей мере на 80% чистым и по меньшей мере на 90% чистым при определении посредством SDS PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия).
Нумерация аминокислот в том виде, в котором она здесь используется для определения вариантов полипептида химозина по настоящему изобретению, осуществляется по нумерации зрелого пептида. В перечне последовательностей, предоставленном с настоящей заявкой:
SEQ ID NO: 1 представляет полную полипептидную последовательность коровьего пре-прохимозина;
SEQ ID NO: 2 представляет полную полипептидную последовательность верблюжьего пре-прохимозина;
SEQ ID NO: 3 представляет полипептидную последовательность зрелого коровьего химозина;
SEQ ID NO: 4 представляет полипептидную последовательность зрелого верблюжьего химозина.
Другими словами, SEQ ID NO: 3 и 4 соответствуют аминокислотам 59-381 в SEQ ID NO: 1 и 2, соответственно. Все идентифицированные здесь конкретные замены идентифицированы по отношению к положению в последовательности зрелого химозина, т.е. по отношению к нумерации аминокислот в SEQ ID NO: 3 или 4. В такой мере, в какой положение идентифицировано относительно нумерации аминокислот в SEQ ID NO: 1 или 2, необходимо вычесть 58 остатков для идентификации положения в SEQ ID NO: 3 или 4 и наоборот.
Термин «зрелый полипептид» означает пептид в его конечной форме после трансляции и любых посттрансляционных модификаций, таких как N-концевой процессинг, С-концевое усечение, гликозилирование, фосфорилирование и т.д. В настоящем контексте релевантный зрелый полипептид химозина может здесь рассматриваться как полипептидная последовательность активного химозина, т.е. без последовательностей пре-части и/или про-части. Здесь релевантные примеры зрелого полипептида представляют собой, например, зрелый полипептид с SEQ ID NO: 1 (коровий химозин), который простирается от аминокислотного положения 59 до аминокислотного положения 381 в SEQ ID NO: 1, или зрелый полипептид с SEQ ID NO: 2 (верблюжий химозин), который простирается от аминокислотного положения 59 до аминокислотного положения 381 в SEQ ID NO: 2.
Термин «родительский», «родительский полипептид» или «родительский полипептид, обладающий химозиновой активностью» означает полипептид, в котором сделано изменение с получением вариантов фермента по настоящему изобретению. Родительским может быть встречающийся в природе полипептид (дикого типа) или его вариант. В предпочтительном воплощении настоящего изобретения родительский полипептид имеет по меньшей мере 80%, например, по меньшей мере, например, 85%, 95%, 97%, 98%, 99% или 100% идентичности последовательности с полипептидом с SEQ ID NO: 4 (верблюжий химозин).
Термин «идентичность последовательности» относится к родству между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями.
Для целей настоящего изобретения степень идентичности последовательности между двумя аминокислотными последовательностями определяют с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453) в том виде, в котором он применяется в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно в версии 3.0.0 или более поздней. Возможными используемыми параметрами являются штраф за открытие пробела 10, штраф за увеличения пробела 0,5 и матрица замен EBLOSUM62 (версия EMBOSS BLOSUM62). В качестве процента идентичности используется результат Needle, отмеченный как «longest identity» («самая протяженная идентичность», полученный с использованием опции -nobrief), и он рассчитывается следующим образом:
(Идентичные остатки × 100) / (Длина выравнивания - Общее число пробелов в выравнивании)
Для целей настоящего изобретения степень идентичности последовательности между двумя последовательностями дезоксирибонуклеотидов определяют с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, выше) в том виде, в котором он применяется в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, выше), предпочтительно в версии 3.0.0 или более поздней. Возможными используемыми параметрами являются штраф за открытие пробела 10, штраф за увеличения пробела 0,5 и матрица замен EDNAFULL (версия EMBOSS NCBI NUC4.4). В качестве процента идентичности используется результат Needle, отмеченный как «longest identity» («самая протяженная идентичность», полученный с использованием опции -nobrief), и он рассчитывается следующим образом:
(Идентичные дезоксирибонуклеотиды × 100) / (Длина выравнивания - Общее число пробелов в выравнивании).
Термин «вариант» означает пептид, обладающий химозиновой активностью, содержащий изменение, т.е. замену, вставку и/или делецию в одном или более чем одном (нескольких) положениях. Термин «замена» означает замену аминокислоты, занимающей некое положение, другой аминокислотой; делеция обозначает удаление аминокислоты, занимающей некое положение, и вставка означает добавление 1-3 аминокислот, смежных с аминокислотой, занимающей некое положение.
Аминокислота может быть природной или неприродной аминокислотой, например, теоретически могла бы быть возможна замена, например, в частности D-изомерами (или D-формами), например, D-аланин мог бы быть теоретически возможен.
Термин пептид «дикого типа» относится к нуклеотдной последовательности или пептидной последовательности в том виде, в котором она встречается в природе, т.е. к нуклеотдной последовательности или пептидной последовательности, которая не подвергалась целевым мутациям посредством действия человека.
ГРАФИЧЕСКИЕ МАТЕРИАЛЫ
Фиг. 1: выравнивание релевантных здесь разных последовательностей химозина. Показанный «химозин_B_Bos_bovis» представляет собой коровий химозин с SEQ ID NO: 1, и показанный «Camelus_dromedarius» представляет собой здесь верблюжий химозин с SEQ ID NO: 2. С использованием коровьего химозина с SEQ ID NO: 1 в качестве эталонной последовательности, как здесь описано, можно видеть, например, что коровий химозин имеет «V» в положении 10, и верблюжий химозин имеет «А» в том же самом положении 10. Также, например, можно видеть, что коровий/крысиный имеют «Q» в положении 352, а верблюжий / C._bactrianus имеют «Е» в том же самом положении 352.
Относительно последовательностей химозина, показанных на Фиг. 1, овечий химозин имеет 94,5%-ую идентичность последовательности с коровьим с SEQ ID NO: 1; C._bactrianus имеет 83,2%-ую идентичность последовательности с коровьим SEQ ID NO: 1; Camelus_dromedarius (верблюжий химозин с SEQ ID NO: 2) имеет 84%-ую идентичность последовательности с коровьим SEQ ID NO: 1; свиной имеет 80,3%-ую идентичность последовательности с коровьим SEQ ID NO: 1, и крысиный имеет 71,9%-ую идентичность последовательности с коровьим SEQ ID NO: 1.
Как понятно специалисту в настоящем контексте, релевантные здесь проценты идентичности последовательности зрелых полипептидных последовательностей, например, овечьего, C._bactrianus, верблюжьего, свиного или крысиного химозина со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин - т.е. положения аминокислот 59-381 в SEQ ID NO: 1) являются относительно сходными с вышеупомянутыми процентами идентичности последовательности.
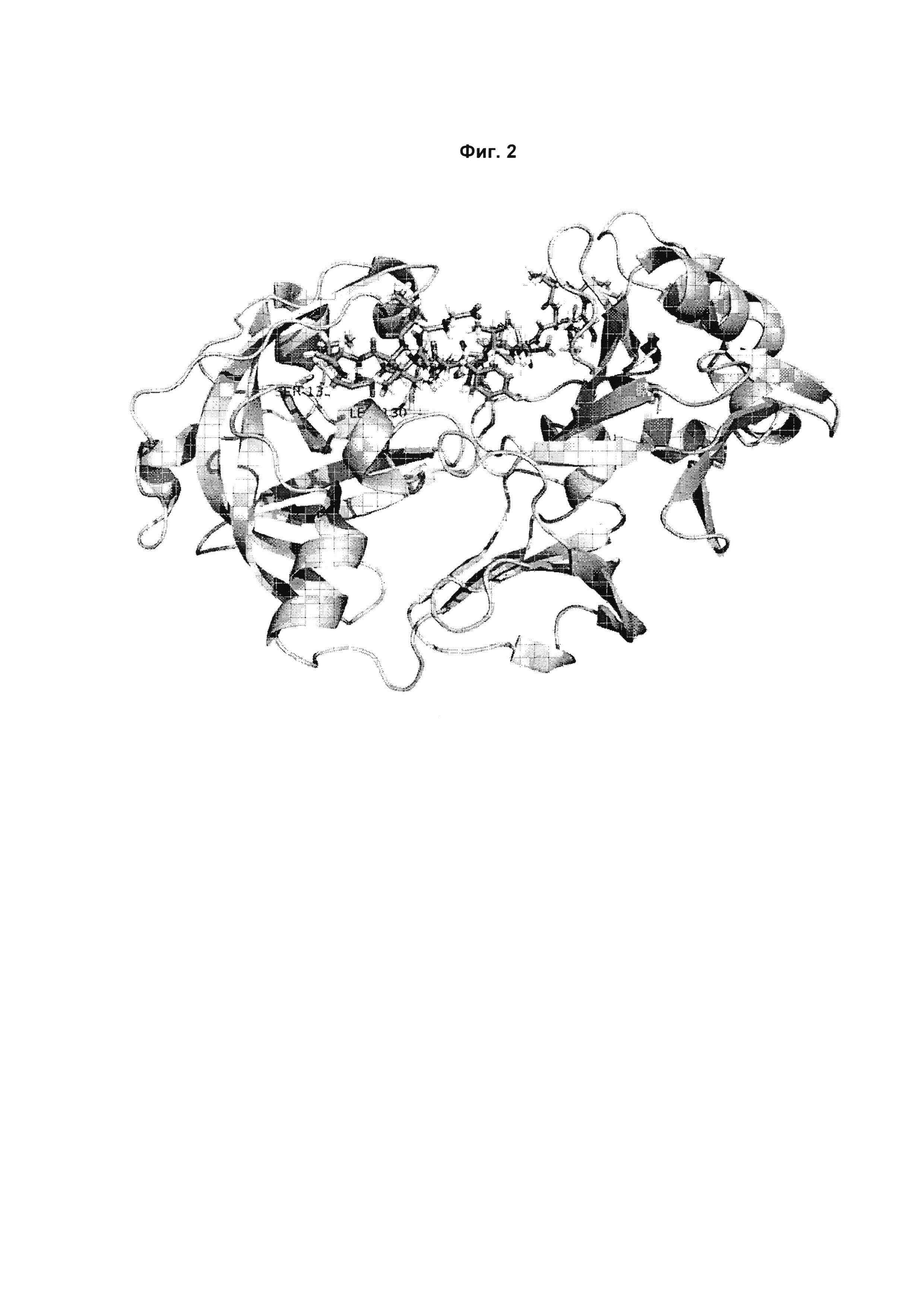
Фиг. 2 и 3:
3D структура верблюжьего химозина (PDB: 4АА9) с моделью связанного β-казеина, показанного фиолетовым. β-казеин размещен в субстратсвязывающей щели химозина с расщепляющейся связью между остатками 192 и 193. Остатки верблюжьего химозина V32, L130 и S132 выделены зеленым.
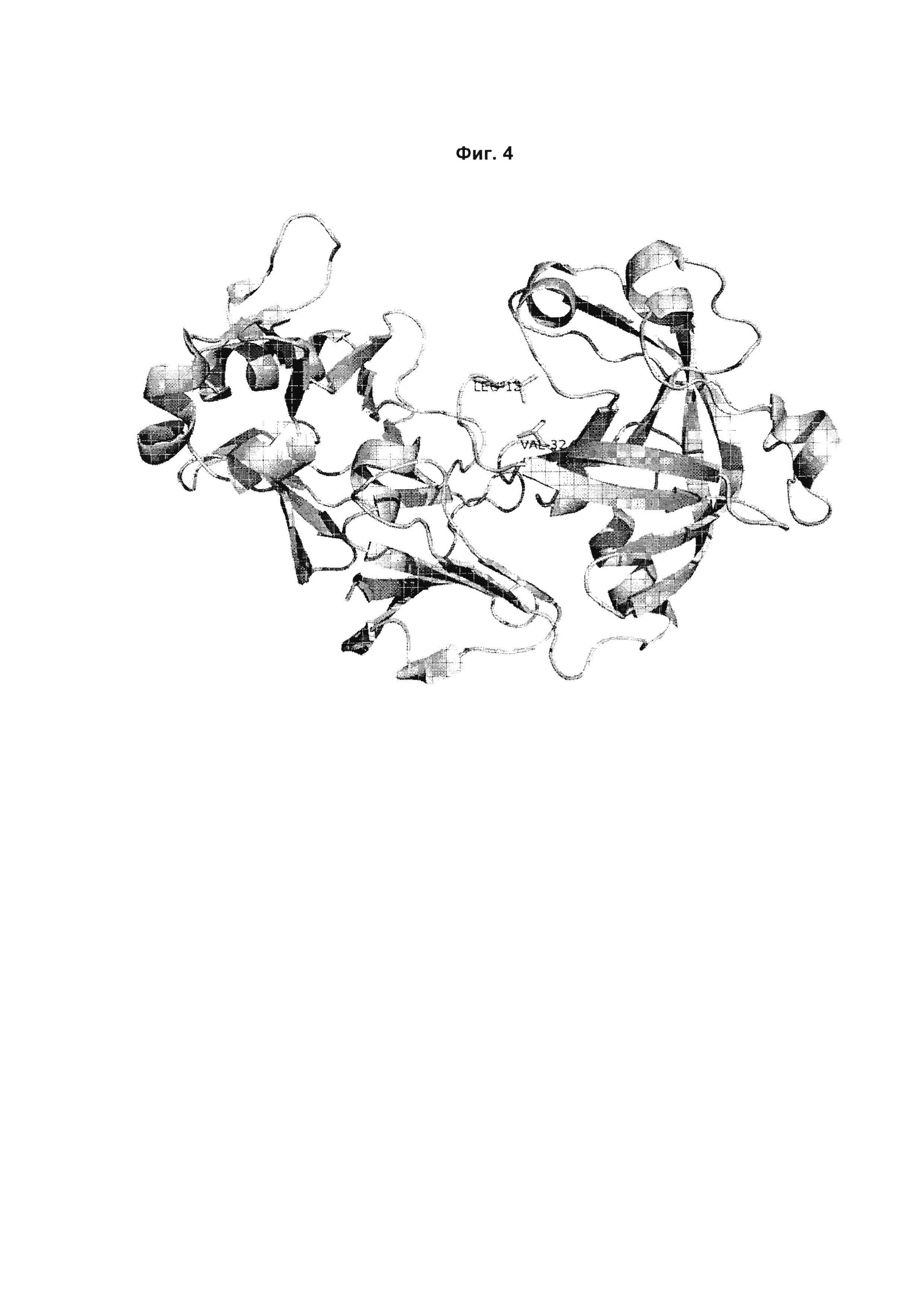
Фиг. 4:
3D структура верблюжьего химозина (PDB: 4АА9). Остатки верблюжьего химозина V32 и L12 выделены зеленым.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определение положения аминокислоты представляющего интерес химозина
Как обсуждалось выше, в качестве эталонной последовательности для определения положения аминокислоты релевантного представляющего интерес полипептида химозина (например верблюжьего, овечьего, коровьего и т.д.) здесь используется общеизвестная последовательность верблюжьего химозина, раскрытая в данном описании как SEQ ID NO: 2.
Аминокислотная последовательность другого полипептида химозина выравнивается с полипептидом, раскрытым в SEQ ID NO: 1, и на основе данного выравнивания определяют номер положения аминокислоты, соответствующего любому аминокислотному остатку в полипептиде, раскрытом в SEQ ID NO: 1, с использованием алгоритма ClustalW, как описано здесь в рабочем Примере 1.
На основе приведенных выше хорошо известных компьютерных программ определение положения аминокислоты релевантного представляющего интерес полипептида химозина (например верблюжьего, овечьего, коровьего и т.д.) является рутинной работой для специалиста.
На Фиг. 1 показан пример выравнивания.
Лишь в качестве примера, на Фиг. 1 можно, например, видеть, что используемая здесь коровья эталонная последовательность SEQ ID NO: 1 имеет «G» в положении 50, a «Camelus_dromedarius» (здесь SEQ ID NO: 2) имеет «А» в данном положении 50.
Номенклатура вариантов
В описании вариантов по настоящему изобретению описанная ниже номенклатура адаптирована для легкости ссылки. Используются принятые IUPAC (Международный союз теоретической и прикладной химии) однобуквенные или трехбуквенные обозначения аминокислот.
Конкретные варианты, обсуждаемые в приведенном ниже разделе «номенклатура» могут не быть релевантными вариантами по настоящему изобретению, т.е. данный раздел «номенклатура» служит лишь для описания релевантной здесь используемой номенклатуры как таковой. Как указано выше, нумерация аминокислот, используемая для определения вариантов полипептида химозина по настоящему изобретению, основана на положении аминокислоты в последовательности зрелого полипептида химозина.
Замены. Для аминокислотной замены используется следующая номенклатура: исходная аминокислота, положение, заменяющая аминокислота.
Соответственно, теоретическая замена треонина аланином в положении 226 обозначается как «Thr226Ala» или «Т226А». Множественные мутации разделяются добавлением значков («+»), например, «Gly205Arg + Ser411Phe» или «G205R + S411F», представляет замены в положениях 205 и 411 глицина (G) аргинином (R) и серина (S) фенилаланином (F), соответственно. Замена, например, обозначенная как «226А» относится к замене родительской аминокислоты (например, Т, Q, S или другой родительской аминокислоты) аланином в положении 226. Подобным же образом, замена, обозначенная как «А226» или «А226Х», относится к замене аланина в положении 226 другой неуточненной аминокислотой.
Делеции. Для делеции аминокислоты используется следующая номенклатура: исходная аминокислота, положение, *. Соответственно, делеция глицина в положении 195 обозначается как «Gly195*» или «G195*». Множественные делеции разделяются добавлением значков («+»), например, «Gly195* + Ser411*» или «G195* + S411*».
Вставки. Для вставки аминокислоты используется следующая номенклатура: исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота. Соответственно, вставка лизина после глицина в положении 195 обозначается как «Gly195GlyLys» или «G195GK». Вставка множественных аминокислот обозначается [Исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота №1, вставленная аминокислота №2 и т.д.]. Например, вставка лизина и аланина после глицина в положении 195 указывается как «Gly195GlyLysAla» или «G195GKA».
В таких случаях вставленный(ые) аминокислотный(ые) остаток(тки) нумеруется(ются) добавлением строчных букв к номеру положения аминокислотного остатка, предшествующего вставленному(ым) аминокислотному(ым) остатку(ткам). В приведенном выше примере данная последовательность, таким образом, была бы следующей:

Множественные изменения. Варианты, содержащие множественные изменения, разделяются добавлением значков («+»), например, «Arg170Tyr+Gly195Glu» или «R170Y+G195E», представляющий замену аргинина и глицина тирозином и глутаминовой кислотой в положениях 170 и 195, соответственно.
Разные замены. Там, где в положении могут быть введены разные замены, данные разные замены разделяются запятой, например, «Arg170Tyr,Glu» или «R170Y,E» представляет собой замену аргинина в положении 170 тирозином или глутаминовой кислотой. Таким образом, «Tyr167Gly,Ala + Arg170Gly,Ala» или «Y167G,A + R170G,A» обозначает следующие варианты:
«Tyr167Gly+Arg170Gly», «Tyr167Gly+Arg170Ala», «Tyr167Ala+Arg170Gly» и «Tyr167Ala+Arg170Ala».
Предпочтительные варианты:
Как описано в приведенных ниже Примерах, авторы изобретения создали целый ряд предпочтительных вариантов полипептида химозина, которые расщепляют β-казеин с меньшей частотой, чем соответствующий родительский полипептид, в то же самое время по меньшей мере частично поддерживая его свертывающую активность.
Предпочтительные варианты с пониженной частотой расщепления β-казеина
Выделенные варианты полипептида химозина по настоящему изобретению имеют удельную свертывающую активность (IMCU/мг общего белка), которая составляет по меньшей мере 80% от удельной свертывающей активности выделенного полипептида верблюжьего химозина, характеризующегося SEQ ID NO: 4, включая удельную свертывающую активность (IMCU/мг общего белка), которая составляет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 97% от удельной свертывающей активности выделенного полипептида верблюжьего химозина, характеризующегося SEQ ID NO: 4.
Выделенный вариант полипептида химозина по настоящему изобретению может происходить от родительского полипептида, который имеет по меньшей мере 80%-ую, например, по меньшей мере например 80%-ую, 85%-ую, 95%-ую, 97%-ую, 98%-ую, 99%-ую идентичность последовательности с полипептидом с SEQ ID NO: 4 (верблюжий химозин).
Выделенный вариант полипептида химозина по настоящему изобретению может содержать одну или более чем одну аминокислотную замену, делецию или вставку, где одна или более чем одна замена, делеция или вставка определяется по отношению к аминокислотной последовательности SEQ ID NO: 4: Y11, L130, S132, V32, S226, R266, L12, V221, S255, S277, L222, L253, М157, V260, S271, Н76, K19, V183, S164, I263, V51, Т239, Y307, R67, G251, R61, Q288, Е83, D59, V309, S273, G251, S154, Y21, V203, L180, Е294, G289, L215, D144, I303, L105, Т284, Y127, V248, K321, V205, Е262, K231, R316, М256, D158, D59, N249, L166, R242 или I96, такой как, например, Y11I, Y11V, L130I, S132A, V32L, S226T, R266V, L12M, V221M, S255Y, S277N, L222I, L253I, M157L, V260T, S271P, H76Q, K19T, V183I, S164G, I263L, V51L, T239S, Y307F, R67Q, G251D, R61Q, Q288E, E83S, D59N, V309I, S273Y, G251W, S154A, Y21S, V203A, L180I, E294Q, G289S, L215V, D144Q, I303L, L105E, T284S, Y127F, V248I, K321P, V205I, Е262Т, K231N, R316L, M256L, D158S, D59N, N249E, L166V, R242E и/или I96L.
В родственном аспекте выделенный вариант полипептида химозина по настоящему изобретению может содержать комбинацию замен, где данная комбинация замен выбрана из списка, содержащего:


или

В родственном аспекте данный вариант может содержать изменения в одном или более чем одном определенном положении по сравнению с родительским полипептидом, обладающим активностью химозина, где данное изменение включает замену, делецию или вставку в по меньшей мере одном положении аминокислоты, соответствующем любому из положений 11, 130, 132, 32, 226, 266, 12, 221, 255, 277, 222, 253, 157, 260, 271, 76, 19, 183, 164, 263, 51, 239, 307, 67, 251, 61, 288, 83, 59, 309, 273, 251, 154, 21, 203, 180, 294, 289, 215, 144, 303, 105, 284, 127, 248, 321, 205, 262, 231, 316, 256, 158, 59, 249, 166, 242 или 96, где положение аминокислоты родительского полипептида определяют выравниванием родительского полипептида со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин), и родительский полипептид имеет по меньшей мере 65% идентичности последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин), который идет от положения аминокислоты 59 до положения аминокислоты 381 в SEQ ID NO: 2, где выделенный вариант полипептида химозина расщепляет β-казеин с меньшей частотой, чем соответствующий родительский полипептид.
В предпочтительном воплощении родительский полипептид имеет по меньшей мере 80%, как, например, по меньшей мере, например, 85%, 95%, 97%, 98%, 99% идентичности последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин).
Предпочтительно выделенный вариант полипептида химозина, как здесь описано, представляет собой вариант, который имеет меньшую частоту расщепления β-казеина по сравнению с родительским пептидом, из которого происходит данный вариант.
Более предпочтительно выделенный вариант полипептида химозина, как здесь описано, представляет собой вариант, который имеет
- химозиновую активность, дающую меньшую частоту расщепления β-казеина по сравнению с коровьим химозином, содержащим зрелый полипептид c SEQ ID NO: 1; и
- химозиновую активность, дающую меньшую частоту расщепления β-казеина по сравнению с верблюжьим химозином, содержащим зрелый полипептид с SEQ ID NO: 2.
Как обсуждалось выше, в качестве эталонной последовательности для определения положения аминокислоты релевантного представляющего интерес полипептида химозина (например верблюжьего, овечьего, коровьего и т.д.) здесь используется зрелый пептид общеизвестной последовательности верблюжьего химозина, раскрытой здесь как SEQ ID NO: 2.
Как обсуждалось выше, на основе, например, обсуждавшихся здесь компьютерных программ выравнивания последовательности, определение релевантного положения аминокислоты релевантного представляющего интерес полипепида химозина (например верблюжьего, овечьего, коровьего и т.д.) является рутинной работой для специалиста.
Термин «родительский полипептид имеет по меньшей мере 65%-ую идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин)» можно рассматривать как относящийся к ограничению на основе последовательности родительского полипептида химозина, использованного для получения его релевантного варианта.
В предпочтительном воплощении родительский полипептид имеет по меньшей мере 92%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), более предпочтительно родительский полипептид имеет по меньшей мере 95%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), и еще более предпочтительно родительский полипептид имеет по меньшей мере 97%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин). Может быть предпочтительно, чтобы родительский полипептид представлял собой зрелый полипептид с SEQ ID NO: 2 (верблюжий химозин).
Как понятно специалисту в настоящем контексте, релевантный родительский полипептид, обладающий химозиновой активностью, может уже, например, быть вариантом, например, соответствующего химозина дикого типа.
Говоря другими словами, релевантный выделенный вариант полипептида химозина может содержать изменения (например замены) в других положениях, чем заявленные здесь положения.
По отношению к последовательностям химозина, показанными здесь на Фиг. 1, овечья имеет 94,5%-ую идентичность последовательности с коровьей SEQ ID NO: 1; C._bactrianus (верблюжья) имеет 83,2%-ую идентичность последовательности с коровьей SEQ ID NO: 1; свиная имеет 80,3%-ую идентичность последовательности с коровьей SEQ ID NO: 1; и крысиная имеет 71,9%-ую идентичность последовательности с коровьей SEQ ID NO: 1.
Как понятно специалисту в настоящем контексте, релевантные проценты идентичности последовательности, например зрелого овечьего, C._bactrianus, верблюжьего, свиного или крысиного химозина, со зрелым полипептидом SEQ ID NO: 1 (коровий химозин - т.е. положения аминокислот 59-381 в SEQ ID NO: 1) являются относительно сходными с вышеупомянутыми процентами идентичности последовательности.
Предпочтительно выделенный вариант полипептида коровьего химозина, как здесь описано, представляет собой вариант, который имеет химозиновую активность, дающую меньшую частоту расщепления β-казеина по сравнению с частотой расщепления β-казеина верблюжьего химозина, содержащего зрелый полипептид с SEQ ID NO: 2.
Как обсуждалось выше, в рабочих примерах здесь были получены варианты с использованием полипептида с SEQ ID NO: 2 (верблюжий химозин) в качестве родительского полипептида - такой вариант может здесь быть назван вариант верблюжьего химозина.
Как понятно специалисту в настоящем контексте, выделенный вариант химозина может содержать изменения (например замены) в других положениях аминокислот, нежели приведенные выше.
Например, вариант верблюжьего химозина, например, с 5-10 изменениями (например, заменами) по сравнению с полипептидом верблюжьего химозина дикого типа с SEQ ID NO: 2, все еще будет родительским полипептидом, который имеет по меньшей мере 95%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин).
Может быть предпочтительно, чтобы выделенный вариант верблюжьего химозина содержал менее 30 изменений аминокислот (например замен) по сравнению со зрелым полипептидом с SEQ ID NO: 2 (верблюжьим химозином), или может быть предпочтительно, чтобы выделенный вариант верблюжьего химозина содержал менее 20 изменений аминокислот (например замен) по сравнению со зрелым полипептидом с SEQ ID NO: 2 (верблюжьим химозином), или может быть предпочтительно, чтобы выделенный вариант верблюжьего химозина содержал менее 10 изменений аминокислот (например замен) по сравнению со зрелым полипептидом с SEQ ID NO: 2 (верблюжьим химозином), или может быть предпочтительно, чтобы выделенный вариант верблюжьего химозина содержал менее 5 изменений аминокислот (например замен) по сравнению со зрелым полипептидом с SEQ ID NO: 2 (верблюжьим химозином).
Как понятно специалисту в настоящем контексте, термин «выделенный вариант полипептида имеет меньше, чем 100%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжьим химозином)», приведенный выше, относится к тому, что описанный здесь выделенный вариант верблюжьего химозина не должен иметь полипептидную последовательность, которая на 100% идентична общеизвестной последовательности верблюжьего химозина дикого типа с SEQ ID NO: 2.
Предпочтительное воплощение относится к выделенному варианту полипептида верблюжьего химозина, в котором изменение включает замену, делецию или вставку в по меньшей мере одном положении аминокислоты, соответствующем любому из заявленных здесь положений.
Может быть предпочтительно, чтобы по меньшей мере одно изменение представляло собой замену, т.е. релевантное здесь предпочтительное воплощение относится к выделенному варианту полипептида химозина, в котором изменение включает замену в по меньшей мере одном положении аминокислоты, соответствующем любому из заявленных здесь положений.
Предпочтительный родительский полипептид, обладающий химозиновой активностью
Предпочтительно родительский полипептид имеет по меньшей мере 80%-ую как, например, 85%-ую, 90%-ую, 95%-ую, 97%-ую, 98%-ую или 99%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин) и/или с SEQ ID NO: 2 (верблюжий химозин).
Лишь в качестве примера - подходящий здесь релевантный родительский полипептид мог бы, например, представлять собой коровий химозин А, как известно в данной области, коровий химозин А может здесь иметь только одно отличие аминокислоты по сравнению с коровьим химозином В с SEQ ID NO: 1.
В предпочтительном воплощении родительский полипептид имеет по меньшей мере 90%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин), более предпочтительно родительский полипептид имеет по меньшей мере 95%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин), и еще более предпочтительно родительский полипептид имеет по меньшей мере 97%-ную идентичность последовательности со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин). Может быть предпочтительным, чтобы родительский полипептид представлял собой зрелый полипептид с SEQ ID NO: 1 (коровий химозин).
Как понятно специалисту в настоящем контексте, релевантный здесь родительский полипептид, обладающий химозиновой активностью, может уже, например, представлять собой вариант, например, соответствующего химозина дикого типа.
Например, вариант коровьего химозина например, с 5-10 изменениями (например заменами) по сравнению с полипептидом зрелого коровьего химозина дикого типа с SEQ ID NO: 1 все еще будет родительским полипептидом, который имеет по меньшей мере 95%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин).
Говоря другими словами и, в общем, релевантный здесь выделенный вариант полипептида химозина может содержать изменения (например замены) в других положениях, чем заявленные здесь положения.
Как понятно специалисту в настоящем контексте, родительский полипептид, который имеет по меньшей мере 90%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжьим), все еще находится в пределах SEQ ID NO: 1 (коровий) на основании требования идентичности последовательности, т.е. он будет родительским полипептидом, который имеет по меньшей мере 65%-ую идентичность поседовательности со зрелым полипептидом с SEQ ID NO: 1 (коровьим химозином).
В предпочтительном воплощении родительский полипептид имеет по меньшей мере 92%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин), более предпочтительно родительский полипептид имеет по меньшей мере 95%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин), и еще более предпочтительно родительский полипептид имеет по меньшей мере 97%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин). Может быть предпочтительным, чтобы родительский полипептид представлял собой зрелый полипептид с SEQ ID NO: 1 (коровий химозин).
Как понятно специалисту в настоящем контексте, выделенный вариант химозина может содержать изменения (например замены) в других положениях аминокислот, чем приведенные выше.
Например, вариант коровьего химозина, например с 5-10 изменениями (например, заменами) по сравнению с полипептидом коровьего химозина дикого типа с SEQ ID NO: 1, все еще будет родительским полипептидом, который имеет по меньшей мере 95%-ую идентичность последовательности со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин).
Может быть предпочтительным, чтобы выделенный вариант коровьего химозина содержал менее 30 изменений аминокислот (например замен) по сравнению со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин), или может быть предпочтительным, чтобы выделенный вариант коровьего химозина содержал менее 20 изменений аминокислот (например замен) по сравнению со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин), или может быть предпочтительным, чтобы выделенный вариант коровьего химозина содержал менее 10 изменений аминокислот (например замен) по сравнению со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин), или может быть предпочтительным, чтобы выделенный вариант коровьего химозина содержал менее 5 изменений аминокислот (например замен) по сравнению со зрелым полипептидом с SEQ ID NO: 1 (коровий химозин).
Полипептид верблюжьего химозина с SEQ ID NO: 2 имеет 84%-ую идентичность последовательности с коровьим полипептидом с SEQ ID NO: 1 (т.е. с полной SEQ ID NO: 1 от положения 1 до 381, которая включает пре- и про-последовательность).
Способ получения выделенного варианта полипептида химозина
Как обсуждалось выше, как известно в данной области, специалист может, на основе его общих обычных знаний, рутинным образом получать и очищать химозин и варианты химозина.
Говоря другими словами, как только в распоряжении специалиста оказывается релевантный здесь родительский полипептид, обладающий представляющей интерес химозиновой активностью (например, из жвачных, верблюдов, овец, свиней или крыс), получение варианта такого представляющего интерес родительского химозина оказывается рутинной работой для специалиста.
Пример подходящего способа получения и выделения химозина (варианта или родительского) может быть хорошо известен, например, технология на основе рекомбинантной экспрессии/продукции у грибов, например, как описано в WO 02/36752 A2 (Chr. Hansen).
Для специалиста также является рутинной работой осуществление изменения в одном или более чем одном положении в родительском полипептиде, обладающем химозиновой активностью, где данное изменение включает замену, делецию или вставку в по меньшей мере одном положении аминокислоты.
Как известно специалисту, это может быть, например, осуществлено посредством так называемого сайт-направленного мутагенеза и технологии на основе рекомбинантной экспрессии/продукции.
Для специалиста также является рутинной работой определение того, обладает ли релевантный здесь родительский полипептид (например, верблюжий или коровий химозин дикого типа) и/или релевантный здесь вариант химозиновой активностью или нет. Как известно в данной области, специфичность химозина может быть определена посредством так называемого отношения С/P, которое определяется делением удельной свертывающей активности (С) на протеолитическую активность (P).
Как известно в данной области, более высокое отношение С/P в общем подразумевает, что потеря белка, например, во время изготовления сыра, обусловленная неспецифичной деградацией белка, уменьшается, т.е. выход сыра повышается.
Как также известно в данной области, расщепление β-казеина и образование β-казеина (включая β(193-209)) могут быть определены с использованием стандартных способов, доступных специалисту в данной области.
Способ получения продукта на основе молока
Как обсуждалось выше, выделенный вариант полипептида химозина, как здесь описано, может использоваться согласно данной области, например для приготовления представляющего интерес продукта на основе молока (такого как, например, сырный продукт).
Как обсуждалось выше, один аспект данного изобретения относится к способу получения пищевого или кормового продукта, включающему добавление эффективного количества выделенного варианта полипептида химозина, как здесь описано, к пищевому(вым) или кормовому(вым) ингредиенту(там) и осуществление дальнейших стадий изготовления для получения пищевого или кормового продукта.
Предпочтительно пищевой или кормовой продукт представляет собой продукт на основе молока, и где данный способ включает добавление эффективного количества выделенного варианта полипептида химозина, как здесь описано, к молоку и осуществление дальнейших стадий изготовления для получения продукта на основе молока.
Например, вариант полипептида химозина по настоящему изобретению может быть добавлен в продукт на основе молока после ферментирования молока. В одном аспекте вариант полипептида химозина по настоящему изобретению добавляют для свертывания ферментированного молочного продукта как часть способа производства сыра.
Молоко может представлять собой, например, соевое молоко, овечье молоко, козье молоко, буйволиное молоко, молоко яка, молоко ламы, верблюжье молоко или коровье молоко.
Продукт на основе молока может представлять собой, например, ферментированный продукт, такой как творог или сыр.
Пищевые и кормовые продукты
Согласно настоящему изобретению также предложены пищевые и кормовые продукты, содержащие вариант полипептида химозина по настоящему изобретению или вариант полипептида химозина, который можно получить согласно способу по настоящему изобретению. Пищевой и кормовой продукт предпочтительно представляет собой ферментированный пищевой продукт, такой как ферментированный молочный продукт, включающий сыр и творог.
В еще одном родственном аспекте настоящее изобретение относится к способу получения пищевого или кормового продукта, включающему добавление эффективного количества выделенного варианта полипептида химозина согласно данному изобретению. Предпочтительно пищевой или кормовой продукт представляет собой продукт на основе молока.
Вариант полипептида химозина по настоящему изобретению также можно использовать в способе приготовления сыра, как, например, для уменьшения горечи в сыре.
ПРИМЕРЫ
ПРИМЕР 1: выравнивание и нумерация последовательностей белка химозина и последовательностей вариантов
Последовательности белка химозина выравнивали с использованием алгоритма ClustalW в том виде, в котором он предоставлен EBI (EBI, инструменты, выравнивание многих последовательностей, CLUSTALW", http://www.ebi.ac.uk/Tools/msa/clustalw2/), и как описано в Larkin MA, Blackshields G, Brown NP, Chenna R, McGettigan PA, McWilliam H, Valentin F, Wallace IM, Wilm A, Lopez R, Thompson JD, Gibson TJ, Higgins DG (2007). Bioinformatics 23(21), 2947-2948.
Установки ClustalW2 для выравнивания многих последовательностей представляли собой матрицу веса белка BLOSUM, GAP open - 10, GAP EXTENSION - 0,05, GAP DISTANCES - 8, отсутствие концевых пробелов, ITERATION - нет, NUMITER - 1, CLUSTERING - NJ.
В качестве эталонной последовательности использовали препрохимозин коровьего химозина В (номер доступа Genbank Р00794 - раскрытый здесь как SEQ ID NO: 1), где N-концевой метионин имеет номер 1 (MRCL…), и С-концевой изолейцин (в последовательности белка … LAKAI) имеет номер 381.
ПРИМЕР 2: конструирование вариантов химозина
Варианты химозина конструировали с использованием разных стратегий.
Когда здесь делается ссылка на верблюжий химозин, то это означает ссылку на верблюжий химозин, содержащий зрелый полипептид с SEQ ID NO: 2.
Верблюжий химозин с SEQ ID NO: 2 можно здесь рассматривать как релевантный родительский полипептид, обладающий химозиновой активностью, используемый для получения вариантов верблюжьего химозина.
Когда здесь делается ссылка на коровий химозин, то это означает ссылку на коровий химозин, содержащий полипептид с SEQ ID NO: 1.
Коровий химозин с SEQ ID NO: 1 можно рассматривать как релевантный родительский полипептид, обладающий химозиновой активностью, используемый для получения вариантов коровьего химозина.
Варианты 1-269 и 367-461 верблюжьего химозина конструировали на основе выравнивания большого набора последовательностей общеизвестных аспартатпротеаз, имеющих идентичость 25% или более по сравнению с коровьим химозином В.
Вариации обычно вводили в области с высоким уровнем варьирования аминокислот между видами, тогда как консервативные области не изменяли. Аминокислотные замены выбирали на основе филогенетической, структурной и экспериментальной информации для идентификации изменений с высокой вероятностью демонстрации полезных эффектов на расщепление β-казеина. В каждый вариант конструкции вводили многочисленные вариации, убеждаясь в том, что каждая одиночная мутация присутствовала в конструкциях многих вариантов для минимизации эффекта ковариации между разными заменами. Машинное обучение и статистический анализ экспериментальных данных использовали для определения относительных вкладов аминокислотных замен в измеренную коагулирующую эффективность вариантов химозина (ссылки 14, 15).
Варианты 271-366 конструировали на основе подробного структурного анализа коровьего химозина (код PDB (база данных белков): 4АА8) и верблюжьего химозина (код PDB: 4АА9). Вариации выбирали на основе химической природы соответствующих аминокислотных боковых цепей и их ожидаемого влияния либо на связывание субстрата - казеина, либо на общие ферментативные свойства. Большинство аминокислотных замен в вариантах 271-346 делали в положениях последовательности, находящихся либо в пределах, либо в тесной структурной близости к субстратсвязывающей щели, либо во вторичных структурных элементах, которые приходят в контакт с субстратом - связавшимся казеином. Кроме того, делали изменения в положениях на поверхности белка, которые изменяют профиль заряда данных областей (ссылка 5) и, следовательно, ожидается, что они будут иметь влияние на эффективность фермента. Варианты 347-366 делали на основе отличной структурной конформации N-концевой последовательности в коровьем и верблюжьем химозине. Аминокислотные замены делали в положениях в пределах субстратсвязывающей щели, которая взаимодействует с N-концом в верблюжьем химозине.
ПРИМЕР 3: получение ферментативного вещества вариантов химозина
Все варианты химозина синтезировали в виде синтетических генов и клонировали в грибной экспрессионный вектор, такой как, например, pGAMpR-C (описанный в WO 02/36752 A2).
Данные векторы трансформировали в Е. coli, и плазмидную ДНК очищали с использованием стандартных протоколов молекулярной биологии, известных специалисту в данной области. Варианты плазмид индивидуально трансформировали в штамм Aspergillus niger или Aspergillus nidulans, и белок продуцировали, по существу как описано в WO 02/36752 A2, и очищали с использованием стандартных хроматографических методик.
Как известно в данной области, специалист на основе его обычных общих знаний может продуцировать и очищать химозин и варианты химозина - такие как описанные здесь варианты коровьего и верблюжьего химозина.
ПРИМЕР 4: определение удельной активности химозина
4.1. Определение активности свертывания молока
Активность свертывания молока определяли с использованием способа REMCAT, который представляет собой стандартный способ, разработанный Международной федерацией предприятий молочной промышленности (способ IDF). Активность свертывания молока определяется, исходя из времени, необходимого для видимой флокуляции стандартного молочного субстрата, приготовленного из маложирного сухого молока низкотемпературного сгущения с раствором хлорида кальция 0,5 г на литр (рН приблизительно равен 6,5). Время свертывания образца реннина сравнивается с временем свертывания эталонного стандарта, имеющего известную активность свертывания молока и имеющего такой же ферментативный состав, определенный по стандарту IDF 110В, что и образец. Образцы и эталонные стандарты измеряли при идентичных химических и физических условиях. Образцы вариантов корректировали до приблизительно 3 IMCU/мл с использованием буфера на основе 84 мМ уксусной кислоты, рН 5,5. Затем 200 мкл ферментативного препарата добавляли в 10 мл предварительно нагретого молока (32°С) в стеклянной пробирке, помещенной на водяную баню, способную поддерживать постоянную температуру 32°С плюс/минус 1°С, при постоянном перемешивании. В качестве альтернативы 20 мкл ферментативного препарата добавляли в 1 мл предварительно нагретого молока, как описано выше.
Общую молокосвертывающую активность («силу») реннина рассчитывали в международных молокосвертывающих единицах (IMCU) на мл относительно стандарта, имеющего такой же ферментативный состав, что и образец, согласно следующей формуле:

S стандарта: молокосвертывающая активность международного эталонного стандарта для реннина.
Т стандарта: время свертывания в секундах, полученное для стандартного разведения.
D образца: кратность разведения для образца.
D стандарта: кратность разведения для стандарта.
Т образца: время свертывания в секундах, полученное для разведенного образца реннина, от момента добавления фермента, до момента флокуляции.
Для определения свертывающей активности вариантов библиотеки 1, 3, 4 и 6, а также вариантов, полученных посредством конструирования структуры, использовали способ μIMCU вместо способа REMCAT. По сравнению с REMCAT, время флокуляции вариантов химозина в анализе μIMCU определяли посредством измерений ОП (оптическая плотность) в 96-луночных планшетах для микротитрования при 800 нм в планшет-ридере, работающем в диапазоне ультрафиолетового(УФ)/видимого(В) излучения. На каждом планшете записывали стандартную кривую разных разведений эталонного стандарта с известной «силой» свертывания. Образцы получали разведением фермента в 84 мМ ацетатном буфере, 0,1% Triton Х-100, рН 5,5. Реакцию при 32°С начинали добавлением 250 мкл стандартного молочного субстрата, содержащего 4% (масс./масс.) маложирного сухого молока низкотемпературного сгущения и 7,5% (масс./масс.) хлорида кальция (рН приблизительно равен 6,5) к 25 мкл образца фермента. Активность свертывания молока вариантов химозина в международных молокосвертывающих единицах (IMCU) на мл определяли на основе времени флокуляции образца относительно стандартной кривой.
4.2 Определение общего содержания белка
Общее содержание белка определяли с использованием набора для анализа белка Pierce ВСА от Thermo Scientific, следуя инструкциям поставщиков.
4.3 Расчет удельной свертывающей активности
Удельную свертывающую активность (IMCU/ г общего белка) определяли делением свертывающей активности (IMCU/мл) на общее содержание белка (мг общего белка на мл).
ПРИМЕР 5: определение расщепления β-казеина
Определение активности гидролиза β-казеина
Опосредованный химозином протеолиз белков молока был охарактеризован путем определения профилей водорастворимых пептидов, экстрагированных при рН 4,6. Для данного исследования использовали модель сыра, не содержащего культуру, полученную в 96-луночных планшетах. Вкратце, 750 мкл обезжиренного молока от

Профили пептидов, растворимых при рН 4,5, определяли с использованием RP-HPLC в сочетании с ESI-Q-TOF масс-спектрометром. Анализ проводили, используя систему жидкостной хроматографии (Agilent 1290 infinity, Agilent Technologies A/S, Санта-Клара, Калифорния, США) в сочетании с масс-спектрометром (G6540A Q-TOF, Agilent Technologies A/S, Санта-Клара, Калифорния, США). Колонка в LC системе представляла собой Ascentis Express Peptide ES-C18m, 2,7 мкм, 100×2,1 мм (Supelco, Sigma-Aldrich, Сент Луис, США). Подвижная фаза состояла из элюета А (0,1%-ная муравьиная кислота в воде) и элюента Б (ацетонитрил: 0,1%-ная муравьиная кислота в воде, 9:1). После уравновешивания колонки 2% Б инъецировали объем образца 10 мкл. Пептиды разделяли градиентной элюцией, полученной путем увеличения содержания элюента Б от 2% до 50% за 15 объемов колонки. Скорость потока составляла 0,44 мл/мин. Пептиды выявляли непрерывным измерением УФ поглощения при 214 нм. Масс-спектры собирали посредством прогона MS сканов от 100 до 2000 m/z. Анализ МС/МС проводили на двух самых интенсивных ионах из каждого скана. Получали образец СМЕСЬ, состоящий из равного объема всех анализируемых образцов, и данный образец анализировали на каждый из 12 образцов. Данные МС превращали из формата Agilent.d в файлы .mzml с использованием MSConvert в версии 3.0.6618. Весь дальнейший анализ данных проводили с использованием R 3.1.3. Пептиды идентифицировали из спектров МС/МС с использованием пакета R 'MSGFplus' в версии 1.05. Поисковая база данных для идентификации пептидов была ограничена следующими белками коровьего молока: αs1-казеин, αs2-казеин, β-казеин, κ-казеин, β-лактоглобулин, α-лактальбумин, лактопероксидаза и лактоферрин. В качестве переменных модификаций включали фосфорилирование серина и окисление метионина. Пакет R 'xcms' в версии 1.42.0 использовали для выявления и группировки пиков по образцам в наборе образцов согласно Smith et al. (2006). Для выявления пиков использовали способ Massifquant, и группировка пиков была основана на способе плотности. Сгруппированные пики идентифицировали, что давало количественные таблицы идентифицированных пептидов, включая β-казеин 193-209.
Статистический анализ позиционных и мутационных эффектов на расщепление β-казеина
Для определения эффектов всех одиночных мутаций, присутствующих в вариантах библиотек 1-3, 4 и 6 с множественными заменами, на расщепление β-казеина в положении 192/193 использовали подход статистического машинного обучения и анализ на основе ГК (главных компонент).
РЕЗУЛЬТАТЫ
Библиотека 1 со множественными заменами
Получали варианты верблюжьего химозина, каждый из которых имеет множественные замены по сравнению с диким типом, и анализировали, как описано выше. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину (зрелый полипептид SEQ ID NO: 2), за исключением вариаций, упомянутых в таблице. И коровий, и верблюжий химозин включали в качестве контролей.
Активности свертывания определяли с использованием способа μIMCU.


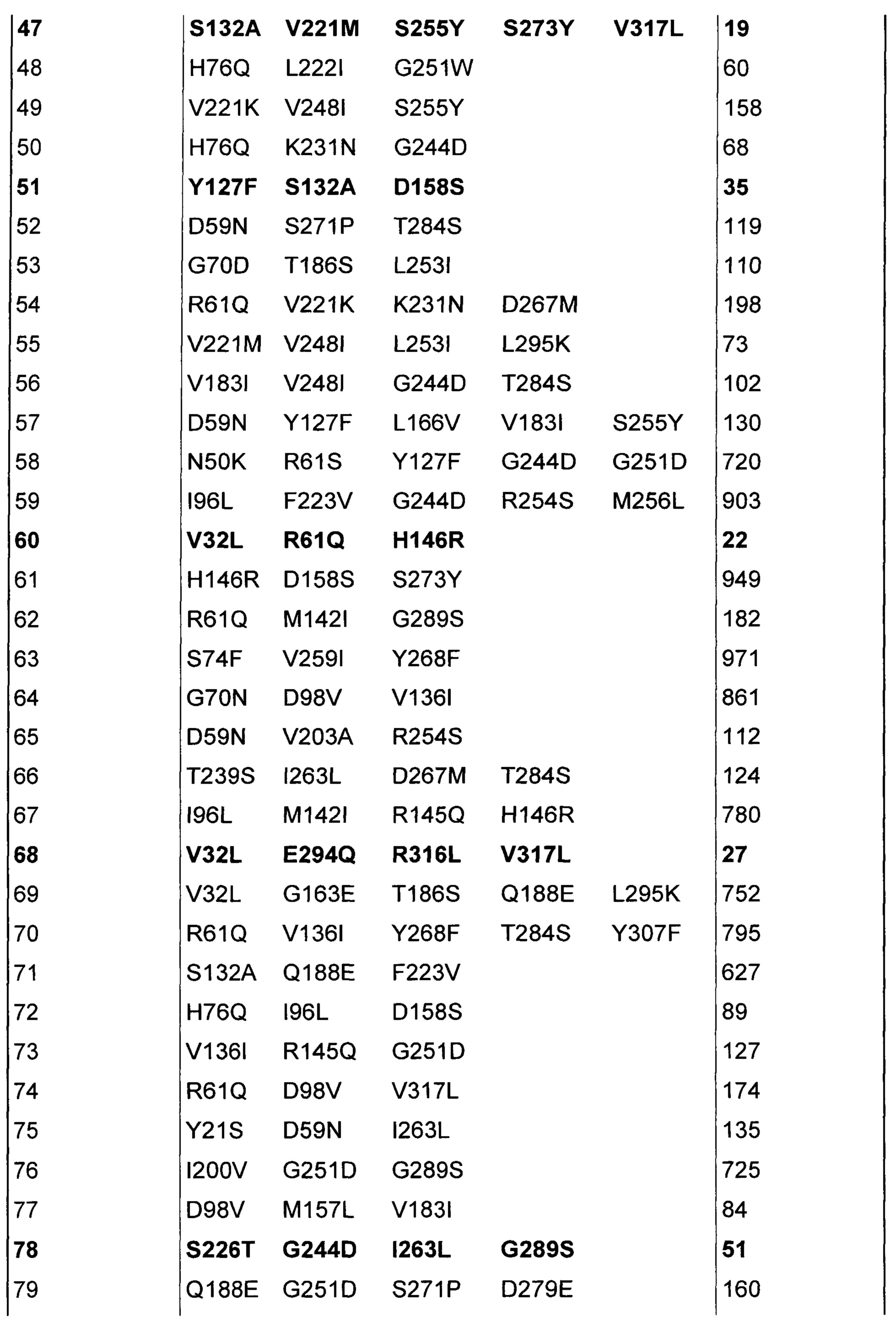

В Таблице 1 показаны варианты верблюжьего химозина с данными по расщеплению β-казеина в положении 192/193. Поскольку все варианты фермента использовали в экспериментах в нормированной концентрации 0,05 IMCU/мл, низкое расщепление β-казеина указывает на высокую специфичность соответствующего варианта в отношении κ-казеина 104/105 относительно расщепления β-казеина 192/193, а не на низкую общую ферментативную активность.
Варианты с половиной или меньше, чем половиной протеолитической активности дикого типа на β-казеине выделены жирным шрифтом (варианты 9, 16, 26, 39, 47, 51, 60, 68, 78, 84, 95). В них сверхпредставлены мутации V32L, L130I и S132A по сравнению с мутационной картиной, присутствующей в показанном полном наборе вариантов. Четыре из шести вариантов с мутацией V32L, четыре из шести вариантов с мутацией L130I и три из пяти вариантов с мутацией S132A демонстрируют расщепление β-казеина 192/193, равное или меньшее, чем 50% относительно верблюжьего химозина дикого типа.
В трехмерной структуре верблюжьего химозина положение V32 взаимодействует с остатком Р1 пептидной последовательности субстрата (Фиг. 2), тогда как положения L130 и S132 взаимодействуют с Р5' (L130), а также с Р2' и Р6' (S132) соответственно (Фиг. 3; ссылки 5-10). Расположение данных трех положений в субстратсвязывающем сайте химозина свидетельствует о том, что мутации V32L, L130I и S132A вызывают меньшее расщепление β-казеина 192/193 и, таким образом, меньшее образование фрагмента β(193-209) β-казеина при постоянной коагулирующей «силе» посредством непосредственного взаимодействия с κ- и β-казеином. Вариант 95, который демонстрирует наименьшее расщепление β-казеина 192/193 во всем наборе вариантов, содержит обе мутации V32L и L130I. Это свидетельствует об аддитивности мутационных эффектов на специфичность в отношении субстрата - казеина.
Библиотека 2 с множественными заменами
Получали другой набор вариантов верблюжьего химозина, причем каждый из них имеет множественные замены по сравнению с диким типом, и анализировали, как здесь описано. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину, за исключением вариаций, упомянутых в таблице. И коровий, и верблюжий химозин были включены в качестве контролей. Свертывающие активности определяли с использованием способа REMCAT.
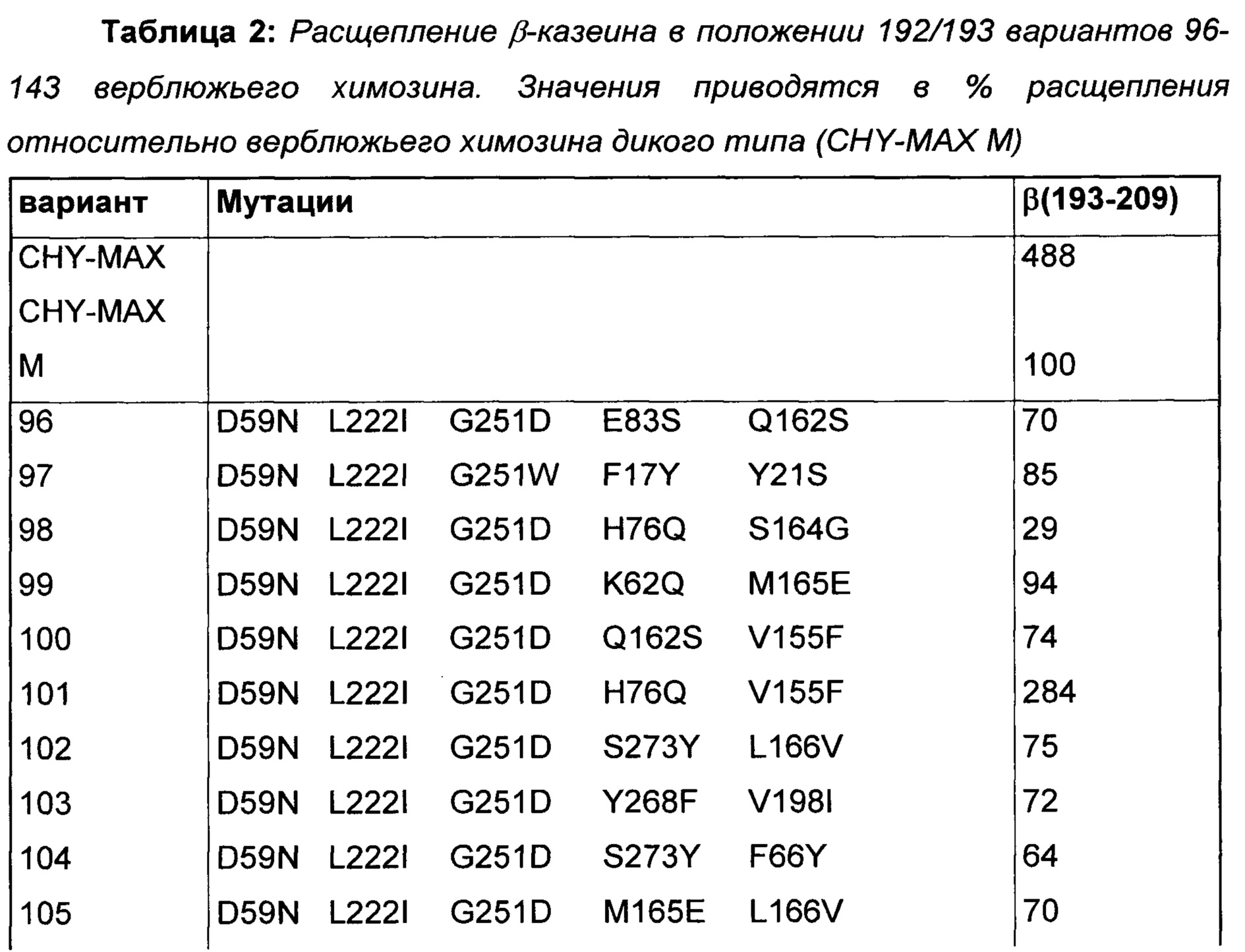


В Таблице 2 показаны варианты верблюжьего химозина с данными по расщеплению β-казеина в положении 192/193. Поскольку все варианты фермента использовали в экспериментах в нормированной концентрации 0,05 IMCU/мл, низкое расщепление β-казеина указывает на высокую специфичность соответствующего варианта в отношении κ-казеина 104/105 относительно расщепления β-казеина 192/193, а не на низкую общую ферментативную активность.
Варианты с менее чем 25% протеолитической активности дикого типа на β-казеине выделены жирным шрифтом (варианты 110, 112, 122, 125, 132). В них сверхпредставлена мутация V32L по сравнению с мутационной картиной, присутствующей в показанном полном наборе вариантов. Пять из шести вариантов с мутацией V32L демонстрируют расщепление β-казеина 192/193, равное или меньшее, чем 25% относительно верблюжьего химозина дикого типа. Данные результаты поддерживают данные и заключения по предыдущему набору вариантов.
Библиотека 3 с множественными заменами
Получали третий набор вариантов верблюжьего химозина, причем каждый из них имеет множественные замены по сравнению с диким типом, и анализировали, как здесь описано. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину, за исключением вариаций, упомянутых в таблице. И коровий, и верблюжий химозин были включены в качестве контролей. Свертывающие активности определяли с использованием способа μIMCU.


В Таблице 3 показаны варианты верблюжьего химозина с данными по расщеплению β-казеина в положении 192/193. Поскольку все варианты фермента использовали в экспериментах в нормированной концентрации 0,05 IMCU/мл, низкое расщепление β-казеина указывает на высокую специфичность соответствующего варианта в отношении κ-казеина 104/105 относительно расщепления β-казеина 192/193, а не на низкую общую ферментативную активность.
Варианты с менее чем 10% протеолитической активности дикого типа на β-казеине выделены жирным шрифтом (варианты 150, 161, 165). В них сверхпредставлена мутация V32L по сравнению с мутационной картиной, присутствующей в показанном полном наборе вариантов. Все три варианта с мутацией V32L демонстрируют расщепление β-казеина 192/193, меньшее, чем 10% относительно верблюжьего химозина дикого типа.
Только один вариант из данного набора вариантов (вариант 176) показывает больше, чем 50% расщепления β-казеина 192/193 по сравнению с верблюжьим химозином дикого типа. Это также единственный вариант из данного набора, у которого отсутствует мутация L12M.
Положение L12 располагается в отрезке последовательности, близком к N-концу верблюжьего химозина, который связывается в субстратсвязывающей щели фермента (Фиг. 4). Было описано, что в верблюжьем химозине N-концевая последовательность блокирует субстратсвязывающую щель фермента, когда не связан субстрат (ссылка 5). Молекулы субстрата - казеина должны вытеснить эту N-концевую последовательность для того, чтобы связываться с активным сайтом и затем расщепляться. Мутации в химозине, которые стабилизируют эту неактивную форму фермента, могут вследствие этого уменьшать связывание субстрата и, таким образом, влияют на специфичность расщепления казеина. Авторы изобретения делают заключение об этом способе действия для мутации L12M. В трехмерной структуре верблюжьего химозина положения L12 и V32 находятся в непосредственном контакте друг с другом. Помимо этого прямого влияния на связывание β-казеина, V32L также может стабилизировать неактивную форму фермента. Поскольку варианты, содержащие обе мутации (150, 161, 165), демонстрируют наименьшее расщепление β-казеина 192/193 среди всех вариантов данного набора, их влияние на специфичность в отношении субстрата-казеина, по-видимому, является аддитивным.
Мутационный анализ библиотек 1-3 с множественными заменами
Провели статистический анализ позиционных и мутационных эффектов на расщепление β-казеина на основе протеолитических данных библиотек 1-3. Наиболее полезные мутации для пониженного расщепления β-казеина показаны в Таблице 4.
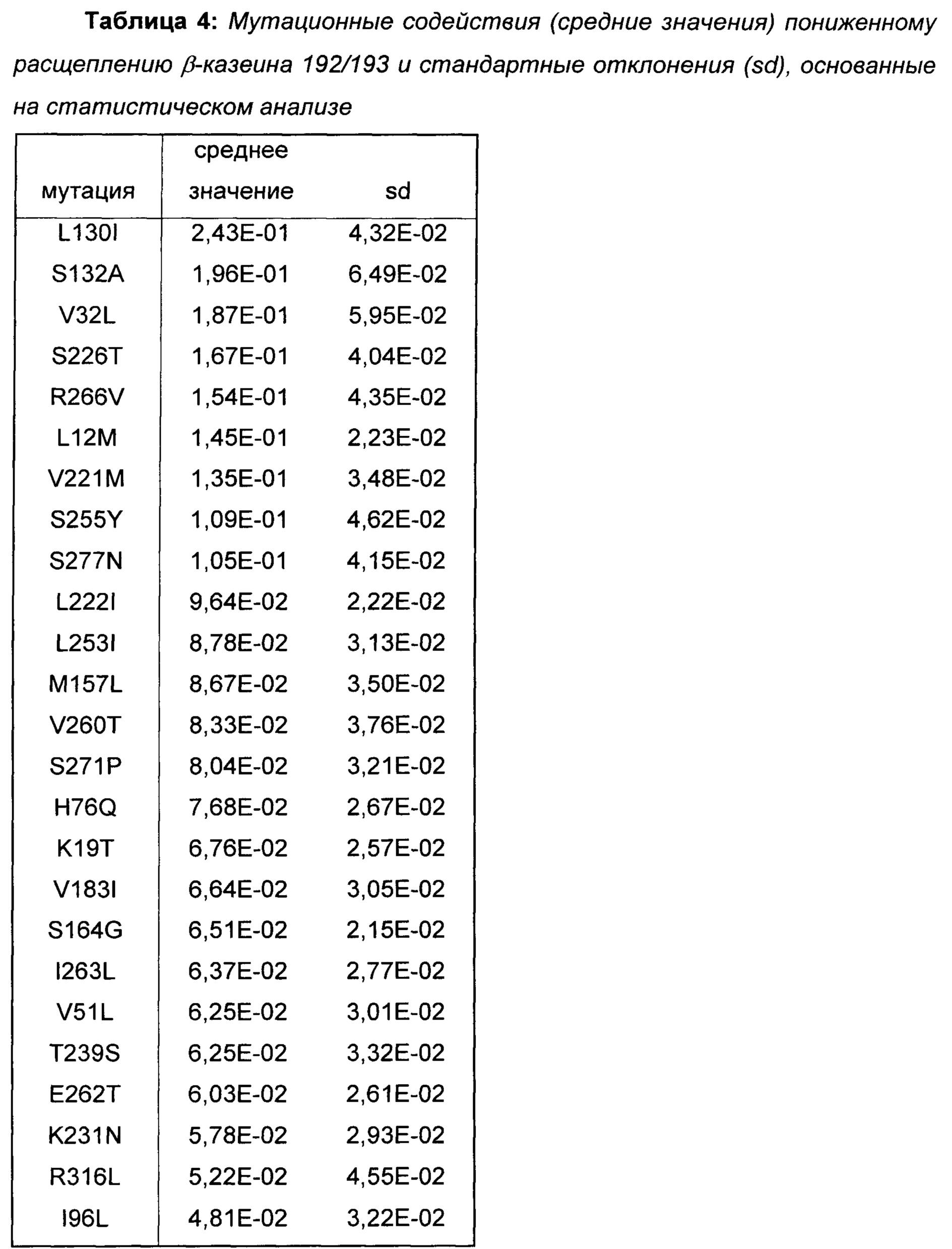
На основе полученных результатов делается заключение о том, что мутации, показанные в Таблице 4, уменьшают расщепление β-казеина 192/193, причем вышеописанные мутации L130I, S132A, V32L и L12M принадлежат к числу мутаций с наиболее сильным влиянием (выделены жирным шрифтом в Таблице 4).
Поскольку мутации, показанные в Таблице 4, вызывают меньшее образование C-концевого фрагмента β-казеина, β(193-209), они представляют собой предпочтительные мутации в вариантах химозина для приготовления сыра с менее горьким вкусом из-за пониженного расщепления β-казеина.
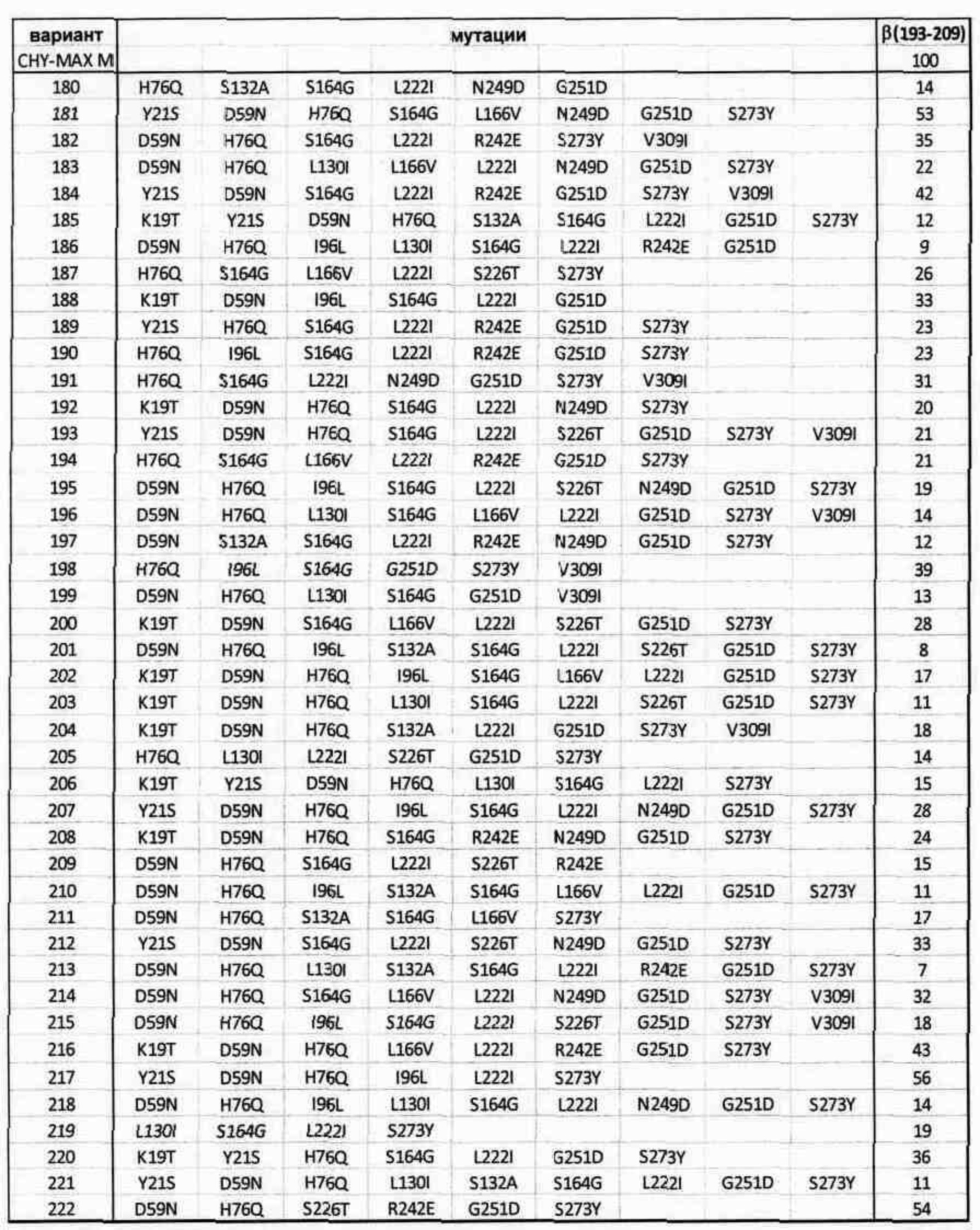
Библиотека 4 с множественными заменами
Получали и анализировали, как описано выше, другой набор вариантов верблюжьего химозина, причем каждый из них имеет множественные замены по сравнению с диким типом. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину (зрелому полипептиду с SEQ ID NO: 2), за исключением вариаций, упомянутых в таблице. Верблюжий химозин (CHY-MAX М) включен в качестве эталона. Свертывающие активности определяли с использованием способа μIMCU.

В Таблице 5 показаны варианты верблюжьего химозина с данными по расщеплению β-казеина 192/193. Все варианты показывают сниженную на 44%-93% протеолитическую активность по сравнению с верблюжьим химозином дикого типа.
Мутационный анализ библиотеки 4 с множественными заменами
Провели статистический анализ позиционных и мутационных эффектов на расщепление β-казеина на основе протеолитических данных вариантов библиотеки 4. Наиболее полезные мутации для пониженного расщепления β-казеина показаны в Таблице 6.
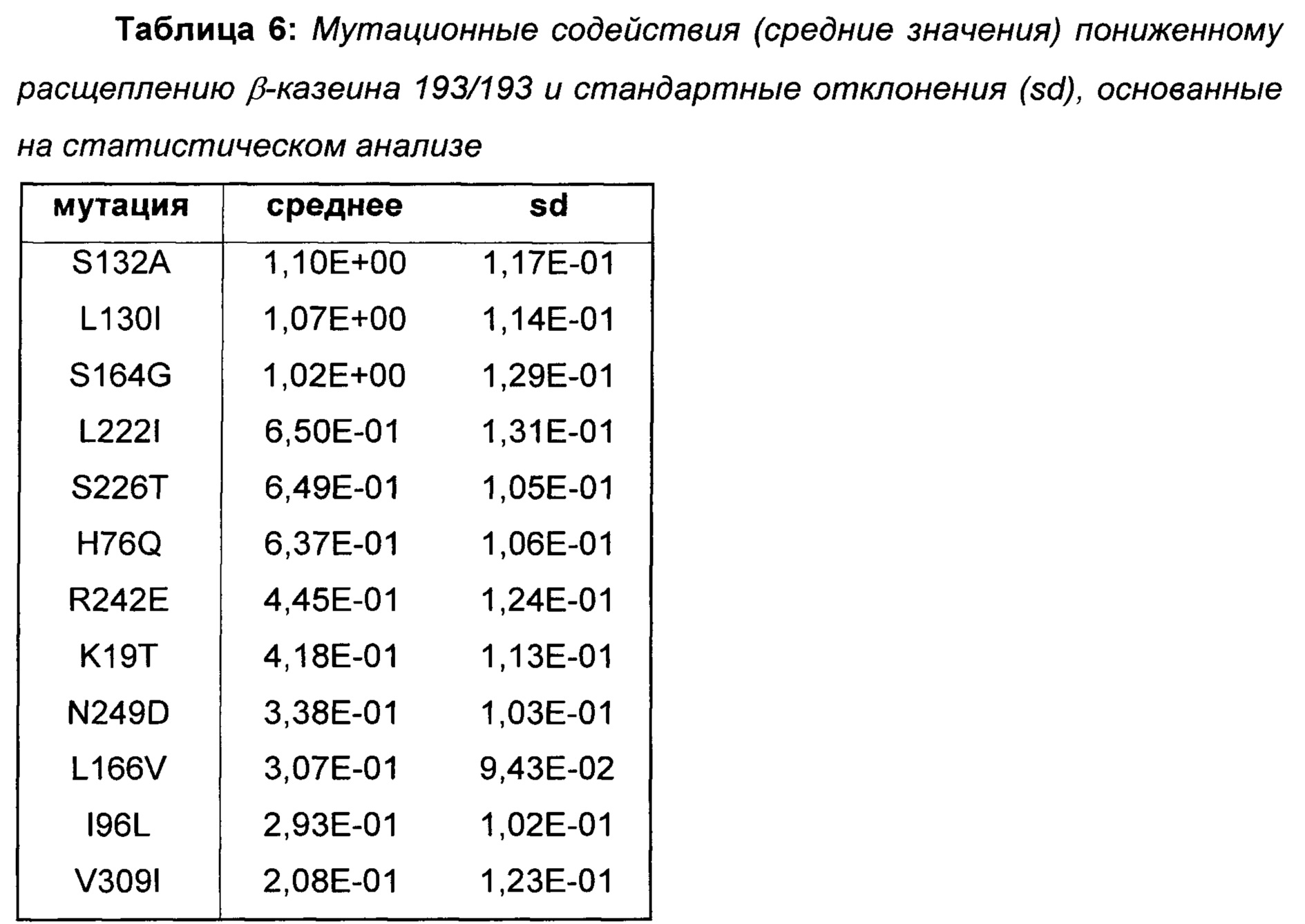
На основе полученных результатов делается заключение о том, что мутации, показанные в Таблице 6, уменьшают расщепление β-казеина 192/193.
Поскольку данные мутации вызывают меньшее образование С-концевого фрагмента β-казеина, β(193-209), они представляют собой предпочтительные мутации в вариантах химозина для приготовления сыра с менее горьким вкусом из-за пониженного расщепления β-казеина.
Библиотека 5 с множественными заменами
Получали и анализировали, как описано выше, другой набор вариантов верблюжьего химозина, причем каждый из них имеет множественные замены по сравнению с диким типом. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину (зрелому полипептиду SEQ ID NO: 2), за исключением вариаций, упомянутых в таблице. Верблюжий химозин (CHY-MAX М) включен в качестве контроля. Свертывающие активности определяли с использованием способа REMCAT.
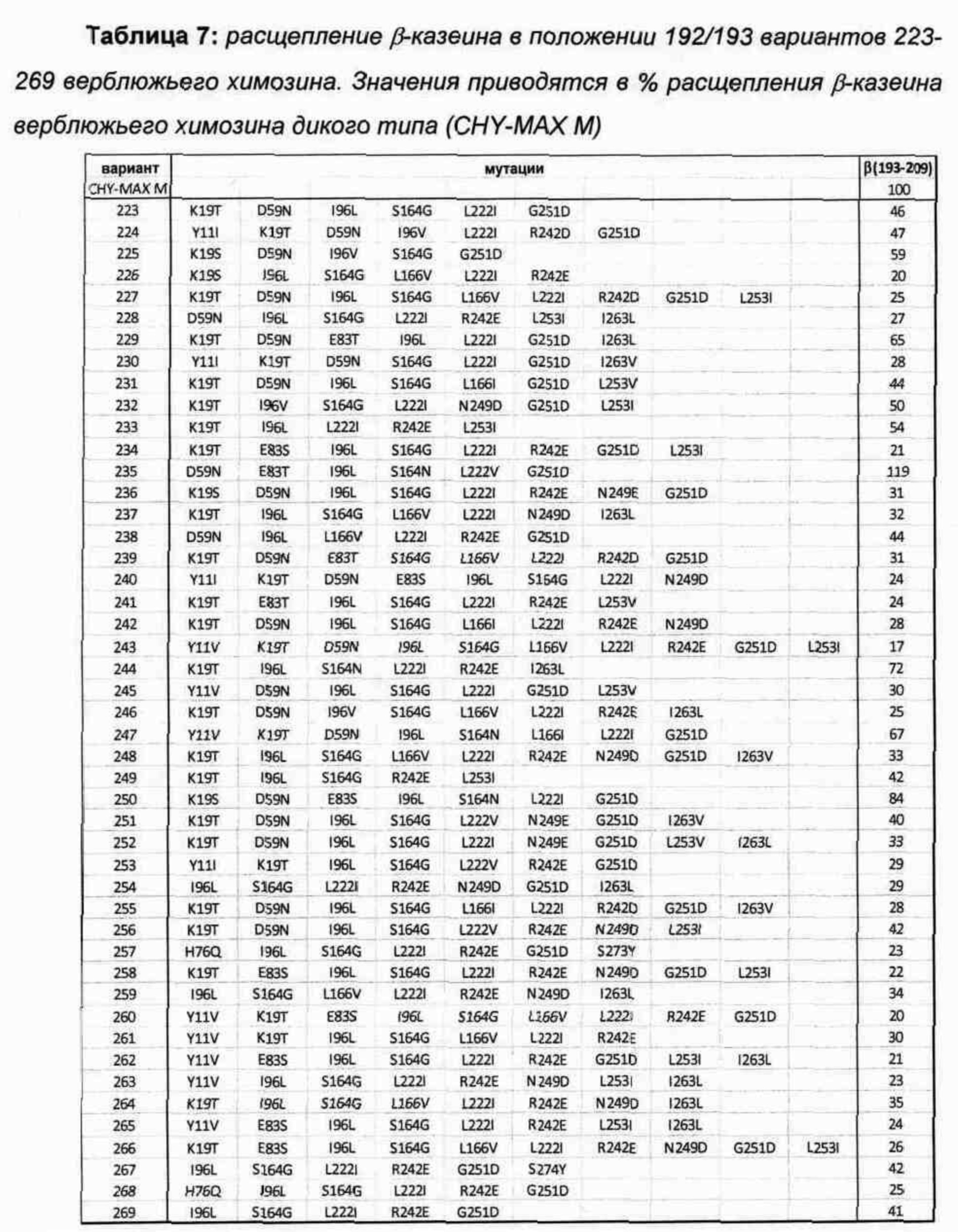
В Таблице 7 показаны варианты верблюжьего химозина с данными по расщеплению β-казеина 192/193. Из 47 вариантов 46 показывают на 16%-83% меньшую протеолитическую активность по сравнению с верблюжьим химозином дикого типа.
Мутационный анализ библиотеки 5 с множественными заменами
Провели статистический анализ позиционных и мутационных эффектов на расщепление β-казеина на основе протеолитических данных вариантов библиотеки 5. Наиболее полезные мутации для пониженного расщепления β-казеина показаны в Таблице 8.
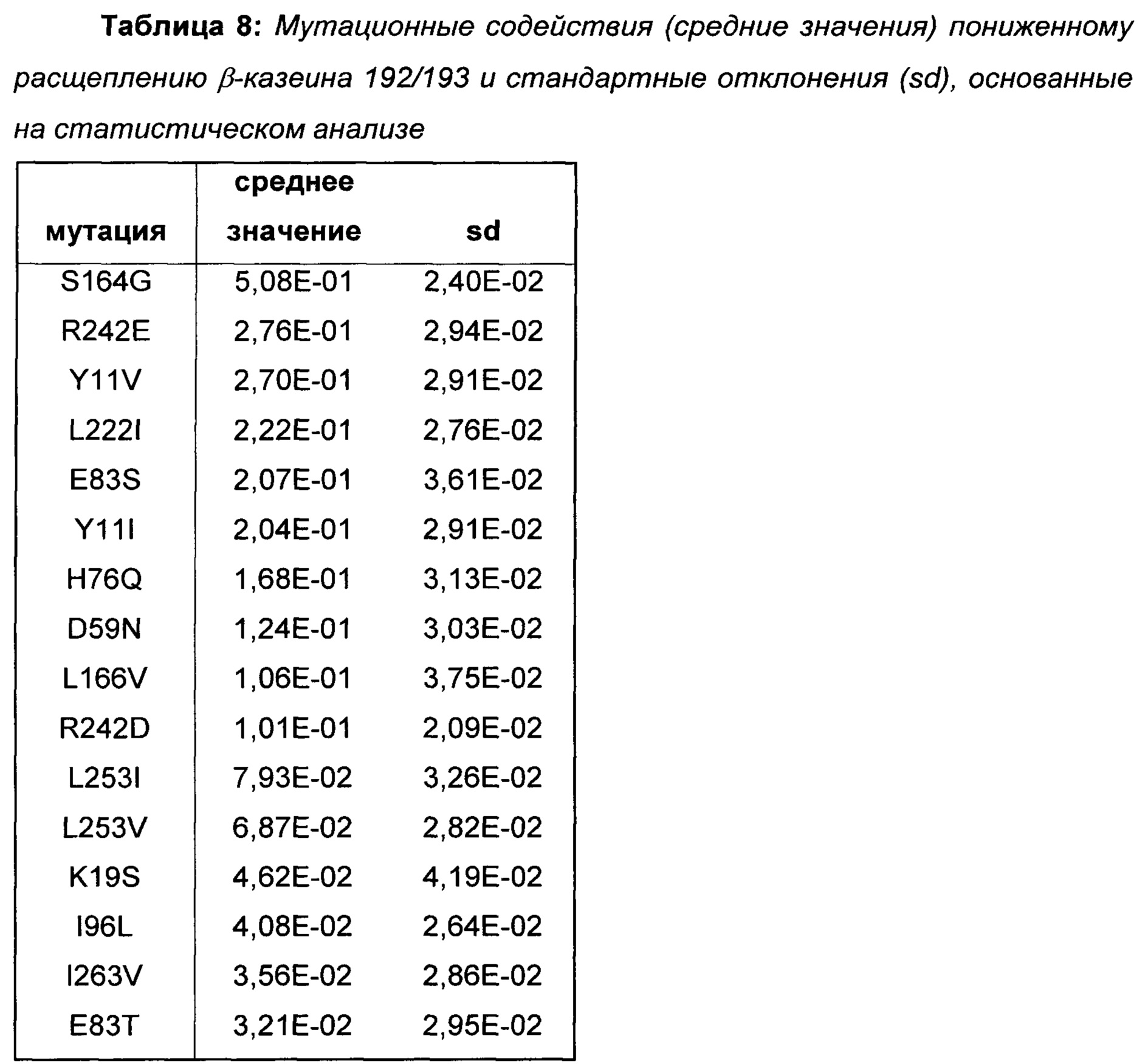
На основе полученных результатов делается заключение о том, что мутации, показанные в Таблице 8, уменьшают расщепление β-казеина 192/193.
Поскольку данные мутации вызывают меньшее образование С-концевого фрагмента β-казеина, β(193-209), они представляют собой предпочтительные мутации в вариантах химозина для приготовления сыра с менее горьким вкусом из-за пониженного расщепления β-казеина.
Основанные на структуре вариации в верблюжьем химозине
Получали варианты верблюжьего химозина (SEQ ID NO: 2) с изменениями аминокислот в положениях, определенных структурным анализом белка (Таблица 9). Мутации N100Q и N291Q вводили в оба сайта N-гликозилирования данных вариантов и контрольного верблюжьего химозина (CamUGly) с получением негликозилированных гомогенных образцов белка.
Свертывающие активности определяли с использованием способа μIMCU.
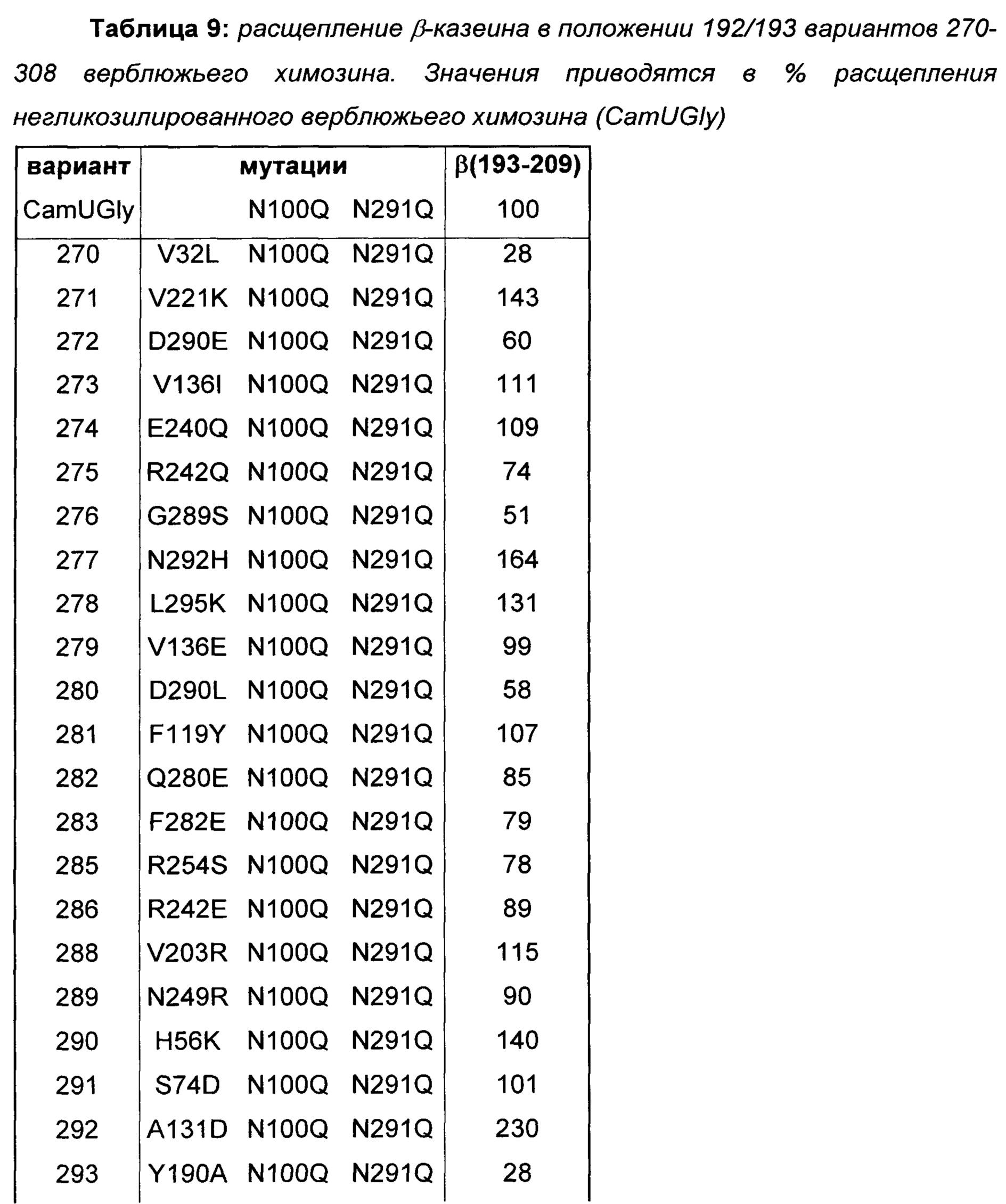

На основе результатов, показанных в Таблице 9, делается заключение о том, что мутации K19T, Y21S, V32L, D59N, H76Q, I96L, L130I, S132A, Y190A, L222I, S226T, D290E, D290L, R242E, R242Q, Y243E, G251D, R254S, S273D, S273Y, Q280E, F282E, G289S и V309I уменьшают расщепление β-казеина 192/193 более чем на 10%. Поскольку данные мутации вызывают меньшее образование С-концевого фрагмента β-казеина, β(193-209), они представляют собой предпочтительные мутации в вариантах химозина для приготовления сыра с менее горьким вкусом из-за пониженного расщепления β-казеина.
Десять из 24 вариантов с пониженным расщеплением β-казеина 192/193, показанные в Таблице 9, несут мутации (V32L, H76Q, L130I, S132A, Y190A, L222I, S226T, G289S, D290E, D290L) в пределах или в структурной близости к субстратсвязывающей щели (Фиг. 5), свидетельствуя о прямом влиянии данных мутаций на связывание β-казеина.
Девять из 24 вариантов с пониженным расщеплением β-казеина 192/193, показанные в Таблице 9, несут мутации (R242E, R242Q, Y243E, G251D, R254S, S273D, S273Y, Q280E, F282E) в отличной области на поверхности белка, которая расположена поблизости от связывающей щели, как видно на Фиг. 6. Предполагают, что данная область поддерживает связывание субстрата, κ-казеина, посредством взаимодействия с его положительно заряженной последовательностью от Arg96 до His102 (ссылки 5, 16-18) в положениях от Р10 до Р4 (ссылка 10). Введенные мутации могут усиливать данные взаимодействия посредством уменьшения результирующего заряда данной области на поверхности белка. Повышенное связывание κ-казеина в конечном счете будет ингибировать связывание и гидролиз других субстратов, таких как β-казеин. Данные результаты показывают, что одноаминокислотные замены в данной области могут значительно увеличивать С/Р.
Комбинации отрицательных зарядов в верблюжьем химозине
Получали больше вариантов верблюжьего химозина (SEQ ID NO: 2) с комбинациями мутаций, которые вводят отрицательные заряды в поверхностную область, описанную выше (R242E, Y243E, G251D, N252D, R254E, S273D, Q280E). Мутации N100Q и N291Q вводили в оба сайта N-гликозилирования данных вариантов и контрольного верблюжьего химозина (CamUGly) с получением негликозилированных гомогенных образцов белка (Таблица 10).
Свертывающие активности определяли с использованием способа μIMCU.


Все варианты, показанные в Таблице 10, демонстрируют пониженное расщепление β-казеина по сравнению с негликозилированным верблюжьим химозином. Делается заключение о том, что ингибирование расщепления β-казеина посредством введения отрицательных зарядов во взаимодействующую область Р10-Р4 на структуре химозина может дополнительно усиливаться комбинациями соответствующих мутаций.
Основанные на структуре вариации в коровьем химозине
Получали варианты коровьего химозина (SEQ ID NO: 1) с изменениями аминокислот в положениях, определенных структурным анализом белка (Таблица 11). Мутации N252Q и N291Q вводили в оба сайта N-гликозилирования данных вариантов и контрольного верблюжьего химозина (BovUGly) с получением негликозилированных гомогенных образцов белка.
Свертывающие активности определяли с использованием способа μIMCU.
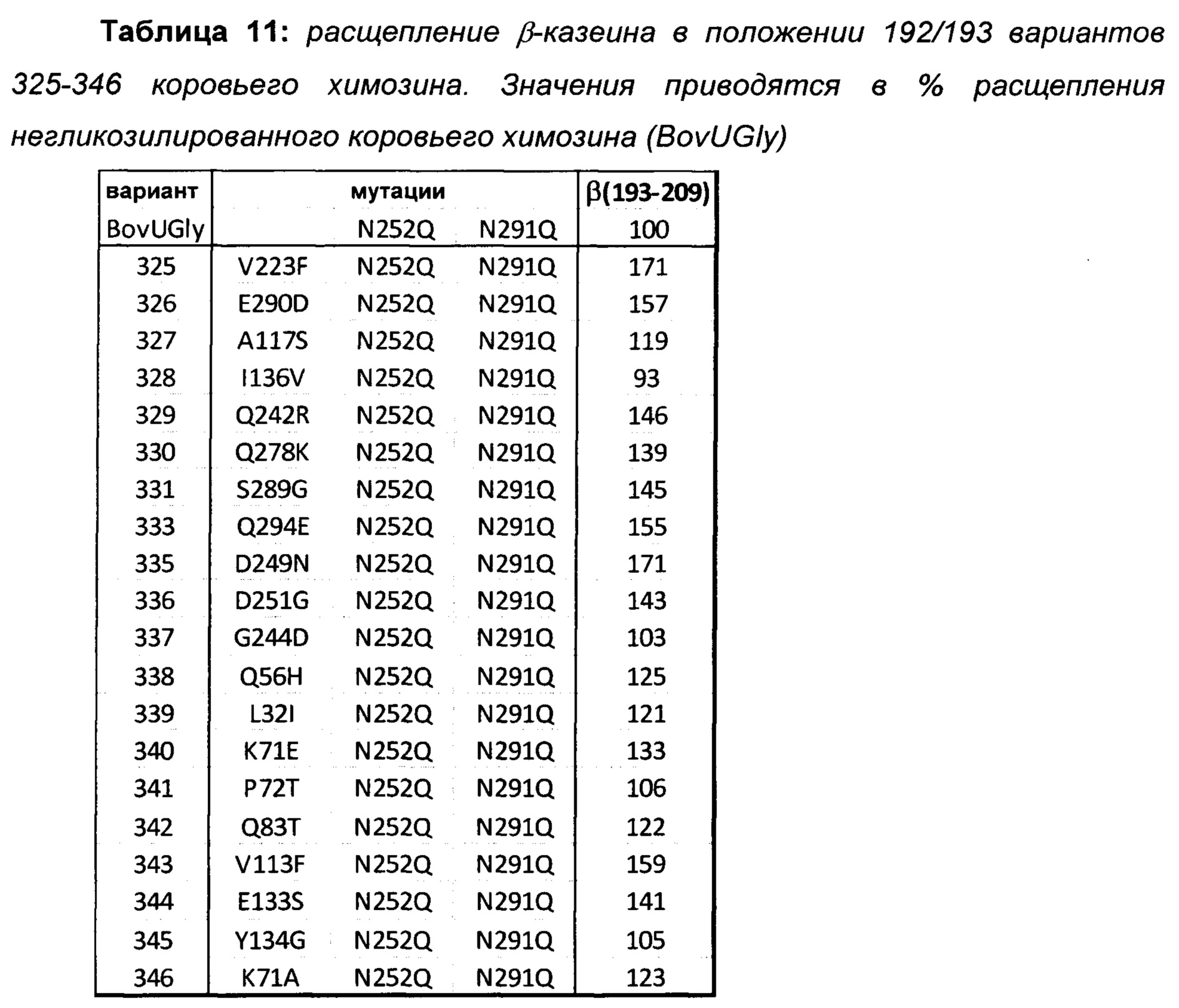
За исключением I136V, все мутации вызывали повышенное расщепление β-казеина 192/193 в вариантах, показанных в Таблице 11. Примечательно, что, в то время как замены I136V, Q242R, D251G, S289G и E290D увеличивали расщепление β-казеина коровьего химозина, пониженное расщепление β-казеина наблюдали при соответствующих обратных мутациях V136I, R242Q, G251D, G289S и D290E в верблюжьем химозине (Таблица 9). Аналогичный эффект наблюдается в положении 32. В то время как V32L вызывала пониженное расщепление β-казеина верблюжьего химозина, мутация L32 до I - β разветвленной гидрофобной аминокислоты со структурным сходством с V - приводила к повышенному расщеплению β-казеина коровьего химозина. Это демонстрирует, что данные изменения аминокислот оказывают аналогичные эффекты на специфичность химозина у разных видов.
Вариации N-конца верблюжьего химозина
Получали варианты верблюжьего химозина (SEQ ID NO: 2) с изменениями аминокислот в определенных структурным анализом белка положениях молекулярных взаимодействий N-концевой последовательности Y11-D13 в пределах субстратсвязывающей щели (Таблица 12). Мутации N100Q и N291Q вводили в оба сайта N-гликозилирования данных вариантов и контрольного верблюжьего химозина (CamUGly) с получением негликозилированных гомогенных образцов белка.
Свертывающие активности определяли с использованием способа μIMCU.

Анализ структуры верблюжьего химозина направил вариации в N-концевой последовательности Y11-D13, а также в положении D290, потенциальном партнере по взаимодействию с Y11 (Фиг. 7). Поскольку казеиновые субстраты конкурируют с N-концевой последовательностью химозина за связывание в пределах связывающей щели, ожидается, что аминокислотные замены, которые изменяют взаимодействия между связывающей щелью и мотивом Y11-D13, влияют на ферментативную активность в отношении разных казеиновых субстратов, и, таким образом, на расщепление β-казеина 192/193. Результаты с соответствующими вариантами 347-366 показывают сильную вариацию в расщеплении β-казеина (Таблица 12). А именно: варианты 353 и 355, оба несущие мутацию D290E, показывают пониженное расщепление β-казеина.
Библиотека 6 с множественными заменами
Получали и анализировали, как описано выше, другой набор вариантов верблюжьего химозина, причем каждый из них имеет множественные замены по сравнению с диким типом. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину (зрелому полипептиду SEQ ID NO: 2), за исключением вариаций, упомянутых в таблице. Верблюжий химозин (CHY-MAX М) включен в качестве эталона. Свертывающие активности определяли с использованием способа μIMCU.

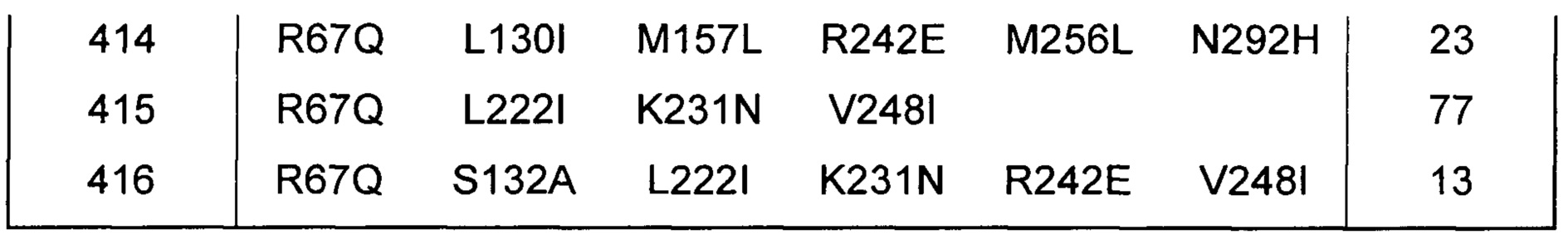
В Таблице 13 показаны варианты верблюжьего химозина с данными по расщеплению β-казеина 192/193. Все 50 вариантов демонстрируют на 19%-97% пониженную протеолитическую активность по сравнению с верблюжьим химозином дикого типа.
Мутационный анализ библиотеки 6 с множественными заменами
Провели статистический анализ позиционных и мутационных эффектов на расщепление β-казеина на основе протеолитических данных вариантов библиотеки 6. Наиболее полезные мутации для пониженного расщепления β-казеина показаны в Таблице 14.
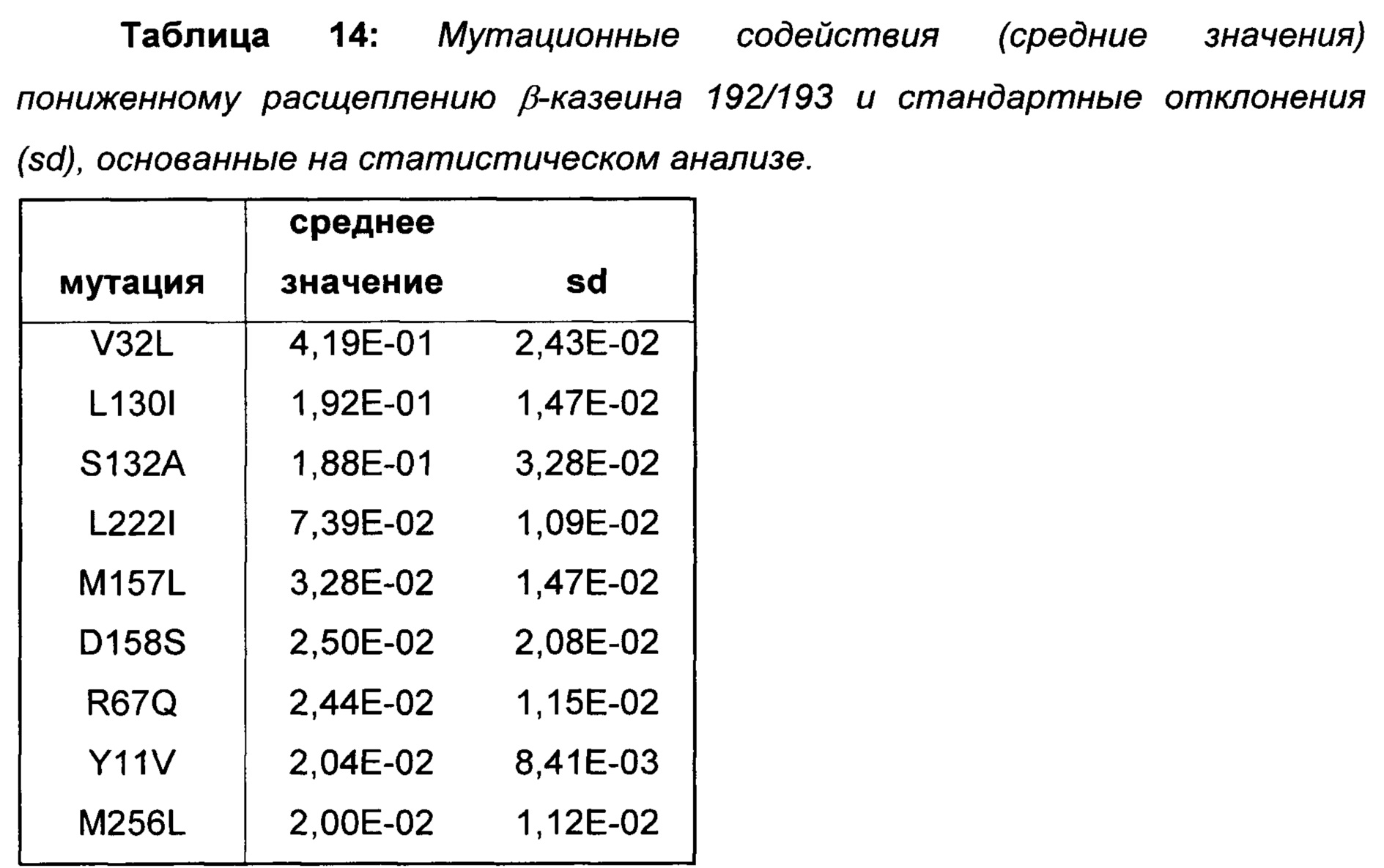
На основе полученных результатов делается заключение о том, что мутации, показанные в Таблице 14, уменьшают расщепление β-казеина 192/193.
Поскольку данные мутации вызывают меньшее образование С-концевого фрагмента β-казеина, β(193-209), они представляют собой предпочтительные мутации в вариантах химозина для приготовления сыра с менее горьким вкусом из-за пониженного расщепления β-казеина.
Получали и анализировали, как описано выше, другой набор вариантов верблюжьего химозина, причем каждый из них имеет множественные замены по сравнению с диким типом. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину (зрелому полипептиду SEQ ID NO: 2), за исключением вариаций, упомянутых в таблице. Верблюжий химозин (CHY-MAX М) включен в качестве эталона.
Свертывающие активности определяли с использованием способа μIMCU.
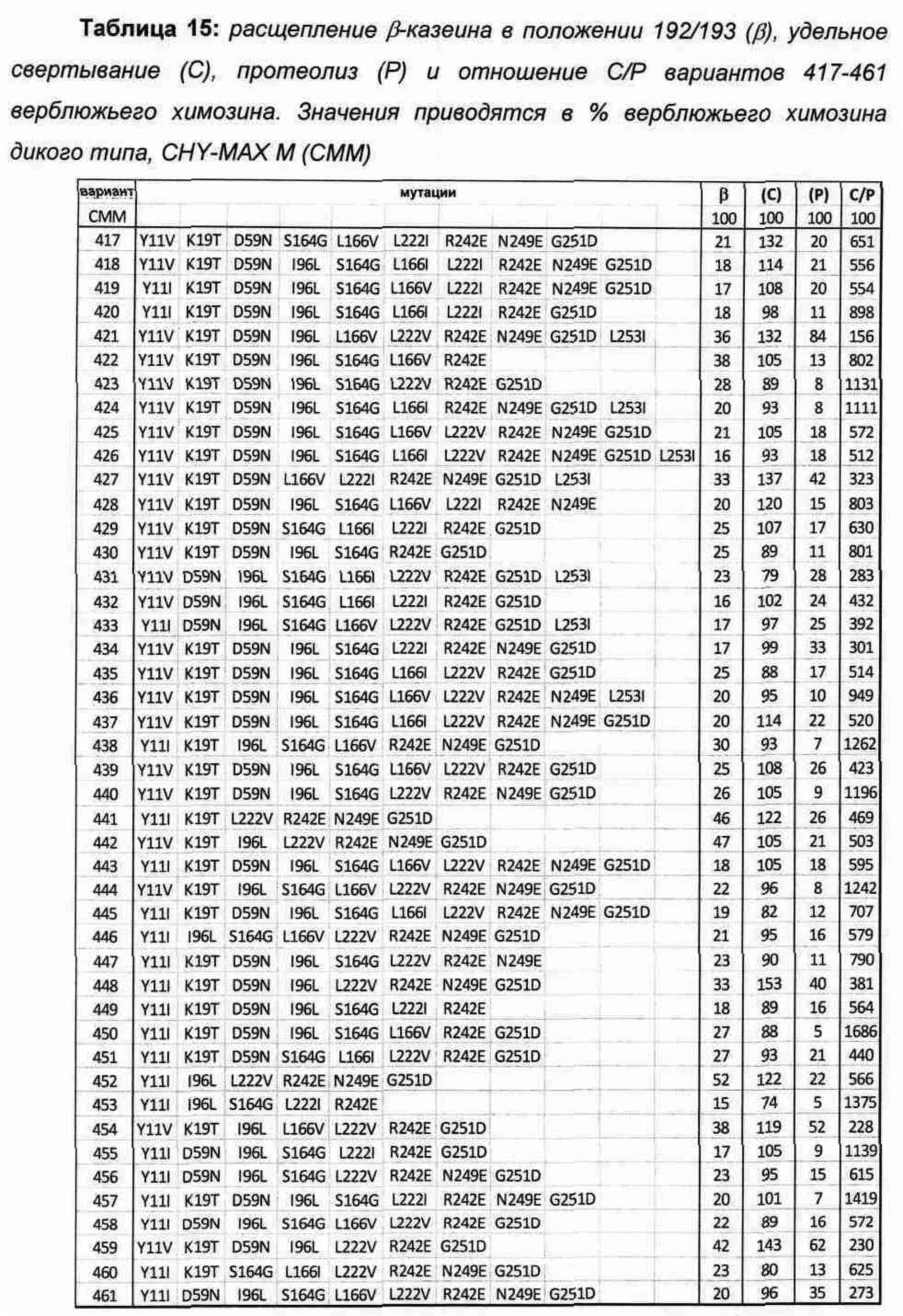
В Таблице 15 показаны варианты верблюжьего химозина с данными по расщеплению β-казеина 192/193. Все 45 вариантов демонстрируют пониженную протеолитическую активность по сравнению с верблюжьим химозином дикого типа.
ССЫЛКИ
1. A. Kumar, S. Grover, J. Sharma, V.K. Batish, Crit. Rev. Biotechnol. 2010, 30, 243-258.
2. M.W.



3. K. Kastberg

4. P.L.H. McSweeney, Int. J. Dairy Technol. 2004, 57, 127-144.
5. J. Langholm Jensen, A.


6. S. Chitpinityol, D. Goode, M.J.C. Crabbe, Food Chem. 1998, 62, 133-139.
7. G.L. Gilliland, E.L. Winborne, J. Nachman, A. Wlodawer, Proteins 1990, 8, 82-101.
8. D.S. Palmer, A.U. Christensen, J.


9. J.


10. I. Schechter, A. Berger, Biochem. Biophys. Res. Commun. 1967, 425, 497-502.
11. L.K. Creamer, N.F. Olsen, J. Food Sci. 1982, 47:631-636
12. N. Bansal, M.A. Drake, P. Piraino, M.L. Broe, M. Harboe, P.F. Fox, P.L.H. McSweeney, Int. Dairy J. 2009, 19:510-517.
13. A.C. Moynihan, S. Govindasamy-Lucey, J.J. Jaeggi, M.E. Johnson, J.A. Lucey, P.L.H. McSweeney, J. Dairy Sci. 2014, 97:85-96.
14. J. Ehren, S. Govindarajan, B. Moron, J. Minshull, C. Khosla, Prot. Eng. Des. Sel. 2008, 21, 699-707.
15. S. Govindarajan, B. Mannervik, J.A. Silverman, K. Wright, D. Regitsky, U. Hegazy, T.J. Purcell, M. Welch, J. Minshull, C. Gustafsson, ACS Synth. Biol. 2015, 4, 221-227.
16. M. Newman, М. Safro, С. Frazao, G. Khan, A. Zdanov, I.J. Tickle, T.L. Blundell, N. Andreeva, J. Mol. Biol. 1991, 221, 1295-1309.
17. E. Gustchina, L. Rumsh, L. Ginodman, P. Majer, N. Andreeva, FEBS Lett. 1996, 379, 60-62.
18. S. Visser, C.J. Slangen, P.J. van Rooijen, Biochem. J. 1987, 244, 553-558.
Реферат
Изобретение относится к биотехнологии и представляет собой выделенный вариант полипептида химозина, отличающийся тем, что он(а) имеет удельную свертывающую активность (IMCU (международная молокосвертывающая единица)/мг общего белка), которая составляет по меньшей мере 70% удельной свертывающей активности выделенного полипептида верблюжьего химозина, характеризующегося SEQ ID NO:4; и (б) расщепляет казеин с частотой меньше чем 50% от частоты расщепления казеина выделенного полипептида верблюжьего химозина, характеризующегося SEQ ID NO:4, где расщепление казеина определяют посредством количественного определения пептидов казеина, полученных инкубированием обезжиренного молока с вариантом химозина или верблюжьим химозином, где количественное определение осуществляют посредством RPHPLC (высокоэффективная жидкостная хроматография с обращенной фазой) в сочетании с ESI-Q-TOF масс-спектрометром (времяпролетный квадрупольный масс-спектрометр с электрораспылительной ионизацией). Изобретение касается также способа изготовления пищевого продукта с использованием такого фермента. 7 н. и 7 з.п. ф-лы, 4 ил., 15 табл., 1 пр.

Комментарии