Секвенирование с помощью одиночного источника света и двух оптических каналов - RU2736384C1
Код документа: RU2736384C1
Чертежи






Описание
РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет по предварительной заявке США №62/468242, опубликованной 7 марта 2017. Содержание этой родственной заявки полностью включено в настоящую заявку посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники
[0002] Настоящее изобретение относится в целом к секвенированию ДНК и, более конкретно, оно относится к системам и способам секвенирования ДНК с помощью одиночного источника света и по меньшей мере двух красителей, таких как две флуоресцентных метки.
Уровень техники
[0003] Существующие системы и способы секвенирования ДНК используют два или более источников света для возбуждения аналогов дезоксирибонуклеиновых кислот, конъюгированных с флуоресцентными метками. Тем не менее, во время работы источники света характеризуются высоким энергопотреблением и могут выделять значительное количество тепла, которое необходимо рассеивать. Флуоресцентные метки, которые могут эффективно возбуждаться одиночным источником света, могут характеризоваться взаимными помехами, вследствие чего каждая метка будет излучать свет с длиной волны, которая перекрывается с другими метками. При отсутствии коррекции эти взаимные помехи способны затруднить надлежащее распознавание правильного нуклеотидного основания в процессе секвенирования в системах секвенирования ДНК.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0004] В настоящем изобретении предложены системы и способы определения нуклеотидной последовательности полинуклеотидов. В одном примере система содержит: одиночный источник света, такой как лазер или светодиод, выполненный с возможностью генерирования света, такого как свет заданной длины волны; по меньшей мере один детектор, выполненный с возможностью обнаружения флуоресцентных излучений из флуорофора, присоединенного к нуклеотиду, причем указанный по меньшей мере один детектор выполнен с возможностью обнаружения флуоресцентных излучений первой длины волны и второй длины волны; процессор, выполненный с возможностью исполнения команд для осуществления способа, включающего этапы, на которых: излучают свет от источника света на нуклеотид; идентифицируют нуклеотид как нуклеотид первого типа, если указанным по меньшей мере одним детектором не обнаружено флуоресцентное излучение; идентифицируют нуклеотид как нуклеотид второго типа, если указанным по меньшей мере одним детектором обнаружено флуоресцентное излучение с первой длиной волны; идентифицируют нуклеотид как нуклеотид третьего типа, если указанным по меньшей мере одним детектором обнаружено флуоресцентное излучение со второй длиной волны; и идентифицируют нуклеотид как нуклеотид четвертого типа, если указанным по меньшей мере одним детектором обнаружены флуоресцентные излучения с первой длиной волны и со второй длиной волны.
[0005] Еще один пример представляет собой осуществляемый посредством компьютера способ, включающий этапы, на которых: излучают свет с помощью источника света на флуорофор, присоединенный к нуклеотиду; обнаруживают флуоресцентные излучения из флуорофора, присоединенного к нуклеотиду, с первой длиной волны и со второй длиной волны с помощью по меньшей мере одного детектора; и идентифицируют нуклеотид, причем идентификация включает этап, на котором идентифицируют нуклеотид как нуклеотид первого типа, если указанным по меньшей мере одним детектором не обнаружено флуоресцентное излучение; идентифицируют нуклеотид как нуклеотид второго типа, если указанным по меньшей мере одним детектором обнаружено флуоресцентное излучение с первой длиной волны; идентифицируют нуклеотид как нуклеотид третьего типа, если указанным по меньшей мере одним детектором обнаружено флуоресцентное излучение со второй длиной волны; и идентифицируют нуклеотид как нуклеотид четвертого типа, если указанным по меньшей мере одним детектором обнаружены флуоресцентные излучения с первой длиной волны и со второй длиной волны.
[0006] В еще одном примере система содержит одиночный источник света, выполненный с возможностью генерирования света; по меньшей мере один детектор, выполненный с возможностью обнаружения четырех значительно отличающихся флуоресцентных излучений из разных флуорофоров, присоединенных к нуклеотидам; процессор, выполненный с возможностью исполнения команд для осуществления способа, включающего этапы, на которых: излучают свет от источника света на нуклеотид; идентифицируют нуклеотид как нуклеотид первого типа, если указанным по меньшей мере одним детектором обнаружено первое флуоресцентное излучение; идентифицируют нуклеотид как нуклеотид второго типа, если указанным по меньшей мере одним детектором обнаружено второе флуоресцентное излучение; идентифицируют нуклеотид как нуклеотид третьего типа, если указанным по меньшей мере одним детектором обнаружено третье флуоресцентное излучение; и идентифицируют нуклеотид как нуклеотид четвертого типа, если указанным по меньшей мере одним детектором обнаружено четвертое флуоресцентное излучение, причем первое флуоресцентное излучение, второе флуоресцентное излучение, третье флуоресцентное излучение и четвертое флуоресцентное излучение имеют значительно отливающиеся длины волн.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0007] На ФИГ. 1 показана схематичная иллюстрация примера секвенатора с одиночным источником света и двумя оптическими каналами.
[0008] На ФИГ. 2 показана функциональная блок-схема примера компьютерной системы для осуществления секвенирования с одиночным источником света и двумя оптическими каналами.
[0009] На ФИГ. 3 показана блок-схема примера способа секвенирования путем синтеза посредством секвенирования с одиночным источником света и двумя оптическими каналами.
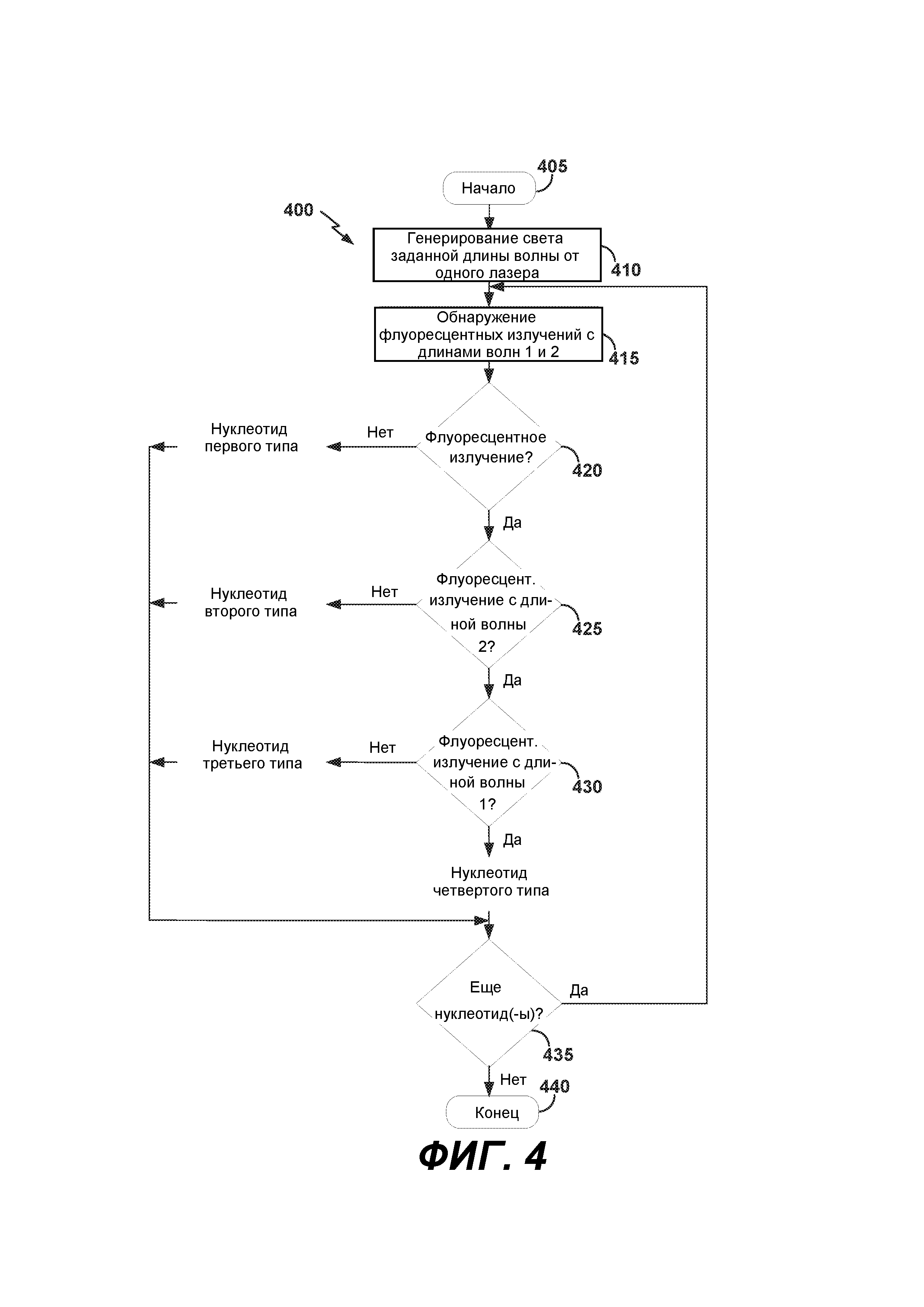
[0010] На ФИГ. 4 показана блок-схема примера способа осуществления распознавания нуклеотидных оснований при секвенировании с одиночным источником света и двумя оптическими каналами.
[0011] На ФИГ. 5 показана блок-схема примера осуществления секвенирования с одиночным источником света и двумя оптическими каналами.
[0012] На ФИГ. 6 показано схематичное изображение полинуклеотидных кластеров и их секвенирование с одиночным источником света и двумя оптическими каналами.
[0013] На ФИГ. 7A-D представлены схематичные графики, показывающие цветовую коррекцию и фазовую коррекцию при секвенировании с одиночным источником света и двумя оптическими каналами.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
[0014] В нижеследующем подробном описании даны ссылки на сопроводительные чертежи, которые составляют его часть. На чертежах одинаковые символы обычно обозначают одинаковые компоненты, если контекст не указывает на иное. Примеры вариантов осуществления, описанные в подробном описании, чертежи и формула изобретения не предназначены для ограничения. Могут использоваться другие варианты осуществления и могут вноситься другие изменения без выхода за рамки идеи и объема предмета изобретения, представленного в данном документе. Легко понять, что аспекты настоящего изобретения, в целом описанные в данном документе и проиллюстрированные на фигурах, могут быть размещены, заменены, объединены, разделены и спроектированы в пределах широкого спектра разных конфигураций, все из которых однозначным образом предусмотрены в данном документе.
[0015] Варианты осуществления настоящего изобретения относятся к новому поколению систем секвенирования нуклеотидов, которые способны идентифицировать все четыре нуклеотидных основания с помощью одиночного источника света и лишь двух разных оптических каналов. В системах секвенирования используется процесс секвенирования путем синтеза. В ходе каждого цикла секвенирования в растущие праймеры, гибридизующиеся с секвенируемыми полинуклеотидами, могут встраиваться четыре типа аналогов нуклеотидов. В некоторых вариантах осуществления указанные четыре типа аналогов нуклеотидов могут включать аналог дезоксигуанозинтрифосфата (дГТФ), не конъюгированный с каким-либо флуоресцентным красителем, аналог дезокситимидинтрифосфата (дТТФ), конъюгированный с первым флуоресцентным красителем, аналог дезоксицитидинтрифосфата (дЦТФ), конъюгированный со вторым флуоресцентным красителем, и аналог дезоксиаденозинтрифосфата (дАТФ), конъюгированный с обоими флуоресцентными красителями (или смесь двух аналогов дАТФ, один из которых конъюгирован с первым флуоресцентным красителем, а другой конъюгирован со вторым флуоресцентным красителем). Флуоресцентные красители, конъюгированные с указанными четырьмя типами аналогов нуклеотидов, приведены лишь в качестве примера и не предполагают ограничения. Например, аналог дТТФ может быть конъюгирован с любым флуоресцентным красителем, аналог дЦТФ может быть конъюгирован с первым флуоресцентным красителем, аналог дАТФ может быть конъюгирован со вторым флуоресцентным красителем, и аналог дГТФ может быть конъюгирован с обоими флуоресцентными красителями (или возможна смесь двух аналогов дГТФ, один из которых конъюгирован с первым флуоресцентным красителем, а другой конъюгирован со вторым флуоресцентным красителем). В еще одном примере аналог дЦТФ может не быть конъюгирован с каким-либо флуоресцентным красителем, аналог дАТФ может быть конъюгирован с первым флуоресцентным красителем, аналог дТТФ может быть конъюгирован со вторым флуоресцентным красителем, и аналог дГТФ может быть конъюгирован с обоими флуоресцентными красителями (или возможна смесь двух аналогов дГТФ, один из которых конъюгирован с первым флуоресцентным красителем, а другой конъюгирован со вторым флуоресцентным красителем). В еще одном примере аналог нуклеотида, не конъюгированный с каким-либо флуоресцентным красителем, может представлять собой дГТФ, дТТФ, дЦТФ или дАТФ. Аналог нуклеотида, конъюгированный с первым флуоресцентным красителем, может представлять собой дГТФ, дТТФ, дЦТФ или дАТФ. Аналог нуклеотида, конъюгированный с двумя флуоресцентными красителями, может представлять собой дГТФ, дТТФ, дЦТФ или дАТФ. Аналог дГТФ, дТТФ, дЦТФ или дАТФ может содержать смесь двух аналогов, один из которых конъюгирован с первым флуоресцентным красителем, а другой конъюгирован со вторым флуоресцентным красителем.
[0016] Источник света (например, лазер или светодиод) способен возбуждать два указанных флуоресцентных красителя. Первый флуоресцентный краситель флуоресцирует с первой длиной волны и может быть обнаружен на первом флуоресцентном изображении. Второй флуоресцентный краситель флуоресцирует со второй длиной волны и может быть обнаружен на втором флуоресцентном изображении. Значения интенсивности обнаруженных флуоресцентных излучений измеряются на двух указанных флуоресцентных изображениях. В некоторых вариантах осуществления два указанных флуоресцентных красителя могут характеризоваться взаимными помехами, и флуоресцентные излучения аналога дТТФ и аналога дЦТФ могут быть обнаружены на обоих флуоресцентных изображениях. Таким образом, извлеченные значения интенсивности должны быть скорректированы, например путем цветовой коррекции. В некоторых вариантах осуществления два указанных флуоресцентных красителя могут иметь большой стоксов сдвиг частоты, и взаимные помехи флуоресцентных излучений могут быть минимальными или отсутствовать.
[0017] В некоторых вариантах осуществления один из двух указанных флуоресцентных красителей может представлять собой краситель с нормальным стоксовым сдвигом частоты, а другой из указанных флуоресцентных красителей может представлять собой краситель с большим стоксовым сдвигом частоты. Неограничивающие примеры красителя с нормальным стоксовым сдвигом частоты включают Alexa 488 или его аналоги (такие как 3,6-бис(этиламино)-2,7-диметил-[2-карбоксилато-5-(3-карбоксипропилокси)фенил]ксантилий бетаин (краситель 1-3), и 3,6-бис(этиламино)-2,7-диметил-[2-карбоксилато-4-(3-карбоксипропилокси)фенил]ксантилиий бетаин (краситель 1-4), раскрытые в патенте США №8,754,244, содержание которого полностью включено в настоящую заявку). Краситель с нормальным стоксовым сдвигом частоты может возбуждаться с помощью лазерного или светодиодного (LED) источника света с длиной волны 488 нм, и он может иметь пик излучения на 520 нм. Краситель с большим стоксовым сдвигом частоты может представлять собой краситель NR520LS, описанный в патентной заявке РСТ № PCT/GB 2016/051474, содержание которой полностью включено в настоящую заявку. Краситель с большим стоксовым сдвигом частоты может иметь пик излучения на 590 нм. В некоторых вариантах осуществления два указанных флуоресцентных красителя могут представлять собой Су3 (с пиком излучения приблизительно на 575 нм) и обладающий свойством резонансного переноса энергии флуоресценции (FRET) парный краситель Су3-Су5 (с пиком излучения приблизительно на 670 нм).
[0018] При цветовой коррекции может использоваться цветовая матрица для приведения к нужному виду извлеченных значений интенсивности с использованием свойств исходного распределения интенсивностей в пределах каждого флуоресцентного изображения. Цветовая матрица может быть оценена путем построения графика зависимости значений интенсивности, измеренных на первом флуоресцентном изображении, от значений интенсивности, измеренных в соответствующих точках на втором флуоресцентном изображении, в точках (xi, yi). Здесь xi and yi обозначают значение интенсивности, измеренное в точке i растущего праймера-полинуклеотида на втором флуоресцентном изображении и на первом флуоресцентном изображении соответственно. Нанесенные на график значения интенсивности в точках (xi, yi) преобразуют к полярным координатам и вычисляют взвешенную по радиусу гистограмму углов θi. Два локальных максимума θ1 и θ2 на взвешенной по радиусу гистограмме могут использоваться для оценки цветовой матрицы. Цветовая матрица может иметь вид

[0019] После применения матрицы, обратной цветовой матрице, к построенным графикам значений интенсивности в точках (xi, yi), могут быть определены основания включенных нуклеотидов. Например, если флуоресцентное излучение не обнаружено, то включенный нуклеотид может представлять собой аналог дГТФ. Если флуоресцентное излучение обнаружено на втором флуоресцентном изображении, но не на первом флуоресцентном изображении, то включенный нуклеотид может представлять собой аналог дТТФ. Если флуоресцентное излучение обнаружено на первом флуоресцентном изображении, но не на втором флуоресцентном изображении, то встроенный нуклеотид может представлять собой аналог дЦТФ. Если флуоресцентные излучения обнаружены на обеих флуоресцентных изображениях, то встроенный нуклеотид может представлять собой аналог дАТФ.
Определения
[0020] Если не указано иное, то технические и научные термины, используемые в данном документе, имеют то же самое значение, в каком их обычно понимают специалисты в области техники, к которой относится настоящее изобретение. См., например, Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (Нью-Йорк, NY 1994); Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press (Cold Spring Harbor, NY 1989). Для целей настоящего изобретения далее приведены определения используемых ниже терминов.
Секвенатор с одиночным источником света и двумя оптическими каналами
[0021] Раскрытые в данном документе системы и способы определения нуклеотидной последовательности полинуклеотидов используют одиночный источник света (например, лазер или светодиод). В одном варианте осуществления по меньшей мере два красителя используются для секвенирования полинуклеотидов. На ФИГ. 1 показан схематичный вид примера системы 100 секвенирования с одиночным источником света и двумя оптическими каналами. Система 100 секвенирования с одиночным источником света и двумя оптическими каналами может быть выполнена с возможностью использования способов секвенирования, основанных на двух красителях, например на первой флуоресцентной метке и второй флуоресцентной метке. Неограничивающие примеры используемых способов секвенирования могут включать секвенирование путем синтеза и секвенирование отдельных молекул в гелиоскопе. Система 100 секвенирования с одиночным источником света и двумя оптическими каналами может содержать оптическую систему 102, выполненную с возможностью генерирования исходных данных о секвенировании с использованием реагентов, подаваемых с помощью флюидной системы 104, которая является частью системы 100 секвенирования с одиночным источником света и двумя оптическими каналами. Исходные данные о секвенировании могут содержать флуоресцентные изображения, обнаруженные с помощью оптической системы 102. Компьютерная система 106, которая представляет собой часть системы 100 секвенирования с одиночным источником света и двумя оптическими каналами, может быть выполнена с возможностью управления оптической системой 102 и флюидной системой 104 посредством каналов 108А и 108В связи. Например, компьютерный интерфейс 110 оптической системы 102 может быть выполнен с возможностью связи с компьютерной системой 106 посредством канала 108А связи.
[0022] Во время реакций секвенирования флюидная система 104 может направлять поток реагентов по одной или более реагентным трубкам 112 в проточную ячейку 114, размещенную на предметном столике 116, и из этой ячейки. Реагенты могут представлять собой, например, флуоресцентно меченные нуклеотиды, буферы, ферменты и отщепляющие реагенты. Проточная ячейка 114 может содержать по меньшей мере один флюидный канал. Проточная ячейка 114 может представлять собой проточную ячейку со структурированным массивом или проточную ячейку с произвольным массивом. Проточная ячейка 114 может содержать множество кластеров одноцепочечных полинуклеотидов, подлежащих секвенированию, в по меньшей мере одном флюидном канале. Длина полинуклеотидов может варьироваться в диапазоне, например, от 200 оснований до 1000 оснований. Полинуклеотиды могут быть прикреплены к одному или более флюидным каналам проточной ячейки 114. В некоторых вариантах осуществления проточная ячейка 114 может содержать множество гранул, каждая из которых может содержать множество копий полинуклеотида, подлежащего секвенированию. Предметный столик 116 может быть выполнен с возможностью обеспечения надлежащего выравнивания и перемещения проточной ячейки 114 относительно других компонентов оптической системы 102. В одном варианте осуществления опорный столик 116 может использоваться для выравнивания проточной ячейки 114 с объективом 118.
[0023] Оптическая система 102 может содержать одиночный источник 120 света, например один лазерный или один светодиодный источник света, выполненный с возможностью генерирования света с заданной длиной волны, например 532 нм. Свет, генерируемый источником 120 света, может проходить по оптоволоконному кабелю 122 для возбуждения флуоресцентных меток в проточной ячейке 114. Объектив 118, установленный на фокусирующем устройстве 124, имеет возможность перемещения вдоль оси z. Сфокусированные флуоресцентные излучения могут обнаруживаться с помощью детектора 126, например датчика на приборах с зарядовой связью (ПЗС) или датчика на комплементарной структуре металл-оксид- полупроводник (КМОП).
[0024] Блок 128 фильтров оптической системы 102 может быть выполнен с возможностью фильтрации флуоресцентных излучений флуоресцентных меток в проточной ячейке 114. Блок 128 фильтров может содержать первый фильтр и второй фильтр. Каждый фильтр может представлять собой фильтр пропускания длинных волн, фильтр пропускания коротких волн или полосовой пропускающий фильтр. Первый фильтр может быть выполнен с возможностью обнаружения флуоресцентных излучений первых флуоресцентных меток с помощью детектора 126. Второй фильтр может быть выполнен с возможностью обнаружения флуоресцентных излучений вторых флуоресцентных меток с помощью детектора 126. С помощью двух фильтров в блоке 128 фильтров детектор 126 может обнаруживать свет с двумя разными длинами волн. Свет с двумя разными длинами волн может излучаться одной и той же флуоресцентной меткой или разными флуоресцентными метками. Две указанных длины волны могут отличаться друг от друга, например, по меньшей мере на 20 нм.
[0025] В некоторых вариантах осуществления оптическая система 102 может содержать дихроичное зеркало, выполненное с возможностью разделения флуоресцентных излучений. Оптическая система 102 может содержать два детектора: первый детектор, соединенный с первым фильтром и предназначенный для обнаружения флуоресцентных излучений с первой длиной волны, и второй детектор, соединенный со вторым фильтром и предназначенный для обнаружения флуоресцентных излучений со второй длиной волны. После разделения флуоресцентных излучений с помощью дихроичного зеркала, оптическая система 102 может обнаруживать флуоресцентные излучения с двумя длинами волн одновременно (или близко по времени) с помощью двух указанных детекторов, соединенных с разными фильтрами. Такая конфигурация обеспечивает возможность повышения скорости процесса формирования изображений. Соответственно, обеспечивается возможность одновременной обработки множества проточных ячеек таким образом, чтобы для одной проточной ячейки осуществлялось формирование изображения и одновременно с этим происходило встраивание аналогов нуклеотидов в полинуклеотидые кластеры одной или более других проточных ячеек.
[0026] При использовании образец, содержащий секвенируемый полинуклеотид, загружают внутрь проточной ячейки 114 и размещают последнюю на предметном столике 116. Затем компьютерная система 106 активирует флюидную систему 104 для запуска цикла секвенирования. Во время реакций секвенирования компьютерная система 106 подает команды на флюидную систему 104 посредством интерфейса 108В связи для подачи реагентов, например аналогов нуклеотидов, на проточную ячейку 114. Благодаря интерфейсу 108А связи и компьютерному интерфейсу 110, компьютерная система 106 выполнена с возможностью управления источником 120 света оптической системы 102 для генерирования света с заданной длиной волны и освещения аналогов нуклеотидов, встраиваемых в растущие праймеры, гибридизующиеся с секвенируемыми полинуклеотидами. Компьютерная система 106 управляет детектором 126 оптической системы 102 для обнаружения спектра излучения аналогов нуклеотидов на флуоресцентных изображениях. Компьютерная система 106 принимает флуоресцентные изображения от детектора 126 и обрабатывает принятые флуоресцентные изображения для определения нуклеотидной последовательности секвенируемых полинуклеотидов.
Источник света и фильтры
[0027] Система 100 секвенирования с одиночным источником света и двумя оптическими каналами может использовать одиночный источник света, такой как лазер или светодиод, способный возбуждать две флуоресцентных метки со спектрами излучения, которые по существу не перекрываются. Длина волны, генерируемого источником 120 света, может варьироваться, например, в диапазоне от 400 нм до 800 нм. В некоторых вариантах осуществления длина волны, генерируемого источником 120 света, может составлять или приблизительно составлять 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800 нм, или представлять собой число или ряд чисел между любыми двумя из этих значений. В некоторых вариантах осуществления длина волны, генерируемого источником 120 света, может составлять по меньшей мере или максимум 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790 или 800 нм.
[0028] Детектор 126 с блоком 128 фильтров может быть выполнен с возможностью обнаружения света с двумя или приблизительно с двумя разными длинами волн, например с первой длиной волны и второй длиной волны. Первая длина волны и вторая длина волны могут отличаться друг от друга на величину, находящуюся в диапазоне, например, от 10 нм до 100 нм. В некоторых вариантах осуществления первая длина волны и вторая длина волны могут отличаться друг от друга на величину, составляющую или приблизительно составляющую 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50, 60, 70, 80, 90, 100 нм или представлять собой число или ряд чисел между любыми двумя из этих значений. В некоторых вариантах осуществления первая длина волны и вторая длина волны могут отстоять друг от друга на величину, составляющую по меньшей мере или максимум 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50, 60, 70, 80, 90 или 100 нм.
[0029] Количество фильтров в блоке 128 фильтров может варьироваться в диапазоне от 1 до 10. В некоторых вариантах осуществления количество фильтров в блоке 128 фильтров может составлять или приблизительно составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или представлять собой ряд чисел между любыми двумя из этих значений. В некоторых вариантах осуществления количество фильтров в блоке 128 фильтров может составлять по меньшей мере или максимум 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
[0030] Фильтр может представлять собой полосовой пропускающий фильтр и иметь длину волны пика пропускания в диапазоне от 400 нм до 800 нм. В некоторых вариантах осуществления длина волны пика пропускания может составлять или приблизительно составлять 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800 нм или представлять собой число или ряд чисел между любыми двумя из этих значений. В некоторых вариантах осуществления длина волны пика пропускания может составлять по меньшей мере или максимум 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790 или 800 нм. Ширина полосы пропускания фильтра может варьироваться, например, в диапазоне от 1 нм до 50 нм. В некоторых вариантах осуществления ширина полосы пропускания фильтра может составлять или приблизительно составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50 нм или представлять собой число или ряд чисел между любыми двумя из этих значений. В некоторых вариантах осуществления ширина полосы пропускания фильтра может составлять по меньшей мере или максимум 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40 или 50 нм.
Флуоресцентные метки
[0031] Флуоресцентные метки, используемые в системах и способах, раскрытых в данном документе, могут иметь разные длины волн пика поглощения, например, в диапазоне от 400 нм до 800 нм. В некоторых вариантах осуществления, длины волн пика поглощения флуоресцентных меток могут составлять или приблизительно составлять 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800 нм или представлять собой число или ряд чисел между любыми двумя из этих значений. В некоторых вариантах осуществления, длины волн пика поглощения флуоресцентных меток могут составлять по меньшей мере или максимум 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790 или 800 нм.
[0032] Флуоресцентные метки могут иметь разные длины волн пика излучения, например в диапазоне от 400 нм до 800 нм. В некоторых вариантах осуществления, длины волн пика излучения флуоресцентных меток могут составлять или приблизительно составлять 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800 нм или представлять собой число или ряд чисел между любыми двумя из этих значений. В некоторых вариантах осуществления, длины волн пика излучения флуоресцентных меток могут составлять по меньшей мере или максимум 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790 или 800 нм.
[0033] Флуоресцентные метки могут иметь разный стоксов сдвиг частоты, например в диапазоне от 10 нм до 200 нм. В некоторых вариантах осуществления стоксов сдвиг частоты может составлять или приблизительно составлять 10, 20, 30, 40, 50, 60,70,80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 нм или представлять собой число или ряд чисел между любыми двумя из этих значений. В некоторых вариантах осуществления стоксов сдвиг частоты может составлять по меньшей мере или максимум 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 нм.
[0034] Системы и способы, раскрытые в данном документе, могут использовать две флуоресцентных метки, например первую флуоресцентную метку и вторую флуоресцентную метки, которые могут иметь перекрывающиеся спектры излучения и могут характеризоваться взаимными помехами. В некоторых вариантах осуществления, длины волн пикового излучения двух указанных флуоресцентных меток могут варьироваться, например, в диапазоне от 10 нм до 200 нм. В некоторых вариантах осуществления, длины волны пикового излучения двух указанных флуоресцентных меток могут составлять или приблизительно составлять 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 нам или представлять собой число или ряд чисел между любыми двумя из этих значений. В некоторых вариантах осуществления, длины волн пикового излучения двух указанных флуоресцентных меток могут составлять по меньшей мере или максимум 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 нм. Детектор 126 с помощью одного из фильтров в блоке 128 фильтров способен обнаруживать флуоресцентные излучения первой флуоресцентной метки. Детектор 126 с помощью другого из фильтров в блоке 128 фильтров способен обнаруживать флуоресцентное излучение второй флуоресцентной метки.
[0035] В некоторых вариантах осуществления один из двух указанных флуоресцентных красителей может представлять собой краситель с нормальным стоксовым сдвигом частоты, а другой из флуоресцентных красителей может представлять собой краситель с большим стоксовым сдвигом частоты. Неограничивающие примеры красителей с нормальным стоксовым сдвигом частоты включают Alexa 488 или красители, являющиеся его аналогами (такие как 3,6-бис(этиламино)-2,7-диметил-[2-карбоксилато-5-(3-карбоксипропилокси)фенил]ксантилий бетаин (краситель 1-3), и 3,6-бис(этиламино)-2,7-диметил-[2-карбоксилато-4-(3-карбоксипропилокси)фенил]ксантилий бетаин (краситель 1-4) в патенте США №8,754,244). Краситель с нормальным стоксовым сдвигом частоты может возбуждаться с помощью лазерного или светодиодиночного источника света с длиной волны 488 нм, и он может иметь пик излучения при 520 нм. Краситель с большим стоксовым сдвигом частоты может представлять собой краситель NR520LS в патентной заявке РСТ № PCT/GB 2016/051474. Краситель с большим стоксовым сдвигом частоты может иметь пик излучения при 590 нм. В некоторых вариантах осуществления два указанных красителя могут представлять собой Су3 (с пиком излучения приблизительно при 575 нм) и обладающий свойством резонансного переноса энергии флуоресценции (FRET) парный краситель Су3-Су5 (с пиком излучения приблизительно при 670 нм).


Компьютерная система
[0036] Компьютерная система 106 системы 100 секвенирования с одиночным источником света и двумя оптическими каналами может быть выполнена с возможностью управления оптической системой 102 и флюидной системой 104, описанными выше. Хотя возможны многие конфигурации оптической системы 106, один вариант осуществления показан на ФИГ. 2. Как показано на ФИГ. 2, компьютерная система 106 может содержать процессор 202, который имеет электрическую связь с памятью 204, запоминающим устройством 206 и интерфейсом 208 связи.
[0037] Процессор 202 может быть выполнен с возможностью исполнения команд, которые инициируют подачу флюидной системой 104 реагентов в проточную ячейку 114 во время реакций секвенирования. Процессор 202 может исполнять команды, которые обеспечивают управление источником 120 света оптической системы 102 для генерирования света с заданной длиной волны. Процессор 202 может исполнять команды, которые обеспечивают управление детектором 126 оптической системы 102 и прием данных от детектора 126. Процессор 202 может исполнять команды для обработки данных, например флуоресцентных изображений, принимаемых от детектора 126, и для определения нуклеотидной последовательности полинуклеотидов на основе данных, принимаемых от детектора 126.
[0038] Память 204 может быть выполнена с возможностью хранения команд для конфигурирования процессора 202 с возможностью выполнения функций компьютерной системы 106 при включении питания системы 100 секвенирования с одиночным источником света и двумя оптическими каналами. При выключении питания системы 100 секвенирования с одиночным источником света и двумя оптическими каналами, запоминающее устройство 206 имеет возможность сохранения команд для конфигурирования процессора 202 с возможностью выполнения функций компьютерной системы 106. Интерфейс 208 связи может быть выполнен с возможностью содействия связи между компьютерной системой 106, оптической системой 102 и флюидной системой 104.
[0039] Компьютерная система 106 может содержать интерфейс 210 пользователя, выполненный с возможностью связи с дисплейным устройством (не показано) для отображения результатов секвенирования, полученных системой 100 секвенирования с одиночным источником света и двумя оптическими каналами. Интерфейс 210 пользователя может быть выполнен с возможностью приема входных данных от пользователей системы 100 секвенирования с одиночным источником света и двумя оптическими каналами. Интерфейс 212 оптической системы и интерфейс 214 флюидной системы в компьютерной системе 106 могут быть выполнены с возможностью управления оптической системой 102 и флюидной системой 104 посредством каналов 108А и 108В связи, показанных на ФИГ. 1. Например, интерфейс 212 оптической системы может осуществлять связь с компьютерным интерфейсом 110 оптической системы посредством канала 108А связи.
[0040] Компьютерная система 106 может содержать определитель 216 нуклеотидных оснований, выполненный с возможностью определения нуклеотидной последовательности полинуклеотидов с использованием данных, принимаемых от детектора 216. Определитель 216 нуклеотидных оснований может содержать одно или более из следующего: генератор 218 шаблона, регистратор 220 мест нахождения, измеритель 222 интенсивности, корректор 224 интенсивности, распознаватель 226 нуклеотидных оснований и определитель 228 показателей качества. Генератор 218 шаблона может быть выполнен с возможностью генерирования шаблона мест нахождения полинуклеотидных кластеров в проточной ячейке 114 с использованием флуоресцентных изображений, обнаруживаемых детектором 126. Регистратор 220 мест нахождения может быть выполнен с возможностью регистрации мест нахождения полинуклеотидных кластеров в проточной ячейке 114 на флуоресцентных изображениях, обнаруживаемых с помощью детектора 126, на основе шаблона мест нахождения, генерируемого генератором 218 шаблона. Измеритель 222 интенсивности может быть выполнен с возможностью измерения интенсивности флуоресцентных излучений на флуоресцентных изображениях и для генерирования измеренных значений интенсивности. Корректор 224 может быть выполнен с возможностью уменьшения или исключения взаимных помех между флуоресцентными метками, например, путем цветовой коррекции измеренных значений интенсивности для генерирования скорректированных значений интенсивности. В некоторых вариантах осуществления корректор 224 интенсивности может осуществлять фазовую коррекцию или предварительную фазовую коррекцию измеренных значений интенсивности. Распознаватель 226 нуклеотидных оснований может быть выполнен с возможностью определения оснований полинуклеотидов на основе скорректированных значений интенсивности. Основания полинуклеотидов, определенные с помощью распознавателя 228, могут быть ассоциированы с показателями качества, определяемыми с помощью определителя 228 показателей качества.
Секвенирование путем синтеза
[0041] На ФИГ. 3 показана блок-схема способа 300 секвенирования путем синтеза с использованием системы 100 секвенирования. После начала выполнения способа на этапе 305, размещают проточную ячейку 114, содержащую разрозненные полинуклеотидные фрагменты (например, разрозненные одно- или двухцепочечные полинуклеотидные фрагменты), на этапе 310. Разрозненные полинуклеотидные фрагменты могут быть получены из образца дезоксирибонуклеиновой кислоты (ДНК). Указанный образец ДНК может быть взят из разных источников, например, представлять собой биологический образец, клеточный образец, образец окружающей среды или любую их комбинацию. Образец ДНК может содержать одно или более из биологических жидкостей, тканей и клеток, взятых у пациента. Например, образец ДНК может быть взят из или содержать кровь, мочу, спинномозговую жидкость, плевральную жидкость, околоплодную жидкость, сперму, слюну, костный мозг, биопсийный образец или любую их комбинацию.
[0042] Образец ДНК может содержать ДНК из интересующих клеток. Интересующие клетки могут быть различными, и в некоторых вариантах осуществления они могут демонстрировать злокачественный фенотип. В некоторых вариантах осуществления интересующие клетки могут включать опухолевые клетки, клетки костного мозга, раковые клетки, стволовые клетки, эндотелиальные клетки, клетки, инфицированные вирусом, патогенные клетки, клетки паразитических организмов или любые их комбинации.
[0043] Длина разрозненных полинуклеотидных фрагментов может находиться в диапазоне от 200 оснований до 1000 оснований. После того, как проточная ячейка 114, содержащая разрозненные полинуклеотидные фрагменты, размещена на этапе 310, переходят к этапу 320 способа 300, на котором осуществляют мостиковую амплификацию полинуклеотидных фрагментов до кластеров полинуклеотидных фрагментов, присоединенных к внутренней поверхности одного или более каналов проточной ячейки, например проточной ячейки 114. Внутренняя поверхность указанных одного или более каналов проточной ячейки может содержать праймеры двух типов, например праймер (Р1) первого типа и праймер (Р2) второго типа, и фрагменты ДНК могут быть амплифицированы хорошо известными способами.
[0044] После создания кластеров внутри проточной ячейки 114, возможен переход способа 300 к началу процесса секвенирования путем синтеза. Процесс секвенирования путем синтеза может включать определение нуклеотидной последовательности кластеров одноцепочечных полинуклеотидных фрагментов. Для определения последовательности кластеров одноцепочечных полинуклеотидных фрагментов с последовательностью 5'-P1-F-A2R-3', праймеры с последовательностью A2F, которые являются комплементарными к последовательности A2R, могут увеличиваться или удлиняться на этапе 325 аналогами нуклеотидов с нулем, одной или тремя метками под действием ДНК-полимеразы с образованием растущих праймеров-полинуклеотидов.
[0045] Во время каждого цикла секвенирования аналоги нуклеотидов четырех типов могут добавляться и встраиваться в растущие праймеры-полинуклеотиды. Указанные аналоги нуклеотидов четырех типов могут иметь разные модификации. Например, нуклеотид первого типа может представлять собой аналог дезоксигуанозинтрифосфата (дГТФ), не конъюгированный с какой-либо флуоресцентной меткой. Нуклеотид второго типа может представлять собой аналог дезокситимидинтрифосфата (дТТФ), конъюгированный с флуоресцентной меткой первого типа посредством линкера. Нуклеотид третьего типа может представлять собой аналог дезоксицитидинтрифосфата (дЦТФ), конъюгированный с флуоресцентной меткой второго типа посредством линкера. Нуклеотид четвертого типа может представлять собой аналог дезоксиаденозинтрифосфата (дАТФ), конъюгированный с обеими из флуоресцентной метки первого типа и флуоресцентной метки второго типа посредством одного или более линкеров. Линкеры могут включать одну или более расщепляемых групп. Перед следующим циклом секвенирования флуоресцентные метки могут быть удалены из аналогов нуклеотидов. Например, линкер, присоединяющий флуоресцентную метку к аналогу нуклеотида, может содержать азидную и/или алкоксильную группу, например, у одного и того же атома углерода, что обеспечивает возможность расщепления линкера после каждого цикла встраивания посредством фосфинового реагента, в результате чего флуоресцентная метка отделяется и не участвует в следующих циклах секвенирования.
[0046] Трифосфаты-нуклеотиды могут быть обратимым образом заблокированы в положении 3', за счет чего секвенирование становится управляемым, и не более чем один аналог нуклеотида может быть добавлен к каждому удлиняющемуся праймеру-полинуклеотиду в каждом цикле. Например, положение 3' рибозы аналоге нуклеотида может включать как алкоксильные, так и азидные группы, которые могут быть удалены путем отщепления под действием фосфинового реагента, в результате чего образуется нуклеотид, который может быть удлинен далее. После встраивания аналогов нуклеотидов флюидная система 104 может осуществлять промывку указанных одного или более каналов проточной ячейки 114 с целью удаления всех невстроенных аналогов нуклеотидов и ферментов. Перед следующим циклом секвенирования обратимые 3'-блоки могут быть удалены, и таким образом будет обеспечена возможность добавления нового аналога нуклеотида к каждому удлиняющемуся праймеру-полинуклеотиду.
[0047] На этапе 330 одиночный источник света, такой как лазерный 120 или светодиодный источник, может возбуждать флуоресценцию двух флуоресцентных меток с заданной длиной волны. В некоторых вариантах осуществления один лазерный или светодиодный источник может быть нерегулируемым. На этапе 335 возможно обнаружение сигналов от флуоресцентных меток. Обнаружение флуоресцентных меток может включать обнаружение флуоресцентных излучений с первой длиной волны и со второй длиной волны на двух флуоресцентных изображениях посредством, например, детектора 126 с использованием двух фильтров. Флуоресцентные излучения первой флуоресцентной метки могут иметь первую или приблизительно первую длину волны, а флуоресцентные излучения второй флуоресцентной метки могут иметь вторую или приблизительно вторую длину волны. Флуоресцентные изображения могут быть сохранены для дальнейшей автономной обработки. В некоторых вариантах осуществления флуоресцентные изображения могут быть обработаны для определения последовательности растущих праймеров-полинуклеотидов в каждом кластере в реальном времени.
[0048] На этапе 340 принятия решения может быть определено, должно ли быть обнаружено больше нуклеотидов, на основе, например, качества сигнала или после достижения заданного количества оснований. Если должно быть обнаружено больше нуклеотидов, то возможно осуществление определения нуклеотидов в следующем цикле секвенирования, начиная вновь с этапа 325, с применением аналогов нуклеотидов с нулем, одной или двумя метками, добавляемых для удлинения праймеров-полинуклеотидов. Перед следующим циклом секвенирования флуоресцентные метки могут быть удалены из встроенных аналогов нуклеотидов, и могут быть также удалены обратимые 3'-блоки, так что будет обеспечена возможность добавления нового аналога нуклеотида к каждому удлиняющемуся праймеру-полинуклеотиду.
[0049] При автономной обработке флуоресцентных изображений, если на этапе 340 принятия решения определено, что не должно осуществляться обнаружение дополнительных нуклеотидов, флуоресцентные изображения, содержащие обнаруживаемые флуоресцентные сигналы, могут быть обработаны на этапе 345, и могут быть определены встроенные нуклеотидные основания. Для каждого определенного нуклеотидного основания может быть определен показатель качества на этапе 350. После обработки всех флуоресцентных изображений способ 300 может быть завершен на этапе 355.
Распознавание нуклеотидных оснований
[0050] Распознавание нуклеотидных оснований описано в патенте США №8,965,076, содержание которого полностью включено в настоящую заявку. Если говорить коротко, то термин «распознавание нуклеотидных оснований» может относиться к процессу, в котором нуклеотидные основания, встроенные в кластеры секвенируемых растущих праймеров-полинуклеотидов, секвенируют как гуанин (Г), тимин (Т), цитозин (Ц) или аденин (А). На ФИГ. 4 показана блок-схема примера способа 400 осуществления распознавания нуклеотидных оснований с помощью системы 100 секвенирования. Обработка обнаруживаемых сигналов на этапе 345, показанном на ФИГ. 3, может включать осуществление распознавания нуклеотидных оснований согласно способу 400. После начала способа на этапе 405 возможно генерирование света заданной длины волны с помощью источника света и освещением им аналогов нуклеотидов на этапе 410. Например, компьютерная система 106, посредством ее интерфейса 212 оптической системы и канала 108А связи, способна инициировать генерирование света заданной длины волны источником 120 света.
[0051] Свет, генерируемый источником света, может освещать аналоги нуклеотидов, встроенные в растущие праймеры-полинуклеотиды, присоединенные к внутренней поверхности одного или более каналов проточной ячейки, например проточной ячейки 114. Праймеры-полинуклеотиды могут включать кластеры одноцепочечных полинуклеотидных фраментов, гибридизующихся с праймерами секвенирования. Каждый из аналогов нуклеотидов может содержать ноль, одну или две флуоресцентные метки. Две флуоресцентных метки могут представлять собой первую флуоресцентную метку и вторую флуоресцентную метку. Флуоресцентные метки, после их возбуждения светом, генерируемых с помощью источника света, способны эмитировать флуоресцентные излучения. Например, первая флуоресцентная метка может эмитировать флуоресцентные излучения с первой длиной волны, которые могут быть обнаружены, например, на первом флуоресцентном изображении. Вторая флуоресцентная метка может эмитировать флуоресцентные излучения со второй длиной волны, которые могут быть обнаружены, например, на втором флуоресцентном изображении.
[0052] Аналоги нуклеотидов могут включать нуклеотид первого типа, нуклеотид второго типа, нуклеотид третьего типа и нуклеотид четвертого типа. Нуклеотид первого типа, например аналог дезоксигуанозинтрифосфата (дГТФ), не конъюгирован ни с первой флуоресцентной меткой, ни со второй флуоресцентной меткой. Нуклеотид второго типа, например аналог дезокситимидинтрифосфата (дТТФ), может быть конъюгирован с флуоресцентной меткой первого типа, но не с флуоресцентной меткой второго типа. Нуклеотид третьего типа, например аналог дезоксицитидинтрифосфата (дЦТФ), может быть конъюгирован с флуоресцентной меткой второго типа, но не с флуоресцентной меткой первого типа. Нуклеотид четвертого типа, например аналог дезоксиаденозинтрифосфата (дАТФ), может быть конъюгирован с обеими из флуоресцентных меток первого типа и второго типа.
[0053] На этапе 415 флуоресцентные излучения аналогов нуклеотидов с первой длиной волны и со второй длиной волны могут быть обнаружены с помощью по меньшей мере одного детектора. Например, детектор 126 может обнаруживать два флуоресцентных изображения: первое флуоресцентное изображение с первой длиной волны и второе флуоресцентное изображение со второй длиной волны. После приема указанных двух флуоресцентных изображений от оптической системы 102, определитель 216 нуклеотидных оснований может определять наличие или отсутствие флуоресцентных излучений на двух указанных флуоресцентных изображениях.
[0054] Поскольку нуклеотид первого типа не конъюгирован ни с первой флуоресцентной меткой, ни со второй флуоресцентной меткой, этот нуклеотид первого типа не способен или способен лишь в минимальной степени эмитировать флуоресцентное излучение как с первой длиной волны, так и со второй длиной волны. Если на этапе 420 принятия решения флуоресцентное излучение не обнаружено, возможно определение нуклеотида как нуклеотида первого типа, например, дГТФ. При наличии или превышении минимального уровня флуоресцентного излучения, возможен переход способа 400 к этапу 425 принятия решения.
[0055] Поскольку нуклеотид второго типа конъюгирован с флуоресцентной меткой первого типа, а не с флуоресцентной меткой второго типа, этот нуклеотид второго типа способен эмитировать флуоресцентное излучение с первой длиной волны, но не способен или способен лишь в минимальной степени эмитировать флуоресцентное излучение со второй длиной волны. Если на этапе 425 принятия решения не обнаружено флуоресцентное излучение со второй длиной волны на втором флуоресцентном изображении и при этом на этапе 420 принятия решения обнаружены флуоресцентные излучения с первой длиной волны, то нуклеотид может быть определен как нуклеотид второго типа, например дТТФ. Если обнаружены флуоресцентные излучения со второй длиной волны, то возможен переход способа 400 к этапу 430 принятия решения.
[0056] Поскольку нуклеотид третьего типа конъюгирован с флуоресцентной меткой второго типа, но не с флуоресцентной меткой первого типа, этот нуклеотид третьего типа способен эмитировать флуоресцентные излучения с второй длиной волны и не способен или способен лишь в минимальной степени эмитировать флуоресцентное излучение с первой длиной волны. Если на этапе 430 принятия решения не обнаружено флуоресцентное излучение с первой длиной волны на первом флуоресцентном изображении и при этом на этапе 425 принятия решения обнаружено флуоресцентною излучение со второй длиной волны на втором флуоресцентном изображении, то нуклеотид может быть определен как нуклеотид третьего типа, например дЦТФ.
[0057] Поскольку нуклеотид четвертого типа конъюгирован с обеими из флуоресцентной метки первого типа и флуоресцентной метки второго типа, этот нуклеотид четвертого типа может эмитировать флуоресцентные излучения как с первой длиной волны, так и со второй длиной волны. Если на этапе 430 принятия решения обнаружены флуоресцентные излучения с первой длиной волны на первом флуоресцентном изображении при этом на этапе 425 принятия решения обнаружены флуоресцентные излучения со второй длиной волны на втором флуоресцентном изображении, то нуклеотид может быть определен как нуклеотид четвертого типа, например дАТФ.
[0058] Проточная ячейка может содержать кластеры растущих секвенируемых праймеров-полинуклеотидов. Если на этапе 435 принятия решения определено, что по меньшей мере еще один кластер с флуоресцентными излучениями должен быть обработан в данном цикле секвенирования, то возможно продолжение способа 400 на этапе 415. Если же обработка еще одного кластера одноцепочечных полинуклеотидов не требуется, то возможно завершение способа 400 на этапе 440.
Последовательность операций при секвенировании с одиночным источником света и двумя оптическими каналами
Цикл 1: Генерирование шаблона, регистрация мест нахождения и измерение интенсивности
[0059] На ФИГ. 5 показана блок-схема примера способа 500 осуществления секвенирования с одиночным источником света и двумя оптическими каналами. Способ 500 может быть осуществлен с помощью системы 100 секвенирования с одиночным источником света и двумя оптическими каналами. После начала на этапе 505, источник света может генерировать свет с заданной длиной волны, направляемый на нуклеотиды, на этапе 510. На этапе 515 возможно обнаружение флуоресцентных излучений от первой флуоресцентной метки с первой длиной волны и от второй флуоресцентной метки со второй длиной волны с использованием, например, по меньшей мере одного детектора для генерирования первого флуоресцентного изображения и второго флуоресцентного изображения. Обнаружение флуоресцентных излучений может включать определение значений интенсивности флуоресцентных излучений. После приема двух указанных флуоресцентных изображений возможно генерирование шаблона мест нахождения на этапе 520 с помощью, например, генератора 218 шаблона.
[0060] Генерирование шаблона мест нахождения может быть необходимо во время первого цикла секвенирования для определения мест нахождения кластеров одноцепочечных полинуклеотидов. На ФИГ. 6 схематично показаны кластеры и их секвенирование методом секвенирования с одиночным источником света и двумя оптическими каналами. Во время первого цикла секвенирования места нахождения кластеров неизвестны. Проточная ячейка может содержать четыре кластера 1-4. Во время первого цикла секвенирования генератор 218 шаблона может определять наличие кластеров 1, 2 и 4 в проточной ячейке.
[0061] Во время первого цикла секвенирования могут генерироваться первое флуоресцентное изображение 602 и второе флуоресцентное изображение 604 проточной ячейки в первом состоянии 606, соответствующем первому циклу секвенирования. Аналоги нуклеотидов, встраиваемые в кластеры растущих праймеров-полинуклеотидов, могут варьировать. Например, нуклеотид, встроенный в кластер 1, может представлять собой аналог дезоксиаденозинтрифосфата (дАТФ), конъюгированный с обеими из флуоресцентной метки первого типа и флуоресцентной метки второго типа. Первое флуоресцентное изображение 602 может содержать флуоресцентные излучения флуоресцентной метки первого типа на аналоге дАТФ. Второе флуоресцентное изображение 604 может содержать флуоресцентные излучения флуоресцентной метки второго типа на аналоге дАТФ. Генератор 218 шаблона может определять на первом флуоресцентном изображении 602 или на втором флуоресцентном изображении 604 наличие кластера 1 в конкретном месте нахождения кластера 1.
[0062] Нуклеотид, встроенный в кластер 2, может представлять собой аналог дезоксицитидинтрифосфата (дЦТФ), конъюгированный с флуоресцентной меткой второго типа, но не с флуоресцентной меткой первого типа. Второе флуоресцентное изображение может содержать флуоресцентные излучения флуоресцентной метки второго типа на аналоге дЦТФ. Если первая флуоресцентная метка и вторая флуоресцентная метка характеризуются взаимными помехами, то некоторая часть флуоресцентных излучений кластера 2 может присутствовать на первом флуоресцентном изображении. Генератор 218 шаблона может определять на втором флуоресцентном изображении 504 наличие кластера 2 в конкретном месте нахождения кластера 2.
[0063] Нуклеотид, встроенный в кластер 3, может представлять собой аналог дезоксигуанозинтрифосфата (дГТФ), не конъюгированный ни с одной из первой флуоресцентной метки и второй флуоресцентной метки. Таким образом, первое флуоресцентное изображение 602 и второе флуоресцентное изображение 604 не содержат или содержат лишь в минимальной степени флуоресцентное излучение из кластера 3. Генератор 218 шаблона может быть неспособен определить на первом флуоресцентном изображении 602 и втором флуоресцентном изображении 603 наличие кластера 3 в конкретном месте нахождения кластера 3.
[0064] Нуклеотид, встроенный в кластер 4, может представлять собой аналог дезокситимидинтрифосфата (дТТФ), конъюгированный с флуоресцентной меткой первого типа, но не с флуоресцентной меткой второго типа. Первое флуоресцентное изображение 602 может содержать флуоресцентные излучения флуоресцентной метки первого типа на аналоге дТТФ. Если первая флуоресцентная метка и вторая флуоресцентная метка характеризуются взаимными помехами, то некоторая часть флуоресцентных излучений кластера 4 может присутствовать на втором флуоресцентном изображении 604. Генератор 218 шаблона способен определить на первом флуоресцентном изображении наличие кластера 4 в конкретном месте нахождения кластера 4.
[0065] Генератор 218 может генерировать шаблон мест нахождения кластеров 1, 2 и 4 на основе первого флуоресцентного изображения 602 и второго флуоресцентного изображения 604 в первом цикле секвенирования. В некоторых вариантах осуществления генерирование шаблона мест нахождения может включать обнаружение взаимных помех между первой флуоресцентной меткой и второй флуоресцентной меткой. Указанные взаимные помехи обеспечивают преимущество, состоящее в возможности обеспечения более надежной регистрации изображений, особенно при низком уровне разнообразия, поскольку обеспечивается возможность обнаружения излучений флуоресцентных меток на обеих из первого флуоресцентного изображения 602 и второго флуоресцентного изображения 604.
Цикл 2: Генерирование шаблона и регистрация мест нахождения
[0066] Генерирование шаблона мест нахождения может быть необходимо во время второго цикла секвенирования, когда используются произвольные проточные ячейки, для определения мест нахождения кластеров одноцепочечных полинуклеотидов. После первого цикла секвенирования место нахождения кластера 3 может быть неизвестно. Нуклеотид, встроенный в кластер 3 во время второго цикла секвенирования, может представлять собой аналог дезоксицитидинтрифосфата (дЦТФ), конъюгированный с флуоресцентной меткой первого типа, но не с флуоресцентной меткой второго типа. Первое флуоресцентное изображение 612 может содержать флуоресцентные излучения флуоресцентной метки первого типа на аналоге дТТФ. Во время второго цикла секвенирования генератор 218 шаблона способен определить на первом флуоресцентном изображении 612 наличие кластера 3 в конкретном месте нахождения кластера 3. Генерирование шаблона при использовании упорядоченно расположенных проточных ячеек описано в патентной заявке США №14/530,299, содержание которой полностью включено в настоящую заявку.
Регистрация мест нахождения и измерение интенсивности
[0067] Как показано на ФИГ. 5, на этапе 525 места нахождения кластеров на шаблоне могут быть зарегистрированы на обнаруженных флуоресцентных изображениях в первом цикле секвенирования и последующих циклах секвенирования. Интенсивность флуоресцентных излучений кластеров растущих праймеров-полинуклеотидов в зарегистрированных местах нахождения, например в местах 1, 2 и 4, может быть измерена на этапе 530. Измеренные значения интенсивности могут быть скорректированы на этапе 535 для генерирования скорректированных значений интенсивности. Коррекция измеренных значений интенсивности с помощью, например, корректора 224 значений интенсивности может включать одно или более из следующего: пространственное нормирование на этапе 540, цветовую коррекцию на этапе 545 и фазовую коррекцию на этапе 550.
Пространственное нормирование, цветовая коррекция и фазовая коррекция
[0068] Пространственное нормирование может включать нормирование значений интенсивности флуоресцентных излучений на разных флуоресцентных изображениях цикла секвенирования для генерирования пространственно нормированных значений интенсивности. Например, в каждом цикле секвенирования 5% и 95% значений интенсивности на первом флуоресцентном изображении и на втором флуоресцентном изображении могут быть нормированы до нуля и единицы. Если следующий цикл секвенирования находится в пределах индексированного считанного фрагмента, то 95-й перцентиль от последнего цикла неиндексированного считанного фрагмента может использоваться для нормирования. Пространственное нормирование обеспечивает возможность уменьшения изменений интенсивности в зависимости от цикла.
[0069] На ФИГ. 7A-7D представлены схематичные графики, показывающие цветовую коррекцию и фазовую коррекцию для секвенирования с одиночным источником света и двумя оптическими каналами. На ФИГ. 7А показана диаграмма рассеяния измеренных значений интенсивности или пространственно нормированных значений интенсивности, полученных на основе первого флуоресцентного изображения, в зависимости от измеренных значений интенсивности в соответствующих точках на втором флуоресцентном изображении, в точках (xi, yi) при отсутствии взаимных помех между первой флуоресцентной меткой и второй флуоресцентной меткой. Здесь xi обозначает пространственно нормированную интенсивность кластера i растущих праймеров-полинуклеотидов на втором флуоресцентном изображении, а yi обозначает пространственно нормированную интенсивность кластера i растущих праймеров-полинуклеотидов на первом флуоресцентном изображении. Поскольку аналог дГТФ не содержит ни первой флуоресцентной метки, ни второй флуоресцентной метки, его флуоресцентное излучение не присутствует ни на первом флуоресцентном изображении, ни на втором флуоресцентном изображении. Таким образом, совокупность аналогов дГТФ находится в точке (0, 0) диаграммы рассеяния. Поскольку аналог дТТФ содержит первую флуоресцентную метку, его излучения присутствует на первом флуоресцентном изображении, но не на втором флуоресцентном изображении. Таким образом, совокупность аналогов дТТФ находится в точке (0, 1) диаграммы рассеяния. Поскольку аналог дЦТФ содержит вторую флуоресцентную метку, его флуоресцентные излучения присутствуют на втором флуоресцентном изображении, но не на первом флуоресцентном изображении. Таким образом, совокупность аналогов дЦТФ находится в точке (1, 0) диаграммы рассеяния. Поскольку аналог дАТФ содержит первую флуоресцентную метку и вторую флуоресцентную метку, его флуоресцентные излучения присутствуют на первом флуоресцентном изображении и на втором флуоресцентном изображении. Совокупность аналогов дАТФ находится в точке (1,1) диаграммы рассеяния, поскольку отсутствуют взаимные помехи между первой флуоресцентной меткой и второй флуоресцентной меткой.
[0070] На ФИГ. 7В показан схематичный пример диаграммы рассеяния в случае, когда две флуоресцентных метки имеют перекрывающиеся спектры излучения и характеризуются взаимными помехами. Поскольку первая флуоресцентная метка и вторая флуоресцентная метка характеризуются взаимными помехами, аналог дТТФи показывают более сильные излучения на первом флуоресцентном изображении и более слабые излучения на втором флуоресцентном изображении. Таким образом, пятно, которое соответствует флуоресцентным излучениям из совокупности аналогов дТТФ, находится в окрестности точки (0, 1), например в точке (0,2, 0,8). Аналоги дЦТФ имеют более сильные излучения на втором флуоресцентном изображении и более слабые излучения на первом флуоресцентном изображении. Таким образом, пятно, которое соответствует флуоресцентным излучениям из совокупности аналогов дЦТФ, находится в окрестности точки (1, 0), например в точке (0,8, 0,2). Пятно, которое соответствует флуоресцентным излучениям из совокупности аналогов дАТФ, находится в окрестности точки (1, 1), например в точке (0,9, 0,9).
[0071] Для уменьшения или исключения взаимных помех между первой флуоресцентной меткой и второй флуоресцентной меткой, измеренные значения интенсивности или пространственно нормированные значения интенсивности могут быть подвергнуты цветовой коррекции на этапе 545. При цветовой коррекции может использоваться цветовая матрица для приведения к нужному виду измеренных значений интенсивности с помощью свойств исходного распределения или значений интенсивности в пределах каждого флуоресцентного изображения.
[0072] Двуканальная цветовая матрица может представлять собой матрицу 2x2, которая используется для коррекции взаимных помех между двумя каналами, например первым каналом и вторым каналом. Первый канал способен обнаруживать первые флуоресцентные изображения и вторые флуоресцентные изображения в циклах секвенирования. Например, если кластер светится в первом канале, соответствующем первому флуоресцентному изображению, то некоторая часть излучений сосредотачивается также во втором канале, соответствующем второму флуоресцентному изображению. Цветовая коррекция может включать использование двухканальной цветовой матрицы для генерирования матрично скорректированных значений интенсивности, что обеспечивает возможность уменьшения или исключения взаимных помех. Цветовая матрица также способна компенсировать любые различия в общей интенсивности между цветовыми каналами. Цветовая матрица М

имеет коэффициенты Mj,k взаимных помех, показывающие величину наблюдаемой интенсивности в канале у, улавливающем флуоресцентные излучения от флуоресцентной метки k. Например, M1,1 показывает величину наблюдаемой интенсивности на первом флуоресцентном изображении (т.е. в канале один), воспринимающем флуоресцентные излучения от первой флуоресцентной метки (т.е. флуоресцентной метки один). Например, М1,2 показывает величину наблюдаемой интенсивности на первом флуоресцентном изображении (т.е. канале один), воспринимающем флуоресцентные излучения от второй флуоресцентной метки (т.е. флуоресцентной метки два) вследствие перекрытия спектров излучения между первой флуоресцентной меткой и второй флуоресцентной меткой.
[0073] Цветовая матрица может быть оценена на основе значений кластерной интенсивности, собранных в ходе конфигурируемого множества предыдущих циклов секвенирования, например, циклов 1-10 секвенирования. Указанная цветовая матрица может использоваться для остальных циклов секвенирования с нормированием для относительной интенсивности, которая зависит от циклов.
[0074] Цветовая матрица может использоваться для оценки взаимных помех между парой каналов, поскольку они имеют перекрывающиеся спектры излучения. В некоторых вариантах осуществления оценка цветовой матрицы может включать преобразование нанесенных на диаграмму значений интенсивности в точках (ai, channel 2, ai, channel 1) к полярным координатам, где i обозначает номер кластера, ai, channel 1 обозначает интенсивность i-го кластера в первом канале, и ai, channel 2 обозначает интенсивность i-го кластера во втором канале. Оценка цветовой матрицы может включать вычисление взвешенной по радиусу гистограммы углов θi в диапазоне [0, 90] на основе нанесенных на диаграмму значений интенсивности в точках (ai, channel 2, ai, channel 1). Для кластера i с интенсивностью ai, channel 2 на первом флуоресцентном изображении абсолютная величина ri может быть определена на основе значений интенсивности ai, channel и ai, channel 2, например (ai, channel 12 + ai, channel 22)1/2. Угол θi может быть равен tan-1(ai, channel 1 / ai, channel 2). На ФИГ. 7C показан схематичный пример взвешенной по радиусу гистограммы в случае, когда две флуоресцентных метки имеют перекрывающиеся спектры излучения и характеризуются взаимными помехами. Значения интенсивности в точках (ai, channel 1, ai, channel 2) по ФИГ. 7В могут быть преобразованы во взвешенную по радиусу угловую гистограмму по фиг. 1С. Центральный пик соответствует пятнам аналогов дАТФ, которые находятся по углом приблизительно 45°. Для секвенирования с одиночным источником света и двумя оптическими каналами взвешенная по радиусу угловая гистограмма содержит три пика, соответствующих пятнам аналогов дТТФ, аналогов дАТФ и аналогов дЦТФ соответственно по ФИГ. 7В. Центральный пик соответствует пятнам аналогов дАТФ с углом приблизительно 45°.
[0075] Оценка цветовой матрицы может включать идентификацию двух внешних локальных максимумов θ1 и θ2 на взвешенной по радиусу гистограмме. Для каналов, которые не имеют взаимных помех, θ1 равен 0° и θ2 равен 90°. Коэффициент M1,2 взаимных помех в матрице может быть равен, например, tan(θ1). Коэффициент М2,1 взаимных помех в матрице может быть равен, например, tan(90-θ2). В некоторых вариантах осуществления, если недостаточное количество кластеров может быть распознано с помощью одного из четырех нуклеотидов, то оценка цветовой матрицы может быть неидеальной, и вместо нее может использоваться матрица тождественности. Диагональные элементы этой матрицы могут быть равны 1, и матрица может иметь вид

[0076] Цветовая матрица может быть нормирована таким образом, чтобы она имела детерминант 1. В некоторых вариантах осуществления цветовая матрица более раннего цикла секвенирования может использоваться для последующих циклов секвенирования. Правильные значения интенсивности могут быть вычислены путем умножения нанесенных на диаграмму значений интенсивности по ФИГ. 7В на матрицу, обратную указанной цветовой матрице, для генерирования значений интенсивности, скорректированных по цвету. На ФИГ. 7D показан схематичный пример диаграммы рассеяния значений интенсивности по ФИГ. 7В после цветовой коррекции. С помощью скорректированных значений интенсивности обеспечивается возможность улучшенного разделения отдельных кластеров, соответствующих дГТФ, дТТФ, дЦТФ и дАТФ. В некоторых вариантах осуществления флуоресцентное изображение может быть разделено на клетки, и цветовая матрица может быть оценена для каждой клетки. В некоторых вариантах осуществления цветовая матрица может быть оценена с использованием значений интенсивности из нескольких циклов секвенирования. Размер и форма пятен флуоресцентных излучений по ФИГ. 7В и 7D приведены лишь в качестве иллюстрации. Например, пятно, которое соответствует совокупности аналогов дАТФ после цветовой коррекции по ФИГ. 7D, может быть больше, чем пятно, которое соответствует совокупности аналогов дАТФ до цветовой коррекции по ФИГ. 7В.
[0077] Как показано на ФИГ. 5, скорректированные по цвету значения интенсивности могут быть скорректированы по фазе на этапе 550. Во время процесса секвенирования путем синтеза, каждый праймер или удлиненный праймер в кластере праймеров-полинуклеотидов может удлиняться на одно нуклеотидное основание за один цикл. Небольшая часть цепей может стать несинфазной с текущим циклом секвенирования, либо отставая на одно нуклеотидное основание (фазирование), либо опережая на одно нуклеотидное основание (пре-фазирование). Для каждого цикла секвенирования может быть произведен расчет фазовой коррекции для максимизации качества данных, например, путем определения фазирующей матрицы и применения этой фазирующей матрицы к измеренным значениям интенсивности.
Распознавание нуклеотидных оснований
[0078] На этапе 555 возможно определение оснований нуклеотидов, встроенных в кластеры растущих праймеров-нуклеотидов, с помощью, например, распознавателя 226 оснований. Возможно определение показателя качества для каждого распознаваемого нуклеотидного основания. Как показано на ФИГ. 6, в первом цикле секвенирования, поскольку флуоресцентные излучения кластера 1 присутствуют на обеих из первого флуоресцентного изображения и второго флуоресцентного изображения, встроенный нуклеотид представляет собой аналог дАТФ. Поскольку флуоресцентные излучения кластера 2 присутствуют лишь на втором флуоресцентном изображении, встроенный нуклеотид представляет собой аналог дЦТФ. Поскольку флуоресцентные излучения кластера 4 присутствуют лишь на первом флуоресцентном изображении, встроенный нуклеотид представляет собой аналог дТТФ.
[0079] Во втором цикле секвенирования нуклеотиды, встроенные в кластеры 1-4, могут представлять собой дГТФ, дЦТФ, дТТФ и дАТФ соответственно. После определения наличия кластера 3, нуклеотид, встроенный в кластер во время первого цикла секвенирования может представлять собой дГТФ, флуоресцентное излучение которого не присутствует ни на первом флуоресцентном изображении, ни на втором флуоресцентном изображении. После третьего цикла секвенирования кластеры 1-4 могут быть определены как имеющие нуклеотидную последовательность AGT, ССА, GTA и TAG соответственно.
[0080] В некоторых вариантах осуществления распознавание нуклеотидных оснований на этапе 555 может быть основано на скорректированных значениях интенсивности, полученных на этапе 535. Соответствие между нуклеотидами и совокупностями на диаграмме рассеяния по ФИГ. 7D может быть определено следующим образом: если совокупность отсутствует в первом канале и во втором канале, то встроенный нуклеотид представляет собой дГТФ; если совокупность отсутствует во втором канале и присутствует в первом канале, то встроенный нуклеотид представляет собой аналог дТТФ; если совокупность присутствует во втором канале и отсутствует в первом канале, то встроенный нуклеотид представляет собой аналог дЦТФ; и если совокупность присутствует как в первом канале, так и во втором канале, то встроенный нуклеотид представляет собой аналог дАТФ.
[0081] Распознавание нуклеотидных оснований может включать нормирование скорректированных значений интенсивности до (0, 1) с помощью 5-го и 95-го перцентилей. Для гауссовых распределений одно из дГТФ, дТТФ, дЦТФ и дАТФ может быть согласовано с данными по скорректированным и нормированным значениям интенсивности посредством ЕМ-алгоритма. ЕМ-алгоритм обеспечивает возможность определения того, какие средние значения и распределения лучше всего согласуются с указанными данными. После вычисления гауссовых распределений, для каждой совокупности может быть вычислена вероятность принаджлежности данной совокупности к каждому гауссову распределению. Распознавание нуклеотидных оснований может быть основано на наибольшей вероятности принадлежности данной совокупности к конкретному гауссову распределению. В случае образцов с низким уровнем разнообразия ЕМ-алгоритм может использоваться для идентификации ковариационных матриц, чтобы избежать чрезмерного согласования данных. Количество мишеней подвыборки может быть увеличено, чтобы осуществить выборку большего количества данных для точности
[0082] В некоторых вариантах осуществления возможна фильтрация совокупностей посредством «чистой» метрики. «Чистая» метрика может представлять собой, например, D1/(D1÷D2). Здесь D1 может представлять собой расстояние до ближайшего среднего нормально распределенной совокупности и D2 может представлять собой расстояние до следующего ближайшего среднего. Указанное расстояние может быть измерено с использованием, например, метода Махаланобиса, который позволяет учитывать ширину распределения вдоль линии, определяемой барицентром нормального распределения и рассматриваемой точкой.
[0083] На этапе 560 возможно определение одной или более метрик качества перед завершением способа на этапе 565. Метрики качества секвенирования могут обеспечивать важную информацию о точности каждого этапа в данном процессе, включая подготовку библиотеки, распознавание нуклеотидных оснований, выравнивание фрагментов и распознавание вариантов. Точность распознавания нуклеотидных оснований, измеренная с помощью показателя качества по Фреду (Q-показателя), может использоваться для определения точности платформы секвенирования. Она может показывать вероятность того, что данное нуклеотидное основание неправильно распознано секвенатором. Q-показатель может представлять собой - 10 log10 Р, где Р - вероятность ошибки распознавания нуклеотидного основания.
Масштабирование кластеров
[0084] В некоторых вариантах осуществления коррекция значений интенсивности может включать масштабирование кластеров. Кластеры могут иметь варьируемую яркость. Например, некоторые кластеры могут быть яркими, а некоторые - темными. Яркость кластера может быть обусловлена распределением фрагментов образца по длине. Варьирование яркости совокупности кластеров может создавать эффект удлинения «включенных» совокупностей на диаграмме рассеяния при распознавании нуклеотидных оснований. Это может быть полезно для нормирования интенсивности каждого кластера его средней интенсивностью в первых 10 циклах для уменьшения колебаний интенсивности совокупности. Например, в первых 10 циклах для каждого распознавания нуклеотидного основания, не являющегося гуанином (G), могут быть вычислены два радиуса: расстояние от интенсивности совокупности до начала координат и расстояние от соответствующего среднего нормально распределенной совокупности до начала координат. Масштабирование кластера может включать нормирование соотношения указанных двух радиусов, усредненного, например, по первым 10 циклам, до среднего. Все значения интенсивности могут быть нормированы посредством этого масштабного коэффициента перед осуществлением фазовой коррекции и распознавания нуклеотидных оснований. Масштабирование кластеров обеспечивает преимущество, состоящее в возможности повышения производительности и снижения частоты ошибок, например, для образцов с распределением большого количества фрагментов по длине.
Секвенатор с одиночным источником света и двумя оптическими каналами
[0085] В данном документе раскрыты варианты осуществления системы и способа определения нуклеотидной последовательности полинуклеотидов. В одном варианте осуществления система содержит или имеет связь с одиночным источником света, таким как лазерный или светодиодный источник света, выполненным с возможностью генерирования света, такого как свет с заданной длиной волны. Система может содержать или иметь связь с по меньшей мере одним детектором, выполненным с возможностью обнаружения четырех существенно отличающихся флуоресцентных излучений от разных флуорофоров, присоединенных к нуклеотидам. Система может инициировать излучение света от указанного источника света на нуклеотид. Нуклеотид может быть идентифицирован как нуклеотид первого типа, если указанным по меньшей мере одним детектором обнаружено первое флуоресцентное излучение. Нуклеотид может быть идентифицирован как нуклеотид второго типа, если указанным по меньшей мере одним детектором обнаружено второе флуоресцентное излучение. Нуклеотид может быть идентифицирован как нуклеотид третьего типа, если указанным по меньшей мере одним детектором обнаружено третье флуоресцентное излучение. Нуклеотид может быть идентифицирован как нуклеотид четвертого типа, если указанным по меньшей мере одним детектором обнаружено четвертое флуоресцентное излучение. По меньшей мере два из первого флуоресцентного излучения, второго флуоресцентного излучения, третьего флуоресцентного излучения и четвертого флуоресцентного излучения могут иметь существенно отличающиеся длины волн.
[0086] Нуклеотиды разных типов могут быть присоединены к разным флуорофорам, или они могут быть не присоединены к флуорофорам. Например, нуклеотид первого типа может быть не присоединен к флуорофору, возбуждаемому указанным одиночным источником света, и первое флуоресцентное излучение не будет содержать излучение этого флуорофора. В еще одном примере нуклеотид первого типа может быть присоединен к двум разным флуорофорам, и первое флуоресцентное излучение будет содержать излучения от этих двух флуорофоров.
[0087] В еще одном примере первое флуоресцентное излучение эмитируется из первого флуорофора, присоединенного к нуклеотиду первого типа, второе флуоресцентное излучение эмитируется из второго флуорофора, присоединенного к нуклеотиду второго типа, третье флуоресцентное излучение эмитируется из третьего флуорофора, присоединенного к нуклеотиду третьего типа, и четвертое флуоресцентное излучение эмитируется из четвертого флуорофора, присоединенного к нуклеотиду четвертого типа. Четыре указанных флуорофора могут возбуждаться с помощью источника света. В одном варианте осуществления все четыре из первого флуорофора, второго флуорофора, третьего флуорофора и четвертого флуорофора отличаются друг от друга. Например, нуклеотидная последовательность может быть определена на основе излучений с четырьмя разными длинами волн от четырех красителей. В еще одном варианте осуществления три из первого флуорофора, второго флуорофора, третьего флуорофора и четвертого флуорофора отличаются друг от друга. Например, нуклеотидная последовательность может быть определена на основе излучений с тремя разными длинами волн от трех красителей. В еще одном варианте осуществления два из первого флуорофора, второго флуорофора, третьего флуорофора и четвертого флуорофора являются идентичными. Например, нуклеотидная последовательность может быть определена на основе излучений с двумя разными длинами волн от двух красителей.
Способы секвенирования
[0088] Способы, описанные в данном документе, могут использоваться в сочетании с рядом методик секвенирования нуклеиновых кислот. Особо пригодными методиками являются те, в которых закрепляют нуклеиновые кислоты в фиксированных местах в матрице таким образом, чтобы их относительное положение не изменялось, и периодически формируют изображение указанной матрицы. Варианты, в которых изображения формируются в разных цветовых каналах, например, совпадающих с разными метками, используемыми для проведения отличия нуклеотидного основания одного типа от нуклеотидного основания другого типа, являются особо предпочтительными. В некоторых вариантах осуществления процесс определения нуклеотидной последовательности целевой нуклеиновой кислоты может представлять собой автоматизированный процесс. Предпочтительные варианты осуществления включают методики секвенирования путем синтеза (sequencing-by-synthesis, SBS).
[0089] Методики секвенирования путем синтеза обычно включают ферментативное удлинение образующейся цепочки нуклеиновой кислоты посредством циклического добавления нуклеотидов к матричной цепи. В традиционных способах секвенирования путем синтеза, один нуклеотидный мономер может быть обеспечен для целевого нуклеотида в присутствии полимеразы при каждой доставке. Тем не менее, в способах, описанных в данном документе, более чем один типа нуклеотидного мономера может быть обеспечен для целевой нуклеиновой кислоты в присутствии полимеразы при доставке.
Терминология
[0090] В некоторых из вышеописанных вариантов осуществления один или более элементов, используемых в вариантах осуществления, могут использоваться взаимозаменяемым образом в других вариантах осуществления, если такие замены не являются технически неосуществимыми. Специалистам в данном области техники будет понятно, что возможны различные иные изъятия, добавления и модификации в вышеописанных способах и конструкциях без выхода за рамки объема заявленного предмета изобретения. Все такие модификации и изменения предназначены для включения в рамки объема предмета изобретения, определяемого приложенной формулой изобретения.
[0091] Что касается использования по существу любых форм единственного и/или множественного числа, то специалисты в данной области техники могут переходить с форм множественного числа на формы единственного числа и/или с форм единственного числа на формы множественного числа в зависимости от контекста и/или конкретного применения. Различные перестановки форм единственного/множественного могут намеренно использоваться в данном документе в целях ясности.
[0092] Специалистам в данной области техники будет понятно, что в целом термины, используемые в данном документе, и, в частности, в приложенной формуле изобретения (например, в отличительных частях приложенной формулы изобретения) в целом понимаются как «открытые» термины (например, термин «включающий» должен пониматься как «включающий, но без ограничения», термин «имеющий» должен пониматься как «имеющий по меньшей мере», термин «включает» должен пониматься как «включает, но без ограничения» и т.д.). Специалистам в данной области техники будет также понятно, что если имеется намерение изложить конкретное число в вводимой формулировке в пункте формулы изобретения, то такое число будет явным образом изложено в формуле изобретения, а если такой формулировки нет, то нет и такого намерения. Например, для помощи в понимании нижеследующие пункты приложенной формулы изобретения могут содержать вводные выражения «по меньшей мере один» и «один или более» для введения формулировок в пункты формулы изобретения. Тем не менее, использование таких выражений не следует истолковывать как подразумевающее, что введение в формуле изобретения формулировки с использованием неопределенных артиклей «а» или «an» (в английском языке) ограничивает любой конкретный пункт формулы изобретения, содержащий такие введенные формулировки, вариантами реализации, содержащими только одну такую формулировку, даже когда этот же пункт формулы изобретения включает в себя вводные выражения «один или более» или «по меньшей мере один» и неопределенные артикли «а» или «an» (например, неопределенный артикль «а» и/или «an» могут быть интерпретированы как означающие «по меньшей мере один» или «один или более»); то же самое справедливо для использовании определенных артиклей, используемых для введения формулировок в пунктах формулы изобретения. Кроме того, даже если конкретное число в формулировке, вводимой в формуле изобретения, сформулировано явным образом, специалистам в данной области техники будет понятно, что такая формулировка должна быть истолкована как обозначающая по меньшей мере сформулированное число (например, простое формулирование «два элемента» без прочих модификаторов означает «по меньшей два элемента» или «два или более элементов»). Кроме того, в тех случаях, когда используется конструкция, аналогичная «по меньшей мере одно из А, В и С», в целом такая конструкция предназначена для ее понимания в том смысле, в каком эту конструкцию должны понимать специалисты в данной области техники (например, «система, имеющая по меньшей мере одно из А, В и С» будет включать, но без ограничения, системы, которые имеют только А, только В, только С, оба из А и В, оба из А и С, оба из В и С и/или все из А, В и С, и т.д.). В тех случаях, когда используется конструкция, аналогичная «по меньшей мере одно из А, В или С, и т.д.», в целом такая конструкция предназначена для ее понимания в том смысле, в каком эту конструкцию должны понимать специалисты в данной области техники (например, «система, имеющая по меньшей мере одно из А, В или С» будет включать, но без ограничения, системы, которые имеют только А, только В, только С, оба из А и В, оба из А и С, оба из В и С и/или все из А, В и С, и т.д.). Специалистам в данной области техники будет также понятно, что по существу любое разделительное слово и/или выражение, представляющие два или более альтернативных терминов, будь то в описании, на чертежах или в формуле изобретения, должны пониматься как подразумевающие возможность включения одного из этих терминов, любого из этих терминов или обоих этих терминов. Например, выражение «А или В» должно пониматься как включающее возможности «А» или «В» или «А и В».
[0093] Кроме того, в случае, если признаки или аспекты настоящего изобретения описаны в терминах группы Маркуша, специалистам в данной области техники будет понятно, что настоящее изобретение тем самым также описано в терминах любого отдельного члена или подгруппы членов группы Маркуша.
[0094] Как будет понятно специалистам в данной области техники, во всех без исключения случаях, в частности при составлении описания, все диапазоны, указанные в данном документе, также охватывают все возможные поддиапазоны и комбинации этих поддиапазонов. Любой из перечисленных диапазонов может быть легко распознан как в достаточной степени описательный и обеспечивающий возможность разбиения одного и того же диапазона на по меньшей мере равные половины, трети, четверти, пятые части, десятые части и т.д. В качестве неограничивающего примера, каждый из диапазонов, приведенных в данном документе, может быть легко разбит на нижнюю треть, среднюю треть и верхнюю треть, и т.п. Специалистам в данной области техники также будет понятно, что все выражения, такие как «вплоть до», «по меньшей мере», «больше, чем», «меньше, чем» и т.п., включают изложенное число и относятся к диапазонам, которые могут быть затем разбиты на поддиапазоны, как описано выше. Наконец, как будет понятно специалистам в данной области техники, диапазон включает каждое отдельное число. Таким образом, например, группа, имеющая 1-3 элемента, относится к группам, имеющим 1, 2 или 3 элемента. Аналогичным образом, группа, имеющая 1-5 элементов, относится к группам, имеющим 1, 2, 3, 4 или 5 элементов, и т.д.
[0095] Хотя в данном документе описаны различные аспекты и варианты осуществления, специалистам в данной области техники будут ясны и другие аспекты и варианты осуществления. Различные аспекты и варианты осуществления, раскрытые в данном документе, предназначены для иллюстративных целей и не предназначены для ограничения, при этом истинные объем и идея настоящего изобретения раскрыты в нижеследующих пунктах формулы изобретения.
Реферат
Группа изобретений относится к области биотехнологии. Предложены система и осуществляемый посредством компьютера способ определения нуклеотидной последовательности полинуклеотидов. Система содержит источник света для вызывания эмиссии флуоресцентного излучения, детектор для обнаружения флуоресцентных излучений из присоединенного к нуклеотиду флуорофора с первой длиной волны и второй длиной волны, а также процессор для исполнения команд. Способ включает генерирование флуоресцентных излучений источником света, обнаружение детектором интенсивности флуоресцентных излучений с первой длиной волны и со второй длиной волны из присоединенного к нуклеотиду флуорофора детектором, цветовую коррекцию интенсивностей флуоресцентных излучений и идентификацию нуклеотида. Изобретения обеспечивают идентификацию всех четырех нуклеотидных оснований с помощью одиночного источника света и двух разных оптических каналов. 2 н. и 24 з.п. ф-лы, 10 ил.
Формула



Документы, цитированные в отчёте о поиске
Способ секвенирования полинуклеотидов

Комментарии