Пробиотический штамм бифидобактерий - RU2546251C2
Код документа: RU2546251C2
Чертежи



Описание
Область техники, к которой относится изобретение
Пробиотический штамм АН 1714 бифидобактерий обладает значительными иммуномодулирующими свойствами при оральном потреблении. Штамм может быть полезен в качестве иммуномодулирующего биотерапевтического средства.
Уровень техники
Изобретение относится к штамму бифидобактерий (Bifidobacterium) и его использованию в качестве пробиотических бактерий, в частности в качестве иммуномодулирующего биотерапевтического вещества.
Механизмы защиты желудочно-кишечного тракта человека от его колонизации кишечными бактериями исключительно сложны и включают иммунные и неиммунные взаимодействия (1). Врожденные защитные механизмы включают низкий рН желудка, желчные соли, перистальтику, муциновые слои и антимикробные вещества и составы, такие, как лизоцим (2). Иммунные механизмы включают специализированные лимфоидные образования, подстилающие М-клетки (называемые также комплексами Пейера), распределенные по всей тонкой и прямой кишке (3). Люминальные антигены, присутствующие в данных местах, стимулируют развитие субпопуляций Т- и В-клеток с образованием цитокиновых сетей и секрецию антител в желудочно-кишечный тракт (4). Кроме того, антигены могут попадать через эпителиальные клетки к интраэпителиальным лимфоцитам и к иммуноцитам находящейся под ними собственной пластины слизистой оболочки (5). Таким образом, человек тратит значительные силы на иммунную защиту желудочно-кишечного тракта. Поскольку слизистая оболочка кишечника является самой большой поверхностью, посредством которой человек контактирует с окружающей средой, ему необходимы специальные механизмы, посредством которых регулируется иммунный ответ на 100 тонн пищи, которая проходит через желудочно-кишечный тракт в течение среднего времени жизни человека. Кроме того, кишечник населяют более 500 видов бактерий, концентрация которых в прямой кишке составляет 1011-1012/г. В связи с этим регулирующие механизмы должны быть способны различать непатогенные бактерии, нормально живущие в кишечнике, от нашествий патогенов, которые могут вызвать серьезные проблемы у хозяина. Кишечная флора активно участвует в защите хозяина, борясь с попадающими через пищеварительную систему потенциально патогенными микроорганизмами.
Бактерии, присутствующие в желудочно-кишечном тракте человека, могут вызывать воспалительные процессы. Некоторые болезненные состояния, связанные с воспалением кишечника, могут быть вызваны аберрантными иммунными реакциями на собственную микрофлору. Антигены, ассоциированные с нормальной микрофлорой, как правило, не должны вызывать иммунного ответа, и нарушение такой толерантности является основным механизмом воспаления слизистой оболочки кишечника (6). О нарушении нормальной толерантности свидетельствуют, в частности, повышенные уровни антител, направленных против собственной флоры кишечника, у пациентов с болезнью воспаленного кишечника (IBD).
Настоящее изобретение относится к штамму бифидобактерий, который, как было нами показано, обладает иммуномодулирующим эффектом за счет регулирования уровней цитокинов или за счет антагонистической активности, исключающей вызывающие воспалительные процессы микроорганизмы из желудочно-кишечного тракта.
Сущность изобретения
В настоящем изобретении предлагается выделенный штамм бифидобактерий NCIMB 41676.
Штамм бифидобактерий может быть в форме живых клеток. Штамм бифидобактерий может быть в форме не живых клеток. Бифидобактерии могут быть получены из ткани толстой кишки здорового человека путем биопсии. Штамм бифидобактерий может обладать значительным иммуномодулирущим действием при его оральном потреблении человеком.
В настоящем изобретении предлагается также состав, содержащий упомянутый штамм бифидобактерий. Состав может дополнительно содержать пробиотический материал. Состав может дополнительно содержать пребиотический материал. Состав может дополнительно содержать носитель для орального приема. Носитель для орального приема может быть одним из фармацевтически приемлемых носителей, таким, как, например, капсула, таблетка, порошок. Носителем для орального приема может быть также пищевой продукт, такой, как, например, сквашенное молоко, йогурт, замороженный йогурт, сухое молоко, концентрированное молоко, сырная паста, заправки или напитки. Состав может дополнительно содержать белок и/или пептид, в частности, белки или пептиды, богатые на глютамин/глутамат, липид, углеводород, витамин, минерал и/или микроэлемент. Штамм бифидобактерий может содержаться в количестве более 106 КОЕ на грамм состава. Состав может дополнительно содержать адъювант. Состав может дополнительно содержать бактериальный компонент. Состав может дополнительно содержать лекарственное средство. Состав может дополнительно содержать смесь биологических компонентов. Состав может быть использован для протоколов иммунизации и вакцинации.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться в продуктах питания.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться в качестве лекарственного средства.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения нежелательных воспалительных процессов.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения нежелательных воспалительных процессов желудочно-кишечного тракта, такие, как, например, воспалительные заболевания кишечника, включая болезнь Крона, язвенный колит, синдром раздраженного кишечника; паучит; или постинфекционный колит.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения новообразований желудочно-кишечного тракта.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения системных заболеваний, таких, как ревматоидный артрит.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения аутоиммунных нарушений, вызванных нежелательными воспалительными процессами.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения раковых заболеваний, вызванных нежелательными воспалительными процессами.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики раковых заболеваний.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения диарейных состояний, вызванных нежелательными воспалительными процессами, таких, как, например, диарея, вызванная Clostridium difficile, ротавирусная диарея, постинфекционная диарея или диарея, вызванная возбудителями инфекций, такими, как E.coli.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав для приготовления противовоспалительных биотерапевтических средств, используемых для профилактики и/или лечения нежелательных воспалительных процессов.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав для приготовления ряда биотерапевтических средств, используемых для коррекции уровня IL-10.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения воспалительных расстройств, иммунодефицита, болезни воспаленного кишечника, синдрома раздраженного кишечника, раковых заболеваний (в особенности желудочно-кишечного тракта и иммунной системы), диарейных состояний, диареи, вызванной антибиотиками, детской диареи, аппендицита, аутоиммунных нарушений, рассеянного склероза, болезни Альцгеймера, ревматоидного артрита, целиакии, сахарного диабета, состояний при трансплантации органов, бактериальных инфекций, вирусных инфекций, грибковых болезней, пародонтоза, болезней мочеполовой системы, болезней, передающихся половым путем, ВИЧ-инфекции, повторной ВИЧ-инфекции, диареи, связанной с ВИЧ-инфекцией, травм, вызванных хирургическим вмешательством, метастатической болезни, вызванной хирургическим вмешательством, сепсиса, потери веса, анорексии, лихорадочных состояний, кахексии, для заживления ран, при язвах, нарушениях барьерной функции кишечника, аллергии, астме, респираторных заболеваниях, нарушениях кровообращения, ишемической болезни сердца, анемии, нарушениях аппарата свертываемости крови, болезнях почек, расстройствах центральной нервной системы, гепатитах, расстройствах питания, остеопорозе, эндокринных нарушениях, болезнях кожного покрова, псориазе, угрях обыкновенных, панических расстройствах, расстройствах поведения и/или расстройствах, вызванных посттравматическим стрессом.
Штамм бифидобактерий в соответствии с настоящим изобретением может использоваться как антагонистическое средство, исключающее провоспалительные микроорганизмы из желудочно-кишечного тракта.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для приготовления противовоспалительных биотерапевтических средств, предназначенных для снижения уровня провоспалительных цитокинов.
Штамм бифидобактерий в соответствии с настоящим изобретением может использоваться в качестве противоинфекционного пробиотического штамма.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения биполярной болезни, депрессии, расстройств настроения и/или тревожности.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться в качестве селективного усиливающего средства для профилактики и/или лечения расстройств центральной нервной системы, таких, как болезнь Альцгеймера, шизофрения и/или незначительные когнитивные расстройства.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения воспалительных процессов, вызванных ожирением.
В настоящем изобретении предлагаются также штамм бифидобактерий или содержащий его состав, которые могут использоваться для профилактики и/или лечения нарушений метаболизма, вызванных ожирением.
Предметом настоящего изобретения являются штамм бифидобактерий АН 1714 (NCIMB 41676), а также его мутанты и варианты. Мутант может быть генетически модифицированным мутантом. Вариант может быть естественно встречающимся вариантом бифидобактерий. Предлагается также устойчивый к рифампицину вариант штамма АН1714. Штамм может быть пробиотиком. Штамм может быть в форме биологически чистой культуры.
В настоящем изобретении предлагается также выделенный штамм бифидобактерий NCIMB 41676. Штаммы бифидобактерий могут быть в форме живых клеток. В качестве альтернативы, штаммы бифидобактерий могут быть в форме неживых клеток. Как правило, пробиотические бактерии используются в форме живых клеток. Однако возможно их использование и в форме не живых клеток, например, в виде умерщвленных культуры или составов, содержащих полезные факторы, экспрессируемые пробиотическими бактериями. Умерщвленные культуры могут включать микроорганизмы, убитые под воздействием высокой температуры, экстремальных значений рН, давления или гамма-излучения. При использовании не живых клеток изготовление конечного продукта из них упрощается, они могут быть включены в широкое разнообразие фармацевтических форм, и условия хранения препаратов из них значительно менее жесткие, чем для препаратов, содержащих живые клетки. Так, например, в патенте США 4347240 описано успешное использование убитых высокой температурой клеток штамма Lactobacillus casei YIT 9018 для лечения и/или профилактики роста опухолей.
Штаммы бифидобактерий могут быть выделены из образцов ткани толстой кишки здорового человека, полученных с помощью биопсии. Штаммы бифидобактерий могут обладать значительным иммуномодулирущим действием при их оральном потреблении человеком.
В настоящем изобретении предлагается также состав, содержащий упомянутый штамм бифидобактерий. Состав может включать еще один пробиотический материал. Состав может включать пребиотический материал. Состав предпочтительно включает носитель для орального приема. Носитель для орального приема предпочтительно является одним из фармацевтически приемлемых, таким, как, например, капсула, таблетка, порошок. Носителем для орального приема может быть также пищевой продукт, такой, как, например, кисломолочный продукт, йогурт, замороженный йогурт, сухое молоко, концентрированное молоко, сырные пасты, заправки или напитки. Состав может дополнительно содержать белок и/или пептид, в частности, белки или пептиды, богатые на глютамин/глутамат, липид, углеводород, витамин, минерал и/или микроэлемент. Штамм бифидобактерий может содержаться в составе в количестве более 106 КОЕ на грамм потребляемого состава. Состав предпочтительно включает один или более из следующих компонентов: адъювант, бактериальный компонент, лекарственное средство, смесь биологических компонентов.
В настоящем изобретении предлагается также штамм бифидобактерий или состав для использования в продуктах питания или в качестве лекарственного средства для профилактики и/или лечения нежелательных воспалительных процессов, профилактики и/или лечения нежелательных воспалительных процессов в органах дыхания, таких как, например, астма, профилактики и/или лечения нежелательных воспалительных процессов желудочно-кишечного тракта, таких как, например, воспалительные заболевания кишечника, включая болезнь Крона, язвенный колит, паучит или пост-инфекционный колит, профилактики и/или лечения новообразований желудочно-кишечного тракта, профилактики и/или лечения системных заболеваний, таких, как ревматоидный артрит, профилактики и/или лечения автоиммунных нарушений, вызванных нежелательными воспалительными процессами, профилактики и/или лечения раковых заболеваний, вызванных нежелательными воспалительными процессами, профилактики и/или лечения диарейных состояний, вызванных нежелательными воспалительными процессами, таких, как, например, диарея, вызванная Clostridium difficile, ротавирусная диарея, постинфекционная диарея или диарея, вызванная возбудителями инфекций, такими, как E.coli.
В настоящем изобретении предлагаются также штамм бифидобактерий или состав для приготовления противовоспалительных биотерапевтических средств, используемых для профилактики и/или лечения нежелательных воспалительных процессов. Состав может работать как антагонист, исключающий вызывающие воспаление микроорганизмы из желудочно-кишечного тракта.
В настоящем изобретении предлагаются также штамм бифидобактерий или состав для приготовления противовоспалительных биотерапевтических средств, предназначенных для снижения уровня провоспалительных цитокинов.
В настоящем изобретении предлагаются также штамм бифидобактерий или состав для приготовления противовоспалительных биотерапевтических средств, предназначенных для коррекции уровня IL-10.
Штамм бифидобактерий может использоваться в качестве противоинфекционного пробиотика благодаря его способности противодействовать росту патогенных организмов.
Нами было найдено, что определенные штаммы бифидобактерий обеспечивают иммуномодулирующий эффект in vitro.
Поэтому изобретение имеет большой терапевтический потенциал для профилактики и лечения нарушенных иммунных реакций, в частности, нежелательных воспалительных процессов, таких как астма.
Бифидобактерии являются симбиотическими микроорганизмами. Они были выделены из микрофлоры желудочно-кишечного тракта человека. Иммунная система желудочно-кишечного тракта не дает выраженной реакции на представителей данной микрофлоры, так как иначе возникшая воспалительная реакция разрушила бы также клетки-хозяева и нарушила бы функционирование тканей. Поэтому существуют определенные механизмы, благодаря которым иммунная система может распознавать не патогенных членов семейства желудочно-кишечной микрофлоры и отличать их от патогенных организмов. Это обеспечивает сохранность клеток-хозяев с одной стороны, и поддержание требуемого защитного барьера от патогенной флоры, с другой стороны.
Штамм Bifidobacterium longum АН 1714 был внесен в Национальную коллекцию промышленных и морских бактерий NCIMB (Абердин, Великобритания) 5 ноября 2009 с присвоением ему номера NCIMB 41676.
Bifidobacterium longum может быть генетически модифицированным мутантом или встречающимся в природе вариантом.
Bifidobacterium longum предпочтительно используется в форме жизнеспособных клеток.
В качестве альтернативы, Bifidobacterium longum может использоваться в форме не жизнеспособных клеток.
Предвидится, что штамм бифидобактерий в соответствии с настоящим изобретением может быть назначен животным (включая человека) в подходящей стандартной форме для орального приема, такой как капсулы, микрокапсулы, таблетки, гранулы, порошок, пастилки, пилюли, суппозитории, суспензии и сиропы. Подходящие составы, содержащие штамм бифидобактерий, могут быть изготовлены традиционно применяемыми способами с использованием органических и неорганических добавок. Количество активного ингредиента в составе может быть на уровне, обеспечивающем требуемый терапевтический эффект.
Состав может также включать бактериальный компонент, лекарственное средство или смесь биологических компонентов.
Кроме того, может быть приготовлена вакцина, содержащая штаммы в соответствии с настоящим изобретением, с использованием любого известного подходящего способа, и которая может содержать любой приемлемый по фармацевтическим требованиям носитель или адъювант.
В контексте настоящего описания термины «мутант», «вариант» и «генетически модифицированный мутант» включают штамм бифидобактерий, генетические и фенотипические свойства которого отличаются от соответствующих свойств родительского штамма. Термин «встречающийся в природе вариант штамма Bifidobacterium longum» подразумевает организмы, отобранные в результате селекции из организмов, в которых произошли спонтанные изменения целевых свойств. Намеренные изменения свойств родительского штамма осуществляются обычными генно-инженерными методами (in vitro), такими как разрыв генов, конъюгационный перенос и прочие. Термин «генетическое модифицирование» включает введение экзогенных и/или эндогенных последовательностей ДНК в геном штамма бифидобактерий, например, путем их вставки в геном бактериального штамма посредством векторов на основе плазмидной ДНК или бактериофагов.
Термины «естественные мутации» и «индуцированные мутации» включают изменения по меньшей мере одного основания путем делеции, вставки, обращения или иных изменений ДНК, которые могут приводить к изменению аминокислотной последовательности, кодируемой последовательностью ДНК.
Термины «мутант», «вариант» и «генетически модифицированный мутант» включают также штамм бифидобактерий, который был подвергнут генетическим изменениям, которые накапливаются в геноме в степени, в сущности и по своей природе одинаковой для всех микроорганизмов, и/или генетическим изменениям, которые происходят в результате спонтанных мутаций, приобретений и/или потерь, которые не могут быть получены путем намеренных (in vitro) преобразований генома, но которые могут быть получены путем естественного отбора вариантов и/или мутантов, и которые обеспечивают требуемые преимущества, повышающие жизнеспособность бактерий при воздействии на них агрессивных факторов среды, таких как, например, антибиотики. Мутант может быть создан путем намеренной (in vitro) вставки тех или иных генов в геном, которые принципиально не меняют биохимической функциональности организма, но продукты экспрессии которых могут быть использованы для идентификации или селекции бактерий, например, которые придают устойчивость к антибиотикам.
Сведущим в данной области техники будет понятно, что мутантные или вариантные штаммы бифидобактерий могут быть идентифицированы посредством анализа последовательности их ДНК на гомологию с родительским штаммом. Штаммы бифидобактерий, имеющие высокую степень идентичности последовательности ДНК с родительским штаммом, могут считаться мутантными или вариантными штаммами. Штамм бифидобактерий, имеющий степень идентичности (гомологии) последовательности ДНК соответствующей последовательности родительского штамма, составляющую 96% или более, 97% или более, 98% или более, или 99% или более, может считаться мутантным или вариантным штаммом. Гомологичность последовательностей может быть определена с помощью программы BLAST, общедоступной на сайте http://www.ncbi.nlm.nih,gov/BLAST/.
Мутанты родительского штамма включают также производные штаммы бифидобактерий, имеющие гомологию межгенной спейсерной полинуклеотидной последовательности 16s-23s, составляющую по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по отношению к соответствующей последовательности родительского штамма. Такие мутанты могут дополнительно содержать мутации ДНК в других последовательностях ДНК бактериального генома.
Краткое описание чертежей
Настоящее изобретение будет более понятным из нижеследующего подробного описания его воплощений, приводимых только в качестве примеров, сопровождаемого прилагаемыми чертежами.
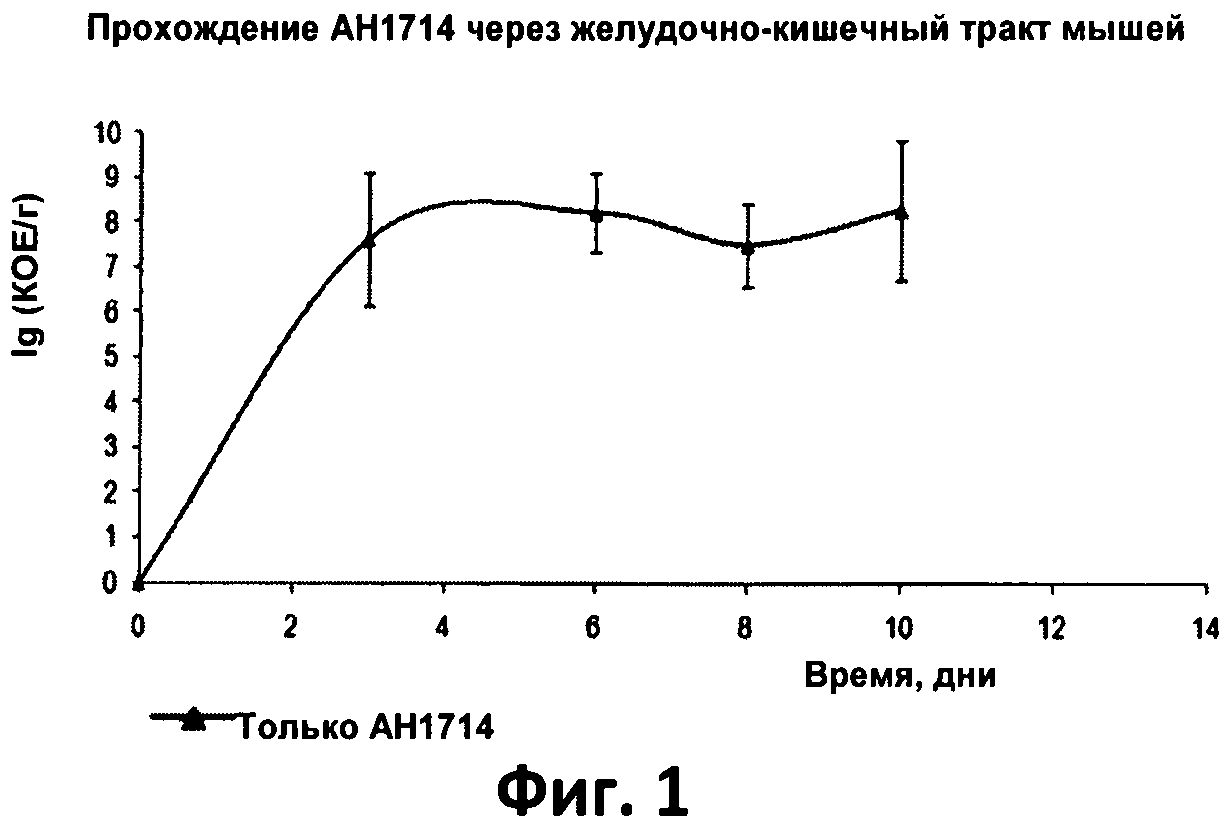
Фиг.1. График, отображающий прохождение В. longum АН 1714 через желудочно-кишечный тракт.
Фиг.2. Фотография В. longum АН 1714, выращенных на агаре с красителем конго красный.
Фиг.3. Столбчатая диаграмма, отображающая отношение экспрессии IL-10:IL-12р70 в мононуклеарах периферической крови, не стимулируемых и стимулируемых штаммом Bifidobacterium longum 1714;
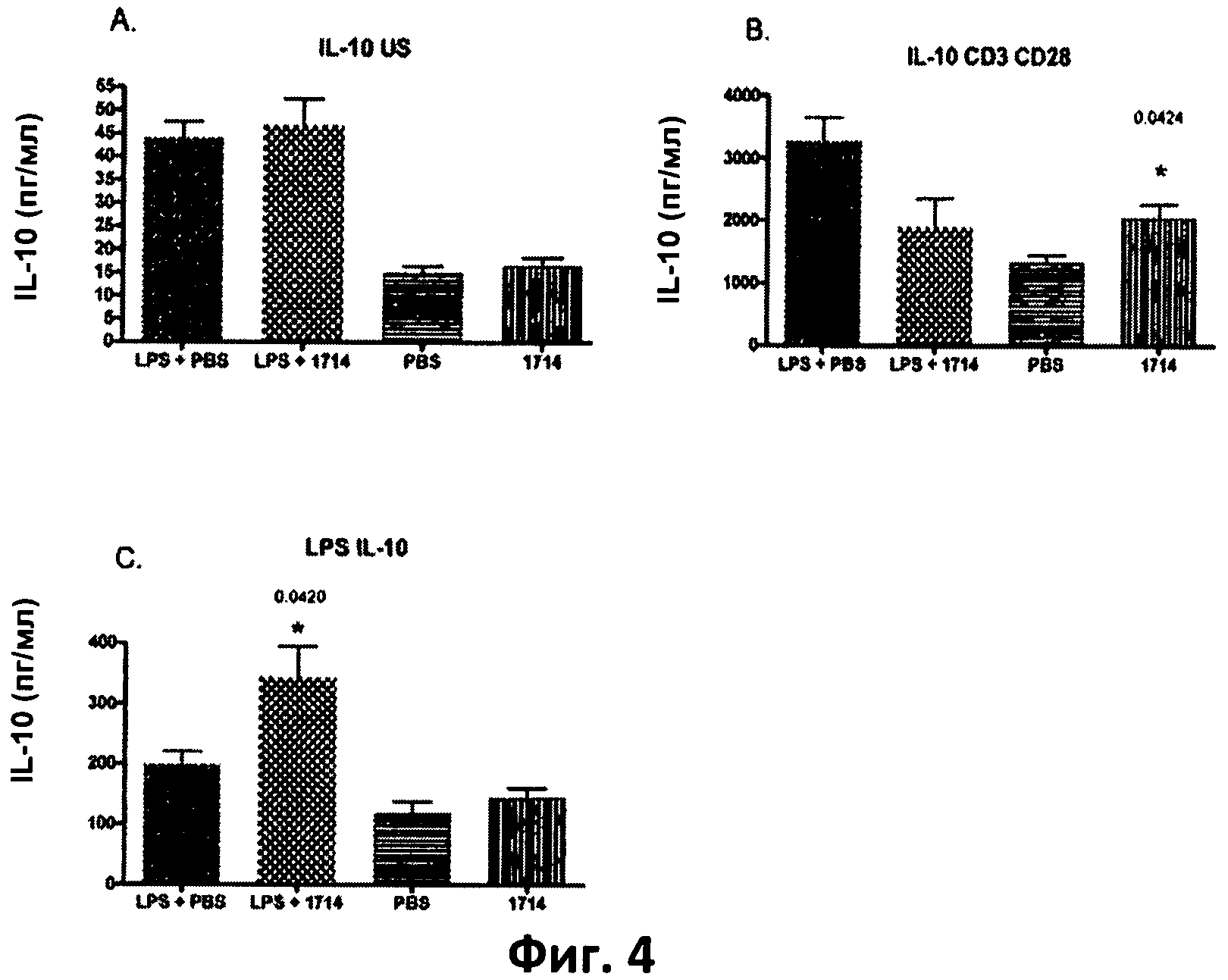
Фиг.4. Столбчатая диаграмма, отображающая уровень IL-10 в спленоцитах, выделенных из мышей, которых кормили штаммом 1714 и его носителем (PBS), при стимуляции липополисахаридами (LPS) in vivo в количестве 1 мг/кг, и без нее. (А) клетки, не стимулированные in vitro, (В) клетки, стимулированные LPS in vitro; (С) клетки, стимулированные antiCD3/CD28 in vitro. Данные представлены в виде среднего значения и среднеквадратичного отклонения.
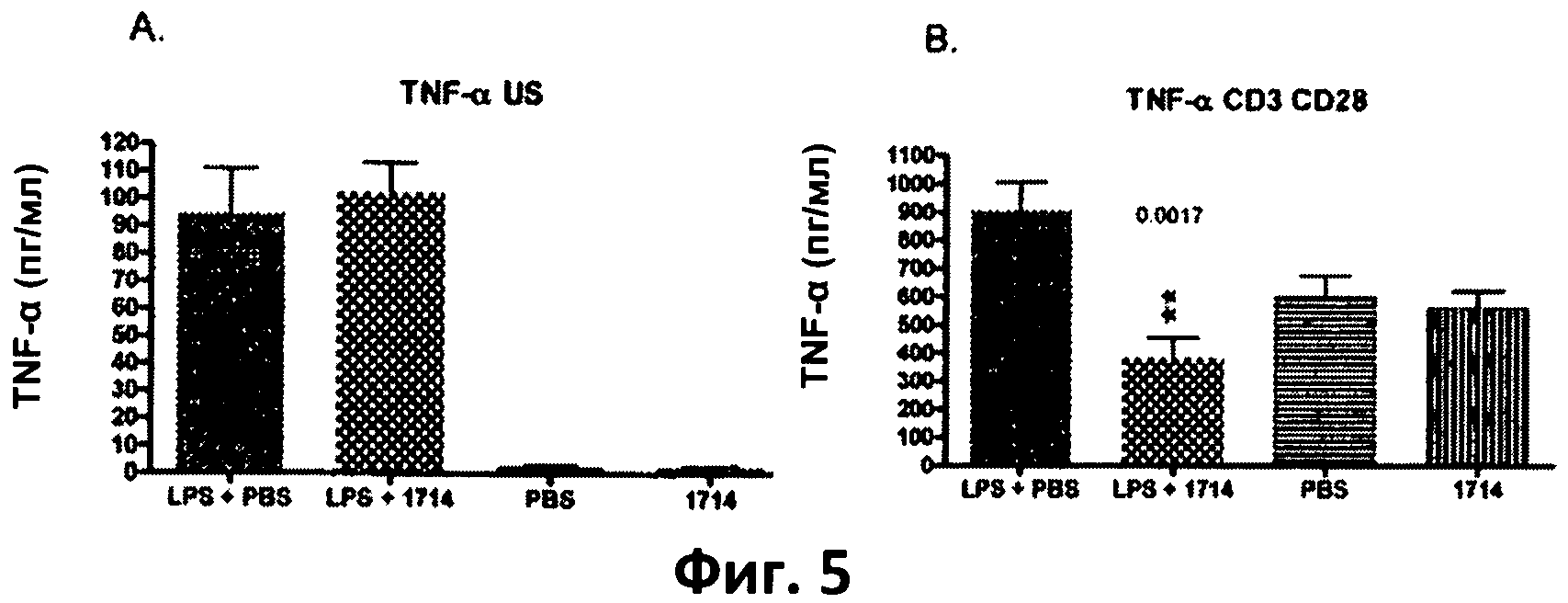
Фиг.5. Столбчатая диаграмма, отображающая уровень TNF-α в спленоцитах, выделенных из мышей, которых кормили штаммом 1714 и его носителем (PBS), при стимуляции липополисахаридами (LPS) in vivo в количестве 1 мг/кг, и без нее. (А) клетки, не стимулированные in vitro; (В) клетки, стимулированные antiCD3/CD28 in vitro. Данные представлены в виде среднего значения и среднеквадратичного отклонения.
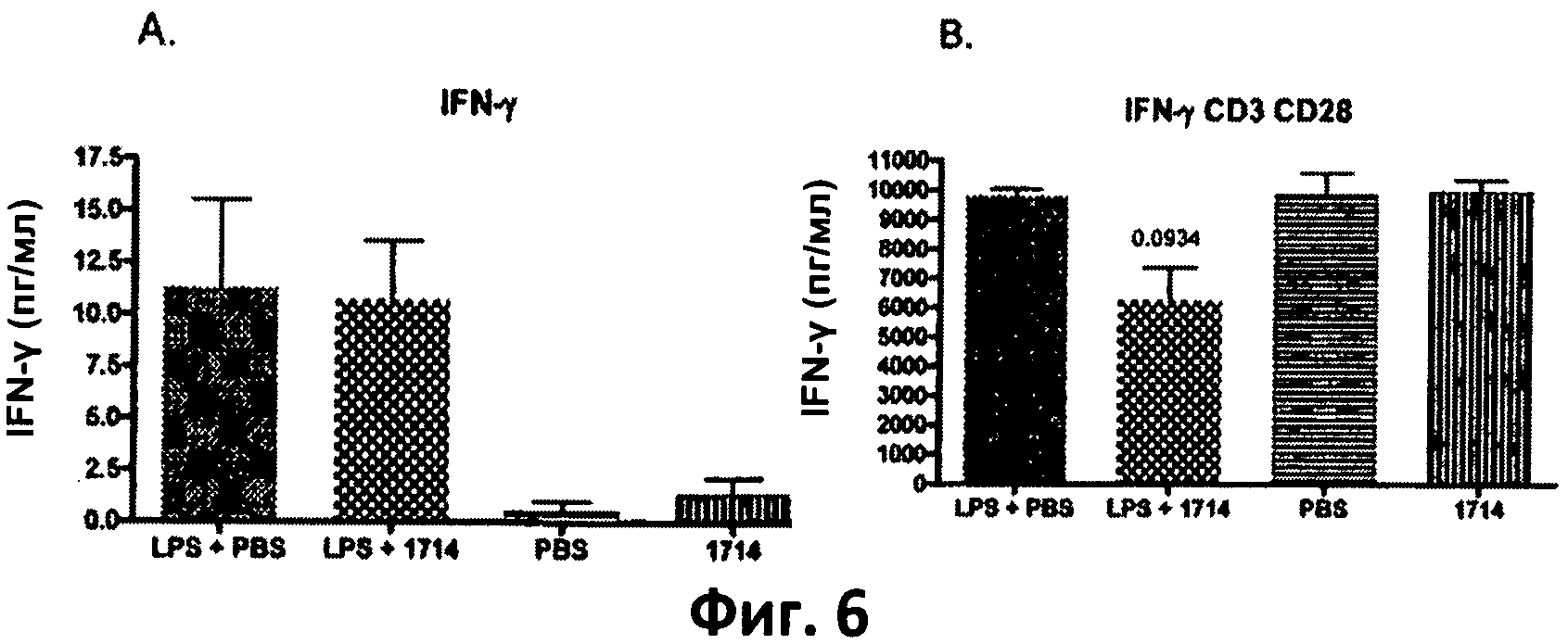
Фиг.6. Столбчатая диаграмма, отображающая уровень IFN-γ в спленоцитах, выделенных из мышей, которых кормили штаммом 1714 и его носителем (PBS), при стимуляции липополисахаридами (LPS) in vivo в количестве 1 мг/кг, и без нее. (А) клетки, не стимулированные in vitro; (В) клетки, стимулированные antiCD3/CD28 in vitro. Данные представлены в виде среднего значения и среднеквадратичного отклонения.
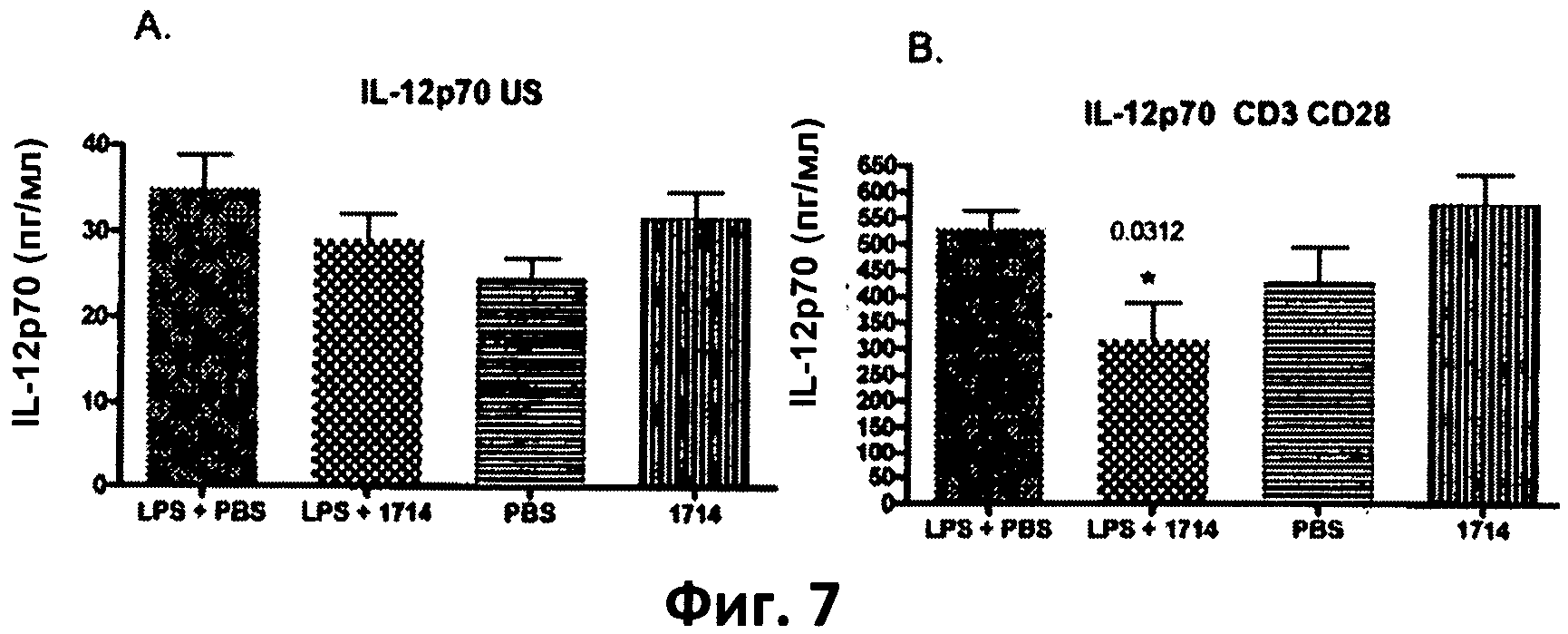
Фиг.7. Столбчатая диаграмма, отображающая уровень IL-12p70 в спленоцитах, выделенных из мышей, которых кормили штаммом 1714 и его носителем (PBS), при стимуляции липополисахаридами (LPS) in vivo в количестве 1 мг/кг, и без нее. (А) клетки, не стимулированные in vitro; (В) клетки, стимулированные antiCD3/CD28 in vitro. Данные представлены в виде среднего значения и среднеквадратичного отклонения.
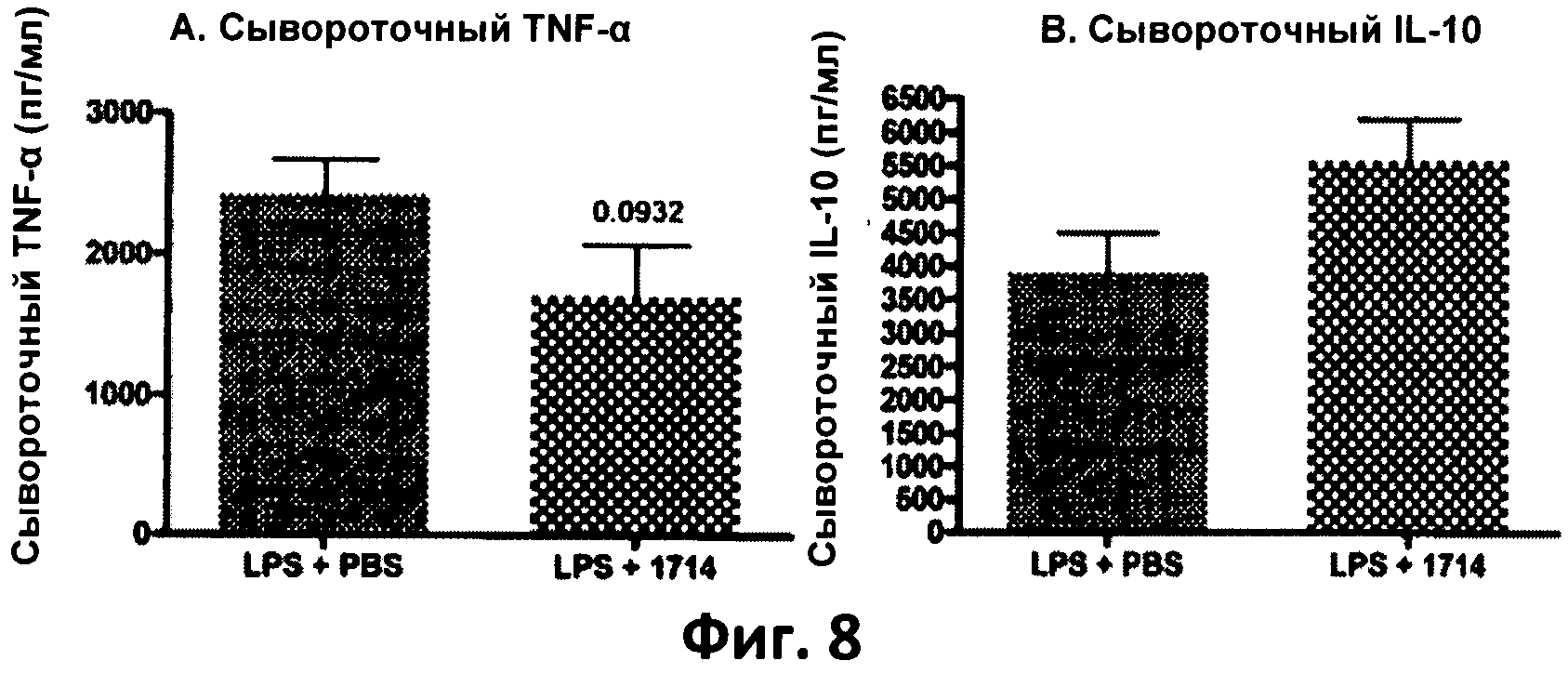
Фиг.8. Столбчатая диаграмма, отображающая уровни TNF-α (А) и IL-10 (В) в сыворотке, взятой у мышей, которых кормили штаммом 1714 и его носителем (PBS), через 2 часа после стимуляции липополисахаридами (LPS) in vivo в количестве 1 мг/кг. Данные представлены в виде среднего значения и среднеквадратичного отклонения.
Фиг.9. Столбчатая диаграмма, отображающая активность NFkB (в фотонах/с) для селезенки, выделенной из животных, которых кормили плацебо и штаммом 1714, через 3 часа после стимуляции одной дозой липополисахаридов (LPS) в количестве 0,5 мг/мг (** означает р<0.01).
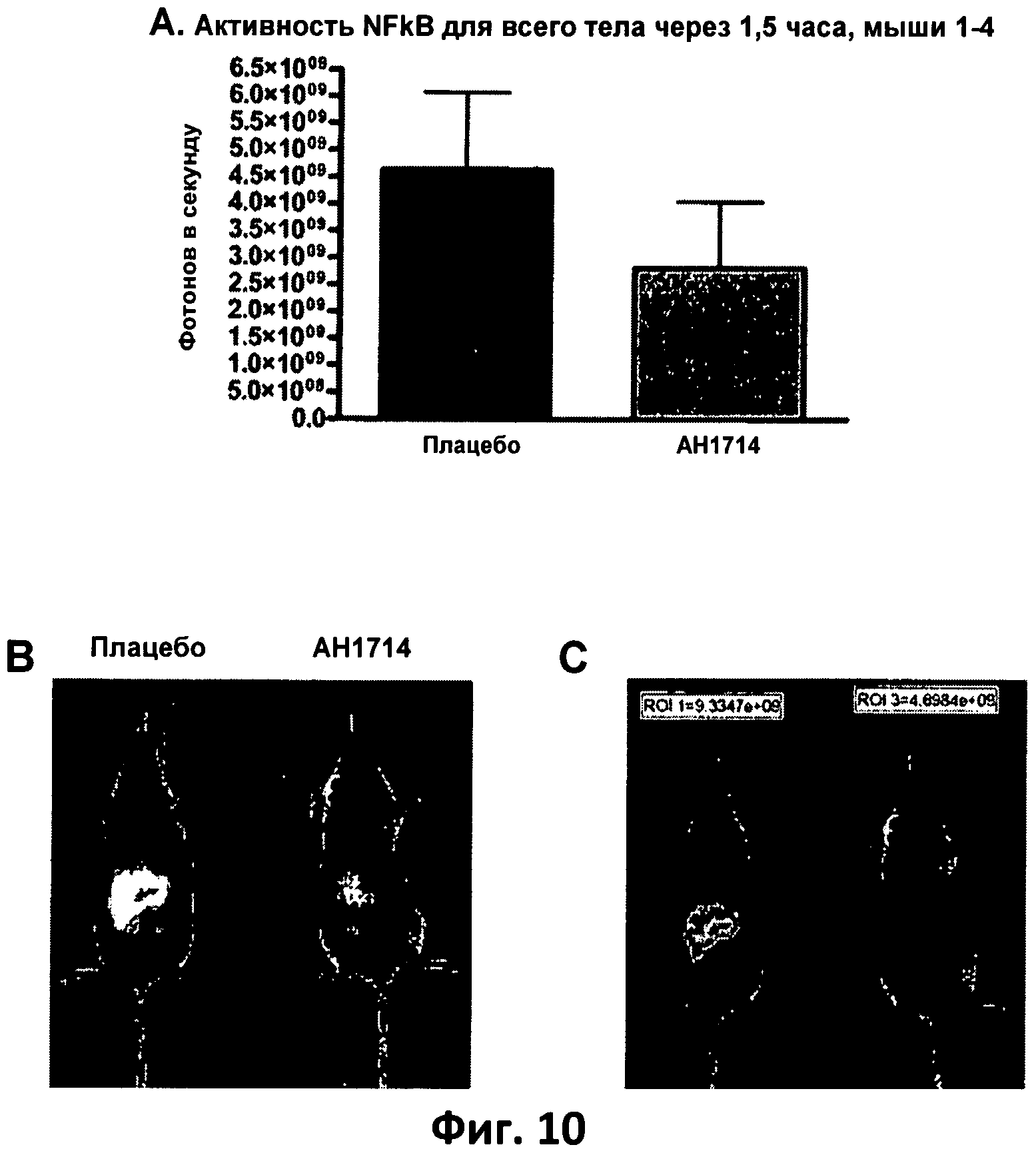
Фиг.10. (А) Столбчатая диаграмма, отображающая активность NFkB (фотонов/с) для целых животных, которых кормили плацебо и штаммом 1714, через 1,5 часа после обработки одной дозой липополисахаридов (LPS) в количестве 0,5 мг/мг; (В) и (С) - представительные изображения целых животных (черно-белое и цветное).
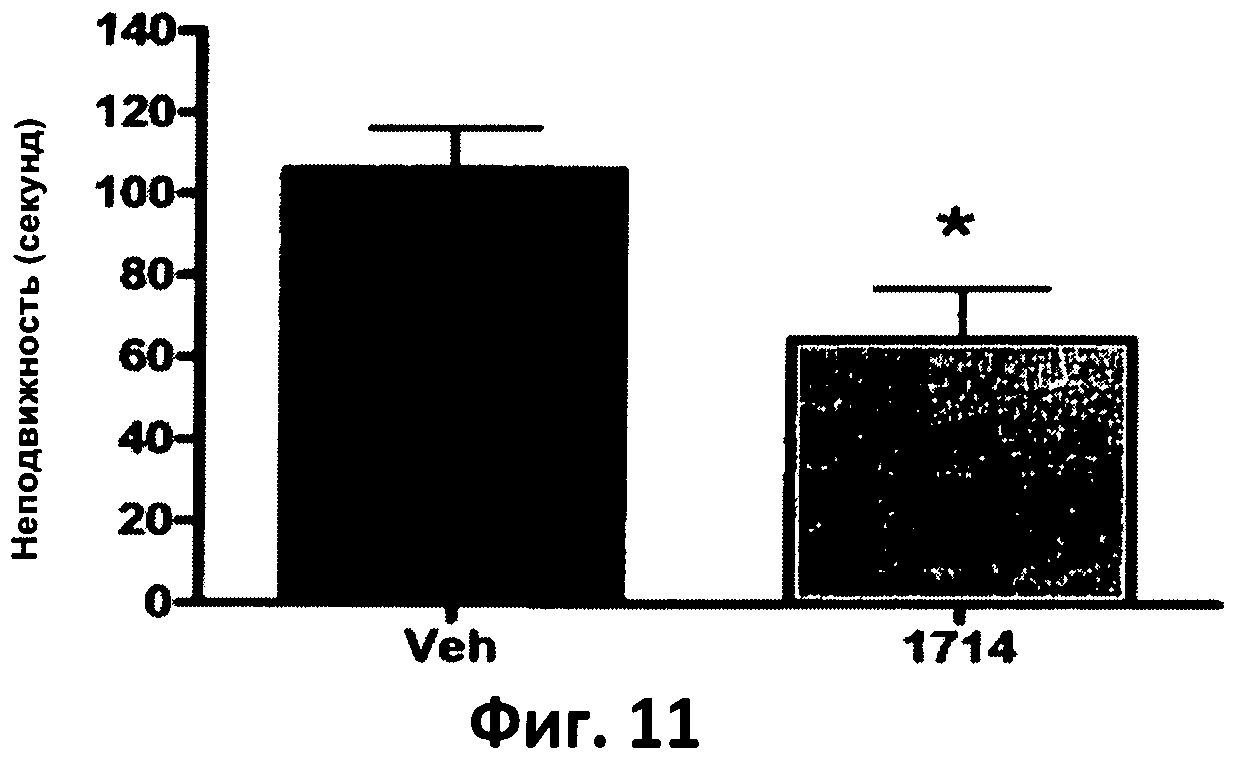
Фиг.11. Столбчатая диаграмма, отображающая время неподвижности мышей после 6-минутного теста на испуг.
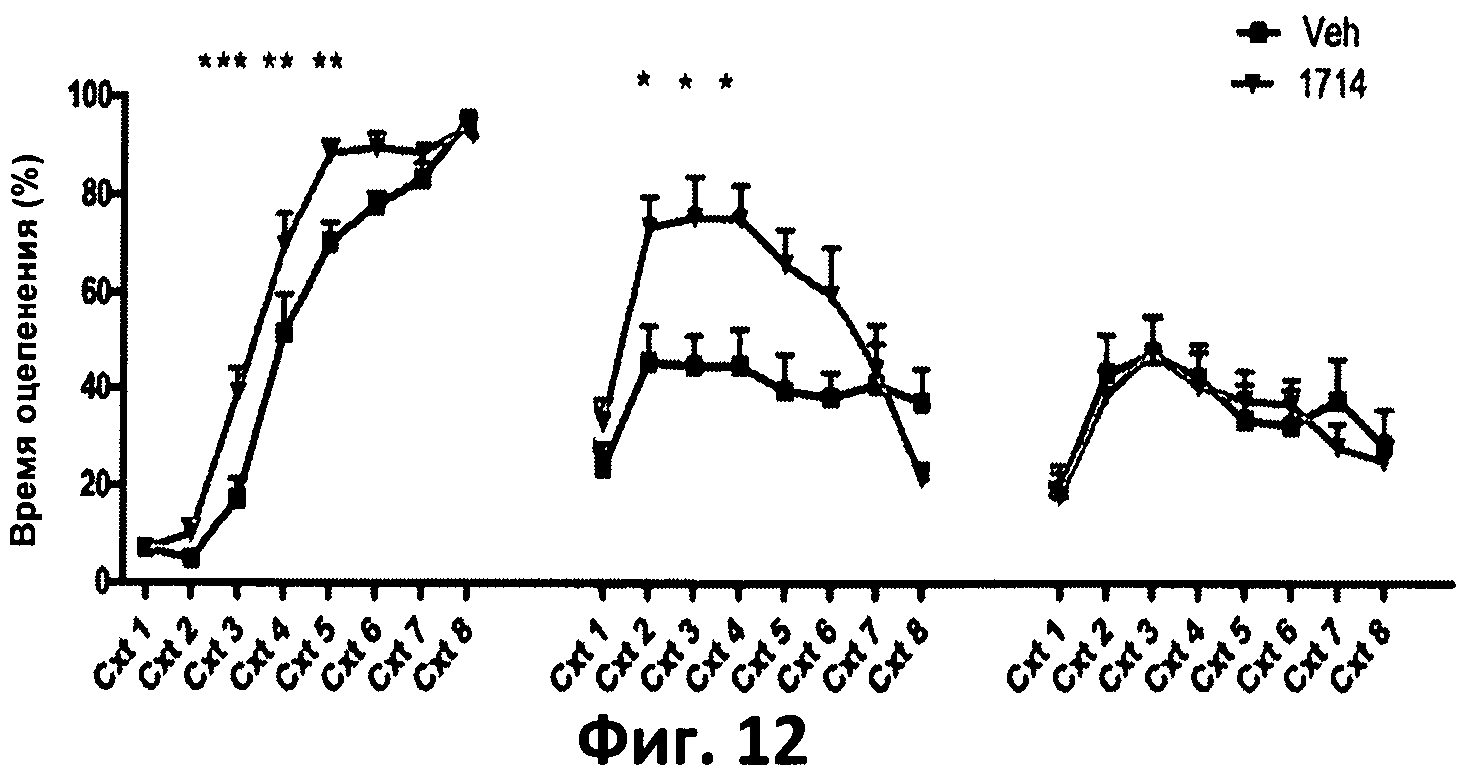
Фиг.12. График, отображающий процент времени оцепенения в ответ на контекстные стимулы (Ctx), ассоциирующиеся с испугом, в первый день (приобретение страха), второго дня (память/забывание) и третьего дня (забывание).
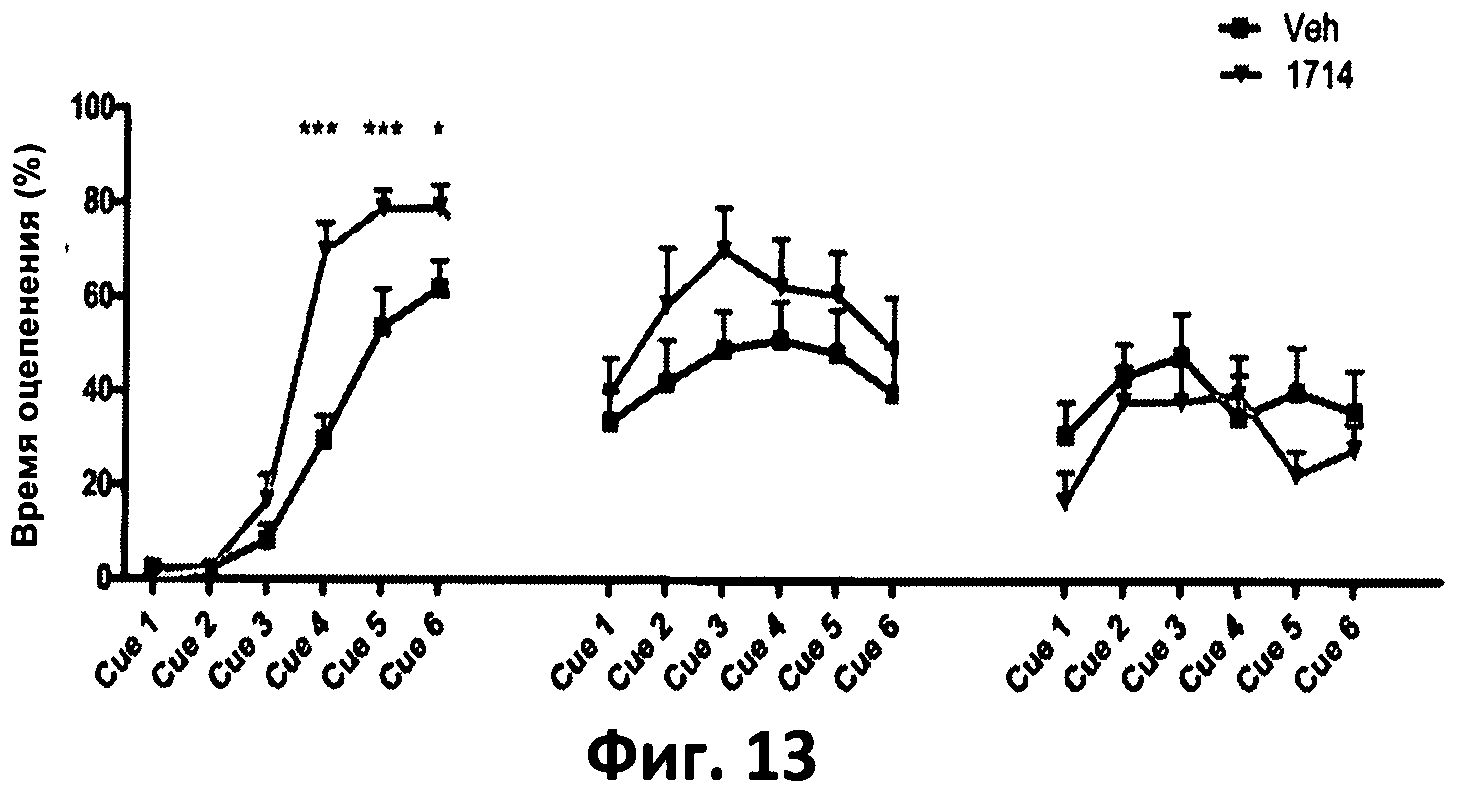
Фиг.13. График, отображающий процент времени оцепенения в ответ на информативные стимулы (Cue), ассоциирующиеся с испугом, в первый день (приобретение страха), второго дня (память/забывание) и третьего дня (забывание).
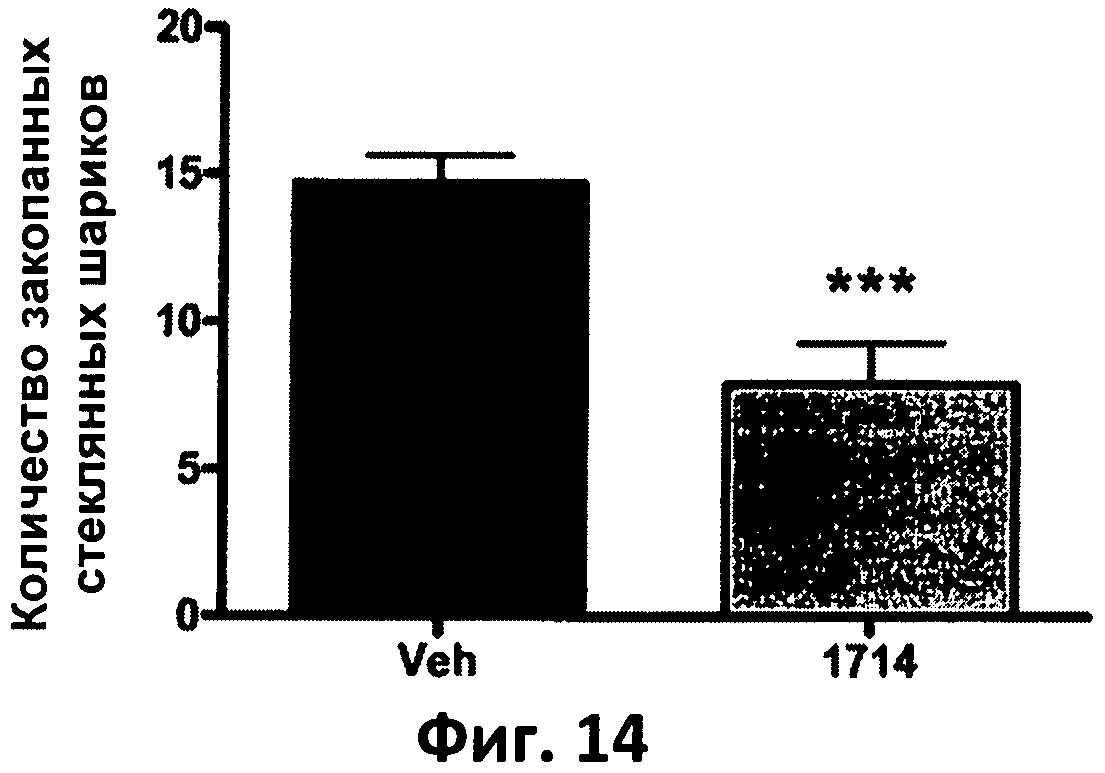
Фиг.14. Столбчатая диаграмма, отображающая количество стеклянных шариков, закопанных мышами в течение 30 минут.
Фиг.15. Столбчатая диаграмма, отображающая изменение температуры тела мышей (ΔТ) после обработки.
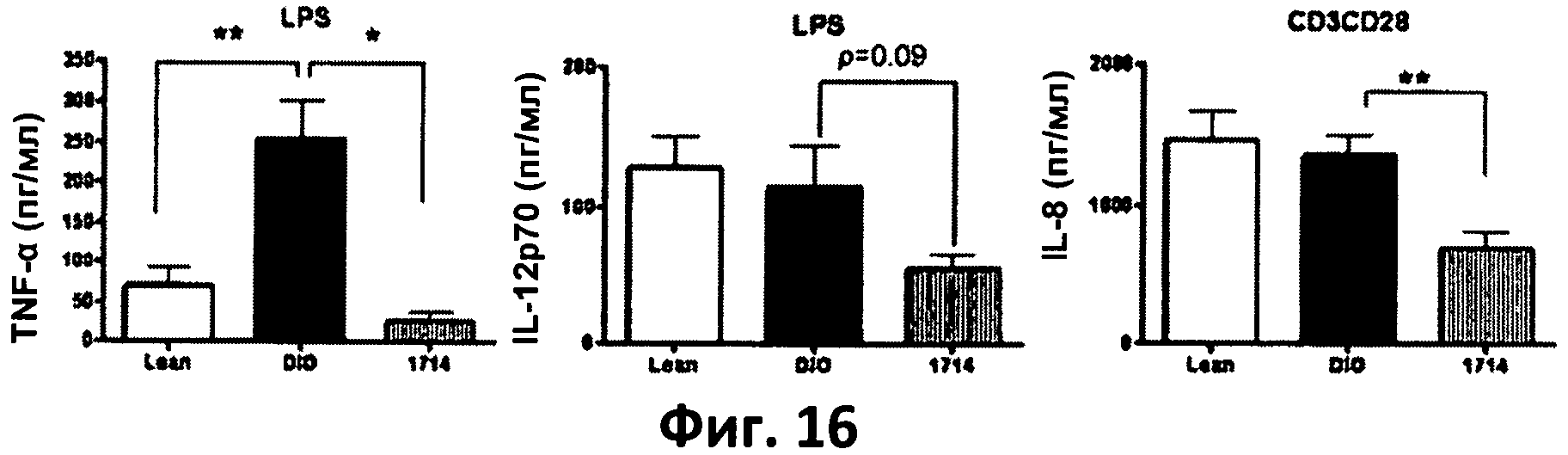
Фиг 16. Столбчатая диаграмма, отображающая изменения уровней цитокинов в стимулированных спленоцитах мышей при различном рационе питания.
Подробное описание изобретения
Штамм Bifidobacterium longum АН 1714 был внесен в Национальную коллекцию промышленных и морских бактерий (NCIMB - Абердин, Великобритания) 5 ноября 2009 года с присвоением ему номера NCIMB 41676.
Штамм Bifidobacterium longum UCC35624 был внесен в Национальную коллекцию промышленных и морских бактерий (NCIMB - Абердин, Великобритания) 13 января 1999 года с присвоением ему номера NCIMB 41003.
Примеры
В приведенных ниже примерах содержится подробное описание воплощений настоящего изобретения. Примеры приведены только в иллюстративных целях и не должны рассматриваться как ограничения настоящего изобретения, так как возможно множество их вариаций без отхода от идей и масштабов настоящего изобретения.
Пример 1 - Выделение Bifidobacterium longum АН 1714
Штамм Bifidobacterium longum АН 1714 был выделен из образцов ткани толстой кишки здоровых людей, полученных способом биопсии.
Проводили скрининг различных отделов желудочно-кишечного тракта человека, предварительно намеченных во время колоректального зондирования, на наличие пробиотических бактериальных штаммов. Образцы ткани слизистой оболочки желудочно-кишечного тракта человека собирали в пробирку с солевым раствором и фосфатным буфером (PBS), с добавлением 0,05% цистеина-HCl). Для выделения микроорганизмов, живущих в ткани, использовали тритон Х-100 (0,05%). После этого образцы тканей инкубировали в течение 10 мин. Образцы энергично встряхивали, после чего бактерии видов Lactobacilli и Bifidobacteria, живущие в ткани, разделяли друг от друга путем посева на селективную агарозную среду (агар De Man, Rogosa and Sharpe (MRS) + ванкомицин и агар Wilkins-Chalgren + мупироцин соответственно). Отдельные колонии снимали с агара и для обеспечения их чистоты проводили трехкратный повторный посев штрихом. Для выявления потенциальных бифидобактерий использовали микроскопию, окрашивание по Грамму, каталазный тест и анализ на фруктозу-6 фосфат фосфокетолазу. Выделенные штаммы растворяли в 40%-ном глицерине и хранили при температуре от -20°С до -80°С. Для дополнительной идентификации выделенных штаммов использовали секвенирование межгенной спейсерной области 16S.
После выделения чистого штамма бифидобактерий, обозначенного АН 1714, оценивали его микробиологические характеристики, которые приведены в Таблице 1 ниже.
Бактерии штамма АН 1714 являются грамположительными, каталаза отрицательными, фруктоза-6-фосфат фосфокетолазаположительными бактериями плеоморфной формы, что подтверждает, что они являются бифидобактериями.
Для дополнительной идентификации выделенных бифидобактерий проводили секвенирование межгенной спейсерной области 16s-23s (далее обозначается так же как IGS) по следующей методике. Из бактерий штамма АН 1714 выделяли ДНК с помощью 100 мкл экстракционного раствора и 25 мкл препарационного раствора для ткани (набор реактивов XNAT2 производства Sigma). Образцы инкубировали в течение 5 мин при комнатной температуре, затем 2 часа при температуре 95°С, после чего добавляли 100 мкл нейтрализующего раствора из того же набора Sigma XNAT2. Определяли количество геномной ДНК в растворе с помощью спектрофотометра Nanodrop. Полученные образцы хранили при 4°С. Проводили полимеразную цепную реакцию с IGS-специфичными праймерами: IGS R 5'-CTGGTGCCAAGGCATCCA-3' (идентификационный №4) и IGS L 5'-GCTGGATCACCTCCTTTCT-3' (идентификационный №3). Реакцию проводили при следующих параметрах циклов: 94°С в течение 4 минут (1 цикл), 94°С в течение 45 секунд, 53°С в течение 45 секунд, 72°С в течение 45 секунд (28 циклов). Реакционная смесь для ПЦР содержала 2 мкл (100 нг) ДНК, набор для ПЦР Red Taq производства Sigma, 0.025 нМ праймеров IGS L и IGS R (MWG Biotech, Германия). Реакции проводили на амплификаторе Biotherma. Для анализа экспрессии IGS продукты ПЦР (в количестве 10 мкл) разделяли в 2% агарозном геле с буфером ТАЕ, окрашенном бромидом этидия, с маркером молекулярного веса (с шагом 100 пар нуклеотидов, производства Roche). Отдельные продукты амплификации, соответствующие отдельным полосам после разделения в геле, очищали с помощью набора реактивов Wizard PCR производства Promeg. Очищенные продукты ПЦР секвенировали с использованием IGS-специфичных праймеров, последовательности которых приведены выше. Расшифрованные последовательности проверяли по базе данных нуклеотидных последовательностей NCBI на гомологию с известными последовательностями с использованием стандартной программы поиска BLAST (http://www.ncbi.nlm.nih.gov/BLAST/). После нахождения наиболее близких последовательностей производили их выравнивание с исследуемыми с помощью программы DNASTAR MegAlign. Полученные последовательности (прямая последовательность IGS, идентификационный номер 1 и обратная последовательность IGS, идентификационный номер 2, - приводятся в списке последовательностей). Поиск по базе данных NCIMB показал, что штамм АН 1714 характеризуется уникальными последовательностями IGS (прямая и обратная), имеющими достаточно высокую степень гомологии с соответствующими последовательностями бактерий Bifidobacterium longum.
Для определения «штрихкода» ПЦР для штамма АН 1714 проводили ПЦР с использованием праймеров BOX (8). Реакции проводили при следующих параметров циклов 94°С в течение 7 минут (1 цикл); 94°С в течение 1 минуты, 53°С в течение 45 секунд, 65°С в течение 8 минут (30 циклов) и 65°С в течение 16 минут. Реакционная смесь содержала 50 нг ДНК, набор для ПЦР Sigma Red Taq и 0,03 нМ праймера BOXA1R (5'- CTACGGCAAGGCGACGCTGACG-3') (идентификационный номер 5) (MWG Biotech, Германия). Реакции проводили на амплификаторе Biotherma. Продукты ПЦР (в количестве 10 мкл) разделяли в 3% агарозном геле с маркером молекулярного веса (с шагом 100 пар нуклеотидов, производства Roche) и фотографировали.
Чувствительность к антибиотикам
Характеристики чувствительности к антибиотикам штамма В. longum АН 1714 определяли методом дисков. Культуру выращивали в подходящей бульонной питательной среде в течение 48 часов, и 100 мкл среды с выросшими бактериями наносили на агар-содержащую среду. Поверх на агар укладывали диски, содержащие антибиотики в известных концентрациях. После инкубации в течение 1-2 дней при температуре 37°С в анаэробных условиях осматривали образцы и определяли чувствительность штамма к антибиотикам.
Прохождение через желудочно-кишечный тракт
Чтобы определить, могут ли бактерии штамма Bifidobacterium longum АН 1714 выживать при низких значениях рН, соответствующих значениям рН в желудке, собирали бактериальные клетки свежевыращенной в течение ночи культуры, дважды промывали в фосфатном буфере (рН 6,5) и ресуспендировали в бульоне TPY, рН которого был доведен до 2,5 (с помощью 1М раствора НСl). Клетки инкубировали при температуре 37°С и определяли их выживание через 5, 30, 60 и 120 минут методом чашечного подсчета. АН1714 хорошо выживали в течение 5 мин при рН 2,5, но спустя 30 минут жизнеспособных клеток не обнаруживалось.
После выхода из желудка клетки возможного пробиотика подвергаются воздействию солей желчной кислоты в тонком кишечнике. Для определения способности штамма В. longum АН1714 выживать под воздействием солей желчной кислоты культуры высевали штрихом на чашках с агаром TPY с добавлением 0,3%, 0,5%, 1%, 2%, 5%, 7,5% и 10% свиной желчи (вес/объем). Рост В. longum АН1714 наблюдали на чашках, содержавших вплоть до 0,5% желчи.
Способность В. longum АН 1714 проходить через желудочно-кишечный тракт изучали на мышах, не содержавших бактерий. Мыши потребляли 1×10 бактерий АН1714 в день и в их фекалиях определяли количество скормленных им бактерий. Обнаружение бактерий АН1714 облегчалось тем, что для кормления использовались спонтанно-вариантные бифидобактерии, устойчивые к рифампицину. Только они давали рост культур на среде RCA+цистеин с добавлением рифампицина. Образцы фекалий собирали ежедневно и определяли в них содержание В. longum АН 1714, в результате чего был получен график прохождения бактерий через желудочно-кишечный тракт (см. фиг.1).
Антимикробное действие
Для оценки антимикробной активности штамма В. longum АН 1714 против показательных культур и выявления, вызвана ли антимикробная активность выработкой кислоты, бактерии АН 1714 выращивали в среде MRS (с добавлением 0,05% цистеин-HCl). 2 мкл культуры АН 1714 точечно наносили на агар и инкубировали в течение 24 часов. Показательные микроорганизмы выращивали в средах: TSB (E.coli и Salmonella typhimurium), бруцелловый бульон (Campylobacter jejuni) и RCM (улучшенная среда для клостридий - Clostridium difficile). Расплавленную среду, содержащую 2% (объем/объем) ночной культуры показательных микроорганизмов выливали в виде второго слоя поверх слоя агара с точечно нанесенными пробиотическими культурами, после чего проводили выращивание культур в течение ночи. Чашки инкубировали при 37°С и прочих условиях, подходящих для роста показательной культуры, и записывали показатели роста спустя 24-48 часов. Зоны просветления диаметром более 1 мм рассматривались как факт чувствительности показательной культуры к пробиотическому штамму. Анализ проводили также на среде с добавлением 2% β-глицерофосфата в качестве буферного вещества, ограничивающего антагонистическую активность бифидобактерий вследствие выработки кислоты.
Получение штаммов АН1714, устойчивых к рифампицину (Rif*)
Для исследования прохождения бактерий АН 1714 через желудочно-кишечный тракт получали вариант, устойчивый к рифампицину (rif+), следующим образом: 100 мкл свежей бульонной культуры АН 1714 размазывали по среде MRS + рифампицин + цистеин с наименьшей концентрацией рифампицина в используемом диапазоне (0,1%, 0,08%, 0,06%, 0,04%, 0,02% и 0,002%). В качестве положительного контроля в тест включали чашку со средой без рифампицина. Оба набора чашек инкубировали в анаэробных условиях при температуре 37°С в течение 48 часов. Вынутые из инкубатора чашки проверяли на чистоту, после чего из агара, содержащего рифампицин, вырезали одну колонию и наносили ее штрихованием на чашку с агаром, содержащим следующий уровень концентрации рифампицина. Кроме того, в качестве контроля из чашки с чистым агаром MRS также вырезали одну колонию и наносили ее на чашку со свежей порцией агара MRS. Оба набора чашек инкубировали в анаэробных условиях при температуре 37°С в течение 48 часов. Данный процесс повторяли, пока не был пройден весь диапазон уровней рифампицина. Единичную колонию полностью выросшей культуры из чашки с агаром MRS, содержавшим 50 мкг/мл рифампицина, инокулировали в 20 мл бульона MRS, и полученную культуру хранили как запас для последующих экспериментов. Соответствие культур, использовавшихся в дальнейших экспериментах, данному штамму подтверждали микроскопическим исследованием, секвенированием области IGS и специфичным ПЦР-анализом.
Пример 2 - Скрининг на агаре с красителем конго красный
Для фенотипического скрининга бактериальных штаммов, экспрессирующих EPS (внеклеточные полисахариды), использовали тест на агаре с красителем конго красный. Процедура состояла в следующем. В 10 мл модифицированной (добавлением 0,05% цистеина) бульонной среды Rogosa асептически инокулировали свежевыращенную колонию бактериального штамма, после чего проводили инкубацию в анаэробных условиях при 37°С до появления мутности (примерно от 16 до 24 часов). Бульонные культуры асептически штриховали на чашки с агаром, содержащим краситель конго красный и инкубировали при 37°С в течение 48 часов. Считается, что EPS, вырабатываемые в качестве побочного продукта роста и/или метаболизма определенных штаммов бактерий, препятствует поглощению ими красителя конго красный, в результате чего колония имеет молочно-белый цвет. Штаммы, вырабатывающие меньше EPS, сильнее окрашиваются красителем конго красный, в результате чего колония имеет цвет между розовым и красным. Штаммы, которые вообще не вырабатывают EPS, приобретают красную окраску и выглядят практически прозрачными на фоне красного агара.
Как показано на фиг.2, колонии В. longum АН 1714 имеют выпуклую мукоидную морфологию и ярко-белый цвет.
Пример 3: В. longum АН 1714 вызывает значительное повышение отношения IL-10:IL-12.
Из периферической крови здоровых людей выделяли мононуклеары с помощью препарационных пробирок Vacutainer производства BD (номер по каталогу 362761), в соответствии с инструкцией производителя. Мононуклеары периферической крови промывали и ресуспендировали в модифицированной среде Glutamax™ производства Dulbecco, содержавшей глутамакс (заменитель глютамина) + пируват + 4,5 г/л глюкозы (Gibco, номер по каталогу 10569-010) + 10% эмбриональную бычью сыворотку (Sigma, номер по каталогу F4135), с добавлением 1% пенициллина/стрептомицина (Sigma, номер по каталогу Р0781). Мононуклеары периферической крови инкубировали в плоскодонных пластинах с 96 ячейками (2×105 клеток в ячейке) с добавлением 20 мкл бактериальной суспензии (с концентрацией бактерий 1×107 КОЕ/мл) в течение 48 часов при температуре 37°С в атмосфере, содержавшей 5% СO2. После инкубации в течение 2 дней чашки центрифугировали при 300 g, супернатант удаляли, и полученные образцы хранили при температуре -80°С до последующих опытов. Уровни интерлейкина 10 (IL-10) и интерлейкина-12р70 (IL-12p70) в супернатанте культуры определяли с помощью набора с 96 ячейками производства Meso Scale Discovery (Гейтерсбург, штат Мэриленд, США; номер по каталогу К15008В-1).
Бактерии для экспериментов совместного выращивания готовили двумя способами: (а) свежевыращенные бактерии выращивали в среде Difco MRS и собирали сразу после входа в стационарную фазу. Все клетки выращивали при анаэробных условиях при температуре 37°С; (b) бактерии выращивали при анаэробных условиях при температуре 37°С в среде Difco MRS и собирали сразу после входа в стационарную фазу. Из каждого препарата бактерий готовили лиофилизированный порошок и хранили при -80°С в отдельной емкости в виде аликвот по 100 мг. Непосредственно перед использованием по одной аликвоте каждого штамма извлекали из холодильника и давали ей прогреться до комнатной температуры. Для каждого опыта использовали новую аликвоту. Каждый штамм промывали 3 раза в пробирке емкостью 10 мл и затем центрифугировали. Для каждого из условий роста строили калибровочные кривые (зависимость оптической плотности от количества живых клеток), и препарат с промытыми клетками нормализовали, чтобы получить нужное число клеток перед его добавлением к мононуклеарам периферийной крови. Во всех экспериментах использовался контроль, не содержавший бактерий. Все анализы проводили троекратно. Результаты представлены на фиг.3.
Борьба организма с воспалительными процессами происходит одновременно на нескольких уровнях. Факторы борьбы организма с воспалительными процессами включают гормоны, простагландины, нейтрализаторы активных форм кислорода и азота, лейкотриены и цитокины. Цитокины представляют собой имеющие низкий молекулярный вес биологически активные белки, участвующие в выработке иммунологических и воспалительных реакций и управлении ими. Цитокины вырабатываются клетками нескольких типов, а основными их источниками являются нейтрофилы, моноциты и лимфоциты, так как они присутствуют в большом количестве при воспалительных реакциях в пораженных местах.
Существует множество механизмов, посредством которых цитокины, вырабатываемые в воспаленных местах, влияют на воспалительную реакцию. Хемотаксис стимулирует локализацию воспаленных клеток в поврежденном месте, в то время как определенные виды цитокинов способствуют инфильтрации клеток в ткань. А именно, вырабатываемые в поврежденной ткани цитокины активизируют инфильтрацию в воспаленную ткань. Большинство цитокинов являются плейотропными и проявляют множество перекрывающихся друг с другом видов биологической активности. Чрезмерная выработка цитокинов может привести к неконтролируемой воспалительной реакции, и одной из болезней такого типа является воспалительная болезнь кишечника.
Интерлейкин-10 (IL-10) является противовоспалительным цитокином, вырабатываемым многими типами клеток, включая моноциты, макрофаги, дендритовые клетки, тучные клетки и лимфоциты (в частности, регуляторные Т-лимфоциты). IL-10 регулируют в сторону снижения экспрессию провоспалительных цитокинов Thl, антигенов главного комплекса гистосовметимости (MHC) класса II и со-стимулирующих молекул по отношению к клеткам, вырабатывающим антигены. Они также повышают выживаемость В-клеток, пролиферацию клеток и выработку антител. Данный цитокин может блокировать активность NF-κВ и участвует в регулировании работы сигнального пути JAK-STAT. Исследования на мышах показали, что IL-10 играет существенную роль в иммунорегуляции, в частности у мышей IL-10KO развивался острый колит. Кроме того, было показано, что бактерии, которые являются мощными индукторами IL-10, стимулируют дифференциацию регуляторных Т-лимфоцитов in vivo и тем самым способствуют иммунологическому равновесию (7; 8).
Интерлейкин-12 (IL-12) является провоспалительным цитокином, который ассоциируется с поляризацией Т-клеток, которые являются эффекторами Nhl, то есть вызывают выработку прочих провоспалительных цитокинов Nhl, таких как интерферон гамма (IFN-γ) и фактор некроза опухолей (TNF-α) в Т-клетках и NK-клетках (природных киллерах). Высокие уровни экспрессии IL-12 связывают также с автоиммунными проблемами. Было показано, что назначение IL-12 пациентам, страдающим автоиммунными болезнями, приводило к обострению симптомов болезни. В противоположность этому, лечение мышей антителами, нейтрализующими IL-12, приводило к улучшению их состояния.
Воспалительной реакцией управляют каскады и сети цитокинов, а не просто имеет место действие одного типа цитокина на один тип клеток. Поэтому относительный уровень экспрессии двух цитокинов (баланс), например IL-10 и IL-12, является значительно более информативным показателем, чем экспрессия одного типа цитокина. В нашем исследовании мы проводили стимулирование мононуклеаров периферической крови человека различными бактериальными штаммами. Все штаммы индуцировали экспрессию как IL-10, так и IL-12. Однако анализ отношения уровней экспрессии IL-10 и IL-12 показал, что некоторые бактериальные штаммы давали более высокое отношение уровней экспрессии (больше IL-10 и меньше IL-12) по сравнению с уровнями экспрессии, вызываемыми другими штаммами, что очень важно, так как именно баланс между данными двумя противоположными сигналами в конечном итоге определяет исход иммунологической реакции. Можно ожидать, что высокое отношение экспрессии IL-10: IL-12 вызовет противовоспалительную реакцию и благоприятные иммунорегуляторные процессы, в то время как низкое отношение IL-10:IL-12 вызовет Thl-поляризацию иммунного ответа. Поэтому отношение уровней экспрессии 1 IL-10:IL-12 в мононуклеарах периферической крови является важным критерием отбора при определении бактериальных штаммов, обладающих иммунорегуляторными свойствами.
Пример 4. Долговременное кормление мышей штаммом Bit. АН 1714 вызывает повышенный уровень противовоспалительного цитокина IL-10 и пониженный уровень провоспалительных Thl-цитокинов TNF-q, IFN-Y и IL-12 у здоровых животных в модели септического воспаления.
Материалы и методы
Для опыта использовали женские особи мышей Balb/c возрастом 6-8 недель (приобретенные у Harlan UK), которых держали в индивидуально вентилируемых клетках и которым обеспечивали неограниченный доступ к воде и стандартному корму для мышей.
Мышей примерно одинакового веса разбивали на 2 произвольные группы, одной из которых назначали солевой раствор с фосфатным буфером (PBS), как носитель бактерий - (контрольная группа с количеством особей n=9), а второй группе назначали штамм Bifidobacterium longum АН 1714 (количество особей n=17) принудительно через оральный зонд в течение 115 дней. После периода назначения брали анализ крови у 10 мышей, которым давали АН 1714, и 6 мышей контрольной группы, после чего мышам вводили LPS (липополисахариды) производства Sigma (номер по каталогу L4391) в количестве 1 мг/кг путем внутрибрюшной инъекции.
После периода назначения брали анализ крови у 6 мышей, потреблявших АН 1714, и 4 мышей контрольной группы. Сыворотку крови выделяли и сохраняли для последующих измерений уровней цитокинов. У мышей удаляли селезенку и из нее выращивали суспензионную культуру одной клетки in vitro. Через 48 часов после выращивания измеряли уровни цитокинов в клеточных супернатантах.
Еще 10 мышам, получавшим АН 1714, и 6 мышам контрольной группы назначали одиночную дозу LPS в количестве 1 мг/кг путем внутрибрюшной инъекции. Спустя 2 часа брали анализ крови и мышей выбраковывали. Из мышей выделяли сыворотку и клетки спленоцитов, которые обрабатывали и анализировали, как описано выше.
Анализ содержания цитокинов в спленоцитах
Из селезенки выделяли спленоциты и инкубировали их при температуре 37°С в течение 48 часов в присутствии пенициллина и стрептомицина в трех средах: в контрольной среде, среде с добавлением LPS и среде с antiCD3/CD28. Анализ уровня цитокинов в супернатантах культур проводили с помощью набора на 96 ячеек производства Meso Scale Discovery (Гейтерсбург, штат Мэриленд, США; № по каталогу К15008В-1). Уровни интерлейкина 1β (Il-1b), интерлейкина 6 (Il-6), интерлейкина 8 (Il-8) интерлейкина 10 (Il-10), интерлейкина 12р70 (Il12р70), интерферона-гамма (IFN-γ) и фактора некроза опухолей альфа (TNFα) определяли количественно и выражали в пикограммах на миллилитр (пг/мл).
Анализ уровня цитокинов в сыворотке
Сыворотку анализировали с помощью сверхчувствительного набора для анализа уровня IL-10 и TNF-α у мышей производства Meso Scale Discovery.
Результаты
Длительное (в течение 115 дней) кормление мышей бифидобактериями АН 1714 вызывало повышение уровня противовоспалительного цитокина IL-10, выделенного из стимулированных ex vivo мононуклеаров периферийной крови, по сравнению с группой, получавшей плацебо (PBS) у здоровых мышей (фиг.4 (В)) и мышей модели септического воспаления (мыши, получавшие LPS - смотри фиг.4 (С))
Длительное (в течение 115 дней) кормление мышей бифидобактериями АН 1714 вызывало понижение уровня провоспалительного цитокина IL-12 (субъединица р70), а также Thl-цитокинов TNF-α и IFN-γ, выделенных из стимулированных ех vivo мононуклеаров периферийной крови, по сравнению с группой, получавшей плацебо (PBS) у мышей модели септического воспаления (мыши, получавшие LPS - фиг.5 (В), 6 (В) и 7 (В)).
Длительное (в течение 115 дней) кормление мышей бифидобактериями АН 1714 вызывало повышение уровня противовоспалительного цитокина IL-10 и понижение уровня провоспалительного цитокина IL-12 (субъединица р70), а также Thl-цитокинов TNF-α, по сравнению с группой, получавшей плацебо (PBS) у здоровых мышей и у мышей модели септического воспаления (мыши, получавшие LPS - фиг.8 (А и В)).
В совокупности данные результаты показывают, что штамм Bifidobacterium longum АН 1714 обладает системным иммуномодулирующим и противовоспалительным действием и защищает против воспалительных реакций, вызванных LPS или TLR-4.
Пример 5: Bifidobacterium longum АН 1714 обладает иммуномодулирующим действием при совместном инкубировании с клетками иммунной системы человека, отличным от действия Bifidobacterium longum AH35624.
Материалы и методы
Две независимые культуры (1 и 2) штамма Bifidobacterium longum infantis UCC35624 (В624) и штамм Bifidobacterium longum АН 1714 подвергали анализу на индукцию цитокинов в мононуклеарах периферийной крови. Бактерии для совместного выращивания готовили следующим образом. Бактерии выращивали при анаэробных условиях при температуре 37°С в среде Difco MRS и собирали сразу после входа в стационарную фазу. Из каждого типа бактерий готовили лиофилизированный порошок и хранили при -80°С в отдельном сосуде в виде аликвот по 100 мг. Непосредственно перед использованием по одной аликвоте каждого штамма извлекали из холодильника и давали ей прогреться до комнатной температуры. Для каждого опыта использовали новую аликвоту. Каждый штамм промывали 3 раза в пробирке емкостью 10 мл и затем центрифугировали.
Проводили прямой подсчет количества клеток под микроскопом в счетной камере Петрова-Хауссера в соответствии с инструкциями производителя. Перед использованием клеток для анализа уровня цитокинов в мононуклеарах периферийной крови раствор промытых клеток нормализовали до получения одного и того же числа клеток в единице объема. В каждую ячейку для анализа добавляли 20 мкл раствора бактерий в солевом растворе с фосфатным буфером (PBS), для получения общего числа бактерий, указанного в каждом эксперименте.
Анализ индукции цитокинов в мононуклеарах периферической крови Мононуклеары периферической крови выделяли из периферической крови здоровых людей с помощью препарационных пробирок Vacutainer производства BD (номер по каталогу 362761), в соответствии с инструкцией производителя. Мононуклеары периферической крови промывали и ресуспендировали в модифицированной среде Modified Eagle Medium-Glutamax™ производства Dulbecco, содержавшей глутамакс (заменитель глютамина) + пируват + 4,5 г/л глюкозы (Gibco, номер по каталогу 10569-010) + 10% эмбриональной бычьей сыворотки (Sigma, номер по каталогу F4135), с добавлением 1% пенициллина/стрептомицина (Sigma, номер по каталогу Р0781). Мононуклеары периферической крови инкубировали в пластинах с 96 плоскодонными ячейками (2×105 клеток в ячейке) с добавлением 20 мкл бактериальной суспензии в течение 48 часов при температуре 37°С в атмосфере, содержавшей 5% СО2. После инкубации в течение 2 дней чашки центрифугировали при 300 g, супернатант снимали, и полученные образцы хранили при температуре -80°С до проведения анализа. Уровни интерлейкина 10 (IL-10) и интерлейкина-12р70 (IL-12p70) в супернатанте культуры определяли с помощью набора с 96 ячейками производства Meso Scale Discovery (Гейтерсбург, штат Мэриленд, США; номер по каталогу К 15008В-1). Уровни человеческого интерлейкина 1β (Il-1β), человеческого интерлейкина 6 (I1-6), человеческого интерлейкина 8 (Il-8) человеческого интерлейкина 10 (Il-10), человеческого интерлейкина 12р70 (Il12р70), человеческого интерферона-гамма (IFN-γ) и человеческого фактора некроза опухолей альфа (TNF-α) определяли количественно и выражали в пикограммах на миллилитр (пг/мл). Для каждого образца проводили по два опыта.
Результаты
Две независимые культуры (1 и 2) штамма Bifidobacterium longum infantis UCC35624 (В624) и штамм Bifidobacterium longum AH1714 исследовали на иммуномодулирующие свойства методом анализа индукции цитокинов в мононуклеарах периферической крови при добавлении 1,0×107 бактерий. Супернатанты исследовали на уровни целого набора цитокинов, включая IL-1β, -6, -8, -10H-12, IFN-α и IFN-γ.
По сравнению со штаммом 35624 (обе партии культур которого давали аналогичные результаты по всем исследованным видам цитокинов), штамм AH1714 также давал схожие результаты по многим исследованным видам цитокинов, но на удивление, штамм AH1714 давал совершенно отличные уровни цитокинов IL-12, IFN-γ и IL-6.
IL-6: инкубация с AH1714 индуцирует значительно меньший уровень IL-6 по сравнению с 35624 при количестве бактерий 1,0×107 на ячейку (смотри таблицу 5).
IL-12: инкубация с AH1714 индуцирует значительно меньший уровень IL-12 по сравнению с инкубацией с 35624 при количестве бактерий 1,0×107 на ячейку (смотри таблицу 6).
INF-γ: инкубация с АН 1714 индуцирует значительно меньший уровень INF-γ по сравнению с инкубацией с 35624 при количестве бактерий 1,0×107 на ячейку (смотри таблицу 6).
Foligne с соавторами (19) показали, что штаммы молочнокислых бактерий, индуцирующие высокий уровень противовоспалительного цитокина IL-10 in vitro и низкий уровень провоспалительного цитокина IL-12, в модельных исследованиях обеспечивали наивысший уровень защиты от колита in vivo и, наоборот, штаммы, индуцирующие низкое отношение цитокинов IL-10/IL-12, не обеспечивали значимое снятие симптомов колита. Характеристики индукции цитокинов для штамма Bifidobacterium longum АН 1714, позволяют предположить, что данный штамм обладает потенциалом снятия симптомов язвенного колита in vivo.
Считается также, что цитокин IL-6 сильно связан с патологическими состояниями, вызванными воспалительными заболеваниями кишечника. IL-6 имеет связь с многими болезненными состояниями, такими как диабет, атеросклероз, депрессия, болезнь Альцгеймера, системная красная волчанка и ревматоидный артрит. Поэтому существует большой интерес к разработке веществ, подавляющих экспрессию IL-6, в качестве терапевтического средства против многих, в том числе перечисленных выше болезней.
Пример 6 - Bifidobacterium longum АН 1714 уменьшает индуцируемую липополисахаридами (LPS) активность NFkB в модели септического воспаления у мышей in vivo
Материалы и методы
Трансгенных мышей NFkBlux на основе C57BL/6J-CBA/J приобретали у Charles River Laboratories (Вилмингтон, США) и выращивали в собственной лаборатории. Мышей содержали с сохранением между ними барьеров.
Особям женского пола назначали Bifidobacterium longum АН 1714 в форме лиофилизированного порошка, восстановленного в воде, в количестве примерно 1×109КОЕ/день на каждое животное. Мыши потребляли симбиотический микроорганизм с питьевой водой до насыщения, в течение 20 дней до воздействия на них липополисахаридами (LPS).
Активность NFkB измеряли после назначения субстратного люциферина, и животных сканировали с помощью аппарата Xenogen IVIS 100. Базовый уровень активности NFkB измеряли до введения одиночной дозы LPS в количестве 0,5 мг/кг. Спустя 3 часа всех животных повторно сканировали. Полная активность NFkB (активность NFkB во всем теле) определялась путем вычитания базового уровня.
После этого всех мышей выбраковывали, удаляли из них селезенку, печень и тонкую кишку. Полученные образцы помещали в чашки для культивирования культур для индивидуального сканирования.
Результаты
Bifidobacterium longum АН 1714 уменьшает системную активность NFkB, индуцируемую LPS в модели септического воспаления у мышей in vivo, что было продемонстрировано в виде уменьшения активности NFkB в селезенках, выделенных спустя 3 часа после введения LPS (см. Фиг.9), и по результатам сканирования целых животных спустя 1,5 часа после введения LPS (см. Фиг.10) у животных, получавших АН 1714, по сравнению с животными, получавшими плацебо. Данные результаты показывают, что кормление Bifidobacterium longum АН 1714 вызывает уменьшение уровня системного воспаления, связанного с фактором транскрипции NFkB.
Пример 7: употребление АН 1714 положительно влияет на преодоление депрессии и тревожности у животных
Депрессия и тревожность являются самыми типичными психическими расстройствами у животных, и степень их распространенности в обществе высока. Связанные с тревожностью нарушения обычно подразделяются на панические расстройства, генерализованные расстройства; пост-травматические расстройства и обсессивно-компульсивные расстройства.
Для лечения данных расстройств широко используются современные антидепрессанты, такие как селективные ингибиторы повторного захвата серотонина (например, флюоксетин) и селективные ингибиторы повторного норадренергического и серотониэнергического захвата (например, венлафаксин). Однако лечение не всегда эффективно и приемлемо для пациентов. Существует потребность в разработке альтернативных стратегий. В частности, на основании более ранних данных о снижении выработки гормона стресса - кортикостерона - у грызунов пробиотиком Bifidobacterium Infantis (9) было высказано предположение о возможной эффективности Bifidobacterium Infantis в вышеперечисленных состояниях.
В настоящем исследовании мы изучили влияние Bifidobacterium longum АН 1714 на поведение мышей в стрессовых моделях и сравнили его с эффектом приема широко используемых препаратов - селективных ингибиторов обратного захвата серотонина, в частности препарата эсциталопрам, который используется для лечения одновременно депрессии и тревожности. Животным в течение трех недель давали либо эсциталопрам, либо АН 1714 в течение трех недель.
Материалы и методы
Тест на подвешивание за хвост
Данный тест является одним из стандартных тестов, позволяющих хорошо оценить степень депрессии и антидепрессионную эффективность терапевтического средства. Мышей по отдельности подвешивали за хвост на горизонтальную перекладину кольцевого штатива (расстояние от перекладины до пола составляло 30 см) с помощью липкой ленты (расстояние от кончика хвоста до перекладины составляло 2 см). Как правило, в таких случаях мыши демонстрируют различные попытки убежать, чередующиеся с временными приступами неподвижности. Длительность теста составляла 6 минут. Поведение мышей во время теста записывали на видеокамеру. После этого хорошо обученный наблюдатель просматривал запись и анализировал поведение мыши. Наблюдатель не знал ничего о предшествующей обработке мышей. Регистрируемым параметром было суммарное время в секундах, в течение которых мышь была неподвижна.
Тест на условно-рефлекторный испуг
Такие тесты также широко применяются для оценки когнитивных составляющих тревожных расстройств. Для наших экспериментов мы использовали трехдневный протокол, который позволял наблюдать за обучением мышей контекстуальным и информативным сигналам, ассоциирующимся с испугом. После того, как мыши подвергались контекстуальному сигналу - 3 минутам на изучение окружающей обстановки, следовало 6 информативных сигналов длительностью 20 с каждый (тон 10 кГц громкостью 70 дБ в сочетании с включением светового сигнала на том же аппарате), в конце которых следовал легкий удар электрическим током по ногам (0,4 мА), после чего оставался лишь контекстуальный сигнал в течение 1 мин. Процедуру повторяли в течение двух последующих дней, но без электрического разряда. При этом наблюдали реакцию в поведении мышей в виде оцепенения в ответ на контекстуальный или информативный сигнал. Стрессовое воздействие в первый день позволяет усилить влияние контекстных и информативных сигналов на стенеь испуга, в то время как на третий день можно наблюдать эффект забывания учебного воздействия степень испуга. Забывание - это формирование новых связей в памяти, и лекарства, которые способствуют скорейшему забыванию, могут быть полезными для лечения расстройств, связанных с посттравматическим стрессом.
Тест на закапывание стеклянных шариков
Данный тест используется в качестве модели обсессивно-компульсивного расстройства. Животные, которые являются более тревожными, обычно склонны к более активному поведению, например, к закапыванию стеклянных шариков в качестве защитной реакции от анксиогенных стимулов, которыми могут быть, например, чередованием света и темноты и каскадные лабиринты в ящике. Мышей помещали в небольшие отдельные клетки, в которых на кучке опилок высотой 5 см было равномерно распределено 20 стеклянных шариков, а сверху на клетку клали сетчатую крышку. Мышей оставляли в покое на 30 минут, после чего подсчитывали число закопанных шариков (закопанными считались шарики, присыпанные опилками более чем на три четверти.
Результаты
В ходе тестов на подвешивание за хвост мыши, употреблявшие АН 1714, показали хорошие результаты, что позволяет предположить о наличии антидепрессантной активности у данного штамма. Как можно видеть на фиг.11, мыши, получавшие АН 1714, характеризовались меньшим временем неподвижности по сравнению с контрольной группой, потреблявшей носитель бактерий (Veh), что позволяет предположить менее депрессивное поведение мышей, потреблявших АН1714. Эффект схож от эффекта традиционно применяемых антидепрессантов, таких, как Lexapro®.
В данных тестах животные, потреблявшие АН1714, также показали лучшие результаты обучения. Как показано на фиг.12, во время теста на контекстуальные сигналы (воздействующие на гиппокапм- и миндалинно-зависимую память), животные, пореблявшие АН1714, в первый и второй день характеризовались большим временем оцепенения, а на третий день такое же время оцепенения, по сравнению с животными контрольной группы, потреблявшими носитель (Veh). Это позволяет предположить, что АН1714 стимулирует запоминание контекстуальных сигналов, ассоциирующихся со страхом, и не влияет на забывание, то есть играет положительную роль в стимулировании контекстуальной памяти связанных со страхом событий. Как показано на фиг.13, во время теста на информационные сигналы (воздействующие на миндалинную память), вызывающие испуг, животные, потреблявшие АН1714, характеризовались большим процентом времени оцепенения после информационного сигнала в первый день и таким же процентом времени оцепенения на второй и третий день по сравнению с мышами, потреблявшими носитель (Veh). Это позволяет предположить, что АН1714 стимулирует обучение информационным (миндалинно-зависимым сигналам страха) и их запоминание, не отражаясь на памяти и забывании, что позволяет предположить наличие положительного влияния АН1714 на запоминание стимулов страха независимо от контекста.
О возможности применения АН1714 для лечения обсессивно-компульсивных нарушений свидетельствуют результаты тестов с закапыванием шариков. Животные, потреблявшие АН1714, закапывали в данном тесте меньше стеклянных шариков, что говорит о меньшей тревожности данных животных и возможности применения АН1714 для лечения обсессивно-компульсивных нарушений (фиг.14). Как и в случае приема эсциталопрама, скармливание АН1714 давало меньшее повышение температуры тела при стрессе (уменьшало индуцированную стрессом гипертермию), что свидетельствует о меньшей тревожности животных, получавших АН1714 (фиг.14). При этом не было разности в результатах при обоих типах стрессовых воздействий.
Заключение
Испытания на животных в моделях депрессии и тревожности показали, что АН 1714 оказывает эффект, аналогичный воздействию обычного антидепрессанта. Наблюдаемое воздействие было аналогично описанному в литературе воздействию антидепрессантов типа SSRI (селективный ингибитор обратного захвата серотонина).
В целом полученные результаты показывают, что АН 1714 может быть полезен при лечении психиатрических синдромов депрессии и тревожности.
Пример 8: АН 1714 уменьшает экспрессию маркеров воспаления при алиментарном ожирении
В последние годы было достаточно хорошо показано, что ожирение связано с незначительным воспалением, которое постепенно приводит к развитию патологий, связанных с ожирением, которые включают сахарный диабет второго типа, болезни сердечно-сосудистой системы, гипертензию, гиперхолестеролемию, гипертриглицеридемию и неалкогольный цирроз печени. Внутренний жир продуцирует ряд воспалительных цитокинов и хемокинов (таких как лептин, фактор некроза опухолей-α (TNF-α), белок-хемоаттрактант макрофагов первого типа, интерлейкин-6 и прочие), продуцирование которых может патологически дерегулироваться в состоянии ожирения (обзор Shoelson с соавторами, 2007). Действительно, хотя предполагается, что макрофаги вносят значительный вклад в резистентность к инсулину, прочие исследования позволяют предположить, что управление противовоспалительными свойствами клеток, имеющих потенциально регуляторный фенотип, также имеет терапевтический потенциал. Недавние исследования позволяют предположить, что регуляторные Т-клетки снимают воспалительное состояние жировой ткани и тем самым резистентность к инсулину у мышей (Feurer с соавторами, 2009). Кроме того, в той же самой работе было показано, что аномалии микрофлоры кишечника являются движущей силой метаболических нарушений при ожирении, и можно предположить, что вмешательства, направленные на оздоровление кишечника, будут способствовать коррекции нарушений метаболизма при ожирении. Предполагается, что микрофлора кишечника может участвовать в развитии ожирения, связанного с нарушением регулирования энергетического равновесия, резистентности к инсулину, неалкогольным циррозом печени, а также энергетическим, липидным и аминокислотным обменом (обзор Ley с соавторами, 2009).
Для оценки влияния пробиотического средства в соответствии с настоящим изобретением на ожирение и связанные с ним нарушения метаболизма, а также на взаимосвязь между ожирением и воспалительными маркерами, в качестве наиболее подходящей модели исследования была выбрана модель ожирения у мышей. Модель состояла в кормлении мышей жирной пищей, что со временем вызывало у них ожирение.
Схема эксперимента
Мыши-самцы линии C57BL/J6 возрастом семь недель получали различный рацион: маложирную пищу (группа «Lean» - 10% калорий за счет жира, корм D 12450В производства Research Diets, Нью-Джерси), высокожирную пищу (группа «DIO»; 45% калорий за счет жира, корм D 12451 производства Research Diets, Нью-Джерси), высокожирную пищу с АН 1714 (1×109 КОЕ/день) в питьевой воде в течение 14 недель. Всех мышей держали в клетках группами по 5 особей, и ежедневно им скармливали свежую аликвоту пробиотика. Еженедельно оценивали потребление пищи и регистрировали массу тела. Спустя 14 недель мышей умерщвляли, их внутренние органы вырезали, взвешивали и хранили при температуре -80°С. Вырезали селезенку и проводили анализ содержания цитокинов в спленоцитах, как описано в примере 4.
Результаты
Как и ожидалось, за 14-недельный период кормления мыши группы «DIO» набирали значительно большую массу жира (р<0.001) по сравнению с «худыми» мышами контрольной группы «Lean» (на основании измерения потребленных калорий за 14-недельный период кормления (р<0.001) с нарастающим итогом). Измерения уровней цитокинов в спленоцитах мышей группы «DIO» под воздействием LPS (стимул врожденного иммунитета) показали, что АН 1714 снижает уровень вырабатываемых TNF-α и цитокина IL-12 при реакции на LPS (фиг.16). В спленоцитах, стимулируемых CD3/CD28 (стимул приобретенного иммунитета), скармливание АН 1714 обеспечивало снижение уровня цитокина IL6 при реакции на стимул. Данные результаты указывают на системный противовоспалительный эффект АН 1714 в модельной группе мышей «DIO», который согласуется с данными измерений цитокинов в мононуклеарах периферийной крови, а также с результатами прочих тестов на мышах in vivo, описанных в прочих примерах.
Иммуномодуляция
Иммунная система человека играет важную роль в этиологии и патологи широкого спектра болезней человека. Гипер- и гипоиммунная чувствительность приводит к множеству болезненных состояний, или является одним из их проявлений. Одно из семейств биологических объектов, называемых цитокинами, играет особо важную роль в управлении иммунными процессами. Нарушения в работе деликатных цепей и сетей цитокинов все чаще ассоциируют с множеством болезней. Такие болезни включают, не ограничиваясь ими, воспалительные расстройства, иммунодефицит, синдром воспаленного кишечника, синдром раздраженного кишечника, раковые опухоли (в особенности желудочно-кишечного тракта и иммунной системы), диарейные состояния, диарею, вызванную антибиотиками, детскую диарею, аппендицит, автоиммунные нарушения, рассеянный склероз, болезнь Альцгеймера, ревматоидный артрит, аппендицит, болезни брюшной полости, сахарный диабет, состояния после трансплантации органов, бактериальные инфекции, вирусные инфекции, грибковые инфекции, пародонтоз, болезни мочеполовой системы, болезни, передающихся половым путем, ВИЧ-инфекции, повторные ВИЧ-инфекции, диарею, связанную с ВИЧ-инфекцией, травмы, вызванных хирургическим вмешательством, метастатические болезни, вызванные хирургическим вмешательством, сепсис, потерю веса, анорексию, лихорадочные состояния, кахексию, заживление ран, язвы, нарушения барьерной функции кишечника, аллергии, астму, респираторные заболевания, нарушения кровообращения, ишемическую болезнь сердца, анемию, нарушения аппарата свертываемости крови, болезни почек, нарушения центральной нервной системы, гепатиты, расстройства питания, остеопороз, эндокринные нарушениях, болезни кожного покрова, псориаз, угри обыкновенные.
Каждый из исследованных пробиотических штаммов характеризовался своим воздействием на выработку цитокинов. Поэтому для исправления дисбаланса цитокинов, присущего определенному заболеванию, может быть подобран свой пробиотический штамм. Разработка терапии той или иной определенной болезни может быть осуществлена с использованием одного штамма АН 1714, набора таких штаммов или его мутантов или вариантов.
Обучение иммунной системы
Для развития и должного функционирования кишечной иммунной системы необходима кишечная флора. В отсутствие кишечной флоры кишечная иммунная система недоразвита, как было показано на модельных исследованиях на животных, не содержавших бактерий. Ухудшаются параметры функционирования их кишечника, такие как фагоцитарная активность макрофагов и выработка иммуноглобулинов (10). Важная роль кишечной флоры в стимулировании не деструктивной иммунной реакции становится все более очевидна. Повышение частоты возникновения и выраженности аллергий в западных странах связывают с развитием санитарии и гигиены, следствием которого является уменьшение частоты и остроты инфекционных атак на клетки-хозяева. Такая пониженная стимуляция иммунной системы может приводить к тому, что клетки-хозяева начинаю реагировать на непатогенные антигены, в результате чего возникают аллергии или аутоиммунные нарушения. Преднамеренное потребление различных непатогенных иммуностимулирующих бактерий дает клеткам-хозяевам дополнительные необходимые «обучающие» стимулы для должного развития и управления функциями иммунитета.
Воспаление
Термин «воспаление» используется для обозначения локального накопления жидкости, белков плазмы и лейкоцитов в месте, пострадавшем от физического повреждения, инфекции, или в котором происходит иммунная реакция. Управление воспалительной реакцией происходит на ряде уровней (11). Управляющие факторы включают цитокины, гормоны (например, гидрокортизон), простагландины, реактивные интермедиаты и лейкотриены. Цитокины - биологически активные белки, имеющие малый молекулярный вес и участвующие в выработке иммунных и воспалительных реакций и управлении ими, а также регулирующие развитие и ремонт поврежденных тканей и кроветворение. Они обеспечивают средства связи между лейкоцитами и другими типами клеток. Большинство цитокинов являются плейотропными, то есть имеют множество биологически перекрывающихся друг с другом функций. Воспалительной реакцией управляют каскады и сети цитокинов, а не просто конкретный тип цитокинов воздействует на конкретный вид клеток (12). При затухании воспалительной реакции концентрации веществ-активаторов и медиаторов снижаются, пока воспалительная реакция полностью не прекратится. Одним из провоспалительных цитокинов является TNF-α, который инициирует каскад цитокинов и биологических эффектов, вследствие которых возникает воспаленное состояние. Поэтому вещества, которые являются ингибиторами TNF-α, например, инфликсимаб, в настоящее время используются для лечения воспалительных болезней.
Предполагается, что провоспалительные цитокины играют важную роль в патогенезе многих воспалительных заболеваний, включая болезнь воспаленного кишечника. Современные подходы к терапевтическому лечению болезни воспаленного кишечника направлены на снижение уровня провоспалительных цитокинов, включая IL-8 и TNF-α. Такие же терапевтические подходы могут оказаться эффективными при лечении системных воспалительных заболеваний, таких, как ревматоидный артрит.
Возможно применение штаммов в соответствии с настоящим изобретением для лечения ряда воспалительных заболеваний, особенно в составе комплексной противовоспалительной терапии, например, в сочетании с нестероидными противовоспалительными средствами и инфликсимабом.
Цитокины и рак
Усиленная выработка многофункциональных цитокинов при самых различных типах опухолей позволяет предположить, что у пациентов с онкологическими заболеваниями идут серьезные воспалительные процессы. В настоящее время неясно, какой защитный эффект против роста и развития опухолевых клеток in vivo дает защитная воспалительная реакция, ведь с другой стороны, воспалительная реакция может негативно влиять на клетку-хозяина, несущую опухоль. В опухолевых и нормальных тканях идут сложные взаимодействия цитокинов, посредством которых регулируется выработка цитокинов и пролиферация клеток (13, 14). Давно признано, что потеря веса (кахексия) является единственной наиболее частой причиной смерти пациентов с онкологическими заболеваниями, и изначальное плохое питание означает плохой прогноз, так как при развитии и распространении опухоли она образует новые кровеносные сосуды и разрушает внеклеточную матрицу. Воспалительная реакция может играть значительную роль в описанных выше механизмах, и тем самым способствовать угасанию клеток-хозяев и росту опухолевых клеток. Противовоспалительные свойства штаммов Bifidobacterium longum в соответствии с настоящим изобретением могут снижать скорость злокачественного перерождения клеток. Кроме того, кишечные бактерии из соединений, поступающих с пищей, могут вырабатывать вещества, обладающие генотоксичным, канцерогенным и опухоль-стимулирующим действием, а также могут активировать про-канцерогены, превращая их в вещества, воздействующие на ДНК (15). В целом штаммы Bifidobacterium характеризуются низкой активностью чужеродных метаболических ферментов по сравнению с прочими популяциями микроорганизмов кишечника, такими, как бактероиды, эубактерии и клостридии. Поэтому рост численности бифидобактерий может благоприятно способствовать регулированию концентраций таких ферментов.
Введение вакцин и лекарств
Большинство патогенных микроорганизмов попадают в организм человека через слизистые оболочки. Вакцинация через слизистые оболочки может обеспечивать защиту от соответствующих инфекций. В частности, вплоть до настоящего времени применяются стратегии оральной вакцинации с помощью живых патогенных организмов или очищенных инкапсулированных антигенов (16). Пробиотические бактерии, генетически модифицированные так, чтобы in vivo они несли возбудителя инфекции, могут служить привлекательной альтернативой, так как данные бактерии считаются безопасными для потребления человеком (класс GRAS - «в целом считаются безопасными»).
Исследования на мышах показали, что потребление пробиотических бактерий, экспрессирующих чужеродные антигены, может вызвать защитную иммунную реакцию. В частности, были сконструированы бактерии Lactococcus lactis, экспрессирующие ген, кодирующий фрагмент С токсина столбняка (TTFC), и мышей иимунизировали данными бактериями посредством орального введения. Такой способ позволял индуцировать достаточное количество титров антител для защиты мышей от летального исхода при последующем введении реального токсина. Кроме того, что векторы на основе живых бактерий могут нести антигены, и на основе таких бактерий могут быть созданы биоактивные соединения, такие как иммуностимулирующие цитокины in vivo. L. lactis, секретирующие биоактивный человеческий IL-2 или IL-6, и TTFC, они индуцировали в 10-15 раз более высокий титр сывороточного IgG в мышах при назальной иммунизации (17). Однако именно при этом штамме бактерий уровень суммарного IgA, совместно экспрессируемого с данными цитокинами, не увеличивался. Изучаются также возможности использования прочих бактериальных штаммов, таких как Streptococcus gordonii, для создания вакцин, вводимых через слизистые оболочки. Рекомбинантные S. Gordonii, заселяющие ротовую и вагинальную полости, индуцировали локальный и системный иммунный ответ на антигены, экспрессируемые данными бактериями (18). Таким образом, оральная иммунизация векторами на основе пробиотических бактерий не только позволит защитить организм хозяина от инфекции, но может также заменить иммунологические стимулы, которые обычно дают патогены, и таким образом способствовать иммунологическому обучению хозяина.
Пребиотики
Эффективное введение пробиотических организмов требует использования подходящего носителя. Предпочтительно обеспечить среду, которая способствовала бы росту пробиотических штаммов в толстом кишечнике. Добавление к препаратам из бактерий одного или более олигосахаридов, полисахаридов или прочих групп веществ - пребиотиков - способствует росту молочнокислых бактерий в желудочно-кишечном тракте. Пребиотиками называются неживые пищевые компоненты, которые перевариваются в толстой кишке бактериями, которые считаются полезными, например, бифидобактериями, лактобациллами. Типичные пребиотики могут включать составы, содержащие фруктозу, ксилозу, сою, галактозу, глюкозу и маннозу. Комплексное назначение пробиотического штамма с одним или более пребиотическими составами может усиливать рост назначенного пробиотика in vivo (такой рост называется симбиотическим), что будет иметь выраженную пользу для здоровья.
Прочие активные ингредиенты
Можно предположить, что пробиотические штаммы могут назначаться в профилактических целях или в качестве метода лечения сами по себе и/или в сочетании с прочими пробиотическими и/или пребиотическими материалами, как было описано выше. Кроме того, бактерии могут использоваться в составе курса профилактики и/или лечения в сочетании с прочими активными веществами, например, с противовоспалительными средствами или средствами для лечения прочих нарушений, особенно связанных с нарушениями работы иммунной системы. Такие комплексы могут назначаться в виде единого препарата, или в качестве набора препаратов, принимаемых одновременно или в различное время, и вводимых одним и тем же путем или различными путями.
Размеры и их значения, содержащиеся в данном документе, не следует рассматривать как строго ограниченные в точности приведенными значениями. Напротив, если не оговорено особо, под приведенным значением понимается данное значение в точности и все значения, находящиеся в функционально эквивалентной его окрестности. Так, например, значение, обозначенное как 40 мм, следует рассматривать как «примерно 40 мм».
Все документы, цитируемые в подробном описании настоящего изобретения в части, относящейся к настоящему изобретению, упоминаются только для ссылки. Цитирование какого-либо документа не должно рассматриваться как признание того, что цитируемый документ должен быть включен в уровень техники по отношению к настоящему изобретению. Если какое-либо значение или определение понятия в настоящем документе не совпадает со значением или определением данного понятия в документе, на который дается ссылка, следует руководствоваться значением или определением данного понятия, содержащимся в настоящем документе.
Несмотря на то что в данном документе иллюстрируются и описываются конкретные воплощения настоящего изобретения, сведущим в данной области техники будет очевидно, что возможно внесение прочих изменений и модификаций, не нарушающих идею и назначение изобретения. С этой целью имелось в виду в прилагаемой формуле изобретения представить все возможные подобные изменения и модификации в объеме настоящего изобретения.
Ссылки
1. McCracken V.J. and Gaskins H.R. Probiotics and the immune system. In: Probiotics a critical review, Tannock, GW (ed). Horizon Scientific Press, UK. 1999, p.85-113.
2. Savage D.C. Interaction between the host and its microbes. In: Microbial Ecology of the Gut, dark and Bauchop (eds). Academic Press, London. 1977, p.277-310.
3. Kagnoff M.F. Immunology of the intestinal tract. Gastroenterol. 1993; 105 (5): 1275-80.
4. Lamm M.E. Interaction of antigens and antibodies at mucosal surfaces. Ann. Rev. Microbiol. 1997; 51: 311-40.
5. Raychaudhuri S., Rock KL. Fully mobilizing host defense: building better vaccines. Nat biotechnol, 1998; 16: 1025-31.
6. Stallmach A., Strober W, MacDonald TT, Lochs H, Zeitz M. Induction and modulation of gastrointestinal inflammation. Immunol. Today, 1998; 19 (10): 438-41.
7. Liam O'Mahony, Louise O'Callaghan, Jane McCarthy, David Shilling, Paul Scully, Shomik Sibartie, Eamon Kavanagh, William O. Kirwan, Henry Paul Redmond, John Kevin Collins, and Fergus Shanahan. Differential cytokine response from dendritic cells to commensal and pathogenic bacteria in different lymphoid compartments in humans. Am J Physiol Gastrointest Liver Physiol 290: G839-G845, 2006.
8. O'Mahony С, Scully P, O'Mahony D, Murphy S, O'Brien F, et al. Commensal-Induced Regulatory Т Cells Mediate Protection against Pathogen-Stimulated NF-kB Activation. PLoS Pathog 2008,4(8): el 0001 12.
9. Desbonnet L, Garrett L, Clarke G, Bienenstock J, Dinan TG. The probiotic Bifidobacteria infantis: An assessment of potential antidepressant properties in the rat. J Psychiatr Res. 2008 Dec; 43(2): 164-74.
10. Crabbe P. A., H. Bazin, H. Eyssen, and J.F. Heremans. The normal microbial flora as a major stimulus for proliferation of plasma cells synthesizing IgA in the gut. The germ free intestinal tract. Into. Arch. Allergy Appi Immunol, 1968; 34: 362-75.
11. Henderson В., Poole, S and Wilson M. 1998. In "Bacteria-Cytokine interactions in health and disease. Portland Press, 79-130.
12. Arai KI, Lee F, Miyajima A, Miyatake S, Arai N, Yokota T. Cytokines: coordinators of immune and inflammatory responses. Annu Rev Biochem, 1990;59:783-836.
13. McGee DW, Bamberg T, Vitkus SJ, McGhee JR. A synergistic relationship between TNF-alpha, IL-1 beta, and TGF-beta 1 on IL-6 secretion by the IEC-6 intestinal epithelial cell line. Immunology, 1995, Sep;86(1):6-11.
14. Wu S, Meeker WA, Wiener JR, Berchuck A, Bast RC Jr, Boyer CM. Transfection of ovarian cancer cells with tumour necrosis factor alpha (TNF-alpha) antisense mRNA abolishes the proliferative response to interleukin-1 (IL-1) but not TNF-alpha. Gynecol Oncol, 1994,Apr;53(l):59-63.
15. Rowland I.R. Toxicology of the colon: role of the intestinal microflora. In: Gibson G.R. (ed). Human colonic bacteria: role in nutrition, physiology and pathology, 1995, pp. 155-174. Boca Raton CRC Press.
16. Walker, R.I. New strategies for using mucosal vaccination to achieve more effective immunization. Vaccine, 1994; 12: 387-400.
17. Steidler L., К. Robinson, L. Chamberlain, K.M Scholfield, E. Remaut, R.W.F. Le Page and J.M. Wells. Mucosal delivery of murine interleukin-2 (IL-2) and IL-6 by recombinant strains of Lactococcus lactis coexpressing antigen and cytokine. Infect. Immun., 1998; 66:3183-9.
18. Medaglini D., G. Pozzi, T.P. King and V.A. Fischetti. Mucosal and systemic immune responses to a recombinant protein expressed on the surface of the oral commensal bacterium Streptococcus gordonii after oral colonization. Proc. Natl. Acad. Sci. USA, 1995; 92:6868-72.
19. McCracken V. J. and Gaskins H.R, 'Probiotics a. critical review', Horizon Scientific Press, UK, 1999, p.278.
20. Foligne, В., Nutten, S., Grangette, C, Dennin V., Goudercourt, D., Poiret, S., Dewulf, J., Brassart, D., Mercenier, A., and Pot, В., Correlation between in vitro and in vivo immunomodulatory properties of lactic acid bacteria. World J. Gastroenterol, 2007; 13(2): 236-243.
21. Feuerer M, Herrero L, Cipolletta D, Naaz A, Wong J, Nayer A, Lee J, Goldfine AB, Benoist C, Shoelson S, Mathis D. Lean, but not obese, fat is enriched for a unique population of regulatory Т cells that affect metabolic parameters. Nature Medicine (2009) 15, 930-939.
22. Shoelson SE, Herrero L, Naaz A. Obesity, inflammation, and insulin resistance. Gastroenterology (2007) 132, 2169-2180.
23. Ley RE. Obesity and the human microbiome. Curr Opin Gastroenterol, (2010) 1,5-11.
Реферат
Группа изобретений относится к биотехнологии. Предложен штамм Bifidobacterium longum NCIMB 41676, обладающий иммуномодулирующим действием. Указанный штамм применяют в качестве противоинфекционного пробиотического штамма. Предложен также пробиотический состав, содержащий указанный штамм и носитель для орального приема. Предложено также применение состава в качестве усилителя когнитивных функций для профилактики расстройств центральной нервной системы, таких, как болезнь Альцгеймера, шизофрения и/или незначительные когнитивные расстройства. Как вариант, применяют состав для профилактики воспаления, связанного с ожирением, для профилактики нарушений метаболизма, связанных с ожирением. Группа изобретений обеспечивает повышение уровня противовоспалительного цитокина IL-10 и понижение уровня провоспалительных цитокинов, уменьшение индуцируемой липополисахаридами активности NfkB. 6 н. и 31 з.п. ф-лы, 16 ил., 6 табл., 8 пр.

Комментарии