Штамм bifidobacterium longum infantis для приготовления пробиотика, антимикробный агент и препарат на основе штамма bifidobacterium longum infantis симмуномодулирующими свойствами - RU2308483C2
Код документа: RU2308483C2
Чертежи



















Описание
Данное изобретение относится к пробиотическим штаммам Bifidobacterium, находящим различное применение в пищевых продуктах и в медицине. Более конкретно, данное изобретение относится к пробиотическим штаммам бифидобактерий, способным к полезному изменению и, следовательно, к облегчению наблюдаемых при воспалительном заболевании симптомов.
Потребители становятся все более и более осведомленными в вопросах, связанных с веществами, необходимыми для поддержания их среды, здоровья и питания. В ответ на это научные исследования фокусируются на той роли, которую могут играть диета, стресс и современная медицинская практика (например, антибиотики и лучевая терапия) как угроза здоровью человека. В частности, сдвиг популяционной динамики в сторону старения общества увеличивает распространенность болезней, которые могут быть вызваны дефицитной или подверженной риску микрофлорой, таких как инфекции желудочно-кишечного тракта (ЖКТ), запор, синдром раздраженного кишечника (IBS), воспалительное заболевание кишечника (IBD) - болезнь Крона и неспецифический язвенный колит, аллергии на пищевые продукты, индуцированная антибиотиками диарея, сердечно-сосудистые заболевания и некоторые виды рака (например, рак толстой и прямой кишки).
Пробиотики определяют как живые микробиологические пищевые добавки, которые благотворно влияют на хозяина, улучшая кишечное микробное равновесие, или более широко как живые микроорганизмы, прием внутрь некоторого количества которых помимо основного питания положительно влияет на здоровье. Смеси различных микроорганизмов, особенно видов Lactobacillus и Streptococcus, традиционно используются в продуктах молочной ферментации для улучшения здоровья.
В последние годы коммерческое изготовление и маркетинг функциональных пищевых продуктов (пищевых продуктов, которые влияют на функции организма целенаправленным способом, оказывая положительное воздействие на физиологию и питание), особенно пробиотических (Ацидофилино-Бифидо; Acidophilus-Bifidus) йогуртов, распространилось из твердо установившейся торговой ниши на японском рынке на прибыльный и расширяющийся Европейский Союз. В то время как ряд пробиотических бактерий человеческого происхождения теперь используется в промышленных масштабах (например, L.acidophilus LA-1), многие потребители, организации потребителей и члены научного сообщества скептически относятся к таким продуктам и их рекламируемым пробиотическим претензиям. Ввиду этого на пищевую молочную промышленность оказывается значительное давление с целью проведения научной проверки этих новых пробиотических продовольственных продуктов.
Критерии, предложенные для выбора потенциально эффективных пробиотических микроорганизмов, могут быть в итоге сформулированы следующим образом: человеческое происхождение, непатогенное поведение, устойчивость при технологических процессах (то есть жизнеспособность и активность в средствах доставки), устойчивость к кислотной среде желудка и к токсичности желчи, адгезия к эпителиальной ткани кишечника, способность колонизировать ЖКТ, продуцирование антимикробных веществ, способность модулировать иммунные ответы и способность влиять на метаболические активности (например, ассимиляцию холестерина, активность лактазы, продуцирование витаминов) (Huis in′t Veld J, Shortt С. Selection criteria for probiotic micro-organisms. In: Leeds, A.R., Rowland, I.R. eds. Gut Flora and Health - Past, Present and Future. London: The Royal Society of Medicine Press Ltd., 1996: 19-26).
Бифидобактерии - одни из нескольких основных способных к культивированию бактерий, представленных в микрофлоре ободочной и толстой кишки.
Функции эндогенных бифидобактерий в толстой кишке полностью не выяснены. Однако известно, что вскармливаемые исключительно грудью младенцы имеют пониженный риск диареи по сравнению с младенцами, получающими искусственное питание. Тот факт, что эти младенцы имеют больше относящихся к ободочной и толстой кишке бифидобактерий, может частично объяснять это наблюдаемое преимущество в здоровье, поскольку занятие доступных ниш в ЖКТ большим числом непатогенных бифидобактерий может помогать в предупреждении бактериальной инфекции. Полагают, что патогенез болезни Крона связан с бактериальной микрофлорой ободочной и толстой кишки (Targan, S. and Shanahan, F. Inflammatory bowel disease: From bench to bedside. Williams and Wilkins, 1994). Недавно обнаружено, что в фекалиях пациентов, страдающих болезнью Крона в активной форме, содержатся значительно менее восстанавливаемые бифидобактерии по сравнению со здоровыми индивидуумами. Наблюдали, что такое сокращение количества бифидобактерий непосредственно коррелирует с пониженными уровнями продуцирования и активности β -D-галактозидазы (Favier, С.et al, Dig. Dis. Sci. 1997; 42: 817-822). β-D-галактозидаза представляет собой фермент, продуцируемый бифидобактериями. Эти результаты подтверждают предположения, высказанные в других исследованиях, о том, что штаммы бифидобактерий могут играть важную роль в поддержании сбалансированной здоровой кишечной микрофлоры.
Бифидобактерин считаются пробиотиками, поскольку они представляют собой живые микроорганизмы, прием внутрь достаточного количества которых помимо основного питания положительно влияет на здоровье. Для проявления пробиотического эффекта многочисленные принятые внутрь бифидобактерии должны достичь места действия в кишечнике. Предложен минимальный уровень, составляющий приблизительно 106-107 жизнеспособных бифидобактерий на грамм содержимого кишечника (Bouhnik, Y., Lait 1993; 73: 241-247). В литературе имеются сообщения о том, что исследования in vivo, выполненные на взрослых и младенцах, указывают на то, что некоторые штаммы бифидобактерий способны к выживанию при прохождении через желудочно-кишечный тракт. Обнаружены существенные различия в способности различных штаммов бифидобактерий быть устойчивыми к кислоте и солям желчных кислот, что указывает на то, что выживание является важным критерием для выбора потенциальных пробиотических штаммов.
Прием внутрь бифидобактерий может улучшать прохождение содержимого через желудочно-кишечный тракт.
Кроме того, косвенным доказательством на людях является тот факт, что потребление молока, сброженного бифидобактериями, может приводить к уменьшению уровней некоторых фекальных ферментов, таких как β-D-галактозидаза, вовлеченных в преобразование проканцерогенов в канцерогены (Bouhnik, Y. et al, Eur. J. Clin. Nutr. 1996; 50: 269-273). Уровень метаболитов фекального гниения, таких как пара-крезол, индол и аммиак, также снижен при потреблении молока, сброженного с помощью Bifidobacterium longum и S. thermophilus (Takiguchi, R. et al. Bifidus-Flores, Fructus et Semina 1996; 9: 135-140).
Сообщается, что с бифидобактериями связана антимикробная активность. Кроме этого показано, что бифидобактерии модулируют различные параметры иммунной системы.
Сообщается, что воспаление слизистой оболочки у IL-10 дефицитных мышей уменьшается при кормлении животных препаратом молочнокислых бактерий (Madsen, К. et al. Gastroenterol. 1997; 112: А 1030). Дальнейшие исследования, выполненные на крысах, демонстрируют, что прием внутрь бифидобактерии может подавлять формирование аберрантных очагов крипты (ранних предопухолевых повреждений) в толстой кишке (Kulkarni, N. and Reddy, В. Proc. Soc. Experim. Biol. Med. 1994; 207: 278-283) в дополнение к существенному уменьшению сферы распространения опухоли толстой кишки и количества имеющихся опухолей (Singh, J. et al Carcinogenesis 1997; 18: 833-841).
Происходит непрерывный поиск пробиотических штаммов со специфическим положительным влиянием на пищу, терапию и здоровье в целом.
Описание изобретения
Согласно данному изобретению предложен штамм Bifidobacterium, выделенный из иссеченного и промытого желудочно-кишечного тракта человека, который является в значительной степени иммуномодулирующим у людей после перорального потребления.
Штамм Bifidobacterium предпочтительно вызывает изменения в иммунологическом маркере при введении в систему, содержащую клетки, которые взаимодействуют с иммунной системой, и клетки иммунной системы. Предпочтительно клетки, которые взаимодействуют с иммунной системой, представляют собой эпителиальные клетки. Предпочтительным иммунологическим маркером является цитокин, в особенности фактор некроза опухоли α (TNFα).
В предпочтительном воплощении клетки, которые взаимодействуют с иммунной системой, и клетки иммунной системы являются клетками подходящего происхождения.
Клетки, которые взаимодействуют с иммунной системой, имеют желудочно-кишечное, респираторное или мочеполовое происхождение.
Клетки иммунной системы имеют предпочтительно желудочно-кишечное, респираторное или мочеполовое происхождение.
Согласно данному изобретению предложен штамм Bifidobacterium longum infantis, выделенный из иссеченного и промытого желудочно-кишечного тракта человека, который является в значительной степени иммуномодулирующим у людей после перорального потребления.
Штамм Bifidobacterium, который оказывает существенное противовоспалительное действие у людей после перорального потребления.
Штамм Bifidobacterium, предпочтительно выделенный из иссеченного и промытого желудочно-кишечного тракта человека, способен бороться с эффектами воспалительного заболевания кишечника, причем упомянутая способность определяется в присутствии физиологических концентраций желчи и желудочного сока человека. Способность бороться с эффектами воспалительного заболевания кишечника оценивается путем измерения реверсирования заболевания, вызывающего истощение, индуцированного у реципиентных мышей с тяжелым комбинированным иммунодефицитом (SCID), которым вводят очищенные CD4+, CD45RBhigh Т-клетки.
Способность штамма Bifidobacterium longum infantis бороться с эффектами воспалительного заболевания кишечника может также измеряться путем измерения ослабления воспаления ободочной и толстой кишки у IL-10 дефицитных мышей (IL-10+ 129 Svex штамм) после введения одного или более чем одного штамма Bifidobacterium longum infantis по изобретению, самого по себе или в комбинации со штаммом Lactobacillus salivarius, как определено здесь далее.
Интерлейкин 10 (IL-10) представляет собой важный регуляторный цитокин, который подавляет эффекторные функции макрофагов/моноцитов, Т-хелперных 1 (Th1) клеток и природных киллерных клеток. Вдобавок IL-10 усиливает пролиферацию и дифференцировку В-клеток. У модельных мышей, лишенных гена IL-10, спонтанно развиваются воспалительное заболевание кишечника и опухоли желудочно-кишечного тракта. Флора желудочно-кишечного тракта вовлечена в патогенез этих болезненных состояний, поскольку у свободных от микробов животных болезнь не развивается.
Штамм Bifidobacterium предпочтительно обладает ингибиторной активностью в отношении широкого диапазона грамположительных и грамотрицательных бактерий.
Предпочтительно штамм Bifidobacterium демонстрирует широкий спектр активности в отношении бактерий, включая виды Staphylococcus, Pseudomonas, Coliform и Bacillus.
В частном аспекте согласно данному изобретению предложен штамм Bifidobacterium longum infantis UCC 35624 или его мутант либо вариант.
Штамм Bifidobacterium longum infantis UCC 35624 депонирован в Национальные коллекции промышленных и морских бактерий (NCIMB) 13 января 1999 и ему присвоен инвентарный номер NCIMB 41003.
В одном воплощении мутант представляет собой генетически модифицированный мутант.
В одном воплощении вариант представляет собой встречающийся в природе вариант Bifidobacterium longum infantis UCC 35624.
Штамм Bifidobacterium может быть представлен жизнеспособными клетками. Альтернативно, штамм Bifidobacterium представлен нежизнеспособными клетками.
Кроме этого, согласно данному изобретению предложен антимикробный агент, полученный из штамма Bifidobacterium по изобретению, который является антагонистом роста других микроорганизмов.
Согласно еще одному аспекту данного изобретения предложен препарат, содержащий штамм Bifidobacterium по данному изобретению.
Препарат может содержать два или более чем два штамма Bifidobacterium.
Препарат может включать в себя другой пробиотический материал. Альтернативно или дополнительно препарат включает в себя пребиотический материал.
Препарат может включать в себя штамм Lactobacillus salivarius.
Штамм Lactobacillus salivarius может быть представлен жизнеспособными клетками или нежизнеспособными клетками.
Lactobacillus salivarius предпочтительно выделен из иссеченного и промытого желудочно-кишечного тракта человека, при этом Lactobacillus salivarius является в значительной степени иммуномодулирующим у людей после перорального потребления. Предпочтительно штамм Lactobacillus salivarius, выделенный из иссеченного и промытого желудочно-кишечного тракта человека, ингибирует широкий диапазон грамположительных и грамотрицательных микроорганизмов.
В предпочтительном воплощении штамм Lactobacillus salivarius секретирует обладающий антимикробной активностью продукт в бесклеточный супернатант, причем упомянутая активность продуцируется только растущими клетками и разрушается под действием протеиназы К и проназы Е, данные ингибиторные свойства вышеупомянутого штамма и его секреторных продуктов сохраняются в присутствии физиологических концентраций желчи человека и желудочного сока человека.
Такие штаммы Lactobacillus salivarius описаны в WO 98/35014.
Идеально штамм Lactobacillus salivarius представляет собой штамм Lactobacillus salivarius UCC 118 или его мутант либо вариант. Мутант представляет собой генетически модифицированный мутант. Вариант может быть встречающимся в природе вариантом Lactobacillus salivarius.
Lactobacillus salivarius штамм UCC 118 депонирован в NCIMB 27 ноября 1996, и ему присвоен инвентарный номер NCIMB 40829.
Предпочтительно препарат включает в себя носитель для приема внутрь. Носитель для приема внутрь может представлять собой фармацевтически приемлемый носитель, такой как капсула, таблетка или порошок.
Носитель для приема внутрь может являться пищевым продуктом, таким как сквашенное молоко, йогурт, замороженный йогурт, сухое молоко, концентрат молока, плавленый сыр, заправки или напитки.
Препарат может содержать белок и/или пептид, в частности белки и/или пептиды, богатые глутамином/глутаматом; липид; углевод; витамин; минеральное вещество и/или микроэлемент.
В одном из воплощений Bifidobacterium представлен в количестве более чем 106 колониеобразующих единиц (КОЕ) на грамм системы доставки.
В другом воплощении данный препарат включает в себя адъювант.
Данный препарат может включать в себя бактериальный компонент. Альтернативно или дополнительно препарат может включать в себя лекарственное начало. Кроме этого препарат может включать в себя биологическое соединение.
Данный препарат может быть в форме для пероральной иммунизации.
Кроме того, согласно данному изобретению предложен штамм Bifidobacterium или его препарат для применения в пищевых продуктах.
Согласно еще одному аспекту данного изобретения предложен штамм Bifidobacterium или его препарат для применения в качестве лекарства.
Штамм или препарат может быть для применения в профилактике и/или лечении нежелательной воспалительной активности.
Штамм или препарат может быть для применения в профилактике и/или лечении нежелательной желудочно-кишечной воспалительной активности, такой как воспалительное заболевание кишечника, например болезнь Крона или неспецифический язвенный колит, синдром раздраженного кишечника, воспаление брюшного кармана или постинфекционный колит.
Нежелательная воспалительная активность может быть обусловлена раком.
Кроме этого штамм или препарат может быть для применения в профилактике и/или лечении рака(ов) желудочно-кишечного тракта.
Данный штамм или препарат может использоваться для профилактики рака. Кроме того, штамм или препарат может быть для применения в профилактике и/или лечении системного заболевания, такого как ревматоидный артрит.
Данный штамм или препарат может быть для применения в профилактике и/или лечении аутоиммунных заболеваний, обусловленных нежелательной воспалительной активностью.
Данный штамм или препарат может быть для применения в профилактике и/или лечении рака, обусловленного нежелательной воспалительной активностью.
Данный штамм или препарат может быть для применения в профилактике и/или лечении диарейного заболевания, обусловленного нежелательной воспалительной активностью, такого как ассоциированная с Clostridium difficile диарея, ассоциированная с ротавирусами диарея или постинфекционная диарея.
Краткое описание фигур
В сопровождающих фигурах:
На Фиг.1 представлен график зависимости КОЕ/мл от времени для Bifidobacterium longum infantis штамма 35612, как описано в Примере 2.
На Фиг.2 представлен график зависимости КОЕ/мл от времени для Bifidobacterium longum infantis штамма 35624, как описано в Примере 2.
На Фиг.3 представлен график изменения массы (в процентах) от времени (в днях) для пяти SCID-мышей (1-5), которым вводили штамм UCC 35624, как описано в Примере 5.
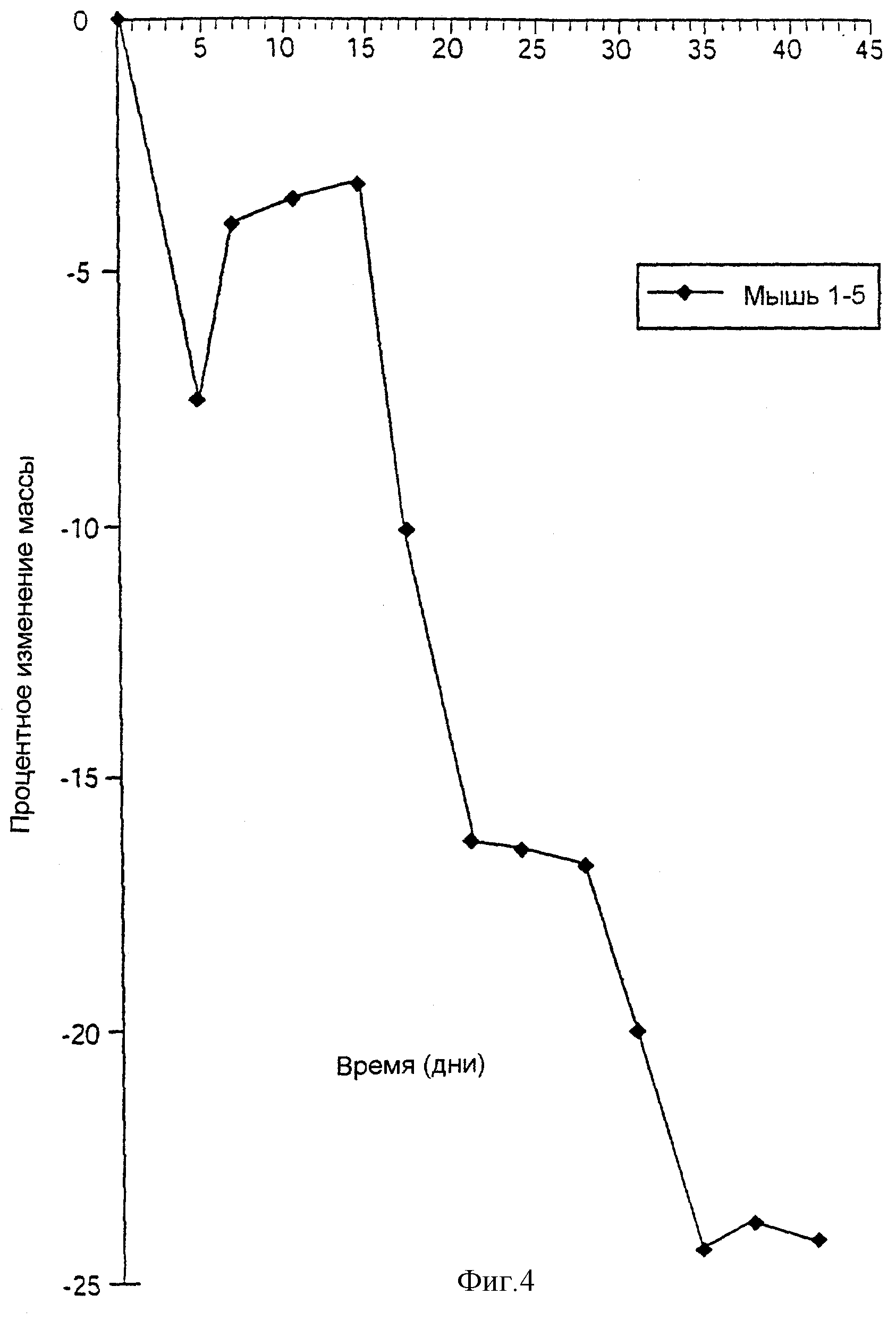
На Фиг.4 представлен график изменения средней массы (в процентах) от времени (в днях) для пяти SCID-мышей (1-5), которым вводили штамм UCC 35624, как описано в Примере 5.
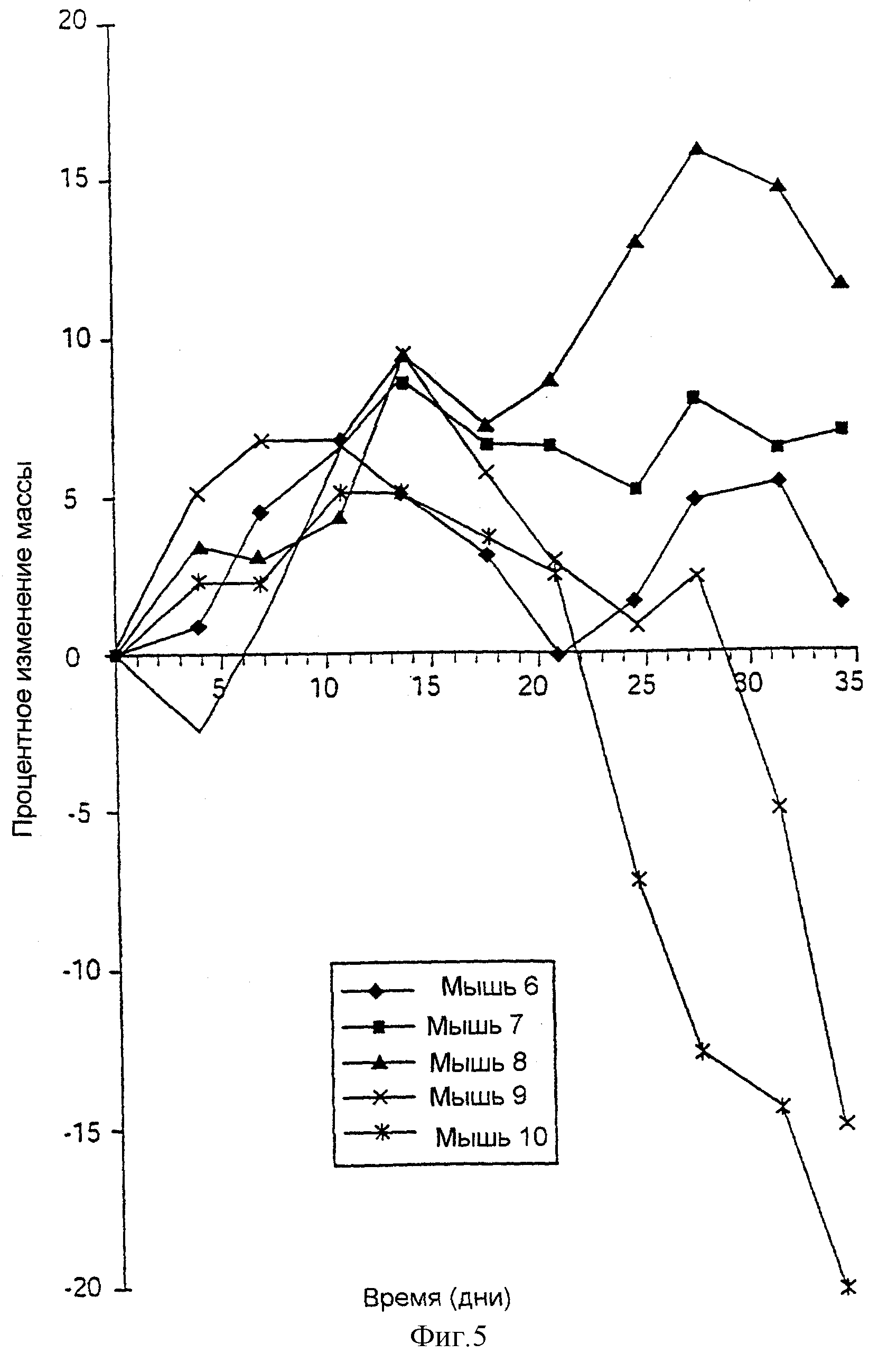
На Фиг.5 представлен график изменения массы (в процентах) от времени (в днях) для мышей (6-10), которым вводили комбинацию штаммов Lactobacillus salivarius UCC 118 и UCC 35624, как описано в Примере 5.
На Фиг.6 представлен график изменения средней массы (в процентах) от времени (в днях) для мышей (6-10), которым вводили комбинацию штаммов UCC 118 и UCC 35624, как описано в Примере 5.
На Фиг.7 представлен график изменения массы (в процентах) от времени (в днях) для мышей (11-15), которым вводили комбинацию штаммов UCC 118 и UCC 35624, как описано в Примере 5.
На Фиг.8 представлен график изменения средней массы (в процентах) от времени (в днях) для мышей (11-15), которым вводят комбинацию штаммов UCC 118 и UCC 35624, как описано в Примере 5.
На Фиг.9 представлена гистограмма уровней TNFα у пациента и в контрольных образцах в присутствии мононуклеарных клеток периферической крови (PBMCs) и Bifidobacterium longum infantis, как описано в Примере 7.
На Фиг.10 представлена гистограмма уровней TNFα и IL-8 при совместном культивировании эпителиальных клеток, PBMCs и Bifidobacterium longum infantis, как описано в Примере 7. Контроли представляют собой результаты совместного культивирования только эпителиальных клеток и PBMCs.
На Фиг.11 представлены гистограммы уровней цитокинов периферической крови после потребления Bifidobacterium longum infantis здоровыми людьми-добровольцами (n=18) в течение трех недель, как описано в Примере 8.
На Фиг.12 представлены гистограммы сывороточных уровней TNFα и IL-1RA после потребления Bifidobacterium longum infantis здоровыми людьми-добровольцами (n=18), как описано в Примере 8.
На Фиг.13 представлена гистограмма уровней TNFα в бесклеточном супернатанте выросшей культуры Bifidobacterium longum infantis и MRS-контролях, как описано в Примере 9.
На Фиг.14 представлено схематическое изображение нижней части кишечника SCID-мыши после лечения с помощью Bifidobacterium longum infantis.
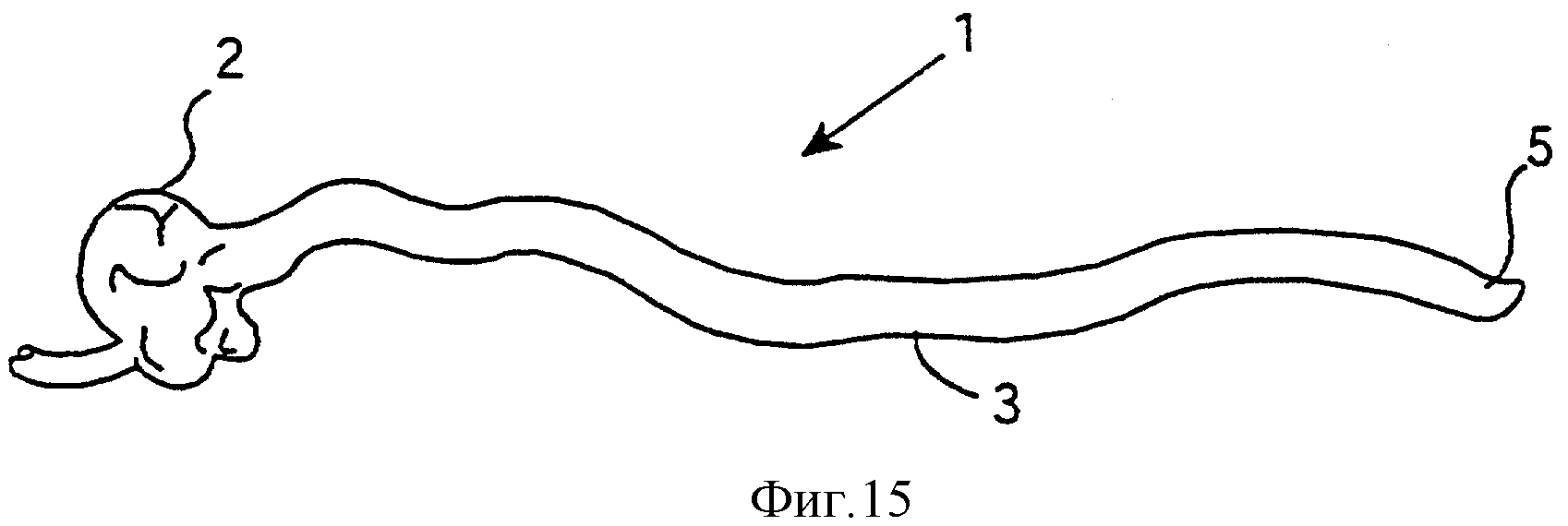
На Фиг.15 представлено схематическое изображение нижней части кишечника не подвергнутой лечению SCID-мыши.
Подробное описание
Выделены штаммы пробиотических бактерий, способные осуществлять полезные модификации и, следовательно, облегчать наблюдаемые симптомы воспалительных расстройств. Эти штаммы и полученные на их основе препараты могут быть использованы в ряде пищевых продуктов и лекарственных средств для борьбы с действием воспалительных расстройств.
С использованием пробиотических штаммов бактерий были проведены исследования in vivo и in vitro. Обнаружено, что у людей, потреблявших в пищу йогурт, содержащий Bifidobacterium longum infantis UCC 35624, регистрируются заметные уменьшения в системных уровнях IL-8. Ввиду этого данный штамм может найти потенциальное применение в лечении ряда воспалительных расстройств, особенно при использовании в комбинации с применяемыми в настоящее время противовоспалительными терапиями, такими как нестероидные противовоспалительные препараты (НПВП) или инфликсимаб (Infliximab).
Кроме этого было исследовано влияние потребления Bifidobacterium longum infantis SCID-мышами. Наряду с тем, что в результате эксперимента происходило значительное ослабление воспалительной активности, мыши, потреблявшие Bifidobacterium longum infantis, сохраняли твердый стул, в то время как контрольные мыши страдали от диареи. Этот противодиарейный эффект может быть связан с противовоспалительной активностью по данному изобретению, возможно опосредованной через модуляцию цАМФ.
Неизвестно, требуются ли неповрежденные бактерии для проявления противовоспалительного эффекта или могут быть использованы только индивидуальные активные компоненты по изобретению. Идентифицированы провоспалительные компоненты некоторых бактериальных штаммов. Провоспалительные эффекты грамотрицательных бактерий опосредованы липополисахаридом (LPS). Сам по себе LPS стимулирует провоспалительную сеть, частично благодаря связыванию LPS с CD14-рецептором на моноцитах. Считается, что компоненты пробиотических бактерий обладают противовоспалительной активностью благодаря эффектам, оказываемым целой клеткой. По мере выделения этих компонентов ожидается изменение фармацевтического качества.
В общем случае Bifidobacterium longum infantis UCC 35624 применяются в виде жизнеспособных клеток. Однако это применение также может быть распространено на нежизнеспособные клетки, такие как убитые культуры или композиции, содержащие благотворные факторы, экспрессируемые Bifidobacterium longum infantis UCC 35624. Это может быть распространено на термически убитые микроорганизмы или микроорганизмы, убитые в результате изменения рН или под действием давления. Получение продукта с помощью нежизнеспособных клеток является более простым, клетки могут быть легко включены в фармацевтические препараты, и требования по их хранению имеют намного меньше ограничений, чем для жизнеспособных клеток. Lactobacillus casei YIT 9018 представляет собой пример эффективного применения термически убитых клеток в качестве способа для лечения и/или предупреждения роста опухоли, как описано в патенте США № US 4347240.
Данное изобретение станет более понятным из следующих далее примеров.
Пример 1
Выделение пробиотических бактерий
Аппендиксы и срезы толстой и тонкой кишки ЖКТ человека, полученные во время восстановительной хирургии, подвергали скринингу на пробиотические бактериальные штаммы, как показано в Таблице 1.
Все образцы в стерильных контейнерах немедленно после хирургической операции помещали на хранение при -80°С. Замороженные ткани подвергали оттаиванию, взвешивали и помещали в цистеинированный (0,05%) раствор Рингера с концентрацией в одну четверть. Каждый образец аккуратно встряхивали для удаления неплотно связанных с ним микроорганизмов (называется промывка "W"). После перенесения во второй объем раствора Рингера, образец интенсивно перемешивали в течение 7 мин для удаления плотно связанных бактерий (называется образец "S"). Кроме этого, для выделения внедрившихся в ткани бактерий образцы А, В и С гомогенизировали в смесителе Брауна (Braun) (называется гомогенат "Н"). Растворы последовательно разбавляли (разведение 10-1 промытого образца обозначали как W1, разведение 10-2 обозначали как W2 и ту же самую систему маркировки использовали для образцов "S" и "Н") и высевали на чашки (100 мкл) со следующими агаровыми средами: RCM (обогащенные клостридиальные среды) и RCM, подведенные до рН 5,5 с использованием уксусной кислоты; TPY (триптический (trypticase) пептон и дрожжевой экстракт), Chevalier, P. et al. (1990) J. Appl. Bacteriol. 68, 619-624). MRS (deMann, Rogosa and Sharpe); ROG (ацетатная среда (SL) Rogosa); LLA (печеночно-лактозный агар Lapiere); BHI (инфузионный сердечно-мозговой агар); LBS (селективный агар на молочнокислые бактерии) и TSAYE (триптоново-соевый агар, дополненный 0,6%-ным дрожжевым экстрактом). Все агаровые среды поставлены Oxoid Chemicals, за исключением TPY-агара. Чашки инкубировали в анаэробных сосудах (BBL, Oxoid), используя генерирующие CO2 наборы (Anaerocult A, Merck) в течение 2-5 дней при 37°С.
Грамположительные, негативные по каталазе, палочковидные или раздвоенные/плеоморфные бактериальные изоляты расчищали, рассевая штрихом на комплексных неселективных средах (TPY). Изоляты культивировали обычным образом на TPY-среде при 37°С в анаэробных условиях, если не указано иначе. Предполагаемые виды бифидобактерий запасали в 40%-ном глицерине и хранили при -20° и -80°С.
Анализ конечного продукта ферментации
Используя колонку для высокоэффективной жидкостной хроматографии (ВЭЖХ) (LKB Bromma, Aminex HPX-87H), изучали метаболизм углевода глюкозы и последующих конечных продуктов - органических кислот. Колонку эксплуатировали при 60°С со скоростью потока 0,6 мл/мин (постоянное давление). В качестве буфера для ВЭЖХ использовали 0,01 н. H2SO4. Перед проведением анализа колонку калибровали, используя 10 мМ цитрат, 10 мМ глюкозу, 20 мМ лактат и 10 мМ ацетат в качестве стандартов. Культуры выращивали анаэробно в модифицированном MRS-бульоне в течение 1-2 дней при 37°С. После центрифугирования в течение 10 мин при 14000 g супернатант разбавляли в отношении 1:5 буфером для ВЭЖХ, и пробу объемом 200 мкл анализировали с помощью ВЭЖХ. Все супернатанты анализировали в двух параллелях.
Биохимические и физиологические характеристики
С целью идентификации бактериальных изолятов определяли их биохимические и физиологические характеристики. Анализировали восстановление нитрата, образование индола и экспрессию β-галактозидазы. Определяли скорость роста при 15°С и 45°С и протеазную активность на желатине. Кроме этого оценивали ростовые характеристики штаммов на бактериологической среде с индикатором рН лакмусом.
Профили чувствительности к антибиотикам
Профили чувствительности к антибиотикам изолятов определяли, используя тест на "дисковую чувствительность". Культуры выращивали на соответствующей жидкой питательной среде в течение 24-48 ч, высевали на чашки (100 мкл) с агаровой средой и помещали на агар диски, содержащие известные концентрации антибиотиков. Штаммы проверяли на чувствительность к антибиотикам после 1-2 дней инкубации при 37°С в анаэробных условиях. Штаммы считали чувствительными, если наблюдали зоны ингибирования в 1 мм или более.
Выделение видов бифидобактерий
Семь срезов ткани, взятых из ЖКТ человека, проверяли на присутствие штаммов, принадлежащих роду Bifidobacterium. Имели место следующие вариации между образцами тканей. Образцы А (подвздошная кишка) и Е (аппендикс) имели наименьшее количество клеток (102), выделенных из грамма ткани. Для сравнения из остальных образцов выделено более чем 103 КОЕ/г ткани. Похожее число бактерий выделено на стадиях "промывка" и "образец" с немного более высокими количествами в растворах "образцов" F (подвздошная кишка) и G (область подвздошной-слепой кишки). Из подвергнутых скринингу на плотно связанные бактерии (образец гомогенат) единственным срезом ткани, дающим существенное количество бактерий, был образец С (область подвздошной-слепой кишки).
Во время скрининга некоторых срезов ткани, например С и В, не наблюдалось прямой корреляции между количеством бактерий, полученных во время серий разведения. Это может указывать на то, что некоторые ростовые факторы, берущие начало как из крови, так и из ткани, обеспечивают рост "требовательных" бактерий в начальной суспензии, которую впоследствии разбавляют.
Селекция и характеристика штаммов
Приблизительно пятнадцать сотен негативных по каталазе бактериальных изолятов было отобрано из различных образцов и охарактеризовано в отношении их реакции по Граму, размера клетки и морфологии, способности к росту при 15°С и 45°С и конечных продуктов ферментации из глюкозы. Более шестидесяти процентов протестированных изолятов являлись грамположительными, гомоферментирующими кокками, расположенными либо в тетрады и цепочки, либо пучки. Восемнадцать процентов изолятов представляли собой грамотрицательные палочки и гетероферментирующие коккобациллы.
Оставшиеся изоляты (двадцать два процента) представляли собой преимущественно гомоферментирующие коккобациллы. Тридцать восемь штаммов охарактеризованы более подробно: 13 изолятов из G; 4 из F; 8 из D; 9 из С; 3 из В и 1 из Е. Все тридцать восемь протестированных изолятов негативны как в отношении восстановления нитрата, так и продуцирования индола из триптофана.
Профили чувствительности к антибиотикам
Для установления профилей чувствительности отобранных бифидобактерий используют антибиотики, имеющие клиническое значение для человека. Протестированные бифидобактерии чувствительны к ампициллину, амоксициллину, цефтаксиму, цефтриаксону, ципрофлоксацину, цефрадину, рифампицину, амикацину, гентамицину и хлорамфениколу. Они также устойчивы к нетилмицину, триметоприму, налидиксовой кислоте, цефуроксиму, ванкомицину и тетрациклину.
Пример 2
Кислотоустойчивость
Первая линия защиты хозяина, которой микроорганизм достигает вслед за потреблением его человеком, представляет собой кислоту желудка. Главным критерием, влияющим на выбор бактерий, является способность к выживанию в желудочном соке. Исследовали способность к выживанию и росту Bifidobacterium longum infantis штаммов 35612 и 35624 в среде с низким значением рН. Штаммы культивировали обычным способом в среде с триптическим-пептонно-дрожжевым экстрактом (TPY) при 37°С в строго анаэробных условиях (газовые сосуды BBL, с использованием системы Merck Anaerocult A gas pak) в течение 12-24 ч. Желудочный сок человека получали от здоровых субъектов аспирацией через носожелудочную трубку (Mercy Hospital, Cork, Ireland). Его немедленно центрифугировали при 13000 g в течение 30 мин для удаления всех твердых частиц, стерилизовали через фильтры 0,45 мкм и 0,2 мкм и хранили при 4°С. Перед использованием в эксперименте измеряли рН и активность пепсина. Активность пепсина измеряли, используя количественный гемоглобиновый анализ (Guantam, S. and R.S. de la Motte. 1989. Proteolytic enzymes, a practical approach. Chapter 3. R.J. Beynon and J.S. Bond (eds.), IRL Press, Oxford University Press; Dawson, R.M. 1969. рН and buffers. In: Data for Biochemical Research, p.138. R.M.Dawson, D.C.Elliot and K.M.Jones (eds.), Clarendon Press, Oxford). Выживание штаммов при низком значении рН in vitro исследовали, используя следующие виды анализов:
(а) Клетки собирали из свежих ночных культур, дважды промывали в фосфатном буфере (рН 6,5) и ресуспендировали в MRS-бульоне, доведенном до рН 3,5; 3,0; 2,5 и 2,0 (с помощью 1н. HCl) до конечной концентрации приблизительно 106 КОЕ/мл. Клетки инкубировали при 37°С и выживаемость измеряли с интервалами 5, 30, 60 и 120 мин, используя метод подсчета на чашках.
Штаммы выживали без потери жизнеспособности при рН 3,5. При рН 2,5 имело место уменьшение на три порядка за инкубационный период в 60 мин, как представлено в Фиг.1 и 2.
Выживание штаммов Bifidobacterium в желудочном соке человека
Собирали свежие ночные культуры, дважды промывали в буфере (рН 6,5) и ресуспендировали в желудочном соке человека до конечной концентрации 106КОЕ/мл. Выживание регистрировали в течение (30-60)-минутного инкубационного периода при 37°С. Эксперимент проводили, используя желудочный сок с рН 1,2 (недоведенный) и рН 2,0 и 2,5 (доведенный с использованием 1 н. NaOH).
Выживание штаммов увеличивалось в желудочном соке с рН 2,0 по сравнению с желудочным соком с рН 1,2. Как видно из Таблицы 2, после 30 минут инкубации при любом значении рН никакие жизнеспособные клетки не восстанавливались.
Пример 3
Устойчивость к желчи
При оценке эффективности использования молочнокислых бактерий в качестве выгодных элементов желудочно-кишечного тракта считается, что устойчивость к желчным кислотам является важной биологической характеристикой штамма, требуемой для выживания в этой враждебной окружающей среде, и кроме того такие штаммы не должны посягать на здоровье хозяина, продуцируя ядовитые соединения, такие дезоксихолевая (DCA) и литохолевая (LCA) кислоты, которые вовлечены в ряд цитотоксических явлений.
Ряд штаммов Bifidobacterium longum infantis высевали штрихом на чашки с TPY-агаром, дополненным желчью свиньи (В-8631, Sigma Chemical Co. LTD, Poole) в концентрациях 0,3; 0,5; 1,0; 1,5; 5,0 и 7,5% (в/о) (Legrand-Defretin, R. et at., Lipids 1991; 26 (8), 578-583). Желчь свиньи является самой близкой по составу к желчи человека в плане соотношений соли желчных кислот/холестерин и фосфолипиды/холестерин. Чашки инкубировали при 37°С в анаэробных условиях и регистрировали рост после 24-48 ч. Обнаружено, что штамм 35624 обладает значительной устойчивостью к желчи и конфлюентно растет в условиях до 5% желчи свиньи, как показано в Таблице 3.
Желчь человека получали из нескольких человеческих желчных пузырей и стерилизовали при 80°С в течение 10 мин. Состав желчных кислот определяли, используя обращенно-фазовую высокоэффективную жидкостную хроматографию (ВЭЖХ) в комбинации с импульсным амперометрическим детектором согласно методу Dekker, R.R et at., Chromatographia 1991, 31 (11/12), 255-256. Желчь человека добавляли в концентрации 0,3% (о/о). Свежерассеянные штрихом культуры исследовали на рост после 24 и 48 ч.
Штамм 35624 был способен к росту в присутствии физиологически значимой концентрации желчи человека (0,3% (о/о)).
Рост штаммов исследовали в присутствии индивидуальных конъюгированных и деконъюгированных желчных кислот. В физиологических условиях желчные кислоты часто находятся в виде натриевых солей. Штаммы подвергали скринингу на рост на TPY-агаре, содержащем конъюгированные и деконъюгированные натриевые соли каждой из следующих желчных кислот:
(а) конъюгированная форма: гликохолевая кислота (GCA); гликодезоксихолевая кислота (GDCA) и гликохенодезоксихолевая кислота (GCDCA);
(б) деконъюгированная форма: литохолевая кислота (LCA); хенодезоксихолевая кислота (CDCA); дезоксихолевая кислота (DCA) и холевая кислота (СА). Для каждой желчной кислоты использовали концентрации 1, 3 и 4 мМ. Рост регистрировали после 24 и 48 ч анаэробной инкубации.
Пять анализируемых штаммов росли на агаровой среде, дополненной 5 мМ GCA и GCDCA, и на агаровой среде, дополненной 1 мМ GDCA, как показано в Таблице 4. Штамм 35624 проявлял устойчивость к концентрациям в 5 мМ LCA (данные не приводятся), и штаммы 35612 и 35624 были способны к росту при концентрациях 5 мМ СА, как показано в Таблице 5. Никакого роста не наблюдалось в присутствии 1 мМ CDCA (данные не приводятся).
GCDCA, гликохенодезоксихолевая кислота; GDCA, гликодезоксихолевая кислота; GCA, гликохолевая кислота.
Пример 4
Антимикробная активность
Виды Bifidobacterium проявляют ингибирующее влияние на другие бактерии, исключая долгосрочную колонизацию инвазивными патогенами. Их антагонистическая активность обусловлена продуцированием уксусной и молочной кислоты во время ферментации (Scardovi, V. (1986) Bifidobacterium in Bergey′s Manual of systemic bacteriology. Vol.2. Eds. Sheath, P.H., Main, N.S., Sharpe, M. and Holdt, J.G., Williams and Wilkins Publishers, Baltimore M.D., p.1418). Практически нет сообщений о продуцировании других антимикробных соединений, отличных от кислот (Anand, S.K. et al. Cult. Dairy Prods. 1985; J. 2, 21-23). Бактериоцины и другие соединения могут оказывать влияние на выживание бактерии в экологической нише и дают им возможность эффективно доминировать над экосистемами ферментации. Такое свойство является хорошей чертой пробиотического штамма.
Спектры ингибирования различных бифидобактериальных штаммов определяли методом Tagg и других (Tagg. J.R. et al. Bacteriol. Rev. 1976; 40, 722-756). Свободный от клеток супернатант анализировали на ингибиторную активность в отношении широкого круга грамположительных и грамотрицательных микроорганизмов. Чашки с агаром покрывали слоями каждого индикатора и позволяли им подсохнуть. На засеянные чашки помещали пробы (5 мл) свободного от клеток супернатанта, позволяли им подсохнуть и чашки инкубировали в течение ночи.
Установлено, что при тестировании на TPY-среде штаммы ингибируют широкий спектр видов Staphylococcus, Pseudomonas, Coliform и Bacillus. Как показано в Таблицах 6 и 7, зоны ингибирования до 4,4 мм зарегистрированы в отношении Pseudomonas и Staphylococcus и до 7,0 мм вокруг видов Bacillus. Однако при проведении замедленных анализов на забуференной TPY-среде зон ингибирования в отношении любого из индикаторных штаммов не наблюдали. Следовательно, ингибирование, вероятно, объясняется исключительно присутствием кислоты, продуцируемой бифидобактериями.
Пример 5
Испытание с целью исследования способности Lactobacillus salivarius, подвида Salivarius UCC 118, и Bifidobacteria longum infantis 35624 в отношении облегчения симптомов воспалительного заболевания кишечника (IBD), осуществляемое посредством кормления мышей
Предпосылки
Недавно с помощью генетических или иммунологических способов был выведен ряд моделей мышей для изучения механизмов IBD. Одна из этих моделей включает в себя передачу СD4+ Т-лимфоцитов селезенки или лимфатического узла от нормальных мышей реципиентным мышам с тяжелым комбинированным иммунодефицитом (SCID). Показано, что у мышей, которые получают очищенные CD4+ , CD45RBhigh Т-клетки, развивается вызывающее истощение заболевание, характеризующееся хроническим кишечным воспалением, которое в более тяжелой форме проявляется в толстой кишке. В этом исследовании контрольную группу SCID-мышей инъецировали CD4+, CD45RBhigh, и у мышей развивалось прогрессирующее вызывающее истощение заболевание, включая сутулость сверх нормы, пилоаррекцию наружного покрова, диарею, потерю в массе и макро- и микроскопическое повреждение толстой кишки. Испытание посредством кормления проводили введением UCC 118 и штамма 35624 (также упоминаемого здесь как UCC 35624) с целью определения, можно ли в этой модели изменить симптомы IBD.
Бактериальные штаммы
Lactobacillus salivarius, подвид Salivarius UCC 118, и Bifidobacterium longum infantis UCC 35624 выделены из области подвздошной-слепой кишки взрослого человека, как описано в Примере 1. В этом примере получали спонтанные рифампицин- и стрептомицинустойчивые производные штаммов из растущих на чашках клеток, которых предварительно выращивали в течение ночи и последовательно промывали в растворе Рингера с крепостью в одну четверть на MRS и TPY-агаре, содержащем 50 мкг/мл рифампицина (Sigma) соответственно, и MRS, содержащем 400 мкг/мл стрептомицина (Sigma). Чашки инкубировали в анаэробных условиях в течение 2 дней при 37°С. Было определено, что полученные устойчивые к антибиотикам производные по остальным признакам были фенотипически подобными родительскому штамму. Эта выбираемая особенность давала возможность легко подсчитать штаммы после прохождения кишечника.
Животные и их содержание
Мышей-доноров (C57BL/6×BALB/c) F1 приобретали у Simosen Laboratories (Gilroy, CA) и содержали в виварии Калифорнийского университета Лос-Анджелеса в вентилируемых клетках-стеллажах (Thoren caging systems, Hazelton, PA) в специальных, свободных от патогенов (SPF) условиях. СВ-17 SCID-мышей разводили в вентилируемых клетках-стеллажах, изначально полученных из центра оборудования SCID Калифорнийского университета Лос-Анджелеса. Мыши являлись мышами с пониженной флорой (RF) в большей степени, чем мышами с отсутствием бактериальной флоры, и применялись в качестве реципиентных мышей (Aranda R. et al. J. of Immunol. 1997; 158 (7), 3464-3473).
Самок СВ-17 (SCID)-мышей возрастом восемь недель размещали попарно в содержащих фильтры верхних клетках вентилируемых стеллажей. Мышей делили на четыре группы. Группа А: потребляли 10%-ное снятое молоко, контроль; группа Б: потребляли Lactobacillus salivarius UCC 118; группа В: потребляли Lactobacillus salivarius UCC 118 и Bifidobacterium longum UCC 35624 9 (в отношении 1:1); группа Г: потребляли Bifidobacterium longum UCC 35624. UCC 118 и UCC 35624, которые выращивали в течение ночи на питательной среде MRS и питательной среде MRS, дополненной 0,05%-ным цистеином (Sigma), соответственно промывали в PBS, ресуспендировали в снятом молоке (10% (о/о)) и вводили в другой стерилизованной питьевой воде (PBS). Мыши в каждой соответствующей группе получали 2,55×108 КОЕ/мл UCC 118 и 2,35×108 КОЕ/мл UCC 35624 ежедневно в продолжение периода кормления. Контрольные мыши получали стерильное молоко, разбавленное стерильным фосфатно-буферным раствором (PBS), и содержались в условиях, идентичных условиям содержания тестируемой группы.
План эксперимента
Всем СВ-17 мышам давали соответствующее питание согласно распределению их по группам в течение 2 дней до инъекции CD4+, CD45RBhigh-клеток. Отсортированные донорские лимфоциты (3-4×105) в 200 мкл стерильного PBS внутрибрюшинно вводили реципиентным СВ-17 SCID-мышам. Всех мышей взвешивали первоначально, затем после этого дважды в неделю. Их наблюдали на предмет клинических признаков болезни: сутулости сверх нормы, пилоаррекции наружного покрова и диареи.
Оценка влияния введения пробиотиков на число природных бактерий, высеваемых из мышиных фекалий
Было исследовано влияние, оказываемое при раздельном введении UCC 118 и UCC 35624 или в комбинации друг с другом на микрофлору кишечника СВ-17 SCID-мышей. Образцы фекалий собирали еженедельно от каждой мыши, взвешивали и ресуспендировали в 10 мл PBS. Затем образцы последовательно разбавляли в PBS и либо выливали, либо наносили штрихом в соответствующих разведениях на чашки с соответствующей средой в двух параллелях. Наблюдали следующие бактериальные группы: молочнокислые бактерии; бифидобактерии; энтерококки; бактероиды и колиформы. Использовали следующие селективные, среды: агар de Mann Rogosa & Sharpe (MRS); MRS-агар, дополненный 0,2% хлорида лития (BDH), 0,3% пропионата натрия (Fluke chemie), 0,5% гидрохлорида цистеина (Sigma) и 5% овечьей крови; агар Slanetz и Bartley; агар Wilkins и Chalgren, дополненный анаэробной добавкой SR 108 и 5% лошадиной крови; и агар с желчью и фиолетовым красным (VRBA) (все от Oxoid, если не указано иначе). Чашки с VRBA и агаром Slanetz и Bartley инкубировали аэробно в течение 24 и 45 ч соответственно. Все другие чашки инкубировали анаэробно в течение 48 ч при 37°С.
Установление численности природной флоры из определенных сегментов ЖКТ CB17 SCID-мышей
По окончании периода кормления всех мышей умертвляли и вскрывали. Извлекали сегменты области подвздошной-слепой кишки, тонкой кишки и толстой кишки. Кроме этого извлекали периферийный лимфатический узел (PLN), мезентериальный лимфатический узел (MLN) и часть селезенки. Все ткани взвешивали перед ресуспендированием в 10 мл PBS. Далее образцы гомогенизировали, последовательно разбавляли PBS и либо наносили штрихом, либо выливали в соответствующих разведениях на соответствующие среды в двух параллелях. Устанавливают численность тех же бактериальных групп, что и при анализе фекалий, и образцы инкубируют, как описано ранее.
Получение интраэпителиальных и lamiinapropria лимфоцитов
Выделение относящихся к слизистой оболочке лимфоцитов проводили: согласно способу Aranda, R. et al ((1997) supra).
Анализ популяции лимфоцитов с помощью поточной цитометрии
Анализ проводили, как описано в Aranda, R. et al. ((1997) supra).
Подготовка ткани для гистопатологического анализа
Образцы ткани брали из тонкой кишки, толстой кишки и области подвздошной-слепой кишки и фиксировали в 10%-ном формалине. Методика такая же, как описана в Aranda, R. et al. ((1997) supra).
В результате проведенного эксперимента наблюдали, что соответствует предыдущим результатам, что у SCID-мышей, воспроизведенных с CD4+, CD45RBhigh Т-лимфоцитами и потреблявших только снятое молоко (контроль), развивалось прогрессирующее вызывающее истощение заболевание, определяемое по существенной потере их веса. Заболевание проявлялось приблизительно через 2 с половиной - три недели и характеризовалось проявлением у больных мышей сутулости сверх нормы, пилоаррекции наружного покрова и частого жидкого стула. Одна из мышей в контрольной группе (мышь 4) умерла через 25 дней, а мыши 1, 2, 3 и 5 показали -20%, 25%, 21% и -35%-ное изменение массы соответственно, как показано на Фиг.3 и 4.
СВ-17 SCID-мыши, потреблявшие только UCC 118, продемонстрировали такой же результат, как и контрольные, с характерной потерей в массе. Мышь 3 умерла через 14 дней, а мыши 4, 5 и 6 показали -15%, -25% и -28%-ное изменение массы соответственно (данные не приводятся). Как было обнаружено, у мышей, потреблявших комбинацию UCC 118 и UCC 35624, наблюдалось значительное улучшение по сравнению с контрольными мышами. В течение периода кормления эти мыши не теряли так много в массе, как контрольные мыши. Даже после 35 дней три мыши в этой группе показывали небольшое процентное изменение массы (Фиг.5 и 6). Две мыши в этой группе показали потерю в массе только после приблизительно 30 дней, в то время как контрольные мыши показывали потерю в массе через 14 дней (Фиг.3 и 4).
Мыши, потреблявшие только UCC 35624, проявляли хорошее здоровье и опять значительно меньшую потерю в массе по сравнению с контрольными (Фиг.7 и 8). Следовательно, может быть сделано заключение, что потребление только UCC 35624 или в комбинации с UCC 118 облегчает признаки воспалительного заболевания кишечника.
В Таблице 8 суммированы экспериментальные данные исследования лечения СВ17 и SCID-мышей с индуцированным CD45RB колитом с помощью смеси UCC 118 и UCC 35624.
В этих исследованиях обнаружено, что мыши успешно восстановлены с помощью лимфоцитов и лимфоцитов, происходящих от модельного донора (данные не приводятся).
А: степень воспалительного инфильтрата; В: муциновое истощение; С: эпителиальная гиперплазия; D: число TEL в криптах; Е: число очагов воспаления на области высокого разрешения.
Пример 7
Исследование in vitro иммунного восприятия Bifidobacterium longum infantis
Ночные промытые культуры бифидобактерий инкубировали с мононуклеарными клетками периферической крови человека (PBMCs) как здоровых добровольцев (n=9), так и пациентов, страдающих воспалительным заболеванием кишечника (n=5). В супернатантах семидесяти двух часовых культур с помощью ELISA измеряли продуцирование провоспалительного цитокина - фактора некроза опухоли α (TNFα). Совместная инкубация Bifidobacterium longum infantis c PBMCs человека не приводила к стимуляции продуцирования TNFα (Фиг.9). Таким образом, воздействие данного вида бактерий на иммунную систему не вызывает воспалительной реакции.
Для оценки иммунного восприятия Bifidobacterium longum infantis на поверхностях слизистой оболочки, в transwell камерах проводили совместное культивирование эпителиальных клеток и PBMCs. Кратко: в верхней камере подращивали эпителиальный клеточный монослой, а PBMCs инкубировали в нижнем отделении. Они были отделены друг от друга пористой мембраной, которая позволяла проходить растворимым медиаторам между двумя отделениями, но не допускала межклеточного контакта. Используя эту модель, измеряли продуцирование TNFα и интерлейкина-8 (IL-8) в присутствии и отсутствие Bifidobacterium longum infantis в отделении РВМС. Совместное культивирование эпителиальных клеток, PBMCs и Bifidobacterium longum infantis приводило к существенному подавлению продуцирования TNFα и IL-8 (Фиг.10). Таким образом, трехклеточная сеть, включающая в себя эпителиальные клетки, PBMCs и Bifidobacterium longum infantis, приводит к подавлению продуцирования провоспалительного цитокина.
Пример 8
Противовоспалительная активность Bifidobacterium longum infantis in vivo
18 здоровых людей в течение трех недель потребляли Bifidobacterium longum infantis (1×109 клеток в день) в ферментированном молочном продукте (йогурте). Перед потреблением и после потребления этого пробиотического штамма проводили отборы сыворотки для анализа цитокина. Для микробиологического анализа собирали образцы фекалий.
В этом эксперименте по питанию наблюдали значительное изменение уровней цитокинов периферической крови. Уровни растворимого рецептора интерлейкина-6 в сыворотке (slL-6R, p=0,007), интерферона-γ (IFN γ, р=0,041) и IL-8 (р=0,004) значительно снижены после потребления этого пробиотического штамма (Фиг.11). Не наблюдали никакого изменения в уровнях TNFα и антагониста рецептора интерлейкина-1 (IL-1RA) в сыворотке (Фиг.12). Bifidobacterium longum infantis определили в количестве приблизительно 1×105 КОЕ на грамм материала фекалий в течение данного исследования по питанию.
Целенаправленные критерии селекции in vitro, отражающие комплексные взаимодействия ЖК среды, предусматривают идентификацию пробиотических штаммов, способных к эффективному функционированию при повторном, попадании в эту среду. Используя изложенные выше критерии селекции, пробиотические бактерии Bifidobacterium longum infantis демонстрируют очевидные иммуномодулирующие свойства in vitro. После потребления SCID-мышами и людьми-добровольцами отмечалось существенное изменение системных иммунных параметров. Таким образом, применение Bifidobacterium longum infantis в качестве биотерапевтического агента при лечении иммуноопосредованных заболеваний является обоснованным.
Пример 9
Измерение TNFα в свободном от клеток Bifidobacterium longum infantis UCC 35624 супернатанте
Ночные культуры Bifidobacterium longum infantis подвергали центрифугированию, и свободный от клеток супернатант исследовали на присутствие ингибиторов цитокинов. Свободные от клеток супернатанты инкубировали с TNFα человека в течение 20 минут при 37°С. После этого с помощью ELISA определяли уровни TNFα. После воздействия супернатанта культуры бифидобактерий уровни TNFα значительно уменьшались (Фиг.13). Таким образом, Bifidobacterium longum infantis UCC 35624 секретирует фактор, который антагонизирует активности TNFα. Продуцирование этого фактора Bifidobacterium longum infantis на поверхности желудочно-кишечного тракта, in vivo, значительно ограничило бы воспалительную реакцию у хозяина.
Это указывает на то, что антагонизм TNFα также имеет место на молекулярном уровне благодаря растворимому фактору, выделяемому UCC 35624.
Воспаление
Воспаление - термин, используемый для описания локального накопления жидкости, плазменных белков и лейкоцитов в месте физического повреждения, инфекции или развивающейся иммунной реакции. Контроль воспалительной реакции проявляется на ряде уровней (смотри обзор Henderson В. and Wilson M. 1998. In: "Bacteria-Cytokine interactions in health and disease". Portland Press, 79-130). Контролирующие факторы включают в себя цитокины, гормоны (например, гидрокортизон), простагландины, реактивные промежуточные соединения и лейкотриены. Цитокины представляют собой биологически активные белки с низкой молекулярной массой, которые вовлечены в генерацию и контроль иммунологических и воспалительных реакций, и в то же время участвуют в регуляции развития, репарации тканей и гематопоэза. Они обеспечивают связь непосредственно между лейкоцитами, а также с другими типами клеток. Большинство цитокинов являются плейотропными и экспрессируют множественные биологически перекрывающиеся виды активности. Цитокиновые каскады и сети контролируют воспалительную реакцию в большей степени, чем действие отдельного цитокина на отдельный тип клеток (Arai KI, et al., Annu. Rev. Biochem. 1990; 59: 783-836). Затухание воспалительной реакции приводит к более низким концентрациям соответствующих активирующих сигналов и других медиаторов воспаления, приводящих к прекращению воспалительной реакции. TNFα является стержневым провоспалительным цитокином, поскольку он инициирует каскад цитокинов и биологические эффекты, приводящие к воспалительному состоянию. Поэтому агенты, ингибирующие TNFα, например инфликсимаб, в настоящее время используются для лечения воспалительных заболеваний.
Полагают, что провоспалительные цитокины играют главную роль в патогенезе многих воспалительных заболеваний, включая воспалительное заболевание кишечника (IBD). Применяемые в настоящее время терапии для лечения IBD направлены на уменьшение уровней этих провоспалительных цитокинов, включая IL-8 и TNFα . Предполагают, что такие терапии могут также играть существенную роль при лечении системных воспалительных заболеваний, таких как ревматоидный артрит. Люди, употреблявшие в пищу йогурт, содержащий Bifidobacterium longum infantis UCC 35624, продемонстрировали значительное снижение системных уровней IL-8. Ввиду этого данный штамм может найти потенциальное применение при лечении ряда воспалительных заболеваний, особенно при использовании в комбинации с другими противовоспалительными терапиями, такими как терапии нестероидными противовоспалительными препаратами (НПВП) или инфликсимабом.
Вызывающее диарею заболевание
Барьерная функция кишечного эпителия может ухудшаться во время секреции, опосредованной нервной (ацетилхолин) и иммунной (гистамин) системами. Некоторые бактериальные токсины могут также индуцировать Са2+- и РКС-зависимую секрецию и вследствие этого могут нарушать эпителиальный; барьер (Ganguly NK and Kaur Т. Indian J. Med. Res. 1996; 104: 28-37; Groot JA. Vet.; Q. 1998; 20(S3): 45-9). В ряде работ исследованы способы предупреждения и лечения диареи с применением пробиотических бактерий. Последующие исследования продемонстрировали эффективность введения молочнокислых бактерий в качестве как профилактического, так и терапевтического средства против диареи у недоношенных младенцев, новорожденных, детей (Isolauri E, et at., Dig. Dis. Sci. 1994 Dec; 39(12): 2595-600), при лечении диареи, связанной с приемом антибиотиков (Siitonen S, et al., Ann. Med. 1990 Feb; 22(1): 57-9) и диареи путешественников (Oksanen PJ, et al., Ann. Med. 1990 Feb; 22(1): 53-6).
Исследовано потребление Bifidobacterium longum infantis UCC 35624 SCID-мышами. Обнаружено, что противовоспалительная активность значительно ослабляется, и у мышей, потреблявших Bifidobacterium longum infantis UCC 35624, сохранялся твердый стул, в то время как контрольные мыши страдали от диареи. На Фиг.14 и 15 представлены изображения тонкой кишки, подвергнутой и не подвергнутой лечению SCID-мыши. Показанная тонкая кишка включает в себя слепую кишку 2, кишечник 3 и анальное отверстие 5. Фиг.14 относится к мыши, подвергнутой лечению с помощью Bifidobacterium longum infantis UCC35624, и видно, что твердый стул 4 сохраняется в кишечнике. В сравнении с этим на Фиг.15 приведен кишечник 3 не подвергнутой лечению мыши с характерным воспалением. Не происходит никакой абсорбции воды, и поэтому в кишечнике совсем не сохраняется твердого стула, что приводит к диарее.
Наблюдаемый противодиарейный эффект может быть связан с противовоспалительной активностью, возможно через модуляцию цАМФ. Цикло-АМФ-зависимая Cl-секреция представляет собой главный секреторный путь в кишечнике человека (Brzuszczak IM, et al., J. Gastroenterol. Hepatol. 1996; 11(9): 804-10). Может быть сделано заключение, что противодиарейный эффект Bifidobacterium longum infantis UCC 35624 не ограничен только диареей, причиной которой является желудочно-кишечное воспаление, а может применяться как общий способ лечения вызывающего диарею заболевания.
Аутоиммунное заболевание
Иммунная система имеет большой набор специфических соединений, экспрессируемых В- и Т-клетками. Некоторые из этих соединений будут специфичны к компонентам самого организма. Самоузнавание обычно контролируется путем делеции клона и инактивации активных в отношении собственного организма лимфоцитов. Однако имеется постоянный фон аутоиммунитета с антителами ко многим белкам, находящимся в сыворотке. Нарушение в системе распознавания "свое - не свое" приводит к аутоиммунитету. При аутоиммунном заболевании имеющийся иммунный ответ вызывает повреждение ткани, несущей нарушающий нормальную работу антиген. Иммунное комплексное депонирование, гиперчувствительность II типа и опосредованные клетками реакции представляют собой наиболее важные механизмы, посредством которых осуществляется аутоиммунное повреждение. Примеры аутоимунных заболеваний включают в себя системную красную волчанку, ревматоидный артрит, инсулинозависимый сахарный диабет, миастению гравис и пернициозную анемию, но не ограничены ими. Bifidobacterium longum infantis и Lactobacillus salivarius, подвид salivarius, представляют собой иммуномодуляторные бактерии. Так, потребление пациентами, страдающими от аутоимунного заболевания, данных бактерий либо как отдельных компонентов, либо в сочетании друг с другом, может ограничивать повреждение органов и помогать восстановлению нормального гомеостаза организма.
Воспаление и рак
Продуцирование многофункциональных цитокинов широким спектром опухолей позволяет предположить, что существенные воспалительные реакции присутствуют у пациентов с раком. В настоящее время неясно, какое защитное действие эта реакция оказывает против роста и развития опухолевых клеток in vivo. Однако эти воспалительные реакции могут оказывать неблагоприятное воздействие на больного раком. В процессы регулирования продуцирования цитокинов и клеточной пролиферации в опухолевых и нормальных тканях вовлечены сложные взаимодействия цитокинов (McGee DW, et al., Immunology 1995 Sep; 86(1): 6-11; Wu S, et al., Gynecol. Oncol. 1994 Apr; 53(1): 59-63). Давно установлено, что потеря в весе (кахексия) является единственной наиболее общей причиной смерти пациентов с раком (Inagaki J, et al., Cancer 1974 Feb; 33(2): 568-73) и начальное нарушение питания служит признаком неблагоприятного прогноза (Van Eys. J. Nutr. Rev. 1982 Dec; 40(12): 353-9). Опухоль для своего роста и распространения должна стимулировать образование новых кровеносных сосудов и разрушать внеклеточный матрикс. Воспалительная реакция может играть существенную роль в вышеупомянутых механизмах, способствуя, таким образом, ухудшению самочувствия хозяина и прогрессированию опухоли. Благодаря противовоспалительным свойствам этих бактериальных штаммов они могут снижать скорость злокачественной трансформации клеток. Более того, кишечные бактерии могут производить из питательных соединений вещества с генотоксическим, канцерогенным и опухолестимулирующим действием и могут активировать про-канцерогены к ДНК-реактивным агентам (Rowland I.R. (1995). Toxicology of the colon: role of the intestinal microflora. In: Gibson G.R. (ed). Human colonic bacteria: role in nutrition, physiology and pathology, pp 155-174. Boca Raton CRC Press). Вообще, виды Bifidobacterium и Lactobacillus имеют низкоактивные ферменты метаболизма ксенобиотиков по сравнению с другими популяциями кишечника, такими как бактероиды, эубактерии и клостридии (Saito Y., et al., Microb. Ecol. Health Dis., 1992; 5, 105-110). Следовательно, увеличивая количество молочнокислых бактерий в кишечнике, можно с успехом изменять уровни этих ферментов.
Пребиотики
Введение пробиотических микроорганизмов осуществляется посредством приема внутрь микроорганизма в подходящем носителе. Было бы выгодно обеспечить среду, которая будет стимулировать рост этих пробиотических, штаммов в толстой кишке. Добавка одного или более чем одного олигосахарида, полисахарида или другого пребиотика усиливает рост молочнокислых бактерий в желудочно-кишечном тракте (Gibson, GR. Br. J. Nutr. 1998; 80(4): S209-12). Термин "пребиотики" относится к любому нежизнеспособному пищевому компоненту, который специфическим образом подвергается ферментации в толстой кишке собственными бактериями, которые считаются полезными, например бифидобактериями, молочнокислыми бактериями. Типы пребиотиков могут включать в себя пребиотики, содержащие фруктозу, ксилозу, сою, галактозу, глюкозу и маннозу. Совместное, называемое симбиотическим, введение пробиотического штамма с одним или более чем одним пребиотическим соединением может стимулировать рост введенного пробиотика in vivo, принося более явную пользу для здоровья.
Другие активные ингредиенты
Очевидно, что Bifidobacterium может вводиться профилактически или применяться в виде способа лечения как сам по себе, так и в комбинации с другими пробиотическими и/или пребиотическими материалами, описанными выше. Кроме этого, бактерии могут быть использованы как часть профилактической схемы или схемы лечения с применением других активных веществ, таких как вещества, используемые для лечения воспаления или других расстройств, в особенности заболеваний желудочно-кишечного тракта. Подобные комбинации могут вводиться в виде одноразового препарата или в виде разделенных препаратов, вводимых в одно и то же или в разное время, и с использованием одного и того же либо различных путей введения.
Изобретение не ограничено вышеописанными воплощениями, которые могут отличаться в деталях.
Эксперимент in vivo на животной модели ревматоидного артрита с использованием штамма Bifidobacterium infantis 35624
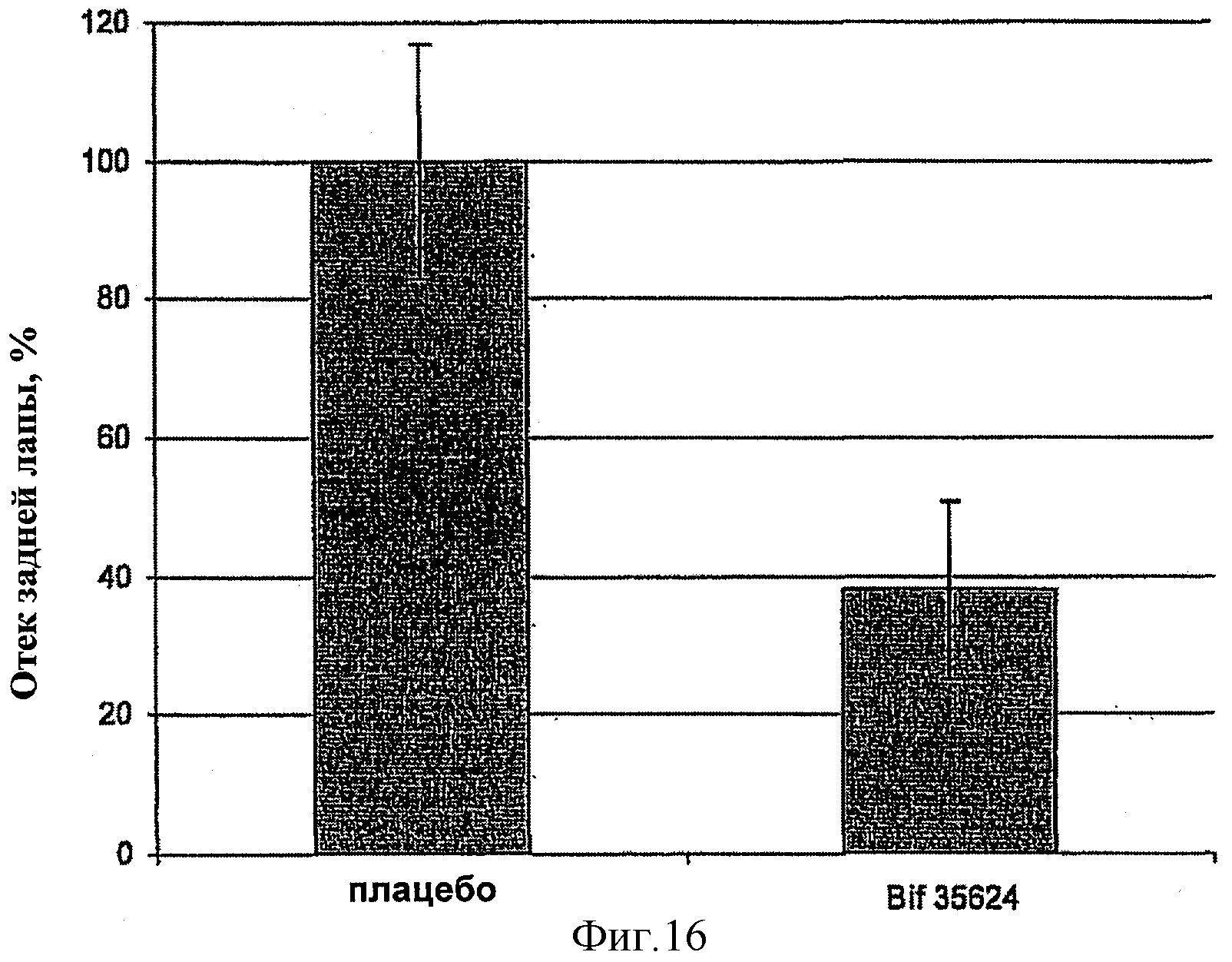
В данном эксперименте оценивали проявления ревматоидного артрита у мышей линии DBA-1 после потребления Bifidobacterium infantis 35624. Кратко, мышам давали указанный пробиотик или плацебо в виде лиофилизированного порошка в течение 10 недель. Артрит индуцировали инъекцией коллагена на 5-ю и 8-ю недели с последующей бустерной инъекцией липополисахарида (ЛПС) на 9-ю неделю. У всех животных на 10-ю неделю оценивали отек задней лапы, используя штангенциркуль. Потребление Bifidobacterium infantis 35624 мышами DBA-1 вызывало значительное снижение отека задней лапы по сравнению с животными, которые получали плацебо (см. Фиг.16, р<0,05).
Двойное слепое плацебо-контролируемое испытание пробиотического штамма Bifidobacterium infantis 35624 на мышах, нокаутированных по интерлейкину-10 (IL-10 КО), и связь с цитокиновым балансом
Целью данного исследования являлась: 1) оценка способности пробиотического штамма Bifidobacterium infantis 35624 воздействовать на колит у IL-10 КО мышей; а также 2) оценка влияния данного пробиотического штамма на продуцирование цитокинов, как на уровне слизистой оболочки, так и на уровне всего организма (системно).
Микрофлора кишечника вовлечена в индукцию аномального воспалительного ответа, наблюдаемого у индивидуумов с воспалительным заболеванием кишечника. Некоторые мышиные модели развивают спонтанный колит, подобный тому, который наблюдается при воспалении кишечника; одной из таких моделей являются мыши, нокаутированные по интерлейкину-10 (IL-10 КО). Дополнительно эта модель дает возможность исследования влияния пробиотиков на иммунный ответ, так как воспаление кишечника ассоциировано с явно разбалансированной продукцией провоспалительных цитокинов Th-1 типа, например подобно тому, как наблюдается при болезни Крона. Интерлейкин-12 (IL-12) и интерферон-γ (IFN-γ) являются ключевыми медиаторами, ответственными за возникновение энтероколита, причем IL-12 необходим для поддержания пролиферации хронически активированных Th-1 клеток.
В данном исследовании использовали самок мышей 129 OlaxC57BL/6-IL-10 КО возраста 7-9 недель (В&К Universal Ltd, East York-shire, UK). Группе этих мышей давали Bifidobacterium infantis 35624 в концентрации 1× 106 клеток/мл молока, в то время как контрольной группе мышей давали только немодифицированное пастеризованное молоко в качестве носителя. Мышей наблюдали ежесуточно. Каждая мышь получала 4-7 мл молока в сутки, таким образом потребляя 4-7×106 клеток микроорганизмов в сутки.
Bifidobacterium infantis 35624 выращивали в 10 мл бульона MRS (de Man, Rogosa, Sharpe) (Oxoid, UK), обогащенного 10%-ным цистеином, путем инкубирования в течение 48 часов при 37°С в анаэробных условиях. 1%-ный инокулят (об./об.) переносили в 400 мл свежего бульона MRS с цистеином и инкубировали в тех же самых условиях. Bifidobacterium infantis 35624 отделяли центрифугированием и ресуспендировали в концентрации 1×106 клеток/мл в 10%-ном пастеризованном молоке. Образцы фекалий собирали еженедельно в течение периода исследования, которое продолжалось 19 недель, после чего мышей умерщвляли смещением шейных позвонков. Подвздошную, слепую и толстую кишку фиксировали в формалине для гистопатологических анализов. У каждой мыши удаляли селезенки и выделяли спленоциты для культивирования in vitro.
Для гистопатологических анализов использовали гистопатологический индекс, изменяющийся от 0 до 4, в зависимости от тяжести воспаления в каждом месте в пределах желудочно-кишечного тракта мыши. Этот индекс основан на степени эрозии эпителиального слоя, истощения эпителиальной клетки и воспалительного клеточного инфильтрата (0=нормально; 1=минимальное проявление воспалительного инфильтрата; 2=значительная выраженность воспалительного инфильтрата (криптит, абсцесс крипт); 3=значительная выраженность воспалительного инфильтрата с истощением эпителиальных клеток; 4=значительная выраженность воспалительного инфильтрата с эрозией слизистой оболочки).
Образцы фекалий собирали еженедельно, взвешивали, диспергировали в 10 мл PBS и проводили микробный анализ, включающий установление численности В infantis 35624, общее количество лактобацилл, общее количество бифидобактерий, колиформ и С perfringens.
Продуцирование цитокинов спленоцитами определяли следующим образом. Селезенки всех мышей удаляли во время забивания. Каждую селезенку непосредственно помещали в среду DMEM, свободную от сыворотки. Селезенки отсеивали на стерилизованном металлическом фильтре в 5 мл хлорида аммония, который лизирует эритроциты. Клеточную суспензию центрифугировали дважды при 100g. Клетки ресуспендировали в DMEM (с 10%-ной фетальной телячьей сывороткой) и разбавляли до концентрации 1×106клеток/мл для культивирования in vitro. Выделенные лимфоциты культивировали совместно с провоспалительной бактерией Salmonella typhimurium (1×106 клеток/мл) в течение 72 часов при 37°С. Клеточные супернатанты отделяли и хранили при -80°С. Анализ на цитокины проводили на супернатантах с использованием твердофазного иммуноферментного анализа (ELISA) (R&D, Abingdon, UK). Цитокины, которые анализировали, представляли собой TNF-α, IFN-γ и IL-12.
Продуцирование цитокинов кишечными иммуноцитами (пейеровыми бляшками) определяли следующим образом. Небольшие части кишечника мышей извлекали путем рассечения и лимфоидные фолликулы пейеровых бляшек осторожно извлекали из боковой части серозной оболочки кишечника с помощью изогнутых ножниц. От 7 до 10 пейеровых бляшек получили на каждую мышь, их собирали в 5 мл забуференного фосфатом физиологического раствора, содержащего 1 мМ ЭДТА и 1 мМ коллагеназы (Sigma; C-6885, type II), и помещали в термостат со встряхиванием при 37°С на 20 минут. Собранные бляшки затем помещали между двумя стерильными стеклянными предметными стеклами и раздавливали. Иммуноциты из фолликулов высвобождались в среду. Эту клеточную суспензию центрифугировали (100g × 10 минут), осадок ресуспендировали и разбавляли в DMEM, 25 мМ глюкозы, дополненной 1% пенициллина-стрептомицина и 40 мкг/мл гентамицина (Faulding Pharmaceuticals Pic, UK), до концентрации 106 клеток/мл.
Пейеровы бляшки засевали в 24-луночные планшеты для тканевых культур (Costar, Corning, New York, USA) в двух повторностях в концентрации 1×106 клеток на лунку. После 72-часового периода инкубации (5% СО2 и 37°С, увлажненная атмосфера) все супернатанты собирали для анализа на цитокины TNF-α и IFN-γ. Продуцирование цитокинов определяли путем ELISA (R&D Systems, Abingdon, UK и BD, Pharmingen, Oxford, UK).
РЕЗУЛЬТАТЫ
Гистопатология
После забивания оценки от 0 до 4 присваивали для каждой проверяемой области кишки: слепой кишки, проксимального отдела толстой кишки (восходящей и поперечной толстой кишки) и дистального отдела толстой кишки (нисходящей, ректальной и анальной области), с суммарно возможной оценкой 12, присвоенной для кишки каждой мыши. Когда все отделы были проверены, рассчитали среднюю оценку для каждой группы. Средняя оценка воспаления для контрольной группы составила 8,25 (среднеквадратическая ошибка, SEM 0, 94), в то время как средняя оценка воспаления для группы, принимавшей Bifidobacterium infantis 35624, составила 4,6. Таким образом, наблюдалось значительное снижение воспаления по сравнению с контрольной группой (Фиг.17). Кроме того, у 4 мышей в контрольной группе был обнаружен панколит с полным поражением проксимального и дистального отделов толстой кишки в равной степени. Никаких случаев панколита не наблюдалось в группе, принимавшей Bifidobacterium infantis 35624, что подтверждает также профилактическое действие данного пробиотика в отношении воспалительных заболеваний кишечника.
Микробный анализ
Образцы фекалий от всех мышей анализировали для оценки транзита пробиотических штаммов в кишечнике. Пробиотические штаммы были выделены в фекалиях всех мышей в пределах 1 недели кормления, подтверждая выживаемость и транзит пробиотических штаммов у тестируемых мышей. Выделение Bifidobacterium infantis 35624 с фекалиями составило приблизительно 1×105 КОЕ/г к 12-ой неделе кормления (Фиг.18). В группе плацебо не было выделено никаких пробиотических штаммов ни у одной мыши.
Продуцирование цитокинов
А) Спленоциты
Анализ на цитокины осуществляли на супернатантах спленоцитов путем ELISA после стимуляции in vitro провоспалительной бактерией Salmonella typhimurium. Эта провоспалительная бактерия была выбрана в качестве стимула in vitro, так как она представляет собой достоверный и релевантный биологический стимул, являясь грамотрицательной бактерией, содержащей липополисахаридный эндотоксин. Было показано, что уровень провоспалительных цитокинов IFN-γ, TNF-α и IL-12 значительно снизился в группе, принимавшей Bifidobacterium infantis 35624 (Фиг.19).
Б) Иммуноциты кишечника (пейеровы бляшки)
Анализ на цитокины осуществляли на супернатантах клеток пейеровых бляшек в отдельной группе Bifidobacterium infantis 35624 и одновременных контролей. Спонтанная продукция TNF-α и IFN-γ была значительно снижена у животных, принимавших Bifidobacterium infantis 35624, по сравнению с контрольными животными (Фиг.20).
ВЫВОДЫ
Результаты настоящего исследования подтверждают выживаемость пробиотических штаммов при прохождении через желудочно-кишечный тракт и показывают, что эти штаммы ослабляют проявления колита в модели IL-10 КО мышей. Влияние пробиотиков на воспаление слизистой оболочки отражено в снижении уровня провоспалительных цитокинов TNF-α и IFN-γ, секретируемых пейеровыми бляшками клеток кишечника. Благоприятное воздействие пробиотиков на слизистую оболочку было также ассоциировано с изменениями в системной продукции цитокинов in vitro. После стимуляции (in vitro бактерией Salmonella typhimurium) имело место снижение Th-1 цитокинов (TNF-α , IFN-γ и IL-12), в то время как продукция иммунорегуляторного (Th-3) цитокина TGF-β сохранялась.
Введение пробиотических организмов в этом исследовании ослабляло воспаление и изменяло системный иммунный ответ у IL-10 КО мышей. Ослабление симптомов колита в модели IL-10 КО мышей подтверждает, что медиаторы, отличные от IL-10, вовлечены в наглядный пробиотический эффект. Наблюдаемое изменение в профилях цитокинов является важным, так как воспаление при болезни Крона и эта мышиная модель ассоциированы с преобладанием Th-1 цитокинов, в то время как Th-3 клетки, продуцирующие TGF-β, вовлечены в подавление воспалительных ответов. Эти результаты подтверждают, что пробиотический эффект опосредован изменением баланса провоспалительных и противовоспалительных или регуляторных цитокинов.
Клинические испытания Lactobacillus и Bifidobacterium при синдроме раздраженного кишечника (IBS): симптоматические ответы и взаимосвязь с профилями цитокинов
Целью данного исследования являлось сравнение симптоматических ответов и соотношений цитокинов при синдроме раздраженного кишечника (IBS) с использованием препаратов, содержащих штаммы лактобацилл или бифидобактерий.
Имеется ряд оснований полагать, почему эти агенты будут давать терапевтическую пользу при IBS. Во-первых, многие пробиотические организмы проявляют антибактериальные и противовирусные эффекты и тем самым смогут предотвратить или ослабить течение постинфекционного IBS. Во-вторых, обладая противовоспалительным действием на слизистые поверхности, пробиотики могут уменьшить иммуноопосредованную активацию моторики кишечника и чувствительных нейронов путем уменьшения воспаления слизистой оболочки. В-третьих, пробиотики изменяют состав микрофлоры кишечника как непосредственно (через увеличение симбиотических лактобацилл или бифидобактерий либо через элиминацию патогенов), так и опосредованно (через уменьшение либо связанного с патогенами воспаления, либо бактериального брожения), оказывая влияние на функцию кишечника. Наконец, пробиотики могут изменять объем и/или состав фекалий и газов или увеличивать секрецию кишечной слизи, эффекты, которые могут модулировать симптомы, такие как запор и диарея.
ПОПУЛЯЦИЯ ИССЛЕДОВАНИЯ
В данном исследовании участвовали пациенты гастроэнтерологической клиники при Cork University Hospital возраста от 18 до 75 лет, которые удовлетворяли критерию Rome II для диагноза IBS, и у которых были исключены органические гастроэнтерологические заболевания, а также клинически значимые системные заболевания. Из исследования также были исключены беременные женщины, индивидуумы с установленной непереносимостью лактозы или иммунодефицитом, а также индивидуумы, которые подвергались какому-либо хирургическому вмешательству, за исключением грыжесечения и аппендэктомии.
ПРОТОКОЛ ИССЛЕДОВАНИЯ
Каждого потенциально пригодного пациента оценивали путем полного анализа клинической истории и проверки физических данных, а также полной картины крови, химического анализа сыворотки и количественных уровней иммуноглобулинов в сыворотке. Клинически значимые отклонения в любом из перечисленных результатов тестов приводили к исключению из рандомизации. Подходящие субъекты затем вступали в 4-недельный вводный период, во время которого они записывали симптомы, а также частоту и форму стула, ежедневно в персональную карту. В течение этого времени и на протяжении всего остального периода исследования субъекты были инструктированы не принимать никаких лекарственных препаратов, которые могут влиять на моторику кишечника или функцию всасывания, в том числе слабительных и противодиарейных агентов, а также никаких препаратов, которые могут изменять микрофлору кишечника, в том числе антибиотиков и коммерчески доступных пробиотических препаратов.
В конце этого вводного периода субъектов рандомизировали на группы, получающие либо лактобациллы, либо бифидобактерии, доставляемые в дозе 1×1010 живых бактериальных клеток в солодовом молочном напитке, или этот солодовый молочный напиток сам по себе в качестве плацебо. Все препараты были идентичны по цвету, вкусу и консистенции. Субъектов инструктировали принимать препарат утром, один раз в сутки в течение 8 недель и записывать симптомы и характеристику стула ежедневно на протяжении всего периода исследования. Согласие со схемой лечения оценивали непосредственным анкетированием при визитах в клинику и по анализам микрофлоры в фекалиях. По завершении этой 8-недельной фазы лечения субъекты продолжали заполнять ежедневную персональную карту симптомов в течение дополнительного 4-недельного периода вымывания.
ПРОБИОТИЧЕСКИЕ ПРЕПАРАТЫ
Пробиотические препараты, используемые в данном исследовании, представляли собой Lactobacillus salivarius подвид salivarius UCC 4331 и Bifidobacterium infantis 35624 и были выделены из илеоцекальной области взрослого человека, подвергнутого пластической хирургии. Эти штаммы были выбраны на основании следующих пробиотических свойств: выделены из организма человека; непатогенны; устойчивы к кислотам ЖКТ и желчи; демонстрируют способность прилипать к человеческим эпителиальным клеткам; и демонстрируют способность временно заселять и быть метаболически активными в пределах ЖКТ человека. Кроме того, эти штаммы выживают при прохождении через ЖКТ при отсутствии побочных эффектов и демонстрируют противовоспалительную активность в ряде моделей. Lactobacillus salivarius UCC 4331 культивировали в бульоне de Man/Rogosa/Sharp (Oxoid, Basingstoke, UK) при 37°С в анаэробных условиях в течение 24 часов. Bifidobacterium infantis 35624 культивировали в бульоне de Man/Rogosa/Sharp, обогащенном цистеином, при 37°С в анаэробных условиях в течение 48 часов.
ОЦЕНИВАЕМЫЕ ПАРАМЕТРЫ
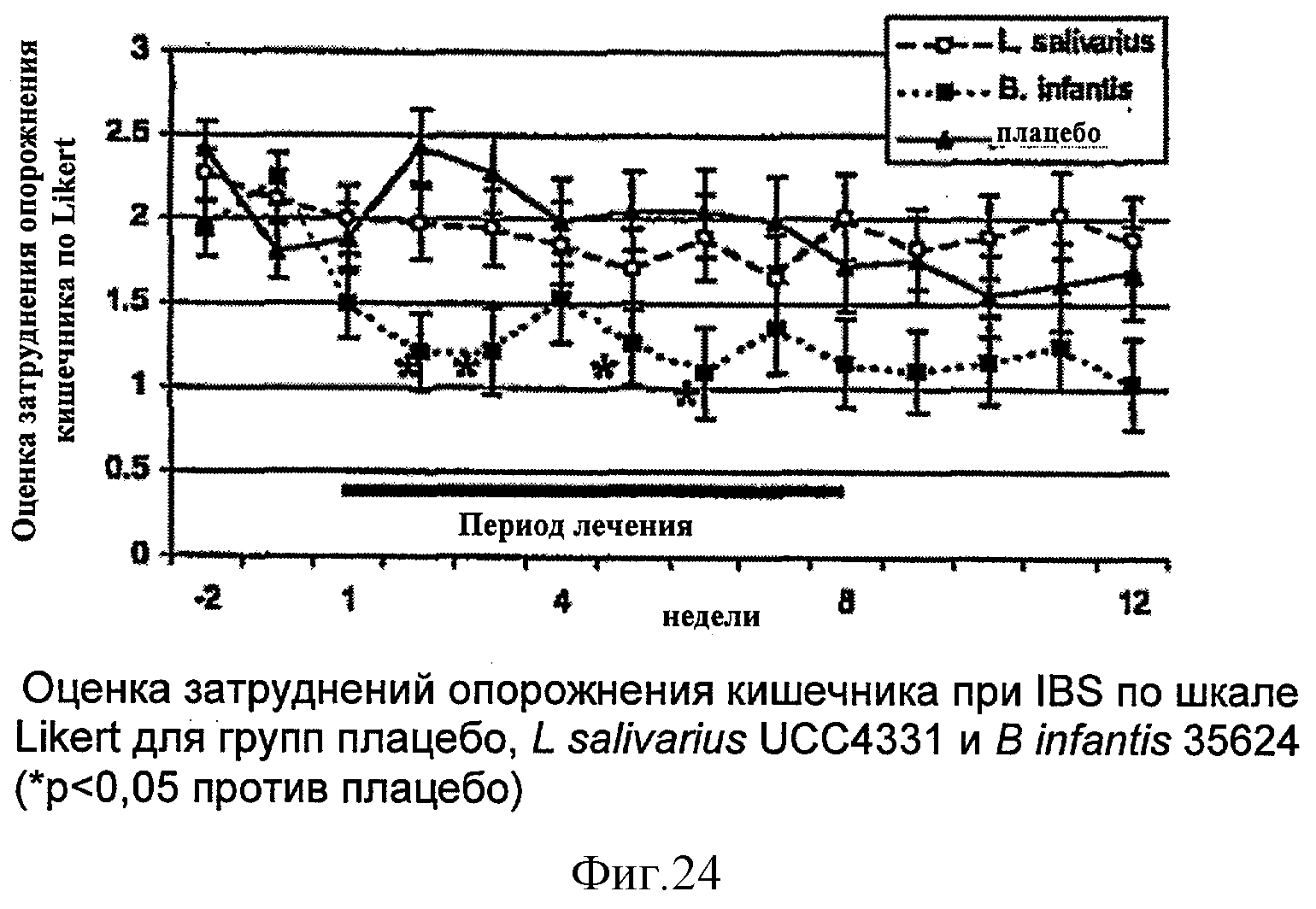
На протяжении всего исследования еженедельно у субъектов оценивали следующие 3 кардинальные группы симптомов IBS: (1) боль в животе или дискомфорт; (2) метеоризм или вздутие живота; и (3) затруднения опорожнения кишечника. Последнее может отражать либо трудности дефекации (то есть напряжение или ощущение неполного опорожнения), либо сильные позывы. Каждый симптом оценивали, используя как одинарную шкалу (Likert scale; максимальный показатель 7), так и 10-см визуальную аналоговую шкалу (VAS; максимальный показатель 10). Комплексную оценку, составленную из суммы 3 кардинальных симптомов (оценки боли/дискомфорта, метеоризма/вздутия живота и затруднений опорожнения кишечника), также рассчитывали для каждого пациента (максимальная оценка: Likert scale, 21; VAS, 30).
Частоту дефекации записывали в виде количества раз в сутки, а консистенцию оценивали, используя Bristol Stool Scale.
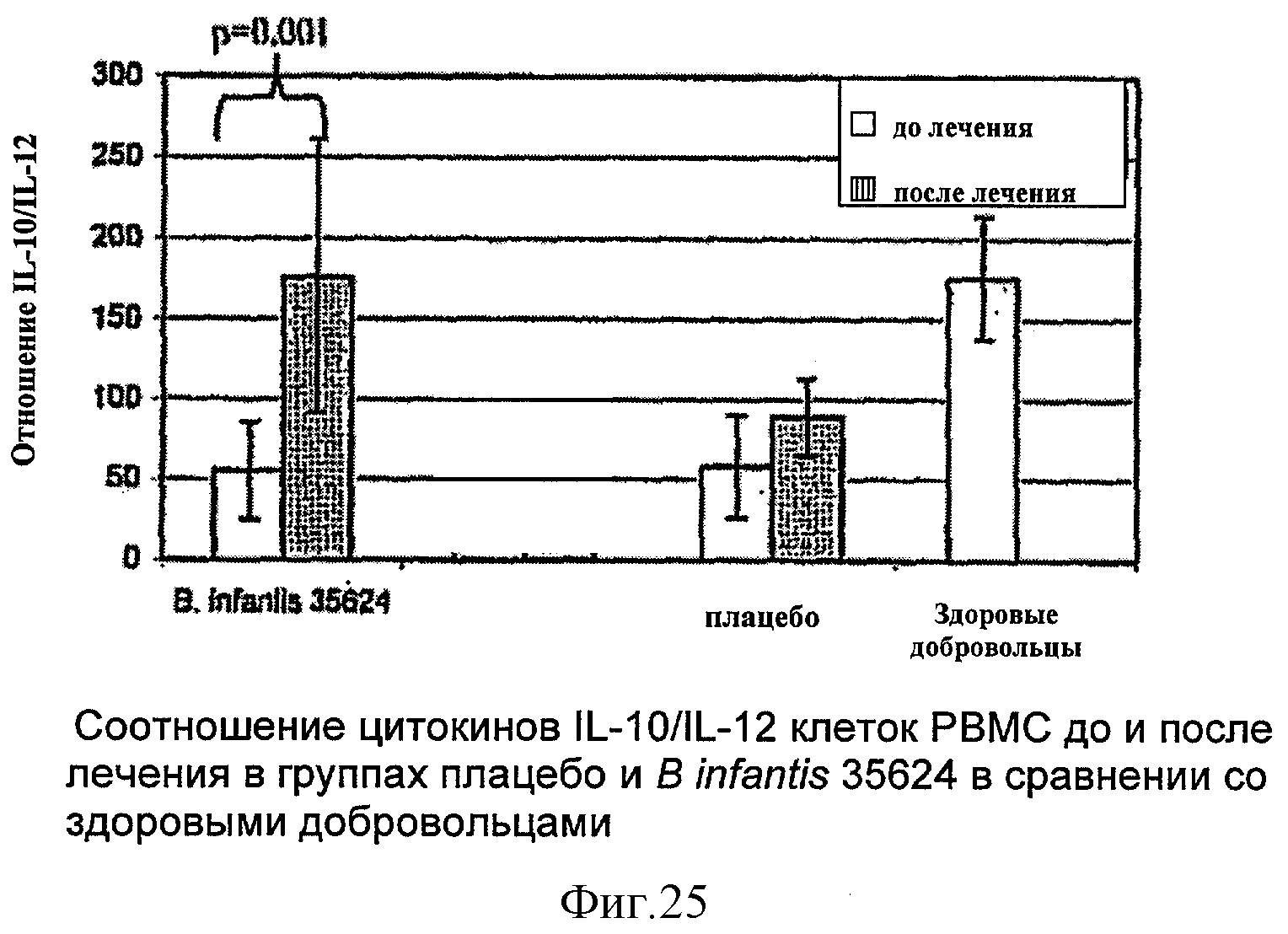
Образцы крови для полного анализа крови, химического анализа сыворотки и количественного определения уровней иммуноглобулинов (интерлейкина-10 (IL-10) и интерлейкина-12р40 (IL-12p40)) получали в начале и в конце исследования. Анализы проводили с использованием стандартных лабораторных методов.
РЕЗУЛЬТАТЫ
На Фиг.21-24 суммированы средние значения, оцененные по методу наименьших квадратов, со среднеквадратическими ошибками, для комплексной оценки и оценки каждого из отдельных симптомов (боли/дискомфорта, метеоризма/вздутия живота и затруднений опорожнения кишечника) в течение каждой недели 8-недельного периода лечения и 4-недельного периода вымывания. Поскольку аналогичные результаты были получены для всех параметров, исследованных с использованием как Likert scale, так и VAS, результаты в отношении обоих шкал представлены выборочно, либо для комплексной оценки, либо по Likert scale или VAS (см. Фиг.21-24). В Таблице 9 представлены результаты анализов площади под кривой (AUC).
Сравнение оценок для каждой недели показало, что у субъектов, которых лечили Bifidobacterium infantis 35624, комплексные оценки были ниже, чем у тех, кто получал плацебо в течение всех недель в фазе лечения и фазе вымывания. Из оценок по VAS для каждой из этих 12 недель 10 были значительно ниже по сравнению с группой плацебо (Фиг.21).
Из сравнения AUC для фазы лечения также видно, что комплексные оценки по Likert scale и VAS значительно ниже для группы субъектов, которых лечили Bifidobacterium infantis 35624, по сравнению с группой плацебо (Таблица 9).
Как видно из представленных данных для каждого индивидуального симптома, группа субъектов, которых лечили Bifidobacterium infantis 35624, проявляла значительно большее снижение в оценках симптомов во время периода лечения (Фиг.21-24 и Таблица 9). Так, указанные субъекты достигли более низких оценок для боли/дискомфорта (AUC, р<0,05, против плацебо для нескорректированных оценок, Таблица 9; оценки по Likert scale для индивидуальных недель, р<0,05 против плацебо для недель 1, 2, 4, 5 и 7 фазы лечения и 1-й недели фазы вымывания, Фиг.22), метеоризма/вздутия живота (AUC, р<0,07 против плацебо для нескорректированных оценок, Таблица 9; оценки по Likert scale для индивидуальных недель, р<0,05 против плацебо для недель 2, 5 и 6 фазы лечения, Фиг.23) и затруднений опорожнения кишечника (AUC, р<0,05 против плацебо для нескорректированных оценок, Таблица 9; оценки по Likert scale для индивидуальных недель, р<0,05 против плацебо для недель 2, 3, 5 и 6 фазы лечения и 1-ой недели фазы вымывания, Фиг.24). Для группы, которых лечили L salivarius UCC 4331, наблюдалось улучшение в оценках абдоминальной боли во время недель 2 и 7 фазы лечения (Likert scale, р<0,05, Фиг.22).
Субъекты, которых лечили Bifidobacterium infantis 35624, продемонстрировали относительно быстрый ответ на лечение; улучшение наступило в конце первой недели и достигло максимума уже к концу второй недели 8-недельного курса терапии (Фиг.21-24).
Продуцирование IL-10 и IL-12 клетками РВМС было разбалансированным в начале исследования у пациентов с IBS по сравнению со здоровыми добровольцами (Фиг.25). Уровни IL-10 были ниже у пациентов с IBS (575±108 пкг/мл против 968±220 пкг/мл), в то время как уровни IL-12 были повышенными у пациентов с IBS (15±2 пкг/мл против 6±4 пкг/мл). Отношение IL-10/IL-12 значительно различалось между этими 2 группами (IBS, 69±15; здоровые добровольцы, 176±31; р=0,003).
После лечения Bifidobacterium infantis 35624 уровни цитокинов вернулись к уровням, аналогичным наблюдаемым у группы здоровых добровольцев (Фиг.25). В противоположность этому уровни цитокинов у субъектов с IBS, получавших плацебо, не вернулись к уровням, наблюдаемым у здоровых добровольцев.
ВЫВОДЫ
Показано преимущество бифидобактерий по сравнению с плацебо в отношении каждого из кардинальных симптомов IBS и комплексной оценки. Более того, данная терапия хорошо переносилась пациентами, никакие побочные эффекты не проявлялись. Показанный в данном исследовании симптоматический ответ на лечение пробиотическими штаммами был ассоциирован с нормализацией отношения противовоспалительных к провоспалительным цитокинам, подтверждая иммуномодулирующую роль этого микроорганизма в заболеваниях кишечника.
Реферат
Штамм Bifidobacterium longum infantis NCIMB 41003, выделен из иссеченного и промытого желудочно-кишечного тракта человека, является в значительной степени иммуномодулирующим у людей после перорального потребления. Данный штамм предназначен для приготовления пробиотика, антимикробного агента и препарата, обладающего иммуномодулирующими свойствами. Препарат применяют при профилактике и/или лечении нежелательной воспалительной активности, в особенности желудочно-кишечной воспалительной активности, такой как воспалительное заболевание кишечника или синдром раздраженного кишечника. Кроме того, воспалительная активность может быть обусловлена раком. 3 н. и 41 з.п. ф-лы, 25 ил., 9 табл.

Комментарии