Композиция для стимулирования продуцирования ламинина-332 - RU2581916C2
Код документа: RU2581916C2
Чертежи





Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции для стимулирования продуцирования ламинина-332, содержащей одно или несколько соединений, выбранных из группы, состоящей из D-аланина и D-гидроксипролина, и их производных и/или солей, и к способу подавления и/или улучшения состояния кожи, включающему стадию введения соединения.
Уровень техники
Ламинин представляет собой тримерный белок, состоящий из трех нитей, включая α (альфа) цепь, β (бета) цепь и γ (гамма) цепь. На основе сочетания пяти типов α (альфа) цепи, трех типов β (бета) цепи и трех типов γ (гамма) цепи, как известно, имеется, по меньшей мере, пятнадцать изомеров. Среди них ламинин-332 (α3β3γ2 (альфа 3 бета 3 гамма 2), то есть, ламинин-5, в соответствии с предыдущим списком) обнаружен в больших количествах в базальной мембране, которая присутствует между эпидермисом и дермисом, и как предполагается, играет важную роль при поддержании структуры и функции кожи (непатентный документ 1). Мыши, нокаутированные ламинином-332, демонстрируют отделение эпидермиса от дермиса с образованием везикул, демонстрируя фенотип, который идентичен рецессивному дистрофическому буллезному эпидермолизу, то есть, наследственному расстройству у людей, и в результате, как показано, ламинин-332 играет важную роль при адгезии эпидермиса на дермисе (непатентный документ 2). Кроме того, когда очищенный образец ламинина-332 добавляют к эквивалентной модели кожи, в которой кератиноциты культивируют на коллагеновом геле, в который погружены фибробласты человека, формирование базальной мембраны усиливается (непатентный документ 3). Плазмин представляет собой протеазу для активированных белков, продуцируемых эпидермальными клетками, и он отщепляет амино-терминальный пептид α (альфа) 3 субъединицы ламинина-332 и карбокси-терминальный пептид и амино-терминальный пептид β (бета) 3 субъединицы. Каждый из отщепленных фрагментов содержит сайт распознавания для молекулы адгезии субстрата в клетке и сайт связывания для коллагена типа VII. Таким образом, ламинин-332, полученный посредством дигестии с помощью плазмина, уменьшаетспособность к адгезии для кератиноцитов. Кроме того, ламинин-332, полученный посредством дигестии с помощью плазмина, понижает сродство к коллагену типа VII.По этим причинам, предполагается, что старение кожи, вызываемое УФ облучением или другими факторам, участвует в дигестии ламинина-332 с помощью плазмина, и ослабляет функцию базальной мембраны, связанную с этим (непатентный документ 4).
Таким образом, посредством стимулирования продуцирования ламинина-332, имеется возможность подавления и/или улучшения старения кожи, вызываемого УФ облучением или другими факторами. Относительно факторов, которые стимулируют продуцирование ламинина-332, недавно сообщалось, что HIF1 (непатентный документ 5) и Smad4 (непатентный документ 6) индуцируют транскрипцию гена α (альфа) 3 субъединицы. Однако HIF1 представляет собой регулятор транскрипции, который реагирует на стимулирование со стороны окружающей среды, подобное отсутствию кислорода и механическому стимулированию, и он также ап-регулируется с помощью провоспалительного цитокина. Smad4 представляет собой регулятор транскрипции, участвующий в передаче сигнала TGF-β (бета). Все эти регуляторы представляют собой белки с высокой молекулярной массой, и их активности контролируются посредством модифицирования, подобного фосфорилированию или состоянию ассоциации с другими субъединицами. По этим причинам невозможно, чтобы они использовались для стимулирования продуцирования ламинина-332 в соответствии с непосредственным введением в живой организм для доставки их в эпидермальные клетки в тканях кожи. Кроме того, поскольку они все регулируются с помощью широкого набора регуляторных факторов, и имеют значительное влияние на функционирование живого организма, подобное воспалительной реакции, в дополнение к стимулированию продуцирования ламинина-332, их трудно безопасно использовать в повседневной практике.
Документы предшествующего уровня техники
Непатентный документ 1: Sugawara, et al., Exp. Dermatol., 17(6), 473-80 (2008)
Непатентный документ 2: Aberdam, et al., Nat. Genet., 6,299, (1994)
Непатентный документ 3: Amano, S., SOFW J., 134:10 (2008)
Непатентный документ 4: Amano, S., J. Investig. Dermatol. Symp. Proc., 14:2-7 (2009)
Непатентный документ 5: Fitsialos, G., et al., J. Cell Sci., 121:2992 (2008)
Непатентный документ 6: Zboralski, D., et al., BMC Cancer, 8:215 (2008)
Описание изобретения
Проблема, решаемая настоящим изобретением
При этих обстоятельствах, имеется необходимость для разработки композиции, которая имеет функцию стимулирования продуцирования ламинина-332, конкретно, композиции, имеющей высокую стабильность и безопасность, которая может использоваться в повседневной практике.
Средства для решения проблемы
Настоящее изобретение предусматривает композицию, стимулирующую продуцирование ламинина-332, содержащую одно или несколько соединений, выбранных из группы, состоящей из D-аланина и D-гидроксипролина, и их производных и/или солей.
Композиция, стимулирующая продуцирование ламинина-332 по настоящему изобретению, может использоваться для подавления и/или улучшения состояния кожи.
Относительно композиции, стимулирующей продуцирование ламинина-332 по настоящему изобретению, состояние кожи включает, но, не ограничиваясь этим, старение кожи от воздействия ультрафиолетовых лучей, морщины, шершавую кожу, мелкие морщинки, и сухую кожу.
Композиция, стимулирующая продуцирование ламинина-332 по настоящему изобретению, может использоваться для фармацевтического продукта.
Композиция, стимулирующая продуцирование ламинина-332 по настоящему изобретению, может использоваться для препарата для наружного применения для кожи.
Композиция, стимулирующая продуцирование ламинина-332 по настоящему изобретению, может использоваться для пищевых продуктов.
Настоящее изобретение также предусматривает способ подавления и/или улучшения состояния кожи, включающий стадию введения композиции, стимулирующей продуцирование ламинина-332, содержащей одно или несколько соединений, выбранных из группы, состоящей из D-аланина и D-гидроксипролина, и их производных и/или солей.
Состояние кожи, которое подавляется и/или улучшается с помощью способа по настоящему изобретению, включает, но, не ограничиваясь этим, старение кожи от воздействия ультрафиолетовых лучей, морщины, шершавую кожу, мелкие морщинки, и сухую кожу.
В соответствии со способом по настоящему изобретению, композиция, стимулирующая продуцирование ламинина-332, может представлять собой фармацевтический продукт.
В соответствии со способом по настоящему изобретению, композиция для стимулирования продуцирования ламинина-332 может представлять собой препарат для наружного применения для кожи.
Относительно способа по настоящему изобретению, композиция для стимулирования продуцирования ламинина-332 по настоящему изобретению может использоваться для композиции пищевых продуктов.
Как используется в настоящем документе, термин "соль" D-аланина и D-гидроксипролина обозначает любую соль, включая соль металла и соль амина, и тому подобное, при условии, что стимулирующее воздействие D-аланина и D-гидроксипролина на продуцирование ламинина-332 не ухудшается. Соль металла может включать соль щелочного металла, соль щелочноземельного металла, и тому подобное. Соль амина может включать триэтиламиновую соль, бензиламиновую соль, и тому подобное.
Как используется в настоящем документе, термин "производные" D-аланина и D-гидроксипролина обозначает молекулу D-аланина или D-гидроксипролина, которая ковалентно связана с любой группой атомов через ее амино группу, карбокси группу или боковую цепь, при условии, что стимулирующее воздействие D-аланина и D-гидроксипролина на продуцирование ламинина-332 не ухудшается. Группа атомов включает, но, не ограничиваясь этим, защитную группу, такую как N-фенилацетильная группа и 4,4'-диметокситритильная (DMT) группа, биополимер, такой как белок, пептид, сахарид, липид и нуклеиновая кислота; синтетический полимер, такой как полистирол, полиэтилен, поливинил и сложный полиэфир; и функциональную группу, такую как сложноэфирная группа. Сложноэфирная группа может включать, например, сложный алифатический эфир, такой как метиловый сложный эфир, и этиловый сложный эфир; и сложный ароматический эфир.
Аминокислота имеет оптические изомеры, которые представляют собой L-форму и D-форму. Природный белок имеет L-аминокислоты, связанные с помощью пептидных связей, и используются только L-аминокислоты, за некоторыми исключениями, такими как стенки бактериальных клеток. По этой причине, считается, что у млекопитающих, включая людей, присутствуют только L-аминокислоты и используются только L-аминокислоты (Kinouchi, T. et al., TANPAKUSHITSU KAKUSAN KOSO (PROTEIN, NUCLEIC ACID AND ENZYME), 50:453-460 (2005), Lehninger Principles of Biochemistry [Vol. 1] 2nd ed., pp132-147 (1993), Japanese-language translation, Hirokawa Shoten Ltd., Harper's Biochemistry, Original version, 22nd ed., pp21-30 (1991), Japanese-language translation, Maruzen Co., Ltd.). Соответственно, в основном, только L-аминокислоты используются в качестве аминокислот в исследованиях и в промышленности в течение длительного времени.
Исключительные случаи, когда используется D-аминокислота, представляют собой, например, случай использования в качестве исходных материалов для антибиотиков, продуцируемых микроорганизмом, и случай пищевой добавки, использующей D-аминокислоту в смеси DL-аминокислот для целей понижения стоимости выделения только L-аминокислоты из смеси L- и D-аминокислот, которые получаются в эквимолярном количестве при синтезе аминокислот. Тем не менее, нет случаев промышленного использования одних только D-аминокислот в качестве биологически активных веществ.
D-серин и D-аспарагиновая кислота имеют высокое отношение D-формы, и по этой причине осуществляется множество исследований по сравнению с другими аминокислотами. D-серин локализуется в головном мозгу и гиппокампе, и он известен как регуляторный фактор для рецептора NMDA. D-аспарагиновая кислота как обнаружено локализуется в яичках или шишковидном теле, и как известно участвует в контроле секреции гормонов (публикация нерассмотренного патента Японии № 2005-3558). Однако физиологическая активность D-аланина и D-гидроксипролина в коже не обнаружена.
Как описано в следующих далее примерах, стимулирующее воздействие D-аланина и D-гидроксипролина на продуцирование ламинина-332 до сих пор неизвестно. Таким образом, композиция, стимулирующая продуцирование ламинина-332 по настоящему изобретению, которая содержит D-аланин и/или D-гидроксипролин, представляет собой новое изобретение.
Недавно сообщалось, что мышам ddY позволяют свободно заглатывать 10 мМ водного раствора D-аминокислоты в течение двух недель, а затем их исследуют на концентрацию D-аминокислоты в каждом органе, которая составляет 3-1000 пмоль на железо в шишковидном теле и 2-500 нмоль на грамм во влажной ткани мозга (Morikawa, A. et al., Amino Acids, 32:13-20 (2007)). На основе того, что указано выше, нижний предел ежедневно принимаемого количества D-аланина и D-гидроксипролина, которые содержатся в композиции по настоящему изобретению, вычисляется, как описано ниже.
D-аланин по настоящему изобретению имеет воздействие на стимулирование продуцирования ламинина-332 в культивируемых эпидермальных кератиноцитах человека в диапазоне концентраций от 0,1 мкМ (микромоль) до 1 мкМ(микромоль), как описывается в следующих далее Примерах. Таким образом, количество D-аланина, которое содержится в композиции для улучшения состояния кожи, препарата для наружного применения для кожи или для композиции пищевых продуктов по настоящему изобретению, может представлять собой любое содержание, при условии, что D-аланин в указанном выше диапазоне концентраций доставляется в клетки фибробластов в тканях кожи in vivo. Что касается препарата для наружного применения для кожи по настоящему изобретению, содержание D-аланина может составлять от 0,000015% масс до 50% масс, или вплоть до максимальной массовой концентрации, которая может быть приготовлена, в общей композиции по настоящему изобретению. Конкретно, когда композиция представляет собой препарат для наружного применения для кожи, содержание D-аланина предпочтительно, составляет от 0,00003% масс до 30% масс, а наиболее предпочтительно, от 0,0003% масс до 3% масс. Когда композиция по настоящему изобретению представляет собой фармацевтический препарат для агента для внутреннего употребления, содержание D-аланина может находиться в диапазоне от 0,00001% масс до 100% масс. Когда композиция по настоящему изобретению представляет собой агент для внутреннего потребления, содержание D-аланина предпочтительно составляет от 0,00002% масс до 80% масс, а наиболее предпочтительно, от 0,0002% масс до 60% масс. Кроме того, нижний предел ежедневно потребляемого количества D-аланина, который содержится в композиции по настоящему изобретению, может составлять 0,01 нг, предпочтительно 0,1 нг, и более предпочтительно, 1 нг на 1 кг массы тела.
D-гидроксипролин по настоящему изобретению имеет воздействие на стимулирование продуцирования ламинина-332 в культивируемых эпидермальных кератиноцитах человека в диапазоне концентраций от 0,1 мкМ (микромоль) до 1 мкМ (микромоль), как описано в следующих далее Примерах. Таким образом, количество D-гидроксипролина, которое содержится в препарате для улучшения состояния кожи, препарате для наружного применения для кожи или в композиции пищевого продукта по настоящему изобретению, может представлять собой любое содержание, при условии, что D-гидроксипролин в указанном выше диапазоне концентраций доставляется в клетки фибробластов в тканях кожи in vivo. Относительно препарата для наружного применения для кожи по настоящему изобретению, содержание D-гидроксипролина в общей композиции по настоящему изобретению может составлять от 0,000015% масс до 50% масс или вплоть до максимальной массовой концентрации, которая может быть приготовлена. Конкретно, когда композиция представляет собой препарат для наружного применения для кожи, содержание D-гидроксипролина предпочтительно составляет от 0,00003% масс до 30% масс, а наиболее предпочтительно, от 0,0003% масс до 3% масс. Когда композиция по настоящему изобретению представляет собой агент для внутреннего потребления, содержание D-гидроксипролинаможет находиться в диапазоне от 0,00001% масс до 100% масс. Когда композиция по настоящему изобретению представляет собой агент для внутреннего потребления, содержание D-гидроксипролинапредпочтительно, составляет от 0,00002% масс до 80% масс, а наиболее предпочтительно, от 0,0002% масс до 60% масс. Кроме того, нижний предел ежедневного потребляемого количества D-гидроксипролина, которое содержится в композиции по настоящему изобретению, может составлять 0,01 нг, предпочтительно 0,1 нг, а более предпочтительно, 1 нг на 1 кг массы тела.
Композиция по настоящему изобретению может дополнительно содержать одну или несколько фармацевтически приемлемых добавок, в дополнение к D-аланину и D-гидроксипролину, к солям D-аланина и D-гидроксипролина, и/или производным D-аланина и D-гидроксипролина, способных высвобождать D-аланин с помощью ферментов, метаболизирующих лекарственные средства, и тому подобное, in vivo, при условии, что стимулирующее воздействие D-аланина и D-гидроксипролина на продуцирование ламинина-332 не ухудшается. Такая добавка включает, но, не ограничиваясь этим, разбавитель и агент для увеличения объема, связующее и адгезив, смазывающее вещество, вещество, способствующее скольжению, пластификатор, разрыхлитель, несущий растворитель, буферный агент, краситель, ароматизирующее вещество, подсластитель, консервант и стабилизатор, адсорбент, а также другие фармацевтические добавки, известные специалистам в данной области.
Композиция по настоящему изобретению может быть получена посредством использования в качестве активного ингредиента, только D-аланина и D-гидроксипролина, солей D-аланина и D-гидроксипролина и/или производных D-аланина и D-гидроксипролина, способных к высвобождению D-аланина и D-гидроксипролина с помощью ферментов, метаболизирующих лекарственные средства, и тому подобное, in vivo. Однако в пределах такого диапазона, что воздействие настоящего изобретения не ухудшается, она можетсоответствующим образом приготавливаться вместе с другими компонентами, которые используются для препарата для наружного применения для кожи, подобных косметике, включая квазилекарственные средства и фармацевтические продукты, если это необходимо. Примеры других компонентов (то есть, необязательно добавляемых компонентов) включают масло, поверхностно-активное вещество, порошок, краситель, воду, спирты, загущающий агент, хелатирующий агент, силиконы, антиоксидант, УФ поглощающий агент, увлажняющий агент, ароматизирующий агент, различные фармацевтически эффективные компоненты, консервант, агент для регулировки pH и нейтрализующий агент.
Дозированная форма композиции, стимулирующей продуцирование ламинина-332 по настоящему изобретению, которая используется для подавления и/или улучшения состояния кожи (далее, упоминается как "агент для улучшения состояния кожи"), может представлять собой любую форму, которая обычно используется для композиций квази-лекарственных средств и фармацевтических композиций, содержащих препарат для наружного применения для кожи, подобный мази, крему, эмульсии, лосьону, компрессу, гелю и пластырю, пероральный препарат, подобный порошку, гранулам, мягкой капсуле и таблетке, перназальный препарат, подобный назальному спрею, и раствор для инъекций.
Дозированная форма препарата для наружного применения для кожи в соответствии с настоящим изобретением не ограничивается как-либо, при условии, что она обычно используется для препарата для наружного применения для кожи, и она включает мазь, крем, эмульсию, лосьон, компресс, гель и пластырь.
Композиция пищевого продукта по настоящему изобретению может дополнительно содержать, приправу, краситель, консервант и другие компоненты, которые могут использоваться для пищевого продукта, при условии, что воздействие на стимулирование продуцирования ламинина-332 посредством D-аланина и D-гидроксипролина не ухудшается, в дополнение к D-аланину и D-гидроксипролину, солям D-аланина и D-гидроксипролина и/или производным D-аланина и D-гидроксипролина, и способным к высвобождению D-аланина и D-гидроксипролина с помощью ферментов, метаболизирующих лекарственные средства, и тому подобное, in vivo.
Композиция пищевого продукта по настоящему изобретению может представлять собой любую композицию, используемую обычно в качестве композиции пищевого продукта,включая, но, не ограничиваясь этим, сладости, печенье, соевую пасту, французскую приправу, майонез, белый хлеб, соевый соус, йогурт, сухую порошкообразную приправу для риса, приправу/соус для натто (японские забродившие соевые бобы), натто, неочищенный черный уксус.
Краткое описание чертежей
Фиг.1 представляет собой диаграмму, иллюстрирующую воздействие D-аланина на клетки KC.
Фиг.2 представляет собой диаграмму, иллюстрирующую воздействие D-аланина на продуцирование ламинина-332 в клетках KC.
Фиг.3 представляет собой диаграмму, иллюстрирующую воздействие D-аланина на клетки HaCaT.
Фиг.4 представляет собой диаграмму, иллюстрирующую воздействие D-гидроксипролинана клетки HaCaT.
Фиг.5 представляет собой диаграмму, иллюстрирующую воздействие D-аланина на продуцирование ламинина-332 в клетках HaCaT.
Фиг.6 представляет собой диаграмму, иллюстрирующую воздействие D-гидроксипролинана продуцирование ламинина-332 в клетках HaCaT.
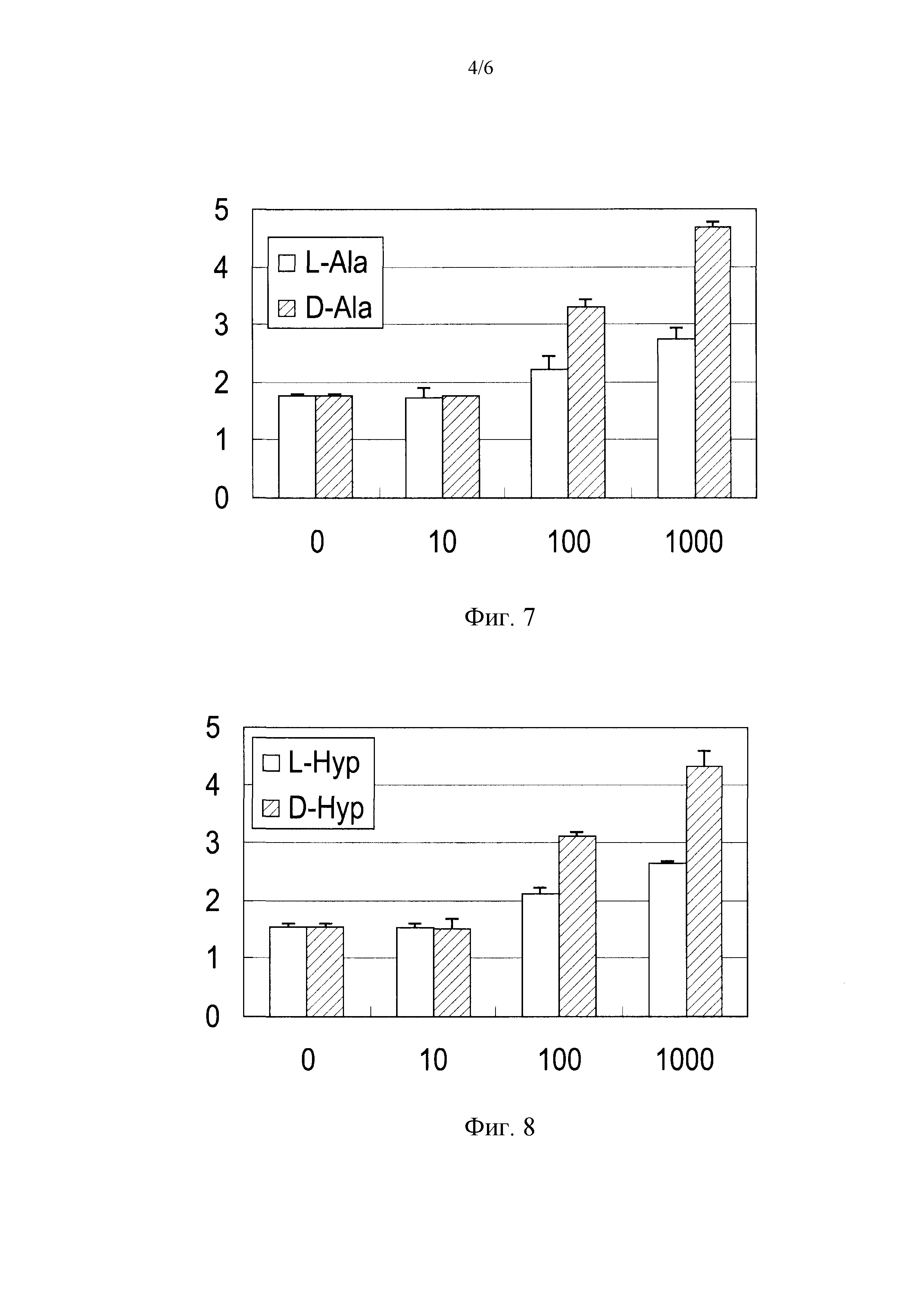
Фиг.7 представляет собой диаграмму, иллюстрирующую воздействие D-аланина при различных концентрациях на продуцирование ламинина-332 в клетках HaCaT.
Фиг.8 представляет собой диаграмму, иллюстрирующую воздействие D-гидроксипролинапри различных концентрациях на продуцирование ламинина-332 в клетках HaCaT.
Фиг.9 представляет собой диаграмму, иллюстрирующую воздействие D-аспарагиновой кислоты при различных концентрациях на продуцирование ламинина-332 в клетках HaCaT.
Фиг.10 представляет собой диаграмму, иллюстрирующую воздействие D-аспарагина при различных концентрациях на продуцирование ламинина-332 в клетках HaCaT.
Фиг.11 представляет собой диаграмму, иллюстрирующую воздействие D-пролина при различных концентрациях на продуцирование ламинина-332 в клетках HaCaT.
Фиг.12 представляет собой диаграмму, иллюстрирующую воздействие D-серина при различных концентрациях на продуцирование ламинина-332 в клетках HaCaT.
Описание вариантов осуществления
Примеры настоящего изобретения, описанные ниже, предназначаются только для иллюстрации настоящего изобретения, но не для ограничения его технических рамок. Технические рамки настоящего изобретения ограничиваются только описаниями, приведенными в формуле изобретения.
Все источники, цитируемые в настоящем документе, включаются в качестве ссылок во всей их полноте.
Пример 1
1. Стимулирование продуцирования ламинина-332 посредством добавления аланина и гидроксипролина
1-1. Материалы и методы
(1)Клетки
Используют полученные из эпидермиса человека клетки HaCaT (H. Hans, et al., Experimental Cell Research, 239:399 (1998)) и полученные из кератиноцитов человека клетки KC (Sanko Junyaku Co., Ltd., производитель: LONZA Walkersville Inc.). Клетки инокулируют в 24-луночный планшет с получением 4×104 клеток на лунку. Затем клетки культивируют в течение 24 часов в среде для клеточной культуры (D-MEM (1 г/л глюкоза), производится Wako Pure Chemical Industries, Ltd.), к которой дополнительно добавляют 0,1% раствор бычьего сывороточного альбумина (BSA) (далее, упоминается как "стандартная среда") в атмосфере 5% CO2 и насыщенных водяных паров при 37°C (градусов Цельсия).
(2) Добавление аланина и гидроксипролина
Затем, среду меняют на стандартную среду, в которую добавляют 1 мкМ (микромоль) L- или D-аланина, 0,5 мкМ (микромоль), каждого, L- и D-аланина, 1 мкМ (микромоль) L- или D-гидроксипролина, или 0,5 мкМ (микромоль), каждого, L- и D-гидроксипролина, и ее культивируют в течение 24 часов. Кроме того, стандартная среда, описанная выше, к которой не добавляют ни аланина, ни гидроксипролина, используется в качестве отрицательного контроля. D-гидроксипролин используемый в этом примере, представляет собой 4-цис-D-гидроксипролин.
(3) Количественное определение продуцируемого количества ламинина-332
После завершения культивирования клеток, культурную среду собирают и центрифугируют при 3000 об/мин в течение пяти минут. Концентрацию ламинина-332 в супернатанте измеряют с помощью ELISA (Amano, S., et al., J. Immunol. Methods, 224:161 (1999)). Используемый метод ELISA представляет собой метод сэндвич-типа, который использует биотинилированный конъюгат BM165, то есть моноклонального антитела против α (альфа) 3 цепи ламинина-5 и 6F12, то есть моноклонального антитела против β (бета) 3 цепи ламинина-5, и детектирование осуществляют посредством использования авидина D, меченного пероксидазой хрена (Vector Laboratories, Catalogue No. A-2004). PBS используют в качестве контроля.
(4) Количественное определение количества жизнеспособных клеток
После сбора культурной среды, клетки промывают PBS, и к ним добавляют alamarBlue (торговое наименование: Biosource International, Inc.) с получением конечной концентрации 10%. Через два часа, в соответствии со способами Ahmed S. A. et al., (J. Immunol. Methods, 170, 211-224 (1994)) и инструкциями, поставляемыми производителем, измеряют интенсивность флуоресценции раствора alamarBlue при длине волны возбуждения 544 нм и длине волны испускания 590 нм.
1-2. Результаты
(1) Количественное определение количества жизнеспособных клеток KC
Фигура 1 показывает результаты эксперимента, полученные посредством исследования воздействия добавления аланина на пролиферацию клеток KC. Величины ошибок для каждых экспериментальных условий показывают стандартные отклонения экспериментально измеренных величин,получаемые посредством повторения экспериментов по три раза при идентичных условиях.
Относительная интенсивность флуоресценции (как и далее) alamarBlue (торговое наименование) в качестве отрицательного контроля составляет 50 для клеток KC. Интенсивность флуоресценции для клеток KC, которые культивируют в среде, в которую добавляют 1 мкМ (микромоль) L-аланина, в среде, в которую добавляют 1 мкМ (микромоль) D-аланина, и в среде, в которую добавляют 0,5 мкМ (микромоль), каждого, L- и D-аланина, составляет 40, 45, и 50, соответственно. По сравнению с отрицательным контролем, интенсивность флуоресценции alamarBlue (торговое наименование) для клеток KC, культивируемых в среде, в которую добавляют аланин, не показывает значимой разницы в соответствии с критерием Тьюки-Крамера. Таким образом, обнаружено, что L- и D-аланин не имеют цитотоксичности относительно клеток KC.
(2) Продуцирование ламинина-332 в клетках KC
Фигура 2 показывает результаты эксперимента, полученные посредством исследования воздействия добавления аланина на продуцирование ламинина-332 в клетках KC. Вертикальная линия диаграммы на Фиг.2 представляет значения, полученные посредством деления коэффициента поглощения, полученного от измерения ELISA, который пропорционален концентрации ламинина-332 в супернатанте культуры от каждой лунки, на интенсивность флуоресценции alamarBlue (торговое наименование), которая пропорциональна количеству клеток, присутствующих в каждой лунке (далее, упоминается как "относительное значение концентрации ламинина-332 по сравнению с количеством клеток"). Величины ошибок для каждых экспериментальных условий показывают стандартные отклонения экспериментально измеренных величин, получаемые посредством повторения экспериментов по три раза при идентичных условиях. Кроме того, двойная звездочка (**) показывает, что p меньше чем 1% в соответствии с критерием Тьюки-Крамера.
Относительное значение концентрации ламинина-332 по сравнению с количеством клеток для отрицательного контроля составляет 0,35. Относительное значение концентрации ламинина-332 по сравнению с количеством клеток для клеток KC, которые культивируют в среде, в которую добавляют 1 мкМ (микромоль) L-аланина, в среде, в которую добавляют 1 мкМ (микромоль) D-аланина, и в среде, в которую добавляют 0,5 мкМ (микромоль), каждого, L- и D-аланина, составляет 0,40, 0,50, и 0,45, соответственно. По сравнению с отрицательным контролем, добавление D-аланина при концентрации 1 мкМ (микромоль) дает в p меньше чем 1% в соответствии с критерием Тьюки-Крамера, демонстрируя значимую разницу. Таким образом, стимулированное продуцирование ламинина-332 в клетках KC при добавлении D-аланина является доказанным.
(3) Количественное определение количества жизнеспособных клеток HaCaT
Фигура 3 и Фигура 4 показывают результаты эксперимента, полученные посредством исследования воздействия добавления аланина или гидроксипролина на пролиферацию клеток HaCaT. Далее, D-гидроксипролин (D-Hyp) означает 4-цис-D-гидроксипролин. Величины ошибок для каждых экспериментальных условий показывают стандартные отклонения экспериментально измеренных величин, получаемые посредством повторения экспериментов по три раза при идентичных условиях.
Интенсивность флуоресценции alamarBlue (торговое наименование) в качестве отрицательного контроля составляет 300 для клеток HaCaT. Интенсивность флуоресценции для клеток HaCaT, которые культивируют в среде, в которую добавляют 1 мкМ (микромоль) L-аланина, в среде, в которую добавляют 1 мкМ (микромоль) D-аланина, и в среде, в которую добавляют 0,5 мкМ (микромоль), каждого, L- и D-аланина, для всех, составляет 250 (Фиг.3). Интенсивность флуоресценции для клеток HaCaT, которые культивируют в среде, в которую добавляют 1 мкМ (микромоль) L-гидроксипролина, в среде, в которую добавляют 1 мкМ (микромоль) D-гидроксипролина, и в среде, в которую добавляют 0,5 мкМ (микромоль), каждого, L- и D-гидроксипролина, составляет, для всех, 280 (Фиг. 4). По сравнению с отрицательным контролем, интенсивность флуоресценции alamarBlue (торговое наименование) от клеток HaCaT, культивируемых в среде, в которую добавляют аланин или D-гидроксипролин, не показывает значимой разницы в соответствии с критерием Тьюки-Крамера. Таким образом, обнаружено, что L- и D-аланин и L- и D-гидроксипролин также не имеют цитотоксичности относительно клеток HaCaT.
(4) Продуцирование ламинина-332 в клетках HaCaT в соответствии с добавлением аланина
Фигура 5 показывает результаты эксперимента, полученные посредством исследования воздействия добавления аланина на продуцирование ламинина-332 в клетках HaCaT. Вертикальная линия диаграммы на Фиг.5 представляет относительные значения концентрации ламинина-332 по сравнению с количеством клеток, которые присутствуют в супернатанте культуры в каждой лунке. Величины ошибок для каждых экспериментальных условий показывают стандартные отклонения экспериментально измеренных величин, получаемые посредством повторения экспериментов по три раза при идентичных условиях. Кроме того, двойная звездочка (**) показывает, что p меньше чем 1% и звездочка (*) показывает, что p меньше чем 5% согласно критерию Шеффе.
Относительное значение концентрации ламинина-332 по сравнению с количеством клеток для отрицательного контроля составляет 0,04. Относительное значение концентрации ламинина-332 по сравнению с количеством клеток в клетках HaCaT, культивируемых в среде, в которую добавляют 1 мкМ (микромоль) L-аланина, в среде, в которую добавляют 1 мкМ (микромоль) D-аланина, и в среде, в которую добавляют 0,5 мкМ (микромоль), каждого, L- и D-аланина, составляет 0,07, 0,11, и 0,10, соответственно. По сравнению с отрицательным контролем, добавление D-аланина при концентрации 1 мкМ (микромоль) дает p меньше чем 1% согласно критерию Шеффе. По сравнению с отрицательным контролем, добавление смеси, содержащей как D-аланин, так и L-аланин при концентрации 0,5 мкМ (микромоль), даетp меньше чем 5% согласно критерию Шеффе. Значение p является меньшим, чем 5% согласно критерию Шеффе в пределах между 1 мкМ (микромоль) D-аланина и 1 мкМ (микромоль) L-аланина, таким образом, все они показывают значимые разницы. Таким образом, подобно клеткам KC, стимулирование продуцирования ламинина-332 посредством добавления D-аланина в клетках HaCaT также является доказанным.
(5) Продуцирование ламинина-332 в клетках HaCaT в соответствии с добавлением гидроксипролина
Фигура 6 показывает результаты эксперимента, полученные посредством исследования воздействия добавления гидроксипролина на продуцирование ламинина-332 в клетках HaCaT. Вертикальная линия диаграммы на Фиг.6 представляет относительные значения концентрации ламинина-332 по сравнению с количеством клеток, присутствующих в супернатанте культуры в каждой лунке. Величины ошибок для каждых экспериментальных условий показывают стандартные отклонения экспериментально измеренных величин, получаемые посредством повторения экспериментов по три раза при идентичных условиях.
Относительное значение концентрации ламинина-332 по сравнению с количеством клеток для отрицательного контроля составляет 0,04. Относительные значения концентрации ламинина-332 по сравнению с количеством клеток в клетках HaCaT, культивируемых в среде, в которую добавляют 1 мкМ (микромоль) L-гидроксипролина, в среде, в которую добавляют 1 мкМ (микромоль) D-гидроксипролина, и в среде, в которую добавляют 0,5 мкМ (микромоль), каждого, L- и D-гидроксипролина, составляют 0,05, 0,065, и 0,06, соответственно.
Пример 2
2. Сравнение продуцируемого количества ламинина-332 в соответствии с добавлением различных аминокислот
2-1. Материалы и методы
Культивирование клеток осуществляют таким же способом, как в Примере 1, посредством использования клеток HaCaT. После этого, среду меняют на стандартную среду, в которую добавляют аминокислоты, такие как L- или D-аланин, L- или D-гидроксипролин, L- или D-аспарагиновую кислоту, L- или D-аспарагин, L- или D-пролин или L- или D-серин при концентрации 10 нМ, 100 нМ, или 1000 нМ, и культивируют в течение 24 часов. Стандартную среду, в которую аминокислоты не добавляют, используют в качестве отрицательного контроля. D-Гидроксипролин, используемый в этом примере, представляет собой 4-цис-D-гидроксипролин. Продуцируемое количество ламинина-332 измеряют таким же способом, как в Примере 1. Цитотоксичности не наблюдается в течение следующих далее экспериментов, в которых аминокислоты добавляют при различных концентрациях, и продуцируемые количества ламинина-332 в клетках сравнивают для каждых экспериментальных условий.
2-2. Результаты
(1) Добавление аланина
Фигура 7 показывает результаты эксперимента, полученные посредством исследования воздействия добавления аланина при различных концентрациях на продуцирование ламинина-332 в клетках HaCaT. Вертикальная линия диаграммы на Фиг.7 представляет концентрации (нг/мл) ламинина-332 в супернатанте культуры в каждой лунке. Величины ошибок для каждых экспериментальных условий показывают стандартные отклонения экспериментально измеренных величин, получаемые посредством повторения экспериментов по четыре раза при идентичных условиях.
Концентрация ламинина-332 составляет 1,7 нг/мл для отрицательного контроля. Концентрация ламинина-332 в клетках HaCaT, которые культивируют в среде, в которую добавляют аланин при концентрации 10 нМ, 100 нМ, и 1000 нМ, составляет 1,7 нг/мл, 2,3 нг/мл, и 2,8 нг/мл, соответственно, для L-аланина, и 1,7 нг/мл, 3,4 нг/мл, и 4,8 нг/мл, соответственно, для D-аланина. На основе приведенных выше результатов, обнаружено, что D-аланин может стимулировать продуцирование ламинина-332 при концентрации 100 нг/мл или выше.
(2) Добавление гидроксипролина
Фигура 8 показывает результаты эксперимента, полученные посредством исследования воздействия добавления гидроксипролина при различных концентрациях на продуцирование ламинина-332 в клетках HaCaT. Вертикальная линия диаграммы на Фиг.8 представляет концентрации (нг/мл) ламинина-332 в супернатанте культуры в каждой лунке. Величины ошибок для каждых экспериментальных условий показывают стандартные отклонения экспериментально измеренных величин, получаемые посредством повторения экспериментов по четыре раза при идентичных условиях.
Концентрация ламинина-332 составляет 1,5 нг/мл для отрицательного контроля. Концентрация ламинина-332 в клетках HaCaT, которые культивируют в среде, в которую добавляют гидроксипролин при концентрации 10 нМ, 100 нМ, и 1000 нМ, составляет 1,5 нг/мл, 2,3 нг/мл, и 2,7 нг/мл, соответственно, для L-гидроксипролина, и 1,5 нг/мл, 3,3 нг/мл, и 4,4 нг/мл, соответственно, для D-гидроксипролина. На основе приведенных выше результатов, обнаружено, что D-гидроксипролин может стимулировать продуцирование ламинина-332 при концентрации 100 нг/мл или выше.
(3) Добавление аспарагиновой кислоты
Фигура 9 показывает результаты эксперимента, полученные посредством исследования воздействия добавления аспарагиновой кислоты при различных концентрациях на продуцирование ламинина-332 в клетках HaCaT. Вертикальная линия диаграммы на Фиг.9 представляет концентрации (нг/мл) ламинина-332 в супернатанте культуры в каждой лунке. Величины ошибок для каждых экспериментальных условий показывают стандартные отклонения экспериментально измеренных величин, получаемые посредством повторения экспериментов по четыре раза при идентичных условиях.
Концентрация ламинина-332 для отрицательного контроля составляет 1,7 нг/мл. Концентрация ламинина-332 в клетках HaCaT, культивируемых в среде, в которую добавляютаспарагиновую кислоту при концентрации 10 нМ, 100 нМ, и 1000 нМ, составляет 1,8 нг/мл, 1,8 нг/мл, и 2,0 нг/мл, соответственно, для L-аспарагиновой кислоты, и 1,9 нг/мл, 1,9 нг/мл, и 1,7 нг/мл, соответственно, для D-аспарагиновой кислоты. На основе приведенных выше результатов, обнаружено, что как L-, так и D-аспарагиновая кислота не стимулирует продуцирования ламинина-332.
(4) Добавление аспарагина
Фигура 10 показывает результаты эксперимента, полученные посредством исследования воздействия добавления аспарагина при различных концентрациях на продуцирование ламинина-332 в клетках HaCaT. Вертикальная линия диаграммы на Фиг.10 представляет концентрации (нг/мл) ламинина-332 в супернатанте культуры в каждой лунке. Величины ошибок для каждых экспериментальных условий показывают стандартные отклонения экспериментально измеренных величин, получаемые посредством повторения экспериментов по четыре раза при идентичных условиях.
Концентрация ламинина-332 составляет 1,5 нг/мл для отрицательного контроля. Концентрация ламинина-332 в клетках HaCaT, которые культивируют в среде, в которую добавляют аспарагин при концентрации 10 нМ, 100 нМ, и 1000 нМ, составляет 1,6 нг/мл, 1,5 нг/мл, и 1,6 нг/мл, соответственно, для L-аспарагина, и 1,5 нг/мл, 1,5 нг/мл, и 1,5 нг/мл, соответственно, для D-аспарагина. На основе приведенных выше результатов, обнаружено, что как L-, так и D-аспарагин не стимулирует продуцирования ламинина-332.
(5) Добавление пролина
Фигура 11 показывает результаты эксперимента, полученные посредством исследования воздействия добавления пролина при различных концентрациях на продуцирование ламинина-332 в клетках HaCaT. Вертикальная линия диаграммы на Фиг.11 представляет концентрации (нг/мл) ламинина-332 в супернатанте культуры в каждой лунке. Величины ошибок для каждых экспериментальных условий показывают стандартные отклонения экспериментально измеренных величин, получаемые посредством повторения экспериментов по четыре раза при идентичных условиях.
Концентрация ламинина-332 для отрицательного контроля составляет 1,8 нг/мл. Концентрация ламинина-332 в клетках HaCaT, культивируемых в среде, в которую добавляют пролин при концентрации 10 нМ, 100 нМ, и 1000 нМ, составляет 1,8 нг/мл, 1,9 нг/мл, и 1,9 нг/мл, соответственно, для L-пролина, и 2,0 нг/мл, 1,9 нг/мл, и 1,9 нг/мл, соответственно, для D-пролина. На основе приведенных выше результатов, обнаружено, что как L-, так и D-пролин не стимулирует продуцирования ламинина-332.
(6) Добавление серина
Фигура 12 показывает результаты эксперимента, полученные посредством исследования воздействия добавления серина при различных концентрациях на продуцирование ламинина-332 в клетках HaCaT. Вертикальная линия диаграммы на Фиг.12 представляет концентрации (нг/мл) ламинина-332 в супернатанте культуры в каждой лунке. Величины ошибок для каждых экспериментальных условий показывают стандартные отклонения экспериментально измеренных величин, получаемые посредством повторения экспериментов по четыре раза при идентичных условиях.
Концентрация ламинина-332 для отрицательного контроля составляет 1,7 нг/мл. Концентрации ламинина-332 в клетках HaCaT, которые культивируют в среде, в которую добавляют серин при концентрации 10 нМ, 100 нМ, и 1000 нМ, составляет 1,8 нг/мл, 1,9 нг/мл и 1,9 нг/мл, соответственно, для L-серина, и 1,8 нг/мл, 1,8 нг/мл и 1,8 нг/мл, соответственно, для D-серина. На основе приведенных выше результатов обнаружено, что как L-, так и D-серин не стимулирует продуцирования ламинина-332.
Выводы
На основе экспериментальных результатов, полученных от Примеров 1 и 2, воздействие на стимулирование продуцирования ламинина-332 наблюдают для D-аланина и D-гидроксипролина. Однако такоговоздействия не наблюдается для аспарагиновой кислоты, аспарагина, пролина и серина. В результате продемонстрировано, что D-аланин и D-гидроксипролин могут использоваться для подавления и/или улучшения состояния кожи посредством стимулирования продуцирования ламинина-332, который играет важную роль при поддержании структуры и функций базальной мембраны.
Пример 3
Примеры препарата композиции, содержащей D-аланин и/или D-гидроксипролин в соответствии с настоящим изобретением, то есть, препарата эмульсии, пластыря, таблетки, мягкой капсулы, гранулы, напитка, сладостей, печенья, соевой пасты, французской приправы, майонеза, белого хлеба, соевого соуса, йогурта, сухой порошкообразной приправы для риса, приправы/соуса для натто, натто, неочищенного черного уксуса, крема, крема для тела, геля, маски для пилинга, влажного компресса, эмульсии, косметической воды и аэрозольного препарата, приводятся ниже. Все эти примеры препаратов являются иллюстративными и не предназначены для ограничения технических рамок настоящего изобретения.
Пример препарата 1 (препарат эмульсии)
Пример препарата 2 (Пластырь)
Пример препарата 3 (Таблетка)
Пример препарата 4 (Таблетка)
Пример препарата 5 (Мягкая капсула)
Пример препарата 6 (мягкая капсула)
Пример препарата 7 (Гранула)
Пример препарата 8 (Напиток)
Пример препарата 9 (Сладости)
Пример препарата 10 (Печенье)
Способ получения для Примера препарата 10 (Печенье)
Гранулированный сахар медленно добавляют в масло при перемешивании, в него добавляют яйца, ароматизирующий агент и D-аланин или D-гидроксипролин и перемешивают. После тщательного перемешивания добавляют однородную просеянную мягкую муку, и перемешивают с малой скоростью, и оставляют стоять в виде массы в холодильнике. После этого ее помещают в форму, и выпекают в течение 15 минут при 170°C (градусов Цельсия) с получением печенья.
Пример препарата 11 (Соевая паста)
Способ получения для Примера препарата 11 (Соевая паста)
Забродивший рис тщательно перемешивают с солью. Промытые соевые бобы вымачивают в течение ночи в объеме воды, превышающем их объем в три раза, эту воду затем удаляют, и добавляют новую воду при кипении, и выливают в дуршлаг для сбора бульона (жидкости танемицу), в котором растворяют D-аланин или D-гидроксипролин при 10% масс/объем. Прокипяченные бобы сразу же измельчают, объединяют с забродившим рисом, перемешанным с солью, к ним добавляют жидкость танемицу, содержащую D-аланин или D-гидроксипролин, растворенный в ней, и перемешивают однородно с получением твердости, подобной глине. Делают лепешки, и компактно заполняют ими контейнер без образования каких-либо пустот, и поверхность содержимого разглаживают, и герметизируют с помощью пластикой пленки. Через три месяца, содержимое переносят в новый контейнер, и поверхность разглаживают, и герметизируют с помощью пластиковой пленки. Вместо добавления D-аланина или D-гидроксипролина к жидкости танемицу, может использоваться забродивший рис, продуцирующий большое количество D-аланина или D-гидроксипролина. Такой забродивший рис может выбираться посредством количественного определения D-аланина или D-гидроксипролина с помощью способа, описанного в публикации нерассмотренного патента Японии № 2008-185558. Альтернативно, коммерчески доступная соевая паста может дополняться D-аланином или D-гидроксипролином, или их солью.
Пример препарата 12 (французская приправа)
Способ получения для Примера препарата 12 (французская приправа)
Уксус объединяют с хлоридом натрия и D-аланином или D-гидроксипролином, а затем тщательно перемешивают для растворения. К смеси добавляют салатное масло, и смесь тщательно перемешивают, а затем добавляют перец.
Пример препарата 13 (майонез)
Способ получения для Примера препарата 13 (майонез)
Уксус, хлорид натрия, перец и D-аланин или D-гидроксипролин добавляют в яичный желток (комнатная температура) и тщательно перемешивают с помощью использования венчика. Продолжают перемешивание, при этом добавляя порциями салатное масло с получением эмульсии. Наконец, добавляют сахар, и смесь перемешивают.
Пример препарата 14 (белый хлеб)
Способ получения для Примера препарата 14 (белый хлеб)
Теплую воду объединяют с 1 г сахара и сухих дрожжей, затем позволяют им подвергаться предварительному сбраживанию. Твердую муку, мягкую муку, хлорид натрия, 5 г сахара и D-аланин или D-гидроксипролин добавляют в миску, в которую добавляют предварительно забродившие дрожжи. После тщательного замешивания в виде шарообразного теста, осуществляют первичную ферментацию при 30°C (градусов Цельсия). Тесто замешивают опять, и оставляют стоять, а затем формируют в соответствующих формах, которые подвергаются конечному сбраживанию с использованием электронной машины для сбраживания. После формирования булок, осуществляют выпекание в течение 30 минут в печи при 220°C (градусов Цельсия).
Пример препарата 15 (Соевый соус)
Способ получения для Примера препарата 15 (соевый соус)
В коммерчески доступный соевый соус добавляют D-аланин или D-гидроксипролин, или их соль, и тщательно перемешивают. Вместо добавления D-аланина или D-гидроксипролина или их соли, забродивший рис, продуцирующий большое количество D-аланина или D-гидроксипролина, может использоваться для ферментирования соевого соуса. Такой забродивший рис может выбираться посредством количественного определения D-аланина или D-гидроксипролина с помощью способа, описанного в публикации нерассмотренного патента Японии № 2008-185558.
Пример препарата 16 (Йогурт)
Способ получения для Примера препарата 16 (Йогурт)
Ферментацию осуществляют при температуре от 40°C (градусов Цельсия) до 45°C (градусов Цельсия). Могут использоваться другие коммерчески доступные организмы для затравки сбраживания, и в коммерчески доступный йогурт может добавляться D-аланин, D-гидроксипролин, или их соль. Вместо добавления D-аланина, D-гидроксипролина или их соли, может использоваться организм, продуцирующий большое количество D-аланина или D-гидроксипролина. Такой организм может быть выбран посредством количественного определения D-аланина или D-гидроксипролина с помощью способа, описанного в публикации нерассмотренного патента Японии №2008-185558.
Пример препарата 17 (Сухая порошкообразная приправа для риса)
Пример препарата 18 (приправа/соус для натто)
Пример препарата 19 (натто)
Способ получения для Примера препарата 19 (натто)
В коммерчески доступный натто добавляют D-аланин или D-гидроксипролин, или их соль, и тщательно перемешивают. Вместо добавления D-аланина или D-гидроксипролина, или их соли, для получения натто может использоваться организм, продуцирующий большое количество D-аланина или D-гидроксипролина. Такой организм может быть выбран посредством количественного определения D-аланина или D-гидроксипролина с помощью способа, описанного в публикации нерассмотренного патента Японии №2008-185558.
Пример препарата 20 (неочищенный черный уксус)
Способ получения для Примера препарата 20 (неочищенный черный уксус)
В коммерчески доступный неочищенный черный уксус добавляют D-аланин или D-гидроксипролин, или их соль, и тщательно перемешивают. Вместо добавления D-аланина или D-гидроксипролина или их соли, для получения уксуса, черного уксуса илинеочищенного уксуса может использоваться организм, продуцирующий большое количество D-аланина или D-гидроксипролина. Такой организм может быть выбран посредством количественного определения D-аланина или D-гидроксипролина с помощью способа, описанного в публикации нерассмотренного патента Японии №2008-185558.
Пример препарата 21 (крем)
Пример препарата 22 (крем для тела)
Пример препарата 23 (гель)
Пример препарата 24 (маска для пилинга)
Пример препарата 25 (влажный компресс)
Пример препарата 26 (эмульсия)
Пример препарата 27 (эмульсия)
Пример препарата 28 (лосьон для кожи)
Пример препарата 29 (лосьон для кожи)
Пример препарата 30 (исходный раствор для аэрозольного препарата мочевины для наружного применения)
Пример препарата 31 (аэрозольный спрей на основе мочевины)
Способ заполнения для Примера препарата 31 (аэрозольный спрей на основе мочевины)
Исходный раствор аэрозольного препарата мочевины для наружного применения и простой диметиловый эфир заполняют в выдерживающую высокое давление алюминиевую банку для аэрозоля, у которой внутренняя поверхность покрыта Teflon (зарегистрированное торговое наименование) с получением аэрозольного препарата.
Реферат
Изобретение относится к медицине и касается способа стимулирования продуцирования ламинина-332 для поддержания структуры и функции базальной мембраны кожи у субъекта, нуждающегося в этом, включающего введение нуждающемуся в этом субъекту композиции, состоящей из D-аланина или его солей и одной или более фармацевтически приемлемых добавок. Изобретение обеспечивает поддержание структуры и функции базальной мембраны кожи у субъекта. 4 з.п. ф-лы, 3 пр., 12 ил.

Комментарии