2,6 -дигалоген-5-алкокси-4-замещенные-пиримидины, пиримидинкарбальдегиды и способы получения и применения - RU2626957C2
Код документа: RU2626957C2
Описание
ПРИОРИТЕТ
По настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой США, серийный №61/582156, поданной 30 декабря 2011.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Варианты осуществления в соответствии с описанием настоящего изобретения относятся к 2,6-дигалоген-5-алкокси-4-замещенным-пиримидинам. Варианты осуществления в соответствии с описанием настоящего изобретения относятся также к 2,6-дигалоген-5-алкокси-4-пиримидинкарбальдегидам. Варианты осуществления в соответствии с описанием настоящего изобретения далее относятся к способам получения 2,6-дигалоген-5-алкокси-4-замещенных-пиримидинов и 2,6-дигалоген-5-алкокси-4-пиримидинкарбальдегидов и способам их применения.
УРОВЕНЬ ТЕХНИКИ
2,6-Дигалоген-5-алкокси-пиримидин-4-карбоновые кислоты и сложные эфиры могут быть использованы в качестве промежуточных соединений для получения фармацевтических и сельскохозяйственных химикатов, таких как гербициды. Обычные способы получения этих соединений могут быть трудоемкими, с низкими выходами и не легко масштабируемыми.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Вариант осуществления в соответствии с описанием настоящего изобретения включает соединения формулы I:

где
X1 представляет собой галоген;
R1 представляет собой углеводородную цепь; и
Q представляет собой C1-C2 алкокси.
В конкретных вариантах осуществления изобретения соединения формулы I независимо охватывают такие, в которых X1 представляет собой хлор, где Q представляет собой метокси, и где R1 представляет собой углеводородную цепь, окисляемую до кислоты, например, без ограничения, алкил, винил, арил, алкенил или фуранил, при этом R1, представляющий собой винил, является наиболее предпочтительным.
Другой вариант осуществления настоящего изобретения включает соединения формулы II:

где
X1 представляет собой галоген; и
Q представляет собой C1-C2 алкокси.
Представительные соединения формулы II независимо включают такие, в которых X1 представляет собой хлор, и где Q представляет собой метокси.
Другой вариант осуществления настоящего изобретения включает способ получения соединения формулы II, то есть 2,6-дигалоген-5-алкокси-пиримидин-4-карбальдегида, путем взаимодействия соединения формулы I, то есть 2,6-дигалоген-5-алкокси-4-замещенного-пиримидина с окислителем.
Еще другой вариант осуществления настоящего изобретения включает способ получения соединения формулы I, то есть 2,6-дигалоген-5-алкокси-4-замещенного-пиримидина, включающий взаимодействие 2,6-дигалоген-5-алкокси-пиримидина с металлоорганическим реагентом с образованием 2,6-дигалоген-5-алкокси-4-замещенного-3-(металл-галоген или металл)-пиримидина и окисления 2,6-дигалоген-5-алкокси-4-замещенного-3-(металл-галоген или металл) пиримидина с образованием 2,6-дигалоген-5-алкокси-4-замещенного-пиримидина.
Другой конкретный вариант осуществления настоящего изобретения включает способ применения 2,6-дигалоген-5-алкокси-4-замещенного-пиримидина для получения алкил 6-амино-2-галоген-5-алкокси-пиримидин-4-карбоксилата. 2,6-Дигалоген-5-алкокси-4-замещенный-пиримидин содержит пиримидиновое кольцо, имеющее 4 положение и 6 положение. Пиримидиновое кольцо имеет углеводородную цепь в 4 положении. Пиримидиновое кольцо имеет галоген в 6 положении. Способ применения 2,6-дигалоген-5-алкокси-4-замещенного-пиримидина включает контактирование углеводородной цепи в 4 положении с окислителем с образованием карбонильной группы в 4 положении. Карбонильная группа в 4 положении контактирует с бромом в спирте с образованием карбалкоксигруппы в 4 положении. Галоген в 6 положении контактирует с амином с образованием аминогруппы в 6 положении.
МЕТОД(Ы) ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Как используется в настоящем документе термин “алкил” относится к ациклическому насыщенному разветвленному или неразветвленному заместителю, состоящему из углерода и водорода, например, метилу, этилу, пропилу, изопропилу, 1-бутилу, 2-бутилу, изобутилу, трет-бутилу, пентилу, 2-метилбутилу, 1,1-диметилпропилу, гексилу, гептилу, октилу, нонилу и децилу.
Как используется в настоящем документе термин “алкокси” относится к алкильной группе, связанной с кислородом, например метокси и этокси.
Как используется в настоящем документе термин “гало” относится к фтору, хлору, брому и йоду.
Как используется в настоящем документе термин “галоген” относится к атому фтора, хлора, брома и йода.
Как используется в настоящем документе термин реактив Гриньяра относится к магнийорганическому галогениду.
Соединения формулы I, таким образом, являются полезными промежуточными соединениями для получения соединений, используемых для изготовления фармацевтических и сельскохозяйственных препаратов, таких как гербициды:

где
X1 представляет собой галоген;
R1 представляет собой углеводородную цепь; и
Q представляет собой C1-C2 алкокси.
Такие 2,6-дигалоген-5-алкокси-4-замещенные-пиримидины могут включать пиримидиновое кольцо, содержащее галогены во 2 и 6 положениях, C1-C2 алкоксигруппу в 5 положении и углеводородную цепь в 4 положении. Галогены во 2 и 6 положениях могут представлять собой хлор, так что соединение может представлять собой 2,6-дихлор-5-алкокси-4-замещенный-пиримидин. Алкоксигруппа в 5 положении может представлять собой метокси, так что соединение может представлять собой 2,6-дигалоген-5-метокси-4-замещенный-пиримидин. Углеводородной цепью в 4 положении является углеводородная группа, окисляемая до кислоты. Цепь может включать, например, и без ограничения, алкильную, винильную, арильную, алкенильную и фуранильную группу. В некоторых вариантах осуществления изобретения углеводородной цепью в 4 положении может быть винильная группа, так что соединение представляет собой 2,6-дигалоген-5-алкокси-4-винил-пиримидин. Соединение формулы I может представлять собой 2,6-дихлор-5-метокси-4-винил-пиримидин.
Соединения формулы II, таким образом, также являются полезными промежуточными соединениями для получения соединений, используемых для изготовления фармацевтических и сельскохозяйственных препаратов, таких как гербициды:

где
X1 представляет собой галоген; и
Q представляет собой C1-C2 алкокси.
Такие 2,6-дигалоген-5-алкокси-пиримидин-4-карбальдегиды могут включать пиримидиновое кольцо, содержащее галогены во 2 и 6 положениях, C1-C2 алкоксигруппу в 5 положении и карбонильную группу в 4 положении. Галогены во 2 и 6 положениях могут представлять собой хлор, так что соединение может представлять собой 2,6-дихлор-5-алкокси-пиримидин-4-карбальдегид. Алкоксигруппа в 5 положении может представлять собой метокси, так что соединение может представлять собой 2,6-дигалоген-5-метокси-пиримидин-4-карбальдегид. Соединение формулы II может представлять собой 2,6-дихлор-5-метокси-пиримидин-4-карбальдегид.
Один из вариантов получения соединения формулы II с использованием соединения формулы I показан на схеме 1, представленной далее:
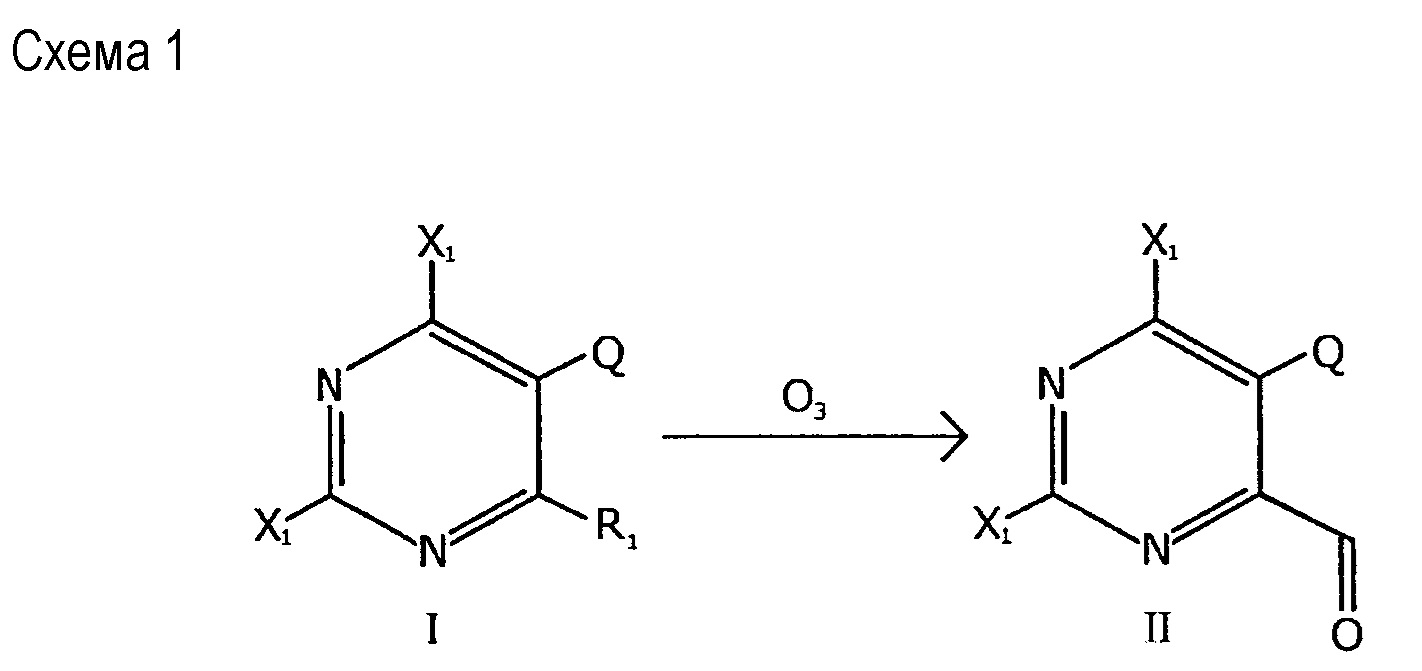
Как показано на схеме 1, соединение формулы II, то есть 2,6-дигалоген-5-алкокси-пиримидин-4-карбальдегид, может быть получено путем окисления соединения формулы I, то есть 2,6-дигалоген-5-алкокси-4-замещенного-пиримидина. Способ по схеме 1 включает взаимодействие соединения формулы I с окислителем с образованием соединения формулы II.
В этом случае X1 представляет собой галоген; Q представляет собой C1-C2 алкокси; и R1 представляет собой углеводородную цепь. Окислителем может быть озон (O3).
Способ по схеме 1 включает контактирование углеводородной цепи в 4 положении пиримидинового кольца соединения формулы I с окислителем с образованием карбонильной группы в 4 положении пиримидинового кольца в полученном соединении формулы II. Так, соединение формулы II может представлять собой карбальдегидное производное соединения формулы I.
Способ по схеме 1 может включать ведение окислителя вместе с растворителем. Растворителем может являться галогенированный растворитель, например, дихлорметан (DCM). Растворителем может являться метанол.
Способ по схеме 1 проиллюстрирован каждым из примеров 6 и 7.
Один из вариантов получения соединения формулы I показан на схеме 2, представленной далее:

Как показано на схеме 2, соединение формулы I, то есть 2,6-дигалоген-5-алкокси-4-замещенный-пиримидин, может быть получено с использованием соединения формулы III, то есть 2,6-дигалоген-5-алкокси-пиримидина. Способ по схеме 2 включает взаимодействие соединения формулы III с металлоорганическим реагентом формулы IV с образованием промежуточного соединения формулы V и взаимодействие промежуточного соединения формулы V с окислителем с образованием соединения формулы I.
В этом случае X1 представляет собой галоген; Q представляет собой C1-C2 алкокси; R1 представляет собой углеводородную цепь, которая может быть окислена до кислоты, например, алкил, винил или арил. M1 представляет собой магний; и X2 представляет собой бром, йод или хлор; или M1-X2 и M1X2 вместе обозначают литий. “Окислитель1” может представлять собой подходящий окислитель, например, органический окислитель, такой как 2,3-дихлор-5,6-дициано-п-бензохинон (DDQ); неорганический окислитель, такой как диоксид марганца (MnO2); окислитель на основе галогена; или катализируемую металлом реакцию окисления проводят в атмосферном кислороде.
Металлоорганическим реагентом формулы IV может быть реактив Гриньяра, такой, где M1 представляет собой магний, и X1 представляет собой галоген. Реактив Гриньяра может представлять собой реагент бромида магния. Например, без ограничения, реактив Гриньяра может представлять собой винилмагнийбромид. Использование магнийорганического бромида в качестве реактива Гриньяра может быть благоприятным для осуществления способа по схеме 2 при температурах в области комнатной температуры или, альтернативно, при температурах в области или выше чем 0°C. Металлоорганический реагент формулы IV, альтернативно, может представлять собой литийорганический реагент, такой, где M1-X2 и M1X2 обозначают литий. Использование литийорганического реагента, кроме того, может включать осуществление способа по схеме 2 при температурах равной или ниже -40°C.
Взаимодействие соединения формулы III с металлоорганическим реагентом формулы IV может приводить к получению промежуточного соединения формулы V, то есть анионного 2,6-дигалоген-5-алкокси-4-замещенного-3-(металл-галоген или металл)пиримидина. В таких вариантах осуществления изобретения, где металлоорганическим реагентом формулы IV является реактив Гриньяра, полученное промежуточное соединения формулы V представляет собой анионный 2,6-дигалоген-5-алкокси-4-замещенный-3-металл-галоген-пиримидин. В таких вариантах осуществления изобретения, где металлоорганический реагент формулы IV представляет собой литийорганический реагент, полученное промежуточное соединения формулы V является анионным 2,6-дигалоген-5-алкокси-4-замещенным-3-металл-пиримидином.
Металлоорганический реагент формулы IV может использоваться с растворителем, подходящим для реакции металлоорганического реагента, таким как тетрагидрофуран (ТГФ), 1,4-диоксан, диэтиловый эфир, диметилоксид или диметоксиэтан.
Взаимодействие соединения формулы III с реагентом металлоорганическим галогенидом формулы IV может приводить к образованию углеводородной цепи в 4 положении пиримидинового кольца и может приводить к образованию металл галогенидной или металлической группы, то есть группы металл (галогенид), в 3 положении пиримидинового кольца. Взаимодействие промежуточного соединения формулы V с подходящим окислителем может приводить к образованию соединения формулы I с углеводородной цепью в 4 положении пиримидинового кольца.
Способ по схеме 2 может дополнительно включать введение в реакцию источника протонов. Источником протонов может являться влажный ацетон, уксусная кислота или соединение с подобными функциональными группами.
Способ по схеме 2 может быть осуществлен без выделения промежуточного соединения формулы V. Таким образом, окисление с образованием соединения формулы I может быть осуществлено in situ. Полученное соединение формулы I перед его использованием может быть как выделено, так и не выделено.
Способ по схеме 2 проиллюстрирован в каждым из примеров 1-5.
Один из вариантов использования соединения формулы II для получения соединения формулы VII показан на схеме 3, представленной далее:

Как показано на схеме 3, соединение формулы VII, то есть алкил-2,6-дигалоген-5-алкокси-пиримидин-4-карбоксилат, может быть получено с использованием соединения формулы II, то есть 2,6-дигалоген-5-алкокси-пиримидин-4-карбальдегида.
В этом случае X1 представляет собой галоген; Q представляет собой C1-C2 алкокси; и R2 представляет собой алкил. R2 может представлять собой метил.
Способ по схеме 3 включает контактирование карбонильной группы в 4 положении пиримидинового кольца соединения формулы II с бромом в спирте формулы VI с образованием карбалкоксигруппы в 4 положении пиримидинового кольца в полученном соединении формулы VII.
Соответственно, способ по схеме 3 относится к способу применения соединения формулы II для получения соединения формулы VII. Кроме того, объединенные способы по схемам 1 и 3 относятся к способу применения соединения формулы I для получения соединения формулы VII. Кроме того, объединенные способы по схемам 1, 2 и 3 относятся к способу применения соединения формулы III для получения соединения формулы VII. Полученные соединения в промежутках объединенных схем могут быть как выделены, так и не выделены.
Способ по схеме 3 проиллюстрирован в каждом из примеров 8 и 9.
Один из вариантов использования соединения формулы VII для получения соединения формулы IX показан на схеме 4, представленной далее:

Как показано на схеме 4, соединение формулы IX, то есть алкил-6-амино-2-галоген-5-алкокси-пиримидин-4-карбоксилат, может быть получено с использованием соединения формулы VII, то есть алкил-2,6-дигалоген-5-алкокси-пиримидин-4-карбоксилата. Способ по схеме 4 включает взаимодействие соединения формулы VII с амином формулы VIII (или его солями) с образованием соединения формулы IX.
В этом случае X1 представляет собой галоген; Q представляет собой C1-C2 алкокси; R2 представляет собой алкил; и R3 и R4 независимо представляют собой H, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, гидроксил, C1-C6 алкокси, амино, C1-C6 ацил, C1-C6 карбоалкокси, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо.
Способ по схеме 4 может дополнительно включать использование растворителя. Например, без ограничения, используемый растворитель в способе может включать диметилсульфоксид.
Способ по схеме 4 включает контактирование галогена в 6 положении пиримидинового кольца соединения формулы VII с амином формулы VIII с образованием аминогруппы в 6 положении пиримидинового кольца в полученном соединении формулы IX.
Соответственно, способ по схеме 4 относится к способу применения соединения формулы VII для получения соединения формулы IX. Кроме того, объединенные способы по схемам 3 и 4 относятся к способу применения соединения формулы II для получения соединения формулы IX. Кроме того, объединенные способы по схемам 1, 3 и 4 относятся к способу применения соединения формулы I для получения соединения формулы IX. Кроме того, объединенные способы по схемам 1-4 относятся к способу применения соединения формулы III для получения соединения формулы IX. Полученные соединения в промежутках объединенных схем могут быть как выделены, так и не выделены.
Способ по схеме 4 проиллюстрирован каждым из примеров 10 и 11. Другие варианты и примеры этого способа описаны в патенте США №7642220 Epp et al. (“схема 2”, указана выше).
Один из вариантов использования соединения формулы IX для получения соединения формулы XI показан на схеме 5, представленной далее:

Как показано на схеме 5, соединение формулы XI, то есть алкил 2-(замещенный фенил)-6-амино-5-алкокси-пиримидин-4-карбоксилат, может быть получено с использованием соединения формулы IX, то есть алкил 6-амино-2-галоген-5-алкокси-пиримидин-4-карбоксилата. Способ по схеме 5 включает взаимодействие соединения формулы IX с металлоорганическим соединением формулы X с образованием соединения формулы XI. Способ может включать инертный растворитель.
В этом случае X1 представляет собой галоген; Q представляет собой C1-C2 алкокси; R2 представляет собой алкил; и R3 и R4 независимо представляют собой H, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, гидроксил, C1-C6 алкокси, амино, C1-C6 ацил, C1-C6 карбоалкокси, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо.
Ar представляет собой фенильную группу, замещенную одним или несколькими заместителями, выбранными из галогена, нитро, циано, формила, C1-C6 алкила, C2-C6 алкенила, C2-C6 алкинила, C1-C6 алкокси, C2-C4 алкоксиалкила, C2-C6 алкилкарбонила, C1-C6 алкилтио, C1-C6 алкилсульфинила, C1-C6 алкилсульфонила, C2-C4 алкенилокси, C2-C4 алкинилокси, C2-C4 алкенилтио, C2-C4 алкинилтио, C1-C6 галогеналкила, C2-C6 галогеналкенила, C2-C6 галогеналкинила, C1-C6 галогеналкокси, C2-C4 галогеналкоксиалкила, C2-C6 галогеналкилкарбонила, C1-C6 галогеналкилтио, C1-C6 галогеналкилсульфинила, C1-C6 галогеналкилсульфонила, C3-C6 триалкилсилила, C2-C4 галогеналкенилокси, C2-C4 галогеналкинилокси, C2-C4 галогеналкенилтио, C2-C4 галогеналкинилтио, -OCH2CH2-, -OCH2CH2CH2-, -OCH2O-, -OCH2CH2O-, C(O)OR6, -C(O)NR5R6, -CR5NOR6, -NR5R6, -NR5OR6, -NR5SO2R6, -NR5C(O)R6, -NR5C(O)OR6, -NR5C(O)NR5R6 или -NCR5NR5R6. R5 представляет собой H, C1-C4 алкил или C1-C4 галогеналкил. R6 представляет собой C1-C4 алкил или C1-C4 галогеналкил.
M2 может представлять собой три-(C1-C4 алкил)олово или B(OR7)(OR8), где R7 и R8 представляют собой, независимо друг от друга, водород, C1-C6 алкил, или, взятые вместе, образуют этиленовую или пропиленовую группу. “Катализатор” может представлять собой катализатор переходного металла, в частности, палладиевый катализатор, такой как дихлорид бис(трифенилфосфин)палладия(II).
Способ по схеме 5 включает замену галогена во 2 положении пиримидинового кольца соединения формулы IX на замещенную фенильную группу во 2 положении пиримидинового кольца в полученном соединении формулы XI.
Соответственно, способ по схеме 5 относится к способу применения соединения формулы IX для получения соединения формулы XI. Кроме того, объединенные способы по схемам 4 и 5 относятся к способу применения соединения формулы VII для получения соединения формулы XI. Кроме того, объединенные способы по схемам 3, 4 и 5 относятся к способу применения соединения формулы II для получения соединения формулы XI. Кроме того, объединенные способы по схемам 1, 3, 4 и 5 относятся к способу применения соединения формулы I для получения соединения формулы XI. Кроме того, объединенные способы по схемам 1-5 относятся к способу применения соединения формулы III для получения соединения формулы XI. Полученные соединения в промежутках объединенных схем могут быть как выделены, так и не выделены.
Способ по схеме 5 проиллюстрирован в примерах, описанных в патенте США №7642220 Epp et al. (“схема 1”, указана выше).
Соединения формулы XI и их соответствующие карбоновые кислоты и/или соли известны как превосходные гербициды с широким спектром подавления сорняков в отношении широколиственных сорняков, а также травы и осоки сорняков и с отличной селективностью при низком расходе при использовании. Указанные соединения, кроме того, обладают отличными токсикологическими или экологическими профилями. Полагают, что карбоновые кислоты формулы XI представляют собой соединения, которые в действительности убивают или подавляют нежелательную растительность. Аналогами указанных соединений являются соединения, в которых кислотная группа или карбоалкоксигруппа пиримидинкарбоновой кислоты или сложного эфира изменена с образованием родственного заместителя, который в растениях или в окружающей среде может быть преобразован в кислотную группу или сложный эфир, обладающий по существу таким же гербицидным действием. Таким образом, используя способы по схемам 1-5, отдельно или в сочетании, можно применять соединения пиримидина формул I, II, III, V, VII и/или IX для получения гербицидного соединения формулы XI и/или его сельскохозяйственно приемлемых производных. Термин “сельскохозяйственно приемлемое производное”, когда он используется для описания функциональной группы карбоксилата или карбоновой кислоты в 4 положении, обозначает соль, сложный эфир, карбоновую кислоту, ацилгидразид, имидат, тиоимидат, амидин, амид, сложный ортоэфир, ацилцианид, ацилгалогенид, сложный тиоэфир, сложный тионоэфир, сложный дитиоловый эфир, нитрил или другое сложноэфирное или кислотное производное, хорошо известное в данной области, которое (a) по существу не воздействует на гербицидную активность активного ингредиента, то есть на 2-(замещенный фенил)-6-амино-5-алкокси-4-пиримидин-карбоновую кислоту, и (b) является или может быть гидролизовано, окислено или метаболизировано в растениях или в почве до 2-(замещенного фенил)-6-амино-5-алкокси-4-пиримидин карбоновой кислоты или сложного эфира, которые, в зависимости от pH, находятся в диссоциированной или недиссоциированной форме. Предпочтительными сельскохозяйственно приемлемыми производными карбоновой кислоты являются сельскохозяйственно приемлемые соли, кислоты, сложные эфиры и амиды.
Другой вариант применения соединения формулы I показан на схеме 6, представленной далее:
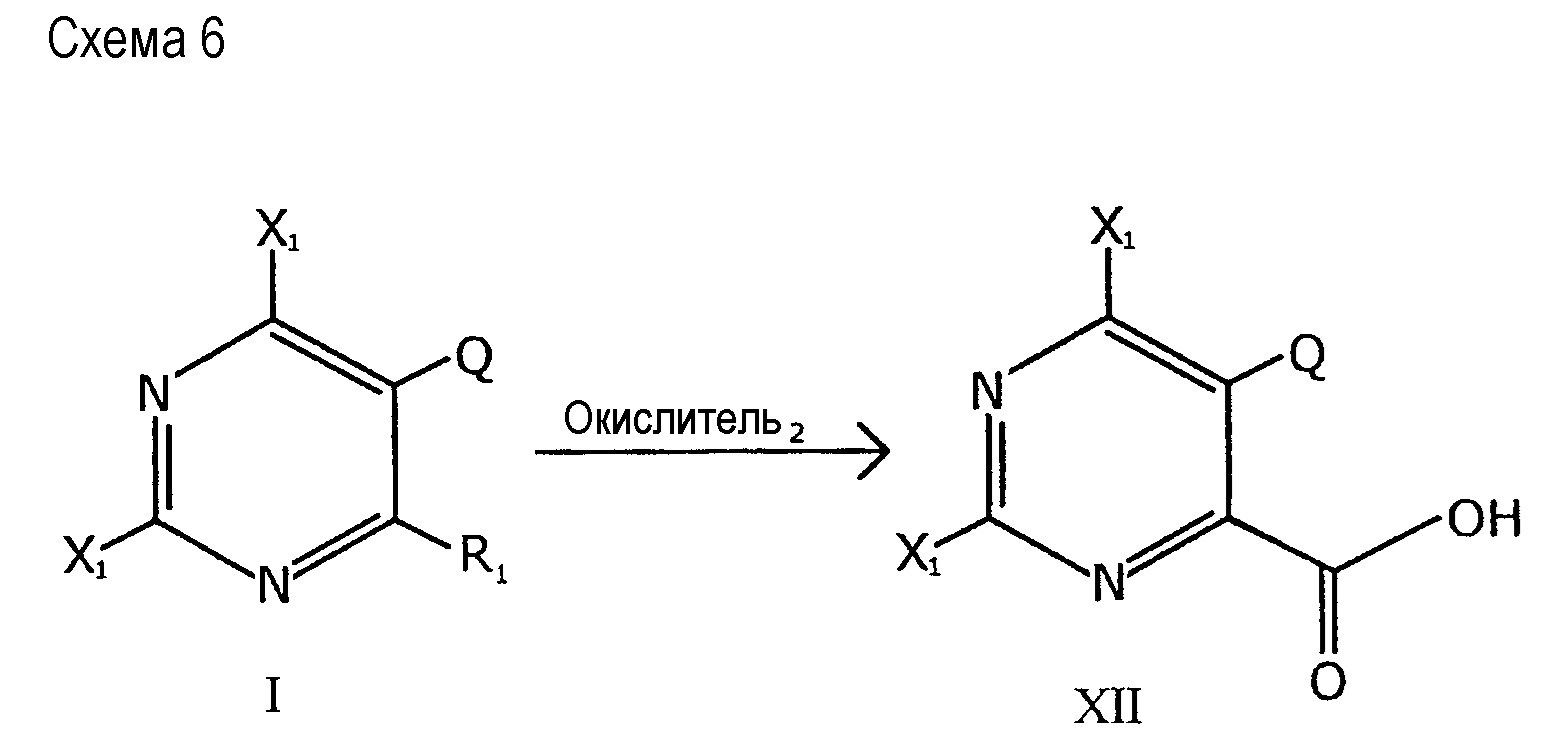
Как показано на схеме 6, соединение формулы XII, то есть 2,6-дигалоген-5-алкокси-пиримидин-4-карбоновая кислота, может быть получено с использованием соединения формулы I, то есть 2,6-дигалоген-5-алкокси-4-замещенного-пиримидина.
В этом случае X1 представляет собой галоген; Q представляет собой C1-C2 алкокси; и R1 представляет собой углеводородную цепь. Углеводородная цепь может быть окислена до кислоты. Например, без ограничения, углеводородной цепью может являться алкил, винил, арил, алкенил или фуранил. “Окислитель2” представляет собой подходящий окислитель, например, перманганат калия или кислород в условиях каталитического окисления.
Способ по схеме 6 включает контактирование углеводородной цепи в 4 положении пиримидинового кольца соединения формулы I с окислителем с образованием карбоксильной группы в 4 положении пиримидинового кольца полученного соединения формулы XII.
Соответственно, способ по схеме 6 относится к способу применения соединения формулы I для получения соединения формулы XII. Кроме того, объединенные способы по схемам 2 и 6 относятся к способу применения соединения формулы III для получения соединения формулы XII. Полученные соединения в промежутках объединенных схем могут быть как выделены, так и не выделены.
Еще один вариант применения соединения формулы I показан на схеме 7, представленной далее:

Как показано на схеме 7, соединение формулы XIII, то есть 6-амино-2-галоген-5-алкокси-4-замещенный-пиримидин, может быть получено с использованием соединения формулы I, то есть 2,6-дигалоген-5-алкокси-4-замещенного-пиримидина. Способ по схеме 7 включает взаимодействие соединения формулы I с амином формулы VIII с образованием соединения формулы XIII.
В этом случае X1 представляет собой галоген; Q представляет собой C1-C2 алкокси; R1 представляет собой углеводородную цепь; и R3 и R4 независимо представляют собой H, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, гидроксил, C1-C6 алкокси, амино, C1-C6 ацил, C1-C6 карбоалкокси, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо.
Способ по схеме 7 может дополнительно включать использование растворителя. Например, без ограничения, используемый растворитель в способе может включать диметилсульфоксид.
Способ по схеме 7 включает контактирование галогена в 6 положении пиримидинового кольца соединения формулы I с амином формулы VIII с образованием аминогруппы в 6 положении пиримидинового кольца в полученном соединении формулы XIII.
Соответственно, способ по схеме 7 относится к способу применения соединения формулы I для получения соединения формулы XIII. Кроме того, объединенные способы по схемам 2 и 7 относятся к способу применения соединения формулы III для получения соединения формулы XIII. Полученные соединения в промежутках объединенных схем могут быть как выделены, так и не выделены.
Способ по схеме 7 проиллюстрирован в примере 12.
Один из вариантов использования соединения формулы XIII для получения соединения формулы XIV показан на схеме 8, представленной далее:

Как показано на схеме 8, соединение формулы XIV, то есть 6-амино-2-галоген-5-алкокси-пиримидин-4-карбальдегид, может быть получено с использованием соединения формулы XIII, то есть 6-амино-2-галоген-5-алкокси-4-замещенного-пиримидина. Способ по схеме 8 включает взаимодействие соединения формулы XIII с окислителем с образованием соединения формулы XIV.
В этом случае X1 представляет собой галоген; Q представляет собой C1-C2 алкокси; R1 представляет собой углеводородную цепь; и R3 и R4 независимо представляют собой H, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, гидроксил, C1-C6 алкокси, амино, C1-C6 ацил, C1-C6 карбоалкокси, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо. Окислителем может быть озон (O3).
Способ по схеме 8 включает контактирование углеводородной цепи в 4 положении пиримидинового кольца соединения формулы XIII с окислителем с образованием карбонильной группы в 4 положении пиримидинового кольца в полученном соединении формулы XIV. Так, соединение формулы XIV может представлять собой карбальдегидное производное соединения формулы XIII.
Способ по схеме 8 может включать введение окислителя с одним или несколькими растворителями. Растворителем может являться галогенированный растворитель, например дихлорметан (DCM). Растворителем может являться метанол.
Соответственно, способ по схеме 8 относится к способу применения соединения формулы XIII для получения соединения формулы XIV. Кроме того, объединенные способы по схемам 7 и 8 относятся к способу применения соединения формулы I для получения соединения формулы XIV. Кроме того, объединенные способы по схемам 2, 7 и 8 относятся к способу применения соединения формулы III для получения соединения формулы XIV. Полученные соединения в промежутках объединенных схем могут быть как выделены, так и не выделены.
Другой вариант получения соединения формулы IX показан на схеме 9, представленной далее:

Как показано на схеме 9, соединение формулы IX, то есть алкил 6-амино-2-галоген-5-алкокси-пиримидин-4-карбоксилат, может быть получено с использованием соединения формулы XIV, то есть 6-амино-2-галоген-5-алкокси-пиримидин-4-карбальдегида.
В этом случае X1 представляет собой галоген; Q представляет собой C1-C2 алкокси; R2 представляет собой алкил; и R3 и R4 независимо представляют собой H, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, гидроксил, C1-C6 алкокси, амино, C1-C6 ацил, C1-C6 карбоалкокси, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо.
Способ по схеме 9 включает контактирование карбонильной группы в 4 положении пиримидинового кольца соединения формулы XIV с бромом в спирте формулы VI с образованием карбалкоксигруппы в 4 положении пиримидинового кольца в полученном соединении формулы IX.
Соответственно, как и способ по схеме 4, способ по схеме 9 относится к способу получения соединения формулы IX. Кроме того, способ по схеме 9 относится к способу применения соединения формулы XIV для получения соединения формулы IX. Кроме того, объединенные способы по схемам 8 и 9 относятся к способу применения соединения формулы XIII для получения соединения формулы IX. Кроме того, объединенные способы по схемам 7-9 относятся к способу применения соединения формулы I для получения соединения формулы IX. Кроме того, объединенные способы по схемам 2 и 7-9 относятся к способу применения соединения формулы III для получения соединения формулы IX. Полученные соединения в промежутках объединенных схем могут быть как выделены, так и не выделены.
Следует учесть, что некоторые реагенты и условия реакции, описанные здесь или в химической литературе, для получения соединений формул IX, XI, XII или их производных могут быть несовместимы с некоторыми функциональными группами, имеющимися в промежуточных соединениях. В этих случаях последовательное введение/удаление защитных групп или взаимные замены функциональных групп в синтезе могут помочь при получении желаемых продуктов. Использование и выбор защитных групп будут очевидны для специалиста в области химического синтеза.
Специалисту в данной области техники будет понятно, что в некоторых случаях после введения данного реагента, как описано в данном документе или в химической литературе, может быть необходимым осуществить обычные дополнительные стадии синтеза, не описанные подробно, чтобы завершить синтез соединений пиримидина, описанных выше. Специалисту в данной области техники также будет понятно, что может быть необходимым осуществить комбинацию стадий, описанных в данном описании или в химической литературе, в том порядке, который отличается от конкретной последовательности, представленной для получения соединений пиримидина, описанных выше.
Наконец, специалисту в данной области техники также понятно, что соединения пиримидина, описанные выше, и их промежуточные соединения, описанные в данном документе или в химической литературе, могут быть подвергнуты различным электрофильным, нуклеофильным, радикальным, металлоорганическим, окислительным и восстановительным реакциям для дополнительного введения заместителей или для модификации имеющихся заместителей.
Было обнаружено, что соединения формулы XI могут быть использованы в качестве предвсходовых и послевсходовых гербицидов. Таким образом, описанные соединения пиримидина формул I, II, III, V, VII, IX, XIII или XIV или их сельскохозяйственно приемлемые производные, включая, например, соединения пиримидина формулы XII, могут быть использованы в качестве промежуточных соединений при производстве гербицидов, получаемых с соединениями формулы XI или тому подобное. Термин гербицид используется в данном документе для обозначения активного ингредиента, который убивает, подавляет или иным образом неблагоприятно влияет на рост растений.
Следующие примеры представлены для более подробной иллюстрации различных вариантов осуществления в соответствии с описанием настоящего изобретения. Данные примеры не должны быть истолкованы как исчерпывающие или исключительные в объеме настоящего изобретения.
ПРИМЕРЫ
Пример 1: Получение 2,6-дихлор-5-метокси-4-винил-пиримидина
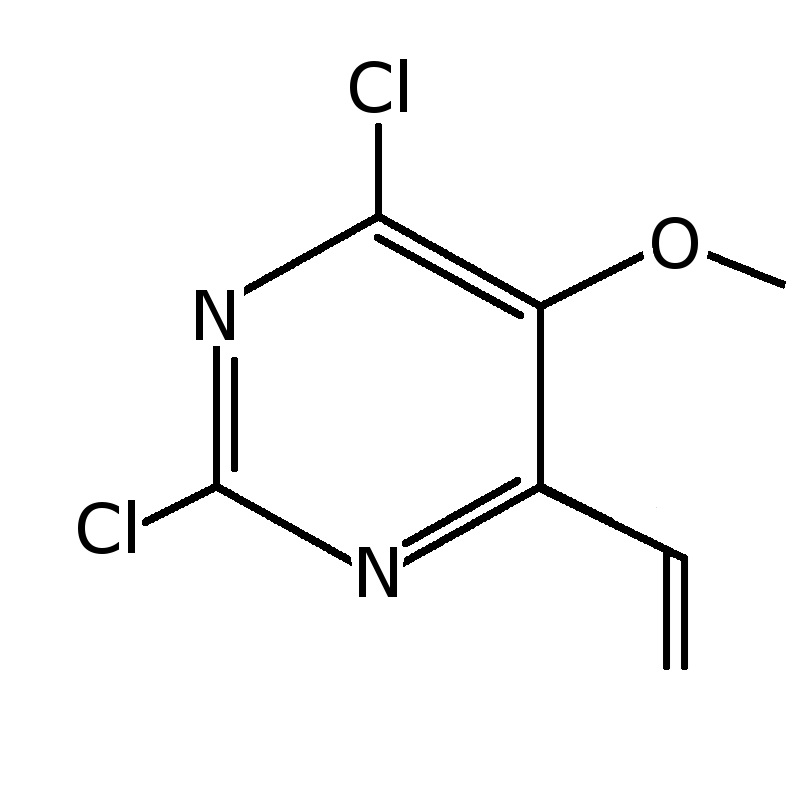
2,6-Дихлор-5-метокси-6-винил-пиримидин может быть получен с использованием 2,6-дихлор-5-метокси-пиримидина, который является коммерчески доступным. К раствору 2,6-дихлор-5-метокси-пиримидина (100 г, 0,55 моль) в растворителе сухом тетрагидрофуране (ТГФ) в течение одного часа при комнатной температуре добавляли по каплям 1M винилмагнийбромид в растворителе ТГФ (124 г, 0,94 моль). Смесь затем перемешивали в течение 4 час при комнатной температуре. Избыток реактива Гриньяра гасили путем добавления ацетона (200 мл), при этом температуру смеси поддерживали ниже 20°C. После этого сразу добавляли 2,3-дихлор-5,6-дициано-п-бензохинон (DDQ) (151 г, 0,67 моль) и перемешивали в течение ночи. Желтое твердое вещество выпадало в осадок. Твердый продукт отфильтровывали и промывали этилацетатом (500 мл). Фильтрат концентрировали при пониженном давлении, и полученное сырое соединение разбавляли этилацетатом (2 л). Полученный нерастворившийся темный полутвердый продукт отделяли путем фильтрования, используя этилацетат. Затем концентрировали при пониженном давлении с получением сырого соединения, которое очищали путем колоночной хроматографии. Соединение элюировали смесью от 5% до 10% этилацетата в гексане с получением указанного в заголовке соединения (70 г, 60%-ный выход): т. пл. 60-61°C;1H ЯМР (CDCl3) δ 3,99 (с, 3H), 5,85 (д, 1H), 6,75 (д, 1H), 6,95 (дд, 1H).
Пример 2: Получение 2,6-дихлор-5-метокси-4-винил-пиримидина

2,6-Дихлор-5-метокси-6-винил-пиримидин может быть получен с использованием 2,6-дихлор-5-метокси-пиримидина, который является коммерчески доступным. 2,6-Дихлор-5-метокси-пиримидин (12,5 г, 69,8 ммоль) объединяли в колбе с ТГФ (125 мл) и помещали на водяную баню при комнатной температуре. Тремя порциями добавляли винилмагнийбромид (78 мл, 76,8 ммоль). Смесь перемешивали в течение 5 час. Для гашения оставшегося реактива Гриньяра добавляли ацетон. К смеси добавляли DDQ (19 г, 83,8 ммоль), и смесь перемешивали в течение ночи. Затем смесь концентрировали для удаления ТГФ. Добавляли дихлорметан (DCM), растирали и оставляли стоять в течение уикенда, затем фильтровали, концентрировали и очищали путем колоночной хроматографии на силикагеле, используя градиент 5-30% этилацетат/гексан. Это дает указанное в заголовке соединение (7,95 г), которое представляется твердым веществом светло-желтого цвета, становящимся на свету серым.
Пример 3: Получение 2,6-дихлор-5-метокси-4-винил-пиримидина

2,6-Дихлор-5-метокси-6-винил-пиримидин может быть получен с использованием 2,6-дихлор-5-метокси-пиримидина, который является коммерчески доступным. 2,6-Дихлор-5-метокси-пиримидин (10 г, 56 ммоль) растворяли в ТГФ (15 мл). Раствор добавляли по каплям к винилмагнийбромиду (60 мл 1M, 60 ммоль) в течение приблизительно 15 минут, поддерживая температуру смеси ниже 30°C при внешнем охлаждении. Согласно данным с использованием ГХ-МС и ВЭЖХ наблюдалось быстрое ясное образование промежуточного дигидровинил-пиримидина (имеющего молярную массу 206 г/моль). Смесь перемешивали в течение приблизительно 3 час при комнатной температуре. С помощью GC/FID наблюдалась конверсия более чем на 95%. Смесь охлаждали до температуры ниже 10°C и обрабатывали порциями лимонной кислоты (150 мл 10%-ной лимонной кислоты). Смесь затем разбавляли этилацетатом (75 мл). Фазы разделяли, и органическую фазу экстрагировали, используя этилацетат (1×50 мл). Органические фазы затем объединяли и промывали насыщенным водным раствором хлорида натрия (1×50 мл), затем сушили и упаривали с получением сырого дигидро промежуточного соединения. Это вещество растворяли в DCM (200 мл) и при перемешивании при комнатной температуре обрабатывали диоксидом марганца (10,4 г, 120 ммоль). Наблюдалось быстрое образование 2,6-дихлор-5-метокси-4-винилпиримидина (имеющего молярную массу 204 г/моль). Спустя примерно 1 час добавляли дополнительное количество диоксида марганца (15 г), и смесь перемешивали в течение ночи. Диоксид марганца удаляли путем фильтрования через целит. Фильтрат промывали DCM и ацетоном. Затем фильтрат концентрировали упариванием растворителей и очищали путем колоночной хроматографии с использованием силикагеля при градиенте 0-10% этилацетат/гексан. Это приводило к указанному в заголовке соединению (порядка 500 мг, приблизительно 4%-ный выход): т. пл. 59-60°C.
Пример 4: Получение 2,6-дихлор-5-метокси-4-аллил-пиримидина

2,6-Дихлор-5-метокси-6-аллил-пиримидин может быть получен с использованием 2,6-дихлор-5-метокси-пиримидина, который является коммерчески доступным. 2,6-Дихлор-5-метокси-пиримидин (3,0 г, 17 ммоль) растворяли в ТГФ (30 мл) и обрабатывали порциями аллилмагнийбромида (17 мл 1M аллилмагнийбромида в диэтиловом эфире, 17 ммоль). Протекающая реакция была экзотермической. Для поддержания температуры смеси ниже 30°C использовали внешнее охлаждение. Спустя 20 минут смесь подвергали ВЭЖХ и ГХ-МС. Через 45 минут смесь охлаждали льдом/солью, и реакцию гасили насыщенным водным раствором хлорида аммония (30 мл), затем разбавляли этилацетатом (75 мл). Органическую фазу промывали насыщенным водным раствором хлорида натрия (30 мл), сушили и упаривали. Остаток растворяли в 1,4-диоксане (50 мл), обрабатывали DDQ (3,9 г, 17 ммоль) и перемешивали в течение 20 час. Анализ ГХ-МС показывал присутствие 2,6-дихлор-5-метокси-6-аллил-пиримидина (имеющего молярную массу 218 г/моль). Остаток промывали водой и этилацетатом и очищали путем колоночной хроматографии с использованием силикагеля с этилацетатом и гексаном. Это приводило к указанному в заголовке соединению (2,5 г, 67%-ный выход): т. пл. 61-62°C.1H ЯМР (400 МГц, CDCl3) δ 6,075-,94 (м, 1H), 5,265-,16 (м, 2H), 3,943-,89 (с, 3H), 3,653-,56 (м, 2H); EIMS m/z 218.
Пример 5: Получение 2,6-дихлор-5-метокси-4-фуран-2-ил-пиримидина

2,6-Дихлор-5-метокси-4-фуран-2-ил-пиримидин может быть получен с использованием 2,6-дихлор-5-метокси-пиримидина, который является коммерчески доступным. Фуран (20,4 г, 300 ммоль) растворяли в ТГФ (44 мл) и диэтиловом эфире (88 мл). Фурановый раствор охлаждали до температуры примерно -20°C и обрабатывали порциями бутиллития (28 мл 2,5 M, 70 ммоль). Раствор фурана и бутиллития перемешивали при температуре от -15° до -5°C в течение приблизительно 75 минут. При температуре примерно -2°C добавляли бромид магния (19 г, 74 ммоль) в диэтиловом эфире и перемешивали в течение 40 минут, затем охлаждали до температуры -20°C. Затем смесь добавляли к 2,6-дихлор-5-метокси-пиримидину (10,0 г, 56 ммоль) и перемешивали при температуре от -15°C до -20°C в течение 30 минут, потом нагревали до комнатной температуры и перемешивали в течение 3 час. Реакцию гасили путем добавления насыщенного водного раствора хлорида аммония. Добавляли DDQ, и затем раствор перемешивали 15 час. Анализ ГХ-МС демонстрировал полную конверсию 2,6-дихлор-5-метокси-пиримидина (с молярной массой 178 г/моль) до 2,6-дихлор-5-метокси-4-фуран-2-ил-пиримидина (с молярной массой 244 г/моль). Смесь разбавляли ТГФ (150 мл) и водой (100 мл). pH смеси понижали до кислых уровней путем добавления соляной кислоты (6 M). Органическую фазу отделяли и экстрагировали дополнительными 100 мл этилацетата. Объединенные органические фазы промывали насыщенным водным раствором хлорида натрия, сушили и концентрировали на силикагеле (50 г). Высушенное вещество помещали на верх колонки с силикагелем и элюировали смесью от 0% до 30% этилацетат/гексан до отсутствия элюированного продукта. Это приводило к выделению указанного в заголовке соединения (7,4 г, 55%-ный выход): т. пл. 105-107°C;1H ЯМР (400 МГц, CDCl3) δ 7,787-,66 (д, J=1,7 Гц, 1H), 7,557-,46 (д, J=3,6 Гц, 1H), 6,716-,57 (м, 1H), 4,313-,48 (с, 3H). EIMS m/z 244.
Пример 6: Получение 2,6-дихлор-5-метокси-пиримидин-4-карбальдегида

Раствор 2,6-дихлор-5-метокси-4-винил-пиримидина (50 г, 0,24 моль) в смеси дихлорметан:метанол (4:1, 2 л), полученного по примеру 1, охлаждали до температуры -78°C. В течение 5 час барботировали газообразный озон. Реакцию гасили диметилсульфидом (50 мл). Смесь медленно нагревали до комнатной температуры и концентрировали при пониженном давлении при температуре 40°C с получением сырого продукта, содержащего указанное в заголовке соединение (50,5 г, 100%-ный выход); ВЭЖХ (85% ацетонитрил, буферированный с 0,1% об./об. уксусной кислоты). Указанное в заголовке соединение не выделяли из сырого продукта.
Пример 7: Получение 2,6-дихлор-5-метокси-пиримидин-4-карбальдегида

Раствор 2,6-дихлор-5-метокси-4-винил-пиримидина (6,64 г, 32,5 ммоль, полученного по примеру 2) в смеси метанол:дихлорметан (1:4, 300 мл) охлаждали до температуры -78°C на бане сухой лед/ацетон. В реакционную смесь барботировали озон до тех пор, пока исходный продукт больше не присутствовал согласно данным тонкослойной хроматографии (ТСХ). Добавляли диметилсульфид (6 мл). Смесь концентрировали на роторном испарителе при температуре 0°C для удаления дихлорметана. Это давало неочищенный продукт, содержащий указанное в заголовке соединение. Указанное в заголовке соединение не выделяли из неочищенного продукта.
Пример 8: Получение метил-2,6-дихлор-5-метокси-пиримидин-4-карбоксилата
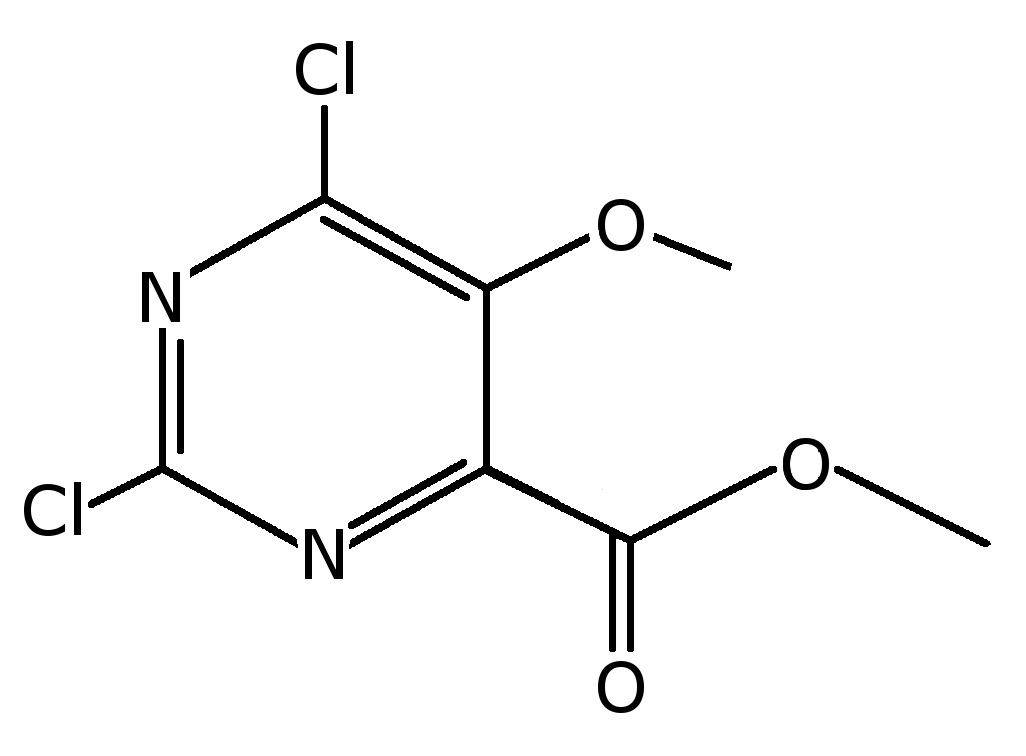
Готовили раствор 2,6-дихлор-5-метокси-пиримидин-4-карбальдегида (смотри примеры 6 и 7 выше для способов получения данного соединения) (50 г, 0,24 моль) в метаноле (1 л) и воде (60 мл). К раствору добавляли бикарбонат натрия (400 г). К пиримидиновому раствору при температуре 0°C в течение 45 минут при перемешивании смеси добавляли по каплям 2M раствор брома (192 г, 1,2 моль) в смеси метанол/вода (600 мл, 9:1). Перемешивание продолжали при той же температуре в течение 1 часа. Потом смесь перемешивали при комнатной температуре в течение 4 час. При перемешивании реакционную смесь далее выливали на смесь измельченного льда (2 л), бисульфита натрия (50 г) и хлорида натрия (200 г). Продукт экстрагировали этилацетатом (1 л × 2), и объединенный органический слой сушили над сульфатом натрия и фильтровали. Упаривание растворителя при пониженном давлении давало вязкое вещество, которое затем становилось твердым при длительном стоянии. Это давало указанное в заголовке соединение (50,8 г, 87%-ный выход); LC-MS 238 (m+1); ВЭЖХ (95% ацетонитрил, буферированный с 0,1% об./об. уксусной кислоты).
Пример 9: Получение метил-2,6-дихлор-5-метокси-пиримидин-4-карбоксилата

Сырой продукт 2,6-дихлор-5-метокси-пиримидин-4-карбальдегид (32,5 ммоль), полученный по примеру 7, охлаждали до температуры 0°C на бане лед/вода. Допускалось, что приблизительно 60 мл метанола все еще присутствовало в сыром продукте. К охлажденному сырому продукту добавляли еще метанол (60 мл) и воду (13 мл). Добавляли твердый бикарбонат натрия (54,7 г), и раствор энергично перемешивали. К раствору сырого продукта в течение 30 минут добавляли по каплям 2M раствор брома (81,4 мл, 163 ммоль) в метаноле и воде (9:1). Реакционную смесь перемешивали при температуре 0°C в течение 1 часа. Затем смесь удаляли с бани лед/вода, и протекание реакции отслеживали, используя GCMS. Приблизительно 6 час спустя после инициирования реакции бромом готовили смесь Na2S2O3·5H2O (4,5 г), насыщенного NaCl (150 мл) и льда (400 г) и в нее выливали реакционную смесь. Разбавляли этилацетатом (200 мл) и использовали дополнительное количество этилацетата (200 мл) для экстракции продукта. Объединенные органический фазы сушили над сульфатом натрия, фильтровали и затем добавляли толуол (50 мл). Продукт затем концентрировали на роторном испарителе при температуре бани менее или равной 25°C. Получали масло желтого цвета, содержащее указанное в заголовке соединение (3,1 г, 45%-ный выход). Указанное в заголовке соединение не выделяли из раствора.
Пример 10: Получение метил-6-амино-2-хлор-5-метокси-пиримидин-4-карбоксилата
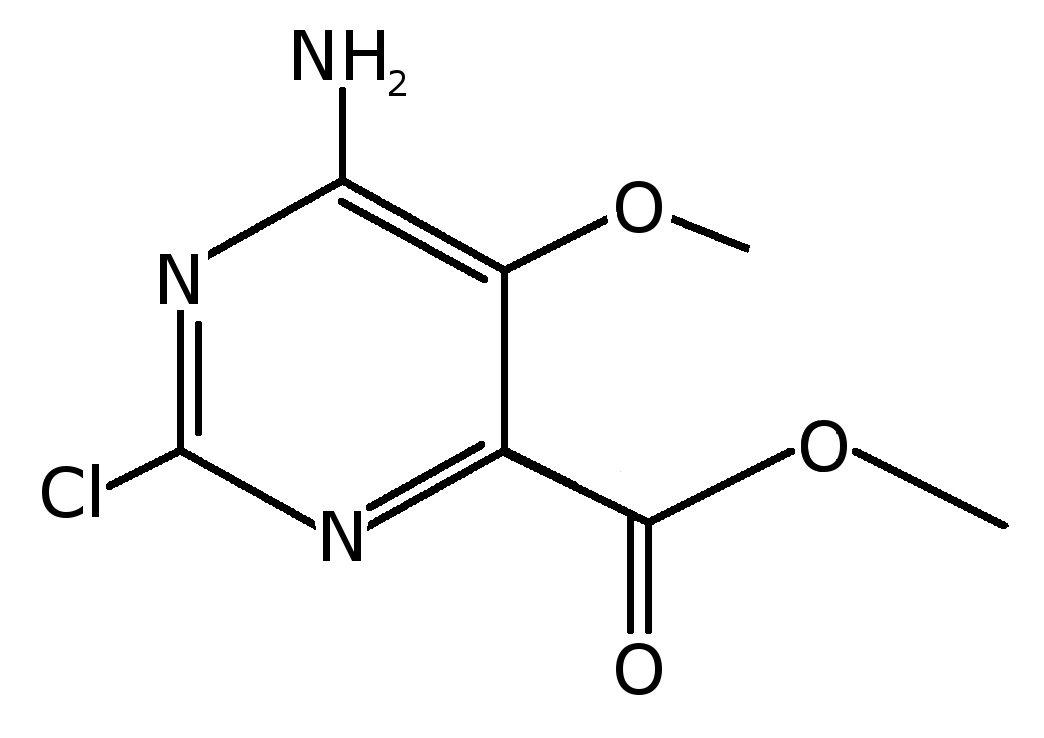
Получали раствор, содержащий реакционную смесь, полученную по примеру 8, где реакционная смесь содержала метил-2,6-дихлор-5-метокси-пиримидин-4-карбоксилат (25 г, 0,1 моль) и диметилсульфоксид (ДМСО). К данному раствору при температуре 0-5° добавляли раствор аммиака в ДМСО (2 экв.). Эту смесь перемешивали при той же температуре 0-5° в течение 10-15 минут. После этого смесь разбавляли этилацетатом, и полученное твердое вещество фильтровали. Фильтрат промывали насыщенным солевым раствором. Органический слой сушили над сульфатом натрия. После концентрирования получали сырой продукт. Сырой продукт перемешивали в минимальном количестве этилацетата и фильтровали с получением чистого соединения. Полученный фильтрат после концентрирования очищали на колонке. Это давало указанное в заголовке соединение (11 г, 50%-ный выход): т. пл. 158°C;1H ЯМР (ДМСО-d6) δ 3,71 (с, 3H), 3,86 (с, 3H), 7,65 (ушир. с, 1H), 8,01 (ушир. с, 1H).
Пример 11: Получение метил-6-амино-2-хлор-5-метокси-пиримидин-4-карбоксилата

К раствору, содержащему реакционную смесь (3,1 г), полученную по примеру 9, где реакционная смесь содержала метил-2,6-дихлор-5-метокси-пиримидин-4-карбоксилат (приблизительно 32,5 ммоль), добавляли ДМСО (33 мл). Эту смесь охлаждали до температуры 0° на бане лед/вода. В смесь барботировали аммиак с интервалом в 1 минуту. Полученную реакцию отслеживали с помощью ТСХ, отмечая расходование исходного вещества. Реакционную смесь разбавляли этилацетатом (200 мл) и затем фильтровали. Органическую фазу затем промывали насыщенным водным раствором хлорида натрия и раствором из 50% этилацетата и 50% гексана. Затем вновь экстрагировали этилацетатом (200 мл). Органические фазы объединяли и сушили над сульфатом натрия, фильтровали и концентрировали. Затем добавляли минимальное количество этилацетата, потом фильтровали. Полученный фильтрат добавляли по каплям в гексан (500 мл) и затем вновь фильтровали. Полученный фильтрат концентрировали и сохраняли. Это давало указанное в заголовке соединение (1,38 г).
Пример 12: Получение 6-амино-2-хлор-5-метокси-4-фуран-2-ил-пиримидина

2,6-Дихлор-5-метокси-4-фуран-2-ил-пиримидин (500 мг, 2,0 ммоль) (смотри пример 5 получения 2,6-дихлор-5-метокси-4-фуран-2-ил-пиримидина) растворяли в сухом ДМСО (10 мл) и нагревали при температуре 60°C. Эту смесь обрабатывали слабым потоком аммиака. Спустя приблизительно 2 часа конверсия завершалась с примерным соотношением 95:5 моно-амино изомеров (имеющих молярную массу 225 г/моль). Эту смесь охлаждали и разбавляли водой (50 мл), и продукт экстрагировали этилацетатом (2×50 мл). Затем продукт промывали этилацетатом, два раза водой (25 мл) и один раз насыщенным водным раствором хлорида натрия (25 мл). Продукт сушили и концентрировали. Продукт очищали путем колоночной хроматографии с использованием силикагеля с градиентом смеси от 5 до 20% этилацетата/гексан с получением указанного в заголовке соединения (400 мг, 89%-ный выход). Различные изомеры не разделяли.
Пример 13: Получение 2-хлор-5-метокси-6-винилпиримидин-4-амина

Готовили раствор 2,6-дихлор-5-метокси-6-винил-пиримидина (полученного как описано в примере 2) и диметилсульфоксида (ДМСО). К данному раствору добавляли при температуре 0-5°C раствор аммиака в ДМСО (2 экв.). Эту смесь перемешивали при той же температуре 0-5°C в течение 10-15 минут. После этого смесь разбавляли этилацетатом, и полученный твердый продукт фильтровали. Фильтрат промывали насыщенным солевым раствором. Органический слой сушили над сульфатом натрия. После концентрирования получали сырой продукт. Сырой продукт перемешивали в минимальном количестве этилацетата и фильтровали с получением чистого соединения. Полученный фильтрат после концентрирования очищали на колонке. Это давало указанное в заголовке соединение.
Пример 14: Получение 6-амино-2-хлор-5-метоксипиримидин-4-карбальдегида

Раствор 2-хлор-5-метокси-6-винилпиримидин-4-амина в смеси метанол:дихлорметан (1:4,) охлаждали до температуры -78°C на бане сухой лед/ацетон. В реакционную смесь барботировали озон до тех пор, пока исходный продукт больше не присутствовал согласно данным тонкослойной хроматографии (ТСХ). Добавляли диметилсульфид. Смесь концентрировали на роторном испарителе при температуре 0°C для удаления дихлорметана. Это давало сырой продукт, содержащий указанное в заголовке соединение.
Пример 15: Получение метил-6-амино-2-хлор-5-метоксипиримидин-4-карбоксилата
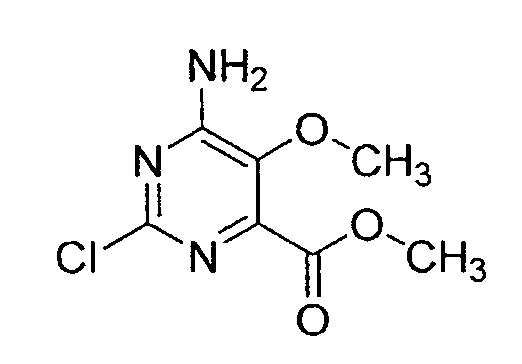
Готовили раствор 6-амино-2-хлор-5-метоксипиримидин-4-карбальдегида в метаноле (1 л) и воде. К пиримидиновому раствору в течение 45 минут при перемешивании смеси при температуре 0°C добавляли по каплям 2M раствор брома в смеси метанол/вода (9:1). Перемешивание продолжали при той же температуре в течение 1 часа. После этого смесь перемешивали при комнатной температуре в течение 4 час. При перемешивании реакционную смесь далее выливали на смесь измельченного льда, бисульфита натрия и хлорида натрия. Продукт экстрагировали этилацетатом, и объединенный органический слой сушили над сульфатом натрия и фильтровали. Упаривание растворителя при пониженном давлении давало указанное в заголовке соединение.
Хотя изобретение может допускать различные модификации и альтернативные формы, конкретные варианты осуществления были подробно описаны здесь в виде примеров. Тем не менее, следует понимать, что изобретение не должно быть ограничено конкретными раскрытыми формами. Напротив, изобретение охватывает все модификации, эквиваленты и альтернативы, подпадающие в пределы объема изобретения, как определено в прилагаемой формуле изобретения ниже и ее законных эквивалентах.
Реферат
Изобретение относится к новым 2,6-дигалоген-5-алкокси-4-замещенные-пиримидинам формулы (I) и 2,6-дигалоген-5-алкокси-4-пиримидинкарбальдегидам формулы (II), которые могут быть использованы в качестве промежуточных соединений для получения гербицидов с широким спектром активности в борьбе с сорняками. Описаны указанные соединения, а также способы их получения и применения указанных соединений.(I),(II).В соединении формулы (I) Xпредставляет собой галоген; Rвыбран из группы, состоящей из винила, алкенила и фурила; и Q представляет собой С-Салкокси. В соединении формулы II Xпредставляет собой галоген; и Q представляет собой С-Салкокси. Изобретение также относится к способу получения 2,6-дигалоген-5-алкокси-4-замещенного-пиримидина формулы (I), где заместитель в положении 4 пиримидинового кольца выбран из группы, состоящей из винила, алкенила, арила и фурила. Способ включает взаимодействие 2,6-дигалоген-5-алкокси-пиримидина с реагентом -металлоорганическим галогенидом с образованием 2,6-дигалоген-5-алкокси-4-замещенного-3-(металл-галоген или металл)-пиримидина и окисление полученного 2,6-дигалоген-5-алкокси-4-замещенного-3-(металл-галоген или металл)-пиримидина с образованием 2,6-дигалоген-5-алкокси-4-замещенного-пиримидина формулы (I). В качестве металлоорганического реагента предпочтительно используют реактив Гриньяра, например винилмагнийбромид. В качестве металлоорганического реагента можно также использовать литийорганический реагент. Дляисления 2,6-дигалоген-5-алкокси-4-замещенного-3-(металл-галоген или металл)-пиримидина используют 2,3-дихлор-5,6-дициано-п-бензохинон. Соединение формулы (I), полученное выше, где Rозначает винил, может быть превращено в соединение (II) путем окисления окислителем, таким как озон. Полученный 2,6-дигалоген-5-алкокси-пиримидин-карбальдегид формулы (II) можно обработать бромом в спирте для получения алкил-2,6-дигалоген-5-алкокси-пиримидин-4-карбоксилата и затем обработать амином с образованием алкил-6-амино-2-галоген-5-алкокси-пиримидин-4-карбоксилата. Либо соединение формулы (I), полученное выше, можно подвергнуть реакции с амином с образованием 6-амино-2-галоген-5-алкокси-4-замещенного-пиримидина, где заместитель в положении 4 пиримидинового цикла представляет собой винил или фурил. Полученное соединение, в случае, когда в 6-амино-2-галоген-5-алкокси-4-замещенном-пиримидине заместитель в положении 4 пиримидинового цикла представляет собой винил, можно окислить окислителем с образованием 6-амино-2-галоген-5-алкокси-пиримидин-4-карбальдегида. Полученное соединение при необходимости можно обработать бромом в среде спирта с получением алкил-6-амино-2-галоген-5-алкокси-пиримидин-4-карбоксилата. 8 н. и 12 з.п. ф-лы, 15 пр.
Формула


Документы, цитированные в отчёте о поиске
Производное 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола, способ его получения, фармацевтическая композиция и промежуточное соединение

Комментарии