Производное 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола, способ его получения, фармацевтическая композиция и промежуточное соединение - RU2180903C2
Код документа: RU2180903C2
Чертежи




Описание
Изобретение относится к новым производным 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола, способу их получения и фармацевтическим композициям, содержащим эти соединения в качестве активного ингредиента. Эти новые соединения оказывают влияние на систему кровообращения и сердце, а также на центральную нервную систему.
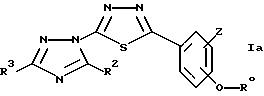
Более конкретно, изобретение относится к новым производным 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола формулы

где R1 означает атом водорода, C1-4 алкильную группу или фенильную группу, которая может быть замещена от 1 до 3 заместителями, выбранными из группы, состоящей из атома галогена, гидроксигруппы, нитрогруппы, С1-4 алкоксигруппы, (С1-4 алкил)аминогруппы и ди(С1-4 алкил)аминогруппы; или группу формулы

где Z означает атом водорода или С1-4 алкоксигруппу,
R0 означает группу формулы Alk-NR4R5
где Alk является алкиленовой группой, имеющей прямую или разветвленную C1-6 цепь,
R4 и R5 означают, независимо друг от друга, атом водорода, С2-6 алкенильную группу, С1-8 алкильную группу, которая может быть замещена заместителем, выбранным из группы, состоящей из гидроксигруппы, (C1-4 алкил)аминогруппы, ди(С1-4 алкил)аминогруппы, фенильной группы - причем последняя может быть замещена от 1 до 3 С1-4 алкоксигруппой(группами) - и 5-ти- или 6-ти-членной насыщенной гетероциклической группой, содержащей один или более атом(ов) азота или атом азота и атом кислорода, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена C1-4 алкильной группой, или
R4 и R5 образуют совместно с соседним атомом азота и, возможно, еще с одним или более атомом(атомами) азота и/или кислорода, и/или серы от 5-ти до 10-ти-членную насыщенную гетероциклическую группу, которая может быть замещена С1-4 алкильной группой или фенильной группой, причем последняя может быть замещена С1-4 алкоксигруппой,
один из R2 и R3 является аминогруппой, а другой является аминогруппой или от 5-ти до 10-ти-членной насыщенной гетероциклической группой, содержащей один или более атом(ов) азота и/или кислорода, и/или серы, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена C1-4 алкильной группой, фенильной группой или галогенофенильной группой, или последний из R2 и R3 является группой формулы -SR,
где R означает C1-8 алкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу, причем алкильная группа может быть замещена фенильной группой или галогенофенильной группой,
и одна или обе аминогруппы могут быть замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, С2-6 алкенильной группы, фенил(С1-4 алкильной) группы или галогенофенил(С1-4 алкильной)группы,
и их фармацевтически приемлемым солям присоединения кислот.
Производные 1,3,4-тиадиазола, замещенные в положении 2 замещенной морфолиновой группой, описаны в заявке на Европейский патент 123473. Эти известные соединения обладают противоопухолевым действием. 2-амино-1,3,4-тиадиазолы, замещенные аминоалкильной группой в положении 5, известны из WO 92/22541. 2-амино-1,3,4-тиадиазолы, замещенные аминоалкилмеркаптогруппой в положении 5, описаны в WO 92/22542. Эти известные производные тиадиазола подходят для лечения заболеваний центральной нервной системы и гипертензии.
Синтез производных 2-(3-метилтио-5-амино-1,2,4-триазол-1-ил)-1,3, 4-тиадиазола, имеющих замещенную меркаптогруппу в тиадиазольном кольце, описан в J. Het. Chem., 30, 333-343 (1993) без какого-либо указания на их возможное биологическое действие.
Цель настоящего изобретения состояла в получении новых производных 1,3,4-тиадиазола, обладающих кардиозащитным действием и/или влияющих на центральную нервную систему.
Указанная цель была достигнута благодаря получению новых производных 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола формулы I.
В описании и формуле изобретения в обозначениях заместителей под атомом галогена следует понимать в первую очередь атом фтора, хлора, брома или иода, предпочтительней атом фтора, хлора или брома.
С1-4 алкильная группа является метильной, этильной, н-пропильной, изопропильной, н-бутильной, втор-бутильной, трет-бутильной или изобутильной группой. Предпочтительней, если C1-4 алкильная группа является метильной, этильной или изопропильной группой.
С1-6 алкильная группа может быть в дополнение к вышеуказанным алкильным группам, н-пентильной, 2-метилбутильной, н-гексильной, 2,2-диметилбутильной или 2,3-диметилбутильной группой и т.д.
В дополнение к вышеуказанным алкильным группам C1-8 алкильная группа может быть, например, н-гептильной, 2-метилгексильной, н-октильной или 2,2-ди-метилгексильной группой и т.д.
С2-6 алкенильная группа может быть, например, винильной, аллильной, 3-бутен-1-ильной, 2-бутен-1-ильной, 3-пентен-2-ильной, 4-пентен-2-ильной, 3-гексен-1-ильной, 4-гексен-1-ильной, 5-гексен-1-ильной, 2-гексен-1-ильной группой и т.д. Предпочтительней, С2-6 алкенильная группа является аллильной группой.
С2-6 алкинильная группа может быть, например, этинильной, пропаргильной, 2-бутин-1-ильной, 3-бутин-1-ильной, 2-пентин-1-ильной, 3-пентин-1-ильной, 4-пентин-1-ильной, 3-гексин-1-ильной или 5-гексин-1-ильной группой и т.д. Предпочтительней, если С2-6 алкинильная группа является пропаргильной группой.
C1-4 алкоксигруппа является, в первую очередь, метокси-, этокси- н-пропокси- или н-бутоксигруппой, предпочтительней, метоксигруппой.
Под от 5-ти до 10-ти-членной насыщенной гетероциклической группой подразумевают гетероциклическую группу, содержащую один или более гетероатомов, где гетероатомом (гетероатомами) может (могут) быть атом(ы) азота и/или кислорода, и/или серы, такую как пирролидинильную, пиперидинильную, морфолинильную, пиперазинильную, имидазолидинильную, пиримидинильную, пиразолидинильную, гексаметиленимин-1-ильную, гептаметиленимин-1-ильную группу и т.д. Предпочтительней, указанная гетероциклическая группа является пиперидинильной, пиперазинильной или морфолин-1-ильной группой.
Под 5-ти или 6-ти-членной насыщенной гетероциклической группой, содержащей один или более атом(ов) азота или атом азота и атом кислорода подразумевают предпочтительней пирролидинильную, пиперидинильную, пиперазинильную или морфолинильную группу.
Под фармацевтически приемлемой солью присоединения кислоты подразумевают соль присоединения кислоты, образованную с помощью фармацевтически подходящей неорганической кислоты, такой как соляная, серная, фосфорная и т.д., или фармацевтически подходящей органической кислоты, такой как уксусная, фумаровая, молочная, яблочная, винная кислота и т.д.
Изобретение включает любые таутомерные формы соединений формулы I и их смеси.
Подгруппа новых соединений формулы I состоит из производных 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола и их фармацевтически приемлемых солей присоединения кислот,
где R1 означает атом водорода, C1-4 алкильную группу или фенильную группу, которая может быть замещена от 1 до 3 заместителями, выбранными из группы, состоящей из атома
галогена, гидроксигруппы, нитрогруппы, С1-4 алкоксигруппы, (C1-4 алкил)аминогруппы и ди(С1-4 алкил)аминогруппы,
один из R2 и R3 является
аминогруппой, а другой является аминогруппой или от 5-ти до 10-ти-членной насыщенной гетероциклической группой, содержащей один или более атом(ов) азота и/или кислорода, и/или серы, и присоединенной
через ее атом азота, причем указанная гетероциклическая группа может быть замещена C1-4 алкильной группой, фенильной группой или галогенофенильной группой, или последний из R2 и
R3 является группой формулы -SR,
где R означает C1-8 алкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу, причем алкильная группа
может быть замещена фенильной группой или галогенофенильной группой,
и одна или обе аминогруппы могут быть замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, С2-6 алкенильной группы, фенил(С1-4 алкильной) группы или галогенофенил(С1-4 алкильной)группы.
Другая подгруппа новых
соединений формулы I состоит из производных 5-фенил-2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола формулы
где R0 означает группу формулы Alk-NR4R5
где Alk является алкиленовой группой, имеющей прямую или разветвленную C1-6 цепь,
R4 и R5 означают, независимо друг от друга, C1-6 алкильную группу или С2-6 алкенильную группу, или
R4 и R5 образуют совместно с соседним атомом азота и, возможно, с еще одним или более атомом(атомами) азота и/или кислорода, и/или серы от 5-ти до 10-ти-членную насыщенную гетероциклическую группу, которая может быть замещена С1-4 алкильной группой или фенильной группой, причем последняя может быть замещена C1-4 алкоксигруппой,
Z означает атом водорода или С1-4 алкоксигруппу,
один из R2 и R3 является аминогруппой, а другой является аминогруппой или от 5-ти до 10-ти-членной насыщенной гетероциклической группой, содержащей один или более атом(ов) азота и/или кислорода, и/или серы, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена C1-4 алкильной группой, фенильной группой или галогенофенильной группой,
или последний из R2 и R3 является группой формулы -SR,
где R означает C1-8 алкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу, причем алкильная группа может быть замещена фенильной группой или галогенофенильной группой,
и одна или обе аминогруппы могут быть замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, С2-6 алкенильной группы, фенил(С1-4 алкильной) группы или галогенофенил(С1-4 алкильной)группы
и их фармацевтически приемлемых солей присоединения кислот.
Еще одна подгруппа новых соединений формулы I состоит из производных
5-(аминоалкоксифенил)-2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола формулы

где один из R2 и R3 является аминогруппой, а другой является аминогруппой или от 5-ти до 10-ти-членной насыщенной гетероциклической группой, содержащей один или более атом(ов) азота и/или кислорода, и/или серы, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена C1-4 алкильной группой, фенильной группой или галогенофенильной группой,
или последний из R2 и R3 является группой формулы -SR,
где R означает C1-8 алкильную группу, C2-6 алкенильную группу или С2-6 алкинильную группу, причем алкильная группа может быть замещена фенильной группой или галогенофенильной группой,
и одна или обе аминогруппы могут быть замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, С2-6 алкенильной группы, фенил(С1-4 алкильной) группы и галогенофенил(С1-4 алкильной)группы,
Alk является C1-6 алкиленовой группой,
R4 и R5 означают, независимо друг от друга, атом водорода или C1-8 алкильную группу, которая может быть замещена заместителем, выбранным из группы, состоящей из гидроксигруппы, (С1-4 алкил)аминогруппы, ди-(С1-4 алкил)аминогруппы, фенильной группы - причем последняя может быть замещена от 1 до 3 C1-4 алкоксигруппой(группами) - и 5-ти- или 6-ти-членной насыщенной гетероциклической группой, содержащей один или более атом(ов) азота или атом азота и атом кислорода, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена С1-4 алкильной группой,
и их фармацевтически приемлемых солей присоединения кислот.
Предпочтительные новые соединения формулы I являются производными 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола,
где R1 означает атом водорода,
метильную, этильную или фенильную группу, которая может быть замещена от 1 до 3 заместителями, выбранными из группы, состоящей из атома галогена, гидроксигруппы, нитрогруппы, метоксигруппы и
диметиламиногруппы,
R2 означает аминогруппу, которая может быть замещена галогенобензильной группой,
R3 означает пиперидин-1-ильную, пиперазин-1-ильную,
морфолин-1-ильную или 4-метилпиперазин-1-ильную группу или группу формулы -SR, где R является метильной группой,
и их фармацевтически приемлемыми солями присоединения кислот.
Среди новых соединений формулы Iа предпочтительными являются производные 5-фенил-2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола,
где R0 означает группу формулы Alk-NR4R5,
где Alk является этиленовой или пропиленовой группой,
R4 и R5 означают, независимо друг от друга, C1-3 алкильную группу, или
R4 и R5 совместно с соседним атомом азота образуют пирролидинильную группу,
R2 является аминогруппой,
R3 является аминогруппой или
пиперидинильной, или 4-метилпиперазинильной группой, причем указанные группы присоединены через атом азота, или группой формулы -SR,
где R является C1-3 алкильной группой,
и аминогруппа может быть замещена двумя метальными группами или двумя аллильными группами,
Z означает атом водорода,
и их фармацевтически приемлемые соли присоединения кислот.
Среди новых соединений формулы Ib предпочтительными являются производные 5-(аминоалкоксифенил)-2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола,
где R4 означает атом водорода или
C1-2 алкильную группу,
R5 означает этильную группу, замещенную заместителем, выбранным из группы, состоящей из гидроксигруппы, диметоксифенильной группы и морфолиновой
группы,
R2 является аминогруппой,
R3 является пиперидильной группой или группой формулы -SR,
где R является C1-3 алкильной группой,
Alk является С2-3 алкиленовой группой,
и их фармацевтически приемлемые соли присоединения кислот.
Особо предпочтительными соединениями формулы I являются
следующие:
1. 2-/5-амино-3-(4-метилпиперазино)-1Н-1,2,4-триазол-1-ил/-5-(2,6-дихлорфенил)-1,3,4-тиадиазол,
2. 2-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-5-/3-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
3. 2-(5-амино-3-диметиламино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
4.
2-/5-амино-3-(2-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол,
5. 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
6 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(2-диметиламиноэтокси)фенил/-1,3,4-тиадиазол,
7.
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-пирролидинопропокси)фенил/-1,3,4-тиадиазол,
8. 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[2-/3-ди(2-метилэтил)аминопропокси/-фенил]-1,
3,4-тиадиазол,
9. 2-/5-амино-3-(4-метилпиперазин-1-ил)-1Н-1,2,4-триазол-1-ил/-5-/4-(3-диметиламино-пропокси)фенил/-1,3,4-тиадиазол,
10. 2-(5-амино-3-диаллиламино-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
11. 2-(5-амино-3-пирролидино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
12.
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{2-[2-/2-этил-2-(2-гидроксиэтил)-амино/этокси]фенил}-1,3,4-тиадиазол,
13. 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-[2-/2-(2-морфолиноэтил)амино/-этокси]фенил-1,3,4-тиадиазол,
14. 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{ 2-[3-метил-3-/2-(3,
4-диметокси-фенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол,
15. 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{2-[3-метил-3-/2-(3,4-диметокси-фенилэтил)амино/пропокси]фенил}-1,3,
4-тиадиазол,
16. 2-/5-амино-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-{ 2-[3-метил-3-/2-(3,4-диметоксифенилэтил)амино/пропокси]-фенил}-1,3,4-тиадиазол,
17.
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{ 3-[3-метил-3-/2-(3,4-диметокси-фенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол,
18. 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{
4-[3-метил-3-/2-(3,4-диметокси-фенилэтил)амино/пропокси] фенил}-1,3,4-тиадиазол, и их фармацевтически приемлемые соли присоединения кислот.
Производные 2-(1,2,4-триазол-1-ил)-1,3,
4-тиадиазола по настоящему изобретению получают:
а) циклизацией гидразона тиокарбоновой кислоты формулы

где R1, R2 и R3 такие, как указано выше, окисляющим агентом; или
b) реакцией гидразида тиокарбоновой кислоты формулы
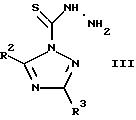
где R2 и R3 такие, как указано выше, с ортоэфиром формулы

где R1 такой, как указано выше, R11 означает отщепляемую группу; или
с) реакцией фенола формулы

где R2, R3 и Z такие, как указано выше, с аминоалкилгалогенидом формулы
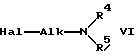
где Alk, R4 и R5 такие, как указано при описании R1, Hal означает атом галогена, для получения соединения формулы I, где R1 означает группу формулы a, R2, R3, R0 и Z такие, как указано в п.1 формулы изобретения; или
d) реакцией галогенида формулы

где R2, R3 и Z такие, как указано выше, Alk такой, как указано при описании R1, Hal означает атом галогена, с амином формулы
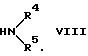
где R4 и R5 такие, как указано при описании R1,
для получения соединения формулы I, где R1 означает группу формулы a, R2, R3, R0 и Z такие, как указано в п.1 формулы изобретения;
и, если необходимо, превращают полученное таким образом соединение формулы I в его фармацевтически приемлемую соль присоединения кислоты, или выделяют соединение формулы I из его соли.
В способе а) используют неорганический или органический окисляющий агент.
В качестве неорганического окисляющего агента используют галогенид тяжелого металла, такой как хлорид железа(III), хлорид ртути(II), хлорид свинца(VI), пентахлорид сурьмы, хлорид таллия(III), предпочтительней хлорид железа(III).
В качестве органического окисляющего агента используют производное бензохинона, такое как 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ), тетрахлор-1,4-бензохинон (п-хлоранил), 2,3-дихлор-1,4-дигидроксиантрахинон, 6,7-дихлор-1,4-дигидроксиантрахинон или 2,3-дихлор-5,8-дигидрокси-1,4-нафтохинон, предпочтительней 2,3-дихлор-5, 6-дициано-1,4-бензохинон (DDQ).
Окисление гидразонов тиокарбоновой кислоты формулы II неорганическим окисляющим агентом проводят в полярном растворителе, таком как вода, уксусная кислота, метанол, ацетонитрил или диметилформамид, предпочтительней в смеси воды и уксусной кислоты, при температуре от -10oС до 120oС, предпочтительней от 20oС до 100oС, в течение от 0,05 до 12 часов, предпочтительней от 0,25 до 2 часов.
Реакцию закрытия кольца с использованием органического окисляющего агента проводят в растворителе, который является инертным по отношению к компонентам реакционной смеси, предпочтительней в тетрагидрофуране, при температуре от 0oС до 80oС, предпочтительней от 15oС до 20oС, в течение от 0,25 до 4 часов, предпочтительней от 1 до 1,5 часов.
Для выделения продукта реакции из реакционной смеси используют известные способы. Так, если продукт кристаллизуется из реакционной смеси, кристаллы отфильтровывают. Если продукт не осаждается главным образом из-за того, что растворитель был взят в избытке, раствор концентрируют и осажденный продукт отфильтровывают. Очищают продукт, как правило, путем перекристаллизации из подходящего растворителя.
В способе b) реакцию гидразида тиокарбоновой кислоты формулы III с ортоэфиром формулы IV проводят в полярном растворителе, таком как спирты, предпочтительней в метаноле при кипячении с обратным холодильником, однако, реакцию также можно проводить в избытке ортоэфира формулы IV. В этом случае избыток ортоэфира играет роль растворителя.
В формуле IV R11 означает отщепляемую группу, т.е. группу, которая отщепляется от реагента в ходе реакции. Если R11 означает алкильную группу, например, этильную, он вместе с соседним атомом кислорода и атомом водорода, отщепляемым от гидразида тиокарбоновой кислоты формулы III, образует в процессе реакции этанол.
Предпочтительней R11 означает С1-4 алкильную отщепляемую группу.
Для выделения продукта реакции из реакционной смеси используют известные способы. Так, если продукт кристаллизуется из реакционной смеси, кристаллы отфильтровывают. Если продукт не осаждается главным образом из-за того, что растворитель был взят в избытке, раствор выпаривают досуха и оставшийся продукт очищают путем перекристаллизации из подходящего растворителя.
В способе с) реакцию фенола формулы V с аминоалкилгалогенидом формулы VI проводят в присутствии органического или неорганического основания в растворителе, который является инертным по отношению к компонентам реакционной смеси.
В качестве неорганического основания используют, например, гидроксид щелочного или щелочноземельного металла, предпочтительней гидроксид калия или натрия, в качестве органического основания используют, как правило, гидроксид тетраалкиламмония, предпочтительней гидроксид тетрабутиламмония. В расчете на фенол формулы V, основание берут в эквимолярном количестве или в небольшом избытке, например, в 0,1-0,5 молярном избытке. В расчете на фенол формулы V, аминоалкилгалогенид формулы VI берут в эквимолярном количестве или в 0,1-0,5 молярном избытке.
Если используют органическое основание, удобнее сначала получить соответствующий гидроксид тетраалкиламмония, а затем проводить реакцию с аминоалкилгалогенидом формулы VI.
В этой реакции в качестве растворителя можно использовать спирты, предпочтительней метанол или этанол, кетоны, предпочтительней ацетон или метилэтилкетон, ацетонитрил, диметилформамид, диметилсульфоксид, галогенированные растворители, предпочтительней 1,2-дихлорэтан или хлорбензол.
Для выделения продукта реакции из реакционной смеси используют известные способы. Так, если используется растворитель, из которого продукт кристаллизуется, кристаллы отфильтровывают и очищают перекристаллизацией. Если продукт не осаждается при использовании не смешивающихся с водой растворителей, реакционную смесь разбавляют водой, фазы разделяют, органическую фазу выпаривают, оставшийся продукт очищают простой перекристаллизацией. При использовании смешивающихся с водой растворителей, продукт осаждают водой, затем фильтруют, или растворитель выпаривают, остаток перемешивают с водой и не смешивающимся с водой растворителем, органическую фазу отделяют, выпаривают, остаток перекристаллизовывают.
В способе d) реакцию галогенида формулы VII с амином формулы VIII проводят в избытке амина, однако, также реакцию можно проводить в растворителе, который является инертным по отношению к компонентам реакционной смеси.
В качестве инертного растворителя можно использовать спирты, предпочтительней метанол или этанол, ацетонитрил, диметилформамид, диметилсульфоксид, галогенированные растворители, предпочтительней 1,2-дихлорэтан или хлорбензол.
Продукт выделяют из реакционной смеси с помощью любого из способов, описанных выше.
Если реакционную смесь выпаривают, то остаток можно размешать с водой и не смешиваемым с водой растворителем, довести реакцию смеси до щелочной, разделить фазы и после выпаривания органической фазы очистить оставшееся основание перекристаллизацией.
Если соединение формулы I превращают в соль присоединения кислоты, то основание формулы I растворяют в подходящем растворителе, добавляют соответствующую кислоту и после охлаждения отфильтровывают кристаллы соли.
Гидразоны тиокарбоновой кислоты формулы II известны из литературы (описание Венгерского патента 206094) либо могут быть легко получены описанным здесь способом. Методика получения некоторых соединений приведена в примерах.
Гидразиды тиокарбоновой кислоты формулы III известны из литературы (описание Венгерского патента 206095).
Соединения формул IV, VI и VIII имеются в продаже.
Фенол формулы V получают из соответствующего гидразона тиокарбоновой кислоты, где R1 является атомом водорода, путем реакции закрытия кольца в условиях, описанных в способе а).
Изобретение также включает новые промежуточные продукты формулы

где R7 означает группу формулы -Alk-L,
где Alk означает прямую или разветвленную С1-6 алкиленовую цепь,
L означает атом галогена или гидроксигруппу,
Z означает атом водорода или С1-4 алкоксигруппу,
один из R2 и R3 является аминогруппой, а другой является аминогруппой или от 5-ти до 10-ти-членной насыщенной гетероциклической группой, содержащей один или более атом(ов) азота и/или кислорода, и/или серы, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена C1-4 алкильной группой, фенильной группой или галогенофенильной группой, или последний из R2 и R3 является группой формулы -SR,
где R означает C1-8 алкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу, причем алкильная группа может быть замещена фенильной группой или галогенофенильной группой,
и одна или обе аминогруппы могут быть замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, С2-6 алкенильной группы, фенил(С1-4 алкильной) группы или галогенофенил(С1-4 алкильной)группы,
и их соли присоединения кислот.
Соединения формулы IX также включают галогениды формулы VII.
Промежуточные продукты формулы IX получают циклизацией гидразона тиокарбоновой
кислоты формулы

где R2, R3, R7 и Z такие, как указано выше, с окисляющим агентом. Реакцию проводят аналогично способу а).
Соединения формулы IX, где L является атомом галогена, R2, R3, Z и Alk такие, как указано выше,
также можно получить реакцией фенола формулы V с дигалогеноалканом формулы
Hal - Alk - Hal XI
где Hal является атомом галогена, Alk такой, как указано выше. Реакцию проводят в
полярном растворителе, таком, как спирт, предпочтительней в метаноле, в присутствии неорганического или органического основания. Также в качестве растворителя можно использовать избыток
дигалогеноалкана формулы XI.
Основание берут в эквимолярном количестве или небольшом избытке (от 0,1 до 0,5 моль). В качестве неорганического основания можно использовать предпочтительней гидроксид щелочного или щелочноземельного металла, лучше гидроксид калия или натрия, в качестве органического основания можно использовать, например, четвертичный амин или гидроксид тетраалкиламмония, а именно, триэтиламин, диметиланилин, гидроксид тетрабутиламмония или гидроксид бензилтриметиламмония.
Реакцию проводят в диапазоне температур от комнатной до температуры кипения реакционной смеси, предпочтительней от 40oС до 80oС.
Соединения формулы IX, где L является атомом галогена, также можно получить реакцией
гидроксисоединения формулы

где R2, R3, Z и Alk такие, как указано выше, с галогенирующим агентом. Реакцию проводят с использованием подходящего галогенирующего агента в инертном растворителе. В качестве реакционной среды можно использовать ароматические углеводороды, предпочтительней бензол или толуол, или галогенированные углеводороды, например, хлорбензол, хлороформ, дихлорметан или четыреххлористый углерод.
В качестве галогенирующего агента можно использовать галогениды элементов 5-й или 6-й групп периодической системы, например, трихлорид фосфора, пентахлорид фосфора, оксихлорид фосфора, тионилхлорид, предпочтительней оксихлорид фосфора или тионилхлорид.
Реакцию галогенирования можно проводить в диапазоне температур от комнатной до температуры кипения реакционной смеси, предпочтительней от 40oС до 70oС.
Гидроксисоединение формулы XII можно получить реакцией фенола формулы V с гидроксиалкилгалогенидом формулы
Hal - Alk - OH XIII
где Hal означает атом
галогена, Alk имеет значения, указанные выше. Реакцию проводят способом, аналогичным способу, описанному в связи с реакцией фенола формулы V с дигалогеналканом формулы XI.
Если необходимо, промежуточный продукт формулы IX превращают в соль присоединения кислоты известным способом или выделяют из соли присоединения кислоты известным способом.
Биологические эффекты производных 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола настоящего изобретения были изучены в следующих экспериментах.
1. Измерение эффекта релаксации сосудов изолированной грудной аорты крысы, контрактированной в хлористом калии.
Эксперименты проводились на грудных аортах, полученных от самцов крыс SPRD весом 250-300 г. Грудные аорты, вырезанные у крыс, умерщвленных путем декапитации и обескровливания, были очищены от жира и соединительных тканей, затем немедленно помещены в раствор карбогенизированного ТИРОДА. Состав нормального раствора ТИРОДА был следующим (в ммоль): NaCl 114,7, KCl 3,7, CaCl2 3,6, MgCl2 0,49, NaHCO3 19,9, NaH2PO4 0,32, глюкоза 5,1.
Полосы шириной 2 мм и длиной 20-25 мм были вырезаны из аорт по спирали под углом 45o. Полосы аорты были помещены вертикально между двумя хлопчатобумажными нитями в камерах объемом 10 мл, при этом нижние нити были прикреплены к камерам, а верхние - связаны с изометрическими динамометрическими датчиками. Полосы инкубировались при остаточном натяжении 1 г при 37oС в течение 120 минут, после чего был зарегистрирован остаточный сосудистый тонус. Затем полосы были контрактированы с помощью раствора ТИРОДА, содержащего 20 ммоль KCl. Состав раствора ТИРОДА с высоким содержанием калия был следующим (в ммоль): NaCl 94,7, KCl 20, CaCl2 3,6, MgCl2 0,49, NaHCO3 19,9, NaH2PO4 0,32, глюкоза 5,1.
Когда был достигнут устойчивый сосудистый тонус, в ванну добавлялись увеличивающиеся дозы контрольного вещества. Воздействие каждой дозы контрольного вещества измерялось по меньшей мере на трех препаратах тканей, полученных от разных животных. Понижение сосудистого тонуса, вызванное контрольными веществами, было выражено как изменение процентного соотношения, а IC50 для каждого препарата ткани определялось аппроксимацией сигмоидной кривой (в отдельных случаях - прямой). Значения IC50 для каждого контрольного вещества были усреднены и приводятся в табл.I.
Для сравнения использовался хромакалим, т.е. (±)-транс-3,4-дигидро-3-гидрокси-2,2-диметил-4-(2-оксо-1-пирролидинил)-2Н-1-бензопиран-6-карбонитрил.
Для дополнительного сравнения использовался дильтиазем, т.е. (2S)-цис-3-ацетилокси-5-(2-диметиламиноэтил)-2,3-дигидро-2-(4-метоксифенил)-1,5-бензотиазепин-4(5Н)-он.
Дильтиазем является блокатором каналов кальция, поэтому его воздействие испытывалось на сосудах, контрактированных с помощью раствора ТИРОДА с содержанием 40 ммоль хлористого калия. Методика тестирования была во всех отношениях идентична той, которая описана выше, за исключением того, что полоски изолированной грудной аорты крысы контрактировались с помощью модифицированного раствора ТИРОДА, содержащего 40 ммоль хлористого калия. Состав раствора ТИРОДА с высоким содержанием калия был следующим (в ммоль): NaCl 74,7, KCl 40, CaCl2 3,6, MgCl2 0,49, NaHCO3 19,9, NaH2PO4 0,32, глюкоза 5,1.
Некоторые испытанные соединения, такие как производные, указанные в примерах 29, 30 и 101, приводили к релаксации изолированной грудной аорты крысы более эффективно, чем эталонные вещества, открывающие канал K+ и блокирующие канал Са2+. Оказалось весьма благоприятным, что другие производные, оказывающие кардиозащитное и/или противоаритмическое воздействие, не вызвали релаксации сосудов.
2. Измерение эффективного рефракторного периода сосочкового мускула правого желудочка морских свинок, in vitro.
Эффективный рефракторный период (ЭРП) рассматривается как кратчайший промежуток времени между двумя идентичными электрическими раздражениями, оба из которых приводят к сокращению сосочковой мышцы. Второе раздражение, приложенное раньше ЭРП, не является эффективным. Соединения, продлевающие ЭРП, могут оказывать противоаритмическое воздействие. Этот метод полезен прежде всего при испытаниях противоаритмических агентов, относящихся к классу III по классификации Вогана Уильямса (Vaughan Williams; Bexton, R.S. and Camm. A., J. Pharmacol. Ther., 17, 315 (1982)).
Опыты проводились в системе ванн типа Schuler с 4 каналами. Самцы морских свинок весом 450-750 г были умерщвлены ударом по голове и обескровлены. Сердце было быстро вырезано, и сосочковые мышцы подходящего размера (менее 1 мм в диаметре) были отделены от правого желудочка. Препараты были помешены вертикально в камеры объемом 20 мл с раствором Кребса, барботированным углеродсодержащим газом (состоящим из 95% О2 и 5% СO2) и температурой 35oС. Верхние концы мышц были соединены с помощью хлопчатобумажных нитей с динамометрическими датчиками, подсоединенными к самописцу для измерения изометрического натяжения с помощью усилителей постоянного тока с мостовой схемой. Нижние концы сосочковых мышц были прикреплены ко дну камеры с помощью серебряного крючка, который использовался также и в качестве стимулирующего электрода. Другой электрод был погружен в ванну и не имел непосредственного контакта с препаратом. Состав раствора Кребса был следующим (в ммоль): NaCl 118, KCl 4,8, NаНСО3 27,2, глюкоза 11,1, MgSO4 1,2, KH2PO4 1, СаСl2 2,6, рН 7,4.
Препараты приводились в равновесие в течение 120 минут при остаточном натяжении 1 г. Во время уравновешивания они подвергались раздражению электрическим током с частотой 2 Гц прямоугольными импульсами длительностью в 1 мсек, которые на 10% превышали диастолическое пороговое напряжение. ЭРП определялся с использованием стандартной технологии экстрастимуляции. Экстрастимуляция (S2) производилась в промежутках между нормальными стимулами (S1) таким образом, что интервал S1-S2 первоначально был меньше рефракторного периода ткани. Затем интервал S1-S2 постепенно увеличивался на 1 мсек до тех пор пока экстрастимул (S2) не вызвал сокращение сосочковой мышцы. Сила сокращения, вызванного S2, была больше силы сокращения, вызванного нормальными стимулами (S1) (постэкстрасистолическое усиление). Кратчайший интервал S1-S2, при котором экстрастимул вызвал сокращение на 25% большей силы, чем сила контрольных сокращений, был измерен с помощью приборов. Этот интервал эквивалентен ЭРП.
Протокол опыта был следующим:
Два контрольных измерения ЭРП проводились с интервалом 20 минут, затем было добавлено
соответствующее количество тестируемого вещества, необходимое для получения в ванне концентрации раствора 10-4 моль. После 30 минут инкубации с тестируемым веществом с интервалом в 30 минут
были проведены два измерения ЭРП.
Когда тестируемое вещество увеличило ЭРП при 10-4 моль на 40 мсек или более, его воздействие на ЭРП было испытано также при 10-5 моль.
Действие тестируемых веществ характеризовалось разницей между первым и вторым контрольными измерениями. Данные, полученные по меньшей мере на 4 различных препаратах, были усреднены. Полученные средние значения представлены в табл. II. В качестве эталонного вещества использовался соталол, т.е. N-[4-/1-гидрокси-2-(1-метилэтиламино)этил/фенил]метансульфонамид.
Как видно из табл.II, многие новые соединения данного изобретения значительно продлевают ЭРП при 10-4 моль с большей эффективностью, чем эталонное вещество соталол. Более того, воздействие соединения из примера 32 было значительным также и при 10-5 моль.
3. Измерение кардиозащитного эффекта на препарате сердца крысы, пораженного ишемией (препарате Лангендорфа).
Если приток крови к части сердечной мышцы прерывается (например, во время инфаркта миокарда), то концентрация межклеточного кальция начинает расти и постепенно достигает патофизиологических уровней. Сокращение сердечной мышцы регулируется кальцием, поэтому высокая концентрация межклеточного кальция приводит к непроизвольному спастическому сокращению сердечной мышцы. В изолированных сердцах крыс непроизвольное спастическое сокращение развивается примерно в течение 10 минут после наступления общей ишемии, и этот период называется временем до контрактуры (ВДК). Любое вещество, которое может ингибировать повышение концентрации межклеточного кальция и развитие контрактуры, вызванной высокой концентрацией кальция при ишемии, защищает миокард от повреждений, т.е. оказывает кардиозащитный эффект. В условиях эксперимента кардиозащитный эффект медикаментов проявляется в их способности продлевать ВДК. Кардиозащитный эффект химических соединений данного изобретения был изучен путем измерения ВДК на сердцах крыс (препарат Лангендорфа), полностью пораженных ишемией (Longman, S.D. and Hamilton, Т.С., Medicinal Research Reviews, 12, 73-148 (1992)).
Самцам вистаровых крыс весом 300-350 г была сделана инъекция 2500 международных единиц (0,5 мл) гепарина внутрибрюшинно, и спустя 10 минут они были анестезированы пентабарбиталом натрия (натриевой солью 5-этил-5-(1-метилбутил)-2,4,6-(1Н, 3Н, 5Н)-пиримидинтриона) в количестве 60 мг/кг внутрибрюшинно. Сердце было быстро вырезано и подсоединено к аппарату Лангендорфа через аорту. Сердца, при постоянном давлении (60 мм ртутного столба) и температуре (37oС), подвергались перфузии модифицированным раствором Кребса-Хензеляйта (Krebs-Henseleit), через который пропускали газ, содержащий 95% O2 и 5% СO2. Состав модифицированного раствора Кребса-Хензеляйта был следующим (в ммоль): NaCl 118, KCl 4,7, CaCl2 2,5, NaHCO3 24,88, KH2PO4 1,18, MgSO4 1,6, EDTA 0,5, глюкоза 11. Парциальные давления О2 и СO2, а также рН были измерены и поддерживались в пределах нормы (рO2 =64000-77000 Па, рСО2= 3800-4500 Па, рН 7,3-7,45). В стенке левого предсердия было проделано отверстие, затем для измерения левого вентрикулярного давления в левый желудочек через левое предсердие был введен наполненный водой пластиковый баллон, соединенный с металлической полой иглой. Конечное диастолическое давление было установлено примерно 645 Па, и затем поддерживалось в течение периода уравновешивания, но не позднее.
После 20-минутного периода уравновешивания сердца в течение 10 минут подвергались перфузии тестируемым веществом с концентрацией 10-5 или 10-6 или растворителем (0,04% диметилсульфоксида). Общая ишемия была вызвана полным перекрытием притока перфузата и карбогенизацией в течение 25 минут. Во время ишемии был измерен период времени с начала ишемии до повышения диастолического давления до 645 Па в конце левого желудочка (ВДК).
Было проведено три опыта с тестируемыми веществами каждой концентрации, одновременно были измерены параметры еще 3 сердец, обработанных растворителем.
Индивидуальные значения ВДК были усреднены, влияние тестируемых веществ было выражено в процентах изменения ВДК по сравнению с группой, которая была обработана растворителем. Соединения, продлевающие ВДК, являются кардиозащитными. Полученные результаты представлены в табл.III. В качестве эталонного вещества использовался лемакалим, т.е. (3S)-транс-3,4-дигидро-3-гидрокси-2,2-диметил-4-(2-оксо-1-пирролидинил)-2Н-1-бензопиран-6-карбонитрил.
Некоторые новые соединения данного изобретения вызвали большее продление ВДК, чем эталонное вещество лемакалим.
Согласно данным, представленным в табл.I и III, вещества, продлевающие ВДК, не вызывали релаксации мышц, в противоположность лемакалиму, который не только продлевает ВДК, но и вызывает значительную релаксацию изолированной грудной аорты крыс. Таким образом, эти новые производные 1,3,4-тиадиазола продемонстрировали селективность по отношению к миокарду. То, что кардиозащитный медикамент не вызывает сосудистой релаксации и, следовательно, понижения кровяного давления, оказывается благоприятным, поскольку для большинства пациентов пониженное кровяное давление, вызванное кардиозащитным соединением, может рассматриваться как нежелательный побочный эффект.
Некоторые новые соединения, например, соединение из примера 26, продлевают не только ВДК, но и ЭРП. Эти результаты обнаруживают наличие двойной - кардиозащитной и противоаритмической - эффективности некоторых новых соединений. Такой профиль повышает возможность крайне благоприятного терапевтического применения, поскольку, назначая одно лекарство, можно добиться как кардиозащитного эффекта, так и предотвращения аритмий, часто наблюдаемых у пациентов, страдающих сердечной недостаточностью. Такое соединение превосходит оба стандартных медикамента, каждый из которых пригоден только для одной терапевтической цели.
Короче говоря, данные, полученные в ходе фармакологических исследований производных 1,3,4-тиадиазола данного изобретения, убедительно доказали, что некоторые из этих соединений оказывают желаемые воздействия на сосуды и миокард. Эффективность некоторых производных 1,3,4-тиадиазола превзошла эффективность терапевтически опробованных стандартных веществ как по своим возможностям, так и по селективности к тканям. Некоторые производные оказывают значительный эффект релаксации сосудов, поэтому такие производные могут быть полезны для лечения гипертонии и для сосудорасширяющей терапии при периферийных сосудистых заболеваниях. Из последних терапевтических показаний следует упомянуть ишемическую болезнь сердца и спазмы сосудов головного мозга (удар). По своим воздействиям на сердце другие соединения данного изобретения удобны для лечения вентрикулярной аритмии и для предотвращения повреждения миокарда, вызываемого недостаточным коронарным кровоснабжением, возникающим при ишемической болезни сердца или во время кардиохирургических операций, т.е. для защиты сердца от воздействия неизбежных ишемических инсультов миокарда.
4. Изучение связывания рецепторов 5-НТ2A и 5-НТ2C
Оценка связывания рецепторов 5-НТ2A и 5-HT2C поводилась по методике, описанной Лейзеном (Leysen)
и др. (Mol. Pharmacol., 21, 301 (1981)) и Пасосом (Pazos) и др. (Eur. J. Pharmacol., 106, 539 (1985)) соответственно. Оценка связывания рецептора 5-HT2A проводилась на препарате оболочки
коры передней части головного мозга крысы с использованием тритированного кетансерина (3-(2-(4-фторбензоил)-1-пиперидинил(этил-2,4-(1Н, 3Н)-хиназолиндиона) (60-90 Ки/ммоль) в качестве лиганда. Оценка
связывания рецептора 5-НТ2C проводилась на препарате оболочки сосудистого сплетения головного мозга свиньи с использованием тритированного месулергина /N'-/(8)-1,6-диметилэрголин-8-ил/-N,
N-диметилсульфамида (70-85 Ки/ммоль) в качестве лиганда. Неспецифическое связывание с рецепторами 5-НТ2A и 5-НТ2C определялось в присутствии 10 мкмоль ципрогептадина
(4-(5Н-дибензо (a,d) циклогептен-5-илиден)-1-метилпиперидин) и 1 мкмоль миансерина (1,2,3,4,10,14b-гексагидро-2-метилдибензо (c, f) пиразино/1,2-а/ азепина) соответственно. Конечные объемы инкубации
составляли 250 и 1000 мкл. Образцы подвергались инкубации в течение 15 и 30 минут при 37oС. Инкубация была остановлена добавлением к реакционной смеси 9 мл ледяного
трис(гидроксиметил)-аминометангидрохлорида (рН 7,7) с концентрацией 50 ммоль. Образцы были быстро отфильтрованы через фильтры Ватмана (Whatman) GF/B из стекловолокна при пониженном давлении. Перед
использованием фильтры вымачивались в 0,05%-ном растворе полиэтиленимина от 2 до 3 часов. Радиоактивность фильтров определялась сцинтилляционным спектрометром.
Полученные результаты представлены в табл.IV.
Из табл.IV видно, что новые соединения данного изобретения обладают значительным сродством к рецепторам 5-HT2C с умеренной или высокой степенью селективности по сравнению с рецепторами 5-НТ2A. Таким образом, данные соединения могут применяться для лечения расстройств, возникающих в результате патологических изменений в центральной нервной системе.
Некоторые соединения данного изобретения продемонстрировали свое сродство прежде всего к подтипам серотонергического рецептора 5-НТ2C. В научной литературе описано, что данный рецептор играет основную роль в патомеханизме фобий, шизофрении и головных болей. Агонист рецептора 5-НТ2C м-хлорфенилпиперазин (Conn et al., Proc. Natl. Acad. Sci USA, 83, 4086 (1986)) вызывает чувство страха как у крыс (Kennett et al., Eur. J. Pharmacol., 164, 455 (1989)), так и у людей (Kahn and Weltzer, Biol. Psychiat., 30, 1139 (1991)). На основании исследований, проведенных на крысах, воздействие м-хлорфенилпиперазина, вызывающего состояние тревоги, можно объяснить активацией рецепторов 5-HT2C (Kennett et al., Eur. J. Pharmacol., 164, 455 (1989)). В опытах над животными показано, что соединения, оказывающие антагонистический эффект на рецепторы 5-НТ2A/2C, обладают успокаивающим действием (Kennett, Psychopharmacol., 107, 379 (1992)). Доказано, что соединение ритансерин (6-[2-(4-бис(4-фторфенил)-метилен)-1-пиперидинилэтил] -7-метил-5Н-тиазоло(3,2-а)пиримидин-5-он), оказывающий антагонистическое действие на рецептор 5-НТ2A/2C, является эффективным при лечении различных форм фобий у людей (Ceulemans et al., Pharmacopsychiat., 18, 303 (1985). Следует подчеркнуть, что соединения, селективно связывающиеся с рецепторами 5-НТ2C, могут иметь преимущества по сравнению с соединениями, обладающими сродством к подтипам рецепторов 5-НТ2A и 5-НТ2C.
Полезность новых соединений данного изобретения для профилактического лечения головных болей обусловлена антагонистическим влиянием данных соединений на рецептор 5-НТ2C (Sleight et al., in Serotonin Receptor Subtypes: Basic and Clinical Aspects, ed. Peroutka, S.J., pp.211, Wiley-Liss Inc., 1991).
Таким образом, некоторые новые соединения данного изобретения могут использоваться в частности для лечения сердечной недостаточности и/или аритмии, в то время как другие соединения данного изобретения полезны при лечении болезней центральной нервной системы.
Как показывают результаты опытов, описанные выше, новые производные 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола формулы I и их фармацевтически приемлемые соли присоединения кислот могут использоваться как активные ингредиенты фармацевтических композиций. Фармацевтические композиции данного изобретения содержат терапевтически активное количество соединения формулы I или его фармацевтически приемлемую соль присоединения кислоты и один или более традиционный носитель.
Фармацевтические композиции данного изобретения удобны для перорального, парентерального или ректального применения, а также для местного лечения, и могут применяться в виде твердых или жидких препаратов.
Твердые фармацевтические композиции, удобные для перорального применения, могут использоваться в виде порошков, капсул, таблеток, таблеток в оболочке, микрокапсул и т.д., и могут содержать связующие вещества, такие как желатин, сорбитол, поливинилпирролидон и т.д.; наполнители, такие как лактоза, глюкоза, крахмал, фосфат кальция и т.д.; вспомогательные вещества для изготовления таблеток, например, стеарат магния, тальк, полиэтиленгликоль, диоксид кремния и т.д.; увлажнители, например, лаурилсульфат натрия и др. в качестве носителей.
Жидкие фармацевтические композиции, удобные для перорального применения, могут использоваться в виде растворов, суспензий или эмульсий и могут содержать, например, суспендирующие агенты, такие как желатин, карбоксиметилцеллюлоза и т.д.; эмульгаторы, например, сорбитанмоноолеат и т.д.; растворители, например, воду, масла, глицерин, пропиленгликоль, этанол и т.д.; консерванты, например, метил-п-гидроксибензоат и т.д. в качестве носителей.
Фармацевтические композиции, удобные для парентерального применения, обычно состоят из стерильных растворов активного ингредиента.
Вышеперечисленные лекарственные формы, как и другие лекарственные формы, известны per se, см., например. Remington's Pharmaceutical Sciences, 18-е изд., Mack Publishing Co., Easton, USA (1990).
Фармацевтические композиции данного изобретения содержат, как правило, 0,1-95,0 мас.% соединения формулы I или его фармацевтически приемлемую соль присоединения кислоты. Типичная доза для взрослого пациента составляет 0,1-20 мг соединения формулы I или его фармацевтически приемлемой соли присоединения кислоты ежедневно. Указанная доза может быть принята в один или несколько приемов. Фактическая доза зависит от многих факторов и определяется врачом.
Фармацевтические композиции по настоящему изобретению получают смешиванием соединения формулы I или его фармацевтически приемлемых солей присоединения кислот с одним или более носителем (носителями) и превращением полученной смеси в фармацевтическую композицию известными способами. Эти способы известны из литературы, например, Remington's Pharmaceutical Sciences.
Подгруппа фармацевтических композиций настоящего
изобретения содержит в качестве активного ингредиента производное 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола формулы I,
где R1 означает атом водорода, C1-4 алкильную группу
или фенильную группу, которая может быть замещена от 1 до 3 заместителями, выбранными из группы, состоящей из атома галогена, гидроксигруппы, нитрогруппы, С1-4 алкоксигруппы, (С1-4 алкил)аминогруппы и ди(С1-4 алкил)аминогруппы,
один из R2 и R3 является аминогруппой, а другой является аминогруппой или от 5-ти до 10-ти-членной
насыщенной гетероциклической группой, содержащей один или более атом(ов) азота и/или кислорода, и/или серы, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть
замещена C1-4 алкильной группой, фенильной группой или галогенофенильной группой, или последний из R2 и R3 является группой формулы -SR,
где R означает C1-8 алкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу, причем алкильная группа может быть замещена фенильной группой или галогенофенильной группой,
и одна или обе аминогруппы могут быть замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, С2-6 алкенильной группы, фенил(C1-4 алкильной) группы или галогенофенил(С1-4 алкильной)группы,
или его фармацевтически приемлемую соль присоединения кислоты.
Другая подгруппа
фармацевтических композиций по настоящему изобретению содержит в качестве активного ингредиента производное 5-фенил-2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола формулы Iа,
где R0
означает группу формулы Alk-NR4R5,
где Alk является алкиленовой группой, имеющей прямую или разветвленную C1-6 цепь,
R4 и R5
означают, независимо друг от друга, C1-6 алкильную группу или С2-6 алкенильную группу, или
R4 и R5 образуют совместно с соседним атомом азота и,
возможно, с еще одним или более атомом(атомами) азота и/или кислорода, и/или серы от 5-ти до 10-ти-членную насыщенную гетероциклическую группу, которая может быть замещена С1-4 алкильной
группой или фенильной группой, причем последняя может быть замещена С1-4 алкоксигруппой,
Z означает атом водорода или С1-4 алкоксигруппу,
один из R2
и R3 является аминогруппой, а другой является аминогруппой или от 5-ти до 10-ти-членной насыщенной гетероциклической группой, содержащей один или более атом(ов) азота, и/или кислорода,
и/или серы, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена C1-4 алкильной группой, фенильной группой или галогенофенильной группой, или
последний из R2 и R3 является группой формулы -SR,
где R означает C1-8 алкильную группу, C2-6 алкенильную группу или С2-6 алкинильную
группу, причем алкильная группа может быть замещена фенильной группой или галогенофенильной группой,
и одна или обе аминогруппы могут быть замещены одним или двумя заместителями, выбранными
из группы, состоящей из C1-6
алкильной группы, С2-6 алкенильной группы, фенил(С1-4 алкильной) группы или галогенофенил(С1-4 алкильной) группы,
или его фармацевтически приемлемую соль присоединения кислоты.
Еще одна подгруппа фармацевтических композиций настоящего изобретения содержит в качестве активного ингредиента
производное 5-(аминоалкоксифенил)-2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола формулы Ib,
где один из R2 и R3 является аминогруппой, а другой является аминогруппой или от
5-ти до 10-ти-членной насыщенной гетероциклической группой, содержащей один или более атом(ов) азота, и/или кислорода, и/или серы, и присоединенной через ее атом азота, причем указанная
гетероциклическая группа может быть замещена C1-4 алкильной группой, фенильной группой или галогенофенильной группой, или последний из R2 и R3 является группой формулы
-SR,
где R означает C1-8 алкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу, причем алкильная группа может быть замещена фенильной группой
или галогенофенильной группой,
и одна или обе аминогруппы могут быть замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, С2-6 алкенильной группы, фенил(С1-4 алкильной) группы или галогенофенил(С1-4 алкильной)группы,
Alk является C1-6 алкиленовой группой,
R4 и R5 означают, независимо друг от друга, атом водорода, C1-8 алкильную группу, которая может быть замещена заместителем, выбранным из группы, состоящей из гидроксигруппы,
(С1-4 алкил)аминогруппы, ди-(С1-4 алкил)аминогруппы, фенильной группы - причем последняя может быть замещена от 1 до 3 С1-4 алкоксигруппой(группами) - и 5-ти- или
6-ти-членной насыщенной гетероциклической группы, содержащей один или более атом(ов) азота или атом азота и атом кислорода, и присоединенной через ее атом азота, причем указанная гетероциклическая
группа может быть замещена C1-4 алкильной группой,
или его фармацевтически приемлемую соль присоединения кислоты.
Предпочтительная фармацевтическая композиция
настоящего изобретения содержит в качестве активного ингредиента производное 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола формулы I,
где R1 означает атом водорода, метильную, этильную
или фенильнуто группу, которая может быть замещена от 1 до 3 заместителями, выбранными из группы, состоящей из атома галогена, гидроксигруппы, нитрогруппы, метоксигруппы и диметиламиногруппы,
R2 означает аминогруппу, которая может быть замещена галогенобензильной группой,
R3 означает пиперидин-1-ильную, пиперазин-1-ильную, морфолин-1-ильную или
4-метилпиперазин-1-ильную группу или группу формулы -SR, где R является метильной группой,
или его фармацевтически приемлемую соль присоединения кислоты.
Соответственно,
фармацевтическая композиция настоящего изобретения содержит в качестве активного ингредиента производное 5-фенил-2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола формулы Iа,
где R0 означает
группу формулы Alk-NR4R5,
где
Alk является этиленовой или пропиленовой группой,
R4 и R5 означают, независимо друг от друга, C1-3 алкильную группу, или
R4 и R5 совместно с соседним атомом азота образуют пирролидинильную группу, R2 является аминогруппой,
R3
является аминогруппой или пиперидинильной, или 4-метилпиперазинильной группой, причем указанные группы присоединены через атом азота, или группой формулы -SR, где R является C1-3 алкильной
группой,
и аминогруппа может быть замещена двумя метильными группами или двумя аллильными группами,
Z означает атом водорода,
или его фармацевтически приемлемую соль
присоединения кислоты.
Еще одна предпочтительная фармацевтическая композиция настоящего изобретения содержит в качестве активного ингредиента производное 5-(аминоалкоксифенил)-2-(1,2,
4-триазол-1-ил)-1,3,4-тиадиазола формулы Ib,
где R4 означает атом водорода или C1-2 алкильную группу,
R5 означает этильную группу, замещенную
заместителем, выбранным из группы, состоящей из гидроксигруппы, диметоксифенильной группы и морфолиновой группы,
R2 является аминогруппой,
R3 является
пиперидильной группой или группой формулы -SR,
где R является С1-3 алкильной группой,
Alk является С2-3 алкиленовой группой,
или его фармацевтически
приемлемую соль присоединения кислоты.
Особо предпочтительная фармацевтическая композиция настоящего изобретения содержит в качестве активного ингредиента любое из следующих
соединений:
1. 2-/5-амино-3-(4-метилпиперазино)-1Н-1,2,4-триазол-1-ил/-5-(2,6-дихлорфенил)-1,3,4-тиадиазол,
2. 2-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-5-/3-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
3. 2-(5-амино-3-диметиламино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
4.
2-/5-амино-3-(2-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол,
5. 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
6. 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(2-диметиламиноэтокси)фенил/-1,3,4-тиадиазол,
7.
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-пирролидинопропокси)фенил/-1,3,4-тиадиазол,
8. 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[2-/3-ди(2-метилэтил)аминопропокси/-фенил]-1,
3,4-тиадиазол,
9. 2-/5-амино-3-(4-метилпиперазин-1-ил)-1Н-1,2,4-триазол-1-ил/-5-/4-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
10. 2-(5-амино-3-диаллиламино-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
11. 2-(5-амино-3-пирролидино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
12.
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{2-[2-/2-этил-2-(2-гидроксиэтил)-амино/этокси]фенил}-1,3,4-тиадиазол,
13. 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-[2-/2-(2-морфолиноэтил)амино/-этокси]фенил-1,3,4-тиадиазол,
14. 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{ 2-[3-метил-3-/2-(3,
4-диметокси-фенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол,
15. 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{2-[3-метил-3-/2-(3,4-диметоксифенилэтил)амино/пропокси]фенил}-1,3,
4-тиадиазол,
16. 2-/5-амино-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-{ 2-[3-метил-3-/2-(3,4-диметоксифенилэтил)амино/пропокси]-фенил}-1,3,4-тиадиазол,
17.
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{ 3-[3-метил-3-/2-(3,4-диметоксифенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол,
18. 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{
4-[3-метил-3-/2-(3,4-диметоксифенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол,
или его фармацевтически приемлемую соль присоединения кислоты.
Кроме того, изобретение относится к способу лечения фармацевтическими препаратами, который включает введение пациенту, страдающему заболеванием сердца и/или системы кровообращения или центральной нервной системы, терапевтически эффективного нетоксичного количества производного 2-(1,2,4-триазол-1-ил)-1,3,4-тиадиазола формулы I или его фармацевтически приемлемой соли присоединения кислоты.
Далее изобретение поясняется детально следующими примерами.
Получение исходных соединений формулы II
1) 1-(5-амино-3-пиперидино

2,72 мл (0,026 моль) салицилового альдегида добавляют к суспензии 4,83 г (0,02 моль) 1-(5-амино-3-пиперидино-1,2,4-триазол-1-ил)тиогидразида в 20 мл метанола; реакционную смесь перемешивают в течение 4 дней. Кристаллы фильтруют, промывают некоторым количеством метанола, хлороформа, затем тетрагидрофурана.
Таким образом получают 5,94 г (86,1%) соединения указанной номенклатуры с температурой плавления 170-175oС.
2) 1-(5-амино-3-метилтио

2,3 мл (0,022 моль) салицилового альдегида добавляют к суспензии 4,08 г (0,02 моль) 1-(5-амино-3-метилтио-1,2,4-триазол-1-ил)тиогидразида в 20 мл метанола; реакционную смесь перемешивают в течение 16 часов. Кристаллы фильтруют и промывают некоторым количеством метанола.
Таким образом получают 5,48 г (88,8%) названного соединения с температурой плавления 180-183oС.
3) 1-(5-амино-3-пропилтио-

2,69 г (0,022 моль) салицилового альдегида добавляют к суспензии 4,65 г (0,02 моль) 1-(5-амино-3-пропилтио-1,2,4-триазол-1-ил)тиогидразида в 25 мл метанола; реакционную смесь перемешивают при комнатной температуре в течение 8 часов. Кристаллы фильтруют, промывают некоторым количеством метанола.
Таким образом получают 6,65 г (98,8%) названного соединения с температурой плавления 178-181oС.
4) 1-(5-амино-3-аллилтио

1,10 г (0,09 моль) салицилового альдегида добавляют к суспензии 1,84 г (0,08 моль) 1-(5-амино-3-аллилтио-1,2, 4-триазол-1-ил)тиогидразида в 15 мл метанола; реакционную смесь перемешивают при комнатной температуре в течение 4 часов. Кристаллы фильтруют, промывают некоторым количеством метанола.
Таким образом получают 2,53 г (94,5%) названного соединения с температурой плавления 171-174oС.
5) 1-(5-амино-3-бензилтио

1,34 г (0,011 моль) салицилового альдегида добавляют к суспензии 2,8 г (0,01 моль) 1-(5-амино-3-бензилтио-1,2,4-триазол-1-ил)тиогидразида в 10 мл метанола; реакционную смесь перемешивают при комнатной температуре в течение 24 часов. Кристаллы фильтруют, промывают некоторым количеством метанола.
Таким образом получают 3,34 г (87,0%) названного соединения с температурой плавления 164-167oС.
6) 1-(5-амино-3-морфолино
1,34 г (0,011 моль) салицилового альдегида добавляют к суспензии 2,43 г (0,01 моль) 1-(5-амино-3-морфолино-1,2,4-триазол-1-ил)тиогидразида в 20 мл метанола; реакционную смесь перемешивают при комнатной температуре в течение 17 часов. Кристаллы фильтруют, промывают некоторым количеством метанола.
Таким образом получают 3,2 г (92,2%) названного соединения с температурой плавления 183-186oС.
7) 1-/5-амино-3-(4-метилпиперазино)
2,68 г (0, 022 моль) салицилового альдегида добавляют к суспензии 5,13 г (0,02 моль) 1-/5-амино-3-(4-метилпиперазино)-1,2,4-триазол-1-ил/тиогидразида в 40 мл метанола; реакционную смесь перемешивают при комнатной температуре в течение 24 часов. Кристаллы фильтруют, промывают некоторым количеством метанола.
Таким образом получают 6,35 г (88,0%) названного соединения с температурой плавления 176-179oС.
8) 1-(5-амино-3-пропаргилтио

1,34 г (0,011 моль) салицилового альдегида добавляют к суспензии 2,28 г (0,01 моль) 1-(5-амино-3-пропаргилтио-1,2,4-триазол-1-ил)тиогидразида в 10 мл метанола; реакционную смесь перемешивают при комнатной температуре в течение 24 часов. Кристаллы фильтруют, промывают некоторым количеством метанола.
Таким образом получают 3,14 г (94, 6%) названного соединения с температурой плавления 177-180oС.
9) 1-/5-амино-3-(н-гексилтио)

0,77 г (0,006 моль) салицилового альдегида добавляют к суспензии 1,37 г (0,005 моль) 1-/(5-амино-3-(н-гексилтио)-1,2, 4-триазол-1-ил/тиогидразида в 10 мл метанола; реакционную смесь перемешивают при комнатной температуре в течение 20 часов. Кристаллы фильтруют, промывают некоторым количеством метанола.
Таким образом получают 1,76 г (93,1%) названного соединения с температурой плавления 158-160oС.
10) 1-(5-амино-3-пиперидино

2,41 г (0,0105 моль) 4-(2-бромэтокси)бензальдегида добавляют к раствору 2, 41 г (0,01 моль) (5-амино-3-пиперидино-1,2,4-триазол-1-ил)карботиогидразида в 13,5 мл хлороформа и 1,5 мл метанола. Реакционную смесь перемешивают при комнатной температуре в течение 22 часов, фильтруют, продукт на фильтре промывают хлороформом. Фильтрат выпаривают досуха при пониженном давлении, и сухой остаток подвергают хроматографии на колонке Kieselgel 60 Н. Фракции, содержащие желаемый продукт, выпаривают.
Таким образом получают 2,92 г (64,6%) названного соединения с температурой плавления 158-161oС (разложение; после перекристаллизации из ацетонитрила).
11) 1-(5-амино-3-пиперидино

9,72 г (0,04 моль) 2-(3-бромпропокси) бензальдегида добавляют к раствору 6,36 г (0,0263 моль) (5-амино-3-пиперидино-1-1,2, 4-триазол-1-ил) карботиогидразида в 100 мл метанола; реакционную смесь перемешивают при комнатной температуре в течение 22 часов. Выпавшие в осадок кристаллы фильтруют, промывают метанолом или эфиром.
Таким образом получают 11,8 г (96,2%) названного соединения с температурой плавления 167-168oС.
12) 1-(5-амино-3-пиперидино
24,05 г (0,105 моль) 2-(2-бромэтокси) бензальдегида добавляют к раствору 24,1 г (0,1 моль) (5-амино-3-пиперидино

Таким образом получают 30, 2 г (66,8%) названного соединения с температурой плавления 150-160oС (разложение; после перекристаллизации из ацетонитрила).
13) 1-(5-амино-3-пиперидино

24,1 г (0,105 моль) 3-(2-бромэтокси)бензальдегида добавляют к раствору 24,13 г (0,1 моль) (5-амино-3-пиперидино

Таким образом получают 34,0 г (75,2%) названного соединения с температурой плавления 173-176oС (разложение; после перекристаллизации из ацетонитрила).
14) 1-(5-амино-3-пиперидино)

14,01 г (0,0545 моль) 2-(4-бромбутокси)бензальдегида добавляют к раствору 12,07 г (0,05 моль) (5-амино-3-пиперидино

Таким образом получают 11,5 г (47,9%) названного соединения с температурой плавления 130-133oС (разложение).
15) 1-(5-амино-3-пиперидино

9,83 г (0,036 моль) 2-(3-бромпропокси)-3-метоксибензальдегида добавляют к раствору 7,24 г (0,03 моль) (5-амино-3-пиперидино
Таким образом получают 13,87 г (93,1%) названного соединения с температурой плавления 149-152oС.
16) 1-(5-амино-3-метилтио

3,65 г (0,015 моль) 2-(3-бромпропокси)бензальдегида добавляют к раствору 2,04 г (0,01 моль) (5-амино-3-метилтио

Таким образом получают 4,0 г (93,1%) названного соединения с температурой плавления 157-159oС (разложение).
17) 1-/5-амино-3-(2-метилэтилтио)
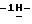
30,6 г (0,125 моль) 2-(3-бромпропокси)бензальдегида добавляют к раствору 23,2 г (0,1 моль) /5-амино-3-(2-метилэтилтио)

Таким образом получают 38,4 г (84,0%) названного соединения с температурой плавления 136-139oС.
18) 1-(5-амино-3-метилтио

35,8 г (0,147 моль) 3-(3-бромпропокси)бензальдегида добавляют к раствору 20,4 г (0,1 моль) (5-амино-3-метилтио
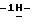
Таким образом получают 36,3 г (84,5%) названного соединения с температурой плавления 134-135oС.
19) 1-(5-амино-3-метилтио

35,8 г (0,147 моль) 4-(3-бромпропокси)бензальдегида добавляют к раствору 20,4 г (0,1 моль) (5-амино-3-метилтио

Таким образом получают 42,0 г (97,8%) названного соединения с температурой плавления 135-137oС.
20) 1-/5-амино-3-(2-метилэтилтио)

15,3 г (0,067 моль) 3-(3-бромпропокси)бензальдегида добавляют к раствору 11,6 г (0,05 моль) /5-амино-3-(2-метилэтилтио)
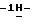
Таким образом получают 20,6 г (90,0%) названного соединения с температурой плавления 136-139oС.
21) 1-/5-амино-3-(2-метилэтилтио)
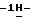
15,3 г (0,067 моль) 4-(3-бромпропокси)бензальдегида добавляют к раствору 11,6 г (0,05 моль) /5-амино-3-(2-метилэтилтио)

Таким образом получают 20,7 г (90,5%) названного соединения с температурой плавления 132-135oС.
22) 1-/5-бензиламино-3-(2-метиэтилтио)

2,80 г (0,012 моль) 2-(3-бромпропокси)бензальдегида добавляют к раствору 3,22 г (0,01 моль) /5-бензиламино-3-(2-метилэтилтио)

Таким образом получают 4,01 г (73,4%) названного соединения с температурой плавления 110-112oС.
23) 1-/5-(4-хлорбензиламино)-3-(2-метилэтилтио)
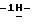
2,80 г (0,012 моль) 2-(3-бромпропокси)бензальдегида добавляют к раствору 3,57 г (0,01 моль) /5-(4-хлорбензиламино)-3-(2-метилэтилтио)

Таким образом получают 4,70 г (81,1%) названного соединения с температурой плавления 109-111oС.
Получение исходных соединений формулы IX
24) 2-(5-амино-3-пиперидино

К суспензии 2,71 г (0,006 моль) 1-(5-амино-3-пиперидино

Таким образом получают 2,56 г (94,7%) названного соединения. После хроматографии на колонке Kieselgel 60 Н и перекристаллизации из ацетонитрила продукт плавится при температуре 229-235oС (разложение).
25) 2-(5-амино-3-пиперидино
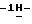
К суспензии 11,5 г (0,0246 моль) 1-(5-амино-3-пиперидино
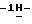
Таким образом получают 9,36 г (81,9%) названного соединения. После хроматографии на колонке Kieselgel 60 Н и перекристаллизации из ацетонитрила продукт плавится при температуре 192-195oС.
26) 2-(5-амино-3-пиперидино

К суспензии 3,62 г (0,008 моль) 1-(5-амино-3-пиперидино
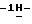
Таким образом получают 3,25 г (90,2%) названного соединения. Продукт очищают с помощью хроматографии на колонке Kieselgel 60 Н и перекристаллизации из ацетонитрила. Температура плавления - 200-203oС (разложение).
27) 2-(5-амино-3-пиперидино

К суспензии 40,7 г (0,09 моль) 1-(5-амино-3-пиперидино

Таким образом получают 38,6 г (94,8%) названного соединения. Продукт очищают с помощью хроматографии на колонке Kieselgel 60 Н и перекристаллизации из смеси хлороформа и метанола в соотношении 2:1. Температура плавления - 175-178oС (разложение).
28) 2-(5-амино-3-пиперидино

К суспензии 11,53 г (0,024 моль) 1-(5-амино-3-пиперидино
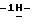
Таким образом получают 10,3 г (89,7%) названного соединения. Продукт очищают с помощью хроматографии на колонке Kieselgel 60 Н и перекристаллизации из смеси ацетонитрила и тетрагидрофурана в соотношении 1:1. Температура плавления - 209-212oС.
29) 2-(5-амино-3-пиперидино

К суспензии 13,4 г (0,027 моль) 1-(5-амино-3-пиперидино

Таким образом получают 13,1 г (98%) названного соединения. Продукт очищают с помощью хроматографии на колонке Kieselgel 60 Н, выпаривания фракций, содержащих желаемый продукт, суспендирования сухого остатка в ацетонитриле, фильтрации и перекристаллизации из тетрагидрофурана. Температура плавления - 199-205oС (разложение).
30) 2-(5-амино-3-метилтио

К суспензии 7,3 г (0,017 моль) 1-(5-амино-3-метилтио

Таким образом получают 6,37 г (87,6%) названного соединения. Продукт очищают с помощью хроматографии на колонке Kieselgel 60 Н и перекристаллизации из ацетонитрила. Температура плавления - 209-212oС.
31) 2-/5-амино-3-(метилэтилтио)

К суспензии 37,38 г (0,0817 моль) 1-(5-амино-3-метилэтилтио

Таким образом получают 29,15 г (78,3%) названного соединения с температурой плавления 183-185oС.
32) 2-(5-амино-3-метилтио

К суспензии 35,8 г (0,0834 моль) 1-(5-амино-3-метилтио

Таким образом получают 24,5 г (67,7%) названного соединения с температурой плавления 174-176oС.
33) 2-(5-амино-3-метилтио

К суспензии 41,5 г (0,0967 моль) 1-(5-амино-3-метилтио

Таким образом получают 35,2 г (82,47%) названного соединения. После перекристаллизации из смеси диметилформамида и ацетонитрила температура плавления составляет 219-222oС.
34) 2-/5-амино-3-(2-метилэтилтио)

К суспензии 20,0 г (0,0437 моль) 1-/5-амино-3-(2-метилэтилтио)

Таким образом получают 14,4 г (72,4%) названного соединения с температурой плавления 177-179oС.
35) 2-/5-амино-3-(2-метилэтилтио)

К суспензии 20,0 г (0,0437 моль) 1-/5-амино-3-(2-метилэтилтио)

Таким образом получают 11,9 г (59,8%) названного соединения с температурой плавления 190-191oС.
36) 2-(5-амино-3-метилтио

К суспензии 0,31 г (0,011 моль) 2-(5-амино-3-метилтио

Таким образом получают 0,39 г (91,3%) названного соединения. После перекристаллизации из смеси диметилформамида и ацетонитрила температура плавления составляет 218-221oС.
37) 2-(5-амино-3 -метилтио

К суспензии 14,0 г (0,045 моль) 2-(5-амино-3-метилтио
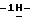
Таким образом получают 22,8 г (92,5%) тетрабутиламмонийной соли 2-(5-амино-3-метилтио

К 0,55 г (0,001 моль) данной соли добавляют 5 мл ацетонитрила и 0,81 г (0,004 моль) 1,3-дибромпропана. Суспензию перемешивают при комнатной температуре еще в течение 24 часов. Выпавшие в осадок кристаллы фильтруют, промывают холодным метанолом и эфиром.
Таким образом получают 0,41 г (96%) названного соединения. После перекристаллизации из смеси диметилформамида и ацетонитрила продукт плавится при температуре 219-221oС.
38) 2-/5-амино-3-(н-гексилтио)
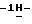
0,4 г (0,01 моль) гидроксида натрия растворяют в 5 мл воды, после чего добавляют раствор 0,68 г (0,002 моль) сульфата тетрабутиламмония в 5 мл воды. К реакционной смеси добавляют 15 мл хлороформа и 0,60 г (0,0016 моль) 2-/5-амино-3-(н-гексилтио)

Реакционную смесь интенсивно перемешивают в течение 5 минут. Фазы разделяют, водный слой экстрагируют с помощью 10 мл хлороформа. Объединенные органические растворы экстрагируют водой, высушивают над безводным сульфатом натрия и выпаривают досуха. Оставшееся кристаллическое вещество суспендируют в эфире, фильтруют, промывают эфиром.
Таким образом получают 0,76 г (76,9%) тетрабутиламмонийной соли 2-/5-амино-3-(н-гексилтио)
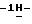
К 0,62 г (0,001 моль) тетрабутиламмонийной соли 2-/5-амино-3-(н-гексилтио)

Таким образом получают 0,38 г (76,4%) названного соединения. После перекристаллизации из смеси диметилформамида и ацетонитрила продукт плавится при температуре 180-186oС.
39) 2-/5-бензиламино-3-(2-метилэтилтио)
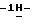
К свежеприготовленной суспензии 0,55 г (0,001 моль) 1-/5-бензиламино-3-(2-метилэтилтио)

Таким образом получают 0,46 г (84,3%) названного соединения с температурой плавления 148-150oС.
40) 2-/5-(4-хлорбензиламино)-3-(2-метилэтилтио)

К суспензии 0,58 г (0,001 моль) 1-/5-(4-хлорбензиламино)-3-(2-метилэтилтио)

Таким образом получают 0,40 г (70,2%) названного соединения с температурой плавления 123-124oС.
41) 2-(5-амино-3-пропаргилтио

5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазол.
К суспензии 1,98 г (0,006 моль) 2-(5-амино-3-пропаргилтио

Таким образом получают 2,84 г (83%) 2-(5-амино-3-пропаргилтио

К 2,29 г (0,004 моль) данной соли добавляют 2 мл ацетонитрила и 4,04 г (0,02 моль) 1,3-дибромпропана. Суспензию перемешивают при комнатной температуре в течение 24 часов. Выпавшие в осадок кристаллы фильтруют, промывают холодным метанолом и эфиром.
Таким образом получают соединение, которое перекристаллизовывают из смеси диметилформамида и ацетонитрила.
42) 2-(5-амино-3-аллилтио
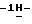
К суспензии 1,66 г (0,005 моль) 2-(5-амино-3-аллилтио

Таким образом получают 2,04 г (74,8%) 2-(5-амино-3-аллилтио

К 2,01 г (0,0035 моль) данной соли добавляют 20 мл ацетонитрила и 3,03 г (0,15 моль) 1,3-дибромпропана. Суспензию перемешивают при комнатной температуре в течение 24 часов. Выпавшие в осадок кристаллы фильтруют, промывают холодным метанолом и эфиром.
Таким образом получают 1,33 г (84,2%) названного соединения. После перекристаллизации из смеси диметилформамида и ацетонитрила получают 1,33 г желаемого продукта с температурой плавления 178-180oС.
43) 2-(5-амино-3-пропилтио

К суспензии 1,34 г (0,004 моль) 2-(5-амино-3-пропилтио

Таким образом получают 1,30 г (56,5%) 2-(5-амино-3-пропилтио

К 1,15 г (0,002 моль) данной соли добавляют 15 мл ацетонитрила и 2,02 г (0,01 моль) 1,3-дибромпропана. Суспензию перемешивают при комнатной температуре в течение 24 часов. Выпавшие в осадок кристаллы фильтруют, промывают холодным метанолом и эфиром.
Таким образом получают 0,78 г (85, 7%) названного соединения. После перекристаллизации из смеси диметилформамида и ацетонитрила продукт плавится при температуре 178-180oС.
44) 2-(5-амино-3-бензилтио

К суспензии 1,61 г (0,0042 моль) 2-(5-амино-3-бензилтио

Таким образом получают 2,00 г (64,3%) 2-(5-амино-3-бензилтио
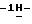
К 1,87 г (0,003 моль) данной соли добавляют 20 мл ацетонитрила и 2,42 г (0,012 моль) 1,3-дибромпропана. Суспензию перемешивают при комнатной температуре в течение 44 часов. Выпавшие в осадок кристаллы фильтруют, промывают холодным метанолом и эфиром.
Таким образом получают 1,37 г (90,7%) названного соединения с температурой плавления 175-180oС.
45) 2-(5-амино-3-метилтио

К 4,60 г (0,015 моль) 2-(5-амино-3-метилтио

Таким образом получают 2,16 г (34,9%) названного соединения с температурой плавления 227-229oС.
46) 2-(5-амино-3-метилтио

К 4,38 г (0,008 моль) тетрабутиламмонийной соли 2-(5-амино-3-метилтио

Таким образом получают 3,02 г (90,9%) названного соединения с температурой плавления 227-228oС.
47) 2-(5-амино-3-морфолино

К 2,64 г (0,0045 моль) тетрабутиламмонийной соли 2-(5-амино-3-морфолино

Таким образом получают 1,85 г (88,1%) названного соединения. После перекристаллизации из смеси диметилформамида и ацетонитрила температура плавления 210-214oС.
Получение соединений формулы I
Пример 1
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-(3,4,5-триметоксифенил)-1,3,4-тиадиазол
К раствору 17,2 г (0,045 моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-(3,4,
5-триметоксибензилиден)-карботиогидразида в 110 мл уксусной кислоты добавляют раствор 67,5 г хлорида железа(III) в 75 мл воды при перемешивании и охлаждении до 20oС. Реакционную смесь
перемешивают при комнатной температуре в течение 2 часов, затем разбавляют 800 мл воды, перемешивают еще 5 часов и оставляют на ночь. На следующий день осажденный продукт фильтруют.
Таким образом получают 15,9 г (92,8%) названного продукта. Температура плавления (после перекристаллизации из этанола): 234-236oС.
Пример 2
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-фенил-1,3,4-тиадиазол
К раствору 0,88 г (0,003 моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-бензилиден-карботиогидразида в 7,5 мл
уксусной кислоты добавляют раствор 4,5 г хлорида железа(III) в 5 мл воды при перемешивании и охлаждении до 20oС. Реакционную смесь перемешивают при комнатной температуре в течение 2 часов,
затем разбавляют 60 мл воды, перемешивают еще 5 часов и оставляют на ночь. На следующий день осажденный продукт фильтруют.
Таким образом получают 0,47 г (54%) названного продукта. Температура плавления (после перекристаллизации из изопропанола): 220-222oС.
Пример 3
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-фенил-1,3,4-тиадиазол
К раствору 2,04 г (0,01 моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-карботиогидразида в 50 мл метанола добавляют 3,4 мл (0,015 моль) триэтилортобензоата и кипятят в течение 4 часов. На
следующий день осажденные кристаллы фильтруют и промывают небольшим количеством метанола.
Таким образом получают 0,95 г (32,8%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 222-224oС.
Пример 4
2-(5-амино-3-морфолино-1Н-1,2,4-триазол-1-ил)-1,3,4-тиадиазол
К раствору 14,58 г (0,06 моль)
1-(5-амино-3-морфолино-1Н-1,2,4-триазол-1-ил)-карботиогидразида в 300 мл метанола добавляют 30 мл триэтилортоформиата и кипятят в течение 8 часов. Осажденные кристаллы фильтруют из горячей смеси и
промывают небольшим количеством метанола.
Таким образом получают 10,4 г (68,4%) названного соединения. Температура плавления (после перекристаллизации из метанола): 203-205o С.
Пример 5
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-1,3,4-тиадиазол
К суспензии 10,2 г (0,05 моль) 1-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-карботиогидразида в 250 мл метанола добавляют 25 мл триэтилортоформиата и кипятят в течение 4 часов. После охлаждения осажденные кристаллы фильтруют и промывают небольшим количеством
метанола.
Таким образом получают 8,8 г (82,1%) чистого названного соединения. Температура плавления: 202-203oС.
Пример 6
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-метил-1,3,4-тиадиазол
К суспензии 2,04 г (0,01 моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-карботиогидразида в 50 мл метанола добавляют 5,
7 мл триэтилортоацетата и кипятят в течение 8 часов. После охлаждения осажденные кристаллы фильтруют и промывают небольшим количеством метанола.
Таким образом получают 1,05 г (46,0%) названного соединения. Температура плавления (после перекристаллизации из метанола): 191-193oС.
Пример 7
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-этил-1,3,
4-тиадиазол
К суспензии 14,28 г (0,07 моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-карботиогидразида в 200 мл метанола добавляют 80 мл триэтилортопропионата и кипятят в течение 8 часов.
После охлаждения осажденные кристаллы фильтруют и промывают небольшим количеством метанола.
Таким образом получают 9,42 г (55,5%) чистого названного соединения. Температура плавления: 166-168oС.
Пример 8
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-(4-диметиламинофенил)-1,3,4-тиадиазол
К суспензии 10,05 г (0,03 моль)
1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-(4-диметиламинобензилиден)карботиогидразида в 32,5 мл уксусной кислоты добавляют раствор 19,5 г хлорида железа(III) в 22 мл воды при перемешивании и
охлаждении до 20oС Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, затем разбавляют 100 мл воды, перемешивают еще 1 час и оставляют на ночь. На следующий день
осажденный продукт фильтруют и промывают небольшим количеством этанола.
Таким образом получают 8,9 г (89%) названного продукта. Температура плавления (после перекристаллизации из диметилформамида): 292-294oС.
Пример 9
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-(4-хлорфенил)-1,3,4-тиадиазол
К суспензии 10,05 г (0,03 моль)
1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-(4-хлорбензилиден)карботиогидразида в 25 мл уксусной кислоты добавляют раствор 15 г хлорида железа(III) в 17 мл воды при перемешивании. Реакционную
смесь кипятят в течение 15 минут, затем разбавляют 100 мл воды, перемешивают еще 1 час, осажденный продукт фильтруют и промывают небольшим количеством этанола.
Таким образом получают 2,71 г (83,4%) названного продукта. Температура плавления (после перекристаллизации из диметилформамида): 269-271oС.
Пример 10
2-/5-амино-3-(4-метилпиперазино)-1Н-1,2,4-триазол-1-ил/-5-(2,6-дихлорфенил)-1,3,4-тиадиазола гидрохлорид моногидрат
К суспензии 2,07 г (0,005 моль) 1-/5-амино-3-(4-метилпиперазино)-1Н-1,2,
4-триазол-1-ил/-N'-(2,6-дихлорбензилиден)карботиогидразида в 12,5 мл уксусной кислоты добавляют раствор 7,5 г хлорида железа(III) в 8,5 мл воды при перемешивании. Реакционную смесь кипятят в течение 1
часа, затем разбавляют 100 мл воды, перемешивают еще 1 час, осажденный продукт фильтруют и промывают небольшим количеством воды и затем изопропанолом.
Таким образом получают 2,12 г (91,0%) названного продукта. Температура плавления (после перекристаллизации из метанола): 281-284oС.
Пример 11
2-/5-(4-хлорбензиламино)-3-метилтио-1Н-1,2,
4-триазол-1-ил/-1,3,4-тиадиазол
К суспензии 1,0 г (0,003 моль) 1-/5-(4-хлорбензиламино)-3-метилтио-1Н-1,2,4-триазол-1-ил/-карботиогидразида в 20 мл метанола добавляют 4 мл триэтилортоформиата
и кипятят в течение 4 часов. После охлаждения осажденные кристаллы фильтруют и промывают небольшим количеством метанола.
Таким образом получают 0,5 г (49,2%) названного соединения. Температура плавления (после перекристаллизации из метанола): 140-141oС.
Пример 12
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-(4-нитрофенил)-1,3,4-тиадиазол
К суспензии 3,37 г (0,01 моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-(4-нитробензилиден)карботиогидразида в 25 мл уксусной кислоты добавляют раствор 15 г хлорида железа(III) в 17 мл
воды при перемешивании. Реакционную смесь кипятят в течение 2 часов, затем разбавляют 200 мл воды, перемешивают еще 1 час, осажденный продукт фильтруют и промывают небольшим количеством этанола.
Таким образом получают 2,44 г (72,8%) названного продукта. Температура плавления (после перекристаллизации из диметилформамида): 301-303oС.
Пример 13
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-(4-фторфенил)-1,3,4-тиадиазол
К суспензии 0,93 г (0,003 моль) 1-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-N'-(4-фторбензилиден)карботиогидразида в 7,5 мл уксусной кислоты добавляют раствор 4,5 г хлорида железа(III) в 5,2 мл воды при перемешивании и охлаждении до 20oС.
Реакционную смесь перемешивают в течение 2 часов, затем разбавляют 50 мл воды, перемешивают еще 1 час и оставляют на ночь. На следующий день осажденный продукт фильтруют и промывают небольшим
количеством этанола.
Таким образом получают 0,75 г (81,0%) названного продукта. Температура плавления (после перекристаллизации из диметилформамида): 246-247oС.
Пример 14
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-(2-гидроксифенил)-1,3,4-тиадиазол
К суспензии 5,18 г (0,015 моль) 1-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-N'-(2-гидроксибензилиден)карботиогидразида в 30 мл тетрагидрофурана добавляют 3,75 г (0,0165 моль) DDQ при перемешивании и охлаждении до 20oС. Суспензию перемешивают при
комнатной температуре в течение еще 1 часа, осажденный продукт фильтруют и промывают тетрагидрофураном.
Таким образом получают 3,04 г (59,7%) чистого названного продукта. Температура плавления: 268-272oС.
Пример 15
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-(2-гидроксифенил)-1,3,4-тиадиазол
К суспензии 6,78 г (0,022 моль)
1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-(2-гидроксибензилиден)карботиогидразида в 50 мл тетрагидрофурана добавляют 5,49 г (0,0242 моль) DDQ при перемешивании и охлаждении до 20oС.
Суспензию перемешивают при комнатной температуре в течение еще 1,5 часов, осажденный продукт фильтруют и промывают тетрагидрофураном.
Таким образом получают 6,17 г (91,6%) чистого названного продукта. Температура плавления: 304-306oС.
Пример 16
2-(5-амино-3-пропилтио-1Н-1,2,4-триазол-1-ил)-5-(2-гидроксифенил)-1,3,4-тиадиазол
К
суспензии 4,04 г (0,012 моль) 1-(5-амино-3-пропилтио-1Н-1,2,4-триазол-1-ил)-N'-(2-гидроксибензилиден)карботиогидразида в 20 мл тетрагидрофурана добавляют 2,95 г (0,013 моль) DDQ при перемешивании и
охлаждении до 20oС. Суспензию перемешивают при комнатной температуре в течение еще 1 часа, осажденный продукт фильтруют и промывают тетрагидрофураном.
Таким образом получают 1,82 г (45,3%) чистого названного продукта. Температура плавления: 224-227oС. Маточный раствор выпаривают досуха, осадок суспендируют в изопропаноле для получения еще 1,05 г (26, 2%) продукта, который идентичен названному соединению. Температура плавления: 221-225oС.
Пример 17
2-(5-амино-3-аллилтио-1Н-1,2,
4-триазол-1-ил)-5-(2-гидроксифенил)-1,3,4-тиадиазол
К суспензии 2,34 г (0,007 моль) 1-(5-амино-3-аллилтио-1Н-1,2,4-триазол-1-ил)-N'-(2-гидроксибензилиден)карботиогидразида в 20 мл
тетрагидрофурана добавляют 1,82 г (0,008 моль) DDQ при перемешивании и охлаждении до 20oС. Суспензию перемешивают при комнатной температуре в течение еще 1 часа, осажденный продукт
фильтруют и промывают тетрагидрофураном и эфиром.
Таким образом получают 1,8 г (77,3%) чистого названного продукта. Температура плавления: 222-224oС. Маточный раствор выпаривают досуха, осадок суспендируют в изопропаноле для получения еще 0,28 г (12,0%) продукта, который идентичен названному соединению. Температура плавления: 222-223oС.
Пример 18
2-(5-амино-3-бензилтио-1Н-1,2,4-триазол-1-ил)-5-(2-гидроксифенил)-1,3,4-тиадиазол
К суспензии 3,08 г (0,008 моль) 1-(5-амино-3-бензилтио-1Н-1,2,
4-триазол-1-ил)-N'-(2-гидроксибензилиден)карботиогидразида в 15 мл тетрагидрофурана добавляют 2,04 г (0,009 моль) DDQ при перемешивании и охлаждении до 20oС. Суспензию перемешивают при
комнатной температуре в течение еще 1 часа, осажденный продукт фильтруют и промывают тетрагидрофураном.
Таким образом получают 1,12 г (36,6%) чистого названного продукта. Температура плавления: 200-202oС. Маточный раствор выпаривают досуха, осадок суспендируют в изопропаноле для получения еще 1,0 г (32,7%) продукта, который идентичен названному соединению. Температура плавления: 198-201oС.
Пример 19
2-(5-амино-3-морфолино-1Н-1,2,4-триазол-1-ил)-5-(2-гидроксифенил)-1,3,4-тиадиазол
К суспензии 1,95 г (0,0085 моль)
1-(5-амино-3-морфолино-1Н-1,2,4-триазол-1-ил)-N'-(2-гидроксибензилиден)карботиогидразида в 30 мл тетрагидрофурана добавляют 2,16 г (0,0095 моль) DDQ при перемешивании и охлаждении до 20oС.
Суспензию перемешивают при комнатной температуре в течение еще 1 часа, осажденный продукт фильтруют и промывают тетрагидрофураном.
Таким образом получают 2,4 г (81,9%) чистого названного продукта. Температура плавления: 265-270oС.
Пример 20
2-/5-амино-3-(4-метилпиперазино)-1Н-1,2,4-триазол-1-ил/-5-(2-гидроксифенил)-1,3,4-тиадиазол
К суспензии 5,95 г (0,0165 моль) 1-/5-амино-3-(4-метилпиперазино)-1Н-1,2,4-триазол-1-ил/-N'-(2-гидроксибензилиден)карботиогидразида в 60 мл тетрагидрофурана добавляют 4,09 г (0,018 моль) DDQ при
перемешивании и охлаждении до 20oС. Суспензию перемешивают при комнатной температуре в течение еще 1 часа, осажденный продукт фильтруют и промывают тетрагидрофураном.
Пример 21
2-(5-амино-3-пропаргилтио-1Н-1,2,4-триазол-1-ил)-5-(2-гидроксифенил)-1,3,4-тиадиазол
К суспензии 2,83 г (0,0085 моль) 1-(5-амино-3-пропаргилтио-1Н-1,2,
4-триазол-1-ил)-N'-(2-гидроксибензилиден)карботиогидразида в 30 мл тетрагидрофурана добавляют 2,13 г (0,0094 моль) DDQ при перемешивании и охлаждении до 20oС. Суспензию перемешивают при
комнатной температуре в течение еще 2 часов, осажденный продукт фильтруют и промывают тетрагидрофураном.
Таким образом получают 1,81 г (64,6%) чистого названного продукта. Температура плавления: 236-240oС.
Пример 22
2-(5-амино-3-н-гексилтио-1Н-1,2,4-триазол-1-ил)-5-(2-гидроксифенил)-1,3,4-тиадиазол
К суспензии 1,59 г (0,0042 моль)
1-(5-амино-3-н-гексилтио-1Н-1,2,4-триазол-1-ил)-N'-(2-гидроксибензилиден)карботиогидразида в 10 мл тетрагидрофурана добавляют 1,07 г (0,0047 моль) DDQ при перемешивании и охлаждении до 20o
С. Суспензию перемешивают при комнатной температуре в течение еще 2 часов, осажденный продукт фильтруют и промывают тетрагидрофураном.
Таким образом получают 1,01 г (63,9%) чистого названного продукта. Температура плавления: 212-214oС.
Пример 23
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламино-2-метилпропокси)-фенил/-1,3,
4-тиадиазола дигидрохлорид моногидрат
14,7 г (0,036 моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-/2-(3-диметиламино-2-метилпропокси)бензилиден/-карботиогидразида растворяют в 40 мл
уксусной кислоты при комнатной температуре. К раствору добавляют 15 мл метанола и к полученной смеси добавляют раствор 43,2 г хлорида железа(III) в 40 мл воды при 25oС при перемешивании и
охлаждении. Реакционную смесь перемешивают в течение 2 часов при комнатной температуре. На следующий день реакционную смесь выпаривают досуха при пониженном давлении, к осадку добавляют 200 мл этанола,
осажденный продукт фильтруют и промывают тщательно дважды метанолом.
Таким образом получают 12,65 г (70,7%) названного продукта. Температура плавления (после перекристаллизации из воды): 244-246oС.
Пример 24
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазола гидрохлорид
К раствору 17,95
г (0,0455 моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)-бензилиден/карботиогидразида в 50 мл уксусной кислоты добавляют раствор 35 г (0,216 моль) хлорида
железа(III) в 35 мл воды при 35oС при перемешивании. Реакционную смесь перемешивают в течение 2 часов при комнатной температуре. Густую реакционную смесь разбавляют 10 мл воды, перемешивают
еще один час и оставляют на ночь. На следующий день осажденный продукт фильтруют. Таким образом получают 15,2 г (78,0%) названного продукта. Температура плавления (после перекристаллизации из воды):
250-252oС.
Пример 25
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол
К суспензии 13,6 г (0,0345 моль)
1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 100 мл тетрагидрофурана добавляют 9,53 г (0,042 моль) DDQ при 25oС при
перемешивании и охлаждении. Затем суспензию перемешивают в течение 6 часов при комнатной температуре. К
реакционной смеси добавляют 300 мл 5% водного раствора гидроксида натрия и перемешивают еще в
течение 0,5 часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 12,65 г (93,5%) названного соединения. Температура плавления (после перекристаллизации из смеси 19 объемов этанола и 1 объема воды): 179-180oС.
Пример 26
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/3-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазола гидрохлорид
К суспензии 13,0 г (0,033 моль) 1-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-N'-/3-(3-диметиламинопропокси)-бензилиден/карботиогидразида в 60 мл уксусной кислоты добавляют раствор 24,3 г (0,09 моль) хлорида железа(III) гексагидрата в 45 мл воды при 25oС при перемешивании. Затем реакционную смесь кипятят в течение 0,5 часа. На следующий день реакционную смесь выпаривают досуха при пониженном давлении. К осадку добавляют 200 мл этанола,
осажденный продукт фильтруют и тщательно промывают.
Таким образом получают 10,8 г (74,5%) названного продукта. Температура плавления (после перекристаллизации из воды): 242-244oС.
Пример 27
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(3-диметиламино-2-метилпропокси)фенил/-1,3,4-тиадиазола гидрохлорид
К суспензии 20,37 г (0,05
моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-/4-(3-диметиламино-2-метилпропокси)-бензилиден/карботиогидразида в 100 мл уксусной кислоты добавляют раствор 54 г (0,09 моль) хлорида железа(III)
гексагидрата в 300 мл воды при 25oС при перемешивании. Затем реакционную смесь перемешивают при комнатной температуре в течение 4 часов. На следующий день осажденный продукт фильтруют и
промывают метанолом.
Таким образом получают 16,9 г (76,5%) названного продукта. Температура плавления (после перекристаллизации из воды): 240-242oС.
Пример
28
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазола гидрохлорид
К суспензии 15,72 г (0,04 моль) 1-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-N'-/4-(3-диметиламинопропокси)-бензилиден/карботиогидразида в 45 мл уксусной кислоты добавляют раствор 26 г (0,09 моль) хлорида железа(III) гексагидрата в 30 мл воды при 25o
С при перемешивании. Затем реакционную смесь кипятят в течение 0,5 часа. На следующий день осажденный продукт фильтруют и промывают метанолом.
Таким образом получают 11,5 г (67,2%) названного продукта. Температура плавления (после перекристаллизации из воды): 267-270oС.
Пример 29
2-(5-амино-3-диметиламино-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 5,86 г (0,015 моль) 1-(5-амино-3-диметиламино-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-димeтилaминoпpoпoкcи)бeнзилидeн/кapбoтиoгидpaзидa в 50 мл тетрагидрофурана добавляют 4,09 г (0,018 моль) DDQ при 25oС при перемешивании и охлаждении. Затем
суспензию перемешивают в течение 3 часов при комнатной температуре. К реакционной смеси добавляют 150 мл 5% водного раствора гидроксида натрия и перемешивают еще в течение 0,5 часа. Осажденный продукт
фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 3,55 г (60,9%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 180-182oС.
Пример 30
2-/5-амино-3-(2-метилэтилтио)-1Н-1,2,
4-триазол-1-ил/-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 2,30 г (0,00545 моль) 1-/5-амино-3-(2-метилэтилтио)-1Н-1,2,
4-триазол-1-ил/-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 15 мл тетрагидрофурана добавляют 1,36 г (0,006 моль) DDQ при 25oС при перемешивании и охлаждении. Затем
суспензию перемешивают в течение 3 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 20 мл 5% водного раствора гидроксида натрия,
смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 2,0 г (87,4%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 161-163oС.
Пример 31
2-/5-амино-3-(4-метилпиперазин-1-ил)-1Н-1,2,4-триазол-1-ил/-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол
К суспензии 5,79 г (0,013 моль) 1-/5-амино-3-(4-метилпиперазин-1-ил)-1Н-1,2,
4-триазол-1-ил/-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 40 мл тетрагидрофурана добавляют 3,41 г (0,015 моль) DDQ при 25oС при перемешивании и охлаждении. Суспензию
перемешивают в течение 5 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 100 мл 5% водного раствора гидроксида натрия, смесь
перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 4,1 г (71,1%) названного соединения. Температура плавления (после перекристаллизации из смеси 1 объема ацетонитрила и 1 объема 2-пропанола): 169-171oС.
Пример 32
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 5,60 г (0,013 моль)
1-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 50 мл тетрагидрофурана добавляют 3,41 г (0,015 моль) DDQ при 25oС при
перемешивании и охлаждении. Суспензию перемешивают в течение 5 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 50 мл 5%
водного раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до
нейтральной реакции и ацетонитрилом.
Таким образом получают 5,1 г (91,7%) названного соединения. Температура плавления (после перекристаллизации из метанола): 179-181oС.
Пример 33
2-(5-амино-3-морфолино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 5,19 г (0,012 моль) 1-(5-амино-3-морфолино-1Н-1,
2,4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 40 мл тетрагидрофурана добавляют 3,18 г (0,014 моль) DDQ при 25oС при перемешивании и охлаждении. Затем
суспензию перемешивают в течение 5 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 50 мл 5% водного раствора гидроксида натрия,
смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции.
Таким образом получают 4,3 г (83,3%) названного соединения. Температура плавления (после перекристаллизации из метанола): 180-182oС.
Пример 34
2-[5-амино-3-/4-(3-хлорфенил)пиперазин-1-ил/-1Н-1,2,4-триазол-1-ил] -5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол
К суспензии 6,78 г (0,0125 моль)
1-[5-амино-3-/4-(хлорфенил)-пиперазин-1-ил/-1Н-1,2,4-триазол-1-ил]-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 60 мл тетрагидрофурана добавляют 3,13 г (0,0138 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию перемешивают в течение 14 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку
добавляют 50 мл 5% водного раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими
порциями воды до нейтральной реакции.
Таким образом получают 5,8 г (85,9%) названного соединения. Температура плавления (после перекристаллизации из смеси 1 объема ацетонитрила и 1 объема тетрагидрофурана): 205-209oС (с разложением).
Пример 35
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/3-(2-диметиламиноэтокси)фенил/-1,3,4-тиадиазол
К суспензии 5,9 г (0,015 моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-/3-(2-диметиламиноэтокси)бензилиден/-карботиогидразида в 50 мл тетрагидрофурана добавляют 3,75 г (0,0165 моль) DDQ
при 25oС при перемешивании и охлаждении. Затем суспензию перемешивают в течение 8 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к
осадку добавляют 50 мл 5% водного раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими
порциями воды до нейтральной реакции.
Таким образом получают 4,3 г (76,0%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 162-163o С.
Пример 36
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(2-диэтиламиноэтокси)фенил/-1,3,4-тиадиазол
К суспензии 10,54 г (0,025 моль)
1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-/4-(2-диэтиламиноэтокси)бензилиден/карботиогидразида в 100 мл тетрагидрофурана добавляют 6,81 г (0,03 моль) DDQ при 25oС при перемешивании и
охлаждении. Затем суспензию перемешивают в течение 8 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 50 мл 5% водного раствора
гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции.
Таким образом получают 8,05 г (79,5%) названного соединения. Температура плавления (после перекристаллизации из смеси 1 объема ацетонитрила и 1 объема 2-пропанола): 163-164o С.
Пример 37
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(2-диметиламиноэтокси)фенил/-1,3,4-тиадиазол
К суспензии 9,11 г (0,024 моль)
1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-/4-(2-диметиламиноэтокси)бензилиден/карботиогидразида в 100 мл тетрагидрофурана добавляют 6,02 г (0,0265 моль) DDQ при 25oС при перемешивании
и охлаждении. Затем суспензию перемешивают в течение 4 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 75 мл 5% водного
раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной
реакции.
Таким образом получают 6,0 г (66,3%) названного соединения. Температура плавления (после перекристаллизации из смеси 1 объема воды и 1 объема 2-пропанола): 183-184o С.
Пример 38
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[2-/3-(4-(метилпиперазин-1-ил)-пропокси/фенил]-1,3,4-тиадиазол
К суспензии 4,93 г (0,011 моль)
1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-[2-/3-(4-метилпиперазин-1-ил)пропокси/бензилиден]карботиогидразида в 30 мл тетрагидрофурана добавляют 2,95 г (0,013 моль) DDQ при 25oС при
перемешивании и охлаждении. Затем суспензию перемешивают в течение 6 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 50 мл 5%
водного раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до
нейтральной реакции и ацетонитрилом.
Таким образом получают 3,98 г (81,1%) названного соединения. Температура плавления (после перекристаллизации из этанола): 177-178oС.
Пример 39
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-пиперидинопропокси)фенил/-1,3,4-тиадиазол
К суспензии 6,59 г (0,0152 моль) 1-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-пиперидинопропокси)бензилиден/карботиогидразида в 50 мл тетрагидрофурана добавляют 4,09 г (0,018 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают в течение 5 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 50 мл 5% водного раствора гидроксида натрия, смесь
перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 6,04 г (93,3%) названного соединения. Температура плавления (после перекристаллизации из смеси 1 объема этанола и 1 объема ацетонитрила): 185-186oС.
Пример 40
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(2-диметиламиноэтокси)фенил/-1,3,4-тиадиазол
К суспензии 8,01 г (0,021 моль) 1-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-N'-/2-(2-диметиламиноэтокси)бензилиден/карботиогидразида в 40 мл тетрагидрофурана добавляют 5,45 г (0,024 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают в течение 5 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 80 мл 5% водного раствора гидроксида натрия, смесь
перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 7,24 г (91,3%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 193-195oС.
Пример 41
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-морфолинопропокси)фенил/-1,3,4-тиадиазол
К суспензии 6,53 г (0,015 моль) 1-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-морфолинопропокси)бензилиден/карботиогидразида в 50 мл тетрагидрофурана добавляют 4,09 г (0,018 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают в течение 13 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 80 мл 5% водного раствора гидроксида натрия, смесь
перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 5,68 г (87,4%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 205-206oС.
Пример 42
2-/5-амино-3-(4-хлорбензилтио)-1Н-1,2,4-триазол-1-ил/-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол
К суспензии 4,53 г (0,009 моль) 1-/5-амино-3-(4-хлорбензилтио)-1Н-1,2,
4-триазол-1-ил/-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 25 мл тетрагидрофурана добавляют 2,45 г (0,0108 моль) DDQ при 25oС при перемешивании и охлаждении. Затем
суспензию перемешивают в течение 13 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 20 мл 5% водного раствора гидроксида
натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и
ацетонитрилом.
Таким образом получают 4,19 г (92,9%) названного соединения. Температура плавления (после перекристаллизации из смеси 1 объема н-бутанола и 1 объема ацетонитрила): 183-184oС.
Пример 43
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-пирролидинопропокси)фенил/-1,3,4-тиадиазол
К суспензии 9,02 г (0,0215 моль)
1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-/2-(3-пирролидинопропокси)бензилиден/карботиогидразида в 70 мл тетрагидрофурана добавляют 5,61 г (0,025 моль) DDQ при 25oС при перемешивании
и охлаждении. Затем суспензию перемешивают в течение 21 часа при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 20 мл 5% водного
раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной
реакции и ацетонитрилом.
Таким образом получают 8,34 г (93%) названного соединения. Температура плавления (после перекристаллизации из смеси 1 объема этанола и 1 объема ацетонитрила): 169,5-171oС.
Пример 44
2-(5-амино-3-пирролидино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол
К суспензии 10,0 г (0,024 моль)
1-(5-амино-3-пирролидино-1Н-1,2,4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 80 мл тетрагидрофурана добавляют 6,13 г (0,027 моль) DDQ при 25oС при
перемешивании и охлаждении. Затем суспензию перемешивают в течение 21 часа при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 80 мл 5%
водного раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до
нейтральной реакции и ацетонитрилом.
Таким образом получают 8,92 г (89,7%) названного соединения. Температура плавления (после перекристаллизации из смеси 1 объема н-бутанола и 1 объема ацетонитрила): 209-211oС.
Пример 45
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[2-/3-ди(2-метилэтил)аминопропокси)фенил]-1,3,4-тиадиазол
К
суспензии 7,19 г (0,016 моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-[2-/3-ди(2-метилэтил)аминопропокси/бензилиден]карботиогидразида в 40 мл тетрагидрофурана добавляют 4,09 г (0,018 моль) DDQ
при 25oС при перемешивании и охлаждении. Затем суспензию перемешивают в течение 6 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к
осадку добавляют 50 мл 5% водного раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими
порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 5,60 г (78,2%) названного соединения. Температура плавления (после перекристаллизации из смеси 1 объема этанола и 1 объема ацетонитрила): 177-178oС.
Пример 46
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диэтиламинопропокси)фенил/-1,3,4-тиадиазол
К
суспензии 7,59 г (0,018 моль) 1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-/2-(3-диэтиламинопропокси)бензилиден/карботиогидразида в 70 мл тетрагидрофурана добавляют 4,54 г (0,020 моль) DDQ при
25oС при перемешивании и охлаждении. Затем суспензию перемешивают в течение 22 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к
осадку добавляют 60 мл 5% водного раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими
порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 5,83 г (77,2%) названного соединения. Температура плавления (после перекристаллизации из 2-пропанола): 142-144oС.
Пример 47
2-/5-амино-3-(4-метилпиперазин-1-ил)-1Н-1,2,4-триазол-1-ил/-5-/4-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол
К суспензии 8,51 г (0,
0185 моль) 1-/5-амино-3-(4-метилпиперазин-1-ил)-1Н-1,2,4-триазол-1-ил/-N'-/4-(3-диметиламинопропокси)бензилиден/карботиогидразида в 50 мл тетрагидрофурана добавляют 4,65 г (0,0205 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию перемешивают в течение 6 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку
добавляют 60 мл 5% водного раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими
порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 6,12 г (72,3%) названного соединения. Температура плавления (после перекристаллизации из смеси 1 объема 2-пропанола и 1 объема ацетонитрила): 172-174oС.
Пример 48
2-(3,5-диамино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол
К
суспензии 5,64 г (0,0155 моль) 1-(3,5-амино-1-ил)-1Н-1,2,4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 40 мл тетрагидрофурана добавляют 3,86 г (0,017 моль) DDQ при
25oС при перемешивании и охлаждении. Затем суспензию перемешивают в течение 5 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку
добавляют 50 мл 5% водного раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими
порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 4,22 г (75,6%) названного соединения, которое затем суспендируют в 15 мл ацетонитрила и интенсивно перемешивают в течение 2 часов. Кристаллы фильтруют и тщательно промывают ацетонитрилом. Таким образом получают 3,57 г чистого продукта. Температура плавления: 217-222oС.
Пример 49
2-(5-амино-3-диаллиламино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол
К суспензии 5,98 г (0,0135 моль) 1-(5-амино-3-диаллиламино-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 30 мл тетрагидрофурана добавляют 3,41 г (0,015 моль) DDQ при 25oС при перемешивании и охлаждении. Затем
суспензию перемешивают в течение 4 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 50 мл 5% водного раствора гидроксида натрия,
смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 4,24 г (71,3%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н): 136-140oС.
Пример 50
2-(5-амино-3-пропилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол
К суспензии 2,95 г (0,007 моль) 1-(5-амино-3-пропилтио-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 20 мл тетрагидрофурана добавляют 1,75 г (0,0077 моль) DDQ при 25oС при перемешивании и охлаждении. Затем
суспензию перемешивают в течение часа при комнатной температуре. Осажденный продукт фильтруют, добавляют к 30 мл 5% водного раствора гидроксида натрия и перемешивают в течение 2 часов при комнатной
температуре. Нерастворимую часть фильтруют, промывают водой и затем тетрагидрофураном.
Таким образом получают 2,32 г (79,2%) названного соединения. Температура плавления: 147-150oС.
Пример 51
2-(5-амино-3-диаллиламино-1Н-1,2,4-триазол-1-ил)-5-/3-(3-диметиламино-2-метилпропокси)фенил/-1,3,4-тиадиазол
К суспензии 4,57 г (0,01 моль)
1-(5-амино-3-диаллиламино-1Н-1,2,4-триазол-1-ил)-N'-/3-(3-диметиламино-2-метилпропокси)бензилиден/карботиогидразида в 25 мл тетрагидрофурана добавляют 2,50 г (0,011 моль) DDQ при 25oС при
перемешивании и охлаждении. Затем суспензию перемешивают в течение 3 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 40 мл 5%
водного раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до
нейтральной реакции.
Таким образом получают 3,92 г (86,3%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н): 135-137oС.
Пример 52
2-(5-амино-3-диаллиламино-1Н-1,2,4-триазол-1-ил)-5-/4-(3-диметиламино-2-метилпропокси)фенил/-1,3,4-тиадиазол
К суспензии 4,57 г (0,01 моль)
1-(5-амино-3-диаллиламино-1Н-1,2,4-триазол-1-ил)-N'-/4-(3-диметиламино-2-метилпропокси)бензилиден/карботиогидразида в 25 мл тетрагидрофурана добавляют 2,50 г (0,011 моль) DDQ при 25oС при
перемешивании и охлаждении. Затем суспензию перемешивают в течение 3 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 50 мл 5%
водного раствора гидроксида натрия, смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до
нейтральной реакции. Продукт растворяют в хлороформе, полученный раствор промывают насыщенным водным раствором хлорида натрия, сушат и выпаривают досуха.
Таким образом получают 3,63 г (79,8%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 105-107oС.
Пример 53
2-(5-амино-3-диаллиламино-1H-1,2,4-триазол-1-ил)-5-/3-(3-диметиламино-2-метилпропокси)фенил/-1,3,4-тиадиазол
К суспензии 4,57 г (0,01 моль) 1-(5-амино-3-диаллиламино-1Н-1,2,
4-триазол-1-ил)-N'-/3-(3-диметиламино-2-метилпропокси)бензилиден/карботиогидразида в 25 мл тетрагидрофурана добавляют 2,50 г (0,011 моль) DDQ при 25oС при перемешивании и охлаждении. Затем
суспензию перемешивают в течение 3 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 40 мл 5% водного раствора гидроксида натрия,
смесь перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции.
Таким образом получают 4,0 г (79,8%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 130-132oС.
Пример 54
2-(5-амино-3-диаллиламино-1Н-1,2,4-триазол-1-ил)-5-/2-(2-диэтиламиноэтокси)-фенил/-1,3,4-тиадиазол
К суспензии 4,57 г (0,01 моль) 1-(5-амино-3-диаллиламино-1Н-1,2,
4-триазол-1-ил)-N'-/2-(2-диэтиламиноэтокси)бензилиден/карботиогидразида в 25 мл тетрагидрофурана добавляют 2,50 г (0,011 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают в течение 2 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 50 мл 5% водного раствора гидроксида натрия, смесь
перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции.
Таким образом получают 3,84 г (84,4%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н): 124-126oС.
Пример 55
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(2-диметиламиноэтокси)-фенил/-1,3,4-тиадиазол
К суспензии 7,50 г (0,018 моль) 1-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-N'-/2-(2-диметиламиноэтокси)бензилиден/карботиогидразида в 50 мл тетрагидрофурана добавляют 4,54 (0,02 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают в течение 5 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 100 мл 5% водного раствора гидроксида натрия, смесь
перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции.
Таким образом получают 6,75 г (81,4%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 189-191oС.
Пример 56
2-(5-амино-3-диаллиламино-1Н-1,2,4-триазол-1-ил)-5-/2-(2-диметиламиноэтокси)-фенил/-1,3,4-тиадиазол
К суспензии 4,28 г (0,01 моль) 1-(5-амино-3-диаллиламино-1Н-1,2,
4-триазол-1-ил)-N'-/2-(2-диметиламиноэтокси)бензилиден/карботиогидразида в 45 мл тетрагидрофурана добавляют 2,50 (0,011 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают в течение 3 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 50 мл 5% водного раствора гидроксида натрия, смесь
перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции.
Таким образом получают 3,8 г (89,0%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н): 138-140oС.
Пример 57
2-(5-амино-3-аллилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 3,78 г (0,009 моль) 1-(5-амино-3-аллилтио-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 20 мл тетрагидрофурана добавляют 2,27 (0,01 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают в течение часа при комнатной температуре. Осажденный продукт фильтруют, добавляют к 30 мл 5% водного раствора гидроксида натрия, смесь перемешивают при комнатной температуре в течение 2
часов. Нерастворимую часть фильтруют, промывают водой и затем тетрагидрофураном.
Таким образом получают 2,98 г (79,5%) названного соединения. Температура плавления: 169-172o С.
Пример 58
2-(5-амино-3-бензилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 3,76 г (0,008 моль)
1-(5-амино-3-бензилтио-1Н-1,2,4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 20 мл тетрагидрофурана добавляют 2,04 (0,009 моль) DDQ при 25oС при перемешивании
и охлаждении. Затем суспензию перемешивают в течение часа при комнатной температуре. Осажденный продукт фильтруют, добавляют к 30 мл 5% водного раствора гидроксида натрия, смесь перемешивают при
комнатной температуре в течение 2 часов. Нерастворимую часть фильтруют, промывают водой и затем тетрагидрофураном.
Таким образом получают 2,76 г (73,8%) названного соединения. Температура плавления: 189-191oС.
Пример 59
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(2-диаллиламиноэтокси)-фенил/-1,3,4-тиадиазол
Смесь 4,50 г
(0,01 моль) 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 15 мл диаллиламина перемешивают при 120oС в течение 3 часов. Из полученного расплава
выпаривают избыток амина при пониженном давлении, к остатку добавляют 70 мл воды и оставляют для кристаллизации. Полученные кристаллы фильтруют, промывают водой и затем ацетонитрилом.
Таким образом получают 4,16 г (89,2%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 148-150oС.
Пример 60
2-(5-амино-3-н-гексилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 0,99 г (0,0036 моль)
1-(5-амино-3-н-гексилтио-1Н-1,2,4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 10 мл тетрагидрофурана добавляют 0,83 (0,004 моль) DDQ при
25oС при
перемешивании и охлаждении. Затем суспензию перемешивают в течение 2 часов при комнатной температуре. Реакционную смесь выпаривают досуха, осадок суспендируют в небольшом количестве этилацетата,
фильтруют и промывают этилацетатом.
Таким образом получают 0,94 г (56,6%) названного соединения. Температура плавления: 114-117oС.
Пример 61
2-(5-бензиламино-3-метилэтилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 5,11 г (0,01 моль) 1-(5-бензиламино-3-метилэтилтио-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 50 мл тетрагидрофурана добавляют 2,73 (0,012 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают еще час при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 30 мл 5% водного раствора гидроксида натрия, смесь перемешивают
в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким
образом получают 4,88 г (95,8%) названного соединения. Температура плавления: 101-102oС
Пример 62
2-(5-бензиламино-3-амино-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 1,81 г (0,004 моль) 1-(5-бензиламино-3-амино-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 15 мл тетрагидрофурана добавляют 1,02 (0,0045 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают еще 4 часа при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 30 мл 5% водного раствора гидроксида натрия, смесь
экстрагируют дихлорметаном. Органическую фракцию экстрагируют 5% водным раствором гидроксида натрия и промывают несколькими порциями воды до нейтральной реакции, затем выпаривают растворитель.
Таким образом получают 1,1 г (61,0%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 180-183oС.
Пример 63
2-(5-амино-3-бензиламино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 3,3 г (0,0073 моль) 1-(5-амино-3-бензиламино-3-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 35 мл тетрагидрофурана добавляют 1,84 (0,0081 моль) DDQ при 25oС при перемешивании и охлаждении, Затем суспензию
перемешивают еще 5 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 30 мл 5% водного раствора гидроксида натрия, осажденный
продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции.
Таким образом получают 3,12 г (94,8%) названного соединения. Температура плавления (после перекристаллизации из смеси 1 объема ацетонитрила и 1 объема этанола): 172-173oС.
Пример 64
2-/5-(4-хлорбензиламино)-3-метилтио-1Н-1,2,4-триазол-1-ил/-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 5,18 г (0,01 моль) 1-/5-(4-хлорбензиламино)-3-метилтио-1Н-1,
2.4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 50 мл тетрагидрофурана добавляют 2,73 (0,012 моль) DDQ при 25oС при перемешивании и охлаждении. Затем
суспензию перемешивают еще час при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 30 мл 5% водного раствора гидроксида натрия, смесь
перемешивают в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 4,65 г (90,1%) названного соединения. Температура плавления: 133-134oС.
Пример 65
2-/5-(4-хлорбензиламино)-3-метилэтилтио-1Н-1,2,
4-триазол-1-ил/-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 2,73 г (0,005 моль) 1-/5-(4-хлорбензиламино)-3-метилэтилтио-1Н-1,2,
4-триазол-1-ил/-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 30 мл тетрагидрофурана добавляют 1,50 (0,006 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают еще час при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси при пониженном давлении, к осадку добавляют 30 мл 5% водного раствора гидроксида натрия, смесь перемешивают
в течение одного часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 2,20 г (88,1%) названного соединения. Температура плавления: 104-105oС.
Пример 66
2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/4-(2-диаллиламиноэтокси)-фенил/-1,3,4-тиадиазол
Смесь 3,60 г (0,008 моль) 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/4-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 7,77 г
(9,9 мл, 0,08 моль) диаллиламина перемешивают при 120oС в течение 3 часов. Полученный раствор кристаллизуют при охлаждении. Добавляют 30 мл эфира к реакционной смеси, которую перемешивают в
течение 30 минут. Полученные кристаллы фильтруют, промывают эфиром и затем ацетонитрилом.
Таким образом получают 3,11 г (83,3%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 163-166oС.
Пример 67
2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/2-(4-ди-н-бутиламинобутокси)-фенил/-1,3,4-тиадиазол
Смесь 0,465 г (0,001 моль) 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(4-бромбутокси)фенил/-1,3,4-тиадиазола и
1,29 г (0,01 моль) ди-н-бутиламина перемешивают при 120oС в течение 2 часов. Добавляют 5 мл воды к реакционной смеси, которую перемешивают в течение 30 минут. Полученные кристаллы фильтруют,
промывают эфиром и затем ацетонитрилом.
Таким образом получают 0,40 г названного соединения, которое подвергают хроматографии в слое Kieselgel 60 Н и затем перекристаллизовывают из ацетонитрила. Выход: 0,33 г (64,3%). Температура плавления: 148-150oС.
Пример 68
2-(5-амино-3-пропаргилтио-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол
К суспензии 3,34 г (0,008 моль) 1-(5-амино-3-пропаргилтио-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 20 мл тетрагидрофурана добавляют 2,0 (0,088 моль) DDQ при 25oС при перемешивании и охлаждении. Осажденный
продукт фильтруют и добавляют к 30 мл 5% (г/мл) водного раствора гидроксида натрия, смесь перемешивают при комнатной температуре в течение 2 часов. Нерастворимую часть фильтруют, промывают 5% водным
раствором гидроксида натрия, водой и тетрагидрофураном.
Таким образом получают 1,86 г (56,0%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 181-183oС.
Пример 69
2-/5-амино-3-(2-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-[3-/3-(4-фенилпиперазин-1-ил)пропокси/фенил]-1,3,
4-тиадиазол
Смесь 4,35 г (0,01 моль) 2-/5-амино-3-(2-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-/3-(3-бромпропокси)/фенил-1,3,4-тиадиазола и 4,98 г (0,03 моль) 4-фенилпиперазина перемешивают при
150oС в течение 0,5 часа. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, полученные кристаллы фильтруют.
Таким образом получают 3,35 г (74,0%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 141-143oС.
Пример 70
2-/5-амино-3-(2-метилтио)-1Н-1,2,4-триазол-1-ил/-5-{ 2-[3-/4-(2-метоксифенил)-пиперазин-1-ил/пропокси]фенил}-1,3,4-тиадиазол
Смесь 4,07 г (0,01 моль) 2-/5-амино-3-(2-метилтио)-1Н-1,2,
4-триазол-1-ил/-5-/2-(3-бромпропокси)/фенил-1,3,4-тиадиазола и 5,88 г (0,03 моль) 4-(2-метоксифенил)-пиперазина перемешивают при 180oС в течение 0,5 часа. После охлаждения к реакционной
смеси добавляют по каплям 40 мл воды, полученные кристаллы фильтруют.
Таким образом получают 3,80 г (79,0%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 159-161oС.
Пример 71
2-/5-амино-3-(2-метилэтилтио)-1Н-1,2,
4-триазол-1-ил/-5-[2-/3-(4-фенилпиперазин-1-ил)пропокси/фенил]-1,3,4-тиадиазол
Смесь 4,35 г (0,01 моль) 2-/5-амино-3-(2-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-/2-(3-бромпропокси)/фенил-1,3,
4-тиадиазола и 4,98 г (0,03 моль) 4-фенилпиперазина перемешивают при 160oС в течение 0,5 часа. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, полученные кристаллы
фильтруют.
Таким образом получают 3,55 г (74,0%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 212-214oС.
Пример 72
2-/5-амино-3-(2-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-{ 2-[3-/4-(2-метоксифенил)-пиперазин-1-ил/пропокси]фенил}-1,3,4-тиадиазол
Смесь 4,35 г (0,01 моль) 2-/5-амино-3-(2-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-/2-(3-бромпропокси)/фенил-1,3,4-тиадиазола и 5,88 г (0,03 моль) 4-(2-метоксифенил)-пиперазина перемешивают при 160oС в течение 0,5 часа. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, полученные кристаллы фильтруют.
Таким образом получают 4,28 г (84,0%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 159-160oС.
Пример 73
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/3-метокси-2-(3-морфолинопропокси)-фенил/-1,3,4-тиадиазол
Смесь 3,96 г (0,008 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/3-метокси-2-(3-бромпропокси)/фенил-1,3,4-тиадиазола и 15 г (0,172 моль) морфолина перемешивают при 140oС в течение 10 часов. После охлаждения избыток морфолина отгоняют
при пониженном давлении, к остатку добавляют по каплям 40 мл воды, полученные кристаллы фильтруют.
Таким образом получают 3,40 г (85%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 160-163oС.
Пример 74
2-(5-бензиламино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-диметиламино)-пропоксифенил/-1,3,4-тиадиазол
К суспензии 5,20 г (0,010 моль) 2-(5-бензиламино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 40 мл тетрагидрофурана добавляют 2,5 (0,011 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают еще 4 час при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси выпариванием при пониженном давлении, осадок очищают хроматографией на колонке, заполненной Киеселгелем Н
(Kieselgel Н).
Таким образом получают 4,09 г (78,5%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 100-101oС.
Пример 75
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/3-2-(3-диаллиламиноэтокси)-фенил/-1,3,4-тиадиазол
Смесь 4,50 г (0,01 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/3-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 9,72 г (0,1 моль) диаллиламина перемешивают при 120oС в течение 1,5 часов. Полученный раствор кристаллизуется при охлаждении.
Добавляют 30 мл эфира к реакционной смеси, которую перемешивают в течение 30 минут. Полученные кристаллы фильтруют, промывают эфиром и затем ацетонитрилом.
Таким образом получают 3,65 г (78,3%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 128-131oС.
Пример 76
2-(5-амино-3-диэтиламино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламино)пропоксифенил/-1,3,4-тиадиазол
К суспензии 3,36 г (0,08 моль) 2-(5-амино-3-диэтиламино-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 25 мл тетрагидрофурана добавляют 2,0 (0,0088 моль) DDQ при 25oС при перемешивании и охлаждении. Затем суспензию
перемешивают еще 3 часа при комнатной температуре. К реакционной смеси добавляют 40 мл 5% водного раствора гидроксида натрия, смесь перемешивают в течение 0,5 часа. Осажденный продукт фильтруют,
промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 2,8 г (84,1%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 159-160oС.
Пример 77
2-(5-амино-3-гептаметиленимино-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-диметиламино)-пропоксифенил/-1,3,4-тиадиазол
К суспензии 6,19 г (0,0135 моль) 2-(5-амино-3-гептаметиленимино-1Н-1,2,
4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 30 мл тетрагидрофурана добавляют 3,41 г (0,015 моль) DDQ при 25oС при перемешивании и охлаждении. Затем
суспензию перемешивают еще 5 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси выпариванием при пониженном давлении, к остатку добавляют 50 мл 5% водного раствора
гидроксида натрия, смесь перемешивают еще в течение часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и
ацетонитрилом.
Таким образом получают 5,05 г (81,9%) названного соединения. Температура плавления (после перекристаллизации из метанола): 164-167oС.
Пример
78
2-/5-амино-3-(4-метилпиперазин-1-ил)-1Н-1,2,4-триазол-1-ил/-5-/2-(3-диметиламино)-2-метилпропоксифенил/-1,3,4-тиадиазол
К раствору 15,72 г (0,0339 моль)
2-(5-амино-3-(4-метилпиперазин-1-ил)-1Н-1,2,4-триазол-1-ил/-N'-/2-(3-диметиламино-2-метилпропокси)-бензилиден/карботиогидразида в 100 мл уксусной кислоты добавляют раствор 26 г (0,09 моль) хлорида
железа(III) в 30 мл воды при 25oС и охлаждении, затем реакционную смесь перемешивают при комнатной температуре в течение 3 часов. К реакционной смеси добавляют 100 мл изопропанола,
осажденный продукт фильтруют и промывают тщательно изопропанолом.
Таким образом получают 21,1 г гидрохлорида названного продукта, к которому добавляют 200 мл хлороформа и 30 мл триэтиламина, раствор дважды экстрагируют, используя по 100 мл воды, сушат над безводным сульфатом натрия, растворитель отгоняют.
Таким образом получают 8,5 г (49,9%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 170-172oС.
Пример 79
2-(5-амино-3-диаллиламино-1Н-1,2,
4-триазол-1-ил)-5-/4-(3-диметиламино)-пропоксифенил/-1,3,4-тиадиазол
К суспензии 5,53 г (0,0125 моль) 2-(5-амино-3-диаллиламино-1Н-1,2,
4-триазол-1-ил)-N'-/4-(3-диметиламинопропокси)бензилиден/карботиогидразида в 30 мл тетрагидрофурана добавляют 3,18 г (0,014 моль) DDQ при 25oС при перемешивании и охлаждении. Затем
суспензию перемешивают еще 4 часа при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси выпариванием при пониженном давлении, к остатку добавляют 50 мл 5% водного раствора гидроксида
натрия, смесь перемешивают еще в течение часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 3,72 г (67,5%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н): 138-141oС.
Пример 80
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/4-(3-диметиламино)-пропоксифенил/-1,3,4-тиадиазол
К суспензии 4,3 г (0,01 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-N'-/4-(3-диметиламинопропокси)бензилиден/карботиогидразида в 25 мл тетрагидрофурана добавляют 2,50 г (0,011 моль) DDQ при 25oС при перемешивании и охлаждении. Затем
суспензию перемешивают еще 5 часов при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси выпариванием при пониженном давлении, к остатку добавляют 30 мл 5% водного раствора
гидроксида натрия, смесь перемешивают еще в течение часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до нейтральной реакции и
ацетонитрилом.
Таким образом получают 3,28 г (76,6%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 185-189oС.
Пример 81
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-[2-/3-(4-метилпиперидин-1-ил)-пропокси/фенил]-1,3,4-тиадиазол
Смесь 3,25 г (0,007 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил-1,3,4-тиадиазола и 11,4 г (0,115 моль) 4-метилпиперидина перемешивают при 130oС в течение 2 часов. После охлаждения избыток 4-метилпиперидина
отгоняют при пониженном давлении, к остатку добавляют по каплям 40 мл воды, полученные кристаллы фильтруют.
Таким образом получают 3,22 г (95,3%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 155-159oС.
Пример 82
2-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-гептаметиленимин-1-ил-пропокси)фенил/-1,3,4-тиадиазол
Смесь 2,56 г (0,006 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил-1,3,
4-тиадиазола и 9,92 г (0,0883 моль) гептаметиленимина перемешивают при 120oС в течение 3 часов. После охлаждения избыток гептаметиленимина отгоняют при пониженном давлении, к остатку
добавляют по каплям 40 мл воды, полученные кристаллы фильтруют.
Таким образом получают 1,7 г (61,6%) названного соединения. Температура плавления (после перекристаллизации из ацетонитрила): 152-157oС.
Пример 83
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-гептаметиленимин-1-ил-пропокси)фенил/-1,3,4-тиадиазола гидрохлорид
0,46 г (0,001 моль) основания 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-гептаметиленимин-1-ил-пропокси)фенил/-1,3,4-тиадиазола, полученного, как описано в Примере 82, растворяют в 20 мл
метанола, к раствору добавляют 5 мл этанола, содержащего 20 вес./об.% хлористого водорода. После охлаждения полученные кристаллы фильтруют и промывают холодным этанолом.
Таким образом получают 0,44 г (88,6%) названного соединения. Температура плавления: 182-186oС.
Пример 84
2-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-тиоморфолинопропокси)фенил/-1,3,4-тиадиазол
Смесь 3,43 г (0,008 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 6,38
г (0,062 моль) тиоморфолина перемешивают при 120oС в течение 8 часов. После охлаждения избыток тиоморфолина отгоняют при пониженном давлении, к остатку добавляют по каплям 40 мл воды,
полученные кристаллы фильтруют.
Таким образом получают 3,32 г (92,3%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из тетрагидрофурана): 196-199oС.
Пример 85
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол
1,71 г (0,004
моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазола, полученного, как описано в Примере 28, суспендируют в 100 мл хлороформа. К суспензии добавляют
2 мл триэтиламина и перемешивают 5 минут. Затем добавляют 50 мл воды, фазы разделяют, органическую фазу экстрагируют другой порцией воды, сушат и выпаривают досуха. Остаток очищают хроматографией в
слое Киеселгеля 60 Н и перекристаллизовывают из ацетонитрила.
Таким образом получают 1,46 г (93,2%) названного основания. Температура плавления: 192-193oС.
Пример 86
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол
2,19 г (0,004 моль) тетрабутиламмонийной соли 2-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-5-(2-гидроксифенил)-1,3,4-тиадиазола растворяют в 15 мл ацетонитрила при 80oС, к полученному раствору добавляют 3,94 мл (0,01 моль) раствора 3-диметиламинопропилхлорида в
гексане с концентрацией 40 вес. /об. % при перемешивании. Реакционную смесь перемешивают при 100oС 1 час. После охлаждения реакционную смесь выпаривают досуха при пониженном давлении,
осадок растворяют в хлороформе, экстрагируют 1N раствором гидроксида натрия, затем водой, сушат над безводным сульфатом натрия и выпаривают досуха.
Таким образом получают 1,05 г (67%) названного основания. Температура плавления (после хроматографии в слое Киеселгеля 60 Н): 177-179oС.
Пример 87
2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/2-(4-морфолинобутокси)фенил/-1,3,4-тиадиазол
Смесь 0,48 г (0,001 моль) 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(4-бромбутокси)фенил/-1,3,4-тиадиазола и 0,87 г
(0,01 моль) морфолина перемешивают при 100oС в течение 0,5 часа. К реакционной смеси добавляют 5 мл воды, смесь перемешивают 30 минут. Полученные кристаллы фильтруют, промывают эфиром и
ацетонитрилом.
Таким образом получают 0,42 г (86,6%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 148-150oС.
Пример 88
2-(5-бензиламино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламино)-пропоксифенил/-1,3,4-тиадиазол
К суспензии 4,56 г (0,01
моль) 2-(5-бензиламино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-/2-(3-диметиламинопропокси)бензилиден/карботиогидразида в 50 мл тетрагидрофурана добавляют 2,73 г (0,012 моль) DDQ при 25oС при
перемешивании и охлаждении. Затем суспензию перемешивают еще час при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси выпариванием при пониженном давлении, к остатку добавляют 30 мл
5% водного раствора гидроксида натрия, смесь перемешивают еще в течение часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими порциями воды до
нейтральной реакции и ацетонитрилом.
Таким образом получают 4,20 г (87,2%) названного соединения. Температура плавления: 127-128oС.
Пример 89
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/3-метокси-4-(3-морфолино-пропокси)фенил/-1,3,4-тиадиазол
Смесь 0,49 г (0,001 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/3-метокси-4-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 1,0 г (0,0115 моль) морфолина перемешивают при 100oС в течение 2 часов. После охлаждения избыток морфолина отгоняют
при пониженном давлении, к остатку добавляют по каплям 40 мл воды. Полученные кристаллы фильтруют, промывают 5 вес./об.% раствором гидроксида натрия, водой и ацетонитрилом.
Таким образом получают 0,21 г (42%) названного соединения, которые очищают хроматографией в слое Kieselgel 60 Н и перекристаллизацией из ацетонитрила.
Пример 90
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{ 2-[2-/2-этил-2-(2-гидроксиэтил)амино/этокси]фенил}-1,3,4-тиадиазол
Смесь 4,50 г (0,01 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/2-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 10 мл этиламиноэтанола перемешивают при 120oС в течение 3 часов. К полученному расплаву добавляют 30 мл воды, продукт оставляют
для кристаллизации. После охлаждения выделенные кристаллы фильтруют, промывают водой и ацетонитрилом.
Таким образом получают 4,19 г (91,4%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 169-172oС.
Пример 91
2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-[2-/2-(2-морфолиноэтил)-амино/-этокси]фенил-1,3,4-тиадиазол
Смесь 4,50 г (0,01 моль) 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(2-бромэтокси)фенил/-1,3,
4-тиадиазола и 13 г (0,1 моль) 2-аминоэтилморфолина перемешивают при 120oС в течение 3 часов. К полученному расплаву добавляют 30 мл воды, продукт оставляют для кристаллизации. После
охлаждения выделенные кристаллы фильтруют, промывают водой и ацетонитрилом.
Таким образом получают 4,52 г (90,5%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 162-164oС.
Пример 92
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{
2-[2-/2-бис(2-гидроксиэтил)-амино/этокси]фенил}-1,3,4-тиадиазол
Смесь 4,50 г (0,01 моль) 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 10 мл
диэтаноламина перемешивают при 120oС в течение 3 часов. К реакционной смеси добавляют 50 мл воды, продукт оставляют для кристаллизации. После охлаждения выделенные кристаллы фильтруют,
промывают водой и ацетонитрилом.
Таким образом получают 4,42 г (93,2%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 181-184oС.
Пример 93
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{ 2-[2-/2-(3,4-диметоксифенил)этиламино/этокси]фенил}-1,3,4-тиадиазол
Смесь 4,50 г (0,01 моль) 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 9,4 г N-метил-N-/2-(3,4-диметоксифенил)этил/амина перемешивают при 120oС
в течение 1 часа. Избыток амина выпаривают из реакционной смеси при пониженном давлении, к остатку добавляют 40 мл воды, смесь оставляют для кристаллизации. Полученные кристаллы фильтруют, промывают
водой и диэтиловым эфиром.
Таким образом получают 4,01 г (71,0%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 104-106oС.
Пример 94
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{ 4-[2-/2-этил-2-(гидроксиэтил)-амино/этокси]фенил}-1,3,4-тиадиазол
Смесь 3,60 г (0,008 моль) 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 7,13 г (7,8 мл, 0,08 моль) этиламиноэтанола перемешивают при 120oС в
течение 1 часа. К полученному расплаву добавляют 40 мл воды, продукт оставляют для кристаллизации. После охлаждения выделенные кристаллы фильтруют, промывают водой и ацетонитрилом.
Таким образом получают 3,45 г (94,2%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 181-184oС.
Пример 95
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{ 4-[2-/бис(2-гидроксиэтил)амино/-этокси]фенил}-1,3,4-тиадиазол
Смесь 3,60 г (0,008 моль)
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/4-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 8,41 г диэтаноламина перемешивают при 120oС в течение 3 часов. К реакционной смеси добавляют 40
мл воды, продукт оставляют для кристаллизации. После охлаждения выделенные кристаллы фильтруют, промывают водой и ацетонитрилом.
Таким образом получают 3,52 г (92,8%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 179-182oС.
Пример 96
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{4-[2-/2(морфолиноэтил)амино/-этокси]фенил}-1,3,4-тиадиазол
Смесь 3,60 г (0,008 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/4-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 10,74 г (10,5 мл, 0,08 моль) 2-аминоэтилморфолина перемешивают при 120oС в течение 1 часа. К полученному расплаву добавляют 30
мл воды, продукт оставляют для кристаллизации. После охлаждения выделенные кристаллы фильтруют, промывают водой и ацетонитрилом.
Таким образом получают 3,74 г (93,7%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 175-177oС.
Пример 97
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{ 4-[2-метил-2-/2-(3,4-диметоксифенил)этиламино/-этокси]фенил}-1,3,4-тиадиазол
Смесь 3,60 г (0,008 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/4-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 9,21 г (0,047 моль) N-метил-N-/2-(3,4-диметоксифенил)этил/амина перемешивают при 120oС в течение 1 часа. После охлаждения к
реакционной смеси добавляют по каплям 30 мл метанола, выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 4,02 г (89,1%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 133-136oС.
Пример 98
2-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-5-{ 2-[3-метил-3-/2-(3,4-диметокси-фенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол
Смесь 3,27 г (0,008 моль) 2-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 9,21 г (0,047 моль) N-метил-N-/2-(3,4-диметоксифенил)пропил/амина перемешивают при 140oС в течение 1 часа. После охлаждения к
реакционной смеси добавляют по каплям 40 мл воды, выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 3,38 г (78%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 138-140oС.
Пример 99
2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-{ 2-[3-метил-3-/2-(3,4-диметокси-фенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол
Смесь 3,60 г (0,008 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 9,21 г (0,047 моль) N-метил-N-/3-(3,4-диметоксифенил)пропил/амина перемешивают при 140oС в течение 1 часа. После охлаждения к
реакционной смеси добавляют по каплям 40 мл воды, выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 4,68 г (81%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 125-127oС.
Пример 100
2-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-5-{ 2-[3-(2-морфолиноэтил)амино/-пропокси]фенил}-1,3,4-тиадиазол
Смесь 3,79 г (0,01 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,
4-тиадиазола и 3,90 г (0,03 моль) 2-морфолиноэтиламина перемешивают при 160oС в течение 0,3 часа. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, выделенные кристаллы
фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 3,91 г (82%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 170-172oС.
Пример 101
2-/5-амино-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-{ 2-[3-метил-3-/2-(3,
4-диметоксифенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол
Смесь 4,07 г (0,01 моль) 2-/5-амино-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 5,88 г
(0,03 моль) N-метил-N-/2-(3,4-диметоксифенил)пропил/амина перемешивают при 140oС в течение 1 часа. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, выделенные кристаллы
фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 4,44 г (78%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 133-134oС.
Пример 102
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[2-/3-(2-гидроксиэтиламино)-пропокси/фенил]-1,3,
4-тиадиазол
Смесь 3,79 г (0,01 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 1,83 г (0,03 моль) 2-гидроксиэтиламина перемешивают при
140oС в течение 1 часа. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 2,90 г (71%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 160-162oС.
Пример 103
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[2-/3-(1,2,2-триметилпропиламино)-пропокси/фенил]-1,3,4-тиадиазол
Смесь 3,79 г (0,01 моль) 2-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 1,83 г (0,03 моль) 1,2,2-триметилпропиламина перемешивают при 140oС в течение 1 часа. После охлаждения к реакционной смеси
добавляют по каплям 40 мл воды, выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 3,09 г (69%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 174-176oС.
Пример 104
2-/5-амино-3-(1-метилэтилтио)-1Н-1,2,
4-триазол-1-ил/-5-[2-/3-(1,2,2-триметилпропиламино)пропокси/фенил]-1,3,4-тиадиазол
Смесь 4,07 г (0,01 моль) 2-/5-амино-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-/2-(3-бромпропокси)фенил/-1,
3,4-тиадиазола и 1,83 г (0,03 моль) 1,2,2-триметилпропиламина перемешивают при 100oС в течение 48 часов. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, выделенные
кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 4,09 г (86%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 184-185oС.
Пример 105
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{ 3-[3-метил-3-/2-(3,
4-диметоксифенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол
Смесь 3,79 г (0,01 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/3-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 5,88 г (0,03
моль) N-метил-N-/2-(3,4-диметоксифенил)пропил/амина перемешивают при 140oС в течение 0,5 часа. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, выделенные кристаллы
фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 3,95 г (73%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 112-114oС.
Пример 106
2-/5-амино-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-{ 2-[3-метил-3-/2-(3,
4-диметоксифенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол
Смесь 4,07 г (0,01 моль) 2-/5-амино-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 5,88 г
(0,03 моль) N-метил-N-/2-(3,4-диметоксифенил)пропил/амина перемешивают при 140oС в течение 0,5 часа. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, выделенные
кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 4,05 г (71%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 98-100oС.
Пример 107
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{ 4-[3-метил-3-/2-(3,
4-диметоксифенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол
Смесь 3,79 г (0,01 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 5,88 г (0,03
моль) N-метил-N-/2-(3,4-диметоксифенил)пропил/амина перемешивают при 140oС в течение 1 часа. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, выделенные кристаллы
фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 3,17 г (68%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 138-140oС.
Пример 108
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{ 4-[3-метил-3-/2-(3,
4-диметоксифенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол
Смесь 3,79 г (0,01 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 5,88 г (0,03
моль) N-метил-N-/2-(3,4-диметоксифенил)пропил/амина перемешивают при 140oС в течение 0,5 часа. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, выделенные кристаллы
фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 4,73 г (83%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 127-129oС.
Пример 109
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[4-/3-(1,2,2-триметилпропиламино)пропокси/фенил]-1,3,
4-тиадиазол
Смесь 3,79 г (0,01 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 1,83 г (0,03 моль) 1,2,2-триметилпропиламина перемешивают при
100oС в течение 48 часов. После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 3,27 г (73%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 154-155oС.
Пример 110
2-/5-амино-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-[4-/3-(1,2,2-триметилпропиламино)пропокси/фенил]-1,3,4-тиадиазол
Смесь 4,07 г (0,01 моль)
2-/5-амино-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-/4-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 1,83 г (0,03 моль) 1,2,2-триметилпропиламина перемешивают при 100oС в течение 48 часов.
После охлаждения к реакционной смеси добавляют по каплям 40 мл воды, выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 3,76 г (79%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 154-156oС.
Пример 111
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{ 2-[2-/2-бутил-2-(2-гидроксиэтил)амино/этокси]фенил}-1,3,4-тиадиазол
Смесь 4,65 г (0,013 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/2-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 10 мл бутиламиноэтанола перемешивают при 110oС в течение 2 часов. К полученному расплаву добавляют 30 мл воды, смесь оставляют
для кристаллизации. После охлаждения выделенные кристаллы фильтруют, промывают водой и ацетонитрилом.
Таким образом получают 4,6 г (91,8%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 152-155oС.
Пример 112
2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-[3-/2-этил-2-(2-гидроксиэтиламино)этокси/фенил]-1,3,4-тиадиазол
Смесь 4,50 г (0,01 моль) 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/3-(2-бромэтокси)фенил/-1,3,
4-тиадиазола и 10 мл этиламиноэтанола перемешивают при 110oС в течение 1,5 часов. К реакционной смеси добавляют 40 мл воды, смесь оставляют для кристаллизации. После охлаждения выделенные
кристаллы фильтруют, промывают водой и ацетонитрилом.
Таким образом получают 3,9 г (85,0%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 138-141oС.
Пример 113
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-[2-/3-бис(2-гидроксиэтил)-аминоэтокси/фенил]-1,3,
4-тиадиазол
Смесь 4,50 г (0,01 моль) 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/3-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 10 мл диэтаноламина перемешивают при 120oС в
течение 2 часов. К реакционной смеси добавляют 40 мл воды, смесь оставляют для кристаллизации. После охлаждения выделенные кристаллы фильтруют, промывают водой и ацетонитрилом.
Таким образом получают 4,22 г (88,9%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 152-155oС.
Пример 114
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-[4-/3-(2-морфолиноэтил)-аминоэтокси/фенил]-1,3,4-тиадиазол
Смесь 4,50 г (0,01 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/3-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 13,2 г (0,1 моль) 2-аминоэтилморфолина перемешивают при 120oС в течение 1,5 часов. К реакционной смеси добавляют 40 мл воды,
смесь оставляют для кристаллизации. После охлаждения выделенные кристаллы фильтруют, промывают водой и ацетонитрилом.
Таким образом получают 4,27 г (85%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из тетрахлорметана): 136-137oС.
Пример 115
2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-{ 3-[2-метил-2-/2-(3,4-диметоксифенил)этиламино/этокси]фенил}-1,3,4-тиадиазол
Смесь 4,50 г (0,01 моль) 2-(5-амино-3-пиперидино-1Н-1,2,
4-триазол-1-ил)-5-/3-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 9,4 г N-метил-N-/2-(3,4-диметоксифенил)этил/амина перемешивают при 120oС в течение 1 часа. Избыток амина выпаривают при
пониженном давлении из реакционной смеси, к остатку добавляют 30 мл воды и 30 мл метанола, смесь оставляют для кристаллизации. Выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 5,1 г (90,3%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из тетрахлорметана): 147-149o С.
Пример 116
2-/5-бензиламино-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-[2-/3-(2-морфолиноэтиламино)пропокси/фенил]-1,3,4-тиадиазол
Смесь 2,00 г (0,0036 моль)
2-(5-бензиламино-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 4,56 г (0,035 моль) 2-морфолиноэтиламина перемешивают при 80oС в течение 7 часов.
После охлаждения к реакционной смеси добавляют по каплям 98 мл воды и 2 мл этилацетата, смесь перемешивают при комнатной температуре 1,5 часа. Выделенные кристаллы фильтруют, промывают водой и
диэтиловым эфиром.
Таким образом получают 2,11 г (96,9%) названного соединения. Температура плавления: 61-63oС.
Пример 117
2-/5-(4-хлорбензиламино)-3-(1-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-[2-/3-(2-морфолиноэтиламино)пропокси/фенил]-1,3,4-тиадиазол
Смесь 1,90 г (0,0032 моль) 2-(5-амино-3-(1-метилэтилтио)-1Н-1,
2,4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 3,80 г (0,029 моль) 2-морфолиноэтиламина перемешивают при 80oС в течение 7 часов. После охлаждения к реакционной смеси
добавляют по каплям 98 мл воды и 2 мл этилацетата, смесь перемешивают при комнатной температуре 1,5 часа. Выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 1,96 г (95,2%) названного соединения. Температура плавления: 118-120oС.
Пример 118
2-/5-(4-хлорбензиламино)-3-метилтио-1Н-1,2,
4-триазол-1-ил/-5-[2-/3-(2-морфолиноэтиламино)пропокси/фенил]-1,3,4-тиадиазол
Смесь 5,00 г (0,009 моль) 2-/5-(4-хлорбензиламино)-3-метилтио-1Н-1,2,
4-триазол-1-ил/-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 5,90 г (0,045 моль) 2-морфолиноэтиламина перемешивают при 80oС в течение 7 часов. После охлаждения к реакционной смеси
добавляют по каплям 98 мл воды и 2 мл этилацетата, смесь перемешивают при комнатной температуре 1,5 часа. Выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 4,39 г (80,6%) названного соединения. Температура плавления: 124-126oС.
Пример 119
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{
2-[3-метил-3-/2-(3,4-диметоксифенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол
Смесь 0,043 г (0,0001 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,
4-тиадиазола и 0,195 г (0,001 моль) N-метил-N-/2-(3,4-диметоксифенил)пропил/амина перемешивают при 100oС в течение 15 минут. Реакционную смесь оставляют при комнатной температуре на 24
часа. Затем к реакционной смеси добавляют по каплям 3 мл воды, выделенные кристаллы перемешивают 1 час, фильтруют, промывают водой, ацетонитрилом и диэтиловым эфиром.
Таким образом получают 0,046 г (85,2%) названного соединения. Температура плавления: 138-141oС.
Пример 120
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{ 2-[3-метил-3-/2-(3,
4-диметоксифенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол
Раствор 1,8 г (0,0066 моль) тетрабутиламмонийной соли 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-(2-гидроксифенил)-1,3,
4-тиадиазола и 1,10 г (0,002 моль) N-метил-N-/2-(3,4-диметоксифенил)этил/-N-(3-хлорпропил)амина в 10 мл ацетонитрила перемешивают при комнатной температуре в течение 67 часов. Выделенный продукт
фильтруют, промывают ацетонитрилом.
Таким образом получают 0,79 г (73,1%) названного соединения. Температура плавления (после хроматографии на колонке, заполненной окисью алюминия, с использованием смесей гексан/хлороформ с увеличивающейся полярностью в качестве элюента): 147,5-148,5oС.
Пример 121
2-/5-амино-3-(н-гексилтио)-1Н-1,2,
4-триазол-1-ил/-5-{ 2-[3-метил-3-/2-(3,4-диметоксифенилэтил)амино/пропокси]фенил}-1,3,4-тиадиазол
Раствор 0,742 г (0,0012 моль) тетрабутиламмонийной соли 2-/5-амино-3-(н-гексилтио)-1Н-1,2,
4-триазол-1-ил/-5-(2-гидроксифенил)-1,3,4-тиадиазола и 0,652 г (0,024 моль) N-метил-N-/2-(3,4-диметоксифенил)этил/-N-(3-хлорпропил)амина в 5 мл ацетонитрила перемешивают при комнатной температуре в
течение 8 дней. Реакционную смесь выпаривают досуха при пониженном давлении, остаток растворяют в 50 мл хлороформа, органический раствор экстрагируют водой, сушат над безводным сульфатом натрия, снова
выпаривают досуха при пониженном давлении.
Таким образом получают 1,11 г черного масла, которое хроматографируют на колонке, заполненной окисью алюминия, с использованием смесей гексан/хлороформ с увеличивающейся полярностью в качестве элюента с получением 0,44 г (44,4%) чистого названного продукта. Температура плавления 106-107,5oС.
Пример 122
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{ 2-[3-метил-3-/2-(3,4-диметоксифенилэтил)амино/-пропокси]фенил}-1,3,4-тиадиазол
К суспензии 0,435 г (0,0008 моль)
1-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-N'-{ 3-[N-/2-(3,4-диметоксифенил)-этил/-N-метил] пропокси}бензилиденкарботиогидразида в 10 мл тетрагидрофурана добавляют 0,204 г (0,0009 моль) DDQ при
25oС при перемешивании и охлаждении. Затем суспензию перемешивают еще час при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси выпариванием при пониженном давлении, к
остатку добавляют 15 мл 5% водного раствора гидроксида натрия, смесь перемешивают еще в течение 2 часов. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем
несколькими порциями воды до нейтральной реакции.
Таким образом получают 0,39 г (90,1%) названного соединения. Температура плавления (после хроматографии в слое окиси алюминия): 147-149oС.
Пример 123
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-[2-/2-метил-2-(2-гидроксиэтиламино)этокси/фенил]-1,3,4-тиадиазол
К суспензии 3,13 г
(0,007 моль) 1-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-N'-{ 2-[N-/2-(гидроксиэтил)-N-метил/этокси] бензилиден} карботиогидразида в 30 мл тетрагидрофурана добавляют 1,75 г (0,0077 моль) DDQ при
25oС при перемешивании и охлаждении. Затем суспензию перемешивают еще час при комнатной температуре. Тетрагидрофуран удаляют из реакционной смеси выпариванием при пониженном давлении, к
остатку добавляют 45 мл 5% водного раствора гидроксида натрия, смесь перемешивают еще в течение часа. Осажденный продукт фильтруют, промывают 5% водным раствором гидроксида натрия, затем несколькими
порциями воды до нейтральной реакции и ацетонитрилом.
Таким образом получают 2,92 г (93,8%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н): 170-173oС.
Пример 124
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[4-/3-(2-морфолиноэтиламино)пропокси/фенил]-1,3,4-тиадиазол
Смесь 4,1 г (0,009 моль)
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 12,4 г (0,09 моль) 2-морфолиноэтиламина перемешивают при 140oС в течение 0,3 часа. После
охлаждения к реакционной смеси добавляют по каплям 100 мл воды, выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 3,41 г (76,8%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 153-154oС.
Пример 125
2-(5-амино-3-диметиламино-1Н-1,2,4-триазол-1-ил)-5-[4-/3-(2-морфолиноэтиламино)пропокси/фенил]-1,3,4-тиадиазол
Смесь 0,85 г (0,002 моль) 2-(5-амино-3-диметиламино-1Н-1,2,
4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 2,6 г (0,02 моль) 2-морфолиноэтиламина перемешивают при 140oС в течение 0,3 часа. После охлаждения к реакционной смеси
добавляют по каплям 50 мл воды, выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 0,47 г (49,5%) названного соединения. Температура плавления (после хроматографии в слое Kieselgel 60 Н и перекристаллизации из ацетонитрила): 160-162oС.
Пример 126
2-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-5-/2-(2-морфолиноэтиламиноэтокси)-фенил/-1,3,4-тиадиазол
Смесь 1,45 г (0,0035 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 4,
56 г (0,035 моль) 2-морфолиноэтиламина перемешивают при 80oС в течение 2 часов. После охлаждения к реакционной смеси добавляют по каплям 10 мл воды, выделенные кристаллы фильтруют,
промывают водой и диэтиловым эфиром.
Таким образом получают 1,48 г (91,9%) названного соединения. Температура плавления: 171-174oС.
Пример 127
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[2-/2-(3-морфолинопропиламино)-этокси/фенил]-1,3,4-тиадиазол
Смесь 1,45 г (0,0035 моль) 2-(5-амино-3-метилтио-1Н-1,2,
4-триазол-1-ил)-5-/2-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 5,05 г (0,035 моль) 2-морфолинопропиламина перемешивают при 80oС в течение 3 часов. После охлаждения к реакционной смеси
добавляют по каплям 10 мл воды, выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 1,59 г (95,8%) названного соединения. Температура плавления: 188-191oС.
Пример 128
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[2-/3-метил-3-(2-морфолиноэтиламино)пропокси/фенил]-1,3,4-тиадиазол
Смесь
1,50 г (0,0035 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 3,30 г (0,03 моль) 2-метил-2-морфолиноэтиламина перемешивают при 80oС в
течение 3 часов. После охлаждения к реакционной смеси добавляют по каплям 10 мл эфира, выделенные кристаллы фильтруют, промывают водой и эфиром.
Таким образом получают 1,47 г (86,0%) названного соединения. Температура плавления: 154-157oС.
Пример 129
2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[2-/3-(3-морфолинопропиламино)-пропокси/фенил]-1,
3,4-тиадиазол
Смесь 1,45 г (0,0035 моль) 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 5,05 г (0,035 моль) 3-морфолинопропиламина перемешивают
при 80oС в течение 1 часа. После охлаждения к реакционной смеси добавляют по каплям 20 мл воды, выделенные кристаллы фильтруют, промывают водой и ацетонитрилом.
Таким образом получают 1,48 г (86,5%) названного соединения. Температура плавления: 157-160oС.
Пример 130
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{
2-[4-метил-4-/2-(3,4-диметоксифенил)этиламино/бутокси]фенил}-1,3,4-тиадиазол
Смесь 0,48 г (0,001 моль) 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(4-бромбутокси)фенил/-1,3,
4-тиадиазола и 1,95 г (0,035 моль) N-метил-N-/2-(3,4-диметоксифенил)этил/амина перемешивают при 100oС в течение 1 часа. После охлаждения к реакционной смеси добавляют по каплям 10 мл эфира,
выделенные кристаллы фильтруют, промывают водой и диэтиловым эфиром.
Таким образом получают 0,29 г (49,1%) названного соединения. Температура плавления: 120-122oС.
Пример 131
2-(5-амино-3-морфолино-1Н-1,2,4-триазол-1-ил)-5-[2-/3-(2-морфолиноэтиламино)-пропокси/фенил]-1,3,4-тиадиазол
Смесь 1,45 г (0,0035 моль)
2-(5-амино-3-морфолино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-бромпропокси)фенил/-1,3,4-тиадиазола и 5,05 г (0,035 моль) 2-морфолиноэтиламина перемешивают при 5oС в течение 2,5 часов. После
охлаждения к реакционной смеси добавляют по каплям 30 мл воды, выделенные кристаллы фильтруют, промывают водой и эфиром.
Таким образом получают 1,51 г (83,9%) названного соединения.
Пример 132
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-[2-/2-метил-2-(2-гидроксиэтиламино)этокси/фенил]-1,3,4-тиадиазол
Смесь 0,36 г (0,0008 моль)
2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-/2-(2-бромэтокси)фенил/-1,3,4-тиадиазола и 1 мл 2-метиламиноэтанола перемешивают при 100oС в течение 1,5 часов. После охлаждения к
реакционной смеси добавляют по каплям 5 мл воды, выделенные кристаллы фильтруют, промывают водой и ацетонитрилом.
Таким образом получают 0,21 г (73,5%) названного соединения.
Реферат
Изобретение относится к новым производным 2-(1,2, 4-триазол-1-ил)-1,3,4-тиадиазола формулы I, в которой R1 означает атом водорода, С1-4 алкильную группу или фенильную группу, которая может быть замещена от 1 до 3 заместителями, выбранными из группы, состоящей из атома галогена, гидроксигруппы, нитрогруппы, С1-4 алкоксигруппы, (С1-4 алкил) аминогруппы и ди(С1-4 алкил)аминогруппы; или группы формулы (а) Z означает атом водорода или С1-4 алкоксигруппу, R0 означает группу формулы Alk-NR4R5, где Alk является алкиленовой группой, имеющей прямую или разветвленную С1-6 цепь, один из R2 и R3 является аминогруппой, а другой является аминогруппой или 5-6-членной насыщенной гетероциклической группой, содержащей один или два атом(ов) азота и/или кислорода и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена С1-4 алкильной группой, фенильной группой или галогенофенильной группой, или последний из R2 и R3 является группой формулы - SR. Соединения оказывают влияние на сердце и центральную нервную систему. Описан также способ получения новых соединений, промежуточные продукты и фармацевтические композиции на основе новых соединений. 4 c. и 14 з.п. ф-лы, 4 табл.


Формула
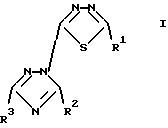
где R1 означает атом водорода, C1-4 алкильную группу или фенильную группу, которая может быть замещена от 1 до 3 заместителями, выбранными из группы, состоящей из атома галогена, гидроксигруппы, нитрогруппы, C1-4 алкоксигруппы, (C1-4 алкил)аминогруппы и ди(С1-4 алкил)аминогруппы; или группу формулы
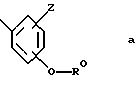
где Z означает атом водорода или С1-4 алкоксигруппу;
R0 означает группу формулы Alk-NR4R5, где Alk является алкиленовой группой, имеющей прямую или разветвленную C1-6цепь, R4 и R5 означают, независимо друг от друга, атом водорода, С2-6 алкенильную группу, C1-8 алкильную группу, которая может быть замещена заместителем, выбранным из группы, состоящей из гидроксигруппы, (C1-4 алкил)аминогруппы, ди(С1-4 алкил)аминогруппы, фенильной группы, причем последняя может быть замешена от 1 до 3 С1-4 алкоксигруппой(группами), 6-членной насыщенной гетероциклической группы, содержащей атом азота и атом кислорода, и присоединенной через атом азота, причем указанная гетероциклическая группа может быть замещена C1-4 алкильной группой, или R4 и R5 образуют совместно с соседним атомом азота и, возможно, еще с одним или более атомом(атомами) азота и/или кислорода, и/или серы от 5- до 7-членную насыщенную гетероциклическую группу, которая может быть замещена C1-4 алкильной группой или фенильной группой, причем последняя может быть замещена С1-4 алкоксигруппой;
один из R2 и R3 является аминогруппой, тогда другой является аминогруппой или 5-6-членной насыщенной гетероциклической группой, содержащей один или два атома(ов) азота и/или кислорода, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена C1-4 алкильной группой, фенильной группой или галогенофенильной группой, или последний из R2 и R3 является группой формулы -SR, где R означает C1-8 алкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу, причем алкильная группа может быть замещена фенильной группой или галогенофенильной группой, и одна или обе аминогруппы могут быть замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, С2-6 алкенильной группы, фенил(С1-4 алкильной) группы или галогенофенил(С1-4 алкильной)группы,
и его фармацевтически приемлемые соли присоединения кислот.
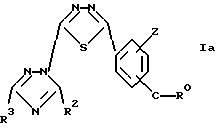
по п. 1,
где R0 означает группу формулы Alk-NR4R5, где Alk является алкиленовой группой, имеющей прямую или разветвленную C1-6 цепь, R4 и R5 означают, независимо друг от друга, C1-6 алкильную группу или С2-6 алкенильную группу, или R4 и R5 образуют совместно с соседним атомом азота и, возможно, еще с одним или более атомом(атомами) азота и/или кислорода, и/или серы от 5- до 7-членную насыщенную гетероциклическую группу, которая может быть замещена С1-4 алкильной группой или фенильной группой, причем последняя может быть замещена С1-4 алкоксигруппой,
Z означает атом водорода или С1-4 алкоксигруппу;
один из R2 и R3 является аминогруппой, тогда другой является аминогруппой или 5-6-членной насыщенной гетероциклической группой, содержащей один или два атом(а) азота и/или кислорода, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена C1-4 алкильной группой, фенильной группой или галогенофенильной группой, или последний из R2 и R3 является группой формулы -SR, где R означает C1-8 алкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу, причем алкильная группа может быть замещена фенильной группой или галогенофенильной группой, и одна или обе аминогруппы могут быть замешены одним или двумя заместителями, выбранными из группы, состоящей из С1-6 алкильной группы, С2-6 алкенильной группы, фенил(С1-4 алкильной) группы или галогенофенил(С1-4 алкильной)группы,
и его фармацевтически приемлемые соли присоединения кислот.

по п. 1,
где один из R2 и R3 является аминогруппой, тогда другой является аминогруппой или 5-6-членной насыщенной гетероциклической группой, содержащей один или два атом(ов) азота и/или кислорода, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена C1-4 алкильной группой, фенильной группой или галогенофенильной группой, или последний из R2 и R3 является группой формулы -SR, где R означает C1-8 алкильную группу, С2-6 алкенильную группу или C2-6 алкинильную группу, причем алкильная группа может быть замещена фенильной группой или галогенофенильной группой, и одна или обе аминогруппы могут быть замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, С2-6 алкенильной группы, фенил (C1-4 алкильной) группы и галогенофенил(С1-4 алкильной) группы;
Alk является C1-6 алкиленовой группой;
R4 и R5 означают, независимо друг от друга, атом водорода или C1-8 алкильную группу, которая может быть замещена заместителем, выбранным из группы, состоящей из гидроксигруппы, (С1-4алкил)аминогруппы, ди-(С1-4 алкил)аминогруппы, фенильной группы, причем последняя может быть замещена от 1 до 3 С1-4 алкоксигруппой(группами), 6-членной насыщенной гетероциклической группой, содержащей атом азота и атом кислорода, и присоединенной через атом азота, причем указанная гетероциклическая группа может быть замещена С1-4 алкильной группой,
и его фармацевтически приемлемые соли присоединения кислот.
Alk является C2-3 алкиленовой группой, и его фармацевтически приемлемые соли присоединения кислот.
1. 2-/5-амино-3-(4-метилпиперазино)-1Н-1,2,4-триазол-1-ил/-5-(2,6-дихлорфенил)-1,3,4-тиадиазол,
2. 2-(5-амиио-3-метилтио-1Н-1,2, 4-триазол-1-ил)-5-/3-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
3. 2-(5-амино-3-диметиламино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
4. 2-/5-амино-3-(2-метилэтилтио)-1Н-1,2,4-триазол-1-ил/-5-/2-(3-диметиламинопропокси)-фенил/-1,3,4-тиадиазол,
5. 2-(5-амино-3-пиперидино-1Н-1,2, 4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
6. 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/4-(2-диметиламиноэтокси)фенил/-1,3,4-тиадиазол,
7. 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-/2-(3-пирролидинопропокси)фенил/-1,3,4-тиадиазол,
8. 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-[2-/3-ди(2-метилэтил)аминопропокси/фенил] -1, 3,4-тиадиазол,
9. 2-/5-амино-3-(4-метилпиперазин-1-ил)-1Н-1,2,4-триазол-1-ил/-5-/4-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
10. 2-(5-амино-3-диаллиламино-1Н-1,2, 4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
11. 2-(5-амино-3-пирролидино-1Н-1,2,4-триазол-1-ил)-5-/2-(3-диметиламинопропокси)фенил/-1,3,4-тиадиазол,
12. 2-(5-амино-3-пиперидино-1Н-1,2,4-триазол-1-ил)-5-{ 2-[2-/2-этил-2-(2-гидроксиэтил)амино/этокси] фенил} -1,3,4-тиадиазол,
13. 2-(5-амино-3-пиперидино-1Н-1,2, 4-триазол-1-ил)-5-[2-/2-(2-морфолиноэтил)амино/этокси] фенил-1,3,4-тиадиазол,
14. 2-(5-амино-3-метилтио-1Н-1,2,4-триазол-1-ил)-5-{ 2-[3-метил-3-/2-(3,4-диметоксифенилэтил)амино/пропокси] фенил} -1,3,4-тиадиазол.
и его фармацевтически приемлемые соли присоединения кислот.

где R1, R2 и R3 такие, как указано выше, с окисляющим агентом,
и, если необходимо, превращают полученное таким образом соединение формулы I в его фармацевтически приемлемую соль присоединения кислоты, или выделяют соединение формулы I из его соли.

где R7 означает группу формулы -Alk-L, где Alk означает прямую или разветвленную С1-6 алкиленовую цепь, L означает атом галогена или гидроксигруппу,
Z означает атом водорода или С1-4 алкоксигруппу,
один из R2 и R3 является аминогруппой, тогда другой является аминогруппой или 5-6-членной насыщенной гетероциклической группой, содержащей один или два атома(ов) азота и/или кислорода, и присоединенной через ее атом азота, причем указанная гетероциклическая группа может быть замещена С1-4 алкильной группой, фенильной группой или галогенофенильной группой, или последний из R2 и R3 является группой формулы -SR, где R означает C1-8 алкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу, причем алкильная группа может быть замещена фенильной группой или галогенофенильной группой, и одна или обе аминогруппы могут быть замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, С2-6 алкенильной группы, фенил (С1-4 алкильной) группы или галогенофенил (С1-4 алкильной) группы,
и его соли присоединения кислот.

Комментарии