Способ получения гидроксида лития - RU2786259C1
Код документа: RU2786259C1
Чертежи







Описание
Область техники
Настоящее изобретение относится к способу получения гидроксида лития. Уровень техники
В последнее время литиевые перезаряжаемые батареи не только по-разному используются в качестве источника питания для IT-устройств (IT - информационно-технологический), таких как мобильные телефоны и портативные компьютеры, но также привлекают внимание в качестве источника питания для электромобилей.
Ожидается, что в ближайшем будущем, когда рынок электромобилей и рынок систем хранения электроэнергии на возобновляемых источниках энергии будут активно активизироваться, спрос на литиевые перезаряжаемые батареи будет быстро расти.
Гидроксид лития используется в качестве сырья для материалов положительного электрода, материалов отрицательного электрода и электролитов, которые являются важными компонентами электромобилей и систем хранения электроэнергии. Следовательно, для бесперебойной поставки на рынок электромобилей и систем хранения электроэнергии, спрос на которые, как ожидается, будет значительно возрастать, требуется технология, способная экономично производить гидроксид лития.
Как правило, путем естественного выпаривания природной рапы для концентрирования лития до высокой концентрации около 60 г/л и последующего добавления карбоната, литий извлекается в виде карбоната лития (Li2CO3) из природной рапы, содержащей от 0,2 до 1,5 г/л лития. Для получения гидроксида лития из экстрагированного таким образом карбоната лития были разработаны различные способы.
Корейский патент с регистрационным номером 10-0725589 раскрывает технологию получения гидроксида лития путем элюирования только растворимого количества (13 г/л) карбоната лития из отходов карбоната лития с получением водного раствора карбоната лития, имеющего концентрацию лития 2,5 г/л и реакции раствора с гидроксидом кальция с получением низкоконцентрированного водного раствора гидроксида лития, имеющего концентрацию лития 2,5 г/л или менее, и последующего выпаривания из него воды.
Однако при использовании этого способа концентрация лития в водном растворе гидроксида лития низка, что влечет за собой высокие затраты на выпаривание.
Кроме того, корейский патент с регистрационным номером 10-1873933 раскрывает способ получения порошка гидроксида лития путем смешивания суспензии карбоната лития и суспензии гидроксида кальция, реакции при 70°С в течение двух часов, фильтрации с получением водного раствора карбоната лития, имеющего концентрацию лития 3,75 г/л или более и выпаривания из него воды. Однако, в этом способе реакционный раствор должен быть нагрет до 70°С для реакции карбоната лития и гидроксида лития, что влечет за собой большие энергозатраты, и поскольку большое количество гидроксида лития элюируется и теряется в процессе промывания для очищения гидроксида лития степень извлечения лития снижается.
В то же время, в корейском патенте с регистрационным номером 10-1179505 карбонат лития растворяют в воде с получением водного раствора карбоната лития, и после добавления пероксида водорода воду выпаривают с получением пероксида лития. Затем в раскрытом способе получения полученный пероксид лития подвергают реакции с водой с получением моногидрата гидроксида лития. Однако, поскольку в этом способе используется сильно окисляющая перекись водорода, существует опасность взрыва, а для предотвращения взрыва реакцию следует проводить при очень низкой концентрации лития, поэтому на кристаллизацию гидроксида лития тратится много энергии.
В японском патенте с регистрационным номером 05769409 обеспечен способ получения гидроксида лития путем реакции карбоната лития с органической кислотой с получением раствора лития в органической кислоте и электродиализа раствора в оборудовании для электродиализа, оснащенном биполярной мембраной. Однако этот метод неэкономичен, поскольку использует дорогостоящее оборудование для электродиализа и чрезмерное количество электроэнергии, и биполярную мембрану дорого и сложно обслуживать и ремонтировать.
Как описано выше, при использовании существующего способа получения гидроксида лития с использованием карбоната лития возникают такие проблемы, как высокие затраты энергии, низкая степень извлечения лития и высокие капиталовложения в оборудование, поэтому экономическая эффективность низка. Поэтому существует острая необходимость в разработке технологии, позволяющей экономично получать гидроксид лития с использованием карбоната лития.
Поэтому в настоящем изобретении предлагается способ экономичного получения гидроксида лития из карбоната лития с использованием небольшого количества энергии и с высокой степенью извлечения лития.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
Настоящее изобретение направлено на обеспечение способа экономичного получения гидроксида лития. Техническое решение
Один аспект настоящего изобретения обеспечивает способ получения гидроксида лития, который включает этапы: получения карбоната лития и гидроксида кальция; и реакции карбоната лития и гидроксида кальция в растворителе и, таким образом, получения водного раствора гидроксида лития, где на этапе реакции карбоната лития и гидроксида кальция в растворителе и, таким образом, получения водного раствора гидроксида лития, концентрация карбоната лития в растворителе составляет 110 г/л или менее.
Более конкретно, концентрация карбоната лития в растворителе может составлять от 25 до 110 г/л.
Более конкретно, концентрация карбоната лития в растворителе может составлять от 25 до 80 г/л.
Концентрация гидроксида кальция в растворителе может составлять от 27 г/л до 115 г/л. Концентрация гидроксида кальция может быть связана с вышеописанной концентрацией карбоната лития. То есть вводимое количество гидроксида кальция, которое может вступать в реакцию, можно регулировать в соответствии с количеством карбоната лития.
Описание вводимого количества карбоната лития будет приведено ниже.
На этапе реакции карбоната лития и гидроксида кальция в растворителе и, таким образом, получения водного раствора гидроксида лития время реакции может составлять от одного до пяти часов. Описание времени реакции будет приведено ниже.
На этапе реакции карбоната лития и гидроксида кальция в растворителе и, таким образом, получения водного раствора гидроксида лития, температура реакции является комнатной. То есть на активацию реакционной атмосферы дополнительная энергия может не требоваться.
Способ может дополнительно включать этапы: концентрирования водного раствора гидроксида лития и его разделения на твердый гидроксид лития и первый фильтрат; и извлечения лития из первого фильтрата после этапа реакции карбоната лития и гидроксида кальция в растворителе с получением, таким образом, водного раствора гидроксида лития.
Способ может дополнительно включать этапы: промывания твердого гидроксида лития; и извлечения лития из фильтрата промывочного раствора, используемого для промывания гидроксида лития после этапа концентрирования водного раствора гидроксида лития и его разделения на твердый гидроксид лития и первый фильтрат.
Этап извлечения лития из первого фильтрата или этап извлечения лития из фильтрата промывочного раствора, используемого для промывания гидроксида лития, может включать этап добавления исходного материала угольной кислоты к первому фильтрату или фильтрату промывочного раствора и таким образом извлечения лития в виде карбоната лития.
Способ может дополнительно включать этапы: разделения твердого карбоната лития и второго фильтрата; промывания твердого карбоната лития; и извлечения лития из второго фильтрата или фильтрата промывочного раствора, используемого для промывания твердого карбоната лития, после этапа добавления исходного материала угольной кислоты в первый фильтрат или фильтрат промывочного раствора и, таким образом, выделения лития в виде карбоната лития.
Этап извлечения лития из второго фильтрата или фильтрата промывочного раствора, используемого для промывания твердого карбоната лития, может включать этап добавления исходного материала фосфора ко второму фильтрату или фильтрату промывочного раствора, используемого для промывания твердого карбоната лития и, таким образом, извлечения лития в виде фосфата лития.
Этап извлечения лития из первого фильтрата или этап извлечения лития из фильтрата промывочного раствора, используемого для промывания гидроксида лития, может включать этап добавления исходного материала фосфора к первому фильтрату или фильтрату промывочного раствора и таким образом извлечения лития в виде фосфата лития.
Преимущества изобретения
Один аспект настоящего изобретения может обеспечить способ экономичного получения гидроксида лития из-за снижения энергозатрат, капиталовложений в оборудование и потерь лития.
Описание чертежей
Фиг. 1 показывает степень превращения гидроксида лития из реакционного раствора фильтрата, полученного после добавления разных количеств карбоната лития и гидроксида кальция к 1 л дистиллированной воды и перемешивания при комнатной температуре (21°С) в течение пяти часов.
Фиг. 2 показывает концентрацию лития в фильтрате реакционного раствора, собранном с 30-минутными интервалами во время получения высококонцентрированного литиевого раствора с концентрацией лития 10 г/л путем добавления 54 г карбоната лития и 57 г гидроксида кальция к 1 л воды при комнатной температуре (21°С) и перемешивании в течение пяти часов.
Фиг. 3 показывает результат рентгеноструктурного анализа, проведенного после добавления 54 г карбоната лития и 57 г гидроксида кальция к 1 л воды при комнатной температуре (21°С) и перемешивания в течение пяти часов с получением высококонцентрированного раствора лития с концентрацией лития 10 г/л, промывания полученного реакционного осадка и затем его высушивания при 105°С в течение 24 часов.
Фиг. 4 показывает результат рентгеноструктурного анализа, проведенного после ввода высококонцентрированного раствора гидроксида лития с концентрацией лития 9,4 г/л в колбу при пониженном давлении 35 мбар, погружения колбы в горячую воду с температурой 50°С, выпаривания воды при вращении колбы для осаждения гидроксида лития, проведения фильтрации, промывания и высушивания осажденного гидроксида лития с получением порошка гидроксида лития.
Фиг. 5 показывает результат рентгеноструктурного анализа реакционного осадка, полученного путем добавления 340 г карбоната натрия к 1 л смешанного раствора фильтрата гидроксида лития и фильтрата промывочного раствора гидроксида лития и перемешивания в течение четырех часов при комнатной температуре.
Фиг. 6 показывает результат рентгеноструктурного анализа реакционного осадка, полученного путем добавления 351 г фосфата натрия к 1 л смешанного раствора фильтрата гидроксида лития и фильтрата промывочного раствора гидроксида лития и перемешивания в течение четырех часов при комнатной температуре.
Фиг. 7 показывает результат рентгеноструктурного анализа реакционного осадка, полученного путем добавления 26 г фосфата натрия к 1 л смешанного раствора фильтрата карбоната лития и фильтрата промывочного раствора карбоната лития и перемешивания в течение четырех часов при комнатной температуре.
Принцип изобретения
Варианты осуществления настоящего изобретения далее будут описаны подробно. Однако, иллюстративные варианты осуществления представлены в качестве примеров, и настоящее изобретение ими не ограничивается, и настоящее изобретение определяется только объемом формулы изобретения.
В соответствии с одним вариантом осуществления настоящего изобретения, реакция между карбонатом лития и гидроксидом кальция в суспензии при комнатной температуре (например, при температуре от 20 до 25°С) может протекать в соответствии со следующей схемой реакции 1.
Схема реакции 1

То есть, когда карбонат лития реагирует с гидроксидом кальция, образуется водный раствор гидроксида лития, и карбонат кальция осаждается.
Для снижения энергозатрат процесса, реакция может быть проведена при комнатной температуре.
Реакционный раствор при комнатной температуре может быть отфильтрован для отделения осажденного карбоната кальция и получения раствора гидроксида лития.
Растворимость гидроксида лития составляет 128 г/л, что составляет 37,1 г/л в пересчете на концентрацию лития.
Следовательно, чтобы отделить твердый гидроксид лития от раствора гидроксида лития путем его осаждения, водный раствор гидроксида лития следует нагреть для выпаривания воды до достижения концентрации лития 37,1 г/л или более.
Следовательно, когда концентрация лития в растворе гидроксида лития низка, поскольку необходимо испарить большое количество воды, возникает проблема, заключающаяся в увеличении энергозатрат. Однако, когда концентрация лития в водном растворе гидроксида лития чрезмерно увеличивается путем добавления избыточного количества карбоната лития и порошка гидроксида кальция для уменьшения испарения воды, вязкость реакционного раствора увеличивается, поэтому реакция протекает неравномерно, и избыток карбоната кальция выпадает в осадок, поэтому фильтрацию проводить сложно, и количество межслоевой воды увеличивается, поэтому теряется большое количество лития.
Кроме того, поскольку большое количество лития и угольной кислоты выводится в водный раствор, карбонат лития повторно осаждается из раствора гидроксида лития, поэтому возникают проблемы, связанные со снижением эффективности реакции и увеличением потерь лития.
Следовательно, в настоящем изобретении количество карбоната лития, вводимого в 1 л реакционного раствора, ограничено 110 г/л или менее. Более конкретно, количество может находиться в диапазоне от 25 г до 110 г.
Согласно одному варианту осуществления настоящего изобретения, осаждение порошка гидроксида лития вследствие испарения воды и концентрирования раствора гидроксида лития может происходить в соответствии со следующей Схемой реакции 2 или Схемой реакции 3.
Схема реакции 2

Схема реакции 3

Согласно одному варианту осуществления настоящего изобретения раствор с осажденным гидроксидом лития может быть отфильтрован и, таким образом, разделен на гидроксид лития (твердую фазу) и фильтрат.
Согласно одному варианту осуществления настоящего изобретения осадок гидроксида лития может быть промыт путем смешивания с водой. Промывочный раствор, в котором смешаны осажденный гидроксид лития и вода, может быть отфильтрован и, таким образом, разделен на гидроксид лития и фильтрат промывочного раствора.
Поскольку гидроксид лития имеет высокую растворимость - 128 г/л, - как описано выше, фильтрат гидроксида лития согласно одному варианту осуществления настоящего изобретения содержит большое количество остаточного лития и, таким образом, имеет концентрацию лития 37 г/л, и фильтрат промывочного раствора гидроксида лития также имеет высокую концентрацию лития из-за присутствия большого количества лития.
Следовательно, когда литий не извлечен из фильтрата гидроксида лития и фильтрата промывочного раствора, поскольку теряется большое количество лития, эффективность и экономическая эффективность процесса получения гидроксида лития снижаются.
Следовательно, важно извлекать литий из фильтрата гидроксида лития и фильтрата промывочного раствора, содержащего большое количество лития, с целью снижения потерь лития в процессе получения гидроксида лития.
При извлечении лития из фильтрата гидроксида лития и фильтрата промывочного раствора литий может быть выделен в виде карбоната лития (растворимость: 13 г/л) или фосфата лития (растворимость: 0,39 г/л), растворимость которых значительно ниже, чем у гидроксида лития, и которые, таким образом, могут осаждать большую часть лития.
Когда исходный материал угольной кислоты добавляют к раствору гидроксида лития, в котором смешивают фильтрат гидроксида лития и фильтрат промывочного раствора гидроксида лития согласно одному варианту осуществления настоящего изобретения, карбонат лития выпадает в осадок, и, следовательно, литий может быть эффективно извлечен.
Реакция осаждения карбоната лития может протекать, как показано на следующей Реакционной схеме 4.
Схема реакции 4

Карбонат натрия, который является одним из примеров исходного материала угольной кислоты, реагирует с литием при комнатной температуре с получением и осаждением карбоната лития.
Конкретными примерами исходного материала угольной кислоты являются газообразный диоксид углерода и карбонат.
Более конкретно, карбонат может представлять собой бикарбонат натрия, карбонат натрия, бикарбонат калия, карбонат калия, карбонат аммония или их комбинацию.
Вводимое количество исходного материала угольной кислоты может составлять один эквивалент или более по отношению к содержанию лития в растворе гидроксида лития. Соответствие вышеуказанному диапазону может быть преимуществом с точки зрения степени реакции.
Осажденный карбонат лития можно отделить от реакционного раствора фильтрованием.
Этап извлечения лития путем получения и осаждения карбоната лития путем добавления исходного материала угольной кислоты к раствору гидроксида лития может быть осуществлена при комнатной температуре.
После получения таким образом карбоната лития, карбонат лития можно отфильтровать и промыть.
В этом случае в фильтрате и фильтрате промывочного раствора может присутствовать остаточный литий. Этот остаточный литий может быть выделен в виде фосфата лития, растворимость которого ниже, чем у карбоната лития.
Способ выделения фосфата лития будет описан ниже.
Кроме того, литий может быть извлечен в виде фосфата лития путем добавления исходного материала фосфора к раствору гидроксида лития, в котором смешиваются фильтрат гидроксида лития и фильтрат промывочного раствора гидроксида лития согласно одному варианту осуществления настоящего изобретения.
Реакция осаждения карбоната лития может протекать, как показано на следующей Реакционной схеме 5.
Схема реакции 5
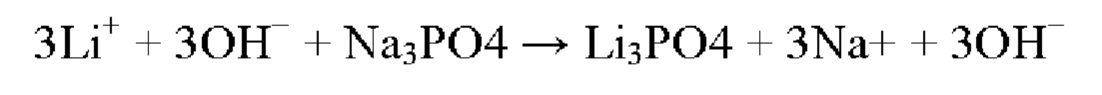
Фосфат натрия, который является одним из примеров исходного материала фосфора, реагирует с литием при комнатной температуре с получением и осаждением фосфата лития.
Конкретными примерами исходного материала фосфора являются фосфор, фосфорная кислота, фосфаты и фосфорсодержащие растворы.
Конкретными примерами фосфата являются фосфат калия, фосфат натрия и фосфат аммония (в частности, например, фосфат аммония может представлять собой (NR4)3PO4, где R может независимо представлять собой водород, дейтерий или замещенную или незамещенную С1-С10 алкильную группу).
Более конкретно, фосфат может представлять быть монофосфатом калия, дифосфатом калия, трифосфатом калия, одноосновным фосфатом натрия, двухосновным фосфатом натрия, трехосновным фосфатом натрия, фосфатом алюминия, фосфатом цинка, полифосфатом аммония, гексаметафосфатом натрия, монофосфатом кальция, дифосфатом кальция, трифосфатом кальция или тому подобным.
Исходный материал фосфора может представлять собой фосфорсодержащий водный раствор. Когда исходный материал фосфора представляет собой фосфорсодержащий водный раствор, он может легко реагировать с литием, содержащимся в растворе гидроксида лития, с получением и осаждением фосфата лития.
Вводимое количество исходного материала угольной кислоты может составлять один эквивалент или более по отношению к содержанию лития в растворе гидроксида лития. Когда вышеуказанный диапазон удовлетворителен, это может быть преимуществом с точки зрения степени реакции.
Осажденный карбонат лития может быть отделен от реакционного раствора фильтрованием.
Кроме того, этап извлечения остаточного лития путем его осаждения в виде фосфата лития путем добавления исходного материала фосфора к раствору гидроксида лития можно проводить при комнатной температуре.
В настоящем описании комнатная температура не означает конкретную температуру, а означает температуру без добавления внешней энергии. Поэтому комнатная температура может меняться в зависимости от места и времени.
Далее будут описаны иллюстративные варианты осуществления настоящего изобретения и сравнительные примеры. Однако следующие примерные варианты осуществления являются только примерами настоящего изобретения, и настоящее изобретение ими не ограничивается.
Пример 1
Чтобы измерить степень превращения карбоната лития в гидроксид лития в соответствии с введенным количеством карбоната лития при получении водного раствора гидроксида лития согласно приведенной выше схеме реакции 1, карбонат лития и гидроксид кальция добавляют к 1 л воды, как показано в Таблице 1 и перемешивают в течение пяти часов при комнатной температуре (21°С).
После завершения реакции собирают образцы реакционного раствора и после фильтрования образцов измеряют концентрацию лития в фильтратах реакционного раствора. Зная вводимое количество карбоната лития в каждый реакционный раствор, и концентрацию лития в растворе после завершения реакции, рассчитывают степень превращения карбоната лития в гидроксид лития, и результаты показаны в Таблице 1 и на Фиг. 1.
Ссылаясь на Фиг. 1 можно увидеть, что когда вводимое количество карбоната лития составляло 80 г или менее, большая часть вводимого карбоната лития превращалась в гидроксид лития, и, следовательно, степень превращения гидроксида лития составляла почти 100%.

С другой стороны, когда вводимое количество карбоната лития составляет 80 г или более, наблюдают тенденцию к снижению степени превращения гидроксида лития, и когда вводимое количество карбоната лития составляло 188 г, наблюдают, что степень превращения гидроксида лития резко снижалась до 39,8%. Эти результаты подтверждают, что при получении водного раствора гидроксида лития, как показано на приведенной выше Схеме реакции 1, предпочтительно ограничивать вводимое количество карбоната лития в пределах определенного диапазона.
Пример 2
Для получения высококонцентрированного раствора гидроксида лития 54 г карбоната лития и 57 г гидроксида кальция добавляют к 1 л дистиллированной воды и перемешивают при комнатной температуре (21°С) в течение пяти часов.
Образцы реакционного раствора отбирают с 30-минутными интервалами, и после фильтрации образцов измеряют рН и концентрацию лития. Результаты приведены в Таблице 2 ниже и Фиг. 2. На Фиг. 2 можно увидеть, что наблюдалась тенденция постепенного увеличения концентрации остаточного лития в реакционном растворе по мере увеличения времени реакции, но после того, как время реакции превысило четыре часа, концентрация лития больше не увеличивалась.
Из этих результатов можно увидеть, что карбонат лития реагирует с гидроксидом кальция при комнатной температуре с получением гидроксида лития. При этом осадок, полученный фильтрованием реакционного раствора, промывают дистиллированной водой, затем сушат при 105°С в течение 24 часов и исследуют минеральную фазу с помощью рентгеноструктурного анализа.
На Фиг. 3 можно увидеть, что карбонат лития и гидроксид кальция реагируют с получением карбоната кальция. Как описано выше, было подтверждено, что можно экономично получать высококонцентрированный водный раствор гидроксида лития с использованием карбоната лития и гидроксида кальция при комнатной температуре на простом оборудовании с низкими энергозатратами.

Пример 3
Для получения порошка моногидрата гидроксида лития (LiOHH2O) высококонцентрированный раствор гидроксида лития помещают в колбу при пониженном давлении 35 мбар, и колбу погружают в горячую воду с температурой 50°С и вращают для испарения воды, таким образом концентрируя литий.
По мере испарения воды концентрация лития в растворе гидроксида лития увеличивалась, и после того, как концентрация лития достигает 37 г/л, гидроксид лития начинает осаждаться.
Суспензию после выпаривания, в которой осаждают гидроксид лития, разделяют на осадок гидроксида лития и фильтрат путем фильтрации. Для промывания отфильтрованного гидроксида лития 100 г отфильтрованного гидроксида лития смешивают со 100 мл дистиллированной воды и перемешивают. После перемешивания в течение одного часа промывочный раствор гидроксида лития фильтруют и таким образом разделяют на гидроксид лития и фильтрат промывочного раствора.
После завершения промывания гидроксид лития сушат при комнатной температуре в вакуумном эксикаторе, и после завершения высушивания минеральную фазу порошка гидроксида лития анализируют с помощью рентгеноструктурного анализа, и результаты показаны на Фиг. 4.
Пример 4
Концентрацию лития в фильтрате гидроксида лития и в фильтрате промывочного раствора гидроксида лития из примера 3 измеряют, и результаты представлены в Таблице 3.

Можно увидеть, что фильтрат гидроксида лития и фильтрат промывочного раствора гидроксида лития содержат большое количество лития и, таким образом, имеют очень высокие концентрации лития: 37,1 г/л и 36,8 г/л, соответственно.
Следовательно, чтобы извлечь из них литий, фильтрат гидроксида лития и фильтрат промывочного раствора гидроксида лития смешивают. После добавления 340 г/л карбоната натрия к смешанному раствору полученную смесь перемешивают при комнатной температуре в течение четырех часов для осаждения карбоната лития. Осажденный карбонат лития фильтруют, промывают и сушат, и затем его минеральную фазу анализируют с использованием рентгеноструктурного анализа, и результаты показаны на Фиг. 5.
В следующей Таблице 4 показана концентрация лития в смешанном растворе фильтрата гидроксида лития и фильтрата промывочного раствора гидроксида лития, и концентрация лития в фильтрате реакционного раствора после добавления для извлечения лития, содержащегося в смешанном растворе, 340 г карбоната натрия к 1 л смешанного раствора и перемешивания при комнатной температуре в течение четырех часов, что приводит к осаждению карбоната лития.

Как показано в Таблице 4, в результате осаждения карбоната лития путем добавления карбоната натрия к фильтрату раствора для осаждения гидроксида лития и фильтрату промывочного раствора гидроксида лития, литий выделяют с высокой степенью извлечения 92,1%.
Таким образом, поскольку большую часть количества лития, содержащегося в фильтрате гидроксида лития и фильтрате промывочного раствора, извлекают в виде карбоната лития при комнатной температуре, можно эффективно предотвращать потерю большого количества лития, которая может произойти в процессе получения гидроксида лития на простом оборудовании с низкими энергозатратами.
Пример 5
В следующей Таблице 5 показана концентрация лития в смешанном растворе фильтрата гидроксида лития и фильтрата промывочного раствора гидроксида лития, и концентрация лития в фильтрате реакционного раствора после добавления для выделения лития, содержащегося в смешанном растворе, 351 г фосфата натрия к 1 л смешанного раствора и перемешивании при комнатной температуре в течение четырех часов, что приводит к осаждению фосфата лития.

Было замечено, что фильтрат гидроксида лития и фильтрат промывочного раствора гидроксида лития имеют очень высокие концентрации лития 37 г/л и 36,8 г/л соответственно, что указывает на то, что содержалось большое количество лития.
Поэтому для извлечения лития фильтрат гидроксида лития и фильтрат промывочного раствора гидроксида лития смешивают при комнатной температуре и добавляют 351 г фосфата натрия к 1 л смешанного раствора для осаждения фосфата лития.
Осажденный фосфат лития фильтруют, промывают и сушат, и затем его минеральную фазу анализируют с использованием рентгеноструктурного анализа, и результаты показаны на Фиг. 6.
Как показано в Таблице 5, в результате осаждения фосфата лития путем добавления фосфата натрия к фильтрату раствора для осаждения гидроксида лития и фильтрату промывочного раствора гидроксида лития, литий выделяют с высокой степенью извлечения 98,1%.
Таким образом, поскольку большую часть количества лития, содержащегося в фильтрате гидроксида лития и фильтрате промывочного раствора, извлекают в виде фосфата лития при комнатной температуре, можно эффективно предотвращать потерю большого количества лития, которая может произойти в процессе получения гидроксида лития, на простом оборудовании с низкими энергозатратами.
Пример 6
Суспензию карбоната лития, полученную добавлением карбоната натрия к фильтрату гидроксида лития и фильтрату промывочного раствора гидроксида лития из примера 4, фильтруют и таким образом разделяют на осадок карбоната лития и фильтрат.
Для промывания отфильтрованного карбоната лития смешивают и перемешивают 100 г карбоната лития и 100 мл дистиллированной воды. После перемешивания в течение одного часа промывочный раствор карбоната лития фильтруют и таким образом разделяют на карбонат лития и фильтрат промывочного раствора. Концентрацию лития в фильтрате карбоната лития и фильтрате промывочного раствора измеряют, и результаты представлены в таблице 6.

Было обнаружено, что фильтрат карбоната лития и фильтрат промывочного раствора карбоната лития содержат литий и имеют концентрации лития 2,9 г/л и 2,45 г/л соответственно.
Следовательно, чтобы извлечь из них литий, смешивают фильтрат карбоната лития и фильтрат промывочного раствора карбоната лития. После добавления 26 г/л фосфата натрия к смешанному раствору, полученную смесь перемешивают при комнатной температуре в течение четырех часов для осаждения фосфата лития. Осажденный фосфат лития фильтруют, промывают и сушат, и затем его минеральную фазу анализируют с использованием рентгеноструктурный анализа, и результаты показаны на Фиг. 7.
В следующей Таблице 7 показана концентрация лития в смешанном растворе фильтрата карбоната лития и фильтрата промывочного раствора, и концентрация лития в фильтрате реакционного раствора после добавления для выделения лития, содержащегося в смешанном растворе, 26 г фосфата натрия к 1 л смешанного раствора и перемешивании при комнатной температуре в течение четырех часов, что приводит к осаждению фосфата лития.

Как показано в Таблице 7, в результате осаждения фосфата лития путем добавления фосфата натрия к фильтрату раствора для осаждения карбоната лития и фильтрату промывочного раствора карбоната лития, литий выделяют с высокой степенью извлечения 70%.
Таким образом, поскольку большую часть количества лития, содержащегося в фильтрате карбоната лития и фильтрате промывочного раствора, извлекают в виде фосфата лития при комнатной температуре, можно эффективно предотвращать потерю лития, которая может произойти в процессе получения гидроксида лития, на простом оборудовании с низкими энергозатратами.
Настоящее изобретение не ограничивается иллюстративными вариантами осуществления, описанными выше, и может быть модифицировано в различных формах, и специалистам в области техники, к которой относится настоящее изобретение, может быть понятно, что приведенные в качестве примеров варианты осуществления могут быть реализованы в других конкретных формах без изменения технического замысла или существенных признаков настоящего изобретения. Поэтому следует понимать, что примерные варианты осуществления, описанные выше, являются примерными во всех отношениях и без ограничений.
Реферат
Изобретение относится к способу получения гидроксида лития. Способ включает реакцию в воде карбоната лития и гидроксида кальция с получением водного раствора гидроксида лития, при этом концентрация карбоната лития в воде находится в диапазоне от 25 до 110 г/л. Способ позволяет получить гидроксид лития из карбоната лития с использованием небольшого количества энергии и высокой степенью извлечения лития. 11 з.п. ф-лы, 7 ил., 7 табл., 6 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ получения гидроксида лития высокой чистоты и соляной кислоты
Способ получения гидроксида лития и карбоната лития

Комментарии