Способы обработки красного шлама - RU2579843C2
Код документа: RU2579843C2
Чертежи



Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет на основании заявок на патент США №61/584993, поданной 10 января 2012 года, №61/706074, поданной 26 сентября 2012 года и №61/713719, поданной 15 октября 2012 года. Содержание указанных документов включено в настоящую заявку во всей полноте посредством ссылок.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к улучшениям в области способов обработки промышленных отходов. Например, оно относится к способам обработки красного шлама. Например, указанные способы могут быть эффективными для экстракции различных материалов из красного шлама, таких как оксид алюминия и различные металлы и их оксиды, оксид кремния, редкоземельные элементы, редкие металлы и т.д.
УРОВЕНЬ ТЕХНИКИ
[0003] Красный шлам представляет собой твердые отходы, получаемые в процессе получения оксида алюминия. Например, красный шлам образуется в процессе Байера при получении оксида алюминия, который является основным промышленным способом обработки боксита с получением оксида алюминия в качестве сырья для электролиза алюминия в процессе Холла-Эру. Как правило, количество красного шлама, производимого на заводах, в один-два раза превосходит количество оксида алюминия. Это отношение зависит от типа боксита или руды, используемых в способе обработки.
[0004] В целом, красный шлам содержит смесь твердых примесей, содержащих оксиды металлов, и представляет одну из наиболее важных проблем для алюминиевой промышленности. Красный цвет может быть вызван, например, присутствием окисленных форм железа. Красный шлам нелегко утилизировать. В большинстве стран, в которых производят красный шлам, его выкачивают в пруды-отстойники. Таким образом, это и является главной проблемой красного шлама, так как он занимает площади, на которых не возможна строительная или сельскохозяйственная деятельность даже после их осушения. Красный шлам, например, является высокоосновным. Например, рН может находиться в диапазоне от 10 до 13. Было разработано несколько способов снижения щелочного рН до приемлемого уровня для уменьшения воздействия на окружающую среду. Для поиска подходящего способа утилизации шлама для его дальнейшего применения проводился ряд исследований, но сушка шлама требует больших количеств энергии (скрытая теплота испарения воды) и может быть высоко затратной, если в способе сушки необходимо использовать ископаемое топливо.
[0005] По всему миру наблюдают рост количества красного шлама. Только в 2010 году в мире было произведено 80 миллионов тонн оксида алюминия, что дает более 120 миллионов тонн красного шлама. По оценкам, количество красного шлама по всему миру фактически составляет уже более 2,5 миллиардов тонн. И это значение будет только расти, так как растущие потребности в алюминии определяют потребности в оксиде алюминия, то есть и в боксите, что означает повышение производства токсичных отходов красного шлама.
[0006] Таким образом, существует необходимость в альтернативном способе обработки красного шлама.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0007] Согласно одному из аспектов предложен способ обработки красного шлама, включающий:
выщелачивание красного шлама с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости; и
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3.
[0008] Согласно другому аспекту предложен способ обработки красного шлама, включающий:
выщелачивание красного шлама с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости; и
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и выделение получаемой таким образом газообразной HCl.
[0009] Согласно другому аспекту предложен способ обработки красного шлама, включающий:
выщелачивание красного шлама с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости; и
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и выделение получаемой таким образом газообразной HCl.
[0010] Согласно другому аспекту предложен способ обработки красного шлама, включающий:
выщелачивание красного шлама с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости; и
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и выделение получаемой таким образом газообразной HCl.
[0011] Согласно другому аспекту предложен способ получения оксида алюминия и/или других продуктов, включающий:
выщелачивание красного шлама с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости; и
нагревание осадка в условиях, эффективных для превращения AlCl3 и Al2O3, и выделение получаемой таким образом газообразной HCl.
[0012] Согласно одному из аспектов предложен способ получения алюминия, включающий:
выщелачивание красного шлама с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, эффективных для превращения AlCl3 и Al2O3; и
обработку Al2O3 в условиях, эффективных для его превращения в алюминий.
[0013] Согласно другому аспекту предложен способ получения алюминия, включающий:
выщелачивание красного шлама с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и выделение получаемой таким образом газообразной HCl; и
обработку Al2O3 в условиях, эффективных для его превращения в алюминий.
[0014] Согласно другому аспекту предложен способ обработки красного шлама, включающий:
выщелачивание красного шлама с использованием кислоты с получением таким образом продукта выщелачивания и твердого остатка и отделение продукта выщелачивания от твердого остатка;
по меньшей мере частичное удаление ионов железа из продукта выщелачивания путем по существу селективного осаждения ионов железа при рН более 10 посредством взаимодействия продукта выщелачивания с основанием и по меньшей мере частичное удаление осажденных ионов железа из продукта выщелачивания с получением, тем самым, композиции, обогащенной Al, содержащей ионы Al3+;
необязательно очистку ионов Al3+; и
необязательно превращение ионов Al3+ в оксид алюминия.
[0015] Согласно другому аспекту предложен способ получения оксида алюминия и необязательно других продуктов, включающий:
выщелачивание алюминийсодержащего материала с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и выделение получаемой таким образом газообразной HCl; и
повторное использование полученной таким образом газообразной HCl путем приведения ее в контакт с водой с получением таким образом композиции, имеющей концентрацию HCl, превышающую азеотропную концентрацию (20,2 масс. %), и взаимодействие композиции с дополнительным количеством алюминийсодержащего материала для его выщелачивания.
[0016] Согласно другому аспекту предложен способ получения оксида алюминия и необязательно других продуктов, включающий:
выщелачивание алюминийсодержащего материала с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и выделение получаемой таким образом газообразной HCl; и
повторное использование полученной в указанных условиях газообразной HCl путем приведения ее в контакт с водой для получения таким образом композиции, имеющей концентрацию от примерно 18 до примерно 45 масс. % или от примерно 25 до примерно 45 масс. %, и взаимодействие композиции с дополнительным количеством алюминийсодержащего материала для его выщелачивания.
[0017] Согласно другому аспекту предложен способ получения оксида алюминия и необязательно других продуктов, включающий:
выщелачивание алюминийсодержащего материала с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и выделение получаемой таким образом газообразной HCl; и
повторное использование полученной таким образом газообразной HCl путем приведения ее в контакт с водой с получением таким образом композиции, имеющей концентрацию от примерно 18 до примерно 45 масс. % или от примерно 25 до примерно 45 масс. %, и использование композиции для выщелачивания алюминийсодержащего материала.
[0018] Согласно другому аспекту предложен способ получения оксида алюминия и необязательно других продуктов, включающий:
выщелачивание алюминийсодержащего материала с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и выделение получаемой таким образом газообразной HCl; и
повторное использование полученной таким образом газообразной HCl путем приведения ее в контакт с продуктом выщелачивания для осаждения таким образом ионов алюминия в виде AlCl3·6Н2О.
[0019] Согласно другому аспекту предложен способ получения оксида алюминия и необязательно других продуктов, включающий:
выщелачивание алюминийсодержащего материала с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости; и
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3.
[0020] Согласно другому аспекту предложен способ получения оксида алюминия и необязательно других продуктов, включающий:
выщелачивание алюминийсодержащего материала с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и выделение осадка из жидкости; и
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и необязательно выделение получаемой таким образом газообразной HCl.
[0021] Согласно одному из аспектов предложен способ получения алюминия и необязательно других продуктов, включающий:
выщелачивание алюминийсодержащего материала с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и
превращение Al2O3 в алюминий.
[0022] Согласно другому аспекту предложен способ получения алюминия и необязательно других продуктов, включающий:
выщелачивание алюминийсодержащего материала с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и необязательно выделение получаемой в этих условиях газообразной HCl; и
превращение Al2O3 в алюминий.
[0023] Согласно другому аспекту предложен способ получения алюминия, включающий:
получение оксида алюминия при помощи раскрытого здесь способа; и
обработку оксида алюминия в условиях, эффективных для его превращения в алюминий.
[0024] Согласно другому аспекту предложен способ обработки красного шлама, включающий:
выщелачивание красного шлама, содержащего первый металл, с использованием HCl с получением таким образом продукта выщелачивания, содержащего ионы первого металла и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением таким образом жидкости и осадка, содержащего хлорид первого металла, и отделение осадка от жидкости; и
нагревание осадка в условиях, эффективных для превращения хлорида первого металла в оксид первого металла.
[0025] Согласно другому примеру предложен способ получения оксида титана, включающий:
выщелачивание красного шлама с использованием HCl с получением таким образом первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, и выделение твердого вещества из первого продукта выщелачивания;
выделение по меньшей мере по существу ионов по меньшей мере одного металла из первого продукта выщелачивания;
выщелачивание твердого вещества с использованием HCl необязательно в присутствии хлорида с получением таким образом второго продукта выщелачивания, содержащего хлорид титана; или взаимодействие твердого вещества с Cl2 и источником углерода с получением таким образом жидкой фракции, содержащей хлорид титана, и твердой фракции, и отделение жидкой фракции от твердой фракции; и
превращение хлорида титана в оксид титана.
[0026] Согласно другому примеру предложен способ получения оксида титана, включающий:
выщелачивание красного шлама с использованием HCl с получением таким образом первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, и выделение твердого вещества из первого продукта выщелачивания;
выделение по меньшей мере по существу ионов по меньшей мере одного металла из первого продукта выщелачивания;
выщелачивание твердого вещества с использованием HCl необязательно в присутствии хлорида с получением таким образом второго продукта выщелачивания, содержащего хлорид титана; и
превращение хлорида титана в оксид титана.
[0027] Согласно другому примеру предложен способ получения хлорида титана, включающий:
выщелачивание красного шлама с использованием HCl с получением таким образом первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, и выделение твердого вещества из первого продукта выщелачивания;
выделение по меньшей мере по существу ионов по меньшей мере одного металла из продукта выщелачивания; и
выщелачивание твердого вещества с использованием HCl необязательно в присутствии хлорида с получением таким образом второго продукта выщелачивания, содержащего хлорид титана.
[0028] Согласно другому примеру предложен способ получения хлорида титана, включающий:
выщелачивание красного шлама с использованием HCl с получением таким образом первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
выделение по меньшей мере по существу ионов по меньшей мере одного металла из первого продукта выщелачивания; и
взаимодействие твердого вещества с Cl2 и источником углерода с получением таким образом жидкой фракции, содержащей хлорид титана, и твердой фракции и отделение жидкой фракции от твердой фракции.
[0029] Было обнаружено, что способы согласно настоящему изобретению могут подходить для обработки различных исходных материалов, таких как различные руды. Кроме того, было обнаружено, что помимо эффективности обработки указанных исходных материалов существует возможность обработки промышленных отходов, таких как красный шлам, при помощи указанных способов. Фактически, было обнаружено, что способы согласно настоящему изобретению являются эффективными для решения проблемы красного шлама: указанные способы обеспечивают его эффективную обработку и выделение различных ценных продуктов из красного шлама. Указанные способы являются простыми, эффективными, и их можно проводить с низкими затратами без вреда для окружающей среды.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0030] На следующих чертежах, на которых исключительно в качестве примеров приведены различные варианты реализации изобретения:
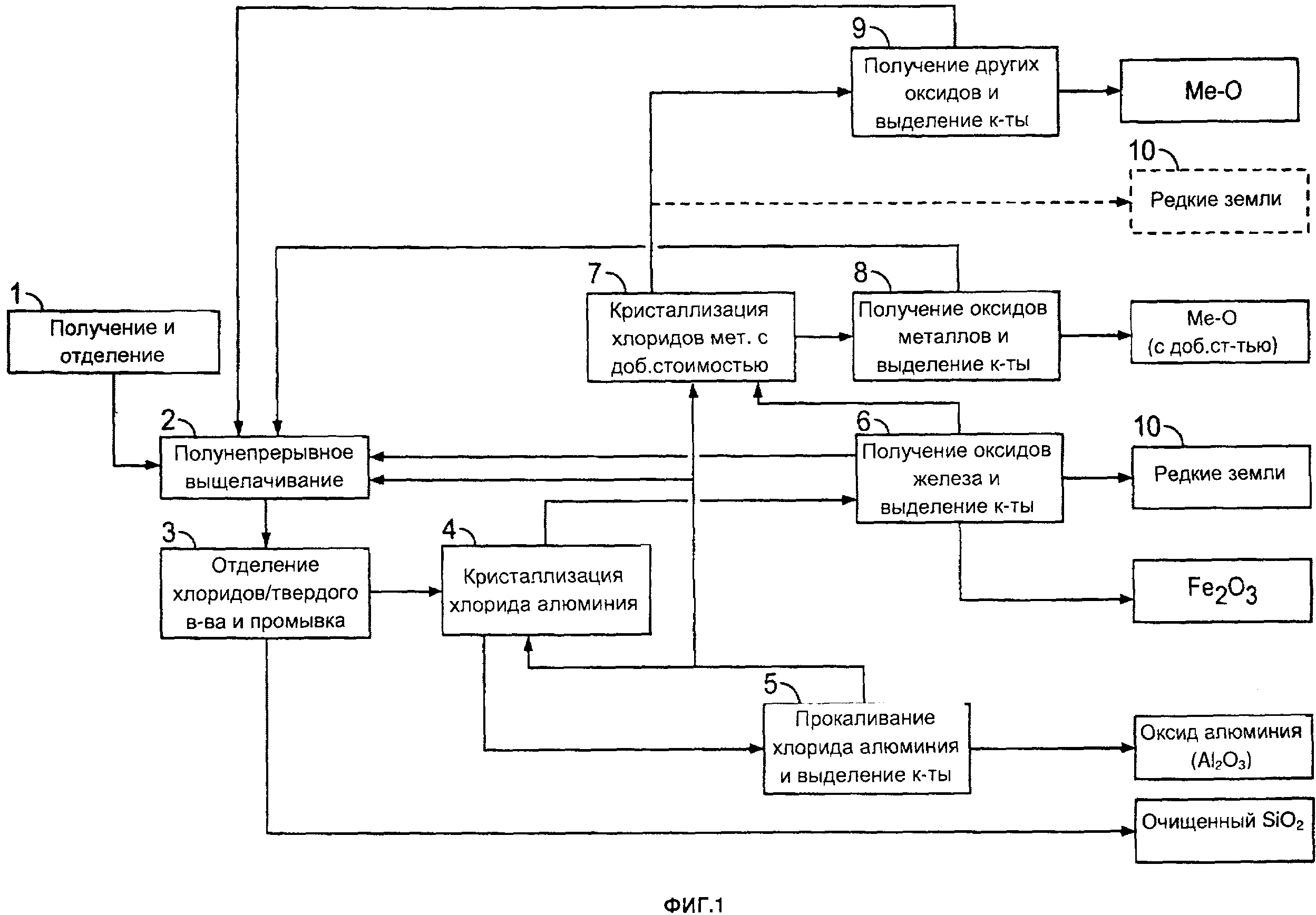
[0031] На фиг. 1 приведена блок-схема одного из примеров способа получения оксида алюминия и различных других продуктов согласно настоящему изобретению;
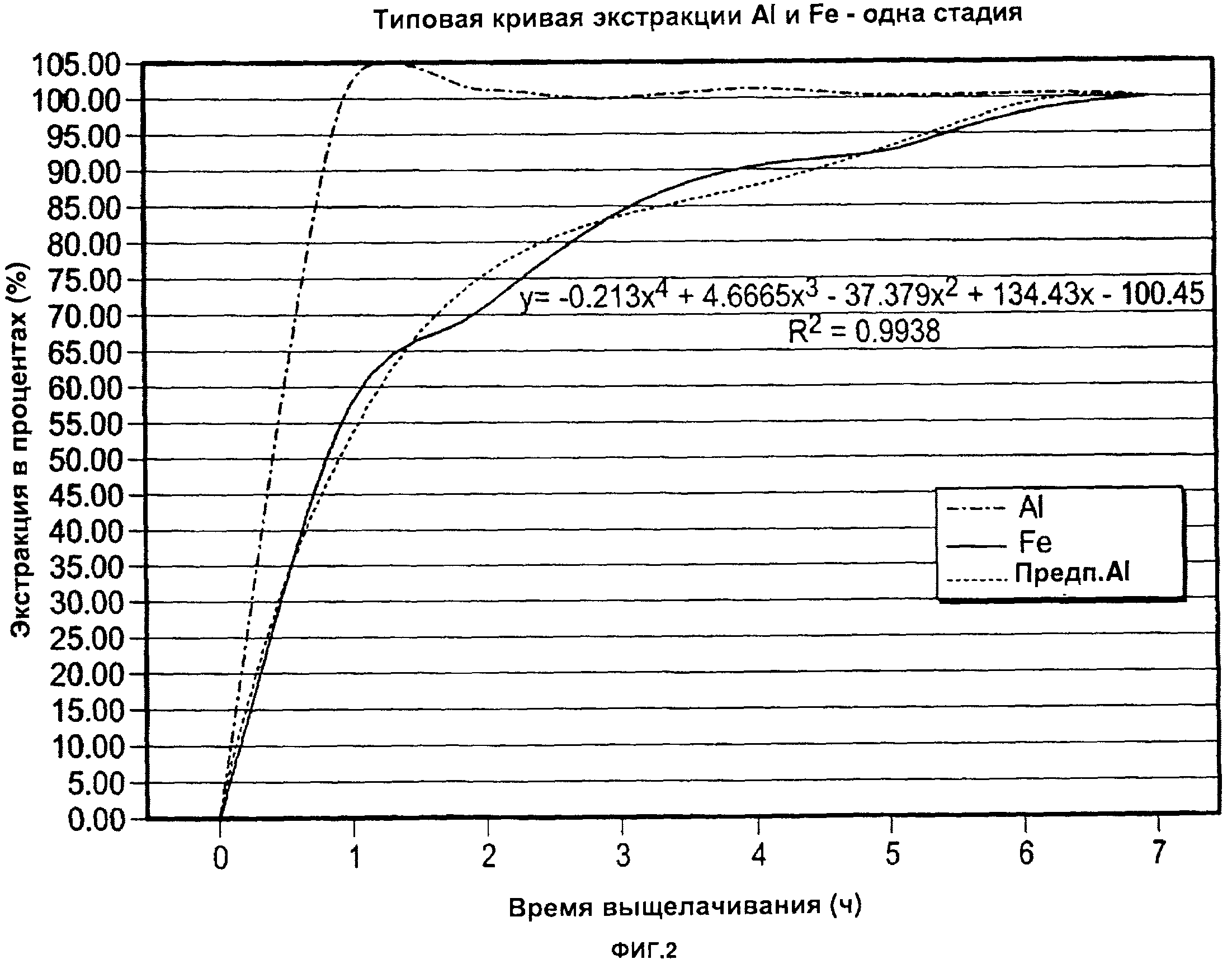
[0032] На фиг. 2 приведена кривая экстракции Al и Fe, где показана зависимость экстракции в процентах от времени выщелачивания в способе согласно одному из примеров, приведенных в настоящей заявке;
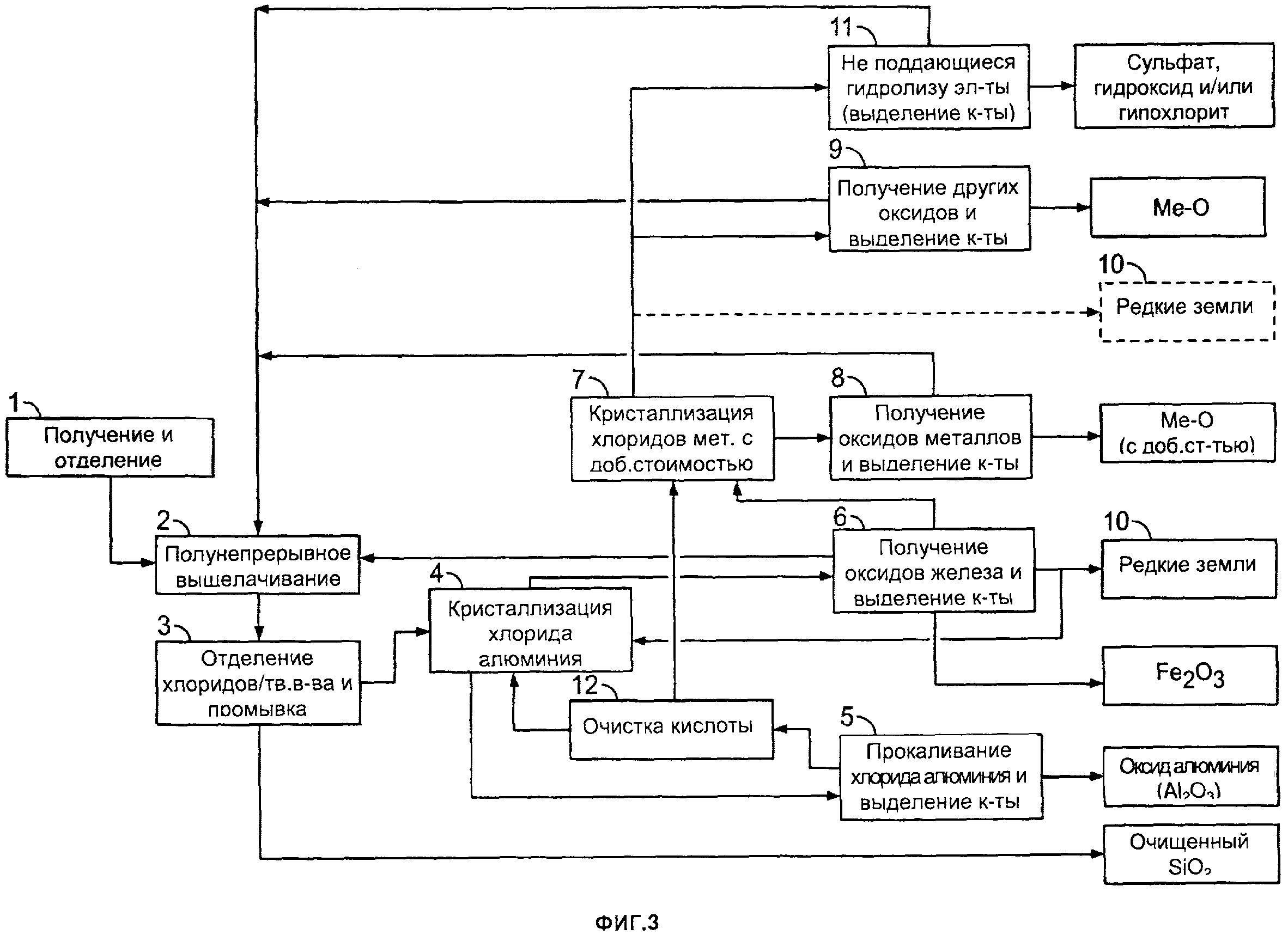
[0033] На фиг. 3 приведена блок-схема другого примера способа получения оксида алюминия и различных других продуктов согласно настоящему изобретению;
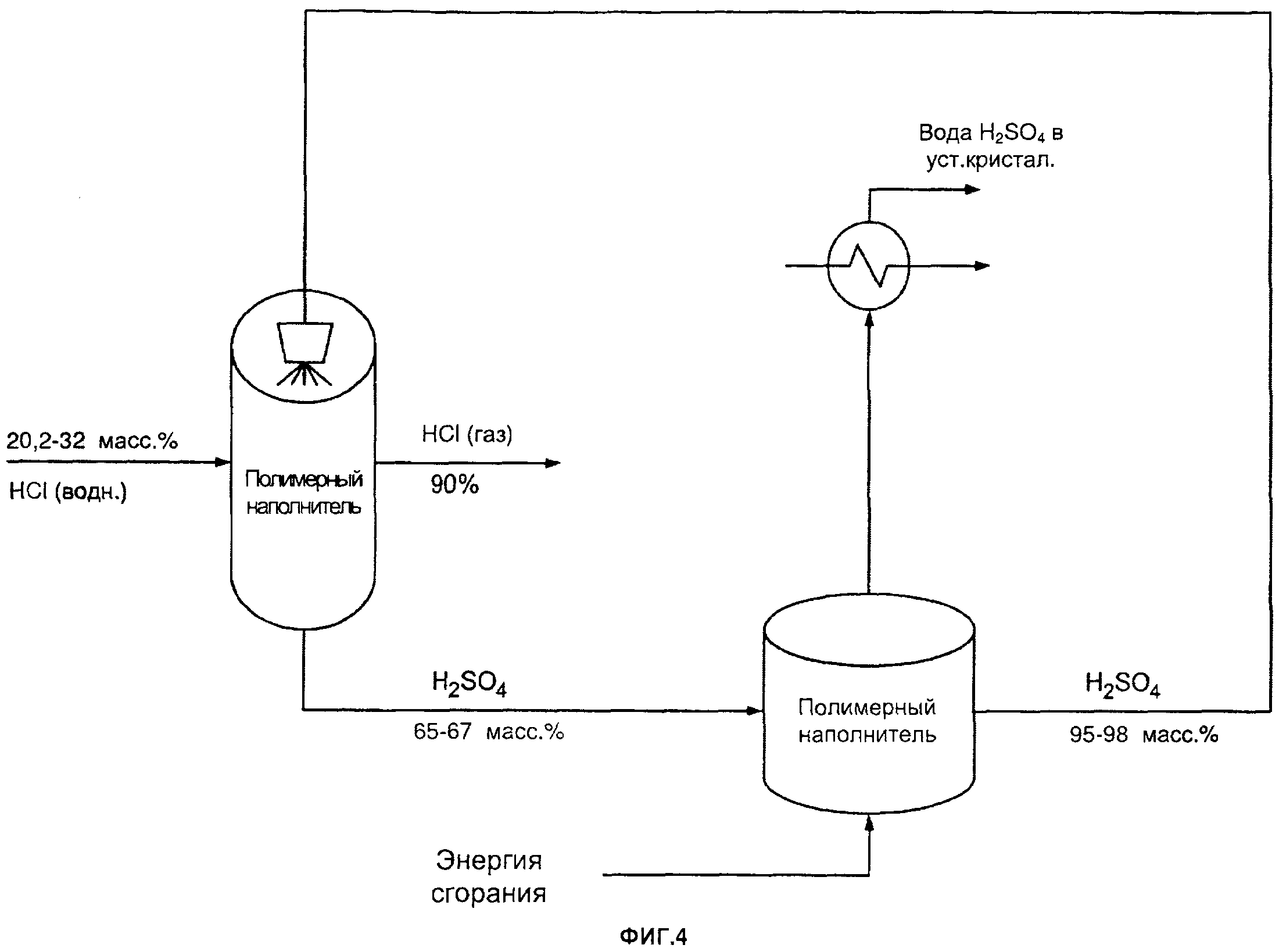
[0034] На фиг. 4 схематически изображен один из примеров способа очистки/концентрирования HCl согласно настоящему изобретению;
[0035] На фиг. 5 схематически изображен один из примеров способа очистки/концентрирования HCl согласно настоящему изобретению;
[0036] На фиг. 6 приведена другая блок-схема одного из примеров способа получения оксида алюминия и различных других продуктов согласно настоящему изобретению;
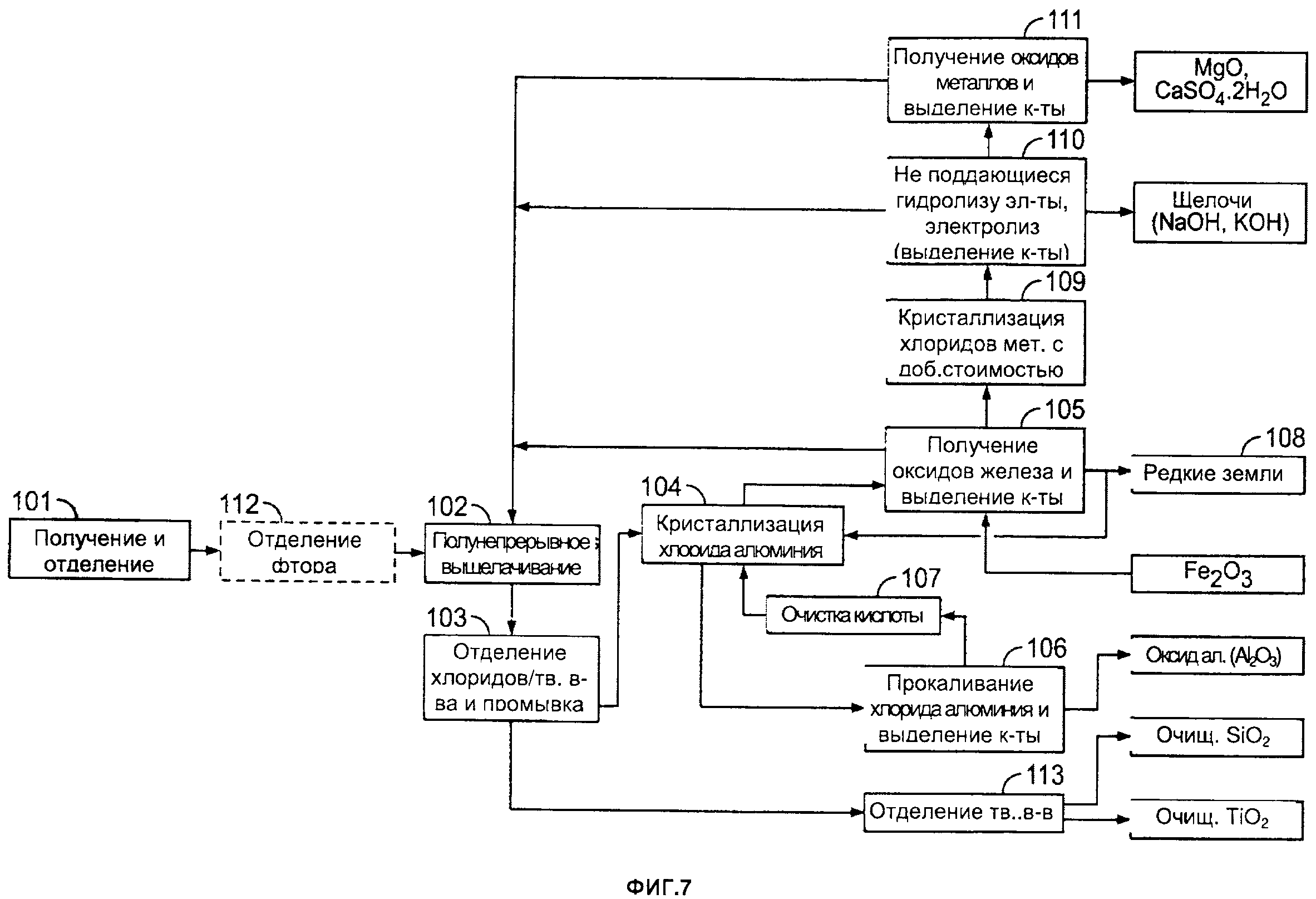
[0001] На фиг. 7 приведена другая блок-схема одного из примеров способа получения оксида алюминия и различных других продуктов согласно настоящему изобретению;
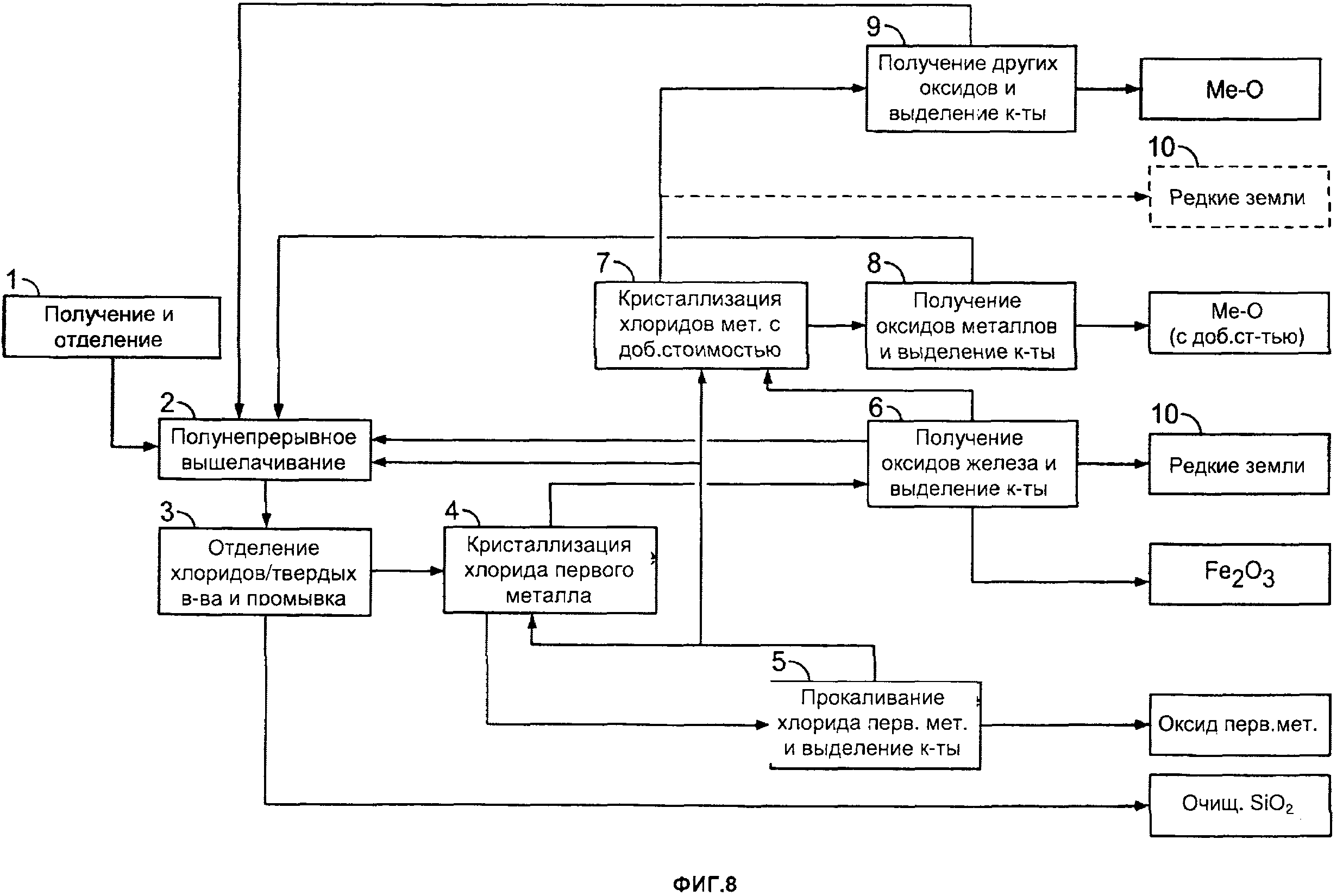
[0002] На фиг. 8 приведена другая блок-схема одного из примеров способа получения различных продуктов согласно настоящему изобретению;
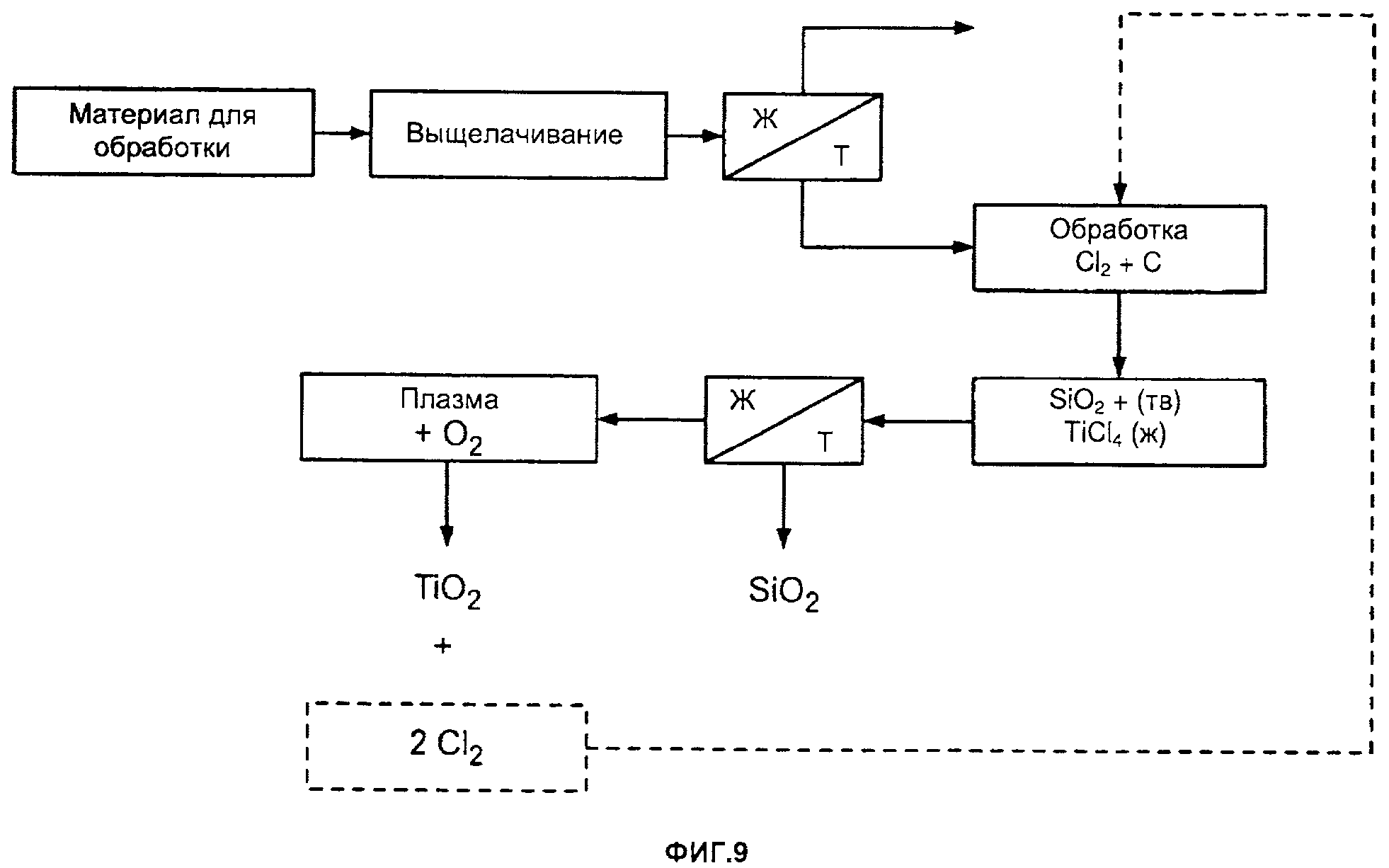
[0003] На фиг. 9 приведена другая блок схема одного из примеров способа получения хлорида титана и/или оксида титана согласно настоящему изобретению;
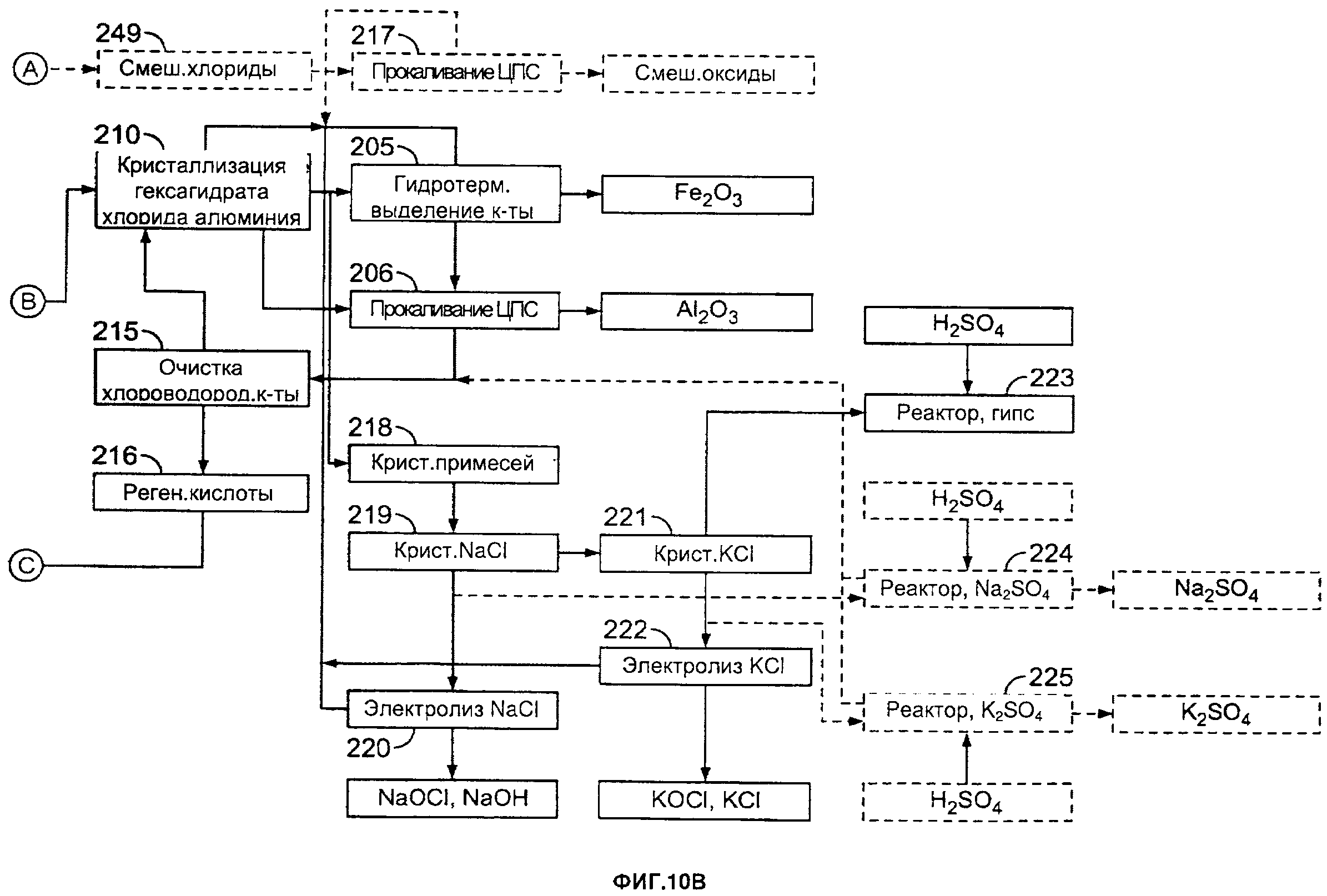
[0004] На фиг. 10А и 10В приведена дополнительная блок-схема одного из примеров способа согласно настоящему изобретению; и
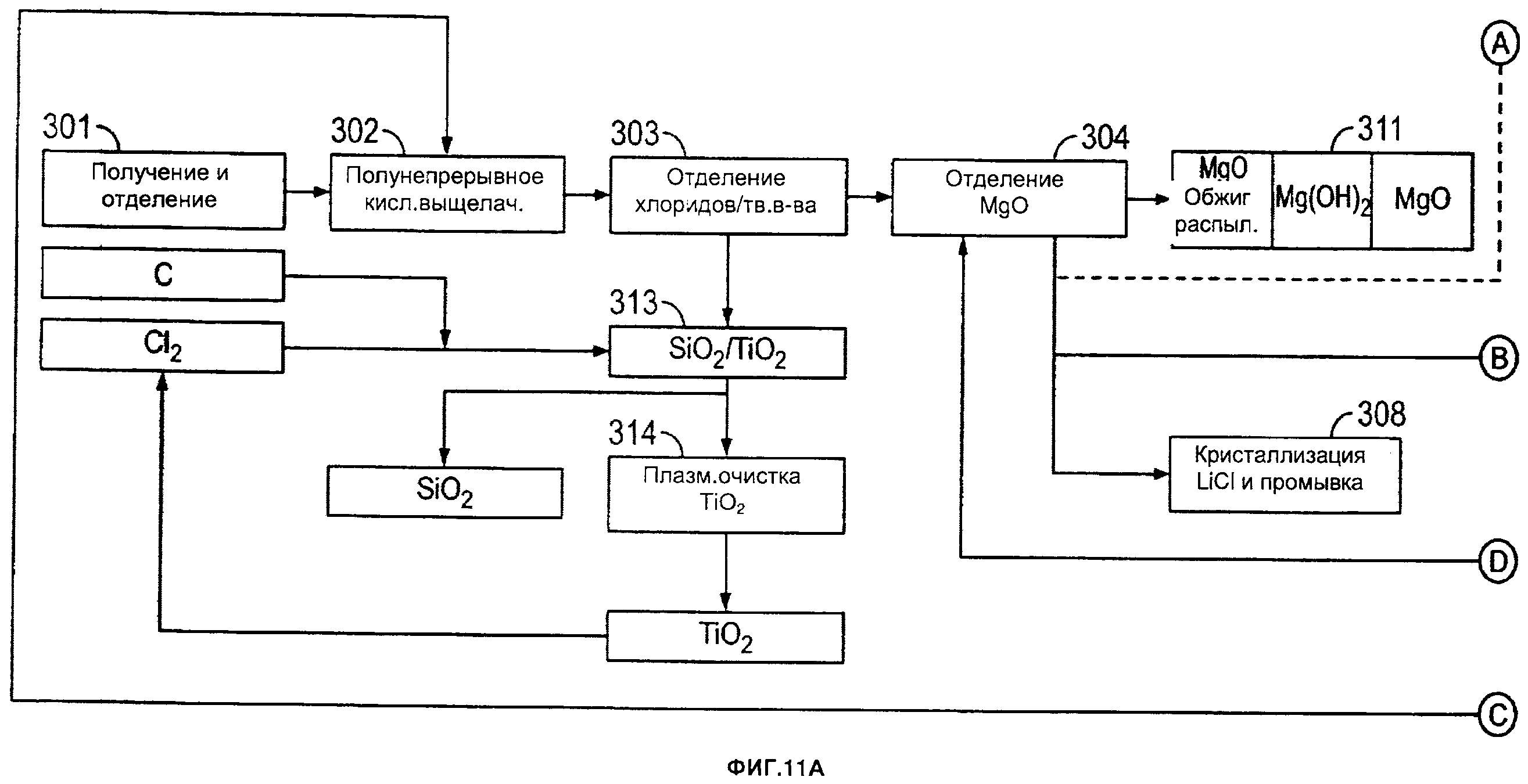
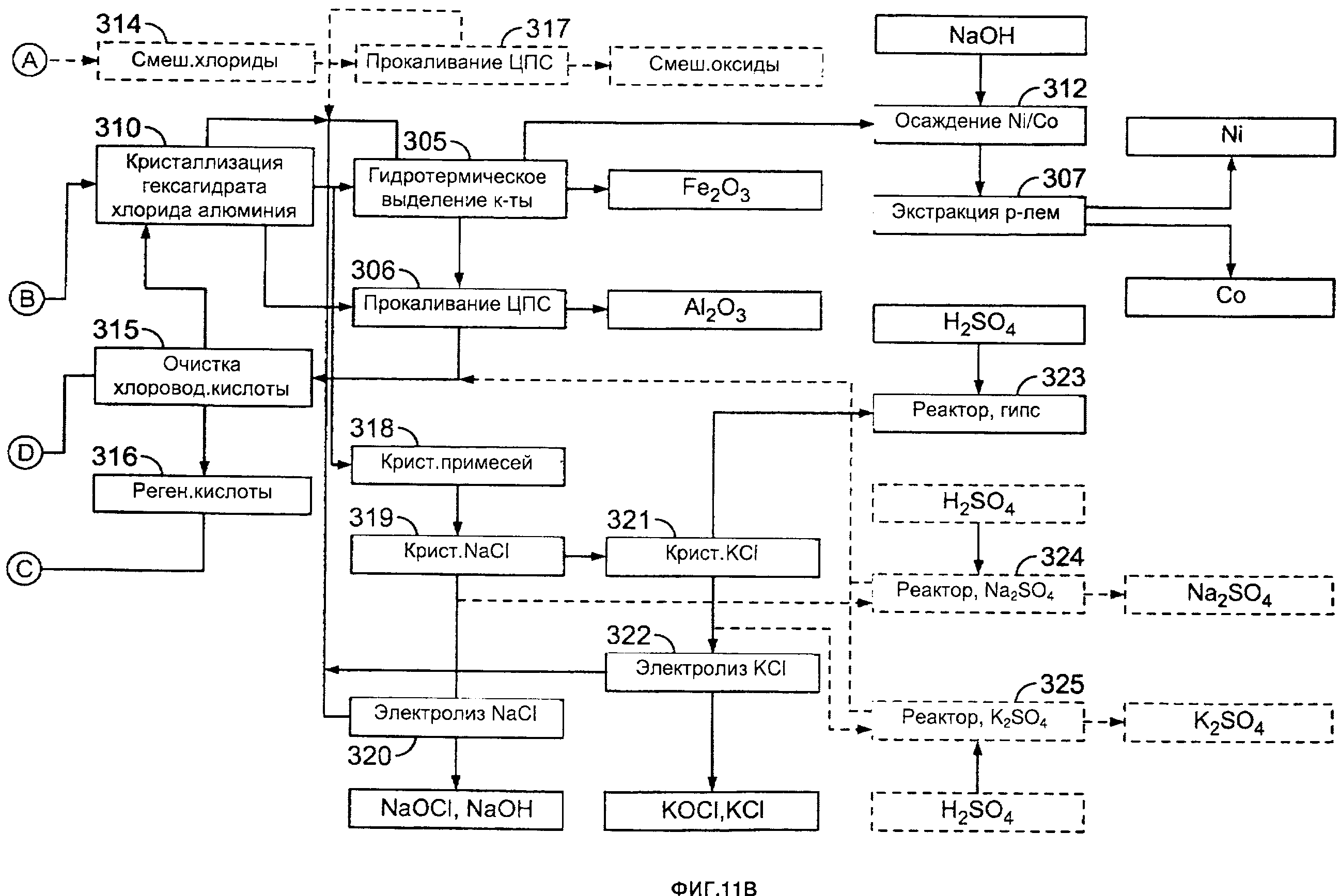
[0005] На фиг. 11А и 11В приведена другая блок-схема одного из примеров способа согласно настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ РАЗЛИЧНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
[0006] Следующие неограничивающие примеры дополнительно иллюстрируют технологию, описанную в настоящем изобретении.
[0007] Алюминийсодержащий материал, например, может быть выбран из алюминийсодержащих руд (можно применять, например, алюмосиликатные минералы, глины, аргиллит, нефелин, сланец, берилл, криолит, гранат, шпинель, боксит, каолин или их смеси). Алюминийсодержащий материал также может представлять собой используемый повторно промышленный алюминийсодержащий материал, такой как шлак, красный шлам или зольная пыль.
[0008] Выражение «красный шлам», используемое в настоящем описании, относится, например, к промышленным отходам, полученным при производстве оксида алюминия. Например, указанные отходы могут содержать оксид кремния, алюминий, железо, кальций и необязательно титан. Также они могут содержать множество незначительных компонентов, таких как Na, K, Cr, V, Ni, Со, Ва, Cu, Mn, Mg, Pb и/или Zn и т.д. Например, красный шлам может содержать от примерно 15 до примерно 80% по массе Fe2O3, от примерно 1 до примерно 35% по массе Al2O3, от примерно 1 до примерно 65% по массе SiO2, от примерно 1 до примерно 20% по массе Na2O, от примерно 1 до примерно 20% по массе СаО и от 0 до примерно 35% по массе TiO2. В другом примере красный шлам может содержать от примерно 30 до примерно 65% по массе Fe2O3, от примерно 10 до примерно 20% по массе Al2O3, от примерно 3 до примерно 50% по массе SiO2, от примерно 2 до примерно 10% по массе Na2O, от примерно 2 до примерно 8% по массе СаО и от 0 до примерно 25% по массе TiO2. Специалисты в данной области техники должны понимать, что состав красного шлама может изменяться в зависимости от природы боксита, используемого в процессе Байера.
[0009] Выражение «зольная пыль», используемое в настоящем описании, относится, например, к промышленным отходам, получаемым при сгорании. Например, указанные отходы могут содержать различные элементы, такие как оксид кремния, кислород, алюминий, железо, кальций. Например, зольная пыль может содержать диоксид кремния (SiO2) и оксид алюминия (Al2O3). Например, зольная пыль может дополнительно содержать оксид кальция (СаО) и/или оксид железа (Fe2O3). Например, зольная пыль может содержать мелкодисперсные частицы, поднимающиеся вместе с дымовыми газами. Например, зольная пыль может образовываться при сгорании угля. Например, зольная пыль также может содержать по меньшей мере один элемент, выбранный из мышьяка, бериллия, бора, кадмия, хрома, хрома VI, кобальта, свинца, марганца, ртути, молибдена, селена, стронция, таллия и/или ванадия. Например, зольная пыль также может содержать редкоземельные элементы и редкие металлы. Например, зольную пыль можно рассматривать как алюминийсодержащий материал.
[0010] Выражение «редкоземельный элемент» (также называемый «РЗЭ»), используемое в настоящем описании, относится, например, к редкому элементу, выбранному из скандия, иттрия, лантана, церия, празеодима, неодима, прометия, самария, европия, гадолиния, тербия, диспрозия, гольмия, эрбия, тулия, иттербия и лютеция. Выражение «редкие металлы», используемое в настоящем описании, относится, например, к редким металлам, выбранным из индия, циркония, лития и галлия. Указанные редкоземельные элементы и редкие металлы могут находиться в различных формах, таких как элементная форма (или металлическая форма), в форме хлоридов, оксидов, гидроксидов и т.д. Выражение «редкие земли», используемое в настоящем описании, является синонимом «редкоземельных элементов и редких металлов», описанных выше.
[0011] Выражение «по меньшей мере один хлорид железа», используемое в настоящем описании, относится к FeCl2, FeCl3 или их смеси.
[0012] Термин «гематит», используемый в настоящем описании, относится, например, к соединению, содержащему α-Fe2O3, γ-Fe2O3, β-FeO·ОН или их смеси.
[0013] Выражение «ионы железа», используемое в настоящем описании, относится, например, к ионам, содержащим по меньшей мере один тип иона железа, выбранный из всех возможных форм ионов Fe. Например, по меньшей мере один тип иона железа может представлять собой Fe2+, Fe3+ или их смесь.
[0014] Выражение «ионы алюминия», используемое в настоящем описании, относится, например, к ионам, содержащим по меньшей мере один тип иона алюминия, выбранный из всех возможных форм ионов Al. Например, по меньшей мере один тип иона алюминия может представлять собой Al3+.
[0015] Выражение «по меньшей мере один ион алюминия», используемое в настоящем описании, относится, например, по меньшей мере к одному типу иона алюминия, выбранному из всех возможных форм ионов Al. Например, по меньшей мере один ион алюминия может представлять собой Al3+.
[0016] Выражение «по меньшей мере один ион железа», используемое в настоящем описании, относится, например, по меньшей мере к одному типу иона железа, выбранному из всех возможных форм ионов Fe. Например, по меньшей мере один ион железа может представлять собой Fe2+, Fe3+ или их смесь.
[0017] Выражение «по меньшей мере один осажденный ион железа», используемое в настоящем описании, относится, например, по меньшей мере к одному типу иона железа, выбранному из всех возможных форм ионов Fe, осажденному в твердой форме. Например, по меньшей мере один ион железа, содержащийся в указанном осадке, может представлять собой Fe2+, Fe3+ или их смесь.
[0018] Выражения степени точности, такие как «примерно» и «приблизительно», используемые в настоящем описании, обозначают приемлемое отклонение модифицированного термина, при котором отсутствуют существенные изменения конечного результата. Указанные выражения степени точности следует рассматривать как включающие отклонение, составляющее по меньшей мере ±5% или по меньшей мере ±10% от модифицированного термина, если такое отклонение не придает отрицательное значение слову, которое оно модифицирует.
[0019] Термин «ALP», используемый в настоящем описании, относится к заводу, на котором проводят кислотное выщелачивание.
[0020] Выражение «хлорид титана», используемое в настоящем описании, относится, например, к соединению, выбранному из TiCl2, TiCl3 и TiCl4 и их смесей. Например, оно относится к TiCl4.
[0021] Например, материал можно выщелачивать с использованием HCl, имеющей концентрацию от примерно 10 до примерно 50 масс. %, от примерно 15 до примерно 45 масс. %, от примерно 18 до примерно 45 масс. %, от примерно 18 до примерно 32 масс. %, от примерно 20 до примерно 45 масс. %, от примерно 25 до примерно 45 масс. %, от примерно 26 до примерно 42 масс. %, от примерно 28 до примерно 40 масс. %, от примерно 30 до примерно 38 масс. % или от 25 до 36 масс. %. Например, можно применять HCl в концентрации примерно 18 масс. % или примерно 32 масс. %.
[0022] Например, материал можно выщелачивать с использованием HCl, имеющей концентрацию от примерно 1М до примерно 12М, от примерно 2М до примерно 10М, от примерно 3М до примерно 9М, от примерно 4М до примерно 8М, от примерно 5М до примерно 7М или примерно 6М.
[0023] Выщелачивание также можно проводить путем добавления в водный раствор сухой высококонцентрированной кислоты (например, 85%, 90% или 95%) в газовой фазе. В качестве альтернативы выщелачивание также можно проводить с использованием слабого раствора кислоты (например, <3 масс. %).
[0024] Например, выщелачивание можно проводить с использованием HCl, имеющей концентрацию от примерно 18 до примерно 32 масс. %, в первом реакторе, а затем с использованием HCl, имеющей концентрацию от примерно 90 до примерно 95% (газ), во втором реакторе.
[0025] Например, выщелачивание можно проводить с использованием HCl, имеющей концентрацию от примерно 18 до примерно 32 масс. %, в первом реакторе, затем с использованием HCl, имеющей концентрацию от примерно 90 до примерно 95% (газ), во втором реакторе; и с использованием HCl, имеющей концентрацию от примерно 90 до примерно 95% (газ), в третьем реакторе.
[0026] Например, выщелачивание можно проводить в атмосфере инертного газа (например, аргона или азота).
[0027] Например, выщелачивание можно проводить в атмосфере NH3.
[0028] Например, материал можно выщелачивать при температуре от примерно 125 до примерно 225°С, от примерно 140 до примерно 165°С, от примерно 145 до примерно 160°С, от примерно 150 до примерно 200°С, от примерно 150 до примерно 190°С, от примерно 160 до примерно 190°С, от примерно 185 до примерно 190°С, от примерно 160 до примерно 180°С, от примерно 160 до примерно 175°С или от примерно 165 до примерно 170°С.
[0029] Например, материал можно выщелачивать под давлением от примерно 4 до примерно 10 бар изб., от примерно 4 до примерно 8 бар изб. или от примерно 5 до примерно 6 бар изб.
[0030] Например, материал можно выщелачивать под давлением от примерно 50 до примерно 150 psig, от примерно 60 до примерно 100 psig или от примерно 70 до примерно 80 psig.
[0031] Например, материал можно выщелачивать с использованием HCl, имеющей концентрацию от примерно 10 до примерно 50 масс. %, от примерно 15 до примерно 45 масс. %, от примерно 18 до примерно 45 масс. %, от примерно 18 до примерно 32 масс. %, от примерно 20 до примерно 45 масс. %, от примерно 25 до примерно 45 масс. %, от примерно 26 до примерно 42 масс. %, от примерно 28 до примерно 40 масс. %, от примерно 30 до примерно 38 масс. % или от 25 до 36 масс. %. Например, можно применять HCl в концентрации 18 масс. % или 32 масс. %.
[0032] Выщелачивание можно проводить путем добавления в водный раствор сухой высококонцентрированной кислоты (например, 85%, 90% или 95%) в газовой фазе. В качестве альтернативы выщелачивание также можно проводить с использованием слабого раствора кислоты (например, <3 масс. %).
[0033] Например, выщелачивание можно проводить с использованием HCl, имеющей концентрацию от примерно 18 до примерно 32 масс. %, в первом реакторе, а затем с использованием HCl, имеющей концентрацию от примерно 90 до примерно 95% или от примерно 95 до примерно 100% (газ), во втором реакторе.
[0034] Например, выщелачивание можно проводить с использованием HCl, имеющей концентрацию от примерно 18 до примерно 32 масс. %, в первом реакторе, затем с использованием HCl, имеющей концентрацию от примерно 90 до примерно 95% (газ), во втором реакторе; и с использованием HCl, имеющей концентрацию от примерно 90 до примерно 95% (газ), в третьем реакторе.
[0035] Например, выщелачивание можно проводить в атмосфере инертного газа (например, аргона или азота).
[0036] Например, выщелачивание можно проводить в атмосфере NH3.
[0037] Например, первое выщелачивание можно проводить при атмосферном давлении, а затем при пониженном давлении можно проводить по меньшей мере одно дополнительное выщелачивание (например, 1, 2 или 3 последующие стадии выщелачивания).
[0038] Например, перед выщелачиванием красного шлама способы могут дополнительно включать удаление фтора, возможно содержащегося в красном шламе, перед проведением выщелачивания.
[0039] Перед проведением выщелачивания материал, например, можно обрабатывать на шаровой мельнице. Например, частицы красного шлама можно измельчать до 80, 85 или 90%, пропуская их через сито 63 микрон.
[0040] Например, выщелачивание можно проводить как непрерывный или полунепрерывный способ выщелачивания.
[0041] Например, способы согласно настоящему изобретению могут быть непрерывными или полунепрерывными.
[0042] Например, способы могут дополнительно включать повторное использование полученной в указанных условиях газообразной HCl путем приведения ее в контакт с водой для получения таким образом композиции, имеющей концентрацию от примерно 18 до примерно 45 масс. %, от примерно 26 до примерно 42 масс. %, от примерно 25 до примерно 45 масс. %, от примерно 28 до примерно 40 масс. %, от примерно 30 до примерно 38 масс. %, от примерно 18 до примерно 36%.
[0043] Например, способы могут дополнительно включать повторное использование полученной в указанных условиях газообразной HCl путем приведения ее в контакт с водой для получения таким образом композиции, имеющей концентрацию от примерно 18 до примерно 45 масс. % или от примерно 25 до примерно 45 масс. %, и применение композиции для выщелачивания материала.
[0044] Например, жидкость может содержать хлорид железа. Хлорид железа может содержать по меньшей мере одно соединение, выбранное из FeCl2, FeCl3 и их смеси.
[0045] Например, жидкость может иметь концентрацию хлорида железа, составляющую по меньшей мере 30% по массе; и ее можно гидролизовать при температуре от примерно 155 до примерно 350°С.
[0046] Например, жидкость можно концентрировать с получением концентрированной жидкости, имеющей концентрацию хлорида железа, составляющую по меньшей мере 30% по массе; затем хлорид железа можно гидролизовать при температуре от примерно 155 до примерно 350°С, поддерживая концентрацию хлорида железа (III) на уровне по меньшей мере 65% по массе, для получения композиции, содержащей жидкость и осажденный гематит, и выделять гематит.
[0047] Например, не поддающиеся гидролизу элементы совместно гематитом можно снова концентрировать до концентрации от примерно 0,125 до примерно 52 масс. % в циркуляционной петле с учетом возможности селективной экстракции.
[0048] Например, жидкость можно концентрировать с получением концентрированной жидкости, имеющей концентрацию по меньшей мере одного хлорида железа, составляющую по меньшей 30% по массе; а затем гидролизовать при температуре от примерно 155 до примерно 350°С.
[0049] Например, жидкость можно концентрировать с получением концентрированной жидкости, имеющей концентрацию по меньшей мере одного хлорида железа, составляющую по меньшей мере 30% по массе; затем по меньшей мере один хлорид железа гидролизуют при температуре от примерно 155 до примерно 350°С, поддерживая концентрацию хлорида железа (III) на уровне но меньшей мере 65% по массе, для получения композиции, содержащей жидкость и осажденный гематит, и выделяют гематит.
[0050] Например, жидкость можно концентрировать с получением концентрированной жидкости, имеющей концентрацию по меньшей мере одного хлорида железа, составляющую по меньшей мере 30% по массе; затем по меньшей мере один хлорид железа гидролизуют при температуре от примерно 155 до примерно 350°С, поддерживая концентрацию хлорида железа (III) на уровне по меньшей мере 65% по массе, для получения композиции, содержащей жидкость и осажденный гематит; выделяют гематит; и выделяют из жидкости редкоземельные элементы и/или редкие металлы.
[0051] Например, по меньшей мере один хлорид железа можно гидролизовать при температуре от примерно 150 до примерно 175, от 155 до примерно 170 или от 165 до примерно 170°С.
[0052] Например, жидкость можно концентрировать с получением концентрированной жидкости, имеющей концентрацию хлорида железа, составляющую по меньшей мере 30% по массе; затем хлорид железа можно гидролизовать при температуре от примерно 155 до примерно 350°С, поддерживая концентрацию хлорида железа (III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит; можно выделять гематит; и выделять из жидкости редкоземельные элементы и/или редкие металлы.
[0053] Например, после выделения редкоземельных элементов и/или редких металлов способы могут дополнительно включать взаимодействие жидкости с HCl для осаждения таким образом MgCl2 и его выделение.
[0054] Например, способы могут дополнительно включать прокаливание MgCl2 с получением MgO.
[0055] Например, способы могут дополнительно включать прокаливание MgCl2 с получением MgO и повторное использование полученной в указанных условиях HCl путем приведения ее в контакт с водой с получением таким образом композиции, имеющей концентрацию от примерно 25 до примерно 45 масс. % или от примерно 18 до примерно 45 масс. %, и применение композиции для выщелачивания красного шлама.
[0056] Например, после выделения редкоземельных элементов и/или редких металлов способы могут дополнительно включать взаимодействие жидкости с HCl и по существу селективное осаждение Na2SO4. Например, Na2SO4 можно осаждать путем взаимодействия жидкости с H2SO4.
[0057] Например, после выделения редкоземельных элементов и/или редких металлов способы могут дополнительно включать взаимодействие жидкости с HCl и по существу селективное осаждение K2SO4. Например, K2SO4 можно осаждать путем добавления H2SO4.
[0058] Например, жидкость можно концентрировать с получением концентрированной жидкости, имеющей концентрацию хлорида железа, составляющую по меньшей мере 30% по массе; затем хлорид железа можно гидролизовать при температуре от примерно 155 до примерно 350°С, поддерживая концентрацию хлорида железа (III) на уровне по меньшей мере 65% по массе, для получения композиции, содержащей жидкость и осажденный гематит; можно выделять гематит; и проводить взаимодействие жидкости с HCl. Например, указанные способы могут дополнительно включать взаимодействие жидкости с H2SO4 для по существу селективного осаждения Na2SO4. Способы также могут дополнительно включать взаимодействие жидкости с H2SO4 для по существу селективного осаждения K2SO4.
[0059] Например, способы могут включать взаимодействие сухих отдельных солей (например, солей Na или K), полученных согласно способам в которых используется H2SO4 и выделение HCl с получением пригодных для продажи K2SO4 и Na2SO4 и выделением от примерно 15 до примерно 90 масс. % хлороводородной кислоты.
[0060] Например, хлорид натрия, получаемый в способах, можно подвергать химическому взаимодействию с серной кислотой для получения таким образом сульфата натрия и регенерации хлороводородной кислоты. Хлорид калия можно подвергать химическому взаимодействию с серной кислотой для получения таким образом сульфата калия и регенерации хлороводородной кислоты. Солевой раствор хлоридов натрия и калия в качестве альтернативы может представлять собой материал, подаваемый в адаптированные небольшие электролитические ячейки для получения хлора и щелочей. В указанном последнем случае получают традиционные основания (NaOH и KOH) и отбеливающие вещества (NaOCl и KOCl).
[0061] Например, после выделения редкоземельных элементов и/или редких металлов способы могут дополнительно включать выделение NaCl из жидкости, взаимодействие NaCl с H2SO4 и по существу селективное осаждение Na2SO4.
[0062] Например, после выделения редкоземельных элементов и/или редких металлов способы могут дополнительно включать выделение KCl из жидкости, взаимодействие KCl с Na2SO4 и по существу селективное осаждение K2SO4.
[0063] Например, после выделения редкоземельных элементов и/или редких металлов способы могут дополнительно включать выделение NaCl из жидкости, проведение электролиза для получения NaOH и NaOCl.
[0064] Например, после выделения редкоземельных элементов и/или редких металлов способы могут дополнительно включать выделение KCl из жидкости, взаимодействие с использованием KCl, проведение электролиза для получения KOH и KOCl.
[0065] Например, жидкость можно концентрировать с получением концентрированной жидкости, имеющей концентрацию по меньшей мере одного хлорида железа, составляющую по меньшей мере 30% по массе; затем по меньшей мере один хлорид железа гидролизуют при температуре от примерно 155 до примерно 350°С, поддерживая концентрацию хлорида железа (III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит; выделяют гематит; и экстрагируют из жидкости NaCl и/или KCl.
[0066] Например, способы могут дополнительно включать взаимодействие NaCl с H2SO4 для по существу селективного осаждения Na2SO4.
[0067] Например, способы могут дополнительно включать взаимодействие KCl с H2SO4 для по существу селективного осаждения K2SO4.
[0068] Например, способы могут дополнительно включать проведение электролиза NaCl с получением NaOH и NaOCl.
[0069] Например, способы могут дополнительно включать проведение электролиза KCl с получением KOH и KOCl.
[0070] Например, способы могут включать выделение твердого вещества из продукта выщелачивания и промывку твердого вещества с получением таким образом оксида кремния с чистотой по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99%, по меньшей мере 99,5% или по меньшей мере 99,9%.
[0071] Например, способы могут включать взаимодействие продукта выщелачивания с газообразной HCl с получением таким образом жидкости и осадка, содержащего первый металл в виде хлорида.
[0072] Например, способы могут включать взаимодействие продукта выщелачивания с сухой газообразной HCl с получением таким образом жидкости и осадка, содержащего первый металл в виде хлорида.
[0073] Например, осаждение AlCl3 может включать кристаллизацию AlCl3·6Н2О.
[0074] Например, способ может включать взаимодействие продукта выщелачивания с HCl, выделенной при проведении способа и имеющей концентрацию по меньшей мере 30%, для получения таким образом жидкости и осадка, содержащего ионы алюминия, где осадок получен путем кристаллизации AlCl3·6Н2О.
[0075] Например, первый металл может быть выбран из алюминия, железа, цинка, меди, золота, серебра, молибдена, кобальта, магния, лития, марганца, никеля, палладия, платины, тория, фосфора, урана и титана и/или по меньшей мере одного редкоземельного элемента и/или по меньшей мере одного редкого металла.
[0076] Например, жидкость может содержать второй металл.
[0077] Например, второй металл может быть выбран из алюминия, железа, цинка, меди, золота, серебра, молибдена, кобальта, магния, лития, марганца, никеля, палладия, платины, тория, фосфора, урана и титана и/или по меньшей мере одного редкоземельного элемента и/или по меньшей мере одного редкого металла.
[0078] Например, второй металл может представлять собой железо.
[0079] Например, способ может включать отделение осадка от жидкости и нагревание второго металла для превращения хлорида второго металла в оксид второго металла.
[0080] Например, способы могут включать:
выделение твердого вещества из продукта выщелачивания;
выщелачивание твердого вещества с использованием кислоты с получением таким образом другого продукта выщелачивания; и
выделение третьего металла из другого продукта выщелачивания.
[0081] Например, третий металл может быть выбран из алюминия, железа, цинка, меди, золота, серебра, молибдена, кобальта, магния, лития, марганца, никеля, палладия, платины, тория, фосфора, урана и титана и/или по меньшей мере одного редкоземельного элемента и/или по меньшей мере одного редкого металла.
[0082] Например, третий металл может представлять собой титан.
[0083] Например, кислота, применяемая для выщелачивания, может быть выбрана из HCl, HNO3, H2SO4 и их смесей.
[0084] Например, кислота может представлять собой HCl.
[0085] Например, кислота может представлять собой газообразную HCl.
[0086] Например, способ может включать выделение третьего металла из другого продукта выщелачивания путем осаждения третьего металла.
[0087] Например, третий металл можно осаждать путем взаимодействия с HCl.
[0088] Например, способ может дополнительно включать нагревание третьего металла для превращения хлорида третьего металла в оксид третьего металла.
[0089] Например, первый металл может представлять собой алюминий.
[0090] Например, первый металл может представлять собой магний.
[0091] Например, первый металл может представлять собой никель.
[0092] Например, второй металл может представлять собой магний.
[0093] Например, второй металл может представлять собой никель.
[0094] Например, способы могут включать взаимодействие продукта выщелачивания с газообразной HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3·6Н2О.
[0095] Например, способы могут включать взаимодействие продукта выщелачивания с сухой газообразной HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3·6H2O.
[0096] Например, способы могут включать взаимодействие продукта выщелачивания с кислотой в концентрации по меньшей мере 30 масс. %, выделенной, регенерируемой и/или очищенной, как указано в настоящем изобретении, с получением таким образом жидкости и осадка, содержащего ионы алюминия в виде AlCl3·6Н2О.
[0097] Например, способы могут включать взаимодействие продукта выщелачивания с газообразной HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия, где осадок получен путем кристаллизации AlCl3·6Н2О.
[0098] Например, способы могут включать взаимодействие продукта выщелачивания с сухой газообразной HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия, где осадок получен путем кристаллизации AlCl3·6H2O.
[0099] Например, ионы алюминия можно осаждать в виде AlCl3 (например, AlCl3·6H2O) в кристаллизаторе, например, путем добавления HCl, имеющей концентрацию от примерно 26 до примерно 32 масс. %.
[00100] Например, газообразная HCl может иметь концентрацию HCl по меньшей мере 85 масс. % или по меньшей мере 90 масс. %.
[00101] Например, газообразная HCl может иметь концентрацию HCl примерно 90 масс. % или от примерно 90% до примерно 95 масс.%.
[00102] Например, во время кристаллизации AlCl3·6Н2О можно поддерживать концентрацию HCl в жидкости от примерно 25 до примерно 35% по массе или от примерно 30 до примерно 32% по массе.
[00103] Например, кристаллизацию можно проводить при температуре от примерно 45 до примерно 65°С или от примерно 50 до примерно 60°С.
[00104] Например, кристаллизацию AlCl3·6Н2О можно проводить путем добавления концентрированной газообразной HCl до достижения соответствующей концентрации, определенной для свободной HCl для данного кристаллизатора. Средние результаты, получаемые для кристаллов. Например, кристаллы гексагидрата можно подавать в блок прокаливания. Гидролиз и конверсию AlCl3 можно проводить при очень низкой температуре (<200°С). Кристаллы можно обрабатывать на первой стадии, где происходит разложение, а затем проводить непосредственно прокаливание. Процесс можно проводить с использованием циркулирующего псевдоожиженного слоя, при этом потребление энергии составляет менее чем 30% относительно количества энергии, обычно требуемого для прокаливания кристаллов гексагидрата. При необходимости получаемый оксид алюминия можно промывать для удаления непрореагировавшей соли.
[00105] Например, HCl можно получать из получаемой в указанных условиях газообразной HCl.
[00106] Например, в способах согласно настоящему изобретению данную партию или количество алюминийсодержащего материала выщелачивают, затем превращают в AlCl3, а HCl, получаемую при прокаливании AlCl3 с образованием Al2O3, используют, например, для выщелачивания другой данной партии или количества алюминийсодержащего материала.
[00107] Например, способы могут включать нагревание осадка для превращения AlCl3 в Al2O3 при температуре, составляющей по меньшей мере 180, 230, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 925, 930, 1000, 1100, 1200 или 1250°С.
[00108] Например, превращение AlCl3 в Al2O3 может включать прокаливание AlCl3.
[00109] Например, прокаливание является эффективным для превращения AlCl3 в бета-Al2O3.
[00110] Например, прокаливание является эффективным для превращения AlCl3 в альфа-Al2O3.
[00111] Например, превращение AlCl3 в Al2O3 может включать проведение прокаливания в двухступенчатом реакторе с циркулирующим псевдоожиженным слоем.
[00112] Например, превращение AlCl3 и Al2O3 может включать проведение прокаливания в двухступенчатом реакторе с циркулирующим псевдоожиженным слоем, содержащем систему предварительного нагревания.
[00113] Например, превращение AlCl3 в Al2O3 может включать проведение прокаливания при низкой температуре, например, от примерно 300 до примерно 600°С, от примерно 325 до примерно 550°С, от примерно 350 до примерно 500°С, от примерно 375 до примерно 450°С, от примерно 375 до примерно 425°С или от примерно 385 до примерно 400°С, и/или при впрыскивании пара.
[00114] Например, превращение AlCl3 в Al2O3 может включать проведение прокаливания при низкой температуре, например, составляющей по меньшей мере 180°С, по меньшей мере 250°С, по меньшей мере 300°С, по меньшей мере 350°С, и/или при впрыскивании пара.
[00115] Например, превращение AlCl3 в Al2O3 может включать проведение прокаливания при низкой температуре, например, менее 600°С, и/или при впрыскивании пара.
[00116] Например, превращение AlCl3 в Al2O3 может включать проведение прокаливания с использованием угля в качестве источника горения и блока дегазификации.
[00117] Например, способ может включать превращение AlCl3·6H2O в Al2O3 путем проведения прокаливания AlCl3·6Н2О, где прокаливание включает впрыскивание пара.
[00118] Например, пар (или водяной пар) можно впрыскивать под давлением от примерно 200 до примерно 700 psig, от примерно 300 до примерно 700 psig, от примерно 400 до примерно 700 psig, от примерно 550 до примерно 650 psig, от примерно 575 до примерно 625 psig или от примерно 590 до примерно 610 psig.
[00119] Например, можно впрыскивать пар (или водяной пар), а для проведения ожижения можно использовать плазменную горелку.
[00120] Например, пар (или водяной пар) может быть перегретым.
[00121] Например, пар (или водяной пар) может иметь температуру от примерно 300 до примерно 400°С.
[00122] Например, кислоту, полученную из отходящих газов, вырабатываемых при прокаливании, можно обрабатывать при помощи способа очистки газовой фазы.
[00123] Например, превращение AlCl3 в Al2O3 может включать проведение прокаливания с использованием монооксида углерода (СО).
[00124] Например, превращение AlCl3 в Al2O3 может включать проведение прокаливания с использованием топливного газа собственной выработки (RFG).
[00125] Например, прокаливание можно проводить путем впрыскивания водяного пара или пара и/или с использованием источника горения, выбранного из ископаемого топлива, монооксида углерода, топливного газа собственной выработки, угля или хлорированных газов и/или растворителей.
[00126] Например, прокаливание можно проводить путем впрыскивания водяного пара или пара и/или с использованием источника горения, выбранного из природного газа или пропана.
[00127] Например, прокаливание можно проводить путем обеспечения подвода тепла посредством электрического нагревания, газового нагревания, микроволнового нагревания.
[00128] Например, способы могут включать осаждение ионов Al3+ в виде Al(ОН)3. Например, осаждение Al3+ в виде Al(ОН)3 проводят при рН от примерно 7 до примерно 10; от примерно 9 до примерно 10; от примерно 9,2 до примерно 9,8; от примерно 9,3 до примерно 9,7; примерно 9,5; от 7,5 до примерно 8,5; от примерно 7,8 до примерно 8,2; или примерно 8.
[00129] Например, ионы железа можно осаждать при рН более 11, рН более 12, рН в диапазоне от 10 до 11, рН от примерно 11,5 до примерно 12,5 или рН от примерно 11,8 до примерно 12,0.
[00130] Например, ионы Al3+ очищают.
[00131] Например, способ может включать осаждение ионов Al3+ в виде AlCl3 для очистки таким образом ионов Al3+. Например, осаждение AlCl3 можно проводить путем кристаллизации AlCl3 в виде AlCl3·6H2O.
[00132] Например, способ может включать превращение AlCl3 в Al2O3 путем превращения AlCl3 в Al2O3 в атмосфере инертного газа или путем превращения AlCl3 в Al2O3 в атмосфере азота.
[00133] Полученный оксид алюминия можно промывать деминерализованной водой для по меньшей мере частичного удаления NaCl и/или KCl.
[00134] Например, реактор с псевдоожиженным слоем может содержать металлический катализатор, выбранный из хлоридов металлов.
[00135] Например, реактор с псевдоожиженным слоем может содержать металлический катализатор, представляющий собой FeCl3, FeCl2 или их смесь.
[00136] Например, реактор с псевдоожиженным слоем может содержать металлический катализатор, представляющий собой FeCl3.
[00137] Например, система предварительного нагревания может содержать плазменную горелку.
[00138] Например, для нагревания псевдоожиженной среды можно использовать пар. Нагревание также может быть электрическим.
[00139] Например, для предварительного нагревания реактора прокаливания можно использовать плазменную горелку.
[00140] Например, для предварительного нагревания воздуха, поступающего в реактор прокаливания, можно использовать плазменную горелку.
[00141] Например, для получения пара, впрыскиваемого в реактор прокаливания, можно использовать плазменную горелку.
[00142] Например, плазменная горелка может быть эффективной для получения пара, который выступает в качестве псевдоожиженной среды в реакторе с псевдоожиженным слоем.
[00143] Например, для предварительного нагревания псевдоожиженного слоя можно использовать плазменную горелку.
[00144] Например, среда, в которой проводят прокаливание, может быть но существу нейтральной с точки зрения содержания О2 (или окисления). Например, среда, в которой проводят прокаливание, может быть благоприятной для восстановления (например, может иметь концентрацию СО примерно 100 ppm).
[00145] Например, среда, в которой проводят прокаливание, является эффективной для предотвращения образования Cl2.
[00146] Например, способы могут включать превращение AlCl3·6H2O в Al2O3 путем проведения прокаливания AlCl3·6Н2О, обеспечиваемого сгоранием газовой смеси, содержащей:
СН4: от 0 до примерно 1 об. %;
С2Н6: от 0 до примерно 2 об. %;
C3H8: от 0 до примерно 2 об. %;
С4Н10: от 0 до примерно 1 об. %;
N2: от примерно 0,25 до примерно 15,1 об. %;
СО: от примерно 70 до примерно 82,5 об. %; и
СО2: от примерно 1,0 до примерно 3,5 об. %.
[00147] Указанная смесь может быть эффективной для снижения объема отходящих газов в диапазоне от 15,3 до 16,3%; таким образом, емкость повышается в диапазоне от 15,3 до 16,3%, что объясняется использованием циркулирующего псевдоожиженного слоя. Таким, для одного и того же расхода Opex составляют 0,65*16,3%=10,6%.
[00148] Например, отношение воздуха к природному газу (Нм3/ч к Нм3/ч) в псевдоожиженном слое может составлять от примерно 9,5 до примерно 10.
[00149] Например, отношение воздуха к газообразному СО (Нм3/ч к Нм3/ч) в псевдоожиженном слое может составлять от примерно 2 до примерно 3.
[00150] Например, О2 может по существу отсутствовать в газовой смеси.
[00151] Например, перед выщелачиванием алюминийсодержащего материала способы могут включать удаление, возможно содержащегося в алюминийсодержащем материале перед проведением выщелачивания.
[00152] Например, способы могут включать выщелачивание алюминийсодержащего материала с использованием HCl для получения таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, выделение твердого вещества из продукта выщелачивания; и дополнительную обработку твердого вещества для отделения таким образом SiO2 от TiO2, содержащихся в указанном твердом веществе.
[00153] Например, способы могут включать выщелачивание алюминийсодержащего материала с использованием HCl для получения таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, выделение твердого вещества из продукта выщелачивания; и дополнительную обработку твердого вещества для отделения таким образом Si от Ti, содержащихся в указанном твердом веществе.
[00154] Например, способы могут включать выщелачивание алюминийсодержащего материала с использованием HCl для получения таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, выделение твердого вещества из продукта выщелачивания; и дополнительную обработку твердого вещества с использованием HCl для отделения таким образом Si от Ti, содержащихся в указанном твердом веществе.
[00155] Например, способ может включать выщелачивание красного шлама с использованием HCl для получения таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, выделение твердого вещества из продукта выщелачивания; и дополнительную обработку твердого вещества с использованием HCl в присутствии хлорида (например, выбранного из хлоридов щелочных металлов и хлоридов щелочноземельных металлов) для отделения таким образом Si от Ti, содержащихся в указанном твердом веществе.
[00156] Например, твердое вещество можно обрабатывать с использованием HCl и хлорида для получения таким образом жидкой фракции, содержащей Ti, и твердой фракции, содержащей Si, где жидкую фракцию отделяют от твердой фракции.
[00157] Например, твердое вещество можно обрабатывать с использованием HCl и хлорида для получения таким образом жидкой фракции, содержащей TiCl4.
[00158] Например, способ может дополнительно включать превращение TiCl4 в TiO2.
[00159] Например, TiCl4 можно превращать в TiO2 путем экстракции растворителем третьей жидкой фракции и последующего образования диоксида титана из экстракта, полученного из раствора.
[00160] Например, для осаждения TiO2 TiCl4 можно подвергать взаимодействию с водой и/или основанием.
[00161] Например, TiCl4 можно превращать в TiO2 путем пирогидролиза для выработки тем самым HCl.
[00162] Например, TiCl4 можно превращать в TiO2 путем пирогидролиза для выработки тем самым HCl, которую затем используют повторно.
[00163] Например, твердое вещество может содержать TiO2 и SiO2, а твердое вещество можно обрабатывать с использованием Cl2 и углерода для получения жидкой фракции и твердой фракции, где твердую фракцию и жидкую фракцию отделяют друг от друга.
[00164] Например, жидкая фракция может содержать TiCl2 и/или TiCl4.
[00165] Например, жидкая фракция может содержать TiCl4.
[00166] Например, способ может дополнительно включать нагревание TiCl4 для его превращения в TiO2.
[00167] Например, полученный TiO2 можно очищать с использованием плазменной горелки.
[00168] Например, способы могут включать выщелачивание алюминийсодержащего материала с использованием HCl для получения таким образом продукта выщелачивания, содержащего ионы алюминия и твердое вещество, выделение твердого вещества из продукта выщелачивания; и дополнительную обработку твердого вещества с использованием HCl в концентрации менее 20 масс. % при температуре менее 85°С в присутствии хлорида для отделения Si от Ti, содержащихся в указанном твердом веществе.
[00169] Например, хлорид может быть выбран из хлоридов щелочных металлов и хлоридов щелочноземельных металлов.
[00170] Например, хлорид может представлять собой MgCl2 или CaCl2.
[00171] После выщелачивания ионы титана в виде хлорида титана находятся в жидкой фазе, a Si остается в твердой. Таким образом, получаемый в указанных условиях Si можно легко отделять от Ti при помощи способов разделения твердое вещество/жидкость. Затем хлорид титана можно превращать в TiO2. Следует отметить, что продукт выщелачивания также может содержать оксихлорид титана.
[00172] Различные способы выделения титана из продукта выщелачивания обсуждают в патенте Канады №2513309, содержание которого включено в настоящую заявку во всей полноте посредством ссылки.
[00173] Например, для удаления различных примесей, например, железа, хрома и ванадия, после выделения титана можно использовать способы выделения, такие как экстракция растворителем, осаждение или ионообмен. Некоторые из указанных способов обсуждают в патенте США №6500396, также включенном в настоящую заявку во всей полноте посредством ссылки.
[00174] Например, для очистки ионов титана продукт выщелачивания можно обрабатывать органической фазой. Органическую фазу можно выбирать таким образом, чтобы данные ионы можно было селективно экстрагировать в органическую фазу, а ионы титана оставались в водном растворе. Таким образом, также можно получать оксиды данного металла с высокой чистотой.
[00175] Примерами органической фазы являются хлориды четвертичного аммония, амины (первичные, вторичные или третичные), фосфорную и фосфиновую кислоту и ее сложные эфиры и оксиды, например, три-н-бутилфосфат, ди-2-этилгексилфосфорную кислоту и оксид фосфина. Органическую фазу можно выделять из ценных железосодержащих продуктов и повторно использовать. Указанную органическую фазу можно выбирать таким образом, чтобы хлорид титана был растворим в органической фазе. Например, органическую фазу можно выбирать таким образом, чтобы органическую фазу и хлорид титана можно было выделять путем фракционной перегонки (например, при существовании разницы между температурами кипения органической фазы и хлорида титана).
[00176] Например, хлорид титана можно обрабатывать водой или основанием (например, оксидом магния) или путем повышения температуры раствора до 85-110°С для осаждения диоксида титана.
[00177] Полученный хлорид титана также можно прокаливать в реакторе пирогидролиза или обрабатывать с использованием плазменной горелки для его превращения в TiO2.
[00178] Например, превращение AlCl3 в Al2O3 может включать проведение одностадийного прокаливания.
[00179] Например, прокаливание можно проводить при различных температурах с использованием пара. Температура применяемого перегретого пара может составлять от примерно 350°С до примерно 550°С или от примерно 350°С до примерно 940°С или от примерно 350°С до примерно 1200°С.
[00180] Например, для значительного снижения потребления энергии в гидролизере можно проводить многоступенчатую стадию выпаривания.
[00181] Например, способы могут быть эффективными для обеспечения выхода Al2O3 после выделения, составляющего по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, от примерно 90 до примерно 95%, от примерно 92 до примерно 95% или от примерно 93 до примерно 95%.
[00182] Например, способы могут быть эффективными для обеспечения выхода Fe2O3 после выделения, составляющего по меньшей мере 98%, по меньшей мере 99%, от примерно 98 до примерно 99,5% или от примерно 98,5 до примерно 99,5%.
[00183] Например, способы могут быть эффективными для обеспечения выхода MgO после выделения, составляющего по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере от примерно 96 до примерно 98%.
[00184] Например, способы могут быть эффективными для обеспечения выхода HCl после выделения, составляющего по меньшей мере 98%, по меньшей мере 99% или от примерно 98 до примерно 99,9%.
[00185] Например, способы могут быть эффективными для обеспечения выхода хлоридов редкоземельных элементов (РЗЭ-Cl) и хлоридов редких металлов (РМ-Cl) после выделения, составляющего от примерно 75% до примерно 96,5%, при помощи внутреннего процесса с использованием внутренней циркуляционной петли.
[00186] Например, способы могут быть эффективными для обеспечения выхода хлороводородной кислоты после выделения, составляющего примерно 99,75%, и не поддающихся гидролизу элементов.
[00187] Например, алюминийсодержащий материал может представлять собой красный шлам.
[00188] Например, алюминийсодержащий материал может быть выбран из промышленных тугоплавких материалов.
[00189] Например, алюминийсодержащий материал выбран из алюмосиликатных минералов.
[00190] Например, способы могут быть эффективными для предотвращения получения красного шлама.
[00191] Например, полученный оксид алюминия и другие продукты по существу не содержат красный шлам.
[00192] Например, можно повторно использовать HCl. Например, указанную повторно используемую HCl можно концентрировать и/или очищать.
[00193] Например, выделяемая HCl может представлять собой газообразную HCl, и ее можно обрабатывать H2SO4 для снижения количества воды, содержащейся в газообразной HCl.
[00194] Например, выделяемая HCl может представлять собой газообразную HCl, и ее можно пропускать через наполненную колонну для приведения се в контакт со встречным потоком H2SO4 и снижения таким образом количества воды, содержащейся в газообразной HCl.
[00195] Например, газообразную HCl можно концентрировать и/или очищать с использованием H2SO4. Например, газообразную HCl можно пропускать через наполненную колонну, где ее приводят в контакт со встречным потоком H2SO4. Например, за счет этого можно повышать концентрацию HCl по меньшей мере на 50 масс. %, по меньшей мере на 60 масс. %, по меньшей мере на 70 масс. %, по меньшей мере на 75 масс. %, по меньшей мере на 80 масс. %, от примерно 50 масс. % до примерно 80 масс. %, от примерно 55 масс. % до примерно 75 масс. % или примерно на 60 масс. %. Например, колонна может быть заполнена полимером, таким как полипропилен (ПП) или политриметилентерефталат (ПТТ).
[00196] Например, газообразную HCl можно концентрировать и/или очищать с использованием CaCl2 или LiCl. Например, газообразную HCl можно пропускать через колонну, наполненную CaCl2 иди LiCl. За счет этого можно снижать количество воды в HCl.
[00197] Например, концентрацию газообразной HCl повышают от значения ниже азеотропной концентрации до обработки до значения выше азеотропной концентрации после обработки.
[00198] Например, после кристаллизации щелочи (главным образом, содержащие Na) можно обрабатывать для выделения высококонцентрированной хлороводородной кислоты (HCl). При помощи способа, выбранного для осуществления конверсии, можно получать продукты с добавленной стоимостью, традиционно используемые в химической промышленности. Например, для получения отбеливающего агента из щелочи солевой раствор хлорида натрия можно подавать в адаптированные небольшие электролитические ячейки для получения хлора и щелочей. Это может быть, например, двухстадийный способ, в котором на солевой раствор воздействуют током высокого напряжения, в результате чего получают основание (NaOH), а также хлор (Cl2) и водород (Н2). Н2 и Cl2 затем можно подавать в традиционную горелку, в которой получают высококонцентрированную кислоту в газовой фазе, после чего ее можно использовать непосредственно на стадиях кристаллизации.
[00199] Например, различные продукты, полученные при помощи способов согласно настоящему изобретению, такие как оксид алюминия, гематит, оксиды титана, оксиды магния, редкоземельные элементы и редкие металлы и т.д., можно дополнительно очищать с использованием плазменной горелки. Например, их можно подавать по отдельности в плазменную горелку для дополнительной очистки.
[00200] Например, способы могут дополнительно включать превращение оксида алюминия (Al2O3) в алюминий. Конверсию оксида алюминия в алюминий можно проводить, например, с использованием процесса Холла-Эру. В различных патентах и заявках на патент, таких как заявки на патент США №20100065435; 20020056650; патенты США №5876584; 6565733, приведены ссылки на указанный хорошо известный процесс. Превращение также можно проводить и при помощи других способов, таких как те, что описаны в патентах США №7867373; 4265716; 6565733 (превращение оксида алюминия в сульфид алюминия и последующая конверсия сульфида алюминия в алюминий). Например, алюминий можно получать в восстановительной среде с использованием углерода при температуре ниже 200°С. Алюминий также можно получать путем восстановления с использованием калия и безводного хлорида алюминия (процесс Велера). Например, конверсию Al2O3 в алюминий можно проводить путем превращения Al2O3 в Al2S3 и последующего превращения Al2S3 в алюминий.
[00201] Например, способ может включать взаимодействие продукта выщелачивания с газообразной HCl для получения таким образом жидкости и осадка, содержащего MgCl2.
[00202] Например, способ включает взаимодействие продукта выщелачивания с газообразной HCl для получения таким образом жидкости и осадка, содержащего MgCl2.
[00203] Например, NaCl, выделенный при помощи способов согласно настоящему изобретению, можно подвергать взаимодействию с SO2 для получения таким образом HCl и Na2SO4. В указанном взаимодействии, которое проходит по экзотермической реакции, может вырабатываться пар, который можно применять для активации турбины и, в конечном итоге, для выработки электричества.
[00204] Например, твердое вещество может содержать TiO2 и SiO2, и твердое вещество можно обрабатывать с использованием Cl2 и углерода для получения жидкой фракции и твердой фракции, где твердую фракцию и жидкую фракцию отделяют друг от друга.
[00205] Например, по меньшей мере один металл может содержать первый металл, выбранный из алюминия, железа, цинка, меди, золота, серебра, молибдена, кобальта, магния, лития, марганца, никеля, палладия, платины, тория, фосфора, урана и титана и/или по меньшей мере одного редкоземельного элемента и/или по меньшей мере одного редкого металла.
[00206] Например, первый металл может представлять собой алюминий.
[00207] Например, способ может включать взаимодействие первого продукта выщелачивания с газообразной HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия, где осадок получен путем кристаллизации AlCl3·6H2O.
[00208] Например, способ может включать взаимодействие первого продукта выщелачивания с сухой газообразной HCl с получением таким образом жидкости и осадка, содержащего ионы алюминия, где осадок получен путем кристаллизации AlCl3·6H2O.
[00209] Например, первый продукт выщелачивания может содержать ионы Al и/или ионы Fe.
[00210] Например, ионы Al можно по существу селективно осаждать из первого продукта выщелачивания в виде AlCl3·6H2O.
[00211] Например, ионы Al можно по существу селективно осаждать из первого продукта выщелачивания в виде AlCl3·6H2O.
[00212] Например, ионы Fe можно по существу селективно экстрагировать путем превращения их в Fe2O3 в процессе гидролиза.
[00213] Например, твердое вещество может содержать TiO2 и SiO2, и твердое вещество обрабатывают с использованием Cl2 и углерода для получения жидкой фракции, содержащей хлорид титана, и твердой фракции, где твердую фракцию и жидкую фракцию отделяют друг от друга.
[00214] Например, способ включает нагревание хлорида титана для превращения его в TiO2.
[00215] Согласно одному из примеров, такому как показано на фиг. 1, способы могут включать следующие стадии (числовые обозначения на фиг. 1 соответствуют следующим стадиям):
1 - Алюминийсодержащий материал измельчают до достижения среднего размера частиц от примерно 50 до примерно 80 мкм.
2 - Измельченный и отобранный материал обрабатывают хлороводородной кислотой которая растворяет при предварительно определенной температуре и давлении алюминий и другие элементов, таких как железо, магний и другие металлы, включая редкоземельные элементы и/или редкие металлы. Оксид кремния и титан (если они присутствуют в сырье) полностью остаются в нерастворенном состоянии.
3 - Маточную жидкость, полученную на стадии выщелачивания, затем разделяют, проводят стадию очистки для выделения очищенного оксида кремния из раствора хлорида металлов. Очищенный оксид кремния затем необязательно можно подвергать обработке на одной или двух дополнительных стадиях выщелачивания (например, при температуре от примерно 150 до примерно 160°С) для увеличения таким образом чистоты оксида кремния более 99,9%. TiO2, содержащийся в оксиде кремния, можно выделять из оксида кремния, путем выщелачивания с использованием HCl и MgCl2 в качестве выщелачивающей композиции.
4 - Концентрацию отработанной кислоты (продукта выщелачивания), полученной на стадии 1, затем повышают с использованием сухого и высококонцентрированного газообразного хлороводорода путем барботирования его в кристаллизатор. Это приводит к кристаллизации гексагидрата хлорида алюминия (осадок), содержащего минимальные количества других примесей. В зависимости от концентрации хлорида железа на этой стадии может требоваться проведение дополнительной(ых) стадии(й) кристаллизации. Затем осадок отделяют от жидкости. Например, размер кристаллов может составлять от примерно 100 до примерно 500 микрон, от примерно 200 до примерно 400 микрон или от примерно 200 до примерно 300 микрон. В качестве альтернативы размер кристаллов может составлять от примерно 100 до примерно 200 микрон, от примерно 300 до примерно 400 микрон или от примерно 400 до 500 микрон.
5 - Гексагидрат хлорида алюминия затем прокаливают (например, с использованием вращающейся печи, псевдоожиженного слоя и т.д.) при высокой температуре для получения оксида алюминия. Затем выделяют высококонцентрированный газообразный хлороводород, и его избыток переводят в водную форму до достижения максимально возможной концентрации для последующего использования (повторного) на стадии кислотного выщелачивания. Кислоту также можно непосредственно в газовой фазе подавать в блок очистки кислоты для увеличения концентрации HCl от примерно 30 масс. % до примерно 95 масс. %. Это можно проводить, например, во время стадии сушки.
6 - Хлорид железа (жидкость, полученная на стадии 4) затем предварительно концентрируют, после чего гидролизуют при низкой температуре для экстракции Fe2O3 (в виде гематита) и выделения кислоты после гидролиза. Все тепло, выделяемое на стадии прокаливания (стадия 5), в экзотермичной реакции на стадии выщелачивания (стадия 1) и на других стадиях способа, отводят и подают в блок предварительной концентрации.
10 - После удаления гематита можно обрабатывать раствор, обогащенный редкоземельными элементами и/или редкими металлами. Как можно увидеть на фиг. 3, можно проводить циркуляцию по замкнутому контуру (после удаления гематита), и раствор, обогащенный редкоземельными элементами и/или редкими металлами, можно использовать на стадии кристаллизации 4. Экстракцию редкоземельных элементов и/или редких металлов можно осуществлять согласно описанию заявок РСТ/СА2012/000253 и/или РСТ/СА2012000419. Содержание указанных двух документов включено в настоящую заявку во всей полноте посредством ссылок.
Затем другие не поддающиеся гидролизу хлориды металлов (Ме-Cl), такие как MgCl2 и другие, обрабатывают на следующих стадиях:
7 - Затем концентрацию раствора, обогащенного хлоридом магния и другими продуктами, не поддающимися гидролизу, повышают при низкой температуре с использованием сухого и высококонцентрированного газообразного хлороводорода путем его барботирования в кристаллизаторе. Это приводит к осаждению хлорида магния в виде гексагидрата, например, после удаления хлоридов натрия и калия.
8 - Затем гексагидрат хлорида магния прокаливают (с использованием вращающейся печи, псевдоожиженного слоя и т.д.), таким образом, выделяют хлороводородную кислоту с очень высокой концентрацией, и ее повторно используют на стадии выщелачивания.
9 - Другие Ме-Cl подвергают стандартной обработке на стадии пирогидролиза, где можно получать смешанные оксиды (Ме-O), также выделяют хлороводородную кислоту с азеотропной концентрацией (20,2 масс. %).
[00216] NaCl можно подвергать химическому взаимодействию с H2SO4 для получения Na2SO4 и HCl в концентрации, равной азеотропной концентрации или более. Кроме того, KCl можно подвергать химическому взаимодействию с H2SO4 для получения K2SO4 и HCl, имеющей концентрацию, равную азеотропной концентрации или более. Солевой раствор хлоридов натрия и калия затем можно подавать в качестве сырья в адаптированные небольшие электролитические ячейки для получения хлора и щелочей. В указанном последнем случае получают традиционные основания (NaOH и KOH) и отбеливающие вещества (NaOCl и KOCl), а также HCl.
[00217] Например, жидкость можно концентрировать с получением концентрированной жидкости, имеющей концентрацию хлорида железа по меньшей мере 30% по массе; а затем хлорид железа можно гидролизовать при температуре от примерно 155 до примерно 350°С, поддерживая концентрацию хлорида железа (III) на уровне по меньшей мере 65% по массе, для получения композиции, содержащей жидкость и осажденный гематит, и выделять гематит.
[00218] Например, жидкость можно концентрировать с получением концентрированной жидкости, имеющей концентрацию хлорида железа по меньшей мере 30% по массе; а затем хлорид железа можно гидролизовать при температуре от примерно 155 до примерно 350°С, поддерживая концентрацию хлорида железа (III) на уровне по меньшей мере 65% по массе, для получения композиции, содержащей жидкость и осажденный гематит; можно выделять гематит; и выделять из жидкости редкоземельные элементы и/или редкие металлы. Например, после выделения редкоземельных элементов и/или редких металлов способ может дополнительно включать взаимодействие жидкости с HCl для осаждения MgCl2 и его выделение.
[00219] Тем не менее, специалисты в данной области техники должны понимать, что непрерывные способы можно проводить при высоком процентном содержании оксида кремния (>55%) и примесей, а также при относительно низком процентном содержании алюминия (например, не более чем примерно 15%), при этом они все равно остаются экономически и технически обоснованными. Можно добиваться удовлетворительного выхода Al2O3 (>93-95%) и более чем 75%, 85 или 90% выхода редкоземельных элементов и/или редких металлов. В большинстве случаев предварительная термическая обработка не требуется. Способы, предложенные в настоящем описании, могут включать специальные техники выщелачивания и выделения кислоты в очень высокой концентрации, и, таким образом, обеспечивают некоторые преимущества по сравнению со способами, в которых используют щелочи.
[00220] На стадии 1 обрабатываемый материал, независимо от того, подвергали его термической обработке или нет, разрушают, измельчают, сушат и отбирают частицы со средним размером от примерно 50 до примерно 80 мкм.
[00221] На стадии 2 измельченный материал вводят в реактор, в котором проводят фазу выщелачивания.
[00222] Хлороводородная кислота, используемая для выщелачивания на стадии 2, может представлять собой кислоту, используемую повторно или регенерируемую на стадиях 5, 6, 8, 9, 10 и 11 (см. фиг. 3), ее концентрация может изменяться от 15 до 45 масс. %. Более высоких концентраций можно добиваться с использованием мембранного разделения, криогенных техник и/или высокого давления. Кислотное выщелачивание можно проводить под давлением и при температуре, близкой к ее температуре кипения, что, тем самым, обеспечивает минимальное время выщелачивания и увеличение степени прохождения реакции (90%-100%). Выщелачивание (стадия 2) можно осуществлять в полунепрерывном режиме, где отработанную кислоту и оставшуюся свободную хлороводородную кислоту заменяют на высококонцентрированную кислоту на определенной стадии взаимодействия или обеспечивают пониженное отношение кислота/минерал, за счет чего сокращается время проведения реакции и улучшается кинетика реакции. Например, константа скорости k может составлять 0,5-0,75 г/моль·л. Например, выщелачивание может представлять собой непрерывное выщелачивание.
[00223] Как отмечалось выше, щелочные металлы, железо, магний, натрий, кальций, калий, редкоземельные элементы и другие элементы также находятся в виде хлоридов на различных стадиях. Оксид кремния и необязательно титан могут оставаться в нерастворенном виде, и их подвергают обработке (стадия 3) на стадии разделения жидкость/твердое вещество и очистки. Для максимизации выхода выделяемой хлороводородной кислоты способы согласно настоящему изобретению направлены на выделение максимального количества оставшейся свободной хлороводородной кислоты и хлоридов из раствора с использованием техник, таких как использование реечных классификаторов, фильтрование с использованием ленточных фильтров, использование высокого давления, центрифугирование с использованием ротофильтров и т.д. SiO2 очищают (одна дополнительная стадия выщелачивания) с использованием нановоды с минимальной чистотой 99%. Маточный раствор, не содержащий оксид кремния, который называют отработанной кислотой (содержащей различные хлориды металлов и воду), подают на стадию кристаллизации (стадия 4). Количество выделяемой свободной HCl и хлоридов может составлять по меньшей мере 99, 99,5, 99,9 или 99,99%.
[00224] На стадии 4 отработанную кислоту (или продукт выщелачивания), содержащую значительное количество хлорида алюминия, насыщают с использованием сухого и высококонцентрированного газообразного хлороводорода, полученного или используемого повторно после стадии 5, или водной HCl>30 масс. %, что приводит к осаждению гексагидрата хлорида алюминия (AlCl3·6Н2О). Оставшийся осадок затем промывают и фильтруют или центрифугируют, после чего подают на стадию прокаливания (стадия 5). Остаток отработанной кислоты, полученной на стадии 4, затем обрабатывают в системе выделения кислоты (стадии 6-8), в которой получают чистые вторичные продукты.
[00225] На стадии 5 оксид алюминия (окись алюминия) получают напрямую в условиях воздействия высоких температур. Полученный высококонцентрированный газообразный хлороводород можно подавать на стадии 4 и 7 для проведения кристаллизации, где его можно обрабатывать, пропуская через гидрофобные мембраны. Избыток хлороводорода абсорбируется, и его выделяют и используют на стадии выщелачивания 2 в качестве высококонцентрированной кислоты, имеющей концентрацию выше азеотропной концентрации (>20,2%). Например, указанная концентрация может составлять от примерно 18 до примерно 45 масс. %, от примерно 25 до примерно 45 масс. % или от 25 до 36 масс. %. Кислоту также можно подавать на стадию очистки кислоты непосредственно в газовой фазе (>30 масс. %).
[00226] После стадии 4 различные хлоридные производные (главным образом, железа и магния, редкоземельных элементов и редких металлов) подвергают обработке на стадии экстракции железа. Указанную стадию можно проводить, например, с использованием технологии, предложенной в международной заявке на патент WO 2009/153321, содержание которой включено в настоящую заявку во всей полноте посредством ссылки. Кроме того, для роста кристаллов можно вводить затравку гематита. Например, внесение затравки гематита может включать повторное использование затравки.
[00227] На стадии 6 проводят гидролиз при низкой температуре (155-350°С) с получением чистого Fe2O3 (гематит) и регенерацией хлороводородной кислоты, имеющей концентрацию по меньшей 15%. Способ, описанный в заявке WO 2009/153321, представляет собой последовательную обработку раствора хлорида железа (II) и хлорида железа (III), их разнообразных смесей и свободной хлороводородной кислоты на стадии предварительного концентрирования, стадии окисления, на которой хлорид железа (II) окисляют до железа (III), и, наконец, на стадии гидролиза в функциональном блоке, называемом гидролизер, в котором поддерживают концентрацию хлорида железа (III) на уровне 65 масс. %, где указанная концентрация обеспечивает получение обогащенного газового потока с концентрацией хлороводорода 15-20,2% и чистого гематита, который затем подвергают обработке на стадии физического отделения. Скрытую теплоту конденсации выделяют и направляют на стадию предварительного концентрирования, где ее используют в качестве источника тепла совместно с теплотой, выделяемой на стадии прокаливания (стадия 5).
[00228] Маточный раствор, полученный в гидролизере (стадия 6), можно частично повторно использовать на первой стадии кристаллизации, на которой увеличивают концентрацию не поддающихся гидролизу элементов. После удаления железа жидкость обогащена другими не поддающимися гидролизу элементами и содержит, главным образом, хлорид магния или разнообразные смеси других элементов (различные хлориды) и редкоземельных элементов и редких металлов, которые, например, тоже находятся в виде хлоридов.
[00229] Редкоземельные элементы и редкие металлы в виде хлоридов концентрируют до достижения высокого процентного содержания в функциональном блоке гидролизера (стадия 6) и экстрагируют из маточного раствора (стадия 10), где для экстракции различных отдельных РЗЭ-O (оксидов редкоземельных элементов) можно применять различные известные техники. Помимо прочего, способы согласно настоящему изобретению позволяют концентрировать в гидролизере следующие элементы до достижения высоких концентраций: скандий (Sc), галлий (Ga), иттрий (Y), диспрозий (Dy), церий (Се), празеодим (Pr), неодим (Nd), европий (Eu), лантан (La), самарий (Sm), гадолиний (Gd), эрбий (Er), цирконий (Zr) и их смеси. Технологии, используемые для экстракции редкоземельных элементов и/или редких металлов, можно найти, например, в Zhou et al., RARE METALS, Vol. 27, No. 3, 2008, p 223-227, и в заявке на патент США №2004/0042945, содержание которых включено в настоящую заявку во всей полноте посредством ссылок. Специалисты в данной области техники также должны понимать, что также можно применять и различные другие способы, обычно используемые для экстракции редкоземельных элементов и/или редких металлов, полученных в процессе Байера. Например, можно использовать различные способы экстракции растворителем. Для определенных элементов можно использовать способ с применением фосфата октилфениловой кислоты (ОРАР) и толуола. В качестве вымывающего агента можно использовать HCl. Этот способ может быть эффективным для выделения Се2О3, Sc2O3, Er2O3 и т.д. Например, для выделения хлорида железа (III) можно применять различные последовательности операций с использованием щавелевой кислоты и металлического железа.
[00230] Отработанный раствор кислоты, полученный на стадиях 6 и 10, обогащенный металлами с высокой добавленной стоимостью, главным образом, магнием, обрабатывают на стадии 7. Раствор насыщают сухим и высококонцентрированным газообразным хлороводородом, полученным на стадии 5, что приводит к осаждению гексагидрата хлорида магния. Например, это можно проводить и с использованием водной HCl с концентрацией более 30 масс. %. Полученный осадок подают на стадию прокаливания 8, где получают чистый MgO (>98 масс. %) и регенерируют высококонцентрированную хлороводородную кислоту (например, с концентрацией по меньшей мере 38%), которую подают на стадию выщелачивания (стадия 2). Альтернативный способ осуществления стадии 7 включает применение сухой газообразной хлороводородной кислоты, полученной на стадии 8.
[00231] На стадии 9 непрореагировавшие хлориды металлов обрабатывают на стадии пирогидролиза (700-900°С) с получением смешанных оксидов, где можно выделять хлороводородную кислоту с 15-20,2 масс. % концентрацией.
[00232] Согласно другому примеру, такому как показано на фиг. 3, способы могут быть схожими с примерами, приведенными на фиг. 1, но могут включать некоторые варианты, обсуждаемые ниже.
[00233] Действительно, как показано на фиг. 3, способы могут включать (после проведения стадии 6 или непосредственно перед стадией 10) внутреннюю рециркуляцию потоков на стадию кристаллизации 4. В этом случае маточный раствор, полученный в гидролизере (стадия 6) можно полностью или частично повторно направлять для кристаллизации на стадии 4, где происходит увеличение концентрации не поддающихся гидролизу элементов, включая редкоземельные элементы и/или редкие металлы.
[00234] Указанная стадия может подходить для значительного увеличения концентрации редкоземельных элементов и/или редких металлов, что способствует их экстракции на стадии 10.
[00235] Что касается стадии 7, то затем раствор, обогащенный хлоридом магния и другими не поддающимися гидролизу продуктами, концентрируют при низкой температуре с использованием сухого и высококонцентрированного газообразного хлороводорода путем его барботирования в кристаллизатор. Это может приводить к осаждению хлорида магния в виде гексагидрата (например, после удаления хлоридов натрия и калия). Эту операцию также можно проводить с использованием водной HCl.
[00236] Как показано на фиг. 3, можно вводить дополнительную стадию 11. Хлорид натрия можно подвергать химическому взаимодействию с серной кислотой для получения таким образом сульфата натрия и регенерации хлороводородной кислоты в концентрации, равной концентрации в азеотропе или более. Хлорид калия можно подвергать химическому взаимодействию с серной кислотой для получения таким образом сульфата калия и регенерации хлороводородной кислоты в концентрации, равной концентрации в азеотропе или более. Солевой раствор хлоридов натрия и калия затем может представлять собой сырье, подаваемое в адаптированные небольшие электролитические ячейки для получения хлора и щелочей. В указанном последнем случае получают традиционные основания (NaOH и KOH) и отбеливающие вещества (NaOCl и KOCl), которые в известной мере можно повторно использовать в других аспектах способов согласно настоящему изобретению (в устройствах очистки газов и т.д.).
[00237] Способ, приведенный на фиг. 8, также похож на способ, показанный на фиг. 1. Различия между двумя способами касаются стадий 4 и 5. Действительно, на стадиях 4 и 5 способа, приведенного на фиг. 8, различные металлы можно превращать в хлориды и кристаллизовать (стадия 4 на фиг. 8), после чего превращать в оксиды путем прокаливания (стадия 5 на фиг. 8). Таким образом, специалисты в данной области техники должны понимать, что в зависимости от состава материала, подвергающегося обработке, и условий на стадии выщелачивания различные металлы можно кристаллизовать таким образом (стадия 4 на фиг. 8) и обрабатывать на стадии прокаливания (стадия 5 на фиг. 8).
[00238] Далее приведены неограничивающие примеры.
Пример 1
Получение оксида алюминия и различных других продуктов
[00239] В качестве исходного материала получали образец глины на площадке Grande Vallee, Quebec, Canada.
[00240] Полученные результаты представляют собой средние значения для 80 исследований образцов массой по 900 кг каждый.
[00241] Необработанная свежедобытая глина после измельчения и отбора частиц имела следующий состав:
Al2O3: 15%-26%;
SiO2: 45%-50%;
Fe2O3: 8%-9%;
MgO: 1%-2%;
Редкоземельные элементы и/или редкие металлы: 0,04%-0,07%;
ППП (потери при прокаливании): 5%-10%.
[00242] Указанный материал далее выщелачивали в двухстадийном способе при 140-170°C с использованием 18-32 масс. % HCl. Раствор HCl использовали в стехиометрическом избытке 10-20% относительно стехиометрического количества, требуемого для удаления компонентов глины, поддающихся кислотному выщелачиванию. На первой стадии выщелачивания полунепрерывного процесса (стадия 2) глину приводили в контакт на 2,5 часа с требуемым количеством или определенной долей требуемого количества хлороводородной кислоты. После удаления отработанной кислоты глину снова приводили в контакт с минимальным количеством 18 масс. % раствора хловодородной кислоты в течение примерно 1,5 часов при той же температуре и давлении.
[00243] Типовая кривая экстракции железа и алюминия после одностадийного выщелачивания показана на фиг. 2.
[00244] Продукт выщелачивания фильтровали, а твердое вещество промывали водой и анализировали при помощи традиционных способов анализа (см. стадию 3 на фиг. 1). Чистота полученного оксида кремния составляла 95,4%, он не содержал какие-либо хлориды и HCl.
[00245] В другом примере чистота оксида кремния после дополнительной стадии выщелачивания составляла 99,67%.
[00246] После выщелачивания и удаления оксида кремния концентрация различных хлоридов металлов была следующей:
AlCl3: 15-20%;
FeCl2: 4-6%;
FeCl3: 0,5-2,0%;
MgCl2: 0,5-2,0%;
РЗЭ-Cl: 0,1-2%
Свободная HCl: 5-50 г/л
[00247] Отработанную кислоту затем кристаллизовали с использованием сухой газообразной хлороводородной кислоты с чистотой от примерно 90 до примерно 98% в две стадии, где содержание железа в получаемом гексагидрате хлорида алюминия составляло менее 25 ppm. Концентрация HCl в растворе (водная фаза) составляла от примерно 22 до примерно 32% или от 25 до примерно 32%, что позволяло выделять 95,3% Al2O3. Выделенный кристаллизованный материал (гидратированную форму Al2O3 с минимальной чистотой 99,8%) затем прокаливали при 930°С или 1250°C с получением таким образом α-формы оксида алюминия. Нагревание при 930°С обеспечивает получение бета-формы оксида алюминия, тогда как нагревание при 1250°С обеспечивает получение альфа-формы.
[00248] В другом примере использовали низкую температуру (разложение и прокаливание примерно при 350°С), содержание α-формы оксида алюминия составляло менее 2%.
[00249] Концентрация HCl в газовой фазе на выходе из стадии прокаливания составляла более 30%, и ее использовали (повторно) для кристаллизации AlCl3 и MgCl2. Избыток хлороводородной кислоты абсорбировали в концентрации, требуемой и желаемой для осуществления стадии выщелачивания.
[00250] Хлорид железа (примерно 90-95%) в виде железа (III)) затем использовали в гидротермическом способе для его экстракции в виде чистого гематита (Fe2O3). Это можно осуществлять при помощи технологии низкотемпературного гидролиза, описанной в международной заявке WO 2009/153321, где полностью использовали теплоту, выделенную на стадиях прокаливания, пирогидролиза и выщелачивания.
[00251] Редкоземельные элементы и редкие металлы экстрагируют из маточного раствора в гидролизере после удаления оксида кремния, алюминия, железа и основной части воды и предварительного концентрирования в гидролизере для кристаллизации. Обнаружили, что редкоземельные элементы можно концентрировать примерно в 4,0-10,0 раза непосредственно в гидролизере, пропуская смесь через гидролизер один раз, т.е. без использования концентрирующей петли. В гидролизере наблюдали следующие значения уровня концентрирования (за один цикл):
Се>6
La>9
Nd>7
Y>9
[00252] Оставшийся хлорид магния барботировали сухой и высококонцентрированной хлороводородной кислотой, а затем прокаливали с получением MgO, выделяя высококонцентрированную кислоту (например, до 38,4%).
[00253] Затем смешанные оксиды (Ме-О), содержащие другие не поддающиеся гидролизу компоненты, подвергали пирогидролизу при 700-800°С и выделенную кислоту (15-20,2 масс. %) повторно направляли, например, в систему выщелачивания.
Итоговый общий выход:
Al2O3: выделяемое количество 93,0-95,03%;
Fe2O3: выделяемое количество 92,65-99,5%;
Редкоземельные элементы: минимальное выделяемое количество 95% (смесь);
MgO: выделяемое количество 92,64-98,00%;
Отбрасываемый материал: максимум 0-5%;
Общее количество выделяемой HCl: минимум 99,75%;
Концентрация HCl, подаваемой для выщелачивания 15-32% (водная); 95% (газ)
Количество получаемого красного шлама: отсутствует.
Пример 2
Получение оксида алюминия и различных других продуктов
[00254] Схожее сырье (боксит вместо глины) обрабатывали согласно примеру 1 до стадии выщелачивания включительно, обнаружили, что оно легко подвергалось выщелачиванию в условиях, приведенных в примере 1. Выщелачивание обеспечивало 100% экстракцию железа и более чем 90-95%) экстракцию алюминия. Было обнаружено, что технология является экономически обоснованной, при этом не образуются вредные побочные продукты (красный шлам). Исследуемые образцы имели различные концентрации Al2O3 (до 51%), Fe2O3 (до 27%) и MgO (до 1,5%). Наблюдали 97,0% экстракцию галлия. Экстракция скандия составляла 95%.
Пример 3
Обогащение и очистка газообразной HCl: метод H2SO4
[00255] Для проведения очистки HCl можно использовать H2SO4. Очистку можно проводить с использованием наполненной колонны и встречного потока H2SO4 (см. фиг. 4). Это позволяет превращать выделенную HCl в HCl, имеющую концентрацию, превышающую ее азеотропную концентрацию (20,1 масс. %), повышая ее концентрацию как минимум до уровня от примерно 60 до примерно 70%.
[00256] Вода абсорбируется H2SO4, а затем путем регенерации концентрацию H2SO4 снова доводят до уровня от примерно 95 до примерно 98 масс. %. Воду, высвобождаемую на этой стадии, не содержащую серу, используют повторно и применяют для кристаллизации, растворения и т.д. Материал, наполняющий колонну, может содержать полипропилен или политриметилентерефталат (ПТТ).
[00257] Энергию сгорания можно использовать для предварительного нагревания воздуха и обогащения кислородом отходящих газов. Обогащение кислородом на +2% соответствует увеличению температуры пламени как максимум на 400°С.
Пример 4
Обогащение и очистка HCl: превращение хлорида кальция в гексагидрат хлорида кальция (процесс абсорбции/десорбции)
[00258] Как показано на фиг. 5, для сушки HCl можно использовать CaCl2. Действительно, для поглощения воды, содержащейся в HCl, можно использовать CaCl2. В этом случае CaCl2 превращается в форму гексахлорида (CaCl2·Н2О), и насыщенная система в итоге переходит в режим регенерации, при котором горячий воздух, выделяемый из отходящих газов прокаливания, полученных при обжиге распылением оксида алюминия и оксида магния, вводят для регенерации псевдоожиженного слоя. В качестве альтернативы вместо CaCl2 можно применять другой абсорбирующий агент, такой как LiCl. Указанный тип ионообменного процесса можно увидеть на фиг. 4, цикл можно обращать для переключения с одной колонны на другую.
[00259] Специалисты в данной области техники должны понимать, что способы, описанные в примерах 3 и 4, можно применять различным образом. Например, указанные способы можно объединять с различными способами, приведенными в настоящем изобретении. Например, указанные способы очистки можно встраивать в способы, показанные на фиг. 1, 3, 6-8, 10А, 10В, 11А и 11В. Например, указанные способы можно использовать после проведения по меньшей мере одной из стадий, выбранных из стадий 5, 6, 8, 9, 10 и 11 (см. фиг. 1 и 3). Также их можно использовать после проведения стадии 4 и/или стадии 7. Также их можно использовать после проведения по меньшей мере одной из стадий, выбранных из стадий 104-111 (см. фиг. 6).
Пример 5
Получение оксида алюминия и различных других продуктов
[00260] В этом примере использовали способ, приведенный на фиг. 6 и 7. Следует отметить, что способы, приведенные на фиг. 6 и 7 отличаются только тем, что на фиг. 7 показаны дополнительные стадии, т.е. стадии 112 и 113.
Получение сырья
[00261] Сырье, например, глину, обрабатывали в дробилке вторичного дробления в блоке получения глины 101. Проводили измельчение и отбор частиц сухого вещества в вертикальных валковых мельницах (например, Fuller-Loesche LM 30.41). Блок получения глины 101 включал три валковые мельницы: эксплуатировали две мельницы с пропускной способностью примерно 160-180 тонн в час и одну держали в качестве запасной. Сырье при необходимости можно измельчать, чтобы 85% частиц имели размер менее 63 микрон. Обработанный материал затем хранили в гомогенизационной емкости, после чего подавали в блок кислотного выщелачивания 102. Ниже в таблице 1 показаны результаты, полученные во время стадии 101. Если руда содержит фтор, то перед проведением стадии 102 можно осуществлять специальную обработку. В присутствии хлороводородной кислоты фтор может превращаться во фтороводородную кислоту. Эта кислота вызывает сильную коррозию и очень опасна для здоровья человека. Таким образом, перед проведением выщелачивания 102 необязательно можно проводить обработку для отделения фтора 112. Стадия 112 может включать обработку обработанного материала, полученного на стадии 101, кислотой в качестве операции предварительного выщелачивания для удаления фтороводородной кислоты. Таким образом, в зависимости от состава сырья можно проводить стадию отделения фтора 112 (или стадию предварительного выщелачивания 112).


Кислотное выщелачивание
[00262] Затем в полунепрерывном режиме проводили кислотное выщелачивание 102 в 80 м3 эмалированном реакторе. Полунепрерывный режим включает замену 1/3 прореагировашей кислоты в процессе взаимодействия на регенерированную кислоту с более высокой концентрацией, что значительно улучшает кинетику реакции. Конфигурация реактора включает, например, три последовательно установленных реактора. В других примерах проводили первое выщелачивание при 1 атм, а затем с использованием водной или газообразной HCl проводили второе и третье выщелачивание в полунепрерывном или непрерывном режиме.
[00263] Выщелачивание проводили при высоких температуре и давлении (от примерно 160 до примерно 195°С под давлением от примерно 5 до примерно 8 бар изб.) в течение заданного периода времени. Время проведения взаимодействия зависело от желаемой степени прохождения реакции (98% для Al2O3), режима выщелачивания, концентрации кислоты и применяемых температуры/давления.
[00264] Затем отработанную кислоту, выделенную после кислотного выщелачивания 102, отфильтровывали 103 от непрореагировавшего оксида кремния и диоксида титана и промывали, пропуская через автоматический фильтр-пресс, где полностью выделяли свободную HCl и хлориды. Это приводило к попаданию в раствор отработанной кислоты как максимум примерно 30 ppm SiO2. Затем получали очищенный оксид кремния в концентрации ≈96%+SiO2. На этой стадии возможны несколько вариантов. Например, 96% оксид кремния можно подвергать конечной нейтрализации в каустической ванне, очистке, а затем брикетированию для хранения. Согласно другому примеру оксид кремния очищали на дополнительной стадии выщелачивания и последующей стадии отделения твердого вещества для обеспечения удаления TiO2 (см. стадию 113 на фиг. 7). В этом конкретном случае получают оксид кремния высокой степени чистоты 99,5%+. На стадии 113 титан и кремний можно отделять друг от друга при помощи различных способов. Например, твердое вещество, полученное на стадии 103, можно выщелачивать в присутствии MgCl2 при температуре ниже 90 или 80°C с использованием кислоты в низкой концентрации. Например, концентрация кислоты может быть ниже 25 или 20%. Кислота может представлять собой HCl или H2SO4. В этом случае титан переходит в раствор после указанного выщелачивания, тогда как титан остается в твердой форме. Таким образом, указанные твердое вещество и жидкость, полученные на стадии 113, разделяют для обеспечения в конечном счете TiO2 и SiO2. Подвод воды и расход оксида кремния при очистке находятся в отношении 1:1 (оксид кремния/вода) (150 т/ч SiO2 / 150 т/ч Н2О), но способ включает циркуляцию промывочной воды по замкнутой петле, что ограничивает количество технической воды для конечной очистки оксида кремния и выделения всех хлоридов и свободной HCl, получаемых на стадии выщелачивания. Ниже в таблице 2 приведены результаты, полученные на стадии 102.


Кристаллизация AlCl3·6Н2О
[00265] Затем отработанную кислоту с содержанием хлорида алюминия от примерно 20 до примерно 30% обрабатывали на стадии кристаллизации 104. Сухую и высококонцентрированную HCl (>90 масс. %) в газовой фазе барботировали в двухступенчатом реакторе кристаллизации, что обеспечивало кристаллизацию гексагидрата хлорида алюминия.
[00266] Расход кислоты в указанных реакторах составлял от примерно 600 до примерно 675 м3/ч, температуру в реакторе поддерживали в диапазоне от примерно 50 до примерно 60°С при прохождении сильно экзотермической реакции. Теплоту отводили и направляли в узел очистки кислоты 107 блока, что, таким образом, обеспечивало подходящий теплообмен и минимизировало потребление теплоты в блоке. При увеличении концентрации свободной HCl в реакторе кристаллизации растворимость хлорида алюминия снижается намного быстрее по сравнению с другими элементами. Концентрация AlCl3 при осаждении/кристаллизации составляла примерно 30%.
[00267] Таким образом, концентрация HCl при кристаллизации составляла от примерно 30 до примерно 32 масс. %.
[00268] Затем водный раствор, полученный на стадии кристаллизации 104, подавали в блок гидротермического выделения кислоты 105, тогда как кристаллы обрабатывали на стадии разложения/прокаливания в блоке прокаливания 106.
[00269] Можно проводить одноэтапную стадию кристаллизации или многоэтапную стадию кристаллизации. Например, можно проводить двухэтапную стадию кристаллизации.
[00270] Ниже в таблицах 3А и 3В приведены результаты, полученные на стадии 104.

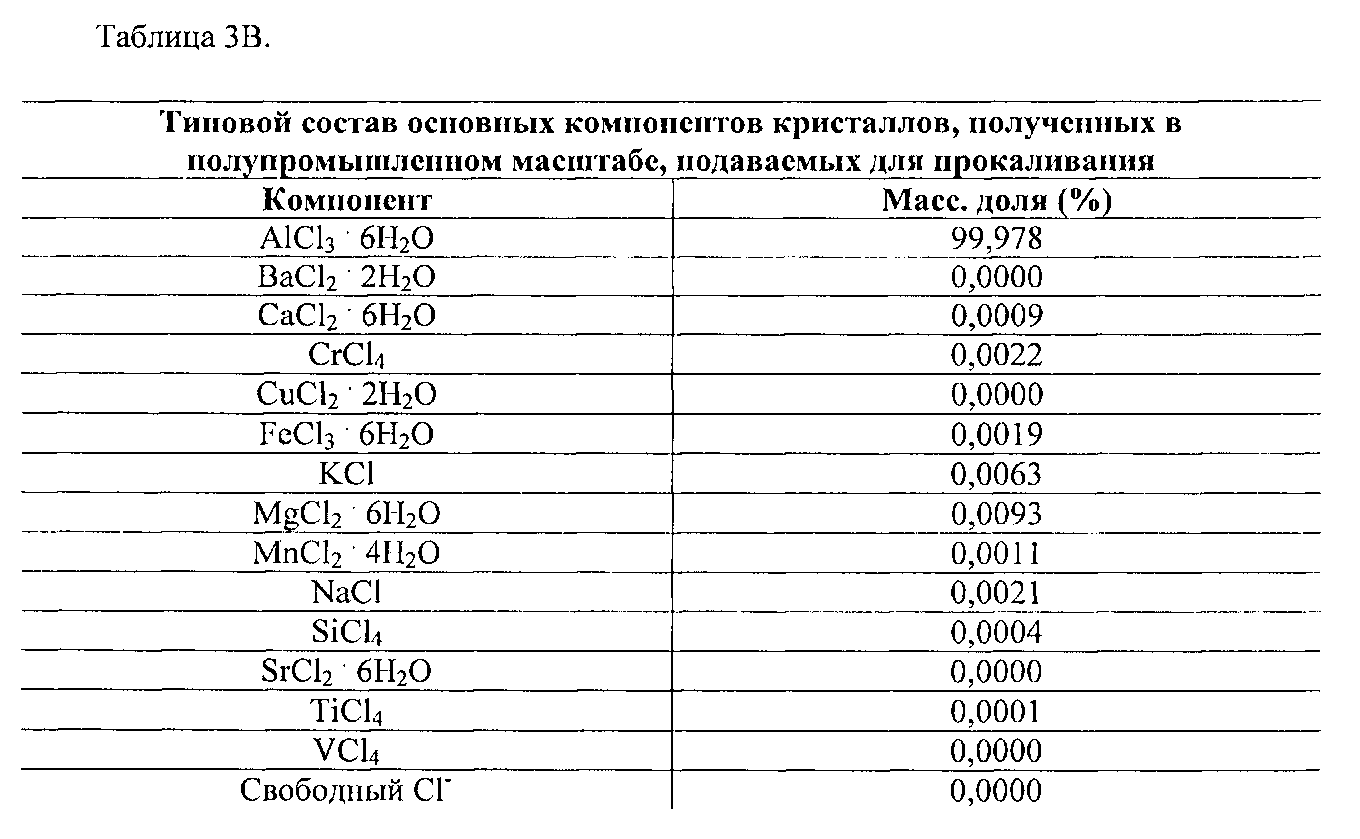
Прокаливание и гидротермическое выделение кислоты
[00271] Прокаливание 106 включает применение двухступенчатых систем с циркулирующим псевдоожиженным слоем (ЦПС) и предварительным нагреванием. Система предварительного нагревания может содержать плазменную горелку для нагревания пара, поступающего в процесс. Это обеспечивает обработку кристаллов на стадии разложения/прокаливания. Основную часть хлороводородной кислоты выделяли на первой стадии, которую проводили при температуре примерно 350°С, тогда как на второй стадии проводят непосредственно прокаливание. Затем кислоту, полученную на двух указанных стадиях (от примерно 66 до примерно 68% кислоты, выделяемой при проведении способов), выделяли и направляли в блок кислотного выщелачивания 102 или очистки кислоты 107. Во втором реакторе, который эксплуатировали при температуре примерно 930°С, кислоту выделяли путем конденсации и абсорбции в двух колоннах с использованием, главным образом, промывочной воды из сектора кислотного выщелачивания 102. Скрытую теплоту из этого сектора выделяли наряду с большими количествами воды, что ограничивает общий подвод воды.
[00272] В системе получения оксидов железа и выделения кислоты 105, которая содержит водный раствор, полученный после кристаллизации 104, сначала проводят стадию предварительного концентрирования, а затем обработку в гидролизере. В указанной системе получали гематит после обработки при низкой температуре (примерно 165°С). Затем использовали рециркуляционную петлю, выходящую из гидролизера и поступающую в установку предварительного концентрирования, что обеспечивало концентрирование РЗЭ, Mg, K и других элементов. Указанная рециркуляционная петля обеспечивает концентрирование хлоридов редкоземельных элементов и/или хлоридов редких металлов и хлоридов различных металлов в отсутствие, до определенной степени, соосаждения указанных продуктов с гематитом.
[00273] В зависимости от кислотного баланса в установке выделенную кислоту направляли непосредственно на стадию 102 или 107. В таблице 4 показаны результаты, полученные на стадии 105.


[00274] В таблице 5 показаны результаты, полученные на стадии 106.

Экстракция редкоземельных элементов и редких металлов
[00275] Поток, выделяемый из рециркуляционной петли 105, затем обрабатывали для экстракции редкоземельных элементов и редких металлов на стадии 108, на которой проводили восстановление оставшегося железа до железа II (Fe2+) и последовательные стадии экстракции растворителем. В качестве реагентов применяли щавелевую кислоту, NaOH, органический раствор DEHPA (ди(2-этилгексил)фосфорную кислоту) и ТВР (три-н-бутилфосфата), керосин и HCl использовали для превращения хлоридов редкоземельных элементов и хлоридов редких металлов в гидроксиды. Перед проведением специфического прокаливания редкоземельных элементов и редких металлов в виде гидроксидов и превращения их в отдельные оксиды высокой степени чистоты для извлечения указанных веществ из раствора с использованием HCl пропускали встречный поток органического растворителя. При помощи техники ионообмена также можно добиваться тех же результатов, что и использованием мембраны из политриметилентерефталата (ПТТ).
[00276] Порошок железа, полученный на стадии 105, или металлолом, такой как FeO, можно использовать с расходом, зависящим от концентрации Fe3+ в маточном растворе. Для разделения РЗЭ путем экстракции растворителем (SX) и повторного выщелачивания оксалатов редкоземельных элементов и/или редких металлов в качестве обедненного раствора может требоваться HCl (100 масс. %) с расходом 1 тонна в час.
[00277] Воду очень высокой степени чистоты, деминерализованную или нановоду, с расходом 100 тонн в час добавляли в раствор для экстракции и для промывки осадков.
[00278] Добавляли щавелевую кислоту в виде дигидрата с расходом 0,2 тонны в час, что способствовало осаждению оксалатов редкоземельных элементов и редких металлов. В качестве нейтрализующего агента можно применять NaOH или Mg(OH)2 с расходом 0,5 тонны в час.
[00279] Органический раствор DEHPA SX с расходом 500 г/ч использовали в качестве активного реагента для выделения редкоземельных элементов, в то же время органический раствор ТВР SX с расходом 5 кг/ч использовали в качестве активного реагента для выделения галлия и выделения иттрия. Наконец, керосиновый разбавитель использовали с расходом примерно 2 кг/ч на протяжении всей стадии SX. Для превращения содержимого в РЗЭ2О3 (в виде оксидов) и сохранения чистоты продукта прокаливание проводили во вращающейся электропечи путем непрямого нагревания.
[00280] Результаты различных исследований, касающихся стадии 108, показаны в таблице 6.
Для выделения следующих элементов путем экстракции растворителем использовали одну линию, разделенную на подсекции (5):
- Ga2O3
- Y2O3
- Sc2O3
- Eu2O3+Er2O3+Dy2O3
- Ce2O3+Nd2O3+Pr2O3
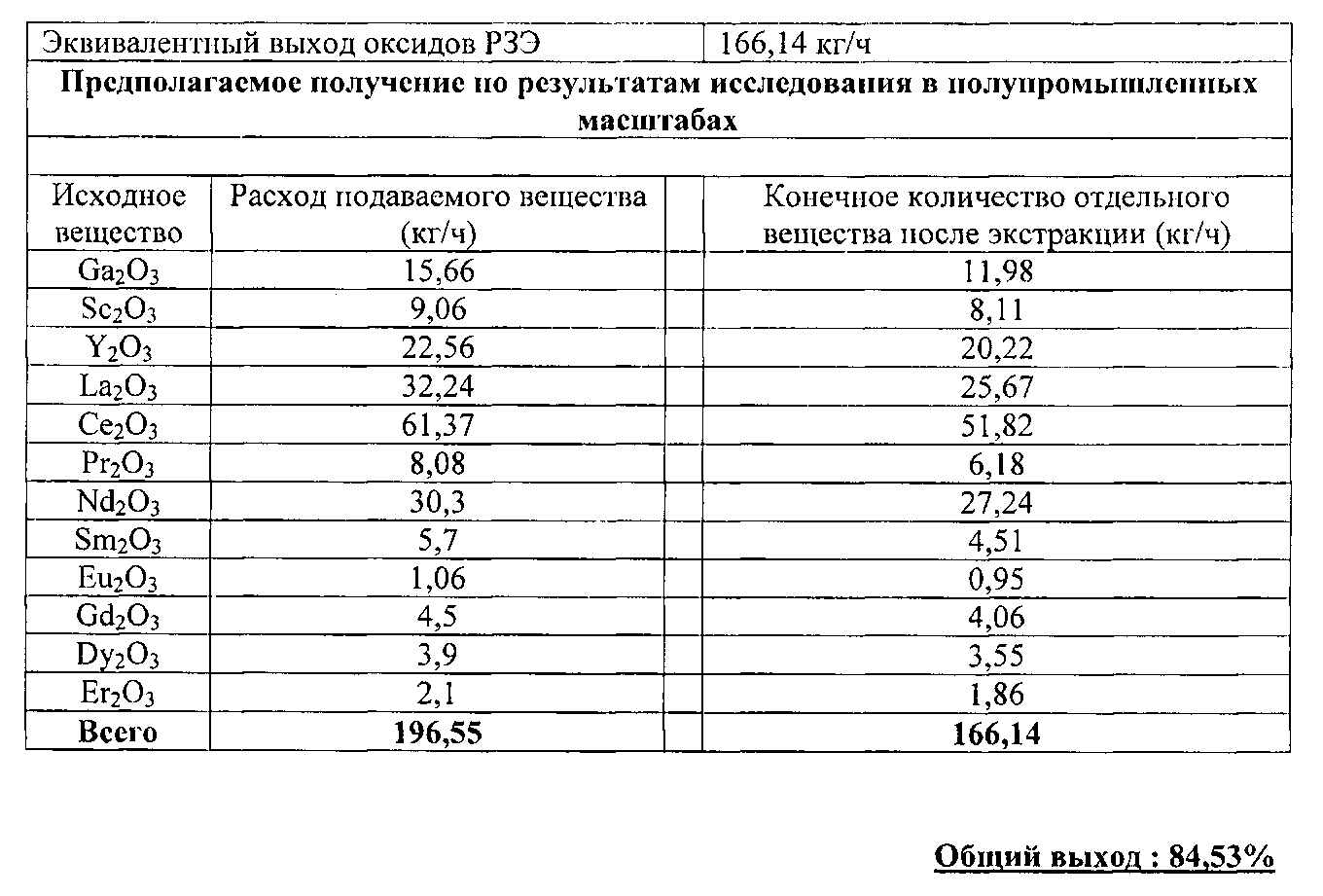
[00281] В качестве альтернативы стадию 108 можно проводить согласно описанию заявок на патент РСТ/СА2012/000253 и/или РСТ/СА2012000419.
[00282] Раствор, полученный на стадиях 108 и 109, содержал, главным образом, MgCl2, NaCl, KCl, CaCl2, FeCl2/FeCl3 и AlCl3 (следы), и его подвергали обработке на стадии 111. После MgO можно экстрагировать Na, K, Ca на стадии 110 путем кристаллизации в определенном порядке: сначала Na, затем K и, наконец, Ca. Этот способ можно применять, например, в перерабатывающих заводах на Мертвом море для получения MgO и удаления щелочных металлов из сырья.
[00283] Обнаружили, что рециркуляционная петля, приведенная на фиг. 7, позволяет концентрировать GaCl2 и ScCl2 в отсутствие осаждения гематита. Затем этот поток подвергают экстракции РЗЭ/РМ, последующей обработке на последовательных стадиях экстракции растворителем и превращению в отдельные оксиды с высокой степенью чистоты. Общий выход выделяемых элементарных РЗЭ составлял 84% для Ga, 95% для Sc и 68% для остальных РЗЭ, содержащихся в небольших количествах.
Регенерация HCl
[00284] После кристаллизации щелочные металлы (Na, K) направляли и обрабатывали в блоке щелочной регенерации хлороводородной кислоты 110 для выделения высококонцентрированной хлороводородной кислоты (HCl). При помощи способа, выбранного для конверсии, можно получать продукты с добавленной стоимостью.
[00285] Для превращения NaCl и KCl с целью выделения HCl доступны различные варианты. Одним из примеров может быть приведение их в контакт с высококонцентрированной серной кислотой (H2SO4), что приводит к получению сульфата натрия (Na2SO4) и сульфата калия (K2SO4), соответственно, и HCl в концентрации более 90 масс. %. Другим примером является применение солевого раствора хлоридов натрия и калия в качестве сырья для адаптированных небольших электролитических ячеек для получения хлора и щелочей. В указанном последнем случае получают традиционные основания (NaOH и KOH) и отбеливающие вещества (NaOCl и KOCl). Электролиз солевого раствора NaCl и KCl проводят в различных ячейках, в которых электрический ток регулируют для соответствия требованиям проведения конкретной химической реакции. В обоих случаях это представляет собой двухстадийный способ, в котором солевой раствор подвергают воздействию тока высокого напряжения с получением основания (NaOH или KOH), хлора (Cl2) и водорода (Н2). Затем Н2 и Cl2 направляют в единое пламя, где образуется высококонцентрированная кислота в газовой фазе (100 масс. %), которую можно использовать непосредственно на стадии кристаллизации 104 или на стадиях кристаллизации, для которых требуется применение сухой высококонцентрированной кислоты.
Оксид магния
[00286] Очищенный поток, по существу не содержащий большую часть элементов (например, AlCl3, FeCl3, РЗЭ-Cl, NaCl, KCl) и обогащенный MgCl2, затем подавали в блок получения оксидов магния 111. В блоке MgO проводили пирогидролиз MgCl2, а любые другие оставшиеся примеси превращали в оксиды, регенерируя при этом кислоту. Первая стадия представляла собой стадию предварительного выпаривания/кристаллизации, на которой кальций удаляли и превращали в гипс (CaSO4·2H2O) путем простого химического взаимодействия с серной кислотой, для чего требуется выделение MgO. Это повышает производительность обжига MgO, а также незначительно потребление энергии, по при этом по существу происходит выделение HCl. На следующей стадии проводили специфический пирогидролиз концентрированного раствора MgO путем обжига распылением. Получали два (2) основных продукта: MgO, которые подвергали дополнительной обработке, и HCl (примерно 18 масс. %), которую или использовали повторно на предшествующей стадии выщелачивания 102 или в блоке очистки хлороводородной кислоты 107. Продукт, содержащий MgO, полученный в печи для обжига распылением, может требовать дополнительной промывки, очистки и, наконец, прокаливания в зависимости от требуемого качества. Очистка и прокаливание могут включать стадию промывки-гидратации и стандартную стадию прокаливания.
[00287] MgO, полученный в печи для обжига распылением, обладает высокой химической активностью, и его помещали непосредственно в резервуар с водой, где он вступал во взаимодействие с водой с образованием гидроксида магния, который плохо растворим в воде. Следовые количества оставшихся хлоридов, таких как MgCl2, NaCl, растворялись в воде. Суспензию Mg(OH)2 после отстаивания в загустителе направляли на вакуумные барабанные фильтры, на которых удаляли оставшуюся воду. Затем очищенный Mg(OH)2 направляли в реактор прокаливания, где его подвергали воздействию высоких температур в вертикальной многозонной печи. Вода, захваченная в процессе гидратации, высвобождалась, что обеспечивало превращение Mg(OH)2 в MgO и воду. На этой стадии оксид магния обладал высокой степенью чистоты (>99%).
Очистка HCl
[00288] Стадия очистки хлороводородной кислоты 107 является эффективной для очистки HCl, регенерируемой на различных стадиях (например, 105, 106, 111) и для увеличения ее чистоты для проведения кристаллизации, где в качестве барботируемого агента можно применять сухую высококонцентрированную кислоту (>90 масс. %). Проведение стадии 107 также позволяло контролировать концентрацию кислоты, поступающей обратно на стадию 102 (от примерно 22 до примерно 32 масс. %) и обеспечивало общий баланс кислоты и воды. Общий баланс воды в установке определялся, главным образом, повторным использованием воды для промывки в качестве абсорбирующей среды, в качестве гасящего агента или среды-растворителя на стадиях кристаллизации. Например, стадию 107 можно осуществлять при помощи способов, показанных на фиг. 4 или на фиг. 5.
[00289] Например, очистку можно проводить при помощи способа мембранной перегонки. В способе мембранной перегонки, применяемом в настоящем изобретении, две водные жидкости, имеющие различную температуру, разделяют с использованием гидрофобной мембраны. Движущей силой процесса являлась разница в парциальном давлении паров, вызванная градиентом температуры между указанными растворами. Пары перемещаются с теплой стороны на холодную. Не желая быть связанными указанной теорией, полагают, что механизм разделения был основан на равновесии пар/жидкость в жидкой смеси HCl/вода. Указанная технология нашла практическое применение для систем HCl/вода, H2SO4/вода, а также для крупных коммерческих партий водного раствора хлорида натрия с целью получения питьевой воды из морской воды и получения нановоды. Таким образом, мембранная перегонка представляет собой способ разделения, основанный на испарении через пористую гидрофобную мембрану. Способ проводили примерно при 60°С, он был эффективным для выделения теплоты, полученной на стадиях 104 и 102, с использованием замкнутой петли рециркуляции воды для поддержания постоянной температуры веществ, подаваемых к мембранам. Например, для получения HCl с концентрацией, превышающей азеотропную концентрацию (т.е. >36%), с производительностью 750 м3/ч в качестве мембраны можно использовать восемь мембран с эквивалентной площадью 300000 м2, затем конечную 90% концентрацию можно получать путем перегонки под давлением (на ректификационной колонне).
[00290] Очистка HCl путем обработки полученной таким образом кислоты на гидрофобной мембране и выделения воды из HCl приводила к увеличению концентрации HCl до примерно 36% (выше азеотропной концентрации), а следовательно позволяла проводить одну стадию ректификации на колонне для отгонки под давлением с получением кислоты с >90% концентрацией в газовой фазе для использования на стадии кристаллизации (в качестве барботируемого агента); и, тем самым, контролировать концентрацию кислоты на стадиях кристаллизации на уровне до 30-35%) (водн.).
[00291] Как показано, стадию 107 проводили примерно при 60°С и подвод тепла обеспечивали при помощи теплоты, выделяемой на стадиях 102-110. Ректификационную колонну эксплуатировали при температуре нагревателя у основания колонны, составляющей примерно 140°С. Чистая потребность в энергии была нейтральной (фактически даже отрицательной, -3,5 ГДж/т Al2O3), так как обе системы находились в равновесии и были сбалансированы.
[00292] Например, очистку кислоты можно проводить при помощи технологии адсорбции на подложке активированного оксида алюминия. В непрерывном режиме требуется использование по меньшей мере двух адсорбционных колонн для обеспечения адсорбции в одной из них и регенерации в другой. Регенерацию можно проводить путем подачи встречного потока горячего или разреженного газа. Эта технология обеспечивает очистку с получением 100 масс. % газа.
[00293] Например, очистку кислоты можно проводить с использованием хлорида кальция в качестве поглотителя воды. Слабый раствор хлороводородной кислоты приводят в контакт с концентрированным раствором хлорида кальция, пропуская через колонну. Затем воду удаляют из раствора хлороводородной кислоты, в результате образуется 99,9% газообразная HCl. Для конденсации следов воды в HCl используют охлаждающую воду и криогенный охладитель. Слабый раствор CaCl2 концентрируют в испарителе, что обеспечивает регенерацию хлорида кальция. В зависимости от примесей, поступающих вместе с раствором HCl, подаваемым в колонну, некоторые металлы могут загрязнять концентрированный раствор хлорида кальция. Осаждение Са(ОН)2 и фильтрование позволяет удалять указанные примеси. Колонну можно эксплуатировать, например, при 0,5 бар изб. Эта технология обеспечивает регенерацию 98% HCl.
[00294] В таблице 7 показаны результаты, полученные для способа, показанного на фиг. 6.

[00295] В таблицах 8-26 показаны результаты, определенные для продуктов, полученных согласно способу, показанному на фиг. 6, по сравнению с промышленными стандартами.
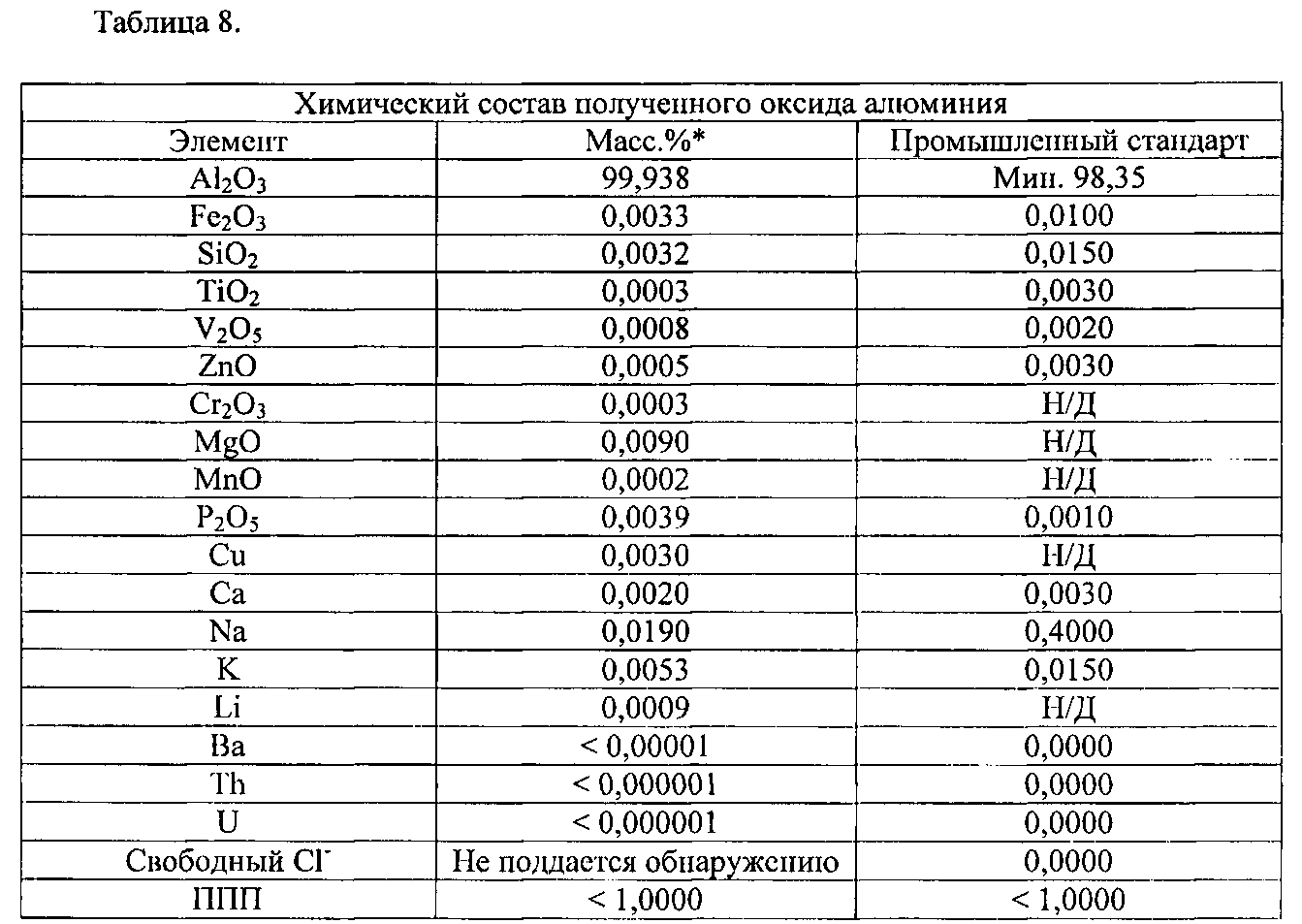
Способ удаления Р2О5 может включать, например, осаждение фосфора с использованием сульфата циркония после проведения выщелачивания. Удаление может быть обеспечено, например, с использованием раствора, нагретого от 80 до примерно 90°С или от примерно 85 до примерно 95°С, в вакууме.
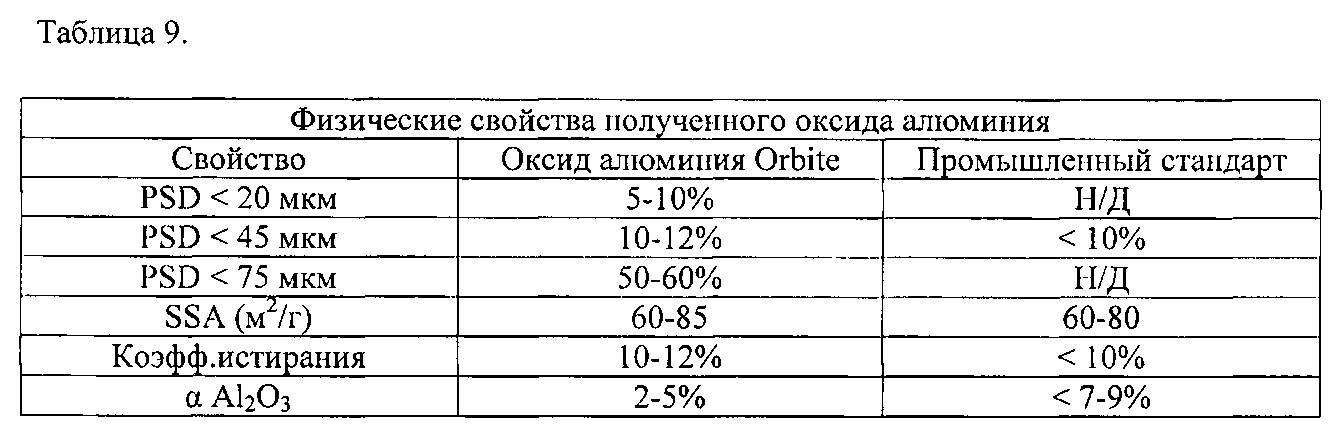
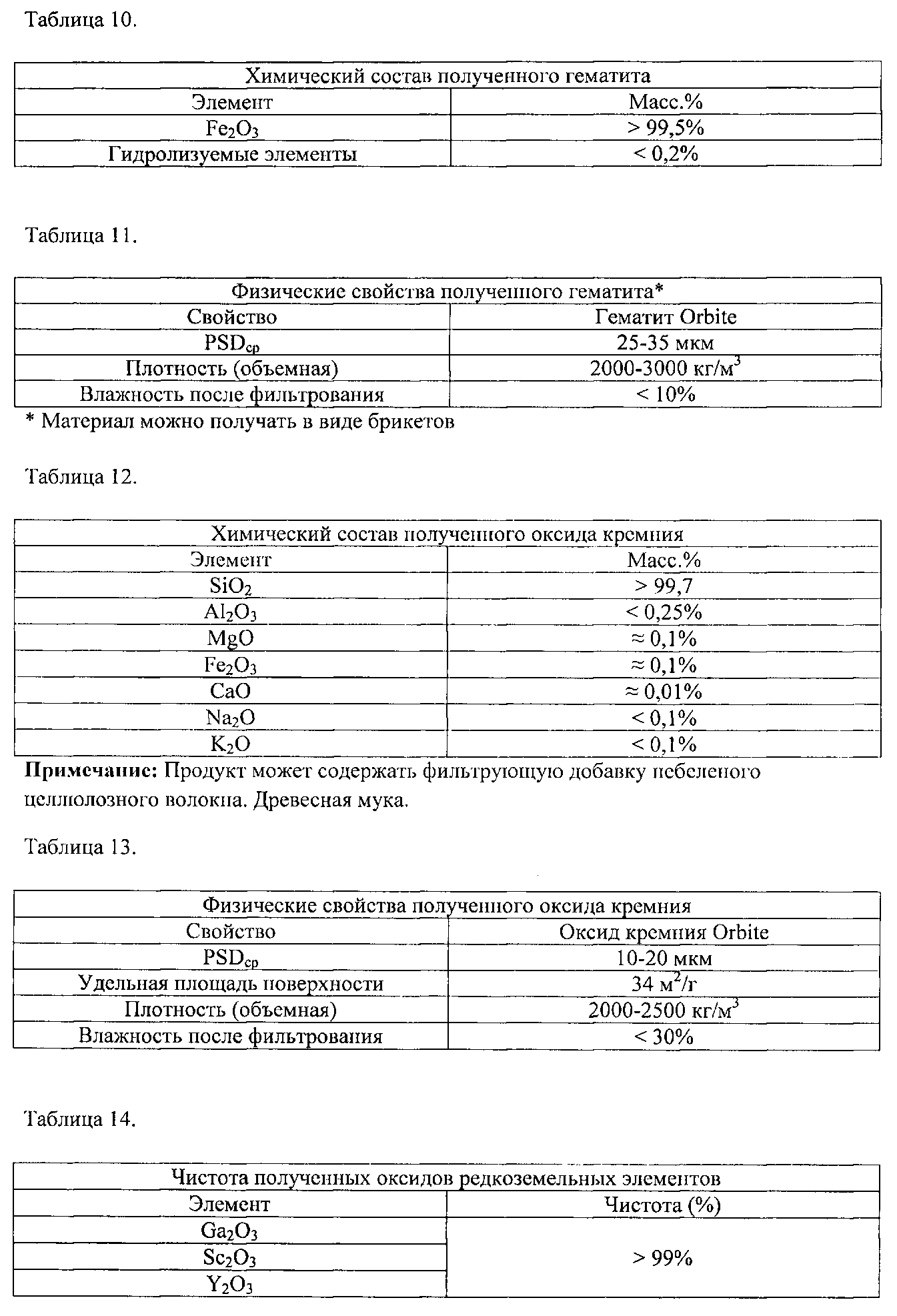
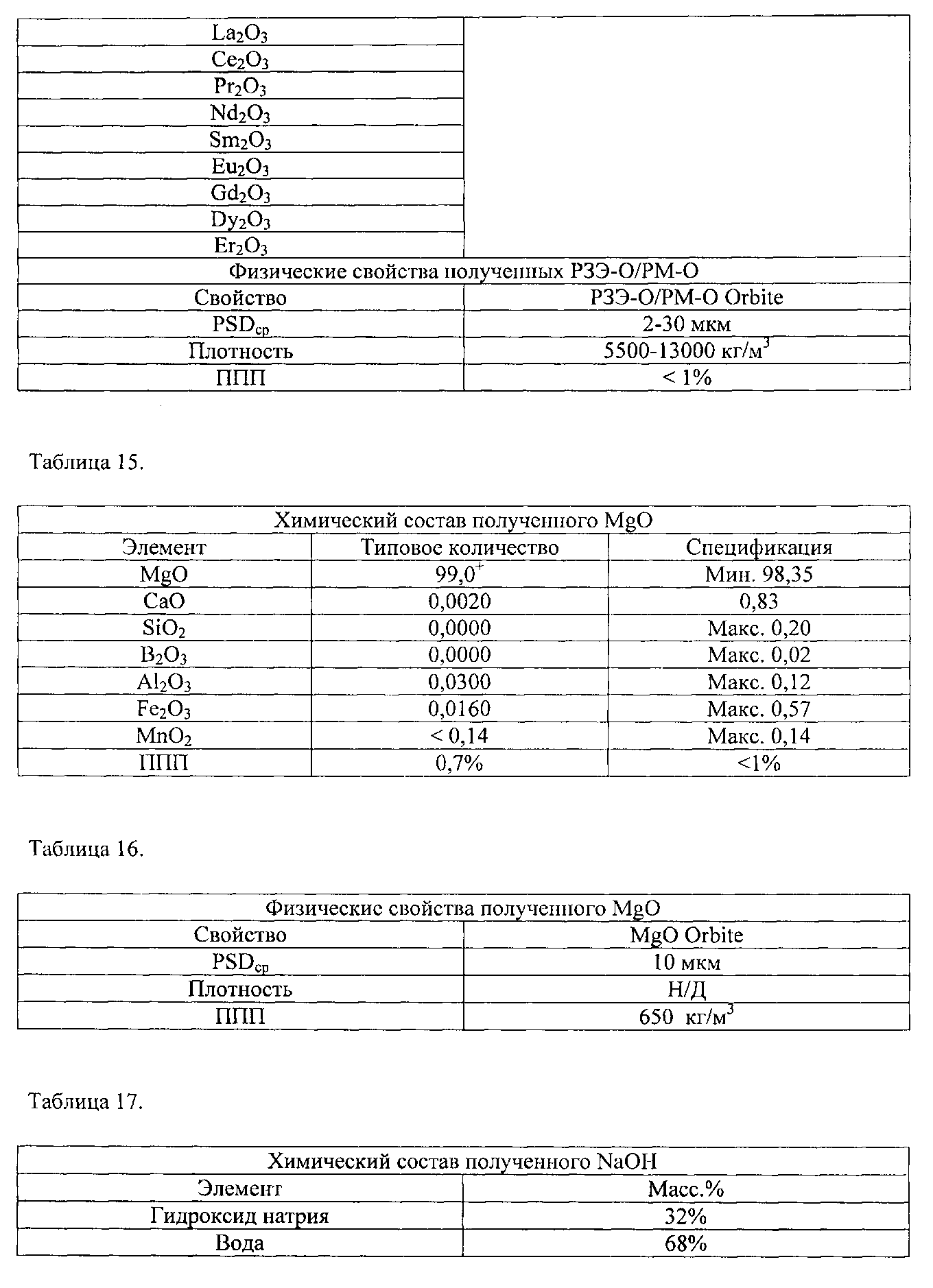

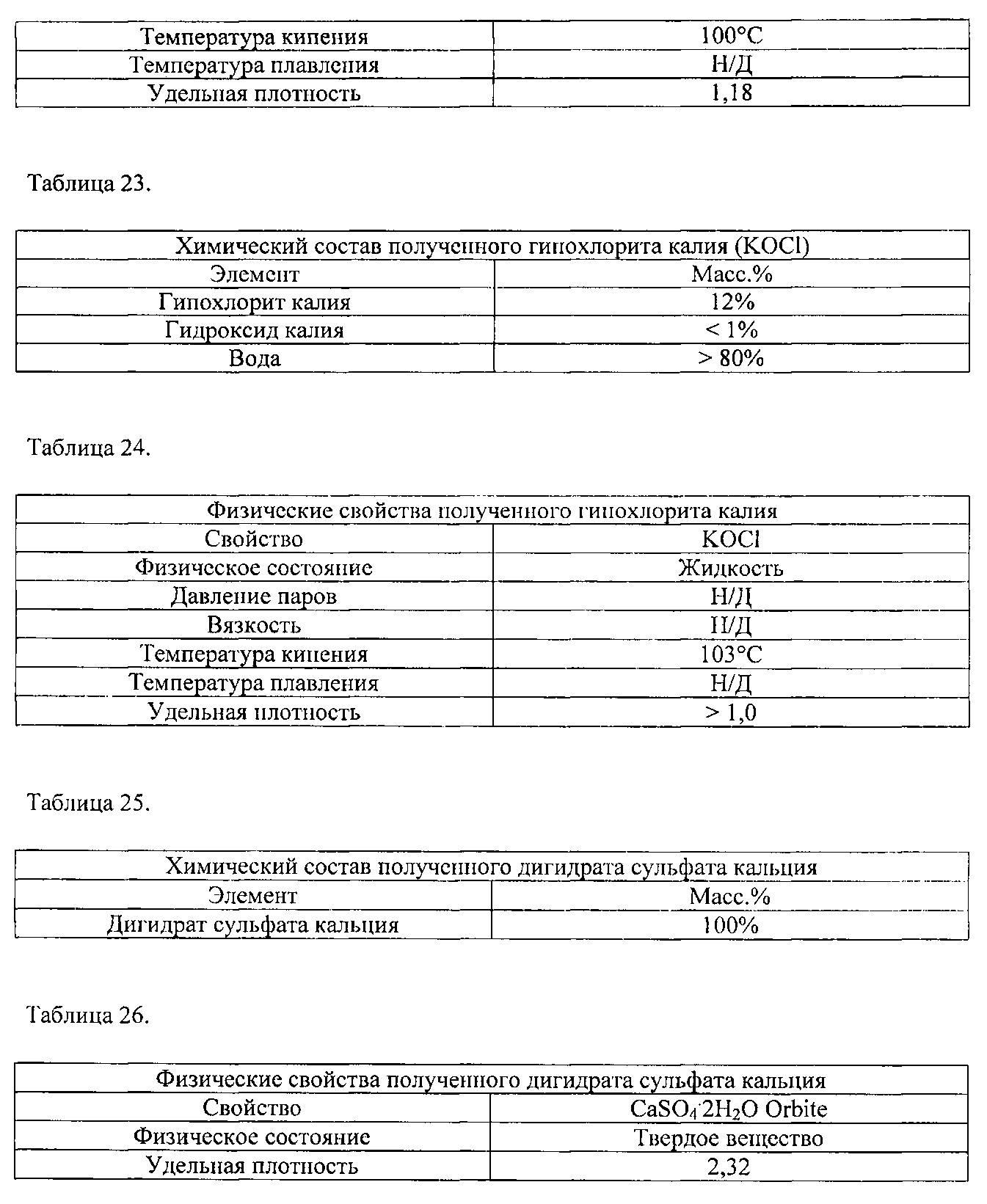
[00296] Для демонстрации универсальности способов согласно настоящему изобретению проводили некоторые другие испытания, чтобы на их примере показать, что указанные способы можно применять для различных источников исходных материалов.
Пример 6
[00297] Для получения кислотных композиций, содержащих различные компоненты, использовали другой исходный материал. Действительно, исследовали материал, представляющий собой концентрат редкоземельных элементов и редких металлов (в частности обогащенный цирконием). В таблице 27 показаны результаты выщелачивания указанного исходного материала при помощи способа, показанного на фиг. 1, 3, 6 и 7 и подробно описанного в примерах 1, 2 и 5. Согласно результатам, приведенным в таблице 27, можно сделать вывод о том, что различные компоненты, присутствующие при выщелачивании (различные металлы, такие как алюминий, железо, магний, а также редкоземельные элементы и редкие металлы), можно экстрагировать из полученной выщелачиваемой композиции, и, в итоге, их можно выделять при помощи способов согласно настоящему изобретению, таких как, например, те, что приведены в примерах 1, 2 и 5.
Пример 7
[00298] Аналогично описанию примера 6 проводили и другие исследования. В данном примере в качестве исходного материала использовали карбонатит (см. таблицу 28 ниже).

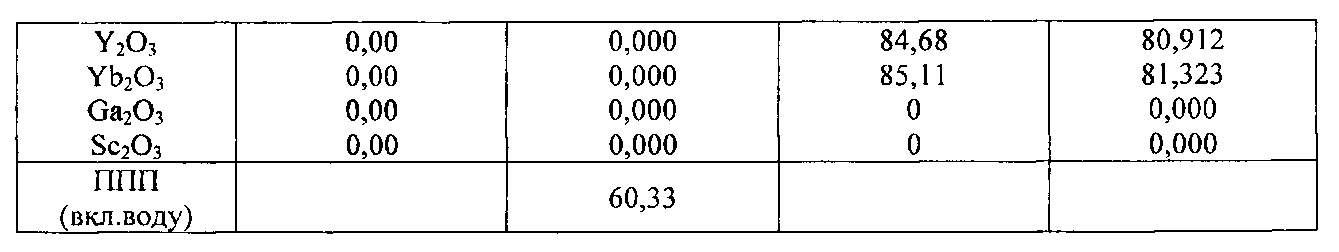
[00299] Согласно результатам, приведенным в таблице 28, таким образом, можно сделать вывод о том, что различные металлы, редкоземельные элементы и редкие металлы, присутствующие при выщелачивании, можно выделять путем экстракции из полученной композиции при помощи способов согласно настоящему изобретению, таких как, например, те, что приведены в примерах 1, 2 и 5. В указанных случаях исходное вещество применяли в способах, приведенных на фиг. 1, 3, 6, 7, 8, 10А, 10В, 11А или 11В.
Пример 8
[00300] Проводили исследования с использованием красного шлама в качестве исходного материала. Для выщелачивания образцов красного шлама (КШ) использовали HCl в 6М концентрации. Результаты показаны ниже в таблицах 29-35.

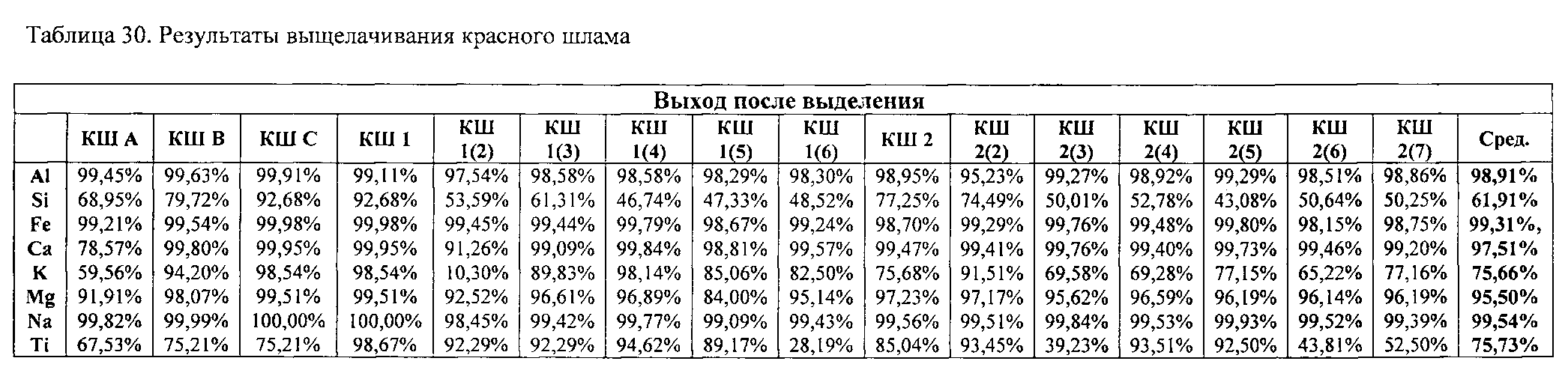

Пример 9
[00301] В таблицах 36 и 37 обобщены общие диапазоны химического состава остатков после обработки (красный шлам из различных стран). Указанные анализы проводили в независимой и сертифицированной лаборатории.


[00302] Таким образом, можно увидеть, что красный шлам эффективно выщелачивали с использованием HCl, что, таким образом, обеспечивало хороший выход при выделении различных компонентов, содержащихся в красном шламе. Указанные различные продукты или компоненты, содержащиеся в получаемом продукте выщелачивания, таким образом, можно полностью выделять и в конечном счете подвергать превращениям, таким как указано выше в способах согласно настоящему изобретению. Затем полученный продукт выщелачивания можно обрабатывать согласно описанию способов согласно настоящему изобретению. Стадию выщелачивания в примере 8 можно рассматривать, например, как стадию выщелачивания 2, приведенную на фиг. 1 или фиг. 3; как стадию выщелачивания 102, приведенную на фиг. 6 или фиг. 7; как стадию выщелачивания 2, приведенную на фиг. 8, как стадию выщелачивания 202, приведенную на фиг. 10A, как стадию выщелачивания 302, приведенную на фиг. 11А и т.д. Например, продукт выщелачивания, полученный в примере 8, затем можно обрабатывать, как показано на фиг. 1, 3, 6-8, 10А, 10В, 11А и 11В. Например, продукт выщелачивания можно обрабатывать согласно описанию примеров 1, 2 и 5.
[00303] На фиг. 9 показан способ отделения Si от Ti. Например, при использовании руды в качестве исходного материала выщелачивание можно проводить в присутствии Cl2 для поддержания Ti в виде TiCl4, так как он переходит в раствор, тогда как Si остается в твердом состоянии (SiO2). Затем Ti можно вводить в плазменную горелку для очистки.
[00304] Указанный способ очистки Si и Ti можно применять во всех способах согласно настоящему изобретению, в которых существует необходимость разделения двух указанных компонентов. Например, см. стадию 113 на фиг. 7.
[00305] Способы, изображенные на фиг. 10А/10В и 11А/11В, представляют собой способы, которые могут подходить для обработки различных материалов, содержащих, например, Mg и другие металлы, такие как Ni и/или Со. Указанные материалы также могут содержать и другие металлы, такие как алюминий, железо и т.д. Указанные способы, таким образом, могут быть эффективными для обработки красного шлама. Способы, приведенные на фиг. 10А/10В и фиг. 11А/11В, являются одинаковыми с тем исключением, что на фиг. 10А/10В после стадии 204 магний остается в растворе (см. стадию 211), тогда как на фиг. 11А/11В после стадии 304 магний осаждают (см. стадию 311).
[00306] Определенные стадии, проводимые в способах, изображенных на фиг. 10А/10В и 11А/11В, являются одинаковыми со стадиями других способов, описанных в настоящей заявке.
[00307] Например, стадии 201 и 301 являются схожими со стадией 101, приведенной на фиг. 6 и 7. Кроме того, стадии 202 и 302, изображенные на фиг. 10А/10В и 11А/11В, являются схожими со стадией 102, приведенной на фиг. 6 и 7.
[00308] Стадии 203 и 303, изображенные на фиг. 10А/В и 11А/В, являются схожими со стадией 103, приведенной на фиг. 6 и 7.
[00309] Стадии 213 и 313, изображенные на фиг. 11 и 12, являются схожими со стадией 113, приведенной на фиг. 7. Что касается стадий 214 и 314, TiO2 в завершении можно очищать с использованием плазменной горелки.
[00310] В завершении CaSO4·2H2O (гипс) можно получать согласно подробному описанию стадий 223 и 323. Наконец, впоследствии на стадиях 224, 324, 225 и 325 можно получать Na2SO4 и K2SO4.
[00311] Что касается стадий 213 и 313, TiO2 можно превращать в хлорид титана для растворения таким образом титана в жидкой фазе. Например, это можно осуществлять путем взаимодействия TiO2 с Cl2 и углеродом (С). Таким образом, можно разделять SiO2 и титан друг от друга, так как SiO2 остается в твердом состоянии, тогда как хлорид титана переходит в раствор. Например, стадии 213, 313, 214 и 314 можно проводить согласно подробному описанию, приведенному на фиг. 9.
[00312] Указанные способы также являются эффективными для достижения полного выделения HCl.
[00313] После осаждения Ni и/или Cd (стадия 212) можно осаждать LiOH и, наконец, промывать на стадии 208. Затем Ni и Со очищают путем экстракции растворителем 207. Таким образом, специалисты в дайной области техники могут выбирать соответствующие условия для разделения двух указанных металлов. Примеры указанных различных способов разделения Ni и Со предложены в заявке на патент США №2011/0283838, содержание которой включено в настоящую заявку во всей полноте посредством ссылки. Затем для дополнительной экстракции металлов можно проводить дополнительное выщелачивание на стадии 209.
[00314] После стадии 304, связанной с отделением MgO, можно кристаллизовать и промывать LiCl (стадия 308). После стадии 305 получают гематит и осаждают Ni и Со (стадия 312). Затем Ni и Со можно отделять друг от друга при помощи вышеуказанных способов (экстракция растворителем), отмеченных при описании стадии 207.
[00315] Например, если исходный материал, используемый в способах, приведенных на фиг. 10A, 10В, 11А и 11В, содержит алюминий, то для осаждения AlCl3 можно проводить стадии 210 и 310. Указанная стадия (210 или 310) является схожей со стадией 104, проводимой согласно фиг. 6 и 7. Аналогично, стадии 205 и 305, изображенные на фиг. 10A, 10В, 11А и 11В, являются схожими со стадией 105, приведенной на фиг. 6 и 7. Стадии 206 и 306, изображенные на фиг. 10А, 10В, 11А и 11В, являются схожими со стадией 106, приведенной на фиг. 6 и 7. Очистка HCl, проводимая на стадиях 215 и 315, является схожей со стадией 107, проводимой согласно фиг. 6 и 7. Как можно увидеть, на стадиях 216 и 316, изображенных на фиг. 10А, 10В, 11А и 11В, таким образом, происходит регенерация HCl.
[00316] В качестве альтернативы после стадии 209 в зависимости от состава исходного материала, используемого в способах, изображенных на фиг. 10А, 10В, 11А и 11В, стадии 210 и 310 можно опускать или пропускать. Таким образом, если исходный материал по существу не содержит алюминий, или если после стадии 209 содержание алюминия значительно снижается, можно проводить стадию 249. Затем после стадий 249 и 349, изображенных на фиг. 10А, 10В, 11А и 11В, не которых получают смесь хлоридов различных металлов, можно проводить прокаливание на стадиях 217 и 317 для получения в итоге смеси оксидов различных металлов.
[00317] Примеси, полученные на стадиях 210 и 310, можно кристаллизовать на стадиях 218 и 318. За счет этого можно кристаллизовать NaCl (стадии 219 и 319) и KCl (стадии 221 и 321). Электролиз NaCl (стадии 220 и 320) и KCl (стадии 222 и 322) можно проводить, как указано выше в настоящем описании.
[00318] Способы согласно настоящему изобретению обеспечивают множество преимуществ и отличительных признаков по сравнению с известными способами.
[00319] Способы согласно настоящему изобретению обеспечивают полностью непрерывные и экономичные решения, при помощи которых можно успешно экстрагировать оксид алюминия из материалов различных типов и при этом обеспечивать вторичные продукты с высокой добавленной стоимостью с ультравысокой степенью чистоты, включая высококонцентрированные редкоземельные элементы и редкие металлы. Технология, описанная в настоящем изобретении, обеспечивает выделение не достижимого до настоящего времени количества кислоты, а также ультравысокую концентрацию выделяемой кислоты. Можно объединить это с тем фактом, что объединение с полунепрерывным способом выщелачивания благоприятствует достижению высоких выходов после экстракции и обеспечивает специфический способ кристаллизации хлорида алюминия и концентрирования других элементов с добавленной стоимостью. Указанные способы также обеспечивают получение алюминия с использованием получаемого таким образом оксида алюминия.
[00320] Другое преимущество способов согласно настоящему изобретению связано с высокой температурой и высокой концентрацией подаваемой хлороводородной кислоты. При объединении с полунепрерывным режимом, при котором систематично используют продвижение свободной HCl, выходы после экстракции железа и алюминия достигают, соответственно, 100% и 98% за период времени, составляющий менее 40% от стандартного времени проведения типового периодического процесса. Другим преимуществом использования HCl в концентрации, превышающий ее азеотропную концентрацию, является возможность увеличения производительности. Также, использование HCl в концентрации, превышающей азеотропную концентрацию HCl, в полунепрерывном режиме обеспечивает значительные преимущества по сравнению с уровнем техники.
[00321] Другим преимуществом методики, используемой для отделения маточного раствора от оксида кремния после стадии выщелачивания с применением промывки встречным потоком, является то, что ленточные фильтры обеспечивают оксид кремния ультравысокой чистоты, где ожидаемое значение чистоты превышает 96%.
[00322] Кристаллизация AlCl3 в виде AlCl3·6H2O с использованием высушенной очищенной и высококонцентрированной HCl в качестве барботируемого агента обеспечивает чистый гексагидрат хлорида алюминия с содержанием железа и других примесей в количестве только лишь несколько частей на миллион. Для обеспечения подходящего роста кристаллов требуется минимальное количество стадий.
[00323] Непосредственная связь с прокаливанием AlCl3·6H2O с получением Al2O3, при котором получается газ с очень высокой концентрацией, обеспечивает точную регулировку концентрации при непрерывной подаче HCl в кристаллизатор и, таким образом, надлежащий контроль роста кристаллов и способа кристаллизации.
[00324] Таким образом, авторы настоящего изобретения продемонстрировали, что предложенные способы являются эффективными для последовательного разделения отдельных ценных и пользующихся спросом компонентов красного шлама (или выбранного материала, подвергающегося разделению) и повторного использования кислоты. Указанные способы, таким образом, обеспечивают выделение большей части оксида алюминия, обычно отбрасываемого в процессе Байера в качестве отходов.
[00325] Способы согласно настоящему изобретению, таким образом, предлагают конкретное решение проблемы указанных крупных прудов-отстойников красного шлама, их рекультивации, а также быстрого возвращения инвестиций вследствие выделения оксида алюминия и других продуктов с добавленной стоимостью, отделяемых и очищаемых на стадии регенерации кислоты. Указанные результаты демонстрируют, что способы согласно настоящему изобретению представляют собой новую и экономичную технологию и являются не только эффективной альтернативой способов получения оксида алюминия из различных алюминийсодержащих руд в отсутствие получения красного шлама, но также способом рекультивации существующих токсичных отходов красного шлама, которые являются основным предметом экологической ответственности при производстве оксида алюминия и алюминия.
[00326] Несмотря на то, что первоначальный состав красного шлама может быть различным в зависимости от природы боксита, рабочих условий и т.д.; способы согласно настоящему изобретению являются универсальными с точки зрения обработки подаваемого сырья, имеющего различный состав. Это позволяет проводить обработку красного шлама, полученного на любом заводе, производящем оксид алюминия. Были проведены успешные исследования различных источников красного шлама из различных областей по всему миру.
[00327] Авторы открыли полностью интегрированные и непрерывные способы экстракции оксида алюминия и других продуктов с добавленной стоимостью из различных материалов, содержащих алюминий (глины, боксита, алюмосиликатных материалов, шлака, красного шлама, зольной пыли и т.д.), в которых по существу полностью выделяют хлороводородную кислоту. Действительно, способы обеспечивают получение по существу чистого оксида алюминия и других очищенных продуктов с добавленной стоимостью, таких как очищенный оксид кремния, очищенный гематит, оксид титана, другие чистые минералы (например, оксид магния), продукты, содержащие редкоземельные элементы и редкие металлы. Кроме того, в способах перед осуществлением кислотного выщелачивания не требуется предварительная термическая обработка. Кислотное выщелачивание проводят при помощи полунепрерывных способов в условиях высокого давления и температуры, при этом выделяют хлороводородную кислоту в очень высокой концентрации. Кроме того, в способах не получают какие-либо отходы, на которые отсутствует спрос, что, таким образом, предотвращает выбросы опасных отходов в окружающую среду, как это происходит в случае способов с применением щелочей.
[00328] Преимуществом стадии высокотемпературного прокаливания помимо обеспечения контроля получения требуемой α-формы оксида алюминия является то, что она эффективно обеспечивает концентрацию хлороводородной кислоты в водном растворе (>38%), превышающую азеотропную концентрацию HCl, что, таким образом, обеспечивает подвод более концентрированной HCl на стадию выщелачивания. Система обработки хлороводородной кислоты, включающая стадию прокаливания, может быть связана с двумя (2) системами кристаллизации, и за счет регулировки давления можно абсорбировать избыток HCl при максимально возможной концентрации в водном растворе. Преимущество использования гексагидрата хлорида с низким содержанием влаги (<2%) в подаваемом потоке обеспечивает непрерывную основу для выделения кислоты в концентрации, превышающей концентрацию в азеотропе. Указанный баланс HCl и двойное использование в трех (3) общих стадиях способов с использованием концентрации, превышающей концентрацию в азеотропе, обеспечивает существенное преимущество по сравнению с уровнем техники.
[00329] Другим преимуществом является использование блока обработки подаваемого химического вещества (хлорида железа (III)) для получения оксида железа и выделения хлороводородной кислоты, в котором всю избыточную теплоту, полученную из любых блоков прокаливания, пирогидролиза и выщелачивания, выделяют для предварительного концентрирования маточного раствора хлорида металла, что, таким образом, позволяет проводить гидролиз хлорида железа (III) при очень низких температурах для получения гематита высокой степени чистоты и выделения кислоты в той же концентрации, что и концентрация в азеотропе.
[00330] Дополнительным значительным преимуществом предложенного способа на стадии гидролиза хлорида железа (III) является возможность концентрирования редкоземельных элементов в виде хлоридов в очень высокой концентрации в гидролизере с использованием замкнутой петли между гидролизером и установкой кристаллизации. Преимущество заключается в том, что в способах согласно настоящему изобретению эффективно используют различные стадии, на которых применяют постепенно изменяющиеся отношения концентраций. Таким образом, на указанной стадии помимо замкнутой циркуляционной петли использование оксида кремния, алюминия, железа в равновесном практически насыщенном растворе (из которого выпарено большое количество воды, свободная хлороводородная кислота отсутствует) позволяет выделять редкоземельные элементы и не поддающиеся гидролизу элементы, содержащиеся в подаваемом потоке в количестве, составляющем несколько частей на миллион, и концентрировать их до достижения высокого процентного содержания непосредственно в гидролизере после удаления хлорида железа (III). Затем можно проводить очистку определенных оксидов (РЗЭ-О) при помощи различных методик, когда их содержание составляет порядка нескольких процентов. В этом заключается двойное преимущество: концентрирование редкоземельных элементов до очень высокой степени чистоты при помощи совмещенных стадий способа и, что самое главное, в таком подходе избегают использования основного потока (очень разбавленного) отработанной кислоты после стадии выщелачивания, которое создает риск загрязнения основного потока хлорида алюминия, что, таким образом, влияет на выход Al2O3. Другим усовершенствованием по сравнению с уровнем техники помимо полной интеграции способа является то, что селективное удаление компонентов обеспечивает концентрирование редкоземельных элементов до достижения очень высоких концентраций (в процентах).
[00331] Другим преимуществом способа также является селективная кристаллизация MgCl2 путем барботирования HCl, полученной на стадии прокаливания оксида алюминия или прямого прокаливания оксида магния, где в обоих случаях вырабатывают высококонцентрированную кислоту в газовой фазе или в виде водного раствора. Согласно способу специфической кристаллизации хлорида алюминия непосредственное совмещение с реактором прокаливания, использование газообразной HCl в очень высокой концентрации (от примерно 85 до примерно 95%, от примерно 90 до 95% или примерно 90% по массе) позволяют проводить точную непрерывную настройку кристаллизатора в зависимости от требуемого качества оксида магния. Если в соответствии с химическим составом подаваемого материала, используемого в способе, требуется проведение указанной стадии (получения MgO или других оксидов металлов с добавленной стоимостью), после указанной дополнительной стадии можно проводить экстракцию редкоземельных элементов и редких металлов; преимуществом является дополнительное концентрирование.
[00332] Пирогидролиз обеспечивает конечную конверсию любых оставшихся хлоридов и получение очищенных оксидов, которые можно использовать (в случае использования глины в качестве исходного материала) в качестве удобрений, и обработку больших количеств промывочной воды, полученной в способах, для выделения хлороводородной кислоты, имеющей концентрацию, равную концентрации в азеотропе, в замкнутой петле для использования на стадии выщелачивания. Преимущество указанной последней стадии связано с тем фактом, что она полностью замыкает петлю обработки с точки зрения выделения кислоты и обеспечивает отсутствие экологически вредных отходов при обработке любого сырья согласно приведенному выше описанию.
[00333] Основной вклад в уровень техники заключается в том, что предложенные полностью интегрированные способы согласно настоящему изобретению действительно обеспечивают помимо прочего экономичную обработку боксита без получения красного шлама или вредных отходов. Помимо возможности применения другого природного сырья (любых подходящих алюминийсодержащих материалов или алюминийсодержащих руд) полное выделение хлороводородной кислоты и получение общей концентрации, превышающей концентрацию в азеотропе (например, от примерно 21% до примерно 38%), селективная экстракция вторичных продуктов с добавленной стоимостью и соблюдение (и при этом сохранение конкурентоспособности с точки зрения затрат на превращение) требований экологической безопасности представляют собой основные преимущества по сравнению с уровнем техники.
[00334] Таким образом, было продемонстрировано, что настоящее изобретение обеспечивает полностью интегрированные способы получения чистого оксида алюминия с использованием обработки хлороводородной кислотой, одновременно с этим получение высокочистых и высококачественных продуктов (минералы) и экстракцию редкоземельных элементов и редких металлов.
[00335] Несмотря на то, что в описании приведены конкретные ссылки на конкретные варианты реализации, следует понимать, что специалистам в данной области должны быть очевидными различные модификации изобретения. Соответственно, приведенное выше описание и прилагаемые чертежи следует рассматривать как конкретные примеры, но не в ограничивающем смысле.
Реферат
Группа изобретений относится к области обработки красного шлама. Способы включают выщелачивание красного шлама с использованием HCl с получением продукта выщелачивания, содержащего ионы первого металла, например алюминия, и твердое вещество. Затем проводят выделение указанного твердого вещества из указанного продукта выщелачивания. При этом из продукта выщелачивания экстрагируют и другие металлы, например Fe, Ni, Со, Mg, редкоземельные элементы, редкие металлы. Из твердого вещества экстрагируют другие компоненты, например, такие как TiO, SiOТехническим результатом являетсявозможность переработки красного шлама, являющегося отходом производства алюминиевой промышленности, с получением чистых продуктов и металлов. 15 н. и 375 з.п. ф-лы, 13 ил., 37 табл., 9 пр.
Формула
выщелачивание красного шлама с использованием соляной кислоты (HCl) при температуре от 125 до 225°C с получением продукта выщелачивания, содержащего ионы алюминия и ионы железа и твердое вещество, и выделение указанного твердого вещества из указанного продукта выщелачивания;
взаимодействие указанного продукта выщелачивания с HCl с получением, жидкости, содержащей указанные ионы железа, и осадка, содержащего указанные ионы алюминия в виде AlCl3, и отделение указанного осадка от указанной жидкости; и
нагревание указанного осадка с получением Al2O3, и необязательно выделение получаемой газообразной HCl.
KCl из указанной жидкости, взаимодействие с применением указанного KCl, проведение электролиза для получения КОН и KOCl.
СН4: от 0 до 1 об. %;
С2Н6: от 0 до 2 об. %;
C3H8: от 0 до 2 об. %;
С4Н10: от 0 до 1 об. %;
N2: от 0 до 0,5 об. %;
Н2: от 0,25 до 15,1 об. %;
СО: от 70 до 82,5 об. %; и
CO2: от 1,0 до 3,5 об. %.
контакт со встречным потоком H2SO4 для уменьшения количества воды, содержащейся в газообразной HCl.
выщелачивание красного шлама с использованием HCl при температуре от 125 до 225°C с получением продукта выщелачивания, содержащего ионы алюминия и ионы железа и твердое вещество, и выделение указанного твердого вещества из указанного продукта выщелачивания;
взаимодействие указанного продукта выщелачивания с HCl с получением жидкости, содержащей указанные ионы железа, и осадка, содержащего указанные ионы алюминия в виде AlCl3, и отделение указанного осадка от указанной жидкости;
агревание указанного осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и необязательно выделение полученной в указанных условиях газообразной HCl; и
превращение указанного Al2O3 в алюминий.
температуре от 185 до 190°C.
СН4: от 0 до 1 об. %;
С2Н6: от 0 до 2 об. %;
C3H8: от 0 до 2 об. %;
С4Н10: от 0 до 1 об. %;
N2: от 0 до 0,5 об. %;
Н2: от 0,25 до 15,1 об. %;
СО: от 70 до 82,5 об. %; и
CO2: от 1,0 до 3,5 об. %.
твердое вещество, выделение указанного твердого вещества из указанного продукта выщелачивания и дополнительную обработку указанного твердого вещества с использованием HCl для отделения Si от Ti, содержащихся в указанном твердом веществе.
выщелачивание указанного красного шлама, содержащего первый металл, с использованием HCl при температуре от 125 до 225°C с получением продукта выщелачивания, содержащего ионы указанного первого металла и твердое вещество, и выделение твердого вещества из продукта выщелачивания;
взаимодействие продукта выщелачивания с HCl с получением жидкости и осадка, содержащего хлорид первого металла, и отделение осадка от жидкости; и
нагревание осадка в условиях, эффективных для превращения хлорида первого металла в оксид первого металла.
выщелачивание указанного твердого вещества с использованием кислоты с получением другого продукта выщелачивания; и
выделение третьего металла из указанного другого продукта выщелачивания.
выщелачивание красного шлама с использованием кислоты с получением продукта выщелачивания и твердого остатка и отделение указанного продукта выщелачивания от указанного твердого остатка;
по меньшей мере частичное удаление ионов железа из указанного продукта выщелачивания путем селективного осаждения указанных ионов железа при pH более 10 путем взаимодействия указанного продукта выщелачивания с основанием и частичного удаления указанных осажденных ионов железа из указанного продукта выщелачивания с получением тем самым композиции, обогащенной Al, содержащей ионы Al3+;
осаждение указанных ионов Al3+в виде Al(ОН)3 при pH от 7 до 10; необязательно очистку указанных ионов Al3+; и превращение указанных ионов Al3+ в оксид алюминия.
9,5.
получение оксида алюминия при помощи способа по любому из п.п. 1-142 и 298-319; и
обработку указанного оксида алюминия в условиях, эффективных для превращения его в алюминий.
выщелачивание красного шлама с использованием HCl с получением первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, и выделение указанного твердого вещества из указанного первого продукта выщелачивания;
выделение по меньшей мере указанных ионов указанного по меньшей мере одного металла из указанного продукта выщелачивания; и
выщелачивание указанного твердого вещества с использованием HCl в присутствии хлорида, выбранного из хлоридов щелочных металлов и хлоридов щелочноземельных металлов, с получением второго продукта выщелачивания, содержащего хлорид титана.
выщелачивание красного шлама с использованием HCl с получением первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, и выделение указанного твердого вещества из указанного продукта выщелачивания;
выделение по меньшей мере указанных ионов указанного по меньшей мере одного металла из указанного первого продукта выщелачивания; и
взаимодействие указанного твердого вещества с Cl2 и источником углерода с получением жидкой фракции, содержащей указанный хлорид титана, и твердой фракции и отделение указанной жидкой фракции от указанной твердой фракции.
выщелачивание красного шлама с использованием HCl с получением первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, и выделение указанного твердого вещества из указанного первого продукта выщелачивания;
выделение по меньшей мере указанных ионов указанного по меньшей мере одного металла из указанного первого продукта выщелачивания;
выщелачивание указанного твердого вещества с использованием HCl в присутствии хлорида, выбранного из хлоридов щелочных металлов и хлоридов щелочноземельных металлов, с получением второго продукта выщелачивания, содержащего хлорид титана; и
превращение указанного хлорида титана в оксид титана.
выщелачивание красного шлама с использованием HCl с получением первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, содержащее TiO2 и SiO2, и выделение указанного твердого вещества из указанного первого продукта выщелачивания;
выделение по меньшей мере указанных ионов указанного по меньшей мере одного металла из указанного первого продукта выщелачивания;
взаимодействие указанного твердого вещества с Cl2 и источником углерода с получением жидкой фракции, содержащей указанный хлорид титана, и твердой фракции и отделение указанной жидкой фракции от указанной твердой фракции; и
превращение указанного хлорида титана в оксид титана.
выщелачивание красного шлама с использованием HCl с получением первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, и выделение указанного твердого вещества из указанного первого продукта выщелачивания, причем указанный первый продукт выщелачивания содержит ионы Al и/или ионы Fe;
выделение по меньшей мере указанных ионов указанного по меньшей мере одного металла из указанного продукта выщелачивания; и
выщелачивание указанного твердого вещества с использованием HCl необязательно в присутствии хлорида с получением второго продукта выщелачивания, содержащего хлорид титана.
выщелачивание красного шлама с использованием HCl с получением первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, и выделение указанного твердого вещества из указанного первого продукта выщелачивания;
выделение по меньшей мере указанных ионов указанного по меньшей мере одного металла из указанного первого продукта выщелачивания;
выщелачивание указанного твердого вещества с использованием HCl необязательно в присутствии хлорида с получением второго продукта выщелачивания, содержащего хлорид титана; и
превращение указанного хлорида титана в оксид титана путем взаимодействия хлорида титана с водой и/или основанием для осаждения оксида титана.
выщелачивание красного шлама с использованием HCl с получением первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, и выделение указанного твердого вещества из указанного первого продукта выщелачивания;
выделение по меньшей мере указанных ионов указанного по меньшей мере одного металла из указанного первого продукта выщелачивания;
выщелачивание указанного твердого вещества с использованием HCl необязательно в присутствии хлорида с получением второго продукта выщелачивания, содержащего хлорид титана; или взаимодействие указанного твердого вещества с Cl2 и источником углерода с получением жидкой фракции, содержащей указанный хлорид титана, и твердой фракции и отделение указанной жидкой фракции от указанной твердой фракции;
превращение указанного хлорида титана в оксид титана; и
нагревание и очистку указанного оксида титана с использованием плазменной горелки.
выщелачивание красного шлама с использованием HCl с получением первого продукта выщелачивания, содержащего ионы по меньшей мере одного металла и твердое вещество, и выделение указанного твердого вещества из указанного первого продукта выщелачивания;
выделение по меньшей мере указанных ионов указанного по меньшей мере одного металла из указанного первого продукта выщелачивания;
выщелачивание указанного твердого вещества с использованием HCl необязательно в присутствии хлорида с получением второго продукта выщелачивания, содержащего хлорид титана; или взаимодействие указанного твердого вещества с Cl2 и источником углерода с получением жидкой фракции, содержащей указанный хлорид титана, и твердой фракции и отделение указанной жидкой фракции от указанной твердой фракции; и превращение указанного хлорида титана в оксид титана с использованием плазменной горелки.
выщелачивание красного шлама с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и ионы железа и твердое вещество, содержащее менее 10% атомов алюминия, содержащихся в указанном красном шламе, и выделение указанного твердого вещества из указанного продукта выщелачивания;
взаимодействие указанного продукта выщелачивания с HCl с получением жидкости, содержащей указанные ионы железа, и осадка, содержащего указанные ионы алюминия в виде Al2O3, и отделение указанного осадка от указанной жидкости; и
нагревание указанного осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и необязательно выделение полученной в указанных условиях газообразной HCl.
выщелачивание красного шлама с использованием HCl в условиях, эффективных для получения твердого вещества и продукта выщелачивания, содержащего по меньшей мере 90% алюминия, содержащегося в указанном красном шламе, в виде ионов алюминия, и ионы железа, и выделение указанного твердого вещества из указанного продукта выщелачивания;
приведение во взаимодействие указанного продукта выщелачивания с HCl с получением жидкости, содержащей указанные ионы железа, и осадка, содержащего указанные ионы алюминия в виде AlCl3, и отделение указанного осадка от указанной жидкости; и нагревание указанного осадка в условиях, эффективных для превращения AlCl3 в Al2O3, и необязательно выделение полученной газообразной HCl.

Комментарии