Способ получения производных ациламинобензамидов - RU2032662C1
Код документа: RU2032662C1
Чертежи







Описание
Изобретение относится к
органической химии, а именно, к
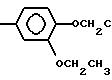
способу получения новых производных ациламинобензамидов общей формулы I
R4-



где А и В независимо друг от друга представляют собой Н, фтор, хлор, бром, С1-С4 алкил, С1-С4 алкокси-группу или галоид (С1-С4) алкил, при условии, что А и В одновременно не могут представлять собой Н; D и Е независимо представляют собой Н или фтор, R1 представляет собой Н, С1-С4 алкил, R2 является С1-С4 алкилом, С1-С4 алкокси-группой или фенилом, либо R1 и R2 вместе с атомом азота, к которому они присоединены, образуют морфолиновое, пиперидиновое, пирролидиновое или азетидиновое кольцо, необязательно замещенное С1-С4-алкилом, R3 представляет собой Н, R4 является трихлорметилом, С2-С8-алкилом (необязательно замещенным галогеном, С1-С8-алкокси-группой или R12 S(0)n, где R12 является С1-С4-алкилом, а n равно 0,1 или 2), циклопропилом (необязательно замещенным С1-4-алкилом) С2-С8 -алкенилом, С2-С8-алкинилом, С1-С8-алкокси-группой, моно- или ди(С1-С4)-алкиламиногруппой или группой R8ON= C(CN), где R13 представляет собой С1-С4-алкил, либо R3 и R4 вместе с группой С(О)N к которой они присоединены, образуют азетидин-2-оновое кольцо, которые обладают фунгицидными свойствами и могут использоваться для борьбы с грибковыми инфекциями растений.
Известно использование анилиновых производных в качестве фунгицидов.
Целью изобретения является разработка доступного способа получения соединений формулы 1.
Поставленная цель достигается описываемым способом получения соединений формулы I, который
заключается в том, что соединение формулы III
R

R
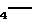

Изобретение иллюстрируется представленными ниже примерами.
В примерах термин "эфир" относится к диэтиловому эфиру, для сушки растворов используют сульфат магния и растворы концентрируют при пониженном давлении. Реакции с участием чувствительных к воде промежуточных соединений проводят в атмосфере азота и растворителя, сушат перед использованием, если это нужно. Представленные инфракрасные и ЯМР-спектры селективны, не делались попытки перечислить все поглощения во всех случаях. За исключением специально указанных случаев 1Н-ЯМР-спектры записывали для растворов в CDCl3.
Введены следующие сокращения:
ТГФ-тетрагидрофуран С-синглет
ДМФ-N,N-диметилформаимд д-дублет
ЯМР-ядерный магнитный резонанс
т-триплет
ИК-инфракрасная спектроскопия м-мультиплет
Т.пл. температура плавления ш широкий
П
р и м е р 1. В этом примере иллюстрируется получение 2-хлор-4-[2,
2-диметилпропионамидо]-N,N-диметилбензамида (соединение 5 в табл. 1).
Стадия 1.
Получение 2-хлор-4-нитро-N,N-диметилбензамида.
2-хлор-4-нитробензойную кислоту (25,0 г) кипятят с обратным холодильником в тионилхлориде (80 г) с несколькими каплями ДМФ 3 час. Затем избыток тионилхлорида отгоняют и сырой 2-хлор-4-нитробензоилхлорид по каплям прибавляют к 40% водному диметиламину (70 мл) при 0-5оС. После перемешивания в течение 0,5 ч отфильтровывают желтый кристаллический осадок, промывают водой, сушат и получают 2-хлор-4-нитродиметилбензамид в виде бледно-желтых кристаллов (24,97 г), т.пл. 116-117оС.
ЯМР (CDCl3 90,
МГц) δ: 2,90 (3Н, с), 3,20 (3Н, с), 7,49 (1Н, д),
8,12 (1Н, д), 8,27 (1Н, м),
ИК (нуйол): 1300, 1640 см-1
Стадия 2.
Получение 4-амино-2-хлор-N, N-диметилбензамида.
Порошкообразное железо (предварительно восстановленное водородом, 10,0 г) суспендируют в этаноле (80 мл) и воде (10 мл) и при интенсивном перемешивании прибавляют концентрированную соляную кислоту (4 мл). Небольшими порциями в течение 15 мин прибавляют 2-хлор-4-нитро-N,N-диметилбензамид (7,50 г) и смесь нагревают 5 час при 50-60оС и перемешивания. Смесь фильтруют через Celite и выпаривают этанол. Прибавляют воду (200 мл) и концентрированную соляную кислоту (20 мл), реакционную смесь промывают этилацетатом и затем подщелачивают до рН 8 бикарбонатом натрия и экстрагируют метиленхлоридом. Органические экстракты сушат, вы- паривают и получают 4-амино-2-хлор-N,N-диметилбензамид в виде серых кристаллов (5,21 г), из которых перекристаллизацией из смеси хлороформ/этилацетат получают белые кристаллы (3,46 г, т.пл. 170-173оС).
ЯМР (CDCl3 270 МГц) δ: 2,89 (3Н, с), 3,11 (3Н, с), 3,
87 (2Н, шс), 6,57 (1Н, дд), 6,7 (1Н, с), 7,07 (1Н, д)
ИК
(жидкая пленка): 3440-3340, 1649 см-1.
Стадия 3.
Получение 2-хлор-4-(2,2, диметилпропионамидо)-N,N-диметилбензамида.
4-амино-2-хлор-N, N-диметилбензамид (1,0 г) и триэтиламин (1,21 г) растворяют в метиленхлориде (20 мл) и раствор охлаждают до 0-5о С. По каплям прибавляют 2,2-диметилпропионилхлорид (1,21 г), поддерживая температуру ниже 10оС и результирующий оранжевый раствор перемешивают при 0-10оС, 8,5 ч. Затем органический раствор промывают водным бикарбонатом натрия и затем водой, сушат, выпаривают и получают оранжевое твердое соединение. Его перекристаллизовывают из смеси этилацетат: хлороформ 3:1 и получают 2-хлор-(2,2-диметилпропионамидо)-диметилбензамид в виде белых кристаллов (1, 027 г), т.пл. 202-203оС.
ЯМР (CDCl3, 270 МГц) δ: 1,32 (9Н, с), 2,86
(3Н, с), 3,13 (3Н, с), 7,16 (1Н, д), 7,34 (1Н, д), 7,68 (1Н, с), 7,72 (1Н, шс),
ИК (нуйол): 3340, 1690, 1630 см-1.
П р и м е р 2. В этом примере иллюстрируется получение 2-хлор-4-(2-метилпропионамидо)-N,N-диэтилбензамида (соединение 1 в табл. 1).
Стадия 1.
Получение 2-хлор-4-(2'-метилпропионамидо)бензойной кислоты.
4-амино-2-хлорбензойную кислоту перемешивают в воде (60 мл) и 1,2-диметоксиэтане (25 мл) с бикарбонатом натрия (5,04 г) и коричневую суспензию охлаждают до 0-5оС. При энергичном перемешивании в течение 10 мин по каплям прибавляют 2-метилпропионилхлорид (4,26 г) и смесь перемешивают 2 час при 0-10оС. Смесь выливают в 2М хлористоводородную кислоту и бледно-коричневый осадок промывают водой, фильтруют, сушат и получают 2-хлор-4-(2'-метилпропионамидо)бензойную кислоту в виде бледно-коричневого кристаллического вещеста (6,30 г) т.пл. 206-209оС.
ЯМР (d6-DMCO, 270 МГц) δ: 1,
05 (6Н, д), 2,53 (1Н, с), 7,51 (1Н.дд), 7,78 (1Н, д), 7,86 (1Н, с), 10,19 (1Н, с), 14-12 (1Н, очень шс)
ИК (нуйол):
3320, 1705, 1670 см-1.
Стадия 2.
Получение 2-хлор-4-(2'-метилпропионамидо)бензоилхлорида.
Оксалилхлорид (0,63 г) в сухом ТГФ (5 мл) по каплям в течение 5 мин прибавляют к раствору 2-хлор-4-(2'-метилпропионамидо)бензойной кислоты (1,0 г) в сухом ТГФ (5 мл) при комнатной температуре. После завершения прибавления прибавляют 1 каплю сухого ДМФ, что вызывает бурное выделение газа и слабый нагрев. После перемешивания в течение 4 ч и прибавления еще одной капли ДМФ, ТГФ выпаривают и получают 2-хлор-4-(2'-метилпропионамидо)бензоилхлорид в виде вязкой коричневой смолы, которую используют без дополнительной очистки.
ИК (жидкая пленка): 3320, 3260, 3160, 3070, 1780, 1710, 1680 см-1.
Стадия 3.
Получение 2-хлор-4-(2'-метилпропионамидо)-N,N-диэтилбензамида.
Сырой 2-хлор-4-(2'-метилпропионамидо)бензоилхлорид из предыдущей стадии в сухом ТГФ (10 мл) по каплям при перемешивании в течение 10-15 мин прибавляют к раствору диэтиламина (1,46 г) в сухом ТГФ (10 мл) при 0-5оС. После перемешивания при 0-10оС реакционную смесь выдерживают в течение ночи при комнатной температуре, выливают в холодную воду и экстрагируют этилацетатом. Экстракт сушат, выпаривают и получают вязкую смолу, которая медленно кристаллизуется и которую затем перекристаллизовывают из этилацетата и получают 2-хлор-4-(2'-метилпропионамидо)-N,N-ди- этилбензамид в виде белых кристаллов (0,507 г).
ЯМР (CDCl3 270 МГц) δ: 1,04 Л (3Н, т), 1,21 (6Н, д), 1,
26 (3Н, т), 2,58 (1Н, септет), 3,15 (2Н, к), 3,39 (1н, шм), 3,74 (1Н, шм), 7,04 (1Н, д), 7,30 (1Н, дд), 7,51 (1Н, с), 8,58
(1Н, шс)
ИК (нуйол, паста): 3300, 3250, 1685 см-1.
П р и м е р 3. В этом примере иллюстрируется получение 1-(3'-хлор-4'-(N, N-диметилкарбамоил)фенил)-3, 3-диметилазети- дин-2-она (соединение 11 в табл. 1).
Стадия 1.
Получение 2-хлор-4-(3'-хлор-2,2'-диметилпропионамидо)-N,N-диметилбензамида.
3-хлор-2, 2-диметилпропионилхлорид (1,86 г) по каплям в течение 5 мин прибавляют к 4-амино-2-хлор-N, N-диметилбензамиду (2,00 г), суспендированному в сухом метиленхлориде (40 мл) и сухом триэтиламине (1,21 г), при перемешивании, поддерживая температуру ниже 10оС. После 1 ч перемешивания и нагрева до комнатной температуры прибавляют метиленхлорид (40 мл) и раствор промывают 2М НCl, насыщенным водным раствором бикарбоната натрия и затем насыщенным раствором соли. Затем раствор сушат, выпаривают и получают липкое желтое твердое соединение, которое перекристаллизовывают из смеси этил- ацетат/хлороформ и получают 2-хлор-4-(3'-хлор-2',2,-диметилпропионамидо)-N,N-диметилбензамид в виде белого твердого кристаллического соединения (2; 349 г), т.пл. 179-181оС.
ЯМР (CDCl3, 270 МГц): δ 1,42 (6Н, с) 2,86 (3Н, с), 3,14 (3Н, с), 3,73 (2Н, с), 7, 96 (1Н, д), 7,26 (1Н, дд), 7,50 (1Н, с), 8,48 (1Н, шс).
ИК (нуйол, паста): 3310, 1670, 1620 см-1.
Стадия 2. 1-(3'-хлор-4'-(N,N-диметилкарбамоил/фенил)-3, 5-диметилазетидин-2-он.
Раствор гидроксида натрия (4,00 г) и тетрабутиламмоний бромида (0,10 г) в воде (10 мл) прибавляют к суспензии 2-хлор-4-(3'-хлор-2',2'-диметилпропионамидо)-N, N-ди-метилбензамида (1,00 г) в метиленхлориде (10 мл) и двухфазную систему перемешивают 1 ч при комнатной температуре. Затем добавляют воду (10 мл) и метиленхлорид (10 мл) и весь метиленхлоридный слой промывают раствором соли, сушат, выпаривают и получают бледно-желтое твердое соединение. Его перекристаллизовывают из смеси этилацетата/гексан и получают 1-(3'-хлор-4'-(N, N-диметилкарбамоил/фенил)-3, 3-ди-метилазетидин-2-он в виде белого кристаллического твердого соединения (0,516 г), т.пл. 122-123оС.
ЯМР (CDCl3 270 МГц) δ: 1,42 (6Н, с), 2,87 (3Н, с). 3, 13 (3Н, с), 3,46 (2Н, с), 7,27 (2Н, т), 7,39 (1Н, с).
ИК (нуйол, паста): 3600-3100, 1740, 1625 см-1.
П р и м е р 4. В этом примере иллюстрируется получение 2-метокси-4-(2', 2'-диметилпропионамидо)-N,N-диметилбензамида (соединение 1 в табл. 2).
Стадия 1.
Получение метил-2-метокси-4-(2',2'-диметилпропионамидо)бензоата.
Метил-2-метокси-4-аминобензоат (3,08 г) и триэтиламин (1,83 г) перемешивают при 0-5оС в сухом метиленхлориде (50 мл). К этому раствору прибавляют по каплям 2, 2-диметилпропионилхлорид (6,07 г) в сухом метиленхлориде (10 мл). После завершения прибавления смесь перемешивают ночь при комнатной температуре и выливают в разбавленную HCl. Органический слой отделяют, промывают разбавленным водным раствором бикарбоната натрия и затем водой, сушат, выпаривают и получают кристаллизующееся масло. После нагрева с гексаном продукт фильтруют и получают в виде белого твердого соединения (3,61 г).
ЯМР (CDCl3 270 МГц) δ: 1,36 (9Н, с), 4,10 (3Н, с), 6,78 (1Н, дд), 8,10 (2Н, м), 10,61 (1Н, с).
Стадия 3.
Получение 2-метокси-4-(2',2'-диметилпропионамидо)бензоилхлорида.
К 2-метокси-4-(2',2-диметилпропионамидо)бензойной кислоте (1,04 г), перемешиваемой в сухом эфире (25 мл) прибавляют по каплям оксалилхлорид (1,4 г) в сухом эфире 5 мл) при комнатной температуре, со следами ДМФ. После завершения прибавления смесь перемешивают 4 ч и оставляют на ночь. Прибавляют метиленхлорид и смесь выпаривают, получая хлорангидрид в виде желтого твердого продукта (1,12 г).
Стадия 4.
Получение 2-метокси-4-(2',2'-диметилпропионамидо)-N, N-диметилбензамида.
2-метокси-4-(2', 2'-диметилпропионами- до)бензоилхлорид (1,12 г) в сухом ТГФ (10 мл) по каплям прибавляют в течение 30 мин к перемешиваемому раствору диметиламина (1,17 г 40% водного раствора) в ТГФ (15 мл) при 0-5оС. После завершения прибавления раствор перемешивают 1 ч при 5 -10оС, выдерживают ночь при комнатной температуре, выливают в воду и экстрагируют этилацетатом. Экстракт сушат, выпаривают и получают желтый твердый продукт (0,889 г), т. пл. 143-144оС.
ЯМР (CDCl3, 270 МГц) δ: 1,33 (9Н, с), 2,85 (3Н, с), 3,11 (2Н, с), 6,75 (1Н, дд), 7,15 (1Н, д), 7,48 (1Н, с), 7,65 (1Н, д).
П р и м е р 5. В этом примере иллюстрируется получение 2-трифторметил-4-(2', 2'-диметилпропионамидо)-N, N-диметил- бензамида (соединение 7 в табл. 2).
Стадия 1.
Получение 2-трифторметил-4-(2,2'-диметилпропионамидо)бензонитрила.
2, 2-диметилпропионилхлорид (3,79 г) в сухом метиленхлориде (5 мл) медленно по каплям прибавляют к 4-циано-3-трифторметиланилину (3,02 г) и триэтиламину (3,34 г) в сухом метиленхлориде (50 мл) при 0-5оС. После завершения прибавления смесь перемешивают при комнатной температуре 1,5 ч и выливают в разбавленную НСl. Органическую фракцию промывают разбавленным водным раствором бикарбоната натрия, затем водой, сушат, и получают после выпаривания оранжевый твердый продукт. Его перекристаллизовывают и получают продукт в виде желтого порошка.
ЯМР (CDCl3, 270 МГц) δ: 1,35 (9Н, с), 7,61 (1Н, с), 7,78 (1Н, д), 7, 95 (1Н, дд), 8,03 (1Н, д).
Стадия 2.
Получение 2-трифторметил-4-(2', 2'-диметилпропионамидо)бензамида.
Перекись водорода (85 мл 30% водного раствора) и гидроксид натрия (8,5 мл 20% водного раствора) прибавляют к 2-трифторметил-4-(2', 2'-диметилпропионамидо)бен-зонитрилу (5,08 г) в этаноле (140 мл) и реакционную смесь перемешивают 5 дней при комнатной температуре, прибавляя в это время дополнительный этанол (100 мл). Затем реакционную смесь нагревают 24 ч при 50оС, выливают в воду и экстрагируют этилацетатом. Органический слой сушат, выпаривают и получают масло, которое хроматографируют на силикагеле и получают целевой продукт (2,89 г).
ЯМР (CDCl3, 270 МГц) δ: 1,35 (9Н, с), 5,80 (2Н, шс), 7,54 (1Н, с), 7,59 (1Н, д), 7,82 (1Н, дд), 7,90 (1Н, д).
Стадия 3.
Получение 2-трифторметил-4-(2',2'-диметилпропионамидо)бензойной кислоты.
Концентрированную HCl (15 мл) прибавляют к 2-трифторметил-4-(2', 2'-диметилпропионамидо)бензамиду (2,35 г) в ледяной уксусной кислоте (35 мл) при -5-0оС. Затем к смеси по каплям прибавляют раствор нитрита натрия (1,807 г) в воде (10 мл) и проводят перемешивание 1 ч при -5-0оС. После разогрева до комнатной температуры перемешивают 24 ч и реакционную смесь выливают в воду и экстрагируют метиленхлоридом. Метиленхлоридную фракцию промывают разбавленным водным раствором гидроксида натрия и щелочной слой подкисляют разбавленной HCl. Подкисленный слой экстрагируют метиленхлоридом, органический слой сушат, выпаривают и получают целевую кислоту в виде белого твердого продукта (0,926 г).
ЯМР (CDCl3 270 МГц): δ 1,20 (9Н, с), 7,79
(1Н, д), 8,02 (1Н, дд), 8,19 (1Н, д), 9,69 (1Н, с)
Стадия 4.
Получение 2-трифторметил-4-(2',2'-диметилпропионамидо)-диметилбензамида.
Оксалилхлорид (0,64 г) в сухом эфире (7 мл) по каплям прибавляют при перемешивании в 2-трифторметил-4-(2',2'-диметилпропионамидо)бензойной кислоте (0,926 г) в сухом эфире (40 мл) при комнатной температуре. В ходе прибавления добавляют каплю ДМФ. Через 2 ч прибавляют еще оксалилхлорид (0,257 г) и реакционную смесь перемешивают еще 2 ч. Затем органический раствор декантируют от осадка, выпаривают и получают 2-трифторметил-4-(2',2'-диметилпропионамидо)бензоилхлорид в виде жидкости (1, 13 г), которую используют без очистки.
Хлорангидрид (1,13 г) в сухом ТГФ (10 мл) по каплям, при перемешивании, в течение 30 мин прибавляют к диметиламину (1,0 г 40% водного раствора) в ТГФ (15 мл) при 0-5оС. Реакционную смесь разогревают до комнатной температуры и выдерживают 2,5 дня, после чего выливают в воду и экстрагируют этилацетатом. Этилацетатную фракцию промывают водным раствором бикарбоната натрия, затем разбавленной HCl и водой. После сушки органический слой выпаривают и получают 2-трифторметил-4-(2',2'-диметилпропионамидо)-N,N-диметил- бензамид в виде белого твердого продукта (0,576 г), т.пл. 198.7-199.6оС.
ЯМР (СDCl3 270 МГц) δ: 1,35 (9Н, с), 2,80 (3Н, с), 3,12 (3Н, с), 7,22 (1Н, д), 7,72 (1Н, с), 7,75 (1Н, дд), 7,85 (1Н, д).
П р и м е р 6. В этом примере иллюстрируется получение 2,3,5, 6-тетрафтор-4-(2', 2'-диметилпропионамидо)-N,N-диметилбенз-амида (соединение 6 в табл. 2).
Стадия 1.
Получение 2,3,5,6-тетрафтор-4-(2', 2'-диметилпропионамидобензоата.
Метил-2,3,5,6-тетрафтор-4-аминобензо- ат (1,887 г) в сухом ТГФ (5 мл) прибавляют к суспензии гидрида натрия (0,764 г 55% дисперсии в масле) в сухом ТГФ (70 мл), перемешивая при комнатной температуре. После окончания выделения газа по каплям, при охлаждении, медленно прибавляют 2, 2-диметилпропионилхлорид (1,127 г) в сухом ТГФ (5 мл). Смесь перемешивают 1 ч при 10оС и выливают в воду, затем экстрагируют этилацетатом. Этилацетатную фракцию промывают разбавленной HCl и разбавленным водным раствором бикарбоната натрия, сушат, выпаривают и получают белый твердый продукт (2,44 г).
ЯМР (CDCl3, 270 МГц) δ: 1,36 (9Н, с), 3,97 (3Н, с), 7, 05 (1Н, с).
Стадия 2.
Получение 2,3,5,6-тетрафтор-4-(2',2'-диметилпропионамидо)бензойной кислоты.
Метил-2,3,5,6-тетрафтор-4-(2', 2'-диме-тилпропионамидо)бензоат (1,83 г) перемешивают ночь с гидроксидом калия (0,669 г растворен в минимальном количестве воды) в диметоксиэтане (ДМЭ) (60 мл) и затем выливают в воду. Смесь экстрагируют этилацетатом. Водную фазу подкисляют и экстрагируют этилацетатом, этилацетатный экстракт сушат, выпаривают и получают кислоту в виде бледно-желтого твердого продукта (1,538 г).
ЯМР (CDCl3, 270 МГц, δ 1,19 (9Н, с), 9,65 (1Н, с).
Стадия 3.
Получение 2,3,5,6-тетрафтор-4-(2',2'-диметилпропионамидо)-N, N-диметилбенз- амида.
Оксалилхлорид (1,00 г) в сухом эфире (5 мл) по каплям, при перемешивании прибавляют к 2,3,4,6-тетрафтор-4-(2',2'-диметилпропионамидо)бензойной кислоте (1,47 г) в сухом эфире (35 мл) и добавляют каплю ДМФ. После перемешивания в течение 2 ч при комнатной температуре эфирный раствор дикантируют от нерастворимых соединений, выпаривают и получают хлорангидрид в виде масла (1,494 г), которое используют без дальнейшей очистки.
Хлорангидрид (1,494 г) в сухом ТГФ (10 мл) медленно, по каплям в течение 30 мин прибавляют к диметиламину (1,363 г) в ТГФ (10 мл) при 0-5оС. После перемешивания 1,5 ч при 10оС реакционную смесь выливают в воду и экстрагируют этилацетатом. Экстракт промывают водным раствором бикарбоната натрия, затем разбавленной HCl, выпаривают и получают белый порошкообразный твердый продукт (1,279 г), т.пл. 187-189оС.
ЯМР (CDCl3, 270 МГц) δ: 1,35 (9Н, с), 2,97 (3Н,с) 3,17 (3Н, с), 7,82 (1Н, с).
П р и м е р 7. В этом примере иллюстрируется получение 2-хлор-4-(2'-фтор-2'-метилпропионамидо)-N,N-диметилбензамида (соединение 38 в табл. 1).
Тетрафторборат серебра (0,60 г) в ацетонитриле (5 мл) прибавляют к 2-хлор-4-(2'-бром-2'-метилпропионамидо)-N, N-диметил- бензамиду (1,065 г) и ацетонитриле (150 мл) и реакционную смесь перемешивают в атмосфере азота, защищая от света 6,5 ч. Прибавляют этилацетат, раствор фильтруют через цеолит и выпаривают. Остаток растворяют в этилацетате, фильтруют через цеолит и выпаривают. Остаток очищают ЖХВД (алюент метиленхлорид:ацетонитрил 2:1) и получают белый кристаллический твердый продукт (0,319 г), т.пл. 125-128оС.
ЯМР (CDCl3, 270 МГц) δ: 1,67 (6Н, д), 2,87 (3Н, с) 3,13 (3Н, с), 7,27 (1Н, д), 7,45 (1Н, дд), 7,80 (1Н, д) 8,18 (1Н, д).
П р и м е р 8. В этом примере иллюстрируется получение 2-хлор-4-(3'-фтор-2', 2'-диметилпропионамидо)-N, N-диметилбенз- амида (соединение 42 в табл. 1). Стадия 1.
Получение 2-хлор-4-(3'-ацетокси-2', 2'-диметилпропионамидо)-N, N-диметилбензамида.
3-ацетокси-2,2-диметилпропионилхло-рид (7,84 г) прибавляют к перемешиваемому раствору 4-амино-2-хлор-N,N-диметилбензамиду (5,08 г) и триэтиламину (5,99 г) в сухом метиленхлориде (15 мл) при 0-5оС. После перемешивания в течение 30 мин реакционную смесь промывают разбавленным водным раствором бикарбоната натрия, разбавленным гидроксидом натрия, разбавленной HCl, а затем водой. Органический слой сушат, выпаривают и получают оранжевое твердое соединение, которое растирают с гексаном и получают целевой продукт (9,08 г), т.пл. 1174120оС.
ЯМР (CDCl3 270 МГц) δ: 1,33 (6Н, с), 2,10 (3Н, с) 2,86 (3Н, с), 3,13 (3Н, с), 4,20 (2Н, с), 7,11 (1Н, д), 7,29 (1Н, дд), 7,60 (1Н, д), 8,21 (1Н, с).
ИК (нуйол, паста), 1740, 1680, 1630 см-1.
Стадия 2.
Получение 2-хлор-4-(3'-гидрокси-2', 2'-диметилпропионамидо)-N, N-диметилбензамида.
2-хлор-4-(3'-ацетокси-2', 2'-диметилпро- пионамидо)-N,N-диметилбензамид (8,14 г) перемешивают 2 ч при комнатной температуре в метаноле (100 мл), содержащем гидроксид калия (2,68 г). Метанол выпаривают и остаток экстрагируют этилацетатом. Этилацетат сушат, выпаривают и получают целевой продукт (5, 08 г) т.пл. 137-139оС.
ЯМР (CDCl3, 270 МГц) δ: 1,17 (6Н, с), 2,89 (3Н, с) 3,15 (3Н, с), 3,56 (3Н, д), 5,12 (1Н, т), 7,17 (1Н, д), 7,30 (1Н, дд), 7,69 (1Н, д), 9,49 (1Н, с).
Стадия 3.
Получение 2-хлор-4-(3'-фтор-2',2'-диметилпропионамидо)-N, N-диметилбенз- амида.
2-хлор-4-(3'-гидрокси-2', 2'-диметилпро- пионамидо)-диметилбензамид (1,008 г) в сухом метиленхлориде (40 мл) по каплям, в течение 3 ч прибавляют к раствору трифторида диэтиламиносеры (ДАСТ) (0,68 г) в сухом метиленхлориде (20 мл) при -70оС. Через 0,5 ч прибавляют дополнительно ДАСТ (0,128 г), раствор перемешивают 0,5 ч при -70оС и затем оставляют на ночь разогреваться до комнатной температуры. Реакционную смесь промывают водой, сушат, выпаривают и получают пену. Ее растирают с гексаном и получают бледно-оранжевый порошкообразный продукт (0,269 г), т.пл. 152-154оС.
ЯМР (CDCl3, 270 МГц) δ: 1,32 (6Н, д), 2,86 (3Н, с), 3,12 (3Н, с), 4,48 (2Н, д), 7,23 (1Н, д), 7,39 (1Н, дд), 7,75 (1Н, д), 7,77 (1Н, с).
П р и м е р 9. В этом примере иллюстрируется получение 2-хлор-4-(3'-метокси-2', 2'-диметилпропионамидо)-N, N-диметилбенз-амида (соединение 40 в табл. 1).
Оксид (2,608 г) и гидроксид (0,540 г) бария прибавляют к раствору 2-хлор-4-(3'-гидрокси-2',2'-диметилпропионамидо)-N,N-ди- метилбензамида (0,510 г) в ДМФ (20 мл) при 0о С. После перемешивания 15 мин при 0оС по каплям прибавляют метилйодид (3,64 г). После разогрева до комнатной температуры в течение 2 ч к реакционной смеси прибавляют метиленхлорид и смесь фильтруют через цеолит. Органическую фракцию сушат, выпаривают и получают подвижную жидкость, которую очищают ЖХВД (элюент: этилацетат) и получают твердый целевой продукт (0,101 г), т.пл. 101-103оС.
ЯМР (CDCl3, 270 МГц) δ: 1,24 (6Н, с), 2,86 (3Н, с), 3,12 (3Н, с), 3,43 (2Н, с), 3,51 (3Н, с), 7,21 (1Н, д), 7,39 (1Н, дд), 7,75 (1Н, д), 9,05 (1Н, с).
П р и м е р 10. В этом примере иллюстрируется получение 2-хлор-4-(2', 2'-диметилтиопропионамидо)-N, N-диметилтиобенз- амида и 2-хлор-4-(2',2'-диметилпропионамидо)-N, N-диметилтиобензамида (соединение соответственно 3 и 1 по табл. 3).
2-Хлор-4-(2',2'-диметилпропионамидо)-N,N-диметилбензамид (1,00 г) суспендируют в сухом толуоле (10 мл) и небольшими
порциями прибавляют реагент Лавессона (0,75 г) в течение 5 мин
при комнатной температуре. Суспензию кипятят с обратным холодильником 1 ч, получая прозрачный раствор, толуол выпаривают и получают
вязкую смолу, которую хроматографируют на силикагеле (элюент:
метиленхлорид) и получают два продукта:
1. 2-Хлор-4-(2',2'-диметилтиопропионамидо)-N,N-диметилтиобензамид (0,104 г), т.пл.
154-156оС.
ЯМР (CDCl3) 270 МГц) δ: 1,47 (9Н, с), 3,14 (3Н, с), 3,60 (3Н, с), 7,29 (1Н, д), 7,52 (1Н, дд), 7,82 (1Н, с), 8,85 (1Н, шс).
2. 2-Хлор-4-(2', 2'-диметилпропионамидо)-N, N-диметилтиобензамид (0, 475 г), т.пл. 164-167оС).
ЯМР (CDCl3, 270 МГц) δ: 1,31 (9Н, с), 3,11 (3Н, с), 3,58 (3Н, с), 7,25 (1Н, д), 7,33 (1Н, дд), 7,38 (1Н, шс), 7,74 (1Н, с).
П р и м е р 11. В этом примере иллюстрируется получение 2-хлор-4-(2', 2'-диметилтиопропионамидо)-N,N-диметилбензамида (соединение 2 в табл. 3).
Стадия 1.
Получение 3-хлор-4-N,N-диметилкарбамеилфенилизотиоцианата.
Тиофосген (1,15 г) по каплям в течение 3 мин прибавляют к бикарбонату натрия (1,68 г), суспендированному и перемешиваемому в воде при комнатной температуре. Затем порциями, в течение 20 мин прибавляют 4-амино-2-хлор-N, N-диметилбензамид (1,00 г), поддерживая температуру 20-25оС. Еще через 15 мин коричневую суспензию экстрагируют метиленхлоридом, органический слой сушат, выпаривают и получают оранжево-желтый твердый целевой продукт (1,18 г), который используют без дополнительной очистки.
ЯМР (CDCl3, 270 МГц) δ: 2,86 (3Н, с), 3,13 (3Н, с), 7,17 (1Н, дд), 7,26 (1Н, с), 7,28 (1Н, д)
ИК
(нуйол, паста): 2149-2080 (шс), 1630 см-1.
Стадия 2.
Получение 2-хлор-4-(2',2'-диметилтиопропионамидо)-N,N-диметилбензамида.
Трет-бутиллитий (3,2 мл 1,7 М раствора в пентане) в течение 20 мин прибавляют к перемешиваемому раствору 2-хлор-4-N,N-диметилкарбамоилфенилизотиоцианата (1,17 г) в ТГФ в атмосфере азота при -70оС. После перемешивания в течение 20 мин осторожно прибавляют воду, а затем концентрированную HCl. Смесь экстрагируют метиленхлоридом, сушат, выпаривают и получают липкий коричневый твердый продукт (1,23 г). Его очищают ЖХВД (элюент: этилацетат) и получают желтую смолу (0,099 г). Растиранием со смесью эфир/толуол получают желтый твердый целевой продукт, т.пл. 120оС (с разложением).
ЯМР (CDCl3 , 270 МГц) δ: 1,66 (9Н, с), 2,88 (3Н, с), 3,14 (3Н, с), 7,25 (1Н, д), 7,45 (1Н. дд), 7,64 (1Н, д), 8,82 (1Н, шс).
П р и м е р 12. В данном примере иллюстрируется получение 2-хлор-4-(2', 2'-диметилпент-4'-инамидо)-N,N-диметилбензами- да (соединение 66 в табл. 1).
Стадия 1.
Получение этил-2, 2-диметилпент-4-иноата.
Литийдиизопропиламид (13,7 мл 1,5Н раствора моно-ТГФ комплекса в циклогексане) по каплям, в течение 20 мин прибавляют к перемешиваемому раствору этилизобутирата (2,38 г) в сухом ТГФ (10 мл) в атмосфере азота, поддерживая температуру ниже -60оС. Через 1 ч пропаргилбромид (2,45 г) в сухом ТГФ (5 мл) по каплям прибавляют, поддерживая температуру ниже -60оС. Реакционную смесь оставляют разогреваться до комнатной температуры в течение 2 ч, затем выливают в воду и экстрагируют этилацетатом. Этилацетатную фракцию сушат, выпаривают и получают оранжево-коричневую жидкость, которую перегоняют (Кугальрох, 115оC/60 мм) и получают целевой продукт (1,39 г).
ЯМР (CDCl3, 270 МГц) δ : 1,19 (3Н, т), 1,21 (6Н, с), 1,93 (1Н, т), 2,38 (2Н, д), 4,8 (2Н, к).
Стадия 2.
Получение 2,2-диметилпент 4-иноевой кислоты.
Этил-2, 2-диметилпент-4-иноат (1,39 г) перемешивают 7,5 часа с гидроксидом калия л (1,07 г) в метаноле (20 мл) при 40оС и затем выдерживают ночь. Смесь выливают в воду и промывают этилацетатом. Водный слой подкисляют и экстрагируют этилацетатом. Этот слой затем сушат, выпаривают и получают жидкую целевую кислоту (1,05 г).
ЯМР (CDCl3, 270 МГц): δ 1,32 (6Н, с), 2,04 (1Н, т) 2,47 (2Н, д).
ИК (жидкая пленка): 3300, 3000-2500, 1720 см-1.
Стадия 3.
Получение 2-хлор-4-(2', 2'-диметилпент-4-инамидо)-N,N-диметилбензамида.
2, 2-диметилпент-4-иноевую кислоту перемешивают в сухом эфире (15 мл) при комнатной температуре и при перемешивании, по каплям, прибавляют оксалилхлорид (1,53 г) в сухом эфире (5 мл). После завершения прибавления смесь перемешивают 0,5 ч.
Смесь декантируют, эфир выпаривают и получают хлорангидрид (0,417 г) в виде бледной жидкости, которую используют без дополнительной очистки.
В перемешиваемый метиленхлоридный раствор 4-амино-2-хлор-N,N-диметилбензамида (0,524 г) и триэтиламина (0,534 г) при 0-5оС прибавляют хлорангидрид 2,2-диметилпент 4-иноевой кислоты (0,6417 г). После 1,5 ч перемешивания реакционную смесь промывают разбавленной HCl, водным раствором бикарбоната натрия и водой. Метиленхлоридный раствор сушат, выпаривают и получают пену, которую кристаллизуют и получают бледно-оранжевый твердый целевой продукт (0,606 г), т.пл. 154-155оС.
ЯМР (CDCl3, 270 МГц) δ: 1,40 (6Н, с), 2,17 (1Н, т), 2,52 (2Н, д), 2,87 (3Н, с), 3,13 (3Н, с), 7,05 (1Н, д), 7,33 (1Н, дд), 7,64 (1Н, д).
Другие соединения, полученные аналогично, представлены в табл. 1, 2, 3.
П р и м е р 13. Соединения испытывают против набора лиственных грибковых заболеваний растений. Используют следующую методику.
Растения выращивают в компосте John.Innes (N 1 или 2) в
маленьких горшках диаметром 4 см. Испытуемые соединения используют либо как смесь с водным Dispersol T. либо в виде раствора в ацетоне или
смеси ацетон/этанол, который разбавляют до требуемой
концентрации непосредственно перед использованием. При заболеваниях листьев рецептуры (100 ч/млн активного ингредиента) наносят опрыскиванием на
листву и на коpни растений в почве. Опрыскивание
делают с максимальным удерживанием и наносят на корни до результирующей концентрации, эквивалентной приблизительно 40 ч/млн активного ингредиента в
сухой почве. При опрыскивании злаковых прибавляют
Tween 20 до результирующей концентрации 0,05%
В большинстве испытаний соединения наносят на почву (корни) и на листву (опрыскиванием) за 1-2
дня до заражения растения носителем заболевания.
Исключение составляло испытание на Erysiphe graminis, где растения заражали за 24 ч до обработки. Лиственные патогенные организмы наносили
разбрызгиванием споровых суспензий на листья испытуемых
растений. После заражения растения помещали в соответствующую среду для развития инфекции и затем инкубировали до тех пор, пока заболевание
будет готово для оценки. Период между заражением и оценкой
варьировался от 4 до 14 дней в зависимости от среды и заболевания.
Подавление заболевания оценивали по следующей шкале:
4 отсутствие заболевания,
3 следы 5%
заболевания от необработанных растений.
2=6-25% заболевания от необработанных растений.
1=26-59% заболевания от
необработанных растений
0=60-100%
заболевания от необработанных растений.
Результаты представлены в табл. 4, 5, 6.
Соединения настоящего изобретения обладают преимуществами перед известными соединениями аналогичной структуры, связанными с их активностью против класса патогенных организмов, известных как фикомицеты (или оомицеты). Эти организмы включают виды фитофтора, Плазмопара, Пероноспора и Псевдопероноспора (Phy- tophthora, Plasmopara, Peronospora и Pseudoperonospora). Соединения изобретения проявляют особенно хорошую активность против Plasmopara viticola и Phy- tophthora infestans при системной обработке.
Промышленно или коммерчески доступный фунгицид, диэтофенкарб, который имеет формулу
(CH3
)2CHO

близко родственен фунгицидам ЕР 0127990, см. соединение 3 табл. 1, которое имеет структуру
(CH3)2CHO


Данное соединение является наиболее близким промышленным соединением для сравнения с соединениями настоящего изобретения. Однако, оно хуже соединений настоящего изобретения, когда оно испытывается по методике примера 13, особенно против патогенов Plasmopara viticola (ложная мучнистая роса винограда). Результаты для диэтофенкарба при испытании по методике примера 13 даны в табл. 7. Как видно из табл. 7 диэтофенкарб не обнаруживает никакой активности против Puccinia recondita, Venturia inaequalis и Plasmopara viticola при 100 ч/млн активного ингредиента). Как видно из результатов в табл. 4 и 5, соединения настоящей заявки явно превосходят его особенно против Plasmopara viticola.
Как можно видеть, полностью отсутствует активность в отношении патогенных организмов Puccinia recondita, Venturia inaegualis, Plasmopara viticola при дозе 100 ч/млн активного ингредиента.
Реферат
Сущность изобретения: продукт-производные ациламинобензамидов ф-лы 1. Реагент 1: соединение ф-лы 2. Реагент 2: соединение ф-лы R1R2NH. Условия реакции: в органическом растворителе в присутствии основания или избытка амина с последующим выделением целевого продукта или при необходимости обработкой полученного соединения, где R4 -CR5R6(CH2X1), где X1-Cl Br, I, основанием или двухфазной системой - органический растворитель вода в присутствии катализатора фазового переноса с получением соединения, где R3 и R4 вместе с С(О)Н образуют ацетилил-2-оновое кольцо. Ф-лы 1, 2:

Формула

где A и B независимо водород, фтор, хлор, бром, C1 - C4-алкил, C1 C4-алкокси или гало-(C1 - C4)-алкил, при условии, что оба не являются водородом;
D и E независимо водород или фтор;
R1 водород или C1 C4-алкил;
R2 C1 C4-алкил, C1 C4-алкокси или фенил или R1 и R2 вместе с азотом, с которым они соединены, образуют морфолиновое, пиперидиновое, пирролидиновое или азетидиновое кольцо, которое возможно замещено C1 C4-алкилом;
R3 водород;
R4 трихлорметил, C2 C8-алкил (возможно замещенный галогеном, C1 C8-алкокси или R12S(O)n, где R12 C1 C4-алкил, n 0, 1 или 2), циклопропил (возможно замещенный C1 C4-алкилом), C2 - C8-алкенил, C2 C8 -алкинил, C1 C8-алкокси, моно- или ди-(C1 C4)-алкиламино или группа R13ON C(CN), где R13 C1 C4-алкил, или R3 и R4 вместе с группой C(O)N, с которой они соединены, образуют азетидин-2-оновое кольцо общей формулы II

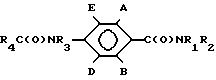
где R5 и R6 независимо водород, галоген или C1 - C4-алкил, отличающийся тем, что осуществляют взаимодействие соединения общей формулы III
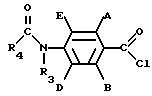
где A, B, E и R4 имеют указанные значения,
с амином общей формулы
R1R2NH,
где R1 и R2 имеют указанные значения,
в органическом растворителе в присутствии основания или избытка R1R2NH с последующим выделением целевого продукта или при необходимости полученное соединение общей формулы I, где R3 водород, R4

где R5, R6 имеет указанные значения;
X1 хлор, бром или йод,
обрабатывают основанием или двухфазной системой из органического растворителя и воды в присутствии катализатора фазового переноса с получением целевого соединения, где R3 и R4 вместе с группой C (O) N образуют азетидин-2-оновое кольцо общей формулы II.

Комментарии