Композиция и способ для контроля численности моллюсков - RU2549697C2
Код документа: RU2549697C2
Чертежи



Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Предложены композиции и способы для контроля численности моллюсков, таких как мидии и/или улитки и/или слизни, которые содержат, не ограничиваясь указанным, соединения, содержащие лактоны, лактамы, карбаматы, амиды и/или карбоновые кислоты, в качестве активных ингредиентов, и/или соединения, выделенные из микроорганизма (например, Pseudomonas и/или Erwinia). Также предложены способы и композиции для повышения эффективности химического и биологического контроля моллюсков, таких как мидии и/или улитки и/или слизни, в открытых водоемах, силовых установках и установках для обработки питьевой воды в условиях холодной воды и/или на твердых поверхностях.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Дрейссена речная или мидия-зебра Dreissena polymorphs первоначально была аборигеном Каспийского моря и реки Урал в Азии. В девятнадцатом веке она распространилась на запад и теперь встречается в большей части Европы, в, западной части Содружества Независимых Государств (прежде Советского Союза) и в Турции. Около двадцати лет назад мидии, такие как речная дрейссена Dreissena polymorpha и бугская дрейссена, Dreissena bugensis, были интродуцированы в Северную Америку. Их широкое распространение во внутренних водах привело к охвату большей части западных штатов США [U.S. Army Engineer Waterways Experiment Station. 1995. Zebra mussels: Biology, Ecology, and Recommended Control Strategies. Technical Note. ZMR-1-01. Zebra Mussel Research Program, Vicksburg, MS]. Подобным образом, золотая мидия, Limnoperna fortune, поразила азиатские и южноамериканские страны (золотая мидия - Limnoperna fortune). Азиатский моллюск Corbicula fluminea распространился почти во всех азиатских странах и США [Non-indigenous species information bulletin: Asian clam, Corbicula fluminea (Muller, 1774) (Mollusca: Corbiculidae)]. Другие мидии, такие как мидии униониды, также существуют в США и других странах.
Способность мидий быстро колонизировать новые области, быстро достигать высоких плотностей и прикрепляться к любому твердому субстрату (например, к камням, бревнам, водным растениям, раковинам нативных мидий и наружным скелетам речных раков, пластмассе, бетону, древесине, стекловолокну, трубам, изготовленным из железа и поливинилхлорида и поверхностям, покрытым обычными красками) делает их способными вызывать серьезные вредные последствия. Эти последствия включают повреждения зависящей от воды инфраструктуры, возрастающие расходы на эксплуатацию, составляющие миллионы долларов, и значительное нарушение экологических систем [O'Neill, C.R., Jr. 1997, Economic impact of zebra mussels-results of the 1995 national zebra mussel information clearing house study. Gt. Lakes Res. Rev.3, 35-44; Karatayev, A.Y., L.E. Burlakova, D.K., Padilla, 1997, The effects of Dreissena polymorpha (Pallas) invasion on aquatic communalities in eastern Europe. Journal Shellfish Research, 16, 187-203; Maclsaac, H.J., 1996. Potential abiotic and biotic impacts of zebra mussels on the inland waters of North America. American Zoology, 36, 289-299; D.P. Molloy, The potential for using biological control technologies in the management of Dreissena SPP, Journal of Shellfish Research, 1998 (17) 177-183], а также снижение эффективности производства, которое является причиной упущенной выручки в размере миллиардов долларов (Connelly, N.А., С.R. O'Neill, Jr, et al. (2007), "Economic impacts of Zebra mussels on drinking water treatment and electric power generation facilities", Environmental Management 90:10. Economic impacts of zebra mussels on drinking water treatment and electric power generation facilities. Environmental Management 40:105-112). Кроме того, быстрая инвазия водных экосистем этими инвазивными мидиями вызвала снижение разнообразия и обилия эндемических мидий унионид, которые являются важной частью биологического разнообразия (Ricciardi, A, Neves, R.J., Rasmussen, J.В. 1998. Impending extinctions of North American freshwater mussels (Unionidae) following the zebra mussel (Dreissena polymorpha) invasion. Journal of Animal Ecology 67:613-619).
Контроль мидий очень важен для защиты зависимой от воды инфраструктуры и водных экологических систем. Существует множество способов сокращения популяции мидий. Эти способы включают предупреждающие и реактивные способы. Реактивное удаление включает механическое удаление, удаление с помощью хищников, а также химическое и биологическое удаление. Например, показано, что рыбы, птицы, раки, крабы, пиявки и млекопитающие истребляют мидий. Однако маловероятно, что популяция мидий будет контролироваться за счет естественного истребления, особенно в искусственных сооружениях, таких как трубы или насосные установки.
Применение моллюскоцидов является другим эффективным путем сокращения популяции мидий. Например, гипохлорит натрия является общепринято используемым агентом для контроля в Европе, США и Канаде. Однако мидии могут выдерживать эту обработку в течение нескольких суток благодаря закрытию их раковин, и к тому же хлор можно использовать только в трубах и трубопроводах, которые содержат датчики давления или другое оборудование, вследствие токсичности хлора для окружающей среды [U.S. Army Engineer Waterways Experiment Station. 1995. Zebra mussels: Biology, Ecology, and Recommended Control Strategies. Technical Note. ZMR-1-01. Zebra Mussel Research Program, Vicksburg, MS]. Кроме того, в продаже имеется много других моллюскоцидов, таких как сурфактанты в виде солей аммония, бутилированный гидрокситолуол (БГТ) в красителях, N-трифенилметилморфолин и т.д. Эти химические вещества либо обладают низкой избирательностью, либо повреждают водные экосистемы. Например, 4-трифторэтил-4-нитрофенол, имеющийся в продаже как Bayluscide® (Bayer), является возможным кандидатом для контроля таких инвазивных экзотических видов. Однако механизм токсичности такого химического вещества состоит в повреждении клеточного дыхания мидии, что в природных условиях ограничивает его избирательность между мидиями и другими водными видами, такими как рыбы [Karen Perry AЕ John Lynn, Detecting physiological and pesticide-induced apoptosis in early developmental stages of invasive bivalves, Hydrobiologia (2009) 628:153-164; I Takougang, J Meli, F Angwafo, Field trials of low dose Bayluscide on snail hosts of schistosome and selected non-target organisms in sahelian Cameroon, Mem Inst Oswaldo Cruz, Rio de Janeiro, 2006, 101(4):355-358].
Принципиально важно контролировать инвазивных мидий безопасным, благоприятным для окружающей среды и дешевым способом. Чтобы найти менее вредные способы регуляции численности этих инвазивных мидий, в научно-исследовательской лаборатории музея штата Нью-Йорк (New York State Museum's (NYSM) Field Research Laboratory) был проведен скрининг более 700 бактериальных изолятов в качестве потенциальных агентов биологического контроля для использования против мидии-зебры и бугской дрейссены. В результате был обнаружен изолят, штамм CL145A Pseudomonas fluorescens, который является летальным для этих мидий (см. Molloy, D.Р. патент США №6194194, опубликованный 27 февраля 2001). Эта бактерия распространена во всем мире и присутствует во всех североамериканских водоемах. В природе она является безвредным видом бактерий, который, как обнаружено, защищает корни растений от гниения и плесневых грибков. Он настолько широко распространен, что является обычным организмом, вызывающим порчу пищевых продуктов в обычном домашнем холодильнике [Daniel P. Molloy and Denise A. Mayer, Overview of a Novel Green Technology: Biological Control of Zebra and Quagga Mussels with Pseudomonas fluorescens, Version 6: Updated August 24, 2007].
Лактоны, лактамы, карбаматы и амиды
Лактоны широко распространены в пищевых продуктах и напитках, а также являются вторичными метаболитами животных (например, губок) и микроорганизмов (например, дрожжей и грибов). Некоторые лактоны обладают специфическим запахом (например, гамма-декалактон), что приводит в результате к возрастающей потребности в натуральных продуктах в пищевой промышленности за счет использования биотехнологических процессов для производства таких лактонов [Mohamed Alchihab, Jacqueline Destain, Mario Aguedo, Lamia Majad, Hakim Ghalfi, Jean-Paul Wathelet, Philippe Thonart, Production of y-Decalactone by a Psychrophilic and a Mesophilic Strain of the Yeast Rhodotorula aurantiaca, Appl Biochem Biotechnol (2009) 158:41-50]. Другие функции различных лактонов связаны с антибактериальной активностью [Ikuko Shimizu, Yasunori Isshiki, Наше Nomura, Keisuke Sakuda, Katsuya Sakuma, Seiichi Kondo, The Antibacterial Activity of Fragrance Ingredients against Legionella pneumophila, Biol. Pharm. Bull. 2009, 32(6) 1114-1117], гепатопротекторной активностью [Yumiko Itoh, Hiroshi Shimura, Mayumi Ito, Naoharu Watanabe, Michio Yamagishi, Masaharu Tamai and Kazunori Hanada, Novel hepatoprotective y-lactone, MH-031, I. Discovery isolation, physicochemical properties and structural elucidation, The Journal of Antibiotics 1991, 832-837], противотуберкулезной активностью [Ma, G.Y. et al. anti-tuberculosis constituents from the stem bark of micromelum hirsutum, Planta Med. 2005, 71, 261-267], анти-ВИЧ активностью [Zhang et al., Sesquiterpenes and butenolides, natural anti-HIV constituents from Litse verticillata, Planta Med, 2005, 71, 452-457], активностью в качестве полового феромона [J.Н. Tumlinson, Identification of the Female Japanese Beetle Sex Pheromone Inhibition of Male Response by an Enantiomer, Science, 1977, 197, 789-792], цитотоксической активностью [Fan, X. N. et al. Chemical Constituents of Heteroplexis micocephala, J. Nat. Prod. 2009, 72, 1184-1190], активностью в качестве сигнальных молекул [M.K. Vinson, et al. Multiple N-acyl-L-homoserine lactone signal molecules regulate production of virulence determinants and secondary metabolites in Pseudomonas aeruginosa, Proc. Natl. Acad. Sci. USA, 1995, 92, 9427-9431] и инсектицидной активностью [John A. Findlay, et al., Insect toxins from spruce endophytes, Can. J. Chem. 2003, 81, 284-292],
Хотя лактамы присутсвуют в некоторых растениях и морских организмах, они часто являются метаболитами грибов. Обзор многих видов биологической активности (например, цитотоксической и противоопухолевой активности, ингибирования ангиогенеза, нейронной активности, антиинфекционной активности) был сделан в недавней публикации [Bastien Nay, Nassima Riache and Laurent Evanno, Chemistry and biology of non-tetramic y-hydroxy-y-lactams and y-alkylidene-y-lactams from natural sources, Natural Product reports, 2009, 26, 1044-1062].
Карбаматы присутствуют в растениях, микроорганизмах и губках, но для этих соединений описано меньше видов биологической активности по сравнению с лактонами и амидами, поскольку многие из этих соединений нестабильны в водных растворах. Имеется один пример фунгицидной активности природных карбаматов [Richard J. Clark, et al., Antifungal Alkyl Amino Alcohols from the Tropical Marine Sponge Haliclona n. sp., J. Nat. Prod. 2001, 64, 1568-1571]. Амиды широко распространены в растениях, микроорганизмах и губках. Например, скалусамид А из гриба морского происхождения Penicillium citrinum проявлял антибактериальную и противогрибковую активность [Masashi Tsuda, et al., Scalusamides A-C, New Pyrrolidine Alkaloids from the Marine-Derived Fungus Penicillium citrinum, J. Nat. Prod. 2005, 68, 273-276].
Другим примером амида является соединение растительного происхождения, названное сарментин (sarmentine), которое проявляет множество видов биологической активности. Сарментин был впервые выделен из плода Piper sarmentosum в 1987 [Likhitwitayawuid, K., Ruangrungsi, N, Lange, G and Decicco, C, Structural Elucidation and Synthesis of New Components isolated from Piper Samentosum, Tetrahedron 1987 (43) 3689-3694], а также из Piper nigrum в 1988 [Kiuchi, F., Nakamura, N., Tsuda, Y., Kondo, К and Yoshimura, H. Studies on Crude Drugs Effective on Visceral Larva Migrans. IV. Isolation and Identification of Larvicidal Principles in Pepper Chemical and Pharmaceutical Bulletin 1988(36):2452], и впервые синтезирован в 1995 [Bernabeu, M., Chinchilla, R. and Najera, C, (2E, 4E)-5-Tosyl-2,4-pentadienamides: New Dienic Sulfones for the Stereoselective Synthesis of (2E, 4E)-Dienamides, Tetrahedron Letter, 1995 (36)3901-3904]. Обнаружено, что сарментин действует как кожный антиоксидант in vivo, защищающая кожу, стареющую под действием света [Cornacchione, S.; Sadick, N.S.; Neveu, M.; Talbourdet, S.; Lazou, K.; Viron, C; Renimel, I.; de Queral, D.; Kurfurst, R.; Schnebert, S.; Heusele, C; Andre, P.; Perrier E. In wVoskin antioxidant effect of a new combination based on a specific Vitis vinifera shoots extract and a biotechnological extract. J. Drugs in Dermatol. 2007, 6S, 8-13], проявляет активность, препятствующую агрегации тромбоцитов [Li, C.Y.; Tsai, W.; Damu, A.G.; Lee, E.J.; Wu, T.S.; Dung. N.X.; Thang, T.D.; Thanh, L. Isolation and identification of antiplatelet aggregatory principles from the leaves of Piper blot, J. Agric. Food Chem. 2007, 55, 9436-9442], обладает антиплазмодийной и антимикобактериальной активностью [Tuntiwachwuttikul, P.; Phansa, P.; Pootaeng-on, Y.; Taylor, W.C. Chemical constituents of the roots of Piper Sarmentosum, Chem. Pharm. Bull. 2006, 54, 149-151] и противотуберкулезной активностью [Rukachaisirikul, Т.; Siriwattanakit, P.; Sukcharoenphol, K.; Wongvein, C; Ruttanaweang, P.; Wongwattanavuch, P.; Suksamrarn, A. Chemical constituents and bioactivity of Piper sarmentosum, J. Ethnopharmacol., 2004, 93, 173-176]. Сарментин используют в качестве солюбилизатора гидрофобных соединений в косметических изделиях и фармацевтических препаратах (Stephen, Т.; Andrew, Н. Compositions comprising macromolecular assembles of lipid surfactant, PCT Publication No. WO/2008/065451). Сарментин и его аналоги можно применять для контроля численности вредителей растений.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям, композициям и способам контроля численности моллюсков, в частности, представителей классов Gastropoda и/или Bivalvia, и более конкретно мидий, улиток и слизней. Изобретение относится к изолированным соединениям, которые (а) могут быть получены или выделены из микроорганизма, в частности, вида рода Pseudomonas, более конкретно Pseudomonas fluorescens, или альтернативно из организма, обладающего идентификационными характеристиками Pseudomonas АТСС 55799; (b) являются токсичными для представителей классов моллюсков, выбранных из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.) и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Theba sp.), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.,), желтого слизня (например, Limacussp.) и тепличного слизня (например, Milax sp.), и (с) имеют молекулярную массу, выбранную из группы, состоящей из: примерно 540-550 и примерно 1280-1335, как определено с помощью жидкостной хроматографии/масс-спектроскопии (ЖХ/МС). Эти соединения можно включать в композиции, которые можно применять для контроля численности моллюсков, в частности, представителей классов Gastropoda и/или Bivalvia, и более конкретно мидий, улиток и слизней. В одном воплощении соединение: (а) может быть получено из микроорганизма, в частности, вида рода Pseudomonas; (b) является токсичным для представителей класса моллюсков, выбранных из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.) и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Theba sp.), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.), и (с) имеет молекулярную массу примерно 1280-1310, и более конкретно 1295, как определено с помощью жидкостной хроматографии/масс-спектроскопии (ЖХ/МС); (d) имеет значения1Н ЯМР δ 9.25, 8.36, 8.06, 7.82, 7.71, 7.52, 7.45, 6.82, 6.36, 6.08, 5.42, 5.39, 5.30, 5.14, 4.68, 4.42, 4.31, 4.16, 4.11, 4.07, 3.95-3.86, 3.83, 3.72, 3.66, 3.53, 3.48, 3.37, 3.17, 3.06, 2.56, 2.53, 2.45, 2.32, 2.21, 2.02, 1.96, 1.84, 1.72, 1.65, 1.61, 1.51, 1.48-1.37, 1.32, 1.12, 0.94, 0.91, 0.68; (е) имеет время удерживания на высокоэффективной жидкостной хроматографии (ВЭЖХ) примерно 50-55 минут, более конкретно примерно 52 минуты, еще более конкретно примерно 51,66 мин на колонке ВЭЖХ с обращенной фазой С-18 (например, Thermo Scientific, Hydersil Gold, 100 x 10 мм), при использовании градиентной системы растворителей вода: ацетонитрил (CH3CN) (0-10 мин; 30-40% водный CH3CN, 10-20 мин; 40-60% водный CH3CN, 20-60 мин; 60-80% водный CH3CN, 60-65 мин; 80-100% водный CH3CN) при скорости тока 2,5 мл/мин и детекции УФ излучением при 210 нм.
В другом воплощении соединение обладает следующими характеристиками: (а) оно может быть получено из микроорганизма, в частности, вида рода Pseudomonas; (b) оно является токсичным для представителей класса моллюсков, выбранных из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.) и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornusp., Theba sp.), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.) и (с) имеет молекулярную массу примерно 1310-1335 и более конкретно 1321, как определено с помощью ЖХ/МС; (d) имеет время удерживания на ВЭЖХ примерно 55-60 минут, более конкретно примерно 60 минут, и еще более конкретно 59,61 минут на колонке ВЭЖХ с обращенной фазой С-18 (например, Thermo Scientific, Hydersil Gold, 100×10 мм), при использовании градиента ацетонитрил: вода в градиентной системе растворителей вода: ацетонитрил (CH3CN) (0-10 мин; 30-40% водный CH3CN, 10-20 мин; 40-60% водный CH3CN, 20-60 мин; 60-80% водный CH3CN, 60-65 мин; 80-100% водный CH3CN) при скорости тока 2,5 мл/мин и детекции УФ излучением при 210 нм. Еще в одном другом воплощении изобретение относится к изолированному соединению, имеющему следующие характеристики: (a) оно может быть получено из микроорганизма, в частности, вида рода Pseudomonas; (b) оно является токсичным для представителей класса моллюсков, выбранных из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.) и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Theba sp.), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.), и (с) оно имеет молекулярную массу примерно 540-550 и более конкретно примерно 546, как определено с помощью ЖХ/МС; (d) оно имеет время удерживания на ВЭЖХ примерно 50-55 минут, более конкретно примерно 52 минуты, и даже более конкретно примерно 51,54 минуты на колонке ВЭЖХ с обращенной фазой С-18 (Phenomenex, Luna С-18 (2) 10 мкм, 100 A Axia, А250 х 30 мм), где используется градиентная система растворителей вода: ацетонитрил (0-10 мин; 35-45% водный CH3CN, 10-20 мин; 45-60% водный CH3CN, 20-50 мин; 60-85% водный CH3CN, 50-60 мин; 85-100% водный CH3CN, 60-70 мин; 100% CH3CN) при скорости тока 10 мл/мин и детекции УФ излучением при 210 нм.
Также изобретение относится к способу получения соединения(й) по настоящему изобретению, включающему (a) получение суспензии клеток, выделенных из вида рода Pseudomonas, и (b) выделение соединения из указанной суспензии хроматографическими способами.
Также изобретение относится к композиции, содержащей указанные соединения, а также к композиции, содержащей фракцию, которая может быть получена из клеточной суспензии вида рода Pseudomonas с помощью ВЭЖХ при использовании системы растворителей вода: ацетонитрил (0-10 мин; 35-45% водный CH3CN, 10-20 мин; 45-60% водный CH3CN, 20-50 мин; 60-85% водный CH3CN, 50-60 мин; 85-100% водный CH3CN, 60-70 мин; 100% CH3CN), при скорости тока 10 мл/мин, и детекции УФ излучением при 210 нм, с временем удерживания примерно 45-50 мин, где указанная фракция содержит по меньшей мере два соединения, которые (a) являются токсичными для представителей класса моллюсков, выбранных из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.) и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Theba sp.), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.), и (b) имеют молекулярные массы примерно 630-660 или примерно 970-1000, как определено с помощью ЖХ/МС.
Изобретение относится к способу регулирования численности одного или более чем одного моллюска в месте, где желателен контроль численности, включающему введение в указанное место по меньшей мере одного из (a) клеточной суспензии или экстракта, выделенного из клеток Erwinia sp.; (b) одного или более чем одного соединения, где указанные соединения представляют собой соединения лактона, лактама, карбамата, карбоновой кислоты и/или амида, или композиции, содержащей указанные соединения, при условии, что указанные соединения не являются гамма-окталактоном, гамма-ноналактоном, гамма-деканолактоном, гамма-ундеканолактоном, N-циклопентилциннамамидом, N-(транс-циннамоил)пирролидином, N-(транс-циннамоил)пиперидином и N-(транс-циннамоил)гексаметиленимином, 4-гидроксидекановой кислотой и додекановой кислотой, и при условии, что композиция не является культурой, экстрактом или суспензией Pseudomonas, (с) одного или более соединения, которое (i) может быть получено или выделено из вида рода Pseudomonas, (ii) является токсичным для представителей класса моллюсков, выбранных из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.) и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Theba sp.), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.) и (iii) имеет молекулярную массу, выбранную из группы, состоящей из примерно 540-550 и примерно 1280-1335, как определено с помощью жидкостной хроматографии/масс-спектроскопии (ЖХ/МС); (d) композиции, содержащей систему растворителей вода: ацетонитрил (0-10 мин; 35-45% водный CH3CN, 10-20 мин; 45-60% водный CH3CN, 20-50 мин; 60-85% водный CH3CN, 50-60 мин; 85-100% водный CH3CN, 60-70 мин; 100% CH3CN) при скорости тока 10 мл/мин и фракцию, детектируемую с помощью УФ при 210 нм, которая может быть получена из клеточной суспензии вида рода Pseudomonas с помощью ВЭЖХ с временем удержания примерно 45-50 мин, где указанная фракция содержит по меньшей мере два соединения, которые (i) являются токсичными для представителей класса моллюсков, выбранного из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.) и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Theba sp.), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp J, желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.) и (ii) имеют молекулярные массы примерно 630-660 и примерно 970-1000, как определено с помощью ЖХ/МС, в количествах, эффективных для контроля численности указанных моллюсков в указанном месте. Этот контроль в одном воплощении может быть достигнут путем индукции гибели одного или более чем одного моллюска, включающей приведение в контакт указанных моллюсков с соединениями, описанными выше. Контакт с моллюсками может осуществляться в водоеме или на твердой поверхности. Подобным образом, изобретение направлено на применение вышеуказанных соединений, суспензий и композиций для изготовления композиции для применения при регулировании численности моллюсков, таких как Gastropoda и/или Bivalvia, в данном месте.
В родственном аспекте изобретение, кроме того, относится к композициям для регулирования численности одного или более чем одного моллюска, в частности, мидий и/или улиток (например, белых и/или обыкновенных коричневых садовых улиток, водных улиток) и/или слизней в месте, где желателен контроль численности, и/или индукции гибели у одного или более чем одного моллюска, в частности, мидий и/или улиток (например, белых и/или обыкновенных коричневых садовых улиток, водных улиток) и/или слизней в указанном месте, где эти композиции включают один или более чем один лактон, лактам, карбамат, карбоновую кислоту и/или амид, опять же, при условии, что указанное соединение не является гамма-окталактоном, гамма-ноналактоном, гамма-деканолактоном, гамма-ундеканолактоном, N-циклопентилциннамамидом, N-(транс-циннамоил)пирролидином, N-(транс-циннамоил)пиперидином и N-(транс-циннамоил)гексаметиленимином, 4-гидроксидекановой кислотой и додекановой кислотой, и при условии, что композиция представляет собой культуру, экстракт или суспензию Pseudomonas.
В конкретном воплощении изобретение относится к способу регулирования численности одного или более чем одного моллюска, в частности, мидий и/или улиток (например, белых и/или обыкновенных коричневых садовых улиток, водных улиток) и/или слизней, где указанный способ включает стадии: (a) приготовления клеточной суспензии или экстракта, выделенного из клеток Erwinia sp.; и (b) введения указанной суспензии или экстракта в месте, где желателен контроль численности, в количестве, эффективном для контроля численности указанных моллюсков.
Экстракты Erwinia могут содержать активные ингредиенты, указанные выше, такие как лактоны и амиды. Подобным образом, клеточную суспензию или экстракт, выделенный из клеток Erwinia sp., можно включать в композиции для применения при регулировании численности моллюсков, в частности, класса моллюсков, выбранного из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.) и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Theba sp.), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp).
Изобретение, кроме того, относится к композиции, включающей по меньшей мере одно или более чем одно вещество, эффективное для регулирования численности одного или более чем одного моллюска, в частности, класса моллюсков, выбранного из группы, состоящей из BivaMa, в частности, мидий (например, Dreissana sp.) и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Thebasp), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.), и, возможно, инертный материал, предпочтительно для применения при регулировании численности одного или более чем одного моллюска. Кроме того, изобретение относится к применению этих веществ и других соединений и композиций по настоящему изобретению при приготовлении композиции для регулирования численности одного или более чем одного моллюска, в частности, класса моллюсков, выбранного из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.) и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Thebasp), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.). Это вещество может быть получено из хлора или вида рода Pseudomonas, более конкретно выделено из Pseudomonas fluorescens или альтернативно из организма (например, штамма Pseudomonas), обладающего идентификационными характеристиками Pseudomonas АТСС 55799. В другом конкретном воплощении композиция может содержать вещество, которое представляет собой клеточную суспензию, выделенную из вида рода Pseudomonas (например, P. fluorescens), и даже в более конкретном воплощении клеточная суспензия может содержать клетки, обладающие характеристиками продуцирования токсина Pseudomonas АТСС 55799. Еще в одном конкретном воплощении вещества в указанной композиции могут представлять собой один или более чем один токсин, выделенный или изолированный из вида рода Pseudomonas, или альтернативно выделенный из организма, обладающего идентификационными характеристиками Pseudomonas АТСС 55799. Композиция может альтернативно содержать соединения, применяемые в способе по настоящему изобретению, описанном выше, а также соединения по настоящему изобретению, описанные выше, и может применяться для контроля численности представителей класса Gastropoda и Bivalvia. Инертный материал может представлять собой глинистый минерал (каолинит, смектит, аттапульгит). Изобретение, кроме того, относится к способу регулирования численности одного или более моллюска, в частности, мидий и/или улиток (например, водных, садовых улиток) и/или слизней в месте, где желателен контроль численности, где этот способ включает введение в указанном месте вещества, эффективного для регулирования численности указанных моллюсков, и возможно одного или более чем одного инертного материала в количестве, эффективном для контроля численности указанных моллюсков в указанном месте, содержащем указанных моллюсков. В частности, вещество для регулирования численности указанных моллюсков присутствует в количестве, эффективном, чтобы привести в результате по меньшей мере примерно к 20% смертности относительно необработанного контроля, типично примерно 50-95%, и указанный инертный материал присутствует в количестве, достаточном или эффективном, чтобы повысить уровень смертности, вызываемой указанным веществом, для регулирования численности указанных моллюсков по меньшей мере примерно на 20%, типично на 25-40%. В конкретном воплощении инертный материал вводят в указанном месте перед введением вещества для регулирования численности указанных моллюсков; в более конкретном воплощении инертный материал вводят по меньшей мере примерно за один час до введения вещества. В другом конкретном воплощении инертный материал вводят в этом месте одновременно с веществом для регулирования численности указанных моллюсков, описанных выше, в частности, мидий, улиток и/или слизней.
В близком аспекте изобретение относится к применению инертного материала для повышения эффективности одного или более чем одного вещества для регулирования численности одного или более чем одного моллюска, в частности, класса моллюсков, выбранного из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.), и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Theba sp.), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.), в месте, где желателен контроль численности. Это место может представлять собой жидкость (например, водоем или краску) или твердую поверхность, такую как пластмасса, бетон, древесина, стекловолокно, трубы, изготовленные из железа и поливинилхлорида, поверхности, покрытые материалами покрытия и/или красками. В частности, изобретение направлено на способ повышения эффективности одного или более чем одного вещества для регулирования численности одного или более чем одного из указанных моллюсков, в частности, класса моллюсков, выбранного из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.), и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Thebasp), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.), где этот способ включает внесение в место, где желателен контроль численности, одного или более инертного вещества в количестве, эффективном для повышения эффективности указанного вещества при внесении в указанное место. В конкретном воплощении эти инертные материалы повышают эффективность указанных веществ по меньшей мере примерно на 20%.
Кроме того, изобретение относится к краске для необрастающего покрытия, содержащей препятствующее росту, биоцидно эффективное количество композиций и соединений по настоящему изобретению в краске-носителе. Изобретение, кроме того, относится к применению соединений и композиций по настоящему изобретению при изготовлении такой краски для необрастающего покрытия.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг.1a и 1b показаны структуры натуральных продуктов, используемых в способе по настоящему изобретению.
На фиг.2 показана схема выделения активных фракций.
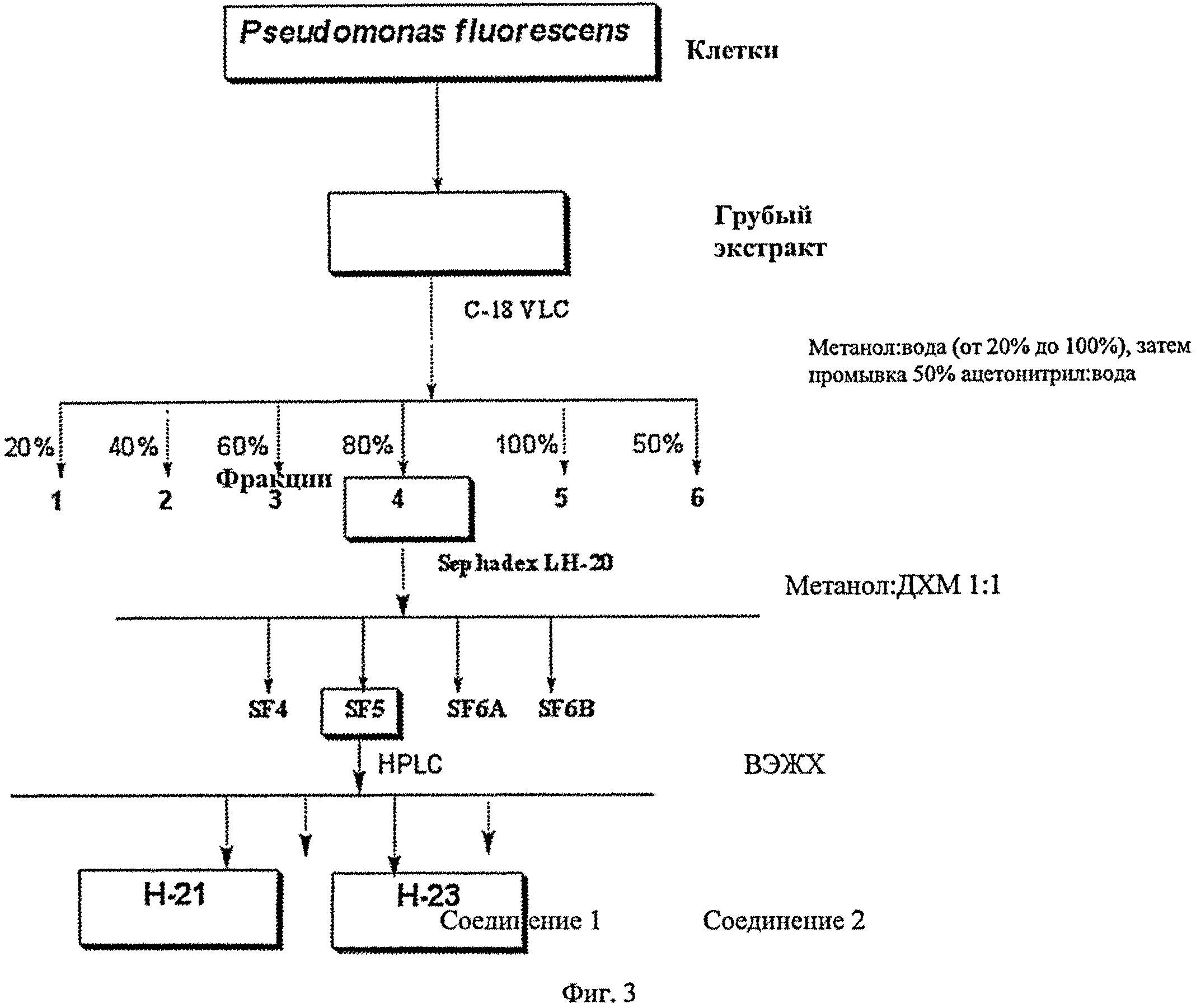
На фиг.3 схематически представлена схема очистки для получения соединений по настоящему изобретению из клеточной культуры Pseudomonas.
На фиг.4 показано развитие смертности с течением времени для мидий, обработанных глиной и биопестицидным продуктом, направленным против Р. Fluorescens, в БиоБоксе.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если приведен диапазон значений, понятно, что каждое промежуточное значение до десятой доли единицы нижнего предела между верхним и нижним пределом этого диапазона, если контекст явно не требует иного, и любое другое указанное или промежуточное значение в данном указанном диапазоне охвачено изобретением. Верхний и нижний пределы этих меньших диапазонов, которые могут быть независимо включены в эти меньшие диапазоны, также охвачены изобретением, принимая во внимание любой конкретно исключенный предел в указанном диапазоне. Если указанный диапазон включает один или оба предела, диапазоны, исключающие любые оба из этих включенных пределов, также включены в изобретение.
Если не определено иное, все технические и научные термины, используемые в данной заявке, имеют то же значение, которое общепринято придают им обычные специалисты в области техники, к которой принадлежит данное изобретение. Хотя любые способы и материалы, подобные или эквивалентные описанным в данной заявке, можно также использовать в практике или при тестировании настоящего изобретения, здесь описаны предпочтительные способы и материалы.
Следует отметить, что, при использовании в данной заявке и в прилагаемой формуле изобретения, формы единственного числа включают ссылки на множественное число, если контекст явно не требует иного.
Как определено в данной заявке, "регулирование численности мидий" означает регулирование численности яиц, личинок, велигеров и поствелигеров мидии путем их уничтожения или нанесения им ущерба таким образом, чтобы они не могли колонизировать данное место.
Как определено в данной заявке, "выделенный из" означает непосредственно изолированный или полученный из конкретного источника или, альтернативно, обладающий идентификационными характеристиками вещества или организма, изолированного или полученного из конкретного источника.
Как используется в данной заявке ниже, термин "алкил" относится к насыщенному углеводородному радикалу, который может быть прямоцепочечным или разветвленным (например, этил, изопропил, грег-ашл или 2,5-диметилгексил и т.д.). Данное определение применимо как при использовании этого термина отдельно, так и при использовании его как части названия соединения.
Термины "циклоалкил" и "циклоалкенил" относятся к насыщенному углеводородному кольцу и включают бициклические и полициклические кольца. Подобным образом, циклоалкильные и циклоалкенильные группы, имеющие гетероатом (например, N, O или S) вместо кольцевого атома углерода, могут быть названы "гетероциклоалкил", "гетероциклил" и "гетероциклоалкилен", соответственно.
Термин "алкенил", как используется в данной заявке, относится к алкильной группе, как описано выше, которая содержит один или более чем один сайт ненасыщенности, который представляет собой двойную связь. Подобным образом, термин "алкинил", как используется в данной заявке, относится к алкильной группе, как описано выше, которая содержит один или более чем один сайт ненасыщенности, который представляет собой тройную связь.
Термин "алкокси" относится к алкильному радикалу, как описано выше, который также несет в качестве заместителя атом кислорода, который способен к ковалентному присоединению к другому углеводородному радикалу (как, например, метокси, этокси, арилокси и грег-бутокси).
Термин "арил" относится к ароматическому карбоциклическому заместителю, который может представлять собой одно кольцо или множественные кольца, которые конденсированы вместе, связаны ковалентно или связаны общей группой, такой как этиленовая или метиленовая группировка. Подобным образом, арильные группы, имеющие гетероатом (например, N, O или S) вместо кольцевого атома углерода, могут быть названы "гетероарил".
Термины "арилалкил", "арилалкенил" и "арилоксиалкил" относятся к арильному радикалу, присоединенному непосредственно к алкильной группе, алкенильной группе или атому кислорода, который присоединен к алкильной группе, соответственно. Для краткости, арил как часть составного термина, как указано выше, понимают как включающий также гетероарил.
Термин "гетеро", как его используют в "алкильной группе, содержащей гетероатом" (то есть "гетероалкильной" группе) или в "арильной группе, содержащей гетероатом" (то есть "гетероарильной" группе) относится к молекуле, связи или заместителю, в которых один или более чем один атом углерода заменен атомом, иным, чем углерод, например, атомом азота, кислорода, серы, фосфора или кремния.
Как определено в данной заявке, "выделен из" и "может быть получен из" означает непосредственно изолированный или полученный из конкретного источника или, альтернативно, обладающий идентификационными характеристиками вещества или организма, изолированного или полученного из конкретного источника. Эти термины используют взаимозаменяемо во всем описании.
Как определено в данной заявке, "изолированное соединение" по существу свободно от других соединений или веществ, например, оно является по меньшей мере примерно на 20% чистым, предпочтительно по меньшей мере примерно на 40% чистым, более предпочтительно примерно на 60% чистым, даже более предпочтительно примерно на 80% чистым, наиболее предпочтительно примерно на 90% чистым, и даже наиболее предпочтительно примерно на 95% чистым, как определено аналитическими способами, включающими, не ограничиваясь указанным, хроматографические способы, электрофоретические способы.
Соединения
Соединения, применяемые в композициях и способах по настоящему изобретению, могут быть членами трех приведенных ниже групп.
Соединения группы I
В конкретном воплощении группа I обладает приведенной ниже химической структурой:

где X включает, не ограничиваясь указанным, атом углерода, серы, фосфора; Y включает, не ограничиваясь указанным, атом серы, кислорода; A и М включают, не ограничиваясь указанным, атом углерода, кислорода, азота, серы, и n равно от 1 до 21, где (R)z представляет собой число Z количества заместителей на группе R на кольце. R и заместители при R могут представлять собой атом водорода, гидроксил, алкилгидроксил, алкенилгидроксил, алкинилгидроксил, алкилокси, алкенилокси, алкинилокси, циклоалкил, циклоалкенил, алкил, алкенил, алкинил, гетероциклил, гетероарил, ароматическую, арильную группу, NH-замещенную или N,N-замещенную группу или любую другую замещенную группу. Длина одной из цепей замещенного R может составлять от 1 до 25 атомов, где предпочтительная длина будет составлять от 7 до 17 атомов; число Z может быть равно 0, 1, 2, 3 до n+2, предпочтительно Z=0, 1, 2, 3.
В конкретном воплощении это соединение может происходить из Pseudomonas fluorescens и имеет структуру лактона гидроксилированной ненасыщенной жирной кислоты, содержащего по меньшей мере одну лактонновую группировку, которая представляет собой 5-членный у-лактон, по меньшей мере одну ненасыщенную группировку и по меньшей мере одну спиртовую группу; молекулярную массу структуры ядра, составляющую от 285 до примерно 310; по меньшей мере 15 атомов углерода и по меньшей мере 3 атома кислорода. В более конкретном воплощении это соединение может иметь структуру

где: каждый X независимо представляет собой -O, -NR1 или -S, где представляет собой -H или C1-C6 алкил; n=0-15, каждый из R2-R4 независимо представляет собой -H, алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероцикл, замещенный гетероцикл, циклоалкил, замещенный циклоалкил, алкокси, замещенный алкокси, тиоалкил, замещенный тиоалкил, гидрокси, галоген, амино, амидо, карбоксил, -C(O)H, ацил, оксиацил, карбамат, сульфонил, сульфонамид или сульфурил; m представляет собой двойную связь или тройную связь. Еще в одном конкретном воплощении Y и M представляют собой атом кислорода, A и X представляют собой атом углерода, и n равно 2 или 3, R представляет собой C7 или C8 алкил, и z равно 0, где, если n равно 2 и R представляет собой C7 алкил, то R присоединен к A.
Еще в одном конкретном воплощении соединения группы I могут представлять собой соединения, перечисленные в 1-28 (фиг.1a и 1b). Они представляют собой либо соединения из природных материалов, либо соединения, полученные из коммерческих источников либо путем химического синтеза. Природные источники соединений группы I включают, не ограничиваясь указанным, растения, кораллы, микроорганизмы, губки и животных. В более конкретном воплощении растения, которые содержат соединения группы I, включают, не ограничиваясь указанным, (или альтернативно соединения группы I могут происходить из них) такие виды, как Myoporum bontioides (соединение 14) [Moe Kanemoto, et al., Chlorine-containing iridoid and iridoid glucoside, and other glucosides from leaves of Myoporum bontioides, Phytochemistry 69 (2008) 2517-2522], Micromelum hirsutum (соединение 18) [Ma, G.Y. et al. anti-tuberculosis constituents from the stem bark of Micromelum hirsutum, Planta Med. 2005, 71, 261-267]. Соединения группы I могут также происходить из микроорганизмов, включающих, не ограничиваясь указанным, Antrodia camphorate (соединения 4, 5) [Shao, Y.Y. et al., Chemical constituents of Antrodia camphorata submerged whole broth, Natural Product Research, 2008, 22 (13) 1151-1157], Saccharomyces cerevisiae (соединение 2) [Gocho, S. et al. Biotransformation of oleic acid to optically active y-dodecalactone, Biosci. Biotech. Biochem. 1995, 59 (8) 1571-1572], Mesorh/zobium sp.(соединения 2, 17) [Wei, G.H. et al., Rhizobialide: A New Stearolactone Produced by Mesorhizobium sp.CCNWGX022, a Rhizobial Endophyte from Glycyrrhiza uralensis, Chemistry and Biodiversity, 2007, 4, 893-898], Ophiostoma piliferum (соединение 16), [Wei, G.H. et al., Rhizobialide: A New Stearolactone Produced by Mesorhizobium sp.CCNWGX022, a Rhizobial Endophyte from Glycyrrhiza uralensis, Chemistry and Biodiversity, 2007, 4, 893-898], Streptomyces sp.(соединение 8) [Khaled A. Shaaban, Mohamed Shaaban, Petrea Facey, Serge Fotso, Holm Frauendorf, Elisabeth Helmke, Armin Maier, Heinz H. Fiebig, Hartmut Laatsch, Electrospray Ionization Mass Spectra of Piperazimycins A and В and y-Butyrolactones from a Marine-derived Streptomyces sp.J. Antibiot. 61(12):736-746, 2008], Macrophomina phaseolzna (соединения 9, 10 и 15) [Shashib, Mahat et al., structure and stereochemistry of phaseolinic acid: a new acid from Macrophomina phaseolzna, Journal of Natural products, 1987, 50 (2) 245-247], Sporidiobolus salmonicolor (соединения 1, 3) [Laurent Dufosse, et al., Chirality of the v-Lactones Produced by Sporidiobolus salmonicolor Grown in Two Different Media, Chirality, 1997, 667-671] и Streptomyces (соединение 7) [Shohei Sakuda, et al., Biosynthetic Studies on Virginiae Butanolide A, a Butyrolactone Autoregulator from Streptomyces. Part 2, Preparation of Possible Biosynthetic Intermediates and Conversion Experiments in a Cell-free System. J. Chem. Soc. Perkin Trans. I 1993, 2309-2315].
В дополнительном конкретном воплощении соединения группы I могут происходить из губок, таких как Haliclona п.sp (соединения 26, 27 и 28) [Richard J. Clark, Mary J. Garson, and John N. A. Hooper, Antifungal Alkyl Amino Alcohols from the Tropical Marine Sponge Haliclonan. sp.J. Nat. Prod. 2001, 64, 1568-1571], Axinellas sp (соединение 25) [Miller, W. F. Tinto, J.-P. Yang, S. McLean and W. F. Reynolds, Axinellamide, a new alkaloid from the marine sponge Axinellas sp.Tetrahedron Lett., 1995, 36, 5851], Plakortis nigra (соединения 19-20) [Joel S. Sandler, et al., Cytotoxic p-Carbolines and Cyclic Peroxides from the Palauan Sponge Plakortis nigra, J.. Nat. Prod. 2002, 65, 1258-1261] и ircinia formosana (соединения 21-24) [Shen, Y. C. et al., Novel linear C22-sesterterpenoids from sponge Ircinia formosana, Tetrahedron Letters 47 (2006) 4007-4010]. Соединения 26-28 являются примерами карбаматов.
В другом конкретном воплощении соединения группы I могут быть выделены из кораллов, включающих, не ограничиваясь указанным, Sarcophyton trocheliophorum и Lithophyton arboretum (соединения 11 и 13) [Tomas Rezanka, et al., y-lactones from the soft corals Sarcophyton trocheliophorum and Lithophyton arboretum, Tetrahedron, 2001, 57, 8743-8749].
Еще в одном конкретном воплощении соединения группы I содержатся в насекомых, или они могут происходить из насекомых, включая, но не ограничиваясь указанным, половой феромон самок хрущика японского (соединение 12) [J.Н. Tumlinson, Identification of the Female Japanese Beetle Sex Pheromone Inhibition of Male Response by an Enantiomer, Science, 1977, 197, 789-792] и токсины насекомых (соединение 6) [John A. Findlay, et al., Insect toxins from spruce endophytes, Can. J. Chem. 2003, 81, 284-292].
Соединения группы I могут также включать, не ограничиваясь указанным, гамма-додекалактон, дельта-тридекалактон, пилиферолид A и альфа-гептил-гамма-бутиролактон, приведенные в Примерах. Они могут быть получены синтетическими способами, с использованием способов, известных в данной области техники, или из коммерческих источников.
Соединения группы II
В другом конкретном воплощении группа II обладает следующей химической структурой:

где X представляет собой атом углерода; Y представляет собой атом кислорЪда; A, B и M представляет собой атом углерода, кислорода, азота, серы или другие атомы, и n равно от 1 до 21,
где (R)z представляет собой число Z количества заместителей на группе R на кольце. R и заместители на R могут представлять собой атом водорода, гидроксил, алкилгидроксил, алкенилгидроксил, алкинилгидроксил, алкилокси, алкенилокси, алкинилокси, циклоалкил, циклоалкенил, алкил, алкенил, алкинил, гетероциклил, гетероарил, ароматическую, арильную группу, NH-замещенную или N,N-замещенную группу или любую другую замещенную группу. Длина одной из цепей замещенного R может составлять от 1 до 25 атомов, где предпочтительная длина будет составлять от 7 до 17 атомов; число Z может быть равно 0, 1, 2, 3 до n+2, предпочтительно Z=0, 1, 2, 3.
В конкретном воплощении соединения группы II, такие как соединения 29-36 и 44, (см. фиг.1a и 1b) могут быть получены из природных источников, путем химического синтеза или из коммерческих источников. Природные источники соединений группы II включают, не ограничиваясь указанным, растения, кораллы, микроорганизмы, губки и животных. В конкретном воплощении примеры таких растений включают, не ограничиваясь указанным, приведенные ниже виды, такие как Heteroplexis micocephala (соединения 30, 31, 32 и 33) [Fan, X.N., et al., Chemical Constituents of Heteroplexis micocephala. J. Nat. Prod. 2009, 72, 1184-1190] и виды Iryanthera (соединение 34) [Vieira, P.C., et al., y-Lactones from Iryanthera species, Phytochemistry, 1983, 22 (3) 711-713] и Litse verticillata (соединение 44) [Zhang, H.J. et al., sesquiterpenes and butenolides, natural anti-HIV constituents from Litse verticillata, Planta Med, 2005, 71, 452-457]. В более конкретном воплощении источники микроорганизмов, которые включают соединения группы II, включают, не ограничиваясь указанным, приведенные ниже виды, такие как Streptomyces rishiriensis А-5969 (соединение 29) [Yumiko Itoh, Hiroshi Shimura, Mayumito, NaoHaru Watanabe, Michio Yamagishi, Masaharu Tamai and Kazunori Hanada, novel hepatoprotective 7-lactone, MH-031, Discovery, Isolation, Physical-Chemical properties and structural elucidation, The Journal of antibiotics, 1991, 44 (8) 832-837]. В более конкретном воплощении кораллы, которые содержат соединения группы II, включают, не ограничиваясь указанным, приведенные ниже виды, такие как Pterogorgia anceps (соединение 35) [Guo, Y.W. et al., Three New Butenolide Lipids from the Caribbean Gorgonian Pterogorgia anceps, J. Nat. Prod. 1999, 62, 1194-1196; Manuel Lorenzo et al., 13C NMR-Based Empirical Rules to Determine the Configuration of Fatty Acid Butanolides. Novel y-Dilactones from Pterogorgia spp, Organic Letters, 8 (22) 5001-5004] и Pterogorgia citrine (соединение 36) [Abimael D. Rodriguez et al., further butenolides from the Caribbean octocoral Pterogorgia citrine, Journal of Natural Products, 1994, 57(3) 339-347].
Соединения группы III
В другом конкретном воплощении соединения группы III обладают приведенной ниже химической структурой:

где X представляет собой атом углерода; Y представляет собой атом кислорода; Z представляет собой атом водорода, гидроксил, алкенилгидроксил, алкинилгидроксил, алкил, алкенил, алкинил, гетероциклил, ароматическую, арильную группу, NH-замещенную или N,N-замещенную группу или любую другую замещенную группу,
где R представляет собой алкенилгидроксил, алкинилгидроксил, алкил, алкенил, алкинил, гетероциклил, ароматическую, арильную группу, NH-замещенную или N,N-замещенную группу или любую другую замещенную группу. Длина цепи R может составлять от 1 до 50, предпочтительно от 7 до 17.
В конкретном воплощении соединения группы III, такие как соединения 37-43 (фиг.1a и 1b) могут быть получены из природных или коммерческих источников или путем химического синтеза. Природные источники соединений группы III включают, не ограничиваясь указанным, растения, кораллы, микроорганизмы, губки и животных. В более конкретном воплощении растительные источники включают, не ограничиваясь указанным, Piper spp (соединение 43) [Likhitwitayawuid, K., Ruangrungsi, N, Lange, G and Decicco, C., Structural Elucidation and Synthesis of New Components isolated from Piper Samentosum, Tetrahedron 1987 (43) 3689-3694; Kiuchi, F., Nakamura, N.. Tsuda, Y., Kondo, К and Yoshimura, H. Studies on Crude Drugs Effective on Visceral Larva Migrans. IV. Isolation and Identification of Larvicidal Principles in Pepper Chemical and Pharmaceutical Bulletin 1988(36):2452]. В более конкретном воплощении кораллы включают, не ограничиваясь указанным, Plexaura flava (соединение 42) [В.N. Ravi, et al., Lipid and Terpenoid Metabolites of the Gorgonian Plexaura flava, Aust. J. Chem., 1982, 35, 105-12], и в более конкретном воплощении микроорганизмы, содержащие соединения группы III, включают, не ограничиваясь указанным, приведенные ниже виды, такие как Lyngbya majuscula и Schizothrix calclcola (соединение 39, 40) [George G. Harrigan, et al., Tumonoic Acids, Novel Metabolites from a Cyanobacterial Assemblage of Lyngbya majuscula and Schizothrix calcicola, J. Nat. Prod. 1999, 62, 464-467], Pseudomonas aeruginosa (соединение 41) [Michael, K. Winson., et al. Multiple N-acyl-L-homoserine lactone signal molecules regulate production of virulence determinants and secondary metabolites in Pseudomonas aeruginosa, Proc. Natl. Acad. Sci. USA, 1995, 92, 9427-9431], Erwinia carotovora (соединение 37) [GQnter Brader, Solveig Sjoblom, Heidi Hyytiainen, Karen Sims-Huopaniemi, and E. Tapio Palva, Altering Substrate Chain Length Specificity of an Acylhomoserine Lactone Synthase in Bacterial Communication, The Journal of Biological Chemistry, 2005, 280(11) 10403-10409] и Photobacterium phosphoreum (соединение 38) [L.R. Flodgaard, P. Dalgaard, J.B. Andersen, K.F. Nielsen, M. Givskov, and L. Gram, Nonbioluminescent Strains of Photobacterium phosphoreum produce the Cell-to-Cell Communication Signal N-(3-Hydroxyoctanoyl)homoserine Lactone, Applied and Environmental Microbiology, 2005, 71(4), 2113-2120].
Еще в одном другом конкретном воплощении соединения группы III могут представлять собой аналог сарментина, имеющий приведенную ниже структуру:

где R1 представляет собой алкил, алкенил, алкинил, гетероциклил, ароматическую, арильную группу, NH-замещенную или N,N-замещенную группу, и длина цепи R1 составляет от 4 до 20 атомов, и предпочтительно от 6 до 12 атомов,
где R2 и R3 представляют собой алкил, алкенил, алкинил, циклоалкил, циклоалкенил, ароматическую группу, арилалкил, гетероциклил или гетероарил; или альтернативно R2+R3+N может представлять собой N-содержащую гетероциклическую группировку,
где, если R2+R3+N представляет собой N-содержащую гетероциклическую группировку, то R1 представляет собой алкил, алкенил, алкинил, гетероциклил, NH-замещенную или N,N-замещенную группу.
В наиболее конкретном воплощении аналог сарментина представляет собой N-циклопентилдеканамид, N-(деканоил)пирролидин, N-(деканоил)пиперидин, N-(деканоил)гексаметиленимин, N-циклопентилдеценамид, (N-(деценоил)пирролидин, N-(деценоил)пиперидин, N-(деценоил)гексаметиленимин и N-(деценоил)пиперидин.
Аналоги сарментина могут быть получены с использованием способов, известных в данной области техники.
Еще в одном другом конкретном воплощении соединение может происходить из Pseudomonas fluorescens и характеризуется как имеющее структуру гидроксилированной ненасыщенной жирной кислоты, содержащей по меньшей мере одну группировку карбоновой кислоты, по меньшей мере одну ненасыщенную группировку и по меньшей мере одну спиртовую группу; имеет молекулярную массу структуры ядра от 285 до примерно 310; по меньшей мере 15 атомов углерода и по меньшей мере 3 атома кислорода.
В более конкретном воплощении изобретения предложены соединения, имеющие структуру

где: каждый X независимо представляет собой -OH, -NR1 или -S, где R1 представляет собой -H или C1-C6 алкил; n=0-15, каждый из R2-R4 независимо представляет собой -H, алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероцикл, замещенный гетероцикл, циклоалкил, замещенный циклоалкил, алкокси, замещенный алкокси, тиоалкил, замещенный тиоалкил, гидрокси, галоген, амино, амидо, карбоксил, -C(O)H, ацил, оксиацил, карбамат, сульфонил, сульфонамид или сульфурил; m представляет собой двойную связь или тройную связь.
В наиболее конкретном воплощении соединение имеет структуру

Способы получения
Как отмечено выше, соединения и композиции по настоящему изобретению являются полученными, могут быть получены, или происходят из организма, обладающего идентификационными характеристиками вида рода Pseudomonas, более конкретно из организма, обладающего идентификационными характеристиками штамма Pseudomonas fluorescens, или альтернативно из организма, обладающего идентификационными характеристиками изолята Pseudomonas fluorescens, АТСС 55799, как изложено в патенте США №6194194. Эти способы включают культивирование этих организмов и получение соединений и/или композиций по настоящему изобретению путем выделения этих соединений из клеток этих организмов.
В частности, организмы культивируют в питательной среде, используя способы, известные в данной области техники. Организмы можно культивировать путем культивирования во встряхиваемых колбах, ферментации в малом масштабе или в крупном масштабе (включая, но не ограничиваясь указанным, непрерывную, периодическую, периодическую с подпиткой или твердофазную ферментацию) в лабораторных или в промышленных ферментерах, проводимую в подходящей среде и в условиях, дающих возможность роста клеток. Культивирование может осуществляться в подходящей питательной среде, содержащей источники углерода и азота и неорганические соли, с использованием способов, известных в данной области техники. Подходящие среды могут быть получены из коммерческих источников или приготовлены в соответствии с опубликованными составами. Конкретное воплощение раскрыто в примерах ниже и в патенте США №6194194.
После культивирования клетки можно концентрировать, а затем суспендировать в буфере с получением клеточной суспензии. Соединения и/или композиции по настоящему изобретению можно экстрагировать из суспензии. Экстракт можно фракционировать с помощью хроматографии. Хроматографию можно оценивать на токсическую активность в отношении моллюсков, таких как мидии, улитки (например, водные и/или садовые улитки) и/или слизни, используя способы, известные в данной области техники; одно конкретное воплощение раскрыто в приведенных ниже примерах. Этот процесс можно повторять один или более чем один раз, используя те же или другие способы хроматографии.
Соединения по настоящему изобретению могут быть также получены синтетическими способами. Альтернативно для пептидных соединений эти соединения могут быть получены путем экспрессии последовательностей нуклеиновых кислот, кодирующих эти соединения, в хозяине рекомбинантной ДНК, используя способы, известные в данной области техники.
Составы
Композиция по настоящему изобретению может включать химический или биопестицидный продукт, который полезен для регуляции численности моллюсков, в частности, представителей классов Gastropoda и/или Bivalvia, и более конкретно мидий, улиток и слизней. Изобретение относится к изолированным соединениям, которые могут быть (а) получены или выделены из микроорганизма, такого как вид рода Pseudomonas, более конкретно Pseudomonas fluorescens или альтернативно из организма, обладающего идентификационными характеристиками Pseudomonas АТСС 55799; (b) являются токсичными для представителя класса моллюсков, выбранного из группы, состоящей из Bivalvia, в частности, мидий (например, Dreissana sp.) и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, Biomphalaria sp.) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Theba sp.), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.), и (с) имеют молекулярную массу, выбранную из группы, состоящей из: примерно 540-550 и примерно 1280-1335, как определено с помощью жидкостной хроматографии/масс-спектроскопии (ЖХ/МС). Эти составы можно включать в композиции, которые можно применять для контроля численности моллюсков, в частности, представителей классов Gastropoda и/или Bivalvia, и более конкретно мидий, улиток и слизней.
Примеры включают, не ограничиваясь указанным, хлор и вещества, имеющие происхождение из вида рода Pseudomonas, как описано, например, в патенте США №6194194. Кроме того, соединения, раскрытые выше и применяемые в изобретении, могут быть получены в виде композиций (также альтернативно называемых "составами"), и их можно готовить в любой форме. Неограничивающие примеры препаратов включают эмульгируемые концентраты (КЭ), смачивающиеся порошки (СП), растворимые жидкости (РЖ), аэрозоли, растворы концентратов сверхнизкого объема (СНО), растворимые порошки (РП), микроинкапсуляцию, гранулы, диспергируемые в воде, жидкотекучие препараты (ЖП), микроэмульсии (МЭ), наноэмульсии (НЭ) и т.д. В любом препарате, описанном в данной заявке, процентное содержание активного ингредиента находится в диапазоне от 0,01% до 99,99%. В конкретном воплощении препараты могут не содержать сурфактантов.
Примеры инертного материала, который можно использовать в композициях по настоящему изобретению, включают, не ограничиваясь указанным, неорганические минералы, такие как каолин, слюда, гипс, филлосиликаты, карбонаты, сульфаты или фосфаты; или растительные материалы, такие как древесные продукты, пробка, порошкообразные кукурузные початки, рисовые отруби, арахисовая шелуха и скорлупа грецких орехов. В конкретном воплощении инертный материал может быть получен или выделен из глинистого минерала (каолинита, смектита, аттапульгита), суспендирован в воде с концентрацией примерно от 1 до 20 мг/литр, соответствующей приблизительно от 1 до 20 НЕМ (нормализованных единиц мутности). Инертные материалы, используемые для усиления сифонирования устриц, можно применять в твердой форме или в виде суспензии в водном растворе, предпочтительно в воде, непосредственно в воде или в месте (например, на твердой поверхности), где обрабатывают устриц. В конкретном воплощении для усиления эффективности препарата инертный материал, такой как глина, ил, осадочные отложения или любой другой материал, не обладающий питательной ценностью, и имеющий достаточно маленький размер частиц, можно суспендировать в воде перед обработкой химическим веществом или биопестицидным препаратом.
Способы применения
Соединения и композиции по настоящему изобретению можно применять для контроля численности моллюсков, в частности, представителей класса Gastropoda и/или Bivalvia, более конкретно мидий (например, вида Dreissana), и/или Gastropoda, в частности, улиток, которые включают, не ограничиваясь указанным, водных улиток (например, вид Biomphalaria) и садовых улиток, включающих, не ограничиваясь указанным, обыкновенных коричневых садовых улиток, белых садовых улиток (например, Cantareus sp., Cornu sp., Theba sp.), и/или слизней, включающих, не ограничиваясь указанным, сетчатого слизня (например, Deroceras sp.), полосатого или трехполосного слизня (например, Lehmannia sp.), желтого слизня (например, Limacus sp.) и тепличного слизня (например, Milax sp.), в водоеме или на поверхностях, где собираются моллюски, такие как мидии, улитки и/или слизни, или альтернативно в качестве агента, препятствующего обрастанию, в краске. В случае, если их применяют в краске в качестве агента, препятствующего обрастанию, они представлены в количестве, препятствующем росту, биоцидно эффективном количестве. Поверхности, где собираются моллюски, такие как мидии, улитки и/или слизни, включают, не ограничиваясь указанным, пластмассу, бетон, древесину, стекловолокно, трубы, изготовленные из железа и поливинилхлорида, и поверхности, покрытые красками и/или покрытиями. Покрытия могут быть изготовлены из пигментов, связующих веществ, добавок и/или жидкостей-носителей, и их предпочтительно наносят в виде тонкой пленки для обеспечения защиты или украшения поверхности. Конечный препарат (который содержит активное соединение) будут применять при концентрации 10-200 мг/л, более конкретно 25-100 мг/л (млн-1) или 25-10000 мг/кг. Его будут наносить либо в виде сухого препарата, либо суспендировать в воде в трубах, строениях дамбы, баках для хранения и открытых водоемах, таких как водотоки, реки, озера, оросительные каналы, пруды и озера посредством особого применения насосов и смесительных систем.
В конкретном воплощении настоящее изобретение относится к способу улучшения биопестицидной и пестицидной активности материалов, применяемых для контроля численности инвазивных моллюсков, в частности, мидий, включающему стадии:
1. суспендирования инертного материала, такого как глина, в воде для запуска сифонирующей активности примерно за 1-24 часа до химической или биопестицидной обработки
2. добавления химического вещества или биопестицида в воду до желаемого уровня
Изобретение также относится к способу, включающему стадию введения микробного биопестицида в сочетании с инертным материалом, таким как глина, для усиления захвата мидиями и, следовательно, увеличения их смертности.
Для активации сифонирования мидий эту обработку глиной (замутнение) следует проводить в течение примерно 1-6 часов, обычно примерно 3-4 часов, и примерно за 1-24 часа, как правило, примерно за 14-18 часов до обработки химическим веществом/пестицидом. Альтернативно обработку замутнением можно применять одновременно с химической или биопестицидной обработкой.
В соответствии с одним воплощением настоящего изобретения обработку моллюсков, таких как мидии, улитки и слизни, можно проводить в 500-мл стеклянных банках или в БиоБоксе, сконструированном из листов акрилового пластика. В стеклянных банках аэрацию во время обработки обеспечивают путем потока воздуха через аквариумные воздушные сепараторы, соединенные с полиамидными трубками. В БиоБоксе вода постоянно течет со скоростью 1 галлон (3,79 л) в минуту.
Материалы для обработки замутнением и химическим/биопестицидным препаратом, можно смешивать в воде путем пипетирования или с помощью перистальтического насоса. В БиоБоксах более однородного смешивания достигают с использованием лопастной мешалки в точке впрыска. Композиции по настоящему изобретению могут быть представлены в подходящей форме для непосредственного применения в виде концентрата или первичной композиции, которая требует разведения подходящим количеством воды или другого разбавителя перед применением.
Эффективное количество материалов, вызывающих мутность, будет зависеть от применения, температуры воды, если их применяют в воде, и от длительности обработки. Как правило, композицию можно применять с концентрацией от примерно 1 до примерно 20 мг на литр; предпочтительно с концентрацией от примерно 5 до примерно 10 мг на литр, так чтобы измеренная мутность не превышала 20 НЕМ.
ПРИМЕРЫ
Приведенные ниже примеры представлены для описания предпочтительных воплощений и практических применений изобретения, и не ограничивают изобретение, если иное не указано в прилагаемой формуле изобретения.
ПРИМЕР 1: ИССЛЕДОВАНИЯ МОЛЛЮСКОЦИДОВ
Материалы и методы
1. Бугским дрейссенам дают возможность акклиматизации в маленьких чашках Петри в течение 24 ч.
- Заливают мидий в чашку Петри, чтобы определить, являются ли они живыми. Выбрасывают мертвых и пустых мидий,
- Отсчитывают 10 живых/здоровых мидий.
- Помещают 10 живых/здоровых мидий в каждую маленькую чашку Петри с минерализованной водой.
- Оставляют отдельную чашку с мидиями. Они являются "запасными мидиями", и их используют для замены мертвых или пустых мидий через 24 часа в других подопытных чашках.
- Аэрация не является необходимой вследствие низкого объема воды (уровень ВК (растворенного кислорода) является высоким).
2. Сутки обработки мидий:
- Проверяют мидий (используют скребок из натурального каучука в каждый момент времени проверки мидий. Для удаления мертвых мидий используют только микропинцеты).
- Производят подсчет, чтобы убедиться, что имеется 10 живых/здоровых мидий на маленькую чашку Петри,
- Готовят образец (образцы).
- Каждый образец растворяют соответствующим образом в минерализованной воде в 50 мл пробирках фирмы Falcon. Перемешивают на вортексе перед дозированием.
- Пример: 70 млн-1, 2 повтора на образец. Добавляют 34 мл минерализованной воды в пробирку фирмы Falcon. Добавляют 51 мкл образца в ту же пробирку фирмы Falcon с минерализованной водой. Перемешивают на вортексе перед дозированием.
3. Дозирование:
- Перемешивают образец на вортексе перед дозированием.
- Используя серологическую пипетку 25 мл, пипетируют образец вверх и вниз для перемешивания. Добавляют пипеткой 15 мл смеси в каждую маленькую чашку Петри,
- Оставляют мидии нетронутыми в течение 24 ч. Отмечают время и дату.
4. Через 24 ч после обработки:
- Через 24 ч после дозирования удаляют обработанную воду и
проверяют смертность мидий,
- Выгружают обработанную воду. Промывают чистой минерализованной водой 3 раза, после чего добавляют воду в каждую маленькую чашку Петри,
- Повторяют этот процесс для всех чашек Петри,
- Все чашки Петри должны быть проавтоклавированы перед тестированием. После автоклавирования чашки следует промыть водой.
5. Вычисляют смертность.
- Смертность (%)=100* (Суммарное количество мертвых устриц при обработке - суммарное количество мертвых устриц в чистом контроле) / Суммарное количество обработанных устриц
Исследования с коммерческими соединениями
Коммерческие соединения, полученные от фирмы Sigma-AIdrich, исследовали при конечной концентрации 11,1 мкг/мл. Результаты представлены в Таблице 1.
Синтетические соединения
Синтезированные соединения подвергают скринингу против бугских дрейссен при конечной концентрации 11,1 мкг/мл. Для получения соединений используют приведенный ниже способ.
Синтез амидов: К охлажденному во льду раствору карбоновой кислоты (3 ммоль) в дихлорметане (20 мл) последовательно добавляют 1-этил-3-(3'-диметиламсинопропил)карбодиимид (3,3 моль) и 4-диметиламинопиридин (3 ммоль). Через 5 мин в реакционный раствор добавляют амин (3,3 моль). Реакционную смесь медленно нагревают до комнатной температуры и оставляют на ночь. Реакционную смесь экстрагируют этилацетатом (200 мл). Органическую фазу высушивают безводным сульфатом натрия. После выпаривания в вакууме остаток прогоняют через колонку силикагеля с соответствующей долей этилацетата в гексане. Выход конечных продуктов находится в интервале от 85% до 90%. Конечные продукты характеризуются протонным ЯМР.
N-Циклопентилциннамамид (SAR-023):1Н ЯМР (CDCl3): δ (млн-1) 7,62 (d, J=15,6 Гц, 1Н), 7,50 (d, J=7,0 Гц, 2Н), 7,35 (m, 3H), 6,37 (d, J=15,6, 1Н), 5,61 (d, J=5,0 Гц, 1Н, NH), 4,35 (секстет, J=7,0, 1Н), 2,06 (m, 2Н), 1,71 (m, 2Н), 1,64 (m, 2Н), 1,46 (m, 2Н).
N-(транс-Циннамоил)пирролидин (SAR-024):1Н ЯМР (CDCl3): δ (млн-1) 7,70 (d, J=15,5 Гц, 1Н), 7,53 (d, J=7,0 Гц, 2Н), 7,36 (m, 3Н), 6,74 (d, J=15,5, 1Н), 3,63 (t, J=7,0, 2Н), 3,60 (t, J=7,0, 2H), 2,01 (квинтет, J=7,0, 2Н), 1,91 (квинтет, J=7,0, 2Н).
N-(транс-Циннамоил)пиперидин (SAR-025):1Н ЯМР (CDCl3): δ (млн-1) 7,64 (d, J=15,5 Гц, 1Н), 7,52 (d, J=7,2 Гц, 2Н), 7,36 (m, 3Н), 6,90 (d, J=15,5, 1Н), 3,67 (s, 2Н), 3,59 (s, 2Н), 1,68 (m, 2Н), 1,62 (m, 4Н).
N-(транс-Циннамоил)гексаметиленимин (SAR-026):1Н ЯМР (CDCl3): δ (млн-1) 7,70 (d, J=15,4 Гц, 1Н), 7,52 (d, J=7,6 Гц, 2Н), 7,36 (m, 3Н), 6,88 (d, J=15,4, 1Н), 3,63 (t, J=6,0, 2Н), 3,61 (t, J=6,0, 2H), 1,76 (m, 4H), 1,59 (m, 4H).
N-Циклопентилдеканамид (SAR-020):1H ЯМР (CDCl3): δ (млн-1) 5,35 (br, 1Н), 4,22 (секстет, J=7,00, 1Н), 2,12 (t, J=7,20, 2Н), 1,98(m, 2H), 1,59-1,67 (m, 6H), 1,26-1,36 (m, 14H), 0,88 (t, J=7,00, 3H).
N-(Деканоил)пирролидин (SAR-007):1H ЯМР (CDCl3): δ (млн-1) 3,45 (t, J=6,80, 2H), 3,40 (t, J=6,80, 2H), 2,24 (t, J=7,20, 2H), 1,94 (quintet, J=6,80, 2H), 1,84 (квинтет, J=6,80, 2H), 1,62 (квинтет, J=7,20, 2H), 1,25-1,30 (m, 12H), 0,87 (t, J=7,20, 3H).
N-(Деканоил)пиперидин (SAR-021):1H ЯМР (CDCl3): δ (млн-1) 3,55 (t, J=5,20, 2H), 3,39 (t, J=5,20, 2H), 2,31 (t, J=7,60, 2H), 1,58-1,65 (m, 4H), 1,52-1,57 (m, 4H), 1,20-1,30 (m, 12H), 0,87 (t, J=7,20, 3H).
N-(Деканоил)гексаметиленимин (SAR-022):1H ЯМР (CDCl3): δ (млн-1) 3,52 (t, J=6,00, 2H), 3,42 (t, J=6,00, 2H), 2,30 (t, J=7,80, 2H), 1,66-1,74 (m, 4H), 1,60-1,66 (m, 2H), 1,50-1,60 (m, 4H), 1,20-1,30 (m, 12H), 0,87 (t, J=7,20, 3H).
N-Циклопентилдеценамид (SAR-027):1H ЯМР (CDCl3): 6 (млн-1) 6,82 (dt, J1=15,20, J2=7,20, 1H), 5,71 (d, J=15,20, 1H), 5,33 (br, 1H), 4,27 (секстет, J=7,00, 1H), 2,15 (m, 2H), 2,10 (m, 2H), 1,67 (m, 2H), 1,60 (m, 2H), 1,40 (m, 4H), 1,28 (m, 8H), 0,88 (t, J=7,00, 3H).
N-(Деценоил)пирролидин (SAR-030):1H ЯМР (CDCl3): δ (млн-1) 6,90 (dt, J1=15,20, J2=7,00, 1H), 6,07 (d, J=15,20, 1H), 3,52 (t, J=6,30, 2H), 3,50 (t, J=6,30, 2Н), 2,19 (m, 2H), 1,96 (квинтет, J=7,00, 2Н), 1,85 (квинтет, J=7,00, 2Н), 1,44 (m, 2Н), 1,28 (m, 8Н), 0,88 (t, J=7,00, 3Н).
N-(Деценоил)пиперидин (SAR-031):1Н ЯМР (CDCl3): δ (млн-1) 6,82 (dt, J1=15,20, J2=7,00, 1Н), 6,23 (d, J=15,20, 1H), 3,59 (t, J=6,30, 2H), 3,47 (t, J=6,30, 2H), 2,17 (m, 2H), 1,64 (квинтет, J=5,60, 2H), 1,56 (квинтет, J=5,60, 4H), 1,44 (квинтет, J=7,00, 2H), 1,28 (m, 8H), 0,88 (t, J=7,00, 3H).
N-(Деценоил)гексаметиленимин (SAR-032):1H ЯМР (CDCl3): δ (млн-1) 6,91 (dt, J1=15,20, J2=7,00, 1H), 6,21 (d, J=15,20, 1H), 3,57 (t, J=6,00, 2H), 3,49 (t, J=6,00, 2H), 2,17 (m, 2H), 1,73 (m, 4H), 1,56 (m, 4H), 1,45 (m, 2H), 1,28 (m, 8H), 0,88 (t, J=7,00, 3H).
N-(Деценоил)пиперидин (SAR-033):1H ЯМР (CDCl3): δ (млн-1) 6,82 (dt, J1=15,20, J2=7,00, 1H), 6,23 (d, J=15,20, 1H), 3,59 (t, J=6,30, 2H), 3,47 (t, J=6,30, 2H), 2,17 (m, 2H), 1,64 (квинтет, J=5,60, 2H), 1,56 (квинтет, J=5,60, 4H), 1,44 (квинтет, J=7,00, 2H), 1,28 (m, 8H), 0,88 (t, J=7,00, 3H).
Результаты представлены в Таблице 2.
ПРИМЕР 2. ЭКСТРАКТЫ ERWINIA
Erwinia carotovora выращивают в среде LB (на литр: 10 г триптона, 5 г дрожжевого экстракта, 10 г NaCl, рН=7,5). Инокулум выращивают путем рассева на чашку ТСА (трипсинизированный соевый агар) из глицеринового концентрированного раствора. Чистоту культуры подтверждают посредством визуального исследования морфологии колоний. Используя стерильную петлю на 10 мкл, колонии собирают с поверхности агара и ресуспендируют в 50 мл среды LB в 250 мл колбе Эрленмейера без перегородки с завинчивающейся крышкой. Жидкую культуру инкубируют в течение 48-72 часов при 200 об/мин и 25°C.
Через 72 ч всю среду экстрагируют этилацетатом. Органическую фазу высушивают в вакууме. Из высушенного экстракта готовят раствор 5,0 мг/мл в диметилсульфоксиде (ДМСО). Затем такой раствор (100 мкл) добавляют в 45 мл минерализованной воды. Конечная концентрация этилацетатных экстрактов составляет 11,1 млн-1.
Данные, представленные в Таблице 3, показывают, что соединения, биологически активные против бугских дрейссен, продуцируются в Erwinia carotovora при выращивании в среде LB. Соединение 37 (фиг.1b), описанное выше, является одним из лактонов, продуцируемых Е carotovora при выращивании в среде LB [Günter Brader, Solveig Sjöblom, Heidi Hyytiäinen, Karen Sims-Huopaniemi, and E. Tapio Palva, Altering Substrate Chain Length Specificity of an Acylhomoserine Lactone. Synthase in Bacterial Communication, The Journal of Biological Chemistry, 2005, 280(11) 10403-10409].
ПРИМЕР 3: ВЫДЕЛЕНИЕ МОЛЛЮСКОЦИДНЫХ СОЕДИНЕНИЙ ИЗ PSEUDOMONAS
Исследование A
Фракционирование соединений
Для фракционирования соединений, экстрагированных из промытых клеток Pseudomonas fluorescens CL-145A, используют следующий способ:
Осадок клеток, полученный из 10 л ферментации P. fluorescens CL 145А (АТСС 55799) в культуральной среде FM2, суспендируют в буфере для разведения и экстрагируют смолой Amberlite XAD-7 (Asolkar, R.N., Jensen, P.R., Kauffman, C.A., Fenical, W. 2006. Daryamides A-C, Weakly Cytotoxic Polyketides from a Marine-Derived Actinomycete of the Genus Streptomyces strain CNQ-085 J. Nat. Prod. 69:1756-1759; Williams, P.G., Miller, E.D., Asolkar, R.N.. Jensen, P.R., Fenical, W. 2007. Arenicolides A-C, 26- Membered Ring Macrolides from the Marine Actinomycete Salinispora arenicola. J. Org. Chem. 725025-5034) путем встряхивания клеточной суспензии со смолой при 225 об/мин в течение двух часов при комнатной температуре. Смолу и клеточную массу собирают путем фильтрования через марлю и промывают деионизованной водой для удаления солей. Затем смолу, клеточную массу и марлю замачивают на 2 ч в ацетоне, после чего ацетон фильтруют и высушивают в вакууме, используя роторный испаритель, с получением грубого экстракта. Затем этот грубый экстракт фракционируют путем использования вакуумной жидкостной хроматографии на колонке C18 (H2O/CH3OH; градиент от 90:20 до 0:100%) с получением семи фракций. Затем эти фракции концентрируют до сухости, используя роторный испаритель, и полученные в результате сухие остатки подвергают скринингу на биологическую активность, используя как тест живых мидий в банках с бугскими дрейссенами, так и анализ на клеточной основе с эмбриональной клеточной линией улиток (Biomphalaria glabrata). Биологические анализы более подробно описаны в примерах №2 и №3. Затем активные фракции подвергают высокоэффективной жидкостной хроматографии (ВЭЖХ) с обращенной/нормальной фазой (Spectra System Р4000 (Thermo Scientific) с получением чистых соединений, которые затем подвергают скринингу в вышеупомянутых биологических системах анализа для локализации/идентификации активных соединений. Для подтверждения идентичности соединения определяют дополнительные спектроскопические данные, такие как ЖХ/МС и ЯМР.
Диаграмма используемого способа представлена на Фиг.3. На основе анализа как живых мидий, так и клеток улиток, фракции №4 и №5 содержат активные соединения. Из всех соединений, разделенных с помощью ВЭЖХ (колонка C-18, градиентная система растворителей вода: ацетонитрил (0-10 мин; 30-40% водный CH3CN, 10-20 мин; 40-60% водный CH3CN, 20-60 мин; 60-80% водный CH3CN, 60-65 мин; 80-100% водный CH3CN) при скорости тока 2,5 мл/мин и детекции УФ излучением при 210 нм пики номер 20, время удерживания 51,66 мин, 21, время удерживания 52,56 мин, и время удерживания 22А 59,61 мин ингибируют рост (например, низкое значение OD600) клеток улиток в биологическом анализе.
Масс-спектроскопический анализ активных пиков проводят на приборе с электрораспылением Thermo Finnigan LCQ Deca XP Plus (ИЭР), используя режимы как положительной, так и отрицательной ионизации в режиме полного сканирования (m/z 100-1500 Да) на масс-спектрометре LCQ DECA XPp,us (Thermo Electron Corp., San Jose, CA). Прибор для высокоэффективной жидкостной хроматографии Thermo (ВЭЖХ) оборудован детектором ФДМ Finnigan Surveyor PDA Plus, автоматическим дозатором Plus, МС насосом и колонкой 4,6 мм х 100 мм Luna С18 5 мкм (Phenomenex). Система растворителей состоит из воды (растворитель A) и ацетонитрила (растворитель В). Подвижную фазу начинают при 10% растворителя B и линейно повышают до 100% растворителя B за 20 мин, а затем выдерживают в течение 4 мин и, наконец, возвращают к 10% растворителя B за 3 мин и держат в течение 3 мин. Скорость тока составляет 0,5 мл/мин. Объем впрыска составляет 10 мкл, образцы выдерживают при комнатной температуре в автоматическом дозаторе. Соединения анализируют с помощью ЖХ-МС, используя ЖХ и хроматографию с обращенной фазой. Масс-спектроскопический анализ настоящих соединений осуществляют в описанных ниже условиях: Скорость тока газа азота фиксировали при 30 и 15 произвольных единицах для скорости тока оболочки и выходящего/продувочного газа, соответственно. Ионизацию электрораспылением осуществляли с помощью распылителя с установкой напряжения 5000 B и капиллярного напряжения при 35,0 В. Капиллярная температура была установлена на 400°C. Данные анализировали с помощью программного обеспечения Xcalibur. Активное соединение при пике #20 имеет молекулярную массу 1294,75 при режиме положительной ионизации. Хроматограмма ЖХ-МС для другого активного соединения (пик #22А) предполагает молекулярную массу 1320,83 при режиме положительной ионизации.
Для идентификации структуры частично очищенное соединение из активного пика #20 дополнительно анализируют, используя прибор ЯМР 600 МГц, и оно имеет значения δ при δ 9,25, 8,36, 8,06, 7,82, 7,71, 7,52, 7,45, 6,82, 6,36, 6,08, 5,42, 5,39, 5,30, 5,14, 4,68, 4,42, 4,31, 4,16, 4,11, 4,07, 3,95-3,86, 3,83, 3,72, 3,66, 3,53, 3,48, 3,37, 3,17, 3,06, 2,56, 2,53, 2,45, 2,32, 2,21, 2,02, 1,96, 1,84, 1,72, 1,65, 1,61, 1,51, 1,48-1,37, 1,32, 1,12, 0,94, 0,91, 0,68 в CDCl3. Данные ЯМР указывают на то, что соединение содержит аминогруппы, эфирные, карбоново-кислотные, фенильные, индольные, алифатические метильные, этильные, метиленовые, оксиметиленовые, метиновые, о-метильные, оксиметиновые и серные группы.
Подобным образом, анализ с помощью ВЭЖХ на колонке С-18 и в системе растворителей ацетонитрил: вода (0-10 мин; 35-45% водный CH3CN, 10-20 мин; 45-60% водный CH3CN, 20-50 мин; 60-85% водный CH3CN, 50-60 мин; 85-100% водный CH3CN, 60-70 мин; 100% CH3CN) при скорости тока 10 мл/мин и детекции УФ излучением при 210 нм активной фракции #4 с использованием фракционирования, контролируемого биологическим анализом, дал множественные пики с активностью как против живых мидий, так и против эмбриональных клеток улиток. Большая часть активности сконцентрирована в пиках #27 времени удерживания 47,73 мин и #30 времени удерживания 51,52 мин.
Пики #27 и #30 дополнительно проанализировали с помощью ЖХ/МС. На основании этих результатов пик # 27 содержит множественные соединения с двумя основными компонентами, имеющими массу примерно 643 и 984. Пик #30 содержит меньше соединений, и анализ массы предполагает молекулярную массу около 546 для основного компонента под этим пиком.
Биологический тест на устрицах
Этот биологический тест на живых устрицах используют для контроля идентификации активных соединений на протяжении всего фракционирования образцов с использованием ВЭЖХ и ЖХ-МС в качестве аналитических инструментов.
Двадцать свежесобранных бугских дрейссен помещают в банку, содержащую 250 мл дехлорированной водопроводной воды, при комнатной температуре. Банки выдерживают при комнатной температуре и соединяют с распределительным трубопроводом, обеспечивающим постоянную подачу воздуха посредством барботирования. Каждый объект тестирования (фракцию или пик ВЭЖХ), растворенный в ДМСО, добавляют в банки пипеткой по отдельности при концентрации 1-5 мг, и дрейссен инкубируют с объектом тестирования в течение 24 часов. После периода инкубации воду в каждой банке выливают, дрейссен промывают свежей водой, и переносят в открытые стеклянные чашки Петри на 10-суточный период наблюдения. Ежесуточно определяют смертность дрейссен, и мертвых дрейссен удаляют и выбрасывают. Каждую обработку проводят в трех повторах, и в конце 10-суточного периода инкубации вычисляют % смертности для каждой обработки.
Аналитическая система на клеточной основе
В качестве альтернативного способа этот анализ на клеточной основе используют как инструмент для облегчения выделения и идентификации активных соединений в клетках P. fluorescens после ферментации.
Эмбриональные клетки пресноводной улитки (Biomphalaria glabrata, АТСС CRL-1494) используют в качестве модельной системы для эпителиальных клеток пищеварительной железы мидий, про которые известно, что они чувствительны к биотоксинам P. fluorescens. Для этого анализа 200 мкл активно растущих клеток в полной ростовой среде, содержащей среду для дрозофилы, фетальную сыворотку теленка, D-галактозу и лактальбумин, добавляют в каждую лунку стерильного 96-луночного планшета. Тестируемое соединение (фракцию или пик ВЭЖХ при 20 мг/мл), растворенное в ДМСО, добавляют в каждую лунку, и планшет закрывают и инкубируют в контролируемой среде при 23°C и 5% CO2. Активность (ингибирование роста=низкая мутность) измеряют при 600 нм, используя считывающее устройство для планшетов SpectraMax с программным обеспечением SoftMax Pro, и сравнивают с отрицательным контролем с чистым ДМСО в качестве тестируемого соединения. Каждую обработку проводят в четырех повторах, и в каждый планшет включают одну копию обработки положительным контролем.
Исследование B
Материалы и методы
Приведенный ниже способ используют для очистки соединений, экстрагированных из клеточной культуры Pseudomonas fluorescens, он кратко изложен на Фиг.3. Конкретно, клеточный осадок, полученный в результате ферментации 10 л P. fluorescens CL 145А (АТСС 55799) в ростовой среде FM2, суспендируют в буфере для разведения и экстрагируют смолой Amberlite XAD-7 (Asolkar, R. N., Jensen, P. R., Kauffman, C. A., Fenical, W. 2006. Daryamides A-C, Weakly Cytotoxic Polyketides from a Marine-Derived Actinomycete of the Genus Streptomyces strain CNQ-085 J. Nat. Prod. 69:1756-1759 и Williams, P.G., Miller, E.D., Asolkar, R.N., Jensen, P.R., Fenical, W. 2007. Arenicolides A-C, 26- Membered Ring Macrolides from the Marine Actinomycete Salinispora arenicola. J. Org. Chem. 725025-5034) путем перемешивания клеточной суспензии со смолой при 225 об/мин в течение двух часов при комнатной температуре. Смолу и клеточную массу собирают фильтрованием через марлю и промывают деионизированной водой для удаления солей. Затем смолу, клеточную массу и марлю замачивают на 2 ч в ацетоне, после чего ацетон фильтруют и высушивают в вакууме, используя роторный испаритель, с получением грубого экстракта. Затем этот грубый экстракт фракционируют с помощью жидкостной хроматографии С18 в вакууме с обращенной фазой (H2O/CH3OH; градиент от 90:20 до 0:100%) с получением семи фракций. Затем эти фракции концентрируют до сухости, используя роторный испаритель, и полученные в результате сухие остатки подвергают скринингу на биологическую активность, используя как биотест с живыми бугскими дрейссенами в банке, так и анализ на клеточной основе с клеточной линией эмбрионов пресноводной улитки (Biomphalaria glabrata). Затем активные фракции подвергают ВЭЖХ с обращенной фазой (Spectra System Р4000 (Thermo Scientific) с получением чистых соединений, которые затем подвергают скринингу в вышеупомянутых биотестах для локализации/идентификации активных соединений. Для подтверждения идентичности соединения определяют дополнительные спектроскопические данные, такие как ЖХ/МС и ЯМР.
Активную фракцию 4 подвергают дальнейшему разделению на подфракции с помощью эксклюзионной хроматографии на Sephadex LH 20 с получением семи подфракции. Очистку Pilferolide A и 11-гидрокси-12-еноктадекановой кислоты проводят с помощью ВЭЖХ на колонке С-18 (Phenomenex, Luna 10u С18(2) 100 A, 250×30), градиентной системы растворителей вода: ацетонитрил (0-10 мин; 50-60% водный CH3CN, 10-20 мин; 60-75% водный CH3CN, 20-45 мин; 75-100% водный CH3CN, 45-55 мин; 100% CH3CN, 55-70 мин; 100-50% водный CH3CN) при скорости тока 8 мл/мин и детекции УФ излучением при 210 нм, активные пики номер 21, время удерживания 45,59 мин, и 23, время удерживания 48,53 мин.
Масс-спектроскопический анализ активных пиков проводят на приборе с ионизацией электрораспылением Thermo Finnigan LCQ Deca XP Plus (ИЭР), используя режимы как положительной, так и отрицательной ионизации в режиме полного сканирования (m/z 100-1500 Да) на масс-спектрометре LCQ DECA XPplus (Thermo Electron Corp., San Jose, CA). Прибор для высокоэффективной жидкостной хроматографии Thermo (ВЭЖХ) оборудован детектором ФДМ Finnigan Surveyor PDA Plus, автоматическим дозатором Plus, МС насосом и колонкой 4,6 мм х 100 мм Luna С18 5 мкм (Phenomenex). Система растворителей состоит из воды (растворитель А) и ацетонитрила (растворитель B). Подвижную фазу начинают при 10% растворителя B и линейно повышают до 100% растворителя B за 20 мин, а затем держат в течение 4 мин и, наконец, возвращают к 10% растворителя B за 3 мин и выдерживают в течение 3 мин. Скорость тока составляет 0,5 мл/мин. Объем впрыска составляет 10 мкл, и образцы держат при комнатной температуре в автоматическом дозаторе. Соединения анализируют с помощью ЖХ-МС, используя ЖХ и хроматографию с обращенной фазой. Масс-спектроскопический анализ настоящих соединений осуществляют при описанных ниже условиях: скорость тока газа азота определяли при 30 и 15 произвольных единицах для скорости тока оболочки и выходящего/продувочного газа, соответственно. Ионизацию электрораспылением осуществляли с помощью распылителя с установкой напряжения 5000 B и капиллярного напряжения при 35,0 B. Температура капилляра была установлена на 400°C. Данные анализировали с помощью программного обеспечения Xcalibur. Активное соединение Piliferolide A имеет молекулярную массу 295,65 в режиме отрицательной ионизации. Хроматограмма ЖХ/МС для другого активного соединения предполагает молекулярную массу 297,74 в режиме отрицательной ионизации.
Для идентификации структуры очищенное соединение Piliferolide A с молекулярной массой 296 дополнительно анализируют, используя прибор ЯМР 500 МГц; сравнение основано на внутреннем стандарте тетраметилсилане (ТМС, 0,00 млн-1). Это соединение имеет значения1Н ЯМР δ при 5,62, 5,42, 4,55, 3,97, 2,58, 2,35, 2,04, 1,88, 1,73, 1,64, 1,54, 1,39, 0,92 и имеет значения13С ЯМР δ 179,1, 133,3, 131,3, 81,9, 72,6, 37,3, 35,4, 32,1, 31,3, 29,5, 29,4, 29,0, 28,6, 27,8, 25,4, 25,3, 22,5, 13,3. Подробный 1D и 2D анализ ЯМР подтверждает, что структура соединения соответствует известному соединению Piliferolide А.
Второе очищенное соединение с молекулярной массой 298 дополнительно анализируют, используя прибор ЯМР 500 МГц, оно имеет значения1Н ЯМР δ при 5,61, 5,41, 3,96, 2,27, 2,04, 1,69, 1,51, 1,42, 1,32, 0,92 и значения13С ЯМР δ 176,6, 133,2, 132,6, 73,5, 37,5, 33,9, 32,4, 31,6, 29,8, 29,7, 29,6, 29,4, 29,3, 29,1, 25,7, 24,9, 22,8, 14,3. Подробный 1D и 2D анализ ЯМР подтверждает структуру соединения, которое не описано для микробиологического источника; Молекулярная формула C18H34O3. Структура этого соединения, 11-гидрокси-12-еноктадекановой кислоты, приведена ниже:

Эффективность соединений, выделенных из клеточной культуры Pseudomonas, тестируют, используя методы, описанные выше. Результаты представлены ниже в Таблице 4.
ПРИМЕР 5: ЭФФЕКТЫ КАОЛИНА
Эффект каолиновой глины в отношении эффективности биопестицида из микроорганизма на основе бактерий P. fluorescens тестируют в исследовании в БиоБоксе, проводимом при 11,8°C. На первые сутки эксперимента каолиновую глину вносят в БиоБокс из концентрированного исходного раствора посредством перистальтического насоса, так что конечная мутность в БиоБоксе составляет примерно 20 НЕМ (нормализованных единиц мутности). Пятьдесят бугских дрейссен помещают в акриловые трубки длиной 1 фут (30,48 см), закрытые нейлоновой сеткой на обоих концах, и трубки помещают на дно БиоБокса для обработки. Продолжительность внесения глины составляет 6 часов, после чего дрейссен в акриловых трубках подвергали воздействию свежей проточной воды в БиоБоксе в течение 18 часов. На следующие сутки избыточную глину вычищали со дна БиоБокса, и биопестицид в водной суспензии вносили посредством перистальтического насоса до конечной концентрации 200 млн-1. После 6-часовой обработки биопестицидом дрейссен в пробирках инкубируют в БиоБоксе со свежей проточной водой при скорости 1 галлон (4,546 л) в минуту. Дрейссен наблюдают и подсчитывают еженедельно в течение 5 недель для определения % смертности. Контрольные обработки, включенные в качестве необработанного контроля, представляют собой обработку только каолиновой глиной (без биопестицида) и обработку только биопестицидом (без предварительной обработки глиной). Все обработки проводят в трех повторах.
Результаты, представленные в Таблице 5 и на Фиг.4, показывают значимое повышение смертности для дрейссен, подвергнутых обработке каолиновой глиной за 18 часов до обработки биопестицидом, по сравнению с дрейссенами без предварительной обработки глиной. Это явление можно объяснить повышенной сифонирующей активностью дрейссен, собранных и обработанных в холодной (11,8°C) воде в течение периода низкой биологической активности. Это повышенное сифонирование приводит в результате к большему захвату пестицидного препарата, что, в свою очередь, приводит в результате к повышенной смертности дрейссен.
Пример 6: Эффекты гамма-додекалактона и N-(деценоил)пирролидина в отношении улиток
Эксперименты с улитками: Соответствующее количество тестируемого соединения сначала растворяют в ацетоне (2 мл). Раствор добавляют в 2,5 грамма кукурузного крахмала и хорошо перемешивают. Полученную в результате смесь переносят в чашку Петри (Ф 25 мм). Затем чашку Петри помещают в вытяжной шкаф для естественного высушивания. После высыхания в чашку Петри добавляют воду (2 мл) с получением пасты.
Коричневых садовых улиток (Cantareus aspersus) собирают из домашнего сада и выращивают по меньшей мере 1 сутки в лаборатории на капусте или моркови. Для каждой обработки выбирают пять индивидуальных особей малого размера, и переносят в 1 л стакан. Чтобы сделать улиток активными, их опрыскивают некоторым количеством воды в стакане с использованием ручного распылителя. После опрыскивания водой чашку Петри с кукурузным крахмалом, содержащим химическое вещество, помещают в стакан, стакан закрывают сверху алюминиевой фольгой. Регистрируют пищевое поведение, количество потребленного кукурузного крахмала и смертность через 24 ч.
Данные (представленные в Таблице 6) показывают, что гамма-додекалактон (SAR-014) при концентрации 100 мг/грамм кукурузного крахмала может быть сильным репеллентом для коричневых садовых улиток. Однако N-деценоил) пирролидин (SAR-030) при концентрации 100 мг/грамм кукурузного крахмала может уничтожить всех коричневых садовых улиток, съевших его.
Хотя данное изобретение описано со ссылкой на конкретные воплощения, их подробное описание не следует истолковывать как ограничивающее, поскольку очевидно, что можно использовать различные эквиваленты, изменения и модификации, и они будут находиться в пределах объема настоящего изобретения.
На протяжении всего данного описания цитируются различные источники, каждый из которых полностью включен в данную заявку посредством ссылки.
Реферат
Изобретения относятся к области биотехнологии. Предложены композиция и способ для контроля численности моллюсков классов Gastropoda и Bivalvia. Композиция содержит пилиферолид А или 11-гидрокси-12-еноктадекановую кислоту, происходящие из Pseudomonas fluorescens АТСС 55799 или суспензии его клеток, в количестве, эффективном для регулирования численности моллюсков, и глинистый минерал. Глинистый минерал представляет собой каолинит, смектит, аттапульгит или любую их комбинацию. Способ регулирования численности моллюсков включает введение одного или более чем одного глинистого минерала и пилиферолида А или 11-гидрокси-12-еноктадекановой кислоты в месте, где желателен контроль численности моллюсков. При этом глинистый минерал берут в количестве, эффективном для повышения эффективности пилиферолида А или 11-гидрокси-12-еноктадекановой кислоты по меньшей мере на 20%. Присутствие глинистого минерала усиливает моллюскоцидный эффект пилиферолида А и 11-гидрокси-12-еноктадекановой кислоты. Изобретения позволяют повысить эффективность химического и биологического контроля численности моллюсков в открытых водоемах, силовых установках и установках для обработки питьевой воды в условиях холодной воды. 2 н. и 2 з.п. ф-лы, 5 ил., 6 табл., 6 пр.















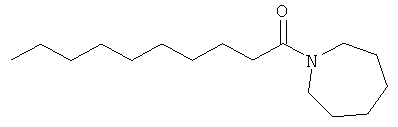











Комментарии