Способ получения энантиомеров амидоацетонитрильных соединений из их рацематов - RU2408574C2
Код документа: RU2408574C2
Описание
Настоящее изобретение относится к новому способу получения чистых энантиомеров из рацемата амидоацетонитрильных соединений формулы I
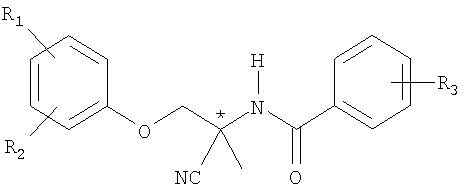
в которой R1, R2 и R3 независимо друг от друга обозначает атом водорода или галогена, нитро, циано, C1-С6алкил, гало-С1-С6алкил, C1-С6алкокси, гало-С1-С6алкокси, С2-С6алкенил, гало-С2-С6алкенил, С2-С6алкинил, гало-С2-С6алкинил, С2-С6алкенилокси, гало-С1-С6алкенилокси, C1-С6алкилтио, гало-С1-С6алкилтио, С1-С6алкилсульфонилокси, гало-С1-С6алкилсульфонилокси, С1-С6алкилсульфинил, гало-С1-С6алкилсульфинил, С1-С6алкилсульфонил, гало-С1-С6алкилсульфонил, C1-С6алкенилтио, гало-С1-С6алкенилтио, C1-С6алкенилсульфинил, гало-С1-С6алкенилсульфинил, С1-С6алкенилсульфонил, гало-С1-С6алкенилсульфонил, С1-С6алкиламино-, ди-(С1-С6алкил)аминогруппу, С1-С6алкиламинокарбонил, ди-(С1-С6алкил)аминокарбонил, С1-С6алкилсульфониламино-, гало-С1-С6алкилсульфониламиногруппу, С1-С6алкилкарбонил, гало-С1-С6алкилкарбонил, С1-С6алкоксикарбонил, незамещенный или от одно- до пятикратно замещенный фенил, незамещенный или от одно- до пятикратно замещенный фенокси, незамещенный или от одно- до пятикратно замещенный фенилацетиленил, незамещенный или от одно- до четырехкратно замещенный пиридилокси, незамещенный или от однодо четырехкратно замещенный пиридил или незамещенный или от одно- до семикратно замещенный нафтил, причем в каждом случае заместители выбирают из группы, включающей атом галогена, нитро, циано, С1-С6алкил, гало-С1-С6алкил, С1-С6алкокси и гало-С1-С6алкокси, которые могут быть использованы для борьбы с эндо- и эктопаразитами теплокровных животных, преимущественно у продуктивного скота, и домашних животных, а также на растениях.
Алкил как собственно группа и как структурный элемент других групп и соединений является в каждом случае (с учетом конкретного числа углеродных атомов в рассматриваемой группе или соединении) либо прямоцепочечным, т.е. метил, этил, пропил, бутил, пентил, гексил, гептил или октил, либо разветвленным, например изопропил, изобутил, втор-бутил, трет-бутил, изопентил, неопентил или изогексил.
Алкенил как собственно группа и как структурный элемент других групп и соединений является в каждом случае (с учетом конкретного числа углеродных атомов в рассматриваемой группе или соединении и сопряженных или изолированных двойных связей) либо прямоцепочечным, например аллил, 2-бутенил, 3-пентенил, 1-гексенил, 1-гептенил, 1,3-гексадиенил или 1,3-октадиенил, либо разветвленным, например изопропенил, изобутенил, изопренил, трет-пентенил, изогексенил, изогептенил или изооктенил.
Алкинил как собственно группа и как структурный элемент других групп и соединений является в каждом случае (с учетом конкретного числа углеродных атомов в рассматриваемой группе или соединении и сопряженных или изолированных двойных связей) либо прямоцепочечным, например пропаргил, 2-бутинил, 3-пентинил, 1-гексинил, 1-гептинил, 3-гексен-1-инил или 1,5-гептадиен-3-инил, либо разветвленным, например 3-метилбут-1-инил, 4-этилпент-1-инил, 4-метилгекс-2-инил или 2-метилгепт-3-инил.
Алкоксигруппы в предпочтительном варианте обладают цепью длиной от 1 до 6 углеродных атомов. Алкокси представляет собой, например, метокси, этокси, пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси, а также изомеры пентилокси и гексилокси, предпочтительно метокси и этокси. Галоалкоксигруппы в предпочтительном варианте обладают цепью длиной от 1 до 6 углеродных атомов. Галоалкокси представляет собой, например, фторметокси, дифторметокси, трифторметокси, 2,2,2-трифторэтокси, 1,1,2,2-тетрафторэтокси, 2-фторэтокси, 2-хлорэтокси, 2,2-дифторэтокси и 2,2,2-трихлорэтокси.
Гало как собственно группа и как структурный компонент других групп и соединений представляет собой атом фтора, хлора, брома или иода, в частности фтора, хлора или брома, преимущественно фтора или хлора.
Галозамещенные углеродсодержащие группы и соединения могут быть частично галоидированными или пергалоидированными, причем в случае полигалоидирования галозаместители могут быть одинаковыми или разными. Примерами галоалкила как собственно группы и как структурного компонента других групп и соединений являются метил, замещенный до трех раз атомом фтора, хлора и/или брома, в частности CHF2 или CF3; этил, замещенный до пяти раз атомом фтора, хлора и/или брома, такой как СН2CF3, CF2CF3, СF2ССl3, CF2CHCl2, CF2CHF2, CF2CFCl2, СF2СНВR2, CF2CHClF, CF2СНВrF и CClFCHClF; пропил и изопропил, замещенный до семи раз атомом фтора, хлора и/или брома, такой как CH2CHBrCH2Br, CF2СНFCF3, СН2CF2CF3 и СН(СF3)2; бутил или один из его изомеров, замещенный до девяти раз атомом фтора, хлора и/или брома, такой как СF(СF3)СНFСF3 и СН2(СF2)2СF3; пентил или один из его изомеров, замещенный до одиннадцати раз атомом фтора, хлора и/или брома, такой как СF(СF3)(СНF)2СF3 и СН2(СF2)3СF3, и гексил или один из его изомеров, замещенный до тринадцати раз атомом фтора, хлора и/или брома, такой как (СН2)4СНВrСН2Вr, СF2(СНF)4СF3, СН2(СF2)4СF3 и С(СF3)2(СНF)2СF3.
Предпочтительные варианты в пределах объема изобретения включают:
(1) получение чистого энантиомера соединения формулы I, в которой R1 и R2 независимо друг от друга обозначают атом галогена, С1-С6галоалкил или CN,
в частности независимо друг от друга С1-С4 галоалкил или CN, более конкретно независимо друг от друга галометил или CN, наиболее конкретно независимо друг от друга трифторметил или CN;
(2) получение чистого энантиомера соединения формулы I, в которой R3 обозначает гало-С1-С6алкокси, гало-С1-С6алкилсульфонил, гало-С1-С6алкилсульфинил или гало-С1-С6алкилтио, в частности гало-С1-С2-алкокси, гало-С1-С2алкилсульфонил, гало-С1-С2-алкилсульфинил или гало-С1-С2-алкилтио, более конкретно галометокси, галометилсульфонил, галометилсульфинил или галометилтио, наиболее конкретно трифторметокси, трифторметилсульфонил, трифторметилсульфинил или трифторметилтио;
(3) получение чистого энантиомера соединения формулы I, в которой R1 и R2 независимо друг от друга обозначают атом галогена, С1-С6 галоалкил или CN, a
R3 обозначает гало-С1-С6алкокси, гало-С1-С6алкилсульфонил, гало-С1-С6алкилсульфинил или гало-С1-С6алкилтио;
(4) получение чистого энантиомера соединения формулы I, в которой R1 и R2 независимо друг от друга обозначают С1-С4галоалкил или CN, а R3 обозначает гало-С1-С2алкокси, гало-С1-С2алкилсульфонил, гало-С1-С2-алкилсульфинил или гало-С1-С2алкилтио;
(5) получение чистого энантиомера соединения формулы I, в которой R1 и R2 независимо друг от друга обозначают галометил или CN, а R3 обозначает галометокси, галометилсульфонил, галометилсульфинил или галометилтио;
(6) получение чистого энантиомера соединения формулы I, в которой R1 и R2 независимо друг от друга обозначают трифторметил или CN, а R3 обозначает трифторметокси, трифторметилсульфонил, трифторметилсульфинил или трифторметилтио.
Наиболее предпочтительным вариантом в объеме изобретения является получение чистого энантиомера N-(1-циано-2-(5-циано-2-трифторметилфенокси)-1-метилэтил)-4-трифторметилсульфанилбензамида.
Синтез рацематов амидоацетонитрильных соединений, аналогичных соединению формулы I, известен хорошо и описан в более ранних публикациях, например в ЕР 0953565 А2. Интересно, как было установлено, что после разделения рацематов на два чистых энантиомера по стандартным методам, например химическим разделением с использованием оптически активной кислоты или основания или хроматографией на хиральных адсорбентах, например жидкостной хроматографией под высоким давлением на ацетилцеллюлозе, один из них, как было установлено, оказывается биологически далеко менее активным (дистомер), тогда как другой энантиомер является биологически высокоактивным (эутомер).
Можно не говорить о том, что в крупномасштабном производстве паразитицидов во время синтеза соединения необходимо избегать образования какого-либо дистомера, поскольку такие дистомеры не только приводят к попаданию в отход из исходного материала, но также "разбавляют" биологическую активность эутомера, следствием чего является применение для достижения той же цели увеличенного количества паразитицидов, что иногда сопровождается даже нежелательными побочными эффектами, которые не возникали бы в случае чистого эутомера. Однако стереоселективные синтезы обычно очень дороги в осуществлении и, таким образом, неэкономичны. Следовательно, в качестве альтернативы эутомер обычно отделяют от дистомера и этот последний просто выбрасывают, избегая тем самым его разбавляющего и других побочных эффектов. Тем не менее очевидно, что эта альтернатива также оказывается неэкономичной. Следовательно, существует большая потребность в превращении дистомера в эутомер, предпочтительно с применением недорогого средства.
По настоящему изобретению предлагается путь удовлетворения этой потребности, заключающийся в том, что его целью является превращение дистомера в эутомер с помощью простых и недорогих средств и последующего выделения этого последнего.
Для достижения этой цели необходимо разорвать одну из четырех связей при хиральном углеродном центре и его преобразовать с противоположной стороны. Если хиральный углеродный атом граничит с гетероатомом, таким как атомы галогена, кислорода, азота и серы, то обычно разрывают и преобразуют именно углеродно-гетероатомную связь. Таким образом, специалист ожидает, по-видимому, что в данном случае разрывают и преобразуют связь между отмеченным звездочкой в формуле I хиральным центром и атомом азота. С целью упростить механизм разрыва этой углерод-азотной связи специалист добавил бы в качестве катализатора кислоту Бренстеда или Льюиса, которая известна как ослабляющая связь углерод-азот. Тем не менее можно было бы показать, что энантиомерные формы соединений формулы I оказываются совершенно инертными к кислотам в том, что касается превращения или рацемизации. В противоположность этому наблюдению было установлено, что превращение дистомера формулы I в рацемат двух энантиомерных форм осуществляют очень легко в присутствии основания и/или нагреванием в полярных растворителях. Это можно объяснить повышенной кислотностью водородного атома при атоме азота в амидной группе благодаря сильному мезомерному и индукционному эффекту присоединенной карбонильной функциональной группы и умеренному индукционному эффекту цианогруппы при присоединенном хиральном заместителе. Поэтому предполагают, что рацемизация протекает в соответствии со следующим механизмом:
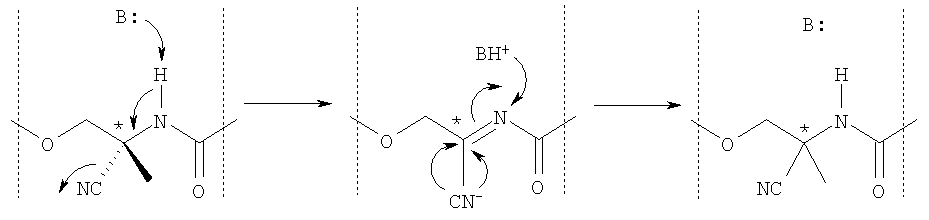
Следовательно, объектом настоящего изобретения является новый способ получения единственного энантиомера из рацемата соединений формулы I, характеризующийся тем, что
1) рацемат разделяют на два чистых энантиомера по стандартным методам и собирают эутомер,
2) дистомер повторно рацемизируют с использованием катализа основанием и/или нагреванием в полярном растворителе и
3) полученный рацемат вновь подвергают разделению стадии 1) в повторном цикле.
Следовательно, объектом изобретения является превращение дистомерной формы соединения формулы I в эутомер повторным циклом, повторная рацемизация/разделение.
В предпочтительном варианте разделение энантиомеров проводят в растворителе или разбавителе, или в их смеси. В качестве примеров таких растворителей или разбавителей можно упомянуть ароматические, алифатические и алициклические углеводороды и галоидированные углеводороды, такие как бензол, толуол, ксилол, мезитилен, тетралин, хлорбензол, дихлорбензол, бромбензол, петролейный эфир, гексан, циклогексан, дихлорметан, трихлорметан, тетрахлорметан, дихлорэтан, трихлорэтен и тетрахлорэтен; спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, изобутанол и трет-бутанол; простые эфиры, такие как диэтиловый эфир, дипропиловый эфир, диизопропиловый эфир, дибутиловый эфир, трет-бутилметиловый эфир, этиленгликольмонометиловый эфир, этиленгликольмоноэтиловый эфир, этиленгликольдиметиловый эфир, диметоксидиэтиловый эфир, тетрагидрофуран и диоксан; кетоны, такие как ацетон, метилэтилкетон и метилизобутилкетон; амиды, такие как N,N-диметилформамид, N,N-диэтилформамид, N,N-диметилацетамид, N-метилпирролидон и гексаметилфосфорамид; нитрилы, такие как ацетонитрил и пропионитрил, и сульфоксиды, такие как диметилсульфоксид. Предпочтительными растворителями являются спирты, в частности метанол, этанол и их смеси.
В целесообразном варианте разделение энантиомеров соединений формулы I проводят хроматографией на хиральных адсорбентах с использованием системы имитации подвижного слоя (ИПС). В методе ИПС подразумевается противоточный контакт между подвижной фазой, несущей энантиомеры, которые необходимо разделить, и хиральной стационарной фазой. Установка ИПС состоит из ряда хроматографических колонок в устройстве циркулирующего потока, разделенных каналами, где можно подавать или собирать входящие и выходящие потоки. Противоточное движение твердых веществ имитируют периодическим смещением в этой установке точек подачи и отвода в таком же направлении, как и у движущегося потока. Существуют четыре внешних потока:
а) рацемическая исходная смесь,
б) десорбент, т.е. элюент или смесь элюентов, составляющих подвижную фазу,
в) поток экстракта, обогащенного энантиомером А, и
г) рафинатный поток, обогащенный энантиомером Б.
Потоки разделяют установку с колонками на четыре секции:
1) секция 1 между впускным приспособлением для десорбента и каналом для экстракта,
2) секция 2 между каналом для экстракта и впускным приспособлением для исходного материала,
3) секция 3 между впускным приспособлением для исходного материала и выпускным приспособлением для рафината и
4) секция 4 между выпускным приспособлением для рафината и впускным приспособлением для десорбента.
Каждая из этих секций играет в процессе особую роль. Разделение проводят в секциях 2 и 3, где менее удерживаемый энантиомер Б должен быть десорбирован и перенесен подвижной фазой к выпускному приспособлению для рафината, тогда как энантиомер А удерживается стационарной фазой и переносится посредством симулируемого движения твердых веществ в направлении канала для экстракта. В секции 1 стационарную фазу регенерируют подачей свежего десорбента, переносящего энантиомер А к каналу для экстракта. Наконец, в секции 4 подвижную фазу регенерируют адсорбцией энантиомера Б, не собираемого в выпускном приспособлении для рафината. Таким образом в секциях соответственно 4 и 1 могут быть возвращены как стационарная, так и подвижная фазы.
При выполнении настоящего изобретения стационарная фаза состоит из полисахарида, а подвижная фаза представляет собой спирт, предпочтительно метанол или этанол, более предпочтительно смесь метанола и этанола, в частности смесь метанола и этанола в соотношении 1:1.
Изобретение преимущественно относится к циклу разделения/повторной рацемизации, описанному в примере.
В предпочтительном варианте повторную рацемизацию дистомера проводят в растворителе или разбавителе, или в их смеси. В качестве примеров таких растворителей или разбавителей могут быть упомянуты ароматические, гетероароматические, алифатические и алициклические углеводороды и галоидированные углеводороды, такие как бензол, толуол, ксилол, мезитилен, тетралин, хлорбензол, дихлорбензол, бромбензол, пиридин, петролейный эфир, гексан, циклогексан, дихлорметан, трихлорметан, тетрахлорметан, дихлорэтан, трихлорэтен и тетрахлорэтен; спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, изобутанол и трет-бутанол; простые эфиры, такие как диэтиловый эфир, дипропиловый эфир, диизопропиловый эфир, дибутиловый эфир, трет-бутилметиловый эфир, этиленгликольмонометиловый эфир, этиленгликольмоноэтиловый эфир, этиленгликольдиметиловый эфир, диметоксидиэтиловый эфир, тетрагидрофуран и диоксан; сложные эфиры, такие как метилацетат, этилацетат и трет-бутилацетат; кетоны, такие как ацетон, метилэтилкетон и метилизобутилкетон; амиды, такие как N,N-диметилформамид, N,N-диэтилформамид, N,N-диметилацетамид, N-метилпирролидон и гексаметилфосфорамид; нитрилы, такие как ацетонитрил и пропионитрил, и сульфоксиды, такие как диметилсульфоксид. Предпочтительными растворителями являются простые эфиры, в частности тетрагидрофуран и диоксан, наиболее предпочтителен диоксан.
Приемлемые для упрощения реакции повторной рацемизации основания представляют собой, например, гидроксиды, гидриды, амиды, алканоляты, ацетаты, карбонаты, цианиды, диалкиламиды и алкилсилиламиды щелочных металлов и щелочно-земельных металлов; алкиламины, алкилендиамины, необязательно N-алкилированные, необязательно ненасыщенные циклоалкиламины, основные гетероциклы, гидроксиды аммония, а также карбоциклические амины. Те, которые могут быть упомянуты в качестве примера, представляют собой гидроксид, гидрид, амид, метанолят, ацетат, карбонат, цианид натрия, трет-бутанолят, гидроксид, карбонат, гидрид калия, диизопропиламид лития, бис-(триметилсилил)амид калия, гидрид кальция, триэтиламин, диизопропилэтиламин, триэтилендиамин, циклогексиламин, N-циклогексил-N,N-диметиламин, N,N-диэтиланилин, пиридин, 4-(N,N-диметиламино)пиридин, хинуклидин, N-метилморфолин, бензилтриметиламмонийгидроксид, а также 1,5-диазабицикло[5.4.0]ундец-5-ен (ДБУ). Особенно предпочтительными основаниями являются цианид натрия, бикарбонат натрия, карбонат натрия, гидрид натрия, карбонат калия и трет-бутанолят калия. Наиболее предпочтителен цианид натрия.
В целесообразном варианте эту реакцию проводят в температурном диапазоне от примерно 20 до примерно 150°С, предпочтительно от примерно 80 до примерно 120°С.
В предпочтительном варианте энантиомер формулы I повторно рацемизируют в температурном диапазоне от примерно 80 до примерно 120°С, предпочтительно при примерно 101°С, в простом эфире, предпочтительно в 1,4-диоксане, предпочтительнее в присутствии цианида натрия.
Примеры получения
а) Разделение энантиомеров N-(1-циано-2-(5-циано-2-трифторметилфенокси)-1-метилэтил)-4-трифторметилсульфанилбензамида
Готовят исходный раствор 4,146 кг указанного в заглавии соединения в 62,22 л смеси этанола/метанола 1:1 и перемешивают в азотной атмосфере до тех пор, пока не добиваются полного растворения. Далее этот раствор фильтруют через смонтированный на линии фильтр в стеклянный сосуд, который соединяют с системой имитации подвижного слоя (ИПС) (установка фирмы Novasep Licosep Lab) и наполняют смесью этанола/метанола 1:1 до общего объема 120 л. Затем исходный раствор непрерывно инжектируют в систему ИПС, которая оборудована восемью одинаковыми колонками длиной 10,0 см и внутреннего диаметра 4,8 см, содержащими 110 г полисахарида Chiralpak в качестве стационарной фазы и с конфигурацией каждой из которых 2-2-2-2, а энантиомеры разделяют с использованием в качестве подвижной фазы смеси этанола/метанола 1:1. Из потока экстрагируют целевой эутомер. Хиральная чистота эутомера ((-)-(S)-N-(1 -циано-2-(5-циано-2-трифторметилфенокси)-1-метилэтил)-4-трифторметилсульфанилбензамида составляет 99,65%, температура плавления равна 126-127°С, а угол вращения плоскости поляризации света равен -37,8° при концентрации в метиленхлориде 20,9 ммоль/л.
Дистомерную форму повторно рацемизируют в соответствии со способом, описанным ниже.
б) Рацемизация (+)-(R)-N-(1-циано-2-(5-циано-2-трифторметилфенокси)-1 -метилэтил)-4-трифторметилсульфанилбензамида
В 3,4 л 1,4-диоксана в течение от 7 до 9 ч перемешивают смесь 500 г (+)-(R)-N-(1-циано-2-(5-циано-2-трифторметилфенокси)-1-метилэтил)-4-трифторметилсульфанилбензамида и 43,48 г цианида натрия при внутренней температуре 101°С. После этого при 45°С и под давлением 140 мбар отгоняют примерно 60-70% растворителя и маслянистый остаток разбавляют 3 л изопропилацетата, а затем полунасыщенным водным раствором хлорида натрия. После перемешивания полученной эмульсии при 40°С в течение 15 мин органический слой отделяют, промывают полунасыщенным водным раствором хлорида натрия и концентрируют отгонкой примерно 15% его объема. После добавления 3 л метилциклогексана гомогенную смесь оставляют остывать в течение от 4 до 5 ч до 20°С и затем в течение 2 ч охлаждают до 0°С. Далее образующую осадок суспензию фильтруют, остаток фильтрования промывают метилциклогексаном и, наконец, сушат с получением указанного в заглавии соединения в рацемической форме.
Затем полученный таким образом рацемат вновь подвергают вышеописанному процессу разделения.
Этот цикл разделения/повторной рацемизации в общем применим ко всем соединениям формулы I.
Реферат
Изобретение относится к способу получения единственного энантиомера из рацемата амидоацетонитрильного соединения формулы ! ! в которой R1, R2 и R3 независимо друг от друга обозначают циано, гало-С1-С6алкил или гало-С1-С6алкилтио. Способ заключается в том, что 1) рацемат разделяют на два чистых энантиомера путем хроматографического разделения на хиральном полисахариде в качестве стационарной фазы спиртом в качестве подвижной фазы и собирают эутомер, 2) дистомер повторно рацемизируют с использованием катализа основанием в растворителе, выбранном из простого эфира, или смеси растворителей, включающей простой эфир, при температуре от 80 до 120°С и 3) полученный рацемат вновь подвергают разделению стадии 1) в повторном цикле. Изобретение относится также к применению чистой S-энантиомерной формы соединения формулы I, в частности (-)-(S)-N-(1-циано-2-(5-циано-2-трифторметилфенокси)-1-метилэтил)-4-трифторметилсульфанилбензамида, для борьбы с эндопаразитами теплокровных животных, такими как гельминты. 5 н. и 10 з.п. ф-лы.
Формула
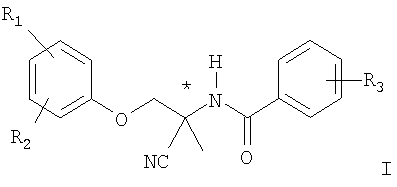
в которой R1, R2 и R3 независимо друг от друга обозначают циано, гало-С1-С6алкил или гало-C1-С6алкилтио,
отличающийся тем, что
1) рацемат разделяют на два чистых энантиомера путем хроматографического разделения на хиральном полисахариде в качестве стационарной фазы спиртом в качестве подвижной фазы и собирают эутомер,
2) дистомер повторно рацемизируют с использованием катализа основанием в растворителе, выбранном из простого эфира, или смеси растворителей, включающей простой эфир, при температуре от 80 до 120°С и
3) полученный рацемат вновь подвергают разделению стадии 1) в повторном цикле.
Документы, цитированные в отчёте о поиске
Способ выделения энантиомеров из рацемической смеси

Комментарии