Кристаллический диацилгидразин и его применение - RU2629113C2
Код документа: RU2629113C2
Чертежи








Описание
УРОВЕНЬ ТЕХНИКИ
[0001] N-(1-трет-бутилбутил)-N'-(2-этил-3-метоксибензоил)-гидразид (R)-3,5-диметилбензойной кислоты (обозначенный в настоящем документе «Соединение 1») представляет собой диацилгидразиновый лиганд, применяемый в системах экспрессии индуцибельных генов на основе рецепторов экдизона для регуляции экспрессии генов in vitro и in vivo и лечения заболеваний, таких как рак.
[0002] В US 2009/0163592 A1 предложены Соединение 1, способы получения Соединения 1, композиции, содержащие Соединение 1, и способы применения Соединения 1 для модулирования экспрессии терапевтических генов in vitro или in vivo в клетке-хозяине. Например, экспрессию интерлейкина-12 (ИЛ-12) мыши, находящуюся под контролем технологии RheoSwitch Therapeutic System® (RTS®), индуцируют путем введения мыши Соединения 1. В US 2009/0163592 A1 также предложен N-(1-трет-бутилбутил)-R'-(2-этил-3-метоксибензоил)-гидразид (S)-3,5-диметилбензойной кислоты (обозначенный в настоящем документе «Соединение 2»).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0003] Существует потребность в стабильных кристаллических полиморфных формах Соединения 1 или Соединения 2, а также способах их воспроизводимого получения, для применения для регуляции экспрессии генов в системах экспрессии индуцибельных генов на основе рецепторов экдизона. В настоящем изобретении предложены кристаллические полиморфные формы Соединения 1 или Соединения 2, включая безводные, гидратированные и сольватированные формы. В настоящем изобретении также предложены аморфные формы Соединения 1 или Соединения 2.
[0004] Согласно другому аспекту, в настоящем изобретении предложены способы получения кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2.
[0005] Согласно другому аспекту, в настоящем изобретении предложены композиции, содержащие одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 и одно или более вспомогательных веществ.
[0006] Согласно другому аспекту, в настоящем изобретении предложены способы получения композиции, содержащие одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 и одно или более вспомогательных веществ.
[0007] Согласно другому аспекту, в настоящем изобретении предложены способы регулирования экспрессии генов в клетке-хозяине in vitro, включающие приведение указанной клетки в контакт с одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или композицией, содержащей одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 и одно или более вспомогательных веществ.
[0008] Согласно другому аспекту, в настоящем изобретении предложены способы регулирования экспрессии генов у субъекта in vivo для лечения заболевания, включающие введение указанному субъекту одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или фармацевтически приемлемой композиции, содержащей одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 и один или более фармацевтически приемлемых носителей.
[0009] Согласно другому аспекту, в настоящем изобретении предложены способы контролирования насекомых, включающие приведение насекомых или их среды обитания в контакт с одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащей их композицией.
[0010] Согласно другому аспекту, в настоящем изобретении предложены наборы, содержащие одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
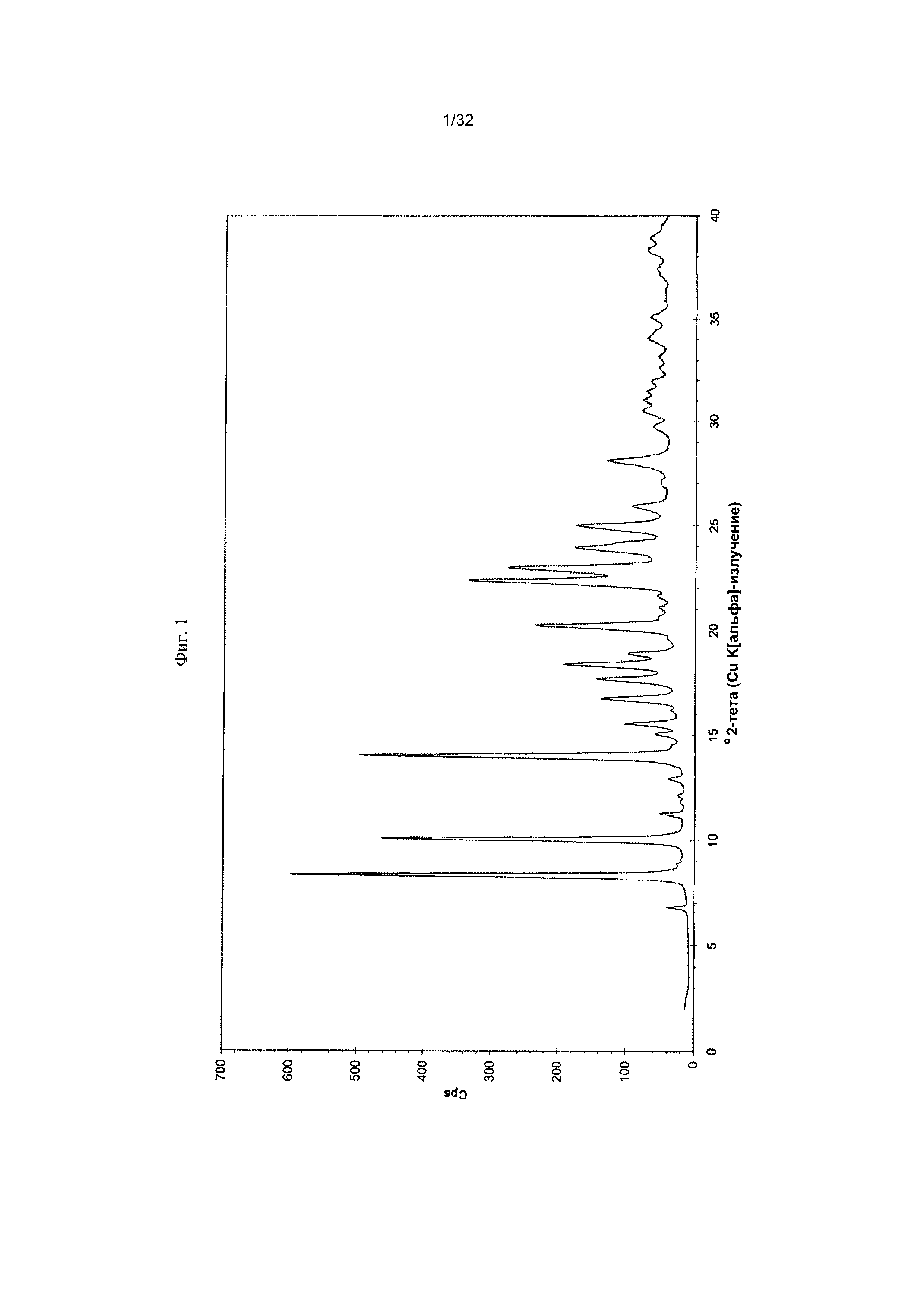
[0011] Фиг. 1 представляет собой дифрактограмму рентгеновской порошковой дифрактометрии (PXRD-дифрактограмму) Формы I-A Соединения 1.
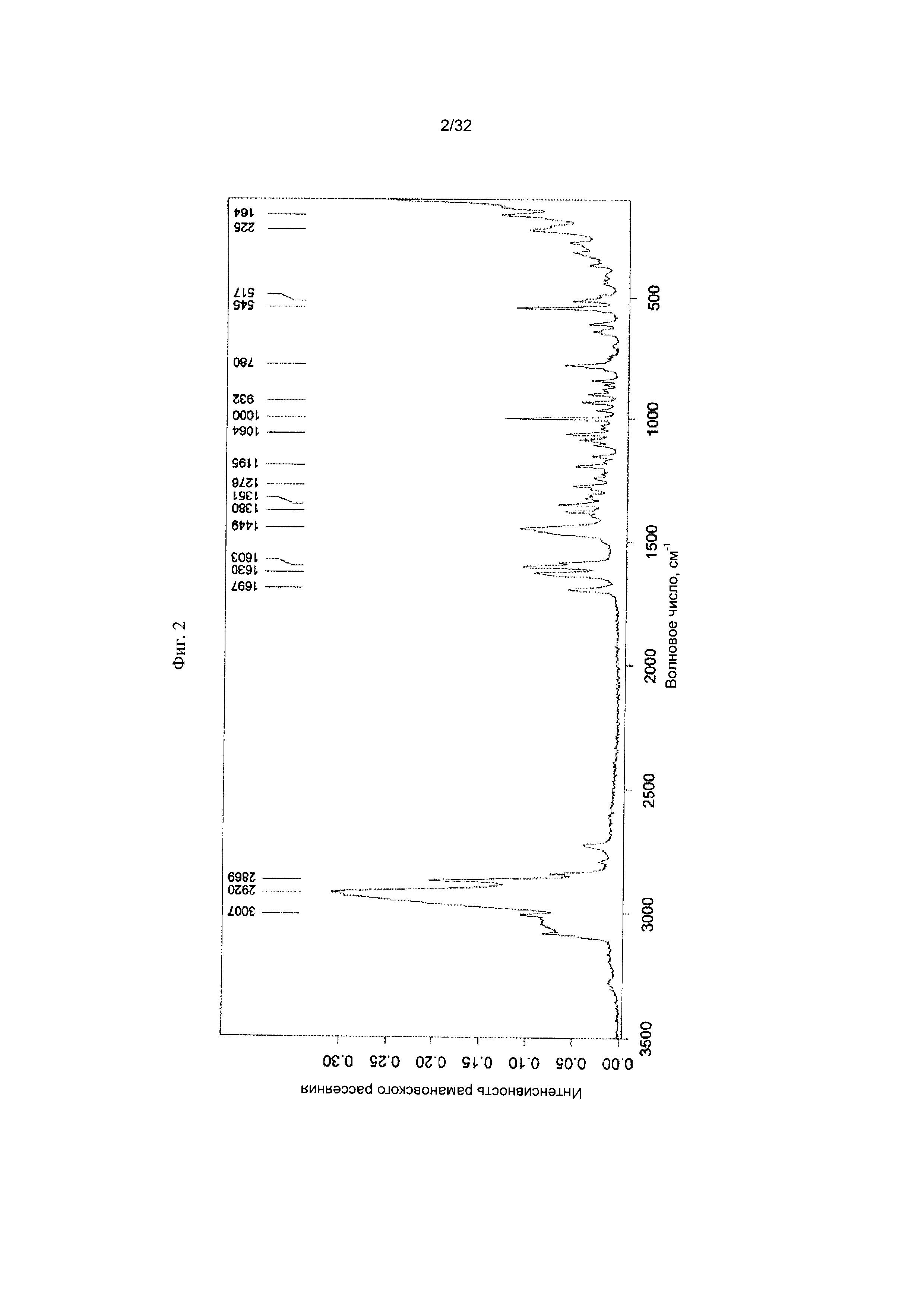
[0012] Фиг. 2 представляет собой Фурье-спектр комбинационного рассеяния Формы I-А Соединения 1.
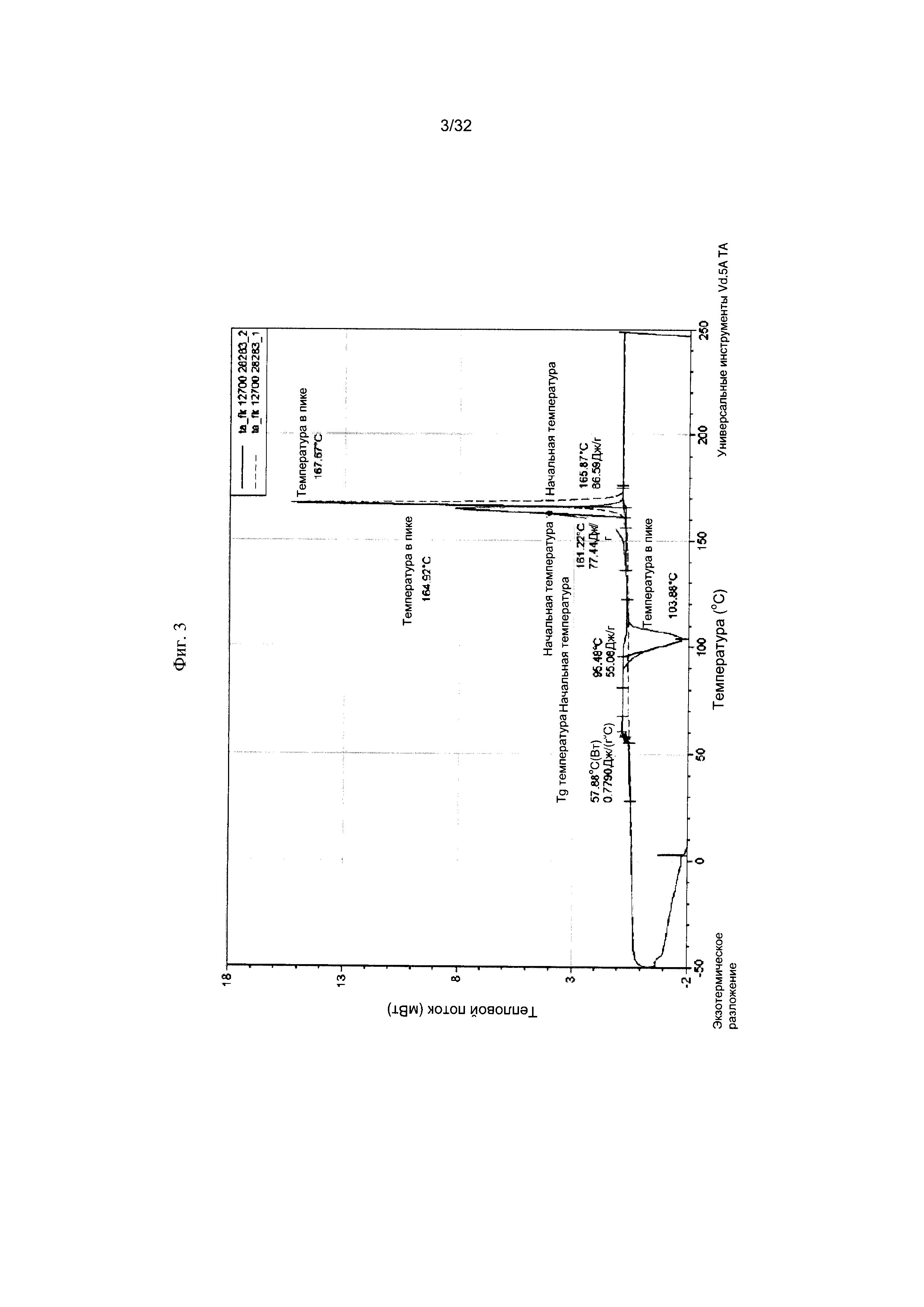
[0013] Фиг. 3 представляет собой термограмму дифференциальной сканирующей калориметрии (ДСК-термограмму) Формы I-A Соединения 1.
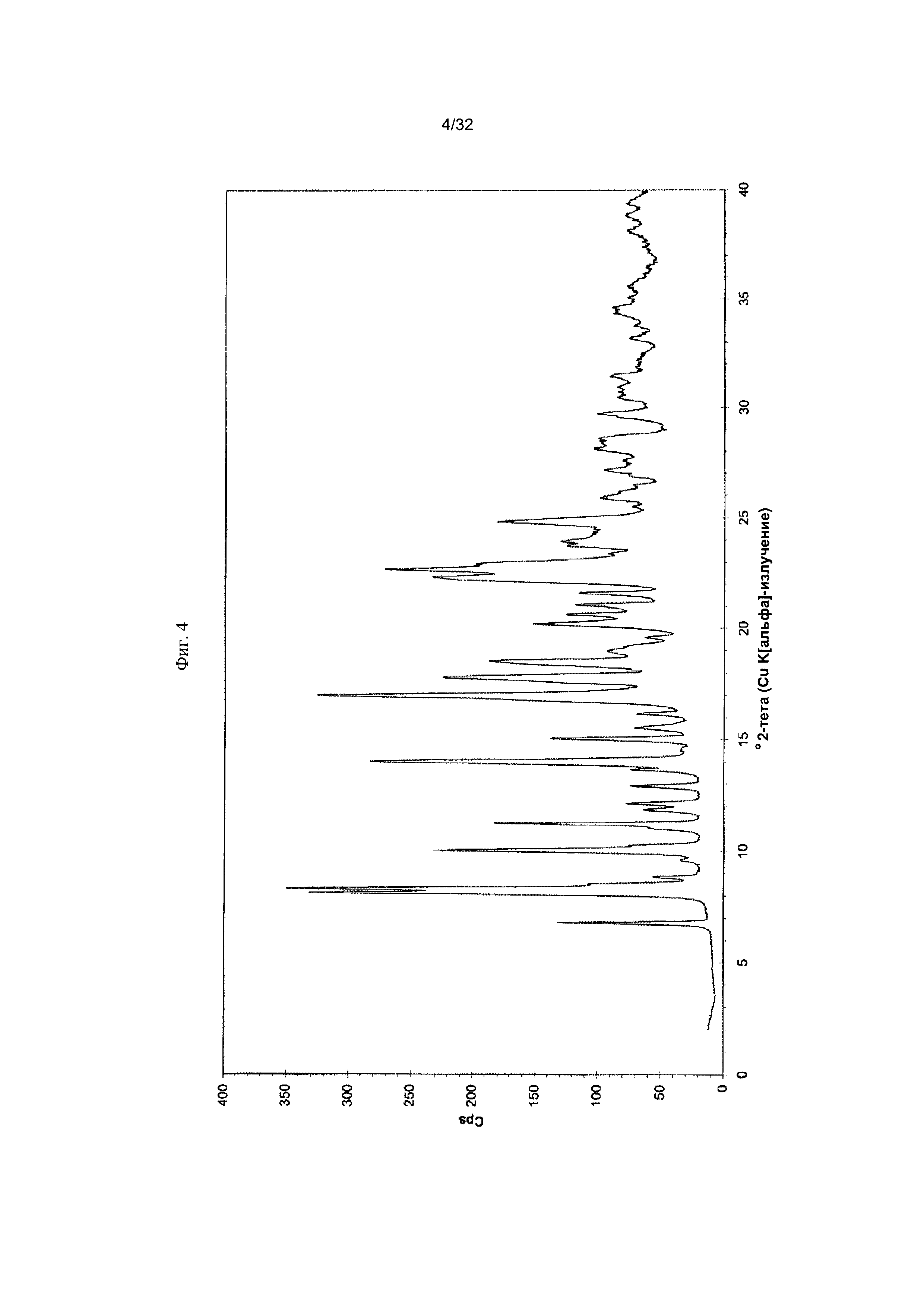
[0014] Фиг. 4 представляет собой PXRD-дифрактограмму Формы I-B Соединения 1.
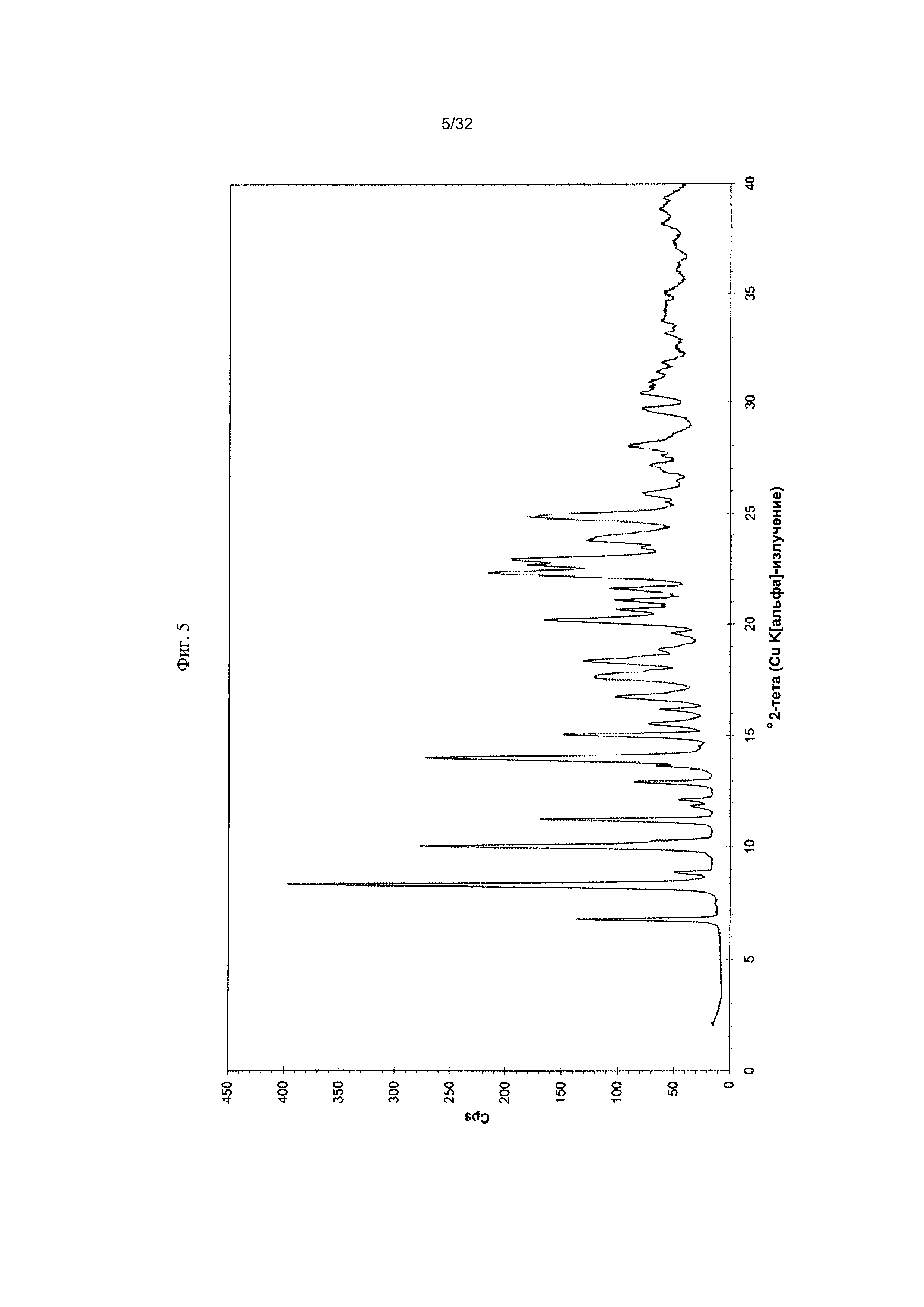
[0015] Фиг. 5 представляет собой PXRD-дифрактограмму Формы I-C Соединения 1.
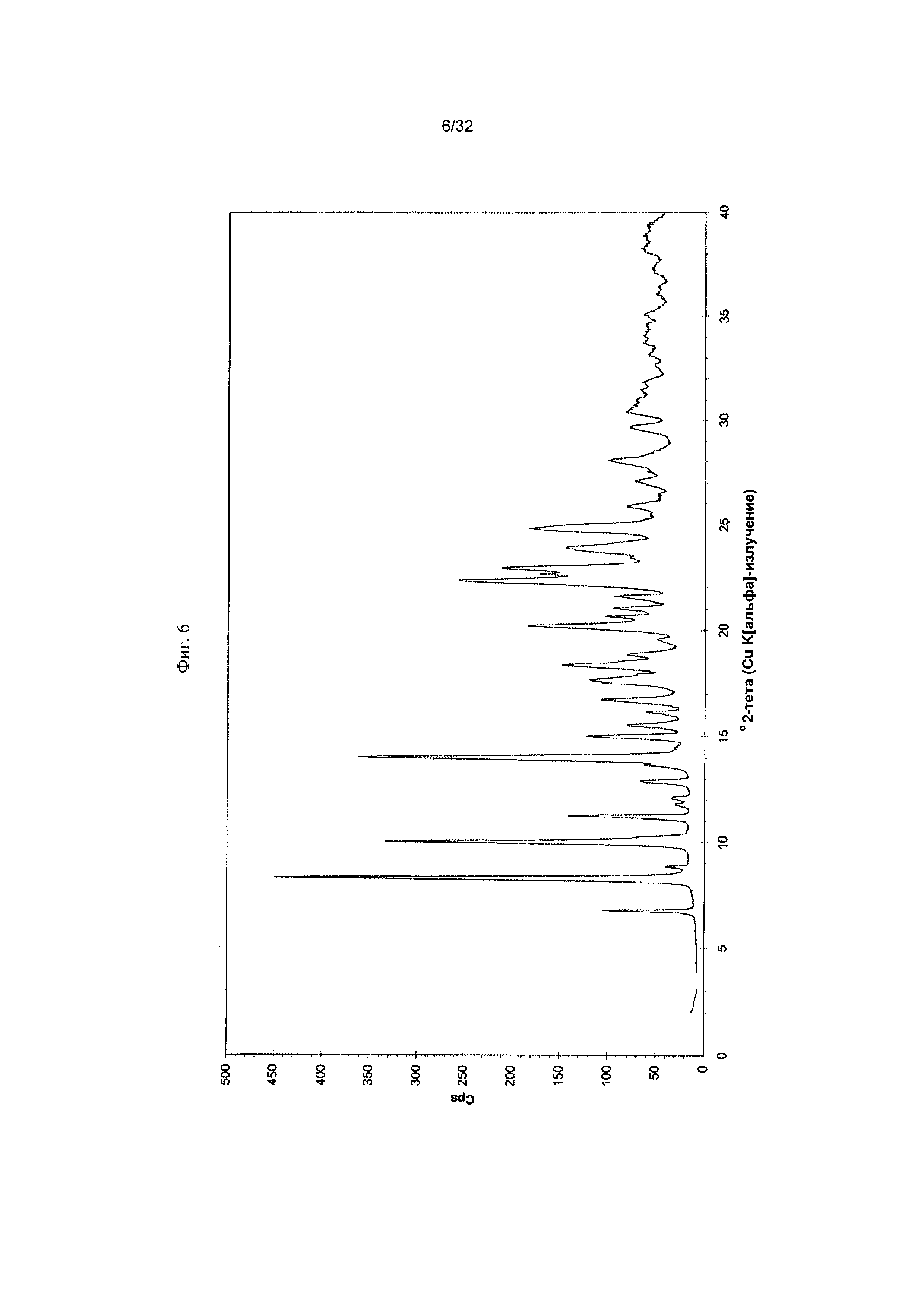
[0016] Фиг. 6 представляет собой PXRD-дифрактограмму Формы I-D Соединения 1.
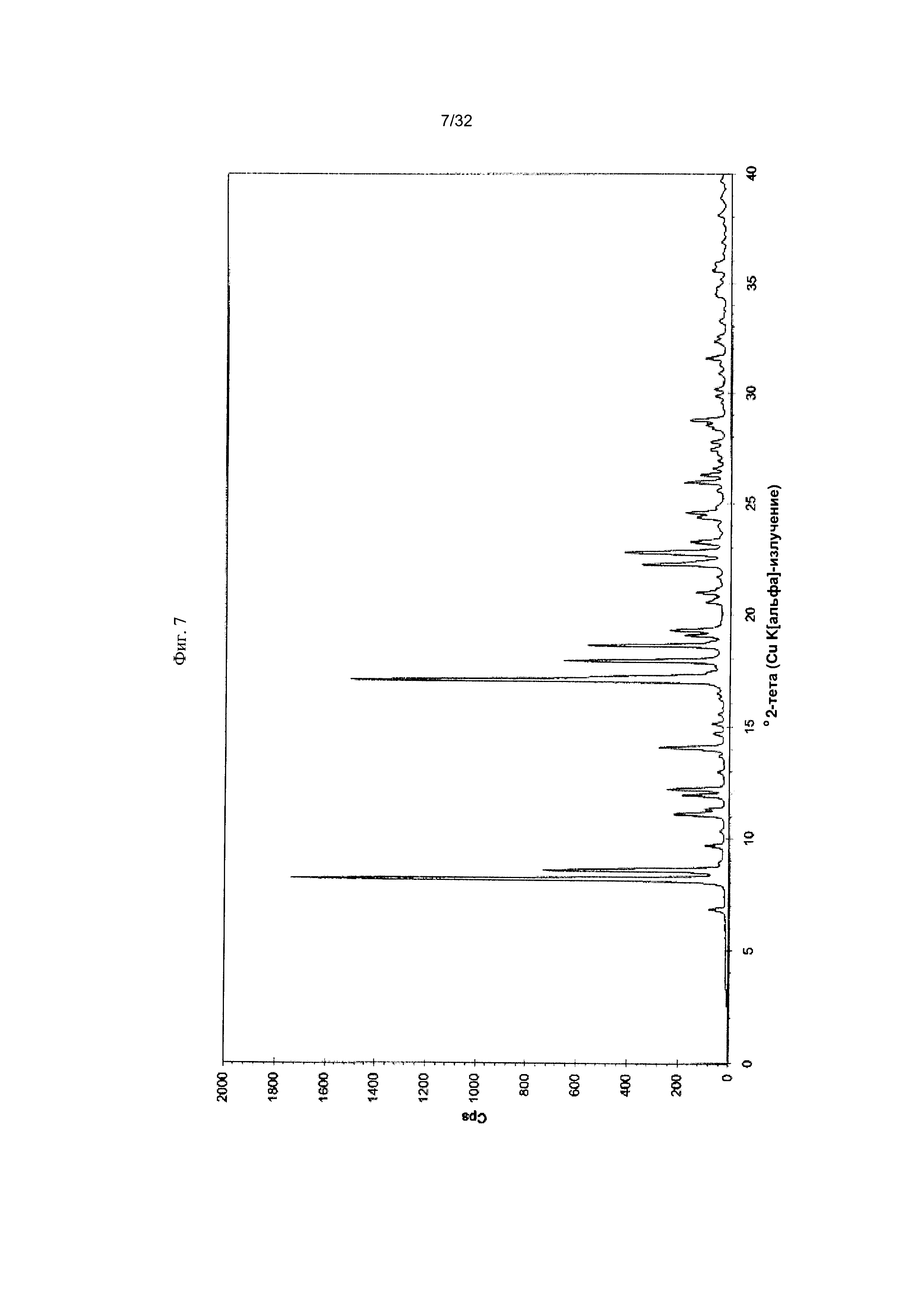
[0017] Фиг. 7 представляет собой PXRD-дифрактограмму Формы 1-Е Соединения 1.
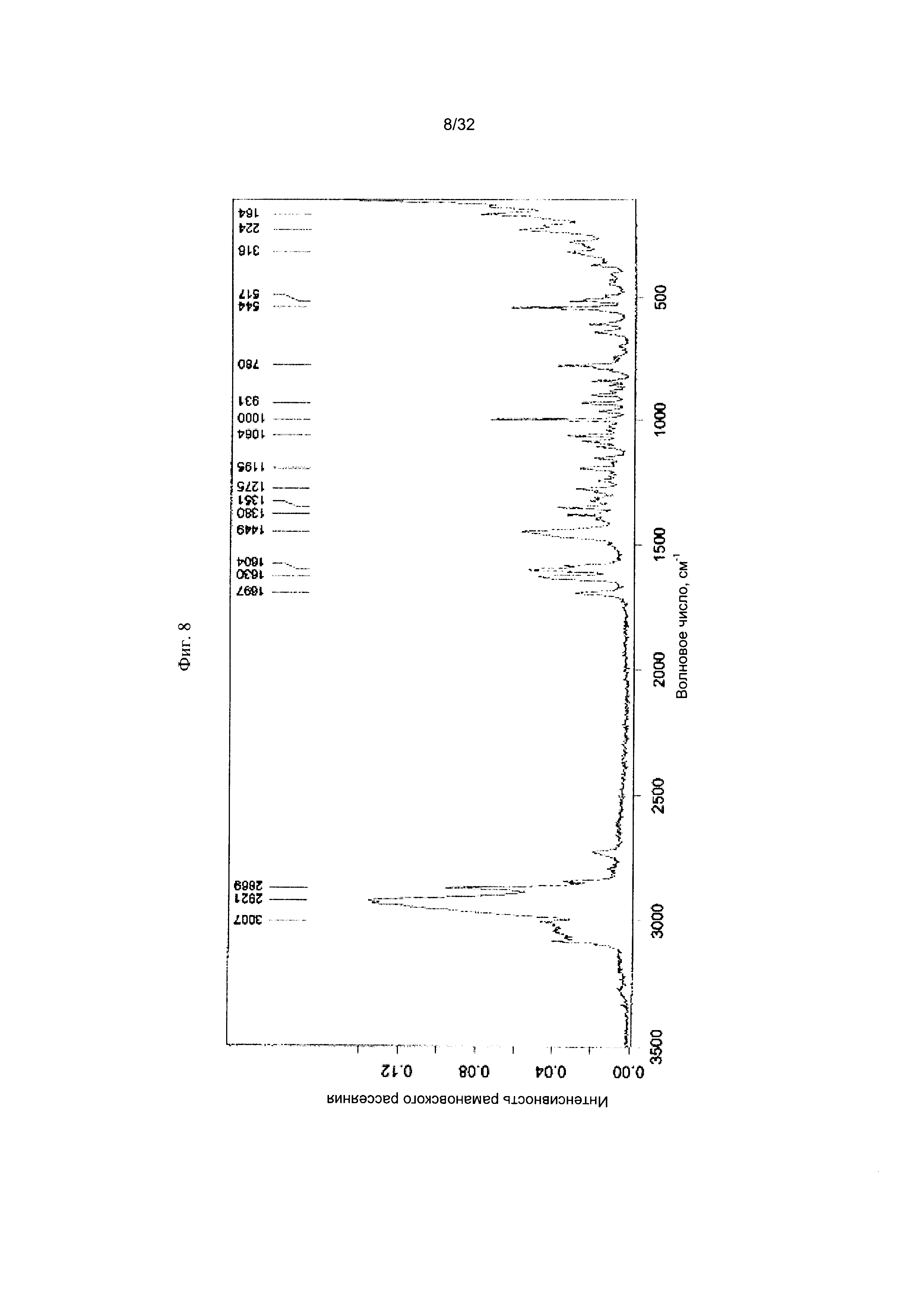
[0018] Фиг. 8 представляет собой Фурье-спектр комбинационного рассеяния Формы I-F Соединения 1.
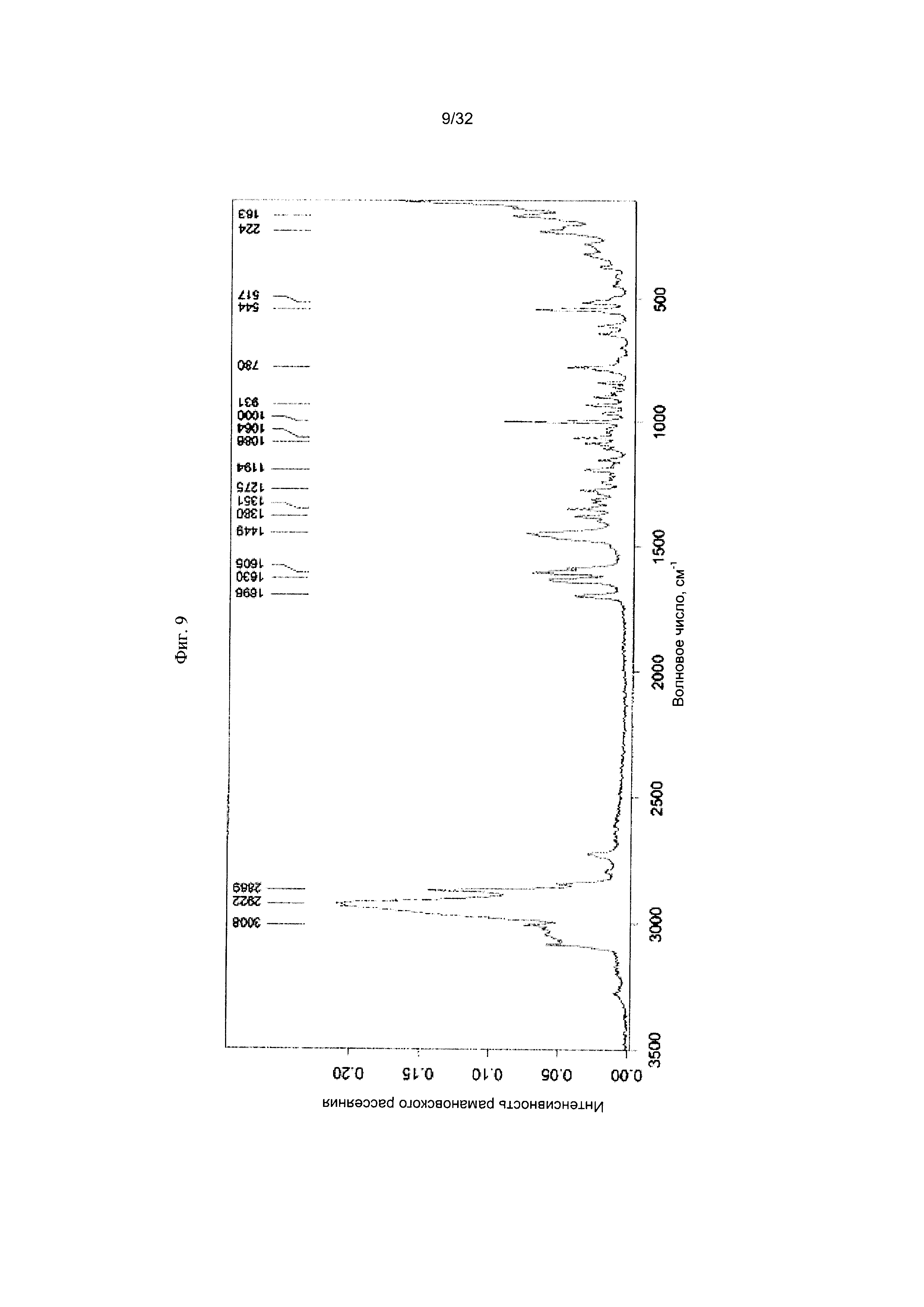
[0019] Фиг. 9 представляет собой Фурье-спектр комбинационного рассеяния Формы I-G Соединения 1.
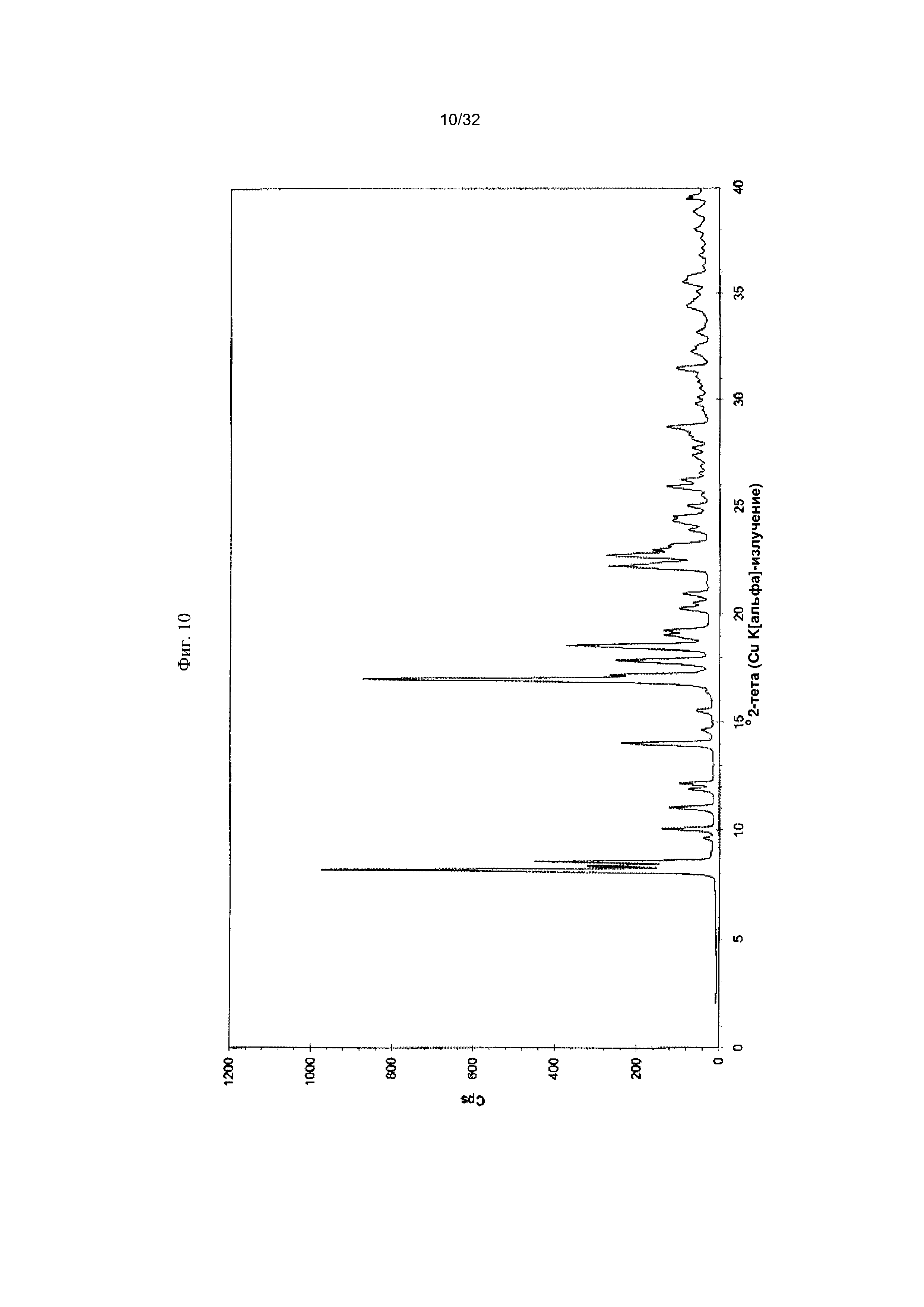
[0020] Фиг. 10 представляет собой PXRD-дифрактограмму Формы I-Η Соединения 1.
[0021] Фиг. 11 представляет собой PXRD-дифрактограмму чистой Формы II Соединения 1.
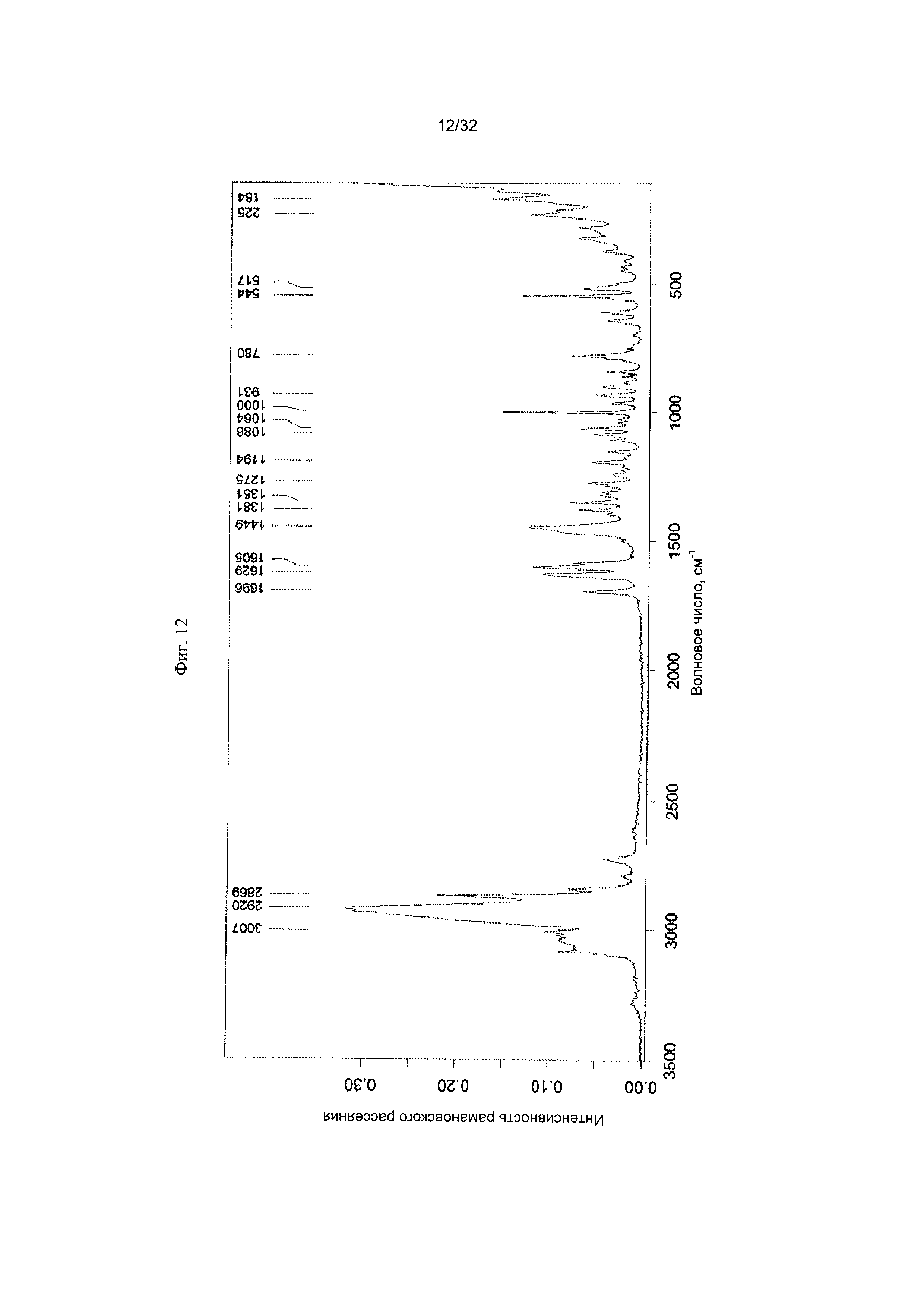
[0022] Фиг. 12 представляет собой Фурье-спектр комбинационного рассеяния чистой Формы II Соединения 1.
[0023] Фиг. 13 представляет собой ДСК-термограмму чистой Формы II Соединения 1.
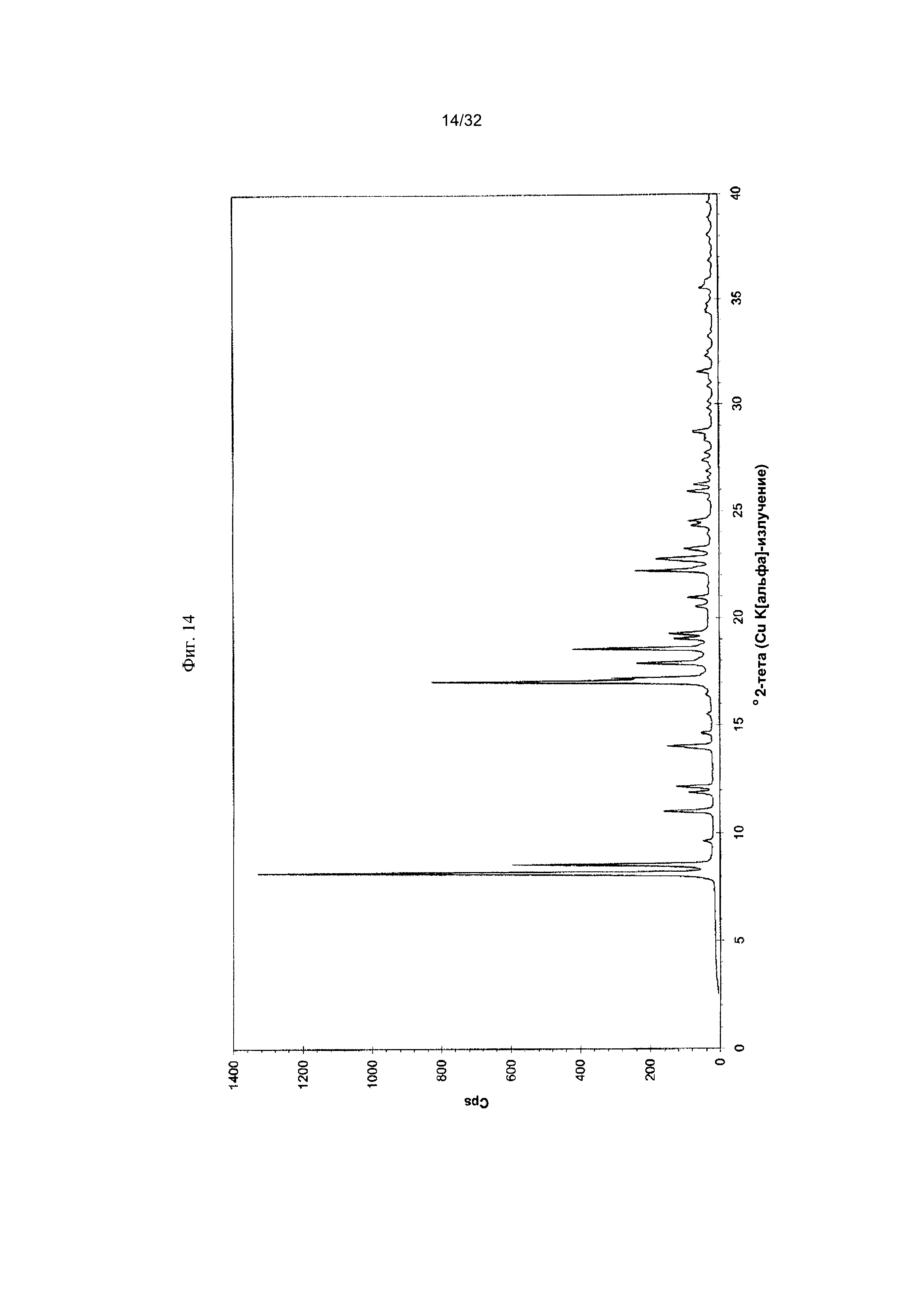
[0024] Фиг. 14 представляет собой PXRD-дифрактограмму чистой Формы III Соединения 1.
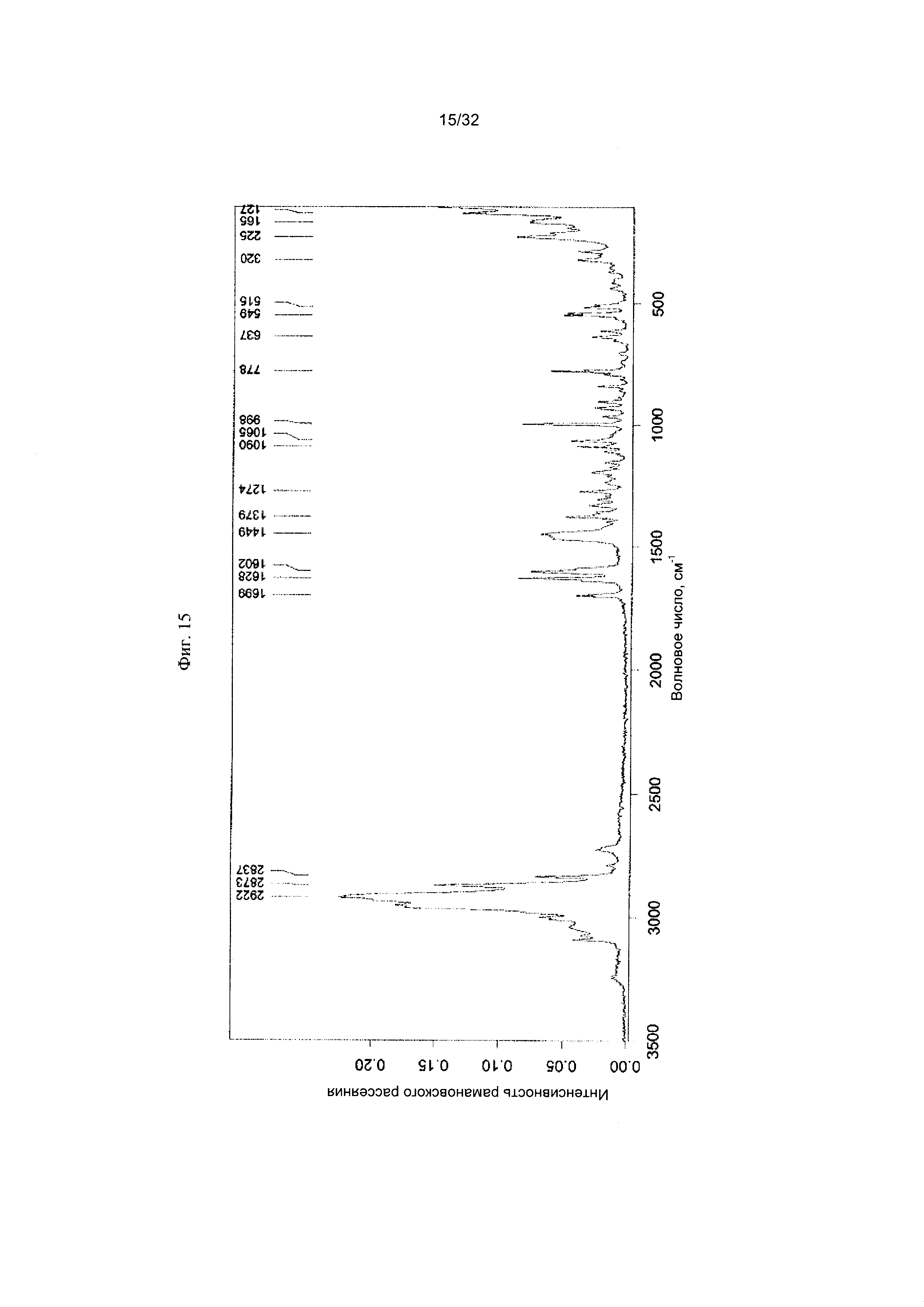
[0025] Фиг. 15 представляет собой Фурье-спектр комбинационного рассеяния чистой Формы III Соединения 1.
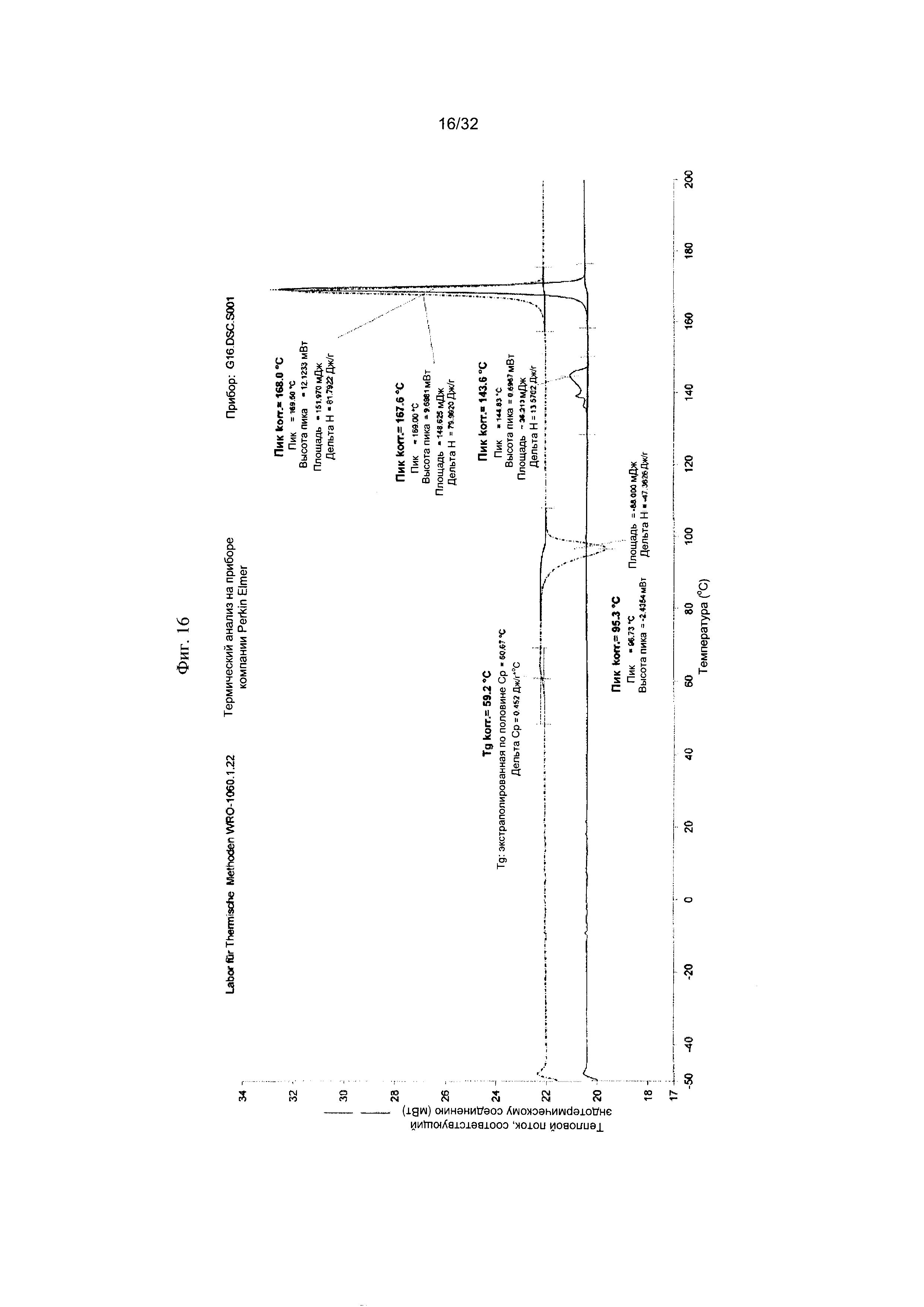
[0026] Фиг. 16 представляет собой термограмму дифференциальной сканирующей калориметрии (DCS) чистой Формы III Соединения 1.
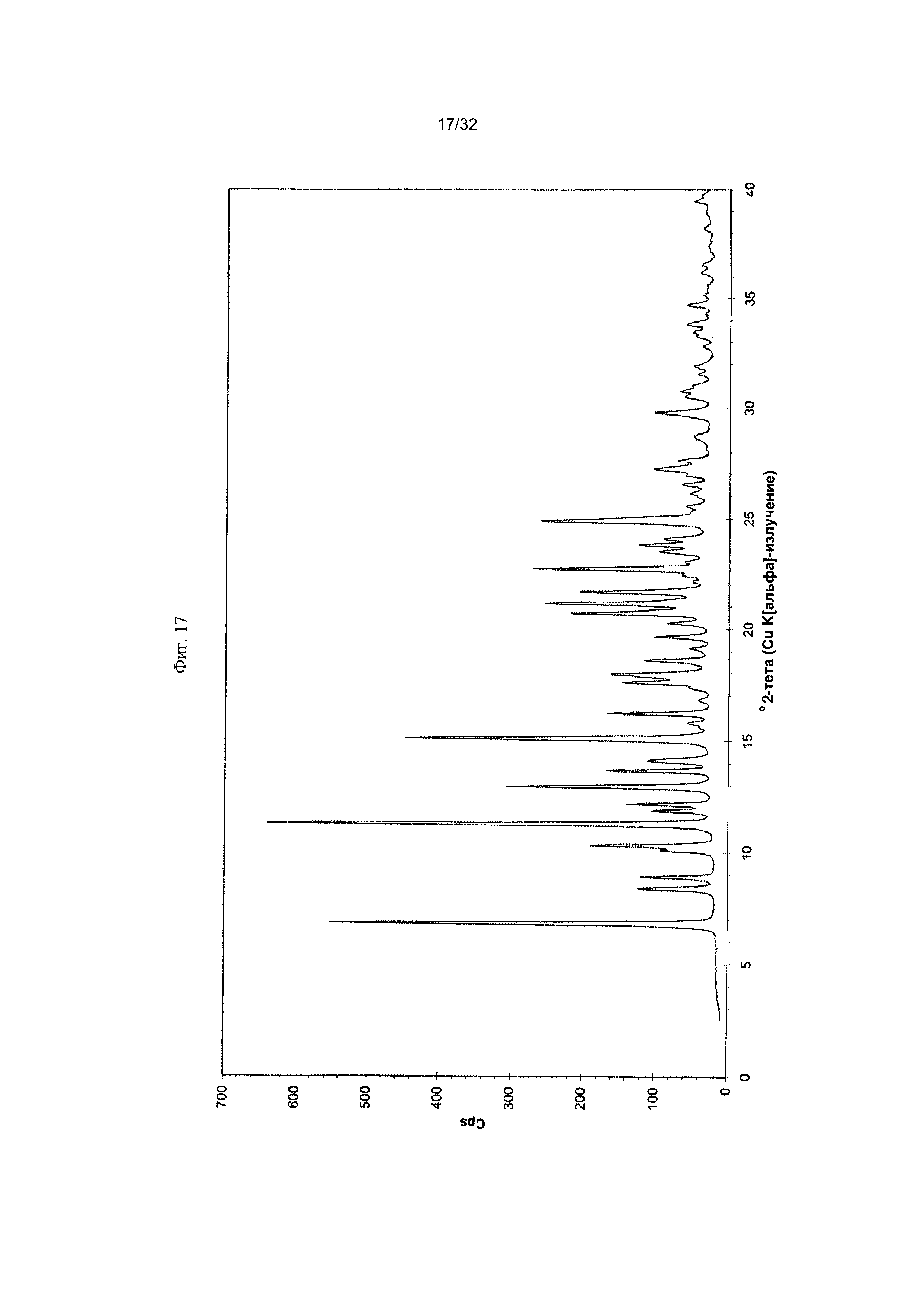
[0027] Фиг. 17 представляет собой PXRD-дифрактограмму чистой Формы IV Соединения 1.
[0028] Фиг. 18 представляет собой Фурье-спектр комбинационного рассеяния чистой Формы IV Соединения 1.
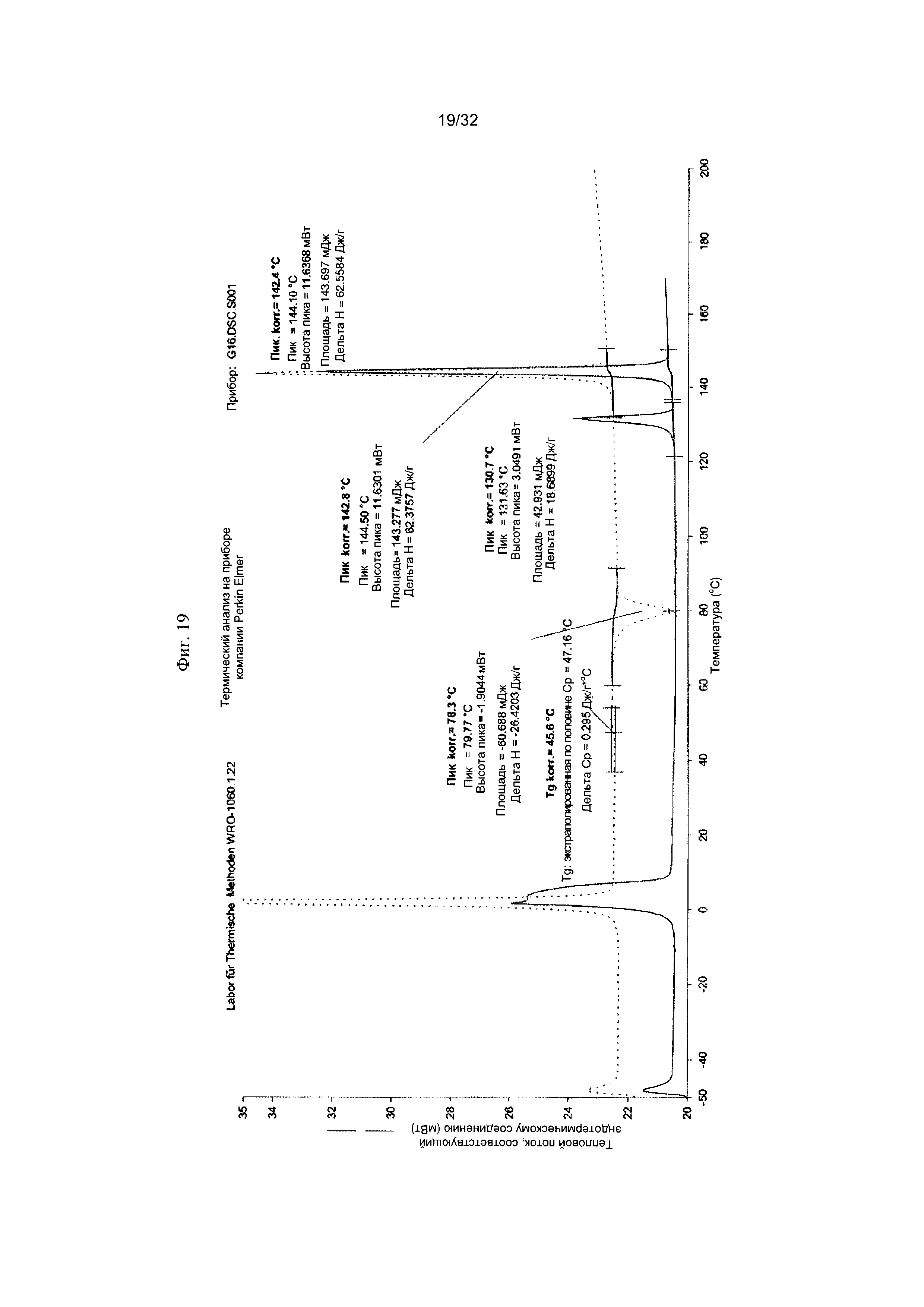
[0029] Фиг. 19 представляет собой ДСК-термограмму чистой Формы IV Соединения 1.
[0030] Фиг. 20 представляет собой ДСК-термограмму чистой Формы IV (высушенной) Соединения 1.
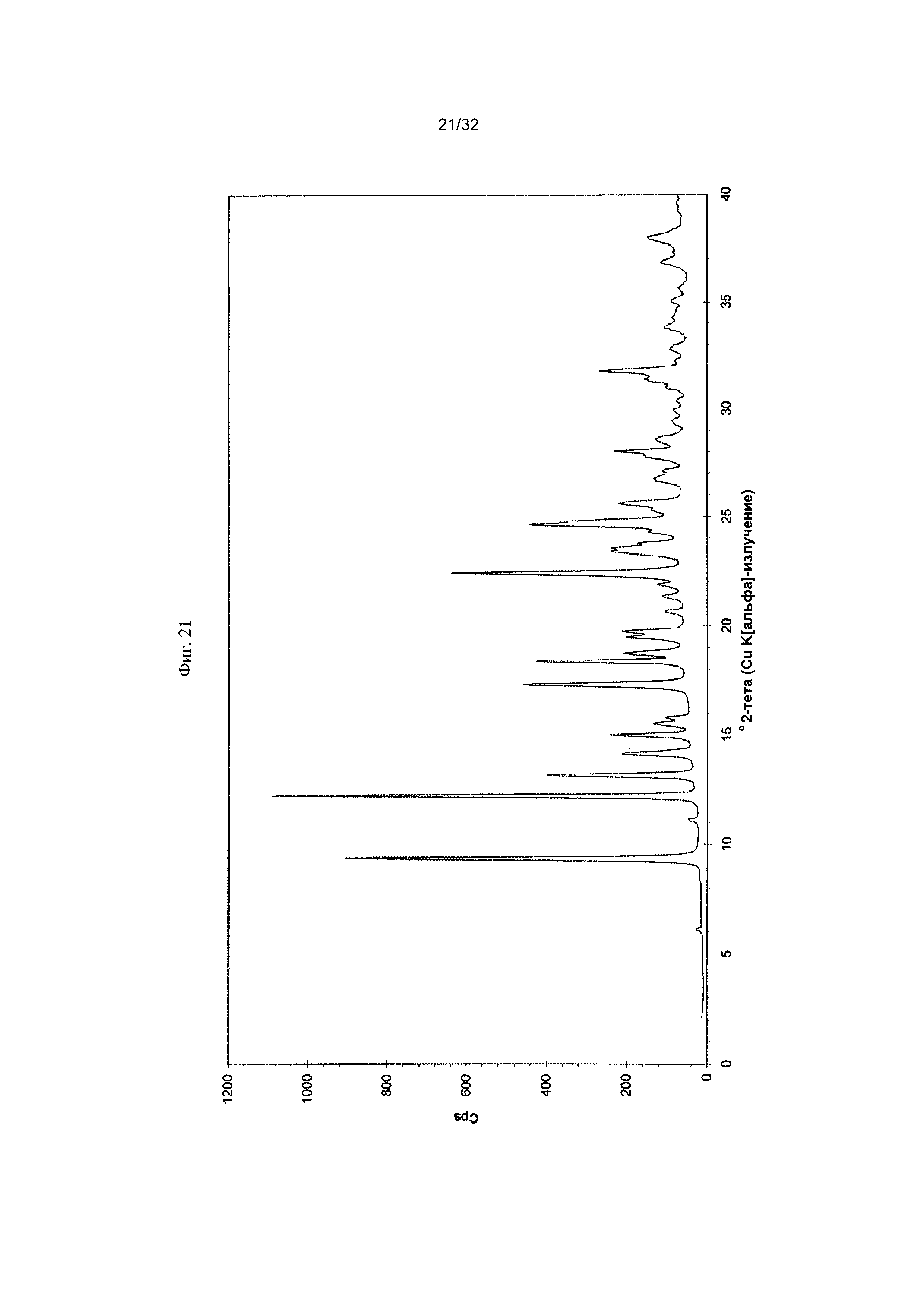
[0031] Фиг. 21 представляет собой PXRD-дифрактограмму чистой Формы V Соединения 1.
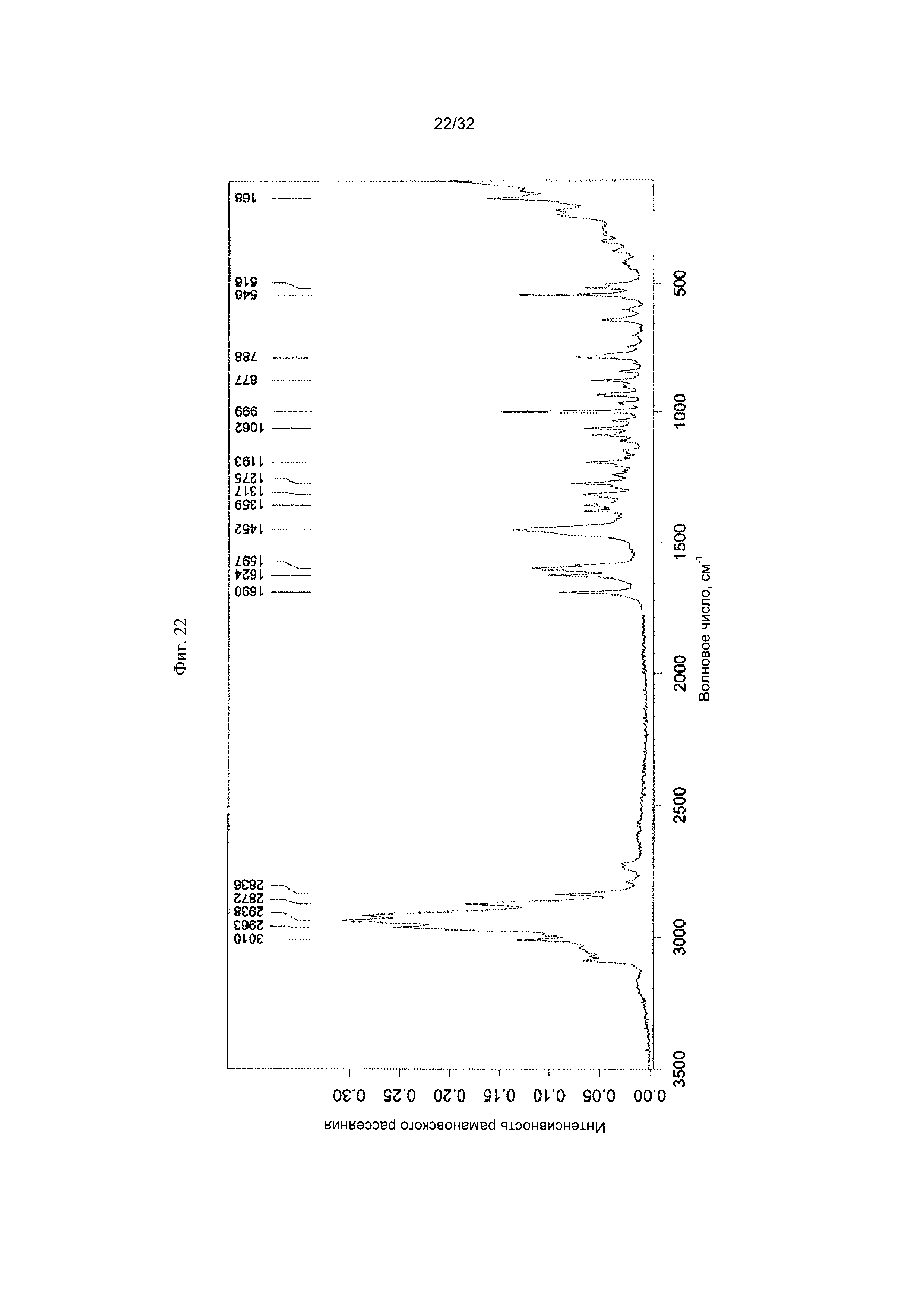
[0032] Фиг. 22 представляет собой Фурье-спектр комбинационного рассеяния чистой Формы V Соединения 1.
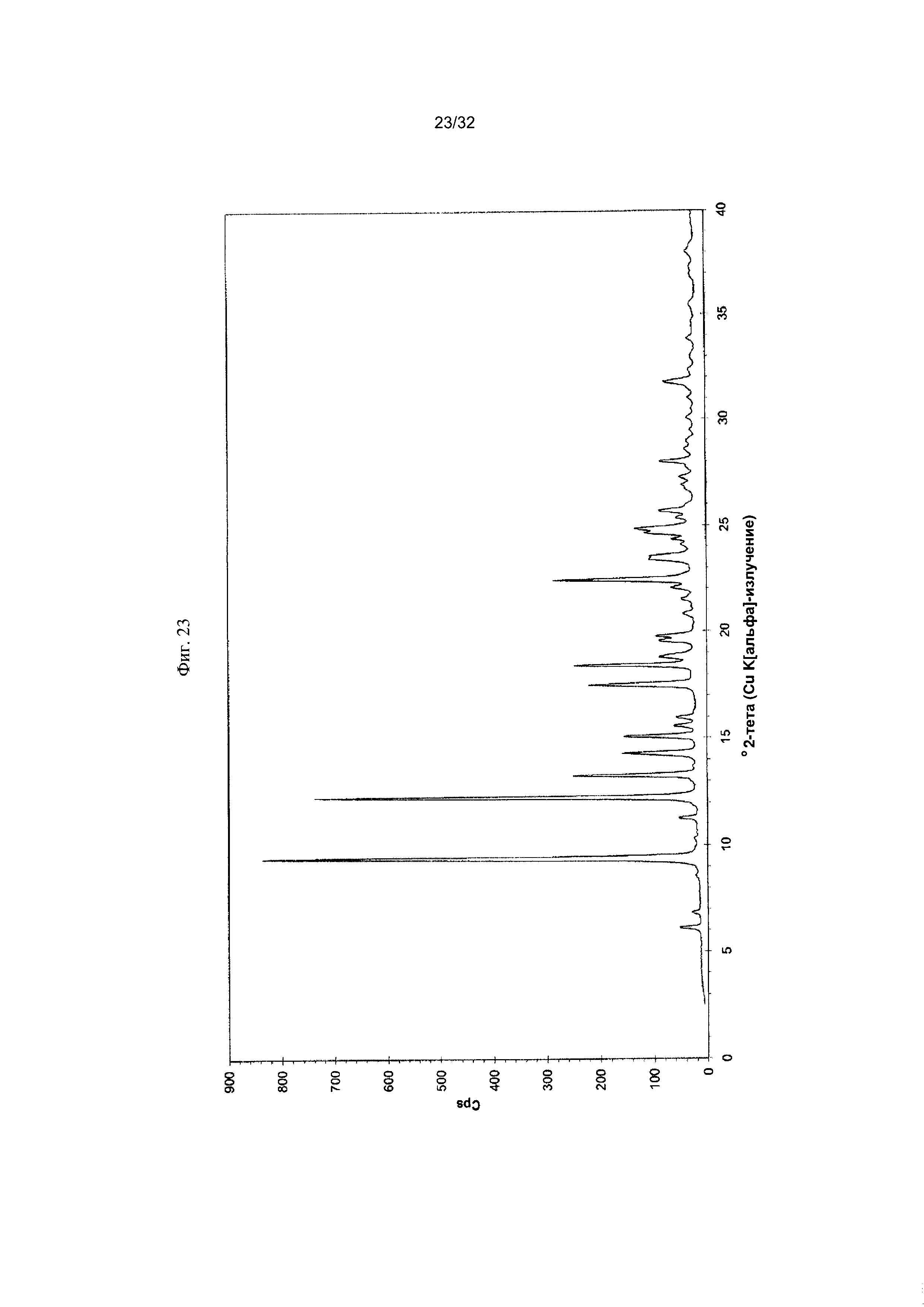
[0033] Фиг. 23 представляет собой PXRD-дифрактограмму чистой Формы VI Соединения 1.
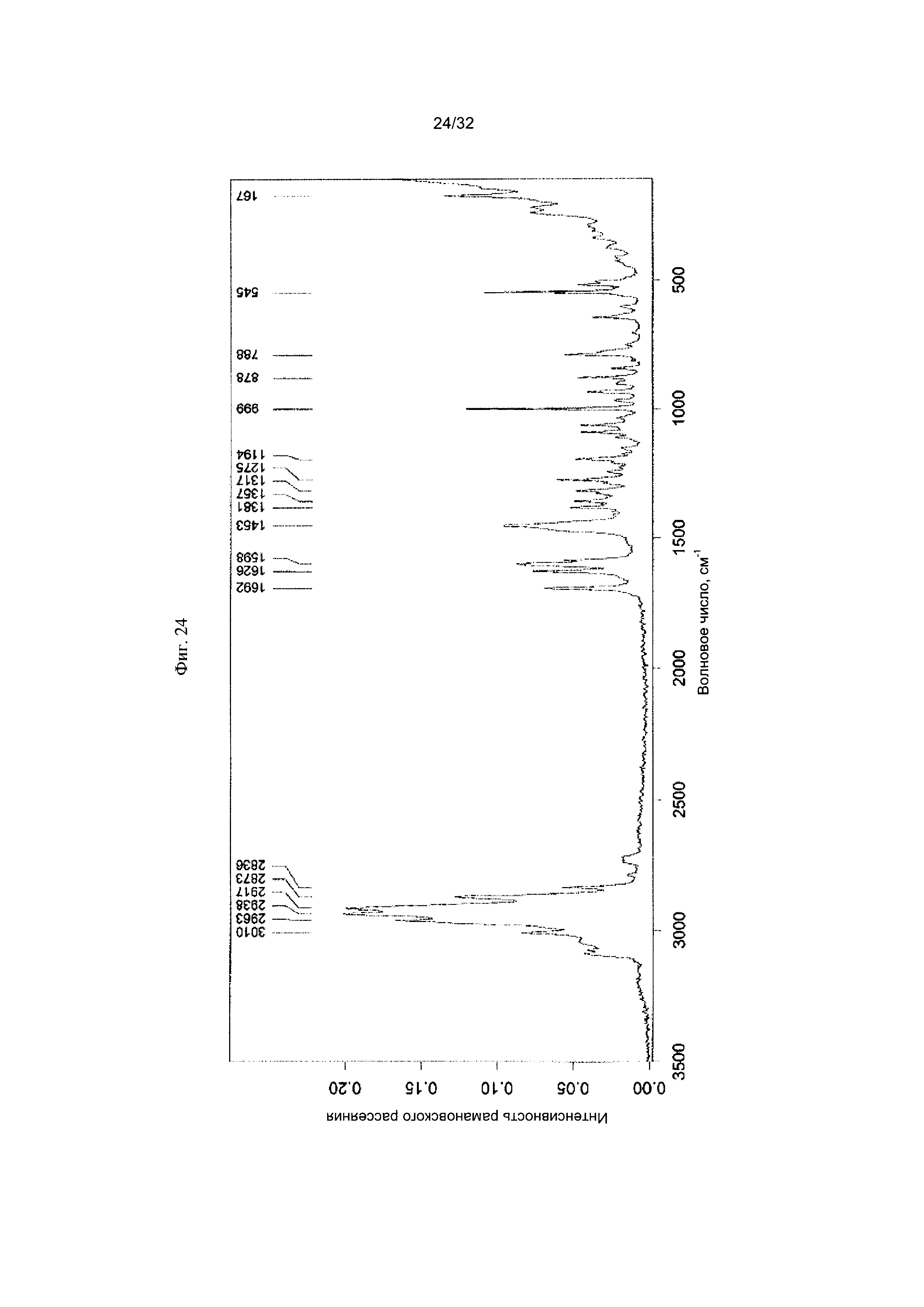
[0034] Фиг. 24 представляет собой Фурье-спектр комбинационного рассеяния чистой Формы VI Соединения 1.
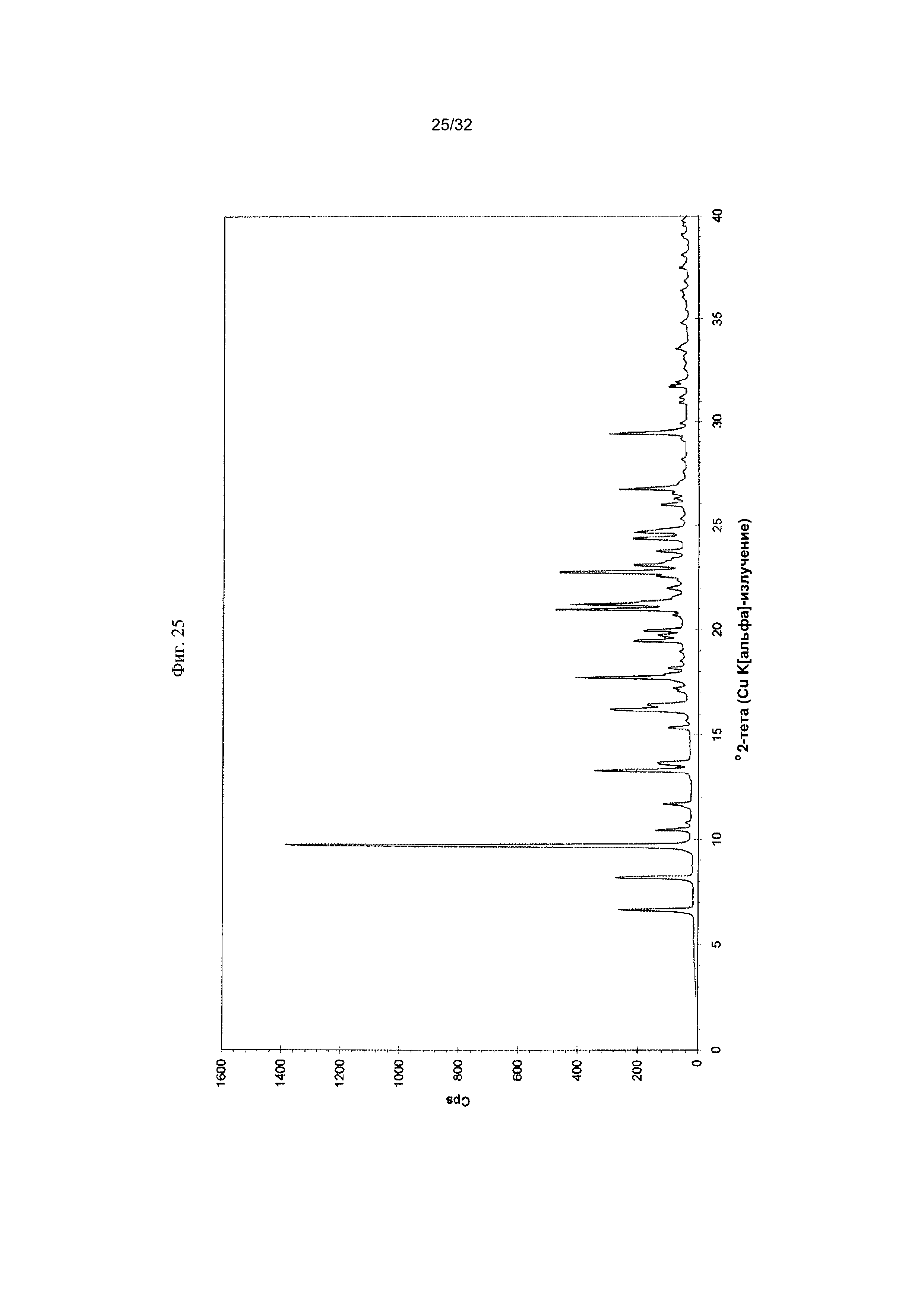
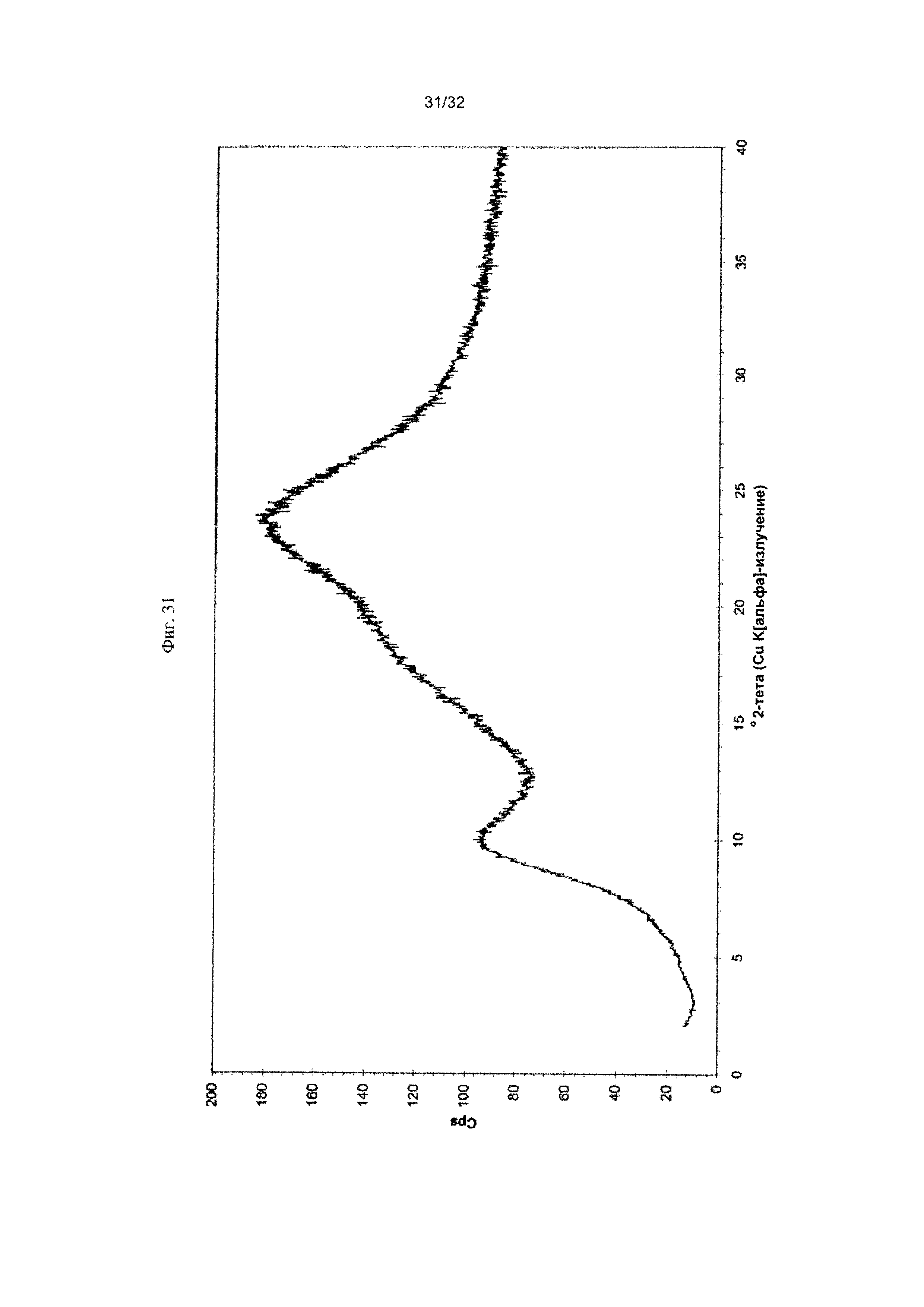
[0035] Фиг. 25 представляет собой PXRD-дифрактограмму чистой Формы VII Соединения 1.
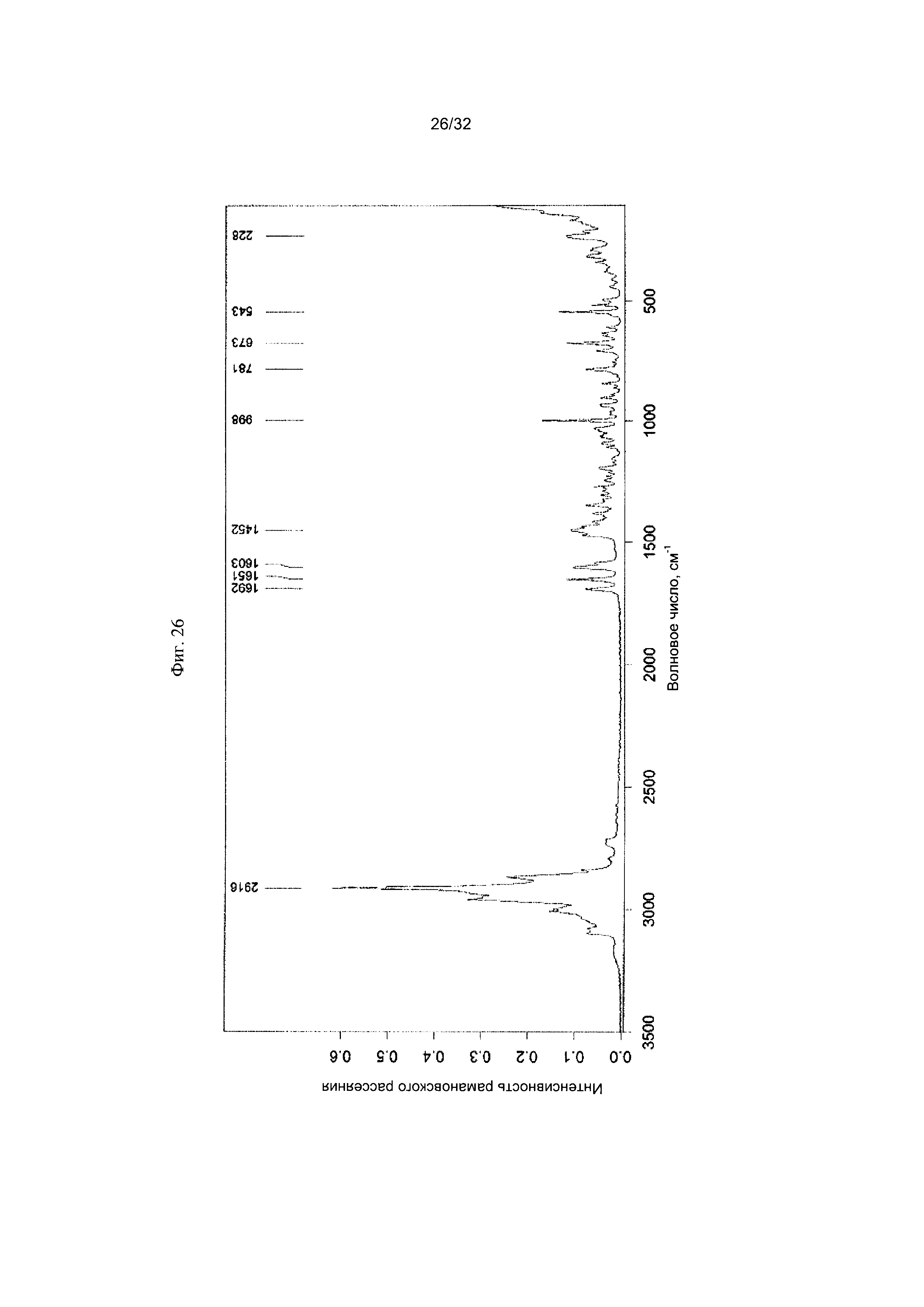
[0036] Фиг. 26 представляет собой Фурье-спектр комбинационного рассеяния чистой Формы VII Соединения 1.
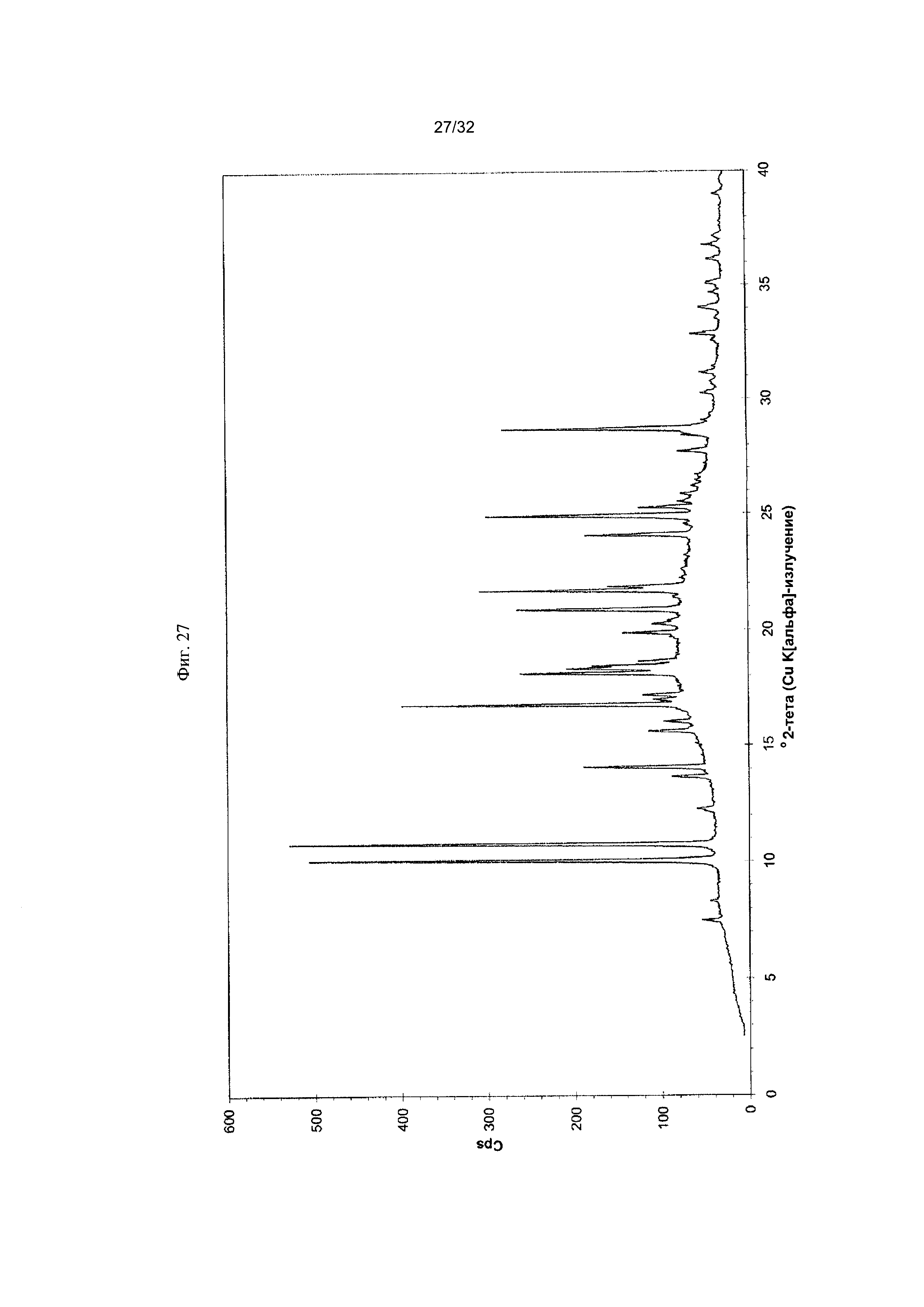
[0037] Фиг. 27 представляет собой PXRD- дифрактограмму чистой Формы VIII Соединения 1.
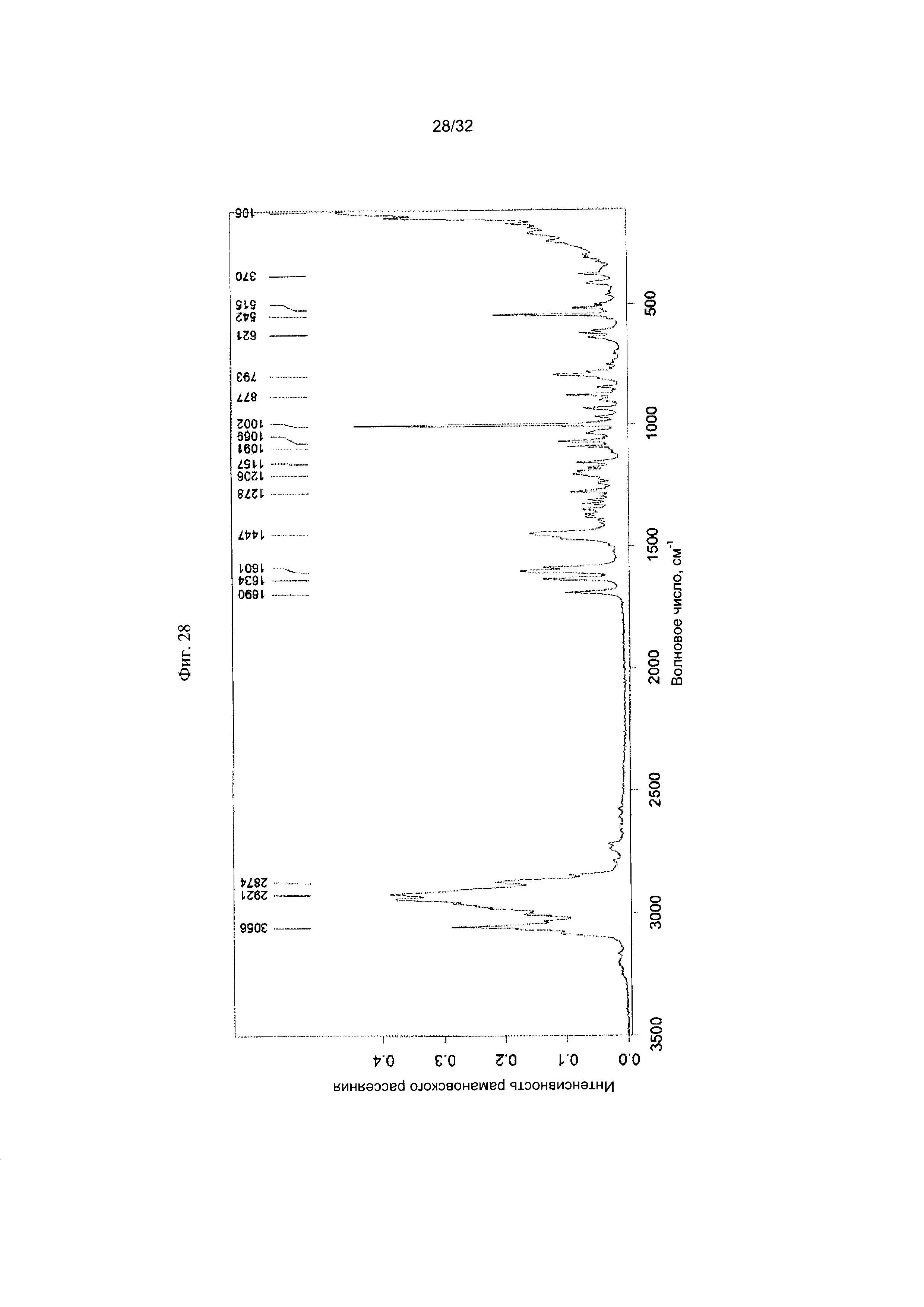
[0038] Фиг. 28 представляет собой Фурье-спектр комбинационного рассеяния чистой Формы VIII Соединения 1.
[0039] Фиг. 29 представляет собой PXRD-дифрактограмму чистой Формы IX Соединения 1.
[0040] Фиг. 30 представляет собой Фурье-спектр комбинационного рассеяния чистой Формы IX Соединения 1.
[0041] Фиг. 31 представляет собой PXRD-дифрактограмму Формы X Соединения 1.
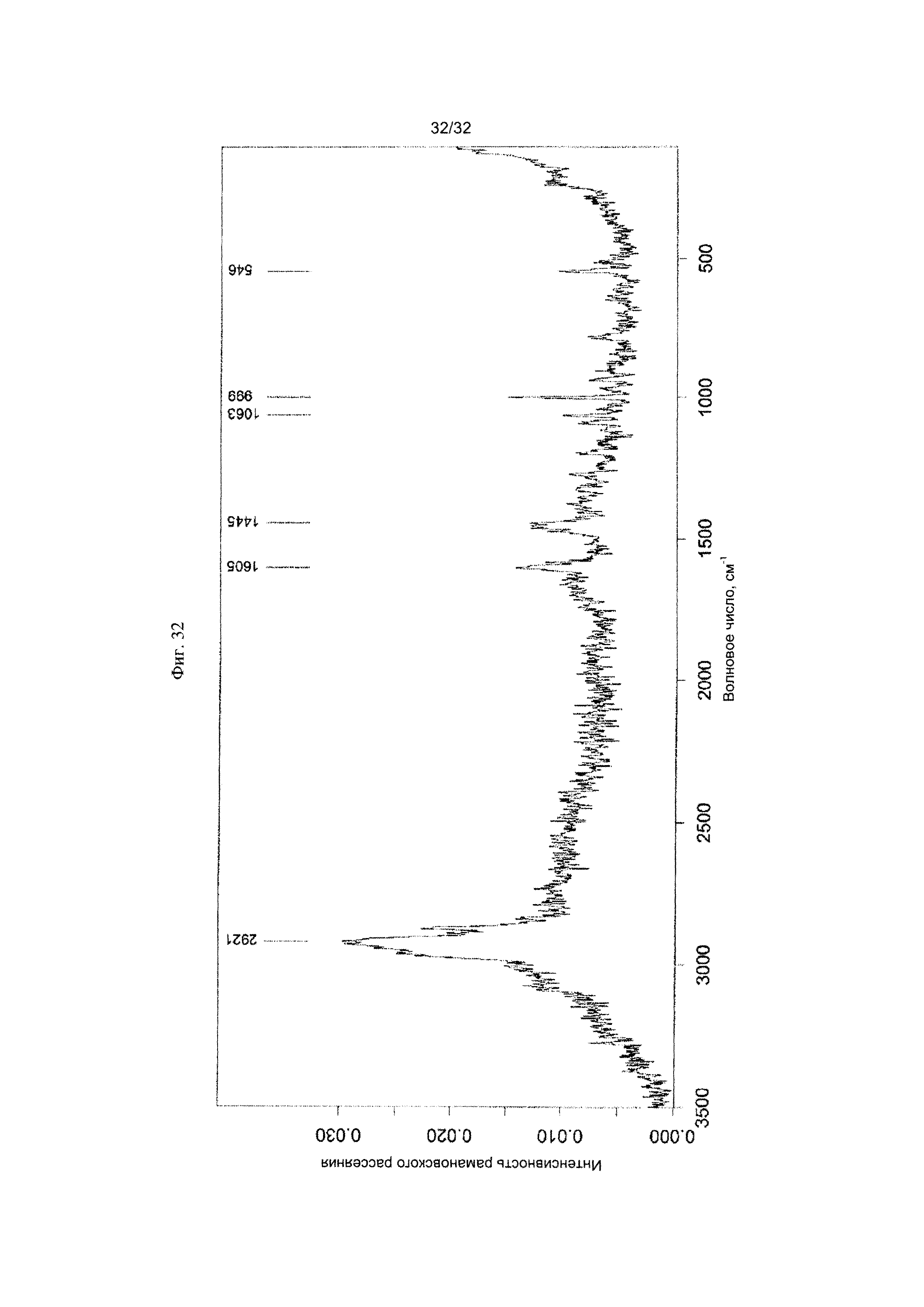
[0042] Фиг. 32 представляет собой Фурье-спектр комбинационного рассеяния Формы X Соединения 1.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0043] Согласно одному из аспектов, в настоящем изобретении предложены кристаллические полиморфные формы Соединения 1, или их смеси, или кристаллические полиморфные формы Соединения 2, или их смеси.
[0044] Согласно другому аспекту, в настоящем изобретении предложены Соединение 1, включающее Форму II, Форму III, Форму IV, Форму V, Форму VI, Форму VII, Форму VIII, или Форму IX, или их смесь, или Соединение 2 включающее Форму II, Форму III, Форму IV, Форму V, Форму VI, Форму VII, Форму VIII, или Форму IX, или их смесь.
[0045] Согласно другому аспекту, в настоящем изобретении предложены Соединение 1, по существу состоящее из Формы II, Формы III, Формы IV, Формы V, Формы VI, Формы VII, Формы VIII или Формы IX, или Соединение 2, по существу состоящее из Формы II, Формы III, Формы IV, Формы V, Формы VI, Формы VII, Формы VIII или Формы IX.
[0046] Согласно другому аспекту, в настоящем изобретении предложены Соединение 1, состоящее из Формы II, Формы III, Формы IV, Формы V, Формы VI, Формы VII, Формы VIII или Формы IX, или Соединение 2, состоящее из Формы II, Формы III, Формы IV, Формы V, Формы VI, Формы VII, Формы VIII или Формы IX.
[0047] Согласно другому аспекту, в настоящем изобретении предложены Соединение 1, включающее Форму III, Форму IV, Форму V, Форму VI, Форму VII, Форму VIII, или Форму IX, или их смесь, или Соединение 2, включающее Форму III, Форму IV, Форму V, Форму VI, Форму VII, Форму VIII, или Форму IX, или их смесь.
[0048] Согласно другому аспекту, в настоящем изобретении предложены Соединение 1, включающее Форму II, Форму III, или Форму IV, или их смесь, или Соединение 2, включающее Форму II, Форму III, или Форму IV, или их смесь.
[0049] Согласно другому аспекту, в настоящем изобретении предложены Соединение I, включающее Форму III, или Форму IV, или их смесь, или Соединение 2, включающее Форму III, или Форму IV, или их смесь.
[0050] Согласно другому аспекту, в настоящем изобретении предложены Форма II Соединения 1 или Форма II Соединения 2. Согласно одному из вариантов реализации настоящего изобретения, Форма II характеризуется дифрактограммой порошковой рентгеновской дифракции (PXRD), содержащей пики при 8,34, 10,06, 14,01, 16,77, 17,70, 18,40, 20,23, 22,36, 22,97 и 25,00 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма II Соединения 1 характеризуется дифрактограммой PXRD, содержащей пики при 8,34, 10,06, 14,01, 14,51, 15,55, 16,77, 17,70, 18,40, 18,88, 20,23, 22,36, 22,97, 23,91, 24,15, 25,00, 25,92, 26,96, 28,09, 28,33, 29,84, 30,52, 31,05, 31,45, 31,97, 32,61, 33,17, 34,02, 34,45 и 35,07 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма II характеризуется дифрактограммой PXRD, по существу такой же, как на фиг. 11. Согласно другому варианту реализации изобретения, Форма II характеризуется Фурье-спектром комбинационного рассеяния, содержащим пики при 3007, 2920, 2869, 1696, 1629, 1605, 1449, 1381, 1351, 1275, 1194, 1086, 1064, 1000, 931, 780, 544, 517, 225, 164 см-1. Согласно другому варианту реализации изобретения, Форма И характеризуется Фурье-спектром комбинационного рассеяния, по существу таким же, как на фиг. 12. Согласно другому варианту реализации, в настоящем изобретении предложена по существу чистая Форма II. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма II. Согласно другому варианту реализации, в настоящем изобретении предложено чистая Форма II Соединения 1.
[0051] Согласно другому аспекту, в настоящем изобретении предложены Форма III Соединения 1 или Форма III Соединения 2. Согласно одному из вариантов реализации настоящего изобретения, Формы III характеризуется дифрактограммой порошковой рентгеновской дифракции (PXRD), содержащей пики при 8,14, 8,52, 17,00, 18,56 и 22,19 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма III характеризуется дифрактограммой PXRD, содержащей пики при 8,14, 8,52, 9,62, 11,02, 11,90, 12,16, 14,02, 14,62, 17,00, 17,88, 18,56, 19,02, 19,24, 20,51, 20,93, 22,19, 22,73, 23,22, 24,31, 24,53, 25,91, 26,22, 27,36, 27,73, 28,70, 30,84, 31,52, 32,30, 33,19 и 34,39 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма III характеризуется дифрактограммой PXRD, по существу такой же, как на фиг. 14. Согласно другому варианту реализации изобретения, Формы III характеризуется Фурье-спектром комбинационного рассеяния, содержащим пики при 2922, 2873, 2837, 1699, 1628, 1602, 1449, 1379, 1274, 1090, 1065, 998, 778, 637, 549, 515, 320, 225, 165 и 127 см-1. Согласно другому варианту реализации изобретения, Формы III характеризуется Фурье-спектром комбинационного рассеяния, по существу таким же, как на фиг. 15. Согласно другому варианту реализации, в настоящем изобретении предложена по существу чистая Форма III. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма III. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма III Соединения 1.
[0052] Согласно другому аспекту, в настоящем изобретении предложены Форма IV Соединения 1 или Форма IV Соединения 2. Согласно одному из вариантов реализации настоящего изобретения, Формы IV характеризуется дифрактограммой порошковой рентгеновской дифракции (PXRD), содержащей пики при 6,83, 10,31, 11,30, 12,18, 12,98, 13,69, 15,11, 16,23, 17,60, 17,99, 20,70, 21,15, 21,68, 22,71, 23,79 и 24,86 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма IV характеризуется дифрактограммой PXRD, содержащей пики при 6,83, 8,38, 8,91, 10,11, 10,31, 11,30, 11,89, 12,18, 12,98, 13,69, 14,14, 15,11, 15,81, 16,23, 17,60, 17,99, 18,60, 19,15, 19,66, 20,28, 20,70, 21,15, 21,68, 22,44, 22,71, 23,50, 23,79, 24,06, 24,86, 25,55, 26,53, 26,94, 27,21, 27,60, 28,67, 29,79, 30,50, 30,75, 31,55, 31,89, 32,78, 33,25, 33,48, 33,81 и 34,68 градусах 2Θ. Согласно другому варианту реализации изобретения, Формы IV характеризуется дифрактограммой PXRD, по существу такой же, как на фиг. 17. Согласно другому варианту реализации изобретения, Форма IV характеризуется Фурье-спектром комбинационного рассеяния, содержащим пики при 3005, 2919, 2873, 2836, 1691, 1625, 1600, 1448, 1380, 1353, 1278, 1195, 1064, 998, 878, 789, 633, 545, 237 и 168 см-1. Согласно другому варианту реализации изобретения, Формы IV характеризуется Фурье-спектром комбинационного рассеяния, по существу таким же, как на фиг. 18. Согласно другому варианту реализации, в настоящем изобретении предложена по существу чистая Форма IV. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма IV. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма IV Соединения 1.
[0053] Согласно другому аспекту, в настоящем изобретении предложены Форма V Соединения 1 или Форма V Соединения 2. Согласно одному из вариантов реализации настоящего изобретения, Форма V характеризуется дифрактограммой порошковой рентгеновской дифракции (PXRD), содержащей пики при 9,38, 12,22, 13,18, 14,98, 17,32, 18,40, 22,41, 23,40, 23,55, 24,63, 24,79, 25,61, 28,02 и 31,77 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма V характеризуется дифрактограммой PXRD, содержащей пики при 6,11, 9,38, 11,13, 12,22, 13,18, 14,14, 14,98, 15,52, 15,78, 17,32, 18,40, 18,75, 19,48, 19,74, 20,63, 21,33, 21,88, 22,41, 23,40, 23,55, 23,76, 24,27, 24,63, 24,79, 25,61, 26,66, 27,10, 27,81, 28,02, 28,58, 29,91, 30,35, 30,95, 31,32, 31,77, 32,77, 33,81 и 34,98 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма V характеризуется дифрактограммой PXRD, по существу такой же, как на фиг. 21. Согласно другому варианту реализации изобретения, Форма V характеризуется Фурье-спектром комбинационного рассеяния, содержащим пики при ЗОЮ, 2963, 2938, 2872, 2836, 1690, 1624, 1597, 1452, 1359, 1317, 1275, 1193, 1062, 999, 877, 788, 546, 516 и 168 см-1. Согласно другому варианту реализации изобретения, Форма V характеризуется Фурье-спектром комбинационного рассеяния, по существу таким же, как на фиг. 22. Согласно другому варианту реализации, в настоящем изобретении предложена по существу чистая Форма V. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма V. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма V Соединения 1.
[0054] Согласно другому аспекту, в настоящем изобретении предложены Форма VI Соединения 1 или Форма VI Соединения 2. Согласно одному из вариантов реализации настоящего изобретения, Форма VI характеризуется дифрактограммой порошковой рентгеновской дифракции (PXRD), содержащей пики при 9,38, 12,23, 13,25, 17,48, 18,41 и 22,41 градусах 2Θ. Согласно другому варианту реализации изобретения, Формы VI характеризуется дифрактограммой PXRD, содержащей пики при 6,09, 6,82, 8,57, 9,38, 11,26, 12,23, 13,25, 14,27, 15,05, 15,54, 15,95, 17,48, 18,41, 18,79, 19,54, 19,76, 20,79, 21,48, 22,02, 22,41, 23,42, 24,07, 24,34, 24,64, 24,83, 25,34, 25,67, 26,74, 26,87, 27,24, 27,99, 28,56, 28,93, 29,47, 30,04, 30,98, 31,75, 32,34, 32,96 и 33,84 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма VI характеризуется дифрактограммой PXRD, по существу такой же, как на фиг. 23. Согласно другому варианту реализации изобретения, Форма VI характеризуется Фурье-спектром комбинационного рассеяния, содержащим пики при 3010, 2963, 2938, 2917, 2873, 2836, 1692, 1626, 1598, 1453, 1381, 1357, 1317, 1275, 1194, 999, 878, 788, 545 и 167 см-1. Согласно другому варианту реализации изобретения, Форма VI характеризуется Фурье-спектром комбинационного рассеяния, по существу таким же, как на фиг. 24. Согласно другому варианту реализации, в настоящем изобретении предложена по существу чистая Форма VI. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма VI. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма VI Соединения 1.
[0055] Согласно другому аспекту, в настоящем изобретении предложены Форма VII Соединения 1 или Форма VII Соединения 2. Согласно одному из вариантов реализации настоящего изобретения, Форма VII характеризуется дифрактограммой порошковой рентгеновской дифракции (PXRD), содержащей пики при 8,18, 9,71, 13,30, 16,22, 17,73, 20,98, 21,20, 22,76, 24,68, 26,72 и 29,39 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма VII характеризуется дифрактограммой PXRD, содержащей пики при 6,64, 8,18, 9,71, 10,44, 10,80, 11,69, 13,30, 13,64, 15,35, 16,22, 16,44, 17,23, 17,73, 18,16, 19,46, 19,72, 19,97, 20,70, 20,98, 21,20, 21,52, 21,98, 22,57, 22,76, 23,09, 23,75, 24,37, 24,68, 25,31, 25,97, 26,25, 26,49, 26,72, 28,13, 29,39, 29,88, 30,92, 31,17, 31,70, 31,96, 33,57 и 34,83 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма VII характеризуется дифрактограммой PXRD, по существу такой же, как на фиг. 25. Согласно другому варианту реализации изобретения, Формы VII характеризуется Фурье-спектром комбинационного рассеяния, содержащим пики при 2916, 1692, 1651, 1603, 1452, 998, 781, 673, 543 и 228 см-1. Согласно другому варианту реализации изобретения, Форма VII характеризуется Фурье-спектром комбинационного рассеяния, по существу таким же, как на фиг. 26. Согласно другому варианту реализации, в настоящем изобретении предложена по существу чистая Форма VII. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма VII. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма VII Соединения 1.
[0056] Согласно другому аспекту, в настоящем изобретении предложены Форма VIII
Соединения 1 или Форма VIII Соединения 2. Согласно одному из вариантов реализации настоящего изобретения, Форма VIII характеризуется дифрактограммой порошковой рентгеновской дифракции (PXRD), содержащей пики при 10,05, 10,77, 14,06, 16,76, 18,11, 18,32, 18,43, 20,89, 21,71, 21,87, 24,07, 24,90 и 28,71 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма VIII характеризуется дифрактограммой PXRD, содержащей пики при 7,48, 8,31, 10,05, 10,77, 12,27, 13,65, 14,06, 15,60, 16,03, 16,76, 16,96, 17,16, 18,11, 18,32, 18,43, 18,65, 19,89, 20,28, 20,89, 21,71, 21,87, 24,07, 24,90, 25,28, 25,54, 25,86, 26,22, 26,66, 27,74, 28,44, 28,71, 29,08, 30,26, 31,16, 32,59, 32,85, 34,01, 34,68 и 35,09 градусах 2Θ. Согласно другому варианту реализации изобретения, Формы VIII характеризуется дифрактограммой PXRD, по существу такой же, как на фиг. 27. Согласно другому варианту реализации изобретения, Форма VIII характеризуется Фурье-спектром комбинационного рассеяния, содержащим пики при 3056, 2921, 2874, 1690, 1634, 1601, 1447, 1278, 1206, 1157, 1091, 1069, 1002, 877, 793, 621, 542, 515, 370 и 105 см-1. Согласно другому варианту реализации изобретения, Формы VIII характеризуется Фурье-спектром комбинационного рассеяния, по существу таким же, как на фиг. 28. Согласно другому варианту реализации, в настоящем изобретении предложена по существу чистая Форма VIII. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма VIII. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма VIII Соединения 1.
[0057] Согласно другому аспекту, в настоящем изобретении предложены Форма IX Соединения 1 или Формы IX Соединения 2. Согласно одному из вариантов реализации настоящего изобретения, Форма IX характеризуется дифрактограммой порошковой рентгеновской дифракции (PXRD), содержащей пики при 7,06, 15,74 и 18,71 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма IX характеризуется дифрактограммой PXRD, содержащей пики при 7,06, 9,93, 12,22, 14,13, 15,74, 17,28, 18,71, 19,96, 21,18, 22,39, 23,51, 24,54, 25,58, 27,52, 28,48, 29,33, 30,18, 31,01, 31,82 и 32,73 градусах 2Θ. Согласно другому варианту реализации изобретения, Форма IX характеризуется дифрактограммой PXRD, по существу такой же, как на фиг. 29. Согласно другому варианту реализации изобретения, Форма IX характеризуется Фурье-спектром комбинационного рассеяния, содержащим пики при 2921, 2870, 1696, 1632, 1602, 1449, 1381, 1350, 1275, 1064, 1000, 932, 780, 544, 516, 225 и 164 см-1. Согласно другому варианту реализации изобретения, Форма IX характеризуется Фурье-спектром комбинационного рассеяния, по существу таким же, как на фиг. 30. Согласно другому варианту реализации, в настоящем изобретении предложена по существу чистая Форма IX. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма IX. Согласно другому варианту реализации, в настоящем изобретении предложена чистая Форма ГХ Соединения 1.
[0058] Согласно другому аспекту, в настоящем изобретении предложены Форма X Соединения 1 или Форма X Соединения 2. Форма X представляет собой аморфную форму Соединения 1 или Соединения 2. Согласно одному из вариантов реализации настоящего изобретения, Форма X характеризуется дифрактограммой PXRD, по существу такой же, как на фиг. 31. Согласно другому варианту реализации изобретения, Форма X характеризуется Фурье-спектром комбинационного рассеяния, по существу таким же, как на фиг. 32. Согласно другому варианту реализации, в настоящем изобретении предложена по существу чистая Форма X. Согласно другому варианту реализации изобретения, в настоящем изобретении предложена чистая Форма X. Согласно другому варианту реализации, в настоящем изобретении предложено чистое Соединение 1 в аморфной форме.
[0059] Согласно другому аспекту, в настоящем изобретении предложены микронизированные кристаллические полиморфные формы или аморфные формы Соединения 1, или микронизированные кристаллические полиморфные формы или аморфные формы Соединения 2. Согласно одному из вариантов реализации настоящего изобретения, среднее распределение размеров частиц микронизированной формы Соединения 1 или Соединения 2 составляет примерно 20 мкм или менее, например примерно 19 мкм, примерно 18 мкм, примерно 17 мкм, примерно 16 мкм, примерно 15 мкм, примерно 14 мкм, примерно 13 мкм, примерно 12 мкм, или примерно 11 мкм, или менее. Согласно другому варианту реализации изобретения, среднее распределение размеров частиц составляет примерно 10 мкм или менее, например примерно 9 мкм, примерно 8 мкм, примерно 7 мкм, примерно 6 мкм, или примерно 5 мкм, или менее. Согласно другому варианту реализации изобретения, среднее распределение размеров частиц составляет примерно 5 мкм или менее, например примерно 4 мкм, примерно 3 мкм, примерно 2 мкм, или примерно 1 мкм, или менее. Согласно другому варианту реализации изобретения, среднее распределение размеров частиц составляет примерно 1 мкм или менее, например примерно 0,9 мкм, примерно 0,8 мкм, примерно 0,7 мкм, примерно 0,6 мкм, примерно 0,5 мкм, примерно 0,4 мкм, примерно 0,3 мкм, примерно 0,2 мкм, примерно 0,1 мкм, примерно 0,09 мкм, примерно 0,08 мкм, примерно 0,07 мкм, примерно 0,06 мкм, примерно 0,05 мкм, примерно 0,04 мкм, примерно 0,03 мкм, примерно 0,02 мкм, или примерно 0,01 мкм или менее. Согласно другому варианту реализации, в настоящем изобретении предложена микронизированная кристаллическая Форма III Соединения 1, имеющая средний размер частиц примерно 20 мкм или менее, например примерно 19 мкм, примерно 18 мкм, примерно 17 мкм, примерно 16 мкм, примерно 15 мкм, примерно 14 мкм, примерно 13 мкм, примерно 12 мкм, примерно 11 мкм, примерно 10 мкм, примерно 9 мкм, примерно 8 мкм, примерно 7 мкм, примерно 6 мкм, примерно 5 мкм, примерно 4 мкм, примерно 3 мкм, примерно 2 мкм, примерно 1 мкм, примерно 0,9 мкм, примерно 0,8 мкм, примерно 0,7 мкм, примерно 0,6 мкм, примерно 0,5 мкм, примерно 0,4 мкм, примерно 0,3 мкм, примерно 0,2 мкм, примерно 0,1 мкм, примерно 0,09 мкм, примерно 0,08 мкм, примерно 0,07 мкм, примерно 0,06 мкм, примерно 0,05 мкм, примерно 0,04 мкм, примерно 0,03 мкм, примерно 0,02 мкм, или примерно 0,01 мкм, или менее. Согласно другому варианту реализации, в настоящем изобретении предложена микронизированная аморфная Форма X Соединения 1, имеющая средний размер частиц примерно 20 мкм или менее, например примерно 19 мкм, примерно 18 мкм, примерно 17 мкм, примерно 16 мкм, примерно 15 мкм, примерно 14 мкм, примерно 13 мкм, примерно 12 мкм, примерно 11 мкм, примерно 10 мкм, примерно 9 мкм, примерно 8 мкм, примерно 7 мкм, примерно 6 мкм, примерно 5 мкм, примерно 4 мкм, примерно 3 мкм, примерно 2 мкм, примерно 1 мкм, примерно 0,9 мкм, примерно 0,8 мкм, примерно 0,7 мкм, примерно 0,6 мкм, примерно 0,5 мкм, примерно 0,4 мкм, примерно 0,3 мкм, примерно 0,2 мкм, примерно 0,1 мкм, примерно 0,09 мкм, примерно 0,08 мкм, примерно 0,07 мкм, примерно 0,06 мкм, примерно 0,05 мкм, примерно 0,04 мкм, примерно 0,03 мкм, примерно 0,02 мкм, или примерно 0,01 мкм, или менее.
[0060] Согласно другому аспекту, в настоящем изобретении предложены способы получения кристаллических полиморфных форм или аморфных форм Соединения 1 или кристаллических полиморфных форм или аморфных форм Соединения 2. Способы получения кристаллических полиморфных форм или аморфных форм Соединения 1 описаны в Примерах, представленных в настоящем документе ниже. Другие способы, используемые для получения кристаллических полиморфных форм Соединения 1, включают сублимацию и создание избыточного давления, например, посредством СО2 (J. Am. Chem. Soc. 133:1399 (2011)). Для получения кристаллических полиморфных форм или аморфных форм Соединения 2 могут быть использованы аналогичные способы.
[0061] Согласно одному из вариантов реализации настоящего изобретения, суспензию одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 уравновешивают в одном или более не образующих сольватов растворителях и проводят выделение, например, посредством фильтрования и центрифугирования, с получением по существу чистой Формы III. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 уравновешивают в одном или более не образующих сольватов растворителях и проводят выделение с получением чистой Формы III. Согласно другому варианту реализации изобретения, уравновешивание одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 повторяют более одного раза, например два, три, четыре или пять раз, или более, с получением чистой Формы III. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 уравновешивают в течение периода времени, составляющего, например, от примерно 15 минут до примерно 24 часов, от примерно 1 часа до примерно 8 часов, или от примерно 1 часа до примерно 4 часов. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 уравновешивают в течение примерно 15 минут, примерно 30 минут, примерно 1 час, примерно 2 час, примерно 3 часа, примерно 4 часа, примерно 5 часов, примерно 6 часов, примерно 7, часов, примерно 8 часов, примерно 9 часов, примерно 10 часов, примерно 12 часов, примерно 15 часов, примерно 18 часов, примерно 20 часов, примерно 21 часов, примерно 1 день, примерно 2 дня, примерно 3 дня, примерно 4 дня, примерно 5 дней, примерно 6 дней, примерно 1 неделю, примерно 2 недели, примерно 3 недели, примерно месяц, или дольше, до того, как будет наблюдаться полное превращение в Форму III. Согласно другому варианту реализации изобретения, уравновешивание суспензии одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 проводят при температуре от примерно 45°С до примерно 5°С, например от примерно 45°С до примерно 20°С или от примерно 35°С до примерно 25°С. Согласно другому варианту реализации изобретения, уравновешивание суспензии одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 проводят при температуре примерно 45°С или менее, например при температуре примерно 44°С, примерно 43°С, примерно 42°С, примерно 41°С, примерно 40°С, примерно 39°С, примерно 38°, примерно 37°С, примерно 36°С, примерно 35°С, примерно 34°С, примерно 33°С, примерно 32°С, примерно 31°С, примерно 30°С, примерно 29°С, примерно 28°С, примерно 27°С, примерно 26°С (то есть, примерно при комнатной температуре), примерно 25°С, примерно 24°С, примерно 23°С, примерно 22°С, примерно 21°С, примерно 20°С, примерно 19°С, примерно 18°С, примерно 17°С, примерно 16°С, примерно 15°С, примерно 14°С, примерно 13°С, примерно 12°С, примерно 11°С, примерно 10°С, примерно 9°С, примерно 8°С, примерно 7°С, примерно 6°С, примерно 5°С, примерно 4°С, примерно 3°С, примерно 2°С, примерно 1°С, или примерно 0°С, или менее. Согласно другому варианту реализации изобретения, уравновешивание суспензии одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 проводят примерно при комнатной температуре или менее. Согласно другому варианту реализации изобретения, указанные один или более не образующие сольватов растворители представляют собой н-гептан, кумол, диэтиловый эфир, толуол, этилацетат, трет-бутилметиловый эфир или н-додекан. Согласно другому варианту реализации изобретения, указанные один или более не образующие сольватов растворители представляют собой н-гептан, толуол, этанол или изопропанол. Если используют два не образующих сольватов растворителя, например гептан/толуол, отношение растворителей составляет примерно 50:1, например примерно 25:1, примерно 20:1; примерно 10:1, примерно 9:1, примерно 8:1, примерно 7:1; примерно 6:1; примерно 5:1, примерно 4:1, примерно 3:1, примерно 2:1, или примерно 1:1.
[0062] Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм Соединения 1 уравновешивают в гептане/толуоле и проводят выделение с получением по существу чистой Формы III. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм Соединения 1 уравновешивают в гептане/толуоле и проводят выделение с получением чистой Формы III. Согласно другому варианту реализации изобретения, отношение гептан:толуол составляет от примерно 10:1 до примерно 1:10, например от примерно 5:1 до примерно 1:5, от примерно 3:1 до примерно 1:3 или от примерно 2:3 до примерно 3:2. Согласно другому варианту реализации изобретения, отношение гептан:толуол составляет примерно 10:1, примерно 9:1, примерно 8:1, примерно 7:1, примерно 6:1, примерно 5:1, примерно 4:1, примерно 3:1, примерно 2:1, примерно 1:1, примерно 1:2, примерно 1:3, примерно 2:3, примерно 1:4, примерно 1:5, примерно 1:6, примерно 1:7, примерно 1:8, примерно 1:9 или примерно 1:10. Согласно другому варианту реализации изобретения, отношение гептан:толуол составляет примерно 9:1. Согласно другому варианту реализации изобретения, отношение гептан:толуол составляет примерно 2:3. Согласно другому варианту реализации изобретения, уравновешивание суспензии в гептане/толуоле проводят при температуре примерно 25°С.Согласно другому варианту реализации изобретения, уравновешивание суспензии в гептане/толуоле проводят при температуре примерно 5°С.Согласно другому варианту реализации изобретения, уравновешивание суспензии в гептане/толуоле проводят в течение примерно 2, примерно 3, примерно 4, или примерно 5 часов. Согласно другому варианту реализации изобретения, уравновешивание суспензии в гептане/толуоле проводят в течение примерно 20 часов. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм Соединения 1 уравновешивают в гептане/толуоле, проводят выделение, повторно уравновешивают в гептане/толуоле или в другом не образующем сольватов растворителе или смеси не образующих сольватов растворителей, и проводят повторное выделение с получением чистой Формы III.
[0063] Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм Соединения 1 уравновешивают в гептане/изопропаноле или в гептане/этаноле и проводят выделение с получением по существу чистой Формы III. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм Соединения 1 уравновешивают в гептане/изопропаноле или в гептане/этаноле и проводят выделение с получением чистой Формы III. Согласно другому варианту реализации изобретения, отношение гептан:изопропанол или гептан:этанол составляет от примерно 25:1 до примерно 1:25, от примерно 20:1 до примерно 1:20, от примерно 10:1 до примерно 1:10, от примерно 5:1 до примерно 1:5 или от примерно 2:3 до примерно 3:2. Согласно другому варианту реализации изобретения, отношение гептан:изопропанол или гептан:этанол составляет примерно 20:1, примерно 19:1, примерно 10:1, примерно 9:1, примерно 8:1, примерно 7:1, примерно 6:1, примерно 5:1, примерно 4:1, примерно 3:1, примерно 2:1, примерно 1:1, примерно 1:2, примерно 1:3, примерно 2:3, примерно 1:4, примерно 1:5, примерно 1:6, примерно 1:7, примерно 1:8, примерно 1:9 или примерно 1:10. Согласно другому варианту реализации изобретения, отношение гептан:изопропанол составляет примерно 3:2. Согласно другому варианту реализации изобретения, отношение гептан:этанол составляет примерно 19:1. Согласно другому варианту реализации изобретения, уравновешивание суспензии в гептане/изопропаноле или гептане/этаноле проводят при температуре примерно 25°С. Согласно другому варианту реализации изобретения, уравновешивание суспензии в гептане/изопропаноле или гептане/этаноле проводят при температуре примерно 5°С. Согласно другому варианту реализации изобретения, уравновешивание суспензии в гептане/изопропаноле или гептане/этаноле проводят в течение примерно 1 часа, примерно 2 часов, примерно 3 часов, примерно 4 часов, примерно 5 часов, примерно 6 часов, примерно 7 часов, примерно 8 часов или более. Согласно другому варианту реализации изобретения, уравновешивание суспензии в гептане/изопропаноле или гептане/этаноле проводят в течение примерно 20 часов. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм Соединения 1 уравновешивают в гептане/изопропаноле, проводят выделение, повторно уравновешивают в гептане/изопропаноле, или в другом не образующем сольватов растворителе, или смеси не образующих сольватов растворителей, и проводят повторное выделение с получением чистой Формы III. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм Соединения 1 уравновешивают в гептане/этаноле, проводят выделение, повторно уравновешивают в гептане/этаноле или в другом не образующем сольватов растворителе, или смеси не образующих сольватов растворителей, и проводят повторное выделение с получением чистой Формы III.
[0064] Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 уравновешивают в метаноле/воде и проводят выделение с получением по существу чистой Формы V. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 уравновешивают в метаноле/воде и проводят выделение с получением чистой Формы V. Согласно другому варианту реализации изобретения, содержание метанола в смеси метанол/вода составляет более 60% по объему. Согласно другому варианту реализации изобретения, уравновешивание одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 в метаноле/воде повторяют более одного раза, например два, три, четыре или пять раз, или более, с получением чистой Формы V. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 уравновешивают в метаноле/воде в течение периода времени, составляющего, например, примерно 15 минут, примерно 30 минут, примерно 1 час, примерно 2 часа, примерно 3 часа, примерно 4 часа, примерно 5 часов, примерно 6 часов, примерно 10 часов, примерно 12 часов, примерно 15 часов, примерно 18 часов, примерно 20 часов, примерно 21 час, примерно 1 день, примерно 2 дня, примерно 3 дня, примерно 4 дня, примерно 5 дня, примерно 6 дней, примерно 1 неделю, примерно 2 недели, примерно 3 недели, примерно месяц, или дольше, до того, как будет наблюдаться полное превращение в Форму V. Согласно другому варианту реализации изобретения, уравновешивание суспензии одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 в метаноле/воде проводят при температуре примерно 65°С или менее, например при температуре примерно 60°С, при температуре примерно 50°С, при температуре примерно 45°С, при температуре примерно 44°С, примерно 43°С, примерно 42°С, примерно 41°С, примерно 40°С, примерно 39°С, примерно 38°, примерно 37°С, примерно 36°С, примерно 35°С, примерно 34°С, примерно 33°С, примерно 32°С, примерно 31°С, примерно 30°С, примерно 29°С, примерно 28°С, примерно 27°С, примерно 26°С (то есть примерно при комнатной температуре), примерно 25°С, примерно 24°С, примерно 23°С, примерно 22°С, примерно 21°С, примерно 20°С, примерно 19°С, примерно 18°С, примерно 17°С, примерно 16°С, примерно 15°С, примерно 14°С, примерно 13°С, примерно 12°С, примерно 11°С, примерно 10°С, примерно 9°С, примерно 8°С, примерно 7°С, примерно 6°С, примерно 5°С, примерно 4°С, примерно 3°С, примерно 2°С, примерно 1°С, или примерно 0°С, или менее.
Согласно другому варианту реализации изобретения, уравновешивание суспензии одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 проводят в метаноле/воде примерно при комнатной температуре или при меньшей температуре.
[0065] Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 уравновешивают в воде и проводят выделение с получением по существу чистой Формы IV. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 уравновешивают в воде и проводят выделение с получением чистой Формы IV. Согласно другому варианту реализации изобретения, уравновешивание одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 в воде повторяют более одного раза, например два, три, четыре или пять раз, или более, с получением чистой Формы IV. Согласно другому варианту реализации изобретения, суспензию одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 уравновешивают в воде в течение периода времени, составляющего, например, примерно 15 минут, примерно 30 минут, примерно 1 час, примерно 2 часа, примерно 3 часа, примерно 4 часа, примерно 5 часов, примерно 6 часов, примерно 10 часов, примерно 12 часов, примерно 15 часов, примерно 18 часов, примерно 20 часов, примерно 21 час, примерно 1 день, примерно 2 дня, примерно 3 дня, примерно 4 дня, примерно 5 дней, примерно 6 дней, примерно 1 неделю, примерно 2 недели, примерно 3 недели, примерно месяц, или дольше, до того, как будет наблюдаться полное превращение в Форму IV. Согласно другому варианту реализации изобретения, уравновешивание суспензии одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 в воде проводят при температуре примерно 65°С или менее, например при температуре примерно 60°С, при температуре примерно 50°С, при температуре примерно 45°С, при температуре примерно 44°С, примерно 43°С, примерно 42°С, примерно 41°С, примерно 40°С, примерно 39°С, примерно 38°, примерно 37°С, примерно 36°С, примерно 35°С, примерно 34°С, примерно 33°С, примерно 32°С, примерно 31°С, примерно 30°С, примерно 29°С, примерно 28°С, примерно 27°С, примерно 26°С (то есть примерно при комнатной температуре), примерно 25°С, примерно 24°С, примерно 23°С, примерно 22°С, примерно 21°С, примерно 20°С, примерно 19°С, примерно 18°С, примерно 17°С, примерно 16°С, примерно 15°С, примерно 14°С, примерно 13°С, примерно 12°С, примерно 11°С, примерно 10°С, примерно 9°С, примерно 8°С, примерно 7°С, примерно 6°С, или примерно 5°С.Согласно другому варианту реализации изобретения, уравновешивание суспензии одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 проводят в воде примерно при комнатной температуре.
[0066] Согласно другому аспекту, в настоящем изобретении предложен способ получения по существу чистой Формы III Соединения 1, включающий: а) объединение смеси одной или более полиморфных или аморфных форм Соединения 1 и двух или более не образующих сольватов растворителей при примерно 26°С с получением суспензии и b) фильтрование суспензии с получением по существу чистой Формы III Соединения 1. Согласно другому варианту реализации изобретения, указанные два или более не образующих сольватов растворителей содержат гептан/толуол, гептан/изопропанол или гептан/этанол. Согласно другому варианту реализации изобретения, согласно стадиям а) и b) получают чистую Форму III Соединения.
[0067] Согласно другому аспекту, в настоящем изобретении предложен способ получения по существу чистой Формы III Соединения 1, включающий: а) объединение смеси одной или более полиморфных или аморфных форм Соединения 1 и двух или более не образующих сольватов растворителей при примерно 26°С с получением суспензии; b) нагревание суспензии с получением раствора; с) охлаждение раствора до примерно 26°С или менее с получением осадка; и d) фильтрование осадка с получением по существу чистой Формы III Соединения 1. Согласно другому варианту реализации изобретения, указанные два или более не образующих сольватов растворителей содержат гептан/толуол, гептан/изопропанол или гептан/этанол. Согласно другому варианту реализации изобретения, суспензию нагревают до примерно 45°С или более, например примерно 50°С, примерно 55°С, примерно 60°С, примерно 65°С, примерно 70°С, примерно 75°С, примерно 80°С или более. Согласно другому варианту реализации изобретения, раствор выдерживают в комнате. Согласно другому варианту реализации изобретения, согласно стадиям а), b), с) и d) получают чистую Форму III Соединения 1.
[0068] Согласно другому аспекту, в настоящем изобретении предложен способ получения по существу чистой Формы III Соединения 1, включающий: а) объединение смеси одной или более кристаллических полиморфных или аморфных форм Соединения 1 и двух или более не образующих сольватов растворителей при примерно 26°С с получением суспензии; b) нагревание суспензии с получением раствора; с) охлаждение раствора до температуры от примерно 40°С до примерно 30°С (что может вызывать или не вызывать некоторое осаждение); d) добавление примерно 0,5 масс. % или менее чистой Формы III Соединения 1 и е) фильтрование осадка с получением по существу чистой Соединение 1 Формы III. Согласно другому варианту реализации изобретения, указанные два или более не образующих сольватов растворителей содержат гептан/толуол, гептан/изопропанол, или гептан/этанол. Согласно другому варианту реализации изобретения, суспензию нагревают до примерно 50°С или более, например примерно 55°С, примерно 60°С, примерно 65°С, примерно 70°С, примерно 75°С, примерно 80°С, или более. Согласно другому варианту реализации изобретения, согласно стадиям а), b), с), d) и е) получают чистую Форму III Соединения 1.
[0069] Согласно другому аспекту, в настоящем изобретении предложены композиции, содержащие одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 и одно или более вспомогательных веществ. Согласно одному из вариантов реализации настоящего изобретения, предложены композиции, содержащие Форму III Соединения 1 и одно или более вспомогательных веществ. Согласно другому варианту реализации изобретения, предложены композиции, содержащие аморфную Форму X Соединения 1 и одно или более вспомогательных веществ. Согласно одному из вариантов реализации настоящего изобретения, вспомогательное вещество содержит диметилсульфоксид или ацетон. Согласно одному из вариантов реализации настоящего изобретения, композиция содержит фармацевтически приемлемое вспомогательное вещество, то есть является «фармацевтически приемлемой композицией». Согласно другому варианту реализации изобретения, композиция содержит микронизированные кристаллические полиморфные формы или аморфные формы Соединения 1 или Соединения 2. Согласно другому варианту реализации изобретения, композиция содержит микронизированную кристаллическую Форму III Соединения 1. Согласно другому варианту реализации изобретения, фармацевтически приемлемое вспомогательное вещество содержит Миглиол 812 (Miglyol 812), фосфолипон 90G (phospholipon 90G) или сукцинат токоферилполиэтиленгликоля 1000 или их смесь. Согласно другому варианту реализации изобретения, фармацевтически приемлемое вспомогательное вещество по существу состоит из Миглиола 812, фосфолипона 90G и сукцината токоферилполиэтиленгликоля 1000. Согласно другому варианту реализации изобретения, фармацевтически приемлемое вспомогательное вещество содержит Labrasol®. Согласно другому варианту реализации изобретения, фармацевтически приемлемое вспомогательное вещество содержит сорбитанмонолаурат, ацетат-сукцинат гидроксипропилметилцеллюлозы, таурохолат натрия, этоцел (ethocel™), или пальмитоил-олеоил-фосфатидилхолин, или их смесь. Согласно другому варианту реализации изобретения, фармацевтически приемлемое вспомогательное вещество содержит гидрогенизированный соевый лецитин. Кристаллические полиморфные формы или аморфные формы Соединения 1 или Соединения 2 могут быть смешаны с одним или более вспомогательных веществ с применением способа, хорошо известного специалисту в данной области.
[0070] Композиции могут содержать от 0,01% до 99% по массе одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, например примерно 1%, примерно 2%, примерно 3%, примерно 4%, примерно 5%, примерно 6%, примерно 7%, примерно 8%, примерно 9%, или примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90% или примерно 95%. Количество в любой конкретной композиции будет зависеть от эффективной дозы, то есть дозы, необходимой для достижения необходимого уровня экспрессии генов. Согласно одному из вариантов реализации настоящего изобретения, композиция содержит от 0,01 до 99% по массе кристаллической Формы III Соединения 1. Согласно другому варианту реализации изобретения, композиция содержит от 0,01 до 99% по массе аморфной Формы X Соединения 1.
[0071] Согласно другому аспекту, в настоящем изобретении предложены способы получения композиции, включающие смешивание одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 с одним или более вспомогательных веществ. Согласно одному из вариантов реализации настоящего изобретения, вспомогательное вещество представляет собой фармацевтически приемлемое вспомогательное вещество. Согласно одному из вариантов реализации настоящего изобретения, предложены способы получения композиции, включающие смешивание Формы III Соединения 1 и одного или более фармацевтически приемлемых вспомогательных веществ. Согласно другому варианту реализации изобретения, предложены способы получения композиции, включающие смешивание аморфной Формы X Соединения 1 и одного или более фармацевтически приемлемых вспомогательных веществ.
[0072] Согласно другому аспекту, в настоящем изобретении предложены способы регуляции экспрессии интересующего гена в клетке-хозяине, включающие приведение указанной клетки-хозяина в контакт с одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащей их композицией. Согласно одному из вариантов реализации настоящего изобретения, предложены способы регуляции экспрессии интересующего гена в клетке-хозяине, включающие приведение указанной клетки-хозяина в контакт с композицией, содержащей кристаллическую Форму III Соединения I. Согласно другому варианту реализации изобретения, предложены способы регуляции экспрессии интересующего гена в клетке-хозяине, включающие приведение указанной клетки-хозяина в контакт с композицией, содержащей аморфное Соединение 1. Согласно одному из вариантов реализации настоящего изобретения, клетка-хозяин содержит полинуклеотид, кодирующий переключатель генов, содержащий лигандсвязывающий домен, который связывается с Соединением 1 или Соединением 2, при этом уровень экспрессии интересующего гена повышается по сравнению с уровнем экспрессии интересующего гена в отсутствие Соединения 1 или Соединения 2, соответственно. Согласно другому варианту реализации изобретения, клетка-хозяин представляет собой выделенную клетку-хозяина. Согласно другому варианту реализации изобретения, клетка-хозяин находится в субъекте, например в животном, например в человеке. Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм Соединения 1 вводят субъекту в виде фармацевтически приемлемой композиции. Согласно другому варианту реализации изобретения, переключатель генов содержит лигандсвязывающий домен рецепторов экдизона. Согласно другому варианту реализации изобретения, переключатель генов дополнительно содержит лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2. Согласно другому варианту реализации изобретения, лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, представляет собой лигандсвязывающий домен ретиноидного X-рецептора. Согласно другому варианту реализации изобретения, лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, представляет собой USP («ультрадышащий» (ultraspiracle) белок) насекомого, относящийся к дикому типу. Согласно другому варианту реализации изобретения, лигандсвязывающий домен ретиноидного X-рецептора представляет собой химерный лигандсвязывающий домен ретиноидного X-рецептора. Согласно другому варианту реализации изобретения, клетка-хозяин дополнительно содержит полинуклеотид, кодирующий пептид, белок или полипептид, экспрессия которых регулируется указанным переключателем генов.
[0073] Согласно другому аспекту, в настоящем изобретении предложены способы лечения заболевания, расстройства, повреждения или состояния у субъекта, включающие введение указанному субъекту одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащей их композиции. Согласно одному из вариантов реализации настоящего изобретения, клетка-хозяин в субъекте содержит полинуклеотид, кодирующий переключатель генов, который содержит лигандсвязывающий домен, который связывается с Соединением 1 или Соединением 2. Согласно другому варианту реализации изобретения, субъект представляет собой человека. Согласно другому варианту реализации изобретения, заболевание, расстройство, повреждение или состояние выбрано из группы, состоящей из рака, расстройства, связанного с метаболизмом, заболевания почек, анемии, аутоиммунного расстройства, офтальмологического расстройства, расстройства со стороны крови, неврологического расстройства, расстройства легких, ревматологического расстройства и инфекционного заболевания. Согласно другому варианту реализации изобретения, заболевание, расстройство, повреждение или состояние представляет собой рак. Согласно другому варианту реализации изобретения, рак представляет собой меланому. Согласно другому варианту реализации изобретения, переключатель генов содержит лигандсвязывающий домен рецептора экдизона. Согласно другому варианту реализации изобретения, переключатель генов дополнительно содержит лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1. Согласно другому варианту реализации изобретения, лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, представляет собой лигандсвязывающий домен ретиноидного Х-рецептора. Согласно другому варианту реализации изобретения, лигандсвязывающий домен ретиноидного X-рецептора представляет собой химерный лигандсвязывающий домен ретиноидного X-рецептора. Согласно другому варианту реализации изобретения, клетка-хозяин дополнительно содержит полинуклеотид, кодирующий пептид, белок или полипептид, экспрессия которых регулируется указанным переключателем генов. Согласно другому варианту реализации изобретения, переключатель генов регулирует экспрессию полинуклеотида, кодирующего ИЛ-12 или его субъединицу. (См., например, WO 2010/042189 А2).
[0074] Согласно другому варианту реализации, в настоящем изобретении предложены одна или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащая их композицией, для применения для лечения заболевания, расстройства, повреждения или состояния у субъекта.
[0075] Согласно другому варианту реализации, в настоящем изобретении предложены одна или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащая их композицией, для применения для получения лекарственного средства для лечения заболевания, расстройства, повреждения или состояния у субъекта.
[0076] Согласно другому аспекту, в настоящем изобретении предложены наборы, содержащие одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или наборы, содержащие композицию одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 и одно или более вспомогательных веществ. Согласно одному из вариантов реализации настоящего изобретения, набор дополнительно содержит инструкции по введению указанных одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 в выделенную клетку-хозяин или субъекту. Согласно другому варианту реализации изобретения, набор дополнительно содержит терапевтическую систему РеоСвитч (RheoSwitch®) (см., например, руководство для системы "RheoSwitch® Mammalian Inducible Expression System", New England BioLabs® Inc., версия 1,3, ноябрь 2007; Karzenowski, D. et al, BioTechiques 59:191-196 (2005); Dai, X. et al, Protein Expr. Purif. 42:236-245 (2005); Palli, S.R. et al, Eur. J. Biochem. 270:1308-1515 (2003); Dhadialla, T.S. et al, Annual Rev. Entomol. 45:545-569 (1998); Kumar, M.B, et al, J. Biol Chem. 279:27211-27218 (2004); Verhaegent, M. and Christopoulos, T.K., Annal. Chem. 74:4378-4385 (2002); Katalam, A.K., et al, Molecular Therapy 13:S103 (2006); и Karzenowski, D. et al, Molecular Therapy 13:S194(2006)).
[0077] Описанные в настоящем документе кристаллические полиморфные формы или аморфные формы Соединения 1 или Соединения 2 могут быть введены субъекту в сочетании с другими фармацевтически активными соединениями. Специалисту в данной области будет понятно, что фармацевтически активные соединения, которые предполагается использовать в комбинации с кристаллическими полиморфными формами или аморфными формами Соединения 1 или Соединения 2, будут выбраны с целью избежать побочных эффектов у реципиента или нежелательного взаимодействия между соединениями. Примеры других фармацевтически активных соединений, которые могут быть использованы в комбинации с одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, включают, например, химиотерапевтические агенты против СПИД, производные аминокислот, анальгетики, анестетики, продукты против аноректальных нарушений, антациды и ветрогонные вещества, антибиотики, антикоагулянты, антидоты, антифибринолитические агенты, антигистаминные вещества, противовоспалительные агенты, противоопухолевые вещества, антипаразитарные вещества, антипротозойные вещества, жаропонижающие вещества, антисептики, спазмолитические вещества и антихолинергические вещества, противовирусные вещества, вещества для подавления аппетита, лекарства от артрита, модификаторы биологического ответа, регуляторы метаболизма костной ткани, вещества, вызывающие опорожнение кишечника, сердечно-сосудистые агенты, стимуляторы центральной нервной системы, усилители метаболизма в головном мозге, церуменолитики, ингибиторы холинэстеразы, препараты от простуды и кашля, колониестимулирующие факторы, контрацептивы, цитозащитные агенты, стоматологические препараты, дезодоранты, дерматологические вещества, детоксифицирующие агенты, агенты против диабета, диагностические агенты, лекарства от диареи, агонисты дофаминовых рецепторов, электролиты, ферменты и вещества, способствующие пищеварению, препараты спорыньи, агенты для повышения фертильности, добавки в виде волокон, противогрибковые агенты, ингибиторы галактореи, ингибиторы секреции желудочной кислоты, желудочно-кишечные прокинетические агенты, ингибиторы гонадотропина, стимуляторы роста волос, гематиновые вещества, гемореологические агенты, гемостатики, антагонисты рецепторов гистамина Нг, гормоны, гипергликемические агенты, гиполипидемические вещества, иммунодепрессанты, слабительные, лепростатические вещества, добавки для лейкафереза, легочные сурфактанты, препараты от мигрени, муколитики, антагонисты миорелаксантов, миорелаксанты, антагонисты наркотиков, назальные спреи, нуклеозидные аналоги лекарств от тошноты, пищевые добавки, препараты от остеопороза, окситоцические вещества, парасимпатолитики, парасимпатомиметики, лекарственные средства от паркинсонизма, адъюванты пенициллина, фосфолипиды, ингибиторы тромбоцитов, агенты против порфирии, аналоги простагландинов, простагландины, ингибиторы протонного насоса, психотропные лекарства против зуда, хинолоны, респираторные стимуляторы, стимуляторы слюны, заменители соли, склерозирующие агенты, препараты для кожных ран, средства для прекращения курения, сульфонамиды, симпатолитики, тромболитики, агенты против синдрома Туретта, препараты против тремора, препараты против туберкулеза, агенты способствующие выведению мочевой кислоты, агенты для мочевыводящих путей, агенты для сокращения матки, агенты для расслабления матки, вагинальные препараты, агенты от головокружения, аналоги витамина D, витамины и контрастные вещества для медицинской визуализации. В некоторых случаях Соединение 1 может быть применено в качестве дополнения к лекарственной терапии, например для «выключения» гена, который производит фермент, благодаря которому происходит метаболизм определенного лекарственное средство.
[0078] Для сельскохозяйственных целей одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 можно применять для регуляции экспрессии пестицидных белков, таких как токсин Bacillus thuringiensis (Bt). Такая экспрессия может быть специфичной в отношении ткани или растения. Кроме того, особенно в случае, когда также необходим контроль вредителей растений, один или более пестицидов можно комбинировать с кристаллическими полиморфными формами или аморфными формами Соединения 1 или Соединения 2 с обеспечением тем самым дополнительных преимуществ и эффективности, включая менее общие области применения, по сравнению с тем, когда пестициды применяют отдельно. Когда используются смеси с пестицидами, относительные пропорции каждого компонента в композиции будут зависеть от относительной эффективности и желаемой применяемой дозы каждого пестицида в отношении обрабатываемых сельскохозяйственных культур, вредителей и/или сорняков. Специалистам в данной области техники будет понятно, что смеси пестицидов могут обеспечить преимущества, такие как более широкий спектр активности, по сравнению с тем, когда один пестицид используется отдельно. Примеры пестицидов, которые могут быть объединены в композиции с кристаллическими полиморфными формами или аморфными формами Соединения 1 или Соединения 2, включают фунгициды, гербициды, инсектициды, акарициды и микробиоциды.
[0079] Рецепторы экдизона у насекомых естественным образом реагируют на стероидный гормон экдизон (гормон линьки) и другие стероидные соединения, такие как понастерон А и муристерон A (Graham et al., Insect Biochemistry and Molecular Biology 37:611-626 (2007); Dinan and Hormann, "Ecdysteroid Agonists and Antagonists," Comprehensive Molecular Insect Science, lst ed.: 197-242, (2005)). Диацилгидразины, обладающие агонистической активностью в отношении рецепторов экдизона, были описаны в качестве инсектицидов (см. патент США №5530028).
[0080] Согласно другому аспекту, в настоящем изобретении предложен способ контролирования, например уменьшения, или предотвращения распространения, или убивания, насекомых, включающий приведение насекомых или их среды обитания в контакт с инсектицидно эффективным количеством одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащей их композицией. Согласно другому варианту реализации изобретения, одна или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащая их композиция, являются инсектицидно активными в отношении:
[0081] (1) насекомых порядка чешуекрылых (Lepidoptera), например Agrotis ypsilon, Agrotis segetum, Alabama argillacea, Anflcarsia gemmatalis, Argyresthia conjugella, Autographa gamma, Bupalus piniarius, Cacoecia murinana, Capua reticulana, Cheimatobia brumata, Choristoneura fumiferana, Choristoneura occidentalis, Cirphis unipuncta, Cydia pomonella, Dendrolimus pini, Diaphania nitidalls, Dlatraea grandiosella, Earias insulana, Elasmopalpus Ugnosellus, Eupoecilia ambiguella, Evetria bouliana, Feltia subterránea, Galleria mellonella, Grapholitha funebrana, Grapholitha molesta, Hellothis armigera, Hellothis virescens, Heliothis zea, Hellula undalis, Hibernia defoliaria, Hyphantria cunea, Hyponomeuta malinellus, Keiferia lycopersicella, Lambdina fiscellaria, Laphygma exigua, Leucoptera coffeella, Leucoptera scitella, Lithocolletis blancardella, Lobesia botrana, Loxostege sticticalis, Lymantria dispar, Lymantria monacha, Lyonetia clerkella, Malacosoma neustria, Mamestra brassicae, Orgyia pseudotsugata, Ostrinia nubilalls, Panolis flammea, Pectinophora gossypiella, Peridroma soucia, Phalera bucephala, Phthorimaea operculella, Phyllocnistis citrella, Pieris brassicae, Plathypena scabra, Plutella xylostella, Pseudoplusia includens, Rhyacionia frustrana, Scrobipalpula absoluta, Sitotroga cerealella, Sparganothis pilleriana, Spodoptera fruglperda, Spodoptera littoralls, Spodoptera litura, Thaumatopoea pityocampa, Tortrix viridana, Trichoplusia ni и Zeiraphera Canadensis;
[0082] (2) жестокрылых (Coleóptera), например Agrilus sinuatus, Agrietes lineatus, Agrietes obscurus, Amphimallus solstitialis, Anisandrus dispar, Anthonomus grandis, Anthonomus pomorum, Aphthona euphoridae, Athous haemorrhoidals, Atomaria linearis, Blastophagus piniperda, Blitophaga undata, Bruchus rufimanus, Bruchus pisorum, Bruchus lentis, Byctiscus betulae, Cassida nebulosa, Cerotoma trifurcata, Cetonia aurata, Ceuthorrhynchus assimilis, Ceuthorrhynchus napi, Chaetocnema tibialis, Conoderus vespertinus, Crioceris asparagi, Ctenicera ssp., Diabrotica longicornis, Diabrotica semipunctata, Diabrotica 12-punctata Diabrotica speciosa, Diabrotica virgifera, Epilachna varivestis, Epitrix hiirtpennis, Eutinobothrus brasiilensis, Hylobius abietis, Hypera brunneipennis, Hypera postica, Ips typographus, Lema bilineata, Lema melanopus, Leptinotarsa decemlineata, Limonius californicus, Lissorhoptrus oryzophilus, Melanotus communis, Meligethes aeneus, Melolontha hippocastani, Melolontha melolontha, Oulema oryzae, Otiorrhynchus sulcatus, Otiorrhynchus ovatus, Phaedon cochleariae, Phyllobius pyri, Phyllotreta chrysocephala, Phyllophaga sp., Phyllopertha horticola, Phyllotreta nemorum, Phyllotreta striolata, Popillia japonica, Sitona lineatus и Sitophilus granaria;
[0083] (3) мух, комаров (Diptera), например Aedes aegypti, Aedes albopictus, Aedes vexans, Anastrepha ludens, Anopheles maculipennis, Anopheles crucians, Anopheles albimanus, Anopheles gambiae, Anopheles freeborni, Anopheles leucosphyrus, Anopheles minimus, Anopheles quadrimaculatus, Calliphora vicina, Ceratitis capitata, Chrysomya bezziana, Chrysomya hominivorax, Chrysomya macellaria, Chrysops discails, Chrysops silacea, Chrysops allanticus, Cochliomyla hominivorax, Contarinia sorghicola Cordylobia anthropophaga, Culicoides furens, Culex pipiens, Culex nigripalpus, Culex quinquefasciatus, Culex tarsalis, Culiseta inornata, Culiseta melanura, Dacus cucurbitae, Dacus oleae, Dasineura brassicae, Delia antique, Delia coarctata, Delia platura, Delia radicum, Dermatobia hominis, Fannia canicularis, Geomyza Tripunctata, Gasterophilus intestinalis, Glossina morsiftans, Glossina palpalis, Glossina fuscipes, Glossina tachinoides, Haematobia irritons, Haplodiplosis equestris, Hippelates spp., Hylemyia platura, Hypoderma lineata, Leptoconops torrens, Liriomyza sativae, Liriomyza trifolii, Lucilia caprina, Lucilia cuprina, Lucilia sericata, Lycoria pectoralis, Mansonia titillanus, Mayetiola destructor, Musca domestica, Muscina stabulans, Oestrus ovis, Opomyza florum, Oscinella frit, Pegomya hysocyami, Phorbia antiqua, Phorbia brassicae, Phorbia coarctata, Phlebotomus argentipes, Psorophora columbiae, Psila rosae, Psorophora discolor, Prosimullum mixtum, Rhagoletis cerasi, Rhagoletis pomonella, Sarcophaga haemorrhoidalis, Sarcophaga sp., Simulium vittatum, Stomoxys calcitrans, Tabanus bovinus, Tabanus atratus, Tabanus lineóla и Tabanus similis, Tipula olerácea и Tipulapaludosa:
[0084] (4) трипсов (Thysanoptera), например Dichromothrips corbetti, Dichromothrips ssp, Frankliniella fusca, Frankllniella occidentalls, Frankllniella tritici, Scirtothrlps citri, Thrips olyzae, Thrips palmi и Thrips tabaci,
[0085] (5) термитов (Isoptera), например Calotermes flavicollis, Leucotermes flavipes, Heterotermes aureus, Reticulltermes flavipes, Retfculltermes virginicus, Reticulltermes lucifugus, Termes natalensis и Coptotermes formosanus,
[0086] (6) тараканов (Blattaria-Blattodea), например Blattella germanica, Blattella asahinae, Periplaneta americana, Periplaneta japonica, Periplaneta brunnea, Periplaneta fuligginosa, Periplaneta australasiae и Blatla orientalis;
[0087] (7) полужесткокрылых (Hemiptera), например Acrosternum hilare, Blissus leucopterus, Cyrtopeltis notatus, Dysdercus cingulatus, Dysdercus intermedius, Eurygaster integriceps, Euschistus impictivenfris, Leptoglossus phyllopus, Lygus llneolaris, Lygus pratensis, Nezara viriduia, Piesma quadrata, Solubea insularis, Thyanta perditor, Acyrthosiphon onobrychis, Adelges laricis, Aphidula nasturti; Aphis fabae, Aphis forbesi, Aphis pomi, Aphis gossypii, Aphis grossulariae, Aphis schneideri, Aphis spiraecola, Aphis sambuci, Acyrthosiphon pisum, Aulacofthum solani, Bemisia argentifolii, Brachycaudus cardui, Brachycaudus helichrysi, Brachycaudus persicae, Brachycaudus prunicola, Brevicoryne brassicae, Capiftophorus horni, Cerosipha gossypii, Chaetosiphon fragaefolii, Cryptomyzus ribis, Dreyfusia nordmannianae, Dreyfusia piceae, Dysaphis radicóla, Dysaulacorthum pseudosolani, Dysaphis plantaginea, Dysaphis pyri, Empoasca fabae, Hyalopterus pruni, Hyperomyzus lactucae, Macrosiphum avenae, Macrosiphum euphorbiae, Macrosiphon rosae, Megoura viciae, Melanaphis pyrarius, Metopolophium dirhodum, Myzus persicae, Myzus ascalonicus, Myzus cerasi, Myzus varions, Nasonovia ribis-nigri, Nilaparvata lugens, Pemphigus bursarius, Perkinsiella saccharicida, Phorodon humuli, Psylla mall, Psylla piri, Rhopalomyzus ascalonicus, Rhopalosiphum maidis, Rhopalosiphum padi, Rhopalosiphum inserfum, Sappaphis mala, Sappaphis mali, Schizaphis graminum, Schizoneura lanuginosa, Sitobion avenae, Trialeurodes vaporariorum, Toxoptera aurantiiand, Viteus vitifolli, Cimex lectularius, Cimex hemipterus, Reduvius senilis, Triatoma spp.и Arilus critatus;
[0088] (8) муравьев, пчел, ос, пилильщиков (Hymenoptera), например Athalia rosae, Atta cephalotes, Atta capiguara, Atta cephalotes, Afta laevigata, Atta robusta, Atta sexdens, Atta texana, Crematogaster spp., Hoplocampa minuta, Hoplocampa testudinea, Monomorium pharaonls, Solenopsis geminata, Solenopsis invicta, Solenopsis richteri, Solenopsis xyloni, Pogonomyrmex barbatus, Pogonomyrmex californicus, Pheidole megacephala, Dasymutilla occidentalis, Bombus spp. Vespula squamosa, Paravespula vulgaris, Paravespula pennsylvanica, Paravespula germanica, Dolichovespula maculata, Yespa crabro, Polistes rubiginosa, Camponotus floridanus и Linepithema humile;
[0089] (9) сверчков, кузнечиков, саранчи (Orthoptera), например Acheta domestica, Gryllotalpa gryllotalpa, Locusta migratoria, Melanoplus bivittatus, Melanoplus femurrubrum, Melanoplus mexicanus, Melanoplus sanguinipes, Melanoplus spretus, Nomadacris septemfasciata, Schistocerca americans, Schistocerca gregaria, Dociostaurus maroccanus, Tachycines asynamorus, Oedaleus senegalensis, Zonozerus variegatus, Hieroglyphus daganensis, Kraussaria angulifera, Calliptamus itallcus, Chortoicetes terminifera и Locustana pardalina;
[0090] (10) Arachnoidea, таких как паукообразные (Acarina), например принадлежащих к семействам Argasidae, Ixodidae и Sarcoptidae, таких как Amblyomma americanum, Amblyomma variegatum, Ambryomma maculatum, Argas persicus, Boophilus annulatus, Boophilus decoloratus, Boophilus microplus, Dermacentor silvarum, Dermacentor andersoni, Dermacentor variabilis, Hyalomma truncatum, Ixodes ricinus, Ixodes rubicundus, Ixodes scapularis, Ixodes holocyclus, Ixodes pacificus, Ornithodorus moubata, Ornithodorus hermsi, Ornithodorus turicata, Ornithonyssus bacoti, Otobius megnini, Dermanyssus gallinae, Psoroptes ovis, Rhipicephalus sanguineus, Rhipicephalus appendiculatus, Rhipicephalus evertsi, Sarcoptes scabiei и Eriophyidae spp., таких как Aculus schlechtendali, Phyllocoptrata oleivora and Eriophyes sheldoni, Tarsonemidae spp., таких как Phytonemus pallidus and Polyphagotarsonemus latus; Tenuipalpidae spp., таких как Brevipalpus phoenicis; Tetranychidae spp., таких как Tetranychus cinnabarinus, Tetranychus kanzawai, Tetranychus paciflcus, Tetranychus telarius и Tetranychus urticae, Panonychus ulmi, Panonychus citri и Oligonychus pratensis; Araneida, например Lafrodectus mactans и Loxosceles reclusa,
[0091] (11) блох (Siphonaptera), например Ctenocephalides felis, Ctenocephalides canis, Xenopsylla cheopis, Pulex irriftans, Tunga penefrans и Nosopsyllus fasciatus;
[0092] (12) чешуйниц, термобий (Thysanura), например Lepisma saccharins и Thermobia domestics:
[0093] (13) губоногих (Chilopoda), например Scutigera coleoptrata,
[0094] (14) двупарноногих многоножек (Diplopoda), например Narceus spp.,
[0095] (15) уховерток (Dermaptera), например Forifcula auricularia; и/или
[0096] (16) пухоедов и вшей (Phthiraptera), например Pediculus humanus capitis, Pediculus humanus corporis, Pthirus pubis, Haematopinus eurysternus, Haematopinus suis, Linognathus vituli, Bovicola bovis, Menopon gallinae, Menacanthus stramineus и Solenopotes capillatus.
[0097] Согласно другому варианту реализации изобретения, одна или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащая их композиция, являются инсектицидно активными в отношении насекомых порядков Diptera, Hemiptera и/или Lepidoptera. Согласно другому варианту реализации изобретения, одна или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащая их композиция, являются инсектицидно активными в отношении насекомых порядка Lepidoptera. Согласно другому варианту реализации изобретения, одна или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащая их композиция, являются инсектицидно активными в отношении насекомых порядка Hemiptera.
[0098] Указанные кристаллические полиморфные формы или аморфные формы Соединения 1 или Соединения 2, описанные в настоящем документе, могут быть нанесены на листву растений в виде водных спреев обычно применяемыми способами, например в виде обычных гидравлических спреев большого объема, спреев малого объема, воздушно-доменных и воздушных спреев. Разведение и применяемая доза будут зависеть от типа применяемого оборудования, способа и необходимой частоты применения и применяемой дозы лиганда. Может быть необходимо включать дополнительные адъюванты в распылительную емкость. Такие адъюванты включают поверхностно-активные вещества, диспергаторы, распределители, клейкие вещества, агенты против вспенивания, эмульгаторы и другие подобные вещества, описанные в источниках McCutcheon's Emulsifiers and Detergents, McCutcheon's Emulsifiers and Detergents/Functional Materials и McCutcheon's Functional Materials, выпускаемых ежегодно отделением McCutcheon Division компании MC Publishing Company (Нью-Джерси). Кристаллические полиморфные формы или аморфные формы Соединения 1 или Соединения 2 могут быть также смешаны с удобрениями или удобряющими материалами перед их применением. Кристаллические полиморфные формы или аморфные формы Соединения 1 или Соединения 2 и твердый удобряющий материал могут быть также смешаны с применением смешивающего или перемешивающего оборудования, или они могут быть включены в удобрения в виде гранулярных составов. Могут использоваться любые относительные количества удобрения, подходящие для обрабатываемых сельскохозяйственных культур и сорняков. Указанные кристаллические полиморфные формы или аморфные формы Соединения 1 или Соединения 2, описанные в настоящем документе, обычно составляют от 5% до 50% от удобряющей композиции. Такие композиции обеспечивают удобряющие материалы, которые способствуют быстрому росту необходимых растений и в то же время регулируют экспрессию генов.
[0099] В настоящем документе термин «Соединение 1» обозначает N-(1-трет-бутилбутил)-N'-(2-этил-3-метоксибензоил)-гидразид (R)-3,5-диметилбензойной кислоты. Согласно одному из вариантов реализации настоящего изобретения, Соединение 1 содержит примерно 10% или менее, то есть примерно 9%, примерно 8%, примерно 7%, примерно 6%, примерно 5%, примерно 4%, примерно 3%, примерно 2%, примерно 1%, или примерно 0,5%, или менее, N-(1-трет-бутилбутил)-N'-(2-этил-3-метоксибензоил)-гидразида (S)-3,5-диметилбензойной кислоты, по массе. Стереоизомерную чистоту Соединения 1 можно определить, используя традиционные аналитические методы, такие как хиральная ВЭЖХ.
[0100] В настоящем документе термин «Соединение 2» обозначает N-(1-трет-бутилбутил)-N'-(2-этил-3-метоксибензоил)-гидразид (S)-3,5-диметилбензойной кислоты. Согласно одному из вариантов реализации настоящего изобретения, Соединение 2 содержит примерно 10% или менее, то есть примерно 9%, примерно 8%, примерно 7%, примерно 6%, примерно 5%, примерно 4%, примерно 3%, примерно 2%, примерно 1%, или примерно 0,5%, или менее, N-(1-трет-бутилбутил)-N'-(2-этил-3-метоксибензоил)-гидразида (R)-3,5-диметилбензойной кислоты, по массе. Стереоизомерную чистоту Соединения 2 можно определить, используя традиционные аналитические методы, такие как хиральная ВЭЖХ.
[0101] В настоящем документе термин «по существу чистый» в отношении конкретной кристаллической полиморфной формы Соединения 1 или Соединения 2 означает, что указанная полиморфная форма содержит примерно 10% или менее, то есть примерно 9%, примерно 8%, примерно 7%, примерно 6%, примерно 5%, примерно 4%, примерно 3%, примерно 2%, или примерно 1%, или менее, по массе любых других физических форм Соединения 1 или Соединения 2, соответственно.
[0102] В настоящем документе термин «по существу чистый» в отношении аморфного Соединения 1 или Соединения 2 означает, что указанная аморфная форма содержит примерно 10% или менее, то есть примерно 9%, примерно 8%, примерно 7%, примерно 6%, примерно 5%, примерно 4%, примерно 3%, примерно 2%, или примерно 1%, или менее, по массе любых кристаллических форм Соединения 1 или Соединения 2, соответственно.
[0103] В настоящем документе термин «чистый» в отношении конкретной кристаллической полиморфной формы Соединения 1 или Соединения 2 означает, что указанная полиморфная форма содержит примерно 1% или менее, то есть примерно 0,9%, примерно 0,8%, примерно 0,7%, примерно 0,6%, примерно 0,5%, примерно 0,4%, примерно 0,3%, примерно 0,2%, или примерно 0,1%, или менее, по массе любых других физических форм Соединения 1 или Соединения 2, соответственно. Согласно одному из вариантов реализации настоящего изобретения, «чистая» полиморфная форма не содержит обнаруживаемых с помощью PXRD количеств любых других физических форм Соединения 1.
[0104] В настоящем документе термин «чистый» в отношении аморфного Соединения 1 или Соединения 2 означает, что указанная аморфная форма содержит примерно 1% или менее, то есть примерно 0,9%, примерно 0,8%, примерно 0,7%, примерно 0,6%, примерно 0,5%, примерно 0,4%, примерно 0,3%, примерно 0,2%, или примерно 0,1%, или менее, по массе любых кристаллических форм Соединения 1 или Соединения 2, соответственно.
[0105] В настоящем документе термин «аморфный» обозначает твердую форму Соединения 1 или Соединения 2, которая не обладает характеристикой дальнего порядка, присущей кристаллу, то есть данное твердое вещество является некристаллическим.
[0106] В настоящем документе термин «по существу такой же» в отношении положения и относительных интенсивностей пиков PXRD означает, что при сравнении дифрактограмм PXRD во внимание принимается вариабельность положения пика и его интенсивности. Аналогично, термин «по существу такой же» в отношении положений пиков Фурье-спектров комбинационного рассеяния означает, что при сравнении Фурье-спектров комбинационного рассеяния во внимание принимается вариабельность положения пика. Например, среди положений пиков PXRD может проявляться приборная вариабельность, например величиной 0,2°. Среди относительных интенсивностей пиков также может проявляться приборная вариабельность вследствие степени кристалличности, ориентации, поверхности полученного образца и других факторов, известных специалистам, и относительные интенсивности пиков должны быть приняты во внимание только как качественные показатели.
[0107] В настоящем документе термин «микронизация» обозначает процесс или способ, посредством которого уменьшают размер совокупности частиц, как правило, до микронных размеров.
[0108] В настоящем документе термины «микрон» или «мкм» обозначают «микрометр», который составляет 1×10-6 метра.
[0109] В настоящем документе термин «терапевтически эффективное количество» обозначает количество Соединения 1 или Соединения 2, достаточное для лечения одного или более симптомов заболевания, состояния, повреждения или расстройства или предотвращения развития заболевания, состояния, повреждения или расстройства, или обеспечения подавления заболевания, состояния, повреждения или расстройства. Например, в отношении лечения рака, согласно одному из вариантов реализации настоящего изобретения, терапевтически эффективное количество будет обозначать количество Соединения 1 или Соединения 2, которое снижает скорость роста опухоли, снижает массу опухоли, снижает количество метастазов, увеличивает время до прогрессирования опухоли или увеличивает время жизни на по меньшей мере примерно 5%, по меньшей мере примерно 10%, по меньшей мере примерно 15%, по меньшей мере примерно 20%, по меньшей мере примерно 25%, по меньшей мере примерно 30%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере примерно 45%, по меньшей мере примерно 50%, по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или по меньшей мере примерно 100%.
[0110] В настоящем документе термин «инсектицидно эффективное количество» обозначает количество Соединения 1 или Соединения 2, достаточное для контролирования, например уменьшения, или предотвращения распространения, или убивания, насекомых. Например, инсектицидно эффективное количество обозначает количество Соединения 1 или Соединения 2, которое индуцирует преждевременную линьку и гибель насекомого.
[0111] Формы единственного числа обозначают один или более чем один.
[0112] Термин «примерно» в настоящем документе включает указанное значение ±10%. Таким образом, «примерно 10» означает от 9 до 11.
[0113] В настоящем документе термин "среднее распределение размеров частиц " или "D50" представляет собой диаметр, где 50 масс. % частиц имеют больший эквивалентный диаметр, а другие 50 масс. % имеют меньший эквивалентный диаметр по данным измерений посредством лазерной дифракции на приборе Master Sizer Microplus компании Malvern или эквивалентном ему, или посредством других подходящих методик.
[0114] В настоящем документе термин «не образующий сольватов растворитель» обозначает растворитель, который не образует сольватов или гидратов с Соединением 1 или Соединением 2, где не образующие сольватов растворители включают, но не ограничиваются только ими, гексан, гептан, кумол, диэтиловый эфир, толуол, этилацетат, трет-бутилметиловый эфир, н-додекан, этанол и изопропанол.
[0115] В настоящем документе термин «вспомогательное вещество» обозначает любой ингредиент в композиции, отличный от одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2. Вспомогательное вещество, как правило, представляет собой инертное вещество, добавленное в композицию для облегчения обработки, обращения, введения и т.п. одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2. Подходящие для применения вспомогательные вещества включают, но не ограничиваются только ими, адъюванты, антиадгезивные вещества, связующие вещества, носители, разрыхлители, наполнители, вкусоароматические вещества, красители, разбавители, смазывающие вещества, вещества, способствующие скольжению, консерванты, сорбенты, растворители, поверхностно-активные вещества и подсластители.
[0116] Традиционные фармацевтические вспомогательные вещества хорошо известны специалистам в данной области. В частности, специалисту в данной области будет понятно, что в смеси с кристаллическими полиморфными формами или аморфными формами Соединения 1 или Соединения 2 можно использовать большое разнообразие фармацевтически приемлемых носителей, включая перечисленные в Handbook of Pharmaceutical Вспомогательных веществ, Pharmaceutical Press 4th Ed. (2003) и Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins, 21st ed. (2005). Согласно одному из вариантов реализации настоящего изобретения, композиция содержит одно или более из следующих вспомогательных веществ: вода, лабразол, лаурогликоль 90, фозал 53 МСТ (Phosal 53 МСТ), миглиол, кремофор EL (Cremophor EL), полисорбат 80, Криллет 1 HP (Crillet 1 HP), изопропилмиристат, олеиновая кислота и/или ПЭГ 400 NF (PEG 400 NF). Согласно другому варианту реализации изобретения, композиция содержит липид.
[0117] Фармацевтически приемлемые вспомогательные вещества включают вспомогательные вещества, такие как сахариды, например трегалозу, лактозу или сахарозу, маннит или сорбит, целлюлозные препараты и/или фосфаты кальция, например трикальцийфосфат или гидрофосфат кальция, а также связующие вещества, такие как крахмальная паста, в которой использован, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакант, метилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллолозу натрия и/или поливинилпирролидон. При необходимости могут быть добавлены разрыхляющие агенты, такие как вышеупомянутые крахмалы, а также карбоксиметилкрахмал, сшитый поливинилпирролидон, агар, или альгиновая кислота или ее соль, такая как альгинат натрия. Вспомогательные вещества представляют собой агенты для регулирования текучести и смазывающие вещества, например диоксид кремния, тальк, стеариновую кислоту или ее соли, такие как стеарат магния или стеарат кальция и/или полиэтиленгликоль. Согласно одному из вариантов реализации настоящего изобретения, ядра драже снабжают подходящими покрытиями, которые, при необходимости, устойчивы к действию желудочного сока. С этой целью могут быть использованы концентрированные растворы сахаридов, которые могут необязательно содержать гуммиарабик, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, растворы лака и подходящие органические растворители или смеси растворителей. Для получения покрытий, устойчивых к желудочному соку, используют растворы подходящих целлюлозных препаратов, таких как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы. К таблеткам или покрытиям для драже могут быть добавлены красящие вещества или пигменты, например для идентификации или для характеристики комбинации доз активных соединений.
[0118] Фармацевтические препараты, которые могут быть применены перорально, включают капсулы, изготовленные из желатина, а также мягкие запечатанные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит.Нажимные капсулы могут содержать активные соединения в форме гранул или наночастиц, которые необязательно могут быть смешаны с наполнителями, такими как лактоза, связующими веществами, такими как крахмалы и/или смазывающими веществами, такими как тальк или стеарат магния, и, необязательно, стабилизаторами. Согласно одному из вариантов реализации настоящего изобретения, проводят растворение или суспендирование в подходящих жидкостях, таких как жирные масла или жидкий парафин, необязательно со стабилизаторами.
[0119] Жирные кислоты могут включать моно-, ди- или триглицериды. Mоно-, ди- и триглицериды включают моно-, ди- или триглицериды, полученные из С6-, С8-, С10-, C12-, C14-, C16-, C18-, C20- и С22-кислот. Иллюстративные диглицериды включают, в частности, диолеиновые, дипальмитолеиновые и смешанные каприлин-каприновые диглицериды. Предпочтительные триглицериды включают растительные масла, рыбий жир, животные жиры, гидрогенизированные растительные масла, частично гидрогенизированные растительные масла, синтетические триглицериды, модифицированные триглицериды, фракционированные триглицериды, триглицериды с цепью средней длины и с длинной цепью, структурированные триглицериды и их смеси. Иллюстративные триглицериды включают: миндальное масло, масло бабассу, масло огуречника, масло семян черной смородины, каноловое масло, касторовое масло, кокосовое масло, кукурузное масло, хлопковое масло, масло примулы вечерней, масло из виноградных косточек, масло земляного ореха, горчичное масло, оливковое масло, пальмовое масло, пальмоядровое масло, арахисовое масло, рапсовое масло, сафлоровое масло, кунжутное масло, масло из печени акулы, соевое масло, подсолнечное масло, гидрогенизированное касторовое масло, гидрогенизированные кокосовое масло, гидрогенизированные пальмовое масло, гидрогенизированное соевое масло, гидрогенизированное растительное масло, гидрогенизированное хлопковое и касторовое масло, частично гидрогенизированное соевое масло, частично соевое и хлопковое масло, глицерилтрикапроат; глицерилтрикаприлат, глицерилтрикапрат, глицерилтриундеканоат, глицерилтрилаурат, глицерилтриолеат, глицерилтрилинолеат, глицерилтрилиноленат, глицерилтрикаприлат/капрат, глицерилтрикаприлат/капрат/лаурат, глицерилтрикаприлат/капрат/линолеат и глицерилтрикаприлат/капрат/стеарат.
[0120] Согласно одному из вариантов реализации настоящего изобретения, триглицерид представляет собой триглицерид с цепью средней длины, доступный под торговым наименованием LABRAFAC СС. Другие триглицериды включают нейтральные масла, например нейтральные растительные масла, в частности фракционированные кокосовые масла, такие как известны и коммерчески доступны под торговым наименованием МИГЛИОЛ (MIGLYOL), включая продукты: МИГЛИОЛ 810 (MIGLYOL 810); МИГЛИОЛ 812 (MIGLYOL 812); МИГЛИОЛ 818 (MIGLYOL 818) и КАПТЕКС 355 (САРТЕХ 355). Другие триглицериды представляют собой триглицериды каприловой-каприновой кислот, такие как известны и коммерчески доступны под торговым наименованием МИРИТОЛ (MYRITOL), включая продукт МИРИТОЛ 813 (MYRITOL 813). Другими триглицеридами из данного класса являются КАПМУЛ МСТ (CAPMUL МСТ), КАПТЕКС 200 (САРТЕХ 200), КАПТЕКС 300 (САРТЕХ 300), КАПТЕКС 800 (САРТЕХ 800), НЕОБИ М5 (NEOBEE М5) и МАЗОЛ 1400 (MAZOL 1400).
[0121] Фармацевтические композиции, содержащие триглицериды, могут дополнительно содержать липофильные и/или гидрофильные поверхностно-активные вещества, которые могут образовывать прозрачные растворы при растворении водным растворителем. Одним из таких поверхностно-активных веществ является сукцинат токоферилполиэтиленгликоля 1000 сукцинат (витамин Ε TPGS). Примеры таких композиций описаны в патенте США 6267985.
[0122] Согласно другому варианту реализации изобретения, фармацевтически приемлемый носитель содержит ЛАБРАЗОЛ (LABRASOL, Gattefosse SA), который представляет собой ПЭГ-8-илированные каприловые/каприновые триглицериды. Согласно другому варианту реализации изобретения, фармацевтически приемлемый носитель содержит PL90G, витамин Ε TPGS и Миглиол 812N (Miglyol 812N).
[0123] В настоящем документе термин «лечить» или "лечение", согласно его значению, охватывает введение субъекту одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащей их композиции, для целей уменьшения выраженности или излечения заболевания, расстройства, повреждения или состояния, включая упреждающее лечение.
[0124] В настоящем документе термин «субъект» обозначает интактное насекомое, растение, водоросль или животное, например человека или животное, отличное от человека, например корову, овцу, свинью, лошадь, собаку или кошку. Согласно одному из вариантов реализации настоящего изобретения, клетка-хозяин субъекта содержит полинуклеотид, кодирующий переключатель генов, который содержит лигандсвязывающий домен, который связывается с Соединением 1. Согласно другому варианту реализации изобретения, клетка-хозяин субъекта содержит полинуклеотид, кодирующий переключатель генов, который содержит лигандсвязывающий домен, который связывается с Соединением 2.
[0125] В настоящем документе термин «интересующий ген» представляет собой любой ген, который необходимо экспрессировать, где данный ген кодирует пептид, белок или полипептид.
[0126] В настоящем документе термин «экспрессия генов» обозначает транскрипцию ДНК с получением информационной РНК (hRNA) и/или трансляцию иРНК с получением аминокислотной последовательности.
[0127] В настоящем документе термин «регулирование экспрессии генов» обозначает повышение уровня экспрессии генов в ответ на приведение Соединения 1 в контакт с лигандсвязывающий доменом, который связывается с Соединением 1, по отношению к уровню экспрессии генов в отсутствие приведения лигандсвязывающего домена, который связывается с Соединением 1, в контакт с Соединением 1.
[0128] В настоящем документе термин «переключатель генов» обозначает пептид, белок или полипептидный комплекс, действие которого заключается в (а) связывании Соединения 1 или Соединения 2, то есть лиганда, и (b) регуляции транскрипции интересующего гена интереса лиганд-зависимым образом. Переключатели генов являются подходят для применения в различных областях, таких как генная терапия, получение белков в клетках, высокопроизводительных скрининговых исследований с применением клеток, функциональной геномики и регулирования признаков трансгенных растений и животных.
[0129] Согласно одному из вариантов реализации настоящего изобретения, полинуклеотид, кодирующий переключатель генов, представляет собой рекомбинантный полинуклеотид, то есть полинуклеотид, который сконструирован путем биологических операций для кодирования переключателя генов. Согласно другому варианту реализации изобретения, указанный рекомбинантный полинуклеотид представляет собой синтетический полинуклеотид.
[0130] В настоящем документе термин «ген» обозначает полинуклеотид, содержащий нуклеотиды, которые кодируют функциональную молекулу, включая функциональные молекулы, полученные исключительно путем транскрипции (например, биологически активные виды РНК) или путем транскрипции и трансляции (например, полипептид). Термин «ген» включает кДНК и нуклеиновые кислоты геномной ДНК. Термин «ген» также обозначает фрагмент нуклеиновой кислоты, который экспрессирует определенную РНК, белок или полипептид, включая регуляторные последовательности, предшествующие (5'-некодирующие последовательности) и находящиеся после (3'-некодирующие последовательности) кодирующей последовательности. Термин «природный ген» обозначает ген, который встречается в природе с его собственными регуляторными последовательностями. Термин «химерный ген» обозначает любой ген, который не является природным геном, включая регуляторные и/или кодирующие последовательности, которые не встречаются вместе в природе. Соответственно, химерный ген может содержать регуляторные последовательности и кодирующие последовательности, которые получены из различных источников, или регуляторные последовательности и кодирующие последовательности, полученные из одного источника, но расположенные не таким образом, как встречается в природе. Химерный ген может содержать кодирующие последовательности, полученные из различных источников и/или регуляторные последовательности, полученные из различных источников. Термин «эндогенный ген» обозначает природный ген в своем естественном месте в геноме организма. Термин «чужеродный» ген, или «гетерологичный», или «экзогенный» ген обозначает ген, обычно не встречающийся в организме хозяина, но который вводится в организм хозяина путем переноса генов. Чужеродные гены могут включать природные гены, введенные в неприродный организм, или химерные гены. «Трансген» представляет собой ген, который был введен в геном с помощью процедуры трансформации.
[0131] Согласно одному из вариантов реализации настоящего изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 вводят в изолированную клетку-хозяин или субъекту в виде композиции. Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 вводят в изолированную клетку-хозяин или субъекту в виде фармацевтически приемлемой композиции.
[0132] В настоящем документе термин «димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1» обозначает селективное белок-белковое взаимодействие.
[0133] Согласно одному из вариантов реализации настоящего изобретения, эффективность переключателя генов или "ЕС50" Соединения 1 составляет примерно 100 нМ или менее, например примерно 75 нМ примерно 50 нМ, примерно 25 нМ, примерно 15 нМ, примерно 10 нМ, примерно 9 нМ, примерно 8 нМ, примерно 7 нМ, примерно 6 нМ, примерно 5 нМ, примерно 4 нМ, примерно 3 нМ, примерно 2 нМ, примерно 1 нМ, примерно 0,5 нМ или менее в анализе переключения генов в клетках. Примеры анализов in vitro для измерения регулируемой переключателем генов экспрессии генов хорошо известны специалистам в данной области. См., например, Karzenowski et al., BioTechniques 39: 191-200 (2005). Согласно другому варианту реализации изобретения, эффективность переключателя генов Соединения 2 составляет примерно 100 нМ или менее, например примерно 75 нМ примерно 50 нМ, примерно 25 нМ, примерно 15 нМ, примерно 10 нМ, примерно 9 нМ, примерно 8 нМ, примерно 7 нМ, примерно 6 нМ, примерно 5 нМ, примерно 4 нМ, примерно 3 нМ, примерно 2 нМ, примерно 1 нМ, примерно 0,5 нМ или менее в анализе переключения генов в клетках. В настоящем документе «ЕС50» представляет собой «половинную максимальную эффективную концентрацию», что обозначает концентрацию Соединения 1 или Соединения 2, которая индуцирует регулируемое переключателем генов изменение экспрессии полинуклеотида, кодирующего интересующий ген, которое составляет половину расстояния между базовым уровнем экспрессии и максимальным уровнем экспрессии по истечении определенного времени выдержки.
[0134] В настоящем документе термин «лигандсвязывающий домен, который связывается с Соединением 1» обозначает аминокислотную последовательность, которая селективно связывается с Соединением 1. В способах, описанных в настоящем документе, Соединение 1 связывается с лигандсвязывающим доменом, например лигандсвязывающим доменом рецептора экдизона, который является частью комплекса лигандзависимой активации транскрипции, регулирующего экспрессию полинуклеотидной последовательности, кодирующей интересующий ген. Таким образом, экспрессия интересующего гена регулируется лигандзависимым образом (зависимым от Соединения 1 образом). Аналогично, термин «лигандсвязывающий домен, который связывается с Соединением 2» обозначает аминокислотную последовательность, которая селективно связывается с Соединением 2.
[0135] Согласно одному из вариантов реализации настоящего изобретения, лигандсвязывающий домен, который связывается с Соединением 1, например лигандсвязывающий домен рецептора экдизона, димеризуется с другим лигандсвязывающим доменом, например лигандсвязывающим доменом ретиноидного Х-рецептора, с образованием белок-белкового комплекса.
[0136] Согласно одному из вариантов реализации настоящего изобретения, экспрессию интересующего гена регулируют посредством Соединения 1 или Соединения 2 в режиме включение/выключение, который зависит от концентрации или дозировки Соединения 1 или Соединения 2, соответственно. Согласно другому варианту реализации изобретения, экспрессию интересующего гена регулируют посредством Соединения 1 в режиме, зависимом от концентрации (или дозировки), то есть существует взаимосвязь доза-ответ между концентрацией (или дозировкой) Соединения 1 и уровнем экспрессии интересующего гена. См., например, US 2009/0123441.
[0137] Термин «функционально связан» обозначает ассоциацию полинуклеотидных последовательностей на едином полинуклеотиде с обеспечением влияния одного на функцию другого. Например, промотор функционально связан с кодирующей последовательностью, когда он может влиять на экспрессию кодирующей последовательности (то есть кодирующая последовательность находится под транскрипционным контролем промотора). Кодирующие последовательности могут быть функционально связаны с регуляторными последовательностями в смысловой и антисмысловой ориентации.
[0138] Согласно одному из вариантов реализации настоящего изобретения, клетка-хозяин представляет собой изолированную клетку-хозяина. Согласно одному из вариантов реализации настоящего изобретения, термин «изолированная» клетка-хозяин обозначает клетку, которая находится в субъекте. Согласно одному из вариантов реализации настоящего изобретения, термин «выделенная» клетка-хозяина обозначает одну или более клеток-хозяев в аппарате для культур клеток или в препарате клеточной культуры.
[0139] Согласно одному из вариантов реализации настоящего изобретения, клетка-хозяин находится внутри субъекта, и с указанной клеткой-хозяином приводят в контакт Соединение 1 или Соединение 2 путем введения субъекту одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащей их композиции. Согласно другому варианту реализации изобретения, клетку-хозяина приводят в контакт с одной или более кристаллических полиморфных форм Соединения 1, или содержащей их композицией, in vitro. Согласно другому варианту реализации изобретения, клетку-хозяина приводят в контакт с одной или более кристаллических полиморфных форм Соединения 1, или содержащей их композицией, ex vivo. Согласно другому варианту реализации изобретения, клетка-хозяин находится в субъекте, представляющем собой человека. Согласно другому варианту реализации изобретения, клетка- хозяин находится в субъекте, представляющем собой животное. Согласно другому варианту реализации изобретения, клетка-хозяин находится в субъекте, представляющем собой растение. Согласно другому варианту реализации изобретения, клетка-хозяин находится в субъекте, представляющем собой водоросль. Согласно другому варианту реализации изобретения, с клеткой-хозяином приводят в контакт кристаллическую Форму III Соединения 1, или композицию, содержащую кристаллическую Форму III Соединения 1 и одно или более вспомогательных веществ.
[0140] Согласно одному из вариантов реализации настоящего изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту. Согласно одному из вариантов реализации настоящего изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту перорально. Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту парентерально. Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят подкожно, внутримышечно, внутривенно, внутрибрюшинно или внутрь опухоли. Согласно другому варианту реализации изобретения, кристаллическую Форму III Соединения 1, или содержащую их композицию, вводят субъекту. Согласно другому варианту реализации изобретения, аморфную Форму X Соединения 1, или содержащую их композицию, вводят субъекту.
[0141] В дополнение к или совместно с вышеуказанными способами введения, одна или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащая их композиция, могут быть добавлены в пищевой продукт, потребляемый субъектом. Согласно одному из вариантов реализации настоящего изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, объединяют, смешивают или примешивают к пищевому материалу с получением «пищевого продукта». Термин «пищевой материал» используется в его наиболее широком значении из возможных и включает любую форму, например твердое вещество, эмульсию, жидкость, проглатываемых материалов, потребляемых животным, например человеком. Пищевые продукты могут быть приготовлены таким образом, что субъект принимает определенное количество одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2 с рационом. Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, готовят в виде премикса для добавления к пищевому материалу. Согласно одному из вариантов реализации настоящего изобретения, указанный пищевой продукт или премикс содержит одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, и один или более липидов.
[0142] Согласно одному из вариантов реализации настоящего изобретения, лигандсвязывающий домен в переключателе генов, который связывается с Соединением 1 или Соединением 2, представляет собой лигандсвязывающий домен ядерного рецептора группы Н, или его мутант, который связывается с Соединением 1 или Соединением 2, соответственно. Согласно другому варианту реализации изобретения, указанный лигандсвязывающий домен ядерного рецептора группы H выбран из группы, состоящей из лигандсвязывающего домена рецептора экдизона, лигандсвязывающего домена убиквитарного (ubiquitous) рецептора, лигандсвязывающего домена орфанного рецептора-1, лигандсвязывающего домена NER-1, лигандсвязывающего домена взаимодействующего с рецептором белка-15, лигандсвязывающего домена печеночного Х-рецептора-3, лигандсвязывающего домена белка, подобного рецептору стероидного гормона, лигандсвязывающего домена печеночного Х-рецептора, лигандсвязывающего домена печеночного Х-рецептора, лигандсвязывающего домена фарнезоидного Х-рецептора, лигандсвязывающего домена взаимодействующего с рецептором белка-14 и лигандсвязывающего домена лигандсвязывающего домена фарнезольного рецептора, или их мутанта, который связывается с Соединением 1.
[0143] Согласно другому варианту реализации изобретения, лигандсвязывающий домен ядерного рецептора группы H представляет собой лигандсвязывающий домен рецептора экдизона или его мутант, который связывается с Соединением 1 или Соединением 2. Согласно другому варианту реализации изобретения, лигандсвязывающий домен рецептора экдизона выбран из группы, состоящей из лигандсвязывающего домена рецептора экдизона Arthropod, лигандсвязывающего домена рецептора экдизона Lepidopter, Dipter лигандсвязывающего домена рецептора экдизона, лигандсвязывающего домена рецептора экдизона Orthopter, лигандсвязывающего домена рецептора экдизона Homopter и лигандсвязывающего домена рецептора экдизона Hemipter, лигандсвязывающего домена рецептора экдизона листовертки-почкоеда елового Choristoneura fumiferana, лигандсвязывающего домена рецептора экдизона жука Tenebrio molitor, лигандсвязывающего домена рецептора экдизона Manduca sexta, лигандсвязывающего домена рецептора экдизона Heliothies virescens, лигандсвязывающего домена рецептора экдизона комара-звонца Chironomus tentons, лигандсвязывающего домена рецептора экдизона тутового шелкопряда Bombyx топ, лигандсвязывающего домена рецептора экдизона коричневой кустарниковой бабочки Bicyclus апупапа, лигандсвязывающего домена рецептора экдизона конскокаштанового насекомого Junonia coenia, лигандсвязывающего домена рецептора экдизона плодовой мушки Drosophila melanogaster, лигандсвязывающего домена рецептора экдизона комара Aedes aegypti, лигандсвязывающего домена рецептора экдизона мясной мухи Lucilia capitata, лигандсвязывающего домена рецептора экдизона мясной мухи Lucilia cuprina, лигандсвязывающего домена рецептора экдизона мясной мухи Calliphora vicinia, лигандсвязывающего домена рецептора экдизона мухи средиземноморской плодовой Ceratitis capitata, лигандсвязывающего домена рецептора экдизона саранчи Locusta migratoria, лигандсвязывающего домена рецептора экдизона тли Myzus persicae, лигандсвязывающего домена рецептора экдизона манящего краба Celuca pugilator, лигандсвязывающего домена рецептора экдизона иксоидного клеща АтЫуотта americanum, лигандсвязывающего домена рецептора экдизона белокрылки Bamecia argentifoli, лигандсвязывающего домена рецептора экдизона кобылочки Nephotetix cincticeps, или их мутанта, который связывается с Соединением 1 или Соединением 2. Согласно другому варианту реализации изобретения, лигандсвязывающий домен рецептора экдизона представляет собой лигандсвязывающий домен рецептора экдизона листовертки-почкоеда елового Choristoneura fumiferana, имеющий следующую аминокислотная последовательность:
Leu Thr Ala Asn Gin Gin Phe Leu Ile Ala Arg Leu Бе Tip Туг Gin Asp Gly Tyr Glu Gin Pro Ser Asp Glu Asp Leu Lys Arg He Thr Gin Thr Trp Gin Gin Ala Asp Asp Glu Asn Glu Glu Ser Asp Thr Pro Phe Arg Gin Ile Thr Glu Met Thr lie Leu Thr Val Gin Leu Ile Val Glu Phe Ala Lys Gly Leu Pro Gly Phe Ala Lys He Ser Gin Pro Asp Gin He Thr Leu Leu Lys Ala Cys Ser Ser Glu Val Met Met Leu Arg Val Ala Arg Arg Tyr Asp Ala Ala Ser Asp Ser Val (position 107) Leu Phe Ala Asn Asn Gin Ala Tyr Thr Arg Asp Asn Tyr Arg Lys Ala Gly Met Ala Tyr (position 127) Val Ile Glu Asp Leu Leu His Phe Cys Arg Cys Met Tyr Ser Met Ala Leu Asp Asn He His Tyr Ala Leu Leu Thr Ala Val Val lie Phe Ser Asp Arg Pro Gly Leu Glu Gin Pro Gin Leu Val Glu Glu Ile Gin Arg Tyr Tyr Leu Asn Thr Leu Arg Ile Tyr Ile Leu Asn Gin Leu Ser Gly Ser Ala Arg Ser Ser Val Бе Туг Gly Lys Ile Leu Ser Ile Leu Ser Glu Leu Arg Thr Leu Gly Met Gin Asn Ser Asn Met Cys lie Ser Leu Lys Leu Lys Asn Arg Lys Leu Pro Pro Phe Leu Glu Glu Ile Trp Asp Val (SEQ ID NO: 1), данная последовательность также представлена как SEQ NO: 1 в патентной публикации США №2006/0100416 Al.
[0144] Согласно другому варианту реализации изобретения, лигандсвязывающий домен рецептора экдизона представляет собой мутант лигандсвязывающего домена рецептора экдизона листовертки-почкоеда елового Choristoneura fumiferana, который связывается с Соединением 1.
[0145] Подходящие лигандсвязывающие домены рецептора экдизона включают домены, описанные, например, в патентах США №№7935510, 7919269, 7563879 и в патентной публикации США №2006/0100416 Al.
[0146] Согласно одному из вариантов реализации настоящего изобретения, переключатель генов содержит лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2. Согласно одному из вариантов реализации настоящего изобретения, указанный лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, представляет собой лигандсвязывающий домен ядерного рецептора группы В. Согласно другому варианту реализации изобретения, указанный лигандсвязывающий домен ядерного рецептора группы В выбран из группы, состоящей из лигандсвязывающего домена ретиноидного Х-рецептора, лигандсвязывающего домена белка, связывающегося с областью Н-2, лигандсвязывающего домена корегулятора-1 ядерного рецептора, лигандсвязывающего домена «ультрадышащего» (ultraspiracle) белка, лигандсвязывающего домена ядерного рецептора 2С1 и лигандсвязывающего домена хорионного фактора 1. Согласно другому варианту реализации изобретения, лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, не является лигандсвязывающим доменом рецептора экдизона.
[0147] Согласно одному из вариантов реализации настоящего изобретения, лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, представляет собой лигандсвязывающий домен ретиноидного Х-рецептора. Согласно другому варианту реализации изобретения, лигандсвязывающий домен ретиноидного Х-рецептора представляет собой лигандсвязывающий домен ретиноидного Х-рецептора позвоночных. Согласно другому варианту реализации изобретения, лигандсвязывающий домен ретиноидного Х-рецептора представляет собой лигандсвязывающий домен ретиноидного Х-рецептора Homo sapiens. Согласно другому варианту реализации изобретения, лигандсвязывающий домен ретиноидного Х-рецептора представляет собой α-изоформу ретиноидного Х-рецептора. Согласно другому варианту реализации изобретения, лигандсвязывающий домен ретиноидного Х-рецептора представляет собой β-изоформу ретиноидного Х-рецептора. Согласно другому варианту реализации изобретения, лигандсвязывающий домен ретиноидного Х-рецептора представляет собой γ-изоформу ретиноидного Х-рецептора.
[0148] Согласно другому варианту реализации изобретения, лигандсвязывающий
домен ретиноидного Х-рецептора представляет собой лигандсвязывающий домен ретиноидного Х-рецептора беспозвоночных. Согласно другому варианту реализации изобретения, лигандсвязывающий домен ретиноидного Х-рецептора беспозвоночных представляет собой лигандсвязывающий домен ретиноидного Х-рецептора Locusta migratoria.
[0149] Согласно другому варианту реализации изобретения, лигандсвязывающий домен ретиноидного Х-рецептора беспозвоночных представляет собой лигандсвязывающий домен ретиноидного Х-рецептора животного, не относящегося ни к Lepidoptera, ни к Diptera.
[0150] Согласно одному из вариантов реализации настоящего изобретения, лигандсвязывающий домен ретиноидного рецептора представляет лигандсвязывающий домен ретиноидного Х-рецептора позвоночных, лигандсвязывающий домен ретиноидного Х-рецептора беспозвоночных, лигандсвязывающий домен «ультрадышащего» (ultraspiracle) белка или химерный лигандсвязывающий домен ретиноидного Х-рецептора.
[0151] Согласно одному из вариантов реализации настоящего изобретения, химерный лигандсвязывающий домен ретиноидного Х-рецептора содержит два полипептидных фрагмента, где первый полипептидный фрагмент - из лигандсвязывающего домена ретиноидного Х-рецептора позвоночных, лигандсвязывающего домена ретиноидного Х-рецептора беспозвоночных или лигандсвязывающего домена «ультрадышащего» (ultraspiracle) белка, а второй полипептидный фрагмент - из другого лигандсвязывающего домена ретиноидного Х-рецептора позвоночных, другого лигандсвязывающего домена ретиноидного Х-рецептора беспозвоночных или другого лигандсвязывающего домена «ультрадышащего» (ultraspiracle) белка.
[0152] Согласно другому варианту реализации изобретения, химерный лигандсвязывающий домен ретиноидного Х-рецептора представляет собой домен, описанный в патенте США №7531326, содержание которого полностью включено в настоящее описание посредством ссылки.
[0153] Согласно другому варианту реализации изобретения, первый полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 1-6, спирали 1-7, спирали 1-8, спирали 1-9, спирали 1-10, спирали 1-11 или спирали 1-12 первого вида ретиноидного Х-рецептора, а второй полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 7-12, спирали 8-12, спирали 9-12, спирали 10-12, спирали 11-12, спираль 12 или F-домен второго вида ретиноидного Х-рецептора, соответственно.
[0154] Согласно другому варианту реализации изобретения, первый полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 1-6 первого вида ретиноидного Х-рецептора (RXR) согласно настоящему изобретению, а второй полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 7-12 второго вида ретиноидного Х-рецептора.
[0155] Согласно другому варианту реализации изобретения, первый полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 1-7 первого вида ретиноидного Х-рецептора согласно настоящему изобретению, а второй полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 8-12 второго вида ретиноидного Х-рецептора.
[0156] Согласно другому варианту реализации изобретения, первый полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 1-8 первого вида ретиноидного Х-рецептора, а второй полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 9-12 второго вида ретиноидного Х-рецептора.
[0157] Согласно другому варианту реализации изобретения, первый полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 1-9 первого вида ретиноидного Х-рецептора, а второй полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 10-12 второго вида ретиноидного Х-рецептора.
[0158] Согласно другому варианту реализации изобретения, первый полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 1-10 первого вида ретиноидного Х-рецептора, а второй полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 11-12 второго вида ретиноидного Х-рецептора.
[0159] Согласно другому варианту реализации изобретения, первый полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 1-11 первого вида ретиноидного Х-рецептора, а второй полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спираль 12 второго вида ретиноидного Х-рецептора.
[0160] Согласно другому предпочтительному варианту реализации настоящего изобретения, первый полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 1-12 первого вида ретиноидного Х-рецептора, а второй полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит F-домен второго вида ретиноидного X-рецептора.
[0161] Согласно одному из вариантов реализации настоящего изобретения, первый полипептидный фрагмент в химерном лигандсвязывающем домене ретиноидного X-рецептора представляет собой последовательность ретиноидного Х-рецептора человека, а второй полипептидный фрагмент в химерном лигандсвязывающем домене ретиноидного Х-рецептора представляет собой последовательность ретиноидного X-рецептора беспозвоночного. Согласно другому варианту реализации изобретения, последовательность ретиноидного Х-рецептора беспозвоночного представляет собой последовательность ретиноидного Х-рецептора Locusta migratoria.
[0162] Согласно другому варианту реализации изобретения, первый полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 1-8 ретиноидного Х-рецептора человека, а второй полипептидный фрагмент химерного лигандсвязывающего домена ретиноидного Х-рецептора содержит спирали 9-12 ретиноидного Х-рецептора Locusta migratoria.
[0163] Согласно одному из вариантов реализации настоящего изобретения, переключатель генов дополнительно содержит ДНК-связывающий домен («DBD»). Согласно другому варианту реализации изобретения, DBD выбран из группы, состоящей из DBD GAL4, DBD LexA, DBD транскрипционного фактора, DBD члена надсемейства ядерных рецепторов стероидных/тиреоидных гормонов, DBD LacZ бактерий и DBD дрожжей.
[0164] Согласно одному из вариантов реализации настоящего изобретения, переключатель генов дополнительно содержит трансактивационный домен ("TD"). Согласно другому варианту реализации изобретения, трансактивационный домен выбран из группы, состоящей из TD VP16, TD GAL4, TD NF-κΒ, TD ВР64 и кислотный TD В42.
[0165] Согласно одному из вариантов реализации настоящего изобретения, ДНК-связывающий домен, лигандсвязывающий домен, который связывается с Соединением 1, лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1, и трансактивационный домен кодируются полинуклеотидными последовательностями, которые содержатся в одном и том же полинуклеотиде.
[0166] Согласно другому варианту реализации изобретения, ДНК-связывающий домен, лигандсвязывающий домен, который связывается с Соединением 1, лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1, и трансактивационный домен кодируются полинуклеотидными последовательностями, которые содержатся в одной или более отдельных полинуклеотидных последовательностях.
[0167] Согласно другому варианту реализации изобретения, ДНК-связывающий домен, лигандсвязывающий домен, который связывается с Соединением 1 или Соединением 2, лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, и трансактивационный домен кодируются полинуклеотидными последовательностями, которые содержатся в двух отдельных полинуклеотидных последовательностях.
[0168] Согласно другому варианту реализации изобретения, ДНК-связывающий домен и лигандсвязывающий домен, который связывается с Соединением 1 или Соединением 2, кодируются полинуклеотидными последовательностями, которые содержатся в первой полинуклеотидной последовательности, а лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, и трансактивационный домен кодируются полинуклеотидными последовательностями, которые содержатся во второй полинуклеотидной последовательности.
[0169] Согласно другому варианту реализации изобретения, ДНК-связывающий домен и лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, кодируются полинуклеотидными последовательностями, которые содержатся в первой полинуклеотидной последовательности, а лигандсвязывающий домен, который связывается с Соединением 1 или Соединением 2, и трансактивационный домен кодируются полинуклеотидными последовательностями, которые содержатся во второй полинуклеотидной последовательности.
[0170] В тех вариантах реализации настоящего изобретения, когда один или более из ДНК-связывающего домена, лигандсвязывающего домена, который связывается с Соединением 1 или Соединением 2, лигандсвязывающего домена, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, и трансактивационного домена кодируются полинуклеотидными последовательностями, которые содержатся в одной или более отдельных полинуклеотидных последовательностях, указанные одна или более отдельных полинуклеотидных последовательностей функционально связаны с одним или более отдельных промоторов. Согласно другому варианту реализации изобретения, указанные одна или более отдельных полинуклеотидных последовательностей функционально связаны с одним или более отдельными элементами энхансеров. Согласно другому варианту реализации изобретения, указанные промотор(ы) и/или энхансер(ы) обладают конститутивной активностью. Согласно другому варианту реализации изобретения, указанные промотор(ы) и/или энхансер(ы) представляют собой тканеспецифичные промоторы и/или энхансеры.
[0171] Согласно одному из вариантов реализации настоящего изобретения, переключатель генов содержит ДНК-связывающий домен, лигандсвязывающий домен рецептора экдизона, лигандсвязывающий домен, который димеризуется с лигандсвязывающим доменом рецептора экдизона, и трансактивационный домен.
[0172] Согласно другому варианту реализации изобретения, переключатель генов содержит ДНК-связывающий домен, лигандсвязывающий домен рецептора экдизона, лигандсвязывающий домен ретиноидного Х-рецептора и трансактивационный домен.
[0173] Согласно другому варианту реализации изобретения, переключатель генов содержит ДНК-связывающий домен, лигандсвязывающий домен рецептора экдизона, химерный лигандсвязывающий домен ретиноидного Х-рецептора позвоночных/беспозвоночных и трансактивационный домен.
[0174] Согласно другому варианту реализации изобретения, переключатель генов содержит ДНК-связывающий домен GAL4, лигандсвязывающий домен рецептора экдизона Choristoneura fumiferana, сконструированный таким образом, что он содержит мутации VI071 и Y127E в последовательности рецептора экдизона Choristoneura fumifrana, представленной в SEQ ГО NO: 1, химерный лигандсвязывающий домен ретиноидного Х-рецептора Homo sapiens/Locusta migratoria и трансактивационный домен VP16.
[0175] Термин «V107I» означает, что остаток аминокислоты валин в положении 107 последовательности SEQ ID NO: 1 заменен на изолейцин. Термин «Y127E» означает, что остаток аминокислоты тирозин в положении 127 последовательности SEQ ID NO: 1 заменен на глутамат.
[0176] Согласно другому варианту реализации изобретения, клетка-хозяин дополнительно содержит полинуклеотид, кодирующий пептид, белок или полипептид, экспрессия которых регулируется указанным переключателем генов. Промотор, который связывается с комплексом переключателя генов, функционально связан с полинуклеотидом, кодирующим пептид, белок или полипептид, экспрессия которых регулируется указанным переключателем генов.
[0177] Согласно другому варианту реализации изобретения, полинуклеотид, кодирующий пептид, белок или полипептид, экспрессия которых регулируется указанным переключателем генов, содержится в том же полинуклеотиде, который кодирует один или более из ДНК-связывающего домена, лигандсвязывающего домена, который связывается с Соединением 1 или Соединением 2, лигандсвязывающего домена, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, и трансактивационного домена. Такие конструкции описаны, например, в патентной публикации США №2009/0123441.
[0178] Согласно другому варианту реализации изобретения, полинуклеотид, кодирующий пептид, белок или полипептид, экспрессия которых регулируется указанным переключателем генов, содержится в полинуклеотиде, отличном от полинуклеотида, который кодирует один или более из ДНК-связывающего домена, лигандсвязывающего домена, который связывается с Соединением 1 или Соединением 2, лигандсвязывающего домен, который димеризуется с лигандсвязывающим доменом, который связывается с Соединением 1 или Соединением 2, и трансактивационного домена.
[0179] Согласно одному из вариантов реализации настоящего изобретения, переключатель генов более чувствителен к Соединению 1 или Соединению 2, чем к стероидному гормону. Согласно другому варианту реализации изобретения, переключатель генов более чувствителен к Соединению 1, чем к другому диацилгидразиновому соединению (включая Соединение 2). Согласно другому варианту реализации изобретения, переключатель генов более чувствителен к Соединению 2, чем к другому диацилгидразиновому соединению (включая Соединение 1).
[0180] Чувствительность переключателя генов к Соединению 1 или Соединению 2, относительно другого лиганда, может быть легко определена путем анализа in vitro, например анализа in vitro, в котором задействуют репортерный ген, такой как ген люциферазы светлячка. Примеры таких анализов in vitro хорошо известны специалистам в данной области. См., например, Karzenowski et al., BioTechniques 39: 191-200 (2005).
[0181] Согласно одному из вариантов реализации настоящего изобретения, полинуклеотид, кодирующий переключатель генов, содержится в векторе. Согласно одному из вариантов реализации настоящего изобретения, указанный вектор выбран из группы, состоящей из плазмиды, вектора экспрессии, репликона, фагового вектора, космиды, вирусного вектора, липосомы, электрически заряженного липида (например, цитофектина), комплекса ДНК-белок и биополимера.
[0182] Согласно другому варианту реализации изобретения, вектор представляет собой ретровирусный вектор. Согласно другому варианту реализации изобретения, вектор выбран из группы, состоящей из аденоассоциированного вирусного вектора, вектора вируса оспы, бакуловирусного вектора, вектора вируса коровьей оспы, вектора вируса простого герпеса, вектора вируса Эпштейна-Барр, аденовирусного вектора, герминивирусного вектора и колимовирусного вектора.
[0183] Согласно одному из вариантов реализации настоящего изобретения, клетка-хозяин представляет собой прокариотическую клетку-хозяина. Согласно другому варианту реализации изобретения, клетка-хозяин представляет собой эукариотическую клетку-хозяина.
[0184] Согласно другому варианту реализации изобретения, клетка-хозяин представляет собой клетку-хозяина позвоночных. Согласно другому варианту реализации изобретения, клетка-хозяин представляет собой клетку-хозяин беспозвоночных.
[0185] Согласно другому варианту реализации изобретения, клетка-хозяин выбрана из группы, состоящей из бактериальной клетки, грибной клетки, дрожжевой клетки, клетки нематоды, клетки насекомого, клетки рыбы, клетки растения, клетки птицы, клетки водоросли, клетки животного и клетки млекопитающего.
[0186] Согласно другому варианту реализации изобретения, клетка-хозяин выбрана из группы, состоящей из клетки данио, клетки курицы, клетки хомяка, клетки мыши, клетки крысы, клетки кролика, клетки кошки, клетки собаки, клетки быка, клетки козы, клетки коровы, клетки свиньи, клетки лошади, клетки овцы, клетки человекообразной обезьяны, клетки обезьяны, клетки шимпанзе и клетки человека.
[0187] Согласно другому варианту реализации изобретения, клетка-хозяин выбрана из группы, состоящей из клетки Aspergillus, клетки Trichoderma, клетки Saccharomyces, клетки Pichia, клетки Candida, клетки Hansenula.
[0188] Согласно другому варианту реализации изобретения, клетка-хозяин выбрана из группы, состоящей из клетки Synechocystis, клетки Synechococcus, клетки Salmonella, клетки Bacillus, клетки Acinetobacter, клетки Rhodococcus, клетки Streptomyces, клетки Escherichia, клетки Pseudomonas, клетки Methylomonas, клетки Methylobacter, клетки Alcaligenes, клетки Synechocystis, клетки Anabaena, клетки Thiobacillus, клетки Methanobacterium и клетки Klebsiella.
[0189] Согласно другому варианту реализации изобретения, клетка-хозяин выбрана из группы, состоящей из клетки яблока, клетки Arabidopsis, клетки посевного просо, клетки банана, клетки ячменя, клетки бобов, клетки свеклы, клетки фасоли мунго, клетки нута, клетки чили, клетки огурца, клетки баклажана, клетки боба садового, клетки кукурузы, клетки дыни, клетки просо, клетки маша, клетки овса, клетки бамия, клетки Panicum, клетки папайи, клетки арахиса, клетки гороха, клетки перца, клетки голубиного гороха, клетки ананаса, клетки Phaseolus, клетки картофеля, клетки тыквы, клетки риса, клетки сорго, клетки сои, клетки тыквы, клетки сахарного тростника, клетки сахарной свеклы, клетки подсолнечника, клетки сладкого картофеля, клетки чая, клетки помидора, клетки табака, клетки арбуза, клетки гриба и клетки пшеницы.
[0190] Согласно другому варианту реализации изобретения, клетка-хозяин выбрана из группы, состоящей из клетки хомяка, клетки мыши, клетки крысы, клетки кролика, клетки кошки, клетки собаки, клетки быка, клетки козы, клетки коровы, клетки свиньи, клетки лошади, клетки овцы, клетки обезьяны, клетки шимпанзе и клетки человека.
[0191] Трансформация клетки-хозяина хорошо известна в данной области и может быть достигнута множеством способов, включая, но не ограничиваясь только ими, электропорацию, вирусную инфекцию, трансфекцию плазмиды (или вектора), трансфекцию, опосредуемую невирусным вектором, трансформацию, опосредуемую Agrobacterium, бомбардировку частицами и т.п.Экспрессия необходимых генных продуктов включает культивирование трансформированных клеток-хозяев в подходящих условиях и индуцирование экспрессии трансформированного гена. Условия культивирования и протоколы экспрессии генов для прокариотических и эукариотических клеток хорошо известны в данной области. Клетки могут быть собраны, а генные продукты выделены согласно протоколам, специфичным для данного генного продукта.
[0192] Кроме того, может быть выбрана клетка-хозяин, которая позволяет модулировать экспрессию вставленного полинуклеотида, или модифицировать и проводить обработку полипептидного продукта конкретным необходимым образом. Различные клетки-хозяева имеют характерные и специфические механизмы для трансляционной и пост-трансляционной обработки и модификации (например, гликозилирование, расщепление (например, сигнальной последовательности)) белков. Соответствующие клеточные линии или системы-хозяева могут быть выбраны таким образом, чтобы обеспечить необходимую модификацию и обработку экспрессированного чужеродного белка. Например, экспрессию в бактериальной системе можно использовать для получения продукта в виде негликозилированного корового белка. Однако полипептид, экспрессированный в бактериях, может быть не должным образом сложен. Путем экспрессии в дрожжах можно получить гликозилированный продукт.Экспрессия в эукариотических клетках может увеличить вероятность «природного» гликозилирования и укладки чужеродного белка. Кроме того, экспрессия в клетках млекопитающих может обеспечить инструмент для восстановления или формирования активности полипептида. Более того, различные системы экспрессии вектор/хозяин в разной степени могут влиять на протекание реакций, таких как протеолитическое расщепление.
[0193] Согласно одному из вариантов реализации настоящего изобретения, клетка-хозяин содержит два или более ортогональных переключателей генов. Говорят, что две или более индивидуально функционирующих системы регуляции генов «ортогональны», когда (а) модулирование каждого из данных переключателей генов его соответствующим лигандом приводит к измеримому изменению в величине экспрессии гена, которая регулируется данным переключателем генов и (b) указанное изменение является статистически значимо отличным от изменения экспрессии всех остальных переключателей генов в данной клетке-хозяине. Согласно одному из вариантов реализации настоящего изобретения, регуляция каждой индивидуально функционирующей системы переключателей генов вызывает изменение экспрессии генов, по меньшей мере в 2 раза, 3 раза, 4 раза, 5 раз, 10 раз, 20 раз, 50 раз, 70 раз, 100 раз, 200 раз, 300 раз, 400 раз или 500 раз большее, чем для всех остальных функционирующих переключателей генов в данной клетке-хозяине. Неограничивающие примеры ортогональных систем переключателей генов представлены в патентной публикации США №2002/0110861 Al.
[0194] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения рака у субъекта, например рака, выбранного из группы, состоящей из миелодисплазии, рака молочной железы, рака предстательной железы, лимфомы, рака кожи, рака поджелудочной железы, рака толстой кишки, меланомы, злокачественной меланомы, рака яичников, рака головного мозга, первичного рака головного мозга, рака головы и шеи, глиомы, глиобластомы, рака печени, рака мочевого пузыря, немелкоклеточного рака легких, карциномы головы или шеи, карциномы молочной железы, карциномы яичников, легочной карциномы, мелкоклеточной карциномы легких, опухоли Вильмса, карциномы шейки матки, карциномы яичка, карциномы мочевого пузыря, карциномы поджелудочной железы, карциномы желудка, карциномы толстой кишки, карциномы предстательной железы, карциномы мочеполовой системы, карциномы щитовидной железы, карциномы пищевода, миеломы, множественной миеломы, карциномы надпочечников, почечно-клеточной карциномы, карциномы эндометрия, карциномы коры надпочечников, злокачественной поджелудочной инсулиномы, злокачественного карциноидного рака, хориокарциномы, грибовидного микоза, злокачественной гиперкальциемии, гиперплазии шейки, лейкоза, острого лимфоцитарный лейкоза, хронического лимфоцитарного лейкоза, острого миелобластного лейкоза, хронического миелолейкоза, хронического гранулоцитарного лейкоза, острого гранулоцитарного лейкоза, лейкоза ворсистых клеток, нейробластомы, рабдомиосаркомы, саркомы Капоши, истинной полицитемии, эссенциальной тромбоцитемии, болезни Ходжкина, неходжкинской лимфомы, саркомы мягких тканей, мезотелиомы, остеогенной саркомы, первичной макроглобулинемии и ретинобластомы и т.п.
[0195] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения расстройства, связанного с метаболизмом, у субъекта, например нарушения обмена веществ, выбранных из группы, состоящей из дислипидемии, атеросклероза, устойчивости к инсулину, диабета (например, диабета I типа, диабета II типа, юношеского диабета взрослого типа (MODY) и гестационного диабета), ожирения, нарушения толерантности к глюкозе, атероматозного заболевания, гипертонии, сердечно-сосудистого заболевания (включая, но не ограничиваясь только ими, ишемическую болезнь сердца, инсульт, сердечную недостаточность, коронарную недостаточность и высокое кровяное давление), гиперлипидемии, отсутствия толерантности к глюкозе, устойчивости к инсулину, гипергликемии, гиперинсулинемии, метаболического синдрома X (или синдрома X, или синдрома устойчивости к инсулину, или синдрома Ривена, или метаболического синдрома с риском сердечно-сосудистой патологии), гипертонии, хронической усталости, ускоренного старения, дегенеративного заболевания, эндокринных расстройств, вызванных старением, ганглиозидоза Gml, болезни Моркио-В, болезни Краббе, болезни Фабри, болезни Гоше, болезни Тея-Сакса, болезни Сандоффа, фукозидоза, нарушений углеводного обмена (например, болезни накопления гликогена), нарушений метаболизма аминокислот (например, фенилкетонурии, болезни кленового сиропа, глутаровой ацидемии типа 1), нарушений метаболизма органических кислот (например, алкаптонурии), нарушений окисления жирных кислот и метаболизма в митохондриях (например, недостаточности дегидрогеназы среднецепочечных кислот), нарушений метаболизма порфирина (например, острой перемежающейся порфирии), нарушений пуринового или пиримидинового метаболизма (например, синдрома Леша-Найхана), нарушений метаболизма стероидов (например, врожденной гиперплазии коры надпочечников), нарушений функции митохондрий (например, синдрома Кернса-Сейра) и расстройств пероксисомальной функции (например, синдрома Зеллвегера).
[0196] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения заболевания почек у субъекта. Согласно одному из вариантов реализации настоящего изобретения, заболевание почек представляет собой почечную недостаточность. Согласно другому варианту реализации изобретения, заболевание почек представляет собой хроническую почечную недостаточность.
[0197] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения анемии у субъекта. Согласно одному из вариантов реализации настоящего изобретения, анемия представляет собой анемию, связанную с заболеванием почек, например почечной недостаточностью или хронической почечной недостаточностью. Согласно другому варианту реализации изобретения, анемия связана с терапией рака с помощью, например, одного или более химиотерапевтических агентов. Согласно другому варианту реализации изобретения, анемия связана с пожилым возрастом. Согласно другому варианту реализации изобретения, анемия связана с нарушением функции легких. Согласно другому варианту реализации изобретения, анемия связана с миелодисплазией. Согласно другому варианту реализации изобретения, анемия связана с лучевой терапией. Согласно другому варианту реализации изобретения, анемия связана с критическим заболеванием. Согласно другому варианту реализации изобретения, анемия связана с заболеванием сердца. Согласно другому варианту реализации изобретения, анемия не является заболеванием сердца. Неограничивающими типами «заболеваний сердца» являются застойная сердечная недостаточность, гипоксия, ишемическая болезнь сердца, гипертоническая болезнь сердца, заболевание коронарных артерий, заболевание периферических сосудов и ишемические потологии сердца, например инфаркт миокарда, инфаркт, сердечная недостаточность, аритмия, разрыв миокарда, перикардит, кардиогенный шок, тромбоз, эмболия, атеросклероз и артериальный стеноз.
[0198] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения аутоиммунного расстройства у субъекта, например аутоиммунного расстройства, выбранного из группы, состоящей из ахлоргидрийного аутоиммунного активного хронического гепатита, острого рассеянного энцефаломиелита, острого геморрагического лейкоэнцефалита, болезни Аддисона, гаммаглобулинемии, агаммаглобулинемии, круговой алопеции, бокового амиотрофического склероза, анкилозирующего спондилита, анти-СВМ/ТВМ-нефрита, антифосфолипидного синдрома, антисинтетазного синдрома, артрита, атопической аллергии, атопического дерматита, апластической анемии, аутоиммунной кардиомиопатии, аутоиммунной гемолитической анемии, аутоиммунного гепатита, аутоиммунного заболевания внутреннего уха, аутоиммунного лимфопролиферативного синдрома, аутоиммунной периферической невропатии, аутоиммунного панкреатита, аутоиммунного полиэндокринного синдрома типов I, II и III, аутоиммунного прогестеронового дерматита, аутоиммунной тромбоцитопенической пурпуры, аутоиммунного увеита, болезни Бало/концентрического склероза Бало, синдрома Бехчета, болезни Бергера, энцефалита Бикерстаффа, синдрома Блау, буллезного пемфигоида, болезни Кастлмана, синдрома хронической усталости и иммунной дисфункции, хронической воспалительной демиелинизирующей полинейропатии, хронического рецидивирующего мультифокального остеомиелита, синдрома Черджа-Стросс, рубцового пемфигоида, целиакии, синдрома Когана, холодовой агглютининовой болезни, дефицита компонента комплемента 2, гигантоклеточного артериита, CREST-синдрома, болезни Крона, синдрома Кушинга, кожного лейкоцитокластического ангиита, болезни Дего, герпетиформного дерматита, дерматомиозита, сахарного диабета 1 типа, диффузного кожного системного склероза, синдрома Дресслера, дискоидной красной волчанки, экземы, связанного с энтезитом артрита, эозинофильного фасциита, приобретенного буллезного эпидермолиза, узловатой эритемы, эссенциальной смешанной криоглобулинемии, синдрома Эвана, оссифицирующей прогрессирующей фибродисплазии, фибромиозита, фиброзирующего альвеолита, гастрита, желудочно-кишечного пемфигоида, гигантоклеточного артериита, синдрома Гудпасчера, болезни Грейвса, синдрома Гийена-Барре (СГБ), энцефалита Хашимото, тиреоидита Хашимото, гемолитической анемии, пурпуры Шенлейна-Геноха, герпеса беременных, синдрома Хьюза (или антифосфолипидного синдрома), гипогаммаглобулинемии, идиопатических воспалительных демиелинизирующих заболеваний, идиопатического легочного фиброза, идиопатической тромбоцитопенической пурпуры, IgA-нефропатии (или болезни Бергера), миозита с включенными тельцами, демиелинизирующей полинейропатии, ювенильного идиопатического артрита, ювенильного ревматоидного артрита, миастенического синдрома Ламберта-Итона, лейкоцитокластического васкулита, красного плоского лишая, склероатрофического лишая, линейного IgA-зависимого линейного дерматоза (LAD), болезни Лу Герига, люпоидного гепатита, красной волчанки, синдрома Маджид, болезни Меньера, микроскопического полиангиита, синдрома Миллера-Фишера, смешанного заболевания соединительной ткани, болезни Мухи-Хабермана, синдрома Макла-Уэллса, множественной миеломы, миастении гравис, миозита, нарколепсии, оптиконевромиелита (также называемого болезнью Девика), глазного рубцующегося пемфигоида, тиреоидита Орда, палиндромного ревматизма, ΠАНДAC (PANDAS, детских аутоиммунных психоневрологических расстройств, связанные со Streptococcus), паранеопластической мозжечковой дегенерации, паранеопластической мозжечковой дегенерации, синдрома Парри-Ромберга, синдрома Персонейджа-Тернера, парспланита, пузырчатки, пузырчатки обыкновенной, злокачественной анемии, перивенозного энцефаломиелита, POEMS-синдрома, узелкового полиартериита, ревматической полимиалгии, полимиозита, первичного билиарного цирроза, псориаза, псориатического артрита, гангренозной пиодермии, истинной эритроцитарной аплазии, энцефалита Расмуссена, феномена Рейно, рецидивирующего полихондрита, синдрома Рейтера, ретроперитонеального фиброза, ревматоидного артрита, ревматической лихорадки, синдрома Шмидта, синдрома Шницлера, склерита, синдрома Шегрена, спондилоартропатии, синдрома липкой крови, болезни Стилла, подострого бактериального эндокардита (SBE), синдрома Сусака, синдром Свита, хореи Сиденгама, симпатической офтальмии, артериита Такаясу, височного артериита, синдрома Толоса-Ханта, поперечного миелита, язвенного колита, недифференцированного заболевания соединительной ткани, недифференцированной спондилоартропатии, васкулита, гранулематоза Вегенера, синдрома Вильсона и синдрома Вискотта-Олдрича.
[0199] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения офтальмологического расстройства у субъекта, например офтальмологического расстройства, выбранного из группы, состоящей из глаукомы, в том числе открытоугольной глаукомы (например, первичной открытоугольной глаукомы, пигментной глаукомы и эксфолиативной глаукомы, глаукомы с низким давлением), закрытоугольной глаукомы (также известной в клинической практике как закрытоугольная глаукома, узкоугольная глаукома, глаукома зрачкового блока и глаукома, вызванная блоком ресничного тела) (например, острой закрытоугольной глаукомы и хронической закрытоугольной глаукомы), глаукомы при аниридии, врожденной глаукомы, юношеской глаукомы, глаукомы, вызванной линзами, неоваскулярной глаукомы (например, с участием векторов, полученных из ловушки фактора роста эндотелия сосудов (VEGF), полученного из пигментов фактора роста (PDGF), эндостатина, ангиостатина или ангиопоэтина-1), посттравматической глаукомы, глаукомы, вызванной стероидами, глаукомы синдрома Стерджа-Вебера и глаукомы, вызванной увеитом, диабетической ретинопатии (например, с участием векторов, полученных из VEGF-ловушки, PDGF, эндостатина, ангиостатина или ангиопоэтина-1), дегенерации желтого пятна (например, векторов, полученных из VEGF-ловушки, PDGF, эндостатина, ангиостатина, ангиопоэтина-1, члена 4 подсемейства А АТФ-связывающих кассетных транспортеров), дегенерации желтого пятна (например, с участием векторов, полученных из VEGF-ловушки, PDGF, эндостатина, ангиостатина, ангиопоэтина-1, члена 4 подсемейства А АТФ-связывающих кассетных транспортеров), неоваскуляризации хориодидеи, (например, с участием векторов, выполненных из VEGF-ловушки, PDGF, эндостатина, ангиостатина или ангиопоэтина-1), пропотевания жидкости из сосудов и/или отека сетчатки, бактериального конъюнктивита, грибкового конъюнктивита, вирусного конъюнктивита, увеита, роговичных преципитатов, отека желтого пятна (например, с участием векторов, полученных из VEGF-ловушки, PDGF, эндостатина, ангиостатина или ангиопоэтина-1), воспалительной реакции после имплантации внутриглазной линзы, увеальных синдромов (например, хронического иридоциклита или хронического эндофтальмита), васкулита сетчатки (например, как показано для ревматоидного артрита, юношеского ревматоидного артрита, системной красной волчанки, прогрессирующего системного склероза, узелкового полиартериита, гранулематоза Вегенера, височного артериита, болезни Адамантиадеса-Бехчета, болезни Шегрена, рецидивирующего полихондрита и связанного с HLA-B27 спондилита), саркоидоза, болезни Илза, острого некроза сетчатки, синдром Фогта-Коянаги-Харада, глазного токсоплазмоза, радиационной ретинопатии, пролиферативной витреоретинопатии, эндофтальмита, глазных глауком (например, воспалительных глауком), неврита зрительного нерва, ишемической оптической невропатии (например, векторов, полученных из единицы 4 аллотропической НАДН-дегидрогеназы), связанной со щитовидной железой орбитопатии, орбитальной псевдоопухоли, пигментно-дисперсного синдрома (пигментной глаукомы), склерита, эписклеритных хориоидопатий (например, синдромов «белых точек», включающих острый мультифокальный задний плакоид, но не ограничивающихся только им), ретинопатии (например, цистоидного отека желтого пятна, центральной серозной ретинопатии и синдрома предполагаемого гистоплазмоза глаз (например, векторов, полученных из полученного из глиальных клеток нейротропного фактора, периферина-2)), сосудистых заболеваний сетчатки (например, диабетической ретинопатии, болезни Коутса и артериальной макроаневризмы сетчатки), окклюзии артерии сетчатки, окклюзии вен сетчатки, ретинопатии недоношенных, пигментного ретинита (например, векторов, полученных из пигментного специфического белка сетчатки массой 65 кДа), семейной экссудативной витреоретинопатии (FEVR), идиопатической полипообразной хориоидальной васкулопатии, эпиретинальных макулярных мембран и катаракты.
[0200] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения расстройства, связанного с кровью, у субъекта, например расстройства, связанного с кровью, выбранного из группы, состоящей из анемии, кровотечения и расстройств свертывания крови (например, диссеминированного внутрисосудистого свертывания крови (ДВС), гемофилии, пурпуры Шенлейна-Геноха, наследственной геморрагической телеангиэктазии, тромбоцитопении (иммунной тромбоцитопении (ИТП, ГГР), тромботической тромбоцитопенической пурпуры (ТТЛ, ТТР)), тромбофилии, болезни фон Виллебранда), лейкозов (например, острого лимфоцитарного лейкоза, острого миелоцитарного лейкоза, хронического лимфоцитарного лейкоза, хронического миелоцитарного лейкоза), лимфом (например, лимфомы Ходжкина, неходжкинской лимфомы), миелопролиферативных расстройств (например, миелофиброза, истинной полицитемии, тромбоцитемии), расстройств, связанных с клетками плазмы (например, макроглобулинемии, моноклональных гаммапатий неясного генеза, множественной миеломы), расстройств селезенки, расстройств, связанных с белыми кровяными клетками (например, расстройства, связанного с базофилами, расстройства, связанного с эозинофилами, лимфоцитопении, расстройств, связанных с моноцитами, нейтропении, нейтрофильного лейкоцитоза), тромбоза, тромбоза глубоких вен (ТГВ), гемохроматоза, меноррагии, серповидноклеточной анемии и талассемии.
[0201] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения неврологического расстройства у субъекта, например неврологического расстройства, выбранного из группы, состоящей из болезни Гоше, болезни Паркинсона, болезни Альцгеймера, бокового амиотрофического склероза (БАС), рассеянного склероза (PC), болезни Хантингтона, атаксии Фридриха, умеренных когнитивных нарушений, церебральной амилоидной ангиопатии, паркинсонизма, заболевания с тельцами Леви, лобно-височной деменции (ЛВД), множественной системной атрофии (МСА), прогрессирующего супрануклеарного паралича, и двигательных расстройств (включая атаксию, церебральный паралич, хореоатетоз, дистонию, синдром Туретта, ядерную желтуху) и расстройств, связанных с тремором, и лейкодистрофий (включая адренолейкодистрофию, метахроматическую лейкодистрофию, болезнь Канавана, болезнь Александра, болезнь Пелицеуса-Мерцбахера), нейрональнных цероидных липофусцинозов, телеангиоэктатической атаксии, синдрома Ретта, альфа-синуклеопатии (например, заболевания с тельцами Леви, множественной системной атрофии, болезни Галлервордена-Шпатца или лобно-височной деменции), болезни Ниманна-Пика типа С (NPCD), спиноцеребеллярной атаксии типа 1, типа 2 и типа 3 и дентаторубральной паллидолюисовой атрофии (DRLPA).
[0202] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения расстройства легких у субъекта, например расстройства легких, выбранного из группы, состоящей из астмы, ателектаза, бронхита, ХОБЛ (хронической обструктивной болезни легких), эмфиземы, рака легких, мезотелиомы, пневмонии, асбестоза, аспергиллемы, аспергиллеза, острого инвазивного аспергиллеза, бронхоэктаза, облитерирующего бронхиолита с организующейся пневмонией (ОБОП, ВООР), эозинофильной пневмонии, некротической пневмонии, выпота, пневмокониоза, пневмоторакса, легочного актиномикоза, легочного альвеолярного протеиноза, легочной формы сибирской язвы, легочной артериовенозной мальформации, легочного фиброза, легочной эмболии, легочного гистиоцитоза X (эозинофильной гранулемы), легочной гипертензии, отека легких, легочного кровотечения, легочного нокардиоза, туберкулеза легких, веноокклюзионной болезни легких, ревматоидного заболевания легких, саркоидоза, лучевого фиброза, аллергического пневмонита, острого респираторного дистресс-синдрома (ОРДС), детского респираторного дистресс-синдрома, идиопатического легочного фиброза, идиопатической интерстициальной пневмонии, лимфангиолейомиоматоза, легочного гистиоцитоза из клеток Лангерганса, легочного альвеолярного протеиноза, синусита, тонзиллита, отита среднего уха, фарингита, ларингита, гамартомы легких, легочной секвестрации, врожденной кистозной аденоматозной мальформации (ССАМ) и муковисцидоза.
[0203] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения ревматологического расстройства у субъекта, например ревматологического расстройства, выбранного из группы, состоящей из системной красной волчанки, дерматомиозита, склеродермии, системного некротизирующего артериита, кожного некротизирующего венулита, ревматоидного артрита, синдрома Шегрена, феномена Рейно, синдрома Рейтера, артрита, псориатического артрита, серонегативных спондилоартропатий, синдрома Шегрена, системного склероза, дерматомиозита/полимиозита, смешанного заболевания соединительной ткани и анкилозирующего спондилита.
[0204] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения инфекционного заболевания у субъекта, например инфекционного заболевания, выбранного из группы, состоящей из заболеваний, вызванных грибами, таких как дерматофитоз (например, трихофитии, инфекций стригущего лишая или опоясывающего лишая), грибкового заболевания ног, паранихии, разноцветного лишая, эритразмы, опрелости, грибковой опрелости, вызываемого грибами Candida вульвита, вызываемого грибами Candida баланита, наружного отита, кандидоза (кожного и кожно-слизистого), хронического кандидоза слизистой оболочки (например, молочницы и вагинального кандидоза), криптококкоза, геотрихоза, трихоспории, аспергиллеза, пенициллиоза, фузариоза, зигомикоза, споротрихоза, хромомикоза, кокцидиоидомикоза, гистоплазмоза, бластомикоза, паракокцидиоидомикоза, псевдаллешериоза (pseudallescheriosis), мицетомы, грибкового кератита, отомикоза, пневмоцистоза и фунгемии, инфекции Acinetobacter, актиномикоза, африканской сонной болезни, СПИД (синдрома приобретенного иммунодефицита), амебиаза, анаплазмоза, сибирской язвы, инфекции Arcanobacterium haemolyticum, аргентинской геморрагической лихорадки, аскаридоза, аспергиллеза, атровирусной (atrovirus) инфекции, бабезиоза, инфекции Bacillus cereus, бактериальной пневмонии, бактериального вагиноза (БВ), инфекции Bacteroides, балантидиаза, инфекции Baylisascaris, ВК-вирусной инфекции, черной пьедры, инфекции Blastocystis hominis, инфекции Borrelia, ботулизма (и детского ботулизма), бразильской геморрагической лихорадки, бруцеллеза, инфекции Burkholderia, язвы Бурули, калицивирусной инфекции (норовирусной и саповирусной), кандидоза, болезни кошачьих царапин, целлюлита, болезни Шагаса (американского трипаносомоза), шанкроида, ветряной оспы, хламидии, холеры, хроиобластомикоза, клонорхоза, Clostridium difficile, кокцидиоидомикоза, колорадской клещевой лихорадки (ККЛ, CTF), простуды (острого вирусного ринофарингита; острого ринита), болезни Крейтцфельдта-Якоба (БКЯ, CJD), криптококкоза, криптоспоридиоза, кожной формы синдрома мигрирующей личинки (CLM), лихорадки денге, диентамоебиаза (dientamoebiasis), дифтерии, дифиллоботриоза, дифиллоботриоза, дракункулеза, геморрагической лихорадки Эбола, эхинококкоза, эрлихиоза, энтеробиоза (инфекции остриц), инфекции Enterococcus, энтеровирусной инфекции, эпидемического сыпного тифа, инфекционной эритемы, внезапной экзантемы, фасциолопсидоза, фасциолеза, фатальной семейной бессонницы (FFI), филяриоза, инфекции Fusobacterium, газовой гангрены (вызываемого клостридиями некроза мышц), геотрихоза, синдрома Герстманна-Штраусслера-Шейнкера (ГШШ), лямблиоза с сапом, гнатостомоза, гонореи, паховой гранулемы (донованоза), стрептококковой инфекции группы А, стрептококковой инфекции группы В, Haemophilus influenzae, болезни рук, ног и рта (hand, foot and mouth disease, HFMD), хантавирусного легочного синдрома (ХЛС), инфекции Helicobacter pylori, гемолитико-уремического синдрома (ГУС), геморрагической лихорадки с почечным синдромом (ГЛПС, HFRS), гепатита А, В, С, D, Е, простого герпеса, гистоплазмоза, анкилостомоза, бокавирусной инфекции, эрлихиоза ewingii человека, гранулоцитарного анаплазмоза человека (HGA), гранул оцитарного анаплазмоза человека (HGA), моноцитарного эрлихиоза человека, инфекции вируса папилломы человека (ВПЧ), инфекции вируса парагриппа человека, гименолепидоза, инфекционного мононуклеоза (моно), вызванного вирусом Эпштейна-Барр, гриппа (грипп), изоспороза, болезни Кавасаки, кератита, инфекции Kingella kingae, куру, лихорадки Ласса, легионеллеза (болезнь легионеров), легионеллеза (лихорадки Понтиак), лейшманиоза, лепры, лептоспироза, листериоза, болезни Лайма (боррелиоза Лайма), лимфатического филяриоза (слоновости), лимфоцитарного хориоменингита, малярии, геморрагической лихорадки Марбург (MHF), кори, мелиоидоза (болезнь Уитмора), менингита, менингококкового заболевания, метагонимоза, микроспоридиоза, контагиозного моллюска (МС), свинки, мышиного тифа (эндемического сыпного тифа), вызываемой микоплазмами пневмонии, мицетомы, миаза, конъюнктивита новорожденных (офтальмии новорожденных), (нового) варианта болезни Крейтцфельда-Якоба (вБКЯ, vCJD, nvCJD), нокардиоза, онхоцеркоза (речной слепоты), паракокцидиоидомикоза (южноамериканского бластомикоза), парагонимоза, пастереллеза, педикулеза волосистой части головы (головных вшей), нательного педикулеза (нательных вшей), педикулеза лобка (лобковых вшей, площиц), воспалительных заболеваний тазовых органов (ВЗТО, PID), коклюша (судорожного кашля), чумы, пневмококковой инфекции, пневмоцистной пневмонии (ПЦП, PCP), пневмонии, полиомиелита, полиомиелита, инфекции Prevotella, первичного амебного менингоэнцефалита (ПАМ, РАМ), прогрессирующей мультифокальной лейкоэнцефалопатии, орнитоза, лихорадки Ку, бешенства, лихорадки от укуса крыс, респираторной синцитиальной вирусной инфекции, риноспоридиоза, иновирусной инфекции, риккетсиозной инфекции, риккетсиоза, лихорадки долины Рифт (RVF), пятнистой лихорадки Скалистых гор (RMSF), ротавирусной инфекции, краснухи, сальмонеллеза, ТОРС (тяжелого острого респираторного синдрома, SARS), чесотки, шистосомоза, сепсиса, шигеллеза (бактериальной дизентерии), опоясывающего лишая (shingles) (опоясывающего герпеса), оспы (натуральной оспы), споротрихоза, стафилококкового пищевого отравления, стафилококковой инфекции, стронгилоидоза, сифилиса, тениидоза, столбняка (спазма жевательных мышц), микоза бороды (зуда Барбера), микоза волосистой части головы (лишая волосистой части головы), дерматомикоза (лишая тела), микоза гладкой кожи туловища (паховой эпидермофитии), микозп рук (лишая руки), черного лишая, микоза ногтей (онихомикоза), разноцветного лишая (отрубевидного лишая), токсокароза (висцеральной формы синдрома мигрирующей личинки (VLM)), токсоплазмоза, трихинеллеза, трихомониаза, трихоцефалеза (инфекции власоглава), туберкулеза, туляремии, инфекции Ureaplasma urealyticum, венесуэльского лошадиного энцефалита, венесуэльской геморрагической лихорадки, вирусной пневмонии, лихорадки Западного Нила, белой пьедры (микоза tinea blanca), инфекции Yersinia pseudotuberculosis, иерсиниоза, желтой лихорадки и зигомикоза.
[0205] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения ангионевротического отека у субъекта. Согласно другому варианту реализации изобретения, ангионевротический отек представляет собой наследственный ангионевротический отек.
[0206] Согласно другому варианту реализации изобретения, одной или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения заболевания, состояния или расстройства, выбранного из группы, состоящей из сепсиса, гиперкоагуляции, легочной дисфункции, гипоксемии, геморрагического панкреатита, инфаркта миокарда, трансплантации легких, травмы, теплового повреждения и пропотевания жидкости из сосудов у субъекта.
[0207] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения заболевания, состояния или расстройства, в котором ингибирование калликреина обеспечивает терапевтически предпочтительный эффект.Примеры таких заболеваний, состояний или расстройств включают, но не ограничиваются только ими, заболевания, состояния или расстройства контактной системы. См., например, Shariat-Madar et al., Innate Immunity, vol. 10, no. 1, 3-13 (2004) и Frick, et ai, EMBO J., (2006) 25, 5569-5578 (2006). Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения заболевания, состояния или расстройства, выбранного из группы, состоящей из атеротромбоза, ишемической болезни сердца, болезни Альцгеймера, воспалительного заболевания кишечника (например, болезни Крона), пропотевания жидкости из сосудов, острого респираторного дистресс-синдромп и брадикинин-опосредованного воспаления у субъекта.
[0208] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения заболевания, состояния или расстройства, при котором ингибирование рецептора брадикинина В2 обеспечивает терапевтически предпочтительный эффект.Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения заболевания, состояния или расстройства, выбранного из группы, состоящей из гломерулосклероза, болезни Альцгеймера, отека мозга, пропотевания жидкости из сосудов, острого респираторного дистресс-синдрома, боли, воспаления, травмы, ожогов, шока, аллергии и сердечно-сосудистого заболевания у субъекта.
[0209] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1 или Соединения 2, или содержащую их композицию, вводят субъекту для лечения инфекционного заболевания у субъекта, например инфекционного заболевания, выбранного из группы, состоящей из респираторного заболевания крупного рогатого скота, респираторного заболевания свиней, птичьего гриппа, инфекционного бронхита птиц, губчатой энцефалопатии крупного рогатого скота, лейшманиоза псовых, хронической изнуряющей болезни, вируса человеческого иммунодефицита (ВИЧ), гепатита, гепатита А, гепатита В, гепатита С, классической чумы свиней, эхинококка, энзоотической пневмонии, FIP, болезни ног и рта, эпизоотического легочного аденоматоза овец, меди-висны, мастита у животных, Microsporum canis, контагиозного пустулезного дерматита (orf) (болезни животных), чумы мелких жвачных, заболеваний оспой, болезни клюва и перьев у попугаев, бешенства, средиземноморской лихорадки (бруцеллеза), или болезни Банга, или волнообразной лихорадки, мальтийской лихорадки, инфекционного аборта, вирусного аборта, пищевого отравления сальмонеллой, кишечного паратифоза, бактериальной дизентерии, псевдотуберкулеза, чумы, чумной лихорадки, туберкулеза, вибрионов, листериоза, болезни Вейля (лептоспироза) или собачьей лихорадки, геморрагической желтухи (Leptospira icterohaemorrhagiae), лихорадки работников молочных хозяйств (L. hardjo), возвратного тифа, клещевого возвратного тифа, спирохетозной лихорадки, бродячей лихорадки, голодного тифа, лайм-артрита, синдрома Баннварта (болезни Лайма), клещевого менингополиневрита, хронической мигрирующей эритемы, вибриоза, колибактериоза, колитоксемии, белого поноса, отека кишечника свиней, кишечного паратифоза, стафилококкового пищевого токсикоза, стафилококкового гастроэнтерита, коронавируса псовых (ККТ) или парвовирусного энтерита псовых, кошачьего инфекционного вирусного перитонита, вируса передающегося гастроэнтерита (TGE), болезни «красный рот» (ERMD), инфекционного гемопоэтического некроза (IHN), вызванной Actinobacillus (Haemophilus) плевропневмонии свиней, болезни Хансена, стрептотрихоза, микотического дерматита овец, мелиоидоза, болезни Уитмора, болезни Франциска, лихорадки оленьей мухи, кроличьей лихорадки, болезни О'Хара, стрптобациллярной лихорадки, хейверхиллской лихорадки, эпидемической суставной эритемы, содоку, транспортной лихорадки, геморрагической септицемии, орнитоза, попугайной лихорадки, хламидиоза, североамериканского бластомикоза, болезни Чикаго, болезни Гилкриста, лихорадки от кошачьих царапин, доброкачественного лимфоретикулеза, доброкачественного небактериального лимфаденита, бациллярного ангиоматоза, бациллярной печеночной пурпуры, ку-лихорадки (query fever), балканского гриппа (Balkan influenza), балканского гриппа (Balkan grippe), ку-лихорадки (abattoir fever), клещевого тифа, пневмориккеттсиоза, американского клещевого тифа (American tick typhus), клещевого сыпного тифа, везикулярного риккетсиоза, пятнистой лихорадки Кью-Гарденс, блошиного сыпного тифа, эндемического сыпного тифа, городского тифа (Urban typhus), стригущего лишая, дерматофитии, лишая, трихофитии, микроспории, паховой эпидермофитии, грибкового заболевания ног, Sporothrix schenckii, диморфного грибка, криптококкоза и гистоплазмоза, доброкачественной эпидермальной обезьяньей оспы, ВЕМР, Herpesvirus simiae, вызываемой вирусом Simian В болезни, венесуэльского лошадиного энцефалита, летаргического энцефалита типа С, желтой лихорадки, рвоты кофейной гущи, хантавирусного легочного синдрома, корейской геморрагической лихорадки, эпидемической нефропатии, эпидемической геморрагической лихорадки, геморрагического нефрозонефрита, лимфоцитарного хореоменингита, калифорнийского энцефалита/ энцефалита Ла-Кросс, африканской геморрагической лихорадки, болезни зеленых мартышек, гидрофобии, бешенства, инфекционного гепатита, эпидемического гепатита, эпидемической желтухи, кори (rubeola), кори (morbilli), свиного и лошадиного гриппа, чумы домашней птицы, болезни Ньюкасла, пироплазмоза, токсоплазмоза, африканской сонной болезни, африканского трипаносомоза, родезийского трипаносомоза, болезни Шагаса, болезни Шагаса-Мацца (Chagas-Mazza Disease), латиноамериканского трипаносомоза, дизентерийной амебы, балантидной дизентерии, криптоспоридиоза, гиардиоза, кожного лейшманиоза: американского лейшманиоза, эспундии, pianbols, уты и тропической фрамбезии (в Америке); восточной язвы, фурункула аллепского (в Старом Свете); фурункула багдадского, фурункула делийского, язвы Бауру, висцерального лейшманиоза: заболевания кала-азар, микроспоридиоза, анизакиаза, трихинеллеза, ангиостронгилеза, эозинофильного менингита или менингоэнцефалита (A. cantonensis), брюшного ангиостронгилеза (A. costaricensis), анкилостомоза, некатороза, глистной болезни, капилляриоза, бругиоза, токсокароза, эзофагостомоза, стронгилоидоза, трихостронгилеза, аскаридоза, дифиллоботриоза, спарганоза, эхинококкоза, гидатидной болезни, гидатидного эхинококкоза, кистозной гидатидной болезни, инфекции ленточных червей и шистосом.
[0210] Согласно другому варианту реализации изобретения, одну или более кристаллических полиморфных форм или аморфных форм Соединения 1, или Соединение 2 или содержащую их композицию, вводят субъекту для лечения хронического заболевания почек, остеоартрита, онкологии, вирусной инфекции верхних дыхательных путей, кошачьего стоматита клеток, кошачьей эозинофильной гранулемы, инфекции вируса кошачей лейкемии, инфекции чумы плотоядных, системных грибковых инфекций, кардиомиопатии и мукополисахаридоза VII типа у субъекта.
[0211] В способах согласно настоящему изобретению переключатель генов регулирует экспрессию полинуклеотида, кодирующего интересующий пептид, белок или полипептид. Согласно одному из вариантов реализации настоящего изобретения, переключатель генов регулирует экспрессию полинуклеотида, кодирующего пептид, белок или полипептид, представляющие терапевтический интерес для лечения заболевания, состояния или расстройства у субъекта, например человека. Согласно другому варианту реализации изобретения, указанный интересующий пептид, белок или полипептид выбран из группы, состоящей из Her-2/neu (ERBB2/c-erbB-2), остеокальцина, стромелизина-1, простатического специфического антигена, натрий-йодидного симпортера человека, H19, IF-1, IGF-2, тимозина β15, Т-клеточного фактора, полученного из хряща белка, чувствительного к ретиноевой кислоте, простатина, каталитической субъединицы теломеразы, циклина-А, мидкина; с-еrbВ-2, прост-специфического мембранного антигена, р51, РНК теломеразы, простатической кислой фосфатазы, PCA3dd3, DF3/MUC1, hex II, циклооксигеназы-2, супер-простатического специфического антигена (super PSA), skp2, PRL-3, CA125/M17S2, IAI.3B, CRG-L2, TRPM4, RTVP, TARP, обратной транскриптазы теломер, амилоидного белка A4, предшественника амилоидного β-белка, предшественника амилоидного белка A4, связанного с болезнью Альцгеймера, нейропептида FF, элементов стресса эндоплазматического ретикулума, урокортина II, тирозингидроксилазы, фактора комплемента 3; сывороточного амилоида A3, тканевого ингибитора металлопротеиназы-3 (TIMP-3), рецептора фактора некроза опухоли р75, фактора некроза опухоли-α, TRPM4, RTVP, TARP, обратной транскриптазы теломер, амилоидного белка A4, предшественника амилоидного β-белка, предшественника амилоидного белка A4, связанного с болезнью Альцгеймера, нейропептида FF, элементов стресса эндоплазматического ретикулума, урокортина II, тирозингидроксилазы, фактора комплемента 3; сывороточного амилоида A3, тканевого ингибитора металлопротеиназы-3 (TIMP-3), рецептора фактора некроза опухоли р75, фактора некроза опухоли-α, рецептора, активируемого пролифератором пероксисом/IIА-1 фосфолипазы А2, секретируемой не поджелудочной железой, SOCS-3, SR-BI, Ob, сайт-1 протеазы, TIGR, VL30, переносчика-2 возбуждающей аминокислоты, MDTS9, LIM, пирролин-5-карбоксилатредуктазы, SIM2, Вах, Fas, bbс3, PINK-1, тропонина Т, myoD, актина, 22α гладкой мускулатуры, атрофина, миостатина, тяжелой цепи миозина гладкой мускулатуры, сердечного белока с анкириновым повтором, MLP, смустелина (smoothelin), MYBPC3, Tal α-тубулина, молекулы межклеточной адгезии-4 (ICAM-4), β1-субъединицы γ-аминомасляной кислоты рецептора типа А, β2-субъединицы нейронального никотинового ацетилхолинового рецептора, пресенилина-1, кальций-кальмодулинзависимой киназы IIа, рецептора CRF2α, фактора роста нервов, рецептора глюкагоноподобного пептида-2 (ГПП-2, GLP-2), трансглутаминазы типа I, К14, стеароил-коА-десатуразы, мегсина (megsin), пролактина, GDF-9, PSP94, NRL, NGAL, кислого белка молочной сыворотки long whey acidic protein, амилоида А, связанного с молочной железой, эндотелина-1, серглицина (serglycin), молекулы-1 адгезии тромбоцит-эндотелиальных клеток (РЕСАМ-1), Tie-рецепторной тирозинкиназы, KDR/flk-1, эндоглина, CCR5, CD11d, тромбоцитарного гликопротеина IIb, препроэндотелина-1, интерлейкин-18-связывающего белка, CD34, Тес-тирозинкиназы, MLH1, MSH2, MSH6, PMS1, APC, LEF-1, F2 receptor, TGF-β type II receptor, ΕΥA4, PCA3, Κ2, PROST 03, PCAM-1, PCADM-1, PCA3dd3, PCAV, PAcP, ATB0, CSA-1, SYG972, Urb-ctf, BCU399, TBX2, Cyr61, DIAPH3, BEHAB, IL-8, BLSA, BP1, DAP-киназы, HOXA9, ARP, Nbk, CD43, β7-hcG, β6-hCG, β6е-hCG, β5-hCG, β8-hcG, β3-hCG, MTAls, Old-35, Old-64, LAGE-1, CIF150/hTAFII150, онкофетального белка P65, теломеразы, CYP1B1, 14-3-3σ, NES1, CAR-1, HMGI, MAG, ELL2, эфрина B2, WAF1, CIF130, C35, BMP2, BUB3, полимеразы каппа, Ε AGI, EAG2, HMG I, HLTF, Barx2, Pp 32rl, BMP4, TS10q23,3, белка Nuclear spindle-associating protein, PFTAIRE, SEMA3B, MOGp, фортилина, IGFBP-3, Polyhomeotic 2, PNQALRE, SCN5A, miR15, miR16, Headpin, PAOhl/SMO, Hippo, Mst2, PSMA-like, JABI, NF-AT, P28ING5, MTG16, ErbB-2, HDAC9, GPBP, MG20, KLF6, ARTS 1, Dock 3, Annexin 8, MH15, DELTA-N p73, RapR6, StarDIO, Cizl, HLJ1, RapR7, A34, Sef, Killin, SGA-1M, рецептора TGFβ типа II, GCA-ассоциированных генов, PRV-1, Vezfl,млP, VEGI, PRO256, AOP2, ремоделина, фосфодиэстеразы 4D, простагландинового рецептора подтипа ЕР3, CARP, HOP, PLTP, UCP-2, FLJ11011, коданина-l (codanin-1), резистина, архипелина (archipelin), нейронатина (neuronatin), Ncb5or, 7B2, PTHrP, PEX, КСhIРl, SLIT-3, CX3CR1, SMAP-2, IC-RFX, E2IG4, UCP2, Ob-рецептора, Ob, Dpl, NRG-1, синапсина IIΙ, NRG1AG1, AL-2, пролиндегидрогеназы, MNR2, ATM, Ho-1, CON202, атаксина-1, NR3B, NIPA-1, DEPP, адреномедуллина, csdA, Inf-20, EOPA, SERT, FRP-1, сывороточного амилоида A, BMP2, BMPR1A, ACLP, резистиноподобной молекулы β, Dlg5, TRANCE, метрилина-3, синовиолина, HIV LTR, SHIVA, EBI1, EBI2, EBI3, нМ23, Eps8, бета-10, фактора роста волосяных фолликулов, Corneodesmosin, GCR9, Bg, FGF23, BBSR, MIC-1, MIA-2, ИЛ-17B, формилглицинобразующего фермента, LPLA2, CXCLIO, HFE2A, ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10R DN или их субъединицы, ИЛ-15, ИЛ-18, ИЛ-21, ИЛ-23, ИЛ-24, ИЛ-27, GM-CSF, интерферона-альфа, интерферона-гамма, интерферона-альфа 1, интерферона-альфа 2, ИЛ-15-R-альфа, CCL3 (MIP-1a), CCL5 (RANTES), CCL7 (МСР3), XCL1 (лимфотактина), CXCL1 (MGSA-альфа), CCR7, CCL19 (MIP-3b), CXCL9 (MIG), CXCL10 (IP-10), CXCL12 (SDF-1), CCL21 (6Ckine), OX40L, 4-1BBL, CD40, CD70, GITRL, LIGHT, b-дефенсина, HMGB1, Flt3L, интерферона-бета, TNF-альфа, dnFADD, BCG, TGF-альфа, PD-L1 RNAi, PD-L1 интисмыслового олигонуклеотида, TGFbRII DN, ICOS-L, S100, CD40L, p53, сурвивина, гибридного белка р53-сурвивин, MAGE3, основного белка миелина, PSА и PSMA.
[0212] Согласно другому варианту реализации изобретения, переключатель генов регулирует экспрессию полинуклеотид а, кодирующего ИЛ-12 или его субъединицу. Согласно другому варианту реализации изобретения, указанный ИЛ-12 или его субъединица представляют собой ИЛ-12 человека или его субъединицу.
[0213] Согласно другому варианту реализации изобретения, переключатель генов регулирует экспрессию полинуклеотид а, кодирующего ингибитор С1-эстеразы (например, ингибитор С1-эстеразы человека), ингибитор калликреина или антагонист рецептора брадикинина В2.
[0214] Примеры ингибитора калликреина включают, но не ограничиваются только ими, экаллантид или другие ингибиторы калликреина, указанные в патентных публикациях США №№2010/0034805, 2009/0264350, 2009/0234009, 2008/0221031, 2007/0213275, 2006/0264603 и 2005/0089515.
[0215] Примеры ингибиторов рецептора брадикинина В2 включают, но не ограничиваются только ими, хелокинестатин и антитела к рецептору брадикинина В2. Хелокинестатин имеет аминокислотную последовательность Gly-Pro-Pro-Tyr-Gln-Pro-Leu-Val-Pro-Arg (SEQ ID NO: 2) (Kwok, H.F. et al, Peptides 291 65-72 (2008), данный источник полностью включен в настоящее описание посредством ссылки). Неограничивающие примеры антител к рецептору брадикинина В2 представлены в источнике Alla, S.A. et al, J. Biol Chem. 271: 1748-1755 (1996).
[0216] Согласно другому варианту реализации изобретения, переключатель генов регулирует экспрессию полинуклеотид а, кодирующего ИЛ-12 или его субъединицу для лечения рака, например меланомы, у субъекта, например человека.
[0217] Согласно другому варианту реализации изобретения, полинуклеотид кодирует (а) переключатель генов, который содержит ДНК-связывающий домен GAL4, лигандсвязывающий домен рецептора экдизона Choristoneura fumiferana, содержащий мутации V107I и Y127E (по отношению к SEQ ID NO: 1), химерный лигандсвязывающий домен RXR, состоящий из спирали 1-8 RXR Homo sapiens и спирали 9-12 RXR Locusta migratoria, трансактивационный домен VP 16 и (b) ИЛ-12 человека, и переключатель генов, кодируемый полинуклеотидом, регулирует экспрессию ИЛ-12 человека при связывании лигандсвязывающего домена рецептора экдизона в переключателе генов с Соединением 1 или Соединением 2. Согласно другому варианту реализации изобретения, полинуклеотид вводят субъекту, страдающему раком, таким как меланома. Полинуклеотид может быть введен внутрь опухоли либо в фармацевтически приемлемом носителе, либо в составе иммунной клетки, такой как дендритная клетка. Согласно одному из вариантов реализации настоящего изобретения, полинуклеотид вводят субъекту с последующим введением одной или более полиморфных форм Соединения 1, или содержащей их композиции. Согласно другому варианту реализации изобретения, одну или более полиморфных форм Соединения 1, или содержащую их композицию, вводят субъекту с последующим введением полинуклеотида. Например, одну или более полиморфных форм или аморфных форм Соединения 1, или содержащую их композицию, можно вводить субъекту в -1, 0, +1, +2, +3, +4, +5, +6, +7 день или позднее по отношению ко дню введения полинуклеотида субъекту.
[0218] Согласно другому варианту реализации изобретения, переключатель генов регулирует экспрессию полинуклеотида, кодирующего фактор транскрипции, например GATA-1, фактор «friend of GATA» (FOG-1), EKLF (Kruppel-подобный фактор транскрипции), р45/ядерный фактор-эритроид 2 (NF-E2), недифференцируемого лейкоза (SCL) или Т-клеточного острого лимфоцитарного лейкоза-1, ОСТ4, или Sry-связанного транскрипционного фактора группы бокс белков с высокой подвижностью (Sry-related high-mobility group box transcription factor) (Sox6), или фактор роста, например IGFII, bFGF, Flt3, фактор стволовых клеток (SCF), тромбопоэтин (ТРО), костный морфогенетический белок 4 (ВМР4), рекомбинантный фактор роста эндотелия сосудов человека (VEGF-A165), интерлейкин-3 (ИЛ-3), интерлейкин-6 (ИЛ-6), или интерлейкин-11 (ИЛ-11), или эритропоэтин, для применения в регенеративной медицине, например для дифференциации, трансдифференциации, перепрограммирования, самообновления или размножения гемопоэтических стволовых клеток, гемопоэтических клеток-предшественников или индуцированных плюрипотентных стволовых клеток в процессе «фарминга» крови, то есть выработки красных кровяных клеток или других продуктов крови, у субъекта.
ПРИМЕРЫ
Оборудование - типовые условия проведения измерений
Порошковая рентгеновская дифракция (PXRD)
[0219] Использовали дифрактометр Bruker D8 Advance с геометрией отражения по Брэггу-Брентано; Сu Кα-излучением, 40 кВ/40 мА; переменное отклонение щели; детектор LynxEye с окном 3°; размер шага 0,02° 2θ; время шага 37 с; диапазон сканирования 2-50° по 2θ. Все образцы вращали (0,5 об/с) в процессе измерения, образцы были подготовлены без какой-либо специальной обработки кроме небольшого давления для получения плоской поверхности. Измерения проводили в условиях среды лаборатории в силиконовом держателе для однокристальных образцов, 0,1 или 1 мм глубиной.
Фурье-спектроскопия комбинационного рассеяния:
[0220] Использовали систему для Фурье-спектроскопии комбинационного рассеяния Bruker RFS 100; Фурье-спектры снимали с помощью лазера NIR Nd:YAG, функционирующего при 1064 нм и германиевого детектора, охлажденного жидким азотом; номинальная мощность лазера - 300 мВ; 64 сканирования с разрешением 2 см-1; измерения проводили в алюминиевом держателе в условиях среды лаборатории.
Дифференциальная сканирующая калориметрия (ДСК):
[0221] Использовали прибор Perkin Elmer DSC7; закрытые золотые тигли, наполненные в атмосфере азота; скорость нагревания 10°С/мин.
Динамическая сорбция пара (ДСП):
[0222] Использовали анализатор сорбции паров воды для множества образцов SPS 11-100n фирмы Projekt Messtechnik или анализатор сорбции паров воды DVS-1 фирмы Surface Measurement Systems Ltd. Образцу давали уравновеситься при относительной влажности (ОВ) 50% до запуска программы с заданной влажностью.
Программа: 50% ОВ → 0% ОВ → 95% ОВ → 50% ОВ, ΔΟΒ=5%/ч
[0223] Деление по гигроскопичности проводили следующим образом:
- достаточно гигроскопичный: вода поглощается с образованием жидкости;
- очень гигроскопичный: увеличение массы составляет>15%;
- гигроксопичный: увеличение массы составляет менее 15% и больше или равно 2%;
- слабо гигроскопичный: увеличение массы составляет менее 2% и больше или равно 0,2%;
- негигроскопичный: увеличение массы составляет менее 0,2%.
Термогравиметрия, совмещенная с Фурье-ИК-спектроскопией (TG-FTIR):
[0224] Использовали прибор Netzsch Thermo-Microbalance TG 209, соединенный с FTIR-спектрометром Bruker Vector 22; алюминиевый тигель с маленьким отверстием, измерения проводили в атмосфере N2, скорость нагревания 10°С/мин.
ПРИМЕР 1
N-(1-трет-бутилбутил)-N'-(2-этил-3-метоксибензоил)-гидразид (R)-3,5-диметилбензойной кислоты (Соединение 1)
[0225] Соединение 1 получали согласно Схеме 1, как описано в US 2009/0163592 (см. Пример 1).
Схема 1
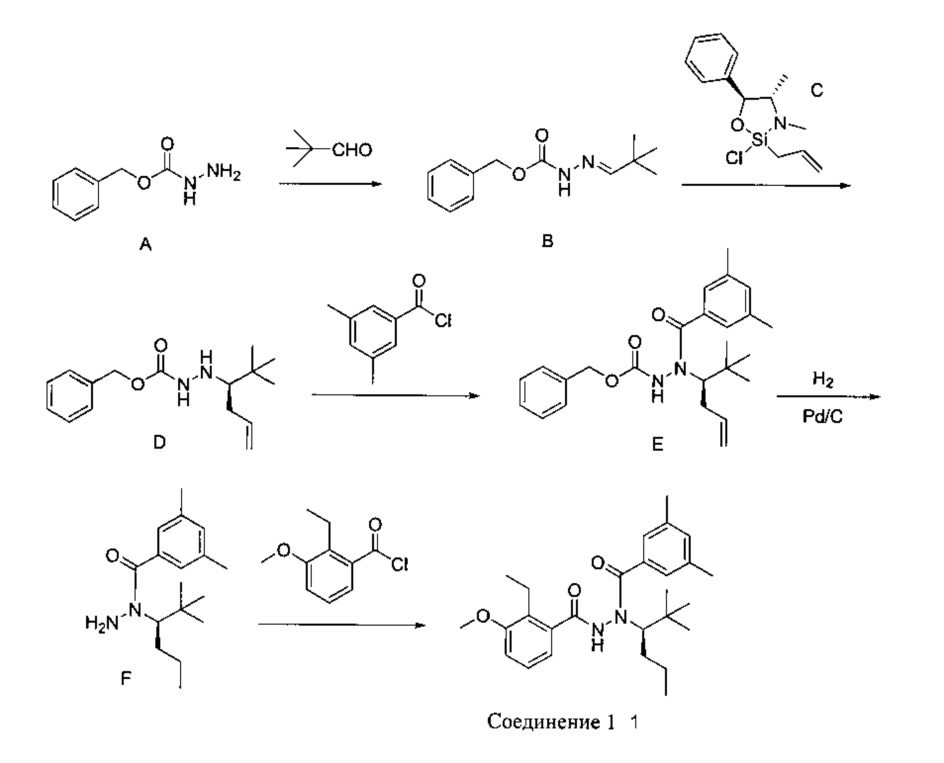
[0226] Вкратце, осуществляли взаимодействие бензилкарбазата (соединения А) с пивальдегидом с получением бензилового эфира (Е)-N'-(2,2-диметилпропилиден)-гидразинкарбоновой кислоты (соединения В). Осуществляли взаимодействие соединения В с (S,S)-2-аллил-2-хлор-3,4-диметил-5-фенил-[1,3,2]оксазасилолидином (соединением С; см. Leighton et al, J. Am. Chem. Soc. 125:9596 (2003) и WO 03/074534) с получением бензилового эфира (R)-N'-(1-трет-бутилбут-3-енил)-гидразинкарбоновой кислоты (соединения D). Осуществляли взаимодействие соединения D с 3,5-диметилбензоилхлоридом с получением бензилового эфира (R)-N'-(1-трет-бутилбут-3-енил)-R'-(3,5-диметилбензоил)-гидразинкарбоновой кислоты (соединения Е). Соединение Ε подвергали гидрированию с получением N-(1-трет-бутилбутил)-гидразида (R)-3,5-диметилбензойной кислоты (соединения F). Осуществляли взаимодействие соединения F с 2-этил-3-метоксибензоилхлоридом с получением Соединения 1. Неочищенное вещество растирали сначала в эфире (2% этанол), а затем в смеси гексан:эфир 1:1 в воронке Бюхнера с пористым стеклом. Полученный продукт далее промывали деонизованной водой при тщательном перемешивании и оставляли сушиться на воздухе. Соединение 1 выделяли в виде белого порошка.
[0227] Соединение 2 получали аналогичным образом с использованием (R,R)-2-аллил-2-хлор-3,4-диметил-5-фенил-[1,3,2]оксазасилолидина, как описано в US 2009/0163592.
[0228] Соединение 1 in vitro и in vivo регулирует экспрессию терапевтических генов посредством основанных на рецепторах экдизона систем экспрессии индуцибельных генов, описанных в US 2009/0163592, примеры 66, 67, 72 и 74.
ПРИМЕР 2
Получение смесей кристаллических полиморфных форм Соединения 1
[0229] Для целей настоящего изобретения смеси кристаллических полиморфных форм Соединения 1 обозначены как Формы I-Α, Форма I-B, Форма I-C, Форма I-D, Форма ΙΕ, Форма I-F, Форма I-G и Форма Ι-Η.
Способ 1
[0230] Соединение 1, полученное с применением методики, описанной в примере 1, перекристаллизовывали из толуола/гептана, отфильтровывали и сушили под вакуумом. Полученное кристаллическое твердое вещество подвергали второй рекристаллизации из метанола/воды, отфильтровывали и сушили под вакуумом. Полученное кристаллическое твердое вещество микронизировали с получением кристаллической Формы I-Α Соединения 1 в виде смеси полиморфных форм (Формы II со следами Формы IV) по данным PXRD, Фурье- спектроскопии комбинационного рассеяния и ДСК (фиг. 1-3, соответственно). Микронизированную Форму I-A Соединения 1 использовали в качестве исходного материала для получения чистых Форм II, III, IV, V, VI, VII, VIII и IX и их смесей согласно способам 2-40, описанным ниже.
[0231] С применением по существу той же процедуры, что описана в способе 1, за исключением микронизации, получали Формы I-B (смесь Формы II, Формы III и Формы IV), Формы I-C (смесь Формы II и Формы IV) и Формы I-D (смесь Формы II и Формы IV) Соединения 1 (фиг. 4-6, соответственно).
Способ 2
[0232] 102 мг Формы I-Α Соединения 1 суспендировали в 2,0 мл н-гексана и обрабатывали ультразвуком. Проводили перемешивание в течение 16 дней при 5°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы I-Е (смесь Формы III со следами Формы IV, фиг. 7).
Способ 3
[0233] 103 мг Формы I-Α Соединения 1 растворяли в 0,25 мл изопропилацетата. Растворитель выпаривали в потоке азота в течение 1 дня. Твердое вещество сушили под вакуумом в течение 35 минут с получением Формы I-F (смесь Формы II со следами Формы IV, фиг. 8).
Способ 4
[0234] 100 мг Формы I-Α Соединения 1 растворяли в 0,15 мл тетрагидрофурана. Растворитель выпаривали в потоке азота в течение 1 дня. Твердое вещество сушили под вакуумом в течение 35 минут с получением смеси Формы I-G (смесь Формы II со следами Формы IV, фиг. 9).
Способ 5
[0235] 108 мг Формы I-Α Соединения 1 растворяли в 3,7 мл диизопропилового эфира при 60°С и нагревали раствор до 65°С.Раствор охлаждали со скоростью 3°С/час до 5°С с получением суспензии. Твердые вещество собирали посредством фильтрования и сушили под вакуумом в течение 1 часа с получением Формы I-Η (смесь Формы II и Формы III, фиг. 10).
ПРИМЕР 3
Получение Формы II Соединения 1
[0236] Чистую кристаллическую Форму II Соединение 1 получали согласно следующим способам:
Способ 6
[0237] 101 мг Формы I-Α Соединения 1 суспендировали в 1,0 мл циклогексана и обрабатывали ультразвуком. Проводили перемешивание в течение 17 дней при 60°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 1 часа с получением Формы II.
Способ 7
[0238] 101 мг Формы I-Α Соединения 1 суспендировали в 0,1 мл смеси бензиловый спирт/циклогексан 1:1 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 17 дней при 60°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 1 часа с получением Формы II.
Способ 8
[0239] 99 мг Формы I-Α Соединения 1 суспендировали в 0,1 мл смеси н-гептан/толуол 3:2 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 17 дней при 60°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 1 часа с получением Формы II.
Способ 9
[0240] 100 мг Формы I-Α Соединения 1 суспендировали в 0,2 мл смеси н-гептан/толуол 10:1 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 17 дней при 60°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 1 часа с получением Формы II.
Способ 10
[0241] 105 мг Формы I-Α Соединения 1 суспендировали в 0,1 мл смеси н-гептан/толуол 1:10 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 17 дней при 60°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 1 часа с получением Формы II.
Способ 11
[0242] 105 мг Формы I-Α Соединения 1 суспендировали в 0,2 мл смеси н-гептан/толуол 3:2 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 5 дней при 90°С, добавляли дополнительно 0,1 мл растворителя. Проводили перемешивание еще в течение 2 дней при 90°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 20 минут с получением Формы II.
Способ 12
[0243] 203 мг Формы I-A Соединения 1 растворяли в 0,2 мл метилэтилкетона и добавляли 2,0 мл н-додекана с получением осадка. Полученный осадок собирали посредством фильтрования и сушили под вакуумом в течение 25 минут с получением Формы II.
Способ 13
[0244] 105 мг Формы I-A Соединения 1 растворяли в 0,25 мл ацетонитрила. Растворитель выпаривали в потоке азота в течение 1 дня. Твердое вещество сушили под вакуумом в течение 35 минут с получением Формы II.
Способ 14
[0245] 105 мг Формы I-A Соединения 1 растворяли в 0,25 мл изопропилацетата. Растворитель выпаривали в потоке азота в течение 1 дня. Твердое вещество сушили под вакуумом в течение 35 минут с получением Формы II.
Способ 15
[0246] 112 мг Формы I-A Соединения 1 растворяли в 0,15 мл дихлорметана. Растворитель выпаривали в потоке азота в течение 1 дня. Твердое вещество сушили под вакуумом в течение 35 минут с получением Формы II.
[0247] Характеристики Формы II Соединения 1, полученные методами PXRD, Фурье-спектроскопии комбинационного рассеяния и ДСК, представлены на фиг. 11-13, соответственно. В таблице 1 перечислены положения пиков PXRD, интенсивности пиков и значения d для Формы II Соединения 1. Исследование методом TG-FTIR показало, что данная форма является несольватированной, то есть безводной формой. Исследование методом ДСП показало, что данная форма является от негигроскопичной до слабо гигроскопичной, так как она накапливает воду в количестве 0,1 масс. % при повышении относительной влажности (ОВ) от 0% до 85%.
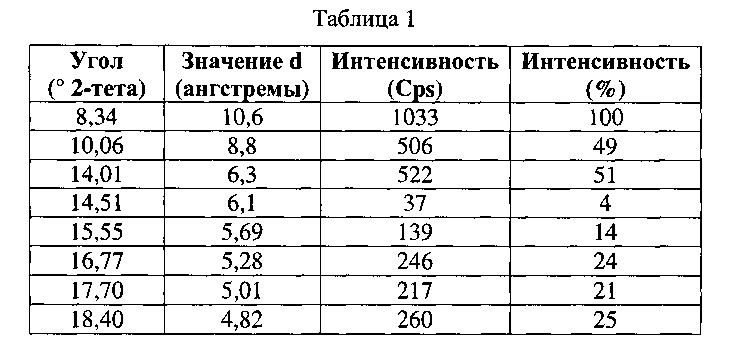
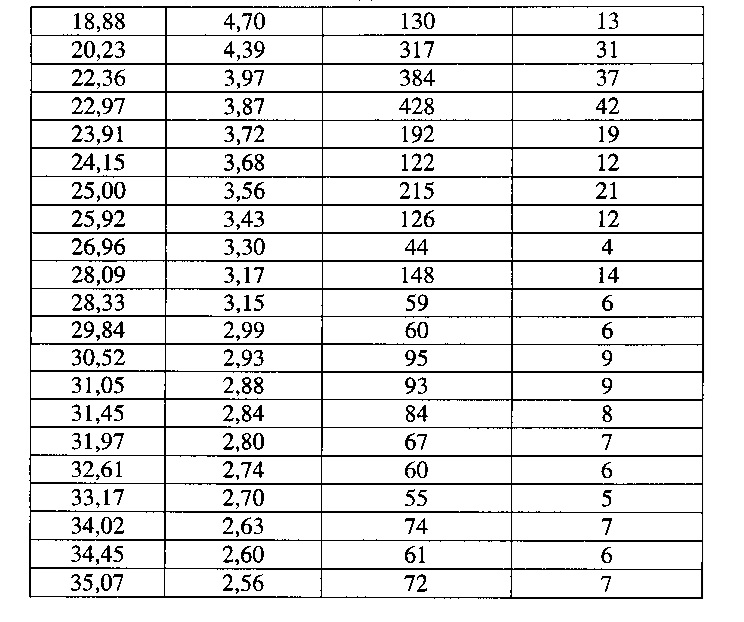
[0248] В отдельном эксперименте 86,9 мг Формы II Соединения 1 выдерживали в открытой емкости в автоклаве под давлением 105 Па (1 бар), созданным атомосферой СО2 и в пересыщенном растворе NaCl (относительная влажность 75-76%) в течение 1 месяца с получением неизмененной Формы II. Признаки образования гидрата (Формы IV) или аддукта с СO2 отсутствовали.
[0249] Механическую стабильность Формы II Соединения 1 устанавливали в экспериментах двух типов. В первом типе эксперименов примерно 200 мг Формы II спрессовывали в прессе для ИК-спектроскопии с силой 10 метрических тонн (диаметр таблеток 13 мм) в течение 30 мин. Полученные таблетки анализировали методом PXRD. Во втором типе экспериментов примерно 150 мг Формы II тщательно измельчали и анализировали методом PXRD. PXRD-дифрактограммы образцов после механической обработки не демонстрировали изменений кристаллической формы после измельчения или прессования.
ПРИМЕР 4
Получение Формы III Соединения 1
[0250] Чистую кристаллическую Соединение 1 Формы III получали согласно следующим способам:
Способ 16
[0251] 109 мг Формы I-A Соединения 1 суспендировали в 2,0 мл циклогексана и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 17
[0252] 113 мг Формы I-Α Соединения 1 суспендировали в 2,0 мл н-гептана и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 18
[0253] 106 мг Формы I-Α Соединения 1 суспендировали в 2,0 мл кумола и обрабатывали ультразвуком. Проводили перемешивание в течение 1 дня при комнатной температуре, после чего добавляли дополнительно 28 мг Формы I-Α Соединения 1. Проводили перемешивание в течение 13 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 19
[0254] 109 мг Формы I-Α Соединения 1 суспендировали в 1,0 мл диэтилового эфира и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 20
[0255] 165 мг Формы I-Α Соединения 1 суспендировали в 0,2 мл этилацетата и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 21
[0256] 105 мг Формы I-Α Соединения 1 суспендировали в 1,0 мл трет-бутилметилового эфира (МТБЭ) и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 22
[0257] 103 мг Формы I-Α Соединения 1 суспендировали в 0,2 мл толуола и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 23
[0258] 101 мг Формы I-Α Соединения 1 суспендировали в 2,0 мл н-додекана и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 24
[0259] 133 мг Формы I-Α Соединения 1 суспендировали в 0,2 мл смеси н-гексан/этанол 1:1 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 25
[0260] 178 мг Формы I-Α Соединения 1 суспендировали в 0,2 мл смеси н-октан/ацетон 1:1 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 26
[0261] 111 мг Формы I-Α Соединения 1 суспендировали в 0,7 мл смеси н-гептан/толуол 3:2 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 2,5 часов с получением Формы III.
Способ 27
[0262] 97 мг Формы I-Α Соединения 1 суспендировали в 0,8 мл смеси п-гептан/толуол 10:1 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 2,5 часов с получением Формы III.
Способ 28
[0263] 100 мг Формы I-Α Соединения 1 суспендировали в 0,5 мл смеси н-гептан/толуол 1:10 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 1 дня при комнатной температуре, после чего добавляли 30 мг Формы I-Α Соединения 1. Проводили перемешивание в течение 13 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 2,5 часов с получением Формы III.
Способ 29
[0264] 105 мг Формы I-Α Соединения 1 суспендировали в 0,7 мл смеси н-гептан/толуол 3:2 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 16 дней при 5°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 30
[0265] 102 мг Формы I-Α Соединения 1 суспендировали в 0,7 мл смеси н-гептан/толуол 10:1 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 16 дней при 5°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
Способ 31
[0266] 115 мг Формы I-Α Соединения 1 суспендировали в 0,7 мл смеси н-гептан/толуол 1:10 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 16 дней при 5°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы III.
[0267] Данные эксперименты показали, что при 5°С и при комнатной температуре Форма III более стабильна, чем Форма II.
[0268] Характеристики Формы III Соединения 1, полученные методами PXRD, Фурье-спектроскопии комбинационного рассеяния и ДСК, представлены на фиг. 14-16, соответственно. В таблице 2 перечислены положения пиков PXRD, интенсивности пиков и значения d для Формы III Соединения 1. Исследование методом TG-FTIR показало, что данная форма является несольватированной, то есть безводной формой. Исследование методом ДСП показало, что данная форма является от негигроскопичной до слабо гигроскопичной, так как она накапливает воду в количестве 0,1 масс. % при повышении при относительной влажности (ОВ) от 0% до 85%.
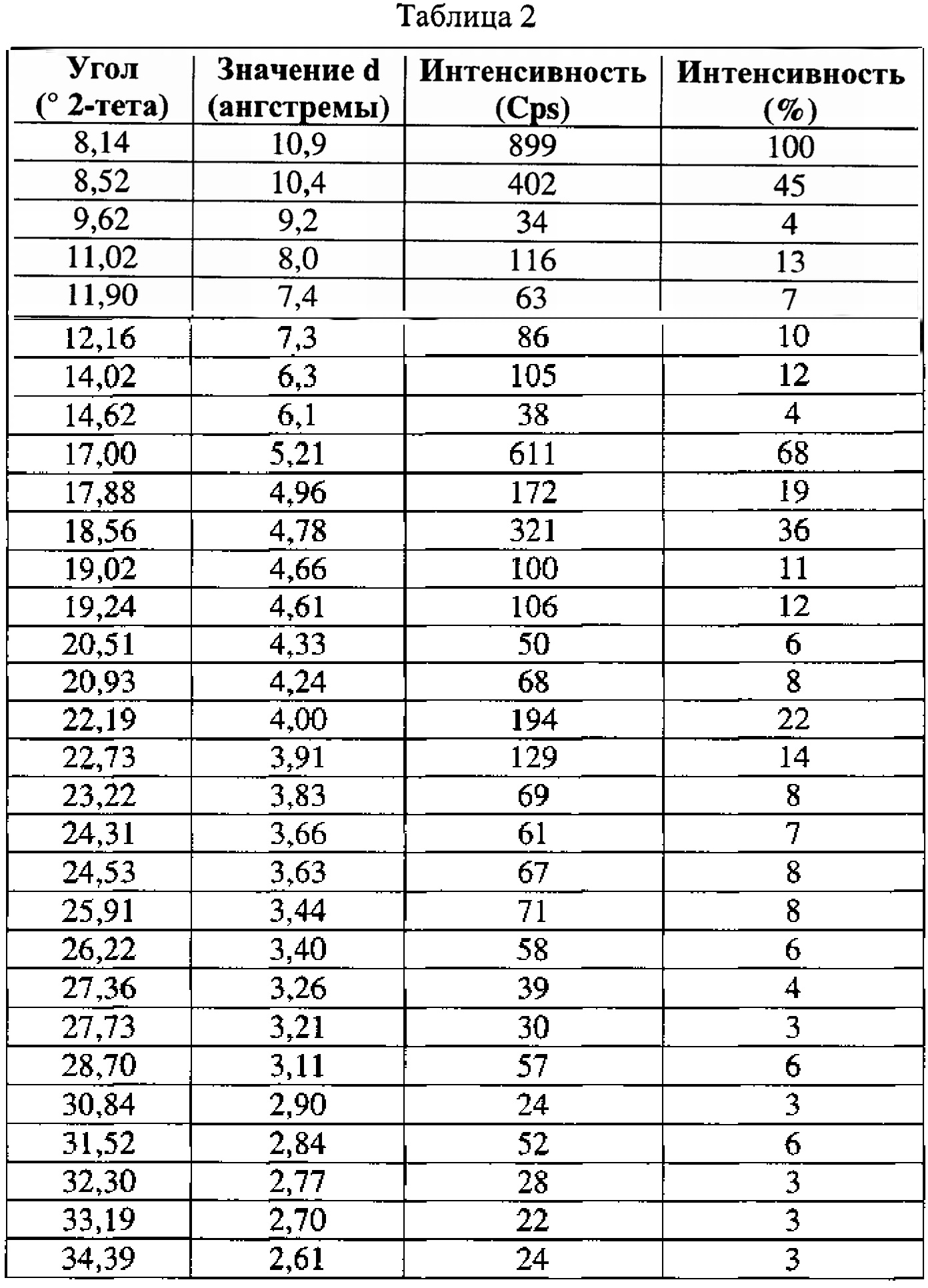
[0269] В отдельном эксперименте 52,4 мг Формы III Соединения 1 выдерживали в открытой емкости в автоклаве под давлением 105 Па (1 бар), созданным атомосферой СО2 и в пересыщенном растворе NaCl (относительная влажность 75-76%) в течение 1 месяца с получением неизмененной Формы III. Признаки образования гидрата (Формы IV) или аддукта с СО2 отсутствовали.
[0270] Механическую стабильность Формы III Соединения 1 устанавливали в экспериментах двух типов. В первом типе эксперименов примерно 200 мг Формы III спрессовывали в прессе для ИК-спектроскопии с силой 10 метрических тонн (диаметр таблеток 13 мм) в течение 30 мин. Полученные таблетки анализировали методом PXRD. Во втором типе экспериментов примерно 150 мг Формы III тщательно измельчали и анализировали методом PXRD. PXRD- дифрактограммы образцов после механической обработки не демонстрировали изменений кристаллической формы после измельчения или прессования.
ПРИМЕР 5
Получение Формы IV Соединения 1
[0271] Чистую кристаллическую Форму IV Соединения 1 получали согласно следующим способам:
Способ 32
[0272] 106 мг Формы I-A Соединения 1 суспендировали в 2,0 мл воды и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы IV. Исследование методом TG-FTIR показало, что Форма IV представляет собой гидрат с потерей 3,5 масс. % воды от 25°С-150°С (3,9 масс. % соответствовали бы моногидрату). По данным TG-FTIR, из гидрата выделяется вода примерно при 100°С.
Способ 33
[0273] 100 мг Формы I-A Соединения 1 суспендировали в 5,0 мл смеси вода:этанол 1:1 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 16 дней при 5°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы IV.
Способ 34
[0274] 109 мг Формы I-A Соединения 1 суспендировали в 5,0 мл смеси вода:2-пропанол 1:1 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 16 дней при 5°С, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы IV.
[0275] Характеристики Формы IV Соединения I, полученные методами PXRD, Фурье-спектроскопии комбинационного рассеяния и ДСК (2 термограммы), представлены на фиг. 17-20, соответственно. В таблице 3 перечислены положения пиков PXRD, интенсивности пиков и значения d для Формы IV Соединения I.
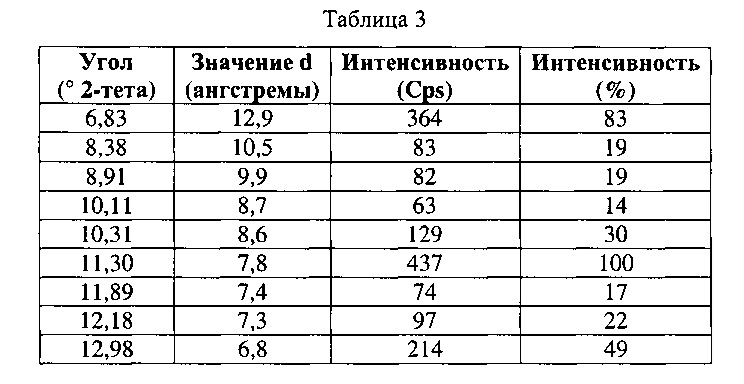
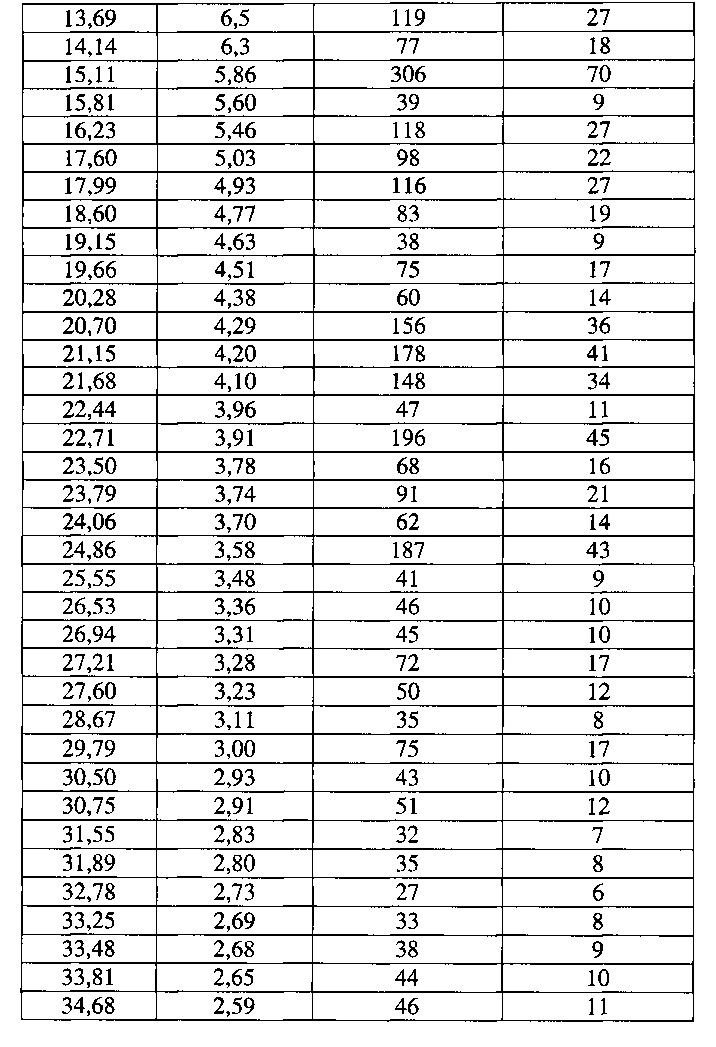
ПРИМЕР 6
Получение Формы V Соединения 1
Способ 35
[0276] 126 мг Формы I-A Соединения 1 растворяли в 0,55 мл метанола. Растворитель выпаривали в потоке азота в течение 1 дня. Твердое вещество сушили под вакуумом в течение 35 минут с получением Формы V. Исследование методом TG-FTIR показало, что Форма V представляла собой метанольный моносольват с потерей 6,7 масс. % метанола от 50-150°С (6,8 масс. % соответствовали бы моносольвату).
[0277] Характеристики Формы V Соединения 1, полученные методами PXRD и Фурье-спектроскопии комбинационного рассеяния, представлены на фиг. 21 и 22, соответственно. В таблице 4 перечислены положения пиков PXRD, интенсивности пиков и значения d для Формы V Соединения 1.
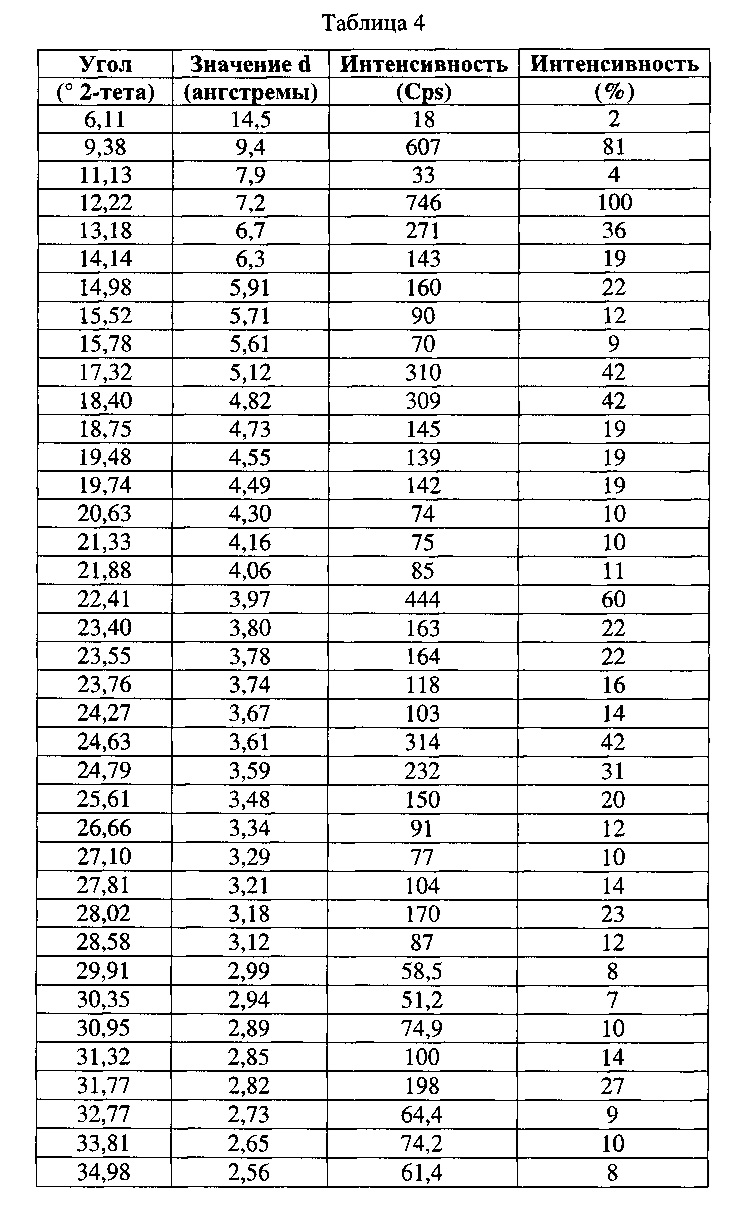
ПРИМЕР 7
Получение Формы VI Соединения 1
Способ 36
[0278] 101 мг Формы I-A Соединения 1 суспендировали в 5,0 мл смеси вода:метанол 1:1 (об.:об.) и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы VI. PXRD-дифрактограмма высушенного образца отличается от наложения Формы IV (гидрата) и Формы V (метанольного моносольвата). Форма VI, возможно, представляет собой смесь метанольного сольвата и гидрата. В данной форме отношение метанол/вода может влиять на структуру твердого вещества и это, вероятно, приводит к смещению положений пиков PXRD. Исследование методом TG-FTIR показало потерю 3,8 масс. % метанола (и немного воды) от 25°С-90°С и 2,1 масс. % воды (и немного метанола) от 90-130°С (3,5 масс. % метанола соответствовали бы полусольвату; 2,0 масс. % воды соответствовали бы полугидрату).
[0279] Характеристики Формы VI Соединения 1, полученные методами PXRD и Фурье-спектроскопии комбинационного рассеяния, представлены на фиг. 23 и 24, соответственно. В Таблице 5 перечислены положения пиков PXRD, интенсивности пиков и значения d для Формы VI Соединения 1.
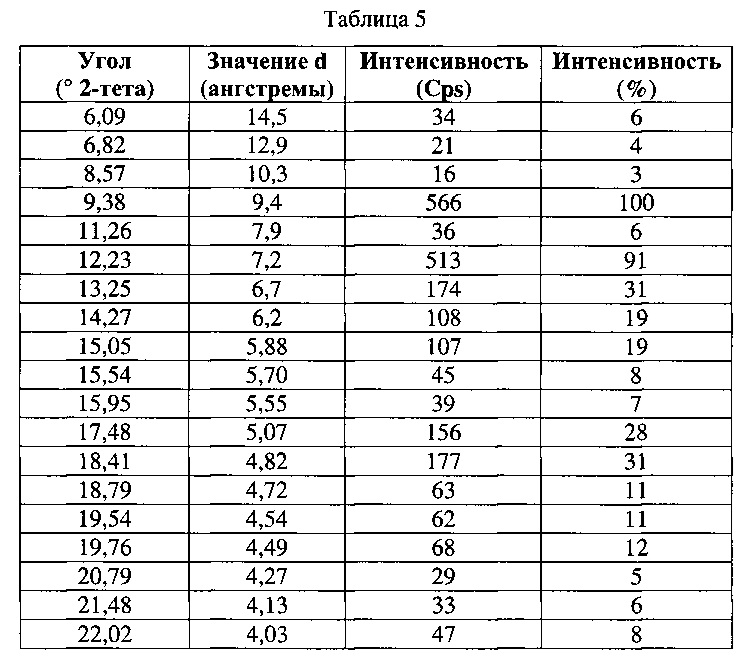
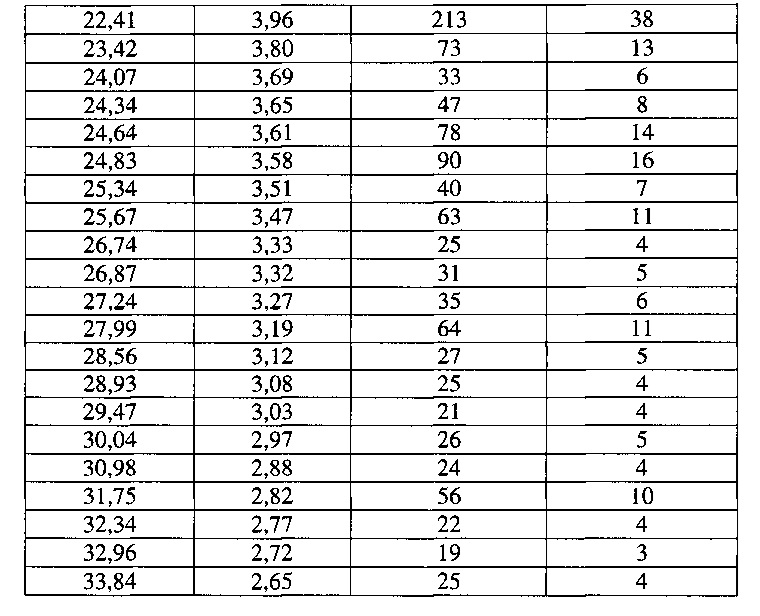
ПРИМЕР 8
Получение Формы VII Соединения 1
Способ 37
[0280] 101 мг Формы I-A Соединения 1 суспендировали в 0,5 мл ДМСО и обрабатывали ультразвуком. Проводили перемешивание в течение 14 дней при комнатной температуре, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 30 минут с получением Формы VII. Исследование методом TG-FTIR показало, что Форма VII представляла собой ДМСО-сольват с потерей 9,9 масс. % ДМСО от 25°С-150°С (8,2 масс. % ДМСО соответствовали бы полусольвату; 15,1 масс. % соответствовали бы моносольвату), это демонстрирует, что Форма VII представляет собой ДМСО-сольват.Характеристики Формы VII Соединения 1, полученные методами PXRD и Фурье-спектроскопии комбинационного рассеяния, представлены на фиг. 25 и 26, соответственно. В таблице 6 перечислены положения пиков PXRD, интенсивности пиков и значения d для Формы VII Соединения 1.

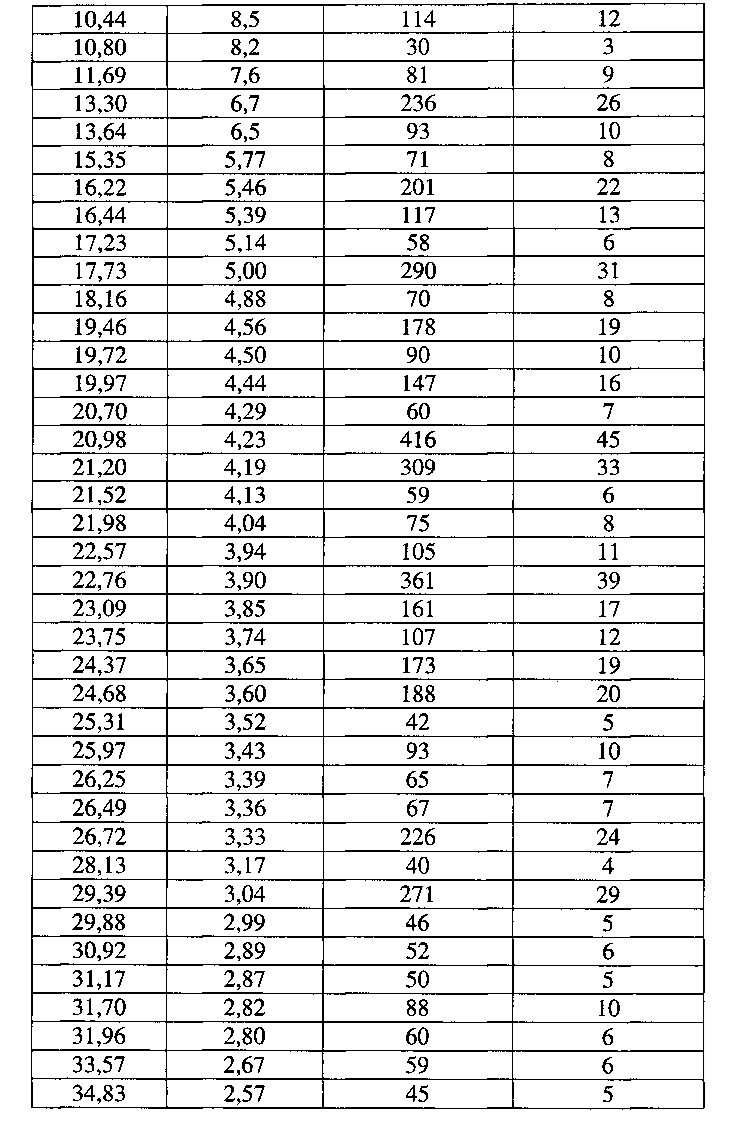
ПРИМЕР 9
Получение Формы VIII Соединения 1
Способ 38
[0281] 199 мг Формы I-A Соединения 1 растворяли в 0,32 мл бензилового спирта и добавляли 2,0 мл метилциклогексана. После перемешивания при 5°С в течение 4 ч получали непрозрачный раствор. Растворитель выпаривали при 5°С.Твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 45 минут с получением Формы VIII (фиг. 27 и 28). В таблице 7 перечислены перечислены положения пиков PXRD, интенсивности пиков и значения d для Формы VIII Соединения 1. Исследование методом TG-FTIR показало потерю бензилового спирта 63,0 масс. % от 25°С-250°С. Образец был, вероятно, не полностью высушен, но также мог соответствовать сольвату. Данный образец повторно исследовали по истечении 2 недель. Было обнаружено, что образец был также во влажном состоянии и соответствовал той же форме. Далее образец сушили в течение 1 дня в потоке азота и в течение последующих 6 дней под вакуумом при комнатной температуре. Оказалось, что порошок стал сухим и его Фурье-спектр комбинационного рассеяния соответствовал Форме VIII, а исследование методом TG-FTIR показало потерю 8,9 масс. % бензилового спирта (не весь растворитель выделился).
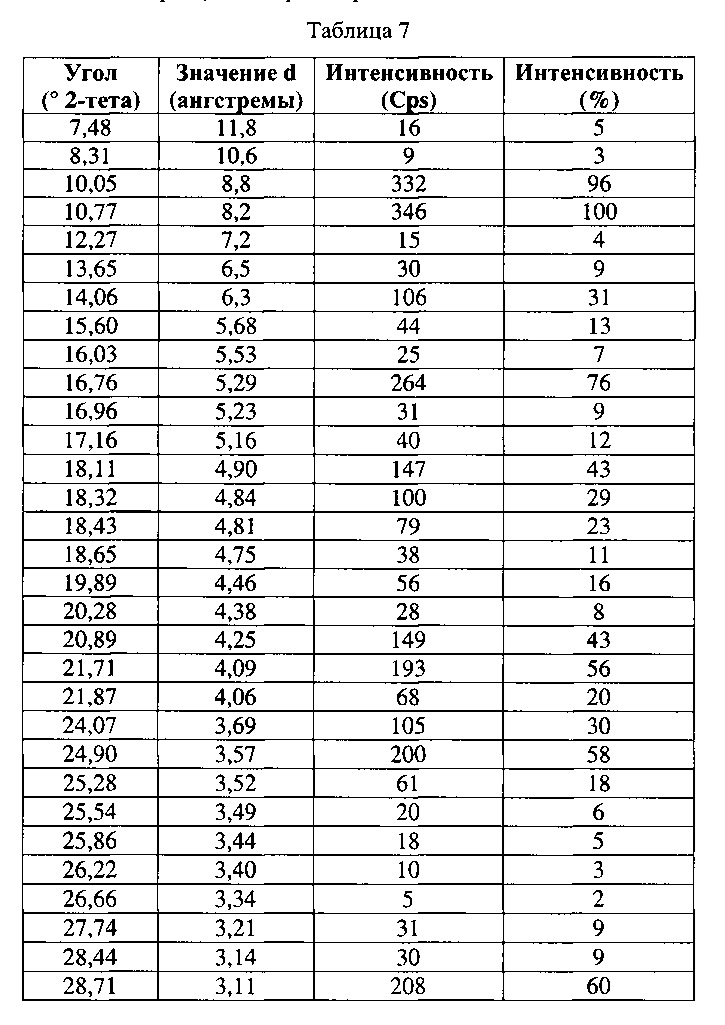
ПРИМЕР 10
Получение Формы IX Соединения 1
Способ 39
[0282] 198 мг Формы I-A Соединения 1 растворяли в 0,2 мл ацетона и 2,0 мл циклогексана. Раствор перемешивали при 5°С в течение 4 часов, после чего упаривали при 5°С в течение 2 часов с получением осадка. Полученный осадок собирали посредством фильтрования и сушили под вакуумом в течение 1 часа с получением Формы IX (фиг. 29 и 30). В таблице 8 перечислены положения пиков PXRD, интенсивности пиков и значения d для Формы К Соединения 1. Исследование методом TG-FTIR показало потерю 51,2 масс. % циклогексана от 25°С-150°С.Образец, вероятно, был не полностью высушен, но также мог соответствовать циклогексановому сольвату. Повторное исследование данного образца методами PXRD и Фурье-спектроскопии комбинационного рассеяния показало, что образец спонтанно перешел в Форму II.
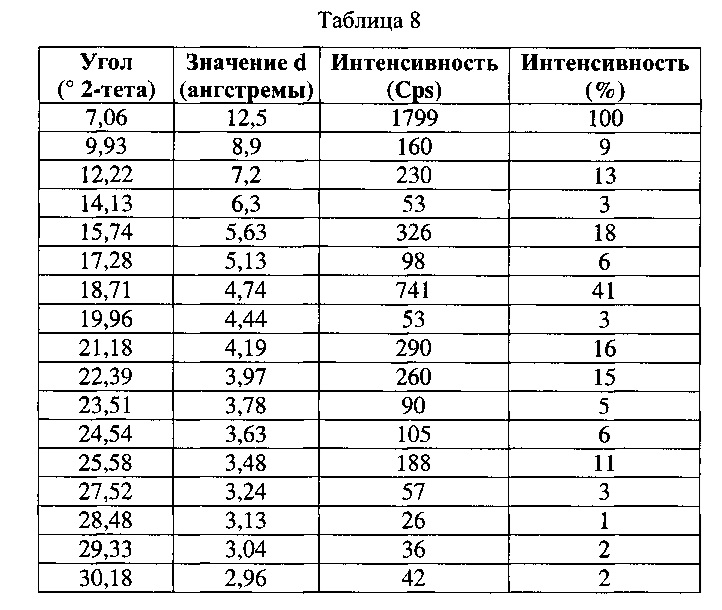
ПРИМЕР 11
Получение Формы X Соединения 1
Способ 40
[0283] 128 мг Формы I-A Соединения 1 растворяли в 0,2 мл муравьиной кислоты. Растворитель выпаривали в потоке азота в течение 1 дня. Твердое вещество сушили под вакуумом в течение 35 минут с получением Соединения 1 в виде аморфного твердого вещества (Формы X), по данным PXRD (фиг. 31) и Фурье-спектроскопии комбинационного рассеяния (фиг. 32).
ПРИМЕР 12
Исследования стабильности с учетом растворителя, проведенные в смеси н-гептан/толуол
[0284] Термодинамическую стабильность Формы II и Формы Ш в зависимости от температуры исследовали в экспериментах по уравновешиванию суспензий.
Способ 41
[0285] 54,6 мг Формы III Соединения 1 и 61,2 мг Формы II Соединения 1 суспендировали в 0,8 мл смеси н-гептан:толуол 3:2 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание при 45°С в течение 6 дней, после чего твердое вещество собирали посредством фильтрования и сушили под вакуумом в течение 1 часа с получением смеси Формы III и Формы IV. В данном эксперименте исходное вещество, вероятно, приобретало влажность окружающей среды с получением Формы IV.
Способ 42
[0286] 18,5 мг Формы III Соединения 1 и 28,0 мг Формы II Соединения 1 суспендировали в 0,4 мл смеси н-гептан:толуол 3:2 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание при 60°С в течение 6 дней, после чего твердое вещество собирали посредством фильтрования с получением Формы II.
Способ 43
[0287] 35,4 мг Формы III Соединения 1 и 46,1 мг Формы II Соединения 1 суспендировали в 0,4 мл смеси н-гептан:толуол 3:2 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание при 50°С в течение 6 дней, после чего твердое вещество собирали посредством фильтрования с получением смеси Формы II и Формы III.
Способ 44
[0288] 40,5 мг Формы III Соединения 1 и 45,7 мг Формы II Соединения 1 суспендировали в 0,4 мл смеси н-гептан:толуол 3:2 (об./об.) и обрабатывали ультразвуком. Проводили перемешивание при 55°С в течение 6 дней, после чего твердое вещество собирали посредством фильтрования с получением Формы II.
[0289] Эксперименты с учетом растворителя представляют собой принципиальные термодинамические исследования стабильности Форм II и III Соединения 1, поскольку были суспендированы смеси обеих форм. При температуре ниже 45°С более стабильной в смеси н-гептан:толуол 3:2 (об./об.) была Форма III. При температуре выше 55°С более стабильной в смеси н-гептан:толуол 3:2 (об./об.) была Форма П. При 50°С смесь в смеси н-гептан:толуол 3:2 (об./об.) была получена как Формы П, так и Формы III. Данный результат был неожиданным. Ожидалось, что при приближении к температуре перехода, термодинамическая движущая сила будет очень мала, что приводило бы к низкой скорости перехода. Возможно, кинетика трансформации была слишком низкой, чтобы трансформация произошла во время эксперимента. По данным этих экспериментов по уравновешиванию суспензий, Форма II и Форма III являются энантиотропными полиморфами. Температура термодинамического перехода между Формой II и Формой III составляет от 45°С до 55°С.
ПРИМЕР 13
Исследования стабильности с учетом растворителя, проведенные в смеси н-гептан/этанол
[0290] Форму II Соединения 1, Форму III Соединения 1 и смесь Форм II и III Соединения 1 суспендировали в смеси 95:5 гептан:этанол (безводный). По истечении одного дня, в течение которого суспензию выдерживали при различных температурах, часть суспензии фильтровали и анализировали методом XRPD. Результаты представлены в таблице 9. Опосредованный раствором переход происходил при 45-47°С в смеси гептан:этанол 95:5. При температуре ниже 45°С более стабильной была Форма III Соединения 1; при температуре выше 47°С более стабильной была Форма II Соединения 1.


ПРИМЕР 14
Исследования стабильности с учетом растворителя, проведенные в смеси вода/метанол
[0291] Смесь Форм II, III, IV и V Соединения 1 суспендировали в различных композициях метанол/вода, или в воде, в течение по меньшей мере трех дней при различных температурах. Результаты представлены в таблице 10. При содержании метанола более 60% по объему, Форма V была наиболее стабильной полиморфной формой Соединения 1 при всех трех температурах. При содержании метанола менее 60% по объему, Форма IV была наиболее стабильной полиморфной формой Соединения 1 при всех трех температурах.

ПРИМЕР 15
Стабильность Форм II, III и IV Соединения 1 в твердом состоянии при 60-65°С
[0292] Форму II Соединения 1, Форму III Соединения и Форму IV Соединения 1 выдерживали при 60-65°С во флаконе с закрытой крышкой в течение различного времени. Результаты представлены в таблице 11. Формы II и III Соединения 1 оставались без изменений при всех условиях. Форма IV Соединения 1 переходила в смесь Форм II и III через 10 дней при 60-65°С.

ПРИМЕР 16
Эффективность Соединения 1 в переключении генов
[0293] Исследования переключения генов в клетках проводили путем трансфекции следующих конструкций в эмбриональные клетки фибробластов мыши (NIH3T3). Домены D, Е и F дикого типа из а) С.fumiferana EcR (CfEcR-DEF) и b) С.fumiferana EcR с мутацией E274V/V390I/Y410E (VY-CfEcR-DEF) подвергали гибридизации с GAL4-DBD и помещали под контроль промотора CMV в вектор pBIND (Promega Corporation, Madison, WI, США). Химерный RXR из RXRb Homo sapiens и RXR Locusta migratoria, гибридизованный с VP16-AD и находящийся под контролем промотора SV40e, был описан ранее. (См., Kothapalli et al, Dev. Genet. 77:319-330 (1995); Palli, et al, FEBS J. 272:5979-5990 (2005); и патент США №7935510 B2). Плазмида, содержащая индуцибельный репортерный ген люциферазы, pFRLuc, (Stratagene Cloning Systems, La Jolla, CA, США) содержит пять копий элемента GAI-4-ответа и синтетический минимальный промотор.
[0294] Соединение 1 исследовали при стандартных условиях исследования в 8 дозах от 0,01-33 мкМ при конечной концентрации ДМСО 0,33% в контрольных лунках и лунках с обработкой Соединением 1. При необходимости Соединение 1 исследовали в более низких концентрациях. Через 48-часовой инкубации после обработки и трансфекции, анализировали люциферазную активность в клетках с применением системы анализа люциферазной активности Bright-GloTM (Promega Corporation, Madison, WI, США) согласно инструкциям производителя. Анализы проводили как минимум в двух повторностях, а анализы определения проводили не менее шести раз. Данные приводили к сигмоидальной кривой доза-ответ. Отн. макс. FI = максимальная кратность индукции относительно положительного контроля. Результаты представлены в таблице 12.

ПРИМЕР 17
Клиническое исследование
[0295] Безопасность, переносимость, трансгенную функцию и иммунологические эффекты внутриопухолевых инъекций трансдуцированных аденовирусом аутологичных дендритных клеток, сконструированных таким образом, чтобы экспрессировать ИЛ-12 человека и один или более других иммуномодуляторов под контролем RTS®, у людей с III и IV стадией меланомы оценивали с использованием методик, таких как описано ниже.
[0296] Исследование, в котором участвовали люди с III и IV стадией меланомы, проводили на 4 когортах (группах) субъектов, где каждому субъекту делали однократную внутриопухолевую инъекцию (внутрь меланомы) трансдуцированных аденовирусом аутологичных (повторно введенных тому же субъекту, из которого они были взяты) дендритных клеток (ДК), сконструированных таким образом, чтобы экспрессировать интерлейкин-12 человека (hIL-12), и один или более других иммуномодуляторов, в дозе 5×107 в комбинации с ежедневными вводимыми перорально дозами одной или более кристаллических полиморфных форм Соединения 1, или содержащей их композиции (совокупно обозначенных в настоящем примере как «активирующее лекарство»). В исследовании использовали инъекции дендритных клеток, трансдуцированных ex vivo (после того, как клетки были извлечены из субъектов) аденовирусным вектором для индуцибельной экспрессии ИЛ-12 человека и одного или более других иммуномодуляторов. Выработку ИЛ-12 и указанных одного или более других иммуномодуляторов инъецированными ДК «запускали» (индуцировали) посредством активации RTS® посредством перорального введения активирующего лекарства. Безопасность и переносимость оценивали посредством физической оценки (включая статус активности ECOG), измерения жизненно-важных параметров, химического анализа сыворотки крови, анализа мочи, гематологии, неблагоприятных явлений - «побочных эффектов» и антител, а также клеточного иммунного ответа на аденовирус, компоненты RTS® и активирующее лекарство. Для оценки прогресса оценивали однократную дозу и фармакокинетику в равновесном состоянии/всасывание, распределение, метаболизм и выведение (ADME) активирующего лекарства, проводили анализ уровней hIL-12, уровней других иммуномодуляторов и клеточного иммунного ответа (Т-клеток) в материалах, взятых на биопсию из целевых опухолей, дренирующих лимфатических узлах и периферической части системы кровообращения, а также измеряли профиль цитокинов сыворотки.
[0297] Например, 16 субъектов с III и IV стадией меланомы разделяли на четыре когорты, где когорты 1 и 2 содержали три субъекта, а когорты 3 и 4 содержали 5 субъектов. Всем субъектам делали однократную внутриопухолевую инъекцию 5×107 аутологичных ДК, трансдуцированных аденовирусным вектором, кодирующим ИЛ-12 человека и один или более других иммуномодуляторов под контролем RTS®. Например, субъектам вводили внутриопухолевую инъекцию аутологичных ДК, трансдуцированных аденовирусным вектором, кодирующим ИЛ-12 человека под контролем RTS® и иммуномодулятор, такой как ИЛ-15 или ИЛ-21.
[0298] Субъекты получали однократную ежедневную вводимую перорально дозу активирующего лекарства (когорта 1: 0,01 мг/кг, когорта 2: 0,1 мг/кг, когорта 3: 1,0 мг/кг и когорта 4: 3 мг/кг), первую дозу вводили приблизительно за 3 часа до инъекции ДК в 1й день и продолжали введение в течение 13 последующих дней. Дополнительные инъекции трансдуцированных аденовирусом аутологичных дендритных клеток в комбинации с 14 однократными (один раз) ежедневными вводимыми перорально дозами активирующего лекарства можно вводить выбранным субъектам, которые соответствуют критериям для повторного лечения. Оценивали безопасность, переносимость и работу дендритных клеток для всех субъектов в каждой группе когорты 1 в течение периода до одного месяца после инъекции сконструированных in vitro дендритных клеток до того, как вводить субъектам следующую более высокую дозу активирующего лекарства. Оценку безопасности продолжали для всех субъектов в течение 3 месяцев после первой инъекции сконструированных дендритных клеток с возможностью продления периода последующего наблюдения в общей сложности до шести месяцев, чтобы контролировать безопасность для субъекта, в случае если наблюдалась токсичность или если субъект получал дополнительную(ые) инъекцию(и) дендритных клеток.
[0299] Такое исследование демонстрирует безопасность и переносимость однократной или множества внутриопухолевых инъекций трансдуцированных аденовирусом аутологичных дендритных клеток в комбинации с вводимым перорально активирующим лекарством у субъектов с меланомой. Данное исследование обеспечивает равновесную фармакокинетику/ADME вводимого перорально активирующего лекарства. Исследование демонстрирует функционирование RTS® в субъектах посредством измерения экспрессии hIL-12 и экспрессии одного или более других иммуномодуляторов в трансдуцированных аденовирусом аутологичных дендритных клетках в целевой опухоли и/или дренирующих лимфатических узлах в ответ на активацию RTS® посредством перорального введения активирующего лекарства. Кроме того, данное исследование демонстрирует иммунологическое действие трансдуцированных аденовирусом аутологичных дендритных клеток в отношении клеточного иммунного ответа в целевой опухоли, дренирующих лимфатических узлах и периферической части системы кровообращения после перорального введения активирующего лекарства.
[0300] Меланома выбрана в качестве примера рака. Было показано, что для меланомы в частности среди солидных опухолей характерен ответ на иммунотерапию, и опухоли меланомы легко доступны для внутриопухолевой инъекции и биопсии. Субъекты, включенные в данное исследование, страдали меланомой нерезектабельных стадий III или IV, которая имела диаметр по меньшей мере 0,5 см, любую толщину опухоли, любое количество вовлеченных лимфоузлов, транзитные метастазы или отдаленные метастазы.
[0301] Следует понимать, что не предполагается, что вышеописанные варианты реализации и примеры каким-либо образом ограничивают объем настоящего изобретения, и предполагается, что представленная формула изобретения охватывает все варианты реализации и примеры, вне зависимости от того, представлены ли они в явной форме или нет.
[0302] Содержание всех патентов и публикаций, которые упоминаются в настоящем описании, полностью включено в настоящее описание посредством ссылки.
Реферат
Изобретение относится к новой кристаллической форме III N-(1-трет-бутилбутил)-N'-(2-этил-3-метоксибензоил)-гидразида (R)-3,5-диметилбензойной кислоты. В настоящем изобретении также предложены композиции, содержащие кристаллическую форму III, способ ее получения и применения для регуляции экспрессии генов в клетке или в субъекте. 7 н. и 13 з.п. ф-лы, 32 ил., 12 табл., 17 пр.

Комментарии