Способы инактивации вирусов с применением n-метилглюкамида и его производных - RU2783667C2
Код документа: RU2783667C2
Чертежи















Описание
Уровень техники
Биотерапевтические средства представляют собой молекулы, полученные в ходе процесса, который включает сырье любого биологического происхождения, т.е. клеточные линии, жидкие среды клеточной культуры и ткани или жидкие среды организма. Производство биологически полученных терапевтических средств представляет собой сложный процесс, требующий множество стадий очистки для обеспечения безопасности. Особенно важно учитывать, что на каждой стадии или в ходе процесса может возникнуть микробное загрязнение. В случае получения рекомбинантного белка биотерапевтические средства в основном получают путем культивирования сконструированных клеток человека или животного [т.е. клеток яичника китайского хомячка (СНО) или почки новорожденного хомяка (BHK)], несущих плазмидную ДНК, содержащую представляющий интерес ген (GOI) или клетки гибридомы, т.е. NS0, и ряд отдельных операций, реализующих процесс очистки. Хорошо известно, что клетки CHO и BHK (Chan, S.Y., 1994, Wang G. et al 1999 & Suzuki A. et al 1982) имеют хромосомно интегрированные провирусные элементы, кодирующие эндогенные ретровирусоподобные частицы (ERVLP). Биотерапевтический препарат из цельной крови или плазмы сталкивается с проблемами загрязнения сырья переносимыми кровью патогенными микроорганизмами, т.е. вирусом гепатита B (HBV), вирусами гепатита C (HCV) и т.д. Кроме того, занесенные агенты могут вводиться в промежуточные продукты получения, что создает дополнительные проблемы для производства. На сегодняшний день имеется много сообщений о случаях заражения вирусами биореакторов (Hsieh, W.T. et al 2008, Qiu Y. et al, 2013). В частности, инактивация и/или удаление вирусов являются неотъемлемой частью промышленности биологических соединений на протяжении многих лет. Некоторые из причин включают вариабельность источников, из которых происходят вирусы, а также небольшие размеры
Вирусы делятся на группы оболочечных и безоболочечных. Эндогенные ретровирусоподобные частицы находятся в оболочке и обнаруживаются в клетках CHO и BHK и связанных с ними жидких средах культуры, что создает риск загрязнения для дальнейших стадий очистки, установок, устройств и окружающей среды. Хотя при использовании существующих методов не наблюдалось инфекционности, эндогенные ретровирусоподобные частицы представляют потенциальный риск для пациентов и для промышленности. По всем этим причинам становится все более важным быстро и эффективно инактивировать и/или удалять эти загрязнители из производственных процессов.
Детергенты применяли в качестве важного инструмента для инактивации вирусов в различных массивах и анализах. Начиная с 1980-х годов, детергенты повысили безопасность пулов образцов крови (для пациентов, нуждающихся в переливании крови или компонентах крови, таких как терапевтические продукты, полученные из плазмы), а также персонала лабораторий, работающего с образцами. В последнее время детергенты широко использовались в производственных процессах биологических терапевтических средств и/или вакцин, которые имеют потенциальный риск вирусного загрязнения. В производстве биологических лекарственных средств наиболее хорошо охарактеризованными и высокоэффективными детергентами, используемыми для инактивации оболочечных вирусов, являются неионные детергенты, такие как полисорбаты (Tween-20, Tween-80), Triton Х-100 (также известный как октоксинол-10) и три-н-бутилфосфат (TnBP, часто используемый в качестве растворителя с полисорбатами или Triton X-100). Полисорбаты весьма эффективны в условиях окружающей среды, но при относительно высоких концентрациях, и эффективность снижается при более низких температурах. Следовательно, эти детергенты могут быть не лучшим вариантом для производства биологических материалов, которые требуют более низких температурных условий, которые важны для стабилизации биологической активности и молекулярных структур.
Triton Х-100 (также октоксинол, октоксинол-3, прецептин) является классическим, хорошо работающим эффективным детергентом при инактивации вирусов. Triton Х-100 вместе с его производными обладает высокой эффективностью при очень низкой температуре. Было установлено, что октилфенольный компонент Triton-X 100 взаимодействует с рецептором эстрогена, что приводит к репродуктивным воздействиям на животных, подвергшихся воздействию. Отходы биопроцесса, содержащие Triton Х-100, могут привести к негативным последствиям, особенно для водных организмов, если они будут сбрасываться напрямую в окружающую среду. Обработка или извлечение Triton X-100 из отходов биопроцесса были бы очень дорогостоящими и трудоемкими. Поиск новых благоприятных для окружающей среды детергентов (или неэкотоксичных), которые эффективно инактивируют вирусы без изменения биологически активного лекарственного средства, является приоритетным для многих биофармацевтических отраслей промышленности. Следовательно, поиск эффективных, надежных и экологически безопасных детергентов является первоочередной задачей для биофармацевтической промышленности.
Сущность изобретения
Варианты осуществления способа согласно настоящему изобретению включают очистку представляющего интерес раствора биологического продукта, имеющего неидентифицированный загрязнитель типа оболочечного вируса, включающую инкубацию представляющего интерес раствора биологического продукта с раствором N-метилглюкамида, инактивацию любого потенциального загрязнителя типа оболочечного вируса, присутствующего в растворе биологического продукта, и очистку раствора биологического продукта.
Способ очистки представляющего интерес раствора биологического продукта, имеющего неидентифицированный загрязнитель типа оболочечного вируса, включающий инкубацию представляющего интерес раствора биологического продукта со стандартным раствором, инактивацию любого потенциального загрязнителя типа оболочечного вируса, присутствующего в растворе биологического продукта со стадии (a), измерение инактивированного вируса, присутствующего в конечном растворе со стадии (b), инкубацию отдельного представляющего интерес раствора биологического продукта с раствором N-метилглюкамида, измерение инактивированного вируса, присутствующего в конечном растворе со стадии (d), и сравнение результатов для конечных растворов со стадии (c) и со стадии (e).
Краткое описание чертежей
Специалисту в данной области техники понятно, что чертежи, описанные ниже, предназначены только для иллюстрации. Чертежи не предназначены для ограничения каким-либо образом объема настоящего изобретения или формулы изобретения.
На Фиг. 1 показан теоретический общий механизм разрушения детергентом оболочечного вируса. Оболочечные вирусы, такие как ретровирус, имеют нуклеокапсид в форме икосаэдра, защищенный вирусной оболочкой, происходящей из клеток-хозяев, и вирус. Каждая молекула детергента имеет гидрофильную головку и гидрофобный хвост, что придает ее амфифильную структуру. Две части определяют критическую концентрацию мицеллообразования (CMC), которая является специфическим свойством каждого детергента. Детергентные мономеры могут вставляться в вирусную оболочку при концентрации ниже специфической CMC и могут или не могут препятствовать прикреплению вируса к хозяину. И наоборот, при концентрациях при или выше CMC большее количество детергентных мономеров может вставляться в оболочку и вызывать разрушение оболочки, что делает вирус неспособным связываться с его рецептором на поверхности клетки-хозяина.
На Фиг.2 показаны гидрофобные (неполярные) и гидрофильные (полярные) области детергента N-метилглюкамида.
На Фиг. 3 показаны двумерные (2D) и трехмерные (3D) структуры гомологов детергента N-метилглюкамида. Аналогично, каждое соединение состоит из гидрофобной цепи жирной кислоты, состоящей из 8-10 или 12 атомов углерода, которая связана амидной связью с ациклическим гидрофильным глюкозным сахарным фрагментом.
На Фиг. 4 показано, что X-MuLV полностью инактивируется в течение 30 минут при комнатной температуре, когда рекомбинантный фактор FVIII (rFVIII) инкубируют с 0,5-ти, 1-, 2-х кратной концентрацией CMC Mega 8 и Mega 9, Mega 10 и Mega 12, по отдельности.
На Фиг. 5 показано, что X-MuLV полностью инактивируется в течение 30 минут при 2,0°C, когда рекомбинантный фактор FVIII (rFVIII) инкубируют с 1- и 2-х кратной концентрацией CMC каждого детергента по отдельности (Mega 8 и Mega 9, Mega 10 и Mega 12).
На Фиг. 6 показано, что полная инактивация X-MuLV достигается с 0,3% (мас./об.) Mega 10 и 0,3% (мас./об.) Triton X-100 при инкубации с рекомбинантным фактором FVIII (rFVIII) при 2,0°C в течение 30 минут, что демонстрирует подобную эффективность двух детергентов.
На Фиг. 7 показано, что рекомбинантный фактор FVIII (rFVIII) сохраняет свою активность даже через 2 часа инкубации с водой или Mega 10 при 2,0°C.
На Фиг. 8 показана зависимость ответа от дозы рекомбинантного фактора FVIII (rFVIII), инкубируемого с X-MuLV и с повышением концентрации Mega 10 при 2,0°C в течение 30 минут. Кривая доза-эффект показывает, что с увеличением концентрации сахарного детергента титр X-MuLV уменьшается обратным образом до предела обнаружения (LOD), где вирус не обнаруживается. Пунктирная линия контроля rFVIII (Ctrl) соответствует титру rFVIII, инкубированному только с X-MuLV.
На Фиг. 9 показана кинетика рекомбинантного фактора FVIII (rFVIII), инкубируемого с X-MuLV и 0,3% (мас./об.) Mega 10 при 2,0°C в течение 0, 5, 15, 30, 60 и 120 минут. Обработки с Mega 10приводили к немедленному уменьшению (полной инактивации) титра вируса, достигающего предела обнаружения (LOD), где вирус не обнаруживается, что отличается от контролей: только rFVIII и только среда.
На Фиг. 10 показана кинетика рекомбинантного фактора FVIII (rFVIII), инкубируемого со стоком X-MuLV с высоким титром с 0,02%, 0,10% или 0,20% (мас./об.) Mega 10 при 2,0°C в течение 0, 5, 30, 60 и 120 минут. Mega 10 при 0,10% (мас./об.) приводил к уменьшению титра вируса, тогда как 0,20% (мас./об.) приводили к немедленному уменьшению (полной инактивации) титра вируса, достигающего предела обнаружения (LOD) в течение 5 минут, где вирус не обнаруживается, в отличие от 0,02% (мас./об.) Mega 10, контрольных образцов rFVIII только и среда только, для которых инактивация вируса не наблюдалась.
На Фиг. 11 показано, что различные полученные молекулы Mega 10 дают подобные и воспроизводимые результаты зависимости ответа от дозы.
На Фиг. 12 показано, что вирус псевдобешенства свиней (PRV) инактивируется до предела обнаружения посредством 0,2 и 0,3 (мас. /об.) Mega 10 при 2,0°C в течение 15 минут при инкубации с рекомбинантным фактором FVIII (rFVIII).
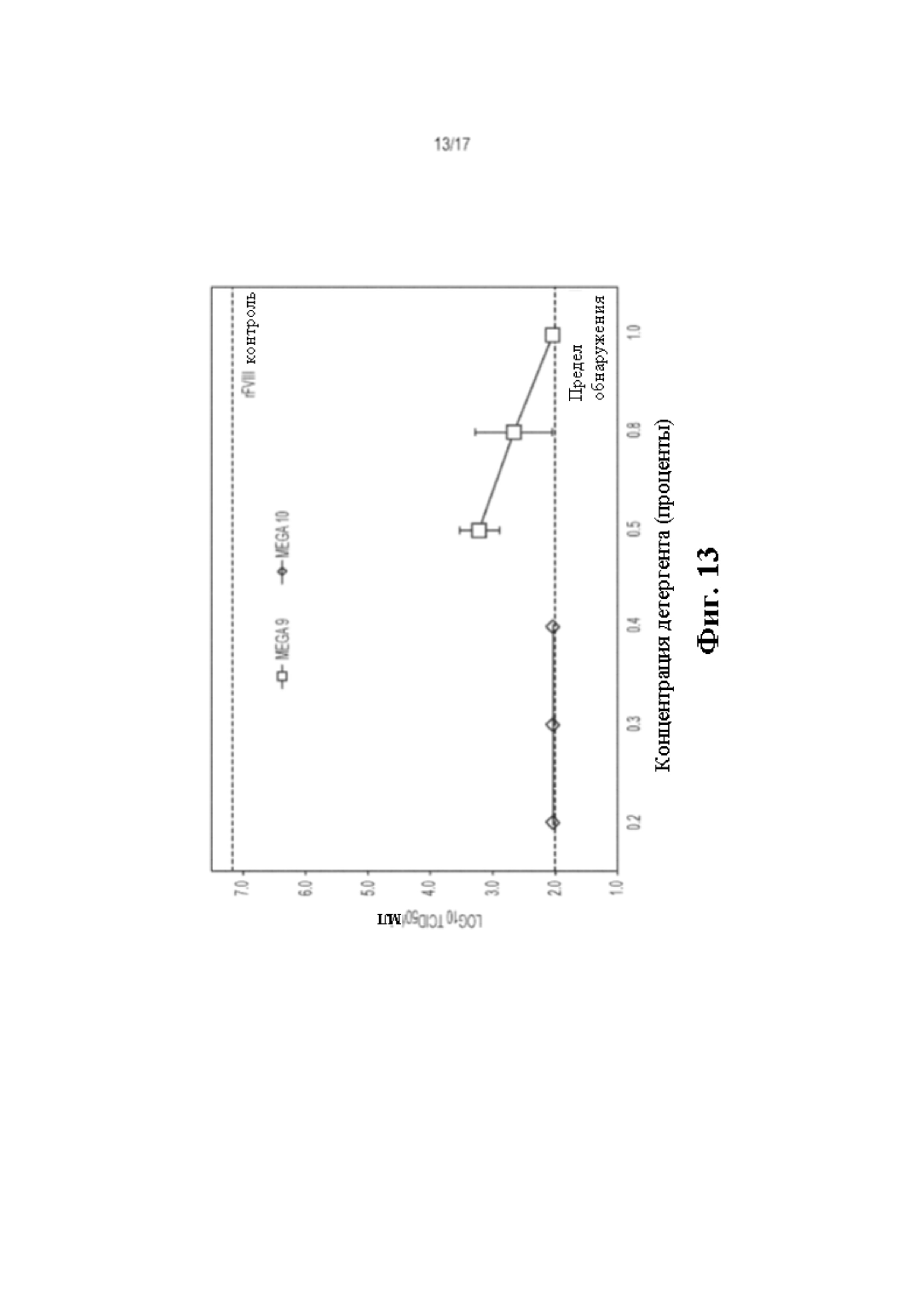
На Фиг. 13 показано, что вирус диареи крупного рогатого скота (BVDV) полностью инактивируется до предела обнаружения посредством 0,2, 0,3, и 0,4 (мас./об.) Mega 10 и 1,0% (мас./об.) Mega 9 при инкубации с рекомбинантным FVIII (rFVIII) при 2,0°C в течение 30 минут.
На Фиг. 14 показано, что X-MuLV полностью инактивируется до предела обнаружения посредством 0,2, 0,3 и 0,4 % (мас./об.) Mega 10 в растворах иммуноглобулина человека G (IgG) и белка плазмы крови человека при 2,0°C в течение 30 минут. Оба раствора белка получали таким образом, что каждый имел конечную концентрацию 30 мг/мл.
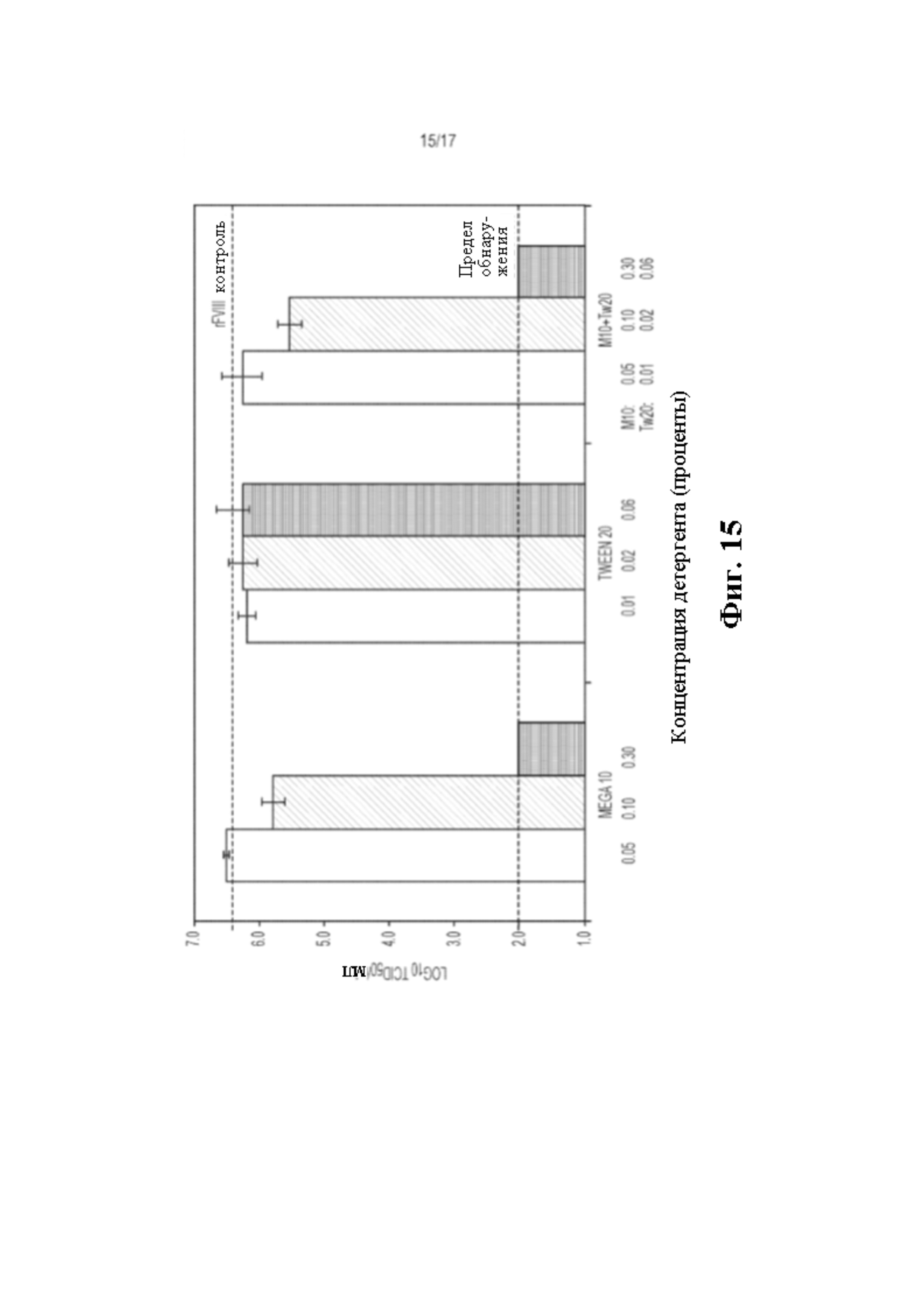
Фиг. 15 показывает инактивацию X-MuLV с Mega 10 (M10) только, Tween 20 (Tw20) только и смесью Mega 10 с Tw20 при концентрациях 0,05% (мас./об.), 0,10% (мас./об.) или 0,30% (мас./об.) Mega 10 с или без 0,01% (мас./об.), 0,02% (мас./об.) или 0,06% (мас./об.) Tw20. При концентрациях 0,30% (мас./об.) M10 только или 0,30% (мас./об.) M10 + 0,06% (мас./об.) Tw20 смеси X-MuLV полностью инактивировался в течение 30 минут.
На Фиг. 16 показана инактивация X-MuLV Mega 10 (M10) только, три(н-бутил)фосфатом (TnBP) только и смесью Mega 10 с TnBP (1: 1) при концентрациях 0,05% (мас./об.) или 0,30% (мас./об.). При концентрациях 0,30% (мас./об.) M10 только или смесь 0,30% (мас./об.) M10 + 0,30% (мас./об.) TnBP X-MuLV полностью инактивировался в течение 30 минут. Интересно, что произошло снижение титра вируса для 0,05% (мас. /об.) M10 + 0,05% (мас. /об.) TnBP (но не полная инактивация), что указывает на то, что может быть синергетический эффект между Mega 10 и TnBP. Остальные обработки детергентом не дали инактивации вируса, так как титры вируса были сопоставимы с контролем rFVIII (без детергента).
На Фиг. 17 показана инактивация X-MuLV с 0,06% (мас./об.), 0,10% (мас./об.) или 0,20% (мас./об.) Mega 10 или 0,30% (мас./об.), 0,51% (мас./об.) или 0,71% (мас./об.) Mega 9 с и без 550 мМ NaCl. При концентрациях 0,20% (мас./об.) Mega 10 только, 0,20% (мас./об.) Mega 10 + NaCl и 0,71% (мас./об.) Mega 9 с и без 500 мМ NaCl, X-MuLV полностью инактивировался. Наблюдалось сокращение титра вируса для 0,10% (мас./об.) Mega 10 + 550 мМ NaCl и 0,51% (мас./об.) Mega 9 + 500 мМ NaCl, что указывает на то, что может быть синергетический эффект между Mega 10 или Mega 9 и NaCl. Остальные обработки детергентом не дали инактивации вируса, так как титры вируса были сопоставимы с контролем rFVIII (без детергента) и контролем NaCl (без детергента).
Подробное описание изобретения
Настоящее раскрытие обеспечивает способы и композиции, которые относятся к инактивации вируса.
Определения
В целях интерпретации настоящего описания будут применяться следующие определения. В случае, если любое из приведенных ниже определений вступает в противоречие с использованием этого термина в любом другом документе, включая любой документ, включенный в настоящий документ посредством ссылки, определение, изложенное ниже, всегда будет интерпретироваться в контексте настоящего изобретения и связанных с ним пунктов формулы изобретения, если явно не подразумевается противоположное значение (например, в документе, где термин первоначально использовался).
При необходимости термины, используемые в единственном числе, также включают множественное число и наоборот. Использование формы единственного числа в настоящем документе означает «один или более», если не указано иное, или если использование «одного или более» явно неуместно. Использование «или» означает «и/или», если не указано иное. Использование «содержат», «содержит», «содержащий», «включают», «включает» и «включающий» является взаимозаменяемым и не является ограничивающим. Термины «такие как», «например» и «в качестве примера» также не предназначены для ограничения. Например, термин «включая» означает «включая, но без ограничения».
Как применяется в настоящем документе, термин “около” относится к +/- 10% от единичного приведенного значения.
Как применяется в настоящем документе, термин «по существу» относится к качественному условию проявления полной или приблизительной степени характеристики или свойства, представляющего интерес. Специалисту в биологической области техники понятно, что биологические и химические явления редко, если вообще когда-либо достигают или избегают абсолютного результата из-за множества переменных, которые влияют на испытания, производство и хранение биологических и химических композиций и материалов, а также из-за ошибки, присущей инструментам и оборудованию, используемым при испытаниях, производстве и хранении биологических и химических композиций и материалов. Поэтому термин «по существу» используется в настоящем документе для обозначения потенциального недостатка полноты, присущей многим биологическим и химическим явлениям.
С 1980-х годов детергенты использовались в качестве основного инструмента для инактивации вирусов в объединенной крови, собранной у доноров крови. Этот процесс важен для безопасности пациентов, получающих кровь, плазму или компоненты, полученные из крови/плазмы, такие как фактор VIII, полученный из плазмы (pdFVIII). Кроме того, это средство очистки повышает безопасность персонала, непосредственно участвующего в обработке крови в клинических лабораториях или на объектах производства биологических продуктов, получаемых из плазмы (PDBP). Совсем недавно эта практика стала неотъемлемой частью процесса производства биофармацевтических лекарственных средств для биологических терапевтических средств или вакцин, содержащих материалы животного происхождения. Материалы животного происхождения (то есть кровь, плазма, ткани и белки, продуцируемые в клетках млекопитающих) могут нести эндогенные вирусы или могут легко загрязняться занесенными вирусами. Таким образом, процесс производства лекарственного средства включает ряд мер эффективной инактивации вируса (т.е. растворитель-детергент, низкое значение pH и тепловые обработки) и методик удаления (т.е. фильтрации вируса), чтобы гарантировать пациентам свободные от вируса средства лечения. Эти процессы жизненно важны для безопасного выпуска для общего пользования биологически полученных терапевтических или вакцинных продуктов. Новые методы для повышения эффективности, надежности и, самое главное, общей безопасности этих продуктов крайне необходимы. Для удовлетворения этих требований в настоящем изобретении описан новый способ использования экологичных детергентов на основе N-метилглюкамида.
Детергенты представляют собой амфифильные молекулы, которые состоят из гидрофильной (полярной) головной группы и гидрофобной (неполярной) хвостовой группы. Эта универсальная структура позволяет детергентам взаимодействовать с другими молекулами, особенно с белками или оболочечными вирусами в водном растворе. В фундаментальной науке и прикладных технологиях детергенты могут использоваться в качестве солюбилизирующего агента или в качестве стабилизирующего агента для предотвращения агрегации биологической молекулы или для солюбилизации мембранных белков из клеточных культур или тканевых суспензий. При использовании для солюбилизации белков следующие свойства делают некоторые детергенты более желательными, чем другие: 1) Детергенты, в которых отсутствуют заряды (неионные детергенты), помогают сохранить структуру и активность представляющего интерес белка, 2) детергенты с низкой критической концентрацией мицеллообразования (CMC) позволяют легко удалять детергент с помощью диализа, 3) детергенты, которые являются прозрачными и, следовательно, не влияют на показания поглощения белка, и 4) детергенты, которые являются весьма чистыми, уменьшая изменчивость от эксперимента к эксперименту. Аналогичным образом, большинство из этих свойств применимы при выборе кандидатов детергента для инактивации вируса, поскольку необходимо не разрушать белковое лекарственное средство, определять концентрацию белка без вмешательства детергента и обеспечивать высокую чистоту детергента, чтобы инактивация вируса происходила последовательно.
В общем, инактивация оболочечного вируса зависит от амфифильной структуры и критической концентрации мицеллообразования (CMC) конкретного детергента. CMC относится к концентрации, при которой детергентные мономеры агрегируют с образованием мицеллярных структур. В водных растворах, когда все больше детергентных мономеров вступают в контакт, гидрофильные головки могут примыкать, чтобы защитить гидрофобные хвосты от водного раствора, в конечном счете, превращаясь в структуры мицелл. CMC, вероятно, связана с концентрацией, при которой инактивация вируса будет происходить для данного детергента при определенных условиях. Теоретический механизм инактивации вируса заключается в том, что мономеры внедряются в вирусную оболочку при концентрации ниже CMC детергента, что может быть вредным для вируса. Как только концентрация достигает или превышает CMC, эти детергентные мономеры, присутствующие в мембране, образуют мицеллы, которые могут нарушить целостность или полностью разрушить вирусную оболочку. Без вирусной оболочки вирус не способен связываться со своим рецептором на плазматической мембране клеток-хозяев и облегчать его репликацию и распространение.
До сих пор промышленность, производящая биотерапевтические средства, использовала ряд детергентов для инактивации оболочечный вирусов. Один из популярных неионогенных детергентов Triton X-100 очень эффективен при инактивации оболочечных вирусов без нарушения белкового лекарственного средства. После использования Triton X-100 в процессах производства биофармацевтических средств он удаляется на установки обработки сточных вод или высвобождается непосредственно в водную среду (Madsen et al., 1996, JAOCS, 73: 929-933). К сожалению, побочный продукт Triton X-100 содержит октилфенол, который может имитировать субстраты рецептора эстрогена и негативно влиять на репродуктивную систему животных, особенно на водные организмы. Поэтому ряд стран считают, что этот детергент является токсичным химическим веществом для окружающей среды и начинают запрещать его использование. Многие биофармацевтические отрасли были направлены на поиск экологически безопасных детергентов, эффективность которых сопоставима с Triton X-100.НАпример, Biogen, Inc. and Genentech, Inc. рассматривали лаурилдиметиламин N-оксид (LDAO) и алкилглюкозиды, соответственно (Conley et al., 2014, US Patent #W02014025771A2; Conley et al., 2016, Biotechnol. Bioeng., Epub ahead of print; Fisher et al., 2016, US Patent #20160333046A1). Хотя этим компаниям удалось выделить новые детергенты разных классов, варианты осуществления настоящего изобретения определяют совершенно новый и высокоэффективный класс неионных детергентов, N-метилглюкамиды (также известные как сахара жирных кислот), для инактивации оболочечных вирусов.
Детергенты на основе сахара обладают превосходными физическими свойствами, являются весьма биоразлагаемыми и не токсичны, что способствует их профилю безопасности, особенно для водной среды (Bogdan, 2007, Stalmans et al., 1993). Таким образом, раскрытые варианты осуществления направлены на использование детергентов на основе сахара, N-метилглюкамиды, в качестве нового способа инактивации вирусов при производстве биологически активных лекарственных средств.
N-метилглюкамиды являются неионными детергентами, которые состоят из высокогидрофильного глюкозного фрагмента и гидрофобной цепи жирной кислоты, связанных амидной связью. Эти детергенты являются экологически безопасными, так как они, как известно, являются весьма биоразлагаемыми с примерно 95-ным индексом возобновляемого углерода и считаются нетоксичными, особенно для водных организмов (Stalmans et al., 1993, SOFW, 119: 794-808). Благодаря увеличенному профилю безопасности и отличным физическим свойствам, эти детергенты приобрели повышенный интерес для использования в фундаментальных научных технологиях, а также для использования в шампунях и мылах для мытья посуды. Аналогичным образом, эти детергенты могут быть основными кандидатами для инактивации вируса в лекарственных препаратах, полученных биологическим методом.
Большинство рекомбинантных белков получают путем ферментации созданных методами генной инженерии клеток млекопитающих (т.е. СНО и ВНК). Известно, что эти клетки имеют хромосомно интегрированные провирусные гены ретровируса или элементы, которые продуцируют эндогенные ретровирусоподобные частицы (ERVLP), которые представляют собой оболочечные вирусные частицы, не имеющие подтвержденной инфекционности. Чтобы продемонстрировать инактивацию ERVLP, X-MuLV использовали в качестве конкретной модели для эндогенных ретровирусов и в настоящее время используют в качестве лабораторного инструмента для оценки промышленного процесса очистки путем добавления образцов, которые подвергаются любой инактивации или удалению с помощью данной операции очистки. Как таковые, раскрытые варианты осуществления будут использовать этот новый способ применения N-метилглюкамидов для инактивации оболочечных вирусов, таких как X-MuLV. На основе модели X-MuLV все остальные оболочечный вирусы должны подвергаться инактивации N-метилглюкамидом, включая герпесвирусы, флавивирусы, филовирусы и т.д. Кроме того, этот новый способ применим к любой стадии процесса очистки лекарственного средства, который может включать стадию удаления детергента, такую как диализ или колоночная хроматография.
В общем, инактивация вируса этим новым классом детергентов включает тестирование лабораторного штамма X-MuLV, добавленного в образец белка (т.е. рекомбинантного фактора VIII, человеческого антитела IgG и компонентов плазмы) с N-метилглюкамидами, инкубацию образца при 2-8°C в течение 30 минут и последующий эксперимент с реакционной пробиркой на индикаторной клеточной линии (т.е. на клеточных линиях PG-4, Vero или EBTr) для наблюдения за заражением вирусом. Системный подход к тестированию N-метилглюкамидов начался с первоначального скрининга в различных условиях, с последующей оценкой активности белка, исследованием зависимости ответа от дозы, исследованием кинетики со стоком вируса с высоким и низким титром, множества вирусов и биологического применения, и, наконец, сравнением множества производителей для обеспечения согласованности. Начальные условия скрининга были основаны на исторических данных для классического детергента Triton X-100, где инактивация вируса была успешной при 2-8°C, в течение 120 минут, и концентрация инактивации составляла от 0,1 до 0,3% (мас./об.). Чтобы гарантировать, что новые детергенты сопоставимы с известным сильнодействующим детергентами (Triton X-100), низкая температура и инкубация в течение 30 и 120 минут были выбраны для начального скрининга N-метилглюкамидов. Оцененные концентрации были основаны на CMC каждого нового детергента. Затем кандидаты N-метилглюкамиды, которые были наиболее эффективны при инактивации оболочечного вируса, оценивались на любое влияние на активность фактора VIII человека с использованием набора для хромогенного анализа. Затем N-метилглюкамиды оценивали по их соответствующим ответам на дозы при увеличении концентрации N-метилглюкамидов, которая составляла 0,014-01,0% (мас./об.) относительно каждого отдельного детергента. Чтобы оценить, как быстро происходит инактивация, были проведены кинетические исследования с N-метилглюкамидами с использованием вирусных препаратов как с низким, так и с высоким титром. Чтобы повысить достоверность данных, сгенерированных на протяжении всего способа, было проанализировано множество источники от разных поставщиков в аналогичных условиях, чтобы продемонстрировать согласованность и надежность протестированных N-метилглюкамидов. Наконец, чтобы оценить, оставались ли N-метилглюкамиды эффективными в других относящихся к крови и плазме матриксах, определяли инактивацию вируса в человеческом иммуноглобулине G и плазме человека в сходных условиях. В совокупности этот системный подход позволил раскрытым вариантам осуществления продемонстрировать применимость N-метилглюкамидов в способе очистки.
Этот способ инактивации вирусов с помощью N-метилглюкамидов применим для способа очистки биологически активных лекарственных средств, таких как белковые субъединицы, белки (ферменты, факторы и т.д.), рекомбинантные белки или антитела. Экологически безопасные (также называемые неэкотоксичными) детергенты, применяемые в этом способе, основаны на множестве гомологов N-метилглюкамида, состоящих из гидрофильного глюкозного фрагмента и гидрофобного хвоста на основе жирной кислоты, связанных амидной связью. Поскольку в N-метилглюкамидах нет известных токсичных промежуточных соединений, таких как октилфенол, это исключает риски, связанные с экологическими проблемами при использовании в производстве биологических средств. Кроме того, эти детергенты на основе сахара являются неионными по своей природе, что не должно разрушать представляющий интерес белок интересующий лекарственного средства. Этот способ включает инкубацию N-метилглюкамида с биологическим продуктом, чтобы инактивировать любой потенциальный загрязнитель типа оболочечного вируса. Для оценки сокращения вируса этим способом модельные оболочечные вирусы (например, вирус ксенотропного лейкоза, вирус псевдобешенства и вирус диареи крупного рогатого скота) были добавлены в образец белкового лекарственного средства (например, нативные белки, рекомбинантные белки, антитела) и инкубированы с N-метилглюкамидами. После инкубации был проведен анализ TCID50 для определения титра вируса и коэффициента логарифмического сокращения (LRF), который представляет собой разницу титров вирусной инфекционности между необработанными контролями и образцами, обработанными N-метилглюкамидом. Кроме того, инактивацию оболочечных вирусов N-метилглюкамидами сравнивали с такой инактивацией для промышленного стандарта, Triton X-100. Взятые вместе, эти превосходные характеристики делают N-метилглюкамиды мощным инструментом в способе очистки лекарственных препаратов, полученных биологическим методом.
Материалы
Пример 1 - стоки вируса:
Стоки вируса мышиного ксенотропного лейкоз (X-MuLV) с низким и высоким титром, штамм pNFS Th-1, были приготовлены внутри лаборатории Bayer Pathogen Safety (Berkeley, CA) или Bioreliance Inc. (Rockville, MD), соответственно. Сток вируса псевдобешенства (PPV) с высоким титром, штамм Aujeszky, был приготовлен Bioreliance Inc. (Rockville, MD). Сток вируса диареи крупного рогатого скота (BVDV) с высоким титром, штамм NADL, также был приготовлен Bioreliance Inc., (Rockville, MD).
Пример 2. Клеточные линии:
Клетки PG-4 кошек (S+L-) (ATCC CRL-2032), клетки Vero почек африканской зелёной мартышки (ATCC CCL-81), и клетки EBTr трахеи эмбриона (ATCC CCL-44) были получены из Американской коллекции типовых культур (ATCC, www.atcc.org).
Пример 3. Среда для клеточной культуры и добавки:
Питательными средами, применяемыми для клеток PG-4, Vero и ETBr, были среда Мак-Коя 5A (Lonza, 12-688F, Slough, UK) и минимально необходимая среда Игла (Corning, 10-010-CV, Manassas, VA). Применялись следующие добавки для среды для роста: фетальная бычья сыворотка (FBS) (Hyclone, SH30070.03, Logan, UT), 100x пенициллина/стрептомицина (P/S) (Corning, 30-002-Cl, Manassas, VA), и 200 мМ L-глютамина (L-Glu) (MP Biomedicals, 1680149, Solon, OH).
Пример 4. Химические соединения:
Химический гексадиметрина бромид (Полибрен) (Sigma-Aldrich, H9268-5g, St. Louis, MO) применяли для повышения эффективности заражения с X-MuLV в PG-4 клетках и добавляли к среде Мак-Коя 5A при конечной концентрации 3 мкг/мл. Неионными детергентами, охарактеризованными в этих исследованиях, являются октаноил-N-метилглюкамид (Mega 8) (G-Biosciences, DG017, St. Louis, MO или Sigma или Sigma-Aldrich, St. Louis, MO), нонаоил-N-метилглюкамид (Mega 9) (G-Biosciences, DG019, St. Louis, MO или Sigma-Aldrich, St. Louis, MO), деканоил-N-метилглюкамид (Mega 10) (G-Biosciences, DG021, St. Louis, MO или Sigma-Aldrich, St. Louis, MO), додеканоил-N-метилглюкамид (Mega 12) (Bachem, P-1175.0001, Torrance, CA), и P-трет-октилфенокси) полиэтоксиэтанол (Triton X-100) (EMD Millipore, 1086432500, Billerica, MA).
Растворы биологических продуктов:
Каждый анализ по инактивации вируса проводили в присутствии раствора биологического продукта, состоящего из либо человеческого рекомбинантного фактора VIII (rFVIII) (дикий тип полной длины, получен самой компанией Bayer), либо человеческого IgG, либо белка плазмы (Sigma-Aldrich, St. Louis, MO).
Способы
Пример 1. Получение детергента
Детергенты Mega 8, Mega 9, Mega 10 и Mega 12 получали при целевой концентрации сток-раствора 5% мас. на об. (мас./об.). Каждый детергент получали в виде порошка у производителя и соответственно отмеряли и растворяли в Milli-Q воде. Если детергент не полностью солюбилизировался при комнатной температуре, раствор нагревали при ≤37°C на водяной бане (Mega 10 и Mega 12) в течение около 10 - 15 минут. Изначально, 5% Mega 12 не растворялся при ≤37°C и поэтому его помещали на водяную баню при ≤60°C, и раствор солюбилизировался через 30 минут. Так как критическая концентрация мицеллообразования Mega 12 находилась при 0,013%, вероятно, что по меньшей мере 10-кратный сток-раствор будет удобен для использования при инактивации вируса. Таким образом, новый сток-раствор получали в воде Milli-Q при концентрации 0,15%, что позволяло смеси быстрее переходить в раствор при помещении в водяную баню с температурой ≤ 60 С (около 15 минут). Детергенты хранилища в темном контейнере при 2-8°C
Пример 2. Скрининг инактивации вируса с помощью Mega 8, Mega 9, Mega 10 и Mega 12
Детергенты на основе N-метилглюкамида (Mega 8, Mega 9, Mega 10 и Mega 12) оценивали в отношении их способности эффективно и надежно инактивировать вирус мышиного ксенотропного лейкоза (X-MuLV), вирус псевдобешенства (PRV), или вирус диареи крупного рогатого скота (BVDV) при типичных производственных условиях для терапевтического лекарственного средства на основе рекомбинантного фактора VIII (rFVIII). Концентрации, протестированные для каждого детергента, были основаны на 0,5-ти, 1- или 2-х кратной критической концентрации мицеллообразования (CMC), соответственно. Каждый детергент инкубировали со свободным от детергента белком rFVIII и добавляли к нему сток X-MuLV высокого титра при соотношении 1:11 и инкубировали при 2,0 ± 1,0°C в течение 30 минут. Образец положительного контроля, содержащий только rFVIII, включали и инкубировали при 2,0 ± 1,0°C в течение 0 и 30 минут. После каждого периода инкубации, 40 мкл каждого образца инактивации или контроля удаляли и переносили в пробирку, объемом 15 мл, содержащую 4,0 мл базовой среды (т.е. среда Мак-Коя 5А с добавкой 3 мкг на мл полибрена (MP) для X-MuLV или EMEM). Такое подавление с коэффициентом разбавления 1:101 позволило развести детергент за пределами эффектов токсичности на индикаторную клеточную линию, а также позволило развести вирус в диапазоне, необходимом для осуществления анализа TCID50. Кратко, анализ TCID50 для оценки инфекционности вируса проводили путем титрования каждого подавленного образца 1:3,2-кратно серийно в MP или EMEM до 11ого уровня разведения. Монослой индикаторных клеток, высеянных за один день до этого, при 3000 клеток на лунку в 96-луночном планшете для культивирования клеток, инокулировали с 100 мкл на разведение подавленного и серийно разведенного образца или базовой среды, при 8 параллельных анализах. Через 1,5 - 2,5 часа инкубации при 37°C, 100 мкл среды анализа, состоящей из базовой среды (среда Мак-Коя 5А или EMEM для PRV или BVDV) с добавками 4% FBS, 2% P/S и 2% L-Glu, добавляли в каждую лунку планшета. Затем клетки инкубировали при 37°C в течение до 6-7 дней и наблюдали под световым микроскопом в отношении цитопатических эффектов (CPE), которые указывают на заражение вирусом.
Пример 3. Хромогенный анализ для оценки активности человеческого фактора VIII
Mega 10 получали при концентрации 0,3% (мас./об.) в матриксе rFVIII (из 5,0% (мас./об.) сток-растворов, полученных в Milli-Q H2O) и инкубировали при 2,0 ± 1,0°C в течение 120 минут. Контроль разбавитель матрикса rFVIII с добавлением только Milli-Q H2O также получали и инкубировали при тех же условиях. После инкубации детергенты и контроль разбавитель разбавляли в 1х аналитическом буфере наряду со стандартом FVIII хромогенного анализа (Chromogenix COATEST SP4 FVIII Kit, Cat: 82409463) и контролями до соответствующих уровней. Тридцать мкл каждого детергента, контроля и стандарта загружали на 96-луночный планшет в трех экземплярах. Реагенты для хромогенного анализа добавляли в соответствии с протоколом производителя и инкубировали при 37,0°C и 5,0% CO2 в течение 8 минут. Планшет для анализа измеряли на поглощение t 405 и 492 нм на устройстве для считывания микропланшетов Molecular Devices SpectraMax M5. Данные анализировали с применением SoftMax Pro v5.
Пример 4. Ответ на дозу в матриксе rFVIII, свободном от Triton
Чтобы оценить самую низкую эффективную концентрацию детергента Mega10, инкубированного с rFVIII и с добавлением X-MuLV, было проведено исследование ответа на дозу детергента. Образец 0,5% (мас./об.) каждого детергента готовили в матриксе рекомбинантного FVIII (rFVIII) с последующими серийными разведениями 1: 2 в матриксе rFVIII с получением 6 образцов каждого детергента в диапазоне от 0,014 до 0,5% (мас./об.). Кроме того, образец положительного контроля, содержащий только матрикс rFVIII, включали. В каждый образец детергента и контроля добавляли сток X-MuLV с низким титром при соотношении 1:11 и инкубировали при 2,0 ± 1,0°C в течение 30 минут. После инкубации 100 мкл каждого образца инактивации и контроля удаляли и переносили в пробирки объемом 15 мл, содержащие 3,0 мл среды Мак-Коя 5А с добавлением 3 мкг на мл полибрена (MP). Этот подавление коэффициентом разведения 1:31 позволило развести детергент за пределами эффектов токсичности на индикаторную клеточную линию (PG-4), а также позволило развести X-MuLV в диапазоне, необходимом для осуществления анализов TCID50. Кратко, анализ TCID50для оценки инфекционности X-MuLV проводили путем титрования каждого подавленного образца 1:3,2-кратно серийно в MP до 11ого уровня разведения. Монослой клеток PG-4, высеянных за 1 день до этого, при 3000 клеток на лунку, инокулировали с 100 мкл на разведение подавленного образца или MP, при 8 параллельных анализах. После инкубации при 37°C в течение 1,5 - 2,5 часов, 100 мкл среды анализа, состоящей из среды Мак-Коя 5А с добавками 4% FBS, 2% P/S и 2% L-Glu, применяли для покрытия клеток. Затем клетки инкубировали при 37°C в течение до 6-7 дней и наблюдали под световым микроскопом в отношении цитопатических эффектов (CPE), которые указывают на заражение X-MuLV.
Пример 4. Кинетические характеристики инактивации вируса
Для оценки скорости инактивации для детергента Mega 10, инкубируемого с rFVIII и с добавлением X-MuLV, проводили исследования кинетических характеристик инактивации вируса. Образец 0,02%, 0,10%, 0,20% и 0,30% (мас./об.) Mega 10 получали в матриксе рекомбинантного FVIII (rFVIII), свободного от Triton. Дополнительно, образцы положительного контроля, содержащие только матрикс rFVIII, или контроль на основе только среды включали. В каждый образец детергента и контроля добавляли сток X-MuLV с низким титром и с высоким титром при соотношении 1:11, и инкубировали при 2,0 ± 1,0 C° в течение 0, 5, 15, 30, 60 и 120 минут. После каждой инкубации 100 или 40 мкл каждого образца инактивации и контроля удаляли и переносили в пробирки объемом 15 мл, содержащие 3,0 мл или 4,0 мл среды Мак-Коя 5А с добавлением 3 мкг на мл полибрена (MP). Этот подавление коэффициентом разведения 1:31 (X-MuLV с низким титром) или 1:101 (X-MuLV с высоким титром) позволило развести детергент за пределами эффектов токсичности на индикаторную клеточную линию (PG-4), а также позволило развести X-MuLV в диапазоне, необходимом для осуществления анализа TCID50. Кратко, анализ TCID50 для оценки инфекционности X-MuLV проводили путем титрования каждого подавленного образца 1:3,2-кратно серийно в MP до 11ого уровня разведения. Монослой клеток PG-4, высеянных за 1 день до этого, при 3000 клеток на лунку, инокулировали с 100 мкл на разведение подавленного образца или MP, при 8 параллельных анализах. Через 1,5 - 2,5 часа инкубации при 37°C и 5% CO2, 100 мкл среды анализа, состоящей из среды Мак-Коя 5А с добавками 4% FBS, 2% P/S и 2% L-Glu, применяли для покрытия клеток. Затем клетки инкубировали при 37°C и 5% CO2 в течение до 6-7 дней и наблюдали под световым микроскопом в отношении цитопатических эффектов (CPE), что является показателем заражения X-MuLV.
Пример 5. Инактивация вируса детергентом на основе N-метилглюкамида в присутствии других белков
Детергенты на основе N-метилглюкамида (Mega 8, Mega 9, Mega 10, and Mega 12) оценивали в отношении их способности эффективно и надежно инактивировать X-MuLV, PRV или BVDV при типичных производственных условиях для плазмы человека, биологических средств, полученных из плазмы, или человеческих антител. Концентрации, протестированные для каждого детергента, были основаны на 0,5-ти, 1-ти или 2-х кратной критической концентрации мицеллообразования (CMC), соответственно. Каждый детергент инкубировали с множеством концентраций свободного белка (высокий градиент белка) и с добавлением стока X-MuLV с высоким титром при соотношении 1:11, и инкубировали при 2,0 ± 1,0°C в течение 30 минут. Образец положительного контроля, содержащий только соответствующий белок, включали и инкубировали при 2,0 ± 1,0°C в течение 0 и 30 минут. После каждого периода инкубации, 40 мкл каждого образца инактивации или контроля удаляли и переносили в пробирку, объемом 15 мл, содержащую 4,0 мл базовой среды (т.е. среда Мак-Коя 5А с добавлением 3 мкг на мл полибрена (MP) для X-MuLV или EMEM для PRV или BVDV). Такое подавление с коэффициентом разбавления 1:101 позволило развести детергент за пределами эффектов токсичности на индикаторную клеточную линию, а также позволило развести вирус в диапазоне, необходимом для осуществления анализа TCID50. Кратко, анализ TCID50 для оценки инфекционности вируса проводили путем титрования каждого подавленного образца 1:3,2-кратно серийно в базовой среде (MP или EMEM) до 11ого уровня разведения. Монослой индикаторных клеток, высеянный за один день до этого, при 3000 клеток на лунку, инокулировали с 100 мкл на разведение подавленного образца или базовой среды, при 8 параллельных анализах. Через 1,5 - 2,5 часа инкубации при 37°C, 100 мкл среды анализа, состоящей из базовой среды (среда Мак-Коя 5А или EMEM) с добавками 4% FBS, 2% P/S и 2% L-Glu, применяли для покрытия клеток. Затем клетки инкубировали при 37°C в течение до 6-7 дней и наблюдали под световым микроскопом в отношении цитопатических эффектов (CPE), которые указывают на заражение вирусом.
Примеры анализов
Пример 1. Детергенты на основе N-метилглюкамида: свойства, получение и оценка
Для этого исследования были проанализированы четыре детергента на основе метилглюкамида: октаноил-N-метилглюкамид (Mega 8), нонаоил-N-метилглюкамид (Mega 9), деканоил-N-метилглюкамид (Mega 10) и додеканоил-N-метилглюкамид (Mega 12) (Таблица 1). Все эти детергенты представляют собой коммерчески доступные N-метилглюкамиды, и несколько партий были закуплены в виде порошка у нескольких поставщиков (G-Biosciences, Sigma или Bachem).
На Фиг. 1 показан предложенный теоретический механизм того, как детергенты могут разрушать оболочку вируса. В общем, ниже критической концентрации мицеллообразования (CMC) соответствующего детергента мономеры детергента могут вставляться в оболочку вируса, что может позволить или помешать вирусу прикрепиться к клетке (хозяину). При концентрациях выше CMC большее количество мономеров внедряется в оболочку вируса, вызывая полное разрушение оболочки вируса, и мономеры могут образовывать мицеллы вместе с ними или со смесью мицелл и вирусных белков из разрушенной оболочки. Как описано в следующих примерах в этом документе, CMC, как оказалось, является показателем эффективной концентрации (Пример 3). При концентрациях при или выше CMC инактивация вируса происходила с каждым из детергентов на основе метилглюкамида, протестированных в этом исследовании.
N-метилглюкамиды содержат ациклическую гидрофильную глюкозную полярную головную группу и гидрофобный хвост на основе цепи жирной кислоты (состоящей из 8-10 или 12 атомов углерода), связанные амидной связью (Фиг. 2). На основании Таблицы 1 N-метилглюкамиды составлены аналогично, различаясь только длиной углеродной цепи, которая пропорционально соответствует увеличению молекулярной массы. Основываясь на работе других авторов, по мере увеличения углеродов в цепи жирной кислоты критическая концентрация мицеллообразования (CMC) обратно уменьшается.

На Фиг. 3 показаны 2-х мерные (2D) и 3-х мерные (3D) структуры N-метилглюкамидов, использованные в этом исследовании. Как 2D, так и 3D структуры показывают одинаковое расположение молекул углерода, водорода, кислорода и азота. Интересно, что молекулярная упаковка Mega 8 по сравнению с другими N-метилглюкамидами может образовывать бислойную упаковку «голова-к-голове», тогда как другие могут упаковываться в виде монослойной упаковки голова-к-хвосту. (Jeffery and Malusynksa ,1988, Acta Cryst., B45:447-452). Эта разница в упаковке может способствовать увеличению эффективности по мере увеличения углеродной цепи.
В таблице 2 перечислены производители порошков детергентов и собственное получение, что также подробно описано в разделе «Способы». Исходя на 5% (масса на объема, мас./об.) приготовленных детергентов Mega 8 и Mega 9 были легко растворены в воде при комнатной температуре. Mega10 необходимо было подогреть на водяной бане при 37 °C, что позволило раствору солюбилизироваться в течение 15 минут. Однако Mega 12 не был способен растворяться в воде на водяной бане при 37°C и постепенно растворялся на водяной бане при 60 °C в течение не менее 5 минут. Это явление наблюдалось и другими, и, возможно, связано с увеличением длины жирной цепи, которая увеличивает гидрофобность, тем самым уменьшая вероятность растворимости, особенно в воде (Gaber et al., Burczyk, 2007). Поэтому в воде Milli-Q был приготовлен новый сток-раствор 0,15%, что составляет по меньшей мере 10-кратную CMC. Этот новый препарат был способен переходить в раствор при помещении на водяную баню при 60 °C в течение 15 минут.

Пример 2. Вирусы: происхождение и свойства
Существует множество оболочечных РНК и ДНК вирусов, таких как принадлежащие к следующим семействам вирусов: Retroviridae, Flaviviridae, Togaviridae, Coronaviridae, Filoviridae, Rhabdoviridae, Bunyaviriae, Orthomyxoviridae, Paramyxoviridea, Arenaviridae, Hepadnaviridae, Herpesviridae, Baculoviridae и Poxviridae. Многие переносимые с кровью вирусы из любого из этих семейств могут потенциально загрязнять продукты животного происхождения, используемые при производстве биологически активных лекарственных продуктов. Поэтому многие фармацевтические компании использовали модельные вирусы, такие как мышиный вирус лейкоза (X-MuLV), вирус диареи крупного рогатого скота (BVDV) и вирус псевдобешенства (PRV), для демонстрации очищения от вируса с помощью различных методов очистки (Таблица 3). X-MuLV является модельным вирусом, обычно используемым для линий клеток-хозяев эндогенных ретровирусоподобных частиц (т.е. клетки СНО или ВНК), для экспрессии белкового лекарственного продукта. X-MuLV также является моделью для других оболочечных вирусов, включая ретровирусы, такие как основной переносимый кровью патоген ВИЧ. BVDV является моделью для флавивирусов и может представлять собой вирусы, такие как вирус Зика (участвует в недавних вспышках по всему миру) и вирус гепатита С (HCV). PRV является моделью для гепаднавирусов и может представлять собой вирус гепатита B (HBV), который является одним из наиболее распространенных переносимых кровью патогенов. Теоретически, все эти оболочечные вирусы чувствительны к детергентной инактивации N-метилглюкамидами.

Типичные условия инактивации вируса N-метилглюкамидом были оценены с использованием стоков X-MuLV с низким и высоким титром (таблица 4). Сток X-MuLV с низким титром использовали для исследования зависимости ответа от дозы и исследования кинетических характеристик. Сток X-MuLV с высоким титром использовали для исследования кинетических характеристик и определения высокой способности инактивации вируса, выраженной в коэффициенте логарифмического сокращения (LRF). Другими вирусами, включенными в Таблицу 4, являются стоки вируса BVDV и PRV с высоким титром, которые также должны быть чувствительны к инактивации детергентом на основе N-метилглюкамида.

Пример 3: Скрининг производных N-метилглюкамида
Производные N-метилглюкамидов были протестированы на их способность инактивировать сток X-MuLV с высоким титром. Каждый детергент (Mega 8, Mega 9, Mega 10 или Mega 12) тестировали при 0,5-ти, 1- и 2-х кратной CMC и смешивали с белковым лекарственным средством (рекомбинантный фактор VIII, rFVIII, антитело или плазма) и добавляли оболочечные вирусы (т.е. X-MuLV, PRV или BVDV) и инкубировали в течение 30 минут при комнатной температуре или 2,0 ± 1,0°C. После инкубации реакцию подавляли и проводили анализ титрования TCID50 с использованием соответствующих индикаторных клеток (клетки PG-4, Vero или EBTr). TCID50 ответил на два вопроса: есть ли наблюдаемое заражение вирусом в любой из протестированных лунок? Если да, каково количество вируса (титра) в тестируемом образце? Как и ожидалось, после 30 минут инкубации при 2°C и комнатной температуре (25°C) измеренный титр контролей rFVIII с добавлением X-MuLV был усреднен до 6,40 и 6,45 Log10TCID50/мл, соответственно (Фиг. 4 и Фиг. 5). Для каждого условия температуры, N-метилглюкамид (Mega 8, 9, 10 и 12) при его протестированных концентрациях инактивировал X-MuLV до предела обнаружения (LOD), когда концентрация N-метилглюкамида составляла однократную CMC или выше, указывая на полную инактивацию инфекционности вируса в ≥104,3 раз или логарифмический коэффициент сокращения (LRF), равный ≥4,3 (Фиг. 4 и Фиг. 5, Таблица 5 и Таблица 6). Важно отметить, что предел обнаружения (LOD) составлял ≤2,03 Log10 TCID50/мл, который также является титром, когда вирус не наблюдается. Концентрация при 0,5-ти кратной CMC для Mega 9 и Mega 10 полностью инактивировала X-MuLV при 25°C, но частично при 2°C. Существенная инактивация отсутствовала при 0,5-ти кратной CMC для Mega 8 и Mega 12, когда обработки проводились при 25°C или 2°C (Фиг. 4 и Фиг. 5).
Инактивация X-MuLV с применением N-метилглюкамидом была такой же эффективной, как и с применением Triton Х-100, но с меньшей токсичностью в отношении индикаторных клеток анализа (Фиг. 6). При 0,3% (мас./об.) оба детергента полностью инактивировали X-MuLV; Mega 10 давал предел обнаружения (LOD) ≤2,03 TCID50/мл, в то время как Triton X-100 имел LOD ≤2,54 TCID50/мл (Фиг. 6). Таким образом, эти результаты показывают, что эти экологически безопасные детергенты эффективны и надежны при инактивации вируса.


Пример 4. Влияние N-метилглюкамидов на rFVIII
После скрининга N-метилглюкамидов Mega 10 был признан лучшим кандидатом среди N-метилглюкамидов из-за высокой эффективности при более низких концентрациях (~ 0,2%) и растворимости. Чтобы гарантировать, что Mega 10 не оказывает отрицательного влияния на активность белкового лекарственного средства, активность препарата rFVIII измеряли с использованием набора для хромогенного анализа. Принцип анализа включает специфическую стадию в механизме свертывания крови, при которой фактор X превращается в фактор Xa, что приводит к гидролизу хромогенного субстрата. Эта реакция зависит от активности фактора VIII (FVIII) и напрямую коррелирует с измеримой интенсивностью цвета. Образцы препарата rFVIII инкубировали с 0,3% (масса/объем, мас./об.) Mega 10 или 0,3% (объем/объем, об/об) воды при 2,0 ± 1,0°C в течение 2 часов, и набор для хромогенного анализа применяли для определения активности rFVIII. Средняя активность (МЕ/мл) контрольного образца воды и образцов, обработанных Мега-10, была сопоставимой при 57,19 и 52,26 МЕ/мл соответственно (Фиг. 7). Эти результаты показывают, что активность rFVIII сохраняется даже после 2 часов инкубации с Mega 10, что является моментом времени, намного превышающим 30 минутную инактивацию вируса. Результаты показывают, что Mega 10 не только эффективен в инактивации оболочечных вирусов, но и не влияет на активность белкового лекарственного средства.
Пример 5: зависимость ответа от дозы
Чтобы определить самую низкую эффективную концентрацию для Mega 10, было выполнено исследование зависимости ответа от дозы. Возрастающие концентрации в интервале от 0,014 до 0,5% (масса/объем, мас./об.) инкубировали с рекомбинантным FVIII (rFVIII) и добавлением X-MuLV (низкий титр) при 2,0 ± 1,0°C в течение 30 минут. Контроль на основе rFVIII только также инкубировали в тех же условиях. После инкубации все реакции подавляли и отбирали образцы для серийного разведения в анализе TCID50. Для реакций Mega 10 титры вируса были сопоставимы с контролями между концентрациями 0,014-0,06% (мас./об.), что указывает на то, что Mega 10 не способен инактивировать оболочечный вирус при этих низких концентрациях (Фиг. 8). Как только концентрация Mega 10 увеличилась до около 0,11%, титр вируса заметно снизился до около 2,62 Log10 TCID50/мл. При около 0,23% Mega 10 титр вируса значительно снижался до уровней, при которых заражение вирусом не наблюдалось (Фиг. 7 и таблица 7). При 0,23% (мас./об.) предел обнаружения (LOD) для Mega 10 составлял ≤1,52 Log10 TCID50/мл и, следовательно, LRF составлял ≥3,96 для Mega 10 при 2,0 ± 1,0°C в течение 30 минут (Таблица 7). Таким образом, самая низкая концентрация для быстрой и полной инактивации X-MuLV составляет около 0,23% для Mega 10.

Пример 6: Исследования кинетики
Было проведено исследование кинетики с использованием препаратов вируса как с низким, так и с высоким титром, чтобы определить, насколько быстро и экстенсивно Mega 10 может инактивировать X-MuLV. Исследования кинетики включали множество концентраций (0,02%, 0,10%, 0,20% и 0,30% (мас./об.)), моментов времени (0, 5, 15, 30, 60 и 120 минут) и низкие и стоки X-MuLV с низким и высоким титром. Путем тестирования дополнительного стока X-MuLV с высоким титром может быть достигнута более высокая чувствительность анализа, что будет отражено в более высоком коэффициенте логарифмического сокращения. Mega 10 в 0,3% инкубировали с препаратом рекомбинантного FVIII (rFVIII) и добавляли вирус X-MuLV с низким титром при 2,0 ± 1,0°C в течение 0, 5, 15, 30, 60 и 120 минут. Затем образцы реакции подавляли, и отбирали образцы для анализа TCID50. Результаты для Mega 10 показывают, что вирус был немедленно инактивирован после смешивания X-MuLV с образцом, содержащим детергент (t ~ 0) (Фиг. 9). Инфекционность вируса не была обнаружена в любой анализируемый момент времени, что снова указывает на полную инактивацию с пределом обнаружения, достигающим ≤1,52 Log10 TCID50/мл и коэффициентом логарифмического сокращения ≥3,80.

При повторении аналогичного эксперимента со стоком X-MuLV с высоким титром и несколькими концентрациями Mega 10 наблюдалась частичная инактивация вируса через 0 минут (t ~ 0) (0,20% Mega 10) с полной инактивацией, достигаемой через 5 минут (0,20% Mega 10) (Фиг. 10). Примечательно, что при 0,20% Mega 10 не наблюдалось ни одного живого вируса от 5 до 120 минут инкубации с пределом обнаружения ≤2,03 Log10 TCID50/мл, что приводило к снижению вирусной инфекционности в ≥104,80 раза (Таблица 9). Этот пример продемонстрировал, что Mega 10 очень эффективен при низких концентрациях при быстром действии в интервале от 0 до 5 минут.

Пример 7: Сравнение партий Mega 10
Чтобы обеспечить согласованность Mega 10 среди множества поставщиков и партий, было проведено сравнение зависимости ответа от дозы для детергентных продуктов от G-Bioscience и Sigma. Для каждого поставщика образцы получали при нескольких концентрациях (0,05, 0,1, 0,2, 0,3, 0,4% мас /об.) и инкубировали с рекомбинантным FVIII (rFVIII) и добавлением X-MuLV (высокий титр) при 2,0 ± 1,0°C в течение 30 минут. Контроль на основе rFVIII только также инкубировали в тех же условиях. После инкубации все реакции подавляли и титровали для TCID50 анализа. Для каждого образца Mega 10, полученного у G-Bioscience и Sigma, вирусные титры соответствовали друг другу при их соответствующих уровнях концентрации (Фиг. 11). Профиль инактивации X-MuLV показывает, что продукты Mega 10 из обоих источников сопоставимы. Образцы, обработанные 0,2-0,4% Mega 10 каждого продукта, дали полную инактивацию ≤2,03 Log10 TCID5 /мл и LRF ≥4,45. Таким образом, Mega 10 из разных источников дал результаты, согласующиеся друг с другом и с предшествующими данными.
Пример 8: Инактивация большего числа оболочечных вирусов (BVDV и PRV) в рекомбинантном FVIII посредством N-метилглюкамидов
Чтобы дополнительно определить, работает ли эффективная и быстрая инактивация X-MuLV N-метилглюкамидами в равной степени с другими оболочечными вирусами, Мега 9 и 10 были оценены на их способность инактивировать BVDV и PRV в растворах рекомбинантного FVIII (rFVIII).
Инактивацию BVDV с помощью Mega 9 и 10 определяли с помощью исследования зависимости ответа от дозы. К образцам rFVIII, содержащим Mega 9 при 0,5, 0,8 и 1,0% (мас./об.) и Mega 10 при 0,2, 0,3 и 0,4% (мас./об.), добавляли сток BVDV при 1:11 и инкубировали при 2,0 ± 1,0°C в течение 30 минут. После инкубации образцы подавляли и титровали для проведения анализа TCID50 с использованием индикаторных клеток EBTr. Результаты показали, что Mega 9 был способен инактивировать BVDV до предела обнаружения (≤2,03 Log10 TCID50/мл) только при концентрации 1,0%. Mega 10 был способен полностью инактивировать BVDV при 0,2, 0,3 и 0,4% (мас./об.). Оба детергента были способны снизить инфекционность BDVD в ≥105,14раз.
PRV добавляли (1:11) в препараты rFVIII, содержащие Mega 10 при 0,2 или 0,3% (мас./об.) и анализировали в моменты времени 0, 5, 15, 30 и 60 минут при 2,0 ± 1,0°C. После инкубации образцы подавляли и тировали в анализе TCID50 с применением индикаторных клеток Vero. Результаты показали, что как при 0,2, так и при 0,3% Mega 10 способен сокращать инфекционность вирусов почти сразу на 104,5 раз или выше и достигать предела обнаружения (≤2,03 Log10 TCID50/мл) в момент 15 минут, с уменьшением инфекционности в ≥105,10 раз при обеих концентрациях Mega 10 (Фиг. 12).
Таким образом, Mega 10 способен инактивировать PRV при 0,2% в течение 15 минут и BVDV при 0,2% сразу после смешивания, что означает снижение инфекционности BVDV в ≥105,14 раз. Mega 9 был эффективен при инактивации BVDV до LOD при 1,0% (мас./об.) в течение 30 минут обработки. Как Mega 10, так и Mega 9 были способны инактивировать BVDV до LOD, что соответствует ≥105,14-кратному снижению инфекционности BVDV. Mega 10 инактивирует BVDV намного быстрее и имеет более низкую концентрацию, чем Mega 9. Эти результаты показали, что N-метилглюкамиды способны эффективно инактивировать оболочечный вирус независимо от семейств и видов вирусов (Фиг. 13).
Метилглюкамиды протестировали с другими соединениями для определения потенциальных синергетических эффектов на инактивацию вируса. Метилглюкамиды смешивали с Tween 20 (Tw20), раствором три(н-бутил)фосфата (TnBP) или солью хлорида натрия (NaCl) и применяли без смешивания с ними и инкубировали с X-MuLV. Затем, титры каждого образца и контролей анализировали с применением TCID50 анализа, описанного ранее. Для каждого эксперимента (Фиг. 15, 16 и 17), контроли состояли из rFVIII с добавлением X-MuLV без детергента, и полученные титры были в ожидаемом диапазоне около 6,5 log10 TCID50/мл. Концентрации 0,05% (мас./об.), 0,10% (мас./об.) или 0,30% (мас./об.) Mega 10 смешивали с общеизвестным детергентом Tw20 при 0,01% (мас./об.), 0,02% (мас./об.) или 0,06% (мас./об.), титры вируса были сопоставимы с титрами вируса для Mega 10 только (Фиг. 15). Поэтому, Mega 10 + Tw20 не усилил далее инактивацию вируса. Концентрации 0,05% (мас./об.) или 0,30% (мас./об.) Mega 10 смешивали с общеизвестным растворителем TnBP при 0,05% (мас./об.) или 0,30% (мас./об.) (соответственно), титры вируса незначительно уменьшились с 0,05% (мас./об.) Mega 10 + 0,05% (мас./об.) TnBP по сравнению с 0,05% Mega 10 только (Фиг. 16). Поэтому, Mega 10 + TnBP незначительно усиливает инактивацию вируса. Наконец, концентрации 0,10% (мас./об.) Mega 10 или 0,51% (мас./об.) Mega 9 смешивали с 500 мМ NaCl, титры вируса уменьшились по сравнению с 0,10% (мас./об.) Mega 10 или 0,51% (мас./об.) Mega 9 только (Фиг. 17). Поэтому, Mega 10 или Mega 9 + NaCl усилили инактивацию вируса. Взятые вместе, результаты показывают, что синергетические эффекты наблюдаются между метилглюкамидами и TnBP или NaCl и могут быть использованы для повышения эффективности метилглюкамидов для инактивации вируса.
Пример 9: Инактивация оболочечных вирусов (X-MuLV) в растворах человеческих антител и плазме человека посредством N-Метилглюкамидов
До сих пор Mega 10 был показан как эффективный инактиватор множества оболочечных вирусов в матриксе рекомбинантного белка FVIII. Для оценки является ли Mega 10 эффективным в других связанных с плазмой белковых матриксах проводили инактивацию X-MuLV в растворах человеческого иммуноглобулина G (IgG) и плазмы. Каждый образец белкового матрикса готовили при концентрации 30 мг/мл, содержащей 0,2, 0,3 и 0,4% (мас./об.) Mega 10, и добавляли в него сток X-MuLV (1:11) и инкубировали при 2,0 ± 1,0°C в течение 30 минут После инкубации образцы гасили и серийно разводили в анализе TCID50 с использованием индикаторных клеток PG-4. Результаты показали, что как в образцах человеческого IgG, так и в образцах плазмы человека Mega 10 был способен инактивировать X-MuLV до предела обнаружения (≤2,03 Log10 TCID50/мл) с уменьшением инфекционности X-MuLV в ≥104,46 раз в растворах IgG и ≥103,50 раз в растворах плазмы человека (Фиг. 14). Разница в значениях снижения инфекционности вируса для двух белковых матриксов была обусловлена тем фактом, что образец плазмы человека имел более низкий титр вируса положительного контроля по сравнению с титром положительного контроля в растворе IgG. Полагают, что причиной этого несоответствия является то, что плазма не подвергается тепловой инактивации до проведения эксперимента, что приводит к неспецифической опосредованной комплементом инактивации вируса. Таким образом, Mega 10 способен инактивировать X-MuLV так же эффективно и быстро во множестве белковых матриксов крови, как и в растворах белка rFVIII, указывая на то, что на инактивацию вируса N-метилглюкамидами не влияют типы, источники и концентрации биологических продуктов.
Этот метод инактивации вирусов с помощью N-метилглюкамидов является подходящим для способа очистки биологически активных лекарственных средств, таких как белковые субъединицы, белки (ферменты, факторы и т.д.), рекомбинантные белки или антитела или терапевтические средства, полученные из крови/плазмы человека. Экологически безопасные детергенты, используемые в этом способе, представляют собой многочисленные N-метилглюкамидные гомологи на основе сахара, состоящие из гидрофильного глюкозного фрагмента и гидрофобного хвоста на основе жирной кислоты, связанных амидной связью. Поскольку в N-метилглюкамидах нет известных токсичных промежуточных соединений, таких как октилфенол, это устраняет риски, связанные с экологическими проблемами. Кроме того, эти детергенты на основе сахара являются неионными по природе, что, как было продемонстрировано, не вызывает разрушение представляющего интерес белка лекарственного средства. По своей природе, N-метилглюкамиды не должны оказывать эффект на безоболочечные вирусы и препараты нуклеиновых кислот. Этот способ включает инкубацию N-метилглюкамида с белковым лекарственным продуктом для инактивации любого потенциального загрязнителя типа оболочечного вируса. Чтобы оценить сокращение вируса этим способом, множественные модельные оболочечные вирусы (например, вирус ксенотропного лейкоза, вирус псевдобешенства и вирус диареи крупного рогатого скота) были добавлены в образцы белкового лекарственного средства (например, нативные белки, рекомбинантные белки, антитела, плазму человека) отдельно и инкубированы с N -метилглюкамидами. После инкубации проводили анализ TCID50 для определения титра инфекционности вируса. Кроме того, инактивация оболочечных вирусов с N-метилглюкамидами сравнима с такой инактивацией для хорошо описанного в литературе детергента для инактивации вируса Triton X-100. Взятые вместе, эти превосходные характеристики делают N-метилглюкамиды мощными инструментами в способе очистки лекарственных препаратов, полученных биологическим методом.
Реферат
Изобретение относится к способам инактивации вирусов. Способ применим для очистки биологически активных лекарственных средств, таких как белковые субъединицы, белки (ферменты, факторы и т.д.), рекомбинантные белки, антитела, вакцины или генно-терапевтические продукты. Способ очистки раствора биологического продукта, имеющего неидентифицированный загрязнитель типа оболочечного вируса, включает инкубацию раствора биологического продукта с раствором N-метилглюкамида до инактивации загрязнителя типа оболочечного вируса, присутствующего в растворе биологического продукта, с образованием инактивированного загрязнителя типа вируса; и очистку полученного раствора биологического продукта для удаления инактивированного загрязнителя типа вируса. Осуществление изобретения обеспечивает повышение эффективности, надежности и общей безопасности получаемых продуктов. 12 з.п. ф-лы, 17 ил., 9 табл., 18 пр.


Комментарии