Инструменты, модули и способы для улучшенного обнаружения отредактированных последовательностей в живых клетках - RU2773331C1
Код документа: RU2773331C1
Чертежи













































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001]Настоящая международная патентная заявка испрашивает приоритет американских предварительных заявок №№ 62/718449, поданной 14 августа 2018 г.; 62/735365, поданной 24 сентября 2018 г.; 62/781112, поданной 18 декабря 2018 г.; и 62/779119, поданной 13 декабря 2018 г.; а также американского патента № 10253316, выданного 09 апреля 2019 г.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение относится к усовершенствованным инструментам, модулям и способам для скрининга, выбора, и таким образом оптимизации обнаружения изменений генома в живых клетках.
УРОВЕНЬ ТЕХНИКИ
[0003] В следующем обсуждении некоторые статьи и способы будут описаны для справочных и вводных целей. Ничто из содержащегося в настоящем документе не должно рассматриваться как «признание» предшествующего уровня техники. Заявитель явно оставляет за собой право продемонстрировать, когда это целесообразно, что способы, упомянутые в настоящем документе, не являются предшествующим уровнем техники в соответствии с применимыми положениями закона.
[0004] Возможность вносить точные и целенаправленные изменения в геном живых клеток является давней целью биомедицинских исследований и разработок. В последнее время были идентифицированы различные нуклеазы, которые позволяют манипулировать последовательностями генов и, следовательно, функцией генов. Эти нуклеазы включают в себя направляемые нуклеиновыми кислотами нуклеазы, которые позволяют исследователям вносить постоянные изменения в живые клетки. Текущие протоколы, использующие направляемые нуклеиновыми кислотами нуклеазные системы, обычно используют постоянно экспрессируемые нуклеазные компоненты для обеспечения высокоэффективного редактирования. Однако в объединенных или мультиплексных форматах постоянная экспрессия редактирующих компонентов может привести к быстрому истощению отредактированных типов клеток и к селективному обогащению клеток, которые не были отредактированы. Это происходит в большинстве типов клеток, потому что только небольшая часть (<1-5%) клеток переживает введение разрывов двухцепочечной ДНК (dsDNA), и таким образом эти клетки вносят меньшее количество жизнеспособных клеток в получаемые популяции по сравнению с неотредактированными клетками, не испытавшими разрыва двухцепочечной ДНК.
[0005] Таким образом, в области генного редактирования с помощью направляемых нуклеиновыми кислотами нуклеаз существует потребность в улучшенных инструментах, модулях и способах для редактирования генома, а также для идентификации и обогащения отредактированных клеток. Настоящее изобретение удовлетворяет эту потребность.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] Данное описание сущности изобретения предназначено для того, чтобы в упрощенной форме сделать введение в набор концепций, которые описываются ниже в подробном описании. Данный раздел не предназначен для того, чтобы идентифицировать все ключевые или существенные особенности заявленного предмета, а также он не предназначен для того, чтобы ограничивать область охвата заявленного предмета. Другие особенности, подробности и преимущества заявленного предмета изобретения станут очевидными из следующего подробного описания, включая аспекты, проиллюстрированные на прилагаемых чертежах и определенные в прилагаемой формуле изобретения.
[0007] Настоящее изобретение предлагает инструменты, модули и способы для жестко регулируемой экспрессии компонентов направляемых нуклеиновой кислотой нуклеазных систем редактирования, которые позволяют разделить процессы трансформации и редактирования генома. Эти композиции и способы используют конструкции индуцибельной направляющей РНК (гРНК), приводящие к увеличенной наблюдаемой эффективности трансформации и удобному для автоматизации контролю над временем и продолжительностью процесса редактирования. Кроме того, эти инструменты, модули и способы обеспечивают автоматизированный высокопроизводительный и чрезвычайно чувствительный скрининг для идентификации отредактированных клеток. Эти инструменты, модули и способы используют преимущества сингуляции или существенной сингуляции, где термин «сингуляция» в этом контексте относится к процессу разделения клеток и выращивания их в клонально изолированные форматы. Термин «существенная сингуляция» относится к процессу разделения клеток в популяции клеток на «группы» из 2-100, или 2-50, и предпочтительно 2-10 клеток. Сингуляция, сопровождаемая начальным периодом роста, индукцией редактирования, и нормализацией роста, приводит к обогащению отредактированных клеток. Кроме того, описанные в настоящем документе инструменты, модули и способы облегчают «отбор» отредактированных колоний клеток, обеспечивая прямой выбор отредактированных клеток. Сингуляция или существенная сингуляция помогают преодолеть уклон роста в сторону неотредактированных клеток, который возникает при конкурентных режимах роста, таких как массовая жидкая культура. Действительно, было определено, что устранение смещения скорости роста посредством сингуляции или существенной сингуляции, индукции и нормализации улучшает наблюдаемую эффективность редактирования до 4 раз (например, с 10% до 40% абсолютной эффективности в масштабе популяции) или больше по сравнению с традиционными способами, и, кроме того, отбор колоний с использованием описанных в настоящем документе способов увеличивает наблюдаемую эффективность редактирования до 8 раз (например, с 10% до 80% абсолютной эффективности в масштабе популяции) по сравнению с традиционными способами. Таким образом, комбинация сингуляции или существенной сингуляции, роста, индукции редактирования, и нормализации или отбора улучшает наблюдаемую эффективность редактирования до 8 раз по сравнению с традиционными способами, в которых сингуляция или существенная сингуляция, рост, индукция редактирования и нормализация или отбор не используются.
[0008] Одним особенно простым модулем или устройством для сингуляции или существенной сингуляции является устройство со сплошной стенкой, где клетки по существу изолируются, выращиваются в клональном формате, индуцируется редактирование и используется либо нормализация, либо отбор. Устройства или модули со сплошной стенкой и их использование подробно описываются в настоящем документе. Эти инструменты, модули и способы в некоторых вариантах осуществления обеспечивают нормализацию колоний отредактированных и неотредактированных клеток. Нормализация относится к росту колоний клеток - отредактированных или неотредактированных - до конечного размера; то есть к выращиванию клеток до тех пор, пока клетки в колониях не войдут в стадию старения из-за, например, истощения питательных веществ или ограниченного пространства для дальнейшего роста. Нормализация колоний клеток обогащает отредактированные клетки, поскольку отредактированные клетки получают равное положение с неотредактированными клетками. Дополнительно к этому, эти инструменты, модули и способы облегчают «отбор» колоний. Отбор обеспечивает прямой выбор отредактированных клеток за счет использования вызванной редактированием задержки роста отредактированных колоний. Отбор колоний с использованием описанных в настоящем документе инструментов, модулей и способов может более чем в два раза увеличить наблюдаемую эффективность редактирования в результате сингуляции или существенной сингуляции.
[0009] Некоторые варианты осуществления этих инструментов, модулей и способов предусматривают обогащение отредактированных клеток во время направляемого нуклеиновой кислотой нуклеазного редактирования, где способы содержат трансформацию клеток одним или несколькими векторами, содержащими промотор, управляющий экспрессией нуклеазы, промотор, управляющий транскрипцией направляющей нуклеиновой кислоты, и последовательность донорной ДНК, причем один или оба из промоторов, управляющий транскрипцией нуклеазы или направляющей нуклеиновой кислоты, представляют собой индуцибельный промотор; разбавление трансформированных клеток до концентрации клеток, достаточной для существенной сингуляции трансформированных клеток на субстрате; выращивание по существу сингулированных клеток на субстрате; инициирование редактирования путем индукции индуцибельного промотора (промоторов); и либо 1) выращивание колоний клеток, полученных из индуцированных клеток, до колоний конечного размера (например, нормализация колоний клеток) и сбор нормализованных колоний клеток; либо 2) мониторинг роста колоний клеток на субстрате с последующим отбором медленно растущих колоний.
[0010] Таким образом, в некоторых вариантах осуществления предлагается узел сингуляции со сплошной стенкой для сингуляции или существенной сингуляции, роста, индукции редактирования и нормализации или отбора («модуль изоляции/индукции/нормализации со сплошной стенкой» или «SWIIN»), содержащий: удерживающий элемент, содержащий верхнюю поверхность и нижнюю поверхность, который содержит по меньшей мере один канал распределения удерживаемого вещества, который пересекает удерживающий элемент от его верхней поверхности до его нижней поверхности на большей части длины удерживающего элемента; в котором нижняя поверхность удерживающего элемента содержит удерживающие ребра, между которыми расположены направляющие для потока удерживаемого вещества; в котором удерживающий элемент дополнительно содержит одно или более отверстий удерживающего элемента, выполненных с возможностью подачи клеток и жидкости в удерживающий элемент и удаления клеток и жидкости из удерживающего элемента; и в котором отверстия удерживающего элемента гидравлически связаны с каналом распределения удерживаемого вещества и направляющими потока удерживаемого вещества; перфорированный элемент с верхней поверхностью и нижней поверхностью, в котором верхняя поверхность перфорированного элемента расположена ниже и рядом с нижней поверхностью удерживающего элемента, и в котором перфорированный элемент содержит по меньшей мере 25000 отверстий; фильтр с верхней поверхностью и нижней поверхностью, в котором верхняя поверхность фильтра расположена ниже и рядом с нижней поверхностью перфорированного элемента, и в котором нижняя поверхность фильтра расположена выше и рядом верхней поверхностью проницаемого элемента; уплотнение, окружающее перфорированный элемент и фильтр; и проницаемый элемент, содержащий верхнюю поверхность и нижнюю поверхность, который содержит по меньшей мере один канал распределения пермеата, который пересекает проницаемый элемент от его нижней поверхности до его верхней поверхности на большую часть длины проницаемого элемента; в котором верхняя поверхность проницаемого элемента содержит проницаемые ребра, между которыми расположены направляющие потока пермеата; в котором проницаемый элемент дополнительно содержит одно или более отверстий проницаемого элемента, выполненных с возможностью подачи жидкости в проницаемый элемент и удаления жидкости из проницаемого элемента; и в котором отверстия проницаемого элемента гидравлически связаны с каналом распределения пермеата и направляющими потока пермеата; а также средство для соединения удерживающего элемента, перфорированного элемента, фильтра, уплотнения и проницаемого элемента.
[0011] В некоторых аспектах варианта осуществления узла сингуляции средство для соединения удерживающего элемента, перфорированного элемента, фильтра, уплотнения и проницаемого элемента содержит ультразвуковую сварку, а в других аспектах это средство содержит чувствительное к давлению клейкое вещество, соединение с помощью растворителя, сопряженные фитинги или комбинацию клейких веществ, сварки, соединения с помощью растворителя и сопряженных фитингов; а также другие такие крепежные детали и соединения. В некоторых аспектах узла сингуляции перфорированный элемент содержит по меньшей мере 50000; 100000; 150000; 200000, 250000 отверстий или больше, и в некоторых аспектах SWIIN представляет собой составной SWIIN, и каждая часть составного SWIIN содержит перфорированный элемент, имеющий по меньшей мере 50000; 100000; 150000; 200000, 250000 отверстий. В некоторых аспектах удерживающий и проницаемый элементы изготовляются из поликарбоната, циклического сополимера олефина, или поли(метилметакрилата); и в некоторых аспектах удерживающий и проницаемый элементы имеют размеры от 75 мм до 350 мм в длину, от 50 мм до 250 мм в ширину и от 2 мм до 15 мм в толщину. В некоторых аспектах узла сингуляции удерживающий и проницаемый элементы имеют размеры от 150 мм до 250 мм в длину, от 100 мм до 150 мм в ширину и от 4 мм до 8 мм в толщину. В некоторых аспектах узла сингуляции имеется два канала распределения пермеата и/или два канала распределения удерживаемого вещества, и в некоторых аспектах каналы распределения удерживаемого вещества и/или каналы распределения пермеата составляют приблизительно 150 мм в длину и 1 мм в ширину. В некоторых аспектах удерживающие и/или проницаемые ребра составляют приблизительно 0,5 мм в высоту и 80 мм в длину, и в некоторых аспектах направляющие потока удерживаемого вещества и/или пермеата имеют приблизительно 5 мм в ширину. В некоторых аспектах объем узла сингуляции составляет от 15 мл до 100 мл.
[0012] Некоторые варианты осуществления настоящего изобретения предлагают модуль SWIIN, содержащий узел сингуляции и дополнительно содержащий: резервуарный узел, содержащий по меньшей мере два резервуара, в котором первый резервуар является 1) гидравлически связанным по меньшей мере с одним отверстием резервуара, через которое жидкости и/или клетки попадают снаружи модуля SWIIN в первый резервуар, 2) гидравлически связанным с отверстием резервуара/канала, через которое жидкости и/или клетки текут в одно или более отверстий удерживающего элемента; и 3) пневматически связанным с источником давления; второй резервуар является 1) гидравлически связанным по меньшей мере с одним отверстием резервуара, через которое жидкости попадают снаружи модуля SWIIN во второй резервуар, 2) гидравлически связанным с отверстием резервуара/канала, через которое жидкости текут в одно или более отверстий проницаемого элемента; и 3) пневматически связанным с источником давления; и крышку SWIIN. В некоторых аспектах варианта осуществления модуля SWIIN модуль SWIIN дополнительно содержит два добавочных резервуара, причем первый и третий резервуар являются 1) гидравлически связанными по меньшей мере с двумя отверстиями резервуара, через которые жидкости и/или клетки попадают снаружи модуля SWIIN в первый и третий резервуары, 2) гидравлически связанными с отверстием резервуара/канала, через которое жидкости и/или клетки текут по меньшей мере в два отверстия удерживающего элемента; и 3) пневматически связанными с источником давления; а второй и четвертый резервуар являются 1) гидравлически связанными по меньшей мере с двумя отверстиями резервуара, через которые жидкости попадают снаружи модуля SWIIN во второй и четвертый резервуары, 2) гидравлически связанными с отверстием резервуара/канала, через которое жидкости текут по меньшей мере в два отверстия проницаемого элемента; и 3) пневматически связанными с источником давления.
[0013] В некоторых аспектах варианта осуществления модуля SWIIN крышка SWIIN содержит часть крышки резервуара крышки SWIIN, причем часть крышки резервуара содержит 1) по меньшей мере два отверстия доступа к резервуару, которые обеспечивают доступ к отверстиям резервуара, и 2) по меньшей мере два отверстия пневматического доступа, которые обеспечивают доступ по меньшей мере к этим двум резервуарам и обеспечивают давление ниже и выше атмосферного в этих по меньшей мере двух резервуарах. В некоторых аспектах модуль SWIIN является выполненным с возможностью отслеживания роста колонии клеток после индуцирования редактирования, и дополнительно содержит средство для отбора медленно растущих колоний клеток. В некоторых аспектах модуля SWIIN редактирование вызывается индуцибeльным промотором, который является температурно индуцибeльным промотором, и температура для индуцирования транскрипции нуклеазы и/или направляющей нуклеиновой кислоты обеспечивается в модуле SWIIN с помощью устройства Пельтье.
[0014] Другие варианты осуществления настоящего изобретения предлагают автоматизированный мультимодульный инструмент для редактирования клеток, содержащий: модуль SWIIN; корпус, выполненный с возможностью вмещать в себя все или некоторые из модулей; приемник, выполненный с возможностью получения клеток; один или более приемников, выполненных с возможностью получения нуклеиновых кислот; модуль выращивания; модуль трансформации, выполненный с возможностью введения нуклеиновых кислот в клетки; и процессор, выполненный с возможностью управления автоматизированным мультимодульным инструментом для редактирования клеток на основе пользовательского ввода и/или выбора предпрограммированного скрипта.
[0015] В некоторых аспектах автоматизированного мультимодульного инструмента для редактирования клеток модуль трансформации содержит проточное устройство электропорации; и в некоторых аспектах автоматизированный мультимодульный инструмент для редактирования клеток дополнительно содержит модуль концентрации клеток. В некоторых аспектах модуль концентрации клеток представляет собой модуль фильтрации с тангенциальным потоком. В некоторых аспектах система обработки жидкости перемещает жидкости между модулями. В некоторых аспектах мультимодульная автоматизированная система обработки клеток выполняет процессы выращивания клеток, концентрирования и делания клеток электрокомпетентными, трансформирования клеток с помощью направляемых нуклеиновой кислотой компонентов редактирования нуклеазы, сингуляции преобразованных клеток, индуцирования редактирования в сингулированных клетках и выращивания и обогащения клеток, причем все это без вмешательства человека.
[0016] В других вариантах осуществления предлагается автоматизированный мультимодульный инструмент для редактирования клеток, содержащий: модуль SWIIN; корпус, выполненный с возможностью вмещать в себя все или некоторые из модулей; приемник, выполненный с возможностью получения клеток; один или более приемников, выполненных с возможностью получения нуклеиновых кислот; модуль трансформации, выполненный с возможностью введения нуклеиновых кислот в клетки; модуль концентрации клеток; и процессор, выполненный с возможностью управления автоматизированным мультимодульным инструментом для редактирования клеток на основе пользовательского ввода и/или выбора предпрограммированного скрипта. В некоторых аспектах автоматизированного мультимодульного инструмента обработки клеток система обработки жидкостей перемещает реагенты в и между модулями, а также модулем SWIIN. В некоторых аспектах автономная, интегрированная, мультимодульная автоматизированная система обработки клеток содержит модуль выращивания, содержащий вращающийся флакон для выращивания, модуль сборки нуклеиновой кислоты или картридж реагента. В некоторых аспектах мультимодульная автоматизированная система обработки клеток выполняет процессы выращивания клеток, концентрирования и делания клеток электрокомпетентными, трансформирования клеток с помощью направляемых нуклеиновой кислотой компонентов редактирования нуклеазы, сингуляции преобразованных клеток, индуцирования редактирования в сингулированных клетках и выращивания и обогащения клеток, причем все это без вмешательства человека. Как и другие варианты осуществления, этот вариант осуществления автоматизированного мультимодульного инструмента для редактирования клеток содержит систему обработки жидкостей для перемещения жидкостей между модулями.
[0017] В еще одном дополнительном варианте осуществления предлагается способ обогащения отредактированных клеток во время направляемого нуклеиновой кислотой нуклеазного редактирования, содержащий: трансформирование клеток с помощью одного или более векторов, содержащих индуцибeльный промотор, управляющий экспрессией нуклеазы, индуцибeльный промотор, управляющий транскрипцией направляющей нуклеиновой кислоты, и последовательность донорной ДНК; разбавление преобразованных клеток до такой концентрации, чтобы по существу сингулировать преобразованные клетки на субстрате; выращивание клеток на субстрате для 2-200 удвоений; инициирование редактирования путем индукции индуцибeльного промотора (промоторов), управляющего транскрипцией направляющей нуклеиновой кислоты и нуклеазы; выращивание индуцированных клеток в колонии; и отбор индуцированных клеток из по существу сингулированных колоний из субстрата, в котором индуцированные по существу сингулированные колонии обогащены отредактированными клетками.
[0018] В некоторых аспектах этого варианта осуществления способа индуцибeльной транскрипции направляющая нуклеиновая кислота представляет собой промотор pL, и индуцибельный промотор, управляющий экспрессией нуклеазы, является промотором pL. В некоторых аспектах нуклеаза, направляющая нуклеиновая кислота и последовательность донорной ДНК находятся на одном и том же векторе. В других аспектах нуклеаза находится на первом векторе, а направляющая нуклеиновая кислота и последовательность донорной ДНК находятся на втором векторе, и требуются две трансформирующих стадии. В некоторых аспектах последовательность донорной ДНК дополнительно содержит изменяющую PAM последовательность, и в некоторых аспектах каждый из одного или более векторов дополнительно содержит ген для селектируемого маркера. В некоторых аспектах способ дополнительно содержит добавление селективных агентов к среде субстрата для выбора селектируемого маркера (маркеров) на одном или более векторах. В некоторых аспектах индуцированные по существу сингулированные выбранные колонии являются малыми колониями, а в других аспектах клетки выращиваются в колонии конечного размера.
[0019] В одном варианте осуществления способа также представлен способ обогащения отредактированных клеток во время управляемого нуклеиновой кислотой нуклеазного редактирования, содержащий: трансформацию клеток с помощью одного или более векторов, содержащих промотор, управляющий экспрессией нуклеазы, управляемую индуцибeльным промотором транскрипцию направляющей нуклеиновой кислоты, и последовательность донорной ДНК; разбавление преобразованных клеток до такой концентрации, чтобы по существу сингулировать преобразованные клетки на первом субстрате; выращивание клеток для формирования колоний на первом субстрате; отбор клеток из по существу сингулированных колоний из первого субстрата и расположение выбранных клеток на втором субстрате; создание дубликата второго субстрата, формирующего третий субстрат; выращивание и индуцирование клеток на втором субстрате; выращивание и индуцирование клеток на третьем субстрате при условиях, которые не допускают починки генома; сравнение роста клеток на втором и третьем субстратах; и отбор клеток, которые растут на втором субстрате, но не растут на третьем субстрате.
[0020] В некоторых аспектах вариантов осуществления способа промотор, управляющий транскрипцией направляющей нуклеиновой кислоты, представляет собой промотор pL, и в некоторых аспектах, промотор, управляющий экспрессией нуклеазы, является индуцибeльным промотором. В некоторых аспектах индуцибeльный промотор, управляющий экспрессией каждой из направляющей нуклеиновой кислоты и нуклеазы, является тем же самым индуцибeльным промотором, и является промотором pL. В некоторых аспектах последовательность донорной ДНК дополнительно содержит изменяющую PAM последовательность, и способ дополнительно содержит добавление селективных агентов к среде первого субстрата для выбора одного или более векторов. В некоторых аспектах направляющая нуклеиновая кислота является направляющей РНК, и в некоторых аспектах клетки являются клетками бактерий, а вектор-двигатель дополнительно содержит рекомбинационную систему.
[0021] Еще один вариант осуществления способа предлагает способ обогащения отредактированных клеток во время направляемого нуклеиновой кислотой нуклеазного редактирования, содержащий: трансформирование клеток с помощью одного или более векторов, содержащих промотор, управляющий экспрессией нуклеазы, индуцибeльный промотор, управляющий транскрипцией направляющей нуклеиновой кислоты, и последовательность донорной ДНК; разбавление преобразованных клеток до такой концентрации, чтобы по существу сингулировать преобразованные клетки на субстрате; выращивание клеток на субстрате для 2-200 удвоений; инициирование редактирования путем индукции индуцибeльного промотора и выращивание клеток для формирования колоний; и отбор малых колоний из по существу сингулированных колоний из субстрата, в котором индуцированные по существу сингулированные колонии обогащены отредактированными клетками.
[0022] Еще один дополнительный вариант осуществления предлагает способ обогащения отредактированных клеток во время направляемого нуклеиновой кислотой нуклеазного редактирования, содержащий: трансформирование клеток с помощью одного или более векторов, содержащих промотор, управляющий экспрессией нуклеазы, индуцибeльный промотор, управляющий транскрипцией направляющей нуклеиновой кислоты, и последовательность донорной ДНК; разбавление преобразованных клеток до такой концентрации, чтобы по существу сингулировать преобразованные клетки на первом субстрате; выращивание клеток на первом субстрате для 2-200 удвоений; иинициирование редактирования путем индукции индуцибeльного промотора; и выращивание клеток для формирования колоний предельного размера. Некоторые аспекты этого варианта осуществления дополнительно содержат объединение колоний предельного размера, и некоторые аспекты этого варианта осуществления дополнительно содержат выбор колоний предельного размера.
[0023] Эти аспекты и другие особенности и преимущества настоящего изобретения более подробно описываются ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0024] Фиг. 1A представляет собой упрощенную блок-схему примерных способов обогащения и отбора отредактированных клеток. Фиг. 1B представляет собой график оптической плотности в зависимости от времени, показывающий кривые роста для отредактированных клеток (пунктир) и неотредактированных клеток (сплошная линия). Фиг. 1C изображает примерную систему индуцибeльной экспрессии для регулирования транскрипции гРНК и/или нуклеазы.
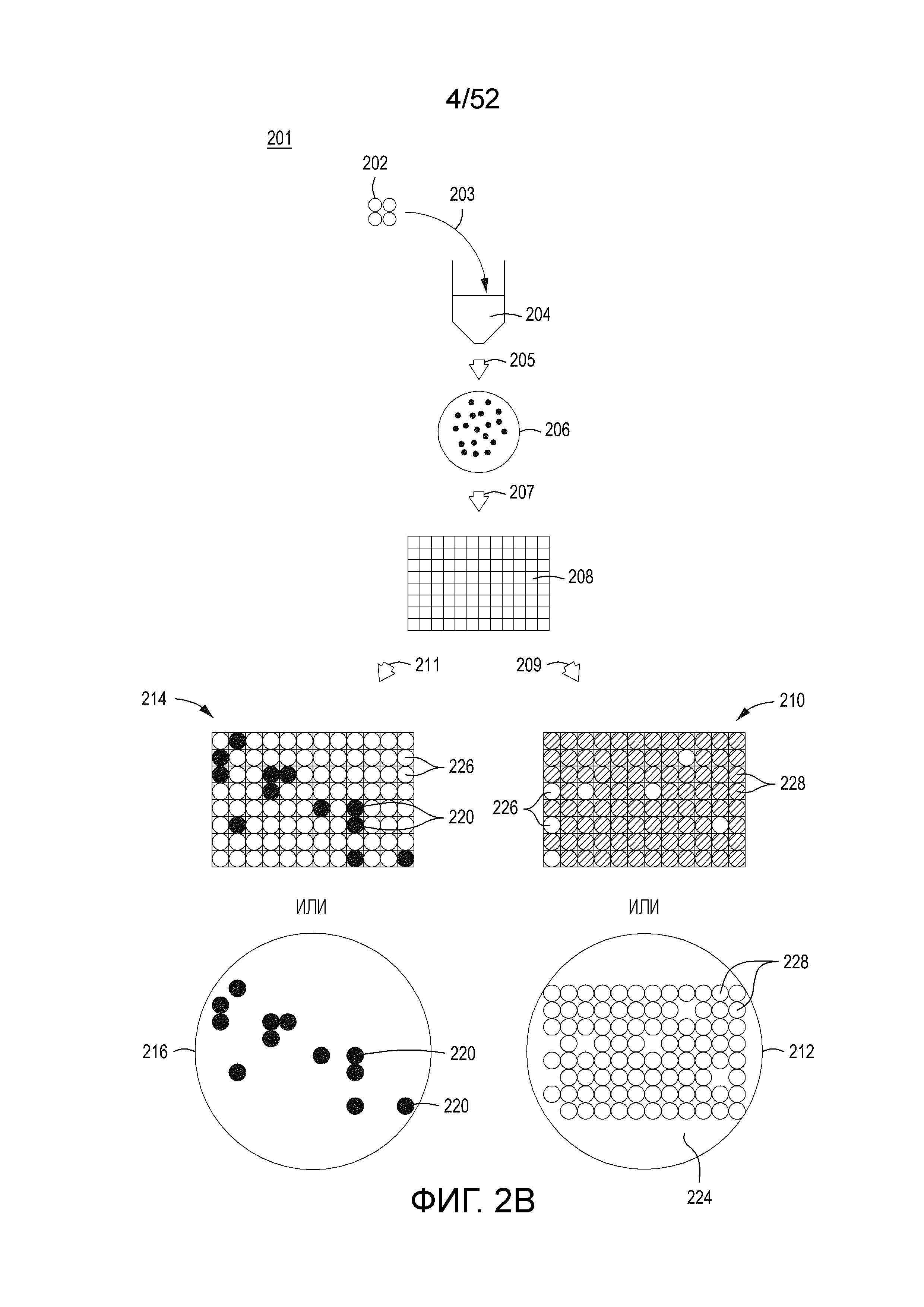
[0025] Фиг. 2A изображает предшествующий уровень техники, стандартный протокол для выполнения направляемого нуклеиновой кислотой нуклеазного редактирования генома. Фиг. 2B-2F изображают улучшенные протоколы, использующие сингуляцию или существенную сингуляцию, индукцию, и нормализацию или отбор (например, выбор) для идентификации отредактированных клеток в популяции, которые подверглись направляемому нуклеиновой кислотой нуклеазному редактированию генома. Фиг. 2B изображает протокол для функциональной деконволюции процесса редактирования, либо путем помещения клеток в 96-луночные пластины, содержащие различные среды, либо путем помещения клеток в чашку для культивирования, содержащую различные среды. Фиг. 2C изображает протокол для забора колоний из чашки для культивирования, расположения колоний на 96-луночной пластине, а затем выполнения функциональной деконволюции. Фиг. 2E изображает протокол для отбора, а Фиг. 2F изображает протокол, используемый для подтверждения того, что отбор является чрезвычайно эффективным для выбора отредактированных клеток.
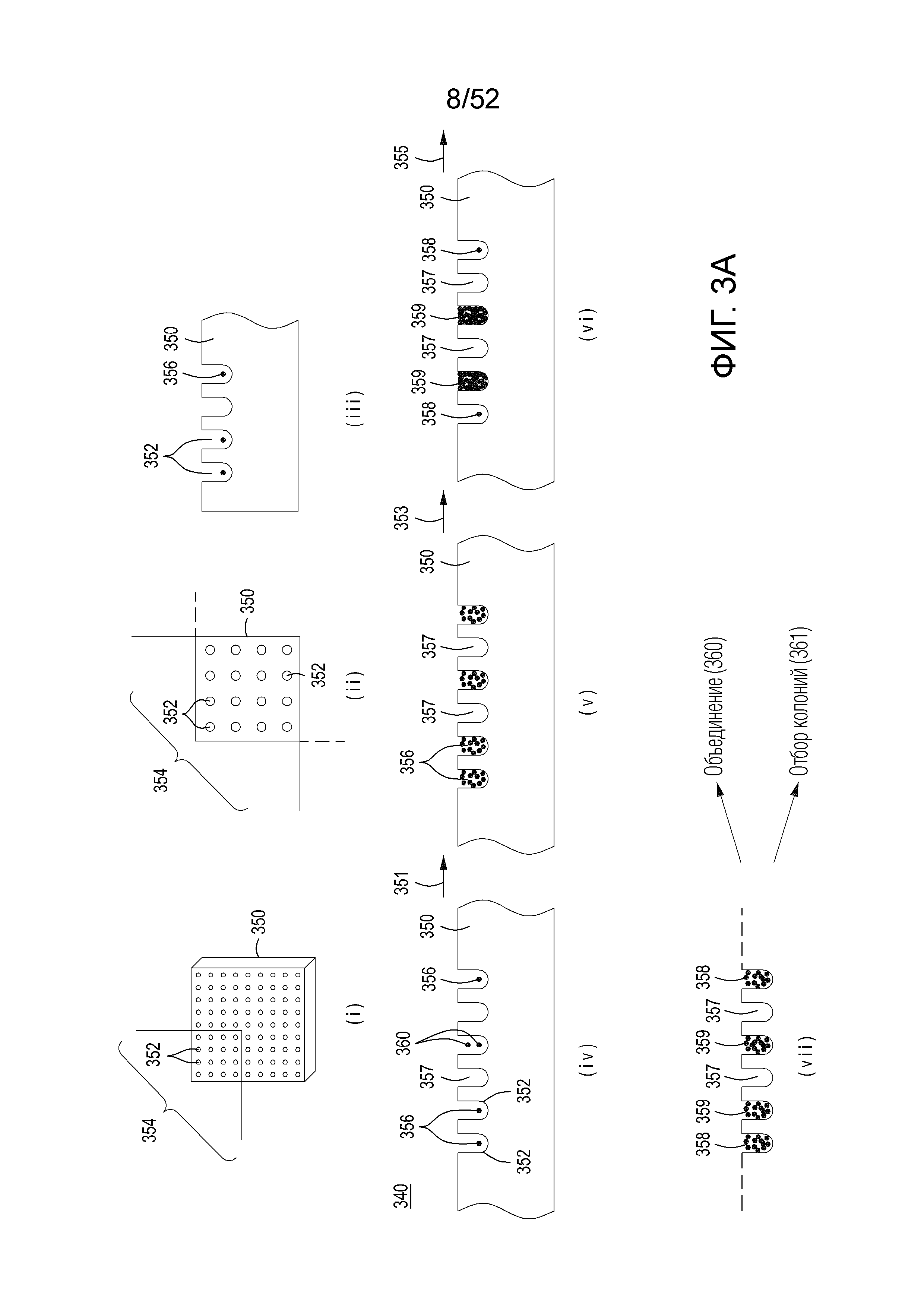
[0026] Фиг. 3A изображает упрощенную блок-схему для сингуляции, редактирования и нормализации клеток в устройстве со сплошной стенкой. Фиг. 3B изображает упрощенную вариацию блок-схемы для существенной сингуляции, редактирования и нормализации клеток в устройстве со сплошной стенкой. Фиг. 3C представляет собой фотографию одного варианта осуществления устройства со сплошной стенкой. Фиг. 3D-3F представляют собой фотографии клеток E.coli, в значительной степени сингулированных (посредством существенного распределения Пуассона) и выращенных в колонии в микролунках в устройстве со сплошной стенкой с проницаемым дном, с низким, средним и высоким увеличением, соответственно.
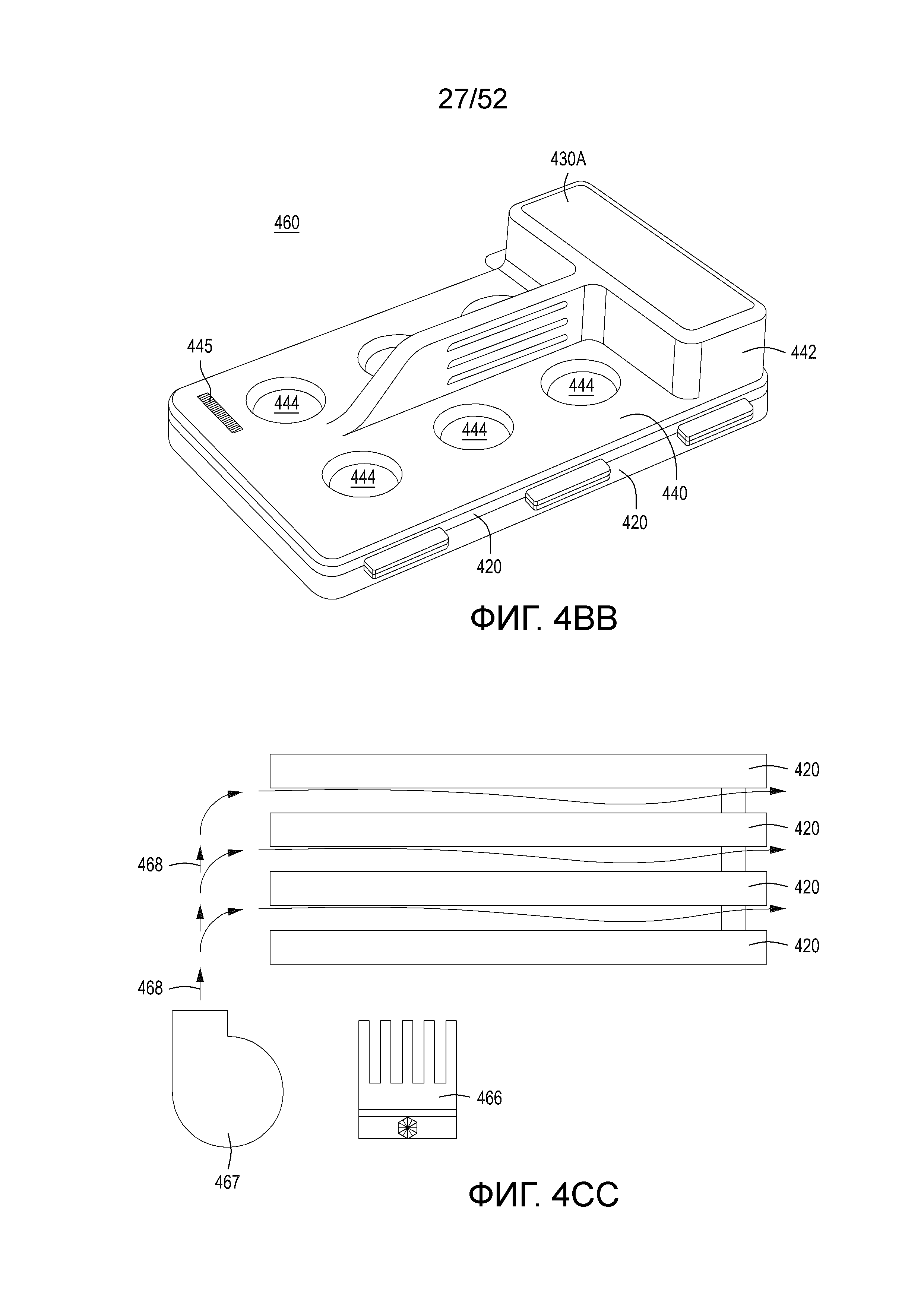
[0027] Фиг. 4A-4E представляют собой фотографии перфорированного элемента и микролунок в нем. Фиг. 4F-4R изображают компоненты трех примерных вариантов осуществления узла сингуляции, содержащего удерживающий и проницаемый элементы, а также узел перфорированный элемент/фильтр/уплотнение. Фиг. 4S-4Z изображают модуль сингуляции, выращивания, индукции редактирования и нормализации или отбора в сборе (например, «модуль изоляции/индукции/нормализации со сплошной стенкой» или «SWIIN»). Фиг. 4AA и 4BB изображают составные модули SWIIN, содержащие два (Фиг. 4AA) или четыре (Фиг. 4BB) узла сингуляции. Фиг. 4CC представляет собой примерную диаграмму пневматическая архитектуры для модуля SWIIN, описанного со ссылкой на Фиг. 4A-4Z.
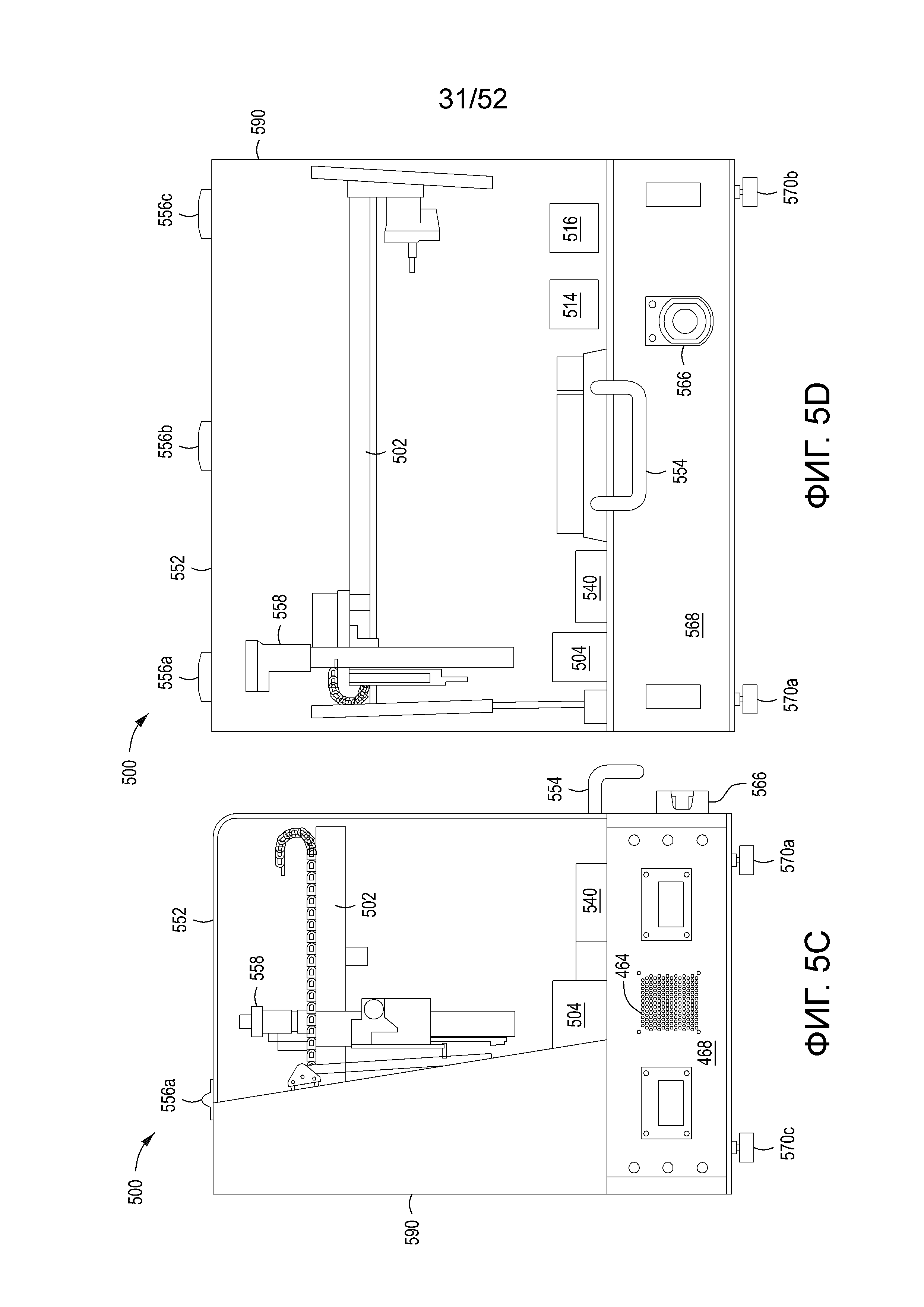
[0028] Фиг. 5A-5D изображают автономный, интегрированный, автоматизированный мультимодульный инструмент и его компоненты, включая модуль сингуляции, с помощью которого можно производить и идентифицировать отредактированные клетки.
[0029] Фиг. 6A изображает один вариант осуществления вращающегося флакона для выращивания для использования с описанным в настоящем документе модулем выращивания клеток. Фиг. 6B иллюстрирует вид в перспективе одного варианта осуществления вращающегося устройства для выращивания в корпусе модуля выращивания клеток. Фиг. 6C изображает вид в разрезе модуля выращивания клеток, показанного на Фиг. 6B. Фиг. 6D иллюстрирует модуль выращивания клеток, показанный на Фиг. 6B, соединенный с LED, детектором и компонентами регулирования температуры.
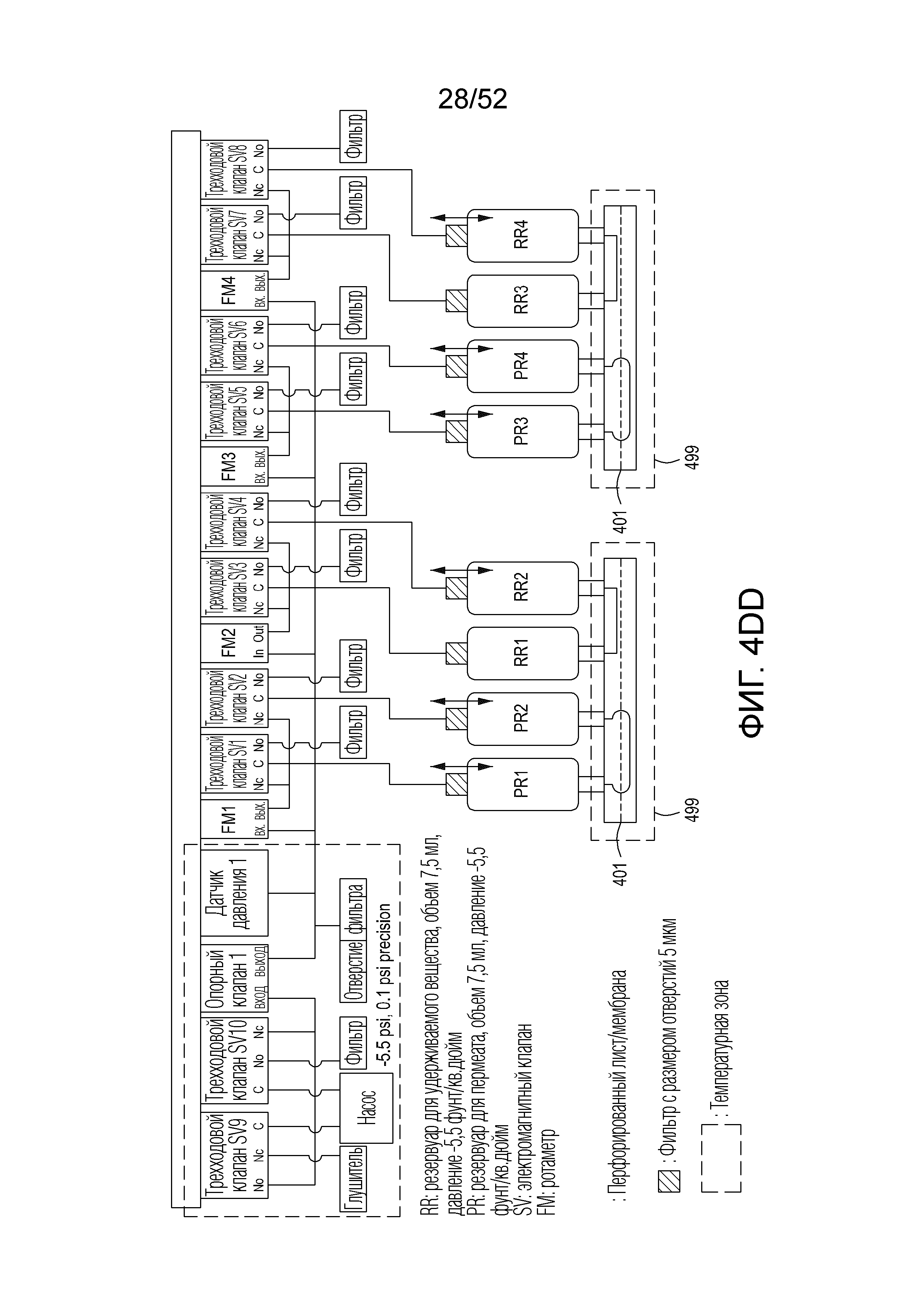
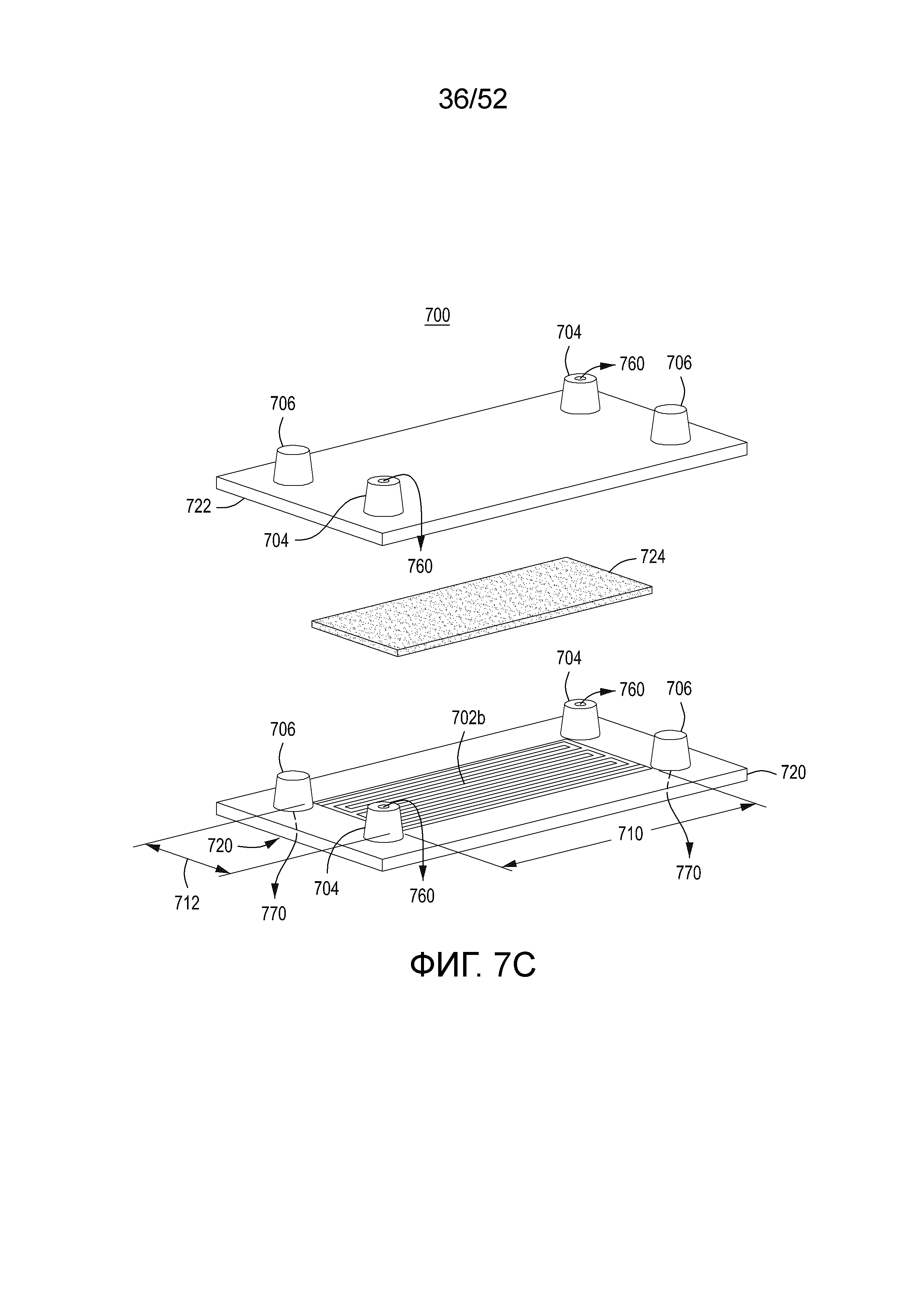
[0030] Фиг. 7A представляет собой модель процесса фильтрации с тангенциальным потоком (TFF), который используется в представленном в настоящем документе модуле TFF. Фиг. 7B изображает вид сверху нижнего элемента одного варианта осуществления примерного устройства/модуля TFF. Фиг. 7C изображает в разобранном виде верхний и нижний элементы и мембрану примерного модуля TFF. Фиг. 7D изображает в перевернутом разобранном виде верхний и нижний элементы и мембрану примерного модуля TFF. Фиг. 7E-7H изображают различные виды одного варианта осуществления модуля TFF, имеющего гидравлически связанные резервуары для удерживаемого вещества, фильтрата и обменного буфера.
[0031] Фиг. 8A и 8B представляют собой вид сверху и вид снизу в перспективе, соответственно, проточных устройств электропорации (здесь шесть таких устройств, соединенных вместе). Фиг. 8C представляет собой вид сверху одного варианта осуществления примерного проточного устройства электропорации. Фиг. 8D изображает вид сверху поперечного сечения устройства электропорации, показанного на Фиг. 8C. Фиг. 8E изображает вид сбоку на поперечное сечение нижней части устройств электропорации, показанного на Фиг. 8C и 8D.
[0032] Фиг. 9 представляет собой упрощенную блок-схему одного варианта осуществления примерного автоматизированного мультимодульного инструмента для обработки клеток, содержащего модуль сингуляции или существенной сингуляции/выращивания/редактирования и нормализации или отбора («модуль изоляции/индукции/нормализации со сплошной стенкой» или «SWIIN»).
[0033] Фиг. 10 представляет собой упрощенную блок-схему одного альтернативного варианта осуществления примерного автоматизированного мультимодульного инструмента для обработки клеток, содержащего модуль сингуляции или существенной сингуляции/выращивания/редактирования и нормализации или отбора («модуль изоляции/индукции/нормализации со сплошной стенкой» или «SWIIN»).
[0034] Фиг. 11A представляет собой карту примерного вектора-двигателя, который может использоваться в описанных в настоящем документе способах; а Фиг. 11B представляет собой карту примерного редактирующего вектора (с редактирующей кассетой), который может использоваться в описанных в настоящем документе способах.
[0035] Фиг. 12 представляет собой гистограмму, показывающую эффективность трансформации, наблюдаемую для кассет нацеливания гРНК galK под различными промоторами.
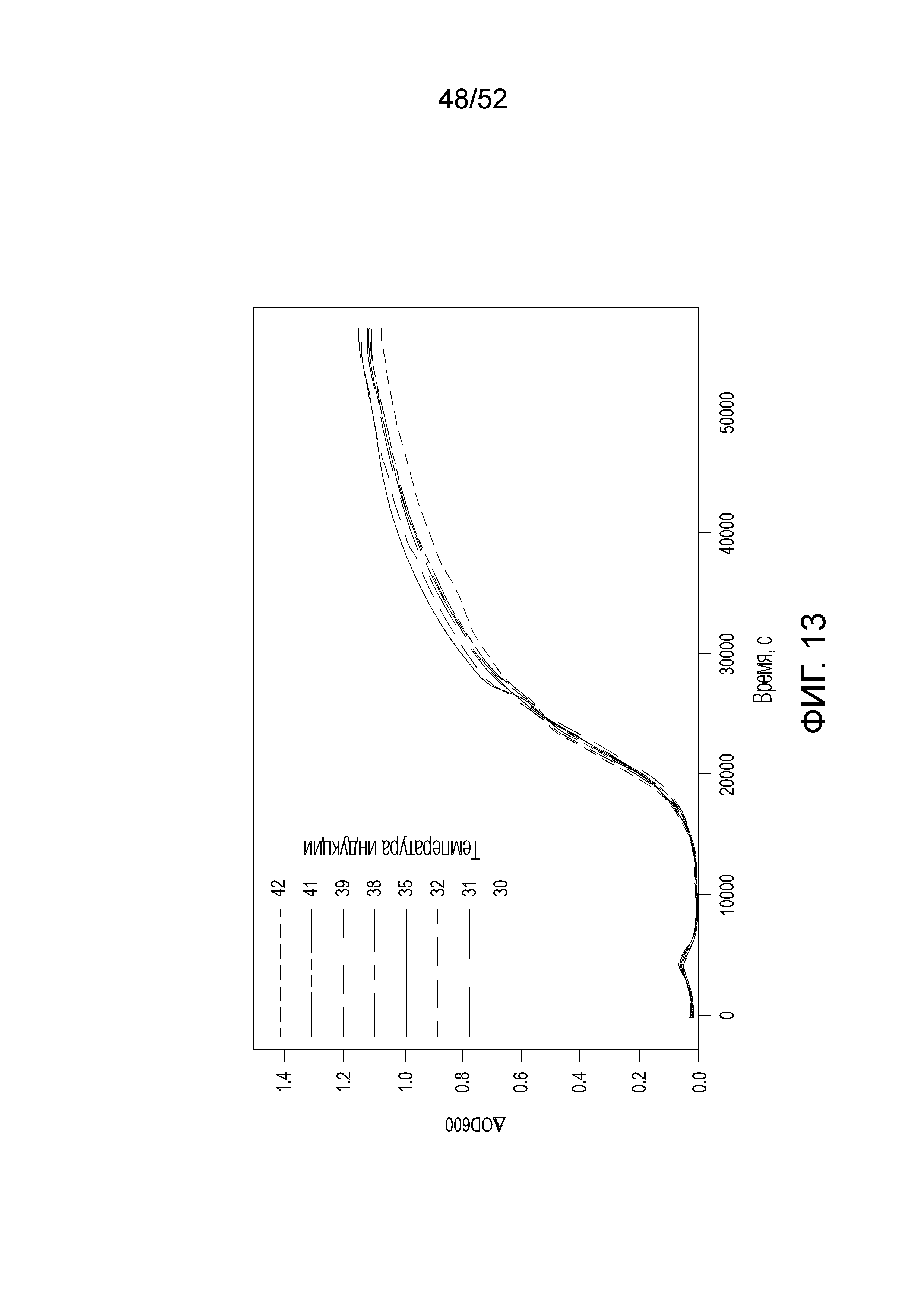
[0036] Фиг. 13 представляет собой график роста клеток в зависимости от времени, демонстрирующий, что тепловая индукция редактирования не влияет на рост или жизнеспособность клеток.
[0037] Фиг. 14 изображает результаты, демонстрирующие, что кассеты с подавленной гРНК дают высокую жизнеспособность/эффективность трансформации клеток для трех примерных нуклеаз.
[0038] Фиг. 15 иллюстрирует тепловые карты и кривые роста, показывающие OD в момент времени 6 час для неиндуцированных и индуцированных популяций клеток.
[0039] Фиг. 16 показывает результаты нормализации колонии клеток для клеток E.coli при различных условиях.
[0040] Фиг. 17A представляет собой фотографию устройства со сплошной стенкой с проницаемым дном на агар-агаре, на котором дрожжевые клетки были по существу сингулированы и выращены в клональные колонии. Фиг. 17B представляет фотографии роста колонии дрожжей в различные моменты времени.
ПОДРОБНОЕ ОПИСАНИЕ
[0041] Предполагается, что все функциональные возможности, описанные в связи с одним вариантом осуществления, применимы к дополнительным вариантам осуществления, описанным в настоящем документе, за исключением случаев, когда это явно указано или когда особенность или функция является несовместимой с этими дополнительными вариантами осуществления. Например, когда данная особенность или функция явно описывается в связи с одним вариантом осуществления, но не упоминается явно в связи с альтернативным вариантом осуществления, следует понимать, что эта особенность или функция может быть развернута, использована или осуществлена в связи с альтернативным вариантом осуществления, за исключением тех случаев, когда эта особенность или функция является несовместимой с альтернативным вариантом осуществления.
[0042] На практике описанные в настоящем документе методики могут использовать, если не указано иное, обычные методы и описания органической химии, технологии полимеров, молекулярной биологии (включая рекомбинантные методики), клеточной биологии, биохимии и технологии секвенирования, которые соответствуют квалификации специалистов в данной области техники. Такие обычные методики включают в себя матричный синтез полимеров, гибридизацию и лигирование полинуклеотидов, а также обнаружение гибридизации с использованием метки. Конкретные иллюстрации подходящих методик можно найти в приведенных в настоящем документе примерах. Однако, конечно же, также могут использоваться другие эквивалентные обычные процедуры. Такие обычные методики и описания можно найти в стандартных лабораторных руководствах, таких как Green, et al., eds., Genome Analysis:A Laboratory Manual Series (Vols. I-IV) (1999); Weiner, Gabriel, Stephens, eds., Genetic Variation: A Laboratory Manual (2007); Dieffenbach, Dveksler, eds., PCR Primer: A Laboratory Manual (2003); Bowtell and Sambrook, DNA Microarrays: A Molecular Cloning Manual (2003); Mount, Bioinformatics: Sequence and Genome Analysis (2004); Sambrook and Russell, Condensed Protocols from Molecular Cloning: A Laboratory Manual (2006); Stryer, Biochemistry (4th Ed.) W. H. Freeman, New York N. Y. (1995); Gait, «Oligonucleotide Synthesis: A Practical Approach» (1984), IRL Press, London; Nelson and Cox, Lehninger, Principles of Biochemistry 3rdEd., W. H. Freeman Pub., New York, N. Y. (2000); Berg et al., Biochemistry, 5thEd., W. H. Freeman Pub., New York, N. Y. (2002); Doyle & Griffiths, eds., Cell and Tissue Culture: Laboratory Procedures in Biotechnology, Doyle & Griffiths, eds., John Wiley & Sons (1998); G. Hadlaczky, ed. Mammalian Chromosome Engineering - Methods and Protocols, Humana Press (2011); и Lanza and Klimanskaya, eds., Essential Stem Cell Methods, Academic Press (2011), все из которых включены в настоящий документ посредством ссылки во всей их полноте для всех целей. Специфические для CRISPR методики можно найти, например, в статьях Appasani and Church, Genome Editing and Engineering From TALENs and CRISPRs to Molecular Surgery (2018); и Lindgren and Charpentier, CRISPR:Methods and Protocols (2015); обе из которых включены в настоящий документ посредством ссылки во всей их полноте для всех целей.
[0043] Следует отметить, что используемые в настоящем документе и в приложенной формуле изобретения грамматические формы единственного числа включают в себя также множественное число, если контекст ясно не указывает иное. Таким образом, например, ссылка на «клетку» относится к одной или более клеткам, а ссылка на «систему» включает в себя ссылку на эквивалентные стадии, способы и устройства, известные специалисту в данной области техники, и т.д. Кроме того, следует понимать, что такие термины, как «лево», «право», «верх», «низ», «передний», «задний», «боковой», «высота», «длина», «ширина», «верхний», «нижний», «интерьер», «экстерьер», «внутренний» и/или «внешний», которые могут использоваться в настоящем документе, просто описывают ориентиры и не обязательно ограничивают варианты осуществления настоящего изобретения какими-либо конкретными ориентациями или конфигурациями. Кроме того, такие термины, как «первый», «второй», «третий» и т.д. просто идентифицируют одно из множества частей, компонентов, стадий, операций, функций и/или ориентиров, раскрытых в настоящем документе, и аналогичным образом не обязательно ограничивают варианты осуществления настоящего изобретения какими-либо конкретными ориентациями или конфигурациями.
[0044] Кроме того, термины «приблизительно», «приблизительный», «незначительный» и аналогичные термины обычно относятся к диапазонам, которые в некоторых вариантах осуществления включают в себя идентифицированное значение в пределах 20%, 10% или предпочтительно 5%, а также любые значения между ними.
[0045]Если не определено иное, все технические и научные термины, используемые в настоящем документе, имеют то же самое значение, что и обычно понимаемое специалистами в области техники, к которой принадлежит настоящее изобретение. Все публикации, упомянутые в настоящем документе, включаются в настоящий документ посредством ссылки с целью описания и раскрытия устройств, способов и популяций клеток, которые могут использоваться в связи с настоящим изобретением.
[0046] В тех случаях, когда указан диапазон значений, подразумевается, что каждое промежуточное значение между верхним и нижним пределом этого диапазона, а также любое другое установленное или промежуточное значение в этом указанном диапазоне, охватывается настоящим изобретением. Верхние и нижние пределы этих более малых диапазонов могут быть независимо включены в более малые диапазоны, и также охватываются настоящим изобретением, с учетом любого конкретно исключенного предела в этом установленном диапазоне. Когда установленный диапазон включает в себя один или оба из пределов, диапазоны, исключающие любой или оба из этих включенных пределов, также включаются в настоящее изобретение.
[0047] В последующем описании формулируются многочисленные конкретные детали для того, чтобы обеспечить более полное понимание настоящего изобретения. Однако специалистам в данной области техники будет очевидно, что настоящее изобретение может быть осуществлено без одной или более из этих конкретных деталей. В других случаях особенности и процедуры, хорошо известные специалистам в данной области техники, не описываются, чтобы не затруднять понимание настоящего изобретения.
[0048] Использующийся в настоящем документе термин «комплементарный» относится к спариванию оснований Уотсона-Крика между нуклеотидами и, в частности, относится к нуклеотидам, которые связаны друг с другом водородными связями: с помощью остатков тимина или урацила и остатков аденина двумя водородными связями, и с помощью остатков цитозина и гуанина тремя водородными связями. Как правило, нуклеиновая кислота включает в себя нуклеотидную последовательность, описываемую как имеющую «процентную комплементарность» или «процентную гомологию» с указанной второй нуклеотидной последовательностью. Например, нуклеотидная последовательность может иметь 80%, 90% или 100% комплементарности с указанной второй нуклеотидной последовательностью, что означает, что 8 из 10, 9 из 10 или 10 из 10 нуклеотидов последовательности являются комплементарными с указанной второй нуклеотидной последовательностью. Например, нуклеотидная последовательность 3'-TCGA-5' является на 100% комплементарной с нуклеотидной последовательностью 5'-AGCT-3'; и нуклеотидная последовательность 3'-TCGA-5' является на 100% комплементарной с областью нуклеотидной последовательности 5'-TTAGCTGG-3'.
[0049] Термин «управляющие последовательности» ДНК в совокупности относится к промоторным последовательностям, сигналам полиаденилирования, последовательностям завершения транскрипции, предшествующим регулирующим доменам, источникам репликации, участкам внутренней посадки рибосомы, последовательностям ядерной локализации, энхансерам и т.п., которые в совокупности обеспечивают репликацию, транскрипцию и трансляцию кодирующей последовательности в клетке-реципиенте. Не все эти типы управляющих последовательностей должны присутствовать при условии, что выбранная кодирующая последовательность способна реплицироваться, транскрибироваться и - для некоторых компонентов - транслироваться в соответствующей клетке-хозяине.
[0050] Используемый в настоящем документе термин «донорная ДНК» или «донорная нуклеиновая кислота» относится к нуклеиновой кислоте, которая предназначена для введения модификации последовательности ДНК (вставки, удаления, замены) в локус посредством гомологичной рекомбинации с использованием направляемых нуклеиновой кислотой нуклеаз. Для гомологически направленного репаративного синтеза донорная ДНК должна иметь достаточную гомологию с областями, расположенными по бокам «вырезаемого участка» или редактируемого участка в геномной целевой последовательности. Длина гомологического плеча (плеч) будет зависеть, например, от типа и размера выполняемой модификации. Например, донорная ДНК будет иметь по меньшей мере одну область гомологической последовательности (например, одно гомологическое плечо) для целевого геномного локуса. Во многих случаях и предпочтительно донорная ДНК будет иметь две области гомологической последовательности (например, два гомологических плеча) для целевого геномного локуса. Предпочтительно область «вставки» или область «модификации последовательности ДНК» - модификации нуклеиновой кислоты, которую желательно ввести в целевой геномный локус в клетке - будет находиться между двумя областями гомологии. Модификация последовательности ДНК может изменять одно или более оснований целевой геномной последовательности ДНК в одном конкретном участке или в нескольких конкретных участках. Изменение может включать в себя изменение 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 50, 75, 100, 150, 200, 300, 400 или 500 или более пар азотистых оснований целевой последовательности. Удаление или вставка могут представлять собой удаление или вставку 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 50, 75, 100, 150, 200, 300, 400 или 500 или более пар азотистых оснований целевой последовательности. Донорная ДНК опционально дополнительно включает в себя изменение целевой последовательности, например, мутацию PAM, которая предотвращает связывание нуклеазы с PAM или спейсером в целевой последовательности после того, как произошло редактирование.
[0051] Используемый в настоящем документе термин «обогащение» относится к обогащению отредактированных клеток с помощью сингуляции или существенной сингуляции клеток, начального выращивания клеток в колонии клеток, индуцирования редактирования и выращивания колоний клеток в колонии предельного размера (например, насыщение или нормализация роста колонии). Используемый в настоящем документе термин «отбор» или «выбор отредактированных клеток» относится к процессу использования комбинации сингуляции или существенной сингуляции, начального выращивания клеток в колонии, индуцирования редактирования, а затем использования роста клеток - измеряемого размером колонии, концентрацией метаболитов или продуктов жизнедеятельности, или другими характеристиками, которые коррелируют со скоростью роста клеток - для выбора клеток, которые были отредактированы, на основе задержки роста, вызванной редактированием.
[0052] Термины «направляющая нуклеиновая кислота» или «направляющая РНК» или «гРНК» относятся к полинуклеотиду, содержащему 1) направляющую последовательность, способную гибридизироваться с целевым геномным локусом, и 2) каркасную последовательность, способную взаимодействовать или образовывать комплекс с направляемой нуклеиновой кислотой нуклеазой.
[0053] Термины «гомология» или «идентичность» или «подобие» относятся к сходству последовательностей между двумя пептидами или, более часто в контексте настоящего изобретения, между двумя молекулами нуклеиновой кислоты. Термин «гомологическая область» или «гомологическое плечо» относится к области на донорной ДНК, имеющей определенную степень гомологии с целевой геномной последовательностью ДНК. Гомология может быть определена путем сравнения положения в каждой последовательности, которое может быть выровнено для целей сравнения. Когда некоторое положение в сравниваемой последовательности занято тем же самым основанием или аминокислотой, тогда молекулы являются гомологичными в этом положении. Степень гомологии между последовательностями является функцией количества соответствующих или гомологичных положений, разделяемых этими последовательностями.
[0054] Термин «функционально связанный» относится к такому расположению элементов, в котором описанные компоненты выполнены с возможностью выполнять свою обычную функцию. Таким образом, управляющие последовательности, функционально связанные с кодирующей последовательностью, способны к осуществлению транскрипции, и в некоторых случаях трансляции кодирующей последовательности. Управляющие последовательности не обязательно должны быть смежными с кодирующей последовательностью, если они способны направлять экспрессию кодирующей последовательности. Таким образом, например, промежуточные нетранслируемые, но транскрибируемые последовательности могут присутствовать между последовательностью промотора и кодирующей последовательностью, и последовательность промотора все еще может считаться «функционально связанной» с кодирующей последовательностью. Фактически такие последовательности не обязательно должны находиться на одной и той же непрерывной молекуле ДНК (т.е. хромосоме) и могут все еще иметь взаимодействия, приводящие к измененной регуляции.
[0055] «Промотор» или «промоторная последовательность» представляет собой регуляторную область ДНК, способную связывать РНК-полимеразу и инициировать транскрипцию кодирующей полинуклеотид или полипептид последовательности, такой как матричная РНК, рибосомная РНК, малая ядерная или ядрышковая РНК, направляющая РНК или любой вид РНК, транскрибируемый любым классом любой РНК-полимеразы I, II или III. Промоторы могут быть конститутивными или индуцибeльными. В способах, описанных в настоящем документе, промоторы, управляющие транскрипцией гРНК, являются индуцибeльными.
[0056] Используемый в настоящем документе термин «селектируемый маркер» относится к введенному в клетку гену, который придает признак, подходящий для искусственного отбора. Селектируемые маркеры общего применения хорошо известны специалистам в данной области техники. Могут использоваться селектируемые лекарственные маркеры, такие как ампициллин/карбенициллин, канамицин, хлорамфеникол, эритромицин, тетрациклин, гентамицин, блеомицин, стрептомицин, пуромицин, гигромицин, бластицидин и G418. В других вариантах осуществления селектируемые маркеры включают в себя, не ограничиваясь этим, рецептор фактора роста нервов человека (обнаруживаемый с помощью MAb, например, как описано в патенте США № 6365373); усеченный рецептор фактора роста человека (обнаруживаемый с помощью MAb); мутантую дигидрофолатредуктазу человека (DHFR; доступен флуоресцентный субстрат MTX); секретируемую щелочную фосфатазу (SEAP; доступен флуоресцентный субстрат); тимидилатсинтазу человека (TS; придает устойчивость к противораковому агенту фтордезоксиуридину); глутатион S-трансферазу альфа человека (GSTA1; конъюгирует глутатион с селективным алкилирующим агентом стволовых клеток бусульфаном; хемопротективный селектируемый маркер в клетках CD34+); поверхностный антиген CD24 в гемопоэтических стволовых клетках; рамнозу; человеческий ген CAD, придающий устойчивость к N-фосфонацетил-L-аспартату (PALA); человеческую мультирезистентность-1 (MDR-1; поверхностный белок Р-гликопротеина, выбираемый по повышенной устойчивости к лекарственным средствам или обогащенный FACS); человеческий CD25 (IL-2α; обнаруживаемый с помощью MAb-FITC); метилгуанин-ДНК-метилтрансферазу (MGMT; выбирается кармустином); и цитидиндезаминазу (CD; выбирается с помощью Ara-C). Используемый в настоящем документе термин «селективная среда» относится к среде для роста клеток, к которой было добавлено химическое соединение или биологический фрагмент, который осуществляет селекцию в пользу или против селектируемых маркеров.
[0057] Используемые в настоящем документе термины «сингуляция» или «сингулировать» означают разделение индивидуальных клеток так, чтобы каждая клетка (а также колонии, сформированные из каждой клетки), была отдельной от других клеток; например, единственная клетка в единственной микролунке, или 100 единственных клеток, каждая в своей собственной микролунке. «Сингуляция» или «сингулированные клетки» в одном варианте осуществления получаются в результате распределения Пуассона в упорядоченных клетках. Термины «существенно сингулированные», «в значительной степени сингулированные» и «существенная сингуляция» означают, что клетки в значительной степени отделены друг от друга небольшими группами или партиями. А именно, когда в микролунку помещается 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или вплоть до 50, но предпочтительно 10 или менее клеток. «Существенно сингулированные» или «в значительной степени сингулированные» клетки в одном варианте осуществления являются результатом «существенного распределения Пуассона» в упорядоченных клетках. С более сложными библиотеками правок - или с библиотеками, которые могут содержать летальные правки или правки с сильно различающимися эффектами приспособляемости - предпочтительно, чтобы клетки сингулировались посредством распределения Пуассона.
[0058] Термины «целевая геномная последовательность ДНК», «целевая последовательность», или «геномный целевой локус» относится к любому локусу in vitro или in vivo, или в нуклеиновой кислоте (например, геноме) клетки или популяции клеток, в котором желательно изменение по меньшей мере одного нуклеотида с использованием системы редактирования на основе направляемой нуклеиновой кислотой нуклеазы. Целевая последовательность может быть геномным локусом или внехромосомным локусом.
[0059] «Вектор» представляет собой любую из множества нуклеиновых кислот, которые содержат желаемую последовательность или последовательности, которые должны быть доставлены и/или экспрессированы в клетке. Векторы обычно состоят из ДНК, хотя также доступны РНК-векторы. Векторы включают в себя, не ограничиваясь этим, плазмиды, фосмиды, фагмиды, вирусные геномы, YAC, BAC, синтетические хромосомы млекопитающих и т.п. Используемая в настоящем документе фраза «вектор-двигатель» содержит кодирующую последовательность для нуклеазы (опционально под управлением индуцибeльного промотора) для использования в системах и способах на основе направляемой нуклеиновой кислотой нуклеазы по настоящему изобретению. Вектор-двигатель может также содержать в бактериальной системе рекомбинационную систему λ Red или ее эквивалент, а также селектируемый маркер. Используемый в настоящем документе «редактирующий вектор» содержит донорную нуклеиновую кислоту, включающую изменение целевой последовательности, которое предотвращает связывание нуклеазы с PAM или спейсером в целевой последовательности после редактирования, а также кодирующую последовательность для гРНК под управлением индуцибeльного промотора. Редактирующий вектор может также содержать селектируемый маркер и/или штриховой код. В некоторых вариантах осуществления вектор-двигатель и редактирующий вектор могут быть объединены; то есть содержимое вектора-двигателя может быть найдено на редактирующем векторе.
Индуцибeльное редактирование в геномных системах на основе направляемой нуклеиновой кислотой нуклеазы в целом
[0060] Настоящее изобретение предлагает инструменты, модули и способы для редактирования генома на основе направляемой нуклеиновой кислотой нуклеазы, которые обеспечивают 1) улучшенную наблюдаемую эффективность редактирования способов редактирования на основе направляемой нуклеиновой кислотой нуклеазы, и 2) улучшение скрининга и обнаружения клеток, геномы которых были должным образом отредактированы, включая методики скрининга с высокой производительностью. В текущих протоколах, использующих нуклеазные системы, конститутивно экспрессируемые нуклеазные компоненты обычно используются для выполнения высокоэффективного редактирования. Однако в объединенных или мультиплексных форматах, конститутивная экспрессия редактирующих компонентов может привести к селективному обогащению клеток, которые не редактируются благодаря отсутствию разрывов двойной цепочки ДНК, которые происходят во время редактирования. Кроме того, конститутивно экспрессируемые компоненты направляемой нуклеиновой кислотой нуклеазы (например, нуклеаза и направляющая нуклеиновая кислота) немедленно подвергают свежетрансформированные физиологически хрупкие клетки редактированию, что приводит к снижению их жизнеспособности. В настоящем документе представлены инструменты для жестко регулируемой экспрессии компонентов системы редактирования на основе направляемой нуклеиновой кислотой нуклеазы (включая жесткую регуляцию транскрипции направляющей нуклеиновой кислоты и, опционально и предпочтительно, нуклеазы (или нуклеазы и, опционально и предпочтительно, направляющей нуклеиновой кислоты)), позволяющие разделить процессы трансформации и редактирования. Кроме того, описанные в настоящем документе способы используют преимущества сингуляции (разделения клеток и выращивания их в клональные колонии) и либо нормализации клеточных колоний, либо отбора медленно растущих колоний. Сингуляция или существенная сингуляция, начальное выращивание, сопровождаемое индукцией редактирования и нормализацией, преодолевают предвзятость роста неотредактированных клеток, а заменяющий отбор для нормализации позволяет осуществлять прямой выбор отредактированных клеток. Эти инструменты, модули и способы могут быть применены ко всем типам клеток, включая клетки простейших, прокариотов и эукариотов (например дрожжей, грибов, растений и животных).
[0061] Инструменты, модули и способы, описанные в настоящем документе, используют редактирующие кассеты, содержащие последовательность направляющей РНК (гРНК), соединенную ковалентной связью с последовательностью донорной ДНК, где гРНК находится под управлением индуцибeльного промотора (например, редактирующие кассеты являются кассетами CREATE; см. патенты США №№ 9/982278, выданный 29 мая 2019 г., и 10/240167, выданный 26 марта 2019 г.; 10/266849, выданный 23 апреля 2019 г.; а также американские патентные заявки №№ 15/948785, поданная 09 апреля 2018 г.; 16/275439, поданная 14 февраля 2019 г.; и 16/275465, поданная 14 февраля 2019 г., все из которых включены в настоящий документ посредством ссылки во всей их полноте). Эти редактирующие кассеты обеспечивают увеличенную эффективность трансформации и управления над выбором времени и продолжительностью процесса редактирования. Раскрытые способы позволяют трансформировать клетки, существенно сингулировать и выращивать для нескольких удвоений, после чего в клетках индуцируется редактирование. Эта комбинация процесса эффективно сводит на нет влияние неотредактированных клеток на популяцию клеток. Комбинация существенной сингуляции клеток, затем начального роста с последующей индукцией транскрипции гРНК (и/или нуклеазы) и нормализации колоний клеток или отбора клеток приводит к 2-250x, 10-225x, 25-200x, 40-175x, 50-150x, 60-100x, или 50-100x усилению идентификации отредактированных клеток по сравнению со способами предшествующего уровня техники и позволяет генерировать сгруппированные или объединенные отредактированные клетки, содержащие библиотеки клеток с отредактированными геномами. Кроме того, эти способы могут быть использованы для создания систем итеративного редактирования для создания комбинаторных библиотек клеток с двумя или многими изменениями в каждом клеточном геноме. Индуцибeльные конструкции гРНК (и/или индуцибeльные конструкции нуклеазы) и способы использования «импульсного» воздействия на клетки активных компонентов редактирования 1) позволяют группировать клетки (например, в значительной степени сингулированные) до инициирования процедуры редактирования, 2) уменьшать нецелевую активность, 3) обеспечивать идентификацию редких изменений клеток, и 4) обогащать отредактированные клетки или позволять приложениям для высокопроизводительного скрининга идентифицировать активность редактирования с использованием роста клеток в качестве индикатора редактирования, например, измеряя оптическую плотность, размер колоний или побочные продукты метаболизма или другие характеристики, обогащая тем самым отредактированную популяцию клеток.
[0062] Инструменты, композиции и способы, описанные в настоящем документе, улучшают редактирующие системы CRISPR, в которых направляемые нуклеиновой кислотой нуклеазы (например, направляемые РНК нуклеазы) используются для редактирования конкретных целевых областей в геноме организма. Направляемая нуклеиновой кислотой нуклеаза, комплексированная с подходящей синтетической направляющей нуклеиновой кислотой в клетке, может разрезать геном клетки в желаемом положении. Направляющая нуклеиновая кислота помогает направляемой нуклеиновой кислотой нуклеазе распознать и разрезать ДНК в конкретной целевой последовательности. Путем манипулирования нуклеотидной последовательностью направляющей нуклеиновой кислоты направляемая нуклеиновой кислотой нуклеаза может быть запрограммирована для нацеливания на любую последовательность ДНК для расщепления до тех пор, пока поблизости находится соответствующий соседний мотив протоспейсера (PAM). В некоторых аспектах система редактирования на основе направляемой нуклеиновой кислотой нуклеазы может использовать две отдельных молекулы направляющей нуклеиновой кислоты, которые объединяются для того, чтобы функционировать как направляющая нуклеиновая кислота, например, РНК CRISPR (crRNA) и трансактивизирующая РНК CRISPR (tracrRNA). В других аспектах направляющая нуклеиновая кислота может быть единственной направляющей нуклеиновой кислотой, которая включает в себя последовательности как crRNA, так и tracrRNA, или единственной направляющей нуклеиновой кислотой, которая не требует tracrRNA. В описанных в настоящем документе композициях и способах, если две отдельных молекулы РНК объединяются для того, чтобы функционировать как направляющая нуклеиновая кислота, по меньшей мере один из компонентов направляющей нуклеиновой кислоты находится под управлением индуцибeльного промотора. Если используется единственная направляющая нуклеиновая кислота, эта единственная направляющая нуклеиновая кислота находится под управлением индуцибeльного промотора.
[0063] Как правило, направляющая нуклеиновая кислота (например, гРНК) комплексируется с совместимой направляемой нуклеиновой кислотой нуклеазой, а затем может гибридизироваться с целевой последовательностью, направляя тем самым нуклеазу к целевой последовательности. Направляющая нуклеиновая кислота может представлять собой ДНК или РНК; альтернативно направляющая нуклеиновая кислота может содержать как ДНК, так и РНК. В некоторых вариантах осуществления направляющая нуклеиновая кислота может содержать модифицированные или не встречающиеся в природе нуклеотиды. В тех случаях, когда направляющая нуклеиновая кислота содержит РНК, гРНК кодируется последовательностью ДНК на молекуле полинуклеотида, такой как плазмида, линейный конструкт, или находится внутри редактирующей кассеты и предпочтительно находится под управлением индуцибeльного промотора.
[0064] Направляющая нуклеиновая кислота содержит направляющую последовательность, представляющую собой полинуклеотидную последовательность, имеющую достаточную комплементарность с целевой последовательностью для гибридизации с целевой последовательностью и прямого последовательного связывания комплексированной нуклеазы, направляемой нуклеиновой кислотой, с целевой последовательностью. Степень комплементарности между направляющей последовательностью и соответствующей целевой последовательностью при оптимальном выравнивании с использованием подходящего алгоритма выравнивания, составляет приблизительно или больше чем приблизительно 50%, 60%, 75%, 80%, 85%, 90%, 95%, 97,5%, 99% или больше. Оптимальное выравнивание может быть определено с использованием любого подходящего алгоритма для выравнивания последовательностей. В некоторых вариантах осуществления направляющая последовательность (часть направляющей нуклеиновой кислоты, которая гибридизируется с целевой последовательностью) имеет приблизительно или больше чем приблизительно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 75 или более нуклеотидов в длину. В некоторых вариантах осуществления направляющая последовательность имеет меньше чем приблизительно 75, 50, 45, 40, 35, 30, 25, 20 нуклеотидов в длину. Предпочтительно направляющая последовательность имеет 10-30 или 15-20 нуклеотидов в длину, или 15, 16, 17, 18, 19 или 20 нуклеотидов в длину.
[0065] В настоящих способах и композициях направляющая нуклеиновая кислота обеспечивается как последовательность, экспрессируемая из плазмиды или вектора, и содержит как направляющую последовательность, так и каркасную последовательность в виде единого транскрипта под управлением индуцибeльного промотора. Альтернативно направляющие нуклеиновые кислоты могут быть транскрибированы из двух отдельных последовательностей, по меньшей мере одна из которых находится под управлением индуцибeльного промотора. Направляющая нуклеиновая кислота может быть сконструирована для нацеливания на желаемую целевую последовательность ДНК путем изменения направляющей последовательности так, чтобы направляющая последовательность была комплементарной целевой последовательности ДНК, обеспечивая тем самым гибридизацию между направляющей последовательностью и целевой последовательностью ДНК. В большинстве случаев для того, чтобы произвести редактирование в целевой последовательности ДНК, комплекс гРНК/нуклеаза связывается с целевой последовательностью, как определяется направляющей РНК, и нуклеаза распознает последовательность смежного мотива протоспейсера (PAM), смежную с целевой последовательностью. Целевая последовательность может быть любым полинуклеотидом (ДНК или РНК), эндогенным или экзогенным по отношению к прокариотической или эукариотической клетке, или in vitro. Например, целевая последовательность может быть полинуклеотидом, находящимся в ядре эукариотической клетки. Целевая последовательность может быть последовательностью, кодирующей генный продукт (например, белок) и/или некодирующей последовательностью (например, регуляторным полинуклеотидом, интроном, PAM или «мусорной» ДНК).
[0066] Направляющая нуклеиновая кислота может быть частью редактирующей кассеты, которая кодирует донорную нуклеиновую кислоту; то есть, редактирующая кассета может быть кассетой CREATE (см., например, патенты США №№ 9/982278, выданный 29 мая 2019 г., и 10/240167, выданный 26 марта 2019 г.; 10/266849, выданный 23 апреля 2019 г.; а также американские патентные заявки №№ 15/948785, поданная 09 апреля 2018 г.; 16/275439, поданная 14 февраля 2019 г.; и 16/275465, поданная 14 февраля 2019 г., все из которых включены в настоящий документ посредством ссылки во всей их полноте). Направляющая нуклеиновая кислота и донорная нуклеиновая кислота могут быть и обычно находятся под управлением единственного (в этом случае предпочтительно индуцибeльного) промотора. Опять же, следует отметить, что, либо направляющая нуклеиновая кислота, либо нуклеаза должны находиться под управлением индуцибeльного промотора, и в некоторых вариантах осуществления и предпочтительно как направляющая нуклеиновая кислота, так и нуклеаза находятся под управлением индуцибeльного промотора. На самом деле важно, чтобы индуцибeльный промотор (промоторы), управляющий транскрипцией направляющей нуклеиновой кислоты и/или (наиболее предпочтительно и) нуклеазы, жестко контролировался. В частности, важно, чтобы активность нуклеазы контролировалась так, чтобы избежать значительного отклонения и потери эффективности до сингуляции и выращивания сингулированных клеток. Таким образом, степень, в которой аппарат редактирования способен достичь статуса выключения, является важной независимо от процесса сингуляции или существенной сингуляции. Альтернативно направляющая нуклеиновая кислота может не быть частью редактирующей кассеты, и вместо этого может кодироваться на цепи вектора-двигателя или редактирующего вектора. Например, кодирование последовательности для направляющей нуклеиновой кислоты может быть сначала собрано или вставлено в цепь вектора, с последующей вставкой донорной нуклеиновой кислоты. В других случаях донорная нуклеиновая кислота может быть сначала вставлена или собрана в векторную цепь, с последующей вставкой кодирования последовательности для направляющей нуклеиновой кислоты. В других случаях кодирование последовательности направляющей нуклеиновой кислоты и донорной нуклеиновой кислоты (вставленной, например, в редактирующую кассету) одновременно, но раздельно, вставляются или собираются в вектор. В других вариантах осуществления (и предпочтительно) кодирование последовательности направляющей нуклеиновой кислоты и кодирование последовательности донорной нуклеиновой кислоты оба включаются в редактирующую кассету.
[0067] Целевая последовательность связывается с PAM, которая является короткой нуклеотидной последовательностью, распознаваемой комплексом гРНК/нуклеаза. Точная последовательность PAM и требования длины для различных направляемых нуклеиновой кислотой нуклеаз варьируются; однако PAM обычно представляют собой последовательности из 2-7 пар азотистых оснований, смежные или находящиеся недалеко от целевой последовательности, и, в зависимости от нуклеазы, могут быть 5' или 3' к целевой последовательности. Разработка PAM-взаимодействующего домена направляемой нуклеиновой кислотой нуклеазы может позволить изменять специфичность PAM, улучшать точность распознавания целевого участка, уменьшать точность распознавания целевого участка и увеличивать универсальность направляемой нуклеиновой кислотой нуклеазы. В некоторых вариантах осуществления редактирование генома целевой последовательности как вводит желаемое изменение ДНК в целевую последовательность, например, геномную ДНК клетки, так и удаляет, видоизменяет или делает неактивной область прото-спейсера (PAM) в целевой последовательности; то есть, донорная ДНК часто включает в себя изменение целевой последовательности, которое предотвращает связывание нуклеазы с PAM в целевой последовательности после того, как произошло редактирование. Дезактивация PAM в целевой последовательности предотвращает дополнительное редактирование клеточного генома в этой целевой последовательности, например, при последующем воздействии направляемой нуклеиновой кислотой нуклеазой, комплексированной с синтетической направляющей нуклеиновой кислотой, в более поздних циклах редактирования. Таким образом, клетки, имеющие желаемое изменение целевой последовательности и измененную PAM, могут быть выбраны с использованием направляемой нуклеиновой кислотой нуклеазы, комплексированной с синтетической направляющей нуклеиновой кислотой, комплементарной к целевой последовательности. Клетки, которые не подверглись первому редактированию, будут разрезаны, что приведет к разрыву двухцепочечной ДНК, и таким образом больше не будут жизнеспособными. Клетки, содержащие желаемое изменение целевой последовательности и измененную PAM, не будет разрезаны, поскольку эти отредактированные клетки больше не содержат необходимый участок PAM, и продолжат расти и распространяться.
[0068] Диапазон целевых последовательностей, которые могут распознавать направляемые нуклеиновой кислотой нуклеазы, ограничивается необходимостью в расположении конкретной PAM около желаемой целевой последовательности. В результате часто может быть трудным нацеливать изменения с такой точностью, которая необходима для редактирования генома. Было найдено, что нуклеазы могут очень хорошо распознавать некоторые PAM (например, канонические PAM), а другие PAM - менее хорошо или плохо (например, неканонические PAM). Поскольку способы, раскрытые в настоящем документе, позволяют идентифицировать отредактированные клетки на большом фоне неотредактированных клеток, эти способы позволяют идентифицировать отредактированные клетки в тех случаях, когда PAM является неоптимальной; то есть способы идентификации отредактированных клеток в настоящем документе позволяют идентифицировать отредактированные клетки, даже если эффективность редактирования является очень низкой. Кроме того, настоящие способы расширяют область охвата целевых последовательностей, которые могут быть отредактированы, поскольку изменения более легко идентифицируются, включая клетки, в которых изменения генома связаны с менее функциональными PAM.
[0069] Что касается нуклеазного компонента системы редактирования на основе направляемой нуклеиновой кислотой нуклеазы, полинуклеотидная последовательность, кодирующая направляемую нуклеиновой кислотой нуклеазу, может быть кодонно оптимизирована для экспрессии в конкретных клетках, таких как простейшие, прокариотические или эукариотические клетки. Эукариотические клетки могут быть клетками дрожжей, грибов, морских водорослей, растений, животных, или клетками человека. Эукариотические клетки могут быть клетками или производными от них конкретного организма, такого как млекопитающее, включая, но не ограничиваясь этим, человека, мышь, крысу, кролика, собаку или млекопитающее, не являющееся человеком, включая приматов, не являющихся человеком. Выбор используемой направляемой нуклеиновой кислотой нуклеазы зависит от многих факторов, таких как тип редактирования, который необходимо произвести в целевой последовательности, и находится ли подходящая PAM близко к желаемой целевой последовательности. Нуклеазы, используемые в описанных в настоящем документе способах, включают в себя, не ограничиваясь этим, Cas 9, Cas 12/CpfI, MAD2 или MAD7, или другие MADзимы. Как и в случае с направляющей нуклеиновой кислотой, нуклеаза может кодироваться последовательностью ДНК на векторе (например, векторе-двигателе) и находиться под управлением конститутивного или, предпочтительно, индуцибeльного промотора. Опять же, по меньшей мере одна и предпочтительно обе из нуклеазы и направляющей нуклеиновой кислоты находятся под управлением индуцибeльного промотора. В некоторых вариантах осуществления последовательность, кодирующая нуклеазу, находится под управлением индуцибeльного промотора, и индуцибeльный промотор может быть отдельным, но тем же самым, что и индуцибeльный промотор, управляющий транскрипцией направляющей нуклеиновой кислоты; то есть отдельный индуцибeльный промотор управляет транскрипцией нуклеазы и последовательностей направляющей нуклеиновой кислоты, но два индуцибeльных промотора могут иметь один и тот же тип (например, оба могут быть промоторами pL). Альтернативно индуцибeльный промотор, управляющий экспрессией нуклеазы, может отличаться от индуцибeльного промотора, управляющего транскрипцией направляющей нуклеиновой кислоты; то есть, например, нуклеаза может находиться под управлением индуцибeльного промотора pBAD, а направляющая нуклеиновая кислота может находиться под управлением индуцибeльного промотора pL. Опять же следует отметить, что важно, чтобы индуцибeльный промотор (промоторы), управляющий транскрипцией направляющей нуклеиновой кислоты и нуклеазы, жестко контролировался. В частности важно, чтобы активность нуклеазы контролировалась так, чтобы избежать значительного отклонения и потери эффективности до сингуляции и процесса выращивания сингулированных клеток. Таким образом, степень, в которой аппарат редактирования способен достичь статуса выключения, является важной независимо от процесса сингуляции или существенной сингуляции.
[0070] Другим компонентом системы на основе направляемой нуклеиновой кислотой нуклеазы является донорная нуклеиновая кислота. В некоторых вариантах осуществления донорная нуклеиновая кислота находится на том же самом полинуклеотиде (например, векторе или редактирующей кассете (CREATE)), что и направляющая нуклеиновая кислота. Донорная нуклеиновая кислота предназначена для использования в качестве матрицы для гомологичной рекомбинации с целевой последовательностью, разрезанной или расщепленной нуклеазой, направляемой нуклеиновой кислотой, в качестве части комплекса гРНК/нуклеаза. Полинуклеотид донорной нуклеиновой кислоты может иметь любую подходящую длину, такую как приблизительно или больше чем приблизительно 30, 35, 40, 45, 50, 75, 100, 150, 200, 500, 1000, 2500, 5000 нуклеотидов или больше. В некоторых предпочтительных аспектах донорная нуклеиновая кислота может обеспечиваться как олигонуклеотид из 40-300 нуклеотидов, более предпочтительно из 50-250 нуклеотидов. Донорная нуклеиновая кислота содержит область, которая является комплементарной к некоторой части целевой последовательности (например, гомологичному плечу). При оптимальном выравнивании донорная нуклеиновая кислота перекрывается с (становится комплементарной к) целевой последовательностью, например, приблизительно на 10, 15, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90 или более нуклеотидов. Во многих вариантах осуществления донорная нуклеиновая кислота содержит два гомологичных плеча (области, комплементарные к целевой последовательности), расположенных по бокам мутации или разности между донорной нуклеиновой кислотой и целевой матрицей. Донорная нуклеиновая кислота содержит по меньшей мере одну мутацию или изменение по сравнению с целевой последовательностью, такую как вставка, удаление, модификация или любая их комбинация, по сравнению с целевой последовательностью.
[0071] Часто донорная нуклеиновая кислота обеспечивается как редактирующая кассета, которая вставляется в цепь вектора, которая может содержать промотор, управляющий транскрипцией гРНК, и кодирующую последовательность гРНК, или цепь вектора может содержать промотор, управляющий транскрипцией гРНК, но не саму гРНК. Кроме того, может быть более одной, например, две, три, четыре или более кассет направляющей нуклеиновой кислоты/донорной нуклеиновой кислоты, вставленных в вектор-двигатель, где направляющие нуклеиновые кислоты находятся под управлением отдельных различных промоторов, отдельных одинаковых промоторов, или где все пары направляющая нуклеиновая кислота/донорная нуклеиновая кислота находятся под управлением единственного промотора. (См., например, патентный документ US № 16/275465, поданный 14 февраля 2019 г., посвященный множественным кассетам CREATE). Промотор, управляющий транскрипцией гРНК и донорной нуклеиновой кислоты (или управляющий больше чем одной парой гРНК/донорная нуклеиновая кислота), предпочтительно является индуцибeльным промотором, и промотор, управляющий транскрипцией нуклеазы, опционально также является индуцибeльным промотором. Таким образом, по меньшей мере одна - и предпочтительно обе - из направляющей нуклеиновой кислоты (гРНК) и нуклеазы находится под управлением индуцибeльного промотора.
[0072] Индуцибeльное редактирование является выгодным тем, что существенно или в значительной степени сингулированные клетки могут быть выращены за несколько или много удвоений клеток, прежде чем будет инициировано редактирование, что увеличивает вероятность того, что клетки с изменениями выживут, поскольку разрезы двойной спирали, вызванные активным редактированием, являются в значительной степени токсичными для клеток. Эта токсичность приводит как к некрозу клеток в отредактированных колониях, так и к задержке роста отредактированных клеток, которые выжили, но должны ремонтироваться и восстанавливаться после редактирования. Однако как только отредактированные клетки получат шанс восстановиться, размер колоний отредактированных клеток в конечном итоге сравняется с размером колоний неотредактированных клеток (например, процесс «нормализации» или выращивания колоний до «конечного размера»; см., например, Фиг. 1B, описываемую ниже).
[0073] В дополнение к донорной нуклеиновой кислоте, редактирующая кассета может содержать один или более участков праймера. Участки праймера могут использоваться для усиления редактирующей кассеты путем использования олигонуклеотидных праймеров; например, если участки праймера располагаются по бокам одного или более других компонентов редактирующей кассеты.
[0074] Кроме того, как было описано выше, донорная нуклеиновая кислота может содержать - в дополнение к по меньшей мере одной мутации относительно целевой последовательности - одно или более изменений последовательности PAM, которые видоизменяют, удаляют или делают неактивным участок PAM в целевой последовательности. Изменение последовательности PAM в целевой последовательности делает участок PAM «устойчивым» к направляемой нуклеиновой кислотой нуклеазе, и предохраняет целевую последовательность от дальнейшего редактирования в последующих циклах редактирования, если используется та же самая нуклеаза.
[0075] Редактирующая кассета может также содержать штриховой код. Штриховой код является уникальной последовательностью ДНК, которая соответствует последовательности донорной ДНК, так что штриховой код может идентифицировать изменение, сделанное в соответствующей целевой последовательности. Штриховой код может содержать больше четырех нуклеотидов. В некоторых вариантах осуществления редактирующие кассеты содержат набор донорных нуклеиновых кислот, представляющий, например, генные или геномные библиотеки донорных нуклеиновых кислот. Библиотека редактирующих кассет клонируется в цепи вектора, где, например, каждый различный дизайн донорной нуклеиновой кислоты связан с различным штриховым кодом, или, альтернативно, каждая различная молекула кассеты связана с различным штриховым кодом.
[0076] Кроме того, в некоторых вариантах осуществления вектор экспрессии или компоненты кодирования кассеты системы на основе направляемой нуклеиновой кислотой нуклеазы дополнительно кодируют направляемую нуклеиновой кислотой нуклеазу, содержащую одну или более ядерных последовательностей локализации (NLS), например, приблизительно или больше чем 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более NLS. В некоторых вариантах осуществления сконструированная нуклеаза содержит NLS на или около амино-конца, NLS на или около карбокси-конца, или комбинацию.
Примерные рабочие процессы для редактирования, обогащения и отбора отредактированных клеток
[0077] Описанные в настоящем документе способы обеспечивают улучшенную наблюдаемую эффективность редактирования способов редактирования на основе направляемой нуклеиновой кислотой нуклеазы в результате комбинации сингуляции или существенной сингуляции, начального роста клеток, индукции редактирования и нормализации получаемых колоний клеток или отбора медленно растущих колоний клеток. Комбинация процессов сингуляции или существенной сингуляции, начального роста клеток, индукции редактирования и нормализации преодолевает сдвиг роста в пользу неотредактированных клеток, а также эффектов пригодности редактирования (включая разные скорости редактирования), обеспечивая таким образом всем клеткам равные возможности. Комбинация сингуляции или существенной сингуляции, первичного роста клеток, индукции редактирования и отбора обеспечивает прямой выбор отредактированных колоний клеток. Результат описанных в настоящем документе способов состоит в том, что даже в системах на основе направляемой нуклеиновой кислотой нуклеазы, где редактирование не является оптимальным (например, в системах, где мишенью являются неканонические PAM), происходит увеличение наблюдаемой эффективности редактирования; то есть отредактированные клетки могут быть идентифицированы даже на большом фоне неотредактированных клеток. Наблюдаемая эффективность редактирования может быть улучшена до 80% или больше. Сингуляция, начальный рост, индукция редактирования и нормализация колоний клеток или отбор колоний клеток приводят к 2-250x, 10-225x, 25-200x, 40-175x, 50-150x, 60-100x или 5-100x усилению идентификации отредактированных клеток по сравнению со способами предшествующего уровня техники и позволяет генерировать сгруппированные или объединенные отредактированные клетки, содержащие библиотеки генома. Кроме того, эти инструменты, модули и способы могут использоваться для создания итерационных систем редактирования с целью создания комбинаторных библиотек, идентификации редких изменений клеток и обеспечения возможности высокопроизводительным приложениям обогащения идентифицировать активность редактирования.
[0078] Фиг. 1A показывает упрощенные блок-схемы для двух альтернативных примерных способов 100a и 100b сингуляции клеток для обогащения (100a) и для отбора (100b). На Фиг. 1A способ 100 начинается с трансформации клеток 110 с помощью компонентов, необходимых для выполнения редактирования с использованием направляемой нуклеиновой кислотой нуклеазы. Например, клетки могут преобразовываться одновременно с отдельным вектором-двигателем и редактирующим вектором; клетки могут быть уже преобразованы с помощью вектора-двигателя, экспрессирующего нуклеазу (например, клетки могут быть уже преобразованы с помощью вектора-двигателя, или кодирующая последовательность для нуклеазы может быть устойчиво интегрирована в клеточный геном), таким образом, что только редактирующий вектор должен быть преобразован в клетки; или клетки могут преобразовываться с помощью единственного вектора, содержащего все компоненты, требуемые для выполнения редактирования генома с использованием направляемой нуклеиновой кислотой нуклеазы.
[0079] Для введения (например, трансформации или трансфекции) компонентов системы редактирования на основе направляемой нуклеиновой кислотой нуклеазы в клетку 110 хозяина можно использовать различные системы доставки. Эти системы доставки включают в себя использование дрожжевых систем, систем липофекции, систем микроинъекций, биолистических систем, виросом, липосом, иммунолипосом, поликатионов, конъюгатов липид:нуклеиновая кислота, вирионов, искусственных вирионов, вирусных векторов, электропорации, клеточно-проницаемых пептидов, наночастиц, нанопроволок и экзосом. Альтернативно молекулярные троянские липосомы могут использоваться для доставки компонентов направляемой нуклеиновой кислотой нуклеазы через гематоэнцефалический барьер. Интересным, особенно в контексте автоматизированного мультимодульного инструмента для редактирования клеток, является использование электропорации, в частности проточной электропорации (как автономного инструмента или как модуля в автоматизированной мультимодульной системе), описанное, например, в патентных документах US № 16/147120, поданном 28 сентября 2018 г.; № 16/147353, поданном 28 сентября 2018 г.; № 16/147865, поданном 30 сентября 2018 г.; и № 16/147871, поданном 30 сентября 2018 г. Если модуль сингуляции или существенной сингуляции/роста/индукции редактирования и нормализации со сплошной стенкой представляет собой один модуль в автоматизированном мультимодульном инструменте для редактирования клеток, описываемом в настоящем документе ниже, клетки могут трансформироваться в автоматизированном модуле трансформации клеток.
[0080] После трансформации клеток с помощью компонентов, необходимых для выполнения редактирования на основе направляемой нуклеиновой кислотой нуклеазы, клетки по существу или в значительной степени сингулируются 120; то есть, клетки разбавляются (в случае необходимости) в жидкой культуральной среде так, чтобы клетки после их доставки на субстрат для сингуляции были по существу отделены друг от друга и могли формировать колонии, по существу отделенные друг от друга. Например, если используется устройство со сплошной стенкой (описываемое ниже со ссылками на Фиг. 3A-3E и 4A-4CC), клетки разбавляются таким образом, что после их доставки в устройство со сплошной стенкой они заполняют микролунки устройства со сплошной стенкой в соответствии с пуассоновским или по существу пуассоновским распределением. В одном примере (проиллюстрированном на Фиг. 3A), сингуляция достигается, когда в среднем половина клеток доставляется в каждую микролунку; то есть когда некоторые микролунки содержат одну клетку, а другие микролунки не содержат клеток. Альтернативно, по существу пуассоновское распределение клеток происходит, когда две или несколько (2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или вплоть до 50, но предпочтительно 10 или меньше, или предпочтительно 5 или меньше) клеток доставляются в микролунку (проиллюстрировано на Фиг. 3B).
[0081] После того, как клетки будут по существу или в значительной степени сингулированы 120, им дают возможность расти, например, до 2-130, или до 5-120, или до 10-100 удвоений, образуя клональные колонии 140. После того, как колонии образовались, индуцируется 130 редактирование, например, когда один или несколько индуцибельных промоторов управляют транскрипцией одной или обеих из гРНК и нуклеазы (предпочтительно обеих), а также, например, компонентов рекомбинантной системы λ red в бактериальных системах. В качестве примерной индуцибeльной системы см. Фиг. 1C, подробно описываемый ниже. После завершения редактирования в способе 100a обогащения клетки выращиваются в колонии конечного размера 150; то есть колонии, возникающие из существенно или в значительной степени сингулированных клеток, выращиваются в колонии до того момента, когда рост клеток достигает пика и нормализуется или насыщается как для отредактированных, так и для неотредактированных клеток. Нормализация происходит, когда питательные вещества в среде вокруг растущей колонии клеток исчерпываются, и/или растущие клетки заполняют микролунки, и дальнейший рост физически ограничивается. Колонии конечного размера объединяются 160 путем, например, соскребания колоний с пластины, содержащей твердую среду или другой субстрат, или путем смыва клональных колоний клеток из микролунок в устройстве или модуле со сплошной стенкой для того, чтобы объединить клетки из нормализованных колоний клеток. Опять же, поскольку сингуляция или существенная сингуляция преодолевают сдвиг роста в пользу неотредактированных клеток или клеток, демонстрирующих эффекты приспособляемости в результате сделанных изменений, сингуляция или существенная сингуляция, начальный рост, индукция редактирования и одна только нормализация обогащает общую популяцию клеток отредактированными клетками; то есть сингуляция или существенная сингуляция, объединенная с первичным ростом клеток, индуцирование редактирования и нормализация (например, выращивание колоний до предельного размера) обеспечивает высокопроизводительное обогащение отредактированных клеток.
[0082] Способ 100b, показанный на Фиг. 1A, подобен способу 100a в том, что интересующие клетки трансформируются 110 с помощью компонентов, необходимых для выполнения редактирования на основе направляемой нуклеиновой кислотой нуклеазы. Как было описано выше, клетки могут трансформироваться одновременно с помощью вектора-двигателя и редактирующего вектора, клетки могут уже экспрессировать нуклеазу (например, клетки могут быть уже трансформированы с помощью вектора-двигателя, или кодирующая последовательность для нуклеазы может быть устойчиво интегрирована в клеточный геном), таким образом, что только редактирующий вектор должен быть трансформирован в клетки; или клетки могут трансформироваться с помощью единственного вектора, содержащего все компоненты, требуемые для выполнения редактирования генома с использованием направляемой нуклеиновой кислотой нуклеазы. Кроме того, если модуль сингуляции или существенной сингуляции клеток, первичного роста клеток, индуцирования редактирования и нормализации или отбора («модуль изоляции/индуцирования/нормализации со сплошной стенкой» или «SWIIN») является одним модулем в автоматизированном мультимодульном инструменте для редактирования клеток, трансформация клеток может выполняться в автоматизированном модуле трансформации, как описывается со ссылками на Фиг. 8A-8E ниже.
[0083] После трансформации 110 клеток с помощью компонентов, необходимых для выполнения редактирования на основе направляемой нуклеиновой кислотой нуклеазы, клетки разбавляются (в случае необходимости) в жидкой среде так, чтобы клетки после их доставки в устройство или модуль сингуляции были отделены друг от друга и могли сформировать колонии, которые отделяются друг от друга. Например, если используется устройство со сплошной стенкой (описанное со ссылками на Фиг. 3A-3E и 4A-4CC), клетки разбавляются таким образом, что после их доставки в устройство со сплошной стенкой они заполняют микролунки устройства со сплошной стенкой в соответствии с пуассоновским или по существу пуассоновским распределением.
[0084] После того, как клетки будут по существу или в значительной степени сингулированы 120, они растут, например, до 2-150, или до 5-120, или до 10-100 удвоений, образуя клональные колонии 130. После образования колоний редактирование индуцируется 140 путем, например, активирования индуцибeльных промоторов, которые управляют транскрипцией по меньшей мере одной из гРНК и нуклеазы (как было описано выше, предпочтительно обеих) и, в случае бактерий, рекомбинационной системы. Когда редактирование индуцируется 140, многие из отредактированных клеток в клональных колониях умирают из-за разрывов двухцепочечной ДНК, которые происходят в процессе редактирования; однако в процентном соотношении отредактированных клеток геном редактируется, и разрыв двухцепочечной ДНК должным образом исправляется. Когда им дают возможность восстановиться, эти отредактированные клетки начинают расти и восстанавливают популяции клеток внутри каждого изолированного раздела или колонии; однако рост отредактированных колоний имеет тенденцию отставать от роста тех клональных колоний, где редактирование не имело места (например, клетки-беглецы). Если рост этих колоний отслеживается 170, малые или медленно растущие колонии (отредактированных клеток) могут быть идентифицированы, а затем выбраны или отобраны 180 на основе наблюдаемых различий в размерах колоний.
[0085] Фиг. 1B представляет собой график оптической плотности в зависимости от времени для неотредактированных клеток (сплошная линия) и отредактированных клеток (пунктирная линия). Фиг. 1B показывает, как происходит нормализация отредактированных и неотредактированных колоний. Следует отметить, что OD (например, рост) отредактированных клеток изначально отстает от неотредактированных клеток, но в конечном итоге догоняет ее, например, из-за того, что неотредактированные клетки истощают питательные вещества в среде, становясь физически ограниченными внутри микролунки или другой ограниченной зоны роста (такой как капелька), или иным образом прекращают рост в логарифмической фазе. Колониям клеток позволяют расти достаточно долго для того, чтобы рост отредактированных колоний догнал (приблизительно, по размеру, например по количеству клеток) неотредактированные колонии.
[0086] Фиг. 1C изображает примерную систему индуцибeльной экспрессии - в данном примере pL-индуцибeльную систему - для регулирования активности гРНК. В верхней части Фиг. 1C показана часть примерного вектора-двигателя 111, содержащего точку начала репликации 112, промотор 114, управляющий экспрессией гена 116 репрессора c1857, и первый промотор 118 pL, управляющий экспрессией нуклеазы 121. В верхней части Фиг. 1C также видна часть примерного редактирующего вектора 131, содержащего точку начала репликации 132, и второй промотор 134 pL, управляющий транскрипцией редактирующей кассеты 136 (например, кассеты CREATE), которая включает в себя кодирующие последовательности как для гРНК, так и для донорной ДНК. Средняя часть Фиг. 1C изображает продукт 124 гена 116 репрессора c1857 на векторе-двигателе 111, активно подавляющий первый промотор 118 pL, управляющий транскрипцией нуклеазы 121, и второй промотор 134 pL, управляющий транскрипцией редактирующей кассеты 136 на редактирующем векторе 131. Наконец, нижняя часть Фиг. 1C изображает белковый продукт 126 гена 116 репрессора c1857 на векторе-двигателе 111, разворачивающийся/разрушающийся при повышении температуры. Развернутый или разрушенный белковый продукт 126 не может связываться с первым промотором 118 pL или вторым промотором 134 pL; таким образом, промотор 118 pL является активным и управляет транскрипцией нуклеазы 121 на векторе-двигателе 111, а промотор 134 pL является активным и управляет транскрипцией кассеты редактирования 136 на редактирующем векторе 131.
[0087] На Фиг. 1C, транскрипция и нуклеазы, и гРНК находится под управлением промотора pL; однако в других вариантах осуществления для управления транскрипцией нуклеазы и гРНК могут использоваться различные индуцибeльные промоторы, или в некоторых вариантах осуществления только одна из нуклеазы и гРНК находится под управлением индуцибeльного промотора. Например, промоторы pL и pBAD показаны в связи с примерными вектором-двигателем и редактирующим вектором на Фиг. 11A и 11B, и был разработан ряд систем контроля регуляции генов для контролируемой экспрессии генов в клетках растений, микробов и животных, включая клетки млекопитающих. Эти системы включают в себя управляемую тетрациклином систему активации транскрипции (Tet-On/Tet-Off, Clontech, Inc.(Пало-Альто, Калифорния); Bujard and Gossen, PNAS, 89(12):5547-5551 (1992)), индуцибeльную систему Lac Switch (Wyborski et al., Environ Mol Mutagen, 28(4):447-58 (1996); DuCoeur et al., Strategies 5(3):70-72 (1992); и американский патент № 4833080), систему экспрессии генов, индуцируемую экдизоном (No et al., PNAS, 93(8):3346-3351 (1996)), систему переключения генов кумата (Mullick et al., BMC Biotechnology, 6:43 (2006)), и индуцируемую тамоксифеном экспрессию гена (Zhang et al., Nucleic Acids Research, 24:543-548 (1996)), и др. Однако, промотор pL является особенно полезным индуцибeльным промотором, потому что он активируется увеличением температуры до, например, 42°C, и дезактивируется возвратом температуры, например, к 30°C. В случае других индуцибельных систем, которые активируются присутствием или отсутствием конкретного молекулярного соединения, активация индуцибельного промотора требует добавления или удаления молекулярного соединения из культуральной среды, что требует обработки жидкости, замены среды, стадий промывки и т.п.
[0088] Фиг. 2A изображает стандартный, обычный протокол 200 предшествующего уровня техники для выполнения редактирования генома на основе направляемой нуклеиновой кислотой нуклеазы, где конститутивно экспрессируемые компоненты нуклеазы обычно используются для управления высокоэффективным редактированием. На Фиг. 2A библиотека или коллекция редактирующих векторов 202 вводится 203 (например, электропорируется) в культивируемые клетки 204, которые содержат кодирующую последовательность для нуклеазы под управлением конститутивного или индуцибeльного промотора. В некоторых вариантах осуществления кодирующая последовательность для нуклеазы содержится на «векторе-двигателе», хотя в других вариантах осуществления кодирующая последовательность для нуклеазы может быть интегрирована в геном клетки. В еще одной альтернативе компоненты вектора-двигателя и редактирующего вектора могут быть объединены. Редактирующие векторы 202 содержат редактирующую последовательность, содержащую последовательность для желаемого редактирования в последовательности нуклеиновой кислоты, эндогенной для клетки, а также необязательную последовательность изменения PAM (чаще всего последовательность, которая отключает PAM в целевой последовательности в геноме), кодирующую последовательность для гРНК под управлением конститутивного промотора и селектируемый маркер. После того как клетки будут трансформированы редактирующими векторами, клетки помещают 205 на селективную среду 206 для выбора клеток, которые имеют как вектор-двигатель, так и редактирующий вектор, и клетки выращиваются до образования колоний. Клетки затем отбираются 207 из колоний и выращиваются, например, в 96-луночных пластинах 208 для того, чтобы подготовить их к секвенированию генома или плазмиды. Клетки, которые растут на пластине 206 с селективной средой, должны содержать как вектор-двигатель, так и редактирующий вектор; однако вероятно, что в некоторых клетках компоненты направляемого нуклеиновой кислотой редактирования могут быть нефункциональными. В объединенных или мультиплексных форматах вероятно избирательное обогащение клеток с нефункциональной системой редактирования, поскольку неотредактированные клетки не подвергаются разрывам двухцепочечной ДНК, которые происходят во время редактирования. Жесткий отбор клеток с нефункциональными системами редактирования на основе направляемой нуклеиновой кислотой нуклеазы приводит к непропорциональному представлению неотредактированных клеток в окончательной популяции клеток и ставит под угрозу целостность библиотек, созданных посредством мультиплексированных нуклеазных систем редактирования.
[0089] Фиг. 2B-2F изображают улучшенные протоколы для выполнения редактирования генома на основе направляемой нуклеиновой кислотой нуклеазы. Фиг. 2B изображает первый вариант осуществления 201 улучшенного протокола для выполнения редактирования генома на основе направляемой нуклеиновой кислотой нуклеазы, использующего индуцибeльный промотор для управления экспрессией гРНК. На Фиг. 2B библиотека или коллекция редактирующих векторов 202 вводится 203 (например, электропорируется) в культивируемые клетки 204, которые содержат кодирующую последовательность для нуклеазы под управлением конститутивного или индуцибeльного промотора; наиболее жесткая регуляция системы на основе направляемой нуклеиновой кислотой нуклеазы достигается при использовании индуцибeльного промотора для управления экспрессией нуклеазы, поэтому предпочтительно, чтобы индуцибельный промотор использовался для управления транскрипцией нуклеазы. В некоторых вариантах осуществления кодирующая последовательность для нуклеазы содержится на «плазмиде-двигателе» (чаще всего вместе, например, с селектируемым маркером), которая уже была трансформирована в клетки, хотя в других вариантах осуществления кодирующая последовательность для нуклеазы может быть интегрирована в геном клеток. В других вариантах осуществления кодирующая последовательность для нуклеазы может быть расположена на редактирующем векторе (то есть объединенном векторе-двигателе и редактирующем векторе). Редактирующие векторы 202 содержат редактирующую последовательность, которая опционально включает в себя изменяющую PAM последовательность (чаще всего последовательность, которая отключает PAM на целевом участке в геноме), кодирующую последовательность для гРНК под управлением индуцибeльного промотора и селектируемый маркер.
[0090] После того, как клетки 204 будут трансформированы редактирующими векторами, клетки помещают 205 на селективную среду для выбора клеток, которые имеют как вектор-двигатель, так и редактирующий вектор, и клетки выращиваются до образования колоний 206. Клетки затем отбираются 207 из колоний и выращиваются в течение ночи, например, в первой 96-луночной пластине 208 в среде, которая выбирает как вектор-двигатель, так и редактирующий вектор. На следующей стадии 209 клетки из первой 96-луночной пластины 208 реплицируются во вторую 96-луночную пластину 210 в среду, содержащую дополнительный селективный компонент, такой как, например, арабиноза, для стимулирования сильной индукции рекомбинационной системы λ red (механизм гомологичного ремонта). Индуцибeльный промотор pBAD (индуцируемый присутствием арабинозы в среде для выращивания) управляет рекомбинационной системой λ red и описывается со ссылкой на Фиг. 11A ниже. Опять же, хотя рекомбинационная система иллюстрируется здесь в бактериальной системе редактирования, рекомбинационные системы обычно не нужны в эукариотических системах редактирования. После начального роста клетки при 30°C разрезание и редактирование клеточного генома индуцируется путем увеличения температуры до 42°C во второй 96-луночной пластине 210 в течение, например, от 0,5 до приблизительно 2 час (в зависимости от типа клеток), чтобы активизировать pL-индуцибeльные промоторы, которые управляют транскрипцией нуклеазы и гРНК. После индуцирования разрезания и редактирования (например, в течение приблизительно 2 час) температура возвращается к 30°C, чтобы дать клеткам возможность восстановиться.
[0091] В дополнение к этому, на стадии 211 клетки из первой 96-луночной пластины 208 реплицируются в третью 96-луночную пластину 214 в среду, которая не содержит селективного компонента, который индуцирует механизм гомологичного ремонта (в данном случае арабинозы, так что рекомбинационная система λ Red не активируется). Однако третья 96-луночная пластина 214 - за исключением того, что она не содержит арабинозы в среде для выращивания - подвергается тем же самым условиям, что и вторая 96-луночная пластина; то есть, начальному росту клеток при 30°C, увеличению температуры до 42°C в течение, например, 2 час, чтобы активизировать pL-индуцибeльный промотор, управляющий экспрессией нуклеазы и гРНК, а затем уменьшению температуры до 30°C, чтобы дать клеткам возможность восстановиться. В качестве альтернативы 96-луночным пластинам 210 и 214 показаны две агаровых пластины 212 и 216, на которую помещаются клетки с пластины 206. Пластина 212 соответствует второй 96-луночной пластине 210, содержащей среду для выращивания с арабинозой, а пластина 216 соответствует третьей 96-луночной пластине 214, содержащей среду для выращивания без арабинозы. Следует отметить, что в качестве альтернативы выполнению способа, изображенного на Фиг. 2B, с +/- арабинозой, можно выполнять способ с +/- температурной индукцией разрезания. Например, в эксперименте с +/- температурной индукцией пластина 210 будет неиндуцируемой пластиной для культивирования (без повышения температуры), а пластина 214 будет температурно индуцируемой. Применяется та же самая общая интерпретация; однако активность разрезания изолируется, чтобы избежать необходимости деконволюции вырезания от вклеивания.
[0092] Глядя на вторую и третью 96-луночные пластины (210 и 214, соответственно) и на пластины 212 и 216, можно увидеть колонии клеток. На второй 96-луночной пластине 210 имеется два типа колоний: 226 (белые лунки) и 228 (заштрихованные лунки). На третьей 96-луночной пластине 214 имеется два типа колоний: 220 (черные лунки) и 226 (белые лунки). Репликация посева клеток из первой 96-луночной пластины во вторую и третью 96-луночные пластины с отличающимися средами обеспечивает функциональную деконволюцию получаемых популяций клеток. В третьей 96-луночной пластине 214 клетки культивировались в среде без арабинозы. Без арабинозы рекомбинационная система λ Red является неактивной, и клетки, которые имеют активную экспрессию гРНК и нуклеазы (индуцируемую увеличением температуры культивируемых клеток до 42°C) являются нежизнеспособными благодаря разрезанию двойной спирали активной гРНК и нуклеазой без ремонта рекомбинационной системой λ Red. Эти клеточные колонии 222 показаны белыми лунками. Клеточные колонии 220, показанные черными лунками, представляют клетки, имеющие неактивные гРНК, так что геномы клеток в этих колониях не режутся комплексом нуклеазы и гРНК. Неактивные гРНК образуются с частотой приблизительно 2-15% в типичном эксперименте по редактированию клетки, и обычно являются результатом ошибок в части направляющей последовательности (гомологичной части) гРНК.
[0093] Во второй 96-луночной пластине 210 клетки культивировались в среде с арабинозой, активируя тем самым рекомбинационную систему λ Red. Клетки, имеющие активную экспрессию гРНК и нуклеазы (индуцируемую увеличением температуры культивируемых клеток до 42°C), режутся, редактируются, и рекомбинационная система λ Red ремонтирует разрывы двойной цепочки ДНК, и таким образом эти клетки являются жизнеспособными. Однако также жизнеспособными являются клетки с неактивными гРНК (или, менее часто, с неактивными нуклеазами). Все жизнеспособные колонии в пластине 210 показаны заштрихованными лунками 228. Наконец, клетки, которые имеют активные гРНК, но не редактируются подходящим образом (благодаря, например, неактивной рекомбинационной системе) обозначены белыми лунками 226. Сравнивая вторую 96-луночную пластину с третьей 96-луночной пластиной, можно определить функцию системы на основе направляемой нуклеиновой кислотой нуклеазы в каждой колонии. Например, если колонии клеток растут без арабинозы (пластина 214, черные лунки 220) и с арабинозой (пластина 210, заштрихованные лунки 228), у этих клеток не должно быть активной гРНК. Если бы у этих клеток была бы активная гРНК, они не были бы жизнеспособными в среде без арабинозы (например, без активной рекомбинационной системы λ Red). Если колонии клеток не растут в среде без арабинозы (пластина 214, белые лунки 226) и растут при добавлении арабинозы к культуральной среде (пластина 210, заштрихованные лунки 228), клетки в этих лунках содержат активную систему на основе направляемой нуклеиновой кислотой нуклеазы - с активными компонентами гРНК и нуклеазы - и с большой вероятностью будут должным образом отредактированы. Наконец, если колонии клеток не растут ни без арабинозы (пластина 214, белые лунки 226), ни с арабинозой (пластина 210, белые лунки 226), гРНК является активной, но клетки по некоторым причинам не могут ремонтировать разрезы. Таким образом, способ, изображенный на Фиг. 2B, позволяет идентифицировать отредактированные колонии клеток посредством функциональной деконволюции различных компонентов редактирующего «механизма» в одном эксперименте.
[0094] В пластинах 212 и 216 фенотипичное считывание является тем же самым, что и в 96-луночных пластинах 210 и 214. Как и 96-луночная пластина 210, среда в чашке 212 для культивирования содержит арабинозу, и, как и 96-луночная пластина 214, среда в чашке 216 для культивирования не содержит арабинозу. Таким образом, в чашке 216 для культивирования клетки с неактивными гРНК растут, поскольку нет изменений (двухцепочечных разрывов), которые надо было бы ремонтировать. Однако в клетках с активной гРНК редактирование имеет место, но нет никакого активного механизма для ремонта изменений, и клетки являются нежизнеспособными и не формируют колонии. В чашке 212 для культивирования, которая содержит арабинозу, клетки, имеющие неактивные гРНК, образуют колонии, также как и клетки, которые имеют активные гРНК, но должным образом редактируются. Клетки, которые не являются жизнеспособными по любой причине, не формируют колонии. Как и в случае с 96-луночными пластинами 210 и 214, сравнение чашек для культивирования 212 и 214 позволяет осуществлять деконволюцию различных компонентов механизма редактирования. Если клетки растут на обеих чашках для культивирования 212 и 214, гРНК скорее всего является неактивной. Если клетки растут на чашке 212 для культивирования, но не на чашке 214 для культивирования, гРНК скорее всего активна, и надлежащее редактирование имело место. Если клетки не растут ни на чашке 212 для культивирования, ни на чашке 214, в клетках, вероятно, имеется активная гРНК, но изменения не ремонтируются должным образом.
[0095] Таким образом, способ 201, изображенный на Фиг. 2B, позволяет идентифицировать клетки с нефункциональными гРНК, которые из-за отсутствия разрывов двухцепочечной ДНК имеют преимущество в росте. Что наиболее важно, способ 201, изображенный на Фиг. 2B, позволяет идентифицировать клетки, которые были должным образом отредактированы. Аликвоту колоний 228 из второй 96-луночной пластины 210 или из агаровой пластины 212 - колоний, для которых подтверждено, что они имеют активную гРНК - можно отбирать и секвенировать для подтверждения редактирования. 96-луночная пластина 210 или агаровая пластина 212 может быть сохранена, так что, когда надлежащее редактирование будет подтверждено, например, с помощью секвенирования, можно будет вернуться к пластине 210 или 212 и извлечь отредактированные должным образом клетки. Пластины 210 и 212 могут упоминаться, например, как «клеточные гостиницы» или «клеточные хранилища». Следует отметить, что способ 201, изображенный на Фиг. 2B, сначала по существу или в значительной степени сингулирует клетки путем посева их на селективную среду в подходящем разбавлении, чтобы одиночные клетки формировали одиночные колонии. Опять же, сингуляция или существенная сингуляция преодолевает рост смещения, характерный для неотредактированных клеток. Этот способ затем позволяет осуществить функциональную деконволюцию различных колоний путем посева реплик колоний в микротитровальные пластины с 96 лунками с различными средами в различных секциях, чтобы обеспечить положительную идентификацию отредактированных колоний. Конкретный протокол для этого примерного способа описывается ниже в Примере 6.
[0096] Фиг. 2C изображает второй примерный вариант осуществления улучшенного протокола 240 для выполнения редактирования генома на основе направляемой нуклеиновой кислотой нуклеазы, использующего индуцибeльный промотор для управления экспрессией гРНК, а также предпочтительно и нуклеазы. На Фиг. 2C, как и на Фиг. 2B, библиотека или коллекция редактирующих векторов 202 вводится 203 (например, электропорируется) в культивируемые клетки 204, которые содержат кодирующую последовательность для нуклеазы под управлением конститутивного или индуцибeльного промотора; наиболее жесткая регуляция системы на основе направляемой нуклеиновой кислотой нуклеазы достигается при использовании индуцибeльного промотора для управления экспрессией нуклеазы, и поэтому является предпочтительной. Так же, как и на Фиг. 2B, в некоторых вариантах осуществления кодирующая последовательность для нуклеазы содержится на «плазмиде-двигателе» (чаще всего вместе, например, с селектируемым маркером), которая уже была трансформирована в клетки, хотя в других вариантах осуществления кодирующая последовательность для нуклеазы может быть интегрирована в геном клеток. В других вариантах осуществления кодирующая последовательность для нуклеазы может быть расположена на редактирующем векторе (то есть объединенном векторе-двигателе и редактирующем векторе). Редактирующие векторы 202 содержат редактирующую последовательность с желаемым редактированием по отношению к эндогенной последовательности нуклеиновой кислоты в клетке вместе с изменяющей PAM последовательностью (чаще всего последовательностью, которая отключает PAM на целевом участке в геноме), кодирующую последовательность для гРНК, предпочтительно под управлением индуцибeльного промотора, и селектируемый маркер.
[0097] После того, как клетки 204 будут трансформированы редактирующими векторами, клетки высеваются 235 на селективную среду на субстрате или пластине 236 для выбора клеток, которые имеют как вектор-двигатель, так и редактирующий вектор. Клетки разбавляются перед посевом таким образом, чтобы они были по существу или в значительной степени сингулированы - разделяются достаточно для того, чтобы они и колонии, которые они формируют, были отделены от других колоний клеток - и эти клетки затем выращиваются 237 на пластине или субстрате 236 до тех пор, пока не начнут формироваться колонии 238. Клеткам дают возможность расти, например, при 30°C, например, до 2-150, или до 5-120, или до 10-100 удвоений, образуя клональные колонии. Этот начальный рост клеток должен накопить достаточно клональных клеток в колонии для того, чтобы пережить индукцию редактирования. После того, как колонии сформируются, резка и редактирование клеточного генома индуцируются путем индуцирования или активации промоторов, управляющих одной или обеими из гРНК и нуклеазы, и рекомбинационной системы λ Red (если она есть). Если рекомбинационная система λ Red присутствует и находится под управлением индуцибeльного промотора, предпочтительно этот индуцибeльный промотор отличается от индуцибeльного промотора, управляющего транскрипцией гРНК и нуклеазы, и активируется (индуцируется) перед индуцированием гРНК и нуклеазы. Рекомбинационная система λ Red работает как «пластырь» или система восстановления для двухцепочечных разрывов в бактериях, и в некоторых разновидностях бактерий должна присутствовать для устранения двухцепочечных разрывов, которые происходят во время редактирования. Рекомбинационная система λ Red может находиться под управлением, например, промотора pBAD. Промотор pBAD, как и промотор pL, является индуцибeльным промотором; однако промотор pBAD регулируется (индуцируется) добавлением арабинозы к среде для выращивания. Таким образом, если арабиноза содержится в селективной среде субстрата или пластины 236, то рекомбинационная система λ Red будет активирована, когда клетки выращиваются 237. Что касается индуцирования редактирования 239, если транскрипция гРНК и нуклеазы управляется промотором pL, транскрипция гРНК и нуклеазы индуцируется путем увеличения температуры до 42°C на, например, 0,5-2 час (или больше, в зависимости от типа клеток), что активирует pL-индуцибeльный промотор. После индуцирования резки и редактирования и двухчасовой инкубации при 42°C температура возвращается к 30°C для того, чтобы дать клеткам возможность восстановиться и отключить систему промотора pL.
[0098] После того, как клетки восстановятся и вырастут при 30°C, они выращиваются на субстрате или пластине 236 в колонии предельного размера 244; то есть колонии, возникающие из существенно или в значительной степени сингулированных клеток, выращиваются в колонии до того момента, когда рост клеток достигает пика и становится нормализованным (например, насыщается) как для отредактированных, так и для неотредактированных клеток. Столь было описано выше, нормализация происходит, когда питательные вещества в среде вокруг растущей колонии клеток исчерпываются, и/или растущие клетки заполняют микролунки или иным образом ограничиваются; то есть, клетки находятся в стадии старения. Колонии предельного размера затем объединяются 241 путем, например, соскребания колоний с субстрата или пластин (или, например, путем смыва клональных колоний клеток из микролунок в устройстве со сплошной стенкой) для того, чтобы объединить 280 клетки из нормализованных колоний клеток. Следует отметить, что способ 240, проиллюстрированный на Фиг. 2C, использует сингуляцию или существенную сингуляцию, начальный рост, индукцию, нормализацию и объединение получаемых колоний клеток. Опять же, поскольку сингуляция или существенная сингуляция преодолевают сдвиг роста в пользу неотредактированных клеток или клеток, демонстрирующих эффекты приспособляемости в результате сделанных изменений, комбинация сингуляции или существенной сингуляции, начального роста, индукции редактирования и нормализации обогащает общую численность популяции клеток теми клетками, которые были отредактированы. Следует отметить, однако, что в отличие от способов 201, 250, изображенных на Фиг. 2B и Фиг. 2D соответственно, способ 240, изображенный на Фиг. 2C, не содержит шагов для деконволюции редактирующего механизма.
[0099] Фиг. 2D изображает третий примерный вариант осуществления улучшенного протокола 250 для выполнения редактирования генома на основе направляемой нуклеиновой кислотой нуклеазы, использующего индуцибeльный промотор для управления экспрессией гРНК, а в некоторых вариантах осуществления и предпочтительно, также и нуклеазы. Фиг. 2D изображает протокол 250 для основанного на активности устранения ошибок и повторного размещения. На Фиг. 2D, как и на Фиг. 2B и 2C, библиотека или коллекция редактирующих векторов 202 вводится 203 (например, электропорируется) в культивируемые клетки 204, которые содержат кодирующую последовательность для нуклеазы под управлением конститутивного или индуцибeльного промотора (предпочтительно индуцибeльного), содержащуюся на «плазмиде-двигателе» (например, вместе с селектируемым маркером), которая уже была трансформирована в клетки или интегрирована в геном клеток. Альтернативно кодирующая последовательность для нуклеазы может быть расположена на редактирующем векторе. Редактирующие векторы 202 содержат редактирующую последовательность, изменяющую PAM последовательность (чаще всего последовательность, которая отключает PAM на целевом участке в геноме), кодирующую последовательность для гРНК предпочтительно под управлением индуцибeльного промотора и селектируемый маркер.
[0100] После того, как клетки будут трансформированы редактирующими векторами, клетки разбавляются и высеваются 205 на селективную среду 206 для выбора клеток, которые имеют как вектор-двигатель, так и редактирующий вектор (например, среду с хлорамфениколом и карбенициллином), и выращиваются до образования колоний 221, снова в процессе, который по существу или в значительной степени сингулирует клетки. Клетки затем отбираются 207 из колоний 221 и выращиваются в течение ночи, например, в первой 96-луночной пластине 208 в среде, которая не содержит селективной среды. На следующей стадии клетки из первой 96-луночной пластины реплицируются 211 во вторую 96-луночную пластину 214 в среду без арабинозы, что приводит к лункам с колониями (черные лунки 220) и лункам без колоний клеток (белые лунки 222). Этот процесс идентифицирует клетки с активными гРНК, поскольку клетки с активными гРНК не будут выживать, потому что без арабинозы рекомбинационная система λ Red является неактивной и не может ремонтировать разрезы в геноме, сделанные с помощью гРНК. Таким образом, лунки 222 с большой вероятностью являются лунками с активными гРНК. Колонии, которые вырастают на этой второй 96-луночной пластине 214, с большой вероятностью имеют неактивные гРНК, и таким образом нет никаких разрезов, чтобы их надо было ремонтировать, и клетки остаются жизнеспособными (показаны черными лунками 220).
[0101] После того, как клетки с активными гРНК идентифицируются (лунки 222), эти клетки затем отбираются 213 из первой 96-луночной пластины и помещаются в третью 96-луночную пластину 252 для сохранения в качестве хранилища клеток или клеточной гостиницы. Все колонии в третьей 96-луночной пластине 252 являются клетками, которые были идентифицированы как с большой вероятностью имеющие активные гРНК 222. С помощью этого клеточного хранилища 252 аликвоты этих отобранных клеток (например, клеток с активными гРНК) могут быть затем помещены 255 в четвертую 96-луночную пластину 254 в среду с арабинозой. После периода начального роста клетки в этой четвертой 96-луночной пластине 254 подвергаются условиям резки и редактирования, например путем увеличения температуры до 42°C на два часа для того, чтобы индуцировать pL-индуцибeльный промотор, управляющий экспрессией нуклеазы и гРНК. После процессов резки и редактирования колонии, содержащие должным образом отредактированные клетки, могут быть идентифицированы путем мониторинга роста колоний и выбора медленно растущих колоний или путем таргетированного или полного секвенирования генома клеток, взятых с пластины 254. После идентификации клеток с желаемыми изменениями они могут быть извлечены из 96-луночной пластины 252 (например, хранилища клеток или клеточной гостиницы). Альтернативно колонии клеток с предположительно активными гРНК на пластине 252 могут быть объединены 253 в смешанную клеточную культуру 256 и либо проанализированы, либо подвергнуты дополнительному циклу редактирования.
[0102] Фиг. 2E изображает еще один примерный вариант осуществления улучшенного протокола 270 для выполнения редактирования генома на основе направляемой нуклеиновой кислотой нуклеазы с использованием индуцибeльного промотора для управления экспрессией гРНК и/или нуклеазы. Протокол 270 на Фиг. 2D не содержит функциональной деконволюции механизма редактирования клеток, но изображает протокол для высокоэффективного скрининга с использованием морфологии колонии для идентификации отредактированных клеток. Опять же в отредактированных клетках жизнеспособность клетки снижается в период после индуцирования редактирования. Настоящий способ использует задержку роста колоний отредактированных клеток для идентификации отредактированных клеток. В некоторых вариантах осуществления размер колонии отредактированных клеток на 20% меньше, чем у колоний неотредактированных клеток. В некоторых аспектах размер колонии отредактированных клеток на 30%, 40%, 50%, 60%, 70%, 80% или 90% меньше, чем у колоний неотредактированных клеток. Во многих вариантах осуществления размер колонии отредактированных клеток на 30-80% меньше, чем у колоний неотредактированных клеток, и в некоторых вариантах осуществления размер колонии отредактированных клеток на 40-70% меньше, чем у колоний неотредактированных клеток.
[0103] На Фиг. 2E, как и на Фиг. 2B-2D, библиотека или коллекция редактирующих векторов 202 вводится 203 (например, электропорируется) в культивируемые клетки 204, которые содержат кодирующую последовательность для нуклеазы под управлением конститутивного или индуцибeльного промотора (предпочтительно индуцибeльного), содержащуюся 1) на «плазмиде-двигателе» (чаще всего вместе с селектируемым маркером), которая уже была трансформирована в клетки; 2) интегрированную в геном трансформируемых клеток; или 3) кодирующая последовательность для нуклеазы может быть расположена на редактирующем векторе. Редактирующие векторы 202 содержат редактирующую последовательность и опционально включают в себя изменяющую PAM последовательность (например последовательность, которая отключает PAM на целевом участке в геноме), кодирующую последовательность для гРНК под управлением предпочтительно индуцибeльного промотора и селектируемый маркер. Во многих вариантах осуществления индуцибeльный промотор включается в скелет редактирующего вектора, и редактирующая кассета вставляется в положение 3' индуцибeльного промотора, где редактирующая кассета содержит, от 5' до 3': кодирующую последовательность для гРНК и донорную ДНК, содержащую желаемое изменение для целевой последовательности, а также и изменяющую PAM последовательность (например, кассету CREATE). Следует отметить, что транскрипция одной или обеих из гРНК и нуклеазы должна находиться под управлением индуцибeльного промотора. Предпочтительно, однако, чтобы транскрипция как гРНК, так и нуклеазы находилась под управлением индуцибeльного промотора.
[0104] На стадии 271 трансформированные клетки разбавляются и высеваются (например, по существу или в значительной степени сингулируются) на селективную среду 272, которая выбирает как вектор-двигатель, так и редактирующий вектор (например, среду, содержащую хлорамфеникол и карбенициллин), и дополнительно содержит арабинозу для активации рекомбинационной системы λ Red. После посева клетки выращиваются 273 при 30°C в течение 6-8 час так, чтобы сформировались колонии, затем температура увеличивается до 42°C, например, на 0,5-2 час для индуцирования экспрессии нуклеазы и гРНК для резки и редактирования. После истечения достаточного количества времени для редактирования температура возвращается к 30°C, так что клетки растут, чтобы восстановить колонии на пластине 272. После появления колоний наблюдаются большие 278 и малые 276 колонии. Колонии 276 малого размера указывают на активную гРНК и с большой вероятностью были отредактированы, поскольку двухцепочечные разрезы, вызванные активным редактированием, в значительной степени токсичны для клеток, что приводит как к гибели клеток в отредактированных колониях, так и к задержке в росте для отредактированных клеток, которые выживают, но должны ремонтироваться и восстанавливаться после редактирования. Малые колонии (отредактированные клетки) отбираются 277 и выстраиваются на 96-луночной пластине 282. Клетки в 96-луночной пластине 282 могут культивироваться, и аликвоты из этой 96-луночной пластины 282 могут быть секвенированы для идентификации колоний с желаемыми изменениями. Эта 96-луночная пластина может быть сохранена в качестве клеточной гостиницы или хранилища клеток, и как только клетки, которые были должным образом отредактированы, идентифицированы, можно извлечь клетки с желаемым изменением из 96-луночной пластины 282 клеточной гостиницы.
[0105] Альтернативно малые колонии 276 могут быть выбраны и объединены 275 для дополнительных циклов редактирования, поскольку отредактированные клетки были выбраны в первом цикле редактирования и с большой вероятностью содержат изменения от первого цикла. Опять же, следует отметить, что этот способ не обеспечивает функциональную деконволюцию редактирующего механизма; однако способ, изображенный на Фиг. 2E, использует сингуляцию или существенную сингуляцию и отбор, и таким образом позволяет способу высокопроизводительной диагностики идентифицировать на основе морфологии размера колонии те клетки, которые имеют высокую вероятность быть отредактированными, и после идентификации популяция отредактированных клеток может быть обогащена. Отсеивание значительной доли клеток с нефункциональными гРНК обеспечивает более легкую идентификацию отредактированных клеток. Было определено, что устранение смещения скорости роста посредством сингуляции или существенной сингуляции улучшает наблюдаемую эффективность редактирования вплоть до 2x, 3x, 4x раз или больше по сравнению с обычными способами, и, кроме того, отбор колоний с использованием описанных в настоящем документе способов в 1,5x, 1,75x, 2,0x, 2,5x раз или больше увеличивает наблюдаемую эффективность редактирования сингуляции. Таким образом, комбинация существенной сингуляции и отбора улучшает наблюдаемую эффективность редактирования в 8x раз по сравнению с обычными способами. Пример 9 ниже описывает материалы и способы для этого варианта осуществления.
[0106] В то время как способ скрининга отредактированных клеток с использованием роста клеток в качестве признака редактирования был описан в настоящем документе в контексте измерения размера колоний клеток на агаровой пластине, вместо этого может измеряться оптическая плотность (OD) растущих колоний клеток, например, на микротитровальной пластине или в серии пробирок. Кроме того, другие параметры роста клеток могут быть измерены в дополнение или вместо размера колонии клеток или OD. Например, спектроскопия с использованием видимого, УФ или ближнего инфракрасного (NIR) света позволяет отслеживать концентрацию питательных веществ и/или отходов в клеточной культуре. Кроме того, спектральные измерения могут использоваться для одновременного количественного определения нескольких химических веществ. Несимметричные химические соединения могут быть определены количественно путем идентификации характерных особенностей поглощения в ближнем инфракрасном диапазоне. И наоборот, симметричные химические соединения могут быть легко определены количественно с использованием рамановской спектроскопии. Многие критические метаболиты, такие как глюкоза, глутамин, аммиак и лактат, имеют явные спектральные особенности ИК-диапазоне, так что их можно легко определить количественно. Количество и частоты света, поглощаемого образцом, могут быть скоррелированы с типом и концентрацией химических веществ, присутствующих в образце. Каждый из этих типов измерения обеспечивает конкретные преимущества. FT-NIR обеспечивает наибольшую глубину проникновения света и поэтому может использоваться для более толстого образца, что обеспечивает более высокую степень светорассеяния. FT в среднем ИК-диапазоне (MIR) предоставляет информацию, которая является легче различимой, так как она является специфической для некоторых аналитов, поскольку эти длины волн ближе к фундаментальным значениям поглощения в ИК-диапазоне. Рамановское FT является выгодным, когда необходимо минимизировать помехи из-за воды. Другие спектральные свойства могут быть измерены посредством, например, спектроскопии диэлектрического импеданса, видимой флуоресценции, поляризации флуоресценции или люминесценции. Кроме того, датчики для измерения, например, растворенного кислорода, диоксида углерода, значения pH и/или удельной электропроводности могут использоваться для оценки скорости роста клеток.
[0107] Фиг. 2F изображает дополнительные подробности примерного варианта осуществления, показанного на Фиг. 2E, используя конкретный пример, основанный на выполненных экспериментах (см. Пример 1 ниже). Фиг. 2F показывает высокопроизводительный скрининг 290 с использованием морфологии колоний для идентификации или отбора отредактированных клеток. Как было описано выше, в отредактированных клетках жизнеспособность клеток снижается в период после индуцирования редактирования. Настоящий способ использует задержку роста колоний отредактированных клеток для идентификации отредактированных клеток. На Фиг. 2F трансформированные клетки разбавляются и высеваются на среду, содержащую арабинозу 274, и выращиваются в течение некоторого времени, например, при 30°C. Редактирование инициируется, например, путем повышения температуры до 42°C на некоторый период времени, затем температура понижается до 30°C (например, трансформированные клетки по существу или в значительной степени сингулируются). Колониям дают возможность расти, и появляются малые 276 и большие 278 колонии. Колонии с этой пластины отбираются 291 и выстраиваются на второй пластине 292, содержащей селективную среду, например среду для выбора успешного редактирования galK, приводящего к белым (в отличие от красных) колониям при высевании на агар-агаре Макконки, содержащем галактозу в качестве единственного источника углерода. Следует отметить, что отбор малых колоний 293 из первой пластины приводит главным образом к отредактированным клеткам 296 (белые колонии, показанные здесь как белые кружки), и с намного более низкой частотой к некоторым клеткам, в которых гРНК неактивна 294 (красные колонии, показанные здесь как черные кружки). Подтверждение колоний, в которых гРНК является неактивной, показано отбором 295 больших колоний 278 из первой пластины и их посевом на вторую пластину (колонии 298), где эти клетки приводят к красным колониям при выращивании на агар-агаре Макконки, содержащем галактозу в качестве единственного источника углерода, подтверждая таким образом неактивную гРНК или другую часть механизма редактирования. Таким образом, использование морфологии малых и больших колоний в качестве признака отредактированных и неотредактированных клеток, соответственно, обеспечивает высокопроизводительный и простой способ скрининга для отредактированных клеток. Следует отметить, что способы, изображенные на Фиг. 2E и 2F, используют как сингуляцию или существенную сингуляцию, так и стратегии отбора.
[0108] Примерные рабочие процессы, описанные в настоящем документе, используют концепцию сингуляции. Сингуляция преодолевает сдвиг роста в пользу неотредактированных клеток, обеспечивая таким образом отредактированным клеткам равное положение с неотредактированными клетками. Кроме того, эти способы используют преимущества жестко регулируемой индуцибeльной системы для отделения отредактированных клеток от неотредактированных клеток (как клеток обоих типов, в которых гРНК нефункциональна, так и клеток, в которых гРНК функциональны, но некоторый компонент системы на основе направляемой нуклеиновой кислотой нуклеазы не функционален). Скрининг может быть выполнен с использованием пластин-реплик и идентификации «беглецов» или клеток, в которых гРНК нефункциональна, скрининг может быть выполнен с использованием преимуществ задержки роста отредактированных клеток по сравнению с неотредактированными клетками, или обогащение может быть выполнено путем использования комбинации сингуляции или существенной сингуляции, начального роста, индукции редактирования и нормализации. Результат этих способов состоит в том, что даже в системах на основе направляемой нуклеиновой кислотой нуклеазы, где редактирование не является оптимальным (например, в системах, где мишенью являются неканонические PAM), происходит увеличение наблюдаемой эффективности редактирования; то есть отредактированные клетки могут быть идентифицированы даже на большом фоне неотредактированных клеток.
[0109] Следует отметить, что способы, изображенные на Фиг. 2B - 2F, показывают сингуляцию колонии клеток, начальный рост и индукцию редактирования на твердой среде в чашках для культивирования или в 96-луночных пластинах. Специалисту в данной области техники с учетом приведенного здесь обсуждения должно быть понятно, что сингуляция, начальный рост и индукция редактирования могут быть выполнены в других форматах, например в устройствах со сплошными стенками, описанных со ссылками на Фиг. 3A-3F и 4A-4CC, или как описано в патентном документе US № 62/735365, озаглавленном как «Обнаружение отредактированных нуклеазами последовательностей в автоматизированных модулях и системах», поданном 24 сентября 2018 г., и в патентном документе US № 62/781112, озаглавленном как «Улучшенное обнаружение отредактированных нуклеазами последовательностей в автоматизированных модулях и системах», поданном 18 декабря 2018 г., которые включают в себя описания сингуляции или существенной сингуляции путем изолирования клеток на функционализированных островах, сингуляции или существенной сингуляции внутри водных капелек, переносимых в гидрофобной жидкости-носителе, или гелевых шариков в эмульсии (GEM, см., например, 10X Genomics, Плезентон, Калифорния), или сингуляции или существенной сингуляции внутри полимеризованного альгинатного каркаса (для этого варианта осуществления сингуляции см. также патентный документ US № 62/769805, озаглавленный как «Улучшенное обнаружение отредактированных нуклеазой последовательностей в автоматизированных модулях и инструментах посредством массовой клеточной культуры», поданный 20 ноября 2018 г.).
Примерные модули для редактирования, обогащения и отбора отредактированных клеток
[0110] Инструменты, способы, и модули, описанные в настоящем документе, обеспечивают улучшенную наблюдаемую эффективность редактирования направляемых нуклеиновой кислотой способов редактирования нуклеазы как результат сингуляции или существенной сингуляции, начального роста клетки, индукции редактирования и нормализации. Комбинация процессов сингуляции или существенной сингуляции, начального роста, индукции редактирования и нормализации преодолевает сдвиг роста в пользу неотредактированных клеток, а также эффектов пригодности редактирования (включая разные скорости редактирования), обеспечивая таким образом всем клеткам равные возможности. Результат описанных в настоящем документе инструментов, модулей и способов состоит в том, что даже в системах на основе направляемой нуклеиновой кислотой нуклеазы, где редактирование не является оптимальным (например, в системах, где мишенью являются неканонические PAM), происходит увеличение наблюдаемой эффективности редактирования; то есть отредактированные клетки могут быть идентифицированы даже на большом фоне неотредактированных клеток. Наблюдаемая эффективность редактирования может быть улучшена до 80% или больше.
[0111] Фиг. 3A изображает устройство 350 со сплошной стенкой и рабочий процесс для сингуляции клеток в микролунках в устройстве со сплошной стенкой, где в этом рабочем процессе одна или обе - предпочтительно обе - из гРНК и нуклеазы находятся под управлением индуцибeльного промотора. На Фиг. (i) изображено устройство 350 со сплошной стенкой с микролунками 352. Секция 354 субстрата 350 показана на Фиг. (ii), также показаны микролунки 352. На Фиг. (iii) показано поперечное сечение устройства 350 со сплошной стенкой, где микролунки 352 загружены, причем в этом варианте осуществления имеет место пуассоновская или по существу пуассоновская загрузка; то есть каждая микролунка имеет одну или ни одной клетки, и вероятность того, что в любой одной микролунке имеется более одной клетки, мала. На Фиг. (iv) показан рабочий процесс 340, где субстрат 350, имеющий микролунки 352, показывает микролунки 356 с одной клеткой на микролунку, микролунки 357 без клеток в микролунках, и одну микролунку 360 с двумя клетками в микролунке. На стадии 351 клеткам в микролунках позволяют удвоиться приблизительно 2-150 раз, чтобы сформировать клональные колонии (v), затем редактирование индуцируется 353 путем нагрева субстрата (например, для термоиндуцируемого редактирования), или протекания химикатов под или над субстратом (например, сахаров, антибиотиков для химически индуцируемого редактирования), или путем перемещения устройства со сплошной стенкой в другую среду, в частности если устройство со сплошной стенкой размещается на мембране, которая формирует дно микролунок 352 (мембрана не показано).
[0112] После индуцирования редактирования 353 многие клетки в колониях клеток, которые были отредактированы, умирают в результате двухцепочечных разрезов, вызванных активным редактированием, и происходит задержка роста отредактированных клеток, которые выживают, но должны ремонтироваться и восстанавливаться после редактирования (микролунки 358), тогда как клетки, не подвергшиеся редактированию, процветают (микролунки 359) (vi). Всем клеткам дают возможность продолжить рост для образования колоний и нормализации, при этом колонии отредактированных клеток в микролунках 358 догоняют по размеру и/или количеству клеток клетки в микролунках 359, которые не подвергаются редактированию (vii). После того, как колонии клеток нормализуются, может иметь место либо объединение 360 всех клеток в микролунках, и в этом случае клетки обогащаются отредактированными клетками за счет устранения систематической ошибки из-за нередактируемых клеток и эффектов приспособляемости от редактирования; альтернативно рост колоний в микролунках отслеживается после редактирования, и медленно растущие колонии (например, клетки в микролунках 358) идентифицируются и выбираются 361 (например, «отбираются»), что приводит к еще большему обогащению отредактированных клеток.
[0113] При выращивании клеток используемая среда будет, конечно, зависеть от типа редактируемых клеток, например, бактериальных, дрожжевых или клеток млекопитающих. Например, среда для выращивания бактерий включает в себя LB, SOC, минимальную среду M9 и среду Magic; среда для роста дрожжевых клеток включает в себя TPD, YPG, YPAD и синтетическую минимальную среду; и среда для роста клеток млекопитающих включает в себя MEM, DMEM, IMDM, RPMI и среду Хэнкса. Для культивирования адгезивных клеток клетки могут быть размещены на шариках или другом типе каркаса, суспендированного в среде. Большинство нормальных клеток, происходящих из ткани млекопитающих, за исключением клеток, происходящих из гематопоэтической системы, зависят от закрепления и нуждаются в поддержке на поверхности или культуре клеток для нормальной пролиферации. В описанном в настоящем документе вращающемся флаконе для выращивания используется технология микроносителя. Микроносители конкретного назначения обычно имеют диаметр 100-300 мкм и плотность немного выше, чем у культуральной среды (что способствует легкому разделению клеток и среды, например, для замены среды), но плотность также должна быть достаточно низкой для того, чтобы обеспечить полное суспендирование носителей при минимальной скорости перемешивания, чтобы избежать гидродинамического повреждения клеток. Доступно множество различных типов микроносителей, и разные микроносители оптимизированы для разных типов клеток. Имеются положительно заряженные носители, такие как Cytodex 1 (на основе декстрана, GE Healthcare), DE-52 (на основе целлюлозы, Sigma-Aldrich Labware), DE-53 (на основе целлюлозы, Sigma-Aldrich Labware), HLX 11-170 (на основе полистирола); покрытые коллагеном или ECM (внеклеточным матриксом) носители, такие как Cytodex 3 (на основе декстрана, GE Healthcare) или HyQ-sphere Pro-F 102-4 (на основе полистирола, Thermo Scientific); незаряженные носители, такие как HyQspheres P 102-4 (Thermo Scientific); или макропористые носители на основе желатина (Cultisphere, Percell Biolytica) или целлюлозы (Cytopore, GE Healthcare).
[0114] Фиг. 3B изображает устройство 350 со сплошной стенкой и рабочий процесс для существенной сингуляции клеток в микролунках в устройстве со сплошной стенкой, где в этом рабочем процессе (как и в рабочем процессе, изображенном на Фиг. 3A) одна или обе - предпочтительно обе - из гРНК и нуклеазы находятся под управлением индуцибeльного промотора. На Фиг. (i) изображено устройство 350 со сплошной стенкой с микролунками 352. Секция 354 субстрата 350 показана на Фиг. (ii), также показаны микролунки 352. На Фиг. (iii) показано поперечное сечение устройства 350 со сплошной стенкой, где микролунки 352 загружены, причем в этом варианте осуществления имеет место по существу пуассоновская загрузка; то есть некоторые микролунки 357 не содержат никаких клеток, а некоторые микролунки 376, 378 содержат несколько клеток. На Фиг. 3B клетки с активными гРНК показаны как черные кружочки, а клетки с неактивными гРНК показаны как белые кружочки. На Фиг. (iv) показан рабочий процесс 370, где субстрат 350, имеющий микролунки 352, показывает три микролунки 376 с несколькими клетками, все с активными гРНК, микролунку 357 без клеток и две микролунки 378 с некоторыми клетками, имеющими активные гРНК, и некоторыми клетками, имеющими неактивные гРНК. На стадии 371 клеткам в микролунках позволяют удвоиться приблизительно 2-150 раз, чтобы сформировать клональные колонии (v), затем редактирование индуцируется 373 путем нагрева субстрата (например, для термоиндуцируемого редактирования), или протекания химикатов под или над субстратом (например, сахаров, антибиотиков для химически индуцируемого редактирования), или путем перемещения устройства со сплошной стенкой в другую среду, в частности если устройство со сплошной стенкой размещается на мембране, которая формирует дно микролунок 352.
[0115] После индуцирования редактирования 373 многие клетки в колониях клеток, которые были отредактированы, умирают в результате двухцепочечных разрезов, вызванных активным редактированием, и происходит задержка роста отредактированных клеток, которые выживают, но должны ремонтироваться и восстанавливаться после редактирования (микролунки 376), тогда как клетки, не подвергшиеся редактированию, процветают (микролунки 378) (vi). Таким образом, в микролунках 376, в которых находятся только клетки с активными гРНК (изображенные черными кружочками), большинство клеток умирает; однако в микролунках 378, содержащих клетки с неактивными гРНК (изображенные белыми кружочками), клетки продолжают расти и не подвергаются воздействию активного редактирования. Клеткам в каждой микролунке (376 и 378) дают возможность расти для продолжения образования колоний и нормализации, где колонии отредактированных клеток в микролунках 376 догоняют по размеру и/или количеству клеток неотредактированные клетки в микролунках 378, которые не подвергаются редактированию (vii). Следует отметить, что в этом рабочем процессе 370 колонии клеток в микролунках не являются клональными; то есть не все клетки в лунке происходят от единственной клетки. Вместо этого колонии клеток в лунке могут быть смешанными колониями, происходящими во многих лунках от двух или нескольких различных клеток. После того, как колонии клеток нормализуются, может иметь место либо объединение 390 всех клеток в микролунках, и в этом случае клетки обогащаются отредактированными клетками за счет устранения систематической ошибки из-за нередактируемых клеток и эффектов приспособляемости от редактирования; альтернативно рост колоний в микролунках отслеживается после редактирования, и медленно растущие колонии (например, клетки в микролунках 376) идентифицируются и выбираются 391 (например, «отбираются»), что приводит к еще большему обогащению отредактированных клеток.
[0116] Фиг. 3C представляет собой фотографию одного варианта осуществления субстрата со сплошной стенкой, содержащего микролунки для сингуляции клеток. Как видно на этой фотографии, субстрат со сплошной стенкой представляет собой перфорированный диск из металла, имеющий диаметр приблизительно 2 дюйма (~47 мм). Перфорированный диск, показанный на этой фотографии, изготавливается из нержавеющей стали 316, где перфорационные отверстия формируют стенки микролунок, а фильтр или мембрана используется для формирования дна микролунок. Использование фильтра или мембраны (такой как тканый мембранный фильтр 0,22 мкм PVDF DuroporeTM) позволяет среде и/или питательным веществам входить в микролунки, но препятствует вытеканию клеток вниз из микролунок. Фильтр или мембранные элементы, которые могут использоваться в модулях сингуляции или существенной сингуляции/начального роста/индукции редактирования и нормализации или отбора со сплошной стенкой, являются стойкими к растворителям, не загрязняющимися во время фильтрации и способны удерживать типы и размеры интересующих клеток. Например, для удержания малых клеток, таких как бактериальные клетки, размеры пор могут составлять всего 0,10 мкм, однако для других типов клеток размеры пор могут составлять 0,5 мкм. На самом деле, размеры пор, полезные в устройстве/модуле концентрации клеток, включают в себя фильтры с размерами отверстий 0,10 мкм, 0,11 мкм, 0,12 мкм, 0,13 мкм, 0,14 мкм, 0,15 мкм, 0,16 мкм, 0,17 мкм, 0,18 мкм, 0,19 мкм, 0,20 мкм, 0,21 мкм, 0,22 мкм, 0,23 мкм, 0,24 мкм, 0,25 мкм, 0,26 мкм, 0,27 мкм, 0,28 мкм, 0,29 мкм, 0,30 мкм, 0,31 мкм, 0,32 мкм, 0,33 мкм, 0,34 мкм, 0,35 мкм, 0,36 мкм, 0,37 мкм, 0,38 мкм, 0,39 мкм, 0,40 мкм, 0,41 мкм, 0,42 мкм, 0,43 мкм, 0,44 мкм, 0,45 мкм, 0,46 мкм, 0,47 мкм, 0,48 мкм, 0,49 мкм, 0,50 мкм и более. Фильтры могут быть изготовлены из любого подходящего материала, включая смешанный эфир целлюлозы (нитрат и ацетат целлюлозы) (CME), поликарбонат (PC), поливинилиденфторид (PVDF), полиэфирсульфон (PES), политетрафторэтилен (PTFE), нейлон или стекловолокно.
[0117] На фотографии, показанной на Фиг. 3C, перфорационные отверстия имеют диаметр приблизительно 150 мкм - 200 мкм, в результате чего микролунки имеют объем приблизительно 2,5 нл, а их общее количество составляет приблизительно 30000 микролунок. Расстояние между центрами микролунок составляет приблизительно 279 нм. Хотя здесь микролунки имеют объем приблизительно 2,5 нл, объем микролунок может составлять от 1 до 25 нл, или предпочтительно от 2 до 10 нл, и еще более предпочтительно от 2 до 4 нл. Предпочтительный размер/объем микролунок будет зависеть от типа клеток (например, бактериальные, дрожжевые, клетки млекопитающих). Перфорированный диск, показанный здесь, делается из нержавеющей стали 316; однако могут использоваться и другие биологически совместимые металлы и материалы. Устройство со сплошной стенкой может быть одноразовым или повторно используемым. Устройство со сплошной стенкой, показанное на Фиг. 3C, является круглым, но может иметь любую форму, например, квадратную, прямоугольную, овальную, и т.д. (см., например, Фиг. 4A). Круглые перфорированные диски являются полезными, если чашки Петри используются для снабжения модуля со сплошной стенкой питательными веществами посредством твердой среды, например, в чашке Петри или другой чашке для культивирования клеток. Фильтры, используемые для формирования дна микролунок устройства со сплошной стенкой, включают в себя тканые мембранные фильтры 0,22 мкм PVDF DuroporeTM. Кроме того, хотя показан перфорированный диск диаметром 2 дюйма (~47 мм), перфорированные диски могут быть по желанию меньше или больше, и конфигурация модуля со сплошной стенкой будет зависеть от того, как питательные вещества подаются в модуль со сплошной стенкой, и как выполняется замена среды. Например, см. перфорированный элемент на Фиг. 4A и варианты осуществления модуля со сплошной стенкой, показанные на Фиг. 4F-4BB.
[0118] Фиг. 3D-3F представляют собой фотографии клеток E.coli, по существу или в значительной степени сингулированных посредством пуассоновского или по существу пуассоновского распределения в микролунках или в отверстиях в перфорированном диске с мембранным дном, при низком, среднем и высоком увеличении, соответственно. Фиг. 3D показывает рост при низком увеличении, где более темные микролунки являются микролунками с растущими клетками. Фиг. 3E представляет собой вид сверху микролунок в перфорированном диске, где более темные микролунки являются микролунками с растущими клетками. Фиг. 3F представляет собой фотографию микролунок, где мембрана (например, проницаемая мембрана, которая формирует дно микролунок) была удалена, где микролунки без рисунка (гладкие) являются микролунками, в которых клетки не растут, а микролунки с неправильным пигментом/рисунком представляют собой микролунки, в которых растут клетки, и на этой фотографии они заполнили микролунки, в которых они растут. На этих фотографиях фильтр (мембрана) с отверстиями 0,2 мкм был приштампован в горячем виде под высоким давлением к перфорированному диску, такому как круглый перфорированный диск, изображенный на Фиг. 3C. Перфорированный диск формировал стенки микролунок, а фильтр формировал дно микролунок. Для загрузки перфорированного диска с фильтром клетки E.coli втягивались в микролунки с использованием вакуума (см. описание способов в Примере 6). Перфорированный диск с фильтром был затем помещен на агаровую пластину LB мембранной стороной вниз, и клетки выращивали в течение ночи при 30°C, а затем два дня при комнатной температуре. Затем мембрана была удалена, и открывшиеся снизу микролунки были сфотографированы с помощью оптического микроскопа. Следует отметить легкость, с которой можно использовать различные селективные среды для отбора определенных фенотипов клеток; то есть нужно только перенести перфорированный диск с фильтром на другую пластину или чашку Петри, содержащую желаемую селективную среду. Обычно количество клеток, загружаемых в устройство или узел сингуляции, колеблется от приблизительно 0,1X до 2,5X количества перфораций или микролунок, или от приблизительно 0,3X до 2,0X количества перфораций или микролунок, или от приблизительно 0,5X до 1,5X количества перфораций или микролунок.
[119] Фиг. 4A - 4BB изображают различные компоненты различных вариантов осуществления и компоненты модуля сингуляции или существенной сингуляции, роста, индукции редактирования и нормализация или отбора со сплошной стенкой («модуль изоляции/индукции/нормализации со сплошной стенкой» или «SWIIN»), подходящего для сингуляции (или существенной сингуляции) клеток всех типов, выращивания клеток для начальных, например, 2-150 циклов клеточного деления, индуцирования редактирования и нормализации или отбора получаемых колоний клеток. Представленные модули SWIIN могут быть автономными устройствами, или зачастую одним модулем в автоматизированном мультимодульном инструменте для обработки клеток. Фиг. 4A показывает перфорированный металлический лист или перфорированный элемент 401, который обычно имеет прямоугольную форму. Отверстия показаны не в масштабе. Как и в случае с перфорированным диском, описанным со ссылками на Фиг. 3C-3F, перфорированный элемент 401 изготовляется из нержавеющей стали 316, где отверстия формируют стенки микролунок, а фильтр или мембрана (не показанные на Фиг. 4A) используются для формирования дна микролунок.
[0120] На полученной с помощью сканирующего электронного микроскопа фотографии, показанной на Фиг. 4B, перфорационные отверстия (микролунки) имеют диаметр приблизительно 150 мкм - 200 мкм, а глубина перфорированного элемента составляет приблизительно 125, в результате чего микролунки имеют объем приблизительно 2,5 нл, а их общее количество составляет приблизительно 200000 микролунок. Расстояние между центрами микролунок составляет приблизительно 279 мкм. Хотя здесь микролунки имеют объем приблизительно 2,5 нл, объем микролунок может составлять от 1 до 25 нл, или предпочтительно от 2 до 10 нл, и еще более предпочтительно от 2 до 4 нл. Перфорированный элемент, изображенный на Фиг. 4A, имеет длину приблизительно 14 см и ширину 10 см (140 мм x 100 мм); однако перфорированные элементы меньшего размера (такие как показанный на Фиг. 3C) или большего размера могут использоваться в зависимости от плотности микролунок в перфорированном элементе и требуемого количества микролунок или перегородок. Например, чем большее плексность (например, сложность) библиотеки, используемой для редактирования популяции клеток, тем большее количество микролунок или перегородок является предпочтительным. Если, например, 10000-плексная библиотека используется для редактирования популяции клеток, перфорированного элемента с 200000 микролунок или перегородок будет более чем достаточно; однако если для редактирования популяции клеток используется 50000-плексная библиотека, предпочтительным может быть перфорированный элемент (или два или более элементов) с общим количеством микролунок или перегородок 400000 или больше. Обычно количество клеток, загружаемых в устройство или узел сингуляции, колеблется от приблизительно 0,1X до 2,5X количества перфораций или микролунок, или от приблизительно 0,3X до 2,0X количества перфораций или микролунок, или от приблизительно 0,5X до 1,5X количества перфораций или микролунок; таким образом количество клеток, загружаемых на перфорированный элемент, содержащий приблизительно 200000 перфораций, будет варьироваться от приблизительно 20000 до приблизительно 500000, или от приблизительно 60000 до приблизительно 400000, или от приблизительно 100000 до приблизительно 300000. Предпочтительный размер/объем микролунок будет зависеть от типа редактируемых клеток (например, археи, бактерии, дрожжи, эукариотические клетки, не относящиеся и/или относящиеся к млекопитающим). Перфорированный элемент, показанный здесь, делается из нержавеющей стали 316; однако могут использоваться и другие биологически совместимые металлы и материалы, такие как титан, сплавы на основе кобальта и керамика. SWIIN может быть одноразовым, или он может быть повторно используемым. При повторном использовании SWIIN может быть нагрет до 55°C или выше для его стерилизации, либо альтернативно он может быть промыт потоком антибиотиков.
[0121] Фиг. 4B-4E представляют собой полученные с помощью электронного микроскопа фотографии части перфорированного элемента 401 (Фиг. 4B), а также увеличенные виды одной микролунки 402 без (Фиг. 4C) и с (Фиг. 4D и 4E) фильтрующей мембраной, формирующей дно микролунки 402. Фиг. 4B показывает перфорированный элемент 401 и приблизительно 30 микролунок 402. Фиг. 4C также показывает перфорированный элемент 401 и единственную микролунку 402, имеющую приблизительно 172 мкм в диаметре. Фиг.4D показывает перфорированный элемент 401 и приблизительно 8 микролунок 402, каждая из которых имеет часть фильтра или мембраны 403, формирующую дно микролунки 402. Фиг. 4E представляет собой микроснимок с более высоким увеличением одной из микролунок 402 перфорированного элемента 401, показанного на Фиг. 4D. Как было описано выше для Фиг. 3C-3F, использование фильтра или мембраны (такой как тканый мембранный фильтр 0,22 мкм PVDF DuroporeTM) позволяет среде и/или питательным веществам входить в микролунки, но препятствует вытеканию клеток вниз из микролунок. Фильтр или мембранные элементы, которые могут использоваться для формирования дна микролунок перфорированного элемента в модуле сингуляции или существенной сингуляции/начального роста/индукции редактирования и нормализации/отбора со сплошной стенкой, являются стойкими к растворителям, не загрязняющимися во время фильтрации, нервущимися под давлением, требуемым для обмена среды и загрузки клеток, и способны удерживать типы и размеры интересующих клеток. Например, для удержания малых клеток, таких как бактериальные клетки, размеры пор могут составлять всего 0,2 мкм, однако для других типов клеток размеры пор могут составлять 0,5 мкм или больше. Фильтры могут быть изготовлены из любого подходящего материала, включая смешанный эфир целлюлозы (нитрат и ацетат целлюлозы) (CME), поликарбонат (PC), поливинилиденфторид (PVDF), полиэфирсульфон (PES), политетрафторэтилен (PTFE), нейлон или стекловолокно. Перфорированный элемент 401 и фильтр 403 штампуются вместе в горячем виде; то есть перфорированный элемент 401 и фильтр 403 спрессовываются под высоким давлением (например, 20 тыс. фунтов/кв.дюйм). В некоторых вариантах осуществления отверстия или перегородки в перфорированном элементе травятся с небольшим сужением, и материал фильтра вдавливается в отверстие, а затем ослабляется, чтобы образовать эффективную обжимку, обеспечивающую соединение без клея. В качестве альтернативы может использоваться клей.
[0122] Фиг. 4F изображает один вариант осуществления узла 420a сингуляции на виде сверху в перспективе, который представляет «удерживающую сторону» узла 420a сингуляции. Используемый в настоящем документе «узел сингуляции» содержит удерживающий элемент 404 в качестве верхнего элемента, проницаемый элемент 408 в качестве нижнего элемента, с уплотнением 416, окружающим перфорированный элемент 401 и фильтр 403, где уплотнение 416, перфорированный элемент 401 и фильтр 403 зажаты между удерживающим элементом 404 и проницаемым элементом 408. Удерживаемый и проницаемый элементы 404 и 408, соответственно, в вариантах осуществления, проиллюстрированных на Фиг. 4F - 4Q и 4Y, являются прозрачными и имеют приблизительно 200 мм в длину, 130 мм в ширину и 4 мм в толщину, хотя в других вариантах осуществления удерживаемый и проницаемый элементы могут иметь длину от 75 мм до 350 мм, или от 100 мм до 300 мм, или от 150 мм до 250 мм; ширину от 50 мм до 250 мм, или от 75 мм до 200 мм, или от 100 мм до 150 мм; и толщину от 2 мм до 15 мм, или от 4 мм до 10 мм, или от 5 мм до 8 мм. В вариантах осуществления, изображенных на Фиг. 4F - 4BB, удерживающие элементы изготовлены от PMMA (полиметилметакрилат); однако могут использоваться другие материалы, включая поликарбонат, сополимер циклического олефина (COC), стекло, поливинилхлорид, полиэтилен, полиамид, полипропилен, полисульфон, полиуретан, а также сополимеры этих и других полимеров. Уплотнение 416 является плоским, круговым образом окружающим перфорированный элемент 401 и фильтр 403, и делается из резины, силикона, нитрильного каучука, политетрафторэтилена, пластичного полимера, такого как полихлортрифторэтилен, или другого легко сжимаемого материала.
[0123] Удерживающий элемент 404 имеет в целом гладкую верхнюю поверхность; единственный канал 405 распределения (в данном случае расположенный по центру), который пересекает удерживающий элемент 404 от его верхней поверхности до его нижней поверхности и на большую часть длины удерживающего элемента 404 (подробности чего описываются в связи с Фиг. 4I); и гребни 406a, которые в данном случае располагаются на нижней поверхности удерживающего элемента 404 (например, рядом с перфорированным элементом 401), где гребни 406a пересекают дно удерживающего элемента 404 от одной стороны к другой (например, слева направо) (в этом варианте осуществления имеется приблизительно 28 гребней 406a). Используемое в настоящем документе для каналов распределения в удерживающем элементе или проницаемом элементе выражение «большая часть длины» означает приблизительно 95% длины удерживающего элемента или проницаемого элемента, или приблизительно 90%, 85%, 80%, 75% или 70% длины удерживающего элемента или проницаемого элемента. Направляющие 406 потока формируются между гребнями 406a. В дополнение к этому, удерживающий элемент 404 имеет единственное отверстие 407, которое позволяет вводить клетки в узел 420a сингуляции; а также имеется крышка 413 канала распределения, которая закрывает единственный канал 405 распределения в удерживающем элементе 404. В этом варианте осуществления канал 405 распределения имеет длину приблизительно 150 мм и ширину 1 мм; гребни 406a удерживающего элемента имеют приблизительно 0,5 мм в высоту и 80 мм в длину; и направляющие 406 потока удерживающего элемента имеют ширину приблизительно 5 мм. Объем жидкости в узле сингуляции составляет от 5 мл до 100 мл, или от 7,5 мл до 60 мл, или от 10 мл до 40 мл (для узла сингуляции с 200000 перфорационных отверстий).
[0124] В дополнение к удерживающему элементу 404, на Фиг. 4F также показаны застежки 412, центральный составной слой, содержащий уплотнение 416, окружающее перфорированный элемент 401, расположенный над фильтром или мембраной 403 (отдельные компоненты на Фиг. 4F не видны). Нижний слой узла 420a сингуляции, показанный на Фиг. 4F, формируется проницаемым элементом 408. Проницаемый элемент 408, как и удерживающий элемент 404, содержит один или более каналов распределения проницаемого элемента, гребни проницаемого элемента, направляющие потока проницаемого элемента, а также одно или более отверстий (ни одно из которых не показано на Фиг. 4F, но показано на Фиг. 4G). Узлы 420 сингуляции и модули 400 SWIIN, содержащие узлы 420 сингуляции, изготавливаются из материала, который выдерживает температуру от 4°C до 60°C. Нагревание и охлаждение модулей SWIIN обеспечиваются устройством Пельтье или термоэлектрическим холодильником; или может использоваться комбинация систем, например в многослойных модулях SWIIN (см., например, Фиг. 4BB и 4CC), таких как охлаждение с обратной компрессией Ренкина или абсорбционные тепловые насосы.
[0125] В модулях сингуляции или существенной сингуляции, роста, индукции редактирования и нормализации и/или отбора со сплошной стенкой («модуль изоляции/индукции/нормализации со сплошной стенкой» или «SWIIN»), описанных на Фиг. 4A - 4CC, клетки и среда (в разбавлении, подходящем для пуассоновского или по существу пуассоновского распределения клеток в микролунках перфорированного элемента) текут в канал 405 распределения через одно или более отверстий (на Фиг. 4F имеется одно отверстие 407) в удерживающем элементе 404, и клетки оседают в микролунках с пуассоновским или по существу пуассоновским распределением клеток в микролунках. Клетки удерживаются в микролунках, поскольку они не могут проходить через фильтр 403. После загрузки клеток подходящая среда может быть введена в узел сингуляции через удерживающий элемент; то есть среда вводится через отверстия 411 (Фиг. 4G), и среда проходит в каналы 409 распределения (Фиг. 4G) в проницаемом элементе 408, а затем распределяется направляющими 410 потока (Фиг. 4G) в проницаемом элементе 408. Среда в проницаемом элементе 408 может течь вверх через фильтр 403 для питания клеток, загруженных в микролунки. В процессе работы, когда клетки помещены в микролунки, они выращиваются для начальных, например, приблизительно 2-100 удвоений, редактирование индуцируется, например, путем повышения температуры SWIIN до 42°C, чтобы индуцировать температурно индуцибeльный промотор, или путем удаления среды для выращивания из проницаемого элемента (обратно через отверстия 411, см. Фиг. 4G) и замены среды для выращивания средой, содержащей химический компонент, который индуцирует индуцибeльный промотор. После редактирования температура SWIIN может быть уменьшена, или индуцирующая среда может быть удалена и заменена свежей средой, не содержащей химического компонента, и таким образом индуцибeльный промотор дезактивируется. Затем клеткам дают возможность продолжать расти в SWIIN до тех пор, пока рост клеточных колоний в микролунках не нормализуется. После того, как нормализация произошла, колонии вымываются из микролунок (например, путем приложения давления к проницаемому элементу 408, и таким образом к фильтру 403), и клетки в колониях объединяются; или, альтернативно, рост колоний клеток в микролунках отслеживается, и медленно растущие колонии отбираются напрямую, например, путем объединения клеток из медленно растущих колоний путем пипетирования медленно растущих клеток из микролунок в пробирку или другой сосуд, или колонии из отдельных микролунок могут быть выбраны и пипетированы, например, в отдельные лунки пластины с 96 или 384 лунками.
[0126] Рост колонии в узле сингуляции (и таким образом в модуле SWIIN) может отслеживаться автоматизированными устройствами, такими как продаваемые компанией JoVE (система ScanLagTM, Кембридж, Массачусетс) (см. также публикацию Levin-Reisman, et al., Nature Methods, 7:737-39 (2010)). Рост клеток, например для клеток млекопитающих, может отслеживаться, например, с помощью монитора роста, продаваемого компанией IncuCyte (Анн-Арбор, Мичиган) (см. также публикацию Choudhry, PLos One, 11(2):e0148469 (2016)). Кроме того, могут использоваться автоматические сборщики колоний, такие как продаваемые, например, компанией TECAN (система PickoloTM, Маннедорф, Швейцария); Hudson Inc. (RapidPickTM, Спрингфилд, Нью-Джерси); Molecular Devices (система QPix 400TM, Сан-Хосе, Калифорния); и Singer Instruments (система PIXLTM, Сомерсет, Великобритания).
[0127] Фиг. 4G изображает вариант осуществления узла 420a сингуляции, показанного на Фиг. 4F, на виде снизу в перспективе, который представляет дно проницаемого элемента 408 узла 420a сингуляции. Проницаемый элемент 408 содержит в целом гладкую нижнюю поверхность (которая на Фиг. 4G обращена вверх); два канала распределения (не показаны), закрытые крышкой 414 канала распределения, расположены с обеих сторон (слева/справа) дна проницаемого элемента 408. Также видны гребни 410a, которые здесь располагаются на верхней поверхности проницаемого элемента 408 (которая на Фиг. 4G обращена вниз) и пересекают верхнюю часть проницаемого элемента 408 справа налево (в этом варианте осуществления имеется приблизительно 28 гребней 410a), с направляющими 410 потока, формируемыми гребнями 410a. В дополнение к этому, проницаемый элемент 408 имеет два отверстия 411, которые подают жидкости в каналы распределения и забирают их оттуда (каналы здесь не видны, поскольку они закрыты крышками 414 канала распределения).
[0128] В дополнение к проницаемому элементу 404, на Фиг. 4F также показаны застежки 412, центральный составной слой, содержащий уплотнение 416, окружающее перфорированный элемент 401, обжатый фильтром или мембраной 403 (отдельные компоненты на Фиг. 4G не видны). Самый нижний слой узла 420a сингуляции на Фиг. 4G является удерживающим элементом 404. Следует отметить, что в вариантах осуществления, изображенных на Фиг. 4F-4CC, показаны застежки 412; однако другие средства могут использоваться для закрепления удерживающего элемента 404, уплотнения 416, перфорированного элемента 401, фильтра 403 и проницаемого элемента 408, например клейкие вещества, такие как чувствительное к давлению клейкое вещество, ультразвуковая сварка или связывание, соединение с помощью растворителя, сопряженные фитинги или комбинация клейких веществ, сварки, соединения с помощью растворителя и сопряженных фитингов; а также другие такие крепежные детали и соединения.
[0129] Фиг. 4H изображает вариант осуществления узла 420a сингуляции, показанного на Фиг. 4F и 4G, на разобранном виде сбоку в перспективе. Сверху на Фиг.4H виден удерживающий элемент 404, содержащий единственный канал 405 распределения, который пересекает удерживающий элемент 404 от его верхней поверхности до его нижней поверхности на большую часть длины удерживающего элемента 404 (подробности чего описываются в связи с Фиг. 4I); гребни 406a, которые располагаются на нижней поверхности удерживающего элемента 404 и пересекают нижнюю поверхность удерживающего элемента 404 слева направо (в этом варианте осуществления имеется приблизительно 26 гребней 406a), и направляющие 406 потока, которые формируются между гребнями 406a. В дополнение к этому, удерживающий элемент 404 имеет единственное отверстие 407, которое позволяет вводить клетки и другие жидкости и удалять их из удерживающего элемента 404, и таким образом вводить или удалять их из узла 420a сингуляции. Также имеется крышка 413 канала распределения, выполненная с возможностью вставляться и закрывать единственный канал 405 распределения.
[0130] Уплотнение 416, перфорированный элемент 401 и фильтр 403 можно более ясно разглядеть на этом разобранном виде узла 420a сингуляции, где перфорированный элемент 401 и фильтр 403 имеют очень похожие, если не идентичные, размеры, и уплотнение 416 выполнено с возможностью окружать перфорированный элемент 401 и фильтр 403 и обеспечивать надежное уплотнение между удерживающим элементом 404 и проницаемым элементом 408. На Фиг. 4H проницаемый элемент 408 изображен на виде сверху, где проницаемый элемент 408 содержит два канала 409 распределения, расположенных вдоль с обеих сторон (слева и справа) проницаемого элемента 408, гребни 410a, которые здесь располагаются на верхней поверхности проницаемого элемента 408 и пересекают верхнюю часть проницаемого элемента 408 от одной его стороны к другой (слева направо) (в этом варианте осуществления имеется приблизительно 28 гребней 410a), и направляющие 410 потока, которые формируются между гребнями 410a в проницаемом элементе 408. В дополнение к этому, проницаемый элемент 408 имеет два отверстия 411 (только одно из которых видно на Фиг. 4Н), которые подают жидкости в каналы 409 распределения, забирают их оттуда. Также видны крышки 414 канала распределения, которые не находятся на месте и не закрывают каналы 409 распределения. Также на Фиг. 4H видны застежки 412, хотя, опять же, другие средства для закрепления компонентов узла 420a сингуляции могут использоваться и предпочтительно используются для производственных узлов сингуляции.
[0131] Фиг. 4I представляет собой увеличенный вид в перспективе верхней поверхности удерживающего элемента 404, включая отверстие 407 (здесь с люэровским соединением от источника жидкости к отверстию 407 в удерживающем элементе 404), канал 405 распределения, который пересекает удерживающий элемент 404 от его верхней поверхности до его нижней поверхности на большую часть длины удерживающего элемента 404 и выполнен с возможностью подачи жидкости (и удаления жидкости) в направляющие 406 потока на нижней поверхности удерживающего элемента 408. Канал 405 распределения содержит направляющие поток отверстия 415, которые соответствуют направляющим 406 потока, поскольку направляющие 415 потока располагаются в канале 405 распределения между гребнями 406a удерживающего элемента. Крышка 413 канала распределения располагается на верхней поверхности удерживающего элемента 404, закрывая (и формируя верхнюю поверхность) канала 405 распределения.
[0132] Фиг. 4J представляет собой увеличенный вид поперечного сечения узла 420a сингуляции. На Фиг. 4J видно отверстие 407 для удерживаемого вещества замечается (с люэровским соединением от источника жидкости к отверстию 407), а также уплотнение 416, перфорированный элемент 401 и фильтр 403, отштампованные вместе в горячем виде и расположенные между удерживающим элементом 404 и проницаемым элементом 408. Также видны гребни 406a, которые располагаются на нижней поверхности удерживающего элемента 404, и направляющие 406 потока, которые формируются между гребнями 406a. В дополнение к этому видны гребни 410a, проницаемый элемент 408, а также направляющие 410 потока, которые формируются между гребнями 410a. Следует отметить, что гребни 406a на удерживающем элементе 404 и гребни 410a на проницаемом элементе 408 встречаются и совпадают друг с другом, и разделяются только перфорированным элементом 401 и фильтром 403, так что направляющие 406 и направляющие 410 потока также совпадают друг с другом. Также видны направляющие поток отверстия 415, которые соответствуют направляющим 406 потока, поскольку они располагаются между гребнями 406a удерживающего элемента. Гребни 406a на удерживающем элементе 404 и гребни 410a на проницаемом элементе 408 не только формируют направляющие 406 и 410 потока в удерживающем элементе 404 и проницаемом элементе 408, соответственно, но и обеспечивают поддержку узлу 420 сингуляции путем распределения давления по всему узлу 420 сингуляции и предотвращения разрывов фильтра или мембраны 403.
[0133] Фиг. 4K изображает другой вариант осуществления узла 420b сингуляции на виде сверху в перспективе, который представляет «удерживающую сторону» узла 420b сингуляции. Вариант осуществления узла 420b сингуляции, показанный на Фиг. 4K, отличается от узла 420a сингуляции, показанного на Фиг. 4F-4Н, тем, что удерживающий элемент 404 на Фиг. 4K-4M имеет два канала 405 распределения, расположенных вдоль с обеих сторон (слева и справа) удерживающего элемента 404 вместо единственного канала 405 распределения, расположенного посередине удерживающего элемента 404. Как и на Фиг. 4F-4H, удерживающий элемент 404, изображенный на Фиг. 4J-4M, содержит в целом гладкую верхнюю поверхность; два канала 405 распределения, которые пересекают удерживающий элемент 404 от его верхней поверхности до его нижней поверхности на большую часть длины удерживающего элемента 404; и гребни 406a, которые располагаются на нижней поверхности удерживающего элемента 404 и пересекают дно удерживающего элемента 404 от одной его стороны к другой, слева направо (в этом варианте осуществления имеется приблизительно 28 гребней 406a удерживающего элемента). Направляющие 406 потока формируются между гребнями 406a на удерживающем элементе 404. В дополнение к этому, удерживающий элемент 404 имеет два отверстия 407, которые позволяют клеткам и среде входить в узел 420b сингуляции и выходить из него. Также имеются крышки 413 канала распределения, которые закрывают два канала 405 распределения и фактически обеспечивают верхнюю поверхность каналов 405 распределения.
[0134] В дополнение к удерживающему элементу 404, на Фиг. 4 также K видны застежки 412, центральный составной слой, содержащий уплотнение 416, окружающее перфорированный элемент 401, расположенный выше фильтра или мембраны 403 и обжатый вместе с ним (отдельные компоненты не видны на Фиг. 4K). Нижний слой узла 420a сингуляции, показанного на Фиг. 4F, формируется проницаемым элементом 408. Проницаемый элемент 408, как и удерживающий элемент 404, содержит один или более (два на Фиг. 4L) каналов распределения проницаемого элемента, множество гребней и направляющие потока, а также одно или более отверстий (которые не показаны на Фиг. 4K, но видны на Фиг. 4L).
[0135] Как описывалось ранее со ссылками на Фиг. 4F-4Н, в модулях сингуляции или существенной сингуляции, роста, индукции редактирования и нормализации или отбора со сплошной стенкой («модуль изоляции/индукции/нормализации со сплошной стенкой» или «SWIIN»), описанных на Фиг. 4F-4CC, клетки и среда (в разбавлении, подходящем для пуассоновского или по существу пуассоновского распределения клеток в микролунках перфорированного элемента) текут в каналы 405 распределения из двух отверстий 407 в удерживающем элементе 404, и клетки оседают в микролунках с пуассоновским или по существу пуассоновским распределением клеток в микролунках. Клетки удерживаются в микролунках перфорированного элемента 401, поскольку они не могут проходить через фильтр 403. Подходящая среда вводится в узел 420b сингуляции через проницаемый элемент 408. Эта среда течет вверх через фильтр 403 для питания клеток. Таким образом, в процессе работы клетки помещаются в микролунки, выращиваются для начальных, например, приблизительно 2-100 удвоений, редактирование индуцируется, например, путем повышения температуры SWIIN до 42°C, чтобы индуцировать температурно индуцибeльный промотор, или путем удаления среды для выращивания из проницаемого элемента и замены среды для выращивания средой, содержащей химический компонент, который индуцирует индуцибeльный промотор. После редактирования температура SWIIN может быть уменьшена, или индуцирующая среда может быть удалена и заменена свежей средой, не содержащей химического компонента, активируя тем самым индуцибeльный промотор. Затем клеткам дают возможность продолжать расти в SWIIN до тех пор, пока рост клеточных колоний в микролунках не нормализуется. Как только колонии нормализуются, они вымываются из микролунок (путем приложения давления к каналам проницаемого элемента и направляющим потока, и таким образом к фильтру) и объединяются; альтернативно рост колоний клеток в микролунках отслеживается, и медленно растущие колонии отбираются напрямую, например, путем объединения клеток из медленно растущих колоний.
[0136] Фиг. 4L изображает вариант осуществления узла 420b сингуляции, показанного на Фиг. 4К, на виде снизу в перспективе, который представляет дно проницаемого элемента 408 узла 420b сингуляции. Проницаемый элемент 408 содержит в целом гладкую нижнюю поверхность (которая на Фиг. 4L обращена вверх); два канала распределения (не показаны), закрытые крышками 414 канала распределения (расположены с обеих сторон (слева и справа) проницаемого элемента 408), гребни 410a, которые располагаются на верхней поверхности проницаемого элемента 408 (которая на Фиг. 4L обращена вниз) и пересекают верхнюю часть проницаемого элемента 408 от одной его стороны к другой (в этом варианте осуществления имеется приблизительно 28 гребней 410a), а также направляющие 410 потока, которые формируются между гребнями 410a. В дополнение к этому, проницаемый элемент 408 имеет два отверстия 411, которые подают жидкости в каналы распределения и забирают их оттуда (каналы здесь не видны, поскольку они закрыты крышками 414 канала распределения), а затем направляют к направляющим 410.
[0137] В дополнение к проницаемому элементу 404, на Фиг. 4L также видны застежки 412, центральный составной слой, содержащий уплотнение 416, окружающее перфорированный элемент 401, расположенный выше фильтра или мембраны 403 и обжатый вместе с ним (отдельные компоненты не видны на Фиг. 4L), и самый нижним слоем узла 420b сингуляции на Фиг. 4L является удерживающий элемент 404. Опять же, следует отметить, что в вариантах осуществления, изображенных на Фиг. 4F-4CC, показаны застежки 412; однако другие средства могут использоваться для закрепления удерживающего элемента 408, уплотнения 416, перфорированного элемента 401, фильтра 403 и проницаемого элемента 408, например клейкие вещества, ультразвуковая сварка или связывание, соединение с помощью растворителя, сопряженные фитинги или комбинация клейких веществ, сварки, соединения с помощью растворителя и сопряженных фитингов; а также другие такие крепежные детали и соединения.
[0138] Фиг. 4М изображает вариант осуществления узла 420b сингуляции, показанного на Фиг. 4K и 4L, на разобранном виде сбоку в перспективе. Сверху на Фиг. 4M виден удерживающий элемент 404, содержащий два канала 405 распределения, расположенные с обеих сторон (слева и справа) удерживающего элемента 404, оба из которых пересекают удерживающий элемент 404 от его верхней поверхности до его нижней поверхности на большую часть длины удерживающего элемента 404; гребни 406a, которые располагаются на нижней поверхности удерживающего элемента 404 и пересекают нижнюю поверхность удерживающего элемента 404 от одной его стороны к другой (в этом варианте осуществления имеется приблизительно 28 гребней 406a), а также направляющие 406 потока, которые формируются между гребнями 406a. В дополнение к этому, удерживающий элемент 404 имеет два отверстия 407, которые позволяют клеткам и другим жидкостям входить в узел 420a сингуляции и выходить из него через каналы 405 распределения. Также имеются две крышки 413 канала распределения, которые выполнены с возможностью вставляться и закрывать два канала 405 распределения.
[0139] Уплотнение 416, перфорированный элемент 401 и фильтр 403 можно более ясно разглядеть на этом разобранном виде узла 420b сингуляции, где перфорированный элемент 401 и фильтр 403 имеют очень похожие размеры, и уплотнение 416 выполнено с возможностью окружать перфорированный элемент 401 и фильтр 403 и обеспечивать надежное уплотнение между удерживающим элементом 404 и проницаемым элементом 408. На Фиг. 4M проницаемый элемент 408 изображен на виде сверху, где проницаемый элемент 408 содержит два канала 409 распределения, расположенных вдоль с обеих сторон (слева и справа) проницаемого элемента 408, оба из которых пересекают проницаемый элемент 408 от его нижней поверхности до его верхней поверхности на большую часть длины проницаемого элемента 408, гребни 410a, которые здесь располагаются на верхней поверхности проницаемого элемента 408 и пересекают верхнюю часть проницаемого элемента 408 от одной его стороны к другой, и направляющие 410 потока, которые формируются между гребнями 410a. В дополнение к этому, проницаемый элемент 408 имеет два отверстия 411, показанные на Фиг. 4M как отверстия на удерживающем элементе 404, которые, когда узел 420b сингуляции собран, являются гидравлически связанными с каналами 409 распределения на проницаемом элементе 408, которые соединены с распределителями 410 потока, и таким образом с фильтром 403, расположенным на проницаемом элементе 408. Также видны крышки 414 канала распределения, которые показаны отдельно от узла 420b сингуляции на этом разобранном виде и не вставлены в проницаемый элемент 408, чтобы закрывать каналы 409 распределения. Также на Фиг. 4M видны отверстия для застежек 412 (застежки не показаны), хотя, опять же, другие средства, кроме застежек, могут использоваться для закрепления компонентов узла 420b сингуляции.
[0140] Фиг. 4N изображает другой вариант осуществления узла 420с сингуляции на виде сверху в перспективе, который представляет «удерживающую сторону» узла 420с сингуляции. Вариант осуществления узла 420с сингуляции, показанный на Фиг. 4N, отличается от узла 420a сингуляции, показанного на Фиг. 4F-4Н, тем, что удерживающий элемент 404 на Фиг. 4N-4Р имеет два канала 405 распределения, расположенных вдоль с обеих сторон (слева и справа) удерживающего элемента 404 вместо единственного канала 405 распределения, расположенного посередине удерживающего элемента 404. Вариант осуществления узла 420c сингуляции, показанный на Фиг. 4N, отличается от узла 420b сингуляции, показанного на Фиг. 4K - 4M, тем, что конфигурация каналов 405 распределения в удерживающем элементе 404 (и каналов 409 распределения в проницаемом элементе 408) на Фиг. 4N-4P отличается от конфигурации на Фиг. 4K-4M. Каналы 405 распределения (и каналы 409 распределения) на Фиг. 4N-4P являются разветвленными; то есть, вместо отверстия 407, подающего жидкости прямо в канал 405 распределения в той точке, где отверстие 407 пересекается с каналом 405 распределения, в варианте осуществления узла сингуляции, показанном на Фиг. 4N-4P, жидкости текут в отверстия 407, затем в разветвленные каналы 405 распределения с обеих сторон (слева и справа) удерживающего элемента 407. Разветвленные каналы распределения имеют первый трубопровод, который заканчивается приблизительно на полпути вниз вдоль длины удерживающего элемента 404, где первый трубопровод затем ветвится на два вторичных трубопровода, эти два вторичных трубопровода ветвятся на четыре третичных трубопровода, и эти третичные трубопроводы подают жидкости в конечный трубопровод, который проходит по всей длине удерживающего элемента, равномерно распределяя поступающие жидкости к направляющим 406 потока.
[0141] Следует отметить, что любая конфигурация каналов распределения (например, каналы 405 распределения на удерживающем элементе 404 и каналы 409 распределения на проницаемом элементе 408) может использоваться на удерживающем элементе 404 или проницаемом элементе 408, при условии, что каналы распределения должным образом распределяют жидкости к направляющим 406 или 410 потока. Как видно на Фиг. 4F-4Н, конфигурация каналов 405 распределения на удерживающем элементе 404 и каналов 409 распределения на проницаемом элементе 408 может различаться, или, как видно на Фиг. 4K-4M и Фиг. 4N-4P, конфигурация каналов 405 распределения на удерживающем элементе 404 и каналов 409 распределения на проницаемом элементе 408 может быть одинаковой. Как показано на Фиг. 4K-4M, удерживающий элемент 404, изображенный на Фиг. 4N-4P, содержит в целом гладкую верхнюю поверхность; два канала 405 распределения, слева и справа удерживающего элемента 404, которые пересекают удерживающий элемент 404 от его верхней поверхности до его нижней поверхности и ветвятся, распределяя таким образом жидкость по длине удерживающего элемента 404.
[0142] Удерживающий элемент 404 также содержит гребни 406a, которые располагаются на нижней поверхности удерживающего элемента 404 и пересекают дно удерживающего элемента 404 от одной его стороны до другой. В дополнение к этому, аналогично предыдущим вариантам осуществления, имеются направляющие 406 потока, которые формируются между гребнями 406a на удерживающем элементе 404; а также два отверстия 407, которые вводят и распределяют клетки и среду в удерживающий элемент 404 узла 420c сингуляции (и удаляют клетки и среду из него). Также видны крышки 413 канала распределения, которые покрывают два разветвленных канала 405 распределения на удерживающем элементе 404 и фактически обеспечивают верхнюю поверхность разветвленных каналов 405 распределения. Следует отметить, что разветвление для каналов 405 распределения является частью удерживающего элемента 404 в этом варианте осуществления; однако удерживающий элемент 404 может не содержать ответвлений, и разветвление может присутствовать на крышках 413 канала распределения, которые сопряжены с удерживающим элементом 404.
[0143] В дополнение к удерживающему элементу 404 на Фиг. 4N также видны застежки 412, центральный составной слой, содержащий уплотнение 416, окружающее перфорированный элемент 401, расположенный выше фильтра или мембраны 403 и обжатый вместе с ним. Нижний слой узла 420с сингуляции, показанного на Фиг. 4F, формируется проницаемым элементом 408. Проницаемый элемент 408, как и удерживающий элемент 404, содержит один или более (два на Фиг. 4O) каналов распределения (в данном случае разветвленных), гребни, направляющие потока, и одно или более отверстий (которые не показаны на Фиг. 4N, но видны на Фиг. 4O).
[0144] Фиг. 4О изображает вариант осуществления узла 420с сингуляции, показанного на Фиг. 4N, на виде снизу в перспективе, который представляет дно проницаемого элемента 408 узла 420с сингуляции. Проницаемый элемент 408 содержит в целом гладкую нижнюю поверхность (которая на Фиг. 4O обращена вверх); два разветвленных канала 409 распределения, закрытые крышками 414 канала распределения, гребни 410a, расположенные на верхней поверхности проницаемого элемента 408 (которая на Фиг. 4O обращена вниз) и пересекающие верхнюю поверхность проницаемого элемента 408 от одной его стороны к другой, а также направляющие 410 потока, которые формируются между гребнями 410a. В дополнение к этому, проницаемый элемент 408 имеет два отверстия 411, которые подают жидкости в разветвленные каналы 409 распределения и к направляющим 410 потока. Как и в случае с удерживающим элементом 404 и крышками 413 канала распределения, разветвление для каналов 409 распределения в проницаемом элементе 408 является частью проницаемого элемента 408; однако проницаемый элемент 408 может не содержать ответвлений, и разветвление вместо этого может присутствовать на крышках 414 канала распределения, которые сопряжены с проницаемым элементом 408.
[0145] В дополнение к проницаемому элементу 404, на Фиг. 4О также видны застежки 412, центральный составной слой, содержащий уплотнение 416, окружающее перфорированный элемент 401, расположенный выше фильтра или мембраны 403 (отдельные компоненты не видны на Фиг. 4М), и самый нижним слоем узла 420а сингуляции на Фиг. 4О является удерживающий элемент 404.
[0146] Фиг. 4Р изображает вариант осуществления узла 420с сингуляции, показанного на Фиг. 4N и 4О, на разобранном виде сбоку в перспективе. Сверху на Фиг. 4P виден удерживающий элемент 404, содержащий два разветвленных канала 405 распределения, расположенные с обеих сторон (слева и справа) удерживающего элемента 404, оба из которых пересекают удерживающий элемент 404 от его верхней поверхности до его нижней поверхности, где ответвления пересекают большую часть длины удерживающего элемента 404; гребни 406a, которые располагаются на нижней поверхности удерживающего элемента 404 и пересекают нижнюю поверхность удерживающего элемента 404 от одной его стороны к другой, а также направляющие 406 потока, которые формируются между гребнями 406a. В дополнение к этому, удерживающий элемент 404 имеет два отверстия 407, которые гидравлически соединены с разветвленными каналами 405 распределения и направляющими 406 потока и выполнены с возможностью ввода клеток и других жидкостей в узел 420a сингуляции, а также вывода клеток и других жидкостей из узла 420a сингуляции. Также имеются крышки 413 канала распределения, которые выполнены с возможностью вставляться в два разветвленных канала 405 распределения и закрывать их.
[0147] Уплотнение 416, перфорированный элемент 401 и фильтр 403 можно более ясно разглядеть на этом разобранном виде узла 420с сингуляции, где перфорированный элемент 401 и фильтр 403 имеют очень похожие размеры, и уплотнение 416 выполнено с возможностью окружать перфорированный элемент 401 и фильтр 403 и обеспечивать надежное уплотнение между удерживающим элементом 404 и проницаемым элементом 408. На Фиг. 4P проницаемый элемент 408 изображен на виде сверху, где проницаемый элемент 408 содержит два разветвленных канала 409 распределения, расположенных вдоль с обеих сторон (слева и справа) проницаемого элемента 408, оба из которых пересекают проницаемый элемент 408 от его нижней поверхности до его верхней поверхности и обеспечивают разветвленные трубопроводы для большей части длины проницаемого элемента 408. Проницаемый элемент 408 дополнительно содержит гребни 410a, которые в данном случае располагаются на верхней поверхности проницаемого элемента 408 и пересекают верхнюю часть проницаемого элемента 408 от одной его стороны до другой, и направляющие 410 потока, которые формируются между гребнями 410a проницаемого элемента. В дополнение к этому, проницаемый элемент 408 имеет два отверстия 411 (на Фиг. 4P видно только одно отверстие 411). Также видны крышки 414 канала распределения, которые показаны отдельно от узла 420c сингуляции на этом разобранном виде и не закрывают разветвленные каналы 409 распределения. Также на Фиг. 4N видны застежки 412, хотя, опять же, другие средства, кроме застежек, могут использоваться для закрепления компонентов узла 420с сингуляции.
[0148] Фиг. 4Q представляет собой увеличенный вид сверху удерживающего элемента 404, показанного на Фиг. 4N и 4P. Видны гребни 406a, которые располагаются на нижней поверхности удерживающего элемента 404 и пересекают нижнюю поверхность удерживающего элемента 404 от одной его стороны до другой, и направляющие 406 потока, которые формируются между гребнями 406a. Дополнительно виден канал 405 распределения, содержащий направляющие поток отверстия, выполненные с возможностью распределения жидкости в направляющие 406 потока, где канал 405 распределения закрыт крышкой 413 канала распределения.
[0149] Фиг. 4R представляет собой увеличенный вид поперечного сечения удерживающего элемента 404, с гребнями 406a и направляющими 406 потока, которые формируются между гребнями 406a. Также виден проницаемый элемент 408 с гребнями 410a и направляющими 410 потока, которые формируются между гребнями 410a проницаемого элемента. Между удерживающим элементом 404 и проницаемым элементом 408 располагаются уплотнение 416, перфорированный элемент 401 и фильтр 403. Следует отметить, что гребни 406a на удерживающем элементе 404 и гребни 410a являются совпадающими друг с другом, и разделяются только перфорированным элементом 401 и фильтром 403. Как было описано ранее, гребни 406a и гребни 410a обеспечивают поддержку перфорированному элементу 401 и фильтру 403 и уменьшают вероятность разрыва фильтра 403 во время, например, загрузки клеток или замены среды.
[0150] Фиг. 4S-4W изображают различные виды одного варианта осуществления модуля 400 сингуляции или существенной сингуляции, роста, индукции редактирования и нормализации или отбора на сплошной стенке (SWIIN). Фиг. 4S показывает вид в перспективе модуля 400 SWIIN. Модуль 400 SWIIN содержит, например, один из примерных узлов сингуляции, показанных на Фиг. 4F-4Н, 4K-4M и 4N-4P, которые размещены в крышке 440 SWIIN и являются одной частью модуля SWIIN. Различные компоненты крышки 440 SWIIN включают в себя крышку 442 резервуара, захват 441, окна 444 (показано шесть окон), ножки 443 и штриховой код (или другую идентификационную информацию) 445. Следует отметить, что в вариантах осуществления, изображенных на Фиг. 4S-4Z, окна являются круглыми; однако специалисту в данной области техники будет понятно, что окна могут иметь любую форму. Как правило, желательно, чтобы 30% или более удерживающего элемента были доступны для просмотра, чтобы получить приемлемую статистику по загрузке клеток. Также видна крышка 430a резервуарного узла, которая в данном варианте осуществления не формуется вместе с крышкой 440 SWIIN, а находится внутри части 442 крышки резервуара крышки 440 SWIIN. Крышка 430a резервуарного узла содержит четыре отверстия доступа к резервуару (432a, 432b, 432c и 432d), а также четыре отверстия пневматического доступа (433a, 433b, 433c, и 433d). Отверстия пневматического доступа 433a, 433b, 433c, и 433d в большинстве вариантов осуществления включают в себя фильтры для предотвращения загрязнения.
[0151] Окна 444 могут использоваться для отслеживания загрузки клеток и/или роста клеток с помощью камеры (например, видеокамеры). Например, видеокамера может использоваться для мониторинга роста клеток, например, путем измерений изменения плотности на основе изображения пустой лунки с помощью фазового контраста, или если, например, используется хромогенный маркер, такой как хромогенный белок, чтобы добавить клеткам различимый цвет. Хромогенные маркеры, такие как блитцен синий, дрейдл бирюзовый, вирджиния фиолетовый, виксен пурпурный, пранцер пурпурный, блестящий пурпурный, маккаби пурпурный, доннер фуксин, купидоновый розовый, серафина розовый, грубый оранжевый и леор оранжевый (Набор хромогенных белковых красителей, производства компании ATUM (Ньюарк, Калифорния)) устраняют потребность в использовании флюоресценции, хотя флуоресцентные клеточные маркеры, флуоресцентные белки и хемилюминесцентные клеточные маркеры также могут использоваться.
[0152] Фиг. 4T представляет собой вид сверху модуля 400 SWIIN, показывающий крышку 440 SWIIN и различные ее компоненты, включая крышку 442 резервуара, захват 441, окна 444 (показано шесть окон), ножки 443 и штриховой код (или другую идентификационную информацию) 445. Также видна крышка 430a резервуарного узла, расположенная внутри части 442 крышки резервуара крышки 440 SWIIN, где крышка 430a резервуарного узла содержит четыре отверстия доступа к резервуару (432a, 432b, 432c и 432d) и четыре отверстия пневматического доступа (433a, 433b, 433c и 433d).
[0153] Фиг. 4U представляет собой вид сбоку модуля 400 SWIIN, показывающий крышку 440 SWIIN, крышку 442 резервуара, захват 441 и ножки 443. Фиг. 4V представляет собой вид от конца со штриховым кодом модуля 400 SWIIN к концу с резервуаром модуля 400 SWIIN. Видны крышка 400 SWIIN, крышка 442 резервуара, захват 441 и ножки 443. Фиг. 4W представляет собой вид снизу в перспективе модуля 400 SWIIN, показывающий крышку 440 SWIIN, крышку 442 резервуара, ножки 443, а также крышки 414 канала распределения, расположенные внизу проницаемого элемента 408.
[0154] Фиг. 4X-4Z показывают резервуарный узел 430. На Фиг. 4X резервуарный узел 430 располагается на узле 420 сингуляции, содержащем удерживающий элемент 404; крышки 413 канала распределения; узел уплотнения, перфорированного элемента и фильтра (не показан подробно), и проницаемый элемент (также не показан подробно). Резервуарный узел 430 содержит крышку 430a резервуарного узла, имеющую четыре отверстия доступа к резервуару (432a, 432b, 432c и 432d) и четыре отверстия пневматического доступа (433a, 433b, 433c и 433d).
[0155] Фиг. 4Y представляет собой вид сверху в перспективе поперечного сечения резервуарного узла 430 на «резервуарном» конце крышки 440 SWIIN. Видны ножки 443 крышки 440 SWIIN. Видны резервуары 431a, 431b, 431c и 431d, а также отверстия резервуара/канала 434a, 434b, 434c и 434d. Резервуары 431b и 431c гидравлически связаны с трубопроводами, которые гидравлически связаны с каналами распределения на удерживающем элементе или с каналами распределения на проницаемом элементе, а резервуары 431a и 431d гидравлически связаны с трубопроводами, которые гидравлически связаны с каналами распределения на удерживающем элементе или каналами распределения на проницаемом элементе; то есть, если резервуары 431b и 431c гидравлически связаны с трубопроводами, которые связаны с каналами распределения на удерживающем элементе, тогда резервуары 431a и 431d гидравлически связаны с трубопроводами, которые связаны с каналами распределения на проницаемом элементе. Однако любой резервуар может быть выполнен с возможностью подачи жидкостей и удаления жидкостей для удерживающего элемента 404 или проницаемого элемента 408. Резервуары 431a, 431b, 431c и 431d обычно имеют объем от 5,0 до 100 мл, или от 7,5 до 60 мл, или от 10 до 40 мл (для узла сингуляции с 200000 перфорационных отверстий). Следует отметить, что резервуары 431a, 431b, 431c и 431d являются воронкообразными в части резервуара, ведущей к отверстиям резервуара/канала 434a, 434b, 434c и 434d, и помогают подаче жидкостей из резервуаров 431a, 431b, 431c и 431d.
[0156] Фиг. 4Z показывает три различных вида четырех соединенных резервуаров 435. Верхний чертеж представляет собой вид сверху соединенных резервуаров 435, средний чертеж представляет собой вид сбоку соединенных резервуаров 435, и нижний чертеж представляет собой вид снизу соединенных резервуаров 435. Резервуары 431a, 431b, 431c и 431d видны на всех чертежах, а отверстия резервуара/канала 434a, 434b, 434c и 434d видны на верхнем и нижнем чертежах.
[0157] Фиг. 4AA представляет собой примерную пневматическую блок-схему, подходящую для модуля SWIIN, изображенного на Фиг. 4S-4W и, например, использующего узлы сингуляции, описанные со ссылками на Фиг. 4F-4R. Следует отметить, что имеется два электромагнитных клапана (SV) для каждого резервуара - двух резервуаров удерживаемого вещества (RR1 и RR2) и двух резервуаров пермеата (PR1 и PR2) - где один из клапанов предназначен для пневматики, и один из клапанов служит для блокировки линии. Следует отметить, что для каждой пары электромагнитных клапанов имеется реометр. Кроме того, в этом варианте осуществления имеется единственный трубопровод, обслуживающий все резервуары; однако другие варианты осуществления могут использовать два трубопровода, где PR1 и RR1 обслуживаются одним трубопроводом, а PR2 и RR2 обслуживаются другим трубопроводом, или каждый резервуар (PR1, RR1, PR2, RR2) может обслуживаться отдельным трубопроводом.
Таблица 1. Состояния клапанов и давление
Таблица 2. Объемы резервуаров
[0158] Фиг. 4BB показывает двухслойный модуль 460 SWIIN, с корпусом, который содержит два узла сингуляции (узлы сингуляции на Фиг. 4AA не видны). Фиг. 4CC графически изображает четырехслойный модуль 465 SWIIN, содержащий четыре узла 420 сингуляции. Фиг. 4BB графически изображает устройство 466 Пельтье и вентилятор 467 с принудительным воздушным потоком 468, который может использоваться для поддержания желаемой температуры четырех узлов 420 сингуляции; однако следует отметить, что в многослойных SWIIN может использоваться комбинация систем, таких как охлаждение с обратной компрессией Ренкина или абсорбционные тепловые насосы.
[0159] Фиг. 4DD представляет собой диаграмму примерной пневматической архитектуры для двухслойного SWIIN, показывающую вместе с Таблицами 1 и 2 один вариант осуществления пневматики, используемой для сингуляции или существенной сингуляции, роста, инициирования редактирования и нормализации клеток в модуле SWIIN, описанном со ссылкой на Фиг. 4BB. На Фиг. 4DD видны четыре резервуара пермеата (PR1, PR2, PR3 и PR4) и четыре резервуара удерживаемого вещества (RR1, RR2, RR3 и RR4). Имеется четыре реометра (FM1, FM2, FM3 и FM4), десять трехходовых электромагнитных клапанов («3SV»), датчик давления, опорный клапан для регулировки давления и насос, способный обеспечивать давление от -5 до 5 фунтов на кв.дюйм. NC означает «нормально закрытый», NO означает «нормально открытый», а C означает «закрытый». Таблица 1 для каждой стадии процесса концентрации клеток показывает состояние каждого клапана, показанного на Фиг. 4CC, и давление, определяемое датчиками давления 1 и 2. В Таблице 1 для насоса 1=вкл, а 0=выкл. Для электромагнитных клапанов 1=вкл, а 0=выкл. Таблица 2 для каждой стадии процесса концентрации клеток показывает объем в мл жидкости в каждом резервуаре (то есть в четырех резервуарах для удерживаемого вещества и в четырех резервуарах для пермеата). Показан перфорированный элемент 401, а также температурная зона 499.
[0160] В дополнение к устройству сингуляции клеток со сплошными стенками (SWIIN), описанному со ссылками на Фиг. 3A-3E и 4A-4BB, другие устройства сингуляции (или существенной сингуляции) клеток могут использоваться в мультимодульном инструменте для обработки клеток, таком как описанные в патентном документе US № 62/735365, озаглавленном как «Обнаружение отредактированных нуклеазами последовательностей в автоматизированных модулях и системах», поданном 24 сентября 2018 г., и в патентном документе US № 62/781112, озаглавленном как «Улучшенное обнаружение отредактированных нуклеазами последовательностей в автоматизированных модулях и системах», поданном 18 декабря 2018 г., которые включают в себя сингуляцию или существенную сингуляцию путем посева на агар-агаре, сингуляцию или существенную сингуляцию путем изолирования клеток на функционализированных островах, сингуляцию или существенную сингуляцию внутри водных капелек, переносимых в гидрофобной жидкости-носителе, или гелевых шариков в эмульсии (GEM, см., например, 10X Genomics, Плезентон, Калифорния), или сингуляцию или существенную сингуляцию внутри полимеризованного альгинатного каркаса (для этого варианта осуществления сингуляции см. также патентный документ US № 62/769805, озаглавленный как «Улучшенное обнаружение отредактированных нуклеазой последовательностей в автоматизированных модулях и инструментах посредством массовой клеточной культуры», поданный 20 ноября 2018 г.).
Автоматизированные инструменты и модули для редактирования клеток
Автоматизированные инструменты для редактирования клеток
[0161] Фиг. 5A изображает примерный автоматизированный мультимодульный инструмент 500 обработки клеток, предназначенный для, например, выполнения одного из примерных технологических процессов, описываемых ниже, содержащий один или более картриджей реагента, описанных в настоящем документе. Инструмент 500, например, может быть и предпочтительно проектируется как автономный настольный инструмент для использования в лабораторных условиях. Инструмент 500 может включать в себя смесь повторно используемых и одноразовых компонентов для выполнения различных интегрированных процессов при проведении автоматического расщепления генома и/или редактирования в клетках. Проиллюстрирован портал 502, обеспечивающий автоматизированную механическую систему перемещения (исполнительный механизм) (не показан), который обеспечивает управление перемещением по осям XYZ для, например, автоматизированной (то есть роботизированной) системы 558 обработки жидкости, включающей, например, пипеттор 532 с вытеснением воздухом, которая обеспечивает обработку клеток во множестве модулей без человеческого вмешательства. В некоторых автоматизированных мультимодульных инструментах обработки клеток пипеттор 532 с вытеснением воздухом перемещается порталом 502, а различные модули и картриджи реагента остаются неподвижными; однако в других вариантах осуществления система 558 обработки жидкости может оставаться неподвижной, в то время как различные модули и картриджи реагента перемещаются. Также в автоматизированный мультимодульный инструмент 500 для обработки клеток включается картридж 510 реагента, содержащий резервуары 512 и модуль 530 трансформации (например, проточное устройство электропорации, подробно описанное со ссылками на Фиг. 8A-8E), а также промывочный картридж 504, содержащий резервуары 506. Промывочный картридж 504 может быть выполнен с возможностью размещения больших пробирок, например, промывочных растворов или растворов, которые часто используются в итеративном процессе. В одном примере промывочный картридж 504 может быть выполнен с возможностью оставаться на месте, когда два или более картриджей 510 реагента последовательно используются и заменяются. Хотя картридж 510 реагента и промывочный картридж 504 показаны на Фиг. 5A как отдельные картриджи, содержимое промывочного картриджа 504 может быть включено в картридж 510 реагента. Картридж 510 реагента и промывочный картридж 504 могут быть идентичными, за исключением вставляемых в них расходных материалов (реагентов или других компонентов, содержащихся внутри различных вставок). Следует отметить, что в этом варианте осуществления модуль 530 трансформации содержится внутри картриджа 510 реагента; однако в альтернативных вариантах осуществления модуль 530 трансформации содержится внутри его собственного модуля или может быть частью другого модуля, такого как модуль выращивания.
[0162] В некоторых реализациях промывочные картриджи и картриджи реагента 504 и 510 содержат одноразовые комплекты (одну или больше различных вставок и реагентов), предусмотренные для использования в автоматизированном мультимодульном инструменте 500 для обработки/редактирования клеток. Например, пользователь может открыть и установить каждый из картриджа 510 реагента и промывочного картриджа 504, содержащих различные желаемые вставки и реагенты, в шасси автоматизированного мультимодульного инструмента 500 для редактирования клеток перед активацией обработки клеток.
[0163] Также на Фиг. 5A проиллюстрирована автоматизированная система 558 обработки жидкости, включающая портал 502 и пипеттор 532 с воздушным вытеснением. В некоторых примерах автоматизированная система 558 может включать в себя автоматизированные системы обработки жидкости, производимые компанией Tecan Group Ltd., Маннедорф, Швейцария, компанией Hamilton Company, Рено, Невада (см., например, патентный документ WO2018015544A1), или компанией Beckman Coulter, Inc., Форт Коллинз, Колорадо (см. например, патентный документ US20160018427A1). Наконечники для пипеток могут быть предусмотрены в комплекте наконечников (не показан) для использования с пипеттором 532 с воздушным вытеснением.
[0164] Вставки или компоненты промывочного картриджа и картриджа реагента 504, 510 в некоторых реализациях маркируются машиночитаемым кодом (не показан), таким как штриховой код, для распознавания автоматизированной системой 558. Например, роботизированная система 558 обработки жидкости может сканировать одну или несколько вставок в каждом из промывочного картриджа и картриджа реагента 504, 510 для подтверждения содержимого. В других реализациях машиночитаемые знаки могут быть нанесены на каждый из промывочного картриджа и картриджа реагента 504, 510, и система обработки (не показана, но см. элемент 526 на Фиг. 5B) автоматизированного мультимодульного инструмента 500 для редактирования клеток может идентифицировать карту хранящихся материалов на основе этих машиночитаемых знаков. Примерный автоматизированный мультимодульный инструмент 500 для обработки клеток, показанный на Фиг. 5A, дополнительно содержит модуль 534 выращивания клеток. (Все модули, кратко упомянутые здесь, будут более подробно описаны ниже). В варианте осуществления, проиллюстрированном на Фиг. 5A, модуль 534 выращивания клеток содержит два флакона 518, 520 для роста клеток (более подробно описанные ниже со ссылкой на Фиг. 6A-6D), а также модуль 522 концентрации клеток (подробно описываемый со ссылками на Фиг. 7A-7H). В альтернативных вариантах осуществления модуль 522 концентрации клеток может быть отдельным от модуля 534 выращивания клеток, например, может находиться в отдельном, специализированном модуле. Также в качестве части автоматизированного мультимодульного инструмента 500 для обработки клеток на Фиг. 5A показан модуль 540 сингуляции, обслуживаемый, например, роботизированной системой 558 обработки жидкости и пипеттором 532 с вытеснением воздухом. Также виден необязательный модуль 514 сборки/обессоливания нуклеиновых кислот, содержащий реакционную камеру или емкость для пробирки (не показаны) и магнит 516 для очистки нуклеиновых кислот с использованием, например, шариков с магнитной твердофазной обратимой иммобилизацией (SPRI) (Applied Biological Materials Inc., Ричмонд, Британская Колумбия. Модуль выращивания клеток, модуль концентрации клеток, модуль трансформации, картридж реагента и модуль сборки нуклеиновой кислоты описываются более подробно ниже, а примерный модуль сингуляции подробно описан выше со ссылками на Фиг. 3A-3E и 4A-4BB.
[0165] Фиг. 5B показывает вид сверху примерного мультимодульного инструмента 500 для обработки клеток, изображенного на Фиг. 5A. Исходные материалы на основе картриджа (например, в картридже 510 с реагентами), например, могут быть расположены в специально отведенных местах на платформе 502 инструмента 500 для доступа роботизированного манипулятора (не показан на этом чертеже). Как проиллюстрировано на Фиг. 5B, платформа может включать в себя защитный слив, так что загрязняющие вещества, проливающиеся, капающие или переливающиеся из любого из модулей инструмента 500, содержатся внутри буртика защитного слива. В дополнение к картриджу 510 реагента, на Фиг. 5B также видны промывочный картридж 504, модуль 540 сингуляции и часть модуля 534 выращивания. Также на этом изображении видны сенсорный экран 550, элементы управления 538 модуля преобразования, стойка 536 для электроники и система 526 обработки.
[0166] Фиг. 5C-5D иллюстрируют вид сбоку и вид спереди, соответственно, мультимодульного инструмента 500 для обработки клеток, содержащего шасси 590 для использования в настольных версиях автоматизированного мультимодульного инструмента 500 для редактирования клеток. Например, шасси 590 может иметь ширину приблизительно 24-48 дюймов, высоту приблизительно 24-48 дюймов и глубину приблизительно 24-48 дюймов. Шасси 590 может быть и предпочтительно предназначено для размещения всех модулей и расходных материалов, используемых при автоматизированной обработке клеток, а также для выполнения всех необходимых процессов без вмешательства человека (то есть шасси 590 выполнено с возможностью обеспечения интегрированного автономного автоматизированного мультимодульного инструмента для обработки клеток). На шасси 590 может быть установлена роботизированная система 558 обработки жидкости для перемещения материалов между модулями. Как проиллюстрировано на Фиг. 5C, шасси 590 включает в себя крышку 552, имеющую ручку 554 и шарнир 556a (шарниры 556b и 556c видны на Фиг. 5D) для поднятия крышки 552 и получения доступа внутрь шасси 590. Охлаждающая решетка 564 (Фиг. 5C) позволяет воздуху проходить через внутренний вентилятор (не показан). Кроме того, шасси 590 поднимается с помощью регулируемых ножек 570a, 570c (ножки 570, 570b показаны на Фиг. 5D). Регулируемые ножки 570a-570c, например, могут обеспечивать дополнительный воздушный поток под шасси 590. Кнопка 566 управления в некоторых вариантах осуществления обеспечивает однокнопочный автоматический запуск и/или остановку обработки клеток в автоматизированном мультимодульном инструменте 500 для обработки клеток.
[0167] Внутри шасси 590, в некоторых реализациях, роботизированная система 558 обработки жидкости располагается вдоль портала 502 над промывочным картриджем 504 (картридж 510 реагента на этих чертежах не показан). Схема управления, трубки для обработки жидкости, органы управления воздушным насосом, клапаны, тепловые блоки (например, блоки нагрева и охлаждения) и другие механизмы управления в некоторых вариантах осуществления расположены под платформой шасси 590, в области 568 блока управления. Также на Фиг. 5C и 5D видно устройство или модуль 540 сингуляции. Модуль 514 сборки нуклеиновой кислоты, содержащий магнит 516, виден на Фиг. 5D.
[0168] Хотя это и не проиллюстрировано, в некоторых вариантах осуществления экран дисплея может располагаться на передней поверхности шасси 590, например покрывая часть крышки (например, см. дисплей 550 на Фиг. 5B). Экран дисплея может предоставлять пользователю информацию о статусе обработки автоматизированного мультимодульного инструмента 500 для редактирования клеток. В другом примере экран дисплея может принимать пользовательский ввод для проведения обработки клеток.
Вращающийся модуль выращивания
[0169] Фиг. 6A изображает один вариант осуществления вращающегося флакона 600 для выращивания для использования с описанным в настоящем документе модулем выращивания клеток. Вращающийся флакон 600 для выращивания является оптически прозрачным контейнером, имеющим открытый конец 604 для приема жидких сред и клеток, центральную область 606, которая определяет главный контейнер для выращивания клеток, сужающуюся область 618, определяющую по меньшей мере один световой путь 610, закрытый конец 616, и механизм 612 зацепления привода. Вращающийся флакон 600 для выращивания имеет центральную продольную ось 620, вокруг которой он вращается, и световой путь 610 обычно перпендикулярен продольной оси флакона. Первый световой путь 610 располагается в нижней сжатой части сужающейся области 618. Опционально некоторые варианты осуществления вращающегося флакона 600 для выращивания имеют второй световой путь 608 в конической части сужающейся области 618. Оба световых пути в этом варианте осуществления располагаются в той области вращающегося флакона для выращивания, которая постоянно заполнена клеточной культурой (клетки+среды для выращивания) и на которую не оказывает влияния частота вращения флакона для выращивания. Первый световой путь 610 является более коротким, чем второй световой путь 608, что позволяет проводить чувствительные измерения значений оптической плотности (OD), когда значения OD клеточной культуры во флаконе находятся на высоком уровне (например, позже в процессе роста клеток), тогда как второй световой путь 608 позволяет проводить чувствительные измерения значений OD, когда значения OD клеточной культуры во флаконе находятся на более низком уровне (например, на более ранней стадии процесса роста клеток).
[0170] Механизм 612 зацепления привода зацепляется с двигателем (не показан), чтобы вращать пробирку. В некоторых вариантах осуществления электродвигатель приводит в действие механизм 612 зацепления привода, так что вращающийся флакон 600 для выращивания вращается только в одном направлении, а в других вариантах осуществления вращающийся флакон 600 для выращивания вращается в первом направлении в течение первого периода времени или с первой периодичностью, затем вращается во втором направлении (то есть в противоположном направлении) в течение второго промежутка времени или со второй периодичностью, и этот процесс может повторяться, так что вращающийся флакон 600 для выращивания (и содержащаяся в нем клеточная культура) подвергается колебательному движению. Кроме того, подвергается ли культура колебаниям, и периодичность этих колебаний могут задаваться пользователем. Первое количество времени и второе количество времени могут быть одинаковыми или отличающимися друг от друга. Количество времени может составлять 1, 2, 3, 4, 5 или более секунд, или может составлять 1, 2, 3, 4 или более минут. В другом варианте осуществления на ранней стадии роста клеток вращающийся флакон 600 для выращивания может колебаться с первой периодичностью (например, каждые 60 с), а затем, на более поздней стадии роста клеток, вращающийся флакон 600 для выращивания может колебаться со второй периодичностью (например, каждую секунду), отличающейся от первой периодичности.
[0171] Вращающийся флакон 600 для выращивания может быть повторно используемым или, предпочтительно, одноразовым. В некоторых вариантах осуществления вращающийся флакон для выращивания является одноразовым и предоставляется пользователю предварительно заполненным средой для выращивания и герметично запечатанным фольгой на открытом конце 604. Заполненный средой вращающийся флакон для выращивания, упакованный таким образом, может быть частью комплекта для использования с автономным устройством выращивания клеток или с модулем выращивания клеток, который является частью мультимодульной автоматизированной системы обработки клеток. Для того чтобы ввести клетки в пробирку, пользователь должен лишь отмерить пипеткой желаемый объем клеток и ввести его во флакон, проткнув кончиком пипетки фольгу. Открытый конец 604 опционально может включать в себя удлиненную кромку 602 для перекрытия и взаимодействия с устройством для выращивания клеток. В автоматизированных системах вращающийся флакон 600 для выращивания может быть помечен штриховым кодом или другими средствами идентификации, которые могут читаться с помощью сканера или камеры (не показаны), которые являются частью автоматизированной системы.
[0172] Объем вращающегося флакона 600 для выращивания и объем клеточной культуры (включая среду для выращивания) могут изменяться в значительной степени, но объем вращающегося флакона 600 для выращивания должен быть достаточно большим для того, чтобы производить заданное общее количество клеток. На практике объем вращающегося флакона 600 для выращивания может составлять 1-250 мл, 2-100 мл, 5-80 мл, 10-50 мл или 12-35 мл. Аналогичным образом, объем клеточной культуры (клетки+среды для выращивания) должен быть подходящим для того, чтобы обеспечить надлежащее аэрирование и смешивание во вращающемся флаконе 600 для выращивания. Надлежащее аэрирование способствует равномерному клеточному дыханию в питательной среде. Таким образом, объем клеточной культуры должен составлять приблизительно 5-85% от объема флакона для выращивания или 20-60% от объема флакона для выращивания. Например, для флакона объемом 30 мл объем клеточной культуры может составлять от приблизительно 1,5 мл до приблизительно 26 мл, или от 6 мл до приблизительно 18 мл.
[0173] Вращающийся флакон 600 для выращивания предпочтительно изготавливается из биологически совместимого оптически прозрачного вещества, или по меньшей мере та часть флакона, которая содержит световой путь (пути), является прозрачной. Кроме того, материал, из которого изготавливается вращающийся флакон для выращивания, должен быть в состоянии охлаждаться до приблизительно 4°C или ниже и нагреваться до приблизительно 55°C или выше, чтобы обеспечить возможность как анализа клеток на основе температуры, так и длительного хранения при низких температурах. Кроме того, материал, который используется для изготовления флакона, должен быть в состоянии выдерживать температуры вплоть до 55°C без деформации при вращении. Подходящие материалы включают в себя сополимер циклического олефина (COC), стекло, поливинилхлорид, полиэтилен, полиамид, полипропилен, поликарбонат, полиметилметакрилат (PMMA), полисульфон, полиуретан, а также сополимеры этих и других полимеров. Предпочтительные материалы включают в себя полипропилен, поликарбонат или полистирол. В некоторых вариантах осуществления вращающийся флакон для выращивания недорого изготавливается, например, путем литья под давлением или экструдирования.
[0174] Фиг. 6B представляет собой вид в перспективе одного варианта осуществления устройства 630 для выращивания клеток. Фиг. 6C изображает вид в разрезе устройства 630 для выращивания клеток, показанного на Фиг. 6B. На обоих чертежах вращающийся флакон 600 для выращивания располагается внутри главного корпуса 636 с удлиненной кромкой 602 вращающегося флакона 600 для выращивания, проходящей выше главного корпуса 636. Кроме того, на обоих чертежах показаны концевые кожухи 652, нижний корпус 632 и фланцы 634. Фланцы 634 используются для присоединения устройства 630 для выращивания клеток к средствам нагрева/охлаждения или другой структуре (не показаны). Фиг. 6C показывает дополнительные детали. На Фиг. 6C показаны верхний подшипник 642 и нижний подшипник 640, расположенные внутри главного корпуса 636. Верхний подшипник 642 и нижний подшипник 640 поддерживают вертикальную нагрузку вращающегося флакона 600 для выращивания. Нижний корпус 632 содержит приводной двигатель 638. Устройство 630 для выращивания клеток, изображенное на Фиг. 6C, содержит два световых пути: первичный световой путь 644 и вторичный световой путь 650. Световой путь 644 соответствует световому пути 610, расположенному в сжатой части сужающейся части вращающегося флакона 600 для выращивания, а световой путь 650 соответствует световому пути 608 в конической части сужающейся части вращающегося флакона 6001 для выращивания. Световые пути 610 и 608 не показаны на Фиг. 6C, но видны на Фиг. 6A. В дополнение к световым путям 644 и 640 имеется эмиссионная плата 648 для освещения светового пути (путей) и детекторная плата 646 для обнаружения света после того, как он пройдет через жидкость клеточной культуры во вращающемся флаконе 600 для выращивания.
[0175] Двигатель 638 зацепляются с приводным механизмом 612 и используется для вращения вращающегося флакона 600 для выращивания. В некоторых вариантах осуществления двигатель 638 является бесщеточным двигателем постоянного тока со встроенными средствами управления, которые могут быть настроены для поддержания постоянной скорости вращения от 0 до приблизительно 3000 об/мин. Альтернативно могут использоваться другие типы двигателей, такие как шаговый, сервомотор, щеточный двигатель постоянного тока и т.п. Опционально двигатель 638 может также иметь управление направлением, обеспечивающее реверсирование, а также тахометр для измерения и передачи фактической скорости вращения. Двигателем управляет процессор (не показан) в соответствии, например, со стандартными протоколами, запрограммированными в процессор, и/или данными, введенными пользователем, и двигатель может быть выполнен с возможностью изменения скорости вращения, чтобы вызвать осевую прецессию клеточной культуры, улучшая тем самым смешивание, например, для предотвращения скопления клеток, увеличения аэрации и оптимизации клеточного дыхания.
[0176] Главный корпус 636, концевые кожухи 652 и нижний корпус 632 устройства 630 для выращивания клеток могут быть изготовлены из любого подходящего жесткого материала, включая алюминий, нержавеющую сталь и другие термопроводящие материалы, включая пластмассы. Эти структуры или их части могут быть созданы с помощью различных методик, например, металлообработки, литья под давлением, создание структурных слоев с последующим их сплавлением и т.д. В то время как в некоторых вариантах осуществления предполагается, что вращающийся флакон 600 для выращивания будет многоразовым, но предпочтительно является расходным, другие компоненты устройства 630 для выращивания клеток предпочтительно являются многоразовыми и функционируют как автономное настольное устройство или как модуль в многомодульной системе обработки клеток.
[0177] Процессор (не показан) устройства 630 для выращивания клеток может быть запрограммирован информацией, используемой в качестве «холостого опыта» или контроля для выращиваемой клеточной культуры. «Холостой опыт» или контроль представляет собой сосуд, содержащий только среду роста клеток, что дает 100%-ную прозрачность и нулевую OD, в то время как образец с клетками будет отклонять лучи света и будет иметь более низкую прозрачность и более высокую OD. По мере того, как клетки растут в среде и становятся более плотными, прозрачность будет уменьшаться, а OD увеличиваться. Процессор (не показан) устройства 630 для выращивания клеток может быть запрограммирован так, чтобы использовать значения длины волны для контроля, соответствующие средам для выращивания, обычно используемым для конкретной клеточной культуры (например, для клеток млекопитающих, бактериальных клеток, животных клеток, дрожжевых клеток и т.д.). Альтернативно в устройство 630 для выращивания клеток могут быть включены второй спектрофотометр и сосуд, где второй спектрофотометр используется для считывания холостого опыта с заданными интервалами.
[0178] Фиг. 6D иллюстрирует устройство 630 для выращивания клеток в качестве части узла, содержащего устройство 630 для выращивания клеток, изображенное на Фиг. 6B, соединенное с источником 690 света, детектором 692 и термокомпонентами 694. Вращающийся флакон 600 для выращивания вставляется в устройство для выращивания клеток. Компоненты источника 690 света и детектора 692 (например, такие как фотодиод с регулировкой усиления для покрытия 5-log) присоединяются к главному корпусу устройства для выращивания клеток. Показаны нижний корпус 632, который вмещает в себя двигатель, вращающий вращающийся флакон 600 для выращивания, а также один из фланцев 634, который крепит устройство 630 для выращивания клеток к узлу. Кроме того, показаны термокомпоненты 694, представляющие собой устройство Пельтье или термоэлектрический холодильник. В этом варианте осуществления терморегулирование осуществляется путем присоединения и электрической интеграции устройства 630 для выращивания клеток с термокомпонентами 694 посредством фланца 634 на основании нижнего корпуса 632. Термоэлектрические холодильники способны «качать» тепло в любую сторону соединения, охлаждая или нагревая поверхность в зависимости от направления электрического тока. В одном варианте осуществления термистор используется для измерения температуры главного корпуса, а затем с помощью стандартного контура электронного пропорционально-интегрально-дифференциального (PID) регулятора температура вращающегося флакона 600 для выращивания регулируется с точностью приблизительно +/-0,5°C.
[0179] При использовании клетки инокулируются (они могут быть пипетированы, например, из автоматизированной системы обработки жидкости или пользователем) в предварительно заполненный питательной средой вращающийся флакон 600 для выращивания путем прокалывания фольги или пленки. Программное обеспечение устройства 630 для выращивания клеток устанавливает контрольную температуру для роста, обычно 30°C, а затем медленно запускает вращение вращающегося флакона 600 для выращивания. Смесь клеток/питательной среды медленно перемещается вертикально вверх по стенке благодаря центробежной силе, что позволяет вращающемуся флакону 600 для выращивания подвергать большую площадь поверхности смеси воздействию нормальной кислородной среды. Система мониторинга роста снимает показания OD постоянно или через заранее заданные или заранее запрограммированные интервалы времени. Эти измерения сохраняются во внутренней памяти, и при необходимости программное обеспечение строит график зависимости измерений от времени для отображения кривой роста. Если требуется улучшенное смешивание, например, для оптимизации условий роста, скорость вращения флакона может варьироваться для того, чтобы вызвать осевую прецессию жидкости, и/или изменение направления вращения может выполняться с запрограммированными интервалами. Мониторинг роста может быть программирован так, чтобы автоматически завершать стадию роста при предопределенной OD, а затем быстро охлаждать смесь до более низкой температуры, чтобы затормозить дальнейший рост.
[0180] Одно из применений устройства 630 для выращивания клеток заключается в постоянном измерении оптической плотности растущей клеточной культуры. Одно преимущество описанного устройства для выращивания клеток состоит в том, что оптическая плотность может измеряться непрерывно (мониторинг кинетики) или с конкретными временными интервалами; например, каждые 5, 10, 15, 20, 30 45 или 60 с, или каждые 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мин. В то время как устройство 630 для выращивания клеток было описано в контексте измерения оптической плотности (OD) растущей клеточной культуры, специалисту в данной области техники с учетом настоящего описания должно быть понятно, что другие параметры роста клеток могут измеряться в дополнение к OD клеточной культуры или вместо нее. Как и в случае с необязательной мерой роста клеток в связи с устройством или модулем со сплошной стенкой, описанной выше, спектроскопия с использованием видимого, УФ или ближнего инфракрасного (NIR) света позволяет контролировать концентрацию питательных веществ и/или отходов в клеточной культуре и другие спектральные измерения; то есть другие спектральные свойства могут быть измерены, например, с помощью спектроскопии диэлектрического импеданса, видимой флуоресценции, поляризации флуоресценции или люминесценции. Кроме того, устройство 630 для выращивания клеток может включать в себя дополнительные датчики для измерения, например, растворенного кислорода, диоксида углерода, значения pH, удельной электропроводности и т.п.
Модуль концентрации клеток
[0181] В автоматизированный многомодульный инструмент для обработки клеток, изображенный на Фиг. 5A-5D, входит модуль 522 концентрации клеток. Фиг. 7A – 7H изображают вариации одного варианта осуществления модуля концентрации клеток/обмена буфера, который использует фильтрацию с тангенциальным потоком. Описанный в настоящем документе модуль концентрации клеток работает с использованием фильтрации с тангенциальным потоком (TFF), также известной как фильтрация с поперечным потоком, в которой большая часть питания течет касательно по поверхности фильтра, уменьшая тем самым образование осадка (удерживаемого вещества) по сравнению с непроточной фильтрацией, в которой питание поступает в фильтр. Вторичные потоки по отношению к главному питанию также используются для создания сил сдвига, которые предотвращают образование фильтрационной корки и засорение мембраны, максимизируя таким образом извлечение частиц, как описано ниже.
[0182] Описанное в настоящем документе устройство TFF было разработано с учетом двух главных конструктивных соображений. Во-первых, геометрия устройства TFF приводит к фильтрованию клеточной культуры на большой площади поверхности, чтобы минимизировать продолжительность обработки. Во-вторых, конструктивное решение устройства TFF выполнено с возможностью минимизации засорения фильтра. Фиг. 7A показывает общую модель 750 фильтрации с тангенциальным потоком. Устройство TFF работает с использованием фильтрации с тангенциальным потоком, также известной как фильтрация с поперечным потоком. Фиг. 7A показывает клетки, текущие над мембраной 754, где поток питания клеток 752 в среде или буфере является параллельным к мембране 754. TFF отличается от непроточной фильтрации, где как поток питания, так и перепад давления перпендикулярны мембране или фильтру.
[0183] Фиг. 7B изображает вид сверху нижнего элемента 720 одного варианта осуществления примерного устройства/модуля TFF, обеспечивающего фильтрацию с тангенциальным потоком. Как можно видеть на Фиг. 7B, нижний элемент 720 устройства/модуля TFF содержит канальную структуру 716, содержащую канал потока, через который течет клеточная культура. Канальная структура 716 содержит единственный канал 702b потока. (Следует отметить, что канал потока в целом обозначен как 702, часть канала потока в верхнем элементе 722 устройства TFF обозначена как 702a, а часть канала потока в нижнем элементе 720 устройства TFF обозначена как 702b). Этот конкретный вариант осуществления содержит канальную конфигурацию 714, например, имеющую волнообразную змеевидную геометрию (то есть небольшие «колебания» в канале 702 потока) и змеевидный «зигзагообразный» рисунок, в котором канал 702b потока пересекает нижний элемент 720 устройства TFF от одного конца в левой части устройства до другого конца в правой части устройства. Этот змеевидный рисунок обеспечивает фильтрацию на большой площади поверхности относительно размера устройства и полного объема канала, в то время как волнистость создает вторичный инерционный поток, обеспечивающий эффективную регенерацию мембраны и предотвращающий ее засорение. Хотя в данном случае проиллюстрированы волнообразная геометрия и змеевидный рисунок иллюстрируются здесь, могут использоваться и другие канальные конфигурации 714, если канал 702 потока может быть разделен мембраной, как обсуждается ниже, и если канальная конфигурация 714 обеспечивает поток клеток через модуль TFF в чередующихся направлениях. Порталы 704 и 706 являются частью канальной структуры 716 за счет работы клеток, проходящих через канал 702 потока. Обычно порталы 704 собирают клетки, проходящие через канал 702 потока на одной стороне мембраны (не показано) («удерживаемое вещество»), а порталы 706 собирают среду («фильтрат» или «пермеат»), проходящий через канал 702 потока на противоположной стороне мембраны (не показано). В этом варианте осуществления углубления 708 вмещают винты или другие крепежные детали (не показаны), которые позволяют прикреплять компоненты устройства TFF друг к другу.
[0184] Длина 710 и ширина 712 канальной структуры 716 может варьироваться в зависимости от объема выращиваемой клеточной культуры и оптической плотности концентрируемой клеточной культуры. Длина 710 канальной структуры 716 обычно составляет от 1 мм до 300 мм, или от 50 мм до 250 мм, или от 60 мм до 200 мм, или от 70 мм до 150 мм, или от 80 мм до 100 мм. Ширина 712 канальной структуры 716 обычно составляет от 1 мм до 120 мм, или от 20 мм до 100 мм, или от 30 мм до 80 мм, или от 40 мм до 70 мм, или от 50 мм до 60 мм. Конфигурация поперечного сечения канала 702 потока может быть круглой, эллиптической, овальной, квадратной, прямоугольной, трапециевидной или нерегулярной. Если поперечное сечение является квадратным, прямоугольным, или имеет другую форму с прямыми сторонами, оно может иметь ширину от приблизительно 10 мкм до 1000 мкм, или от 200 мкм до 800 мкм, или от 300 мкм до 700 мкм, или от 400 мкм до 600 мкм; и высоту от приблизительно 10 мкм до 1000 мкм, или от 200 мкм до 800 мкм, или от 300 мкм до 700 мкм, или от 400 мкм до 600 мкм. Если поперечное сечение канала 702 потока является в целом круглым, овальным или эллиптическим, гидравлический радиус канала может составлять от приблизительно 50 мкм до 1000 мкм, или от 5 мкм до 800 мкм, или от 200 мкм до 700 мкм, или от 300 мкм до 600 мкм, или от приблизительно 200 до 500 мкм.
[0185] На виде сверху нижнего элемента 720 устройства/модуля TFF на Фиг. 7B, можно заметить, что имеется два портала 704 для удерживаемого вещества и два портала 706 для фильтрата, причем на обоих концах (например, узких краях) устройства/модуля 700 TFF имеется по одному порталу каждого типа. В других вариантах осуществления порталы для удерживаемого вещества и для фильтрата могут находиться на одной и той же поверхности одного и того же элемента (например, верхнего элемента 722 или нижнего элемента 720), или они могут быть расположены на боковых поверхностях узла. В отличие от других фильтрующих устройств с тангенциальным потоком, которые функционируют непрерывно, описанное в настоящем документе устройство/модуль TFF использует способ переменного потока для концентрирования клеток. Фиг. 7C изображает вид сверху верхнего (722) и нижнего (720) элементов примерного модуля 700 TFF. Нижняя часть канала 702b потока видна на верхней поверхности нижнего элемента 720. Также видны порталы 704 и 706. Как было отмечено выше, углубления, такие как углубления 708 на Фиг. 7B, обеспечивают средство крепления компонентов (верхнего элемента 722, нижнего элемента 720 и мембраны 724) устройства/мембраны 700 TFF друг к другу во время работы посредством, например, винтов или других подобных крепежных элементов. Однако в альтернативных вариантах осуществления для соединения верхнего элемента 722, нижнего элемента 720 и мембраны 724 вместе может использоваться клейкое вещество, такое как чувствительное к давлению клейкое вещество, или ультразвуковая сварка, или соединение с помощью растворителя. На самом деле специалист в данной области техники, ознакомившись с настоящим раскрытием, может найти и другие конфигурации для соединения компонентов устройства 700 TFF, такие как, например, зажимы; сопряженные фитинги, расположенные на верхнем (722) и нижнем (720) элементах; комбинация клея, сварки, соединения с помощью растворителя и сопряженных фитингов; и другие подобные крепежные детали и соединения.
[0186] Следует отметить, что на Фиг. 7C показан один портал 704 для удерживаемого вещества и один портал 706 для фильтрата на каждом «конце» (например, на узких краях) устройства/модуля 700 TFF. Порталы 704 для удерживаемого вещества и 706 для фильтрата на левой стороне устройства/модуля 700 TFF будут собирать клетки (поток 760 из верхнего элемента 722) и среду (поток 770 из нижнего элемента 720), соответственно, когда клетки и носитель будут течь справа налево в модуле 700 TFF. Аналогичным образом порталы 704 для удерживаемого вещества и 706 для фильтрата на правой стороне устройства/модуля 700 TFF будут собирать клетки (поток 760) и среду (поток 770), соответственно, когда клетки и носитель будут течь слева направо в устройстве TFF. В этом варианте осуществления удерживаемое вещество собирается из порталов 704 на верхней поверхности устройства TFF, а фильтрат собирается из порталов 706 на нижней поверхности устройства. Клетки поддерживаются в канале 702a потока TFF (показанном на Фиг. 7D) над мембраной 724, в то время как фильтрат (среда) течет через мембрану 724, а затем через порталы 706 для фильтрата; таким образом конфигурация с верхними порталами 704 для удерживаемого вещества и нижними порталами 706 для фильтрата является практичной. Однако следует понимать, что могут быть реализованы другие конфигурации порталов 704 для удерживаемого вещества и 706 для фильтрата, такие как размещение обоих порталов 704 для удерживаемого вещества и 706 для фильтрата на боковой поверхности (в отличие от верхней и нижней поверхностей) устройства 700 TFF. На Фиг. 7C, канал 702b потока виден на нижнем элементе 720 устройства 700 TFF. Однако в других вариантах осуществления порталы 704 для удерживаемого вещества и 706 для фильтрата могут находиться на одной и той же поверхности устройства TFF.
[0187] Общий рабочий процесс для концентрации клеток с использованием устройства/модуля 700 TFF включает прохождение культуры клеток или образца клеток по касательной через канальную структуру 716. Мембрана 724, разделяющая каналы 702 потока, удерживает клетки на одной стороне мембраны и позволяет нежелательной среде или буферу течь через мембрану на сторону фильтрата (например, нижнего элемента 720) устройства 700 TFF. В этом процессе фиксированный объем клеток в среде или буфере пропускается через устройство до тех пор, пока образец клеток не будет собран в один из порталов 704 для удерживаемого вещества, а среда/буфер, прошедшие через мембрану, не будут собраны через один или оба из порталов 706 для фильтрата. Все типы прокариотических и эукариотических клеток - как прилипающие, так и неприлипающие - могут быть сконцентрированы в устройстве TFF. Прилипающие клетки можно выращивать на шариках или других клеточных каркасах, суспендированных в среде во вращающемся флаконе для выращивания, а затем пропускать через устройство TFF.
[0188] В процессе концентрации клеток прохождение образца клеток через устройство TFF и сбор клеток в одном из порталов 404 для удерживаемого вещества при сборе среды в одном из порталов 706 для фильтрата считается «одним проходом» образца клеток. Перенос между резервуарами для удерживаемого вещества «переворачивает» культуру. Порталы для удерживаемого вещества и фильтрата, собирающие клетки и среду, соответственно, для данного прохода располагаются на одном конце устройства/модуля 700 TFF с жидкостными соединениями, расположенными так, чтобы было два отдельных слоя потока (не показаны) для сторон удерживаемого вещества и фильтрата, но если портал 404 для удерживаемого вещества находится на верхнем элементе 722 устройства/модуля 700 TFF (то есть клетки перемещаются через канал 702a потока (не показан) над мембраной, а фильтрат (среда) проходит в часть канала 702b потока под мембраной), портал 706 для фильтрата будет находиться на нижнем элементе устройства/модуля 700 TFF, и наоборот (то есть если образец клеток проходит через канал 702b потока под мембраной, то фильтрат (среда) проходит в часть канала 702a потока над мембраной). Эта конфигурация более ясно показана на Фиг. 7C - 7D, где путь 760 потока удерживаемого вещества проходит через порталы 704 для удерживаемого вещества, а путь 770 потока фильтрата проходит через порталы 706 для фильтрата.
[0189] В конце «прохода» образец клеток собирается при прохождении через портал 704 для удерживаемого вещества в резервуар для удерживаемого вещества (не показан). Для инициирования другого «прохода» образец клеток снова пропускается через устройство 700 TFF, на сей раз с противоположным направлением потока по сравнению с первым проходом. Образец клеток собирается при прохождении через портал 704 для удерживаемого вещества в резервуар для удерживаемого вещества (не показан) на противоположном конце устройства/модуля 700 TFF из портала 704 для удерживаемого вещества, который использовался для сбора клеток во время первого прохода. Аналогичным образом, среда/буфер, которая проходит через мембрану во втором проходе, собирается через портал 706 для фильтрата на противоположном конце устройства/модуля 700 TFF из портала 706 для фильтрата, который использовался для сбора фильтрата во время первого прохода, или через оба портала. Этот чередующийся процесс пропускания удерживаемого вещества (концентрированного образца клеток) через устройство/модуль 700 TFF повторяется до тех пор, пока клетки не будут сконцентрированы до желаемого объема, и оба портала 706 для фильтрата могут быть открытыми во время проходов, чтобы сократить время работы. Кроме того, замена буфера может быть произведена путем добавления желаемого буфера (или свежей среды) к образцу клеток в резервуаре для удерживаемого вещества до начала следующего «прохода» и повторения этого процесса до тех пор, пока старая среда или буфер не будут разбавлены и отфильтрованы, и клетки не будут находиться в свежей среде или буфере. Следует отметить, что замена буфера и концентрация клеток могут выполняться (и обычно выполняются) одновременно.
[0190] На Фиг. 7C также видна мембрана или фильтр 724. Фильтры или мембраны, подходящие для использования в устройстве/модуле 700 TFF, должны быть стойкими к растворителям, не содержать загрязнений во время фильтрации и быть в состоянии удерживать интересующие типы и размеры клеток. Например, для удержания малых клеток, таких как бактериальные клетки, размеры пор могут составлять всего 0,2 мкм, однако для других типов клеток размеры пор могут составлять 5 мкм. На самом деле, размеры пор, полезные в устройстве/модуле 700 TFF, включают в себя фильтры 724 с размерами пор 0,20 мкм, 0,21 мкм, 0,22 мкм, 0,23 мкм, 0,24 мкм, 0,25 мкм, 0,26 мкм, 0,27 мкм, 0,28 мкм, 0,29 мкм, 0,30 мкм, 0,31 мкм, 0,32 мкм, 0,33 мкм, 0,34 мкм, 0,35 мкм, 0,36 мкм, 0,37 мкм, 0,38 мкм, 0,39 мкм, 0,40 мкм, 0,41 мкм, 0,42 мкм, 0,43 мкм, 0,44 мкм, 0,45 мкм, 0,46 мкм, 0,47 мкм, 0,48 мкм, 0,49 мкм, 0,50 мкм и больше. Фильтры 724 могут быть изготовлены от любого подходящего инертного материала, включая смешанный эфир целлюлозы (нитрат и ацетат целлюлозы) (CME), поликарбонат (PC), поливинилиденфторид (PVDF), полиэфирсульфон (PES), политетрафторэтилен (PTFE), нейлон, стекловолокно или металлические субстраты, как в случае лазерного или электрохимического травления. Устройство 700 TFF, показанное на Фиг. 7C и 7D, не показывает гнездо в верхнем 722 и нижнем 720 элементах, где фильтр 724 может быть установлен или закреплен (например, гнездо на половину толщины фильтра 724 в каждом из верхнего 722 и нижнего 720 элементов); однако такое гнездо предусматривается в некоторых вариантах осуществления.
[0191] Фиг. 7D изображает вид снизу верхнего элемента 722 и нижнего элемента 720 примерного модуля TFF, показанного на Фиг. 7C. Также видны порталы 704 и 706. Следует отметить, что имеется один портал 704 для удерживаемого вещества и один портал 706 для фильтрата на каждом конце верхнего элемента 722 и нижнего элемента 720 устройства/модуля 700 TFF (не все порталы видны на этом чертеже). На левой стороне устройства 700 TFF порталы 704 для удерживаемого вещества будут собирать клетки (поток 760), а порталы 706 для фильтрата будут собирать среду (поток 770), соответственно, для одного и того же прохода. Аналогичным образом, на правой стороне устройства 700 TFF порталы 704 для удерживаемого вещества будут собирать клетки (поток 760), а порталы 706 для фильтрата будут собирать среду (поток 770), соответственно, для одного и того же прохода. На Фиг. 7D верхняя часть канала 702a потока видна на нижней поверхности верхнего элемента 722 устройства 700 TFF. Таким образом, на Фиг. 7C и 7D имеется канал 702 потока как в верхнем элементе 722 (канал 702a потока на Фиг. 7D), так и в нижнем элементе 722 (канал 702b потока на Фиг. 7C) с мембраной 724 между верхним 722 и нижним 720 элементами. Опять же, каналы 702a и 702b потока верхнего 722 и нижнего 720 элементов сопрягаются для создания канала 702 потока с мембраной 724, расположенной горизонтально между верхним и нижним элементами устройства/модуля TFF, разделяя тем самым канал 702 потока (не показано).
[0192] Замена буфера во время концентрации клеток и/или придания клеткам компетентности выполняется на устройстве/модуле 700 TFF путем добавления желаемого буфера к клеткам, сконцентрированным до желаемого объема; например, после того, как клетки были сконцентрированы по меньшей мере в 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200 раз и более. Желаемая обменная среда или обменный буфер добавляется к клеткам путем добавления в резервуар для удерживаемого вещества (не показан), и процесс пропускания клеток через устройство 700 TFF повторяется до тех пор, пока клетки не будут сконцентрированы до желаемого объема в обменной среде или буфере. Этот процесс может быть повторен любое желаемое количество раз для того, чтобы достичь желаемого уровня замены буфера и желаемого объема клеток. Обменный буфер может содержать, например, глицерин или сорбит, делая тем самым клетки компетентными для трансформации в дополнение к уменьшению общего объема образца клеток.
[0193] Устройство 700 TFF может быть изготовлено из любого прочного материала, в котором могут быть выфрезерованы каналы потока, включая нержавеющую сталь, кремний, стекло, алюминий, или пластмассы, включая сополимер циклического олефина (COC), циклоолефиновый полимер (COP), полистирол, поливинилхлорид, полиамид, полиэтилен, полипропилен, акрилонитрилбутадиен, поликарбонат, полиэфирэфиркетон (PEEK), поли(метилметакрилат) (PMMA), полисульфон и полиуретан, а также сополимеры этих и других полимеров. Если устройство/модуль 700 TFF является одноразовым, оно предпочтительно делается из пластмассы. В некоторых вариантах осуществления материал, используемый для изготовления устройства/модуля 700 TFF, является термопроводящим, так что клеточная культура может нагреваться или охлаждаться до желаемой температуры. В некоторых вариантах осуществления устройство 700 TFF формируется путем прецизионной механической обработки, лазерной обработки, электроэрозионной обработки (для металлических устройств); влажного или сухого травления (для кремниевых устройств); сухого или влажного травления, порошковой или пескоструйной обработки, фотоструктурирования (для изделий из стекла); или термоформования, литья под давлением, горячего тиснения или лазерной обработки (для пластиковых устройств) с использованием материалов, упомянутых выше, которые поддаются этим способам массового производства.
[0194] Фиг. 7E изображает разобранный вид в перспективе одного примерного варианта осуществления модуля TFF, гидравлически связанного с резервуарами для удерживаемого вещества, фильтрата и обменного буфера. В этой конфигурации 790 указывает верхнюю часть или крышку устройства TFF, имеющую три отверстия 766, где кончик пипетки 768 расположен в самом левом отверстии 766. Верхняя часть 790 устройства TFF при работе связана с объединенной структурой 764 резервуара и верхнего элемента. Объединенная структура 764 резервуара и верхнего элемента содержат верхнюю поверхность, которая при работе является смежной с верхней частью или крышкой 790 устройства TFF, нижнюю поверхность, которая содержит верхний элемент 722 устройства TFF, где верхний элемент 722 устройства TFF определяет верхнюю часть канала тангенциального потока (не показан). Объединенная структура 764 резервуара и верхнего элемента содержит два резервуара 772 для удерживаемого вещества и резервуар 774 для буфера или среды. Резервуары 772 для удерживаемого вещества гидравлически связаны с верхней частью канала потока, а резервуар 774 для буфера или среды гидравлически связан с резервуарами 772 для удерживаемого вещества. Также на этом разобранном виде устройства TFF виден нижний элемент 720, который, как было описано ранее, содержит на своей верхней поверхности нижнюю часть канала 702b тангенциального потока (видный на верхней поверхности нижнего элемента 720), где верхняя и нижняя части канала 702 потока верхнего элемента 722 и нижнего элемента 720, соответственно, при соединении формируют единственный канал 702 потока (мембрана, которая располагается между верхним элементом 722 и нижним элементом 720 при работе, не показана).
[0195] Под нижним элементом 720 находится уплотнение 792, которое при работе располагается между нижним элементом 720 и резервуаром 762 для фильтрата (или пермеата). При работе верхняя часть 790, объединенная структура 764 резервуара и верхнего элемента, мембрана (не показана), нижний элемент 720, уплотнение 792 и резервуар 762 для фильтрата соединяются и закрепляются вместе так, чтобы они были непроницаемыми для жидкости и для воздуха. На Фиг. 7E показаны застежки, которые могут использоваться для соединения вместе различных структур (верхней части 790, объединенной структуры 764 резервуара и верхнего элемента, мембраны (не показана), нижнего элемента 720, уплотнения 792 и резервуара 762 для фильтрата). Однако в качестве альтернативы винтам или другим подобным креплениям различные конструкции устройства TFF могут быть соединены с использованием клейкого вещества, такого как чувствительное к давлению клейкое вещество; ультразвуковой сварки; или соединения с помощью растворителя. Кроме того, комбинация застежек, клейких веществ и/или различных типов сварки может использоваться для связывания различных структур устройства TFF. Специалист в данной области техники, ознакомившись с настоящим раскрытием, может найти и другие конфигурации для соединения компонентов устройства TFF, такие как, например, зажимы; сопряженные фитинги и другие подобные крепежные детали.
[0196] Фиг. 7F изображает объединенную структуру 764 резервуара и верхнего элемента, содержащую два резервуара 772 для удерживаемого вещества и резервуар 774 для буфера или среды, а также верхний элемент 722, который располагается под объединенной структурой 764 резервуара и верхнего элемента. Верхний элемент 722 устройства TFF определяет верхнюю часть канала тангенциального потока (не показан), расположенную на нижней поверхности объединенной структуры 764 резервуара и верхнего элемента. Фиг. 7G представляет собой вид сверху верхней поверхности 778 объединенной структуры 764 резервуара и верхнего элемента, изображающий верхнюю часть 780 резервуаров 772 для удерживаемого вещества и верхнюю часть 782 резервуара 774 для буфера или среды. Резервуары 772 для удерживаемого вещества гидравлически связаны с верхней частью канала потока (не показан), а резервуар 774 для буфера или среды гидравлически связан с резервуарами 772 для удерживаемого вещества. Фиг. 7Н представляет собой вид снизу нижней поверхности объединенной структуры 764 резервуара и верхнего элемента, показывающий верхний элемент 722 с верхней частью канала 702a тангенциального потока, расположенной на нижней поверхности верхнего элемента 722. Канал 702a потока, расположенный на нижней поверхности верхнего элемента 722, при работе сопрягается с нижней частью канала 702b тангенциального потока, расположенной на верхней поверхности нижнего элемента 720 (не показана на этом чертеже, см. Фиг. 7E), где верхняя и нижняя части каналов 702a и 702b потока, соответственно, сопрягаются для формирования единственного канала 702 потока с мембраной или фильтром (не показана) между верхней 702a и нижней 702b частями канала потока.
Модуль сборки нуклеиновой кислоты
[0197] Некоторые варианты осуществления автоматизированных мультимодульных инструментов для редактирования клеток по настоящему изобретению опционально включают в себя модуль сборки нуклеиновой кислоты. Модуль сборки нуклеиновой кислоты выполнен с возможностью приема и сборки нуклеиновых кислот, необходимых для облегчения желаемых событий редактирования генома. Термин «вектор» обычно относится к молекуле нуклеиновой кислоты, способной транспортировать в клетку желаемую нуклеиновую кислоту, с которой она связана. Векторы включают в себя, не ограничиваясь этим, молекулы нуклеиновой кислоты, которые являются одноцепочечными, двухцепочечными или частично двухцепочечными; молекулы нуклеиновой кислоты, которые включают в себя один или более свободных концов, не имеют свободных концов (например, циклические); молекулы нуклеиновой кислоты, которые включают в себя ДНК, РНК, или и то, и другое; а также другие разновидности полинуклеотидов, известных в данной области техники. Одним типом вектора является «плазмида», которая относится к циклической двухцепочечной ДНК, в которую дополнительные сегменты ДНК могут быть вставлены, например, с помощью стандартных методик молекулярного клонирования. Другим типом вектора является вирусный вектор, в котором последовательности ДНК или РНК вирусного происхождения присутствуют в векторе для упаковки в вирус (например, ретровирусы, ретровирусы с дефектом репликации, аденовирусы, аденовирусы с дефектом репликации и аденоассоциированные вирусы). Вирусные векторы также включают в себя полинуклеотиды, переносимые вирусом для трансфекции в клетку хозяина. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальный источник репликации, и эписомальные векторы млекопитающих). Другие векторы (например, неэписомальные векторы млекопитающих) интегрируются в геном клетки-хозяина при введении в нее, и тем самым реплицируются вместе с геномом хозяина. Кроме того, некоторые векторы способны направлять экспрессию генов, с которыми они функционально связаны. Такие векторы упоминаются в настоящем документе как «векторы экспрессии» или «редактирующие векторы». Общие векторы экспрессии, применимые в методиках рекомбинантной ДНК, часто имеют форму плазмид. Дополнительные векторы включают в себя фосмиды, фагмиды и синтетические хромосомы.
[0198] Рекомбинантные векторы экспрессии могут включать в себя нуклеиновую кислоту в форме, подходящей для транскрипции, а для некоторых последовательностей нуклеиновых кислот - для трансляции и экспрессии нуклеиновой кислоты в клетке-хозяине, что означает, что рекомбинантные векторы экспрессии включают в себя один или более регулирующих элементов, которые могут выбираться на основе клеток-хозяев, используемых для экспрессии, которые функционально связаны с экспрессируемой последовательностью нуклеиновой кислоты. Внутри рекомбинантного вектора экспрессии «функционально связанный» означает, что интересующая нуклеотидная последовательность связана с регулирующим элементом (элементами) таким образом, который позволяет транскрипцию, а для некоторых последовательностей нуклеиновой кислоты трансляцию и экспрессию нуклеотидной последовательности (например, в системе транскрипции/трансляции in vitro или в клетке - хозяине, когда вектор вводится в клетку хозяина). Подходящие способы рекомбинации и клонирования раскрыты в публикации US № 2004/0171156, содержание которой включено в настоящий документ посредством ссылки во всей его полноте.
[0199] В некоторых вариантах осуществления регулирующий элемент функционально связывается с одним или более элементами нацеливаемой нуклеазной системы для управления транскрипцией, а для некоторых последовательностей нуклеиновой кислоты для трансляции и экспрессии одного или более компонентов нацеливаемой нуклеазной системы.
[0200] В дополнение к этому, полинуклеотидная последовательность, кодирующая направляемую нуклеиновой кислотой нуклеазу, может быть кодонно оптимизирована для экспрессии в конкретных клетках, таких как прокариотические или эукариотические клетки. Эукариотические клетки могут быть клетками дрожжей, грибов, морских водорослей, растений, животных, или клетками человека. Эукариотические клетки могут быть клетками или производными от них конкретного организма, такого как млекопитающее, включая, но не ограничиваясь этим, человека, мышь, крысу, кролика, собаку или млекопитающее, не являющееся человеком, включая приматов, не являющихся человеком. Дополнительно или альтернативно вектор может включить в себя регулирующий элемент, функционально связанный с полинуклеотидной последовательностью, которая при транскрибировании формирует направляющую РНК.
[0201] Модуль сборки нуклеиновой кислоты может быть выполнен с возможностью, выполнения широкого спектра различных методик автоматизированной сборки нуклеиновой кислоты. Методики сборки нуклеиновой кислоты, которые могут быть выполнены в модуле сборки нуклеиновой кислоты раскрытых автоматизированных мультимодульных инструментов для редактирования клеток, включают в себя, не ограничиваясь этим, способы сборки, которые используют рестрикционные эндонуклеазы, включая PCR, сборку BioBrick (патент US № 9361427), клонирование типа IIS (например, сборка GoldenGate, европейская патентная заявка EP 2395087 A1), и реакция цикла лигазы (de Kok, ACS Synth Biol., 3(2):97-106 (2014); Engler, et al., PLoS One, 3(11):e3647 (2008); а также патент US № 6143527). В других вариантах осуществления методики сборки нуклеиновой кислоты, выполняемые раскрытыми мультимодульными автоматизированными инструментами для редактирования клеток, основаны на перекрытии между смежными частями нуклеиновых кислот, например Gibson Assembly®, CPEC, SLIC, цикл лигазы и т.д. Дополнительные способы сборки включают в себя устранение разрыва в дрожжах (Bessa, Yeast, 29(10):419-23 (2012)), клонирование Gateway (Ohtsuka, Curr Pharm Biotechnol, 10(2):244-51 (2009); патенты US №№ 5888732 и 6277608), и опосредованное топоизомеразой клонирование (Udo, PLoS One, 10(9):e0139349 (2015); а также патент US № 6916632). Эти и другие методики сборки нуклеиновой кислоты описываются, например, в публикации Sands and Brent, Curr Protoc Mol Biol., 113:3,26.1-3,26.20 (2016).
[0202] Модуль сборки нуклеиновой кислоты управляется температурой в зависимости от типа сборки нуклеиновой кислоты, используемого в автоматизированном мультимодульном инструменте для редактирования клеток. Например, когда в модуле сборки нуклеиновой кислоты используется PCR, модуль включает в себя возможность термоциклирования, позволяющую циклически менять температуру между стадиями денатурации, отжига и удлинения. Когда в модуле сборки нуклеиновой кислоты используются методы однотемпературной сборки (например, методы изотермической сборки), модуль обеспечивает возможность достижения и удержания температуры, которая оптимизирует конкретный выполняемый процесс сборки. Эти температуры и продолжительность поддержания этих температур могут определяться заранее запрограммированным набором параметров, выполняемых скриптом, или управляться вручную пользователем с помощью системы обработки автоматизированного мультимодульного инструмента для редактирования клеток.
[0203] В одном варианте осуществления модуль сборки нуклеиновой кислоты представляет собой модуль для выполнения сборки, использующий единственную изотермическую реакцию. Некоторые изотермические способы сборки могут объединять одновременно до 15 фрагментов нуклеиновой кислоты на основе идентичности последовательностей. Способ сборки в некоторых вариантах осуществления обеспечивает сборку нуклеиновых кислот, которые включают перекрытие примерно 20-40 оснований с соседними фрагментами нуклеиновой кислоты. Фрагменты смешиваются с коктейлем из трех ферментов - экзонуклеазы, полимеразы и лигазы вместе с буферными компонентами. Поскольку процесс является изотермическим и может быть выполнен в способе с одной или двумя стадиями с использованием единственного реактора, изотермические реакции сборки являются идеальными для использования в автоматизированном мультимодульном инструменте для редактирования клеток. Одностадийный способ позволяет собрать до пяти различных фрагментов с использованием одностадийного изотермического процесса. Фрагменты и мастер-микс ферментов объединяют и инкубируют при 50°C в течение одного часа. Для создания более сложных конструкций, содержащих до пятнадцати фрагментов, или для включения фрагментов от 100 до 10000 пар оснований обычно используется двухстадийный способ, в котором двухстадийная реакция требует двух отдельных добавлений мастер-микса; первое для стадии экзонуклеазы и отжига, а второе для стадии полимеразы и лигирования.
Модуль трансформации
[0204] Фиг. 8A - 8E изображают вариации одного варианта осуществления модуля трансформации клеток (в данном случае проточного устройства электропорации), который может быть включен в инструмент для выращивания/концентрации/трансформации клеток. Фиг. 8A и 8B представляют собой вид сверху и вид снизу в перспективе, соответственно, шести соединенных проточных устройств 850 электропорации. Фиг. 8A изображает шесть проточных блоков 850 электропорации, расположенных на одном субстрате 856. Каждый из шести проточных блоков 850 электропорации имеет входные отстойники 852, которые определяют входы для образца клеток, и выходные отстойники 854, которые определяют выходы для образца клеток. Фиг. 8B представляет собой вид снизу в перспективе шести соединенных проточных устройств электропорации, показанных на Фиг. 8A, также изображающий шесть проточных блоков 850 электропорации, расположенных на одном субстрате 856. Видны шесть входных отстойников 852, по одному для каждого проточного блока 850 электропорации, и один выходной отстойник 854 (выходной отстойник крайнего левого проточного блока 850 электропорации). Дополнительно на Фиг. 8B видны входное отверстие 802, выходное отверстие 804, канал 806 потока и два электрода 808 по обе стороны от сужения в канале 806 потока каждого проточного блока 850 электропорации. После изготовления шести проточных модулей 850 электропорации они могут быть отделены друг от друга (например, «разделены») и использованы по одному, или альтернативно в таких вариантах осуществления, где два или более проточных блока 850 электропорации могут использоваться параллельно без разделения.
[0205] Проточные устройства 850 электропорации достигают высокоэффективной электропорации клетки с низкой токсичностью. Проточные устройства 850 электропорации по настоящему изобретению обеспечивают особенно легкую интеграцию с автоматизированной аппаратурой обработки жидкости, которая обычно используется в автоматизированных системах, таких как пипетторы с вытеснением воздухом. Такая автоматизированная аппаратура включает в себя, не ограничиваясь этим, стандартные автоматизированные системы обработки жидкости производства компаний Tecan (Маннедорф, Швейцария), Hamilton (Рено, Невада), Beckman Coulter (Форт Коллинз, Колорадо) и т.д.
[0206] Вообще говоря, микрофлюидная электропорация - с использованием объемов клеточной суспензии менее приблизительно 10 мл и вплоть до 1 мкл - позволяет более точно контролировать процесс трансфекции или трансформации и допускает гибкую интеграцию с другими инструментами обработки клеток по сравнению с настольными устройствами электропорации. Микрофлюидная электропорация таким образом обеспечивает уникальные преимущества, например, для трансформации, обработки и анализа отдельных клеток; конфигурации мультиблочных устройств электропорации; а также интегрированной автоматической многомодульной обработки и анализа клеток.
[0207] В конкретных вариантах осуществления проточных устройств 850 электропорации по настоящему изобретению уровень токсичности трансформации приводит к более чем 10% жизнеспособных клеток после электропорации, предпочтительно более чем 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 70%, 75%, 80%, 85%, 90%, или даже 95% жизнеспособных клеток после трансформации, в зависимости от типа клеток и нуклеиновых кислот, вводимых в клетки.
[0208] Проточное устройство 850 электропорации, описанное со ссылками на Фиг. 8A-8E, содержит корпус с камерой электропорации, первый электрод и второй электрод, выполненные с возможностью соединения с генератором электрических импульсов. В некоторых вариантах осуществления устройства электропорации являются стерилизуемыми в автоклаве и/или одноразовыми, и могут быть упакованы с реагентами в картридж для реагентов. Устройство 850 электропорации может быть выполнено с возможностью электропорации образца клеток с объемом 1-2 мл, 10 мкл - 1 мл, 25 мкл - 750 мкл, или 50 мкл - 500 мкл. Клетки, которые могут быть электропорированы с раскрытыми устройствами 850 электропорации, включают в себя клетки млекопитающих (включая клетки человека), растительные клетки, дрожжи, другие эукариотические клетки, бактерии, простейшие, и другие типы клеток.
[0209] В одном примерном варианте осуществления Фиг. 8C изображает вид сверху проточного устройства 850 электропорации, имеющего входное отверстие 802 для введения клеток и экзогенного реагента, электропорируемого в клетки («образца клеток»), и выходное отверстие 804 для образца клеток после электропорации. Электроды 808 вводятся через электродные каналы (не показаны на Фиг. 8C) в устройстве. Фиг. 8D показывает вид в разрезе сверху проточного устройства 850 электропорации с входным отверстием 802, выходным отверстием 804 и электродами 808, расположенными относительно сужения в канале 806 потока. Вид сбоку в разрезе нижней части проточного устройства 850 электропорации на Фиг. 8E иллюстрирует, что электроды 808 в этом варианте осуществления располагаются в электродных каналах 810 перпендикулярно каналу 806 потока таким образом, что образец клеток течет из входного канала 812 через канал 806 потока к выходному каналу 814, и в процессе образец клеток затекает в электродные каналы 810 так, чтобы находиться в контакте с электродами 808. В этом аспекте входной канал 812, выходной канал 814 и электродные каналы 810 начинаются от верхней плоской стороны устройства; однако архитектура проточной электропорации, изображенная на Фиг. 8C-8E, является всего лишь одной архитектурой, полезной с описанными в настоящем документе картриджами для реагента. Дополнительные архитектуры электродов описываются, например, в патентных документах US №№ 16/147120, поданном 24 сентября 2018 г.; 16/147865, поданном 30 сентября 2018 г.; и 16/147871, поданном 30 сентября 2018 г.
Примерные рабочие процессы
[0210] Фиг. 9 представляет собой упрощенную блок-схему одного варианта осуществления примерного автоматизированного мультимодульного инструмента для обработки клеток, содержащего модуль сингуляции или существенной сингуляции/выращивания/редактирования и нормализации или отбора для обогащения или выбора отредактированных клеток. Инструмент 900 для обработки клеток может включать в себя корпус 944, резервуар 902 для трансформируемых или трансфектируемых клеток и модуль 904 выращивания (устройство для выращивания клеток). Трансформируемые клетки передаются из резервуара в модуль выращивания для культивирования до тех пор, пока клетки не достигнут целевой OD. Как только клетки достигнут целевой OD, модуль выращивания может охладить или заморозить клетки для более поздней обработки, или клетки могут быть переданы в модуль 930 концентрации клеток, где они делаются электрокомпетентными и концентрируются до объема, оптимального для трансформации клеток. После концентрации клетки передаются в устройство 908 электропорации (например, модуль трансформации/трансфекции, с одним примерным модулем, описанным выше со ссылками на Фиг. 8A-8E). Примерные устройства электропорации, используемые в автоматизированных мультимодульных инструментах для обработки клеток включают в себя проточные устройства электропорации, такие как описанные в патентных документах US №№ 16/147120, поданном 28 сентября 2018 г.; 16/147353, поданном 28 сентября 2018 г.; 16/147865, поданном 30 сентября 2018 г.; и 16/147871, поданном 30 сентября 2018 г., все из которых включены в настоящий документ посредством ссылки во всей их полноте.
[0211] В дополнение к резервуару 930 для хранения клеток автоматизированный мультимодульный инструмент 900 для обработки клеток может включать в себя резервуар для хранения кассет 916 редактирующего олигонуклеотида и резервуар 918 для хранения скелета вектора экспрессии. Как кассеты редактирующего олигонуклеотида, так и скелет вектора экспрессии передаются из картриджа для реагента в модуль 920 сборки нуклеиновой кислоты, где кассеты редактирующего олигонуклеотида вставляются в скелет вектора экспрессии. Собранные нуклеиновые кислоты могут быть перенесены в необязательный модуль 922 очистки для обессоливания и/или других процедур очистки и/или концентрации, необходимых для подготовки собранных нуклеиновых кислот к трансформации. Альтернативно заранее собранные нуклеиновые кислоты, например, редактирующий вектор, могут быть сохранены в резервуаре 916 или 918. После завершения процессов, выполняемых модулем 922 очистки, собранные нуклеиновые кислоты передаются, например, в устройство 908 электропорации, которое уже содержит клеточную культуру, выращенную до целевой OD и сделанную электрокомпетентной посредством модуля 930 концентрации клеток. В устройстве 908 электропорации собранные нуклеиновые кислоты вводятся в клетки. После электропорации клетки передаются в объединенный модуль 910 восстановления/выбора. Примеры мультимодульных инструментов для редактирования клеток можно найти в патентных документах US №№ 16/024816 и 16/024831, поданных 30 июня 2018 г.; 16/147865, поданном 30 сентября 2018 г.; и 16/147871, поданном 30 сентября 2018 г., все из которых включены в настоящий документ посредством ссылки во всей их полноте.
[0212] После восстановления и опционального выбора клетки передаются в модуль 940 сингуляции или существенной сингуляции, редактирования и выращивания, где клетки разбавляются и разделяются по отсекам таким образом, чтобы в среднем на каждый отсек приходилась одна клетка. После того, как они будут по существу или в значительной степени сингулированы, клеткам дают возможность расти для достижения предопределенного количества удвоений. Как только эти начальные колонии образуются, индуцируется редактирование, и отредактированные клетки выращиваются для формирования колоний, которые выращиваются до предельного размера (например, колонии нормализуются). В некоторых вариантах осуществления редактирование индуцируется одним или более редактирующими компонентами, находящимися под управлением индуцибeльного промотора. В некоторых вариантах осуществления индуцибeльный промотор активируется путем повышения температуры и дезактивируется путем понижения температуры. Аналогичным образом в тех вариантах осуществления, в которых устройство со сплошной стенкой, содержащее фильтр, формирующий дно микролунки, устройство со сплошной стенкой можно перенести на пластину (например, агаровую пластину или даже в жидкую среду), содержащую среду с компонентом, который активирует или индуцирует редактирование, а затем перенести на среду, которая дезактивирует редактирование. В устройствах со сплошной стенкой и со сплошным дном индукция редактирования или дезактивация редактирования может осуществляться путем замены среды. Когда колонии вырастают до предельного размера, они объединяются. Опять же сингуляция или существенная сингуляция преодолевает смещение роста в пользу неотредактированных клеток, а также смещение роста в результате эффектов приспособляемости различных изменений.
[0213] Все модули восстановления, выбора и сингуляции/индукции/редактирования и нормализации могут быть отдельными, могут быть расположены и объединены, как показано на Фиг. 9, или могут быть расположены и объединены в других конфигурациях. В некоторых вариантах осуществления все стадии восстановления, выбора, сингуляции или существенной сингуляции, роста, редактирования и нормализации выполняются в единственном модуле, например, на субстрате с питательным агаром, или на устройстве со сплошной стенкой, описанном со ссылками на Фиг. 3A-3E и 4A-4AA. Альтернативно восстановление, выбор и разбавление, в случае необходимости, выполняются в жидкой среде в отдельном сосуде (модуле), а затем выполняется перенос в модуль сингуляции/роста/индукции/редактирования и нормализации.
[0214] После объединения нормализованных колоний клеток клетки могут быть сохранены, например, в блоке или модуле 912 хранения, где клетки могут храниться, например, при температуре 4°C до тех пор, пока клетки не потребуются для дальнейшего исследования 914. Альтернативно клетки могут использоваться в другом цикле редактирования. Мультимодульным инструментом 900 обработки клеток управляет процессор 942 на основе данных, введенных пользователем, на основе одного или более скриптов, или на основе комбинации данных, введенных пользователем, и скрипта. Процессор 942 может управлять выбором времени, продолжительностью, температурой и операциями различных модулей инструмента 900, а также распределением реагентов. Например, процессор 942 может охлаждать клетки после трансформации до тех пор, пока не наступит время для редактирования, когда температура может быть повышена до уровня, способствующего редактированию генома и росту клеток. Процессор может быть запрограммирован стандартными параметрами протокола, из которых пользователь может осуществлять выбор, пользователь может определять один или более параметров вручную, или один или более скриптов, связанных с картриджем реагента, могут определять одну или более операций и/или параметров реакции. В дополнение к этому, процессор может уведомлять пользователя (например, посредством приложения на смартфоне или другом устройстве), что клетки достигли целевой OD, а также держать пользователя в курсе прогресса клеток в различных модулях в мультимодульной системе.
[0215] Автоматизированный мультимодульный инструмент 900 для обработки клеток является нуклеазной системой редактирования генома и может использоваться в системах одиночного редактирования (например, введения одного или более изменений в клеточный геном в единственном процессе редактирования). Описываемая ниже система, показанная на Фиг. 10, выполнена с возможностью выполнения последовательного редактирования, например, используя различные нуклеазные системы последовательно для того, чтобы обеспечить два или более изменений генома в клетке; и/или рекурсивного редактирования, например, используя одну нуклеазную систему для последовательного введения двух или более изменений генома в клетке.
[0216] Фиг. 10 иллюстрирует другой вариант осуществления автоматизированного мультимодульного инструмента обработки клеток, выполненного с возможностью выполнения сингуляции или существенной сингуляции клеток, роста, индукции редактирования и нормализации колоний клеток. Этот вариант осуществления изображает примерную систему, которая выполняет рекурсивное генное редактирование на популяции клеток. Как и в случае варианта осуществления, показанного на Фиг. 9, инструмент 1000 для обработки клеток может включать в себя корпус 1044, резервуар 1002 для хранения клеток, подлежащих трансформации или трансфекции, и модуль 1004 выращивания клеток (содержащий, например, вращающийся флакон для выращивания). Трансформируемые клетки передаются из резервуара в модуль выращивания клеток для культивирования до тех пор, пока клетки не достигнут целевой OD. Как только клетки достигнут целевой OD, модуль выращивания может охладить или заморозить клетки для более поздней обработки, или клетки могут быть переданы в модуль 1060 концентрации клеток, где они подвергаются замене буфера и делаются электрокомпетентными, и объем клеток может быть существенно уменьшен. Когда клетки будут сконцентрированы до подходящего объема, они передаются в устройство 1008 электропорации. В дополнение к резервуару для хранения клеток мультимодульный инструмент 1000 для обработки клеток включает в себя резервуар для хранения вектора, предварительно собранного с редактирующими олигонуклеотидными кассетами 1052. Предварительно собранные векторы нуклеиновой кислоты передаются в устройство 1008 электропорации, которое уже содержит клеточную культуру, выращенную до целевой OD. В устройстве 1008 электропорации нуклеиновые кислоты электропорируются в клетки. После электропорации клетки передаются в необязательный модуль 1056 восстановления, где клеткам дают возможность на короткое время восстановиться после трансформации.
[0217] После восстановления клетки могут быть переданы в блок или модуль 1012 хранения, где клетки могут быть храниться, например, при 4°C для более поздней обработки, или клетки могут быть разбавлены и переданы в модуль 1058 выбора, сингуляции или существенной сингуляции/роста/индукции/редактирования и нормализации со сплошной стенкой. В этом мультипроцессном модуле 1058 клетки выстраиваются таким образом, чтобы в среднем одна клетка приходилась на одну микролунку. Выстраиваемые клетки могут находиться в среде выбора для выбора тех клеток, которые были трансформированы или трансфектированы с помощью редактирующего вектора (векторов). После того, как они будут по существу или в значительной степени сингулированы, клетки растут до 2-50 удвоений и образуют колонии. После образования колоний редактирование индуцируется условиями (например, температурой, добавлением стимулирующих или подавляющих химикатов), необходимыми для индуцирования редактирования. После редактирования клеткам дают возможность вырасти до предельного размера (например, нормализация колоний) в микролунках, после чего они могут быть вымыты из микролунок и объединены, а затем переданы в блок 1014 извлечения клеток или могут быть возвращены обратно в модуль 1004 выращивания для другого цикла редактирования. Между объединением и переносом в модуль выращивания могут иметь место одна или несколько дополнительных стадий, таких как восстановление клеток, замена среды, концентрация клеток и т.д., например фильтрация с тангенциальным потоком. Следует отметить, что модули выбора/сингуляции или существенной сингуляции/роста/индукции/редактирования и нормализации могут быть одним и тем же модулем, где все процессы выполняются в устройстве со сплошной стенкой, или выбор и/или разбавление могут иметь место в отдельном сосуде до того, как клетки будут перенесены в модуль сингуляции или существенной сингуляции/роста/индукции/редактирования и нормализации со сплошной стенкой (устройство со сплошной стенкой). Как только предположительно отредактированные клетки будут объединены, они могут быть подвергнуты другому циклу редактирования, начиная с роста, концентрации клеток и обработки для придания им электрокомпетентности, и трансформации еще одной донорной нуклеиновой кислотой в другой редактирующей кассете посредством модуля 1008 электропорации.
[0218] В устройстве 1008 электропорации клетки, выбранные из первого цикла редактирования, трансформируются вторым набором редактирующих олигонуклеотидов (или другим типом олигонуклеотидов), и цикл повторяется до тех пор, пока клетки не будут трансформированы и отредактированы желаемым количеством, например, редактирующих кассет. Мультимодульный инструмент 1000 обработки клеток, проиллюстрированный на Фиг. 10, управляется процессором 1042 на основе данных, введенных пользователем, или на основе одного или более скриптов, включая по меньшей мере один скрипт, связанный с картриджем реагента. Процессор 1042 может управлять выбором времени, продолжительностью и температурой различных процессов, распределением реагентов и другими операциями различных модулей автоматизированного мультимодульного инструмента 1000 для обработки клеток. Например, скрипт или процессор может управлять распределением клеток, реагентов, векторов и редактирующих олигонуклеотидов; тем, какие редактирующие олигонуклеотиды используются для редактирования клеток и в какой последовательности; временем, температурой и другими условиями, используемыми в модуле восстановления и экспрессии; длиной волны, на которой измеряется OD в модуле выращивания клеток, целевой OD, до которой выращиваются клетки, и целевым временем, за которое клетки достигнут целевого значения OD. В дополнение к этому, процессор может быть запрограммирован для информирования пользователя (например, посредством приложения на смартфоне или другом устройстве) относительно прогресса клеток в автоматизированном мультимодульном инструменте для обработки клеток.
[0219] Специалисту в данной области техники с учетом настоящего раскрытия должно быть очевидно, что описанный процесс может быть рекурсивным и мультиплексированным; то есть клетки могут пройти рабочий процесс, описанный со ссылкой на Фиг. 10, а затем полученная отредактированная культура может пройти еще один (или несколько, или много) циклов дополнительного редактирования (например, рекурсивного редактирования) с различными редактирующими векторами. Например, клетки из цикла 1 редактирования могут быть разбавлены, и аликвота клеток, отредактированных редактирующим вектором A, может быть объединена с редактирующим вектором B, аликвота клеток, отредактированных редактирующим вектором A, может быть объединена с редактирующим вектором C, аликвота клеток, отредактированных редактирующим вектором A, может быть объединена с редактирующим вектором D, и так далее для второго цикла редактирования. После второго цикла аликвота каждых из дважды отредактированных клеток может быть подвергнута третьему циклу редактирования, в котором, например, аликвоты каждых из AB-, AC-, AD-отредактированных клеток объединяются с дополнительными редактирующими векторами, такими как редактирующие векторы X, Y и Z. То есть дважды отредактированные клетки AB могут быть объединены (и отредактированы) с векторами X, Y и Z для получения трижды отредактированных клеток ABX, ABY и ABZ; дважды отредактированные клетки AC могут быть объединены (и отредактированы) с векторами X, Y и Z для получения трижды отредактированных клеток ACX, ACY и ACZ; и дважды отредактированные клетки AD могут быть объединены (и отредактированы) с векторами X, Y и Z для получения трижды отредактированных клеток ADX, ADY и ADZ, и т.д. В этом процессе может быть выполнено множество перестановок и комбинаций редактирования, приводящих к очень разнообразным популяциям клеток и библиотекам клеток. В любом рекурсивном процессе выгодно «вылечить» предыдущие векторы-двигатели и редактирующие векторы (или один вектор-двигатель+редактирующий вектор в одновекторной системе). «Лечение» является процессом, в котором один или более векторов, использованных в предшествующем цикле редактирования, устраняется из трансформированных клеток. Лечение может быть достигнуто, например, путем отщепления вектора (векторов) с использованием лечебной плазмиды, что делает редактирующий вектор и/или вектор-двигатель (или один объединенный вектор) нефункциональным; разбавления вектора (векторов) в популяции клеток посредством роста клеток (то есть чем больше циклов роста проходят клетки, тем меньшее количество дочерних клеток сохранят редактирующий вектор или вектор-двигатель), или, например, за счет использования термочувствительного источника репликации на редактирующем векторе или векторе-двигателе (или объединенном векторе). Условия для лечения будут зависеть от механизма, используемого для лечения; то есть в этом примере от того, как лечебная плазмида отщепляет редактирующую плазмиду и/или плазмиду-двигатель.
Производство библиотек клеток с использованием способов, модулей, инструментов и систем автоматизированного редактирования
[0220] В одном аспекте настоящее раскрытие предлагает способы, модули, инструменты автоматизированного редактирования, а также автоматизированные мультимодульные инструменты для редактирования клеток для создания библиотеки клеток, в которой экспрессия, уровни и/или активность РНК и/или интересующих белков варьируются в различных типах клеток с использованием различных стратегий редактирования, как более подробно описывается в настоящем документе. Соответственно, настоящее раскрытие предназначено для охвата библиотек отредактированных клеток, созданных с помощью способов автоматического редактирования и автоматизированных мультимодульных инструментов для редактирования клеток по настоящему изобретению. Эти библиотеки клеток могут иметь различные целевые изменения, включая, но не ограничиваясь этим, нокауты генов, введения генов, вставки, удаления, изменения единственного нуклеотида, редактирование коротких тандемных повторов, сдвиги рамки считывания, расширение триплетных кодонов и т.п. в клетках различных организмов. Они изменения могут быть направлены на кодирующие или некодирующие области генома и предпочтительно являются рациональными.
[0221] В других аспектах настоящее раскрытие предлагает способы автоматизированного редактирования и автоматизированные мультимодульные инструменты для редактирования клеток для создания библиотеки клеток, в которых варьируются связанные с ДНК процессы. Например, библиотека клеток может включать в себя индивидуальные клетки, имеющие изменения в участках связывания ДНК, чтобы препятствовать связыванию ДНК регуляторных элементов, которые модулируют экспрессию выбранных генов. В дополнение к этому, библиотеки клеток могут включать в себя изменения в геномной ДНК, которые влияют на клеточные процессы, такие как образование гетерохроматина, рекомбинация переключаемого класса и рекомбинация VDJ.
[0222] В конкретных аспектах библиотеки клеток создаются с использованием мультиплексированного редактирования индивидуальных клеток внутри популяции клеток, при этом множество клеток внутри популяции клеток редактируются за один цикл редактирования, то есть множество изменений внутри клеток библиотеки выполняется за одну автоматизированную операцию. Библиотеки, которые могут быть созданы в одной мультиплексной автоматизированной операции, могут содержать 500 отредактированных клеток, 1000 отредактированных клеток, 2000 отредактированных клеток, 5000 отредактированных клеток, 10000 отредактированных клеток, 50000 отредактированных клеток, 100000 отредактированных клеток, 200000 отредактированных клеток, 300000 отредактированных клеток, 400000 отредактированных клеток, 500000 отредактированных клеток, 600000 отредактированных клеток, 700000 отредактированных клеток, 800000 отредактированных клеток, 900000 отредактированных клеток, 1000000 отредактированных клеток, 2000000 отредактированных клеток, 3000000 отредактированных клеток, 4000000 отредактированных клеток, 5000000 отредактированных клеток, 6000000 отредактированных клеток, 7000000 отредактированных клеток, 8000000 отредактированных клеток, 9000000 отредактированных клеток, 10000000 отредактированных клеток или больше.
[0223] В других конкретных аспектах библиотеки клеток создаются с использованием рекурсивного редактирования индивидуальных клеток внутри популяции клеток, причем редактирующие изменения добавляются к индивидуальным клеткам в двух или более циклах редактирования. Использование рекурсивного редактирования приводит к объединению двух или более изменений, нацеленных на два или более участков в геноме в индивидуальных клетках библиотеки. Библиотеки, которые могут быть созданы в автоматизированной рекурсивной операции, могут содержать 500 отредактированных клеток, 1000 отредактированных клеток, 2000 отредактированных клеток, 5000 отредактированных клеток, 10000 отредактированных клеток, 50000 отредактированных клеток, 100000 отредактированных клеток, 200000 отредактированных клеток, 300000 отредактированных клеток, 400000 отредактированных клеток, 500000 отредактированных клеток, 600000 отредактированных клеток, 700000 отредактированных клеток, 800000 отредактированных клеток, 900000 отредактированных клеток, 1000000 отредактированных клеток, 2000000 отредактированных клеток, 3000000 отредактированных клеток, 4000000 отредактированных клеток, 5000000 отредактированных клеток, 6000000 отредактированных клеток, 7000000 отредактированных клеток, 8000000 отредактированных клеток, 9000000 отредактированных клеток, 10000000 отредактированных клеток или больше.
[0224] Примеры стратегий неавтоматизированного редактирования, которые могут быть модифицированы на основе настоящего описания для использования автоматизированных систем, можно найти, например, в американских патентах №№ 8110360, 8332160, 9988624, 20170316353 и 20120277120.
[0225] В конкретных аспектах рекурсивное редактирование может использоваться для того, чтобы сначала создать фенотип клетки, а затем более поздние циклы редактирования могут использоваться для полного изменения фенотипа и/или усиления других свойств клетки.
[0226] В некоторых аспектах библиотека клеток содержит изменения для создания неестественных аминокислот в клетке.
[0227] В конкретных аспектах настоящее раскрытие предлагает библиотеки отредактированных клеток, имеющих изменения в одном или более регулирующих элементах, созданные с использованием способов автоматического редактирования и автоматизированных мультимодульных инструментов для редактирования клеток по настоящему изобретению. Термин «регулирующий элемент» относится к молекулам нуклеиновой кислоты, которые могут влиять на транскрипцию и/или трансляцию функционально связанной кодирующей последовательности в конкретной среде и/или контексте. Этот термин включает в себя все элементы, которые поддерживают или регулируют транскрипцию и стабильность РНК, включая промоторы, основные элементы, необходимые для базового взаимодействия РНК-полимеразы и факторов транскрипции, предшествующие элементы, энхансеры и ответные элементы (см., например, Lewin, «Genes V» (Oxford University Press, Oxford) pages 847-873). Примерные регулирующие элементы прокариотов включают в себя, не ограничиваясь этим, промоторы, операторные последовательности и участки связывания рибосом. Регулирующие элементы, которые используются в эукариотических клетках, могут включать в себя, не ограничиваясь этим, промоторы, энхансеры, инсуляторы, сигналы сплайсинга и сигналы полиаденилирования.
[0228] Предпочтительно библиотека отредактированных клеток включает в себя изменения, рационально разработанные на основе предсказаний структуры, экспрессии и/или активности белка в конкретном типе клеток. Например, рациональный дизайн может быть основан на общесистемной биофизической модели редактирования генома с конкретной нуклеазой и регуляцией гена, чтобы предсказать, как различные параметры редактирования, включая экспрессию и/или связывание нуклеазы, условия роста и другие экспериментальные условия, совместно контролируют динамику нуклеазного редактирования. См., например, Farasat and Salis, PLoS Comput Biol., 29:12(1):e1004724 (2016).
[0229] В одном аспекте настоящее раскрытие предлагает создание библиотеки отредактированных клеток с различными рационально разработанными регулирующими последовательностями, созданными с использованием аппаратуры, систем и способов автоматизированного редактирования по настоящему изобретению. Например, библиотека отредактированных клеток может включать в себя популяции прокариотических клеток, созданные с использованием набора конститутивных и/или индуцибeльных промоторов, последовательностей энхансеров, операторных последовательностей и/или участков связывания рибосом. В другом примере библиотека отредактированных клеток может включать в себя эукариотические последовательности, созданные с использованием набора конститутивных и/или индуцибeльных промоторов, последовательностей энхансеров, операторных последовательностей и/или различных последовательностей Козака для экспрессии интересующих белков.
[0230] В некоторых аспектах настоящее раскрытие предлагает библиотеки клеток, включающие клетки с рационально разработанными изменениями, содержащими один или более классов изменений в представляющих интерес последовательностях в геноме организма. В конкретных аспектах настоящее раскрытие предлагает библиотеки клеток, включающие клетки с рационально разработанными изменениями, содержащими один или более классов изменений в представляющих интерес последовательностях в подмножестве генома. Например, библиотека клеток может включать в себя клетки с рационально разработанными изменениями, содержащими один или более классов изменений в представляющих интерес последовательностях в экзоме, например, в каждой или большинстве открытых рамок считывания генома. Например, библиотека клеток может включать в себя клетки с рационально разработанными изменениями, содержащими один или более классов изменений в представляющих интерес последовательностях в киноме. В еще одном примере библиотека клеток может включать в себя клетки с рационально разработанными изменениями, содержащими один или более классов изменений в представляющих интерес последовательностях в секретоме. В других аспектах библиотека клеток может включать в себя клетки с рационально разработанными изменениями, созданными для анализа различных изоформ белков, кодируемых в экзоме, и библиотеки клеток могут быть разработаны для управления экспрессией одной или нескольких конкретных изоформ, например, для анализа транскриптома.
[0231] Важно отметить, что в некоторых аспектах библиотеки клеток могут содержать изменения, использующие рандомизированные последовательности, например, рандомизированные промоторные последовательности, для уменьшения схожести между экспрессией одного или более белков в индивидуальных клетках внутри библиотеки. Кроме того, промоторы в библиотеке клеток могут быть конститутивными, индуцибeльными или обоими для обеспечения сильной и/или титруемой экспрессии.
[0232] В других аспектах настоящее раскрытие предлагает способы автоматизированного редактирования и автоматизированные мультимодульные инструменты для редактирования клеток для создания библиотеки клеток, содержащих изменения для идентификации оптимальной экспрессии выбранной генной мишени. Например, производство биохимических веществ с помощью метаболической инженерии часто требует экспрессии ферментов пути, и наилучший выход продукции достигается не всегда за счет максимального количества ферментов целевого пути в клетке, а скорее за счет точной настройки уровней экспрессии отдельных ферментов и связанных регуляторных белков и/или путей. Аналогичным образом уровни экспрессии гетерологичных белков иногда можно экспериментально отрегулировать для получения оптимальных выходов.
[0233] Наиболее очевидным способом воздействия транскрипции на уровни экспрессии генов является скорость инициации Pol II, которая может модулироваться комбинацией силы промотора или энхансера и транс-активирующих факторов (Kadonaga, et al., Cell, 116(2):247-57 (2004)). В эукариотах скорость удлинения может также определять рисунки экспрессии генов, влияя на альтернативный сплайсинг (Cramer et al., PNAS USA, 94(21):11456-60 (1997)). Неудачная терминация гена может нарушить экспрессию последующих генов за счет снижения доступности промотора для Pol II (Greger, et al., PNAS USA, 97(15):8415-20 (2000)). Этот процесс, известный как транскрипционная интерференция, особенно актуален для низших эукариот, поскольку они часто имеют близкорасположенные гены.
[0234] В некоторых вариантах осуществления настоящее раскрытие предлагает способы оптимизации транскрипции клеточных генов. Транскрипция генов является результатом нескольких различных биологических явлений, включая инициирование транскрипции (рекрутинг РНК-п и образование транскрипционного комплекса), удлинение (синтез/удлинение цепи), и терминацию транскрипции (отщепление РНК-п и терминацию).
Сайт-направленный мутагенез
[0235] Библиотеки клеток могут быть созданы с использованием способов, модулей, инструментов и систем автоматизированного редактирования, использующих сайт-направленный мутагенез, то есть когда последовательность аминокислот белка или другая геномная особенность может быть изменена сознательно и точно путем мутации белка или геномной особенности. Эти клеточные линии могут быть полезными для различных целей, например для определения функции белка внутри клетки, идентификации ферментативных активных центров внутри клеток и создания новых белков. Например, сайт-направленный мутагенез можно использовать мультиплексным образом для замены одной аминокислоты в последовательности белка на другую аминокислоту с другими химическими свойствами. Это позволяет определить эффект рационально разработанной или случайно сгенерированной мутации в отдельных клетках в клеточной популяции. См., например, публикацию Berg, et al. Biochemistry, Sixth Ed. (New York: W. H. Freeman and Company) (2007).
[0236] В другом примере изменения могут быть сделаны в отдельных клетках внутри библиотеки клеток для замены аминокислот в связывающих участках, например, замена одной или нескольких аминокислот в участке связывания белка для взаимодействия внутри белкового комплекса или замена одной или нескольких аминокислот в ферментативных карманах, которые могут вмещать в себя кофактор или лиганд. Этот класс изменений позволяет создавать определенные манипуляции с белком для измерения определенных свойств одного или нескольких белков, включая взаимодействие с другими кофакторами, лигандами и т.д. внутри белкового комплекса.
[0237] В других примерах различные типы редактирования могут быть выполнены для отдельных клеток в клеточной библиотеке с использованием сайт-специфического мутагенеза для изучения локусов количественных признаков экспрессии (eQTL). eQTL представляет собой локус, который объясняет часть генетической изменчивости фенотипа экспрессии гена. Библиотеки по настоящему изобретению могут быть полезными для оценки и привязки eQTL к фактическим болезненным состояниям.
[0238] В конкретных аспектах изменения, введенные в библиотеки клеток по настоящему изобретению, могут быть созданы с использованием рационального дизайна, основанного на известных или предсказанных структурах белков. См., например, публикацию Chronopoulou and Labrou, Curr Protoc Protein Sci.; Chapter 26:Unit 26,6 (2011). Такой сайт-направленный мутагенез может обеспечить индивидуальные клетки внутри библиотеки с одним или более сайт-направленными изменениями, и предпочтительно двумя или более сайт-направленными изменениями (например, комбинаторными изменениями) в популяции клеток.
[0239] В других аспектах библиотеки клеток по настоящему изобретению создаются с использованием сайт-направленной мутации кодонов, «сканирующей» все или по существу все кодоны в кодирующей области гена. Таким образом, отдельные изменения конкретных кодонов могут быть исследованы на предмет потери или усиления функции на основе конкретных полиморфизмов в одном или нескольких кодонах гена. Эти библиотеки могут быть мощным инструментом для определения того, какие генетические изменения являются скрытыми или являются причиной конкретного фенотипа в клетке или клеточной популяции. Изменения кодонов могут генерироваться случайным образом или могут быть рационально разработаны на основе известных полиморфизмов и/или мутаций, которые были идентифицированы в анализируемом гене. Кроме того, использование этих методик для двух или более генов по отдельности в одном пути в клетке может определять потенциальные взаимодействия белок:белок или избыточность клеточных функций или путей.
[0240] Например, сканирование аланина может использоваться для определения вклада конкретного остатка в стабильность или функцию данного белка. См., например, публикацию

[0241] В других конкретных аспектах библиотеки клеток могут быть созданы с использованием способов автоматизированного редактирования и автоматизированных мультимодульных инструментов для редактирования клеток по настоящему изобретению для определения активного участка белка, такого как фермент или гормон, и выяснения механизма действия одного или более из этих белков в библиотеке клеток. Сайт-направленный мутагенез, связанный с исследованиями молекулярного моделирования, может использоваться для определения структуры активного участка фермента и, следовательно, механизма его действия. Анализ этих библиотек клеток может обеспечить понимание роли, которую играют определенные аминокислотные остатки в активных участках белков, в контактах между подблоками белковых комплексов, во внутриклеточном перемещении и стабильности/периоде полужизни белка на различных генетических фонах.
Насыщающий мутагенез
[0242] В некоторых аспектах библиотеки клеток, созданные с использованием способов автоматизированного редактирования и автоматизированных мультимодульных инструментов для редактирования клеток по настоящему изобретению, могут быть библиотеками насыщающего мутагенеза, в которых один кодон или набор кодонов рандомизируются для получения всех возможных аминокислот в положении определенного гена или генов, представляющих интерес. Эти библиотеки клеток могут быть особенно полезными для генерирования вариантов, например, для направленной эволюции. См., например, публикации Chica, et al., Current Opinion in Biotechnology 16 (4): 378-384 (2005); и Shivange, Current Opinion in Chemical Biology, 13 (1): 19-25 (2009).
[0243] В некоторых аспектах изменения, содержащие различные вырожденные кодоны, можно использовать для кодирования наборов аминокислот в отдельных клетках в библиотеках. Поскольку некоторые аминокислоты кодируются большим количеством кодонов, чем другие, точное соотношение аминокислот не может быть равным. В некоторых аспектах используются более ограниченные вырожденные кодоны. «NNK» и «NNS» имеют то преимущество, что кодируют все 20 аминокислот, но все же кодируют стоп-кодон в 3% случаев. Альтернативные кодоны, такие как «NDT», «DBK», полностью избегают стоп-кодонов и кодируют минимальный набор аминокислот, который по-прежнему охватывает все основные биофизические типы (анионные, катионные, алифатические гидрофобные, ароматические гидрофобные, гидрофильные, малые).
[0244] В конкретных аспектах используется неизбыточный насыщающий мутагенез, в котором обычно используемый кодон для конкретного организма используется в процессе редактирования насыщающего мутагенеза.
Обмены и лесенки промоторов
[0245] Одним из механизмов анализа и/или оптимизации экспрессии одного или нескольких представляющих интерес генов является создание библиотеки клеток с «обменом промотора», в которой клетки содержат генетические модификации, в которых специфические промоторы связаны с одним или более интересующими генами. Соответственно, библиотеки клеток, созданные с использованием способов и автоматизированных мультимодульных инструментов для редактирования клеток по настоящему изобретению, могут быть библиотеками клеток с обменом промотора, которые могут быть использованы, например, для увеличения или уменьшения экспрессии интересующего гена с целью оптимизации метаболического или генетического пути. В некоторых аспектах библиотека клеток с обменом промотора может использоваться для идентификации увеличения или уменьшения экспрессии гена, который влияет на живучесть или жизнеспособность клеток, например, гена, кодирующего белок, который влияет на скорость роста или общее состояние клеток. В некоторых аспектах библиотека клеток с обменом промотора может использоваться для создания клеток, имеющих зависимости и логику между промоторами, с целью создания синтетических генных сетей. В некоторых аспектах обмены промоторов могут использоваться для управления межклеточной коммуникацией между клетками как гомогенных, так и гетерогенных (сложных тканей) популяций в природе.
[0246] Библиотеки клеток могут использовать любое заданное количество промоторов, которые были сгруппированы вместе на основе проявления диапазона силы экспрессии и любого заданного количества целевых генов. Лесенка промоторных последовательностей варьирует экспрессию по меньшей мере одного локуса по меньшей мере при одном условии. Эта лесенка затем систематически применяется к группе генов в организме, используя способы автоматизированного редактирования и автоматизированные мультимодульные инструменты для редактирования клеток по настоящему изобретению.
[0247] В конкретных аспектах библиотека клеток, сформированная с использованием процессов, модулей и систем автоматизированного редактирования по настоящему изобретению, включает в себя индивидуальные клетки, которые являются представителем данного промотора, функционально связанные с одним или более целевыми интересующими генами на в остальном идентичном генетическом фоне. Примеры неавтоматизированных стратегий редактирования, которые могут быть модифицированы для использования автоматизированных систем, можно найти, например, в американском патенте № 9988624.
[0248] В конкретных аспектах библиотека клеток с обменом промотора производится путем редактирования набора целевых генов, которые должны быть функционально связаны с заранее выбранным набором промоторов, которые действуют как «промоторная лесенка» для экспрессии интересующих генов. Например, клетки редактируются так, чтобы один или более из индивидуальных интересующих генов были отредактированы для функциональной связи с различными промоторами в промоторной лесенке. Когда эндогенный промотор не существует, его последовательность является неизвестной, или он был ранее изменен некоторым образом, индивидуальные промоторы промоторной лесенки могут быть вставлены перед интересующими генами. Эти полученные клеточные библиотеки содержат отдельные клетки с индивидуальным промотором лесенки, функционально связанным с одним или несколькими целевыми генами в идентичном во всех остальных отношениях генетическом контексте.
[0249] Промоторы обычно выбираются так, чтобы приводить к вариабельной экспрессии в разных локусах, и могут включать в себя индуцибельные промоторы, конститутивные промоторы или и то, и другое.
[0250] Набор целевых генов, отредактированных с использованием промоторной лесенки, может включать в себя все или большинство открытых рамок считывания (ORF) в геноме или выбранном подмножестве генома, например, ORF кинома или секретома. В некоторых аспектах целевые гены могут включать в себя кодирующие области для различных изоформ генов, и библиотеки клеток могут быть разработаны для экспрессии одной или более конкретных изоформ, например, для анализа транскриптома с использованием различных промоторов.
[0251] Набор целевых генов также может быть генами, о которых известно или предполагается, что они участвуют в конкретном клеточном пути, например, регуляторном пути или сигнальном пути. Набор целевых генов может быть открытыми рамками считывания, относящимися к функции, относящейся к ранее продемонстрированным полезным изменениям (предыдущим обменам промотора или предыдущим обменам SNP), алгоритмическому выбору на основе эпистатических взаимодействий между ранее созданными изменениями, другим критериям отбора, основанным на гипотезах относительно полезных для цели ORF, или случайно выбранными. В конкретных вариантах осуществления целевые гены могут содержать гены, не кодирующие белки, включая некодирующие РНК.
[0252] Редактирование других функциональных генетических элементов, включая элементы инсулятора и другие элементы геномной организации, также может использоваться для систематического изменения уровня экспрессии набора целевых генов и может быть введено с использованием способов и автоматизированных мультимодульных инструментов для редактирования клеток по настоящему изобретению. В одном аспекте популяция клеток редактируется с использованием лесенки энхансерных последовательностей, либо отдельно, либо в комбинации с выбранными промоторами или промоторной лесенкой для создания клеточной библиотеки, имеющей различные изменения в этих энхансерных элементах. В другом аспекте популяция клеток редактируется с использованием лесенки последовательностей связывания рибосом, либо отдельно, либо в комбинации с выбранными промоторами или промоторной лесенкой для создания клеточной библиотеки, имеющей различные изменения в этих последовательностях связывания рибосом.
[0253] В другом аспекте популяция клеток редактируется, чтобы позволить присоединение различных иРНК и/или белковых стабилизирующих или дестабилизирующих последовательностей к 5'- или 3'-концу или в любом другом месте транскрипта или белка.
[0254] В некоторых аспектах популяция клеток ранее созданной клеточной линии может быть отредактирована с использованием способов, модулей, инструментов и систем автоматизированного редактирования по настоящему изобретению для создания библиотеки клеток для улучшения функции, здоровья и/или жизнеспособности клеток. Например, многие промышленные штаммы, используемые в настоящее время для крупномасштабного производства, были разработаны с использованием процессов случайного мутагенеза итеративно в течение многих лет, иногда десятилетий. Нежелательные нейтральные и вредные мутации были введены в штаммы вместе с полезными изменениями, и со временем это привело к появлению штаммов с недостаточной общей надежностью и ключевыми характеристиками, такими как скорость роста. В другом примере клеточные линии млекопитающих продолжают мутировать в течение определенного периода времени, и аналогичным образом эти клеточные линии могут стать нестабильными и приобрести нежелательные черты. Способы автоматизированного редактирования и автоматизированные мультимодульные инструменты для редактирования клеток по настоящему изобретению могут использовать такие стратегии редактирования, как обмен SNP и/или STR, создание вставки-удаления, или другие методики для удаления или изменения нежелательных последовательностей генома и/или введения новых последовательностей генома для устранения недостатков, сохраняя при этом желаемые свойства клеток.
[0255] Когда используется рекурсивное редактирование, редактирование в индивидуальных клетках в библиотеке отредактированных клеток может содержать включение «посадочных площадок» в эктопический участок генома (например, локус CarT) для оптимизации экспрессии, стабильности и/или контроля.
[0256] В некоторых вариантах осуществления каждая полученная библиотека, имеющая индивидуальные клетки, содержащие одно или более изменений (вставок или удалений), культивируется и анализируется по одному или нескольким критериям (например, для получения химического вещества или продукта, представляющего интерес). Клетки, обладающие конкретными критериями, затем связываются или коррелируются с одним или более конкретными изменениями в клетке. Таким образом может быть определено влияние данного изменения на любое количество представляющих интерес генетических или фенотипических признаков. Идентификация множественных изменений, связанных с конкретными критериями или улучшенными функциональными возможностями/надежностью, может привести к клеткам с очень желательными характеристиками.
Нокаутирующие или вводящие библиотеки
[0257] В некоторых аспектах настоящее раскрытие предлагает способы, модули, инструменты и системы автоматизированного редактирования для создания библиотеки клеток, имеющих «нокаутирующие» (KO) или «вводящие» (KI) изменения различных интересующих генов. Таким образом, настоящее изобретение предназначено для охвата библиотек отредактированных клеток, созданных с помощью способов автоматизированного редактирования и автоматизированных мультимодульных инструментов для редактирования клеток по настоящему изобретению, которые имеют одну или более мутаций, которые удаляют или снижают экспрессию выбранных интересующих генов, чтобы исследовать влияние этих изменений на функции гена в индивидуальных клетках внутри библиотеки клеток.
[0258] Библиотеки клеток могут быть созданы с использованием нацеленного гена KO (например, посредством вставки/удаления) или нескольких КО (например, посредством гомологически направленного ремонта). Например, двухцепочечные разрывы часто восстанавливаются посредством пути восстановления соединением негомологичных концов ДНК. Такое восстановление, как известно, подвержено ошибкам, и таким образом могут быть введены вставки и удаления, которые могут нарушить функцию гена. Предпочтительно изменения рационально разрабатываются для специфического воздействия на интересующие гены, и могут быть созданы отдельные клетки, имеющие KI или KI одного или нескольких интересующих локусов. Клетки, имеющие KO или KI двух или более интересующих локусов, могут быть созданы с использованием автоматизированного рекурсивного редактирования по настоящему изобретению.
[0259] В конкретных аспектах библиотеки клеток KO или KI создаются с использованием одновременного мультиплексированного редактирования клеток внутри популяции клеток, и множество клеток внутри популяции клеток редактируются за один цикл редактирования, то есть множество изменений внутри клеток библиотеки выполняется за одну автоматизированную операцию. В других конкретных аспектах библиотеки клеток создаются с использованием рекурсивного редактирования индивидуальных клеток внутри популяции клеток, что приводит к объединению множественных изменений двух или более участков в геноме в одиночных клетках.
Замены SNP или коротких тандемных повторов
[260] В одном аспекте библиотеки клеток создаются с использованием способов автоматизированного редактирования и автоматизированных мультимодульных инструментов для редактирования клеток по настоящему изобретению с помощью систематического введения или замещения единичных нуклеотидных полиморфизмов («SNP») в геномы индивидуальных клеток для того, чтобы создать библиотеку клеток с «обменом SNP». В некоторых вариантах осуществления способы обмена SNP по настоящему изобретению включают в себя как добавление полезных SNP, так и удаление вредных и/или нейтральных SNP. Обмены SNP могут предназначаться для кодирующих последовательностей, некодирующих последовательностей, или и для тех, и для других.
[0261] В другом аспекте библиотека клеток создается с использованием способов, модулей, инструментов и систем автоматизированного редактирования по настоящему изобретению с помощью систематического введения или замещения коротких тандемных повторов («STR») в геномы индивидуальных клеток для того, чтобы создать библиотеку клеток с «обменом STR». В некоторых вариантах осуществления способы обмена STR по настоящему изобретению включают в себя как добавление полезных STR, так и удаление вредных и/или нейтральных STR. Обмены STR могут предназначаться для кодирующих последовательностей, некодирующих последовательностей, или и для тех, и для других.
[0262] В некоторых вариантах осуществления замена SNP и/или STR, используемая для создания библиотеки клеток, мультиплексируется, и множество клеток внутри популяции клеток редактируется в одном цикле редактирования, то есть множественные изменения в клетках библиотеки клеток выполняются в ходе единственной автоматизированной операции. В других вариантах осуществления замена SNP и/или STR, используемая для создания библиотеки клеток, является рекурсивной, что приводит к объединению множества полезных последовательностей и/или удалению вредных последовательностей в одиночных клетках. Множественные изменения могут быть либо конкретным набором определенных изменений, либо частично рандомизированной, комбинаторной библиотекой мутаций. Удаление вредных мутаций и объединение полезных мутаций может обеспечить немедленное улучшение различных клеточных процессов. Удаление генетического бремени или объединение полезных изменений в штамм без генетического бремени также обеспечивает новую надежную отправную точку для дополнительного случайного мутагенеза, который может способствовать дальнейшим улучшениям.
[0263] Обмен SNP преодолевает фундаментальные ограничения подходов случайного мутагенеза, поскольку это не случайный подход, а скорее систематическое введение или удаление индивидуальных мутаций в клетках.
Редактирование участка сплайсинга
[0264] Сплайсинг РНК представляет собой процесс, во время которого интроны вырезаются, а экзоны сплайсируются вместе, чтобы создать иРНК, которая транслируется в белок. Точное распознавание сигналов сплайсинга клеточными механизмами имеет решающее значение для этого процесса. Соответственно, в некоторых аспектах популяция клеток редактируется с использованием систематического редактирования для известных и/или прогнозируемых донорных и/или акцепторных участков сплайсинга в различных локусах для создания библиотеки вариантов участков сплайсинга различных генов. Такое редактирование может помочь выяснить биологическое значение различных изоформ генов в клеточном контексте. Последовательности для рационального конструирования участков сплайсинга различных кодирующих областей, включая фактические или предсказанные мутации, связанные с различными заболеваниями млекопитающих, можно предсказать, используя методы анализа, такие как описанные в публикациях Nalla and Rogan, Hum Mutat, 25:334-342 (2005); Divina, et al., Eur J Hum Genet, 17:759-765 (2009); Desmet, et аl., Nucleic Acids Res, 37:e67 (2009); Faber, et al., BMC Bioinformatics, 12(suppl 4):S2 (2011).
Обмены стартстопных кодонов и включение аналогов нуклеиновых кислот
[0265] В некоторых аспектах настоящее раскрытие предлагает создание библиотек клеток с использованием способов, модулей, инструментов и систем автоматизированного редактирования по настоящему изобретению, где библиотеки создаются путем замены вариантов начального и конечного кодона по всему геному организма или для выбранного подмножества кодирующих областей в геноме, например, кинома или секретома. В этой библиотеке клеток индивидуальные клетки будут иметь один или более начальных и конечных кодонов, заменяющих нативный начальный или конечный кодон для одного или более интересующих генов.
[0266] Например, типичными начальными кодонами, используемыми эукариотами, являются ATG (AUG), а прокариоты чаще всего используют ATG (AUG), за которыми следуют GTG (GUG) и TTG (UUG). Эта библиотека клеток может включать в себя индивидуальные клетки, имеющие подстановки для нативных начальных кодонов для одного или более интересующих генов.
[0267] В некоторых аспектах настоящее раскрытие предлагает автоматизированное создание библиотеки клеток путем замены начальных кодонов ATG на TTG перед выбранными интересующими генами. В других аспектах настоящее раскрытие предлагает автоматизированное создание библиотеки клеток путем замены начальных кодонов ATG на GTG. В других аспектах настоящее раскрытие предлагает автоматизированное создание библиотеки клеток путем замены начальных кодонов GTG на АTG. В других аспектах настоящее раскрытие предлагает автоматизированное создание библиотеки клеток путем замены начальных кодонов GTG на ТTG. В других аспектах настоящее раскрытие предлагает автоматизированное создание библиотеки клеток путем замены начальных кодонов ТTG на АTG. В других аспектах настоящее раскрытие предлагает автоматизированное создание библиотеки клеток путем замены начальных кодонов ТTG на GTG.
[0268] В других примерах типичными стоп-кодонами для S. cerevisiae и млекопитающих являются TAA (UAA) и TGA (UGA), соответственно. Типичным стоп-кодоном для однодольных растений является TGA (UGA), тогда как насекомые и E. coli обычно используют в качестве стоп-кодона TAA (UAA) (Dalphin et al., Nucl. Acids Res., 24: 216-218 (1996)). Эта библиотека клеток может включать в себя индивидуальные клетки, имеющие подстановки для нативных стоп-кодонов для одного или более интересующих генов.
[0269] В некоторых аспектах настоящее раскрытие предлагает автоматизированное создание библиотеки клеток путем замены стоп-кодонов TAA на TAG. В других аспектах настоящее раскрытие предлагает автоматизированное создание библиотеки клеток путем замены стоп-кодонов TAA на TGA. В других аспектах настоящее раскрытие предлагает автоматизированное создание библиотеки клеток путем замены стоп-кодонов TGA на TAA. В других аспектах настоящее раскрытие предлагает автоматизированное создание библиотеки клеток путем замены стоп-кодонов TGA на TAG. В других аспектах настоящее раскрытие предлагает автоматизированное создание библиотеки клеток путем замены стоп-кодонов TAG на TAA. В других аспектах настоящее изобретение предлагает автоматизированное создание библиотеки клеток путем замены стоп-кодонов TAG на TGA.
Обмены и лесенки терминатора
[0270] Одним из механизмов определения оптимальной терминации предварительно сплайсированной иРНК одного или нескольких интересующих генов является создание библиотеки клеток с «заменой терминаторов», в которой клетки содержат генетические изменения, имеющие определенные последовательности терминаторов, связанные с одним или более интересующими генами. Соответственно, библиотеки клеток, созданные с использованием способов, модулей, инструментов и систем по настоящему изобретению, могут быть библиотеками клеток с заменой терминаторов, которые можно использовать, например, для воздействия на стабильность иРНК путем высвобождения транскриптов из участков синтеза. В других вариантах осуществления библиотеку клеток с заменой терминаторов можно использовать для идентификации увеличения или уменьшения эффективности терминации транскрипции и, таким образом, накопления несплайсированной предварительной иРНК (см., например, West and Proudfoot, Mol Cell.; 33(3-9); 354-364 (2009)) и/или обработки 3' конца (см., например, West, et al., Mol Cell. 29(5):600-10 (2008)). В том случае, когда ген связан с несколькими участками терминации, при редактировании можно редактировать комбинацию правок для нескольких терминаторов, связанных с геном. Дополнительные аминокислоты также могут быть добавлены к концам белков для определения влияния длины белка на терминаторы.
[0271] Эти библиотеки клеток могут использовать любое заданное количество редакций терминаторов, которые были выбраны для лесенки терминаторов на основе проявления диапазона активности, и любое заданное количество целевых генов. Лесенка терминирующих последовательностей варьирует экспрессию по меньшей мере одного локуса по меньшей мере при одном условии. Эта лесенка затем систематически применяется к группе генов в организме, используя способы, модули, инструменты и системы автоматизированного редактирования по настоящему изобретению.
[0272] В некоторых аспектах настоящее раскрытие предлагает создание библиотек клеток с использованием способов, модулей, инструментов и систем автоматизированного редактирования по настоящему изобретению, где библиотеки создаются для редактирования сигналов терминатора в одной или нескольких областях генома в отдельных клетках библиотеки. Терминация транскрипции в эукариотах осуществляется посредством сигналов терминатора, которые распознаются белковыми факторами, связанными с РНК-полимеразой II. Например, библиотека клеток может содержать индивидуальные эукариотические клетки с изменениями в генах, кодирующих фактор специфичности полиаденилирования (CPSF) и фактор стимуляции расщепления (CstF), и/или в генах, кодирующих белки, рекрутированные факторами CPSF и CstF в участки терминации. У прокариот два основных механизма, называемых Rho-независимой и Rho-зависимой терминацией, опосредуют терминацию транскрипции. Например, библиотека клеток может содержать индивидуальные прокариотические клетки с изменениями в генах, кодирующих белки, которые влияют на связывание, эффективность и/или активность этих путей терминации.
[0273] В некоторых аспектах настоящее раскрытие предлагает способы выбора терминирующих последовательностей («терминаторов») с оптимальными свойствами. Например, в некоторых вариантах осуществления настоящее раскрытие предлагает способы для введения и/или редактирования одного или более терминаторов и/или генерирования вариантов одного или более терминаторов внутри клетки-хозяина, которые демонстрируют диапазон активности. Конкретная комбинация терминаторов может быть сгруппирована вместе в виде лесенки терминаторов, и клеточные библиотеки по настоящему описанию включают в себя отдельные клетки, которые представляют терминаторы, функционально связанные с одним или более целевых интересующих генов на в остальном идентичном генетическом фоне. Примеры неавтоматизированных стратегий редактирования, которые могут быть модифицированы для использования автоматизированных инструментов, можно найти, например, в американском патенте № 9988624 (Serber et al.), озаглавленном как «Улучшение микробных штаммов с помощью платформы геномной инженерии HTP».
[0274] В конкретных аспектах библиотека клеток с обменом терминаторов производится путем редактирования набора целевых генов, которые должны быть функционально связаны с заранее выбранным набором терминаторов, которые действуют как «лесенка терминаторов» для экспрессии интересующих генов. Например, клетки редактируются так, чтобы эндогенный промотор был функционально связан с индивидуальными интересующими генами, редактируемыми различными промоторами в промоторной лесенке. Когда эндогенный промотор не существует, его последовательность является неизвестной, или он был ранее изменен некоторым образом, индивидуальные промоторы промоторной лесенки могут быть вставлены перед интересующими генами. Эти полученные клеточные библиотеки содержат отдельные клетки с индивидуальным промотором лесенки, функционально связанным с одним или несколькими целевыми генами в идентичном во всех остальных отношениях генетическом контексте. Рассматриваемая лесенка терминаторов затем связывается с данным интересующим геном.
[0275] Лесенка терминаторов может использоваться для более общего воздействия на терминацию всех или большинства ORF в геноме или в выбранном подмножестве генома, например, ORF кинома или секретома. Набор целевых генов также может быть генами, о которых известно или предполагается, что они участвуют в конкретном клеточном пути, например, регуляторном пути или сигнальном пути. Набор целевых генов может быть открытыми рамками считывания, относящимися к функции, относящейся к ранее продемонстрированным полезным изменениям (предыдущим обменам промотора или предыдущим обменам SNP), алгоритмическому выбору на основе эпистатических взаимодействий между ранее созданными изменениями, другим критериям отбора, основанным на гипотезах относительно полезных для цели ORF, или случайно выбранными. В конкретных вариантах осуществления целевые гены могут содержать гены, не кодирующие белки, включая некодирующие РНК.
ПРИМЕРЫ
[0276] Следующие примеры приведены для того, чтобы предоставить специалистам в данной области техники полное раскрытие и описание способов создания и использования настоящего изобретения, и не предназначены для ограничения объема того, что авторы считают своим изобретением, и при этом они не подразумевают, а также не означают того, что приводимые ниже эксперименты являются всеми или единственными выполненными экспериментами. Предполагается, что другие эквивалентные способы, стадии и композиции входят в объем настоящего изобретения. Авторами были приложены все усилия для того, чтобы гарантировать точность использованных чисел (например, количества, температуры и т.д.), но некоторые экспериментальные погрешности и отклонения все-таки необходимо учитывать. Если не указано иное, части являются массовыми частями, молекулярная масса является средневесовой молекулярной массой, температура определяется в градусах по Цельсию, а давление является атмосферным или близким к атмосферному.
Пример 1: Оценка пригодности модельной индуцибeльной системы
[0277] Были оценены основные компоненты модельной системы. Модельная система содержала клетки Е. coli, трансформированные с помощью вектора-двигателя, где вектор-двигатель содержал кодирующую последовательность для нуклеазы MAD (то есть нуклеазы MAD 4 или MAD 7) под управлением термоиндуцибeльного промотора pL, маркер устойчивости к хлорамфениколу и рекомбинационную систему λ Red под управлением промотора pBAD (индуцируемого добавлением арабинозы в питательную среду). Клетки E.coli были также трансформированы с помощью редактирующего вектора, содержащего редактирующий олигонуклеотид, который в этой модельной системе был библиотекой редактирующих олигонуклеотидов, выполненных с возможностью инактивации galK, где успешное редактирование дает белые (по сравнению с красными) колонии при посеве на агар-агаре Макконки, содержащем галактозу в качестве единственного источника углерода. В дополнение к этому, редактирующий вектор содержал кодирующую последовательность гРНК под управлением индуцируемого температурой промотора pL, маркер устойчивости к карбенициллину и последовательность для удаления, мутации или иного инактивирования области PAM в целевой последовательности. Фиг. 11A и 11B изображают примерный вектор-двигатель (Фиг. 11A) и редактирующий вектор (Фиг. 11B), которые могут использоваться в описанных в настоящем документе примерных процессах редактирования. На Фиг. 11A примерный вектор-двигатель 1110 (p197) содержит репликатор 1112 и промотор 1114, управляющий экспрессией гена, кодирующего репрессор 1116 c1857, который управляет промотором pL. Первый промотор pL в этом примерном варианте осуществления управляет транскрипцией гРНК на редактирующем векторе, как описано со ссылкой на Фиг. 11B ниже, а второй промотор pL 1118 на векторе-двигателе управляет экспрессией нуклеазы 1120. Промотор, управляющий нуклеазой 1120, может быть индуцибельным или конститутивным промотором; однако наиболее жесткая регуляция системы на основе направляемой нуклеиновой кислотой нуклеазы достигается при использовании индуцибeльного промотора для управления экспрессией нуклеазы, а также направляющей нуклеиновой кислоты. Опять же, одинаковые индуцибeльные промоторы и различные индуцибeльные промоторы могут использоваться для управления транскрипцией направляющей нуклеиновой кислоты и нуклеазы. Промотор pL может регулироваться (например, подавляться или индуцироваться) термолабильным репрессором c1857 (1116), который является активным при разрешающих температурах (например, 30°C) и неактивным при более высоких температурах (например, 42°C). Регуляция промотора pL более подробно показана на Фиг. 1C выше.
[0278] Вектор-двигатель на Фиг. 11A дополнительно содержит промотор pBAD (1140), управляющий экспрессией компонентов рекомбинационной системы λ Red (1142). Промотор pBAD, как и промотор pL, является индуцибeльным промотором; однако промотор pBAD регулируется (индуцируется) добавлением арабинозы к среде для выращивания. Следует отметить, что в этой примерной системе бактериального редактирования рекомбинационная система, такая как рекомбинационная система λ Red, предусматривается как компонент системы редактирования на основе направляемой нуклеиновой кислотой нуклеазы для починки разрывов ДНК, которые происходят во время редактирования. В некоторых вариантах осуществления, однако, редактируемые клетки могут уже содержать рекомбинационную систему (например, эписомально, интегрированную в клеточный геном или естественным образом). Кроме того, хотя здесь иллюстрируется рекомбинационная система λ Red, следует понимать, что могут использоваться другие рекомбинационные системы. Кроме того, клетки - такие как клетки дрожжей, растений и животных - не нуждаются в рекомбинационной системе, эквивалентной рекомбинационной системе λ Red, для восстановления разрывов ДНК, возникающих в результате редактирования. Таким образом редактирующие компоненты направляемой нуклеиновой кислотой нуклеазы для, например, клеток дрожжей, растений и животных не обязательно должны включать в себя гетерологичную рекомбинационную систему. Наконец, примерный вектор-двигатель 1110 содержит промотор 1150, управляющий экспрессией селектируемого маркера 1152 хлорамфеникола. Кроме того, вектор-двигатель и все другие векторы или конструкции, используемые в раскрытом способе, содержат подходящие управляющие элементы (например, сигналы полиаденилирования, энхансеры), функционально связанные с компонентами системы редактирования на основе направляемой нуклеиновой кислотой нуклеазы.
[0279] Фиг. 11B изображает примерный редактирующий вектор 1130 (pLFORGE). Редактирующий вектор 1130 содержит репликатор 1132 и промотор 1134 pL, управляющий экспрессией редактирующей кассеты 1136. Редактирующая кассета содержит кодирующую последовательность для гРНК 1144, спейсер 1146 и донорную ДНК 1158 (содержащую гомологичные плечи, располагающиеся по бокам желаемого изменения в целевой последовательности). Редактирующий вектор 1130 также содержит промотор 1154, управляющий экспрессией селектируемого маркера 1156 карбенициллина. Следует отметить, что pL-индуцибeльный промотор 1134 кодируется на скелете вектора и не является частью редактирующей кассеты 1136; однако в других вариантах осуществления индуцибeльный промотор, управляющий транскрипцией гРНК, может быть частью редактирующей кассеты. Фиг. 11A и 11B изображают примерные вектор-двигатель и редактирующий вектор, соответственно, но специалисту в данной области техники с учетом настоящего описания будет понятно, что все элементы системы редактирования на основе направляемой нуклеиновой кислотой нуклеазы могут содержаться на единственной плазмиде, или элементы, показанные на векторе-двигателе и редактирующем векторе на Фиг. 11A и 11B, могут находиться на векторе, отличающемся от показанного. Например, промотор pBAD и рекомбинационная система λ Red могут находиться на редактирующем векторе, а не на векторе-двигателе; аналогичным образом ген для репрессора c1857 может находиться на редактирующем векторе, а не на векторе-двигателе.
[0280] Фиг. 12 представляет собой гистограмму, показывающую эффективность трансформации, наблюдаемую для кассет нацеливания гРНК galK под различными промоторами. Эффективность трансформации неиндуцированных промоторов является показателем утечки промоторов. Если имеется высокая базальная экспрессия гРНК (например, «утечка»), то количество КОЕ будет низким. Если имеется низкая базальная экспрессия гРНК (например, жесткое регулирование), то количество КОЕ будет высоким. Эксперимент с нецелевыми гРНК выполнялся с пулом кассет, предназначенных для нацеливания на неактивные последовательности PAM, которые не могут способствовать связыванию и расщеплению гРНК и нуклеазы. Для каждого из изображенных промоторов (pL, pBAD и sigma32) после промотора клонировалась кассета, нацеленная на galK с помощью TTTC PAM, и спейсер, сконфигурированный для вставки стоп-кодона в аминокислоту D70. Концентрации плазмид были нормализованы до 50 нг/мкл и трансформированы в равные объемы клеток. КОЕ посевов для серийных разбавлений использовались для определения эффективности трансформации, выраженной в КОЕ/мкг. Промотор J23119 является конститутивным промотором, промотор pL индуцируется высокой температурой, промотор pBAD индуцируется присутствием арабинозы в среде для выращивания, и промотор sigma32 индуцируется в клетках стационарной фазы. Для нуклеазы MAD7 промотор sigma32 демонстрирует экспрессию с утечкой, в то время как промоторы pL и pBAD жестко репрессируются.
[0281] Фиг. 13 представляет собой график, показывающий влияние термической индукции на жизнеспособность клетки. В этом эксперименте был разработан пул кассет для нацеливания на неактивную последовательность PAM. Клетки были разбавлены в соотношении 1/50 по объему в микротитровальных пластинах, содержащих 200 мкл LB+хлорамфеникол/карбенициллин. Разбавленные культуры индуцировались в течение 1 час при указанных температурах перед возвращением к 30°C при непрерывном встряхивании в планшет-ридере Infinite M Nano+. T0 соответствует времени стадии индуцирования, а рост отслеживался путем измерения OD600 с 10-минутными интервалами. Следует отметить, что высокотемпературное (42°C) индуцирование не оказывает влияния на жизнеспособность клетки или скорость роста.
[0282] Фиг. 14 показывает результаты объединенных экспериментов по индукции с использованием редактирующей кассеты с подтвержденной последовательностью, которая нацелена на локус galK и вводит стоп-кодон в аминокислоту D70. После трехчасового роста клетки либо индуцировались при 42°C в течение 15 мин, либо сохранялись при 30°C перед посевом для серийных разбавлений. Величина КОЕ/мл вычислялась на основе объемов посева. Для справки пунктирная линия на Фиг. 14 показывает типичное значение КОЕ, получаемое в эквивалентном эксперименте с использованием конститутивного промотора J23119 (данные не показаны). Как можно заметить, отсутствие индукции (то есть отсутствие редактирования) обеспечивает высокую эффективность трансформации (10-100 раз) из-за отсутствия токсичных разрывов двухцепочечной ДНК.
[0283] Фиг. 15 показывает профили роста случайным образом выбранных вариантов из библиотеки тихих мутаций PAM (SPM). Эта библиотека из 500 элементов нацелена на области, расположенные по всему организму E. coli, и объединяет синонимичные мутации, которые не имеют ожидаемых эффектов приспособляемости. Колонии отбирались из агаровых пластин с неиндуцированными трансформированными клетками. Клетки отбирались из агаровой пластинки и выращивались в 200 мкл LB+хлорамфеникол/карбенициллин в течение ночи в 96-луночной микротитровальной пластине. Затем 10 мкл содержимого лунок исходной микротитровальной пластины переносились на две реплики дочерних микротитровальных пластин, которые не подвергались индукции (наверху) или индукции гРНК и нуклеазы (посредством pL-индуцибeльного промотора) в течение 1 часа при 42°C (внизу). Карты лунок показывают относительную OD через 6 час. Врезки показывают примеры полных кривых роста для указанных лунок в качестве справки. Лунки с репликами представляют рост, наблюдаемый для кассет одной и той же конструкции с индукцией гРНК или без нее. В то время как большинство лунок для пластины без индукции показывают нормальные профили роста, пластина с индукцией показывает, что большая часть конструкций гРНК все еще является активной при индуцировании, на что указывает большая задержка до того момента, как клетки достигнут экспоненциального роста. Таким образом, активно редактируемые клетки имеют пониженную жизнеспособность из-за повреждения ДНК, так что многие из них вымирают, а выжившие отредактированные клетки с самого начала растут медленно, поскольку клеточный механизм работает над восстановлением редактирования. Эта характеристика отредактированных клеток может использоваться для скрининга активного редактирования с высокой производительностью.
Пример 2: Амплификация и сборка редактирующей кассеты и основной цепи
[0284]Подготовка редактирующей кассеты: 5 нМ олигонуклеотидов, синтезированных на чипе, были амплифицированы с использованием полимеразы Q5 в объемах 50 мкл. Условия PCR были следующими: 95°C в течение 1 мин; 8 циклов при 95°C в течение 30 с/60°C в течение 30 с/72°C в течение 2,5 мин; с окончательной выдержкой при 72°C в течение 5 мин. После амплификации продукты PCR были подвергнуты очистке SPRI, где 30 мкл смеси SPRI добавлялись к 50 мкл реакции ПЦР и инкубировались в течение 2 мин. Пробирки были подвергнуты воздействию магнитного поля в течение 2 мин, жидкость была удалена, и шарики были промыты 2 раза 80%-ным этанолом с перерывом в 1 мин между промывками. После окончательной промывки шарикам давали высохнуть в течение 2 минут, в пробирки добавляли 50 мкл 0,5x TE с pH 8,0, и шарики встряхивали для перемешивания. Эта суспензия культивировалась при комнатной температуре в течение 2 мин, а затем подвергалась воздействию магнитного поля в течение 2 мин. Затем элюат удалялся, и ДНК определялась количественно.
[0285] После количественного анализа вторая процедура амплификации выполнялась с использованием разбавления элюата после очистки SPRI. PCR выполнялась при следующих условиях: 95°C в течение 1 мин; 18 циклов при 95°C в течение 30 с/72°C в течение 2,5 мин; с окончательной выдержкой при 72°C в течение 5 мин. Ампликоны были проверены на 2%-ном агарозном геле, и были идентифицированы пулы с наиболее чистым выходом (выходами). Продукты амплификации, содержащие гетеродимеры или химеры, не использовались.
[0286]Подготовка основной цепи: Была выполнена 10-кратная серия серийных разбавлений очищенной основной цепи, и каждая из серий разбавленных основных цепей была амплифицирована при следующих условиях: 95°C в течение 1 мин; затем 30 циклов при 95°C в течение 30 с/60°C в течение 1,5 мин/72°C в течение 2,5 мин; с окончательной выдержкой при 72°C в течение 5 мин. После амплификации амплифицированная основная цепь была подвергнута очистке SPRI, описанной выше для кассет. Основная цепь элюировалась в 100 мкл дистиллированной деминерализированной воды и количественно определялась перед сборкой Gibson Assembly®.
[0287]Сборка Gibson Assembly: 150 нг основной цепи ДНК было объединено со 100 нг кассетной ДНК. Был добавлен равный объем 2x Gibson Master Mix, и реакционная смесь инкубировалась в течение 45 мин при 50°C. После сборки собранная основная цепь и кассеты были подвергнуты очистке SPRI, как было описано выше.
Пример 3: Трансформация библиотеки редактирующих векторов в E cloni®
[0288] Трансформация: 20 мкл подготовленной реакционной смеси редактирующего вектора Gibson Assembly были добавлены к 30 мкл охлажденной воды вместе с 10 мкл максимально компетентных клеток E cloni® (Lucigen, Миддлтон, Висконсин). Аликвоты трансформированных клеток высевались пятнами для проверки эффективности трансформации, при этом для продолжения требовалось более чем 100-кратное покрытие. Трансформированные клетки E cloni® выращивались в 25 мл SOB+100 мкг/мл карбенициллина. Исходные глицериновые смеси получали из насыщенной культуры путем добавления 500 мкл 50% глицерина к 1000 мкл насыщенной ночной культуры. Эти исходные смеси были заморожены при -80°C. Эта стадия является необязательной и обеспечивает готовое сырье клонированной редактирующей библиотеки. Альтернативно перед каждым экспериментом редактирования может выполняться гибсоновская или другая сборка редактирующих кассет и основной цепи вектора.
Пример 4: Подготовка компетентных клеток
[0289] 1 мл аликвота свежевыращенной ночной культуры клеток EC1, трансформированных с помощью вектора-двигателя, была добавлена в колбу емкостью 250 мл, содержащую среду из 100 мл LB/SOB+25 мкг/мл хлорамфеникола. Клетки выращивались до OD 0,4-0,7, и рост клеток был остановлен путем переноса культуры на лед на 10 мин. Клетки были осаждены при 8000 g в роторе JA-18 в течение 5 мин, промыты 3 раза 50 мл ледяной дистиллированной деминерализированной воды или 10%-ным глицерином, и осаждены при 8000 g в роторе JA-18 в течение 5 мин. Промытые клетки были повторно суспендированы в ледяном 10%-ном глицерине на 5 мл и поделены на аликвоты по 200 мкл. Опционально в этой точке глицериновое сырье могло сохраняться при -80°C для более позднего использования.
Пример 5: Создание новой клеточной линии, трансформированной с помощью вектора-двигателя
[0290] Трансформация: 1 мкл ДНК вектора-двигателя (содержащей кодирующую последовательность для нуклеазы MAD7 под управлением pL-индуцибeльного промотора, ген устойчивости к хлорамфениколу и рекомбинационную систему λ Red) был добавлен к 50 мкл штамма EC1 клеток E.coli. Трансформированные клетки были посеяны на пластинах LB с 25 мкг/мл хлорамфеникола и культивировались в течение ночи для накопления клональных (или по существу клональных) изолятов. На следующий день колония была отобрана, выращена за ночь в LB+25 мкг/мл хлорамфеникола, и глицериновое сырье было приготовлено из насыщенной ночной культуры путем добавления 500 мкл 50%-ного глицерина к 1000 мкл культуры. Сырье EC1, содержащее вектор-двигатель, было заморожено при -80°C.
Пример 6: Высокопроизводительное клональное редактирование
[0291] Следующие протоколы решают проблему смещения роста/выживания клеток благодаря разрывам двухцепочечной ДНК:
[0292] Трансформация: 100 нг клонированной библиотеки редактирующего вектора или реакционной смеси редактирующего вектора Gibson Assembly® было трансформировано электропорацией в 100 мкл компетентных клеток EC1, содержащих вектор-двигатель. Электропоратор был установлен на 2400 В в кювете размером 2 мм. После трансформации клеткам давали возможность восстановиться в течение 3 час в среде SOB. Серия 10-кратных разведений восстановленных клеток (в H2О) высевалась пятнами, и полученные соотношения КОЕ/разведение использовались для расчета эффективности трансформации.
[0293] Посев и выстраивание колоний: 100 мкл подходящего разбавления клеток были посеяны на среде LB+25 мкг/мл хлорамфеникола и выращивались при 30°C в течение ночи. Колонии отбирались и выращивались в течение ночи до насыщения при 30°C в 96-луночных микротитровальных пластинах.
[0294] Индуцированная резка, редактирование и валидация редактирования: Репликатор использовался для переноса колоний из лунок ночных пластин в 200 мкл свежего SOB+1% арабинозы в 96-луночных микротитровальных пластинах для реплик. Репликатор переносит приблизительно 1-2 мкл на лунку, что приводит к 100-кратному разбавлению для выращивания. Микротитровальные пластины инкубировались при встряхивании с частотой 250 об/мин в течение 3-4 час, чтобы позволить клеткам достичь середины логарифмической фазы. Пластины были затем перенесены в статический инкубатор при 42°C и инкубировались 2 час, а затем были помещены в инкубатор с температурой 30°C на 1 час для восстановления. На этом этапе реплики клеток были готовы к геномной подготовке и были проверены с помощью секвенирующего анализа. Как было описано со ссылкой на Фиг. 2B, дополнительные пластины-реплики свежего SOB без арабинозы могут использоваться для обеспечения функциональной деконволюции неактивных дизайнов нарезки из популяции.
Пример 7: Коррекция ошибок: Повторное выстраивание и объединенное редактирование с использованием индуцибeльных гРНК
[0295] Трансформация: 100 нг клонированной библиотеки редактирующего вектора или реакции Gibson Assembly® было трансформировано электропорацией в 100 мкл компетентных клеток EC1, содержащих вектор-двигатель. Электропоратор был установлен на 2400 В в кювете размером 2 мм. После трансформации клеткам давали возможность восстановиться в течение 3 час в среде SOB. Серия 10-кратных разведений восстановленных клеток (в H2О) высевалась пятнами, и полученные соотношения КОЕ/разведение использовались для расчета эффективности трансформации.
[0296] Посев и выстраивание колоний: 100 мкл подходящего разбавления клеток были посеяны на среде LB+25 мкг/мл хлорамфеникола и выращивались при 30°C в течение ночи. Колонии отбирались и выращивались в течение ночи до насыщения в 1 мл SOB+25 мкг/мл хлорамфеникола /100 мкг/мл карбенициллина при 30°C в 96-луночных микротитровальных пластинах.
[0297] Идентификация активных кассет и повторное выстраивание: Репликатор использовался для переноса колоний из лунок ночных пластин в 200 мкл свежего SOB без арабинозы в 96-луночных микротитровальных пластинах для реплик. Репликатор переносит приблизительно 1-2 мкл на лунку, что приводит к 100-кратному разбавлению для выращивания. Микротитровальные пластины реплик инкубировались при встряхивании с частотой 250 об/мин в течение 3-4 час, чтобы позволить клеткам достичь середины логарифмического роста. Пластины были затем перенесены в статический инкубатор при 42°C и инкубировались 2 час, а затем были помещены в инкубатор с температурой 30°C на 1 час для восстановления. Репликатор затем использовался для переноса клеток из микротитровальных пластин реплик на агаровые пластины со средой LB+25 мкг/мл хлорамфеникола /100 мкг/мл карбенициллина, после чего клеткам позволяли расти в течение ночи. Лунки с активными гРНК идентифицировались, и 50 мкл клеток из этих колоний с первоначальной 96-луночной микротитровальной пластины повторно выстраивалось в «функционально исправленные» пластины (например, клетки, идентифицированные как имеющие функциональные гРНК, переносились (отбирались) в 96-луночную пластину).
[0298] Объединенное редактирование с использованием объединенных кассет, идентифицированных как активные: 100 мкл клеток, идентифицированных как имеющие функциональные гРНК, были перенесены в 5 мл среды SOB и выращивались до тех пор, пока культура не насыщалась. 1% арабинозы добавлялся в пробирку, и пробирка инкубировалась 2 час при 30°C. Резка/редактирование индуцировалась путем переноса пробирки во встряхиваемую водяную баню с температурой 42°C на 2 час. Затем пробирка удалялась из водяной бани и оставлялась для восстановления на 2 час при 30°C в инкубаторе, встряхиваемом с частотой 250 об/мин. Разбавленная культура (приблизительно 10-4-10-5) высевалась на среду LB+25 мкг/мл хлорамфеникола /100 мкг/мл карбенициллина, в результате чего получались изолированные клональные колонии. Редактирование оценивалось/валидировалось секвенированием целевого или полного генома.
Пример 8: Коррекция ошибок: Повторное выстраивание и клонирование
[0299] Трансформация: 100 нг клонированной библиотеки редактирующего вектора или реакции Gibson Assembly® было трансформировано электропорацией в 100 мкл компетентных клеток EC1, содержащих вектор-двигатель. Электропоратор был установлен на 2400 В в кювете размером 2 мм. После трансформации клеткам давали возможность восстановиться в течение 3 час в среде SOB. Серия 10-кратных разведений восстановленных клеток (в H2О) высевалась пятнами, и полученные соотношения КОЕ/разведение использовались для расчета эффективности трансформации.
[0300] Посев и выстраивание колоний: 100 мкл подходящего разбавления клеток были посеяны на среде LB+25 мкг/мл хлорамфеникола и выращивались при 30°C в течение ночи. Колонии отбирались и выращивались в течение ночи до насыщения в 1 мл SOB+25 мкг/мл хлорамфеникола и 100 мкг/мл карбенициллина при 30°C в 96-луночных микротитровальных пластинах.
[0301] Идентификация активных кассет и повторное выстраивание: Репликатор использовался для переноса колоний из лунок ночных пластин в 200 мкл свежего SOB без арабинозы в 96-луночных микротитровальных пластинах для реплик. Репликатор переносит приблизительно 1-2 мкл на лунку, что приводит к 100-кратному разбавлению для выращивания. Микротитровальные пластины реплик инкубировались при встряхивании с частотой 250 об/мин в течение 3-4 час, чтобы позволить клеткам достичь середины логарифмического роста. Пластины были затем перенесены в статический инкубатор при 42°C и инкубировались 2 час, а затем были помещены в инкубатор с температурой 30°C на 1 час для восстановления. Репликатор затем использовался для переноса клеток из микротитровальных пластин реплик на пластины со средой LB+25 мкг/мл хлорамфеникола /100 мкг/мл карбенициллина, после чего клеткам позволяли расти в течение ночи. Лунки с активными гРНК идентифицировались, и 50 мкл клеток из этих колоний с первоначальной 96-луночной микротитровальной пластины повторно выстраивалось в «функционально исправленные» пластины (например, клетки, идентифицированные как имеющие функциональные гРНК, переносились в 96-луночную пластину).
[0294] Повторная амплификация, клонирование и валидация библиотеки: Клетки, идентифицированные как имеющие функциональные гРНК, были объединены, и ДНК была извлечена и изолирована. Серийные разведения были сделаны из изолированной ДНК, и амплификация выполнялась с праймерами, разработанными для амплификации редактирующих кассет. PCR выполнялась при следующих условиях: 95°C в течение 1 мин; 18 циклов при 95°C в течение 30 с/60°C в течение 30 с/72°C в течение 2,5 мин; с окончательной выдержкой при 72°C в течение 5 мин. Ампликоны были проверены на 1%-ном агарозном геле, и были идентифицированы пулы с наиболее чистым выходом (выходами). Амплифицированные кассеты были мини-препарированы и элюированы в 50 мкл дистиллированной деминерализированной воды. Затем была выполнена реакция Gibson Assembly®, содержащая 150 нг основной цепи ДНК со на 100 нг кассетных вставок. К основной цепи и вставке добавлялся равный объем 2x Master Mix, и реакционная смесь инкубировалась 45 мин при 50°C, затем диализировалась в течение 30 мин в сидящей капельке с помощью дискового фильтра с размером пор 0,25 мкм. 100 нг реакции Gibson Assembly® трансформировалось электропорацией в компетентные клетки EC1, содержащие вектор-двигатель, как было описано выше. После трансформации клеткам давали возможность восстановиться в течение 3 час в среде SOB. Серия 10-кратных разведений восстановленных клеток (в H2О) высевалась пятнами, и полученные соотношения КОЕ/разведение использовались для расчета эффективности трансформации. 100 мкл подходящего разбавления клеток были посеяны на среде LB+25 мкг/мл хлорамфеникола и выращивались при 30°C в течение ночи. Редактирование оценивалось/валидировалось, например, секвенированием.
Пример 9: Обогащение отредактированных клеток с помощью идентификации задержки роста
[0303] Трансформация: 100 нг клонированной библиотеки редактирующего вектора или реакции Gibson Assembly® было трансформировано электропорацией в 100 мкл компетентных клеток EC1, содержащих вектор-двигатель. Электропоратор был установлен на 2400 В в кювете размером 2 мм. После трансформации клеткам давали возможность восстановиться в течение 3 час в среде SOB. Серия 10-кратных разведений восстановленных клеток (в H2О) высевалась пятнами, и полученные соотношения КОЕ/разведение использовались для расчета эффективности трансформации.
[0304] Посев и выстраивание колоний: 100 мкл подходящего разбавления клеток были посеяны на агаровой среде LB+25 мкг/мл хлорамфеникола+арабиноза и выращивались при 30°C в течение 6-8 час. Альтернативно клетки могут быть выращены в жидкой культуре в среде LB+25 мкг/мл хлорамфеникола при 30°C до насыщения и разбавлены до подходящей концентрации перед посевом на агаровой среде LB+25 мкг/мл хлорамфеникола+арабиноза с последующим выращиванием при 30°C в течение 6-8 час. После 6-8 часов выращивания температура пластины была отрегулирована до 42°C, и пластины инкубировались в течение 2 час. Температура была затем снижена до 30°C, и клеткам была дана возможность восстановиться за ночь.
[0305] Идентификация отредактированных клеток: Идентифицировались колонии малого размера. Фенотип колоний малого размера указывает на то, что жизнеспособность клеток была нарушена во время процедуры индуцированного редактирования. Эффективное извлечение отредактированных клеток из исходного пула было достигнуто путем идентификации и отбора небольших колоний и размещения клеток из этих небольших колоний на 96-луночной пластине для создания библиотеки отредактированных клеток, либо клетки из колоний были объединены, создавая сильно отредактированные популяции ячеек для рекурсивного редактирования. Редактирование оценивалось/валидировалось секвенированием. Было найдено, что 85% малых колоний были отредактированными клетками.
Пример 10: Управление стандартным протоколом посева
[0306] Этот протокол описывает стандартный протокол посева для обогащения бактериальных клеток, отредактированных с помощью направляемой нуклеиновой кислотой нуклеазы, путем сингуляции или существенной сингуляции, роста, редактирования и нормализации. Этот протокол использовался для усиления индуцибeльной системы как для нуклеазы, так и для гРНК, чтобы обеспечить фенотипические различия в колониях. Из полученных агаровых пластин можно было выбрать отредактированные клетки с высокой степенью достоверности (~80%). Хотя очевидно, что этот протокол можно использовать для обогащения отредактированных клеток, в описанных здесь экспериментах этот «стандартный протокол посева» или «SPP» использовался для сравнения эффективности сингуляции или существенной сингуляции, редактирования и нормализации с помощью устройства со сплошной стенкой. Материалы: Помимо стандартных инструментов молекулярной биологии, потребуется следующее:
Таблица 3
[0307] Протокол: Входами для этого протокола являются замороженные электрокомпетентные клетки и очищенный продукт сборки нуклеиновой кислоты. Сразу после электропорации смесь клетки/ДНК переносилась в культуральную пробирку, содержащую 2,7 мл среды SOB. Подготовка аликвот объемом 2,7 мл в культуральных пробирках на 14 мл перед электропорацией позволила быстрее извлечь клетки из кюветы для электропорации; конечный объем извлечения составил 3 мл. Все культуральные пробирки были помещены в инкубатор со встряхиванием, установленный на 250 об/мин и 30°C, на 3 час. В то время как культуры восстанавливались, необходимое количество агаровых пластин LB с хлорамфениколом и карбенициллином+1% арабинозы было извлечено из холодильника и подогрето до комнатной температуры. Для каждого посева использовались многократные разведения, чтобы иметь на пластинах счетные и изолированные колонии. Предложения по посеву:
Таблица 4
[0308] Через 3 час культуральные пробирки были удалены из инкубатора. Сначала проводился посев для секвенирования ампликона в соответствии с приведенной выше таблицей. Посевные шарики использовались для того, чтобы равномерно распределить культуру по агар-агару. Эти шарики были удалены с пластины, и пластине была дана возможность высохнуть без накрытия в шкафу с ламинарным потоком. Пока пластины сохли, оставшаяся культура использовалась для выполнения серийных разведений, где стандартные разведения составляли 50 мкл культуры на 450 мкл стерильного 0,8% NaCl. Пластина/пробирки, используемые для этих разведений (а также для первоначальной культуры), поддерживались при 4°C в том случае, если было необходимо дополнительное разведение в зависимости от количества колоний. Посев для SinglePlex выполнялся в соответствии с Таблицей 4. Может использоваться большее или меньшее число разведений на основе знаний о библиотеке/компетентных клетках. Культуры были равномерно распределены по агар-агару с использованием стерильных посадочных шариков. Эти шарики были затем удалены с пластины, и пластинам была дана возможность высохнуть без накрытия в шкафу с ламинарным потоком. Пока пластины сохли, инкубатор был запрограммирован в соответствии со следующими настройками: 30°C в течение 9 час → 42°C в течение 2 час → 30°C в течение 9 час. Агаровые пластины были помещены в настроенный инкубатор, и после того, как температурный цикл был завершен (~21 час), агаровые пластины были удалены из инкубатора. Индукция редактирования была успешной, на что указывает различие в размерах полученных колоний клеток.
Пример 11: Сингуляция культуры E. coli в устройстве со сплошной стенкой
[0309] Электрокомпетентные клетки E.coli были трансформированы с помощью клонированной библиотеки, изотермически собранной библиотеки, или плазмиды sгРНК для контроля процесса (суррогат потерь), как описано в Примерах 2-5 выше. Штамм E.coli нес подходящие компоненты эндонуклеазы и λ Red, а также систему индукции редактирования (например, на плазмиде-двигателе или интегрированную в бактериальный геном, или их комбинацию). Трансформации обычно использовали 150 нг ДНК плазмиды (или реакционной смеси Gibson Assembly) со 150 нг основной цепи ДНК pL sгРНК. После электропорации клеткам была дана возможность восстановиться в 3 мл SOB, после чего они инкубировались при 30°C со встряхиванием в течение 3 час. Параллельно с обработкой образцов в устройстве со сплошной стенкой образцы были также обработаны по стандартному протоколу посева (см. Пример 10 выше), чтобы сравнить «нормализацию» в устройстве со сплошной стенкой со стандартным лабораторным процессом. Непосредственно перед введением клеток в устройство со сплошной стенкой и проницаемым дном, фильтр с размером пор 0,2 мкм, образующий дно микролунок, обрабатывался 0,1% раствором твина для обеспечения надлежащего распределения клеток в микролунках устройства со сплошной стенкой. Фильтры были помещены в держатель фильтра Swinnex (47 мм, Millipore®, SX0004700), и 3 мл раствора с 0,85% NaCl и 0,1% твина пропускалось через устройство со сплошной стенкой и фильтровалось с использованием вакуума. Были оценены различные концентрации твина, и было определено, что для устройства со сплошной стенкой диаметром 47 мм с фильтром 0,2 мкм, образующим дно микролунок, предварительная обработка устройства со сплошной стенкой+фильтра 0,1% твина является предпочтительной (данные не показаны).
[0310] После 3-часового восстановления в SOB трансформированные клетки были разбавлены, и 3 мл разбавленных клеток были обработаны с помощью обработанных твином устройства со сплошной стенкой и фильтра, опять с использованием вакуума. Ожидалось, что количество успешно трансформированных клеток составит приблизительно от 1,0E+06 до 1,0E+08 с целью загрузки приблизительно 10000 трансформированных клеток в текущее устройство со сплошной стенкой и проницаемым дном диаметром 47 мм (имеющее ~30000 лунок). Были подготовлены серийные разведения 10-1, 10-2 и 10-3, затем 100 мкл каждого из этих разведений были объединены с 3 мл 0,85% NaCl, и образцы были загружены в устройства со сплошной стенкой. Каждое устройство со сплошной стенкой и проницаемым дном было затем удалено из держателя фильтра Swinnex и перенесено на агаровую пластину LB, содержащую карбенициллин (100 мкг/мл), хлорамфеникол (25 мкг/мл) и арабинозу (с конечной концентрацией 1%). Устройства со сплошной стенкой были размещены металлической стороной вверх, так, чтобы мембрана проницаемого дна касалась поверхности агар-агара и питательные вещества из пластины могли проходить вверх через фильтрующее дно лунок. Устройства со сплошной стенкой на агаровых пластинах LB инкубировались 9 час при 30°C, 2 час при 42°C, затем опять при 30°C в течение 12-16 час, а в другом эксперименте в течение 36-40 час.
[0311] В конце инкубации перфорированные диски и фильтры (все еще собранные) были удалены с опорного источника питания (в данном случае агаровой пластины) и были сфотографированы со сфокусированным просвечивающим источником света так, чтобы можно было оценить количество и распределение загруженных микролунок на устройстве со сплошной стенкой (данные не показаны). Для извлечения клеток из устройства со сплошной стенкой и проницаемым дном фильтр был перенесен в маркированную стерильную чашку Петри диаметром 100 мм, которая содержала 15 мл стерильного NaCl с концентрацией 0,85%, затем эта чашка Петри была помещена во встряхиваемый инкубатор, настроенный на 30°C/80 об/мин, чтобы аккуратно удалить клетки из фильтра и повторно суспендировать их в растворе NaCl. Клетки встряхивались 15 мин, а затем были перенесены в стерильную пробирку, например в коническую пробирку для центрифуги объемом 50 мл. Было измерено значение OD600 клеточной суспензии, и на этом этапе клетки могут быть обработаны разными способами в зависимости от цели исследования. Например, если плазмиды или библиотеки предназначены для нацеливания на ген пути метаболизма сахара, такой как galK, то повторно суспендированные клетки могут быть нанесены на агаровые пластины Макконки, содержащие галактозу (с конечной концентрацией 1%) и подходящие антибиотики. Ожидается, что на этой дифференциальной среде колонии, которые являются результатом успешно отредактированных клеток, фенотипически будут иметь белый цвет, тогда как неотредактированные колонии будут иметь красный цвет. Этот красный/белый фенотип может затем использоваться для оценки процента отредактированных клеток и степени нормализации отредактированных и неотредактированных клеток. Результаты одного эксперимента показаны ниже в Таблице 5. Во всех повторах трансформированные клетки росли в устройствах со сплошной стенкой в течение 9 час при 30°C, 2 час при 42°C, и в течение ночи при 30°C.
Таблица 5
[0312] Фиг. 16 представляет собой график, показывающий степень нормализации клеток (% отредактированных клеток) для различных разбавлений трансформированных клеток, при отсутствии обработки твином, предварительной обработке твином и предварительной обработке твином+твин в буфере при загрузке клеток в микролунки устройства со сплошной стенкой. Стандартный протокол посева (SPP) выполнялся параллельно с экспериментами по сингуляции со сплошной стенкой в качестве ориентира (первый столбик слева на диаграмме). Следует отметить, что процент изменений для стандартного протокола посева составлял приблизительно 27,5%, а процент изменений для двух повторов разведения клеток до 10-3 с предварительной обработкой твином составлял приблизительно 20% и 26%, соответственно.
Пример 12: Сингуляция колоний дрожжей в устройстве со сплошной стенкой
[0313] Электрокомпетентные клетки дрожжей были трансформированы с помощью клонированной библиотеки, изотермически собранной библиотеки, или плазмиды sгРНК для контроля процесса (суррогат потерь), как описано в Примерах 2-5 выше. Электрокомпетентные клетки Saccharomyces cerevisiae были подготовлены следующим образом: За день до того, как должна была произойти трансформация, 10 мл YPAD было инокулировано выбранным штаммом Saccharomyces cerevisiae. Эта культура встряхивалась при 250 об/мин и 30°C в течение ночи. На следующий день 100 мл YPAD было добавлено в 250-миллилитровую колбу с перегородками и инокулировалось ночной культурой (приблизительно 2 мл ночной культуры) до тех пор, пока значение OD600 не достигло 0,3 +/- 0,05. Эта культура была помещена в инкубатор с температурой 30°C, встряхиваемый с частотой 250 об/мин, и выращивалась в течение 4-5 час с ежечасной проверкой OD. Когда культура достигла OD600 приблизительно 1,5, по 50 мл было отлито в две конические пробирки на 50 мл, которые затем центрифугировались при 4300 об/мин в течение 2 мин при комнатной температуре. Надосадочная жидкость была осторожно слита с осадка из всех конических пробирок. В каждую коническую пробирку было добавлено 50 мл раствора ацетата лития/дитиотреитола, и осадок был осторожно суспендирован. Обе суспензии были перенесены в колбу объемом 250 мл и помещены в шейкер; а затем встряхивались при 30°C и 200 об/мин в течение 30 мин. После завершения инкубации суспензия была перенесена в две конические пробирки на 50 мл. Эти пробирки затем центрифугировались при 4300 об/мин в течение 3 мин, после чего надосадочная жидкость была слита.
[0314] После стадии обработки ацетатом лития/дитиотреитолом использовались холодные жидкости, и клетки хранились на льду до электропорации. Было добавлено 50 мл 1М сорбита, и осадок повторно суспендировался, а затем центрифугировался при 4300 об/мин в течение 3 мин при 4°C, после чего надосадочная жидкость была слита. Промывка 1M сорбитом была повторена дважды, чтобы получилось в общей сложности три промывки. К одному осадку было добавлено 50 мкл 1М сорбита, клетки были повторно суспендированы, а затем перенесены в другую пробирку для суспендирования второго осадка. Объем клеточной суспензии был измерен и доведен до 1 мл холодным 1М сорбитом. На этом этапе клетки были электрокомпетентными и могли быть трансформированы с помощью клонированной библиотеки, изотермически собранной библиотеки или плазмид sгРНК для контроля процесса. Вкратце, необходимое количество кювет для электропорации с зазором 2 мм было подготовлено путем маркировки кювет и последующего охлаждения на льду. Подходящая плазмида - или смесь ДНК - была добавлена в каждую соответствующую кювету, и она была помещена обратно на лед. 100 мкл электрокомпетентных клеток было перенесено в каждую маркированную кювету, и каждый образец был электропорирован с использованием подходящих условий электропорации. Затем в каждую кювету было добавлено 900 мкл среды YPAD-сорбит с комнатной температурой. Клеточная суспензия была перенесена в культуральную пробирку на 14 мл, а затем встряхивалась при 30°C и 250 об/мин в течение 3 час. После 3 час восстановления было добавлено 9 мл YPAD, содержащего подходящий антибиотик, например генетицин или гигромицин B.
[0315] На этом этапе трансформированные клетки обрабатывались параллельно в устройстве со сплошной стенкой и по стандартному протоколу посева (см. Пример 10 выше), чтобы сравнить «нормализацию» в устройстве со сплошной стенкой со стандартным лабораторным процессом. Непосредственно перед введением клеток в устройство со сплошной стенкой и проницаемым дном, фильтр с размером пор 0,45 мкм, образующий дно микролунок, обрабатывался 0,1% раствором твина для обеспечения надлежащего распределения клеток в микролунках устройства со сплошной стенкой. Фильтры были помещены в держатель фильтра Swinnex (47 мм, Millipore®, SX0004700), и 3 мл раствора с 0,85% NaCl и 0,1% твина пропускалось через устройство со сплошной стенкой и фильтровалось с использованием вакуума. Были оценены различные концентрации твина, и было определено, что для устройства со сплошной стенкой диаметром 47 мм с фильтром 0,45 мкм, образующим дно микролунок, предварительная обработка устройства со сплошной стенкой+фильтра 0,1% твина является предпочтительной (данные не показаны).
[0316] После 3-часового восстановления в SOB трансформированные клетки были разбавлены, и 3 мл разбавленных клеток были обработаны с помощью обработанных твином устройства со сплошной стенкой и фильтра, опять с использованием вакуума. Ожидалось, что количество успешно трансформированных клеток составит приблизительно от 1,0E+06 до 1,0E+08 с целью загрузки приблизительно 10000 трансформированных клеток в текущее устройство со сплошной стенкой и проницаемым дном диаметром 47 мм (имеющее ~30000 лунок). Были подготовлены серийные разведения 10-1, 10-2 и 10-3, затем 100 мкл каждого из этих разведений были объединены с 3 мл 0,85% NaCl, и образцы были загружены в устройства со сплошной стенкой. Каждое устройство со сплошной стенкой и проницаемым дном было затем удалено из держателя фильтра Swinnex и перенесено на агаровую пластину LB, содержащую карбенициллин (100 мкг/мл), хлорамфеникол (25 мкг/мл) и арабинозу (с конечной концентрацией 1%). Устройства со сплошной стенкой были размещены металлической стороной вверх, так, чтобы мембрана проницаемого дна касалась поверхности агар-агара и питательные вещества из пластины могли проходить вверх через фильтрующее дно лунок. Устройства со сплошной стенкой на агаровых пластинах YPD инкубировались в течение 2-3 дней при 30°C.
[0317] В конце инкубации перфорированные диски и фильтры (все еще собранные) были удалены с опорного источника питания (в данном случае агаровой пластины) и были сфотографированы со сфокусированным просвечивающим источником света так, чтобы можно было оценить количество и распределение загруженных микролунок на устройстве со сплошной стенкой (см. Фиг. 17A и 17B). Для извлечения клеток из устройства со сплошной стенкой и проницаемым дном фильтр был перенесен в маркированную стерильную чашку Петри диаметром 100 мм, которая содержала 15 мл стерильного NaCl с концентрацией 0,85%, затем эта чашка Петри была помещена во встряхиваемый инкубатор, настроенный на 30°C/80 об/мин, чтобы аккуратно удалить клетки из фильтра и повторно суспендировать их в растворе NaCl. Клетки встряхивались 15 мин, а затем были перенесены в стерильную пробирку, например в коническую пробирку для центрифуги объемом 50 мл. Было измерено значение OD600 клеточной суспензии; на этом этапе клетки могут быть обработаны разными способами в зависимости от цели исследования. Например, если используется библиотека мутагенеза стоп-кодона ADE2, успешно отредактированные клетки должны приводить к образованию колоний с фенотипом красного цвета, когда повторно суспендированные клетки помещаются на агаровые пластины YPD и им дают возможность расти в течение 4-7 дней. Это фенотипическое различие позволяет количественно оценить процент отредактированных ячеек и степень нормализации отредактированных и неотредактированных ячеек.
Пример 13:Сингуляция, рост и редактирование E.coli в SWIIN с 200K отверстий
[0318] Автоматизированное редактирование генома Singleplex с использованием нуклеазы MAD7, библиотеки с 94 различными редакциями в одном гене (yagP) и с использованием устройства сингуляции с 200K ячеек, такого как проиллюстрированное на Фиг. 4F-4R, было выполнено успешно. Использованный вектор-двигатель был по существу подобен изображенному на Фиг. 11A (с MAD7 под управлением pL-индуцибeльного промотора), а использованный редактирующий вектор был по существу подобен изображенному на Фиг. 11B, включая редактирующую кассету, находящуюся под управлением pL-индуцибeльного промотора, и рекомбинационную систему λ Red под управлением индуцибeльного промотора pBAD, за исключением того, что редактирующая кассета содержала 94 изменения гена yagP (донорные ДНК) и подходящие соответствующие гРНК. Были сравнены два процесса SWIIN, и их эффективность была сравнена со стандартным протоколом посева (см. Пример 7). Эти протоколы SWIIN отличаются друг от друга тем, что в одном наборе реплик среда LB, содержащая арабинозу, использовалась для распределения клеток в SWIIN (арабиноза использовалась для индукции рекомбинационной системы λ Red (которая позволяет восстанавливать двухцепочечные разрывы в E. coli, образующиеся во время редактирования), а в другом наборе реплик среда SOB без арабинозы использовалась для распределения клеток в SWIIN и для начального роста, с заменой среды SOB без арабинозы на среду SOB с арабинозой. Приблизительно 70000 клеток были загружены в SWIIN с 200К лунок.
[0319] Во всех протоколах (стандартный посев, LB-SWIIN и SOB-SWIIN) клеткам предоставлялась возможность расти при 30°C в течение 9 час, и редактирование индуцировалось путем повышения температуры до 42°C на 2,5 час, после чего температура возвращалась к 30°C, и клетки выращивались в течение ночи. Результаты этого эксперимента показаны на Фиг. 18 и в нижеприведенной Таблице 6. Следует отметить, что подобная эффективность редактирования наблюдалась с четырьмя репликами этих двух процессов SWIIN, что означает, что эффективность посева SWIIN с и без арабинозы в начальном носителе является схожей. Процент редактирования в стандартном протоколе посева составил приблизительно 77%, в объеме жидкости - приблизительно 67%, а для реплик SWIIN - от приблизительно 63% до 71%. Следует отметить, что процент уникальных редактирующих кассет, деленный на общее количество редактирующих кассет, был одинаковым для каждого протокола.
Таблица 6
Пример 14:Полностью автоматизированный прогон управляемого RGN редактирования Singleplex
[0320] Автоматизированное геномное редактирование Singleplex с использованием нуклеазы MAD7 было успешно выполнено с помощью автоматизированного мультимодульного инструмента, такого как показанный на Фиг. 5A-5D. См. патенты US №№ 9982279, выданный 29 мая 2018 г., и 10/240167, выданный 09 апреля 2019 г.
[0321] Основная цепь плазмиды ampR и редактирующая кассета lacZ_F172* были собраны посредством сборки Gibson Assembly® в «редактирующий вектор» в модуле изотермической сборки нуклеиновой кислоты, включенном в автоматизированный инструмент. lacZ_F172 функционально нокаутирует ген lacZ. «lacZ_F172*» означает, что редактирование происходит в 172-м остатке в последовательности аминокислот lacZ. После сборки продукт был обессолен в модуле изотермической сборки нуклеиновой кислоты с использованием шариков AMPure, промыт 80%-ным этанолом и элюирован в буфер. Собранный редактирующий вектор и готовые к рекомбинации электрокомпетентные клетки Е. Coli были перенесены в модуль трансформации для электропорации. Клетки и нуклеиновые кислоты были объединены и смешивались в течение 1 мин, и электропорация выполнялась в течение 30 с. Параметры порирующего импульса были следующими: напряжение 2400 В; длительность 5 мс; интервал 50 мс; количество импульсов 1; полярность +. Параметры импульса переноса были следующими: напряжение 150 В; длительность 50 мс; интервал 50 мс; количество импульсов 20; полярность +/-. После электропорации клетки были перенесены в модуль восстановления (другой модуль выращивания) и им была дана возможность восстановиться в среде SOC, содержащей хлорамфеникол. Карбенициллин был добавлен к среде через 1 час, и клеткам была дана возможность восстановиться в течение еще 2 час. После восстановления клетки хранились при 4°C до тех пор, пока они не были востребованы пользователем.
[0322] После автоматизированного процесса и восстановления аликвота клеток была посеяна на агар-агар Макконки с лактозой (в качестве сахарного субстрата), хлорамфениколом и карбенициллином, и выращивалась до образования колоний. Белые колонии представляли функционально отредактированные клетки, пурпурные колонии представляли неотредактированные клетки. Все переносы жидкостей выполнялись автоматизированным устройством для обработки жидкости автоматизированного мультимодульного инструмента для обработки клеток.
[0323] В результате автоматизированной обработки всего было трансформировано приблизительно 1,0E-03 клеток (сопоставимо с обычными лабораторными результатами), а эффективность редактирования составила 83,5%. Редактирование lacZ_172 в белых колониях было подтверждено секвенированием отредактированной области генома клеток. Кроме того, стадии автоматизированной обработки клеток дистанционно наблюдались с помощью веб-камеры, и текстовые сообщения посылались для обновления статуса процедуры автоматизированной обработки.
Пример 15:Полностью автоматизированный прогон рекурсивного редактирования
[0324] Рекурсивное редактирование было успешно достигнуто с использованием мультимодульной автоматизированной системы обработки клеток. Основная цепь плазмиды ampR и редактирующая кассета lacZ_V10* были собраны посредством сборки Gibson Assembly® в «редактирующий вектор» в модуле изотермической сборки нуклеиновой кислоты, включенном в автоматизированный инструмент. Аналогично редактированию lacZ_F172, редактирование lacZ_V10 функционально нокаутирует ген lacZ. «lacZ_V10» означает, что редактирование происходит в положении 10 аминокислоты в последовательности аминокислот lacZ. После сборки продукт был обессолен в модуле изотермической сборки нуклеиновой кислоты с использованием шариков AMPure, промыт 80%-ным этанолом и элюирован в буфер. Первый собранный редактирующий вектор и готовые к рекомбинации электрокомпетентные клетки Е. Coli были перенесены в модуль трансформации для электропорации. Клетки и нуклеиновые кислоты были объединены и смешивались в течение 1 мин, и электропорация выполнялась в течение 30 с. Параметры порирующего импульса были следующими: напряжение 2400 В; длительность 5 мс; интервал 50 мс; количество импульсов 1; полярность +. Параметры импульса переноса были следующими: напряжение 150 В; длительность 50 мс; интервал 50 мс; количество импульсов 20; полярность +/-. После электропорации клетки были перенесены в модуль восстановления (другой модуль выращивания) и им была дана возможность восстановиться в среде SOC, содержащей хлорамфеникол. Карбенициллин был добавлен к среде через 1 час, и клетки выращивались в течение еще 2 час. Клетки были затем перенесены в модуль центрифуги, и была выполнена замена среды. Клетки повторно суспендировались в TB, содержащем хлорамфеникол и карбенициллин, где клетки выращивались до OD600=2,7, а затем концентрировались и делались электрокомпетентными.
[0325] Во время роста клеток второй редактирующий вектор был подготовлен в модуле изотермической сборки нуклеиновой кислоты. Второй редактирующий вектор содержал ген устойчивости к канамицину, а редактирующая кассета содержала изменение galK Y145*. В случае успеха изменение galK Y145* придает клеткам способность поглощать и метаболизировать галактозу. Редактирование, производимое кассетой galK Y154*, вводит стоп-кодон в месте расположения 154-й аминокислоты, изменяя аминокислоту тирозин на стоп-кодон. Это редактирование делает продукт гена galK нефункциональным и препятствует усвоению клетками галактозы. После сборки продукт второго редактирующего вектора был обессолен в модуле изотермической сборки нуклеиновой кислоты с использованием шариков AMPure, промыт 80%-ным этанолом и элюирован в буфер. Собранный редактирующий вектор и электрокомпетентные клетки Е. Coli (которые были трансформированы и выбраны для первого редактирующего вектора) были перенесены в модуль трансформации для электропорации с использованием тех же самых параметров, что и описанные выше. После электропорации клетки были перенесены в модуль восстановления (другой модуль выращивания) и им была дана возможность восстановиться в среде SOC, содержащей карбенициллин. После восстановления клетки выдерживались при 4°C до извлечения, после чего аликвота клеток высевалась на агар-агаре LB с хлорамфениколом и канамицином. Для количественной оценки изменений lacZ и galK пластины реплик были созданы на двух типах сред: 1) агар-агар Макконки с добавлением лактозы (в качестве сахарного субстрата), хлорамфеникола и канамицина, и 2) агар-агар Макконки с добавлением галактозы (в качестве сахарного субстрата), хлорамфеникола и канамицина. Все переносы жидкостей выполнялись автоматизированным устройством для обработки жидкости автоматизированной мультимодульной системы для обработки клеток.
[0326] В этом эксперименте рекурсивного редактирования 41% проверенных колоний имели изменения как lacZ, так и galK, результаты которых были сопоставимы с двойной эффективностью редактирования, получаемой с использованием «лабораторного» или ручного подхода.
[0327] В то время как настоящее изобретение удовлетворяется вариантами осуществления во многих различных формах, как подробно описано в связи с предпочтительными вариантами осуществления изобретения, следует понимать, что настоящее раскрытие представляет собой всего лишь пример принципов изобретения и не предназначено для ограничения настоящего изобретения конкретными вариантам осуществления, проиллюстрированными и описанными в настоящем документе. Многочисленные вариации могут быть сделаны специалистами в данной области техники без отступлений от духа настоящего изобретения. Область охвата настоящего изобретения определяется пунктами прилагаемой формулы изобретения, а также их эквивалентами. Реферат и название не должны толковаться как ограничивающие объем настоящего изобретения, поскольку их цель состоит в том, чтобы позволить соответствующим органам, а также широкой общественности, быстро определить общий характер настоящего изобретения. В нижеследующей формуле изобретения, если не используется термин «средство», никакие из особенностей или элементов, перечисленных в нем, не должны толковаться как ограничение «средство плюс функция» в соответствии с действующим патентным законодательством США.
Реферат
Группа изобретений относится к инструментам для оптимизации обнаружения изменений генома в живых клетках. Раскрыт узел для модуля разделения клеток на сплошной стенке, существенного разделения, роста, индукции редактирования, нормализации и отбора (SWIIN), предназначенного для выделения клеток, роста клеток, создания условий для редактирования клеток, и нормализации или отбора малых клеточных колоний, содержащий удерживающий элемент, перфорированный элемент, фильтр, уплотнение, окружающее перфорированный элемент и фильтр; проницаемый элемент и средство для соединения удерживающего элемента, перфорированного элемента, фильтра, уплотнения и проницаемого элемента. Также раскрыты модули SWIIN. Группа изобретений обеспечивает автоматизированный высокопроизводительный и чрезвычайно чувствительный скрининг для идентификации отредактированных клеток. 3 н. и 17 з.п. ф-лы, 78 ил., 6 табл., 15 пр.
Формула
Документы, цитированные в отчёте о поиске
Микрофлюидные платформы для детектирования множественных мишеней
Патенты аналоги
Микрофлюидные платформы для детектирования множественных мишеней

Комментарии