Восстановление лития из водных растворов - RU2470878C2
Код документа: RU2470878C2
Чертежи





Описание
Данная заявка заявляет приоритет заявки на патент США, серийный номер 61/199,495, поданной 17 ноября 2008 г., включенной ссылкой во всей своей полноте для всех целей.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001] Данное изобретение касается частично восстановления лития из содержащих литий растворов, например, таких как сырьевые потоки, применяемые в производстве литий-ионных батарей, а также сырьевые потоки, образованные при извлечении лития из материалов на основе руды.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0002] Содержащие литий батареи стали предпочтительными батареями в широком разнообразии существующих и предложенных новых применений благодаря их высокому соотношению плотности энергии к весу, а также их относительно длительному сроку службы по сравнению с другими типами батарей. Литий-ионные батареи используются для многочисленных применений, например сотовых телефонов, переносных компьютеров, медицинских приборов и имплантатов, таких как сердечные стимуляторы.
[0003] Литий-ионные батареи также становятся чрезвычайно полезными вариантами источников энергии в разработке новых автомобилей, например, гибридных и электрических транспортных средств, которые и экологически приемлемые, и "экологически чистые" по причине пониженных выбросов и уменьшенной зависимости от углеводородных видов топлива. Очевидное преимущество заключается в том, что применение этих батарей устраняет или снижает потребность в углеводородных видах топлива и образующиеся в результате способствующие "парниковому эффекту" газообразные выбросы и другой вред окружающей среде, свойственный сжиганию ископаемых типов топлива в двигателях внутреннего сжигания. Кроме того, выбор литий-ионных батарей для применения в транспортных средствах из-за, главным образом, высокого соотношения плотности энергии к весу, пониженного веса батарей по сравнению с другими батареями является важным фактором в производстве транспортных средств.
[0004] Литий-ионные батареи типично сделаны из трех основных компонентов: 1) углеродного анода, 2) разделителя и 3) содержащего литий катодного материала. Предпочтительные содержащие литий катодные материалы включают материалы оксидов лития и металлов, таких как лития кобальта оксид, лития никель-кобальта оксид, литий-марганца оксид и фосфат литий-железа, а также могут использоваться другие соединения лития.
[0005] Фосфат лития-железа является особенно предпочтительным соединением для применения в качестве содержащего литий катодного материала, поскольку он представляет улучшенный профиль безопасности, приемлемые функциональные характеристики и менее токсичный по сравнению с другими упомянутыми катодными материалами. Это особенно подходит для батарей относительно больших размеров, таких, которые можно было бы использовать в электрических транспортных средствах. Улучшенные характеристики безопасности обусловлены способностью фосфата лития-железа (также называемого LIP) избегать перегрева, к чему склонны другие литий-ионные батареи. Это особенно важно, поскольку батареи получаются больше. В то же время функциональные характеристики LIP батарей равны таковым других соединений, которые используются в настоящее время. Другие соединения лития обладают тенденцией снижения перегрева, однако проигрывают по функциональным характеристикам. Лития-железа фосфат сульфаты подобны LIP и также используются в батареях.
[0006] Фосфат лития-железа можно получить с помощью влажного химического процесса с использованием водного сырьевого потока, включающего ионы лития из литиевого источника, например, карбоната лития, гидроксида лития моногидрата, лития нитрата и т.д. Типичная схема реакции описана Yang и др., Journal of Power Sources 146 (2005) 539-543, а именно:


[0007] Фосфат лития-железа можно получить с помощью влажного химического процесса с использованием водного сырьевого потока, включающего ионы лития из литиевого источника, например, карбоната лития, гидроксида лития моногидрата, лития нитрата и т.д. Получают лития-железа фосфат сульфаты подобным образом, но источник сульфата необходим для производства. Например, каждый из патентов США Goodenough и др. №5910382 и Armand и др. №6514640 описывают водное получение фосфатов лития-железа. Как правило, из-за неэффективности процесса эти влажные химические способы получения фосфата лития-железа дают водный поток, который содержит значительное количество ионов лития наряду с другими примесями. Композиция типичного потока, который образуется в результате влажного химического получения фосфата лития-железа, приведена ниже:
[0008] Поскольку литий - один из основных и более дорогих компонентов материала фосфата лития-железа, было бы желательно восстанавливать любой избыток лития для повторного использования во влажном химическом производстве фосфата лития-железа, особенно если относительно большой избыток лития обеспечивается в производственном процессе для получения продукта фосфата лития-железа. Процессы восстановления и очистки лития из отходов литиевых батарей известны из опубликованной РСТ заявки WO 98/59385, но улучшенные и альтернативные способы восстановления лития описаны в данной области.
ЦЕЛИ И КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0009] Данное изобретение достигает этой и других целей с использованием биполярного электродиализа, который также известен как технология разложения соли для восстановления лития из сырьевых потоков. Литий восстанавливается в качестве раствора гидроксида лития, который можно рециркулировать в сырьевые потоки, используемые для получения фосфата лития-железа с помощью влажного химического процесса. Также в результате процесса образуется раствор серной кислоты, которую можно восстановить и использовать в других процессах или продавать коммерчески. В предпочтительных вариантах осуществления любой фосфатный ион в сырьевом потоке восстанавливается или более предпочтительно удаляется перед биполярным электродиализом сырьевого потока, поскольку обнаружено, что фосфат склонен загрязнять мембраны, что снижает выход гидроксида лития или полностью прекращает его получение. Альтернативно, в сернокислотном восстановлении несущей литий руды, полученной в результате, очищенный поток сульфата лития также можно обработать таким образом. Это также имеет преимущество, заключающееся в получении потока серной кислоты, который при концентрировании можно использовать для компенсации затрат на необходимую серную кислоту.
[0010] Биполярный мембранный электродиализ использует отдельные камеры и мембраны для получения кислоты и основания соответствующего введенного солевого раствора. Согласно этому процессу ионообменные мембраны разделяют виды ионов в растворе с помощью электрического поля. Биполярная мембрана диссоциирует воду на положительно заряженные ионы водорода (Н+, присутствующие в форме Н3О+ (ионы гидрония) в водном растворе) и отрицательно заряженные гидроксильные анионы (ОН-).
[0011] Биполярные мембраны типично образованы из анион-обменного слоя и катион-обменного слоя, которые связаны вместе. Обеспечен слой диффузии воды или граница раздела, где диффундирует вода из внешнего водного солевого раствора.
[0012] Селективно проницаемые анионные и катионные мембраны дополнительно обеспечены для направления разделения солевых ионов, например ионов лития и сульфата, по желанию. Таким образом, типично в биполярном мембранном электродиализе используется система из трех мембран.
[0013] Мембраны из коммерчески доступных источников, например, Astom АСМ, СМВ, AAV и ВР1 мембраны или FumaTech FKB мембраны можно применять в комбинации их сопротивления обратной миграции нежелательного иона (или H+, или ОН-), низкого электрического удельного сопротивления и сопротивления потенциально коррозионной природе полученного в результате раствора кислоты и основания. Эти мембраны расположены между электродами, т.е. анодом и катодом, и постоянный ток (DC) подается через электроды.
[0014] Предпочтительные производители ячеек включают Eurodia, a EUR20 и EUR40 являются предпочтительными.
[0015] Предпочтительная сборка с использованием технологии биполярной мембраны для восстановления лития в качестве гидроксида лития из потока, включающего сульфат лития, показана на Фиг.4. Как показано на Фиг.4, "А" - проницаемая для анионов мембрана; "С" - проницаемая для катионов мембрана. "В" - биполярная мембрана. Анионная мембрана позволяет отрицательно заряженному сульфат иону проходить, но затрудняет прохождение положительно заряженного иона лития. Наоборот, катионная мембрана позволяет проходить положительно заряженному иону лития, но затрудняет прохождение отрицательного сульфат иона. Предзаряженный резервуар кислоты и основания показан в середине, с полученными в результате Н+ и ОН- ионами в комбинации с выделенными отрицательно заряженным сульфат ионом и положительно заряженным ионом лития. Таким образом, получается раствор гидроксида лития, который можно подавать в технологический поток для получения фосфата лития-железа. Раствор серной кислоты получается на катодной стороне.
[0016] Раствор сульфата лития ранее описанного типа предпочтительно предварительно обрабатывают до относительно высокого рН, типично до рН от 10 до 11, путем добавления приемлемого основания, предпочтительно щелочного гидроксида. Гидроксиды Li, Na, K являются особенно предпочтительными. Регулирование рН до этого диапазона позволяет удаление примесей в виде осадков, особенно фосфатов, которые вероятно мешают электрохимическим реакциям в электродиализном устройстве. Особенно предпочтительно удалять, по меньшей мере, фосфат из подачи, поскольку обнаружили, что эта примесь, в частности, приводит к загрязнению мембраны, ухудшая процесс. Эти осадки отфильтровываются из раствора до подачи в биполярную ячейку для электродиализа. Затем раствор можно отрегулировать до более низкого рН, например до рН 1-4 и предпочтительно 2-3, предпочтительно с использованием полученной в результате кислоты из процесса, если нужно, и затем подавать в ячейку для электродиализа. Как объяснено выше, во время этого процесса ионы лития пересекают катионную мембрану, образуя в результате поток гидроксида лития, а сульфат пересекает анионную мембрану, образуя поток серной кислоты. (Смотри Фигуру 4).
[0017] Полученные в результате потоки LiOH и серной кислоты являются относительно слабыми потоками по молярному содержанию соответствующих компонентов. Например, тестирование показало следующие средние диапазоны:
LiOH: 1,6-1,85 MH2SO4: 0,57-1,1 М.
[0018] Другой аспект данного изобретения касается чистоты продукта гидроксида лития, поскольку чрезвычайно желателен очищенный продукт гидроксида лития.
[0019] Обнаружили, что снижение концентрации продукта серной кислоты до около 50% дает в результате концентрацию сульфата в гидроксидном растворе, понижающуюся на соответствующее количество (от 430 ppm до 200 ppm). Кроме того, эффективность тока относительно получения кислоты повысилась на около 10% со снижением концентрации кислоты.
[0020] Блок-схема вышеупомянутого процесса показана на Фиг.1.
[0021] Более специфически, что касается Фигуры 1, сырьевой поток, включающий сульфат лития, предпочтительно от получения компонента литиевой батареи, очищают удалением каких-либо твердых примесей путем регулирования рН от около 10 до около 11 для осаждения каких-либо твердых примесей из потока. Полученный в результате очищенный сырьевой поток сульфата лития затем подвергают биполярному диализу, предпочтительно после регулирования рН до около 2-3,5 серной кислотой, с приемлемой биполярной мембраной, которая позволит отделение лития из потока, который будет восстановлен как гидроксид лития. В предпочтительном варианте осуществления перед тем, как поддавать сырьевой поток сульфата лития биполярному электродиализу для этапа очистки, или возможно в течение этапа очистки, какой-либо фосфат удаляют, например, путем регулирования рН для удаления фосфатных солей или путем использования подходящей ионообменной мембраны для удаления фосфата из раствора. Альтернативно, поток сульфата лития из процесса выделения серной кислоты из руды, соответственно очищенный принятой в данной области практикой, можно подвергать биполярному диализу, предпочтительно после регулирования рН до около 2-3,5 серной кислотой, с приемлемой биполярной мембраной, которая позволит отделение лития из потока, который будет восстановлен как гидроксид лития.
[0022] Полагают, что неэффективности тока, особенно, что касается катионной мембраны, приводят к высоким локализованным рН рядом с мембраной, вызывая формированием осадков в центральном сырьевом отсеке. Это также можно видеть снаружи ячейки при преднамеренном повышении рН подачи до 10 и позволении осадку сформироваться. Таблица 1 показывает композицию твердых веществ, взятых из 10 л порции поданного раствора сульфата лития, в котором рН отрегулировали до 10, оставили на ночь и профильтровали. Всего было восстановлено 3,02 г твердого вещества. Часть твердых веществ (0,3035 г) повторно растворили в 100 мл 1 М HCl для анализа с помощью ICP2. Как можно видеть из Таблицы 1 ниже, основными примесями в осадке оказались Fe, Сu, Р, Si, Zn и Mn3.
[0023] Биполярный диализ сырьевого потока сульфата лития с приемлемой биполярной мембраной дает раствор гидроксида лития и раствор серной кислоты, как показано на правой и левой сторонах Фиг.1, соответственно.
[0024] Раствор гидроксида лития можно восстановить или предпочтительно можно напрямую ввести в процесс для получения LiFePO4 или других включающих литий солей или продуктов. Конечно, гидроксид лития можно восстановить и использовать, например, как основание в приемлемых химических реакциях или для регулирования рН начального сырьевого потока для удаления примесей, таких как фосфат.
[0025] Раствор гидроксида лития, который восстановлен, можно концентрировать, по желанию, перед применением или, если нужно, подвергнуть дополнительным этапам очистки.
[0026] Что касается левой стороны Фигуры 1, раствор серной кислоты восстанавливается и продается или используется как кислота в приемлемых химических и промышленных процессах. Альтернативно, его можно концентрировать и использовать для компенсации затрат на серную кислоту, необходимую в кислотном выделении лития из несущих литий руд.
[0027] Фиг.2 показывает альтернативный вариант осуществления данного изобретения, при котором потоки и гидроксида лития, и серной кислоты восстанавливаются и используются в процессе изготовления фосфата лития-железа, который, по сути, делает процесс непрерывным. Поскольку в процесс добавляют железо в форме сульфата железа, возможно применение восстановленного потока серной кислоты для формирования сульфата железа. Это будет зависеть от требований чистоты сульфата железа, а также необходимого уровня. Согласно этому способу, однако, можно было бы использовать другой источник железа, а не сульфат железа, с раствором серной кислоты, обеспечивающим источник сульфата.
[0028] Более конкретно, на Фигуре 2 сырьевой поток сульфата лития очищается, как описано выше, путем регулирования рН от 10 до 11, и затем рН понижают от 2 до 3,5 перед тем, как поддать электродиализу.
[0029] На Фигуре 1 показан очищенный биполярный электродиализ с приемлемой мембраной для формирования водного потока серной кислоты и водного сырьевого потока гидроксида лития. В этом варианте осуществления внимание обращено на восстановление сырьевых потоков и серной кислоты, и гидроксида лития и возвращение их для применения в получении литиевого продукта, особенно фосфата лития-железа. Что касается левой стороны Фигуры 2, водный поток серной кислоты превращается в сульфат железа путем добавления источника железа в раствор серной кислоты. Источником может быть любой приемлемый источник, включая металлическое железо, обнаруженное в железной руде природного происхождения. Сульфат железа является предпочтительной солью железа, поскольку раствор уже содержит сульфат ион. Добавление железа дает раствор фосфата железа, который затем, в конечном счете, смешивают с раствором гидроксида лития, восстановленным из процесса биполярного электродиализа, и источником фосфата для получения фосфата лития-железа.
[0030] Как показано на правой стороне Фигуры 2, раствор гидроксида лития предпочтительно регулируют до необходимого уровня гидроксида лития введением гидроксида лития из другого источника или концентрированием восстановленного потока.
[0031] Другой предпочтительный вариант осуществления показан на Фиг.3. В этом варианте источник лития, отличный от гидроксида лития, например, карбонат лития, применяют в процессе. В этом варианте осуществления поток серной кислоты реагирует с карбонатом лития предварительно определенной чистоты для получения дополнительного раствора сульфата лития, который затем будет добавлен к исходному рециркулирующему раствору перед подачей в ячейки биполярного электролиза. Этот процесс показан на левой стороне блок-схемы на Фигуре 3. Таким образом, различные источники лития можно использовать для получения литиевого раствора, из которого гидроксид лития можно выделить. Этапы регулирования рН сырьевого потока LiSO4 описаны выше.
[0032] Следует отметить, что сульфат железа, как показано, добавляют ко всему или части потока серной кислоты для получения раствора сульфата железа, который вместе с восстановленным раствором гидроксида лития дает фосфат лития-железа согласно влажному химическому процессу, такому как описанный в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1:
Блок-схема упрощенного рециркуляционного процесса биполярного электродиализа сульфата лития для рециркуляции гидроксида лития, сульфата лития в процесс производства фосфата лития-железа.
Фигура 2:
Блок-схема рециркуляционного процесса биполярного электродиализа сульфата лития для рециркуляции и гидроксида лития, и серной кислоты в процесс производства фосфата лития-железа.
Фигура 3:
Блок-схема рециркуляционного процесса биполярного электродиализа сульфата лития для использования рециркулированного гидроксида лития, серной кислоты и гидроксида лития, образованного из дополнительного источника лития для производства фосфата лития-железа.
Фигура 4:
Схематическая диаграмма биполярной ячейки для электродиализа, используемой для восстановления лития как гидроксида лития из потока, включающего сульфат лития.
Фигура 5:
График плотности тока как функции времени в ходе процесса прохождения рН 10 предварительно обработанных сырьевых растворов через ячейку для электродиализа, включающего мембраны Astom.
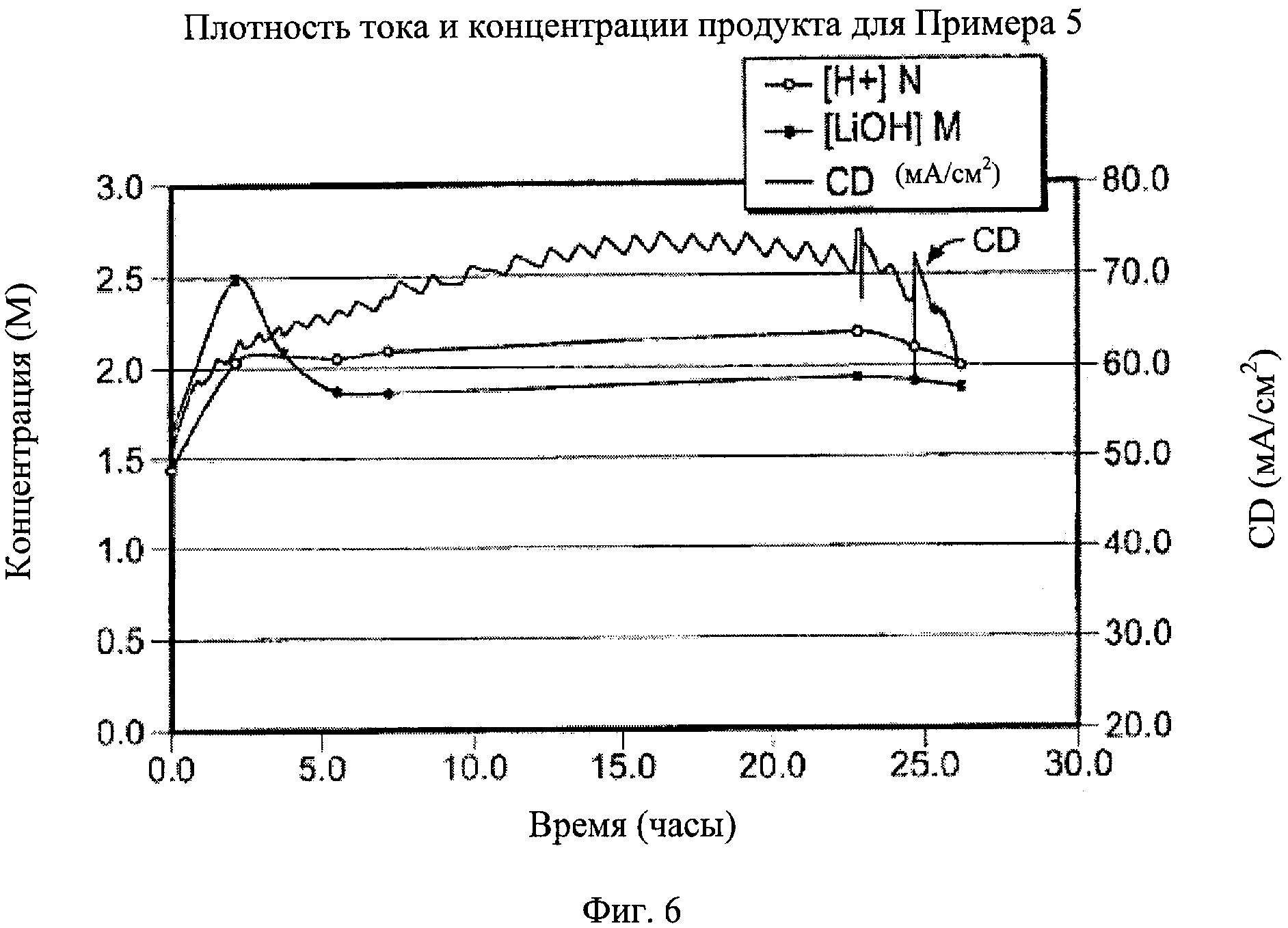
Фигура 6:
График плотности тока и концентраций продуктов кислоты и основания как функции времени в ходе процесса прохождения рН 11 предварительно обработанных сырьевых растворов через ячейку для электродиализа.
Фигура 7:
График плотности тока как функции времени в ходе процесса прохождения сырьевых растворов через Eurodia EUR-2C ячейку для электродиализа, функционирующую при постоянном напряжении.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Пример 1
[0033] EUR-2C ячейку для электродиализа, коммерчески доступную от Euroduce, модифицировали для включения Astom биполярных мембран (ВР1) и FuMaTech анионной и катионной мембран (FAB и FKB, соответственно). Через ячейку прогнали сырьевой раствор, который предварительно был обработан регулированием рН до 10 для осаждения фосфата и других примесей с последующей фильтрацией для удаления осадков. Затем рН регулировали до рН 3,5 перед подачей его в ячейку.
[0034] Как видно из Таблицы 2, катионная мембрана образовала до 2,16 М LiOH при эффективностях тока приблизительно 75%. Анионообменная мембрана дала эффективности тока 40% для 0,6 М раствора H2SO4 продукта. Средняя плотность тока на всем протяжении прохода составляла почти 62 мА/см2, в то время как ячейка функционировала при постоянном напряжении 25 V. (Это напряжение подают на все семь наборов мембран и отсек ополаскивания электрода.) Твердые вещества не наблюдали в ячейке в такой короткий срок функционирования, что указывает на то, что предварительная обработка регулированием рН до 10 перед введением в ячейку улучшала результаты по сравнению с использованием сырьевого раствора без регулирования рН.
[0035] Общая эффективность ячейки, как представляется, обусловлена самой низкой эффективностью тока какой-либо конкретной мембраны, поскольку следует применять один из потоков продукта для поддержания рН в центральном отсеке. Так в Примере 1 было необходимо добавление некоторого количества продукта LiOH обратно в центральный отсек для нейтрализации обратно мигрирующего протона из отсека кислоты. Поэтому полная эффективность тока для ячейки составила 40%, опровергая преимущество FKB мембраны.
Пример 2-5
[0036] Примеры 2-5 выполнили с Astom мембранами (АСМ, СМВ и BPI). Примеры 2 и 3 были краткосрочными экспериментами с использованием сырьевых растворов сульфата лития, которые предварительно обработали до рН 10, как описано ранее. Оба примера давали эффективности тока кислоты и основания, близкие к 60%, и поддерживали хорошие плотности тока короткое время, показывая, что предварительная обработка улучшила результаты по сравнению с предварительными прогонами. Пример 4 был экспериментальным прогоном в течение ночи при тех же условиях и показал заметное понижение плотности тока, вероятно из-за загрязнения мембраны фосфатом или другими осадками.
[0037] Фигура 5 показывает плотность тока для всех трех прогонов. Через 1250 минут ячейку остановили и насосы выключили, чтобы позволить отбор проб. При повторном запуске системы плотность тока резко снизилась, показывая, что падение тока произошло из-за небольших количеств осадка, впоследствии вымываемого из ячейки.
[0038] Так как предварительная обработка при рН 10, казалось, оставила некоторое вещество, ухудшающее качество, в сырьевом потоке, в Примере 5 использовали раствор, который предварительно обработали до рН 11 в течение трех дней, а затем отфильтровали. Как показано на Фигуре 6, плотность тока, которую поддерживали в течение 24 часов, явно улучшила результат. Окончательное падение тока, как считают, произошло из-за расходования сульфата лития, так как его прогнали как одну большую порцию.
[0039] Фигура 6 также показывает, что концентрации кислоты и основания поддерживали довольно постоянными путем постоянного добавления воды. Таким образом, желательно, а иногда необходимо, добавлять продукционную кислоту или основание для контроля рН в центральном сырьевом отсеке. Для облегчения контроля этого отсека выбрали более высокую концентрацию кислоты, чтобы тем самым понизить эффективность тока кислоты так, чтобы рН в центральном отсеке можно было бы контролировать при 3,5 исключительно добавлением LiOH. Средняя эффективность тока для гидроксидного формирования составила почти 60%.
[0040] Фигура 6 показывает концентрацию сульфата во всех трех отсеках как функцию времени. Центральный отсек прогнали как одну порцию, и в конце эксперимента концентрация достигла около 0,2 М. Сульфат в LiOH составлял приблизительно 400 мг/л, что составляет приблизительно 0,85% тока. Снижение концентрации серной кислоты будет снижать содержание сульфата в LiOH, которое можно дополнительно снизить.
Примеры 6-10
[0041] В Примерах 6-10 применили Eurodia EUR-2C ячейку для электродиализа для демонстрации применимости трехотсекового разложения соли сульфата лития. Ячейку собрали с семью компонентами, включая одну биполярную мембрану, две проницаемые для анионов мембраны, две проницаемые для катионов мембраны, один анод и один катод, сконфигурированными, как показано на Фигуре 4. Каждая мембрана имеет активную площадь 0,02 м2.
[0042] Полагают, что лития фосфат, который образуется в областях с высоким рН, прилегающих к катионной мембране, из-за обратной миграции гидроксид иона, главным образом отвечает за загрязнение мембраны, когда это происходит. Предварительная обработка сырьевого раствора для удаления фосфата и других примесей путем повышения рН до 11 осаждает большинство из этих солей и дает улучшенные результаты по сравнению с регулированием только до рН 10.
[0043] Пример 9 является характерным и описан в деталях ниже. 1 М исходный раствор сульфата лития предварительно обработали для удаления нерастворимых фосфатных солей путем повышения рН до 11 с 4 М LiOH при соотношении приблизительно 1 л LiOH к 60 л 1 М Li2SO4. Обработанный сульфат лития хорошо смешали и осадку позволили оседать на протяжении ночи перед фильтрованием через стекловолоконную фильтровальную бумагу (размер пор 1 мкм). Повторно отрегулировали рН отфильтрованного Li2SO4 до рН 2 добавлением приблизительно 12 мл 4 М серной кислоты на литр Li2SO4.
[0044] Исходный объем подачи предварительно обработанного Li2SO4 составил 8 л и был предварительно нагрет до приблизительно 60°С перед перенесением в 20 л стеклянный сырьевой резервуар. Исходным LiOH основанием был остаток 3 литра из Примера 8, который анализировали в начале эксперимента при 1,8 М LiOH. Начальной кислотой был остаток 2 л H2SO4 также из Примера 8, который анализировали при 0,93 М H2SO4. Электродным ополаскивателем было 2 литра 50 мМ серной кислоты. Растворы прокачали через Eurodia ячейку (EUR-2C-BP7) при приблизительно 0,5 л/миниотсек (3-4 л/минута всего потока) с равным противодавлением, поддерживаемым в каждом отсеке (3-4 psi) для предупреждения избыточного давления на любой мембране, которое могло бы привести к внутреннему просачиванию. Скорости потока и давления каждого контролировали вместе с температурой подачи, рН подачи, током ячейки, напряжением, прохождением заряда и объемом подачи.
[0045] Электродиализ действовал при постоянных 25 вольтах. Температуру подачи Li2SO4 контролировали при 35°С. Насосы (TE-MDK-MT3, Kynar March Pump) и ED ячейка обеспечили достаточное нагревание для поддержания температуры. 20-литровый сырьевой бак оснастили рубашкой так, что охлажденную воду можно было бы прокачивать через рубашку с помощью электромагнитного клапана и температурного контроллера (OMEGA CN76000), когда температура превышала 35°С.
[0046] Мембраны ячейки обеспечили достаточными для передачи тепла для охлаждения других отсеков. Для прогона этого эксперимента непрерывно в течение 20 часов подачу Li2SO4 снова выполнили, прокачивая подачу предварительно обработанного до рН 2 1 М Li2SO4 при постоянной скорости 10 мл/минута. Обратная миграция протона сквозь АСМ мембрану была больше, чем обратная миграция гидроксида сквозь FKB катионную мембрану, таким образом, рН центрального отсека будет нормально снижен. рН центрального отсека контролировали путем добавления 4 М LiOH с использованием высокого натриевого рН электрода и JENCO pH/ORP контроллер, установленный до рН 2. Электронная регистрация данных рН подачи каждую минуту в течение 20-часового эксперимента показала изменение рН от 1,9 до 2,1, таким образом, всего 3,67 л 4 М LiOH добавили в подачу для нейтрализации обратной миграции гидроксида. Объем подачи повысился от 8 л до 15,3 л через 20 часов работы из-за добавления 11,8 л Li2SO4 и 3,7 л LiOH, 6,8 л воды перешли к кислоте, а 0,7 л воды перешли к основанию.
[0047] Основание LiOH циркулировало через ячейку из 1-галлонного закрытого полипропиленового бака. Объем 3 литра поддерживали отведением верхней части с использованием трубы, зафиксированной на поверхности LiOH, и с использованием перистальтического насоса для сбора LiOH продукта в 15-галонный переточный резервуар. Концентрацию LiOH поддерживали при концентрации 1,85 М LiOH добавлением воды в бак с LiOH при постоянной скорости 17 мл/минута.
[0048] Серная кислота циркулировала через кислотный отсек ячейки из 2 л стеклянного резервуара. Порт переполнения в верхней части резервуара поддерживал постоянный объем 2,2 л H2SO4, переливая кислотный продукт в 15-галлонный бак. Концентрацию H2SO4 держали постоянной при 1,9 М с добавлением воды при постоянной скорости 16 мл/минута.
[0049] Электродный ополаскиватель (50 мМ H2SO4) циркулировал через и анолитный, и католитный концевые отсеки и воссоединялся на выходе ячейки в верхней части 2-литрового полипропиленового бака, где образованные на электродах газы О2 и H2 выходили к задней части вытяжного шкафа.
[0050] Несколько образцов взяли во время эксперимента для гарантии того, что скорости добавления воды в кислоту и основание были достаточными для поддержания концентраций постоянными в ходе эксперимента. В конце 19,9-часового эксперимента источник энергии выключили, баки опустошили и измерили объемы окончательных продуктов вместе с окончательным Li2SO4 и электродным ополаскивателем. Весь полученный LiOH составил 30,1 л 1,86 М LiOH (включая 3 л остаток) и 21,1 л 1,92 М H2SO4 (включая 2 л остаток). Окончательная подача составила 15,3 литров 0,28 М Li2SO4, а окончательный электродный ополаскиватель включал 1,5 л 67 мМ H2SO4. 0,5 л воды перенеслось из электродного ополаскивателя через катионную мембрану в кислоту. Добавили общее количество воды 18,6 литров в кислоту и 20,4 литров в основание. Общий проход заряда составил 975660 кулонов (70,78 моль) с обратной миграцией 33,8 моля Н, обратной миграцией 20,2 моля ОН-, и добавили 14,97 моля LiOH в подачу. Средняя плотность тока в этом эксперименте составила 67,8 мА/см2. Эффективность тока H2SO4 составила 52,5% на основе анализа накопления сульфата в кислоте, и эффективность тока LiOH составила 72,4% на основе анализа Li+ в LiOH продукте.
[0051] Начальные и конечные образцы проанализировали на


[0052] Таблица 3 приводит результаты электродиализных экспериментов, выполненных с Astom АСМ мембраной. В Примере 6 также использовали Astom СМВ и ВР1 катионную и биполярную мембрану, соответственно. Сырьевой раствор сульфата лития предварительно обработали до рН 11, отфильтровали, а затем повторно регулировали до рН 3,5 перед прогоном в ячейку. Результаты сопоставимы с теми, о которых сообщалось в прошлом месяце, по эффективности тока; однако средняя плотность тока ниже, чем в предыдущих прогонах, что все еще указывает на некоторое загрязнение. Градиент рН на катионной мембране при рН 3,5, как оказалось, вызывает выход осадков, рН сырьевого отсека снизили до рН 2 и использовали FuMaTech FKB катионную мембрану, которая имела меньшую обратную миграцию гидроксида. Составление пар FI(13 и АСМ мембран означает, что рН в центральном отсеке преобладает обратная миграция протона через АСМ, и контроль рН выполняется исключительно добавлением LiOH.
[0053] Примеры 7-9 повторяют прогоны с FKB/ACM/BP1 комбинацией, всего 70 часов работы в трех порциях. Из Таблицы 1 можно видеть, что воспроизводимость этих прогонов является отличной с эффективностью тока для LiOH, измеренной тремя различными путями при 71-75% (измерена с помощью потери Li+ из подачи, увеличения Li+ и гидроксид иона в отсеке основания). Также эффективность тока кислоты составляет 50-52% при всех трех способах измерения. Данные из этих примеров показывают стабильность средней плотности тока. Фигура 7 показывает это графически, где начальные плотности тока очень хорошо соответствуют друг другу. Отклонение в конце каждой порции объясняется различными размерами порции и поэтому разными окончательными концентрациями сульфата лития.
[0054] Высокая эффективность тока FKB мембраны, как оказалось, помогает избежать проблем осаждения на граничном слое на стороне подачи катионной мембраны. Полную эффективность тока процесса определяли по наименее производительной мембране. То есть неэффективность АСМ мембраны должна быть компенсирована добавлением LiOH из отсека основания обратно в сырьевой отсек, тем самым снижая полную эффективность до таковой анионной мембраны. В попытке повысить эффективность анионной мембраны концентрацию кислоты снизили в отсеке продуционной кислотного. Пример 10 выполняли с 0,61 М серной кислотой, которая обладает эффектом повышения эффективности тока кислоты на почти 10%-62%. (Смотри Таблицу 3).
Примеры 11-12
[0055] В попытке дополнительно повысить эффективность тока кислоты ячейку модифицировали AAV альтернативной анионной мембраной от Astom в Примерах 11 и 12. AAV мембрана является блокирующей кислоту мембраной, ранее доступной от Ashahi Chemical. Таблица 4 приводит данные этих экспериментов с использованием комбинации FKB, AAV и ВР-1 биполярной мембраны.
[0056] Эффективности тока и кислоты, и основания из этих мембран очень похожи на комбинацию Примеров 7-9. Наблюдали около 10% повышение эффективности тока кислоты при использовании более низкой концентрации кислоты. Средняя плотность тока для этой комбинации мембран немного ниже, чем с использованием АСМ мембраны (приблизительно 10 мА/см2 для той же концентрации кислоты и работы при постоянном напряжении пакета 25 V). Измерения внешнего АС полного сопротивления подтвердили, что сопротивление AAV выше, чем АСМ при измерении в Li2SO4 растворе.
[0057] Чистота продукта гидроксида лития, подлежащего рециркулированию в процессе получения фосфата лития-железа, очень важна. Главной примесью в LiOH потоке с использованием этой методики разложения соли будет сульфат ион, который переносится через биполярную мембрану из кислотного отсека в основание. Количество транспорта должно быть напрямую связано с концентрацией кислоты. Это можно четко увидеть, сравнивая Пример 9 с Примером 10 (смотри Таблицу 3) и Пример 11 с Примером 12 (Таблица 4). В каждом случае примесь сульфата в 1,88 М LiOH была снижена приблизительно на половину, когда концентрацию кислоты понизили от 1 М до 0,6 М. Устойчивое состояние концентраций сульфата составляет 430 и 200 ppm, соответственно.
[0058] Поскольку ионы сульфата и лития переносятся через ионообменные мембраны, вода также переносится из-за гидратации ионов (электро-осмос) и осмоса. Однако транспорт воды из центрального отсека не достаточный для поддержания концентрации постоянной. Это проиллюстрировано обсуждением переноса воды в Примере 8. На каждый ион лития, который переносится через катионную мембрану, также переносится 7 молекул воды. Подобным образом, в среднем 1,8 молекулы воды было перенесено с сульфат ионом, что дает в общем 15,8 молекул воды для каждого сульфата лития. Поскольку сырьевой раствор был всего одномолярным по сульфату лития, он содержит почти 55 молей воды для каждого сульфата лития, что приведет к непрерывному разбавлению сульфата лития в центральном отсеке. Удаление воды из сырьевого отсека можно контролировать и можно выполнять, например, обратным осмосом.
[0059] Все ссылки, цитированные в данном документе, включены путем ссылки во всей их полноте для всех целей.
Температура 35°С, постоянное напряжение=25, рН подачи контролировали при 3,5
Температура 35°С, постоянное напряжение = 25, рН подачи контролировали при 3,5/2,0.
Температура 35°С, постоянное напряжение = 25, рН подачи контролировали при 3,5/2,0.
Реферат
Изобретение относится к восстановлению лития из водных растворов, таких как сырьевые потоки, применяемые в производстве литий-ионных батарей, или образованные при извлечении лития из материалов на основе руды. Способ восстановления лития как гидроксида лития осуществляют путем подачи водного потока, включающего ионы лития, в биполярную ячейку для электродиализа, где ячейка формирует раствор гидроксида лития. Способ реализуют в устройстве, содержащем биполярную ячейку для электродиализа, где указанная биполярная ячейка включает (а) проницаемую для анионов мембрану, позволяющую прохождение отрицательно заряженного иона, но затрудняющую прохождение положительно заряженного иона лития; (b) проницаемую для катионов мембрану, позволяющую прохождение положительно заряженного иона лития, но затрудняющую прохождение отрицательно заряженного иона; (с) биполярную мембрану, расположенную между проницаемой для анионов мембраной и проницаемой для катионов мембраной, формирующую отдельные камеры с проницаемой для анионов мембраной и проницаемой для катионов мембраной, соответственно; (d) анод и катод с расположенными между ними указанными проницаемой для анионов мембраной, проницаемой для катионов мембраной и биполярной мембраной, и (е) постоянный ток, подаваемый через электроды. Изобретение позволяет получить гидроксид лития в виде очищенного продукта. 3 н. и 34 з.п. ф-лы, 7 ил., 4 табл., 12 пр.
Формула
(a) подают включающий литий поток в устройство, включающее биполярную ячейку для электродиализа;
(b) электродиализируют включающий литий раствор для разделения положительно заряженных ионов лития и отрицательно заряженных ионов;
(c) восстанавливают литий как раствор гидроксида лития, образованного на этапе электродиализного разделения.
(a) подают поток сульфата лития в устройство, включающее биполярную ячейку для электродиализа;
(b) электродиализируют поток сульфата лития для разделения положительно заряженных ионов лития и отрицательно заряженных ионов сульфата;
(c) создают раствор гидроксида лития на анодной стороне и раствор серной кислоты на катодной стороне; и
(d) восстанавливают литий как раствор гидроксида лития, образованный из биполярного электродиализа.
(a) регулируют поток сульфата лития до рН от 10 до 11 для удаления примеси добавлением щелочного гидроксида;
(b) осаждают примесь из потока сульфата лития;
(c) фильтруют примесь из потока сульфата лития; и
(d) регулируют рН полученного в результате потока до рН от 1 до 4 перед подачей указанного потока в устройство биполярного электродиализа.
(a) восстанавливают раствор серной кислоты, полученный в результате из биполярного электродиализа;
(b) добавляют источник железа в восстановленный раствор серной кислоты;
(c) превращают указанный раствор серной кислоты в ион сульфат;
(d) смешивают указанный ион сульфат, восстановленный раствор гидроксида лития и источник фосфата для получения иона лития фосфата, где указанный лития фосфат образуется при непрерывном процессе.
(a) регулируют поток сульфата лития до рН от 10 до 11 для удаления примесей добавлением щелочного гидроксида;
(b) осаждают примесь из потока сульфата лития;
(c) фильтруют примесь из потока сульфата лития; и
(d) регулируют рН полученного в результате потока до рН от 2 до 3,5 до подачи указанного потока в устройство биполярного электродиализа.
(a) восстанавливают оба потока и гидроксида лития, и серной кислоты, образованные в результате биполярного электродиализа;
(b) проводят реакцию потока серной кислоты с карбонатом лития для получения дополнительного раствора сульфата лития;
(c) добавляют указанный дополнительный раствор сульфата лития в исходный сырьевой поток, содержащий сульфат лития; и
(d) непрерывно подают поток сульфата лития в биполярное электролизное устройство.
(a) регулируют поток сульфата лития до рН от 10 до 11 для удаления примесей добавлением щелочного гидроксида;
(b) осаждают примесь из потока сульфата лития;
(c) фильтруют примесь из потока сульфата лития; и
(d) регулируют рН полученного в результате потока до рН от 2 до 3,5 до подачи указанного потока в устройство биполярного электродиализа.
(a) проницаемую для анионов мембрану, позволяющую прохождение отрицательно заряженного иона, но затрудняющую прохождение положительно заряженного иона лития;
(b) проницаемую для катионов мембрану, позволяющую прохождение положительно заряженного иона лития, но затрудняющую прохождение отрицательно заряженного иона;
(c) биполярную мембрану, расположенную между проницаемой для анионов мембраной и проницаемой для катионов мембраной, формирующую отдельные камеры с проницаемой для анионов мембраной и проницаемой для катионов мембраной соответственно;
(d) анод и катод с указанной проницаемой для анионов мембраной, проницаемой для катионов мембраной и биполярной мембраной, расположенными между указанным анодом и указанным катодом; и
(e) постоянный ток, подаваемый через электроды.
(a) проницаемую для анионов мембрану, позволяющую прохождение отрицательно заряженного сульфат иона, но затрудняющую прохождение положительно заряженного иона лития;
(b) проницаемую для катионов мембрану, позволяющую прохождение положительно заряженного иона лития, но затрудняющую прохождение отрицательно заряженному сульфат иону;
(c) биполярную мембрану, расположенную между проницаемой для анионов мембраной и проницаемой для катионов мембраной, формирующую отдельные камеры с проницаемой для анионов мембраной и проницаемой для катионов мембраной соответственно;
(d) анод и катод с указанной проницаемой для анионов мембраной, проницаемой для катионов мембраной и биполярной мембраной, расположенными между указанным анодом и указанным катодом; и
(e) постоянный ток, подаваемый через электроды.

Комментарии