Способ получения водного подкисленного раствора, содержащего хлоратные ионы, способ электрохимической обработки водного раствора смеси солей щелочных металлов, способ получения двуокиси хлора - RU2108413C1
Код документа: RU2108413C1
Чертежи



Описание
Изобретение относится к электротехнической обработке водных растворов с получением кислой среды для применения во многих областях техники, в частности с целью производства двуокиси хлора.
Двуокись хлора, которая полезна в качестве отбеливающего агента на
целлюлозном заводе, получают химическим путем за счет восстановления кислого водного хлоратного раствора в соответствии с нижеследующим уровнем реакции:
ClO+2H++e-_→ ClO2+H2O,
где источником электрона e-
могут служить различные восстановительные агенты, например метанол, хлорный ион и перекись водорода. Для проведения такой реакции во многих промышленных процессах кислую среду создают с помощью серной
кислоты, тогда как хлоратные ионы создают с использованием хлората натрия. Присутствие таких агентов приводит к образованию в качестве побочного продукта сульфата натрия определенной формы.
В патенте США N 4115217 описывается способ электрохимической обработки водного раствора смеси солей щелочных металлов, содержащей сульфат щелочного металла и хлорат щелочного металла.
Одним из конкретных вариантов осуществления промышленного способа является так называемый способ R8, разработанный владельцем данной патентной заявки и предлагаемый в описании к американскому патенту N 4081520, который был выдан заявителю данной заявки и который упомянут в этом подробном описании в качестве ссылки. В данном патенте раскрывается способ получения водного подкисленного раствора, содержащего хлоратные ионы, для производства двуокиси хлора. Совершенствования и модификации этого способа предлагаются и в описаниях к выданным на имя также владельца данной заявки американским патентам NN 4465658, 4473540 и 4627969, которые также упомянуты в данном подробном описании в качестве ссылки.
При осуществлении способа получения двуокиси хлора в реакционной среде создают высокую общую кислотную нормальность серной кислоты и поддерживают температуру ее кипения под давлением, которое ниже атмосферного. В качестве восстановительного агента для хлоратных ионов используют метанол, благодаря чему двуокись хлора образуется в практически чистом виде. Благодаря кипению реакционной среды образуется водяной пар, который в отношении газообразной двуокиси хлора служит разбавителем, что позволяет предотвратить разложение двуокиси хлора.
После начала процесса образующийся в качестве подобного продукта сульфат натрия накапливается в реакционной среде до тех пор, пока раствор не насыщается этим сульфатом натрия, после чего сульфат натрия начинает осаждаться из такой реакционной среды. Образующийся в результате шлам сульфата натрия отводят из реакционного сосуда, отфильтровывают из шлама кристаллический сульфат натрия, а маточный раствор после добавления в него свежеприготовленных порций хлората натрия, серной кислоты и метанола возвращают в реакционную зону.
Этот способ является высокоэффективным, а его осуществление позволяет быстро получать двуокись хлора в промышленных количествах. Как можно заключить из вышеприведенного уравнения реакции, на каждый моль получаемой двуокиси хлора в реакционную среду вводят моль хлоратного иона и, следовательно, иона натрия. Натриевые ионы соединяются с сульфатными ионами, вводимыми совместно с серной кислотой, благодаря чему образуется сульфат натрия, который может представлять собой бисульфат натрия или, что более естественно в условиях осуществления способа R8, двойную соль сесквисульфата натрия, то есть Na3H(SO4)2 или NaHSO4 • Na2SO4, в зависимости от кислотности раствора. При осуществлении другого способа получения двуокиси хлора на основе использования серной кислоты, низкокислотного способа R3, который предлагается в описании к американскому патенту N 3864456, выданному на имя владельца данной заявки на патент, который в данном описании упомянут в качестве ссылки, в виде побочного продукта получают нейтральный сульфат натрия.
Такие являющиеся побочными продуктами сульфат натрия и сесквисульфат натрия (иногда называемые "солевым брикетом") обычно используют с целью компенсации потерь серы целлюлозным заводом.
Однако ориентация на замещение в значительной степени хлора двуокисью хлора на стадии хлорирования в отдельном отделе привела к производству солевого брикета как побочного продукта процесса производства двуокиси хлора в таких количествах, которые превышают потребности компенсации их потерь целлюлозным заводом.
Таким образом, существует необходимость разработки способа получения двуокиси хлора, обладающего, например, достоинствами способа R8 с одновременным образованием в ходе его осуществления меньшего количества натрийсульфатного побочного продукта при том же уровне производства двуокиси хлора. Еще более выгодно когда помимо уменьшения количества образующегося солевого брикета совместно с двуокисью хлора получают раствор каустической соды, что позволяет, таким образом, свести к минимальному дисбаланс гидрат окиси натрия/хлор, [(NaOH)/Cl2] , который в настоящее время возникает на целлюлозных заводах.
В описании к американскому патенту N 4129484 содержится предположение о возможности обработки водной массы, отводимой из процесса электролитического производства двуокиси хлора, с целью выделения обогащенной кислотой фракции из исходного раствора, который затем можно возвращать в аппарат для получения двуокиси хлора.
С целью утилизации получаемых в качестве побочных продуктов солевых брикетов в технике уже было предложено применять электрохимический процесс конверсии сульфата натрия в серную кислоту и раствор каустической соды в трехсекционном электролизере, снабженном катионообменной мембраной, обращенной к катоду, и анионной мембраной или диафрагмой, обращенной к аноду, где раствор солевого брикета направляют в среднюю секцию. В электрическом поле натриевые и сульфатные или кислые сульфатные ионы перемещаются соответственно в катодную и анодную камеры, в которой они рекомбинируют с образующимися электролитическим путем гидроксильными и водородными ионами, в результате чего образуются соответственно каустическая сода и серная кислота.
При осуществлении аналогично вышеизложенному упрощенного способа с применением двухкамерного электролизера, снабженного катионообменной мембраной, параллельно с получением раствора каустической соды в катодной камере было предложено получать в анодной камере смесь сульфата с серной кислотой.
Основной недостаток этих известных предложений состоит в том, что получаемый раствор серной кислоты характеризуется слабой концентрацией этой кислоты (менее чем 10 вес. % серной кислоты), благодаря чему на установку, производяющую двуокись хлора, ложиться чрезмерная нагрузка по выпариванию, вследствие чего весь процесс в целом становится неэкономичным и непрактичным.
Хотя при электрохимическом отделении солевого брикета так, как это описано в известной литературе, можно достичь более высокой концентрации серной кислоты, эффективность по току такого способа оказывается непозволительно низкой вследствие утечки водородных ионов (H+) через ионообменную мембрану. Такая миграция водородных ионов к катоду связана с их очень высокой подвижностью в сравнении с натриевыми ионами (Na+).
Так, например, в описании к вышеупомянутому американскому патенту N 4129484 говорится о том, что при получении приблизительно 1 нормального раствора каустической соды эффективность по току составляет всего 9%, а при получении примерно 2 М серной кислоты она равна 39%.
При осуществлении аналогичных способов, которые изложены в описании к американскому патенту N 4115217, такую электрохимическую обработку сульфата натрия можно сочетать с электрохимическим получением хлорита натрия в катодной секции (камере) путем электровосстановления двуокиси хлора.
Краткое изложение сущности изобретения.
С целью противодействия нежелательной миграции водородных ионов к катоду и, следовательно, максимизации эффективности тока в процессе подкисления в соответствии с изобретением в ходе проведения электролитического процесса в анолите поддерживают высокую величину соотношения концентраций ионов натрия и водорода (Na+/H+).
В соответствии с одним из вариантов воплощения изобретения предлагается способ электрохимической обработки смеси сульфата натрия с хлоратом натрия с целью ее подкисления и направления кислоты в процессе получения двуокиси хлора при одновременном получении водного раствора гидрата окиси натрия. Хотя такое совместное получение водного раствора гидрата окиси натрия наиболее желательно для применения на целлюлозных заводах, в сочетании с анодным подкислением смесей солей можно проводить любые другие приемлемые катодные реакции, например электровосстановление кислорода до перекиси водорода и гидрата окиси натрия, а также другие процессы, описанные ниже.
Возможности применения способа настоящего изобретения не ограничиваются только обработкой таких смесей. В более широком аспекте целью изобретения является обработка водных растворов солей некоторых щелочных металлов и их смесей с получением водной подкисленной среды.
В соответствии с одним из аспектов в более широком смысле целью изобретения является разработка способа получения водного подкисленного раствора, содержащего хлоратные ионы, который может быть использован в качестве исходного материала для подачи в процесс получения двуокиси хлора или для других целей, когда в водный кислой среде хлоратные ионы восстанавливают до двуокиси хлора.
Водный раствор по меньшей мере одной соли щелочного металла, выбранной из группы, состоящей из хлората щелочного металла, сульфата щелочного металла и смеси хлората щелочного металла и сульфата щелочного металла, электрохимически подкисляют. Этот водный раствор готовят из твердой фазы материалов.
В том случае, когда соль щелочного металла выбирают из группы, состоящей из хлората щелочного металла и смеси хлората щелочного металла с сульфатом щелочного металла, ионы щелочного металла электрохимическим путем удаляют из водного раствора с получением подкисленного раствора соли щелочного металла, который представляет собой водный подкисленный раствор, содержащий хлоратные ионы.
В том случае, когда соль щелочного металла представляет собой сульфат щелочного металла, для приготовления водного подкисленного раствора, содержащего хлоратные ионы, в подкисленный раствор соли щелочного металла добавляют хлорат щелочного металла.
Согласно одному из вариантов осуществления этой процедуры предусмотрено применение электролитической ячейки (электролизера), снабженной катионнообменной мембраной, которая разделяет ячейку на анодное отделение и катодное отделение. В анодное отделение направляют водный раствор по меньшей мере одной соли щелочного металла, и в этом анодном отделении за счет электролитического процесса образуют водородные ионы, тогда как ионы щелочного металла поступают из анодного отделения через катионообменую мембрану в катодное отделение. Из анодного отделения отводят подкисленный раствор соли щелочного металла.
В качестве анодной реакции по другому варианту может быть использована любая другая реакция окисления, в результате которой образуются водородные ионы, например окисление газообразного водорода до водородных ионов. Такое анодное окисление газообразного кислорода можно сочетать с электровосстановлением газообразного кислорода в качестве катодной реакции, что является процессом работы топливного элемента, в котором помимо подкисления анолита и получения раствора гидрата окиси щелочного металла в католите выделяется электрическая энергия.
Когда анодное окисление газообразного водорода до водородных ионов сочетается с катодным восстановлением воды до гидроксильных ионов и газообразного водорода, этот последний газ может быть использован в качестве анодного исходного материала, причем одновременно с этим таким образом может быть достигнута существенная экономия энергии как результат разницы потенциалов электрохимических реакций. Точно также аналогичная экономия энергии и материалов достигается в случае сочетания анодного окисления воды до водородных ионов и кислорода с катодным восстановлением потока газообразного кислорода.
В соответствии с одним из вариантов воплощения настоящего изобретения предлагается способ электрохимической обработки водного раствора смесей солей щелочных металлов, который включает в себя множество стадий. Водный раствор при этом направляют в анодное отделение электролизера, снабженного катионообменной мембраной, которая разделяет электролизер на анодное отделение и катодное отделение.
В анодном отделении электролитическим путем получают водородные ионы, а в катодном отделении за счет электролитической реакции образуются гидроксильные ионы. Одновременно с этим катионы щелочных металлов переходят через катионообменную мембрану из анодного отделения в катодное отделение.
В результате такой миграции катионов щелочных металлов и электрохимической реакции с образованием водородных ионов и гидроксильных ионов достигается эффект образования раствора гидратов окисей щелочных металлов в катодном отделении и кислоты из анионов солей щелочных металлов в анодном отделении. Из отделений электролизера отводят соответствующие водные растворы.
С целью достичь высокой эффективности тока, составляющей по меньшей мере приблизительно 70%, предпочтительно по меньшей мере приблизительно 80%, и, следовательно, разработать экономичный способ молярное соотношение [Na+]: [H+] в анолите обычно следует варьировать в пределах от приблизительно 1000: 1 до приблизительно 1:5, предпочтительно от приблизительно 1000:1 до приблизительно 1: 2, по ходу всей электролитической реакции. В предпочтительном аспекте изобретения повышенная эффективность тока должна достигаться регулированием обратной миграции гидроксильных ионов из катодного отделения через катионнообменную мембрану в анодное отделение.
В соответствии с другим аспектом изобретения способ получения водного подкисленного раствора, содержащего хлоратные ионы, объединен со способом получения двуокиси хлора с созданием водной кислой реакционной среды, выделяющей двуокись хлора, которая содержит в реакционной зоне ионы серной кислоты и щелочных металлов, путем подачи водного подкисленного раствора, содержащего хлоратные ионы, в реакционную зону для обеспечения водной кислой реакционной среды, выделяющей двуокись хлора, хлоратными ионами и водородными ионами и удаления из реакционной зоны сульфата щелочного металла.
На фиг. 1 представлена технологическая схема процесса получения двуокиси хлора, проводимого в соответствии с одним из вариантов воплощения настоящего изобретения; на фиг. 2 схематически проиллюстрирован биполярный мембранный электролизер, который может быть использован в ходе проведения процесса получения двуокиси хлора, который показан схематически на фиг. 1; на фиг. 3 графическим путем представлены экспериментальные данные, иллюстрирующие соотношение между кислотной нормальностью и эффективностью тока для различных концентраций соли щелочного металла; на фиг. 4 также графическим путем представлены дополнительные экспериментальные данные, иллюстрирующие соотношение между кислотной нормальностью и эффективностью тока для различных католитов.
Как указано выше, целью изобретения в общем является электрохимическая обработка водных
растворов солей щелочных металлов и их смесей для получения водной подкисленной среды. Способ изобретения особенно полезен в ходе проведения процессов получения двуокиси хлора на основе серной кислоты,
поскольку практическое воплощение изобретения позволяет не только уменьшить количество получаемого в качестве подобного продукта сульфата щелочного металла, но и вовсе предотвратить его образование в
сочетании с той же самой производительностью по двуокиси хлора
В соответствии с одним из вариантов воплощения изобретения в анодное отделение электрохимической ячейки, разделенной
катионообменной мембраной, вводят водный раствор по меньшей мере одной соли щелочного металла, которая представляет собой хлорат щелочного металла, сульфат щелочного металла или, что предпочтительнее,
их смесь, в результате чего ионы щелочного металла переходят из анодного отделения в катодное отделение. Эту процедуру можно использовать при осуществлении настоящего изобретения различными путями с
достижением уменьшенного выхода сульфата щелочного металла в ходе проведения процесса получения двуокиси хлора. Для процессов получения двуокиси хлора является обычным применение солей натрия,
вследствие чего в описании нижеследующих конкретных вариантов воплощения изобретения содержатся ссылки на такие натриевые соли. Однако совершенно очевидно, что сущность настоящего изобретения в равной
степени применима и в отношении солей других щелочных металлов.
В соответствии с предпочтительным вариантом воплощения настоящего изобретения в анодное отделение электролизера подают сочетание хлората натрия с сульфатом натрия, в частности, в форме сесквисульфата натрия, поскольку присутствие обеих солей позволяет максимизировать молярное соотношение [Na+]:[H+ ] в анодном отделении, в результате чего достигается высокая эффективность тока, а благодаря этому снижается расход энергии. Кроме того, повышение эффективности тока позволяет уменьшить капитальные затраты, поскольку для той же самой производительности установки требуется меньшее число электролизеров.
По предпочтительному варианту следует применять насыщенный исходный раствор или шлам, что позволяет свести к минимуму сопротивление электролита при одновременном поддержании высокого соотношения [Na+]:[H+] в анодном отделении. Когда исходный материал представляет собой шлам, обычно предпочтительнее предусмотреть наличие между исходным потоком и анодом дополнительного сепаратора или сепараторов, в частности ионообменной мембраны или диафрагмы, что позволяет предотвратить истирание и износ материала анода окружающим материалом.
При желании такой дополнительный сепаратор можно использовать и в том случае, когда в качестве
исходного материала не применяют шлам. Такая конструкция полезна в том случае, когда используют серную кислоту, циркулирующую в анодном отделении, и анод типа DSA-O
Из смешанного сырья, то есть хлората натрия и сульфата натрия, в анодном отделении электролизер образует подкисленный раствор, а в катодном отделении - раствор гидрата окиси натрия. Затем подкисленный раствор направляют в процесс получения двуокиси хлора в качестве источников кислоты и хлората для него.
В том случае, когда на конкретном целлюлозном заводе отсутствует необходимость в солевом брикете, режим работы электролизера предпочтительнее подбирать таким образом, чтобы удалять из сырья, представляющего собой смесь хлората натрия с сульфатом натрия, некоторое количество натриевых ионов, соответствующее тому количеству натриевых ионов, которое поступает совместно с хлоратом натрия. Благодаря этому полностью удовлетворяются потребности генератора двуокиси хлора в кислоте и хлорате, вследствие чего в качестве побочного продукта не образуется никакого дополнительного количества сульфата натрия. Таким образом между генератором двуокиси хлора и электролизером сульфат натрия циркулирует в качестве мертвого груза.
Когда способ настоящего изобретения осуществляют с использованием смесей хлората натрия с сульфатом натрия, хлорат натрия предпочтительнее растворять в растворе сульфата натрия. По другому варианту сульфат натрия можно добавлять в форме шлама или кристаллической форме в водный раствор хлората натрия или же, если желательно, можно смешивать в желаемом соотношении растворы сульфата натрия и хлората натрия.
Анолитный исходный материал можно приготовить одновременным смешением индивидуальных компонентов, то есть сульфата натрия и хлората натрия, или постепенным добавлением одного компонента к другому по ходу электролиза. Так, например, добавлением хлората натрия в электролизере можно предварительно подкислять сульфат натрия. Действительно, этот процесс моно проводить таким образом, что при этом нейтральный сульфат натрия или сесквисульфат натрия подкисляется до бисульфата, NaHSO4, после чего этот раствор используют для растворения хлората натрия с целью извлечь преимущество от повышенной растворимости бисульфата в сравнении с растворимостью других сульфатов. Эту смесь можно подавать в генератор или подвергать дополнительному подкислению в электролизере.
Из вышеприведенного обсуждения совершенно очевидно, что для удовлетворения требованиям конкретного целлюлозного завода можно подобрать любое сочетание сульфата натрия с хлоратом натрия Выпуск получаемого в качестве побочного продукта сульфата натрия можно наладить в соответствии с любыми потребностями в нем целлюлозного завода.
Присутствие в анолите сульфата (сесквисульфата) натрия улучшает соотношение [Na+]:[H+] не только благодаря повышению концентрации натриевого иона, но также и вследствие буферного действия сульфатных ионов, которые проявляют тенденцию к рекомбинации с водородными ионами с образованием бисульфата, что вызывает снижение концентрации свободных водородных ионов. Кроме того, объединенные подкисленные исходные хлорат и сульфат эффективно уменьшают количество воды, которое вводят в генератор двуокиси хлора, вследствие эффекта "участия" воды.
Хотя процесс, проводимый с использованием смесей хлората натрия/сульфата натрия, обладает практически
неограниченной гибкостью в выборе уровня производительности в отношении такого побочного продукта, как солевой брикет, что соответствует рециркуляции сульфата в количестве от 0 до 100%, можно также
достичь частично снижения производства солевого брикета электролитическим подкислением исходного раствора чистого хлората натрия, то есть без какого-либо добавления сульфата. Реакцию в целом в ходе
проведения такого процесса можно отобразить следующим образом:

Такое частичное подкисление хлората натрия ведет к образованию смеси хлората натрия с хлорноватой кислотой, в которой содержание хлорноватой кислоты определяет степень уменьшения количества добавляемой серной кислоты в генератор двуокиси хлора и, следовательно, количество получаемого в качестве побочного продукта сульфата натрия. По другому варианту подкисленный раствор хлората натрия можно использовать в качестве среды для регулирования величины pH в электролитическом хлоратном электролизере.
Поскольку соотношение [Na+]:[H+] составляет определяющий фактор для эффективности тока в процессе подкисления, в этом случае возможна только частичная конверсия хлората натрия в хлорноватую кислоту. Обычно путем подкисления чистого исходного хлората натрия при практической эффективности тока может быть достигнуто приблизительно 20%-ное снижение количества образующего в качестве побочного продукта солевого брикета.
Водный раствор гидрата окиси натрия, который совместно получают в соответствии с одним из вариантов настоящего изобретения, легко находит сбыт на целлюлозном заводе в работе его отдельного отдела при очистке беленой целлюлозы. В том случае, когда электролитический процесс проводят непосредственно на целлюлозных заводах с получением водного раствора гидрата окиси натрия обычно из хлористого натрия, результатом таких процессов является одновременное получение хлора. Однако часто возможность использования такого одновременно полученного хлора ограничена, что приводит к созданию дисбаланса каустика/хлора на целлюлозном заводе. Осуществление такого варианта способа настоящего изобретения дает возможность разрешать не только проблему одновременного получения избытка сульфата натрия в ходе проведения процесса получения двуокиси хлора, но также и проблему одновременного получения хлора в процессе гидрата окиси натрия. Концентрацию раствора гидрата окиси натрия, который образуется в катодном отделении, можно регулировать на каком-либо приемлемом уровне путем регулирования расхода потока материала и рециркулирующего раствора продукта.
Как указано выше, эффективность тока в ходе проведения процесса в значительной степени зависит от соотношения [Na+]:[H+] в анодном отделении, которое обычно требует циркулирования между электролизером и генератором двуокиси хлора натриевых ионов в виде мертвого груза, что при осуществлении вышеописанного варианта может быть достигнуто с использованием в качестве такого мертвого груза сульфата натрия. Однако с этой целью моно использовать также любую другую натриевую соль, которая не оказывает нежелательного эффекта на процесс производства двуокиси хлора.
Было установлено, что эффективность тока, которая может быть достигнута с помощью катионообменной мембраны, разделяющей электролизер, где гидрат окиси натрия образуется в катодном отделении, обычно не превышает приблизительно 80-85%. В соответствии с одним из предпочтительных вариантов воплощения изобретения эту эффективность тока повышают до уровня выше чем примерно 85% путем сведения к минимальной обратной миграции гидроксильных ионов из катодного отделения через катионообменную мембрану в подкисленный раствор.
Этот результат может быть достигнут согласно различным процедурам. По одной процедуре в двухсекционном электролизере создают менее щелочной католит. Так, например, кислый сульфат натрия, обычно сесквисульфат натрия, получаемый в процессе получения двуокиси хлора, может быть нейтрализован в катодном отделении электролизера. Нейтрализованный таким путем кислый сульфат натрия составляет обычно ту часть получаемого в качестве побочного продукта кислого сульфата натрия, которую удаляют из генератора двуокиси хлора и которая предназначена для использования при компенсации потерь серы на целлюлозном заводе в качестве свежей порции и или для сброса в отход. Другое достоинство использования кислого сульфата натрия в катодном отделении состоит в возможности использования в электролизере тока меньшего напряжения вследствие зависимости потенциала от величины pH.
Другим примером использования менее щелочного католита для сведения к минимуму обратной реакции гидроксильных ионов является приготовление католита в форме раствора гидрата окиси натрия низкой концентрации.
Помимо повышения эффективности тока применение менее щелочного католита ослабляет также негативный эффект жесткости на срок службы мембраны. Влияние жесткости можно также свести к минимальному добавлением карбоната, в частности карбоната натрия, в катодное отделение. Карбонаты как кальция, так и магния менее растворимы, чем соответствующие гидраты окисей, вследствие чего их присутствие снижает концентрацию кальциевых и магниевых ионов, являющихся основными причинами жесткости, в католите и сводит к минимальному образование нерастворимых гидратов окисей в мембране.
Менее щелочной католит может быть также создан с использованием другой электрохимической реакции, отличной от реакции образования гидрата окиси натрия. Одной из таких реакций является электросинтез дитионита за счет электровосстановления бисульфата в катодном отделении. Другой реакцией этого типа является электросинтез хлорита натрия за счет электровосстановления двуокиси хлора в катодном отделении.
Согласно другой процедуре сведения к минимальному миграции гидроксильных ионов в трехсекционном электролизере в центральном его отделении предусмотрено создание буферного электролита. Так, например, в это центральное отделение можно направлять в качестве электролита кислый сульфат натрия, обычно сесквисульфат натрия, получаемый в процессе работы генератора двуокиси хлора. Кислый сульфат натрия нейтрализует все гидроксильные ионы, которые мигрируют из катодного отделения через катионообменную мембрану, и предотвращает их переход в анодное отделение. Используемый таким образом кислый сульфат натрия обычно составляет ту часть побочного кислого сульфата натрия, которую удаляют из генератора двуокиси хлора и которая предназначена для использования при компенсации потерь серы на целлюлозном заводе или для отправки в отход.
В качестве буферного электролита в центральном отделении можно использовать электролит из смесей хлората натрия и сульфата натрия, обычно кислого сульфата натрия, в частности сесквисульфата натрия. Этот электролит в дальнейшем можно направлять из центрального отделения в анодное отделение для подкисления аналогично вышеизложенному, а затем подавать в генератор двуокиси хлора. В ходе одного из экспериментов было установлено, что раствор 1 М сесквисульфата натрия и 2 М хлората натрия, который циркулировал как в анодном, так и центральном отделениях, давал подкисленный раствор с эффективностью тока 89%.
Согласно еще одному варианту воплощения изобретения процесс подкисления можно сочетать с другой полезной анодной реакцией с образованием водородного иона в качестве носителя заряда, который проходит через ионообменную мембрану. Такой результат может быть достигнут в трехсекционном электролизере, который снабжен двумя катионообменными мембранами, причем подкисляемую водную среду направляют в среднее отделение.
Примеры процедур, которые можно осуществлять в отделении, смежном с анодным, охватывают окисление серной кислоты с получением надсерной кислоты, применение платинового анода, получение других перекисных соединений, включая надуксусную кислоту, и окисление органических соединений, в частности альдегидов, до кислот в кислой среде, в частности в серной кислоте.
Анод, используемый в электролизере, может
характеризоваться любой желаемой формой, но предпочтительнее использовать анод с низким перенапряжением относительно реакции выделения кислорода, например электрод типа DSA-O
Катионообменную мембрану можно изготовить из любого подходящего материала, который селективно пропускает преимущественно катионы в отличие от анионов. Предпочтительнее катионообменную мембрану изготовлять из перфторуглеродного полимера, молекулы которого содержат боковые катионообменные функциональные группы, в частности из такого, который поступает в продажу под торговым наименованием NAFION (фирма "Дюпон") или FLEMION (фирма "Асахи гласс").
В случае применения в анодном отделении дополнительной ионообменной мембраны или дополнительных мембран такие мембраны могут быть изготовлены из любого подходящего ионообменного материала.
В соответствии с одним из вариантов воплощения изобретения, в котором предусмотрено использование биполярных мембран, водный раствор смеси солей щелочных металлов обрабатывают в большом числе единичных ячеек, причем каждая такая единичная ячейка отделена от смежных биполярными мембранами. У биполярной мембраны имеется анионная сторона, находящаяся в основном отделении одной ячейки, и катионная сторона, находящаяся в кислотном отделении смежной ячейки. Индивидуальные ячейки разделены катионообменной мембраной.
В случае множества ячеек, разделенных биполярными мембранами, в кислотном и основном отделениях не происходит выделения газов
и реакцию в целом можно отобразить следующим уравнением:

Это множество ячеек с обоих концов завершается катионными мембранами. Между катодными и анодными отделениями, смежными соответственно с катодом и анодом, циркулирует отдельный электродный промывной раствор, в частности раствор сульфата натрия или раствор черной кислоты. С целью обеспечить подкисление параллельно во множество единичных ячеек с выделением газов только в конечных анодных и катодных отделениях применяют единственный источник электрохимического питания.
Биполярные мембраны и принцип их действия хорошо известны, поскольку они представлены в описаниях к американским патентам NN 4024043, 4180815, 4057481, 4355116, 4116889, 4253900, 4584246 и 46734574, поэтому за подробностями можно обратиться к описаниям к этим патентам.
При желании сесквисульфат натрия можно подвергнуть конверсии путем реакции обмена (metathesis) в нейтральный безводный сульфат натрия, в частности, в соответствии с изложенным в описании к совместно рассматриваемой американской заявке на патент N 688438, поданной 22 апреля 1991 г. (Е439), владельцем которой является владелец данной патентной заявки и которая упомянута здесь в качестве ссылки. Затем нейтральный безводный сульфат натрия можно использовать в качестве сульфата натрия, который попадает в электролизер для подкисления.
Такая реакция обмена дает благоприятную возможность свести к минимуму содержание вызывающих жесткость веществ в солевом брикете, используемом в процессе подкисления. Сведены к минимуму количества на производительность электролизера (то есть на эффективность тока), и, кроме того, это позволяет удлинить срок службы используемых в процессе подкисления мембран (как катионообменных, так и биполярных).
Удаление обуславливающих жесткость веществ из сесквисульфата или кислого сульфата является сложной и дорогостоящей процедурой, которая в обычных условиях требует нейтрализации солевого брикета каустиком.
Применение реакции обмена согласно изложенному в описании к вышеупомянутой патентной заявке позволяет не только рекуперировать ценные кислоты в солевом брикете и создать источник сульфата натрия для процесса подкисления, но и свести к минимуму затраты, с которыми связано добавление в сесквивульфат гидрата окиси натрия с целью осаждения вызывающих жесткость ионов (Ca2+, Mg2+, Fe2+, Fe3+ и тому подобное).
Параметры работы электролизера не имеют решающего значения для осуществления способа настоящего изобретения, поэтому их можно широко варьировать. Так, например, электролитический процесс можно проводить в любых желаемых условиях электролиза, бычно при мембранной плотности тока от приблизительно 0,01 до приблизительно 10 кА/м2, предпочтительнее примерно от примерно 1 до примерно 5 кА/м2.
Подобным образом способ может быть проведен в широком интервале температур, в основном от приблизительно 0o до приблизительно 150oC, предпочтительно от приблизительно 15 до приблизительно 90oC.
Обычно повышенная температура предпочтительнее, принимая во внимание обычно более высокую растворимость солей щелочных металлов при повышенной температуре, благодаря чему улучшается соотношение между натриевыми и водородными ионами [Na+]:[H+]. Эта повышенная растворимость при высокой температуре особенно заметна для хлората натрия, вследствие чего в том случае, когда такую соль вводят в состав сырья для электролизера, предпочтительнее повышенная температуре процесса, превышающая приблизительно 60oC. Поток подкисленного продукта, отводимого из процесса электролиза, характеризуется высоким содержанием хлората натрия, из-за чего охлаждение такого потока продукта перед подачей в генератор двуокиси хлора может привести к выпадению из него в осадок хлората натрия, который можно выделять и возвращать в процесс, вводя в исходный материал для электролизера.
Как указано выше, одним из важных параметров, влияющих на эффективность тока, является молярное соотношение между ионами натрия и водорода в анодном отделении. Обычно такое молярное соотношение варьируется в интервале от приблизительно 1000:1 до приблизительно 1:5, предпочтительнее примерно от 1000: 1 до 1:2. Такое соотношение зависит от концентрации исходного раствора, подаваемого в анодное отделение, и той степени, с которой натриевые ионы перемещаются из анодного отделения в катодное отделение. Таким образом, предпочтительнее использовать исходный раствор, концентрация натриевых ионов в котором составляет приблизительно от 0,1 до 1,5 М, и подавать в процесс получения двуокиси хлора в качестве исходного материала подкисленный раствор, концентрация натриевых ионов в котором находится в интервале примерно от 0,1 до 12 М.
В результате электролитического процесса общая кислотная нормальность раствора соли щелочного металла повышается. В зависимости от исходной общей кислотной нормальности и степени электролиза, которому подвергается исходный материал, может оказаться желательным концентрирование, в частности, путем выпаривания потока продукта с целью повысить его общую кислотную нормальность перед подачей в процесс получения двуокиси хлора. Обычно общую кислотную нормальность исходного раствора варьируют от почти нейтральной реакции приблизительно до 12 н., предпочтительнее примерно от 0,1 до 10 н., и электролиз ведут до такой степени, при которой обеспечивается отвод из анодного отделения потока продукта с общей кислотной нормальностью обычно приблизительно от 0,2 до 15 н., предпочтительнее примерно от 0,5 до 6 н.
Описание предпочтительных вариантов.
На фиг. 1 проиллюстрирован вариант применения основных принципов настоящего изобретения в отношении получения двуокиси хлора.
На этой фигуре показана технологическая схема процесса получения двуокиси хлора 10, где представлен сам процесс получения двуокиси хлора 12, в ходе проведения которого протекает реакция между хлоратом натрия, серной кислотой и метанолом при температуре кипения реакционной среды под давлением ниже атмосферного, в результате чего образуется газообразная двуокись хлора, направляемая по линии 14 (то есть осуществляется способ R8).
В ходе проведения процесса получения двуокиси хлора в генераторе 12 происходит выпадение в осадок в качестве побочного продукта сульфата натрия сразу же после начала насыщения им реакционной среды. Форма получаемого натрийсульфатного побочного продукта, а именно нейтрального сульфата натрия, сесквисульфата натрия, бисульфата натрия или их смеси, зависит от общей кислотной нормальности реакционной среды, которую можно варьировать в интервале от приблизительно 2 до приблизительно 11 н.
Кристаллический сульфат натрия (иногда именуемый "солевым брикетом") удаляют из реакционной среды в форме шлама в отработавшей реакционной среде по линии 16 и направляют к фильтру 18, в котором кристаллический материал отделяется от отработавшей реакционной среды.
Отделенную от побочного продукта отработавшую реакционную среду по линии 20 возвращают в генератор 12 совместно со свежими порциями реагентов, а именно хлората натрия, серной кислоты и метанола, которые вводят в рециркулируемый по линии 20 поток соответственно по линиям 22, 24 и 26.
Кристаллический сульфат натрия, выделенный на фильтре 18, можно удалять по линии 28 для утилизации на каком-либо участке целлюлозного завода в каком-нибудь определенном количестве (включая и нулевое количество), где желателен сульфат натрия в виде шлама.
Ту часть сульфата натрия, которую не удаляют по линии 28, направляют по линии 30 в растворительную емкость 32, где сульфат натрия растворяют в воде, подаваемой по линии 34, с образованием водного раствора, который по предпочтительному варианту должен быть насыщенным. Этот раствор по линиям 36 и 38 направляют в разделенный мембранами электролизер 40. Нет необходимости в полном растворении сульфата натрия в воде, поскольку его можно подавать и в виде шлама. В том случае, когда используют такой шлам, с целью предотвратить интенсивный износ анода за счет истирания этот анод обычно желательно изолировать от шлама в электролизере 40.
В электролизере 40 предусмотрено наличие катионообменной мембраны 42, которая делит внутренне пространство электролизера 40 на анодное отделение 44 и катодное отделение 46, где размещены соответственно анод 48 и катод 50 электролизера.
В подаваемый по линии 36 раствор сульфата натрия по линии 52 добавляют хлорат натрия, благодаря чему в линии 38 образуется исходный раствор для анодного отделения 44 электролизера 40. В катодное отделение 46 по линии 54 подают электролит. Анод 48 и катод 50 подключают к источнику электрического тока. Хлорат натрия можно подавать по линии 52 в форме его водного раствора или твердого хлората натрия.
В электролизере 40 одновременно протекают несколько реакций. На аноде 48
происходит электролиз воды с образованием кислорода и водного иона согласно нижеследующему уравнению:
H2O _→ 1/2 O2+2H++2e-,
в то время как на катоде 50 происходит электролиз воды с образованием водорода и гидроксильного иона согласно нижеследующему уравнению:
e-+H2O _→ 1/2 H2+OH-.
Одновременно с этим под воздействием прилагаемой разницы потенциалов электрического тока в водном растворе или шламе из смеси сульфата натрия с хлоратом натрия
натриевые ионы перемещаются из анодного отделения 44 через катионообменную мембрану 42 в катодное отделение 46. Таким образом, в действительности электролитически получаемые водородные ионы замещают
натриевые ионы в анодном отделении 44, а переместившиеся натриевые ионы в катодном отделении 46 получают возможность взаимодействия с получаемыми электролитическим путем гидроксильными ионами.
Сульфат натрия, содержащийся в растворе, который по линии 38 подают в электролизер 40, можно рассматривать как мертвый груз, который циркулирует через генератор 12 по замкнутому кругу,
вследствие чего реакцию в электролизере 40 в целом можно представить следующим образом:

где
x - молярное количество хлората натрия, которое участвует в процессе.
Затем полученный раствор, содержащий хлорноватую кислоту, по линии 54 направляют на рециркуляцию в рециркуляционную линию 20 с целью обеспечить генератор 12 двуокиси хлора кислотой и хлоратными ионами. Часть сульфата натрия, которую удаляют из системы по линии 28, соответствует пропорции серной кислоты и хлората натрия, подаваемых в качестве реагентов в процессе получения двуокиси хлора из внешних источников, а именно по линии 24 для серной кислоты и по линии 24, а также по линии 22 для не подвергшегося конверсии хлората натрия. В устоявшихся рабочих условиях технологического процесса при осаждении сесквисульфата натрия, когда нет необходимости в получении сульфата натрия, обработка водного раствора смеси сесквисульфата натрия и хлората натрия в электролизере 40 позволяет получить все количество водородных ионов и хлоратных ионов, которые необходимы для поддержания реакции, поэтому дополнительные серная кислота и хлорат натрия не требуются.
Поэтому в действительности хлорат натрия, направляемый в электролизер 40 по меньшей мере частично подвергают конверсии в хлорноватую кислоту, благодаря чему натрийсульфатный компонент исходного раствора 38 циркулирует в качестве мертвого груза между электролизером 40 и генератором двуокиси хлора 12.
Кислород удаляют из анодного отделения 44 по линии 56. По другому варианту поток продукта можно направлять на рециркуляцию по линии 58 совместно с кислородом, который отводят от газожидкостного сепаратора 60 по линии 62, где для достижения желаемой нормальности подкисленного раствора 54 необходима рециркуляция анолита.
Гидрат окиси натрия, полученный в катодном отделении 46, направляют на рециркуляцию по линии 64 через газожидкостный сепаратор 66, из которого по линии 68 удаляют водород, до достижения желаемой концентрации раствора гидрата окиси натрия. Образующийся водный раствор гидрата окиси натрия удаляют в виде водного потока продукта по линии 70. Этот раствор обладает значительной полезностью для целлюлозного завода, в особенности в качестве химиката, используемого для операций очистки и отбеливания в отдельном отделе целлюлозного завода. Газообразные побочные продукты, а именно водород и кислород, также могут быть использованы на целлюлозном заводе.
Как указано выше, высокая эффективность тока в ходе электролитического процесса в электролизере 40 может быть обусловлена высоким молярным соотношением между натриевыми и водородными ионами в анодном отделении 44, а также буферным эффектом сульфатных ионов в отношении водородных ионов, благодаря чему проявляется тенденция к поддержанию в анодном отделении низкой концентрации свободных водородных ионов, вследствие чего наблюдается тенденция к поддержанию высокого молярного соотношения между натриевыми и водородными ионами.
Как совершенно очевидно из вышеприведенной части описания, в ходе проведения процесса, показанного на фиг. 1, двуокись хлора получают согласно способу R8,благодаря чему сохраняются достоинства этого способа. Более важно то, что при осуществлении предлагаемого способа не образуется никакого избытка являющего побочным продуктом сульфата натрия, требующего его размещения в качестве отхода. То количество сульфата натрия, которое получают, допускается как используемое для нужд целлюлозного завода или же его образование можно полностью исключить. Действительно, в том случае, когда на целлюлозном заводе отсутствует потребность в солевом брикете, сульфат натрия удерживают в замкнутом цикле процесса, а натриевые ионы, которые попадают в процесс получения двуокиси хлора совместно с хлоратом натрия, отводятся из процесса в форме водного раствора гидрата окиси натрия. Кислоту для процесса получения двуокиси хлора производят электролитическим путем из воды, которая одновременно выделяет и гидроксильные ионы, необходимые для сочетания с натриевыми ионами с образованием гидрата окиси натрия.
На фиг. 2 проиллюстрировано применение батареи 100 единичных элементов, включающей в себя индивидуальные электролизеры 102, в которых производят подкисленную смесь, подаваемую по линии 104 для питания генератора двуокиси хлора, как это изложено в отношении технологического процесса фиг.1, из исходной водной смеси сесквисульфата натрия и хлората натрия, подаваемой по линии 106. Число единичных элементов 102 в батарее элементов можно варьировать в широком интервале в зависимости от требуемой производительности установки, но обычно его варьируют в пределах от приблизительно 20 до приблизительно 500.
Каждый единичный элемент отделен от смежного с ним единичного элемента биополярными мембранами 108, 110. Катодная сторона такой биполярной мембраны 108 обращена к кислотному отделению 112, вследствие чего под действием электрического тока, к которому подключена батарея элементов 100. образуются водородные ионы, вызывающие подкисление исходной смеси, а натриевые ионы переходят из кислотного отделения 112 через катионообменную мембрану 114 в основное отделение 116.
Анионная сторона биполярной мембраны 110 обращена к основному отделению 116, благодаря чему под действием электрического тока, к которому подключена батарея элементов 100, из водной исходной среды, подаваемой в это отделение по линии 118, образуются гидроксильные ионы. Таким образом в основном отделении 116 образуется гидрат окиси натрия, который удаляют по линии 120.
Для батареи 100 единичных элементов 102 необходимы только один анод 122 и один катод 124. На соответствующих поверхностях электродов образуются кислород и водород, которые удаляют из крайних единичных элементов.
Электрохимические эксперименты проводили в двухсекционных электролизерах MP, поставляемых на рынок фирмой
"Электроселл АБ", Швеция, которые снабжены кислородотводящим анодом (DSA-O
В ходе проведения таких экспериментов плотность тока составляет в основном 3 кА/м2 (иногда 2 кА/м2), анолитом служит хлорат натрия (NaClO3) или смеси хлората натрия с сульфатом натрия и серной кислотой (NaClO3/Na2SO4 /H2SO4), а в качестве католита использовали 1 н. водный раствор гидрата окиси натрия, тогда как температура составляла от 40 до 50oC.
Пример 1. В ходе проведения экспериментов первого ряда в качестве анолита использованы водные растворы хлората натрия различных концентраций. В процессе электролита анолит обогащался водородными ионами, в то время как хлорат натрия подвергся частичной конверсии в хлорноватую кислоту. При различной концентрации получаемой хлорноватой кислоты для различных начальных концентраций хлората натрия определяли эффективность тока и по результатам строили графики. Эти результаты представлены на фиг. 3.
Из оценки данных, которые приведены на этой фигуре, совершенно очевидно, что с возрастанием молярного соотношения между водородными (H+) и натриевыми ионами (Na+) в электролизуемом растворе эффективность тока уменьшается.
Пример 2. Приготовили и подвергли электролизу различные смеси хлората натрия с сульфатом натрия и серной кислотой (NaSO4/H2SO4).
a). Смешением сульфата с серной кислотой в молярном соотношении 3:1 приготовили 1 л приблизительно 2 М водного раствора Na3H(SO4)2. Кислотность определяли титрованием гидроокисью натрия, в результате чего установили, что начальная концентрация составляла 1,9 н. В качестве католита использовали 0,5 1 н. раствора гидрата окиси натрия.
Электроды подключили к источнику электрического тока, создав плотность тока 3 кА/м2, и в анолит постепенно добавили кристаллы хлорита натрия в общем количестве, которое соответствовало необходимости приготовления 2 М водного раствора. Наблюдали очень быстрое растворение хлората натрия. Повышение кислотности анолита контролировали титрованием, а когда его кислотность достигла 4,12 н., процесс электролиза прекратили. Определение щелочности католита показало, что она рана 4,55 н. гидрата окиси натрия. Общая продолжительность электролиза составила 6583 с, а общий расход электричества составил 257490 А•с.
При расчете эффективности тока приняли во внимание объемные изменения анолита и католита, поскольку совместно с натриевыми ионами в католит перемещается вода, которая к тому же расходуется в результате электролиза. Было установлено, что эффективность тока, основанная на повышении кислотности анолита, составила 79%, тогда как эффективность тока на основе повышения щелочности католита была равной 80%.
Общую конверсию в анолите можно
представить следующим образом:

причем в катодном отделении было совместно получено эквивалентное количество каустика. Газообразными побочными продуктами служили водород(на катоде) и кислород (на аноде). Все реагенты и продукты, которые представлены в этом уравнении, сильно диссоциируют в растворе с образованием нижеследующих ионов: Na+,H+,H2SO
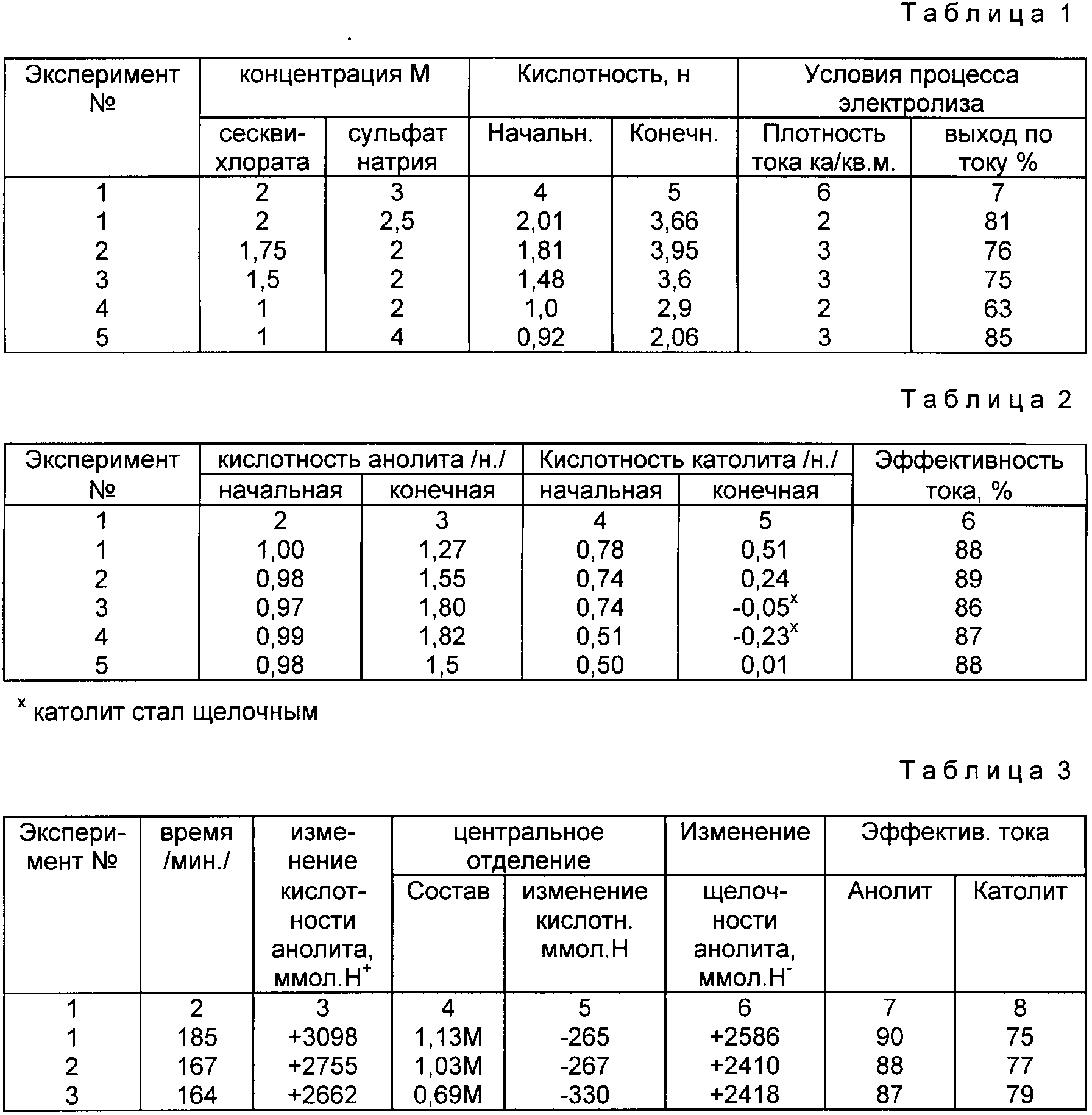
b). Аналогичным образом обработке подвергали другие смеси хлората натрия и сесквисульфата натрия (аналогично вышеизложенному) с количественной (с 1 по 4) или частичной (5) конверсией хлората натрия в хлорную кислоту. Полученные таким образом результаты приведены в табл. 1.
Из данных, которые представлены в таблице, и данных вышеприведенного раздела a) совершенно очевидно, что в сравнении с результатами, которые были достигнуты в ходе экспериментов примера 1, повышение эффективности тока в этом случае достигалось за счет присутствия сульфатного иона в сочетании с высоким соотношением между натриевыми и водородными ионами. Так, например, 1,5 М хлорноватая кислота может быть получена при эффективности тока приблизительно 60% в чистом водном растворе хлората натрия и при эффективности тока примерно 80% в смесях сесквисульфата натрия и хлората натрия.
Пример 3.
a). Дополнительный ряд экспериментов провели с заменой никелевого катода, который был использован в ходе экспериментов примеров 1 и 2, графитовым катодом и с помощью катионообменной мембраны NAFION 417. В качестве анолита использовали водный раствор 1 М сесквисульфата натрия и 2 М хлората натрия, а католитом при этом служил водный раствор сесквисульфата натрия, концентрация которого находилась в пределах от 0,5 до 1,5 М.
Полученные результаты сведены в табл. 2.
Из оценки результатов, представленных в табл. 2, можно видеть, что в случае сведения к минимальной магнации гидроксильных ионов, а это было достигнуто с использованием сесквисульфата натрия в качестве католита, эффективность тока возрастает.
b). В электролизере, описанном в вышеприведенном разделе a), провели еще один ряд экспериментов, используя в качестве анолита 6 М раствор хлората натрия и в качестве католита 1,5 М водный раствор сесквисульфата натрия. Эффективность тока определяли при различных концентрациях получаемой хлорноватой кислоты, а полученные результаты использовали для построения графиков. Эти результаты представлены на фиг. 4.
На фиг. 4 приведены также данные фиг.3 для 6 М хлоратных растворов, что позволяет их сопоставлять. Как очевидно из фиг.4, с повышением молярного соотношения между водородными и натриевыми ионами в подвергаемых электролизу растворах для обоих рядов данных эффективность тока снижается, но в случае наличия в католите сесквисульфата натрия эффективность тока возрастает.
Пример 4. Путем модификации двухсекционного электролизера, который использовали в ходе проведения экспериментов примеров с 1 по 3 , установкой в нем второй катионообменной мембраны ( обе NAFION 417) изготовили трехсекционный электролизер. В анодное отделение вводили водный раствор 1 М сесквисульфата натрия и 2 М хлората натрия, в центральное отделение подавали водный раствор сесквисульфата натрия, концентрация которого составляла приблизительно от 0,5 до 1,5 М, а в катодное отделение загружали раствор гидрата окиси натрия в воде концентрацией 5 вес.%.
Полученные результаты сведены в табл.3.
Результаты табл. 3 показывают, что сведение к минимальной миграции гидроксильных ионов, а это в данном случае было достигнуто введением кислоты в центральное отделение, которое отделяет друг от друга анодное и катодное отделения, позволяет повысить эффективность тока.
Согласно краткому изложению сущности данного описания в соответствии с изобретением предлагается новый способ проведения электрохимического процесса, в ходе которого обеспечивается возможность уменьшения количества сульфата натрия, образующегося в качестве побочного продукта реакции получения двуокиси хлората. В варианты воплощения можно вносить любые модификации, не выходя при этом за рамки изобретения.
Реферат
Использование: касается электрохимической обработки хлоратов щелочных металлов, сульфатов щелочных металлов и их смесей с получением подкисленных растворов, которые могут быть использованы в качестве содержащих хлоратные ионы исходных материалов для процессов производства двуокиси хлора или для других целей. Сущность: для получения водного подкисленного раствора, содержащего хлоратные ионы для производства двуокиси хлора, готовят водный раствор, содержащий хлорат щелочного металла, сульфат щелочного металла, с последующим электрохимическим окислением указанного раствора в электролизере, содержащем анодное и катодное отделения, разделенные катионообменной мембраной, с подачей исходного раствора в анодное отделение, с удалением части ионов щелочного металла из раствора через катионообменную мембрану в катодное отделение, с получением раствора, содержащего сульфат щелочного металла, хлорат щелочного металла и хлоратные ионы, с последующим удалением его из анодной камеры, с последующей подачей полученного раствора в процесс образования двуокиси хлора. 3 с. и 61 з.п. ф-лы, 3 табл., 4 ил.


Комментарии